高分子−第IX因子部分の抱合体
【課題】第IX因子活性を有する部分に高分子を抱合するためのより単純なプロセスを提供。
【解決手段】IX因子部分および1つ以上の水溶性高分子の抱合体を提供することによる。一般に、水溶性高分子は、ポリエチレングリコールまたはその誘導体である。また、(とりわけ)抱合体を含む組成物、抱合体の生成方法、および抱合体を含む組成物の患者への投与方法も提供する。
【解決手段】IX因子部分および1つ以上の水溶性高分子の抱合体を提供することによる。一般に、水溶性高分子は、ポリエチレングリコールまたはその誘導体である。また、(とりわけ)抱合体を含む組成物、抱合体の生成方法、および抱合体を含む組成物の患者への投与方法も提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、概して、第IX因子部分(すなわち第IX因子の活性を有する部分)および高分子を含む抱合体に関する。さらに、本発明は、抱合体を含む組成物、抱合体を合成するための方法、抱合体を送達するための方法、および患者を治療するための方法に関する。
【背景技術】
【0002】
止血は、傷ついた血管からの血液の流出を抑えるプロセスである。哺乳類の場合、多くの他の生命体と同様に、止血プロセスは生存し続けるために極めて重要である。止血プロセスにおける欠陥によって、例えば、血管を損傷した後の失血を抑える役目をする凝血を効果的に形成することができなくなる可能性がある。凝血させることができない人を血友病患者と呼ぶ。血友病患者に対し特に懸念されることは、出血し始めるとそれが止まらないという、致命的なリスクである。
【0003】
概して、血友病患者には、可溶性フィブリノゲンの不溶性フィブリンへの変換に最終的に必要となる、1つ以上の物質の有効量を生成する能力が欠如している。例えば、血友病B(「先天性第IX因子欠乏症」および「クリスマス病」とも呼ばれる)を罹患している血友病患者は、有効なレベルの第IX因子を生成することができない。第IX因子は、凝血の形成をもたらす、反応の複数の「カスケード」のうちの1つの主要な構成要素である。「内因系」と称される反応のカスケードに重要な第IX因子は、最終的に、凝血の主要な構成要素であるフィブリンへのフィブリノゲンの変換に影響を与える。
【0004】
凝血を形成するプロセスは比較的複雑であるが、内因系における第IX因子の役割は、簡潔に説明することができる。血液が、(例えば、裂傷に伴う組織の損傷の結果として)陰性荷電を帯びた面および/または内皮下の結合組織と接触するときに、他の物質の存在下で、第XII因子(ハーゲマン因子)は第XIIa因子に変換される。(他の物質と共に)第XIIa因子は、第XI因子を第XIa因子に変換する。次に、(他の物質と共に)第XIa因子は、第IX因子を第IXa因子に変換する。第VIII因子、第IXa因子、カルシウムイオン、およびリン脂質ミセルは、第X因子を伴うリポタンパク質複合体を形成し、それを活性化して第Xa因子を形成する。その後、(他の物質と共に)第Xa因子はプロトロンビンをトロンビンに変換するので、その結果、比較的多量のトロンビンが経時的に生成される。比較的多量のトロンビンは、フィブリノゲンをフィブリンに変換する。フィブリンは、次に、凝血の形成に関与するマトリクスまたは格子を形成する。
【0005】
血液凝固の内因系における第IX因子の役割を、以下に概略的に示す。
【化1】

【0006】
男性34,500人中1人に発症する血友病Bは、X染色体上に位置する第IX因子の遺伝子の様々な突然変異のうちのいずれか1つに起因しうる。特定の突然変異によって、血友病Bは、重度、中程度、または軽度に現れることがある。最も重度の血友病Bを罹患している人は、第IX因子の活性化を発現する能力が完全に欠如している。臨床的に、血友病Bにかかっている人は、鼻出血、易傷性、関節出血、および傷による長時間の出血を被る。現在の血友病Bの治療は、ヒト血漿から収集された、または組み換えDNA技術によって生成された、外生の第IX因子の点滴を伴う。これらの治療は、有効なレベルの第IX因子の不足を補う役目しか果たさないので、重度の血友病Bを罹患している人は、一生を通じて、(週3回もの)第IX因子の濃縮物の定期的な注射を必要とする。より軽度の血友病Bを罹患している患者であっても、しばしば手術および歯の治療の前および/または後の第IX因子の濃縮物の注射を必要とする。
【0007】
血友病Bを罹患している患者に補充療法を提供するために、いくつかの市販の第IX因子の濃縮物が入手可能である。例えば、血液由来の第IX因子複合製品(他の因子を含む)は、BEBULIN VH(登録商標)(Baxter Healthcare、ウィーン、オーストリア)、KONYNE80(登録商標)(Bayer社、Eikhart IN)、PROFILNINE SD(登録商標)(Alpha Therapeutic社、ロサンゼルス、CA)、およびPROPLEX T(登録商標)(Baxter Healthcare、Glendale CA)のブランドで販売されている。幾分精製された形態の第IX因子製品は、ALPHANINE SD(登録商標)Alpha Therapeutic社、ロサンゼルス、CA)、およびMONONINE(登録商標)(Aventis Behring、Kankakee、IL)のブランドで販売されている。組み換え的に調製された第IX因子濃縮物に関しては、1つの製品が、BENEFIX(登録商標)(Wyeth/Genetics Institute、Cambridge MA)のブランドで現在入手可能である。
【0008】
概して、第IX因子の濃縮物の組み換えソースが血液由来のものよりも好まれるが、これは後者がウイルスおよび/または他の疾病を伝染させるリスクを伴うためである。さらに、多くの場合組み換えソースの方が純度がより高いため、血液由来ソースに概して存在する不要な血液因子およびその他のタンパク質の投与によって生じる潜在的な問題が回避される。
【0009】
組み換えベースの処方を投与する利点があったとしても、組み換えベースの製品の製造には、アルブミンのような特定のタンパク質の存在が必要であり、それは患者に投与される最終的な処方に存在しうる。その結果、このような処方を受ける患者は、これらの外来のタンパク質に対するアレルギー反応が起こる。いずれにせよ、血液由来および組み換えベースの製品は、繰り返し投与という不利な点を被る。
【0010】
PEG化、すなわちタンパク質へのポリ(エチレングリコール)誘導体の付着が、免疫性を減じるための手段として、またタンパク質の生体内半減期を伸ばすための手段として開示された。しかし、第IX因子に関して、タンパク質−高分子抱合体を形成するための以前の手法には、いくつかの欠点があった。
【0011】
例えば、米国特許第5,969,040号では、アルデヒドを形成するために、第IX因子の活性化領域内の炭水化物部分のビシナルジオールを酸化させる段階を含むプロセスを開示している。酸化段階に続けて、開示されたプロセスは、酸化炭水化物部分に、(ヒドラジンを有するポリ(エチレングリコール)誘導体のような)1つ以上の非抗原性の高分子を共有結合させる段階を含む。しかし、この手法による問題点は、第IX因子の酸化型を得るために必要とされる、更なる段階によって複雑さが増すことである。さらに、酸化段階後に残存する可能性のあるいずれかの酸化剤が、抱合体に関連する高分子を劣化させる場合がある。最終的に、この手法は、特定の高分子(すなわち、ヒドラジド含有高分子)、および第IX因子上の特定の領域(すなわち、第IX因子の活性化領域内の炭水化物部分のビシナルジオール)を使用した抱合に制限される。
【0012】
酸化剤の存在(米国特許第5,969,040号に開示されたプロセスの結果によるか、または他の原因によって存在する)は、第IX因子に抱合される高分子の許容される医薬品を提供することに関して、更なる課題をもたらす。特に、メチオニンおよび他の水酸基含有アミノ酸は、酸化剤の存在下で不要な酸化を被る場合があるので、それによってアルデヒド基がもたらされる。高分子試薬と反応しない残留アルデヒドは、反応性であり、タンパク質を潜在的に傷つけることになる。この問題に対処するために、未反応のアルデヒドは、タンパク質を安定させるために、グリシンまたは他の小分子でキャップする必要がある。しかし、その際に、制限的目的に対して、製品が容易に定義されなければならないという分析的問題が生じ、更なる構成要素の導入は、その他の点で、直接的な製品定義を妨げる可能性がある。特に、キャップ薬剤の使用は、とりわけ困難な課題を呈する。
【0013】
米国特許第6,037,452号は、第IX因子へのポリ(酸化アルキレン)の付着を開示しており、第IX因子への付着は、反応基(トリアジン、アセチル、ヒドラジン、ジアゾニウム、アミノ、およびスクシンイミジルエステル)のうちの1つを有するポリ(酸化アルキレン)を介して達成される。しかしまた、その参考文献でも、トリアジン、アセチル、ヒドラジン、ジアゾニウム、アミノ、またはスクシンイミジルエステル以外の反応基を有する高分子を介した効果的な達成の開示が欠如している。
【0014】
したがって、水溶性高分子と第IX因子活性を有する部分との間に更なる抱合体を提供する必要性が、従来技術に依然として存在する。特に、第IX因子活性を有する部分に高分子を抱合するためのより単純なプロセスを提供する必要性が存在する。したがって、本発明は、本願明細書に開示されるような、新しく、従来技術ではまったく提案されていない、このような抱合体、その抱合体を含む組成物、および関連する方法を対象とする。
【発明の概要】
【0015】
従って、本発明の1つ以上の実施態様では、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に共有結合した第IX因子部分を含む抱合体であって、前記水溶性高分子の分子量は、5,000ダルトンより多く、約150,000ダルトンより少ない、抱合体を提供する。
【0016】
本発明の1つ以上の実施態様では、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子にアミノ酸残基において共有結合した第IX因子部分を含む抱合体であって、前記アミノ酸残基は、直接的にまたは前記スペーサ部分を介して、−CH2−C(O)−O−、−N(H)−C(O)CH2−O−、−C(O)−N(H)−、−N(H)−C(O)−CH2−O−、−C(O)−CH2−O−、−C(O)−CH2−CH2−C(O)−O−、ジアゾ、またはトリアジン結合により結合していない抱合体を提供する。
【0017】
本発明の1つ以上の実施態様では、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、非線形の水溶性高分子に共有結合した第IX因子部分を含む抱合体を提供する。
【0018】
本発明の1つ以上の実施態様では、複数の抱合体を含む組成物であって、前記組成物中の全ての抱合体の少なくとも約80%は、それぞれが1つ、2つ、3つ、または4つの水溶性高分子に共有結合した第IX因子部分を含み、さらに、前記抱合体中の各水溶性高分子に対して前記第IX因子部分が直接的にまたは1つ以上の原子を含むスペーサ部分を介して水溶性高分子に結合した組成物を提供する。前記組成物は、全ての種類の製剤、特に再構成することができる粉末および液体(例、懸濁液および溶液)のような注射に好適な製剤を包含する。
【0019】
本発明の1つ以上の実施態様では、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に共有結合した第IX因子部分を含む抱合体を得るのに十分な条件下で、第IX因子の組成物に、高分子試薬の組成物を添加する段階を含む、抱合体を生成するための方法を提供する。
【0020】
本発明の1つ以上の実施態様では、患者に本願明細書で開示されているような抱合体を含む組成物を投与する段階を含む、抱合体を送達するための方法を提供する。前記抱合体を投与する段階は、注射(筋内注射、静脈注射、皮下注射など)または他の手法によって達成することができる。
【図面の簡単な説明】
【0021】
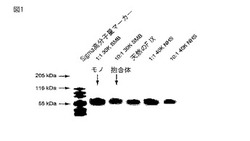
【図1】実施例1乃至4に記述されるサンプルのドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動(SDS−PAGE)分析によるゲルのコピーである。
【図2】実施例1乃至4に記述されるサンプルのドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動(SDS−PAGE)分析によるゲルのコピーである。
【図3】実施例5、6、10、および11に記述されるサンプルのSDS−PAGE分析によるゲルのコピーである。
【図4】実施例2、9、および12乃至16に記述されるサンプルのSDS−PAGE分析によるゲルのコピーである。
【図5】実施例1の得られた抱合体溶液に対応する図である。
【図6】実施例2の得られた抱合体溶液に対応する図である。
【図7】実施例3の得られた抱合体溶液に対応する図である。
【図8】実施例4の得られた抱合体溶液に対応する図である。
【図9】実施例12の得られた抱合体溶液に対応する図である。
【図10】実施例13の得られた抱合体溶液に対応する図である。
【図11】実施例14の得られた抱合体溶液に対応する図である。
【図12】実施例15の得られた抱合体溶液に対応する図である。
【発明を実施するための形態】
【0022】
本発明の1つ以上の実施態様を詳細に説明する前に、本発明は、特定の高分子、合成技術、第IX因子部分などに制限されず、その点を考慮して変化する場合があると理解されるべきである。
【0023】
本明細書および特許請求の範囲に使用されているように、単数形は、本文脈が明確に別途指示しない限り、複数の指示対象を含む点に留意されたい。したがって、例えば、「高分子」という記述には、単一の高分子および2つ以上の同一または異なる高分子が含まれ、「任意の賦形剤」という記述は、単一の任意の賦形剤および2つ以上の同一または異なる任意の賦形剤が含まれる。
【0024】
本発明の説明および特許請求の範囲では、次の用語は、下記の定義に従って使用される。
【0025】
本願明細書で使用される場合、「PEG」、「ポリエチレングリコール」、および「ポリ(エチレングリコール)」は、交換可能である。一般に、本発明によって用いるPEGは、「−(OCH2CH2O)n−」という構造を含み、(n)は2乃至4,000である。本願明細書で使用される場合、PEGはまた、末端酸素が置換されたかどうかに基づいて、「−CH2CH2−O(CH2CH2O)n−CH2CH2−」および「−(OCH2CH2)nO−」も含む。本明細書および特許請求の範囲を通じて、「PEG」は、種々の末端、すなわち「末端をキャップする」ような基などを有する構造を含むことを念頭に置いていただきたい。「PEG」という用語はまた、大多数、すなわち50%を超える−OCH2CH2−の繰り返しサブユニットを含む高分子のことでもある。特定の形態に関して、PEGは、いかなる数の様々な分子量、および「分岐状」、「線状」、「叉状」、「多官能性」などのような構造または形状をとることができ、以下に詳述する。
【0026】
「エンドキャップされた」および「末端がキャップされた」という用語は、エンドキャップ部分を有する高分子の末端または端点を示して、本願明細書において交換可能に使用される。一般に、必ずではないが、エンドキャップ部分は、ヒドロキシまたはC1-20アルコキシ基、より好ましくはC1-10アルコキシ基、さらに好ましくはC1-5アルコキシ基を含む。したがって、エンドキャップ部分の例には、アルコキシ(例、メトキシ、エトキシ、およびベンジルオキシ)、およびアリール、ヘテロアリール、シクロ、ヘテロシクロなどが挙げられる。エンドキャップ部分は、高分子(例、CH3(OCH2CH2O)n−内のエンドキャップ部分「メトキシ」)または(CH3(OCH2CH2)n−内の「CH3」)に、1つ以上の原子の末端の単量体を含むことが可能である。さらに、前述のそれぞれの飽和、不飽和、置換、および非置換の形態が想定される。さらに、エンドキャップの基は、シランにもなりうる。エンドキャップの基はまた、検出可能なラベルを好都合に含むこともできる。高分子が、検出可能なラベルを含むエンドキャップを有する場合、高分子および/または高分子が結合する部分(例えば活性剤)の量または場所は、好適な検出器を使用することにより決定することができる。このようなラベルには、これに限定されないが、蛍光剤、ケミルミネサー(chemiluminescer)、酵素のラベリングに使用される部分、比色部分(例、染料)、金属イオン、放射性部分などが挙げられる。好適な検出器には、光度計、フィルム、分光計などが挙げられる。エンドキャップの基はまた、好都合にリン脂質を含むこともできる。高分子が、リン脂質を含むエンドキャップの基を有する場合、高分子および任意の得られる抱合体に一意の特性が与えられる。典型的なリン脂質には、これに限定されないが、ホスファチジルコリンと呼ばれるリン脂質類から選択されるものが挙げられる。特定のリン脂質には、これに限定されないが、ジラウロイルホスファチジルコリン、ジオレイルホスファチジルコリン、ジパルミトイルホスファチジルコリン、ジステロイルホスファチジルコリン、ベヘノイルホスファチジルコリン、アラキドイルホスファチジルコリン、およびレシチンから成る群から選択されるものが挙げられる。
【0027】
本願明細書に記述されているように、高分子に関して「非天然に生じる」とは、その全体が自然界には見られない高分子のことである。しかし、非天然に生じる高分子は、全体的な高分子構造が自然界には見られない限り、1つ以上の単量体または天然に発生する単量体のセグメントを含む場合がある。
【0028】
「水溶性高分子」にあるような「水溶性」とは、室温で水溶性である任意の高分子のことである。一般に、水溶性高分子は、ろ過後の同じ溶液によって透過される光の少なくとも約75%、より好ましくは少なくとも約95%を透過する。重量基準で、水溶性高分子は、少なくとも約35重量%の水溶性であることが好ましく、少なくとも約50重量%の水溶性であることがより好ましく、約70重量%の水溶性であることがさらに好ましく、約85重量%の水溶性であることがさらに好ましい。しかし、水溶性高分子は、約95%の水溶性、または完全な水溶性であることが最も好ましい。
【0029】
PEGのような水溶性高分子の本文脈における分子量は、数平均分子量または重量平均分子量で表すことができる。特に明記しない限り、本願明細書での分子量という記述は、重量平均分子量のことである。数平均および重量平均の両方の分子量の決定は、ゲル透過クロマトグラフィまたは他の液体クロマトグラフィ技術を使用して測定することができる。分子量の値を測定するための他の方法では、数平均分子量を決定するために末端基分析または束一性(例、凝固点降下、沸点上昇、または浸透圧)の測定を使用すること、または重量平均分子量を決定するために光散乱技術、超遠心分離または粘度計を使用することもできる。本発明の高分子は、一般に多分散系(すなわち、高分子の数平均分子量および重量平均分子量が等しくない)であり、その多分散性は低く、約1.2未満であることが好ましく、約1.15未満であることがより好ましく、約1.10未満であることがさらに好ましく、約1.05未満であることがさらに好ましく、約1.03未満であることが最も好ましい。本願明細書で使用される場合、一つの重量平均分子量または数平均分子量を有する単一の水溶性高分子として言及されるものもあるが、これは、その単一の水溶性高分子が、前述のような分子量を有する水溶性高分子の組成物から得られたことを意味すると理解されよう。
【0030】
特定の官能基とともに使用される場合の「活性」または「活性化」という用語は、求電子物質または別の分子上の求核体と容易に反応する、反応性官能基のことである。これは、反応のために強力な触媒または非常に非実用的な反応条件を必要とする、基(すなわち「非反応性」または「不活性」基)とは対照的である。
【0031】
本願明細書で使用される場合、「官能基」という用語またはその任意の同義語は、その保護形態および非保護形態を包含することが意図されている。
【0032】
「スペーサ部分」、「結合」、および「リンカー」という用語は、水溶性高分子および第IX因子部分の終端、または第IX因子部分の求電子物質または求核体のような、相互接続部分を結合するために使用される原子または一群の原子を示すために本願明細書において使用される。スペーサ部分は、加水分解的に安定であってもよく、または生理学的に加水分解性の、または酵素的に分解可能な結合を含んでいてもよい。
【0033】
「アルキル」は炭化水素鎖のことであり、一般に約1乃至15の原子長である。このような炭化水素鎖は、一般に直鎖であることが好ましいが、必ずではないが飽和していることが好ましく、分岐または直鎖であってよい。典型的なアルキル基には、メチル、エチル、プロピル、ブチル、ペンチル、1−メチルブチル、1−エチルプロピル、3−メチルペンチルなどが挙げられる。本願明細書で使用される場合、「アルキル」には、シクロアルキルおよびシクロアルキレン含有アルキルが含まれる。
【0034】
「低級アルキル」とは、1乃至6個の炭素原子を含むアルキル基のことであり、メチル、エチル、n−ブチル、i−ブチル、およびt−ブチルなどのように、直鎖または分岐したものであってよい。
【0035】
「シクロアルキル」とは、架橋、縮合、またはスピロ環状化合物を含む、飽和または不飽和の環状炭化水素鎖のことであり、3乃至12個の炭素原子で構成されることが好ましく、3乃至8個の炭素原子で構成されることがより好ましい。「シクロアルキレン」とは、環状系内のいずれか2つの炭素での鎖の結合によって、アルキル鎖に挿入されるシクロアルキル基のことである。
【0036】
「アルコキシ」とは、−O−R基のことであり、ここでRは、アルキルまたは置換アルキルであって、C1-6アルキル(例、メトキシ、エトキシ、プロピルオキシなど)が好ましい。
【0037】
例えば、「置換アルキル」にあるような「置換」とは、これに限定されないが、以下のような1つ以上の非妨害置換基によって置換される部分(例、アルキル基)のことである:アルキル、C3-8シクロアルキル(例、シクロプロピル、シクロブチルなど);ハロ(例、フルオロ、クロロ、ブロモ、およびヨード);シアノ;アルコキシ、低級フェニル;置換フェニル;など。「置換アリール」は、置換基として1つ以上の非妨害基を有するアリールである。フェニル環上の置換に対して、置換基は任意の配向性(すなわち、オルト、メタ、またはパラ)であってよい。
【0038】
「非妨害置換基」とは、分子内に存在する場合に、一般にその分子に含まれる他の官能基と反応しない基である。
【0039】
「アリール」とは、それぞれが5乃至6個のコア炭素原子である、1つ以上の芳香族環のことである。アリールには、ナフチルのように縮合させることが可能であるか、またはビフェニルのように縮合させないことが可能である、複数のアリール環を含む。アリール環はまた、1つ以上の環状炭化水素、ヘテロアリール、または複素環と縮合させるか、または縮合させないことが可能である。本願明細書で使用される場合、「アリール」は、ヘテロアリールを含む。
【0040】
「ヘテロアリール」は、1乃至4個のヘテロ原子を含むアリール基であり、硫黄、酸素、または窒素、あるいはそれらを組み合わせたものであることが好ましい。ヘテロアリール環はまた、1つ以上の環状炭化水素、複素環、アリール、またはヘテロアリール環と縮合することも可能である。
【0041】
「ヘテロ環」または「複素環」とは、不飽和または芳香族特性の有無にかかわらず、炭素ではない少なくとも1つの環状の原子を有する、1つ以上の5乃至12個の原子、好ましくは5乃至7個の原子の環のことである。好適なヘテロ原子には、硫黄、酸素、および窒素が挙げられる。
【0042】
「置換ヘテロアリール」は、置換基として1つ以上の非妨害基を有するヘテロアリールである。
【0043】
「置換ヘテロ環」は、非妨害置換基から形成される1つ以上の側鎖を有するヘテロ環である。
【0044】
本願明細書で使用される場合、「有機ラジカル」は、アルキル、置換アルキル、アリール、および、置換アリールを含むものとする。
【0045】
「求電子物質」および「求電子基」とは、イオンを含むことが可能であり、求電子中心(すなわち、電子を求める中心)を有し、求核体と反応することができる、イオンまたは原子、あるいは一群の原子のことである。
【0046】
「求核体」および「求核基」とは、イオンを含むことが可能であり、求核中心(すなわち求電子中心を求めている中心または求電子物質を有する中心)を有する、イオンまたは原子、あるいは一群の原子のことである。
【0047】
「生理学的に開裂可能な」または「加水分解性の」結合は、生理学的条件下で水と反応する(すなわち加水分解される)結合である。水中での加水分解に対する結合の傾向は、2つの中心原子を結合する一般型の結合だけでなく、これらの中心原子に付着した置換基にも依存する。適切な加水分解的に不安定な、または弱い結合には、これに限定されないが、カルボン酸エステル、リン酸塩エステル、無水物、アセタール、ケタール、アシルオキシアルキルエーテル、イミン、オルトエステル、ペプチド、およびオリゴヌクレオチドが挙げられる。
【0048】
「酵素的に分解可能な結合」とは、1つ以上の酵素によって分解される結合のことである。
【0049】
「加水分解的に安定した」連結または結合とは、実質的に水中で安定している、すなわち、長期間にわたって相当の程度の生理学的条件下で加水分解を受けない、化学的結合、一般に共有結合のことである。加水分解的に安定した結合の例には、これに限定されないが、(例えば、脂肪族鎖内の)炭素−炭素結合、エーテル、アミド、ウレタンなどが挙げられる。概して、加水分解的に安定した結合は、生理学的条件下で、1日に約1乃至2%未満の加水分解の比率を示すものである。代表的な化学的結合の加水分解比率は、大部分の標準的な化学の教科書に見られる。
【0050】
「医薬として許容される賦形剤」とは、任意に、本発明の組成物に含むことが可能であり、患者に著しい有害な毒物学的影響を生じさせない、賦形剤のことである。
【0051】
「治療有効量」は、本願明細書において使用され、血流内または標的組織内に所望のレベルの抱合体(または対応する非抱合の第IX因子部分)の提供に必要である、高分子−第IX因子部分の抱合体の量のことである。その正確な量は、特定の第IX因子部分、治療組成物の構成要素および物理的特性、対象とする患者集団、送達様式、個々の患者の考慮すべき問題、などの数多くの要素に基づくものであり、本願明細書において提供される情報に基づいて、当業者が容易に決定することができる。
【0052】
「多官能性」とは、高分子内に含まれる3つ以上の官能基を有する高分子のことであり、官能基は同一か、または異なるものであってよい。多官能性高分子試薬は、一般に、3乃至100の官能基、3乃至50の官能基、3乃至25の官能基、3乃至15の官能基、または3乃至10の官能基を含むか、あるいは高分子骨格内に3、4、5、6、7、8、9、または10の官能基を含む。
【0053】
本願明細書で使用される場合、「第IX因子部分」という用語は、第IX因子活性を有する部分のことである。第IX因子部分はまた、高分子試薬との反応に好適な、少なくとも1つの求電子基または求核基も有する。一般に、必ずではないが、第IX因子部分はタンパク質である。さらに、「第IX因子部分」という用語は、抱合前の第IX因子部分および抱合後の第IX因子部分の残留物の両方を包含する。以下に詳述するように、当業者は、所定の部分が第IX因子活性を有するかどうかを決定することができる。配列番号:1に対応するアミノ酸配列を含むタンパク質は、第IX因子部分およびその生物学的特性が第IX因子の活性をもたらす、任意のタンパク質またはポリペプチドである。本願明細書で使用される場合、「第IX因子部分」という用語は、例えば部位特異的突然変異生成によって、または偶然に突然変異を介して、意図的に改変されたタンパク質を含む。「第IX因子部分」という用語はまた、1つ乃至6つの更なるグリコシル化部位を有する誘導体、更なるアミノ酸が少なくとも1つのグリコシル化部位を含む、タンパク質のカルボキシ末端部で少なくとも1つの更なるアミノ酸を有する誘導体、および少なくとも1つのグリコシル化部位を含むアミノ酸配列を有する誘導体も含む。
【0054】
「実質的に相同」という用語は、例えば変異配列などの特定の対象配列が、1つ以上の置換、欠損、または付加によって参照配列とは異なり、その正味の影響が、参照配列と対象配列との間の不都合な機能的相違点をもたらさないことを示す。本発明の目的を達成するために、95%を超える相同性、同等の生物学的特性(潜在的に異なる活性の程度)、および同等の発現特性を有する配列は、実質的に相同であるとみなす。相同性を決定するために、成熟配列の切断は無視されるべきである。より少ない程度の相同性、相当する生物活性、および同等の発現特性を有する配列は、実質的に同等であるとみなす。本願明細書に使用する典型的な第IX因子部分には、配列番号:1に実質的に相同な配列を有するタンパク質が挙げられる。
【0055】
「フラグメント」という用語は、ある程度の第IX因子活性を保持する、一部の第IX因子部分のアミノ酸配列を有する、任意のタンパク質またはポリペプチドのことである。フラグメントは、第IX因子のタンパク質のタンパク質分解によって生成されるか、または従来技術の方法のルーチンによる化学合成によって生成されるタンパク質またはポリペプチドを含む。特定のフラグメントが、第IX因子の生物学的活性を有するかどうかの決定は、1つ以上の哺乳類の種に関するこのような目的に用いられる、従来の公知の試験によって行うことができる。このような生物学的活性を実証するために用いることができる適切な試験を、本願明細書に記述する。
【0056】
第IX因子の「欠損変異体」は、第IX因子部分の1つのアミノ酸残基が欠損したペプチドまたはタンパク質であり、欠損したアミノ酸残基に前後するアミノ酸残基は、アミド結合によって結合する(欠損したアミノ酸残基が、ペプチドまたはタンパク質の終端上に位置した場合を除く)。欠損変異体は、アミノ酸残基が1つだけ欠損した場合、および2つのアミノ酸が欠損した場合、3つのアミノ酸が欠損した場合、および4つのアミノ酸が欠損した場合、などを含む。しかし、各欠損変異体は、ある程度の第IX因子活性を保持しなければならない。
【0057】
第IX因子部分の「置換変異体」は、第IX因子部分の1つのアミノ酸残基が欠損して、異なるアミノ酸残基が置き換わった、ペプチドまたはタンパク質である。置換変異体は、アミノ酸残基が1つだけ置換された場合、および2つのアミノ酸が置換された場合、3つのアミノ酸が置換された場合、および4つのアミノ酸が置換された場合、などを含む。しかし、各置換変異体は、ある程度の第IX因子活性を有さなければならない。
【0058】
第IX因子部分の「付加変異体」は、アミノ酸配列に第IX因子部分の1つのアミノ酸残基が添加されたペプチドまたはタンパク質であり、隣接したアミノ酸残基は、アミド結合を通じて、添加されたアミノ酸残基に付着する(添加されたアミノ酸残基が、ペプチドまたはタンパク質の終端上に位置し、アミド結合の1つだけが添加されたアミノ酸残基を付着する場合を除く)。付加変異体は、アミノ酸残基が1つだけ添加された場合、および2つのアミノ酸が添加された場合、3つのアミノ酸が添加された場合、および4つのアミノ酸が添加された場合、などを含む。しかし、各付加変異体は、ある程度の第IX因子活性を有さなければならない。
【0059】
「患者」という用語は、活性剤(例、抱合体)の投与によって予防または治療することができる症状に、罹患したまたはその傾向のある生物のことであり、人間および動物の両方を含む。
【0060】
「任意の」または「任意に」とは、記述が、状況が生じた場合、および生じなかった場合を含むように、後述する状況が生じ得る又は生じ得ないことを意味する。
【0061】
「実質的に」とは(他で特定の文脈に対して特に定義されていなければ、または文脈が別に明確に指示していない限り)、例えば、その状態の50%を超える、51%以上、75%以上、80%以上、90%以上、および95%以上、のうちの1つ以上をほぼ完全に、または完全に満たすことである。
【0062】
コンテキストが別に明確に指示していない限り、数値の前に「約」がある場合は、その数値は、所定の数値の±10%を示すものであると理解される。
【0063】
ペプチド内のアミノ酸残基は、次のように省略される:
フェニルアラニンは、PheまたはF;ロイシンは、LeuまたはL;イソロイシンは、IleまたはI;メチオニンは、MetまたはM;バリンは、ValまたはV;セリンは、SerまたはS;プロリンは、ProまたはP;スレオニンは、ThrまたはT;アラニンは、AlaまたはA;チロシンは、TyrまたはY;ヒスチジンは、HisまたはH;グルタミン(Glutarnine)は、GlnまたはQ;アスパラギンは、AsnまたはN;リシンは、LysまたはK;アスパラギン酸は、AspまたはD;グルタミン酸は、GluまたはE;システインは、CysまたはC;トリプトファンは、TrpまたはW;アルギニンは、ArgまたはR;グリシンは、GlyまたはG。
【0064】
本発明の1つ以上の実施態様を参照すると、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に共有結合した第IX因子部分を含む抱合体を提供する。本発明の抱合体は、以下の特徴のうちの1つ以上を有する。
【0065】
第IX因子部分
【0066】
上述のように、「第IX因子部分」という用語は、抱合前の第IX因子部分、および水溶性高分子への付着後の第IX因子部分を含むものとする。しかし、第IX因子部分が非ペプチド性の水溶性高分子に付着する場合、第IX因子部分は、高分子(または高分子に付着したスペーサ部分)への結合に関連する1つ以上の共有結合の存在により、わずかに変更されると理解される。しばしば、別の分子に付着した第IX因子部分の、このわずかに変更された形態を、第IX因子部分の「残留物」と称する。
【0067】
第IX因子部分は、非組み換え方法または組み替え方法から誘導することができ、本発明はこの点に関しては制限されない。さらに、第IX因子部分は、ヒトのソースから、または動物のソースから誘導することができる。
【0068】
第IX因子部分は、非組み換え的に誘導することができる。例えば、第IX因子部分は、血液由来ソースから得ることができる。特に、第IX因子は、当業者に公知の沈殿および遠心分離技術を使用して、ヒト血漿から分画することができる。Wickerhauser(1976)のTransfusion 16(4):345〜350、およびSlichter他(1976)のTransfusion 16(6):616〜626を参照のこと。第IX因子はまた、ヒト顆粒球から分離することもできる。Szmitkoski他(1977)のHaematologia(Budap.)11(1−2):177〜187を参照のこと。
【0069】
第IX因子部分は、組み換え方法から誘導することができる。例えば、第IX因子部分である天然の第IX因子をコードするcDNAは、分離、特徴づけ、および発現ベクターにクローニングされている。Choo他(1982)の「Molecular Cloning of the Gene for Human Anti−hemophilic Factor IX」、Naure、Vol.299:178〜180、およびKurauchi他(1982)の「Isolation and Characterization of a cDNA Coding for Human Factor IX」、Proc. Natl. Acad. Sci. U.S.A、Vol.79:6461〜65を参照のこと。
【0070】
天然の第IX因子は、発現すると約55,000のダルトンの一本鎖の糖タンパク質となる。それは構造的に、Glaまたはγカルボキシグルタミン酸が豊富なドメイン、EGF様の領域、活性化ペプチド、および活性部位、の4つのドメインを有するとみなすことができる。発現アミノ酸配列は、配列番号:1に提供される。特に注記されていなければ、本願明細書において提供されるアミノ酸残基の数値の場所の全ての割り当ては、配列番号:1に基づくものである。
【0071】
第IX因子部分に使用される典型的な組み換え方法は、(天然の第IX因子であっても、第IX因子活性を有する異なるタンパク質であっても)、簡潔に述べることができる。このような方法は、所望のポリペプチドまたはフラグメントをコードする核酸の構築、核酸の発現ベクターへのクローニング、宿主細胞(例えば、植物、E.コリ(E.coli)のような細菌類、サッカロマイセス・セルビシエ(Saccharomyces cerevisiae)のような酵母、またはチャイニーズハムスター卵巣細胞またはベイビーハムスター腎臓細胞のような哺乳類の細胞)の形質転換、および所望のポリペプチドまたはフラグメントを産生するための核酸の発現を伴う。発現は、外因性発現(宿主細胞が自然に所望の遺伝子コードを含む場合)によって、または内因性発現によって生じさせることができる。インビトロ並びに原核生物および真核生物の宿主細胞におけるの組み換えポリペプチドの産生および発現のための方法は、当業者には公知である。米国特許第4,868,122号を参照のこと。
【0072】
組み換えポリペプチドの同定および精製を容易にするために、エピトープ標識または他の親和性結合配列をコードする核酸配列は、コード配列を用いて挿入またはフレーム単位で追加することができ、それによって、所望のポリペプチドおよび結合に適したポリペプチドを含む融合タンパク質を産生する。融合タンパク質は、融合タンパク質内のエピトープ標識または他の結合配列に対象とする結合部分(例、抗体)を有するアフィニティカラムに、融合タンパク質を含む混合物を最初に流し、それによってカラム内に融合タンパク質を結合させることにより、同定および精製することができる。その後、結合した融合タンパク質を解放するために、適切な溶液(例、酸)でカラムを洗浄することによって、融合タンパク質を回収することができる。組み換えポリペプチドも、宿主細胞を溶解させて、例えばサイズ排除クロマトグラフィによってポリペプチドを分離して、ポリペプチドを収集することによって、同定および精製することができる。組み換えポリペプチドを同定および精製するためのこれらの方法および他の方法は、当業者には公知である。しかし、本発明の1つ以上の実施態様では、第IX因子部分が融合タンパク質の形態でないことが好ましい。
【0073】
第IX因子活性を有するタンパク質を発現させるために使用される系に依存して、第IX因子部分を非グリコシル化またはグリコシル化することができ、そのいずれも使用することが可能である。すなわち、第IX因子部分を非グリコシル化することも、第IX因子部分をグリコシル化することもできる。本発明の1つ以上の実施態様では、第IX因子部分がグリコシル化されることが好ましい。
【0074】
第IX因子活性を有する部分は、アミノ酸内の原子に高分子を容易に付着させるために、例えば、リシン、システイン、および/またはアルギニンのような、1つ以上のアミノ酸残基を含むように、好都合に改変することができる。さらに、第IX因子部分は、非天然に生じるアミノ酸残基を含むように、改変することができる。アミノ酸残基を添加し、非天然にアミノ酸残基を生じさせるための技術は、当業者に公知である。J.March、Organic Che mistry:Reactions Mechanisms and Structure、4th Ed.(New York:Wiley−Interscience、1992)を参照した。
【0075】
さらに、第IX因子部分は、(官能基を含むアミノ酸残基の付加によるもの以外の)官能基の付着を含むように、好都合に改変することができる。例えば、第IX因子部分は、チオール基を含むように、改変することができる。さらに、第IX因子部分は、N末端のα炭素を含むように、改変することができる。さらに、第IX因子部分は、1つ以上の炭水化物部分を含むように、改変することができる。アミノキシ、アルデヒド、または他の官能基を含むように改変された第IX因子部分を使用することもできる。
【0076】
第IX因子部分には、これに限定されないが、第IX因子、第IXa因子、第IX因子の切断バージョン、ハイブリッドタンパク質、および第IX因子活性を有するペプチド模倣剤が挙げられる。生物活性フラグメント、欠損変異体、置換変異体、または少なくともある程度の第IX因子活性を保持する上述のうちのいずれかの付加変異体も、第IX因子部分としての機能を果たすことができる。
【0077】
任意の所定の部分に対して、その部分が第IX因子活性を有するかどうかを決定することが可能である。例えば、複数の動物の系統は、このような系統から作り出された動物が、非常に低く不十分なレベルの第IX因子を有するように、血友病に対する遺伝変種によって意図的に繁殖される。このような系統は、これに限定されないが、Division of Laboratories and Research、New York Department of Public Health、Albany、NY、およびDepartment of Pathorogy、University of North Carolina、Chapel Hill、NC、のような様々なソースから利用可能である。これらのソースのどちらも、例えばイヌ血友病Bを罹患しているイヌを提供する。このような任意の所定の第IX因子活性を試験するために、小さな切り傷を与えた、罹患動物にその部分を注射し、出血時間を健常対照群と比較する。第IX因子活性の決定に有用な別の方法では、共同因子、および、凝血促進活性を決定する。Mertens他(1993)Brit.J.Haematol. 85:133〜42を参照のこと。所定の部分が第IX因子活性を有するかどうかを決定するために、当業者に公知の他の方法を使用することもできる。このような方法は、提案された第IX因子部分および対応する高分子−第IX因子部分抱合体の両方の第IX因子活性の決定に有用である。
【0078】
水溶性高分子
【0079】
上述のように、各抱合体は、水溶性高分子に付着した第IX因子部分を含む。水溶性高分子に関して、水溶性高分子は、非ペプチド性、非中毒性であり、非天然に生じ、生体適合性がある。生体適合性に関して、ある物質を単独で、または生体組織に関連して(例、患者への投与)、別の物質(例、第IX因子部分のような活性剤)との使用に関連する有益な効果が、臨床医(例、医師)によって任意の悪影響を上回ると評価された場合、その物質は生体適合性があるとみなされる。非免疫原性に関して、生体内でのある物質の使用で不要な免疫反応(例えば抗体の形成)を生じない場合は、その物質は非免疫原性があるとみなされるか、または免疫反応が生じた場合、このような反応は臨床医によって臨床上有意または重要とみなされない。水溶性高分子は、生体適合性および非免疫原性があることが特に好ましい。
【0080】
さらに、高分子は、一般に2乃至約300の終端を有するものと特徴付けられる。このような高分子の例には、これに限定されないが、ポリエチレングリコール(PEG)、ポリ(プロピレングリコール)(「PPG」)、エチレングリコールの共重合体、およびプロピレングリコールなどのようなポリ(アルキレングリコール)、ポリ(オキシエチル化ポリオール)、ポリ(オレフィンアルコール)、ポリ(ビニルピロリドン)、ポリ(ヒドロキシアルキルメタクリルアミド)、ポリ(サッカライド)、ポリ(α−ヒドロキシ酸)、ポリ(ビニルアルコール)、ポリホスファゼン、ポリオキサゾリン、ポリ(N−アクリロイルモルホリン)、およびこれらを組み合わせたものが挙げられる。
【0081】
高分子は、特定の構造に限定されるものでなく、線形(例、アルコキシPEGまたは二官能性PEG)、または分岐状、叉状、多腕状(例、ポリオールコアに付着させたPEG)、および樹枝状のような非線形とすることができる。さらに、高分子の内部構造は、複数の異なるパターンで構成することができ、ホモ重合体、交互共重合体、ランダム共重合体、ブロック共重合体、交互3種共重合体、ランダム3種共重合体、およびブロック3種共重合体から成る群から選択することができる。
【0082】
一般に、活性化PEGおよび他の活性化水溶性高分子(すなわち高分子試薬)は、第IX因子部分上の所望の部位への結合に適切な、好適な活性化基によって活性化される。したがって、高分子試薬は、第IX因子部分との反応のための反応基を備える。活性部分にこれらの高分子を抱合するための、代表的な高分子試薬および方法は公知技術であり、Polyethylene Glycol Chemistry:Biotechnical and Biomedical Applications、J.M.Harris、Plenus Press、New York(1992)のZalipsky,S.他の「Use of Functionalized Poly(Ethylene Glycols) for Modification of Polypeptides」、およびZalipsky(1995)のAdvanced Drug Reviews 16:157〜182に詳述されている。
【0083】
一般に、抱合体中の水溶性高分子の重量平均分子量は、約100ダルトン乃至約150,000ダルトンである。しかし、重量平均分子量の範囲の例には、5,000ダルトン乃至約100,000ダルトンの範囲、約6,000ダルトン乃至約90,000ダルトンの範囲、約10,000ダルトン乃至約85,000ダルトンの範囲、10,000ダルトン乃至約85,000ダルトンの範囲、約20,000ダルトン乃至約85,000ダルトンの範囲、約53,000ダルトン乃至約85,000ダルトンの範囲、約25,000ダルトン乃至約120,000ダルトンの範囲、約29,000ダルトン乃至約120,000ダルトンの範囲、約35,000ダルトン乃至約120,000ダルトンの範囲、および約40,000ダルトン乃至約120,000ダルトンの範囲、が挙げられる。任意の所定の水溶性高分子に対して、これらの範囲の1つ以上の分子量を有するPEGが好ましい。
【0084】
水溶性高分子の典型的な重量平均分子量には、約100ダルトン、約200ダルトン、約300ダルトン、約400ダルトン、約500ダルトン、約600ダルトン、約700ダルトン、約750ダルトン、約800ダルトン、約900ダルトン、約1,000ダルトン、約1,500ダルトン、約2,000ダルトン、約2,200ダルトン、約2,500ダルトン、約3,000ダルトン、約4,000ダルトン、約4,400ダルトン、約4,500ダルトン、約5,000ダルトン、約5,500ダルトン、約6,000ダルトン、約7,000ダルトン、約7,500ダルトン、約8,000ダルトン、約9,000ダルトン、約10,000ダルトン、約11,000ダルトン、約12,000ダルトン、約13,000ダルトン、約14,000ダルトン、約15,000ダルトン、約20,000ダルトン、約22,500ダルトン、約25,000ダルトン、約30,000ダルトン、約35,000ダルトン、約40,000ダルトン、約45,000ダルトン、約50,000ダルトン、約55,000ダルトン、約60,000ダルトン、約65,000ダルトン、約70,000ダルトン、および、約75,000ダルトン、が挙げられる。上述のいずれかの総分子量を有する、水溶性高分子の分岐バージョン(例えば、2つの20,000ダルトンの高分子を含む、分岐した40,000ダルトンの水溶性高分子)を使用することもできる。1つ以上の実施態様では、抱合体は、直接的または間接的に、約6,000ダルトン未満の重量平均分子量を有するPEGと結合した任意のPEG部分を有さない。
【0085】
高分子として使用される場合、PEGは一般に、複数の(OCH2CH2)単量体(または(CH2CH2O)単量体、そのPEGがどのように定義されるかに依存して)を含む。本記述を通じて使用される場合、繰り返し単位の数は、「(OCH2CH2)n」の下付き数字の「n」によって同定される。したがって、一般に(n)の値は、以下の1つ以上の範囲に含まれる。2乃至約3400、約100乃至約2300、約100乃至約2270、約136乃至約2050、約225乃至約1930、約450乃至約1930、約1200乃至約1930、約568乃至約2727、約660乃至約2730、約795乃至約2730、約795乃至約2730、約909乃至約2730、および約1,200乃至約1,900。分子量が公知である任意の所定の高分子に対して、高分子の総重量平均分子量を繰り返しモノマーの分子量で割ることによって、繰り返し単位の数(すなわち「n」)を決定することが可能である。
【0086】
水溶性高分子の分子量に関して、本発明の1つ以上の実施態様では、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に共有結合した第IX因子部分を含む抱合体であって、前記水溶性高分子の分子量が、5,000ダルトンより多く、約150,000ダルトンより少ない抱合体を提供する。
【0087】
水酸基を使用することもできるが、本発明で使用される1つの特に好適な高分子は、エンドキャップされた高分子、すなわち、低級C1-6アルコキシ基のような比較的不活性な基でキャップされた少なくとも1つの終端を有する高分子である。例えば、高分子がPEGである場合、線状のPEGであるメトキシ−PEG(一般に、mPEGと称される)を使用することが好ましく、高分子の1つの終端はメトキシ基(−OCH3)を有するが、他の終端はヒドロキシルまたは任意に化学的に改変できる官能基である。
【0088】
本発明において有用な1つの形態において、遊離または非結合PEGは、水酸基により各末端が終端した線状の高分子である:
【化2】

{ここで、(n)は一般にゼロ乃至約4,000の範囲である}。
【0089】
上述の高分子、α−、ω−ジヒドロキシポリ(エチレングリコール)は、簡単にHO−PEG−OHで表すことができ、記号−PEG−は、以下の構造単位を表すことができると理解される:
【化3】

{ここで、(n)は上述の通りである}。
【0090】
本発明において有用なPEGの別のタイプは、メトキシ−PEG−OHまたは簡単にmPEGであり、その1つの終端は比較的不活性なメトキシ基であるが、他の終端は水酸基である。mPEGの構造は、下記で与えられる:
【化4】

{ここで、(n)は上述の通りである}。
【0091】
米国特許第5,932,462号に開示されているような、多腕状または分岐状PEG分子は、PEG高分子としても使用することができる。例えば、PEGは、以下の構造を有することができる:
【化5】

{ここで、
polyaおよびpolybは、メトキシポリ(エチレングリコール)のような、(同一の、または異なる)PEG骨格である;
R”は、H、メチル、またはPEG骨格のような非反応性部分である:且つ
PおよびQは、非反応性結合である}。1つ以上の実施態様では、分岐PEG高分子は、メトキシポリ(エチレングリコール)二置換リシンである。使用される特定の第IX因子に依存して、二置換リシンの反応性エステル官能基は、第IX因子部分内のターゲットグループとの反応に好適な官能基を形成するように、さらに改変することが可能である。
【0092】
さらに、PEGは、叉状PEGを含むことができる。叉状PEGの一例は、以下の構造によって表される:
【化6】

{ここで、Xは1つ以上の原子のスペーサ部分であり、Zは定義された長さの原子の鎖によってCHに結合した活性化末端基である}。国際特許出願第PCT/US99/05333号は、本発明の1つ以上の実施態様で使用することができる、種々の叉状PEG構造を開示している。分岐炭素原子にZ官能基を結合する原子の鎖は、テザリング基としての機能を果たし、例えば、アルキル鎖、エーテル鎖、エステル鎖、アミド鎖、およびそれらを組み合わせたものを含むことが可能である。
【0093】
PEG高分子は、PEG鎖の端部においてではなく、PEGに沿って共有結合した、カルボキシルのような反応基を有するペンダントPEG分子を含むことが可能である。アルキレン基のような、ペンダント反応基は、直接的にまたはスペーサ部分を介して、PEGに付着させることができる。
【0094】
上述のPEGの形態に加えて、高分子はまた、上述の高分子のいずれかを含む、高分子内の1つ以上の弱い、または分解可能な結合(加水分解的に分解可能な結合など)によって調製することもできる。例えば、PEGは、加水分解を受ける高分子内のエステル結合によって調製することができる。以下に示すように、この加水分解は、より低い分子量のフラグメントへの高分子の開裂をもたらす:
【化7】

【0095】
ポリマー骨格内の分解可能な結合として有用な、他の加水分解的に分解可能な結合は、以下を含む。炭酸塩結合;例えば、アミンおよびアルデヒドの反応によって得られるイミン結合(Ouchi他(1977)Polymer Preprints 38(1):582〜3を参照のこと);例えば、リン酸基とアルコールの反応によって形成されるリン酸塩エステル結合;一般にヒドラジドおよびアルデヒドの反応によって形成されるヒドラゾン結合;一般にアルデヒドおよびアルコールの反応によって形成されるアセタール結合;例えば、ギ酸塩およびアルコールの反応によって形成されるオルトエステル結合;例えばPEGのような高分子の末端において、アミン基および別のPEG鎖のカルボキシル基によって形成されるアミド結合;例えば末端イソシアン酸塩基を有するPEGおよびPEGアルコールの反応によって形成されるウレタン結合;例えばPEGのような高分子の末端において、アミン基およびペプチドのカルボキシル基によって形成されるペプチド結合;例えば高分子の末端において、例えば、ホスホラミダイト基およびオリゴヌクレオチドの5’水酸基によって形成されるオリゴヌクレオチド結合。
【0096】
高分子抱合体のこのような任意の特徴、すなわち高分子鎖への1つ以上の分解可能な結合の導入は、投与時に、抱合体の最終的に所望する薬理学的特性に更なる制御を提供することが可能である。例えば、大きくて比較的不活性な抱合体(例、第IX因子部分に付着した1つ以上の高分子量のPEG鎖、例えば、約10,000を超える分子量を有する1つ以上のPEG鎖を有し、抱合体は基本的に生物活性を持たない)を投与することが可能であり、それは元のPEG鎖の一部を持つ生理活性抱合体を生成するように加水分解される。このように、抱合体の特性は、経時的に抱合体の生物活性の平衡を保たせるために、より効果的に調製することができる。
【0097】
当業者は、実質的に水溶性の高分子セグメントに関わる上述の説明は、決して網羅的でなく、単に例証を示すだけであり、上述の特性を有する全ての高分子物質を考慮したものであると認識するだろう。本願明細書で使用される場合、「高分子試薬」という用語は、概して分子全体のことであり、水溶性高分子セグメントおよび官能基を含むことができる。
【0098】
抱合体
【0099】
上述のように、本発明の抱合体は、(直接的にまたはスペーサ部分を介して)第IX因子部分に共有結合した水溶性高分子を含む。一般に、任意の所定の抱合体に対して、第IX因子部分に共有結合した1つ乃至4つの水溶性高分子が存在する(各水溶性高分子に対して、水溶性高分子は、直接的にまたはスペーサ部分を介して、第IX因子部分に付着させることができる)。しかし、場合によっては、抱合体は、第IX因子部分に共有結合した1、2、3、4、5、6、7、8つ以上の水溶性高分子を有することが可能である。さらに、抱合体は、第IX因子部分に共有結合した8つを超えない水溶性高分子、第IX因子部分に共有結合した7つを超えない水溶性高分子、第IX因子部分に共有結合した6つを超えない水溶性高分子、第IX因子部分に共有結合した5つを超えない水溶性高分子、第IX因子部分に共有結合した4つを超えない水溶性高分子、第IX因子部分に共有結合した3つを超えない水溶性高分子、および第IX因子部分に共有結合した2つを超えない水溶性高分子、を含むことが可能である。
【0100】
第IX因子部分と高分子(または高分子に付着したスペーサ部分)との特定の結合は、複数の因子に基づくものである。このような因子には、例えば、化学的に用いられる特定の結合、特定の第IX因子部分、第IX因子部分内の利用可能な官能基(高分子への付着、または好適な付着部位への変換に対して)、第IX因子部分内に更なる反応性官能基が存在する可能性、などが挙げられる。
【0101】
本発明の1つ以上の実施態様では、第IX因子部分と高分子(または高分子に付着したスペーサ部分)との結合は、アミド、ウレタン(別名カルバメート)、アミン、チオエーテル(別名硫化物)または尿素(別名カルバミド)のような、加水分解的に安定した結合である。1つ以上の実施態様では、トリアジン、アセチル、ヒドラジン、ジアゾニウム、または第IX因子部分を有するスクシンイミジルエステル官能基を有する、高分子試薬の反応によって結合は生じない。ある場合では、その結合がカルバメート結合でもカルバミド結合でもないことが好ましく、さらに、第IX因子部分に対して、イソシアン酸塩またはイソチオシアン酸塩種を持つ高分子誘導体の反応に基づいて、いかなる結合も形成されないことが好ましい。また、好適な加水分解的に安定な結合は、アミドである。アミドは、第IX因子部分内に含まれるカルボキシル基(例えば、第IX因子活性を有するペプチド部分の末端カルボキシル)の、アミノ末端高分子との反応によって容易に調製することができる。
【0102】
本発明の1つ以上の実施態様では、第IX因子部分と高分子(または高分子に付着したスペーサ部分)の結合は、分解可能な結合である。このように、水溶性高分子(および任意のスペーサ部分)の結合は、「開裂可能」である。すなわち、水溶性高分子(および任意のスペーサ部分)は、(加水分解、酵素のプロセス、または別の方法を介して)開裂し、それによって天然または非抱合の第IX因子部分が得られる。開裂可能な結合は、水溶性高分子(および任意のスペーサ部分)の任意のフラグメントを残さずに、生体内の第IX因子部分から分離する高分子(および任意のスペーサ部分)をもたらすことが好ましい。典型的な分解可能な結合には、炭酸塩、カルボン酸エステル、リン酸塩エステル、チオールエステル、無水物、アセタール、ケタール、アシルオキシアルキルエーテル、イミン、およびオルトエステルが挙げられる。このような結合は、従来技術において一般的に用いられる結合方法を使用して、第IX因子部分(例、タンパク質のカルボキシル基C末端、またはタンパク質内に含まれるセリンまたはスレオニンのようなアミノ酸の側鎖水酸基)、および/または高分子試薬の適切な改変によって容易に調製することができる。しかし、適切に活性化した高分子と、第IX因子活性を有する部分内に含まれる非改変の官能基との反応によって、容易に形成される加水分解性の結合が最も好ましい。
【0103】
結合に関して、本発明の1つ以上の実施態様では、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子にアミノ酸残基において共有結合した第IX因子部分を含む抱合体であって、前記アミノ酸残基は、直接的にまたは前記スペーサ部分を介して、CH2−C(O)−O−、−N(H)−C(O)CH2−O−、−C(O)−N(H)−、−N(H)−C(O)−CH2−O−、−C(O)−CH2−O−、−C(O)−CH2−CH2−C(O)−O−、ジアゾ、またはトリアジン結合により結合していない抱合体を提供する。
【0104】
抱合体(非抱合の第IX因子部分に対して)は、測定可能な程度の第IX因子活性を有し得るか又は有し得ない。すなわち、本発明による抱合体は、0%乃至100%又はそれ以上の未改変の親第IX因子部分の生物活性をどこかに持っている。好ましくは、ほとんどまたは全く第IX因子活性を持っていない化合物は、一般に、抱合体中の活性の欠損に関係なく、活性親分子(または第IX因子活性を有するその誘導体)が、水性誘導性の結合の開裂時に開放されるように、その部分に高分子を接続する加水分解性の結合を含む。このような活性は、用いられる第IX因子活性を有する特定の部分の公知の活性に応じて、好適な生体内または生体外モデルを使用して決定することが可能である。
【0105】
各水溶性高分子部分の開裂は、ウレタン、アミド、炭酸塩、またはエステル含有の結合のような、生理学的に開裂可能な、および/または酵素的に分解可能な結合の使用を介して容易にされることが最も好ましい。このように、(個々の水溶性高分子の開裂による)抱合体のクリアランス(clearance)は、所望のクリアランス特性を提供する、高分子の分子サイズおよび官能基のタイプを選択することによって、調製することができる。当業者は、高分子の適切な分子サイズ、および開裂可能な官能基を決定することができる。例えば、当業者は、決まりきった試験を使用して、最初に、異なる高分子重量および開裂可能な官能基を有する様々な高分子−第IX因子抱合体を調製し、次いで、その抱合体を患者に投与して、定期的に血液および/または尿のサンプリングを行って、各抱合体に対するクリアランスプロファイルを得ることによって、適切な分子サイズおよび開裂可能な官能基を決定することができる。試験した抱合体のそれぞれに対する一連のクリアランスプロファイルが得られれば、所望のクリアランスを有する抱合体を識別することができる。
【0106】
第IX因子部分を高分子に結合させる加水分解的に安定な結合を持つ抱合体に対して、抱合体は、一般に、測定可能な程度の第IX因子活性を持つ。例えば、このような抱合体は、非抱合の第IX因子部分の生物活性に対する、1つ以上の以下の割合を満たす生物活性を有するものと特徴付けられる:少なくとも約2%、少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約25%、少なくとも約30%、少なくとも約40%、少なくとも約50%、少なくとも約60%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約97%、少なくとも約100%、および105%以上(本願明細書に示す、および/または公知技術のような、好適なモデルにおいて測定した場合)。加水分解的に安定な結合(例、アミド結合)を有する抱合体は、少なくともある程度の未改変の親第IX因子部分の生物活性を有することが好ましい。
【0107】
以下、典型的な抱合体について説明する。第IX因子部分は、(少なくとも部分的に)天然の第IX因子に類似するか、またはこれに関するアミノ酸配列を共有するものと思われる。したがって、天然の第IX因子タンパク質内の特定の場所または原子を参照するが、このような参照は、便宜上のものであり、また、第IX因子活性を有する他の部分内の対応する場所または原子を容易に決定できる当業者に対するものである。特に、天然の第IX因子に対して本願明細書に提供される記述は、しばしば第IXa因子、およびフラグメント、欠損変異体、置換変異体、または上述のうちのいずれかの付加変異体に適用可能である。
【0108】
第IX因子部分上のアミノ基は、第IX因子部分と水溶性高分子との付着場所を提供することができる。天然の第IX因子は、27のリシン残基を含み、それぞれが、抱合および1つのアミノ終端に利用可能である、ε−アミノ基を有する。したがって、このような第IX因子部分の典型的な付着場所には、位置39、45、51、68、89、109、127、137、146、168、189、234、247、260、274、293、311、339、347、362、387、438、440、446、455、457、および459のうちのいずれか1つ以上における、(リシンのアミン含有側鎖を介して)アミノ酸での付着が挙げられる。さらに、第IX因子活性を有する任意のタンパク質のN末端アミンはまた、付着の場所としての機能を果たすこともできる。
【0109】
第IX因子部分の利用可能なアミンとの共有結合の形成に有用な、好適な水溶性高分子試薬には複数の例がある。具体的な例を、対応する抱合体とともに下記の表1に示す。表において、変数(n)は、単量体の繰り返し単位の数を表し、「−NH−F9」は、水溶性高分子への抱合に続く第IX因子部分を表す。表1に示す各高分子部分((OCH2CH2)nまたは(CH2CH2O)n)は、「CH3」基において終端するが、他の基(Hおよびベンジルなど)は、そのために置換することができる。
【0110】
【表1】

【表2】

【表3】

【表4】

【表5】

【表6】

【表7】

【0111】
第IX因子部分のアミン基への高分子試薬の抱合は、様々な技術によって達成することができる。1つの手法では、第IX因子部分は、スクシンイミジル誘導体(または、他の活性化エステル基であり、スクシンイミジル誘導体に対して記述された手法に類似する手法を、他の活性化エステル基含有の高分子試薬に使用するができる)によって官能化される高分子試薬に抱合することができる。この手法では、異なる反応条件(例えば、6乃至7のような低いpH、または異なる温度、および/または15℃未満)は、第IX因子部分上の異なる場所への高分子の付着をもたらすことができるが、スクシンイミジル基を持つ高分子試薬は、7.0乃至9.0のpHでの水性媒体において第IX因子部分に付着することができる。さらに、アミド結合は、アミン末端非ペプチド、水溶性高分子をアルデヒドまたは活性化カルボン酸基を持つ第IX因子部分と反応させることによって、形成することができる。
【0112】
典型的な抱合体は、以下の構造を含む
【化8】

{ここで、
(n)は、2乃至3400の値を有する整数である;
Xは、スペーサ部分であり、メチレン(「−CH2−」)、エチレン(「−CH2CH2−」)、およびプロピレン(「−CH2CH2CH2−」)のうちの1つのであることが好ましい;
R1は、有機ラジカルであり、Hまたはメチル(「−CH3」)であることが好ましい;且つ
F9は、第IX因子部分である}。
【0113】
高分子試薬に第IX因子部分を抱合するための有用な別の手法の典型例には、第IX因子部分の第1級アミンを、ケトン、アルデヒド、またはその水和型(例、ケトン水和物およびアルデヒド水和物)によって抱合するための、還元的アミノ化反応の使用が挙げられる。この手法では、第IX因子部分からの第1級アミンは、アルデヒドまたはケトン(または水和したアルデヒドまたはケトンの、対応するヒドロキシを含む基)のカルボニル基と反応し、それによってシッフ塩基を形成する。シッフ塩基は、次に、水素化ホウ素ナトリウムのような還元剤の使用を介して、安定した抱合体に還元的に変換することができる。選択的な反応(例えばN末端で可能である)は、特に、ケトンまたはα−メチル分岐アルデヒド、および/または特定の反応条件下(例、低いpH)で官能化される高分子によって可能である。
【0114】
カルボキシル基は、第IX因子部分上の付着場所としての機能を果たすことができる、別の官能基を表す。構造的に、抱合体は以下を含んで成る
【化9】

{ここで、F9および隣接したカルボニル基は、カルボキシルを含む第IX因子部分に対応し、Xは、スペーサ部分、好ましくはO、N(H)、およびSから選択されるヘテロ原子であり、POLYは、PEGのような水溶性高分子であり、任意にエンドキャップ部分において終端する}。
【0115】
C(O)−X結合は、末端官能基を持つ高分子誘導と、カルボキシル含有の第IX因子部分との反応によって生じる。上述のように、特定の結合は、用いられる官能基のタイプに依存する。高分子が末端官能基化されるか、または水酸基によって「活性化される」場合、得られる結合は、カルボン酸エステルであり、XはOとなる。ポリマー骨格がチオール基によって官能化される場合、得られる結合はチオエステルであり、XはSとなる。特定の多腕、分岐、または叉状の高分子を用いた場合、C(O)X部分、および、特にX部分は、比較的により複雑になる場合があり、より長い結合構造を含む場合がある。
【0116】
ヒドラジド部分を含む高分子試薬も、カルボニルでの抱合に有用である。第IX因子部分がカルボニル部分を含まない限り、カルボニル部分は、任意のカルボン酸(例、C末端カルボン酸)を還元することによって、および/またはグリコシル化または糖化された(添加された糖は、カルボニル部分を有する)バージョンの第IX因子部分を提供することによって、導入することができる。ヒドラジド部分を含む高分子試薬の具体的な例を、対応する抱合体とともに下記の表2に示す。さらに、活性化エステル(例、スクシンイミジル基)を含む任意の高分子試薬は、活性化エステルを含む高分子試薬を、ヒドラジン(NH2−NH2)またはtert−ブチルカルバゼート(NH2NHCO2C(CH3)3)と反応させることによって、ヒドラジド部分を含むように変換することができる。表において、変数(n)は、単量体の繰り返し単位の数を表し、「=C−F9」は、高分子試薬への抱合に続く第IX因子部分を表す。任意に、ヒドラゾン結合は、好適な還元剤を使用して還元することができる。表1に示す各高分子部分(例、(OCH2CH2)nまたは(CH2CH2O)n)は、「CH3」基において終端するが、他の基(Hおよびベンジルなど)は、そのために置換することができる。
【0117】
【表8】

【表9】

【0118】
第IX因子部分内に含まれるチオール基は、水溶性高分子に対する付着の有効な部位としての機能を果たすことができる。特に、第IX因子部分がタンパク質である場合、システイン残基はチオール基を提供する。このようなシステイン残基内のチオール基は、米国特許第5,739,208号および国際特許出願公開WO 01/62827に開示されるように、N−マレイミジル高分子または他の誘導体などの、チオール基との反応に特有である、活性化PEGと反応させることができる。
【0119】
理論によって制約する意図はないが、第IX因子内のシステイン残基の全てがジスルフィド結合に関与すると考えられる。その結果、ジスルフィド結合に関与するシステイン残基への抱合は、第IX因子の三次構造を分離させる場合があり、潜在的にその活性全体を著しく減じる場合がある。したがって、任意の特定の第IX因子部分のチオール基の不足が回避される限り、従来の合成技術を使用して、第IX因子部分にシステイン残基を添加することができる。システイン残基を添加し、このような手順を第IX因子部分に適応させることができる、国際特許出願公開WO 90/12874に開示されている手順を参照のこと。さらに、従来の遺伝子工学プロセスはまた、第IX因子部分にシステイン残基を導くために使用することもできる。
【0120】
具体的な例を、対応する抱合体とともに下記の表3に示す。表において、変数(n)は、単量体の繰り返し単位の数を表し、「−S−F9」は、水溶性高分子への抱合に続く第IX因子部分を表す。表3に示す各高分子部分((OCH2CH2)nまたは(CH2CH2O)n)は、「CH3」基において終端するが、他の基(Hおよびベンジルなど)は、そのために置換することができる。
【0121】
【表10】

【表11】

【表12】

【0122】
1つ以上のマレイミド官能基(マレイミドが第IX因子部分上のアミンまたはチオール基と反応するかどうかに関係なく)を持つ、水溶性高分子から形成される抱合体に関して、第IX因子部分の対応するマレアミン酸型はまた、水溶性高分子と反応することもできる。特定の条件下(例えば、pH約7乃至9、および水の存在下)で、マレイミド環が「開いて」、対応するマレアミン酸を形成する。マレアミン酸は、次に、第IX因子部分のアミンまたはチオール基と反応することができる。典型的なマレアミン酸ベースの反応を、概略的に下記に示す。POLYは、水溶性高分子を表し、F9は第IX因子部分を表す。
【化10】

【0123】
本発明による代表的な抱合体は、以下の構造を有することができる。
【化11】

{ここで、POLYは、水溶性高分子であり、Lは、任意のリンカーであり、Zは、O、NH、およびSから成る群から選択されるヘテロ原子であり、Yは、C2-10アルキル、C2-10置換アルキル、アリール、および置換アリールから成る群から選択され、F9は、第IX因子部分である}。第IX因子部分と反応してこのタイプの抱合体を得ることができる高分子試薬は、米国特許出願公開第2005/0014903号に開示されている。
【0124】
高分子試薬に関して、本願明細書および他で開示されるものは、商業的な供給元(例、Nektar Therapeutics、Hunts ville AL)から購入することができる。さらに、高分子試薬を調製するための方法が、文献に記述されている。
【0125】
第IX因子部分と水溶性高分子との付着は、直接的(第IX因子部分と水溶性高分子との間に介在する原子がない)に、または非直接的(第IX因子部分と水溶性高分子との間に1つ以上の原子がある)に行うことができる。間接的な付着に関して、「スペーサ部分」は、第IX因子部分と水溶性高分子とののリンクとしての機能を果たす。スペーサ部分を構成する1つ以上の原子には、1つ以上の炭素原子、窒素原子、硫黄原子、酸素原子、およびそれらを組み合わせたものが挙げられる。スペーサ部分は、アミド、第2級アミン、カルバメート、チオエーテルおよび/またはジスルフィド基を含むことができる。特定のスペーサ部分の例には、これに限定されないが、−O、−S、−S−S−、−C(O)−、−C(O)−NH−、−NH−C(O)−NH−、−O−C(O)−NH−、−C(S)−、−CH2−、−CH2−CH2−、−CH2−CH2−CH2−、−CH2−CH2−CH2−CH2−、−O−CH2−、−CH2−O−、−O−CH2−CH2−、−CH2−O−CH2−、−CH2−CH2−O−、−O−CH2−CH2−CH2−、−CH2−O−CH2−CH2−、−CH2−CH2−O−CH2−、−CH2−CH2−CH2−O−、−O−CH2−CH2−CH2−CH2−、−CH2−O−CH2−CH2−CH2−、−CH2−CH2−O−CH2−CH2−、−CH2−CH2−CH2−O−CH2−、−CH2−CH2−CH2−CH2−O−、−C(O)−NH−CH2−、−C(O)−NH−CH2−CH2−、−CH2−C(O)−NH−CH2−、−CH2−CH2−C(O)−NH−、−C(O)−NH−CH2−CH2−CH2−、−CH2−C(O)−NH−CH2−CH2−、−CH2−CH2−C(O)−NH−CH2−、−CH2−CH2−CH2−C(O)−NH−、−C(O)−NH−CH2−CH2−CH2−CH2−、−CH2−C(O)−NH−CH2−CH2−CH2−、−CH2−CH2−C(O)−NH−CH2−CH2−、−CH2−CH2−CH2−C(O)−NH−CH2−、−CH2−CH2−CH2−C(O)−NH−CH2−CH2−、−CH2−CH2−CH2−CH2−C(O)−NH−、−C(O)−O−CH2−、−CH2−C(O)−O−CH2−、−CH2−CH2−C(O)−O−CH2−、−C(O)−O−CH2−CH2−、−NH−C(O)−CH2−、−CH2−NH−C(O)−CH2−、−CH2−CH2−NH−C(O)−CH2−、−NH−C(O)−CH2−CH2−、−CH2−NH−C(O)−CH2−CH2−、−CH2−CH2−NH−C(O)−CH2−CH2−、−C(O)−NH−CH2−、−C(O)−NH−CH2−CH2−、−O−C(O)−NH−CH2−、−O−C−(O)−NH−CH2−CH2−、−NH−CH2−、−NH−CH2−CH2−、−CH2−NH−CH2−、−CH2−CH2−NH−CH2−、−C(O)−CH2−、−C(O)−CH2−CH2−、−CH2−C(O)−CH2−、−CH2−CH2−C(O)−CH2−、−CH2−CH2−C(O)−CH2−CH2−、−CH2−CH2−C(O)−、−CH2−CH2−CH2−C(O)−NH−CH2−CH2−NH−、−CH2−CH2−CH2−C(O)−NH−CH2−CH2−NH−C(O)−、−CH2−CH2−CH2−C(O)−NH−CH2−CH2−NH−C(O)−CH2−、−CH2−CH2−CH2−C(O)−NH−CH2−CH2−NH−C(O)−CH2−CH2−、−O−C(O)−NH−[CH2]h−(OCH2CH2)j−、二価シクロアルキル基、−O−、−S−、アミノ酸、−N(R6)−、および上述のものを2つ以上の組み合わせたもの、から成る群から選択されるものが挙げられ、ここで、R6は、H、またはアルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アリール、および置換アリールから成る群から選択される有機ラジカルであり、(h)はゼロ乃至6であり、(j)はゼロ乃至20である。他の特定のスペーサ部分は、次の構造を有する。−C(O)−NH(CH2)1-6−NH−C(O)−、−NH−C(O)−NH−(CH2)1-6−NH−C(O)−、および−O−C(O)−NH−(CH2)1-6−NH−C(O)−、ここで、各メチレンに続く下付き数字の値は、構造に含まれるメチレンの数を示し、例えば、(CH2)1-6は、その構造が、1、2、3、4、5または、6つのメチレンを含むことができることを示す。さらに、上述のスペーサのうちのいずれも、1乃至20の酸化エチレンモノマー単位(すなわち、−(CH2CH2O)1-20)を含む酸化エチレンオリゴマ鎖を更に含むことが可能である。すなわち、酸化エチレンオリゴマ鎖は、スペーサ部分の前か後に、および任意に2つ以上の原子を含むスペーサ部分のいずれか2つの原子間に生じさせることができる。また、オリゴマ鎖は、オリゴマが高分子セグメントに隣接し、単に高分子セグメントの延長を表すだけである場合には、スペーサ部分の一部であるとみなされない。スペーサ部分は、糖または炭水化物を含まず、抱合体には、直接的にまたはスペーサ部分を介して、糖または次に第IX因子部分に付着した炭水化物に付着した水溶性高分子が不足していることが好ましい。
【0126】
場合によっては、抱合体は、単一の第IX因子部分に関連する単一の水溶性高分子を有するだけの場合がある。その結果、水溶性高分子を非線形の水溶性高分子にすること(および非線形高分子試薬を使用した抱合体の調製)が望まれる場合がある。多分岐水溶性高分子が含まれるが、好適な非線形の水溶性高分子は、分岐水溶性高分子である。分岐水溶性高分子を組み込むことによって、例えば、単一の高分子と比較して、各付着部位に対する分子量を2倍にすることができる。
【0127】
水溶性高分子が分岐形態である、本発明の典型的な抱合体には、リシンベースの分岐高分子を含む分岐形態、および以下の構造を含む分岐手法が挙げられる:
【化12】

{ここで、各(n)は、それぞれ2乃至3400の値を有する整数である}。
【0128】
本発明の典型的な抱合体は、以下の構造を含む:
【化13】

{ここで、
各(n)は、それぞれ2乃至3400の値を有する整数である;
Xは、スペーサ部分である;
(b)は、2乃至6の値を有する整数である;
(c)は、2乃至6の値を有する整数である;
各発生におけるR2は、それぞれHまたは低級アルキルである;
F9は、第IX因子部分である}。
【0129】
本発明の典型的な抱合体は、以下の構造を含む:
【化14】

{ここで、
各(n)は、それぞれ2乃至3400の値を有する整数であり;且つ
F9は、第IX因子部分である}。
【0130】
本発明の別の典型的な抱合体は、以下の構造を含む:
【化15】

{ここで、
各(n)は、それぞれ2乃至3400の値を有する整数である;
(a)は、ゼロでまたは1である;
Xは、存在する場合、1つ以上の原子を含むスペーサ部分である;
(b’)は、ゼロまたは1乃至10の値を有する整数である;
(c)は、1乃至10の値を有する整数である;
各発生におけるR2は、それぞれHまたは有機ラジカルである;
各発生におけるR3は、それぞれHまたは有機ラジカルである;且つ
F9は、第IX因子部分である}。
【0131】
本発明の典型的な抱合体は、以下の構造を含む:
【化16】

{ここで、
各(n)は、それぞれ2乃至3400の値を有する整数であり;且つ
F9は、第IX因子部分である}。
【0132】
組成物
【0133】
抱合体は、一般に組成物の一部である。概して、組成物は複数の抱合体を含み、必ずではないが、それぞれが、1つの第IX因子部分に別々に共有結合した、1つ、2つ、3つ、または4つの水溶性高分子を有することが好ましい。しかし、組成物はまた、第IX因子活性を有する任意の所定の部分に付着した、4つ、5つ、6つ、7つ、8つ以上の高分子を有する他の抱合体を含むこともできる。さらに、本発明は、組成物が複数の抱合体を含み、それぞれの抱合体が、第IX因子部分に共有結合した1つの水溶性高分子を含む場合、および組成物が、第IX因子部分に共有結合した、2つ、3つ、4つ、5つ、6つ、7つ、8つ以上の水溶性高分子を含む場合を含む。
【0134】
本発明の1つ以上の実施態様では、複数の抱合体を含む組成物であって、前記組成物中の全ての抱合体の少なくとも約80%は、それぞれが1つ、2つ、3つ、または4つの水溶性高分子に共有結合した第IX因子部分を含み、さらに、前記抱合体中の各水溶性高分子に対して、前記第IX因子部分は、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に結合した、組成物を提供する。
【0135】
組成物の抱合体に関して、組成物は、一般に次の特性のうちの1つ以上を満たす:組成物中の抱合体の少なくとも約85%が、第IX因子部分に付着した1つ乃至5つの高分子を有する;組成物中の抱合体の少なくとも約85%が、第IX因子部分に付着した1つ乃至4つの高分子を有する;組成物中の抱合体の少なくとも約85%が、第IX因子部分に付着した1つ乃至3つの高分子を有する;組成物中の抱合体の少なくとも約85%が、第IX因子部分に付着した1つ乃至2つの高分子を有する;組成物中の抱合体の少なくとも約85%が、第IX因子部分に付着した1つの高分子を有する(すなわち、モノPEG化である);組成物中の抱合体の少なくとも約95%が、第IX因子部分に付着した1つ乃至5つの高分子を有する;組成物中の抱合体の少なくとも約95%が、第IX因子部分に付着した1つ乃至4つの高分子を有する;組成物中の抱合体の少なくとも約95%が、第IX因子部分に付着した1つ乃至3つの高分子を有する;組成物中の抱合体の少なくとも約95%が、第IX因子部分に付着した1つ乃至2つの高分子を有する;組成物中の抱合体の少なくとも約95%が、第IX因子部分に付着した1つの高分子を有する;組成物中の抱合体の少なくとも約99%が、第IX因子部分に付着した1つ乃至5つの高分子を有する;組成物中の抱合体の少なくとも約99%が、第IX因子部分に付着した1つ乃至4つの高分子を有する;組成物中の抱合体の少なくとも約99%が、第IX因子部分に付着した1つ乃至3つの高分子を有する;組成物中の抱合体の少なくとも約99%が、第IX因子部分に付着した1つ乃至2つの高分子を有する;および組成物中の抱合体の少なくとも約99%が、第IX因子部分に付着した1つの高分子を有する(すなわち、モノPEG化である)。
【0136】
1つ以上の実施態様では、抱合体を含む組成物は、アルブミンが遊離したもの、または実質的に遊離したものであることが好ましい。また、組成物は、第IX因子活性を有さないタンパク質が遊離したもの、または実質的に遊離したものであることが好ましい。したがって、85%の、より好ましくは95%の、および最も好ましくは99%のアルブミンが遊離したものが好ましい。加えて、85%の、より好ましくは95%の、および最も好ましくは99%の第IX因子活性を有さないタンパク質が遊離したものが好ましい。アルブミンが組成物中に存在する限り、本発明の典型的な組成物は、アルブミンに第IX因子部分の残留物を結合させているポリ(エチレングリコール)高分子を含む抱合体が、実質的に遊離している。
【0137】
任意の所定の部分に対する高分子の所望の数の制御は、適切な高分子試薬、第IX因子部分に対する高分子試薬の比率、温度、pH条件、および抱合反応の他の側面を選択することによって、達成することができる。さらに、不要な抱合体(例えば、4つ以上の高分子を付着した抱合体)の還元または除去は、精製手段を介して達成することができる。
【0138】
例えば、高分子−第IX因子部分抱合体を精製して、異なる抱合種を得る/分離させることができる。特に、生成混合物は、精製して、第IX因子部分ごとに1つ、2つ、3つ、4つ、5つ以上のPEG、典型的には第IX因子部分ごとに1つ、2つ、または3つのPEGのいずれかの平均を得ることができる。最終的な抱合体の反応混合物の精製のための方策は、例えば、用いる高分子試薬の分子量、特定の第IX因子部分、所望の投与計画、および個々の抱合体の残留活性および生体内の特性を含む、複数の因子に依存する。
【0139】
必要に応じて、ゲル濾過クロマトグラフィおよび/またはイオン交換クロマトグラフィを使用して、異なる分子量を有する抱合体を分離することができる。すなわち、ゲル濾過クロマトグラフィは、それらの異なる分子量(差異は、基本的に水溶性高分子部分の平均分子量に対応する)に基づいて、異なる番号をつけた(例えば、1−mer、2−mer、3−merなどであり、「1−mer」は、第IX因子部分に1つの高分子が付着したことを示し、「2−mer」は、第IX因子部分に2つの高分子が付着したことを示す、など)高分子対第IX因子部分の比率を細分するために使用される。例えば、55,000ダルトンのタンパク質が、約20,000ダルトンの分子量を有する高分子試薬に、ランダムに抱合される典型的な反応では、得られる反応混合物は、未改変タンパク質(約55,000ダルトンの分子量を有する)、モノPEG化タンパク質(または「1−mer」)(約75,000ダルトンの分子量を有する)、ジPEG化タンパク質(または「2−mer」)(約95,000ダルトンの分子量を有する)、などを含むことが可能である。
【0140】
この手法は、異なる分子量を有するPEGおよび他の高分子−第IX因子部分の抱合体を分離するために使用することができるが、この手法は、一般に、第IX因子部分内に異なる高分子付着部位を有する、位置異性体の分離には概して効果がない。例えば、ゲル濾過クロマトグラフィは、回収されたPEG−merのそれぞれが、第IX因子部分内の異なる反応性アミノ基(例、リシン残基)に付着したPEGを含む場合があるが、1−mer、2−mer、3−merなどの混合物を互いから分離するために使用することができる。
【0141】
この種の分離を行うための好適なゲル濾過カラムには、Amarcham Biosciences(Piscataway、NJ)から入手可能な、Superdex(登録商標)およびSephadex(登録商標)が挙げられる。特定のカラムの選択は、所望の分留範囲に依存する。溶出は、概して、リン酸塩、酢酸などのような好適なバッファを使用して行われる。収集した留分は、例えば、次のような複数の異なる方法によって分析することが可能である:(i)タンパク質含有量に対する280nmでの吸収、(ii)基準として、ウシ血清アルブミンを使用した染料ベースのタンパク質の分析、(iii)PEG含有量のためのヨウ素試験(Sims他(1980)、Anal.Biochem、107:60〜63)、(iv)ドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動(SDS PAGE)、その後のヨウ化バリウムによる染色、及びより高速の液体クロマトグラフィ。
【0142】
位置異性体の分離は、例えばC18カラムまたはC3カラム(Amersham BiosciencesまたはVydac)を使用した、逆相−高速液体クロマトグラフィ(RP−HPLC)法を用いた逆相クロマトグラフィによって、または、例えばAmersham Biosciencesから入手可能なSepharose(登録商標)イオン交換カラムのようなイオン交換カラムを使用した、イオン交換クロマトグラフィによって行うことができる。いずれの手法も、同じ分子量(位置異性体)を有する高分子−活性剤異性体を分離するために使用することができる。
【0143】
組成物は、第IX因子活性を有さないタンパク質が実質的に遊離したものであることが好ましい。さらに、組成物は、他の全ての非共有結合的に付着した水溶性高分子が実質的に遊離したものであることが好ましい。しかし、状況によっては、組成物は、高分子−第IX因子部分抱合体および非抱合第IX因子の混合物を含むことができる。
【0144】
任意に、本発明の組成物は、医薬として許容される賦形剤を更に備える。必要に応じて、医薬として許容される賦形剤は、抱合体に添加して組成物を形成することができる。
【0145】
典型的な賦形剤には、これに限定されないが、炭水化物、無機塩類、抗菌剤、酸化防止剤、界面活性剤、バッファ、酸、ベース、およびそれらを組み合わせたものから成る群から選択したものが挙げられる。
【0146】
糖のような炭水化物、アルジトールのような誘導体化された糖、アルドン酸、エステル化された糖、および/または糖高分子は、賦形剤として存在することが可能である。特定の炭水化物賦形剤は、例えば、次のようなものが含まれる:フルクトース、マルトース、ガラクトース、グルコース、D−マンノース、ソルボース、などの単糖類;ラクトース、サッカロース、トレハロース、セロビオース、などの二糖類;ラフィノース、メレチトース、マルトデキストリン、デキストラン、スターチ、などの多糖類;および、マンニトール、キシリトール、マルチトール、ラクチトール、キシリトール、ソルビトール(グルシトール)、ピラノシルソルビトール、ミオイノシトールなどのアルジトール類。
【0147】
賦形剤はまた、クエン酸、塩化ナトリウム、塩化カリウム、硫酸ナトリウム、硝酸カリウム、塩基性リン酸ナトリウム、二塩基性リン酸ナトリウム、およびそれらを組み合わせたもの、のような無機塩またはバッファも含むことができる。
【0148】
組成物はまた、微生物の成長を予防または抑止するための抗菌剤も含むことができる。本発明に好適な抗菌剤の例には、これに限定されないが、塩化ベンザルコニウム、塩化ベンゼトニウム、ベンジルアルコール、塩化セチルピリジニウム、クロロブタノール、フェノール、フェニルエチルアルコール、硝酸フェニル水銀、チメロサール、およびそれらを組み合わせたもの、が挙げられる。
【0149】
酸化防止剤も、同様に組成物中に存在させることができる。酸化防止剤は、酸化を防ぐために使用され、それによって、抱合体の劣化または他の構成要素の生成を防ぐ。本発明に使用する好適な酸化防止剤には、例えば、アスコルビルパルミテート、ブチルヒドロキシアニソール、ブチルヒドロキシトルエン、次亜リン酸、モノチオグリセロール、プロピルガレート、亜硫酸水素ナトリウム、フォルムアルデヒドスルホキシル酸ナトリウム、メタ重亜硫酸ナトリウム、およびそれらを組み合わせたものが挙げられる。
【0150】
界面活性剤は、賦形剤として存在させることができる。典型的な界面活性剤には、次のようなものが挙げられる:「Tween20」および「Tween80」のようなポリソルベート、およびF68およびF88(どちらも、BASF、Mount Olive、New Jerseyから入手可能)のようなプルロニック;ソルビタンエステル;レシチンおよび他のホスファチジルコリン、ホスファチジルエタノールアミン(リポソーム型でないことが好ましい)、脂肪酸、および脂肪酸エステルなどの、リン脂質のような脂質;コレステロールのようなステロイド;および、EDTA、亜鉛、および他のこのような好適な陽イオンのようなキレート剤。
【0151】
酸または塩基は、組成物中の賦形剤として存在させることができる。使用できる酸の例には、これに限定されないが、塩酸、酢酸、リン酸、クエン酸、リンゴ酸、乳酸、ギ酸、トリクロロ酢酸、硝酸、過塩素酸、リン酸、硫酸、フマル酸、およびそれらを組み合わせたものから成る群から選択されたものが挙げられる。好適な塩基の例には、これに限定されないが、水酸化ナトリウム、酢酸ナトリウム、水酸化アンモニウム、水酸化カリウム、酢酸アンモニウム、酢酸カリウム、リン酸ナトリウム、リン酸カリウム、クエン酸ナトリウム、ギ酸ナトリウム、硫酸ナトリウム、硫酸カリウム、フマル酸カリウム、およびそれらを組み合わせたものから成る群から選択されたものが挙げられる。
【0152】
組成物中の抱合体(すなわち、活性剤と高分子試薬との間に形成される抱合体)の量は、複数の因子によって変化するが、組成物を単回服用量の容器(例、バイアル)に保存すれば、最適に治療有効量となる。さらに、医薬品は、注射器に収容することができる。治療有効量は、どの量が臨床的に所望のエンドポイントをもたらすかを決定するために、抱合体の量を増加させながらの繰り返し投与によって決定することができる。
【0153】
組成物中の任意の個々の賦形剤の量は、賦形剤の活性および組成物の特定のニーズによって変化する。一般に、任意の個々の賦形剤の最適量は、決まりきった試験を介して、すなわち、さまざまな量(少量から多量)の賦形剤を含む組成物を調製し、安定性および他のパラメータを調査し、次いで、著しい副作用のない最適性能が達成される範囲を決定することによって、決定される。
【0154】
しかし、概して賦形剤は、約1乃至約99重量%、好ましくは約5乃至約98重量%、より好ましくは約15乃至約95重量%、最も好ましくは濃度30重量%未満で、組成物中に存在する。
【0155】
他の賦形剤とともにこれらの上述の医薬品賦形剤は、「Remington:The Sciene & Practice of Pharmacy」19th ed.、 Williams & Williams、(1995)、「Physician’s Desk Reference」、52nd、Medical Economics、Montvale、NJ(1998)、およびKibbe、A.H.、Handbook of Pharmaceutical Excipients、3rd Edition、American Pharmaceutical Association、Washington D.C.、2000、に記述されている。
【0156】
組成物は、全種類の製剤形態、および特に、例えば液体と同様に再構成することができる粉末または凍結乾燥したものなどの、注射に好適なものを包含する。注射前に固体組成物を再構成する好適な希釈剤の例には、注射用の静菌性水、5%デキストロース水溶液、リンガー溶液、生理食塩水、滅菌水、脱イオン水、およびそれらを組み合わせたものが挙げられる。液体の医薬組成物に関しては、溶液および懸濁液が想定される。
【0157】
本発明の組成物は、必ずではないが、一般に注射によって投与されるので、投与直前は、概して液体溶液または懸濁液である。医薬品はまた、シロップ、クリーム、軟膏、錠剤、粉末などのような他の形態を取ることもできる。他の投与様式には、肺、直腸、経皮的、経粘膜的、経口的、髄膜下、皮下、動脈内などが挙げられる。
【0158】
本発明はまた、抱合体による治療に応答する症状に罹患する患者に、本願明細書において提供されるような抱合体を送達するための方法も提供する。この方法は、一般に注射によって治療有効量の抱合体を送達する(医薬組成物の一部として提供されることが好ましい)段階を含む。この抱合体(一般に医薬組成物の一部として)は、例えば静脈注射、筋肉内注射、皮下注射などによって送達することができる。非経口投与のための好適な処方のタイプには、特に、すぐに注射できる溶液、使用前に溶媒と混合する乾燥粉末、すぐに注射できる懸濁液、使用前にビヒクルと混合する乾燥不溶性組成物、および投与前に希釈する原液が挙げられる。
【0159】
この方法は、抱合体を投与することによって改善または予防することができる症状を有する患者の治療に使用することが可能である。当業者は、どの条件で特定の抱合体が有効に治療できるのかを理解するであろう。例えば、この抱合体は、血友病Bに罹患している人を治療するために、補充療法として、または予防に基づくものとして使用することができる。予防のための抱合体の投与には、血友病Bを罹患している患者が手術を受けようとしている状況が挙げられ、抱合体は、手術の1乃至4時間前に投与される。さらに、抱合体は、抑制できない出血に対する予防薬として、任意に血友病に罹患していない患者での使用に適している。したがって、例えば、抱合体は、出血が抑制できないというリスクのある患者に手術前に投与することができる。
【0160】
投与される実際の用量は、対象者の年齢、体重、および全体的な状態、および治療する症状の程度、医療関係者の判断、および投与される抱合体によって変化する。治療有効量は、当業者に公知であり、および/または関連する参照文および文献に記述される。概して、治療有効量は、重量基準で約0.001mg乃至100mgの範囲となり、0.01mg/日乃至75mg/日の用量が好ましく、0.10mg/日乃至50mg/日の用量がより好ましい。活性を基準に、活性の国際単位に基づく対応用量は、当業者によって計算することができる。
【0161】
任意の所定の抱合体(また、好ましくは医薬組成物の一部として提供される)の単回服用量は、臨床医の判断、患者のニーズなどに基づいて、様々な投薬スケジュールで投与することができる。特定の投薬スケジュールは、当業者によって公知であるか、または決まりきった方法を使用して実験的に決定することができる。典型的な投薬スケジュールには、これに限定されないが、1日5回、1日4回、1日3回、1日2回、1日1回、週3回、週2回、週1回、月2回、月1回、およびそれらを組み合わせた投与が挙げられる。臨床的な終点を達成したら、組成物の投薬を中止する。
【0162】
本発明は、その好適な実施態様に関して開示されているが、その上述の説明およびそれに続く例は例示を目的としたものであり、本発明の範囲を制限するものではないと理解されるべきである。本発明の範囲内の他の側面、利点、および変更は、本発明に関係する当業者に明らかである。
【実施例】
【0163】
実験
本発明の実施は、特に明記しない限り、従来技術の範囲内にある、有機合成などの従来の技術を用いる。このような技術は、文献において完全に説明される。試薬および物質は、逆に定められていなければ市販のものである。前掲の、J.March、Organic Chamistry:Reactions Mechanisms and Structure、4th Ed.(New York:Wiley−Interscience、1992)を参照のこと。
【0164】
以下の諸例では、使用される数(例、量、温度など)に関して、精度を確保するよう努めたが、ある程度の実験誤差および偏差を考慮しなければならない。他に示されない限り、温度は摂氏温度であり、圧力は海面位での大気圧またはほぼ大気圧である。
【0165】
当業者が公知である他の略語を参照するが、他の試薬および物質が使用され、当業者が公知の他の方法が使用され、次のリストおよび方法の記述は便宜上提供されるものである。
【0166】
NaCNBH3 ナトリウムシアノボロハイドライド、95%(Aldrich)
【0167】
HCl 塩酸、氷(Fisher)
【0168】
KまたはkDa キロダルトン
【0169】
アセトニトリル (Fisher Optima)
【0170】
TFA トリフルオロ酢酸、HPLCグレード(JT Baker)
【0171】
PBS リン酸緩衝生理食塩水(Sigma)
【0172】
SEC サイズ排除クロマトグラフィ
【0173】
HPLC 高速液体クロマトグラフィ
【0174】
SDS−PAGE ドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動
【0175】
HEPES[4−(2−ヒドロキシエチル)−1−ピペラジニースアネスルホン酸(piperazineethanesulfonic acid)]認定されたバイオテクノロジ性能、99.5%以上(Sigma)
【0176】
エチルアルコール、USP、Absolute−200 Proof(AAPER)
【0177】
NuPAGE(登録商標) MES[2−(N−モルホリノ)エタンスルホン酸]SDSランニングバッファ(Invitrogen Corporation、Carlsbad CA)
【0178】
NuPAGE(登録商標) 4xLDS(リチウム硫酸ドデシル)サンプルバッファ(Invitrogen Corporation、Carlsbad CA)
【0179】
SigmaMarker、低範囲(M.W.6,500−66,000)(Sigma)
【0180】
SigmaMarker、高範囲(M.W.36,900−205,000)(Sigma)
【0181】
NuPAGE(登録商標) Novex Bis−Tris[Bis(2−ヒドロキシエチル)イミノ−tris(ヒドロキシメチル)メタン−HCl]ゲル(Invitrogen Corporation、Carlsbad CA)
【0182】
SEC−HPLC分析
【0183】
サイズ排除クロマトグラフィ(SEC)は、Agilent 1100 HPLCシステム(Agilent)上で使用した。SEC−HPLCを使用して分析するサンプルに対して、各サンプルは、pH7.2で、SHODEXタンパク質、KW−804カラム(昭和電工、東京、日本)を使用して分析した。カラムの流量は、0.5mL/分に設定した。抽出されたタンパク質およびPEG−タンパク質抱合体は、波長を280nmに設定したUVベースの手法を使用して検出した。
【0184】
SDS−PAGE分析
【0185】
ドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動(SDS−PAGE)は、XCELL SURELOCK Mini−Cell電気泳動システム(Invitrogen Corporation、Carlsbad CA)を使用して行った。SDS−PAGEを使用して分析するサンプルに対して、各サンプルは、4x LDS Sample Buffer(Invitrogen Corporation、Carlsbad CA)と混合した。調製したサンプルは、次いで、NuPAGE Novex4乃至12%のBis−Trisゲル上に装填され、NuPAGE(登録商標) MESランニングバッファ(Invitrogen Corporation、Carlsbad CA)を使用して、200Vで30分間実施した。
【0186】
RP−HPLC分析
【0187】
逆相−高速液体クロマトグラフィは、C3逆カラム(Hamilton、Zorbax)を使用して実施した。30乃至80%勾配のアセトニトリルを、0.5mL/分で、温度上昇とともに30分にわたって使用した。
【0188】
配列番号1のアミノ酸配列に対応する組み換え第IX因子を、例1乃至16で使用した。第IX因子は、L−ヒスチジンおよびグリシンの両方を含むバッファで得た。バッファ内のL−ヒスチジンおよびグリシンに関連するアミン基は、第IX因子に関連するアミン基と競合するので、アミン指向性高分子試薬を使用して抱合を達成するときに、第IX因子の抱合の収率を改善するために、アミン含有バッファの交換が必要であった。
【0189】
簡潔には、アミン含有バッファは、交換されるバッファの量に基づいて、2つのうちの1つの手法によって、アミン遊離バッファと交換した。比較的少量のバッファに対しては、メーカーが提供するプロトコルに基づいて、500μLのZeba Desalt遠心カラム(Pierce Biotechnology、Rockford IL)を使用した。比較的大量のバッファに対しては、メーカーが提供するプロトコルに基づいて、10,000のまたは30,000ダルトンの分子量カットオフで、2mLのCENTRICON(登録商標)遠心フィルタ装置(Millipore Corporation、Billierica MA)を使用した。エタノールを伴わない諸例で使用される全てのサンプルは、pH7.5を有する1xPBSバッファに変更し、一方で、エタノールを伴う諸例で使用される全てのサンプルは、10%エタノール含有の第IX因子反応混合物を形成するようにエタノールを添加した、pH7.5を有する1xPBSバッファに交換した。
【0190】
配列番号1のアミノ酸配列に対応する組み換え第IX因子を含むアミン遊離バッファを、例1乃至16で使用した。第IX因子の原液は、約0.2mg/mL乃至0.55mg/mLの第IX因子を含むものとした。
実施例1
mPEG−SMB(30kDa)による第IX因子のPEG化
(高分子と第IX因子の比率 1:1;エタノールなし)
【化17】

【0191】
アルゴン下で−20℃で保存したmPEG−SMB(30kDa)を室温まで加温した。加温したmPEG−SMB(4.1mg)を、1mLの2mM HClに溶解して、mPEG−SMB溶液を作製した。第IX因子に対するmPEG−SMBのモル比が1:1になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、mPEG−SMB溶液を添加した。mPEG−SMBを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子へのmPEG−SMBの結合が可能になるように、SDS−PAGEをサンプル上で実施した後に、その反応溶液を室温で3時間撹拌し、モノ抱合物質(「1−mer」)の存在を確認した。図1に示したゲルの「1:1 30K SMB」と表記したレーンを参照のこと。その後、その反応溶液を4℃で15時間撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0192】
RP−HPLC(C3)および第2のSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。第2のSDS−PAGEの結果に基づいて、抱合を示した。図2に示したゲルの「1:1 30K SMB」と表記したレーンを参照のこと。RP−HPLC(C3)を使用して、得られた抱合体溶液の構成要素を分離した。得られたクロマトグラムは、0.54%の収率を示した(100%のモノPEG化または「1−mer」種を表す)。図5に示すクロマトグラムを参照のこと。
【0193】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SMBを使用して、他の抱合体を調製することができる。
実施例2
mPEG−SMB(30kDa)による第IX因子のPEG化
(高分子と第IX因子の比率10:1;エタノールなし)
【化18】

【0194】
アルゴン下で−20℃で保存したmPEG−SMB(30kDa)を室温まで加温した。加温したmPEG−SMB(4.1mg)を、1mLの2mM HClに溶解して、mPEG−SMB溶液を作製した。第IX因子に対してmPEG−SMBが10モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、mPEG−SMB溶液を添加した。mPEG−SMBを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子へのmPEG−SMBの結合が可能になるように、SDS−PAGEをサンプル上で実施した後に、その反応溶液を室温で3時間撹拌し、モノ抱合物質(「1−mer」)の存在を確認した。図1に示すゲルの「10:1 30K SMB」と表記したレーンを参照のこと。その後、その反応溶液を4℃で15時間撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0195】
RP−HPLC(C3)および第2のSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。第2のSDS−PAGEの結果に基づいて、抱合を示した。図2に示すゲルの「10:1 30K SMB」と表記したレーンを参照のこと。RP−HPLC(C3)を使用して、得られた抱合体溶液の構成要素を分離した。得られたクロマトグラムは、6.4%の収率を示した(100%のモノPEG化または「1−mer」種を表す)。図6に示すクロマトグラムを参照のこと。
【0196】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。したがって、この実験を、4℃で一晩反応を継続する前に、室温で長時間繰り返した場合、SDS−PAGEゲルに見られる暗帯によって表されるように抱合体の収率が増加した。図4の「10:1 30K SMB」と表記したレーンを参照のこと。ここに記述される同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SMBを使用して、他の抱合体を調製することができる。
実施例3
分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)による第IX因子のPEG化
(高分子と第IX因子の比率1:1;エタノールなし)
【化19】

【0197】
アルゴン下で−20℃で保存した分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)を室温まで加温した。加温した分岐mPEG2−N−ヒドロキシスクシンイミド(2.0mg)を、1mLの2mM HClに溶解して、分岐mPEG2−N−ヒドロキシスクシンイミド溶液を作製した。第IX因子に対するmPEG2−N−ヒドロキシスクシンイミドのモル比が1:1になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、mPEG2−N−ヒドロキシスクシンイミド溶液を添加した。分岐mPEG2−N−ヒドロキシスクシンイミドを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子への分岐mPEG2−N−ヒドロキシスクシンイミドの結合が可能になるように、SDS−PAGEをサンプル上で実施した後に、その反応溶液を室温で3時間撹拌したが、検出可能な抱合を示さなかった。図1に示すゲルの「1:1 40K NHS」と表記したレーンを参照のこと。その後、その反応溶液を4℃で15時間撹拌することによって、抱合のための添加時間が提供され、それによって、抱合体溶液が得られた。
【0198】
RP−HPLC(C3)および第2のSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。第2のSDS−PAGEの結果に基づいて、抱合を示した。図2に示すゲルの「1:1 40K NHS」と表記したレーンを参照のこと。RP−HPLC(C3)を使用して、得られた抱合体溶液の構成要素を分離した。得られたクロマトグラムは、0.1%の収率を示した(100%のモノPEG化または「1−mer」種を表す)。図7に示すクロマトグラムを参照のこと。
【0199】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG2−N−ヒドロキシスクシンイミドを使用して、他の抱合体を調製することができる。
実施例4
分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)による第IX因子のPEG化
(高分子と第IX因子の比率10:1;エタノールなし)
【化20】

【0200】
アルゴン下で−20℃で保存した分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)を室温まで加温した。加温した分岐mPEG2−N−ヒドロキシスクシンイミド(2.0mg)を、1mLの2mM HClに溶解して、分岐mPEG2−N−ヒドロキシスクシンイミド溶液を作製した。第IX因子に対するmPEG2−N−ヒドロキシスクシンイミドが10モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、mPEG2−N−ヒドロキシスクシンイミド溶液を添加した。分岐mPEG2−N−ヒドロキシスクシンイミドを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子への分岐mPEG2−N−ヒドロキシスクシンイミドの結合が可能になるように、SDS−PAGEをサンプル上で実施した後に、その反応溶液を室温で3時間撹拌したが、検出可能な抱合を示さなかった。図1に示すゲルの「10:1 40K NHS」と表記したレーンを参照のこと。その後、その反応溶液を4℃で15時間撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0201】
RP−HPLC(C3)および第2のSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。第2のSDS−PAGEの結果に基づいて、抱合は依然として検出されなかった。図2に示すゲルの「10:1 40K NHS」と表記したレーンを参照のこと。RP−HPLC(C3)を使用して、得られた抱合体溶液の構成要素を分離した。得られたクロマトグラムには、検出可能な収率は示されなかった。図8に示すクロマトグラムを参照のこと。
【0202】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG2−N−ヒドロキシスクシンイミドを使用して、他の抱合体を調製することができる。
実施例5
mPEG−SMB(30kDa)による第IX因子のPEG化
(高分子と第IX因子の比率10:1;エタノールあり)
【化21】

【0203】
エタノールは、特定のタンパク質の構造的な柔軟性を増加させると考えられるので、エタノールを、バッファおよび反応系に導入する。アルゴン下で−20℃で保存したmPEG−SMB(30kDa)を室温まで加温した。加温したmPEG−SMB(10.0mg)を、0.5mLの2mM HClに溶解して、10%のエタノール含有mPEG−SMB溶液を作製した。第IX因子に対してmPEG−SMBが10モル過剰になるまで、10%のエタノール含有第IX因子の反応混合物に、10%のエタノール含有mPEG−SMB溶液を添加した。mPEG−SMBを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子へのmPEG−SMBの結合が可能になるように、その反応溶液を室温で3時間撹拌した。その反応溶液を4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0204】
SDS−PAGEは、得られた抱合体溶液の特徴づけに使用した。SDS−PAGEの結果に基づいて、抱合は検出されなかった。図3に示すゲルの「10:1 30K SMB+EtOH」と表記したレーンを参照のこと。エタノールの導入は、mPEG−SMB(30kDa)の抱合の増加を可能にするために、第IX因子の構造的な柔軟性を増加させないと考えられる。
【0205】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SMBを使用して、他の抱合体を調製することができる。
実施例6
mPEG−SMB(30kDa)による第IX因子のPEG化
(高分子と第IX因子の比率20:1;エタノールあり)
【化22】

【0206】
エタノールは、特定のタンパク質の構造的な柔軟性を増加させると考えられるので、エタノールを、バッファおよび反応系に導入する。アルゴン下で−20℃で保存したmPEG−SMB(30kDa)を室温まで加温した。加温したmPEG−SMB(10.0mg)を、0.5mLの2mM HClに溶解して、10%のエタノール含有mPEG−SMB溶液を作製した。第IX因子に対してmPEG−SMBが20モル過剰になるまで、10%のエタノール含有第IX因子の反応混合物に、10%のエタノール含有mPEG−SMB溶液を添加した。mPEG−SMBを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子へのmPEG−SMBの結合が可能になるように、その反応溶液を室温で3時間撹拌した。その反応溶液を4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0207】
SDS−PAGEは、得られた抱合体溶液の特徴づけに使用した。SDS−PAGEの結果に基づいて、抱合は検出されなかった。図3に示すゲルの「20:1 30K SMB+EtOH」と表記したレーンを参照のこと。エタノールの導入は、mPEG−SMB(30kDa)の抱合の増加を可能にするために、第IX因子の構造的な柔軟性を増加させないと考えられる。
【0208】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SMBを使用して、他の抱合体を調製することができる。
実施例7
分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)による第IX因子のPEG化
(高分子と第IX因子の比率10:1;エタノールあり)
【化23】

【0209】
エタノールは、特定のタンパク質の構造的な柔軟性を増加させると考えられるので、エタノールを、バッファおよび反応系に導入する。アルゴン下で−20℃で保存した分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)を室温まで加温した。加温した分岐mPEG2−N−ヒドロキシスクシンイミド(2.0mg)を、エタノールを添加した1.0mLの2mM HClに溶解して、10%のエタノール含有分岐mPEG2−N−ヒドロキシスクシンイミド溶液を作製した。第IX因子に対する分岐mPEG2−N−ヒドロキシスクシンイミドのモル比が10モル過剰になるまで、10%のエタノール含有第IX因子の反応混合物に、10%のエタノール含有分岐mPEG2−N−ヒドロキシスクシンイミド溶液を添加した。分岐mPEG2−N−ヒドロキシスクシンイミドを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子への分岐mPEG2−N−ヒドロキシスクシンイミドの結合が可能になるように、その反応溶液を室温で3時間撹拌した。その反応溶液を4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0210】
SDS−PAGEは、得られた抱合体溶液の特徴づけに使用した。SDS−PAGEの結果に基づいて、抱合は検出されなかった(結果は示さず)。エタノールの導入は、分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)の抱合の増加を可能にするために、第IX因子の構造的な柔軟性を増加させないと考えられる。
【0211】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG2−N−ヒドロキシスクシンイミドを使用して、他の抱合体を調製することができる。
実施例8
分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)による第IX因子のPEG化
(高分子と第IX因子の比率20:1;エタノールあり)
【化24】

【0212】
エタノールは、特定のタンパク質の構造的な柔軟性を増加させると考えられるので、エタノールを、バッファおよび反応系に導入する。アルゴン下で−20℃で保存した分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)を室温まで加温した。加温した分岐mPEG2−N−ヒドロキシスクシンイミド(2.0mg)を、1.0mLの2mM HClに溶解して、10%のエタノール含有分岐mPEG2−N−ヒドロキシスクシンイミド溶液を作製した。第IX因子に対する分岐mPEG2−N−ヒドロキシスクシンイミドのモル比が20モル過剰になるまで、10%のエタノール含有第IX因子の反応混合物に、10%のエタノール含有分岐mPEG2−N−ヒドロキシスクシンイミド溶液を添加した。分岐mPEG2−N−ヒドロキシスクシンイミドを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子への分岐mPEG2−N−ヒドロキシスクシンイミドの結合が可能になるように、その反応溶液を室温で3時間撹拌した。その反応溶液を4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0213】
SDS−PAGEは、得られた抱合体溶液の特徴づけに使用した。SDS−PAGEの結果に基づいて、抱合は検出されなかった(結果は示さず)。エタノールの導入は、分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)の抱合の増加を可能にするために、第IX因子の構造的な柔軟性を増加させないと考えられる。
【0214】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG2−N−ヒドロキシスクシンイミドを使用して、他の抱合体を調製することができる。
実施例9
mPEG−SMB(30kDa)による第IX因子のPEG化
(高分子と第IX因子の比率20:1;エタノールなし)
【化25】

【0215】
アルゴン下で−20℃で保存したmPEG−SMB(30kDa)を室温まで加温した。加温したmPEG−SMB(8.6mg)を、1.0mLの2mM HClに溶解して、mPEG−SMB溶液を作製した。第IX因子に対してmPEG−SMBが20モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、mPEG−SMB溶液を添加した。mPEG−SMBを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験した。アミド結合を介して、第IX因子へのmPEG−SMBの結合が可能になるように、その反応溶液を室温で2時間撹拌した。その反応溶液を4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。その後、4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0216】
SDS−PAGEは、特徴づけに使用した。第2のSDS−PAGEの結果に基づいて、抱合を示した。図4に示すゲルの「20:1 30K SMB」と表記したレーンを参照のこと。
【0217】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG−SMBを使用して、他の抱合体を調製することができる。
実施例10
mPEG−SPA(20kDa)による第IX因子のPEG化
(高分子と第IX因子の比率20:1;エタノールなし)
【化26】

【0218】
エタノールは、特定のタンパク質の構造的な柔軟性を増加させると考えられるので、エタノールを、バッファおよび反応系に導入する。アルゴン下で−20℃で保存したmPEG−SPA(20kDa)を室温まで加温した。加温した分岐mPEG−SPA(10.0mg)を、エタノールを添加した0.5mLの2mM HClに溶解して、10%のエタノール含有mPEG−SPA溶液を作製した。第IX因子に対してmPEG−SPAが20モル過剰になるまで、10%のエタノール含有第IX因子の反応混合物に、10%のエタノール含有mPEG−SPA溶液を添加した。mPEG−SPAを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子へのmPEG−SPAの結合が可能になるように、その反応溶液を室温で2時間撹拌した。その反応溶液を撹拌することによって、結合の継続が可能となった。
【0219】
SDS−PAGEの結果に基づいて、抱合は検出されなかった。図3に示すゲルの「20:1 20K SPA+EtOH」と表記したレーンを参照のこと。エタノールの導入は、mPEG−SPA(20kDa)の抱合の増加を可能にするために、第IX因子の構造的な柔軟性を増加させないと考えられる。
【0220】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SPAを使用して、他の抱合体を調製することができる。
実施例11
mPEG−SPA(20kDa)による第IX因子のPEG化
(高分子と第IX因子の比率40:1;エタノールなし)
【化27】

【0221】
エタノールは、特定のタンパク質の構造的な柔軟性を増加させると考えられるので、エタノールを、バッファおよび反応系に導入する。アルゴン下で−20℃で保存したmPEG−SPA(20kDa)を室温まで加温した。加温した分岐mPEG−SPA(10.0mg)を、エタノールを添加した0.5mLの2mM HClに溶解して、10%のエタノール含有mPEG−SPA溶液を作製した。第IX因子に対してmPEG−SPAが40モル過剰になるまで、10%のエタノール含有第IX因子の反応混合物に、10%のエタノール含有mPEG−SPA溶液を添加した。mPEG−SPAを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子へのmPEG−SPAの結合が可能になるように、その反応溶液を室温で2時間撹拌した。その反応溶液を撹拌することによって、結合の継続が可能となった。
【0222】
SDS−PAGEの結果に基づいて、抱合は検出されなかった。図3に示すゲルの「40:1 20K SPA+EtOH」と表記したレーンを参照のこと。エタノールの導入は、mPEG−SPA(20kDa)の抱合の増加を可能にするために、第IX因子の構造的な柔軟性を増加させないと考えられる。
【0223】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SPAを使用して、他の抱合体を調製することができる。
実施例12
分岐mPEG−ブチルアルデヒド(20kDa)による第IX因子のPEG化
(高分子と第IX因子の比率10:1;エタノールなし)
【化28】

【0224】
アルゴン下で−20℃で保存した分岐mPEG2−ブチルアルデヒド(20kDa)を室温まで加温した。加温した分岐mPEG2−ブチルアルデヒド(10.9mg)を、1mLの2mM HClに溶解して、分岐mPEG2−ブチルアルデヒド溶液を作製した。第IX因子に対する分岐mPEG2−ブチルアルデヒドが10モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、分岐mPEG2−ブチルアルデヒド溶液を添加した。30分撹拌した後、分岐mPEG2−ブチルアルデヒドに対して過剰に、還元剤NaCNBH3(1xBPSで溶解)を添加した(pHを試験して、第2級アミンに対する還元の確認の必要に応じて調製した)。次いで、その溶液を4℃で一晩撹拌して、アミン結合を介した結合を確認した。
【0225】
RP−HPLC(C3)およびSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。SDS−PAGEの結果に基づいて、抱合は検出されなかった。図4に示すゲルの「10:1 20K BYA」と表記したレーンを参照のこと。得られた抱合体溶液の構成要素を分離するために、RP−HPLC(C3)を使用した。得られたクロマトグラムでは、抱合物質の存在は確認されなかった。図9に示すクロマトグラムを参照のこと。
【0226】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG2−ブチルアルデヒドを使用して、他の抱合体を調製することができる。
実施例13
分岐mPEG−ブチルアルデヒド(20kDa)による第IX因子のPEG化
(高分子と第IX因子の比率20:1;エタノールなし)
【化29】

【0227】
アルゴン下で−20℃で保存した分岐mPEG2−ブチルアルデヒド(20kDa)を室温まで加温した。加温した分岐mPEG2−ブチルアルデヒド(10.9mg)を、1mLの2mM HClに溶解して、分岐mPEG2−ブチルアルデヒド溶液を作製した。第IX因子に対する分岐mPEG2−ブチルアルデヒドが20モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、分岐mPEG2−ブチルアルデヒド溶液を添加した。30分撹拌した後、分岐mPEG2−ブチルアルデヒドに対して過剰に、還元剤NaCNBH3(1xBPSで溶解)を添加した(pHを試験して、第2級アミンに対する還元の確認の必要に応じて調製した)。次いで、その溶液を4℃で一晩撹拌して、アミン結合を介した結合を確認した。
【0228】
RP−HPLC(C3)およびSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。SDS−PAGEの結果に基づいて、抱合は検出されなかった。図4に示すゲルの「20:1 20K BYA」と表記したレーンを参照のこと。得られた抱合体溶液の構成要素を分離するために、RP−HPLC(C3)を使用した。得られたクロマトグラムでは、抱合物質の存在は確認されなかった。図10に示すクロマトグラムを参照のこと。
【0229】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG2−ブチルアルデヒドを使用して、他の抱合体を調製することができる。
実施例14
mPEG−SPA(20kDa)による第IX因子のPEG化
(高分子と第IX因子の比率53:1;エタノールなし)
【化30】

【0230】
アルゴン下で−20℃で保存したmPEG−SPA(20kDa)を室温まで加温した。加温したmPEG−SPA(5.4mg)を、1mLの2mM HClに溶解して、mPEG−SPA溶液を作製した。第IX因子に対してmPEG−SPAが53モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、mPEG−SPA溶液を添加した。mPEG−SPAを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験した。アミド結合を介して、第IX因子へのmPEG−SPAの結合が可能になるように、その反応溶液を室温で2時間撹拌した。その反応溶液を4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0231】
RP−HPLC(C3)および第2のSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。SDS−PAGEの結果に基づいて、抱合を確認した。図4に示すゲルの「53:1 20K SPA」と表記したレーンを参照のこと。RP−HPLC(C3)を使用して、得られた抱合体溶液の構成要素を分離した。得られたクロマトグラムは、約60%の抱合体収率を示した(51.9%のモノPEG化または「1−mer」種、および8%のジPEG化または「2−mer」種を含む)。図11に示すクロマトグラムを参照のこと。しかし、実際の収率は、高分子試薬が比較的大量に過剰であるため、幾分低くなる場合があると考えられる。
【0232】
この同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SPAを使用して、他の抱合体を調製することができる。
実施例15
mPEG−SPA(20kDa)による第IX因子のPEG化
(高分子と第IX因子の比率110:1;エタノールなし)
【化31】

【0233】
アルゴン下で−20℃で保存したmPEG−SPA(20kDa)を室温まで加温した。加温したmPEG−SPA(5.4mg)を、1mLの2mM HClに溶解し、mPEG−SPA溶液を作製した。第IX因子に対してmPEG−SPAが110モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、mPEG−SPA溶液を添加した。mPEG−SPAを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験した。アミド結合を介して、第IX因子へのmPEG−SPAの結合が可能になるように、その反応溶液を室温で2時間撹拌した。その反応溶液を4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0234】
RP−HPLC(C3)および第2のSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。SDS−PAGEの結果に基づいて、抱合を確認した。図4に示すゲルの「110:1 20K SPA」と表記したレーンを参照のこと。RP−HPLC(C3)を使用して、得られた抱合体溶液の構成要素を分離した。得られたクロマトグラムは、約44%の抱合体収率を示した(ほぼ100%のモノPEG化または「1−mer」種を表す)。図12に示すクロマトグラムを参照のこと。しかし、実際の収率は、高分子試薬が比較的大量に過剰であるため、幾分低くなる場合がある、と考えられる。
【0235】
この同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SPAを使用して、他の抱合体を調製することができる。
実施例16
分岐mPEG−ブチルアルデヒド(20kDa)による第IX因子のPEG化
(高分子と第IX因子の比率は20:1;エタノールあり)
【化32】

【0236】
エタノールは、特定のタンパク質の構造的な柔軟性を増加させると考えられるので、エタノールを、バッファおよび反応系に導入する。アルゴン下で−20℃で保存した分岐mPEG2−ブチルアルデヒド(20kDa)を室温まで加温した。加温した分岐mPEG2−ブチルアルデヒド(10.9mg)を、エタノールを添加した1mLの2mM HClに溶解して、10%のエタノール含有分岐mPEG2−ブチルアルデヒド溶液を作製した。第IX因子に対する分岐mPEG2−ブチルアルデヒドのモル比が20モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、10%のエタノール含有分岐mPEG2−ブチルアルデヒド溶液を添加した。30分撹拌した後、分岐mPEG2−ブチルアルデヒドに対して過剰に、還元剤NaCNBH3(1xBPSで溶解)を添加した(pHを試験して、第2級アミンに対する還元の確認の必要に応じて調製した)。次いで、その溶液を4℃で一晩撹拌して、アミン結合を介した結合を確認した。
【0237】
RP−HPLC(C3)およびSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。SDS−PAGEの結果に基づいて、抱合は検出されなかった。図4に示すゲルの「20:1 20K BYA+EtOH」と表記したレーンを参照のこと。RP−HPLC(C3)では、検出可能な抱合物質の欠乏を確認した(結果は示さず)。エタノールの導入は、分岐mPEG2−ブチルアルデヒドの抱合の増加を可能にするために、第IX因子の構造的な柔軟性を増加させないと考えられる。
【0238】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG2−ブチルアルデヒドを使用して、他の抱合体を調製することができる。
実施例17
mPEG−SBAによる第IXa因子のPEG化
【0239】
10,000ダルトンの分子量を有するmPEG−スクシンイミジルブトナートは、Nekter Therapeutics(Huntsville、AL)から入手する。高分子試薬の基本構造は、下記で与えられる:
【化33】

【0240】
凍結乾燥されている場合、第IXa因子は、リン酸塩のようなアミンを含まないバッファ内に溶解され、7.2乃至9の最終pHが得られる。次いでこの溶液に、1.5乃至10モル過剰のmPEG−SBAを添加する。得られた混合物を、数時間、室温で撹拌する。
【0241】
反応混合物をSDS−PAGEによって分析して、タンパク質のPEG化の程度を決定する。
実施例18
mPEG−RIP(5K)による第IX因子のPEG化
【化34】

【0242】
ケトンおよび対応するケタールとして示す上述の高分子試薬を、米国特許出願第2005/0031576号に開示されているように調製する。
【0243】
上述の高分子試薬を調製するために、メチレンクロライド(20ml)内に5,000ダルトンの重量平均分子量を有するメトキシポリエチレングリコール−スクシンイミジルプロピオン酸塩(1.0g、0.002モル)に、トリエチルアミン(0.084ml、0.006モル)および4−ピペリドン一水和物塩酸塩(0.077g、0.005モル)を添加する。反応混合物を、窒素雰囲気の下で室温で一晩撹拌し、抱合前に精製する。或いは、高分子試薬は、Nektar Therapeuticsから購入することができる。
【0244】
抱合を達成するために、水性バッファの第IX因子の溶液に、20モル過剰のmPEG−RIP(5K)を添加する。得られた溶液は、室温での反応を容易にするために、低速に設定したRoto Mix(登録商標)オービタルシェーカー(Thermolyne Corp.、Dubuque、IA)に入れる。15分後に、第IX因子に対して50モル過剰に等しい量の水溶性のNaCNBH3を添加する。アリコートを、反応混合物から定期的に回収して、(Bio−Rad Laboratories、Hercules、CAから入手可能なゲルを使用して)SDS−PAGEで分析する。
【0245】
SDS−PAGE分析は、付着した1、2、および3PEG部分を有する第IX因子のPEG誘導体の存在を示す。
実施例19
mPEG−KALによるシステイン挿入第IX因子の抱合、20K
【0246】
第IX因子には、国際特許出願公開WO90/12874に開示されるプロセスに基づいて、1つ以上のシステイン残基を挿入する。
【0247】
抱合前に、第IX因子のバッファ交換を行って、ヒスチジンをHEPESに置き換える。
【0248】
アルゴン下で−20℃で保存したmPEG−MAL(20K)を室温まで加温する。加温したmPEG−MAL試薬(4.4mg)を、0.044mlのHEPESバッファ(50mMのHEPES(または他の好適なバッファ)、pH7.0)に溶解して、10%のmPEG−MAL溶液を作製する。そのmPEG−MAL溶液を、4mlの第IX因子溶液(50mMのHEPESに0.4324mg/ml(または他の好適な処方)、pH7.0)に迅速に添加し、十分に混合する。室温で30分反応させた後、反応バイアルを低温室(4℃)に移し、その反応混合物に、さらに0.044mlのmPEG−MAL溶液を添加し、次いで3つ以上のアリコートの0.044mlのmPEG−MAL溶液を、2時間にわたり添加する。pHを測定する(pH7.0±0.2)。タンパク質に対するmPEG−MALのモル比は、50:1である。最終的なmPEG−MALの濃度は5.213mg/mlであり、最終的な第IX因子の濃度は0.410mg/mlである。反応は、Rotomix上で(低速、Thermolyne)、4℃で一晩進行させることが可能である。
【0249】
抱合体の混合物は、ゲル濾過クロマトグラフィを使用して精製する。サイズ排除クロマトグラフィ方法は、反応混合物および最終的な製品を分析するために開発されたものである。SDS−PAGE分析はまた、サンプルの特徴づけにも使用される。
実施例20
典型的な第IX因子−PEG抱合体の生体外活性
【0250】
実施例1、2、3、9、14、および15に記述した、第IX因子−PEG抱合体それぞれの生物学的活性を決定する。試験される全ての第IX因子−PEG抱合体は、ある程度の第IX因子活性を有するものと決定される。
【技術分野】
【0001】
本発明は、概して、第IX因子部分(すなわち第IX因子の活性を有する部分)および高分子を含む抱合体に関する。さらに、本発明は、抱合体を含む組成物、抱合体を合成するための方法、抱合体を送達するための方法、および患者を治療するための方法に関する。
【背景技術】
【0002】
止血は、傷ついた血管からの血液の流出を抑えるプロセスである。哺乳類の場合、多くの他の生命体と同様に、止血プロセスは生存し続けるために極めて重要である。止血プロセスにおける欠陥によって、例えば、血管を損傷した後の失血を抑える役目をする凝血を効果的に形成することができなくなる可能性がある。凝血させることができない人を血友病患者と呼ぶ。血友病患者に対し特に懸念されることは、出血し始めるとそれが止まらないという、致命的なリスクである。
【0003】
概して、血友病患者には、可溶性フィブリノゲンの不溶性フィブリンへの変換に最終的に必要となる、1つ以上の物質の有効量を生成する能力が欠如している。例えば、血友病B(「先天性第IX因子欠乏症」および「クリスマス病」とも呼ばれる)を罹患している血友病患者は、有効なレベルの第IX因子を生成することができない。第IX因子は、凝血の形成をもたらす、反応の複数の「カスケード」のうちの1つの主要な構成要素である。「内因系」と称される反応のカスケードに重要な第IX因子は、最終的に、凝血の主要な構成要素であるフィブリンへのフィブリノゲンの変換に影響を与える。
【0004】
凝血を形成するプロセスは比較的複雑であるが、内因系における第IX因子の役割は、簡潔に説明することができる。血液が、(例えば、裂傷に伴う組織の損傷の結果として)陰性荷電を帯びた面および/または内皮下の結合組織と接触するときに、他の物質の存在下で、第XII因子(ハーゲマン因子)は第XIIa因子に変換される。(他の物質と共に)第XIIa因子は、第XI因子を第XIa因子に変換する。次に、(他の物質と共に)第XIa因子は、第IX因子を第IXa因子に変換する。第VIII因子、第IXa因子、カルシウムイオン、およびリン脂質ミセルは、第X因子を伴うリポタンパク質複合体を形成し、それを活性化して第Xa因子を形成する。その後、(他の物質と共に)第Xa因子はプロトロンビンをトロンビンに変換するので、その結果、比較的多量のトロンビンが経時的に生成される。比較的多量のトロンビンは、フィブリノゲンをフィブリンに変換する。フィブリンは、次に、凝血の形成に関与するマトリクスまたは格子を形成する。
【0005】
血液凝固の内因系における第IX因子の役割を、以下に概略的に示す。
【化1】

【0006】
男性34,500人中1人に発症する血友病Bは、X染色体上に位置する第IX因子の遺伝子の様々な突然変異のうちのいずれか1つに起因しうる。特定の突然変異によって、血友病Bは、重度、中程度、または軽度に現れることがある。最も重度の血友病Bを罹患している人は、第IX因子の活性化を発現する能力が完全に欠如している。臨床的に、血友病Bにかかっている人は、鼻出血、易傷性、関節出血、および傷による長時間の出血を被る。現在の血友病Bの治療は、ヒト血漿から収集された、または組み換えDNA技術によって生成された、外生の第IX因子の点滴を伴う。これらの治療は、有効なレベルの第IX因子の不足を補う役目しか果たさないので、重度の血友病Bを罹患している人は、一生を通じて、(週3回もの)第IX因子の濃縮物の定期的な注射を必要とする。より軽度の血友病Bを罹患している患者であっても、しばしば手術および歯の治療の前および/または後の第IX因子の濃縮物の注射を必要とする。
【0007】
血友病Bを罹患している患者に補充療法を提供するために、いくつかの市販の第IX因子の濃縮物が入手可能である。例えば、血液由来の第IX因子複合製品(他の因子を含む)は、BEBULIN VH(登録商標)(Baxter Healthcare、ウィーン、オーストリア)、KONYNE80(登録商標)(Bayer社、Eikhart IN)、PROFILNINE SD(登録商標)(Alpha Therapeutic社、ロサンゼルス、CA)、およびPROPLEX T(登録商標)(Baxter Healthcare、Glendale CA)のブランドで販売されている。幾分精製された形態の第IX因子製品は、ALPHANINE SD(登録商標)Alpha Therapeutic社、ロサンゼルス、CA)、およびMONONINE(登録商標)(Aventis Behring、Kankakee、IL)のブランドで販売されている。組み換え的に調製された第IX因子濃縮物に関しては、1つの製品が、BENEFIX(登録商標)(Wyeth/Genetics Institute、Cambridge MA)のブランドで現在入手可能である。
【0008】
概して、第IX因子の濃縮物の組み換えソースが血液由来のものよりも好まれるが、これは後者がウイルスおよび/または他の疾病を伝染させるリスクを伴うためである。さらに、多くの場合組み換えソースの方が純度がより高いため、血液由来ソースに概して存在する不要な血液因子およびその他のタンパク質の投与によって生じる潜在的な問題が回避される。
【0009】
組み換えベースの処方を投与する利点があったとしても、組み換えベースの製品の製造には、アルブミンのような特定のタンパク質の存在が必要であり、それは患者に投与される最終的な処方に存在しうる。その結果、このような処方を受ける患者は、これらの外来のタンパク質に対するアレルギー反応が起こる。いずれにせよ、血液由来および組み換えベースの製品は、繰り返し投与という不利な点を被る。
【0010】
PEG化、すなわちタンパク質へのポリ(エチレングリコール)誘導体の付着が、免疫性を減じるための手段として、またタンパク質の生体内半減期を伸ばすための手段として開示された。しかし、第IX因子に関して、タンパク質−高分子抱合体を形成するための以前の手法には、いくつかの欠点があった。
【0011】
例えば、米国特許第5,969,040号では、アルデヒドを形成するために、第IX因子の活性化領域内の炭水化物部分のビシナルジオールを酸化させる段階を含むプロセスを開示している。酸化段階に続けて、開示されたプロセスは、酸化炭水化物部分に、(ヒドラジンを有するポリ(エチレングリコール)誘導体のような)1つ以上の非抗原性の高分子を共有結合させる段階を含む。しかし、この手法による問題点は、第IX因子の酸化型を得るために必要とされる、更なる段階によって複雑さが増すことである。さらに、酸化段階後に残存する可能性のあるいずれかの酸化剤が、抱合体に関連する高分子を劣化させる場合がある。最終的に、この手法は、特定の高分子(すなわち、ヒドラジド含有高分子)、および第IX因子上の特定の領域(すなわち、第IX因子の活性化領域内の炭水化物部分のビシナルジオール)を使用した抱合に制限される。
【0012】
酸化剤の存在(米国特許第5,969,040号に開示されたプロセスの結果によるか、または他の原因によって存在する)は、第IX因子に抱合される高分子の許容される医薬品を提供することに関して、更なる課題をもたらす。特に、メチオニンおよび他の水酸基含有アミノ酸は、酸化剤の存在下で不要な酸化を被る場合があるので、それによってアルデヒド基がもたらされる。高分子試薬と反応しない残留アルデヒドは、反応性であり、タンパク質を潜在的に傷つけることになる。この問題に対処するために、未反応のアルデヒドは、タンパク質を安定させるために、グリシンまたは他の小分子でキャップする必要がある。しかし、その際に、制限的目的に対して、製品が容易に定義されなければならないという分析的問題が生じ、更なる構成要素の導入は、その他の点で、直接的な製品定義を妨げる可能性がある。特に、キャップ薬剤の使用は、とりわけ困難な課題を呈する。
【0013】
米国特許第6,037,452号は、第IX因子へのポリ(酸化アルキレン)の付着を開示しており、第IX因子への付着は、反応基(トリアジン、アセチル、ヒドラジン、ジアゾニウム、アミノ、およびスクシンイミジルエステル)のうちの1つを有するポリ(酸化アルキレン)を介して達成される。しかしまた、その参考文献でも、トリアジン、アセチル、ヒドラジン、ジアゾニウム、アミノ、またはスクシンイミジルエステル以外の反応基を有する高分子を介した効果的な達成の開示が欠如している。
【0014】
したがって、水溶性高分子と第IX因子活性を有する部分との間に更なる抱合体を提供する必要性が、従来技術に依然として存在する。特に、第IX因子活性を有する部分に高分子を抱合するためのより単純なプロセスを提供する必要性が存在する。したがって、本発明は、本願明細書に開示されるような、新しく、従来技術ではまったく提案されていない、このような抱合体、その抱合体を含む組成物、および関連する方法を対象とする。
【発明の概要】
【0015】
従って、本発明の1つ以上の実施態様では、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に共有結合した第IX因子部分を含む抱合体であって、前記水溶性高分子の分子量は、5,000ダルトンより多く、約150,000ダルトンより少ない、抱合体を提供する。
【0016】
本発明の1つ以上の実施態様では、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子にアミノ酸残基において共有結合した第IX因子部分を含む抱合体であって、前記アミノ酸残基は、直接的にまたは前記スペーサ部分を介して、−CH2−C(O)−O−、−N(H)−C(O)CH2−O−、−C(O)−N(H)−、−N(H)−C(O)−CH2−O−、−C(O)−CH2−O−、−C(O)−CH2−CH2−C(O)−O−、ジアゾ、またはトリアジン結合により結合していない抱合体を提供する。
【0017】
本発明の1つ以上の実施態様では、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、非線形の水溶性高分子に共有結合した第IX因子部分を含む抱合体を提供する。
【0018】
本発明の1つ以上の実施態様では、複数の抱合体を含む組成物であって、前記組成物中の全ての抱合体の少なくとも約80%は、それぞれが1つ、2つ、3つ、または4つの水溶性高分子に共有結合した第IX因子部分を含み、さらに、前記抱合体中の各水溶性高分子に対して前記第IX因子部分が直接的にまたは1つ以上の原子を含むスペーサ部分を介して水溶性高分子に結合した組成物を提供する。前記組成物は、全ての種類の製剤、特に再構成することができる粉末および液体(例、懸濁液および溶液)のような注射に好適な製剤を包含する。
【0019】
本発明の1つ以上の実施態様では、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に共有結合した第IX因子部分を含む抱合体を得るのに十分な条件下で、第IX因子の組成物に、高分子試薬の組成物を添加する段階を含む、抱合体を生成するための方法を提供する。
【0020】
本発明の1つ以上の実施態様では、患者に本願明細書で開示されているような抱合体を含む組成物を投与する段階を含む、抱合体を送達するための方法を提供する。前記抱合体を投与する段階は、注射(筋内注射、静脈注射、皮下注射など)または他の手法によって達成することができる。
【図面の簡単な説明】
【0021】
【図1】実施例1乃至4に記述されるサンプルのドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動(SDS−PAGE)分析によるゲルのコピーである。
【図2】実施例1乃至4に記述されるサンプルのドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動(SDS−PAGE)分析によるゲルのコピーである。
【図3】実施例5、6、10、および11に記述されるサンプルのSDS−PAGE分析によるゲルのコピーである。
【図4】実施例2、9、および12乃至16に記述されるサンプルのSDS−PAGE分析によるゲルのコピーである。
【図5】実施例1の得られた抱合体溶液に対応する図である。
【図6】実施例2の得られた抱合体溶液に対応する図である。
【図7】実施例3の得られた抱合体溶液に対応する図である。
【図8】実施例4の得られた抱合体溶液に対応する図である。
【図9】実施例12の得られた抱合体溶液に対応する図である。
【図10】実施例13の得られた抱合体溶液に対応する図である。
【図11】実施例14の得られた抱合体溶液に対応する図である。
【図12】実施例15の得られた抱合体溶液に対応する図である。
【発明を実施するための形態】
【0022】
本発明の1つ以上の実施態様を詳細に説明する前に、本発明は、特定の高分子、合成技術、第IX因子部分などに制限されず、その点を考慮して変化する場合があると理解されるべきである。
【0023】
本明細書および特許請求の範囲に使用されているように、単数形は、本文脈が明確に別途指示しない限り、複数の指示対象を含む点に留意されたい。したがって、例えば、「高分子」という記述には、単一の高分子および2つ以上の同一または異なる高分子が含まれ、「任意の賦形剤」という記述は、単一の任意の賦形剤および2つ以上の同一または異なる任意の賦形剤が含まれる。
【0024】
本発明の説明および特許請求の範囲では、次の用語は、下記の定義に従って使用される。
【0025】
本願明細書で使用される場合、「PEG」、「ポリエチレングリコール」、および「ポリ(エチレングリコール)」は、交換可能である。一般に、本発明によって用いるPEGは、「−(OCH2CH2O)n−」という構造を含み、(n)は2乃至4,000である。本願明細書で使用される場合、PEGはまた、末端酸素が置換されたかどうかに基づいて、「−CH2CH2−O(CH2CH2O)n−CH2CH2−」および「−(OCH2CH2)nO−」も含む。本明細書および特許請求の範囲を通じて、「PEG」は、種々の末端、すなわち「末端をキャップする」ような基などを有する構造を含むことを念頭に置いていただきたい。「PEG」という用語はまた、大多数、すなわち50%を超える−OCH2CH2−の繰り返しサブユニットを含む高分子のことでもある。特定の形態に関して、PEGは、いかなる数の様々な分子量、および「分岐状」、「線状」、「叉状」、「多官能性」などのような構造または形状をとることができ、以下に詳述する。
【0026】
「エンドキャップされた」および「末端がキャップされた」という用語は、エンドキャップ部分を有する高分子の末端または端点を示して、本願明細書において交換可能に使用される。一般に、必ずではないが、エンドキャップ部分は、ヒドロキシまたはC1-20アルコキシ基、より好ましくはC1-10アルコキシ基、さらに好ましくはC1-5アルコキシ基を含む。したがって、エンドキャップ部分の例には、アルコキシ(例、メトキシ、エトキシ、およびベンジルオキシ)、およびアリール、ヘテロアリール、シクロ、ヘテロシクロなどが挙げられる。エンドキャップ部分は、高分子(例、CH3(OCH2CH2O)n−内のエンドキャップ部分「メトキシ」)または(CH3(OCH2CH2)n−内の「CH3」)に、1つ以上の原子の末端の単量体を含むことが可能である。さらに、前述のそれぞれの飽和、不飽和、置換、および非置換の形態が想定される。さらに、エンドキャップの基は、シランにもなりうる。エンドキャップの基はまた、検出可能なラベルを好都合に含むこともできる。高分子が、検出可能なラベルを含むエンドキャップを有する場合、高分子および/または高分子が結合する部分(例えば活性剤)の量または場所は、好適な検出器を使用することにより決定することができる。このようなラベルには、これに限定されないが、蛍光剤、ケミルミネサー(chemiluminescer)、酵素のラベリングに使用される部分、比色部分(例、染料)、金属イオン、放射性部分などが挙げられる。好適な検出器には、光度計、フィルム、分光計などが挙げられる。エンドキャップの基はまた、好都合にリン脂質を含むこともできる。高分子が、リン脂質を含むエンドキャップの基を有する場合、高分子および任意の得られる抱合体に一意の特性が与えられる。典型的なリン脂質には、これに限定されないが、ホスファチジルコリンと呼ばれるリン脂質類から選択されるものが挙げられる。特定のリン脂質には、これに限定されないが、ジラウロイルホスファチジルコリン、ジオレイルホスファチジルコリン、ジパルミトイルホスファチジルコリン、ジステロイルホスファチジルコリン、ベヘノイルホスファチジルコリン、アラキドイルホスファチジルコリン、およびレシチンから成る群から選択されるものが挙げられる。
【0027】
本願明細書に記述されているように、高分子に関して「非天然に生じる」とは、その全体が自然界には見られない高分子のことである。しかし、非天然に生じる高分子は、全体的な高分子構造が自然界には見られない限り、1つ以上の単量体または天然に発生する単量体のセグメントを含む場合がある。
【0028】
「水溶性高分子」にあるような「水溶性」とは、室温で水溶性である任意の高分子のことである。一般に、水溶性高分子は、ろ過後の同じ溶液によって透過される光の少なくとも約75%、より好ましくは少なくとも約95%を透過する。重量基準で、水溶性高分子は、少なくとも約35重量%の水溶性であることが好ましく、少なくとも約50重量%の水溶性であることがより好ましく、約70重量%の水溶性であることがさらに好ましく、約85重量%の水溶性であることがさらに好ましい。しかし、水溶性高分子は、約95%の水溶性、または完全な水溶性であることが最も好ましい。
【0029】
PEGのような水溶性高分子の本文脈における分子量は、数平均分子量または重量平均分子量で表すことができる。特に明記しない限り、本願明細書での分子量という記述は、重量平均分子量のことである。数平均および重量平均の両方の分子量の決定は、ゲル透過クロマトグラフィまたは他の液体クロマトグラフィ技術を使用して測定することができる。分子量の値を測定するための他の方法では、数平均分子量を決定するために末端基分析または束一性(例、凝固点降下、沸点上昇、または浸透圧)の測定を使用すること、または重量平均分子量を決定するために光散乱技術、超遠心分離または粘度計を使用することもできる。本発明の高分子は、一般に多分散系(すなわち、高分子の数平均分子量および重量平均分子量が等しくない)であり、その多分散性は低く、約1.2未満であることが好ましく、約1.15未満であることがより好ましく、約1.10未満であることがさらに好ましく、約1.05未満であることがさらに好ましく、約1.03未満であることが最も好ましい。本願明細書で使用される場合、一つの重量平均分子量または数平均分子量を有する単一の水溶性高分子として言及されるものもあるが、これは、その単一の水溶性高分子が、前述のような分子量を有する水溶性高分子の組成物から得られたことを意味すると理解されよう。
【0030】
特定の官能基とともに使用される場合の「活性」または「活性化」という用語は、求電子物質または別の分子上の求核体と容易に反応する、反応性官能基のことである。これは、反応のために強力な触媒または非常に非実用的な反応条件を必要とする、基(すなわち「非反応性」または「不活性」基)とは対照的である。
【0031】
本願明細書で使用される場合、「官能基」という用語またはその任意の同義語は、その保護形態および非保護形態を包含することが意図されている。
【0032】
「スペーサ部分」、「結合」、および「リンカー」という用語は、水溶性高分子および第IX因子部分の終端、または第IX因子部分の求電子物質または求核体のような、相互接続部分を結合するために使用される原子または一群の原子を示すために本願明細書において使用される。スペーサ部分は、加水分解的に安定であってもよく、または生理学的に加水分解性の、または酵素的に分解可能な結合を含んでいてもよい。
【0033】
「アルキル」は炭化水素鎖のことであり、一般に約1乃至15の原子長である。このような炭化水素鎖は、一般に直鎖であることが好ましいが、必ずではないが飽和していることが好ましく、分岐または直鎖であってよい。典型的なアルキル基には、メチル、エチル、プロピル、ブチル、ペンチル、1−メチルブチル、1−エチルプロピル、3−メチルペンチルなどが挙げられる。本願明細書で使用される場合、「アルキル」には、シクロアルキルおよびシクロアルキレン含有アルキルが含まれる。
【0034】
「低級アルキル」とは、1乃至6個の炭素原子を含むアルキル基のことであり、メチル、エチル、n−ブチル、i−ブチル、およびt−ブチルなどのように、直鎖または分岐したものであってよい。
【0035】
「シクロアルキル」とは、架橋、縮合、またはスピロ環状化合物を含む、飽和または不飽和の環状炭化水素鎖のことであり、3乃至12個の炭素原子で構成されることが好ましく、3乃至8個の炭素原子で構成されることがより好ましい。「シクロアルキレン」とは、環状系内のいずれか2つの炭素での鎖の結合によって、アルキル鎖に挿入されるシクロアルキル基のことである。
【0036】
「アルコキシ」とは、−O−R基のことであり、ここでRは、アルキルまたは置換アルキルであって、C1-6アルキル(例、メトキシ、エトキシ、プロピルオキシなど)が好ましい。
【0037】
例えば、「置換アルキル」にあるような「置換」とは、これに限定されないが、以下のような1つ以上の非妨害置換基によって置換される部分(例、アルキル基)のことである:アルキル、C3-8シクロアルキル(例、シクロプロピル、シクロブチルなど);ハロ(例、フルオロ、クロロ、ブロモ、およびヨード);シアノ;アルコキシ、低級フェニル;置換フェニル;など。「置換アリール」は、置換基として1つ以上の非妨害基を有するアリールである。フェニル環上の置換に対して、置換基は任意の配向性(すなわち、オルト、メタ、またはパラ)であってよい。
【0038】
「非妨害置換基」とは、分子内に存在する場合に、一般にその分子に含まれる他の官能基と反応しない基である。
【0039】
「アリール」とは、それぞれが5乃至6個のコア炭素原子である、1つ以上の芳香族環のことである。アリールには、ナフチルのように縮合させることが可能であるか、またはビフェニルのように縮合させないことが可能である、複数のアリール環を含む。アリール環はまた、1つ以上の環状炭化水素、ヘテロアリール、または複素環と縮合させるか、または縮合させないことが可能である。本願明細書で使用される場合、「アリール」は、ヘテロアリールを含む。
【0040】
「ヘテロアリール」は、1乃至4個のヘテロ原子を含むアリール基であり、硫黄、酸素、または窒素、あるいはそれらを組み合わせたものであることが好ましい。ヘテロアリール環はまた、1つ以上の環状炭化水素、複素環、アリール、またはヘテロアリール環と縮合することも可能である。
【0041】
「ヘテロ環」または「複素環」とは、不飽和または芳香族特性の有無にかかわらず、炭素ではない少なくとも1つの環状の原子を有する、1つ以上の5乃至12個の原子、好ましくは5乃至7個の原子の環のことである。好適なヘテロ原子には、硫黄、酸素、および窒素が挙げられる。
【0042】
「置換ヘテロアリール」は、置換基として1つ以上の非妨害基を有するヘテロアリールである。
【0043】
「置換ヘテロ環」は、非妨害置換基から形成される1つ以上の側鎖を有するヘテロ環である。
【0044】
本願明細書で使用される場合、「有機ラジカル」は、アルキル、置換アルキル、アリール、および、置換アリールを含むものとする。
【0045】
「求電子物質」および「求電子基」とは、イオンを含むことが可能であり、求電子中心(すなわち、電子を求める中心)を有し、求核体と反応することができる、イオンまたは原子、あるいは一群の原子のことである。
【0046】
「求核体」および「求核基」とは、イオンを含むことが可能であり、求核中心(すなわち求電子中心を求めている中心または求電子物質を有する中心)を有する、イオンまたは原子、あるいは一群の原子のことである。
【0047】
「生理学的に開裂可能な」または「加水分解性の」結合は、生理学的条件下で水と反応する(すなわち加水分解される)結合である。水中での加水分解に対する結合の傾向は、2つの中心原子を結合する一般型の結合だけでなく、これらの中心原子に付着した置換基にも依存する。適切な加水分解的に不安定な、または弱い結合には、これに限定されないが、カルボン酸エステル、リン酸塩エステル、無水物、アセタール、ケタール、アシルオキシアルキルエーテル、イミン、オルトエステル、ペプチド、およびオリゴヌクレオチドが挙げられる。
【0048】
「酵素的に分解可能な結合」とは、1つ以上の酵素によって分解される結合のことである。
【0049】
「加水分解的に安定した」連結または結合とは、実質的に水中で安定している、すなわち、長期間にわたって相当の程度の生理学的条件下で加水分解を受けない、化学的結合、一般に共有結合のことである。加水分解的に安定した結合の例には、これに限定されないが、(例えば、脂肪族鎖内の)炭素−炭素結合、エーテル、アミド、ウレタンなどが挙げられる。概して、加水分解的に安定した結合は、生理学的条件下で、1日に約1乃至2%未満の加水分解の比率を示すものである。代表的な化学的結合の加水分解比率は、大部分の標準的な化学の教科書に見られる。
【0050】
「医薬として許容される賦形剤」とは、任意に、本発明の組成物に含むことが可能であり、患者に著しい有害な毒物学的影響を生じさせない、賦形剤のことである。
【0051】
「治療有効量」は、本願明細書において使用され、血流内または標的組織内に所望のレベルの抱合体(または対応する非抱合の第IX因子部分)の提供に必要である、高分子−第IX因子部分の抱合体の量のことである。その正確な量は、特定の第IX因子部分、治療組成物の構成要素および物理的特性、対象とする患者集団、送達様式、個々の患者の考慮すべき問題、などの数多くの要素に基づくものであり、本願明細書において提供される情報に基づいて、当業者が容易に決定することができる。
【0052】
「多官能性」とは、高分子内に含まれる3つ以上の官能基を有する高分子のことであり、官能基は同一か、または異なるものであってよい。多官能性高分子試薬は、一般に、3乃至100の官能基、3乃至50の官能基、3乃至25の官能基、3乃至15の官能基、または3乃至10の官能基を含むか、あるいは高分子骨格内に3、4、5、6、7、8、9、または10の官能基を含む。
【0053】
本願明細書で使用される場合、「第IX因子部分」という用語は、第IX因子活性を有する部分のことである。第IX因子部分はまた、高分子試薬との反応に好適な、少なくとも1つの求電子基または求核基も有する。一般に、必ずではないが、第IX因子部分はタンパク質である。さらに、「第IX因子部分」という用語は、抱合前の第IX因子部分および抱合後の第IX因子部分の残留物の両方を包含する。以下に詳述するように、当業者は、所定の部分が第IX因子活性を有するかどうかを決定することができる。配列番号:1に対応するアミノ酸配列を含むタンパク質は、第IX因子部分およびその生物学的特性が第IX因子の活性をもたらす、任意のタンパク質またはポリペプチドである。本願明細書で使用される場合、「第IX因子部分」という用語は、例えば部位特異的突然変異生成によって、または偶然に突然変異を介して、意図的に改変されたタンパク質を含む。「第IX因子部分」という用語はまた、1つ乃至6つの更なるグリコシル化部位を有する誘導体、更なるアミノ酸が少なくとも1つのグリコシル化部位を含む、タンパク質のカルボキシ末端部で少なくとも1つの更なるアミノ酸を有する誘導体、および少なくとも1つのグリコシル化部位を含むアミノ酸配列を有する誘導体も含む。
【0054】
「実質的に相同」という用語は、例えば変異配列などの特定の対象配列が、1つ以上の置換、欠損、または付加によって参照配列とは異なり、その正味の影響が、参照配列と対象配列との間の不都合な機能的相違点をもたらさないことを示す。本発明の目的を達成するために、95%を超える相同性、同等の生物学的特性(潜在的に異なる活性の程度)、および同等の発現特性を有する配列は、実質的に相同であるとみなす。相同性を決定するために、成熟配列の切断は無視されるべきである。より少ない程度の相同性、相当する生物活性、および同等の発現特性を有する配列は、実質的に同等であるとみなす。本願明細書に使用する典型的な第IX因子部分には、配列番号:1に実質的に相同な配列を有するタンパク質が挙げられる。
【0055】
「フラグメント」という用語は、ある程度の第IX因子活性を保持する、一部の第IX因子部分のアミノ酸配列を有する、任意のタンパク質またはポリペプチドのことである。フラグメントは、第IX因子のタンパク質のタンパク質分解によって生成されるか、または従来技術の方法のルーチンによる化学合成によって生成されるタンパク質またはポリペプチドを含む。特定のフラグメントが、第IX因子の生物学的活性を有するかどうかの決定は、1つ以上の哺乳類の種に関するこのような目的に用いられる、従来の公知の試験によって行うことができる。このような生物学的活性を実証するために用いることができる適切な試験を、本願明細書に記述する。
【0056】
第IX因子の「欠損変異体」は、第IX因子部分の1つのアミノ酸残基が欠損したペプチドまたはタンパク質であり、欠損したアミノ酸残基に前後するアミノ酸残基は、アミド結合によって結合する(欠損したアミノ酸残基が、ペプチドまたはタンパク質の終端上に位置した場合を除く)。欠損変異体は、アミノ酸残基が1つだけ欠損した場合、および2つのアミノ酸が欠損した場合、3つのアミノ酸が欠損した場合、および4つのアミノ酸が欠損した場合、などを含む。しかし、各欠損変異体は、ある程度の第IX因子活性を保持しなければならない。
【0057】
第IX因子部分の「置換変異体」は、第IX因子部分の1つのアミノ酸残基が欠損して、異なるアミノ酸残基が置き換わった、ペプチドまたはタンパク質である。置換変異体は、アミノ酸残基が1つだけ置換された場合、および2つのアミノ酸が置換された場合、3つのアミノ酸が置換された場合、および4つのアミノ酸が置換された場合、などを含む。しかし、各置換変異体は、ある程度の第IX因子活性を有さなければならない。
【0058】
第IX因子部分の「付加変異体」は、アミノ酸配列に第IX因子部分の1つのアミノ酸残基が添加されたペプチドまたはタンパク質であり、隣接したアミノ酸残基は、アミド結合を通じて、添加されたアミノ酸残基に付着する(添加されたアミノ酸残基が、ペプチドまたはタンパク質の終端上に位置し、アミド結合の1つだけが添加されたアミノ酸残基を付着する場合を除く)。付加変異体は、アミノ酸残基が1つだけ添加された場合、および2つのアミノ酸が添加された場合、3つのアミノ酸が添加された場合、および4つのアミノ酸が添加された場合、などを含む。しかし、各付加変異体は、ある程度の第IX因子活性を有さなければならない。
【0059】
「患者」という用語は、活性剤(例、抱合体)の投与によって予防または治療することができる症状に、罹患したまたはその傾向のある生物のことであり、人間および動物の両方を含む。
【0060】
「任意の」または「任意に」とは、記述が、状況が生じた場合、および生じなかった場合を含むように、後述する状況が生じ得る又は生じ得ないことを意味する。
【0061】
「実質的に」とは(他で特定の文脈に対して特に定義されていなければ、または文脈が別に明確に指示していない限り)、例えば、その状態の50%を超える、51%以上、75%以上、80%以上、90%以上、および95%以上、のうちの1つ以上をほぼ完全に、または完全に満たすことである。
【0062】
コンテキストが別に明確に指示していない限り、数値の前に「約」がある場合は、その数値は、所定の数値の±10%を示すものであると理解される。
【0063】
ペプチド内のアミノ酸残基は、次のように省略される:
フェニルアラニンは、PheまたはF;ロイシンは、LeuまたはL;イソロイシンは、IleまたはI;メチオニンは、MetまたはM;バリンは、ValまたはV;セリンは、SerまたはS;プロリンは、ProまたはP;スレオニンは、ThrまたはT;アラニンは、AlaまたはA;チロシンは、TyrまたはY;ヒスチジンは、HisまたはH;グルタミン(Glutarnine)は、GlnまたはQ;アスパラギンは、AsnまたはN;リシンは、LysまたはK;アスパラギン酸は、AspまたはD;グルタミン酸は、GluまたはE;システインは、CysまたはC;トリプトファンは、TrpまたはW;アルギニンは、ArgまたはR;グリシンは、GlyまたはG。
【0064】
本発明の1つ以上の実施態様を参照すると、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に共有結合した第IX因子部分を含む抱合体を提供する。本発明の抱合体は、以下の特徴のうちの1つ以上を有する。
【0065】
第IX因子部分
【0066】
上述のように、「第IX因子部分」という用語は、抱合前の第IX因子部分、および水溶性高分子への付着後の第IX因子部分を含むものとする。しかし、第IX因子部分が非ペプチド性の水溶性高分子に付着する場合、第IX因子部分は、高分子(または高分子に付着したスペーサ部分)への結合に関連する1つ以上の共有結合の存在により、わずかに変更されると理解される。しばしば、別の分子に付着した第IX因子部分の、このわずかに変更された形態を、第IX因子部分の「残留物」と称する。
【0067】
第IX因子部分は、非組み換え方法または組み替え方法から誘導することができ、本発明はこの点に関しては制限されない。さらに、第IX因子部分は、ヒトのソースから、または動物のソースから誘導することができる。
【0068】
第IX因子部分は、非組み換え的に誘導することができる。例えば、第IX因子部分は、血液由来ソースから得ることができる。特に、第IX因子は、当業者に公知の沈殿および遠心分離技術を使用して、ヒト血漿から分画することができる。Wickerhauser(1976)のTransfusion 16(4):345〜350、およびSlichter他(1976)のTransfusion 16(6):616〜626を参照のこと。第IX因子はまた、ヒト顆粒球から分離することもできる。Szmitkoski他(1977)のHaematologia(Budap.)11(1−2):177〜187を参照のこと。
【0069】
第IX因子部分は、組み換え方法から誘導することができる。例えば、第IX因子部分である天然の第IX因子をコードするcDNAは、分離、特徴づけ、および発現ベクターにクローニングされている。Choo他(1982)の「Molecular Cloning of the Gene for Human Anti−hemophilic Factor IX」、Naure、Vol.299:178〜180、およびKurauchi他(1982)の「Isolation and Characterization of a cDNA Coding for Human Factor IX」、Proc. Natl. Acad. Sci. U.S.A、Vol.79:6461〜65を参照のこと。
【0070】
天然の第IX因子は、発現すると約55,000のダルトンの一本鎖の糖タンパク質となる。それは構造的に、Glaまたはγカルボキシグルタミン酸が豊富なドメイン、EGF様の領域、活性化ペプチド、および活性部位、の4つのドメインを有するとみなすことができる。発現アミノ酸配列は、配列番号:1に提供される。特に注記されていなければ、本願明細書において提供されるアミノ酸残基の数値の場所の全ての割り当ては、配列番号:1に基づくものである。
【0071】
第IX因子部分に使用される典型的な組み換え方法は、(天然の第IX因子であっても、第IX因子活性を有する異なるタンパク質であっても)、簡潔に述べることができる。このような方法は、所望のポリペプチドまたはフラグメントをコードする核酸の構築、核酸の発現ベクターへのクローニング、宿主細胞(例えば、植物、E.コリ(E.coli)のような細菌類、サッカロマイセス・セルビシエ(Saccharomyces cerevisiae)のような酵母、またはチャイニーズハムスター卵巣細胞またはベイビーハムスター腎臓細胞のような哺乳類の細胞)の形質転換、および所望のポリペプチドまたはフラグメントを産生するための核酸の発現を伴う。発現は、外因性発現(宿主細胞が自然に所望の遺伝子コードを含む場合)によって、または内因性発現によって生じさせることができる。インビトロ並びに原核生物および真核生物の宿主細胞におけるの組み換えポリペプチドの産生および発現のための方法は、当業者には公知である。米国特許第4,868,122号を参照のこと。
【0072】
組み換えポリペプチドの同定および精製を容易にするために、エピトープ標識または他の親和性結合配列をコードする核酸配列は、コード配列を用いて挿入またはフレーム単位で追加することができ、それによって、所望のポリペプチドおよび結合に適したポリペプチドを含む融合タンパク質を産生する。融合タンパク質は、融合タンパク質内のエピトープ標識または他の結合配列に対象とする結合部分(例、抗体)を有するアフィニティカラムに、融合タンパク質を含む混合物を最初に流し、それによってカラム内に融合タンパク質を結合させることにより、同定および精製することができる。その後、結合した融合タンパク質を解放するために、適切な溶液(例、酸)でカラムを洗浄することによって、融合タンパク質を回収することができる。組み換えポリペプチドも、宿主細胞を溶解させて、例えばサイズ排除クロマトグラフィによってポリペプチドを分離して、ポリペプチドを収集することによって、同定および精製することができる。組み換えポリペプチドを同定および精製するためのこれらの方法および他の方法は、当業者には公知である。しかし、本発明の1つ以上の実施態様では、第IX因子部分が融合タンパク質の形態でないことが好ましい。
【0073】
第IX因子活性を有するタンパク質を発現させるために使用される系に依存して、第IX因子部分を非グリコシル化またはグリコシル化することができ、そのいずれも使用することが可能である。すなわち、第IX因子部分を非グリコシル化することも、第IX因子部分をグリコシル化することもできる。本発明の1つ以上の実施態様では、第IX因子部分がグリコシル化されることが好ましい。
【0074】
第IX因子活性を有する部分は、アミノ酸内の原子に高分子を容易に付着させるために、例えば、リシン、システイン、および/またはアルギニンのような、1つ以上のアミノ酸残基を含むように、好都合に改変することができる。さらに、第IX因子部分は、非天然に生じるアミノ酸残基を含むように、改変することができる。アミノ酸残基を添加し、非天然にアミノ酸残基を生じさせるための技術は、当業者に公知である。J.March、Organic Che mistry:Reactions Mechanisms and Structure、4th Ed.(New York:Wiley−Interscience、1992)を参照した。
【0075】
さらに、第IX因子部分は、(官能基を含むアミノ酸残基の付加によるもの以外の)官能基の付着を含むように、好都合に改変することができる。例えば、第IX因子部分は、チオール基を含むように、改変することができる。さらに、第IX因子部分は、N末端のα炭素を含むように、改変することができる。さらに、第IX因子部分は、1つ以上の炭水化物部分を含むように、改変することができる。アミノキシ、アルデヒド、または他の官能基を含むように改変された第IX因子部分を使用することもできる。
【0076】
第IX因子部分には、これに限定されないが、第IX因子、第IXa因子、第IX因子の切断バージョン、ハイブリッドタンパク質、および第IX因子活性を有するペプチド模倣剤が挙げられる。生物活性フラグメント、欠損変異体、置換変異体、または少なくともある程度の第IX因子活性を保持する上述のうちのいずれかの付加変異体も、第IX因子部分としての機能を果たすことができる。
【0077】
任意の所定の部分に対して、その部分が第IX因子活性を有するかどうかを決定することが可能である。例えば、複数の動物の系統は、このような系統から作り出された動物が、非常に低く不十分なレベルの第IX因子を有するように、血友病に対する遺伝変種によって意図的に繁殖される。このような系統は、これに限定されないが、Division of Laboratories and Research、New York Department of Public Health、Albany、NY、およびDepartment of Pathorogy、University of North Carolina、Chapel Hill、NC、のような様々なソースから利用可能である。これらのソースのどちらも、例えばイヌ血友病Bを罹患しているイヌを提供する。このような任意の所定の第IX因子活性を試験するために、小さな切り傷を与えた、罹患動物にその部分を注射し、出血時間を健常対照群と比較する。第IX因子活性の決定に有用な別の方法では、共同因子、および、凝血促進活性を決定する。Mertens他(1993)Brit.J.Haematol. 85:133〜42を参照のこと。所定の部分が第IX因子活性を有するかどうかを決定するために、当業者に公知の他の方法を使用することもできる。このような方法は、提案された第IX因子部分および対応する高分子−第IX因子部分抱合体の両方の第IX因子活性の決定に有用である。
【0078】
水溶性高分子
【0079】
上述のように、各抱合体は、水溶性高分子に付着した第IX因子部分を含む。水溶性高分子に関して、水溶性高分子は、非ペプチド性、非中毒性であり、非天然に生じ、生体適合性がある。生体適合性に関して、ある物質を単独で、または生体組織に関連して(例、患者への投与)、別の物質(例、第IX因子部分のような活性剤)との使用に関連する有益な効果が、臨床医(例、医師)によって任意の悪影響を上回ると評価された場合、その物質は生体適合性があるとみなされる。非免疫原性に関して、生体内でのある物質の使用で不要な免疫反応(例えば抗体の形成)を生じない場合は、その物質は非免疫原性があるとみなされるか、または免疫反応が生じた場合、このような反応は臨床医によって臨床上有意または重要とみなされない。水溶性高分子は、生体適合性および非免疫原性があることが特に好ましい。
【0080】
さらに、高分子は、一般に2乃至約300の終端を有するものと特徴付けられる。このような高分子の例には、これに限定されないが、ポリエチレングリコール(PEG)、ポリ(プロピレングリコール)(「PPG」)、エチレングリコールの共重合体、およびプロピレングリコールなどのようなポリ(アルキレングリコール)、ポリ(オキシエチル化ポリオール)、ポリ(オレフィンアルコール)、ポリ(ビニルピロリドン)、ポリ(ヒドロキシアルキルメタクリルアミド)、ポリ(サッカライド)、ポリ(α−ヒドロキシ酸)、ポリ(ビニルアルコール)、ポリホスファゼン、ポリオキサゾリン、ポリ(N−アクリロイルモルホリン)、およびこれらを組み合わせたものが挙げられる。
【0081】
高分子は、特定の構造に限定されるものでなく、線形(例、アルコキシPEGまたは二官能性PEG)、または分岐状、叉状、多腕状(例、ポリオールコアに付着させたPEG)、および樹枝状のような非線形とすることができる。さらに、高分子の内部構造は、複数の異なるパターンで構成することができ、ホモ重合体、交互共重合体、ランダム共重合体、ブロック共重合体、交互3種共重合体、ランダム3種共重合体、およびブロック3種共重合体から成る群から選択することができる。
【0082】
一般に、活性化PEGおよび他の活性化水溶性高分子(すなわち高分子試薬)は、第IX因子部分上の所望の部位への結合に適切な、好適な活性化基によって活性化される。したがって、高分子試薬は、第IX因子部分との反応のための反応基を備える。活性部分にこれらの高分子を抱合するための、代表的な高分子試薬および方法は公知技術であり、Polyethylene Glycol Chemistry:Biotechnical and Biomedical Applications、J.M.Harris、Plenus Press、New York(1992)のZalipsky,S.他の「Use of Functionalized Poly(Ethylene Glycols) for Modification of Polypeptides」、およびZalipsky(1995)のAdvanced Drug Reviews 16:157〜182に詳述されている。
【0083】
一般に、抱合体中の水溶性高分子の重量平均分子量は、約100ダルトン乃至約150,000ダルトンである。しかし、重量平均分子量の範囲の例には、5,000ダルトン乃至約100,000ダルトンの範囲、約6,000ダルトン乃至約90,000ダルトンの範囲、約10,000ダルトン乃至約85,000ダルトンの範囲、10,000ダルトン乃至約85,000ダルトンの範囲、約20,000ダルトン乃至約85,000ダルトンの範囲、約53,000ダルトン乃至約85,000ダルトンの範囲、約25,000ダルトン乃至約120,000ダルトンの範囲、約29,000ダルトン乃至約120,000ダルトンの範囲、約35,000ダルトン乃至約120,000ダルトンの範囲、および約40,000ダルトン乃至約120,000ダルトンの範囲、が挙げられる。任意の所定の水溶性高分子に対して、これらの範囲の1つ以上の分子量を有するPEGが好ましい。
【0084】
水溶性高分子の典型的な重量平均分子量には、約100ダルトン、約200ダルトン、約300ダルトン、約400ダルトン、約500ダルトン、約600ダルトン、約700ダルトン、約750ダルトン、約800ダルトン、約900ダルトン、約1,000ダルトン、約1,500ダルトン、約2,000ダルトン、約2,200ダルトン、約2,500ダルトン、約3,000ダルトン、約4,000ダルトン、約4,400ダルトン、約4,500ダルトン、約5,000ダルトン、約5,500ダルトン、約6,000ダルトン、約7,000ダルトン、約7,500ダルトン、約8,000ダルトン、約9,000ダルトン、約10,000ダルトン、約11,000ダルトン、約12,000ダルトン、約13,000ダルトン、約14,000ダルトン、約15,000ダルトン、約20,000ダルトン、約22,500ダルトン、約25,000ダルトン、約30,000ダルトン、約35,000ダルトン、約40,000ダルトン、約45,000ダルトン、約50,000ダルトン、約55,000ダルトン、約60,000ダルトン、約65,000ダルトン、約70,000ダルトン、および、約75,000ダルトン、が挙げられる。上述のいずれかの総分子量を有する、水溶性高分子の分岐バージョン(例えば、2つの20,000ダルトンの高分子を含む、分岐した40,000ダルトンの水溶性高分子)を使用することもできる。1つ以上の実施態様では、抱合体は、直接的または間接的に、約6,000ダルトン未満の重量平均分子量を有するPEGと結合した任意のPEG部分を有さない。
【0085】
高分子として使用される場合、PEGは一般に、複数の(OCH2CH2)単量体(または(CH2CH2O)単量体、そのPEGがどのように定義されるかに依存して)を含む。本記述を通じて使用される場合、繰り返し単位の数は、「(OCH2CH2)n」の下付き数字の「n」によって同定される。したがって、一般に(n)の値は、以下の1つ以上の範囲に含まれる。2乃至約3400、約100乃至約2300、約100乃至約2270、約136乃至約2050、約225乃至約1930、約450乃至約1930、約1200乃至約1930、約568乃至約2727、約660乃至約2730、約795乃至約2730、約795乃至約2730、約909乃至約2730、および約1,200乃至約1,900。分子量が公知である任意の所定の高分子に対して、高分子の総重量平均分子量を繰り返しモノマーの分子量で割ることによって、繰り返し単位の数(すなわち「n」)を決定することが可能である。
【0086】
水溶性高分子の分子量に関して、本発明の1つ以上の実施態様では、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に共有結合した第IX因子部分を含む抱合体であって、前記水溶性高分子の分子量が、5,000ダルトンより多く、約150,000ダルトンより少ない抱合体を提供する。
【0087】
水酸基を使用することもできるが、本発明で使用される1つの特に好適な高分子は、エンドキャップされた高分子、すなわち、低級C1-6アルコキシ基のような比較的不活性な基でキャップされた少なくとも1つの終端を有する高分子である。例えば、高分子がPEGである場合、線状のPEGであるメトキシ−PEG(一般に、mPEGと称される)を使用することが好ましく、高分子の1つの終端はメトキシ基(−OCH3)を有するが、他の終端はヒドロキシルまたは任意に化学的に改変できる官能基である。
【0088】
本発明において有用な1つの形態において、遊離または非結合PEGは、水酸基により各末端が終端した線状の高分子である:
【化2】

{ここで、(n)は一般にゼロ乃至約4,000の範囲である}。
【0089】
上述の高分子、α−、ω−ジヒドロキシポリ(エチレングリコール)は、簡単にHO−PEG−OHで表すことができ、記号−PEG−は、以下の構造単位を表すことができると理解される:
【化3】

{ここで、(n)は上述の通りである}。
【0090】
本発明において有用なPEGの別のタイプは、メトキシ−PEG−OHまたは簡単にmPEGであり、その1つの終端は比較的不活性なメトキシ基であるが、他の終端は水酸基である。mPEGの構造は、下記で与えられる:
【化4】

{ここで、(n)は上述の通りである}。
【0091】
米国特許第5,932,462号に開示されているような、多腕状または分岐状PEG分子は、PEG高分子としても使用することができる。例えば、PEGは、以下の構造を有することができる:
【化5】

{ここで、
polyaおよびpolybは、メトキシポリ(エチレングリコール)のような、(同一の、または異なる)PEG骨格である;
R”は、H、メチル、またはPEG骨格のような非反応性部分である:且つ
PおよびQは、非反応性結合である}。1つ以上の実施態様では、分岐PEG高分子は、メトキシポリ(エチレングリコール)二置換リシンである。使用される特定の第IX因子に依存して、二置換リシンの反応性エステル官能基は、第IX因子部分内のターゲットグループとの反応に好適な官能基を形成するように、さらに改変することが可能である。
【0092】
さらに、PEGは、叉状PEGを含むことができる。叉状PEGの一例は、以下の構造によって表される:
【化6】

{ここで、Xは1つ以上の原子のスペーサ部分であり、Zは定義された長さの原子の鎖によってCHに結合した活性化末端基である}。国際特許出願第PCT/US99/05333号は、本発明の1つ以上の実施態様で使用することができる、種々の叉状PEG構造を開示している。分岐炭素原子にZ官能基を結合する原子の鎖は、テザリング基としての機能を果たし、例えば、アルキル鎖、エーテル鎖、エステル鎖、アミド鎖、およびそれらを組み合わせたものを含むことが可能である。
【0093】
PEG高分子は、PEG鎖の端部においてではなく、PEGに沿って共有結合した、カルボキシルのような反応基を有するペンダントPEG分子を含むことが可能である。アルキレン基のような、ペンダント反応基は、直接的にまたはスペーサ部分を介して、PEGに付着させることができる。
【0094】
上述のPEGの形態に加えて、高分子はまた、上述の高分子のいずれかを含む、高分子内の1つ以上の弱い、または分解可能な結合(加水分解的に分解可能な結合など)によって調製することもできる。例えば、PEGは、加水分解を受ける高分子内のエステル結合によって調製することができる。以下に示すように、この加水分解は、より低い分子量のフラグメントへの高分子の開裂をもたらす:
【化7】

【0095】
ポリマー骨格内の分解可能な結合として有用な、他の加水分解的に分解可能な結合は、以下を含む。炭酸塩結合;例えば、アミンおよびアルデヒドの反応によって得られるイミン結合(Ouchi他(1977)Polymer Preprints 38(1):582〜3を参照のこと);例えば、リン酸基とアルコールの反応によって形成されるリン酸塩エステル結合;一般にヒドラジドおよびアルデヒドの反応によって形成されるヒドラゾン結合;一般にアルデヒドおよびアルコールの反応によって形成されるアセタール結合;例えば、ギ酸塩およびアルコールの反応によって形成されるオルトエステル結合;例えばPEGのような高分子の末端において、アミン基および別のPEG鎖のカルボキシル基によって形成されるアミド結合;例えば末端イソシアン酸塩基を有するPEGおよびPEGアルコールの反応によって形成されるウレタン結合;例えばPEGのような高分子の末端において、アミン基およびペプチドのカルボキシル基によって形成されるペプチド結合;例えば高分子の末端において、例えば、ホスホラミダイト基およびオリゴヌクレオチドの5’水酸基によって形成されるオリゴヌクレオチド結合。
【0096】
高分子抱合体のこのような任意の特徴、すなわち高分子鎖への1つ以上の分解可能な結合の導入は、投与時に、抱合体の最終的に所望する薬理学的特性に更なる制御を提供することが可能である。例えば、大きくて比較的不活性な抱合体(例、第IX因子部分に付着した1つ以上の高分子量のPEG鎖、例えば、約10,000を超える分子量を有する1つ以上のPEG鎖を有し、抱合体は基本的に生物活性を持たない)を投与することが可能であり、それは元のPEG鎖の一部を持つ生理活性抱合体を生成するように加水分解される。このように、抱合体の特性は、経時的に抱合体の生物活性の平衡を保たせるために、より効果的に調製することができる。
【0097】
当業者は、実質的に水溶性の高分子セグメントに関わる上述の説明は、決して網羅的でなく、単に例証を示すだけであり、上述の特性を有する全ての高分子物質を考慮したものであると認識するだろう。本願明細書で使用される場合、「高分子試薬」という用語は、概して分子全体のことであり、水溶性高分子セグメントおよび官能基を含むことができる。
【0098】
抱合体
【0099】
上述のように、本発明の抱合体は、(直接的にまたはスペーサ部分を介して)第IX因子部分に共有結合した水溶性高分子を含む。一般に、任意の所定の抱合体に対して、第IX因子部分に共有結合した1つ乃至4つの水溶性高分子が存在する(各水溶性高分子に対して、水溶性高分子は、直接的にまたはスペーサ部分を介して、第IX因子部分に付着させることができる)。しかし、場合によっては、抱合体は、第IX因子部分に共有結合した1、2、3、4、5、6、7、8つ以上の水溶性高分子を有することが可能である。さらに、抱合体は、第IX因子部分に共有結合した8つを超えない水溶性高分子、第IX因子部分に共有結合した7つを超えない水溶性高分子、第IX因子部分に共有結合した6つを超えない水溶性高分子、第IX因子部分に共有結合した5つを超えない水溶性高分子、第IX因子部分に共有結合した4つを超えない水溶性高分子、第IX因子部分に共有結合した3つを超えない水溶性高分子、および第IX因子部分に共有結合した2つを超えない水溶性高分子、を含むことが可能である。
【0100】
第IX因子部分と高分子(または高分子に付着したスペーサ部分)との特定の結合は、複数の因子に基づくものである。このような因子には、例えば、化学的に用いられる特定の結合、特定の第IX因子部分、第IX因子部分内の利用可能な官能基(高分子への付着、または好適な付着部位への変換に対して)、第IX因子部分内に更なる反応性官能基が存在する可能性、などが挙げられる。
【0101】
本発明の1つ以上の実施態様では、第IX因子部分と高分子(または高分子に付着したスペーサ部分)との結合は、アミド、ウレタン(別名カルバメート)、アミン、チオエーテル(別名硫化物)または尿素(別名カルバミド)のような、加水分解的に安定した結合である。1つ以上の実施態様では、トリアジン、アセチル、ヒドラジン、ジアゾニウム、または第IX因子部分を有するスクシンイミジルエステル官能基を有する、高分子試薬の反応によって結合は生じない。ある場合では、その結合がカルバメート結合でもカルバミド結合でもないことが好ましく、さらに、第IX因子部分に対して、イソシアン酸塩またはイソチオシアン酸塩種を持つ高分子誘導体の反応に基づいて、いかなる結合も形成されないことが好ましい。また、好適な加水分解的に安定な結合は、アミドである。アミドは、第IX因子部分内に含まれるカルボキシル基(例えば、第IX因子活性を有するペプチド部分の末端カルボキシル)の、アミノ末端高分子との反応によって容易に調製することができる。
【0102】
本発明の1つ以上の実施態様では、第IX因子部分と高分子(または高分子に付着したスペーサ部分)の結合は、分解可能な結合である。このように、水溶性高分子(および任意のスペーサ部分)の結合は、「開裂可能」である。すなわち、水溶性高分子(および任意のスペーサ部分)は、(加水分解、酵素のプロセス、または別の方法を介して)開裂し、それによって天然または非抱合の第IX因子部分が得られる。開裂可能な結合は、水溶性高分子(および任意のスペーサ部分)の任意のフラグメントを残さずに、生体内の第IX因子部分から分離する高分子(および任意のスペーサ部分)をもたらすことが好ましい。典型的な分解可能な結合には、炭酸塩、カルボン酸エステル、リン酸塩エステル、チオールエステル、無水物、アセタール、ケタール、アシルオキシアルキルエーテル、イミン、およびオルトエステルが挙げられる。このような結合は、従来技術において一般的に用いられる結合方法を使用して、第IX因子部分(例、タンパク質のカルボキシル基C末端、またはタンパク質内に含まれるセリンまたはスレオニンのようなアミノ酸の側鎖水酸基)、および/または高分子試薬の適切な改変によって容易に調製することができる。しかし、適切に活性化した高分子と、第IX因子活性を有する部分内に含まれる非改変の官能基との反応によって、容易に形成される加水分解性の結合が最も好ましい。
【0103】
結合に関して、本発明の1つ以上の実施態様では、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子にアミノ酸残基において共有結合した第IX因子部分を含む抱合体であって、前記アミノ酸残基は、直接的にまたは前記スペーサ部分を介して、CH2−C(O)−O−、−N(H)−C(O)CH2−O−、−C(O)−N(H)−、−N(H)−C(O)−CH2−O−、−C(O)−CH2−O−、−C(O)−CH2−CH2−C(O)−O−、ジアゾ、またはトリアジン結合により結合していない抱合体を提供する。
【0104】
抱合体(非抱合の第IX因子部分に対して)は、測定可能な程度の第IX因子活性を有し得るか又は有し得ない。すなわち、本発明による抱合体は、0%乃至100%又はそれ以上の未改変の親第IX因子部分の生物活性をどこかに持っている。好ましくは、ほとんどまたは全く第IX因子活性を持っていない化合物は、一般に、抱合体中の活性の欠損に関係なく、活性親分子(または第IX因子活性を有するその誘導体)が、水性誘導性の結合の開裂時に開放されるように、その部分に高分子を接続する加水分解性の結合を含む。このような活性は、用いられる第IX因子活性を有する特定の部分の公知の活性に応じて、好適な生体内または生体外モデルを使用して決定することが可能である。
【0105】
各水溶性高分子部分の開裂は、ウレタン、アミド、炭酸塩、またはエステル含有の結合のような、生理学的に開裂可能な、および/または酵素的に分解可能な結合の使用を介して容易にされることが最も好ましい。このように、(個々の水溶性高分子の開裂による)抱合体のクリアランス(clearance)は、所望のクリアランス特性を提供する、高分子の分子サイズおよび官能基のタイプを選択することによって、調製することができる。当業者は、高分子の適切な分子サイズ、および開裂可能な官能基を決定することができる。例えば、当業者は、決まりきった試験を使用して、最初に、異なる高分子重量および開裂可能な官能基を有する様々な高分子−第IX因子抱合体を調製し、次いで、その抱合体を患者に投与して、定期的に血液および/または尿のサンプリングを行って、各抱合体に対するクリアランスプロファイルを得ることによって、適切な分子サイズおよび開裂可能な官能基を決定することができる。試験した抱合体のそれぞれに対する一連のクリアランスプロファイルが得られれば、所望のクリアランスを有する抱合体を識別することができる。
【0106】
第IX因子部分を高分子に結合させる加水分解的に安定な結合を持つ抱合体に対して、抱合体は、一般に、測定可能な程度の第IX因子活性を持つ。例えば、このような抱合体は、非抱合の第IX因子部分の生物活性に対する、1つ以上の以下の割合を満たす生物活性を有するものと特徴付けられる:少なくとも約2%、少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約25%、少なくとも約30%、少なくとも約40%、少なくとも約50%、少なくとも約60%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約97%、少なくとも約100%、および105%以上(本願明細書に示す、および/または公知技術のような、好適なモデルにおいて測定した場合)。加水分解的に安定な結合(例、アミド結合)を有する抱合体は、少なくともある程度の未改変の親第IX因子部分の生物活性を有することが好ましい。
【0107】
以下、典型的な抱合体について説明する。第IX因子部分は、(少なくとも部分的に)天然の第IX因子に類似するか、またはこれに関するアミノ酸配列を共有するものと思われる。したがって、天然の第IX因子タンパク質内の特定の場所または原子を参照するが、このような参照は、便宜上のものであり、また、第IX因子活性を有する他の部分内の対応する場所または原子を容易に決定できる当業者に対するものである。特に、天然の第IX因子に対して本願明細書に提供される記述は、しばしば第IXa因子、およびフラグメント、欠損変異体、置換変異体、または上述のうちのいずれかの付加変異体に適用可能である。
【0108】
第IX因子部分上のアミノ基は、第IX因子部分と水溶性高分子との付着場所を提供することができる。天然の第IX因子は、27のリシン残基を含み、それぞれが、抱合および1つのアミノ終端に利用可能である、ε−アミノ基を有する。したがって、このような第IX因子部分の典型的な付着場所には、位置39、45、51、68、89、109、127、137、146、168、189、234、247、260、274、293、311、339、347、362、387、438、440、446、455、457、および459のうちのいずれか1つ以上における、(リシンのアミン含有側鎖を介して)アミノ酸での付着が挙げられる。さらに、第IX因子活性を有する任意のタンパク質のN末端アミンはまた、付着の場所としての機能を果たすこともできる。
【0109】
第IX因子部分の利用可能なアミンとの共有結合の形成に有用な、好適な水溶性高分子試薬には複数の例がある。具体的な例を、対応する抱合体とともに下記の表1に示す。表において、変数(n)は、単量体の繰り返し単位の数を表し、「−NH−F9」は、水溶性高分子への抱合に続く第IX因子部分を表す。表1に示す各高分子部分((OCH2CH2)nまたは(CH2CH2O)n)は、「CH3」基において終端するが、他の基(Hおよびベンジルなど)は、そのために置換することができる。
【0110】
【表1】

【表2】

【表3】

【表4】

【表5】

【表6】

【表7】

【0111】
第IX因子部分のアミン基への高分子試薬の抱合は、様々な技術によって達成することができる。1つの手法では、第IX因子部分は、スクシンイミジル誘導体(または、他の活性化エステル基であり、スクシンイミジル誘導体に対して記述された手法に類似する手法を、他の活性化エステル基含有の高分子試薬に使用するができる)によって官能化される高分子試薬に抱合することができる。この手法では、異なる反応条件(例えば、6乃至7のような低いpH、または異なる温度、および/または15℃未満)は、第IX因子部分上の異なる場所への高分子の付着をもたらすことができるが、スクシンイミジル基を持つ高分子試薬は、7.0乃至9.0のpHでの水性媒体において第IX因子部分に付着することができる。さらに、アミド結合は、アミン末端非ペプチド、水溶性高分子をアルデヒドまたは活性化カルボン酸基を持つ第IX因子部分と反応させることによって、形成することができる。
【0112】
典型的な抱合体は、以下の構造を含む
【化8】

{ここで、
(n)は、2乃至3400の値を有する整数である;
Xは、スペーサ部分であり、メチレン(「−CH2−」)、エチレン(「−CH2CH2−」)、およびプロピレン(「−CH2CH2CH2−」)のうちの1つのであることが好ましい;
R1は、有機ラジカルであり、Hまたはメチル(「−CH3」)であることが好ましい;且つ
F9は、第IX因子部分である}。
【0113】
高分子試薬に第IX因子部分を抱合するための有用な別の手法の典型例には、第IX因子部分の第1級アミンを、ケトン、アルデヒド、またはその水和型(例、ケトン水和物およびアルデヒド水和物)によって抱合するための、還元的アミノ化反応の使用が挙げられる。この手法では、第IX因子部分からの第1級アミンは、アルデヒドまたはケトン(または水和したアルデヒドまたはケトンの、対応するヒドロキシを含む基)のカルボニル基と反応し、それによってシッフ塩基を形成する。シッフ塩基は、次に、水素化ホウ素ナトリウムのような還元剤の使用を介して、安定した抱合体に還元的に変換することができる。選択的な反応(例えばN末端で可能である)は、特に、ケトンまたはα−メチル分岐アルデヒド、および/または特定の反応条件下(例、低いpH)で官能化される高分子によって可能である。
【0114】
カルボキシル基は、第IX因子部分上の付着場所としての機能を果たすことができる、別の官能基を表す。構造的に、抱合体は以下を含んで成る
【化9】

{ここで、F9および隣接したカルボニル基は、カルボキシルを含む第IX因子部分に対応し、Xは、スペーサ部分、好ましくはO、N(H)、およびSから選択されるヘテロ原子であり、POLYは、PEGのような水溶性高分子であり、任意にエンドキャップ部分において終端する}。
【0115】
C(O)−X結合は、末端官能基を持つ高分子誘導と、カルボキシル含有の第IX因子部分との反応によって生じる。上述のように、特定の結合は、用いられる官能基のタイプに依存する。高分子が末端官能基化されるか、または水酸基によって「活性化される」場合、得られる結合は、カルボン酸エステルであり、XはOとなる。ポリマー骨格がチオール基によって官能化される場合、得られる結合はチオエステルであり、XはSとなる。特定の多腕、分岐、または叉状の高分子を用いた場合、C(O)X部分、および、特にX部分は、比較的により複雑になる場合があり、より長い結合構造を含む場合がある。
【0116】
ヒドラジド部分を含む高分子試薬も、カルボニルでの抱合に有用である。第IX因子部分がカルボニル部分を含まない限り、カルボニル部分は、任意のカルボン酸(例、C末端カルボン酸)を還元することによって、および/またはグリコシル化または糖化された(添加された糖は、カルボニル部分を有する)バージョンの第IX因子部分を提供することによって、導入することができる。ヒドラジド部分を含む高分子試薬の具体的な例を、対応する抱合体とともに下記の表2に示す。さらに、活性化エステル(例、スクシンイミジル基)を含む任意の高分子試薬は、活性化エステルを含む高分子試薬を、ヒドラジン(NH2−NH2)またはtert−ブチルカルバゼート(NH2NHCO2C(CH3)3)と反応させることによって、ヒドラジド部分を含むように変換することができる。表において、変数(n)は、単量体の繰り返し単位の数を表し、「=C−F9」は、高分子試薬への抱合に続く第IX因子部分を表す。任意に、ヒドラゾン結合は、好適な還元剤を使用して還元することができる。表1に示す各高分子部分(例、(OCH2CH2)nまたは(CH2CH2O)n)は、「CH3」基において終端するが、他の基(Hおよびベンジルなど)は、そのために置換することができる。
【0117】
【表8】

【表9】

【0118】
第IX因子部分内に含まれるチオール基は、水溶性高分子に対する付着の有効な部位としての機能を果たすことができる。特に、第IX因子部分がタンパク質である場合、システイン残基はチオール基を提供する。このようなシステイン残基内のチオール基は、米国特許第5,739,208号および国際特許出願公開WO 01/62827に開示されるように、N−マレイミジル高分子または他の誘導体などの、チオール基との反応に特有である、活性化PEGと反応させることができる。
【0119】
理論によって制約する意図はないが、第IX因子内のシステイン残基の全てがジスルフィド結合に関与すると考えられる。その結果、ジスルフィド結合に関与するシステイン残基への抱合は、第IX因子の三次構造を分離させる場合があり、潜在的にその活性全体を著しく減じる場合がある。したがって、任意の特定の第IX因子部分のチオール基の不足が回避される限り、従来の合成技術を使用して、第IX因子部分にシステイン残基を添加することができる。システイン残基を添加し、このような手順を第IX因子部分に適応させることができる、国際特許出願公開WO 90/12874に開示されている手順を参照のこと。さらに、従来の遺伝子工学プロセスはまた、第IX因子部分にシステイン残基を導くために使用することもできる。
【0120】
具体的な例を、対応する抱合体とともに下記の表3に示す。表において、変数(n)は、単量体の繰り返し単位の数を表し、「−S−F9」は、水溶性高分子への抱合に続く第IX因子部分を表す。表3に示す各高分子部分((OCH2CH2)nまたは(CH2CH2O)n)は、「CH3」基において終端するが、他の基(Hおよびベンジルなど)は、そのために置換することができる。
【0121】
【表10】

【表11】

【表12】

【0122】
1つ以上のマレイミド官能基(マレイミドが第IX因子部分上のアミンまたはチオール基と反応するかどうかに関係なく)を持つ、水溶性高分子から形成される抱合体に関して、第IX因子部分の対応するマレアミン酸型はまた、水溶性高分子と反応することもできる。特定の条件下(例えば、pH約7乃至9、および水の存在下)で、マレイミド環が「開いて」、対応するマレアミン酸を形成する。マレアミン酸は、次に、第IX因子部分のアミンまたはチオール基と反応することができる。典型的なマレアミン酸ベースの反応を、概略的に下記に示す。POLYは、水溶性高分子を表し、F9は第IX因子部分を表す。
【化10】

【0123】
本発明による代表的な抱合体は、以下の構造を有することができる。
【化11】

{ここで、POLYは、水溶性高分子であり、Lは、任意のリンカーであり、Zは、O、NH、およびSから成る群から選択されるヘテロ原子であり、Yは、C2-10アルキル、C2-10置換アルキル、アリール、および置換アリールから成る群から選択され、F9は、第IX因子部分である}。第IX因子部分と反応してこのタイプの抱合体を得ることができる高分子試薬は、米国特許出願公開第2005/0014903号に開示されている。
【0124】
高分子試薬に関して、本願明細書および他で開示されるものは、商業的な供給元(例、Nektar Therapeutics、Hunts ville AL)から購入することができる。さらに、高分子試薬を調製するための方法が、文献に記述されている。
【0125】
第IX因子部分と水溶性高分子との付着は、直接的(第IX因子部分と水溶性高分子との間に介在する原子がない)に、または非直接的(第IX因子部分と水溶性高分子との間に1つ以上の原子がある)に行うことができる。間接的な付着に関して、「スペーサ部分」は、第IX因子部分と水溶性高分子とののリンクとしての機能を果たす。スペーサ部分を構成する1つ以上の原子には、1つ以上の炭素原子、窒素原子、硫黄原子、酸素原子、およびそれらを組み合わせたものが挙げられる。スペーサ部分は、アミド、第2級アミン、カルバメート、チオエーテルおよび/またはジスルフィド基を含むことができる。特定のスペーサ部分の例には、これに限定されないが、−O、−S、−S−S−、−C(O)−、−C(O)−NH−、−NH−C(O)−NH−、−O−C(O)−NH−、−C(S)−、−CH2−、−CH2−CH2−、−CH2−CH2−CH2−、−CH2−CH2−CH2−CH2−、−O−CH2−、−CH2−O−、−O−CH2−CH2−、−CH2−O−CH2−、−CH2−CH2−O−、−O−CH2−CH2−CH2−、−CH2−O−CH2−CH2−、−CH2−CH2−O−CH2−、−CH2−CH2−CH2−O−、−O−CH2−CH2−CH2−CH2−、−CH2−O−CH2−CH2−CH2−、−CH2−CH2−O−CH2−CH2−、−CH2−CH2−CH2−O−CH2−、−CH2−CH2−CH2−CH2−O−、−C(O)−NH−CH2−、−C(O)−NH−CH2−CH2−、−CH2−C(O)−NH−CH2−、−CH2−CH2−C(O)−NH−、−C(O)−NH−CH2−CH2−CH2−、−CH2−C(O)−NH−CH2−CH2−、−CH2−CH2−C(O)−NH−CH2−、−CH2−CH2−CH2−C(O)−NH−、−C(O)−NH−CH2−CH2−CH2−CH2−、−CH2−C(O)−NH−CH2−CH2−CH2−、−CH2−CH2−C(O)−NH−CH2−CH2−、−CH2−CH2−CH2−C(O)−NH−CH2−、−CH2−CH2−CH2−C(O)−NH−CH2−CH2−、−CH2−CH2−CH2−CH2−C(O)−NH−、−C(O)−O−CH2−、−CH2−C(O)−O−CH2−、−CH2−CH2−C(O)−O−CH2−、−C(O)−O−CH2−CH2−、−NH−C(O)−CH2−、−CH2−NH−C(O)−CH2−、−CH2−CH2−NH−C(O)−CH2−、−NH−C(O)−CH2−CH2−、−CH2−NH−C(O)−CH2−CH2−、−CH2−CH2−NH−C(O)−CH2−CH2−、−C(O)−NH−CH2−、−C(O)−NH−CH2−CH2−、−O−C(O)−NH−CH2−、−O−C−(O)−NH−CH2−CH2−、−NH−CH2−、−NH−CH2−CH2−、−CH2−NH−CH2−、−CH2−CH2−NH−CH2−、−C(O)−CH2−、−C(O)−CH2−CH2−、−CH2−C(O)−CH2−、−CH2−CH2−C(O)−CH2−、−CH2−CH2−C(O)−CH2−CH2−、−CH2−CH2−C(O)−、−CH2−CH2−CH2−C(O)−NH−CH2−CH2−NH−、−CH2−CH2−CH2−C(O)−NH−CH2−CH2−NH−C(O)−、−CH2−CH2−CH2−C(O)−NH−CH2−CH2−NH−C(O)−CH2−、−CH2−CH2−CH2−C(O)−NH−CH2−CH2−NH−C(O)−CH2−CH2−、−O−C(O)−NH−[CH2]h−(OCH2CH2)j−、二価シクロアルキル基、−O−、−S−、アミノ酸、−N(R6)−、および上述のものを2つ以上の組み合わせたもの、から成る群から選択されるものが挙げられ、ここで、R6は、H、またはアルキル、置換アルキル、アルケニル、置換アルケニル、アルキニル、置換アルキニル、アリール、および置換アリールから成る群から選択される有機ラジカルであり、(h)はゼロ乃至6であり、(j)はゼロ乃至20である。他の特定のスペーサ部分は、次の構造を有する。−C(O)−NH(CH2)1-6−NH−C(O)−、−NH−C(O)−NH−(CH2)1-6−NH−C(O)−、および−O−C(O)−NH−(CH2)1-6−NH−C(O)−、ここで、各メチレンに続く下付き数字の値は、構造に含まれるメチレンの数を示し、例えば、(CH2)1-6は、その構造が、1、2、3、4、5または、6つのメチレンを含むことができることを示す。さらに、上述のスペーサのうちのいずれも、1乃至20の酸化エチレンモノマー単位(すなわち、−(CH2CH2O)1-20)を含む酸化エチレンオリゴマ鎖を更に含むことが可能である。すなわち、酸化エチレンオリゴマ鎖は、スペーサ部分の前か後に、および任意に2つ以上の原子を含むスペーサ部分のいずれか2つの原子間に生じさせることができる。また、オリゴマ鎖は、オリゴマが高分子セグメントに隣接し、単に高分子セグメントの延長を表すだけである場合には、スペーサ部分の一部であるとみなされない。スペーサ部分は、糖または炭水化物を含まず、抱合体には、直接的にまたはスペーサ部分を介して、糖または次に第IX因子部分に付着した炭水化物に付着した水溶性高分子が不足していることが好ましい。
【0126】
場合によっては、抱合体は、単一の第IX因子部分に関連する単一の水溶性高分子を有するだけの場合がある。その結果、水溶性高分子を非線形の水溶性高分子にすること(および非線形高分子試薬を使用した抱合体の調製)が望まれる場合がある。多分岐水溶性高分子が含まれるが、好適な非線形の水溶性高分子は、分岐水溶性高分子である。分岐水溶性高分子を組み込むことによって、例えば、単一の高分子と比較して、各付着部位に対する分子量を2倍にすることができる。
【0127】
水溶性高分子が分岐形態である、本発明の典型的な抱合体には、リシンベースの分岐高分子を含む分岐形態、および以下の構造を含む分岐手法が挙げられる:
【化12】

{ここで、各(n)は、それぞれ2乃至3400の値を有する整数である}。
【0128】
本発明の典型的な抱合体は、以下の構造を含む:
【化13】

{ここで、
各(n)は、それぞれ2乃至3400の値を有する整数である;
Xは、スペーサ部分である;
(b)は、2乃至6の値を有する整数である;
(c)は、2乃至6の値を有する整数である;
各発生におけるR2は、それぞれHまたは低級アルキルである;
F9は、第IX因子部分である}。
【0129】
本発明の典型的な抱合体は、以下の構造を含む:
【化14】

{ここで、
各(n)は、それぞれ2乃至3400の値を有する整数であり;且つ
F9は、第IX因子部分である}。
【0130】
本発明の別の典型的な抱合体は、以下の構造を含む:
【化15】

{ここで、
各(n)は、それぞれ2乃至3400の値を有する整数である;
(a)は、ゼロでまたは1である;
Xは、存在する場合、1つ以上の原子を含むスペーサ部分である;
(b’)は、ゼロまたは1乃至10の値を有する整数である;
(c)は、1乃至10の値を有する整数である;
各発生におけるR2は、それぞれHまたは有機ラジカルである;
各発生におけるR3は、それぞれHまたは有機ラジカルである;且つ
F9は、第IX因子部分である}。
【0131】
本発明の典型的な抱合体は、以下の構造を含む:
【化16】

{ここで、
各(n)は、それぞれ2乃至3400の値を有する整数であり;且つ
F9は、第IX因子部分である}。
【0132】
組成物
【0133】
抱合体は、一般に組成物の一部である。概して、組成物は複数の抱合体を含み、必ずではないが、それぞれが、1つの第IX因子部分に別々に共有結合した、1つ、2つ、3つ、または4つの水溶性高分子を有することが好ましい。しかし、組成物はまた、第IX因子活性を有する任意の所定の部分に付着した、4つ、5つ、6つ、7つ、8つ以上の高分子を有する他の抱合体を含むこともできる。さらに、本発明は、組成物が複数の抱合体を含み、それぞれの抱合体が、第IX因子部分に共有結合した1つの水溶性高分子を含む場合、および組成物が、第IX因子部分に共有結合した、2つ、3つ、4つ、5つ、6つ、7つ、8つ以上の水溶性高分子を含む場合を含む。
【0134】
本発明の1つ以上の実施態様では、複数の抱合体を含む組成物であって、前記組成物中の全ての抱合体の少なくとも約80%は、それぞれが1つ、2つ、3つ、または4つの水溶性高分子に共有結合した第IX因子部分を含み、さらに、前記抱合体中の各水溶性高分子に対して、前記第IX因子部分は、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に結合した、組成物を提供する。
【0135】
組成物の抱合体に関して、組成物は、一般に次の特性のうちの1つ以上を満たす:組成物中の抱合体の少なくとも約85%が、第IX因子部分に付着した1つ乃至5つの高分子を有する;組成物中の抱合体の少なくとも約85%が、第IX因子部分に付着した1つ乃至4つの高分子を有する;組成物中の抱合体の少なくとも約85%が、第IX因子部分に付着した1つ乃至3つの高分子を有する;組成物中の抱合体の少なくとも約85%が、第IX因子部分に付着した1つ乃至2つの高分子を有する;組成物中の抱合体の少なくとも約85%が、第IX因子部分に付着した1つの高分子を有する(すなわち、モノPEG化である);組成物中の抱合体の少なくとも約95%が、第IX因子部分に付着した1つ乃至5つの高分子を有する;組成物中の抱合体の少なくとも約95%が、第IX因子部分に付着した1つ乃至4つの高分子を有する;組成物中の抱合体の少なくとも約95%が、第IX因子部分に付着した1つ乃至3つの高分子を有する;組成物中の抱合体の少なくとも約95%が、第IX因子部分に付着した1つ乃至2つの高分子を有する;組成物中の抱合体の少なくとも約95%が、第IX因子部分に付着した1つの高分子を有する;組成物中の抱合体の少なくとも約99%が、第IX因子部分に付着した1つ乃至5つの高分子を有する;組成物中の抱合体の少なくとも約99%が、第IX因子部分に付着した1つ乃至4つの高分子を有する;組成物中の抱合体の少なくとも約99%が、第IX因子部分に付着した1つ乃至3つの高分子を有する;組成物中の抱合体の少なくとも約99%が、第IX因子部分に付着した1つ乃至2つの高分子を有する;および組成物中の抱合体の少なくとも約99%が、第IX因子部分に付着した1つの高分子を有する(すなわち、モノPEG化である)。
【0136】
1つ以上の実施態様では、抱合体を含む組成物は、アルブミンが遊離したもの、または実質的に遊離したものであることが好ましい。また、組成物は、第IX因子活性を有さないタンパク質が遊離したもの、または実質的に遊離したものであることが好ましい。したがって、85%の、より好ましくは95%の、および最も好ましくは99%のアルブミンが遊離したものが好ましい。加えて、85%の、より好ましくは95%の、および最も好ましくは99%の第IX因子活性を有さないタンパク質が遊離したものが好ましい。アルブミンが組成物中に存在する限り、本発明の典型的な組成物は、アルブミンに第IX因子部分の残留物を結合させているポリ(エチレングリコール)高分子を含む抱合体が、実質的に遊離している。
【0137】
任意の所定の部分に対する高分子の所望の数の制御は、適切な高分子試薬、第IX因子部分に対する高分子試薬の比率、温度、pH条件、および抱合反応の他の側面を選択することによって、達成することができる。さらに、不要な抱合体(例えば、4つ以上の高分子を付着した抱合体)の還元または除去は、精製手段を介して達成することができる。
【0138】
例えば、高分子−第IX因子部分抱合体を精製して、異なる抱合種を得る/分離させることができる。特に、生成混合物は、精製して、第IX因子部分ごとに1つ、2つ、3つ、4つ、5つ以上のPEG、典型的には第IX因子部分ごとに1つ、2つ、または3つのPEGのいずれかの平均を得ることができる。最終的な抱合体の反応混合物の精製のための方策は、例えば、用いる高分子試薬の分子量、特定の第IX因子部分、所望の投与計画、および個々の抱合体の残留活性および生体内の特性を含む、複数の因子に依存する。
【0139】
必要に応じて、ゲル濾過クロマトグラフィおよび/またはイオン交換クロマトグラフィを使用して、異なる分子量を有する抱合体を分離することができる。すなわち、ゲル濾過クロマトグラフィは、それらの異なる分子量(差異は、基本的に水溶性高分子部分の平均分子量に対応する)に基づいて、異なる番号をつけた(例えば、1−mer、2−mer、3−merなどであり、「1−mer」は、第IX因子部分に1つの高分子が付着したことを示し、「2−mer」は、第IX因子部分に2つの高分子が付着したことを示す、など)高分子対第IX因子部分の比率を細分するために使用される。例えば、55,000ダルトンのタンパク質が、約20,000ダルトンの分子量を有する高分子試薬に、ランダムに抱合される典型的な反応では、得られる反応混合物は、未改変タンパク質(約55,000ダルトンの分子量を有する)、モノPEG化タンパク質(または「1−mer」)(約75,000ダルトンの分子量を有する)、ジPEG化タンパク質(または「2−mer」)(約95,000ダルトンの分子量を有する)、などを含むことが可能である。
【0140】
この手法は、異なる分子量を有するPEGおよび他の高分子−第IX因子部分の抱合体を分離するために使用することができるが、この手法は、一般に、第IX因子部分内に異なる高分子付着部位を有する、位置異性体の分離には概して効果がない。例えば、ゲル濾過クロマトグラフィは、回収されたPEG−merのそれぞれが、第IX因子部分内の異なる反応性アミノ基(例、リシン残基)に付着したPEGを含む場合があるが、1−mer、2−mer、3−merなどの混合物を互いから分離するために使用することができる。
【0141】
この種の分離を行うための好適なゲル濾過カラムには、Amarcham Biosciences(Piscataway、NJ)から入手可能な、Superdex(登録商標)およびSephadex(登録商標)が挙げられる。特定のカラムの選択は、所望の分留範囲に依存する。溶出は、概して、リン酸塩、酢酸などのような好適なバッファを使用して行われる。収集した留分は、例えば、次のような複数の異なる方法によって分析することが可能である:(i)タンパク質含有量に対する280nmでの吸収、(ii)基準として、ウシ血清アルブミンを使用した染料ベースのタンパク質の分析、(iii)PEG含有量のためのヨウ素試験(Sims他(1980)、Anal.Biochem、107:60〜63)、(iv)ドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動(SDS PAGE)、その後のヨウ化バリウムによる染色、及びより高速の液体クロマトグラフィ。
【0142】
位置異性体の分離は、例えばC18カラムまたはC3カラム(Amersham BiosciencesまたはVydac)を使用した、逆相−高速液体クロマトグラフィ(RP−HPLC)法を用いた逆相クロマトグラフィによって、または、例えばAmersham Biosciencesから入手可能なSepharose(登録商標)イオン交換カラムのようなイオン交換カラムを使用した、イオン交換クロマトグラフィによって行うことができる。いずれの手法も、同じ分子量(位置異性体)を有する高分子−活性剤異性体を分離するために使用することができる。
【0143】
組成物は、第IX因子活性を有さないタンパク質が実質的に遊離したものであることが好ましい。さらに、組成物は、他の全ての非共有結合的に付着した水溶性高分子が実質的に遊離したものであることが好ましい。しかし、状況によっては、組成物は、高分子−第IX因子部分抱合体および非抱合第IX因子の混合物を含むことができる。
【0144】
任意に、本発明の組成物は、医薬として許容される賦形剤を更に備える。必要に応じて、医薬として許容される賦形剤は、抱合体に添加して組成物を形成することができる。
【0145】
典型的な賦形剤には、これに限定されないが、炭水化物、無機塩類、抗菌剤、酸化防止剤、界面活性剤、バッファ、酸、ベース、およびそれらを組み合わせたものから成る群から選択したものが挙げられる。
【0146】
糖のような炭水化物、アルジトールのような誘導体化された糖、アルドン酸、エステル化された糖、および/または糖高分子は、賦形剤として存在することが可能である。特定の炭水化物賦形剤は、例えば、次のようなものが含まれる:フルクトース、マルトース、ガラクトース、グルコース、D−マンノース、ソルボース、などの単糖類;ラクトース、サッカロース、トレハロース、セロビオース、などの二糖類;ラフィノース、メレチトース、マルトデキストリン、デキストラン、スターチ、などの多糖類;および、マンニトール、キシリトール、マルチトール、ラクチトール、キシリトール、ソルビトール(グルシトール)、ピラノシルソルビトール、ミオイノシトールなどのアルジトール類。
【0147】
賦形剤はまた、クエン酸、塩化ナトリウム、塩化カリウム、硫酸ナトリウム、硝酸カリウム、塩基性リン酸ナトリウム、二塩基性リン酸ナトリウム、およびそれらを組み合わせたもの、のような無機塩またはバッファも含むことができる。
【0148】
組成物はまた、微生物の成長を予防または抑止するための抗菌剤も含むことができる。本発明に好適な抗菌剤の例には、これに限定されないが、塩化ベンザルコニウム、塩化ベンゼトニウム、ベンジルアルコール、塩化セチルピリジニウム、クロロブタノール、フェノール、フェニルエチルアルコール、硝酸フェニル水銀、チメロサール、およびそれらを組み合わせたもの、が挙げられる。
【0149】
酸化防止剤も、同様に組成物中に存在させることができる。酸化防止剤は、酸化を防ぐために使用され、それによって、抱合体の劣化または他の構成要素の生成を防ぐ。本発明に使用する好適な酸化防止剤には、例えば、アスコルビルパルミテート、ブチルヒドロキシアニソール、ブチルヒドロキシトルエン、次亜リン酸、モノチオグリセロール、プロピルガレート、亜硫酸水素ナトリウム、フォルムアルデヒドスルホキシル酸ナトリウム、メタ重亜硫酸ナトリウム、およびそれらを組み合わせたものが挙げられる。
【0150】
界面活性剤は、賦形剤として存在させることができる。典型的な界面活性剤には、次のようなものが挙げられる:「Tween20」および「Tween80」のようなポリソルベート、およびF68およびF88(どちらも、BASF、Mount Olive、New Jerseyから入手可能)のようなプルロニック;ソルビタンエステル;レシチンおよび他のホスファチジルコリン、ホスファチジルエタノールアミン(リポソーム型でないことが好ましい)、脂肪酸、および脂肪酸エステルなどの、リン脂質のような脂質;コレステロールのようなステロイド;および、EDTA、亜鉛、および他のこのような好適な陽イオンのようなキレート剤。
【0151】
酸または塩基は、組成物中の賦形剤として存在させることができる。使用できる酸の例には、これに限定されないが、塩酸、酢酸、リン酸、クエン酸、リンゴ酸、乳酸、ギ酸、トリクロロ酢酸、硝酸、過塩素酸、リン酸、硫酸、フマル酸、およびそれらを組み合わせたものから成る群から選択されたものが挙げられる。好適な塩基の例には、これに限定されないが、水酸化ナトリウム、酢酸ナトリウム、水酸化アンモニウム、水酸化カリウム、酢酸アンモニウム、酢酸カリウム、リン酸ナトリウム、リン酸カリウム、クエン酸ナトリウム、ギ酸ナトリウム、硫酸ナトリウム、硫酸カリウム、フマル酸カリウム、およびそれらを組み合わせたものから成る群から選択されたものが挙げられる。
【0152】
組成物中の抱合体(すなわち、活性剤と高分子試薬との間に形成される抱合体)の量は、複数の因子によって変化するが、組成物を単回服用量の容器(例、バイアル)に保存すれば、最適に治療有効量となる。さらに、医薬品は、注射器に収容することができる。治療有効量は、どの量が臨床的に所望のエンドポイントをもたらすかを決定するために、抱合体の量を増加させながらの繰り返し投与によって決定することができる。
【0153】
組成物中の任意の個々の賦形剤の量は、賦形剤の活性および組成物の特定のニーズによって変化する。一般に、任意の個々の賦形剤の最適量は、決まりきった試験を介して、すなわち、さまざまな量(少量から多量)の賦形剤を含む組成物を調製し、安定性および他のパラメータを調査し、次いで、著しい副作用のない最適性能が達成される範囲を決定することによって、決定される。
【0154】
しかし、概して賦形剤は、約1乃至約99重量%、好ましくは約5乃至約98重量%、より好ましくは約15乃至約95重量%、最も好ましくは濃度30重量%未満で、組成物中に存在する。
【0155】
他の賦形剤とともにこれらの上述の医薬品賦形剤は、「Remington:The Sciene & Practice of Pharmacy」19th ed.、 Williams & Williams、(1995)、「Physician’s Desk Reference」、52nd、Medical Economics、Montvale、NJ(1998)、およびKibbe、A.H.、Handbook of Pharmaceutical Excipients、3rd Edition、American Pharmaceutical Association、Washington D.C.、2000、に記述されている。
【0156】
組成物は、全種類の製剤形態、および特に、例えば液体と同様に再構成することができる粉末または凍結乾燥したものなどの、注射に好適なものを包含する。注射前に固体組成物を再構成する好適な希釈剤の例には、注射用の静菌性水、5%デキストロース水溶液、リンガー溶液、生理食塩水、滅菌水、脱イオン水、およびそれらを組み合わせたものが挙げられる。液体の医薬組成物に関しては、溶液および懸濁液が想定される。
【0157】
本発明の組成物は、必ずではないが、一般に注射によって投与されるので、投与直前は、概して液体溶液または懸濁液である。医薬品はまた、シロップ、クリーム、軟膏、錠剤、粉末などのような他の形態を取ることもできる。他の投与様式には、肺、直腸、経皮的、経粘膜的、経口的、髄膜下、皮下、動脈内などが挙げられる。
【0158】
本発明はまた、抱合体による治療に応答する症状に罹患する患者に、本願明細書において提供されるような抱合体を送達するための方法も提供する。この方法は、一般に注射によって治療有効量の抱合体を送達する(医薬組成物の一部として提供されることが好ましい)段階を含む。この抱合体(一般に医薬組成物の一部として)は、例えば静脈注射、筋肉内注射、皮下注射などによって送達することができる。非経口投与のための好適な処方のタイプには、特に、すぐに注射できる溶液、使用前に溶媒と混合する乾燥粉末、すぐに注射できる懸濁液、使用前にビヒクルと混合する乾燥不溶性組成物、および投与前に希釈する原液が挙げられる。
【0159】
この方法は、抱合体を投与することによって改善または予防することができる症状を有する患者の治療に使用することが可能である。当業者は、どの条件で特定の抱合体が有効に治療できるのかを理解するであろう。例えば、この抱合体は、血友病Bに罹患している人を治療するために、補充療法として、または予防に基づくものとして使用することができる。予防のための抱合体の投与には、血友病Bを罹患している患者が手術を受けようとしている状況が挙げられ、抱合体は、手術の1乃至4時間前に投与される。さらに、抱合体は、抑制できない出血に対する予防薬として、任意に血友病に罹患していない患者での使用に適している。したがって、例えば、抱合体は、出血が抑制できないというリスクのある患者に手術前に投与することができる。
【0160】
投与される実際の用量は、対象者の年齢、体重、および全体的な状態、および治療する症状の程度、医療関係者の判断、および投与される抱合体によって変化する。治療有効量は、当業者に公知であり、および/または関連する参照文および文献に記述される。概して、治療有効量は、重量基準で約0.001mg乃至100mgの範囲となり、0.01mg/日乃至75mg/日の用量が好ましく、0.10mg/日乃至50mg/日の用量がより好ましい。活性を基準に、活性の国際単位に基づく対応用量は、当業者によって計算することができる。
【0161】
任意の所定の抱合体(また、好ましくは医薬組成物の一部として提供される)の単回服用量は、臨床医の判断、患者のニーズなどに基づいて、様々な投薬スケジュールで投与することができる。特定の投薬スケジュールは、当業者によって公知であるか、または決まりきった方法を使用して実験的に決定することができる。典型的な投薬スケジュールには、これに限定されないが、1日5回、1日4回、1日3回、1日2回、1日1回、週3回、週2回、週1回、月2回、月1回、およびそれらを組み合わせた投与が挙げられる。臨床的な終点を達成したら、組成物の投薬を中止する。
【0162】
本発明は、その好適な実施態様に関して開示されているが、その上述の説明およびそれに続く例は例示を目的としたものであり、本発明の範囲を制限するものではないと理解されるべきである。本発明の範囲内の他の側面、利点、および変更は、本発明に関係する当業者に明らかである。
【実施例】
【0163】
実験
本発明の実施は、特に明記しない限り、従来技術の範囲内にある、有機合成などの従来の技術を用いる。このような技術は、文献において完全に説明される。試薬および物質は、逆に定められていなければ市販のものである。前掲の、J.March、Organic Chamistry:Reactions Mechanisms and Structure、4th Ed.(New York:Wiley−Interscience、1992)を参照のこと。
【0164】
以下の諸例では、使用される数(例、量、温度など)に関して、精度を確保するよう努めたが、ある程度の実験誤差および偏差を考慮しなければならない。他に示されない限り、温度は摂氏温度であり、圧力は海面位での大気圧またはほぼ大気圧である。
【0165】
当業者が公知である他の略語を参照するが、他の試薬および物質が使用され、当業者が公知の他の方法が使用され、次のリストおよび方法の記述は便宜上提供されるものである。
【0166】
NaCNBH3 ナトリウムシアノボロハイドライド、95%(Aldrich)
【0167】
HCl 塩酸、氷(Fisher)
【0168】
KまたはkDa キロダルトン
【0169】
アセトニトリル (Fisher Optima)
【0170】
TFA トリフルオロ酢酸、HPLCグレード(JT Baker)
【0171】
PBS リン酸緩衝生理食塩水(Sigma)
【0172】
SEC サイズ排除クロマトグラフィ
【0173】
HPLC 高速液体クロマトグラフィ
【0174】
SDS−PAGE ドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動
【0175】
HEPES[4−(2−ヒドロキシエチル)−1−ピペラジニースアネスルホン酸(piperazineethanesulfonic acid)]認定されたバイオテクノロジ性能、99.5%以上(Sigma)
【0176】
エチルアルコール、USP、Absolute−200 Proof(AAPER)
【0177】
NuPAGE(登録商標) MES[2−(N−モルホリノ)エタンスルホン酸]SDSランニングバッファ(Invitrogen Corporation、Carlsbad CA)
【0178】
NuPAGE(登録商標) 4xLDS(リチウム硫酸ドデシル)サンプルバッファ(Invitrogen Corporation、Carlsbad CA)
【0179】
SigmaMarker、低範囲(M.W.6,500−66,000)(Sigma)
【0180】
SigmaMarker、高範囲(M.W.36,900−205,000)(Sigma)
【0181】
NuPAGE(登録商標) Novex Bis−Tris[Bis(2−ヒドロキシエチル)イミノ−tris(ヒドロキシメチル)メタン−HCl]ゲル(Invitrogen Corporation、Carlsbad CA)
【0182】
SEC−HPLC分析
【0183】
サイズ排除クロマトグラフィ(SEC)は、Agilent 1100 HPLCシステム(Agilent)上で使用した。SEC−HPLCを使用して分析するサンプルに対して、各サンプルは、pH7.2で、SHODEXタンパク質、KW−804カラム(昭和電工、東京、日本)を使用して分析した。カラムの流量は、0.5mL/分に設定した。抽出されたタンパク質およびPEG−タンパク質抱合体は、波長を280nmに設定したUVベースの手法を使用して検出した。
【0184】
SDS−PAGE分析
【0185】
ドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動(SDS−PAGE)は、XCELL SURELOCK Mini−Cell電気泳動システム(Invitrogen Corporation、Carlsbad CA)を使用して行った。SDS−PAGEを使用して分析するサンプルに対して、各サンプルは、4x LDS Sample Buffer(Invitrogen Corporation、Carlsbad CA)と混合した。調製したサンプルは、次いで、NuPAGE Novex4乃至12%のBis−Trisゲル上に装填され、NuPAGE(登録商標) MESランニングバッファ(Invitrogen Corporation、Carlsbad CA)を使用して、200Vで30分間実施した。
【0186】
RP−HPLC分析
【0187】
逆相−高速液体クロマトグラフィは、C3逆カラム(Hamilton、Zorbax)を使用して実施した。30乃至80%勾配のアセトニトリルを、0.5mL/分で、温度上昇とともに30分にわたって使用した。
【0188】
配列番号1のアミノ酸配列に対応する組み換え第IX因子を、例1乃至16で使用した。第IX因子は、L−ヒスチジンおよびグリシンの両方を含むバッファで得た。バッファ内のL−ヒスチジンおよびグリシンに関連するアミン基は、第IX因子に関連するアミン基と競合するので、アミン指向性高分子試薬を使用して抱合を達成するときに、第IX因子の抱合の収率を改善するために、アミン含有バッファの交換が必要であった。
【0189】
簡潔には、アミン含有バッファは、交換されるバッファの量に基づいて、2つのうちの1つの手法によって、アミン遊離バッファと交換した。比較的少量のバッファに対しては、メーカーが提供するプロトコルに基づいて、500μLのZeba Desalt遠心カラム(Pierce Biotechnology、Rockford IL)を使用した。比較的大量のバッファに対しては、メーカーが提供するプロトコルに基づいて、10,000のまたは30,000ダルトンの分子量カットオフで、2mLのCENTRICON(登録商標)遠心フィルタ装置(Millipore Corporation、Billierica MA)を使用した。エタノールを伴わない諸例で使用される全てのサンプルは、pH7.5を有する1xPBSバッファに変更し、一方で、エタノールを伴う諸例で使用される全てのサンプルは、10%エタノール含有の第IX因子反応混合物を形成するようにエタノールを添加した、pH7.5を有する1xPBSバッファに交換した。
【0190】
配列番号1のアミノ酸配列に対応する組み換え第IX因子を含むアミン遊離バッファを、例1乃至16で使用した。第IX因子の原液は、約0.2mg/mL乃至0.55mg/mLの第IX因子を含むものとした。
実施例1
mPEG−SMB(30kDa)による第IX因子のPEG化
(高分子と第IX因子の比率 1:1;エタノールなし)
【化17】

【0191】
アルゴン下で−20℃で保存したmPEG−SMB(30kDa)を室温まで加温した。加温したmPEG−SMB(4.1mg)を、1mLの2mM HClに溶解して、mPEG−SMB溶液を作製した。第IX因子に対するmPEG−SMBのモル比が1:1になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、mPEG−SMB溶液を添加した。mPEG−SMBを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子へのmPEG−SMBの結合が可能になるように、SDS−PAGEをサンプル上で実施した後に、その反応溶液を室温で3時間撹拌し、モノ抱合物質(「1−mer」)の存在を確認した。図1に示したゲルの「1:1 30K SMB」と表記したレーンを参照のこと。その後、その反応溶液を4℃で15時間撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0192】
RP−HPLC(C3)および第2のSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。第2のSDS−PAGEの結果に基づいて、抱合を示した。図2に示したゲルの「1:1 30K SMB」と表記したレーンを参照のこと。RP−HPLC(C3)を使用して、得られた抱合体溶液の構成要素を分離した。得られたクロマトグラムは、0.54%の収率を示した(100%のモノPEG化または「1−mer」種を表す)。図5に示すクロマトグラムを参照のこと。
【0193】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SMBを使用して、他の抱合体を調製することができる。
実施例2
mPEG−SMB(30kDa)による第IX因子のPEG化
(高分子と第IX因子の比率10:1;エタノールなし)
【化18】

【0194】
アルゴン下で−20℃で保存したmPEG−SMB(30kDa)を室温まで加温した。加温したmPEG−SMB(4.1mg)を、1mLの2mM HClに溶解して、mPEG−SMB溶液を作製した。第IX因子に対してmPEG−SMBが10モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、mPEG−SMB溶液を添加した。mPEG−SMBを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子へのmPEG−SMBの結合が可能になるように、SDS−PAGEをサンプル上で実施した後に、その反応溶液を室温で3時間撹拌し、モノ抱合物質(「1−mer」)の存在を確認した。図1に示すゲルの「10:1 30K SMB」と表記したレーンを参照のこと。その後、その反応溶液を4℃で15時間撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0195】
RP−HPLC(C3)および第2のSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。第2のSDS−PAGEの結果に基づいて、抱合を示した。図2に示すゲルの「10:1 30K SMB」と表記したレーンを参照のこと。RP−HPLC(C3)を使用して、得られた抱合体溶液の構成要素を分離した。得られたクロマトグラムは、6.4%の収率を示した(100%のモノPEG化または「1−mer」種を表す)。図6に示すクロマトグラムを参照のこと。
【0196】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。したがって、この実験を、4℃で一晩反応を継続する前に、室温で長時間繰り返した場合、SDS−PAGEゲルに見られる暗帯によって表されるように抱合体の収率が増加した。図4の「10:1 30K SMB」と表記したレーンを参照のこと。ここに記述される同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SMBを使用して、他の抱合体を調製することができる。
実施例3
分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)による第IX因子のPEG化
(高分子と第IX因子の比率1:1;エタノールなし)
【化19】

【0197】
アルゴン下で−20℃で保存した分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)を室温まで加温した。加温した分岐mPEG2−N−ヒドロキシスクシンイミド(2.0mg)を、1mLの2mM HClに溶解して、分岐mPEG2−N−ヒドロキシスクシンイミド溶液を作製した。第IX因子に対するmPEG2−N−ヒドロキシスクシンイミドのモル比が1:1になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、mPEG2−N−ヒドロキシスクシンイミド溶液を添加した。分岐mPEG2−N−ヒドロキシスクシンイミドを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子への分岐mPEG2−N−ヒドロキシスクシンイミドの結合が可能になるように、SDS−PAGEをサンプル上で実施した後に、その反応溶液を室温で3時間撹拌したが、検出可能な抱合を示さなかった。図1に示すゲルの「1:1 40K NHS」と表記したレーンを参照のこと。その後、その反応溶液を4℃で15時間撹拌することによって、抱合のための添加時間が提供され、それによって、抱合体溶液が得られた。
【0198】
RP−HPLC(C3)および第2のSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。第2のSDS−PAGEの結果に基づいて、抱合を示した。図2に示すゲルの「1:1 40K NHS」と表記したレーンを参照のこと。RP−HPLC(C3)を使用して、得られた抱合体溶液の構成要素を分離した。得られたクロマトグラムは、0.1%の収率を示した(100%のモノPEG化または「1−mer」種を表す)。図7に示すクロマトグラムを参照のこと。
【0199】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG2−N−ヒドロキシスクシンイミドを使用して、他の抱合体を調製することができる。
実施例4
分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)による第IX因子のPEG化
(高分子と第IX因子の比率10:1;エタノールなし)
【化20】

【0200】
アルゴン下で−20℃で保存した分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)を室温まで加温した。加温した分岐mPEG2−N−ヒドロキシスクシンイミド(2.0mg)を、1mLの2mM HClに溶解して、分岐mPEG2−N−ヒドロキシスクシンイミド溶液を作製した。第IX因子に対するmPEG2−N−ヒドロキシスクシンイミドが10モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、mPEG2−N−ヒドロキシスクシンイミド溶液を添加した。分岐mPEG2−N−ヒドロキシスクシンイミドを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子への分岐mPEG2−N−ヒドロキシスクシンイミドの結合が可能になるように、SDS−PAGEをサンプル上で実施した後に、その反応溶液を室温で3時間撹拌したが、検出可能な抱合を示さなかった。図1に示すゲルの「10:1 40K NHS」と表記したレーンを参照のこと。その後、その反応溶液を4℃で15時間撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0201】
RP−HPLC(C3)および第2のSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。第2のSDS−PAGEの結果に基づいて、抱合は依然として検出されなかった。図2に示すゲルの「10:1 40K NHS」と表記したレーンを参照のこと。RP−HPLC(C3)を使用して、得られた抱合体溶液の構成要素を分離した。得られたクロマトグラムには、検出可能な収率は示されなかった。図8に示すクロマトグラムを参照のこと。
【0202】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG2−N−ヒドロキシスクシンイミドを使用して、他の抱合体を調製することができる。
実施例5
mPEG−SMB(30kDa)による第IX因子のPEG化
(高分子と第IX因子の比率10:1;エタノールあり)
【化21】

【0203】
エタノールは、特定のタンパク質の構造的な柔軟性を増加させると考えられるので、エタノールを、バッファおよび反応系に導入する。アルゴン下で−20℃で保存したmPEG−SMB(30kDa)を室温まで加温した。加温したmPEG−SMB(10.0mg)を、0.5mLの2mM HClに溶解して、10%のエタノール含有mPEG−SMB溶液を作製した。第IX因子に対してmPEG−SMBが10モル過剰になるまで、10%のエタノール含有第IX因子の反応混合物に、10%のエタノール含有mPEG−SMB溶液を添加した。mPEG−SMBを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子へのmPEG−SMBの結合が可能になるように、その反応溶液を室温で3時間撹拌した。その反応溶液を4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0204】
SDS−PAGEは、得られた抱合体溶液の特徴づけに使用した。SDS−PAGEの結果に基づいて、抱合は検出されなかった。図3に示すゲルの「10:1 30K SMB+EtOH」と表記したレーンを参照のこと。エタノールの導入は、mPEG−SMB(30kDa)の抱合の増加を可能にするために、第IX因子の構造的な柔軟性を増加させないと考えられる。
【0205】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SMBを使用して、他の抱合体を調製することができる。
実施例6
mPEG−SMB(30kDa)による第IX因子のPEG化
(高分子と第IX因子の比率20:1;エタノールあり)
【化22】

【0206】
エタノールは、特定のタンパク質の構造的な柔軟性を増加させると考えられるので、エタノールを、バッファおよび反応系に導入する。アルゴン下で−20℃で保存したmPEG−SMB(30kDa)を室温まで加温した。加温したmPEG−SMB(10.0mg)を、0.5mLの2mM HClに溶解して、10%のエタノール含有mPEG−SMB溶液を作製した。第IX因子に対してmPEG−SMBが20モル過剰になるまで、10%のエタノール含有第IX因子の反応混合物に、10%のエタノール含有mPEG−SMB溶液を添加した。mPEG−SMBを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子へのmPEG−SMBの結合が可能になるように、その反応溶液を室温で3時間撹拌した。その反応溶液を4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0207】
SDS−PAGEは、得られた抱合体溶液の特徴づけに使用した。SDS−PAGEの結果に基づいて、抱合は検出されなかった。図3に示すゲルの「20:1 30K SMB+EtOH」と表記したレーンを参照のこと。エタノールの導入は、mPEG−SMB(30kDa)の抱合の増加を可能にするために、第IX因子の構造的な柔軟性を増加させないと考えられる。
【0208】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SMBを使用して、他の抱合体を調製することができる。
実施例7
分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)による第IX因子のPEG化
(高分子と第IX因子の比率10:1;エタノールあり)
【化23】

【0209】
エタノールは、特定のタンパク質の構造的な柔軟性を増加させると考えられるので、エタノールを、バッファおよび反応系に導入する。アルゴン下で−20℃で保存した分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)を室温まで加温した。加温した分岐mPEG2−N−ヒドロキシスクシンイミド(2.0mg)を、エタノールを添加した1.0mLの2mM HClに溶解して、10%のエタノール含有分岐mPEG2−N−ヒドロキシスクシンイミド溶液を作製した。第IX因子に対する分岐mPEG2−N−ヒドロキシスクシンイミドのモル比が10モル過剰になるまで、10%のエタノール含有第IX因子の反応混合物に、10%のエタノール含有分岐mPEG2−N−ヒドロキシスクシンイミド溶液を添加した。分岐mPEG2−N−ヒドロキシスクシンイミドを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子への分岐mPEG2−N−ヒドロキシスクシンイミドの結合が可能になるように、その反応溶液を室温で3時間撹拌した。その反応溶液を4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0210】
SDS−PAGEは、得られた抱合体溶液の特徴づけに使用した。SDS−PAGEの結果に基づいて、抱合は検出されなかった(結果は示さず)。エタノールの導入は、分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)の抱合の増加を可能にするために、第IX因子の構造的な柔軟性を増加させないと考えられる。
【0211】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG2−N−ヒドロキシスクシンイミドを使用して、他の抱合体を調製することができる。
実施例8
分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)による第IX因子のPEG化
(高分子と第IX因子の比率20:1;エタノールあり)
【化24】

【0212】
エタノールは、特定のタンパク質の構造的な柔軟性を増加させると考えられるので、エタノールを、バッファおよび反応系に導入する。アルゴン下で−20℃で保存した分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)を室温まで加温した。加温した分岐mPEG2−N−ヒドロキシスクシンイミド(2.0mg)を、1.0mLの2mM HClに溶解して、10%のエタノール含有分岐mPEG2−N−ヒドロキシスクシンイミド溶液を作製した。第IX因子に対する分岐mPEG2−N−ヒドロキシスクシンイミドのモル比が20モル過剰になるまで、10%のエタノール含有第IX因子の反応混合物に、10%のエタノール含有分岐mPEG2−N−ヒドロキシスクシンイミド溶液を添加した。分岐mPEG2−N−ヒドロキシスクシンイミドを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子への分岐mPEG2−N−ヒドロキシスクシンイミドの結合が可能になるように、その反応溶液を室温で3時間撹拌した。その反応溶液を4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0213】
SDS−PAGEは、得られた抱合体溶液の特徴づけに使用した。SDS−PAGEの結果に基づいて、抱合は検出されなかった(結果は示さず)。エタノールの導入は、分岐mPEG2−N−ヒドロキシスクシンイミド(40kDa)の抱合の増加を可能にするために、第IX因子の構造的な柔軟性を増加させないと考えられる。
【0214】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG2−N−ヒドロキシスクシンイミドを使用して、他の抱合体を調製することができる。
実施例9
mPEG−SMB(30kDa)による第IX因子のPEG化
(高分子と第IX因子の比率20:1;エタノールなし)
【化25】

【0215】
アルゴン下で−20℃で保存したmPEG−SMB(30kDa)を室温まで加温した。加温したmPEG−SMB(8.6mg)を、1.0mLの2mM HClに溶解して、mPEG−SMB溶液を作製した。第IX因子に対してmPEG−SMBが20モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、mPEG−SMB溶液を添加した。mPEG−SMBを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験した。アミド結合を介して、第IX因子へのmPEG−SMBの結合が可能になるように、その反応溶液を室温で2時間撹拌した。その反応溶液を4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。その後、4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0216】
SDS−PAGEは、特徴づけに使用した。第2のSDS−PAGEの結果に基づいて、抱合を示した。図4に示すゲルの「20:1 30K SMB」と表記したレーンを参照のこと。
【0217】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG−SMBを使用して、他の抱合体を調製することができる。
実施例10
mPEG−SPA(20kDa)による第IX因子のPEG化
(高分子と第IX因子の比率20:1;エタノールなし)
【化26】

【0218】
エタノールは、特定のタンパク質の構造的な柔軟性を増加させると考えられるので、エタノールを、バッファおよび反応系に導入する。アルゴン下で−20℃で保存したmPEG−SPA(20kDa)を室温まで加温した。加温した分岐mPEG−SPA(10.0mg)を、エタノールを添加した0.5mLの2mM HClに溶解して、10%のエタノール含有mPEG−SPA溶液を作製した。第IX因子に対してmPEG−SPAが20モル過剰になるまで、10%のエタノール含有第IX因子の反応混合物に、10%のエタノール含有mPEG−SPA溶液を添加した。mPEG−SPAを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子へのmPEG−SPAの結合が可能になるように、その反応溶液を室温で2時間撹拌した。その反応溶液を撹拌することによって、結合の継続が可能となった。
【0219】
SDS−PAGEの結果に基づいて、抱合は検出されなかった。図3に示すゲルの「20:1 20K SPA+EtOH」と表記したレーンを参照のこと。エタノールの導入は、mPEG−SPA(20kDa)の抱合の増加を可能にするために、第IX因子の構造的な柔軟性を増加させないと考えられる。
【0220】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SPAを使用して、他の抱合体を調製することができる。
実施例11
mPEG−SPA(20kDa)による第IX因子のPEG化
(高分子と第IX因子の比率40:1;エタノールなし)
【化27】

【0221】
エタノールは、特定のタンパク質の構造的な柔軟性を増加させると考えられるので、エタノールを、バッファおよび反応系に導入する。アルゴン下で−20℃で保存したmPEG−SPA(20kDa)を室温まで加温した。加温した分岐mPEG−SPA(10.0mg)を、エタノールを添加した0.5mLの2mM HClに溶解して、10%のエタノール含有mPEG−SPA溶液を作製した。第IX因子に対してmPEG−SPAが40モル過剰になるまで、10%のエタノール含有第IX因子の反応混合物に、10%のエタノール含有mPEG−SPA溶液を添加した。mPEG−SPAを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験して、十分に混合した。アミド結合を介して、第IX因子へのmPEG−SPAの結合が可能になるように、その反応溶液を室温で2時間撹拌した。その反応溶液を撹拌することによって、結合の継続が可能となった。
【0222】
SDS−PAGEの結果に基づいて、抱合は検出されなかった。図3に示すゲルの「40:1 20K SPA+EtOH」と表記したレーンを参照のこと。エタノールの導入は、mPEG−SPA(20kDa)の抱合の増加を可能にするために、第IX因子の構造的な柔軟性を増加させないと考えられる。
【0223】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SPAを使用して、他の抱合体を調製することができる。
実施例12
分岐mPEG−ブチルアルデヒド(20kDa)による第IX因子のPEG化
(高分子と第IX因子の比率10:1;エタノールなし)
【化28】

【0224】
アルゴン下で−20℃で保存した分岐mPEG2−ブチルアルデヒド(20kDa)を室温まで加温した。加温した分岐mPEG2−ブチルアルデヒド(10.9mg)を、1mLの2mM HClに溶解して、分岐mPEG2−ブチルアルデヒド溶液を作製した。第IX因子に対する分岐mPEG2−ブチルアルデヒドが10モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、分岐mPEG2−ブチルアルデヒド溶液を添加した。30分撹拌した後、分岐mPEG2−ブチルアルデヒドに対して過剰に、還元剤NaCNBH3(1xBPSで溶解)を添加した(pHを試験して、第2級アミンに対する還元の確認の必要に応じて調製した)。次いで、その溶液を4℃で一晩撹拌して、アミン結合を介した結合を確認した。
【0225】
RP−HPLC(C3)およびSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。SDS−PAGEの結果に基づいて、抱合は検出されなかった。図4に示すゲルの「10:1 20K BYA」と表記したレーンを参照のこと。得られた抱合体溶液の構成要素を分離するために、RP−HPLC(C3)を使用した。得られたクロマトグラムでは、抱合物質の存在は確認されなかった。図9に示すクロマトグラムを参照のこと。
【0226】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG2−ブチルアルデヒドを使用して、他の抱合体を調製することができる。
実施例13
分岐mPEG−ブチルアルデヒド(20kDa)による第IX因子のPEG化
(高分子と第IX因子の比率20:1;エタノールなし)
【化29】

【0227】
アルゴン下で−20℃で保存した分岐mPEG2−ブチルアルデヒド(20kDa)を室温まで加温した。加温した分岐mPEG2−ブチルアルデヒド(10.9mg)を、1mLの2mM HClに溶解して、分岐mPEG2−ブチルアルデヒド溶液を作製した。第IX因子に対する分岐mPEG2−ブチルアルデヒドが20モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、分岐mPEG2−ブチルアルデヒド溶液を添加した。30分撹拌した後、分岐mPEG2−ブチルアルデヒドに対して過剰に、還元剤NaCNBH3(1xBPSで溶解)を添加した(pHを試験して、第2級アミンに対する還元の確認の必要に応じて調製した)。次いで、その溶液を4℃で一晩撹拌して、アミン結合を介した結合を確認した。
【0228】
RP−HPLC(C3)およびSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。SDS−PAGEの結果に基づいて、抱合は検出されなかった。図4に示すゲルの「20:1 20K BYA」と表記したレーンを参照のこと。得られた抱合体溶液の構成要素を分離するために、RP−HPLC(C3)を使用した。得られたクロマトグラムでは、抱合物質の存在は確認されなかった。図10に示すクロマトグラムを参照のこと。
【0229】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG2−ブチルアルデヒドを使用して、他の抱合体を調製することができる。
実施例14
mPEG−SPA(20kDa)による第IX因子のPEG化
(高分子と第IX因子の比率53:1;エタノールなし)
【化30】

【0230】
アルゴン下で−20℃で保存したmPEG−SPA(20kDa)を室温まで加温した。加温したmPEG−SPA(5.4mg)を、1mLの2mM HClに溶解して、mPEG−SPA溶液を作製した。第IX因子に対してmPEG−SPAが53モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、mPEG−SPA溶液を添加した。mPEG−SPAを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験した。アミド結合を介して、第IX因子へのmPEG−SPAの結合が可能になるように、その反応溶液を室温で2時間撹拌した。その反応溶液を4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0231】
RP−HPLC(C3)および第2のSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。SDS−PAGEの結果に基づいて、抱合を確認した。図4に示すゲルの「53:1 20K SPA」と表記したレーンを参照のこと。RP−HPLC(C3)を使用して、得られた抱合体溶液の構成要素を分離した。得られたクロマトグラムは、約60%の抱合体収率を示した(51.9%のモノPEG化または「1−mer」種、および8%のジPEG化または「2−mer」種を含む)。図11に示すクロマトグラムを参照のこと。しかし、実際の収率は、高分子試薬が比較的大量に過剰であるため、幾分低くなる場合があると考えられる。
【0232】
この同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SPAを使用して、他の抱合体を調製することができる。
実施例15
mPEG−SPA(20kDa)による第IX因子のPEG化
(高分子と第IX因子の比率110:1;エタノールなし)
【化31】

【0233】
アルゴン下で−20℃で保存したmPEG−SPA(20kDa)を室温まで加温した。加温したmPEG−SPA(5.4mg)を、1mLの2mM HClに溶解し、mPEG−SPA溶液を作製した。第IX因子に対してmPEG−SPAが110モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、mPEG−SPA溶液を添加した。mPEG−SPAを添加した後に、pH7.2乃至7.5を確保するように反応混合物のpHを試験した。アミド結合を介して、第IX因子へのmPEG−SPAの結合が可能になるように、その反応溶液を室温で2時間撹拌した。その反応溶液を4℃で一晩撹拌することによって、結合の継続が可能となり、それによって、抱合体溶液が得られた。
【0234】
RP−HPLC(C3)および第2のSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。SDS−PAGEの結果に基づいて、抱合を確認した。図4に示すゲルの「110:1 20K SPA」と表記したレーンを参照のこと。RP−HPLC(C3)を使用して、得られた抱合体溶液の構成要素を分離した。得られたクロマトグラムは、約44%の抱合体収率を示した(ほぼ100%のモノPEG化または「1−mer」種を表す)。図12に示すクロマトグラムを参照のこと。しかし、実際の収率は、高分子試薬が比較的大量に過剰であるため、幾分低くなる場合がある、と考えられる。
【0235】
この同じ手法を使用することによって、他の重量平均分子量を有するmPEG−SPAを使用して、他の抱合体を調製することができる。
実施例16
分岐mPEG−ブチルアルデヒド(20kDa)による第IX因子のPEG化
(高分子と第IX因子の比率は20:1;エタノールあり)
【化32】

【0236】
エタノールは、特定のタンパク質の構造的な柔軟性を増加させると考えられるので、エタノールを、バッファおよび反応系に導入する。アルゴン下で−20℃で保存した分岐mPEG2−ブチルアルデヒド(20kDa)を室温まで加温した。加温した分岐mPEG2−ブチルアルデヒド(10.9mg)を、エタノールを添加した1mLの2mM HClに溶解して、10%のエタノール含有分岐mPEG2−ブチルアルデヒド溶液を作製した。第IX因子に対する分岐mPEG2−ブチルアルデヒドのモル比が20モル過剰になるまで、0.07mgの第IX因子を含む第IX因子の原液のアリコートに、10%のエタノール含有分岐mPEG2−ブチルアルデヒド溶液を添加した。30分撹拌した後、分岐mPEG2−ブチルアルデヒドに対して過剰に、還元剤NaCNBH3(1xBPSで溶解)を添加した(pHを試験して、第2級アミンに対する還元の確認の必要に応じて調製した)。次いで、その溶液を4℃で一晩撹拌して、アミン結合を介した結合を確認した。
【0237】
RP−HPLC(C3)およびSDS−PAGEを、得られた抱合体溶液の特徴づけのために使用した。SDS−PAGEの結果に基づいて、抱合は検出されなかった。図4に示すゲルの「20:1 20K BYA+EtOH」と表記したレーンを参照のこと。RP−HPLC(C3)では、検出可能な抱合物質の欠乏を確認した(結果は示さず)。エタノールの導入は、分岐mPEG2−ブチルアルデヒドの抱合の増加を可能にするために、第IX因子の構造的な柔軟性を増加させないと考えられる。
【0238】
反応時間を長くし、温度を高めて、および/または複数の高分子試薬を添加することで、収率が増加するものと期待される。この同じ手法を使用することによって、他の重量平均分子量を有する分岐mPEG2−ブチルアルデヒドを使用して、他の抱合体を調製することができる。
実施例17
mPEG−SBAによる第IXa因子のPEG化
【0239】
10,000ダルトンの分子量を有するmPEG−スクシンイミジルブトナートは、Nekter Therapeutics(Huntsville、AL)から入手する。高分子試薬の基本構造は、下記で与えられる:
【化33】

【0240】
凍結乾燥されている場合、第IXa因子は、リン酸塩のようなアミンを含まないバッファ内に溶解され、7.2乃至9の最終pHが得られる。次いでこの溶液に、1.5乃至10モル過剰のmPEG−SBAを添加する。得られた混合物を、数時間、室温で撹拌する。
【0241】
反応混合物をSDS−PAGEによって分析して、タンパク質のPEG化の程度を決定する。
実施例18
mPEG−RIP(5K)による第IX因子のPEG化
【化34】

【0242】
ケトンおよび対応するケタールとして示す上述の高分子試薬を、米国特許出願第2005/0031576号に開示されているように調製する。
【0243】
上述の高分子試薬を調製するために、メチレンクロライド(20ml)内に5,000ダルトンの重量平均分子量を有するメトキシポリエチレングリコール−スクシンイミジルプロピオン酸塩(1.0g、0.002モル)に、トリエチルアミン(0.084ml、0.006モル)および4−ピペリドン一水和物塩酸塩(0.077g、0.005モル)を添加する。反応混合物を、窒素雰囲気の下で室温で一晩撹拌し、抱合前に精製する。或いは、高分子試薬は、Nektar Therapeuticsから購入することができる。
【0244】
抱合を達成するために、水性バッファの第IX因子の溶液に、20モル過剰のmPEG−RIP(5K)を添加する。得られた溶液は、室温での反応を容易にするために、低速に設定したRoto Mix(登録商標)オービタルシェーカー(Thermolyne Corp.、Dubuque、IA)に入れる。15分後に、第IX因子に対して50モル過剰に等しい量の水溶性のNaCNBH3を添加する。アリコートを、反応混合物から定期的に回収して、(Bio−Rad Laboratories、Hercules、CAから入手可能なゲルを使用して)SDS−PAGEで分析する。
【0245】
SDS−PAGE分析は、付着した1、2、および3PEG部分を有する第IX因子のPEG誘導体の存在を示す。
実施例19
mPEG−KALによるシステイン挿入第IX因子の抱合、20K
【0246】
第IX因子には、国際特許出願公開WO90/12874に開示されるプロセスに基づいて、1つ以上のシステイン残基を挿入する。
【0247】
抱合前に、第IX因子のバッファ交換を行って、ヒスチジンをHEPESに置き換える。
【0248】
アルゴン下で−20℃で保存したmPEG−MAL(20K)を室温まで加温する。加温したmPEG−MAL試薬(4.4mg)を、0.044mlのHEPESバッファ(50mMのHEPES(または他の好適なバッファ)、pH7.0)に溶解して、10%のmPEG−MAL溶液を作製する。そのmPEG−MAL溶液を、4mlの第IX因子溶液(50mMのHEPESに0.4324mg/ml(または他の好適な処方)、pH7.0)に迅速に添加し、十分に混合する。室温で30分反応させた後、反応バイアルを低温室(4℃)に移し、その反応混合物に、さらに0.044mlのmPEG−MAL溶液を添加し、次いで3つ以上のアリコートの0.044mlのmPEG−MAL溶液を、2時間にわたり添加する。pHを測定する(pH7.0±0.2)。タンパク質に対するmPEG−MALのモル比は、50:1である。最終的なmPEG−MALの濃度は5.213mg/mlであり、最終的な第IX因子の濃度は0.410mg/mlである。反応は、Rotomix上で(低速、Thermolyne)、4℃で一晩進行させることが可能である。
【0249】
抱合体の混合物は、ゲル濾過クロマトグラフィを使用して精製する。サイズ排除クロマトグラフィ方法は、反応混合物および最終的な製品を分析するために開発されたものである。SDS−PAGE分析はまた、サンプルの特徴づけにも使用される。
実施例20
典型的な第IX因子−PEG抱合体の生体外活性
【0250】
実施例1、2、3、9、14、および15に記述した、第IX因子−PEG抱合体それぞれの生物学的活性を決定する。試験される全ての第IX因子−PEG抱合体は、ある程度の第IX因子活性を有するものと決定される。
【特許請求の範囲】
【請求項1】
直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に共有結合した第IX因子部分を含み、当該水溶性高分子の分子量が5,000ダルトンより多く、約150,000ダルトンより少ない抱合体。
【請求項2】
直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子にアミノ酸残基において共有結合した第IX因子部分を含み、当該アミノ酸残基が直接的にまたは当該スペーサ部分を介して、−CH2−C(O)−O−、−N(H)−C(O)CH2−O−、−C(O)−N(H)−、−N(H)−C(O)−CH2−O−、−C(O)−CH2−O−、−C(O)−CH2−CH2−C(O)−O−、ジアゾ、またはトリアジン結合により結合していない抱合体。
【請求項3】
直接的にまたは1つ以上の原子を含むスペーサ部分を介して、非線形の水溶性高分子に共有結合した第IX因子部分を含む抱合体。
【請求項4】
各抱合体中の前記水溶性高分子が、ポリ(酸化アルキレン)、ポリ(ビニルピロリドン)、ポリ(ビニルアルコール)、ポリオキサゾリン、およびポリ(アクリロイルモルホリン)から成る群から選択される、請求項1、2、または3に記載の抱合体。
【請求項5】
各水溶性高分子が、ポリ(酸化アルキレン)である、請求項4に記載の抱合体。
【請求項6】
各ポリ(酸化アルキレン)が、ポリ(エチレングリコール)である、請求項5に記載の抱合体。
【請求項7】
前記ポリ(エチレングリコール)が、ヒドロキシ、アルコキシ、置換アルコキシ、アルケノキシ、置換アルケノキシ、アルキノキシ、置換アルキノキシ、アリールオキシ、および置換アリールオキシから成る群から選択される、エンドキャップ部分で末端がキャップされる、請求項6に記載の抱合体。
【請求項8】
前記ポリ(エチレングリコール)が、メトキシで末端がキャップされる、請求項6に記載の抱合体。
【請求項9】
前記水溶性高分子が、5,000ダルトン乃至約150,000ダルトンの範囲の総重量平均分子量を有する、請求項2または3に記載の抱合体。
【請求項10】
前記ポリ(エチレングリコール)が、約6,000ダルトン乃至約100,000ダルトンの範囲の総重量平均分子量を有する、請求項6に記載の抱合体。
【請求項11】
前記ポリ(エチレングリコール)が、約10,000ダルトン乃至約85,000ダルトンの範囲の総重量平均分子量を有する、請求項10に記載の抱合体。
【請求項12】
前記ポリ(エチレングリコール)が、約20,000ダルトン乃至約85,000ダルトンの範囲の総重量平均分子量を有する、請求項11に記載の抱合体。
【請求項13】
各水溶性高分子が線状である、請求項1または2に記載の抱合体。
【請求項14】
各水溶性高分子が分岐状である、請求項1または2に記載の抱合体。
【請求項15】
前記第IX因子部分が、第IX因子、第IXa因子、およびそれらのいずれかの生物活性フラグメント、欠損変異体、置換変異体、または付加変異体から成る群から選択される、請求項1、2、または3に記載の抱合体。
【請求項16】
前記第IX因子部分が第IX因子である、請求項15に記載の抱合体。
【請求項17】
前記第IX因子部分が第IXa因子である、請求項16に記載の抱合体。
【請求項18】
前記第IX因子部分が組み換え的に誘導される、請求項6に記載の抱合体。
【請求項19】
前記第IX因子部分が血液由来である、請求項6に記載の抱合体。
【請求項20】
前記第IX因子部分に、3つを超えない水溶性高分子が結合した、請求項6に記載の抱合体。
【請求項21】
複数の抱合体を含み、当該組成物中の全ての抱合体の少なくとも約80%が、それぞれが1つ、2つ、3つ、または4つの水溶性高分子に共有結合した第IX因子部分を含み、さらに、当該抱合体中の各水溶性高分子に対して、当該第IX因子部分が、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に結合した組成物。
【請求項22】
複数の抱合体を含み、当該組成物中の全ての抱合体の少なくとも約85%が、それぞれ第IX因子部分に共有結合した1つ乃至3つの水溶性高分子を有し、各水溶性高分子が、5,000ダルトン乃至約150,000ダルトンの範囲の重量平均分子量を有する組成物。
【請求項23】
複数のモノPEG化第IX因子部分の抱合体を含み、当該組成物中の全ての抱合体の少なくとも約85%が、モノPEG化第IX因子部分の抱合体である組成物。
【請求項24】
各抱合体中の前記水溶性高分子が、ポリ(酸化アルキレン)、ポリ(ビニルピロリドン)、ポリ(ビニルアルコール)、ポリオキサゾリン、およびポリ(アクリロイルモルホリン)から成る群から選択される、請求項21、22、または23に記載の組成物。
【請求項25】
各水溶性高分子が、ポリ(酸化アルキレン)である、請求項24に記載の組成物。
【請求項26】
各ポリ(酸化アルキレン)が、ポリ(エチレングリコール)である、請求項25に記載の組成物。
【請求項27】
前記ポリ(エチレングリコール)が、ヒドロキシ、アルコキシ、置換アルコキシ、アルケノキシ、置換アルケノキシ、アルキノキシ、置換アルキノキシ、アリールオキシ、および置換アリールオキシから成る群から選択される、エンドキャップ部分で末端がキャップされる、請求項26に記載の組成物。
【請求項28】
前記ポリ(エチレングリコール)が、メトキシで末端がキャップされる、請求項26に記載の組成物。
【請求項29】
前記水溶性高分子が、5,000ダルトン乃至約150,000ダルトンの範囲の総重量平均分子量を有する、請求項21または23に記載の組成物。
【請求項30】
前記ポリ(エチレングリコール)が、約6,000ダルトン乃至約100,000ダルトンの範囲の総重量平均分子量を有する、請求項26に記載の組成物。
【請求項31】
前記ポリ(エチレングリコール)が、約10,000ダルトン乃至約85,000ダルトンの範囲の総重量平均分子量を有する、請求項30に記載の組成物。
【請求項32】
前記ポリ(エチレングリコール)が、約20,000ダルトン乃至約85,000ダルトンの範囲の総重量平均分子量を有する、請求項31に記載の組成物。
【請求項33】
各水溶性高分子が線状である、請求項6に記載の組成物。
【請求項34】
各水溶性高分子が分岐状である、請求項6に記載の組成物。
【請求項35】
前記第IX因子部分が、第IX因子、第IXa因子、およびそれらのいずれかの生物活性フラグメント、欠損変異体、置換変異体、または付加変異体から成る群から選択される、請求項21、22、または23に記載の組成物。
【請求項36】
前記第IX因子部分が第IX因子である、請求項35に記載の組成物。
【請求項37】
前記第IX因子部分が第IXa因子である、請求項35に記載の組成物。
【請求項38】
前記第IX因子部分が組み換え的に誘導される、請求項26に記載の組成物。
【請求項39】
前記第IX因子部分が血液由来である、請求項26に記載の組成物。
【請求項40】
前記第IX因子部分に、3つを超えない水溶性高分子が結合した、請求項21または22に記載の組成物。
【請求項41】
前記組成物が、実質的にアルブミンを含まない、請求項26に記載の組成物。
【請求項42】
前記組成物が、第IX因子の活性を有さないタンパク質を実質的に含まない、請求項26に記載の組成物。
【請求項43】
前記組成物が、非共有結合の水溶性高分子を実質的に含まない、請求項26に記載の組成物。
【請求項44】
凍結乾燥形態である、請求項26に記載の組成物。
【請求項45】
液体の形態である、請求項26に記載の組成物。
【請求項46】
医薬として許容される賦形剤をさらに含む、請求項26に記載の組成物。
【請求項47】
各モノPEG化第IX因子部分の抱合体が、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に共有結合した第IX因子部分を含む、請求項23に記載の組成物。
【請求項48】
各抱合体が、前記水溶性高分子またはスペーサ部分に、前記第IX因子部分を結合するアミド結合を含む、請求項21、22、または26に記載の組成物。
【請求項49】
各抱合体が、前記水溶性高分子またはスペーサ部分に、前記第IX因子部分を結合する第2級アミン結合を含む、請求項21、22、または26に記載の組成物。
【請求項50】
各抱合体が、前記水溶性高分子またはスペーサ部分に、前記第IX因子部分を結合するカルバメート結合を含む、請求項21、22、または26に記載の組成物。
【請求項51】
各抱合体が、前記水溶性高分子またはスペーサ部分に、前記第IX因子部分を結合するチオエーテル結合を含む、請求項21、22、または26に記載の組成物。
【請求項52】
各抱合体が、前記水溶性高分子またはスペーサ部分に、前記第IX因子部分を結合するジスルフィド結合を含む、請求項21、22、または26に記載の組成物。
【請求項53】
抱合条件下で、第IX因子部分を高分子試薬と接触させる段階を含む、抱合体を生成するための方法。
【請求項54】
更なるアルコールを加えない、請求項53に記載の方法。
【請求項55】
酸化段階を実施しない、請求項53に記載の方法。
【請求項56】
直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に共有結合した第IX因子部分を含む抱合体を得るに十分な条件下で、第IX因子の組成物に、高分子試薬の組成物を添加する段階を含む、抱合体を生成するための方法。
【請求項57】
更なるアルコールを加えない、請求項56に記載の方法。
【請求項58】
酸化段階を実施しない、請求項56に記載の方法。
【請求項59】
患者に請求項46に記載の組成物を投与する段階を含む、抱合体を送達するための方法。
【請求項60】
皮下注射によって実施される、請求項59に記載の方法。
【請求項61】
前記患者が血友病Bを罹患している、請求項59に記載の方法。
【請求項62】
前記患者に、手術前の2日以内に前記組成物を投与する、請求項59に記載の方法。
【請求項1】
直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に共有結合した第IX因子部分を含み、当該水溶性高分子の分子量が5,000ダルトンより多く、約150,000ダルトンより少ない抱合体。
【請求項2】
直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子にアミノ酸残基において共有結合した第IX因子部分を含み、当該アミノ酸残基が直接的にまたは当該スペーサ部分を介して、−CH2−C(O)−O−、−N(H)−C(O)CH2−O−、−C(O)−N(H)−、−N(H)−C(O)−CH2−O−、−C(O)−CH2−O−、−C(O)−CH2−CH2−C(O)−O−、ジアゾ、またはトリアジン結合により結合していない抱合体。
【請求項3】
直接的にまたは1つ以上の原子を含むスペーサ部分を介して、非線形の水溶性高分子に共有結合した第IX因子部分を含む抱合体。
【請求項4】
各抱合体中の前記水溶性高分子が、ポリ(酸化アルキレン)、ポリ(ビニルピロリドン)、ポリ(ビニルアルコール)、ポリオキサゾリン、およびポリ(アクリロイルモルホリン)から成る群から選択される、請求項1、2、または3に記載の抱合体。
【請求項5】
各水溶性高分子が、ポリ(酸化アルキレン)である、請求項4に記載の抱合体。
【請求項6】
各ポリ(酸化アルキレン)が、ポリ(エチレングリコール)である、請求項5に記載の抱合体。
【請求項7】
前記ポリ(エチレングリコール)が、ヒドロキシ、アルコキシ、置換アルコキシ、アルケノキシ、置換アルケノキシ、アルキノキシ、置換アルキノキシ、アリールオキシ、および置換アリールオキシから成る群から選択される、エンドキャップ部分で末端がキャップされる、請求項6に記載の抱合体。
【請求項8】
前記ポリ(エチレングリコール)が、メトキシで末端がキャップされる、請求項6に記載の抱合体。
【請求項9】
前記水溶性高分子が、5,000ダルトン乃至約150,000ダルトンの範囲の総重量平均分子量を有する、請求項2または3に記載の抱合体。
【請求項10】
前記ポリ(エチレングリコール)が、約6,000ダルトン乃至約100,000ダルトンの範囲の総重量平均分子量を有する、請求項6に記載の抱合体。
【請求項11】
前記ポリ(エチレングリコール)が、約10,000ダルトン乃至約85,000ダルトンの範囲の総重量平均分子量を有する、請求項10に記載の抱合体。
【請求項12】
前記ポリ(エチレングリコール)が、約20,000ダルトン乃至約85,000ダルトンの範囲の総重量平均分子量を有する、請求項11に記載の抱合体。
【請求項13】
各水溶性高分子が線状である、請求項1または2に記載の抱合体。
【請求項14】
各水溶性高分子が分岐状である、請求項1または2に記載の抱合体。
【請求項15】
前記第IX因子部分が、第IX因子、第IXa因子、およびそれらのいずれかの生物活性フラグメント、欠損変異体、置換変異体、または付加変異体から成る群から選択される、請求項1、2、または3に記載の抱合体。
【請求項16】
前記第IX因子部分が第IX因子である、請求項15に記載の抱合体。
【請求項17】
前記第IX因子部分が第IXa因子である、請求項16に記載の抱合体。
【請求項18】
前記第IX因子部分が組み換え的に誘導される、請求項6に記載の抱合体。
【請求項19】
前記第IX因子部分が血液由来である、請求項6に記載の抱合体。
【請求項20】
前記第IX因子部分に、3つを超えない水溶性高分子が結合した、請求項6に記載の抱合体。
【請求項21】
複数の抱合体を含み、当該組成物中の全ての抱合体の少なくとも約80%が、それぞれが1つ、2つ、3つ、または4つの水溶性高分子に共有結合した第IX因子部分を含み、さらに、当該抱合体中の各水溶性高分子に対して、当該第IX因子部分が、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に結合した組成物。
【請求項22】
複数の抱合体を含み、当該組成物中の全ての抱合体の少なくとも約85%が、それぞれ第IX因子部分に共有結合した1つ乃至3つの水溶性高分子を有し、各水溶性高分子が、5,000ダルトン乃至約150,000ダルトンの範囲の重量平均分子量を有する組成物。
【請求項23】
複数のモノPEG化第IX因子部分の抱合体を含み、当該組成物中の全ての抱合体の少なくとも約85%が、モノPEG化第IX因子部分の抱合体である組成物。
【請求項24】
各抱合体中の前記水溶性高分子が、ポリ(酸化アルキレン)、ポリ(ビニルピロリドン)、ポリ(ビニルアルコール)、ポリオキサゾリン、およびポリ(アクリロイルモルホリン)から成る群から選択される、請求項21、22、または23に記載の組成物。
【請求項25】
各水溶性高分子が、ポリ(酸化アルキレン)である、請求項24に記載の組成物。
【請求項26】
各ポリ(酸化アルキレン)が、ポリ(エチレングリコール)である、請求項25に記載の組成物。
【請求項27】
前記ポリ(エチレングリコール)が、ヒドロキシ、アルコキシ、置換アルコキシ、アルケノキシ、置換アルケノキシ、アルキノキシ、置換アルキノキシ、アリールオキシ、および置換アリールオキシから成る群から選択される、エンドキャップ部分で末端がキャップされる、請求項26に記載の組成物。
【請求項28】
前記ポリ(エチレングリコール)が、メトキシで末端がキャップされる、請求項26に記載の組成物。
【請求項29】
前記水溶性高分子が、5,000ダルトン乃至約150,000ダルトンの範囲の総重量平均分子量を有する、請求項21または23に記載の組成物。
【請求項30】
前記ポリ(エチレングリコール)が、約6,000ダルトン乃至約100,000ダルトンの範囲の総重量平均分子量を有する、請求項26に記載の組成物。
【請求項31】
前記ポリ(エチレングリコール)が、約10,000ダルトン乃至約85,000ダルトンの範囲の総重量平均分子量を有する、請求項30に記載の組成物。
【請求項32】
前記ポリ(エチレングリコール)が、約20,000ダルトン乃至約85,000ダルトンの範囲の総重量平均分子量を有する、請求項31に記載の組成物。
【請求項33】
各水溶性高分子が線状である、請求項6に記載の組成物。
【請求項34】
各水溶性高分子が分岐状である、請求項6に記載の組成物。
【請求項35】
前記第IX因子部分が、第IX因子、第IXa因子、およびそれらのいずれかの生物活性フラグメント、欠損変異体、置換変異体、または付加変異体から成る群から選択される、請求項21、22、または23に記載の組成物。
【請求項36】
前記第IX因子部分が第IX因子である、請求項35に記載の組成物。
【請求項37】
前記第IX因子部分が第IXa因子である、請求項35に記載の組成物。
【請求項38】
前記第IX因子部分が組み換え的に誘導される、請求項26に記載の組成物。
【請求項39】
前記第IX因子部分が血液由来である、請求項26に記載の組成物。
【請求項40】
前記第IX因子部分に、3つを超えない水溶性高分子が結合した、請求項21または22に記載の組成物。
【請求項41】
前記組成物が、実質的にアルブミンを含まない、請求項26に記載の組成物。
【請求項42】
前記組成物が、第IX因子の活性を有さないタンパク質を実質的に含まない、請求項26に記載の組成物。
【請求項43】
前記組成物が、非共有結合の水溶性高分子を実質的に含まない、請求項26に記載の組成物。
【請求項44】
凍結乾燥形態である、請求項26に記載の組成物。
【請求項45】
液体の形態である、請求項26に記載の組成物。
【請求項46】
医薬として許容される賦形剤をさらに含む、請求項26に記載の組成物。
【請求項47】
各モノPEG化第IX因子部分の抱合体が、直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に共有結合した第IX因子部分を含む、請求項23に記載の組成物。
【請求項48】
各抱合体が、前記水溶性高分子またはスペーサ部分に、前記第IX因子部分を結合するアミド結合を含む、請求項21、22、または26に記載の組成物。
【請求項49】
各抱合体が、前記水溶性高分子またはスペーサ部分に、前記第IX因子部分を結合する第2級アミン結合を含む、請求項21、22、または26に記載の組成物。
【請求項50】
各抱合体が、前記水溶性高分子またはスペーサ部分に、前記第IX因子部分を結合するカルバメート結合を含む、請求項21、22、または26に記載の組成物。
【請求項51】
各抱合体が、前記水溶性高分子またはスペーサ部分に、前記第IX因子部分を結合するチオエーテル結合を含む、請求項21、22、または26に記載の組成物。
【請求項52】
各抱合体が、前記水溶性高分子またはスペーサ部分に、前記第IX因子部分を結合するジスルフィド結合を含む、請求項21、22、または26に記載の組成物。
【請求項53】
抱合条件下で、第IX因子部分を高分子試薬と接触させる段階を含む、抱合体を生成するための方法。
【請求項54】
更なるアルコールを加えない、請求項53に記載の方法。
【請求項55】
酸化段階を実施しない、請求項53に記載の方法。
【請求項56】
直接的にまたは1つ以上の原子を含むスペーサ部分を介して、水溶性高分子に共有結合した第IX因子部分を含む抱合体を得るに十分な条件下で、第IX因子の組成物に、高分子試薬の組成物を添加する段階を含む、抱合体を生成するための方法。
【請求項57】
更なるアルコールを加えない、請求項56に記載の方法。
【請求項58】
酸化段階を実施しない、請求項56に記載の方法。
【請求項59】
患者に請求項46に記載の組成物を投与する段階を含む、抱合体を送達するための方法。
【請求項60】
皮下注射によって実施される、請求項59に記載の方法。
【請求項61】
前記患者が血友病Bを罹患している、請求項59に記載の方法。
【請求項62】
前記患者に、手術前の2日以内に前記組成物を投与する、請求項59に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2012−25768(P2012−25768A)
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−221316(P2011−221316)
【出願日】平成23年10月5日(2011.10.5)
【分割の表示】特願2007−519528(P2007−519528)の分割
【原出願日】平成17年6月30日(2005.6.30)
【出願人】(597148884)ネクター セラピューティクス (30)
【Fターム(参考)】
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願番号】特願2011−221316(P2011−221316)
【出願日】平成23年10月5日(2011.10.5)
【分割の表示】特願2007−519528(P2007−519528)の分割
【原出願日】平成17年6月30日(2005.6.30)
【出願人】(597148884)ネクター セラピューティクス (30)
【Fターム(参考)】
[ Back to top ]

