高分子カルバゾール化合物
化学式(I)のモノマーユニットを有する高分子カルバゾール化合物が開示され、
-(C1)-(C2)x-(C3)y-(P)n- (I)
式中、xおよびyは0または1であり、nは以上0または0よりも大きい整数であり、Pはフェニル基を示し、C1、C2およびC3はカルバゾール基を示す。ビフェニル構造上で三重項波動関数が局在化する。二つのカルバゾールユニットが結合しているポリマー骨格中にねじれを導入することで、三重項エネルギーは増加する。置換基、例えばメトキシまたは3、7−ジメチルオクチルオキシ、によってねじれが導入された。高分子カルバゾール化合物は半導体材料として使用してもよい。半導体材料はルミネッセント発光材に対するホストマトリックスとして使用してもよい。
-(C1)-(C2)x-(C3)y-(P)n- (I)
式中、xおよびyは0または1であり、nは以上0または0よりも大きい整数であり、Pはフェニル基を示し、C1、C2およびC3はカルバゾール基を示す。ビフェニル構造上で三重項波動関数が局在化する。二つのカルバゾールユニットが結合しているポリマー骨格中にねじれを導入することで、三重項エネルギーは増加する。置換基、例えばメトキシまたは3、7−ジメチルオクチルオキシ、によってねじれが導入された。高分子カルバゾール化合物は半導体材料として使用してもよい。半導体材料はルミネッセント発光材に対するホストマトリックスとして使用してもよい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、高分子カルバゾール化合物、この種の高分子カルバゾール化合物を有する半導体材料、およびこの種の半導体材料を有するエレクトロルミネッセントデバイスに関する。この半導体材料はルミネッセント発光材と組み合わせてもよい。
【0002】
本発明は、半導体材料としてのこの種の化合物の使用ばかりではなく、この種の高分子カルバゾール化合物を生成するプロセスにも関する。半導体材料はルミネッセント発光材に対するホストマトリックスとして使用してもよい。
【背景技術】
【0003】
有機発光ダイオード(OLED)では、電流から光への変換効率は、電子および正孔の再結合効率、および発光化合物の発光量子効率に依存する。最先端技術のデバイスでは、再結合効率は一に近く、すなわち注入された電荷キャリアのほとんど全てがデバイス中で再結合する。この種の再結合で生じた励起状態は一重項状態または三重項状態の何れかになり得る。一重項および三重項という用語は電荷キャリアのスピンモーメントが相互に向き合う配向を示す。
【0004】
室温における大多数の有機材料では、小分子および高分子の両方において、最低励起一重項状態からのみ光を放出する。このプロセスは蛍光と呼ばれている。ほんのわずかの分子が最低励起三重項状態から光を放出する。このプロセスはリン光と呼ばれている。従って、従来のOLEDでは、発光は励起分子の蛍光による。
【0005】
量子スピン状態によれば、電子および正孔の再結合の25%は一重項励起状態を形成することになり、一方75%は三重項励起状態を形成する。従って、従来のOLEDでは内部量子効率は25%に制限される.これは従来のOLEDデバイスに加えられる電力の75%は光を発生するためには使用されないことを意味する。これは、特に自動車用途で考えてみると、容認できないほど高率でエネルギーが無駄になっている。
【0006】
OLEDで形成されるすべての励起状態を光の生成のために使用する明快な方法は、発光層でリン光放出材(三重項発光材またはリン光性金属錯体とも名付けられている)を導入することである(Baldo、M.A.らNature1998、395、151)。これらの放出材では、発光層で形成される三重項および一重項励起の両方を利用するので、すべての励起状態を発光のために使用する。結果として、デバイス効率は著しく向上する。
【0007】
リン光放出材に使用可能な化合物の種類は重金属錯体である。重金属原子が存在すると、この種の錯体の励起状態は一重項−三重項特性が混合したものとなる(いわゆる重原子効果によって)。原理上は、この種の重金属錯体のどの励起状態も光を放出する可能性がある(もちろん、励起状態から無放射減衰する可能性は常にあるので全ての励起状態が光を放出するわけではない)。励起状態は(電子と正孔が順にトラッピングして)重金属錯体上に直接形成されてもよいし、ホストの励起状態からエネルギー遷移を経由して形成されてもよい。ホストの一重項および三重項励起状態の両方から(双極子―双極子相互作用または交換相互作用経由で)重金属錯体へのエネルギー遷移が可能である。
【0008】
リン光放出材は通常ホスト化合物中に分散される。ホスト化合物(小分子または高分子のいずれかからなる)はリン光放出材の固体マトリックスとしての役目を果たす。ホスト化合物は、通常、電荷キャリアを輸送する働きを可能とする(半)導体材料である。
【0009】
小分子に基づく高効率OLED(smOLED)は、ホスト材料に分散したリン光放出材を利用し、ホストおよびリン光放出材の組み合わせは蒸着で多層構造中の一層に適用される。このような系はsmOLEDでは周知であるが、(共役)ポリマーに基づくOLED(pLED)ではあまり知られていない。
【0010】
pLEDにおけるリン光放出材を広く利用することを妨げる主な問題は、好適なホストポリマーがあまりないということであり、特に高エネルギーリン光放出材(すなわち緑色および青色)に好適なホストポリマーがないということである。
【0011】
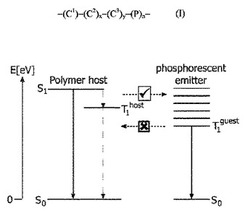
リン光放出材に対するホスト化合物では、ホストの三重項エネルギーがリン光放出材の三重項エネルギーよりも高くなければならないという重要な条件を満たさなければならない。リン光放出材から効率的なリン光を提供するためには、ホストの最低励起三重項状態がリン光放出材の最低放出状態よりもエネルギーが高くなければならない(図1参照)。エネルギーは系の最低励起状態上に常に存在する(遷移する)ものであることからこの要件が生じる。リン光放出材での発光が求められるので、最低励起状態はホスト化合物ではなくリン光放出材になければならない。
【0012】
図1では、一重項基低状態をS0で示す。すべての励起状態準位のエネルギーは、基低状態のエネルギーに対する相対値で示されている。ポリマーホストに対しては、最低励起一重項(S1)および三重項(T1host)準位のみを示す。リン光放出材に対しては、多くの異なる種類の励起三重項準位を示し、最低励起三重項準位はT1guestで示す。実線矢印は放射過程を示し、一方破線矢印は非放射過程を示す。水平破線矢印はエネルギー遷移過程を示す。この特別な状態では、励起状態エネルギーはポリマーからリン光放出材へ遷移可能である、しかし逆の場合も同じではない。リン光放出材の最低励起状態のエネルギーが、ホストポリマーの最低励起状態のエネルギーよりも低ければ、リン光放出材はホストポリマーからの一重項および三重項励起子の両方を利用することが可能となるので、有機発光ダイオードの効率は100%に高まる。
【0013】
ポリマーOLEDに対するホスト材料としてのカルバゾールに基づく化合物は公知である(特許文献1)。これらのカルバゾール誘導体の最低励起三重項状態のエネルギーは、赤色または緑色リン光放出材に対応するには十分高い。この種のカルバゾールベース(コ)ポリマーに由来する化合物では最大2.6eVまでの三重項エネルギーを有している。多くの用途のためには明らかに青色が必要である。そのためには、エネルギーが2.6eVよりも高い三重項を有するホストポリマーが必要である。青色リン光放出材のホストとなるためには、ホストポリマーの三重項エネルギーは少なくとも2.725eVでなければならない。このことが、ホストの適用範囲を455nm(2.725eV)青色光を放出するリン光放出材に広げる。
【0014】
このように、高エネルギー(すなわち青色)リン光放出材用の新しいホストポリマー材料に対する継続した要求が存在する。
【0015】
【特許文献1】国際公開第2004/055129号
【発明の開示】
【発明が解決しようとする課題】
【0016】
本発明の目的は、高エネルギーリン光放出材用の改良されたホストポリマー材料を必要とする要求を満たすことである。
【課題を解決するための手段】
【0017】
この目的は化学式(I)のモノマーユニットを有する高分子カルバゾール化合物によって達成される。
【0018】
-(C1)-(C2)x-(C3)y-(P)n- (I)
式中、
xおよびyは0または1であり、
nは0または0よりも大きい整数であり、
C1は次式(II)の化合物であり
【0019】
【化1】

(II)
C2は次式(III)の化合物であり、
【0020】
【化2】

(III)
C3は次式(IV)の化合物であり、
【0021】
【化3】

(IV)
Pは次式(V)の化合物であり、
【0022】
【化4】

(V)
R1、R2、R3、R4、R6、R7、R8、R9、R11、R12、R13、R14、R16、R17、R18およびR19はHまたは−OR41、−OR42、−SR41、−SR42、−NR41R45、および−NR42R45から成るグループから選択された置換基でもよい。
R5、R10、およびR15はそれぞれの出現毎に同一または異り、R41またはR42から選択されてもよく、
R41は炭素数1〜20の環式または非環式で直鎖または分岐アルキルであり、−O−、−OC(=O)−、−C(=O)O−、−S−、第二級窒素、第三級窒素、第四級窒素、−CR45=CR46−、−C≡C−、−C(=O)−、−C(=O)NR45−、−NR45C(=O)−、−S(=O)−、−S(=O)2−、または−X6−で一回以上分断されていてもよく、および/または一回以上R42、R57、またはR58で置換されたものであってもよく、
R42は炭素数5〜30のアリールであり、一つ以上の芳香族炭素原子はN、OまたはSで置換されていてもよく、一つ以上の芳香族炭素原子はR41、R57、またはR58基を有していてもよく、
R57は、−CN、−CF3、−CSN、−NH2、−NO2、−NCO、−NCS、−OH、−F、−PO2、−PH2、−SH、−Cl、−Br、または−Iであり、
R58は、−C(=O)R45、−C(=O)OR45、−C(=O)NR45R46、−NHR45、−NR45R46、−N(+)R45R46R47、−NC(=O)R45−、−OR45、−OC(=O)R45、−SR45、−S(=O)R45、または−S(=O)2R45であり、
R45、R46、およびR47はそれぞれの出現毎に同一または異なる、H、R41、またはR42であり、
X6は炭素数4〜30のアリーレンであり、一つ以上の芳香族炭素原子はN、OまたはSで置換されていてもよく、一つ以上の芳香族炭素原子はR41、R57、またはR58基を有していてもよく、
xが0であり、yが0であり、およびnが1以上である場合には、
少なくとも一つの[R3、R4、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基であり、
xが0であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4、R11、およびR12]は一つの前記置換基であり、
xが0であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4、R11、およびR12]および少なくとも一つの[R13、R14、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基であり、
xが1であり、yが0であり、およびnが0である場合には、
少なくとも一つの[R3、R4、R6、およびR7]は一つの前記置換基であり、
xが1であり、yが0であり、およびnが1以上である場合には、
少なくとも一つの[R3、R4、R6、およびR7]および少なくとも一つの[R8、R9、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基であり、
xが1であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4、R6、およびR7]および少なくとも一つの[R8、R9、R11、およびR12]は一つの前記置換基あり、
xが1であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4、R6、およびR7]および少なくとも一つの[R8、R9、R11、およびR12]および少なくとも一つの[R13、R14、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基である。
特に、
xが0であり、yが0であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R16、R17]は一つの前記置換基であり、
xが0であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R11、R12]は一つの前記置換基であり、
xが0であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R11、R12]、および少なくとも一つの[R13、R14]、および少なくとも一つの[R16、R17]は一つの前記置換基であり、
xが1であり、yが0であり、およびnが0である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R6、R7]は一つの前記置換基であり、
xが1であり、yが0であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R6、R7]、および少なくとも一つの[R16、R17]、および少なくとも一つの[R18、R19]は一つの前記置換基であり、
xが1であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R11、R12]、および少なくとも一つの[R6、R7、R8、R9]は一つの前記置換基であり、
xが1であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R6、R7]、および少なくとも一つの[R8、R9]、および少なくとも一つの[R11、R12]、および少なくとも一つの[R13、R14]、および少なくとも一つの[R16、R17]は一つの前記置換基である。
【0023】
これらの特別な位置に置換基を導入することで、二つのユニット(カルバゾールまたはフェニルのどちらか)が結合している場所にあるポリマー骨格内にねじれが発生した。このため、三重項波動関数が局在化し、三重項エネルギーが大きくなった。これにより、これらの化合物は、高エネルギー(すなわち、青色)リン光放出材用のホストポリマー材料として機能するのに優れる。
【0024】
本発明による好ましい高分子カルバゾール化合物では、xは1であり;yは0であり;nは1であり、R1、R2、R3、R7、R8、R9、R17、およびR19のそれぞれはHであり、R4、R6、R16およびR18のそれぞれは−OR41、であり、R5およびR10のそれぞれはR41である(NK938に相当する、下記参照)。
【0025】
本発明による他の好ましい高分子カルバゾール化合物では、xは1であり;yは1であり;nは0であり;R2、R3、R6、R7、R8、R12、R13、R14のそれぞれはHであり、;R1、R4、R9、R11、のそれぞれは−OR41であり、R5、R10およびR15のそれぞれはR41である(NK921に相当する、下記参照)。
【0026】
本発明による他の好ましい高分子カルバゾール化合物では、xは1であり;yは1であり;nは0であり、R1、R2、R3、R7、R8、R9、R12、R13、のそれぞれはHであり、;R4、R6、R11、およびR14のそれぞれは−OR41、であり、R5、R10およびR15のそれぞれはR41である(NK957に相当する、下記参照)。
−OR41は、例えばメトキシ(−OCH3、MeO)または化学式−OC10H21の直鎖または分岐のアルコキシ鎖(例を挙げると3、7−ジメチルオクチルオキシ)であってもよい。R41は、例えば化学式−C10H21の直鎖または分岐のアルキル鎖(例を挙げると3、7−ジメチルオクチル)であってもよい。
【0027】
本発明の好ましい高分子カルバゾール化合物は、下記の化学式NK938、NK921およびNK957のモノマーユニットを有する。
【化5】

【0028】
本発明は、上で定義した高分子カルバゾール化合物を含む半導体材料ばかりではなく、この種の半導体材料を含むエレクトロルミネッセントデバイスにも関する。半導体材料はルミネッセント発光材と組み合わせてもよい。
【0029】
更に、本発明は、上で定義した高分子カルバゾール化合物の合成方法、およびこの種の高分子カルバゾール化合物を半導体材料として使用することに関する。特に、上述した高分子カルバゾール化合物は、ルミネッセント発光材のためのホストマトリックスとして使用するには好適である。
【0030】
本発明につながる研究において、発明者達はとても予想外な青色リン光放出材のホストに好適なカルバゾールポリマーの新しいグループを発見した。このカルバゾールポリマーは化学式(I)のモノマーユニットを有する。
【0031】
-(C1)-(C2)x-(C3)y-(P)n- (I)
式中、xおよびyは0または1であり、nは0以上の整数である。Pはフェニル基を示し、C1、C2およびC3はカルバゾールユニットを示す。二つのカルバゾールユニットが結合している場所であるポリマー骨格中にねじれを導入することでビフェニル構造における三重項波動関数は局在化し、それによって三重項エネルギーは増加した。置換基(例えばメトキシまたは3、7−ジメチルオクチルオキシ)によってねじれが導入された。高分子カルバゾール化合物は半導体材料として使用してもよい。半導体材料はルミネッセント発光材に対するホストマトリックスとして使用してもよい。
【0032】
上述したように、ホストポリマーがリン光消光剤として働かないために、ポリマーには、三重項エネルギーがリン光放出材のエネルギーよりも大きいことが要求される。赤色リン光放出材に対しては、この条件はすでに達成されているが、緑色および特に青色リン光放出材にとってはこの条件を達成することがとても難しい。それ故に、本発明の重要な点は、大きな三重項エネルギーギャップと好適な電荷輸送準位とを組み合わせることのできるポリマーを提供することである。
【0033】
ホスト化合物の三重項エネルギーの増加を可能にするには、カルバゾールポリマーの基本構成要素に三重項波動関数を局在化させることに注目しなければならない。通常、三重項波動関数を非局在化させるほど、三重項エネルギーは小さくなる。従って、戦略としてはカルバゾールポリマー基本構成要素の小さな部分に三重項波動関数を局在化させることになろう。
【0034】
ポリフェニル分子に注目することで問題に対する見識を得る事が可能になる。ポリフェニル分子では、フェニル基の数が増加すると三重項エネルギーが小さくなる。ベンゼンからビフェニルまたはp−テルフェニルまでは、三重項エネルギーは、3.65eVから2.84eVまたは2.55eVまでそれぞれ小さくなる。しかしながら、ビフェニルからm−テルフェニルまでは、三重項エネルギーほとんど変化しない(ビフェニルでは2.84eVであり、m−テルフェニルでは2.81eVである。)(Birks、J.B.芳香族化合物の光物理学;JohnWiley&Sons:NewYork、1970)。
【発明の効果】
【0035】
従って、これらの化合物は高エネルギー(すなわち青色)リン光放出材用のホストポリマー材料として素晴らしい機能を有する。
【発明を実施するための最良の形態】
【0036】
表1
様々なポリフェニル分子の三重項エネルギー(T1)
【表1】

【0037】
これは、ポリ(p−フェニル)分子では共役系は最長分子軸に沿って非局在化し、m−ポリフェニル分子では全てのビフェニル構造の構成で三重項状態が局在化するということを示したポリフェニル分子に関する研究と一致した(Higuchi、J.らJ.Phys.Chem.A2001、105、6084;およびHiguchi、J.らJ.Phys.Chem.A2002、106、8609)。
【0038】
この点において、フルオレンおよびカルバゾールの三重項エネルギー(それぞれ2.95eVおよび3.05eVである)はビフェニルの三重項エネルギーよりも大きいことを示しているのは興味深い。しかしながら、上述したカルバゾール誘導体を基本構成要素とする[3、3’]−ビカルバゾリルでは、三重項エネルギー(2.75eV)がビフェニルの三重項エネルギー値の近くまで減少した(表2参照)。
【0039】
表2
フルオレン、カルバゾール、および[3、3’]−ビカルバゾリルの三重項エネルギー(T1)
【表2】

【0040】
これは[3、3’]−ビカルバゾリルの三重項励起子はカルバゾールの三重項励起子よりも非局在化しているということだけではなく、三重項励起子の大部分は二つのカルバゾールユニット間で共有されているビフェニル構造上で非局在化しているということを示している。このことは、三重項エネルギーがモノマーから二量体になると変化するが、二量体から三量体になる場合は一定の値を保つことから説明される(Brunner、K.らJ.Am.Chem.Soc.2004、126、6035;およびvAnDijken、A.らJ.Am.Chem.Soc.2004、126、7718)。
【0041】
カルバゾール誘導体である[3、3’]−ビカルバゾリルの基本構成要素の化学構造を以下に示す。三重項波動関数が局在化しているおおよその場所を波線で示す。
【0042】
【化6】

【0043】
三重項エネルギーを増加させるためには、ビフェニル構造上の三重項波動関数を局在化させなければならない。本発明によれば、これは、二つのカルバゾールユニットが結合しているポリマー骨格中にねじれ(twists)を導入することで実現される。
【0044】
本発明による高分子カルバゾール化合物は化学式(I)のモノマーユニットを備える。
-(C1)-(C2)x-(C3)y-(P)n- (I)
式中、
xおよびyは0または1であり、
nは0または0よりも大きい整数であり、
C1は次式(II)の化合物であり、
【0045】
【化7】

(II)
C2は次式(III)の化合物であり、
【0046】
【化8】

(III)
C3は次式(IV)の化合物であり、
【0047】
【化9】

(IV)
Pは次式(V)の化合物であり、
【0048】
【化10】

(V)
R1、R2、R3、R4、R6、R7、R8、R9、R11、R12、R13、R14、R16、R17、R18およびR19はHまたはねじれ誘導置換基でもよい。
【0049】
どのような置換の組み合わせもで本発明の範囲内の所望の三重項エネルギー増加につながることが分かる。
【0050】
本発明によって示唆されたようにカルバゾール骨格上に置換基を導入すると、隣接した二つのカルバゾール骨格間に、立体的な障害のために、ねじれが誘発される。このねじれの結果、共役量、つまり三重項励起状態の非局在化量、が減少する。これによってポリマーの三重項エネルギーが増加することにつながる(つまり、ポリマーの三重項エネルギーがカルバゾール骨格単一の三重項エネルギーに近づく)。
【0051】
ポリマーLEDでは、ポリマーのイオン化ポテンシャルは、好ましくは陽極の仕事関数よりも小さくなるべきである。この状態で、デバイスが順バイアスされている場合には、正孔が陽極からポリマーに注入する際の障壁がないことになる。エネルギー準位スキームを構築する場合に、この条件はポリマーのHOMO準位は好ましくは陽極のフェルミ準位よりも大きいエネルギー準位であるべきだということを意味する(このエネルギー準位は通常真空準位である0に対してマイナスの値で表現される)。
【0052】
カルバゾールをベースにするポリマーの三重項エネルギーを増加させるために置換基を用いた場合に、その同じポリマーのHOMO準位を、陽極から正孔がこれ以上注入されることが不可能なほど、シフトさせることになってはならない。一方、このことは必ずしも、置換基を用いることがHOMO準位に全く影響を与えるべきではないということを意味していない。ここで重要な点は、陽極のフェルミ準位(仕事関数)とポリマーのHOMO準位(イオン化ポテンシャル)とのエネルギー差である。
【0053】
本発明につながる研究において、発明者達は、他の置換基、例えばアルキル基の場合には、HOMO準位をかなり負の値にシフトさせるのだが、驚いたことにある置換基はHOMO準位の位置に影響を及ぼさないことを見出した。特に、次の基は、本発明によるねじれ誘導置換基として使用可能である:
−OR41、−OR42、−SR41、−SR42、−NR41R45、または−NR42R45
R41は炭素数1〜20の環式または非環式で直鎖または分岐アルキルであり、−O−、−OC(=O)−、−C(=O)O−、−S−、第二級窒素、第三級窒素、第四級窒素、−CR45=CR46−、−C≡C−、−C(=O)−、−C(=O)NR45−、−NR45C(=O)−、−S(=O)−、−S(=O)2−、または−X6−で一回以上分断されていてもよく、および/または一回以上R42、R57、またはR58で置換されていてもよく、
R42は炭素数5〜30のアリールであり、この中で、一つ以上の芳香族炭素原子はN、OまたはSで置換されていてもよく、一つ以上の芳香族炭素原子はR41、R57、またはR58基を有していてもよく、
R57は−CN、−CF3、−CSN、−NH2、−NO2、−NCO、−NCS、−OH、−F、−PO2、−PH2、−SH、−Cl、−Br、または−Iであり、
R58は−C(=O)R45、−C(=O)OR45、−C(=O)NR45R46、−NHR45、−NR45R46、−N(+)R45R46R47、−NC(=O)R45−、−OR45、−OC(=O)R45、−SR45、−S(=O)R45、または−S(=O)2R45であり、
R45、R46、およびR47はそれぞれの出現毎に同一または異なる、H、R41、またはR42であり、
X6は炭素数4〜30のアリーレンであり、この中で、一つ以上の芳香族炭素原子はN、OまたはSで置換されていてもよく、一つ以上の芳香族炭素原子はR41、R57、またはR58基を有していてもよい。
【0054】
−OR41基、すなわちアルコキシ基、特にメトキシおよび/または3、7−ジメチルオクチルオキシは、好ましいねじれ誘導置換基である。
【0055】
化学式C1、C2およびC3では、R5、R10、およびR15はそれぞれの出現毎に同一であっても異なってもよく、上で定義されたR41およびR42から選択されてもよい。
【0056】
本発明の好ましい高分子カルバゾール化合物は次の化学式NK938、NK921およびNK957のモノマーユニットを備える。
【0057】
【化11】

【0058】
特許請求の範囲および明細書全体から明らかなように、モノマー(I)中に共役があってはならないし、モノマー(I)とモノマー(I)に隣り合うポリマー鎖中のモノマーとの間にも共役があってはならない。
【0059】
本発明で開示された実施例では化学式(I)のモノマーだけを含むポリマーを開示しているが、本発明による高分子カルバゾール化合物は他のモノマーを含むことが可能だということが理解される。この種の他のモノマーが共役化合物そのものである場合には、これらのモノマーおよびモノマー(I)間の共役は、それらの間にねじれを導入することで、中断されるべきである。実際、これらの他の共役モノマーはフェニル環を介してモノマー(I)へ結合されるだろう。このフェニル環は、どのような共役化合物の一部であってもよい。この場合、モノマー(I)(一端はR1またはR2であり、他端は、x、y、およびnに依存して、R3またはR4、R8またはR9、R13またはR14、R18またはR19である)のそれぞれの末端における少なくとも一つの置換基は、ねじれ誘導置換基でなければならない。
【0060】
本発明による高分子カルバゾール化合物は、ルミネッセント発光材、すなわちリン光放出材および蛍光放出材の両方におけるホスト材料として使用することに非常に適している。特に、リン光放出材用のホスト材料として使用することに適している。
【0061】
本発明は、有機エレクトロルミネッセント材料に基づくどのような用途でも実施可能であり、特に照明用途(例えば広域の照明設備)に適用できる。
【実施例】
【0062】
以下の実施例1および2では、ポリマー骨格中に所望のねじれを招く二つの具体的な方法が記載されている。これらの実施例で紹介される具体的なねじれ誘導置換基、すなわちメトキシおよび3、7−ジメチルオクチルオキシは、上で定義した他のどのようなねじれ誘導側置換基でも置換可能であろうことが理解される。特に、他のどのようなねじれ誘導アルコキシ基を使用してもよい。さらに、ねじれ誘導置換基の数および位置は実施例で示されるものに限定されない。
【0063】
実施例1
ねじれ誘導置換基
カルバゾールユニットが[3,3’]位置を介して結合されている同一のカルバゾールを主成分とした骨格を持つ二つのポリマーNK351とNK921を比較した図で原理を示す。これら二つのポリマーで唯一異なるのは、NK921では[2,2’]位置の幾つかでメトキシユニット(OMe)を有することである。これらの基では、二つのカルバゾールユニットがお互いの波動関数の重なりが減少するようにねじれる。
【0064】
このねじれの結果、三重項エネルギーはNK351における2.56eVからNK921における2.73eVへ増加する(表3参照)。これらの値は下限値であるように見え、77K(ケルビン)の固体フィルムに記録した。さらに、半波酸化電位は、ポリマー骨格中にこの特別なひねりを導入した結果、ほとんど増加しなかった。これは、電荷を注入するために使用されるHOMO準位がシフトすることなく三重項エネルギーが増加したことを示す。全ての酸化は可逆である。
【0065】
図2は、77K(ケルビン)におけるポリマーNK921(波線)およびNK351(実線)のリン光スペクトルを示す。最低励起三重項準位の位置を波線で示す。
【0066】
表3
化学構造、三重項エネルギー(T1)、およびNK351およびNK921の半波酸化電位(EOX1/2)
【表3】

【0067】
実施例2
主鎖に取り込まれたねじれ誘導分子
カルバゾール主鎖は主鎖にねじれを誘導する分子を取り込むことでもねじられ得る.この原理を以下に図示する。
【0068】
【化12】

NK938の化学構造
【0069】
アルコキシ置換フェニルを二つ連続した[3,3’]−ビカルバゾリルユニット間に挿入する。この取り組みは三重項エネルギーに関してはこれまでの取り組みと同一の結果になるが、生成に関してはある程度有利になる。重合前にカルバゾール主鎖ポリマーのモノマーである[3,3’]−ビカルバゾリルを生成する。これらのモノマーはでされたアルコキシ置換フェニル基を介して結合しており、これを合成するのは[3,3’]−ビカルバゾリルを直接結合するよりも容易である。
【0070】
結果
三重項エネルギーが増加すると、青色デバイスのエレクトロルミネッセンス効率で直ちに確認できる。このデバイスは青色リン光放出材ADS065BE(American Dye Source,Inc.)が質量比20%で分散されたホストポリマー(ここに記載されているカルバゾールポリマーおよび特許文献1に記載された“ねじれ”てはいないポリマー)を含む。この層はITO/PEDOT:PSS陽極とATPBI/LiF/Al陰極とで挟まれている。ねじれのないホストポリマーに比べてポリマー骨格のねじれを導入する第一または第二の方法では、光放出開始電圧を増加させることなく、4から8倍効率が増加した(図4)。
【0071】
図3は青色リン光放出材ADS065BE(American Dye Source,Inc.)が質量比20%で分散されたNK957の正規化されたエレクトロルミネッセンススペクトラムを示す。このデバイスの構造はITO/PEDOT:PSS(200nm)/NK957+ADS065BE(80nm)/TPBI(30nm)/LiF(5nm)/Al(100nm)である。
【0072】
実験
半波酸化電位は、サイクリック・ボルタンメトリー(CV)測定で決定した。CV測定は、支持電解質として1M(モル)ヘキサフルオロリン酸テトラブチルアンモニウムを含むジクロロメタン中で記録した。作用電極として白金円板(0.2cm2)、対電極として白金板(0.5cm2)、およびFc(フェロセン)/Fc+対で較正した飽和Ag/AgCl電極を参照電極として使用した。三重項準位はリン光測定で決定された。放出スペクトルは77K(ケルビン)にてEdinburgh900分光蛍光光度計で記録した。蛍光からリン光を区別するためにゲートの有無でスペクトルを記録した。ゲート遅延はゲート幅9msで500μsである。リン光スペクトラム中の最高エネルギーピークはS0ν=0←T1ν=0遷移で得られた。ねじれ骨格を有するいくつかのカルバゾールベースホストポリマーを表4にまとめた。
【0073】
表4
ねじれ骨格を有するカルバゾールベースのいくつかのホストポリマーの概要
【表4】

【0074】
合成手順
【化13】

【0075】
[参考実施例1]2,5−ジヨード−4−(3,7−ジメチルオクチルオキシ)アニソール
25.0g(95mmol)の4−(3,7−ジメチルオクチルオキシ)アニソール、28g(111mmol)のヨウ素並びに8.2g(38mmol)のKIO3を含む500mlの酢酸、40mlの水および10mlの濃H2SO4の混合物をアルゴンで充満させ、還流温度で16時間加熱させた。混合物を室温まで冷却させた。水/ジエチルエーテルおよび飽和NA2CO3(水溶液.)/ジエチルエーテルを別々に使用して生成物を抽出した。有機層を乾燥させ(MgSO4)、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、90/10、体積/体積)後に、34g(70%)の生成物が得られた。
【0076】
1HNMR(CDCl3):δ7.23(s、1H)、7.22(s、1H)、4.0(t、J=6.5Hz、2H)、3.83(s、3H)、1.93−1.15(m、10H)、0.98(d、J=6.5Hz、3H)、0.90(d、J=6.5Hz、6H)。
13CNMR(CDCl3):δ153、153、123、121、86、85、69、57、39、37、36、30、28、25、23、23、20。
【0077】
【化14】

【0078】
[参考実施例2]4,4’−ジメトキシ−2−ニトロ−1,1’−ビフェニル
14.9g(64mmol)の4−ブロモ−3−ニトロアニソール、18g(77mmol)の4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)アニソール、70mlのトルエンおよび70mlの2M炭酸カリウム(水溶液)の混合物を含むフラスコを3回排気し、アルゴンを充満させ、その後2mol%のPd(PPh3)4を加えた。排気とアルゴンの充満をもう一度繰り返し、環流温度で60時間その混合物を攪拌した。混合物を室温まで冷却させ、有機層を分離し、乾燥させ(MgSO4)、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、50/50、体積/体積)後に、12.0g(72%)の生成物が得られた。
【0079】
1HNMR(CDCl3):δ7.33(s、J=1.5Hz、1H)、7.32(d、J=8Hz、1H)、7.20(d、J=8Hz、2H)、7.12(dd、J=1.5Hz、J=8Hz、1H)、6.93(d、J=8Hz、2H)、3.88(s、3H)、3.83(s、3H)。
13CNMR(CDCl3):δ159、159、149、132、129、129、128、119、114、109、56、55。
mp:138℃。
【0080】
【化15】

【0081】
[参考実施例3]2,7−ジメトキシカルバゾール
10g(38.6mmol)の4,4’−ジメトキシ−2−ニトロ−1,1’−ビフェニルを35mlの亜リン酸トリエチル中で16時間還流させる。混合物を室温まで冷却させ、そこに生成物を沈殿させる。濾過すると6.5g(74%)の白色固体が得られた。
【0082】
1HNMR(DMSO−d6):δ11.00(s、1H)、7.85(d、J=8Hz、2H)、6.94(d、J=1.5Hz、2H)、6.74(dd、J=1.5Hz、J=8Hz、2H)、3.82(s、6H)。
13CNMR(DMSO−d6):δ157、141、119、116、107、94、55。
mp:285℃。
【0083】
【化16】

【0084】
[参考実施例4]3,6−ジブロモ−2,7−ジメトキシカルバゾール
アルミニウム箔で覆ったフラスコで、1.48g(6.5mmol)2,7−ジメトキシカルバゾールを60mlのテトラヒドロフラン中で攪拌した溶液を0℃まで冷却させた。2.3g(13mmol)のN−ブロモスクシンイミドを少しずつ添加した。混合物を室温で一晩放置させた。THFを蒸発させ、生成物を更に精製することなく使用した。
【0085】
1HNMR(DMSO−d6):δ11.30(s、1H)、8.30(s、2H)、7.13(s、2H)、3.90(s、6H)。
13CNMR(DMSO−d6):δ153、140、123、116、102、94、56。
【0086】
【化17】

【0087】
[参考実施例5]3,6−ジブロモ−9−(3,7−ジメチルオクチル)−2,7−ジメトキシカルバゾール
2.5g(6.5mmol)の3,6−ジブロモ−2,7−ジメトキシカルバゾールおよび40mgのベンジルトリエチルアンモニウムクロリドを10mlのトルエン中で攪拌した溶液を滴下で3.8gの50質量%NaOH(水溶液)へ添加した。それから1.7g(7.7mmol)の3,7−ジメチルオクチルブロマイドを滴下で添加した。全て添加した後に、反応混合物を6時間還流加熱させた。有機層を分離し、飽和Na2CO3(水溶液)で洗浄し、MgSO4で乾燥させ、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン/Et3N、80/20/1、体積/体積/体積)後に、結晶化させ(ジクロロメタン/エタノール)、2.1g(61%)の白色固体が得られた。
【0088】
1HNMR(CDCl3):δ8.10(s、2H)、6.84(s、2H)、4.26(t、J=8Hz、2H)、4.03(s、6H)、1.98−1.150(m、10H)、1.07(d、J=6.5Hz、3H)、0.88(d、J=6.5Hz、6H)。
13CNMR(CDCl3):δ154、140、124、117、103、92、56、41、39、37、35、31、28、25、23、23、20。
mp:113℃。
【0089】
【化18】

【0090】
[参考実施例6]4’−メトキシ−2−ニトロ−1,1’−ビフェニル
10.7g(53mmol)の1−ブロモ−2−ニトロベンゼン、14.9g(64mmol)の4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)アニソール、70mlのトルエンおよび70mlの2M炭酸カリウム(水溶液)の混合物を含むフラスコを3回排気し、アルゴンを充満させ、その後2mol%のPd(PPh3)4を添加した。排気とアルゴンの充満をもう一度繰り返し、環流温度で48時間その混合物を攪拌した。混合物を室温まで冷却させ、有機層を分離し、乾燥させ(MgSO4)、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、60/40、体積/体積)後に、8.5g(70%)の生成物が得られた。
【0091】
1HNMR(CDCl3):δ7.84(dd、J=1.5Hz、J=8Hz、1H)、7.62(dt、J=1.5Hz、J=8Hz、1H)、7.48(dd、J=1.5Hz、J=8Hz、1H)、7.46(dt、J=1.5Hz、J=8Hz、1H)、7.29(d、J=8Hz、2H)、7.00(d、J=8Hz、2H)、3.82(s、3H)。
13CNMR(CDCl3):δ159、136、132、132、129、129、128、124、114、55。
【0092】
【化19】

【0093】
[参考実施例7]2−メトキシカルバゾール
8.36g(36.7mmol)の4’−メトキシ−2−ニトロ−1,1’−ビフェニルを40mlの亜リン酸トリエチル中で6時間還流した。混合物を室温まで冷却させ、そこに生成物を沈殿させる。濾過すると6.67g(93%)の白色固体が得られる。
【0094】
1HNMR(DMSO−d6):δ11.10(s、1H)、8.00(dd、J=1.5Hz、J=8Hz、1H)、7.8(d、J=8Hz、1H)、7.44(dd、J=1.5Hz、J=8Hz、1H)、7.30(dt、J=1.5Hz、J=8Hz、1H)、7.12(dt、J=1.5Hz、J=8Hz、1H)、6.98(d、J=1.5Hz、1H)、6.78(dd、J=1.5Hz、J=8Hz、1H)、3.83(s、3H)。
13CNMR(DMSO−d6):δ158、141、140、124、123、121、119、118、116、111、108、94、55。
mp:239℃。
【0095】
【化20】

【0096】
[参考実施例8]3−ブロモ−2−メトキシカルバゾール
アルミニウム箔で覆ったフラスコで、6.62g(33.6mmol)の2−メトキシカルバゾールを150mlのテトラヒドロフラン中で攪拌した溶液を0℃まで冷却させた。5.38g(30.2mmol)のN−ブロモスクシンイミドを少しずつ添加した。混合物を室温で一晩放置させた。THFを蒸発させ、生成物を更に精製することなく使用した。
【0097】
1HNMR(DMSO−d6):δ11.30(s、1H)、8.34(s、1H)、8.04(dd、J=1.5Hz、J=8Hz、1H)、7.46(dd、J=1.5Hz、J=8Hz、1H)、7.33(dt、J=1.5Hz、J=8Hz、1H)、7.14(dt、J=1.5Hz、J=8Hz、1H)、7.14(s、1H)、3.93(s、3H)。
13CNMR(DMSO−d6):δ153、140、139、124、124、122、120、119、116、110、101、95、56。
【0098】
【化21】

【0099】
[参考実施例9]3−ブロモ−9−(3,7−ジメチルオクチル)−2−メトキシカルバゾール
7.16g(26mmol)の3−ブロモ−2−メトキシカルバゾールおよび0.17gのベンジルトリエチルアンモニウムクロリドを25mlのトルエン中で攪拌した溶液を滴下で15gの50質量%NaOH(水溶液)へ添加した。それから6.9g(31mmol)の3,7−ジメチルオクチルブロマイドを滴下で添加した。完全に添加した後に、反応混合物を16時間還流加熱させた。有機層を分離し、水で洗浄し、MgSO4で乾燥させ、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、80/20、体積/体積)後に、9.3g(76%)の生成物が得られた。
【0100】
1HNMR(CDCl3):δ8.24(s、1H)、8.00(dd、J=1.5Hz、J=8Hz、1H)、7.42(dt、J=1.5Hz、J=8Hz、1H)、7.38(dd、J=1.5Hz、J=8Hz、1H)、7.24(dt、J=1.5Hz、J=8Hz、1H)、6.88(s、1H)、4.27(t、J=8Hz、2H)、4.03(s、3H)、1.98−1.10(m、10H)、1.05(d、J=6.5Hz、3H)、0.88(d、J=6.5Hz、6H)。
13CNMR(CDCl3):154、140、140、125、125、122、120、119、118、109、103、92、56、41、39、37、35、31、25、23、23、20。
mp:55℃。
【0101】
【化22】

【0102】
[参考実施例10]9−(3,7−ジメチルオクチル)−2−メトキシ−3−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)カルバゾール
75mlのテトラヒドロフラン中に5.6g(13mmol)の3−ブロモ−9−(3,7−ジメチルオクチル)−2−メトキシカルバゾールを溶解した溶液を−78℃まで冷却させた。7ml(18mmol)の2.5Mn−ブチルリチウムを滴下で添加した。1時間後、3.4ml(16mmol)の2−イソプロポキシ−4,4,5,5−テトラメチル−1,3,2−ジオキサボロランを滴下で添加した。反応混合物を室温で一晩放置させた。THFを蒸発させ、ジエチルエーテルおよび水で抽出して生成物を精製した。有機層を乾燥させ(MgSO4)、ろ過し、濃縮した。5.9g(95%)の生成物を更に精製することなく使用した。
【0103】
1HNMR(CDCl3):δ8.46(s、1H)、8.06(dd、J=1.5Hz、J=8Hz、1H)、7.38(dt、J=1.5Hz、J=8Hz、1H)、7.37(dd、J=1.5Hz、J=8Hz、1H)、7.24(dt、J=1.5Hz、J=8Hz、1H)、6.80(s、1H)、4.27(t、J=8Hz、2H)、3.95(s、3H)、1.95−1.10(m、10H)、1.40(s、12H)、1.05(d、J=6.5Hz、3H)、0.88(d、J=6.5Hz、6H)。
13CNMR(CDCl3):164、144、140、130、124、123、120、119、116、108、91、83、56、41、39、37、35、31、31、28、25、24、22、22、20、14。
【0104】
【化23】

【0105】
[参考実施例11]9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ジメトキシ−3,3’−ビカルバゾリル
2.7g(6.5mmol)の3−ブロモ−9−(3,7−ジメチルオクチル)−2−メトキシカルバゾール、3.0g(6.5mmol)の9−(3,7−ジメチルオクチル)−2−メトキシ−3−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)カルバゾール、10mlのトルエンおよび10mlの2M炭酸カリウム(水溶液)の混合物を含むフラスコを3回排気し、アルゴンを充満させ、その後2mol%のPd(PPh3)4を添加した。排気とアルゴンの充満をもう一度繰り返し、還流温度で20時間その混合物を攪拌した。混合物を室温まで冷却させ、有機層を分離し、乾燥させ(MgSO4)、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、70/30、体積/体積)および結晶化(エタノール)後に、1.9g(44%)の生成物が得られた。
【0106】
1HNMR(CDCl3):δ8.05(s、2H)、8.03(dd、J=1.5Hz、J=8Hz、2H)、7.43(dt、J=1.5Hz、J=8Hz、2H)、7.42(dd、J=1.5Hz、J=8Hz、2H)、7.23(dt、J=1.5Hz、J=8Hz、2H)、6.95(s、2H)、4.37(t、J=8Hz、4H)、3.95(s、6H)、2.03−1.15(m、20H)、1.07(d、J=6.5Hz、6H)、0.88(d、J=6.5Hz、12H)。
13CNMR(CDCl3):δ157、141、140、124、123、121、120、119、116、108、91、56、41、39、37、36、31、28、25、23、23、20。
mp:139℃。
【0107】
【化24】

【0108】
[参考実施例12]6,6’−ジブロモ−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ジメトキシ−3,3’−ビカルバゾリル
アルミニウム箔で覆ったフラスコで、0.5g(0.74mmol)の9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ジメトキシ)−3,3’−ビカルバゾリルを5mlのテトラヒドロフラン中で攪拌した溶液を0℃まで冷却させた。0.25g(1.4mmol)のN−ブロモスクシンイミドを少しずつ添加した。混合物を室温で一晩放置させた。THFを蒸発させた。ジクロロメタンおよび飽和Na2CO3(水溶液)で抽出後、0.57g(98%)の生成物が得られた。これを更に精製することなく使用した。
【0109】
1HNMR(CDCl3):δ8.10(d、J=1.5Hz、2H)、7.96(s、2H)、7.49(dd、J=1.5Hz、J=8Hz、2H)、7.25(d、J=8Hz、2H)、6.94(s、2H)、4.30(t、J=8Hz、4H)、3.95(s、6H)、2.00−1.15(m、20H)、1.10(d、J=6.5Hz、6H)、0.88(d、J=6.5Hz、12H)。
13CNMR(CDCl3):δ158、141、139、127、125、123、122、121、115、112、110、91、56、41、39、37、35、31、28、25、23、23、20。
【0110】
【化25】

【0111】
[参考実施例13]6,6’−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ジメトキシ−3,3’−ビカルバゾリル
40mlのテトラヒドロフラン中に5.62g(6.8mmol)の6,6’−ジブロモ−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ジメトキシ−3,3’−ビカルバゾリルを溶解した溶液を−78℃まで冷却させた。6.2ml(15.5mmol)の2.5Mn−ブチルリチウムを滴下で添加した。1時間後、3.0ml(15mmol)の2−イソプロポキシ−4,4,5,5−テトラメチル−1,3,2−ジオキサボロランを滴下で添加した。反応混合物を室温で一晩放置させた。THFを蒸発させ、ジエチルエーテルおよび水で抽出して生成物を精製した。有機層を乾燥させ(MgSO4)、ろ過し、濃縮した。ジクロロメタン/エタノールからいくらか結晶化させ、3.8g(61%)の白色固体の生成物が得られた。
【0112】
1HNMR(CDCl3):δ8.54(d、J=1.5Hz、2H)、8.10(s、2H)、7.88(dd、J=1.5Hz、J=8Hz、2H)、7.38(d、J=8Hz、2H)、6.97(s、2H)、4.32(t、J=8Hz、4H)、3.94(s、6H)、2.02−1.00(m、20H)、1.38(s、24H)、1.10(d、J=6.5Hz、6H)、0.88(d、J=6.5Hz、12H)。
13CNMR(CDCl3):δ157、143、141、131、127、124、123、121、116、108、91、83、56、41、39、37、36、31、28、25、25、23、20。
【0113】
【化26】

【0114】
[参考実施例14]4’−(3,7−ジメチルオクチルオキシ)−2−ニトロ−1,1’−ビフェニル
11.2g(55mmol)の1−ブロモ−2−ニトロベンゼン、23.9g(66mmol)の1−(3,7−ジメチルオクチルオキシ)−4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)ベンゼン、60mlのトルエンおよび60mlの2M炭酸カリウム(水溶液)の混合物を含むフラスコを3回排気し、アルゴンを充満させ、その後2mol%のPd(PPh3)4を添加した。排気とアルゴンの充満をもう一度繰り返し、環流温度で60時間その混合物を攪拌した。混合物を室温まで冷却させ、水を添加した。有機層を分離し、乾燥させ(MgSO4)、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、80/20、体積/体積)後に、12.9g(66%)の生成物が得られた。
【0115】
1HNMR(CDCl3):δ7.80(dd、J=1.5Hz、J=8Hz、1H)、7.58(dt、J=1.5Hz、J=8Hz、1H)、7.44(dd、J=1.5Hz、J=8Hz、1H)、7.43(dt、J=1.5Hz、J=8Hz、1H)、7.25(d、J=8Hz、2H)、6.96(d、J=8Hz、2H)、4.02(t、J=8Hz、2H)、1.90−1.13(m、10H)、0.97(d、J=6.5Hz、3H)、0.88(d、J=6.5Hz、6H)。
13CNMR(CDCl3):δ159、136、132、132、129、129、128、124、115、66、39、37、36、30、28、25、23、23、20。
【0116】
【化27】

【0117】
[参考実施例15]2−(3,7−ジメチルオクチルオキシ)カルバゾール
33mlの亜リン酸トリエチル中で13g(36.6mmol)の4’−(3,7−ジメチルオクチルオキシ)−2−ニトロ−1,1’−ビフェニルを16時間還流させる。混合物を室温まで冷却させた。亜リン酸トリエチルの蒸発後に、10.5g(89%)の白色固体の生成物が得られた。
【0118】
1HNMR(DMSO−d6):δ11.0(s、1H)、7.95(d、J=8Hz、1H)、7.92(d、J=8Hz、1H)、7.39(d、J=8Hz、1H)、7.25(t、J=8Hz、1H)、7.17(t、J=8Hz、1H)、6.93(d、J=1.5Hz、1H)、6.73(dd、J=1.5Hz、J=8Hz、1H)、4.02(t、J=8Hz、2H)、1.80−1.10(m、10H)、0.92(d、J=6.5Hz、3H)、0.82(d、J=6.5Hz、6H)。
13CNMR(DMSO−d6):δ158、141、140、124、123、121、119、118、116、111、108、95、66、39、37、36、29、27、24、23、23、20。
mp:188℃。
【0119】
【化28】

【0120】
[参考実施例16]3−ブロモ−2−(3,7−ジメチルオクチルオキシ)カルバゾール
アルミニウム箔で覆ったフラスコで、10.5g(32.5mmol)の2−(3,7−ジメチルオクチルオキシ)カルバゾールを40mlのテトラヒドロフラン中で攪拌した溶液を0℃まで冷却させた。5.20g(29.2mmol)のN−ブロモスクシンイミドを少しずつ添加した。混合物を室温で一晩放置させた。THFを蒸発させ、生成物を更に精製することなく使用した。
【0121】
1HNMR(DMSO−d6):δ11.20(s、1H)、8.33(s、1H)、8.05(dd、J=1.5Hz、J=8Hz、1H)、7.46(dd、J=1.5Hz、J=8Hz、1H)、7.33(dt、J=1.5Hz、J=8Hz、1H)、7.14(dt、J=1.5Hz、J=8Hz、1H)、7.14(s、1H)、4.15(t、J=8Hz、2H)、1.95−1.10(m、10H)、0.98(d、J=6.5Hz、3H)、0.83(d、J=6.5Hz、6H)。
13CNMR(DMSO−d6):153、140、140、125、122、120、119、117、111、111、102、96、67、39、37、36、29、27、24、23、23、20。
【0122】
【化29】

【0123】
[参考実施例17]3−ブロモ−9−(3,7−ジメチルオクチル)−2−(3,7−ジメチルオクチルオキシ)カルバゾール
13g(32.3mmol)の3−ブロモ−2−(3,7−ジメチルオクチルオキシ)カルバゾールおよび0.2gのベンジルトリエチルアンモニウムクロリドを35mlのトルエン中で攪拌した溶液に20gの50質量%NaOH(水溶液)を滴下で添加した。それから8.6g(38.9mmol)の3,7−ジメチルオクチルブロマイドを滴下で添加した。完全に添加した後に、反応混合物を60時間還流加熱させた。有機層を分離し、水で洗浄し、MgSO4で乾燥させ、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、80/20、体積/体積)後に、10.1g(57%)の淡黄色の油が得られた。
【0124】
1HNMR(CDCl3):δ8.23(s、1H)、7.99(dd、J=1.5Hz、J=8Hz、1H)、7.41(dt、J=1.5Hz、J=8Hz、1H)、7.38(dd、J=1.5Hz、J=8Hz、1H)、7.23(dt、J=1.5Hz、J=8Hz、1H)、6.87(s、1H)、4.30−4.12(m、4H)、2.07−1.10(m、20H)、1.07(d、J=6.5Hz、3H)、1.03(d、J=6.5Hz、3H)、0.92(d、J=6.5Hz、6H)、0.88(d、J=6.5Hz、6H)。
13CNMR(CDCl3):δ154、140、140、125、124、122、120、119、117、108、103、93、67、41、39、37、37、36、35、31、30、28、28、26、25、25、23、23、20。
【0125】
【化30】

【0126】
[参考実施例18]9−(3,7−)−2−(3,7−ジメチルオクチルオキシ)−3−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)カルバゾール
4.81g(9mmol)の3−ブロモ−9−(3,7−ジメチルオクチル)−2−(3,7−ジメチルオクチルオキシ)カルバゾールを40mlのテトラヒドロフラン中で溶解した溶液を−78℃まで冷却させた。4.6ml(11.5mmol)の2.5Mn−ブチルリチウムを滴下で添加した。1時間後に、2.2ml(10.8mmol)の2−イソプロポキシ−4,4,5,5−テトラメチル−1,3,2−ジオキサボロランを滴下で添加した。反応混合物を室温で一晩放置させた。
【0127】
THFを蒸発させ、ジエチルエーテルおよび水で抽出して生成物を精製した。有機層を乾燥させ(MgSO4)、ろ過し、濃縮した。3.7g(70%)の生成物を更に精製することなく使用した。
【0128】
1HNMR(CDCl3):δ8.42(s、1H)、8.06(dd、J=1.5Hz、J=8Hz、1H)、7.38(dt、J=1.5Hz、J=8Hz、1H)、7.37(dd、J=1.5Hz、J=8Hz、1H)、7.24(dt、J=1.5Hz、J=8Hz、1H)、6.80(s、1H)、4.28(t、J=8Hz、2H)、4.18(t、J=8Hz、2H)、1.98−1.10(m、20H)、1.05(d、J=6.5Hz、3H)、1.01(d、J=6.5Hz、3H)、0.98(d、J=6.5Hz、6H)、0.97(d、J=6.5Hz、6H)。
13CNMR(CDCl3):δ163、144、140、129、124、123、120、119、116、108、92、83、67、41、39、37、37、36、35、31、30、28、28、26、25、25、23、23、20。
【0129】
【化31】

【0130】
[参考実施例19]9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ビス(3,7−ジメチルオクチルオキシ)−3,3’−ビカルバゾリル
0.5g(0.9mmol)の3−ブロモ−9−(3,7−ジメチルオクチル)−2−(3,7−ジメチルオクチルオキシ)カルバゾール、0.65g(1.1mmol)の9−(3,7−ジメチルオクチル)−2−(3,7−ジメチルオクチルオキシ)−3−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)カルバゾール、5mlのトルエンおよび5mlの2M炭酸カリウム(水溶液)の混合物を含むフラスコを3回排気し、アルゴンを充満させ、その後2mol%のPd(PPh3)4を添加した。排気とアルゴンの充満をもう一度繰り返し、105℃で48時間その混合物を攪拌した。混合物を室温まで冷却させ、有機層を分離し、乾燥させ(MgSO4)、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、80/20、体積/体積)後に、0.55g(65%)の生成物が得られた。
【0131】
1HNMR(CDCl3):δ8.03(s、2H)、7.97(dd、J=1.5Hz、J=8Hz、2H)、7.41−7.36(m、4H)、7.21−7.14(m、2H)、6.91(s、2H)、4.30(t、J=8Hz、4H)、4.07(t、J=8Hz、4H)、1.98−1.00(m、40H)、1.10(d、J=6.5Hz、6H)、0.85(d、J=6.5Hz、12H)、0.80(d、J=6.5Hz、6H)、0.78(d、J=6.5Hz、12H)。
13CNMR(CDCl3):δ157、141、140、124、123、122、119、119、116、108、92、67、41、39、39、37、37、36、36、31、30、28、28、25、23、23、23、20、20。
【0132】
【化32】

【0133】
[参考実施例20]6,6’−ジブロモ−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ビス(3,7−ジメチルオクチルオキシ)−3,3’−ビカルバゾリル
アルミニウム箔で覆ったフラスコで、0.42g(0.45mmol)の9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ビス(3,7−ジメチルオクチルオキシ)−3,3’−ビカルバゾリルを5mlのテトラヒドロフラン中で攪拌させた溶液を0℃まで冷却させた。0.15g(0.84mmol)のN−ブロモスクシンイミドを少しずつ添加した。混合物を室温で一晩放置させた。THFを蒸発させた。ジクロロメタンおよび飽和Na2CO3(水溶液)で抽出後、0.37g(75%)の生成物が得られた。
【0134】
1HNMR(CDCl3):δ8.07(d、J=1.5Hz、2H)、7.98(s、2H)、7.48(dd、J=1.5Hz、J=8Hz、2H)、7.24(d、J=8Hz、2H)、6.91(s、2H)、4.30(t、J=8Hz、4H)、4.08(t、J=8Hz、4H)、1.98−1.00(m、40H)、1.10(d、J=6.5Hz、12H)、0.88(d、J=6.5Hz、12H)、0.78(d、J=6.5Hz、12H)。
13CNMR(CDCl3):δ157、141、139、127、125、124、122、122、115、112、110、92、67、41、39、39、37、37、36、35、31、30、28、28、25、23、23、23、20、20。
【0135】
【化33】

【0136】
[参考実施例21]6,6’−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ビス(3,7−ジメチルオクチルオキシ)−3,3’−ビカルバゾリル
4.45g(4mmol)の6,6’−ジブロモ−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ビス(3,7−ジメチルオクチルオキシ)−3,3’−ビカルバゾリルを40mlのテトラヒドロフラン中に溶解した溶液を−78℃まで冷却させた。3.8ml(11.5mmol)の2.5Mn−ブチルリチウムを滴下で添加した。1時間後に、1.9ml(9mmol)の2−イソプロポキシ−4,4,5,5−テトラメチル−1,3,2−ジオキサボロランを滴下で添加した。反応混合物を室温で一晩放置させた。THFを蒸発させ、ジエチルエーテルおよび水で抽出して生成物を精製した。有機層を乾燥させ(MgSO4)、ろ過し、濃縮した。ジクロロメタン/メタノールから数回結晶化させ、2.6g(54%)の白色固体の生成物が得られた。
【0137】
1HNMR(CDCl3):δ8.50(d、J=1.5Hz、2H)、8.08(s、2H)、7.84(dd、J=1.5Hz、J=8Hz、2H)、7.36(d、J=8Hz、2H)、6.93(s、2H)、4.32(t、J=8Hz、4H)、4.06(t、J=8Hz、4H)、1.98−1.00(m、40H)、1.38(s、24H)、1.10(d、J=6.5Hz、12H)、0.88(d、J=6.5Hz、12H)、0.83(d、J=6.5Hz、6H)、0.78(d、J=6.5Hz、6H)。
13CNMR(CDCl3):δ157、143、141、131、127、124、123、122、116、108、93、83、41、39、39、37、37、36、35、31、30、28、28、25、25、23、23、23、20、20。
【0138】
【化34】

【0139】
本発明によるモノマーユニットを有する高分子カルバゾール化合物:NK938の実施例1
0.5g(0.54mmol)の6,6’−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ジメトキシ−3,3’−ビカルバゾリルと、0.28g(0.54mmol)の2,5−ジヨード−4−(3,7−ジメチルオクチルオキシ)アニソールとの混合物を25mlのトルエン中で室温にて完全に溶解するまで撹拌させた。脱気し、アルゴンを充満し、2mol%のテトラキス(トリフェニルホスフィン)パラジウム(0)を添加し、その後1.7mlの20重量%テトラエチル水酸化アンモニウム水を添加した。混合物を20時間還流させた。そして、1.0mmolの4,4,5,5−テトラメチル−1,3,2−ジオキサボロリルベンゼン(末端封鎖剤)およびいくらかの未使用の触媒を添加し、その後さらに16時間還流させた。反応混合物を室温まで冷却させた。残留触媒を除去するために、シアン化ナトリウム水で何度か洗浄を行った。それから有機層を乾燥させ、濃縮した。テトラヒドロフランおよびメタノールをそれぞれ使用して何度か分溜と沈殿をさせてポリマーを分離した。収率40%で白色の繊維としてポリマーが得られた。サイズ排除クロマトグラフィでは、分子量が18kg/mol、多分散性が1.8を示した。
【0140】
【化35】

【0141】
本発明によるモノマーユニットを有する高分子カルバゾール化合物:NK921の実施例2
0.5g(0.54mmol)の6,6’−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ジメトキシ−3,3’−ビカルバゾリルと、0.28g(0.54mmol)の3,6−ジブロモ−9−(3,7−ジメチルオクチル)−2,7−ジメトキシカルバゾールとの混合物を10mlのトルエン中で室温にて完全に溶解するまで撹拌させた。脱気をし、アルゴンを充満し、2mol%のテトラキス(トリフェニルホスフィン)パラジウム(0)を添加し、その後1.5mlの20重量%テトラエチル水酸化アンモニウム水を添加した。混合物を40時間還流させた。そして1.0mmolの4,4,5,5−テトラメチル−1,3,2−ジオキサボロリルベンゼン(末端封鎖剤)およびいくらかの未使用の触媒を添加し、その後さらに16時間還流させた。反応混合物を室温まで冷却させた。残留触媒を除去するために、シアン化ナトリウム水で何度か洗浄を行った。それから有機層を乾燥させ、濃縮した。テトラヒドロフランおよびメタノールをそれぞれ使用して何度か分溜と沈殿をさせてポリマーを分離した。白色の繊維としてポリマー0.3gが得られた。サイズ排除クロマトグラフィでは、分子量が11kg/mol、多分散性が1.5を示した。
【0142】
【化36】

【0143】
本発明によるモノマーユニットを有する高分子カルバゾール化合物:NK957の実施例3
1.0g(0.85mmol)の6,6’−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ビス(3,7−ジメチルオクチルオキシ)−3,3’−ビカルバゾリルと、0.45g(0.85mmol)の3,6−ジブロモ−9−(3,7−ジメチルオクチル)−2,7−ジメトキシカルバゾールとの混合物を15mlのトルエン中で室温にて完全に溶解するまで撹拌させた。脱気し、アルゴンを充満し、2mol%のテトラキス(トリフェニルホスフィン)パラジウム(0)を添加し、その後2.4mlの20重量%テトラエチル水酸化アンモニウム水を添加した。混合物を16時間還流させた。そして、1.0mlの4,4,5,5−テトラメチル−1,3,2−ジオキサボロリルベンゼン(末端封鎖剤)およびいくらかの未使用の触媒を添加し、その後さらに40時間還流させた。反応混合物を室温まで冷却させた。残留触媒を除去するために、シアン化ナトリウム水で何度か洗浄を行った。それから有機層を乾燥させ、濃縮した。テトラヒドロフランおよびメタノールをそれぞれ使用して何度か分溜と沈殿をさせてポリマーを分離した。白色の繊維としてポリマー0.68gが得られた。サイズ排除クロマトグラフィでは、分子量が9kg/mol、多分散性が1.6を示した。
【図面の簡単な説明】
【0144】
【図1】ポリマーホストおよびリン光放出材のエネルギー準位スキームを示す図である。
【図2】ポリマーNK921(破線)およびNK351(実線)の77K(ケルビン)におけるリン光スペクトルを示す図である。最低励起三重項準位の位置を破線で示す。
【図3】青色リン光放出材(ADS065BE)を分散した本発明によるホストポリマーNK957のエレクトロルミネッセンススペクトラムを正規化した図を示す。
【図4】本発明によるカルバゾールホストポリマー中に青色リン光放出材を分散させた、NK921[“ねじれた(twisted)ポリマー(方法1)”で示される]、NK938[“ねじれたポリマー(方法2)”で示される]、および従来技術であるカルバゾールホストポリマー[“ねじれていない(non−twisted)ポリマー”で示される]のエレクトロルミネッセンス効率を電圧の関数としてそれぞれ示した図である。
【技術分野】
【0001】
本発明は、高分子カルバゾール化合物、この種の高分子カルバゾール化合物を有する半導体材料、およびこの種の半導体材料を有するエレクトロルミネッセントデバイスに関する。この半導体材料はルミネッセント発光材と組み合わせてもよい。
【0002】
本発明は、半導体材料としてのこの種の化合物の使用ばかりではなく、この種の高分子カルバゾール化合物を生成するプロセスにも関する。半導体材料はルミネッセント発光材に対するホストマトリックスとして使用してもよい。
【背景技術】
【0003】
有機発光ダイオード(OLED)では、電流から光への変換効率は、電子および正孔の再結合効率、および発光化合物の発光量子効率に依存する。最先端技術のデバイスでは、再結合効率は一に近く、すなわち注入された電荷キャリアのほとんど全てがデバイス中で再結合する。この種の再結合で生じた励起状態は一重項状態または三重項状態の何れかになり得る。一重項および三重項という用語は電荷キャリアのスピンモーメントが相互に向き合う配向を示す。
【0004】
室温における大多数の有機材料では、小分子および高分子の両方において、最低励起一重項状態からのみ光を放出する。このプロセスは蛍光と呼ばれている。ほんのわずかの分子が最低励起三重項状態から光を放出する。このプロセスはリン光と呼ばれている。従って、従来のOLEDでは、発光は励起分子の蛍光による。
【0005】
量子スピン状態によれば、電子および正孔の再結合の25%は一重項励起状態を形成することになり、一方75%は三重項励起状態を形成する。従って、従来のOLEDでは内部量子効率は25%に制限される.これは従来のOLEDデバイスに加えられる電力の75%は光を発生するためには使用されないことを意味する。これは、特に自動車用途で考えてみると、容認できないほど高率でエネルギーが無駄になっている。
【0006】
OLEDで形成されるすべての励起状態を光の生成のために使用する明快な方法は、発光層でリン光放出材(三重項発光材またはリン光性金属錯体とも名付けられている)を導入することである(Baldo、M.A.らNature1998、395、151)。これらの放出材では、発光層で形成される三重項および一重項励起の両方を利用するので、すべての励起状態を発光のために使用する。結果として、デバイス効率は著しく向上する。
【0007】
リン光放出材に使用可能な化合物の種類は重金属錯体である。重金属原子が存在すると、この種の錯体の励起状態は一重項−三重項特性が混合したものとなる(いわゆる重原子効果によって)。原理上は、この種の重金属錯体のどの励起状態も光を放出する可能性がある(もちろん、励起状態から無放射減衰する可能性は常にあるので全ての励起状態が光を放出するわけではない)。励起状態は(電子と正孔が順にトラッピングして)重金属錯体上に直接形成されてもよいし、ホストの励起状態からエネルギー遷移を経由して形成されてもよい。ホストの一重項および三重項励起状態の両方から(双極子―双極子相互作用または交換相互作用経由で)重金属錯体へのエネルギー遷移が可能である。
【0008】
リン光放出材は通常ホスト化合物中に分散される。ホスト化合物(小分子または高分子のいずれかからなる)はリン光放出材の固体マトリックスとしての役目を果たす。ホスト化合物は、通常、電荷キャリアを輸送する働きを可能とする(半)導体材料である。
【0009】
小分子に基づく高効率OLED(smOLED)は、ホスト材料に分散したリン光放出材を利用し、ホストおよびリン光放出材の組み合わせは蒸着で多層構造中の一層に適用される。このような系はsmOLEDでは周知であるが、(共役)ポリマーに基づくOLED(pLED)ではあまり知られていない。
【0010】
pLEDにおけるリン光放出材を広く利用することを妨げる主な問題は、好適なホストポリマーがあまりないということであり、特に高エネルギーリン光放出材(すなわち緑色および青色)に好適なホストポリマーがないということである。
【0011】
リン光放出材に対するホスト化合物では、ホストの三重項エネルギーがリン光放出材の三重項エネルギーよりも高くなければならないという重要な条件を満たさなければならない。リン光放出材から効率的なリン光を提供するためには、ホストの最低励起三重項状態がリン光放出材の最低放出状態よりもエネルギーが高くなければならない(図1参照)。エネルギーは系の最低励起状態上に常に存在する(遷移する)ものであることからこの要件が生じる。リン光放出材での発光が求められるので、最低励起状態はホスト化合物ではなくリン光放出材になければならない。
【0012】
図1では、一重項基低状態をS0で示す。すべての励起状態準位のエネルギーは、基低状態のエネルギーに対する相対値で示されている。ポリマーホストに対しては、最低励起一重項(S1)および三重項(T1host)準位のみを示す。リン光放出材に対しては、多くの異なる種類の励起三重項準位を示し、最低励起三重項準位はT1guestで示す。実線矢印は放射過程を示し、一方破線矢印は非放射過程を示す。水平破線矢印はエネルギー遷移過程を示す。この特別な状態では、励起状態エネルギーはポリマーからリン光放出材へ遷移可能である、しかし逆の場合も同じではない。リン光放出材の最低励起状態のエネルギーが、ホストポリマーの最低励起状態のエネルギーよりも低ければ、リン光放出材はホストポリマーからの一重項および三重項励起子の両方を利用することが可能となるので、有機発光ダイオードの効率は100%に高まる。
【0013】
ポリマーOLEDに対するホスト材料としてのカルバゾールに基づく化合物は公知である(特許文献1)。これらのカルバゾール誘導体の最低励起三重項状態のエネルギーは、赤色または緑色リン光放出材に対応するには十分高い。この種のカルバゾールベース(コ)ポリマーに由来する化合物では最大2.6eVまでの三重項エネルギーを有している。多くの用途のためには明らかに青色が必要である。そのためには、エネルギーが2.6eVよりも高い三重項を有するホストポリマーが必要である。青色リン光放出材のホストとなるためには、ホストポリマーの三重項エネルギーは少なくとも2.725eVでなければならない。このことが、ホストの適用範囲を455nm(2.725eV)青色光を放出するリン光放出材に広げる。
【0014】
このように、高エネルギー(すなわち青色)リン光放出材用の新しいホストポリマー材料に対する継続した要求が存在する。
【0015】
【特許文献1】国際公開第2004/055129号
【発明の開示】
【発明が解決しようとする課題】
【0016】
本発明の目的は、高エネルギーリン光放出材用の改良されたホストポリマー材料を必要とする要求を満たすことである。
【課題を解決するための手段】
【0017】
この目的は化学式(I)のモノマーユニットを有する高分子カルバゾール化合物によって達成される。
【0018】
-(C1)-(C2)x-(C3)y-(P)n- (I)
式中、
xおよびyは0または1であり、
nは0または0よりも大きい整数であり、
C1は次式(II)の化合物であり
【0019】
【化1】

(II)
C2は次式(III)の化合物であり、
【0020】
【化2】

(III)
C3は次式(IV)の化合物であり、
【0021】
【化3】

(IV)
Pは次式(V)の化合物であり、
【0022】
【化4】

(V)
R1、R2、R3、R4、R6、R7、R8、R9、R11、R12、R13、R14、R16、R17、R18およびR19はHまたは−OR41、−OR42、−SR41、−SR42、−NR41R45、および−NR42R45から成るグループから選択された置換基でもよい。
R5、R10、およびR15はそれぞれの出現毎に同一または異り、R41またはR42から選択されてもよく、
R41は炭素数1〜20の環式または非環式で直鎖または分岐アルキルであり、−O−、−OC(=O)−、−C(=O)O−、−S−、第二級窒素、第三級窒素、第四級窒素、−CR45=CR46−、−C≡C−、−C(=O)−、−C(=O)NR45−、−NR45C(=O)−、−S(=O)−、−S(=O)2−、または−X6−で一回以上分断されていてもよく、および/または一回以上R42、R57、またはR58で置換されたものであってもよく、
R42は炭素数5〜30のアリールであり、一つ以上の芳香族炭素原子はN、OまたはSで置換されていてもよく、一つ以上の芳香族炭素原子はR41、R57、またはR58基を有していてもよく、
R57は、−CN、−CF3、−CSN、−NH2、−NO2、−NCO、−NCS、−OH、−F、−PO2、−PH2、−SH、−Cl、−Br、または−Iであり、
R58は、−C(=O)R45、−C(=O)OR45、−C(=O)NR45R46、−NHR45、−NR45R46、−N(+)R45R46R47、−NC(=O)R45−、−OR45、−OC(=O)R45、−SR45、−S(=O)R45、または−S(=O)2R45であり、
R45、R46、およびR47はそれぞれの出現毎に同一または異なる、H、R41、またはR42であり、
X6は炭素数4〜30のアリーレンであり、一つ以上の芳香族炭素原子はN、OまたはSで置換されていてもよく、一つ以上の芳香族炭素原子はR41、R57、またはR58基を有していてもよく、
xが0であり、yが0であり、およびnが1以上である場合には、
少なくとも一つの[R3、R4、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基であり、
xが0であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4、R11、およびR12]は一つの前記置換基であり、
xが0であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4、R11、およびR12]および少なくとも一つの[R13、R14、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基であり、
xが1であり、yが0であり、およびnが0である場合には、
少なくとも一つの[R3、R4、R6、およびR7]は一つの前記置換基であり、
xが1であり、yが0であり、およびnが1以上である場合には、
少なくとも一つの[R3、R4、R6、およびR7]および少なくとも一つの[R8、R9、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基であり、
xが1であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4、R6、およびR7]および少なくとも一つの[R8、R9、R11、およびR12]は一つの前記置換基あり、
xが1であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4、R6、およびR7]および少なくとも一つの[R8、R9、R11、およびR12]および少なくとも一つの[R13、R14、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基である。
特に、
xが0であり、yが0であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R16、R17]は一つの前記置換基であり、
xが0であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R11、R12]は一つの前記置換基であり、
xが0であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R11、R12]、および少なくとも一つの[R13、R14]、および少なくとも一つの[R16、R17]は一つの前記置換基であり、
xが1であり、yが0であり、およびnが0である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R6、R7]は一つの前記置換基であり、
xが1であり、yが0であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R6、R7]、および少なくとも一つの[R16、R17]、および少なくとも一つの[R18、R19]は一つの前記置換基であり、
xが1であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R11、R12]、および少なくとも一つの[R6、R7、R8、R9]は一つの前記置換基であり、
xが1であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R6、R7]、および少なくとも一つの[R8、R9]、および少なくとも一つの[R11、R12]、および少なくとも一つの[R13、R14]、および少なくとも一つの[R16、R17]は一つの前記置換基である。
【0023】
これらの特別な位置に置換基を導入することで、二つのユニット(カルバゾールまたはフェニルのどちらか)が結合している場所にあるポリマー骨格内にねじれが発生した。このため、三重項波動関数が局在化し、三重項エネルギーが大きくなった。これにより、これらの化合物は、高エネルギー(すなわち、青色)リン光放出材用のホストポリマー材料として機能するのに優れる。
【0024】
本発明による好ましい高分子カルバゾール化合物では、xは1であり;yは0であり;nは1であり、R1、R2、R3、R7、R8、R9、R17、およびR19のそれぞれはHであり、R4、R6、R16およびR18のそれぞれは−OR41、であり、R5およびR10のそれぞれはR41である(NK938に相当する、下記参照)。
【0025】
本発明による他の好ましい高分子カルバゾール化合物では、xは1であり;yは1であり;nは0であり;R2、R3、R6、R7、R8、R12、R13、R14のそれぞれはHであり、;R1、R4、R9、R11、のそれぞれは−OR41であり、R5、R10およびR15のそれぞれはR41である(NK921に相当する、下記参照)。
【0026】
本発明による他の好ましい高分子カルバゾール化合物では、xは1であり;yは1であり;nは0であり、R1、R2、R3、R7、R8、R9、R12、R13、のそれぞれはHであり、;R4、R6、R11、およびR14のそれぞれは−OR41、であり、R5、R10およびR15のそれぞれはR41である(NK957に相当する、下記参照)。
−OR41は、例えばメトキシ(−OCH3、MeO)または化学式−OC10H21の直鎖または分岐のアルコキシ鎖(例を挙げると3、7−ジメチルオクチルオキシ)であってもよい。R41は、例えば化学式−C10H21の直鎖または分岐のアルキル鎖(例を挙げると3、7−ジメチルオクチル)であってもよい。
【0027】
本発明の好ましい高分子カルバゾール化合物は、下記の化学式NK938、NK921およびNK957のモノマーユニットを有する。
【化5】

【0028】
本発明は、上で定義した高分子カルバゾール化合物を含む半導体材料ばかりではなく、この種の半導体材料を含むエレクトロルミネッセントデバイスにも関する。半導体材料はルミネッセント発光材と組み合わせてもよい。
【0029】
更に、本発明は、上で定義した高分子カルバゾール化合物の合成方法、およびこの種の高分子カルバゾール化合物を半導体材料として使用することに関する。特に、上述した高分子カルバゾール化合物は、ルミネッセント発光材のためのホストマトリックスとして使用するには好適である。
【0030】
本発明につながる研究において、発明者達はとても予想外な青色リン光放出材のホストに好適なカルバゾールポリマーの新しいグループを発見した。このカルバゾールポリマーは化学式(I)のモノマーユニットを有する。
【0031】
-(C1)-(C2)x-(C3)y-(P)n- (I)
式中、xおよびyは0または1であり、nは0以上の整数である。Pはフェニル基を示し、C1、C2およびC3はカルバゾールユニットを示す。二つのカルバゾールユニットが結合している場所であるポリマー骨格中にねじれを導入することでビフェニル構造における三重項波動関数は局在化し、それによって三重項エネルギーは増加した。置換基(例えばメトキシまたは3、7−ジメチルオクチルオキシ)によってねじれが導入された。高分子カルバゾール化合物は半導体材料として使用してもよい。半導体材料はルミネッセント発光材に対するホストマトリックスとして使用してもよい。
【0032】
上述したように、ホストポリマーがリン光消光剤として働かないために、ポリマーには、三重項エネルギーがリン光放出材のエネルギーよりも大きいことが要求される。赤色リン光放出材に対しては、この条件はすでに達成されているが、緑色および特に青色リン光放出材にとってはこの条件を達成することがとても難しい。それ故に、本発明の重要な点は、大きな三重項エネルギーギャップと好適な電荷輸送準位とを組み合わせることのできるポリマーを提供することである。
【0033】
ホスト化合物の三重項エネルギーの増加を可能にするには、カルバゾールポリマーの基本構成要素に三重項波動関数を局在化させることに注目しなければならない。通常、三重項波動関数を非局在化させるほど、三重項エネルギーは小さくなる。従って、戦略としてはカルバゾールポリマー基本構成要素の小さな部分に三重項波動関数を局在化させることになろう。
【0034】
ポリフェニル分子に注目することで問題に対する見識を得る事が可能になる。ポリフェニル分子では、フェニル基の数が増加すると三重項エネルギーが小さくなる。ベンゼンからビフェニルまたはp−テルフェニルまでは、三重項エネルギーは、3.65eVから2.84eVまたは2.55eVまでそれぞれ小さくなる。しかしながら、ビフェニルからm−テルフェニルまでは、三重項エネルギーほとんど変化しない(ビフェニルでは2.84eVであり、m−テルフェニルでは2.81eVである。)(Birks、J.B.芳香族化合物の光物理学;JohnWiley&Sons:NewYork、1970)。
【発明の効果】
【0035】
従って、これらの化合物は高エネルギー(すなわち青色)リン光放出材用のホストポリマー材料として素晴らしい機能を有する。
【発明を実施するための最良の形態】
【0036】
表1
様々なポリフェニル分子の三重項エネルギー(T1)
【表1】

【0037】
これは、ポリ(p−フェニル)分子では共役系は最長分子軸に沿って非局在化し、m−ポリフェニル分子では全てのビフェニル構造の構成で三重項状態が局在化するということを示したポリフェニル分子に関する研究と一致した(Higuchi、J.らJ.Phys.Chem.A2001、105、6084;およびHiguchi、J.らJ.Phys.Chem.A2002、106、8609)。
【0038】
この点において、フルオレンおよびカルバゾールの三重項エネルギー(それぞれ2.95eVおよび3.05eVである)はビフェニルの三重項エネルギーよりも大きいことを示しているのは興味深い。しかしながら、上述したカルバゾール誘導体を基本構成要素とする[3、3’]−ビカルバゾリルでは、三重項エネルギー(2.75eV)がビフェニルの三重項エネルギー値の近くまで減少した(表2参照)。
【0039】
表2
フルオレン、カルバゾール、および[3、3’]−ビカルバゾリルの三重項エネルギー(T1)
【表2】

【0040】
これは[3、3’]−ビカルバゾリルの三重項励起子はカルバゾールの三重項励起子よりも非局在化しているということだけではなく、三重項励起子の大部分は二つのカルバゾールユニット間で共有されているビフェニル構造上で非局在化しているということを示している。このことは、三重項エネルギーがモノマーから二量体になると変化するが、二量体から三量体になる場合は一定の値を保つことから説明される(Brunner、K.らJ.Am.Chem.Soc.2004、126、6035;およびvAnDijken、A.らJ.Am.Chem.Soc.2004、126、7718)。
【0041】
カルバゾール誘導体である[3、3’]−ビカルバゾリルの基本構成要素の化学構造を以下に示す。三重項波動関数が局在化しているおおよその場所を波線で示す。
【0042】
【化6】

【0043】
三重項エネルギーを増加させるためには、ビフェニル構造上の三重項波動関数を局在化させなければならない。本発明によれば、これは、二つのカルバゾールユニットが結合しているポリマー骨格中にねじれ(twists)を導入することで実現される。
【0044】
本発明による高分子カルバゾール化合物は化学式(I)のモノマーユニットを備える。
-(C1)-(C2)x-(C3)y-(P)n- (I)
式中、
xおよびyは0または1であり、
nは0または0よりも大きい整数であり、
C1は次式(II)の化合物であり、
【0045】
【化7】

(II)
C2は次式(III)の化合物であり、
【0046】
【化8】

(III)
C3は次式(IV)の化合物であり、
【0047】
【化9】

(IV)
Pは次式(V)の化合物であり、
【0048】
【化10】

(V)
R1、R2、R3、R4、R6、R7、R8、R9、R11、R12、R13、R14、R16、R17、R18およびR19はHまたはねじれ誘導置換基でもよい。
【0049】
どのような置換の組み合わせもで本発明の範囲内の所望の三重項エネルギー増加につながることが分かる。
【0050】
本発明によって示唆されたようにカルバゾール骨格上に置換基を導入すると、隣接した二つのカルバゾール骨格間に、立体的な障害のために、ねじれが誘発される。このねじれの結果、共役量、つまり三重項励起状態の非局在化量、が減少する。これによってポリマーの三重項エネルギーが増加することにつながる(つまり、ポリマーの三重項エネルギーがカルバゾール骨格単一の三重項エネルギーに近づく)。
【0051】
ポリマーLEDでは、ポリマーのイオン化ポテンシャルは、好ましくは陽極の仕事関数よりも小さくなるべきである。この状態で、デバイスが順バイアスされている場合には、正孔が陽極からポリマーに注入する際の障壁がないことになる。エネルギー準位スキームを構築する場合に、この条件はポリマーのHOMO準位は好ましくは陽極のフェルミ準位よりも大きいエネルギー準位であるべきだということを意味する(このエネルギー準位は通常真空準位である0に対してマイナスの値で表現される)。
【0052】
カルバゾールをベースにするポリマーの三重項エネルギーを増加させるために置換基を用いた場合に、その同じポリマーのHOMO準位を、陽極から正孔がこれ以上注入されることが不可能なほど、シフトさせることになってはならない。一方、このことは必ずしも、置換基を用いることがHOMO準位に全く影響を与えるべきではないということを意味していない。ここで重要な点は、陽極のフェルミ準位(仕事関数)とポリマーのHOMO準位(イオン化ポテンシャル)とのエネルギー差である。
【0053】
本発明につながる研究において、発明者達は、他の置換基、例えばアルキル基の場合には、HOMO準位をかなり負の値にシフトさせるのだが、驚いたことにある置換基はHOMO準位の位置に影響を及ぼさないことを見出した。特に、次の基は、本発明によるねじれ誘導置換基として使用可能である:
−OR41、−OR42、−SR41、−SR42、−NR41R45、または−NR42R45
R41は炭素数1〜20の環式または非環式で直鎖または分岐アルキルであり、−O−、−OC(=O)−、−C(=O)O−、−S−、第二級窒素、第三級窒素、第四級窒素、−CR45=CR46−、−C≡C−、−C(=O)−、−C(=O)NR45−、−NR45C(=O)−、−S(=O)−、−S(=O)2−、または−X6−で一回以上分断されていてもよく、および/または一回以上R42、R57、またはR58で置換されていてもよく、
R42は炭素数5〜30のアリールであり、この中で、一つ以上の芳香族炭素原子はN、OまたはSで置換されていてもよく、一つ以上の芳香族炭素原子はR41、R57、またはR58基を有していてもよく、
R57は−CN、−CF3、−CSN、−NH2、−NO2、−NCO、−NCS、−OH、−F、−PO2、−PH2、−SH、−Cl、−Br、または−Iであり、
R58は−C(=O)R45、−C(=O)OR45、−C(=O)NR45R46、−NHR45、−NR45R46、−N(+)R45R46R47、−NC(=O)R45−、−OR45、−OC(=O)R45、−SR45、−S(=O)R45、または−S(=O)2R45であり、
R45、R46、およびR47はそれぞれの出現毎に同一または異なる、H、R41、またはR42であり、
X6は炭素数4〜30のアリーレンであり、この中で、一つ以上の芳香族炭素原子はN、OまたはSで置換されていてもよく、一つ以上の芳香族炭素原子はR41、R57、またはR58基を有していてもよい。
【0054】
−OR41基、すなわちアルコキシ基、特にメトキシおよび/または3、7−ジメチルオクチルオキシは、好ましいねじれ誘導置換基である。
【0055】
化学式C1、C2およびC3では、R5、R10、およびR15はそれぞれの出現毎に同一であっても異なってもよく、上で定義されたR41およびR42から選択されてもよい。
【0056】
本発明の好ましい高分子カルバゾール化合物は次の化学式NK938、NK921およびNK957のモノマーユニットを備える。
【0057】
【化11】

【0058】
特許請求の範囲および明細書全体から明らかなように、モノマー(I)中に共役があってはならないし、モノマー(I)とモノマー(I)に隣り合うポリマー鎖中のモノマーとの間にも共役があってはならない。
【0059】
本発明で開示された実施例では化学式(I)のモノマーだけを含むポリマーを開示しているが、本発明による高分子カルバゾール化合物は他のモノマーを含むことが可能だということが理解される。この種の他のモノマーが共役化合物そのものである場合には、これらのモノマーおよびモノマー(I)間の共役は、それらの間にねじれを導入することで、中断されるべきである。実際、これらの他の共役モノマーはフェニル環を介してモノマー(I)へ結合されるだろう。このフェニル環は、どのような共役化合物の一部であってもよい。この場合、モノマー(I)(一端はR1またはR2であり、他端は、x、y、およびnに依存して、R3またはR4、R8またはR9、R13またはR14、R18またはR19である)のそれぞれの末端における少なくとも一つの置換基は、ねじれ誘導置換基でなければならない。
【0060】
本発明による高分子カルバゾール化合物は、ルミネッセント発光材、すなわちリン光放出材および蛍光放出材の両方におけるホスト材料として使用することに非常に適している。特に、リン光放出材用のホスト材料として使用することに適している。
【0061】
本発明は、有機エレクトロルミネッセント材料に基づくどのような用途でも実施可能であり、特に照明用途(例えば広域の照明設備)に適用できる。
【実施例】
【0062】
以下の実施例1および2では、ポリマー骨格中に所望のねじれを招く二つの具体的な方法が記載されている。これらの実施例で紹介される具体的なねじれ誘導置換基、すなわちメトキシおよび3、7−ジメチルオクチルオキシは、上で定義した他のどのようなねじれ誘導側置換基でも置換可能であろうことが理解される。特に、他のどのようなねじれ誘導アルコキシ基を使用してもよい。さらに、ねじれ誘導置換基の数および位置は実施例で示されるものに限定されない。
【0063】
実施例1
ねじれ誘導置換基
カルバゾールユニットが[3,3’]位置を介して結合されている同一のカルバゾールを主成分とした骨格を持つ二つのポリマーNK351とNK921を比較した図で原理を示す。これら二つのポリマーで唯一異なるのは、NK921では[2,2’]位置の幾つかでメトキシユニット(OMe)を有することである。これらの基では、二つのカルバゾールユニットがお互いの波動関数の重なりが減少するようにねじれる。
【0064】
このねじれの結果、三重項エネルギーはNK351における2.56eVからNK921における2.73eVへ増加する(表3参照)。これらの値は下限値であるように見え、77K(ケルビン)の固体フィルムに記録した。さらに、半波酸化電位は、ポリマー骨格中にこの特別なひねりを導入した結果、ほとんど増加しなかった。これは、電荷を注入するために使用されるHOMO準位がシフトすることなく三重項エネルギーが増加したことを示す。全ての酸化は可逆である。
【0065】
図2は、77K(ケルビン)におけるポリマーNK921(波線)およびNK351(実線)のリン光スペクトルを示す。最低励起三重項準位の位置を波線で示す。
【0066】
表3
化学構造、三重項エネルギー(T1)、およびNK351およびNK921の半波酸化電位(EOX1/2)
【表3】

【0067】
実施例2
主鎖に取り込まれたねじれ誘導分子
カルバゾール主鎖は主鎖にねじれを誘導する分子を取り込むことでもねじられ得る.この原理を以下に図示する。
【0068】
【化12】

NK938の化学構造
【0069】
アルコキシ置換フェニルを二つ連続した[3,3’]−ビカルバゾリルユニット間に挿入する。この取り組みは三重項エネルギーに関してはこれまでの取り組みと同一の結果になるが、生成に関してはある程度有利になる。重合前にカルバゾール主鎖ポリマーのモノマーである[3,3’]−ビカルバゾリルを生成する。これらのモノマーはでされたアルコキシ置換フェニル基を介して結合しており、これを合成するのは[3,3’]−ビカルバゾリルを直接結合するよりも容易である。
【0070】
結果
三重項エネルギーが増加すると、青色デバイスのエレクトロルミネッセンス効率で直ちに確認できる。このデバイスは青色リン光放出材ADS065BE(American Dye Source,Inc.)が質量比20%で分散されたホストポリマー(ここに記載されているカルバゾールポリマーおよび特許文献1に記載された“ねじれ”てはいないポリマー)を含む。この層はITO/PEDOT:PSS陽極とATPBI/LiF/Al陰極とで挟まれている。ねじれのないホストポリマーに比べてポリマー骨格のねじれを導入する第一または第二の方法では、光放出開始電圧を増加させることなく、4から8倍効率が増加した(図4)。
【0071】
図3は青色リン光放出材ADS065BE(American Dye Source,Inc.)が質量比20%で分散されたNK957の正規化されたエレクトロルミネッセンススペクトラムを示す。このデバイスの構造はITO/PEDOT:PSS(200nm)/NK957+ADS065BE(80nm)/TPBI(30nm)/LiF(5nm)/Al(100nm)である。
【0072】
実験
半波酸化電位は、サイクリック・ボルタンメトリー(CV)測定で決定した。CV測定は、支持電解質として1M(モル)ヘキサフルオロリン酸テトラブチルアンモニウムを含むジクロロメタン中で記録した。作用電極として白金円板(0.2cm2)、対電極として白金板(0.5cm2)、およびFc(フェロセン)/Fc+対で較正した飽和Ag/AgCl電極を参照電極として使用した。三重項準位はリン光測定で決定された。放出スペクトルは77K(ケルビン)にてEdinburgh900分光蛍光光度計で記録した。蛍光からリン光を区別するためにゲートの有無でスペクトルを記録した。ゲート遅延はゲート幅9msで500μsである。リン光スペクトラム中の最高エネルギーピークはS0ν=0←T1ν=0遷移で得られた。ねじれ骨格を有するいくつかのカルバゾールベースホストポリマーを表4にまとめた。
【0073】
表4
ねじれ骨格を有するカルバゾールベースのいくつかのホストポリマーの概要
【表4】

【0074】
合成手順
【化13】

【0075】
[参考実施例1]2,5−ジヨード−4−(3,7−ジメチルオクチルオキシ)アニソール
25.0g(95mmol)の4−(3,7−ジメチルオクチルオキシ)アニソール、28g(111mmol)のヨウ素並びに8.2g(38mmol)のKIO3を含む500mlの酢酸、40mlの水および10mlの濃H2SO4の混合物をアルゴンで充満させ、還流温度で16時間加熱させた。混合物を室温まで冷却させた。水/ジエチルエーテルおよび飽和NA2CO3(水溶液.)/ジエチルエーテルを別々に使用して生成物を抽出した。有機層を乾燥させ(MgSO4)、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、90/10、体積/体積)後に、34g(70%)の生成物が得られた。
【0076】
1HNMR(CDCl3):δ7.23(s、1H)、7.22(s、1H)、4.0(t、J=6.5Hz、2H)、3.83(s、3H)、1.93−1.15(m、10H)、0.98(d、J=6.5Hz、3H)、0.90(d、J=6.5Hz、6H)。
13CNMR(CDCl3):δ153、153、123、121、86、85、69、57、39、37、36、30、28、25、23、23、20。
【0077】
【化14】

【0078】
[参考実施例2]4,4’−ジメトキシ−2−ニトロ−1,1’−ビフェニル
14.9g(64mmol)の4−ブロモ−3−ニトロアニソール、18g(77mmol)の4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)アニソール、70mlのトルエンおよび70mlの2M炭酸カリウム(水溶液)の混合物を含むフラスコを3回排気し、アルゴンを充満させ、その後2mol%のPd(PPh3)4を加えた。排気とアルゴンの充満をもう一度繰り返し、環流温度で60時間その混合物を攪拌した。混合物を室温まで冷却させ、有機層を分離し、乾燥させ(MgSO4)、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、50/50、体積/体積)後に、12.0g(72%)の生成物が得られた。
【0079】
1HNMR(CDCl3):δ7.33(s、J=1.5Hz、1H)、7.32(d、J=8Hz、1H)、7.20(d、J=8Hz、2H)、7.12(dd、J=1.5Hz、J=8Hz、1H)、6.93(d、J=8Hz、2H)、3.88(s、3H)、3.83(s、3H)。
13CNMR(CDCl3):δ159、159、149、132、129、129、128、119、114、109、56、55。
mp:138℃。
【0080】
【化15】

【0081】
[参考実施例3]2,7−ジメトキシカルバゾール
10g(38.6mmol)の4,4’−ジメトキシ−2−ニトロ−1,1’−ビフェニルを35mlの亜リン酸トリエチル中で16時間還流させる。混合物を室温まで冷却させ、そこに生成物を沈殿させる。濾過すると6.5g(74%)の白色固体が得られた。
【0082】
1HNMR(DMSO−d6):δ11.00(s、1H)、7.85(d、J=8Hz、2H)、6.94(d、J=1.5Hz、2H)、6.74(dd、J=1.5Hz、J=8Hz、2H)、3.82(s、6H)。
13CNMR(DMSO−d6):δ157、141、119、116、107、94、55。
mp:285℃。
【0083】
【化16】

【0084】
[参考実施例4]3,6−ジブロモ−2,7−ジメトキシカルバゾール
アルミニウム箔で覆ったフラスコで、1.48g(6.5mmol)2,7−ジメトキシカルバゾールを60mlのテトラヒドロフラン中で攪拌した溶液を0℃まで冷却させた。2.3g(13mmol)のN−ブロモスクシンイミドを少しずつ添加した。混合物を室温で一晩放置させた。THFを蒸発させ、生成物を更に精製することなく使用した。
【0085】
1HNMR(DMSO−d6):δ11.30(s、1H)、8.30(s、2H)、7.13(s、2H)、3.90(s、6H)。
13CNMR(DMSO−d6):δ153、140、123、116、102、94、56。
【0086】
【化17】

【0087】
[参考実施例5]3,6−ジブロモ−9−(3,7−ジメチルオクチル)−2,7−ジメトキシカルバゾール
2.5g(6.5mmol)の3,6−ジブロモ−2,7−ジメトキシカルバゾールおよび40mgのベンジルトリエチルアンモニウムクロリドを10mlのトルエン中で攪拌した溶液を滴下で3.8gの50質量%NaOH(水溶液)へ添加した。それから1.7g(7.7mmol)の3,7−ジメチルオクチルブロマイドを滴下で添加した。全て添加した後に、反応混合物を6時間還流加熱させた。有機層を分離し、飽和Na2CO3(水溶液)で洗浄し、MgSO4で乾燥させ、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン/Et3N、80/20/1、体積/体積/体積)後に、結晶化させ(ジクロロメタン/エタノール)、2.1g(61%)の白色固体が得られた。
【0088】
1HNMR(CDCl3):δ8.10(s、2H)、6.84(s、2H)、4.26(t、J=8Hz、2H)、4.03(s、6H)、1.98−1.150(m、10H)、1.07(d、J=6.5Hz、3H)、0.88(d、J=6.5Hz、6H)。
13CNMR(CDCl3):δ154、140、124、117、103、92、56、41、39、37、35、31、28、25、23、23、20。
mp:113℃。
【0089】
【化18】

【0090】
[参考実施例6]4’−メトキシ−2−ニトロ−1,1’−ビフェニル
10.7g(53mmol)の1−ブロモ−2−ニトロベンゼン、14.9g(64mmol)の4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)アニソール、70mlのトルエンおよび70mlの2M炭酸カリウム(水溶液)の混合物を含むフラスコを3回排気し、アルゴンを充満させ、その後2mol%のPd(PPh3)4を添加した。排気とアルゴンの充満をもう一度繰り返し、環流温度で48時間その混合物を攪拌した。混合物を室温まで冷却させ、有機層を分離し、乾燥させ(MgSO4)、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、60/40、体積/体積)後に、8.5g(70%)の生成物が得られた。
【0091】
1HNMR(CDCl3):δ7.84(dd、J=1.5Hz、J=8Hz、1H)、7.62(dt、J=1.5Hz、J=8Hz、1H)、7.48(dd、J=1.5Hz、J=8Hz、1H)、7.46(dt、J=1.5Hz、J=8Hz、1H)、7.29(d、J=8Hz、2H)、7.00(d、J=8Hz、2H)、3.82(s、3H)。
13CNMR(CDCl3):δ159、136、132、132、129、129、128、124、114、55。
【0092】
【化19】

【0093】
[参考実施例7]2−メトキシカルバゾール
8.36g(36.7mmol)の4’−メトキシ−2−ニトロ−1,1’−ビフェニルを40mlの亜リン酸トリエチル中で6時間還流した。混合物を室温まで冷却させ、そこに生成物を沈殿させる。濾過すると6.67g(93%)の白色固体が得られる。
【0094】
1HNMR(DMSO−d6):δ11.10(s、1H)、8.00(dd、J=1.5Hz、J=8Hz、1H)、7.8(d、J=8Hz、1H)、7.44(dd、J=1.5Hz、J=8Hz、1H)、7.30(dt、J=1.5Hz、J=8Hz、1H)、7.12(dt、J=1.5Hz、J=8Hz、1H)、6.98(d、J=1.5Hz、1H)、6.78(dd、J=1.5Hz、J=8Hz、1H)、3.83(s、3H)。
13CNMR(DMSO−d6):δ158、141、140、124、123、121、119、118、116、111、108、94、55。
mp:239℃。
【0095】
【化20】

【0096】
[参考実施例8]3−ブロモ−2−メトキシカルバゾール
アルミニウム箔で覆ったフラスコで、6.62g(33.6mmol)の2−メトキシカルバゾールを150mlのテトラヒドロフラン中で攪拌した溶液を0℃まで冷却させた。5.38g(30.2mmol)のN−ブロモスクシンイミドを少しずつ添加した。混合物を室温で一晩放置させた。THFを蒸発させ、生成物を更に精製することなく使用した。
【0097】
1HNMR(DMSO−d6):δ11.30(s、1H)、8.34(s、1H)、8.04(dd、J=1.5Hz、J=8Hz、1H)、7.46(dd、J=1.5Hz、J=8Hz、1H)、7.33(dt、J=1.5Hz、J=8Hz、1H)、7.14(dt、J=1.5Hz、J=8Hz、1H)、7.14(s、1H)、3.93(s、3H)。
13CNMR(DMSO−d6):δ153、140、139、124、124、122、120、119、116、110、101、95、56。
【0098】
【化21】

【0099】
[参考実施例9]3−ブロモ−9−(3,7−ジメチルオクチル)−2−メトキシカルバゾール
7.16g(26mmol)の3−ブロモ−2−メトキシカルバゾールおよび0.17gのベンジルトリエチルアンモニウムクロリドを25mlのトルエン中で攪拌した溶液を滴下で15gの50質量%NaOH(水溶液)へ添加した。それから6.9g(31mmol)の3,7−ジメチルオクチルブロマイドを滴下で添加した。完全に添加した後に、反応混合物を16時間還流加熱させた。有機層を分離し、水で洗浄し、MgSO4で乾燥させ、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、80/20、体積/体積)後に、9.3g(76%)の生成物が得られた。
【0100】
1HNMR(CDCl3):δ8.24(s、1H)、8.00(dd、J=1.5Hz、J=8Hz、1H)、7.42(dt、J=1.5Hz、J=8Hz、1H)、7.38(dd、J=1.5Hz、J=8Hz、1H)、7.24(dt、J=1.5Hz、J=8Hz、1H)、6.88(s、1H)、4.27(t、J=8Hz、2H)、4.03(s、3H)、1.98−1.10(m、10H)、1.05(d、J=6.5Hz、3H)、0.88(d、J=6.5Hz、6H)。
13CNMR(CDCl3):154、140、140、125、125、122、120、119、118、109、103、92、56、41、39、37、35、31、25、23、23、20。
mp:55℃。
【0101】
【化22】

【0102】
[参考実施例10]9−(3,7−ジメチルオクチル)−2−メトキシ−3−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)カルバゾール
75mlのテトラヒドロフラン中に5.6g(13mmol)の3−ブロモ−9−(3,7−ジメチルオクチル)−2−メトキシカルバゾールを溶解した溶液を−78℃まで冷却させた。7ml(18mmol)の2.5Mn−ブチルリチウムを滴下で添加した。1時間後、3.4ml(16mmol)の2−イソプロポキシ−4,4,5,5−テトラメチル−1,3,2−ジオキサボロランを滴下で添加した。反応混合物を室温で一晩放置させた。THFを蒸発させ、ジエチルエーテルおよび水で抽出して生成物を精製した。有機層を乾燥させ(MgSO4)、ろ過し、濃縮した。5.9g(95%)の生成物を更に精製することなく使用した。
【0103】
1HNMR(CDCl3):δ8.46(s、1H)、8.06(dd、J=1.5Hz、J=8Hz、1H)、7.38(dt、J=1.5Hz、J=8Hz、1H)、7.37(dd、J=1.5Hz、J=8Hz、1H)、7.24(dt、J=1.5Hz、J=8Hz、1H)、6.80(s、1H)、4.27(t、J=8Hz、2H)、3.95(s、3H)、1.95−1.10(m、10H)、1.40(s、12H)、1.05(d、J=6.5Hz、3H)、0.88(d、J=6.5Hz、6H)。
13CNMR(CDCl3):164、144、140、130、124、123、120、119、116、108、91、83、56、41、39、37、35、31、31、28、25、24、22、22、20、14。
【0104】
【化23】

【0105】
[参考実施例11]9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ジメトキシ−3,3’−ビカルバゾリル
2.7g(6.5mmol)の3−ブロモ−9−(3,7−ジメチルオクチル)−2−メトキシカルバゾール、3.0g(6.5mmol)の9−(3,7−ジメチルオクチル)−2−メトキシ−3−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)カルバゾール、10mlのトルエンおよび10mlの2M炭酸カリウム(水溶液)の混合物を含むフラスコを3回排気し、アルゴンを充満させ、その後2mol%のPd(PPh3)4を添加した。排気とアルゴンの充満をもう一度繰り返し、還流温度で20時間その混合物を攪拌した。混合物を室温まで冷却させ、有機層を分離し、乾燥させ(MgSO4)、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、70/30、体積/体積)および結晶化(エタノール)後に、1.9g(44%)の生成物が得られた。
【0106】
1HNMR(CDCl3):δ8.05(s、2H)、8.03(dd、J=1.5Hz、J=8Hz、2H)、7.43(dt、J=1.5Hz、J=8Hz、2H)、7.42(dd、J=1.5Hz、J=8Hz、2H)、7.23(dt、J=1.5Hz、J=8Hz、2H)、6.95(s、2H)、4.37(t、J=8Hz、4H)、3.95(s、6H)、2.03−1.15(m、20H)、1.07(d、J=6.5Hz、6H)、0.88(d、J=6.5Hz、12H)。
13CNMR(CDCl3):δ157、141、140、124、123、121、120、119、116、108、91、56、41、39、37、36、31、28、25、23、23、20。
mp:139℃。
【0107】
【化24】

【0108】
[参考実施例12]6,6’−ジブロモ−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ジメトキシ−3,3’−ビカルバゾリル
アルミニウム箔で覆ったフラスコで、0.5g(0.74mmol)の9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ジメトキシ)−3,3’−ビカルバゾリルを5mlのテトラヒドロフラン中で攪拌した溶液を0℃まで冷却させた。0.25g(1.4mmol)のN−ブロモスクシンイミドを少しずつ添加した。混合物を室温で一晩放置させた。THFを蒸発させた。ジクロロメタンおよび飽和Na2CO3(水溶液)で抽出後、0.57g(98%)の生成物が得られた。これを更に精製することなく使用した。
【0109】
1HNMR(CDCl3):δ8.10(d、J=1.5Hz、2H)、7.96(s、2H)、7.49(dd、J=1.5Hz、J=8Hz、2H)、7.25(d、J=8Hz、2H)、6.94(s、2H)、4.30(t、J=8Hz、4H)、3.95(s、6H)、2.00−1.15(m、20H)、1.10(d、J=6.5Hz、6H)、0.88(d、J=6.5Hz、12H)。
13CNMR(CDCl3):δ158、141、139、127、125、123、122、121、115、112、110、91、56、41、39、37、35、31、28、25、23、23、20。
【0110】
【化25】

【0111】
[参考実施例13]6,6’−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ジメトキシ−3,3’−ビカルバゾリル
40mlのテトラヒドロフラン中に5.62g(6.8mmol)の6,6’−ジブロモ−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ジメトキシ−3,3’−ビカルバゾリルを溶解した溶液を−78℃まで冷却させた。6.2ml(15.5mmol)の2.5Mn−ブチルリチウムを滴下で添加した。1時間後、3.0ml(15mmol)の2−イソプロポキシ−4,4,5,5−テトラメチル−1,3,2−ジオキサボロランを滴下で添加した。反応混合物を室温で一晩放置させた。THFを蒸発させ、ジエチルエーテルおよび水で抽出して生成物を精製した。有機層を乾燥させ(MgSO4)、ろ過し、濃縮した。ジクロロメタン/エタノールからいくらか結晶化させ、3.8g(61%)の白色固体の生成物が得られた。
【0112】
1HNMR(CDCl3):δ8.54(d、J=1.5Hz、2H)、8.10(s、2H)、7.88(dd、J=1.5Hz、J=8Hz、2H)、7.38(d、J=8Hz、2H)、6.97(s、2H)、4.32(t、J=8Hz、4H)、3.94(s、6H)、2.02−1.00(m、20H)、1.38(s、24H)、1.10(d、J=6.5Hz、6H)、0.88(d、J=6.5Hz、12H)。
13CNMR(CDCl3):δ157、143、141、131、127、124、123、121、116、108、91、83、56、41、39、37、36、31、28、25、25、23、20。
【0113】
【化26】

【0114】
[参考実施例14]4’−(3,7−ジメチルオクチルオキシ)−2−ニトロ−1,1’−ビフェニル
11.2g(55mmol)の1−ブロモ−2−ニトロベンゼン、23.9g(66mmol)の1−(3,7−ジメチルオクチルオキシ)−4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)ベンゼン、60mlのトルエンおよび60mlの2M炭酸カリウム(水溶液)の混合物を含むフラスコを3回排気し、アルゴンを充満させ、その後2mol%のPd(PPh3)4を添加した。排気とアルゴンの充満をもう一度繰り返し、環流温度で60時間その混合物を攪拌した。混合物を室温まで冷却させ、水を添加した。有機層を分離し、乾燥させ(MgSO4)、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、80/20、体積/体積)後に、12.9g(66%)の生成物が得られた。
【0115】
1HNMR(CDCl3):δ7.80(dd、J=1.5Hz、J=8Hz、1H)、7.58(dt、J=1.5Hz、J=8Hz、1H)、7.44(dd、J=1.5Hz、J=8Hz、1H)、7.43(dt、J=1.5Hz、J=8Hz、1H)、7.25(d、J=8Hz、2H)、6.96(d、J=8Hz、2H)、4.02(t、J=8Hz、2H)、1.90−1.13(m、10H)、0.97(d、J=6.5Hz、3H)、0.88(d、J=6.5Hz、6H)。
13CNMR(CDCl3):δ159、136、132、132、129、129、128、124、115、66、39、37、36、30、28、25、23、23、20。
【0116】
【化27】

【0117】
[参考実施例15]2−(3,7−ジメチルオクチルオキシ)カルバゾール
33mlの亜リン酸トリエチル中で13g(36.6mmol)の4’−(3,7−ジメチルオクチルオキシ)−2−ニトロ−1,1’−ビフェニルを16時間還流させる。混合物を室温まで冷却させた。亜リン酸トリエチルの蒸発後に、10.5g(89%)の白色固体の生成物が得られた。
【0118】
1HNMR(DMSO−d6):δ11.0(s、1H)、7.95(d、J=8Hz、1H)、7.92(d、J=8Hz、1H)、7.39(d、J=8Hz、1H)、7.25(t、J=8Hz、1H)、7.17(t、J=8Hz、1H)、6.93(d、J=1.5Hz、1H)、6.73(dd、J=1.5Hz、J=8Hz、1H)、4.02(t、J=8Hz、2H)、1.80−1.10(m、10H)、0.92(d、J=6.5Hz、3H)、0.82(d、J=6.5Hz、6H)。
13CNMR(DMSO−d6):δ158、141、140、124、123、121、119、118、116、111、108、95、66、39、37、36、29、27、24、23、23、20。
mp:188℃。
【0119】
【化28】

【0120】
[参考実施例16]3−ブロモ−2−(3,7−ジメチルオクチルオキシ)カルバゾール
アルミニウム箔で覆ったフラスコで、10.5g(32.5mmol)の2−(3,7−ジメチルオクチルオキシ)カルバゾールを40mlのテトラヒドロフラン中で攪拌した溶液を0℃まで冷却させた。5.20g(29.2mmol)のN−ブロモスクシンイミドを少しずつ添加した。混合物を室温で一晩放置させた。THFを蒸発させ、生成物を更に精製することなく使用した。
【0121】
1HNMR(DMSO−d6):δ11.20(s、1H)、8.33(s、1H)、8.05(dd、J=1.5Hz、J=8Hz、1H)、7.46(dd、J=1.5Hz、J=8Hz、1H)、7.33(dt、J=1.5Hz、J=8Hz、1H)、7.14(dt、J=1.5Hz、J=8Hz、1H)、7.14(s、1H)、4.15(t、J=8Hz、2H)、1.95−1.10(m、10H)、0.98(d、J=6.5Hz、3H)、0.83(d、J=6.5Hz、6H)。
13CNMR(DMSO−d6):153、140、140、125、122、120、119、117、111、111、102、96、67、39、37、36、29、27、24、23、23、20。
【0122】
【化29】

【0123】
[参考実施例17]3−ブロモ−9−(3,7−ジメチルオクチル)−2−(3,7−ジメチルオクチルオキシ)カルバゾール
13g(32.3mmol)の3−ブロモ−2−(3,7−ジメチルオクチルオキシ)カルバゾールおよび0.2gのベンジルトリエチルアンモニウムクロリドを35mlのトルエン中で攪拌した溶液に20gの50質量%NaOH(水溶液)を滴下で添加した。それから8.6g(38.9mmol)の3,7−ジメチルオクチルブロマイドを滴下で添加した。完全に添加した後に、反応混合物を60時間還流加熱させた。有機層を分離し、水で洗浄し、MgSO4で乾燥させ、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、80/20、体積/体積)後に、10.1g(57%)の淡黄色の油が得られた。
【0124】
1HNMR(CDCl3):δ8.23(s、1H)、7.99(dd、J=1.5Hz、J=8Hz、1H)、7.41(dt、J=1.5Hz、J=8Hz、1H)、7.38(dd、J=1.5Hz、J=8Hz、1H)、7.23(dt、J=1.5Hz、J=8Hz、1H)、6.87(s、1H)、4.30−4.12(m、4H)、2.07−1.10(m、20H)、1.07(d、J=6.5Hz、3H)、1.03(d、J=6.5Hz、3H)、0.92(d、J=6.5Hz、6H)、0.88(d、J=6.5Hz、6H)。
13CNMR(CDCl3):δ154、140、140、125、124、122、120、119、117、108、103、93、67、41、39、37、37、36、35、31、30、28、28、26、25、25、23、23、20。
【0125】
【化30】

【0126】
[参考実施例18]9−(3,7−)−2−(3,7−ジメチルオクチルオキシ)−3−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)カルバゾール
4.81g(9mmol)の3−ブロモ−9−(3,7−ジメチルオクチル)−2−(3,7−ジメチルオクチルオキシ)カルバゾールを40mlのテトラヒドロフラン中で溶解した溶液を−78℃まで冷却させた。4.6ml(11.5mmol)の2.5Mn−ブチルリチウムを滴下で添加した。1時間後に、2.2ml(10.8mmol)の2−イソプロポキシ−4,4,5,5−テトラメチル−1,3,2−ジオキサボロランを滴下で添加した。反応混合物を室温で一晩放置させた。
【0127】
THFを蒸発させ、ジエチルエーテルおよび水で抽出して生成物を精製した。有機層を乾燥させ(MgSO4)、ろ過し、濃縮した。3.7g(70%)の生成物を更に精製することなく使用した。
【0128】
1HNMR(CDCl3):δ8.42(s、1H)、8.06(dd、J=1.5Hz、J=8Hz、1H)、7.38(dt、J=1.5Hz、J=8Hz、1H)、7.37(dd、J=1.5Hz、J=8Hz、1H)、7.24(dt、J=1.5Hz、J=8Hz、1H)、6.80(s、1H)、4.28(t、J=8Hz、2H)、4.18(t、J=8Hz、2H)、1.98−1.10(m、20H)、1.05(d、J=6.5Hz、3H)、1.01(d、J=6.5Hz、3H)、0.98(d、J=6.5Hz、6H)、0.97(d、J=6.5Hz、6H)。
13CNMR(CDCl3):δ163、144、140、129、124、123、120、119、116、108、92、83、67、41、39、37、37、36、35、31、30、28、28、26、25、25、23、23、20。
【0129】
【化31】

【0130】
[参考実施例19]9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ビス(3,7−ジメチルオクチルオキシ)−3,3’−ビカルバゾリル
0.5g(0.9mmol)の3−ブロモ−9−(3,7−ジメチルオクチル)−2−(3,7−ジメチルオクチルオキシ)カルバゾール、0.65g(1.1mmol)の9−(3,7−ジメチルオクチル)−2−(3,7−ジメチルオクチルオキシ)−3−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)カルバゾール、5mlのトルエンおよび5mlの2M炭酸カリウム(水溶液)の混合物を含むフラスコを3回排気し、アルゴンを充満させ、その後2mol%のPd(PPh3)4を添加した。排気とアルゴンの充満をもう一度繰り返し、105℃で48時間その混合物を攪拌した。混合物を室温まで冷却させ、有機層を分離し、乾燥させ(MgSO4)、ろ過し、濃縮した。コラムクロマトグラフィ(SiO2、ヘキサン/ジクロロメタン、80/20、体積/体積)後に、0.55g(65%)の生成物が得られた。
【0131】
1HNMR(CDCl3):δ8.03(s、2H)、7.97(dd、J=1.5Hz、J=8Hz、2H)、7.41−7.36(m、4H)、7.21−7.14(m、2H)、6.91(s、2H)、4.30(t、J=8Hz、4H)、4.07(t、J=8Hz、4H)、1.98−1.00(m、40H)、1.10(d、J=6.5Hz、6H)、0.85(d、J=6.5Hz、12H)、0.80(d、J=6.5Hz、6H)、0.78(d、J=6.5Hz、12H)。
13CNMR(CDCl3):δ157、141、140、124、123、122、119、119、116、108、92、67、41、39、39、37、37、36、36、31、30、28、28、25、23、23、23、20、20。
【0132】
【化32】

【0133】
[参考実施例20]6,6’−ジブロモ−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ビス(3,7−ジメチルオクチルオキシ)−3,3’−ビカルバゾリル
アルミニウム箔で覆ったフラスコで、0.42g(0.45mmol)の9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ビス(3,7−ジメチルオクチルオキシ)−3,3’−ビカルバゾリルを5mlのテトラヒドロフラン中で攪拌させた溶液を0℃まで冷却させた。0.15g(0.84mmol)のN−ブロモスクシンイミドを少しずつ添加した。混合物を室温で一晩放置させた。THFを蒸発させた。ジクロロメタンおよび飽和Na2CO3(水溶液)で抽出後、0.37g(75%)の生成物が得られた。
【0134】
1HNMR(CDCl3):δ8.07(d、J=1.5Hz、2H)、7.98(s、2H)、7.48(dd、J=1.5Hz、J=8Hz、2H)、7.24(d、J=8Hz、2H)、6.91(s、2H)、4.30(t、J=8Hz、4H)、4.08(t、J=8Hz、4H)、1.98−1.00(m、40H)、1.10(d、J=6.5Hz、12H)、0.88(d、J=6.5Hz、12H)、0.78(d、J=6.5Hz、12H)。
13CNMR(CDCl3):δ157、141、139、127、125、124、122、122、115、112、110、92、67、41、39、39、37、37、36、35、31、30、28、28、25、23、23、23、20、20。
【0135】
【化33】

【0136】
[参考実施例21]6,6’−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ビス(3,7−ジメチルオクチルオキシ)−3,3’−ビカルバゾリル
4.45g(4mmol)の6,6’−ジブロモ−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ビス(3,7−ジメチルオクチルオキシ)−3,3’−ビカルバゾリルを40mlのテトラヒドロフラン中に溶解した溶液を−78℃まで冷却させた。3.8ml(11.5mmol)の2.5Mn−ブチルリチウムを滴下で添加した。1時間後に、1.9ml(9mmol)の2−イソプロポキシ−4,4,5,5−テトラメチル−1,3,2−ジオキサボロランを滴下で添加した。反応混合物を室温で一晩放置させた。THFを蒸発させ、ジエチルエーテルおよび水で抽出して生成物を精製した。有機層を乾燥させ(MgSO4)、ろ過し、濃縮した。ジクロロメタン/メタノールから数回結晶化させ、2.6g(54%)の白色固体の生成物が得られた。
【0137】
1HNMR(CDCl3):δ8.50(d、J=1.5Hz、2H)、8.08(s、2H)、7.84(dd、J=1.5Hz、J=8Hz、2H)、7.36(d、J=8Hz、2H)、6.93(s、2H)、4.32(t、J=8Hz、4H)、4.06(t、J=8Hz、4H)、1.98−1.00(m、40H)、1.38(s、24H)、1.10(d、J=6.5Hz、12H)、0.88(d、J=6.5Hz、12H)、0.83(d、J=6.5Hz、6H)、0.78(d、J=6.5Hz、6H)。
13CNMR(CDCl3):δ157、143、141、131、127、124、123、122、116、108、93、83、41、39、39、37、37、36、35、31、30、28、28、25、25、23、23、23、20、20。
【0138】
【化34】

【0139】
本発明によるモノマーユニットを有する高分子カルバゾール化合物:NK938の実施例1
0.5g(0.54mmol)の6,6’−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ジメトキシ−3,3’−ビカルバゾリルと、0.28g(0.54mmol)の2,5−ジヨード−4−(3,7−ジメチルオクチルオキシ)アニソールとの混合物を25mlのトルエン中で室温にて完全に溶解するまで撹拌させた。脱気し、アルゴンを充満し、2mol%のテトラキス(トリフェニルホスフィン)パラジウム(0)を添加し、その後1.7mlの20重量%テトラエチル水酸化アンモニウム水を添加した。混合物を20時間還流させた。そして、1.0mmolの4,4,5,5−テトラメチル−1,3,2−ジオキサボロリルベンゼン(末端封鎖剤)およびいくらかの未使用の触媒を添加し、その後さらに16時間還流させた。反応混合物を室温まで冷却させた。残留触媒を除去するために、シアン化ナトリウム水で何度か洗浄を行った。それから有機層を乾燥させ、濃縮した。テトラヒドロフランおよびメタノールをそれぞれ使用して何度か分溜と沈殿をさせてポリマーを分離した。収率40%で白色の繊維としてポリマーが得られた。サイズ排除クロマトグラフィでは、分子量が18kg/mol、多分散性が1.8を示した。
【0140】
【化35】

【0141】
本発明によるモノマーユニットを有する高分子カルバゾール化合物:NK921の実施例2
0.5g(0.54mmol)の6,6’−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ジメトキシ−3,3’−ビカルバゾリルと、0.28g(0.54mmol)の3,6−ジブロモ−9−(3,7−ジメチルオクチル)−2,7−ジメトキシカルバゾールとの混合物を10mlのトルエン中で室温にて完全に溶解するまで撹拌させた。脱気をし、アルゴンを充満し、2mol%のテトラキス(トリフェニルホスフィン)パラジウム(0)を添加し、その後1.5mlの20重量%テトラエチル水酸化アンモニウム水を添加した。混合物を40時間還流させた。そして1.0mmolの4,4,5,5−テトラメチル−1,3,2−ジオキサボロリルベンゼン(末端封鎖剤)およびいくらかの未使用の触媒を添加し、その後さらに16時間還流させた。反応混合物を室温まで冷却させた。残留触媒を除去するために、シアン化ナトリウム水で何度か洗浄を行った。それから有機層を乾燥させ、濃縮した。テトラヒドロフランおよびメタノールをそれぞれ使用して何度か分溜と沈殿をさせてポリマーを分離した。白色の繊維としてポリマー0.3gが得られた。サイズ排除クロマトグラフィでは、分子量が11kg/mol、多分散性が1.5を示した。
【0142】
【化36】

【0143】
本発明によるモノマーユニットを有する高分子カルバゾール化合物:NK957の実施例3
1.0g(0.85mmol)の6,6’−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロリル)−9,9’−ビス(3,7−ジメチルオクチル)−2,2’−ビス(3,7−ジメチルオクチルオキシ)−3,3’−ビカルバゾリルと、0.45g(0.85mmol)の3,6−ジブロモ−9−(3,7−ジメチルオクチル)−2,7−ジメトキシカルバゾールとの混合物を15mlのトルエン中で室温にて完全に溶解するまで撹拌させた。脱気し、アルゴンを充満し、2mol%のテトラキス(トリフェニルホスフィン)パラジウム(0)を添加し、その後2.4mlの20重量%テトラエチル水酸化アンモニウム水を添加した。混合物を16時間還流させた。そして、1.0mlの4,4,5,5−テトラメチル−1,3,2−ジオキサボロリルベンゼン(末端封鎖剤)およびいくらかの未使用の触媒を添加し、その後さらに40時間還流させた。反応混合物を室温まで冷却させた。残留触媒を除去するために、シアン化ナトリウム水で何度か洗浄を行った。それから有機層を乾燥させ、濃縮した。テトラヒドロフランおよびメタノールをそれぞれ使用して何度か分溜と沈殿をさせてポリマーを分離した。白色の繊維としてポリマー0.68gが得られた。サイズ排除クロマトグラフィでは、分子量が9kg/mol、多分散性が1.6を示した。
【図面の簡単な説明】
【0144】
【図1】ポリマーホストおよびリン光放出材のエネルギー準位スキームを示す図である。
【図2】ポリマーNK921(破線)およびNK351(実線)の77K(ケルビン)におけるリン光スペクトルを示す図である。最低励起三重項準位の位置を破線で示す。
【図3】青色リン光放出材(ADS065BE)を分散した本発明によるホストポリマーNK957のエレクトロルミネッセンススペクトラムを正規化した図を示す。
【図4】本発明によるカルバゾールホストポリマー中に青色リン光放出材を分散させた、NK921[“ねじれた(twisted)ポリマー(方法1)”で示される]、NK938[“ねじれたポリマー(方法2)”で示される]、および従来技術であるカルバゾールホストポリマー[“ねじれていない(non−twisted)ポリマー”で示される]のエレクトロルミネッセンス効率を電圧の関数としてそれぞれ示した図である。
【特許請求の範囲】
【請求項1】
式(I)のモノマーユニットを有する高分子カルバゾール化合物。
-(C1)-(C2)x-(C3)y-(P)n- (I)
(式中、
xおよびyは0または1であり、
nは0または0よりも大きい整数であり、
C1は次式(II)の化合物であり、
【化1】

(II)
C2は次式(III)の化合物であり、
【化2】

(III)
C3は次式(IV)の化合物であり、
【化3】

(IV)
Pは次式(V)の化合物であり、
【化4】

(V)
R1、R2、R3、R4、R6、R7、R8、R9、R11、R12、R13、R14、R16、R17、R18およびR19はHまたは−OR41、−OR42、−SR41、−SR42、−NR41R45、および−NR42R45から成るグループから選択された一つの置換基でもよく、
R5、R10、およびR15はそれぞれの出現毎に同一または異り、R41またはR42から選択されてもよく、
R41は炭素数10〜20の環式または非環式で直鎖または分岐アルキルであり、−O−、−OC(=O)−、−C(=O)O−、−S−、第二級窒素、第三級窒素、第四級窒素、−CR45=CR46−、−C≡C−、−C(=O)−、−C(=O)NR45−、−NR45C(=O)−、−S(=O)−、−S(=O)2−、または−X6−で一回以上分断されていてもよく、および/または一回以上R42、R57、またはR58で置換されたものであってもよく、
R42は炭素数5〜30のアリールであり、一つ以上の芳香族炭素原子はN、OまたはSで置換されていてもよく、一つ以上の芳香族炭素原子はR41、R57、またはR58基を有していてもよく、
R57は、−CN、−CF3、−CSN、−NH2、−NO2、−NCO、−NCS、−OH、−F、−PO2、−PH2、−SH、−Cl、−Br、または−Iであり、
R58は、−C(=O)R45、−C(=O)OR45、−C(=O)NR45R46、−NHR45、−NR45R46、−N(+)R45R46R47、−NC(=O)R45−、−OR45、−OC(=O)R45、−SR45、−S(=O)R45、または−S(=O)2R45であり、
R45、R46、およびR47はそれぞれの出現毎に同一または異なる、H、R41、またはR42であり、
X6は炭素数4〜30のアリーレンであり、一つ以上の芳香族炭素原子はN、OまたはSで置換されていてもよく、一つ以上の芳香族炭素原子はR41、R57、またはR58基を有していてもよく、
xが0であり、yが0であり、およびnが1以上である場合には、
少なくとも一つの[R3、R4、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基であり、
xが0であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4、R11、およびR12]は一つの前記置換基であり、
xが0であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4、R11、およびR12]および少なくとも一つの[R13、R14、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基であり、
xが1であり、yが0であり、およびnが0である場合には、
少なくとも一つの[R3、R4、R6、およびR7]は一つの前記置換基であり、
xが1であり、yが0であり、およびnが1以上である場合には、
少なくとも一つの[R3、R4、R6、およびR7]および少なくとも一つの[R8、R9、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基であり、
xが1であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4、R6、およびR7]および少なくとも一つの[R8、R9、R11、およびR12]は一つの前記置換基あり、
xが1であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4、R6、およびR7]および少なくとも一つの[R8、R9、R11、およびR12]および少なくとも一つの[R13、R14、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基である。)
【請求項2】
請求項1に記載の高分子カルバゾール化合物であって、
式中、
xが0であり、yが0であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R16、R17]は一つの前記置換基であり、
xが0であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R11、R12]は一つの前記置換基であり、
xが0であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R11、R12]、および少なくとも一つの[R13、R14]、および少なくとも一つの[R16、R17]は一つの前記置換基であり、
xが1であり、yが0であり、およびnが0である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R6、R7]は一つの前記置換基であり、
xが1であり、yが0であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R6、R7]、および少なくとも一つの[R16、R17]、および少なくとも一つの[R18、R19]は一つの前記置換基であり、
xが1であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R11、R12]、および少なくとも一つの[R6、R7、R8、R9]は一つの前記置換基であり、
xが1であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R6、R7]、および少なくとも一つの[R8、R9]、および少なくとも一つの[R11、R12]、および少なくとも一つの[R13、R14]、および少なくとも一つの[R16、R17]は一つの前記置換基である化合物。
【請求項3】
請求項1に記載の高分子カルバゾール化合物であって、
式中、xは1であり、yは0であり、nは1であり、R1、R2、R3、R7、R8、R9、R17およびR19のそれぞれはHであり、R4、R6、R16およびR18のそれぞれは−OR41であり、R5およびR10のそれぞれはR41である化合物。
【請求項4】
請求項1に記載の高分子カルバゾール化合物であって、
式中、xは1であり、yは1であり、nは0であり、R2、R3、R6、R7、R8、R12、R13、R14のそれぞれはHであり、R1、R4、R9、R11のそれぞれは−OR41であり、R5、R10およびR15のそれぞれはR41である化合物。
【請求項5】
請求項1に記載の高分子カルバゾール化合物であって、
式中、xは1であり、yは1であり、nは0であり、R1、R2、R3、R7、R8、R9、R12、R13のそれぞれはHであり、R4、R6、R11、およびR14のそれぞれは−OR41であり、R5、R10およびR15のそれぞれはR41である化合物。
【請求項6】
請求項1乃至5の何れか一項に記載の高分子カルバゾール化合物であって、
式中、−OR41はメトキシ(−OCH3、MeO)である化合物。
【請求項7】
請求項1乃至5の何れか一項に記載の高分子カルバゾール化合物であって、
式中、−OR41は化学式−OC10H21の直鎖または分岐アルコキシ鎖である化合物。
【請求項8】
請求項7に記載の高分子カルバゾール化合物であって、
式中、前記化学式−OC10H21の直鎖または分岐アルコキシ鎖は3、7−ジメチルオクチルオキシである化合物。
【請求項9】
請求項1乃至8の何れか一項に記載の高分子カルバゾールであって、
式中、R41は化学式−C10H21の直鎖または分岐アルキル鎖である化合物。
【請求項10】
請求項9に記載の高分子カルバゾール化合物であって、
式中、前記化学式−C10H21の直鎖または分岐アルキル鎖は3、7−ジメチルオクチルである化合物。
【請求項11】
請求項1乃至10の何れか一項に記載の高分子カルバゾール化合物を有する半導体材料。
【請求項12】
請求項11に記載の半導体材料を有するエレクトロルミネッセントデバイス。
【請求項13】
請求項12に記載のエレクトロルミネッセントデバイスであって、
前記半導体材料はルミネッセント発光材と組み合わせる。
【請求項14】
請求項1乃至10の何れか一項に記載の高分子カルバゾール化合物の合成方法。
【請求項15】
請求項1乃至10の何れか一項に記載の高分子カルバゾール化合物の半導体材料としての使用。
【請求項16】
請求項1乃至10の何れか一項に記載の高分子カルバゾール化合物のルミネッセント発光材に対するホストマトリックスとしての使用。
【請求項1】
式(I)のモノマーユニットを有する高分子カルバゾール化合物。
-(C1)-(C2)x-(C3)y-(P)n- (I)
(式中、
xおよびyは0または1であり、
nは0または0よりも大きい整数であり、
C1は次式(II)の化合物であり、
【化1】

(II)
C2は次式(III)の化合物であり、
【化2】

(III)
C3は次式(IV)の化合物であり、
【化3】

(IV)
Pは次式(V)の化合物であり、
【化4】

(V)
R1、R2、R3、R4、R6、R7、R8、R9、R11、R12、R13、R14、R16、R17、R18およびR19はHまたは−OR41、−OR42、−SR41、−SR42、−NR41R45、および−NR42R45から成るグループから選択された一つの置換基でもよく、
R5、R10、およびR15はそれぞれの出現毎に同一または異り、R41またはR42から選択されてもよく、
R41は炭素数10〜20の環式または非環式で直鎖または分岐アルキルであり、−O−、−OC(=O)−、−C(=O)O−、−S−、第二級窒素、第三級窒素、第四級窒素、−CR45=CR46−、−C≡C−、−C(=O)−、−C(=O)NR45−、−NR45C(=O)−、−S(=O)−、−S(=O)2−、または−X6−で一回以上分断されていてもよく、および/または一回以上R42、R57、またはR58で置換されたものであってもよく、
R42は炭素数5〜30のアリールであり、一つ以上の芳香族炭素原子はN、OまたはSで置換されていてもよく、一つ以上の芳香族炭素原子はR41、R57、またはR58基を有していてもよく、
R57は、−CN、−CF3、−CSN、−NH2、−NO2、−NCO、−NCS、−OH、−F、−PO2、−PH2、−SH、−Cl、−Br、または−Iであり、
R58は、−C(=O)R45、−C(=O)OR45、−C(=O)NR45R46、−NHR45、−NR45R46、−N(+)R45R46R47、−NC(=O)R45−、−OR45、−OC(=O)R45、−SR45、−S(=O)R45、または−S(=O)2R45であり、
R45、R46、およびR47はそれぞれの出現毎に同一または異なる、H、R41、またはR42であり、
X6は炭素数4〜30のアリーレンであり、一つ以上の芳香族炭素原子はN、OまたはSで置換されていてもよく、一つ以上の芳香族炭素原子はR41、R57、またはR58基を有していてもよく、
xが0であり、yが0であり、およびnが1以上である場合には、
少なくとも一つの[R3、R4、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基であり、
xが0であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4、R11、およびR12]は一つの前記置換基であり、
xが0であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4、R11、およびR12]および少なくとも一つの[R13、R14、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基であり、
xが1であり、yが0であり、およびnが0である場合には、
少なくとも一つの[R3、R4、R6、およびR7]は一つの前記置換基であり、
xが1であり、yが0であり、およびnが1以上である場合には、
少なくとも一つの[R3、R4、R6、およびR7]および少なくとも一つの[R8、R9、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基であり、
xが1であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4、R6、およびR7]および少なくとも一つの[R8、R9、R11、およびR12]は一つの前記置換基あり、
xが1であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4、R6、およびR7]および少なくとも一つの[R8、R9、R11、およびR12]および少なくとも一つの[R13、R14、R16、およびR17]および少なくとも一つの[R16、R17、R18、およびR19]は一つの前記置換基である。)
【請求項2】
請求項1に記載の高分子カルバゾール化合物であって、
式中、
xが0であり、yが0であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R16、R17]は一つの前記置換基であり、
xが0であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R11、R12]は一つの前記置換基であり、
xが0であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R11、R12]、および少なくとも一つの[R13、R14]、および少なくとも一つの[R16、R17]は一つの前記置換基であり、
xが1であり、yが0であり、およびnが0である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R6、R7]は一つの前記置換基であり、
xが1であり、yが0であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R6、R7]、および少なくとも一つの[R16、R17]、および少なくとも一つの[R18、R19]は一つの前記置換基であり、
xが1であり、yが1であり、およびnが0である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R11、R12]、および少なくとも一つの[R6、R7、R8、R9]は一つの前記置換基であり、
xが1であり、yが1であり、およびn≧1である場合には、
少なくとも一つの[R3、R4]、および少なくとも一つの[R6、R7]、および少なくとも一つの[R8、R9]、および少なくとも一つの[R11、R12]、および少なくとも一つの[R13、R14]、および少なくとも一つの[R16、R17]は一つの前記置換基である化合物。
【請求項3】
請求項1に記載の高分子カルバゾール化合物であって、
式中、xは1であり、yは0であり、nは1であり、R1、R2、R3、R7、R8、R9、R17およびR19のそれぞれはHであり、R4、R6、R16およびR18のそれぞれは−OR41であり、R5およびR10のそれぞれはR41である化合物。
【請求項4】
請求項1に記載の高分子カルバゾール化合物であって、
式中、xは1であり、yは1であり、nは0であり、R2、R3、R6、R7、R8、R12、R13、R14のそれぞれはHであり、R1、R4、R9、R11のそれぞれは−OR41であり、R5、R10およびR15のそれぞれはR41である化合物。
【請求項5】
請求項1に記載の高分子カルバゾール化合物であって、
式中、xは1であり、yは1であり、nは0であり、R1、R2、R3、R7、R8、R9、R12、R13のそれぞれはHであり、R4、R6、R11、およびR14のそれぞれは−OR41であり、R5、R10およびR15のそれぞれはR41である化合物。
【請求項6】
請求項1乃至5の何れか一項に記載の高分子カルバゾール化合物であって、
式中、−OR41はメトキシ(−OCH3、MeO)である化合物。
【請求項7】
請求項1乃至5の何れか一項に記載の高分子カルバゾール化合物であって、
式中、−OR41は化学式−OC10H21の直鎖または分岐アルコキシ鎖である化合物。
【請求項8】
請求項7に記載の高分子カルバゾール化合物であって、
式中、前記化学式−OC10H21の直鎖または分岐アルコキシ鎖は3、7−ジメチルオクチルオキシである化合物。
【請求項9】
請求項1乃至8の何れか一項に記載の高分子カルバゾールであって、
式中、R41は化学式−C10H21の直鎖または分岐アルキル鎖である化合物。
【請求項10】
請求項9に記載の高分子カルバゾール化合物であって、
式中、前記化学式−C10H21の直鎖または分岐アルキル鎖は3、7−ジメチルオクチルである化合物。
【請求項11】
請求項1乃至10の何れか一項に記載の高分子カルバゾール化合物を有する半導体材料。
【請求項12】
請求項11に記載の半導体材料を有するエレクトロルミネッセントデバイス。
【請求項13】
請求項12に記載のエレクトロルミネッセントデバイスであって、
前記半導体材料はルミネッセント発光材と組み合わせる。
【請求項14】
請求項1乃至10の何れか一項に記載の高分子カルバゾール化合物の合成方法。
【請求項15】
請求項1乃至10の何れか一項に記載の高分子カルバゾール化合物の半導体材料としての使用。
【請求項16】
請求項1乃至10の何れか一項に記載の高分子カルバゾール化合物のルミネッセント発光材に対するホストマトリックスとしての使用。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公表番号】特表2009−524703(P2009−524703A)
【公表日】平成21年7月2日(2009.7.2)
【国際特許分類】
【出願番号】特願2008−546697(P2008−546697)
【出願日】平成18年11月22日(2006.11.22)
【国際出願番号】PCT/IB2006/054377
【国際公開番号】WO2007/072240
【国際公開日】平成19年6月28日(2007.6.28)
【出願人】(590000248)コーニンクレッカ フィリップス エレクトロニクス エヌ ヴィ (12,071)
【Fターム(参考)】
【公表日】平成21年7月2日(2009.7.2)
【国際特許分類】
【出願日】平成18年11月22日(2006.11.22)
【国際出願番号】PCT/IB2006/054377
【国際公開番号】WO2007/072240
【国際公開日】平成19年6月28日(2007.6.28)
【出願人】(590000248)コーニンクレッカ フィリップス エレクトロニクス エヌ ヴィ (12,071)
【Fターム(参考)】
[ Back to top ]

