高分子ミセル及びそれを有効成分として含有する固形がんの診断又は治療剤
【課題】造影剤又は治療剤として有用な金属イオンを配位することができ、公知の高分子ミセルよりも血中安定性が高い、新規な高分子ミセルを提供する。
【解決手段】高分子ミセルは、親水性ポリマー鎖セグメントと、側鎖を複数有するセグメントであって該複数の側鎖の60%以上に、三級アミノ基とカルボキシル基を有するキレート化剤残基が直接又はリンカー構造を介して結合されているキレート化剤含有セグメントとを含むブロックコポリマーの自己会合により形成されたものである。
【解決手段】高分子ミセルは、親水性ポリマー鎖セグメントと、側鎖を複数有するセグメントであって該複数の側鎖の60%以上に、三級アミノ基とカルボキシル基を有するキレート化剤残基が直接又はリンカー構造を介して結合されているキレート化剤含有セグメントとを含むブロックコポリマーの自己会合により形成されたものである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、金属イオンが配位可能な新規な高分子ミセルに関する。金属イオンが配位した高分子ミセルは、固形がんの造影剤や治療剤として有用である。
【背景技術】
【0002】
がんに対する療法は外科療法、放射線療法、化学療法の3つに大別される。各療法の進歩によって、有効率・治癒率は向上を続けているものの、がん発生率の上昇に追いつけずに、死亡率の増加を許しているのが現状である。これらの療法に共通しているのは、がんが早期に発見されれば治療成績は大きく向上することである。よって診断技術の進歩はがん死亡率低下に大きく貢献できる。
【0003】
がんの診断技術には、採取した細胞の組織学的診断、血液の生化学的検査、画像診断等がある。画像診断は、X線CT、核磁気共鳴画像(Magnetic Resonance Imaging,以下、「MRI」と略す)、超音波画像などがあるが、その中で、MRIはX線などの被爆がなく非侵襲性であり、X線CTに次ぐ解像度が得られることなどが特長である。
【0004】
このMRIの診断精度を上昇させる目的で、MRI造影剤が用いられている。MRI造影剤を血液内に投与した後に、MRIの撮影を行う。このMRI造影剤として頻繁に用いられているのはGdイオンを配位した低分子キレート化合物である。この様な錯体または複合体の代表例は商品名Magnevistの下に市販されているGd-DTPAである(DTPAとは低分子キレート化剤のジエチレントリアミン五酢酸であり、1分子のDTPAがGd1イオンを配位している)。このキレート化剤中のGdイオンは周辺に存在する水分子の水素原子に働きかけて、そのT1(縦緩和時間)を短縮させる。MRI測定の際に種々の装置パラメーターを適切に設定することで、この短縮したT1を有する水分子をその他の水分子と画像上で明確に区別することが可能となる。よって、このT1短縮効果のおかげで、MRI画像上で高いコントラストを与えることができる。Gd−DTPAは主に血液をコントラスト高く映し出すことで、がん組織の異常血管形成を明瞭にすることで画像診断に役立てている。よって、Gd−DTPAそれ自体は固形がんなどに選択性があるわけではない。また、Gd−DTPAは低分子であるために血管から組織への浸透が速いので、造影剤が生体に注入された後すぐにMRI造影を開始しなければならない。たとえば患者が急に気分が悪くなって2時間ほど休息するような場合には、MRI造影は造影剤の注入からやり直さねばならない。
【0005】
以上のような低分子MRI造影剤の弱点を補い、さらに性能の高い造影剤の開発を目指して、MRI造影効果のあるGdイオンを高分子に結合させる研究が1980年代から行われてきた。これらの研究は、主として、高分子の性質によって造影剤が固形がんなどに夕一ゲティングされ、標的に選択的なMRI画像が得られ、疾患のより正確な診断に役立て得ることを可能にすることを目的とし、さらには、高分子造影剤は血管から組織に拡散する速度が低分子造影剤よりも遅いことを利用し、投与後に適切な造影ができる時間範囲を広くし、患者及び医師の両方にとってMRI診断がより容易なものとすることを目的としている。
【0006】
この高分子化MRI造影剤の代表例としては、天然の高分子であるアルブミンや多糖誘導体や合成のポリ(L−リジン)誘導体を用いたものなどがある。より具体的には、以下の3つの例を挙げることができる。Wikstromらは、アルブミンにキレート剤DTPAを複数結合させそれにGdイオンを配位させたMRI造影剤を報告している(非特許文献1参照。)。Gdイオンが高分子物質のアルブミンに結合することにより、GdイオンあたりのT1を短縮能力(緩和能という)は低分子のGd−DTPAに比べて約4倍に増加している。これはGdイオンが高分子物質に結合することでGdイオンの動きが規制されるために、緩和能が上昇するものと理解されている。この緩和能の上昇は、高分子MRI造影剤の特長の1つである。また、Corotらは多糖のカルボキシメチルデキストランにキレート剤であるDOTA(テトラアザシクロドデカン四酢酸)を結合させ、それにGdイオンを配位させた高分子MRI造影剤を報告している(非特許文献2参照)。この例でも高分子化することにより、T1の緩和能は上昇し、対応する低分子MRI造影剤であるDOTA−Gdの3.4に対し、高分子化したものでは10.6と3倍程になっている。この研究例ではラットに投与したときの血漿中濃度変化も観察している。静脈内投与後30分で、投与量の40%より少し多い量が血漿中に存在したと報告されている。対応する低分子の造影剤DOTA−Gdに比べると約5倍高い濃度であるが、固形がんにターゲティングまたは送達するためには、これでも血液循環性は不足していると考えられる。
【0007】
高分子の構造を最適化し、血液中を長期間に渡って安定に循環し、固形がんへの選択的ターゲティング(またはデリバリー)をもっとも良く達成し得た研究例は、Weisslederらによるものである(非特許文献3参照)。彼らは、ポリ(L−リジン)にポリエチレングリコール鎖を結合させた高分子をキャリヤーに用いることで、DTPAに配位したGdを、血液中を長期間渡って安定に循環して固形がんにターゲティングすることに成功している(150g程度の体重のラットに投与24時間後の、固形がんへの蓄積量が約1.5%dose/gであった)。しかし、この場合でも明確ながんの画像を得ることに成功していない。
【0008】
本出願人は、先に、固形がん組織に選択的に集積し、固形がん組織において解離して高い緩和能を発揮する、Gd内包高分子ミセルを有効成分とするMRI造影剤について特許出願した(特許文献1、非特許文献4)。このGd内包高分子ミセルは、親水性ポリマー鎖セグメントと、側鎖にカルボキシル基及びキレート化剤残基を有するポリマー鎖セグメントとを含んで成るブロックコポリマーと、該ブロックコポリマーに配位したガドリニウムイオンと、ポリアミンとから形成されるものであり、固形がん組織に集積する性質を有し、血液中では解離しないが固形がん組織中で解離して高い緩和能を発揮するため、固形がん組織を選択的にかつ鮮明に映像化できるものである。しかしながら、特許文献1に記載されたGd内包高分子ミセル型MRI造影剤は、固形がん組織を選択的に鮮明に映像化できる優れたものであるが、高分子ミセルからGdイオンがわずかに漏出する恐れがあることを本願発明者らは見出した。Gdイオンは毒性があるので、微量でも漏出しないことが望まれる。
【0009】
この問題を解決するため、本願発明者らは、さらに、キレート化剤を結合する官能基として、カルボキシル基ではなく、水系媒体中で正に帯電するアミノ基を用いることにより防止することができ、それによって、高分子ミセルからのGd3+の漏出を防止し得ることに想到し、親水性ポリマー鎖セグメントと、アミノ基を含む側鎖を複数有するセグメントであって該複数のアミノ基の一部又は全部にガドリニウムキレート化剤残基が直接又はリンカー構造を介して結合されており、かつ、該ガドリニウムキレート化剤残基の一部又は全部にガドリニウムイオンがキレートされているキレート化剤含有セグメントとを含むブロックコポリマーと、該キレート化剤含有セグメントが、高分子ミセル形成時に正の電荷を有する場合にはポリアニオン、負の電荷を有する場合にはポリカチオンとから水系媒体中で形成された高分子ミセルを有効成分とするMRI造影剤を発明した(非特許文献6)。
【0010】
【特許文献1】国際公開WO 2006/003731
【非特許文献1】Investigative Radiology,24,609-615 (1989)
【非特許文献2】Acta Radiologia,38,supplement 412,91-99 (1997)
【非特許文献3】J.Drug Targeting,4,321-330 (1997)
【非特許文献4】Journal of Controlled Release, 2006, Vol 114,Pages 325-333
【非特許文献5】Bioconjugate Chem., 1990, 1, 65-71
【非特許文献6】財団法人神奈川科学技術アカデミー 平成18年度研究概要 39〜42頁、平成19年7月19日発行
【発明の開示】
【発明が解決しようとする課題】
【0011】
非特許文献6に記載した高分子ミセルよりも血中安定性が高い高分子ミセルがもし得られれば、固形がんに到達するまでの時間がより長くても安定に存在するため、血液中で安定に循環し、その結果固形がんへの集積度をより高めることができ、造影剤の場合にはより高感度に固形がんを検出することができる。また、放射線治療に用いられている放射性金属イオンを高分子ミセルに配位させれば、固形がんの放射線治療剤としても有用である。従って、本発明の目的は、造影剤又は治療剤として有用な金属イオンを配位することができ、公知の高分子ミセルよりも血中安定性が高い、新規な高分子ミセルを提供することである。
【課題を解決するための手段】
【0012】
本願発明者らは、鋭意研究の結果、親水性ポリマー鎖セグメントと、側鎖を複数有するセグメントであって該複数の全ての側鎖に三級アミノ基とカルボキシル基を有するキレート化剤残基が直接又はリンカー構造を介して結合されているキレート化剤含有セグメントとを含むブロックコポリマーが、金属イオンを配位していない状態で臨界ミセル濃度以上の濃度で水系媒体中に存在すると、非特許文献6に記載されているようなポリアニオンやポリカチオンのような対イオンがなくても自己会合により高分子ミセルを形成することを見出した。そして、このような自己会合性高分子ミセルを形成後に、高分子ミセルと金属イオンを接触させることにより上記キレート化剤に金属イオンを配位させることができ、得られた金属イオン配位高分子ミセルは、血液中での安定性に優れていることを見出し本発明を完成した。
【0013】
すなわち、本発明は、親水性ポリマー鎖セグメントと、側鎖を複数有するセグメントであって該複数の側鎖の60%以上に、三級アミノ基とカルボキシル基を有するキレート化剤残基が直接又はリンカー構造を介して結合されているキレート化剤含有セグメントとを含むブロックコポリマーの自己会合により形成された高分子ミセルを提供する。また、本発明は、上記本発明の高分子ミセルに金属イオンが配位した金属イオン配位高分子ミセルを提供する。さらに、本発明は、金属イオン配位高分子ミセルを有効成分として含有する、固形がんの診断又は治療剤を提供する。
【発明の効果】
【0014】
本発明により、公知の高分子ミセルよりも血中安定性が高い、新規な高分子ミセルが提供された。本発明の高分子ミセルは、各種金属イオンを配位することが可能であり、ガドリニウム等の造影剤として有用な金属イオンを配位させることにより、造影剤として利用可能であり、また、放射性銅イオンのような、固形がんの治療に有用な金属イオンを配位させることにより固形がんの治療剤として有用である。本発明の高分子ミセルは、血中安定性が高いので、長期間に渡って安定に循環し、固形がんへ選択的にターゲティングすることができる。一方、本発明の高分子ミセルは、高分子ミセルとしては血中安定性が高いが、高分子ミセルであるので、時間が経てば各ブロックコポリマーに分解し、腎臓から自然に排出される。従って、体内での残留毒性の問題もほとんど起きない。このことも実用上、大きな効果である。
【発明を実施するための最良の形態】
【0015】
上記の通り、本発明の高分子ミセルを構成するブロックコポリマーは、親水性ポリマー鎖セグメントと、側鎖を複数有するセグメントであって該複数の側鎖の60%以上に、三級アミノ基とカルボキシル基を有するキレート化剤残基が直接又はリンカー構造を介して結合されているキレート化剤含有セグメントとを含むブロックコポリマーである。
【0016】
上記親水性ポリマー鎖セグメントは、後述するキレート化剤含有セグメントよりも親水性が高いセグメントであり、水系媒体中で高分子ミセルを形成した際にミセルの外側に来る領域である。親水性ポリマー鎖セグメントは、水系媒体中での高分子ミセルの形成を可能にするものであれば特に限定されないが、高分子ミセルを形成しやすく、毒性がない又は低いという観点から、ポリエチレングリコール鎖、ポリビニルアルコール鎖及びポリビニルピロリドン鎖から成る群より選ばれる少なくとも1種から成るものであることが好ましく、特に、ポリエチレングリコール鎖から成るものが好ましい。親水性ポリマー鎖セグメントの分子量は、直径が10nm〜100nm程度の高分子ミセルを効率良く形成する観点から、2000〜2万程度が好ましく、4000〜12000程度がさらに好ましい。
【0017】
上記キレート化剤含有セグメントは、後述するキレート化剤残基との結合に用いられる官能基、好ましくはアミノ基を有する側鎖を複数有するポリマー鎖から誘導されるものである。このようなポリマー鎖は、側鎖に複数のアミノ基のような上記官能基を有し、水系媒体中での高分子ミセルの形成を可能にするものであれば特に限定されないが、高分子ミセルを形成しやすく、毒性がない又は低いという観点から、側鎖にアミノ基を有するアミノ酸(天然のタンパク質を構成するアミノ酸に限定されない)がペプチド結合したポリアミノ酸が好ましく、特にポリリシンが好ましい。なお、ポリリシンを構成するリシンはL体でもD体でもよい(同様に、本明細書及び特許請求の範囲に記載されるアミノ酸であって、光学異性体が存在するアミノ酸は、特に断りがない限りL体でもD体でもよい)。上記官能基を有する側鎖を複数有するポリマー鎖(キレート化剤導入前)の分子量は、直径が10nm〜100nm程度の高分子ミセルを効率良く形成する観点から、2000〜3万程度が好ましく、2000〜1万程度がさらに好ましい。
【0018】
上記側鎖を複数有するポリマー鎖の該側鎖の上記官能基に、キレート化剤残基が直接又はリンカー構造を介して結合される。ここで、キレート化剤残基は、三級アミノ基とカルボキシル基を有するものであることが自己会合高分子ミセルの形成に必要である。好ましくは、三級アミノ基とカルボキシル基をそれぞれ複数、さらに好ましくはそれぞれ2個〜6個、特に3個〜5個有する。キレート化剤残基は、このようなキレート化剤残基であって、固形がんの診断又は治療に有用な金属イオン(後述)をキレートできるものであれば特に限定されず、1,4,7.10-テトラアザシクロドデカン-1,4,7,10-四酢酸(DOTA)、ジエチレントリアミン五酢酸(DTPA)、エチレンジアミン四酢酸(EDTA)等を好ましく用いることができる。これらのうち、構造が安定していて金属イオンをしっかりと保持できる観点からDOTAが特に好ましい。DOTAの化学構造を以下に示す。
【0019】
【化1】

【0020】
なお、DOTAの上記側鎖への結合は、DOTAの4つの酢酸のうちの1つのカルボキシル基をアミノ基とのアミド結合に供することにより行なうことができる。以下、このアミド結合に供されたDOTA残基、すなわち、下記構造式で表される基を「DOTA基」ということがある。
【0021】
【化2】

【0022】
キレート化剤残基は、側鎖が有する上記官能基、好ましくはアミノ基に、アミド結合等により直接結合してもよいし、リンカー構造を介して結合させることもできる。リンカー構造は、単に上記官能基とキレート化剤残基を連結する構造であるから、高分子ミセルの形成に悪影響を与えないものであればその構造は何ら限定されるものではなく、好ましい例として、-OC-(CH2)u-NH-(ここでuは、1〜8の整数)等を挙げることができる。
【0023】
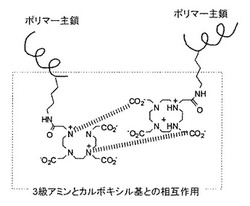
上記キレート化剤残基は、キレート化剤含有セグメントの側鎖の60%以上、好ましくは70%以上、さらに好ましくは90%以上、最も好ましくは100%に導入される。このように、ほとんどの側鎖、好ましくは全ての側鎖にキレート化剤残基が存在することにより、高分子量の自己会合性高分子ミセルが形成可能になる。三級アミンとカルボキシル基を有するキレート化剤残基を各側鎖に有するブロックコポリマーが高分子ミセルを形成する際の、隣接する側鎖に存在するキレート化剤残基の三級アミンとカルボキシル基の相互作用を図1に模式的に示す。キレート化剤残基の導入数は、通常の1H-NMR測定により測定することができる。
【0024】
上記した親水性ポリマー鎖セグメントと、キレート化剤含有セグメントとは、直接結合されていてもよいが、通常、(1) −NH−、−Ra−(CH2)r−Rb−(ここでRaはOCO、OCONH、NHCO、NHCONH、COOまたはCONHを表し、RbはNHまたはOを表し、rは1〜6の整数を表す)等や、(2)COまたは−Rc−(CH2)r−Rd−(ここでRcはOCO、OCONH、NHCO、NHCONH、COOまたはCONHを表し、RdはCOを表し、rは1〜6の整数を表す)等の基を介して結合される。
【0025】
上記したブロックコポリマーの好ましい例として、下記一般式[I]ないし[VIII]で表されるものを挙げることができる。なお、ブロックコポリマーは、単独でも、2種又はそれ以上のものを混合して用いることもできる。
【0026】
【化3】

【0027】
【化4】

【0028】
【化5】

【0029】
【化6】

【0030】
【化7】

【0031】
【化8】

【0032】
【化9】

【0033】
【化10】

【0034】
(上記一般式[I]〜[VIII]中、Xは水素原子、C1−C6アルキル、ヒドロキシ−C1−C6アルキル、アセタールもしくはケタール化ホルミルC1−C6アルキル、アミノC1−C6アルキルまたはベンジル基を有し、
Zは水素原子もしくはヒドロキシ、C1−C6アルキルもしくはC1−C6アルキルオキシ、フェニル−C1−C4アルキルもしくはフェニル−C1−C4アルキルオキシ、C1−C4アルキルフェニルもしくはC1−C4アルキルフェニルオキシ、C1−C6アルコキシカルボニル、フェニル−C1−C4アルコキシカルボニル、C1−C6アルキルアミノカルボニル、またはフェニル−C1−C4アルキルアミノカルボニル基を有し、
nは10〜10,000の整数であり、好ましくは、親水性ポリマー鎖セグメントの上記した好ましい分子量を与える整数であり、
sは0〜6の整数であり、
mは1〜6の整数であり、好ましくは4であり、
tは1〜5の整数であり、好ましくは3であり、
Rは、水素原子、キレート化剤残基又はリンカー−キレート化剤残基を表し、
p及びqは、相互に独立して1〜300の整数であり、好ましくは、アミノ基含有ポリマー鎖の上記した好ましい分子量を与える整数であり、
Y1は、−NH−または−Ra−(CH2)r−Rb−を表し、ここでRaはOCO、OCONH、NHCO、NHCONH、COOまたはCONHを表し、RbはNHまたはOを表し、
Y2は、COまたは−Rc−(CH2)r−Rd−を表し、ここでRcはOCO、OCONH、NHCO、NHCONH、COOまたはCONHを表し、RdはCOを表し、そしてrは1〜6の整数を表す)。
【0035】
本発明に関して使用するC1−C6アルキルまたはC1−C6アルキルオキシ等の基中のアルキル部分は、炭素原子数が1〜6のアルキルであり、メチル、エチル、n−プロピル、iso−プロピル、n−ブチル、tert−ブチル、n−ヘキシル等を意味する。
【0036】
本発明のブロックコポリマーは、それ自体公知のセグメントやキレート化剤を結合することにより製造することができるので、市販又は容易に入手可能な材料を用い、有機化学の常識に従って容易に製造することができる。例えば次の反応スキームに準じて製造したブロックコポリマーに自己会合性高分子ミセルを形成させることにより製造することができる。なお、下記の反応スキームは、好ましいブロックコポリマーの一例の製造方法を示しているが、他のブロックコポリマーも同様な方法により製造することができる。また、下記反応スキームの各工程自体は、当業者が化学常識に基づいて容易に実施することができ、下記実施例に条件を詳細に記載しているので、実施例の記述に準じて容易に実施することができる。
反応スキーム:
【0037】
【化11】

【0038】
上記ブロックコポリマーを、水系媒体中に臨界ミセル濃度(高分子ミセルが形成されない低濃度から濃度を上げて行った際に、複数のブロックコポリマー分子の自己会合により高分子ミセルが形成され始める濃度)以上の濃度で溶解することにより、複数の上記ブロックコポリマー分子が自己会合して自己会合性高分子ミセルが形成される。臨界ミセル濃度は、ブロックコポリマー分子の構造により異なるが、通常、10-2mg/mL程度である。ブロックコポリマーを臨界ミセル濃度以上の濃度で溶解すると高分子ミセルが形成されるが、臨界ミセル濃度の500倍〜5000倍程度、好ましくは800倍〜2000倍程度の高濃度でブロックコポリマーを水系媒体中に溶解して高分子ミセルを形成させることが好ましい。このような高濃度において形成された高分子ミセルは、低濃度で形成された高分子ミセルと比較して粒径はほとんど同じであるが、高分子ミセルを構成するブロックコポリマーの分子数が増大し、その結果、高分子ミセルの重量平均分子量が増大する。臨界ミセル濃度の1000倍の濃度下で形成された高分子ミセルは、300倍の濃度下で形成された高分子ミセルと比較してより大きな分子量を有する。臨界ミセル濃度近傍で形成された高分子ミセルはゆるい会合体を形成しているためGPCでは計測できない。このようなより高分子量の高分子ミセル(以下、「高分子量高分子ミセル」)は、血液中での安定性がさらに高いので好ましい。このようにして形成される高分子量高分子ミセルの重量平均分子量は、通常、100万〜2000万程度、好ましくは400万〜1000万程度である。ここで、高分子量高分子ミセルの分子量は、ゲルろ過クロマトグラフィーにより測定することができる。なお、一旦高分子量高分子ミセルが形成されれば、形成時の濃度よりも低い濃度に希釈しても高分子ミセル構造は壊れない。高分子ミセルが形成されたか否かは、下記実施例に具体的に記載するように、ゲルろ過クロマトグラフィー(GPC)や、DLS(動的光散乱法)等の光学的方法等により溶液中の粒子の粒径を測定することにより調べることができる(ブロックコポリマー分子はDLSでは測定できず、DLSで粒径が測定されれば高分子ミセルが形成されたことがわかる)。また、高分子量高分子ミセルが形成されたか否かは、その分子量を測定することにより確認することができる。水系媒体中で形成される自己会合性高分子ミセルでは、キレート化剤含有セグメントが内側、親水性ポリマー鎖セグメントが外側になる。形成した高分子ミセルは、透析等により濃縮又は回収することができる。
【0039】
上記した本発明の高分子ミセルには、上記キレート化剤残基に金属イオンを配位させることができる。なお、高分子ミセルを形成させる以前のブロックコポリマーに金属イオンを配位させると、金属イオンの陽電荷とカルボキシル基の陰電荷が相互作用し、多くの場合、高分子ミセルの形成が不可能又は困難になる。従って、先に高分子ミセルを形成し、その後、金属イオンを配位させることが好ましい。先に高分子ミセルが形成されている場合には、後から金属イオンを配位させてもそれによって高分子ミセルが解離するようなことはなく、ミセル構造は安定に存在し得る。配位させる金属イオンの量は、用途に応じて適宜設定することができ、全てのキレート化剤残基に配位させてもよいし、一部のキレート化剤残基に配位させてもよい。通常、20%〜100%、好ましくは30%〜70%程度のキレート化剤残基に金属が配位される。
【0040】
配位させる金属イオンは、導入されているキレート化剤にキレートされる、何らかの有用性を与える金属イオンであれば特に限定されないが、本発明の高分子ミセルが血液中に安定に存在し、その結果固形がんへの集積が大きいことから、固形がんの診断用途又は治療用途に有用な金属イオンを配位させることが好ましい。なお、金属の放射性同位体のイオンでもよい。診断用途としては、例えば、MRI(核磁気共鳴画像法)、PET(ポジトロン断層法)又はSPECT(単一光子放射断層撮影法)等の造影剤を挙げることができる。固形がんの診断に有用な金属イオンとしては、ガドリニウム、テクネチウム(99mTc)、タリウム(201Tl)、ガリウム(67Ga)及びインジウム(111In)の各イオンを挙げることができる。これらのうち、ガドリニウムイオンは、MRI造影剤を与えるのに有用であり、テクネチウムイオンは、SPECTに有用であり、タリウムイオンはSPECTに有用であり、ガリウムイオンは、PETに有用であり、インジウムイオンは、SPECTに有用である。また、固形がんの治療に有用な放射性金属イオンとしては、ストロンチウム(89Sr)、サマリウム(153Sm)、銅(67Cu)、イットリウム(90Y)及びレニウム(186Re)を挙げることができる。
【0041】
高分子ミセル内のキレート化剤への上記金属イオンの配位は、単に高分子ミセルの水溶液に、水溶液中で電離により所望の金属イオンが生じる金属塩を混合するだけで達成することができる。金属塩としては、水中での電離度が高い強酸の塩、例えば金属塩化物、硝酸塩、硫酸塩等を用いることが好ましく、特に金属塩化物を用いることが好ましい。この際の混合は、水を溶媒とし、高分子ミセルの濃度を臨界ミセル濃度以上(通常10mg/mL以上)、好ましくは臨界ミセル濃度以上でその2倍以下の濃度とし、金属塩の濃度は、金属イオンを配位させるキレート化剤残基の割合から算出される化学量論量とし、pHを弱酸性〜中性(5.5〜7程度、好ましくは6〜6.5程度)とし、通常、室温〜70℃、好ましくは40℃〜60℃の温度下、通常、1時間〜5時間、好ましくは2時間〜4時間撹拌することにより行なうことができる。金属イオンを配位させた高分子ミセルは、透析などにより精製することができる。配位した金属イオンの数は、ICP(Inductive Coupled Plasma)発光分光分析等により確認することができる。
【0042】
自己会合性高分子ミセルは、上記したブロックコポリマー分子を、通常、数百個含み、その直径が通常10nm〜100nm程度のものである。高分子ミセルは、上記親水性セグメントが外側に向いて水系媒体と接触し、キレート化剤含有セグメントは、内側を向いて配置される。
【0043】
本発明の高分子ミセルは、固形がん組織内の、ナノサイズ粒子の透過性が亢進した血管壁は通過するが、正常組織内の血管壁は通過できない大きさを有するので、固形がん組織内の血管壁を介して癌組織内に選択的に移行し、集積する。固形がん細胞では、塩濃度が高い(NaCl濃度として0.5M程度)ので、固形がん細胞中では解離(dissociate)するのに対し、血液中では、高分子ミセル状態を維持する。
【0044】
金属イオンが配位した高分子ミセルを固形がんの造影剤として用いる場合、例えば、金属イオンがガドリニウムイオンで、MRIの造影剤に用いる場合、高分子ミセルが解離すると、より水分子がGd3+に接近できるようになり、Gd3+による緩和能がより効果的に発揮され、MRIによる映像化ができる。しかも、高分子ミセルが解離しても、Gd3+は、ブロックコポリマーに結合しているため、比較的長時間細胞中に滞在し、その間は癌細胞の映像化が可能である。また、万一血液中で高分子ミセルが解離しても、ブロックコポリマーは腎臓により速やかに除去される。このため、本発明のMRI造影剤によれば、固形がん組織を映像化することが可能であり、しかも、映像化可能な時間は比較的長く、患者にしばらく休息が必要な場合でもMRIの注射をやり直す必要がない。PETやSPECT等の造影剤として用いる場合も同様である。
【0045】
造影剤として用いる場合、例えば、生理食塩水等に溶解したものを、静脈注射等により非経口投与する。投与量は、金属イオン量として、公知の造影剤と同程度でよく、例えば、ガドリニウムイオンが配位したMRI造影剤の場合は、体重1kg当たり、ガドリニウムイオン量として0.01mmol〜0.5mmol程度である。
【0046】
放射性の金属イオンを配位させて高分子ミセルを固形がんの治療剤として用いる場合、上記の通り、高分子ミセルは固形がんに集積され、固形がん中で解離して放射性金属イオンが放出され、放射性金属イオンによる治療効果が発揮される。
【0047】
固形がんの治療剤として用いる場合も、造影剤の場合と同様、例えば、生理食塩水等に溶解したものを、静脈注射等により非経口投与する。投与量は、放射性金属イオン量として、公知の造影剤と同程度でよく、例えば、体重1kg、1日当たり、放射性金属イオン量として、0.01MBq〜5MBq程度である。
【0048】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【実施例1】
【0049】
キレート化剤残基を有するブロックコポリマーの合成
【0050】
下記反応スキーム1及び反応スキーム2により、キレート化剤残基を有するブロックコポリマーを合成した。
【0051】
【化12】

反応スキーム1
【0052】
【化13】

反応スキーム2
【0053】
(1) 酸加水分解
ポリエチレングリコール−block−ポリ(ε−ベンジルオキシカルボニル−L−リシン)(以下PEG−PLys(Z)と略記する。)のポリエチレングリコール鎖の分子量が5000でε−ベンジルオキシカルボニル−L−リシンの重合度が28のものを3.22gとり、トリフルオロ酢酸32.0mL加えて室温で1時間攪拌し、透明の溶液を得た。アニソール32.0mL及びメタンスルホン酸24.0mLを加えて、室温でさらに攪拌した。蒸留水160mLおよびエーテル150mLを加えた。有機層が中性になるまで水層をエーテルで抽出し、水層をトリエチルアミンを加えて中性にした。その後、0.1N水酸化ナトリウム、蒸留水で透析操作を行った。最後に、凍結乾燥を行い、ポリエチレングリコール−block−ポリリシン(以下、PEG−PLysと略記する。)2.07gを得た。
【0054】
以上と同様の手順により、下記の表1に示す2種のPEG−PLysを得た。
【0055】
【表1】

【0056】
(2) DOTA(1,4,7.10−テトラアザシクロドデカン−1,4,7,10−四酢酸)ユニットの結合
PEG−PLys(5000−28)(表1のRun1)204mgと残存アミノ基に対して2.0倍モル等量の活性エステル化DOTAを加え、DMFを加えて溶解させた後に、トリエチルアミンを加え、50℃で一晩攪拌した。得られた溶液を水に対して透析し(3.3mg/mLのポリマー濃度)、凍結乾燥した。精製後に得られたDOTA基導入ブロックコポリマー(PEG−P(Lys−DOTA))のLysのユニット数、DOTAのユニット数は、1H−NMR測定により求め、Lysのユニット数が21、DOTAユニット数は21であった。上記で得られたPEG−P(Lys−DOTA)を10mg/mLの濃度で再度水へ溶解させて透析を行い、凍結乾燥した。この際、得られたサンプルのLysのユニット数、DOTA基のユニット数は同じであった。
【0057】
以上と同様の手順によって実験を行い、PEG−P(Lys−DOTA)のLysのユニット数が20、DOTAユニット数は20が得られた。また、PEG−PLys(5000−21)からDOTA基の導入を行い、Lysのユニット数が17、DOTAユニット数が17のEG−P(Lys−DOTA)を得た(表2)。
【0058】
【表2】

【実施例2】
【0059】
PEG−P(Lys−DOTA)へのガドリニウムイオンの結合
(1)ガドリニウム(III)イオンの配位
PEG−PLL(DOTA)(5,000‐21‐21)(上記に示した高分子ミセルを形成させたブロックコポリマー)199mgに対して、20mLの蒸留水を加えて溶解し、pHを6.0−6.5に調整した。DOTA基21残基に対して0.40倍等量のGdイオンをGdCl3水溶液として加え、50℃、3時間pHを6−6.5に調整しながら攪拌した。得られた溶液を分画分子量1000の透析膜を用いて、蒸留水に対して透析し、凍結乾燥した。Gdイオンの導入量はICP(Inductive Coupled Plasma)発光分光分析を用いて決定した。精製後に得られたPEG−P(Lys−DOTA−Gd)のGdイオン導入数は7となった(表3)。
【0060】
以上と同様の手順によって、PEG−PLL(DOTA)(5,000‐17‐17)からGdイオンを含むポリマーPEG−PLL(DOTA―Gd)を得た(表3)。
【0061】
(2)銅(II)イオンの配位
PEG−PLL(DOTA)(5,000‐20‐20)25.0 mgに対して、5mLの蒸留水を加えて溶解し、pHを6.0−6.5に調整した。DOTA基20残基に対して0.46倍等量(9.2個/20DOTA基)のCu(II)イオンをCuCl3水溶液として加え、50℃、3時間pHを6−6.5に調整しながら攪拌した。得られた溶液を分画分子量1000の透析膜を用いて、蒸留水に対して透析し、凍結乾燥した。Gdイオンの導入量はICP(Inductive Coupled Plasma)発光分光分析を用いて決定した。精製後に得られたPEG−P(Lys−DOTA−Cu)のCu(II)イオン導入数は9となった(表3)。
【0062】
【表3】

【実施例3】
【0063】
ブロックコポリマーのGPC及びDLS測定
上記に得られたブロックコポリマーPEG−P(Lys−DOTA)、10mg/mLで再透析したPEG−P(Lys−DOTA)、及びそのブロックコポリマーから得られたPEG−P(Lys−DOTA−Gd)のGPC測定をポリマー濃度2.0mg/mLとして測定した。再透析したブロックコポリマーの保持時間(Retention time)が6.17分から5.72分へと早くなった(表4、図2)。このことは形成された粒子が見かけ上より大きな分子量へ変化したことを示している。また、GPCにより測定された重量平均分子量は、407万から504万へと大きく現れた。また、形成されたPEG−P(Lys−DOTA−Gd)の粒子径をDLS測定によって求めた。粒子径はキュムラント法で計算され、Gd(III)の場合とCu(II)の場合どちらも200nm以下の粒子径を与えた(表5)。
【0064】
【表4】

【0065】
【表5】

【実施例4】
【0066】
高分子ミセルMRI造影剤の血液中濃度の変化
上記で高分子ミセル化したPEG−P(Lys−DOTA−Gd)(5、000−17−17−7)を生理食塩水に溶解し、一晩かくはんした後に0.22μmサイズでろ過滅菌した。Gdイオン濃度は10mMとなるように調整した。マウス(ddY4週齢)の尾静脈より10mMGdイオン濃度の高分子ミセル溶液を0.1mL静脈から注射し、30分、1時間、4時間、25時間、48時間毎に血液を採取し、その血液中のGdイオン濃度をICPにより測定し、全血液中のGdイオン濃度を算出した。
【0067】
結果を図3に示す。図3に示されるように、血液中のGdイオン量は、静脈注射48時間後でもなお約10%残留しており、高分子ミセルに金属イオンが封入されたものとしては極めて血液安定性が高かった。
【実施例5】
【0068】
高分子ミセルMRI造影剤の固形がんへの集積
上記で高分子ミセル化したPEG−P(Lys−DOTA−Gd)(5、000−21−21−7)を生理食塩水に溶解し、一晩かくはんした後に0.22μmサイズでろ過滅菌した。Gdイオン濃度は10mMとなるように調整した。担がんマウス(CDF1マウス)の尾静脈より10mMGdイオン濃度の高分子ミセル溶液を0.1mL静脈から注射し、24時間後の腫瘍のGdイオン濃度によって算出した。また、同時に腫瘍におけるMRI測定を投与前と24時間後に行いT1強調画像を取得し、その画像強度を比較した。MRI造影剤投与後、24時間後にマウス血液中にMRI造影剤は25.6±1.9%(平均±標準偏差)以上が残存し、腫瘍へ高分子ミセルMRI造影剤が集積していることを確認した。MRI造影剤投与前の腫瘍の画像強度に対して、MRI造影剤投与後に得られた腫瘍の画像強度は元の画像に対して高くなった。
【図面の簡単な説明】
【0069】
【図1】本発明の自己会合性高分子ミセルにおける、ポリマー側鎖に導入されたキレート化剤残基中の三級アミノ基とカルボキシル基の相互作用を模式的に示す図である。
【図2】本発明の実施例で作製したブロックコポリマーをミセル化する前後におけるゲルろ過クロマトグラフィーの溶出パターンを示す図である。
【図3】本発明の実施例で作製した、ガドリニウムイオンが配位した自己会合性高分子ミセルをマウスに静脈注射した際の血液中のガドリニウムイオン量(相対値)の経時変化を示すである。
【技術分野】
【0001】
本発明は、金属イオンが配位可能な新規な高分子ミセルに関する。金属イオンが配位した高分子ミセルは、固形がんの造影剤や治療剤として有用である。
【背景技術】
【0002】
がんに対する療法は外科療法、放射線療法、化学療法の3つに大別される。各療法の進歩によって、有効率・治癒率は向上を続けているものの、がん発生率の上昇に追いつけずに、死亡率の増加を許しているのが現状である。これらの療法に共通しているのは、がんが早期に発見されれば治療成績は大きく向上することである。よって診断技術の進歩はがん死亡率低下に大きく貢献できる。
【0003】
がんの診断技術には、採取した細胞の組織学的診断、血液の生化学的検査、画像診断等がある。画像診断は、X線CT、核磁気共鳴画像(Magnetic Resonance Imaging,以下、「MRI」と略す)、超音波画像などがあるが、その中で、MRIはX線などの被爆がなく非侵襲性であり、X線CTに次ぐ解像度が得られることなどが特長である。
【0004】
このMRIの診断精度を上昇させる目的で、MRI造影剤が用いられている。MRI造影剤を血液内に投与した後に、MRIの撮影を行う。このMRI造影剤として頻繁に用いられているのはGdイオンを配位した低分子キレート化合物である。この様な錯体または複合体の代表例は商品名Magnevistの下に市販されているGd-DTPAである(DTPAとは低分子キレート化剤のジエチレントリアミン五酢酸であり、1分子のDTPAがGd1イオンを配位している)。このキレート化剤中のGdイオンは周辺に存在する水分子の水素原子に働きかけて、そのT1(縦緩和時間)を短縮させる。MRI測定の際に種々の装置パラメーターを適切に設定することで、この短縮したT1を有する水分子をその他の水分子と画像上で明確に区別することが可能となる。よって、このT1短縮効果のおかげで、MRI画像上で高いコントラストを与えることができる。Gd−DTPAは主に血液をコントラスト高く映し出すことで、がん組織の異常血管形成を明瞭にすることで画像診断に役立てている。よって、Gd−DTPAそれ自体は固形がんなどに選択性があるわけではない。また、Gd−DTPAは低分子であるために血管から組織への浸透が速いので、造影剤が生体に注入された後すぐにMRI造影を開始しなければならない。たとえば患者が急に気分が悪くなって2時間ほど休息するような場合には、MRI造影は造影剤の注入からやり直さねばならない。
【0005】
以上のような低分子MRI造影剤の弱点を補い、さらに性能の高い造影剤の開発を目指して、MRI造影効果のあるGdイオンを高分子に結合させる研究が1980年代から行われてきた。これらの研究は、主として、高分子の性質によって造影剤が固形がんなどに夕一ゲティングされ、標的に選択的なMRI画像が得られ、疾患のより正確な診断に役立て得ることを可能にすることを目的とし、さらには、高分子造影剤は血管から組織に拡散する速度が低分子造影剤よりも遅いことを利用し、投与後に適切な造影ができる時間範囲を広くし、患者及び医師の両方にとってMRI診断がより容易なものとすることを目的としている。
【0006】
この高分子化MRI造影剤の代表例としては、天然の高分子であるアルブミンや多糖誘導体や合成のポリ(L−リジン)誘導体を用いたものなどがある。より具体的には、以下の3つの例を挙げることができる。Wikstromらは、アルブミンにキレート剤DTPAを複数結合させそれにGdイオンを配位させたMRI造影剤を報告している(非特許文献1参照。)。Gdイオンが高分子物質のアルブミンに結合することにより、GdイオンあたりのT1を短縮能力(緩和能という)は低分子のGd−DTPAに比べて約4倍に増加している。これはGdイオンが高分子物質に結合することでGdイオンの動きが規制されるために、緩和能が上昇するものと理解されている。この緩和能の上昇は、高分子MRI造影剤の特長の1つである。また、Corotらは多糖のカルボキシメチルデキストランにキレート剤であるDOTA(テトラアザシクロドデカン四酢酸)を結合させ、それにGdイオンを配位させた高分子MRI造影剤を報告している(非特許文献2参照)。この例でも高分子化することにより、T1の緩和能は上昇し、対応する低分子MRI造影剤であるDOTA−Gdの3.4に対し、高分子化したものでは10.6と3倍程になっている。この研究例ではラットに投与したときの血漿中濃度変化も観察している。静脈内投与後30分で、投与量の40%より少し多い量が血漿中に存在したと報告されている。対応する低分子の造影剤DOTA−Gdに比べると約5倍高い濃度であるが、固形がんにターゲティングまたは送達するためには、これでも血液循環性は不足していると考えられる。
【0007】
高分子の構造を最適化し、血液中を長期間に渡って安定に循環し、固形がんへの選択的ターゲティング(またはデリバリー)をもっとも良く達成し得た研究例は、Weisslederらによるものである(非特許文献3参照)。彼らは、ポリ(L−リジン)にポリエチレングリコール鎖を結合させた高分子をキャリヤーに用いることで、DTPAに配位したGdを、血液中を長期間渡って安定に循環して固形がんにターゲティングすることに成功している(150g程度の体重のラットに投与24時間後の、固形がんへの蓄積量が約1.5%dose/gであった)。しかし、この場合でも明確ながんの画像を得ることに成功していない。
【0008】
本出願人は、先に、固形がん組織に選択的に集積し、固形がん組織において解離して高い緩和能を発揮する、Gd内包高分子ミセルを有効成分とするMRI造影剤について特許出願した(特許文献1、非特許文献4)。このGd内包高分子ミセルは、親水性ポリマー鎖セグメントと、側鎖にカルボキシル基及びキレート化剤残基を有するポリマー鎖セグメントとを含んで成るブロックコポリマーと、該ブロックコポリマーに配位したガドリニウムイオンと、ポリアミンとから形成されるものであり、固形がん組織に集積する性質を有し、血液中では解離しないが固形がん組織中で解離して高い緩和能を発揮するため、固形がん組織を選択的にかつ鮮明に映像化できるものである。しかしながら、特許文献1に記載されたGd内包高分子ミセル型MRI造影剤は、固形がん組織を選択的に鮮明に映像化できる優れたものであるが、高分子ミセルからGdイオンがわずかに漏出する恐れがあることを本願発明者らは見出した。Gdイオンは毒性があるので、微量でも漏出しないことが望まれる。
【0009】
この問題を解決するため、本願発明者らは、さらに、キレート化剤を結合する官能基として、カルボキシル基ではなく、水系媒体中で正に帯電するアミノ基を用いることにより防止することができ、それによって、高分子ミセルからのGd3+の漏出を防止し得ることに想到し、親水性ポリマー鎖セグメントと、アミノ基を含む側鎖を複数有するセグメントであって該複数のアミノ基の一部又は全部にガドリニウムキレート化剤残基が直接又はリンカー構造を介して結合されており、かつ、該ガドリニウムキレート化剤残基の一部又は全部にガドリニウムイオンがキレートされているキレート化剤含有セグメントとを含むブロックコポリマーと、該キレート化剤含有セグメントが、高分子ミセル形成時に正の電荷を有する場合にはポリアニオン、負の電荷を有する場合にはポリカチオンとから水系媒体中で形成された高分子ミセルを有効成分とするMRI造影剤を発明した(非特許文献6)。
【0010】
【特許文献1】国際公開WO 2006/003731
【非特許文献1】Investigative Radiology,24,609-615 (1989)
【非特許文献2】Acta Radiologia,38,supplement 412,91-99 (1997)
【非特許文献3】J.Drug Targeting,4,321-330 (1997)
【非特許文献4】Journal of Controlled Release, 2006, Vol 114,Pages 325-333
【非特許文献5】Bioconjugate Chem., 1990, 1, 65-71
【非特許文献6】財団法人神奈川科学技術アカデミー 平成18年度研究概要 39〜42頁、平成19年7月19日発行
【発明の開示】
【発明が解決しようとする課題】
【0011】
非特許文献6に記載した高分子ミセルよりも血中安定性が高い高分子ミセルがもし得られれば、固形がんに到達するまでの時間がより長くても安定に存在するため、血液中で安定に循環し、その結果固形がんへの集積度をより高めることができ、造影剤の場合にはより高感度に固形がんを検出することができる。また、放射線治療に用いられている放射性金属イオンを高分子ミセルに配位させれば、固形がんの放射線治療剤としても有用である。従って、本発明の目的は、造影剤又は治療剤として有用な金属イオンを配位することができ、公知の高分子ミセルよりも血中安定性が高い、新規な高分子ミセルを提供することである。
【課題を解決するための手段】
【0012】
本願発明者らは、鋭意研究の結果、親水性ポリマー鎖セグメントと、側鎖を複数有するセグメントであって該複数の全ての側鎖に三級アミノ基とカルボキシル基を有するキレート化剤残基が直接又はリンカー構造を介して結合されているキレート化剤含有セグメントとを含むブロックコポリマーが、金属イオンを配位していない状態で臨界ミセル濃度以上の濃度で水系媒体中に存在すると、非特許文献6に記載されているようなポリアニオンやポリカチオンのような対イオンがなくても自己会合により高分子ミセルを形成することを見出した。そして、このような自己会合性高分子ミセルを形成後に、高分子ミセルと金属イオンを接触させることにより上記キレート化剤に金属イオンを配位させることができ、得られた金属イオン配位高分子ミセルは、血液中での安定性に優れていることを見出し本発明を完成した。
【0013】
すなわち、本発明は、親水性ポリマー鎖セグメントと、側鎖を複数有するセグメントであって該複数の側鎖の60%以上に、三級アミノ基とカルボキシル基を有するキレート化剤残基が直接又はリンカー構造を介して結合されているキレート化剤含有セグメントとを含むブロックコポリマーの自己会合により形成された高分子ミセルを提供する。また、本発明は、上記本発明の高分子ミセルに金属イオンが配位した金属イオン配位高分子ミセルを提供する。さらに、本発明は、金属イオン配位高分子ミセルを有効成分として含有する、固形がんの診断又は治療剤を提供する。
【発明の効果】
【0014】
本発明により、公知の高分子ミセルよりも血中安定性が高い、新規な高分子ミセルが提供された。本発明の高分子ミセルは、各種金属イオンを配位することが可能であり、ガドリニウム等の造影剤として有用な金属イオンを配位させることにより、造影剤として利用可能であり、また、放射性銅イオンのような、固形がんの治療に有用な金属イオンを配位させることにより固形がんの治療剤として有用である。本発明の高分子ミセルは、血中安定性が高いので、長期間に渡って安定に循環し、固形がんへ選択的にターゲティングすることができる。一方、本発明の高分子ミセルは、高分子ミセルとしては血中安定性が高いが、高分子ミセルであるので、時間が経てば各ブロックコポリマーに分解し、腎臓から自然に排出される。従って、体内での残留毒性の問題もほとんど起きない。このことも実用上、大きな効果である。
【発明を実施するための最良の形態】
【0015】
上記の通り、本発明の高分子ミセルを構成するブロックコポリマーは、親水性ポリマー鎖セグメントと、側鎖を複数有するセグメントであって該複数の側鎖の60%以上に、三級アミノ基とカルボキシル基を有するキレート化剤残基が直接又はリンカー構造を介して結合されているキレート化剤含有セグメントとを含むブロックコポリマーである。
【0016】
上記親水性ポリマー鎖セグメントは、後述するキレート化剤含有セグメントよりも親水性が高いセグメントであり、水系媒体中で高分子ミセルを形成した際にミセルの外側に来る領域である。親水性ポリマー鎖セグメントは、水系媒体中での高分子ミセルの形成を可能にするものであれば特に限定されないが、高分子ミセルを形成しやすく、毒性がない又は低いという観点から、ポリエチレングリコール鎖、ポリビニルアルコール鎖及びポリビニルピロリドン鎖から成る群より選ばれる少なくとも1種から成るものであることが好ましく、特に、ポリエチレングリコール鎖から成るものが好ましい。親水性ポリマー鎖セグメントの分子量は、直径が10nm〜100nm程度の高分子ミセルを効率良く形成する観点から、2000〜2万程度が好ましく、4000〜12000程度がさらに好ましい。
【0017】
上記キレート化剤含有セグメントは、後述するキレート化剤残基との結合に用いられる官能基、好ましくはアミノ基を有する側鎖を複数有するポリマー鎖から誘導されるものである。このようなポリマー鎖は、側鎖に複数のアミノ基のような上記官能基を有し、水系媒体中での高分子ミセルの形成を可能にするものであれば特に限定されないが、高分子ミセルを形成しやすく、毒性がない又は低いという観点から、側鎖にアミノ基を有するアミノ酸(天然のタンパク質を構成するアミノ酸に限定されない)がペプチド結合したポリアミノ酸が好ましく、特にポリリシンが好ましい。なお、ポリリシンを構成するリシンはL体でもD体でもよい(同様に、本明細書及び特許請求の範囲に記載されるアミノ酸であって、光学異性体が存在するアミノ酸は、特に断りがない限りL体でもD体でもよい)。上記官能基を有する側鎖を複数有するポリマー鎖(キレート化剤導入前)の分子量は、直径が10nm〜100nm程度の高分子ミセルを効率良く形成する観点から、2000〜3万程度が好ましく、2000〜1万程度がさらに好ましい。
【0018】
上記側鎖を複数有するポリマー鎖の該側鎖の上記官能基に、キレート化剤残基が直接又はリンカー構造を介して結合される。ここで、キレート化剤残基は、三級アミノ基とカルボキシル基を有するものであることが自己会合高分子ミセルの形成に必要である。好ましくは、三級アミノ基とカルボキシル基をそれぞれ複数、さらに好ましくはそれぞれ2個〜6個、特に3個〜5個有する。キレート化剤残基は、このようなキレート化剤残基であって、固形がんの診断又は治療に有用な金属イオン(後述)をキレートできるものであれば特に限定されず、1,4,7.10-テトラアザシクロドデカン-1,4,7,10-四酢酸(DOTA)、ジエチレントリアミン五酢酸(DTPA)、エチレンジアミン四酢酸(EDTA)等を好ましく用いることができる。これらのうち、構造が安定していて金属イオンをしっかりと保持できる観点からDOTAが特に好ましい。DOTAの化学構造を以下に示す。
【0019】
【化1】

【0020】
なお、DOTAの上記側鎖への結合は、DOTAの4つの酢酸のうちの1つのカルボキシル基をアミノ基とのアミド結合に供することにより行なうことができる。以下、このアミド結合に供されたDOTA残基、すなわち、下記構造式で表される基を「DOTA基」ということがある。
【0021】
【化2】

【0022】
キレート化剤残基は、側鎖が有する上記官能基、好ましくはアミノ基に、アミド結合等により直接結合してもよいし、リンカー構造を介して結合させることもできる。リンカー構造は、単に上記官能基とキレート化剤残基を連結する構造であるから、高分子ミセルの形成に悪影響を与えないものであればその構造は何ら限定されるものではなく、好ましい例として、-OC-(CH2)u-NH-(ここでuは、1〜8の整数)等を挙げることができる。
【0023】
上記キレート化剤残基は、キレート化剤含有セグメントの側鎖の60%以上、好ましくは70%以上、さらに好ましくは90%以上、最も好ましくは100%に導入される。このように、ほとんどの側鎖、好ましくは全ての側鎖にキレート化剤残基が存在することにより、高分子量の自己会合性高分子ミセルが形成可能になる。三級アミンとカルボキシル基を有するキレート化剤残基を各側鎖に有するブロックコポリマーが高分子ミセルを形成する際の、隣接する側鎖に存在するキレート化剤残基の三級アミンとカルボキシル基の相互作用を図1に模式的に示す。キレート化剤残基の導入数は、通常の1H-NMR測定により測定することができる。
【0024】
上記した親水性ポリマー鎖セグメントと、キレート化剤含有セグメントとは、直接結合されていてもよいが、通常、(1) −NH−、−Ra−(CH2)r−Rb−(ここでRaはOCO、OCONH、NHCO、NHCONH、COOまたはCONHを表し、RbはNHまたはOを表し、rは1〜6の整数を表す)等や、(2)COまたは−Rc−(CH2)r−Rd−(ここでRcはOCO、OCONH、NHCO、NHCONH、COOまたはCONHを表し、RdはCOを表し、rは1〜6の整数を表す)等の基を介して結合される。
【0025】
上記したブロックコポリマーの好ましい例として、下記一般式[I]ないし[VIII]で表されるものを挙げることができる。なお、ブロックコポリマーは、単独でも、2種又はそれ以上のものを混合して用いることもできる。
【0026】
【化3】

【0027】
【化4】

【0028】
【化5】

【0029】
【化6】

【0030】
【化7】

【0031】
【化8】

【0032】
【化9】

【0033】
【化10】

【0034】
(上記一般式[I]〜[VIII]中、Xは水素原子、C1−C6アルキル、ヒドロキシ−C1−C6アルキル、アセタールもしくはケタール化ホルミルC1−C6アルキル、アミノC1−C6アルキルまたはベンジル基を有し、
Zは水素原子もしくはヒドロキシ、C1−C6アルキルもしくはC1−C6アルキルオキシ、フェニル−C1−C4アルキルもしくはフェニル−C1−C4アルキルオキシ、C1−C4アルキルフェニルもしくはC1−C4アルキルフェニルオキシ、C1−C6アルコキシカルボニル、フェニル−C1−C4アルコキシカルボニル、C1−C6アルキルアミノカルボニル、またはフェニル−C1−C4アルキルアミノカルボニル基を有し、
nは10〜10,000の整数であり、好ましくは、親水性ポリマー鎖セグメントの上記した好ましい分子量を与える整数であり、
sは0〜6の整数であり、
mは1〜6の整数であり、好ましくは4であり、
tは1〜5の整数であり、好ましくは3であり、
Rは、水素原子、キレート化剤残基又はリンカー−キレート化剤残基を表し、
p及びqは、相互に独立して1〜300の整数であり、好ましくは、アミノ基含有ポリマー鎖の上記した好ましい分子量を与える整数であり、
Y1は、−NH−または−Ra−(CH2)r−Rb−を表し、ここでRaはOCO、OCONH、NHCO、NHCONH、COOまたはCONHを表し、RbはNHまたはOを表し、
Y2は、COまたは−Rc−(CH2)r−Rd−を表し、ここでRcはOCO、OCONH、NHCO、NHCONH、COOまたはCONHを表し、RdはCOを表し、そしてrは1〜6の整数を表す)。
【0035】
本発明に関して使用するC1−C6アルキルまたはC1−C6アルキルオキシ等の基中のアルキル部分は、炭素原子数が1〜6のアルキルであり、メチル、エチル、n−プロピル、iso−プロピル、n−ブチル、tert−ブチル、n−ヘキシル等を意味する。
【0036】
本発明のブロックコポリマーは、それ自体公知のセグメントやキレート化剤を結合することにより製造することができるので、市販又は容易に入手可能な材料を用い、有機化学の常識に従って容易に製造することができる。例えば次の反応スキームに準じて製造したブロックコポリマーに自己会合性高分子ミセルを形成させることにより製造することができる。なお、下記の反応スキームは、好ましいブロックコポリマーの一例の製造方法を示しているが、他のブロックコポリマーも同様な方法により製造することができる。また、下記反応スキームの各工程自体は、当業者が化学常識に基づいて容易に実施することができ、下記実施例に条件を詳細に記載しているので、実施例の記述に準じて容易に実施することができる。
反応スキーム:
【0037】
【化11】

【0038】
上記ブロックコポリマーを、水系媒体中に臨界ミセル濃度(高分子ミセルが形成されない低濃度から濃度を上げて行った際に、複数のブロックコポリマー分子の自己会合により高分子ミセルが形成され始める濃度)以上の濃度で溶解することにより、複数の上記ブロックコポリマー分子が自己会合して自己会合性高分子ミセルが形成される。臨界ミセル濃度は、ブロックコポリマー分子の構造により異なるが、通常、10-2mg/mL程度である。ブロックコポリマーを臨界ミセル濃度以上の濃度で溶解すると高分子ミセルが形成されるが、臨界ミセル濃度の500倍〜5000倍程度、好ましくは800倍〜2000倍程度の高濃度でブロックコポリマーを水系媒体中に溶解して高分子ミセルを形成させることが好ましい。このような高濃度において形成された高分子ミセルは、低濃度で形成された高分子ミセルと比較して粒径はほとんど同じであるが、高分子ミセルを構成するブロックコポリマーの分子数が増大し、その結果、高分子ミセルの重量平均分子量が増大する。臨界ミセル濃度の1000倍の濃度下で形成された高分子ミセルは、300倍の濃度下で形成された高分子ミセルと比較してより大きな分子量を有する。臨界ミセル濃度近傍で形成された高分子ミセルはゆるい会合体を形成しているためGPCでは計測できない。このようなより高分子量の高分子ミセル(以下、「高分子量高分子ミセル」)は、血液中での安定性がさらに高いので好ましい。このようにして形成される高分子量高分子ミセルの重量平均分子量は、通常、100万〜2000万程度、好ましくは400万〜1000万程度である。ここで、高分子量高分子ミセルの分子量は、ゲルろ過クロマトグラフィーにより測定することができる。なお、一旦高分子量高分子ミセルが形成されれば、形成時の濃度よりも低い濃度に希釈しても高分子ミセル構造は壊れない。高分子ミセルが形成されたか否かは、下記実施例に具体的に記載するように、ゲルろ過クロマトグラフィー(GPC)や、DLS(動的光散乱法)等の光学的方法等により溶液中の粒子の粒径を測定することにより調べることができる(ブロックコポリマー分子はDLSでは測定できず、DLSで粒径が測定されれば高分子ミセルが形成されたことがわかる)。また、高分子量高分子ミセルが形成されたか否かは、その分子量を測定することにより確認することができる。水系媒体中で形成される自己会合性高分子ミセルでは、キレート化剤含有セグメントが内側、親水性ポリマー鎖セグメントが外側になる。形成した高分子ミセルは、透析等により濃縮又は回収することができる。
【0039】
上記した本発明の高分子ミセルには、上記キレート化剤残基に金属イオンを配位させることができる。なお、高分子ミセルを形成させる以前のブロックコポリマーに金属イオンを配位させると、金属イオンの陽電荷とカルボキシル基の陰電荷が相互作用し、多くの場合、高分子ミセルの形成が不可能又は困難になる。従って、先に高分子ミセルを形成し、その後、金属イオンを配位させることが好ましい。先に高分子ミセルが形成されている場合には、後から金属イオンを配位させてもそれによって高分子ミセルが解離するようなことはなく、ミセル構造は安定に存在し得る。配位させる金属イオンの量は、用途に応じて適宜設定することができ、全てのキレート化剤残基に配位させてもよいし、一部のキレート化剤残基に配位させてもよい。通常、20%〜100%、好ましくは30%〜70%程度のキレート化剤残基に金属が配位される。
【0040】
配位させる金属イオンは、導入されているキレート化剤にキレートされる、何らかの有用性を与える金属イオンであれば特に限定されないが、本発明の高分子ミセルが血液中に安定に存在し、その結果固形がんへの集積が大きいことから、固形がんの診断用途又は治療用途に有用な金属イオンを配位させることが好ましい。なお、金属の放射性同位体のイオンでもよい。診断用途としては、例えば、MRI(核磁気共鳴画像法)、PET(ポジトロン断層法)又はSPECT(単一光子放射断層撮影法)等の造影剤を挙げることができる。固形がんの診断に有用な金属イオンとしては、ガドリニウム、テクネチウム(99mTc)、タリウム(201Tl)、ガリウム(67Ga)及びインジウム(111In)の各イオンを挙げることができる。これらのうち、ガドリニウムイオンは、MRI造影剤を与えるのに有用であり、テクネチウムイオンは、SPECTに有用であり、タリウムイオンはSPECTに有用であり、ガリウムイオンは、PETに有用であり、インジウムイオンは、SPECTに有用である。また、固形がんの治療に有用な放射性金属イオンとしては、ストロンチウム(89Sr)、サマリウム(153Sm)、銅(67Cu)、イットリウム(90Y)及びレニウム(186Re)を挙げることができる。
【0041】
高分子ミセル内のキレート化剤への上記金属イオンの配位は、単に高分子ミセルの水溶液に、水溶液中で電離により所望の金属イオンが生じる金属塩を混合するだけで達成することができる。金属塩としては、水中での電離度が高い強酸の塩、例えば金属塩化物、硝酸塩、硫酸塩等を用いることが好ましく、特に金属塩化物を用いることが好ましい。この際の混合は、水を溶媒とし、高分子ミセルの濃度を臨界ミセル濃度以上(通常10mg/mL以上)、好ましくは臨界ミセル濃度以上でその2倍以下の濃度とし、金属塩の濃度は、金属イオンを配位させるキレート化剤残基の割合から算出される化学量論量とし、pHを弱酸性〜中性(5.5〜7程度、好ましくは6〜6.5程度)とし、通常、室温〜70℃、好ましくは40℃〜60℃の温度下、通常、1時間〜5時間、好ましくは2時間〜4時間撹拌することにより行なうことができる。金属イオンを配位させた高分子ミセルは、透析などにより精製することができる。配位した金属イオンの数は、ICP(Inductive Coupled Plasma)発光分光分析等により確認することができる。
【0042】
自己会合性高分子ミセルは、上記したブロックコポリマー分子を、通常、数百個含み、その直径が通常10nm〜100nm程度のものである。高分子ミセルは、上記親水性セグメントが外側に向いて水系媒体と接触し、キレート化剤含有セグメントは、内側を向いて配置される。
【0043】
本発明の高分子ミセルは、固形がん組織内の、ナノサイズ粒子の透過性が亢進した血管壁は通過するが、正常組織内の血管壁は通過できない大きさを有するので、固形がん組織内の血管壁を介して癌組織内に選択的に移行し、集積する。固形がん細胞では、塩濃度が高い(NaCl濃度として0.5M程度)ので、固形がん細胞中では解離(dissociate)するのに対し、血液中では、高分子ミセル状態を維持する。
【0044】
金属イオンが配位した高分子ミセルを固形がんの造影剤として用いる場合、例えば、金属イオンがガドリニウムイオンで、MRIの造影剤に用いる場合、高分子ミセルが解離すると、より水分子がGd3+に接近できるようになり、Gd3+による緩和能がより効果的に発揮され、MRIによる映像化ができる。しかも、高分子ミセルが解離しても、Gd3+は、ブロックコポリマーに結合しているため、比較的長時間細胞中に滞在し、その間は癌細胞の映像化が可能である。また、万一血液中で高分子ミセルが解離しても、ブロックコポリマーは腎臓により速やかに除去される。このため、本発明のMRI造影剤によれば、固形がん組織を映像化することが可能であり、しかも、映像化可能な時間は比較的長く、患者にしばらく休息が必要な場合でもMRIの注射をやり直す必要がない。PETやSPECT等の造影剤として用いる場合も同様である。
【0045】
造影剤として用いる場合、例えば、生理食塩水等に溶解したものを、静脈注射等により非経口投与する。投与量は、金属イオン量として、公知の造影剤と同程度でよく、例えば、ガドリニウムイオンが配位したMRI造影剤の場合は、体重1kg当たり、ガドリニウムイオン量として0.01mmol〜0.5mmol程度である。
【0046】
放射性の金属イオンを配位させて高分子ミセルを固形がんの治療剤として用いる場合、上記の通り、高分子ミセルは固形がんに集積され、固形がん中で解離して放射性金属イオンが放出され、放射性金属イオンによる治療効果が発揮される。
【0047】
固形がんの治療剤として用いる場合も、造影剤の場合と同様、例えば、生理食塩水等に溶解したものを、静脈注射等により非経口投与する。投与量は、放射性金属イオン量として、公知の造影剤と同程度でよく、例えば、体重1kg、1日当たり、放射性金属イオン量として、0.01MBq〜5MBq程度である。
【0048】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【実施例1】
【0049】
キレート化剤残基を有するブロックコポリマーの合成
【0050】
下記反応スキーム1及び反応スキーム2により、キレート化剤残基を有するブロックコポリマーを合成した。
【0051】
【化12】

反応スキーム1
【0052】
【化13】

反応スキーム2
【0053】
(1) 酸加水分解
ポリエチレングリコール−block−ポリ(ε−ベンジルオキシカルボニル−L−リシン)(以下PEG−PLys(Z)と略記する。)のポリエチレングリコール鎖の分子量が5000でε−ベンジルオキシカルボニル−L−リシンの重合度が28のものを3.22gとり、トリフルオロ酢酸32.0mL加えて室温で1時間攪拌し、透明の溶液を得た。アニソール32.0mL及びメタンスルホン酸24.0mLを加えて、室温でさらに攪拌した。蒸留水160mLおよびエーテル150mLを加えた。有機層が中性になるまで水層をエーテルで抽出し、水層をトリエチルアミンを加えて中性にした。その後、0.1N水酸化ナトリウム、蒸留水で透析操作を行った。最後に、凍結乾燥を行い、ポリエチレングリコール−block−ポリリシン(以下、PEG−PLysと略記する。)2.07gを得た。
【0054】
以上と同様の手順により、下記の表1に示す2種のPEG−PLysを得た。
【0055】
【表1】

【0056】
(2) DOTA(1,4,7.10−テトラアザシクロドデカン−1,4,7,10−四酢酸)ユニットの結合
PEG−PLys(5000−28)(表1のRun1)204mgと残存アミノ基に対して2.0倍モル等量の活性エステル化DOTAを加え、DMFを加えて溶解させた後に、トリエチルアミンを加え、50℃で一晩攪拌した。得られた溶液を水に対して透析し(3.3mg/mLのポリマー濃度)、凍結乾燥した。精製後に得られたDOTA基導入ブロックコポリマー(PEG−P(Lys−DOTA))のLysのユニット数、DOTAのユニット数は、1H−NMR測定により求め、Lysのユニット数が21、DOTAユニット数は21であった。上記で得られたPEG−P(Lys−DOTA)を10mg/mLの濃度で再度水へ溶解させて透析を行い、凍結乾燥した。この際、得られたサンプルのLysのユニット数、DOTA基のユニット数は同じであった。
【0057】
以上と同様の手順によって実験を行い、PEG−P(Lys−DOTA)のLysのユニット数が20、DOTAユニット数は20が得られた。また、PEG−PLys(5000−21)からDOTA基の導入を行い、Lysのユニット数が17、DOTAユニット数が17のEG−P(Lys−DOTA)を得た(表2)。
【0058】
【表2】

【実施例2】
【0059】
PEG−P(Lys−DOTA)へのガドリニウムイオンの結合
(1)ガドリニウム(III)イオンの配位
PEG−PLL(DOTA)(5,000‐21‐21)(上記に示した高分子ミセルを形成させたブロックコポリマー)199mgに対して、20mLの蒸留水を加えて溶解し、pHを6.0−6.5に調整した。DOTA基21残基に対して0.40倍等量のGdイオンをGdCl3水溶液として加え、50℃、3時間pHを6−6.5に調整しながら攪拌した。得られた溶液を分画分子量1000の透析膜を用いて、蒸留水に対して透析し、凍結乾燥した。Gdイオンの導入量はICP(Inductive Coupled Plasma)発光分光分析を用いて決定した。精製後に得られたPEG−P(Lys−DOTA−Gd)のGdイオン導入数は7となった(表3)。
【0060】
以上と同様の手順によって、PEG−PLL(DOTA)(5,000‐17‐17)からGdイオンを含むポリマーPEG−PLL(DOTA―Gd)を得た(表3)。
【0061】
(2)銅(II)イオンの配位
PEG−PLL(DOTA)(5,000‐20‐20)25.0 mgに対して、5mLの蒸留水を加えて溶解し、pHを6.0−6.5に調整した。DOTA基20残基に対して0.46倍等量(9.2個/20DOTA基)のCu(II)イオンをCuCl3水溶液として加え、50℃、3時間pHを6−6.5に調整しながら攪拌した。得られた溶液を分画分子量1000の透析膜を用いて、蒸留水に対して透析し、凍結乾燥した。Gdイオンの導入量はICP(Inductive Coupled Plasma)発光分光分析を用いて決定した。精製後に得られたPEG−P(Lys−DOTA−Cu)のCu(II)イオン導入数は9となった(表3)。
【0062】
【表3】

【実施例3】
【0063】
ブロックコポリマーのGPC及びDLS測定
上記に得られたブロックコポリマーPEG−P(Lys−DOTA)、10mg/mLで再透析したPEG−P(Lys−DOTA)、及びそのブロックコポリマーから得られたPEG−P(Lys−DOTA−Gd)のGPC測定をポリマー濃度2.0mg/mLとして測定した。再透析したブロックコポリマーの保持時間(Retention time)が6.17分から5.72分へと早くなった(表4、図2)。このことは形成された粒子が見かけ上より大きな分子量へ変化したことを示している。また、GPCにより測定された重量平均分子量は、407万から504万へと大きく現れた。また、形成されたPEG−P(Lys−DOTA−Gd)の粒子径をDLS測定によって求めた。粒子径はキュムラント法で計算され、Gd(III)の場合とCu(II)の場合どちらも200nm以下の粒子径を与えた(表5)。
【0064】
【表4】

【0065】
【表5】

【実施例4】
【0066】
高分子ミセルMRI造影剤の血液中濃度の変化
上記で高分子ミセル化したPEG−P(Lys−DOTA−Gd)(5、000−17−17−7)を生理食塩水に溶解し、一晩かくはんした後に0.22μmサイズでろ過滅菌した。Gdイオン濃度は10mMとなるように調整した。マウス(ddY4週齢)の尾静脈より10mMGdイオン濃度の高分子ミセル溶液を0.1mL静脈から注射し、30分、1時間、4時間、25時間、48時間毎に血液を採取し、その血液中のGdイオン濃度をICPにより測定し、全血液中のGdイオン濃度を算出した。
【0067】
結果を図3に示す。図3に示されるように、血液中のGdイオン量は、静脈注射48時間後でもなお約10%残留しており、高分子ミセルに金属イオンが封入されたものとしては極めて血液安定性が高かった。
【実施例5】
【0068】
高分子ミセルMRI造影剤の固形がんへの集積
上記で高分子ミセル化したPEG−P(Lys−DOTA−Gd)(5、000−21−21−7)を生理食塩水に溶解し、一晩かくはんした後に0.22μmサイズでろ過滅菌した。Gdイオン濃度は10mMとなるように調整した。担がんマウス(CDF1マウス)の尾静脈より10mMGdイオン濃度の高分子ミセル溶液を0.1mL静脈から注射し、24時間後の腫瘍のGdイオン濃度によって算出した。また、同時に腫瘍におけるMRI測定を投与前と24時間後に行いT1強調画像を取得し、その画像強度を比較した。MRI造影剤投与後、24時間後にマウス血液中にMRI造影剤は25.6±1.9%(平均±標準偏差)以上が残存し、腫瘍へ高分子ミセルMRI造影剤が集積していることを確認した。MRI造影剤投与前の腫瘍の画像強度に対して、MRI造影剤投与後に得られた腫瘍の画像強度は元の画像に対して高くなった。
【図面の簡単な説明】
【0069】
【図1】本発明の自己会合性高分子ミセルにおける、ポリマー側鎖に導入されたキレート化剤残基中の三級アミノ基とカルボキシル基の相互作用を模式的に示す図である。
【図2】本発明の実施例で作製したブロックコポリマーをミセル化する前後におけるゲルろ過クロマトグラフィーの溶出パターンを示す図である。
【図3】本発明の実施例で作製した、ガドリニウムイオンが配位した自己会合性高分子ミセルをマウスに静脈注射した際の血液中のガドリニウムイオン量(相対値)の経時変化を示すである。
【特許請求の範囲】
【請求項1】
親水性ポリマー鎖セグメントと、側鎖を複数有するセグメントであって該複数の側鎖の60%以上に、三級アミノ基とカルボキシル基を有するキレート化剤残基が直接又はリンカー構造を介して結合されているキレート化剤セグメントとを含むブロックコポリマーの自己会合により形成された高分子ミセル。
【請求項2】
前記キレート化剤残基が側鎖の70%以上に結合されている請求項1記載の高分子ミセル。
【請求項3】
前記キレート化剤残基が全ての側鎖に結合されている請求項2記載の高分子ミセル。
【請求項4】
重量平均分子量が100万〜2000万である請求項1ないし3のいずれか1項に記載の高分子ミセル。
【請求項5】
前記キレート化剤残基が、1,4,7.10−テトラアザシクロドデカン−1,4,7,10−四酢酸、ジエチレントリアミン五酢酸及びエチレンジアミン四酢酸から成る群より選ばれる少なくとも1種である請求項1ないし4のいずれか1項に記載の高分子ミセル。
【請求項6】
前記キレート化剤残基が、1,4,7.10−テトラアザシクロドデカン−1,4,7,10−四酢酸である請求項5記載の高分子ミセル。
【請求項7】
前記親水性ポリマー鎖セグメントがポリエチレングリコール鎖、ポリビニルアルコール鎖及びポリビニルピロリドン鎖から成る群より選ばれる少なくとも1種から成る請求項1ないし6のいずれか1項に記載の高分子ミセル。
【請求項8】
前記親水性ポリマー鎖セグメントがポリエチレングリコール鎖である請求項7記載の高分子ミセル。
【請求項9】
前記キレート化剤セグメントが、側鎖にアミノ基を有するアミノ酸がペプチド結合したポリアミノ酸に前記キレート化剤残基を導入したものである請求項1ないし8のいずれか1項に記載の高分子ミセル。
【請求項10】
前記ポリアミノ酸がポリリシンである請求項9記載の高分子ミセル。
【請求項11】
前記ブロックコポリマーが、下記一般式[I]ないし[VIII]で表されるブロックコポリマーから成る群より選ばれる少なくとも1種である請求項1記載の高分子ミセル。
【化1】

【化2】

【化3】

【化4】

【化5】

【化6】

【化7】

【化8】

(上記一般式[I]〜[VIII]中、Xは水素原子、C1−C6アルキル、ヒドロキシ−C1−C6アルキル、アセタールもしくはケタール化ホルミルC1−C6アルキル、アミノC1−C6アルキルまたはベンジル基を有し、
Zは水素原子もしくはヒドロキシ、C1−C6アルキルもしくはC1−C6アルキルオキシ、フェニル−C1−C4アルキルもしくはフェニル−C1−C4アルキルオキシ、C1−C4アルキルフェニルもしくはC1−C4アルキルフェニルオキシ、C1−C6アルコキシカルボニル、フェニル−C1−C4アルコキシカルボニル、C1−C6アルキルアミノカルボニル、またはフェニル−C1−C4アルキルアミノカルボニル基を有し、
nは10〜10,000の整数であり、
sは0〜6の整数であり、
mは1〜6の整数であり、
tは1〜5の整数であり、
Rは、水素原子、キレート化剤残基又はリンカー−キレート化剤残基を表し、
p及びqは、相互に独立して1〜300の整数であり、
Y1は、−NH−または−Ra−(CH2)r−Rb−を表し、ここでRaはOCO、OCONH、NHCO、NHCONH、COOまたはCONHを表し、RbはNHまたはOを表し、
Y2は、COまたは−Rc−(CH2)r−Rd−を表し、ここでRcはOCO、OCONH、NHCO、NHCONH、COOまたはCONHを表し、RdはCOを表し、そしてrは1〜6の整数を表す)。
【請求項12】
請求項1ないし11のいずれか1項に記載の高分子ミセルに金属イオンが配位した金属配位高分子ミセル。
【請求項13】
前記金属イオンが、ガドリニウム、テクネチウム、タリウム、ガリウム、インジウム、ストロンチウム、サマリウム、銅、イットリウム、レニウムから成る群より選ばれる少なくとも1種の金属のイオンである、請求項12記載の金属イオン配位高分子ミセル。
【請求項14】
請求項12又は13記載の金属イオン配位高分子ミセルを有効成分として含有する、固形がんの診断又は治療剤。
【請求項15】
前記金属イオンがガドリニウムイオンであり、前記金属イオン配位高分子ミセルがMRI造影剤である請求項14記載の診断又は治療剤。
【請求項1】
親水性ポリマー鎖セグメントと、側鎖を複数有するセグメントであって該複数の側鎖の60%以上に、三級アミノ基とカルボキシル基を有するキレート化剤残基が直接又はリンカー構造を介して結合されているキレート化剤セグメントとを含むブロックコポリマーの自己会合により形成された高分子ミセル。
【請求項2】
前記キレート化剤残基が側鎖の70%以上に結合されている請求項1記載の高分子ミセル。
【請求項3】
前記キレート化剤残基が全ての側鎖に結合されている請求項2記載の高分子ミセル。
【請求項4】
重量平均分子量が100万〜2000万である請求項1ないし3のいずれか1項に記載の高分子ミセル。
【請求項5】
前記キレート化剤残基が、1,4,7.10−テトラアザシクロドデカン−1,4,7,10−四酢酸、ジエチレントリアミン五酢酸及びエチレンジアミン四酢酸から成る群より選ばれる少なくとも1種である請求項1ないし4のいずれか1項に記載の高分子ミセル。
【請求項6】
前記キレート化剤残基が、1,4,7.10−テトラアザシクロドデカン−1,4,7,10−四酢酸である請求項5記載の高分子ミセル。
【請求項7】
前記親水性ポリマー鎖セグメントがポリエチレングリコール鎖、ポリビニルアルコール鎖及びポリビニルピロリドン鎖から成る群より選ばれる少なくとも1種から成る請求項1ないし6のいずれか1項に記載の高分子ミセル。
【請求項8】
前記親水性ポリマー鎖セグメントがポリエチレングリコール鎖である請求項7記載の高分子ミセル。
【請求項9】
前記キレート化剤セグメントが、側鎖にアミノ基を有するアミノ酸がペプチド結合したポリアミノ酸に前記キレート化剤残基を導入したものである請求項1ないし8のいずれか1項に記載の高分子ミセル。
【請求項10】
前記ポリアミノ酸がポリリシンである請求項9記載の高分子ミセル。
【請求項11】
前記ブロックコポリマーが、下記一般式[I]ないし[VIII]で表されるブロックコポリマーから成る群より選ばれる少なくとも1種である請求項1記載の高分子ミセル。
【化1】

【化2】

【化3】

【化4】

【化5】

【化6】

【化7】

【化8】

(上記一般式[I]〜[VIII]中、Xは水素原子、C1−C6アルキル、ヒドロキシ−C1−C6アルキル、アセタールもしくはケタール化ホルミルC1−C6アルキル、アミノC1−C6アルキルまたはベンジル基を有し、
Zは水素原子もしくはヒドロキシ、C1−C6アルキルもしくはC1−C6アルキルオキシ、フェニル−C1−C4アルキルもしくはフェニル−C1−C4アルキルオキシ、C1−C4アルキルフェニルもしくはC1−C4アルキルフェニルオキシ、C1−C6アルコキシカルボニル、フェニル−C1−C4アルコキシカルボニル、C1−C6アルキルアミノカルボニル、またはフェニル−C1−C4アルキルアミノカルボニル基を有し、
nは10〜10,000の整数であり、
sは0〜6の整数であり、
mは1〜6の整数であり、
tは1〜5の整数であり、
Rは、水素原子、キレート化剤残基又はリンカー−キレート化剤残基を表し、
p及びqは、相互に独立して1〜300の整数であり、
Y1は、−NH−または−Ra−(CH2)r−Rb−を表し、ここでRaはOCO、OCONH、NHCO、NHCONH、COOまたはCONHを表し、RbはNHまたはOを表し、
Y2は、COまたは−Rc−(CH2)r−Rd−を表し、ここでRcはOCO、OCONH、NHCO、NHCONH、COOまたはCONHを表し、RdはCOを表し、そしてrは1〜6の整数を表す)。
【請求項12】
請求項1ないし11のいずれか1項に記載の高分子ミセルに金属イオンが配位した金属配位高分子ミセル。
【請求項13】
前記金属イオンが、ガドリニウム、テクネチウム、タリウム、ガリウム、インジウム、ストロンチウム、サマリウム、銅、イットリウム、レニウムから成る群より選ばれる少なくとも1種の金属のイオンである、請求項12記載の金属イオン配位高分子ミセル。
【請求項14】
請求項12又は13記載の金属イオン配位高分子ミセルを有効成分として含有する、固形がんの診断又は治療剤。
【請求項15】
前記金属イオンがガドリニウムイオンであり、前記金属イオン配位高分子ミセルがMRI造影剤である請求項14記載の診断又は治療剤。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2010−6768(P2010−6768A)
【公開日】平成22年1月14日(2010.1.14)
【国際特許分類】
【出願番号】特願2008−169694(P2008−169694)
【出願日】平成20年6月28日(2008.6.28)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年6月6日 日本DDS学会発行の「第24回日本DDS学会プログラム予稿集」に発表
【出願人】(591243103)財団法人神奈川科学技術アカデミー (271)
【Fターム(参考)】
【公開日】平成22年1月14日(2010.1.14)
【国際特許分類】
【出願日】平成20年6月28日(2008.6.28)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年6月6日 日本DDS学会発行の「第24回日本DDS学会プログラム予稿集」に発表
【出願人】(591243103)財団法人神奈川科学技術アカデミー (271)
【Fターム(参考)】
[ Back to top ]

