高分子膜及びガスバリア材
【課題】ガスバリア性を有し、成型加工性が良好な高分子膜及びガスバリア材を提供する。
【解決手段】高分子膜は、下記一般式(1)で表される化合物を含み、ガスバリア材として用いる。

【解決手段】高分子膜は、下記一般式(1)で表される化合物を含み、ガスバリア材として用いる。

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ガスバリア性を有する高分子膜及び該高分子膜を有するガスバリア材に関する。
【背景技術】
【0002】
空気中の酸素と窒素の分離や特定ガスの吸着・貯蔵は、高度情報化社会の安全・エネルギー面を支える基幹技術である。
非常に高い気体透過性を有する高分子骨格としてポリアセチレン誘導体が知られている。現在知られている最も優れた気体透過性高分子はポリトリメチルシリルプロピンである。
このポリトリメチルシリルプロピンは、剛直なポリアセチレン主鎖骨格のため自由体積が大きい点と、嵩高くプロペラ様に回転するトリメチルシリル基とが分子設計のポイントとなっている。下記表1に代表的な高分子膜に対する各気体の気体透過係数を示す。この表1に示す各気体の気体透過係数の違いは、気体分子のサイズを反映している。
【0003】
一方、ポリビニル型高分子は、気体透過性が低い(気体バリア性が高い)高分子として食品、電子機器等の包装材として利用されている。特に、ポリアクリロニトリルやポリビニルアルコール等の気体透過性が低い理由は、高分子鎖間の官能基相互作用(双極子相互作用、水素結合)によって高分子鎖の熱運動が抑制されているためと説明できる。
これらの高分子は、ガラス転位点がそれほど高くないため、室温近傍では熱運動しており高分子鎖間を気体分子が移動していく。即ち、水素結合した高分子鎖間は高密度になり、気体透過性を減少させることができる。
【0004】
【表1】

【0005】
しかしながら、現行の気体透過性が低い(気体バリア性が高い)高分子は、溶媒への溶解性が低いため単独では成形加工性に劣る点に問題がある。また、気体透過性が低い(気体バリア性が高い)高分子膜を食品、電子機器等の包装材などとして利用する場合、用途に応じて必要な耐熱性を有している必要がある。
【0006】
ところで、本発明者は、以前に、電子豊富アルキンと強力アクセプター分子の定量的付加反応を発見した(特許文献1、非特許文献1〜4)。この反応において、ジアルキルアニリンやフェロセン等の強力ドナーが置換したアルキンは、テトラシアノエチレン(TCNE)やテトラシアノキノジメタン(TCNQ)及びその誘導体と選択的に反応して4つのシアノ基が置換した生成物を与える。この反応は、高分子反応であっても温和な条件下で副反応無く進行する。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2009−270011号公報
【非特許文献】
【0008】
【非特許文献1】Tsuyoshi Michinobu 他8名、Chemical Communications、Issue6、pp.737−739(2005)
【非特許文献2】Y.Li、T.Michinobu、Polym.Chem.1、pp.72−74(2010)
【非特許文献3】Y.Li、K.Tsuboi、T.Michinobu、Macromolecules、Vol.43、No.12、pp.5277−5286(2010)
【非特許文献4】T.Michinobu、J.Am.Chem.Soc.130、pp.14074−14075(2008)
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、従来における前記諸問題を解決し、以下の目的を達成することを課題とする。即ち、本発明は、ガスバリア性を有し、成型加工性が良好な高分子膜及びガスバリア材を提供することを目的とする。
【0010】
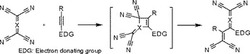
前記課題を解決するために、本発明者らが鋭意検討を行ったところ、以下の知見が得られた。前述の通り、電子豊富アルキンと強力アクセプター分子の定量的付加反応により4つのシアノ基が置換した生成物が得られる。この生成物の合成スキームを図1に示す。この反応を使用してポリアセチレン誘導体のポスト機能化を実施すれば、得られる高分子膜の気体透過係数を変化させることができる。また、成形加工性が高い前駆体高分子に所望のシアノ基量を簡便に導入でき、透過係数の制御やガスバリア性が高い強靭膜を得ることができる。
【課題を解決するための手段】
【0011】
本発明は、前記知見に基づくものであり、前記課題を解決するための手段としては、以下の通りである。即ち、
<1> 下記一般式(1)で表される化合物を含み、ガスバリア材として用いられることを特徴とする高分子膜。
【化1】

ただし、前記一般式(1)中、R1は、水素原子又は電子供与性基を表し、R2は、ポリマー鎖主鎖を形成する基を表し、R3は、キノイド型構造を有するアリール基又は二重結合を表し、R4は、前記ポリマー鎖主鎖の末端基又はハロゲン原子を表し、x及びyはそれぞれ、0≦x<l00、0<y≦100、及びx+y=100の式を満たす整数であって、モノマーの重合比を示す数値を表し、*は、前記ポリマー鎖主鎖を形成する基と結合する側鎖の炭素原子の位置を表す。
<2> ポリマー鎖主鎖を形成する基が、ポリフェニルアセチレン、ポリスチレン、ポリアクリル酸、ポリメタクリル酸、ポリシロキサン、ポリフェニルオキサイド、芳香族ポリアミド、芳香族ポリエステル、ポリイミド、ポリエチレン、ポリプロピレン、ポリアクリロニトリル、ポリブタジエン、ポリ塩化ビニル、ポリ塩化ビニリデン、ポリメチルメタクリレート、ポリカーボネート、ポリアリルエステル、ポリオキシメチレン、ポリフェニレンスルフィド、ポリエステル、ポリスルホン、ポリエーテルケトン、ポリウレタン、ポリアクリルアミド、ヘテロ環ポリマー、ポリビニルアルコール及びこれらの誘導体のいずれかの構造単位を有する基である前記<1>に記載の高分子膜。
<3> ポリマー鎖主鎖を形成する基が、下記構造式(2−1)から(2−9)のいずれかで表されるポリマー鎖主鎖の構造単位及びこれらの誘導体から選択される基である前記<2>に記載の高分子膜。
【化2】

ただし、前記構造式(2−1)から(2−9)中、nは、繰り返し単位数を表し、*は、一般式(1)で表される化合物中、*の位置の炭素原子と結合することを表す。
<4> ポリマー鎖主鎖を形成する基が、構造式(2−1)、(2−2)で表されるポリマー鎖主鎖の構造単位及びこれらの誘導体から選択される基であり、前記構造式(2−1)、(2−2)中のフェニレン基が、一般式(1)で表される化合物中、*の位置の炭素原子とパラ位で結合する前記<3>に記載の高分子膜。
<5> 電子供与性基が、パラ位とオルト位の少なくとも一方にアミンを有するフェニル基、パラ位とオルト位の少なくとも一方にアルコキシ基を有するフェニル基、アミノ基、モノ置換アミノ基、ジ置換アミノ基、置換基を有していてもよいフェロセン含有基、置換基を有していてもよいチオフェン含有基、置換基を有していてもよいピロール含有基及び置換基を有していてもよいカルバゾール含有基からなる群から選択される前記<1>から<4>のいずれかに記載の高分子膜。
<6> キノイド型構造を有するアリール基が、シクロヘキサ−2,5−ジエン−1,4−ジイリデン基、2,3,5,6−テトラフルオロヘキサ−2,5−ジエン−1,4−ジイリデン基、ナフタレン−2,6−ジイリデン基、アントラセン−9,10−ジイリデン基からなる群から選択される基である前記<1>から<5>のいずれかに記載の高分子膜。
<7> 少なくとも、前記<1>から<6>のいずれかに記載の高分子膜を有することを特徴とするガスバリア材。
【発明の効果】
【0012】
本発明によれば、従来における前記諸問題を解決することができ、ガスバリア性を有し、成型加工性が良好な高分子膜及びガスバリア材を提供することができる。
【図面の簡単な説明】
【0013】
【図1】図1は、本発明に用いられる化合物の合成スキームを示す説明図である。
【図2(a)】図2(a)は、ポリフェニルアセチレン誘導体2及び目的化合物3の窒素雰囲気下での熱分析結果を示すグラフである。
【図2(b)】図2(b)は、ポリフェニルアセチレン誘導体5及び目的化合物6の窒素雰囲気下での熱分析結果を示すグラフである。
【発明を実施するための形態】
【0014】
(高分子膜)
本発明の高分子膜は、下記一般式(1)で表される化合物を含み、ガスバリア材として用いられることを特徴とする。
【0015】
【化3】

ただし、前記一般式(1)中、R1は、水素原子又は電子供与性基を表し、R2は、ポリマー鎖主鎖を形成する基を表し、R3は、キノイド型構造を有するアリール基又は二重結合を表し、R4は、前記ポリマー鎖主鎖の末端基又はハロゲン原子を表し、x及びyはそれぞれ、0≦x<l00、0<y≦100、及びx+y=100の式を満たす整数であって、モノマーの重合比を示す数値を表し、*は、前記ポリマー鎖主鎖を形成する基と結合する側鎖の炭素原子の位置を表す。
【0016】
前記一般式(1)で表される化合物は、下記の反応式(I)に示されるように、一般式(2)で表されるアルキン含有前駆体ポリマーに、一般式(3)で示されるテトラシアノ構造を有する化合物を添加し、両者を反応させることにより製造することができる。
【0017】
【化4】

ただし、前記反応式(I)中、R1は、水素原子又は電子供与性基を表し、R2は、ポリマー鎖主鎖を形成する基を表し、R3は、キノイド型構造を有するアリール基又は二重結合を表し、R4は、前記ポリマー鎖主鎖の末端基又はハロゲン原子を表し、x及びyはそれぞれ、0≦x<l00、0<y≦100、及びx+y=100の式を満たす整数であって、モノマーの重合比を示す数値を表し、*は、前記ポリマー鎖主鎖を形成する基と結合する側鎖の炭素原子の位置を表す。
【0018】
<前駆体ポリマーの合成>
前記一般式(1)で表される化合物の前駆体となる、前記一般式(2)で示されるアルキン含有前駆体ポリマーは、エチニレン基(炭素−炭素三重結合)を有するモノマーと、必要により他のモノマーを共重合させることにより得ることができる。
【0019】
前記モノマーの重合方法としては、特に制限はなく目的に応じて適宜選択することができ、例えば、ビニル基に対するラジカル重合、イオン重合、リビング重合による方法、エチニル基に対する遷移金属触媒(ロジウム、タンタル、ニオブ、タングステ、ルテニウム等)を用いたメタセシス重合による方法、重縮合による方法、パラジウム/リン触媒を用いたクロスカップリング反応により重合する方法、薗頭カップリング反応により重合する方法、HECKカップリング反応により重合する方法、Suzukiカップリング反応により重合する方法、Grignard反応により重合する方法、スルホニウム塩前駆体法、Wittig−Horner反応、Knoevenagel法、Ni(O)触媒により重合する方法、FeCl3等の酸化剤により重合する方法、電気化学的に酸化重合する方法、適当な脱離基を有する中間体高分子の分解による方法、原子移動ラジカル重合法により重合する方法等が挙げられる。
【0020】
また、前記側鎖にエチニレン基(炭素−炭素三重結合)を有するモノマーとしては、特に制限はなく、前記アルキン含有前駆体ポリマーに導入されるポリマー鎖主鎖の構造に応じて適宜選択される。このようなモノマーとしては、公知の製造方法により製造することができ、また、市販されているものを用いることができる。
【0021】
前記反応式(I)において、前記一般式(2)で表されるアルキン含有前駆体ポリマーのエチニレン基(炭素−炭素三重結合)に隣接するR1が、電子供与性基であると、前記一般式(3)で表されるテトラシアノ構造を有する化合物を付加する反応の反応性が高められる。そのため、例えば、0℃〜300℃の比較的緩やかな温度条件下にて、無触媒又は遷移金属等の触媒を用いて、有機溶媒中で反応させることができる。
【0022】
ここで、前記電子供与性基としては、特に制限はなく目的に応じて適宜選択することができ、例えば、パラ位とオルト位の少なくとも一方にアミンを有するフェニル基、パラ位とオルト位の少なくとも一方にアルコキシ基を有するフェニル基、アミノ基、モノ置換アミノ基、ジ置換アミノ基、置換基を有していてもよいフェロセン含有基、置換基を有していてもよいチオフェン含有基、置換基を有していてもよいピロール含有基又は置換基を有していてもよいカルバゾール含有基等が挙げられる。
中でも、前記電子供与性基が、パラ位とオルト位の少なくとも一方にアミンを有するフェニル基又は置換基を有していてもよいフェロセン含有基である場合には、さらに反応性を高めることができる。
【0023】
前記電子供与性基の置換基としては、それほど反応性の高くない基であれば、特に制限はなく、例えば、アルキル基、シクロアルキル基、アルケニル基、アルキニル基、アリール基、ヘテロアリール基、ヘテロ環基、アルコキシ基、シクロアルコキシ基、アリールオキシ基、アルキルチオ基、シクロアルキルチオ基、アリールチオ基、アルコキシカルボニル基、アリールオキシカルボニル基、スルファモイル基、アシル基、アシルオキシ基、アミド基、カルバモイル基、ウレイド基、スルフィニル基、アルキルスルホニル基、アリールスルホニル基、アミノ基、ハロゲン原子、フッ化炭化水素基、シアノ基、シリル基等が挙げられる。
なお、前記R1が水素原子の場合には、化学的安定性が低下した高分子化合物となる。
【0024】
前記反応式(I)で使用される溶媒としては、特に制限はなく、目的に応じて適宜選択することができるが、例えば、ジクロロエタン、THF(テトラヒドロフラン)、ジクロロメタン、クロロホルム、クロロベンゼン、ジクロロベンゼン、ベンゼン、トルエン、アセトニトリル等が挙げられる。
【0025】
前記反応式(I)において、R2は、ポリマー鎖主鎖を形成する基とされ、前記モノマーの重合方法により、ポリマー鎖主鎖を形成する。
前記ポリマー鎖主鎖を形成する基としては、特に制限はなく目的に応じて適宜選択することができ、公知のポリマー鎖主鎖を形成する基を挙げることができるが、例えば、ポリフェニルアセチレン、ポリスチレン、ポリアクリル酸、ポリメタクリル酸、ポリシロキサン、ポリフェニルオキサイド、芳香族ポリアミド、芳香族ポリエステル、ポリイミド、ポリエチレン、ポリプロピレン、ポリアクリロニトリル、ポリブタジエン、ポリ塩化ビニル、ポリ塩化ビニリデン、ポリメチルメタクリレート、ポリカーボネート、ポリアリルエステル、ポリオキシメチレン、ポリフェニレンスルフィド、ポリエステル、ポリスルホン、ポリエーテルケトン、ポリウレタン、ポリアクリルアミド、ヘテロ環ポリマー、ポリビニルアルコール及びこれらの誘導体のいずれかの構造単位を有する基が好ましい。
これらの中でも、成型加工性に優れ、高い耐熱性が期待できるポリスチレン及び芳香族ポリアミドが特に好ましい。
【0026】
また、前記ポリマー鎖主鎖を形成する基の具体的な構造例としては、下記構造式(2−1)から(2−9)のいずれかで表されるポリマー鎖主鎖の構造単位及びこれらの誘導体から選択される基が挙げられる。
【0027】
【化5】

【0028】
また、前記誘導体に係るポリマー鎖主鎖の構造例を下記構造式(2−10)から(2−14)に示す。
下記構造式(2−10)は、前記構造式(2−7)のポリアミドにジフェニルエーテルを重合付加した誘導体に係り、置換基の結合位置(−*)を変更したものである。
下記構造式(2−11)は、下記構造式(2−10)から置換基の結合位置(−*)を変更したものである。
下記構造式(2−12)は、前記構造式(2−7)のポリエステルにジフェニルエーテルを重合付加した誘導体に係り、置換基の結合位置(−*)を変更したものである。
下記構造式(2−13)は、下記構造式(2−12)から置換基の結合位置(−*)を変更したものである。
下記構造式(2−14)は、前記構造式(2−9)から置換基の結合位置(−*)を変更したものである。
なお、前記誘導体としては、このような誘導体の例に限らず、目的に応じて適宜選択することができる。
【0029】
【化6】

【0030】
これらの構造例の中でも、前記構造式(2−1)及び(2−2)中のフェニレン基が、パラ位で側鎖と結合する(前記一般式(1)における*の位置の炭素原子と結合する)ものが特に好ましい。
【0031】
なお、前記ポリマー鎖主鎖を形成する基が導入される前記一般式(1)で表される化合物において、隣接する前記ポリマー鎖主鎖を形成する基同士は、同一の構造単位のほかに異なる構造単位を有していてもよく、前記ポリマー鎖主鎖としては、前記ポリマー鎖主鎖を形成する基を2種以上有する共重合体であってもよい。
【0032】
前記一般式(1)において、R4は、前記ポリマー鎖主鎖の末端基又はハロゲン原子とされる。
なお、R4をハロゲン原子(例えば、Br)とする場合、例えば、原子移動ラジカル重合法などにより、前記前駆体ポリマーを合成し、目的化合物の合成に用いることができる。
【0033】
<目的化合物の合成>
前記の反応式(I)では、下記一般式(3)で表されるテトラシアノ構造を有する化合物が使用される。この化合物は、強力なアクセプター分子として作用し、前記一般式(2)で表される電子供与性の前駆体ポリマーと良好な反応性を示す。このような合成方法により、目的化合物としての前記一般式(1)で表される化合物を簡便かつ収率良く合成することができる。
【0034】
【化7】

ただし、前記一般式(3)中、R3は、キノイド型構造を有するアリール基又は二重結合を表す。
【0035】
前記キノイド型構造を有するアリール基としては、特に限定はなく目的に応じて適宜選択することができ、例えば、シクロヘキサ−2,5−ジエン−1,4−ジイリデン基、2,3,5,6−テトラフルオロヘキサ−2,5−ジエン−1,4−ジイリデン基、ナフタレン−2,6−ジイリデン基、アントラセン−9,10−ジイリデン基、フェナントレン−3,9−ジイリデン基、フェナントレン−2,7−ジイリデン基等が挙げられる。
これらの中でも、シクロヘキサ−2,5−ジエン−1,4−ジイリデン基、2,3,5,6−テトラフルオロヘキサ−2,5−ジエン−1,4−ジイリデン基、ナフタレン−2,6−ジイリデン基、アントラセン−9,10−ジイリデン基が好ましい。
【0036】
前記一般式(3)で示される化合物の具体的な化合物としては、例えば、下記の構造式(A−1)〜(A−5)に示される化合物が挙げられる。
【0037】
【化8】

【0038】
前記一般式(3)において、R3が二重結合の場合には、前記構造式(A−1)で示されるテトラシアノエチレン(以下、TCNEと示すことがある)となる。
前記一般式(3)において、R3がシクロヘキサ−2,5ジエン−1,4−ジイリデン基の場合には、前記構造式(A−2)で示されるテトラシアノキノジメタンとなる。
前記一般式(3)において、R3が2,3,5,6−テトラフルオロヘキサ−2,5ジエン−1,4−ジイリデン基の場合には、前記構造式(A−3)で示されるテトラフルオロテトラシアノキノジメタンとなる。
前記一般式(3)において、R3がナフタレン−2,6−ジイリデン基の場合には、前記構造式(A−4)で示される11,11,12,12−テトラシアノナフト−2,6−キノジメタンとなる。
前記一般式(3)において、R3がアントラセン−9,10−ジイリデン基の場合には、前記構造式(A−5)で示される9,10−ビス(ジシアノメチレン)−9,10−ジヒドロアントラセンとなる。
これらの中でも、前記構造式(A−1)で示されるテトラシアノエチレンを用いることが好ましい。
前記テトラシアノエチレン(TCNE)を使用すれば、過剰に添加しても、副反応を誘起しないため、昇華精製で容易にテトラシアノエチレンを除去することができ、製造コストを低減することができる。また、テトラシアノエチレンを昇華精製により除去した後の反応物の重量から重量増加を計算すれば、反応収率を容易に計算することができる。
【0039】
前記一般式(2)で表されるアルキン含有前駆体ポリマーと、前記一般式(3)で示されるテトラシアノ構造を有する化合物との反応条件に関し、温度条件としては、20℃〜100℃が好ましく、反応時間としては、0.1時間〜3時間が好ましく、環境条件としては、窒素雰囲気下で反応させることが好ましい。
【0040】
前記一般式(1)で表される化合物の数平均分子量としては、特に制限はなく目的に応じて適宜選択することができ、例えば、10,000〜300,000とすることができる。
【0041】
<高分子膜の形成>
前記高分子膜の形成方法としては、特に制限はなく目的に応じて適宜選択することができ、例えば、前記一般式(1)で表される化合物を含む溶液を基板、シート等の基材に塗工する方法、前記一般式(1)で表される化合物を含む高分子膜を基板から伸長させる方法などが挙げられる。
また、前記高分子膜としては、本発明の効果を損なわない限り、前記一般式(1)で表される化合物以外の添加材を含むことができ、このような添加材としては、目的に応じて、高分子膜の形成材料として用いられる公知の材料から適宜選択することができる。
【0042】
前記高分子膜は、良好なガスバリア性を示す。これは、前記一般式(1)で表される化合物の側鎖に導入されるシアノ基間の双極子相互作用が、前記高分子膜の膜密度を高めることにより、気体の透過を妨げるものと考えられる。
前記ガスバリア性に関し、前記一般式(1)で表される化合物は、前記反応式(I)において、前記一般式(3)で表される化合物の添加量を調整することにより、前記一般式(1)におけるxとyの重合比を変更し、導入するシアノ基量を調節可能であり、前記高分子膜の気体透過係数を制御することができる。
また、前記高分子膜は、前記導入するシアノ基量を調節して前記高分子膜の膜密度を制御することにより、目的とする気体の分子サイズに応じて、これらの透過性を選択的に制御することができる。
【0043】
(ガスバリア材)
本発明のガスバリア材は、少なくとも、前記高分子膜を有することを特徴とする。
前記ガスバリア材は、前記高分子膜のガスバリア性を利用して、気体透過制御膜、気体封止膜、塗料材料、塗装材料、及び包装用フィルム、シーリング材、パッキング材等の各種資材として用いることができる。
また、前記ガスバリア材としては、前記高分子膜以外の部材を有していてもよく、前記部材としては、それぞれの用途に応じて、公知の部材から適宜選択することができる。
【実施例】
【0044】
(実施例1)
<モノマー1の合成>
モノマー1を非特許文献1(Y.Li,T.Michinobu,Polym.Chem.1,72(2010))に記載の合成方法を参考にして、以下の通り合成した。
【0045】
<<N,N−ジヘキサデシル−4−ヨードアニリンの合成>>
4−ヨードアニリン(5.30g,24.2mmoL)の脱水ジメチルホルムアミド(50mL)溶液に1-ヨードヘキサデカン(28.0g,79.5mmol)と炭酸ナトリウム(4.50g,42.5mmol)を加え、95℃で20時間反応させた。室温まで冷却し、200mLの純水で洗浄し、ジクロロメタン200mLで抽出した。有機層を回収し、硫酸ナトリウムで乾燥させた。ロータリーエバポレーターで濃縮し、シリカゲルカラムを用い、ヘキサンを展開溶媒として分画し、N,N−ジヘキサデシル−4−ヨードアニリンを13.0g得た。
【0046】
<<N,N−ジヘキサデシル−4−({4−[(トリイソプロピルシリル)エチニル]フェニル}エチニル)アニリン(モノマー1)の合成>>
脱気した[(4−エチニルフェニル)エチニル](トリイソプロピル)シラン(1.00g,3.54mmol)とN,N−ジヘキサデシル−4−ヨードアニリン(2.36g,3.53mmol)のジイソプロピルアミン溶液(40mL)に,ビス(トリフェニルホスフィン)パラジウム(II)ジクロライド(50mg,0.070mmol)とヨウ化銅(I)(25mg,0.13mmol)を加え、窒素雰囲気下、室温で18時間反応させた。析出、沈殿した塩を濾別後、ロータリーエバポレーターで濃縮し、シリカゲルカラムを用い、ヘキサンを展開溶媒として分画し、目的物N,N−ジヘキサデシル−4−({4−[(トリイソプロピルシリル)エチニル]フェニル}エチニル)アニリンを粘稠液体として2.16g得た。
【0047】
<<4−[(4−エチニルフェニル)エチニル]−N,N−ジヘキサデシルアニリン(モノマ−1)の合成>>:
N,N−ジヘキサデシル−4−({4−[(トリイソプロピルシリル)エチニル]フェニル}エチニル)アニリン(1.00g,1.21mmol)のテトラヒドロフラン溶液(12mL)に、テトラブチルアンモニウムフロライド(1M テトラヒドロフラン溶液)(2.4mL)を加え、0℃空気下で20分反応させた。シリカゲルカラムを用い、ジクロロメタンを展開溶媒として分画し、4−[(4−エチニルフェニル)エチニル]−N,N−ジヘキサデシルアニリンを黄色粉末として786mg得た。
【0048】
・モノマー1の合成
【化9】

【0049】
<ポリフェニルアセチレン誘導体2の合成>
次に、モノマー1からポリフェニルアセチレン誘導体2を以下の方法により合成した。
先ず、30mL二口ナシ型フラスコにモノマー1を170mg(0.255mmol)と攪拌子を加えた。前記フラスコを窒素雰囲気下に曝した後、トルエン(1.25mL)を加えてモノマー1を溶解させた。
次に、触媒溶液([Rh(nbd)Cl]2:0.128mmol、トルエン:1.25mL、トリエチルアミン:1滴)を乾燥したシリンジで加え、モノマー1溶液と反応させた。
この反応溶液をアルゴン雰囲気下、室温で24時間攪拌し、重合反応させた。重合終了後、トルエン2mLを加えた後、メタノール/ジクロロメタン(6/1)の混合溶液(200mL)中に滴下して沈殿物を得た。
この沈殿物をろ過により回収した後、再沈澱精製してポリフェニルアセチレン誘導体2を黄色粉末として122mg得た。
【0050】
・ポリフェニルアセチレン誘導体2の合成
【化10】

【0051】
この合成方法におけるポリフェニルアセチレン誘導体2の収率と、同定結果は、以下の通りであった。
収率:72%。1H NMR(300MHz,CDCl3):δ 0.86(s,CH3),1.24(s,NCH2CH2(CH2)15CH3),1.59(s,NCHZCHZ),2.87−3.60(br s,NCH2),6.15−6.55(br s,PhH and olefin proton),7.05−7.55(br s,PhH)。IR(neat):2920,2851,2209,1608,1518,1464,1368,1196,1137,811,722cm−1。
【0052】
<TCNE付加反応による目的化合物3の合成>
TCNEの付加反応は、以下の方法により行った。
50mLフラスコにポリフェニルアセチレン誘導体2を41.4mg(0.062mmol/repeat unit)を入れ、1,2−ジクロロベンゼン(12mL)を加えて溶解させた後、これにTCNEの1,2−ジクロロエタン溶液(5.686M、1.4mL)を加えて反応させた。
この反応溶液を窒素雰囲気下、100℃で24時間攪拌し反応させた。
反応終了後、室温に冷却してから溶媒を減圧除去し、シアノ基が導入された目的化合物3を赤色粉末として49.3mg得た。
【0053】
・目的化合物3の合成
【化11】

【0054】
この合成方法における目的化合物3の収率と、同定結果は、以下の通りであった。
収率100%。1H NMR(300MHz,CDCl3):δ 0.88(s,CH3),1.25(s,NCH2CH2(CH2)15CH3),1.57(s,NCH2CH2),2.80−3.60(br s,NCH2),6.42−6.97(br s,PhH and olefin proton),7.50−7.90(br s,PhH)。IR(neat):2921,2851,2214,1601,1483,1443,1415,1345,1210,1182,820,796,720cm−1。Elemental analysis calcd for (C54H75N5)n:C 81.66,H 9.52,N 8.82;found:C 81.81,H 9.90,N 8.29%。
【0055】
<高分子膜の形成>
目的化合物3(25mg)をトルエン(1.5mL)に溶解させた後、テフロン板上にキャスト塗工して、実施例1における高分子膜を得た。
なお、実施例1における高分子膜の膜厚は、60μm程度であった。
【0056】
(実施例2)
<モノマー4の合成>
モノマー4を非特許文献2(Y.Li,T.Michinobu,Polym.Chem.1,pp.72−74(2010))に記載の合成方法を参考にして、以下の通り合成した。
【0057】
<<N,N−ジヘキサデシル−4−({3−[(トリイソプロピルシリル)エチニル]フェニル}エチニル)アニリンの合成>>
脱気した[(3−エチニルフェニル)エチニル](トリイソプロピル)シラン(1.00g,3.54mmol)と、モノマー1の合成に用いたN,N−ジヘキサデシル−4−ヨードアニリン(2.36g,3.53mmol)のジイソプロピルアミン溶液(40mL)にビス(トリフェニルホスフィン)パラジウム(II)ジクロライド(50mg,0.070mmol)とヨウ化銅(I)(25mg,0.13mmol)を加え、窒素雰囲気下、室温で18時間反応させた。析出、沈殿した塩を濾別後、ロータリーエバポレーターで濃縮し、シリカゲルカラムを用い、ヘキサンを展開溶媒として分画し、N,N−ジヘキサデシル−4−({3−[(トリイソプロピルシリル)エチニル]フェニル}エチニル)アニリンを粘稠液体として1.98g得た。
【0058】
<<4−[(3−エチニルフェニル)エチニル]−N,N−ジヘキサデシルアニリン(モノマー4)の合成>>
N,N−ジヘキサデシル−4−({3−[(トリイソプロピルシリル)エチニル]フェニル}エチニル)アニリン(650mg,0.790mmol)のテトラヒドロフラン溶液(8mL)にテトラブチルアンモニウムフロライド(1M テトラヒドロフラン溶液)(2.4mL)を加え、0℃空気下で20分反応させた。シリカゲルカラムを用い、ジクロロメタンを展開溶媒として分画し、目的物4−[(4−エチニルフェニル)エチニル]−N,N−ジヘキサデシルアニリンを黄色粉末として520mg得た。
【0059】
・モノマー4の合成
【化12】

【0060】
<ポリフェニルアセチレン誘導体5の合成>
ポリフェニルアセチレン誘導体2の合成において、モノマー1に代えてモノマー4を同量用いたこと以外は、ポリフェニルアセチレン誘導体2の合成方法と同様にして、ポリフェニルアセチレン誘導体5を合成した。ポリフェニルアセチレン誘導体5は、黄色粉末として105mg得られた。
【0061】
・ポリフェニルアセチレン誘導体5の合成
【化13】

【0062】
この合成方法におけるポリフェニルアセチレン誘導体5の収率と、同定結果は、以下の通りであった。
収率70%。1H NMR(300MHz,CDCl3):δ 0.88(m,CH3),1.25(s,NCH2CH2(CH2)15CH3,1.59(br s,NCH2CH2),2.80−3.30(br s,NCH2),6.20−6.62(br s,PhH and olefin proton),7.05−7.45(br s,PhH)。IR(neat):2921,2851,2208,1608,1590,1518,1465,1368,1193,812,789,720cm−1。
【0063】
<TCNE付加反応による目的化合物6の合成>
TCNE付加反応による目的化合物3の合成において、ポリフェニルアセチレン誘導体2に代えてポリフェニルアセチレン誘導体5を同量用いたこと以外は、目的化合物3の合成と同様にして、シアノ基が導入された目的化合物6の合成を行った。
目的化合物6は、赤色粉末として49.0mg得られた。
【0064】
・目的化合物6の合成
【化14】

【0065】
この合成方法における目的化合物6の収率と、同定結果は、以下の通りであった。
収率100%。1H NMR(300MHz,CDCl3):δ 0.86(s,CH3),1.26(s,NCH2CH2(CH2)15CH3),1.59(s,NCH2CH2),3.20−3.40(br s,NCH2),6.40−6.85(br s,PhH and olefin proton),7.50−8.00(br s,PhH)。IR(neat):2921,2851,2214,1602,1486,1466,1416,1341,1210,1181,818,719cm−1。Elemental analysis calcd for (C54H75N5)n:C 81.66,H 9.52,N 8.82;found:C 81.54,H 9.80,N 8.64%。
【0066】
<高分子膜の形成>
実施例1における高分子膜の形成において、目的化合物3に代えて目的化合物6を同量用いたこと以外は、実施例1における高分子膜の形成方法と同様にして、実施例2における高分子膜を得た。
【0067】
<実施例1、2における目的化合物3、6の合成スキーム>
前駆体高分子として電子豊富アルキンを有するポリアセチレン誘導体を合成する。電子供与性基としてジアルキルアニリンを採用する。アルキル鎖長により高分子の溶解性及び成形加工性を制御できると共に、ポスト機能化反応における高収率が期待される。
Rh触媒は一置換アルキンのみ重合活性を示すポリアセチレン誘導体合成用の触媒である。電子豊富アルキンと末端アルキンのみを有するモノマー1及び4を非特許文献2に記載の合成方法を参考にして合成した。
モノマー1及び4の末端アルキンのみにRh触媒が作用して重合することで、対応するポリフェニルアセチレン誘導体2及び5が得られた。
得られたポリフェニルアセチレン誘導体2及び5にアクセプター分子であるテトラシアノエチレン(TCNE)を加えると室温で定量的に反応進行し、モノマー繰返し単位当たり4つのシアノ基が導入された目的化合物3及び6を合成することができた。
【0068】
【化15】

【0069】
(測定結果)
得られたポリフェニルアセチレン誘導体2、5及び目的化合物3、6の各高分子の構造は、NMR、IR、GPC、元素分析より確実に同定した。GPCで算出した高分子の分子量は、全て6万以上であり、十分な高分子量体が得られていた(ポリフェニルアセチレン誘導体2:Mn=66,300、Mw/Mn=3.06、目的化合物3:Mn=210,000、Mw/Mn=4.01、ポリフェニルアセチレン誘導体5:Mn=90,500、Mw/Mn=2.91、目的化合物6:Mn=159,600、Mw/Mn=3.41)。
【0070】
熱分析したところ、全ての高分子の5%重量減少温度が330℃以上であり、非常に高い耐熱性を有していた。窒素雰囲気下で毎分10℃の昇温速度で測定した重量変化曲線を図2(a)及び図2(b)に示す。また、ガラス転位点は約100℃付近にあり、TCNE付加で若干の上昇が観測された。
【0071】
次に、各高分子のトルエン溶液をテフロン板上にキャストし、各々膜厚が60μm程度の高分子膜を形成した。ポリフェニルアセチレン誘導体2、及び目的化合物3、6の高分子膜は、十分な強度の高分子膜が得られたため、気体透過測定に供することができた。一方、ポリフェニルアセチレン誘導体5の高分子膜は、脆く透過測定中に壊れてしまった。
気体透過性を評価するための代表的な気体として酸素を選択した。30℃で測定した酸素透過係数PO2を下記表2に示す。なお、酸素透過係数PO2は、数値が小さい程、ガスバリア性が高いことを示す。
【0072】
【表2】

【0073】
シアノ基を繰返し単位あたり4つ導入すると酸素透過係数が約30%に減少した。これは、シアノ基間の双極子相互作用が膜密度を高めて酸素の移動を妨げたためと考えられる。
なお、高分子のポスト機能化で気体透過性を変化(または低下)させた報告例が存在する(T.Masuda et al.,J.Polym.Sci.A44,5028(2006))。この報告で増田らは、トリアルキルシリル基を側鎖に有するポリフェニルアセチレン誘導体の膜に、テトラフルオロアンモニウムフルオリドを作用させて選択的にシリル基のみを除去して不溶性のポリフェニルアセチレン膜へと誘導している。シリル基がなくなることで膜中の空隙が大きくなり、気体透過性が向上している。また、アルコール保護のシリル基を除去すると、逆に気体透過性が減少している。これは水酸基由来の水素結合が有効に作用した結果と考えられる。
しかしながら、シアノ基は定量的に保護できないため、同様の方法論は適用できない。
即ち、本発明では、アルキン含有前駆体ポリマーとテトラシアノ構造を有するアクセプター化合物間の定量的付加反応を利用し、簡単かつ収率良くガスバリア性を有する高分子の高分子膜を得ることとしている。また、本発明における高分子化合物は、ポスト機能化後でも高い溶解性を保持しており、優れた成形加工性を得ることができる。
更に、実施例1における目的化合物3と実施例2における目的化合物6の酸素透過性を比較すると、対称性が悪く密にパッキングできない目的化合物6では、目的化合物3よりも約3倍多く酸素を透過することが分かった。これにより炭素一つ分の置換位置の違いでも気体透過性を制御できることが理解される。
以上、実施例1及び2では、気体透過性に優れたポリアセチレン誘導体を気体バリア性に優れたシアノ基含有高分子として、ガスバリア材として有用な高分子膜を得ることができている。
【産業上の利用可能性】
【0074】
本発明の高分子膜は、ガスバリア性を有し、成型加工性が良好であることから、ガスバリア材として、気体透過制御膜、気体封止膜、塗料材料、塗装材料、及び包装用フィルム、シーリング材、パッキング材等の各種資材などに広く利用することができる。
【技術分野】
【0001】
本発明は、ガスバリア性を有する高分子膜及び該高分子膜を有するガスバリア材に関する。
【背景技術】
【0002】
空気中の酸素と窒素の分離や特定ガスの吸着・貯蔵は、高度情報化社会の安全・エネルギー面を支える基幹技術である。
非常に高い気体透過性を有する高分子骨格としてポリアセチレン誘導体が知られている。現在知られている最も優れた気体透過性高分子はポリトリメチルシリルプロピンである。
このポリトリメチルシリルプロピンは、剛直なポリアセチレン主鎖骨格のため自由体積が大きい点と、嵩高くプロペラ様に回転するトリメチルシリル基とが分子設計のポイントとなっている。下記表1に代表的な高分子膜に対する各気体の気体透過係数を示す。この表1に示す各気体の気体透過係数の違いは、気体分子のサイズを反映している。
【0003】
一方、ポリビニル型高分子は、気体透過性が低い(気体バリア性が高い)高分子として食品、電子機器等の包装材として利用されている。特に、ポリアクリロニトリルやポリビニルアルコール等の気体透過性が低い理由は、高分子鎖間の官能基相互作用(双極子相互作用、水素結合)によって高分子鎖の熱運動が抑制されているためと説明できる。
これらの高分子は、ガラス転位点がそれほど高くないため、室温近傍では熱運動しており高分子鎖間を気体分子が移動していく。即ち、水素結合した高分子鎖間は高密度になり、気体透過性を減少させることができる。
【0004】
【表1】

【0005】
しかしながら、現行の気体透過性が低い(気体バリア性が高い)高分子は、溶媒への溶解性が低いため単独では成形加工性に劣る点に問題がある。また、気体透過性が低い(気体バリア性が高い)高分子膜を食品、電子機器等の包装材などとして利用する場合、用途に応じて必要な耐熱性を有している必要がある。
【0006】
ところで、本発明者は、以前に、電子豊富アルキンと強力アクセプター分子の定量的付加反応を発見した(特許文献1、非特許文献1〜4)。この反応において、ジアルキルアニリンやフェロセン等の強力ドナーが置換したアルキンは、テトラシアノエチレン(TCNE)やテトラシアノキノジメタン(TCNQ)及びその誘導体と選択的に反応して4つのシアノ基が置換した生成物を与える。この反応は、高分子反応であっても温和な条件下で副反応無く進行する。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2009−270011号公報
【非特許文献】
【0008】
【非特許文献1】Tsuyoshi Michinobu 他8名、Chemical Communications、Issue6、pp.737−739(2005)
【非特許文献2】Y.Li、T.Michinobu、Polym.Chem.1、pp.72−74(2010)
【非特許文献3】Y.Li、K.Tsuboi、T.Michinobu、Macromolecules、Vol.43、No.12、pp.5277−5286(2010)
【非特許文献4】T.Michinobu、J.Am.Chem.Soc.130、pp.14074−14075(2008)
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、従来における前記諸問題を解決し、以下の目的を達成することを課題とする。即ち、本発明は、ガスバリア性を有し、成型加工性が良好な高分子膜及びガスバリア材を提供することを目的とする。
【0010】
前記課題を解決するために、本発明者らが鋭意検討を行ったところ、以下の知見が得られた。前述の通り、電子豊富アルキンと強力アクセプター分子の定量的付加反応により4つのシアノ基が置換した生成物が得られる。この生成物の合成スキームを図1に示す。この反応を使用してポリアセチレン誘導体のポスト機能化を実施すれば、得られる高分子膜の気体透過係数を変化させることができる。また、成形加工性が高い前駆体高分子に所望のシアノ基量を簡便に導入でき、透過係数の制御やガスバリア性が高い強靭膜を得ることができる。
【課題を解決するための手段】
【0011】
本発明は、前記知見に基づくものであり、前記課題を解決するための手段としては、以下の通りである。即ち、
<1> 下記一般式(1)で表される化合物を含み、ガスバリア材として用いられることを特徴とする高分子膜。
【化1】

ただし、前記一般式(1)中、R1は、水素原子又は電子供与性基を表し、R2は、ポリマー鎖主鎖を形成する基を表し、R3は、キノイド型構造を有するアリール基又は二重結合を表し、R4は、前記ポリマー鎖主鎖の末端基又はハロゲン原子を表し、x及びyはそれぞれ、0≦x<l00、0<y≦100、及びx+y=100の式を満たす整数であって、モノマーの重合比を示す数値を表し、*は、前記ポリマー鎖主鎖を形成する基と結合する側鎖の炭素原子の位置を表す。
<2> ポリマー鎖主鎖を形成する基が、ポリフェニルアセチレン、ポリスチレン、ポリアクリル酸、ポリメタクリル酸、ポリシロキサン、ポリフェニルオキサイド、芳香族ポリアミド、芳香族ポリエステル、ポリイミド、ポリエチレン、ポリプロピレン、ポリアクリロニトリル、ポリブタジエン、ポリ塩化ビニル、ポリ塩化ビニリデン、ポリメチルメタクリレート、ポリカーボネート、ポリアリルエステル、ポリオキシメチレン、ポリフェニレンスルフィド、ポリエステル、ポリスルホン、ポリエーテルケトン、ポリウレタン、ポリアクリルアミド、ヘテロ環ポリマー、ポリビニルアルコール及びこれらの誘導体のいずれかの構造単位を有する基である前記<1>に記載の高分子膜。
<3> ポリマー鎖主鎖を形成する基が、下記構造式(2−1)から(2−9)のいずれかで表されるポリマー鎖主鎖の構造単位及びこれらの誘導体から選択される基である前記<2>に記載の高分子膜。
【化2】

ただし、前記構造式(2−1)から(2−9)中、nは、繰り返し単位数を表し、*は、一般式(1)で表される化合物中、*の位置の炭素原子と結合することを表す。
<4> ポリマー鎖主鎖を形成する基が、構造式(2−1)、(2−2)で表されるポリマー鎖主鎖の構造単位及びこれらの誘導体から選択される基であり、前記構造式(2−1)、(2−2)中のフェニレン基が、一般式(1)で表される化合物中、*の位置の炭素原子とパラ位で結合する前記<3>に記載の高分子膜。
<5> 電子供与性基が、パラ位とオルト位の少なくとも一方にアミンを有するフェニル基、パラ位とオルト位の少なくとも一方にアルコキシ基を有するフェニル基、アミノ基、モノ置換アミノ基、ジ置換アミノ基、置換基を有していてもよいフェロセン含有基、置換基を有していてもよいチオフェン含有基、置換基を有していてもよいピロール含有基及び置換基を有していてもよいカルバゾール含有基からなる群から選択される前記<1>から<4>のいずれかに記載の高分子膜。
<6> キノイド型構造を有するアリール基が、シクロヘキサ−2,5−ジエン−1,4−ジイリデン基、2,3,5,6−テトラフルオロヘキサ−2,5−ジエン−1,4−ジイリデン基、ナフタレン−2,6−ジイリデン基、アントラセン−9,10−ジイリデン基からなる群から選択される基である前記<1>から<5>のいずれかに記載の高分子膜。
<7> 少なくとも、前記<1>から<6>のいずれかに記載の高分子膜を有することを特徴とするガスバリア材。
【発明の効果】
【0012】
本発明によれば、従来における前記諸問題を解決することができ、ガスバリア性を有し、成型加工性が良好な高分子膜及びガスバリア材を提供することができる。
【図面の簡単な説明】
【0013】
【図1】図1は、本発明に用いられる化合物の合成スキームを示す説明図である。
【図2(a)】図2(a)は、ポリフェニルアセチレン誘導体2及び目的化合物3の窒素雰囲気下での熱分析結果を示すグラフである。
【図2(b)】図2(b)は、ポリフェニルアセチレン誘導体5及び目的化合物6の窒素雰囲気下での熱分析結果を示すグラフである。
【発明を実施するための形態】
【0014】
(高分子膜)
本発明の高分子膜は、下記一般式(1)で表される化合物を含み、ガスバリア材として用いられることを特徴とする。
【0015】
【化3】

ただし、前記一般式(1)中、R1は、水素原子又は電子供与性基を表し、R2は、ポリマー鎖主鎖を形成する基を表し、R3は、キノイド型構造を有するアリール基又は二重結合を表し、R4は、前記ポリマー鎖主鎖の末端基又はハロゲン原子を表し、x及びyはそれぞれ、0≦x<l00、0<y≦100、及びx+y=100の式を満たす整数であって、モノマーの重合比を示す数値を表し、*は、前記ポリマー鎖主鎖を形成する基と結合する側鎖の炭素原子の位置を表す。
【0016】
前記一般式(1)で表される化合物は、下記の反応式(I)に示されるように、一般式(2)で表されるアルキン含有前駆体ポリマーに、一般式(3)で示されるテトラシアノ構造を有する化合物を添加し、両者を反応させることにより製造することができる。
【0017】
【化4】

ただし、前記反応式(I)中、R1は、水素原子又は電子供与性基を表し、R2は、ポリマー鎖主鎖を形成する基を表し、R3は、キノイド型構造を有するアリール基又は二重結合を表し、R4は、前記ポリマー鎖主鎖の末端基又はハロゲン原子を表し、x及びyはそれぞれ、0≦x<l00、0<y≦100、及びx+y=100の式を満たす整数であって、モノマーの重合比を示す数値を表し、*は、前記ポリマー鎖主鎖を形成する基と結合する側鎖の炭素原子の位置を表す。
【0018】
<前駆体ポリマーの合成>
前記一般式(1)で表される化合物の前駆体となる、前記一般式(2)で示されるアルキン含有前駆体ポリマーは、エチニレン基(炭素−炭素三重結合)を有するモノマーと、必要により他のモノマーを共重合させることにより得ることができる。
【0019】
前記モノマーの重合方法としては、特に制限はなく目的に応じて適宜選択することができ、例えば、ビニル基に対するラジカル重合、イオン重合、リビング重合による方法、エチニル基に対する遷移金属触媒(ロジウム、タンタル、ニオブ、タングステ、ルテニウム等)を用いたメタセシス重合による方法、重縮合による方法、パラジウム/リン触媒を用いたクロスカップリング反応により重合する方法、薗頭カップリング反応により重合する方法、HECKカップリング反応により重合する方法、Suzukiカップリング反応により重合する方法、Grignard反応により重合する方法、スルホニウム塩前駆体法、Wittig−Horner反応、Knoevenagel法、Ni(O)触媒により重合する方法、FeCl3等の酸化剤により重合する方法、電気化学的に酸化重合する方法、適当な脱離基を有する中間体高分子の分解による方法、原子移動ラジカル重合法により重合する方法等が挙げられる。
【0020】
また、前記側鎖にエチニレン基(炭素−炭素三重結合)を有するモノマーとしては、特に制限はなく、前記アルキン含有前駆体ポリマーに導入されるポリマー鎖主鎖の構造に応じて適宜選択される。このようなモノマーとしては、公知の製造方法により製造することができ、また、市販されているものを用いることができる。
【0021】
前記反応式(I)において、前記一般式(2)で表されるアルキン含有前駆体ポリマーのエチニレン基(炭素−炭素三重結合)に隣接するR1が、電子供与性基であると、前記一般式(3)で表されるテトラシアノ構造を有する化合物を付加する反応の反応性が高められる。そのため、例えば、0℃〜300℃の比較的緩やかな温度条件下にて、無触媒又は遷移金属等の触媒を用いて、有機溶媒中で反応させることができる。
【0022】
ここで、前記電子供与性基としては、特に制限はなく目的に応じて適宜選択することができ、例えば、パラ位とオルト位の少なくとも一方にアミンを有するフェニル基、パラ位とオルト位の少なくとも一方にアルコキシ基を有するフェニル基、アミノ基、モノ置換アミノ基、ジ置換アミノ基、置換基を有していてもよいフェロセン含有基、置換基を有していてもよいチオフェン含有基、置換基を有していてもよいピロール含有基又は置換基を有していてもよいカルバゾール含有基等が挙げられる。
中でも、前記電子供与性基が、パラ位とオルト位の少なくとも一方にアミンを有するフェニル基又は置換基を有していてもよいフェロセン含有基である場合には、さらに反応性を高めることができる。
【0023】
前記電子供与性基の置換基としては、それほど反応性の高くない基であれば、特に制限はなく、例えば、アルキル基、シクロアルキル基、アルケニル基、アルキニル基、アリール基、ヘテロアリール基、ヘテロ環基、アルコキシ基、シクロアルコキシ基、アリールオキシ基、アルキルチオ基、シクロアルキルチオ基、アリールチオ基、アルコキシカルボニル基、アリールオキシカルボニル基、スルファモイル基、アシル基、アシルオキシ基、アミド基、カルバモイル基、ウレイド基、スルフィニル基、アルキルスルホニル基、アリールスルホニル基、アミノ基、ハロゲン原子、フッ化炭化水素基、シアノ基、シリル基等が挙げられる。
なお、前記R1が水素原子の場合には、化学的安定性が低下した高分子化合物となる。
【0024】
前記反応式(I)で使用される溶媒としては、特に制限はなく、目的に応じて適宜選択することができるが、例えば、ジクロロエタン、THF(テトラヒドロフラン)、ジクロロメタン、クロロホルム、クロロベンゼン、ジクロロベンゼン、ベンゼン、トルエン、アセトニトリル等が挙げられる。
【0025】
前記反応式(I)において、R2は、ポリマー鎖主鎖を形成する基とされ、前記モノマーの重合方法により、ポリマー鎖主鎖を形成する。
前記ポリマー鎖主鎖を形成する基としては、特に制限はなく目的に応じて適宜選択することができ、公知のポリマー鎖主鎖を形成する基を挙げることができるが、例えば、ポリフェニルアセチレン、ポリスチレン、ポリアクリル酸、ポリメタクリル酸、ポリシロキサン、ポリフェニルオキサイド、芳香族ポリアミド、芳香族ポリエステル、ポリイミド、ポリエチレン、ポリプロピレン、ポリアクリロニトリル、ポリブタジエン、ポリ塩化ビニル、ポリ塩化ビニリデン、ポリメチルメタクリレート、ポリカーボネート、ポリアリルエステル、ポリオキシメチレン、ポリフェニレンスルフィド、ポリエステル、ポリスルホン、ポリエーテルケトン、ポリウレタン、ポリアクリルアミド、ヘテロ環ポリマー、ポリビニルアルコール及びこれらの誘導体のいずれかの構造単位を有する基が好ましい。
これらの中でも、成型加工性に優れ、高い耐熱性が期待できるポリスチレン及び芳香族ポリアミドが特に好ましい。
【0026】
また、前記ポリマー鎖主鎖を形成する基の具体的な構造例としては、下記構造式(2−1)から(2−9)のいずれかで表されるポリマー鎖主鎖の構造単位及びこれらの誘導体から選択される基が挙げられる。
【0027】
【化5】

【0028】
また、前記誘導体に係るポリマー鎖主鎖の構造例を下記構造式(2−10)から(2−14)に示す。
下記構造式(2−10)は、前記構造式(2−7)のポリアミドにジフェニルエーテルを重合付加した誘導体に係り、置換基の結合位置(−*)を変更したものである。
下記構造式(2−11)は、下記構造式(2−10)から置換基の結合位置(−*)を変更したものである。
下記構造式(2−12)は、前記構造式(2−7)のポリエステルにジフェニルエーテルを重合付加した誘導体に係り、置換基の結合位置(−*)を変更したものである。
下記構造式(2−13)は、下記構造式(2−12)から置換基の結合位置(−*)を変更したものである。
下記構造式(2−14)は、前記構造式(2−9)から置換基の結合位置(−*)を変更したものである。
なお、前記誘導体としては、このような誘導体の例に限らず、目的に応じて適宜選択することができる。
【0029】
【化6】

【0030】
これらの構造例の中でも、前記構造式(2−1)及び(2−2)中のフェニレン基が、パラ位で側鎖と結合する(前記一般式(1)における*の位置の炭素原子と結合する)ものが特に好ましい。
【0031】
なお、前記ポリマー鎖主鎖を形成する基が導入される前記一般式(1)で表される化合物において、隣接する前記ポリマー鎖主鎖を形成する基同士は、同一の構造単位のほかに異なる構造単位を有していてもよく、前記ポリマー鎖主鎖としては、前記ポリマー鎖主鎖を形成する基を2種以上有する共重合体であってもよい。
【0032】
前記一般式(1)において、R4は、前記ポリマー鎖主鎖の末端基又はハロゲン原子とされる。
なお、R4をハロゲン原子(例えば、Br)とする場合、例えば、原子移動ラジカル重合法などにより、前記前駆体ポリマーを合成し、目的化合物の合成に用いることができる。
【0033】
<目的化合物の合成>
前記の反応式(I)では、下記一般式(3)で表されるテトラシアノ構造を有する化合物が使用される。この化合物は、強力なアクセプター分子として作用し、前記一般式(2)で表される電子供与性の前駆体ポリマーと良好な反応性を示す。このような合成方法により、目的化合物としての前記一般式(1)で表される化合物を簡便かつ収率良く合成することができる。
【0034】
【化7】

ただし、前記一般式(3)中、R3は、キノイド型構造を有するアリール基又は二重結合を表す。
【0035】
前記キノイド型構造を有するアリール基としては、特に限定はなく目的に応じて適宜選択することができ、例えば、シクロヘキサ−2,5−ジエン−1,4−ジイリデン基、2,3,5,6−テトラフルオロヘキサ−2,5−ジエン−1,4−ジイリデン基、ナフタレン−2,6−ジイリデン基、アントラセン−9,10−ジイリデン基、フェナントレン−3,9−ジイリデン基、フェナントレン−2,7−ジイリデン基等が挙げられる。
これらの中でも、シクロヘキサ−2,5−ジエン−1,4−ジイリデン基、2,3,5,6−テトラフルオロヘキサ−2,5−ジエン−1,4−ジイリデン基、ナフタレン−2,6−ジイリデン基、アントラセン−9,10−ジイリデン基が好ましい。
【0036】
前記一般式(3)で示される化合物の具体的な化合物としては、例えば、下記の構造式(A−1)〜(A−5)に示される化合物が挙げられる。
【0037】
【化8】

【0038】
前記一般式(3)において、R3が二重結合の場合には、前記構造式(A−1)で示されるテトラシアノエチレン(以下、TCNEと示すことがある)となる。
前記一般式(3)において、R3がシクロヘキサ−2,5ジエン−1,4−ジイリデン基の場合には、前記構造式(A−2)で示されるテトラシアノキノジメタンとなる。
前記一般式(3)において、R3が2,3,5,6−テトラフルオロヘキサ−2,5ジエン−1,4−ジイリデン基の場合には、前記構造式(A−3)で示されるテトラフルオロテトラシアノキノジメタンとなる。
前記一般式(3)において、R3がナフタレン−2,6−ジイリデン基の場合には、前記構造式(A−4)で示される11,11,12,12−テトラシアノナフト−2,6−キノジメタンとなる。
前記一般式(3)において、R3がアントラセン−9,10−ジイリデン基の場合には、前記構造式(A−5)で示される9,10−ビス(ジシアノメチレン)−9,10−ジヒドロアントラセンとなる。
これらの中でも、前記構造式(A−1)で示されるテトラシアノエチレンを用いることが好ましい。
前記テトラシアノエチレン(TCNE)を使用すれば、過剰に添加しても、副反応を誘起しないため、昇華精製で容易にテトラシアノエチレンを除去することができ、製造コストを低減することができる。また、テトラシアノエチレンを昇華精製により除去した後の反応物の重量から重量増加を計算すれば、反応収率を容易に計算することができる。
【0039】
前記一般式(2)で表されるアルキン含有前駆体ポリマーと、前記一般式(3)で示されるテトラシアノ構造を有する化合物との反応条件に関し、温度条件としては、20℃〜100℃が好ましく、反応時間としては、0.1時間〜3時間が好ましく、環境条件としては、窒素雰囲気下で反応させることが好ましい。
【0040】
前記一般式(1)で表される化合物の数平均分子量としては、特に制限はなく目的に応じて適宜選択することができ、例えば、10,000〜300,000とすることができる。
【0041】
<高分子膜の形成>
前記高分子膜の形成方法としては、特に制限はなく目的に応じて適宜選択することができ、例えば、前記一般式(1)で表される化合物を含む溶液を基板、シート等の基材に塗工する方法、前記一般式(1)で表される化合物を含む高分子膜を基板から伸長させる方法などが挙げられる。
また、前記高分子膜としては、本発明の効果を損なわない限り、前記一般式(1)で表される化合物以外の添加材を含むことができ、このような添加材としては、目的に応じて、高分子膜の形成材料として用いられる公知の材料から適宜選択することができる。
【0042】
前記高分子膜は、良好なガスバリア性を示す。これは、前記一般式(1)で表される化合物の側鎖に導入されるシアノ基間の双極子相互作用が、前記高分子膜の膜密度を高めることにより、気体の透過を妨げるものと考えられる。
前記ガスバリア性に関し、前記一般式(1)で表される化合物は、前記反応式(I)において、前記一般式(3)で表される化合物の添加量を調整することにより、前記一般式(1)におけるxとyの重合比を変更し、導入するシアノ基量を調節可能であり、前記高分子膜の気体透過係数を制御することができる。
また、前記高分子膜は、前記導入するシアノ基量を調節して前記高分子膜の膜密度を制御することにより、目的とする気体の分子サイズに応じて、これらの透過性を選択的に制御することができる。
【0043】
(ガスバリア材)
本発明のガスバリア材は、少なくとも、前記高分子膜を有することを特徴とする。
前記ガスバリア材は、前記高分子膜のガスバリア性を利用して、気体透過制御膜、気体封止膜、塗料材料、塗装材料、及び包装用フィルム、シーリング材、パッキング材等の各種資材として用いることができる。
また、前記ガスバリア材としては、前記高分子膜以外の部材を有していてもよく、前記部材としては、それぞれの用途に応じて、公知の部材から適宜選択することができる。
【実施例】
【0044】
(実施例1)
<モノマー1の合成>
モノマー1を非特許文献1(Y.Li,T.Michinobu,Polym.Chem.1,72(2010))に記載の合成方法を参考にして、以下の通り合成した。
【0045】
<<N,N−ジヘキサデシル−4−ヨードアニリンの合成>>
4−ヨードアニリン(5.30g,24.2mmoL)の脱水ジメチルホルムアミド(50mL)溶液に1-ヨードヘキサデカン(28.0g,79.5mmol)と炭酸ナトリウム(4.50g,42.5mmol)を加え、95℃で20時間反応させた。室温まで冷却し、200mLの純水で洗浄し、ジクロロメタン200mLで抽出した。有機層を回収し、硫酸ナトリウムで乾燥させた。ロータリーエバポレーターで濃縮し、シリカゲルカラムを用い、ヘキサンを展開溶媒として分画し、N,N−ジヘキサデシル−4−ヨードアニリンを13.0g得た。
【0046】
<<N,N−ジヘキサデシル−4−({4−[(トリイソプロピルシリル)エチニル]フェニル}エチニル)アニリン(モノマー1)の合成>>
脱気した[(4−エチニルフェニル)エチニル](トリイソプロピル)シラン(1.00g,3.54mmol)とN,N−ジヘキサデシル−4−ヨードアニリン(2.36g,3.53mmol)のジイソプロピルアミン溶液(40mL)に,ビス(トリフェニルホスフィン)パラジウム(II)ジクロライド(50mg,0.070mmol)とヨウ化銅(I)(25mg,0.13mmol)を加え、窒素雰囲気下、室温で18時間反応させた。析出、沈殿した塩を濾別後、ロータリーエバポレーターで濃縮し、シリカゲルカラムを用い、ヘキサンを展開溶媒として分画し、目的物N,N−ジヘキサデシル−4−({4−[(トリイソプロピルシリル)エチニル]フェニル}エチニル)アニリンを粘稠液体として2.16g得た。
【0047】
<<4−[(4−エチニルフェニル)エチニル]−N,N−ジヘキサデシルアニリン(モノマ−1)の合成>>:
N,N−ジヘキサデシル−4−({4−[(トリイソプロピルシリル)エチニル]フェニル}エチニル)アニリン(1.00g,1.21mmol)のテトラヒドロフラン溶液(12mL)に、テトラブチルアンモニウムフロライド(1M テトラヒドロフラン溶液)(2.4mL)を加え、0℃空気下で20分反応させた。シリカゲルカラムを用い、ジクロロメタンを展開溶媒として分画し、4−[(4−エチニルフェニル)エチニル]−N,N−ジヘキサデシルアニリンを黄色粉末として786mg得た。
【0048】
・モノマー1の合成
【化9】

【0049】
<ポリフェニルアセチレン誘導体2の合成>
次に、モノマー1からポリフェニルアセチレン誘導体2を以下の方法により合成した。
先ず、30mL二口ナシ型フラスコにモノマー1を170mg(0.255mmol)と攪拌子を加えた。前記フラスコを窒素雰囲気下に曝した後、トルエン(1.25mL)を加えてモノマー1を溶解させた。
次に、触媒溶液([Rh(nbd)Cl]2:0.128mmol、トルエン:1.25mL、トリエチルアミン:1滴)を乾燥したシリンジで加え、モノマー1溶液と反応させた。
この反応溶液をアルゴン雰囲気下、室温で24時間攪拌し、重合反応させた。重合終了後、トルエン2mLを加えた後、メタノール/ジクロロメタン(6/1)の混合溶液(200mL)中に滴下して沈殿物を得た。
この沈殿物をろ過により回収した後、再沈澱精製してポリフェニルアセチレン誘導体2を黄色粉末として122mg得た。
【0050】
・ポリフェニルアセチレン誘導体2の合成
【化10】

【0051】
この合成方法におけるポリフェニルアセチレン誘導体2の収率と、同定結果は、以下の通りであった。
収率:72%。1H NMR(300MHz,CDCl3):δ 0.86(s,CH3),1.24(s,NCH2CH2(CH2)15CH3),1.59(s,NCHZCHZ),2.87−3.60(br s,NCH2),6.15−6.55(br s,PhH and olefin proton),7.05−7.55(br s,PhH)。IR(neat):2920,2851,2209,1608,1518,1464,1368,1196,1137,811,722cm−1。
【0052】
<TCNE付加反応による目的化合物3の合成>
TCNEの付加反応は、以下の方法により行った。
50mLフラスコにポリフェニルアセチレン誘導体2を41.4mg(0.062mmol/repeat unit)を入れ、1,2−ジクロロベンゼン(12mL)を加えて溶解させた後、これにTCNEの1,2−ジクロロエタン溶液(5.686M、1.4mL)を加えて反応させた。
この反応溶液を窒素雰囲気下、100℃で24時間攪拌し反応させた。
反応終了後、室温に冷却してから溶媒を減圧除去し、シアノ基が導入された目的化合物3を赤色粉末として49.3mg得た。
【0053】
・目的化合物3の合成
【化11】

【0054】
この合成方法における目的化合物3の収率と、同定結果は、以下の通りであった。
収率100%。1H NMR(300MHz,CDCl3):δ 0.88(s,CH3),1.25(s,NCH2CH2(CH2)15CH3),1.57(s,NCH2CH2),2.80−3.60(br s,NCH2),6.42−6.97(br s,PhH and olefin proton),7.50−7.90(br s,PhH)。IR(neat):2921,2851,2214,1601,1483,1443,1415,1345,1210,1182,820,796,720cm−1。Elemental analysis calcd for (C54H75N5)n:C 81.66,H 9.52,N 8.82;found:C 81.81,H 9.90,N 8.29%。
【0055】
<高分子膜の形成>
目的化合物3(25mg)をトルエン(1.5mL)に溶解させた後、テフロン板上にキャスト塗工して、実施例1における高分子膜を得た。
なお、実施例1における高分子膜の膜厚は、60μm程度であった。
【0056】
(実施例2)
<モノマー4の合成>
モノマー4を非特許文献2(Y.Li,T.Michinobu,Polym.Chem.1,pp.72−74(2010))に記載の合成方法を参考にして、以下の通り合成した。
【0057】
<<N,N−ジヘキサデシル−4−({3−[(トリイソプロピルシリル)エチニル]フェニル}エチニル)アニリンの合成>>
脱気した[(3−エチニルフェニル)エチニル](トリイソプロピル)シラン(1.00g,3.54mmol)と、モノマー1の合成に用いたN,N−ジヘキサデシル−4−ヨードアニリン(2.36g,3.53mmol)のジイソプロピルアミン溶液(40mL)にビス(トリフェニルホスフィン)パラジウム(II)ジクロライド(50mg,0.070mmol)とヨウ化銅(I)(25mg,0.13mmol)を加え、窒素雰囲気下、室温で18時間反応させた。析出、沈殿した塩を濾別後、ロータリーエバポレーターで濃縮し、シリカゲルカラムを用い、ヘキサンを展開溶媒として分画し、N,N−ジヘキサデシル−4−({3−[(トリイソプロピルシリル)エチニル]フェニル}エチニル)アニリンを粘稠液体として1.98g得た。
【0058】
<<4−[(3−エチニルフェニル)エチニル]−N,N−ジヘキサデシルアニリン(モノマー4)の合成>>
N,N−ジヘキサデシル−4−({3−[(トリイソプロピルシリル)エチニル]フェニル}エチニル)アニリン(650mg,0.790mmol)のテトラヒドロフラン溶液(8mL)にテトラブチルアンモニウムフロライド(1M テトラヒドロフラン溶液)(2.4mL)を加え、0℃空気下で20分反応させた。シリカゲルカラムを用い、ジクロロメタンを展開溶媒として分画し、目的物4−[(4−エチニルフェニル)エチニル]−N,N−ジヘキサデシルアニリンを黄色粉末として520mg得た。
【0059】
・モノマー4の合成
【化12】

【0060】
<ポリフェニルアセチレン誘導体5の合成>
ポリフェニルアセチレン誘導体2の合成において、モノマー1に代えてモノマー4を同量用いたこと以外は、ポリフェニルアセチレン誘導体2の合成方法と同様にして、ポリフェニルアセチレン誘導体5を合成した。ポリフェニルアセチレン誘導体5は、黄色粉末として105mg得られた。
【0061】
・ポリフェニルアセチレン誘導体5の合成
【化13】

【0062】
この合成方法におけるポリフェニルアセチレン誘導体5の収率と、同定結果は、以下の通りであった。
収率70%。1H NMR(300MHz,CDCl3):δ 0.88(m,CH3),1.25(s,NCH2CH2(CH2)15CH3,1.59(br s,NCH2CH2),2.80−3.30(br s,NCH2),6.20−6.62(br s,PhH and olefin proton),7.05−7.45(br s,PhH)。IR(neat):2921,2851,2208,1608,1590,1518,1465,1368,1193,812,789,720cm−1。
【0063】
<TCNE付加反応による目的化合物6の合成>
TCNE付加反応による目的化合物3の合成において、ポリフェニルアセチレン誘導体2に代えてポリフェニルアセチレン誘導体5を同量用いたこと以外は、目的化合物3の合成と同様にして、シアノ基が導入された目的化合物6の合成を行った。
目的化合物6は、赤色粉末として49.0mg得られた。
【0064】
・目的化合物6の合成
【化14】

【0065】
この合成方法における目的化合物6の収率と、同定結果は、以下の通りであった。
収率100%。1H NMR(300MHz,CDCl3):δ 0.86(s,CH3),1.26(s,NCH2CH2(CH2)15CH3),1.59(s,NCH2CH2),3.20−3.40(br s,NCH2),6.40−6.85(br s,PhH and olefin proton),7.50−8.00(br s,PhH)。IR(neat):2921,2851,2214,1602,1486,1466,1416,1341,1210,1181,818,719cm−1。Elemental analysis calcd for (C54H75N5)n:C 81.66,H 9.52,N 8.82;found:C 81.54,H 9.80,N 8.64%。
【0066】
<高分子膜の形成>
実施例1における高分子膜の形成において、目的化合物3に代えて目的化合物6を同量用いたこと以外は、実施例1における高分子膜の形成方法と同様にして、実施例2における高分子膜を得た。
【0067】
<実施例1、2における目的化合物3、6の合成スキーム>
前駆体高分子として電子豊富アルキンを有するポリアセチレン誘導体を合成する。電子供与性基としてジアルキルアニリンを採用する。アルキル鎖長により高分子の溶解性及び成形加工性を制御できると共に、ポスト機能化反応における高収率が期待される。
Rh触媒は一置換アルキンのみ重合活性を示すポリアセチレン誘導体合成用の触媒である。電子豊富アルキンと末端アルキンのみを有するモノマー1及び4を非特許文献2に記載の合成方法を参考にして合成した。
モノマー1及び4の末端アルキンのみにRh触媒が作用して重合することで、対応するポリフェニルアセチレン誘導体2及び5が得られた。
得られたポリフェニルアセチレン誘導体2及び5にアクセプター分子であるテトラシアノエチレン(TCNE)を加えると室温で定量的に反応進行し、モノマー繰返し単位当たり4つのシアノ基が導入された目的化合物3及び6を合成することができた。
【0068】
【化15】

【0069】
(測定結果)
得られたポリフェニルアセチレン誘導体2、5及び目的化合物3、6の各高分子の構造は、NMR、IR、GPC、元素分析より確実に同定した。GPCで算出した高分子の分子量は、全て6万以上であり、十分な高分子量体が得られていた(ポリフェニルアセチレン誘導体2:Mn=66,300、Mw/Mn=3.06、目的化合物3:Mn=210,000、Mw/Mn=4.01、ポリフェニルアセチレン誘導体5:Mn=90,500、Mw/Mn=2.91、目的化合物6:Mn=159,600、Mw/Mn=3.41)。
【0070】
熱分析したところ、全ての高分子の5%重量減少温度が330℃以上であり、非常に高い耐熱性を有していた。窒素雰囲気下で毎分10℃の昇温速度で測定した重量変化曲線を図2(a)及び図2(b)に示す。また、ガラス転位点は約100℃付近にあり、TCNE付加で若干の上昇が観測された。
【0071】
次に、各高分子のトルエン溶液をテフロン板上にキャストし、各々膜厚が60μm程度の高分子膜を形成した。ポリフェニルアセチレン誘導体2、及び目的化合物3、6の高分子膜は、十分な強度の高分子膜が得られたため、気体透過測定に供することができた。一方、ポリフェニルアセチレン誘導体5の高分子膜は、脆く透過測定中に壊れてしまった。
気体透過性を評価するための代表的な気体として酸素を選択した。30℃で測定した酸素透過係数PO2を下記表2に示す。なお、酸素透過係数PO2は、数値が小さい程、ガスバリア性が高いことを示す。
【0072】
【表2】

【0073】
シアノ基を繰返し単位あたり4つ導入すると酸素透過係数が約30%に減少した。これは、シアノ基間の双極子相互作用が膜密度を高めて酸素の移動を妨げたためと考えられる。
なお、高分子のポスト機能化で気体透過性を変化(または低下)させた報告例が存在する(T.Masuda et al.,J.Polym.Sci.A44,5028(2006))。この報告で増田らは、トリアルキルシリル基を側鎖に有するポリフェニルアセチレン誘導体の膜に、テトラフルオロアンモニウムフルオリドを作用させて選択的にシリル基のみを除去して不溶性のポリフェニルアセチレン膜へと誘導している。シリル基がなくなることで膜中の空隙が大きくなり、気体透過性が向上している。また、アルコール保護のシリル基を除去すると、逆に気体透過性が減少している。これは水酸基由来の水素結合が有効に作用した結果と考えられる。
しかしながら、シアノ基は定量的に保護できないため、同様の方法論は適用できない。
即ち、本発明では、アルキン含有前駆体ポリマーとテトラシアノ構造を有するアクセプター化合物間の定量的付加反応を利用し、簡単かつ収率良くガスバリア性を有する高分子の高分子膜を得ることとしている。また、本発明における高分子化合物は、ポスト機能化後でも高い溶解性を保持しており、優れた成形加工性を得ることができる。
更に、実施例1における目的化合物3と実施例2における目的化合物6の酸素透過性を比較すると、対称性が悪く密にパッキングできない目的化合物6では、目的化合物3よりも約3倍多く酸素を透過することが分かった。これにより炭素一つ分の置換位置の違いでも気体透過性を制御できることが理解される。
以上、実施例1及び2では、気体透過性に優れたポリアセチレン誘導体を気体バリア性に優れたシアノ基含有高分子として、ガスバリア材として有用な高分子膜を得ることができている。
【産業上の利用可能性】
【0074】
本発明の高分子膜は、ガスバリア性を有し、成型加工性が良好であることから、ガスバリア材として、気体透過制御膜、気体封止膜、塗料材料、塗装材料、及び包装用フィルム、シーリング材、パッキング材等の各種資材などに広く利用することができる。
【特許請求の範囲】
【請求項1】
下記一般式(1)で表される化合物を含み、ガスバリア材として用いられることを特徴とする高分子膜。
【化1】

ただし、前記一般式(1)中、R1は、水素原子又は電子供与性基を表し、R2は、ポリマー鎖主鎖を形成する基を表し、R3は、キノイド型構造を有するアリール基又は二重結合を表し、R4は、前記ポリマー鎖主鎖の末端基又はハロゲン原子を表し、x及びyはそれぞれ、0≦x<l00、0<y≦100、及びx+y=100の式を満たす整数であって、モノマーの重合比を示す数値を表し、*は、前記ポリマー鎖主鎖を形成する基と結合する側鎖の炭素原子の位置を表す。
【請求項2】
ポリマー鎖主鎖を形成する基が、ポリフェニルアセチレン、ポリスチレン、ポリアクリル酸、ポリメタクリル酸、ポリシロキサン、ポリフェニルオキサイド、芳香族ポリアミド、芳香族ポリエステル、ポリイミド、ポリエチレン、ポリプロピレン、ポリアクリロニトリル、ポリブタジエン、ポリ塩化ビニル、ポリ塩化ビニリデン、ポリメチルメタクリレート、ポリカーボネート、ポリアリルエステル、ポリオキシメチレン、ポリフェニレンスルフィド、ポリエステル、ポリスルホン、ポリエーテルケトン、ポリウレタン、ポリアクリルアミド、ヘテロ環ポリマー、ポリビニルアルコール及びこれらの誘導体のいずれかの構造単位を有する基である請求項1に記載の高分子膜。
【請求項3】
ポリマー鎖主鎖を形成する基が、下記構造式(2−1)から(2−9)のいずれかで表されるポリマー鎖主鎖の構造単位及びこれらの誘導体から選択される基である請求項2に記載の高分子膜。
【化2】

ただし、前記構造式(2−1)から(2−9)中、nは、繰り返し単位数を表し、*は、一般式(1)で表される化合物中、*の位置の炭素原子と結合することを表す。
【請求項4】
ポリマー鎖主鎖を形成する基が、構造式(2−1)、(2−2)で表されるポリマー鎖主鎖の構造単位及びこれらの誘導体から選択される基であり、前記構造式(2−1)、(2−2)中のフェニレン基が、一般式(1)で表される化合物中、*の位置の炭素原子とパラ位で結合する請求項3に記載の高分子膜。
【請求項5】
電子供与性基が、パラ位とオルト位の少なくとも一方にアミンを有するフェニル基、パラ位とオルト位の少なくとも一方にアルコキシ基を有するフェニル基、アミノ基、モノ置換アミノ基、ジ置換アミノ基、置換基を有していてもよいフェロセン含有基、置換基を有していてもよいチオフェン含有基、置換基を有していてもよいピロール含有基及び置換基を有していてもよいカルバゾール含有基からなる群から選択される請求項1から4のいずれかに記載の高分子膜。
【請求項6】
キノイド型構造を有するアリール基が、シクロヘキサ−2,5−ジエン−1,4−ジイリデン基、2,3,5,6−テトラフルオロヘキサ−2,5−ジエン−1,4−ジイリデン基、ナフタレン−2,6−ジイリデン基、アントラセン−9,10−ジイリデン基からなる群から選択される基である請求項1から5のいずれかに記載の高分子膜。
【請求項7】
少なくとも、請求項1から6のいずれかに記載の高分子膜を有することを特徴とするガスバリア材。
【請求項1】
下記一般式(1)で表される化合物を含み、ガスバリア材として用いられることを特徴とする高分子膜。
【化1】

ただし、前記一般式(1)中、R1は、水素原子又は電子供与性基を表し、R2は、ポリマー鎖主鎖を形成する基を表し、R3は、キノイド型構造を有するアリール基又は二重結合を表し、R4は、前記ポリマー鎖主鎖の末端基又はハロゲン原子を表し、x及びyはそれぞれ、0≦x<l00、0<y≦100、及びx+y=100の式を満たす整数であって、モノマーの重合比を示す数値を表し、*は、前記ポリマー鎖主鎖を形成する基と結合する側鎖の炭素原子の位置を表す。
【請求項2】
ポリマー鎖主鎖を形成する基が、ポリフェニルアセチレン、ポリスチレン、ポリアクリル酸、ポリメタクリル酸、ポリシロキサン、ポリフェニルオキサイド、芳香族ポリアミド、芳香族ポリエステル、ポリイミド、ポリエチレン、ポリプロピレン、ポリアクリロニトリル、ポリブタジエン、ポリ塩化ビニル、ポリ塩化ビニリデン、ポリメチルメタクリレート、ポリカーボネート、ポリアリルエステル、ポリオキシメチレン、ポリフェニレンスルフィド、ポリエステル、ポリスルホン、ポリエーテルケトン、ポリウレタン、ポリアクリルアミド、ヘテロ環ポリマー、ポリビニルアルコール及びこれらの誘導体のいずれかの構造単位を有する基である請求項1に記載の高分子膜。
【請求項3】
ポリマー鎖主鎖を形成する基が、下記構造式(2−1)から(2−9)のいずれかで表されるポリマー鎖主鎖の構造単位及びこれらの誘導体から選択される基である請求項2に記載の高分子膜。
【化2】

ただし、前記構造式(2−1)から(2−9)中、nは、繰り返し単位数を表し、*は、一般式(1)で表される化合物中、*の位置の炭素原子と結合することを表す。
【請求項4】
ポリマー鎖主鎖を形成する基が、構造式(2−1)、(2−2)で表されるポリマー鎖主鎖の構造単位及びこれらの誘導体から選択される基であり、前記構造式(2−1)、(2−2)中のフェニレン基が、一般式(1)で表される化合物中、*の位置の炭素原子とパラ位で結合する請求項3に記載の高分子膜。
【請求項5】
電子供与性基が、パラ位とオルト位の少なくとも一方にアミンを有するフェニル基、パラ位とオルト位の少なくとも一方にアルコキシ基を有するフェニル基、アミノ基、モノ置換アミノ基、ジ置換アミノ基、置換基を有していてもよいフェロセン含有基、置換基を有していてもよいチオフェン含有基、置換基を有していてもよいピロール含有基及び置換基を有していてもよいカルバゾール含有基からなる群から選択される請求項1から4のいずれかに記載の高分子膜。
【請求項6】
キノイド型構造を有するアリール基が、シクロヘキサ−2,5−ジエン−1,4−ジイリデン基、2,3,5,6−テトラフルオロヘキサ−2,5−ジエン−1,4−ジイリデン基、ナフタレン−2,6−ジイリデン基、アントラセン−9,10−ジイリデン基からなる群から選択される基である請求項1から5のいずれかに記載の高分子膜。
【請求項7】
少なくとも、請求項1から6のいずれかに記載の高分子膜を有することを特徴とするガスバリア材。
【図1】


【図2(a)】


【図2(b)】




【図2(a)】


【図2(b)】


【公開番号】特開2012−92269(P2012−92269A)
【公開日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願番号】特願2010−242549(P2010−242549)
【出願日】平成22年10月28日(2010.10.28)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.テフロン
【出願人】(301031392)独立行政法人土木研究所 (107)
【Fターム(参考)】
【公開日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願日】平成22年10月28日(2010.10.28)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.テフロン
【出願人】(301031392)独立行政法人土木研究所 (107)
【Fターム(参考)】
[ Back to top ]

