高分岐ポリマー及びその製造方法、並びに、高分岐ポリマー合成用モノマー及びその前駆体
【課題】合成が容易で製造コストの低廉な高分岐ポリマー、その製造方法及び高分岐ポリマー合成用モノマー前駆体を提供する。
【解決手段】ジカルボン酸と、一般式(a)で示されるトリオールの水酸基の1つとがエステル結合したモノエステルモノマーを重縮合させてなることを特徴とする(式中R1は炭素数が1〜5のアルキル基であり、nは0又は1を示す)。

【解決手段】ジカルボン酸と、一般式(a)で示されるトリオールの水酸基の1つとがエステル結合したモノエステルモノマーを重縮合させてなることを特徴とする(式中R1は炭素数が1〜5のアルキル基であり、nは0又は1を示す)。

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、エステル結合によって多分岐構造が形成される、ポリエステル型高分岐ポリマー及びその製造方法、並びにそれらの製造原料となる高分岐ポリマー合成用モノマー及びその前駆体に関する。
【背景技術】
【0002】
近年、高度に分岐した構造を有するデンドリティック高分子が注目されている。デンドリティック高分子は、その特異な分子構造から、非晶質である、有機溶媒への溶解性が高い、粘度が極端に小さい、機能性基を導入可能な鎖末端が多く存在する等、線状高分子とは異なる特徴があり、様々な分野での応用が期待され、近年盛んに研究が行われている。
【0003】
デンドリティック高分子には、多官能基を有するモノマーを一段階づつ化学反応させ、分岐構造を形成させるデンドリマーと、ABx型モノマーを重縮合させて一気に分岐構造を形成する高分岐ポリマーとが知られている。高分岐ポリマーはモノマーから重縮合で一気に製造することができるため、製造が容易であり、製造コストが低廉であるという長所を有する。また、合成条件を適宜選択することにより、分岐度も制御できるため期待されている(非特許文献1)。
【非特許文献1】K.E.Uhrich、C.J.Hawker、J.M.J.Frechet、S.R.Turner「Macromolecules」25,4583-4587(1992)
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明は、新規なポリエステル系の高分岐ポリマー、その製造方法、それの合成原料となる高分岐ポリマー合成用モノマー及びその前駆体を提供することを目的とする。
【課題を解決するための手段】
【0005】
本発明の高分岐ポリマーは、ジカルボン酸と、一般式(a)(式中R1は水素原子又は炭素数が1〜5のアルキル基を示し、nは0又は1を示す)で示されるトリオールの水酸基の1つとがエステル結合したモノエステルモノマーを重縮合させてなることを特徴とする。
【化1】

【0006】
本発明の高分岐ポリマーを合成するためのモノエステルモノマーは、ジカルボン酸の一方のカルボキシル基と、一般式(a)で示されるトリオールの水酸基の1つとがエステル結合しており、1つのカルボキシル基と2つのヒドロキシル基を持つ。このモノエステルモノマーを重縮合させた場合、二つの水酸基のそれぞれにカルボキシル基がエステル結合して、次々と枝分かれをし、高分岐ポリエステルとなる。例えば、ジカルボン酸がコハク酸であり、トリオールが1,1,1−トリス(ヒドロキシメチル)エタンである場合の反応式を示せば、次式のようになる。
【化2】

【0007】
高分岐ポリマーの原料となる上記モノエステルモノマーはベンジリデン保護基で保護されたトリオールとジカルボン酸の一方のカルボキシル基とのモノエステル化物の水素化分解によって得られるが、上記一般式(a)におけるnが0の場合には、その水素化分解反応時に転位が起こって副生成物が得られる。例えば、ベンジリデン保護基で保護されたグリセリンとコハク酸とのモノエステル化物(4)の水素化分解を行った場合、転位反応が起こり、下記化学反応式に示すように目的のモノエステルモノマー(5)以外に、副生成物(6)が生ずる。これは、図1に示すように、カルボニル炭素へのプロトンの付加に起因すると推測される。
【化3】

【0008】
一方、上記一般式(a)におけるnが1のトリオールの場合には、このような転位反応が生じたとしても結果として全く同じ化合物となるため、高分岐ポリマーの原料となるモノエステルモノマーを容易かつ高収率で得られるため、好適である。
【0009】
また、本発明の高分岐ポリマーの原料となるジカルボン酸は、例えばアルキル基の両末端にカルボキシル基が結合したジカルボン酸のコハク酸やマロン酸、フェニル基の両末端にカルボキシル基が結合したフタル酸のようなジカルボン酸を用いることができる。
【0010】
本発明の高分岐ポリマーの製造方法は、一般式(a)(式中R1は水素原子又は炭素数が1〜5のアルキル基を示し、nは0又は1を示す)で示されるトリオールにベンジリデン保護基を導入してトリオールベンジリデン誘導体とする保護基導入工程と、該トリオールベンジリデン誘導体と、ジカルボン酸又はその誘導体とを反応させてベンジリデン保護モノエステルとするモノエステル化工程と、該ベンジリデン保護モノエステルの保護基を脱離させてモノエステルモノマーとする脱離工程と、該モノエステルモノマーを重縮合して高分岐ポリマーとする重合工程と、を備えることを特徴とする。
【化4】

ここで、nが1のトリオールを用いれば、上述したように、脱離工程で転位反応が生じたとしても、結果として全く同じ化合物となるため、好適である。
【0011】
重合工程における重合触媒としては、一般的にエステル化触媒として用いられている固体酸触媒や硫酸等の液体の酸の他、カルボジイミド(ジシクロへキシルカルボジイミド等)を用いることができる。発明者らは、重合工程における重合触媒としてジシクロヘキシルカルボジイミド(DCC)、p−トルエンスルホン酸、トリフルオロメタンスルホン酸スカンジウム及びカルボニルジイミダゾールを用いることにより、目的の高分岐ポリマーを収率よく得ることができることを確認している。また、p−トルエンスルホン酸クロライド及びイミダゾールの両方を用いることによっても、目的の高分岐ポリマーを収率よく得ることができることを確認している。
【0012】
本発明の高分岐ポリマーの原料となる高分岐ポリマー合成用モノマーは、ジカルボン酸の一方のカルボキシル基と、一般式(a)で示されるトリオールの水酸基の1つとがエステル結合していることを特徴とする(式中R1は水素原子又は炭素数が1〜5のアルキル基を示し、nは0又は1を示す)。
【化5】

ここで、nが1であれば、たとえこの化合物をベンジリデン保護基が結合した化合物から保護基を脱離させて製造した場合において、転位反応が生じたとしても同じ化合物となるため、転位反応による副生成物は生じることがないため、製造が容易となる。
【0013】
本発明の高分岐ポリマー合成用モノマーの原料となる高分岐ポリマー合成用モノマー前駆体は、ジカルボン酸の一方のカルボキシル基と、一般式(c)で示されるベンジリデン保護トリオール誘導体の水酸基とがエステル結合していることを特徴とする(式中R1は水素原子又は炭素数が1〜5のアルキル基であり、φは置換されてもよいアリール基であり、nは0又は1である)。
【化6】

例えば、トリオールとしての1、1、1−トリス(ヒドロキシメチル)エタンのベンジリデン保護誘導体を合成し、この化合物と無水コハク酸を反応させてモノエステルモノマーを製造する場合を例に挙げれば(下式参照)、ベンジリデン保護基を脱離させる最後の反応工程において、転位反応を生じたとしても同じ化合物となるため、収率は極めてよい。このモノエステルモノマーを用いれば、容易かつ安価に本発明の高分岐ポリマーを製造することができる。
【化7】

【発明を実施するための最良の形態】
【0014】
以下、本発明を具体化した実施例について詳細に説明する。
(実施例1)
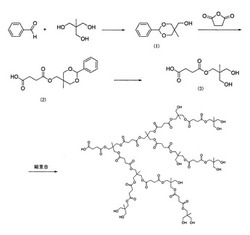
実施例1では、図2の合成経路に示すように、コハク酸と、1,1,1-トリス(ヒドロキシメチル)エタンとのモノエステルを合成し、それを重縮合反応させることによって高分岐ポリマーを得た。
【0015】
<保護基導入工程>
ベンズアルデヒドと1、1、1−トリス(ヒドロキシメチル)エタンとを反応させて、5-メチル−2−フェニル−5−[1,3]ジオキサニルメタノール(1)を合成した。
すなわち、ジムロート冷却器、Dean-Stark水分離器、マグネティックスターラーを装備した100mlナスフラスコに5.00 g (47.1 mmol) のベンズアルデヒド、5.77 g (48.0 mmol) の1,1,1-トリス(ヒドロキシメチル)エタン、および50 mLのトルエンを取り、4時間加熱還流攪拌した。反応終了後、反応混合物にジエチルエーテルを加え、飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液で洗浄、無水硫酸マグネシウムで乾燥後、溶媒を減圧留去し、淡黄色透明オイルを得た。クロロホルム / ヘキサンで再結晶することにより白色固体として(1)を収率96.9%で得た。1HNMR及び13C NMRのスペクトルから、(1)はcis体とtrans体が5.8:1の混合物であることが分かった。混合物の融点は90〜93℃であった。
【0016】
<モノエステル化工程>
次に、上記のようにして得られた化合物(1)と無水コハク酸とのモノエステル化反応を行い、5-メチル−2−フェニル−5−[1,3]ジオキサニルメチルサクシネート(2)を合成した。
すなわち、ジムロート冷却器およびマグネティックスターラーを装備した50 mL二口ナスフラスコに5.00 g (27.7mmol)の5-メチル−2−フェニル−5−[1,3]ジオキサニルメタノール(1)、ピリジン24 mL、無水コハク酸2.76 g (27.6 mmol)の順に取り、窒素下で5時間加熱還流攪拌した。反応終了後、溶媒を減圧留去し、淡黄色オイルを得た。酢酸エチル/ヘキサン混合溶媒で再結晶することにより白色固体として化合物(2)を収率68.9%で得た。化合物(2)はcis体のみであり、融点は84〜90°Cであった。スペクトルデータは以下のとおりである。
1H NMR (CDCl3,δppm)
7.49〜7.43 (m, 2H)、7.41〜7.35 (m, 3H)、5.43 (s, 1H)、4.43 (s, 2H)、4.05 (d, J = 11.87Hz, 2H)、3.67 (d, J = 11.88 Hz, 2H)、2.69 (s, 4H)、0.81 (s, 3H)
13C NMR (CDCl3,δ ppm)
178.06、171.97、137.84、129.00、128.25、126.07、101.96、73.17、66.90、33.64、28.86、28.83、16.97
IR (KBr,cm−1)
2966、1719、1467、1383、1208、1103、
また、元素分析はC (62.08%)、H (6.57%)であり計算値とほぼ一致した。
【0017】
<脱離工程(3-Hydroxy-2-hydroxymethyl-2-methylpropyl succinate
(3)の合成)>
さらに、上記のようにして得られた5-メチル−2−フェニル−5−[1,3]ジオキサニルメチルサクシネート(2)のベンジリデン保護基の脱離反応を以下のようにして行った。
すなわち、マグネティックスターラー、三方コック、セラムキャップを装備した200 mL三口フラスコを、減圧乾燥、窒素置換し、1.00g (3.24 mmol) の5-メチル−2−フェニル−5−[1,3]ジオキサニルメチルサクシネート(2)、100mLのテトラヒドロフラン、0.14 gのパラジウム‐活性炭の順に取り、2 mLのメタノールに0.05 mLの濃塩酸を溶解した溶液を0.057 mL加え、窒素置換した後、水素置換し、室温で1.5時間攪拌した。反応終了後、吸引ろ過によりパラジウム‐活性炭をろ別し、溶媒を減圧留去し、白色固体を得た。酢酸エチルで再結晶することにより白色固体として3-ヒドロキシ−2−ヒドロキシメチル−2−メチルプロピルサクシネート(3)を92.2%の収率で得た。このものの融点は102〜103°Cであった。スペクトルデータは以下のとおりである。
1H NMR (CD3OD,δ, ppm)
4.89 (s, 2H)、4.00 (s, 2H)、3.46〜3.41 (m, 4H)、2.62 〜2.58 (m, 4H)、0.89 (s, 3H)
13C NMR (CD3OD,δ, ppm)
176.02、174.30、67.51、65.55、41.91、30.04、29.72、16.79
IR (KBr, cm−1)
3370、2966、1729、1702、1322、1163、1090
また、元素分析はC (49.33%)、H (6.87%)であり計算値とほぼ一致した。
【0018】
<重合工程>
さらに、上記脱離工程で得られた3-ヒドロキシ−2−ヒドロキシメチル−2−メチルプロピルサクシネート(3)を重縮合させて、高分岐ポリマーであるポリ3-ヒドロキシ−2−ヒドロキシメチル−2−メチルプロピルサクシネートを合成した。
すなわち、マグネティックスターラーを装備した10 mLナスフラスコに110 mg (0.50mmol) のモノマー (3) 、5 mLのジクロロメタン、124 mg (0.60 mmol) のジシクロへキシルカルボジイミドの順に取り、窒素下、0 °Cで2時間攪拌した後、6.1 mg (0.05mol) の4-ジメチルアミノピリジンを加え、窒素下、室温で1時間攪拌した。メタノールを加えることにより、重合を停止した。重合後、吸引ろ過によりジシクロへキシル尿素をろ別し、溶媒を減圧留去した。反応混合物を少量のメタノールに溶解させ、イソプロピルエーテルで再沈殿を行うことによりポリマーを単離した(収率66.1%)。スペクトルデータは以下のとおりである。
1H NMR (CD3OD,δppm)
4.86、4.04、4.00、3.47〜3.41、2.65、1.03、0.96、0.89
13C NMR (CD3OD,δ, ppm)
174.17、173.93、67.68、67.40、67.11、65.62、65.06、41.94、40.95、39.77、29.95、17.42、17.17、16.90
IR (NaCl, cm−1)
3468、2946、1734、1156
また、元素分析はC (52.84%)、H (7.06%)であり計算値とほぼ一致した。
【0019】
(実施例2)
実施例2では、実施例1と同様にして3-ヒドロキシ−2−ヒドロキシメチル−2−メチルプロピルサクシネート(3)を合成し、重合工程における触媒としてトリフルオロメタンスルホン酸スカンジウムを用いて以下のように重縮合させた。すなわち、マグネティックスターラーを装備した10 mLナスフラスコに110 mg (0.50mmol) のモノマー(3)及びトリフルオロメタンスルホン酸スカンジウム(0.05mmol)を入れ、減圧下110°Cで10分間攪拌した後、メタノールを加えることにより、重合を停止した。重合後、溶媒を減圧留去し、少量のメタノールに溶解させ、イソプロピルエーテルで再沈殿を行うことによりポリマーを単離した(収率92%)。1H NMR、13C NMR、及びIRのスペクトルデータは、実施例1の場合と一致した。
【0020】
(実施例3)
実施例3では、実施例1と同様にして3-ヒドロキシ−2−ヒドロキシメチル−2−メチルプロピルサクシネート(3)を合成し、重合工程における触媒としてp−TsOH(p−トルエンスルホン酸)を用いて以下のように重縮合させた。すなわち、マグネティックスターラーを装備した10 mLナスフラスコに110 mg (0.50mmol) のモノマー(3)及びp−TsOH(0.05mmol)を入れ、減圧下100°Cで10分間攪拌した後、メタノールを加えることにより、重合を停止した。重合後、溶媒を減圧留去し、少量のメタノールに溶解させ、イソプロピルエーテルで再沈殿を行うことによりポリマーを単離した(収率25%)。1H NMR、13C NMR、及びIRのスペクトルデータは、実施例1の場合と一致した。
【0021】
(実施例4)
実施例4では、実施例1と同様にして3-ヒドロキシ−2−ヒドロキシメチル−2−メチルプロピルサクシネート(3)を合成し、重合工程における触媒としてp−TsOH(p−トルエンスルホン酸)を用いて以下のように重縮合させた。すなわち、マグネティックスターラーを装備した10 mLナスフラスコに220 mg (1.00mmol) のモノマー(3)、5mLのアセトニトリル及びp−TsOH190mg(1.00mmol)を入れ、窒素下で還流し24時間攪拌した後、メタノールを加えることにより、重合を停止した。重合後、溶媒を減圧留去し、少量のメタノールに溶解させ、イソプロピルエーテルで再沈殿を行うことによりポリマーを単離した(収率37%)。1H NMR、13C NMR、及びIRのスペクトルデータは、実施例1の場合と一致した。
なお、p−TsOHの代わりにカルボニルジイミダゾールを触媒とし、THF溶媒を用い、室温下8時間の撹拌を行うことによっても、実施例4と同様のポリマーを得ることができた。
【0022】
(実施例5)
実施例5では、実施例1と同様にして3-ヒドロキシ−2−ヒドロキシメチル−2−メチルプロピルサクシネート(3)を合成し、重合工程における触媒としてp−トルエンスルホン酸クロライド及びイミダゾールの両方を用いて以下のように重縮合させた。すなわち、マグネティックスターラーを装備した10 mLナスフラスコに220 mg (1.00mmol) のモノマー(3)とp−TsCl210mg(1.1mmol)とイミダゾール170mg(2.5mmol)とアセトニトリル5mLとを入れ、還流下で24時間攪拌した後、メタノールを加えることにより、重合を停止した。重合後、溶媒を減圧留去し、少量のメタノールに溶解させ、イソプロピルエーテルで再沈殿を行うことによりポリマーを得た。1H NMR、13C NMR、及びIRのスペクトルデータは、実施例1の場合と一致した。
【0023】
(実施例6)
実施例6では、下記工程によりコハク酸とグリセリンのモノエステルを合成した。
<モノエステル化工程>
下式に示すように1,3-O-ベンジリデングリセロール(アルドリッチ社製)と無水コハク酸とのモノエステル化反応を行った。
【化8】

すなわち、ジムロート冷却器およびマグネティックスターラーを装備した50 mL二口ナスフラスコに1,3-O-ベンジリデングリセロールと、ピリジンと、無水コハク酸とを入れ、窒素下で5時間加熱還流攪拌した。反応終了後、溶媒を減圧留去し、相当するモノエステル(4)を得た。
【0024】
<脱離工程>
さらに、上記のようにして得られたモノエステル(4)のベンジリデン保護基の脱離反応を以下のようにして行った。
【化9】

すなわち、マグネティックスターラー、三方コック、セラムキャップを装備した200 mL三口フラスコを、減圧乾燥、窒素置換し、テトラヒドロフラン150mL及びモノエステル(4)を3.00g(1.07 mmol)入れ、さらに0.56 gのパラジウム‐活性炭、濃塩酸2.5質量%のメタノール溶液0.19mLを加え、窒素置換した後、水素置換し、室温で1.5時間攪拌した。反応終了後、吸引ろ過によりパラジウム‐活性炭をろ別し、溶媒を減圧留去し、ベンジリデン保護基が脱離したモノエステル(5)を得た。ただし、1H NMRの測定から、下記転位生成物(6)も16%生成していることが分かった。
【化10】

【0025】
上記のようにして得られたモノエステル(5)を実施例1と同様の方法の重合工程を行うことにより、容易に相当する高分岐ポリマーを得ることができる。
【0026】
この発明は、上記発明の実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【産業上の利用可能性】
【0027】
本発明は機能性高分子である高分岐ポリマー及びその製造方法に適用することができる。
【図面の簡単な説明】
【0028】
【図1】モノエステル化物(4)の水素化分解における転位反応の反応機構を示す図である。
【図2】実施例1の高分岐ポリマーの合成経路を示す図である。
【技術分野】
【0001】
本発明は、エステル結合によって多分岐構造が形成される、ポリエステル型高分岐ポリマー及びその製造方法、並びにそれらの製造原料となる高分岐ポリマー合成用モノマー及びその前駆体に関する。
【背景技術】
【0002】
近年、高度に分岐した構造を有するデンドリティック高分子が注目されている。デンドリティック高分子は、その特異な分子構造から、非晶質である、有機溶媒への溶解性が高い、粘度が極端に小さい、機能性基を導入可能な鎖末端が多く存在する等、線状高分子とは異なる特徴があり、様々な分野での応用が期待され、近年盛んに研究が行われている。
【0003】
デンドリティック高分子には、多官能基を有するモノマーを一段階づつ化学反応させ、分岐構造を形成させるデンドリマーと、ABx型モノマーを重縮合させて一気に分岐構造を形成する高分岐ポリマーとが知られている。高分岐ポリマーはモノマーから重縮合で一気に製造することができるため、製造が容易であり、製造コストが低廉であるという長所を有する。また、合成条件を適宜選択することにより、分岐度も制御できるため期待されている(非特許文献1)。
【非特許文献1】K.E.Uhrich、C.J.Hawker、J.M.J.Frechet、S.R.Turner「Macromolecules」25,4583-4587(1992)
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明は、新規なポリエステル系の高分岐ポリマー、その製造方法、それの合成原料となる高分岐ポリマー合成用モノマー及びその前駆体を提供することを目的とする。
【課題を解決するための手段】
【0005】
本発明の高分岐ポリマーは、ジカルボン酸と、一般式(a)(式中R1は水素原子又は炭素数が1〜5のアルキル基を示し、nは0又は1を示す)で示されるトリオールの水酸基の1つとがエステル結合したモノエステルモノマーを重縮合させてなることを特徴とする。
【化1】

【0006】
本発明の高分岐ポリマーを合成するためのモノエステルモノマーは、ジカルボン酸の一方のカルボキシル基と、一般式(a)で示されるトリオールの水酸基の1つとがエステル結合しており、1つのカルボキシル基と2つのヒドロキシル基を持つ。このモノエステルモノマーを重縮合させた場合、二つの水酸基のそれぞれにカルボキシル基がエステル結合して、次々と枝分かれをし、高分岐ポリエステルとなる。例えば、ジカルボン酸がコハク酸であり、トリオールが1,1,1−トリス(ヒドロキシメチル)エタンである場合の反応式を示せば、次式のようになる。
【化2】

【0007】
高分岐ポリマーの原料となる上記モノエステルモノマーはベンジリデン保護基で保護されたトリオールとジカルボン酸の一方のカルボキシル基とのモノエステル化物の水素化分解によって得られるが、上記一般式(a)におけるnが0の場合には、その水素化分解反応時に転位が起こって副生成物が得られる。例えば、ベンジリデン保護基で保護されたグリセリンとコハク酸とのモノエステル化物(4)の水素化分解を行った場合、転位反応が起こり、下記化学反応式に示すように目的のモノエステルモノマー(5)以外に、副生成物(6)が生ずる。これは、図1に示すように、カルボニル炭素へのプロトンの付加に起因すると推測される。
【化3】

【0008】
一方、上記一般式(a)におけるnが1のトリオールの場合には、このような転位反応が生じたとしても結果として全く同じ化合物となるため、高分岐ポリマーの原料となるモノエステルモノマーを容易かつ高収率で得られるため、好適である。
【0009】
また、本発明の高分岐ポリマーの原料となるジカルボン酸は、例えばアルキル基の両末端にカルボキシル基が結合したジカルボン酸のコハク酸やマロン酸、フェニル基の両末端にカルボキシル基が結合したフタル酸のようなジカルボン酸を用いることができる。
【0010】
本発明の高分岐ポリマーの製造方法は、一般式(a)(式中R1は水素原子又は炭素数が1〜5のアルキル基を示し、nは0又は1を示す)で示されるトリオールにベンジリデン保護基を導入してトリオールベンジリデン誘導体とする保護基導入工程と、該トリオールベンジリデン誘導体と、ジカルボン酸又はその誘導体とを反応させてベンジリデン保護モノエステルとするモノエステル化工程と、該ベンジリデン保護モノエステルの保護基を脱離させてモノエステルモノマーとする脱離工程と、該モノエステルモノマーを重縮合して高分岐ポリマーとする重合工程と、を備えることを特徴とする。
【化4】

ここで、nが1のトリオールを用いれば、上述したように、脱離工程で転位反応が生じたとしても、結果として全く同じ化合物となるため、好適である。
【0011】
重合工程における重合触媒としては、一般的にエステル化触媒として用いられている固体酸触媒や硫酸等の液体の酸の他、カルボジイミド(ジシクロへキシルカルボジイミド等)を用いることができる。発明者らは、重合工程における重合触媒としてジシクロヘキシルカルボジイミド(DCC)、p−トルエンスルホン酸、トリフルオロメタンスルホン酸スカンジウム及びカルボニルジイミダゾールを用いることにより、目的の高分岐ポリマーを収率よく得ることができることを確認している。また、p−トルエンスルホン酸クロライド及びイミダゾールの両方を用いることによっても、目的の高分岐ポリマーを収率よく得ることができることを確認している。
【0012】
本発明の高分岐ポリマーの原料となる高分岐ポリマー合成用モノマーは、ジカルボン酸の一方のカルボキシル基と、一般式(a)で示されるトリオールの水酸基の1つとがエステル結合していることを特徴とする(式中R1は水素原子又は炭素数が1〜5のアルキル基を示し、nは0又は1を示す)。
【化5】

ここで、nが1であれば、たとえこの化合物をベンジリデン保護基が結合した化合物から保護基を脱離させて製造した場合において、転位反応が生じたとしても同じ化合物となるため、転位反応による副生成物は生じることがないため、製造が容易となる。
【0013】
本発明の高分岐ポリマー合成用モノマーの原料となる高分岐ポリマー合成用モノマー前駆体は、ジカルボン酸の一方のカルボキシル基と、一般式(c)で示されるベンジリデン保護トリオール誘導体の水酸基とがエステル結合していることを特徴とする(式中R1は水素原子又は炭素数が1〜5のアルキル基であり、φは置換されてもよいアリール基であり、nは0又は1である)。
【化6】

例えば、トリオールとしての1、1、1−トリス(ヒドロキシメチル)エタンのベンジリデン保護誘導体を合成し、この化合物と無水コハク酸を反応させてモノエステルモノマーを製造する場合を例に挙げれば(下式参照)、ベンジリデン保護基を脱離させる最後の反応工程において、転位反応を生じたとしても同じ化合物となるため、収率は極めてよい。このモノエステルモノマーを用いれば、容易かつ安価に本発明の高分岐ポリマーを製造することができる。
【化7】

【発明を実施するための最良の形態】
【0014】
以下、本発明を具体化した実施例について詳細に説明する。
(実施例1)
実施例1では、図2の合成経路に示すように、コハク酸と、1,1,1-トリス(ヒドロキシメチル)エタンとのモノエステルを合成し、それを重縮合反応させることによって高分岐ポリマーを得た。
【0015】
<保護基導入工程>
ベンズアルデヒドと1、1、1−トリス(ヒドロキシメチル)エタンとを反応させて、5-メチル−2−フェニル−5−[1,3]ジオキサニルメタノール(1)を合成した。
すなわち、ジムロート冷却器、Dean-Stark水分離器、マグネティックスターラーを装備した100mlナスフラスコに5.00 g (47.1 mmol) のベンズアルデヒド、5.77 g (48.0 mmol) の1,1,1-トリス(ヒドロキシメチル)エタン、および50 mLのトルエンを取り、4時間加熱還流攪拌した。反応終了後、反応混合物にジエチルエーテルを加え、飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液で洗浄、無水硫酸マグネシウムで乾燥後、溶媒を減圧留去し、淡黄色透明オイルを得た。クロロホルム / ヘキサンで再結晶することにより白色固体として(1)を収率96.9%で得た。1HNMR及び13C NMRのスペクトルから、(1)はcis体とtrans体が5.8:1の混合物であることが分かった。混合物の融点は90〜93℃であった。
【0016】
<モノエステル化工程>
次に、上記のようにして得られた化合物(1)と無水コハク酸とのモノエステル化反応を行い、5-メチル−2−フェニル−5−[1,3]ジオキサニルメチルサクシネート(2)を合成した。
すなわち、ジムロート冷却器およびマグネティックスターラーを装備した50 mL二口ナスフラスコに5.00 g (27.7mmol)の5-メチル−2−フェニル−5−[1,3]ジオキサニルメタノール(1)、ピリジン24 mL、無水コハク酸2.76 g (27.6 mmol)の順に取り、窒素下で5時間加熱還流攪拌した。反応終了後、溶媒を減圧留去し、淡黄色オイルを得た。酢酸エチル/ヘキサン混合溶媒で再結晶することにより白色固体として化合物(2)を収率68.9%で得た。化合物(2)はcis体のみであり、融点は84〜90°Cであった。スペクトルデータは以下のとおりである。
1H NMR (CDCl3,δppm)
7.49〜7.43 (m, 2H)、7.41〜7.35 (m, 3H)、5.43 (s, 1H)、4.43 (s, 2H)、4.05 (d, J = 11.87Hz, 2H)、3.67 (d, J = 11.88 Hz, 2H)、2.69 (s, 4H)、0.81 (s, 3H)
13C NMR (CDCl3,δ ppm)
178.06、171.97、137.84、129.00、128.25、126.07、101.96、73.17、66.90、33.64、28.86、28.83、16.97
IR (KBr,cm−1)
2966、1719、1467、1383、1208、1103、
また、元素分析はC (62.08%)、H (6.57%)であり計算値とほぼ一致した。
【0017】
<脱離工程(3-Hydroxy-2-hydroxymethyl-2-methylpropyl succinate
(3)の合成)>
さらに、上記のようにして得られた5-メチル−2−フェニル−5−[1,3]ジオキサニルメチルサクシネート(2)のベンジリデン保護基の脱離反応を以下のようにして行った。
すなわち、マグネティックスターラー、三方コック、セラムキャップを装備した200 mL三口フラスコを、減圧乾燥、窒素置換し、1.00g (3.24 mmol) の5-メチル−2−フェニル−5−[1,3]ジオキサニルメチルサクシネート(2)、100mLのテトラヒドロフラン、0.14 gのパラジウム‐活性炭の順に取り、2 mLのメタノールに0.05 mLの濃塩酸を溶解した溶液を0.057 mL加え、窒素置換した後、水素置換し、室温で1.5時間攪拌した。反応終了後、吸引ろ過によりパラジウム‐活性炭をろ別し、溶媒を減圧留去し、白色固体を得た。酢酸エチルで再結晶することにより白色固体として3-ヒドロキシ−2−ヒドロキシメチル−2−メチルプロピルサクシネート(3)を92.2%の収率で得た。このものの融点は102〜103°Cであった。スペクトルデータは以下のとおりである。
1H NMR (CD3OD,δ, ppm)
4.89 (s, 2H)、4.00 (s, 2H)、3.46〜3.41 (m, 4H)、2.62 〜2.58 (m, 4H)、0.89 (s, 3H)
13C NMR (CD3OD,δ, ppm)
176.02、174.30、67.51、65.55、41.91、30.04、29.72、16.79
IR (KBr, cm−1)
3370、2966、1729、1702、1322、1163、1090
また、元素分析はC (49.33%)、H (6.87%)であり計算値とほぼ一致した。
【0018】
<重合工程>
さらに、上記脱離工程で得られた3-ヒドロキシ−2−ヒドロキシメチル−2−メチルプロピルサクシネート(3)を重縮合させて、高分岐ポリマーであるポリ3-ヒドロキシ−2−ヒドロキシメチル−2−メチルプロピルサクシネートを合成した。
すなわち、マグネティックスターラーを装備した10 mLナスフラスコに110 mg (0.50mmol) のモノマー (3) 、5 mLのジクロロメタン、124 mg (0.60 mmol) のジシクロへキシルカルボジイミドの順に取り、窒素下、0 °Cで2時間攪拌した後、6.1 mg (0.05mol) の4-ジメチルアミノピリジンを加え、窒素下、室温で1時間攪拌した。メタノールを加えることにより、重合を停止した。重合後、吸引ろ過によりジシクロへキシル尿素をろ別し、溶媒を減圧留去した。反応混合物を少量のメタノールに溶解させ、イソプロピルエーテルで再沈殿を行うことによりポリマーを単離した(収率66.1%)。スペクトルデータは以下のとおりである。
1H NMR (CD3OD,δppm)
4.86、4.04、4.00、3.47〜3.41、2.65、1.03、0.96、0.89
13C NMR (CD3OD,δ, ppm)
174.17、173.93、67.68、67.40、67.11、65.62、65.06、41.94、40.95、39.77、29.95、17.42、17.17、16.90
IR (NaCl, cm−1)
3468、2946、1734、1156
また、元素分析はC (52.84%)、H (7.06%)であり計算値とほぼ一致した。
【0019】
(実施例2)
実施例2では、実施例1と同様にして3-ヒドロキシ−2−ヒドロキシメチル−2−メチルプロピルサクシネート(3)を合成し、重合工程における触媒としてトリフルオロメタンスルホン酸スカンジウムを用いて以下のように重縮合させた。すなわち、マグネティックスターラーを装備した10 mLナスフラスコに110 mg (0.50mmol) のモノマー(3)及びトリフルオロメタンスルホン酸スカンジウム(0.05mmol)を入れ、減圧下110°Cで10分間攪拌した後、メタノールを加えることにより、重合を停止した。重合後、溶媒を減圧留去し、少量のメタノールに溶解させ、イソプロピルエーテルで再沈殿を行うことによりポリマーを単離した(収率92%)。1H NMR、13C NMR、及びIRのスペクトルデータは、実施例1の場合と一致した。
【0020】
(実施例3)
実施例3では、実施例1と同様にして3-ヒドロキシ−2−ヒドロキシメチル−2−メチルプロピルサクシネート(3)を合成し、重合工程における触媒としてp−TsOH(p−トルエンスルホン酸)を用いて以下のように重縮合させた。すなわち、マグネティックスターラーを装備した10 mLナスフラスコに110 mg (0.50mmol) のモノマー(3)及びp−TsOH(0.05mmol)を入れ、減圧下100°Cで10分間攪拌した後、メタノールを加えることにより、重合を停止した。重合後、溶媒を減圧留去し、少量のメタノールに溶解させ、イソプロピルエーテルで再沈殿を行うことによりポリマーを単離した(収率25%)。1H NMR、13C NMR、及びIRのスペクトルデータは、実施例1の場合と一致した。
【0021】
(実施例4)
実施例4では、実施例1と同様にして3-ヒドロキシ−2−ヒドロキシメチル−2−メチルプロピルサクシネート(3)を合成し、重合工程における触媒としてp−TsOH(p−トルエンスルホン酸)を用いて以下のように重縮合させた。すなわち、マグネティックスターラーを装備した10 mLナスフラスコに220 mg (1.00mmol) のモノマー(3)、5mLのアセトニトリル及びp−TsOH190mg(1.00mmol)を入れ、窒素下で還流し24時間攪拌した後、メタノールを加えることにより、重合を停止した。重合後、溶媒を減圧留去し、少量のメタノールに溶解させ、イソプロピルエーテルで再沈殿を行うことによりポリマーを単離した(収率37%)。1H NMR、13C NMR、及びIRのスペクトルデータは、実施例1の場合と一致した。
なお、p−TsOHの代わりにカルボニルジイミダゾールを触媒とし、THF溶媒を用い、室温下8時間の撹拌を行うことによっても、実施例4と同様のポリマーを得ることができた。
【0022】
(実施例5)
実施例5では、実施例1と同様にして3-ヒドロキシ−2−ヒドロキシメチル−2−メチルプロピルサクシネート(3)を合成し、重合工程における触媒としてp−トルエンスルホン酸クロライド及びイミダゾールの両方を用いて以下のように重縮合させた。すなわち、マグネティックスターラーを装備した10 mLナスフラスコに220 mg (1.00mmol) のモノマー(3)とp−TsCl210mg(1.1mmol)とイミダゾール170mg(2.5mmol)とアセトニトリル5mLとを入れ、還流下で24時間攪拌した後、メタノールを加えることにより、重合を停止した。重合後、溶媒を減圧留去し、少量のメタノールに溶解させ、イソプロピルエーテルで再沈殿を行うことによりポリマーを得た。1H NMR、13C NMR、及びIRのスペクトルデータは、実施例1の場合と一致した。
【0023】
(実施例6)
実施例6では、下記工程によりコハク酸とグリセリンのモノエステルを合成した。
<モノエステル化工程>
下式に示すように1,3-O-ベンジリデングリセロール(アルドリッチ社製)と無水コハク酸とのモノエステル化反応を行った。
【化8】

すなわち、ジムロート冷却器およびマグネティックスターラーを装備した50 mL二口ナスフラスコに1,3-O-ベンジリデングリセロールと、ピリジンと、無水コハク酸とを入れ、窒素下で5時間加熱還流攪拌した。反応終了後、溶媒を減圧留去し、相当するモノエステル(4)を得た。
【0024】
<脱離工程>
さらに、上記のようにして得られたモノエステル(4)のベンジリデン保護基の脱離反応を以下のようにして行った。
【化9】

すなわち、マグネティックスターラー、三方コック、セラムキャップを装備した200 mL三口フラスコを、減圧乾燥、窒素置換し、テトラヒドロフラン150mL及びモノエステル(4)を3.00g(1.07 mmol)入れ、さらに0.56 gのパラジウム‐活性炭、濃塩酸2.5質量%のメタノール溶液0.19mLを加え、窒素置換した後、水素置換し、室温で1.5時間攪拌した。反応終了後、吸引ろ過によりパラジウム‐活性炭をろ別し、溶媒を減圧留去し、ベンジリデン保護基が脱離したモノエステル(5)を得た。ただし、1H NMRの測定から、下記転位生成物(6)も16%生成していることが分かった。
【化10】

【0025】
上記のようにして得られたモノエステル(5)を実施例1と同様の方法の重合工程を行うことにより、容易に相当する高分岐ポリマーを得ることができる。
【0026】
この発明は、上記発明の実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【産業上の利用可能性】
【0027】
本発明は機能性高分子である高分岐ポリマー及びその製造方法に適用することができる。
【図面の簡単な説明】
【0028】
【図1】モノエステル化物(4)の水素化分解における転位反応の反応機構を示す図である。
【図2】実施例1の高分岐ポリマーの合成経路を示す図である。
【特許請求の範囲】
【請求項1】
ジカルボン酸と、一般式(a)(式中R1は水素原子又は炭素数が1〜5のアルキル基を示し、nは0又は1を示す)で示されるトリオールの水酸基の1つとがエステル結合したモノエステルモノマーを重縮合させてなることを特徴とする高分岐ポリマー。
【化1】

【請求項2】
前記nは1であることを特徴とする請求項1記載の高分岐ポリマー。
【請求項3】
前記R1は水素原子、メチル基及びエチル基のいずれかであることを特徴とする請求項1又は2記載の高分岐ポリマー。
【請求項4】
前記ジカルボン酸は一般式(b)で示されることを特徴とする請求項1乃至3のいずれか1項記載の高分岐ポリマー(式中R2は炭素数0〜10のアルキレン基又はフェニレン基を示す)。
【化2】

【請求項5】
一般式(a)(式中R1は水素原子又は炭素数が1〜5のアルキル基を示し、nは0又は1を示す)で示されるトリオールにベンジリデン保護基を導入してトリオールベンジリデン誘導体とする保護基導入工程と、
該トリオールベンジリデン誘導体と、ジカルボン酸又はその誘導体とを反応させてベンジリデン保護モノエステルとするモノエステル化工程と、
該ベンジリデン保護モノエステルの保護基を脱離させてモノエステルモノマーとする脱離工程と、
該モノエステルモノマーを重縮合して高分岐ポリマーとする重合工程と、
を備えることを特徴とする高分岐ポリマーの製造方法。
【化3】

【請求項6】
重合工程における重合触媒としてジシクロヘキシルカルボジイミド(DCC)、p−トルエンスルホン酸、トリフルオロメタンスルホン酸スカンジウム及びカルボニルジイミダゾールのいずれか、又はp−トルエンスルホン酸クロライド及びイミダゾールの両方を用いることを特徴とする請求項5記載の高分岐ポリマーの製造方法。
【請求項7】
ジカルボン酸の一方のカルボキシル基と、一般式(a)で示されるトリオールの水酸基の1つとがエステル結合していることを特徴とする高分岐ポリマー合成用モノマー(式中R1は水素原子又は炭素数が1〜5のアルキル基を示し、nは0又は1を示す)。
【化4】

【請求項8】
ジカルボン酸の一方のカルボキシル基と、一般式(c)で示されるベンジリデン保護トリオール誘導体の水酸基とがエステル結合していることを特徴とする高分岐ポリマー合成用モノマー前駆体(式中R1は水素原子又は炭素数が1〜5のアルキル基であり、φは置換されてもよいアリール基であり、nは0又は1である)。
【化5】

【請求項1】
ジカルボン酸と、一般式(a)(式中R1は水素原子又は炭素数が1〜5のアルキル基を示し、nは0又は1を示す)で示されるトリオールの水酸基の1つとがエステル結合したモノエステルモノマーを重縮合させてなることを特徴とする高分岐ポリマー。
【化1】

【請求項2】
前記nは1であることを特徴とする請求項1記載の高分岐ポリマー。
【請求項3】
前記R1は水素原子、メチル基及びエチル基のいずれかであることを特徴とする請求項1又は2記載の高分岐ポリマー。
【請求項4】
前記ジカルボン酸は一般式(b)で示されることを特徴とする請求項1乃至3のいずれか1項記載の高分岐ポリマー(式中R2は炭素数0〜10のアルキレン基又はフェニレン基を示す)。
【化2】

【請求項5】
一般式(a)(式中R1は水素原子又は炭素数が1〜5のアルキル基を示し、nは0又は1を示す)で示されるトリオールにベンジリデン保護基を導入してトリオールベンジリデン誘導体とする保護基導入工程と、
該トリオールベンジリデン誘導体と、ジカルボン酸又はその誘導体とを反応させてベンジリデン保護モノエステルとするモノエステル化工程と、
該ベンジリデン保護モノエステルの保護基を脱離させてモノエステルモノマーとする脱離工程と、
該モノエステルモノマーを重縮合して高分岐ポリマーとする重合工程と、
を備えることを特徴とする高分岐ポリマーの製造方法。
【化3】

【請求項6】
重合工程における重合触媒としてジシクロヘキシルカルボジイミド(DCC)、p−トルエンスルホン酸、トリフルオロメタンスルホン酸スカンジウム及びカルボニルジイミダゾールのいずれか、又はp−トルエンスルホン酸クロライド及びイミダゾールの両方を用いることを特徴とする請求項5記載の高分岐ポリマーの製造方法。
【請求項7】
ジカルボン酸の一方のカルボキシル基と、一般式(a)で示されるトリオールの水酸基の1つとがエステル結合していることを特徴とする高分岐ポリマー合成用モノマー(式中R1は水素原子又は炭素数が1〜5のアルキル基を示し、nは0又は1を示す)。
【化4】

【請求項8】
ジカルボン酸の一方のカルボキシル基と、一般式(c)で示されるベンジリデン保護トリオール誘導体の水酸基とがエステル結合していることを特徴とする高分岐ポリマー合成用モノマー前駆体(式中R1は水素原子又は炭素数が1〜5のアルキル基であり、φは置換されてもよいアリール基であり、nは0又は1である)。
【化5】

【図1】


【図2】




【図2】


【公開番号】特開2008−56894(P2008−56894A)
【公開日】平成20年3月13日(2008.3.13)
【国際特許分類】
【出願番号】特願2007−121768(P2007−121768)
【出願日】平成19年5月2日(2007.5.2)
【出願人】(304026696)国立大学法人三重大学 (270)
【出願人】(000234166)伯東株式会社 (135)
【Fターム(参考)】
【公開日】平成20年3月13日(2008.3.13)
【国際特許分類】
【出願日】平成19年5月2日(2007.5.2)
【出願人】(304026696)国立大学法人三重大学 (270)
【出願人】(000234166)伯東株式会社 (135)
【Fターム(参考)】
[ Back to top ]

