高分泌型ウミボタル類縁発光酵素のタンパク質
【課題】短時間に起こる細胞内のわずかな遺伝子転写活性の変化を高分解能に発光活性として測定ないしは可視化できる分泌効率の高い発光酵素をクローン化し、その分泌シグナルの特性を利用して転写活性を速やかに細胞外で測定できるレポータタンパク質のベクター系の作成及び利用をはかる。
【解決手段】上記課題を解決するためには、ウミボタル近縁種Cypridina noctilucaから細胞内に留まる発光酵素量が一般のVargula hilgendorfiiの約1/10である分泌効率の高い発光酵素を同定し、遺伝子発現検出ベクターを構築する。
【解決手段】上記課題を解決するためには、ウミボタル近縁種Cypridina noctilucaから細胞内に留まる発光酵素量が一般のVargula hilgendorfiiの約1/10である分泌効率の高い発光酵素を同定し、遺伝子発現検出ベクターを構築する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は,細胞内にとどまることなく細胞外に効率良く分泌されるウミボタル発光酵素のタンパク質並びに該タンパク質をコードするDNA配列に関する。
【背景技術】
【0002】
一般の発光性甲殻類ウミボタルVargula hilgendorfiiは分泌性の発光酵素を持ち、そのウミボタル発光酵素のタンパク質のcDNAは既にクローン化されている。ここで発光酵素とは、発光酵素のタンパク質が細胞内で何らかの修飾を受けたものを含むものとする。上記一般のウミボタル発光酵素はウミボタル発光基質Cypridinaルシフェリンと反応して最大発光波長460nmの青色の光を発する。
【0003】
上記一般のウミボタル発光酵素は細胞外に分泌される特徴をもつことから、クローン化されたcDNAをレポータ遺伝子として利用すると、細胞を破壊することなく遺伝子転写活性が測定(非特許文献1)できるために、有為であり、既に特許化がなされている(特許文献1及び特許文献2)。特許化されている各種の発光酵素のうち、分泌可能なものは上記一般のVargula hilgendorfii発光酵素のみである。
【0004】
この発光酵素を利用した報告には、画像解析システムを用いて細胞からの発光酵素の分泌を可視化した例(非特許文献2)および、哺乳類細胞に成長ホルモン遺伝子の転写活性領域を挿入したウミボタルレポータ遺伝子を導入し、生細胞における転写活性の変化を連続的に測定した例(非特許文献3)がある。
【0005】
上記一般のVargula hilgendorfii発光酵素は、そのタンパク質合成後、小胞体膜を経てゴルジ体へ移行する段階で糖鎖修飾等を受け成熟型となり分泌することが知られており、分泌効率は分泌シグナル配列及び糖修飾の程度に依存すると考えられている。上記一般のVargula hilgendorfii発光酵素の分泌効率測定例では、例えば一般的に良く用いられるNIH3T3細胞においては、24時間培養後に、生産された発光酵素の7%が、HeLa細胞では71%が分泌されず細胞内に留まっている(非特許文献4)。
【0006】
創薬ではタンパク発現阻害剤や分泌阻害剤などの開発及び探索が重要であり、細胞内におけるターゲットタンパク質の遺伝子転写活性の変化を指標としてスクリーニングが行われている。阻害剤の効果に伴う遺伝子転写活性の変化を伝えるのがレポータ遺伝子の役目である。そのレポータ遺伝子からつくられるレポータタンパク質は、単に遺伝子のON/OFFを知らせるだけでなく、阻害剤効果の経時変化が解析できること(時間分解能が高いこと)やレポータタンパク質自体が阻害効果を持たない、或いは細胞内機能を撹乱しない(細胞毒性がない)などの特性を持つ事が要求される。高い時間分解能を達成し且つ細胞毒性がないレポータ遺伝子としては、細胞内で作られたレポータタンパク質が速やかに分泌されるか、代謝される必要がある。
【0007】
上記一般のVargula hilgendorfii発光酵素は、効率は低くとも分泌されることから、細胞外で転写活性の変化を速やかに測定できるが、細胞内に留まった大量のタンパク質は安定、且つ壊れにくく、速やかな代謝は期待できない。また、分子内に34個のシステイン残基を持つことから、細胞内に留まったタンパクは回りの酸化還元状態に大きな影響を及ぼす可能性がある。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】国際特許公開番号WO90/01542
【特許文献2】特公平3−30678号公報
【非特許文献】
【0009】
【非特許文献1】Thompson,E.M.,Nagata,S.& Tsuji,F.I.,Vargula hilgendorfii luciferase:a secreted reporter enzymefor monitoring gene expression in mammalian cells.Gene96,257−62(1990)
【非特許文献2】Inouye,S.,Ohmiya,Y.,Toya,Y.& Tsuji,F.,Imaging of luciferasesecretion from transformed Chinese hamster ovary cells.Proc Natl Acad Sci USA89,9584−7(1992)
【非特許文献3】Tanahashi,Y.,Ohmiya,Y.,Honma,S.,Katsuno,Y.,Ohta,H.,Nakamura,H.,Honma,K.,Continuous measurement of targeted promoter activity by a secreted bioluminescence reporter,Vargula hilgendorfii luciferase.Anal Biochem.289,260−6(2001)
【非特許文献4】Thompson,E.M.,Nagata,S.& Tsuji,F.I.,Vargula hilgendorfii luciferase:a secreted reporter enzyme for monitoring gene expression in mammalian cells. Gene 96,257−62(1990)
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、短時間に起こる細胞内のわずかな遺伝子転写活性の変化を高分解能に発光活性として測定ないしは可視化できる分泌効率の高い発光酵素をクローン化し、その分泌シグナルの特性を利用して転写活性を速やかに細胞外で測定できるレポータタンパク質のベクター系の作成及び利用をしようとするものである。
【課題を解決するための手段】
【0011】
上記課題を解決するため、上記一般のVargula hilgendorfiiのウミボタル近縁種ではあるが浮遊性の特徴をもち、採取の難しいCypridina noctilucaから細胞内に留まる発光酵素量が上記一般のVargula hilgendorfiiの約1/10である分泌効率の高い発光酵素を同定し、遺伝子発現検出ベクターを構築し、本発明の完成に至った。
【発明の効果】
【0012】
本発明は,遺伝子の転写活性モニタータンパク質及びそれをコードする遺伝子、及び分泌シグナル配列を提供する。このモニタータンパク質は従来の発光酵素と比べ、数倍から数十倍の効率で分泌する特性を持ち、且つ同様の生物発光活性を有している。合成された発光酵素はリアルタイムに分泌されることから、遺伝子の転写活性のわずかな変化もモニターすることが可能となり、高い時間分解能を有するモニタータンパク質として利用できる。
【図面の簡単な説明】
【0013】
【図1】哺乳類発現用ベクターpcDNA3のBamHI、NotIサイトへ挿入した発現用プラスミドpcDNA−CLを示す図である。
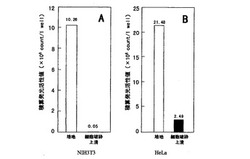
【図2】NIH3T3とHeLa細胞夫々の形質転換体によるCypridina noctiluca発光酵素の培地と細胞破砕上清の積算発光活性値との関係を夫々A,Bのグラフで示す。
【図3】人肺腫細胞A549の形質転換体によるCypridina noctiluca発光酵素の分泌測定結果を示すグラフである。
【図4】Cypridina noctiluca発光酵素についてはAで、一般のVargula hilgendorfii発光酵素についてはBで夫々発光スペクトルの強度を示すグラフである。
【図5】Cypridina noctiluca発光酵素を○でプロットし、一般のVargula hilgendorfii発光酵素を●でプロットした熱安定性を示すグラフである。
【図6】Cypridina noctiluca発光酵素の37℃における安定性を示すグラフである。
【発明を実施するための形態】
【0014】
以下、本発明の実施の形態について説明する。
【0015】
本発明で明らかにされたCypridina noctiluca発光酵素は、全体として上記一般のVargula hilgendorfii発光酵素と80%程度の相同性があるが、N末端配列約30残基のアミノ酸配列に限れば相同性が50%となる特徴的な配列を有している。本Cypridina noctiluca発光酵素遺伝子を哺乳類細胞に形質導入すると、合成された発光酵素は、効率良く細胞外に分泌され、細胞内に留まる発光酵素は上記一般のVargula hilgendorfii発光酵素の約1/10となり、従来の分泌効率を凌駕する分泌型発光酵素が得られた。
【0016】
本発明におけるDNA配列とDNA配列を含むベクターおよびベクターによって形質転換された形質転換体は、1、2として、以下ようにして得ることができる。
1.Cypridina noctiluca より作成されたcDNAライブラリーより上記一般のVargula hilgendorfii発光酵素遺伝子をプローブとして相同性の高いC末端領域の一部の配列がクローン化できる。この部分配列をもとに、ポリメラーゼ連鎖反応(PCR)を利用して、本発明のDNA配列をクローン化する。これら一連の操作は、市販のキットを用いて行うことができる。
2.本発明のDNA配列を哺乳類細胞での発現プロモータ領域を持つ市販のベクターに挿入して、このベクターを哺乳類細胞に形質導入する。遺伝子導入後の、培地の一部を取り出し、その発光活性を測定することで、発現プロモータの転写活性を評価することができる。これら一連の操作は、市販のキットを用いて行うことができる。
本発明では、N末端に高効率の分泌シグナルを持つCypridina noctiluca発光酵素のタンパク質の構造を配列表に明らかにした。
【0017】
本発明にかかるタンパク質は次のように書き表わされる。
1)配列番号1記載のアミノ酸配列を有する高分泌型発光酵素のタンパク質。
2)配列番号1記載のアミノ酸配列において、1若しくは複数個のアミノ酸が欠出、置換、若しくは付加されたアミノ酸配列により表わされる、高分泌型発光酵素のタンパク質。
3)配列番号2記載のDNA配列又はその相補配列によりコードされる高分泌型発光酵素。
【実施例】
【0018】
以下、本発明実施についての具体例を列挙しさらに詳細に説明する。
【0019】
実施例1
Cypridina noctiluca cDNAの構築及び塩基配列の決定について。
Cypridina noctilucaは伊豆半島下田にて採集し、採集個体は液体窒素で固定後、cDNA作成まで−80℃で保存した。全RNAはISOGEN(商品名・日本ジーン)を用いて抽出した。続いてOligotex−dt30(商品名・宝酒造)を用いmRNAを抽出し、cDNA合成をTimesaver cDNA synthesis kit(商品名・アマシャムバイオサイエンス)で行った。
【0020】
合成されたcDNAはλZAPIIベクター(商品名・ストラタジーン)に4℃、12時間の条件下で挿入した。ライゲーション後、GigaPackIII(商品名・ストラタジーン)を用いてインビトロパッケージングを行い、大腸菌XL1−Blueへ形質導入し、2.3×105pfu/ml(増幅後2.9×108pfu/ml)のcDNAライブラリーを得る。
【0021】
cDNAクローンの同定と塩基配列の決定は以下のように行う。cDNAライブラリーからの発光酵素cDNAクローンの同定はプラークハイブリダイゼーション法によって行った。プラーク(8.0×104プラーク分)をナイロンメンブレンに写し取り、ろ紙上で10分乾燥させた。変性溶液(0.5M水酸化ナトリウム,15M塩化ナトリウム)を染み込ませたろ紙にメンブレンを置き、5分間変性させた後、中和溶液(1.0Mトリスヒドロキシアミノメタン−塩酸(pH7.5),1.5M塩化ナトリウム)を染み込ませたろ紙にメンブレンを置き、5分間中和を行った。次に、ろ紙に2×SSC(0.15Mクエン酸ナトリウム,1.5M塩化ナトリウム(pH7.0))を染み込ませ、その上にメンブレンを置き、15分放置し、最後にメンブレンに125mJのUVを照射し、DNAのクロスリンクを行った。
【0022】
プローブはウミボタルVargula hilgendorfii発光酵素DNAを制限酵素XbaIで切断したDNA断片にアルカリフォスタファーゼをラベルしたものを用いた。ハイブリダイゼーションは、55℃、12−14時間、Alkphos Direct Hybridizationbuffer(商品名・アマシャムバイオサイエンス)中で行った。ハイブリダイゼーション後、メンブレンは1st洗浄緩衝液(2M尿素,0.1%ドデシル硫酸ナトリウム,50mMリン酸ナトリウム緩衝液(pH7.0),150mM塩化ナトリウム,1mM塩化マグネシウム)で55℃、10分間、2回洗浄した。その後、2nd洗浄緩衝液(50mMトリスヒドロキシアミノメタン−塩酸(pH10),100mM塩化ナトリウム,2mM塩化マグネシウム)で室温、5分間、2回洗浄を行った。
【0023】
検出はCDP−star(商品名・アマシャムバイオサイエンス)を用いて行った。ポジティブプラークはすべて再スクリーニングを行い同定し、ExAssistヘルパーファージ(商品名・ストラタジーン)を用いpBluescriptファージミドとして切り出した。挿入したcDNAの塩基配列決定は、BigDyeTM Terminator Cycle Sequencing Ready Reaction kit(商品名・アプライドバイオシステム)を用いて行った。
【0024】
プラークハイブリダイゼーションではポリAを含む発光酵素DNAの3’側を同定した。5’末端側のクローニングはPCRで行った。プライマーはファージスクリーニングにより得られた3’側ポジティブクローンの配列から設計した(CL−1R)5’−TTGAACTTGACGACCAGAGC−3’、(CL−2R)5’−GTAGATGGAAGTGTTCTGGG−3’およびベクタープライマーを用いた。1stPCRはCL−1RとM13 Reverse primer5’−GTAAAACGACGGCCAGTG−3’を用い、1サイクル:94℃,2min;35サイクル:94℃,30sec;55℃,1min;72℃,1min 30sec;1サイクル:72℃7minの条件下で行った。2ndPCRはCL−2Rと、T3 primer5’−AATTAACCCTCACTAAAGGG−3’を用いて、1stPCRと同じ反応サイクルで行った。その結果、電気泳動により約1.4kbpのシングルバンドが確認された。
【0025】
このフラグメントをプラスミドpCR2.1−TOPO(商品名・インビトロジェン)へ挿入し配列の確認を行った。配列番号2にその全塩基配列を示した。
【0026】
実施例2
哺乳類細胞用ベクターの作成について。
哺乳類細胞でのCypridina noctiluca発光酵素発現用ベクターを作成するため、完全長発光酵素オープンリーディングフレーム部位をプライマー1(CL−N)5’−ATGAAGACCTTAATTCTTGC−3’とプライマー2(CL−C)5’−CTATTTGCATTCATCTGGTAC−3’を用い、1サイクル:94℃,3min;35サイクル:94℃,30sec;55℃,30sec;72℃,1min;1サイクル:72℃,7minの条件下でcDNAライブラリーよりDNAの増幅を行い、pCR2.1−TOPOベクターに挿入した。続いて制限酵素BamHIとNotIで発光酵素cDNAを切断後、哺乳類発現用ベクターpcDNA3(商品名・インビトロジェン社)のBamHI、NotIサイトへ挿入した図1の発現用プラスミドpcDNA−CLを作成した。
【0027】
実施例3
NIH3T3及びHeLa細胞の形質転換体によるCypridina noctiluca発光酵素の分泌特性について。
【0028】
図2にCypridina noctiluca発光酵素の分泌特性を示した。NIH3T3及びHeLa細胞を24ウェルプレートの1ウェルにつき4.0×104個をまき、80%コンフルエント時にLIPOFECTAMIN PLUS(商品名・インビトロジェン)を用いてpcDNA−CL 0.4μgをNIH3T3及びHeLa細胞に形質導入した。
【0029】
形質導入2時間後、リン酸塩を含む生理的食塩水(PBS)で2度細胞洗浄を行い、無血清のDulbecco’s Modified Eagle Medium(商品名・インビトロジェン)2mLを加え、37℃、5%CO2インキュベーター中で19時間細胞培養を行った。培地を回収後、培地50μlに対し50nM Cypridinaルシフェリン溶液50μlを加え、Luminescencer−PSN AB−2200(商品名・アトー)を用いて20秒間の積算発光活性値を測定した。培地回収後の細胞はPBSで2度洗浄し、250μlのPBSを加え、超音波破砕を行い、遠心分離後上清を回収し、細胞破砕上清50μl中の積算発光活性値を測定した。
【0030】
NIH3T3細胞とHcLa細胞内に留まるCypridina noctiluca発光酵素は、NIH3T3細胞で0.5%(図2A)、HeLa細胞でも10%(図2B)であった。これは、Thompsonらにより報告された上記一般のVargula hilgendorfii発光酵素が細胞内に留まる量、NIH3T3細胞の7%、HeLa細胞の71%と比較し、分泌効率において格段に優れていた。
【0031】
実施例4
人肺腫細胞A549の形質転換体によるCypridina noctiluca発光酵素の分泌測定について。
【0032】
図3に人肺腫細胞A549にpcDNA−CLを形質導入した後のCypridina noctiluca発光酵素の分泌結果を示した。
【0033】
24ウェルプレートの1ウェルにつき人肺腫細胞A549を4.0×104個まき、80%コンフルエント時にLIPOFECTAMIN PLUS(商品名・インビトロジェン)を用いてpcDNA−CL 0.4μgを人肺腫細胞A549に形質導入した。形質導入2時間後に、細胞をPBSで二度洗浄し、培地をOpti−MEM(商品名・インビトロジェン)1mLに交換した。培地交換後、一定時間毎に1ウェルから10μLを採取し活性測定用試料とし、ウェルにはOpti−MEMを10μL添加した。採取した活性測定用試料にOpti−MEM 40μLを加え全量を50μLにし、これに50nM Cypridinaルシフェリン50μLを加え、20秒間の積算発光活性値を測定した。その結果、3時間後には分泌されてくるCypridina noctiluca発光酵素を測定できた。採取する培地の量を増やすことにより、分単位での活性測定も可能である。時間の経過にともない、積算発光活性値が指数関数的に大きくなるのは、Cypridina noctiluca発光酵素の培地への蓄積が原因である。
【0034】
なお参考のため実施に際しての更に具体的な例を申し述べる。
Cypridina noctiluca発光酵素の発光スペクトルについて。
【0035】
発光スペクトルは、Spectrophotometer AB1850(商品名・アトー株式会社)を用いて測定を行った。COS−7細胞にpcDNA−CLを形質導入後、Dulbecco’s Modified Eagle Medium(商品名・インビトロジェン社)を用い、37℃、5%CO2インキュベーター中で29時間培養を行った。その発光酵素を含む培地1μlに0.5μM Cypridinaルシフェリン溶液20μLを加え、10秒間の計測により相対発光強度を測定し、図4のAの460nmに発光極大のあるスペクトルが得られた。これは図4のBの上記一般のVargula hilgendorfii発光酵素による発光スペクトルと一致した。
Cypridina noctiluca発光酵素の熱安定性について。
【0036】
COS−7細胞を24ウェルプレートの1ウェルにつき4.0×104個をまき、80%コンフルエント時にLIPOFECTAMIN PLUS(商品名・インビトロジェン)を用いてpcDNA−CL 0.4μgを形質導入した。形質導入2時間後に、細胞をPBSで二度洗浄し、培地をDulbecco’s Modified Eagle Medium(商品名・インビトロジェン)2mLに交換した。その後19時間培養し、培地を取り出し50mMモプス緩衝液pH7.0で100倍に希釈したサンプルを作成した。
【0037】
サンプルは0,20,37,50,60℃の各温度で30分間インキュベートし、5分間氷上に置き、その後、1.16nM Cypridinaルシフェリン100μlを加え、Luminescencer−PSN AB−2200(商品名・アトー株式会社)を用いて20秒間の積算発光活性量を測定した。
【0038】
図5にCypridina noctiluca発光酵素及び上記一般のVargula hilgendorfii発光酵素の熱安定性を示した。いずれも0℃サンプルの積算発光活性量を100%とした相対活性値で示してある。図5○のCypridina noctiluca発光酵素は37℃で30分間インキュベート後も約70%の活性を保っており、この安定性は図5に●で示す上記一般のVargula hilgendorfii発光酵素とほぼ同じであった。
Cypridina noctiluca発光酵素の37℃における安定性について。
【0039】
COS−7細胞を24ウェルプレートの1ウェルにつき4.0×104個をまき80%コンフルエント時にLIPOFECTAMIN PLUS(商品名・インビトロジェン)を用いてpcDNA−CL 0.4μgを形質導入した。形質導入2時間後に、細胞をPBSで二度洗浄し、培地をDulbecco’s Modified Eagle Medium(商品名・インビトロジェン)2mLに交換した。培地交換後、29時間培養後の培地を回収しサンプルを作成した。
【0040】
取り出したサンプルは更に37℃で29、53時間インキュベート後、培地に50nM Cypridinaルシフェリンを添加し積算発光活性量を測定した。図6に29時間培養直後の積算発光活性量を100%とした相対活性値を示した。29時間培養直後に得られた発光酵素の活性値が半減するのに約50時間を要した。
【技術分野】
【0001】
本発明は,細胞内にとどまることなく細胞外に効率良く分泌されるウミボタル発光酵素のタンパク質並びに該タンパク質をコードするDNA配列に関する。
【背景技術】
【0002】
一般の発光性甲殻類ウミボタルVargula hilgendorfiiは分泌性の発光酵素を持ち、そのウミボタル発光酵素のタンパク質のcDNAは既にクローン化されている。ここで発光酵素とは、発光酵素のタンパク質が細胞内で何らかの修飾を受けたものを含むものとする。上記一般のウミボタル発光酵素はウミボタル発光基質Cypridinaルシフェリンと反応して最大発光波長460nmの青色の光を発する。
【0003】
上記一般のウミボタル発光酵素は細胞外に分泌される特徴をもつことから、クローン化されたcDNAをレポータ遺伝子として利用すると、細胞を破壊することなく遺伝子転写活性が測定(非特許文献1)できるために、有為であり、既に特許化がなされている(特許文献1及び特許文献2)。特許化されている各種の発光酵素のうち、分泌可能なものは上記一般のVargula hilgendorfii発光酵素のみである。
【0004】
この発光酵素を利用した報告には、画像解析システムを用いて細胞からの発光酵素の分泌を可視化した例(非特許文献2)および、哺乳類細胞に成長ホルモン遺伝子の転写活性領域を挿入したウミボタルレポータ遺伝子を導入し、生細胞における転写活性の変化を連続的に測定した例(非特許文献3)がある。
【0005】
上記一般のVargula hilgendorfii発光酵素は、そのタンパク質合成後、小胞体膜を経てゴルジ体へ移行する段階で糖鎖修飾等を受け成熟型となり分泌することが知られており、分泌効率は分泌シグナル配列及び糖修飾の程度に依存すると考えられている。上記一般のVargula hilgendorfii発光酵素の分泌効率測定例では、例えば一般的に良く用いられるNIH3T3細胞においては、24時間培養後に、生産された発光酵素の7%が、HeLa細胞では71%が分泌されず細胞内に留まっている(非特許文献4)。
【0006】
創薬ではタンパク発現阻害剤や分泌阻害剤などの開発及び探索が重要であり、細胞内におけるターゲットタンパク質の遺伝子転写活性の変化を指標としてスクリーニングが行われている。阻害剤の効果に伴う遺伝子転写活性の変化を伝えるのがレポータ遺伝子の役目である。そのレポータ遺伝子からつくられるレポータタンパク質は、単に遺伝子のON/OFFを知らせるだけでなく、阻害剤効果の経時変化が解析できること(時間分解能が高いこと)やレポータタンパク質自体が阻害効果を持たない、或いは細胞内機能を撹乱しない(細胞毒性がない)などの特性を持つ事が要求される。高い時間分解能を達成し且つ細胞毒性がないレポータ遺伝子としては、細胞内で作られたレポータタンパク質が速やかに分泌されるか、代謝される必要がある。
【0007】
上記一般のVargula hilgendorfii発光酵素は、効率は低くとも分泌されることから、細胞外で転写活性の変化を速やかに測定できるが、細胞内に留まった大量のタンパク質は安定、且つ壊れにくく、速やかな代謝は期待できない。また、分子内に34個のシステイン残基を持つことから、細胞内に留まったタンパクは回りの酸化還元状態に大きな影響を及ぼす可能性がある。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】国際特許公開番号WO90/01542
【特許文献2】特公平3−30678号公報
【非特許文献】
【0009】
【非特許文献1】Thompson,E.M.,Nagata,S.& Tsuji,F.I.,Vargula hilgendorfii luciferase:a secreted reporter enzymefor monitoring gene expression in mammalian cells.Gene96,257−62(1990)
【非特許文献2】Inouye,S.,Ohmiya,Y.,Toya,Y.& Tsuji,F.,Imaging of luciferasesecretion from transformed Chinese hamster ovary cells.Proc Natl Acad Sci USA89,9584−7(1992)
【非特許文献3】Tanahashi,Y.,Ohmiya,Y.,Honma,S.,Katsuno,Y.,Ohta,H.,Nakamura,H.,Honma,K.,Continuous measurement of targeted promoter activity by a secreted bioluminescence reporter,Vargula hilgendorfii luciferase.Anal Biochem.289,260−6(2001)
【非特許文献4】Thompson,E.M.,Nagata,S.& Tsuji,F.I.,Vargula hilgendorfii luciferase:a secreted reporter enzyme for monitoring gene expression in mammalian cells. Gene 96,257−62(1990)
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、短時間に起こる細胞内のわずかな遺伝子転写活性の変化を高分解能に発光活性として測定ないしは可視化できる分泌効率の高い発光酵素をクローン化し、その分泌シグナルの特性を利用して転写活性を速やかに細胞外で測定できるレポータタンパク質のベクター系の作成及び利用をしようとするものである。
【課題を解決するための手段】
【0011】
上記課題を解決するため、上記一般のVargula hilgendorfiiのウミボタル近縁種ではあるが浮遊性の特徴をもち、採取の難しいCypridina noctilucaから細胞内に留まる発光酵素量が上記一般のVargula hilgendorfiiの約1/10である分泌効率の高い発光酵素を同定し、遺伝子発現検出ベクターを構築し、本発明の完成に至った。
【発明の効果】
【0012】
本発明は,遺伝子の転写活性モニタータンパク質及びそれをコードする遺伝子、及び分泌シグナル配列を提供する。このモニタータンパク質は従来の発光酵素と比べ、数倍から数十倍の効率で分泌する特性を持ち、且つ同様の生物発光活性を有している。合成された発光酵素はリアルタイムに分泌されることから、遺伝子の転写活性のわずかな変化もモニターすることが可能となり、高い時間分解能を有するモニタータンパク質として利用できる。
【図面の簡単な説明】
【0013】
【図1】哺乳類発現用ベクターpcDNA3のBamHI、NotIサイトへ挿入した発現用プラスミドpcDNA−CLを示す図である。
【図2】NIH3T3とHeLa細胞夫々の形質転換体によるCypridina noctiluca発光酵素の培地と細胞破砕上清の積算発光活性値との関係を夫々A,Bのグラフで示す。
【図3】人肺腫細胞A549の形質転換体によるCypridina noctiluca発光酵素の分泌測定結果を示すグラフである。
【図4】Cypridina noctiluca発光酵素についてはAで、一般のVargula hilgendorfii発光酵素についてはBで夫々発光スペクトルの強度を示すグラフである。
【図5】Cypridina noctiluca発光酵素を○でプロットし、一般のVargula hilgendorfii発光酵素を●でプロットした熱安定性を示すグラフである。
【図6】Cypridina noctiluca発光酵素の37℃における安定性を示すグラフである。
【発明を実施するための形態】
【0014】
以下、本発明の実施の形態について説明する。
【0015】
本発明で明らかにされたCypridina noctiluca発光酵素は、全体として上記一般のVargula hilgendorfii発光酵素と80%程度の相同性があるが、N末端配列約30残基のアミノ酸配列に限れば相同性が50%となる特徴的な配列を有している。本Cypridina noctiluca発光酵素遺伝子を哺乳類細胞に形質導入すると、合成された発光酵素は、効率良く細胞外に分泌され、細胞内に留まる発光酵素は上記一般のVargula hilgendorfii発光酵素の約1/10となり、従来の分泌効率を凌駕する分泌型発光酵素が得られた。
【0016】
本発明におけるDNA配列とDNA配列を含むベクターおよびベクターによって形質転換された形質転換体は、1、2として、以下ようにして得ることができる。
1.Cypridina noctiluca より作成されたcDNAライブラリーより上記一般のVargula hilgendorfii発光酵素遺伝子をプローブとして相同性の高いC末端領域の一部の配列がクローン化できる。この部分配列をもとに、ポリメラーゼ連鎖反応(PCR)を利用して、本発明のDNA配列をクローン化する。これら一連の操作は、市販のキットを用いて行うことができる。
2.本発明のDNA配列を哺乳類細胞での発現プロモータ領域を持つ市販のベクターに挿入して、このベクターを哺乳類細胞に形質導入する。遺伝子導入後の、培地の一部を取り出し、その発光活性を測定することで、発現プロモータの転写活性を評価することができる。これら一連の操作は、市販のキットを用いて行うことができる。
本発明では、N末端に高効率の分泌シグナルを持つCypridina noctiluca発光酵素のタンパク質の構造を配列表に明らかにした。
【0017】
本発明にかかるタンパク質は次のように書き表わされる。
1)配列番号1記載のアミノ酸配列を有する高分泌型発光酵素のタンパク質。
2)配列番号1記載のアミノ酸配列において、1若しくは複数個のアミノ酸が欠出、置換、若しくは付加されたアミノ酸配列により表わされる、高分泌型発光酵素のタンパク質。
3)配列番号2記載のDNA配列又はその相補配列によりコードされる高分泌型発光酵素。
【実施例】
【0018】
以下、本発明実施についての具体例を列挙しさらに詳細に説明する。
【0019】
実施例1
Cypridina noctiluca cDNAの構築及び塩基配列の決定について。
Cypridina noctilucaは伊豆半島下田にて採集し、採集個体は液体窒素で固定後、cDNA作成まで−80℃で保存した。全RNAはISOGEN(商品名・日本ジーン)を用いて抽出した。続いてOligotex−dt30(商品名・宝酒造)を用いmRNAを抽出し、cDNA合成をTimesaver cDNA synthesis kit(商品名・アマシャムバイオサイエンス)で行った。
【0020】
合成されたcDNAはλZAPIIベクター(商品名・ストラタジーン)に4℃、12時間の条件下で挿入した。ライゲーション後、GigaPackIII(商品名・ストラタジーン)を用いてインビトロパッケージングを行い、大腸菌XL1−Blueへ形質導入し、2.3×105pfu/ml(増幅後2.9×108pfu/ml)のcDNAライブラリーを得る。
【0021】
cDNAクローンの同定と塩基配列の決定は以下のように行う。cDNAライブラリーからの発光酵素cDNAクローンの同定はプラークハイブリダイゼーション法によって行った。プラーク(8.0×104プラーク分)をナイロンメンブレンに写し取り、ろ紙上で10分乾燥させた。変性溶液(0.5M水酸化ナトリウム,15M塩化ナトリウム)を染み込ませたろ紙にメンブレンを置き、5分間変性させた後、中和溶液(1.0Mトリスヒドロキシアミノメタン−塩酸(pH7.5),1.5M塩化ナトリウム)を染み込ませたろ紙にメンブレンを置き、5分間中和を行った。次に、ろ紙に2×SSC(0.15Mクエン酸ナトリウム,1.5M塩化ナトリウム(pH7.0))を染み込ませ、その上にメンブレンを置き、15分放置し、最後にメンブレンに125mJのUVを照射し、DNAのクロスリンクを行った。
【0022】
プローブはウミボタルVargula hilgendorfii発光酵素DNAを制限酵素XbaIで切断したDNA断片にアルカリフォスタファーゼをラベルしたものを用いた。ハイブリダイゼーションは、55℃、12−14時間、Alkphos Direct Hybridizationbuffer(商品名・アマシャムバイオサイエンス)中で行った。ハイブリダイゼーション後、メンブレンは1st洗浄緩衝液(2M尿素,0.1%ドデシル硫酸ナトリウム,50mMリン酸ナトリウム緩衝液(pH7.0),150mM塩化ナトリウム,1mM塩化マグネシウム)で55℃、10分間、2回洗浄した。その後、2nd洗浄緩衝液(50mMトリスヒドロキシアミノメタン−塩酸(pH10),100mM塩化ナトリウム,2mM塩化マグネシウム)で室温、5分間、2回洗浄を行った。
【0023】
検出はCDP−star(商品名・アマシャムバイオサイエンス)を用いて行った。ポジティブプラークはすべて再スクリーニングを行い同定し、ExAssistヘルパーファージ(商品名・ストラタジーン)を用いpBluescriptファージミドとして切り出した。挿入したcDNAの塩基配列決定は、BigDyeTM Terminator Cycle Sequencing Ready Reaction kit(商品名・アプライドバイオシステム)を用いて行った。
【0024】
プラークハイブリダイゼーションではポリAを含む発光酵素DNAの3’側を同定した。5’末端側のクローニングはPCRで行った。プライマーはファージスクリーニングにより得られた3’側ポジティブクローンの配列から設計した(CL−1R)5’−TTGAACTTGACGACCAGAGC−3’、(CL−2R)5’−GTAGATGGAAGTGTTCTGGG−3’およびベクタープライマーを用いた。1stPCRはCL−1RとM13 Reverse primer5’−GTAAAACGACGGCCAGTG−3’を用い、1サイクル:94℃,2min;35サイクル:94℃,30sec;55℃,1min;72℃,1min 30sec;1サイクル:72℃7minの条件下で行った。2ndPCRはCL−2Rと、T3 primer5’−AATTAACCCTCACTAAAGGG−3’を用いて、1stPCRと同じ反応サイクルで行った。その結果、電気泳動により約1.4kbpのシングルバンドが確認された。
【0025】
このフラグメントをプラスミドpCR2.1−TOPO(商品名・インビトロジェン)へ挿入し配列の確認を行った。配列番号2にその全塩基配列を示した。
【0026】
実施例2
哺乳類細胞用ベクターの作成について。
哺乳類細胞でのCypridina noctiluca発光酵素発現用ベクターを作成するため、完全長発光酵素オープンリーディングフレーム部位をプライマー1(CL−N)5’−ATGAAGACCTTAATTCTTGC−3’とプライマー2(CL−C)5’−CTATTTGCATTCATCTGGTAC−3’を用い、1サイクル:94℃,3min;35サイクル:94℃,30sec;55℃,30sec;72℃,1min;1サイクル:72℃,7minの条件下でcDNAライブラリーよりDNAの増幅を行い、pCR2.1−TOPOベクターに挿入した。続いて制限酵素BamHIとNotIで発光酵素cDNAを切断後、哺乳類発現用ベクターpcDNA3(商品名・インビトロジェン社)のBamHI、NotIサイトへ挿入した図1の発現用プラスミドpcDNA−CLを作成した。
【0027】
実施例3
NIH3T3及びHeLa細胞の形質転換体によるCypridina noctiluca発光酵素の分泌特性について。
【0028】
図2にCypridina noctiluca発光酵素の分泌特性を示した。NIH3T3及びHeLa細胞を24ウェルプレートの1ウェルにつき4.0×104個をまき、80%コンフルエント時にLIPOFECTAMIN PLUS(商品名・インビトロジェン)を用いてpcDNA−CL 0.4μgをNIH3T3及びHeLa細胞に形質導入した。
【0029】
形質導入2時間後、リン酸塩を含む生理的食塩水(PBS)で2度細胞洗浄を行い、無血清のDulbecco’s Modified Eagle Medium(商品名・インビトロジェン)2mLを加え、37℃、5%CO2インキュベーター中で19時間細胞培養を行った。培地を回収後、培地50μlに対し50nM Cypridinaルシフェリン溶液50μlを加え、Luminescencer−PSN AB−2200(商品名・アトー)を用いて20秒間の積算発光活性値を測定した。培地回収後の細胞はPBSで2度洗浄し、250μlのPBSを加え、超音波破砕を行い、遠心分離後上清を回収し、細胞破砕上清50μl中の積算発光活性値を測定した。
【0030】
NIH3T3細胞とHcLa細胞内に留まるCypridina noctiluca発光酵素は、NIH3T3細胞で0.5%(図2A)、HeLa細胞でも10%(図2B)であった。これは、Thompsonらにより報告された上記一般のVargula hilgendorfii発光酵素が細胞内に留まる量、NIH3T3細胞の7%、HeLa細胞の71%と比較し、分泌効率において格段に優れていた。
【0031】
実施例4
人肺腫細胞A549の形質転換体によるCypridina noctiluca発光酵素の分泌測定について。
【0032】
図3に人肺腫細胞A549にpcDNA−CLを形質導入した後のCypridina noctiluca発光酵素の分泌結果を示した。
【0033】
24ウェルプレートの1ウェルにつき人肺腫細胞A549を4.0×104個まき、80%コンフルエント時にLIPOFECTAMIN PLUS(商品名・インビトロジェン)を用いてpcDNA−CL 0.4μgを人肺腫細胞A549に形質導入した。形質導入2時間後に、細胞をPBSで二度洗浄し、培地をOpti−MEM(商品名・インビトロジェン)1mLに交換した。培地交換後、一定時間毎に1ウェルから10μLを採取し活性測定用試料とし、ウェルにはOpti−MEMを10μL添加した。採取した活性測定用試料にOpti−MEM 40μLを加え全量を50μLにし、これに50nM Cypridinaルシフェリン50μLを加え、20秒間の積算発光活性値を測定した。その結果、3時間後には分泌されてくるCypridina noctiluca発光酵素を測定できた。採取する培地の量を増やすことにより、分単位での活性測定も可能である。時間の経過にともない、積算発光活性値が指数関数的に大きくなるのは、Cypridina noctiluca発光酵素の培地への蓄積が原因である。
【0034】
なお参考のため実施に際しての更に具体的な例を申し述べる。
Cypridina noctiluca発光酵素の発光スペクトルについて。
【0035】
発光スペクトルは、Spectrophotometer AB1850(商品名・アトー株式会社)を用いて測定を行った。COS−7細胞にpcDNA−CLを形質導入後、Dulbecco’s Modified Eagle Medium(商品名・インビトロジェン社)を用い、37℃、5%CO2インキュベーター中で29時間培養を行った。その発光酵素を含む培地1μlに0.5μM Cypridinaルシフェリン溶液20μLを加え、10秒間の計測により相対発光強度を測定し、図4のAの460nmに発光極大のあるスペクトルが得られた。これは図4のBの上記一般のVargula hilgendorfii発光酵素による発光スペクトルと一致した。
Cypridina noctiluca発光酵素の熱安定性について。
【0036】
COS−7細胞を24ウェルプレートの1ウェルにつき4.0×104個をまき、80%コンフルエント時にLIPOFECTAMIN PLUS(商品名・インビトロジェン)を用いてpcDNA−CL 0.4μgを形質導入した。形質導入2時間後に、細胞をPBSで二度洗浄し、培地をDulbecco’s Modified Eagle Medium(商品名・インビトロジェン)2mLに交換した。その後19時間培養し、培地を取り出し50mMモプス緩衝液pH7.0で100倍に希釈したサンプルを作成した。
【0037】
サンプルは0,20,37,50,60℃の各温度で30分間インキュベートし、5分間氷上に置き、その後、1.16nM Cypridinaルシフェリン100μlを加え、Luminescencer−PSN AB−2200(商品名・アトー株式会社)を用いて20秒間の積算発光活性量を測定した。
【0038】
図5にCypridina noctiluca発光酵素及び上記一般のVargula hilgendorfii発光酵素の熱安定性を示した。いずれも0℃サンプルの積算発光活性量を100%とした相対活性値で示してある。図5○のCypridina noctiluca発光酵素は37℃で30分間インキュベート後も約70%の活性を保っており、この安定性は図5に●で示す上記一般のVargula hilgendorfii発光酵素とほぼ同じであった。
Cypridina noctiluca発光酵素の37℃における安定性について。
【0039】
COS−7細胞を24ウェルプレートの1ウェルにつき4.0×104個をまき80%コンフルエント時にLIPOFECTAMIN PLUS(商品名・インビトロジェン)を用いてpcDNA−CL 0.4μgを形質導入した。形質導入2時間後に、細胞をPBSで二度洗浄し、培地をDulbecco’s Modified Eagle Medium(商品名・インビトロジェン)2mLに交換した。培地交換後、29時間培養後の培地を回収しサンプルを作成した。
【0040】
取り出したサンプルは更に37℃で29、53時間インキュベート後、培地に50nM Cypridinaルシフェリンを添加し積算発光活性量を測定した。図6に29時間培養直後の積算発光活性量を100%とした相対活性値を示した。29時間培養直後に得られた発光酵素の活性値が半減するのに約50時間を要した。
【特許請求の範囲】
【請求項1】
下記1),2)または3)のDNA;
1)配列番号1記載のアミノ酸配列を有する高分泌型発光酵素のタンパク質をコードするDNA、
2)前記1)のタンパク質のアミノ酸配列において、1もしくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を有し、高分泌型発光酵素活性を有するタンパク質をコードするDNA、
3)配列番号2に記載のDNAまたはその相補鎖。
【請求項2】
配列番号1記載のアミノ酸配列を有する高分泌型発光酵素のタンパク質をコードするDNAである、請求項1に記載のDNA。
【請求項3】
請求項1または2に記載のDNA配列を含むベクター。
【請求項4】
請求項3に記載のベクターによって形質転換された形質転換体。
【請求項5】
前記形質転換体が哺乳類細胞の形質転換体形質転換体である、請求項4に記載の形質転換体。
【請求項6】
下記1),2)または3)のタンパク質;
1)配列番号1記載のアミノ酸配列を有する高分泌型発光酵素のタンパク質。
2)配列番号1記載のアミノ酸配列において、1若しくは数個のアミノ酸が欠出、置換、若しくは付加されたアミノ酸配列により表わされる、高分泌型発光酵素のタンパク質。
3)配列番号2記載のDNA配列によりコードされる高分泌型発光酵素のタンパク質。
【請求項1】
下記1),2)または3)のDNA;
1)配列番号1記載のアミノ酸配列を有する高分泌型発光酵素のタンパク質をコードするDNA、
2)前記1)のタンパク質のアミノ酸配列において、1もしくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列を有し、高分泌型発光酵素活性を有するタンパク質をコードするDNA、
3)配列番号2に記載のDNAまたはその相補鎖。
【請求項2】
配列番号1記載のアミノ酸配列を有する高分泌型発光酵素のタンパク質をコードするDNAである、請求項1に記載のDNA。
【請求項3】
請求項1または2に記載のDNA配列を含むベクター。
【請求項4】
請求項3に記載のベクターによって形質転換された形質転換体。
【請求項5】
前記形質転換体が哺乳類細胞の形質転換体形質転換体である、請求項4に記載の形質転換体。
【請求項6】
下記1),2)または3)のタンパク質;
1)配列番号1記載のアミノ酸配列を有する高分泌型発光酵素のタンパク質。
2)配列番号1記載のアミノ酸配列において、1若しくは数個のアミノ酸が欠出、置換、若しくは付加されたアミノ酸配列により表わされる、高分泌型発光酵素のタンパク質。
3)配列番号2記載のDNA配列によりコードされる高分泌型発光酵素のタンパク質。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2010−29216(P2010−29216A)
【公開日】平成22年2月12日(2010.2.12)
【国際特許分類】
【出願番号】特願2009−257631(P2009−257631)
【出願日】平成21年11月11日(2009.11.11)
【分割の表示】特願2002−382996(P2002−382996)の分割
【原出願日】平成14年12月6日(2002.12.6)
【出願人】(000101466)アトー株式会社 (7)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成22年2月12日(2010.2.12)
【国際特許分類】
【出願日】平成21年11月11日(2009.11.11)
【分割の表示】特願2002−382996(P2002−382996)の分割
【原出願日】平成14年12月6日(2002.12.6)
【出願人】(000101466)アトー株式会社 (7)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

