高性能固相
両性イオン添加剤の存在下において、固体担体を検体特異的生体分子でコーティングすることによって製造される、バイオアフィニティアッセイと他の固相用途に有用な高性能固相が開示されている。本発明にしたがって製造される構造体は、結合特性が増大した高性能固相を提供し、こうした高性能固相は、いかなる固相ベースのアッセイに対しても有利である。本発明はさらに、このような固相の使用、およびこのような固相の製造方法に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、バイオアフィニティアッセイと他の固相用途に有用な高性能(high capacity)固相に関する。本発明はさらに、このような高性能固相とその製造方法に関する。
【背景技術】
【0002】
固相バイオアフィニティアッセイは、固体担体上(例えば、球状粒子の外表面上、試験管の内表面上、マイクロタイトレーションウェル上、または平面状の「チップ」表面上)の抗体もしくは他の生体分子の吸着(こうした吸着が、次いで、別の捕捉分子または検出しようとする検体を固定化するのに使用される)に基づいている。
【0003】
現在では、固相用途のための機能的に活性な表面を得るための多くの異なったコーティング法が知られている。しかしながら、アッセイの感度、速度論、およびロバスト性に対する現在の期待から、重要なアッセイ成分(固相の特性など)に対する新たな要求が設けられている。現行のパターン化表面は、アッセイ性能とより高い表面結合能力に対する要求に必ずしも対処できるとは限らない。
【0004】
固相コーティングを得るための最も簡単な方法は、固体担体上への未修飾タンパク質の吸着であり、固体担体は通常、ポリスチレン、ポリプロピレン、または他の数種のプラスチック材料もしくはガラスで造られている。タンパク質を緩衝液(例えば、炭酸塩緩衝液やリン酸塩緩衝液)中に溶解させ、固体担体の表面に塗布する。コーティングは湿潤環境にて行い、次いで非特異的結合部位をふさぐために飽和工程を施し、そして最後に表面を乾燥する。しかしながら通常は、ほんのわずかの天然タンパク質だけしか、こうした受動的吸着後にその活性を保持しないので、このようにして得られる固相コーティングは、必ずしも結合能力に関して最良の選択であるとは限らない。
【0005】
したがって幾つかの研究では、例えば、タンパク質を異なった「キャリア」タンパク質に連結させてから固体担体に吸着させるときの、タンパク質コーティングの吸着特性と表面安定性を改良すべく探求がなされた。厳しいアッセイに対する改良された吸着特性を得るために、巨大分子の天然構造の修飾が要求されることもしばしばある。
【0006】
このような巨大分子の1つがストレプトアビジンであり、固相上にビオチン化タンパク質を捕捉するのに広く使用されている。ビオチンを堅く結合させるというストレプトアビジンの基本的な特性が、マイクロアレイ、バイオセンサー、および他のバイオアフィニティアッセイを含めた多くの固相ベースの用途において利用されている。
【0007】
米国特許第5,061,640A号は、ストレプトアビジンの吸着を高めるために、より大きな前駆体タンパク質を使用することを開示している。この方法は、ストレプトアビジンをより疎水性のキャリア分子(ウシ血清アルブミン等)とコンジュゲートさせてから疎水性の固体担体にコーティングする(これにより改良された結合特性を有する固相を得る)ことにより、固体担体へのストレプトアビジンの接着性を向上させるコーティングプロセスを提供する。
【0008】
コーティングされた物質の吸着特性を改良するための他の方法が米国特許第6,638,728B1号に開示されており、該特許は、ストレプトアビジンモノマーと二官能性リンカーとを重合させて、ストレプトアビジンのダイマー、トリマー、およびテトラマー(これらは、ポリスチレン上に吸着されたときに、天然ストレプトアビジンの表面と比較して改良されたビオチン結合能力を有する)の混合物を得ることを説明している。
【0009】
ジスルフィド基を介してのチオール化ストレプトアビジンの重合により、固相特性も改良され、ポリスチレン表面上にコーティングしたときに、インキュベーション時における固相からのタンパク質の漏れをできるだけ抑えることにより、表面安定性を向上させることがわかった(Valimaa,L.,Laurikainen,K.,2006:“Comparison−study of streptavidin coated microtitration plates”,J.Immunol.Methods.308,203)。しかしながら、この研究はさらに、チオール化ストレプトアビジンをベースとするコーティングが、天然ストレプトアビジンと比較して良好な固相特性と改良された結合能力を示すけれども、他のコーティングがより高い吸着能力を示す、ということを明らかにした。他方、このようなコーティングは不安定になりやすい。
【0010】
実際、固相の特性はさらに、使用するコーティング条件(適用される緩衝液組成や、使用するコーティング方法を含む)に強く依存する。したがって幾つかの研究は、スポットのモルホロジーや再現性を改良する上で、プリンティング溶液中の緩衝液添加剤が重要であることを明らかにした。スポットモルホロジー間の変動を少なくするために、そしてスポット生成の全体的な再現性を向上させるために、一般には種々の界面活性剤が使用される。
【0011】
したがって、米国特許第2006/0223074A1号では、アルキレンジオール、ベタイン、洗浄剤、および塩を含む、固体担体をコーティングするためのスポッティング溶液が提唱されている。ベタインは両性イオン構造を有するが、米国特許第2006/0223074号に開示の洗浄剤はイオン性または非イオン性である。このような組成物は、スポットの高いコンシステンシーと高い安定性をもたらすだけでなく、製造しやすさと長期貯蔵のしやすさももたらす。
【0012】
DNAマイクロアレイに対する最適化された緩衝液組成物に関して他の幾つかの研究が報告されている。しかしながら、このような研究は、スポッティング溶液中の添加剤としてベタインが使用されたときには、添加剤なしの通常のスポッティング溶液と比較して、シグナル強度が改良されることを報告しているけれども、このようなコーティングを使用して得られる全結合能力はかなり低かった。
【0013】
したがって、固相が、安定性特性を損なわない状態で高い結合能力を示す、という固体担体のための固相コーティングを提供することが依然として求められている。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】米国特許第5,061,640A号
【特許文献2】米国特許第6,638,728B1号
【特許文献3】米国特許第2006/0223074A1号
【非特許文献】
【0015】
【非特許文献1】Valimaa,L.,Laurikainen,K.,2006:“Comparison−study of streptavidin coated microtitration plates”,J.Immunol.Methods.308,203
【発明の概要】
【発明が解決しようとする課題】
【0016】
したがって、本発明の目的は、マイクロアレイ、バイオセンサー、および他のバイオアフィニティアッセイ等の高度に効率的な用途に使用することができる高性能固相を提供することである。
【課題を解決するための手段】
【0017】
したがって本発明の第1の態様は、
a)両性イオン添加剤の存在下において、固体担体を検体特異的生体分子でコーティングする工程、ここで該生体分子はSH基を含有する;
b)該固体担体への該生体分子の固定化を引き起こすために十分な時間にわたって該固体担体をインキュベートする工程;および
c)該固体担体を乾燥する工程;
の逐次工程を含む方法によって製造される高性能固相に関する。
【0018】
本発明の文脈において、本明細書で使用している「高性能固相」とは、バイオアッセイの目的に適した任意の適切な固相を表わしている。
さらに本発明の文脈において、本明細書で使用している「固体担体」とは、上記の高性能固相でコーティングされるのに適した任意の適切な固体担体を表わしている。一般に、このような固体担体は、ポリスチレン、ポリプロピレン、他の数種のプラスチック材料、またはガラスであってよい。
【0019】
本明細書で使用している「検体特異的生体分子」とは、検体に対して特異的な結合能力を有する任意の生体分子を表わしている。理解しておかなければならないことは、生体分子は、直接的な結合によって検体に対し特異的であってよい(例えば、検体を特異的に結合させる生体分子として抗体を使用するとき)、という点である。これとは別に、生体分子は、検体を間接的に結合させてもよい(例えば、測定しようとする検体に対してコンジュゲートしているビオチン部分を結合させる生体分子としてストレプトアビジンを使用するとき)。
【0020】
本発明に従って理解しておかなければならないことは、生体分子と共に含まれるSH基は、使用される生体分子の天然構造中に存在してもよいし(例えば、生体分子の還元されたジスルフィド結合)、あるいは化学的修飾によって天然タンパク質構造中につくりだすこともできる、という点である。
【0021】
本明細書で使用している「両性イオン添加剤」とは、電気的に中性ではあるが、異なった原子上に形式的な正電荷と負電荷を有する任意の極性化合物を表わしている。両性イオン添加剤の例としては、ベタインとホスホリルコリンが挙げられる。
【0022】
本発明の高性能固相を使用すると、驚くほど高度に改善された結合特性を有する新規の固相が得られる。驚くべきことに、本発明による新しい画期的なコーティング緩衝液(すなわち、両性イオン添加剤のほかにSH基を有する生体分子を含有する)で固体担体をコーティングすると、このコーティング液をドライコーティング法によって塗布したときに、従来のコーティングと比較して極めて増大した結合活性がもたらされる、ということが観察された。したがって本発明のコーティングは、コーティングされた物質に関して驚くほど高度に改善された吸着特性(最大で100倍の向上)をもたらし、これにより高性能の結合特性を有する高密度固相の製造が可能となる。
【0023】
さらに、得られる固相の安定性が高いので、改良されたスポットモルホロジーが観察される。
本発明の固相は、最初のインキュベーション時に(すなわち、任意の飽和工程の前に)コーティングを乾燥するということを含む方法によって得られる。このようなコーティング法は「ドライコーティング」と呼ばれる。ドライコーティングは、実施するのが簡単な速やかなコーティングプロセスを可能にし、そしてさらに、従来のコーティング手順と比較して、コーティングプロセスに必要とされる全体的な時間も短縮する。ドライコーティングはさらに、通常のスポットコーティング法(例えば、ドロップ・ディスペンシングやソリッドピン・プリンティング)のほかに他のプリンティング法(例えばインクジェット・プリンティング)に関しても適用することができる。
【0024】
本発明の幾つかの実施態様では、本発明による高性能固相は、固体担体上の非特異的結合部位を非相互作用部分で飽和させる工程をさらに含む方法によって製造される。
本明細書で使用している「非相互作用部分」とは、本発明に従って使用される生体分子または検体と特異的に相互作用しない有機化合物もしくは別の生体分子を表わしている(すなわち、非相互作用部分は非特異的結合部位だけに結合する)。一般には、このような非相互作用部分は、ウシ血清アルブミン等の不活性タンパク質であり、固体担体の非特異的結合部位に結合する。非相互作用部分はさらに、固相の非特異的タンパク質部位に結合してよい。これにより特異的結合と非特異的結合のシグナル/ノイズ比が改良され、検出システムは当該検体に対してより高感度になる。
【0025】
本発明の検体特異的生体分子は、タンパク質、抗体、抗体のフラグメント、抗原、受容体リガンド、タンパク質受容体、特異的結合タンパク質、アプタマー、核酸、オリゴヌクレオチド、およびペプチドからなる群から選択することができる。
【0026】
この文脈では、本明細書で使用している「抗体」という用語は、任意の免疫グロブリンもしくはそれらのフラグメントを表わしており、抗原結合部位を含む任意のポリペプチドを包含する。この用語は、ポリクローナル抗体、モノクローナル抗体、単一特異的抗体、多特異的抗体、非特異的抗体、ヒト化抗体、ヒト抗体、一本鎖抗体、キメラ抗体、合成抗体、組み換え抗体、ハイブリッド抗体、突然変異抗体、グラフト化抗体、およびインビトロ生成抗体を含むが、これらに限定されない。
【0027】
異なったアッセイを使用する場合、これらの群の生体分子のそれぞれに関連した利点は当業者に公知である。
ストレプトアビジンは、一般的に使用されている生体分子の1つである。
【図面の簡単な説明】
【0028】
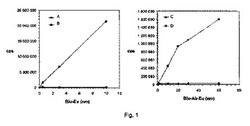
【図1】図1は、それぞれ、ユーロピウム標識されたビオチンおよびビオチン化・ユーロピウム標識された巨大分子を使用したときの、ストレプトアビジンコーティングされたスポット表面のビオチン結合能力を示す。
【図2】図2は、コーティング溶液中に添加剤を含む場合と含まない場合の、そしてコーティング溶液中にチオール化ストレプトアビジンと添加剤を含む場合の、未修飾ストレプトアビジンを用いて製造したストレプトアビジンコーティングされたC型マイクロタイトレーションウェルのビオチン結合能力を示す。
【図3】図3は、未修飾ストレプトアビジンの場合と比較したときの、ドロップ・ディスペンシング法を使用して製造したチオール化ストレプトアビジンコーティングされたスポットウェルのビオチン結合能力を示す。
【図4】図4は、天然抗体またはチオール化抗体(cTnlとユーロピウム標識されたトレーサー抗体を添加した後に得られる)を使用してポリスチレン上の抗体コーティングにおいて改良された表面特性を得るために、コーティング溶液中に添加剤としてベタインとともにチオール化タンパク質を使用することを示す。
【図5】図5は、コンタクト・プリンティング法を使用してポリスチレン上に製造される抗体コーティングに対し、コーティング溶液中にベタインとともにチオール化フラグメント抗体を使用することを示す。
【図6】図6は、コンタクト・プリンティング法で製造される高性能スポット表面および対照標準スポット表面にて行われるオリゴヌクレオチドアッセイからの蛍光誘導体化特異的シグナル(fluorescence derived specific signals)を示す。
【発明を実施するための形態】
【0029】
幾つかの実施態様では、生体分子は核酸ではない。
本発明の幾つかの実施態様では、生体分子でコーティングする前に、生体分子をチオール化によって修飾した。
【0030】
理解しておかなければならないことは、生体分子上の機能的なSH基は、例えば、抗体または他のタンパク質を酵素的切断もしくは化学的切断によって還元して反応性スルフィドリルを含有する抗体フラグメントを放出させることで、生体分子内の内在性ジスルフィド結合を還元することにより生成させることができる、という点である。これとは別に、チオール化は、生体分子上に新たなチオール基をもたらす任意の適切なチオール化剤によっても行われる。
【0031】
1つの実施態様では、生体分子は、生体分子中に既に存在するSH基を含有する。
1つの実施態様では、生体分子中の内在性ジスルフィド結合を還元することによりSH基が導入されるよう、生体分子に修飾を施した。
【0032】
1つの実施態様では、生体分子中に既に存在するイオウ基を還元することによりSH基が導入されるよう、生体分子に修飾を施した。
本発明の幾つかの実施態様では、任意の適切なチオール化試薬(例えば、S−(アセチルチオ)酢酸(SATA)、3−(2−ピリジルジチオ)プロピオン酸N−ヒドロキシスクシンイミドエステル(SPDP)、N−スクシンイミジル−S−アセチルチオプロピオネート(SADP)、スクシンイミジルオキシカルボニル−α−メチル−α−(2−ピリジルジチオ)トルエン(SMPT)、および2−イミノチオラン(トラウト試薬)等から選ばれるチオール化試薬)によってSH基が導入されるよう、チオール化によって生体分子に修飾を施した。
【0033】
このようなチオール化試薬を使用すると、生体分子の効率的且つ安定なチオール化を果たすことができる。
本発明の幾つかの実施態様では、両性イオン添加剤は、以下の一般構造:
A’−R−A”
[式中、
A’は、
【0034】
【化1】

【0035】
(式中、R1、R2、およびR3は独立して、水素、ハロゲン、−NO2、−CN、−OR4、−SR4、−SO2R4、−SOR4、C1−6−アルキル、C1−6−ポリフルオロアルキル、C2−6−アルケニル、C2−6−アルキニル、C3−6−シクロアルキル、C2−6−アルコキシアルキル、C2−6−アルキルチオアルキル、またはC2−6−アルキルアミノアルキルであって、ここで、R4は水素またはC1−6−アルキルである)
から選ばれる基であり;
Rは、式−(CH2)m−のアルキル鎖であって、m=0〜22であり;そして
A”は、−O−、−CO2−、−OSO3−、−OPO32−、および−OPO3H−から選ばれる基である]
を有する。
【0036】
1つの特定の実施態様では、R1、R2、およびR3は、独立して水素であるか、あるいは式CH3−(CH2)n−(式中、n=0〜5)の同一もしくは異なったアルキル基である。
【0037】
本発明の幾つかの特定の実施態様では、R1、R2、およびR3は水素ではない。
したがって、本発明のこれらの実施態様では、両性イオン添加剤は、効率的で安定なコーティングをもたらすベタインとの構造類似性を有する。
【0038】
幾つかの実施態様では、両性イオン添加剤は、ベタインとホスホリルコリンから選ばれる。本明細書で使用している「ベタイン」とは、N,N,N−トリメチルグリシンという特定の化合物を表わしている。
【0039】
本発明の幾つかの実施態様では、コーティングは、ドロップ−ディスペンシング・コーティング、ソリッド−ピン・プリンティング、およびインクジェット・プリンティングから選ばれるコーティング法によって行われる。
【0040】
このようなコーティング法は、ドライコーティングという考え方のもとで施すと、本発明の高性能固相を得るための高度に再現性のあるコーティングを得ることを可能にする。
コーティングするための方法はさらに、受動的吸着、官能基を介しての化学的カップリング、または生化学的相互作用を含んでよい。
【0041】
本発明の他の側面は、サンプル中の検体を固相検出するための方法において、本発明の高性能固相を使用することに関し、該方法は、
a)検体の含量に関して試験しようとするサンプルを、本発明にしたがって製造した高性能固相に加える工程;および
b)検体の存在もしくは濃度を測定する工程;
を含む。
【0042】
高性能固相に特異的に結合した検体を測定もしくは検出するための方法は、当業者に公知である。これは、例えば、UV分光光度法を使用するUV吸収によりタンパク質、ペプチド、アミノ酸および/または核酸の含量を測定することによって、固相に特異的に結合した検体量を検出する、等の受動的な方法によって果たすことができる。これとは別に、そして好ましくは、検体は、検出システム中に存在する標識を使用することによって検出または測定される。この標識は、検体上に存在しても、生体分子に対するパートナー上に存在しても、あるいは検体に結合している別の生体分子上に存在してもよい。
【0043】
標識は、検体自体の内在的な酵素メンバーであっても、酵素活性標識もしくは放射性標識を有する部分であっても、あるいは分光学的方法、光学的方法、光化学的方法、免疫化学的方法、電気的方法、熱量測定法、または化学的方法によって検出できる他の任意の適切な検出可能なシグナル応答性部分であってもよい。
【0044】
幾つかの実施態様では、標識は蛍光染料である。幾つかの実施態様では、蛍光染料は、ユーロピウムキレート等の希土類キレート;FITC、5−カルボキシフルオレセイン、および6−カルボキシフルオレセインを含むフルオレセインタイプ;TAMRA、ダンシル、リサミン、シアニン、フィコエリトリン、およびテキサスレッドを含むローダミンタイプ;ならびにこれらの類縁体;から選ばれる。
【0045】
幾つかの実施態様では、標識は、3H、11C、14C、18F、32P、35S、64Cu、68Ga、86Y、99Tc、111In、123I、124I、125I、131I、133Xe、177Lu、211At、213Bi、および51Crから選ばれる放射性核種である。
【0046】
本発明の幾つかの実施態様では、標識は、検体上に存在しても、固相の生体分子に対するパートナー上に存在しても、あるいは検体に結合している別の生体分子上に存在してもよい。
【0047】
これら実施態様のそれぞれに関連した利点は当業者に公知である。
本発明の幾つかの実施態様では、検体は、生体分子のための結合パートナーに検体をコンジュゲートさせることによって生体分子に対して特異的になる。
【0048】
したがって本発明の好ましい実施態様では、結合パートナーがビオチンであり、生体分子は、アビジンとストレプトアビジンから選ばれる。これとは別に、結合パートナーがアビジンとストレプトアビジンから選ばれ、生体分子はビオチンである。
【0049】
本発明の幾つかの実施態様では、生体分子が、抗原に対して特異的な抗体もしくは抗体フラグメントであり、抗原は結合パートナーである。
本発明の幾つかの実施態様では、検体が、生体分子に直接的且つ特異的に結合する。幾つかの実施態様では、生体分子が抗体もしくは抗体フラグメントであって、これが検体に特異的に結合する。
【0050】
これら実施態様のそれぞれに関連した利点は当業者に公知である。したがって、本発明の実施態様のそれぞれは、高性能固相の高度に効率的な使用を提供する。
本発明の第3の側面によれば、高性能固相を製造する方法が提供され、該製造方法は、
a)両性イオン添加剤の存在下において、固体担体を検体特異的生体分子でコーティングする工程、ここで該生体分子がSH基を含有する;
b)該生体分子の該固体担体への固定化を引き起こすために十分な時間にわたって、該固体担体をインキュベートする工程;および
c)該固体担体を乾燥する工程;
の逐次工程を含む。
【0051】
以下に実施例を挙げて本発明を説明するが、本発明がこれらの実施例によって限定されることはない。
【実施例】
【0052】
実施例1
チオール化ストレプトアビジンの製造とコンタクト・プリンティングによるコーティング:
ストレプトアビジン(4mg)をリン酸塩緩衝液(50mM NaH2PO4/Na2HPO4、pH7.5)中に溶解して、148μMの最終濃度にした。二官能性の架橋剤であるS−(アセチルチオ)酢酸のN−ヒドロキシスクシンイミドエステル(SATA)をジメチルホルムアミド中に溶解し、次いでこの溶液を反応混合物中に導入して、ストレプトアビジンより30倍モル過剰のSATAとした。反応混合物を室温で30分インキュベートした。インキュベーション後、タンパク質アミンとともに組み込まれた保護チオール基を、50mM ヒドロキシルアミンを使用して2時間にわたって脱保護した。次いで、チオール化ストレプトアビジンを含有する最終生成物を、脱塩カラムを通して精製し、1mM EDTAを含有する50mM ホウ酸塩緩衝液(pH8.3)にて溶出させた。エルマン反応を使用して不対チオール基の存在が確認され、ストレプトアビジン1分子当たり平均して10〜12の組み込まれたチオール基が規則的に見出された。
【0053】
上記のチオール化ストレプトアビジンをコーティング緩衝液(100mM Na2HPO4/50mM クエン酸、0.5M ベタイン)中に希釈して1.5mg/mlの濃度にし、ポリスチレンマイクロタイトレーションウェル上に高性能コーティングを製造するのに使用した。2.0mmのソリッドピンを利用するソリッドピン・プリンティング法を使用して、この溶液を塗布した。プリンティング後、プリントされたスポットを有するウェルをインキュベートし、+35℃で一晩乾燥した。一晩のインキュベーション後に、ウェルを洗浄溶液(5mM Tris−HCl(pH7.75)、9g/l NaCl、1g/l GermallII、および0.05g/l TWEEN20)で洗浄し、50mM Tris−HCl(pH7.0)、150mM NaCl、0.5g/l NaN3、60g/l D−ソルビトール、および2g/l ウシ血清アルブミンを含有するブロッキング溶液を使用して室温で2〜20時間飽和させた。飽和後、使用する前にウェルをドラフト中で5時間乾燥した。
【0054】
スポットウェルのビオチン結合能力(すなわち固定化効率)は、2つのレポーター分子(すなわち、ユーロピウム標識されたビオチン(Bio−Eu)と、ビオチンおよびユーロピウム標識されたモノクローナル抗体(Bio−Mab−Eu))とを使用して決定した。Bio−Euはサイズが小さいので立体障害のある部位に結合することができ、したがって全ビオチン結合能力をシミュレートする。Bio−EuとBio−Mab−Euをアッセイ緩衝液(Innotrac buffer solution red、Innotrac Diagnostics、Turku、Finland)中に希釈して一連の希釈液(0.2nM〜10nM Bio−Eu、0.1nM〜60nM Bio−Mab−Eu)を調製し、50μl/ウェルの量にてウェルに加えた。ウェルを、振盪しながら室温にて1時間インキュベートしてから、9g/l NaCl、1g/l GermallII、および0.005g/l TWEEN20を含有する5mM Tris−HCl(pH7.75)で6回洗浄した。熱風フロー(60℃)にて5分乾燥した後、時間分解蛍光強度を、ビクター・マルチラベルカウンター(PerkinElmer Life Sciences−Wallac Oy、Turku、Finland)を使用して乾燥ウェルボトムから直接測定した。
【0055】
図1は、Bio−Eu(図「Bio−Eu」にて)とBio−Mab−Eu(図「Bio−Mab−Eu」にて)の濃度に関して、蛍光強度をカウント数/秒(cps)でそれぞれ示す。Bio−EuとBio−Mab−Euを使用して、上記の修飾された(チオール化された、およびベタイン処理された)(それぞれBとD)ストレプトアビジンを、天然のストレプトアビジン(それぞれAとC)と比較している。このように、普通の化学にしたがって調製したスポット表面(すなわち、チオール誘導化のない、そしてコーティング溶液中にベタインを加えない天然のストレプトアビジン)と比較すると、実施例1に記載のスポットウェルの結合能力は、Bio−Euの場合には最大で約100倍高く、Bio−Mab−Eu巨大分子の場合には最大で約40倍高い。他の界面活性剤(ホスホリルコリン)を使用すると、ストレプトアビジン表面の結合能力は、Bio−Euの場合には最大で100倍に増大し、Bio−Mab−Euの場合には最大で30倍に増大した(図示せず)。
【0056】
実施例2
ストレプトアビジンコーティングされた通常のC型マイクロタイトレーションウェルの結合能力を改良するための、コーティング溶液におけるベタインとタンパク質チオール化の使用:
本実施例は、通常のC型マイクロタイトレーションウェルにおいて200μlのコーティング量を使用して作製されるコーティングに対するコーティング添加剤としてベタインを使用することを説明する。ここで説明する実験は、未修飾でチオール化されたストレプトアビジンを使用して作製されていて、さらなるベタインでコーティングした場合と、コーティングしない場合のストレプトアビジンコーティングされたプレートの結合能力を比較する。
【0057】
ストレプトアビジンをコーティング緩衝液(100mM Na2HPO4/50mM クエン酸、追加の0.5M ベタインを添加する場合と添加しない場合)中に希釈して5μg/mlの最終濃度にし、マイクロタイトレーションウェル(マキシソープマイクロタイトレーションウェル、NUNC A/S、Denmark)に200μl/ウェルの量にて加えた。ウェルを+35℃で一晩インキュベートした。コーティング溶液は、一晩のインキュベーションの間にそのまま乾燥した。翌日、ウェルを洗浄溶液で洗浄し、実施例1に記載のように、室温で一晩飽和させた。この飽和溶液を吸引し、ウェルをドラフトにて数時間(2〜5時間)乾燥した。
【0058】
ユーロピウム標識されたビオチンを使用して、ウェルのビオチン結合能力を測定した。Bio−Euをアッセイ緩衝液(Innotrac buffer solution red)中に希釈して0.1μMと1μMの濃度にし、ストレプトアビジンコーティングされたウェルに200μl/ウェルの量にて加えた。そのほかの点では、実施例1に記載の手順を使用して試験を行った。
【0059】
図2は、A(天然ストレプトアビジン)、B(天然ストレプトアビジンとベタイン)、およびC(チオール化ストレプトアビジンとベタイン)の結合能力(蛍光によりcpsで測定)を示す。追加のベタインでコーティングされたストレプトアビジンプレートは、ビオチン結合能力が3倍に増大した。コーティング溶液中にチオール化ストレプトアビジンをベタインとともに使用すると、結合能力がさらに14倍に増大した。
【0060】
実施例3
ドロップ・ディスペンシング法によって作製したストレプトアビジンーティングされたスポットウェルの結合能力を改良するための、コーティング溶液におけるベタインとタンパク質チオール化の使用:
本実施例は、増大した結合能力を有するスポットウェルを作製するのに、ソリッドピン・プリンティングとは異なるスポッティング法を使用することを説明する。スポットウェルは、4μlのコーティング溶液をマイクロタイトレーションウェルボトムの中央にピペッティングすることによって作製される(すなわちドロップ・ディスペンシング法)。チオール化ストレプトアビジンと添加剤を含有するコーティング溶液を使用して作製した高性能スポット表面の結合能力を、未修飾ストレプトアビジンの対照標準スポット表面と比較する。
【0061】
実施例1に記載の手順を使用して、ストレプトアビジンを、チオールを含有するように修飾した。チオール化ストレプトアビジンをコーティング緩衝液(0.5M ベタインを含有する)中に溶解して1.5mg/mlの最終濃度にした。普通のピペット(フィンピペット)を使用することによって、4μlのチオール化ストレプトアビジン溶液をマイクロタイトレーションウェルボトムに施した。使用したコーティング条件は、実施例1に記載の条件と同じであった。コーティングされたウェルのビオチン結合能力を、実施例1に記載の手順を使用してBio−Euに関して測定した。
【0062】
図3は、A(天然ストレプトアビジン)とB(チオール化ストレプトアビジンとベタイン)の結合能力(蛍光によりcpsで測定)を示す。天然ストレプトアビジンを使用して作製したスポットウェルと比較すると、追加のベタインでコーティングされたチオール修飾ストレプトアビジンは、少なくとも27倍のビオチン結合能力の増大を示した。
【0063】
実施例4
コンタクト・プリンティングによって作製したスポット表面上の抗体コーティングにおけるベタインとタンパク質チオール化の使用:
本実施例は、コンタクト・プリンティング法を使用して行われる抗体コーティングにおいて、ベタインをコーティング添加剤として使用することを説明する。本アッセイでは、追加のベタインを使用して作製した高性能SH−修飾モノクローナル抗体表面の固定化効率と、追加のベタインを使用せずに作製した対照標準表面の固定化効率とを比較する。
【0064】
タンパク質にさらなるチオールが組み込まれるよう、SATA試剤を使用してモノクローナル抗体(抗−cTnlモノクローナル抗体)に修飾を施した。2mgのモノクローナル抗体をリン酸塩緩衝液(50mM NaH2PO4/Na2HPO4;pH7.5)中に溶解して28μMの最終濃度にした。ジメチルホルムアミド中にSATAを溶解し、この溶液を反応混合物に加えて、SATAがモノクローナル抗体に対して50倍モル過剰となるようにした。30分のインキュベーション後、抗体に組み込まれた形成保護チオールを、50mM ヒドロキシルアミンで2時間脱保護処理した。次いで反応混合物を、脱塩カラムを通して精製し、生成物であるチオール化モノクローナル抗体を、EDTAを含有する0.1M リン酸ナトリウム緩衝液(pH7.2)にて溶出した。
【0065】
チオール化抗体をコーティング緩衝液中に希釈して0.5mg/mlの濃度とし、この溶液を、直径2.0mmのソリッドピンを使用してコンタクト・プリンティングによりマイクロタイトレーションウェル(マキシソープ、NUNC A/S、Denmark)のボトムに施した。コーティングされたスポットウェルを、実施例1に記載のようにさらに処理した。コーティングされたウェルのイムノアッセイにおける性能を、cTnl−イムノアッセイを使用して測定した。cTnl抗原を7.5% BSA−TSA緩衝液(50mM Tris−HCl、pH7.75;154mM NaCl;0.05g/l NaN3;75g/l BSA)中に希釈して得られる一連の希釈液を、0.001〜800ng/mlの濃度にて調製した。20μlのトレーサー抗体(ユーロピウムで標識された抗−cTnlモノクローナル抗体で、固相抗体とは別のcTnlエピトープに結合する)を、20μlの標準希釈液とともにコーティングされたスポットウェルに加え、振盪(900rpm)しながら+36℃で1時間インキュベートした。1時間のインキュベーション後、ウェルを洗浄液で6回洗浄し、熱風フロー(+60℃)のもとで5分乾燥してからシグナルの測定を行った。時間分解蛍光シグナルを、ビクター・マルチラベルカウンターを使用して、乾燥ウェルボトムから直接測定した。
【0066】
図4は、A(標準的な抗体)とB(チオール修飾とベタイン処理がなされた抗体)のcTnlイムノアッセイシグナル(cpsで測定される蛍光)を示す。チオール化抗体でコーティングされ、且つ追加のベタインでコーティングされたウェルは、対照標準の表面と比較して、cTnlイムノアッセイにおける特異的シグナルのレベル(バックグラウンドシグナルは差し引く)に関して最大で66%の向上をもたらした。
【0067】
さらに、上記と類似の手順にしたがって、コーティング溶液中にチオール化フラグメント抗体をベタインとともに使用すると、ベタインを含有しないコーティング溶液中の天然フラグメント抗体でコーティングされた表面と比較して、cTnlに対する表面結合能力が50〜60倍向上した。このことは図5に示されており、図5には、A(標準的なフラグメント抗体)とB(チオール修飾とベタイン処理がなされたフラグメント抗体)のcTnlアッセイシグナル(cpsにて)を示す。
【0068】
実施例5
ビオチン化オリゴヌクレオチドの捕捉における高性能ストレプトアビジンコーティング(チオール化ストレプトアビジンとベタイン)の使用:
チオール化ストレプトアビジンとベタイン添加を組み込んだスポットコーティングされた表面を、実施例1に記載のコンタクト・プリンティング法を使用して作製した。対照標準の表面として、ベタイン添加せずにチオール化ストレプトアビジンを使用して作製したスポットコーティングされたウェルを使用した。対照標準ウェルは、コンタクト・プリンティング法を使用して、高性能表面の場合と同じ仕方にて作製したが、ベタインの添加は行わなかった。
【0069】
ビオチン化オリゴヌクレオチドをアッセイ緩衝液(さらに1M NaClを含有する)中に希釈して、0.0002、0.0001、0.002、0.01、0.02、および0.04 pmol/μlの濃度とし、50μl/スポットウェルの量にてスポット表面に施した。ウェルを、ゆっくり振盪しながら室温にて30分インキュベートし、インキュベーション後にウェルを、洗浄液(5mM Tris−HCl(pH7.75)、9g/l NaCl、1g/l GermallII、および0.05g/l TWEEN20)で2回洗浄した。テルビウム(Tb)標識された二次オリゴヌクレオチドをアッセイ緩衝液中に希釈して0.03 pmol/μlの濃度とし、スポットウェルに施した。ウェルを、洗浄液で4回洗浄した。20分のDelfia増強の後に、テルビウム誘導シグナルを時間分解蛍光光度法により測定した。
【0070】
図6は、A(チオール化ストレプトアビジンによるオリゴヌクレオチドの捕捉)とB(チオール修飾とベタイン処理が施されたストレプトアビジン)のアッセイシグナル(cpsで測定された蛍光)を示す。図6はさらに、A(C)とB(D)に対するサンプル間の変動(すなわち、CV%値、n=3)を示す。
【0071】
チオール化ストレプトアビジンをベタインの添加とともに使用して作製したスポット表面は、チオール化ストレプトアビジンをベタインの添加なしで使用して作製したスポット表面と比較して、オリゴヌクレオチドアッセイにおいて得られる特異的シグナルが明らかに改良された。高性能コーティングを使用すると、対照標準コーティングと比較して、特異的なテルビウム誘導シグナルが最大で5倍改良された。高性能スポットコーティングを使用すると、特異的シグナルレベルが改良されたことのほかに、明らかに反復ウェル間の変動が減少した。
【技術分野】
【0001】
本発明は、バイオアフィニティアッセイと他の固相用途に有用な高性能(high capacity)固相に関する。本発明はさらに、このような高性能固相とその製造方法に関する。
【背景技術】
【0002】
固相バイオアフィニティアッセイは、固体担体上(例えば、球状粒子の外表面上、試験管の内表面上、マイクロタイトレーションウェル上、または平面状の「チップ」表面上)の抗体もしくは他の生体分子の吸着(こうした吸着が、次いで、別の捕捉分子または検出しようとする検体を固定化するのに使用される)に基づいている。
【0003】
現在では、固相用途のための機能的に活性な表面を得るための多くの異なったコーティング法が知られている。しかしながら、アッセイの感度、速度論、およびロバスト性に対する現在の期待から、重要なアッセイ成分(固相の特性など)に対する新たな要求が設けられている。現行のパターン化表面は、アッセイ性能とより高い表面結合能力に対する要求に必ずしも対処できるとは限らない。
【0004】
固相コーティングを得るための最も簡単な方法は、固体担体上への未修飾タンパク質の吸着であり、固体担体は通常、ポリスチレン、ポリプロピレン、または他の数種のプラスチック材料もしくはガラスで造られている。タンパク質を緩衝液(例えば、炭酸塩緩衝液やリン酸塩緩衝液)中に溶解させ、固体担体の表面に塗布する。コーティングは湿潤環境にて行い、次いで非特異的結合部位をふさぐために飽和工程を施し、そして最後に表面を乾燥する。しかしながら通常は、ほんのわずかの天然タンパク質だけしか、こうした受動的吸着後にその活性を保持しないので、このようにして得られる固相コーティングは、必ずしも結合能力に関して最良の選択であるとは限らない。
【0005】
したがって幾つかの研究では、例えば、タンパク質を異なった「キャリア」タンパク質に連結させてから固体担体に吸着させるときの、タンパク質コーティングの吸着特性と表面安定性を改良すべく探求がなされた。厳しいアッセイに対する改良された吸着特性を得るために、巨大分子の天然構造の修飾が要求されることもしばしばある。
【0006】
このような巨大分子の1つがストレプトアビジンであり、固相上にビオチン化タンパク質を捕捉するのに広く使用されている。ビオチンを堅く結合させるというストレプトアビジンの基本的な特性が、マイクロアレイ、バイオセンサー、および他のバイオアフィニティアッセイを含めた多くの固相ベースの用途において利用されている。
【0007】
米国特許第5,061,640A号は、ストレプトアビジンの吸着を高めるために、より大きな前駆体タンパク質を使用することを開示している。この方法は、ストレプトアビジンをより疎水性のキャリア分子(ウシ血清アルブミン等)とコンジュゲートさせてから疎水性の固体担体にコーティングする(これにより改良された結合特性を有する固相を得る)ことにより、固体担体へのストレプトアビジンの接着性を向上させるコーティングプロセスを提供する。
【0008】
コーティングされた物質の吸着特性を改良するための他の方法が米国特許第6,638,728B1号に開示されており、該特許は、ストレプトアビジンモノマーと二官能性リンカーとを重合させて、ストレプトアビジンのダイマー、トリマー、およびテトラマー(これらは、ポリスチレン上に吸着されたときに、天然ストレプトアビジンの表面と比較して改良されたビオチン結合能力を有する)の混合物を得ることを説明している。
【0009】
ジスルフィド基を介してのチオール化ストレプトアビジンの重合により、固相特性も改良され、ポリスチレン表面上にコーティングしたときに、インキュベーション時における固相からのタンパク質の漏れをできるだけ抑えることにより、表面安定性を向上させることがわかった(Valimaa,L.,Laurikainen,K.,2006:“Comparison−study of streptavidin coated microtitration plates”,J.Immunol.Methods.308,203)。しかしながら、この研究はさらに、チオール化ストレプトアビジンをベースとするコーティングが、天然ストレプトアビジンと比較して良好な固相特性と改良された結合能力を示すけれども、他のコーティングがより高い吸着能力を示す、ということを明らかにした。他方、このようなコーティングは不安定になりやすい。
【0010】
実際、固相の特性はさらに、使用するコーティング条件(適用される緩衝液組成や、使用するコーティング方法を含む)に強く依存する。したがって幾つかの研究は、スポットのモルホロジーや再現性を改良する上で、プリンティング溶液中の緩衝液添加剤が重要であることを明らかにした。スポットモルホロジー間の変動を少なくするために、そしてスポット生成の全体的な再現性を向上させるために、一般には種々の界面活性剤が使用される。
【0011】
したがって、米国特許第2006/0223074A1号では、アルキレンジオール、ベタイン、洗浄剤、および塩を含む、固体担体をコーティングするためのスポッティング溶液が提唱されている。ベタインは両性イオン構造を有するが、米国特許第2006/0223074号に開示の洗浄剤はイオン性または非イオン性である。このような組成物は、スポットの高いコンシステンシーと高い安定性をもたらすだけでなく、製造しやすさと長期貯蔵のしやすさももたらす。
【0012】
DNAマイクロアレイに対する最適化された緩衝液組成物に関して他の幾つかの研究が報告されている。しかしながら、このような研究は、スポッティング溶液中の添加剤としてベタインが使用されたときには、添加剤なしの通常のスポッティング溶液と比較して、シグナル強度が改良されることを報告しているけれども、このようなコーティングを使用して得られる全結合能力はかなり低かった。
【0013】
したがって、固相が、安定性特性を損なわない状態で高い結合能力を示す、という固体担体のための固相コーティングを提供することが依然として求められている。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】米国特許第5,061,640A号
【特許文献2】米国特許第6,638,728B1号
【特許文献3】米国特許第2006/0223074A1号
【非特許文献】
【0015】
【非特許文献1】Valimaa,L.,Laurikainen,K.,2006:“Comparison−study of streptavidin coated microtitration plates”,J.Immunol.Methods.308,203
【発明の概要】
【発明が解決しようとする課題】
【0016】
したがって、本発明の目的は、マイクロアレイ、バイオセンサー、および他のバイオアフィニティアッセイ等の高度に効率的な用途に使用することができる高性能固相を提供することである。
【課題を解決するための手段】
【0017】
したがって本発明の第1の態様は、
a)両性イオン添加剤の存在下において、固体担体を検体特異的生体分子でコーティングする工程、ここで該生体分子はSH基を含有する;
b)該固体担体への該生体分子の固定化を引き起こすために十分な時間にわたって該固体担体をインキュベートする工程;および
c)該固体担体を乾燥する工程;
の逐次工程を含む方法によって製造される高性能固相に関する。
【0018】
本発明の文脈において、本明細書で使用している「高性能固相」とは、バイオアッセイの目的に適した任意の適切な固相を表わしている。
さらに本発明の文脈において、本明細書で使用している「固体担体」とは、上記の高性能固相でコーティングされるのに適した任意の適切な固体担体を表わしている。一般に、このような固体担体は、ポリスチレン、ポリプロピレン、他の数種のプラスチック材料、またはガラスであってよい。
【0019】
本明細書で使用している「検体特異的生体分子」とは、検体に対して特異的な結合能力を有する任意の生体分子を表わしている。理解しておかなければならないことは、生体分子は、直接的な結合によって検体に対し特異的であってよい(例えば、検体を特異的に結合させる生体分子として抗体を使用するとき)、という点である。これとは別に、生体分子は、検体を間接的に結合させてもよい(例えば、測定しようとする検体に対してコンジュゲートしているビオチン部分を結合させる生体分子としてストレプトアビジンを使用するとき)。
【0020】
本発明に従って理解しておかなければならないことは、生体分子と共に含まれるSH基は、使用される生体分子の天然構造中に存在してもよいし(例えば、生体分子の還元されたジスルフィド結合)、あるいは化学的修飾によって天然タンパク質構造中につくりだすこともできる、という点である。
【0021】
本明細書で使用している「両性イオン添加剤」とは、電気的に中性ではあるが、異なった原子上に形式的な正電荷と負電荷を有する任意の極性化合物を表わしている。両性イオン添加剤の例としては、ベタインとホスホリルコリンが挙げられる。
【0022】
本発明の高性能固相を使用すると、驚くほど高度に改善された結合特性を有する新規の固相が得られる。驚くべきことに、本発明による新しい画期的なコーティング緩衝液(すなわち、両性イオン添加剤のほかにSH基を有する生体分子を含有する)で固体担体をコーティングすると、このコーティング液をドライコーティング法によって塗布したときに、従来のコーティングと比較して極めて増大した結合活性がもたらされる、ということが観察された。したがって本発明のコーティングは、コーティングされた物質に関して驚くほど高度に改善された吸着特性(最大で100倍の向上)をもたらし、これにより高性能の結合特性を有する高密度固相の製造が可能となる。
【0023】
さらに、得られる固相の安定性が高いので、改良されたスポットモルホロジーが観察される。
本発明の固相は、最初のインキュベーション時に(すなわち、任意の飽和工程の前に)コーティングを乾燥するということを含む方法によって得られる。このようなコーティング法は「ドライコーティング」と呼ばれる。ドライコーティングは、実施するのが簡単な速やかなコーティングプロセスを可能にし、そしてさらに、従来のコーティング手順と比較して、コーティングプロセスに必要とされる全体的な時間も短縮する。ドライコーティングはさらに、通常のスポットコーティング法(例えば、ドロップ・ディスペンシングやソリッドピン・プリンティング)のほかに他のプリンティング法(例えばインクジェット・プリンティング)に関しても適用することができる。
【0024】
本発明の幾つかの実施態様では、本発明による高性能固相は、固体担体上の非特異的結合部位を非相互作用部分で飽和させる工程をさらに含む方法によって製造される。
本明細書で使用している「非相互作用部分」とは、本発明に従って使用される生体分子または検体と特異的に相互作用しない有機化合物もしくは別の生体分子を表わしている(すなわち、非相互作用部分は非特異的結合部位だけに結合する)。一般には、このような非相互作用部分は、ウシ血清アルブミン等の不活性タンパク質であり、固体担体の非特異的結合部位に結合する。非相互作用部分はさらに、固相の非特異的タンパク質部位に結合してよい。これにより特異的結合と非特異的結合のシグナル/ノイズ比が改良され、検出システムは当該検体に対してより高感度になる。
【0025】
本発明の検体特異的生体分子は、タンパク質、抗体、抗体のフラグメント、抗原、受容体リガンド、タンパク質受容体、特異的結合タンパク質、アプタマー、核酸、オリゴヌクレオチド、およびペプチドからなる群から選択することができる。
【0026】
この文脈では、本明細書で使用している「抗体」という用語は、任意の免疫グロブリンもしくはそれらのフラグメントを表わしており、抗原結合部位を含む任意のポリペプチドを包含する。この用語は、ポリクローナル抗体、モノクローナル抗体、単一特異的抗体、多特異的抗体、非特異的抗体、ヒト化抗体、ヒト抗体、一本鎖抗体、キメラ抗体、合成抗体、組み換え抗体、ハイブリッド抗体、突然変異抗体、グラフト化抗体、およびインビトロ生成抗体を含むが、これらに限定されない。
【0027】
異なったアッセイを使用する場合、これらの群の生体分子のそれぞれに関連した利点は当業者に公知である。
ストレプトアビジンは、一般的に使用されている生体分子の1つである。
【図面の簡単な説明】
【0028】
【図1】図1は、それぞれ、ユーロピウム標識されたビオチンおよびビオチン化・ユーロピウム標識された巨大分子を使用したときの、ストレプトアビジンコーティングされたスポット表面のビオチン結合能力を示す。
【図2】図2は、コーティング溶液中に添加剤を含む場合と含まない場合の、そしてコーティング溶液中にチオール化ストレプトアビジンと添加剤を含む場合の、未修飾ストレプトアビジンを用いて製造したストレプトアビジンコーティングされたC型マイクロタイトレーションウェルのビオチン結合能力を示す。
【図3】図3は、未修飾ストレプトアビジンの場合と比較したときの、ドロップ・ディスペンシング法を使用して製造したチオール化ストレプトアビジンコーティングされたスポットウェルのビオチン結合能力を示す。
【図4】図4は、天然抗体またはチオール化抗体(cTnlとユーロピウム標識されたトレーサー抗体を添加した後に得られる)を使用してポリスチレン上の抗体コーティングにおいて改良された表面特性を得るために、コーティング溶液中に添加剤としてベタインとともにチオール化タンパク質を使用することを示す。
【図5】図5は、コンタクト・プリンティング法を使用してポリスチレン上に製造される抗体コーティングに対し、コーティング溶液中にベタインとともにチオール化フラグメント抗体を使用することを示す。
【図6】図6は、コンタクト・プリンティング法で製造される高性能スポット表面および対照標準スポット表面にて行われるオリゴヌクレオチドアッセイからの蛍光誘導体化特異的シグナル(fluorescence derived specific signals)を示す。
【発明を実施するための形態】
【0029】
幾つかの実施態様では、生体分子は核酸ではない。
本発明の幾つかの実施態様では、生体分子でコーティングする前に、生体分子をチオール化によって修飾した。
【0030】
理解しておかなければならないことは、生体分子上の機能的なSH基は、例えば、抗体または他のタンパク質を酵素的切断もしくは化学的切断によって還元して反応性スルフィドリルを含有する抗体フラグメントを放出させることで、生体分子内の内在性ジスルフィド結合を還元することにより生成させることができる、という点である。これとは別に、チオール化は、生体分子上に新たなチオール基をもたらす任意の適切なチオール化剤によっても行われる。
【0031】
1つの実施態様では、生体分子は、生体分子中に既に存在するSH基を含有する。
1つの実施態様では、生体分子中の内在性ジスルフィド結合を還元することによりSH基が導入されるよう、生体分子に修飾を施した。
【0032】
1つの実施態様では、生体分子中に既に存在するイオウ基を還元することによりSH基が導入されるよう、生体分子に修飾を施した。
本発明の幾つかの実施態様では、任意の適切なチオール化試薬(例えば、S−(アセチルチオ)酢酸(SATA)、3−(2−ピリジルジチオ)プロピオン酸N−ヒドロキシスクシンイミドエステル(SPDP)、N−スクシンイミジル−S−アセチルチオプロピオネート(SADP)、スクシンイミジルオキシカルボニル−α−メチル−α−(2−ピリジルジチオ)トルエン(SMPT)、および2−イミノチオラン(トラウト試薬)等から選ばれるチオール化試薬)によってSH基が導入されるよう、チオール化によって生体分子に修飾を施した。
【0033】
このようなチオール化試薬を使用すると、生体分子の効率的且つ安定なチオール化を果たすことができる。
本発明の幾つかの実施態様では、両性イオン添加剤は、以下の一般構造:
A’−R−A”
[式中、
A’は、
【0034】
【化1】

【0035】
(式中、R1、R2、およびR3は独立して、水素、ハロゲン、−NO2、−CN、−OR4、−SR4、−SO2R4、−SOR4、C1−6−アルキル、C1−6−ポリフルオロアルキル、C2−6−アルケニル、C2−6−アルキニル、C3−6−シクロアルキル、C2−6−アルコキシアルキル、C2−6−アルキルチオアルキル、またはC2−6−アルキルアミノアルキルであって、ここで、R4は水素またはC1−6−アルキルである)
から選ばれる基であり;
Rは、式−(CH2)m−のアルキル鎖であって、m=0〜22であり;そして
A”は、−O−、−CO2−、−OSO3−、−OPO32−、および−OPO3H−から選ばれる基である]
を有する。
【0036】
1つの特定の実施態様では、R1、R2、およびR3は、独立して水素であるか、あるいは式CH3−(CH2)n−(式中、n=0〜5)の同一もしくは異なったアルキル基である。
【0037】
本発明の幾つかの特定の実施態様では、R1、R2、およびR3は水素ではない。
したがって、本発明のこれらの実施態様では、両性イオン添加剤は、効率的で安定なコーティングをもたらすベタインとの構造類似性を有する。
【0038】
幾つかの実施態様では、両性イオン添加剤は、ベタインとホスホリルコリンから選ばれる。本明細書で使用している「ベタイン」とは、N,N,N−トリメチルグリシンという特定の化合物を表わしている。
【0039】
本発明の幾つかの実施態様では、コーティングは、ドロップ−ディスペンシング・コーティング、ソリッド−ピン・プリンティング、およびインクジェット・プリンティングから選ばれるコーティング法によって行われる。
【0040】
このようなコーティング法は、ドライコーティングという考え方のもとで施すと、本発明の高性能固相を得るための高度に再現性のあるコーティングを得ることを可能にする。
コーティングするための方法はさらに、受動的吸着、官能基を介しての化学的カップリング、または生化学的相互作用を含んでよい。
【0041】
本発明の他の側面は、サンプル中の検体を固相検出するための方法において、本発明の高性能固相を使用することに関し、該方法は、
a)検体の含量に関して試験しようとするサンプルを、本発明にしたがって製造した高性能固相に加える工程;および
b)検体の存在もしくは濃度を測定する工程;
を含む。
【0042】
高性能固相に特異的に結合した検体を測定もしくは検出するための方法は、当業者に公知である。これは、例えば、UV分光光度法を使用するUV吸収によりタンパク質、ペプチド、アミノ酸および/または核酸の含量を測定することによって、固相に特異的に結合した検体量を検出する、等の受動的な方法によって果たすことができる。これとは別に、そして好ましくは、検体は、検出システム中に存在する標識を使用することによって検出または測定される。この標識は、検体上に存在しても、生体分子に対するパートナー上に存在しても、あるいは検体に結合している別の生体分子上に存在してもよい。
【0043】
標識は、検体自体の内在的な酵素メンバーであっても、酵素活性標識もしくは放射性標識を有する部分であっても、あるいは分光学的方法、光学的方法、光化学的方法、免疫化学的方法、電気的方法、熱量測定法、または化学的方法によって検出できる他の任意の適切な検出可能なシグナル応答性部分であってもよい。
【0044】
幾つかの実施態様では、標識は蛍光染料である。幾つかの実施態様では、蛍光染料は、ユーロピウムキレート等の希土類キレート;FITC、5−カルボキシフルオレセイン、および6−カルボキシフルオレセインを含むフルオレセインタイプ;TAMRA、ダンシル、リサミン、シアニン、フィコエリトリン、およびテキサスレッドを含むローダミンタイプ;ならびにこれらの類縁体;から選ばれる。
【0045】
幾つかの実施態様では、標識は、3H、11C、14C、18F、32P、35S、64Cu、68Ga、86Y、99Tc、111In、123I、124I、125I、131I、133Xe、177Lu、211At、213Bi、および51Crから選ばれる放射性核種である。
【0046】
本発明の幾つかの実施態様では、標識は、検体上に存在しても、固相の生体分子に対するパートナー上に存在しても、あるいは検体に結合している別の生体分子上に存在してもよい。
【0047】
これら実施態様のそれぞれに関連した利点は当業者に公知である。
本発明の幾つかの実施態様では、検体は、生体分子のための結合パートナーに検体をコンジュゲートさせることによって生体分子に対して特異的になる。
【0048】
したがって本発明の好ましい実施態様では、結合パートナーがビオチンであり、生体分子は、アビジンとストレプトアビジンから選ばれる。これとは別に、結合パートナーがアビジンとストレプトアビジンから選ばれ、生体分子はビオチンである。
【0049】
本発明の幾つかの実施態様では、生体分子が、抗原に対して特異的な抗体もしくは抗体フラグメントであり、抗原は結合パートナーである。
本発明の幾つかの実施態様では、検体が、生体分子に直接的且つ特異的に結合する。幾つかの実施態様では、生体分子が抗体もしくは抗体フラグメントであって、これが検体に特異的に結合する。
【0050】
これら実施態様のそれぞれに関連した利点は当業者に公知である。したがって、本発明の実施態様のそれぞれは、高性能固相の高度に効率的な使用を提供する。
本発明の第3の側面によれば、高性能固相を製造する方法が提供され、該製造方法は、
a)両性イオン添加剤の存在下において、固体担体を検体特異的生体分子でコーティングする工程、ここで該生体分子がSH基を含有する;
b)該生体分子の該固体担体への固定化を引き起こすために十分な時間にわたって、該固体担体をインキュベートする工程;および
c)該固体担体を乾燥する工程;
の逐次工程を含む。
【0051】
以下に実施例を挙げて本発明を説明するが、本発明がこれらの実施例によって限定されることはない。
【実施例】
【0052】
実施例1
チオール化ストレプトアビジンの製造とコンタクト・プリンティングによるコーティング:
ストレプトアビジン(4mg)をリン酸塩緩衝液(50mM NaH2PO4/Na2HPO4、pH7.5)中に溶解して、148μMの最終濃度にした。二官能性の架橋剤であるS−(アセチルチオ)酢酸のN−ヒドロキシスクシンイミドエステル(SATA)をジメチルホルムアミド中に溶解し、次いでこの溶液を反応混合物中に導入して、ストレプトアビジンより30倍モル過剰のSATAとした。反応混合物を室温で30分インキュベートした。インキュベーション後、タンパク質アミンとともに組み込まれた保護チオール基を、50mM ヒドロキシルアミンを使用して2時間にわたって脱保護した。次いで、チオール化ストレプトアビジンを含有する最終生成物を、脱塩カラムを通して精製し、1mM EDTAを含有する50mM ホウ酸塩緩衝液(pH8.3)にて溶出させた。エルマン反応を使用して不対チオール基の存在が確認され、ストレプトアビジン1分子当たり平均して10〜12の組み込まれたチオール基が規則的に見出された。
【0053】
上記のチオール化ストレプトアビジンをコーティング緩衝液(100mM Na2HPO4/50mM クエン酸、0.5M ベタイン)中に希釈して1.5mg/mlの濃度にし、ポリスチレンマイクロタイトレーションウェル上に高性能コーティングを製造するのに使用した。2.0mmのソリッドピンを利用するソリッドピン・プリンティング法を使用して、この溶液を塗布した。プリンティング後、プリントされたスポットを有するウェルをインキュベートし、+35℃で一晩乾燥した。一晩のインキュベーション後に、ウェルを洗浄溶液(5mM Tris−HCl(pH7.75)、9g/l NaCl、1g/l GermallII、および0.05g/l TWEEN20)で洗浄し、50mM Tris−HCl(pH7.0)、150mM NaCl、0.5g/l NaN3、60g/l D−ソルビトール、および2g/l ウシ血清アルブミンを含有するブロッキング溶液を使用して室温で2〜20時間飽和させた。飽和後、使用する前にウェルをドラフト中で5時間乾燥した。
【0054】
スポットウェルのビオチン結合能力(すなわち固定化効率)は、2つのレポーター分子(すなわち、ユーロピウム標識されたビオチン(Bio−Eu)と、ビオチンおよびユーロピウム標識されたモノクローナル抗体(Bio−Mab−Eu))とを使用して決定した。Bio−Euはサイズが小さいので立体障害のある部位に結合することができ、したがって全ビオチン結合能力をシミュレートする。Bio−EuとBio−Mab−Euをアッセイ緩衝液(Innotrac buffer solution red、Innotrac Diagnostics、Turku、Finland)中に希釈して一連の希釈液(0.2nM〜10nM Bio−Eu、0.1nM〜60nM Bio−Mab−Eu)を調製し、50μl/ウェルの量にてウェルに加えた。ウェルを、振盪しながら室温にて1時間インキュベートしてから、9g/l NaCl、1g/l GermallII、および0.005g/l TWEEN20を含有する5mM Tris−HCl(pH7.75)で6回洗浄した。熱風フロー(60℃)にて5分乾燥した後、時間分解蛍光強度を、ビクター・マルチラベルカウンター(PerkinElmer Life Sciences−Wallac Oy、Turku、Finland)を使用して乾燥ウェルボトムから直接測定した。
【0055】
図1は、Bio−Eu(図「Bio−Eu」にて)とBio−Mab−Eu(図「Bio−Mab−Eu」にて)の濃度に関して、蛍光強度をカウント数/秒(cps)でそれぞれ示す。Bio−EuとBio−Mab−Euを使用して、上記の修飾された(チオール化された、およびベタイン処理された)(それぞれBとD)ストレプトアビジンを、天然のストレプトアビジン(それぞれAとC)と比較している。このように、普通の化学にしたがって調製したスポット表面(すなわち、チオール誘導化のない、そしてコーティング溶液中にベタインを加えない天然のストレプトアビジン)と比較すると、実施例1に記載のスポットウェルの結合能力は、Bio−Euの場合には最大で約100倍高く、Bio−Mab−Eu巨大分子の場合には最大で約40倍高い。他の界面活性剤(ホスホリルコリン)を使用すると、ストレプトアビジン表面の結合能力は、Bio−Euの場合には最大で100倍に増大し、Bio−Mab−Euの場合には最大で30倍に増大した(図示せず)。
【0056】
実施例2
ストレプトアビジンコーティングされた通常のC型マイクロタイトレーションウェルの結合能力を改良するための、コーティング溶液におけるベタインとタンパク質チオール化の使用:
本実施例は、通常のC型マイクロタイトレーションウェルにおいて200μlのコーティング量を使用して作製されるコーティングに対するコーティング添加剤としてベタインを使用することを説明する。ここで説明する実験は、未修飾でチオール化されたストレプトアビジンを使用して作製されていて、さらなるベタインでコーティングした場合と、コーティングしない場合のストレプトアビジンコーティングされたプレートの結合能力を比較する。
【0057】
ストレプトアビジンをコーティング緩衝液(100mM Na2HPO4/50mM クエン酸、追加の0.5M ベタインを添加する場合と添加しない場合)中に希釈して5μg/mlの最終濃度にし、マイクロタイトレーションウェル(マキシソープマイクロタイトレーションウェル、NUNC A/S、Denmark)に200μl/ウェルの量にて加えた。ウェルを+35℃で一晩インキュベートした。コーティング溶液は、一晩のインキュベーションの間にそのまま乾燥した。翌日、ウェルを洗浄溶液で洗浄し、実施例1に記載のように、室温で一晩飽和させた。この飽和溶液を吸引し、ウェルをドラフトにて数時間(2〜5時間)乾燥した。
【0058】
ユーロピウム標識されたビオチンを使用して、ウェルのビオチン結合能力を測定した。Bio−Euをアッセイ緩衝液(Innotrac buffer solution red)中に希釈して0.1μMと1μMの濃度にし、ストレプトアビジンコーティングされたウェルに200μl/ウェルの量にて加えた。そのほかの点では、実施例1に記載の手順を使用して試験を行った。
【0059】
図2は、A(天然ストレプトアビジン)、B(天然ストレプトアビジンとベタイン)、およびC(チオール化ストレプトアビジンとベタイン)の結合能力(蛍光によりcpsで測定)を示す。追加のベタインでコーティングされたストレプトアビジンプレートは、ビオチン結合能力が3倍に増大した。コーティング溶液中にチオール化ストレプトアビジンをベタインとともに使用すると、結合能力がさらに14倍に増大した。
【0060】
実施例3
ドロップ・ディスペンシング法によって作製したストレプトアビジンーティングされたスポットウェルの結合能力を改良するための、コーティング溶液におけるベタインとタンパク質チオール化の使用:
本実施例は、増大した結合能力を有するスポットウェルを作製するのに、ソリッドピン・プリンティングとは異なるスポッティング法を使用することを説明する。スポットウェルは、4μlのコーティング溶液をマイクロタイトレーションウェルボトムの中央にピペッティングすることによって作製される(すなわちドロップ・ディスペンシング法)。チオール化ストレプトアビジンと添加剤を含有するコーティング溶液を使用して作製した高性能スポット表面の結合能力を、未修飾ストレプトアビジンの対照標準スポット表面と比較する。
【0061】
実施例1に記載の手順を使用して、ストレプトアビジンを、チオールを含有するように修飾した。チオール化ストレプトアビジンをコーティング緩衝液(0.5M ベタインを含有する)中に溶解して1.5mg/mlの最終濃度にした。普通のピペット(フィンピペット)を使用することによって、4μlのチオール化ストレプトアビジン溶液をマイクロタイトレーションウェルボトムに施した。使用したコーティング条件は、実施例1に記載の条件と同じであった。コーティングされたウェルのビオチン結合能力を、実施例1に記載の手順を使用してBio−Euに関して測定した。
【0062】
図3は、A(天然ストレプトアビジン)とB(チオール化ストレプトアビジンとベタイン)の結合能力(蛍光によりcpsで測定)を示す。天然ストレプトアビジンを使用して作製したスポットウェルと比較すると、追加のベタインでコーティングされたチオール修飾ストレプトアビジンは、少なくとも27倍のビオチン結合能力の増大を示した。
【0063】
実施例4
コンタクト・プリンティングによって作製したスポット表面上の抗体コーティングにおけるベタインとタンパク質チオール化の使用:
本実施例は、コンタクト・プリンティング法を使用して行われる抗体コーティングにおいて、ベタインをコーティング添加剤として使用することを説明する。本アッセイでは、追加のベタインを使用して作製した高性能SH−修飾モノクローナル抗体表面の固定化効率と、追加のベタインを使用せずに作製した対照標準表面の固定化効率とを比較する。
【0064】
タンパク質にさらなるチオールが組み込まれるよう、SATA試剤を使用してモノクローナル抗体(抗−cTnlモノクローナル抗体)に修飾を施した。2mgのモノクローナル抗体をリン酸塩緩衝液(50mM NaH2PO4/Na2HPO4;pH7.5)中に溶解して28μMの最終濃度にした。ジメチルホルムアミド中にSATAを溶解し、この溶液を反応混合物に加えて、SATAがモノクローナル抗体に対して50倍モル過剰となるようにした。30分のインキュベーション後、抗体に組み込まれた形成保護チオールを、50mM ヒドロキシルアミンで2時間脱保護処理した。次いで反応混合物を、脱塩カラムを通して精製し、生成物であるチオール化モノクローナル抗体を、EDTAを含有する0.1M リン酸ナトリウム緩衝液(pH7.2)にて溶出した。
【0065】
チオール化抗体をコーティング緩衝液中に希釈して0.5mg/mlの濃度とし、この溶液を、直径2.0mmのソリッドピンを使用してコンタクト・プリンティングによりマイクロタイトレーションウェル(マキシソープ、NUNC A/S、Denmark)のボトムに施した。コーティングされたスポットウェルを、実施例1に記載のようにさらに処理した。コーティングされたウェルのイムノアッセイにおける性能を、cTnl−イムノアッセイを使用して測定した。cTnl抗原を7.5% BSA−TSA緩衝液(50mM Tris−HCl、pH7.75;154mM NaCl;0.05g/l NaN3;75g/l BSA)中に希釈して得られる一連の希釈液を、0.001〜800ng/mlの濃度にて調製した。20μlのトレーサー抗体(ユーロピウムで標識された抗−cTnlモノクローナル抗体で、固相抗体とは別のcTnlエピトープに結合する)を、20μlの標準希釈液とともにコーティングされたスポットウェルに加え、振盪(900rpm)しながら+36℃で1時間インキュベートした。1時間のインキュベーション後、ウェルを洗浄液で6回洗浄し、熱風フロー(+60℃)のもとで5分乾燥してからシグナルの測定を行った。時間分解蛍光シグナルを、ビクター・マルチラベルカウンターを使用して、乾燥ウェルボトムから直接測定した。
【0066】
図4は、A(標準的な抗体)とB(チオール修飾とベタイン処理がなされた抗体)のcTnlイムノアッセイシグナル(cpsで測定される蛍光)を示す。チオール化抗体でコーティングされ、且つ追加のベタインでコーティングされたウェルは、対照標準の表面と比較して、cTnlイムノアッセイにおける特異的シグナルのレベル(バックグラウンドシグナルは差し引く)に関して最大で66%の向上をもたらした。
【0067】
さらに、上記と類似の手順にしたがって、コーティング溶液中にチオール化フラグメント抗体をベタインとともに使用すると、ベタインを含有しないコーティング溶液中の天然フラグメント抗体でコーティングされた表面と比較して、cTnlに対する表面結合能力が50〜60倍向上した。このことは図5に示されており、図5には、A(標準的なフラグメント抗体)とB(チオール修飾とベタイン処理がなされたフラグメント抗体)のcTnlアッセイシグナル(cpsにて)を示す。
【0068】
実施例5
ビオチン化オリゴヌクレオチドの捕捉における高性能ストレプトアビジンコーティング(チオール化ストレプトアビジンとベタイン)の使用:
チオール化ストレプトアビジンとベタイン添加を組み込んだスポットコーティングされた表面を、実施例1に記載のコンタクト・プリンティング法を使用して作製した。対照標準の表面として、ベタイン添加せずにチオール化ストレプトアビジンを使用して作製したスポットコーティングされたウェルを使用した。対照標準ウェルは、コンタクト・プリンティング法を使用して、高性能表面の場合と同じ仕方にて作製したが、ベタインの添加は行わなかった。
【0069】
ビオチン化オリゴヌクレオチドをアッセイ緩衝液(さらに1M NaClを含有する)中に希釈して、0.0002、0.0001、0.002、0.01、0.02、および0.04 pmol/μlの濃度とし、50μl/スポットウェルの量にてスポット表面に施した。ウェルを、ゆっくり振盪しながら室温にて30分インキュベートし、インキュベーション後にウェルを、洗浄液(5mM Tris−HCl(pH7.75)、9g/l NaCl、1g/l GermallII、および0.05g/l TWEEN20)で2回洗浄した。テルビウム(Tb)標識された二次オリゴヌクレオチドをアッセイ緩衝液中に希釈して0.03 pmol/μlの濃度とし、スポットウェルに施した。ウェルを、洗浄液で4回洗浄した。20分のDelfia増強の後に、テルビウム誘導シグナルを時間分解蛍光光度法により測定した。
【0070】
図6は、A(チオール化ストレプトアビジンによるオリゴヌクレオチドの捕捉)とB(チオール修飾とベタイン処理が施されたストレプトアビジン)のアッセイシグナル(cpsで測定された蛍光)を示す。図6はさらに、A(C)とB(D)に対するサンプル間の変動(すなわち、CV%値、n=3)を示す。
【0071】
チオール化ストレプトアビジンをベタインの添加とともに使用して作製したスポット表面は、チオール化ストレプトアビジンをベタインの添加なしで使用して作製したスポット表面と比較して、オリゴヌクレオチドアッセイにおいて得られる特異的シグナルが明らかに改良された。高性能コーティングを使用すると、対照標準コーティングと比較して、特異的なテルビウム誘導シグナルが最大で5倍改良された。高性能スポットコーティングを使用すると、特異的シグナルレベルが改良されたことのほかに、明らかに反復ウェル間の変動が減少した。
【特許請求の範囲】
【請求項1】
a)両性イオン添加剤の存在下において、固体担体を検体特異的生体分子でコーティングする工程、ここで該生体分子はSH基を含有する;
b)該固体担体への該生体分子の固定化を引き起こすために十分な時間にわたって該固体担体をインキュベートする工程;および
c)該固体担体を乾燥する工程;
の逐次工程を含む方法によって製造される、高性能固相。
【請求項2】
前記方法が、
d)固体担体上の非特異的結合部位を非相互作用部分で飽和させる工程、
をさらに含む、請求項1に記載の固相。
【請求項3】
前記検体特異的生体分子が、タンパク質、抗体、抗体のフラグメント、抗原、受容体リガンド、タンパク質受容体、特異的結合タンパク質、アプタマー、核酸、オリゴヌクレオチド、およびペプチドからなる群から選ばれる、請求項1また2のいずれかに記載の固相。
【請求項4】
前記検体特異的生体分子がストレプトアビジンである、請求項1〜3のいずれかに記載の固相。
【請求項5】
前記生体分子が、S−(アセチルチオ)酢酸(SATA)、3−(2−ピリジルジチオ)プロピオン酸N−ヒドロキシスクシンイミドエステル(SPDP)、N−スクシンイミジル−S−アセチルチオプロピオネート(SADP)、スクシンイミジルオキシカルボニル−α−メチル−α−(2−ピリジルジチオ)トルエン(SMPT)、および2−イミノチオラン(トラウト試薬)から選ばれるチオール化試薬によってSH基が導入されるよう、チオール化によって修飾されている、請求項1〜4のいずれかに記載の固相。
【請求項6】
前記両性イオン添加剤が、以下の一般構造:
A’−R−A”
[式中、
A’は、
【化1】

(式中、R1、R2、およびR3は独立して、水素、ハロゲン、−NO2、−CN、−OR4、−SR4、−SO2R4、−SOR4、C1−6−アルキル、C1−6−ポリフルオロアルキル、C2−6−アルケニル、C2−6−アルキニル、C3−6−シクロアルキル、C2−6−アルコキシアルキル、C2−6−アルキルチオアルキル、またはC2−6−アルキルアミノアルキルであって、R4は水素またはC1−6−アルキルである)
から選ばれる基であり;
Rは、式−(CH2)m−のアルキル鎖であって、m=0〜22であり;そして
A”は、−O−、−CO2−、−OSO3−、−OPO32−、および−OPO3H−から選ばれる基である]
を有する、請求項1〜5のいずれかに記載の固相。
【請求項7】
R1、R2、およびR3は独立して、水素、または式CH3−(CH2)n−の同一もしくは異なったアルキル基であって、nは0〜5である、請求項6に記載の固相。
【請求項8】
前記コーティング工程が、ドロップ・ディスペンシング・コーティング、ソリッドピン・プリンティング、およびインクジェット・プリンティングから選ばれるコーティング法によって行われる、請求項1〜7のいずれかに記載の固相。
【請求項9】
サンプル中の検体を固相検出するための方法における、請求項1〜8のいずれかに記載の高性能固相の使用であって、
該方法が、
a)検体の含量に関して試験しようとするサンプルを、請求項1〜8のいずれか一項に記載の高性能固相に加える工程;および
b)検体の存在もしくは濃度を測定する工程;
を含む上記使用。
【請求項10】
前記検体上に、生体分子に対するパートナー上に、あるいは検体に結合している別の生体分子上に存在する標識を検出することによって検体が測定される、請求項9に記載の使用。
【請求項11】
前記検体が、前記生体分子に対する結合パートナーとコンジュゲート化する、請求項9と10のいずれかに記載の使用。
【請求項12】
前記結合パートナーがビオチンであって、前記生体分子がアビジンとストレプトアビジンから選ばれる、請求項11に記載の使用。
【請求項13】
前記生体分子が、抗原に対して特異的な抗体もしくは抗体フラグメントであって、抗原が結合パートナーである、請求項11に記載の使用。
【請求項14】
a)両性イオン添加剤の存在下において、固体担体を検体特異的生体分子でコーティングする工程、ここで該生体分子がSH基を含有する;
b)該生体分子の該固体担体への固定化を引き起こすために十分な時間にわたって、該固体担体をインキュベートする工程;および
c)該固体担体を乾燥する工程;
の逐次工程を含む、高性能固相の製造方法。
【請求項1】
a)両性イオン添加剤の存在下において、固体担体を検体特異的生体分子でコーティングする工程、ここで該生体分子はSH基を含有する;
b)該固体担体への該生体分子の固定化を引き起こすために十分な時間にわたって該固体担体をインキュベートする工程;および
c)該固体担体を乾燥する工程;
の逐次工程を含む方法によって製造される、高性能固相。
【請求項2】
前記方法が、
d)固体担体上の非特異的結合部位を非相互作用部分で飽和させる工程、
をさらに含む、請求項1に記載の固相。
【請求項3】
前記検体特異的生体分子が、タンパク質、抗体、抗体のフラグメント、抗原、受容体リガンド、タンパク質受容体、特異的結合タンパク質、アプタマー、核酸、オリゴヌクレオチド、およびペプチドからなる群から選ばれる、請求項1また2のいずれかに記載の固相。
【請求項4】
前記検体特異的生体分子がストレプトアビジンである、請求項1〜3のいずれかに記載の固相。
【請求項5】
前記生体分子が、S−(アセチルチオ)酢酸(SATA)、3−(2−ピリジルジチオ)プロピオン酸N−ヒドロキシスクシンイミドエステル(SPDP)、N−スクシンイミジル−S−アセチルチオプロピオネート(SADP)、スクシンイミジルオキシカルボニル−α−メチル−α−(2−ピリジルジチオ)トルエン(SMPT)、および2−イミノチオラン(トラウト試薬)から選ばれるチオール化試薬によってSH基が導入されるよう、チオール化によって修飾されている、請求項1〜4のいずれかに記載の固相。
【請求項6】
前記両性イオン添加剤が、以下の一般構造:
A’−R−A”
[式中、
A’は、
【化1】

(式中、R1、R2、およびR3は独立して、水素、ハロゲン、−NO2、−CN、−OR4、−SR4、−SO2R4、−SOR4、C1−6−アルキル、C1−6−ポリフルオロアルキル、C2−6−アルケニル、C2−6−アルキニル、C3−6−シクロアルキル、C2−6−アルコキシアルキル、C2−6−アルキルチオアルキル、またはC2−6−アルキルアミノアルキルであって、R4は水素またはC1−6−アルキルである)
から選ばれる基であり;
Rは、式−(CH2)m−のアルキル鎖であって、m=0〜22であり;そして
A”は、−O−、−CO2−、−OSO3−、−OPO32−、および−OPO3H−から選ばれる基である]
を有する、請求項1〜5のいずれかに記載の固相。
【請求項7】
R1、R2、およびR3は独立して、水素、または式CH3−(CH2)n−の同一もしくは異なったアルキル基であって、nは0〜5である、請求項6に記載の固相。
【請求項8】
前記コーティング工程が、ドロップ・ディスペンシング・コーティング、ソリッドピン・プリンティング、およびインクジェット・プリンティングから選ばれるコーティング法によって行われる、請求項1〜7のいずれかに記載の固相。
【請求項9】
サンプル中の検体を固相検出するための方法における、請求項1〜8のいずれかに記載の高性能固相の使用であって、
該方法が、
a)検体の含量に関して試験しようとするサンプルを、請求項1〜8のいずれか一項に記載の高性能固相に加える工程;および
b)検体の存在もしくは濃度を測定する工程;
を含む上記使用。
【請求項10】
前記検体上に、生体分子に対するパートナー上に、あるいは検体に結合している別の生体分子上に存在する標識を検出することによって検体が測定される、請求項9に記載の使用。
【請求項11】
前記検体が、前記生体分子に対する結合パートナーとコンジュゲート化する、請求項9と10のいずれかに記載の使用。
【請求項12】
前記結合パートナーがビオチンであって、前記生体分子がアビジンとストレプトアビジンから選ばれる、請求項11に記載の使用。
【請求項13】
前記生体分子が、抗原に対して特異的な抗体もしくは抗体フラグメントであって、抗原が結合パートナーである、請求項11に記載の使用。
【請求項14】
a)両性イオン添加剤の存在下において、固体担体を検体特異的生体分子でコーティングする工程、ここで該生体分子がSH基を含有する;
b)該生体分子の該固体担体への固定化を引き起こすために十分な時間にわたって、該固体担体をインキュベートする工程;および
c)該固体担体を乾燥する工程;
の逐次工程を含む、高性能固相の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2011−528106(P2011−528106A)
【公表日】平成23年11月10日(2011.11.10)
【国際特許分類】
【出願番号】特願2011−517750(P2011−517750)
【出願日】平成21年7月10日(2009.7.10)
【国際出願番号】PCT/DK2009/000168
【国際公開番号】WO2010/006604
【国際公開日】平成22年1月21日(2010.1.21)
【出願人】(500554782)ラジオメーター・メディカル・アー・ペー・エス (20)
【Fターム(参考)】
【公表日】平成23年11月10日(2011.11.10)
【国際特許分類】
【出願日】平成21年7月10日(2009.7.10)
【国際出願番号】PCT/DK2009/000168
【国際公開番号】WO2010/006604
【国際公開日】平成22年1月21日(2010.1.21)
【出願人】(500554782)ラジオメーター・メディカル・アー・ペー・エス (20)
【Fターム(参考)】
[ Back to top ]

