高感度質量分析装置および分析方法
【課題】試料を切断した断面を、直ちに、かつ、高感度に、質量分析する装置および方法の提供。
【解決手段】金属薄膜が設けられた切刃面を有する切刃を用いて、試料を薄く斜めに切断し、切刃面に付着した試料切片を質量分析する。
【解決手段】金属薄膜が設けられた切刃面を有する切刃を用いて、試料を薄く斜めに切断し、切刃面に付着した試料切片を質量分析する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、切刃面の少なくとも一部に金属薄膜を有する切刃を用いて試料を切断し、切刃面に付着した試料切片を質量分析する装置および方法に関する。
【背景技術】
【0002】
近年のゲノム(genome)解析の進展により、生体内に存在する遺伝子産物であるタンパク質の解析の重要性が急速にクローズアップされてきている。中でも、組織切片におけるタンパク質解析の重要性が指摘されている。例えば、癌組織切片から再発や転移に関わるタンパク質を明らかにするといった試みが数多くなされている。生体試料におけるタンパク質解析手法は以下の手順で行われるのが一般的である。
(1)生体組織や細胞からのタンパク質の抽出。
(2)抽出物(液)からのタンパク質の分離。
(3)分離されたタンパク質またはその分解物としての(ポリ)ペプチド等の分析。
(4)得られた分析結果の同定。
【0003】
タンパク質の分析方法としても種々の方法が知られているが、微量の試料で精度よい分析が行える方法として、飛行時間型質量分析法が注目されている。その中で、生体組織切片におけるタンパク質の二次元分布の可視化を目的とした、TOF−SIMS法(飛行時間型二次イオン質量分析法)をベースとする情報取得手法及び装置が、国際公開第2005/003715号パンフレット(特許文献1)に開示されている。この分析方法では、イオン化促進物質かつ/または消化酵素を生体組織切片に直接付与し、タンパク質の種類に関する情報(消化酵素により限定分解されたペプチドの情報を含む)が、その位置情報を保持したままTOF−SIMS法により可視化される。すなわち、この分析方法は、切断した生体組織の断面を直ちに分析することは目的としていない。
【0004】
特開2004−219261号公報(特許文献2)には、ミクロトームにより斜め切断された下面を質量分析することによって、多層薄膜の斜め断面を解析し、結果的に薄膜を高い空間分解能で分析する手法が開示されている。また、Analytical Chemistry,74(2002),4955-4968 "Organic secondary ion Mass spectrometry : sensitivity enhancement by gold deposition."(非特許文献1)には、金蒸着によってTOF−SIMSのイオン化効率を向上させる技術が紹介されている。また、イオンビームの影響が基板に到達する程度の薄い試料であれば、金基板上に試料が存在しても、イオン増感効果が得られることが知られている。
【特許文献1】国際公開第2005/003715号パンフレット
【特許文献2】特開2004−219261号公報
【非特許文献1】Analytical Chemistry, 74(2002), 4955-4968, "Organic secondary ion Mass spectrometry : sensitivity enhancement by gold deposition."
【発明の開示】
【発明が解決しようとする課題】
【0005】
以上のことから、ミクロトームやSAICAS(Surface And Interfacial Cutting Analysis System)により切断された切片を金属基板上に移し、質量分析を行えば、イオン増感効果によって試料切片に存在する分子が効率良くイオン化されるため、感度向上が期待できる。しかし、試料切片を位置精度良く基板上に移すことは容易ではない。
【0006】
また、特開2004−219261号公報のように、切断された基板上の試料表面を分析することは容易である。しかしながら、イオン増感効果を得るには、試料切断後、基板上の試料断面に金属を蒸着することが必要である。その結果、マスク等を施さない限り、試料の蒸着したくない部分にも金属が蒸着されてしまう。また、基板上の試料表面を一度質量分析してしまうと、高エネルギーの照射により試料内部の組織分解物においても分解、揮発が生じる。以上のことから、一度分析した基板上の試料は、表面に限らず内部においても、金属蒸着や分析によって試料形態が変化しているため、さらに内部の情報を取得しようとしても、適正な分析対象にならないという問題点があった。
【0007】
本発明の目的は、試料を切刃によって切断した後、切刃上に存在する試料切片の位置精度を保持したまま、飛行時間型質量分析を高い感度で行い、分析結果をイメージングすることが可能である質量分析装置及び質量分析方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明は、上記のような問題点を克服するため、試料を切断した断面を、直ちに、かつ、高感度に、質量分析することが可能な装置および手法を提供するものである。即ち、本発明は、分析用の試料切片を調製するための試料切片調製部と、該試料切片調製部で調製された試料切片の飛行時間型質量分析を行う質量分析部と、を有する質量分析装置であって、前記試料切片調製部は、試料を保持するための試料保持機構と、切刃面の少なくとも一部に金属薄膜を有する切刃と、前記切刃の位置を制御して、試料の切断と切断により生じた試料切片の切刃面への載置とを行うための切刃位置制御機構と、を有し、前記質量分析部は、前記切刃を保持する切刃保持機構と、該切刃の前記試料切片が載置された面にパルスレーザーあるいはパルスイオンビームを照射するためのビーム照射機構と、を備えていることを特徴する質量分析装置を提供する。
【0009】
また、本発明は、試料切片にパルスレーザーあるいはパルスイオンビーム照射することにより、該試料切片内の分子をイオン化して飛行時間型質量分析を行う質量分析方法において、切刃面の少なくとも一部に金属薄膜を有する切刃により試料を切断し、該切刃面に付着した試料切片に、パルスレーザーあるいはパルスイオンビーム照射することを特徴とする質量分析方法を提供する。
【発明の効果】
【0010】
以上の構成によれば、装置内において、保持された試料を切刃によって切断した後、切刃上に存在する試料切片の位置精度を保持したまま、飛行時間型質量分析を高い感度で実施し、イメージングすることが可能である。
【発明を実施するための最良の形態】
【0011】
(装置の構成)
本発明の質量分析装置は、図13に示すように、試料切片を調製するための試料切片調製部1と、この試料切片調製部で調製された試料切片に対して飛行時間型質量分析を行うための質量分析部2と、を少なくとも有して構成される。以下、装置各部について説明する。
【0012】
(試料切片調製部)
試料切片調製部には、少なくとも、試料保持機構3、切刃4及び切刃位置制御機構5が設けられている。
【0013】
(試料保持機構)
試料保持機構3は、切刃による試料切断時に試料6を確実に保持しておくための機構を有し、試料切片などの調製において用いられている試料保持機構を利用して構成することができる。例えば、ミクロトームやSAICASで用いられている試料ホルダーなどを切刃保持機構として利用することができる。
【0014】
(切刃及び切刃位置制御機構)
切刃4としては、試料保持機構に保持された試料を切断し、切断により生じた試料切片を切刃の所定面に載置可能である構造を有するものが用いられる。また、本発明においては、切刃面に載せた試料切片に対して質量分析のためのビーム照射が行われるので、切刃としては、かかるビーム照射処理に適合したものが選択される。かかる目的用途に適した切刃であれば、いかなるものでも良いが、市販されているミクロトーム、SAICASの切刃が好ましい。ミクロトームとは、試料を顕微鏡で見るために薄く切る前処理装置であり、滑走式、回転式などがある。ミクロトームは、主に病理検査のときに使われ、一般的には、細胞をミクロトームで2ミクロンや3ミクロンの厚さに切り、薬剤で染色をして顕微鏡で観察するために用いられる。最近では素材の研究等にも多く使われるようになり、切断した物の表面は1ミクロン以下の精度で平坦になっているため、研究用途などではその表面を観察したりもされている。例えば写真の感光フィルムの断面を観察したり、ゴム素材の密度を観察したりするときに使用される。SAICASとは、鋭利な切刃を用いて、素材の表面から内部にかけて切込み、切刃に生ずる抵抗力を検出するシステムである。市販のSAICAS装置では、測定される膜厚が0.1〜1000μmであるが、原理的には1Åから切断することが可能である。このときの試料切断の空間分解能は、切刃の位置制御能力により決定する。なお、適切な膜厚については後述する。
【0015】
本発明においては、切刃面の少なくとも一部に金属薄膜7が形成されており、薄膜に付着した試料切片に、パルスレーザーやパルスイオンビームを照射することにより、切片内の分子は効率良くイオン化される。
【0016】
金属薄膜は、切刃面の試料断片が載置される領域に少なくとも設けられる。試料の上端に水平方向に切刃を入れて切断を行う場合には、切刃の上面に金属薄膜を設けることが好ましく、上面全面に設けることが更に好ましい。この構成により、装置構成が簡便となる。
【0017】
切刃の材質としては、一般的にミクロトーム等ではダイヤモンドなどが用いられるが、本発明ではステンレス、チタンなどの金属類、ガラスやセラミックなどの陶材でもよく、試料が非常に軟らかいものであれば、プラスチックなどでも良い。金属薄膜としては、金、銀、銅、白金などを含むものが好ましいが、上記の効果が得られるものであればこれらに限定されない。より好ましくは金、銀であり、さらに好ましくは金である。このとき、金属薄膜が切刃から剥れにくくするために、チタン、クロムなど吸着性を高めるための金属層を介しても良い。検体の一次イオン照射付近に金が存在するとき、飛行時間型質量分析において優れたイオン増感効果を発揮することが明らかとなっている。図1に、Siウエハ上と金基板上の各々に、同じポリペプチドをスポッティングしたものを同条件で分析したTOF−SIMSのイメージングプロファイルを示している。
【0018】
以上のことから、切刃上面には金などからなる金属薄膜が設けられていることが好ましく、その上に試料切片が存在することにより、一次イオンビーム照射後の検体の二次イオン化が効率良く行われる。上記薄膜は、切刃上面を蒸着機またはスパッタ装置のチャンバーのターゲット側に向けて切刃を設置し、蒸着またはスパッタすることで形成される。薄膜の厚さは、分析を可能とする厚さであればよく、少なくとも1nmであることが好ましい。膜厚が1nm未満の場合は切片内の分子を効率良くイオン化させるためには十分でない恐れがある。なお、切刃下面には、切断時に試料内容物を付着させないための処理が施されていることが好ましい。例えば、いわゆる非特異吸着による共雑物の吸着による不必要なシグナルを防止するために、スキムミルクやカゼイン、血清アルブミン、リン脂質、ポリエチレングリコール及びそれらの誘導体などによるコーティングを行うと、好適である。なお、以上に記載した切刃を装置内に複数準備し、位置制御することにより、試料の切断と質量分析を繰り返すことができ、試料を3次元的に分析することも可能となる。
【0019】
なお、3次元的な質量分析方法は、上記に限定されず、例えばC60イオンを併用するなどしても良い。
【0020】
さらには、切刃を洗浄するなど、切刃上の金属薄膜表面を露出させる機構を装置内に有することで、切刃を繰り返して使用することもできる。
【0021】
切刃における試料に対する切断動作は、切刃位置制御機構により制御する。この切刃位置制御機構も、ミクロトームやSAICASにおける切刃位置制御機構を利用して構成することができる。
【0022】
装置内において、試料を切断する空間(領域)と、パルスレーザーあるいはパルスイオンビームを照射する空間(領域)は、一緒としても別々としても良い。同一空間(領域)でこれらの処理を行う場合には、質量分析のためのビームを照射する空間、即ち、質量分析を行う分析チャンバー中に試料切片調製用の機構を設け、更に、切片調製後に残された試料を分析チャンバー外に取り出せる構造としておく。
【0023】
これらを別々の空間として設ける場合は、それぞれの空間において、その用途に応じた制御が可能となる。この場合、試料保持機構を配置した試料切片調製領域とビーム照射が行われる領域を、それぞれ独立して温度及び湿度の制御が可能となるように設けることが好ましい。例えば、ビームの照射が行われる分析チャンバーは、高真空である必要があり、そのための構造が必要となる。これに対して、試料を切断する空間を分析チャンバーと別空間であるロードロックチャンバーとし、そこでの温度と湿度を制御すれば、例えば、常温では液状の物質を凍結させた後、切刃によって切断することが可能となる。ロードロックチャンバー内は、市販の凍結ミクロトームのように冷凍システムを装着することで冷却することが可能となる。真空制御後、試料切刃を分析チャンバーに移動させ、ビームを照射する位置にこれを配置して、試料切片を分析することができる。また、切刃面上に載置された試料切片に対応し分析結果のイメージングを行う場合などは、検出計の直下に切刃面を配置する。切刃の各チャンバー間の移動は、図13のように制御装置5を利用して自動的に実施しても良い。その際、各チャンバー間のゲートの開閉動作に連動して、各チャンバー内の真空度などの条件を適宜調整してもよい。また、切断を自動化してもよく、切断時には切刃にかかる抵抗等の物理的パラメーターをモニターしながら、電圧制御によって切断速度を制御する機構があっても良い。
【0024】
(試料)
本発明の試料はいかなる材質、形態を有するものでも良いが、好ましくは、生体組織、細胞である。
【0025】
試料である生体組織や細胞は、酵素処理されていても良い。酵素としては、主にトリプシンなどが用いられる。また、多くの水分を含む生体組織や細胞は、凍結後に切断されることが適切であるため、切刃上の切片内容物のほとんどが水である。そのため、水分を蒸発させたときの試料膜厚は、凍結中の切断時よりもはるかに薄くなる。
【0026】
上記を鑑みると、本発明において、試料を切断する際の、表面からの試料厚さは10nm〜10000nmであることが好ましいが、10nm〜1000nmであればさらに好ましい。前記範囲の上限及び下限の設定理由には、以下の2つの理由が挙げられる。
(1)下限の設定理由
生体組織や細胞に存在するタンパク質(大きさが10nm未満)を切断しない範囲であること。
(2)上限の設定理由
試料厚さ数十nm程度の有機試料であれば、容易にイオンビームが前記金属薄膜表面に達し、後述のイオン増感効果を発揮すること。また、試料形態が生体組織や細胞である場合、その内容物の多くが水であり、真空測定時には水分は蒸発する。前記範囲の上限の設定理由には、上記(2)の理由に付け加えて、真空時における水分蒸発後の切片の膜厚が凍結時のおよそ数重量%乃至30重量%程度になること、が挙げられる。すなわち、切断する際に100nm以下の厚さであれば、イオンビーム照射時には試料厚さを数十nm以下にすることができる。なお、水分蒸発によって切刃上に付着したタンパク質等の物体を質量分析する際には、多くの分子がイオン増感効果により効率良くイオン化され、質量分析を可能にするものと考えられる。
【0027】
(液滴付与機構)
本発明の質量分析装置は、液滴付与機構を有していても良い。かかる装置の一例の模式的な断面図を図14に示す。図14中、液滴付与チャンバー13は、液滴付与機構14を有している。液滴付与機構14は、本発明の質量分析装置内において、試料切断によって切刃面に付着した試料切片に対し、位置精度を保持したまま溶液15を付与するための機構である。液滴付与機構は、試料切片調製部あるいは質量分析部と同じ室内にあってもよいが、好ましくは別途チャンバーを設け、常温常圧の状態で使用できる方がよい。さらに好ましくは、本チャンバーは湿度コントロールが可能であることが好ましい。また、本チャンバーは溶液処理後には、真空状態にもできるものであることが好ましい。液滴付与機構の形態としては、インクジェット装置が好ましく、ピエゾ方式、バブルジェット方式のどちらの装置を用いてもよい。前記溶液15としてペプシン、トリプシン、キモトリプシンなどの消化酵素を含む溶液を用いれば、試料切片中に存在するタンパク質を分解し、高感度な領域で質量分析を行うことができる。酵素溶液付与の際、切片に付与した液滴が互いに接触しないよう、付与量と距離を調節することが好ましい。
【0028】
(飛行時間型質量分析部)
飛行時間型質量分析を行う質量分析部2に用いられる質量分析装置は、切刃面に載置された試料切片の質量分析が可能である構成を有する装置であればよい。例えば、少なくも以下の各構成要素を用いて質量分析部を構成することができる。
(1)試料切片を保持するホルダーを有する、分析チャンバー2。
(2)試料切片にビームを照射するためのビーム発生源、ビームを所定位置に照射するための光学系などを有するビーム照射手段8。
(3)分析チャンバー内の雰囲気を測定条件(真空)に整えるための雰囲気調整手段9。
(4)二次イオンなどの検出計10。
【0029】
また、先に述べたように、試料切片調製部と分析チャンバーを兼用とする構成を用いることもできる。
【0030】
切刃面上の試料切片にビーム照射した際に発生したイオンはMALDI−TOFMS(マトリックス支援レーザー脱離イオン化飛行時間型質量分析計)やTOF−SIMSで検出することにより、試料の位置情報を保ったまま、質量分析を行うことができる。これは、ビームを照射することによって生じるイオンを瞬時に検出計に吸い込み、照射位置と検出位置をスキャンして、照射・検出を繰り返すことによって行われる。さらに、ビームは、ピコ秒からナノ秒のパルス幅を有することが好ましく、このことによって分子量検出時のピーク分解能を高めることができる。
【0031】
ビームとしては、パルスレーザービームまたはパルスイオンビームが用いられる。
【0032】
生体組織や細胞レベルの大きさの試料について質量分析を行う場合、TOF−SIMSを用いることが好ましい。TOF−SIMSによれば、サブミクロンレベルの空間分解能での質量分析イメージングが可能となるため、検出されたイオンがどの細胞由来のものであるかが容易に判別することができる。その際、必要に応じ、本発明者らが開示した国際公開第2005/003715号パンフレットに記載のイオン化促進物質(増感物質)を付与してもよい。また、一次イオンとしてはGa+などの一般的な液体金属イオンの他、C60、Au3+やBi3+などのクラスターイオンを用いることもできる。
【実施例】
【0033】
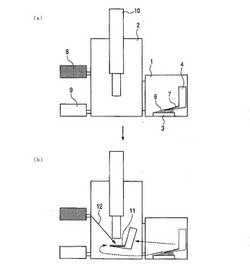
(実施例1)(図2(a)及び(b)に示すような、ロードロックチャンバー中で、金蒸着切刃を用いて、生体組織を切断し、生体組織切片が付着した切刃を分析チャンバーに移動させてのTOF−SIMS分析)
金蒸着切刃で切断した生体組織切片のポリペプチドをTOF−SIMS分析する。生体組織6(ヒト癌組織:Tissue Microarray Human Tumor Tissue(Lymphoma))をSi基板3上に付着させ、ロードロックチャンバー1内に保持させる(図2(a))。基板が保持されたロードロックチャンバー内の温度を−80℃に設定し、生体組織を凍結させる。このときの試料厚さは約100nmである。上面に金薄膜7が形成された切刃4を操作して、図3のように生体組織を斜めから切断する。このとき切刃の上面には、クロム薄膜5nmを介して、金薄膜10nmを積層させている。切断することによって切刃上面に付着した生体組織の切片11(図4(a))を分析チャンバー2内のTOF−SIMS検出計10の真下に水平になるように移動させる(図2(b))。分析チャンバー2内は室温下、超高真空であり、切刃上面に付着した生体組織は、内容物が切刃上面に付着したまま、水分が昇華される(図4(b))。このときの試料厚さは約20nmである。試料表面に対しパルスイオンビーム(一次イオンビーム)12を照射し、発生した二次イオンを検出する二次元的なスキャンにより、図4(b)の切片内容物を質量分析し、イメージングする。分析によって得られる細胞膜由来のPO3イメージ(図5(a))およびポリペプチド特有のイメージ(図5(b))のイメージング結果によって、生体組織内の特定の細胞内にポリペプチドが存在することがわかる。
【0034】
(参照例1)(実施例1の金薄膜なしの例)
金蒸着のない切刃を持つSAICAS装置で切断した生体組織切片のポリペプチドをTOF−SIMS分析する。
【0035】
生体組織としてヒト癌組織:Tissue Microarray Human Tumor Tissue(Lymphoma))を用いる。この生体組織をSi基板上に付着させ、−80℃の温度下で市販のSAICAS装置によって生体組織を斜め切断後、切断面をTOF−SIMS検出計の真下に水平になるように移動させる。このときの試料厚さは約100nmである。実施例1同様に、分析チャンバー中は室温下、超高真空であり、切刃上面に付着した生体組織は、内容物が切刃上面に付着したまま、水分が昇華される。このときの試料厚さは約20nmである。試料表面に対しパルスイオンビームを照射し、発生した二次イオンを検出する二次元的なスキャンにより、図4(b)の切片内容物を質量分析し、イメージングする。分析によって得られるPO3イメージ(図6(a))は、実施例1のPO3イメージ(図5(a))よりも少なく、ポリペプチド特有のイメージ(図6(b))は、ほとんど検出されない。
【0036】
(実施例2)(図7(a)、(b)及び(c)に示すような、複数の切刃による複数の切片分析による生体組織の3次元的分析)
金蒸着切刃で多重に切断した複数の生体組織切片に含まれるポリペプチドをTOF−SIMS分析することにより、生体組織の3次元的分析を行う。
【0037】
生体組織6(ヒト癌組織:Tissue MicroArray Human Tumor Tissue(Colon Carcinoma))をSi基板3上に付着させ、ロードロックチャンバー1内に保持させる(図7(a))。基板が保持されたロードロックチャンバー内の温度を−80℃に設定し、生体組織を凍結させる。このときの試料厚さは約500nmである。上面に金薄膜7aが形成された切刃A(4a)を操作して、図8(a)のように生体組織を斜めから切断する。このとき切刃の上面には、クロム薄膜5nmを介して、金薄膜50nmを積層させている。切断することによって、切刃上面に付着した生体組織の切片11a(図9(a))をTOF−SIMS検出計の真下に水平になるように移動させる。分析チャンバー中は室温下、超高真空であり、切刃上面に付着した生体組織は、内容物が切刃上面に付着したまま、水分が昇華される(図9(b))。このときの試料厚さは約50nmである。試料表面に対しパルスイオンビーム(一次イオンビーム)12を照射し、発生した二次イオンを検出する二次元的なスキャンにより、図9(b)の切片内容物を質量分析し、イメージングする(図7(b))。分析によって得られるPO3イメージ(図10(a))およびポリペプチド特有のイメージ(図10(b))のイメージング結果によって、生体組織を切刃Aで切断した切片内の特定の細胞内にタンパクが存在することがわかる。
【0038】
引き続き、上面に金薄膜7bが形成された切刃B(4b)を操作して、図8(b)のように生体組織を斜めから切断する。切断することによって、切刃上面に付着した生体組織の切片11b(図11(a))をTOF−SIMS検出計の真下に水平になるように移動させる。分析チャンバー中は室温下、超高真空であり、切刃上面に付着した生体組織は、内容物が切刃上面に付着したまま、水分が昇華される(図11(b))。試料表面に対しパルスイオンビーム(一次イオンビーム)12を照射し、発生した二次イオンを検出する二次元的なスキャンにより、図11(b)の切片内容物を質量分析し、イメージングする(図7(c))。分析によって得られるPO3イメージ(図12(a))およびポリペプチド特有のイメージ(図12(b))のイメージング結果によって、生体組織を切刃Bで切断した切片内の特定の細胞内にポリペプチドが存在することがわかる。
【0039】
以上のように、切刃を用いて生体組織を複数回切断し、複数の切片をTOF−SIMS分析することにより、生体組織を3次元的に分析することが可能である。
【0040】
(実施例3)(図14に示すように、ロードロックチャンバー中で、金蒸着切刃を用いて、生体組織を切断する。生体組織切片が付着した切刃を溶液付与チャンバーに移動させ、インクジェットで酵素溶液を付与する。酵素処理済みの生体組織切片が付着した切刃を分析チャンバーに移動させてTOF−SIMS分析する。)
本実施例においては、以下の点を除き、実施例1と同様にして金蒸着切刃で切断した生体組織切片のポリペプチドをTOF−SIMS分析する。本実施例では、図14(a)と14(b)に示すように、生体組織切片が付着した切刃を溶液付与チャンバーに移動させ、インクジェットで酵素溶液を付与する。具体的には、切断することによって切刃上面に付着した生体組織の切片11(図4(a))を、溶液付与チャンバー13に移動させ、インクジェット14の真下に水平になるよう移動させる(図14(b))。常温常圧下、リン酸緩衝溶液(pH7.4)にトリプシン(CHEMICON社製)を含む酵素溶液を、切片11上にインクジェットにて付与する。1時間後、インクジェットから溶液が出ないよう処置し、溶液付与チャンバーを真空にする。真空に達すると、切刃上面に付着した生体組織は、内容物が切刃上面に付着したまま、水分が昇華される(図4(b))。このときの試料厚さは約20nmである。切刃上面に付着した生体組織の切片11を分析チャンバー2に移動させ、TOF−SIMS検出計10の真下に水平になるように移動させる(図14(c))。
【図面の簡単な説明】
【0041】
【図1】TOF−SIMSイメージング結果を示す図であり、(a)はSiウエハ上での結果を示し、(b)は金基板上での結果を示す。
【図2】本発明の実施例1で用いる質量分析装置の動作の一例を示す模式図である。図2(a)は試料を切断する段階、図2(b)は切片にイオンビームを照射する段階を示す。
【図3】切刃によって生体組織を斜め切断する様子の一例を示す模式図である。
【図4】生体組織切片の一例を示す模式図であり、(a)は凍結中、切断直後の状態を、(b)は室温、水分蒸発後の状態を示す。
【図5】実施例1におけるTOF−SIMSイメージング結果として推定されるものを観念的に示す図であり、(a)はPO3イメージを、(b)はポリペプチド特有のイメージを示す。
【図6】参照例1におけるTOF−SIMSイメージング結果として推定されるものを観念的に示す図であり、(a)はPO3イメージを、(b)はポリペプチド特有のイメージを示す。
【図7】本発明の実施例2で用いる質量分析装置の動作の一例を示す模式図である。(a)は切刃Aで生体組織を切断する段階、(b)は切刃Aで切断した生体組織切片を質量分析し、同時に切刃Bで生体組織をさらに切断する段階、(c)は切刃Bで切断した生体組織切片を質量分析する段階を示す。
【図8】実施例2において生体組織を斜め切断する様子の一例を示す模式図である。(a)は切刃Aで切断する様子、(b)は切刃Bで切断する様子を示す。
【図9】切刃Aによる生体組織切片の一例を示す模式図であり、(a)は凍結中、切断直後の状態を示し、(b)は室温、水分蒸発後の状態を示す。
【図10】実施例2における切刃AのTOF−SIMSイメージング結果として推定されるものを観念的に示す図であり、(a)はPO3イメージを、(b)はポリペプチド特有のイメージを示す。
【図11】切刃Bによる生体組織切片の一例を示す模式図であり、(a)は凍結中、切断直後の状態を、(b)は室温、水分蒸発後の状態を示す。
【図12】実施例2における切刃BのTOF−SIMSイメージング結果として推定されるものを観念的に示す図であり、(a)はPO3イメージを、(b)はポリペプチド特有のイメージを示す。
【図13】本発明に関わる質量分析装置の一例を示す模式図である。
【図14】本発明の実施例3に関わる質量分析装置の動作の一例を示す模式図である。(a)は試料を切断する段階、(b)は試料切片に酵素溶液を塗布する段階、(c)は試料切片にイオンビームを照射する段階を示す。
【符号の説明】
【0042】
1 試料切片調製部(ロードロックチャンバー)
2 質量分析部(分析チャンバー)
3 試料保持機構(Si基板)
4、4a、4b 切刃
5 切刃位置制御機構
6 生体組織
7、7a、7b 金属薄膜
8 ビーム照射手段
9 雰囲気調整手段
10 検出計
11、11a、11b 切片
12 ビーム
13 液滴付与チャンバー
14 液滴付与機構
15 溶液
【技術分野】
【0001】
本発明は、切刃面の少なくとも一部に金属薄膜を有する切刃を用いて試料を切断し、切刃面に付着した試料切片を質量分析する装置および方法に関する。
【背景技術】
【0002】
近年のゲノム(genome)解析の進展により、生体内に存在する遺伝子産物であるタンパク質の解析の重要性が急速にクローズアップされてきている。中でも、組織切片におけるタンパク質解析の重要性が指摘されている。例えば、癌組織切片から再発や転移に関わるタンパク質を明らかにするといった試みが数多くなされている。生体試料におけるタンパク質解析手法は以下の手順で行われるのが一般的である。
(1)生体組織や細胞からのタンパク質の抽出。
(2)抽出物(液)からのタンパク質の分離。
(3)分離されたタンパク質またはその分解物としての(ポリ)ペプチド等の分析。
(4)得られた分析結果の同定。
【0003】
タンパク質の分析方法としても種々の方法が知られているが、微量の試料で精度よい分析が行える方法として、飛行時間型質量分析法が注目されている。その中で、生体組織切片におけるタンパク質の二次元分布の可視化を目的とした、TOF−SIMS法(飛行時間型二次イオン質量分析法)をベースとする情報取得手法及び装置が、国際公開第2005/003715号パンフレット(特許文献1)に開示されている。この分析方法では、イオン化促進物質かつ/または消化酵素を生体組織切片に直接付与し、タンパク質の種類に関する情報(消化酵素により限定分解されたペプチドの情報を含む)が、その位置情報を保持したままTOF−SIMS法により可視化される。すなわち、この分析方法は、切断した生体組織の断面を直ちに分析することは目的としていない。
【0004】
特開2004−219261号公報(特許文献2)には、ミクロトームにより斜め切断された下面を質量分析することによって、多層薄膜の斜め断面を解析し、結果的に薄膜を高い空間分解能で分析する手法が開示されている。また、Analytical Chemistry,74(2002),4955-4968 "Organic secondary ion Mass spectrometry : sensitivity enhancement by gold deposition."(非特許文献1)には、金蒸着によってTOF−SIMSのイオン化効率を向上させる技術が紹介されている。また、イオンビームの影響が基板に到達する程度の薄い試料であれば、金基板上に試料が存在しても、イオン増感効果が得られることが知られている。
【特許文献1】国際公開第2005/003715号パンフレット
【特許文献2】特開2004−219261号公報
【非特許文献1】Analytical Chemistry, 74(2002), 4955-4968, "Organic secondary ion Mass spectrometry : sensitivity enhancement by gold deposition."
【発明の開示】
【発明が解決しようとする課題】
【0005】
以上のことから、ミクロトームやSAICAS(Surface And Interfacial Cutting Analysis System)により切断された切片を金属基板上に移し、質量分析を行えば、イオン増感効果によって試料切片に存在する分子が効率良くイオン化されるため、感度向上が期待できる。しかし、試料切片を位置精度良く基板上に移すことは容易ではない。
【0006】
また、特開2004−219261号公報のように、切断された基板上の試料表面を分析することは容易である。しかしながら、イオン増感効果を得るには、試料切断後、基板上の試料断面に金属を蒸着することが必要である。その結果、マスク等を施さない限り、試料の蒸着したくない部分にも金属が蒸着されてしまう。また、基板上の試料表面を一度質量分析してしまうと、高エネルギーの照射により試料内部の組織分解物においても分解、揮発が生じる。以上のことから、一度分析した基板上の試料は、表面に限らず内部においても、金属蒸着や分析によって試料形態が変化しているため、さらに内部の情報を取得しようとしても、適正な分析対象にならないという問題点があった。
【0007】
本発明の目的は、試料を切刃によって切断した後、切刃上に存在する試料切片の位置精度を保持したまま、飛行時間型質量分析を高い感度で行い、分析結果をイメージングすることが可能である質量分析装置及び質量分析方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明は、上記のような問題点を克服するため、試料を切断した断面を、直ちに、かつ、高感度に、質量分析することが可能な装置および手法を提供するものである。即ち、本発明は、分析用の試料切片を調製するための試料切片調製部と、該試料切片調製部で調製された試料切片の飛行時間型質量分析を行う質量分析部と、を有する質量分析装置であって、前記試料切片調製部は、試料を保持するための試料保持機構と、切刃面の少なくとも一部に金属薄膜を有する切刃と、前記切刃の位置を制御して、試料の切断と切断により生じた試料切片の切刃面への載置とを行うための切刃位置制御機構と、を有し、前記質量分析部は、前記切刃を保持する切刃保持機構と、該切刃の前記試料切片が載置された面にパルスレーザーあるいはパルスイオンビームを照射するためのビーム照射機構と、を備えていることを特徴する質量分析装置を提供する。
【0009】
また、本発明は、試料切片にパルスレーザーあるいはパルスイオンビーム照射することにより、該試料切片内の分子をイオン化して飛行時間型質量分析を行う質量分析方法において、切刃面の少なくとも一部に金属薄膜を有する切刃により試料を切断し、該切刃面に付着した試料切片に、パルスレーザーあるいはパルスイオンビーム照射することを特徴とする質量分析方法を提供する。
【発明の効果】
【0010】
以上の構成によれば、装置内において、保持された試料を切刃によって切断した後、切刃上に存在する試料切片の位置精度を保持したまま、飛行時間型質量分析を高い感度で実施し、イメージングすることが可能である。
【発明を実施するための最良の形態】
【0011】
(装置の構成)
本発明の質量分析装置は、図13に示すように、試料切片を調製するための試料切片調製部1と、この試料切片調製部で調製された試料切片に対して飛行時間型質量分析を行うための質量分析部2と、を少なくとも有して構成される。以下、装置各部について説明する。
【0012】
(試料切片調製部)
試料切片調製部には、少なくとも、試料保持機構3、切刃4及び切刃位置制御機構5が設けられている。
【0013】
(試料保持機構)
試料保持機構3は、切刃による試料切断時に試料6を確実に保持しておくための機構を有し、試料切片などの調製において用いられている試料保持機構を利用して構成することができる。例えば、ミクロトームやSAICASで用いられている試料ホルダーなどを切刃保持機構として利用することができる。
【0014】
(切刃及び切刃位置制御機構)
切刃4としては、試料保持機構に保持された試料を切断し、切断により生じた試料切片を切刃の所定面に載置可能である構造を有するものが用いられる。また、本発明においては、切刃面に載せた試料切片に対して質量分析のためのビーム照射が行われるので、切刃としては、かかるビーム照射処理に適合したものが選択される。かかる目的用途に適した切刃であれば、いかなるものでも良いが、市販されているミクロトーム、SAICASの切刃が好ましい。ミクロトームとは、試料を顕微鏡で見るために薄く切る前処理装置であり、滑走式、回転式などがある。ミクロトームは、主に病理検査のときに使われ、一般的には、細胞をミクロトームで2ミクロンや3ミクロンの厚さに切り、薬剤で染色をして顕微鏡で観察するために用いられる。最近では素材の研究等にも多く使われるようになり、切断した物の表面は1ミクロン以下の精度で平坦になっているため、研究用途などではその表面を観察したりもされている。例えば写真の感光フィルムの断面を観察したり、ゴム素材の密度を観察したりするときに使用される。SAICASとは、鋭利な切刃を用いて、素材の表面から内部にかけて切込み、切刃に生ずる抵抗力を検出するシステムである。市販のSAICAS装置では、測定される膜厚が0.1〜1000μmであるが、原理的には1Åから切断することが可能である。このときの試料切断の空間分解能は、切刃の位置制御能力により決定する。なお、適切な膜厚については後述する。
【0015】
本発明においては、切刃面の少なくとも一部に金属薄膜7が形成されており、薄膜に付着した試料切片に、パルスレーザーやパルスイオンビームを照射することにより、切片内の分子は効率良くイオン化される。
【0016】
金属薄膜は、切刃面の試料断片が載置される領域に少なくとも設けられる。試料の上端に水平方向に切刃を入れて切断を行う場合には、切刃の上面に金属薄膜を設けることが好ましく、上面全面に設けることが更に好ましい。この構成により、装置構成が簡便となる。
【0017】
切刃の材質としては、一般的にミクロトーム等ではダイヤモンドなどが用いられるが、本発明ではステンレス、チタンなどの金属類、ガラスやセラミックなどの陶材でもよく、試料が非常に軟らかいものであれば、プラスチックなどでも良い。金属薄膜としては、金、銀、銅、白金などを含むものが好ましいが、上記の効果が得られるものであればこれらに限定されない。より好ましくは金、銀であり、さらに好ましくは金である。このとき、金属薄膜が切刃から剥れにくくするために、チタン、クロムなど吸着性を高めるための金属層を介しても良い。検体の一次イオン照射付近に金が存在するとき、飛行時間型質量分析において優れたイオン増感効果を発揮することが明らかとなっている。図1に、Siウエハ上と金基板上の各々に、同じポリペプチドをスポッティングしたものを同条件で分析したTOF−SIMSのイメージングプロファイルを示している。
【0018】
以上のことから、切刃上面には金などからなる金属薄膜が設けられていることが好ましく、その上に試料切片が存在することにより、一次イオンビーム照射後の検体の二次イオン化が効率良く行われる。上記薄膜は、切刃上面を蒸着機またはスパッタ装置のチャンバーのターゲット側に向けて切刃を設置し、蒸着またはスパッタすることで形成される。薄膜の厚さは、分析を可能とする厚さであればよく、少なくとも1nmであることが好ましい。膜厚が1nm未満の場合は切片内の分子を効率良くイオン化させるためには十分でない恐れがある。なお、切刃下面には、切断時に試料内容物を付着させないための処理が施されていることが好ましい。例えば、いわゆる非特異吸着による共雑物の吸着による不必要なシグナルを防止するために、スキムミルクやカゼイン、血清アルブミン、リン脂質、ポリエチレングリコール及びそれらの誘導体などによるコーティングを行うと、好適である。なお、以上に記載した切刃を装置内に複数準備し、位置制御することにより、試料の切断と質量分析を繰り返すことができ、試料を3次元的に分析することも可能となる。
【0019】
なお、3次元的な質量分析方法は、上記に限定されず、例えばC60イオンを併用するなどしても良い。
【0020】
さらには、切刃を洗浄するなど、切刃上の金属薄膜表面を露出させる機構を装置内に有することで、切刃を繰り返して使用することもできる。
【0021】
切刃における試料に対する切断動作は、切刃位置制御機構により制御する。この切刃位置制御機構も、ミクロトームやSAICASにおける切刃位置制御機構を利用して構成することができる。
【0022】
装置内において、試料を切断する空間(領域)と、パルスレーザーあるいはパルスイオンビームを照射する空間(領域)は、一緒としても別々としても良い。同一空間(領域)でこれらの処理を行う場合には、質量分析のためのビームを照射する空間、即ち、質量分析を行う分析チャンバー中に試料切片調製用の機構を設け、更に、切片調製後に残された試料を分析チャンバー外に取り出せる構造としておく。
【0023】
これらを別々の空間として設ける場合は、それぞれの空間において、その用途に応じた制御が可能となる。この場合、試料保持機構を配置した試料切片調製領域とビーム照射が行われる領域を、それぞれ独立して温度及び湿度の制御が可能となるように設けることが好ましい。例えば、ビームの照射が行われる分析チャンバーは、高真空である必要があり、そのための構造が必要となる。これに対して、試料を切断する空間を分析チャンバーと別空間であるロードロックチャンバーとし、そこでの温度と湿度を制御すれば、例えば、常温では液状の物質を凍結させた後、切刃によって切断することが可能となる。ロードロックチャンバー内は、市販の凍結ミクロトームのように冷凍システムを装着することで冷却することが可能となる。真空制御後、試料切刃を分析チャンバーに移動させ、ビームを照射する位置にこれを配置して、試料切片を分析することができる。また、切刃面上に載置された試料切片に対応し分析結果のイメージングを行う場合などは、検出計の直下に切刃面を配置する。切刃の各チャンバー間の移動は、図13のように制御装置5を利用して自動的に実施しても良い。その際、各チャンバー間のゲートの開閉動作に連動して、各チャンバー内の真空度などの条件を適宜調整してもよい。また、切断を自動化してもよく、切断時には切刃にかかる抵抗等の物理的パラメーターをモニターしながら、電圧制御によって切断速度を制御する機構があっても良い。
【0024】
(試料)
本発明の試料はいかなる材質、形態を有するものでも良いが、好ましくは、生体組織、細胞である。
【0025】
試料である生体組織や細胞は、酵素処理されていても良い。酵素としては、主にトリプシンなどが用いられる。また、多くの水分を含む生体組織や細胞は、凍結後に切断されることが適切であるため、切刃上の切片内容物のほとんどが水である。そのため、水分を蒸発させたときの試料膜厚は、凍結中の切断時よりもはるかに薄くなる。
【0026】
上記を鑑みると、本発明において、試料を切断する際の、表面からの試料厚さは10nm〜10000nmであることが好ましいが、10nm〜1000nmであればさらに好ましい。前記範囲の上限及び下限の設定理由には、以下の2つの理由が挙げられる。
(1)下限の設定理由
生体組織や細胞に存在するタンパク質(大きさが10nm未満)を切断しない範囲であること。
(2)上限の設定理由
試料厚さ数十nm程度の有機試料であれば、容易にイオンビームが前記金属薄膜表面に達し、後述のイオン増感効果を発揮すること。また、試料形態が生体組織や細胞である場合、その内容物の多くが水であり、真空測定時には水分は蒸発する。前記範囲の上限の設定理由には、上記(2)の理由に付け加えて、真空時における水分蒸発後の切片の膜厚が凍結時のおよそ数重量%乃至30重量%程度になること、が挙げられる。すなわち、切断する際に100nm以下の厚さであれば、イオンビーム照射時には試料厚さを数十nm以下にすることができる。なお、水分蒸発によって切刃上に付着したタンパク質等の物体を質量分析する際には、多くの分子がイオン増感効果により効率良くイオン化され、質量分析を可能にするものと考えられる。
【0027】
(液滴付与機構)
本発明の質量分析装置は、液滴付与機構を有していても良い。かかる装置の一例の模式的な断面図を図14に示す。図14中、液滴付与チャンバー13は、液滴付与機構14を有している。液滴付与機構14は、本発明の質量分析装置内において、試料切断によって切刃面に付着した試料切片に対し、位置精度を保持したまま溶液15を付与するための機構である。液滴付与機構は、試料切片調製部あるいは質量分析部と同じ室内にあってもよいが、好ましくは別途チャンバーを設け、常温常圧の状態で使用できる方がよい。さらに好ましくは、本チャンバーは湿度コントロールが可能であることが好ましい。また、本チャンバーは溶液処理後には、真空状態にもできるものであることが好ましい。液滴付与機構の形態としては、インクジェット装置が好ましく、ピエゾ方式、バブルジェット方式のどちらの装置を用いてもよい。前記溶液15としてペプシン、トリプシン、キモトリプシンなどの消化酵素を含む溶液を用いれば、試料切片中に存在するタンパク質を分解し、高感度な領域で質量分析を行うことができる。酵素溶液付与の際、切片に付与した液滴が互いに接触しないよう、付与量と距離を調節することが好ましい。
【0028】
(飛行時間型質量分析部)
飛行時間型質量分析を行う質量分析部2に用いられる質量分析装置は、切刃面に載置された試料切片の質量分析が可能である構成を有する装置であればよい。例えば、少なくも以下の各構成要素を用いて質量分析部を構成することができる。
(1)試料切片を保持するホルダーを有する、分析チャンバー2。
(2)試料切片にビームを照射するためのビーム発生源、ビームを所定位置に照射するための光学系などを有するビーム照射手段8。
(3)分析チャンバー内の雰囲気を測定条件(真空)に整えるための雰囲気調整手段9。
(4)二次イオンなどの検出計10。
【0029】
また、先に述べたように、試料切片調製部と分析チャンバーを兼用とする構成を用いることもできる。
【0030】
切刃面上の試料切片にビーム照射した際に発生したイオンはMALDI−TOFMS(マトリックス支援レーザー脱離イオン化飛行時間型質量分析計)やTOF−SIMSで検出することにより、試料の位置情報を保ったまま、質量分析を行うことができる。これは、ビームを照射することによって生じるイオンを瞬時に検出計に吸い込み、照射位置と検出位置をスキャンして、照射・検出を繰り返すことによって行われる。さらに、ビームは、ピコ秒からナノ秒のパルス幅を有することが好ましく、このことによって分子量検出時のピーク分解能を高めることができる。
【0031】
ビームとしては、パルスレーザービームまたはパルスイオンビームが用いられる。
【0032】
生体組織や細胞レベルの大きさの試料について質量分析を行う場合、TOF−SIMSを用いることが好ましい。TOF−SIMSによれば、サブミクロンレベルの空間分解能での質量分析イメージングが可能となるため、検出されたイオンがどの細胞由来のものであるかが容易に判別することができる。その際、必要に応じ、本発明者らが開示した国際公開第2005/003715号パンフレットに記載のイオン化促進物質(増感物質)を付与してもよい。また、一次イオンとしてはGa+などの一般的な液体金属イオンの他、C60、Au3+やBi3+などのクラスターイオンを用いることもできる。
【実施例】
【0033】
(実施例1)(図2(a)及び(b)に示すような、ロードロックチャンバー中で、金蒸着切刃を用いて、生体組織を切断し、生体組織切片が付着した切刃を分析チャンバーに移動させてのTOF−SIMS分析)
金蒸着切刃で切断した生体組織切片のポリペプチドをTOF−SIMS分析する。生体組織6(ヒト癌組織:Tissue Microarray Human Tumor Tissue(Lymphoma))をSi基板3上に付着させ、ロードロックチャンバー1内に保持させる(図2(a))。基板が保持されたロードロックチャンバー内の温度を−80℃に設定し、生体組織を凍結させる。このときの試料厚さは約100nmである。上面に金薄膜7が形成された切刃4を操作して、図3のように生体組織を斜めから切断する。このとき切刃の上面には、クロム薄膜5nmを介して、金薄膜10nmを積層させている。切断することによって切刃上面に付着した生体組織の切片11(図4(a))を分析チャンバー2内のTOF−SIMS検出計10の真下に水平になるように移動させる(図2(b))。分析チャンバー2内は室温下、超高真空であり、切刃上面に付着した生体組織は、内容物が切刃上面に付着したまま、水分が昇華される(図4(b))。このときの試料厚さは約20nmである。試料表面に対しパルスイオンビーム(一次イオンビーム)12を照射し、発生した二次イオンを検出する二次元的なスキャンにより、図4(b)の切片内容物を質量分析し、イメージングする。分析によって得られる細胞膜由来のPO3イメージ(図5(a))およびポリペプチド特有のイメージ(図5(b))のイメージング結果によって、生体組織内の特定の細胞内にポリペプチドが存在することがわかる。
【0034】
(参照例1)(実施例1の金薄膜なしの例)
金蒸着のない切刃を持つSAICAS装置で切断した生体組織切片のポリペプチドをTOF−SIMS分析する。
【0035】
生体組織としてヒト癌組織:Tissue Microarray Human Tumor Tissue(Lymphoma))を用いる。この生体組織をSi基板上に付着させ、−80℃の温度下で市販のSAICAS装置によって生体組織を斜め切断後、切断面をTOF−SIMS検出計の真下に水平になるように移動させる。このときの試料厚さは約100nmである。実施例1同様に、分析チャンバー中は室温下、超高真空であり、切刃上面に付着した生体組織は、内容物が切刃上面に付着したまま、水分が昇華される。このときの試料厚さは約20nmである。試料表面に対しパルスイオンビームを照射し、発生した二次イオンを検出する二次元的なスキャンにより、図4(b)の切片内容物を質量分析し、イメージングする。分析によって得られるPO3イメージ(図6(a))は、実施例1のPO3イメージ(図5(a))よりも少なく、ポリペプチド特有のイメージ(図6(b))は、ほとんど検出されない。
【0036】
(実施例2)(図7(a)、(b)及び(c)に示すような、複数の切刃による複数の切片分析による生体組織の3次元的分析)
金蒸着切刃で多重に切断した複数の生体組織切片に含まれるポリペプチドをTOF−SIMS分析することにより、生体組織の3次元的分析を行う。
【0037】
生体組織6(ヒト癌組織:Tissue MicroArray Human Tumor Tissue(Colon Carcinoma))をSi基板3上に付着させ、ロードロックチャンバー1内に保持させる(図7(a))。基板が保持されたロードロックチャンバー内の温度を−80℃に設定し、生体組織を凍結させる。このときの試料厚さは約500nmである。上面に金薄膜7aが形成された切刃A(4a)を操作して、図8(a)のように生体組織を斜めから切断する。このとき切刃の上面には、クロム薄膜5nmを介して、金薄膜50nmを積層させている。切断することによって、切刃上面に付着した生体組織の切片11a(図9(a))をTOF−SIMS検出計の真下に水平になるように移動させる。分析チャンバー中は室温下、超高真空であり、切刃上面に付着した生体組織は、内容物が切刃上面に付着したまま、水分が昇華される(図9(b))。このときの試料厚さは約50nmである。試料表面に対しパルスイオンビーム(一次イオンビーム)12を照射し、発生した二次イオンを検出する二次元的なスキャンにより、図9(b)の切片内容物を質量分析し、イメージングする(図7(b))。分析によって得られるPO3イメージ(図10(a))およびポリペプチド特有のイメージ(図10(b))のイメージング結果によって、生体組織を切刃Aで切断した切片内の特定の細胞内にタンパクが存在することがわかる。
【0038】
引き続き、上面に金薄膜7bが形成された切刃B(4b)を操作して、図8(b)のように生体組織を斜めから切断する。切断することによって、切刃上面に付着した生体組織の切片11b(図11(a))をTOF−SIMS検出計の真下に水平になるように移動させる。分析チャンバー中は室温下、超高真空であり、切刃上面に付着した生体組織は、内容物が切刃上面に付着したまま、水分が昇華される(図11(b))。試料表面に対しパルスイオンビーム(一次イオンビーム)12を照射し、発生した二次イオンを検出する二次元的なスキャンにより、図11(b)の切片内容物を質量分析し、イメージングする(図7(c))。分析によって得られるPO3イメージ(図12(a))およびポリペプチド特有のイメージ(図12(b))のイメージング結果によって、生体組織を切刃Bで切断した切片内の特定の細胞内にポリペプチドが存在することがわかる。
【0039】
以上のように、切刃を用いて生体組織を複数回切断し、複数の切片をTOF−SIMS分析することにより、生体組織を3次元的に分析することが可能である。
【0040】
(実施例3)(図14に示すように、ロードロックチャンバー中で、金蒸着切刃を用いて、生体組織を切断する。生体組織切片が付着した切刃を溶液付与チャンバーに移動させ、インクジェットで酵素溶液を付与する。酵素処理済みの生体組織切片が付着した切刃を分析チャンバーに移動させてTOF−SIMS分析する。)
本実施例においては、以下の点を除き、実施例1と同様にして金蒸着切刃で切断した生体組織切片のポリペプチドをTOF−SIMS分析する。本実施例では、図14(a)と14(b)に示すように、生体組織切片が付着した切刃を溶液付与チャンバーに移動させ、インクジェットで酵素溶液を付与する。具体的には、切断することによって切刃上面に付着した生体組織の切片11(図4(a))を、溶液付与チャンバー13に移動させ、インクジェット14の真下に水平になるよう移動させる(図14(b))。常温常圧下、リン酸緩衝溶液(pH7.4)にトリプシン(CHEMICON社製)を含む酵素溶液を、切片11上にインクジェットにて付与する。1時間後、インクジェットから溶液が出ないよう処置し、溶液付与チャンバーを真空にする。真空に達すると、切刃上面に付着した生体組織は、内容物が切刃上面に付着したまま、水分が昇華される(図4(b))。このときの試料厚さは約20nmである。切刃上面に付着した生体組織の切片11を分析チャンバー2に移動させ、TOF−SIMS検出計10の真下に水平になるように移動させる(図14(c))。
【図面の簡単な説明】
【0041】
【図1】TOF−SIMSイメージング結果を示す図であり、(a)はSiウエハ上での結果を示し、(b)は金基板上での結果を示す。
【図2】本発明の実施例1で用いる質量分析装置の動作の一例を示す模式図である。図2(a)は試料を切断する段階、図2(b)は切片にイオンビームを照射する段階を示す。
【図3】切刃によって生体組織を斜め切断する様子の一例を示す模式図である。
【図4】生体組織切片の一例を示す模式図であり、(a)は凍結中、切断直後の状態を、(b)は室温、水分蒸発後の状態を示す。
【図5】実施例1におけるTOF−SIMSイメージング結果として推定されるものを観念的に示す図であり、(a)はPO3イメージを、(b)はポリペプチド特有のイメージを示す。
【図6】参照例1におけるTOF−SIMSイメージング結果として推定されるものを観念的に示す図であり、(a)はPO3イメージを、(b)はポリペプチド特有のイメージを示す。
【図7】本発明の実施例2で用いる質量分析装置の動作の一例を示す模式図である。(a)は切刃Aで生体組織を切断する段階、(b)は切刃Aで切断した生体組織切片を質量分析し、同時に切刃Bで生体組織をさらに切断する段階、(c)は切刃Bで切断した生体組織切片を質量分析する段階を示す。
【図8】実施例2において生体組織を斜め切断する様子の一例を示す模式図である。(a)は切刃Aで切断する様子、(b)は切刃Bで切断する様子を示す。
【図9】切刃Aによる生体組織切片の一例を示す模式図であり、(a)は凍結中、切断直後の状態を示し、(b)は室温、水分蒸発後の状態を示す。
【図10】実施例2における切刃AのTOF−SIMSイメージング結果として推定されるものを観念的に示す図であり、(a)はPO3イメージを、(b)はポリペプチド特有のイメージを示す。
【図11】切刃Bによる生体組織切片の一例を示す模式図であり、(a)は凍結中、切断直後の状態を、(b)は室温、水分蒸発後の状態を示す。
【図12】実施例2における切刃BのTOF−SIMSイメージング結果として推定されるものを観念的に示す図であり、(a)はPO3イメージを、(b)はポリペプチド特有のイメージを示す。
【図13】本発明に関わる質量分析装置の一例を示す模式図である。
【図14】本発明の実施例3に関わる質量分析装置の動作の一例を示す模式図である。(a)は試料を切断する段階、(b)は試料切片に酵素溶液を塗布する段階、(c)は試料切片にイオンビームを照射する段階を示す。
【符号の説明】
【0042】
1 試料切片調製部(ロードロックチャンバー)
2 質量分析部(分析チャンバー)
3 試料保持機構(Si基板)
4、4a、4b 切刃
5 切刃位置制御機構
6 生体組織
7、7a、7b 金属薄膜
8 ビーム照射手段
9 雰囲気調整手段
10 検出計
11、11a、11b 切片
12 ビーム
13 液滴付与チャンバー
14 液滴付与機構
15 溶液
【特許請求の範囲】
【請求項1】
分析用の試料切片を調製するための試料切片調製部と、該試料切片調製部で調製された試料切片の飛行時間型質量分析を行う質量分析部と、を有する質量分析装置であって、
前記試料切片調製部は、試料を保持するための試料保持機構と、切刃面の少なくとも一部に金属薄膜を有する切刃と、前記切刃の位置を制御して、試料の切断と切断により生じた試料切片の切刃面への載置とを行うための切刃位置制御機構と、を有し、
前記質量分析部は、前記切刃を保持する切刃保持機構と、該切刃の前記試料切片が載置された面にパルスレーザーあるいはパルスイオンビームを照射するためのビーム照射機構と、を備えている
ことを特徴する質量分析装置。
【請求項2】
前記試料の切断時に、前記切刃面が上面となるように前記切刃が位置制御される請求項1に記載の質量分析装置。
【請求項3】
前記金属薄膜が金薄膜である請求項1に記載の質量分析装置。
【請求項4】
前記パルスレーザーあるいは前記パルスイオンビームは、ピコ秒からナノ秒のパルス幅を有する請求項1に記載の質量分析装置。
【請求項5】
前記試料保持機構を配置した領域と前記ビーム照射が行われる領域は、それぞれ独立して温度及び湿度の制御が可能となっている請求項1に記載の質量分析装置。
【請求項6】
前記試料がポリペプチドを含む請求項1に記載の質量分析装置。
【請求項7】
前記質量分析が飛行時間型二次イオン質量分析である請求項1に記載の質量分析装置。
【請求項8】
前記切刃面に付着した試料切片に、液滴を付与するための液滴付与機構を更に備えている請求項1に記載の質量分析装置。
【請求項9】
試料切片にパルスレーザーあるいはパルスイオンビーム照射することにより、該試料切片内の分子をイオン化して飛行時間型質量分析を行う質量分析方法において、
切刃面の少なくとも一部に金属薄膜を有する切刃により試料を切断し、該切刃面に付着した試料切片に、パルスレーザーあるいはパルスイオンビーム照射することを特徴とする質量分析方法。
【請求項10】
前記切刃面に付着した試料切片に、消化酵素溶液を付与する工程を含む請求項9に記載の質量分析方法。
【請求項1】
分析用の試料切片を調製するための試料切片調製部と、該試料切片調製部で調製された試料切片の飛行時間型質量分析を行う質量分析部と、を有する質量分析装置であって、
前記試料切片調製部は、試料を保持するための試料保持機構と、切刃面の少なくとも一部に金属薄膜を有する切刃と、前記切刃の位置を制御して、試料の切断と切断により生じた試料切片の切刃面への載置とを行うための切刃位置制御機構と、を有し、
前記質量分析部は、前記切刃を保持する切刃保持機構と、該切刃の前記試料切片が載置された面にパルスレーザーあるいはパルスイオンビームを照射するためのビーム照射機構と、を備えている
ことを特徴する質量分析装置。
【請求項2】
前記試料の切断時に、前記切刃面が上面となるように前記切刃が位置制御される請求項1に記載の質量分析装置。
【請求項3】
前記金属薄膜が金薄膜である請求項1に記載の質量分析装置。
【請求項4】
前記パルスレーザーあるいは前記パルスイオンビームは、ピコ秒からナノ秒のパルス幅を有する請求項1に記載の質量分析装置。
【請求項5】
前記試料保持機構を配置した領域と前記ビーム照射が行われる領域は、それぞれ独立して温度及び湿度の制御が可能となっている請求項1に記載の質量分析装置。
【請求項6】
前記試料がポリペプチドを含む請求項1に記載の質量分析装置。
【請求項7】
前記質量分析が飛行時間型二次イオン質量分析である請求項1に記載の質量分析装置。
【請求項8】
前記切刃面に付着した試料切片に、液滴を付与するための液滴付与機構を更に備えている請求項1に記載の質量分析装置。
【請求項9】
試料切片にパルスレーザーあるいはパルスイオンビーム照射することにより、該試料切片内の分子をイオン化して飛行時間型質量分析を行う質量分析方法において、
切刃面の少なくとも一部に金属薄膜を有する切刃により試料を切断し、該切刃面に付着した試料切片に、パルスレーザーあるいはパルスイオンビーム照射することを特徴とする質量分析方法。
【請求項10】
前記切刃面に付着した試料切片に、消化酵素溶液を付与する工程を含む請求項9に記載の質量分析方法。
【図2】


【図3】


【図4】


【図7】


【図8】


【図13】


【図14】


【図1】


【図5】


【図6】


【図9】


【図10】


【図11】


【図12】




【図3】


【図4】


【図7】


【図8】


【図13】


【図14】


【図1】


【図5】


【図6】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2007−271612(P2007−271612A)
【公開日】平成19年10月18日(2007.10.18)
【国際特許分類】
【出願番号】特願2007−62653(P2007−62653)
【出願日】平成19年3月12日(2007.3.12)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.バブルジェット
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
【公開日】平成19年10月18日(2007.10.18)
【国際特許分類】
【出願日】平成19年3月12日(2007.3.12)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.バブルジェット
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
[ Back to top ]

