高温耐性植物及びそのスクリーニング方法
【課題】高温による可食部の障害が抑制された高温耐性植物及び、効率よく高温耐性植物をスクリーニングする方法を提供する。
【解決手段】(a)配列番号2で示されるアミノ酸配列からなるタンパク質又は(b)配列番号2で示されるアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつミトコンドリアF1ATP合成酵素βサブユニット活性を有するタンパク質の各タンパク質をコードする遺伝子と過剰発現プロモータとを含む植物体用の組換えベクターを植物に導入することによって得られた高温耐性植物と;被検植物を、高温環境条件下で生育させる高温生育期間に供すること、前記高温生育期間後における前記被検植物におけるATP量を測定すること、得られたATP量が通常条件での生育時でのATP量と比較して低下していないものを、被検植物を高温耐性植物として選別する方法。
【解決手段】(a)配列番号2で示されるアミノ酸配列からなるタンパク質又は(b)配列番号2で示されるアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつミトコンドリアF1ATP合成酵素βサブユニット活性を有するタンパク質の各タンパク質をコードする遺伝子と過剰発現プロモータとを含む植物体用の組換えベクターを植物に導入することによって得られた高温耐性植物と;被検植物を、高温環境条件下で生育させる高温生育期間に供すること、前記高温生育期間後における前記被検植物におけるATP量を測定すること、得られたATP量が通常条件での生育時でのATP量と比較して低下していないものを、被検植物を高温耐性植物として選別する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、高温耐性植物及びそのスクリーニング方法に関する。
【背景技術】
【0002】
近年、CO2の排出量の増加やオゾン層の破壊などによる地球温暖化の影響が懸念されている。特に、植物は至適温度の環境下において最も良好に生育することから、温度上昇に伴って種々の障害が確認されている。穀物の場合、温度上昇に伴う障害は収量の大幅な減少に繋がることもある。例えば、イネ科植物の場合、イネ登熟期の高温は胚乳の白濁化と収量の減少を引き起こすことが知られている。またトウモロコシの場合にも、穀粒の重量が減少することが知られている。このため、高温環境下でも適応可能な植物の開発が種々行われている。
【0003】
例えば、特許文献1には、熱ショックタンパク質sHS17.7遺伝子をイネ科植物細胞中に導入して恒常的に高発現させることによって、イネ科植物の環境ストレス、例えば、高温耐性、紫外線耐性、乾燥耐性などの複合環境ストレス下でも栽培可能な植物が得られると記載されている。
特許文献2には、脂肪酸不飽和化酵素遺伝子の発現を抑制することによって不飽和脂肪酸顔料を低下させることによって、タバコなどの植物に高温耐性が付与された植物が得られると記載されている。
特許文献3には、ADP−グルコースピロホスホリラーゼ(AGP)大サブユニットにアミノ酸変異を導入することによって、高温ストレス条件下で生育させると収量の増加をもたらすトウモロコシなどの植物が得られると記載されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2006−34252号公報
【特許文献2】WO00/19806号パンフレット
【特許文献3】特開2010−84号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、作物においては、高温環境下で単に生育できるだけでは十分でなく、作物の収量面においても通常栽培環境下と同等程度であることが要求される。特に、実を可食部とする作物植物では、登熟発生過程で高温に晒されると商品価値が著しく低下する。例えばイネの場合、通常温度での栽培と同様に胚乳の白濁化が生じないことや穀粒の質量が低下しないことが、高温耐性の特性として必要である。
また、高温耐性植物の開発については、高温耐性の特性を有する植物体を用いた交配が適用されることがあるが、このような高温耐性の植物体を選別する際に有効な指標がない。このため、経験に基づいて高温耐性植物を選別することが多く、効率的でない。
【0006】
従って、本発明の目的は、高温による可食部の障害が抑制された高温耐性植物を提供することである。
また本発明の目的は、効率よく高温耐性植物をスクリーニングする方法を提供することである。
【課題を解決するための手段】
【0007】
本発明は以下のとおりである。
[1] 以下の(a)又は(b)のタンパク質をコードする遺伝子と過剰発現プロモータとを含む植物体用の組換えベクター:
(a) 配列番号2で示されるアミノ酸配列からなるタンパク質、
(b) 配列番号2で示されるアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつミトコンドリアF1ATP合成酵素βサブユニット活性を有するタンパク質。
[2] 以下の(c)又は(d)のDNAと過剰発現プロモータとを含む植物体用の組換えベクター:
(c) 配列番号1で示される塩基配列からなるDNA、
(d) 配列番号1で示される塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつミトコンドリアF1ATP合成酵素βサブユニット活性を有するタンパク質をコードするDNA。
[3] 前記過剰発現プロモータが、高温耐性貯蔵タンパク質遺伝子プロモータである[1]又は[2]に記載の組換えベクター。
[4] 前記過剰発現プロモータが、グルテリンプロモータである[1]〜[3]のいずれかに記載の組換えベクター。
[5] [1]〜[4]のいずれかに記載の組換えベクターを、植物に導入することによって得られた高温耐性植物。
[6] イネ科植物である請求項[5]に記載の高温耐性植物。
[7] [1]〜[4]のいずれかに記載の組換えベクターを、植物に導入することを含む高温耐性植物の作出方法。
[8] 前記植物が、植物体、植物器官、植物組織又は植物細胞である[7]に記載の高温耐性植物の作出方法。
[9] 高温耐性植物をスクリーニングする方法であって、被検植物を、高温環境条件下で生育させる高温生育期間に供すること、前記高温生育期間後における前記被検植物におけるATP量を測定すること、得られたATP量が通常条件下での生育におけるATP量と比較して有意に低下していないものを、被検植物を高温耐性植物として選別すること、を含む高温耐性イネ科植物スクリーニング方法。
【発明の効果】
【0008】
本発明によれば、高温による可食部の障害が抑制された高温耐性植物及び、効率よく高温耐性植物をスクリーニングする方法を提供することができる。
【図面の簡単な説明】
【0009】
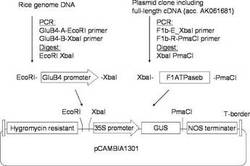
【図1】本発明の実施例2にかかるミトコンドリアF1ATP合成酵素βサブユニット高発現組換えベクターの作製を説明する図である。
【図2】本発明の実施例3にかかる「金南風」の高温登熟環境下でのATP量の変動を示すグラフである。
【図3】本発明の実施例3にかかる「日本晴」の高温登熟環境下でのATP量の変動を示すグラフである。
【図4】本発明の実施例3にかかる「台中65号」の高温登熟環境下でのATP量の変動を示すグラフである。
【発明を実施するための形態】
【0010】
本発明は、植物に普遍に存在するミトコンドリアのF1ATP合成酵素βサブユニット遺伝子が植物の高温耐性に寄与する遺伝子であることを見出したことに基づくものである。
即ち、本発明の高温耐性植物は、ミトコンドリアF1ATP合成酵素βサブユニット遺伝子を強発現させた形質転換体である。また、本発明の組換えベクターは、ミトコンドリアF1ATP合成酵素βサブユニット遺伝子を強発現させるための植物体用の組換えベクターであり、高温耐性植物を作出するために有用なものである。
【0011】
本発明において「高温耐性」とは、対象となる植物の生育において、昼夜サイクルに代表される高温域及び低温域の温度サイクルで構成された至適温度範囲の低温域において、最低温度が25℃以上高い温度でも障害(高温障害)が生じないことを意味し、対象となる植物によって異なるが、一般に、25℃以上の温度、好ましくは28℃以上の高温条件下でも植物に障害が生じないことを意味する。高温障害とは、至適温度での生育と比較して活性等が低下した状態を意味し、具体的には植物種によって異なるが、イネの場合、胚の白濁化又は穀粒の質量低下などに代表される高温登熟障害を挙げることができる。
なお、本明細書において「工程」との語は、独立した工程だけでなく、他の工程と明確に区別できない場合であっても本工程の所期の作用が達成されれば、本用語に含まれる。
以下、本発明について説明する。
【0012】
本発明にかかるミトコンドリアF1ATP合成酵素βサブユニット(以下、単に「F1ATP合成酵素βサブユニット」ということがある)は、植物細胞内のミトコンドリアの内膜に存在するATP合成酵素のうち、ミトコンドリア内部側のF1部分を構成するサブニットのひとつである。F1ATP合成酵素βは、α、γ及びδの各サブユニットと共に、膜内のF0複合体と所定の立体構造を構成して、ミトコンドリアでのATP合成を担っている。本発明では、このようなF1ATP合成酵素βサブユニットを強発現させることによって、植物に高温耐性を付与することができ、イネの場合、高温登熟障害のひとつである胚乳の白濁化を効果的に抑制できる。
【0013】
本発明において、F1ATP合成酵素βサブユニット遺伝子は、配列番号1で示される塩基配列からなるDNA又は、この塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつF1ATP合成酵素βサブユニット活性を有するタンパク質をコードするDNA、或いは、配列番号2で示されるアミノ酸配列からなるタンパク質をコードする遺伝子又は、配列番号2で示されるアミノ酸配列において1若しくは数個(例えば、1〜10個)のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつF1ATP合成酵素βサブユニット活性を有するタンパク質をコードする遺伝子である。
【0014】
ここで、「配列番号1で示される塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつF1ATP合成酵素βサブユニット活性を有するタンパク質をコードするDNA」は、配列番号1で示される塩基配列からなるDNAと同等の配列を意味する。
ストリンジェントな条件とは、塩基配列同士が特異的にハイブリダイズし、非特異的にハイブリダイズしない条件を意味し、例えば、相同性が高い核酸、すなわち60%以上、好ましくは80%以上、より好ましくは90%以上の相同性を有するDNAの相補鎖がハイブリダイズし、それより相同性が低い核酸の相補鎖がハイブリダイズしない条件が挙げられる。より具体的には、ナトリウム濃度が150〜900mM、好ましくは600〜900mMであり、温度が60〜68℃、好ましくは65℃での条件をいう。本発明において「相同性」を具体的な数値として示す場合、例えば、汎用されている相同性検索アルゴリズムであるBLAST(Basic Local Alignment Search Tool)(NCBI、又はAltschul, S. F. et al. J. Mol. Biol., 215:403-410(1990))を用いた配列比較で決定することができる。
【0015】
F1ATP合成酵素βサブユニット活性とは、ADPとP1のATPへの変換を生じ得るものであればよい。対象となるタンパク質がF1ATP合成酵素βサブユニット活性を有していることは、例えば、ATPの生成によって確認することができる。
【0016】
F1ATP合成酵素β遺伝子の配列は、種々の植物由来のF1ATP合成酵素βサブユニット遺伝子として公知であり、目的とする植物細胞の遺伝子から後述するプライマーを用いて単離してもよく、生物のcDNAライブラリーから単離することで得てもよい。本明細書において示される所定の配列から合成してもよい。例えば、イネ(Oryza sativa L. japonica)のF1ATP合成酵素βサブユニットの遺伝子の全長のcDNAは、例えば、GenBank Accession No.AK061681として入手可能である。
【0017】
本発明にかかるF1ATP合成酵素β遺伝子を過剰発現させるプロモータとしては、恒常的な発現を可能にするものであればよく、例えばカリフラワーモザイクウイルス35Sプロモータ、NOSプロモータ、ユビキチンプロモータ、RuBisCOの小サブユニット遺伝子のプロモータ、LHCP(集光タンパク質)等の光合成関連遺伝子のプロモータ、イネアクチンプロモータ、貯蔵デンプンや貯蔵タンパク質の生合成に関わる遺伝子のプロモータ等が挙げられる。中でも、制御下にある遺伝子を高温下で発現可能なプロモータであることが好ましく、例えば、ヒートショックタンパク質遺伝子プロモータ(例えば、HSP26プロモータなど)又は貯蔵タンパク質遺伝子プロモータ等を挙げることができる。より好ましくは、高温耐性貯蔵タンパク質遺伝子プロモータ、例えば、グルテリンプロモータ、プロラミンプロモータ等が好ましく、グルテリンプロモータが特に好ましい。
【0018】
本発明における組換えベクターは、必要に応じて、転写のエンハンサーなどのシスエレメント、スプライシングシグナル、ポリA付加シグナル、選択マーカー、リボソーム結合配列(SD配列)、NOSなどのターミネーター、等を有していてもよい。選択マーカーとしては、例えば、抗生物質耐性遺伝子(例えば、アンピシリン、ネオマイシン、カナマイシン、ハイグロマイシンの各耐性遺伝子)、除草剤耐性遺伝子(例えば、ビアラホス耐性遺伝子)、突然変異型アセト乳酸合成酵素遺伝子などが挙げられる。
【0019】
また組換えベクターには、目的とする遺伝子の導入を確認するためのレポーター遺伝子を含んでいてもよい。このようなレポーター遺伝子としては、GUS(β−グルクロニダーゼ)遺伝子、ルシフェラーゼ遺伝子、GFP(緑色蛍光タンパク質)遺伝子等を挙げることができる。
【0020】
植物形質転換用ベクターとしては、例えば、pCAMBIA1301等のpCAMBIAベクター(オーストラリアCAMBIA)、pGWB2等のpGWBベクター(GenBank Accession No.AB289765、J.Biosci Bioeng. 2007 Jul;104(1):34-41)、MATベクター(日本製紙)、pBI121等が挙げられる。
【0021】
F1ATP合成酵素βサブユニット遺伝子をベクターに組み込むには、例えば、当該遺伝子を含むDNA断片を適当な制限酵素で切断し、ベクター中の過剰発現プロモータ下流の適当な制限酵素部位にイン・フレームとなるように、当業界で公知の技術を用いて挿入すればよい。
【0022】
本発明にかかる組換えベクターが導入される植物としては、特に制限されず、例えば、単子葉植物及び双子葉植物のいずれでもよい。単子葉植物としては、具体的には、イネ科のイネ、コムギ、オオムギ、カラスムギ、ライムギ、キビ、アワ、ヒエ、トウモロコシ、シコクビエ、モロコシ、タケ、ヨシ、ススキ、アマランサス、ミスカンサス、スイッチグラス、ソルガム等、サトイモ科のサトイモ等、ヤシ科のヤシ、ナツメヤシ等、バショウ科のバナナ等が挙げられる。
また双子葉植物としては、具体的には、ナス科のナス、タバコ、トマト、ジャガイモ等、ウリ科のメロン、カボチャ等、マメ科のダイズ等、ブドウ科のブドウ等が挙げられる。
これらの植物としては、高温耐性効果の確実性の観点から、イネ科の植物であることが好ましく、イネであることが更に好ましい。
【0023】
組換えベクターを導入する植物試料としては、植物体全体、植物器官(例えば葉、花弁、茎、根、種子等)、植物組織(例えば表皮、師部、柔組織、木部、維管束、柵状組織、海綿状組織等)、植物細胞(例えばカルス)等が挙げられる。
【0024】
目的遺伝子を含む上記組換えベクターは、植物の形質転換に用いられる方法、例えばアグロバクテリウム法、パーティクルガン法、PEG法、エレクトロポレーション法等によって植物細胞中に導入することができる。例えばアグロバクテリウム法を用いる場合は、構築した植物用発現ベクターを適当なアグロバクテリウム、例えばアグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)に導入し、この菌株をイネのカルスに接種して感染させ、トランスジェニック植物細胞を得ることができる。また、パーティクルガン法を用いる場合には、市販の遺伝子導入装置を製造業者の説明書に従って使用すればよい。遺伝子導入装置による操作条件は植物又は試料により異なるが、通常は450psi〜2000psi程度の圧力、4cm〜12cm程度の距離で行う。植物試料としては、植物体、植物器官、又は植物組織自体をそのまま使用してもよく、切片を調製した後に使用してもよく、プロトプラストを調製して使用してもよい。
【0025】
形質転換した腫瘍組織やシュート、毛状根等は、例えば従来知られている植物組織培養法を用い、適当な濃度の植物ホルモン(オーキシン、サイトカイニン、ジベレリン、アブシジン酸、エチレン、ブラシノライド等)の投与などによって植物体に再生させることができる。
目的遺伝子が目的のトランスジェニックイネ科植物に導入されたか否かの確認は、PCR法、サザンハイブリダイゼーション法、ノーザンハイブリダイゼーション法、ウェスタンブロット法等の通常用いられる技術を利用して行えばよい。
【0026】
本発明における高温耐性植物は、上記組換えベクターを植物に導入することによって得ることができる。
また本発明における高温耐性植物の作出方法は、上記組換えベクターを植物に導入することを含むものである。
【0027】
組換えベクターの導入については前述した事項をそのまま適用することができる。
作出された植物体又は、その繁殖形態(種子、切穂、塊茎など)はいずれも、野生型と比較してF1ATP合成酵素βサブユニットが過剰発現されており、高温環境に対して耐性を示す。特にイネの場合、高温登熟障害、例えば穀粒の白濁化、穀粒の質量低下又はこれらの組み合わせが効果的に抑制された植物体となる。
本発明において得られた高温耐性植物では、安定してF1ATP合成酵素βサブユニットが過剰発現されているので、高温耐性植物を、植物種に応じた通常の方法に従って、継代、維持することができる。
【0028】
本発明における高温耐性植物のスクリーニング方法は、被検植物を、高温環境条件下で生育させる高温生育期間に供すること(以下、高温生育工程)、前記高温生育期間後における前記被検植物におけるATP量を測定すること(以下、測定工程)、測定によって得られたATP量が通常条件での生育時でのATP量よりも有意に低下していない被検植物を高温耐性植物として選別すること、(以下、選別工程)、を含む高温耐性イネ科植物スクリーニング方法である。
本発明は、高温条件下で生育させてもATP量が変化しない植物が、可食部の高温障害が抑制された高温耐性植物であることを見出したことに基づくものである。このような高温耐性植物では、F1ATP合成酵素βサブユニットの活性が高温条件下でも低下しないため、ATP量が低下しない。従って、植物におけるATP量に基づいて効率よく高温耐性植物をスクリーニングすることができる。
【0029】
本スクリーニング方法における高温生育工程では、被検植物を高温環境条件下で生育させる。本スクリーニング方法における「高温環境条件」とは、被検植物によって異なるが、当該植物の品種及び/又は栽培場所によって通常用いられる種子の登熟期の生育環境の温度条件よりも相対的に高い温度条件をいい、一般に、高温域及び低温域で構成された温度サイクルにおいて、低温域の最低温度が25℃以上、好ましくは低温域の温度が25℃〜30℃、特に28℃程度であることを言う。本発明における高温条件の例としては、低温域の温度として25℃〜30℃(例えば28℃)で少なくとも2時間、好ましくは5時間以上曝露されることが挙げられる。なお、高温域については特に限定されず、被検植物が生育可能であればよい。適用可能な高温域については、植物種及び栽培地域によって異なるが、例えば、30℃〜35℃の範囲とすることができる。また昼夜サイクルは、ほぼ半日毎のサイクルとすることができるが、必ずしもこれに限定されず、対象となる植物の生育条件に応じて、適宜変更可能である。
【0030】
高温生育工程に適用される好ましい高温環境サイクルとしては、被検植物の種類によって異なり、植物種に応じて当業界で公知の高温環境サイクルを適用すればよい。例えば、イネ科植物の場合、12時間/12時間の昼夜サイクルとし、それぞれ30℃〜33℃/25℃〜30℃の条件を適用すればよい(例えば、Plant Physiol., (2007) Vol.144, pp.258-277)が、これに限定されない。
【0031】
また「通常条件」とは、被検植物の通常の生育環境と等しい温度条件をいい、被検植物の種類によって異なり、植物種に応じて当業界で公知の通常条件サイクルを適用すればよい。例えば、イネの場合、15℃〜35℃の平均温度の範囲内で、12時間/12時間の昼夜サイクルとし、種子の登熟期の昼間条件を25℃〜30℃、夜間条件を15℃〜25℃とすることができるが、これに限定されない。
【0032】
より確実に高温耐性植物をスクリーニングする観点から、高温環境条件は、被検植物の胚乳期に上記高温環境条件に付すことが好ましく、胚乳において貯蔵物質(例えば、貯蔵デンプン)の生合成が活発に行われている時期であることが更に好ましい。イネの場合、貯蔵物質の生合成は開花から5日目〜7日目の期間で高くなるので、この時期に高温環境条件下で生育されていればよい。例えば、開花から〜15日目、好ましくは開花から5日目〜10日目の期間、更に好ましくは開花から5日目〜7日目まで高温環境条件下で被検植物の生育を行う。
【0033】
測定工程で適用されるATP量の測定は、当業界で既知の方法、例えばルシフェラーゼ発光法などによって測定すればよく、特に制限されない。ルシフェラーゼ発光法による測定については、市販のルシフェラーゼアッセイキット(例えば、キッコーマン社製など)を利用してもよい。
【0034】
また、ATP量の測定方法は、ATP量が高温生育期間前又は通常条件下での生育での量との相対量が検出できれば、ATP量を直接測定する方法に限定されない。例えば、ATP合成酵素の発現量に対応していることから、F1ATP合成酵素βサブユニットの発現量に基づいて測定してもよい。F1ATP合成酵素βサブユニットの発現量の測定には、この目的のために当業界で通常用いられている方法を適用すればよく、例えば、PCR法、サザンハイブリダイゼーション法、ノーザンハイブリダイゼーション法、ドットブロット等を挙げることができる。
【0035】
ATP量の測定は、上記の高温生育期間にわたって測定してもよいが、好ましくは開花から5〜10日、効率的観点からは、貯蔵澱粉などの貯蔵物質の生産が活発化する時期、例えばイネの場合、7日目で測定すればよい。この時期で測定を行うことによって、高温生育条件に基づくストレスが最も顕著に表れるため、通常条件下でのATP量と差が大きくなる傾向があり、好ましい。
【0036】
選別工程では、得られたATP量が通常条件での生育時でのATP量と比較して低下していないものを、被検植物を高温耐性植物として選別する。
ATP量の対比については、高温生育期間開始時に測定したATP量と比較してもよく、また通常条件による文献値としてのATP量と対比してもよい。
高温耐性植物であるとの判定については、通常条件での生育時での通常ATP量と比較して有意に低下していないか否かにより判定すればよい。ここで「通常ATP量と比較して有意に低下していない」とは、同等以上のものを意味しており、例えば、通常ATP量と比較して20%以内の低下率、好ましくは通常ATP量と比較して10%以内の低下率のものから、通常ATP量を上回るものを高温耐性植物と判定することができる。
【0037】
本発明におけるスクリーニング方法で得られた高温耐性植物は、それ自体を高温環境下での栽培に利用すると共に、高温耐性の品種を開発する際の掛け合わせ候補にするなどの育種に利用することもできる。
【実施例】
【0038】
以下、本発明を実施例にて詳細に説明する。しかしながら、本発明はそれらに何ら限定されるものではない。なお、特に断りのない限り、「部」は質量基準である。
【0039】
[実施例1]
公知の高温登熟における5品種のイネ(「日本晴」、「こしいぶき」、「てんたかく」、「ササニシキ」及び「初星」)の遺伝子発現変動(Plant Physiol., (2007) Vol.144, pp.258-277)と、高温登熟種子の表現型と類似した表現型を有するflory2変異体(flo2変異体)の遺伝子発現変動と、マイクロアレイ分析により比較した。flo2変異体の遺伝子発現変動については、Rice Expression Database (http://cdna02.dna.affrc.go.jp/RED/) で公開されているものを利用した。
遺伝子発現変動の比較は、具体的には、高温ストレスにより変動した遺伝子のうち、75%以下に減少し、かつflo2変異体で1/5以下に減少していた遺伝子を選択した。これらのデータを比較した結果、高温登熟における遺伝子発現変動パターンとflo2変異体のパターンとに共通して発現減少を示す遺伝子として123種類が見出された。このうちから、ATP量の減少に着目して、F1ATP合成酵素βサブユニット遺伝子を抽出した。
【0040】
イネ(oryza sativa L.)の胚乳に由来するF1ATPaseβをコードする完全長cDNAクローンから、プライマーF1b-E_XbaI(CTATCTAGAATGGCGACTCGCCGGGC:配列番号3)、プライマーF1b-R-PmaCI(CCCCACGTGTTATGAAGCCGACTCCTTG:配列番号4)を用いて、PCR法によって部分配列を増幅した。PCRにはKOD plus DNA polymemrase(TOYOBO)を用いた。反応液の組成はKOD plus DNA polymemraseに付属する説明書に従った。PCRの反応条件は、94℃で2分間保持した後、94℃で30秒間、55℃で30秒間、68℃で3分間の繰返しを30サイクル行った後、68℃で10分間保持した。得られた増幅断片はアガロースゲル電気泳動で分離し、目的の増幅断片を抽出、精製した。断片の精製にはWizard SV Gel and PCR Clean-Up System(Promega)を用いた。精製した断片はpENTR/D-TOPO cloning kit(Invitrogen)を用いてpENTR/D-TOPO(Invitrogen)にクローニングして、Gateway法で用いるEntryプラスミドとした。
EntryプラスミドをEcoRVで切断し、これを線状とした後、フェノール処理を行って残存する制限酵素を除去した。このEntryプラスミド100ngを用い、150ngのpANDA vectorと混合し、LR clonase (Invitrogen)を加えて、25℃60分間反応させることで、Gateway法を利用してF1ATPaseβ遺伝子のRNAiを誘導する遺伝子を構築した。
【0041】
得られたF1ATP合成酵素β遺伝子を、形質転換用プラスミドとしてアグロバクテリウム(Agrobacterium tumefaciens EHA105)を用いてイネ栽培品種の日本晴に導入し、形質転換体を作製した
形質転換は、公知の方法(Hiei, Y. et al., Plant J., 6, 271-282 (1994))に従って行った。即ち、形質転換用プラスミドを導入したアグロバクテリウムの菌体を懸濁し、これに30μlのアセトシリンゴン溶液 (10mg/ml)を加え、この懸濁液を用いてイネの培養細胞に感染させた。感染後の培養細胞は28℃、暗所で3日間の共存培養を行った。共存培養後の培養細胞は滅菌水で洗浄後、N6D (+Cla)プレート培地(Hiei, Y. et al., Plant J., 6, 271-282 (1994))に置床し、28℃、明条件で3〜7日間培養した。N6D (+Cla) プレート培地で培養した培養細胞を、N6D (+Cla、Hm) プレート培地(同)に移植し、28℃、明条件で3〜4週間培養した。その後、MSR (+Hm) プレート培地(同)に移植した。この培養細胞を28℃、明条件で培養し、ハイグロマイシン耐性により培養細胞を選抜した。
得られた日本晴由来の形質転換体を、通常環境で栽培した。
本実施例で用いた「通常環境」での処理(栽培)は、相対湿度70%において、33℃12時間(昼)/25℃12時間(夜)の昼夜サイクルにて周期的に温度条件を変更する処理である。
約4ヵ月の通常環境下での栽培を継続した結果、白濁した玄米を形成する形質転換体が得られた。従ってF1ATP合成酵素βサブユニットの遺伝子の発現を抑制すると、高温登熟障害のひとつである玄米の白濁化を誘導することができた。
【0042】
[実施例2]
実施例1においてF1ATP合成酵素βサブユニットの遺伝子の発現抑制が玄米の白濁化を誘導したことから、F1ATP合成酵素βサブユニットの遺伝子を強発現させるベクターを以下のようにして構築した。
イネゲノムDNAから、プライマーGluB4-B-XbaI(CCCTCTAGAAGCTATTTGAGGATGTTATT:配列番号5)、プライマーGluB4-A-EcoRI(CCCGAATTCTACAGGGTTCCTTGCGTGAA:配列番号6)を用いて、実施例1で行ったものと同一の条件によるPCRによって、グルテリンB4遺伝子のプロモーター部位(配列番号7、GenBank accession number: AY427571)を増幅した。
F1ATPaseβ遺伝子をコードするcDNA配列は、実施例1と同様にして、イネ完全長cDNAクローンから同様にPCRによって増幅した。
用いたプライマーは、F1ATPaseβ遺伝子の開始コドン上流とグルテリンB4プロモータの下流を接続可能となるように、設計されたものである。
得られたグルテリン4プロモータに相当するDNA断片の下流に、F1ATP合成酵素βサブユニットに相当するDNA断片が位置するように、これらをそれぞれEcoRIと
XbaI、XbaIとPmaCIで切断することによって、ハイグロマイシン耐性遺伝子、NOSターミネーターを有するPCAMBIA1301ベクターのEcoRI切断部位とPmaCI切断部位(35Sプロモータ領域+GUS領域)に導入した。(図1参照)。
【0043】
得られたF1ATP合成酵素β高発現ベクターを、形質転換用プラスミドとしてアグロバクテリウム(Agrobacterium tumefaciens EHA105)を用いてイネ栽培品種の日本晴に導入し、形質転換体を作製した
形質転換は、公知の方法(Hiei, Y. et al., Plant J., 6, 271-282 (1994))に従い、実施例1と同様にして行った。即ち、形質転換用プラスミドを導入したアグロバクテリウムの菌体を懸濁し、これに30μlのアセトシリンゴン溶液 (10mg/ml)を加え、この懸濁液を用いてイネの培養細胞に感染させた。感染後の培養細胞は25℃、暗所で3日間の共存培養を行った。共存培養後の培養細胞は滅菌水で洗浄後、N6D (+Cla)プレート培地(Hiei, Y. et al., Plant J., 6, 271-282 (1994))に置床し、28℃、明条件で3〜7日間培養した。N6D (+Cla) プレート培地で培養した培養細胞を、N6D (+Cla、Hm) プレート培地(同)に移植し、28℃、明条件で3〜4週間培養した。その後、MSR (+Hm) プレート培地(同)に移植した。この培養細胞を28℃、明条件で培養し、ハイグロマイシン耐性により培養細胞を選抜した。
【0044】
得られた日本晴由来の形質転換体及び未処理の日本晴を、それぞれ通常環境下と高温登熟環境下で栽培した。方法は山川ら(Yamakawa et al., 2007, Plant Physiol.)の方法を用いた。この方法では、開花後5日目から15日目までの10日間をグロースチャンバー内で栽培するもので、高温登熟環境の栽培を行うため、グロースチャンバー内は昼の12時間を気温33℃、夜の12時間を気温28℃、湿度を常時70%に保たれていた。
一方、通常環境の栽培は、夜間の温度を気温25℃、昼間の温度を28℃とした以外は高温登熟環境と同一とした。
【0045】
開花後15日目の栽培終了時に、それぞれの植物体を回収し、粒の白濁化の程度を外観観察によって評価した。その結果、通常環境下での栽培では白濁が見られない日本晴は、高温登熟環境下での栽培では白濁するが、本発明にかかるF1ATP合成酵素βサブユニット遺伝子強発現株では、通常環境下での栽培でも高温登熟環境下での栽培でも白濁化は認められなかった。
このように、F1ATP合成酵素βサブユニットの遺伝子を強発現させることによって、高温耐性植物体を得ることができる。
【0046】
[実施例3]
高温耐性イネにおいて、ATP量が増加することを以下のようにして確認した。
イネ品種として、「日本晴」(Nipponnbare)、高温耐性として知られている「金南風」(Kinmaze)及び「台中65号」(Taichung 65)を、開花後(DAF)5日目から25日目まで、それぞれ実施例2と同様に、高温登熟環境と通常環境のそれぞれの環境下で栽培した。
開花後5日目、7日目、10日目、15日目、20日目及び25日目に種子を回収して、ルシフェラーゼアッセイ法によりATP量を測定した。ルシフェラーゼアッセイには、Lucifer 250-plus kit(キッコーマン社製)を使用し、ARVOTMLight luminometer(PerkinElmer社製)を使用した。各植物体からの種子を回収して質量を測定した後に、自動凍結粉砕器 TK-AM5(Tokken社製)を用いて液体窒素中で粉末化してから、キット内のバッファーに懸濁して測定した。結果を表1、図2〜図4に示す。なお、図2〜図4において、白四角は通常環境下でのATP量、黒四角は高温登熟環境でのATP量を表す。
【0047】
【表1】

【0048】
表1及び図2〜図4に示されるように、開花日から5〜15日の期間を比較すると、「金南風」(図2参照)では高温登熟環境での栽培と通常環境での栽培においてATP量に有意な差が認められないのに対して、「日本晴」(図3)と「台中65号」(図4)では高温登熟環境での栽培ではATP量の低下が認められた。特に、開花後7日目での測定値において大きな差異が認められた。開花後7日目は、貯蔵澱粉の合成が活性化する時期である。
従って、「金南風」は、高温耐性の品種であることがわかる。
【0049】
[実施例4]
実施例3で評価した「日本晴」、「金南風」及び「台中65号」について、高温登熟障害の発生有無について確認した。
実施例3と同様にして、高温登熟環境下及び通常環境下のそれぞれで栽培を行い、外観による白濁化の評価と、質量測定を行った。質量は、60粒まとめて精密天秤を用いて測定し、3反復で行ってその平均値とした。
結果を表2に示す。
【0050】
【表2】

【0051】
表2に示されるように、実施例3でATP量が高温登熟環境下でも低下しなかった「金南風」は、高温登熟環境下でも通常環境下と大きな差がなく、温度の変化に対して影響を受けないことが確認された。
一方、高温登熟環境下において開花後7日目のATP量の減少が認められた「日本晴」は、高温登熟環境下で粒の白濁化及び質量の減少が認められ、高温に対する抵抗性が低いことが確認された。また、同様に開花後7日目のATP量の減少が認められた「台中65号」は、高温登熟環境下で粒粒質量の低減が認められ、高温に対する抵抗性が低いことが確認された。
【0052】
従って、本発明によれば、ATP量を高発現することによって高温耐性植物を得ることができる。また、ATP量を指標として高温耐性植物を効果的にスクリーニングすることができる。
【技術分野】
【0001】
本発明は、高温耐性植物及びそのスクリーニング方法に関する。
【背景技術】
【0002】
近年、CO2の排出量の増加やオゾン層の破壊などによる地球温暖化の影響が懸念されている。特に、植物は至適温度の環境下において最も良好に生育することから、温度上昇に伴って種々の障害が確認されている。穀物の場合、温度上昇に伴う障害は収量の大幅な減少に繋がることもある。例えば、イネ科植物の場合、イネ登熟期の高温は胚乳の白濁化と収量の減少を引き起こすことが知られている。またトウモロコシの場合にも、穀粒の重量が減少することが知られている。このため、高温環境下でも適応可能な植物の開発が種々行われている。
【0003】
例えば、特許文献1には、熱ショックタンパク質sHS17.7遺伝子をイネ科植物細胞中に導入して恒常的に高発現させることによって、イネ科植物の環境ストレス、例えば、高温耐性、紫外線耐性、乾燥耐性などの複合環境ストレス下でも栽培可能な植物が得られると記載されている。
特許文献2には、脂肪酸不飽和化酵素遺伝子の発現を抑制することによって不飽和脂肪酸顔料を低下させることによって、タバコなどの植物に高温耐性が付与された植物が得られると記載されている。
特許文献3には、ADP−グルコースピロホスホリラーゼ(AGP)大サブユニットにアミノ酸変異を導入することによって、高温ストレス条件下で生育させると収量の増加をもたらすトウモロコシなどの植物が得られると記載されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2006−34252号公報
【特許文献2】WO00/19806号パンフレット
【特許文献3】特開2010−84号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、作物においては、高温環境下で単に生育できるだけでは十分でなく、作物の収量面においても通常栽培環境下と同等程度であることが要求される。特に、実を可食部とする作物植物では、登熟発生過程で高温に晒されると商品価値が著しく低下する。例えばイネの場合、通常温度での栽培と同様に胚乳の白濁化が生じないことや穀粒の質量が低下しないことが、高温耐性の特性として必要である。
また、高温耐性植物の開発については、高温耐性の特性を有する植物体を用いた交配が適用されることがあるが、このような高温耐性の植物体を選別する際に有効な指標がない。このため、経験に基づいて高温耐性植物を選別することが多く、効率的でない。
【0006】
従って、本発明の目的は、高温による可食部の障害が抑制された高温耐性植物を提供することである。
また本発明の目的は、効率よく高温耐性植物をスクリーニングする方法を提供することである。
【課題を解決するための手段】
【0007】
本発明は以下のとおりである。
[1] 以下の(a)又は(b)のタンパク質をコードする遺伝子と過剰発現プロモータとを含む植物体用の組換えベクター:
(a) 配列番号2で示されるアミノ酸配列からなるタンパク質、
(b) 配列番号2で示されるアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつミトコンドリアF1ATP合成酵素βサブユニット活性を有するタンパク質。
[2] 以下の(c)又は(d)のDNAと過剰発現プロモータとを含む植物体用の組換えベクター:
(c) 配列番号1で示される塩基配列からなるDNA、
(d) 配列番号1で示される塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつミトコンドリアF1ATP合成酵素βサブユニット活性を有するタンパク質をコードするDNA。
[3] 前記過剰発現プロモータが、高温耐性貯蔵タンパク質遺伝子プロモータである[1]又は[2]に記載の組換えベクター。
[4] 前記過剰発現プロモータが、グルテリンプロモータである[1]〜[3]のいずれかに記載の組換えベクター。
[5] [1]〜[4]のいずれかに記載の組換えベクターを、植物に導入することによって得られた高温耐性植物。
[6] イネ科植物である請求項[5]に記載の高温耐性植物。
[7] [1]〜[4]のいずれかに記載の組換えベクターを、植物に導入することを含む高温耐性植物の作出方法。
[8] 前記植物が、植物体、植物器官、植物組織又は植物細胞である[7]に記載の高温耐性植物の作出方法。
[9] 高温耐性植物をスクリーニングする方法であって、被検植物を、高温環境条件下で生育させる高温生育期間に供すること、前記高温生育期間後における前記被検植物におけるATP量を測定すること、得られたATP量が通常条件下での生育におけるATP量と比較して有意に低下していないものを、被検植物を高温耐性植物として選別すること、を含む高温耐性イネ科植物スクリーニング方法。
【発明の効果】
【0008】
本発明によれば、高温による可食部の障害が抑制された高温耐性植物及び、効率よく高温耐性植物をスクリーニングする方法を提供することができる。
【図面の簡単な説明】
【0009】
【図1】本発明の実施例2にかかるミトコンドリアF1ATP合成酵素βサブユニット高発現組換えベクターの作製を説明する図である。
【図2】本発明の実施例3にかかる「金南風」の高温登熟環境下でのATP量の変動を示すグラフである。
【図3】本発明の実施例3にかかる「日本晴」の高温登熟環境下でのATP量の変動を示すグラフである。
【図4】本発明の実施例3にかかる「台中65号」の高温登熟環境下でのATP量の変動を示すグラフである。
【発明を実施するための形態】
【0010】
本発明は、植物に普遍に存在するミトコンドリアのF1ATP合成酵素βサブユニット遺伝子が植物の高温耐性に寄与する遺伝子であることを見出したことに基づくものである。
即ち、本発明の高温耐性植物は、ミトコンドリアF1ATP合成酵素βサブユニット遺伝子を強発現させた形質転換体である。また、本発明の組換えベクターは、ミトコンドリアF1ATP合成酵素βサブユニット遺伝子を強発現させるための植物体用の組換えベクターであり、高温耐性植物を作出するために有用なものである。
【0011】
本発明において「高温耐性」とは、対象となる植物の生育において、昼夜サイクルに代表される高温域及び低温域の温度サイクルで構成された至適温度範囲の低温域において、最低温度が25℃以上高い温度でも障害(高温障害)が生じないことを意味し、対象となる植物によって異なるが、一般に、25℃以上の温度、好ましくは28℃以上の高温条件下でも植物に障害が生じないことを意味する。高温障害とは、至適温度での生育と比較して活性等が低下した状態を意味し、具体的には植物種によって異なるが、イネの場合、胚の白濁化又は穀粒の質量低下などに代表される高温登熟障害を挙げることができる。
なお、本明細書において「工程」との語は、独立した工程だけでなく、他の工程と明確に区別できない場合であっても本工程の所期の作用が達成されれば、本用語に含まれる。
以下、本発明について説明する。
【0012】
本発明にかかるミトコンドリアF1ATP合成酵素βサブユニット(以下、単に「F1ATP合成酵素βサブユニット」ということがある)は、植物細胞内のミトコンドリアの内膜に存在するATP合成酵素のうち、ミトコンドリア内部側のF1部分を構成するサブニットのひとつである。F1ATP合成酵素βは、α、γ及びδの各サブユニットと共に、膜内のF0複合体と所定の立体構造を構成して、ミトコンドリアでのATP合成を担っている。本発明では、このようなF1ATP合成酵素βサブユニットを強発現させることによって、植物に高温耐性を付与することができ、イネの場合、高温登熟障害のひとつである胚乳の白濁化を効果的に抑制できる。
【0013】
本発明において、F1ATP合成酵素βサブユニット遺伝子は、配列番号1で示される塩基配列からなるDNA又は、この塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつF1ATP合成酵素βサブユニット活性を有するタンパク質をコードするDNA、或いは、配列番号2で示されるアミノ酸配列からなるタンパク質をコードする遺伝子又は、配列番号2で示されるアミノ酸配列において1若しくは数個(例えば、1〜10個)のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつF1ATP合成酵素βサブユニット活性を有するタンパク質をコードする遺伝子である。
【0014】
ここで、「配列番号1で示される塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつF1ATP合成酵素βサブユニット活性を有するタンパク質をコードするDNA」は、配列番号1で示される塩基配列からなるDNAと同等の配列を意味する。
ストリンジェントな条件とは、塩基配列同士が特異的にハイブリダイズし、非特異的にハイブリダイズしない条件を意味し、例えば、相同性が高い核酸、すなわち60%以上、好ましくは80%以上、より好ましくは90%以上の相同性を有するDNAの相補鎖がハイブリダイズし、それより相同性が低い核酸の相補鎖がハイブリダイズしない条件が挙げられる。より具体的には、ナトリウム濃度が150〜900mM、好ましくは600〜900mMであり、温度が60〜68℃、好ましくは65℃での条件をいう。本発明において「相同性」を具体的な数値として示す場合、例えば、汎用されている相同性検索アルゴリズムであるBLAST(Basic Local Alignment Search Tool)(NCBI、又はAltschul, S. F. et al. J. Mol. Biol., 215:403-410(1990))を用いた配列比較で決定することができる。
【0015】
F1ATP合成酵素βサブユニット活性とは、ADPとP1のATPへの変換を生じ得るものであればよい。対象となるタンパク質がF1ATP合成酵素βサブユニット活性を有していることは、例えば、ATPの生成によって確認することができる。
【0016】
F1ATP合成酵素β遺伝子の配列は、種々の植物由来のF1ATP合成酵素βサブユニット遺伝子として公知であり、目的とする植物細胞の遺伝子から後述するプライマーを用いて単離してもよく、生物のcDNAライブラリーから単離することで得てもよい。本明細書において示される所定の配列から合成してもよい。例えば、イネ(Oryza sativa L. japonica)のF1ATP合成酵素βサブユニットの遺伝子の全長のcDNAは、例えば、GenBank Accession No.AK061681として入手可能である。
【0017】
本発明にかかるF1ATP合成酵素β遺伝子を過剰発現させるプロモータとしては、恒常的な発現を可能にするものであればよく、例えばカリフラワーモザイクウイルス35Sプロモータ、NOSプロモータ、ユビキチンプロモータ、RuBisCOの小サブユニット遺伝子のプロモータ、LHCP(集光タンパク質)等の光合成関連遺伝子のプロモータ、イネアクチンプロモータ、貯蔵デンプンや貯蔵タンパク質の生合成に関わる遺伝子のプロモータ等が挙げられる。中でも、制御下にある遺伝子を高温下で発現可能なプロモータであることが好ましく、例えば、ヒートショックタンパク質遺伝子プロモータ(例えば、HSP26プロモータなど)又は貯蔵タンパク質遺伝子プロモータ等を挙げることができる。より好ましくは、高温耐性貯蔵タンパク質遺伝子プロモータ、例えば、グルテリンプロモータ、プロラミンプロモータ等が好ましく、グルテリンプロモータが特に好ましい。
【0018】
本発明における組換えベクターは、必要に応じて、転写のエンハンサーなどのシスエレメント、スプライシングシグナル、ポリA付加シグナル、選択マーカー、リボソーム結合配列(SD配列)、NOSなどのターミネーター、等を有していてもよい。選択マーカーとしては、例えば、抗生物質耐性遺伝子(例えば、アンピシリン、ネオマイシン、カナマイシン、ハイグロマイシンの各耐性遺伝子)、除草剤耐性遺伝子(例えば、ビアラホス耐性遺伝子)、突然変異型アセト乳酸合成酵素遺伝子などが挙げられる。
【0019】
また組換えベクターには、目的とする遺伝子の導入を確認するためのレポーター遺伝子を含んでいてもよい。このようなレポーター遺伝子としては、GUS(β−グルクロニダーゼ)遺伝子、ルシフェラーゼ遺伝子、GFP(緑色蛍光タンパク質)遺伝子等を挙げることができる。
【0020】
植物形質転換用ベクターとしては、例えば、pCAMBIA1301等のpCAMBIAベクター(オーストラリアCAMBIA)、pGWB2等のpGWBベクター(GenBank Accession No.AB289765、J.Biosci Bioeng. 2007 Jul;104(1):34-41)、MATベクター(日本製紙)、pBI121等が挙げられる。
【0021】
F1ATP合成酵素βサブユニット遺伝子をベクターに組み込むには、例えば、当該遺伝子を含むDNA断片を適当な制限酵素で切断し、ベクター中の過剰発現プロモータ下流の適当な制限酵素部位にイン・フレームとなるように、当業界で公知の技術を用いて挿入すればよい。
【0022】
本発明にかかる組換えベクターが導入される植物としては、特に制限されず、例えば、単子葉植物及び双子葉植物のいずれでもよい。単子葉植物としては、具体的には、イネ科のイネ、コムギ、オオムギ、カラスムギ、ライムギ、キビ、アワ、ヒエ、トウモロコシ、シコクビエ、モロコシ、タケ、ヨシ、ススキ、アマランサス、ミスカンサス、スイッチグラス、ソルガム等、サトイモ科のサトイモ等、ヤシ科のヤシ、ナツメヤシ等、バショウ科のバナナ等が挙げられる。
また双子葉植物としては、具体的には、ナス科のナス、タバコ、トマト、ジャガイモ等、ウリ科のメロン、カボチャ等、マメ科のダイズ等、ブドウ科のブドウ等が挙げられる。
これらの植物としては、高温耐性効果の確実性の観点から、イネ科の植物であることが好ましく、イネであることが更に好ましい。
【0023】
組換えベクターを導入する植物試料としては、植物体全体、植物器官(例えば葉、花弁、茎、根、種子等)、植物組織(例えば表皮、師部、柔組織、木部、維管束、柵状組織、海綿状組織等)、植物細胞(例えばカルス)等が挙げられる。
【0024】
目的遺伝子を含む上記組換えベクターは、植物の形質転換に用いられる方法、例えばアグロバクテリウム法、パーティクルガン法、PEG法、エレクトロポレーション法等によって植物細胞中に導入することができる。例えばアグロバクテリウム法を用いる場合は、構築した植物用発現ベクターを適当なアグロバクテリウム、例えばアグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)に導入し、この菌株をイネのカルスに接種して感染させ、トランスジェニック植物細胞を得ることができる。また、パーティクルガン法を用いる場合には、市販の遺伝子導入装置を製造業者の説明書に従って使用すればよい。遺伝子導入装置による操作条件は植物又は試料により異なるが、通常は450psi〜2000psi程度の圧力、4cm〜12cm程度の距離で行う。植物試料としては、植物体、植物器官、又は植物組織自体をそのまま使用してもよく、切片を調製した後に使用してもよく、プロトプラストを調製して使用してもよい。
【0025】
形質転換した腫瘍組織やシュート、毛状根等は、例えば従来知られている植物組織培養法を用い、適当な濃度の植物ホルモン(オーキシン、サイトカイニン、ジベレリン、アブシジン酸、エチレン、ブラシノライド等)の投与などによって植物体に再生させることができる。
目的遺伝子が目的のトランスジェニックイネ科植物に導入されたか否かの確認は、PCR法、サザンハイブリダイゼーション法、ノーザンハイブリダイゼーション法、ウェスタンブロット法等の通常用いられる技術を利用して行えばよい。
【0026】
本発明における高温耐性植物は、上記組換えベクターを植物に導入することによって得ることができる。
また本発明における高温耐性植物の作出方法は、上記組換えベクターを植物に導入することを含むものである。
【0027】
組換えベクターの導入については前述した事項をそのまま適用することができる。
作出された植物体又は、その繁殖形態(種子、切穂、塊茎など)はいずれも、野生型と比較してF1ATP合成酵素βサブユニットが過剰発現されており、高温環境に対して耐性を示す。特にイネの場合、高温登熟障害、例えば穀粒の白濁化、穀粒の質量低下又はこれらの組み合わせが効果的に抑制された植物体となる。
本発明において得られた高温耐性植物では、安定してF1ATP合成酵素βサブユニットが過剰発現されているので、高温耐性植物を、植物種に応じた通常の方法に従って、継代、維持することができる。
【0028】
本発明における高温耐性植物のスクリーニング方法は、被検植物を、高温環境条件下で生育させる高温生育期間に供すること(以下、高温生育工程)、前記高温生育期間後における前記被検植物におけるATP量を測定すること(以下、測定工程)、測定によって得られたATP量が通常条件での生育時でのATP量よりも有意に低下していない被検植物を高温耐性植物として選別すること、(以下、選別工程)、を含む高温耐性イネ科植物スクリーニング方法である。
本発明は、高温条件下で生育させてもATP量が変化しない植物が、可食部の高温障害が抑制された高温耐性植物であることを見出したことに基づくものである。このような高温耐性植物では、F1ATP合成酵素βサブユニットの活性が高温条件下でも低下しないため、ATP量が低下しない。従って、植物におけるATP量に基づいて効率よく高温耐性植物をスクリーニングすることができる。
【0029】
本スクリーニング方法における高温生育工程では、被検植物を高温環境条件下で生育させる。本スクリーニング方法における「高温環境条件」とは、被検植物によって異なるが、当該植物の品種及び/又は栽培場所によって通常用いられる種子の登熟期の生育環境の温度条件よりも相対的に高い温度条件をいい、一般に、高温域及び低温域で構成された温度サイクルにおいて、低温域の最低温度が25℃以上、好ましくは低温域の温度が25℃〜30℃、特に28℃程度であることを言う。本発明における高温条件の例としては、低温域の温度として25℃〜30℃(例えば28℃)で少なくとも2時間、好ましくは5時間以上曝露されることが挙げられる。なお、高温域については特に限定されず、被検植物が生育可能であればよい。適用可能な高温域については、植物種及び栽培地域によって異なるが、例えば、30℃〜35℃の範囲とすることができる。また昼夜サイクルは、ほぼ半日毎のサイクルとすることができるが、必ずしもこれに限定されず、対象となる植物の生育条件に応じて、適宜変更可能である。
【0030】
高温生育工程に適用される好ましい高温環境サイクルとしては、被検植物の種類によって異なり、植物種に応じて当業界で公知の高温環境サイクルを適用すればよい。例えば、イネ科植物の場合、12時間/12時間の昼夜サイクルとし、それぞれ30℃〜33℃/25℃〜30℃の条件を適用すればよい(例えば、Plant Physiol., (2007) Vol.144, pp.258-277)が、これに限定されない。
【0031】
また「通常条件」とは、被検植物の通常の生育環境と等しい温度条件をいい、被検植物の種類によって異なり、植物種に応じて当業界で公知の通常条件サイクルを適用すればよい。例えば、イネの場合、15℃〜35℃の平均温度の範囲内で、12時間/12時間の昼夜サイクルとし、種子の登熟期の昼間条件を25℃〜30℃、夜間条件を15℃〜25℃とすることができるが、これに限定されない。
【0032】
より確実に高温耐性植物をスクリーニングする観点から、高温環境条件は、被検植物の胚乳期に上記高温環境条件に付すことが好ましく、胚乳において貯蔵物質(例えば、貯蔵デンプン)の生合成が活発に行われている時期であることが更に好ましい。イネの場合、貯蔵物質の生合成は開花から5日目〜7日目の期間で高くなるので、この時期に高温環境条件下で生育されていればよい。例えば、開花から〜15日目、好ましくは開花から5日目〜10日目の期間、更に好ましくは開花から5日目〜7日目まで高温環境条件下で被検植物の生育を行う。
【0033】
測定工程で適用されるATP量の測定は、当業界で既知の方法、例えばルシフェラーゼ発光法などによって測定すればよく、特に制限されない。ルシフェラーゼ発光法による測定については、市販のルシフェラーゼアッセイキット(例えば、キッコーマン社製など)を利用してもよい。
【0034】
また、ATP量の測定方法は、ATP量が高温生育期間前又は通常条件下での生育での量との相対量が検出できれば、ATP量を直接測定する方法に限定されない。例えば、ATP合成酵素の発現量に対応していることから、F1ATP合成酵素βサブユニットの発現量に基づいて測定してもよい。F1ATP合成酵素βサブユニットの発現量の測定には、この目的のために当業界で通常用いられている方法を適用すればよく、例えば、PCR法、サザンハイブリダイゼーション法、ノーザンハイブリダイゼーション法、ドットブロット等を挙げることができる。
【0035】
ATP量の測定は、上記の高温生育期間にわたって測定してもよいが、好ましくは開花から5〜10日、効率的観点からは、貯蔵澱粉などの貯蔵物質の生産が活発化する時期、例えばイネの場合、7日目で測定すればよい。この時期で測定を行うことによって、高温生育条件に基づくストレスが最も顕著に表れるため、通常条件下でのATP量と差が大きくなる傾向があり、好ましい。
【0036】
選別工程では、得られたATP量が通常条件での生育時でのATP量と比較して低下していないものを、被検植物を高温耐性植物として選別する。
ATP量の対比については、高温生育期間開始時に測定したATP量と比較してもよく、また通常条件による文献値としてのATP量と対比してもよい。
高温耐性植物であるとの判定については、通常条件での生育時での通常ATP量と比較して有意に低下していないか否かにより判定すればよい。ここで「通常ATP量と比較して有意に低下していない」とは、同等以上のものを意味しており、例えば、通常ATP量と比較して20%以内の低下率、好ましくは通常ATP量と比較して10%以内の低下率のものから、通常ATP量を上回るものを高温耐性植物と判定することができる。
【0037】
本発明におけるスクリーニング方法で得られた高温耐性植物は、それ自体を高温環境下での栽培に利用すると共に、高温耐性の品種を開発する際の掛け合わせ候補にするなどの育種に利用することもできる。
【実施例】
【0038】
以下、本発明を実施例にて詳細に説明する。しかしながら、本発明はそれらに何ら限定されるものではない。なお、特に断りのない限り、「部」は質量基準である。
【0039】
[実施例1]
公知の高温登熟における5品種のイネ(「日本晴」、「こしいぶき」、「てんたかく」、「ササニシキ」及び「初星」)の遺伝子発現変動(Plant Physiol., (2007) Vol.144, pp.258-277)と、高温登熟種子の表現型と類似した表現型を有するflory2変異体(flo2変異体)の遺伝子発現変動と、マイクロアレイ分析により比較した。flo2変異体の遺伝子発現変動については、Rice Expression Database (http://cdna02.dna.affrc.go.jp/RED/) で公開されているものを利用した。
遺伝子発現変動の比較は、具体的には、高温ストレスにより変動した遺伝子のうち、75%以下に減少し、かつflo2変異体で1/5以下に減少していた遺伝子を選択した。これらのデータを比較した結果、高温登熟における遺伝子発現変動パターンとflo2変異体のパターンとに共通して発現減少を示す遺伝子として123種類が見出された。このうちから、ATP量の減少に着目して、F1ATP合成酵素βサブユニット遺伝子を抽出した。
【0040】
イネ(oryza sativa L.)の胚乳に由来するF1ATPaseβをコードする完全長cDNAクローンから、プライマーF1b-E_XbaI(CTATCTAGAATGGCGACTCGCCGGGC:配列番号3)、プライマーF1b-R-PmaCI(CCCCACGTGTTATGAAGCCGACTCCTTG:配列番号4)を用いて、PCR法によって部分配列を増幅した。PCRにはKOD plus DNA polymemrase(TOYOBO)を用いた。反応液の組成はKOD plus DNA polymemraseに付属する説明書に従った。PCRの反応条件は、94℃で2分間保持した後、94℃で30秒間、55℃で30秒間、68℃で3分間の繰返しを30サイクル行った後、68℃で10分間保持した。得られた増幅断片はアガロースゲル電気泳動で分離し、目的の増幅断片を抽出、精製した。断片の精製にはWizard SV Gel and PCR Clean-Up System(Promega)を用いた。精製した断片はpENTR/D-TOPO cloning kit(Invitrogen)を用いてpENTR/D-TOPO(Invitrogen)にクローニングして、Gateway法で用いるEntryプラスミドとした。
EntryプラスミドをEcoRVで切断し、これを線状とした後、フェノール処理を行って残存する制限酵素を除去した。このEntryプラスミド100ngを用い、150ngのpANDA vectorと混合し、LR clonase (Invitrogen)を加えて、25℃60分間反応させることで、Gateway法を利用してF1ATPaseβ遺伝子のRNAiを誘導する遺伝子を構築した。
【0041】
得られたF1ATP合成酵素β遺伝子を、形質転換用プラスミドとしてアグロバクテリウム(Agrobacterium tumefaciens EHA105)を用いてイネ栽培品種の日本晴に導入し、形質転換体を作製した
形質転換は、公知の方法(Hiei, Y. et al., Plant J., 6, 271-282 (1994))に従って行った。即ち、形質転換用プラスミドを導入したアグロバクテリウムの菌体を懸濁し、これに30μlのアセトシリンゴン溶液 (10mg/ml)を加え、この懸濁液を用いてイネの培養細胞に感染させた。感染後の培養細胞は28℃、暗所で3日間の共存培養を行った。共存培養後の培養細胞は滅菌水で洗浄後、N6D (+Cla)プレート培地(Hiei, Y. et al., Plant J., 6, 271-282 (1994))に置床し、28℃、明条件で3〜7日間培養した。N6D (+Cla) プレート培地で培養した培養細胞を、N6D (+Cla、Hm) プレート培地(同)に移植し、28℃、明条件で3〜4週間培養した。その後、MSR (+Hm) プレート培地(同)に移植した。この培養細胞を28℃、明条件で培養し、ハイグロマイシン耐性により培養細胞を選抜した。
得られた日本晴由来の形質転換体を、通常環境で栽培した。
本実施例で用いた「通常環境」での処理(栽培)は、相対湿度70%において、33℃12時間(昼)/25℃12時間(夜)の昼夜サイクルにて周期的に温度条件を変更する処理である。
約4ヵ月の通常環境下での栽培を継続した結果、白濁した玄米を形成する形質転換体が得られた。従ってF1ATP合成酵素βサブユニットの遺伝子の発現を抑制すると、高温登熟障害のひとつである玄米の白濁化を誘導することができた。
【0042】
[実施例2]
実施例1においてF1ATP合成酵素βサブユニットの遺伝子の発現抑制が玄米の白濁化を誘導したことから、F1ATP合成酵素βサブユニットの遺伝子を強発現させるベクターを以下のようにして構築した。
イネゲノムDNAから、プライマーGluB4-B-XbaI(CCCTCTAGAAGCTATTTGAGGATGTTATT:配列番号5)、プライマーGluB4-A-EcoRI(CCCGAATTCTACAGGGTTCCTTGCGTGAA:配列番号6)を用いて、実施例1で行ったものと同一の条件によるPCRによって、グルテリンB4遺伝子のプロモーター部位(配列番号7、GenBank accession number: AY427571)を増幅した。
F1ATPaseβ遺伝子をコードするcDNA配列は、実施例1と同様にして、イネ完全長cDNAクローンから同様にPCRによって増幅した。
用いたプライマーは、F1ATPaseβ遺伝子の開始コドン上流とグルテリンB4プロモータの下流を接続可能となるように、設計されたものである。
得られたグルテリン4プロモータに相当するDNA断片の下流に、F1ATP合成酵素βサブユニットに相当するDNA断片が位置するように、これらをそれぞれEcoRIと
XbaI、XbaIとPmaCIで切断することによって、ハイグロマイシン耐性遺伝子、NOSターミネーターを有するPCAMBIA1301ベクターのEcoRI切断部位とPmaCI切断部位(35Sプロモータ領域+GUS領域)に導入した。(図1参照)。
【0043】
得られたF1ATP合成酵素β高発現ベクターを、形質転換用プラスミドとしてアグロバクテリウム(Agrobacterium tumefaciens EHA105)を用いてイネ栽培品種の日本晴に導入し、形質転換体を作製した
形質転換は、公知の方法(Hiei, Y. et al., Plant J., 6, 271-282 (1994))に従い、実施例1と同様にして行った。即ち、形質転換用プラスミドを導入したアグロバクテリウムの菌体を懸濁し、これに30μlのアセトシリンゴン溶液 (10mg/ml)を加え、この懸濁液を用いてイネの培養細胞に感染させた。感染後の培養細胞は25℃、暗所で3日間の共存培養を行った。共存培養後の培養細胞は滅菌水で洗浄後、N6D (+Cla)プレート培地(Hiei, Y. et al., Plant J., 6, 271-282 (1994))に置床し、28℃、明条件で3〜7日間培養した。N6D (+Cla) プレート培地で培養した培養細胞を、N6D (+Cla、Hm) プレート培地(同)に移植し、28℃、明条件で3〜4週間培養した。その後、MSR (+Hm) プレート培地(同)に移植した。この培養細胞を28℃、明条件で培養し、ハイグロマイシン耐性により培養細胞を選抜した。
【0044】
得られた日本晴由来の形質転換体及び未処理の日本晴を、それぞれ通常環境下と高温登熟環境下で栽培した。方法は山川ら(Yamakawa et al., 2007, Plant Physiol.)の方法を用いた。この方法では、開花後5日目から15日目までの10日間をグロースチャンバー内で栽培するもので、高温登熟環境の栽培を行うため、グロースチャンバー内は昼の12時間を気温33℃、夜の12時間を気温28℃、湿度を常時70%に保たれていた。
一方、通常環境の栽培は、夜間の温度を気温25℃、昼間の温度を28℃とした以外は高温登熟環境と同一とした。
【0045】
開花後15日目の栽培終了時に、それぞれの植物体を回収し、粒の白濁化の程度を外観観察によって評価した。その結果、通常環境下での栽培では白濁が見られない日本晴は、高温登熟環境下での栽培では白濁するが、本発明にかかるF1ATP合成酵素βサブユニット遺伝子強発現株では、通常環境下での栽培でも高温登熟環境下での栽培でも白濁化は認められなかった。
このように、F1ATP合成酵素βサブユニットの遺伝子を強発現させることによって、高温耐性植物体を得ることができる。
【0046】
[実施例3]
高温耐性イネにおいて、ATP量が増加することを以下のようにして確認した。
イネ品種として、「日本晴」(Nipponnbare)、高温耐性として知られている「金南風」(Kinmaze)及び「台中65号」(Taichung 65)を、開花後(DAF)5日目から25日目まで、それぞれ実施例2と同様に、高温登熟環境と通常環境のそれぞれの環境下で栽培した。
開花後5日目、7日目、10日目、15日目、20日目及び25日目に種子を回収して、ルシフェラーゼアッセイ法によりATP量を測定した。ルシフェラーゼアッセイには、Lucifer 250-plus kit(キッコーマン社製)を使用し、ARVOTMLight luminometer(PerkinElmer社製)を使用した。各植物体からの種子を回収して質量を測定した後に、自動凍結粉砕器 TK-AM5(Tokken社製)を用いて液体窒素中で粉末化してから、キット内のバッファーに懸濁して測定した。結果を表1、図2〜図4に示す。なお、図2〜図4において、白四角は通常環境下でのATP量、黒四角は高温登熟環境でのATP量を表す。
【0047】
【表1】

【0048】
表1及び図2〜図4に示されるように、開花日から5〜15日の期間を比較すると、「金南風」(図2参照)では高温登熟環境での栽培と通常環境での栽培においてATP量に有意な差が認められないのに対して、「日本晴」(図3)と「台中65号」(図4)では高温登熟環境での栽培ではATP量の低下が認められた。特に、開花後7日目での測定値において大きな差異が認められた。開花後7日目は、貯蔵澱粉の合成が活性化する時期である。
従って、「金南風」は、高温耐性の品種であることがわかる。
【0049】
[実施例4]
実施例3で評価した「日本晴」、「金南風」及び「台中65号」について、高温登熟障害の発生有無について確認した。
実施例3と同様にして、高温登熟環境下及び通常環境下のそれぞれで栽培を行い、外観による白濁化の評価と、質量測定を行った。質量は、60粒まとめて精密天秤を用いて測定し、3反復で行ってその平均値とした。
結果を表2に示す。
【0050】
【表2】

【0051】
表2に示されるように、実施例3でATP量が高温登熟環境下でも低下しなかった「金南風」は、高温登熟環境下でも通常環境下と大きな差がなく、温度の変化に対して影響を受けないことが確認された。
一方、高温登熟環境下において開花後7日目のATP量の減少が認められた「日本晴」は、高温登熟環境下で粒の白濁化及び質量の減少が認められ、高温に対する抵抗性が低いことが確認された。また、同様に開花後7日目のATP量の減少が認められた「台中65号」は、高温登熟環境下で粒粒質量の低減が認められ、高温に対する抵抗性が低いことが確認された。
【0052】
従って、本発明によれば、ATP量を高発現することによって高温耐性植物を得ることができる。また、ATP量を指標として高温耐性植物を効果的にスクリーニングすることができる。
【特許請求の範囲】
【請求項1】
以下の(a)又は(b)のタンパク質をコードする遺伝子と過剰発現プロモータとを含む植物体用の組換えベクター:
(a) 配列番号2で示されるアミノ酸配列からなるタンパク質、
(b) 配列番号2で示されるアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつミトコンドリアF1ATP合成酵素βサブユニット活性を有するタンパク質。
【請求項2】
以下の(c)又は(d)のDNAと過剰発現プロモータとを含む植物体用の組換えベクター:
(c) 配列番号1で示される塩基配列からなるDNA、
(d) 配列番号1で示される塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつミトコンドリアF1ATP合成酵素βサブユニット活性を有するタンパク質をコードするDNA。
【請求項3】
前記過剰発現プロモータが、高温耐性貯蔵タンパク質遺伝子プロモータである請求項1又は請求項2記載の組換えベクター。
【請求項4】
前記過剰発現プロモータが、グルテリンプロモータである請求項1〜請求項3のいずれか1項記載の組換えベクター。
【請求項5】
請求項1〜請求項4のいずれか1項記載の組換えベクターを、植物に導入することによって得られた高温耐性植物。
【請求項6】
イネ科植物である請求項5記載の高温耐性植物。
【請求項7】
請求項1〜請求項4のいずれか1項記載の組換えベクターを、植物に導入することを含む高温耐性植物の作出方法。
【請求項8】
前記植物が、植物体、植物器官、植物組織又は植物細胞である請求項7記載の耐熱性植物の作出方法。
【請求項9】
高温耐性植物をスクリーニングする方法であって、
被検植物を、高温環境条件下で生育させる高温生育期間に供すること、
前記高温生育期間後における前記被検植物におけるATP量を測定すること、
得られたATP量が通常条件下での生育におけるATP量と比較して有意に低下していないものを、被検植物を高温耐性植物として選別すること、
を含む高温耐性イネ科植物スクリーニング方法。
【請求項1】
以下の(a)又は(b)のタンパク質をコードする遺伝子と過剰発現プロモータとを含む植物体用の組換えベクター:
(a) 配列番号2で示されるアミノ酸配列からなるタンパク質、
(b) 配列番号2で示されるアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつミトコンドリアF1ATP合成酵素βサブユニット活性を有するタンパク質。
【請求項2】
以下の(c)又は(d)のDNAと過剰発現プロモータとを含む植物体用の組換えベクター:
(c) 配列番号1で示される塩基配列からなるDNA、
(d) 配列番号1で示される塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつミトコンドリアF1ATP合成酵素βサブユニット活性を有するタンパク質をコードするDNA。
【請求項3】
前記過剰発現プロモータが、高温耐性貯蔵タンパク質遺伝子プロモータである請求項1又は請求項2記載の組換えベクター。
【請求項4】
前記過剰発現プロモータが、グルテリンプロモータである請求項1〜請求項3のいずれか1項記載の組換えベクター。
【請求項5】
請求項1〜請求項4のいずれか1項記載の組換えベクターを、植物に導入することによって得られた高温耐性植物。
【請求項6】
イネ科植物である請求項5記載の高温耐性植物。
【請求項7】
請求項1〜請求項4のいずれか1項記載の組換えベクターを、植物に導入することを含む高温耐性植物の作出方法。
【請求項8】
前記植物が、植物体、植物器官、植物組織又は植物細胞である請求項7記載の耐熱性植物の作出方法。
【請求項9】
高温耐性植物をスクリーニングする方法であって、
被検植物を、高温環境条件下で生育させる高温生育期間に供すること、
前記高温生育期間後における前記被検植物におけるATP量を測定すること、
得られたATP量が通常条件下での生育におけるATP量と比較して有意に低下していないものを、被検植物を高温耐性植物として選別すること、
を含む高温耐性イネ科植物スクリーニング方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−188744(P2011−188744A)
【公開日】平成23年9月29日(2011.9.29)
【国際特許分類】
【出願番号】特願2010−54838(P2010−54838)
【出願日】平成22年3月11日(2010.3.11)
【出願人】(803000115)学校法人東京理科大学 (545)
【Fターム(参考)】
【公開日】平成23年9月29日(2011.9.29)
【国際特許分類】
【出願日】平成22年3月11日(2010.3.11)
【出願人】(803000115)学校法人東京理科大学 (545)
【Fターム(参考)】
[ Back to top ]

