高発現細胞の効率的な選別に有用な薬剤選択マーカー遺伝子発現カセット
【課題】目的タンパク質遺伝子を高レベルで発現する形質転換細胞を効率的に選別する方法の提供。
【解決手段】プロモーター、薬剤選択マーカー遺伝子、mRNA不安定化配列、及びポリアデニレーションシグナルを有する薬剤選択マーカー遺伝子発現カセット。また、かかるカセットを使用した、目的タンパク質遺伝子を高レベルで発現する細胞群の選別方法。
【解決手段】プロモーター、薬剤選択マーカー遺伝子、mRNA不安定化配列、及びポリアデニレーションシグナルを有する薬剤選択マーカー遺伝子発現カセット。また、かかるカセットを使用した、目的タンパク質遺伝子を高レベルで発現する細胞群の選別方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、遺伝子組換え技術によって、目的とするタンパク質の遺伝子を挿入した発現ベクターを宿主細胞に導入し、得られた形質転換細胞の中から目的とするタンパク質の遺伝子を高レベルで発現する細胞を効率的に選別するために使用できる薬剤選択マーカー遺伝子発現カセットに関する。本発明の薬剤選択マーカー遺伝子発現カセットは、所望のタンパク質の機能解析などの基礎研究は勿論、遺伝子工学的手法により、動物細胞において医薬品などの有用タンパク質を生産するために有用である。
【背景技術】
【0002】
組換えタンパク質を生産する発現システムの開発は、研究または治療に供されるタンパク質の供給源を提供するうえで重要である。発現システムとしては、大腸菌などの原核細胞に基づくもの、ならびに酵母(Saccharomyces属,Pichia属、Kluyveromyces属など)及び哺乳類細胞などの動物細胞を含む真核細胞に基づくものの両者が用いられている。これらの中でも動物細胞、特に哺乳類細胞に基づく発現システムが治療用タンパク質の製造には好ましい。なぜなら、ヒトをはじめとする哺乳類動物において起こるタンパク質の翻訳後修飾は、時にその生物活性に深く寄与するため、タンパク質の投与対象と類似した翻訳後修飾が可能な哺乳類細胞に基づく発現システムを利用した方が、治療用タンパク質の有効性を増強しうるからである。
【0003】
組換えタンパク質を産生する細胞を樹立する方法としては、一般に、目的タンパク質の遺伝子を発現する遺伝子構築物を宿主細胞へ遺伝子導入し、得られた形質転換細胞の中からこの遺伝子構築物が宿主細胞のゲノム上に安定導入された細胞を選別する。この際、前記遺伝子構築物に、薬剤選択マーカーとなる薬剤耐性遺伝子を目的タンパク質の遺伝子と同一プロモーター下あるいは別個のプロモーター下で発現するように挿入しておき、薬剤選択によって生き残った細胞を目的タンパク質の遺伝子が安定導入された細胞として選別する。目的タンパク質の発現レベルは、目的タンパク質をコードする遺伝子が宿主細胞ゲノム内のどの領域に導入されるかによって大きく変動するが、導入領域の制御は、通常不可能である。従って、遺伝子導入しても大半の細胞は目的タンパク質遺伝子を発現しないか又は発現量が低い。このため、従来、目的タンパク質遺伝子を高レベルで発現する形質転換細胞の取得には、1000〜数千の細胞サンプルから1〜2個の細胞株を選別する作業を数ヶ月〜1年かけて繰り返し行っており、目的タンパク質遺伝子を高レベルで発現する形質転換細胞の選別に膨大な労力と時間を要していた。
【0004】
そこで、目的タンパク質遺伝子を高レベルで発現する形質転換細胞を効率的に選別するため、薬剤選択マーカーの発現や機能を減弱化することに基づく方法が開発されてきた。薬剤選択マーカーの発現や機能を減弱化すると、薬剤選択マーカー遺伝子が宿主細胞ゲノム内の低発現領域に導入された形質転換細胞は、薬剤選択マーカー(薬剤耐性遺伝子)を十分に発現することができないので、死滅してしまい、高発現領域に導入された形質転換細胞のみが薬剤選択によって生き残る。この生き残った形質転換細胞では、薬剤選択マーカー遺伝子に隣接して目的タンパク質遺伝子を有する可能性が高いため、目的タンパク質遺伝子も宿主細胞ゲノム内の高発現部位に導入されており、目的タンパク質遺伝子が高レベルで発現されている可能性が高い。このことを利用して、目的タンパク質遺伝子を高レベルで発現する形質転換細胞を効率良く選別することができると考えられる。
【0005】
薬剤選択マーカーの発現や機能を減弱化する1つの方法としては、薬剤選択マーカーの発現に用いるプロモーターとして、転写活性の弱いプロモーターであるHerpes simplex virus thymidine kinase(HSV−tk)プロモーターを利用する方法(非特許文献1)や、野生型の転写活性レベルよりも減弱化された変異型プロモーターを用いて薬剤選択マーカーの発現を抑える方法(特許文献1、2)が挙げられる。しかしながら、本発明者らがこれらの方法を追試したところ、いずれの方法も薬剤選択マーカーの発現を減弱化するという面で効果がほとんど見られなかった。このことから、これらの方法を用いて目的タンパク質遺伝子を高レベルで発現する形質転換細胞を効率的に選別するということは難しいと考えられた。
【0006】
薬剤選択マーカーの発現や機能を減弱化する別の方法としては、ネオマイシンホスホトランスフェラーゼなどの薬剤選択マーカー遺伝子のコード配列に変異を導入して薬剤選択マーカー自体の機能を減弱化する方法(特許文献3、4)が挙げられる。本発明者らがこの方法を追試したところ、この方法を用いることにより薬剤選択マーカーの機能を多少減弱化することができ、薬剤選択の結果として少量の発現量の向上した細胞株を取得することができた。しかしながら、目的タンパク質遺伝子を高レベルで発現する形質転換細胞を選別する点での効率は良くなく、この方法による顕著な効果は見られなかった。
【0007】
このように、従来公知の薬剤選択マーカーの発現や機能を減弱化する方法は、いずれも効率が悪く、目的タンパク質遺伝子を高レベルで発現する形質転換細胞を効率的に選別する好適な方法は未だ確立されていない。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】US5,627,033
【特許文献2】WO2005/024015
【特許文献3】WO2001/032901
【特許文献4】WO2004/050884
【非特許文献】
【0009】
【非特許文献1】Niwa H、Yamamura K,Miyazaki J.(1991) Gene 108:193−200
【非特許文献2】Bakheet T,Frevel M,Williams B.R.G、 Greer W,Khabar K.S.A.(2001) Nucleic Acids Research 29:246−254
【非特許文献3】Lagnado C.A,Brown C.L,Goodall G.J.(1994) Molecular and Cellular Biology 14:7984−7995
【非特許文献4】Zubiaga A.M,Belasco J.G,Greenberg M.E.(1995) Molecular and Cellular Biology 15:2219−2230
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明の目的は、目的タンパク質遺伝子を高レベルで発現する形質転換細胞を効率的に選別することを可能にすることにある。
【課題を解決するための手段】
【0011】
本発明者らは、上記目的を達成するため、薬剤選択マーカーの発現や機能を効率的に減弱化する別の方法について鋭意検討した結果、mRNA不安定化配列を利用して薬剤選択マーカー遺伝子の発現を減弱化することを想起した。そして、種々の薬剤選択マーカーの発現カセットにmRNA不安定化配列を挿入し、細胞の形質転換及び薬剤選択を行ったところ、コロニー数が有意に減少した。さらに導入された目的タンパク質遺伝子の発現を詳しく解析した結果、高発現細胞の割合が有意に上昇することを見出し、本発明を完成させるに到った。
【0012】
すなわち、本発明によれば、以下が提供される:
(1)プロモーター、薬剤選択マーカー遺伝子、mRNA不安定化配列、及びポリアデニレーションシグナルを有することを特徴とする薬剤選択マーカー遺伝子発現カセット。
(2)薬剤選択マーカー遺伝子が、タンパク質合成阻害系抗生物質耐性遺伝子であることを特徴とする(1)に記載の発現カセット。
(3)薬剤選択マーカー遺伝子が、ピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン−B−ホスホトランスフェラーゼ、及びネオマイシンホスホトランスフェラーゼからなる群より選択されることを特徴とする(2)に記載の発現カセット。
(4)mRNA不安定化配列が、サイトカイン、インターロイキン、又は癌原遺伝子の3’非翻訳領域に存在するATリッチ配列に由来することを特徴とする(1)〜(3)のいずれか一項に記載の発現カセット。
(5)mRNA不安定化配列が、TTATTTA(A/T)(A/T)のモチーフ配列を有することを特徴とする(1)〜(3)のいずれか一項に記載の発現カセット。
(6)モチーフ配列が、2回以上繰り返されていることを特徴とする(5)に記載の発現カセット。
(7)モチーフ配列の繰り返し間に1塩基以上のスペーサー配列を含むことを特徴とする(6)に記載の発現カセット。
(8)mRNA不安定化配列中に1ないし数塩基の置換、挿入または欠失を含むことを特徴とする(4)〜(7)のいずれか一項に記載の発現カセット。
(9)(1)〜(8)のいずれか一項に記載の薬剤選択マーカー遺伝子発現カセットを有することを特徴とする発現ベクター。
(10)目的タンパク質遺伝子発現カセットをさらに有することを特徴とする(9)に記載の発現ベクター。
(11)目的タンパク質遺伝子発現カセット中の目的タンパク質遺伝子が、抗体の重鎖又は/及び軽鎖遺伝子のコード配列であることを特徴とする(10)に記載の発現ベクター。
(12)マルチクローニングサイトを備えた発現カセットをさらに有することを特徴とする(9)に記載の発現ベクター。
(13)マルチクローニングサイトに目的タンパク質遺伝子が導入されていることを特徴とする(12)に記載の発現ベクター。
(14)(9)に記載の発現ベクターと、目的タンパク質遺伝子発現カセット又はマルチクローニングサイトを備えた発現カセットを有する発現ベクターとからなる一対の発現ベクター。
(15)マルチクローニングサイトに目的タンパク質遺伝子が導入されている(14)に記載の一対の発現ベクター。
(16)(9)〜(15)のいずれか一項に記載の発現ベクターで宿主細胞を形質転換して得られることを特徴とする形質転換細胞。
(17)宿主細胞が動物細胞であることを特徴とする(16)に記載の形質転換細胞。
(18)動物細胞が哺乳類細胞であることを特徴とする(17)に記載の形質転換細胞。
(19)哺乳類細胞がチャイニーズハムスター卵巣(CHO)細胞であることを特徴とする(18)に記載の形質転換細胞。
(20)(16)〜(19)のいずれか一項に記載の形質転換細胞を薬剤選択する工程を含むことを特徴とする、目的タンパク質遺伝子を高レベルで発現する細胞群を選別する方法。
(21)(16)〜(19)のいずれか一項に記載の形質転換細胞からなる細胞群であって、目的タンパク質遺伝子を高レベルで発現することを特徴とする細胞群。
(22)(16)〜(19)のいずれか一項に記載の形質転換細胞を用いることを特徴とする、タンパク質を生産する方法。
(23)タンパク質が、抗体であることを特徴とする(22)に記載の方法。
(24)タンパク質が、ワクチンであることを特徴とする(22)に記載の方法。
(25)(16)〜(19)のいずれか一項に記載の形質転換細胞を用いることを特徴とする、アミノ酸を生産する方法。
(26)(16)〜(19)のいずれかに記載の形質転換細胞を用いることを特徴とする、ヌクレオチドを生産する方法。
【発明の効果】
【0013】
本発明の薬剤選択マーカー遺伝子発現カセットは、mRNA不安定化配列が挿入されているため、mRNA不安定化配列を有さない従来の薬剤選択マーカー遺伝子発現カセットに比べてmRNAが不安定化されて薬剤選択マーカーの発現が減弱化されており、宿主細胞ゲノム内の高発現領域に組み込まれないと、薬剤存在下で形質転換細胞の生存が困難となる。このため、薬剤選択マーカー遺伝子及び目的タンパク質遺伝子が宿主細胞ゲノム内の高発現領域に組み込まれた形質転換細胞のみが薬剤選択によって生き残ることができる。その結果、目的タンパク質遺伝子を高レベルで発現する高発現細胞を効率的に選別することができる。
【図面の簡単な説明】
【0014】
【図1】pBS−CMV−SNAPm2の構築を示す図である。
【図2】pPUR・N4の構築を示す図である。以下、図中、Purとは、ピューロマイシン耐性遺伝子のことである。また、図中、iPCRとは、Inverse PCRのことである。
【図3】pBS−CMV−SNAPm−Pur及びpBS−CMV−SNAPm−Pur・N4の構築を示す図である。
【図4】pBS−CMV−SNAPm−Pur及びpBS−CMV−SNAPm−Pur・N4で形質転換された細胞集団のFACS解析の結果を示す図である。
【図5】pBS−CMV−SNAPm−Pur及びpBS−CMV−SNAPm−Pur・N4で形質転換された細胞集団のうち、SNAPmを高発現する細胞の割合をプロットしたグラフである。
【図6】pBS−CMV−SNAPm−Pur及びpBS−CMV−SNAPm−Pur・N4で形質転換された細胞集団を薬剤選択した際の明視野像である。
【図7】pBS−CMV−SNAPm−Purのコロニーを単離し、FACS解析した結果を示す図である。
【図8】pBS−CMV−SNAPm−Pur・N4のコロニーを単離し、FACS解析した結果を示す図である。
【図9】pEF1α−KOD3G8HC−RE2の構築を示す図である。以下、図中、Neoとは、ネオマイシン耐性遺伝子のことである。
【図10】pEF1α−SNAP26m−Pur・N4及びpEF1α−SNAP26m−Pur−RE2の構築を示す図である。
【図11】pEF1α−SNAP26m−Pur−RE2及びpEF1α−SNAP26m−Pur・N4で形質転換された細胞集団のFACS解析の結果を示す図である。
【図12】pEF1α−SNAP26m−Pur−RE2及びpEF1α−SNAP26m−Pur・N4で形質転換された細胞集団のうち、SNAPmを高発現する細胞の割合をプロットしたグラフである。
【図13】pEF1α−KOD3G8LC−Hyg−RE2の構築を示す図である。以下、図中、Hygとは、ハイグロマイシン耐性遺伝子のことである。
【図14】pEF1α−SNAP26m−Hyg−RE2及びpEF1α−SNAP26m−Hyg・N4の構築を示す図である。
【図15】pEF1α−SNAP26m−Hyg−RE2及びpEF1α−SNAP26m−Hyg・N4で形質転換された細胞集団のFACS解析の結果を示す図である。
【図16】pEF1α−SNAP26m−Hyg−RE2及びpEF1α−SNAP26m−Hyg・N4で形質転換された細胞集団のうち、SNAPmを高発現する細胞の割合をプロットしたグラフである。
【図17】pEF1α−SNAP26m−Neo・N4の構築を示す図である。
【図18】pEF1α−SNAP26m−Neo−RE2及びpEF1α−SNAP26m−Neo・N4で形質転換された細胞集団のFACS解析の結果を示す図である。
【図19】pEF1α−SNAP26m−Neo−RE2及びpEF1α−SNAP26m−Neo・N4で形質転換された細胞集団のうち、SNAPmを高発現する細胞の割合をプロットしたグラフである。
【図20】pEF1α−SNAP26m−Pur・N2、pEF1α−SNAP26m−Pur・N6及びpEF1α−SNAP26m−Pur・N8の構築を示す図である。
【図21】pEF1α−SNAP26m−Pur−RE2、pEF1α−SNAP26m−Pur・N2、pEF1α−SNAP26m−Pur・N4、pEF1α−SNAP26m−Pur・N6及びpEF1α−SNAP26m−Pur・N8で形質転換された細胞集団のFACS解析の結果を示す図である。
【図22】pEF1α−SNAP26m−Pur−RE2、pEF1α−SNAP26m−Pur・N2、pEF1α−SNAP26m−Pur・N4、pEF1α−SNAP26m−Pur・N6及びpEF1α−SNAP26m−Pur・N8で形質転換された細胞集団のうち、SNAPmを高発現する細胞の割合をプロットしたグラフである。
【発明を実施するための形態】
【0015】
以下に本発明を詳細に説明する。
【0016】
タンパク質の機能解析や有用タンパク質の生産のために、遺伝子組み換え技術を用いて、細胞、特に動物細胞に、目的とするタンパク質の遺伝子を導入し、組換えタンパク質として発現させる方法が広く用いられている。具体的には、プラスミドベクターに代表されるベクターに目的タンパク質遺伝子を挿入し、細胞にベクターを取り込ませた後、組換えにより目的タンパク質遺伝子を細胞ゲノムに組み込み、細胞を形質転換させる方法がよく用いられている。
【0017】
細胞のゲノムは染色体上に存在するが、染色体はヒストンのアセチル化や高度な凝集(ヘテロクロマチン)等により遺伝子の発現が制御されており、挿入される染色体の場所によって遺伝子の発現量は大きく異なる。ベクターを用いて細胞を形質転換する方法においては、細胞ゲノムのどの場所に目的タンパク質遺伝子が導入されるかを制御することはできず、そのため形質転換細胞における目的タンパク質遺伝子の発現量、ひいては目的タンパク質の生産量は、細胞株によって大きく異なることになる。
【0018】
また、遺伝子組み換えがうまくいかず、目的タンパク質遺伝子が細胞ゲノムに組み込まれていない場合も多い。
【0019】
そこで、従前、予め発現ベクターに薬剤耐性(薬剤選択マーカー)遺伝子を挿入しておき、細胞にこのベクターを遺伝子導入した後、培地中に薬剤を投与して(薬剤選択)、形質転換が成功した細胞を選択し、その後、生じた細胞群から高い発現を示す細胞株を繰り返し選別する作業が行われてきた。しかしながら、この方法では多数の細胞株を用意する必要があり、また長期間の培養を必要とする細胞の選別作業を繰り返し行うため、多大の労力と時間を要してきた。加えて、薬剤耐性遺伝子は多くの場合、少量の発現でも薬剤に対する耐性を示すため、生存した細胞の中には、薬剤耐性遺伝子及び目的タンパク質遺伝子が細胞ゲノム内の低発現領域に組込まれており目的タンパク質遺伝子の発現量が少ない細胞株も混在しており、更に労力と時間に拍車をかけてきた。
【0020】
本発明はこれらの問題を解決するためになされたものであり、従来公知の薬剤耐性(薬剤選択マーカー)遺伝子を使用した選別において、mRNA不安定化配列を利用することによって薬剤耐性遺伝子の発現量を大きく抑え、宿主細胞ゲノム内の高発現領域に薬剤耐性遺伝子が組込まれた形質転換細胞のみが薬剤選択後に生き残るようにしたものである。薬剤耐性遺伝子の近隣には目的タンパク質の遺伝子が組込まれているため、生き残った細胞では、目的タンパク質遺伝子も高発現領域に組込まれている可能性が高い。従って、本発明によれば、(i)遺伝子組み換えがうまくいかず、目的タンパク質遺伝子が細胞ゲノムに組み込まれていない細胞、(ii)遺伝子組み換えに成功したが、薬剤耐性遺伝子及び目的タンパク質遺伝子が宿主細胞ゲノムの低発現領域に組込まれている細胞、及び(iii)遺伝子組み換えに成功し、しかも薬剤耐性遺伝子及び目的タンパク質遺伝子が宿主細胞ゲノムの高発現領域に組込まれている細胞の中から、(iii)の遺伝子組み換えに成功し、しかも薬剤耐性遺伝子及び目的タンパク質遺伝子が宿主細胞ゲノムの高発現領域に組込まれている細胞のみを薬剤選択によって効率的に選別することができる。従来公知の選別方法では、(i)〜(iii)の細胞から(ii)及び(iii)の細胞を薬剤選択によって選別することができるが、(ii)及び(iii)の細胞から(iii)の細胞のみを薬剤選択によって選別することはできず、薬剤選択後に生き残った形質転換細胞について目的タンパク質遺伝子の発現レベルを別途確認して、(iii)の高発現細胞を選別していた。本発明の方法は、薬剤選択のみによって(i)〜(iii)の細胞から(iii)の高発現細胞を一気に選別することができるため、効率的であり、結果として高発現細胞を迅速に選別することができる。
【0021】
本発明の第一の側面によれば、プロモーター、薬剤選択マーカー遺伝子、mRNA不安定化配列、及びポリアデニレーションシグナルを有することを特徴とする薬剤選択マーカー遺伝子発現カセットが提供される。
【0022】
本発明において、発現カセットとは、プロモーターから遺伝子コード配列、ターミネーター配列(ポリアデニレーションシグナル)までの遺伝子発現の単位をいう。加えて、イントロン、スペーサー配列、翻訳増強領域等を含むこともある。したがって、例えば「薬剤選択マーカー遺伝子発現カセット」という場合、前記発現カセットの遺伝子コード配列が薬剤選択マーカー遺伝子のコード配列であるものをいう。
【0023】
本発明の薬剤選択マーカー遺伝子発現カセットは、mRNA不安定化配列を有することを除いては、従来公知の薬剤選択マーカー遺伝子発現カセットと同様の構成を有する。そこで、まず、mRNA不安定化配列について説明する。
本発明は、mRNA不安定化配列が極めて効果的に薬剤耐性遺伝子の発現を減弱化することができることを見出したことに基づくものである。本発明のmRNA不安定化配列を含む薬剤選択マーカー遺伝子発現カセットを搭載した発現ベクターを宿主細胞へ遺伝子導入した場合、mRNA不安定化配列を含まない場合と比較して、薬剤選択後の生存細胞数、あるいはそのコロニーは1/10〜1/100に減少する。これはmRNA不安定配列の存在により薬剤選択マーカーのmRNAが不安定化し、薬剤選択マーカーの発現量が下がるため、宿主細胞のゲノム中で転写活性の高い高発現領域に当該発現カセットが組み込まれた細胞でなければ薬剤選択下での生存が困難になるためと考えられる。
【0024】
「mRNA不安定化配列」とは、この配列を有するDNAから転写されたmRNAの細胞内半減期を低減させる機能を有するヌクレオチド配列のことであり、自然界では初期応答遺伝子などに存在することが見出されている。
【0025】
mRNA不安定化配列は、いくつかの遺伝子ではコード配列中、あるいは5’UTR(非翻訳領域)に存在するものもあるが、多くは3’UTRに存在する。3’UTRに存在するmRNA不安定化配列としては、AU−rich element(ARE)、histone mRNA 3’−terminal stem−loop、iron−responsive element(IRE)、insulin−like growth factor II(IGF−II)、long stem−loopなどが知られている。これらの中でもAREは、恒常的にmRNAを不安定化できることから、本発明に用いるmRNA不安定化配列として好ましい。
【0026】
AREとは、mRNAにおける「AUが豊富なエレメント」、すなわちアデニン(A)及びウラシル(U)を高い割合で含む配列もしくは領域を意味する。またAREとは、前記エレメントをコードするDNAにおける「ATが豊富なエレメント」、すなわちアデニン(A)及びチミン(T)を高い割合で含む配列もしくは領域を指すためにも用いられる。
【0027】
AREは、造血細胞増殖因子遺伝子、成長因子遺伝子、インターロイキン遺伝子、インターフェロン等のサイトカイン遺伝子、及びいくつかの癌原遺伝子(プロトオンコジーン)などに見られる(非特許文献2)。本発明の薬剤選択マーカー遺伝子発現カセットでは、これらの遺伝子中のAREに相当する核酸配列をそのまま利用してもよいが、ARE中のモチーフ配列として知られるTATTTAT(非特許文献3)やTTATTTA(T/A)(T/A)(非特許文献4)などを利用する方が、不要な制限酵素認識配列を発現ベクターに挿入してしまうことを避けることができ、利便性が高い。
【0028】
AREを持つ遺伝子の例としては、造血細胞増殖因子についてはGranulocyte−monocyte colony sitimulationg factor(GM−CSF),インターロイキンについてはInterleukin−1β、2,3、4、6、8、10、11、インターフェロンについてはInterferon−α、癌原遺伝子についてはc−fos,c−myc,c−jun,c−myb,Pim−1などが例示される。このほかにもTumor necrosis factor,Cyclin D1,Cyclooxygenase,Plasminogen activator inhibitor type2など多くの遺伝子がAREを持つことが知られており、例示された遺伝子に限定されない。
【0029】
本発明の薬剤選択マーカー遺伝子発現カセットにおいて使用することができるmRNA不安定化配列としては、下記のものが例示される。
【0030】
ATTTのモチーフ配列の1ないし2回以上の繰り返し。
【0031】
ATTTAのモチーフ配列の1ないし2回以上の繰り返し。
【0032】
TATTTATのモチーフ配列の1ないし2回以上の繰り返し。
【0033】
TTATTTA(T/A)(T/A)のモチーフ配列の1ないし2回以上の繰り返し。(T/A)はTまたはAのいずれかである。
【0034】
これらの配列は、1ないし数塩基の置換/挿入/欠失を含んでもよく、DNAの複製の誤りや突然変異などの自然変異によるもの、人為的な変異導入によるもの等が想定される。また、モチーフ配列の繰り返し間には1〜100塩基程度のスペーサー配列またはリンカー配列を含んでもよい。加えて、モチーフ配列の逆位を含むものであってもよい。
【0035】
これらのモチーフ配列の繰り返し数は、1回でもよいが、2回以上、より好ましくは4回以上とすることにより、mRNAの不安定化効果を一層高めることができ、選別効率を顕著に増大させることができる。
【0036】
繰り返しの回数の上限は特に限定されないが、細胞へのベクターの取り込みの観点から、発現ベクターが最大10kbp〜20kbp長となるようなものが望ましい。ただし、繰り返し配列数が増えるにしたがって、mRNAの不安定化の効果は飽和に向かい、一定の繰り返し数を超えるとそれ以上の顕著な効果を望めなくなる。上限値を定めるものではないが、10回以上の繰り返し配列は実用上意味がない。
【0037】
本発明の薬剤選択マーカー遺伝子発現カセットにおけるプロモーターとしては、動物細胞、特に哺乳類細胞で発現可能なプロモーターであれば特に限定されるものではないが、ヒトやマウスのサイトメガロウイルス(CMV)プロモーター、サルウイルス40(SV40)プロモーター、ヒトヘルペス単純ウイルスのチミジンキナーゼ遺伝子(HSV−tk)プロモーター、などのウイルスに由来するものや、マウスphosphoglycerate−kinase1遺伝子(PGK)プロモーターなどの非ウイルス性の細胞遺伝子に由来するプロモーター、及び由来の異なるプロモーターのハイブリッドが挙げられる。ここで、プロモーターは、プロモーターのコア領域に限るものではなく、エンハンサー領域を含む場合もある。薬剤選択マーカーの発現を減弱化するため、転写活性が低いものがより好ましい。転写活性の低いプロモーターとして変異型のプロモーターなどを利用してもよいし、コザック配列を置換してもよい。さらに、mRNA不安定化配列のモチーフ配列の繰り返しの回数を少なくし、転写活性の弱いプロモーターを併用するのも1つの想定される実施態様である。
【0038】
本発明の薬剤選択マーカー遺伝子発現カセットにおける薬剤選択マーカー遺伝子としては、薬剤選択に一般的に使用される薬剤に対して耐性を示す遺伝子が好適に用いられる。タンパク質合成阻害系抗生物質を薬剤として用いる場合には、タンパク質合成阻害系抗生物質耐性遺伝子を用いることが好ましい。特に限定されるものではないが、ネオマイシン耐性遺伝子(ジェネティシン耐性遺伝子としての機能も有する)として、Tn5由来ネオマイシンホスホトランスフェラーゼ(aminoglycoside 3’−phosphotransferase)(Neo)、ハイグロマイシン耐性遺伝子として、E.coli由来ハイグロマイシン−B−ホスホトランスフェラーゼ(Hph、実施例、比較例および図面ではHygと記載)、ピューロマイシン耐性遺伝子として、Streptomyces由来ピューロマイシン−N−アセチルトランスフェラーゼ遺伝子(pac、実施例、比較例および図面ではPurと記載)、ブラストサイジン耐性遺伝子として、Bacillus cereus由来ブラストサイジン耐性遺伝子(bsr)などが例示される。これらの中でも、ピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン‐B−ホスホトランスフェラーゼ、ネオマイシンホスホトランスフェラーゼが好ましく、より好ましくはピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン‐B−ホスホトランスフェラーゼであり、さらに好ましくはピューロマイシン−N−アセチルトランスフェラーゼである。
【0039】
本発明の薬剤選択マーカー遺伝子発現カセットにおけるポリアデニレーションシグナル(ターミネーター配列)としては、SV40ウイルス由来late polyAシグナル、early polyAシグナル、HSV−tk由来polyAシグナル、ウシ成長因子遺伝子由来polyAシグナル、ウサギβ−グロビン遺伝子由来polyAシグナルなどが例示されるが、特に限定されるものではない。
【0040】
本発明の薬剤選択マーカー遺伝子発現カセット中でのプロモーター、薬剤選択マーカー遺伝子、mRNA不安定化配列、及びポリアデニレーションシグナルの配置順序は、薬剤選択マーカー遺伝子の発現が可能である限り特に限定されないが、一般的にプロモーター、薬剤選択マーカー遺伝子、mRNA不安定化配列、及びポリアデニレーションシグナルをこの順序で上流から下流に向かって配置する。これらの四つの要素は、相互に直接連結されている必要はなく、所望により、イントロン、スペーサー配列、翻訳増強領域等を間に有していてもよい。
【0041】
本発明の第二の側面によれば、本発明の第一の側面による薬剤選択マーカー遺伝子発現カセットを有することを特徴とする発現ベクターが提供される。
【0042】
本発明において、発現ベクターとは、遺伝子工学に利用されるベクターである。発現ベクターは、プラスミドベクターであることができる。しかし、これに限らず、例えば、ウイルスベクター、コスミドベクター、細菌人工染色体(BAC)、酵母人工染色体(YAC)及び他の非プラスミドベクターも使用できる。
【0043】
本発明の発現ベクターは、目的タンパク質の遺伝子を、薬剤選択マーカー遺伝子発現カセットと独立した別個の発現カセットの形でさらに含むことが好ましい。真核細胞の場合、目的タンパク質遺伝子と薬剤選択マーカー遺伝子を内在性リボソームエントリー部位(Internal ribosome entry sites、IRES)でつなぐポリシストロン性の発現を行う方法もあるが、目的タンパク質遺伝子と薬剤選択マーカー遺伝子のコード配列が1つのmRNAとして合成されるため、mRNA不安定化配列を挿入すると、目的タンパク質遺伝子のmRNAが減少してしまい、高発現細胞を得られない。そのため、本発明の発現ベクターでは、目的タンパク質遺伝子は、薬剤選択マーカー遺伝子発現カセットと独立した発現カセットとして配置されることが好ましい。この場合、目的タンパク質遺伝子発現カセットと薬剤選択マーカー遺伝子発現カセットが別個のベクター上に配置された一対の発現ベクターの形で利用されてもよいが、目的タンパク質遺伝子発現カセットと薬剤選択マーカー遺伝子発現カセットが同一のベクター上に配置されることがより好ましい。
【0044】
前記薬剤選択マーカー遺伝子発現カセットと目的遺伝子タンパク質の発現カセットが同一のベクター上に配置される場合、両者は隣接してもよいし、間にスペーサー配列が挿入されていてもよい。目的タンパク質遺伝子の発現カセットは薬剤選択マーカー遺伝子発現カセットの上流、下流のいずれに配置されても良いが、隣接して挿入される際には、目的タンパク質遺伝子の発現カセットが上流になるように配置される方が好ましい。さらに、スペーサー配列として、隣接する発現カセットの転写干渉を抑制するためのインスレーター配列が挿入されていても良い。
【0045】
薬剤選択マーカー遺伝子発現カセットは、1つのベクターに2つ以上含まれていても良い。この場合、同一の薬剤選択マーカーが選ばれる場合もあるし、それぞれ異なる薬剤選択マーカーが選ばれる場合もある。また、各薬剤選択マーカーは隣接して配置されても良いし、離れて配置されていても良い。
【0046】
目的のタンパク質が抗体の重鎖、軽鎖のように複数のポリペプチドからなる場合、目的タンパク質の発現カセットを複数配置してもよく、あるいは複数のポリペプチド遺伝子をIRESでつなぎ、ポリシストロン性の1つの発現カセットの形にしてもよい。
【0047】
また、複数のポリペプチド発現カセットをそれぞれ異なるベクターに挿入し、それぞれのベクターを1つの宿主細胞へ導入して形質転換細胞を作製し、目的タンパク質を生産することができる。この場合、各ベクターに薬剤選択マーカー遺伝子発現カセットを配置することができ、それぞれ同一の薬剤選択マーカーを用いることもできるが、異なる薬剤選択マーカーを用いる方が、各ポリペプチドが全て高発現を示す細胞を効率よく取得する点で有利であり、好ましい。
【0048】
目的タンパク質遺伝子の発現カセットは、プロモーター、遺伝子コード配列、及びターミネーター配列(ポリアデニレーションシグナル)からなる。加えて、イントロンやスペーサー配列、翻訳増強領域を含むこともある。目的タンパク質遺伝子の発現プロモーターとしてはできるだけ転写活性の高いものが好ましく、ヒトやマウスのサイトメガロウイルス(CMV)プロモーター、サルウイルス40(SV40)プロモーターなどのウイルスに由来するものや、ヒトやマウス、さらにはCHO由来のElongation Factor 1(EF1α)遺伝子、ユビキチン遺伝子、β−アクチン遺伝子など、非ウイルス性の細胞遺伝子に由来するプロモーター、及び由来の異なるプロモーター/エンハンサーのハイブリッド、例えばCAGプロモーターなどが挙げられる。
【0049】
代替実施態様として、目的タンパク質遺伝子の発現カセットに、このタンパク質遺伝子のコード配列の代わりに、複数の制限酵素認識配列からなるマルチクローニングサイトが配置されており、このマルチクローニングサイトに種々の目的タンパク質遺伝子(外来遺伝子)のcDNAやコード配列を導入できるように構築された発現ベクターを挙げることができる。
【0050】
本発明の第三の側面によれば、本発明の第二の側面による発現ベクターで宿主細胞を形質転換して得られることを特徴とする形質転換細胞が提供される。
【0051】
本発明の形質転換細胞における宿主細胞としては、組換えタンパク質の産生に一般的に用いられるチャイニーズハムスター卵巣細胞(CHO)の他、マウスミエローマ細胞(NSO)、ベビーハムスターキドニー細胞(BHK)、ヒト繊維肉腫細胞(HT1080)、COS細胞などの哺乳類由来の細胞が例示されるが、これらに限定されるものではなく、ヒト、マウス、ラット、ハムスター、モルモット、ウサギ、イヌ、ウシ、ウマ、ヒツジ、サル、ブタなどの動物由来の細胞などを広く導入対象とすることができる。また、大腸菌などの細菌細胞や酵母、昆虫細胞などを用いたタンパク質生産システムにも応用しうる。
【0052】
宿主細胞の形質転換方法は、当業者であれば適宜選択しうるが、例えばリポフェクション法、リン酸カルシウム法、エレクトロポレーション法、DEAEデキストラン法、マイクロインジェクション等が挙げられる。
【0053】
本発明の第四の側面によれば、本発明の第三の側面による形質転換細胞を薬剤選択する工程を含むことを特徴とする、目的タンパク質遺伝子を高レベルで発現する細胞群を選別する方法が提供される。また、本発明の第五の側面によれば、本発明の第三の側面による形質転換細胞からなる細胞群であって、目的タンパク質遺伝子を高レベルで発現することを特徴とする細胞群が提供される。
【0054】
薬剤選択に使用する薬剤は、薬剤選択マーカー遺伝子発現カセット中の薬剤選択マーカー遺伝子の種類に応じて決定される。また、使用する薬剤の濃度としては、一般に使用される濃度の範囲で高発現細胞の濃縮が可能であるが、少し高めの濃度が好ましい。最適な濃度は、宿主細胞や用いる培地の種類によって変化する。これらの濃度の設定方法は当業者にとっては公知であり、適宜設定しうる。例えば、産業用の生産細胞として用いられるチャイニーズハムスター卵巣(CHO)細胞を10%ウシ胎児血清を含むHam‘s F12培地で培養し、ピューロマイシン耐性遺伝子発現カセットを利用した場合のピューロマイシンの濃度としては、5μg/ml以上、より好ましくは7.5μg/ml以上、さらに好ましくは10μg/ml以上である。同様の培養条件でハイグロマイシン耐性遺伝子発現カセットを利用した場合のハイグロマイシンBの濃度としては、200μg/ml以上、より好ましくは600μg/ml以上、さらに好ましくは800μg/ml以上である。同様の培養条件でネオマイシン耐性遺伝子発現カセットを利用した場合のG418の濃度としては、好ましくは400μg/ml以上、より好ましくは800μg/ml以上、さらに好ましくは1,000μg/ml以上である。
【0055】
本発明の選別方法では、薬剤選択により、mRNAの不安定化を伴わない従来の薬剤選択を行った細胞群に比べて、目的タンパク質遺伝子を高レベルで発現する細胞の割合が有意に高くなる。従って、従来は、薬剤選択後の膨大なサンプルから目的タンパク質遺伝子を高レベルで発現する細胞株を選別する作業を繰り返し行わなければならなかったが、本発明によれば、薬剤選択マーカーのmRNA不安定化を含む薬剤選択のみによって、選別の候補となるサンプル数を大幅に絞ることができる。本発明の選別方法を用いれば、薬剤選択後も生存する細胞群(ポリクローン)の大部分を占める、目的タンパク質遺伝子を高レベルで発現する細胞群から細胞を単離し、培養することにより、容易に高発現を示す細胞株(モノクローン)を取得することができる。本発明の実施態様の一例として、4.0×105個の細胞に本発明の薬剤選択マーカー遺伝子発現カセットが挿入されたベクターを遺伝子導入した後、薬剤選択を行って生じた細胞群から100の細胞株をランダムに選択して、個々の細胞株の発現量を調べることにより目的タンパク質の高発現株を容易に取得することができる。
【0056】
細胞の発現レベルはレポーター遺伝子の発現量により調べることができるが、一例として、SNAP26m遺伝子(Covalys社)やGFP(Green Fluorescent Protein)遺伝子等の蛍光タンパク質遺伝子を含む発現カセットを本発明の発現ベクターに導入し、FACS(fluorescence activated cell sorting)等のフローサイトメーターを用いて蛍光強度を解析することにより調べることができる。別の例として、ルシフェラーゼ遺伝子を含む発現カセットを本発明による発現ベクターに導入後、細胞溶解液にD−ルシフェリンを添加してルミノメーターで発光量を測定することにより調べることができる。また、レポーター遺伝子に限らず、ELISA(Enzyme−Linked Immunosorbent Assay)、酵素免疫測定法(EIA)等を利用することで抗体等の目的タンパク質の発現を調べることもできる。
【0057】
本発明により、細胞選別の工程及び時間を大幅に短縮することができると共に、高発現を示す細胞の割合が上昇することにより、短時間で効率的に目的タンパク質遺伝子を高レベルで発現する細胞を取得することができ、従来技術と比べて極めて顕著な効果を示す。
【0058】
例えばFACSCalibur(ベクトン・ディッキンソン社製)により、蛍光強度FL1にてSNAP26mの発現量を測定した場合、FL1が200以上若しくは1000以上を示す細胞の割合は、本発明の薬剤選択マーカー遺伝子発現カセットを有さない細胞に比べて、本発明による細胞では1.1倍以上、また多くの場合1.5倍から2倍以上大きくなる効果が認められた。また、FL1が200以上を示す細胞の割合の増加率よりもFL1が1000以上を示す細胞の割合の増加率の方が高い傾向が見られており、本発明により選別される細胞群が、本発明の薬剤選択マーカー遺伝子発現カセットを有さない細胞に比べて高い発現を示すという効果を裏付けている。
【0059】
本発明の第六の側面によれば、本発明の第三の側面による形質転換細胞を用いることを特徴とする、タンパク質を生産する方法が提供される。
【0060】
一つの実施態様では、生産されるタンパク質は、抗体である。哺乳類の抗体には、IgM、IgD、IgG、IgA、IgEの5種類のクラスが存在することが明らかとなっているが、ヒトの各種疾患の診断、予防及び治療には血中半減期が長く、各種エフェクター機能を有する等の機能特性からヒトIgGクラスの抗体が主として利用されている。抗体は、形質転換細胞の培養上清よりプロテインAカラムを用いて精製することができる。また、その他に通常、蛋白質の精製で用いられる精製方法を使用することができる。例えば、ゲル濾過、イオン交換クロマトグラフィー及び限外濾過等を組み合わせて行い、精製することができる。精製したヒト化抗体のH鎖、L鎖或いは抗体分子全体の分子量は、二次元電気泳動等により測定することができる。
【0061】
本発明の方法により生産された抗体は、医薬として使用することができる。かかる医薬は、治療薬として単独で投与することも可能ではあるが、通常は薬理学的に許容される一つあるいはそれ以上の担体と一緒に混合し、製剤学の技術分野にて公知の任意の方法により製造した医薬製剤として提供されるのが好ましい。
【0062】
投与経路は、治療に際して最も効果的なものを使用するのが望ましく、経口投与、または口腔内、気道内、直腸内、皮下、筋肉内および静脈内等の非経口投与をあげることができ、抗体製剤の場合、好ましくは静脈内投与をあげることができる。投与形態としては、噴霧剤、カプセル剤、錠剤、顆粒剤、シロップ剤、乳剤、座剤、注射剤、軟膏、テープ剤等があげられる。
【0063】
経口投与に適当な製剤としては、乳剤、シロップ剤、カプセル剤、錠剤、散剤、顆粒剤等があげられる。乳剤およびシロップ剤のような液体調製物は、水、ショ糖、ソルビトール、果糖等の糖類、ポリエチレングリコール、プロピレングリコール等のグリコール類、ごま油、オリーブ油、大豆油等の油類、p−ヒドロキシ安息香酸エステル類等の防腐剤、ストロベリーフレーバー、ペパーミント等のフレーバー類等を添加剤として用いて製造できる。カプセル剤、錠剤、散剤、顆粒剤等は、乳糖、ブドウ糖、ショ糖、マンニトール等の賦形剤、デンプン、アルギン酸ナトリウム等の崩壊剤、ステアリン酸マグネシウム、タルク等の滑沢剤、ポリビニルアルコール、ヒドロキシプロピルセルロース、ゼラチン等の結合剤、脂肪酸エステル等の界面活性剤、グリセリン等の可塑剤等を添加剤として用いて製造できる。
【0064】
非経口投与に適当な製剤としては、注射剤、座剤、噴霧剤等があげられる。注射剤は、塩溶液、ブドウ糖溶液、あるいは両者の混合物からなる担体等を用いて調製される。または、ヒト化抗体を常法に従って凍結乾燥し、これに塩化ナトリウムを加えることによって粉末注射剤を調製することもできる。座剤はカカオ脂、水素化脂肪またはカルボン酸等の担体を用いて調製される。また、噴霧剤は該化合物そのもの、ないしは受容者の口腔および気道粘膜を刺激せず、かつ該化合物を微細な粒子として分散させ吸収を容易にさせる担体等を用いて調製される。
【0065】
担体として具体的には乳糖、グリセリン等が例示される。該化合物および用いる担体の性質により、エアロゾル、ドライパウダー等の製剤が可能である。また、これらの非経口剤においても経口剤で添加剤として例示した成分を添加することもできる。
【0066】
別の実施態様では、生産されるタンパク質は、ワクチンである。
【0067】
ワクチンとしては、病原体のエピトープのアミノ酸配列からなるタンパク質をワクチンとして使用することができる。また、ウイルス体の構成タンパク質すべてを生産するのみならず、エンベロープタンパク等を生産し、ワクチンとして使用することができる。
【0068】
ワクチンは任意の経路の投与のための製剤とすることができる。粘膜型投与、例えば、経口経路、経鼻経路、経気道経路、経膣経路、経直腸経路の他、非粘膜経路による投与、例えば皮下、静脈内もしくは筋肉内投与のためのワクチン製剤が挙げられる。
【0069】
本発明の第七の側面によれば、本発明の第三の側面による形質転換細胞を用いることを特徴とする、アミノ酸を生産する方法が提供される。また、本発明の第八の側面によれば、本発明の第三の側面による形質転換細胞を用いることを特徴とする、ヌクレオチドを生産する方法が提供される。
【0070】
アミノ酸の生産は、まず形質転換細胞にポリペプチドを生産させ、そのポリペプチドを加水分解することによって行うことができる。また、アミノ酸の生体外合成に必要な酵素などを形質転換細胞に生産させることによって行うこともできる。ヌクレオチドの生産も、ヌクレオチドの生体外合成に必要な酵素などを形質転換細胞に生産させることによって行うことができる。
【実施例】
【0071】
以下、実施例を例示することによって、本発明の効果をより一層明確なものとする。
【0072】
(実施例1及び比較例1)
薬剤選択マーカー遺伝子としてピューロマイシン耐性遺伝子を使用した薬剤選択マーカー遺伝子発現カセットにおけるmRNA不安定化配列の効果
(1)プラスミドベクターpBS−CMV−SNAPm−Pur(比較例)及びpBS−CMV−SNAPm−Pur・N4(実施例)の構築
図1に示すスキームに従って、プラスミドベクターpBS−CMV−SNAPm2を構築した。即ち、まずEmerald Lucベクター(pELuc−test)(東洋紡績社製)の制限酵素ClaI、EcoRIサイトにCMVプロモーター(配列番号1)が導入されたpELuc−CMVプラスミドから制限酵素EcoRI、NotIでEmerald Luc(ELuc)遺伝子を切出した。一方、SNAPm発現プラスミドpSNAPm(Covalys社製)からSNAP26m遺伝子を配列番号2,3のプライマーを用いてPCRで増幅し、pELuc−CMVプラスミドの制限酵素EcoRI、NotIサイトに導入してpSNAP26m−CMVを構築した。続いて、pSNAP26m−CMVより、CMVプロモーター/SNAP26m/SV40 polyAを配列番号4,5のプライマーを用いてPCRで増幅し、部分消化によって、プラスミドpBluescript II KS(−)(ストラタジーン社製)の制限酵素ClaI、BamHIサイトへ導入し、プラスミドpBS−CMV−SNAPm2を構築した。
【0073】
続いて、図2に示すスキームに従って、pPUR(クロンテック社製)のピューロマイシン耐性遺伝子のコード配列の3’末端に、配列番号6、7のプライマーとKOD−Plus−Mutagenesis Kit(東洋紡績社製)を用いたInverse PCR法によって、mRNA不安定化配列としてAREモチーフ配列TTATTTATTの4回の繰り返し(N4)を挿入してpPUR・N4を構築した。
【0074】
つづいて、図3に示すスキームに従って、pPUR,pPUR・N4を鋳型として、配列番号8、9のプライマーとKOD−Plus−ver.2(東洋紡績社製)を用いたPCRによって、SV40 Promoter−Pur−pA、SV40 Promoter−Pur・N4−pAの薬剤発現カセット断片を増幅した。pBS−CMV−SNAPm2と前記増幅断片をそれぞれ制限酵素BamHI、SacIで部分消化して連結し、pBS−CMV−SNAPm−Pur(比較例),pBS−CMV−SNAPm−Pur・N4(実施例)を構築した。
【0075】
(2)プラスミドベクターpBS−CMV−SNAPm−Pur(比較例)及びpBS−CMV−SNAPm−Pur・N4(実施例)の細胞導入
CHO−K1細胞(理研バイオリソースセンター、No.RCB0285)を1×105cells/mlに調整し、12ウェルプレートに2mlずつ前日に播種し、一晩培養して、トランスフェクション用のCHO−K1細胞を準備した。この際、培地として10%牛胎児血清を添加したHam’s F12培地(日水製薬社製)を使用した。
【0076】
トランスフェクションは、3μl GeneJuice Transfection Reagent(メルク社製)を100μl Opti−MEM I Reduced−Serum Medium(GIBCO社製)で希釈し、1μgのプラスミドとしてpBS−CMV−SNAPm−PurあるいはpBS−CMV−SNAPm−Pur・N4にこの希釈液103μlを加え、10分間放置した後、この混合液を前記CHO−K1細胞に加え、24時間インキュベートすることにより行った。翌日、培地を除去し、2.5g/l−Trypsin・1mmol/l−EDTA Solution(ナカライテスク社製)で処理して細胞を分散させ、90mmペトリディッシュに移し、6μg/mlピューロマイシン(InvivoGen社製)を含むHam’s F12+10%FBS培地中で3週間選択培養を行った。選択培養中、3〜4日ごとに培地を交換した。3週間の選択培養終了後、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、1ウェル当たり2×105細胞を12ウェルプレートに播き込み、翌日、0.5mlのHam’s F12培地に2μM SNAP−Cell−505(Covalys社製)を加え、60分間、37℃でインキュベートした。その後、Ham’s F12培地で3回リンスし、培地交換をしながら、10分間のインキュベートを3回行い、未反応の蛍光色素を除去した。この細胞を2.5g/l−Trypsin/1mmol/l−EDTA Solutionで処理して細胞を分散し、D−PBS(−)(ナカライテスク社製)に細胞を懸濁し、フローサイトメーターBD FACSCalibur(Becton,Dickinson社製)でSNAP26mの発現強度を解析した。
【0077】
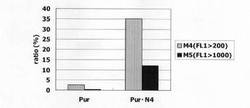
図4は、薬剤選択後のpBS−CMV−SNAPm−Pur(比較例)及びpBS−CMV−SNAPm−Pur・N4(実施例)で形質転換された細胞集団のFACS解析の結果を示す。横軸が蛍光強度(FL1)、縦軸がカウント数である。また、図5に蛍光強度FL1がそれぞれ200以上、1000以上の細胞の割合のプロットを示す。この結果、mRNA不安定化配列であるN4(実施例)が挿入されたpBS−CMV−SNAPm−Pur・N4(実施例)で形質転換された細胞集団には、N4が挿入されていないpBS−CMV−SNAPm−Pur(比較例)で形質転換された細胞集団と比較して、薬剤選択後、SNAPmの高発現を示す細胞が有意に濃縮されていることが分かる。
【0078】
(実施例2及び比較例2)
薬剤選択マーカー遺伝子としてピューロマイシン耐性遺伝子を使用した薬剤選択マーカー遺伝子発現カセットにおけるmRNA不安定化配列の効果
実施例1(1)で構築した二種類のプラスミドベクターを使用して実施例1(2)と同様に遺伝子導入を行った。次に、ピューロマイシンの濃度を9μg/mlに変更し、選択培養の期間を2週間に変更した以外は、実施例1(2)と同様にして選択培養を行った。選択培養終了後、形成されたコロニーを顕微鏡下でピペットの先でpBS−CMV−SNAPm−Purについては48クローン、pBS−CMV−SNAPm−Pur・N4については20クローンをかきとり、12ウェルプレートに播種した。増殖が認められた、それぞれ36クローン、10クローンについて、実施例1(2)と同様にSNAP−Cell−505で標識処理をし、FACS解析を実施した。
【0079】
図6に、薬剤選択後の細胞の明視野像を示す。この結果、pBS−CMV−SNAPm−Pur(比較例)に比べ、pBS−CMV−SNAPm−Pur・N4(実施例)については生存細胞数、コロニー数が顕著に減少し、選択効果が高いことが示唆される。
【0080】
図7にpBS−CMV−SNAPm−Pur(比較例)形質転換細胞クローンにおける、ピーク強度が1000を超える、特にSNAPm発現の高いクローンのFACS解析の結果を示す。図8にpBS−CMV−SNAPm−Pur・N4(実施例)形質転換細胞クローンにおける、ピーク強度が1000を超える、特にSNAPm発現の高いクローンのFACS解析の結果を示す。この結果、pBS−CMV−SNAPm−Pur(比較例)では、高発現クローンは36クローン中1クローン(2.8%)しか認められなかった。一方、pBS−CMV−SNAPm−Pur・N4(実施例)では、取得されたクローンは少ないものの、SNAPm高発現クローンのヒット率が40%(10クローン中4クローン)と非常に選択効果が高いことが確認された。また、これらの結果から、実施例1(2)で認められたように、薬剤選択後の細胞集団をFACS解析することによって示される高発現細胞の割合の上昇と、高発現クローンの取得の効率化との間に相関が確認されたことから、以後の解析は細胞集団のFACS解析によって効果の確認を実施した。
【0081】
(実施例3及び比較例3)
EF1αプロモーター使用下での薬剤選択マーカー遺伝子としてピューロマイシン耐性遺伝子を使用した薬剤選択マーカー遺伝子発現カセットにおけるmRNA不安定化配列の効果
(1)プラスミドベクターpEF1α−SNAP26m−Pur・N4(実施例)及びpEF1α−SNAP26m−Pur−RE2(比較例)の構築
次に、目的タンパク質遺伝子発現カセットのプロモーターをCMVプロモーターからEF1αプロモーターに置換した場合も、実施例1,2と同様の効果が認められるかどうかを検討するため、プラスミドベクターを構築した。本実験では、図9に示すスキームに従って構築されたプラスミドpEF1α−KOD3G8HC−RE2を利用した。即ち、まず、CMVプロモーターをEF−1αプロモーターに置換したpCI−neoプラスミド(プロメガ社製)の制限酵素XbaI−NotIサイトに抗KOD抗体の重鎖を挿入したプラスミドのpEF1α−KOD3G8HCを鋳型に、KOD−Plus−Mutagenesis Kitを用いたInverse PCR法によって、配列番号10、11のプライマーを用いて発現カセットの上流に制限酵素SalIおよびNheIサイトを付加したpEF1α−KOD3G8HC−REを構築した。更にこのプラスミドを鋳型に、KOD−Plus−Mutagenesis Kitを用いたInverse PCR法によって、配列番号12、13のプライマーを用いて発現カセットの下流に制限酵素BsiWIおよびXhoIサイトを付加して、プラスミドpEF1α−KOD3G8HC−RE2を構築した。
【0082】
このpEF1α−KOD3G8HC−RE2を用いて、図10に示すスキームに従って、プラスミドpEF1α−SNAP26m−Pur・N4(実施例)およびpEF1α−SNAP26m−Pur−RE2(比較例)を構築した。即ち、プラスミドpEF1α−KOD3G8HC−RE2から制限酵素EcoRI、NotIを用いて抗KOD抗体の重鎖遺伝子を切出した。一方、SNAPm発現プラスミドpSNAPmからSNAP26m遺伝子を配列番号2,3のプライマーを用いてPCRで増幅し、pEF1α−KOD3G8HC−RE2プラスミドの制限酵素EcoRI、NotIサイトに導入してpEF1α−SNAP26m−Neo−RE2を構築した。このプラスミドから制限酵素AflII、BstBIを用いてネオマイシン耐性遺伝子を切出した。一方、pPUR・N4から下流にN4配列を付加したピューロマイシン耐性遺伝子を配列番号14,15のプライマーを用いてPCRで増幅し、pEF1α−SNAP26m−RE2プラスミドの制限酵素AflII、BstBIサイトに導入してpEF1α−SNAP26m−Pur・N4(実施例)を構築した。続いて、このプラスミドを鋳型に、KOD−Plus−Mutagenesis Kitを用いたInverse PCR法によって、配列番号16、17のプライマーを用いてピューロマイシン耐性遺伝子の下流のN4配列を削除したプラスミドpEF1α−SNAP26m−Pur−RE2(比較例)を構築した。
【0083】
(2)プラスミドベクターpEF1α−SNAP26m−Pur−RE2(比較例)及びpEF1α−SNAP26m−Pur・N4(実施例)の細胞導入
実施例1(2)に記載の方法でトランスフェクション用のCHO−K1細胞を準備した。一方、実施例3(1)で構築したSNAP26m発現コンストラクトを制限酵素AhdI(New England Biolabs社製)でリニアライズ(直鎖状化)した。トランスフェクションは、3μl GeneJuice Transfection Reagentを100μl Opti−MEM I Reduced−Serum Mediumで希釈した後、前記のリニアライズしたプラスミド1μgを加え、10分間放置した後、この混合液を前記CHO−K1細胞に加え、24時間インキュベートすることにより行った。翌日、培地を除去し、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散させ、90mmペトリディッシュに移し、5、7.5、あるいは10μg/mlピューロマイシンをそれぞれ含むHam’s F12+10%FBS培地中で1週間選択培養を行った。選択培養中、3〜4日ごとに培地を交換した。選択培養終了後、実施例1(2)に記載の方法で、細胞集団のSNAP26mの発現強度を解析した。
【0084】
図11は、薬剤選択後のpEF1α−SNAP26m−Pur−RE2(比較例)及びpEF1α−SNAP26m−Pur・N4(実施例)で形質転換された細胞集団のFACS解析の結果を示す。また、図12に蛍光強度FL1が200以上、1000以上の細胞の割合のプロットを示す。この結果、薬剤選択中のピューロマイシン濃度に関わらず、mRNA不安定化配列であるN4が挿入されたpEF1α−SNAP26m−Pur・N4(実施例)で形質転換された細胞集団には、N4が挿入されていないpEF1α−SNAP26m−Pur―RE2(比較例)で形質転換された細胞集団と比較して、薬剤選択後、SNAPmの高発現を示す細胞が有意に濃縮されていることが分かる。
【0085】
(実施例4及び比較例4)
薬剤選択マーカー遺伝子としてハイグロマイシン耐性遺伝子を使用した薬剤選択マーカー遺伝子発現カセットにおけるmRNA不安定化配列の効果
(1)プラスミドベクターpEF1α−SNAP26m−Hyg‐RE2(比較例)及びpEF1α−SNAP26m−Hyg・N4(実施例)の構築
薬剤選択マーカー遺伝子としてピューロマイシン耐性遺伝子の代わりにハイグロマイシン耐性遺伝子を用いた場合もmRNA不安定化配列の効果が認められるかどうかを検討するため、プラスミドを構築した。本実験では、図13に示すスキームに従って構築されたプラスミドpEF1α−KOD3G8LC−Hyg−RE2を利用した。即ち、まず、CMVプロモーターをEF−1αプロモーターに変更したpCI−neoプラスミドの制限酵素XbaI−NotIサイトに抗KOD抗体の軽鎖を挿入したプラスミドのpEF1α−KOD3G8LCを鋳型に、KOD−Plus−Mutagenesis Kitを用いたInverse PCR法によって、配列番号10、11のプライマーを使って発現カセットの上流に制限酵素SalIおよびNheIサイトを付加したpEF1α−KOD3G8LC−REを構築した。更にこのプラスミドを鋳型に、KOD−Plus−Mutagenesis Kitを用いたInverse PCR法によって、配列番号12、13のプライマーを用いて発現カセットの下流に制限酵素BsiWIおよびXhoIサイトを付加して、プラスミドpEF1α−KOD3G8LC−RE2を構築した。
【0086】
このpEF1α−KOD3G8LC−RE2をAflII、BstBIで処理し、ネオマイシン耐性遺伝子を切出した。一方、pTK−Hyg(クロンテック社製)からハイグロマイシン耐性遺伝子を配列番号18、19のプライマーを用いてPCRで増幅し、pEF1α−KOD3G8LC−RE2の制限酵素AflII、BstBIサイトに導入してpEF1α−KOD3G8LC−Hyg−RE2を構築した。続いて、図14に示すスキームに従って、プラスミドpEF1α−SNAP26m−Hyg−RE2及びpEF1α−SNAP26m−Hyg・N4を構築した。即ち、プラスミドpEF1α−KOD3G8LC−Hyg−RE2から制限酵素MluI、NotIを用いて抗KOD抗体の軽鎖遺伝子を切出した。一方、SNAPm発現プラスミドpSNAPmからSNAP26m遺伝子を配列番号3,20のプライマーを用いてPCRで増幅し、pEF1α−KOD3G8LC−Hyg−RE2プラスミドの制限酵素MluI、NotIサイトに導入してpEF1α−SNAP26m−Hyg−RE2(比較例)を構築した。続いて、このプラスミドを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号21、22のプライマーを用いてハイグロマイシン耐性遺伝子の下流にN4(実施例)配列を付加して、pEF1α−SNAP26m−Hyg・N4(実施例)を構築した。
【0087】
(2)プラスミドベクターpEF1α−SNAP26m−Hyg−RE2(比較例)及びpEF1α−SNAP26m−Hyg・N4(実施例)の細胞導入
実施例1(2)に記載の方法でトランスフェクション用のCHO−K1細胞を準備した。一方、実施例4(1)で構築したSNAP26m発現コンストラクトを制限酵素AhdIでリニアライズした。トランスフェクションは、実施例3(2)に記載の方法で行い、トランスフェクションの翌日、培地を除去し、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散させ、90mmペトリディッシュに移し、800μg/mlハイグロマイシン HygroGold(InvivoGen社製)を含むHam’s F12+10%FBS培地中で1週間選択培養を行った。選択培養中、3〜4日ごとに培地を交換した。選択培養終了後、実施例1(2)に記載の方法で、細胞集団のSNAP26mの発現強度を解析した。
【0088】
図15は、薬剤選択後のpEF1α−SNAP26m−Hyg−RE2(比較例)及びpEF1α−SNAP26m−Hyg・N4(実施例)で形質転換された細胞集団のFACS解析の結果を示す。また、図16に蛍光強度FL1が200以上、1000以上の細胞の割合のプロットを示す。この結果、mRNA不安定化配列であるN4が挿入されたpEF1α−SNAP26m−Hyg・N4(実施例)で形質転換された細胞集団には、N4が挿入されていないpEF1α−SNAP26m−Hyg−RE2(比較例)で形質転換された細胞集団と比較して、薬剤選択後、SNAPmの高発現を示す細胞が有意に濃縮されていることが分かる。
【0089】
(実施例5及び比較例5)
薬剤選択マーカー遺伝子としてネオマイシン耐性遺伝子を使用した薬剤選択マーカー遺伝子発現カセットにおけるmRNA不安定化配列の効果
(1)プラスミドベクターpEF1α−SNAP26m−Neo−RE2(比較例)及びpEF1α−SNAP26m−Neo・N4(実施例)の構築
薬剤選択マーカー遺伝子としてピューロマイシン耐性遺伝子の代わりにネオマイシン耐性遺伝子を用いた場合もmRNA不安定化配列の効果が認められるかどうかを検討するため、図17に示すスキームに従って、プラスミドpEF1α−SNAP26m−Neo・N4(実施例)を構築した。即ち、実施例4と同様にしてpEF1α−SNAP26m−Neo−RE2(比較例)構築した。次に、このプラスミドを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号21、23のプライマーを用いてネオマイシン耐性遺伝子の下流にN4配列を付加したpEF1α−SNAP26m−Neo・N4(実施例)を構築した。
【0090】
(2)プラスミドベクターpEF1α−SNAP26m−Neo−RE2(比較例)及びpEF1α−SNAP26m−Neo・N4(実施例)の細胞導入
実施例1(2)に記載の方法でトランスフェクション用のCHO−K1細胞を準備した。一方、pEF1α−SNAP26m−Neo−RE2及びpEF1α−SNAP26m−Neo・N4を制限酵素AhdIでリニアライズした。トランスフェクションは、実施例3(2)に記載の方法で行い、トランスフェクションの翌日、培地を除去し、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散させ、90mmペトリディッシュに移し、1mg/mlジェネティシン G418(ナカライテスク社製)を含むHam’s F12+10%FBS培地中で1週間選択培養を行った。選択培養中、3〜4日ごとに培地を交換した。選択培養終了後、実施例1(2)に記載の方法で、細胞集団のSNAP26mの発現強度を解析した。
【0091】
図18は、薬剤選択後のpEF1α−SNAP26m−Neo−RE2(比較例)及びpEF1α−SNAP26m−Neo・N4(実施例)で形質転換された細胞集団のFACS解析の結果を示す。また、図19に蛍光強度FL1が200以上、1000以上の細胞の割合のプロットを示す。この結果、mRNA不安定化配列であるN4が挿入されたpEF1α−SNAP26m−Neo・N4(実施例)で形質転換された細胞集団には、N4が挿入されていないpEF1α−SNAP26m−Neo−RE2(比較例)で形質転換された細胞集団と比較して、薬剤選択後、SNAPmの高発現を示す細胞が有意に濃縮されていることが分かる。
【0092】
(実施例6)
mRNA不安定化配列のモチーフ配列の繰り返し回数の検討
mRNA不安定化配列のモチーフ配列の繰り返し回数が高発現細胞の選択効率に与える影響を検討するため、実施例3のプラスミドにおいて繰り返し回数を4回から2回、6回、又は8回に変更したものを図20に示すスキームに従って構築した。即ち、実施例3(1)に記載のpEF1α−SNAP26m−Pur・N4を鋳型に、KOD−Plus−Mutagenesis Kitを用いたInverse PCR法によって、配列番号16、24のプライマーを用いてピューロマイシン耐性遺伝子の下流にN2配列(AREモチーフ配列TTATTTATTの2回の繰り返し)を付加したプラスミドpEF1α−SNAP26m−Pur・N2を構築した。また、同様の方法で、配列番号7、24のプライマーを用いてピューロマイシン耐性遺伝子の下流にN6配列(AREモチーフ配列TTATTTATTの6回の繰り返し)を付加したプラスミドpEF1α−SNAP26m−Pur・N6を構築し、配列番号7、25のプライマーを用いてピューロマイシン耐性遺伝子の下流にN8配列(AREモチーフ配列TTATTTATTの8回の繰り返し)を付加したプラスミドpEF1α−SNAP26m−Pur・N8を構築した。
【0093】
実施例1(2)に記載の方法でトランスフェクション用のCHO−K1細胞を準備した。一方、pEF1α−SNAP26m−Pur−RE2、pEF1α−SNAP26m−Pur・N2、pEF1α−SNAP26m−Pur・N4、pEF1α−SNAP26m−Pur・N6及びpEF1α−SNAP26m−Pur・N8の各SNAP26m発現コンストラクトを制限酵素AhdIでリニアライズした。トランスフェクションは、実施例3(2)に記載の方法で行い、トランスフェクションの翌日、培地を除去し、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散させ、90mmペトリディッシュに移し、7.5μg/ml ピューロマイシンを含むHam’s F12+10%FBS培地中で1週間選択培養を行った。選択培養中、3〜4日ごとに培地を交換した。選択培養終了後、実施例1(2)に記載の方法で、細胞集団のSNAP26mの発現強度を解析した。
【0094】
図21は、薬剤選択後のpEF1α−SNAP26m−Pur−RE2、pEF1α−SNAP26m−Pur・N2、pEF1α−SNAP26m−Pur・N4、pEF1α−SNAP26m−Pur・N6及びpEF1α−SNAP26m−Pur・N8で形質転換された細胞集団のFACS解析の結果を示す。また、図22に蛍光強度FL1が200以上、1000以上の細胞の割合のプロットを示す。この結果、繰り返し回数の多い、N6あるいはN8が挿入されたプラスミドのpEF1α−SNAP26m−Pur・N6あるいはpEF1α−SNAP26m−Pur・N8で形質転換したとき、繰り返し回数の少ない、N2あるいはN4が挿入されたプラスミドのpEF1α−SNAP26m−Pur・N2あるいはpEF1α−SNAP26m−Pur・N4で形質転換したときと比較して、SNAPm高発現細胞の割合が更に多く、mRNA不安定化配列のモチーフ配列の繰り返し回数が多いほど高発現細胞の選択効率が高いことが明らかになった。
【産業上の利用可能性】
【0095】
本発明の薬剤選択マーカー遺伝子発現カセットは、一緒に導入された目的タンパク質遺伝子を高レベルで発現する細胞を薬剤選択によって効率的に濃縮でき、高発現細胞株の樹立作業を低減短縮することができる。従って、本発明の薬剤選択マーカー遺伝子発現カセットを使用した細胞発現システムは、種々の哺乳類細胞のタンパク質の機能解析は勿論、バイオ医薬品として創薬・医療などの産業界に寄与することが大である。
【配列表フリーテキスト】
【0096】
配列番号2〜9は、実施例1に記載された設計されたポリヌクレオチドの配列である。
配列番号10〜17は、実施例4に記載された設計されたポリヌクレオチドの配列である。
配列番号18〜22は、実施例6に記載された設計されたポリヌクレオチドの配列である。
配列番号23は、実施例8に記載された設計されたポリヌクレオチドの配列である。
配列番号24及び25は、実施例10に記載された設計されたポリヌクレオチドの配列である。
【技術分野】
【0001】
本発明は、遺伝子組換え技術によって、目的とするタンパク質の遺伝子を挿入した発現ベクターを宿主細胞に導入し、得られた形質転換細胞の中から目的とするタンパク質の遺伝子を高レベルで発現する細胞を効率的に選別するために使用できる薬剤選択マーカー遺伝子発現カセットに関する。本発明の薬剤選択マーカー遺伝子発現カセットは、所望のタンパク質の機能解析などの基礎研究は勿論、遺伝子工学的手法により、動物細胞において医薬品などの有用タンパク質を生産するために有用である。
【背景技術】
【0002】
組換えタンパク質を生産する発現システムの開発は、研究または治療に供されるタンパク質の供給源を提供するうえで重要である。発現システムとしては、大腸菌などの原核細胞に基づくもの、ならびに酵母(Saccharomyces属,Pichia属、Kluyveromyces属など)及び哺乳類細胞などの動物細胞を含む真核細胞に基づくものの両者が用いられている。これらの中でも動物細胞、特に哺乳類細胞に基づく発現システムが治療用タンパク質の製造には好ましい。なぜなら、ヒトをはじめとする哺乳類動物において起こるタンパク質の翻訳後修飾は、時にその生物活性に深く寄与するため、タンパク質の投与対象と類似した翻訳後修飾が可能な哺乳類細胞に基づく発現システムを利用した方が、治療用タンパク質の有効性を増強しうるからである。
【0003】
組換えタンパク質を産生する細胞を樹立する方法としては、一般に、目的タンパク質の遺伝子を発現する遺伝子構築物を宿主細胞へ遺伝子導入し、得られた形質転換細胞の中からこの遺伝子構築物が宿主細胞のゲノム上に安定導入された細胞を選別する。この際、前記遺伝子構築物に、薬剤選択マーカーとなる薬剤耐性遺伝子を目的タンパク質の遺伝子と同一プロモーター下あるいは別個のプロモーター下で発現するように挿入しておき、薬剤選択によって生き残った細胞を目的タンパク質の遺伝子が安定導入された細胞として選別する。目的タンパク質の発現レベルは、目的タンパク質をコードする遺伝子が宿主細胞ゲノム内のどの領域に導入されるかによって大きく変動するが、導入領域の制御は、通常不可能である。従って、遺伝子導入しても大半の細胞は目的タンパク質遺伝子を発現しないか又は発現量が低い。このため、従来、目的タンパク質遺伝子を高レベルで発現する形質転換細胞の取得には、1000〜数千の細胞サンプルから1〜2個の細胞株を選別する作業を数ヶ月〜1年かけて繰り返し行っており、目的タンパク質遺伝子を高レベルで発現する形質転換細胞の選別に膨大な労力と時間を要していた。
【0004】
そこで、目的タンパク質遺伝子を高レベルで発現する形質転換細胞を効率的に選別するため、薬剤選択マーカーの発現や機能を減弱化することに基づく方法が開発されてきた。薬剤選択マーカーの発現や機能を減弱化すると、薬剤選択マーカー遺伝子が宿主細胞ゲノム内の低発現領域に導入された形質転換細胞は、薬剤選択マーカー(薬剤耐性遺伝子)を十分に発現することができないので、死滅してしまい、高発現領域に導入された形質転換細胞のみが薬剤選択によって生き残る。この生き残った形質転換細胞では、薬剤選択マーカー遺伝子に隣接して目的タンパク質遺伝子を有する可能性が高いため、目的タンパク質遺伝子も宿主細胞ゲノム内の高発現部位に導入されており、目的タンパク質遺伝子が高レベルで発現されている可能性が高い。このことを利用して、目的タンパク質遺伝子を高レベルで発現する形質転換細胞を効率良く選別することができると考えられる。
【0005】
薬剤選択マーカーの発現や機能を減弱化する1つの方法としては、薬剤選択マーカーの発現に用いるプロモーターとして、転写活性の弱いプロモーターであるHerpes simplex virus thymidine kinase(HSV−tk)プロモーターを利用する方法(非特許文献1)や、野生型の転写活性レベルよりも減弱化された変異型プロモーターを用いて薬剤選択マーカーの発現を抑える方法(特許文献1、2)が挙げられる。しかしながら、本発明者らがこれらの方法を追試したところ、いずれの方法も薬剤選択マーカーの発現を減弱化するという面で効果がほとんど見られなかった。このことから、これらの方法を用いて目的タンパク質遺伝子を高レベルで発現する形質転換細胞を効率的に選別するということは難しいと考えられた。
【0006】
薬剤選択マーカーの発現や機能を減弱化する別の方法としては、ネオマイシンホスホトランスフェラーゼなどの薬剤選択マーカー遺伝子のコード配列に変異を導入して薬剤選択マーカー自体の機能を減弱化する方法(特許文献3、4)が挙げられる。本発明者らがこの方法を追試したところ、この方法を用いることにより薬剤選択マーカーの機能を多少減弱化することができ、薬剤選択の結果として少量の発現量の向上した細胞株を取得することができた。しかしながら、目的タンパク質遺伝子を高レベルで発現する形質転換細胞を選別する点での効率は良くなく、この方法による顕著な効果は見られなかった。
【0007】
このように、従来公知の薬剤選択マーカーの発現や機能を減弱化する方法は、いずれも効率が悪く、目的タンパク質遺伝子を高レベルで発現する形質転換細胞を効率的に選別する好適な方法は未だ確立されていない。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】US5,627,033
【特許文献2】WO2005/024015
【特許文献3】WO2001/032901
【特許文献4】WO2004/050884
【非特許文献】
【0009】
【非特許文献1】Niwa H、Yamamura K,Miyazaki J.(1991) Gene 108:193−200
【非特許文献2】Bakheet T,Frevel M,Williams B.R.G、 Greer W,Khabar K.S.A.(2001) Nucleic Acids Research 29:246−254
【非特許文献3】Lagnado C.A,Brown C.L,Goodall G.J.(1994) Molecular and Cellular Biology 14:7984−7995
【非特許文献4】Zubiaga A.M,Belasco J.G,Greenberg M.E.(1995) Molecular and Cellular Biology 15:2219−2230
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明の目的は、目的タンパク質遺伝子を高レベルで発現する形質転換細胞を効率的に選別することを可能にすることにある。
【課題を解決するための手段】
【0011】
本発明者らは、上記目的を達成するため、薬剤選択マーカーの発現や機能を効率的に減弱化する別の方法について鋭意検討した結果、mRNA不安定化配列を利用して薬剤選択マーカー遺伝子の発現を減弱化することを想起した。そして、種々の薬剤選択マーカーの発現カセットにmRNA不安定化配列を挿入し、細胞の形質転換及び薬剤選択を行ったところ、コロニー数が有意に減少した。さらに導入された目的タンパク質遺伝子の発現を詳しく解析した結果、高発現細胞の割合が有意に上昇することを見出し、本発明を完成させるに到った。
【0012】
すなわち、本発明によれば、以下が提供される:
(1)プロモーター、薬剤選択マーカー遺伝子、mRNA不安定化配列、及びポリアデニレーションシグナルを有することを特徴とする薬剤選択マーカー遺伝子発現カセット。
(2)薬剤選択マーカー遺伝子が、タンパク質合成阻害系抗生物質耐性遺伝子であることを特徴とする(1)に記載の発現カセット。
(3)薬剤選択マーカー遺伝子が、ピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン−B−ホスホトランスフェラーゼ、及びネオマイシンホスホトランスフェラーゼからなる群より選択されることを特徴とする(2)に記載の発現カセット。
(4)mRNA不安定化配列が、サイトカイン、インターロイキン、又は癌原遺伝子の3’非翻訳領域に存在するATリッチ配列に由来することを特徴とする(1)〜(3)のいずれか一項に記載の発現カセット。
(5)mRNA不安定化配列が、TTATTTA(A/T)(A/T)のモチーフ配列を有することを特徴とする(1)〜(3)のいずれか一項に記載の発現カセット。
(6)モチーフ配列が、2回以上繰り返されていることを特徴とする(5)に記載の発現カセット。
(7)モチーフ配列の繰り返し間に1塩基以上のスペーサー配列を含むことを特徴とする(6)に記載の発現カセット。
(8)mRNA不安定化配列中に1ないし数塩基の置換、挿入または欠失を含むことを特徴とする(4)〜(7)のいずれか一項に記載の発現カセット。
(9)(1)〜(8)のいずれか一項に記載の薬剤選択マーカー遺伝子発現カセットを有することを特徴とする発現ベクター。
(10)目的タンパク質遺伝子発現カセットをさらに有することを特徴とする(9)に記載の発現ベクター。
(11)目的タンパク質遺伝子発現カセット中の目的タンパク質遺伝子が、抗体の重鎖又は/及び軽鎖遺伝子のコード配列であることを特徴とする(10)に記載の発現ベクター。
(12)マルチクローニングサイトを備えた発現カセットをさらに有することを特徴とする(9)に記載の発現ベクター。
(13)マルチクローニングサイトに目的タンパク質遺伝子が導入されていることを特徴とする(12)に記載の発現ベクター。
(14)(9)に記載の発現ベクターと、目的タンパク質遺伝子発現カセット又はマルチクローニングサイトを備えた発現カセットを有する発現ベクターとからなる一対の発現ベクター。
(15)マルチクローニングサイトに目的タンパク質遺伝子が導入されている(14)に記載の一対の発現ベクター。
(16)(9)〜(15)のいずれか一項に記載の発現ベクターで宿主細胞を形質転換して得られることを特徴とする形質転換細胞。
(17)宿主細胞が動物細胞であることを特徴とする(16)に記載の形質転換細胞。
(18)動物細胞が哺乳類細胞であることを特徴とする(17)に記載の形質転換細胞。
(19)哺乳類細胞がチャイニーズハムスター卵巣(CHO)細胞であることを特徴とする(18)に記載の形質転換細胞。
(20)(16)〜(19)のいずれか一項に記載の形質転換細胞を薬剤選択する工程を含むことを特徴とする、目的タンパク質遺伝子を高レベルで発現する細胞群を選別する方法。
(21)(16)〜(19)のいずれか一項に記載の形質転換細胞からなる細胞群であって、目的タンパク質遺伝子を高レベルで発現することを特徴とする細胞群。
(22)(16)〜(19)のいずれか一項に記載の形質転換細胞を用いることを特徴とする、タンパク質を生産する方法。
(23)タンパク質が、抗体であることを特徴とする(22)に記載の方法。
(24)タンパク質が、ワクチンであることを特徴とする(22)に記載の方法。
(25)(16)〜(19)のいずれか一項に記載の形質転換細胞を用いることを特徴とする、アミノ酸を生産する方法。
(26)(16)〜(19)のいずれかに記載の形質転換細胞を用いることを特徴とする、ヌクレオチドを生産する方法。
【発明の効果】
【0013】
本発明の薬剤選択マーカー遺伝子発現カセットは、mRNA不安定化配列が挿入されているため、mRNA不安定化配列を有さない従来の薬剤選択マーカー遺伝子発現カセットに比べてmRNAが不安定化されて薬剤選択マーカーの発現が減弱化されており、宿主細胞ゲノム内の高発現領域に組み込まれないと、薬剤存在下で形質転換細胞の生存が困難となる。このため、薬剤選択マーカー遺伝子及び目的タンパク質遺伝子が宿主細胞ゲノム内の高発現領域に組み込まれた形質転換細胞のみが薬剤選択によって生き残ることができる。その結果、目的タンパク質遺伝子を高レベルで発現する高発現細胞を効率的に選別することができる。
【図面の簡単な説明】
【0014】
【図1】pBS−CMV−SNAPm2の構築を示す図である。
【図2】pPUR・N4の構築を示す図である。以下、図中、Purとは、ピューロマイシン耐性遺伝子のことである。また、図中、iPCRとは、Inverse PCRのことである。
【図3】pBS−CMV−SNAPm−Pur及びpBS−CMV−SNAPm−Pur・N4の構築を示す図である。
【図4】pBS−CMV−SNAPm−Pur及びpBS−CMV−SNAPm−Pur・N4で形質転換された細胞集団のFACS解析の結果を示す図である。
【図5】pBS−CMV−SNAPm−Pur及びpBS−CMV−SNAPm−Pur・N4で形質転換された細胞集団のうち、SNAPmを高発現する細胞の割合をプロットしたグラフである。
【図6】pBS−CMV−SNAPm−Pur及びpBS−CMV−SNAPm−Pur・N4で形質転換された細胞集団を薬剤選択した際の明視野像である。
【図7】pBS−CMV−SNAPm−Purのコロニーを単離し、FACS解析した結果を示す図である。
【図8】pBS−CMV−SNAPm−Pur・N4のコロニーを単離し、FACS解析した結果を示す図である。
【図9】pEF1α−KOD3G8HC−RE2の構築を示す図である。以下、図中、Neoとは、ネオマイシン耐性遺伝子のことである。
【図10】pEF1α−SNAP26m−Pur・N4及びpEF1α−SNAP26m−Pur−RE2の構築を示す図である。
【図11】pEF1α−SNAP26m−Pur−RE2及びpEF1α−SNAP26m−Pur・N4で形質転換された細胞集団のFACS解析の結果を示す図である。
【図12】pEF1α−SNAP26m−Pur−RE2及びpEF1α−SNAP26m−Pur・N4で形質転換された細胞集団のうち、SNAPmを高発現する細胞の割合をプロットしたグラフである。
【図13】pEF1α−KOD3G8LC−Hyg−RE2の構築を示す図である。以下、図中、Hygとは、ハイグロマイシン耐性遺伝子のことである。
【図14】pEF1α−SNAP26m−Hyg−RE2及びpEF1α−SNAP26m−Hyg・N4の構築を示す図である。
【図15】pEF1α−SNAP26m−Hyg−RE2及びpEF1α−SNAP26m−Hyg・N4で形質転換された細胞集団のFACS解析の結果を示す図である。
【図16】pEF1α−SNAP26m−Hyg−RE2及びpEF1α−SNAP26m−Hyg・N4で形質転換された細胞集団のうち、SNAPmを高発現する細胞の割合をプロットしたグラフである。
【図17】pEF1α−SNAP26m−Neo・N4の構築を示す図である。
【図18】pEF1α−SNAP26m−Neo−RE2及びpEF1α−SNAP26m−Neo・N4で形質転換された細胞集団のFACS解析の結果を示す図である。
【図19】pEF1α−SNAP26m−Neo−RE2及びpEF1α−SNAP26m−Neo・N4で形質転換された細胞集団のうち、SNAPmを高発現する細胞の割合をプロットしたグラフである。
【図20】pEF1α−SNAP26m−Pur・N2、pEF1α−SNAP26m−Pur・N6及びpEF1α−SNAP26m−Pur・N8の構築を示す図である。
【図21】pEF1α−SNAP26m−Pur−RE2、pEF1α−SNAP26m−Pur・N2、pEF1α−SNAP26m−Pur・N4、pEF1α−SNAP26m−Pur・N6及びpEF1α−SNAP26m−Pur・N8で形質転換された細胞集団のFACS解析の結果を示す図である。
【図22】pEF1α−SNAP26m−Pur−RE2、pEF1α−SNAP26m−Pur・N2、pEF1α−SNAP26m−Pur・N4、pEF1α−SNAP26m−Pur・N6及びpEF1α−SNAP26m−Pur・N8で形質転換された細胞集団のうち、SNAPmを高発現する細胞の割合をプロットしたグラフである。
【発明を実施するための形態】
【0015】
以下に本発明を詳細に説明する。
【0016】
タンパク質の機能解析や有用タンパク質の生産のために、遺伝子組み換え技術を用いて、細胞、特に動物細胞に、目的とするタンパク質の遺伝子を導入し、組換えタンパク質として発現させる方法が広く用いられている。具体的には、プラスミドベクターに代表されるベクターに目的タンパク質遺伝子を挿入し、細胞にベクターを取り込ませた後、組換えにより目的タンパク質遺伝子を細胞ゲノムに組み込み、細胞を形質転換させる方法がよく用いられている。
【0017】
細胞のゲノムは染色体上に存在するが、染色体はヒストンのアセチル化や高度な凝集(ヘテロクロマチン)等により遺伝子の発現が制御されており、挿入される染色体の場所によって遺伝子の発現量は大きく異なる。ベクターを用いて細胞を形質転換する方法においては、細胞ゲノムのどの場所に目的タンパク質遺伝子が導入されるかを制御することはできず、そのため形質転換細胞における目的タンパク質遺伝子の発現量、ひいては目的タンパク質の生産量は、細胞株によって大きく異なることになる。
【0018】
また、遺伝子組み換えがうまくいかず、目的タンパク質遺伝子が細胞ゲノムに組み込まれていない場合も多い。
【0019】
そこで、従前、予め発現ベクターに薬剤耐性(薬剤選択マーカー)遺伝子を挿入しておき、細胞にこのベクターを遺伝子導入した後、培地中に薬剤を投与して(薬剤選択)、形質転換が成功した細胞を選択し、その後、生じた細胞群から高い発現を示す細胞株を繰り返し選別する作業が行われてきた。しかしながら、この方法では多数の細胞株を用意する必要があり、また長期間の培養を必要とする細胞の選別作業を繰り返し行うため、多大の労力と時間を要してきた。加えて、薬剤耐性遺伝子は多くの場合、少量の発現でも薬剤に対する耐性を示すため、生存した細胞の中には、薬剤耐性遺伝子及び目的タンパク質遺伝子が細胞ゲノム内の低発現領域に組込まれており目的タンパク質遺伝子の発現量が少ない細胞株も混在しており、更に労力と時間に拍車をかけてきた。
【0020】
本発明はこれらの問題を解決するためになされたものであり、従来公知の薬剤耐性(薬剤選択マーカー)遺伝子を使用した選別において、mRNA不安定化配列を利用することによって薬剤耐性遺伝子の発現量を大きく抑え、宿主細胞ゲノム内の高発現領域に薬剤耐性遺伝子が組込まれた形質転換細胞のみが薬剤選択後に生き残るようにしたものである。薬剤耐性遺伝子の近隣には目的タンパク質の遺伝子が組込まれているため、生き残った細胞では、目的タンパク質遺伝子も高発現領域に組込まれている可能性が高い。従って、本発明によれば、(i)遺伝子組み換えがうまくいかず、目的タンパク質遺伝子が細胞ゲノムに組み込まれていない細胞、(ii)遺伝子組み換えに成功したが、薬剤耐性遺伝子及び目的タンパク質遺伝子が宿主細胞ゲノムの低発現領域に組込まれている細胞、及び(iii)遺伝子組み換えに成功し、しかも薬剤耐性遺伝子及び目的タンパク質遺伝子が宿主細胞ゲノムの高発現領域に組込まれている細胞の中から、(iii)の遺伝子組み換えに成功し、しかも薬剤耐性遺伝子及び目的タンパク質遺伝子が宿主細胞ゲノムの高発現領域に組込まれている細胞のみを薬剤選択によって効率的に選別することができる。従来公知の選別方法では、(i)〜(iii)の細胞から(ii)及び(iii)の細胞を薬剤選択によって選別することができるが、(ii)及び(iii)の細胞から(iii)の細胞のみを薬剤選択によって選別することはできず、薬剤選択後に生き残った形質転換細胞について目的タンパク質遺伝子の発現レベルを別途確認して、(iii)の高発現細胞を選別していた。本発明の方法は、薬剤選択のみによって(i)〜(iii)の細胞から(iii)の高発現細胞を一気に選別することができるため、効率的であり、結果として高発現細胞を迅速に選別することができる。
【0021】
本発明の第一の側面によれば、プロモーター、薬剤選択マーカー遺伝子、mRNA不安定化配列、及びポリアデニレーションシグナルを有することを特徴とする薬剤選択マーカー遺伝子発現カセットが提供される。
【0022】
本発明において、発現カセットとは、プロモーターから遺伝子コード配列、ターミネーター配列(ポリアデニレーションシグナル)までの遺伝子発現の単位をいう。加えて、イントロン、スペーサー配列、翻訳増強領域等を含むこともある。したがって、例えば「薬剤選択マーカー遺伝子発現カセット」という場合、前記発現カセットの遺伝子コード配列が薬剤選択マーカー遺伝子のコード配列であるものをいう。
【0023】
本発明の薬剤選択マーカー遺伝子発現カセットは、mRNA不安定化配列を有することを除いては、従来公知の薬剤選択マーカー遺伝子発現カセットと同様の構成を有する。そこで、まず、mRNA不安定化配列について説明する。
本発明は、mRNA不安定化配列が極めて効果的に薬剤耐性遺伝子の発現を減弱化することができることを見出したことに基づくものである。本発明のmRNA不安定化配列を含む薬剤選択マーカー遺伝子発現カセットを搭載した発現ベクターを宿主細胞へ遺伝子導入した場合、mRNA不安定化配列を含まない場合と比較して、薬剤選択後の生存細胞数、あるいはそのコロニーは1/10〜1/100に減少する。これはmRNA不安定配列の存在により薬剤選択マーカーのmRNAが不安定化し、薬剤選択マーカーの発現量が下がるため、宿主細胞のゲノム中で転写活性の高い高発現領域に当該発現カセットが組み込まれた細胞でなければ薬剤選択下での生存が困難になるためと考えられる。
【0024】
「mRNA不安定化配列」とは、この配列を有するDNAから転写されたmRNAの細胞内半減期を低減させる機能を有するヌクレオチド配列のことであり、自然界では初期応答遺伝子などに存在することが見出されている。
【0025】
mRNA不安定化配列は、いくつかの遺伝子ではコード配列中、あるいは5’UTR(非翻訳領域)に存在するものもあるが、多くは3’UTRに存在する。3’UTRに存在するmRNA不安定化配列としては、AU−rich element(ARE)、histone mRNA 3’−terminal stem−loop、iron−responsive element(IRE)、insulin−like growth factor II(IGF−II)、long stem−loopなどが知られている。これらの中でもAREは、恒常的にmRNAを不安定化できることから、本発明に用いるmRNA不安定化配列として好ましい。
【0026】
AREとは、mRNAにおける「AUが豊富なエレメント」、すなわちアデニン(A)及びウラシル(U)を高い割合で含む配列もしくは領域を意味する。またAREとは、前記エレメントをコードするDNAにおける「ATが豊富なエレメント」、すなわちアデニン(A)及びチミン(T)を高い割合で含む配列もしくは領域を指すためにも用いられる。
【0027】
AREは、造血細胞増殖因子遺伝子、成長因子遺伝子、インターロイキン遺伝子、インターフェロン等のサイトカイン遺伝子、及びいくつかの癌原遺伝子(プロトオンコジーン)などに見られる(非特許文献2)。本発明の薬剤選択マーカー遺伝子発現カセットでは、これらの遺伝子中のAREに相当する核酸配列をそのまま利用してもよいが、ARE中のモチーフ配列として知られるTATTTAT(非特許文献3)やTTATTTA(T/A)(T/A)(非特許文献4)などを利用する方が、不要な制限酵素認識配列を発現ベクターに挿入してしまうことを避けることができ、利便性が高い。
【0028】
AREを持つ遺伝子の例としては、造血細胞増殖因子についてはGranulocyte−monocyte colony sitimulationg factor(GM−CSF),インターロイキンについてはInterleukin−1β、2,3、4、6、8、10、11、インターフェロンについてはInterferon−α、癌原遺伝子についてはc−fos,c−myc,c−jun,c−myb,Pim−1などが例示される。このほかにもTumor necrosis factor,Cyclin D1,Cyclooxygenase,Plasminogen activator inhibitor type2など多くの遺伝子がAREを持つことが知られており、例示された遺伝子に限定されない。
【0029】
本発明の薬剤選択マーカー遺伝子発現カセットにおいて使用することができるmRNA不安定化配列としては、下記のものが例示される。
【0030】
ATTTのモチーフ配列の1ないし2回以上の繰り返し。
【0031】
ATTTAのモチーフ配列の1ないし2回以上の繰り返し。
【0032】
TATTTATのモチーフ配列の1ないし2回以上の繰り返し。
【0033】
TTATTTA(T/A)(T/A)のモチーフ配列の1ないし2回以上の繰り返し。(T/A)はTまたはAのいずれかである。
【0034】
これらの配列は、1ないし数塩基の置換/挿入/欠失を含んでもよく、DNAの複製の誤りや突然変異などの自然変異によるもの、人為的な変異導入によるもの等が想定される。また、モチーフ配列の繰り返し間には1〜100塩基程度のスペーサー配列またはリンカー配列を含んでもよい。加えて、モチーフ配列の逆位を含むものであってもよい。
【0035】
これらのモチーフ配列の繰り返し数は、1回でもよいが、2回以上、より好ましくは4回以上とすることにより、mRNAの不安定化効果を一層高めることができ、選別効率を顕著に増大させることができる。
【0036】
繰り返しの回数の上限は特に限定されないが、細胞へのベクターの取り込みの観点から、発現ベクターが最大10kbp〜20kbp長となるようなものが望ましい。ただし、繰り返し配列数が増えるにしたがって、mRNAの不安定化の効果は飽和に向かい、一定の繰り返し数を超えるとそれ以上の顕著な効果を望めなくなる。上限値を定めるものではないが、10回以上の繰り返し配列は実用上意味がない。
【0037】
本発明の薬剤選択マーカー遺伝子発現カセットにおけるプロモーターとしては、動物細胞、特に哺乳類細胞で発現可能なプロモーターであれば特に限定されるものではないが、ヒトやマウスのサイトメガロウイルス(CMV)プロモーター、サルウイルス40(SV40)プロモーター、ヒトヘルペス単純ウイルスのチミジンキナーゼ遺伝子(HSV−tk)プロモーター、などのウイルスに由来するものや、マウスphosphoglycerate−kinase1遺伝子(PGK)プロモーターなどの非ウイルス性の細胞遺伝子に由来するプロモーター、及び由来の異なるプロモーターのハイブリッドが挙げられる。ここで、プロモーターは、プロモーターのコア領域に限るものではなく、エンハンサー領域を含む場合もある。薬剤選択マーカーの発現を減弱化するため、転写活性が低いものがより好ましい。転写活性の低いプロモーターとして変異型のプロモーターなどを利用してもよいし、コザック配列を置換してもよい。さらに、mRNA不安定化配列のモチーフ配列の繰り返しの回数を少なくし、転写活性の弱いプロモーターを併用するのも1つの想定される実施態様である。
【0038】
本発明の薬剤選択マーカー遺伝子発現カセットにおける薬剤選択マーカー遺伝子としては、薬剤選択に一般的に使用される薬剤に対して耐性を示す遺伝子が好適に用いられる。タンパク質合成阻害系抗生物質を薬剤として用いる場合には、タンパク質合成阻害系抗生物質耐性遺伝子を用いることが好ましい。特に限定されるものではないが、ネオマイシン耐性遺伝子(ジェネティシン耐性遺伝子としての機能も有する)として、Tn5由来ネオマイシンホスホトランスフェラーゼ(aminoglycoside 3’−phosphotransferase)(Neo)、ハイグロマイシン耐性遺伝子として、E.coli由来ハイグロマイシン−B−ホスホトランスフェラーゼ(Hph、実施例、比較例および図面ではHygと記載)、ピューロマイシン耐性遺伝子として、Streptomyces由来ピューロマイシン−N−アセチルトランスフェラーゼ遺伝子(pac、実施例、比較例および図面ではPurと記載)、ブラストサイジン耐性遺伝子として、Bacillus cereus由来ブラストサイジン耐性遺伝子(bsr)などが例示される。これらの中でも、ピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン‐B−ホスホトランスフェラーゼ、ネオマイシンホスホトランスフェラーゼが好ましく、より好ましくはピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン‐B−ホスホトランスフェラーゼであり、さらに好ましくはピューロマイシン−N−アセチルトランスフェラーゼである。
【0039】
本発明の薬剤選択マーカー遺伝子発現カセットにおけるポリアデニレーションシグナル(ターミネーター配列)としては、SV40ウイルス由来late polyAシグナル、early polyAシグナル、HSV−tk由来polyAシグナル、ウシ成長因子遺伝子由来polyAシグナル、ウサギβ−グロビン遺伝子由来polyAシグナルなどが例示されるが、特に限定されるものではない。
【0040】
本発明の薬剤選択マーカー遺伝子発現カセット中でのプロモーター、薬剤選択マーカー遺伝子、mRNA不安定化配列、及びポリアデニレーションシグナルの配置順序は、薬剤選択マーカー遺伝子の発現が可能である限り特に限定されないが、一般的にプロモーター、薬剤選択マーカー遺伝子、mRNA不安定化配列、及びポリアデニレーションシグナルをこの順序で上流から下流に向かって配置する。これらの四つの要素は、相互に直接連結されている必要はなく、所望により、イントロン、スペーサー配列、翻訳増強領域等を間に有していてもよい。
【0041】
本発明の第二の側面によれば、本発明の第一の側面による薬剤選択マーカー遺伝子発現カセットを有することを特徴とする発現ベクターが提供される。
【0042】
本発明において、発現ベクターとは、遺伝子工学に利用されるベクターである。発現ベクターは、プラスミドベクターであることができる。しかし、これに限らず、例えば、ウイルスベクター、コスミドベクター、細菌人工染色体(BAC)、酵母人工染色体(YAC)及び他の非プラスミドベクターも使用できる。
【0043】
本発明の発現ベクターは、目的タンパク質の遺伝子を、薬剤選択マーカー遺伝子発現カセットと独立した別個の発現カセットの形でさらに含むことが好ましい。真核細胞の場合、目的タンパク質遺伝子と薬剤選択マーカー遺伝子を内在性リボソームエントリー部位(Internal ribosome entry sites、IRES)でつなぐポリシストロン性の発現を行う方法もあるが、目的タンパク質遺伝子と薬剤選択マーカー遺伝子のコード配列が1つのmRNAとして合成されるため、mRNA不安定化配列を挿入すると、目的タンパク質遺伝子のmRNAが減少してしまい、高発現細胞を得られない。そのため、本発明の発現ベクターでは、目的タンパク質遺伝子は、薬剤選択マーカー遺伝子発現カセットと独立した発現カセットとして配置されることが好ましい。この場合、目的タンパク質遺伝子発現カセットと薬剤選択マーカー遺伝子発現カセットが別個のベクター上に配置された一対の発現ベクターの形で利用されてもよいが、目的タンパク質遺伝子発現カセットと薬剤選択マーカー遺伝子発現カセットが同一のベクター上に配置されることがより好ましい。
【0044】
前記薬剤選択マーカー遺伝子発現カセットと目的遺伝子タンパク質の発現カセットが同一のベクター上に配置される場合、両者は隣接してもよいし、間にスペーサー配列が挿入されていてもよい。目的タンパク質遺伝子の発現カセットは薬剤選択マーカー遺伝子発現カセットの上流、下流のいずれに配置されても良いが、隣接して挿入される際には、目的タンパク質遺伝子の発現カセットが上流になるように配置される方が好ましい。さらに、スペーサー配列として、隣接する発現カセットの転写干渉を抑制するためのインスレーター配列が挿入されていても良い。
【0045】
薬剤選択マーカー遺伝子発現カセットは、1つのベクターに2つ以上含まれていても良い。この場合、同一の薬剤選択マーカーが選ばれる場合もあるし、それぞれ異なる薬剤選択マーカーが選ばれる場合もある。また、各薬剤選択マーカーは隣接して配置されても良いし、離れて配置されていても良い。
【0046】
目的のタンパク質が抗体の重鎖、軽鎖のように複数のポリペプチドからなる場合、目的タンパク質の発現カセットを複数配置してもよく、あるいは複数のポリペプチド遺伝子をIRESでつなぎ、ポリシストロン性の1つの発現カセットの形にしてもよい。
【0047】
また、複数のポリペプチド発現カセットをそれぞれ異なるベクターに挿入し、それぞれのベクターを1つの宿主細胞へ導入して形質転換細胞を作製し、目的タンパク質を生産することができる。この場合、各ベクターに薬剤選択マーカー遺伝子発現カセットを配置することができ、それぞれ同一の薬剤選択マーカーを用いることもできるが、異なる薬剤選択マーカーを用いる方が、各ポリペプチドが全て高発現を示す細胞を効率よく取得する点で有利であり、好ましい。
【0048】
目的タンパク質遺伝子の発現カセットは、プロモーター、遺伝子コード配列、及びターミネーター配列(ポリアデニレーションシグナル)からなる。加えて、イントロンやスペーサー配列、翻訳増強領域を含むこともある。目的タンパク質遺伝子の発現プロモーターとしてはできるだけ転写活性の高いものが好ましく、ヒトやマウスのサイトメガロウイルス(CMV)プロモーター、サルウイルス40(SV40)プロモーターなどのウイルスに由来するものや、ヒトやマウス、さらにはCHO由来のElongation Factor 1(EF1α)遺伝子、ユビキチン遺伝子、β−アクチン遺伝子など、非ウイルス性の細胞遺伝子に由来するプロモーター、及び由来の異なるプロモーター/エンハンサーのハイブリッド、例えばCAGプロモーターなどが挙げられる。
【0049】
代替実施態様として、目的タンパク質遺伝子の発現カセットに、このタンパク質遺伝子のコード配列の代わりに、複数の制限酵素認識配列からなるマルチクローニングサイトが配置されており、このマルチクローニングサイトに種々の目的タンパク質遺伝子(外来遺伝子)のcDNAやコード配列を導入できるように構築された発現ベクターを挙げることができる。
【0050】
本発明の第三の側面によれば、本発明の第二の側面による発現ベクターで宿主細胞を形質転換して得られることを特徴とする形質転換細胞が提供される。
【0051】
本発明の形質転換細胞における宿主細胞としては、組換えタンパク質の産生に一般的に用いられるチャイニーズハムスター卵巣細胞(CHO)の他、マウスミエローマ細胞(NSO)、ベビーハムスターキドニー細胞(BHK)、ヒト繊維肉腫細胞(HT1080)、COS細胞などの哺乳類由来の細胞が例示されるが、これらに限定されるものではなく、ヒト、マウス、ラット、ハムスター、モルモット、ウサギ、イヌ、ウシ、ウマ、ヒツジ、サル、ブタなどの動物由来の細胞などを広く導入対象とすることができる。また、大腸菌などの細菌細胞や酵母、昆虫細胞などを用いたタンパク質生産システムにも応用しうる。
【0052】
宿主細胞の形質転換方法は、当業者であれば適宜選択しうるが、例えばリポフェクション法、リン酸カルシウム法、エレクトロポレーション法、DEAEデキストラン法、マイクロインジェクション等が挙げられる。
【0053】
本発明の第四の側面によれば、本発明の第三の側面による形質転換細胞を薬剤選択する工程を含むことを特徴とする、目的タンパク質遺伝子を高レベルで発現する細胞群を選別する方法が提供される。また、本発明の第五の側面によれば、本発明の第三の側面による形質転換細胞からなる細胞群であって、目的タンパク質遺伝子を高レベルで発現することを特徴とする細胞群が提供される。
【0054】
薬剤選択に使用する薬剤は、薬剤選択マーカー遺伝子発現カセット中の薬剤選択マーカー遺伝子の種類に応じて決定される。また、使用する薬剤の濃度としては、一般に使用される濃度の範囲で高発現細胞の濃縮が可能であるが、少し高めの濃度が好ましい。最適な濃度は、宿主細胞や用いる培地の種類によって変化する。これらの濃度の設定方法は当業者にとっては公知であり、適宜設定しうる。例えば、産業用の生産細胞として用いられるチャイニーズハムスター卵巣(CHO)細胞を10%ウシ胎児血清を含むHam‘s F12培地で培養し、ピューロマイシン耐性遺伝子発現カセットを利用した場合のピューロマイシンの濃度としては、5μg/ml以上、より好ましくは7.5μg/ml以上、さらに好ましくは10μg/ml以上である。同様の培養条件でハイグロマイシン耐性遺伝子発現カセットを利用した場合のハイグロマイシンBの濃度としては、200μg/ml以上、より好ましくは600μg/ml以上、さらに好ましくは800μg/ml以上である。同様の培養条件でネオマイシン耐性遺伝子発現カセットを利用した場合のG418の濃度としては、好ましくは400μg/ml以上、より好ましくは800μg/ml以上、さらに好ましくは1,000μg/ml以上である。
【0055】
本発明の選別方法では、薬剤選択により、mRNAの不安定化を伴わない従来の薬剤選択を行った細胞群に比べて、目的タンパク質遺伝子を高レベルで発現する細胞の割合が有意に高くなる。従って、従来は、薬剤選択後の膨大なサンプルから目的タンパク質遺伝子を高レベルで発現する細胞株を選別する作業を繰り返し行わなければならなかったが、本発明によれば、薬剤選択マーカーのmRNA不安定化を含む薬剤選択のみによって、選別の候補となるサンプル数を大幅に絞ることができる。本発明の選別方法を用いれば、薬剤選択後も生存する細胞群(ポリクローン)の大部分を占める、目的タンパク質遺伝子を高レベルで発現する細胞群から細胞を単離し、培養することにより、容易に高発現を示す細胞株(モノクローン)を取得することができる。本発明の実施態様の一例として、4.0×105個の細胞に本発明の薬剤選択マーカー遺伝子発現カセットが挿入されたベクターを遺伝子導入した後、薬剤選択を行って生じた細胞群から100の細胞株をランダムに選択して、個々の細胞株の発現量を調べることにより目的タンパク質の高発現株を容易に取得することができる。
【0056】
細胞の発現レベルはレポーター遺伝子の発現量により調べることができるが、一例として、SNAP26m遺伝子(Covalys社)やGFP(Green Fluorescent Protein)遺伝子等の蛍光タンパク質遺伝子を含む発現カセットを本発明の発現ベクターに導入し、FACS(fluorescence activated cell sorting)等のフローサイトメーターを用いて蛍光強度を解析することにより調べることができる。別の例として、ルシフェラーゼ遺伝子を含む発現カセットを本発明による発現ベクターに導入後、細胞溶解液にD−ルシフェリンを添加してルミノメーターで発光量を測定することにより調べることができる。また、レポーター遺伝子に限らず、ELISA(Enzyme−Linked Immunosorbent Assay)、酵素免疫測定法(EIA)等を利用することで抗体等の目的タンパク質の発現を調べることもできる。
【0057】
本発明により、細胞選別の工程及び時間を大幅に短縮することができると共に、高発現を示す細胞の割合が上昇することにより、短時間で効率的に目的タンパク質遺伝子を高レベルで発現する細胞を取得することができ、従来技術と比べて極めて顕著な効果を示す。
【0058】
例えばFACSCalibur(ベクトン・ディッキンソン社製)により、蛍光強度FL1にてSNAP26mの発現量を測定した場合、FL1が200以上若しくは1000以上を示す細胞の割合は、本発明の薬剤選択マーカー遺伝子発現カセットを有さない細胞に比べて、本発明による細胞では1.1倍以上、また多くの場合1.5倍から2倍以上大きくなる効果が認められた。また、FL1が200以上を示す細胞の割合の増加率よりもFL1が1000以上を示す細胞の割合の増加率の方が高い傾向が見られており、本発明により選別される細胞群が、本発明の薬剤選択マーカー遺伝子発現カセットを有さない細胞に比べて高い発現を示すという効果を裏付けている。
【0059】
本発明の第六の側面によれば、本発明の第三の側面による形質転換細胞を用いることを特徴とする、タンパク質を生産する方法が提供される。
【0060】
一つの実施態様では、生産されるタンパク質は、抗体である。哺乳類の抗体には、IgM、IgD、IgG、IgA、IgEの5種類のクラスが存在することが明らかとなっているが、ヒトの各種疾患の診断、予防及び治療には血中半減期が長く、各種エフェクター機能を有する等の機能特性からヒトIgGクラスの抗体が主として利用されている。抗体は、形質転換細胞の培養上清よりプロテインAカラムを用いて精製することができる。また、その他に通常、蛋白質の精製で用いられる精製方法を使用することができる。例えば、ゲル濾過、イオン交換クロマトグラフィー及び限外濾過等を組み合わせて行い、精製することができる。精製したヒト化抗体のH鎖、L鎖或いは抗体分子全体の分子量は、二次元電気泳動等により測定することができる。
【0061】
本発明の方法により生産された抗体は、医薬として使用することができる。かかる医薬は、治療薬として単独で投与することも可能ではあるが、通常は薬理学的に許容される一つあるいはそれ以上の担体と一緒に混合し、製剤学の技術分野にて公知の任意の方法により製造した医薬製剤として提供されるのが好ましい。
【0062】
投与経路は、治療に際して最も効果的なものを使用するのが望ましく、経口投与、または口腔内、気道内、直腸内、皮下、筋肉内および静脈内等の非経口投与をあげることができ、抗体製剤の場合、好ましくは静脈内投与をあげることができる。投与形態としては、噴霧剤、カプセル剤、錠剤、顆粒剤、シロップ剤、乳剤、座剤、注射剤、軟膏、テープ剤等があげられる。
【0063】
経口投与に適当な製剤としては、乳剤、シロップ剤、カプセル剤、錠剤、散剤、顆粒剤等があげられる。乳剤およびシロップ剤のような液体調製物は、水、ショ糖、ソルビトール、果糖等の糖類、ポリエチレングリコール、プロピレングリコール等のグリコール類、ごま油、オリーブ油、大豆油等の油類、p−ヒドロキシ安息香酸エステル類等の防腐剤、ストロベリーフレーバー、ペパーミント等のフレーバー類等を添加剤として用いて製造できる。カプセル剤、錠剤、散剤、顆粒剤等は、乳糖、ブドウ糖、ショ糖、マンニトール等の賦形剤、デンプン、アルギン酸ナトリウム等の崩壊剤、ステアリン酸マグネシウム、タルク等の滑沢剤、ポリビニルアルコール、ヒドロキシプロピルセルロース、ゼラチン等の結合剤、脂肪酸エステル等の界面活性剤、グリセリン等の可塑剤等を添加剤として用いて製造できる。
【0064】
非経口投与に適当な製剤としては、注射剤、座剤、噴霧剤等があげられる。注射剤は、塩溶液、ブドウ糖溶液、あるいは両者の混合物からなる担体等を用いて調製される。または、ヒト化抗体を常法に従って凍結乾燥し、これに塩化ナトリウムを加えることによって粉末注射剤を調製することもできる。座剤はカカオ脂、水素化脂肪またはカルボン酸等の担体を用いて調製される。また、噴霧剤は該化合物そのもの、ないしは受容者の口腔および気道粘膜を刺激せず、かつ該化合物を微細な粒子として分散させ吸収を容易にさせる担体等を用いて調製される。
【0065】
担体として具体的には乳糖、グリセリン等が例示される。該化合物および用いる担体の性質により、エアロゾル、ドライパウダー等の製剤が可能である。また、これらの非経口剤においても経口剤で添加剤として例示した成分を添加することもできる。
【0066】
別の実施態様では、生産されるタンパク質は、ワクチンである。
【0067】
ワクチンとしては、病原体のエピトープのアミノ酸配列からなるタンパク質をワクチンとして使用することができる。また、ウイルス体の構成タンパク質すべてを生産するのみならず、エンベロープタンパク等を生産し、ワクチンとして使用することができる。
【0068】
ワクチンは任意の経路の投与のための製剤とすることができる。粘膜型投与、例えば、経口経路、経鼻経路、経気道経路、経膣経路、経直腸経路の他、非粘膜経路による投与、例えば皮下、静脈内もしくは筋肉内投与のためのワクチン製剤が挙げられる。
【0069】
本発明の第七の側面によれば、本発明の第三の側面による形質転換細胞を用いることを特徴とする、アミノ酸を生産する方法が提供される。また、本発明の第八の側面によれば、本発明の第三の側面による形質転換細胞を用いることを特徴とする、ヌクレオチドを生産する方法が提供される。
【0070】
アミノ酸の生産は、まず形質転換細胞にポリペプチドを生産させ、そのポリペプチドを加水分解することによって行うことができる。また、アミノ酸の生体外合成に必要な酵素などを形質転換細胞に生産させることによって行うこともできる。ヌクレオチドの生産も、ヌクレオチドの生体外合成に必要な酵素などを形質転換細胞に生産させることによって行うことができる。
【実施例】
【0071】
以下、実施例を例示することによって、本発明の効果をより一層明確なものとする。
【0072】
(実施例1及び比較例1)
薬剤選択マーカー遺伝子としてピューロマイシン耐性遺伝子を使用した薬剤選択マーカー遺伝子発現カセットにおけるmRNA不安定化配列の効果
(1)プラスミドベクターpBS−CMV−SNAPm−Pur(比較例)及びpBS−CMV−SNAPm−Pur・N4(実施例)の構築
図1に示すスキームに従って、プラスミドベクターpBS−CMV−SNAPm2を構築した。即ち、まずEmerald Lucベクター(pELuc−test)(東洋紡績社製)の制限酵素ClaI、EcoRIサイトにCMVプロモーター(配列番号1)が導入されたpELuc−CMVプラスミドから制限酵素EcoRI、NotIでEmerald Luc(ELuc)遺伝子を切出した。一方、SNAPm発現プラスミドpSNAPm(Covalys社製)からSNAP26m遺伝子を配列番号2,3のプライマーを用いてPCRで増幅し、pELuc−CMVプラスミドの制限酵素EcoRI、NotIサイトに導入してpSNAP26m−CMVを構築した。続いて、pSNAP26m−CMVより、CMVプロモーター/SNAP26m/SV40 polyAを配列番号4,5のプライマーを用いてPCRで増幅し、部分消化によって、プラスミドpBluescript II KS(−)(ストラタジーン社製)の制限酵素ClaI、BamHIサイトへ導入し、プラスミドpBS−CMV−SNAPm2を構築した。
【0073】
続いて、図2に示すスキームに従って、pPUR(クロンテック社製)のピューロマイシン耐性遺伝子のコード配列の3’末端に、配列番号6、7のプライマーとKOD−Plus−Mutagenesis Kit(東洋紡績社製)を用いたInverse PCR法によって、mRNA不安定化配列としてAREモチーフ配列TTATTTATTの4回の繰り返し(N4)を挿入してpPUR・N4を構築した。
【0074】
つづいて、図3に示すスキームに従って、pPUR,pPUR・N4を鋳型として、配列番号8、9のプライマーとKOD−Plus−ver.2(東洋紡績社製)を用いたPCRによって、SV40 Promoter−Pur−pA、SV40 Promoter−Pur・N4−pAの薬剤発現カセット断片を増幅した。pBS−CMV−SNAPm2と前記増幅断片をそれぞれ制限酵素BamHI、SacIで部分消化して連結し、pBS−CMV−SNAPm−Pur(比較例),pBS−CMV−SNAPm−Pur・N4(実施例)を構築した。
【0075】
(2)プラスミドベクターpBS−CMV−SNAPm−Pur(比較例)及びpBS−CMV−SNAPm−Pur・N4(実施例)の細胞導入
CHO−K1細胞(理研バイオリソースセンター、No.RCB0285)を1×105cells/mlに調整し、12ウェルプレートに2mlずつ前日に播種し、一晩培養して、トランスフェクション用のCHO−K1細胞を準備した。この際、培地として10%牛胎児血清を添加したHam’s F12培地(日水製薬社製)を使用した。
【0076】
トランスフェクションは、3μl GeneJuice Transfection Reagent(メルク社製)を100μl Opti−MEM I Reduced−Serum Medium(GIBCO社製)で希釈し、1μgのプラスミドとしてpBS−CMV−SNAPm−PurあるいはpBS−CMV−SNAPm−Pur・N4にこの希釈液103μlを加え、10分間放置した後、この混合液を前記CHO−K1細胞に加え、24時間インキュベートすることにより行った。翌日、培地を除去し、2.5g/l−Trypsin・1mmol/l−EDTA Solution(ナカライテスク社製)で処理して細胞を分散させ、90mmペトリディッシュに移し、6μg/mlピューロマイシン(InvivoGen社製)を含むHam’s F12+10%FBS培地中で3週間選択培養を行った。選択培養中、3〜4日ごとに培地を交換した。3週間の選択培養終了後、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、1ウェル当たり2×105細胞を12ウェルプレートに播き込み、翌日、0.5mlのHam’s F12培地に2μM SNAP−Cell−505(Covalys社製)を加え、60分間、37℃でインキュベートした。その後、Ham’s F12培地で3回リンスし、培地交換をしながら、10分間のインキュベートを3回行い、未反応の蛍光色素を除去した。この細胞を2.5g/l−Trypsin/1mmol/l−EDTA Solutionで処理して細胞を分散し、D−PBS(−)(ナカライテスク社製)に細胞を懸濁し、フローサイトメーターBD FACSCalibur(Becton,Dickinson社製)でSNAP26mの発現強度を解析した。
【0077】
図4は、薬剤選択後のpBS−CMV−SNAPm−Pur(比較例)及びpBS−CMV−SNAPm−Pur・N4(実施例)で形質転換された細胞集団のFACS解析の結果を示す。横軸が蛍光強度(FL1)、縦軸がカウント数である。また、図5に蛍光強度FL1がそれぞれ200以上、1000以上の細胞の割合のプロットを示す。この結果、mRNA不安定化配列であるN4(実施例)が挿入されたpBS−CMV−SNAPm−Pur・N4(実施例)で形質転換された細胞集団には、N4が挿入されていないpBS−CMV−SNAPm−Pur(比較例)で形質転換された細胞集団と比較して、薬剤選択後、SNAPmの高発現を示す細胞が有意に濃縮されていることが分かる。
【0078】
(実施例2及び比較例2)
薬剤選択マーカー遺伝子としてピューロマイシン耐性遺伝子を使用した薬剤選択マーカー遺伝子発現カセットにおけるmRNA不安定化配列の効果
実施例1(1)で構築した二種類のプラスミドベクターを使用して実施例1(2)と同様に遺伝子導入を行った。次に、ピューロマイシンの濃度を9μg/mlに変更し、選択培養の期間を2週間に変更した以外は、実施例1(2)と同様にして選択培養を行った。選択培養終了後、形成されたコロニーを顕微鏡下でピペットの先でpBS−CMV−SNAPm−Purについては48クローン、pBS−CMV−SNAPm−Pur・N4については20クローンをかきとり、12ウェルプレートに播種した。増殖が認められた、それぞれ36クローン、10クローンについて、実施例1(2)と同様にSNAP−Cell−505で標識処理をし、FACS解析を実施した。
【0079】
図6に、薬剤選択後の細胞の明視野像を示す。この結果、pBS−CMV−SNAPm−Pur(比較例)に比べ、pBS−CMV−SNAPm−Pur・N4(実施例)については生存細胞数、コロニー数が顕著に減少し、選択効果が高いことが示唆される。
【0080】
図7にpBS−CMV−SNAPm−Pur(比較例)形質転換細胞クローンにおける、ピーク強度が1000を超える、特にSNAPm発現の高いクローンのFACS解析の結果を示す。図8にpBS−CMV−SNAPm−Pur・N4(実施例)形質転換細胞クローンにおける、ピーク強度が1000を超える、特にSNAPm発現の高いクローンのFACS解析の結果を示す。この結果、pBS−CMV−SNAPm−Pur(比較例)では、高発現クローンは36クローン中1クローン(2.8%)しか認められなかった。一方、pBS−CMV−SNAPm−Pur・N4(実施例)では、取得されたクローンは少ないものの、SNAPm高発現クローンのヒット率が40%(10クローン中4クローン)と非常に選択効果が高いことが確認された。また、これらの結果から、実施例1(2)で認められたように、薬剤選択後の細胞集団をFACS解析することによって示される高発現細胞の割合の上昇と、高発現クローンの取得の効率化との間に相関が確認されたことから、以後の解析は細胞集団のFACS解析によって効果の確認を実施した。
【0081】
(実施例3及び比較例3)
EF1αプロモーター使用下での薬剤選択マーカー遺伝子としてピューロマイシン耐性遺伝子を使用した薬剤選択マーカー遺伝子発現カセットにおけるmRNA不安定化配列の効果
(1)プラスミドベクターpEF1α−SNAP26m−Pur・N4(実施例)及びpEF1α−SNAP26m−Pur−RE2(比較例)の構築
次に、目的タンパク質遺伝子発現カセットのプロモーターをCMVプロモーターからEF1αプロモーターに置換した場合も、実施例1,2と同様の効果が認められるかどうかを検討するため、プラスミドベクターを構築した。本実験では、図9に示すスキームに従って構築されたプラスミドpEF1α−KOD3G8HC−RE2を利用した。即ち、まず、CMVプロモーターをEF−1αプロモーターに置換したpCI−neoプラスミド(プロメガ社製)の制限酵素XbaI−NotIサイトに抗KOD抗体の重鎖を挿入したプラスミドのpEF1α−KOD3G8HCを鋳型に、KOD−Plus−Mutagenesis Kitを用いたInverse PCR法によって、配列番号10、11のプライマーを用いて発現カセットの上流に制限酵素SalIおよびNheIサイトを付加したpEF1α−KOD3G8HC−REを構築した。更にこのプラスミドを鋳型に、KOD−Plus−Mutagenesis Kitを用いたInverse PCR法によって、配列番号12、13のプライマーを用いて発現カセットの下流に制限酵素BsiWIおよびXhoIサイトを付加して、プラスミドpEF1α−KOD3G8HC−RE2を構築した。
【0082】
このpEF1α−KOD3G8HC−RE2を用いて、図10に示すスキームに従って、プラスミドpEF1α−SNAP26m−Pur・N4(実施例)およびpEF1α−SNAP26m−Pur−RE2(比較例)を構築した。即ち、プラスミドpEF1α−KOD3G8HC−RE2から制限酵素EcoRI、NotIを用いて抗KOD抗体の重鎖遺伝子を切出した。一方、SNAPm発現プラスミドpSNAPmからSNAP26m遺伝子を配列番号2,3のプライマーを用いてPCRで増幅し、pEF1α−KOD3G8HC−RE2プラスミドの制限酵素EcoRI、NotIサイトに導入してpEF1α−SNAP26m−Neo−RE2を構築した。このプラスミドから制限酵素AflII、BstBIを用いてネオマイシン耐性遺伝子を切出した。一方、pPUR・N4から下流にN4配列を付加したピューロマイシン耐性遺伝子を配列番号14,15のプライマーを用いてPCRで増幅し、pEF1α−SNAP26m−RE2プラスミドの制限酵素AflII、BstBIサイトに導入してpEF1α−SNAP26m−Pur・N4(実施例)を構築した。続いて、このプラスミドを鋳型に、KOD−Plus−Mutagenesis Kitを用いたInverse PCR法によって、配列番号16、17のプライマーを用いてピューロマイシン耐性遺伝子の下流のN4配列を削除したプラスミドpEF1α−SNAP26m−Pur−RE2(比較例)を構築した。
【0083】
(2)プラスミドベクターpEF1α−SNAP26m−Pur−RE2(比較例)及びpEF1α−SNAP26m−Pur・N4(実施例)の細胞導入
実施例1(2)に記載の方法でトランスフェクション用のCHO−K1細胞を準備した。一方、実施例3(1)で構築したSNAP26m発現コンストラクトを制限酵素AhdI(New England Biolabs社製)でリニアライズ(直鎖状化)した。トランスフェクションは、3μl GeneJuice Transfection Reagentを100μl Opti−MEM I Reduced−Serum Mediumで希釈した後、前記のリニアライズしたプラスミド1μgを加え、10分間放置した後、この混合液を前記CHO−K1細胞に加え、24時間インキュベートすることにより行った。翌日、培地を除去し、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散させ、90mmペトリディッシュに移し、5、7.5、あるいは10μg/mlピューロマイシンをそれぞれ含むHam’s F12+10%FBS培地中で1週間選択培養を行った。選択培養中、3〜4日ごとに培地を交換した。選択培養終了後、実施例1(2)に記載の方法で、細胞集団のSNAP26mの発現強度を解析した。
【0084】
図11は、薬剤選択後のpEF1α−SNAP26m−Pur−RE2(比較例)及びpEF1α−SNAP26m−Pur・N4(実施例)で形質転換された細胞集団のFACS解析の結果を示す。また、図12に蛍光強度FL1が200以上、1000以上の細胞の割合のプロットを示す。この結果、薬剤選択中のピューロマイシン濃度に関わらず、mRNA不安定化配列であるN4が挿入されたpEF1α−SNAP26m−Pur・N4(実施例)で形質転換された細胞集団には、N4が挿入されていないpEF1α−SNAP26m−Pur―RE2(比較例)で形質転換された細胞集団と比較して、薬剤選択後、SNAPmの高発現を示す細胞が有意に濃縮されていることが分かる。
【0085】
(実施例4及び比較例4)
薬剤選択マーカー遺伝子としてハイグロマイシン耐性遺伝子を使用した薬剤選択マーカー遺伝子発現カセットにおけるmRNA不安定化配列の効果
(1)プラスミドベクターpEF1α−SNAP26m−Hyg‐RE2(比較例)及びpEF1α−SNAP26m−Hyg・N4(実施例)の構築
薬剤選択マーカー遺伝子としてピューロマイシン耐性遺伝子の代わりにハイグロマイシン耐性遺伝子を用いた場合もmRNA不安定化配列の効果が認められるかどうかを検討するため、プラスミドを構築した。本実験では、図13に示すスキームに従って構築されたプラスミドpEF1α−KOD3G8LC−Hyg−RE2を利用した。即ち、まず、CMVプロモーターをEF−1αプロモーターに変更したpCI−neoプラスミドの制限酵素XbaI−NotIサイトに抗KOD抗体の軽鎖を挿入したプラスミドのpEF1α−KOD3G8LCを鋳型に、KOD−Plus−Mutagenesis Kitを用いたInverse PCR法によって、配列番号10、11のプライマーを使って発現カセットの上流に制限酵素SalIおよびNheIサイトを付加したpEF1α−KOD3G8LC−REを構築した。更にこのプラスミドを鋳型に、KOD−Plus−Mutagenesis Kitを用いたInverse PCR法によって、配列番号12、13のプライマーを用いて発現カセットの下流に制限酵素BsiWIおよびXhoIサイトを付加して、プラスミドpEF1α−KOD3G8LC−RE2を構築した。
【0086】
このpEF1α−KOD3G8LC−RE2をAflII、BstBIで処理し、ネオマイシン耐性遺伝子を切出した。一方、pTK−Hyg(クロンテック社製)からハイグロマイシン耐性遺伝子を配列番号18、19のプライマーを用いてPCRで増幅し、pEF1α−KOD3G8LC−RE2の制限酵素AflII、BstBIサイトに導入してpEF1α−KOD3G8LC−Hyg−RE2を構築した。続いて、図14に示すスキームに従って、プラスミドpEF1α−SNAP26m−Hyg−RE2及びpEF1α−SNAP26m−Hyg・N4を構築した。即ち、プラスミドpEF1α−KOD3G8LC−Hyg−RE2から制限酵素MluI、NotIを用いて抗KOD抗体の軽鎖遺伝子を切出した。一方、SNAPm発現プラスミドpSNAPmからSNAP26m遺伝子を配列番号3,20のプライマーを用いてPCRで増幅し、pEF1α−KOD3G8LC−Hyg−RE2プラスミドの制限酵素MluI、NotIサイトに導入してpEF1α−SNAP26m−Hyg−RE2(比較例)を構築した。続いて、このプラスミドを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号21、22のプライマーを用いてハイグロマイシン耐性遺伝子の下流にN4(実施例)配列を付加して、pEF1α−SNAP26m−Hyg・N4(実施例)を構築した。
【0087】
(2)プラスミドベクターpEF1α−SNAP26m−Hyg−RE2(比較例)及びpEF1α−SNAP26m−Hyg・N4(実施例)の細胞導入
実施例1(2)に記載の方法でトランスフェクション用のCHO−K1細胞を準備した。一方、実施例4(1)で構築したSNAP26m発現コンストラクトを制限酵素AhdIでリニアライズした。トランスフェクションは、実施例3(2)に記載の方法で行い、トランスフェクションの翌日、培地を除去し、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散させ、90mmペトリディッシュに移し、800μg/mlハイグロマイシン HygroGold(InvivoGen社製)を含むHam’s F12+10%FBS培地中で1週間選択培養を行った。選択培養中、3〜4日ごとに培地を交換した。選択培養終了後、実施例1(2)に記載の方法で、細胞集団のSNAP26mの発現強度を解析した。
【0088】
図15は、薬剤選択後のpEF1α−SNAP26m−Hyg−RE2(比較例)及びpEF1α−SNAP26m−Hyg・N4(実施例)で形質転換された細胞集団のFACS解析の結果を示す。また、図16に蛍光強度FL1が200以上、1000以上の細胞の割合のプロットを示す。この結果、mRNA不安定化配列であるN4が挿入されたpEF1α−SNAP26m−Hyg・N4(実施例)で形質転換された細胞集団には、N4が挿入されていないpEF1α−SNAP26m−Hyg−RE2(比較例)で形質転換された細胞集団と比較して、薬剤選択後、SNAPmの高発現を示す細胞が有意に濃縮されていることが分かる。
【0089】
(実施例5及び比較例5)
薬剤選択マーカー遺伝子としてネオマイシン耐性遺伝子を使用した薬剤選択マーカー遺伝子発現カセットにおけるmRNA不安定化配列の効果
(1)プラスミドベクターpEF1α−SNAP26m−Neo−RE2(比較例)及びpEF1α−SNAP26m−Neo・N4(実施例)の構築
薬剤選択マーカー遺伝子としてピューロマイシン耐性遺伝子の代わりにネオマイシン耐性遺伝子を用いた場合もmRNA不安定化配列の効果が認められるかどうかを検討するため、図17に示すスキームに従って、プラスミドpEF1α−SNAP26m−Neo・N4(実施例)を構築した。即ち、実施例4と同様にしてpEF1α−SNAP26m−Neo−RE2(比較例)構築した。次に、このプラスミドを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号21、23のプライマーを用いてネオマイシン耐性遺伝子の下流にN4配列を付加したpEF1α−SNAP26m−Neo・N4(実施例)を構築した。
【0090】
(2)プラスミドベクターpEF1α−SNAP26m−Neo−RE2(比較例)及びpEF1α−SNAP26m−Neo・N4(実施例)の細胞導入
実施例1(2)に記載の方法でトランスフェクション用のCHO−K1細胞を準備した。一方、pEF1α−SNAP26m−Neo−RE2及びpEF1α−SNAP26m−Neo・N4を制限酵素AhdIでリニアライズした。トランスフェクションは、実施例3(2)に記載の方法で行い、トランスフェクションの翌日、培地を除去し、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散させ、90mmペトリディッシュに移し、1mg/mlジェネティシン G418(ナカライテスク社製)を含むHam’s F12+10%FBS培地中で1週間選択培養を行った。選択培養中、3〜4日ごとに培地を交換した。選択培養終了後、実施例1(2)に記載の方法で、細胞集団のSNAP26mの発現強度を解析した。
【0091】
図18は、薬剤選択後のpEF1α−SNAP26m−Neo−RE2(比較例)及びpEF1α−SNAP26m−Neo・N4(実施例)で形質転換された細胞集団のFACS解析の結果を示す。また、図19に蛍光強度FL1が200以上、1000以上の細胞の割合のプロットを示す。この結果、mRNA不安定化配列であるN4が挿入されたpEF1α−SNAP26m−Neo・N4(実施例)で形質転換された細胞集団には、N4が挿入されていないpEF1α−SNAP26m−Neo−RE2(比較例)で形質転換された細胞集団と比較して、薬剤選択後、SNAPmの高発現を示す細胞が有意に濃縮されていることが分かる。
【0092】
(実施例6)
mRNA不安定化配列のモチーフ配列の繰り返し回数の検討
mRNA不安定化配列のモチーフ配列の繰り返し回数が高発現細胞の選択効率に与える影響を検討するため、実施例3のプラスミドにおいて繰り返し回数を4回から2回、6回、又は8回に変更したものを図20に示すスキームに従って構築した。即ち、実施例3(1)に記載のpEF1α−SNAP26m−Pur・N4を鋳型に、KOD−Plus−Mutagenesis Kitを用いたInverse PCR法によって、配列番号16、24のプライマーを用いてピューロマイシン耐性遺伝子の下流にN2配列(AREモチーフ配列TTATTTATTの2回の繰り返し)を付加したプラスミドpEF1α−SNAP26m−Pur・N2を構築した。また、同様の方法で、配列番号7、24のプライマーを用いてピューロマイシン耐性遺伝子の下流にN6配列(AREモチーフ配列TTATTTATTの6回の繰り返し)を付加したプラスミドpEF1α−SNAP26m−Pur・N6を構築し、配列番号7、25のプライマーを用いてピューロマイシン耐性遺伝子の下流にN8配列(AREモチーフ配列TTATTTATTの8回の繰り返し)を付加したプラスミドpEF1α−SNAP26m−Pur・N8を構築した。
【0093】
実施例1(2)に記載の方法でトランスフェクション用のCHO−K1細胞を準備した。一方、pEF1α−SNAP26m−Pur−RE2、pEF1α−SNAP26m−Pur・N2、pEF1α−SNAP26m−Pur・N4、pEF1α−SNAP26m−Pur・N6及びpEF1α−SNAP26m−Pur・N8の各SNAP26m発現コンストラクトを制限酵素AhdIでリニアライズした。トランスフェクションは、実施例3(2)に記載の方法で行い、トランスフェクションの翌日、培地を除去し、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散させ、90mmペトリディッシュに移し、7.5μg/ml ピューロマイシンを含むHam’s F12+10%FBS培地中で1週間選択培養を行った。選択培養中、3〜4日ごとに培地を交換した。選択培養終了後、実施例1(2)に記載の方法で、細胞集団のSNAP26mの発現強度を解析した。
【0094】
図21は、薬剤選択後のpEF1α−SNAP26m−Pur−RE2、pEF1α−SNAP26m−Pur・N2、pEF1α−SNAP26m−Pur・N4、pEF1α−SNAP26m−Pur・N6及びpEF1α−SNAP26m−Pur・N8で形質転換された細胞集団のFACS解析の結果を示す。また、図22に蛍光強度FL1が200以上、1000以上の細胞の割合のプロットを示す。この結果、繰り返し回数の多い、N6あるいはN8が挿入されたプラスミドのpEF1α−SNAP26m−Pur・N6あるいはpEF1α−SNAP26m−Pur・N8で形質転換したとき、繰り返し回数の少ない、N2あるいはN4が挿入されたプラスミドのpEF1α−SNAP26m−Pur・N2あるいはpEF1α−SNAP26m−Pur・N4で形質転換したときと比較して、SNAPm高発現細胞の割合が更に多く、mRNA不安定化配列のモチーフ配列の繰り返し回数が多いほど高発現細胞の選択効率が高いことが明らかになった。
【産業上の利用可能性】
【0095】
本発明の薬剤選択マーカー遺伝子発現カセットは、一緒に導入された目的タンパク質遺伝子を高レベルで発現する細胞を薬剤選択によって効率的に濃縮でき、高発現細胞株の樹立作業を低減短縮することができる。従って、本発明の薬剤選択マーカー遺伝子発現カセットを使用した細胞発現システムは、種々の哺乳類細胞のタンパク質の機能解析は勿論、バイオ医薬品として創薬・医療などの産業界に寄与することが大である。
【配列表フリーテキスト】
【0096】
配列番号2〜9は、実施例1に記載された設計されたポリヌクレオチドの配列である。
配列番号10〜17は、実施例4に記載された設計されたポリヌクレオチドの配列である。
配列番号18〜22は、実施例6に記載された設計されたポリヌクレオチドの配列である。
配列番号23は、実施例8に記載された設計されたポリヌクレオチドの配列である。
配列番号24及び25は、実施例10に記載された設計されたポリヌクレオチドの配列である。
【特許請求の範囲】
【請求項1】
プロモーター、薬剤選択マーカー遺伝子、mRNA不安定化配列、及びポリアデニレーションシグナルを有することを特徴とする薬剤選択マーカー遺伝子発現カセット。
【請求項2】
薬剤選択マーカー遺伝子が、タンパク質合成阻害系抗生物質耐性遺伝子であることを特徴とする請求項1に記載の発現カセット。
【請求項3】
薬剤選択マーカー遺伝子が、ピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン−B−ホスホトランスフェラーゼ、及びネオマイシンホスホトランスフェラーゼからなる群より選択されることを特徴とする請求項2に記載の発現カセット。
【請求項4】
mRNA不安定化配列が、サイトカイン、インターロイキン、又は癌原遺伝子の3’非翻訳領域に存在するATリッチ配列に由来することを特徴とする請求項1〜3のいずれか一項に記載の発現カセット。
【請求項5】
mRNA不安定化配列が、TTATTTA(A/T)(A/T)のモチーフ配列を有することを特徴とする請求項1〜3のいずれか一項に記載の発現カセット。
【請求項6】
モチーフ配列が、2回以上繰り返されていることを特徴とする請求項5に記載の発現カセット。
【請求項7】
モチーフ配列の繰り返し間に1塩基以上のスペーサー配列を含むことを特徴とする請求項6に記載の発現カセット。
【請求項8】
mRNA不安定化配列中に1ないし数塩基の置換、挿入または欠失を含むことを特徴とする請求項4〜7のいずれか一項に記載の発現カセット。
【請求項9】
請求項1〜8のいずれか一項に記載の薬剤選択マーカー遺伝子発現カセットを有することを特徴とする発現ベクター。
【請求項10】
目的タンパク質遺伝子発現カセットをさらに有することを特徴とする請求項9に記載の発現ベクター。
【請求項11】
目的タンパク質遺伝子発現カセット中の目的タンパク質遺伝子が、抗体の重鎖又は/及び軽鎖遺伝子のコード配列であることを特徴とする請求項10に記載の発現ベクター。
【請求項12】
マルチクローニングサイトを備えた発現カセットをさらに有することを特徴とする請求項9に記載の発現ベクター。
【請求項13】
マルチクローニングサイトに目的タンパク質遺伝子が導入されていることを特徴とする請求項12に記載の発現ベクター。
【請求項14】
請求項9に記載の発現ベクターと、目的タンパク質遺伝子発現カセット又はマルチクローニングサイトを備えた発現カセットを有する発現ベクターとからなる一対の発現ベクター。
【請求項15】
マルチクローニングサイトに目的タンパク質遺伝子が導入されている請求項14に記載の一対の発現ベクター。
【請求項16】
請求項9〜15のいずれか一項に記載の発現ベクターで宿主細胞を形質転換して得られることを特徴とする形質転換細胞。
【請求項17】
宿主細胞が動物細胞であることを特徴とする請求項16に記載の形質転換細胞。
【請求項18】
動物細胞が哺乳類細胞であることを特徴とする請求項17に記載の形質転換細胞。
【請求項19】
哺乳類細胞がチャイニーズハムスター卵巣(CHO)細胞であることを特徴とする請求項18に記載の形質転換細胞。
【請求項20】
請求項16〜19のいずれか一項に記載の形質転換細胞を薬剤選択する工程を含むことを特徴とする、目的タンパク質遺伝子を高レベルで発現する細胞群を選別する方法。
【請求項21】
請求項16〜19のいずれか一項に記載の形質転換細胞からなる細胞群であって、目的タンパク質遺伝子を高レベルで発現することを特徴とする細胞群。
【請求項22】
請求項16〜19のいずれか一項に記載の形質転換細胞を用いることを特徴とする、タンパク質を生産する方法。
【請求項23】
タンパク質が、抗体であることを特徴とする請求項22に記載の方法。
【請求項24】
タンパク質が、ワクチンであることを特徴とする請求項22に記載の方法。
【請求項25】
請求項16〜19のいずれか一項に記載の形質転換細胞を用いることを特徴とする、アミノ酸を生産する方法。
【請求項26】
請求項16〜19のいずれかに記載の形質転換細胞を用いることを特徴とする、ヌクレオチドを生産する方法。
【請求項1】
プロモーター、薬剤選択マーカー遺伝子、mRNA不安定化配列、及びポリアデニレーションシグナルを有することを特徴とする薬剤選択マーカー遺伝子発現カセット。
【請求項2】
薬剤選択マーカー遺伝子が、タンパク質合成阻害系抗生物質耐性遺伝子であることを特徴とする請求項1に記載の発現カセット。
【請求項3】
薬剤選択マーカー遺伝子が、ピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン−B−ホスホトランスフェラーゼ、及びネオマイシンホスホトランスフェラーゼからなる群より選択されることを特徴とする請求項2に記載の発現カセット。
【請求項4】
mRNA不安定化配列が、サイトカイン、インターロイキン、又は癌原遺伝子の3’非翻訳領域に存在するATリッチ配列に由来することを特徴とする請求項1〜3のいずれか一項に記載の発現カセット。
【請求項5】
mRNA不安定化配列が、TTATTTA(A/T)(A/T)のモチーフ配列を有することを特徴とする請求項1〜3のいずれか一項に記載の発現カセット。
【請求項6】
モチーフ配列が、2回以上繰り返されていることを特徴とする請求項5に記載の発現カセット。
【請求項7】
モチーフ配列の繰り返し間に1塩基以上のスペーサー配列を含むことを特徴とする請求項6に記載の発現カセット。
【請求項8】
mRNA不安定化配列中に1ないし数塩基の置換、挿入または欠失を含むことを特徴とする請求項4〜7のいずれか一項に記載の発現カセット。
【請求項9】
請求項1〜8のいずれか一項に記載の薬剤選択マーカー遺伝子発現カセットを有することを特徴とする発現ベクター。
【請求項10】
目的タンパク質遺伝子発現カセットをさらに有することを特徴とする請求項9に記載の発現ベクター。
【請求項11】
目的タンパク質遺伝子発現カセット中の目的タンパク質遺伝子が、抗体の重鎖又は/及び軽鎖遺伝子のコード配列であることを特徴とする請求項10に記載の発現ベクター。
【請求項12】
マルチクローニングサイトを備えた発現カセットをさらに有することを特徴とする請求項9に記載の発現ベクター。
【請求項13】
マルチクローニングサイトに目的タンパク質遺伝子が導入されていることを特徴とする請求項12に記載の発現ベクター。
【請求項14】
請求項9に記載の発現ベクターと、目的タンパク質遺伝子発現カセット又はマルチクローニングサイトを備えた発現カセットを有する発現ベクターとからなる一対の発現ベクター。
【請求項15】
マルチクローニングサイトに目的タンパク質遺伝子が導入されている請求項14に記載の一対の発現ベクター。
【請求項16】
請求項9〜15のいずれか一項に記載の発現ベクターで宿主細胞を形質転換して得られることを特徴とする形質転換細胞。
【請求項17】
宿主細胞が動物細胞であることを特徴とする請求項16に記載の形質転換細胞。
【請求項18】
動物細胞が哺乳類細胞であることを特徴とする請求項17に記載の形質転換細胞。
【請求項19】
哺乳類細胞がチャイニーズハムスター卵巣(CHO)細胞であることを特徴とする請求項18に記載の形質転換細胞。
【請求項20】
請求項16〜19のいずれか一項に記載の形質転換細胞を薬剤選択する工程を含むことを特徴とする、目的タンパク質遺伝子を高レベルで発現する細胞群を選別する方法。
【請求項21】
請求項16〜19のいずれか一項に記載の形質転換細胞からなる細胞群であって、目的タンパク質遺伝子を高レベルで発現することを特徴とする細胞群。
【請求項22】
請求項16〜19のいずれか一項に記載の形質転換細胞を用いることを特徴とする、タンパク質を生産する方法。
【請求項23】
タンパク質が、抗体であることを特徴とする請求項22に記載の方法。
【請求項24】
タンパク質が、ワクチンであることを特徴とする請求項22に記載の方法。
【請求項25】
請求項16〜19のいずれか一項に記載の形質転換細胞を用いることを特徴とする、アミノ酸を生産する方法。
【請求項26】
請求項16〜19のいずれかに記載の形質転換細胞を用いることを特徴とする、ヌクレオチドを生産する方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【公開番号】特開2011−152047(P2011−152047A)
【公開日】平成23年8月11日(2011.8.11)
【国際特許分類】
【出願番号】特願2010−12703(P2010−12703)
【出願日】平成22年1月25日(2010.1.25)
【特許番号】特許第4491808号(P4491808)
【特許公報発行日】平成22年6月30日(2010.6.30)
【出願人】(000003160)東洋紡績株式会社 (3,622)
【Fターム(参考)】
【公開日】平成23年8月11日(2011.8.11)
【国際特許分類】
【出願日】平成22年1月25日(2010.1.25)
【特許番号】特許第4491808号(P4491808)
【特許公報発行日】平成22年6月30日(2010.6.30)
【出願人】(000003160)東洋紡績株式会社 (3,622)
【Fターム(参考)】
[ Back to top ]

