高硫酸化コンドロイチン硫酸類の合成方法、高硫酸化コンドロイチン硫酸類、および解析用試薬
【課題】高硫酸化コンドロイチン硫酸類の合成方法を提供する。
【解決手段】高硫酸化コンドロイチン硫酸類の合成方法は、コンドロイチンに、硫酸基転移酵素C4ST−1を作用させ、コンドロイチン硫酸のA構造を形成するステップ(A1)と、前記A構造に、硫酸基転移酵素GalNAc4S−6STを作用させ、コンドロイチン硫酸のE構造を形成するステップ(A2)と、前記E構造に、硫酸基転移酵素USTを作用させ、コンドロイチン硫酸のtriS構造を形成するステップ(A3)と、を含む。
【解決手段】高硫酸化コンドロイチン硫酸類の合成方法は、コンドロイチンに、硫酸基転移酵素C4ST−1を作用させ、コンドロイチン硫酸のA構造を形成するステップ(A1)と、前記A構造に、硫酸基転移酵素GalNAc4S−6STを作用させ、コンドロイチン硫酸のE構造を形成するステップ(A2)と、前記E構造に、硫酸基転移酵素USTを作用させ、コンドロイチン硫酸のtriS構造を形成するステップ(A3)と、を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、高硫酸化コンドロイチン硫酸類の合成方法、高硫酸化コンドロイチン硫酸類、および解析用試薬に関する。
【背景技術】
【0002】
コンドロイチン硫酸(chondroitin sulfate:CS)は、アミノ糖誘導体とヘキソース誘導体の繰り返し構造を有する直鎖状の多糖体であるグリコサミノグリカン(glycosaminoglycan)の1つである。コンドロイチン硫酸は、コアタンパク質に結合したプロテオグリカンとして動物組織に広く分布しており、動物の発生・分化・成長および再生に重要な役割を担っている。コンドロイチン硫酸は、たとえば軟骨中の主要成分として、水和力や弾性に寄与して軟骨組織形成に役立っている。また、コンドロイチン硫酸は、多様な生理活性分子との結合性を示し、生理活性分子の貯留や、安定化あるいはマスキングの役割を持ち、細胞膜受容体と協働して、シグナル伝達機構を制御している。また、コンドロイチン硫酸は、神経系においては神経細胞の軸索の伸展促進や阻害効果を示し、免疫系細胞においては顆粒に存在し、免疫物質の蓄積や放出を制御している。マラリヤ原虫やウイルスなどの感染においては、コンドロイチン硫酸は、受容体となるとともに、感染阻害効果を示すことが知られている。多くの場合、以下に述べるD構造やE構造のようなコンドロイチン硫酸が、特に高い生理活性を示すことが知られている。
【0003】
コンドロイチン硫酸は、分子量数万(糖鎖数20〜400個)の直鎖多糖体構造を有する。この構造は、グルクロン酸(GlcA)とN−アセチルガラクトサミン(GalNAc)とがβ1−3およびβ1−4で交互に結合した二糖の繰り返しを基本構造とする。コンドロイチン硫酸は、コンドロイチン(chondroitin:CH)が、たとえば図1に示すような多様な硫酸基修飾を受けた物質である。
【0004】
具体的には、コンドロイチン硫酸(CS)は、コンドロイチン(chondroitin:CH)の二糖単位のうちGalNAc残基4位が硫酸化(4S)されたA構造(CSA)、GalNAc残基6位が硫酸化(6S)されたC構造(CSC)、GlcA残基2位とGalNAc残基6位の二糖単位の2カ所が硫酸化(2S,6S)されたD構造(CSD)、GalNAc残基の4位と6位の2カ所が硫酸化(4S,6S)されたE構造(CSE)、GlcA残基2位、GalNAc残基4位および6位の計3カ所が硫酸化(2S,4S,6S)されたtriS構造(CStriSまたはCtriS)など、様々な修飾二糖単位を含む。また、本明細書中では、A構造とC構造が1つのポリマー中に混在した構造をAC構造またはAC混在構造(CSAC)と呼び、A構造とD構造が1つのポリマー中に混在した構造をAD構造またはAD混在構造(CSAD)と呼び、D構造とE構造が1つのポリマー中に混在した構造をDE構造またはDE混在構造(CSDE)と呼ぶ。コンドロイチン硫酸は、これらの硫酸基修飾構造が組み合わさった、きわめて複雑な多糖体構造を有する。
【0005】
コンドロイチンの糖鎖骨格を特異的に硫酸化する硫酸基転移酵素は、広く動物細胞が産生しており、硫酸基を修飾する糖残基の水酸基位置特異的に、それぞれ別個の酵素が存在する(非特許文献1)。ヒトでは、GalNAc残基の4位を硫酸化するコンドロイチン4硫酸基転移酵素として、C4ST−1、C4ST−2、C4ST−3の3個のアイソザイムが知られている。また、デルマタン硫酸骨格(GlcAがIdoAにエピメリ化したもの)のGalNAc残基4位を硫酸化する酵素であるD4STも存在する。また、GalNAc残基の6位に硫酸基を転移するコンドロイチン6硫酸基転移酵素として、ヒトではC6ST−1、C6ST−2の2個のアイソザイムがある。4位が硫酸化されたGalNAc(4S)残基の6位に特異的に硫酸基修飾しE構造をつくる酵素は、GalNAc4S−6硫酸基転移酵素(GalNAc4S−6ST)と呼ばれる。GalNAc(6S)残基の非還元末端側のGlcA残基の2位に硫酸基修飾しD構造をつくる酵素は、ウロン酸二硫酸基転移酵素(UST)と呼ばれる。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Trends in Glycoscience and Glycotechnology Vol.12、No.67(2000)307−319
【発明の概要】
【発明が解決しようとする課題】
【0007】
上述したように、D構造やE構造を有するコンドロイチン硫酸は、高い生理活性を有している。そのため、高頻度に硫酸化されたコンドロイチン硫酸が求められている。しかしながら、従来の硫酸化方法では、求められる程度に高度に硫酸化したコンドロイチン硫酸を合成することは困難であった。
【0008】
本発明はこうした状況に鑑みてなされたものであり、その目的とするところは、高硫酸化されたコンドロイチン硫酸類を合成する技術を提供することにある。
【課題を解決するための手段】
【0009】
上記課題を解決するために、本発明のある態様の高硫酸化コンドロイチン硫酸類の合成方法は、コンドロイチンに、硫酸基転移酵素C4ST−1を作用させ、コンドロイチン硫酸のA構造を形成するステップ(A1)と、A構造に、硫酸基転移酵素GalNAc4S−6STを作用させ、コンドロイチン硫酸のE構造を形成するステップ(A2)と、E構造に、硫酸基転移酵素USTを作用させ、コンドロイチン硫酸のtriS構造を形成するステップ(A3)と、を含む。
【0010】
この態様によると、triS構造などの高硫酸化構造を高頻度に有する高硫酸化コンドロイチン硫酸類を効率的に合成することができる。
【0011】
なお、本明細書中で「コンドロイチン硫酸類」というときには、コンドロイチン硫酸およびその誘導体を意味するものとする。また、本明細書中で「高硫酸化」とは、コンドロイチン硫酸類を構成する複数の二糖単位のうち少なくとも50%が2硫酸化(D構造、E構造、およびDE構造など)または3硫酸化(triS構造)されていることを意味する。これに加えて、またはこれに代えて、「高硫酸化」とは、後述の「硫酸化度」が100%以上であることを意味してもよい。
【0012】
本発明の別の態様は、高硫酸化コンドロイチン硫酸類の合成方法である。この高硫酸化コンドロイチン硫酸類の合成方法は、コンドロイチンに、硫酸基転移酵素C4ST−1および硫酸基転移酵素C6ST−1を作用させ、1分子のコンドロイチン中にA構造とC構造とを形成するステップ(B1)と、C構造に、硫酸基転移酵素USTを作用させ、D構造を形成するステップ(B2)と、D構造の形成後、A構造に硫酸基転移酵素GalNAc4S−6STを作用させ、E構造を形成するステップ(B3)と、を含む。
【0013】
この態様によると、DE構造などの高硫酸化構造を高頻度に有する高硫酸化コンドロイチン硫酸類を効率的に合成することができる。
【0014】
本発明の別の態様は、高硫酸化コンドロイチン硫酸類である。この高硫酸化コンドロイチン硫酸類は、上述したいずれかの態様の高硫酸化コンドロイチン硫酸類の合成方法により合成される。
【0015】
この態様によると、triS構造やDE構造などを高頻度に有する高硫酸化コンドロイチン硫酸類を提供することができる。
【0016】
本発明の別の態様は、解析用試薬である。この解析用試薬は、上述したいずれかの態様により合成された高硫酸化コンドロイチン硫酸類を含み、生理活性分子または細胞表面分子と、当該高硫酸化コンドロイチン硫酸類とを特異的に相互作用させる。
【0017】
この態様によると、triS構造やDE構造などを高頻度に有し、生理活性分子または細胞表面分子との相互作用解析に有用な解析用試薬を提供することができる。
【発明の効果】
【0018】
本発明によれば、高硫酸化されたコンドロイチン硫酸類を合成することができる。
【図面の簡単な説明】
【0019】
【図1】コンドロイチン硫酸類の主な二糖単位構造を示す図である。
【図2】図2(A)は、第1の実施の形態に係る合成方法を示す図である。図2(B)は、第2の実施の形態に係る合成方法を示す図である。
【発明を実施するための形態】
【0020】
以下、本発明を実施するための形態について詳細に説明する。
【0021】
本発明者は、コンドロイチン(CH)またはコンドロイチン硫酸(CS)に硫酸基転移酵素を組み合わせて段階的に反応させることで、特定の糖水酸基位置に高頻度で硫酸基が結合した高硫酸化コンドロイチン硫酸を合成できる合成方法を見出した。この合成方法により合成されたコンドロイチン硫酸は、天然には存在しない程度に高度な硫酸基修飾がなされている。また、合成されたコンドロイチン硫酸は、コンドロイチンまたはコンドロイチン硫酸を化学的に硫酸化したときのようなランダムな硫酸化は起こっていない。したがって、合成されるコンドロイチン硫酸の性質をある程度制御することが可能となる。
【0022】
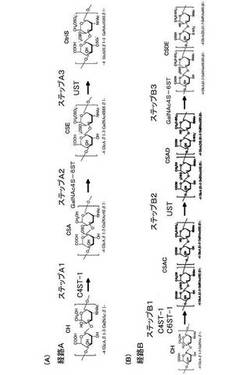
図2(A)は、第1の実施の形態に係る合成方法を示す図である。図2(B)は、第2の実施の形態に係る合成方法を示す図である。図1、図2(A)および図2(B)に基づいて、高硫酸化コンドロイチン硫酸類の合成経路を説明する。
【0023】
(第1の実施の形態)
第1の実施の形態の合成方法(経路A)は、ステップA1〜A3を含む。ステップA1は、コンドロイチンに、硫酸基転移酵素C4ST−1を作用させ、ほぼ完全にA構造[GlcA−GalNAc(4S)]を有するコンドロイチン硫酸のA構造(CSA)を形成するステップである。ステップA2は、ステップA1で形成されたA構造に、硫酸基転移酵素GalNAc4S−6STを作用させ、大部分がE構造[GlcA−GalNAc(4S,6S)]であるコンドロイチン硫酸のE構造(CSE)を形成するステップである。ステップA3は、ステップA2で形成されたE構造に、硫酸基転移酵素USTを作用させ、天然には微量にしか存在しないtriS構造[GlcA(2S)−GalNAc(4S,6S)]を含む高硫酸化CtriSを形成するステップである。
【0024】
経路Aにより、二糖単位が高頻度で2硫酸化(E構造など)または3硫酸化(triS構造)された高硫酸化コンドロイチン硫酸類が得られる。得られる高硫酸化コンドロイチン硫酸類は、二糖単位のうち少なくとも50%が2硫酸化(E構造など)または3硫酸化(triS構造)された構造を有する。また、後述の硫酸化度が100%以上である構造を有している。
【0025】
(第2の実施の形態)
第2の実施の形態の合成方法(経路B)は、ステップB1〜B3を含む。ステップB1は、コンドロイチンに、硫酸基転移酵素C4ST−1および硫酸基転移酵素C6ST−1を同時にまたは順不同で作用させ、A構造[GlcA−GalNAc(4S)]とC構造[GlcA−GalNAc(6S)]とが1分子中に混在したCSACを形成するステップである。ステップB2は、ステップB1で形成されたCSAC中のC構造に、硫酸基転移酵素USTを作用させ、C構造がD構造[GlcA(2S)−GalNAc(6S)]となったCSADを形成するステップである。ステップB3は、D構造の形成後、ステップB2で形成されたCSAD中のA構造に硫酸基転移酵素GalNAc4S−6STを作用させ、A構造の大部分をE構造に変換させ、DE構造に富む高硫酸化CSDEを形成するステップである。なお、図2(B)では、例示的に図の左側にCSA、右側にCSCが並んだCSACを示したが、CSAとCSCとの並びはこれに限られない。たとえば、CSCとCSAとの順序は逆であってもよい。また、CSAが連続する構造、またはCSCが連続する構造を有していてもよい。CSAD、CSDEについても同様である。
【0026】
ステップB1では、CHにC4ST−1とC6ST−1を同時に作用させることが好ましい。これにより、酵素量に応じた割合で1つの分子中にA構造とC構造とを有するCSACが1つのステップで合成できる。ここで「同時に作用させる」とは、C4ST−1とC6ST−1とを同一の系で、少なくとも一時的に反応がオーバーラップすればよいことを意味する。つまり、C4ST−1とC6ST−1との作用の開始時刻および終了時刻の少なくともいずれかは、異なっていてもよい。
【0027】
経路Bにより、二糖単位が高頻度で2硫酸化(DE構造など)された高硫酸化コンドロイチン硫酸類が得られる。得られる高硫酸化コンドロイチン硫酸類は、二糖単位のうち少なくとも50%が2硫酸化(DE構造など)された構造を有する。また、後述の硫酸化度が100%以上である構造を有している。
【0028】
なお、第1の実施の形態および第2の実施の形態で用いる硫酸化反応前のコンドロイチン類は、市販の化学的脱硫酸化したコンドロイチンを原料として用いることが出来る。また、コンドロイチンオリゴ糖(oligoCHともいう)に大腸菌由来のコンドロイチンポリメラーゼ(K4CP)を作用させて合成したコンドロイチン(CH)類を用いることもできる(ステップ0)。この方法で得られたCH類は任意の糖鎖長のコンドロイチンを合成することが可能なのでより好ましい。ステップ0により合成されたCH類を用いることにより、経路Aおよび経路Bの高硫酸化コンドロイチン硫酸類の合成を効率的に行うことができる。ただし、既に合成されたCHを使用できるのであれば、ステップ0は省略できる。ステップ0で使用するコンドロイチンオリゴ糖は2糖以上であれば糖鎖長に制限はないが、4糖(コンドロイチン四糖:CH4)以上のコンドロイチンオリゴ糖であることが好ましく、6糖(コンドロイチン六糖:CH6)以上のコンドロイチンオリゴ糖であることがさらに好ましい。コンドロイチンオリゴ糖は、コンドロイチンを加水分解酵素で限定分解することにより得られる。また、コンドロイチンオリゴ糖には、還元末端が標識されていてもよい。このような標識として、たとえばヘキサメチレンジアミン基(HMDA)、ピリジルアミン基(PA)、およびベンジルアミド基(AB)が考えられる。
【実施例】
【0029】
まず、以下の実験例1〜8について詳細に説明する前に、各実験例および各比較実験例に共通する測定方法、硫酸化度、CHの調製、および硫酸基転移酵素の調製について説明する。
【0030】
(蛍光不飽和二糖分析方法)
各実験例で合成されたコンドロイチン硫酸類は、以下の方法で定量および組成分析した。合成コンドロイチン硫酸類をコンドロイチナーゼABCまたはコンドロイチナーゼACII(生化学工業製)で完全に分解し、その分解物をSenshu PAK DOCOSILカラム(4.6×150mm、センシュウ科学社製)で分離し、シアノアセトアミドを反応させるポストカラム微量蛍光二糖分析HPLCシステム(Toypda H. et al. J.Biol.Chem.275(2000)2269−2275)を使用して分析した。濃度既知の不飽和二糖標準品(生化学工業社製)を同時に分析し、標準品との比較から、各二糖成分の組成比を算出し、二糖成分量の合計から元のコンドロイチン硫酸の含量を算出した。
【0031】
(硫酸化度)
本明細書では、硫酸化の程度を表す指標として、「硫酸化度」を規定した。コンドロイチンの二糖単位では、GlcA残基2位、GalNAc残基4位および6位の3か所が、硫酸化されうる。硫酸化されていない二糖単位の割合をA(%)、1硫酸化されている二糖単位の割合をB(%)、2硫酸化されている二糖単位の割合をC(%)、3硫酸化されている二糖単位をD(%)(ただし、A+B+C+D=100%)とすると、硫酸化度は以下の式1により定義される。
硫酸化度=A×0+B×1+C×2+D×3(%)・・・(式1)
【0032】
第1の実施の形態または第2の実施の形態に示した合成方法を用いた場合、硫酸化度は、100%以上であることが好ましく、120%以上であることがより好ましく、140%以上であることがさらに好ましい。
【0033】
(CH類の調製(ステップ0))
高硫酸化コンドロイチン硫酸類を合成するための基質として、還元末端が標識されていないコンドロイチン六糖(CH6)、還元末端ヘキサメチレンジアミン(HMDA)標識コンドロイチン六糖(CH6−HMDA)、還元末端ピリジルアミン(PA)基標識コンドロイチン六糖(CH6−PA)、還元末端ベンジルアミド(AB)基標識コンドロイチン六糖(CH6−AB)の4つをそれぞれ用いた。還元末端が標識されたoligoCHを原料として合成されたコンドロイチン硫酸類は、後述の用途のとおり、固定化や検出に使用できる点で有用である。なお、高硫酸化コンドロイチン硫酸類を合成するための基質として、ここではコンドロイチン六糖を示したが、糖鎖長が2糖以上のコンドロイチンオリゴ糖を使用できる点は、上述の通りである。
【0034】
CH6およびoligoCHは、天然コンドロイチン硫酸を化学的に脱硫酸化したコンドロイチン(生化学工業社製)をヒツジ睾丸由来ヒアルロニダーゼ(シグマ社製)で限定分解することにより合成した(N.Sugiura et al. Glycoconj.J.25(2008)521−530)。
【0035】
CH6−HMDAは、CH6に100倍量のHMDAと50倍量のNaBH3CNをpH5に調製した水溶液中で、70℃で一晩(19時間)反応させ、ゲルろ過(Superdex 30カラム、GEヘルスケア社製)することにより合成した。
【0036】
CH6−PAは、CH6に100倍量のアミノピリジンと15倍量のNaBH3CNをpH6.2に調製した水溶液中で、90℃で一晩(20時間)反応させ、Superdex 30カラムでゲルろ過精製することにより合成した(N.Sugiura et al. Glycoconj.J.25(2008)521−530)。
【0037】
CH6−ABは、CH6に100倍量の2−アミノベンズアミドと200倍量のNaBH3CNを30%酢酸−DMSO混合液中で、65℃で一晩(16時間)反応させ、Superdex 30カラムでゲルろ過精製することにより合成した(A.Kinoshita et al. Anal.Biochem.269(1999)367−378)。
【0038】
CH6(0.24mg)、CH6−HMDA(0.26mg)、CH6−PA(0.26mg)、CH6−AB(0.27mg)をそれぞれ、大腸菌由来コンドロイチンポリメラーゼ(K4CP:T.Ninomiya et al. J.Biol.Chem.277(2002)21567−21575)0.5μg、UDP−GlcA 6nmol、およびUDP−GalNAc 6nmolを含む50mM Tris−HCl,pH7.2, 0.15M NaCl, 0.2mM MnCl2水溶液3.2ml中にて、30℃で48時間振盪させながら反応させた。反応後、100℃で5分間加熱して酵素を失活させ、Superdex 30カラムでゲルろ過精製して、CH類(CHまたは還元末端標識CH)が得られた。具体的には、CH(10k)、CH(10k)−HMDA、CH(10k)−PA、CH(10k)−ABが、それぞれ1.6mg、1.86mg、1.54mg、1.72mg得られた。得られたCH類の基本骨格は、分子量が約1万(10k:糖鎖数約46個)であった。
【0039】
コンドロイチン(CH)の分子量は、1万(10k)に限られず、約1000(1k)〜約100万(1000k)であってもよい。これらの分子量は、酵素量、基質量および反応時間などにより調整することができる。
【0040】
(硫酸基転移酵素の調製)
ステップA1およびステップB1にて使用する硫酸基転移酵素であるC4ST1(アクセッション番号:NM_018713)、ステップB1にて使用するC6ST1(アクセッション番号:NM_004273)、ステップA3およびステップB2にて使用するUST(アクセッション番号:NM_005715)、ステップA2およびステップB3にて使用するGalNAc4S−6ST(アクセッション番号:NM_015892)を調製した。これらの酵素は、以下のとおり、動物細胞安定発現株の培養により発現・精製したものを用いたが、他の発現系、例えば大腸菌、酵母、昆虫細胞、無細胞系で発現および精製したものを用いてもよい。また、天然物から精製した酵素を用いてもよい。
【0041】
PCRの鋳型として、C4ST1用にpFLAG−CMV3−DEST−C4ST1、C6ST1用にpFLAG−CMV3−DEST−C6ST1、UST用にpFLAG−CMV3−DEST−UST、GalNAc4S−6ST用にpFLAG−CMV3−DEST−GalNAc4S−6ST(いずれも産業技術総合研究所糖鎖医工学研究センター提供)をそれぞれ使用した。これらを鋳型として、FLAGタグを含む硫酸転移酵素遺伝子のDNAフラグメントをPCRで増幅した。増幅されたDNAフラグメントを、pIRESpuro発現ベクター(クロンテック社製)のMCS領域にライゲーションし、C4ST1用にpIRESpuro−FLAG−C4ST1、C6ST1用にpIRESpuro−FLAG−C6ST1、UST用にpIRESpuro−FLAG−UST、GalNAc4S−6ST用にpIRESpuro−FLAG−GalNAc4S−6STプラスミドをそれぞれ作製した。これらのプラスミドDNAをLipofectamin 2000(インビトロジェン社製)を用いて動物細胞株HEK293Tにトランスフェクションした。継代細胞をピューロマイシンでセレクションして、各硫酸基転移酵素安定高発現株を樹立した。
【0042】
C4ST1、C6ST1、UST、GalNAc4S−6STの安定高発現HEK293T細胞株を、10%ウシ胎児血清および5μg/mlピューロマイシン含有GlutaMax−DMEM液体培地(インビトロジェン社製)にて37℃で7日間培養し、培養液上清を抗FLAG抗体固定化樹脂(シグマ社製)カラムに通し、10mM Tris−HCl,150mM NaCl,5% glycerol,0.01% Tween 20,pH7.4緩衝液で洗除後、10mM Tris−HCl,150mM NaCl,20% glycerol,200μg/ml FLAG peptide,pH7.4緩衝液で溶出させて、精製酵素液とした。C4ST1は980pmol/min/ml,C6ST1は1580pmol/min/ml,USTは280pmol/min/ml,GalNAc4S−6STは950pmol/min/mlの酵素液がそれぞれ得られた。
【0043】
[実験例]
以下、実験例1〜4は経路A、実験例5〜8は経路Bに関する実験例を示す。CH類として、実験例1、5ではCH(10k)−HMDAを、実験例2、6ではCH(10k)を、実験例3、7ではCSAC(10k)−PAを、実験例4、8ではCSAC(10k)−ABを、それぞれ用いた。酵素液は、上述の調製により得られた酵素液を用いた。
【0044】
[実験例1]
(ステップA1)
CH(10k)−HMDA 0.5mgを、C4ST1溶液1.8ml、3’−ホスホアデニル5’−ホスホ硫酸(PAPS、シグマ社製)11.5μmolおよび2mMジチオスレイトール(DTT)を含む50mM TriS−HCl,pH6.8緩衝液(3ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が4位硫酸化されたCSA(10k)−HMDAが0.34mg得られた。
【0045】
(ステップA2)
得られたCSA(10k)−HMDA 0.2mgを、GalNAc4S−6ST溶液0.52ml、PAPS 4.6μmolおよび2mM DTTを含む50mM TriS−HCl,pH 6.8緩衝液(1ml)に溶解させ、37℃で24時間反応させた後、GalNAc4S−6ST 0.26mlおよびPAPS 2.3μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を92.5%、4位硫酸化された二糖単位を7.5%もつCSE(10k)−HMDAが0.22mg得られた。
【0046】
(ステップA3)
得られたCSE(10k)−HMDA 0.2mgを、UST溶液0.95ml、PAPS 4.6μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(1.6ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の4位と6位が共に硫酸化された三硫酸化二糖単位を18%、GalNAc残基の4位と6位が共に硫酸化された二糖単位を75%、4位硫酸化された二糖単位を8%もつCtriS(10k)−HMDAが0.14mg得られた。
【0047】
実験例1では、二糖単位のうち約92%が少なくとも2硫酸化された構造(E構造、triS構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、0%×0+8%×1+75%×2+18%×3=約212(%)であった。
【0048】
[実験例2]
(ステップA1)
CH(10k) 0.4mgを、C4ST1溶液1.6ml、PAPS 10μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(3ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が4位硫酸化されたCSA(10k)が0.36mg得られた。
【0049】
(ステップA2)
得られたCSA(10k) 0.12mgを、GalNAc4S−6ST溶液0.36ml、PAPS 3.2μmolおよび2mM DTTを含む50mM TriS−HCl, pH6.8緩衝液(1ml)に溶解させ、37℃で24時間反応させた後、GalNAc4S−6ST 0.15mlおよびPAPS 0.8μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を86%、4位硫酸化された二糖単位を13%もつCSE(10k)が0.13mg得られた。
【0050】
(ステップA3)
得られたCSE(10k) 0.005mgを、UST溶液0.05ml、PAPS 0.3μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.15ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の4位と6位が共に硫酸化された三硫酸化二糖単位を51%、GalNAc残基の4位と6位が共に硫酸化された二糖単位を39%、4位硫酸化された二糖単位を8%もつCtriS(10k)が0.003mg得られた。
【0051】
実験例2では、二糖単位のうち約90%が少なくとも2硫酸化された構造(E構造、triS構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、2%×0+8%×1+39%×2+51%×3=約239(%)であった。
【0052】
[実験例3]
(ステップA1)
CH(10k)−PA 0.1mgを、C4ST1溶液0.4ml、PAPS 2.5μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(1ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が4位硫酸化されたCSA(10k)−PAが0.08mg得られた。
【0053】
(ステップA2)
得られたCSA(10k)−PA 0.03mgを、GalNAc4S−6ST溶液0.09ml、PAPS 0.8μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.25ml)に溶解させ、37℃で24時間反応させた後、GalNAc4S−6ST 0.03mlおよびPAPS 0.2μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を68%、4位硫酸化された二糖単位を29%もつCSE(10k)−PAが0.04mg得られた。
【0054】
(ステップA3)
得られたCSE(10k)−PA 0.005mgを、UST溶液0.8ml、PAPS 0.8μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(1.8ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の4位と6位が共に硫酸化された3硫酸化二糖単位を11%、GalNAc残基の4位と6位が共に硫酸化された二糖単位を54%、4位硫酸化された二糖単位を28%もつCtriS(10k)−PAが0.003mg得られた。
【0055】
実験例3では、二糖単位のうち約65%が少なくとも2硫酸化された構造(E構造、triS構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、7%×0+28%×1+54%×2+11%×3=約169(%)であった。
【0056】
[実験例4]
(ステップA1)
CH(10k)−AB 0.1mgを、C4ST1溶液0.4ml、PAPS 2.5μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.8ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が4位硫酸化されたCSA(10k)−ABが0.08mg得られた。
【0057】
(ステップA2)
得られたCSA(10k)−AB 0.02mgを、GalNAc4S−6ST溶液0.06ml、PAPS 0.52μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.2ml)に溶解させ、37℃で24時間反応させた後、GalNAc4S−6ST 0.03mlおよびPAPS 0.26μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を57%、4位硫酸化された二糖単位を41%もつCSE(10k)−ABが0.02mg得られた。
【0058】
(ステップA3)
得られたCSE(10k)−AB 0.001mgを、UST溶液0.15ml、PAPS 0.9μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.2ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の4位と6位が共に硫酸化された3硫酸化二糖単位を8%、GalNAc残基の4位と6位が共に硫酸化された二糖単位を48%、4位硫酸化された二糖単位を40%もつCtriS(10k)−ABが0.0008mg得られた。
【0059】
実験例4では、二糖単位のうち約56%が少なくとも2硫酸化された構造(E構造、triS構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、4%×0+40%×1+48%×2+8%×3=約160(%)であった。
【0060】
[実験例5]
(ステップB1)
CH(10k)−HMDA 0.3mgを、C4ST1溶液0.66ml、C6ST1溶液0.27ml、PAPS 6.9μmolおよび2mM DTTを含む50mM TriS−HCl, pH6.8緩衝液(2ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位硫酸化が48%、6位硫酸化が51%のCSAC(10k)−HMDAが0.19mg得られた。
【0061】
(ステップB2)
得られたCSAC(10k)−HMDA 0.14mgを、UST溶液1.13ml、PAPS 3.3μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(2ml)に溶解させ、37℃で24時間反応させた後、UST 0.56mlおよびPAPS 1.6μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を48%、4位硫酸化された二糖単位を52%もつCSAD(10k)−HMDAが0.14mg得られた。
【0062】
(ステップB3)
得られたCSAD(10k)−HMDA 0.1mgを、GalNAc4S−6ST溶液0.18ml、PAPS 2.3μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.3ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を20%、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を48%、4位硫酸化された二糖単位を32%もつCSDE(10k)−HMDAが0.32mg得られた。
【0063】
実験例5では、二糖単位のうち約68%が少なくとも2硫酸化された構造(DE混在構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、0%×0+32%×1+68%×2+0%×3=約168(%)であった。
【0064】
(参考実験1)
CH(10k)−HMDA 0.2mgを、C6ST1溶液0.6ml、PAPS 4.6μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(2ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が6位硫酸化されたCSC(10k)−HMDAが0.14mg得られた。実験例5のステップB1にかえて実験例1のステップA1と本参考実験1の反応とを組み合わせることにより、CSAC(10k)−HMDAを合成してもよい。
【0065】
[実験例6]
(ステップB1)
CH(10k) 0.2mgを、C4ST1溶液0.44ml、C6ST1溶液0.20ml、PAPS 4.5μmolおよび2mM DTTを含む50mM TriS−HCl,pH 6.8緩衝液(2ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位硫酸化が42%、6位硫酸化が56%のCSAC(10k)が0.14mg得られた。
【0066】
(ステップB2)
得られたCSAC(10k) 0.07mgを、UST溶液1.1ml、PAPS 3.2μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(2ml)に溶解させ、37℃で24時間反応させた後、UST 0.55mlおよびPAPS 1.6μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を42%、4位硫酸化された二糖単位を44%、6位硫酸化された二糖単位を8%もつCSAD(10k)が0.04mg得られた。
【0067】
(ステップB3)
得られたCSAD(10k) 0.006mgを、GalNAc4S−6ST溶液0.03ml、PAPS 0.3μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.15ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を19%、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を44%、4位硫酸化された二糖単位を26%、6位硫酸化された二糖単位を8%もつCSDE(10k)が0.007mg得られた。
【0068】
実験例6では、二糖単位のうち約63%が少なくとも2硫酸化された構造(DE混在構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、3%×0+34%×1+63%×2+0%×3=約160(%)であった。
【0069】
(参考実験2)
CH(10k) 0.2mgを、C6ST1溶液0.5ml、PAPS 4.2μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(2ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が6位硫酸化されたCSC(10k)が0.15mg得られた。実験例6のステップB1にかえて実験例2のステップA1と本参考実験2の反応とを組み合わせることにより、CSAC(10k)を合成してもよい。
【0070】
[実験例7]
(ステップB1)
CH(10k)−PA 0.05mgを、C4ST1溶液0.11ml、C6ST1溶液0.05ml、PAPS 1.1μmolおよび2mM DTTを含む50mM TriS−HCl, pH6.8緩衝液(0.5ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位硫酸化が38%、6位硫酸化が61%のCSAC(10k)−PAが0.14mg得られた。
【0071】
(ステップB2)
得られたCSAC(10k)−PA 0.02mgを、UST溶液0.3ml、PAPS 0.9μmolおよび2mM DTTを含む50mM TriS−HCl,pH 6.8緩衝液(0.5ml)に溶解させ、37℃で24時間反応させた後、UST 0.15mlおよびPAPS 0.45μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を30%、4位硫酸化された二糖単位を38%、6位硫酸化された二糖単位を31%もつCSAD(10k)−PAが0.011mg得られた。
【0072】
(ステップB3)
得られたCSAD(10k)−PA 0.005mgを、GalNAc4S−6ST溶液0.02ml、PAPS 0.2μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.15ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を31%、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を30%、4位硫酸化された二糖単位を7%、6位硫酸化された二糖単位を28%もつCSDE(10k)−PAが0.005mg得られた。
【0073】
実験例7では、二糖単位のうち約61%が少なくとも2硫酸化された構造(DE混在構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、4%×0+35%×1+61%×2+0%×3=約157(%)であった。
【0074】
(参考実験3)
CH(10k)−PA 0.1mgを、C6ST1溶液0.25ml、PAPS 2.1μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(1ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が6位硫酸化されたCSC(10k)−PAが0.08mg得られた。実験例7のステップB1にかえて実験例3のステップA1と本参考実験3の反応とを組み合わせることにより、CSAC(10k)−PAを合成してもよい。
【0075】
[実験例8]
(ステップB1)
CH(10k)−AB 0.1mgを、C4ST1溶液0.22ml、C6ST1溶液0.10ml、PAPS 2.1μmolおよび2mM DTTを含む50mM TriS−HCl, pH6.8緩衝液(0.8ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位硫酸化が39%、6位硫酸化が59%のCSAC(10k)−ABが0.07mg得られた。
【0076】
(ステップB2)
得られたCSAC(10k)−AB 0.01mgを、UST溶液0.15ml、PAPS 0.5μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.3ml)に溶解させ、37℃で24時間反応させた後、UST 0.09mlおよびPAPS 0.25μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を24%、4位硫酸化された二糖単位を38%、6位硫酸化された二糖単位を35%もつCSAD(10k)−ABが0.008mg得られた。
【0077】
(ステップB3)
得られたCSAD(10k)−AB 0.001mgを、GalNAc4S−6ST溶液0.05ml、PAPS 0.5μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.1ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を26%、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を24%、4位硫酸化された二糖単位を12%、6位硫酸化された二糖単位を34%もつCSDE(10k)−ABが0.0007mg得られた。
【0078】
実験例8では、二糖単位のうち約50%が少なくとも2硫酸化された構造(DE混在構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、4%×0+46%×1+50%×2+0%×3=約146(%)であった。
【0079】
(参考実験4)
CH(10k)−AB 0.1mgを、C6ST1溶液0.25ml、PAPS 2.1μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.8ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が6位硫酸化されたCSC(10k)−ABが0.08mg得られた。実験例8のステップB1にかえて実験例4のステップA1と本参考実験4の反応とを組み合わせることにより、CSAC(10k)−ABを合成してもよい。
【0080】
[比較実験例]
次に、図2に示した経路Aおよび経路Bの反応に用いた3つ以上の酵素を同時に反応させた比較実験例1および比較実験例2の結果を示す。
【0081】
(比較実験例1)
経路Bに用いる4つの酵素であるC4ST1、C6ST1、UST、GalNAc4S−6STを同時に反応させた。具体的には、CH(10k)−HMDA 0.1mgを、C4ST1溶液0.26ml、C6ST1溶液0.09ml、UST溶液0.76ml、GalNAc4S−6ST溶液0.18ml、PAPS 2.3μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(1.5ml)に溶解させ、37℃で48時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製した。得られた硫酸化糖鎖は、4Sが66.3%、6Sが12.0%の二糖単位組成であり、2硫酸化二糖単位は合成できなかった。この場合、硫酸化度は、21.7%×0+78.3%×1+0%×2+0%×3=約78.3(%)であった。
【0082】
(比較実験例2)
経路Aに用いる3つの酵素であるC4ST1、UST、GalNAc4S−6STを同時に反応させた。具体的には、CH(10k)−HMDA 0.1mgを、C4ST1溶液0.33ml、UST溶液0.76ml、GalNAc4S−6ST溶液0.18ml、PAPS 2.3μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(1.5ml)に溶解させ、37℃で48時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製した。得られた硫酸化糖鎖は、4Sが30.5%の二糖単位組成であり、2硫酸化二糖単位および3硫酸化二糖単位は合成できなかった。この場合、硫酸化度は、69.5%×0+30.5%×1+0%×2+0%×3=約30.5(%)であった。
【0083】
CH(10k)−HMDAを基質として3つ以上の酵素を同時に反応させた場合、2硫酸化二糖単位および3硫酸化二糖単位は合成できなかった。したがって、高硫酸化コンドロイチン硫酸類を合成するためには、図2の経路Aまたは経路Bの順序で反応を行う必要があることが明らかとなった。なお、経路BのステップB1においてのみ複数の酵素(C4ST1とC6ST1)を同時に反応させても合成効率を維持できる。
【0084】
次に、図2の経路BのステップB2において、CSAが存在しない状況下でCSCからCSDへの合成反応が進むかどうかを検討した結果を比較実験例3として示す。
【0085】
(比較実験例3)
実験例5のステップB1で得られたCSC(10k)−HMDA 0.1mgを、UST溶液0.76ml、PAPS 2.3μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(1.5ml)に溶解させ、37℃で24時間反応させた後、UST 0.38mlおよびPAPS 1.1μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製した。得られた硫酸化糖鎖は、GlcA残基の2位とGalNAc残基の6位がいずれも硫酸化された二糖単位(D構造)が4%であり、6位硫酸化された二糖単位が94%残ったものであった。
【0086】
CSAが存在しない状況下では、CSC(10k)−HMDAからCSD(10k)−HMDAへの合成効率は著しく低下した。このことから、CSD(10k)−HMDAを効率よく合成するためには、CSC構造に加えてCSA構造が同一分子中に存在する必要があることが明らかとなった。
【0087】
以上、説明したように、いずれの基質の場合も、経路AでCtriS、経路BでCSDEを、いずれも高収率で合成することができた。一方、これらの経路を経ない場合(3つ以上の酵素を同時に反応させた場合)には、高硫酸化コンドロイチン硫酸類を合成することはできなかった。なお、各反応に使用する基質の量を増やした場合、経路AのCtriS、経路BのCSDEとも、さらに合成効率を向上させることができると考えられる。
【0088】
(用途)
本発明に係る合成方法により合成された高硫酸化コンドロイチン硫酸類は、たとえば以下の用途に使用することができる。
【0089】
本発明の合成方法により合成された高硫酸化コンドロイチン硫酸類は、糖鎖と特異的に作用する生理活性分子との相互作用解析などの機能性研究試薬に利用することができる。
【0090】
本発明の合成方法(実験例1)により合成された還元末端HMDA修飾体は、活性エステルやエポキシなどで活性化したプレートやチップなどの担体に共有結合で固定化することができる。そのため、本発明の合成方法により合成された還元末端がHMDAで修飾された高硫酸化コンドロイチン硫酸類は、各種生理活性分子などや細胞表面分子との親和性解析(分子間相互作用解析)に有用である。
【0091】
本発明の合成方法により合成された高硫酸化コンドロイチン硫酸類は、還元末端をPAやABで修飾した場合(PA修飾:実験例3、AB修飾:実験例4)、蛍光で検出できる。そのため、本発明の合成方法により合成された還元末端がPAやABで修飾された高硫酸化コンドロイチン硫酸を、1pmol以下の極めて微量使用する場合にも、当該高硫酸化コンドロイチン硫酸をトレース可能である。
【0092】
以上、本発明を上述の実施の形態や実験例を参照して説明したが、本発明は上述の実施の形態や実験例に限定されるものではなく、実施の形態や実験例の構成を適宜組み合わせたものや置換したものについても本発明に含まれるものである。また、当業者の知識に基づいて実施の形態や実験例における組合せや工程の順番を適宜組み替えることや各種の設計変更等の変形を実施の形態に対して加えることも可能であり、そのような変形が加えられた実施の形態や各実験例も本発明の範囲に含まれうる。
【技術分野】
【0001】
本発明は、高硫酸化コンドロイチン硫酸類の合成方法、高硫酸化コンドロイチン硫酸類、および解析用試薬に関する。
【背景技術】
【0002】
コンドロイチン硫酸(chondroitin sulfate:CS)は、アミノ糖誘導体とヘキソース誘導体の繰り返し構造を有する直鎖状の多糖体であるグリコサミノグリカン(glycosaminoglycan)の1つである。コンドロイチン硫酸は、コアタンパク質に結合したプロテオグリカンとして動物組織に広く分布しており、動物の発生・分化・成長および再生に重要な役割を担っている。コンドロイチン硫酸は、たとえば軟骨中の主要成分として、水和力や弾性に寄与して軟骨組織形成に役立っている。また、コンドロイチン硫酸は、多様な生理活性分子との結合性を示し、生理活性分子の貯留や、安定化あるいはマスキングの役割を持ち、細胞膜受容体と協働して、シグナル伝達機構を制御している。また、コンドロイチン硫酸は、神経系においては神経細胞の軸索の伸展促進や阻害効果を示し、免疫系細胞においては顆粒に存在し、免疫物質の蓄積や放出を制御している。マラリヤ原虫やウイルスなどの感染においては、コンドロイチン硫酸は、受容体となるとともに、感染阻害効果を示すことが知られている。多くの場合、以下に述べるD構造やE構造のようなコンドロイチン硫酸が、特に高い生理活性を示すことが知られている。
【0003】
コンドロイチン硫酸は、分子量数万(糖鎖数20〜400個)の直鎖多糖体構造を有する。この構造は、グルクロン酸(GlcA)とN−アセチルガラクトサミン(GalNAc)とがβ1−3およびβ1−4で交互に結合した二糖の繰り返しを基本構造とする。コンドロイチン硫酸は、コンドロイチン(chondroitin:CH)が、たとえば図1に示すような多様な硫酸基修飾を受けた物質である。
【0004】
具体的には、コンドロイチン硫酸(CS)は、コンドロイチン(chondroitin:CH)の二糖単位のうちGalNAc残基4位が硫酸化(4S)されたA構造(CSA)、GalNAc残基6位が硫酸化(6S)されたC構造(CSC)、GlcA残基2位とGalNAc残基6位の二糖単位の2カ所が硫酸化(2S,6S)されたD構造(CSD)、GalNAc残基の4位と6位の2カ所が硫酸化(4S,6S)されたE構造(CSE)、GlcA残基2位、GalNAc残基4位および6位の計3カ所が硫酸化(2S,4S,6S)されたtriS構造(CStriSまたはCtriS)など、様々な修飾二糖単位を含む。また、本明細書中では、A構造とC構造が1つのポリマー中に混在した構造をAC構造またはAC混在構造(CSAC)と呼び、A構造とD構造が1つのポリマー中に混在した構造をAD構造またはAD混在構造(CSAD)と呼び、D構造とE構造が1つのポリマー中に混在した構造をDE構造またはDE混在構造(CSDE)と呼ぶ。コンドロイチン硫酸は、これらの硫酸基修飾構造が組み合わさった、きわめて複雑な多糖体構造を有する。
【0005】
コンドロイチンの糖鎖骨格を特異的に硫酸化する硫酸基転移酵素は、広く動物細胞が産生しており、硫酸基を修飾する糖残基の水酸基位置特異的に、それぞれ別個の酵素が存在する(非特許文献1)。ヒトでは、GalNAc残基の4位を硫酸化するコンドロイチン4硫酸基転移酵素として、C4ST−1、C4ST−2、C4ST−3の3個のアイソザイムが知られている。また、デルマタン硫酸骨格(GlcAがIdoAにエピメリ化したもの)のGalNAc残基4位を硫酸化する酵素であるD4STも存在する。また、GalNAc残基の6位に硫酸基を転移するコンドロイチン6硫酸基転移酵素として、ヒトではC6ST−1、C6ST−2の2個のアイソザイムがある。4位が硫酸化されたGalNAc(4S)残基の6位に特異的に硫酸基修飾しE構造をつくる酵素は、GalNAc4S−6硫酸基転移酵素(GalNAc4S−6ST)と呼ばれる。GalNAc(6S)残基の非還元末端側のGlcA残基の2位に硫酸基修飾しD構造をつくる酵素は、ウロン酸二硫酸基転移酵素(UST)と呼ばれる。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Trends in Glycoscience and Glycotechnology Vol.12、No.67(2000)307−319
【発明の概要】
【発明が解決しようとする課題】
【0007】
上述したように、D構造やE構造を有するコンドロイチン硫酸は、高い生理活性を有している。そのため、高頻度に硫酸化されたコンドロイチン硫酸が求められている。しかしながら、従来の硫酸化方法では、求められる程度に高度に硫酸化したコンドロイチン硫酸を合成することは困難であった。
【0008】
本発明はこうした状況に鑑みてなされたものであり、その目的とするところは、高硫酸化されたコンドロイチン硫酸類を合成する技術を提供することにある。
【課題を解決するための手段】
【0009】
上記課題を解決するために、本発明のある態様の高硫酸化コンドロイチン硫酸類の合成方法は、コンドロイチンに、硫酸基転移酵素C4ST−1を作用させ、コンドロイチン硫酸のA構造を形成するステップ(A1)と、A構造に、硫酸基転移酵素GalNAc4S−6STを作用させ、コンドロイチン硫酸のE構造を形成するステップ(A2)と、E構造に、硫酸基転移酵素USTを作用させ、コンドロイチン硫酸のtriS構造を形成するステップ(A3)と、を含む。
【0010】
この態様によると、triS構造などの高硫酸化構造を高頻度に有する高硫酸化コンドロイチン硫酸類を効率的に合成することができる。
【0011】
なお、本明細書中で「コンドロイチン硫酸類」というときには、コンドロイチン硫酸およびその誘導体を意味するものとする。また、本明細書中で「高硫酸化」とは、コンドロイチン硫酸類を構成する複数の二糖単位のうち少なくとも50%が2硫酸化(D構造、E構造、およびDE構造など)または3硫酸化(triS構造)されていることを意味する。これに加えて、またはこれに代えて、「高硫酸化」とは、後述の「硫酸化度」が100%以上であることを意味してもよい。
【0012】
本発明の別の態様は、高硫酸化コンドロイチン硫酸類の合成方法である。この高硫酸化コンドロイチン硫酸類の合成方法は、コンドロイチンに、硫酸基転移酵素C4ST−1および硫酸基転移酵素C6ST−1を作用させ、1分子のコンドロイチン中にA構造とC構造とを形成するステップ(B1)と、C構造に、硫酸基転移酵素USTを作用させ、D構造を形成するステップ(B2)と、D構造の形成後、A構造に硫酸基転移酵素GalNAc4S−6STを作用させ、E構造を形成するステップ(B3)と、を含む。
【0013】
この態様によると、DE構造などの高硫酸化構造を高頻度に有する高硫酸化コンドロイチン硫酸類を効率的に合成することができる。
【0014】
本発明の別の態様は、高硫酸化コンドロイチン硫酸類である。この高硫酸化コンドロイチン硫酸類は、上述したいずれかの態様の高硫酸化コンドロイチン硫酸類の合成方法により合成される。
【0015】
この態様によると、triS構造やDE構造などを高頻度に有する高硫酸化コンドロイチン硫酸類を提供することができる。
【0016】
本発明の別の態様は、解析用試薬である。この解析用試薬は、上述したいずれかの態様により合成された高硫酸化コンドロイチン硫酸類を含み、生理活性分子または細胞表面分子と、当該高硫酸化コンドロイチン硫酸類とを特異的に相互作用させる。
【0017】
この態様によると、triS構造やDE構造などを高頻度に有し、生理活性分子または細胞表面分子との相互作用解析に有用な解析用試薬を提供することができる。
【発明の効果】
【0018】
本発明によれば、高硫酸化されたコンドロイチン硫酸類を合成することができる。
【図面の簡単な説明】
【0019】
【図1】コンドロイチン硫酸類の主な二糖単位構造を示す図である。
【図2】図2(A)は、第1の実施の形態に係る合成方法を示す図である。図2(B)は、第2の実施の形態に係る合成方法を示す図である。
【発明を実施するための形態】
【0020】
以下、本発明を実施するための形態について詳細に説明する。
【0021】
本発明者は、コンドロイチン(CH)またはコンドロイチン硫酸(CS)に硫酸基転移酵素を組み合わせて段階的に反応させることで、特定の糖水酸基位置に高頻度で硫酸基が結合した高硫酸化コンドロイチン硫酸を合成できる合成方法を見出した。この合成方法により合成されたコンドロイチン硫酸は、天然には存在しない程度に高度な硫酸基修飾がなされている。また、合成されたコンドロイチン硫酸は、コンドロイチンまたはコンドロイチン硫酸を化学的に硫酸化したときのようなランダムな硫酸化は起こっていない。したがって、合成されるコンドロイチン硫酸の性質をある程度制御することが可能となる。
【0022】
図2(A)は、第1の実施の形態に係る合成方法を示す図である。図2(B)は、第2の実施の形態に係る合成方法を示す図である。図1、図2(A)および図2(B)に基づいて、高硫酸化コンドロイチン硫酸類の合成経路を説明する。
【0023】
(第1の実施の形態)
第1の実施の形態の合成方法(経路A)は、ステップA1〜A3を含む。ステップA1は、コンドロイチンに、硫酸基転移酵素C4ST−1を作用させ、ほぼ完全にA構造[GlcA−GalNAc(4S)]を有するコンドロイチン硫酸のA構造(CSA)を形成するステップである。ステップA2は、ステップA1で形成されたA構造に、硫酸基転移酵素GalNAc4S−6STを作用させ、大部分がE構造[GlcA−GalNAc(4S,6S)]であるコンドロイチン硫酸のE構造(CSE)を形成するステップである。ステップA3は、ステップA2で形成されたE構造に、硫酸基転移酵素USTを作用させ、天然には微量にしか存在しないtriS構造[GlcA(2S)−GalNAc(4S,6S)]を含む高硫酸化CtriSを形成するステップである。
【0024】
経路Aにより、二糖単位が高頻度で2硫酸化(E構造など)または3硫酸化(triS構造)された高硫酸化コンドロイチン硫酸類が得られる。得られる高硫酸化コンドロイチン硫酸類は、二糖単位のうち少なくとも50%が2硫酸化(E構造など)または3硫酸化(triS構造)された構造を有する。また、後述の硫酸化度が100%以上である構造を有している。
【0025】
(第2の実施の形態)
第2の実施の形態の合成方法(経路B)は、ステップB1〜B3を含む。ステップB1は、コンドロイチンに、硫酸基転移酵素C4ST−1および硫酸基転移酵素C6ST−1を同時にまたは順不同で作用させ、A構造[GlcA−GalNAc(4S)]とC構造[GlcA−GalNAc(6S)]とが1分子中に混在したCSACを形成するステップである。ステップB2は、ステップB1で形成されたCSAC中のC構造に、硫酸基転移酵素USTを作用させ、C構造がD構造[GlcA(2S)−GalNAc(6S)]となったCSADを形成するステップである。ステップB3は、D構造の形成後、ステップB2で形成されたCSAD中のA構造に硫酸基転移酵素GalNAc4S−6STを作用させ、A構造の大部分をE構造に変換させ、DE構造に富む高硫酸化CSDEを形成するステップである。なお、図2(B)では、例示的に図の左側にCSA、右側にCSCが並んだCSACを示したが、CSAとCSCとの並びはこれに限られない。たとえば、CSCとCSAとの順序は逆であってもよい。また、CSAが連続する構造、またはCSCが連続する構造を有していてもよい。CSAD、CSDEについても同様である。
【0026】
ステップB1では、CHにC4ST−1とC6ST−1を同時に作用させることが好ましい。これにより、酵素量に応じた割合で1つの分子中にA構造とC構造とを有するCSACが1つのステップで合成できる。ここで「同時に作用させる」とは、C4ST−1とC6ST−1とを同一の系で、少なくとも一時的に反応がオーバーラップすればよいことを意味する。つまり、C4ST−1とC6ST−1との作用の開始時刻および終了時刻の少なくともいずれかは、異なっていてもよい。
【0027】
経路Bにより、二糖単位が高頻度で2硫酸化(DE構造など)された高硫酸化コンドロイチン硫酸類が得られる。得られる高硫酸化コンドロイチン硫酸類は、二糖単位のうち少なくとも50%が2硫酸化(DE構造など)された構造を有する。また、後述の硫酸化度が100%以上である構造を有している。
【0028】
なお、第1の実施の形態および第2の実施の形態で用いる硫酸化反応前のコンドロイチン類は、市販の化学的脱硫酸化したコンドロイチンを原料として用いることが出来る。また、コンドロイチンオリゴ糖(oligoCHともいう)に大腸菌由来のコンドロイチンポリメラーゼ(K4CP)を作用させて合成したコンドロイチン(CH)類を用いることもできる(ステップ0)。この方法で得られたCH類は任意の糖鎖長のコンドロイチンを合成することが可能なのでより好ましい。ステップ0により合成されたCH類を用いることにより、経路Aおよび経路Bの高硫酸化コンドロイチン硫酸類の合成を効率的に行うことができる。ただし、既に合成されたCHを使用できるのであれば、ステップ0は省略できる。ステップ0で使用するコンドロイチンオリゴ糖は2糖以上であれば糖鎖長に制限はないが、4糖(コンドロイチン四糖:CH4)以上のコンドロイチンオリゴ糖であることが好ましく、6糖(コンドロイチン六糖:CH6)以上のコンドロイチンオリゴ糖であることがさらに好ましい。コンドロイチンオリゴ糖は、コンドロイチンを加水分解酵素で限定分解することにより得られる。また、コンドロイチンオリゴ糖には、還元末端が標識されていてもよい。このような標識として、たとえばヘキサメチレンジアミン基(HMDA)、ピリジルアミン基(PA)、およびベンジルアミド基(AB)が考えられる。
【実施例】
【0029】
まず、以下の実験例1〜8について詳細に説明する前に、各実験例および各比較実験例に共通する測定方法、硫酸化度、CHの調製、および硫酸基転移酵素の調製について説明する。
【0030】
(蛍光不飽和二糖分析方法)
各実験例で合成されたコンドロイチン硫酸類は、以下の方法で定量および組成分析した。合成コンドロイチン硫酸類をコンドロイチナーゼABCまたはコンドロイチナーゼACII(生化学工業製)で完全に分解し、その分解物をSenshu PAK DOCOSILカラム(4.6×150mm、センシュウ科学社製)で分離し、シアノアセトアミドを反応させるポストカラム微量蛍光二糖分析HPLCシステム(Toypda H. et al. J.Biol.Chem.275(2000)2269−2275)を使用して分析した。濃度既知の不飽和二糖標準品(生化学工業社製)を同時に分析し、標準品との比較から、各二糖成分の組成比を算出し、二糖成分量の合計から元のコンドロイチン硫酸の含量を算出した。
【0031】
(硫酸化度)
本明細書では、硫酸化の程度を表す指標として、「硫酸化度」を規定した。コンドロイチンの二糖単位では、GlcA残基2位、GalNAc残基4位および6位の3か所が、硫酸化されうる。硫酸化されていない二糖単位の割合をA(%)、1硫酸化されている二糖単位の割合をB(%)、2硫酸化されている二糖単位の割合をC(%)、3硫酸化されている二糖単位をD(%)(ただし、A+B+C+D=100%)とすると、硫酸化度は以下の式1により定義される。
硫酸化度=A×0+B×1+C×2+D×3(%)・・・(式1)
【0032】
第1の実施の形態または第2の実施の形態に示した合成方法を用いた場合、硫酸化度は、100%以上であることが好ましく、120%以上であることがより好ましく、140%以上であることがさらに好ましい。
【0033】
(CH類の調製(ステップ0))
高硫酸化コンドロイチン硫酸類を合成するための基質として、還元末端が標識されていないコンドロイチン六糖(CH6)、還元末端ヘキサメチレンジアミン(HMDA)標識コンドロイチン六糖(CH6−HMDA)、還元末端ピリジルアミン(PA)基標識コンドロイチン六糖(CH6−PA)、還元末端ベンジルアミド(AB)基標識コンドロイチン六糖(CH6−AB)の4つをそれぞれ用いた。還元末端が標識されたoligoCHを原料として合成されたコンドロイチン硫酸類は、後述の用途のとおり、固定化や検出に使用できる点で有用である。なお、高硫酸化コンドロイチン硫酸類を合成するための基質として、ここではコンドロイチン六糖を示したが、糖鎖長が2糖以上のコンドロイチンオリゴ糖を使用できる点は、上述の通りである。
【0034】
CH6およびoligoCHは、天然コンドロイチン硫酸を化学的に脱硫酸化したコンドロイチン(生化学工業社製)をヒツジ睾丸由来ヒアルロニダーゼ(シグマ社製)で限定分解することにより合成した(N.Sugiura et al. Glycoconj.J.25(2008)521−530)。
【0035】
CH6−HMDAは、CH6に100倍量のHMDAと50倍量のNaBH3CNをpH5に調製した水溶液中で、70℃で一晩(19時間)反応させ、ゲルろ過(Superdex 30カラム、GEヘルスケア社製)することにより合成した。
【0036】
CH6−PAは、CH6に100倍量のアミノピリジンと15倍量のNaBH3CNをpH6.2に調製した水溶液中で、90℃で一晩(20時間)反応させ、Superdex 30カラムでゲルろ過精製することにより合成した(N.Sugiura et al. Glycoconj.J.25(2008)521−530)。
【0037】
CH6−ABは、CH6に100倍量の2−アミノベンズアミドと200倍量のNaBH3CNを30%酢酸−DMSO混合液中で、65℃で一晩(16時間)反応させ、Superdex 30カラムでゲルろ過精製することにより合成した(A.Kinoshita et al. Anal.Biochem.269(1999)367−378)。
【0038】
CH6(0.24mg)、CH6−HMDA(0.26mg)、CH6−PA(0.26mg)、CH6−AB(0.27mg)をそれぞれ、大腸菌由来コンドロイチンポリメラーゼ(K4CP:T.Ninomiya et al. J.Biol.Chem.277(2002)21567−21575)0.5μg、UDP−GlcA 6nmol、およびUDP−GalNAc 6nmolを含む50mM Tris−HCl,pH7.2, 0.15M NaCl, 0.2mM MnCl2水溶液3.2ml中にて、30℃で48時間振盪させながら反応させた。反応後、100℃で5分間加熱して酵素を失活させ、Superdex 30カラムでゲルろ過精製して、CH類(CHまたは還元末端標識CH)が得られた。具体的には、CH(10k)、CH(10k)−HMDA、CH(10k)−PA、CH(10k)−ABが、それぞれ1.6mg、1.86mg、1.54mg、1.72mg得られた。得られたCH類の基本骨格は、分子量が約1万(10k:糖鎖数約46個)であった。
【0039】
コンドロイチン(CH)の分子量は、1万(10k)に限られず、約1000(1k)〜約100万(1000k)であってもよい。これらの分子量は、酵素量、基質量および反応時間などにより調整することができる。
【0040】
(硫酸基転移酵素の調製)
ステップA1およびステップB1にて使用する硫酸基転移酵素であるC4ST1(アクセッション番号:NM_018713)、ステップB1にて使用するC6ST1(アクセッション番号:NM_004273)、ステップA3およびステップB2にて使用するUST(アクセッション番号:NM_005715)、ステップA2およびステップB3にて使用するGalNAc4S−6ST(アクセッション番号:NM_015892)を調製した。これらの酵素は、以下のとおり、動物細胞安定発現株の培養により発現・精製したものを用いたが、他の発現系、例えば大腸菌、酵母、昆虫細胞、無細胞系で発現および精製したものを用いてもよい。また、天然物から精製した酵素を用いてもよい。
【0041】
PCRの鋳型として、C4ST1用にpFLAG−CMV3−DEST−C4ST1、C6ST1用にpFLAG−CMV3−DEST−C6ST1、UST用にpFLAG−CMV3−DEST−UST、GalNAc4S−6ST用にpFLAG−CMV3−DEST−GalNAc4S−6ST(いずれも産業技術総合研究所糖鎖医工学研究センター提供)をそれぞれ使用した。これらを鋳型として、FLAGタグを含む硫酸転移酵素遺伝子のDNAフラグメントをPCRで増幅した。増幅されたDNAフラグメントを、pIRESpuro発現ベクター(クロンテック社製)のMCS領域にライゲーションし、C4ST1用にpIRESpuro−FLAG−C4ST1、C6ST1用にpIRESpuro−FLAG−C6ST1、UST用にpIRESpuro−FLAG−UST、GalNAc4S−6ST用にpIRESpuro−FLAG−GalNAc4S−6STプラスミドをそれぞれ作製した。これらのプラスミドDNAをLipofectamin 2000(インビトロジェン社製)を用いて動物細胞株HEK293Tにトランスフェクションした。継代細胞をピューロマイシンでセレクションして、各硫酸基転移酵素安定高発現株を樹立した。
【0042】
C4ST1、C6ST1、UST、GalNAc4S−6STの安定高発現HEK293T細胞株を、10%ウシ胎児血清および5μg/mlピューロマイシン含有GlutaMax−DMEM液体培地(インビトロジェン社製)にて37℃で7日間培養し、培養液上清を抗FLAG抗体固定化樹脂(シグマ社製)カラムに通し、10mM Tris−HCl,150mM NaCl,5% glycerol,0.01% Tween 20,pH7.4緩衝液で洗除後、10mM Tris−HCl,150mM NaCl,20% glycerol,200μg/ml FLAG peptide,pH7.4緩衝液で溶出させて、精製酵素液とした。C4ST1は980pmol/min/ml,C6ST1は1580pmol/min/ml,USTは280pmol/min/ml,GalNAc4S−6STは950pmol/min/mlの酵素液がそれぞれ得られた。
【0043】
[実験例]
以下、実験例1〜4は経路A、実験例5〜8は経路Bに関する実験例を示す。CH類として、実験例1、5ではCH(10k)−HMDAを、実験例2、6ではCH(10k)を、実験例3、7ではCSAC(10k)−PAを、実験例4、8ではCSAC(10k)−ABを、それぞれ用いた。酵素液は、上述の調製により得られた酵素液を用いた。
【0044】
[実験例1]
(ステップA1)
CH(10k)−HMDA 0.5mgを、C4ST1溶液1.8ml、3’−ホスホアデニル5’−ホスホ硫酸(PAPS、シグマ社製)11.5μmolおよび2mMジチオスレイトール(DTT)を含む50mM TriS−HCl,pH6.8緩衝液(3ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が4位硫酸化されたCSA(10k)−HMDAが0.34mg得られた。
【0045】
(ステップA2)
得られたCSA(10k)−HMDA 0.2mgを、GalNAc4S−6ST溶液0.52ml、PAPS 4.6μmolおよび2mM DTTを含む50mM TriS−HCl,pH 6.8緩衝液(1ml)に溶解させ、37℃で24時間反応させた後、GalNAc4S−6ST 0.26mlおよびPAPS 2.3μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を92.5%、4位硫酸化された二糖単位を7.5%もつCSE(10k)−HMDAが0.22mg得られた。
【0046】
(ステップA3)
得られたCSE(10k)−HMDA 0.2mgを、UST溶液0.95ml、PAPS 4.6μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(1.6ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の4位と6位が共に硫酸化された三硫酸化二糖単位を18%、GalNAc残基の4位と6位が共に硫酸化された二糖単位を75%、4位硫酸化された二糖単位を8%もつCtriS(10k)−HMDAが0.14mg得られた。
【0047】
実験例1では、二糖単位のうち約92%が少なくとも2硫酸化された構造(E構造、triS構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、0%×0+8%×1+75%×2+18%×3=約212(%)であった。
【0048】
[実験例2]
(ステップA1)
CH(10k) 0.4mgを、C4ST1溶液1.6ml、PAPS 10μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(3ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が4位硫酸化されたCSA(10k)が0.36mg得られた。
【0049】
(ステップA2)
得られたCSA(10k) 0.12mgを、GalNAc4S−6ST溶液0.36ml、PAPS 3.2μmolおよび2mM DTTを含む50mM TriS−HCl, pH6.8緩衝液(1ml)に溶解させ、37℃で24時間反応させた後、GalNAc4S−6ST 0.15mlおよびPAPS 0.8μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を86%、4位硫酸化された二糖単位を13%もつCSE(10k)が0.13mg得られた。
【0050】
(ステップA3)
得られたCSE(10k) 0.005mgを、UST溶液0.05ml、PAPS 0.3μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.15ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の4位と6位が共に硫酸化された三硫酸化二糖単位を51%、GalNAc残基の4位と6位が共に硫酸化された二糖単位を39%、4位硫酸化された二糖単位を8%もつCtriS(10k)が0.003mg得られた。
【0051】
実験例2では、二糖単位のうち約90%が少なくとも2硫酸化された構造(E構造、triS構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、2%×0+8%×1+39%×2+51%×3=約239(%)であった。
【0052】
[実験例3]
(ステップA1)
CH(10k)−PA 0.1mgを、C4ST1溶液0.4ml、PAPS 2.5μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(1ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が4位硫酸化されたCSA(10k)−PAが0.08mg得られた。
【0053】
(ステップA2)
得られたCSA(10k)−PA 0.03mgを、GalNAc4S−6ST溶液0.09ml、PAPS 0.8μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.25ml)に溶解させ、37℃で24時間反応させた後、GalNAc4S−6ST 0.03mlおよびPAPS 0.2μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を68%、4位硫酸化された二糖単位を29%もつCSE(10k)−PAが0.04mg得られた。
【0054】
(ステップA3)
得られたCSE(10k)−PA 0.005mgを、UST溶液0.8ml、PAPS 0.8μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(1.8ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の4位と6位が共に硫酸化された3硫酸化二糖単位を11%、GalNAc残基の4位と6位が共に硫酸化された二糖単位を54%、4位硫酸化された二糖単位を28%もつCtriS(10k)−PAが0.003mg得られた。
【0055】
実験例3では、二糖単位のうち約65%が少なくとも2硫酸化された構造(E構造、triS構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、7%×0+28%×1+54%×2+11%×3=約169(%)であった。
【0056】
[実験例4]
(ステップA1)
CH(10k)−AB 0.1mgを、C4ST1溶液0.4ml、PAPS 2.5μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.8ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が4位硫酸化されたCSA(10k)−ABが0.08mg得られた。
【0057】
(ステップA2)
得られたCSA(10k)−AB 0.02mgを、GalNAc4S−6ST溶液0.06ml、PAPS 0.52μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.2ml)に溶解させ、37℃で24時間反応させた後、GalNAc4S−6ST 0.03mlおよびPAPS 0.26μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を57%、4位硫酸化された二糖単位を41%もつCSE(10k)−ABが0.02mg得られた。
【0058】
(ステップA3)
得られたCSE(10k)−AB 0.001mgを、UST溶液0.15ml、PAPS 0.9μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.2ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の4位と6位が共に硫酸化された3硫酸化二糖単位を8%、GalNAc残基の4位と6位が共に硫酸化された二糖単位を48%、4位硫酸化された二糖単位を40%もつCtriS(10k)−ABが0.0008mg得られた。
【0059】
実験例4では、二糖単位のうち約56%が少なくとも2硫酸化された構造(E構造、triS構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、4%×0+40%×1+48%×2+8%×3=約160(%)であった。
【0060】
[実験例5]
(ステップB1)
CH(10k)−HMDA 0.3mgを、C4ST1溶液0.66ml、C6ST1溶液0.27ml、PAPS 6.9μmolおよび2mM DTTを含む50mM TriS−HCl, pH6.8緩衝液(2ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位硫酸化が48%、6位硫酸化が51%のCSAC(10k)−HMDAが0.19mg得られた。
【0061】
(ステップB2)
得られたCSAC(10k)−HMDA 0.14mgを、UST溶液1.13ml、PAPS 3.3μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(2ml)に溶解させ、37℃で24時間反応させた後、UST 0.56mlおよびPAPS 1.6μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を48%、4位硫酸化された二糖単位を52%もつCSAD(10k)−HMDAが0.14mg得られた。
【0062】
(ステップB3)
得られたCSAD(10k)−HMDA 0.1mgを、GalNAc4S−6ST溶液0.18ml、PAPS 2.3μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.3ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を20%、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を48%、4位硫酸化された二糖単位を32%もつCSDE(10k)−HMDAが0.32mg得られた。
【0063】
実験例5では、二糖単位のうち約68%が少なくとも2硫酸化された構造(DE混在構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、0%×0+32%×1+68%×2+0%×3=約168(%)であった。
【0064】
(参考実験1)
CH(10k)−HMDA 0.2mgを、C6ST1溶液0.6ml、PAPS 4.6μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(2ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が6位硫酸化されたCSC(10k)−HMDAが0.14mg得られた。実験例5のステップB1にかえて実験例1のステップA1と本参考実験1の反応とを組み合わせることにより、CSAC(10k)−HMDAを合成してもよい。
【0065】
[実験例6]
(ステップB1)
CH(10k) 0.2mgを、C4ST1溶液0.44ml、C6ST1溶液0.20ml、PAPS 4.5μmolおよび2mM DTTを含む50mM TriS−HCl,pH 6.8緩衝液(2ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位硫酸化が42%、6位硫酸化が56%のCSAC(10k)が0.14mg得られた。
【0066】
(ステップB2)
得られたCSAC(10k) 0.07mgを、UST溶液1.1ml、PAPS 3.2μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(2ml)に溶解させ、37℃で24時間反応させた後、UST 0.55mlおよびPAPS 1.6μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を42%、4位硫酸化された二糖単位を44%、6位硫酸化された二糖単位を8%もつCSAD(10k)が0.04mg得られた。
【0067】
(ステップB3)
得られたCSAD(10k) 0.006mgを、GalNAc4S−6ST溶液0.03ml、PAPS 0.3μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.15ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を19%、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を44%、4位硫酸化された二糖単位を26%、6位硫酸化された二糖単位を8%もつCSDE(10k)が0.007mg得られた。
【0068】
実験例6では、二糖単位のうち約63%が少なくとも2硫酸化された構造(DE混在構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、3%×0+34%×1+63%×2+0%×3=約160(%)であった。
【0069】
(参考実験2)
CH(10k) 0.2mgを、C6ST1溶液0.5ml、PAPS 4.2μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(2ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が6位硫酸化されたCSC(10k)が0.15mg得られた。実験例6のステップB1にかえて実験例2のステップA1と本参考実験2の反応とを組み合わせることにより、CSAC(10k)を合成してもよい。
【0070】
[実験例7]
(ステップB1)
CH(10k)−PA 0.05mgを、C4ST1溶液0.11ml、C6ST1溶液0.05ml、PAPS 1.1μmolおよび2mM DTTを含む50mM TriS−HCl, pH6.8緩衝液(0.5ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位硫酸化が38%、6位硫酸化が61%のCSAC(10k)−PAが0.14mg得られた。
【0071】
(ステップB2)
得られたCSAC(10k)−PA 0.02mgを、UST溶液0.3ml、PAPS 0.9μmolおよび2mM DTTを含む50mM TriS−HCl,pH 6.8緩衝液(0.5ml)に溶解させ、37℃で24時間反応させた後、UST 0.15mlおよびPAPS 0.45μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を30%、4位硫酸化された二糖単位を38%、6位硫酸化された二糖単位を31%もつCSAD(10k)−PAが0.011mg得られた。
【0072】
(ステップB3)
得られたCSAD(10k)−PA 0.005mgを、GalNAc4S−6ST溶液0.02ml、PAPS 0.2μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.15ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を31%、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を30%、4位硫酸化された二糖単位を7%、6位硫酸化された二糖単位を28%もつCSDE(10k)−PAが0.005mg得られた。
【0073】
実験例7では、二糖単位のうち約61%が少なくとも2硫酸化された構造(DE混在構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、4%×0+35%×1+61%×2+0%×3=約157(%)であった。
【0074】
(参考実験3)
CH(10k)−PA 0.1mgを、C6ST1溶液0.25ml、PAPS 2.1μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(1ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が6位硫酸化されたCSC(10k)−PAが0.08mg得られた。実験例7のステップB1にかえて実験例3のステップA1と本参考実験3の反応とを組み合わせることにより、CSAC(10k)−PAを合成してもよい。
【0075】
[実験例8]
(ステップB1)
CH(10k)−AB 0.1mgを、C4ST1溶液0.22ml、C6ST1溶液0.10ml、PAPS 2.1μmolおよび2mM DTTを含む50mM TriS−HCl, pH6.8緩衝液(0.8ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位硫酸化が39%、6位硫酸化が59%のCSAC(10k)−ABが0.07mg得られた。
【0076】
(ステップB2)
得られたCSAC(10k)−AB 0.01mgを、UST溶液0.15ml、PAPS 0.5μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.3ml)に溶解させ、37℃で24時間反応させた後、UST 0.09mlおよびPAPS 0.25μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を24%、4位硫酸化された二糖単位を38%、6位硫酸化された二糖単位を35%もつCSAD(10k)−ABが0.008mg得られた。
【0077】
(ステップB3)
得られたCSAD(10k)−AB 0.001mgを、GalNAc4S−6ST溶液0.05ml、PAPS 0.5μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.1ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、GalNAc残基の4位と6位が共に硫酸化された二糖単位を26%、GlcA残基の2位とGalNAc残基の6位が共に硫酸化された二糖単位を24%、4位硫酸化された二糖単位を12%、6位硫酸化された二糖単位を34%もつCSDE(10k)−ABが0.0007mg得られた。
【0078】
実験例8では、二糖単位のうち約50%が少なくとも2硫酸化された構造(DE混在構造など)を有する高硫酸化コンドロイチン硫酸類を合成することができた。この場合、硫酸化度は、4%×0+46%×1+50%×2+0%×3=約146(%)であった。
【0079】
(参考実験4)
CH(10k)−AB 0.1mgを、C6ST1溶液0.25ml、PAPS 2.1μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(0.8ml)に溶解させ、37℃で24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製することで、98%以上のGalNAc残基が6位硫酸化されたCSC(10k)−ABが0.08mg得られた。実験例8のステップB1にかえて実験例4のステップA1と本参考実験4の反応とを組み合わせることにより、CSAC(10k)−ABを合成してもよい。
【0080】
[比較実験例]
次に、図2に示した経路Aおよび経路Bの反応に用いた3つ以上の酵素を同時に反応させた比較実験例1および比較実験例2の結果を示す。
【0081】
(比較実験例1)
経路Bに用いる4つの酵素であるC4ST1、C6ST1、UST、GalNAc4S−6STを同時に反応させた。具体的には、CH(10k)−HMDA 0.1mgを、C4ST1溶液0.26ml、C6ST1溶液0.09ml、UST溶液0.76ml、GalNAc4S−6ST溶液0.18ml、PAPS 2.3μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(1.5ml)に溶解させ、37℃で48時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製した。得られた硫酸化糖鎖は、4Sが66.3%、6Sが12.0%の二糖単位組成であり、2硫酸化二糖単位は合成できなかった。この場合、硫酸化度は、21.7%×0+78.3%×1+0%×2+0%×3=約78.3(%)であった。
【0082】
(比較実験例2)
経路Aに用いる3つの酵素であるC4ST1、UST、GalNAc4S−6STを同時に反応させた。具体的には、CH(10k)−HMDA 0.1mgを、C4ST1溶液0.33ml、UST溶液0.76ml、GalNAc4S−6ST溶液0.18ml、PAPS 2.3μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(1.5ml)に溶解させ、37℃で48時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製した。得られた硫酸化糖鎖は、4Sが30.5%の二糖単位組成であり、2硫酸化二糖単位および3硫酸化二糖単位は合成できなかった。この場合、硫酸化度は、69.5%×0+30.5%×1+0%×2+0%×3=約30.5(%)であった。
【0083】
CH(10k)−HMDAを基質として3つ以上の酵素を同時に反応させた場合、2硫酸化二糖単位および3硫酸化二糖単位は合成できなかった。したがって、高硫酸化コンドロイチン硫酸類を合成するためには、図2の経路Aまたは経路Bの順序で反応を行う必要があることが明らかとなった。なお、経路BのステップB1においてのみ複数の酵素(C4ST1とC6ST1)を同時に反応させても合成効率を維持できる。
【0084】
次に、図2の経路BのステップB2において、CSAが存在しない状況下でCSCからCSDへの合成反応が進むかどうかを検討した結果を比較実験例3として示す。
【0085】
(比較実験例3)
実験例5のステップB1で得られたCSC(10k)−HMDA 0.1mgを、UST溶液0.76ml、PAPS 2.3μmolおよび2mM DTTを含む50mM TriS−HCl,pH6.8緩衝液(1.5ml)に溶解させ、37℃で24時間反応させた後、UST 0.38mlおよびPAPS 1.1μmolを追加し37℃でさらに24時間反応させた。反応液をSuperdex 30カラムでゲルろ過精製した。得られた硫酸化糖鎖は、GlcA残基の2位とGalNAc残基の6位がいずれも硫酸化された二糖単位(D構造)が4%であり、6位硫酸化された二糖単位が94%残ったものであった。
【0086】
CSAが存在しない状況下では、CSC(10k)−HMDAからCSD(10k)−HMDAへの合成効率は著しく低下した。このことから、CSD(10k)−HMDAを効率よく合成するためには、CSC構造に加えてCSA構造が同一分子中に存在する必要があることが明らかとなった。
【0087】
以上、説明したように、いずれの基質の場合も、経路AでCtriS、経路BでCSDEを、いずれも高収率で合成することができた。一方、これらの経路を経ない場合(3つ以上の酵素を同時に反応させた場合)には、高硫酸化コンドロイチン硫酸類を合成することはできなかった。なお、各反応に使用する基質の量を増やした場合、経路AのCtriS、経路BのCSDEとも、さらに合成効率を向上させることができると考えられる。
【0088】
(用途)
本発明に係る合成方法により合成された高硫酸化コンドロイチン硫酸類は、たとえば以下の用途に使用することができる。
【0089】
本発明の合成方法により合成された高硫酸化コンドロイチン硫酸類は、糖鎖と特異的に作用する生理活性分子との相互作用解析などの機能性研究試薬に利用することができる。
【0090】
本発明の合成方法(実験例1)により合成された還元末端HMDA修飾体は、活性エステルやエポキシなどで活性化したプレートやチップなどの担体に共有結合で固定化することができる。そのため、本発明の合成方法により合成された還元末端がHMDAで修飾された高硫酸化コンドロイチン硫酸類は、各種生理活性分子などや細胞表面分子との親和性解析(分子間相互作用解析)に有用である。
【0091】
本発明の合成方法により合成された高硫酸化コンドロイチン硫酸類は、還元末端をPAやABで修飾した場合(PA修飾:実験例3、AB修飾:実験例4)、蛍光で検出できる。そのため、本発明の合成方法により合成された還元末端がPAやABで修飾された高硫酸化コンドロイチン硫酸を、1pmol以下の極めて微量使用する場合にも、当該高硫酸化コンドロイチン硫酸をトレース可能である。
【0092】
以上、本発明を上述の実施の形態や実験例を参照して説明したが、本発明は上述の実施の形態や実験例に限定されるものではなく、実施の形態や実験例の構成を適宜組み合わせたものや置換したものについても本発明に含まれるものである。また、当業者の知識に基づいて実施の形態や実験例における組合せや工程の順番を適宜組み替えることや各種の設計変更等の変形を実施の形態に対して加えることも可能であり、そのような変形が加えられた実施の形態や各実験例も本発明の範囲に含まれうる。
【特許請求の範囲】
【請求項1】
コンドロイチンに、硫酸基転移酵素C4ST−1を作用させ、コンドロイチン硫酸のA構造を形成するステップ(A1)と、
前記A構造に、硫酸基転移酵素GalNAc4S−6STを作用させ、コンドロイチン硫酸のE構造を形成するステップ(A2)と、
前記E構造に、硫酸基転移酵素USTを作用させ、コンドロイチン硫酸のtriS構造を形成するステップ(A3)と、を含む高硫酸化コンドロイチン硫酸類の合成方法。
【請求項2】
コンドロイチンに、硫酸基転移酵素C4ST−1および硫酸基転移酵素C6ST−1を作用させ、1分子のコンドロイチン中にA構造とC構造とを形成するステップ(B1)と、
前記C構造に、硫酸基転移酵素USTを作用させ、D構造を形成するステップ(B2)と、
前記D構造の形成後、前記A構造に硫酸基転移酵素GalNAc4S−6STを作用させ、E構造を形成するステップ(B3)と、を含む高硫酸化コンドロイチン硫酸類の合成方法。
【請求項3】
前記硫酸基転移酵素C4ST−1および前記硫酸基転移酵素C6ST−1を同時に作用させることにより、前記A構造と前記C構造とを形成する請求項2に記載の合成方法。
【請求項4】
前記高硫酸化コンドロイチン硫酸類を構成する複数の二糖単位のうち、少なくとも50%が2硫酸化または3硫酸化されている請求項1〜3のいずれか1項に記載の合成方法。
【請求項5】
前記高硫酸化コンドロイチン硫酸類は、硫酸化度が100%以上である請求項1〜4のいずれか1項に記載の合成方法。
【請求項6】
コンドロイチンオリゴ糖にコンドロイチンポリメラーゼを作用させることにより、前記コンドロイチンを合成するステップをさらに含む請求項1〜5のいずれか1項に記載の合成方法。
【請求項7】
請求項1〜6のいずれか1項の合成方法により合成された高硫酸化コンドロイチン硫酸類。
【請求項8】
請求項7に記載の高硫酸化コンドロイチン硫酸類を含み、生理活性分子または細胞表面分子と、当該高硫酸化コンドロイチン硫酸類とを特異的に相互作用させるための解析用試薬。
【請求項9】
前記高硫酸化コンドロイチン硫酸類は、担体固定化用の末端修飾基が付加されている請求項8の解析用試薬。
【請求項10】
前記高硫酸化コンドロイチン硫酸類は、蛍光検出用の末端修飾基が付加されている請求項8の解析用試薬。
【請求項1】
コンドロイチンに、硫酸基転移酵素C4ST−1を作用させ、コンドロイチン硫酸のA構造を形成するステップ(A1)と、
前記A構造に、硫酸基転移酵素GalNAc4S−6STを作用させ、コンドロイチン硫酸のE構造を形成するステップ(A2)と、
前記E構造に、硫酸基転移酵素USTを作用させ、コンドロイチン硫酸のtriS構造を形成するステップ(A3)と、を含む高硫酸化コンドロイチン硫酸類の合成方法。
【請求項2】
コンドロイチンに、硫酸基転移酵素C4ST−1および硫酸基転移酵素C6ST−1を作用させ、1分子のコンドロイチン中にA構造とC構造とを形成するステップ(B1)と、
前記C構造に、硫酸基転移酵素USTを作用させ、D構造を形成するステップ(B2)と、
前記D構造の形成後、前記A構造に硫酸基転移酵素GalNAc4S−6STを作用させ、E構造を形成するステップ(B3)と、を含む高硫酸化コンドロイチン硫酸類の合成方法。
【請求項3】
前記硫酸基転移酵素C4ST−1および前記硫酸基転移酵素C6ST−1を同時に作用させることにより、前記A構造と前記C構造とを形成する請求項2に記載の合成方法。
【請求項4】
前記高硫酸化コンドロイチン硫酸類を構成する複数の二糖単位のうち、少なくとも50%が2硫酸化または3硫酸化されている請求項1〜3のいずれか1項に記載の合成方法。
【請求項5】
前記高硫酸化コンドロイチン硫酸類は、硫酸化度が100%以上である請求項1〜4のいずれか1項に記載の合成方法。
【請求項6】
コンドロイチンオリゴ糖にコンドロイチンポリメラーゼを作用させることにより、前記コンドロイチンを合成するステップをさらに含む請求項1〜5のいずれか1項に記載の合成方法。
【請求項7】
請求項1〜6のいずれか1項の合成方法により合成された高硫酸化コンドロイチン硫酸類。
【請求項8】
請求項7に記載の高硫酸化コンドロイチン硫酸類を含み、生理活性分子または細胞表面分子と、当該高硫酸化コンドロイチン硫酸類とを特異的に相互作用させるための解析用試薬。
【請求項9】
前記高硫酸化コンドロイチン硫酸類は、担体固定化用の末端修飾基が付加されている請求項8の解析用試薬。
【請求項10】
前記高硫酸化コンドロイチン硫酸類は、蛍光検出用の末端修飾基が付加されている請求項8の解析用試薬。
【図1】


【図2】




【図2】


【公開番号】特開2012−157271(P2012−157271A)
【公開日】平成24年8月23日(2012.8.23)
【国際特許分類】
【出願番号】特願2011−18629(P2011−18629)
【出願日】平成23年1月31日(2011.1.31)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成22年度独立行政法人新エネルギー・産業技術総合開発機構「糖鎖機能活用技術開発」委託研究、産業技術強化法第19条の適用を受ける出願)
【出願人】(506111240)学校法人 愛知医科大学 (6)
【Fターム(参考)】
【公開日】平成24年8月23日(2012.8.23)
【国際特許分類】
【出願日】平成23年1月31日(2011.1.31)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成22年度独立行政法人新エネルギー・産業技術総合開発機構「糖鎖機能活用技術開発」委託研究、産業技術強化法第19条の適用を受ける出願)
【出願人】(506111240)学校法人 愛知医科大学 (6)
【Fターム(参考)】
[ Back to top ]

