高血圧治療のための新規タンパク質相互作用
【課題】
WNK1及びWNK4の基質を同定すること、両タンパク質の関連シグナル伝達経路を明らかにすること、両タンパク質の関連シグナル伝達経路を標的とする降圧剤を提供すること。
【解決手段】
本発明者らは、WNK1及びWNK4とSPAKとが相互作用すること(相互に結合すること)、及び、WNK1及びWNK4がSPAKを基質とし、SPAKをリン酸化する作用があることを新規に見出した。そこで、本発明では、まず、SPAKを基質とするWNK1、SPAKを基質とするWNK4、WNK1又は/及びWNK4の基質であるSPAK、WNK1及びWNK4とSPAKとが相互作用を促進又は抑制する降圧剤を提供する。
WNK1及びWNK4の基質を同定すること、両タンパク質の関連シグナル伝達経路を明らかにすること、両タンパク質の関連シグナル伝達経路を標的とする降圧剤を提供すること。
【解決手段】
本発明者らは、WNK1及びWNK4とSPAKとが相互作用すること(相互に結合すること)、及び、WNK1及びWNK4がSPAKを基質とし、SPAKをリン酸化する作用があることを新規に見出した。そこで、本発明では、まず、SPAKを基質とするWNK1、SPAKを基質とするWNK4、WNK1又は/及びWNK4の基質であるSPAK、WNK1及びWNK4とSPAKとが相互作用を促進又は抑制する降圧剤を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、WNK1又はWNK4とSPAKとの相互作用、前記相互作用を阻害または抑制する降圧剤、前記相互作用を用いたスクリーニング方法、などに関する。
【背景技術】
【0002】
高血圧は、安静時の血圧が異常に上昇した状態をいい、本態性高血圧と二次的高血圧に分類される。本態性高血圧は、血圧上昇の原因となる基礎疾患が明らかでない高血圧をいい、高血圧の全体の90〜95%を占める。成人の20%が本態性高血圧であると推測され、治療を行わないで放置すると脳卒中、心筋梗塞など重大な疾患を引き起こす要因になる。そのため、長年、発症機序に関する研究や治療剤(降圧剤)の開発が行われている。なお、二次的高血圧は、他の疾患により二次的に血圧が上昇した病態をいう。
【0003】
本態性高血圧に関して、NaCl(塩)代謝との関連性がよく知られている。NaCl代謝は、主に、腎臓の尿細管に存在するイオンチャネルによって調節されている。イオンチャネルによるNaCl再吸収が過剰になると、腎臓における水分再吸収も過剰になるため、血圧が上昇する。なお、NaCl再吸収に関連するイオンチャネルとして、例えば、NKCC1、NKCC2,NCCなどが知られている。
【0004】
PHA2(偽性アルドステロン症2型)は、高血圧、腎臓における塩再吸収の増大、K+(カリウムイオン)及びH+(水素イオン)の排泄不全、などを特徴とするメンデル遺伝型の疾患である。近年、PHA2(偽性アルドステロン症2型)の原因遺伝子として、WNK1及びWNK4が同定された(非特許文献1参照)。その後の報告では、WNKの機能亢進が、PHA2(高血圧)を引き起こすと推測されている。なお、WNKは本態性高血圧の発症メカニズムにも関与すると推測されているが、具体的な作用機序は現在のところ不明である。
【0005】
WNK1及びWNK4は、ともに腎臓の遠位尿細管と皮質集合管に存在し、WNK1は細胞内に、WNK4はタイトジャンクション(密着結合、細胞間接着装置の一つ)に局在することが報告されている。また、両タンパク質は、NaCl代謝と関連性を有することが報告されている。
【0006】
両タンパク質は、セリン/スレオニンキナーゼのWNKファミリー(WNKタンパク質群)に分類され、リン酸化酵素であることが明らかになっているが、両タンパク質の基質(酵素によって触媒作用を受ける化合物又は分子)は現時点で明らかになっていない。
【0007】
ここで、本発明と関連性があるタンパク質、SPAKについて、以下説明する。
【0008】
SPAK(STE20/SPS1−related Proline− and Alanine−rich Kinase、PASK(Proline−Alanine−rich STE20−related Kinase)と呼ばれる場合もある。)は、STK39(Serine/Threonine protein Kinase 39)のキナーゼ活性領域フラグメントとして同定された、STE20/SPS1キナーゼファミリー(酵母のSTE20やSPS1と高いホモロジーを持つキナーゼファミリー)のタンパク質である(以下、「SPAK」とする)。
【0009】
SPAKに関して、SPAKがNKCC1、NKCC2などのイオンチャネルと結合すること、及び、SPAKのドミナントネガティブ変異タンパク質を過剰発現させるとNKCC1の活性が低下すること、についての報告がある(非特許文献2、非特許文献3参照)。
【非特許文献1】Wilson et al, “Human Hypertension caused by Mutations in WNK Kinases”Science, Vol.293: 1107-1112
【非特許文献2】Piechotta K et al, “Cation chlpride cotransporters interact with thestress-related kinases Ste20-related proline-alanine-rich kinase (SPAK) andoxidative stress response 1 (OSR1)” J Biol Chem. 277(52):50812-9 (2002)
【非特許文献3】Dowd BF et al, “PASK (proline-alanine-rich STE20-related kinase), aregulatory kinase of the Na-K-Cl cotransporter (NKCC1)” J Biol Chem.278(30):27347-53 (2003)
【発明の開示】
【発明が解決しようとする課題】
【0010】
前記の通り、WNKタンパク質の基質は未同定である。従って、PHA2の発症メカニズム、即ち、WNKタンパク質の亢進から高血圧などの病態に至るまでのシグナル伝達経路は未解明のままである。
【0011】
一方、前記の通り、WNKは本態性高血圧の発症メカニズムにも関与すると推測されており、また、WNKタンパク質は、NaCl代謝と関連性を有することが報告されている。従って、両タンパク質の基質を同定し、両タンパク質のシグナル伝達経路を明らかにすることにより、そのシグナル伝達経路を標的とした降圧剤を開発できる可能性がある。
【0012】
そこで、本発明は、WNKタンパク質の基質を同定すること、PHA2の発症機序を明らかにすること、両タンパク質のシグナル伝達経路を標的とする降圧剤を提供すること、を主な目的とする。
【課題を解決するための手段】
【0013】
本発明者は、WNK1及びWNK4とSPAKとが相互作用すること(相互に結合すること)、WNK1及びWNK4がSPAKを基質とし、SPAKをリン酸化する作用を有すること、並びにSPAKがリン酸化されることにより活性化すること、を新規に見出した。
【0014】
そこで、本発明では、まず、SPAKと相互作用するWNK1、SPAKと相互作用するWNK4、WNK1又はWNK4と相互作用するSPAKを提供する。
【0015】
前記相互作用は、PHA2(偽性アルドステロン症2型、以下同じ)における高血圧が、次のようなメカニズムにより惹起されることを強く示唆する。まず、WNKタンパク質の亢進はSPAKのリン酸化を亢進する。次に、過剰にリン酸化されたSPAKは、NKCC1などのイオンチャネルに結合し、NKCC1などイオンチャネルの活性を亢進する。次に、イオンチャネルの活性が亢進することにより、NaCl再吸収が過剰になり、高血圧が惹起される。以上のように、本発明は、NaCl代謝に係わる高血圧発症メカニズムに関し、重要な知見である。
【0016】
次に、本発明では、WNKタンパク質とSPAKとの間の相互作用を阻害又は抑制する降圧剤を提供する。
【0017】
上記の通り、本発明は、WNKタンパク質とSPAKとの間の相互作用の亢進が高血圧を惹起することを強く示唆する。従って、WNKタンパク質とSPAKとの間の相互作用を阻害又は抑制する物質、即ち、WNKタンパク質によるSPAKリン酸化を阻害又は抑制する物質は、単に、PHA2予防剤若しくは治療剤として有効なだけでなく、本態性高血圧を改善する薬剤(降圧剤)としても有効である可能性がある。
【0018】
WNKタンパク質とSPAKとの相互作用を阻害又は抑制する物質として、例えば、
(A)WNKタンパク質に作用する物質(WNKタンパク質の立体構造中のSPAKとの結合部位に対して特異的に結合する物質、WNKタンパク質と結合してWNKタンパク質の立体構造を変化させる物質、WNKタンパク質のリン酸化を阻害又は抑制する物質、抗WNK抗体など)、
(B)SPAKに作用する物質(SPAKの立体構造中のWNKタンパク質との結合部位に対して特異的に結合する物質、SPAKと結合してSPAKの立体構造を変化させる物質、WNKタンパク質によるSPAKのリン酸化を阻害又は抑制する物質、抗SPAK抗体など)、
(C)イオンチャネルに作用する物質(イオンチャネルの立体構造中のSPAKとの結合部位に対して特異的に結合する物質、イオンチャネルと結合してイオンチャネルの立体構造を変化させる物質、SPAKによるイオンチャネルのリン酸化を阻害又は抑制する物質など)、
(D)WNKタンパク質若しくはSPAKの発現を抑制する物質、などが考えられる。
【0019】
続いて、本発明では、WNK1又はWNK4とSPAKとの相互作用を用いた降圧剤のスクリーニング方法を提供する。
【0020】
例えば、標的物質によって、WNKタンパク質とSPAKとの結合が阻害又は抑制された場合、若しくはWNKタンパク質によるSPAKリン酸化が阻害又は抑制された場合、その物質は、降圧剤として有効である可能性がある。
【0021】
以下、本発明に係るタンパク質について、説明する。
【0022】
本発明に係るWNK1は、配列表1のアミノ酸配列を有するタンパク質、若しくはWNK1のアミノ酸配列と相同性を有し、SPAKリン酸化作用を保持するタンパク質である。即ち、例えば、WNK1のスプライシング・バリアント(同一の遺伝子に由来するが、スプライシングにより、配列の一部が異なっているタンパク質、以下同じ)や、前記アミノ酸配列中の一部に、置換、欠損、挿入、付加部分が含まれる場合も、本発明に係るWNK1に包含される。
【0023】
本発明に係るWNK4は、配列表2のアミノ酸配列を有するタンパク質、若しくはWNK4のアミノ酸配列と相同性を有し、SPAKリン酸化作用を保持するタンパク質である。即ち、例えば、WNK4のスプライシング・バリアントや、前記アミノ酸配列中の一部に、置換、欠損、挿入、付加部分が含まれる場合も、本発明に係るWNK4に包含される。
【0024】
本発明に係る「WNKタンパク質」は、WNK1、WNK4、若しくは前記タンパク質のいずれか又は両方とアミノ酸配列と相同性を有し、SPAKリン酸化作用を保持するタンパク質である。即ち、例えば、前記タンパク質のいずれかのスプライシング・バリアントや、前記アミノ酸配列中の一部に、置換、欠損、挿入、付加部分が含まれる場合も、本発明に係るWNKタンパク質に包含される。
【0025】
本発明に係るSPAKは、配列表3のアミノ酸配列を有するタンパク質、若しくはSPAKのアミノ酸配列と相同性を有し、WNKによってリン酸化される領域を保持するタンパク質である。即ち、例えば、前記タンパク質のスプライシング・バリアントや、前記アミノ酸配列中の一部に、置換、欠損、挿入、付加部分が含まれる場合も、本発明に係るSPAKに包含される。
【発明の効果】
【0026】
本発明により、新規な作用機序に基づく降圧剤又はそのスクリーニング方法を提供できる。
【発明を実施するための最良の形態】
【0027】
まず、本発明に係るWNKタンパク質とSPAKとの相互作用について、図1を用いて、以下説明する。
【0028】
上記の通り、WNKタンパク質(符号1)は、SPAK(符号2)と相互作用し(符号A)する。WNKタンパク質(符号1)は、立体構造中に、SPAK(符号2)との結合部位11を有する。一方、SPAK(符号2)も、立体構造中に、WNKタンパク質(符号1)との結合部位21を有する。
【0029】
次に、前記相互作用を阻害又は抑制する物質について、引き続き、図1を用いて説明する。
【0030】
上記の通り、WNKタンパク質とSPAKとの相互作用(符号A)を阻害又は抑制する物質としては、例えば、
(A)WNKタンパク質に作用する物質(WNKタンパク質の立体構造中のSPAKとの結合部位に対して特異的に結合する物質、WNKタンパク質と結合してWNKタンパク質の立体構造を変化させる物質、WNKタンパク質のリン酸化を阻害又は抑制する物質、抗WNK抗体など)、
(B)SPAKに作用する物質(SPAKの立体構造中のWNKタンパク質との結合部位に対して特異的に結合する物質、SPAKと結合してSPAKの立体構造を変化させる物質、WNKタンパク質によるSPAKのリン酸化を阻害又は抑制する物質、抗SPAK抗体など)、
(C)イオンチャネルに作用する物質(イオンチャネルの立体構造中のSPAKとの結合部位に対して特異的に結合する物質、イオンチャネルと結合してイオンチャネルの立体構造を変化させる物質、SPAKによるイオンチャネルのリン酸化を阻害又は抑制する物質など)、
(D)WNKタンパク質若しくはSPAKの発現を抑制する物質、などが考えられる。
【0031】
<(A)WNKタンパク質に作用する物質について>
WNKタンパク質に作用する物質として、例えば、WNKタンパク質の立体構造中のSPAKとの結合部位に対して特異的に結合する物質、WNKタンパク質と結合しWNKタンパク質の立体構造を変化させる物質、WNKタンパク質のリン酸化を阻害又は抑制する物質、抗WNK抗体、などが考えられる。
以下、順に説明する。
【0032】
(1)WNKタンパク質の立体構造中の、SPAKとの結合部位に対して特異的に結合する物質について:
この物質(符号M1)が、WNKタンパク質の立体構造中の、SPAK結合部位11に結合した場合、WNKタンパク質とSPAKとの結合が競合的に阻害される。従って、降圧剤として適用できる可能性がある。
【0033】
なお、物質M1には、SPAKデコイも含まれる。ここで、SPAKデコイとは、SPAK立体構造中のWNKタンパク質結合部位21と類似の構造を有し、SPAKのおとりとして、WNKタンパク質立体構造中のSPAK結合部位11と結合することができる物質をいう。SPAKデコイには、SPAK立体構造中の、WNKタンパク質とSPAKとの結合部位21又はその一部分と同様の立体構造を含むタンパク質又はポリペプチドも含まれる。
【0034】
(2)WNKタンパク質と結合して、前記タンパク質の立体構造を変化させる物質について:
この物質(符M2)が、WNKタンパク質と結合することにより、前記タンパク質の立体構造が変化する場合、WNKタンパク質とSPAKとの結合が阻害又は抑制される。従って、降圧剤として適用できる可能性がある。
【0035】
(3)WNKタンパク質のリン酸化を阻害又は抑制する物質について:
例えば、この物質(図示せず)が、WNKタンパク質のリン酸化部位又はその近傍に結合し、WNKタンパク質のリン酸化を抑制する場合、WNKタンパク質とSPAKとの相互作用が阻害又は抑制される。従って、降圧剤として適用できる可能性がある。
【0036】
このような物質として、例えば、WNKタンパク質のリン酸化部位又はその近傍に特異的に結合する抗WNK抗体又は抗WNKアプタマーなども想定できる。ここで、アプタマーは、抗体代替分子であり、標的分子を特異的に認識するオリゴヌクレオチドである(以下同じ)。
なお、WNKタンパク質のリン酸化部位に特異的に結合する抗WNK抗体には、抗原抗体反応により、該部位と特異的に結合するタンパク質が全て包含される。また、WNKタンパク質のリン酸化部位に特異的に結合する抗WNKアプタマーには、該部位と特異的に結合するオリゴヌクレオチドが全て包含される。
抗体又はアプタマーは、公知の方法により作製できる(以下同じ)。
【0037】
(4)抗WNK抗体について:
抗WNK抗体又は抗WNKアプタマー(符号M3)を用いて、WNKタンパク質の機能を阻害又は抑制することにより、WNKとSPAKとの相互作用を阻害又は抑制できる。従って、降圧剤として適用できる可能性がある。
なお、抗WNK抗体には、抗原抗体反応により、WNKタンパク質又はリン酸化されたWNKタンパク質と特異的に結合するタンパク質が全て包含される。抗WNKアプタマーには、WNKタンパク質又はリン酸化されたWNKタンパク質と特異的に結合するオリゴヌクレオチドが全て包含される。
【0038】
<(B)SPAKに作用する物質について>
SPAKに作用する物質として、例えば、SPAKの立体構造中のWNKタンパク質との結合部位に対して特異的に結合する物質、SPAKと結合してSPAKの立体構造を変化させる物質、WNKタンパク質によるSPAKのリン酸化を阻害又は抑制する物質、抗SPAK抗体、などが考えられる。
以下、順に説明する。
【0039】
(1)SPAKの立体構造中の、WNKタンパク質との結合部位に対して特異的に結合する物質について:
この物質(符号M4)が、SPAKの立体構造中の、WNKタンパク質との結合部位21に対して特異的に結合した場合、WNKタンパク質とSPAKとの結合が競合的に阻害される。従って、降圧剤として適用できる可能性がある。
【0040】
なお、物質M4には、WNKデコイも含まれる。ここで、WNKデコイとは、WNKタンパク質立体構造中のSPAK結合部位11と類似の構造を有し、WNKタンパク質のおとりとして、SPAK立体構造中のWNKタンパク質結合部位21に結合することができる物質をいう。WNKデコイには、WNKタンパク質立体構造中の、WNKタンパク質とSPAKとの結合部位11又はその一部分と同様の立体構造を含むタンパク質又はポリペプチドも含まれる。
【0041】
(2)SPAKと結合して、SPAKの立体構造を変化させる物質について:
この物質(符号M5)がSPAKと結合して、SPAKの立体構造を変化させた場合、SPAKとWNKタンパク質との結合が阻害又は抑制される。従って、降圧剤として適用できる可能性がある。
【0042】
(3)WNK1又はWNK4による、SPAKのリン酸化を阻害又は抑制する物質について:
例えば、この物質(符号M6)がSPAKのリン酸化部位22又はその近傍に結合し、SPAKのリン酸化を阻害又は抑制する場合、SPAKによるイオンチャネルのリン酸化が阻害又は抑制される。従って、降圧剤として適用できる可能性がある。
【0043】
このような物質として、例えば、SPAKのリン酸化部位22に特異的に結合する抗SPAK抗体又は抗SPAKアプタマーなども想定できる。
なお、SPAKのリン酸化部位に特異的に結合する抗SPAK抗体には、抗原抗体反応により、該部位と特異的に結合するタンパク質が全て包含される。また、SPAKのリン酸化部位に特異的に結合する抗SPAKアプタマーには、該部位と特異的に結合するオリゴヌクレオチドが全て包含される。
【0044】
(4)抗SPAK抗体について:
抗SPAK抗体又は抗SPAKアプタマー(符号M7)を用いて、SPAKの機能を阻害又は抑制することにより、WNKとSPAKとの相互作用を阻害又は抑制できる。従って、降圧剤として適用できる可能性がある。
なお、抗SPAK抗体には、抗原抗体反応により、SPAK又はリン酸化されたSPAKと特異的に結合するタンパク質が全て包含される。抗SPAKアプタマーには、SPAK又はリン酸化されたSPAKと特異的に結合するオリゴヌクレオチドが全て包含される。
【0045】
<(C)イオンチャネルに作用する物質について>
イオンチャネル(NKCC1、NKCC2、NCCなど、以下同じ)に作用する物質として、例えば、イオンチャネルの立体構造中のSPAKとの結合部位に対して特異的に結合する物質、イオンチャネルと結合してイオンチャネルの立体構造を変化させる物質、SPAKによるイオンチャネルのリン酸化を阻害又は抑制する物質などが考えられる。
以下、順に説明する。
【0046】
(1)イオンチャネルの立体構造中の、SPAKとの結合部位に対して特異的に結合する物質について:
この物質(図示せず)が、イオンチャネルの立体構造中の、SPAKとの結合部位に対して特異的に結合した場合、SPAKによるイオンチャネルのリン酸化が阻害又は抑制されるため、WNKとSPAKとの相互作用も阻害又は抑制される。従って、降圧剤として適用できる可能性がある。
【0047】
なお、この物質には、SPAKデコイも含まれる。ここで、SPAKデコイとは、SPAK立体構造中のイオンチャネル結合部位と類似の構造を有し、SPAKのおとりとして、イオンチャネル立体構造中のSPAK結合部位に結合することができる物質をいう。SPAKデコイには、SPAK立体構造中の、SPAKとイオンチャネルとの結合部位又はその一部分と同様の立体構造を含むタンパク質又はポリペプチドも含まれる。
【0048】
(2)イオンチャネルと結合して、イオンチャネルの立体構造を変化させる物質について:
この物質(図示せず)が、イオンチャネルの立体構造を変化させた場合、SPAKによるイオンチャネルのリン酸化が阻害又は抑制される。これにより、リン酸化したSPAKが過剰になるため、WNKタンパク質によるSPAKのリン酸化も阻害又は抑制される。従って、降圧剤として適用できる可能性がある。
【0049】
(3)SPAKによるイオンチャンネルのリン酸化を阻害又は抑制する物質について:
この物質(図示せず)が、SPAKによるイオンチャネルのリン酸化を阻害又は抑制した場合、イオンチャネルの活性化が阻害又は抑制される。これにより、リン酸化したSPAKが過剰になるため、WNKタンパク質によるSPAKのリン酸化も阻害又は抑制される。
【0050】
このような物質として、例えば、イオンチャネルのリン酸化部位に特異的に結合する抗イオンチャネル抗体又は抗イオンチャネルアプタマーなども想定できる。
なお、イオンチャネルのリン酸化部位に特異的に結合する抗イオンチャネル抗体には、抗原抗体反応により、該部位と特異的に結合するタンパク質が全て包含される。また、イオンチャネルのリン酸化部位に特異的に結合する抗イオンチャネルアプタマーには、該部位と特異的に結合するオリゴヌクレオチドが全て包含される。
【0051】
<(D)WNKタンパク質若しくはSPAKの発現を抑制する物質について>
この物質(図示せず)が、WNKタンパク質の発現を抑制した場合、WNKタンパク質によるSPAKリン酸化が減少するため、SPAKの活性を低下させることができる。SPAKの発現を抑制した場合も、リン酸化SPAKが減少するため、SPAKの活性を低下させることができる。
【0052】
WNKタンパク質の発現を抑制する物質として、例えば、WNKタンパク質をコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、WNKタンパク質の発現を抑制する二本鎖RNAがある。また、SPAKの発現を抑制する物質として、例えば、SPAKをコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、SPAKの発現を抑制する二本鎖RNAがある。なお、RNA干渉に基づく二本鎖RNAは、公知方法により作製できる。
【0053】
続いて、本発明に係るスクリーニング方法の一例について、以下説明する。
【0054】
WNKタンパク質とSPAKとの相互作用を用いたスクリーニング方法としては、例えば、(1)WNKタンパク質とSPAKが存在する特定の反応領域中に、候補物質を供給した後、相互作用を検出し、候補物質の中から標的物質をスクリーニングする方法、(2)特定の反応領域中に、WNKタンパク質とSPAKと候補物質を供給した後、相互作用を検出し、候補物質の中から標的物質をスクリーニングする方法、などがある。
【0055】
相互作用の検出は、WNKタンパク質とSPAKとの結合を検出することによって行ってもよいし、WNKタンパク質とSPAKリン酸化を検出することによって行ってもよい。相互作用の検出は、既知の方法を用いることができる。WNKタンパク質とSPAKとの結合によって相互作用を検出する場合、例えば、共免疫沈降法などを適用できる。WNKタンパク質とSPAKのリン酸化によって相互作用を検出する場合、例えば、共免疫沈降法、ウエスタンブロットなどを適用できる。
【0056】
本発明に係るスクリーニング方法は、キット化が可能である。その場合、例えば、WNKタンパク質、SPAK、抗WNK抗体、抗SPAK抗体、リン酸化SPAKと特異的に結合する抗体、相互作用検出(共免疫沈降法、ウエスタンブロットなど)に用いる試薬、などを、相互作用検出方法に応じて適宜組み合わせ、キット化する。
【実施例1】
【0057】
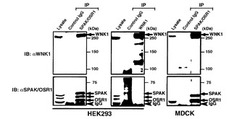
実施例1では、WNK1とSPAKとの相互作用について、実験を行った。
【0058】
本実験は、共免疫沈降法により行った。実験手順の概要は次の通りである。
まず、公知方法により、抗WNK1抗体、及び、抗SPAK/OSR1抗体を作製した。
次に、培養したHEK293細胞又はMDCK細胞(イヌ腎尿細管上皮細胞)を、1%Triton X−100 lysis bufferを用いて溶解し、細胞抽出液を得た。
次に、抗SPAK/OSR1抗体を用いて、細胞抽出液からSPAKの相互作用複合体を、特異的に免疫沈降させた。次に、回収した相互作用複合体についてSDS−PAGE(ドデシル硫酸−ポリアクリルアミドゲル電気泳動、以下同じ)を行った後、抗WNK1抗体を用いて免疫プロットを行い、WNK1を検出した。同様に、細胞抽出液からWNK1の相互作用複合体を、抗WNK1抗体を用いて特異的に免疫沈降させた後、回収した免疫沈降物について抗SPAK/OSR1抗体を用いて免疫プロットを行い、SPAKを検出した。
【0059】
結果を図2に示す。
図中、「HEK293」及び「MDCK」は、用いた培養細胞の種類を示す。
図中、「IP(ImmunoPrecipitation)」は、免疫沈降を行ったことを示し、「ControlIgG」は、コントロールとして、IgG(免疫グロブリン)を用いて免疫沈降を行った後、免疫ブロットを行ったレーンであることを、「SPAK/OSR1」は、抗SPAK/OSR1抗体を用いて免疫沈降を行った後、免疫ブロットを行ったレーンであることを、「WNK1」は、抗WNK1抗体を用いて免疫沈降を行った後、免疫ブロットを行ったレーンであることを、それぞれ示す。なお、「Lysate」は、免疫沈降を行わず、細胞抽出液について、免疫ブロットを行ったレーンであることを示す。
図中、「IB(ImmunoBlot)」は、免疫ブロットを行ったことを示し、「IB:αWNK1」は、免疫沈降、SDS−PAGEの後、抗WNK1抗体を用いて免疫ブロットを行ったことを、「IB:αSPAK/OSR1」は、免疫沈降、SDS−PAGEの後、抗SPAK/OSR1抗体を用いて免疫ブロットを行ったことを、それぞれ示す。
図中、矢印は、各タンパク質のバンドの位置を、各写真の右側に記載された数字は分子量(kD)を、それぞれ示す。
【0060】
図2の左側の免疫ブロット写真では、抗SPAK/OSP1抗体を用いて免疫沈降(IP)を行ったレーンにおいて、WNK1のバンドが検出された(その写真中、IB:αWNK1の部分を参照)。
同様に、図2の右側の免疫ブロット写真(MDCK細胞を用いた場合)でも、抗SPAK/OSP1抗体を用いて免疫沈降(IP)を行ったレーンにおいて、WNK1のバンドが検出された(その写真中、IB:αWNK1の部分を参照)。
即ち、この結果は、HEK293細胞又はMDCK細胞中に存在するタンパク質について、抗SPAK/OSR1抗体を用いて免疫沈降を行うと、その免疫沈降物中に、WNK1が存在することを示す。
【0061】
一方、図2の真ん中の免疫ブロット写真では、抗WNK1抗体を用いて免疫沈降(IP)を行ったレーンにおいて、SPAKのバンドが検出された(その写真中、IB:αSPAK/OSR1の部分を参照)。
即ち、この結果は、HEK293細胞又はMDCK細胞中に存在するタンパク質について、抗WNK1抗体を用いて免疫沈降を行うと、その免疫沈降物中に、SPAKが存在することを示す。
【0062】
従って、以上の結果は、WNK1とSPAKが相互に結合すること、即ち、両タンパク質が相互作用することを強く示唆する。
【実施例2】
【0063】
実施例2では、WNK1及びWNK4とSPAKとの相互作用について、実験を行うとともに、WNKタンパク質の配列における、SPAKとの相互作用部位について、検討を行った。
【0064】
実験手順の概要は次の通りである。
【0065】
まず、SPAK発現プラスミド、OSR1発現プラスミド、及び、WNKタンパク質発現プラスミドを作製した。
SPAK発現プラスミド及びOSR1発現プラスミドは、プラスミドpRK5−T7に、SPAK又はOSR1の配列を組み込んで作製した。なお、pRK5−T7は、挿入した配列にT7−タグを付加させた形で発現させるプラスミドである。
WNK発現プラスミドは、プラスミドpRK5−flagに、WNKの配列を組み込んで作製した。なお、pRK5−flagは、挿入した配列にflag−タグを付加させた形で発現させるプラスミドである。
【0066】
WNK1発現プラスミドとして、次のものを作製した。
(1)WNK1の全長配列を挿入したもの(Wild Type)、
(2)WNK1のアミノ酸配列の1258番目のフェニルアラニンをアラニンに置換した配列を挿入したもの(F1258A)、
(3)WNK1のアミノ酸配列の1869番目のフェニルアラニンをアラニンに置換した配列を挿入したもの(F1869A)、
(4)WNK1のアミノ酸配列の1946番目のフェニルアラニンをアラニンに置換した配列を挿入したもの(F1946A)、
(5)WNK1のアミノ酸配列の1958番目のフェニルアラニンをアラニンに置換した配列を挿入したもの(F1958A)、
(6)WNK1のアミノ酸配列の1258、1869、1946、1958番目の各フェニルアラニンを全てアラニンに置換した配列を挿入したもの(4FA)。
また、WNK4発現プラスミドとして、次のものを作製した。
(1)WNK4の全長配列を挿入したもの(Wild Type)、
(2)WNK4のアミノ酸配列の1017番目のフェニルアラニンをアラニンに置換した配列を挿入したもの(F1017A)。
【0067】
次に、実施例1と同様に、HEK293細胞に、SPAK発現プラスミド又はOSR1発現プラスミドとWNKタンパク質発現プラスミドをトランスフェクトし、両タンパク質を共発現させ、細胞溶解後、免疫沈降を行った。そして、免疫沈降物(相互作用複合体)について、SDS−PAGEを行った後、免疫ブロットを行った。
本実験では、抗Flag抗体を用いてWNKの相互作用複合体を回収した後、抗T7抗体を用いて免疫ブロットを行い、SPAK又はOSR1を検出した。同様に、抗T7抗体を用いてSPAK又はOSR1の相互作用複合体を回収した後、抗Flag抗体を用いて免疫ブロットを行い、WNKタンパク質を検出した。
【0068】
結果を図3に示す。
【0069】
図3Aは、WNK1及びWNK4のアミノ酸配列モチーフを模式的に記載した図である。
図3AのWNK1の配列中、左から、「RFIV」は1258番目のフェニルアラニン(F)及びその近傍のアミノ酸配列を、「RFQV」は1869番目のフェニルアラニン(F)及びその近傍のアミノ酸配列を、同じく「RFQV」は1946番目のフェニルアラニン(F)及びその近傍のアミノ酸配列を、「RFSV」は1958番目のフェニルアラニン(F)及びその近傍のアミノ酸配列を、それぞれ示す。なお、「2382aa」は、WNK1のアミノ酸配列の全長が2382個であることを示す。
同様に、図3AのWNK4の配列中、「RFQV」は1017番目のフェニルアラニン(F)及びその近傍のアミノ酸配列を示す。なお、「1243aa」は、WNK4のアミノ酸配列の全長が1243個であることを示す。
【0070】
図3Bは、実験結果を示す免疫ブロット写真である。
図3B中、左側の6つの写真は、WNKタンパク質とSPAKとを共発現させた場合の免疫ブロット写真であり、右側の6つの写真は、WNKタンパク質とOSR1とを共発現させた場合の免疫ブロット写真である。
図中、「Flag−hWNK」の項目は、HEK293細胞において、Flagタグで標識したヒトWNKタンパク質を発現させたかどうかを示し、「−」は発現させていないことを、その他は、それぞれ記載されたWNKタンパク質又はその変異タンパク質を発現させたことを示す。
「T7−rSPAK」の項目は、HEK293細胞において、T7タグで標識したラットSPAKを発現させたかどうかを示し、「−」は発現させていないことを、「+」は発現させたことを示す。
図中、「Total」は、免疫沈降を行わず、細胞抽出液についてそのまま免疫ブロットを行った結果であることを、「IP:αFlag」は、抗Flag抗体を用いて免疫沈降を行い、WNKタンパク質の相互作用複合体を回収した場合の結果であることを、「IP:αT7」は、抗T7抗体を用いて免疫沈降を行い、SPAK又はOSR1の相互作用複合体を回収した場合の結果であることを、それぞれ示す。
「IB:αFlag」は、免疫沈降物を回収した後、抗Flag抗体で免疫ブロットを行い、免疫沈降物中のWNKタンパク質を検出した結果であることを、「IB:αT7」は、免疫沈降物を回収した後、抗T7抗体で免疫ブロットを行い、免疫沈降物中のSPAK又はOSR1を検出した結果であることを、それぞれ示す。
【0071】
図3Bの左側の免疫ブロット写真では、WNK1を発現させたレーン(左から3番目)及びWNK4を発現させたレーン(右から2番目)において、抗Flag抗体を用いて免疫沈降(IP)を行った後、抗T7抗体を用いて免疫ブロット(IB)を行った場合、SPAKのバンドが検出された(上から4段目、左から3番目のバンド、及び、上から4段目、右から2番目のバンドを参照)。
即ち、この結果は、抗Flag抗体を用いて免疫沈降を行い、WNKタンパク質の相互作用複合体を回収すると、その免疫沈降物中にSPAKが存在することを示す。
【0072】
同様に、WNK1を発現させたレーン(左から3番目)及びWNK4を発現させたレーン(右から2番目)において、抗T7抗体を用いて免疫沈降(IP)を行った後、抗Flag抗体を用いて免疫ブロット(IB)を行った場合、WNKタンパク質のバンドが検出された(上から5段目、左から3番目のバンド、及び、上から5段目、右から2番目のバンドを参照)。
即ち、この結果は、抗T7抗体を用いて免疫沈降を行い、SPAKの相互作用複合体を回収すると、その免疫沈降物中にWNKタンパク質が存在することを示す。
【0073】
従って、以上の結果は、実施例1と同様、WNK1とSPAKが相互に結合すること、即ち、両タンパク質が相互作用することを強く示唆する。
【0074】
また、WNKタンパク質の変異タンパク質を発現させ(左から4番目から9番目のレーン、及び、一番右側のレーン)、抗Flag抗体を用いて免疫沈降(IP)を行った後、抗T7抗体を用いて免疫ブロット(IB)を行った場合、SPAKのバンドが減弱した(上から4段目の免疫ブロット写真を参照)。
同様に、WNKタンパク質の変異タンパク質を発現させ(左から4番目から9番目のレーン、及び、一番右側のレーン)、抗T7抗体を用いて免疫沈降(IP)を行った後、抗Flag抗体を用いて免疫ブロット(IB)を行った場合、WNKタンパク質のバンドが減弱した。
【0075】
このことは、WNK1のアミノ酸配列中、1258番目、1869番目、1946番目、1958番目のフェニルアラニンの部分、並びにWNK4のアミノ酸配列中、1017番目のフェニルアラニンの部分が、WNKタンパク質とSPAKとの相互作用に関与していることを示唆する。
【0076】
なお、この新知見(WNKタンパク質とSPAKとの相互作用部位に関する示唆)は、例えば、WNKデコイを作製する上で重要な知見である。即ち、この知見に基づいて、WNKデコイ(例えば、WNKタンパク質立体構造中の、WNKタンパク質とSPAKとの結合部位又はその一部分と同様の立体構造を含むタンパク質又はポリペプチド)を作製した場合、その物質は、降圧剤として適用できる可能性が高い。
【0077】
その他、図3Bの右側の免疫ブロット写真が示す通り、WNKタンパク質とOSR1を共発現させた場合も、WNKタンパク質とSPAKを共発現させた場合とほぼ同様の結果が得られた。
【実施例3】
【0078】
実施例3では、WNK1が実際にSPAKをリン酸化しているかどうかを調べた。
【0079】
WNK1にキナーゼ活性(SPAKリン酸化作用)がある場合、WNK1はATPのリン酸基をSPAKに移動させ、SPAKをリン酸化すると予想される。
【0080】
そこで、まず、WNK1にSPAKとγ−32P−ATPを加え、30℃、30分間、インキュベートした後、SDSを添加して酵素反応を止め、SDS−PAGEを行った。そして、オートラジオグラフィー及びイメージ解析(BAS2500)により、γ−32Pを検出し、放射性リン酸基がSPAKへ移動したかどうかを調べた。
【0081】
結果を図4に示す。
【0082】
図4は、実験結果を示すオートラジオグラフである。
図中、上側の写真(「32P」と記載された写真)は、オートラジオグラフである。下側の写真(「CBB」と記載された写真)は、同じものをCBB(Coomasie Brilliant Blue)染色した写真である。
図中、「GST−WNK1(1−666)」は、用いたWNK1を示す。「−」のレーンは、WNK1を添加しなかった場合の結果を、「Wild type」のレーンは、WNK1を用いた場合の結果を、「WNK1(K233M)」のレーンは、WNK1のアミノ酸配列の233番目のリシン残基をメチオニンに置換した変異タンパク質を用いた場合の結果を、「WNK1(D368A)」のレーンは、WNK1のアミノ酸配列の368番目のアスパラギン酸残基をアラニンに置換した変異タンパク質を用いた場合の結果を、「WNK1(S382A)」のレーンは、WNK1のアミノ酸配列の382番目のセリン残基をアラニンに置換した変異タンパク質を用いた場合の結果を、それぞれ示す。なお、WNK1のアミノ酸配列の233番目、368番目、382番目の残基は、それぞれ、キナーゼ活性部位として、既知の配列である。
「GST−WNK1(1−665)」はWNK1のバンドの位置を、「GST−SPAK(KM)」はSPAKのバンドの位置を、それぞれ示す。なお、「GST−」はGSTタグで標識した変異タンパク質であることを、「(KM)」はキナーゼ活性を失った変異タンパク質であることを、それぞれ示す。
【0083】
図4では、「Wild Type」のレーンでは、SPAKの位置に32Pのバンドが検出された(オートラジオグラフ中、下側のバンド)。また、WNK1の変異タンパク質を用いた場合、SPAKの位置に32Pのバンドは検出されなかった。
上述の通り、WNK1にキナーゼ活性がある場合、WNK1はATPのリン酸基をSPAKに移動させると推測される。また、上述の通り、WNK1のアミノ酸配列のうち、本実験で変異させた部分は、キナーゼ活性部位であることが既知である。
従って、以上の結果は、WNK1がSPAKをリン酸化することを示唆する。
【実施例4】
【0084】
実施例4では、SPAKの配列中の、WNKタンパク質によってリン酸化される部位について、検討した。
【0085】
実験手順の概要は次の通りである。
まず、SPAK又はOSR1のアミノ酸配列の一部を置換した変異タンパク質を作製した。次に、実施例3と同様に、WNKタンパク質に、その変異SPAK又は変異OSR1とγ−32P−ATPを加え、インキュベートし、SDSを添加して酵素反応を止めた後、SDS−PAGEを行った。そして、オートラジオグラフィー及びイメージ解析(BAS2500)により、γ−32Pを検出し、放射性リン酸基が変異SPAKへ移動するかどうかを調べた。
【0086】
結果を図5に示す。
【0087】
図5Aは、SPAKのアミノ酸配列のうち、WNK1によるリン酸化部位を模式的に示す図である。
「rSPAK」はラットのSPAKのアミノ酸配列であることを、「mOSR1」はマウスのOSR1のアミノ酸配列であることを、「Fray」はハエにおけるファミリータンパク質のアミノ酸配列であることを、それぞれ示す。
「WNK1 phosphorylation site」は、WNK1によるリン酸化部位であることを示す(詳細は後述する)。
SPAKのアミノ酸配列の380番目のセリン、及び、OSR1のアミノ酸配列の325番目のセリンは、その近傍の配列も含め、高度に保存されている。
【0088】
図5Bは、実施例4の実験結果を示すオートラジオグラフである。
図中、左側の二つの写真は「WNK1」を用いた場合の写真、右側の二つの写真は「WNK4」を用いた場合の写真、である。
また、上側の2つの写真(「32P」と記載された写真)は、それぞれ、オートラジオグラフ、下側の2つの写真(「CBB」と記載された写真)は、同じものをCBB(Coomasie Brilliant Blue)染色した写真である。
「rSPAK(KM)」は、キナーゼ活性を失活させたラットSPAKを用いたことを、「rSPAK(KM/S380A)」は、キナーゼ活性を失活させかつアミノ酸配列の380番目のセリン残基をアラニンに置換した変異タンパク質を用いたことを、それぞれ示す。また、「mOSR1(KM)」は、キナーゼ活性を失活させたマウスOSR1を用いたことを、「mOSR1(KM/S325A)」は、キナーゼ活性を失活させかつアミノ酸配列の325番目のセリン残基をアラニンに置換した変異タンパク質を用いたことを、それぞれ示す。
【0089】
図5Bでは、WNKタンパク質とrSPAK(KM)とを放射性リン酸基の存在下でインキュベートした場合、32Pのバンドが検出されたのに対し(上側の2つの写真中、それぞれ、一番左側のレーンを参照)、WNKタンパク質とrSPAK(KM/S380A)とを放射性リン酸基の存在下でインキュベートした場合、32Pのバンドが検出されなかった(上側の2つの写真中、それぞれ、左から2番目のレーンを参照)。
また、WNKタンパク質とOSR1とを放射性リン酸基の存在下でインキュベートした場合も、同様の結果であった。
【0090】
従って、以上の結果は、SPAKのアミノ酸配列の380番目のセリン残基、及び、OSR1のアミノ酸配列の325番目のセリン残基が、WNKタンパク質によるSPAK又はOSR1のリン酸化に、深く関与することを示唆する。
【0091】
なお、この新知見(リン酸化部位に関する示唆)は、SPAKのリン酸化部位又はその近傍に特異的に結合する抗SPAK抗体又は抗SPAKアプタマー、該部位又はその近傍に特異的に結合するその他の化合物、などを作製する上で重要な知見である。即ち、この新知見に基づいて、それらの物質の設計・作製を行った場合、それらの物質は、降圧剤として適用できる可能性が高い。
【実施例5】
【0092】
実施例5では、SPAK及びOSR1が、イオンチャネルを活性化するかどうかについて、検討した。
【0093】
イオンチャネルとして知られているNKCC1、NKCC2、NCCなどは、アミノ酸配列中のスレオニン残基のリン酸化により、活性化することが知られている。そこで、本実験では、SPAK及びOSR1が、イオンチャネルをリン酸化するかどうかについて、調べた。
【0094】
実験手順の概要は実施例3又は実施例4とほぼ同様である。即ち、SPAK又はOSR1に、イオンチャネル(NKCC1、NKCC2、NCC)とγ−32P−ATPを加え、インキュベートし、SDSを添加して酵素反応を止めた後、SDS−PAGEを行い、そして、オートラジオグラフィー及びイメージ解析(BAS2500)により、γ−32Pを検出し、放射性リン酸基がイオンチャネルへ移動するかどうかを調べた。
【0095】
結果を図6に示す。
【0096】
図6Aは、イオンチャネルのアミノ酸配列のうち、リン酸化されるスレオニン残基の位置を示す図である。それぞれ、「NKCC1(shark)」には、サメのNKCC1のアミノ酸配列が、「NKCC1(human)」には、ヒトのNKCC1のアミノ酸配列が、「NKCC2(human)」には、ヒトのNKCC2のアミノ酸配列が、「NCC(human)」には、ヒトのNCCのアミノ酸配列が、「NCC(mouse)」には、マウスのNCCのアミノ酸配列の一部が、それぞれ記載されている。
図6Aに示す通り、リン酸化されるスレオニン残基は、イオンチャネルの種類、動物種を超えて、高度に保存されている。
【0097】
図6Bは、SPAK又はOSR1と、各イオンチャネルを用いた場合のオートラジオグラフである。
図中、左側の二つの写真は「rSPAK(ラットSPAK)」を用いた場合の写真、右側の二つの写真は「mOSR1(マウスOSR1)」を用いた場合の写真、である。
また、上側の2つの写真(「32P」と記載された写真)は、それぞれ、オートラジオグラフ、下側の2つの写真(「CBB」と記載された写真)は、同じものをCBB(Coomasie Brilliant Blue)染色した写真である。
「GST−PAK3(65−135)」は、GSTタグで標識したPAK3(アミノ酸配列の65番目から135番目までの断片)を用いたことを、「GST−hNKCC2(1−181)」は、GSTタグで標識したヒトNKCC2(アミノ酸配列の1番目から181番目までの断片)を用いたことを、「GST−hNKCC1(1−289)」は、GSTタグで標識したヒトNKCC1(アミノ酸配列の1番目から289番目までの断片)を用いたことを、「GST−mNCC(1−138)」は、GSTタグで標識したマウスNCC(アミノ酸配列の1番目から138番目までの断片)を用いたことを、それぞれ示す。なお、PAK3は、SPAK及びOSR1の基質として公知のタンパク質であり、ポジティブコントロールである。
図中のアスタリスク(「*」)は、基質のバンドの位置を表す。
【0098】
図6Cは、NCCのスレオニン残基を置換した変異タンパク質を用いた場合のオートラジオグラフである。
図中、上側の写真(「32P」と記載された写真)は、オートラジオグラフ、下側の写真(「CBB」と記載された写真)は、同じものをCBB(Coomasie Brilliant Blue)染色した写真である。
「GST−mNCC(1−138)」は、GSTタグで標識したマウスNCC(アミノ酸配列の1番目から138番目までの断片)を用いたことを示し、「Wild type」は、そのNCCをそのまま用いたことを、「T53A」はそのNCCのアミノ酸配列中、53番目のスレオニン残基をアラニンに置換した変異タンパク質を用いたことを、「T58A」は同じく58番目のスレオニン残基をアラニンに置換した変異タンパク質を用いたことを、「S71A」は同じく71番目のセリン残基をアラニンに置換した変異タンパク質を用いたことを、「T53A/T58A/S71A」は前記の全ての部位を置換した変異タンパク質を用いたことを、それぞれ示す。
【0099】
図6Bでは、SPAK又はOSR1と各イオンチャネルとを放射性リン酸基の存在下でインキュベートした場合、32Pのバンドが検出された(アスタリスクが付された部分を参照)。このことは、SPAK及びOSR1がイオンチャネルをリン酸化すること、即ち、両タンパク質がイオンチャネルを活性化することを強く示唆する。
【0100】
図6Cでは、NCCのリン酸化部位のアミノ酸残基を置換することにより、32Pのバンドがやや減弱した(上側の写真の左から2〜4番目のバンドを参照)。そして、NCCのリン酸化部位のアミノ酸残基を3箇所全て置換することにより、32Pのバンドがより減弱した(上側の写真の一番右側のバンドを参照)。このことは、SPAK及びOSR1が、イオンチャネルのリン酸化部位に作用していることを示唆する。
【0101】
なお、この新知見(リン酸化部位に関する示唆)は、イオンチャネルのリン酸化部位に特異的に結合する抗イオンチャネル抗体又は抗イオンチャネルアプタマー、該部位又はその近傍に特異的に結合するその他の化合物、などを作製する上で重要な知見である。即ち、この新知見に基づいて、それらの物質を設計・作製した場合、それらの物質は、降圧剤として適用できる可能性が高い。
【産業上の利用可能性】
【0102】
本発明に係るタンパク質及び物質は、降圧剤に適用可能である。また、本発明に係る相互作用は、生体内における重要なシグナル伝達経路を新規に見出したものであり、降圧剤のスクリーニングにも適用可能である。
【0103】
本発明に係るスクリーニング方法は、例えば、用いるタンパク質、試薬などをセットにすることにより、降圧剤スクリーニングキットとして、適用できる。
【図面の簡単な説明】
【0104】
【図1】WNKタンパク質とSPAKとの相互作用を示す模式図。
【図2】実施例1の実験結果を示す免疫ブロット写真。
【図3A】WNK1及びWNK4のアミノ酸配列モチーフを模式的に記載した図。
【図3B】実施例2の実験結果を示す免疫ブロット写真。
【図4】実施例3の実験結果を示すオートラジオグラフ。
【図5A】SPAKのアミノ酸配列のうち、WNK1によるリン酸化部位を模式的に示す図。
【図5B】実施例4の実験結果を示すオートラジオグラフ。
【図6A】イオンチャネルのアミノ酸配列のうち、リン酸化されるスレオニン残基の位置を示す図。
【図6B】SPAK又はOSR1と、各イオンチャネルを用いた場合のオートラジオグラフ。
【図6C】NCCのスレオニン残基を置換した変異タンパク質を用いた場合のオートラジオグラフ。
【技術分野】
【0001】
本発明は、WNK1又はWNK4とSPAKとの相互作用、前記相互作用を阻害または抑制する降圧剤、前記相互作用を用いたスクリーニング方法、などに関する。
【背景技術】
【0002】
高血圧は、安静時の血圧が異常に上昇した状態をいい、本態性高血圧と二次的高血圧に分類される。本態性高血圧は、血圧上昇の原因となる基礎疾患が明らかでない高血圧をいい、高血圧の全体の90〜95%を占める。成人の20%が本態性高血圧であると推測され、治療を行わないで放置すると脳卒中、心筋梗塞など重大な疾患を引き起こす要因になる。そのため、長年、発症機序に関する研究や治療剤(降圧剤)の開発が行われている。なお、二次的高血圧は、他の疾患により二次的に血圧が上昇した病態をいう。
【0003】
本態性高血圧に関して、NaCl(塩)代謝との関連性がよく知られている。NaCl代謝は、主に、腎臓の尿細管に存在するイオンチャネルによって調節されている。イオンチャネルによるNaCl再吸収が過剰になると、腎臓における水分再吸収も過剰になるため、血圧が上昇する。なお、NaCl再吸収に関連するイオンチャネルとして、例えば、NKCC1、NKCC2,NCCなどが知られている。
【0004】
PHA2(偽性アルドステロン症2型)は、高血圧、腎臓における塩再吸収の増大、K+(カリウムイオン)及びH+(水素イオン)の排泄不全、などを特徴とするメンデル遺伝型の疾患である。近年、PHA2(偽性アルドステロン症2型)の原因遺伝子として、WNK1及びWNK4が同定された(非特許文献1参照)。その後の報告では、WNKの機能亢進が、PHA2(高血圧)を引き起こすと推測されている。なお、WNKは本態性高血圧の発症メカニズムにも関与すると推測されているが、具体的な作用機序は現在のところ不明である。
【0005】
WNK1及びWNK4は、ともに腎臓の遠位尿細管と皮質集合管に存在し、WNK1は細胞内に、WNK4はタイトジャンクション(密着結合、細胞間接着装置の一つ)に局在することが報告されている。また、両タンパク質は、NaCl代謝と関連性を有することが報告されている。
【0006】
両タンパク質は、セリン/スレオニンキナーゼのWNKファミリー(WNKタンパク質群)に分類され、リン酸化酵素であることが明らかになっているが、両タンパク質の基質(酵素によって触媒作用を受ける化合物又は分子)は現時点で明らかになっていない。
【0007】
ここで、本発明と関連性があるタンパク質、SPAKについて、以下説明する。
【0008】
SPAK(STE20/SPS1−related Proline− and Alanine−rich Kinase、PASK(Proline−Alanine−rich STE20−related Kinase)と呼ばれる場合もある。)は、STK39(Serine/Threonine protein Kinase 39)のキナーゼ活性領域フラグメントとして同定された、STE20/SPS1キナーゼファミリー(酵母のSTE20やSPS1と高いホモロジーを持つキナーゼファミリー)のタンパク質である(以下、「SPAK」とする)。
【0009】
SPAKに関して、SPAKがNKCC1、NKCC2などのイオンチャネルと結合すること、及び、SPAKのドミナントネガティブ変異タンパク質を過剰発現させるとNKCC1の活性が低下すること、についての報告がある(非特許文献2、非特許文献3参照)。
【非特許文献1】Wilson et al, “Human Hypertension caused by Mutations in WNK Kinases”Science, Vol.293: 1107-1112
【非特許文献2】Piechotta K et al, “Cation chlpride cotransporters interact with thestress-related kinases Ste20-related proline-alanine-rich kinase (SPAK) andoxidative stress response 1 (OSR1)” J Biol Chem. 277(52):50812-9 (2002)
【非特許文献3】Dowd BF et al, “PASK (proline-alanine-rich STE20-related kinase), aregulatory kinase of the Na-K-Cl cotransporter (NKCC1)” J Biol Chem.278(30):27347-53 (2003)
【発明の開示】
【発明が解決しようとする課題】
【0010】
前記の通り、WNKタンパク質の基質は未同定である。従って、PHA2の発症メカニズム、即ち、WNKタンパク質の亢進から高血圧などの病態に至るまでのシグナル伝達経路は未解明のままである。
【0011】
一方、前記の通り、WNKは本態性高血圧の発症メカニズムにも関与すると推測されており、また、WNKタンパク質は、NaCl代謝と関連性を有することが報告されている。従って、両タンパク質の基質を同定し、両タンパク質のシグナル伝達経路を明らかにすることにより、そのシグナル伝達経路を標的とした降圧剤を開発できる可能性がある。
【0012】
そこで、本発明は、WNKタンパク質の基質を同定すること、PHA2の発症機序を明らかにすること、両タンパク質のシグナル伝達経路を標的とする降圧剤を提供すること、を主な目的とする。
【課題を解決するための手段】
【0013】
本発明者は、WNK1及びWNK4とSPAKとが相互作用すること(相互に結合すること)、WNK1及びWNK4がSPAKを基質とし、SPAKをリン酸化する作用を有すること、並びにSPAKがリン酸化されることにより活性化すること、を新規に見出した。
【0014】
そこで、本発明では、まず、SPAKと相互作用するWNK1、SPAKと相互作用するWNK4、WNK1又はWNK4と相互作用するSPAKを提供する。
【0015】
前記相互作用は、PHA2(偽性アルドステロン症2型、以下同じ)における高血圧が、次のようなメカニズムにより惹起されることを強く示唆する。まず、WNKタンパク質の亢進はSPAKのリン酸化を亢進する。次に、過剰にリン酸化されたSPAKは、NKCC1などのイオンチャネルに結合し、NKCC1などイオンチャネルの活性を亢進する。次に、イオンチャネルの活性が亢進することにより、NaCl再吸収が過剰になり、高血圧が惹起される。以上のように、本発明は、NaCl代謝に係わる高血圧発症メカニズムに関し、重要な知見である。
【0016】
次に、本発明では、WNKタンパク質とSPAKとの間の相互作用を阻害又は抑制する降圧剤を提供する。
【0017】
上記の通り、本発明は、WNKタンパク質とSPAKとの間の相互作用の亢進が高血圧を惹起することを強く示唆する。従って、WNKタンパク質とSPAKとの間の相互作用を阻害又は抑制する物質、即ち、WNKタンパク質によるSPAKリン酸化を阻害又は抑制する物質は、単に、PHA2予防剤若しくは治療剤として有効なだけでなく、本態性高血圧を改善する薬剤(降圧剤)としても有効である可能性がある。
【0018】
WNKタンパク質とSPAKとの相互作用を阻害又は抑制する物質として、例えば、
(A)WNKタンパク質に作用する物質(WNKタンパク質の立体構造中のSPAKとの結合部位に対して特異的に結合する物質、WNKタンパク質と結合してWNKタンパク質の立体構造を変化させる物質、WNKタンパク質のリン酸化を阻害又は抑制する物質、抗WNK抗体など)、
(B)SPAKに作用する物質(SPAKの立体構造中のWNKタンパク質との結合部位に対して特異的に結合する物質、SPAKと結合してSPAKの立体構造を変化させる物質、WNKタンパク質によるSPAKのリン酸化を阻害又は抑制する物質、抗SPAK抗体など)、
(C)イオンチャネルに作用する物質(イオンチャネルの立体構造中のSPAKとの結合部位に対して特異的に結合する物質、イオンチャネルと結合してイオンチャネルの立体構造を変化させる物質、SPAKによるイオンチャネルのリン酸化を阻害又は抑制する物質など)、
(D)WNKタンパク質若しくはSPAKの発現を抑制する物質、などが考えられる。
【0019】
続いて、本発明では、WNK1又はWNK4とSPAKとの相互作用を用いた降圧剤のスクリーニング方法を提供する。
【0020】
例えば、標的物質によって、WNKタンパク質とSPAKとの結合が阻害又は抑制された場合、若しくはWNKタンパク質によるSPAKリン酸化が阻害又は抑制された場合、その物質は、降圧剤として有効である可能性がある。
【0021】
以下、本発明に係るタンパク質について、説明する。
【0022】
本発明に係るWNK1は、配列表1のアミノ酸配列を有するタンパク質、若しくはWNK1のアミノ酸配列と相同性を有し、SPAKリン酸化作用を保持するタンパク質である。即ち、例えば、WNK1のスプライシング・バリアント(同一の遺伝子に由来するが、スプライシングにより、配列の一部が異なっているタンパク質、以下同じ)や、前記アミノ酸配列中の一部に、置換、欠損、挿入、付加部分が含まれる場合も、本発明に係るWNK1に包含される。
【0023】
本発明に係るWNK4は、配列表2のアミノ酸配列を有するタンパク質、若しくはWNK4のアミノ酸配列と相同性を有し、SPAKリン酸化作用を保持するタンパク質である。即ち、例えば、WNK4のスプライシング・バリアントや、前記アミノ酸配列中の一部に、置換、欠損、挿入、付加部分が含まれる場合も、本発明に係るWNK4に包含される。
【0024】
本発明に係る「WNKタンパク質」は、WNK1、WNK4、若しくは前記タンパク質のいずれか又は両方とアミノ酸配列と相同性を有し、SPAKリン酸化作用を保持するタンパク質である。即ち、例えば、前記タンパク質のいずれかのスプライシング・バリアントや、前記アミノ酸配列中の一部に、置換、欠損、挿入、付加部分が含まれる場合も、本発明に係るWNKタンパク質に包含される。
【0025】
本発明に係るSPAKは、配列表3のアミノ酸配列を有するタンパク質、若しくはSPAKのアミノ酸配列と相同性を有し、WNKによってリン酸化される領域を保持するタンパク質である。即ち、例えば、前記タンパク質のスプライシング・バリアントや、前記アミノ酸配列中の一部に、置換、欠損、挿入、付加部分が含まれる場合も、本発明に係るSPAKに包含される。
【発明の効果】
【0026】
本発明により、新規な作用機序に基づく降圧剤又はそのスクリーニング方法を提供できる。
【発明を実施するための最良の形態】
【0027】
まず、本発明に係るWNKタンパク質とSPAKとの相互作用について、図1を用いて、以下説明する。
【0028】
上記の通り、WNKタンパク質(符号1)は、SPAK(符号2)と相互作用し(符号A)する。WNKタンパク質(符号1)は、立体構造中に、SPAK(符号2)との結合部位11を有する。一方、SPAK(符号2)も、立体構造中に、WNKタンパク質(符号1)との結合部位21を有する。
【0029】
次に、前記相互作用を阻害又は抑制する物質について、引き続き、図1を用いて説明する。
【0030】
上記の通り、WNKタンパク質とSPAKとの相互作用(符号A)を阻害又は抑制する物質としては、例えば、
(A)WNKタンパク質に作用する物質(WNKタンパク質の立体構造中のSPAKとの結合部位に対して特異的に結合する物質、WNKタンパク質と結合してWNKタンパク質の立体構造を変化させる物質、WNKタンパク質のリン酸化を阻害又は抑制する物質、抗WNK抗体など)、
(B)SPAKに作用する物質(SPAKの立体構造中のWNKタンパク質との結合部位に対して特異的に結合する物質、SPAKと結合してSPAKの立体構造を変化させる物質、WNKタンパク質によるSPAKのリン酸化を阻害又は抑制する物質、抗SPAK抗体など)、
(C)イオンチャネルに作用する物質(イオンチャネルの立体構造中のSPAKとの結合部位に対して特異的に結合する物質、イオンチャネルと結合してイオンチャネルの立体構造を変化させる物質、SPAKによるイオンチャネルのリン酸化を阻害又は抑制する物質など)、
(D)WNKタンパク質若しくはSPAKの発現を抑制する物質、などが考えられる。
【0031】
<(A)WNKタンパク質に作用する物質について>
WNKタンパク質に作用する物質として、例えば、WNKタンパク質の立体構造中のSPAKとの結合部位に対して特異的に結合する物質、WNKタンパク質と結合しWNKタンパク質の立体構造を変化させる物質、WNKタンパク質のリン酸化を阻害又は抑制する物質、抗WNK抗体、などが考えられる。
以下、順に説明する。
【0032】
(1)WNKタンパク質の立体構造中の、SPAKとの結合部位に対して特異的に結合する物質について:
この物質(符号M1)が、WNKタンパク質の立体構造中の、SPAK結合部位11に結合した場合、WNKタンパク質とSPAKとの結合が競合的に阻害される。従って、降圧剤として適用できる可能性がある。
【0033】
なお、物質M1には、SPAKデコイも含まれる。ここで、SPAKデコイとは、SPAK立体構造中のWNKタンパク質結合部位21と類似の構造を有し、SPAKのおとりとして、WNKタンパク質立体構造中のSPAK結合部位11と結合することができる物質をいう。SPAKデコイには、SPAK立体構造中の、WNKタンパク質とSPAKとの結合部位21又はその一部分と同様の立体構造を含むタンパク質又はポリペプチドも含まれる。
【0034】
(2)WNKタンパク質と結合して、前記タンパク質の立体構造を変化させる物質について:
この物質(符M2)が、WNKタンパク質と結合することにより、前記タンパク質の立体構造が変化する場合、WNKタンパク質とSPAKとの結合が阻害又は抑制される。従って、降圧剤として適用できる可能性がある。
【0035】
(3)WNKタンパク質のリン酸化を阻害又は抑制する物質について:
例えば、この物質(図示せず)が、WNKタンパク質のリン酸化部位又はその近傍に結合し、WNKタンパク質のリン酸化を抑制する場合、WNKタンパク質とSPAKとの相互作用が阻害又は抑制される。従って、降圧剤として適用できる可能性がある。
【0036】
このような物質として、例えば、WNKタンパク質のリン酸化部位又はその近傍に特異的に結合する抗WNK抗体又は抗WNKアプタマーなども想定できる。ここで、アプタマーは、抗体代替分子であり、標的分子を特異的に認識するオリゴヌクレオチドである(以下同じ)。
なお、WNKタンパク質のリン酸化部位に特異的に結合する抗WNK抗体には、抗原抗体反応により、該部位と特異的に結合するタンパク質が全て包含される。また、WNKタンパク質のリン酸化部位に特異的に結合する抗WNKアプタマーには、該部位と特異的に結合するオリゴヌクレオチドが全て包含される。
抗体又はアプタマーは、公知の方法により作製できる(以下同じ)。
【0037】
(4)抗WNK抗体について:
抗WNK抗体又は抗WNKアプタマー(符号M3)を用いて、WNKタンパク質の機能を阻害又は抑制することにより、WNKとSPAKとの相互作用を阻害又は抑制できる。従って、降圧剤として適用できる可能性がある。
なお、抗WNK抗体には、抗原抗体反応により、WNKタンパク質又はリン酸化されたWNKタンパク質と特異的に結合するタンパク質が全て包含される。抗WNKアプタマーには、WNKタンパク質又はリン酸化されたWNKタンパク質と特異的に結合するオリゴヌクレオチドが全て包含される。
【0038】
<(B)SPAKに作用する物質について>
SPAKに作用する物質として、例えば、SPAKの立体構造中のWNKタンパク質との結合部位に対して特異的に結合する物質、SPAKと結合してSPAKの立体構造を変化させる物質、WNKタンパク質によるSPAKのリン酸化を阻害又は抑制する物質、抗SPAK抗体、などが考えられる。
以下、順に説明する。
【0039】
(1)SPAKの立体構造中の、WNKタンパク質との結合部位に対して特異的に結合する物質について:
この物質(符号M4)が、SPAKの立体構造中の、WNKタンパク質との結合部位21に対して特異的に結合した場合、WNKタンパク質とSPAKとの結合が競合的に阻害される。従って、降圧剤として適用できる可能性がある。
【0040】
なお、物質M4には、WNKデコイも含まれる。ここで、WNKデコイとは、WNKタンパク質立体構造中のSPAK結合部位11と類似の構造を有し、WNKタンパク質のおとりとして、SPAK立体構造中のWNKタンパク質結合部位21に結合することができる物質をいう。WNKデコイには、WNKタンパク質立体構造中の、WNKタンパク質とSPAKとの結合部位11又はその一部分と同様の立体構造を含むタンパク質又はポリペプチドも含まれる。
【0041】
(2)SPAKと結合して、SPAKの立体構造を変化させる物質について:
この物質(符号M5)がSPAKと結合して、SPAKの立体構造を変化させた場合、SPAKとWNKタンパク質との結合が阻害又は抑制される。従って、降圧剤として適用できる可能性がある。
【0042】
(3)WNK1又はWNK4による、SPAKのリン酸化を阻害又は抑制する物質について:
例えば、この物質(符号M6)がSPAKのリン酸化部位22又はその近傍に結合し、SPAKのリン酸化を阻害又は抑制する場合、SPAKによるイオンチャネルのリン酸化が阻害又は抑制される。従って、降圧剤として適用できる可能性がある。
【0043】
このような物質として、例えば、SPAKのリン酸化部位22に特異的に結合する抗SPAK抗体又は抗SPAKアプタマーなども想定できる。
なお、SPAKのリン酸化部位に特異的に結合する抗SPAK抗体には、抗原抗体反応により、該部位と特異的に結合するタンパク質が全て包含される。また、SPAKのリン酸化部位に特異的に結合する抗SPAKアプタマーには、該部位と特異的に結合するオリゴヌクレオチドが全て包含される。
【0044】
(4)抗SPAK抗体について:
抗SPAK抗体又は抗SPAKアプタマー(符号M7)を用いて、SPAKの機能を阻害又は抑制することにより、WNKとSPAKとの相互作用を阻害又は抑制できる。従って、降圧剤として適用できる可能性がある。
なお、抗SPAK抗体には、抗原抗体反応により、SPAK又はリン酸化されたSPAKと特異的に結合するタンパク質が全て包含される。抗SPAKアプタマーには、SPAK又はリン酸化されたSPAKと特異的に結合するオリゴヌクレオチドが全て包含される。
【0045】
<(C)イオンチャネルに作用する物質について>
イオンチャネル(NKCC1、NKCC2、NCCなど、以下同じ)に作用する物質として、例えば、イオンチャネルの立体構造中のSPAKとの結合部位に対して特異的に結合する物質、イオンチャネルと結合してイオンチャネルの立体構造を変化させる物質、SPAKによるイオンチャネルのリン酸化を阻害又は抑制する物質などが考えられる。
以下、順に説明する。
【0046】
(1)イオンチャネルの立体構造中の、SPAKとの結合部位に対して特異的に結合する物質について:
この物質(図示せず)が、イオンチャネルの立体構造中の、SPAKとの結合部位に対して特異的に結合した場合、SPAKによるイオンチャネルのリン酸化が阻害又は抑制されるため、WNKとSPAKとの相互作用も阻害又は抑制される。従って、降圧剤として適用できる可能性がある。
【0047】
なお、この物質には、SPAKデコイも含まれる。ここで、SPAKデコイとは、SPAK立体構造中のイオンチャネル結合部位と類似の構造を有し、SPAKのおとりとして、イオンチャネル立体構造中のSPAK結合部位に結合することができる物質をいう。SPAKデコイには、SPAK立体構造中の、SPAKとイオンチャネルとの結合部位又はその一部分と同様の立体構造を含むタンパク質又はポリペプチドも含まれる。
【0048】
(2)イオンチャネルと結合して、イオンチャネルの立体構造を変化させる物質について:
この物質(図示せず)が、イオンチャネルの立体構造を変化させた場合、SPAKによるイオンチャネルのリン酸化が阻害又は抑制される。これにより、リン酸化したSPAKが過剰になるため、WNKタンパク質によるSPAKのリン酸化も阻害又は抑制される。従って、降圧剤として適用できる可能性がある。
【0049】
(3)SPAKによるイオンチャンネルのリン酸化を阻害又は抑制する物質について:
この物質(図示せず)が、SPAKによるイオンチャネルのリン酸化を阻害又は抑制した場合、イオンチャネルの活性化が阻害又は抑制される。これにより、リン酸化したSPAKが過剰になるため、WNKタンパク質によるSPAKのリン酸化も阻害又は抑制される。
【0050】
このような物質として、例えば、イオンチャネルのリン酸化部位に特異的に結合する抗イオンチャネル抗体又は抗イオンチャネルアプタマーなども想定できる。
なお、イオンチャネルのリン酸化部位に特異的に結合する抗イオンチャネル抗体には、抗原抗体反応により、該部位と特異的に結合するタンパク質が全て包含される。また、イオンチャネルのリン酸化部位に特異的に結合する抗イオンチャネルアプタマーには、該部位と特異的に結合するオリゴヌクレオチドが全て包含される。
【0051】
<(D)WNKタンパク質若しくはSPAKの発現を抑制する物質について>
この物質(図示せず)が、WNKタンパク質の発現を抑制した場合、WNKタンパク質によるSPAKリン酸化が減少するため、SPAKの活性を低下させることができる。SPAKの発現を抑制した場合も、リン酸化SPAKが減少するため、SPAKの活性を低下させることができる。
【0052】
WNKタンパク質の発現を抑制する物質として、例えば、WNKタンパク質をコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、WNKタンパク質の発現を抑制する二本鎖RNAがある。また、SPAKの発現を抑制する物質として、例えば、SPAKをコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、SPAKの発現を抑制する二本鎖RNAがある。なお、RNA干渉に基づく二本鎖RNAは、公知方法により作製できる。
【0053】
続いて、本発明に係るスクリーニング方法の一例について、以下説明する。
【0054】
WNKタンパク質とSPAKとの相互作用を用いたスクリーニング方法としては、例えば、(1)WNKタンパク質とSPAKが存在する特定の反応領域中に、候補物質を供給した後、相互作用を検出し、候補物質の中から標的物質をスクリーニングする方法、(2)特定の反応領域中に、WNKタンパク質とSPAKと候補物質を供給した後、相互作用を検出し、候補物質の中から標的物質をスクリーニングする方法、などがある。
【0055】
相互作用の検出は、WNKタンパク質とSPAKとの結合を検出することによって行ってもよいし、WNKタンパク質とSPAKリン酸化を検出することによって行ってもよい。相互作用の検出は、既知の方法を用いることができる。WNKタンパク質とSPAKとの結合によって相互作用を検出する場合、例えば、共免疫沈降法などを適用できる。WNKタンパク質とSPAKのリン酸化によって相互作用を検出する場合、例えば、共免疫沈降法、ウエスタンブロットなどを適用できる。
【0056】
本発明に係るスクリーニング方法は、キット化が可能である。その場合、例えば、WNKタンパク質、SPAK、抗WNK抗体、抗SPAK抗体、リン酸化SPAKと特異的に結合する抗体、相互作用検出(共免疫沈降法、ウエスタンブロットなど)に用いる試薬、などを、相互作用検出方法に応じて適宜組み合わせ、キット化する。
【実施例1】
【0057】
実施例1では、WNK1とSPAKとの相互作用について、実験を行った。
【0058】
本実験は、共免疫沈降法により行った。実験手順の概要は次の通りである。
まず、公知方法により、抗WNK1抗体、及び、抗SPAK/OSR1抗体を作製した。
次に、培養したHEK293細胞又はMDCK細胞(イヌ腎尿細管上皮細胞)を、1%Triton X−100 lysis bufferを用いて溶解し、細胞抽出液を得た。
次に、抗SPAK/OSR1抗体を用いて、細胞抽出液からSPAKの相互作用複合体を、特異的に免疫沈降させた。次に、回収した相互作用複合体についてSDS−PAGE(ドデシル硫酸−ポリアクリルアミドゲル電気泳動、以下同じ)を行った後、抗WNK1抗体を用いて免疫プロットを行い、WNK1を検出した。同様に、細胞抽出液からWNK1の相互作用複合体を、抗WNK1抗体を用いて特異的に免疫沈降させた後、回収した免疫沈降物について抗SPAK/OSR1抗体を用いて免疫プロットを行い、SPAKを検出した。
【0059】
結果を図2に示す。
図中、「HEK293」及び「MDCK」は、用いた培養細胞の種類を示す。
図中、「IP(ImmunoPrecipitation)」は、免疫沈降を行ったことを示し、「ControlIgG」は、コントロールとして、IgG(免疫グロブリン)を用いて免疫沈降を行った後、免疫ブロットを行ったレーンであることを、「SPAK/OSR1」は、抗SPAK/OSR1抗体を用いて免疫沈降を行った後、免疫ブロットを行ったレーンであることを、「WNK1」は、抗WNK1抗体を用いて免疫沈降を行った後、免疫ブロットを行ったレーンであることを、それぞれ示す。なお、「Lysate」は、免疫沈降を行わず、細胞抽出液について、免疫ブロットを行ったレーンであることを示す。
図中、「IB(ImmunoBlot)」は、免疫ブロットを行ったことを示し、「IB:αWNK1」は、免疫沈降、SDS−PAGEの後、抗WNK1抗体を用いて免疫ブロットを行ったことを、「IB:αSPAK/OSR1」は、免疫沈降、SDS−PAGEの後、抗SPAK/OSR1抗体を用いて免疫ブロットを行ったことを、それぞれ示す。
図中、矢印は、各タンパク質のバンドの位置を、各写真の右側に記載された数字は分子量(kD)を、それぞれ示す。
【0060】
図2の左側の免疫ブロット写真では、抗SPAK/OSP1抗体を用いて免疫沈降(IP)を行ったレーンにおいて、WNK1のバンドが検出された(その写真中、IB:αWNK1の部分を参照)。
同様に、図2の右側の免疫ブロット写真(MDCK細胞を用いた場合)でも、抗SPAK/OSP1抗体を用いて免疫沈降(IP)を行ったレーンにおいて、WNK1のバンドが検出された(その写真中、IB:αWNK1の部分を参照)。
即ち、この結果は、HEK293細胞又はMDCK細胞中に存在するタンパク質について、抗SPAK/OSR1抗体を用いて免疫沈降を行うと、その免疫沈降物中に、WNK1が存在することを示す。
【0061】
一方、図2の真ん中の免疫ブロット写真では、抗WNK1抗体を用いて免疫沈降(IP)を行ったレーンにおいて、SPAKのバンドが検出された(その写真中、IB:αSPAK/OSR1の部分を参照)。
即ち、この結果は、HEK293細胞又はMDCK細胞中に存在するタンパク質について、抗WNK1抗体を用いて免疫沈降を行うと、その免疫沈降物中に、SPAKが存在することを示す。
【0062】
従って、以上の結果は、WNK1とSPAKが相互に結合すること、即ち、両タンパク質が相互作用することを強く示唆する。
【実施例2】
【0063】
実施例2では、WNK1及びWNK4とSPAKとの相互作用について、実験を行うとともに、WNKタンパク質の配列における、SPAKとの相互作用部位について、検討を行った。
【0064】
実験手順の概要は次の通りである。
【0065】
まず、SPAK発現プラスミド、OSR1発現プラスミド、及び、WNKタンパク質発現プラスミドを作製した。
SPAK発現プラスミド及びOSR1発現プラスミドは、プラスミドpRK5−T7に、SPAK又はOSR1の配列を組み込んで作製した。なお、pRK5−T7は、挿入した配列にT7−タグを付加させた形で発現させるプラスミドである。
WNK発現プラスミドは、プラスミドpRK5−flagに、WNKの配列を組み込んで作製した。なお、pRK5−flagは、挿入した配列にflag−タグを付加させた形で発現させるプラスミドである。
【0066】
WNK1発現プラスミドとして、次のものを作製した。
(1)WNK1の全長配列を挿入したもの(Wild Type)、
(2)WNK1のアミノ酸配列の1258番目のフェニルアラニンをアラニンに置換した配列を挿入したもの(F1258A)、
(3)WNK1のアミノ酸配列の1869番目のフェニルアラニンをアラニンに置換した配列を挿入したもの(F1869A)、
(4)WNK1のアミノ酸配列の1946番目のフェニルアラニンをアラニンに置換した配列を挿入したもの(F1946A)、
(5)WNK1のアミノ酸配列の1958番目のフェニルアラニンをアラニンに置換した配列を挿入したもの(F1958A)、
(6)WNK1のアミノ酸配列の1258、1869、1946、1958番目の各フェニルアラニンを全てアラニンに置換した配列を挿入したもの(4FA)。
また、WNK4発現プラスミドとして、次のものを作製した。
(1)WNK4の全長配列を挿入したもの(Wild Type)、
(2)WNK4のアミノ酸配列の1017番目のフェニルアラニンをアラニンに置換した配列を挿入したもの(F1017A)。
【0067】
次に、実施例1と同様に、HEK293細胞に、SPAK発現プラスミド又はOSR1発現プラスミドとWNKタンパク質発現プラスミドをトランスフェクトし、両タンパク質を共発現させ、細胞溶解後、免疫沈降を行った。そして、免疫沈降物(相互作用複合体)について、SDS−PAGEを行った後、免疫ブロットを行った。
本実験では、抗Flag抗体を用いてWNKの相互作用複合体を回収した後、抗T7抗体を用いて免疫ブロットを行い、SPAK又はOSR1を検出した。同様に、抗T7抗体を用いてSPAK又はOSR1の相互作用複合体を回収した後、抗Flag抗体を用いて免疫ブロットを行い、WNKタンパク質を検出した。
【0068】
結果を図3に示す。
【0069】
図3Aは、WNK1及びWNK4のアミノ酸配列モチーフを模式的に記載した図である。
図3AのWNK1の配列中、左から、「RFIV」は1258番目のフェニルアラニン(F)及びその近傍のアミノ酸配列を、「RFQV」は1869番目のフェニルアラニン(F)及びその近傍のアミノ酸配列を、同じく「RFQV」は1946番目のフェニルアラニン(F)及びその近傍のアミノ酸配列を、「RFSV」は1958番目のフェニルアラニン(F)及びその近傍のアミノ酸配列を、それぞれ示す。なお、「2382aa」は、WNK1のアミノ酸配列の全長が2382個であることを示す。
同様に、図3AのWNK4の配列中、「RFQV」は1017番目のフェニルアラニン(F)及びその近傍のアミノ酸配列を示す。なお、「1243aa」は、WNK4のアミノ酸配列の全長が1243個であることを示す。
【0070】
図3Bは、実験結果を示す免疫ブロット写真である。
図3B中、左側の6つの写真は、WNKタンパク質とSPAKとを共発現させた場合の免疫ブロット写真であり、右側の6つの写真は、WNKタンパク質とOSR1とを共発現させた場合の免疫ブロット写真である。
図中、「Flag−hWNK」の項目は、HEK293細胞において、Flagタグで標識したヒトWNKタンパク質を発現させたかどうかを示し、「−」は発現させていないことを、その他は、それぞれ記載されたWNKタンパク質又はその変異タンパク質を発現させたことを示す。
「T7−rSPAK」の項目は、HEK293細胞において、T7タグで標識したラットSPAKを発現させたかどうかを示し、「−」は発現させていないことを、「+」は発現させたことを示す。
図中、「Total」は、免疫沈降を行わず、細胞抽出液についてそのまま免疫ブロットを行った結果であることを、「IP:αFlag」は、抗Flag抗体を用いて免疫沈降を行い、WNKタンパク質の相互作用複合体を回収した場合の結果であることを、「IP:αT7」は、抗T7抗体を用いて免疫沈降を行い、SPAK又はOSR1の相互作用複合体を回収した場合の結果であることを、それぞれ示す。
「IB:αFlag」は、免疫沈降物を回収した後、抗Flag抗体で免疫ブロットを行い、免疫沈降物中のWNKタンパク質を検出した結果であることを、「IB:αT7」は、免疫沈降物を回収した後、抗T7抗体で免疫ブロットを行い、免疫沈降物中のSPAK又はOSR1を検出した結果であることを、それぞれ示す。
【0071】
図3Bの左側の免疫ブロット写真では、WNK1を発現させたレーン(左から3番目)及びWNK4を発現させたレーン(右から2番目)において、抗Flag抗体を用いて免疫沈降(IP)を行った後、抗T7抗体を用いて免疫ブロット(IB)を行った場合、SPAKのバンドが検出された(上から4段目、左から3番目のバンド、及び、上から4段目、右から2番目のバンドを参照)。
即ち、この結果は、抗Flag抗体を用いて免疫沈降を行い、WNKタンパク質の相互作用複合体を回収すると、その免疫沈降物中にSPAKが存在することを示す。
【0072】
同様に、WNK1を発現させたレーン(左から3番目)及びWNK4を発現させたレーン(右から2番目)において、抗T7抗体を用いて免疫沈降(IP)を行った後、抗Flag抗体を用いて免疫ブロット(IB)を行った場合、WNKタンパク質のバンドが検出された(上から5段目、左から3番目のバンド、及び、上から5段目、右から2番目のバンドを参照)。
即ち、この結果は、抗T7抗体を用いて免疫沈降を行い、SPAKの相互作用複合体を回収すると、その免疫沈降物中にWNKタンパク質が存在することを示す。
【0073】
従って、以上の結果は、実施例1と同様、WNK1とSPAKが相互に結合すること、即ち、両タンパク質が相互作用することを強く示唆する。
【0074】
また、WNKタンパク質の変異タンパク質を発現させ(左から4番目から9番目のレーン、及び、一番右側のレーン)、抗Flag抗体を用いて免疫沈降(IP)を行った後、抗T7抗体を用いて免疫ブロット(IB)を行った場合、SPAKのバンドが減弱した(上から4段目の免疫ブロット写真を参照)。
同様に、WNKタンパク質の変異タンパク質を発現させ(左から4番目から9番目のレーン、及び、一番右側のレーン)、抗T7抗体を用いて免疫沈降(IP)を行った後、抗Flag抗体を用いて免疫ブロット(IB)を行った場合、WNKタンパク質のバンドが減弱した。
【0075】
このことは、WNK1のアミノ酸配列中、1258番目、1869番目、1946番目、1958番目のフェニルアラニンの部分、並びにWNK4のアミノ酸配列中、1017番目のフェニルアラニンの部分が、WNKタンパク質とSPAKとの相互作用に関与していることを示唆する。
【0076】
なお、この新知見(WNKタンパク質とSPAKとの相互作用部位に関する示唆)は、例えば、WNKデコイを作製する上で重要な知見である。即ち、この知見に基づいて、WNKデコイ(例えば、WNKタンパク質立体構造中の、WNKタンパク質とSPAKとの結合部位又はその一部分と同様の立体構造を含むタンパク質又はポリペプチド)を作製した場合、その物質は、降圧剤として適用できる可能性が高い。
【0077】
その他、図3Bの右側の免疫ブロット写真が示す通り、WNKタンパク質とOSR1を共発現させた場合も、WNKタンパク質とSPAKを共発現させた場合とほぼ同様の結果が得られた。
【実施例3】
【0078】
実施例3では、WNK1が実際にSPAKをリン酸化しているかどうかを調べた。
【0079】
WNK1にキナーゼ活性(SPAKリン酸化作用)がある場合、WNK1はATPのリン酸基をSPAKに移動させ、SPAKをリン酸化すると予想される。
【0080】
そこで、まず、WNK1にSPAKとγ−32P−ATPを加え、30℃、30分間、インキュベートした後、SDSを添加して酵素反応を止め、SDS−PAGEを行った。そして、オートラジオグラフィー及びイメージ解析(BAS2500)により、γ−32Pを検出し、放射性リン酸基がSPAKへ移動したかどうかを調べた。
【0081】
結果を図4に示す。
【0082】
図4は、実験結果を示すオートラジオグラフである。
図中、上側の写真(「32P」と記載された写真)は、オートラジオグラフである。下側の写真(「CBB」と記載された写真)は、同じものをCBB(Coomasie Brilliant Blue)染色した写真である。
図中、「GST−WNK1(1−666)」は、用いたWNK1を示す。「−」のレーンは、WNK1を添加しなかった場合の結果を、「Wild type」のレーンは、WNK1を用いた場合の結果を、「WNK1(K233M)」のレーンは、WNK1のアミノ酸配列の233番目のリシン残基をメチオニンに置換した変異タンパク質を用いた場合の結果を、「WNK1(D368A)」のレーンは、WNK1のアミノ酸配列の368番目のアスパラギン酸残基をアラニンに置換した変異タンパク質を用いた場合の結果を、「WNK1(S382A)」のレーンは、WNK1のアミノ酸配列の382番目のセリン残基をアラニンに置換した変異タンパク質を用いた場合の結果を、それぞれ示す。なお、WNK1のアミノ酸配列の233番目、368番目、382番目の残基は、それぞれ、キナーゼ活性部位として、既知の配列である。
「GST−WNK1(1−665)」はWNK1のバンドの位置を、「GST−SPAK(KM)」はSPAKのバンドの位置を、それぞれ示す。なお、「GST−」はGSTタグで標識した変異タンパク質であることを、「(KM)」はキナーゼ活性を失った変異タンパク質であることを、それぞれ示す。
【0083】
図4では、「Wild Type」のレーンでは、SPAKの位置に32Pのバンドが検出された(オートラジオグラフ中、下側のバンド)。また、WNK1の変異タンパク質を用いた場合、SPAKの位置に32Pのバンドは検出されなかった。
上述の通り、WNK1にキナーゼ活性がある場合、WNK1はATPのリン酸基をSPAKに移動させると推測される。また、上述の通り、WNK1のアミノ酸配列のうち、本実験で変異させた部分は、キナーゼ活性部位であることが既知である。
従って、以上の結果は、WNK1がSPAKをリン酸化することを示唆する。
【実施例4】
【0084】
実施例4では、SPAKの配列中の、WNKタンパク質によってリン酸化される部位について、検討した。
【0085】
実験手順の概要は次の通りである。
まず、SPAK又はOSR1のアミノ酸配列の一部を置換した変異タンパク質を作製した。次に、実施例3と同様に、WNKタンパク質に、その変異SPAK又は変異OSR1とγ−32P−ATPを加え、インキュベートし、SDSを添加して酵素反応を止めた後、SDS−PAGEを行った。そして、オートラジオグラフィー及びイメージ解析(BAS2500)により、γ−32Pを検出し、放射性リン酸基が変異SPAKへ移動するかどうかを調べた。
【0086】
結果を図5に示す。
【0087】
図5Aは、SPAKのアミノ酸配列のうち、WNK1によるリン酸化部位を模式的に示す図である。
「rSPAK」はラットのSPAKのアミノ酸配列であることを、「mOSR1」はマウスのOSR1のアミノ酸配列であることを、「Fray」はハエにおけるファミリータンパク質のアミノ酸配列であることを、それぞれ示す。
「WNK1 phosphorylation site」は、WNK1によるリン酸化部位であることを示す(詳細は後述する)。
SPAKのアミノ酸配列の380番目のセリン、及び、OSR1のアミノ酸配列の325番目のセリンは、その近傍の配列も含め、高度に保存されている。
【0088】
図5Bは、実施例4の実験結果を示すオートラジオグラフである。
図中、左側の二つの写真は「WNK1」を用いた場合の写真、右側の二つの写真は「WNK4」を用いた場合の写真、である。
また、上側の2つの写真(「32P」と記載された写真)は、それぞれ、オートラジオグラフ、下側の2つの写真(「CBB」と記載された写真)は、同じものをCBB(Coomasie Brilliant Blue)染色した写真である。
「rSPAK(KM)」は、キナーゼ活性を失活させたラットSPAKを用いたことを、「rSPAK(KM/S380A)」は、キナーゼ活性を失活させかつアミノ酸配列の380番目のセリン残基をアラニンに置換した変異タンパク質を用いたことを、それぞれ示す。また、「mOSR1(KM)」は、キナーゼ活性を失活させたマウスOSR1を用いたことを、「mOSR1(KM/S325A)」は、キナーゼ活性を失活させかつアミノ酸配列の325番目のセリン残基をアラニンに置換した変異タンパク質を用いたことを、それぞれ示す。
【0089】
図5Bでは、WNKタンパク質とrSPAK(KM)とを放射性リン酸基の存在下でインキュベートした場合、32Pのバンドが検出されたのに対し(上側の2つの写真中、それぞれ、一番左側のレーンを参照)、WNKタンパク質とrSPAK(KM/S380A)とを放射性リン酸基の存在下でインキュベートした場合、32Pのバンドが検出されなかった(上側の2つの写真中、それぞれ、左から2番目のレーンを参照)。
また、WNKタンパク質とOSR1とを放射性リン酸基の存在下でインキュベートした場合も、同様の結果であった。
【0090】
従って、以上の結果は、SPAKのアミノ酸配列の380番目のセリン残基、及び、OSR1のアミノ酸配列の325番目のセリン残基が、WNKタンパク質によるSPAK又はOSR1のリン酸化に、深く関与することを示唆する。
【0091】
なお、この新知見(リン酸化部位に関する示唆)は、SPAKのリン酸化部位又はその近傍に特異的に結合する抗SPAK抗体又は抗SPAKアプタマー、該部位又はその近傍に特異的に結合するその他の化合物、などを作製する上で重要な知見である。即ち、この新知見に基づいて、それらの物質の設計・作製を行った場合、それらの物質は、降圧剤として適用できる可能性が高い。
【実施例5】
【0092】
実施例5では、SPAK及びOSR1が、イオンチャネルを活性化するかどうかについて、検討した。
【0093】
イオンチャネルとして知られているNKCC1、NKCC2、NCCなどは、アミノ酸配列中のスレオニン残基のリン酸化により、活性化することが知られている。そこで、本実験では、SPAK及びOSR1が、イオンチャネルをリン酸化するかどうかについて、調べた。
【0094】
実験手順の概要は実施例3又は実施例4とほぼ同様である。即ち、SPAK又はOSR1に、イオンチャネル(NKCC1、NKCC2、NCC)とγ−32P−ATPを加え、インキュベートし、SDSを添加して酵素反応を止めた後、SDS−PAGEを行い、そして、オートラジオグラフィー及びイメージ解析(BAS2500)により、γ−32Pを検出し、放射性リン酸基がイオンチャネルへ移動するかどうかを調べた。
【0095】
結果を図6に示す。
【0096】
図6Aは、イオンチャネルのアミノ酸配列のうち、リン酸化されるスレオニン残基の位置を示す図である。それぞれ、「NKCC1(shark)」には、サメのNKCC1のアミノ酸配列が、「NKCC1(human)」には、ヒトのNKCC1のアミノ酸配列が、「NKCC2(human)」には、ヒトのNKCC2のアミノ酸配列が、「NCC(human)」には、ヒトのNCCのアミノ酸配列が、「NCC(mouse)」には、マウスのNCCのアミノ酸配列の一部が、それぞれ記載されている。
図6Aに示す通り、リン酸化されるスレオニン残基は、イオンチャネルの種類、動物種を超えて、高度に保存されている。
【0097】
図6Bは、SPAK又はOSR1と、各イオンチャネルを用いた場合のオートラジオグラフである。
図中、左側の二つの写真は「rSPAK(ラットSPAK)」を用いた場合の写真、右側の二つの写真は「mOSR1(マウスOSR1)」を用いた場合の写真、である。
また、上側の2つの写真(「32P」と記載された写真)は、それぞれ、オートラジオグラフ、下側の2つの写真(「CBB」と記載された写真)は、同じものをCBB(Coomasie Brilliant Blue)染色した写真である。
「GST−PAK3(65−135)」は、GSTタグで標識したPAK3(アミノ酸配列の65番目から135番目までの断片)を用いたことを、「GST−hNKCC2(1−181)」は、GSTタグで標識したヒトNKCC2(アミノ酸配列の1番目から181番目までの断片)を用いたことを、「GST−hNKCC1(1−289)」は、GSTタグで標識したヒトNKCC1(アミノ酸配列の1番目から289番目までの断片)を用いたことを、「GST−mNCC(1−138)」は、GSTタグで標識したマウスNCC(アミノ酸配列の1番目から138番目までの断片)を用いたことを、それぞれ示す。なお、PAK3は、SPAK及びOSR1の基質として公知のタンパク質であり、ポジティブコントロールである。
図中のアスタリスク(「*」)は、基質のバンドの位置を表す。
【0098】
図6Cは、NCCのスレオニン残基を置換した変異タンパク質を用いた場合のオートラジオグラフである。
図中、上側の写真(「32P」と記載された写真)は、オートラジオグラフ、下側の写真(「CBB」と記載された写真)は、同じものをCBB(Coomasie Brilliant Blue)染色した写真である。
「GST−mNCC(1−138)」は、GSTタグで標識したマウスNCC(アミノ酸配列の1番目から138番目までの断片)を用いたことを示し、「Wild type」は、そのNCCをそのまま用いたことを、「T53A」はそのNCCのアミノ酸配列中、53番目のスレオニン残基をアラニンに置換した変異タンパク質を用いたことを、「T58A」は同じく58番目のスレオニン残基をアラニンに置換した変異タンパク質を用いたことを、「S71A」は同じく71番目のセリン残基をアラニンに置換した変異タンパク質を用いたことを、「T53A/T58A/S71A」は前記の全ての部位を置換した変異タンパク質を用いたことを、それぞれ示す。
【0099】
図6Bでは、SPAK又はOSR1と各イオンチャネルとを放射性リン酸基の存在下でインキュベートした場合、32Pのバンドが検出された(アスタリスクが付された部分を参照)。このことは、SPAK及びOSR1がイオンチャネルをリン酸化すること、即ち、両タンパク質がイオンチャネルを活性化することを強く示唆する。
【0100】
図6Cでは、NCCのリン酸化部位のアミノ酸残基を置換することにより、32Pのバンドがやや減弱した(上側の写真の左から2〜4番目のバンドを参照)。そして、NCCのリン酸化部位のアミノ酸残基を3箇所全て置換することにより、32Pのバンドがより減弱した(上側の写真の一番右側のバンドを参照)。このことは、SPAK及びOSR1が、イオンチャネルのリン酸化部位に作用していることを示唆する。
【0101】
なお、この新知見(リン酸化部位に関する示唆)は、イオンチャネルのリン酸化部位に特異的に結合する抗イオンチャネル抗体又は抗イオンチャネルアプタマー、該部位又はその近傍に特異的に結合するその他の化合物、などを作製する上で重要な知見である。即ち、この新知見に基づいて、それらの物質を設計・作製した場合、それらの物質は、降圧剤として適用できる可能性が高い。
【産業上の利用可能性】
【0102】
本発明に係るタンパク質及び物質は、降圧剤に適用可能である。また、本発明に係る相互作用は、生体内における重要なシグナル伝達経路を新規に見出したものであり、降圧剤のスクリーニングにも適用可能である。
【0103】
本発明に係るスクリーニング方法は、例えば、用いるタンパク質、試薬などをセットにすることにより、降圧剤スクリーニングキットとして、適用できる。
【図面の簡単な説明】
【0104】
【図1】WNKタンパク質とSPAKとの相互作用を示す模式図。
【図2】実施例1の実験結果を示す免疫ブロット写真。
【図3A】WNK1及びWNK4のアミノ酸配列モチーフを模式的に記載した図。
【図3B】実施例2の実験結果を示す免疫ブロット写真。
【図4】実施例3の実験結果を示すオートラジオグラフ。
【図5A】SPAKのアミノ酸配列のうち、WNK1によるリン酸化部位を模式的に示す図。
【図5B】実施例4の実験結果を示すオートラジオグラフ。
【図6A】イオンチャネルのアミノ酸配列のうち、リン酸化されるスレオニン残基の位置を示す図。
【図6B】SPAK又はOSR1と、各イオンチャネルを用いた場合のオートラジオグラフ。
【図6C】NCCのスレオニン残基を置換した変異タンパク質を用いた場合のオートラジオグラフ。
【特許請求の範囲】
【請求項1】
SPAKと相互作用するWNK1。
【請求項2】
SPAKと相互作用するWNK4。
【請求項3】
WNK1又はWNK4と相互作用するSPAK。
【請求項4】
WNK1又はWNK4とSPAKとの相互作用を阻害又は抑制する降圧剤。
【請求項5】
WNK1又はWNK4の立体構造中の、SPAKとの結合部位に対して特異的に結合する物質であることを特徴とする請求項4記載の降圧剤。
【請求項6】
WNK1又はWNK4と結合して、前記タンパク質の立体構造を変化させる物質であることを特徴とする請求項4記載の降圧剤。
【請求項7】
WNK1又はWNK4のリン酸化を阻害又は抑制する物質であることを特徴とする請求項4記載の降圧剤。
【請求項8】
抗WNK抗体であることを特徴とする請求項4記載の降圧剤。
【請求項9】
抗WNKアプタマーであることを特徴とする請求項4記載の降圧剤。
【請求項10】
SPAKの立体構造中の、WNK1又はWNK4との結合部位に対して特異的に結合する物質であることを特徴とする請求項4記載の降圧剤。
【請求項11】
SPAKと結合して、SPAKの立体構造を変化させる物質であることを特徴とする請求項4記載の降圧剤。
【請求項12】
WNK1又はWNK4による、SPAKのリン酸化を阻害又は抑制する物質であることを特徴とする請求項4記載の降圧剤。
【請求項13】
抗SPAK抗体であることを特徴とする請求項4記載の降圧剤。
【請求項14】
抗SPAKアプタマーであることを特徴とする請求項4記載の降圧剤。
【請求項15】
イオンチャネルの立体構造中の、SPAKとの結合部位に対して特異的に結合する物質であることを特徴とする請求項4記載の降圧剤。
【請求項16】
イオンチャネルと結合して、イオンチャネルの立体構造を変化させる物質であることを特徴とする請求項4記載の降圧剤。
【請求項17】
SPAKによるイオンチャネルのリン酸化を阻害又は抑制することを特徴とする請求項4記載の降圧剤。
【請求項18】
イオンチャネルのリン酸化部位に特異的に結合する抗イオンチャネル抗体であることを特徴とする請求項4記載の降圧剤。
【請求項19】
イオンチャネルのリン酸化部位に特異的に結合する抗イオンチャネルアプタマーであることを特徴とする請求項4記載の降圧剤。
【請求項20】
WNK1又はWNK4の発現を抑制する物質であることを特徴とする請求項4記載の降圧剤。
【請求項21】
WNK1又はWNK4をコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、前記タンパク質の発現を抑制する二本鎖RNAであることを特徴とする請求項20記載の降圧剤。
【請求項22】
SPAKの発現を抑制する物質であることを特徴とする請求項4記載の降圧剤。
【請求項23】
SPAKをコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、前記タンパク質の発現を抑制する二本鎖RNAであることを特徴とする請求項22記載の降圧剤。
【請求項24】
WNK1又はWNK4とSPAKとの相互作用を用いた降圧剤のスクリーニング方法。
【請求項1】
SPAKと相互作用するWNK1。
【請求項2】
SPAKと相互作用するWNK4。
【請求項3】
WNK1又はWNK4と相互作用するSPAK。
【請求項4】
WNK1又はWNK4とSPAKとの相互作用を阻害又は抑制する降圧剤。
【請求項5】
WNK1又はWNK4の立体構造中の、SPAKとの結合部位に対して特異的に結合する物質であることを特徴とする請求項4記載の降圧剤。
【請求項6】
WNK1又はWNK4と結合して、前記タンパク質の立体構造を変化させる物質であることを特徴とする請求項4記載の降圧剤。
【請求項7】
WNK1又はWNK4のリン酸化を阻害又は抑制する物質であることを特徴とする請求項4記載の降圧剤。
【請求項8】
抗WNK抗体であることを特徴とする請求項4記載の降圧剤。
【請求項9】
抗WNKアプタマーであることを特徴とする請求項4記載の降圧剤。
【請求項10】
SPAKの立体構造中の、WNK1又はWNK4との結合部位に対して特異的に結合する物質であることを特徴とする請求項4記載の降圧剤。
【請求項11】
SPAKと結合して、SPAKの立体構造を変化させる物質であることを特徴とする請求項4記載の降圧剤。
【請求項12】
WNK1又はWNK4による、SPAKのリン酸化を阻害又は抑制する物質であることを特徴とする請求項4記載の降圧剤。
【請求項13】
抗SPAK抗体であることを特徴とする請求項4記載の降圧剤。
【請求項14】
抗SPAKアプタマーであることを特徴とする請求項4記載の降圧剤。
【請求項15】
イオンチャネルの立体構造中の、SPAKとの結合部位に対して特異的に結合する物質であることを特徴とする請求項4記載の降圧剤。
【請求項16】
イオンチャネルと結合して、イオンチャネルの立体構造を変化させる物質であることを特徴とする請求項4記載の降圧剤。
【請求項17】
SPAKによるイオンチャネルのリン酸化を阻害又は抑制することを特徴とする請求項4記載の降圧剤。
【請求項18】
イオンチャネルのリン酸化部位に特異的に結合する抗イオンチャネル抗体であることを特徴とする請求項4記載の降圧剤。
【請求項19】
イオンチャネルのリン酸化部位に特異的に結合する抗イオンチャネルアプタマーであることを特徴とする請求項4記載の降圧剤。
【請求項20】
WNK1又はWNK4の発現を抑制する物質であることを特徴とする請求項4記載の降圧剤。
【請求項21】
WNK1又はWNK4をコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、前記タンパク質の発現を抑制する二本鎖RNAであることを特徴とする請求項20記載の降圧剤。
【請求項22】
SPAKの発現を抑制する物質であることを特徴とする請求項4記載の降圧剤。
【請求項23】
SPAKをコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、前記タンパク質の発現を抑制する二本鎖RNAであることを特徴とする請求項22記載の降圧剤。
【請求項24】
WNK1又はWNK4とSPAKとの相互作用を用いた降圧剤のスクリーニング方法。
【図1】


【図2】


【図3A】


【図3B】


【図4】


【図5A】


【図5B】


【図6A】


【図6B】


【図6C】




【図2】


【図3A】


【図3B】


【図4】


【図5A】


【図5B】


【図6A】


【図6B】


【図6C】


【公開番号】特開2007−74951(P2007−74951A)
【公開日】平成19年3月29日(2007.3.29)
【国際特許分類】
【出願番号】特願2005−265207(P2005−265207)
【出願日】平成17年9月13日(2005.9.13)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成17年度文部科学省「ベンチャー開発戦略研究センター」委託研究、産業活力再生特別措置法第30条の適用を受ける特許出願
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成19年3月29日(2007.3.29)
【国際特許分類】
【出願日】平成17年9月13日(2005.9.13)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成17年度文部科学省「ベンチャー開発戦略研究センター」委託研究、産業活力再生特別措置法第30条の適用を受ける特許出願
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

