鬱病治療のための多重標的受容体逆作用の機序をもつ薬剤組成物
鬱病治療のための多重標的受容体逆作用の機序をもつ経口薬剤組成物あるいは機能性食品はチョウセンニンジンサポニン(Rg1+Rb1)、グリチルリチン酸および棗cAMPからなる。実験は鬱病治療のための望ましい従来技術の医薬品、パロキセチンと比較して、本発明は著しい抗鬱病効果を有することを実証する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は鬱病治療のためのジンセノサイド(ニンジンサポニン)Rg1およびRb1、グリチルリチン酸およびジュジュバ環状アデノシン一リン酸塩(棗cAMP)の生の材料から製造される多重標的、受容体後機序に基づく薬剤組成物に関する。特に、本発明は確実な機能および組成、明白な治療上の効果および長期間の使用に対する高い安全性を有し、そしてひどい嘔吐のような副作用のない鬱病治療のための経口薬剤あるいは健康食品に関する。
【発明の背景】
【0002】
鬱病は一般的な病気である。統計に従って、全世界の人口の約25%の女性が彼女の生活で鬱病を経験しており、約10%の男性が鬱病を経験している(Ch’un−Hsing Chang著、Modern Psycology参照)。世界保健機構(WHO)は“世界の鬱病の発病率は約11%である。現在、約3億4千万人の心理的鬱病患者が世界におり、そして数が増加しつつある。鬱病は今から20年後に世界で一般的な病気の第2番に増加するだろ”と発表した。
【0003】
現在、主な抗鬱病薬剤はプロザック、パキシルおよびゾロフト等であり、これらは5−ヒドロキシトリプタミン(5−HT)、ノルエピネフリン(NE)およびドーパミン(DA)のような神経伝達物質の再取込を阻害する選択的セロトニン再取込阻害薬(SSRI)、セレトニン−ノルエピネフリン再取込阻害薬(SNRI)そしてノルエピネフリンおよびドーパミン再取込阻害薬(NDRI)に属する。これらによる機序はこれらの抗鬱病薬剤が鬱病の症状を減じそして緩和するように人間の神経伝達物質5−HTの含有量を増大することによる。
【0004】
しかしながら、市場の抗鬱病薬剤は増加した自殺率、頭痛、目眩、目の眩み、失眼、過眠症、耳鳴り、喉の渇き、拒食、食欲、体重の増加、血圧の上昇、胃の変調、胃の吐き戻し、嘔吐、消化不良、下痢、便秘、脚痛、皮疹、身震い、痙攣、多汗症、浮腫、性的欲望、および性的不能等のような異なる過激な種々の副作用を有する。近年、プロザック等のような抗鬱病薬剤が重大な社会問題となっている。2004年に、米国の食品医薬品局(FDA)は市場の32の主な抗鬱病薬剤の説明書の副作用および注意を明確に記述することを製剤会社に命令し、そして医師および看護士にこれらの薬剤が子供および青年の自殺率を増加するかも知れないことを強調した。32の抗鬱病薬剤の内、パキシルは1996年に有害であることをはや発見され、そして2001年来市場から継続してリコールされてきている。2004年6月に、ニューヨク州検事長はパキシルおよび“青年期の自殺行動および傾向の増大する危険性”間の関連の研究報告を騙したとして、英国GlaxoSmithKline会社を告発した。現在の状況の観点から、副作用のないそしてもっと著しい効能のある抗鬱病品質をもつ薬剤の新しい生成のための研究が全薬剤世界の注目の中心となってきている。
【0005】
近年、薬剤の科学者は鬱病の発病の機序の研究に新しい突破口を作り、彼等は鬱病の治療のための戦略として5−HT、NEおよびDAのような神経伝達物質の再取込の阻害に加えて、受容体後機序の制御が鬱病治療のためにまた採用され得ることを発見した。さらに、受容体後機序を調節する薬剤、ロリプラムが発売されたので、受容体後機序が薬理学的に鬱病治療のための研究の焦点となった。ロリプラムはホスホジエステラーゼ4(PDE−4)の阻害剤であり、そして明らかな抗鬱病機能を有することを臨床的試行で示されてきている;しかしながら、ロリプラムは激しい嘔吐を起こすため、ロリプラムに関するさらなる研究が中止せざるを得なかった。この挫折にも拘わらず、ロリプラムは“抗鬱病薬剤のための受容体後機序”の新しい種類の考えを開始した。
【0006】
それ故、先行技術に直面する上記の状況を取り扱うことが申請者によって試みられる。
【0007】
[発明の要約]
現在の技術の不十分さを克服するために、本発明の目的は、鬱病治療のためのジンセノサイドRg1およびRb1、グリチルリチン酸および棗cAMPの生材料から製造されるような多標的および受容体後機序を基本とする経口薬剤あるいは健康食品を提供することである。特に、確実な機能および成分、長期間の使用に対して激しい嘔吐等のような副作用なしに明らかな治療上の効果および高い安全性のある新しい技術的計画が提供される。
【0008】
本発明の薬剤の解決する計画は鬱病治療のための最新の医学の病理学および薬理学の理論に従って試みられた結果である。特に、本発明は、アデニルシクラーゼ酸塩(AC)に対するジンセノサイドの強い模擬実験効果およびcAMPホスホジエステラーゼ(CAPD)に対するグリチルリチン酸(およびグリチルレチン酸)の強い阻害効果を役立たせることにより抗鬱病薬剤および受容体後機序に関する最近の研究進展を組み合わせる。本発明の抗鬱病機能は多くの動物実験で証明されてきた。ジンセノサイドおよびグリチルリチン酸(およびグリチルレチン酸)が対になったときcAMPの使用および活性をさらに増大するために相乗効果的に作用する。cAMPの結果としての濃度および活性は(1)ノルエピネフリン等のような神経伝達物質の合成および分泌を増大し、(2)脳由来の神経親和性因子(BDNF)の発現を増大し、そして(3)著しい抗鬱病機能を達成するように視床下部−脳下垂体−腎傍(HPA)軸椎および糖質コルチコイドの分泌作用の過敏性を阻害できる。追加的に、棗cAMPはまた抗鬱病機能を誘起するように人間のcAMPの水準を増大することができる。棗cAMPの微量(1万分の1)が動物実験で抗実験鬱病機能を実施するために1%の棗cAMPを有する棗抽出物として抽出されそして精製される。結果は1%の棗cAMPを含む棗抽出物は著しい抗実験鬱病機能を有することを示す。しかしながら、正常の棗抽出物(例えば、加熱によって水に抽出される棗、しかしその中の棗cAMPの濃度はさらには増加しない)は、微量の棗cAMPを含むけれども、明らかな抗実験鬱病機能を有さない。本発明の抗鬱病効果をさらに増大するために、本発明の棗cAMP、ジンセノサイドおよびグリチルリチン酸はさらに対になりそして集合的に作用する。チョウセンニンジン、甘草(カンゾウ)および棗は中国の医療では一般的な薬剤材料および食品であり、そして数千年の間食事の栄養になる医療食において使用されてきている。医療および食事の使用の数千年の歴史において、対および一緒に摂取されるチョウセンニンジン、甘草および棗の安全性は十分に証明されている。発明者の研究および実験結果は、もしこれらの3つの材料が普通に単に個々に煎じられそして抽出されるなら、鬱病治療のため本抗鬱病薬剤をもつ抽出体と比較して著しい抗鬱病効果を有しない。これは本発明において抽出物の効果的な成分(ジンセノサイドRg1およびRb1、および棗cAMP等のような)の濃度が精製(クロマトグラフィのような)によってさらに増大され、そして生の材料(グリチルリチン酸およびグリチルレチン酸等のような)が鬱病治療のための薬剤を調整するため抽出物に添加されるからである。動物実験はこのように作られる薬剤が従来の抗鬱病薬剤と比べて著しい優れた抗鬱病機能を有すること示す。抽出、クロマトグラフィそして精製後これらの3つの薬剤材料からの破片(debris)は高性能液体クロマトグラフィ(HPLC)によってまた収集されそして試験された。破片は微量のジンセノサイドRg1およびRb1、グリチルリチン酸および棗cAMPを含むけれども、破片は動物実験によって試験されたような著しい抗鬱病機能を有しない。重要なことに、チョウセンニンジン、甘草および棗は激しい嘔吐等のような副作用を生じない。それ故、発明者は鬱病治療のため多重標的および受容体前機構をもつジンセノサイドRg1およびRb1、グリチルリチン酸および棗cAMPを含む生の材料から経口薬剤あるいは健康食品を提案する。特に、溶媒(水およびエタノール等のような)中で加熱による抽出に加えて、抽出物は生の材料(ジンセノサイドRg1およびRb1、および棗cAMP)の濃度を増大させるためにさらに精製され、そしてグリチルリチン酸およびグリチルレチン酸がここに添加される。新しい技術計画は、流通し使用可能な抗鬱病剤の不適当を克服するために、確実な機能および成分、明らかな治療上の効果、長期間使用のための高い安全性を有し、そして嘔吐等の副作用を含まないで調整される。
【0009】
本発明の薬剤組成物およびロリプラムの抗鬱病薬剤指標および機序の比較が次ぎに提供される。

【0010】
本発明の薬剤および受容体後機序をもつ抗鬱病薬剤(ロリプラム)間の差異は抗鬱病反応が多重標的および受容体後機序によって達成されそしてロリプラムにより引き起こされる副作用(激しい嘔吐等のような)が避けられることにある。
【0011】
人間の身体内でグリチルリチン酸のグリチルレチン酸への転換率は殆ど100%であり、そしてグリチルレチン酸はグリチルリチン酸よりもその高い脂質溶解性により、血液−脳バリアを通して脳内に侵入できる。それ故、CAPDに対するグリチルリチン酸の阻害性は身体内でグリチルリチン酸のグリチルレチン酸への転換によって進展される。従って、グリチルリチン酸あるいはグリチルレチン酸は本発明の薬剤組成物を製造するための生の材料であり得る。
【0012】
本発明の1つの観点に従って、鬱病治療のため多重標的受容体後機序をもつ薬剤組成物が提供される。薬剤組成物は次ぎを含む:ジンセノサイドRg1およびRb1、グリチルリチン酸、グリチルレチン酸およびこれらの組み合わせからなる群から選ばれる1つであるグリチルリチン酸関連の酸、および棗cAMP。
【0013】
望ましくは、薬剤組成物は2〜26重量部のジンセノサイド、3〜48重量部のグリチルリチン酸的に関連の酸、および0.002〜0.5重量部の棗cAMPを含む。
【0014】
望ましくは、薬剤組成物は4〜13重量部のジンセノサイド、5〜16重量部のグリチルリチン酸関連の酸、および0.01〜0.1重量部の棗cAMPを含む。
【0015】
望ましくは、ジンセノサイドはチョウセンニンジンから抽出され、グリチルリチン酸関連の酸は甘草から抽出され、そして棗cAMPは棗から抽出される。
【0016】
望ましくは、棗は第1の棗cAMP濃度を有する第1の抽出物を得るために抽出され、第1の抽出物は第2の棗cAMP濃度を有する第2の抽出物を得るためにさらに抽出され、第2の棗cAMP濃度は第1の棗cAMP濃度よりも高く、そして第2の抽出物は薬剤組成物において生の材料である。
【0017】
本発明の他の観点に従って、鬱病治療のための多重標的受容体後薬剤組成物が提供される。薬剤組成物は次ぎを含む:ジンセノサイド;グリチルリチン酸、グリチルレチン酸およびこれらの組み合わせからなる群から選択される1つであるグリチルリチン酸関連の酸。
【0018】
望ましくは、ジンセノサイドはRg1およびRb1を含む。
【0019】
望ましくは、薬剤組成物は2〜26重量部のジンセノサイド、3〜48重量部のグリチルリチン酸関連の酸を含む。
【0020】
望ましくは、薬剤組成物は4〜13重量部のジンセノサイド、5〜16重量部のグリチルリチン酸関連の酸を含む。
【0021】
望ましくは、ジンセノサイドはチョウセンニンジンから精製され、グリチルリチン酸関連の酸は甘草から精製される。
【0022】
望ましくは、薬剤組成物は少なくとも1つの薬理学的に許容される担体および添加剤を含む。
【0023】
望ましくは、薬剤組成物は錠剤、カプセル、粉末、丸薬、微粒子、溶液、マイクロカプセル、懸濁液、粒子、滴下する丸薬および巻物からなる群から選ばれる1つである投与形態を有する。
【0024】
望ましくは、薬剤組成物は健康食品および栄養補助剤(サプリメントとも云う)の1つとして製造される。
【0025】
本発明の他の観点に従って、鬱病治療のための多重標的受容体後機序をもつ薬剤組成物の調整方法が提供される。薬剤組成物は生の材料として棗cAMPを含む。調整方法は次の段階を含む:(a)第1の棗cAMP濃度を有する第1の抽出物を得るために棗を抽出する;そして(b)第2の棗cAMP濃度を有する第2の抽出物を得るために第1の抽出物を精製し、ここで第2の棗cAMP濃度は第1の棗cAMP濃度よりも高い。
【0026】
望ましくは、段階(b)はアルデヒド基と結合するマクロ多孔性樹脂で第1抽出物をクロマトグラフ法によって実施される。
【0027】
望ましくは、マクロ多孔性樹脂はOU−2である。
【0028】
望ましくは、第1の抽出物はアルデヒド基と結合するME−2マクロ多孔性樹脂でさらにクロマトグラフ法にかけられる。
【0029】
本発明の明細書および特許請求項に記載される鬱病治療のための経口薬剤は本発明の目的の核心的内容である。本発明が公開された後、当業者は、中国医薬の理論あるいは近代薬理学の関連する理論に従って上述の薬剤に特有の効果/機能を有する薬草の医薬(オンジサポニン、サイコサポニンおよびリコリスクマリン等のような)の他の効果的な成分に対して通常の増加/減少あるいは置換を実施できる。この通常の増加/減少、同様の機構を有する薬草の医薬、他の確実なCAPD阻害剤、AC開始剤、あるいは相応する効果的な成分の置換は当業者の通常の技術活動に属する。それ故、置換は本発明の保護範囲である。
【0030】
本発明の上述の目的および優位性は次の詳細な記載および付帯図面を閲読した後、通常の当業者にもっと容易に明らかになるであろう。
【図面の簡単な説明】
【0031】
【図1】図1は本発明の第1の望ましい実施態様に従う薬剤組成物の調整方法を示すフロ−チャートである。
【図2】図2は本発明の第2の望ましい実施態様に従う薬剤組成物の調整方法を示すフロ−チャートである。
【図3】図3は本発明の第3の望ましい実施態様に従う薬剤組成物の調整方法を示すフロ−チャートである。
【図4】図4は本発明の第4の望ましい実施態様に従う薬剤組成物の調整方法を示すフロ−チャートである。
【図5】図5は本発明の第5の望ましい実施態様に従う薬剤組成物の調整方法を示すフロ−チャートである。
【図6】図6は本発明の第6の望ましい実施態様に従う薬剤組成物の調整方法を示すフロ−チャートである。
【発明を実施するための形態】
【0032】
[望ましい実施態様の詳細説明]
本発明は次の実施態様を参照してもっと明確に今記載される。本発明の望ましい実施態様の次の説明は図および説明の目的にのみここに提示されていることが注意されることである;網羅的であること、あるいは開示される正確な形式に制約されることは意図されない。
【0033】
本発明の目的を完成させるために、本発明の技術的計画は特に次のように提供される。
【0034】
鬱病治療のための多重標的および受容体後機序をもつ薬剤組成物は本発明において開示され、そして薬剤化合物はジンセノサイドRg1およびRb1、およびグリチルリチン酸(あるいはグリチルレチン酸)の生の材料を含むことによって製造される。
【実施例1】
【0035】
鬱病治療のための本発明の多重標的および受容体後機序をもつ薬剤組成物はジンセノサイドRg1およびRb1、およびグリチルリチン酸(あるいはグリチルレチン酸)の生の材料を含むことによって製造される。
【実施例2】
【0036】
本発明の薬剤組成物は全体の2〜26重量部のジンセノサイドRg1およびRb1、および3〜48重量部のグリチルリチン酸(あるいはグリチルレチン酸)を有する生の材料から製造される。
【実施例3】
【0037】
本発明の薬剤組成物は全体の4〜13重量部のジンセノサイドRg1およびRb1、および5〜16重量部のグリチルリチン酸(あるいはグリチルレチン酸)を有する生の材料を含むことによって製造される。
【実施例4】
【0038】
本発明の鬱病治療のための多重標的および受容体後機序をもつ薬剤組成物はジンセノサイドRg1およびRb1、およびグリチルリチン酸(あるいはグリチルレチン酸)および棗cAMPの生の材料を含むことによって製造される。
【実施例5】
【0039】
本発明の薬剤組成物は全体の2〜26重量部のジンセノサイドRg1およびRb1、および3〜48重量部のグリチルリチン酸(あるいはグリチルレチン酸)および0.002〜0.5重量部の棗cAMPを有する生の材料を含むことによって製造される。
【実施例6】
【0040】
本発明の薬剤組成物は全体の4〜13重量部のジンセノサイドRg1およびRb1、および5〜16重量部のグリチルリチン酸(あるいはグリチルレチン酸)および0.01〜0.1重量部の棗cAMPを有する生の材料を含むことによって製造される。
【実施例7】
【0041】
本発明の薬剤組成物は薬理学的に許容できる担体および添加剤を含む。薬剤化合物は投与形態として製造され得て、そして投与形態は錠剤、カプセル、粉末、丸薬、微粒子、溶液、マイクロカプセル、懸濁液、粒子、滴下する丸薬、巻物および薬理学的に経口薬剤投与形態の1つから選ばれる。
【実施例8】
【0042】
本発明の薬剤組成物は鬱病治療のための薬剤、健康食品および栄養補助剤として製造され得る。
【0043】
本発明の目的を完成するために、薬剤組成物の調整方法が次ぎに記載される。
【0044】
[方法1]
鬱病治療のための本発明の多重標的および受容体後機序をもつ薬剤組成物は生の材料としてチョウセンニンジンから抽出されるジンセノサイドRg1およびRb1を有する1つの抽出物、および甘草から抽出されるグリチルリチン酸を有する他の抽出物から製造される。付け加えると、前述の薬剤組成物はジンセノサイドRg1およびRb1、およびグリチルリチン酸(あるいはグリチルレチン酸)を有する調整された生の材料を直接使用することによって製造される。
【0045】
[方法2]
本発明の薬剤組成物は全体の2〜26重量部のジンセノサイドRg1およびRb1、および3〜48重量部のグリチルリチン酸(あるいはグリチルレチン酸)を有する生の材料から製造される。
【0046】
[方法3]
本発明の薬剤組成物は全体の4〜13重量部のジンセノサイドRg1およびRb1、および5〜16重量部のグリチルリチン酸(あるいはグリチルレチン酸)を有する生の材料を含むことによって製造される。
【0047】
[方法4]
鬱病治療のための本発明の多重標的および受容体後機序をもつ薬剤組成物は生の材料としてチョウセンニンジンから抽出されるジンセノサイドRg1およびRb1を有する1つの抽出物、甘草から抽出されるグリチルリチン酸を有する他の抽出物、および棗から抽出される棗cAMPを有する別の抽出物から製造される。付け加えると、前述の薬剤組成物はジンセノサイドRg1およびRb1、グリチルリチン酸(あるいはグリチルレチン酸)および棗cAMPを有する調整された生の材料を直接使用することによって製造される。
【0048】
[方法5]
本発明の薬剤組成物は全体の2〜26重量部のジンセノサイドRg1およびRb1、3〜48重量部のグリチルリチン酸(あるいはグリチルレチン酸)および0.002〜0.5重量部の棗cAMPを有する生の材料から製造される。
【0049】
[方法6]
本発明の薬剤組成物は全体の4〜13重量部のジンセノサイドRg1およびRb1、5〜16重量部のグリチルリチン酸(あるいはグリチルレチン酸)および0.01〜0.1重量部の棗cAMPを有する生の材料から製造される。
【0050】
[方法7]
本発明の薬剤組成物は薬理学的に許容できる担体および添加剤を含み得る。薬剤組成物は投与形態として製造され得て、そして投与形態は錠剤、カプセル、粉末、丸薬、微粒子、溶液、マイクロカプセル、懸濁液、粒子、滴下する丸薬、巻物および薬理学的に経口薬剤投与形態の1つから選ばれる。
【0051】
[方法8]
本発明の薬剤組成物は健康食品に関する良い製造実施(Good Manufacturing Practce(GMP))の方法に従って本発明に記載される生の材料から製造され得る。
【0052】
[望ましい実施態様]
本発明は図面および望ましい実施態様の組み合わせによって次のようにさらに図示される。
【0053】
[実施態様1]
本発明の第1の望ましい実施態様に従い薬剤組成物の調整方法を示すフローチャートである図1を参照して下さい。図1において、20kgのチョウセンニンジンが砕かれる後、砕かれたチョウセンニンジンは70%の濃度のエタノール溶液によって抽出するために加熱される。抽出されたチョウセンニンジンはカラムクロマトグラフィによって分離され、精製されそして乾燥され、そして120gのジンセノサイドRg1およびRb1を有する0.8kgのチョウセンニンジン抽出物が得られる。それから、10kgの甘草が砕かれる後、砕かれた甘草が室温で12時間浸漬される。浸漬された甘草が脱炭素およびアルコール沈澱によって抽出され、濃縮されおよび乾燥され、そして200gのグリチルリチン酸を有する2kgの甘草抽出物が得られる。その後、150gの得られたチョウセンニンジン抽出物および200gの甘草抽出物が粉砕されそして混合され、そして本発明の実施例1の350gの薬剤組成物(22.5gのジンセノサイドRg1およびRb1、そして20gのグリチルリチン酸を含む)が得られる。
【0054】
[実施態様2]
本発明の第2の望ましい実施態様に従い薬剤組成物の調整方法を示すフローチャートである図2を参照して下さい。図2において、純度96%を有する調整された3.96gのグリチルレチン酸および実施態様1において得られた200gのチョウセンニンジン抽出物が粉砕されそして混合される後、本発明の実施例2の203.96gの薬剤組成物(30gのジンセノサイドRg1およびRb1、そして3.8gのグリチルレチン酸を含む)が得られる。
【0055】
[実施態様3]
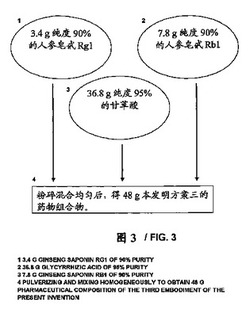
本発明の第3の望ましい実施態様に従い薬剤組成物の調整方法を示すフローチャートである図3を参照して下さい。図3において、純度90%を有する調整された3.4gのジンセノサイドRg1、純度90%を有する調整された7.8gのジンセノサイドRb1および純度90%を有する36.8gのグリチルリチン酸が粉砕されそして混合される後、本発明の実施例3の48gの薬剤組成物(10gのジンセノサイドRg1およびRb1、そして35gのグリチルリチン酸を含む)が得られる。
【0056】
[実施態様4]
本発明の第4の望ましい実施態様に従い薬剤組成物の調整方法を示すフローチャートである図4を参照して下さい。図4において、10kgの棗が砕かれそして室温で水に浸漬される。それから、浸漬された棗が棗抽出物を得るために脱炭素およびアルコール沈澱によって抽出され、それは連続してOU−2およびME−2マクロ多孔性樹脂によってさらに吸収されそして分離される。0.3gの棗cAMPを含む30gの棗抽出物が本発明の薬剤を調整するため生の材料として得られる。
【0057】
その後、実施態様1において得られた150gのチョウセンニンジン抽出物および200gの甘草抽出物が粉砕されそして後述される3gの棗抽出物と混合される後、本発明の実施例の353gの薬剤組成物(22.5gのジンセノサイドRg1およびRb1、20gのグリチルリチン酸および0.03gの棗cAMPを含む)が得られる。
【0058】
[実施態様5]
本発明の第5の望ましい実施態様に従い薬剤組成物の調整方法を示すフローチャートである図5を参照して下さい。図5において、実施態様1においてそれぞれ得られた150gのチョウセンニンジン抽出物および200gの甘草抽出物が粉砕されそして実施態様4において得られた05gの棗抽出物と混合される後、本発明の実施例5の350.5gの薬剤組成物(22.5gのジンセノサイドRg1およびRb1、20gのグリチルリチン酸そして0.005gの棗cAMPを含む)が得られる。
【0059】
[実施態様6]
本発明の第6の望ましい実施態様に従い薬剤組成物の調整方法を示すフローチャートである図6を参照して下さい。図6において、純度90%を有する調整された6.8gのジンセノサイドRg1、純度90を有する調整されるジンセノサイドRb1、純度96%を有する26gのグリチルレチン酸および実施態様4において得られた10gの棗抽出物が粉砕されそして混合される後、本発明の実施例6の58.4gの薬剤組成物(20gのジンセノサイドRg1およびRb1、25gのグリチルリチン酸そして0.1gの棗cAMPを含む)が得られる。
【0060】
[実験1:ハツカネズミ(mouse)の尻尾吊り下げ実験における実施態様1の影響]
1.1 実験動物:ICR ハツカネズミ、雄、体重22.0±2g、二級、北京、首都医科大学の実験動物科学部によって提供される。
【0061】
1.2 実験薬剤:実施態様1の薬剤がBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.の製品である。
【0062】
1.3 実験器具:ストップウオッチ。
【0063】
1.4 投与量設計:1.実施態様1の高投与量(80mg/kg/d);2.実施態様1の中間投与量(40mg/kg/d);および3.実施態様1の低投与量(20mg/kg/d)。
【0064】
1.5 実験方法および結果:
【0065】
1.5.1 グループ区分および医薬品の投与:ハツカネズミは無作為にグループ分けされ、そして10匹のハツカネズミがそれぞれのグループである。1.実施態様1の高投与量(80mg/kg、経口当り(P.O.)、7日間投与);2.実施態様1の中間投与量(40mg/kg、P.O.、7日間投与);3.実施態様1の低投与量(20mg/kg、P.O.、7日間投与);4.パロキセチン(3mg/kg、P.O.、7日間投与);および5.生理食塩水(P.O.)。医薬品の最終投与1時間後、ハツカネズミの尻尾吊り下げ実験が実施される。
【0066】
1.5.2 実験方法:ハツカネズミの尻尾(尻尾の端に1cm)が5cm台より高く木製帯板上にテープ止めされそして6分間吊り下げられる。最終の5分間ハツカネズミの無動作の時間が記録される。
【0067】

【0068】
1.5.4 実験結果:表1を参照して下さい。

【0069】
結論:上記の実験に従って、本発明の実施態様1の高および中間投与量およびパロキセチンの全てがハツカネズミの尻尾が吊り下げられる後、生理グループ(照合)と比較して著しく異なって減少することがみられ得る。それ故、抗実験鬱病機能を有する本発明の実施態様1は外挿され得る。
【0070】
[実験2:レセトピン誘起ハツカネズミの身体温度低下実験における実施態様1の影響]
2.1 実験動物:ICR ハツカネズミ、雄、体重22.0±2g、二級、北京、首都医科大学の実験動物科学部によって提供される。
【0071】
2.2 実験薬剤:実施態様1の薬剤がBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.の製品であり、そしてレセトピンはGuangdong BangMin Pharmaceuticals Co.Ltd.の製品である。
【0072】
1.3 実験器具:電子温度計(型式:GM222)およびストップウオッチ。
【0073】
2.4 投与量設計:1.実施態様1の高投与量(80mg/kg/d);2.実施態様1の中間投与量(40mg/kg/d);および3.実施態様1の低投与量(20mg/kg/d)。
【0074】
2.5 実験方法および結果:
【0075】
2.5.1 グループ区分および医薬品の投与:ハツカネズミは無作為にグループ分けされ、そして10匹のハツカネズミがそれぞれのグループである。1.実施態様1の高投与量(80mg/kg、P.O.、7日間投与);2.実施態様1の中間投与量(40mg/kg、P.O.、7日間投与);3.実施態様1の低投与量(20mg/kg、P.O.、7日間投与);4.パロキセチン(3mg/kg、P.O.、7日間投与);および5.生理食塩水(P.O.)。
【0076】
2.5.2 実験方法:第8日の医薬品の最終投与の1時間後ハツカネズミの肛門温度が決定される。それから体重kg当り2mgのレセトピンが腹腔内注射によって与えられる。レセトピン注射の4時間後、ハツカネズミの肛門温度が再び決定される。ハツカネズミの肛門への温度計の挿入深さおよび時間は各温度測定において同一である。
【0077】

【0078】
2.5.4 実験結果:表2を参照して下さい。

【0079】
結論:上記の実験に従って、本発明の実施態様1の高、中間および低投与量およびパロキセチンの全てがレセトピンによって誘起され変えられる身体温度を低下することがみられ得る;これらの薬剤の抗実験鬱病機能はモノアミン神経伝達物質の含有量に関してこれらの効果に関連付けられることを意味する。それ故、抗実験鬱病機能を有する本発明の実施態様1は外挿され得る。
【0080】
[実験3:ハツカネズミの尻尾吊り下げ実験における実施態様2の影響]
3.1 実験動物:ICR ハツカネズミ、雄、体重22.0±2g、二級、北京、首都医科大学の実験動物科学部によって提供される。
【0081】
3.2 実験薬剤:実施態様2の薬剤がBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.の製品である。
【0082】
3.3 実験器具:ストップウオッチ。
【0083】
3.4 投与量設計:1.実施態様2の高投与量(80mg/kg/d);2.実施態様2の中間投与量(40mg/kg/d);および3.実施態様1の低投与量(20mg/kg/d)。
【0084】
3.5 実験方法および結果:
【0085】
3.5.1 グループ区分および医薬品の投与:ハツカネズミは無作為にグループ分けされ、そして10匹のハツカネズミがそれぞれのグループである。1.実施態様2の高投与量(80mg/kg、経口当り(P.O.)、7日間投与);2.実施態様2の中間投与量(40mg/kg、P.O.、7日間投与);3.実施態様2の低投与量(20mg/kg、P.O.、7日間投与);4.パロキセチン(3mg/kg、P.O.、7日間投与);および5.生理食塩水(P.O.)。医薬品の最終の投与1時間後、ハツカネズミの尻尾吊り下げ実験が実施される。
【0086】
3.5.2 実験方法:ハツカネズミの尻尾(尻尾の端に1cm)が5cm台より高く木製帯板上にテープ止めされそして6分間吊り下げられる。最終の5分間ハツカネズミの無動作の時間が記録される。
【0087】

【0088】
3.5.4 実験結果:表3を参照して下さい。

【0089】
結論:上記の実験に従って、本発明の実施態様2の中間投与量およびパロキセチンの全てがハツカネズミの尻尾が吊り下げられる後、生理食塩水グループ(照合)と比較して著しく異なって減少することがみられ得る。それ故、抗実験鬱病機能を有する本発明の実施態様2は外挿され得る。
【0090】
[実験4:レセトピン誘起ハツカネズミの身体温度低下実験における実施態様2の影響]
4.1 実験動物:ICR ハツカネズミ、雄、体重22.0±2g、二級、北京、首都医科大学の実験動物科学部によって提供される。
【0091】
4.2 実験薬剤:実施態様2の薬剤がBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.の製品であり、そしてレセトピンはGuangdong BangMin Pharmaceuticals Co.Ltd.の製品である。
【0092】
4.3 実験器具:電子温度計(型式:GM222)およびストップウオッチ。
【0093】
4.4 投与量設計:1.実施態様2の高投与量(80mg/kg/d);2.実施態様2の中間投与量(40mg/kg/d);および3.実施態様2の低投与量(20mg/kg/d)。
【0094】
4.5 実験方法および結果:
【0095】
4.5.1 グループ区分および医薬品の投与:ハツカネズミは無作為にグループ分けされ、そして10匹のハツカネズミがそれぞれのグループである。1.実施態様2の高投与量(80mg/kg、P.O.、7日間投与);2.実施態様2の中間投与量(40mg/kg、P.O.、7日間投与);3.実施態様2の低投与量(20mg/kg、P.O.、7日間投与);4.パロキセチン(3mg/kg、P.O.、7日間投与);および5.生理食塩水(P.O.)。
【0096】
4.5.2 実験方法:第8日の医薬品の最終投与の1時間後ハツカネズミの肛門温度が決定される。それから体重kg当り2mgのレセトピンが腹腔内注射によって与えられる。レセトピン注射の4時間後、ハツカネズミの肛門温度が再び決定される。ハツカネズミの肛門への温度計の挿入深さおよび時間は各温度測定において同一である。
【0097】

【0098】
4.5.4 実験結果:表4を参照して下さい。

【0099】
結論:上記の実験に従って、本発明の実施態様2の中間投与量およびパロキセチンの全てがレセトピンによって誘起され変えられる身体温度を低下することがみられ得る;薬剤の抗実験鬱病機能はモノアミン神経伝達物質の含有量に関してこれらの効果に関連付けられることを意味している。それ故、抗実験鬱病機能を有する本発明の実施態様2は外挿され得る。
【0100】
[実験5:ハツカネズミの尻尾吊り下げ実験における実施態様3の影響]
5.1 実験動物:ICR ハツカネズミ、雄、体重22.0±2g、二級、北京、首都医科大学の実験動物科学部によって提供される。
【0101】
5.2 実験薬剤:実施態様2の薬剤がBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.の製品である。
【0102】
5.3 実験器具:ストップウオッチ。
【0103】
5.4 投与量設計:1.実施態様3の高投与量(80mg/kg/d);2.実施態様3の中間投与量(40mg/kg/d);および3.実施態様3の低投与量(20mg/kg/d)。
【0104】
5.5 実験方法および結果:
【0105】
5.5.1 グループ区分および医薬品の投与:ハツカネズミは無作為にグループ分けされ、そして10匹のハツカネズミがそれぞれのグループである。1.実施態様3の高投与量(80mg/kg、P.O.、7日間投与);2.実施態様3の中間投与量(40mg/kg、P.O.、7日間投与);3.実施態様3の低投与量(20mg/kg、P.O.、7日間投与);4.パロキセチン(3mg/kg、P.O.、7日間投与);および5.生理食塩水(P.O.)。医薬品の最終の投与1時間後、ハツカネズミの尻尾吊り下げ実験が実施される。
【0106】
5.5.2 実験方法:ハツカネズミの尻尾(尻尾の端に1cm)が5cm台より高く木製帯板上にテープ止めされそして6分間吊り下げられる。最終の5分間ハツカネズミの無動作の時間が記録される。
【0107】

【0108】
5.5.4 実験結果:表5を参照して下さい。

【0109】
結論:上記の実験に従って、本発明の実施態様3の高および中間投与量およびパロキセチンの全てがハツカネズミの尻尾が吊り下げられる後、生理食塩水グループ(照合)と比較して著しく異なって減少することがみられ得る。それ故、抗実験鬱病機能を有する本発明の実施態様3は外挿され得る。
【0110】
[実験6:レセトピン誘起ハツカネズミの身体温度低下実験における実施態様3の影響]
6.1 実験動物:ICR ハツカネズミ、雄、体重22.0±2g、二級、北京、首都医科大学の実験動物科学部によって提供される。
【0111】
6.2 実験薬剤:実施態様3の薬剤がBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.の製品であり、そしてレセトピンはGuangdong BangMin Pharmaceuticals Co.Ltd.の製品である。
【0112】
6.3 実験器具:電子温度計(型式:GM222)およびストップウオッチ。
【0113】
6.4 投与量設計:1.実施態様3の高投与量(80mg/kg/d);2.実施態様3の中間投与量(40mg/kg/d);および3.実施態様3の低投与量(20mg/kg/d)。
【0114】
6.5 実験方法および結果:
【0115】
6.5.1 グループ区分および医薬品の投与:ハツカネズミは無作為にグループ分けされ、そして10匹のハツカネズミがそれぞれのグループである。1.実施態様3の高投与量(80mg/kg、P.O.、7日間投与);2.実施態様3の中間投与量(40mg/kg、P.O.、7日間投与);3.実施態様3の低投与量(20mg/kg、P.O.、7日間投与);4.パロキセチン(3mg/kg、P.O.、7日間投与);および5.生理食塩水(P.O.)。
【0116】
6.5.2 実験方法:第8日の医薬品の最終投与の1時間後ハツカネズミの肛門温度が決定される。それから体重kg当り2mgのレセトピンが腹腔内注射によって与えられる。レセトピン注射の4時間後、ハツカネズミの肛門温度が再び決定される。ハツカネズミの肛門への温度計の挿入深さおよび時間は各温度測定において同一である。
【0117】

【0118】
6.5.4 実験結果:表6を参照して下さい。

【0119】
結論:上記の実験に従って、本発明の実施態様3の高、中間および低投与量およびパロキセチンの全てがレセトピンによって誘起され変えられる身体温度を低下することがみられ得る;薬剤の抗実験鬱病機能はモノアミン神経伝達物質の含有量に関してこれらの効果に関連付けられることを意味している。それ故、抗実験鬱病機能を有する本発明の実施態様3は外挿され得る。
【0120】
[実験7:ドブネズミ(rat)の嗅球損傷実験における実施態様4の影響]
7.1 実験動物:
【0121】
嗅球損傷モデル:Health Wisterの雄のドブネズミ、二級、体重330±20gが、Beijing Vital River Experimental Animal Technology Ltd. Co.より購入される(品質証明番号:SCXK(JING)2002−2003)。
【0122】
7.2 薬品および薬剤:実施態様4の薬剤はBeijing Wonner Biotech Ltd. Co.(ロット:060313)によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.(ロット:04050011)の製品である。上記の薬剤は胃内に供給するため0.5%のナトリウムカルボキシメチルセルロース(CMC−Na)で調整される。注射のためのナトリウムベンジルペニシリンはNorth China Phermaceutical Huasheng Co. Ltd.の製品(ロット:S0511204)であり、そしてノルエピネフリン(NE)および5−ヒドロトリプタミン(5−HT)標準品はSigma Co.の製品である。他の薬品は全て市販品である。
【0123】
7.3 器具:自家製の開放フィールド活動箱、ステップスルー箱、ドブネズミ定位器具、高性能液体クロマトグラフィ(HPLC)および10−チューブγ線免疫アリスモメーター(型式:DFM−96)。
【0124】
7.4 実験方法
【0125】
7.4.1 グループ区分および医薬品の投与:ドブネズミは無作為に6グループ分けされる。1.偽の治療グループ;2.モデルグループ(照合)、3.実施態様4の高投与量(60mg/kg/d);4.実施態様4の中間投与量(30mg/kg/d);5.実施態様4の低投与量(15mg/kg/d);および6.パロキセチン(2mg/kg/d)。試験医薬品および受動的医薬品は1日に1回胃内に供給するため0.5%のCMC−Naで調整される。
【0126】
7.4.2 モデルの調整方法:ドブネズミは抱水クロラールによって麻酔される。麻酔後、ドブネズミの泉門の正中線は前泉門の前1cmから前泉門の後ろ1cm切開され、そして頭蓋骨が曝露される。直径2mmを有する頭蓋骨窓は前泉門の前8mmからそして正中線の2つの側の2mmから開かれる。特製の電気半田鏝が2秒間頭蓋骨に垂直に挿入され、そして嗅球が破壊される。止血スポンジが頭蓋骨窓に充填されそして皮膚が縫合される。治療の後、体重kg当り40,000ユニットのベンジルペニシリンが4日毎に腹腔内注射によって与えられ、そして試験される薬剤が24日間連続的に摂取される。
【0127】
7.5 観察指標:
【0128】
7.5.1 開放フィールド活動実験:開放フィールド活動箱(1m×1m×0.4m)が紺色の合板およびアルミニウム枠によって作られる。箱の底は25格子(各格子当り20cm×20cm)に区分され、外周は周囲の格子(16格子)で、そして中央格子(9格子)である。ドブネズミは中央格子の中央に置かれ、そしてドブネズミの交差格子数(3つの鉤形よりも多い隣接の格子内に交差する数)およびドブネズミの立ち上がる数(1cm以上床から離れる2つの前脚)が3分以内で計算され/観察される。
【0129】
7.5.2 受動的回避実験(ステップスルー学習実験):ステップスルー箱は明るい部屋と暗い部屋によって構成され、経路がドブネズミの入口および出口のため明るい部屋と暗い部屋の間を連絡される。暗い部屋の格子窓は電気衝撃装置に接続されそして可働板がその間に組み立てられる。もしドブネズミが暗い部屋へ入ると、ドブネズミは電気的に衝撃される。訓練の間、ドブネズミは明るい部屋に置かれそして5分間適応のため穴に戻る。それから、板は撤去されそしてドブネズミはもう5分間観察される。ドブネズミが最初に侵入する時(電気衝撃の潜伏期間)が記録され、そしてその時間が学習記録である。24時間の後、試験が繰り返される。板が撤去され暗い部屋が5分間通電され、ドブネズミが最初に暗い部屋内に入る時を観察するようにする。これがその記憶記録である。
【0130】

【0131】
7.7 実験結果:
【0132】
7.7.1 開放フィールド活動実験結果:表7を参照して下さい。

【0133】
7.7.2 ステップスルー学習試験の結果:表8を参照して下さい。

【0134】
結論:実験7の結果は実施態様4の高投与量は嗅球損傷によって起こされるドブネズミの水平および垂直動作の増加が明らかに減り得て、そして実施態様4の中間投与量はドブネズミの嗅球損傷モデルの垂直動作の増加に関して明らかな改善機能をまた有していることを示す。付け加えて、実施態様4の高および中間投与量は嗅球損傷によって起こされるドブネズミの研究および記憶機能の減少に関して明らかな改善効果を有している。
【0135】
[実験8:ドブネズミの予知できない長期間の刺激実験における実施態様4の影響]
8.1 実験動物:
【0136】
予知できない長期間の刺激モデル:Health Wisterの雄のドブネズミ、二級、体重240〜270gが、Beijing Vital River Experimental Animal Technology Ltd. Co.より購入される(品質証明番号:SCXK(JING)2002−2003)。
【0137】
8.2 薬品および薬剤:実施態様4の薬剤はBeijing Wonner Biotech Ltd. Co.によって提供(ロット:060313)され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.の製品(ロット:04050011)である。上記の薬剤は胃内に供給するため0.5%のナトリウムカルボキシメチルセルロース(CMC−Na)で調整される。注射のためのナトリウムベンジルペニシリンはNorth China Phermaceutical Huasheng Co. Ltd.の製品(ロット:S0511204)であり、そしてノルエピネフリン(NE)および5−ヒドロトリプタミン(5−HT)標準品はSigma Co.の製品である。他の薬品は全て市販品である。
【0138】
8.3 器具:自家製の開放フィールド活動箱、ステップスルー箱、ドブネズミ定位器具、高性能液体クロマトグラフィ(HPLC)および10−チューブγ線免疫アリスモメーター(型式:DFM−96)。
【0139】
8.4 実験方法
【0140】
8.4.1 グループ区分および医薬品の投与:ドブネズミは無作為に6グループ分けされる。1.偽の治療グループ;2.モデルグループ(照合)、3.実施態様4の高投与量(60mg/kg/d);4.実施態様4の中間投与量(30mg/kg/d);5.実施態様4の低投与量(15mg/kg/d);および6.パロキセチン(2mg/kg/d)。試験医薬品および受動的医薬品は1日に1回胃内に供給するため0.5%のCMC−Naで調整される。
【0141】
8.4.2 モデルの調整方法:
【0142】
予知できない長期間の刺激モデル:照合グループのドブネズミは通常に食べそして飲み、そこでは刺激は行われない。他の5グループにおいては、1つのドブネズミは各籠で供給され、そしてドブネズミは24日予知できないストレス/刺激に曝され、3回24時間の断食、3回24時間無飲料、3回24時間湿った床(200mLの水がドブネズミの籠に加えられる)、3回夜間の照明、3回5分間4℃で水泳、3回5分間に亘り加熱炉で45℃で加熱、3回1分間ドブネズミの尻尾をクリップ止めし、3回30分の高速水平振動をすることを含む。1つの刺激は毎日そして全24日無作為に行われる。薬剤は全24日間毎日ドブネズミの胃内に供給される。
【0143】
8.5 観察指標
【0144】
8.5.1 開放フィールド活動実験:上記と同様。
【0145】
8.5.2 受動的回避実験:上記と同様。
【0146】
8.5.3 衝動によるドブネズミの水泳:この実験は医薬品の最終の投与の後、2日間行われる。第1日に、実験は15分間事前に行われる。ガラス容器の水温は25℃で、そして水深は25cmである。24時間の後、正式の実験が行われる。医薬品の投与1時間後、ドブネズミは容器に置かれ、そして最終の5分間ドブネズミの無動作の時間が記録される。
【0147】
8.5.4 体重測定:各動物実験の前後の増加値が比較される。
【0148】
8.5.5 蔗糖を飲む容量試験:ドブネズミの蔗糖摂取容量が比較される。各グループのドブネズミは1時間1%の蔗糖を飲む。飲む容量は刺激の前および刺激の3週間後に決定される。ドブネズミは14時間断食および水中にいる後、1%の蔗糖が籠に置かれ、そして最初の飲料水に対して置き換えられる。1時間蔗糖をドブネズミが飲む前後の容器間重量差異が測定されおよび記録され、そして各回の蔗糖を飲む容量が計算される。各回の蔗糖を飲む容量の差異が比較される。
【0149】
8.5.6 HPLC−電気化学試験:ドブネズミの大脳皮質のノルエピネフリンおよび5−ヒドロトリプタミンの量が測定される。
【0150】

【0151】
8.7 実験結果:
【0152】
8.7.1 蔗糖を飲む容量試験:表9を参照して下さい。

【0153】
8.7.2 増加するドブネズミの体重の結果:表10を参照して下さい。

【0154】
8.7.3 衝動実験によって水泳するドブネズミの無動作の時間の結果:表11を参照して下さい。

【0155】
8.7.4 ドブネズミの開放フィールド活動実験の結果:表12を参照して下さい。

【0156】
8.7.5 ステップスルー学習実験の結果:表13を参照して下さい。

【0157】
8.7.6 ドブネズミの頭蓋骨中のNEおよび5−HT含有量の結果:表14を参照して下さい。

【0158】
結論:実験8の結果は次ぎのように示される。実施態様4の中間および低投与量は予知できない長期間ストレス/刺激に反応して減少される蔗糖を飲む容量および減少される体重を明らかに改善し得る。実施態様4の高、中間および低投与量は衝動によるドブネズミの水泳の無動作の時間を明らかに増加し得る。実施態様4の高投与量は予知できない長期間ストレス/刺激によって起こされる減少するドブネズミの水平および垂直動作を明らかに改善し得る。実施態様4の低投与量は予知できない長期間ストレス/刺激によって起こされる減少するドブネズミの垂直動作に関して改善される機能を明らかに有する。実施態様4の低投与量は予知できない長期間ストレス/刺激によって起こされる減少するドブネズミの学習能力に関して改善される機能を明らかに有する。実施態様4の高、中間および低投与量はドブネズミの頭骸骨中のNEおよび5−HT含有量を明らかに増加し得る。
【0159】
[実験9:ハツカネズミの尻尾吊り下げ実験における実施態様5の影響]
9.1 実験薬剤:実施態様5の薬剤はBeijing Wonner Biotech Ltd. Co.(パイロット拡張製品)によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.(ロット:05070384)の製品である。上述の薬剤は胃の内に供給するため生理食塩水とともに供給される。
【0160】
9.2 実験動物:ICR ハツカネズミ、雄、体重20.0±1g、二級、北京、首都医科大学の実験動物科学部によって提供される。ハツカネズミの品質証明書番号はSCXK(JINK)2006−2008である。
【0161】
9.3 実験器具:ストップウオッチ。
【0162】
9.4 方法 70匹のハツカネズミが5つのグループに無作為にグループ分けされる:通常の生理食塩水(NS)グループ、パロキセチン(3mg/kg/d)、実施態様5の高投与量(80mg/kg/d)、実施態様5の中間投与量(40mg/kg/d、実施態様5の低投与量(20mg/kg/d)。薬剤は毎日1度ハツカズミの胃内に供給される。第8日に医薬品の最終投与の1時間後、ハツカネズミの尻尾(尻尾の端に1cm)は開放箱内の水平支持体の上にテープ止めされ、そしてハツカネズミは逆に吊り下げられる状況を示す。ハツカネズミの頭は開放箱の底から約10cm離れ、そしてハツカネズミは6分間吊り下げられる。最終の5分間ハツカネズミの無動作の時間が記録される。
【0163】

【0164】
9.6 実験結果:ハツカネズミの尻尾吊り下げ実験における無動作の時間の結果:表15を参照して下さい。

【0165】
結論:研究結果は実施態様5の高、中間、および低投与量そして臨床上の効果的な抗鬱病薬剤、パロキセチンの全てがハツカネズミの尻尾吊り下げ実験における無動作の累積時間を明らかに減少し得ることを示す。これは実施態様5が特別の抗実験鬱病機能を有することを示す。
【0166】
[実験10:衝動実験によってハツカネズミの水泳における実施態様5の影響]
10.1 実験薬剤:実施態様5の薬剤はBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.(ロット:05070384)の製品である。上述の薬剤は胃内に供給するため生理食塩水とともに供給される。
【0167】
10.2 実験動物:ICR ハツカネズミ、雄、体重20.0±1g、二級、北京、首都医科大学の実験動物科学部によって提供される。ハツカネズミの品質証明書番号はSCXK(JINK)2006−2008である。
【0168】
10.3 実験器具:ストップウオッチ。
【0169】
10.4 実験方法:ハツカネズミのグループおよび医薬品の投与はハツカネズミの尻尾吊り下げ実験と同様である。実験は医薬品の投与の1時間後、各グループの試験されるハツカネズミで実施される。ハツカネズミは実験前15分間および第8日に水泳するために訓練される。24時間後、実験が行われる。ハツカネズミは水深14cm、直径14cmそして25℃の水温を有するガラス容器中に置かれる。最終の5分間ハツカネズミの無動作の累計時間が記録される。
【0170】

【0171】
10.6 実験結果:衝撃によって水泳するハツカネズミの結果:表16を参照して下さい。

【0172】
結論:研究結果は実施態様5の高、中間、および低投与量そして臨床上の効果的な抗鬱病薬剤、パロキセチンの全てが衝撃試験によって水泳するハツカネズミにおける無動作の累積時間を明らかに減少し得る。それは実施態様5が特別の抗実験鬱病機能を有することを示す。
【0173】
[実験11]
実施態様1および4の抽出物から9kgの残りのチョウセンニンジンの破片(debris)、7kgの残りの甘草および0.9kgの棗の破片が微量のジンセノサイドRg1およびRb1、グリチルリチン酸および棗cAMPを含む破片混合物を得るために収集され、乾燥され、粉砕されそして良く混合される。ハツカネズミの尻尾吊り下げ試験における破片の影響を試験するため照合実験が実施される。
【0174】
11.1 実験動物:ICR ハツカネズミ、雄、体重20.0±2g、二級、北京、首都医科大学の実験動物科学部によって提供される。
【0175】
11.2 実験薬剤:破片混合物はBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.)の製品である。
【0176】
11.3 実験器具:ストップウオッチ。
【0177】
11.4 投与量設計:1.破片混合物の高投与量(160mg/kg/d;2.破片混合物の中間投与量(80mg/kg/d);3.破片混合物の低投与量(40mg/kg/d)。
【0178】
11.5 実験方法および結果
【0179】
11.5.1 グループ区分および医薬品の投与:ハツカネズミは各グループ10匹のハツカネズミで無作為にグループ分けされる。1.破片混合物の高投与量(160mg/kg、P.O.、7日間投与);2.破片混合物の中間投与量(80mg/kg、P.O.、7日間投与);3.破片混合物の低投与量(40mg/kg、P.O.、7日間投与);4.パロキセチン(3mg/kg、P.O.、7日間投与);および5.生理食塩水(P.O.)。医薬品の最終投与1時間後、ハツカネズミの尻尾吊り下げ実験が実施される。
【0180】
11.5.2 実験方法:ハツカネズミの尻尾(尻尾の端に1cm近く)は5cm台より高く木製帯板上にテープ止めされそして6分間吊り下げられる。最終の5分間ドブネズミの無動作の時間が記録される。
【0181】

【0182】
11.5.4 実験結果:表17を参照して下さい。

【0183】
結論:上記の実験に従って、破片混合物の高、中間および低投与量は尻尾吊り下げでハツカネズミの無動作の時間を短縮し得るけれども、これらの差異は生理食塩水グループ(照合)と比較して統計的に著しくない。それ故、破片混合物は抗実験鬱病機能を欠いている結論が外挿し得る。
【0184】
鬱病治療のための本発明の記載される経口薬剤は次ぎにある:
【0185】
1.鬱病治療のための本発明の記載される経口薬剤は薬理学的に許容される添加剤である;
【0186】
2.鬱病治療のための本発明の記載される経口薬剤は粉末、カプセル、錠剤等のような既知の投与形態として製造され得る;
【0187】
3.鬱病治療のための本発明の記載される経口薬剤は鬱病治療のための健康食品として製造され得る。
【0188】
本発明は現在最も実用的でそして望ましい実施態様であると考えられることに関して記載されている一方、本発明は開示される実施態様に制限される必要がないことは理解されることである。それどころか、付帯する特許請求の精神および範囲内に含まれる種々の修正および類似の配置を含むことが意図され、特許請求の範囲はこのような修正および同様な構造の全てを包含するように広範な解釈と一致されることである。
【技術分野】
【0001】
本発明は鬱病治療のためのジンセノサイド(ニンジンサポニン)Rg1およびRb1、グリチルリチン酸およびジュジュバ環状アデノシン一リン酸塩(棗cAMP)の生の材料から製造される多重標的、受容体後機序に基づく薬剤組成物に関する。特に、本発明は確実な機能および組成、明白な治療上の効果および長期間の使用に対する高い安全性を有し、そしてひどい嘔吐のような副作用のない鬱病治療のための経口薬剤あるいは健康食品に関する。
【発明の背景】
【0002】
鬱病は一般的な病気である。統計に従って、全世界の人口の約25%の女性が彼女の生活で鬱病を経験しており、約10%の男性が鬱病を経験している(Ch’un−Hsing Chang著、Modern Psycology参照)。世界保健機構(WHO)は“世界の鬱病の発病率は約11%である。現在、約3億4千万人の心理的鬱病患者が世界におり、そして数が増加しつつある。鬱病は今から20年後に世界で一般的な病気の第2番に増加するだろ”と発表した。
【0003】
現在、主な抗鬱病薬剤はプロザック、パキシルおよびゾロフト等であり、これらは5−ヒドロキシトリプタミン(5−HT)、ノルエピネフリン(NE)およびドーパミン(DA)のような神経伝達物質の再取込を阻害する選択的セロトニン再取込阻害薬(SSRI)、セレトニン−ノルエピネフリン再取込阻害薬(SNRI)そしてノルエピネフリンおよびドーパミン再取込阻害薬(NDRI)に属する。これらによる機序はこれらの抗鬱病薬剤が鬱病の症状を減じそして緩和するように人間の神経伝達物質5−HTの含有量を増大することによる。
【0004】
しかしながら、市場の抗鬱病薬剤は増加した自殺率、頭痛、目眩、目の眩み、失眼、過眠症、耳鳴り、喉の渇き、拒食、食欲、体重の増加、血圧の上昇、胃の変調、胃の吐き戻し、嘔吐、消化不良、下痢、便秘、脚痛、皮疹、身震い、痙攣、多汗症、浮腫、性的欲望、および性的不能等のような異なる過激な種々の副作用を有する。近年、プロザック等のような抗鬱病薬剤が重大な社会問題となっている。2004年に、米国の食品医薬品局(FDA)は市場の32の主な抗鬱病薬剤の説明書の副作用および注意を明確に記述することを製剤会社に命令し、そして医師および看護士にこれらの薬剤が子供および青年の自殺率を増加するかも知れないことを強調した。32の抗鬱病薬剤の内、パキシルは1996年に有害であることをはや発見され、そして2001年来市場から継続してリコールされてきている。2004年6月に、ニューヨク州検事長はパキシルおよび“青年期の自殺行動および傾向の増大する危険性”間の関連の研究報告を騙したとして、英国GlaxoSmithKline会社を告発した。現在の状況の観点から、副作用のないそしてもっと著しい効能のある抗鬱病品質をもつ薬剤の新しい生成のための研究が全薬剤世界の注目の中心となってきている。
【0005】
近年、薬剤の科学者は鬱病の発病の機序の研究に新しい突破口を作り、彼等は鬱病の治療のための戦略として5−HT、NEおよびDAのような神経伝達物質の再取込の阻害に加えて、受容体後機序の制御が鬱病治療のためにまた採用され得ることを発見した。さらに、受容体後機序を調節する薬剤、ロリプラムが発売されたので、受容体後機序が薬理学的に鬱病治療のための研究の焦点となった。ロリプラムはホスホジエステラーゼ4(PDE−4)の阻害剤であり、そして明らかな抗鬱病機能を有することを臨床的試行で示されてきている;しかしながら、ロリプラムは激しい嘔吐を起こすため、ロリプラムに関するさらなる研究が中止せざるを得なかった。この挫折にも拘わらず、ロリプラムは“抗鬱病薬剤のための受容体後機序”の新しい種類の考えを開始した。
【0006】
それ故、先行技術に直面する上記の状況を取り扱うことが申請者によって試みられる。
【0007】
[発明の要約]
現在の技術の不十分さを克服するために、本発明の目的は、鬱病治療のためのジンセノサイドRg1およびRb1、グリチルリチン酸および棗cAMPの生材料から製造されるような多標的および受容体後機序を基本とする経口薬剤あるいは健康食品を提供することである。特に、確実な機能および成分、長期間の使用に対して激しい嘔吐等のような副作用なしに明らかな治療上の効果および高い安全性のある新しい技術的計画が提供される。
【0008】
本発明の薬剤の解決する計画は鬱病治療のための最新の医学の病理学および薬理学の理論に従って試みられた結果である。特に、本発明は、アデニルシクラーゼ酸塩(AC)に対するジンセノサイドの強い模擬実験効果およびcAMPホスホジエステラーゼ(CAPD)に対するグリチルリチン酸(およびグリチルレチン酸)の強い阻害効果を役立たせることにより抗鬱病薬剤および受容体後機序に関する最近の研究進展を組み合わせる。本発明の抗鬱病機能は多くの動物実験で証明されてきた。ジンセノサイドおよびグリチルリチン酸(およびグリチルレチン酸)が対になったときcAMPの使用および活性をさらに増大するために相乗効果的に作用する。cAMPの結果としての濃度および活性は(1)ノルエピネフリン等のような神経伝達物質の合成および分泌を増大し、(2)脳由来の神経親和性因子(BDNF)の発現を増大し、そして(3)著しい抗鬱病機能を達成するように視床下部−脳下垂体−腎傍(HPA)軸椎および糖質コルチコイドの分泌作用の過敏性を阻害できる。追加的に、棗cAMPはまた抗鬱病機能を誘起するように人間のcAMPの水準を増大することができる。棗cAMPの微量(1万分の1)が動物実験で抗実験鬱病機能を実施するために1%の棗cAMPを有する棗抽出物として抽出されそして精製される。結果は1%の棗cAMPを含む棗抽出物は著しい抗実験鬱病機能を有することを示す。しかしながら、正常の棗抽出物(例えば、加熱によって水に抽出される棗、しかしその中の棗cAMPの濃度はさらには増加しない)は、微量の棗cAMPを含むけれども、明らかな抗実験鬱病機能を有さない。本発明の抗鬱病効果をさらに増大するために、本発明の棗cAMP、ジンセノサイドおよびグリチルリチン酸はさらに対になりそして集合的に作用する。チョウセンニンジン、甘草(カンゾウ)および棗は中国の医療では一般的な薬剤材料および食品であり、そして数千年の間食事の栄養になる医療食において使用されてきている。医療および食事の使用の数千年の歴史において、対および一緒に摂取されるチョウセンニンジン、甘草および棗の安全性は十分に証明されている。発明者の研究および実験結果は、もしこれらの3つの材料が普通に単に個々に煎じられそして抽出されるなら、鬱病治療のため本抗鬱病薬剤をもつ抽出体と比較して著しい抗鬱病効果を有しない。これは本発明において抽出物の効果的な成分(ジンセノサイドRg1およびRb1、および棗cAMP等のような)の濃度が精製(クロマトグラフィのような)によってさらに増大され、そして生の材料(グリチルリチン酸およびグリチルレチン酸等のような)が鬱病治療のための薬剤を調整するため抽出物に添加されるからである。動物実験はこのように作られる薬剤が従来の抗鬱病薬剤と比べて著しい優れた抗鬱病機能を有すること示す。抽出、クロマトグラフィそして精製後これらの3つの薬剤材料からの破片(debris)は高性能液体クロマトグラフィ(HPLC)によってまた収集されそして試験された。破片は微量のジンセノサイドRg1およびRb1、グリチルリチン酸および棗cAMPを含むけれども、破片は動物実験によって試験されたような著しい抗鬱病機能を有しない。重要なことに、チョウセンニンジン、甘草および棗は激しい嘔吐等のような副作用を生じない。それ故、発明者は鬱病治療のため多重標的および受容体前機構をもつジンセノサイドRg1およびRb1、グリチルリチン酸および棗cAMPを含む生の材料から経口薬剤あるいは健康食品を提案する。特に、溶媒(水およびエタノール等のような)中で加熱による抽出に加えて、抽出物は生の材料(ジンセノサイドRg1およびRb1、および棗cAMP)の濃度を増大させるためにさらに精製され、そしてグリチルリチン酸およびグリチルレチン酸がここに添加される。新しい技術計画は、流通し使用可能な抗鬱病剤の不適当を克服するために、確実な機能および成分、明らかな治療上の効果、長期間使用のための高い安全性を有し、そして嘔吐等の副作用を含まないで調整される。
【0009】
本発明の薬剤組成物およびロリプラムの抗鬱病薬剤指標および機序の比較が次ぎに提供される。

【0010】
本発明の薬剤および受容体後機序をもつ抗鬱病薬剤(ロリプラム)間の差異は抗鬱病反応が多重標的および受容体後機序によって達成されそしてロリプラムにより引き起こされる副作用(激しい嘔吐等のような)が避けられることにある。
【0011】
人間の身体内でグリチルリチン酸のグリチルレチン酸への転換率は殆ど100%であり、そしてグリチルレチン酸はグリチルリチン酸よりもその高い脂質溶解性により、血液−脳バリアを通して脳内に侵入できる。それ故、CAPDに対するグリチルリチン酸の阻害性は身体内でグリチルリチン酸のグリチルレチン酸への転換によって進展される。従って、グリチルリチン酸あるいはグリチルレチン酸は本発明の薬剤組成物を製造するための生の材料であり得る。
【0012】
本発明の1つの観点に従って、鬱病治療のため多重標的受容体後機序をもつ薬剤組成物が提供される。薬剤組成物は次ぎを含む:ジンセノサイドRg1およびRb1、グリチルリチン酸、グリチルレチン酸およびこれらの組み合わせからなる群から選ばれる1つであるグリチルリチン酸関連の酸、および棗cAMP。
【0013】
望ましくは、薬剤組成物は2〜26重量部のジンセノサイド、3〜48重量部のグリチルリチン酸的に関連の酸、および0.002〜0.5重量部の棗cAMPを含む。
【0014】
望ましくは、薬剤組成物は4〜13重量部のジンセノサイド、5〜16重量部のグリチルリチン酸関連の酸、および0.01〜0.1重量部の棗cAMPを含む。
【0015】
望ましくは、ジンセノサイドはチョウセンニンジンから抽出され、グリチルリチン酸関連の酸は甘草から抽出され、そして棗cAMPは棗から抽出される。
【0016】
望ましくは、棗は第1の棗cAMP濃度を有する第1の抽出物を得るために抽出され、第1の抽出物は第2の棗cAMP濃度を有する第2の抽出物を得るためにさらに抽出され、第2の棗cAMP濃度は第1の棗cAMP濃度よりも高く、そして第2の抽出物は薬剤組成物において生の材料である。
【0017】
本発明の他の観点に従って、鬱病治療のための多重標的受容体後薬剤組成物が提供される。薬剤組成物は次ぎを含む:ジンセノサイド;グリチルリチン酸、グリチルレチン酸およびこれらの組み合わせからなる群から選択される1つであるグリチルリチン酸関連の酸。
【0018】
望ましくは、ジンセノサイドはRg1およびRb1を含む。
【0019】
望ましくは、薬剤組成物は2〜26重量部のジンセノサイド、3〜48重量部のグリチルリチン酸関連の酸を含む。
【0020】
望ましくは、薬剤組成物は4〜13重量部のジンセノサイド、5〜16重量部のグリチルリチン酸関連の酸を含む。
【0021】
望ましくは、ジンセノサイドはチョウセンニンジンから精製され、グリチルリチン酸関連の酸は甘草から精製される。
【0022】
望ましくは、薬剤組成物は少なくとも1つの薬理学的に許容される担体および添加剤を含む。
【0023】
望ましくは、薬剤組成物は錠剤、カプセル、粉末、丸薬、微粒子、溶液、マイクロカプセル、懸濁液、粒子、滴下する丸薬および巻物からなる群から選ばれる1つである投与形態を有する。
【0024】
望ましくは、薬剤組成物は健康食品および栄養補助剤(サプリメントとも云う)の1つとして製造される。
【0025】
本発明の他の観点に従って、鬱病治療のための多重標的受容体後機序をもつ薬剤組成物の調整方法が提供される。薬剤組成物は生の材料として棗cAMPを含む。調整方法は次の段階を含む:(a)第1の棗cAMP濃度を有する第1の抽出物を得るために棗を抽出する;そして(b)第2の棗cAMP濃度を有する第2の抽出物を得るために第1の抽出物を精製し、ここで第2の棗cAMP濃度は第1の棗cAMP濃度よりも高い。
【0026】
望ましくは、段階(b)はアルデヒド基と結合するマクロ多孔性樹脂で第1抽出物をクロマトグラフ法によって実施される。
【0027】
望ましくは、マクロ多孔性樹脂はOU−2である。
【0028】
望ましくは、第1の抽出物はアルデヒド基と結合するME−2マクロ多孔性樹脂でさらにクロマトグラフ法にかけられる。
【0029】
本発明の明細書および特許請求項に記載される鬱病治療のための経口薬剤は本発明の目的の核心的内容である。本発明が公開された後、当業者は、中国医薬の理論あるいは近代薬理学の関連する理論に従って上述の薬剤に特有の効果/機能を有する薬草の医薬(オンジサポニン、サイコサポニンおよびリコリスクマリン等のような)の他の効果的な成分に対して通常の増加/減少あるいは置換を実施できる。この通常の増加/減少、同様の機構を有する薬草の医薬、他の確実なCAPD阻害剤、AC開始剤、あるいは相応する効果的な成分の置換は当業者の通常の技術活動に属する。それ故、置換は本発明の保護範囲である。
【0030】
本発明の上述の目的および優位性は次の詳細な記載および付帯図面を閲読した後、通常の当業者にもっと容易に明らかになるであろう。
【図面の簡単な説明】
【0031】
【図1】図1は本発明の第1の望ましい実施態様に従う薬剤組成物の調整方法を示すフロ−チャートである。
【図2】図2は本発明の第2の望ましい実施態様に従う薬剤組成物の調整方法を示すフロ−チャートである。
【図3】図3は本発明の第3の望ましい実施態様に従う薬剤組成物の調整方法を示すフロ−チャートである。
【図4】図4は本発明の第4の望ましい実施態様に従う薬剤組成物の調整方法を示すフロ−チャートである。
【図5】図5は本発明の第5の望ましい実施態様に従う薬剤組成物の調整方法を示すフロ−チャートである。
【図6】図6は本発明の第6の望ましい実施態様に従う薬剤組成物の調整方法を示すフロ−チャートである。
【発明を実施するための形態】
【0032】
[望ましい実施態様の詳細説明]
本発明は次の実施態様を参照してもっと明確に今記載される。本発明の望ましい実施態様の次の説明は図および説明の目的にのみここに提示されていることが注意されることである;網羅的であること、あるいは開示される正確な形式に制約されることは意図されない。
【0033】
本発明の目的を完成させるために、本発明の技術的計画は特に次のように提供される。
【0034】
鬱病治療のための多重標的および受容体後機序をもつ薬剤組成物は本発明において開示され、そして薬剤化合物はジンセノサイドRg1およびRb1、およびグリチルリチン酸(あるいはグリチルレチン酸)の生の材料を含むことによって製造される。
【実施例1】
【0035】
鬱病治療のための本発明の多重標的および受容体後機序をもつ薬剤組成物はジンセノサイドRg1およびRb1、およびグリチルリチン酸(あるいはグリチルレチン酸)の生の材料を含むことによって製造される。
【実施例2】
【0036】
本発明の薬剤組成物は全体の2〜26重量部のジンセノサイドRg1およびRb1、および3〜48重量部のグリチルリチン酸(あるいはグリチルレチン酸)を有する生の材料から製造される。
【実施例3】
【0037】
本発明の薬剤組成物は全体の4〜13重量部のジンセノサイドRg1およびRb1、および5〜16重量部のグリチルリチン酸(あるいはグリチルレチン酸)を有する生の材料を含むことによって製造される。
【実施例4】
【0038】
本発明の鬱病治療のための多重標的および受容体後機序をもつ薬剤組成物はジンセノサイドRg1およびRb1、およびグリチルリチン酸(あるいはグリチルレチン酸)および棗cAMPの生の材料を含むことによって製造される。
【実施例5】
【0039】
本発明の薬剤組成物は全体の2〜26重量部のジンセノサイドRg1およびRb1、および3〜48重量部のグリチルリチン酸(あるいはグリチルレチン酸)および0.002〜0.5重量部の棗cAMPを有する生の材料を含むことによって製造される。
【実施例6】
【0040】
本発明の薬剤組成物は全体の4〜13重量部のジンセノサイドRg1およびRb1、および5〜16重量部のグリチルリチン酸(あるいはグリチルレチン酸)および0.01〜0.1重量部の棗cAMPを有する生の材料を含むことによって製造される。
【実施例7】
【0041】
本発明の薬剤組成物は薬理学的に許容できる担体および添加剤を含む。薬剤化合物は投与形態として製造され得て、そして投与形態は錠剤、カプセル、粉末、丸薬、微粒子、溶液、マイクロカプセル、懸濁液、粒子、滴下する丸薬、巻物および薬理学的に経口薬剤投与形態の1つから選ばれる。
【実施例8】
【0042】
本発明の薬剤組成物は鬱病治療のための薬剤、健康食品および栄養補助剤として製造され得る。
【0043】
本発明の目的を完成するために、薬剤組成物の調整方法が次ぎに記載される。
【0044】
[方法1]
鬱病治療のための本発明の多重標的および受容体後機序をもつ薬剤組成物は生の材料としてチョウセンニンジンから抽出されるジンセノサイドRg1およびRb1を有する1つの抽出物、および甘草から抽出されるグリチルリチン酸を有する他の抽出物から製造される。付け加えると、前述の薬剤組成物はジンセノサイドRg1およびRb1、およびグリチルリチン酸(あるいはグリチルレチン酸)を有する調整された生の材料を直接使用することによって製造される。
【0045】
[方法2]
本発明の薬剤組成物は全体の2〜26重量部のジンセノサイドRg1およびRb1、および3〜48重量部のグリチルリチン酸(あるいはグリチルレチン酸)を有する生の材料から製造される。
【0046】
[方法3]
本発明の薬剤組成物は全体の4〜13重量部のジンセノサイドRg1およびRb1、および5〜16重量部のグリチルリチン酸(あるいはグリチルレチン酸)を有する生の材料を含むことによって製造される。
【0047】
[方法4]
鬱病治療のための本発明の多重標的および受容体後機序をもつ薬剤組成物は生の材料としてチョウセンニンジンから抽出されるジンセノサイドRg1およびRb1を有する1つの抽出物、甘草から抽出されるグリチルリチン酸を有する他の抽出物、および棗から抽出される棗cAMPを有する別の抽出物から製造される。付け加えると、前述の薬剤組成物はジンセノサイドRg1およびRb1、グリチルリチン酸(あるいはグリチルレチン酸)および棗cAMPを有する調整された生の材料を直接使用することによって製造される。
【0048】
[方法5]
本発明の薬剤組成物は全体の2〜26重量部のジンセノサイドRg1およびRb1、3〜48重量部のグリチルリチン酸(あるいはグリチルレチン酸)および0.002〜0.5重量部の棗cAMPを有する生の材料から製造される。
【0049】
[方法6]
本発明の薬剤組成物は全体の4〜13重量部のジンセノサイドRg1およびRb1、5〜16重量部のグリチルリチン酸(あるいはグリチルレチン酸)および0.01〜0.1重量部の棗cAMPを有する生の材料から製造される。
【0050】
[方法7]
本発明の薬剤組成物は薬理学的に許容できる担体および添加剤を含み得る。薬剤組成物は投与形態として製造され得て、そして投与形態は錠剤、カプセル、粉末、丸薬、微粒子、溶液、マイクロカプセル、懸濁液、粒子、滴下する丸薬、巻物および薬理学的に経口薬剤投与形態の1つから選ばれる。
【0051】
[方法8]
本発明の薬剤組成物は健康食品に関する良い製造実施(Good Manufacturing Practce(GMP))の方法に従って本発明に記載される生の材料から製造され得る。
【0052】
[望ましい実施態様]
本発明は図面および望ましい実施態様の組み合わせによって次のようにさらに図示される。
【0053】
[実施態様1]
本発明の第1の望ましい実施態様に従い薬剤組成物の調整方法を示すフローチャートである図1を参照して下さい。図1において、20kgのチョウセンニンジンが砕かれる後、砕かれたチョウセンニンジンは70%の濃度のエタノール溶液によって抽出するために加熱される。抽出されたチョウセンニンジンはカラムクロマトグラフィによって分離され、精製されそして乾燥され、そして120gのジンセノサイドRg1およびRb1を有する0.8kgのチョウセンニンジン抽出物が得られる。それから、10kgの甘草が砕かれる後、砕かれた甘草が室温で12時間浸漬される。浸漬された甘草が脱炭素およびアルコール沈澱によって抽出され、濃縮されおよび乾燥され、そして200gのグリチルリチン酸を有する2kgの甘草抽出物が得られる。その後、150gの得られたチョウセンニンジン抽出物および200gの甘草抽出物が粉砕されそして混合され、そして本発明の実施例1の350gの薬剤組成物(22.5gのジンセノサイドRg1およびRb1、そして20gのグリチルリチン酸を含む)が得られる。
【0054】
[実施態様2]
本発明の第2の望ましい実施態様に従い薬剤組成物の調整方法を示すフローチャートである図2を参照して下さい。図2において、純度96%を有する調整された3.96gのグリチルレチン酸および実施態様1において得られた200gのチョウセンニンジン抽出物が粉砕されそして混合される後、本発明の実施例2の203.96gの薬剤組成物(30gのジンセノサイドRg1およびRb1、そして3.8gのグリチルレチン酸を含む)が得られる。
【0055】
[実施態様3]
本発明の第3の望ましい実施態様に従い薬剤組成物の調整方法を示すフローチャートである図3を参照して下さい。図3において、純度90%を有する調整された3.4gのジンセノサイドRg1、純度90%を有する調整された7.8gのジンセノサイドRb1および純度90%を有する36.8gのグリチルリチン酸が粉砕されそして混合される後、本発明の実施例3の48gの薬剤組成物(10gのジンセノサイドRg1およびRb1、そして35gのグリチルリチン酸を含む)が得られる。
【0056】
[実施態様4]
本発明の第4の望ましい実施態様に従い薬剤組成物の調整方法を示すフローチャートである図4を参照して下さい。図4において、10kgの棗が砕かれそして室温で水に浸漬される。それから、浸漬された棗が棗抽出物を得るために脱炭素およびアルコール沈澱によって抽出され、それは連続してOU−2およびME−2マクロ多孔性樹脂によってさらに吸収されそして分離される。0.3gの棗cAMPを含む30gの棗抽出物が本発明の薬剤を調整するため生の材料として得られる。
【0057】
その後、実施態様1において得られた150gのチョウセンニンジン抽出物および200gの甘草抽出物が粉砕されそして後述される3gの棗抽出物と混合される後、本発明の実施例の353gの薬剤組成物(22.5gのジンセノサイドRg1およびRb1、20gのグリチルリチン酸および0.03gの棗cAMPを含む)が得られる。
【0058】
[実施態様5]
本発明の第5の望ましい実施態様に従い薬剤組成物の調整方法を示すフローチャートである図5を参照して下さい。図5において、実施態様1においてそれぞれ得られた150gのチョウセンニンジン抽出物および200gの甘草抽出物が粉砕されそして実施態様4において得られた05gの棗抽出物と混合される後、本発明の実施例5の350.5gの薬剤組成物(22.5gのジンセノサイドRg1およびRb1、20gのグリチルリチン酸そして0.005gの棗cAMPを含む)が得られる。
【0059】
[実施態様6]
本発明の第6の望ましい実施態様に従い薬剤組成物の調整方法を示すフローチャートである図6を参照して下さい。図6において、純度90%を有する調整された6.8gのジンセノサイドRg1、純度90を有する調整されるジンセノサイドRb1、純度96%を有する26gのグリチルレチン酸および実施態様4において得られた10gの棗抽出物が粉砕されそして混合される後、本発明の実施例6の58.4gの薬剤組成物(20gのジンセノサイドRg1およびRb1、25gのグリチルリチン酸そして0.1gの棗cAMPを含む)が得られる。
【0060】
[実験1:ハツカネズミ(mouse)の尻尾吊り下げ実験における実施態様1の影響]
1.1 実験動物:ICR ハツカネズミ、雄、体重22.0±2g、二級、北京、首都医科大学の実験動物科学部によって提供される。
【0061】
1.2 実験薬剤:実施態様1の薬剤がBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.の製品である。
【0062】
1.3 実験器具:ストップウオッチ。
【0063】
1.4 投与量設計:1.実施態様1の高投与量(80mg/kg/d);2.実施態様1の中間投与量(40mg/kg/d);および3.実施態様1の低投与量(20mg/kg/d)。
【0064】
1.5 実験方法および結果:
【0065】
1.5.1 グループ区分および医薬品の投与:ハツカネズミは無作為にグループ分けされ、そして10匹のハツカネズミがそれぞれのグループである。1.実施態様1の高投与量(80mg/kg、経口当り(P.O.)、7日間投与);2.実施態様1の中間投与量(40mg/kg、P.O.、7日間投与);3.実施態様1の低投与量(20mg/kg、P.O.、7日間投与);4.パロキセチン(3mg/kg、P.O.、7日間投与);および5.生理食塩水(P.O.)。医薬品の最終投与1時間後、ハツカネズミの尻尾吊り下げ実験が実施される。
【0066】
1.5.2 実験方法:ハツカネズミの尻尾(尻尾の端に1cm)が5cm台より高く木製帯板上にテープ止めされそして6分間吊り下げられる。最終の5分間ハツカネズミの無動作の時間が記録される。
【0067】

【0068】
1.5.4 実験結果:表1を参照して下さい。

【0069】
結論:上記の実験に従って、本発明の実施態様1の高および中間投与量およびパロキセチンの全てがハツカネズミの尻尾が吊り下げられる後、生理グループ(照合)と比較して著しく異なって減少することがみられ得る。それ故、抗実験鬱病機能を有する本発明の実施態様1は外挿され得る。
【0070】
[実験2:レセトピン誘起ハツカネズミの身体温度低下実験における実施態様1の影響]
2.1 実験動物:ICR ハツカネズミ、雄、体重22.0±2g、二級、北京、首都医科大学の実験動物科学部によって提供される。
【0071】
2.2 実験薬剤:実施態様1の薬剤がBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.の製品であり、そしてレセトピンはGuangdong BangMin Pharmaceuticals Co.Ltd.の製品である。
【0072】
1.3 実験器具:電子温度計(型式:GM222)およびストップウオッチ。
【0073】
2.4 投与量設計:1.実施態様1の高投与量(80mg/kg/d);2.実施態様1の中間投与量(40mg/kg/d);および3.実施態様1の低投与量(20mg/kg/d)。
【0074】
2.5 実験方法および結果:
【0075】
2.5.1 グループ区分および医薬品の投与:ハツカネズミは無作為にグループ分けされ、そして10匹のハツカネズミがそれぞれのグループである。1.実施態様1の高投与量(80mg/kg、P.O.、7日間投与);2.実施態様1の中間投与量(40mg/kg、P.O.、7日間投与);3.実施態様1の低投与量(20mg/kg、P.O.、7日間投与);4.パロキセチン(3mg/kg、P.O.、7日間投与);および5.生理食塩水(P.O.)。
【0076】
2.5.2 実験方法:第8日の医薬品の最終投与の1時間後ハツカネズミの肛門温度が決定される。それから体重kg当り2mgのレセトピンが腹腔内注射によって与えられる。レセトピン注射の4時間後、ハツカネズミの肛門温度が再び決定される。ハツカネズミの肛門への温度計の挿入深さおよび時間は各温度測定において同一である。
【0077】

【0078】
2.5.4 実験結果:表2を参照して下さい。

【0079】
結論:上記の実験に従って、本発明の実施態様1の高、中間および低投与量およびパロキセチンの全てがレセトピンによって誘起され変えられる身体温度を低下することがみられ得る;これらの薬剤の抗実験鬱病機能はモノアミン神経伝達物質の含有量に関してこれらの効果に関連付けられることを意味する。それ故、抗実験鬱病機能を有する本発明の実施態様1は外挿され得る。
【0080】
[実験3:ハツカネズミの尻尾吊り下げ実験における実施態様2の影響]
3.1 実験動物:ICR ハツカネズミ、雄、体重22.0±2g、二級、北京、首都医科大学の実験動物科学部によって提供される。
【0081】
3.2 実験薬剤:実施態様2の薬剤がBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.の製品である。
【0082】
3.3 実験器具:ストップウオッチ。
【0083】
3.4 投与量設計:1.実施態様2の高投与量(80mg/kg/d);2.実施態様2の中間投与量(40mg/kg/d);および3.実施態様1の低投与量(20mg/kg/d)。
【0084】
3.5 実験方法および結果:
【0085】
3.5.1 グループ区分および医薬品の投与:ハツカネズミは無作為にグループ分けされ、そして10匹のハツカネズミがそれぞれのグループである。1.実施態様2の高投与量(80mg/kg、経口当り(P.O.)、7日間投与);2.実施態様2の中間投与量(40mg/kg、P.O.、7日間投与);3.実施態様2の低投与量(20mg/kg、P.O.、7日間投与);4.パロキセチン(3mg/kg、P.O.、7日間投与);および5.生理食塩水(P.O.)。医薬品の最終の投与1時間後、ハツカネズミの尻尾吊り下げ実験が実施される。
【0086】
3.5.2 実験方法:ハツカネズミの尻尾(尻尾の端に1cm)が5cm台より高く木製帯板上にテープ止めされそして6分間吊り下げられる。最終の5分間ハツカネズミの無動作の時間が記録される。
【0087】

【0088】
3.5.4 実験結果:表3を参照して下さい。

【0089】
結論:上記の実験に従って、本発明の実施態様2の中間投与量およびパロキセチンの全てがハツカネズミの尻尾が吊り下げられる後、生理食塩水グループ(照合)と比較して著しく異なって減少することがみられ得る。それ故、抗実験鬱病機能を有する本発明の実施態様2は外挿され得る。
【0090】
[実験4:レセトピン誘起ハツカネズミの身体温度低下実験における実施態様2の影響]
4.1 実験動物:ICR ハツカネズミ、雄、体重22.0±2g、二級、北京、首都医科大学の実験動物科学部によって提供される。
【0091】
4.2 実験薬剤:実施態様2の薬剤がBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.の製品であり、そしてレセトピンはGuangdong BangMin Pharmaceuticals Co.Ltd.の製品である。
【0092】
4.3 実験器具:電子温度計(型式:GM222)およびストップウオッチ。
【0093】
4.4 投与量設計:1.実施態様2の高投与量(80mg/kg/d);2.実施態様2の中間投与量(40mg/kg/d);および3.実施態様2の低投与量(20mg/kg/d)。
【0094】
4.5 実験方法および結果:
【0095】
4.5.1 グループ区分および医薬品の投与:ハツカネズミは無作為にグループ分けされ、そして10匹のハツカネズミがそれぞれのグループである。1.実施態様2の高投与量(80mg/kg、P.O.、7日間投与);2.実施態様2の中間投与量(40mg/kg、P.O.、7日間投与);3.実施態様2の低投与量(20mg/kg、P.O.、7日間投与);4.パロキセチン(3mg/kg、P.O.、7日間投与);および5.生理食塩水(P.O.)。
【0096】
4.5.2 実験方法:第8日の医薬品の最終投与の1時間後ハツカネズミの肛門温度が決定される。それから体重kg当り2mgのレセトピンが腹腔内注射によって与えられる。レセトピン注射の4時間後、ハツカネズミの肛門温度が再び決定される。ハツカネズミの肛門への温度計の挿入深さおよび時間は各温度測定において同一である。
【0097】

【0098】
4.5.4 実験結果:表4を参照して下さい。

【0099】
結論:上記の実験に従って、本発明の実施態様2の中間投与量およびパロキセチンの全てがレセトピンによって誘起され変えられる身体温度を低下することがみられ得る;薬剤の抗実験鬱病機能はモノアミン神経伝達物質の含有量に関してこれらの効果に関連付けられることを意味している。それ故、抗実験鬱病機能を有する本発明の実施態様2は外挿され得る。
【0100】
[実験5:ハツカネズミの尻尾吊り下げ実験における実施態様3の影響]
5.1 実験動物:ICR ハツカネズミ、雄、体重22.0±2g、二級、北京、首都医科大学の実験動物科学部によって提供される。
【0101】
5.2 実験薬剤:実施態様2の薬剤がBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.の製品である。
【0102】
5.3 実験器具:ストップウオッチ。
【0103】
5.4 投与量設計:1.実施態様3の高投与量(80mg/kg/d);2.実施態様3の中間投与量(40mg/kg/d);および3.実施態様3の低投与量(20mg/kg/d)。
【0104】
5.5 実験方法および結果:
【0105】
5.5.1 グループ区分および医薬品の投与:ハツカネズミは無作為にグループ分けされ、そして10匹のハツカネズミがそれぞれのグループである。1.実施態様3の高投与量(80mg/kg、P.O.、7日間投与);2.実施態様3の中間投与量(40mg/kg、P.O.、7日間投与);3.実施態様3の低投与量(20mg/kg、P.O.、7日間投与);4.パロキセチン(3mg/kg、P.O.、7日間投与);および5.生理食塩水(P.O.)。医薬品の最終の投与1時間後、ハツカネズミの尻尾吊り下げ実験が実施される。
【0106】
5.5.2 実験方法:ハツカネズミの尻尾(尻尾の端に1cm)が5cm台より高く木製帯板上にテープ止めされそして6分間吊り下げられる。最終の5分間ハツカネズミの無動作の時間が記録される。
【0107】

【0108】
5.5.4 実験結果:表5を参照して下さい。

【0109】
結論:上記の実験に従って、本発明の実施態様3の高および中間投与量およびパロキセチンの全てがハツカネズミの尻尾が吊り下げられる後、生理食塩水グループ(照合)と比較して著しく異なって減少することがみられ得る。それ故、抗実験鬱病機能を有する本発明の実施態様3は外挿され得る。
【0110】
[実験6:レセトピン誘起ハツカネズミの身体温度低下実験における実施態様3の影響]
6.1 実験動物:ICR ハツカネズミ、雄、体重22.0±2g、二級、北京、首都医科大学の実験動物科学部によって提供される。
【0111】
6.2 実験薬剤:実施態様3の薬剤がBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.の製品であり、そしてレセトピンはGuangdong BangMin Pharmaceuticals Co.Ltd.の製品である。
【0112】
6.3 実験器具:電子温度計(型式:GM222)およびストップウオッチ。
【0113】
6.4 投与量設計:1.実施態様3の高投与量(80mg/kg/d);2.実施態様3の中間投与量(40mg/kg/d);および3.実施態様3の低投与量(20mg/kg/d)。
【0114】
6.5 実験方法および結果:
【0115】
6.5.1 グループ区分および医薬品の投与:ハツカネズミは無作為にグループ分けされ、そして10匹のハツカネズミがそれぞれのグループである。1.実施態様3の高投与量(80mg/kg、P.O.、7日間投与);2.実施態様3の中間投与量(40mg/kg、P.O.、7日間投与);3.実施態様3の低投与量(20mg/kg、P.O.、7日間投与);4.パロキセチン(3mg/kg、P.O.、7日間投与);および5.生理食塩水(P.O.)。
【0116】
6.5.2 実験方法:第8日の医薬品の最終投与の1時間後ハツカネズミの肛門温度が決定される。それから体重kg当り2mgのレセトピンが腹腔内注射によって与えられる。レセトピン注射の4時間後、ハツカネズミの肛門温度が再び決定される。ハツカネズミの肛門への温度計の挿入深さおよび時間は各温度測定において同一である。
【0117】

【0118】
6.5.4 実験結果:表6を参照して下さい。

【0119】
結論:上記の実験に従って、本発明の実施態様3の高、中間および低投与量およびパロキセチンの全てがレセトピンによって誘起され変えられる身体温度を低下することがみられ得る;薬剤の抗実験鬱病機能はモノアミン神経伝達物質の含有量に関してこれらの効果に関連付けられることを意味している。それ故、抗実験鬱病機能を有する本発明の実施態様3は外挿され得る。
【0120】
[実験7:ドブネズミ(rat)の嗅球損傷実験における実施態様4の影響]
7.1 実験動物:
【0121】
嗅球損傷モデル:Health Wisterの雄のドブネズミ、二級、体重330±20gが、Beijing Vital River Experimental Animal Technology Ltd. Co.より購入される(品質証明番号:SCXK(JING)2002−2003)。
【0122】
7.2 薬品および薬剤:実施態様4の薬剤はBeijing Wonner Biotech Ltd. Co.(ロット:060313)によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.(ロット:04050011)の製品である。上記の薬剤は胃内に供給するため0.5%のナトリウムカルボキシメチルセルロース(CMC−Na)で調整される。注射のためのナトリウムベンジルペニシリンはNorth China Phermaceutical Huasheng Co. Ltd.の製品(ロット:S0511204)であり、そしてノルエピネフリン(NE)および5−ヒドロトリプタミン(5−HT)標準品はSigma Co.の製品である。他の薬品は全て市販品である。
【0123】
7.3 器具:自家製の開放フィールド活動箱、ステップスルー箱、ドブネズミ定位器具、高性能液体クロマトグラフィ(HPLC)および10−チューブγ線免疫アリスモメーター(型式:DFM−96)。
【0124】
7.4 実験方法
【0125】
7.4.1 グループ区分および医薬品の投与:ドブネズミは無作為に6グループ分けされる。1.偽の治療グループ;2.モデルグループ(照合)、3.実施態様4の高投与量(60mg/kg/d);4.実施態様4の中間投与量(30mg/kg/d);5.実施態様4の低投与量(15mg/kg/d);および6.パロキセチン(2mg/kg/d)。試験医薬品および受動的医薬品は1日に1回胃内に供給するため0.5%のCMC−Naで調整される。
【0126】
7.4.2 モデルの調整方法:ドブネズミは抱水クロラールによって麻酔される。麻酔後、ドブネズミの泉門の正中線は前泉門の前1cmから前泉門の後ろ1cm切開され、そして頭蓋骨が曝露される。直径2mmを有する頭蓋骨窓は前泉門の前8mmからそして正中線の2つの側の2mmから開かれる。特製の電気半田鏝が2秒間頭蓋骨に垂直に挿入され、そして嗅球が破壊される。止血スポンジが頭蓋骨窓に充填されそして皮膚が縫合される。治療の後、体重kg当り40,000ユニットのベンジルペニシリンが4日毎に腹腔内注射によって与えられ、そして試験される薬剤が24日間連続的に摂取される。
【0127】
7.5 観察指標:
【0128】
7.5.1 開放フィールド活動実験:開放フィールド活動箱(1m×1m×0.4m)が紺色の合板およびアルミニウム枠によって作られる。箱の底は25格子(各格子当り20cm×20cm)に区分され、外周は周囲の格子(16格子)で、そして中央格子(9格子)である。ドブネズミは中央格子の中央に置かれ、そしてドブネズミの交差格子数(3つの鉤形よりも多い隣接の格子内に交差する数)およびドブネズミの立ち上がる数(1cm以上床から離れる2つの前脚)が3分以内で計算され/観察される。
【0129】
7.5.2 受動的回避実験(ステップスルー学習実験):ステップスルー箱は明るい部屋と暗い部屋によって構成され、経路がドブネズミの入口および出口のため明るい部屋と暗い部屋の間を連絡される。暗い部屋の格子窓は電気衝撃装置に接続されそして可働板がその間に組み立てられる。もしドブネズミが暗い部屋へ入ると、ドブネズミは電気的に衝撃される。訓練の間、ドブネズミは明るい部屋に置かれそして5分間適応のため穴に戻る。それから、板は撤去されそしてドブネズミはもう5分間観察される。ドブネズミが最初に侵入する時(電気衝撃の潜伏期間)が記録され、そしてその時間が学習記録である。24時間の後、試験が繰り返される。板が撤去され暗い部屋が5分間通電され、ドブネズミが最初に暗い部屋内に入る時を観察するようにする。これがその記憶記録である。
【0130】

【0131】
7.7 実験結果:
【0132】
7.7.1 開放フィールド活動実験結果:表7を参照して下さい。

【0133】
7.7.2 ステップスルー学習試験の結果:表8を参照して下さい。

【0134】
結論:実験7の結果は実施態様4の高投与量は嗅球損傷によって起こされるドブネズミの水平および垂直動作の増加が明らかに減り得て、そして実施態様4の中間投与量はドブネズミの嗅球損傷モデルの垂直動作の増加に関して明らかな改善機能をまた有していることを示す。付け加えて、実施態様4の高および中間投与量は嗅球損傷によって起こされるドブネズミの研究および記憶機能の減少に関して明らかな改善効果を有している。
【0135】
[実験8:ドブネズミの予知できない長期間の刺激実験における実施態様4の影響]
8.1 実験動物:
【0136】
予知できない長期間の刺激モデル:Health Wisterの雄のドブネズミ、二級、体重240〜270gが、Beijing Vital River Experimental Animal Technology Ltd. Co.より購入される(品質証明番号:SCXK(JING)2002−2003)。
【0137】
8.2 薬品および薬剤:実施態様4の薬剤はBeijing Wonner Biotech Ltd. Co.によって提供(ロット:060313)され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.の製品(ロット:04050011)である。上記の薬剤は胃内に供給するため0.5%のナトリウムカルボキシメチルセルロース(CMC−Na)で調整される。注射のためのナトリウムベンジルペニシリンはNorth China Phermaceutical Huasheng Co. Ltd.の製品(ロット:S0511204)であり、そしてノルエピネフリン(NE)および5−ヒドロトリプタミン(5−HT)標準品はSigma Co.の製品である。他の薬品は全て市販品である。
【0138】
8.3 器具:自家製の開放フィールド活動箱、ステップスルー箱、ドブネズミ定位器具、高性能液体クロマトグラフィ(HPLC)および10−チューブγ線免疫アリスモメーター(型式:DFM−96)。
【0139】
8.4 実験方法
【0140】
8.4.1 グループ区分および医薬品の投与:ドブネズミは無作為に6グループ分けされる。1.偽の治療グループ;2.モデルグループ(照合)、3.実施態様4の高投与量(60mg/kg/d);4.実施態様4の中間投与量(30mg/kg/d);5.実施態様4の低投与量(15mg/kg/d);および6.パロキセチン(2mg/kg/d)。試験医薬品および受動的医薬品は1日に1回胃内に供給するため0.5%のCMC−Naで調整される。
【0141】
8.4.2 モデルの調整方法:
【0142】
予知できない長期間の刺激モデル:照合グループのドブネズミは通常に食べそして飲み、そこでは刺激は行われない。他の5グループにおいては、1つのドブネズミは各籠で供給され、そしてドブネズミは24日予知できないストレス/刺激に曝され、3回24時間の断食、3回24時間無飲料、3回24時間湿った床(200mLの水がドブネズミの籠に加えられる)、3回夜間の照明、3回5分間4℃で水泳、3回5分間に亘り加熱炉で45℃で加熱、3回1分間ドブネズミの尻尾をクリップ止めし、3回30分の高速水平振動をすることを含む。1つの刺激は毎日そして全24日無作為に行われる。薬剤は全24日間毎日ドブネズミの胃内に供給される。
【0143】
8.5 観察指標
【0144】
8.5.1 開放フィールド活動実験:上記と同様。
【0145】
8.5.2 受動的回避実験:上記と同様。
【0146】
8.5.3 衝動によるドブネズミの水泳:この実験は医薬品の最終の投与の後、2日間行われる。第1日に、実験は15分間事前に行われる。ガラス容器の水温は25℃で、そして水深は25cmである。24時間の後、正式の実験が行われる。医薬品の投与1時間後、ドブネズミは容器に置かれ、そして最終の5分間ドブネズミの無動作の時間が記録される。
【0147】
8.5.4 体重測定:各動物実験の前後の増加値が比較される。
【0148】
8.5.5 蔗糖を飲む容量試験:ドブネズミの蔗糖摂取容量が比較される。各グループのドブネズミは1時間1%の蔗糖を飲む。飲む容量は刺激の前および刺激の3週間後に決定される。ドブネズミは14時間断食および水中にいる後、1%の蔗糖が籠に置かれ、そして最初の飲料水に対して置き換えられる。1時間蔗糖をドブネズミが飲む前後の容器間重量差異が測定されおよび記録され、そして各回の蔗糖を飲む容量が計算される。各回の蔗糖を飲む容量の差異が比較される。
【0149】
8.5.6 HPLC−電気化学試験:ドブネズミの大脳皮質のノルエピネフリンおよび5−ヒドロトリプタミンの量が測定される。
【0150】

【0151】
8.7 実験結果:
【0152】
8.7.1 蔗糖を飲む容量試験:表9を参照して下さい。

【0153】
8.7.2 増加するドブネズミの体重の結果:表10を参照して下さい。

【0154】
8.7.3 衝動実験によって水泳するドブネズミの無動作の時間の結果:表11を参照して下さい。

【0155】
8.7.4 ドブネズミの開放フィールド活動実験の結果:表12を参照して下さい。

【0156】
8.7.5 ステップスルー学習実験の結果:表13を参照して下さい。

【0157】
8.7.6 ドブネズミの頭蓋骨中のNEおよび5−HT含有量の結果:表14を参照して下さい。

【0158】
結論:実験8の結果は次ぎのように示される。実施態様4の中間および低投与量は予知できない長期間ストレス/刺激に反応して減少される蔗糖を飲む容量および減少される体重を明らかに改善し得る。実施態様4の高、中間および低投与量は衝動によるドブネズミの水泳の無動作の時間を明らかに増加し得る。実施態様4の高投与量は予知できない長期間ストレス/刺激によって起こされる減少するドブネズミの水平および垂直動作を明らかに改善し得る。実施態様4の低投与量は予知できない長期間ストレス/刺激によって起こされる減少するドブネズミの垂直動作に関して改善される機能を明らかに有する。実施態様4の低投与量は予知できない長期間ストレス/刺激によって起こされる減少するドブネズミの学習能力に関して改善される機能を明らかに有する。実施態様4の高、中間および低投与量はドブネズミの頭骸骨中のNEおよび5−HT含有量を明らかに増加し得る。
【0159】
[実験9:ハツカネズミの尻尾吊り下げ実験における実施態様5の影響]
9.1 実験薬剤:実施態様5の薬剤はBeijing Wonner Biotech Ltd. Co.(パイロット拡張製品)によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.(ロット:05070384)の製品である。上述の薬剤は胃の内に供給するため生理食塩水とともに供給される。
【0160】
9.2 実験動物:ICR ハツカネズミ、雄、体重20.0±1g、二級、北京、首都医科大学の実験動物科学部によって提供される。ハツカネズミの品質証明書番号はSCXK(JINK)2006−2008である。
【0161】
9.3 実験器具:ストップウオッチ。
【0162】
9.4 方法 70匹のハツカネズミが5つのグループに無作為にグループ分けされる:通常の生理食塩水(NS)グループ、パロキセチン(3mg/kg/d)、実施態様5の高投与量(80mg/kg/d)、実施態様5の中間投与量(40mg/kg/d、実施態様5の低投与量(20mg/kg/d)。薬剤は毎日1度ハツカズミの胃内に供給される。第8日に医薬品の最終投与の1時間後、ハツカネズミの尻尾(尻尾の端に1cm)は開放箱内の水平支持体の上にテープ止めされ、そしてハツカネズミは逆に吊り下げられる状況を示す。ハツカネズミの頭は開放箱の底から約10cm離れ、そしてハツカネズミは6分間吊り下げられる。最終の5分間ハツカネズミの無動作の時間が記録される。
【0163】

【0164】
9.6 実験結果:ハツカネズミの尻尾吊り下げ実験における無動作の時間の結果:表15を参照して下さい。

【0165】
結論:研究結果は実施態様5の高、中間、および低投与量そして臨床上の効果的な抗鬱病薬剤、パロキセチンの全てがハツカネズミの尻尾吊り下げ実験における無動作の累積時間を明らかに減少し得ることを示す。これは実施態様5が特別の抗実験鬱病機能を有することを示す。
【0166】
[実験10:衝動実験によってハツカネズミの水泳における実施態様5の影響]
10.1 実験薬剤:実施態様5の薬剤はBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.(ロット:05070384)の製品である。上述の薬剤は胃内に供給するため生理食塩水とともに供給される。
【0167】
10.2 実験動物:ICR ハツカネズミ、雄、体重20.0±1g、二級、北京、首都医科大学の実験動物科学部によって提供される。ハツカネズミの品質証明書番号はSCXK(JINK)2006−2008である。
【0168】
10.3 実験器具:ストップウオッチ。
【0169】
10.4 実験方法:ハツカネズミのグループおよび医薬品の投与はハツカネズミの尻尾吊り下げ実験と同様である。実験は医薬品の投与の1時間後、各グループの試験されるハツカネズミで実施される。ハツカネズミは実験前15分間および第8日に水泳するために訓練される。24時間後、実験が行われる。ハツカネズミは水深14cm、直径14cmそして25℃の水温を有するガラス容器中に置かれる。最終の5分間ハツカネズミの無動作の累計時間が記録される。
【0170】

【0171】
10.6 実験結果:衝撃によって水泳するハツカネズミの結果:表16を参照して下さい。

【0172】
結論:研究結果は実施態様5の高、中間、および低投与量そして臨床上の効果的な抗鬱病薬剤、パロキセチンの全てが衝撃試験によって水泳するハツカネズミにおける無動作の累積時間を明らかに減少し得る。それは実施態様5が特別の抗実験鬱病機能を有することを示す。
【0173】
[実験11]
実施態様1および4の抽出物から9kgの残りのチョウセンニンジンの破片(debris)、7kgの残りの甘草および0.9kgの棗の破片が微量のジンセノサイドRg1およびRb1、グリチルリチン酸および棗cAMPを含む破片混合物を得るために収集され、乾燥され、粉砕されそして良く混合される。ハツカネズミの尻尾吊り下げ試験における破片の影響を試験するため照合実験が実施される。
【0174】
11.1 実験動物:ICR ハツカネズミ、雄、体重20.0±2g、二級、北京、首都医科大学の実験動物科学部によって提供される。
【0175】
11.2 実験薬剤:破片混合物はBeijing Wonner Biotech Ltd. Co.によって提供され、そしてパロキセチン(パキシル)はZhong Mei Tianjin Smith Kline Pharmaceuticals Co.Ltd.)の製品である。
【0176】
11.3 実験器具:ストップウオッチ。
【0177】
11.4 投与量設計:1.破片混合物の高投与量(160mg/kg/d;2.破片混合物の中間投与量(80mg/kg/d);3.破片混合物の低投与量(40mg/kg/d)。
【0178】
11.5 実験方法および結果
【0179】
11.5.1 グループ区分および医薬品の投与:ハツカネズミは各グループ10匹のハツカネズミで無作為にグループ分けされる。1.破片混合物の高投与量(160mg/kg、P.O.、7日間投与);2.破片混合物の中間投与量(80mg/kg、P.O.、7日間投与);3.破片混合物の低投与量(40mg/kg、P.O.、7日間投与);4.パロキセチン(3mg/kg、P.O.、7日間投与);および5.生理食塩水(P.O.)。医薬品の最終投与1時間後、ハツカネズミの尻尾吊り下げ実験が実施される。
【0180】
11.5.2 実験方法:ハツカネズミの尻尾(尻尾の端に1cm近く)は5cm台より高く木製帯板上にテープ止めされそして6分間吊り下げられる。最終の5分間ドブネズミの無動作の時間が記録される。
【0181】

【0182】
11.5.4 実験結果:表17を参照して下さい。

【0183】
結論:上記の実験に従って、破片混合物の高、中間および低投与量は尻尾吊り下げでハツカネズミの無動作の時間を短縮し得るけれども、これらの差異は生理食塩水グループ(照合)と比較して統計的に著しくない。それ故、破片混合物は抗実験鬱病機能を欠いている結論が外挿し得る。
【0184】
鬱病治療のための本発明の記載される経口薬剤は次ぎにある:
【0185】
1.鬱病治療のための本発明の記載される経口薬剤は薬理学的に許容される添加剤である;
【0186】
2.鬱病治療のための本発明の記載される経口薬剤は粉末、カプセル、錠剤等のような既知の投与形態として製造され得る;
【0187】
3.鬱病治療のための本発明の記載される経口薬剤は鬱病治療のための健康食品として製造され得る。
【0188】
本発明は現在最も実用的でそして望ましい実施態様であると考えられることに関して記載されている一方、本発明は開示される実施態様に制限される必要がないことは理解されることである。それどころか、付帯する特許請求の精神および範囲内に含まれる種々の修正および類似の配置を含むことが意図され、特許請求の範囲はこのような修正および同様な構造の全てを包含するように広範な解釈と一致されることである。
【特許請求の範囲】
【請求項1】
鬱病治療のための多重標的受容体後機序をもつ薬剤組成物であって次からなる:
Rg1およびRb1を有するジンセノサイド;および
グリチルリチン酸、グリチルレチン酸およびその組み合わせを含む群から選ばれる1つであるグリチルリチン関連の酸。
【請求項2】
2〜26重量部のRg1およびRb1を有するジンセノサイドおよび3〜48重量部のグリチルリチン関連の酸からなる請求項1に従う薬剤組成物。
【請求項3】
4〜13重量部のRg1およびRb1を有するジンセノサイドおよび5〜16重量部のグリチルリチン関連の酸からなる請求項1に従う薬剤組成物。
【請求項4】
ジンセノサイドがジンセノサイドRg1およびRb1からなるチョウセンニンジン抽出物である請求項1に従う薬剤組成物。
【請求項5】
少なくとも1つの薬理学的に許容される担体および添加物からなる請求項1に従う薬剤組成物。
【請求項6】
錠剤、カプセル、粉末、丸薬、微粒子、溶液、マイクロカプセル、懸濁液、乳化液、粒子、滴下する丸薬およびロールを含む群から選らばれる1つである剤形を有する請求項1に従う薬剤組成物。
【請求項7】
健康食品および栄養補助剤(サプリメントとも云う)の1つとして製造される請求項1に従う薬剤組成物。
【請求項8】
鬱病治療のための多重標的受容体後薬剤組成物であって次からなる:
Rg1およびRb1を有するジンセノサイド;
グリチルリチン酸、グリチルレチン酸およびその組み合わせを含む群から選ばれる1つであるグリチルリチン関連の酸;および
ジュジュバ環状アデノシン一リン酸塩(棗cAMP)。
【請求項9】
2〜26重量部のRg1およびRb1を有するジンセノサイド、および3〜48重量部のグリチルリチン関連の酸および0.002〜0.5重量部の棗cAMPからなる請求項8に従う薬剤組成物。
【請求項10】
4〜13重量部のRg1およびRb1を有するジンセノサイド、および5〜16重量部のグリチルリチン関連の酸および0.01〜0.1重量部の棗cAMPからなる請求項8に従う薬剤組成物。
【請求項11】
ジンセノサイドがジンセノサイドRg1およびRb1からなるチョウセンニンジン抽出物であり、リコリッシュがグリチルリチン酸からなる甘草(カンゾウ)抽出物であり、そして棗cAMPが棗cAMPからなる棗抽出物である請求項8に従う薬剤組成物。
【請求項12】
棗cAMPからなる材料が最初に第1の抽出物を得るために棗を抽出しそしてそれから第1の抽出物を精製することによって得られる第2の抽出物であり、ここで第2の抽出物の棗cAMP濃度が第1の抽出物の棗cAMP濃度よりも高い請求項8に従う薬剤組成物。
【請求項13】
少なくとも1つの薬理学的に許容される担体および添加物からなる請求項8に従う薬剤組成物。
【請求項14】
錠剤、カプセル、粉末、丸薬、微粒子、溶液、マイクロカプセル、懸濁液、乳化液、粒子、滴下する丸薬およびロールを含む群から選らばれる1つである剤形を有する請求項8に従う薬剤組成物。
【請求項15】
健康食品および栄養補助剤(サプリメント)の1つとして製造される請求項8に従う薬剤組成物。
【請求項16】
鬱病治療のための多重標的受容体後機序をもつ薬剤組成物の調製方法であって、薬剤組成物が原料としてジュジュバ環状一リン酸塩(棗cAMP)からなり、調整方法が次の段階からなる:
(a)第1の抽出物を得るために棗を抽出する;および
(b)第2の抽出物を得るために第1の抽出物を精製する、
ここで、第2の抽出物の棗cAMP濃度が第1の棗cAMP抽出物濃度よりも高い。
【請求項17】
前記段階(b)がアルデヒド基と結合されるマクロ多孔性樹脂で第1の抽出物中の棗cAMPをクロマトグラフィ法によって処理される請求項16に従う調整方法。
【請求項18】
前記段階(b)がアルデヒド基と結合されるOU−2マクロ多孔性樹脂で第1の抽出物中の棗cAMPをクロマトグラフィ法によって処理される請求項17に従う調整方法。
【請求項19】
前記段階(b)がアルデヒド基と結合されるME−2マクロ多孔性樹脂で第1の抽出物中の棗cAMPをクロマトグラフィ法によってさらに処理される請求項18に従う調整方法。
【請求項1】
鬱病治療のための多重標的受容体後機序をもつ薬剤組成物であって次からなる:
Rg1およびRb1を有するジンセノサイド;および
グリチルリチン酸、グリチルレチン酸およびその組み合わせを含む群から選ばれる1つであるグリチルリチン関連の酸。
【請求項2】
2〜26重量部のRg1およびRb1を有するジンセノサイドおよび3〜48重量部のグリチルリチン関連の酸からなる請求項1に従う薬剤組成物。
【請求項3】
4〜13重量部のRg1およびRb1を有するジンセノサイドおよび5〜16重量部のグリチルリチン関連の酸からなる請求項1に従う薬剤組成物。
【請求項4】
ジンセノサイドがジンセノサイドRg1およびRb1からなるチョウセンニンジン抽出物である請求項1に従う薬剤組成物。
【請求項5】
少なくとも1つの薬理学的に許容される担体および添加物からなる請求項1に従う薬剤組成物。
【請求項6】
錠剤、カプセル、粉末、丸薬、微粒子、溶液、マイクロカプセル、懸濁液、乳化液、粒子、滴下する丸薬およびロールを含む群から選らばれる1つである剤形を有する請求項1に従う薬剤組成物。
【請求項7】
健康食品および栄養補助剤(サプリメントとも云う)の1つとして製造される請求項1に従う薬剤組成物。
【請求項8】
鬱病治療のための多重標的受容体後薬剤組成物であって次からなる:
Rg1およびRb1を有するジンセノサイド;
グリチルリチン酸、グリチルレチン酸およびその組み合わせを含む群から選ばれる1つであるグリチルリチン関連の酸;および
ジュジュバ環状アデノシン一リン酸塩(棗cAMP)。
【請求項9】
2〜26重量部のRg1およびRb1を有するジンセノサイド、および3〜48重量部のグリチルリチン関連の酸および0.002〜0.5重量部の棗cAMPからなる請求項8に従う薬剤組成物。
【請求項10】
4〜13重量部のRg1およびRb1を有するジンセノサイド、および5〜16重量部のグリチルリチン関連の酸および0.01〜0.1重量部の棗cAMPからなる請求項8に従う薬剤組成物。
【請求項11】
ジンセノサイドがジンセノサイドRg1およびRb1からなるチョウセンニンジン抽出物であり、リコリッシュがグリチルリチン酸からなる甘草(カンゾウ)抽出物であり、そして棗cAMPが棗cAMPからなる棗抽出物である請求項8に従う薬剤組成物。
【請求項12】
棗cAMPからなる材料が最初に第1の抽出物を得るために棗を抽出しそしてそれから第1の抽出物を精製することによって得られる第2の抽出物であり、ここで第2の抽出物の棗cAMP濃度が第1の抽出物の棗cAMP濃度よりも高い請求項8に従う薬剤組成物。
【請求項13】
少なくとも1つの薬理学的に許容される担体および添加物からなる請求項8に従う薬剤組成物。
【請求項14】
錠剤、カプセル、粉末、丸薬、微粒子、溶液、マイクロカプセル、懸濁液、乳化液、粒子、滴下する丸薬およびロールを含む群から選らばれる1つである剤形を有する請求項8に従う薬剤組成物。
【請求項15】
健康食品および栄養補助剤(サプリメント)の1つとして製造される請求項8に従う薬剤組成物。
【請求項16】
鬱病治療のための多重標的受容体後機序をもつ薬剤組成物の調製方法であって、薬剤組成物が原料としてジュジュバ環状一リン酸塩(棗cAMP)からなり、調整方法が次の段階からなる:
(a)第1の抽出物を得るために棗を抽出する;および
(b)第2の抽出物を得るために第1の抽出物を精製する、
ここで、第2の抽出物の棗cAMP濃度が第1の棗cAMP抽出物濃度よりも高い。
【請求項17】
前記段階(b)がアルデヒド基と結合されるマクロ多孔性樹脂で第1の抽出物中の棗cAMPをクロマトグラフィ法によって処理される請求項16に従う調整方法。
【請求項18】
前記段階(b)がアルデヒド基と結合されるOU−2マクロ多孔性樹脂で第1の抽出物中の棗cAMPをクロマトグラフィ法によって処理される請求項17に従う調整方法。
【請求項19】
前記段階(b)がアルデヒド基と結合されるME−2マクロ多孔性樹脂で第1の抽出物中の棗cAMPをクロマトグラフィ法によってさらに処理される請求項18に従う調整方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2011−504887(P2011−504887A)
【公表日】平成23年2月17日(2011.2.17)
【国際特許分類】
【出願番号】特願2010−535193(P2010−535193)
【出願日】平成19年11月30日(2007.11.30)
【国際出願番号】PCT/CN2007/003400
【国際公開番号】WO2009/070924
【国際公開日】平成21年6月11日(2009.6.11)
【出願人】(510151326)
【出願人】(510151337)
【Fターム(参考)】
【公表日】平成23年2月17日(2011.2.17)
【国際特許分類】
【出願日】平成19年11月30日(2007.11.30)
【国際出願番号】PCT/CN2007/003400
【国際公開番号】WO2009/070924
【国際公開日】平成21年6月11日(2009.6.11)
【出願人】(510151326)

【出願人】(510151337)

【Fターム(参考)】
[ Back to top ]

