魚鱗由来コラーゲンゲルとその作成方法
【課題】細胞担体および医療用材料として幅広く使用し得る、高い強度、熱安定性および生体内安定性を有するコラーゲンゲルとその作成方法を提供する。
【解決手段】変成温度が30℃以上である魚鱗由来コラーゲン溶液に架橋剤および線維化剤を添加し、線維化と同時に線維間の架橋を生成させ、ゲル化させたコラーゲンゲルとする。
【解決手段】変成温度が30℃以上である魚鱗由来コラーゲン溶液に架橋剤および線維化剤を添加し、線維化と同時に線維間の架橋を生成させ、ゲル化させたコラーゲンゲルとする。
【発明の詳細な説明】
【技術分野】
【0001】
この出願の発明は魚鱗由来コラーゲンゲルとその作成方法に関するものである。より詳しくは、魚鱗由来のコラーゲンを架橋剤を用いて架橋してなるコラーゲンゲルとその作成方法、並びに、これを用いた細胞担体および医療用材料に関するものである。
【背景技術】
【0002】
コラーゲンは、少なくとも部分的に螺旋構造(コラーゲン螺旋)を有するタンパク質または糖タンパク質として定義される。これは、3本のポリペプチド鎖から形成される3重螺旋で、分子量10万程度の各ポリペプチド鎖にはグリシン残基が3個目ごとに、またその他のアミノ酸残基としてプロリン残基、ヒドロキシプロリン残基が高頻度に現れる。コラーゲンは無脊椎動物あるいは脊椎動物の組織、特に皮膚から多く抽出することができる。コラーゲン分子には構造の違いによって19種類の型の存在が報告されており、さらに同じ型に分類されるコラーゲンにも数種類の異なる分子種が存在する場合がある。
中でも、I、II、III型及びIV型コラーゲンが主にバイオマテリアルの原料として用
いられている。I型はほとんどの結合組織に存在し、生体内に最も多量に存在するコラーゲ
ン型である。特に腱、真皮及び骨に多く、工業的にはコラーゲンはこれらの部位から抽出される場合が多い。II型は軟骨を形成するコラーゲンである。III型は少量ではあるがI
型と同様の部位に存在することが多い。IV型は基底膜を形成するコラーゲンである。I、
II及びIII型はコラーゲン線維として生体内に存在し、主に組織あるいは器官の強度を保つ役割をはたしている。IV型は線維形成能力を有しないが、4分子で構成される網目状会合体を形成し、基底膜における細胞分化に関与しているとされる。本明細書において、以下コラーゲンという呼称はI型コラーゲンおよびそれを主成分とするコラーゲン混合物を示
すこととする。
コラーゲン線維は上記コラーゲン分子の自己集合体であり、コラーゲン分子が直列かつ並列にパッキングされた特異的な線維構造を有する。工業的には酸、アルカリ、あるいはタンパク質分解酵素を用いて組織内コラーゲン線維から可溶化されたコラーゲンが作成される。
可溶性コラーゲンは、コラーゲン分子が数分子以下の集合体にまで微細化されていて、水あるいは塩水溶液に溶解して均一な透明溶液を形成する。一度可溶化されたコラーゲン分子は条件次第では試験管内でコラーゲン線維を再形成することが知られている。この現象は線維化(fibril formationあるいはfibrillation)と呼ばれ、その性質については非特許文献1に詳細に記載されている。
コラーゲンに熱を加えるとコラーゲンの三重螺旋構造がほぐれ、それぞれのポリペプチド鎖がランダムコイル状の熱変性物を与える。そのような構造変化を起こす温度は変性温度と呼ばれ、熱変性物はゼラチンと呼ばれる。ゼラチンはコラーゲンに比べ水溶性が高い他に、生体内プロテアーゼに対する感受性が高いことが知られている。溶媒の条件によってはゼラチンがコラーゲン螺旋構造を部分的に回復することが知られている。ゼラチンはコラーゲン線維形成能を失っているが、部分的にコラーゲン螺旋構造を回復させることでコラーゲン線維形成能を回復できることが知られている。
コラーゲンの変性温度は溶液状態の時に最も低くなる。また、コラーゲンは一般に生物原料から得られるが、生物から得たコラーゲンの変性温度はその生物の生活環境温度と密接に関係していると言われる。水溶液でのコラーゲンの変性温度は、哺乳類では38℃前後
であるが、魚類はおおむね哺乳類よりも低く、特に鮭等の寒流系の魚類では20℃を下回る場合もある。
コラーゲンは優れた保湿性を有し、ヒアルロン酸などの他の生体由来保湿剤に比べ収量が多く安価であるために、化粧品原料として有効に用いられている。また、細胞の接着や増殖を促す、抗原性が低い、生体親和性が高い、生分解性である、などの多くの優れた性質から、細胞実験用材料および医療用材料など様々な用途に有効に使用されている。コラーゲンがこれらの目的で使用される場合、水溶液、綿状物、フィルム、スポンジ、ゲルなど用途に応じて種々の形態で使用される。特にコラーゲンゲルは細胞担体、医療用材料などに有効に用いられており、近年では再生医療における重要なマテリアルとして盛んに研究されている。
上記コラーゲンゲルの原料となるコラーゲンは、従来、そのほとんどが牛皮など家畜の組織から採取されているが、近年、BSE(牛海綿状脳症)問題が顕在化し、牛皮由来を含む家畜由来の原料を用いたコラーゲン製品により、人間に対して病原体が感染する危険性を潜在的に指摘されるに至った。そこで安全性と資源量等の観点から、魚類由来コラーゲンが化粧品材料及び食品材料として俄に脚光を浴び、細胞担体および医療用材料コラーゲンゲルの原料としても、魚類由来コラーゲンを用いることが重要になりつつある。
コラーゲンゲルを作製する方法としては大きく3種類に分けることができる。
1.コラーゲン溶液に架橋剤を導入し、溶液をゲル化する方法。
2.コラーゲン溶液に架橋を惹起する光線を照射し、溶液をゲル化する方法。
3.コラーゲン溶液に中性緩衝液を加えてコラーゲンの線維化を惹起させ、コラーゲン線維ネットワークから構成されるゲルを得る方法。
【0003】
上記1の方法については、例えばコラーゲン溶液に化学架橋剤を混合してゲル化させた眼科用コラーゲンゲル成形物(特許文献1)、グリコサミノグリカンとコラーゲンの混合溶液を水溶性カルボジイミドで架橋した組織再生マトリックス用ゲル(特許文献2)などが開示されている。2の方法については、例えば窒素で十分に置換したコラーゲン溶液に紫外線を照射すると、コラーゲン溶液がゲル化することが報告されている(非特許文献2)。3の方法については、例えばサメ由来コラーゲン溶液と中性緩衝液を混合してコラーゲンの線維化を惹起させることにより得られる、コラーゲン線維ネットワークから構成されるゲルが報告されている(非特許文献3)。
上記3種類のゲル化方法によって魚類由来コラーゲンから作製したコラーゲンゲルは、ゲル強度、熱安定性および生体内安定性が不十分であり、細胞担体および医療用材料の用途においてゲルの収縮や崩壊をきたす場合や、生体内吸収性が高すぎる場合があった。
そこで近年、魚類由来コラーゲンゲルの強度および熱安定性を大幅に向上させる技術として、コラーゲンを線維化させる工程に架橋剤を共存させ、コラーゲン線維内に架橋結合を導入させる技術が公表されている(非特許文献4)。魚類由来コラーゲンの変性温度は一般的に低く、工業的に生産されている魚類由来コラーゲンの変性温度は30℃以下であり、上記技術において用いられている魚類由来コラーゲンの変性温度は19℃である。これらの魚類由来コラーゲンから上記方法でコラーゲンゲルを作製すると、細胞培養温度および生体内温度である37℃において部分的に変性し、ゲルの収縮や崩壊をきたす場合や、生体内で速やかに吸収される場合があり、魚類由来コラーゲンから細胞担体および医療用材料としてのコラーゲンゲルを作成する方法としては必ずしも十分ではなかった。
【0004】
公知の架橋剤はコラーゲン分子の螺旋内ではなくコラーゲン分子間に作用するという本質的な問題、および魚類由来コラーゲンの変性温度が低く変性を完全に抑制できないという問題がいまだ解決されていないため、魚類由来コラーゲンゲルの強度、熱安定性および生体内安定性の向上は十分に達成されていない。すなわち、上記のゲル化方法は、魚類由来コラーゲンから細胞担体および医療用材料として十分に使用可能なコラーゲンゲルを作成する方法として必ずしも十分ではない。
以上に述べた、従来の作成方法を用いた魚類由来コラーゲンゲルの強度、熱安定性および
生体内安定性の不足などの問題点は、家畜由来コラーゲンゲルの代替としての魚類由来コラーゲンゲルの細胞担体および医療用材料医療用材料への応用を制限してきた。
【特許文献1】特開平11−197234号公報
【特許文献2】特開2002−80501号公報
【特許文献3】特開平8−283667号公報
【非特許文献1】Biochemical Journal, 316, 1(1996).
【非特許文献2】Biochimica Biophysica Acta, 229, 672 (1971).
【非特許文献3】Journal of Agricultural Food Chemistry, 48, 2028 (2000).
【非特許文献4】Journal of Bioscience and Bioengineering, 98, 40 (2004)
【発明の開示】
【発明が解決しようとする課題】
【0005】
従来のコラーゲンゲルの作成方法では、上記のように、魚類由来コラーゲンを用いた場合に、熱変性によってゲルの収縮や崩壊をきたしやすいため、ゲルの強度、熱安定性、ならびに生体内安定性が不十分であった。
そこで、この出願の発明は、魚類とりわけ魚鱗を由来とするコラーゲンを含むコラーゲンゲルであって、細胞担体および医療用材料として幅広く使用し得る、高い強度、熱安定性、および生体内安定性を有するコラーゲンゲルとその作成方法を提供することを課題としている。
【課題を解決するための手段】
【0006】
この出願の発明者らは、前記問題点を改善すべく鋭意研究を重ねた結果、変性温度の高い魚鱗由来コラーゲンの線維化途上に線維間の架橋反応を起こすことにより、従来の方法では困難であった魚鱗由来コラーゲンゲルの強度、熱安定性および生体内安定性の大幅な向上を同時に達成でき、細胞担体および医療用材料として極めて有用なコラーゲン材料が得られることを見出し、この出願の発明に到達した。
すなわち、この出願の発明は、第1には、変性温度が30℃以上である魚鱗由来コラーゲンを含むコラーゲン溶液に対して架橋剤と線維化剤を添加しゲル化させることを特徴とするコラーゲンゲルの作成方法を提供する。この出願の発明は、第2には、変性温度が30℃以上である魚鱗由来コラーゲンがオレオクロミス属の鱗由来のコラーゲンであることを特徴とする前記のコラーゲンゲルの作成方法を提供する。この出願の発明は、第3には、コラーゲン溶液のコラーゲン濃度が0.01〜3.0(w/v)%であることを特徴とす
る前記のコラーゲンゲルの作成方法を提供する。
さらに、この出願の発明は、第4には、架橋剤濃度が、作成したコラーゲンゲルにおける終濃度として0.001mM〜100mMであることを特徴とする前記のいずれかに記載のコラーゲンゲルの作成方法を提供する。この出願の発明は、第5には、架橋剤が、水溶性カルボジイミドを含むことを特徴とする前記のいずれか記載のコラーゲンゲルの作成方法を提供する。この出願の発明は、第6には架橋剤がグルタルアルデヒドを含むことを前記のいずれか記載のコラーゲンゲルの作成方法を提供する。この出願の発明は、第7には線維化剤が、リン酸塩、酢酸塩、炭酸塩およびTrisからなる群より選択される1種類以上の緩衝能を有する塩水溶液である前記のいずれか記載のコラーゲンゲルの作成方法を提供する。この出願の発明は、第8には、コラーゲン溶液への架橋剤および線維化剤の添加を、コラーゲンの変性温度+5℃以下の温度で行う前記のいずれか記載のコラーゲンゲルの作成方法を提供する。この出願の発明は、第9にはコラーゲン溶液への架橋剤および線維化剤の添加後、コラーゲンの変性温度+5℃以下の温度で少なくとも3時間インキュベートすることを特徴とする前記のいずれか記載のコラーゲンゲルの作成方法を提供する。この出願の発明は、第10にはコラーゲン溶液への架橋剤および線維化剤の添加後、コラーゲンの変性温度+5℃以下の温度で少なくとも1時間インキュベートすることを特徴とする前記のいずれか記載のコラーゲンゲルの作成方法を提供する。この出願の発明は、第11には、磁場中でゲル化を行うことを特徴とする前記のいずれか記載のコラーゲンゲ
ルの作成方法を提供する。
また、この出願の発明は、第12には前記第1発明ないし第11発明のいずれか記載のコラーゲンゲルの作成方法により作成されたコラーゲンゲルを提供する。この出願の発明は、第13には前記第12発明のコラーゲンゲルをさらに50℃以上の温度で熱処理したコラーゲンゲルを提供する。この出願の発明は、第14には、前記のコラーゲンゲルからなる細胞担体を、第15には、前記のコラーゲンゲルからなる医療用材料を提供する。
【発明の効果】
【0007】
この出願の発明は、変性温度の高い魚鱗由来コラーゲンの線維化途上に線維間に架橋反応を起こすことにより、架橋ならびに線維化によるコラーゲンゲルの機械強度、熱安定性および生体内安定性の向上を相乗的に得ることを可能とする。
【発明を実施するための最良の形態】
【0008】
以下にこの出願の発明を詳細に説明する。
【0009】
この出願の発明に用いられる魚鱗由来コラーゲンは、線維化能を有し、かつ変性温度が30℃以上であることが重要である。魚鱗由来コラーゲンは特に線維化反応が速くすすみ、家畜由来コラーゲンで通常24時間以上かかる線維化が1時間以内の短時間で繊維化が完了する。魚鱗由来コラーゲンとしてはそれらの性質を満たすものであればその型について特に限定されるものではないが、工業的な利用という観点から、収量の多いI型コラーゲンあるいはそれを主成分とするコラーゲンが好ましい。
この出願の発明におけるコラーゲン線維とは、文献(Journal of Agricultural Food Chemistry 48, 2028 (2000))の走査型電子顕微鏡写真に示されているようなナノサイズの径を有する糸状構造のことを意味する。
この出願の発明において、コラーゲンの変成温度とは、この出願の発明の方法で作成されたコラーゲンの酸性水溶液を、円偏光二色性分光計を使用して、コラーゲン水溶液の温度を段階的に上昇させることによって求められる。具体的にはThe Journal of Biological Chemistry, 275(33), 25870 (2000)やInternational Journal of Biological Macromolecules, 32 199 (2003)に記載の方法によって求められた、円偏光二色性から求められる螺
旋率(Helicity; %)が50%になるときの温度である。
この出願の発明に用いられる魚鱗由来コラーゲンは、線維化能を有し、かつ変性温度が30℃以上であれば、その分子構造について特に限定されるものではない。コラーゲン分子の両末端に存在する非螺旋領域(テロペプチド)は抗原性を有するという報告がある。用途によっては除去されるべき場合があるが、線維化能を有する限りはテロペプチドが除去されていても除去されていなくても構わない。
この出願の発明に用いられる魚鱗由来コラーゲンは、線維化能を有し、かつ変性温度が30℃以上であれば、その由来について特に限定されるものではないが、変成温度の特に高いコラーゲンを含有するオレオクロミス属の鱗が好ましく用いられる。さらに、中国や日本国内で食用として養殖されており入手が容易であるナイルテラピア(Oreochromis niloticus)の鱗が特に好ましく用いられる。
この出願の発明に用いられる架橋剤は、タンパク質を架橋でき、水溶性を有するものであれば特に限定されるものではない。タンパク質の架橋剤については、Biomaterials 18, 95 (1997)に詳細に記載されている。中でも、アルデヒド系、カルボジイミド系、エポキシド系およびイミダゾール系架橋剤が経済性、安全性および操作性の観点から好ましく用いられる。特に、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド・塩酸塩、1−シクロヘキシル−3−(2−モルホリニル−4−エチル)カルボジイミド・スルホン酸塩などの水溶性カルボジイミドを、後述の線維化剤の緩衝液に混合した溶液として使用することが好ましい。
この出願の発明に用いられる架橋剤が水溶性カルボジイミドの場合、N-ヒドロキシコハ
ク酸イミドを共存させることで架橋効率を高めることができる。
この出願の発明の魚鱗由来コラーゲンゲルの作成方法は、コラーゲンの線維化途上に架橋反応を起こすことを特徴の1つとしている。これを達成するための具体的方法としては、以下の3つの方法が挙げられる。
A.コラーゲン溶液に対し、線維化剤と架橋剤をあらかじめ混合した溶液を混合する方法。
B.コラーゲン溶液に対し、線維化剤溶液を混合し、それと同時あるいはその後に架橋剤溶液を添加する方法。
C.コラーゲン溶液に対し、架橋剤溶液を添加し、その後線維化剤溶液を混合する方法。これらの方法により、コラーゲン線維化の途上に架橋反応が起こり、コラーゲン分子間およびコラーゲン線維間に架橋が起こる。この反応はコラーゲン線維化と架橋の相乗効果をもたらし、従来の方法では達成困難であった強度と熱安定性を有するコラーゲンゲルが得られる。操作性の観点から、Aの方法により魚鱗由来コラーゲンゲルを作成することが特に好ましい。
この出願の発明の魚鱗由来コラーゲンゲルの作成に用いられるコラーゲン溶液のpHは、コラーゲン原料の作成方法に応じて変わる。コラーゲンは主に、酸性水溶液で抽出される酸可溶化コラーゲンと、アルカリ水溶液で抽出されるアルカリ可溶化コラーゲンに分けられる。この出願の発明に用いられるコラーゲン溶液が酸可溶化コラーゲン溶液の場合、そのpHは2.0〜6.0の間であることが好ましい。pHが2.0よりも低い場合、コラーゲン分
子が加水分解を受ける場合があり好ましくない。pHが6.0よりも高い場合、コラーゲン
が十分に可溶化されない場合があり好ましくない。一方、この出願の発明に用いられるコラーゲン溶液がアルカリ可溶化コラーゲン溶液の場合、pHは5.5〜10の間であることが
好ましい。pHが5.5よりも低い場合、コラーゲンが十分に可溶化されない場合があり好
ましくない。pHが10よりも高い場合、コラーゲン分子が加水分解を受ける場合があり好ましくない。
この出願の発明の魚鱗由来コラーゲンゲルの作成に用いられるコラーゲン溶液の溶媒としては、酸性溶媒の場合、最終用途から見て安全で、工業用として広く使用されている水、あるいは塩酸、酢酸、クエン酸、フマル酸等の水溶液が望ましい。中性〜アルカリ性の場合、上記と同様の理由から、水、あるいはリン酸塩、酢酸塩、Tris等の水溶液が望ましい。ここでTrisは、2-Amino-2-hydroxymethyl-1,3-propanediol Tris(hydroxymethyl)aminomethaneである。
この出願の発明の魚鱗由来コラーゲンゲルの作成に用いられるコラーゲン溶媒の塩濃度としては、用いられるコラーゲンが可溶化されるpHを溶媒に付与できれば特に限定されるものではない。しかし、塩濃度が高すぎると、塩の種類によっては目的範囲のpHを付与できない場合や、コラーゲンの線維化を阻害する場合、あるいは得られるゲルの細胞接着性などの物性を阻害する場合があり好ましくない。塩濃度は、好ましくは1.0M以下であ
り、より好ましくは0.50M以下である。
この出願の発明の魚鱗由来コラーゲンゲルの作成に用いられるコラーゲン溶液のコラーゲン濃度としては、コラーゲンの溶解性、溶液の粘性あるいはゲルの物性の観点から0.01〜3.0(w/v)%の範囲であることが好ましい。濃度が0.01(w/v)%よりも低い場合、
ゲルの強度が不足する場合があり好ましくない。濃度が3.0(w/v)%よりも高い場合、コラーゲン溶液の粘性が高すぎてゲルの作成が困難になる場合があり好ましくない。好ましくは0.05〜2.0(w/v)%の範囲である。
この出願の発明の魚鱗由来コラーゲンゲルの作成に用いられる架橋剤の濃度としては、架橋剤溶液の濃度よりもむしろコラーゲンゲルにおける架橋剤終濃度が重要である。架橋剤種、コラーゲンの線維化能、および温度によって変わるが、架橋度および架橋速度の観点から、終濃度として0.001mM〜100mMの範囲であることが好ましい。架橋剤の終濃度が0.001mMよりも低い場合、架橋度が不足してゲルの強度、熱安定性あるいは生体内吸収性が不十分となる場合があり好ましくない。架橋剤の終濃度が100mMよりも高い場合、架橋剤の共存によるコラーゲン線維化の阻害が顕著になり、ゲルの強度、熱安定性あるいは生体内吸収性が不十分となる場合があり好ましくない。より好ましくは
0.01mM〜50mMの範囲である。
この出願の発明の魚鱗由来コラーゲンゲルの作成に用いられる線維化剤は、コラーゲンの線維化を惹起する溶媒であればよい。好ましくは、細胞担体あるいは医療材料などの最終用途を考慮し、細胞毒性が無いかあるいは低く、工業用として広く使用されているリン酸塩、酢酸塩、炭酸塩、Tris等の緩衝能を有する塩水溶液が用いられることが好ましい。コラーゲンの線維化に適するpHは、コラーゲンの種類によって変化するがpH5〜9の範囲である場合が多く、その範囲で高い緩衝能を有するリン酸塩が特に好ましく用いられる。線維化剤としてはたらくこれら緩衝液の塩濃度については、前述のコラーゲンゲルの作成に用いられるコラーゲン溶液の塩濃度に準ずる。
コラーゲン溶液と線維剤溶液あるいは架橋剤溶液と混合する操作は、これらの溶液温度を、変性温度を大きく超えない温度に保って行われる。特に混合後の溶液温度が重要である。混合溶液の温度がコラーゲンの変性温度を大きく超える場合、架橋反応は起こるもののコラーゲンが変性して線維化能を減じ、高いゲル強度と熱安定性を有するコラーゲンゲルを作成するというこの出願の発明の効果が十分に達成されない場合があり好ましくない。好ましくは使用するコラーゲンの変性温度+5℃以下であり、より好ましくは使用するコラーゲンの変性温度以下である。
コラーゲン溶液に対して線維化剤および架橋剤を混合する操作において、これらの溶液を混合する方法としては特に限定されるものではないが、線維化による溶液のゲル化によって溶液の流動性が失われる前に、できるだけ均一に混合することが好ましい。容器内に混合溶液を入れて手作業あるいはシェーカーで容器を振る方法、マグネティックスターラーあるいは羽根付き攪拌棒などを用いて機械的に溶液を攪拌する方法が好ましく用いられる。
上記のコラーゲン溶液に対して線維化剤および架橋剤を混合する操作を、磁場の中で行うことにより、コラーゲン線維を特定方向に配向させることができる。磁場によるコラーゲン線維の配向については、Journal of Cell Science, 105, 317 (1993)に詳細に記載されている。磁場の強度は1.0〜20 Tであることが好ましい。1.0 T未満ではコラーゲン線維の配向が不十分である場合があり好ましくない。20 T以上ではコラーゲン線維の配向は十分であるが磁場を発生する装置にコストがかかり過ぎ好ましくない。好ましくは2.0〜10 T
である。
コラーゲン溶液に対して線維化剤および架橋剤を混合した後、線維化反応と架橋反応を十分に起こすために混合溶液をインキュベートする。インキュベート時間としては、高いゲル強度あるいは熱安定性を付与するという観点から、少なくとも3時間以上、より少なくとも1時間以上であることが望ましい。インキュベート温度は、コラーゲンの変性を防ぐという観点から、好ましくはコラーゲンの変性温度+5℃以下であり、より好ましくはコラーゲンの変性温度以下である。
上記方法で得られたコラーゲンゲルを50℃以上の温度で熱処理することにより、コラーゲンゲルに伸縮性が付与される。熱処理はゲルの乾燥を防ぐため水あるいは水蒸気の中で行われる。熱処理温度は50〜150℃の範囲で行われることが好ましい。温度が50℃以下ではコラーゲンゲルに伸縮性が付与されない場合があり好ましくなく、温度が150℃以上ではコラーゲン分子の分解が起こる場合があり好ましくない。より好ましくは70〜130℃の温度範囲である。
以上の方法により得られたこの出願の発明の魚鱗由来コラーゲンゲルは、高い機械強度を有しており、同時に熱安定性および生体内安定性にも優れる。このため、従来の家畜由来コラーゲンゲルの代替として、再生医療における細胞担体あるいは医療用材料へ応用するに十分な機械強度、熱安定性および生体内安定性を有する魚鱗由来コラーゲンゲルを作成できる。
【実施例】
【0010】
以下、この出願の発明を実施例と比較例を挙げてより具体的に説明するが、この出願の発明は下記の例によって限定されるものではない。
【0011】
はじめに各種測定方法を示す。
1.コラーゲン線維の観察
以下の操作によりコラーゲンゲル中のコラーゲン線維を観察した。コラーゲンゲルを2.5(w/v) %のグルタルアルデヒド水溶液に24時間浸した後、20, 50, 75および99(v/v) %エタ
ノール水溶液に各30分づつ順次浸し、コラーゲンゲルを脱水した。これをt-ブタノールに15分づつ2回浸した後、4℃で凝固させ、0℃において減圧乾燥した。乾燥したコラーゲンゲルに白金を蒸着し、走査型電子顕微鏡(SEM)用試料とした。SEM観察はJEOL-5600LV
を用いて、倍率15,000倍で行った。
2.コラーゲンゲルの変成温度の測定
以下の操作によりコラーゲンゲルの変成温度を測定し、コラーゲンゲルの熱安定性を評価した。スパチュラでコラーゲンゲルの小片(内径約3 mmの塊)を採取し、キムワイプで余分な水を吸い取った。重量は15 mgであった。ゲル小片を示差走査型熱量分析計(DSC)用のアルミニウム製サンプルパンに詰め、DSC測定用試料とした。DSC測定は室温から60℃まで、昇温速度1℃/分で大気中にて行った。得られたDSC曲線はコラーゲンゲルの変成によ
る熱流変化を示し、昇温に伴うベースラインからの変曲が観測される。そのDSC曲線の低
温側変曲点を与える温度(変成開始温度)をゲルの変成温度とした。
〔実施例1〕
1.魚燐からの可溶性コラーゲンの作成
(1) 魚燐のアルカリ処理
ナイルテラピアの鱗を水で十分に洗浄し、鰭等の夾雑物を除去した後風乾した後、冷凍庫で保管したものをコラーゲン作成に供した。乾燥魚鱗50 gを500 mlの0.1 M 水酸化ナトリウム水溶液に浸漬し、攪拌羽根を用いて24時間穏やかに攪拌した。金網で魚鱗をろ過し、1000 mlの0.1 M 水酸化ナトリウム水溶液に加えて同様の操作を行った。魚鱗を水でpHが
中性を示すまで繰り返し洗浄した。
(2) 魚燐のペプシン処理
上記魚鱗を1000 mlの0.5 M 酢酸水溶液に加え、攪拌羽根を用いて室温で3日間穏やかに攪拌した。この水溶液を遠心(10000×g, 20分)し、魚鱗を沈殿させた。5 gのペプシン(
和光純薬、ペプシン1:100)を含む1000 mlの0.5 M 酢酸水溶液に前記魚鱗を加え、攪拌羽根を用いて室温で3日間穏やかに攪拌した。この水溶液を遠心(10000×g, 20分)し、魚
鱗を沈殿させた。上清を回収し、ガラスフィルター(SHIBATA, 151G P16)を用いて吸引
ろ過した。ろ液に0.5 g/lになるようにペプシンを加え、室温で24時間攪拌した。魚鱗残
渣を上記と同様のペプシン含有酢酸水溶液に加え、同様に攪拌した。この操作を4回繰り返し、4バッチの上清を得た。
(3) コラーゲンの精製
ペプシン処理を終えた上清に対し、終濃度が0.9 Mになるように塩化ナトリウム水溶液を
加え、ガラス棒で混合した後、4℃で24時間静置して塩析した。これを遠心(10000×g, 20分)し、沈殿物を300 mlの0.5 M 酢酸水溶液に溶解した。この塩析工程を3回繰り返し
、コラーゲンの酢酸水溶液をセルロースチューブに入れて蒸留水に対して透析し、凍結乾燥した。
2.コラーゲンゲルの作成
凍結乾燥コラーゲンを0.01 M希塩酸に溶解し、0.10 (w/v)%のコラーゲン水溶液を調製し
た。コラーゲン水溶液9 mlに対し、架橋剤として0.0014 mmolの1−エチル−3−(3−
ジメチルアミノプロピル)カルボジイミド・塩酸塩を含む10倍濃度のリン酸緩衝生理食塩水1mlからなる線維化剤を添加し、速やかに混合した後33℃で3時間インキュベートし、コラーゲンゲルを得た。
3.コラーゲンゲルの分析
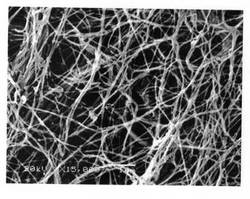
(1)コラーゲン線維
コラーゲンゲル中のコラーゲン線維構造を観察した結果を図1に示す。これより本実施例のコラーゲンゲルは、比較例における架橋を導入しないコラーゲンゲル(比較例1)と同
様のナノサイズの径を有するコラーゲン線維で構成されていることが明らかとなった。
(2)コラーゲンゲルの変成温度
コラーゲンゲルの変成温度は47.0℃であり、得られたDSC曲線を図4に示す。これより、
本実施例のコラーゲンゲルは架橋を導入しない比較例1より高い変成温度を有しており、熱に対する安定性や生体内安定性が比較例1より優れていることが示された。
〔実施例2〕
架橋剤のみを1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド・塩酸塩よりグルタルアルデヒドに変更し、実施例1と同様にコラーゲンゲルを得た。コラーゲンゲル中のコラーゲン線維構造を観察した結果を図2に示す。比較例における架橋を導入しないコラーゲンゲル(比較例1)と同様のナノサイズの径を有するコラーゲン線維で構成されていることが明らかとなった。また、コラーゲンゲルの変成温度は46.8℃であり、得られたDSC曲線を図4に示す。これより、本実施例のコラーゲンゲルは架橋を導入しない
比較例1より高い変成温度を有しており、熱に対する安定性や生体内安定性が比較例1より優れていることが示された。
〔比較例1〕
比較例として、架橋剤である1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド・塩酸塩を添加しないほかは実施例1と同様の方法によりコラーゲンゲルを得た。コラーゲンゲル中のコラーゲン線維構造を観察した結果を図3に示す。また、コラーゲンゲルの変成温度を測定した。変成温度は43.6℃であり、得られたDSC曲線を図4に示す。
【図面の簡単な説明】
【0012】
【図1】実施例1のコラーゲンゲル中のコラーゲン線維のSEM写真である。
【図2】実施例2のコラーゲンゲル中のコラーゲン線維のSEM写真である。
【図3】比較例1のコラーゲンゲル中のコラーゲン線維のSEM写真である。
【図4】実施例1および2、および比較例1のコラーゲンゲルのDSC曲線である。
【技術分野】
【0001】
この出願の発明は魚鱗由来コラーゲンゲルとその作成方法に関するものである。より詳しくは、魚鱗由来のコラーゲンを架橋剤を用いて架橋してなるコラーゲンゲルとその作成方法、並びに、これを用いた細胞担体および医療用材料に関するものである。
【背景技術】
【0002】
コラーゲンは、少なくとも部分的に螺旋構造(コラーゲン螺旋)を有するタンパク質または糖タンパク質として定義される。これは、3本のポリペプチド鎖から形成される3重螺旋で、分子量10万程度の各ポリペプチド鎖にはグリシン残基が3個目ごとに、またその他のアミノ酸残基としてプロリン残基、ヒドロキシプロリン残基が高頻度に現れる。コラーゲンは無脊椎動物あるいは脊椎動物の組織、特に皮膚から多く抽出することができる。コラーゲン分子には構造の違いによって19種類の型の存在が報告されており、さらに同じ型に分類されるコラーゲンにも数種類の異なる分子種が存在する場合がある。
中でも、I、II、III型及びIV型コラーゲンが主にバイオマテリアルの原料として用
いられている。I型はほとんどの結合組織に存在し、生体内に最も多量に存在するコラーゲ
ン型である。特に腱、真皮及び骨に多く、工業的にはコラーゲンはこれらの部位から抽出される場合が多い。II型は軟骨を形成するコラーゲンである。III型は少量ではあるがI
型と同様の部位に存在することが多い。IV型は基底膜を形成するコラーゲンである。I、
II及びIII型はコラーゲン線維として生体内に存在し、主に組織あるいは器官の強度を保つ役割をはたしている。IV型は線維形成能力を有しないが、4分子で構成される網目状会合体を形成し、基底膜における細胞分化に関与しているとされる。本明細書において、以下コラーゲンという呼称はI型コラーゲンおよびそれを主成分とするコラーゲン混合物を示
すこととする。
コラーゲン線維は上記コラーゲン分子の自己集合体であり、コラーゲン分子が直列かつ並列にパッキングされた特異的な線維構造を有する。工業的には酸、アルカリ、あるいはタンパク質分解酵素を用いて組織内コラーゲン線維から可溶化されたコラーゲンが作成される。
可溶性コラーゲンは、コラーゲン分子が数分子以下の集合体にまで微細化されていて、水あるいは塩水溶液に溶解して均一な透明溶液を形成する。一度可溶化されたコラーゲン分子は条件次第では試験管内でコラーゲン線維を再形成することが知られている。この現象は線維化(fibril formationあるいはfibrillation)と呼ばれ、その性質については非特許文献1に詳細に記載されている。
コラーゲンに熱を加えるとコラーゲンの三重螺旋構造がほぐれ、それぞれのポリペプチド鎖がランダムコイル状の熱変性物を与える。そのような構造変化を起こす温度は変性温度と呼ばれ、熱変性物はゼラチンと呼ばれる。ゼラチンはコラーゲンに比べ水溶性が高い他に、生体内プロテアーゼに対する感受性が高いことが知られている。溶媒の条件によってはゼラチンがコラーゲン螺旋構造を部分的に回復することが知られている。ゼラチンはコラーゲン線維形成能を失っているが、部分的にコラーゲン螺旋構造を回復させることでコラーゲン線維形成能を回復できることが知られている。
コラーゲンの変性温度は溶液状態の時に最も低くなる。また、コラーゲンは一般に生物原料から得られるが、生物から得たコラーゲンの変性温度はその生物の生活環境温度と密接に関係していると言われる。水溶液でのコラーゲンの変性温度は、哺乳類では38℃前後
であるが、魚類はおおむね哺乳類よりも低く、特に鮭等の寒流系の魚類では20℃を下回る場合もある。
コラーゲンは優れた保湿性を有し、ヒアルロン酸などの他の生体由来保湿剤に比べ収量が多く安価であるために、化粧品原料として有効に用いられている。また、細胞の接着や増殖を促す、抗原性が低い、生体親和性が高い、生分解性である、などの多くの優れた性質から、細胞実験用材料および医療用材料など様々な用途に有効に使用されている。コラーゲンがこれらの目的で使用される場合、水溶液、綿状物、フィルム、スポンジ、ゲルなど用途に応じて種々の形態で使用される。特にコラーゲンゲルは細胞担体、医療用材料などに有効に用いられており、近年では再生医療における重要なマテリアルとして盛んに研究されている。
上記コラーゲンゲルの原料となるコラーゲンは、従来、そのほとんどが牛皮など家畜の組織から採取されているが、近年、BSE(牛海綿状脳症)問題が顕在化し、牛皮由来を含む家畜由来の原料を用いたコラーゲン製品により、人間に対して病原体が感染する危険性を潜在的に指摘されるに至った。そこで安全性と資源量等の観点から、魚類由来コラーゲンが化粧品材料及び食品材料として俄に脚光を浴び、細胞担体および医療用材料コラーゲンゲルの原料としても、魚類由来コラーゲンを用いることが重要になりつつある。
コラーゲンゲルを作製する方法としては大きく3種類に分けることができる。
1.コラーゲン溶液に架橋剤を導入し、溶液をゲル化する方法。
2.コラーゲン溶液に架橋を惹起する光線を照射し、溶液をゲル化する方法。
3.コラーゲン溶液に中性緩衝液を加えてコラーゲンの線維化を惹起させ、コラーゲン線維ネットワークから構成されるゲルを得る方法。
【0003】
上記1の方法については、例えばコラーゲン溶液に化学架橋剤を混合してゲル化させた眼科用コラーゲンゲル成形物(特許文献1)、グリコサミノグリカンとコラーゲンの混合溶液を水溶性カルボジイミドで架橋した組織再生マトリックス用ゲル(特許文献2)などが開示されている。2の方法については、例えば窒素で十分に置換したコラーゲン溶液に紫外線を照射すると、コラーゲン溶液がゲル化することが報告されている(非特許文献2)。3の方法については、例えばサメ由来コラーゲン溶液と中性緩衝液を混合してコラーゲンの線維化を惹起させることにより得られる、コラーゲン線維ネットワークから構成されるゲルが報告されている(非特許文献3)。
上記3種類のゲル化方法によって魚類由来コラーゲンから作製したコラーゲンゲルは、ゲル強度、熱安定性および生体内安定性が不十分であり、細胞担体および医療用材料の用途においてゲルの収縮や崩壊をきたす場合や、生体内吸収性が高すぎる場合があった。
そこで近年、魚類由来コラーゲンゲルの強度および熱安定性を大幅に向上させる技術として、コラーゲンを線維化させる工程に架橋剤を共存させ、コラーゲン線維内に架橋結合を導入させる技術が公表されている(非特許文献4)。魚類由来コラーゲンの変性温度は一般的に低く、工業的に生産されている魚類由来コラーゲンの変性温度は30℃以下であり、上記技術において用いられている魚類由来コラーゲンの変性温度は19℃である。これらの魚類由来コラーゲンから上記方法でコラーゲンゲルを作製すると、細胞培養温度および生体内温度である37℃において部分的に変性し、ゲルの収縮や崩壊をきたす場合や、生体内で速やかに吸収される場合があり、魚類由来コラーゲンから細胞担体および医療用材料としてのコラーゲンゲルを作成する方法としては必ずしも十分ではなかった。
【0004】
公知の架橋剤はコラーゲン分子の螺旋内ではなくコラーゲン分子間に作用するという本質的な問題、および魚類由来コラーゲンの変性温度が低く変性を完全に抑制できないという問題がいまだ解決されていないため、魚類由来コラーゲンゲルの強度、熱安定性および生体内安定性の向上は十分に達成されていない。すなわち、上記のゲル化方法は、魚類由来コラーゲンから細胞担体および医療用材料として十分に使用可能なコラーゲンゲルを作成する方法として必ずしも十分ではない。
以上に述べた、従来の作成方法を用いた魚類由来コラーゲンゲルの強度、熱安定性および
生体内安定性の不足などの問題点は、家畜由来コラーゲンゲルの代替としての魚類由来コラーゲンゲルの細胞担体および医療用材料医療用材料への応用を制限してきた。
【特許文献1】特開平11−197234号公報
【特許文献2】特開2002−80501号公報
【特許文献3】特開平8−283667号公報
【非特許文献1】Biochemical Journal, 316, 1(1996).
【非特許文献2】Biochimica Biophysica Acta, 229, 672 (1971).
【非特許文献3】Journal of Agricultural Food Chemistry, 48, 2028 (2000).
【非特許文献4】Journal of Bioscience and Bioengineering, 98, 40 (2004)
【発明の開示】
【発明が解決しようとする課題】
【0005】
従来のコラーゲンゲルの作成方法では、上記のように、魚類由来コラーゲンを用いた場合に、熱変性によってゲルの収縮や崩壊をきたしやすいため、ゲルの強度、熱安定性、ならびに生体内安定性が不十分であった。
そこで、この出願の発明は、魚類とりわけ魚鱗を由来とするコラーゲンを含むコラーゲンゲルであって、細胞担体および医療用材料として幅広く使用し得る、高い強度、熱安定性、および生体内安定性を有するコラーゲンゲルとその作成方法を提供することを課題としている。
【課題を解決するための手段】
【0006】
この出願の発明者らは、前記問題点を改善すべく鋭意研究を重ねた結果、変性温度の高い魚鱗由来コラーゲンの線維化途上に線維間の架橋反応を起こすことにより、従来の方法では困難であった魚鱗由来コラーゲンゲルの強度、熱安定性および生体内安定性の大幅な向上を同時に達成でき、細胞担体および医療用材料として極めて有用なコラーゲン材料が得られることを見出し、この出願の発明に到達した。
すなわち、この出願の発明は、第1には、変性温度が30℃以上である魚鱗由来コラーゲンを含むコラーゲン溶液に対して架橋剤と線維化剤を添加しゲル化させることを特徴とするコラーゲンゲルの作成方法を提供する。この出願の発明は、第2には、変性温度が30℃以上である魚鱗由来コラーゲンがオレオクロミス属の鱗由来のコラーゲンであることを特徴とする前記のコラーゲンゲルの作成方法を提供する。この出願の発明は、第3には、コラーゲン溶液のコラーゲン濃度が0.01〜3.0(w/v)%であることを特徴とす
る前記のコラーゲンゲルの作成方法を提供する。
さらに、この出願の発明は、第4には、架橋剤濃度が、作成したコラーゲンゲルにおける終濃度として0.001mM〜100mMであることを特徴とする前記のいずれかに記載のコラーゲンゲルの作成方法を提供する。この出願の発明は、第5には、架橋剤が、水溶性カルボジイミドを含むことを特徴とする前記のいずれか記載のコラーゲンゲルの作成方法を提供する。この出願の発明は、第6には架橋剤がグルタルアルデヒドを含むことを前記のいずれか記載のコラーゲンゲルの作成方法を提供する。この出願の発明は、第7には線維化剤が、リン酸塩、酢酸塩、炭酸塩およびTrisからなる群より選択される1種類以上の緩衝能を有する塩水溶液である前記のいずれか記載のコラーゲンゲルの作成方法を提供する。この出願の発明は、第8には、コラーゲン溶液への架橋剤および線維化剤の添加を、コラーゲンの変性温度+5℃以下の温度で行う前記のいずれか記載のコラーゲンゲルの作成方法を提供する。この出願の発明は、第9にはコラーゲン溶液への架橋剤および線維化剤の添加後、コラーゲンの変性温度+5℃以下の温度で少なくとも3時間インキュベートすることを特徴とする前記のいずれか記載のコラーゲンゲルの作成方法を提供する。この出願の発明は、第10にはコラーゲン溶液への架橋剤および線維化剤の添加後、コラーゲンの変性温度+5℃以下の温度で少なくとも1時間インキュベートすることを特徴とする前記のいずれか記載のコラーゲンゲルの作成方法を提供する。この出願の発明は、第11には、磁場中でゲル化を行うことを特徴とする前記のいずれか記載のコラーゲンゲ
ルの作成方法を提供する。
また、この出願の発明は、第12には前記第1発明ないし第11発明のいずれか記載のコラーゲンゲルの作成方法により作成されたコラーゲンゲルを提供する。この出願の発明は、第13には前記第12発明のコラーゲンゲルをさらに50℃以上の温度で熱処理したコラーゲンゲルを提供する。この出願の発明は、第14には、前記のコラーゲンゲルからなる細胞担体を、第15には、前記のコラーゲンゲルからなる医療用材料を提供する。
【発明の効果】
【0007】
この出願の発明は、変性温度の高い魚鱗由来コラーゲンの線維化途上に線維間に架橋反応を起こすことにより、架橋ならびに線維化によるコラーゲンゲルの機械強度、熱安定性および生体内安定性の向上を相乗的に得ることを可能とする。
【発明を実施するための最良の形態】
【0008】
以下にこの出願の発明を詳細に説明する。
【0009】
この出願の発明に用いられる魚鱗由来コラーゲンは、線維化能を有し、かつ変性温度が30℃以上であることが重要である。魚鱗由来コラーゲンは特に線維化反応が速くすすみ、家畜由来コラーゲンで通常24時間以上かかる線維化が1時間以内の短時間で繊維化が完了する。魚鱗由来コラーゲンとしてはそれらの性質を満たすものであればその型について特に限定されるものではないが、工業的な利用という観点から、収量の多いI型コラーゲンあるいはそれを主成分とするコラーゲンが好ましい。
この出願の発明におけるコラーゲン線維とは、文献(Journal of Agricultural Food Chemistry 48, 2028 (2000))の走査型電子顕微鏡写真に示されているようなナノサイズの径を有する糸状構造のことを意味する。
この出願の発明において、コラーゲンの変成温度とは、この出願の発明の方法で作成されたコラーゲンの酸性水溶液を、円偏光二色性分光計を使用して、コラーゲン水溶液の温度を段階的に上昇させることによって求められる。具体的にはThe Journal of Biological Chemistry, 275(33), 25870 (2000)やInternational Journal of Biological Macromolecules, 32 199 (2003)に記載の方法によって求められた、円偏光二色性から求められる螺
旋率(Helicity; %)が50%になるときの温度である。
この出願の発明に用いられる魚鱗由来コラーゲンは、線維化能を有し、かつ変性温度が30℃以上であれば、その分子構造について特に限定されるものではない。コラーゲン分子の両末端に存在する非螺旋領域(テロペプチド)は抗原性を有するという報告がある。用途によっては除去されるべき場合があるが、線維化能を有する限りはテロペプチドが除去されていても除去されていなくても構わない。
この出願の発明に用いられる魚鱗由来コラーゲンは、線維化能を有し、かつ変性温度が30℃以上であれば、その由来について特に限定されるものではないが、変成温度の特に高いコラーゲンを含有するオレオクロミス属の鱗が好ましく用いられる。さらに、中国や日本国内で食用として養殖されており入手が容易であるナイルテラピア(Oreochromis niloticus)の鱗が特に好ましく用いられる。
この出願の発明に用いられる架橋剤は、タンパク質を架橋でき、水溶性を有するものであれば特に限定されるものではない。タンパク質の架橋剤については、Biomaterials 18, 95 (1997)に詳細に記載されている。中でも、アルデヒド系、カルボジイミド系、エポキシド系およびイミダゾール系架橋剤が経済性、安全性および操作性の観点から好ましく用いられる。特に、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド・塩酸塩、1−シクロヘキシル−3−(2−モルホリニル−4−エチル)カルボジイミド・スルホン酸塩などの水溶性カルボジイミドを、後述の線維化剤の緩衝液に混合した溶液として使用することが好ましい。
この出願の発明に用いられる架橋剤が水溶性カルボジイミドの場合、N-ヒドロキシコハ
ク酸イミドを共存させることで架橋効率を高めることができる。
この出願の発明の魚鱗由来コラーゲンゲルの作成方法は、コラーゲンの線維化途上に架橋反応を起こすことを特徴の1つとしている。これを達成するための具体的方法としては、以下の3つの方法が挙げられる。
A.コラーゲン溶液に対し、線維化剤と架橋剤をあらかじめ混合した溶液を混合する方法。
B.コラーゲン溶液に対し、線維化剤溶液を混合し、それと同時あるいはその後に架橋剤溶液を添加する方法。
C.コラーゲン溶液に対し、架橋剤溶液を添加し、その後線維化剤溶液を混合する方法。これらの方法により、コラーゲン線維化の途上に架橋反応が起こり、コラーゲン分子間およびコラーゲン線維間に架橋が起こる。この反応はコラーゲン線維化と架橋の相乗効果をもたらし、従来の方法では達成困難であった強度と熱安定性を有するコラーゲンゲルが得られる。操作性の観点から、Aの方法により魚鱗由来コラーゲンゲルを作成することが特に好ましい。
この出願の発明の魚鱗由来コラーゲンゲルの作成に用いられるコラーゲン溶液のpHは、コラーゲン原料の作成方法に応じて変わる。コラーゲンは主に、酸性水溶液で抽出される酸可溶化コラーゲンと、アルカリ水溶液で抽出されるアルカリ可溶化コラーゲンに分けられる。この出願の発明に用いられるコラーゲン溶液が酸可溶化コラーゲン溶液の場合、そのpHは2.0〜6.0の間であることが好ましい。pHが2.0よりも低い場合、コラーゲン分
子が加水分解を受ける場合があり好ましくない。pHが6.0よりも高い場合、コラーゲン
が十分に可溶化されない場合があり好ましくない。一方、この出願の発明に用いられるコラーゲン溶液がアルカリ可溶化コラーゲン溶液の場合、pHは5.5〜10の間であることが
好ましい。pHが5.5よりも低い場合、コラーゲンが十分に可溶化されない場合があり好
ましくない。pHが10よりも高い場合、コラーゲン分子が加水分解を受ける場合があり好ましくない。
この出願の発明の魚鱗由来コラーゲンゲルの作成に用いられるコラーゲン溶液の溶媒としては、酸性溶媒の場合、最終用途から見て安全で、工業用として広く使用されている水、あるいは塩酸、酢酸、クエン酸、フマル酸等の水溶液が望ましい。中性〜アルカリ性の場合、上記と同様の理由から、水、あるいはリン酸塩、酢酸塩、Tris等の水溶液が望ましい。ここでTrisは、2-Amino-2-hydroxymethyl-1,3-propanediol Tris(hydroxymethyl)aminomethaneである。
この出願の発明の魚鱗由来コラーゲンゲルの作成に用いられるコラーゲン溶媒の塩濃度としては、用いられるコラーゲンが可溶化されるpHを溶媒に付与できれば特に限定されるものではない。しかし、塩濃度が高すぎると、塩の種類によっては目的範囲のpHを付与できない場合や、コラーゲンの線維化を阻害する場合、あるいは得られるゲルの細胞接着性などの物性を阻害する場合があり好ましくない。塩濃度は、好ましくは1.0M以下であ
り、より好ましくは0.50M以下である。
この出願の発明の魚鱗由来コラーゲンゲルの作成に用いられるコラーゲン溶液のコラーゲン濃度としては、コラーゲンの溶解性、溶液の粘性あるいはゲルの物性の観点から0.01〜3.0(w/v)%の範囲であることが好ましい。濃度が0.01(w/v)%よりも低い場合、
ゲルの強度が不足する場合があり好ましくない。濃度が3.0(w/v)%よりも高い場合、コラーゲン溶液の粘性が高すぎてゲルの作成が困難になる場合があり好ましくない。好ましくは0.05〜2.0(w/v)%の範囲である。
この出願の発明の魚鱗由来コラーゲンゲルの作成に用いられる架橋剤の濃度としては、架橋剤溶液の濃度よりもむしろコラーゲンゲルにおける架橋剤終濃度が重要である。架橋剤種、コラーゲンの線維化能、および温度によって変わるが、架橋度および架橋速度の観点から、終濃度として0.001mM〜100mMの範囲であることが好ましい。架橋剤の終濃度が0.001mMよりも低い場合、架橋度が不足してゲルの強度、熱安定性あるいは生体内吸収性が不十分となる場合があり好ましくない。架橋剤の終濃度が100mMよりも高い場合、架橋剤の共存によるコラーゲン線維化の阻害が顕著になり、ゲルの強度、熱安定性あるいは生体内吸収性が不十分となる場合があり好ましくない。より好ましくは
0.01mM〜50mMの範囲である。
この出願の発明の魚鱗由来コラーゲンゲルの作成に用いられる線維化剤は、コラーゲンの線維化を惹起する溶媒であればよい。好ましくは、細胞担体あるいは医療材料などの最終用途を考慮し、細胞毒性が無いかあるいは低く、工業用として広く使用されているリン酸塩、酢酸塩、炭酸塩、Tris等の緩衝能を有する塩水溶液が用いられることが好ましい。コラーゲンの線維化に適するpHは、コラーゲンの種類によって変化するがpH5〜9の範囲である場合が多く、その範囲で高い緩衝能を有するリン酸塩が特に好ましく用いられる。線維化剤としてはたらくこれら緩衝液の塩濃度については、前述のコラーゲンゲルの作成に用いられるコラーゲン溶液の塩濃度に準ずる。
コラーゲン溶液と線維剤溶液あるいは架橋剤溶液と混合する操作は、これらの溶液温度を、変性温度を大きく超えない温度に保って行われる。特に混合後の溶液温度が重要である。混合溶液の温度がコラーゲンの変性温度を大きく超える場合、架橋反応は起こるもののコラーゲンが変性して線維化能を減じ、高いゲル強度と熱安定性を有するコラーゲンゲルを作成するというこの出願の発明の効果が十分に達成されない場合があり好ましくない。好ましくは使用するコラーゲンの変性温度+5℃以下であり、より好ましくは使用するコラーゲンの変性温度以下である。
コラーゲン溶液に対して線維化剤および架橋剤を混合する操作において、これらの溶液を混合する方法としては特に限定されるものではないが、線維化による溶液のゲル化によって溶液の流動性が失われる前に、できるだけ均一に混合することが好ましい。容器内に混合溶液を入れて手作業あるいはシェーカーで容器を振る方法、マグネティックスターラーあるいは羽根付き攪拌棒などを用いて機械的に溶液を攪拌する方法が好ましく用いられる。
上記のコラーゲン溶液に対して線維化剤および架橋剤を混合する操作を、磁場の中で行うことにより、コラーゲン線維を特定方向に配向させることができる。磁場によるコラーゲン線維の配向については、Journal of Cell Science, 105, 317 (1993)に詳細に記載されている。磁場の強度は1.0〜20 Tであることが好ましい。1.0 T未満ではコラーゲン線維の配向が不十分である場合があり好ましくない。20 T以上ではコラーゲン線維の配向は十分であるが磁場を発生する装置にコストがかかり過ぎ好ましくない。好ましくは2.0〜10 T
である。
コラーゲン溶液に対して線維化剤および架橋剤を混合した後、線維化反応と架橋反応を十分に起こすために混合溶液をインキュベートする。インキュベート時間としては、高いゲル強度あるいは熱安定性を付与するという観点から、少なくとも3時間以上、より少なくとも1時間以上であることが望ましい。インキュベート温度は、コラーゲンの変性を防ぐという観点から、好ましくはコラーゲンの変性温度+5℃以下であり、より好ましくはコラーゲンの変性温度以下である。
上記方法で得られたコラーゲンゲルを50℃以上の温度で熱処理することにより、コラーゲンゲルに伸縮性が付与される。熱処理はゲルの乾燥を防ぐため水あるいは水蒸気の中で行われる。熱処理温度は50〜150℃の範囲で行われることが好ましい。温度が50℃以下ではコラーゲンゲルに伸縮性が付与されない場合があり好ましくなく、温度が150℃以上ではコラーゲン分子の分解が起こる場合があり好ましくない。より好ましくは70〜130℃の温度範囲である。
以上の方法により得られたこの出願の発明の魚鱗由来コラーゲンゲルは、高い機械強度を有しており、同時に熱安定性および生体内安定性にも優れる。このため、従来の家畜由来コラーゲンゲルの代替として、再生医療における細胞担体あるいは医療用材料へ応用するに十分な機械強度、熱安定性および生体内安定性を有する魚鱗由来コラーゲンゲルを作成できる。
【実施例】
【0010】
以下、この出願の発明を実施例と比較例を挙げてより具体的に説明するが、この出願の発明は下記の例によって限定されるものではない。
【0011】
はじめに各種測定方法を示す。
1.コラーゲン線維の観察
以下の操作によりコラーゲンゲル中のコラーゲン線維を観察した。コラーゲンゲルを2.5(w/v) %のグルタルアルデヒド水溶液に24時間浸した後、20, 50, 75および99(v/v) %エタ
ノール水溶液に各30分づつ順次浸し、コラーゲンゲルを脱水した。これをt-ブタノールに15分づつ2回浸した後、4℃で凝固させ、0℃において減圧乾燥した。乾燥したコラーゲンゲルに白金を蒸着し、走査型電子顕微鏡(SEM)用試料とした。SEM観察はJEOL-5600LV
を用いて、倍率15,000倍で行った。
2.コラーゲンゲルの変成温度の測定
以下の操作によりコラーゲンゲルの変成温度を測定し、コラーゲンゲルの熱安定性を評価した。スパチュラでコラーゲンゲルの小片(内径約3 mmの塊)を採取し、キムワイプで余分な水を吸い取った。重量は15 mgであった。ゲル小片を示差走査型熱量分析計(DSC)用のアルミニウム製サンプルパンに詰め、DSC測定用試料とした。DSC測定は室温から60℃まで、昇温速度1℃/分で大気中にて行った。得られたDSC曲線はコラーゲンゲルの変成によ
る熱流変化を示し、昇温に伴うベースラインからの変曲が観測される。そのDSC曲線の低
温側変曲点を与える温度(変成開始温度)をゲルの変成温度とした。
〔実施例1〕
1.魚燐からの可溶性コラーゲンの作成
(1) 魚燐のアルカリ処理
ナイルテラピアの鱗を水で十分に洗浄し、鰭等の夾雑物を除去した後風乾した後、冷凍庫で保管したものをコラーゲン作成に供した。乾燥魚鱗50 gを500 mlの0.1 M 水酸化ナトリウム水溶液に浸漬し、攪拌羽根を用いて24時間穏やかに攪拌した。金網で魚鱗をろ過し、1000 mlの0.1 M 水酸化ナトリウム水溶液に加えて同様の操作を行った。魚鱗を水でpHが
中性を示すまで繰り返し洗浄した。
(2) 魚燐のペプシン処理
上記魚鱗を1000 mlの0.5 M 酢酸水溶液に加え、攪拌羽根を用いて室温で3日間穏やかに攪拌した。この水溶液を遠心(10000×g, 20分)し、魚鱗を沈殿させた。5 gのペプシン(
和光純薬、ペプシン1:100)を含む1000 mlの0.5 M 酢酸水溶液に前記魚鱗を加え、攪拌羽根を用いて室温で3日間穏やかに攪拌した。この水溶液を遠心(10000×g, 20分)し、魚
鱗を沈殿させた。上清を回収し、ガラスフィルター(SHIBATA, 151G P16)を用いて吸引
ろ過した。ろ液に0.5 g/lになるようにペプシンを加え、室温で24時間攪拌した。魚鱗残
渣を上記と同様のペプシン含有酢酸水溶液に加え、同様に攪拌した。この操作を4回繰り返し、4バッチの上清を得た。
(3) コラーゲンの精製
ペプシン処理を終えた上清に対し、終濃度が0.9 Mになるように塩化ナトリウム水溶液を
加え、ガラス棒で混合した後、4℃で24時間静置して塩析した。これを遠心(10000×g, 20分)し、沈殿物を300 mlの0.5 M 酢酸水溶液に溶解した。この塩析工程を3回繰り返し
、コラーゲンの酢酸水溶液をセルロースチューブに入れて蒸留水に対して透析し、凍結乾燥した。
2.コラーゲンゲルの作成
凍結乾燥コラーゲンを0.01 M希塩酸に溶解し、0.10 (w/v)%のコラーゲン水溶液を調製し
た。コラーゲン水溶液9 mlに対し、架橋剤として0.0014 mmolの1−エチル−3−(3−
ジメチルアミノプロピル)カルボジイミド・塩酸塩を含む10倍濃度のリン酸緩衝生理食塩水1mlからなる線維化剤を添加し、速やかに混合した後33℃で3時間インキュベートし、コラーゲンゲルを得た。
3.コラーゲンゲルの分析
(1)コラーゲン線維
コラーゲンゲル中のコラーゲン線維構造を観察した結果を図1に示す。これより本実施例のコラーゲンゲルは、比較例における架橋を導入しないコラーゲンゲル(比較例1)と同
様のナノサイズの径を有するコラーゲン線維で構成されていることが明らかとなった。
(2)コラーゲンゲルの変成温度
コラーゲンゲルの変成温度は47.0℃であり、得られたDSC曲線を図4に示す。これより、
本実施例のコラーゲンゲルは架橋を導入しない比較例1より高い変成温度を有しており、熱に対する安定性や生体内安定性が比較例1より優れていることが示された。
〔実施例2〕
架橋剤のみを1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド・塩酸塩よりグルタルアルデヒドに変更し、実施例1と同様にコラーゲンゲルを得た。コラーゲンゲル中のコラーゲン線維構造を観察した結果を図2に示す。比較例における架橋を導入しないコラーゲンゲル(比較例1)と同様のナノサイズの径を有するコラーゲン線維で構成されていることが明らかとなった。また、コラーゲンゲルの変成温度は46.8℃であり、得られたDSC曲線を図4に示す。これより、本実施例のコラーゲンゲルは架橋を導入しない
比較例1より高い変成温度を有しており、熱に対する安定性や生体内安定性が比較例1より優れていることが示された。
〔比較例1〕
比較例として、架橋剤である1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド・塩酸塩を添加しないほかは実施例1と同様の方法によりコラーゲンゲルを得た。コラーゲンゲル中のコラーゲン線維構造を観察した結果を図3に示す。また、コラーゲンゲルの変成温度を測定した。変成温度は43.6℃であり、得られたDSC曲線を図4に示す。
【図面の簡単な説明】
【0012】
【図1】実施例1のコラーゲンゲル中のコラーゲン線維のSEM写真である。
【図2】実施例2のコラーゲンゲル中のコラーゲン線維のSEM写真である。
【図3】比較例1のコラーゲンゲル中のコラーゲン線維のSEM写真である。
【図4】実施例1および2、および比較例1のコラーゲンゲルのDSC曲線である。
【特許請求の範囲】
【請求項1】
変性温度が30℃以上である魚鱗由来コラーゲンを含むコラーゲン溶液に対して架橋剤と線維化剤を添加しゲル化させることを特徴とするコラーゲンゲルの作成方法。
【請求項2】
変性温度が30℃以上である魚鱗由来コラーゲンがオレオクロミス属の鱗由来のコラーゲンであることを特徴とする請求項1に記載のコラーゲンゲルの作成方法。
【請求項3】
コラーゲン溶液のコラーゲン濃度が0.01〜3.0(w/v)%であることを特徴とす
る請求項1または2に記載のコラーゲンゲルの作成方法。
【請求項4】
架橋剤濃度が、作成したコラーゲンゲルにおける終濃度として0.001mM〜100mMであることを特徴とする請求項1ないし3のいずれか1項に記載のコラーゲンゲルの作成方法。
【請求項5】
架橋剤が、水溶性カルボジイミドを含むことを特徴とする請求項1ないし4のいずれか1項記載のコラーゲンゲルの作成方法。
【請求項6】
架橋剤がグルタルアルデヒドを含むことを特徴とする請求項1ないし5のいずれか1項に記載のコラーゲンゲルの作成方法。
【請求項7】
線維化剤が、リン酸塩、酢酸塩、炭酸塩およびTrisからなる群より選択される1種類以上の緩衝能を有する塩水溶液である請求項1ないし6のいずれか1項に記載のコラーゲンゲルの作成方法。
【請求項8】
コラーゲン溶液への架橋剤および線維化剤の添加を、コラーゲンの変性温度+5℃以下の温度で行う請求項1ないし7のいずれか1項に記載のコラーゲンゲルの作成方法。
【請求項9】
コラーゲン溶液への架橋剤および線維化剤の添加後、コラーゲンの変性温度+5℃以下の温度で少なくとも3時間インキュベートすることを特徴とする請求項1ないし8のいずれか1項に記載のコラーゲンゲルの作成方法。
【請求項10】
コラーゲン溶液への架橋剤および線維化剤の添加後、コラーゲンの変性温度+5℃以下の温度で少なくとも1時間インキュベートすることを特徴とする請求項1ないし8のいずれか1項に記載のコラーゲンゲルの作成方法。
【請求項11】
磁場中でゲル化を行うことを特徴とする請求項1ないし10のいずれか1項記載のコラーゲンゲルの作成方法。
【請求項12】
請求項1ない11のいずれか1項に記載のコラーゲンゲルの作成方法により作成されたことを特徴とするコラーゲンゲル。
【請求項13】
請求項12記載のコラーゲンゲルをさらに50℃以上の温度で熱処理したことを特徴とするコラーゲンゲル。
【請求項14】
請求項12または13記載のコラーゲンゲルからなることを特徴とする細胞担体
【請求項15】
請求項12または13記載のコラーゲンゲルからなることを特徴とする医療用材料。
【請求項1】
変性温度が30℃以上である魚鱗由来コラーゲンを含むコラーゲン溶液に対して架橋剤と線維化剤を添加しゲル化させることを特徴とするコラーゲンゲルの作成方法。
【請求項2】
変性温度が30℃以上である魚鱗由来コラーゲンがオレオクロミス属の鱗由来のコラーゲンであることを特徴とする請求項1に記載のコラーゲンゲルの作成方法。
【請求項3】
コラーゲン溶液のコラーゲン濃度が0.01〜3.0(w/v)%であることを特徴とす
る請求項1または2に記載のコラーゲンゲルの作成方法。
【請求項4】
架橋剤濃度が、作成したコラーゲンゲルにおける終濃度として0.001mM〜100mMであることを特徴とする請求項1ないし3のいずれか1項に記載のコラーゲンゲルの作成方法。
【請求項5】
架橋剤が、水溶性カルボジイミドを含むことを特徴とする請求項1ないし4のいずれか1項記載のコラーゲンゲルの作成方法。
【請求項6】
架橋剤がグルタルアルデヒドを含むことを特徴とする請求項1ないし5のいずれか1項に記載のコラーゲンゲルの作成方法。
【請求項7】
線維化剤が、リン酸塩、酢酸塩、炭酸塩およびTrisからなる群より選択される1種類以上の緩衝能を有する塩水溶液である請求項1ないし6のいずれか1項に記載のコラーゲンゲルの作成方法。
【請求項8】
コラーゲン溶液への架橋剤および線維化剤の添加を、コラーゲンの変性温度+5℃以下の温度で行う請求項1ないし7のいずれか1項に記載のコラーゲンゲルの作成方法。
【請求項9】
コラーゲン溶液への架橋剤および線維化剤の添加後、コラーゲンの変性温度+5℃以下の温度で少なくとも3時間インキュベートすることを特徴とする請求項1ないし8のいずれか1項に記載のコラーゲンゲルの作成方法。
【請求項10】
コラーゲン溶液への架橋剤および線維化剤の添加後、コラーゲンの変性温度+5℃以下の温度で少なくとも1時間インキュベートすることを特徴とする請求項1ないし8のいずれか1項に記載のコラーゲンゲルの作成方法。
【請求項11】
磁場中でゲル化を行うことを特徴とする請求項1ないし10のいずれか1項記載のコラーゲンゲルの作成方法。
【請求項12】
請求項1ない11のいずれか1項に記載のコラーゲンゲルの作成方法により作成されたことを特徴とするコラーゲンゲル。
【請求項13】
請求項12記載のコラーゲンゲルをさらに50℃以上の温度で熱処理したことを特徴とするコラーゲンゲル。
【請求項14】
請求項12または13記載のコラーゲンゲルからなることを特徴とする細胞担体
【請求項15】
請求項12または13記載のコラーゲンゲルからなることを特徴とする医療用材料。
【図4】


【図1】


【図2】


【図3】




【図1】


【図2】


【図3】


【公開番号】特開2006−257013(P2006−257013A)
【公開日】平成18年9月28日(2006.9.28)
【国際特許分類】
【出願番号】特願2005−76051(P2005−76051)
【出願日】平成17年3月16日(2005.3.16)
【出願人】(301023238)独立行政法人物質・材料研究機構 (1,333)
【Fターム(参考)】
【公開日】平成18年9月28日(2006.9.28)
【国際特許分類】
【出願日】平成17年3月16日(2005.3.16)
【出願人】(301023238)独立行政法人物質・材料研究機構 (1,333)
【Fターム(参考)】
[ Back to top ]

