鱗片状リン酸水素カルシウムからなる制酸剤
【課題】
アルミニウム系無機制酸剤は制酸持続効果が優れているが、腎臓機能低下した糖尿病患者では、人工透析によるアルミニウム骨症やアルミニウム脳症などのアルミニウム障害を防止するため、アルミニウムを含有しない制酸剤が求められている。
【解決手段】
平均粒子径が0.05〜5μmの一次粒子から構成され、形状が平均粒子径0.1〜10μmの粉体又は平均粒子径10〜500μmの粒体であり、比表面積が5〜60m2/g、静的嵩比容積が1〜10ml/g、吸油量が0.5〜3.0ml/gである下式(I)
Al2O3・xMgO・ySiO2・mH2O (I)
(式中、mは0≦m≦0.5の範囲の数を示す)で表される鱗片状のリン酸水素カルシウムは、一般のリン酸水素カルシウムよりも制酸持続時間が長く、制酸剤として好適である。
アルミニウム系無機制酸剤は制酸持続効果が優れているが、腎臓機能低下した糖尿病患者では、人工透析によるアルミニウム骨症やアルミニウム脳症などのアルミニウム障害を防止するため、アルミニウムを含有しない制酸剤が求められている。
【解決手段】
平均粒子径が0.05〜5μmの一次粒子から構成され、形状が平均粒子径0.1〜10μmの粉体又は平均粒子径10〜500μmの粒体であり、比表面積が5〜60m2/g、静的嵩比容積が1〜10ml/g、吸油量が0.5〜3.0ml/gである下式(I)
Al2O3・xMgO・ySiO2・mH2O (I)
(式中、mは0≦m≦0.5の範囲の数を示す)で表される鱗片状のリン酸水素カルシウムは、一般のリン酸水素カルシウムよりも制酸持続時間が長く、制酸剤として好適である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、鱗片状リン酸水素カルシウムからなる持続性の制酸剤及びそれを含有する医薬製剤に関する。
【背景技術】
【0002】
制酸剤(又は制酸薬)としては、アミノ酢酸を有効成分とするアミノ酢酸系製剤、合成又は天然ケイ酸アルミニウム、乾燥水酸化アルミニウムゲル、ケイ酸アルミン酸マグネシウム、メタケイ酸アルミン酸マグネシウム、ヒドロタルサイト、ケイ酸アルミン酸マグネシウムビスマス等のアルミニウム化合物製剤、炭酸水素ナトリウム、酸化マグネシウム、水酸化マグネシウム、炭酸マグネシウム、ケイ酸マグネシウム、沈降炭酸カルシウム等の無機製剤、ボレイ末(牡蛎末)等の動物製剤等が知られている。しかしながら従来の制酸剤は、何らかの欠点を有し、例えば、アミノ酢酸系製剤は、食欲減退、下痢、不快感、長期大量投与で高カルシウム血症、まれに尿毒症を誘発する等の副作用が知られている。また、アルミニウム化合物製剤は、持続時間が長いが、腎機能が悪化している場合に限るがアルニウムの蓄積によりアルミ脳症を引き起こす副作用がある。マグネシウム化合物製剤は、中和性が速いが、持続時間が短い。炭酸水素ナトリウム等のナトリウムを含む無機製剤は、アルカローシスにより高血圧の原因となる。
【0003】
リン酸水素カルシウムは、カルシウム成分、リン酸成分の補強源、固結防止剤、歯磨き粉の研磨剤、賦形剤、制酸剤等として、医薬品、食品、化粧品等に使用されている。特に、結合性や分散性に劣るという問題がありながも、水に難溶でありかつ非吸湿性で主薬との反応が少ないため、医薬品の賦形剤として広く用いられている。しかし、通常のリン酸水素カルシウムは、一次粒子の平均粒子径が10μm以上の板状結晶であり、制酸効果としては、酸との反応性が低いため制酸持続時間が短いという問題があった。そのため、リン酸水素カルシウムを配合した胃腸薬としては、マグネシウム塩とリン酸水素カルシウムの併用(特許文献1)、ヒスタミンH2遮断薬とリン酸水素カルシウムの併用(特許文献2)が知られている。
【0004】
これを改善するため、本出願人は比表面積が20〜60m2/g、静的嵩比容積が5ml/g以上、吸油量が1.0ml/g以上であり、電子顕微鏡で測定した一次粒子が0.1〜5μm、その凝集した二次粒子の平均粒子径が2〜10μmである鱗片状のリン酸水素カルシウムを噴霧乾燥造粒して球状粒子としたリン酸水素カルシウムを開示している(特許文献3)。これはフジカリンSG〔製品名、富士化学工業(株)製〕として市販されている。これまで、本出願人は、この鱗片状リン酸水素カルシウムを微細で表面積が大きいため酸との反応性が通常のリン酸水素カルシウムより高いことから、制酸持続時間が長く、制酸剤として有効であることを見いだした。
【特許文献1】特開平11−124334号公報
【特許文献2】特開2008−56567号公報
【特許文献3】特開平7−118005号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
胃酸過多の症状において、アルミニウムを含有しておらず、制酸持続時間の長い無機系の制酸剤が求められている。
【課題を解決するための手段】
【0006】
本発明者らは、1次粒子が微細であり表面積が大きい鱗片状リン酸水素カルシウムを制酸剤として用いることによって、通常のリン酸水素カルシウムにない制酸活性を有していること、すなわち酸との制酸持続時間が長く、制酸剤として良好な性質を有していることを見出した。
【0007】
すなわち、本発明は以下の構成よりなる。
(1)平均粒子径0.05〜5μmの一次粒子からなる平均粒子径0.1〜500μmの凝集体であり、比表面積が5〜60m2/g、静的嵩比容積が1〜10ml/g、吸油量が0.5〜5ml/gである下式(I)
Al2O3・xMgO・ySiO2・mH2O (I)
(式中、mは0≦m≦0.5の範囲の数を示す)で示される鱗片状のリン酸水素カルシウムを有効成分とする制酸剤、
(2)凝集体が平均粒子径10〜500μmの粒子である(1)に記載の鱗片状のリン酸水素カルシウを有効成分とする制酸剤、
(3) 凝集体が平均粒子径0.1〜20μmの粉末である(1)に記載の鱗片状のリン酸水素カルシウを有効成分とする制酸剤、
(4)(1)〜(3)のいずれかに記載の制酸剤を配合してなる医薬製剤
(5)活性薬物を配合してなる(4)に記載の医薬製剤、
(6)活性薬物が、H2遮断剤、健胃剤、消化剤、整腸剤、止瀉剤、粘膜修復剤、粘膜保護剤、生薬、消化酵素、制酸剤(鱗片状リン酸水素カルシウム除く)、菌製剤のいずれか1種以上を配合してなる(5)に記載の医薬製剤。
【発明の効果】
【0008】
本発明の制酸剤は、1次粒子が微細で表面積が大きい鱗片状リン酸水素カルシウムは制酸持続時間が長く、制酸剤として良好な性質を有していることを見出した。さらには、制酸効果が短時間で発揮する成分やその他の胃腸薬成分と配合することによって、有用な経口用の医薬製剤を提供することができる。
【発明を実施するための最良の形態】
【0009】
本発明において、リン酸水素カルシウムの鱗片状の形状は、リン酸水素カルシウム一次粒子の形状がカードハウス類似構造を形成可能な面積/厚み比が大きい形状を指し、例えば、鱗片状、薄片状、皿状を含む。これらリン酸水素カルシウム一次粒子の形状はSEM写真で観察される。本発明で用いる鱗片状リン酸水素カルシウムは、粉体、粒体、粉末、球状造粒粒子、スラリーを用いることができ、最終的な形態−錠剤などの固体、懸濁液などにより適宜選ぶことができる。また、同時に良好な成形性や打錠性も有しており、錠剤の製造時に特に結合剤や他の賦形剤の添加を必要としない。
【0010】
本発明の鱗片状リン酸水素カルシウムは、微細な一次粒子がカードハウス類似構造を形成して凝集する二次粒子を形成しているため、比表面積が大きく、従来の板状リン酸水素カルシウムにない良好な制酸効果を有している。鱗片状リン酸水素カルシウムの一次粒子の平均粒子としては0.05〜5μmであり、二次粒子の平均粒子径としては0.1〜500μmである。これら鱗片状リン酸水素カルシウムの一次粒子の平均粒子は、前述同様SEM写真で観察される。鱗片状リン酸水素カルシウムの二次粒子の平均粒子径は、後述実施例の測定方法にて測定される。二次粒子の形状としては、粒子状、粉末状、顆粒状などの形態をとることができ、これらの形態は制酸剤としての使用にあわせて適宜選ぶ。粒子状の形態としては、後述の通常の造粒方法によって得られ、錠剤時の打錠性から平均粒子径10〜500μmであり、好ましくは20〜400μm、より好ましくは50〜200μmである。粉末状の形態としては、造粒工程を行わずに製造したものであり、高い比容積や微細な粒径が求められる場合に用いることができ、平均粒子径0.1〜30μm、好ましくは0.1〜20μm、より好ましくは0.1〜10μmである。
【0011】
本発明の鱗片状リン酸水素カルシウムの比表面積は5〜60m2/gであり、好ましくは10〜50m2/gである。
本発明の鱗片状リン酸水素カルシウムの静的比容積は1〜20mlであり、好ましくは1〜10mlである。
本発明の鱗片状リン酸水素カルシウムの吸油量は0.5〜5ml/gであり、好ましくは0.5〜3mlである。
【0012】
本発明の鱗片状リン酸水素カルシウムは、公知の方法によって製造することができ、例えば、特開平7−118005号公報、特開平10−120408号公報に記載の方法が挙げられる。
【0013】
本発明の鱗片状リン酸水素カルシウムを製造する方法は、1)リン酸とアルカリ性カルシウム化合物、又はアルカリ金属リン酸塩とカルシウム化合物とを水媒体中において反応させて柱状のリン酸水素カルシウムとし、2)次いでこの柱状物を60℃以上で水熱反応する。1)及び2)の工程のいずれか又は両方で、配位能を有した多価有機酸を添加する。多価有機酸は、カルシウム化合物とリン酸との反応時にリン酸水素カルシウムの結晶成長の制御、並びにリン酸水素カルシウムから無水リン酸水素カルシウムへの結晶変換時の結晶成長の制御することによって、本発明の鱗片状リン酸水素カルシウムを形成させる。
【0014】
本発明に使用するアルカリ性カルシウム化合物はリン酸と中和反応する化合物であり、生石灰、消石灰、炭酸カルシウム等の内の1種または2種以上を用いることができる。これらのカルシウム化合物は中和に必要な理論量を算出して反応に用いられる。また、アルカリ性金属リン酸塩は塩化カルシウムなどの水溶性カルシウム化合物と中和反応する化合物であり、リン酸水素ナトリウム、リン酸ナトリウム等の内の1種または2種を用いることができる。
【0015】
多価有機酸は、配位能を有する多価有機酸であればいずれでもよく、例えば、クエン酸、酒石酸、エチレンジアミン四酢酸(EDTA)、リンゴ酸、コハク酸などの内、1種または2種以上を選択することができる。これらの多価有機酸の使用量は、生成するリン酸水素カルシウム結晶粒子の大きさ等を考慮して決定され、生成するリン酸水素カルシウムに対し、0.5〜10mol%が良好である。
【0016】
リン酸とアルカリ性カルシウム化合物、又はアルカリ金属リン酸塩とカルシウム化合物とを水媒体中において反応させて柱状のリン酸水素カルシウムとする反応は、反応温度は50℃以下で行うことができ、反応を促進させるため、攪拌や超音波振動等を加えることができる。反応時のpHは、反応収率等の面からpH4〜5の範囲内で反応を行う。この反応中に多価有機酸を添加する場合は、リン酸とカルシウム化合物の反応前もしくは反応中においても、適宜、添加することができる。
【0017】
続いて、この柱状水和物を含有したスラリーを加温して水熱反応を行い鱗片状の推算カルシウムとする。必要に応じて多価有機酸を添加することができる。水熱反応の温度は、60℃以上、好ましくは60〜100℃、特に好ましくは90〜100℃である。この水熱処理温度の範囲は、60〜90℃では脱水時間がかかり、90℃以上では比較的速やかに脱水化するということに基づき、製造設備に照らし合わせて適宜設定すればよい。
【0018】
水熱処理時間は、使用するリン酸水素カルシウム二水塩及び多価有機酸の種類、使用量、反応時間及び機器の設備状況等により異なり特に限定されないが、好ましくは数10分〜数時間である。上記スラリーは撹拌しながら加温し、所定の温度範囲まで昇温させ、必要ならばさらに数10〜30分間この温度を保持後に反応を終了させてもよい。
【0019】
反応生成物は常法に従って、濾過し、水洗後、水分を除去することにより得ることができる。
【0020】
目的物は、常法に従って、例えば噴霧乾燥、棚式乾燥等により乾燥し、白色の鱗片状リン酸水素カルシウム粉末を得る。この鱗片状リン酸水素カルシウムの水分に関しては、乾燥条件により0.5水和物から無水物とすることができ、例えば50〜300℃に加温して乾燥することにより、容易に無水物とすることができる。
【0021】
特に、噴霧乾燥を行うことによって、鱗片状のリン酸水素カルシウムが凝集した球状造粒物を得ることができ、好適である。この噴霧乾燥によって得られる造粒物は、瞬時に乾燥させるため錠剤成型時の成形性や、制酸時の接触面が向上する。
【0022】
前述工程により製造した鱗片状リン酸水素カルシウムと崩壊剤、必要に応じて水溶性物質を水に懸濁及び/又は溶解させて、噴霧乾燥を行う。懸濁液の濃度としては、噴霧乾燥できる範囲であればよく、すなわち固形分は1〜40重量%であり、好ましくは5〜30重量%である。結合剤、被覆剤、界面活性剤、賦形剤、崩壊剤などのリン酸水素カルシウム以外の成分を添加する場合は、懸濁液の調製時に配合し、同時に噴霧乾燥を行う。噴霧乾燥の条件は特に限定されないが、噴霧乾燥機としては、円盤式またはノズル式の噴霧乾燥機を用いるのが好ましい。そして、噴霧乾燥の際の温度としては、入口温度が約120〜400℃であり、出口温度が約80〜300℃が好ましい。
【0023】
本発明の鱗片状リン酸水素カルシウムからなる制酸剤に活性薬物を配合し医薬製剤とする。さらに、必要に応じて通常医薬品に配合可能な添加成分を添加する。
【0024】
活性成分としては、特に限定されず、H2遮断剤、健胃剤、消化剤、整腸剤、吐瀉剤、粘膜修復剤、粘膜保護剤、生薬、消化酵素、消化剤、制酸剤などの消化管用薬剤;末梢神経用剤、解熱鎮痛消炎剤、催眠鎮静剤、精神神経用剤などの中枢神経用薬剤;骨格筋弛緩剤、自律神経剤などの末梢神経用薬剤;強心剤、不整脈用剤、利尿剤、血管拡張剤などの循環器用薬剤;気管支拡張剤、鎮咳剤などの呼吸器官用薬剤;ホルモン剤、抗ヒスタミン剤、ビタミン剤などの代謝性薬剤;抗潰瘍剤;抗生物質;化学療法剤;生薬エキス剤;微生物類などが挙げられる。
特に消化管用薬剤、胃に障害を与える活性成分及び胃酸抑制必要な活性成分とともに配合することが好ましい。
【0025】
消化管用薬剤は、H2遮断剤、健胃剤、消化剤、整腸剤、止瀉剤、粘膜修復剤、粘膜保護剤、生薬、消化酵素、消化剤、制酸剤などのである。これらの消化管用薬剤と鱗片状リン酸水素カルシウムを配合することによって、胃腸薬を製造することができる。
H2遮断剤としては、ファモチジン、ニザチジン、塩酸ラニチジン、シメチジン、塩酸ロキサチジンアセタートなどが挙げられる。
【0026】
粘膜保護剤としては、ソルビトール硫酸エステル、デキストラン、カルボキシメチルエステル、メチルメチオニンスルホニウムクロライド、銅クロロフィリンナトリウム、銅クロロフィリンカリウム、アルジオキサ、ガストリックムチン、デキストラン硫酸エステルアルミニウム塩、L−グルタミン、アズレンスルホン酸ナトリウム、ショ糖硫酸エステルアルミニウム塩などが挙げられる。
【0027】
健胃剤としては、ソウジュツ、トウヒ、ウコン、コウボクなどの各種生薬、塩酸ベタイン、塩化カルニチン、グルタミン酸塩酸塩、塩化ベタネコール、乾燥酵母などが挙げられる。
【0028】
消化剤としては、でんぷん消化酵素、たんぱく質消化酵素死亡消化酵素、繊維消化酵素、ウルソデスオキシコール酸、オキシコーラン酸、コール酸、胆汁末、デヒドロコール酸などが挙げられる。
整腸剤としては、乳酸菌や納豆菌などの整腸菌成分、赤芽柏、アセンヤク、ウバイ、ケツメイシ、ゲンノショウコなどが挙げられる。
止瀉剤としては、アクリノール、塩化ベルベリン、次硝酸ビスマス、次炭酸ビスマス、カオリン、天然ケイ酸カルシウム、乳酸カルシウム、オウバクなどが挙げられる。
抗潰瘍剤としては、例えば、テプレノン、ファモチジン、ランソプラゾール、オメプラゾール、ラベプラゾール、シメチジン、塩酸ラニチジンなどが挙げられる。
その他の消化器官用薬としては、クエン酸モサプリドなどが挙げられる。
【0029】
制酸剤としては、炭酸水素ナトリウム、酸化マグネシウム、炭酸マグネシウム、ケイ酸マグネシウム、沈降炭酸カルシウム、ボレイ、ロートエキス、水酸化アルミニウム・炭酸マグネシウム混合乾燥ゲル、水酸化アルミニウムゲル、水酸化アルミニウム・炭酸マグネシウム・炭酸カルシウム共沈殿生成物、アルミニウムグリシネート、合成ヒドロタルサイト、合成ケイ酸アルミニウム、ケイ酸アルミン酸マグネシウム及びメタケイ酸アルミン酸マグネシウムなどが挙げられる。本発明の鱗片状リン酸水素カルシウムは、制酸時の持続性に優れてはいるが、即効性は十分とは言えないため、即効性の制酸剤と配合することが好ましく、ケイ酸マグネシウム、酸化マグネシウム、水酸化マグネシウム、炭酸水素ナトリウム、炭酸マグネシウム及び沈降炭酸マグネシウムなどのマグネシウム化合物、並びに沈降炭酸カルシウムなどのカルシウム化合物との併用がよい。
【0030】
胃に障害を与える活性成分としては、アミノ安息香酸エチル、塩酸パパベリン、塩酸オキシフェンサイクリミン、塩酸ジサイクロミン、塩酸メチキセン、臭化水素酸スポコラミン、臭化メチルアトロピン、臭化メチル−l−ヒヨスチアミンなどの鎮痛剤などが挙げられる。
【0031】
医薬品に配合可能な添加成分としては、一般に結合剤、被覆剤、界面活性剤、賦形剤と区分されているものであり、例えば、結合剤(ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルアルコール、ポリビニルピロリドン、マクロゴール等)、被覆剤(ヒドロキシプロピルメチルセルロースフタレート、ヒドロキシプロピルメチルセルロースアセテートサクシネート、カルボキシメチルエチルセルロース、エチルセルロース、エチルセルロース水分散液、アミノアルキルメタアクリレートコポリマーE、メタアクリル酸コポリマーL、メタアクリル酸コポリマーS、メタアクリル酸コポリマーLD、アミノアルキルメタアクリレートコポリマーRS、硬化油等)、界面活性剤(ショ糖脂肪酸エステル、ポリオキシエチレンポリオキシプロピレングリコール、ポリソルベート、ラウリル硫酸ナトリウム等)、賦形剤(トウモロコシデンプン、ジャガイモデンプン、コメデンプン、トレハロース、結晶セルロース・カルメロースナトリウム、タルク、ステアリン酸マグネシウム、無水ケイ酸、メタケイ酸アルミン酸マグネシウム、ケイ酸アルミン酸マグネシウム、ハイドタルサイト、合成ケイ酸アルミニウム、酸化チタン等)、崩壊剤(低置換度ヒドロキシプロピルセルロース、カルメロースカルシウム、クロスカルメロースナトリウム、部分アルファー化デンプン等)、その他の添加剤などの製剤に一般的に使用可能な成分が使用される。
【0032】
本発明の医薬製剤は、錠剤、口腔内速崩壊錠、カプセル、顆粒、細粒などの固形投薬形態、懸濁液の液状製剤などの製剤形状とすることができる。
錠剤の製造方法は、顆粒状組成物を医薬品に配合可能な添加成分と乾式混合や湿式混合などの方法で混合したのち、圧縮成型する。このとき、F−MELT〔商標 富士化学工業(株)製〕、クロスポビドン、低置換度ヒドロキシプロピルセルロース、カルボキシメチルスターチナトリウム、クロスカルメロースナトリウム、澱粉などの崩壊剤を添加することによって、口腔内速崩壊剤とすることができる。
【0033】
本発明の医薬製剤は、鱗片状リン酸水素カルシウムを全体量に対して、1〜99重量%配合することができ、好ましくは2〜80重量%、より好ましくは、5〜70重量%である。他の制酸剤として用いる場合は、鱗片状リン酸水素カルシウムに対して他の制酸剤は、1:005〜5、好ましくは1:0.1〜3の割合で配合する。制酸剤以外の活性成分とともに配合する場合は、鱗片状リン酸水素カルシウムに対して活性成分は、1:0.01〜100、好ましくは1:0.1〜10の割合で配合することができる。
【0034】
本発明の制酸剤は、pHが中性であり、反応性が低く、リン酸水素カルシウムは天然物として存在していることから、酸の中和に用いることができる。例えばアルカリ土壌の改善、流出した酸の中和、口腔内などの乳酸抑制などに用いることができる。
【実施例】
【0035】
以下に、本発明を実施例により説明するが、これらの実施例は本発明の範囲を限定するものではない。
[SEM写真]
SEM(走査型顕微鏡)(日立製作所(株)、S−3000N)を用いて撮影した。
[粒子径測定方法]
懸濁液中の粒子の平均粒子径は、湿式粒度分布測定器(SALD−2000J、島津製作所(株)製)で屈折率1.7−0.20iの条件で平均粒子径を測定した。
乾式粉末の平均粒子径は、乾式粒度分布測定器(LA−920、(株)堀場製作所製)で平均粒子径を測定した。
[比表面積]
比表面積は、BET比表面積測定装置(モノソーブMS−17、ユアサアイオニクス(株)製)を用いて測定した。
[吸油量]
吸水量はJISK5101に基づき、アマニ油を用いて行った。
[静的比容積]
静的比容積は100mlのメスシリンダーにガラス管を挿入し、90〜100mlの容量となるようにロートで試料をガラス管内に入れ、ガラス管を静かに引き抜き、試料の表面を平らにしたときの容積(Vml)と試料の重量(Wg)をV/Wにより求めた。
【0036】
[フックス試験]
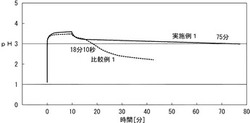
フックス変法試験装置(pHメーター;HM−5S、東亜ディーケーケー(株)製)を用い、37℃±2℃、回転数300rpmに設定した0.1N−塩酸溶液50mlに試料を適量投入し、10分間pHの経時変化をレコーダーの記録し10分後のpH(最大pH)を読み取った。10分後より2.0ml/分の速度で0.1N−塩酸溶液を添加し、pHの経時変化をレコーダーに記録した。pHが下がりpH3.5及びpH3.0を切った時間を持続時間として記録した。
【0037】
[実施例1]
水3.4Lに撹拌しながら生石灰(CaO純度96%)340gを投入し、30分間撹拌して、石灰乳とし、この石灰乳を100メッシュで篩過し、粗粒物を除去した。室温〜40℃で撹拌しながら、この液に50%濃度のリン酸水溶液1.12kgと前述の手順で調製した石灰乳とを30分間で同時に添加した。そして30分間撹拌を続行して反応を完結させた。クエン酸一水和物12gを添加して95℃まで加温し、30分間保持した後、濾過・洗浄した。このケーキを乾燥してSEM写真を撮った(図1)。洗浄スラリーの濃度を16%w/wに調製し、噴霧乾燥機(LT−8型,大川原化工機(株)製)を用いて、入熱170℃、排熱110℃、アトマイザー回転数25,000rpmで乾燥し、鱗片状リン酸水素カルシウムの造粒物を得た。
【0038】
[比較例1]
水3.4Lに撹拌しながら生石灰(CaO純度96%)340gを投入し、30分間撹拌して、石灰乳とし、この石灰乳を100メッシュで篩過し、粗粒物を除去した。室温〜40℃で撹拌しながら、この液に50%濃度のリン酸水溶液1.12kgと前述の手順で調製した石灰乳とを30分間で同時に添加した。そして30分間撹拌を続行して反応を完結させた。95℃まで加温し、30分間保持した後、濾過・洗浄した。このケーキを乾燥してSEM写真を撮った(図2)。洗浄スラリーの濃度を16%w/wに調製し、噴霧乾燥機(LT−8型,大川原化工機(株)製)を用いて、入熱170℃、排熱110℃、アトマイザー回転数25,000rpmで乾燥し、リン酸水素カルシウムを得た。
【0039】
[表1]分析値

【0040】
[表2] フックス試験
各合成品を2.4g使用し、フックス試験を行った。

【0041】
本発明の鱗片状リン酸水素カルシウムは、持続時間が長く、従来のリン酸水素カルシウムよりも非常に良好な制酸特性を有している。
【0042】
[実施例2] 胃腸薬
以下成分に水を同量添加して乳鉢で混合し、篩過後、50℃で一晩乾燥し、胃腸顆粒薬を製造した。
実施例1の鱗片状リン酸水素カルシウム 44.72重量%
水酸化マグネシウム 28.46重量%
コーンスターチ 6.82重量%
部分α化澱粉 20.00重量%
【0043】
[比較例2] 胃腸薬
比較例1のリン酸水素カルシウムを用いた以外は、実施例2と同様に胃腸顆粒薬を製造した。
【0044】
[表3] フックス試験
各胃腸顆粒薬を1.23g使用し、フックス試験を行った。

【0045】
本発明の制酸剤を配合した胃腸薬は、通常のリン酸水素カルシウムを配合した胃腸薬より持続時間が長く、非常に良好な制酸特性を有している。
【図面の簡単な説明】
【0046】
【図1】実施例1の鱗片状リン酸水素カルシウムのSEM写真(1メモリ1μm)である。
【図2】比較例1のリン酸水素カルシウムのSEM写真(1メモリ10μm)である。
【図3】実施例1の鱗片状リン酸水素カルシウムと比較例1のリン酸水素カルシウムのフックスカーブである。
【図4】実施例2の胃腸薬と比較例2の胃腸薬のフックスカーブである。
【技術分野】
【0001】
本発明は、鱗片状リン酸水素カルシウムからなる持続性の制酸剤及びそれを含有する医薬製剤に関する。
【背景技術】
【0002】
制酸剤(又は制酸薬)としては、アミノ酢酸を有効成分とするアミノ酢酸系製剤、合成又は天然ケイ酸アルミニウム、乾燥水酸化アルミニウムゲル、ケイ酸アルミン酸マグネシウム、メタケイ酸アルミン酸マグネシウム、ヒドロタルサイト、ケイ酸アルミン酸マグネシウムビスマス等のアルミニウム化合物製剤、炭酸水素ナトリウム、酸化マグネシウム、水酸化マグネシウム、炭酸マグネシウム、ケイ酸マグネシウム、沈降炭酸カルシウム等の無機製剤、ボレイ末(牡蛎末)等の動物製剤等が知られている。しかしながら従来の制酸剤は、何らかの欠点を有し、例えば、アミノ酢酸系製剤は、食欲減退、下痢、不快感、長期大量投与で高カルシウム血症、まれに尿毒症を誘発する等の副作用が知られている。また、アルミニウム化合物製剤は、持続時間が長いが、腎機能が悪化している場合に限るがアルニウムの蓄積によりアルミ脳症を引き起こす副作用がある。マグネシウム化合物製剤は、中和性が速いが、持続時間が短い。炭酸水素ナトリウム等のナトリウムを含む無機製剤は、アルカローシスにより高血圧の原因となる。
【0003】
リン酸水素カルシウムは、カルシウム成分、リン酸成分の補強源、固結防止剤、歯磨き粉の研磨剤、賦形剤、制酸剤等として、医薬品、食品、化粧品等に使用されている。特に、結合性や分散性に劣るという問題がありながも、水に難溶でありかつ非吸湿性で主薬との反応が少ないため、医薬品の賦形剤として広く用いられている。しかし、通常のリン酸水素カルシウムは、一次粒子の平均粒子径が10μm以上の板状結晶であり、制酸効果としては、酸との反応性が低いため制酸持続時間が短いという問題があった。そのため、リン酸水素カルシウムを配合した胃腸薬としては、マグネシウム塩とリン酸水素カルシウムの併用(特許文献1)、ヒスタミンH2遮断薬とリン酸水素カルシウムの併用(特許文献2)が知られている。
【0004】
これを改善するため、本出願人は比表面積が20〜60m2/g、静的嵩比容積が5ml/g以上、吸油量が1.0ml/g以上であり、電子顕微鏡で測定した一次粒子が0.1〜5μm、その凝集した二次粒子の平均粒子径が2〜10μmである鱗片状のリン酸水素カルシウムを噴霧乾燥造粒して球状粒子としたリン酸水素カルシウムを開示している(特許文献3)。これはフジカリンSG〔製品名、富士化学工業(株)製〕として市販されている。これまで、本出願人は、この鱗片状リン酸水素カルシウムを微細で表面積が大きいため酸との反応性が通常のリン酸水素カルシウムより高いことから、制酸持続時間が長く、制酸剤として有効であることを見いだした。
【特許文献1】特開平11−124334号公報
【特許文献2】特開2008−56567号公報
【特許文献3】特開平7−118005号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
胃酸過多の症状において、アルミニウムを含有しておらず、制酸持続時間の長い無機系の制酸剤が求められている。
【課題を解決するための手段】
【0006】
本発明者らは、1次粒子が微細であり表面積が大きい鱗片状リン酸水素カルシウムを制酸剤として用いることによって、通常のリン酸水素カルシウムにない制酸活性を有していること、すなわち酸との制酸持続時間が長く、制酸剤として良好な性質を有していることを見出した。
【0007】
すなわち、本発明は以下の構成よりなる。
(1)平均粒子径0.05〜5μmの一次粒子からなる平均粒子径0.1〜500μmの凝集体であり、比表面積が5〜60m2/g、静的嵩比容積が1〜10ml/g、吸油量が0.5〜5ml/gである下式(I)
Al2O3・xMgO・ySiO2・mH2O (I)
(式中、mは0≦m≦0.5の範囲の数を示す)で示される鱗片状のリン酸水素カルシウムを有効成分とする制酸剤、
(2)凝集体が平均粒子径10〜500μmの粒子である(1)に記載の鱗片状のリン酸水素カルシウを有効成分とする制酸剤、
(3) 凝集体が平均粒子径0.1〜20μmの粉末である(1)に記載の鱗片状のリン酸水素カルシウを有効成分とする制酸剤、
(4)(1)〜(3)のいずれかに記載の制酸剤を配合してなる医薬製剤
(5)活性薬物を配合してなる(4)に記載の医薬製剤、
(6)活性薬物が、H2遮断剤、健胃剤、消化剤、整腸剤、止瀉剤、粘膜修復剤、粘膜保護剤、生薬、消化酵素、制酸剤(鱗片状リン酸水素カルシウム除く)、菌製剤のいずれか1種以上を配合してなる(5)に記載の医薬製剤。
【発明の効果】
【0008】
本発明の制酸剤は、1次粒子が微細で表面積が大きい鱗片状リン酸水素カルシウムは制酸持続時間が長く、制酸剤として良好な性質を有していることを見出した。さらには、制酸効果が短時間で発揮する成分やその他の胃腸薬成分と配合することによって、有用な経口用の医薬製剤を提供することができる。
【発明を実施するための最良の形態】
【0009】
本発明において、リン酸水素カルシウムの鱗片状の形状は、リン酸水素カルシウム一次粒子の形状がカードハウス類似構造を形成可能な面積/厚み比が大きい形状を指し、例えば、鱗片状、薄片状、皿状を含む。これらリン酸水素カルシウム一次粒子の形状はSEM写真で観察される。本発明で用いる鱗片状リン酸水素カルシウムは、粉体、粒体、粉末、球状造粒粒子、スラリーを用いることができ、最終的な形態−錠剤などの固体、懸濁液などにより適宜選ぶことができる。また、同時に良好な成形性や打錠性も有しており、錠剤の製造時に特に結合剤や他の賦形剤の添加を必要としない。
【0010】
本発明の鱗片状リン酸水素カルシウムは、微細な一次粒子がカードハウス類似構造を形成して凝集する二次粒子を形成しているため、比表面積が大きく、従来の板状リン酸水素カルシウムにない良好な制酸効果を有している。鱗片状リン酸水素カルシウムの一次粒子の平均粒子としては0.05〜5μmであり、二次粒子の平均粒子径としては0.1〜500μmである。これら鱗片状リン酸水素カルシウムの一次粒子の平均粒子は、前述同様SEM写真で観察される。鱗片状リン酸水素カルシウムの二次粒子の平均粒子径は、後述実施例の測定方法にて測定される。二次粒子の形状としては、粒子状、粉末状、顆粒状などの形態をとることができ、これらの形態は制酸剤としての使用にあわせて適宜選ぶ。粒子状の形態としては、後述の通常の造粒方法によって得られ、錠剤時の打錠性から平均粒子径10〜500μmであり、好ましくは20〜400μm、より好ましくは50〜200μmである。粉末状の形態としては、造粒工程を行わずに製造したものであり、高い比容積や微細な粒径が求められる場合に用いることができ、平均粒子径0.1〜30μm、好ましくは0.1〜20μm、より好ましくは0.1〜10μmである。
【0011】
本発明の鱗片状リン酸水素カルシウムの比表面積は5〜60m2/gであり、好ましくは10〜50m2/gである。
本発明の鱗片状リン酸水素カルシウムの静的比容積は1〜20mlであり、好ましくは1〜10mlである。
本発明の鱗片状リン酸水素カルシウムの吸油量は0.5〜5ml/gであり、好ましくは0.5〜3mlである。
【0012】
本発明の鱗片状リン酸水素カルシウムは、公知の方法によって製造することができ、例えば、特開平7−118005号公報、特開平10−120408号公報に記載の方法が挙げられる。
【0013】
本発明の鱗片状リン酸水素カルシウムを製造する方法は、1)リン酸とアルカリ性カルシウム化合物、又はアルカリ金属リン酸塩とカルシウム化合物とを水媒体中において反応させて柱状のリン酸水素カルシウムとし、2)次いでこの柱状物を60℃以上で水熱反応する。1)及び2)の工程のいずれか又は両方で、配位能を有した多価有機酸を添加する。多価有機酸は、カルシウム化合物とリン酸との反応時にリン酸水素カルシウムの結晶成長の制御、並びにリン酸水素カルシウムから無水リン酸水素カルシウムへの結晶変換時の結晶成長の制御することによって、本発明の鱗片状リン酸水素カルシウムを形成させる。
【0014】
本発明に使用するアルカリ性カルシウム化合物はリン酸と中和反応する化合物であり、生石灰、消石灰、炭酸カルシウム等の内の1種または2種以上を用いることができる。これらのカルシウム化合物は中和に必要な理論量を算出して反応に用いられる。また、アルカリ性金属リン酸塩は塩化カルシウムなどの水溶性カルシウム化合物と中和反応する化合物であり、リン酸水素ナトリウム、リン酸ナトリウム等の内の1種または2種を用いることができる。
【0015】
多価有機酸は、配位能を有する多価有機酸であればいずれでもよく、例えば、クエン酸、酒石酸、エチレンジアミン四酢酸(EDTA)、リンゴ酸、コハク酸などの内、1種または2種以上を選択することができる。これらの多価有機酸の使用量は、生成するリン酸水素カルシウム結晶粒子の大きさ等を考慮して決定され、生成するリン酸水素カルシウムに対し、0.5〜10mol%が良好である。
【0016】
リン酸とアルカリ性カルシウム化合物、又はアルカリ金属リン酸塩とカルシウム化合物とを水媒体中において反応させて柱状のリン酸水素カルシウムとする反応は、反応温度は50℃以下で行うことができ、反応を促進させるため、攪拌や超音波振動等を加えることができる。反応時のpHは、反応収率等の面からpH4〜5の範囲内で反応を行う。この反応中に多価有機酸を添加する場合は、リン酸とカルシウム化合物の反応前もしくは反応中においても、適宜、添加することができる。
【0017】
続いて、この柱状水和物を含有したスラリーを加温して水熱反応を行い鱗片状の推算カルシウムとする。必要に応じて多価有機酸を添加することができる。水熱反応の温度は、60℃以上、好ましくは60〜100℃、特に好ましくは90〜100℃である。この水熱処理温度の範囲は、60〜90℃では脱水時間がかかり、90℃以上では比較的速やかに脱水化するということに基づき、製造設備に照らし合わせて適宜設定すればよい。
【0018】
水熱処理時間は、使用するリン酸水素カルシウム二水塩及び多価有機酸の種類、使用量、反応時間及び機器の設備状況等により異なり特に限定されないが、好ましくは数10分〜数時間である。上記スラリーは撹拌しながら加温し、所定の温度範囲まで昇温させ、必要ならばさらに数10〜30分間この温度を保持後に反応を終了させてもよい。
【0019】
反応生成物は常法に従って、濾過し、水洗後、水分を除去することにより得ることができる。
【0020】
目的物は、常法に従って、例えば噴霧乾燥、棚式乾燥等により乾燥し、白色の鱗片状リン酸水素カルシウム粉末を得る。この鱗片状リン酸水素カルシウムの水分に関しては、乾燥条件により0.5水和物から無水物とすることができ、例えば50〜300℃に加温して乾燥することにより、容易に無水物とすることができる。
【0021】
特に、噴霧乾燥を行うことによって、鱗片状のリン酸水素カルシウムが凝集した球状造粒物を得ることができ、好適である。この噴霧乾燥によって得られる造粒物は、瞬時に乾燥させるため錠剤成型時の成形性や、制酸時の接触面が向上する。
【0022】
前述工程により製造した鱗片状リン酸水素カルシウムと崩壊剤、必要に応じて水溶性物質を水に懸濁及び/又は溶解させて、噴霧乾燥を行う。懸濁液の濃度としては、噴霧乾燥できる範囲であればよく、すなわち固形分は1〜40重量%であり、好ましくは5〜30重量%である。結合剤、被覆剤、界面活性剤、賦形剤、崩壊剤などのリン酸水素カルシウム以外の成分を添加する場合は、懸濁液の調製時に配合し、同時に噴霧乾燥を行う。噴霧乾燥の条件は特に限定されないが、噴霧乾燥機としては、円盤式またはノズル式の噴霧乾燥機を用いるのが好ましい。そして、噴霧乾燥の際の温度としては、入口温度が約120〜400℃であり、出口温度が約80〜300℃が好ましい。
【0023】
本発明の鱗片状リン酸水素カルシウムからなる制酸剤に活性薬物を配合し医薬製剤とする。さらに、必要に応じて通常医薬品に配合可能な添加成分を添加する。
【0024】
活性成分としては、特に限定されず、H2遮断剤、健胃剤、消化剤、整腸剤、吐瀉剤、粘膜修復剤、粘膜保護剤、生薬、消化酵素、消化剤、制酸剤などの消化管用薬剤;末梢神経用剤、解熱鎮痛消炎剤、催眠鎮静剤、精神神経用剤などの中枢神経用薬剤;骨格筋弛緩剤、自律神経剤などの末梢神経用薬剤;強心剤、不整脈用剤、利尿剤、血管拡張剤などの循環器用薬剤;気管支拡張剤、鎮咳剤などの呼吸器官用薬剤;ホルモン剤、抗ヒスタミン剤、ビタミン剤などの代謝性薬剤;抗潰瘍剤;抗生物質;化学療法剤;生薬エキス剤;微生物類などが挙げられる。
特に消化管用薬剤、胃に障害を与える活性成分及び胃酸抑制必要な活性成分とともに配合することが好ましい。
【0025】
消化管用薬剤は、H2遮断剤、健胃剤、消化剤、整腸剤、止瀉剤、粘膜修復剤、粘膜保護剤、生薬、消化酵素、消化剤、制酸剤などのである。これらの消化管用薬剤と鱗片状リン酸水素カルシウムを配合することによって、胃腸薬を製造することができる。
H2遮断剤としては、ファモチジン、ニザチジン、塩酸ラニチジン、シメチジン、塩酸ロキサチジンアセタートなどが挙げられる。
【0026】
粘膜保護剤としては、ソルビトール硫酸エステル、デキストラン、カルボキシメチルエステル、メチルメチオニンスルホニウムクロライド、銅クロロフィリンナトリウム、銅クロロフィリンカリウム、アルジオキサ、ガストリックムチン、デキストラン硫酸エステルアルミニウム塩、L−グルタミン、アズレンスルホン酸ナトリウム、ショ糖硫酸エステルアルミニウム塩などが挙げられる。
【0027】
健胃剤としては、ソウジュツ、トウヒ、ウコン、コウボクなどの各種生薬、塩酸ベタイン、塩化カルニチン、グルタミン酸塩酸塩、塩化ベタネコール、乾燥酵母などが挙げられる。
【0028】
消化剤としては、でんぷん消化酵素、たんぱく質消化酵素死亡消化酵素、繊維消化酵素、ウルソデスオキシコール酸、オキシコーラン酸、コール酸、胆汁末、デヒドロコール酸などが挙げられる。
整腸剤としては、乳酸菌や納豆菌などの整腸菌成分、赤芽柏、アセンヤク、ウバイ、ケツメイシ、ゲンノショウコなどが挙げられる。
止瀉剤としては、アクリノール、塩化ベルベリン、次硝酸ビスマス、次炭酸ビスマス、カオリン、天然ケイ酸カルシウム、乳酸カルシウム、オウバクなどが挙げられる。
抗潰瘍剤としては、例えば、テプレノン、ファモチジン、ランソプラゾール、オメプラゾール、ラベプラゾール、シメチジン、塩酸ラニチジンなどが挙げられる。
その他の消化器官用薬としては、クエン酸モサプリドなどが挙げられる。
【0029】
制酸剤としては、炭酸水素ナトリウム、酸化マグネシウム、炭酸マグネシウム、ケイ酸マグネシウム、沈降炭酸カルシウム、ボレイ、ロートエキス、水酸化アルミニウム・炭酸マグネシウム混合乾燥ゲル、水酸化アルミニウムゲル、水酸化アルミニウム・炭酸マグネシウム・炭酸カルシウム共沈殿生成物、アルミニウムグリシネート、合成ヒドロタルサイト、合成ケイ酸アルミニウム、ケイ酸アルミン酸マグネシウム及びメタケイ酸アルミン酸マグネシウムなどが挙げられる。本発明の鱗片状リン酸水素カルシウムは、制酸時の持続性に優れてはいるが、即効性は十分とは言えないため、即効性の制酸剤と配合することが好ましく、ケイ酸マグネシウム、酸化マグネシウム、水酸化マグネシウム、炭酸水素ナトリウム、炭酸マグネシウム及び沈降炭酸マグネシウムなどのマグネシウム化合物、並びに沈降炭酸カルシウムなどのカルシウム化合物との併用がよい。
【0030】
胃に障害を与える活性成分としては、アミノ安息香酸エチル、塩酸パパベリン、塩酸オキシフェンサイクリミン、塩酸ジサイクロミン、塩酸メチキセン、臭化水素酸スポコラミン、臭化メチルアトロピン、臭化メチル−l−ヒヨスチアミンなどの鎮痛剤などが挙げられる。
【0031】
医薬品に配合可能な添加成分としては、一般に結合剤、被覆剤、界面活性剤、賦形剤と区分されているものであり、例えば、結合剤(ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルアルコール、ポリビニルピロリドン、マクロゴール等)、被覆剤(ヒドロキシプロピルメチルセルロースフタレート、ヒドロキシプロピルメチルセルロースアセテートサクシネート、カルボキシメチルエチルセルロース、エチルセルロース、エチルセルロース水分散液、アミノアルキルメタアクリレートコポリマーE、メタアクリル酸コポリマーL、メタアクリル酸コポリマーS、メタアクリル酸コポリマーLD、アミノアルキルメタアクリレートコポリマーRS、硬化油等)、界面活性剤(ショ糖脂肪酸エステル、ポリオキシエチレンポリオキシプロピレングリコール、ポリソルベート、ラウリル硫酸ナトリウム等)、賦形剤(トウモロコシデンプン、ジャガイモデンプン、コメデンプン、トレハロース、結晶セルロース・カルメロースナトリウム、タルク、ステアリン酸マグネシウム、無水ケイ酸、メタケイ酸アルミン酸マグネシウム、ケイ酸アルミン酸マグネシウム、ハイドタルサイト、合成ケイ酸アルミニウム、酸化チタン等)、崩壊剤(低置換度ヒドロキシプロピルセルロース、カルメロースカルシウム、クロスカルメロースナトリウム、部分アルファー化デンプン等)、その他の添加剤などの製剤に一般的に使用可能な成分が使用される。
【0032】
本発明の医薬製剤は、錠剤、口腔内速崩壊錠、カプセル、顆粒、細粒などの固形投薬形態、懸濁液の液状製剤などの製剤形状とすることができる。
錠剤の製造方法は、顆粒状組成物を医薬品に配合可能な添加成分と乾式混合や湿式混合などの方法で混合したのち、圧縮成型する。このとき、F−MELT〔商標 富士化学工業(株)製〕、クロスポビドン、低置換度ヒドロキシプロピルセルロース、カルボキシメチルスターチナトリウム、クロスカルメロースナトリウム、澱粉などの崩壊剤を添加することによって、口腔内速崩壊剤とすることができる。
【0033】
本発明の医薬製剤は、鱗片状リン酸水素カルシウムを全体量に対して、1〜99重量%配合することができ、好ましくは2〜80重量%、より好ましくは、5〜70重量%である。他の制酸剤として用いる場合は、鱗片状リン酸水素カルシウムに対して他の制酸剤は、1:005〜5、好ましくは1:0.1〜3の割合で配合する。制酸剤以外の活性成分とともに配合する場合は、鱗片状リン酸水素カルシウムに対して活性成分は、1:0.01〜100、好ましくは1:0.1〜10の割合で配合することができる。
【0034】
本発明の制酸剤は、pHが中性であり、反応性が低く、リン酸水素カルシウムは天然物として存在していることから、酸の中和に用いることができる。例えばアルカリ土壌の改善、流出した酸の中和、口腔内などの乳酸抑制などに用いることができる。
【実施例】
【0035】
以下に、本発明を実施例により説明するが、これらの実施例は本発明の範囲を限定するものではない。
[SEM写真]
SEM(走査型顕微鏡)(日立製作所(株)、S−3000N)を用いて撮影した。
[粒子径測定方法]
懸濁液中の粒子の平均粒子径は、湿式粒度分布測定器(SALD−2000J、島津製作所(株)製)で屈折率1.7−0.20iの条件で平均粒子径を測定した。
乾式粉末の平均粒子径は、乾式粒度分布測定器(LA−920、(株)堀場製作所製)で平均粒子径を測定した。
[比表面積]
比表面積は、BET比表面積測定装置(モノソーブMS−17、ユアサアイオニクス(株)製)を用いて測定した。
[吸油量]
吸水量はJISK5101に基づき、アマニ油を用いて行った。
[静的比容積]
静的比容積は100mlのメスシリンダーにガラス管を挿入し、90〜100mlの容量となるようにロートで試料をガラス管内に入れ、ガラス管を静かに引き抜き、試料の表面を平らにしたときの容積(Vml)と試料の重量(Wg)をV/Wにより求めた。
【0036】
[フックス試験]
フックス変法試験装置(pHメーター;HM−5S、東亜ディーケーケー(株)製)を用い、37℃±2℃、回転数300rpmに設定した0.1N−塩酸溶液50mlに試料を適量投入し、10分間pHの経時変化をレコーダーの記録し10分後のpH(最大pH)を読み取った。10分後より2.0ml/分の速度で0.1N−塩酸溶液を添加し、pHの経時変化をレコーダーに記録した。pHが下がりpH3.5及びpH3.0を切った時間を持続時間として記録した。
【0037】
[実施例1]
水3.4Lに撹拌しながら生石灰(CaO純度96%)340gを投入し、30分間撹拌して、石灰乳とし、この石灰乳を100メッシュで篩過し、粗粒物を除去した。室温〜40℃で撹拌しながら、この液に50%濃度のリン酸水溶液1.12kgと前述の手順で調製した石灰乳とを30分間で同時に添加した。そして30分間撹拌を続行して反応を完結させた。クエン酸一水和物12gを添加して95℃まで加温し、30分間保持した後、濾過・洗浄した。このケーキを乾燥してSEM写真を撮った(図1)。洗浄スラリーの濃度を16%w/wに調製し、噴霧乾燥機(LT−8型,大川原化工機(株)製)を用いて、入熱170℃、排熱110℃、アトマイザー回転数25,000rpmで乾燥し、鱗片状リン酸水素カルシウムの造粒物を得た。
【0038】
[比較例1]
水3.4Lに撹拌しながら生石灰(CaO純度96%)340gを投入し、30分間撹拌して、石灰乳とし、この石灰乳を100メッシュで篩過し、粗粒物を除去した。室温〜40℃で撹拌しながら、この液に50%濃度のリン酸水溶液1.12kgと前述の手順で調製した石灰乳とを30分間で同時に添加した。そして30分間撹拌を続行して反応を完結させた。95℃まで加温し、30分間保持した後、濾過・洗浄した。このケーキを乾燥してSEM写真を撮った(図2)。洗浄スラリーの濃度を16%w/wに調製し、噴霧乾燥機(LT−8型,大川原化工機(株)製)を用いて、入熱170℃、排熱110℃、アトマイザー回転数25,000rpmで乾燥し、リン酸水素カルシウムを得た。
【0039】
[表1]分析値

【0040】
[表2] フックス試験
各合成品を2.4g使用し、フックス試験を行った。

【0041】
本発明の鱗片状リン酸水素カルシウムは、持続時間が長く、従来のリン酸水素カルシウムよりも非常に良好な制酸特性を有している。
【0042】
[実施例2] 胃腸薬
以下成分に水を同量添加して乳鉢で混合し、篩過後、50℃で一晩乾燥し、胃腸顆粒薬を製造した。
実施例1の鱗片状リン酸水素カルシウム 44.72重量%
水酸化マグネシウム 28.46重量%
コーンスターチ 6.82重量%
部分α化澱粉 20.00重量%
【0043】
[比較例2] 胃腸薬
比較例1のリン酸水素カルシウムを用いた以外は、実施例2と同様に胃腸顆粒薬を製造した。
【0044】
[表3] フックス試験
各胃腸顆粒薬を1.23g使用し、フックス試験を行った。

【0045】
本発明の制酸剤を配合した胃腸薬は、通常のリン酸水素カルシウムを配合した胃腸薬より持続時間が長く、非常に良好な制酸特性を有している。
【図面の簡単な説明】
【0046】
【図1】実施例1の鱗片状リン酸水素カルシウムのSEM写真(1メモリ1μm)である。
【図2】比較例1のリン酸水素カルシウムのSEM写真(1メモリ10μm)である。
【図3】実施例1の鱗片状リン酸水素カルシウムと比較例1のリン酸水素カルシウムのフックスカーブである。
【図4】実施例2の胃腸薬と比較例2の胃腸薬のフックスカーブである。
【特許請求の範囲】
【請求項1】
平均粒子径0.05〜5μmの一次粒子からなる平均粒子径0.1〜500μmの凝集体であり、比表面積が5〜60m2/g、静的嵩比容積が1〜20ml/g、吸油量が0.5〜5ml/gである下式(I)
Al2O3・xMgO・ySiO2・mH2O (I)
(式中、mは0≦m≦0.5の範囲の数を示す)で表される鱗片状のリン酸水素カルシウを有効成分とする制酸剤。
【請求項2】
凝集体が平均粒子径10〜500μmの粒子である請求項1に記載の鱗片状のリン酸水素カルシウを有効成分とする制酸剤。
【請求項3】
凝集体が平均粒子径0.1〜30μmの粉末である請求項1に記載の鱗片状のリン酸水素カルシウを有効成分とする制酸剤。
【請求項4】
請求項1〜3のいずれかに記載の制酸剤を配合してなる医薬製剤
【請求項5】
活性薬物を配合してなる請求項4に記載の医薬製剤。
【請求項6】
活性薬物が、H2遮断剤、健胃剤、消化剤、整腸剤、止瀉剤、粘膜修復剤、粘膜保護剤、生薬、消化酵素、制酸剤(鱗片状リン酸水素カルシウム除く)、菌製剤のいずれか1種以上を配合してなる請求項5に記載の医薬製剤。
【請求項1】
平均粒子径0.05〜5μmの一次粒子からなる平均粒子径0.1〜500μmの凝集体であり、比表面積が5〜60m2/g、静的嵩比容積が1〜20ml/g、吸油量が0.5〜5ml/gである下式(I)
Al2O3・xMgO・ySiO2・mH2O (I)
(式中、mは0≦m≦0.5の範囲の数を示す)で表される鱗片状のリン酸水素カルシウを有効成分とする制酸剤。
【請求項2】
凝集体が平均粒子径10〜500μmの粒子である請求項1に記載の鱗片状のリン酸水素カルシウを有効成分とする制酸剤。
【請求項3】
凝集体が平均粒子径0.1〜30μmの粉末である請求項1に記載の鱗片状のリン酸水素カルシウを有効成分とする制酸剤。
【請求項4】
請求項1〜3のいずれかに記載の制酸剤を配合してなる医薬製剤
【請求項5】
活性薬物を配合してなる請求項4に記載の医薬製剤。
【請求項6】
活性薬物が、H2遮断剤、健胃剤、消化剤、整腸剤、止瀉剤、粘膜修復剤、粘膜保護剤、生薬、消化酵素、制酸剤(鱗片状リン酸水素カルシウム除く)、菌製剤のいずれか1種以上を配合してなる請求項5に記載の医薬製剤。
【図3】


【図4】


【図1】


【図2】




【図4】


【図1】


【図2】


【公開番号】特開2010−13362(P2010−13362A)
【公開日】平成22年1月21日(2010.1.21)
【国際特許分類】
【出願番号】特願2008−172356(P2008−172356)
【出願日】平成20年7月1日(2008.7.1)
【出願人】(390011877)富士化学工業株式会社 (53)
【Fターム(参考)】
【公開日】平成22年1月21日(2010.1.21)
【国際特許分類】
【出願日】平成20年7月1日(2008.7.1)
【出願人】(390011877)富士化学工業株式会社 (53)
【Fターム(参考)】
[ Back to top ]

