鳥類卵管細胞を用いた抗体製造方法
【課題】鳥類卵管細胞でタンパク質を高効率で、かつ特異的に発現する技術。これまでに行なわれている卵管特異的なプロモーターの下流に抗体遺伝子を連結させ鳥類卵管細胞に発現させる方法よりも効率よく抗体分子を生産することを可能にする方法を提供する。
【解決手段】鳥類卵管細胞を用いたタンパク質の発現方法であって、(i)リコンビナーゼ認識配列によって挟まれたスタッファー遺伝子配列の上流側に構成的発現プロモーター配列が配置され、該スタッファー遺伝子の下流側に抗体をコードする遺伝子配列が配置された少なくとも1つの遺伝子配列カセットを含むベクター、および(ii)鳥類卵管細胞に特異的なプロモーター、および該プロモーターの下流に配置されたリコンビナーゼをコードする遺伝子配列を含むベクターを鳥類卵管細胞に導入する工程を含む、タンパク質の発現方法。
【解決手段】鳥類卵管細胞を用いたタンパク質の発現方法であって、(i)リコンビナーゼ認識配列によって挟まれたスタッファー遺伝子配列の上流側に構成的発現プロモーター配列が配置され、該スタッファー遺伝子の下流側に抗体をコードする遺伝子配列が配置された少なくとも1つの遺伝子配列カセットを含むベクター、および(ii)鳥類卵管細胞に特異的なプロモーター、および該プロモーターの下流に配置されたリコンビナーゼをコードする遺伝子配列を含むベクターを鳥類卵管細胞に導入する工程を含む、タンパク質の発現方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は鳥類卵管細胞に対してタンパク質発現遺伝子を導入し、タンパク質を発現させる技術分野に属する。
【背景技術】
【0002】
遺伝子組み換え技術を用いた医療用のモノクローナル抗体は診断や疾患の治療において優れた効果を有する。一般に治療に用いられる医療用抗体はサイトカインなど他の生物製剤に比べて大量に投与されるため、使用に際して医療費が高額になることが大きな問題である。医療用抗体の生産技術の効率化は製造コストを下げ、この問題の解決の為に有効である。
【0003】
現在、医療用抗体の生産方法としてはCHO細胞のような主に哺乳動物の培養細胞に外因
性の抗体分子の重鎖、軽鎖を遺伝子導入し、培養上清中に抗体分子を分泌させる方法が主流である。この方法は大規模な培養装置を用いる為、商業規模の抗体生産を行う上で莫大な設備投資が必要である。また、細胞培養に用いる高額な培地類も医療用抗体のコスト高の原因になっている。これらのことから培養細胞に依存しない効率的な医療用抗体の生産法が必要とされている。
【0004】
一方、培養細胞ではなく動物を遺伝子改変し、医療用抗体を生産させようとする試みがなされている。この場合、動物の組織から有益な抗体を回収するには、発現されたタンパク質は容易に回収可能で、かつ治療的有効性を有し、その発現がいくつかの特定の組織に限定されている必要がある。外因性の抗体タンパク質を特定の組織ではなく全身性に発現させた場合、動物の発生や健康に障害を与え得る為、このような問題の少ない特定組織での発現が望ましい。これらの点から鳥類の卵は有効な媒介物であると考えられている。実際、特許文献1においてはニワトリ卵管特異的に発現するオボアルブミン分子のプロモーターによりヒト抗体分子を卵管細胞特異的に発現させることにより、卵白中に治療的有効性の高い化学的特性を有する抗体タンパク質を蓄積している。
【0005】
また、非特許文献1ではウイルスベクターを用いてオボアルブミンプロモーターの下流に改変した一本鎖抗体遺伝子を有するトランスジェニックニワトリを作製し、卵管由来細胞特異的発現ならびに卵白中への外来一本鎖抗体分子の蓄積を認めている。
【0006】
すなわち、既に報告されているように、オボアルブミンプロモーターのような鳥類卵管特異的発現を誘導する調節領域の直下に外因性のタンパク質をコードする遺伝子をつなげることにより鳥類卵管由来細胞特異的にタンパク質を発現させることが可能であり、抗体分子の場合ニワトリの卵管由来細胞に発現させることにより卵中に治療的有効性の高い化学的特性を有する抗体タンパク質を蓄積可能である。
【0007】
医療用の抗体分子は様々な形状のものが考えられるが、主なものはイムノグロブリンの軽鎖、重鎖から構成されており、ニワトリ卵に機能性抗体を蓄積するには卵管細胞において2種類の分子を同時に発現することが望ましく、さらに、その発現効率が高ければ高いほうが望ましい。
【0008】
しかしながら上述のオボアルブミンプロモーターは卵管由来細胞での特異性は高いものの、外因性の蛋白質を発現させるにはプロモーターそのものとしての力が十分満足できるほどに強くなく、望ましい発現量が望めない欠点がある。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特表2008−532939号公報
【非特許文献】
【0010】
【非特許文献1】S. G. Lillico, A. Sherman, M. J. McGrew, C. D. Robertson, J. Smith, C. Haslam, P. Barnard, P. A. Radcliffe, K. A. Mitrophanous , E. A. Elliot, and H. M. Sang. Proc. Natl. Acad. Sci. U. S. A. 2007 Feb 6; 104(6):1771-6. Epub 2007 Jan 26.
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は鳥類卵管細胞でタンパク質を高効率で、かつ特異的に発現する技術を提供する。これにより、これまでに行なわれている卵管特異的なプロモーターの下流に抗体遺伝子を連結させ鳥類卵管細胞に発現させる方法よりも効率よく抗体分子を生産することが可能になる。
【課題を解決するための手段】
【0012】
上記課題を解決すべく、本願発明者は鋭意検討した結果、以下の発明を提供するに至った。
【0013】
項1
鳥類卵管細胞を用いたタンパク質の発現方法であって、
(i)リコンビナーゼ認識配列によって挟まれたスタッファー遺伝子配列の上流側に構成
的発現プロモーター配列が配置され、該スタッファー遺伝子の下流側に抗体をコードする遺伝子配列が配置された少なくとも1つの遺伝子配列カセットを含むベクター、および(ii)鳥類卵管細胞に特異的なプロモーター、および該プロモーターの下流に配置されたリコンビナーゼをコードする遺伝子配列を含むベクターを鳥類卵管細胞に導入する工程を含む、タンパク質の発現方法。
【0014】
項2
前記のリコンビナーゼが、Creリコンビナーゼであることを特徴とする、項1に記載のタ
ンパク質の発現方法。
【0015】
項3
(i)リコンビナーゼ認識配列に挟まれたスタッファー遺伝子配列の上流側に構成的発現
プロモーター配列が配置され、該スタッファー遺伝子の下流側に抗体をコードする遺伝子配列が配置された少なくとも1つの遺伝子配列カセットを含むベクター、および(ii)鳥類卵管細胞に特異的なプロモーター、および該プロモーターの下流に配置されたリコンビナーゼをコードする遺伝子配列を含むベクターが導入された鳥類卵管細胞。
【0016】
項4
前記のリコンビナーゼが、Creリコンビナーゼであることを特徴とする項3に記載の鳥類
卵管細胞。
【発明の効果】
【0017】
ニワトリ卵管由来初代培養細胞系において、従来提唱されているニワトリオボアルブミンプロモーターにより直接二量体の抗体分子を発現させる手法に比べ、本願発明の手法により40倍以上の発現効率の向上を認めた。また、本願発明の方法によって、トランスジェニック鳥類の生体内卵管細胞での抗体分子の発現効率を向上ならしめ、卵内またはその
卵白中へ、抗体分子を蓄積させる効果を有することも予想される。
【図面の簡単な説明】
【0018】
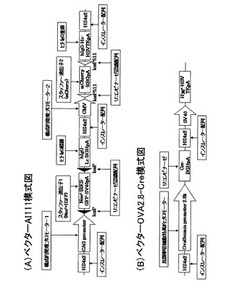
【図1】ベクターAI111およびベクターOVA2.8-Creの模式図
【図2】抗体遺伝子配列の説明図
【図3】ベクターAI111による同一細胞での2つの遺伝子発現とCreリコンビナーゼ依存的な蛍光タンパク質発現抑制を示す図
【図4】ベクターAI111によるCreリコンビナーゼ依存的な抗体分子の発現
【図5】ベクターOVA2.8-Hc+Lc模式図
【図6】鳥類卵管由来初代培養細胞におけるベクターAI111によるベクターOVA2.8-Cre依存的な抗体分子の発現を示す図
【図7】鳥類卵管由来初代培養細胞を用いた外因性ヒト抗体生産能のELISAによる比較を示す図
【発明を実施するための形態】
【0019】
この発明におけるその他の用語や概念は、発明の実施形態の説明や実施例において詳しく規定する。また、この発明を実施するために使用する様々な技術は、特にその出典を明示した技術を除いては、公知の文献等に基づいて当業者であれば容易かつ確実に実施可能である。例えば、遺伝子工学および分子生物学的技術はSambrook and Maniatis,” Molecular Cloning A Laboratory Manual ”, Cold Spring Harbor Laboratory Press, New
York, 2001; Ausubel, F. M. et al. ” Current Protocols in Molecular Biology ”, John Wiley & Sons, New York, N. Y, 2007等に記載されている。
【0020】
本発明の「鳥類」とは、卵生であり卵が殻に覆われているものが望ましい。具体例として、ダチョウ類、キジ類、ウズラ類、ハト類、ニワトリ類、またはアヒル類などが挙げられる。好ましくはニワトリ類である。
【0021】
本発明の「鳥類卵管細胞」とは、鳥類の卵の構成成分を分泌させることを特徴とする卵管組織に存在する細胞であり、卵管腺細胞、または卵管上皮細胞などが挙げられる。ここで、本発明の鳥類卵管細胞とは、前記の組織から採取される初代培養細胞であってもよく、さらにその後に不死化処理などが施された株化細胞であっても良いものとする。
【0022】
本発明の「鳥類卵管細胞に特異的なプロモーター」とは、鳥類卵管組織に含まれる細胞において、優先的に外来遺伝子を発現させることが可能であるプロモーターである。具体的には、鳥類卵管細胞に含まれるオボアルブミン、オボトランスフェリン、オボムコイド、オボムチン、リゾチーム、オボグロブリン、またはオボインヒビターなどのプロモーターが挙げられる。より好ましくはオボアルブミンのプロモーターである。
【0023】
本発明の「構成的発現プロモーター」とは、通常の遺伝子組み換え技術によって使用され、一般的な動物細胞に、恒常的に遺伝子を発現させることが可能であるプロモーターのことであり、特に限定されるものではないが、強力なプロモーター活性を有するものが望ましい。具体的には、CAGプロモーター、CMVプロモーター、EF-1αプロモーター、またはSV40プロモーターなどが挙げられる。好ましくはCAGプロモーター、またはCMVプロモーターである。上記のようなプロモーターを有する遺伝子発現ベクターは、いずれもInvitrogen社やClontech社などの試薬会社から市販されているか若しくは公的な機関から入手することが可能である。
【0024】
本発明の「スタッファー遺伝子」とは、リコンビナーゼ存在下においては、構成的発現プロモーターによって発現し、逆にリコンビナーゼ非存在下においては、切り出されて欠失する遺伝子である。また、本発明のスタッファー遺伝子は、その下流に配置された、抗
体をコードする遺伝子の発現を抑制し、前記スタッファー遺伝子がコードするタンパク質が、鳥類の細胞に対して無害のものであれば特に限定されない。具体的には、ネオマイシン、ハイグロマイシン、またはピューロマイシンなどの薬剤耐性遺伝子や、EGFP(Enhanced GFP)、またはmCherry(Clontech社)などの蛍光タンパク質をコードする遺伝子など
が挙げられる。
【0025】
本発明の「リコンビナーゼ認識配列」とは、リコンビナーゼによって認識されるポリヌクレオチド配列である。リコンビナーゼの具体例として、Creリコンビナーゼ、FLPリコンビナーゼ、またはRリコンビナーゼなどが挙げられる。あるいはこれらリコンビナーゼの
細胞内局在を制御できるCre-ERのような核内受容体との融合型のリコンビナーゼもこれに含まれる。好ましくはCreリコンビナーゼである。Creリコンビナーゼによって認識されるポリヌクレオチド配列の例としては、一連のloxP配列が挙げられる。前記の一連のloxP配列とは、Hoess, RH. et al (1986)Nucleic Acids Research vol. 14 2287-2300の記載
、若しくはNCBI(National Center for Biotechnology Information)のウェブサイトな
どを参照して入手することが出来る。
【0026】
本発明の方法は、下記のベクターを用いて実施できる。
【0027】
(i):同一のリコンビナーゼ認識配列に挟まれたスタッファー遺伝子配列の上流側に
構成的発現プロモーター配列を配置し、下流側には抗体をコードする遺伝子配列を配置した遺伝子配列カセット作製する。前記の遺伝子配列カセットを、少なくとも1つ配置したベクターを作製する。このようなベクターは図1の(A)に記載のベクターを例に説明す
ることが出来る。
【0028】
(ii):鳥類卵管細胞にて特異的に働くことを特徴とするプロモーター配列の下流に、リコンビナーゼをコードする遺伝子配列を配置した遺伝子配列カセットを含むベクターを作製する。このようなベクターは、図1の(B)に記載のベクターを例に説明することが
出来る。
【0029】
上記(i)に記載の遺伝子配列カセットに含まれるスタッファー遺伝子、構成的発現プ
ロモーターならびに、抗体をコードする遺伝子の配列は、遺伝子配列カセット間において同一であっても異なっていても良いものとする。ただし抗体をコードする遺伝子配列がカセット間において異なっている場合は、それぞれのカセット間に含まれるリコンビナーゼ認識配列が、異なっていることが望ましい。
【0030】
上記(i)に記載の遺伝子配列カセットに含まれる抗体をコードする遺伝子は、同一の
リコンビナーゼ認識配列のうち、下流側に配置されたものよりも更に下流に設置される。
【0031】
上記の(ii)に記載の方法によって作製されるベクターに含まれる、遺伝子配列カセットは、(i)に記載の方法によって作製されるベクターに含まれていても良いものとする
。また、上記の(i)に記載の方法によって作製されるベクターに含まれる、少なくとも
1つ以上の遺伝子配列カセットは、それぞれが異なるベクターに含まれていても良いものとする。
【0032】
上記の(i)(ii)に記載のベクターには、必要に応じてさらにエンハンサー配列、プ
ロモーター配列、ポリアデニレーション配列、インスレーター配列、リボソーム導入部位(Internal Ribosome Entry Site; IRES)配列、薬剤耐性遺伝子配列、レポーター遺伝子配列トランスポゾン配列またはインテグラーゼ配列などが含まれていても良いものとする。
【0033】
ここで、インスレーター配列とは、DNAのメチル化などによる発現制御の影響を抑制す
る機能や、遺伝子間のエンハンサーの干渉作用を断ち切るような、エンハンサーブロッキング機能を有する配列のこといい、前記の機能を有する限り特に限定されない。具体的には、ヒト由来βグロビンのHS1〜5、ニワトリ由来βグロビンのHS4などが挙げられる。
【0034】
上記のそれぞれの遺伝子配列カセットの両端には、インスレーター配列が含まれていても良いものとする。前記のインスレーター配列は、タンデムに並んだものであっても良いものとし、数種類のインスレーター配列を併用しても良いものとする。
【0035】
上記の方法によって作製されるベクターが数種類のベクターとなる場合、経時的にまたは同時に鳥類卵管細胞に導入しても良いものとする。ここで、経時的に前記ベクターを鳥類卵管細胞に導入する際において、例えば前記の(i)のベクターの導入後、(ii)のベ
クターの導入前に、(i)のベクター内に含まれる薬剤耐性遺伝子や蛍光タンパク質の遺
伝子などのマーカーの発現を確認する方法を用いて、導入細胞を選抜する工程が含まれていても良いものとする。
【0036】
逆に(ii)のベクターの導入後、(i)のベクターの導入前であれば、(ii)のベクタ
ー内に含まれる薬剤耐性遺伝子や蛍光タンパク質の遺伝子などのマーカーの発現を確認する方法を用いて、導入細胞を選抜する工程が含まれていても良いものとする。さらに、導入するベクターの比に関しても、抗体の生産に適した範囲で自由に設定することができる。
【0037】
上記の方法によって作製されるベクターを、鳥類卵管細胞に導入する方法は、公知の方法を用いることが出来る。具体的には、カチオン性リポソームなどの脂質を用いたリポフェクション法、パーティクルガン法、マイクロインジェクション法、ソノポレーション法、エレクトロポレーション法、塩化カルシウム法、またはアデノウイルス、レンチウイルスまたはレトロウイルスなどの感染機構利用するウイルス感染法などが挙げられる。好ましくは、リポフェクション法である。
【0038】
上記のベクターが導入された鳥類卵管細胞において発現するそれぞれの遺伝子は、一過性であっても、恒常的であってもよいものとする。
【0039】
本発明の方法によってベクターが導入される鳥類卵管細胞が初代培養細胞である場合、その細胞は公知の方法を用いて培養することが出来る。また、培養に用いる培地は血清が含まれていても、無血清培地であっても良いものとする。
【0040】
本発明の「抗体」とは、免疫反応において抗原に対して特異的に結合する生体分子であり、具体的にはイムノグロブリン分子としてIgA、IgG、IgM、IgE、IgDまたはIgYなどが挙げられる。さらに、抗原−抗体反応を発揮する機能を有するものであればイムノグロブリンに限定されることはない。具体的には抗体断片若しくはその多量体、多価化抗体、二重特異性抗体、単鎖抗体または融合抗体などが挙げられる。
【0041】
本発明のスタッファー遺伝子配列、構成的発現プロモーター配列、リコンビナーゼ認識配列、インスレーター配列、抗体をコードする遺伝子の配列およびリコンビナーゼ遺伝子配列に対して、上述のそれぞれ機能の期待を減殺しない範囲であれば、変異、置換、欠失、挿入、タンデム化などの改変を加えて利用することが可能である。
【実施例】
【0042】
以下に本発明を実施例に基づいて、より詳細に説明するが本発明がこれら実施例に限定されないことはいうまでもない。
【0043】
鳥類卵管細胞に高効率に抗体分子を発現させるのに好ましい導入遺伝子構築物
図1の(A)に示す第1のベクターはCreリコンビナーゼ認識配列である2つのloxP配列(配列番号1)に挟まれたスタッファー遺伝子領域(ネオマイシン耐性遺伝子、IRES配列ならびに強化緑色蛍光タンパク質(EGFP)遺伝子、およびSV40ポリA付加シグナル配列を
含む)を、その上流に構成的発現プロモーターとしてCAGプロモーターを、更にスタッフ
ァー遺伝子領域の下流に、ヒトイムノグロブリン軽鎖遺伝子(配列番号2)およびウシ成長ホルモン(BGH)ポリA付加シグナル配列を有し、これらを1つ目の遺伝子配列カセットとした。
【0044】
ここで上記のヒトイムノグロブリン軽鎖遺伝子とは、NCBI Protein Database 1N8Z_A (GI:28948772)の一部をコードする393b.pからなるヌクレオチドを人工合成し(図2の(A
)大文字・下線・太字部分)、ヒトイムノグロブリンκ軽鎖Genbank CAA75031.1 (GI:2765423)の一部をコードするヌクレオチド(図2の(A)小文字部分)と融合させたものである。
【0045】
このベクターは更に2つ目の遺伝子配列カセットとして、構成的発現プロモーターであるCMVプロモーター、その下流に上述のCAGプロモーターの上流および下流に配置したリコンビナーゼ認識配列であるloxP配列とは異なる種類のリコンビナーゼ認識配列であるloxP配列(loxP511; 配列番号3)に挟まれたスタッファー遺伝子領域(単量体赤色蛍光タン
パク質(Clontech)およびウサギβ-グロビン(RBG)ポリA付加シグナル配列を含む)、
さらにその下流に発現を所望するタンパク質としてヒトイムノグロブリン重鎖遺伝子(配列番号4)および単純ヘルペスウイルス(HSV)のチミジンキナーゼ(TK)ポリA付加シグナルを有する。
【0046】
ここで上記のヒトイムノグロブリン重鎖とは、NCBI Protein Database 1N8Z_B (GI:28948773)をコードする配列を含んだ776bpからなるヌクレオチドを人工合成し(図2の(B)大文字・下線・太字部分)、ヒトイムノグロブリンκ重鎖Genbank CAA75030.1 (GI:2765421)の一部をコードするヌクレオチド(図2の(B)小文字部分)と融合させたものである。
【0047】
また、2つの構成的発現プロモーターによる干渉や鳥類ゲノムに挿入された場合の内因性遺伝子制御による影響の抑制の為、遺伝子配列カセットの両端にニワトリ由来βグロビンのHS4インスレーター配列を2回くりかえして挿入した。このベクターをAI111と名づけた。
【0048】
図1の(B)に示す第2のベクターは鳥類卵管細胞特異的発現プロモーターとして非特
許文献1に記載されたオボアルブミンプロモーターを含む領域2.8kbを有し、その下流にCreリコンビナーゼ遺伝子(GenBank: AB449974.1, (GI:194578727))およびBGHポリA付加
シグナルを有している。鳥類卵管細胞においてゲノムに挿入された場合の内因性遺伝子制御の影響を抑制する為にプロモーター上流並びにCreリコンビナーゼ遺伝子の下流にニワ
トリ由来βグロビンのHS4インスレーター配列を2回くりかえして挿入した。加えて培養
細胞中で導入遺伝子が選択可能になるようにSV40プロモーターの下流に抗生物質耐性遺伝子としてハイグロマイシン耐性遺伝子ならびにHSVのTKのポリA付加シグナルを含んでいる。このベクターをOVA2.8-Creと名づけた。
【0049】
発現ベクターの働きの確認
ベクターAI111が導入細胞内で2つの構成的発現プロモーターによる外来遺伝子を発現
するか、また、Creリコンビナーゼ依存的にスタッファー分子の発現を抑制しヒト抗体分
子を発現誘導するかをヒト胎児腎臓由来培養細胞株HEK293T細胞を用いて検討した。HEK293T細胞1.5x105を6穴細胞培養プレートに播種し、翌日各々6μlのFuGENE6(Roche)を用
いて表1の組み合わせにより遺伝子導入を行なった。ベクターCMV-Creは構成的発現プロモーターCMVプロモーターの下流にCreリコンビナーゼおよびウシ成長ホルモンポリA付加シ
グナルを有している。
【0050】
【表1】

【0051】
トランスフェクションの2日後、それぞれトランスフェクションを施した細胞を、蛍光顕微鏡を用いて緑色蛍光、赤色蛍光を観察した結果は図3及び以下の表2の通りであり、また図3のようにほとんどの細胞で緑色蛍光、赤色蛍光は同一の細胞で発現が認められた。
【0052】
【表2】

【0053】
更に、これらの結果はベクターAI111が導入細胞内で同時に2つの構成的発現プロモー
ターにより外来遺伝子を発現しうること、また、Creリコンビナーゼ量依存的にスタッフ
ァー分子の発現を抑制することを示している。
【0054】
抗体の発現について検討
HEK293T細胞1.5x105を6穴細胞培養プレートに播種し、翌日各々6μlのFuGENE6 (Roche)を用いて表3に記載の組み合わせにより遺伝子導入を行なった。ベクターCMV-HcはCMV
プロモーターの下流にヒトイムノグロブリン重鎖遺伝子(配列番号4、)およびHSVのTK
ポリA付加シグナルを、ベクターCMV-Lcは、CMVプロモーターの下流にヒトイムノグロブリン軽鎖遺伝子(配列番号2、)およびBGHポリA付加シグナルをそれぞれ有している。ベクターpBSはトランスフェクションに用いるDNA量を同一にする為のコントロールベクターとして使用した。
【0055】
【表3】

【0056】
トランスフェクションの3日後、それぞれの培養細胞上清を回収し15μlを非還元条件
下でポリアクリルアミドゲル電気泳動し、PVDF膜に転写後、高次構造を有するヒトIgGを
特異的に認識することができる抗ヒトIgGFc抗体(I-124, Leinco Technologies Inc. MO
)を用いたウェスタンブロッティング法により培養上清中のヒトIgGを測定した。図4の
レーン3に示すようにベクターAI111を導入したHEK239T細胞の培養上清は、Creリコンビ
ナーゼを共発現させた場合にのみ、該抗ヒトIgGFc抗体に認識されるほぼ単一のシグナル
(移動度150kDa以上)を認めた。このシグナルはヒトイムノグロブリン軽鎖及び重鎖を共発現させた場合に認められるシグナルと同一の移動度とみなされた(図4、レーン4)。
【0057】
一方、Creリコンビナーゼ非存在下ではシグナルを認めなかった(図4、レーン2)。
これらのことから、ベクターAI111は細胞内において2つの蛍光分子を同時に発現するこ
と、Creリコンビナーゼ非存在下ではヒト抗体分子を殆ど発現しないこと、Creリコンビナーゼ依存的に蛍光分子の発現が消失すること、Creリコンビナーゼ依存的に蛍光分子の下
流にあるヒト抗体分子が、高次構造を保った状態で生産されることが示された。
【0058】
ニワトリ卵管由来細胞を用いたヒト抗体生産の検討
鳥類卵管細胞に対して特異的な発現を示すオボアルブミンプロモーターの下に、Creリ
コンビナーゼを発現させるベクターOVA2.8-Creと、ベクターAI111をニワトリ卵管由来初
代培養細胞に導入し培養上清中のヒトイムノグロブリンを測定した。また、従前より提唱されている技術との比較のためにオボアルブミンプロモーターによりヒトイムノグロブリン遺伝子が発現誘導を受ける図5のベクターとして、ベクターOVA2.8-Hc+Lcを作製した。
【0059】
図5に示すベクターOVA2.8-Hc+Lcは、ベクターOVA2.8-Creと同一のオボアルブミンプロモーターを2つ配置し、そのそれぞれの下流にヒトイムノグロブリン重鎖遺伝子(配列番号4、図2の(B))およびHSVのTKポリA付加シグナルあるいはヒトイムノグロブリン軽
鎖遺伝子(配列番号2、図2の(A))およびBGHポリA付加シグナルをそれぞれ導入し、
各オボアルブミンプロモーターの上流およびHSVのTKポリA付加シグナルの下流にニワトリ由来βグロビンのHS4インスレーター配列をを2回くりかえしてつないだものである。
【0060】
ニワトリ卵管由来初代培養細胞は18-24ヶ月齢の白色レグホン雌の2-9cm2の卵管組織よ
り、既に報告された技法に則り採取し、(Muramatsu T.らComp.Biochem.Physiol. 112B巻209-216頁, 1995, Sanders M. M.およびMcKnight G.S. Endocrinology 116巻398-405頁, 1985)12穴細胞培養プレートに40-60%の密度になるよう等量ずつ播種した。採取後48時間以内に以下のベクターの組み合わせで各々FuGENE6を1.5μl用いてトランスフェクション
を行なった。ベクターpBSはトランスフェクションに用いるDNA量を同一にする為のコントロールベクターとして使用した。
【0061】
【表4】

【0062】
トランスフェクションの3日後、それぞれの培養細胞上清を回収し15μlを非還元条件
下でポリアクリルアミド電気泳動し、PVDF膜に転写後、抗ヒトIgGFc抗体(I-124)を用いたウェスタンブロッティング法により培養上清中のヒトIgGを測定した。図6に示すよう
にベクターAI111とベクターOVA2.8-Creを導入したニワトリ卵管由来初代培養細胞培養上
清中に抗ヒトIgGFc抗体に認識される移動度150kDa以上のほぼ単一のシグナルを認めた(
図5、レーン2)。一方で、ベクターAI111とベクターpBS、あるいはベクターOVA2.8-Hc+LcとベクターpBSを導入した細胞の培養上清中には殆どシグナルを認めなかった(図6、
レーン1および3)。この結果から、ベクターAI111とベクターOVA2.8-Creの組み合わせ
は、鳥類卵管細胞に対しても、抗体の発現に対して効果を有することが判明した。
【0063】
培養上清中のヒトIgG抗体濃度のELISA法による定量的な比較解析
カーボネートコートバッファー(0.025M sodium bicarbonate, 0.025M sodium carbonate)100μlに抗ヒトIgGFc抗体(I-124)100ngを懸濁し、96-well Nunc-Immuno plate(Nalge-Nunc International、Roskilde、Denmark)に4℃で一夜吸着させた。洗浄バッファー(20mM Tris-HCl(pH7.6), 150mM NaCl, 0.05% Tween 20)250μlで2回洗浄後、ブロッ
キング溶液(5% ウシ血清アルブミン/洗浄バッファー)250μlを加え室温で1時間静置後、
ブロッキング溶液を廃棄し、洗浄バッファー250μlで1回洗浄後、培養上清ならびに培養
液にヒトモノクローナル抗体(ハーセプチン、中外製薬)を20μg/mlから0.256ng/mlまで培地で1/5倍ずつ連続希釈したものをそれぞれ100μlずつ加え、室温で2時間インキュベートした。液を捨て、洗浄バッファー250μlで3回洗浄後、ブロッキング溶液にて10000倍希
釈したPeroxidase-conjugated AffiniPure Goat Anti-Human IgG(H+L)(109-035-003, Jackson Immuno Research, PA)を100μlずつ加え室温で2時間インキュベートした。液を捨て、洗浄バッファー250μlで3回洗浄後、TMB One Solution(Promega, WI)100μlを添加し5分後1M-HClを加え、マイクロプレートリーダー(Molecular Devices, CA)を用い、450nMでの吸光度を計測した。
【0064】
結果を図7に示す。この例ではベクターAI111とベクターOVA2.8-Creを導入した場合と
ベクターOVA2.8-Hc+Lcを導入した場合培養上清1mlあたりに含まれるヒトイムノグロブリ
ン量はそれぞれ約20ngと0.5ngと推定され、本発明により従来提唱されていた方法の40
倍以上の外来の抗体タンパク質発現誘導能を認めた。
【産業上の利用可能性】
【0065】
本発明によって、設備、原料、生産管理等の生産コストの削減などの点で、医療用抗体生産の効率化が期待できる。また本発明の方法を、鳥類個体に応用することで、卵中に抗体を蓄積させることが可能となる。
【技術分野】
【0001】
本発明は鳥類卵管細胞に対してタンパク質発現遺伝子を導入し、タンパク質を発現させる技術分野に属する。
【背景技術】
【0002】
遺伝子組み換え技術を用いた医療用のモノクローナル抗体は診断や疾患の治療において優れた効果を有する。一般に治療に用いられる医療用抗体はサイトカインなど他の生物製剤に比べて大量に投与されるため、使用に際して医療費が高額になることが大きな問題である。医療用抗体の生産技術の効率化は製造コストを下げ、この問題の解決の為に有効である。
【0003】
現在、医療用抗体の生産方法としてはCHO細胞のような主に哺乳動物の培養細胞に外因
性の抗体分子の重鎖、軽鎖を遺伝子導入し、培養上清中に抗体分子を分泌させる方法が主流である。この方法は大規模な培養装置を用いる為、商業規模の抗体生産を行う上で莫大な設備投資が必要である。また、細胞培養に用いる高額な培地類も医療用抗体のコスト高の原因になっている。これらのことから培養細胞に依存しない効率的な医療用抗体の生産法が必要とされている。
【0004】
一方、培養細胞ではなく動物を遺伝子改変し、医療用抗体を生産させようとする試みがなされている。この場合、動物の組織から有益な抗体を回収するには、発現されたタンパク質は容易に回収可能で、かつ治療的有効性を有し、その発現がいくつかの特定の組織に限定されている必要がある。外因性の抗体タンパク質を特定の組織ではなく全身性に発現させた場合、動物の発生や健康に障害を与え得る為、このような問題の少ない特定組織での発現が望ましい。これらの点から鳥類の卵は有効な媒介物であると考えられている。実際、特許文献1においてはニワトリ卵管特異的に発現するオボアルブミン分子のプロモーターによりヒト抗体分子を卵管細胞特異的に発現させることにより、卵白中に治療的有効性の高い化学的特性を有する抗体タンパク質を蓄積している。
【0005】
また、非特許文献1ではウイルスベクターを用いてオボアルブミンプロモーターの下流に改変した一本鎖抗体遺伝子を有するトランスジェニックニワトリを作製し、卵管由来細胞特異的発現ならびに卵白中への外来一本鎖抗体分子の蓄積を認めている。
【0006】
すなわち、既に報告されているように、オボアルブミンプロモーターのような鳥類卵管特異的発現を誘導する調節領域の直下に外因性のタンパク質をコードする遺伝子をつなげることにより鳥類卵管由来細胞特異的にタンパク質を発現させることが可能であり、抗体分子の場合ニワトリの卵管由来細胞に発現させることにより卵中に治療的有効性の高い化学的特性を有する抗体タンパク質を蓄積可能である。
【0007】
医療用の抗体分子は様々な形状のものが考えられるが、主なものはイムノグロブリンの軽鎖、重鎖から構成されており、ニワトリ卵に機能性抗体を蓄積するには卵管細胞において2種類の分子を同時に発現することが望ましく、さらに、その発現効率が高ければ高いほうが望ましい。
【0008】
しかしながら上述のオボアルブミンプロモーターは卵管由来細胞での特異性は高いものの、外因性の蛋白質を発現させるにはプロモーターそのものとしての力が十分満足できるほどに強くなく、望ましい発現量が望めない欠点がある。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特表2008−532939号公報
【非特許文献】
【0010】
【非特許文献1】S. G. Lillico, A. Sherman, M. J. McGrew, C. D. Robertson, J. Smith, C. Haslam, P. Barnard, P. A. Radcliffe, K. A. Mitrophanous , E. A. Elliot, and H. M. Sang. Proc. Natl. Acad. Sci. U. S. A. 2007 Feb 6; 104(6):1771-6. Epub 2007 Jan 26.
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は鳥類卵管細胞でタンパク質を高効率で、かつ特異的に発現する技術を提供する。これにより、これまでに行なわれている卵管特異的なプロモーターの下流に抗体遺伝子を連結させ鳥類卵管細胞に発現させる方法よりも効率よく抗体分子を生産することが可能になる。
【課題を解決するための手段】
【0012】
上記課題を解決すべく、本願発明者は鋭意検討した結果、以下の発明を提供するに至った。
【0013】
項1
鳥類卵管細胞を用いたタンパク質の発現方法であって、
(i)リコンビナーゼ認識配列によって挟まれたスタッファー遺伝子配列の上流側に構成
的発現プロモーター配列が配置され、該スタッファー遺伝子の下流側に抗体をコードする遺伝子配列が配置された少なくとも1つの遺伝子配列カセットを含むベクター、および(ii)鳥類卵管細胞に特異的なプロモーター、および該プロモーターの下流に配置されたリコンビナーゼをコードする遺伝子配列を含むベクターを鳥類卵管細胞に導入する工程を含む、タンパク質の発現方法。
【0014】
項2
前記のリコンビナーゼが、Creリコンビナーゼであることを特徴とする、項1に記載のタ
ンパク質の発現方法。
【0015】
項3
(i)リコンビナーゼ認識配列に挟まれたスタッファー遺伝子配列の上流側に構成的発現
プロモーター配列が配置され、該スタッファー遺伝子の下流側に抗体をコードする遺伝子配列が配置された少なくとも1つの遺伝子配列カセットを含むベクター、および(ii)鳥類卵管細胞に特異的なプロモーター、および該プロモーターの下流に配置されたリコンビナーゼをコードする遺伝子配列を含むベクターが導入された鳥類卵管細胞。
【0016】
項4
前記のリコンビナーゼが、Creリコンビナーゼであることを特徴とする項3に記載の鳥類
卵管細胞。
【発明の効果】
【0017】
ニワトリ卵管由来初代培養細胞系において、従来提唱されているニワトリオボアルブミンプロモーターにより直接二量体の抗体分子を発現させる手法に比べ、本願発明の手法により40倍以上の発現効率の向上を認めた。また、本願発明の方法によって、トランスジェニック鳥類の生体内卵管細胞での抗体分子の発現効率を向上ならしめ、卵内またはその
卵白中へ、抗体分子を蓄積させる効果を有することも予想される。
【図面の簡単な説明】
【0018】
【図1】ベクターAI111およびベクターOVA2.8-Creの模式図
【図2】抗体遺伝子配列の説明図
【図3】ベクターAI111による同一細胞での2つの遺伝子発現とCreリコンビナーゼ依存的な蛍光タンパク質発現抑制を示す図
【図4】ベクターAI111によるCreリコンビナーゼ依存的な抗体分子の発現
【図5】ベクターOVA2.8-Hc+Lc模式図
【図6】鳥類卵管由来初代培養細胞におけるベクターAI111によるベクターOVA2.8-Cre依存的な抗体分子の発現を示す図
【図7】鳥類卵管由来初代培養細胞を用いた外因性ヒト抗体生産能のELISAによる比較を示す図
【発明を実施するための形態】
【0019】
この発明におけるその他の用語や概念は、発明の実施形態の説明や実施例において詳しく規定する。また、この発明を実施するために使用する様々な技術は、特にその出典を明示した技術を除いては、公知の文献等に基づいて当業者であれば容易かつ確実に実施可能である。例えば、遺伝子工学および分子生物学的技術はSambrook and Maniatis,” Molecular Cloning A Laboratory Manual ”, Cold Spring Harbor Laboratory Press, New
York, 2001; Ausubel, F. M. et al. ” Current Protocols in Molecular Biology ”, John Wiley & Sons, New York, N. Y, 2007等に記載されている。
【0020】
本発明の「鳥類」とは、卵生であり卵が殻に覆われているものが望ましい。具体例として、ダチョウ類、キジ類、ウズラ類、ハト類、ニワトリ類、またはアヒル類などが挙げられる。好ましくはニワトリ類である。
【0021】
本発明の「鳥類卵管細胞」とは、鳥類の卵の構成成分を分泌させることを特徴とする卵管組織に存在する細胞であり、卵管腺細胞、または卵管上皮細胞などが挙げられる。ここで、本発明の鳥類卵管細胞とは、前記の組織から採取される初代培養細胞であってもよく、さらにその後に不死化処理などが施された株化細胞であっても良いものとする。
【0022】
本発明の「鳥類卵管細胞に特異的なプロモーター」とは、鳥類卵管組織に含まれる細胞において、優先的に外来遺伝子を発現させることが可能であるプロモーターである。具体的には、鳥類卵管細胞に含まれるオボアルブミン、オボトランスフェリン、オボムコイド、オボムチン、リゾチーム、オボグロブリン、またはオボインヒビターなどのプロモーターが挙げられる。より好ましくはオボアルブミンのプロモーターである。
【0023】
本発明の「構成的発現プロモーター」とは、通常の遺伝子組み換え技術によって使用され、一般的な動物細胞に、恒常的に遺伝子を発現させることが可能であるプロモーターのことであり、特に限定されるものではないが、強力なプロモーター活性を有するものが望ましい。具体的には、CAGプロモーター、CMVプロモーター、EF-1αプロモーター、またはSV40プロモーターなどが挙げられる。好ましくはCAGプロモーター、またはCMVプロモーターである。上記のようなプロモーターを有する遺伝子発現ベクターは、いずれもInvitrogen社やClontech社などの試薬会社から市販されているか若しくは公的な機関から入手することが可能である。
【0024】
本発明の「スタッファー遺伝子」とは、リコンビナーゼ存在下においては、構成的発現プロモーターによって発現し、逆にリコンビナーゼ非存在下においては、切り出されて欠失する遺伝子である。また、本発明のスタッファー遺伝子は、その下流に配置された、抗
体をコードする遺伝子の発現を抑制し、前記スタッファー遺伝子がコードするタンパク質が、鳥類の細胞に対して無害のものであれば特に限定されない。具体的には、ネオマイシン、ハイグロマイシン、またはピューロマイシンなどの薬剤耐性遺伝子や、EGFP(Enhanced GFP)、またはmCherry(Clontech社)などの蛍光タンパク質をコードする遺伝子など
が挙げられる。
【0025】
本発明の「リコンビナーゼ認識配列」とは、リコンビナーゼによって認識されるポリヌクレオチド配列である。リコンビナーゼの具体例として、Creリコンビナーゼ、FLPリコンビナーゼ、またはRリコンビナーゼなどが挙げられる。あるいはこれらリコンビナーゼの
細胞内局在を制御できるCre-ERのような核内受容体との融合型のリコンビナーゼもこれに含まれる。好ましくはCreリコンビナーゼである。Creリコンビナーゼによって認識されるポリヌクレオチド配列の例としては、一連のloxP配列が挙げられる。前記の一連のloxP配列とは、Hoess, RH. et al (1986)Nucleic Acids Research vol. 14 2287-2300の記載
、若しくはNCBI(National Center for Biotechnology Information)のウェブサイトな
どを参照して入手することが出来る。
【0026】
本発明の方法は、下記のベクターを用いて実施できる。
【0027】
(i):同一のリコンビナーゼ認識配列に挟まれたスタッファー遺伝子配列の上流側に
構成的発現プロモーター配列を配置し、下流側には抗体をコードする遺伝子配列を配置した遺伝子配列カセット作製する。前記の遺伝子配列カセットを、少なくとも1つ配置したベクターを作製する。このようなベクターは図1の(A)に記載のベクターを例に説明す
ることが出来る。
【0028】
(ii):鳥類卵管細胞にて特異的に働くことを特徴とするプロモーター配列の下流に、リコンビナーゼをコードする遺伝子配列を配置した遺伝子配列カセットを含むベクターを作製する。このようなベクターは、図1の(B)に記載のベクターを例に説明することが
出来る。
【0029】
上記(i)に記載の遺伝子配列カセットに含まれるスタッファー遺伝子、構成的発現プ
ロモーターならびに、抗体をコードする遺伝子の配列は、遺伝子配列カセット間において同一であっても異なっていても良いものとする。ただし抗体をコードする遺伝子配列がカセット間において異なっている場合は、それぞれのカセット間に含まれるリコンビナーゼ認識配列が、異なっていることが望ましい。
【0030】
上記(i)に記載の遺伝子配列カセットに含まれる抗体をコードする遺伝子は、同一の
リコンビナーゼ認識配列のうち、下流側に配置されたものよりも更に下流に設置される。
【0031】
上記の(ii)に記載の方法によって作製されるベクターに含まれる、遺伝子配列カセットは、(i)に記載の方法によって作製されるベクターに含まれていても良いものとする
。また、上記の(i)に記載の方法によって作製されるベクターに含まれる、少なくとも
1つ以上の遺伝子配列カセットは、それぞれが異なるベクターに含まれていても良いものとする。
【0032】
上記の(i)(ii)に記載のベクターには、必要に応じてさらにエンハンサー配列、プ
ロモーター配列、ポリアデニレーション配列、インスレーター配列、リボソーム導入部位(Internal Ribosome Entry Site; IRES)配列、薬剤耐性遺伝子配列、レポーター遺伝子配列トランスポゾン配列またはインテグラーゼ配列などが含まれていても良いものとする。
【0033】
ここで、インスレーター配列とは、DNAのメチル化などによる発現制御の影響を抑制す
る機能や、遺伝子間のエンハンサーの干渉作用を断ち切るような、エンハンサーブロッキング機能を有する配列のこといい、前記の機能を有する限り特に限定されない。具体的には、ヒト由来βグロビンのHS1〜5、ニワトリ由来βグロビンのHS4などが挙げられる。
【0034】
上記のそれぞれの遺伝子配列カセットの両端には、インスレーター配列が含まれていても良いものとする。前記のインスレーター配列は、タンデムに並んだものであっても良いものとし、数種類のインスレーター配列を併用しても良いものとする。
【0035】
上記の方法によって作製されるベクターが数種類のベクターとなる場合、経時的にまたは同時に鳥類卵管細胞に導入しても良いものとする。ここで、経時的に前記ベクターを鳥類卵管細胞に導入する際において、例えば前記の(i)のベクターの導入後、(ii)のベ
クターの導入前に、(i)のベクター内に含まれる薬剤耐性遺伝子や蛍光タンパク質の遺
伝子などのマーカーの発現を確認する方法を用いて、導入細胞を選抜する工程が含まれていても良いものとする。
【0036】
逆に(ii)のベクターの導入後、(i)のベクターの導入前であれば、(ii)のベクタ
ー内に含まれる薬剤耐性遺伝子や蛍光タンパク質の遺伝子などのマーカーの発現を確認する方法を用いて、導入細胞を選抜する工程が含まれていても良いものとする。さらに、導入するベクターの比に関しても、抗体の生産に適した範囲で自由に設定することができる。
【0037】
上記の方法によって作製されるベクターを、鳥類卵管細胞に導入する方法は、公知の方法を用いることが出来る。具体的には、カチオン性リポソームなどの脂質を用いたリポフェクション法、パーティクルガン法、マイクロインジェクション法、ソノポレーション法、エレクトロポレーション法、塩化カルシウム法、またはアデノウイルス、レンチウイルスまたはレトロウイルスなどの感染機構利用するウイルス感染法などが挙げられる。好ましくは、リポフェクション法である。
【0038】
上記のベクターが導入された鳥類卵管細胞において発現するそれぞれの遺伝子は、一過性であっても、恒常的であってもよいものとする。
【0039】
本発明の方法によってベクターが導入される鳥類卵管細胞が初代培養細胞である場合、その細胞は公知の方法を用いて培養することが出来る。また、培養に用いる培地は血清が含まれていても、無血清培地であっても良いものとする。
【0040】
本発明の「抗体」とは、免疫反応において抗原に対して特異的に結合する生体分子であり、具体的にはイムノグロブリン分子としてIgA、IgG、IgM、IgE、IgDまたはIgYなどが挙げられる。さらに、抗原−抗体反応を発揮する機能を有するものであればイムノグロブリンに限定されることはない。具体的には抗体断片若しくはその多量体、多価化抗体、二重特異性抗体、単鎖抗体または融合抗体などが挙げられる。
【0041】
本発明のスタッファー遺伝子配列、構成的発現プロモーター配列、リコンビナーゼ認識配列、インスレーター配列、抗体をコードする遺伝子の配列およびリコンビナーゼ遺伝子配列に対して、上述のそれぞれ機能の期待を減殺しない範囲であれば、変異、置換、欠失、挿入、タンデム化などの改変を加えて利用することが可能である。
【実施例】
【0042】
以下に本発明を実施例に基づいて、より詳細に説明するが本発明がこれら実施例に限定されないことはいうまでもない。
【0043】
鳥類卵管細胞に高効率に抗体分子を発現させるのに好ましい導入遺伝子構築物
図1の(A)に示す第1のベクターはCreリコンビナーゼ認識配列である2つのloxP配列(配列番号1)に挟まれたスタッファー遺伝子領域(ネオマイシン耐性遺伝子、IRES配列ならびに強化緑色蛍光タンパク質(EGFP)遺伝子、およびSV40ポリA付加シグナル配列を
含む)を、その上流に構成的発現プロモーターとしてCAGプロモーターを、更にスタッフ
ァー遺伝子領域の下流に、ヒトイムノグロブリン軽鎖遺伝子(配列番号2)およびウシ成長ホルモン(BGH)ポリA付加シグナル配列を有し、これらを1つ目の遺伝子配列カセットとした。
【0044】
ここで上記のヒトイムノグロブリン軽鎖遺伝子とは、NCBI Protein Database 1N8Z_A (GI:28948772)の一部をコードする393b.pからなるヌクレオチドを人工合成し(図2の(A
)大文字・下線・太字部分)、ヒトイムノグロブリンκ軽鎖Genbank CAA75031.1 (GI:2765423)の一部をコードするヌクレオチド(図2の(A)小文字部分)と融合させたものである。
【0045】
このベクターは更に2つ目の遺伝子配列カセットとして、構成的発現プロモーターであるCMVプロモーター、その下流に上述のCAGプロモーターの上流および下流に配置したリコンビナーゼ認識配列であるloxP配列とは異なる種類のリコンビナーゼ認識配列であるloxP配列(loxP511; 配列番号3)に挟まれたスタッファー遺伝子領域(単量体赤色蛍光タン
パク質(Clontech)およびウサギβ-グロビン(RBG)ポリA付加シグナル配列を含む)、
さらにその下流に発現を所望するタンパク質としてヒトイムノグロブリン重鎖遺伝子(配列番号4)および単純ヘルペスウイルス(HSV)のチミジンキナーゼ(TK)ポリA付加シグナルを有する。
【0046】
ここで上記のヒトイムノグロブリン重鎖とは、NCBI Protein Database 1N8Z_B (GI:28948773)をコードする配列を含んだ776bpからなるヌクレオチドを人工合成し(図2の(B)大文字・下線・太字部分)、ヒトイムノグロブリンκ重鎖Genbank CAA75030.1 (GI:2765421)の一部をコードするヌクレオチド(図2の(B)小文字部分)と融合させたものである。
【0047】
また、2つの構成的発現プロモーターによる干渉や鳥類ゲノムに挿入された場合の内因性遺伝子制御による影響の抑制の為、遺伝子配列カセットの両端にニワトリ由来βグロビンのHS4インスレーター配列を2回くりかえして挿入した。このベクターをAI111と名づけた。
【0048】
図1の(B)に示す第2のベクターは鳥類卵管細胞特異的発現プロモーターとして非特
許文献1に記載されたオボアルブミンプロモーターを含む領域2.8kbを有し、その下流にCreリコンビナーゼ遺伝子(GenBank: AB449974.1, (GI:194578727))およびBGHポリA付加
シグナルを有している。鳥類卵管細胞においてゲノムに挿入された場合の内因性遺伝子制御の影響を抑制する為にプロモーター上流並びにCreリコンビナーゼ遺伝子の下流にニワ
トリ由来βグロビンのHS4インスレーター配列を2回くりかえして挿入した。加えて培養
細胞中で導入遺伝子が選択可能になるようにSV40プロモーターの下流に抗生物質耐性遺伝子としてハイグロマイシン耐性遺伝子ならびにHSVのTKのポリA付加シグナルを含んでいる。このベクターをOVA2.8-Creと名づけた。
【0049】
発現ベクターの働きの確認
ベクターAI111が導入細胞内で2つの構成的発現プロモーターによる外来遺伝子を発現
するか、また、Creリコンビナーゼ依存的にスタッファー分子の発現を抑制しヒト抗体分
子を発現誘導するかをヒト胎児腎臓由来培養細胞株HEK293T細胞を用いて検討した。HEK293T細胞1.5x105を6穴細胞培養プレートに播種し、翌日各々6μlのFuGENE6(Roche)を用
いて表1の組み合わせにより遺伝子導入を行なった。ベクターCMV-Creは構成的発現プロモーターCMVプロモーターの下流にCreリコンビナーゼおよびウシ成長ホルモンポリA付加シ
グナルを有している。
【0050】
【表1】

【0051】
トランスフェクションの2日後、それぞれトランスフェクションを施した細胞を、蛍光顕微鏡を用いて緑色蛍光、赤色蛍光を観察した結果は図3及び以下の表2の通りであり、また図3のようにほとんどの細胞で緑色蛍光、赤色蛍光は同一の細胞で発現が認められた。
【0052】
【表2】

【0053】
更に、これらの結果はベクターAI111が導入細胞内で同時に2つの構成的発現プロモー
ターにより外来遺伝子を発現しうること、また、Creリコンビナーゼ量依存的にスタッフ
ァー分子の発現を抑制することを示している。
【0054】
抗体の発現について検討
HEK293T細胞1.5x105を6穴細胞培養プレートに播種し、翌日各々6μlのFuGENE6 (Roche)を用いて表3に記載の組み合わせにより遺伝子導入を行なった。ベクターCMV-HcはCMV
プロモーターの下流にヒトイムノグロブリン重鎖遺伝子(配列番号4、)およびHSVのTK
ポリA付加シグナルを、ベクターCMV-Lcは、CMVプロモーターの下流にヒトイムノグロブリン軽鎖遺伝子(配列番号2、)およびBGHポリA付加シグナルをそれぞれ有している。ベクターpBSはトランスフェクションに用いるDNA量を同一にする為のコントロールベクターとして使用した。
【0055】
【表3】

【0056】
トランスフェクションの3日後、それぞれの培養細胞上清を回収し15μlを非還元条件
下でポリアクリルアミドゲル電気泳動し、PVDF膜に転写後、高次構造を有するヒトIgGを
特異的に認識することができる抗ヒトIgGFc抗体(I-124, Leinco Technologies Inc. MO
)を用いたウェスタンブロッティング法により培養上清中のヒトIgGを測定した。図4の
レーン3に示すようにベクターAI111を導入したHEK239T細胞の培養上清は、Creリコンビ
ナーゼを共発現させた場合にのみ、該抗ヒトIgGFc抗体に認識されるほぼ単一のシグナル
(移動度150kDa以上)を認めた。このシグナルはヒトイムノグロブリン軽鎖及び重鎖を共発現させた場合に認められるシグナルと同一の移動度とみなされた(図4、レーン4)。
【0057】
一方、Creリコンビナーゼ非存在下ではシグナルを認めなかった(図4、レーン2)。
これらのことから、ベクターAI111は細胞内において2つの蛍光分子を同時に発現するこ
と、Creリコンビナーゼ非存在下ではヒト抗体分子を殆ど発現しないこと、Creリコンビナーゼ依存的に蛍光分子の発現が消失すること、Creリコンビナーゼ依存的に蛍光分子の下
流にあるヒト抗体分子が、高次構造を保った状態で生産されることが示された。
【0058】
ニワトリ卵管由来細胞を用いたヒト抗体生産の検討
鳥類卵管細胞に対して特異的な発現を示すオボアルブミンプロモーターの下に、Creリ
コンビナーゼを発現させるベクターOVA2.8-Creと、ベクターAI111をニワトリ卵管由来初
代培養細胞に導入し培養上清中のヒトイムノグロブリンを測定した。また、従前より提唱されている技術との比較のためにオボアルブミンプロモーターによりヒトイムノグロブリン遺伝子が発現誘導を受ける図5のベクターとして、ベクターOVA2.8-Hc+Lcを作製した。
【0059】
図5に示すベクターOVA2.8-Hc+Lcは、ベクターOVA2.8-Creと同一のオボアルブミンプロモーターを2つ配置し、そのそれぞれの下流にヒトイムノグロブリン重鎖遺伝子(配列番号4、図2の(B))およびHSVのTKポリA付加シグナルあるいはヒトイムノグロブリン軽
鎖遺伝子(配列番号2、図2の(A))およびBGHポリA付加シグナルをそれぞれ導入し、
各オボアルブミンプロモーターの上流およびHSVのTKポリA付加シグナルの下流にニワトリ由来βグロビンのHS4インスレーター配列をを2回くりかえしてつないだものである。
【0060】
ニワトリ卵管由来初代培養細胞は18-24ヶ月齢の白色レグホン雌の2-9cm2の卵管組織よ
り、既に報告された技法に則り採取し、(Muramatsu T.らComp.Biochem.Physiol. 112B巻209-216頁, 1995, Sanders M. M.およびMcKnight G.S. Endocrinology 116巻398-405頁, 1985)12穴細胞培養プレートに40-60%の密度になるよう等量ずつ播種した。採取後48時間以内に以下のベクターの組み合わせで各々FuGENE6を1.5μl用いてトランスフェクション
を行なった。ベクターpBSはトランスフェクションに用いるDNA量を同一にする為のコントロールベクターとして使用した。
【0061】
【表4】

【0062】
トランスフェクションの3日後、それぞれの培養細胞上清を回収し15μlを非還元条件
下でポリアクリルアミド電気泳動し、PVDF膜に転写後、抗ヒトIgGFc抗体(I-124)を用いたウェスタンブロッティング法により培養上清中のヒトIgGを測定した。図6に示すよう
にベクターAI111とベクターOVA2.8-Creを導入したニワトリ卵管由来初代培養細胞培養上
清中に抗ヒトIgGFc抗体に認識される移動度150kDa以上のほぼ単一のシグナルを認めた(
図5、レーン2)。一方で、ベクターAI111とベクターpBS、あるいはベクターOVA2.8-Hc+LcとベクターpBSを導入した細胞の培養上清中には殆どシグナルを認めなかった(図6、
レーン1および3)。この結果から、ベクターAI111とベクターOVA2.8-Creの組み合わせ
は、鳥類卵管細胞に対しても、抗体の発現に対して効果を有することが判明した。
【0063】
培養上清中のヒトIgG抗体濃度のELISA法による定量的な比較解析
カーボネートコートバッファー(0.025M sodium bicarbonate, 0.025M sodium carbonate)100μlに抗ヒトIgGFc抗体(I-124)100ngを懸濁し、96-well Nunc-Immuno plate(Nalge-Nunc International、Roskilde、Denmark)に4℃で一夜吸着させた。洗浄バッファー(20mM Tris-HCl(pH7.6), 150mM NaCl, 0.05% Tween 20)250μlで2回洗浄後、ブロッ
キング溶液(5% ウシ血清アルブミン/洗浄バッファー)250μlを加え室温で1時間静置後、
ブロッキング溶液を廃棄し、洗浄バッファー250μlで1回洗浄後、培養上清ならびに培養
液にヒトモノクローナル抗体(ハーセプチン、中外製薬)を20μg/mlから0.256ng/mlまで培地で1/5倍ずつ連続希釈したものをそれぞれ100μlずつ加え、室温で2時間インキュベートした。液を捨て、洗浄バッファー250μlで3回洗浄後、ブロッキング溶液にて10000倍希
釈したPeroxidase-conjugated AffiniPure Goat Anti-Human IgG(H+L)(109-035-003, Jackson Immuno Research, PA)を100μlずつ加え室温で2時間インキュベートした。液を捨て、洗浄バッファー250μlで3回洗浄後、TMB One Solution(Promega, WI)100μlを添加し5分後1M-HClを加え、マイクロプレートリーダー(Molecular Devices, CA)を用い、450nMでの吸光度を計測した。
【0064】
結果を図7に示す。この例ではベクターAI111とベクターOVA2.8-Creを導入した場合と
ベクターOVA2.8-Hc+Lcを導入した場合培養上清1mlあたりに含まれるヒトイムノグロブリ
ン量はそれぞれ約20ngと0.5ngと推定され、本発明により従来提唱されていた方法の40
倍以上の外来の抗体タンパク質発現誘導能を認めた。
【産業上の利用可能性】
【0065】
本発明によって、設備、原料、生産管理等の生産コストの削減などの点で、医療用抗体生産の効率化が期待できる。また本発明の方法を、鳥類個体に応用することで、卵中に抗体を蓄積させることが可能となる。
【特許請求の範囲】
【請求項1】
鳥類卵管細胞を用いたタンパク質の発現方法であって、
(i)リコンビナーゼ認識配列によって挟まれたスタッファー遺伝子配列の上流側に構成
的発現プロモーター配列が配置され、該スタッファー遺伝子の下流側に抗体をコードする遺伝子配列が配置された少なくとも1つの遺伝子配列カセットを含むベクター、および(ii)鳥類卵管細胞に特異的なプロモーター、および該プロモーターの下流に配置されたリコンビナーゼをコードする遺伝子配列を含むベクターを鳥類卵管細胞に導入する工程を含む、タンパク質の発現方法。
【請求項2】
前記のリコンビナーゼが、Creリコンビナーゼであることを特徴とする、請求項1に記
載のタンパク質の発現方法。
【請求項3】
(i)リコンビナーゼ認識配列に挟まれたスタッファー遺伝子配列の上流側に構成的発
現プロモーター配列が配置され、該スタッファー遺伝子の下流側に抗体をコードする遺伝子配列が配置された少なくとも1つの遺伝子配列カセットを含むベクター、および(ii)鳥類卵管細胞に特異的なプロモーター、および該プロモーターの下流に配置されたリコンビナーゼをコードする遺伝子配列を含むベクターが導入された鳥類卵管細胞。
【請求項4】
前記のリコンビナーゼが、Creリコンビナーゼであることを特徴とする請求項3に記載
の鳥類卵管細胞。
【請求項1】
鳥類卵管細胞を用いたタンパク質の発現方法であって、
(i)リコンビナーゼ認識配列によって挟まれたスタッファー遺伝子配列の上流側に構成
的発現プロモーター配列が配置され、該スタッファー遺伝子の下流側に抗体をコードする遺伝子配列が配置された少なくとも1つの遺伝子配列カセットを含むベクター、および(ii)鳥類卵管細胞に特異的なプロモーター、および該プロモーターの下流に配置されたリコンビナーゼをコードする遺伝子配列を含むベクターを鳥類卵管細胞に導入する工程を含む、タンパク質の発現方法。
【請求項2】
前記のリコンビナーゼが、Creリコンビナーゼであることを特徴とする、請求項1に記
載のタンパク質の発現方法。
【請求項3】
(i)リコンビナーゼ認識配列に挟まれたスタッファー遺伝子配列の上流側に構成的発
現プロモーター配列が配置され、該スタッファー遺伝子の下流側に抗体をコードする遺伝子配列が配置された少なくとも1つの遺伝子配列カセットを含むベクター、および(ii)鳥類卵管細胞に特異的なプロモーター、および該プロモーターの下流に配置されたリコンビナーゼをコードする遺伝子配列を含むベクターが導入された鳥類卵管細胞。
【請求項4】
前記のリコンビナーゼが、Creリコンビナーゼであることを特徴とする請求項3に記載
の鳥類卵管細胞。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2011−10598(P2011−10598A)
【公開日】平成23年1月20日(2011.1.20)
【国際特許分類】
【出願番号】特願2009−157413(P2009−157413)
【出願日】平成21年7月2日(2009.7.2)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成23年1月20日(2011.1.20)
【国際特許分類】
【出願日】平成21年7月2日(2009.7.2)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

