麹のタンパク質分解酵素活性測定用の基質、タンパク質分解酵素活性測定方法及びキット
【課題】醸造物のアミノ酸は品質に重要であるため、その生成に関与する麹の総合タンパク質分解酵素活性を正確に反映する基質、タンパク質分解酵素活性測定方法及びキットを開発する必要があった。
【解決手段】清酒や焼酎の醸造原料である米、米糠及び白糠の米タンパク質を、乳酸抽出し等電点沈殿で米グルテリンを主成分として取得して、タンパク質分解酵素活性測定用の基質とする。米グルテリンを主成分とする基質を、麹のタンパク質分解酵素活性測定方法及びキットに用いる。
【解決手段】清酒や焼酎の醸造原料である米、米糠及び白糠の米タンパク質を、乳酸抽出し等電点沈殿で米グルテリンを主成分として取得して、タンパク質分解酵素活性測定用の基質とする。米グルテリンを主成分とする基質を、麹のタンパク質分解酵素活性測定方法及びキットに用いる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、米を原料とする清酒、焼酎、味噌、食酢等の醸造物の製造に使用される麹のタンパク質分解酵素活性測定用の基質、タンパク質分解酵素活性測定方法及びキットに関する。
【背景技術】
【0002】
清酒、焼酎(米焼酎、芋焼酎、麦焼酎、蕎麦焼酎など)、味噌、食酢(米酢)などの米を原料とする醸造物の製造においては麹(コウジカビ属:Aspergillus)が使用され、麹のタンパク質分解酵素によって原料タンパク質からアミノ酸やペプチドが生成し、これらのアミノ酸やペプチドは呈味性成分として重要な成分となる。このためタンパク質分解酵素活性は、醸造物の品質に大きく影響するため、使用する麹のタンパク質分解酵素活性が古くから測定されている。
【0003】
麹のタンパク質分解酵素は、高分子タンパク質分子鎖の中間のペプチド結合を分解して低分子の可溶性タンパク質やペプチドにするエンドプロテアーゼと、タンパク質の末端から1個づつアミノ酸を分解するエキソプロテアーゼの2つに大別される。エキソプロテアーゼにはタンパク質のC末端から分解するカルボキシペプチダーゼとN末端から分解するアミノペプチダーゼの2種類が存在する。
そこで、麹のタンパク質分解酵素活性は清酒や焼酎の醸造では醪が酸性であることから、例えば、酸性に最適pHを持つエンドプロテアーゼである酸性プロテアーゼ(APase)の活性に対する基質としてミルクカゼインを用いて測定する方法が下記非特許文献1に記載されている。また、エキソプロテアーゼである酸性カルボキシペプチダーゼ(ACPase)の活性に対する基質としてCbz−Glu−Tyrを用いて測定する方法が下記特許文献1に記載されている。
【0004】
また、米タンパク質分解酵素活性測定の基質として抽出した米タンパク質を用いることも考えられる。米タンパク質は易消化性タンパク質のグルテリン及びグロブリン、並びに難消化性タンパク質のプロラミンに分類され、希薄な酸あるいはアルカリ溶液で溶解するタンパク質をグルテリン、塩溶液で溶解するタンパク質をグロブリン、及びアルコール溶液で溶解するタンパク質をプロラミンと定義される。
例えば、原料米を蒸きょうして希酸処理して米グルテリンを抽出する方法が下記特許文献2に記載されているが、アミノ酸等の夾雑物が存在しタンパク質分解酵素活性測定用の基質としては不適当であった。
【特許文献1】特許3667470号公報
【特許文献2】特許3146344号公報
【非特許文献1】注釈編集委員会編「第四回改正国税庁所定分析法注解」、日本醸造協会、1993年
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかしながら、非特許文献1及び特許文献1の方法では、基質が米タンパク質と異なるため麹のタンパク質分解酵素の活性が醸造時のアミノ酸生成量に反映していなかった。特に、ACPase活性の基質は一個の合成ペプチドであってタンパク質のC末端からの分解活性のみを示しており、N末端からの分解活性を無視しているという問題点があった。
また、特許文献2の方法では、米抽出物にペプチド、アミノ酸、糖類、無機塩、フィチン酸といった夾雑物が存在し、麹のタンパク質分解酵素活性を正確に測定するための基質としては問題があった。
このように、品質に重要である醸造物のアミノ酸生成量と麹の総合タンパク質分解酵素活性との相関を正確に反映する基質、タンパク質分解酵素活性測定方法及びキットが存在しなかった。
【0006】
本発明は、斯かる課題に鑑みてなされたもので、上記課題を解決できる麹のタンパク質分解酵素活性測定用の基質、タンパク質分解酵素活性測定方法及びキットを提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明は上記課題を解決すべく、以下に掲げる構成とした。
本発明のタンパク質分解酵素活性測定用基質では、米グルテリンが主成分であることを特徴とする。
本発明のタンパク質分解酵素活性測定用基質の製造方法では、米グルテリンは、米、米糠若しくは白糠から酸抽出し、pH6.4〜10.0の等電点沈殿で取得した米タンパク質であることを特徴とする。
本発明のタンパク質分解酵素活性測定用基質の製造方法では、酸抽出に、乳酸を用いることを特徴とする。
本発明のタンパク質分解酵素活性測定用基質の製造方法では、米タンパク質は粉末化されたことを特徴とする。
本発明のタンパク質分解酵素活性測定用基質では、上記タンパク質分解酵素活性測定用基質の製造方法から製造されたことを特徴とする。
本発明の麹のタンパク質分解酵素活性測定方法では、上記タンパク質分解酵素活性測定用の基質を調整する基質調整ステップと、麹酵素液を調整する酵素液調整ステップと、基質調整ステップで調整された基質と酵素液調整ステップで調整された酵素液とを反応させる酵素反応ステップとを備えることを特徴とする。
本発明の麹のタンパク質分解酵素活性測定方法では、酵素反応ステップは、pH3〜5で行うことを特徴とする。
本発明の麹のタンパク質分解酵素活性測定キットでは、上記タンパク質分解酵素活性測定用の基質を調整する基質調整手段と、麹酵素液を調整する酵素液調整手段と、基質調整手段で調整された基質と酵素液調整手段で調整された酵素液とを反応させる酵素反応手段とを備えることを特徴とする。
【発明の効果】
【0008】
本発明によれば、醸造の原料である米から抽出されたタンパク質であるグルテリンを主成分とする基質をタンパク質分解酵素活性測定に用いることにより、麹のタンパク質分解酵素活性と醸造物のアミノ酸生成量との相関を正確に反映する測定を行うことが可能になる。
【発明を実施するための最良の形態】
【0009】
<米グルテリン基質の調整>
実施の形態1.
米グルテリンは米、米糠若しくは白糠に対して酸を加えて攪拌しpH3.0以下で抽出する。好ましくは、米グルテリンは米、米糠若しくは白糠に対して0.05〜1Mの乳酸(pH2.1〜2.8)を加えて攪拌し、少なくとも1時間、好ましくは2〜3時間静置して抽出する。そして、ろ過若しくは遠心分離(1,000〜15,000rpm、1〜30分間)により抽出液を取得した後、米グルテリンの等電点であるpH6.4〜10.0で中和して、米グルテリンを主成分とする米タンパク質を等電点沈殿させる。なお、主成分とは、SDS−PAGE等を用いてタンパク質を分離した場合に、米グルテリンが全体の米タンパク質の中で主要な構成成分であることを意味する。そして、遠心分離(1,000〜15,000rpm、1〜30分間)で沈殿物を取得し、これに蒸留水を加えて沈殿に付着する混雑物を洗い出し、再度の遠心分離で沈殿物を回収する。この洗浄操作を1〜3回行った後、沈殿物を真空凍結乾燥して米グルテリン粉末を取得する。
【0010】
以下に実施例を挙げて本発明の米グルテリン基質の調整を具体的に説明する。本発明は以下の実施例に限定されるものでなく、本発明の技術分野において通常の変更をすることができる。
【0011】
実施例1.米グルテリンの等電点の検討
泳動用試料は、原料米一粒を1.5mlのマイクロチューブに取り、膨潤/サンプルバッファー(Bio−rad)を700μl加えて3時間室温でゆっくりと攪拌しながら溶解し、その後13,000rpm、10分間の遠心分離を行い上澄みを回収して調整した。
一次元泳動はプロティアンIEFセル(Bio−Rad)を用いた。IPG Ready Strip,pH3.0〜10.0,11cm(Bio−Rad)(IPGストリップ)をフォーカシングトレイにセットし、泳動用試料185μlを加え、50Vで20時間の条件で膨潤した。次いで8,000Vにて25,000V/時間となるように泳動した。
二次元泳動はCriterionセル(Bio−Rad)を用いた。IPGストリップを平衡化バッファーI,平衡化バッファーII(Bio−Rad)にて処理した後、200Vで60分間泳動した。
ゲルの染色はBio−Safe CBB G−250(Bio−Rad)により行った。ゲルの解析はGS−800 Calibrated Densitometer(Bio−Rad)にてゲルイメージを取り込んだ後、二次元電気泳動ゲルイメージ解析ソフトPDQuest(Bio−Rad)を用いて解析した。
【0012】
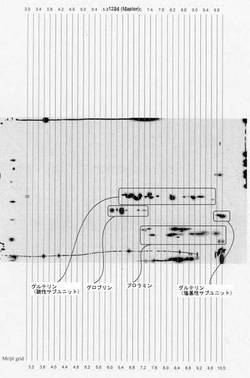
原料米タンパク質の等電点を二次元電気泳動で調べた結果を図1に示す。この結果よりグルテリンの酸性サブユニットはpH6.4〜9.7付近、グルテリンの塩基性サブユニットはpH9.7〜10.0付近、グロブリンはpH6.0〜7.3付近、及びプロラミンはpH7.1〜10.0付近に等電点を持つことが明らかになった。
【0013】
実施例2.米グルテリン基質の調整条件の検討
米タンパク質は、市販されていないことから基質の調整を検討した。まず、白米粉末(山田錦55%精米)からのタンパク質抽出条件を検討した。白米粉末は白米をミルで数分間粉砕して調整した。白米粉末1gに各種濃度の乳酸溶液10mlを加えて1時間静置し、ろ液を0.45μmのフィルターでろ過して、280nmの吸光度若しくはブラッドフォード法によるタンパク質の定量、及び抽出液のpH測定を行った。
米からの米タンパク質の抽出条件を検討した結果を表1に示す。乳酸濃度が0.05MになるとpHが2.8となり抽出BSA換算タンパク質量が2mg/mlを超えた。この濃度は、清酒醸造において酒母仕込みの際に使用する乳酸使用量(仕込水100リットルに乳酸500〜700ml使用)とほぼ一致し醸造時の条件を反映するものであった。また、乳酸濃度をさらに高めると抽出タンパク質量がさらに増加した。
【0014】
【表1】

【0015】
次に、抽出時間の影響を調べた結果を表2に示す。抽出時間は2時間で最大になった。
【0016】
【表2】

【0017】
次に、抽出方法として静置と振盪の比較をした結果を表3に示す。静置と振盪の両者に大きな違いはなく静置で十分であることが分かった。
【表3】

【0018】
次に、原料米品種の違いによる抽出タンパク質量の違いを調べた結果を表4に示す。品種により抽出タンパク質量にかなりの違いが認められた。
【表4】

【0019】
次に、白米粉末から0.1Mの乳酸で抽出した米タンパク質溶液の等電点沈殿を行った。抽出したタンパク質溶液は1NのNaOHで中和するとpH6.0付近で沈殿が観察され始め、pHをさらにpH9.0にかけて増加するとすぐに大量の沈殿が観察された。これよりpH6.5付近でほぼ全ての米グルテリンが共沈して沈殿すると考えられた。
【0020】
次に、白米粉末から抽出した米タンパク質をSDS−PAGEで調べた結果を図2に示す。SDS−PAGEのアクリルアミド濃度は15%、及び電気泳動後の染色はCBB−R250を用いて行った。レーンMはマーカータンパク質(GEライフサイエンス社)、レーン1は8Mの尿素を用いて抽出した米タンパク質、並びにレーン2は上述の0.1Mの乳酸を用いて抽出し、pH6.5付近で等電点沈殿して、及び凍結乾燥して粉末化した米タンパク質を試料とした。レーン2の結果より、乳酸抽出を行うと、ほぼ純粋に米グルテリンの酸性サブユニット及び塩基性サブユニットが主成分として抽出された。
【0021】
グルテリンは弱酸あるいは弱塩基性で溶解し、グロブリンは塩溶液で溶解し、プロラミンはアルコール溶液で溶解するタンパク質と定義されているため、まず本発明では酸抽出によって米グルテリンのみを溶解した。次に、pH6.5付近での等電点沈殿により米グルテリン以外の物質であって主にアミノ酸、糖類、無機塩、フィチン酸等を除いて最終的に米グルテリンのみを主成分として取得することができた(図2、レーン2)。これより本実施例で取得した凍結乾燥して粉末化した米グルテリンを用いて麹のタンパク質分解酵素活性用の基質とした。
【0022】
実施例3.山田錦55%精米を用いた米グルテリン基質の調整例
山田錦55%精米の白米粉末1kgに0.1Mの乳酸5リットルを加えて、室温で2時間静置し、遠心分離(3,000rpm、15分間)で抽出液を取得した。そして、1NのNaOHで中和し、pH6前後で等電点沈殿を行った。そして、遠心分離(5,000rpm、15分間)を行い、沈殿固形物を少量の蒸留水に懸濁し、付着物を洗浄した。この操作を2回繰り返した。さらに、遠心分離(5,000rpm、15分間)を行い、沈殿固形物を少量の蒸留水に懸濁し、凍結乾燥した。最終的に、山田錦55%精米の白米粉末1kgから米グルテリン粉末7.6gが得られた。米グルテリン基質は、米グルテリン粉末200mgを精秤し、これに10mMの乳酸溶液50ml、防腐剤として安息香酸20mgを加えて加熱溶解して調整した。基質濃度は4mg/mlとし、調整した基質溶液は冷蔵保存した。
【0023】
<米グルテリンを基質とした総合タンパク質分解酵素活性測定>
実施の形態2.
米グルテリンを基質とした総合タンパク質分解酵素活性測定方法を行う。図3は、本実施の形態に係る麹のタンパク質分解酵素活性測定のプロセス図である。
【0024】
(1)基質調整ステップS1:米グルテリンを主成分とする基質の調整
実施の形態1.に記載した米グルテリン基質と同様の調整を行う。
【0025】
(2)酵素液調整ステップS2:麹由来のタンパク質分解酵素の調整
国税庁所定分析法(参照URL:http://www.nta.go.jp/shiraberu/zeiho−kaishaku/tsutatsu/kobetsu/sonota/070622/pdf/211.pdf)の静置抽出法に従って酵素液の調製を行う。具体的には、固体麹10gに塩化ナトリウム溶液50mlを加え、低温室(5℃以下)で一夜、又は室温(15〜20℃)で3時間時々振り混ぜながら浸出した後ろ過する。そのろ液10mlを透析膜に入れ、0.01M酢酸緩衝液に対して低温で一夜透析した後、水で20mlとし麹酵素液とする。
【0026】
(3)酵素反応ステップS3:基質調整ステップS1で調整された基質と酵素液調整ステップS2で調整された酵素液との反応
基質調整ステップS1で調整した米グルテリン基質に緩衝液、好ましくは乳酸緩衝液pH3.0〜5.0を加えて、30〜50℃、好ましくは40℃で予熱する。そして、透析済の麹酵素液を添加して酵素反応を開始する。酵素反応は5〜40分間、好ましくは10分間、30〜50℃、好ましくは40℃で行い、反応停止液としてトリクロロ酢酸(TCA)を添加して反応を停止する。そして、ろ過して反応液を得る。
基質ブランク溶液は、上述の麹酵素液を蒸留水に置換して調整する。酵素ブランク溶液は、上述の米グルテリン基質溶液を蒸留水に置換して調整する。
【0027】
(4)測定ステップS4:酵素反応ステップで得られたアミノ酸量を測定
上述の反応液、基質ブランク溶液、酵素ブランク溶液にニンヒドリン試薬を加えて混合し、80〜100℃で呈色反応を行う。その後、570nmで吸光度測定する。
検量線は、標準溶液としてアルギニン溶液にニンヒドリン試薬を加えて呈色反応を行い、及び対照溶液として蒸留水にニンヒドリン試薬を加えて呈色反応を行い作成する。
なお、総合タンパク質分解酵素活性は、60分間に1mgのアルギニンを生成する活性を1単位とする。計算式は以下に示す。
【0028】
【数1】

【0029】
なお、基質調整ステップS1では、米タンパク質の抽出は乳酸酸性下で行うが、酸性条件を作ることができればよく任意の酸を用いることができる。例えば、乳酸、リンゴ酸、酒石酸、クエン酸、コハク酸、アジピン酸、フマル酸、グルコン酸、リン酸、酢酸、塩酸、硫酸、硝酸などの酸を用いて溶液を酸性にしてもよい。好ましくは米タンパク質の抽出は、0.05M以上の濃度の乳酸を用いてpH3以下で行う。この場合、米から抽出されたタンパク質は、米グルテリンが主成分となる。
【0030】
また、基質調整ステップS1では、米タンパク質の沈殿は米グルテリンの等電点(pH6.4〜10.0)で等電点沈殿で行うが、米グルテリンを主成分とする米タンパク質を回収することができれば、当業者が用いることができる任意のタンパク質沈殿法及び濃縮法も用いることができる。例えば、硫安沈殿、限外ろ過、電気泳動、密度勾配遠心法、分子ふるい、イオン交換クロマトグラフィー、アフィニティークロマトグラフィー、化学物質による沈殿等の方法がある。
【0031】
また、米グリテリンは、全長もしくは一部を発現させた組換えタンパク質でもよい。組換え米グルテリンタンパク質の作製は、当業者が用いることのできる一般的な手法を用いて行い、米グルテリンは、遺伝子配列は、例えばGenbank/DDBJ/EMBLデータベースから入手することが可能である。米グルテリンは多重遺伝子ファミリー群を形成する米貯蔵蛋白質であり、例えば米グルテリン−1は、http://www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?db=protein&id=556399から遺伝子配列を取得することが可能である。米グルテリンタンパク質をコードする全長若しくは一部長のcDNAをベクターに組み込み、大腸菌、酵母、培養細胞などの宿主細胞で発現させて回収してもよい。回収には、上述した任意のタンパク質沈殿法及び濃縮法を用いることができる。
【0032】
なお、酵素液調整ステップS2では、麹由来のタンパク質分解酵素の調整を国税庁所定分析法に従って行うが、麹のタンパク質分解酵素が取得できれば任意の方法も用いることができる。例えば、ホモジナイズ抽出、界面活性剤を用いた化学処理等を用いてもよい。
【0033】
なお、酵素反応ステップS3では、pHの調整は乳酸(pH3.0〜5.0)を用いて行うのが好ましいが、例えば国税庁所定分析法ではアミラーゼ活性には酢酸緩衝液、タンパク質分解酵素にはクエン酸緩衝液(マッキルベン緩衝液)を採用しており、これらを用いてもよい。また、酵素反応は、酵素濃度、基質濃度、阻害剤や活性化剤の濃度、pH、温度、種々の塩の濃度などに影響を受けるが、酵素活性が最大となる条件及び実際の醸造時の条件を加味して行ってもよい。
また、酵素反応ステップS3では、反応停止液にTCAを用いているが、例えば過塩素酸(PCA)等を用いることも可能である。
【0034】
なお、測定ステップS4では、全てのアミノ酸に対して感度が高く、タンパク質に対して感度が低い定量法であるニンヒドリン法を用いるが、当業者が使用できるアミノ酸を定量する方法を用いることができる。例えば、蛍光試薬を用いて行う方法がある。
また、総合タンパク質分解酵素活性は、60分間に1mgのアルギニンを生成する活性を1単位としたが、当業者が使用できる任意の活性単位に変更することもできる。例えば、チロシンやプロリンといった単一のアミノ酸等を生成する活性を1単位としても良いし、複合したアミノ酸を生成する活性を1単位としてもよい。
【0035】
以下に実施例を挙げて本発明の米グルテリンを基質とした総合タンパク質分解酵素活性測定を具体的に説明する。本発明は以下の実施例に限定されるものでなく、本発明の技術分野において通常の変更をすることができる。
【0036】
実施例4.米グルテリンを基質とした総合タンパク質分解酵素活性測定条件の検討
米グルテリン基質を用いて、酵素反応に及ぼすpHの影響を調べた結果を図4に示す。pHは、0.1Mのマイキウルベイン緩衝液を使用して調整した。縦軸は、ニンヒドリン反応の呈色値をアルギニン換算値で表した。
ミルクカゼイン及びCbz−Glu−Tyrを基質とした従来法の場合には最適反応pHは3.0であったが、米グルテリンを基質とした場合には最適反応pHは4.0となり清酒醸造のpH範囲3.5〜4.5と一致した。この結果より、米グルテリンを基質として麹のタンパク質分解酵素活性を測定する場合は、最適pH4前後のpH範囲は3.0〜5.0の範囲で行うのが適当であると判断した。
ミルクカゼインを基質とした従来法は、所定時間反応させた後に0.4Mのトリクロロ酢酸(TCA)を加えて反応を停止し、及び未反応の基質を沈殿させて、ろ過して得た反応液中のTCA可溶性タンパク質の生成量を測定して酵素活性とする。本実施例も従来法と同様に、基質をミルクカゼインに変えて米グルテリンを使用し、所定時間反応させた後にTCA添加により未反応の基質を沈殿除去し、ろ液中のアミノ酸量を測定して総合タンパク質分解酵素活性を測定した。アミノ酸の定量は、ニンヒドリン法を用いた。
酵素反応に及ぼす温度の影響を調べた結果を表5に示す。アミノ酸生成速度(μgアルギニン/分)は、45℃で最大となった。この結果及び酵素の失活の影響も鑑みて40℃が測定温度として適当であると判断した。
【0037】
【表5】

【0038】
米タンパク質の酵素分解パターンを図5に示す。横軸は酵素反応時間、及び縦軸はニンヒドリン呈色反応によるアミノ酸量(μgアルギニン)を表す。アミノ酸量は、40分まで時間に比例して直線的に増加した。この結果から反応時間は10分間を適当であると判断した。
【0039】
実施例5.米グルテリンを基質とした総合タンパク質分解酵素活性測定
(1)基質調整ステップS1:米グルテリンを主成分とする基質の調整
白米粉末100gを0.1Mの乳酸250mlで2時間抽出し、東洋ろ紙No.5Aでろ過した。1NのNaOH溶液で中性(pH6.5)に調整し等電点沈殿を行った。遠心分離(3,000rpm,15分間)して沈殿を集め、蒸留水を用いて付着物を洗浄し、再度遠心分離を行い沈殿を得た。この沈殿を凍結乾燥して米グルテリンとした。そして、米グルテリン粉末0.2gを秤量し、10mMの乳酸を50ml加えて加熱溶解し基質溶液とした。
(2)酵素液調整ステップS2:麹由来のタンパク質分解酵素の調整
国税庁所定分析法に従って抽出及び透析を行った。麹10gを秤量し、麹抽出液50mlを加えて室温で3時間抽出した。東洋ろ紙No.5Aでろ過し、ろ液20mlを透析チューブにとり、20mMの酢酸緩衝液(pH5.0)に対して一夜透析した。透析液を40mlに定容し酵素液とした。
(3)酵素反応ステップS3:基質調整ステップS1で調整された基質と酵素液調整ステップS2で調整された酵素液との反応
米グルテリン溶液1.0ml(米グルテリン4mg)に0.1Mの乳酸緩衝液(pH4.0)を1.0ml加え、40℃で2分間予熱した。そして、透析済の麹酵素液を0.2ml添加して反応を開始した。10分間反応後に0.4MのTCA溶液を3.0ml添加して反応を停止した。ろ過して反応液を得た。
なお、基質ブランク溶液は、米グルテリン溶液1.0mlに0.1Mの乳酸緩衝液(pH4.0)1.0ml、蒸留水0.2ml及び0.4MのTCA溶液3.0mlを加えて、ろ過して作成した。酵素ブランク溶液は、蒸留水1.0ml、0.1Mの乳酸緩衝液(pH4.0)1.0mlに酵素液0.2mlを加えて、直ちに0.4MのTCA溶液3.0mlを加えて反応を止め、ろ過せずに作成した。
(4)測定ステップS4:酵素反応ステップで得られたアミノ酸量の測定
反応液1.0ml(基質ブランク溶液、酵素ブランク溶液、対照溶液、標準溶液)にニンヒドリン試薬(日立アミノ酸分析試薬)1.0mlを加えて混合し、沸騰水中で15分間呈色反応を行った。その後、60%のエタノール5ml加えて攪拌し、570nmで吸光度測定した。
検量線は、標準溶液としてアルギニン(50μg/ml)溶液1.0mlにニンヒドリン1.0mlを加えて呈色反応を行い、及び対照溶液として蒸留水1.0mlにニンヒドリン1.0mlを加えて呈色反応を行い作成した。
【0040】
実施例6.米グルテリンを基質とした酵素活性と蒸米消化液のアミノ酸量との相関
33個の清酒麹の酵素活性について、本実施形態の米グルテリンを基質としたタンパク質分解酵素活性測定(本法)及び国税庁所定分析法の合成ペプチドCbz−Glu−Tyrを基質としたタンパク質分解酵素活性測定(従来法)とを比較した結果を図6に示す。横軸に従来法による酸性カルボキシペプチダーゼ活性(ACPase)を、縦軸に本実施形態の米グルテリンを基質とした総合ペプチダーゼ活性(総合タンパク質分解酵素活性)を示した。このように従来法で同一の活性であっても、本法の米グルテリンを基質とした総合タンパク質分解酵素活性では大きな違いが認められた。
次に、麹米5品種を用いて3回製麹して造った15麹を用いて酵素抽出液を調整し、5品種の蒸米の消化試験を実施した。消化試験は実際の製造場の醪の条件を考慮して、温度15℃で14日間行った。蒸米消化液中のアミノ酸量とタンパク質分解酵素活性との相関を表6に示すが、従来法ではほとんど相関が認められなかったアミノ酸が多かったが、本法の米グルテリンを基質としたタンパク質分解酵素活性では全アミノ酸と危険率5%で相関が認められ、個々のアミノ酸では清酒の呈味に関係するアラニン(r=0.653**)、グルタミン酸(r=0.766***)、アスパラギン酸(r=0.795***)、アルギニン(r=0.711**)は、高い相関関係が認められた。またスポーツ飲料では重要なアミノ酸とされている分岐アミノ酸(BCAA)は従来法では相関が認められなかったが、本法では酵素活性と高い相関関係(r=0.800***)が認められた。必須アミノ酸の存在量は、従来法では相関が認められなかったが、本法では酵素活性と高い相関係数(r=0.778***)が認められた。
【0041】
【表6】

【0042】
以上の結果より、米グルテリンを基質としたタンパク質分解酵素活性は、蒸米タンパク質の分解に関わる数多くの酵素の活性を総合して示し、醸造時におけるアミノ酸生成量と高い相関関係を持つことが明らかとなった。
【0043】
実施の形態3.タンパク質分解酵素活性測定キット
図7は、本実施の形態に係る麹のタンパク質分解酵素活性測定キットの概念図である。
A.試薬キット(50回分)
基質1: 4mg/ml 米グルテリン溶液 100ml
緩衝液2: 0.1M 乳酸緩衝液(pH4.0) 100ml
反応停止液3: 0.4M TCA溶液 300ml
発色試薬4: ニンヒドリン溶液 100ml
標準溶液5: 50μg/ml アルギニン溶液
B.反応操作
(i)1mlの基質1、1mlの緩衝液2、及び0.2mlの供試酵素液6を混和し、40℃で10分間反応させて反応液7を得る。また、基質ブランク液8及び酵素ブランク液9は、各々基質1及び供試酵素液6と同量の蒸留水を加えて作成する。
(ii)反応液7、基質ブランク液8、及び酵素ブランク液9に対して、3mlの反応停止液3を混和し反応を停止させる。その後、ろ過しろ液10を得る。
(iii)1mlのろ液10に対して、1mlの発色試薬4を加えて混和し、80℃〜100℃で15分間反応させて測定試料11を得る。
(iv)測定試料11を570nmの吸光度で分光光度計を用いて測定する。
(v)別途、1mlの標準溶液5と1mlの発色試薬4を混和し、570nmの吸光度で分光光度計を用いて測定し検量線を作成する。また、1mlの蒸留水である対照溶液12と1mlの発色試薬4を混和しバックグラウンドとする。
【0044】
このように、麹のタンパク質分解酵素活性測定にあたって、予め使用する試薬が調整されたキットを用いることにより、活性測定を簡便且つ容易に再現性高く行うことが可能となる。
なお、当業者が技術的に用いることができる範囲でスケールを変更することが可能である。例えば、より小スケールの場合、吸光度の測定は96穴プレート等を用いてプレートリーダーで行ってもよい。また、各段階における操作は、装置を用いて自動測定としてもよい。
【0045】
上述のように、本発明は従来のタンパク質分解酵素活性測定法に存する問題点を克服した。すなわち、従来法では現実の醸造現場でのアミノ酸生成量に活性が反映していなかったが、本発明による麹のタンパク質分解酵素活性測定方法では、米タンパク質を基質とすることによって、麹の総合タンパク質分解酵素活性を品質に重要である醸造物のアミノ酸生成量と極めて高い相関を有する測定をすることが可能となった。特に、麹のアミラーゼ、プロテアーゼ活性の最適pHは4前後に集中しているため、清酒や焼酎の醸造条件であるpH3〜4.5の間でタンパク質分解酵素活性測定を行うことにより、実際の清酒や焼酎の醸造時の正確なタンパク質分解酵素活性を反映させることが可能となる。
【0046】
また、清酒醸造は乳酸を添加して乳酸酸性(pH3)として発酵を開始し、腐造乳酸菌の増殖を防いで安全醸造を図るが、本発明ではこのような条件下で、原料となる米、米糠、及び白糠から米グルテリンが希酸処理することで容易に抽出される。これは従来法と異なり、蒸きょう工程を必要とせずに行うことが可能なため、基質調整の手間を削減することもできる。
【0047】
また、蒸米タンパク質のうち主に米グルテリンが麹酵素で分解されてアミノ酸になることが相関分析より明らかとなっており、タンパク質分解酵素活性を阻害する要因となる可能性がある他の米タンパク質が混在するよりも、本発明の米グルテリンを主成分としてタンパク質分解酵素活性測定用の基質とする方が、正確にアミノ酸生成に関わる酵素活性を測定することができる。
【0048】
麹菌はゲノム解析より134個のタンパク質分解酵素遺伝子を有していると推論されており、醪における米タンパク質の酵素分解は多くの酵素の総合作用によると考えられ、麹の総合タンパク質分解酵素が測定可能である本発明は顕著な効果を有する。
【0049】
なお、本実施の形態は、清酒及び焼酎の醸造を対象として、麹のタンパク質分解酵素活性を測定するために米タンパク質を基質とする場合について記載したが、醸造に用いる原料としては味噌や醤油ならば大豆、焼酎ならば麦、芋、とうもろこし及び糖蜜等の任意の食品があげられ、麹のタンパク質分解酵素活性を測定するための基質は各食品に対応する抽出物を用いることができる。さらに、基質タンパク質としては、味噌や醤油等の大豆由来の食品であれば大豆タンパク質の主成分であるグリシニンを用いることができる。このように麹のタンパク質分解酵素活性測定の基質となるタンパク質は、用いる原料によって変更することができる。
【0050】
なお、上記実施の形態の構成、解析及び測定は例であって、本発明の趣旨を逸脱しない範囲で適宜変更することができることは言うまでもない。
【産業上の利用可能性】
【0051】
米グルテリンを基質とした本発明のタンパク質分解酵素活性測定は、清酒の醪に含まれる多数のタンパク質分解酵素の総合した活性を示し、清酒や焼酎の醸造における米タンパク質の分解量を正確に行うことができる。従って、清酒や焼酎の醸造をはじめとする醸造物の製造時における、アミノ酸生成量に反映するタンパク質分解酵素活性測定に用いることができ、本発明を利用することにより新しい麹菌の開発、製麹方法の改善、麹米品種の選定や新しい麹米の育種など醸造の現場において大きな貢献が期待される。
【図面の簡単な説明】
【0052】
【図1】全体の米タンパク質の二次元電気泳動を示した図。
【図2】白米粉末から抽出した米タンパク質のSDS−PAGEを示した図。
【図3】本実施形態のタンパク質分解酵素活性測定方法のプロセスフローを示した図。
【図4】本実施形態の酵素反応に及ぼすpHの影響を示した図。
【図5】本実施形態の米タンパク質の酵素分解パターンを示した図。
【図6】本実施形態のタンパク質分解酵素活性測定方法と国税庁所定分析法との比較図。
【図7】本実施形態のタンパク質分解酵素活性測定キットの概念図。
【技術分野】
【0001】
本発明は、米を原料とする清酒、焼酎、味噌、食酢等の醸造物の製造に使用される麹のタンパク質分解酵素活性測定用の基質、タンパク質分解酵素活性測定方法及びキットに関する。
【背景技術】
【0002】
清酒、焼酎(米焼酎、芋焼酎、麦焼酎、蕎麦焼酎など)、味噌、食酢(米酢)などの米を原料とする醸造物の製造においては麹(コウジカビ属:Aspergillus)が使用され、麹のタンパク質分解酵素によって原料タンパク質からアミノ酸やペプチドが生成し、これらのアミノ酸やペプチドは呈味性成分として重要な成分となる。このためタンパク質分解酵素活性は、醸造物の品質に大きく影響するため、使用する麹のタンパク質分解酵素活性が古くから測定されている。
【0003】
麹のタンパク質分解酵素は、高分子タンパク質分子鎖の中間のペプチド結合を分解して低分子の可溶性タンパク質やペプチドにするエンドプロテアーゼと、タンパク質の末端から1個づつアミノ酸を分解するエキソプロテアーゼの2つに大別される。エキソプロテアーゼにはタンパク質のC末端から分解するカルボキシペプチダーゼとN末端から分解するアミノペプチダーゼの2種類が存在する。
そこで、麹のタンパク質分解酵素活性は清酒や焼酎の醸造では醪が酸性であることから、例えば、酸性に最適pHを持つエンドプロテアーゼである酸性プロテアーゼ(APase)の活性に対する基質としてミルクカゼインを用いて測定する方法が下記非特許文献1に記載されている。また、エキソプロテアーゼである酸性カルボキシペプチダーゼ(ACPase)の活性に対する基質としてCbz−Glu−Tyrを用いて測定する方法が下記特許文献1に記載されている。
【0004】
また、米タンパク質分解酵素活性測定の基質として抽出した米タンパク質を用いることも考えられる。米タンパク質は易消化性タンパク質のグルテリン及びグロブリン、並びに難消化性タンパク質のプロラミンに分類され、希薄な酸あるいはアルカリ溶液で溶解するタンパク質をグルテリン、塩溶液で溶解するタンパク質をグロブリン、及びアルコール溶液で溶解するタンパク質をプロラミンと定義される。
例えば、原料米を蒸きょうして希酸処理して米グルテリンを抽出する方法が下記特許文献2に記載されているが、アミノ酸等の夾雑物が存在しタンパク質分解酵素活性測定用の基質としては不適当であった。
【特許文献1】特許3667470号公報
【特許文献2】特許3146344号公報
【非特許文献1】注釈編集委員会編「第四回改正国税庁所定分析法注解」、日本醸造協会、1993年
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかしながら、非特許文献1及び特許文献1の方法では、基質が米タンパク質と異なるため麹のタンパク質分解酵素の活性が醸造時のアミノ酸生成量に反映していなかった。特に、ACPase活性の基質は一個の合成ペプチドであってタンパク質のC末端からの分解活性のみを示しており、N末端からの分解活性を無視しているという問題点があった。
また、特許文献2の方法では、米抽出物にペプチド、アミノ酸、糖類、無機塩、フィチン酸といった夾雑物が存在し、麹のタンパク質分解酵素活性を正確に測定するための基質としては問題があった。
このように、品質に重要である醸造物のアミノ酸生成量と麹の総合タンパク質分解酵素活性との相関を正確に反映する基質、タンパク質分解酵素活性測定方法及びキットが存在しなかった。
【0006】
本発明は、斯かる課題に鑑みてなされたもので、上記課題を解決できる麹のタンパク質分解酵素活性測定用の基質、タンパク質分解酵素活性測定方法及びキットを提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明は上記課題を解決すべく、以下に掲げる構成とした。
本発明のタンパク質分解酵素活性測定用基質では、米グルテリンが主成分であることを特徴とする。
本発明のタンパク質分解酵素活性測定用基質の製造方法では、米グルテリンは、米、米糠若しくは白糠から酸抽出し、pH6.4〜10.0の等電点沈殿で取得した米タンパク質であることを特徴とする。
本発明のタンパク質分解酵素活性測定用基質の製造方法では、酸抽出に、乳酸を用いることを特徴とする。
本発明のタンパク質分解酵素活性測定用基質の製造方法では、米タンパク質は粉末化されたことを特徴とする。
本発明のタンパク質分解酵素活性測定用基質では、上記タンパク質分解酵素活性測定用基質の製造方法から製造されたことを特徴とする。
本発明の麹のタンパク質分解酵素活性測定方法では、上記タンパク質分解酵素活性測定用の基質を調整する基質調整ステップと、麹酵素液を調整する酵素液調整ステップと、基質調整ステップで調整された基質と酵素液調整ステップで調整された酵素液とを反応させる酵素反応ステップとを備えることを特徴とする。
本発明の麹のタンパク質分解酵素活性測定方法では、酵素反応ステップは、pH3〜5で行うことを特徴とする。
本発明の麹のタンパク質分解酵素活性測定キットでは、上記タンパク質分解酵素活性測定用の基質を調整する基質調整手段と、麹酵素液を調整する酵素液調整手段と、基質調整手段で調整された基質と酵素液調整手段で調整された酵素液とを反応させる酵素反応手段とを備えることを特徴とする。
【発明の効果】
【0008】
本発明によれば、醸造の原料である米から抽出されたタンパク質であるグルテリンを主成分とする基質をタンパク質分解酵素活性測定に用いることにより、麹のタンパク質分解酵素活性と醸造物のアミノ酸生成量との相関を正確に反映する測定を行うことが可能になる。
【発明を実施するための最良の形態】
【0009】
<米グルテリン基質の調整>
実施の形態1.
米グルテリンは米、米糠若しくは白糠に対して酸を加えて攪拌しpH3.0以下で抽出する。好ましくは、米グルテリンは米、米糠若しくは白糠に対して0.05〜1Mの乳酸(pH2.1〜2.8)を加えて攪拌し、少なくとも1時間、好ましくは2〜3時間静置して抽出する。そして、ろ過若しくは遠心分離(1,000〜15,000rpm、1〜30分間)により抽出液を取得した後、米グルテリンの等電点であるpH6.4〜10.0で中和して、米グルテリンを主成分とする米タンパク質を等電点沈殿させる。なお、主成分とは、SDS−PAGE等を用いてタンパク質を分離した場合に、米グルテリンが全体の米タンパク質の中で主要な構成成分であることを意味する。そして、遠心分離(1,000〜15,000rpm、1〜30分間)で沈殿物を取得し、これに蒸留水を加えて沈殿に付着する混雑物を洗い出し、再度の遠心分離で沈殿物を回収する。この洗浄操作を1〜3回行った後、沈殿物を真空凍結乾燥して米グルテリン粉末を取得する。
【0010】
以下に実施例を挙げて本発明の米グルテリン基質の調整を具体的に説明する。本発明は以下の実施例に限定されるものでなく、本発明の技術分野において通常の変更をすることができる。
【0011】
実施例1.米グルテリンの等電点の検討
泳動用試料は、原料米一粒を1.5mlのマイクロチューブに取り、膨潤/サンプルバッファー(Bio−rad)を700μl加えて3時間室温でゆっくりと攪拌しながら溶解し、その後13,000rpm、10分間の遠心分離を行い上澄みを回収して調整した。
一次元泳動はプロティアンIEFセル(Bio−Rad)を用いた。IPG Ready Strip,pH3.0〜10.0,11cm(Bio−Rad)(IPGストリップ)をフォーカシングトレイにセットし、泳動用試料185μlを加え、50Vで20時間の条件で膨潤した。次いで8,000Vにて25,000V/時間となるように泳動した。
二次元泳動はCriterionセル(Bio−Rad)を用いた。IPGストリップを平衡化バッファーI,平衡化バッファーII(Bio−Rad)にて処理した後、200Vで60分間泳動した。
ゲルの染色はBio−Safe CBB G−250(Bio−Rad)により行った。ゲルの解析はGS−800 Calibrated Densitometer(Bio−Rad)にてゲルイメージを取り込んだ後、二次元電気泳動ゲルイメージ解析ソフトPDQuest(Bio−Rad)を用いて解析した。
【0012】
原料米タンパク質の等電点を二次元電気泳動で調べた結果を図1に示す。この結果よりグルテリンの酸性サブユニットはpH6.4〜9.7付近、グルテリンの塩基性サブユニットはpH9.7〜10.0付近、グロブリンはpH6.0〜7.3付近、及びプロラミンはpH7.1〜10.0付近に等電点を持つことが明らかになった。
【0013】
実施例2.米グルテリン基質の調整条件の検討
米タンパク質は、市販されていないことから基質の調整を検討した。まず、白米粉末(山田錦55%精米)からのタンパク質抽出条件を検討した。白米粉末は白米をミルで数分間粉砕して調整した。白米粉末1gに各種濃度の乳酸溶液10mlを加えて1時間静置し、ろ液を0.45μmのフィルターでろ過して、280nmの吸光度若しくはブラッドフォード法によるタンパク質の定量、及び抽出液のpH測定を行った。
米からの米タンパク質の抽出条件を検討した結果を表1に示す。乳酸濃度が0.05MになるとpHが2.8となり抽出BSA換算タンパク質量が2mg/mlを超えた。この濃度は、清酒醸造において酒母仕込みの際に使用する乳酸使用量(仕込水100リットルに乳酸500〜700ml使用)とほぼ一致し醸造時の条件を反映するものであった。また、乳酸濃度をさらに高めると抽出タンパク質量がさらに増加した。
【0014】
【表1】

【0015】
次に、抽出時間の影響を調べた結果を表2に示す。抽出時間は2時間で最大になった。
【0016】
【表2】

【0017】
次に、抽出方法として静置と振盪の比較をした結果を表3に示す。静置と振盪の両者に大きな違いはなく静置で十分であることが分かった。
【表3】

【0018】
次に、原料米品種の違いによる抽出タンパク質量の違いを調べた結果を表4に示す。品種により抽出タンパク質量にかなりの違いが認められた。
【表4】

【0019】
次に、白米粉末から0.1Mの乳酸で抽出した米タンパク質溶液の等電点沈殿を行った。抽出したタンパク質溶液は1NのNaOHで中和するとpH6.0付近で沈殿が観察され始め、pHをさらにpH9.0にかけて増加するとすぐに大量の沈殿が観察された。これよりpH6.5付近でほぼ全ての米グルテリンが共沈して沈殿すると考えられた。
【0020】
次に、白米粉末から抽出した米タンパク質をSDS−PAGEで調べた結果を図2に示す。SDS−PAGEのアクリルアミド濃度は15%、及び電気泳動後の染色はCBB−R250を用いて行った。レーンMはマーカータンパク質(GEライフサイエンス社)、レーン1は8Mの尿素を用いて抽出した米タンパク質、並びにレーン2は上述の0.1Mの乳酸を用いて抽出し、pH6.5付近で等電点沈殿して、及び凍結乾燥して粉末化した米タンパク質を試料とした。レーン2の結果より、乳酸抽出を行うと、ほぼ純粋に米グルテリンの酸性サブユニット及び塩基性サブユニットが主成分として抽出された。
【0021】
グルテリンは弱酸あるいは弱塩基性で溶解し、グロブリンは塩溶液で溶解し、プロラミンはアルコール溶液で溶解するタンパク質と定義されているため、まず本発明では酸抽出によって米グルテリンのみを溶解した。次に、pH6.5付近での等電点沈殿により米グルテリン以外の物質であって主にアミノ酸、糖類、無機塩、フィチン酸等を除いて最終的に米グルテリンのみを主成分として取得することができた(図2、レーン2)。これより本実施例で取得した凍結乾燥して粉末化した米グルテリンを用いて麹のタンパク質分解酵素活性用の基質とした。
【0022】
実施例3.山田錦55%精米を用いた米グルテリン基質の調整例
山田錦55%精米の白米粉末1kgに0.1Mの乳酸5リットルを加えて、室温で2時間静置し、遠心分離(3,000rpm、15分間)で抽出液を取得した。そして、1NのNaOHで中和し、pH6前後で等電点沈殿を行った。そして、遠心分離(5,000rpm、15分間)を行い、沈殿固形物を少量の蒸留水に懸濁し、付着物を洗浄した。この操作を2回繰り返した。さらに、遠心分離(5,000rpm、15分間)を行い、沈殿固形物を少量の蒸留水に懸濁し、凍結乾燥した。最終的に、山田錦55%精米の白米粉末1kgから米グルテリン粉末7.6gが得られた。米グルテリン基質は、米グルテリン粉末200mgを精秤し、これに10mMの乳酸溶液50ml、防腐剤として安息香酸20mgを加えて加熱溶解して調整した。基質濃度は4mg/mlとし、調整した基質溶液は冷蔵保存した。
【0023】
<米グルテリンを基質とした総合タンパク質分解酵素活性測定>
実施の形態2.
米グルテリンを基質とした総合タンパク質分解酵素活性測定方法を行う。図3は、本実施の形態に係る麹のタンパク質分解酵素活性測定のプロセス図である。
【0024】
(1)基質調整ステップS1:米グルテリンを主成分とする基質の調整
実施の形態1.に記載した米グルテリン基質と同様の調整を行う。
【0025】
(2)酵素液調整ステップS2:麹由来のタンパク質分解酵素の調整
国税庁所定分析法(参照URL:http://www.nta.go.jp/shiraberu/zeiho−kaishaku/tsutatsu/kobetsu/sonota/070622/pdf/211.pdf)の静置抽出法に従って酵素液の調製を行う。具体的には、固体麹10gに塩化ナトリウム溶液50mlを加え、低温室(5℃以下)で一夜、又は室温(15〜20℃)で3時間時々振り混ぜながら浸出した後ろ過する。そのろ液10mlを透析膜に入れ、0.01M酢酸緩衝液に対して低温で一夜透析した後、水で20mlとし麹酵素液とする。
【0026】
(3)酵素反応ステップS3:基質調整ステップS1で調整された基質と酵素液調整ステップS2で調整された酵素液との反応
基質調整ステップS1で調整した米グルテリン基質に緩衝液、好ましくは乳酸緩衝液pH3.0〜5.0を加えて、30〜50℃、好ましくは40℃で予熱する。そして、透析済の麹酵素液を添加して酵素反応を開始する。酵素反応は5〜40分間、好ましくは10分間、30〜50℃、好ましくは40℃で行い、反応停止液としてトリクロロ酢酸(TCA)を添加して反応を停止する。そして、ろ過して反応液を得る。
基質ブランク溶液は、上述の麹酵素液を蒸留水に置換して調整する。酵素ブランク溶液は、上述の米グルテリン基質溶液を蒸留水に置換して調整する。
【0027】
(4)測定ステップS4:酵素反応ステップで得られたアミノ酸量を測定
上述の反応液、基質ブランク溶液、酵素ブランク溶液にニンヒドリン試薬を加えて混合し、80〜100℃で呈色反応を行う。その後、570nmで吸光度測定する。
検量線は、標準溶液としてアルギニン溶液にニンヒドリン試薬を加えて呈色反応を行い、及び対照溶液として蒸留水にニンヒドリン試薬を加えて呈色反応を行い作成する。
なお、総合タンパク質分解酵素活性は、60分間に1mgのアルギニンを生成する活性を1単位とする。計算式は以下に示す。
【0028】
【数1】

【0029】
なお、基質調整ステップS1では、米タンパク質の抽出は乳酸酸性下で行うが、酸性条件を作ることができればよく任意の酸を用いることができる。例えば、乳酸、リンゴ酸、酒石酸、クエン酸、コハク酸、アジピン酸、フマル酸、グルコン酸、リン酸、酢酸、塩酸、硫酸、硝酸などの酸を用いて溶液を酸性にしてもよい。好ましくは米タンパク質の抽出は、0.05M以上の濃度の乳酸を用いてpH3以下で行う。この場合、米から抽出されたタンパク質は、米グルテリンが主成分となる。
【0030】
また、基質調整ステップS1では、米タンパク質の沈殿は米グルテリンの等電点(pH6.4〜10.0)で等電点沈殿で行うが、米グルテリンを主成分とする米タンパク質を回収することができれば、当業者が用いることができる任意のタンパク質沈殿法及び濃縮法も用いることができる。例えば、硫安沈殿、限外ろ過、電気泳動、密度勾配遠心法、分子ふるい、イオン交換クロマトグラフィー、アフィニティークロマトグラフィー、化学物質による沈殿等の方法がある。
【0031】
また、米グリテリンは、全長もしくは一部を発現させた組換えタンパク質でもよい。組換え米グルテリンタンパク質の作製は、当業者が用いることのできる一般的な手法を用いて行い、米グルテリンは、遺伝子配列は、例えばGenbank/DDBJ/EMBLデータベースから入手することが可能である。米グルテリンは多重遺伝子ファミリー群を形成する米貯蔵蛋白質であり、例えば米グルテリン−1は、http://www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?db=protein&id=556399から遺伝子配列を取得することが可能である。米グルテリンタンパク質をコードする全長若しくは一部長のcDNAをベクターに組み込み、大腸菌、酵母、培養細胞などの宿主細胞で発現させて回収してもよい。回収には、上述した任意のタンパク質沈殿法及び濃縮法を用いることができる。
【0032】
なお、酵素液調整ステップS2では、麹由来のタンパク質分解酵素の調整を国税庁所定分析法に従って行うが、麹のタンパク質分解酵素が取得できれば任意の方法も用いることができる。例えば、ホモジナイズ抽出、界面活性剤を用いた化学処理等を用いてもよい。
【0033】
なお、酵素反応ステップS3では、pHの調整は乳酸(pH3.0〜5.0)を用いて行うのが好ましいが、例えば国税庁所定分析法ではアミラーゼ活性には酢酸緩衝液、タンパク質分解酵素にはクエン酸緩衝液(マッキルベン緩衝液)を採用しており、これらを用いてもよい。また、酵素反応は、酵素濃度、基質濃度、阻害剤や活性化剤の濃度、pH、温度、種々の塩の濃度などに影響を受けるが、酵素活性が最大となる条件及び実際の醸造時の条件を加味して行ってもよい。
また、酵素反応ステップS3では、反応停止液にTCAを用いているが、例えば過塩素酸(PCA)等を用いることも可能である。
【0034】
なお、測定ステップS4では、全てのアミノ酸に対して感度が高く、タンパク質に対して感度が低い定量法であるニンヒドリン法を用いるが、当業者が使用できるアミノ酸を定量する方法を用いることができる。例えば、蛍光試薬を用いて行う方法がある。
また、総合タンパク質分解酵素活性は、60分間に1mgのアルギニンを生成する活性を1単位としたが、当業者が使用できる任意の活性単位に変更することもできる。例えば、チロシンやプロリンといった単一のアミノ酸等を生成する活性を1単位としても良いし、複合したアミノ酸を生成する活性を1単位としてもよい。
【0035】
以下に実施例を挙げて本発明の米グルテリンを基質とした総合タンパク質分解酵素活性測定を具体的に説明する。本発明は以下の実施例に限定されるものでなく、本発明の技術分野において通常の変更をすることができる。
【0036】
実施例4.米グルテリンを基質とした総合タンパク質分解酵素活性測定条件の検討
米グルテリン基質を用いて、酵素反応に及ぼすpHの影響を調べた結果を図4に示す。pHは、0.1Mのマイキウルベイン緩衝液を使用して調整した。縦軸は、ニンヒドリン反応の呈色値をアルギニン換算値で表した。
ミルクカゼイン及びCbz−Glu−Tyrを基質とした従来法の場合には最適反応pHは3.0であったが、米グルテリンを基質とした場合には最適反応pHは4.0となり清酒醸造のpH範囲3.5〜4.5と一致した。この結果より、米グルテリンを基質として麹のタンパク質分解酵素活性を測定する場合は、最適pH4前後のpH範囲は3.0〜5.0の範囲で行うのが適当であると判断した。
ミルクカゼインを基質とした従来法は、所定時間反応させた後に0.4Mのトリクロロ酢酸(TCA)を加えて反応を停止し、及び未反応の基質を沈殿させて、ろ過して得た反応液中のTCA可溶性タンパク質の生成量を測定して酵素活性とする。本実施例も従来法と同様に、基質をミルクカゼインに変えて米グルテリンを使用し、所定時間反応させた後にTCA添加により未反応の基質を沈殿除去し、ろ液中のアミノ酸量を測定して総合タンパク質分解酵素活性を測定した。アミノ酸の定量は、ニンヒドリン法を用いた。
酵素反応に及ぼす温度の影響を調べた結果を表5に示す。アミノ酸生成速度(μgアルギニン/分)は、45℃で最大となった。この結果及び酵素の失活の影響も鑑みて40℃が測定温度として適当であると判断した。
【0037】
【表5】

【0038】
米タンパク質の酵素分解パターンを図5に示す。横軸は酵素反応時間、及び縦軸はニンヒドリン呈色反応によるアミノ酸量(μgアルギニン)を表す。アミノ酸量は、40分まで時間に比例して直線的に増加した。この結果から反応時間は10分間を適当であると判断した。
【0039】
実施例5.米グルテリンを基質とした総合タンパク質分解酵素活性測定
(1)基質調整ステップS1:米グルテリンを主成分とする基質の調整
白米粉末100gを0.1Mの乳酸250mlで2時間抽出し、東洋ろ紙No.5Aでろ過した。1NのNaOH溶液で中性(pH6.5)に調整し等電点沈殿を行った。遠心分離(3,000rpm,15分間)して沈殿を集め、蒸留水を用いて付着物を洗浄し、再度遠心分離を行い沈殿を得た。この沈殿を凍結乾燥して米グルテリンとした。そして、米グルテリン粉末0.2gを秤量し、10mMの乳酸を50ml加えて加熱溶解し基質溶液とした。
(2)酵素液調整ステップS2:麹由来のタンパク質分解酵素の調整
国税庁所定分析法に従って抽出及び透析を行った。麹10gを秤量し、麹抽出液50mlを加えて室温で3時間抽出した。東洋ろ紙No.5Aでろ過し、ろ液20mlを透析チューブにとり、20mMの酢酸緩衝液(pH5.0)に対して一夜透析した。透析液を40mlに定容し酵素液とした。
(3)酵素反応ステップS3:基質調整ステップS1で調整された基質と酵素液調整ステップS2で調整された酵素液との反応
米グルテリン溶液1.0ml(米グルテリン4mg)に0.1Mの乳酸緩衝液(pH4.0)を1.0ml加え、40℃で2分間予熱した。そして、透析済の麹酵素液を0.2ml添加して反応を開始した。10分間反応後に0.4MのTCA溶液を3.0ml添加して反応を停止した。ろ過して反応液を得た。
なお、基質ブランク溶液は、米グルテリン溶液1.0mlに0.1Mの乳酸緩衝液(pH4.0)1.0ml、蒸留水0.2ml及び0.4MのTCA溶液3.0mlを加えて、ろ過して作成した。酵素ブランク溶液は、蒸留水1.0ml、0.1Mの乳酸緩衝液(pH4.0)1.0mlに酵素液0.2mlを加えて、直ちに0.4MのTCA溶液3.0mlを加えて反応を止め、ろ過せずに作成した。
(4)測定ステップS4:酵素反応ステップで得られたアミノ酸量の測定
反応液1.0ml(基質ブランク溶液、酵素ブランク溶液、対照溶液、標準溶液)にニンヒドリン試薬(日立アミノ酸分析試薬)1.0mlを加えて混合し、沸騰水中で15分間呈色反応を行った。その後、60%のエタノール5ml加えて攪拌し、570nmで吸光度測定した。
検量線は、標準溶液としてアルギニン(50μg/ml)溶液1.0mlにニンヒドリン1.0mlを加えて呈色反応を行い、及び対照溶液として蒸留水1.0mlにニンヒドリン1.0mlを加えて呈色反応を行い作成した。
【0040】
実施例6.米グルテリンを基質とした酵素活性と蒸米消化液のアミノ酸量との相関
33個の清酒麹の酵素活性について、本実施形態の米グルテリンを基質としたタンパク質分解酵素活性測定(本法)及び国税庁所定分析法の合成ペプチドCbz−Glu−Tyrを基質としたタンパク質分解酵素活性測定(従来法)とを比較した結果を図6に示す。横軸に従来法による酸性カルボキシペプチダーゼ活性(ACPase)を、縦軸に本実施形態の米グルテリンを基質とした総合ペプチダーゼ活性(総合タンパク質分解酵素活性)を示した。このように従来法で同一の活性であっても、本法の米グルテリンを基質とした総合タンパク質分解酵素活性では大きな違いが認められた。
次に、麹米5品種を用いて3回製麹して造った15麹を用いて酵素抽出液を調整し、5品種の蒸米の消化試験を実施した。消化試験は実際の製造場の醪の条件を考慮して、温度15℃で14日間行った。蒸米消化液中のアミノ酸量とタンパク質分解酵素活性との相関を表6に示すが、従来法ではほとんど相関が認められなかったアミノ酸が多かったが、本法の米グルテリンを基質としたタンパク質分解酵素活性では全アミノ酸と危険率5%で相関が認められ、個々のアミノ酸では清酒の呈味に関係するアラニン(r=0.653**)、グルタミン酸(r=0.766***)、アスパラギン酸(r=0.795***)、アルギニン(r=0.711**)は、高い相関関係が認められた。またスポーツ飲料では重要なアミノ酸とされている分岐アミノ酸(BCAA)は従来法では相関が認められなかったが、本法では酵素活性と高い相関関係(r=0.800***)が認められた。必須アミノ酸の存在量は、従来法では相関が認められなかったが、本法では酵素活性と高い相関係数(r=0.778***)が認められた。
【0041】
【表6】

【0042】
以上の結果より、米グルテリンを基質としたタンパク質分解酵素活性は、蒸米タンパク質の分解に関わる数多くの酵素の活性を総合して示し、醸造時におけるアミノ酸生成量と高い相関関係を持つことが明らかとなった。
【0043】
実施の形態3.タンパク質分解酵素活性測定キット
図7は、本実施の形態に係る麹のタンパク質分解酵素活性測定キットの概念図である。
A.試薬キット(50回分)
基質1: 4mg/ml 米グルテリン溶液 100ml
緩衝液2: 0.1M 乳酸緩衝液(pH4.0) 100ml
反応停止液3: 0.4M TCA溶液 300ml
発色試薬4: ニンヒドリン溶液 100ml
標準溶液5: 50μg/ml アルギニン溶液
B.反応操作
(i)1mlの基質1、1mlの緩衝液2、及び0.2mlの供試酵素液6を混和し、40℃で10分間反応させて反応液7を得る。また、基質ブランク液8及び酵素ブランク液9は、各々基質1及び供試酵素液6と同量の蒸留水を加えて作成する。
(ii)反応液7、基質ブランク液8、及び酵素ブランク液9に対して、3mlの反応停止液3を混和し反応を停止させる。その後、ろ過しろ液10を得る。
(iii)1mlのろ液10に対して、1mlの発色試薬4を加えて混和し、80℃〜100℃で15分間反応させて測定試料11を得る。
(iv)測定試料11を570nmの吸光度で分光光度計を用いて測定する。
(v)別途、1mlの標準溶液5と1mlの発色試薬4を混和し、570nmの吸光度で分光光度計を用いて測定し検量線を作成する。また、1mlの蒸留水である対照溶液12と1mlの発色試薬4を混和しバックグラウンドとする。
【0044】
このように、麹のタンパク質分解酵素活性測定にあたって、予め使用する試薬が調整されたキットを用いることにより、活性測定を簡便且つ容易に再現性高く行うことが可能となる。
なお、当業者が技術的に用いることができる範囲でスケールを変更することが可能である。例えば、より小スケールの場合、吸光度の測定は96穴プレート等を用いてプレートリーダーで行ってもよい。また、各段階における操作は、装置を用いて自動測定としてもよい。
【0045】
上述のように、本発明は従来のタンパク質分解酵素活性測定法に存する問題点を克服した。すなわち、従来法では現実の醸造現場でのアミノ酸生成量に活性が反映していなかったが、本発明による麹のタンパク質分解酵素活性測定方法では、米タンパク質を基質とすることによって、麹の総合タンパク質分解酵素活性を品質に重要である醸造物のアミノ酸生成量と極めて高い相関を有する測定をすることが可能となった。特に、麹のアミラーゼ、プロテアーゼ活性の最適pHは4前後に集中しているため、清酒や焼酎の醸造条件であるpH3〜4.5の間でタンパク質分解酵素活性測定を行うことにより、実際の清酒や焼酎の醸造時の正確なタンパク質分解酵素活性を反映させることが可能となる。
【0046】
また、清酒醸造は乳酸を添加して乳酸酸性(pH3)として発酵を開始し、腐造乳酸菌の増殖を防いで安全醸造を図るが、本発明ではこのような条件下で、原料となる米、米糠、及び白糠から米グルテリンが希酸処理することで容易に抽出される。これは従来法と異なり、蒸きょう工程を必要とせずに行うことが可能なため、基質調整の手間を削減することもできる。
【0047】
また、蒸米タンパク質のうち主に米グルテリンが麹酵素で分解されてアミノ酸になることが相関分析より明らかとなっており、タンパク質分解酵素活性を阻害する要因となる可能性がある他の米タンパク質が混在するよりも、本発明の米グルテリンを主成分としてタンパク質分解酵素活性測定用の基質とする方が、正確にアミノ酸生成に関わる酵素活性を測定することができる。
【0048】
麹菌はゲノム解析より134個のタンパク質分解酵素遺伝子を有していると推論されており、醪における米タンパク質の酵素分解は多くの酵素の総合作用によると考えられ、麹の総合タンパク質分解酵素が測定可能である本発明は顕著な効果を有する。
【0049】
なお、本実施の形態は、清酒及び焼酎の醸造を対象として、麹のタンパク質分解酵素活性を測定するために米タンパク質を基質とする場合について記載したが、醸造に用いる原料としては味噌や醤油ならば大豆、焼酎ならば麦、芋、とうもろこし及び糖蜜等の任意の食品があげられ、麹のタンパク質分解酵素活性を測定するための基質は各食品に対応する抽出物を用いることができる。さらに、基質タンパク質としては、味噌や醤油等の大豆由来の食品であれば大豆タンパク質の主成分であるグリシニンを用いることができる。このように麹のタンパク質分解酵素活性測定の基質となるタンパク質は、用いる原料によって変更することができる。
【0050】
なお、上記実施の形態の構成、解析及び測定は例であって、本発明の趣旨を逸脱しない範囲で適宜変更することができることは言うまでもない。
【産業上の利用可能性】
【0051】
米グルテリンを基質とした本発明のタンパク質分解酵素活性測定は、清酒の醪に含まれる多数のタンパク質分解酵素の総合した活性を示し、清酒や焼酎の醸造における米タンパク質の分解量を正確に行うことができる。従って、清酒や焼酎の醸造をはじめとする醸造物の製造時における、アミノ酸生成量に反映するタンパク質分解酵素活性測定に用いることができ、本発明を利用することにより新しい麹菌の開発、製麹方法の改善、麹米品種の選定や新しい麹米の育種など醸造の現場において大きな貢献が期待される。
【図面の簡単な説明】
【0052】
【図1】全体の米タンパク質の二次元電気泳動を示した図。
【図2】白米粉末から抽出した米タンパク質のSDS−PAGEを示した図。
【図3】本実施形態のタンパク質分解酵素活性測定方法のプロセスフローを示した図。
【図4】本実施形態の酵素反応に及ぼすpHの影響を示した図。
【図5】本実施形態の米タンパク質の酵素分解パターンを示した図。
【図6】本実施形態のタンパク質分解酵素活性測定方法と国税庁所定分析法との比較図。
【図7】本実施形態のタンパク質分解酵素活性測定キットの概念図。
【特許請求の範囲】
【請求項1】
米グルテリンが主成分であるタンパク質分解酵素活性測定用基質。
【請求項2】
前記米グルテリンは、米、米糠若しくは白糠から酸抽出し、pH6.4〜10.0の等電点沈殿で取得した米タンパク質であるタンパク質分解酵素活性測定用基質の製造方法。
【請求項3】
前記酸抽出に、乳酸を用いる請求項2に記載のタンパク質分解酵素活性測定用基質の製造方法。
【請求項4】
前記米タンパク質は粉末化された請求項2又は3に記載のタンパク質分解酵素活性測定用基質の製造方法。
【請求項5】
請求項2乃至4の何れかに記載のタンパク質分解酵素活性測定用基質の製造方法から製造されたタンパク質分解酵素活性測定用基質。
【請求項6】
請求項1又は5に記載のタンパク質分解酵素活性測定用の基質を調整する基質調整ステップと、
麹酵素液を調整する酵素液調整ステップと、
前記基質調整ステップで調整された基質と前記酵素液調整ステップで調整された酵素液とを反応させる酵素反応ステップと
を備える麹のタンパク質分解酵素活性測定方法。
【請求項7】
前記酵素反応ステップは、pH3〜5で行うことを特徴とする請求項6に記載の麹のタンパク質分解酵素活性測定方法。
【請求項8】
請求項1又は5に記載のタンパク質分解酵素活性測定用の基質を調整する基質調整手段と、
麹酵素液を調整する酵素液調整手段と、
前記基質調整手段で調整された基質と前記酵素液調整手段で調整された酵素液とを反応させる酵素反応手段と
を備える麹のタンパク質分解酵素活性測定キット。
【請求項1】
米グルテリンが主成分であるタンパク質分解酵素活性測定用基質。
【請求項2】
前記米グルテリンは、米、米糠若しくは白糠から酸抽出し、pH6.4〜10.0の等電点沈殿で取得した米タンパク質であるタンパク質分解酵素活性測定用基質の製造方法。
【請求項3】
前記酸抽出に、乳酸を用いる請求項2に記載のタンパク質分解酵素活性測定用基質の製造方法。
【請求項4】
前記米タンパク質は粉末化された請求項2又は3に記載のタンパク質分解酵素活性測定用基質の製造方法。
【請求項5】
請求項2乃至4の何れかに記載のタンパク質分解酵素活性測定用基質の製造方法から製造されたタンパク質分解酵素活性測定用基質。
【請求項6】
請求項1又は5に記載のタンパク質分解酵素活性測定用の基質を調整する基質調整ステップと、
麹酵素液を調整する酵素液調整ステップと、
前記基質調整ステップで調整された基質と前記酵素液調整ステップで調整された酵素液とを反応させる酵素反応ステップと
を備える麹のタンパク質分解酵素活性測定方法。
【請求項7】
前記酵素反応ステップは、pH3〜5で行うことを特徴とする請求項6に記載の麹のタンパク質分解酵素活性測定方法。
【請求項8】
請求項1又は5に記載のタンパク質分解酵素活性測定用の基質を調整する基質調整手段と、
麹酵素液を調整する酵素液調整手段と、
前記基質調整手段で調整された基質と前記酵素液調整手段で調整された酵素液とを反応させる酵素反応手段と
を備える麹のタンパク質分解酵素活性測定キット。
【図3】


【図4】


【図5】


【図6】


【図7】


【図1】


【図2】




【図4】


【図5】


【図6】


【図7】


【図1】


【図2】


【公開番号】特開2009−183239(P2009−183239A)
【公開日】平成21年8月20日(2009.8.20)
【国際特許分類】
【出願番号】特願2008−28316(P2008−28316)
【出願日】平成20年2月8日(2008.2.8)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成19年9月26日 社団法人 日本生物工学会主催の「平成19年度日本生物工学大会」に文書をもって発表
【出願人】(306024148)公立大学法人秋田県立大学 (74)
【Fターム(参考)】
【公開日】平成21年8月20日(2009.8.20)
【国際特許分類】
【出願日】平成20年2月8日(2008.2.8)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成19年9月26日 社団法人 日本生物工学会主催の「平成19年度日本生物工学大会」に文書をもって発表
【出願人】(306024148)公立大学法人秋田県立大学 (74)
【Fターム(参考)】
[ Back to top ]

