黄色ブドウ球菌をコアグラーゼ陰性ブドウ球菌と区別することができる培養培地
本発明は、黄色ブドウ球菌細菌の増殖、検出、同定および/または測定のための特異的培養培地であって、それがホスホリパーゼCの少なくとも1つの蛍光性、発色性または発光性基質を含むことを特徴とする、培地に本質的に関する。該培地は、黄色ブドウ球菌とコアグラーゼ陰性ブドウ球菌との区別を可能にする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、一般に、微生物学的分析の分野に関する。特に、本発明は、黄色ブドウ球菌(Staphylococcus aureus)をコアグラーゼ陰性ブドウ球菌と区別することを可能にする、ブドウ球菌の増殖、検出、同定および/または測定のための選択培養培地に関する。
【背景技術】
【0002】
ブドウ球菌(Staphylococcus)属の細菌、すなわちブドウ球菌は、多くの院内感染の原因であり、病院における相当な問題である。これらの細菌はグラム陽性球菌であり、グラム陽性球菌は、血漿の凝固を誘発するタンパク質である、コアグラーゼの産生によって区別される2つの主な群に分類することができる。したがって、区別は、その主な代表が表皮ブドウ球菌(Staphylococcus epidermidis)である、コアグラーゼ陰性ブドウ球菌と、その主な代表が、その毒性で有名な、黄色ブドウ球菌である、コアグラーゼ陽性ブドウ球菌との間で行なわれる。ブドウ球菌は、環境、ヒトおよび動物の皮膚および粘膜において広く発生する。これらの宿主からの定期的に落屑することにより、自然界(水、土壌、大気、食料、物体)に、および衛生の厳格な対策と患者の隔離とが表皮性菌株の拡大を制限するために必要とされる病院環境に広く拡散される。したがって、臨床現場で分離されるブドウ球菌の80〜90%に相当する黄色ブドウ球菌は、特に、院内肺炎、手術創の感染症、火傷の感染症、異物(心臓弁、人工股関節、クランプなど)の感染症、およびしばしば血管内カテーテルの使用が原因であるか、または別の感染の部位からの細菌の伝播が原因である全身感染症または敗血症などの、病院環境における多くの感染症の原因となる主なヒト病原菌である。
【0003】
ブドウ球菌、および特に黄色ブドウ球菌は、食品の分野においても相当な危険性をもたらす。実際、黄色ブドウ球菌の特定の株は腸毒素を産生することができ、消費者によるその摂取は中毒をもたらし、吐き気、腹痛および特に、しばしば下痢を伴う、激しい、反復嘔吐を引き起こす。
【0004】
ブドウ球菌食中毒は、したがって、細菌由来の食中毒の主な形態の1つに相当する。
【0005】
拡散は、通常、病気または健康な保菌者である動物およびヒトにより、生乳(乳腺炎)により、食品や健康または感染保菌者と接触している大気および汚染表面または機器により生じる。
【0006】
食品中のブドウ球菌のおよび特に黄色ブドウ球菌の検出および同定は、それゆえ、主な公衆衛生課題を構成する。
【0007】
ブドウ球菌属の細菌の検出、同定および測定に使用される培養培地の中で、区別は、コロンビア培地またはトリプチケース−ソイ寒天などの非選択培地とチャップマン寒天およびベアド−パーカー寒天などの、選択培地との間で行なわれる。黄色ブドウ球菌は、その形態学的特徴およびその溶血プロファイルによっては、血液寒天上で検出することもできるが、この方法は、感度および特異性があまり高くなく、仮にそうであるとしても、食品業界ではほとんど使用されない。心臓−脳培養液も通常ブドウ球菌の調査に使用される。
【0008】
特定の細菌学的培養培地は特定の微生物の増殖を促進し、その他の増殖を制限する。それらは、標的病原菌以外の微生物の少なくとも1つの阻害剤を含有する。対象の微生物が、生産される食品調製物中で損傷されることがあるので、阻害剤の効果は、前記対象の微生物に限定されたままでなければならない。チャップマン寒天は、その発酵がpH指示薬によって検出される、マンニトールを基質として用いた、普通の栄養基剤上の高塩培地に対応する。前記pH指示薬は、着色指示薬または蛍光指示薬であることができる。ベアド−パーカー培地は、黄色ブドウ球菌を増殖させるのによく用いられる選択剤である、添加されたテルル酸カリウムおよび塩化リチウムを含む富栄養基剤に対応する。塩化リチウムは腸球菌の阻害剤である。他の化学薬品、すなわち、硫酸アンモニウム、ソルビン酸、グリシン、ポリミキシンBを、テルル酸カリウムおよび塩化ナトリウムまたは塩化リチウムと組み合わせることができる。
【0009】
とはいえ、潜在的に毒素原性のブドウ球菌についての食品マトリックスの分析は、臨床実施のために開発された方法の実践的な使用を制限する、特殊な問題を提起する。実際、よく提案される培地は、食品汚染の媒介物とみなされない、コアグラーゼ陰性ブドウ球菌の増殖および、要求される表現型特徴によっては、検出も可能にする。
【0010】
ISO6888−1および6888−2標準に従う参照培地である、ベアド−パーカー+RPF(ウサギ血漿+ウシフィブリノーゲン)培地の場合、いくらかの欠点が一般に観察される。
【0011】
第1に、読取りおよび感度における問題がある。黄色ブドウ球菌の特定の株が、この培地上で発育しないか、またはコアグラーゼ陰性ブドウ球菌の存在を示唆する、非常に弱くかつ遅延したコアグラーゼを示すという事実のために、偽陰性が潜在的に現れる可能性がある。さらに、偽陰性結果は、マトリックスからの干渉のために観察される可能性もある。実際、黄色ブドウ球菌による低レベルの汚染を測定するために、試料の最低限の希釈が行なわれ(1/10)、これは、マトリックス化合物の存在のために、ハローを読み取るときの困難をもたらす(例えば、乳および/または乳製品の試料:カゼインの白色がコアグラーゼを明らかにするハローを隠す)。
【0012】
ベアド−パーカー+RPF培地は、トロンビンの源とプラスミノーゲンの源を組み合わせることを必要とする。後者は、動物の血液から得られるが、このことは、供給の信頼性(品質、量など)の問題を提起する。
さらに、ハローの読取りは、ブロス(液体培地)中では不可能であり、かつハローと培地のコントラストが低下する可能性がある。最後に、コンフルエントなコロニーの場合、ハローを産生するものとそれを産生しないものとを区別するのは困難である。
【0013】
第2に、特異性の問題もあり得る。豊富な付随的細菌叢(例えば、バチルス(Bacillus)属)の存在下で、この種の培地を用いると偽陽性結果が現れることがある。これは、例えば、スタフィロコッカス・キシローサス(Staphylococcus xylosus)をスターターとして用いる特定の肉原料製品(ドライソーセージ)および乳製品(マンステールタイプのチーズ)中の黄色ブドウ球菌を測定する場合に当てはまる。したがって、ハローによって囲まれた黒いコロニー、すなわち、通常はこの培地上の黄色ブドウ球菌の特徴を示すものであるが、実際はスタフィロコッカス・キシローサスの株(ハローのない黒いコロニーを産生する)と、寒天上でハローと認定され得る、濁りを生じさせるバチルスの特定の株との近接した増殖によって生じるコロニーが、ベアドパーカー+RPF培地上に出現する。
【0014】
コアグラーゼ陽性ブドウ球菌とコアグラーゼ陰性ブドウ球菌の類似性がより大きいために、発色性培地などの、代替法の中に、これら2つの群を極めて特異的に識別することを可能にする培地はない。実際、コアグラーゼ陽性ブドウ球菌をコアグラーゼ陰性ブドウ球菌と区別する目的でこの種の培地において利用される区別という概念(すなわち、阻害剤系と組み合わされる、多かれ少なかれ特異的である基質および/または糖)は、非常に多くの場合、複雑であり、特に多様でかつ豊富な微生物叢を含有する食品試料に対する優れた識別を提供しない。
【0015】
コアグラーゼ陽性ブドウ球菌とコアグラーゼ陰性ブドウ球菌(または他の細菌種さえも)の区別のための特異的基質または糖の不在は、偽陰性結果が得られることを潜在的にもたらす、黄色ブドウ球菌の問題となる増殖または酵素活性を変化させ得るかまたは阻害し得る、「積極的な」選択/阻害系を使用することを意味する。
【0016】
マトリックス相互作用を避けるために必要とされる希釈のために、少しの汚染の場合の偽陰性結果が、特定の培地を用いると得られることもある。例えば、3M(商標)ペトリフィルム(商標)Staphエクスプレス測定プレートを用いると、乳製品に存在する高レベルのホスファターゼによってピンク色の着色が生じる。
【0017】
逆に、黄色ブドウ球菌に対する特異性が低い基質の分解または糖の発酵に基づく培地は、十分には選択的でない阻害系と更に組合わせられると、偽陽性結果が得られることになる。
【0018】
最後に、特定の培地は、黄色ブドウ球菌と他のブドウ球菌および細菌種の最適な区別を確実にするために、2つの基質の使用に基づいている。そのような概念の適用は、特に、食品から得られる試料の場合、十分な特異性を提供することなく、培地の費用を増加させる。
【0019】
ホスホリパーゼCタイプの酵素が知られており、多くの微生物中に存在するものとして文献に記載されている。
【0020】
ホスホリパーゼCの中で、黄色ブドウ球菌由来のホスファチジルイノシトールホスホリパーゼC(PIPLC)が精製され、かつ特徴解析されている(Phosphatidylinositol−Specific Phospholipase C from Staphylococcus aureus,METHODS IN ENZYMOLOGY,1981−Vol.71)。
【0021】
この酵素はまた、黄色ブドウ球菌の考えられる毒性因子であると記載されている(JOURNAL OF CLINICAL MICROBIOLOGY,Nov.1989,p.2451−2454−Vol.27,No.11およびINFECTION AND IMMUNITY,Dec.1993,p.5078−5089−Vol.61,No.12)。さらに、黄色ブドウ球菌における活性のあるPIPLCの最大産生を可能にするインビトロでの条件を評価するための研究も発表されている(Marques et al.;Growth in Acidic Media Increases Production of Phosphatidylinositol−Specific Phospholipase C by Staphylococcus aureus;CURRENT MICROBIOLOGY Vol.25(1992),pp.125−128)。
【0022】
文書EP−0 970 239 B1は、様々な微生物によって分泌される、PIPLCの検出を可能にする新規の発色性基質を記載している。示された実施例は、一方で、言及された様々な基質の調製を記載し、他方で、この方法の使用のための最適条件(例えば、基質/酵素濃度、推奨される誘導因子など)を示している。しかしながら、ブドウ球菌の検出を可能にする培養培地はこの文書に記載されていない。
【0023】
文書EP−1 506 309 B1は、PIPLCを産生することができる微生物の検出のための培養培地であって、それらがPIPLCと接触したときに、それぞれ、蛍光と着色を発生させることができる、少なくとも1つの蛍光性化合物と少なくとも1つの発色性化合物の組合せを含有する培養培地を記載している。この培養培地は、阻害剤を添加することなく、リステリア・モノサイトゲネス(Listeria monocytogenes)、リステリア・イバノビイ(Listeria ivanovii)、セレウス菌(Bacillus cereus)、バチルス・チューリンゲンシス(Bacillus thuringiensis)、バチルス・ミコイデス(Bacillus mycoides)、炭疽菌(Bacillus anthracis)、黄色ブドウ球菌、レジオネラ・ニューモフィラ(Legionella pneumophila)、クロストリジウム(Clostridium)の種、ヘリコバクター・ピロリ(Helicobacter pylori)、カンジダ(Candida)の種、およびアスペルギルス(Aspergillus)の種などの、様々な細菌種の検出を可能にするものとして記載されている。しかしながら、黄色ブドウ球菌を検出することを目的とした、そのようなものと同様の培養培地は、この文書に記載されていない。記載されている培養培地は、リステリア・モノサイトゲネスおよびバチルスのセレウス群の検出に関するもののみである。さらに、記載されている全ての培養培地上で、ブドウ球菌の種、および特に黄色ブドウ球菌は増殖しないように思われる。
【0024】
文書EP−0 949 266 B1は、特にリステリア属の細菌活性の指示薬としての、PIPLCに特異的な基質を記載している。該基質は、色または蛍光を生じさせることができる少なくとも1つの化合物を含有する。記載されている培養培地は、リステリア・モノサイトゲネスの検出に関するもののみである。さらに、記載されている全ての培養培地上で、ブドウ球菌の種および特に黄色ブドウ球菌は、それらの阻害のために、増殖しないように思われる。
【0025】
他のホスホリパーゼCと同様に、ホスファチジルコリンホスホリパーゼC(PCPLC)も、黄色ブドウ球菌を含む、様々な細菌に存在するものとして記載されている(J.G.Songer,Trends in Microbiology,Volume 5,Number 4,April 1997,pp.156−161(6))。
【0026】
文書EP−1 219 628は、微生物の検出および同定のための新規の発色基質を記載している。これらの基質は、PCPLCに特異的な基質である。とはいえ、この文書は、黄色ブドウ球菌の検出および同定のための基質も、特異的培養培地も記載していない。
【0027】
このように、25年よりも前に黄色ブドウ球菌由来のPIPLCの特徴解析およびこの細菌種の毒性における潜在的な役割が同定されているにも関わらず、発色性、蛍光性または発光性の、PIPLCに特異的な少なくとも1つの基質の使用に基づく、黄色ブドウ球菌の検出および/または測定に特異的であり、かつブドウ球菌のこの種とその他の種の識別を可能にする培養培地はこれまで記載されていないようなので、記載の培地における黄色ブドウ球菌の株の阻害はそもそも不可能である。さらに、黄色ブドウ球菌を検出または測定するための特異的培養培地における、PCPLCに特異的な発色性、蛍光性または発光性基質の使用、ブドウ球菌のこの種とその他の種の識別を可能にする該基質の使用を記載した文書はない。
【発明の概要】
【発明が解決しようとする課題】
【0028】
上で考慮された当該技術分野の状況によって提起される問題を念頭に置くと、本発明の本質的な目的の1つは、それらを検出するおよび/またはそれらを同定するおよび/またはそれらを測定する、ならびに黄色ブドウ球菌とその他のブドウ球菌の種との識別を可能にする目的のために、ブドウ球菌の増殖を促進する培養培地を供給することである。
【0029】
本発明の別の目的は、特にコアグラーゼ陰性ブドウ球菌による、偽陽性結果の生成を制限する培養培地を供給することである。
【0030】
本発明の別の目的は、特に低レベルの汚染の場合に、減らされた阻害系の使用によって、標的細菌のよりカバーできる培養培地を供給することである。
【0031】
本発明の別の目的は、単一の特異的基質の使用によって、簡単な読取りおよび解釈を可能にする培養培地を供給することである。
【0032】
本発明の別の目的は、読取りの自動化を可能にする培養培地を供給することである。
【0033】
最後に、本発明の最後の目的は、黄色ブドウ球菌の増殖を促進する減らされた選択性のために、結果を返す時間を減らすことを可能にする培養培地を供給することである。
【課題を解決するための手段】
【0034】
これらの目的はとりわけ、本発明によって達成され、本発明は、第1に、黄色ブドウ球菌細菌の増殖、検出、同定および/または測定のための特異的培養培地であって、それがホスホリパーゼCの少なくとも1つの発色性、蛍光性、または発光性基質を含むことを特徴とする培地に関する。
【0035】
「基質」は、微生物の酵素または代謝活性により、直接的にまたは間接的に、検出可能なシグナルを生じさせることができる任意の分子を意味する。
【0036】
基質は、特に酵素基質、すなわち、酵素によって微生物の直接的または間接的な検出を可能にする産物に代謝されることができる基質であることができる。
【0037】
この基質は、特に、検出される酵素活性に特異的な第1の部分と、以下、マーカー部分と呼ばれる、マーカーとしての役割を果たす第2の部分とを含む。このマーカー部分は、発色性、蛍光性、発光性である。好ましくは、本発明において使用される基質は、蛍光性である。本発明者らは、クマリンの誘導体および特にウンベリフェロン、ナフトール、レゾルフィン、フルオレセインについて言及する場合がある。
【0038】
本発明の意味において、この基質は、ホスファチジルイノシトールホスホリパーゼC(PIPLC)の基質であることができる。この場合、培地中のPIPLC基質の濃度は、0.01〜1g/lである。
【0039】
好ましくは、PIPLCの基質は、4−ニトロフェニルミオ−イノシトール1−リン酸、4−メチルウンベリフェリルミオ−イノシトール1−リン酸、3−クロロ−7−ヒドロキシ−4−メチルクマリンミオ−イノシトール1−リン酸、3−エトキシカルボニル−4−メチルクマリンミオ−イノシトール1−リン酸、3−シアノ−4−メチルクマリンミオ−イノシトール1−リン酸を含む群から選ばれる。
【0040】
代わりの方法によれば、基質は、ホスファチジルコリンホスホリパーゼC(PCPLC)の基質であることができる。この場合、培地中のPCPLC基質の濃度は、0.01〜1g/lである。
【0041】
好ましくは、PCPLCの基質は、5−ブロモ−4−クロロ−3−インドキシルコリンリン酸、3−インドキシルコリンリン酸、4−メチルウンベリフェリルコリン−リン酸を含む群から選ばれる。
【0042】
好ましい実施形態では、本発明による培養培地は液体形態である。実際、この形態は、該試料中に潜在的に存在する微生物の放出を可能にするために、培養培地中での固体試料の混合の段階を必要とし得る、食品の微生物学的分析に特に好適である。
【0043】
それでもなお、培養培地は、固体形態(例えば、寒天ベースの培地)であることもできる。液体培地と同じように、ホスホリパーゼC(PIPLCまたはPCPLC)の基質がこれらの固体培地中に存在し、黄色ブドウ球菌の検出、同定、または測定すら可能にすることができる。
【0044】
あるいは、本発明による培養培地は、エステラーゼ(特に、リパーゼまたはホスファターゼ)、コアグラーゼまたはα−グルコシダーゼ活性などの、ホスホリパーゼC活性とは異なる、標的微生物の酵素または代謝活性を検出するのを可能にする基質をさらに含むことができる。直接的な検出のために、この基質を、蛍光または発色性の、マーカーとしての役割を果たす部分に結合させることができる。間接的な検出のために、本発明による培養培地は、基質の消費によって誘導されるpH変化に感受性がありかつ標的微生物の増殖を明らかにする、pH指示薬をさらに含むことができる。該pH指示薬は、発色団または蛍光団であることができる。
【0045】
第1の実施形態によれば、本発明による選択培地は、食品の微生物学的検査において使用される。好ましくは、それは、乳製品中で黄色ブドウ球菌を増殖させて、測定するために使用される。
【0046】
第2の実施形態によれば、本発明による選択培地は、環境の微生物学的モニタリングにおいて使用される。「環境」は、大気の試料、水の試料、または表面からの試料を意味する。表面からの試料の中では、本発明の目的は、院内感染の原因となるコアグラーゼ陽性ブドウ球菌の中で、病院環境における黄色ブドウ球菌の検出に特定の用途を見出すことができる。
【0047】
最後の実施形態によれば、本発明による選択培地は、黄色ブドウ球菌を検出するおよび/または同定するおよび/または測定するための臨床解析において使用される。
【0048】
有利には、本発明による選択培地は、例えば、黄色ブドウ球菌の株のメチシリンに対する耐性の検査の範囲内で、耐性のマーカーをさらに含むことができる。
【0049】
本発明の別の目的は、黄色ブドウ球菌細菌とコアグラーゼ陰性ブドウ球菌との区別のためのホスホリパーゼCの少なくとも1つの発色性、蛍光性、または発光性基質の使用に関する。
【0050】
該使用は、培養培地の製造に限定されない。実際には、ホスホリパーゼC(PIPLCまたはPCPLC)の1以上の基質を有しかつ黄色ブドウ球菌の同定を可能にする同定試薬を作製することが完全に想定される。該試薬を、VITEK(登録商標)カード、API(登録商標)またはRAPiDEC(登録商標)生化学検査キットなどの、本出願人により市販されている製品において使用することができる。
【0051】
本発明の別の目的は、黄色ブドウ球菌細菌の増殖、検出、同定および/または測定のための特異的培養培地を調製するためのホスホリパーゼCの少なくとも1つの基質の使用に関する。
【0052】
本発明の別の目的は、複合試料中の黄色ブドウ球菌細菌を検出するおよび/または同定するおよび/または測定するための、本発明による培養培地の使用に関する。
【0053】
最後に、本発明の最後の目的は、黄色ブドウ球菌細菌の検出および/または同定の方法であって、
a)本発明による培養培地に、黄色ブドウ球菌細菌を含有し得る試料を播種すること;及び
b)該培養培地中の黄色ブドウ球菌細菌の増殖に対応する、培養培地中の蛍光、発光または着色の変化を測定すること
からなる工程を含む、方法に関する。
【0054】
有利には、本発明による方法は、上に述べたように播種された培養培地を、黄色ブドウ球菌細菌の増殖を可能にするのに好適な条件に置くことからなる中間工程a’)を含む。
【0055】
特定の実施形態によれば、本発明による方法は、標的微生物を測定する補足的工程を含むことができる。該測定段階は、好ましくは最確数(MPN)の方法に従って行なわれる。この方法は、本出願人の名における特許EP 1 105 457において説明されている。
【0056】
好ましくは、生物学的試料は、臨床試料、食品試料または環境試料である。
【0057】
本発明による目的の適用は、単一タイプの支持体に限定されるものではないことが最後に留意されるべきである。実際には、インビトロ診断の分野において使用される全てのタイプの支持体、すなわち、マイクロプレート、マイクロチューブ、マイクロカプセル、キャピラリーなどが、使用に好適である。
【0058】
以下の実施例は、図1と併せて、例示の目的のために示されており、決して限定するものではない。これらは本発明を理解することをより容易にするであろう。
【図面の簡単な説明】
【0059】
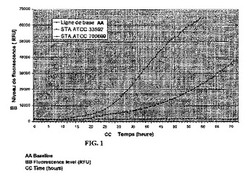
【図1】2株の黄色ブドウ球菌のPC−PLC(レシチナーゼ)酵素活性を反映する、経時的な蛍光の測定を示す。
【実施例】
【0060】
実施例1:黄色ブドウ球菌におけるPIPLC活性とコアグラーゼの存在との間の相関関係の調査−TEMPO(登録商標)システム/ベアド−パーカー+RPF(BP+RPF)培地の比較
43株の黄色ブドウ球菌および20株のコアグラーゼ陰性ブドウ球菌を、本出願人により市販されているTEMPO(登録商標)システムとともに使用される、ベアド−パーカー+RPF培地(ビオメリュー Ref.:44003)及びオッタビアーニ・アゴスティ寒天培地(OAA)から得られた液体培地に播種することにより検査した。
【0061】
OAAから得られた培地:
使用された培地は以下の組成からなる。

− 0.1MのMOPSバッファー pH6.70(6N HClを用いて調整した)
− 基質:4−メチルウンベリフェリルミオ−イノシトール−1−リン酸、N−メチル−モルフォリン塩、Biosynth、Ref.M−5717 バッチ20078/1)
上記の培養培地は4−メチルウンベリフェリルミオ−イノシトール−1−リン酸を含有しており、増殖と同時に、蛍光の出現による黄色ブドウ球菌の検出を可能にするための栄養基剤と組み合わされる。
【0062】
TEMPO(登録商標)カードの播種およびインキュベーション:
108コロニー形成単位(CFU)/mlの初期濃度の、検査される株を、103CFU/mlの最終濃度を得るように、トリプトン塩ブロス中に希釈する。
50μlのこの細菌懸濁液を4mlの培養培地に添加する。細菌の量が50CFU/カードとなるように、全部をTEMPO(登録商標)カードに充填する。
TEMPO(登録商標)カードを37℃で24時間インキュベートする。
【0063】
ベアド−パーカー+RPF培地の播種およびインキュベーション:
103CFU/mlの細菌懸濁液は、50μlの割合でベアド−パーカー+RPF培地に播種するためにも使用する。
この培地を37℃で24時間インキュベートする。
【0064】
結果:
TEMPO(登録商標)カードを用いて得られた結果を、最確数(MPN)の方法に従って、TEMPO(登録商標)システムにより解析する。蛍光の出現は、蛍光4−メチルウンベリフェロンの放出を導くPIPLCの4−メチルウンベリフェリルミオ−イノシトール1−リン酸に対する触媒活性に直接関連する。
ベアド−パーカー+RPF培地上で得られたコロニーを従来通りに測定する。
【0065】
以下に示す表1および2は、2つの方法により得られた結果をまとめている。
表1:黄色ブドウ球菌におけるPIPLC活性とコアグラーゼの存在との間の相関関係および各々の方法と関連する数(24h)


表2:ブドウ球菌属におけるPIPLC活性とコアグラーゼの不在の間の相関関係および各々の方法と関連する数(40h)

【0066】
− 検査された黄色ブドウ球菌の全ての株がインキュベーションの24時間後にベアド−パーカー+RPF培地上で発育した。それらは全て、コアグラーゼを有している。
− 非黄色ブドウ球菌の中で、S46という株だけが、コアグラーゼの存在を示す。この株に対してAPIキットを用いて行なわれた検査は、それが実際には黄色ブドウ球菌であることを示した。
− S45株は、ベアド−パーカー+RPF上では、コアグラーゼ表現型を有するが、TEMPOを用いると、陽性シグナルが観察される。ディッシュからの単離は、バチルス属による試料の汚染を示した。
− 24時間で、2株の黄色ブドウ球菌(S1およびS15)は、陽性シグナルとバックグラウンドノイズの間にわずかな変化を示す。これは、ベアド−パーカー+RPF上のこれらのコロニーの周辺の明るくなったハローの小さい直径と一致する。長期のインキュベーション(40時間)は、シグナル対ノイズ比が正しいことを裏付けた。
− PIPLC活性を、ベアド−パーカー+RPF上でコアグラーゼが陽性である株の各々について検出する。コアグラーゼ陰性株は、S45を除いて、PIPLC活性の陽性シグナルを誘導しない。
こうして得られた結果は、それゆえ、黄色ブドウ球菌のコアグラーゼ活性とPIPLC活性との間の相関関係をはっきりと示す。
【0067】
実施例2:2つの異なるPIPLC基質を用いたマイクロプレート中の黄色ブドウ球菌におけるPIPLC活性の解析
19株のATCCの黄色ブドウ球菌をマイクロプレート中のそれらのPIPLC活性について検査する。これらの検査を、実施例1に記載のOAA培地から得られる培地の成分に様々な濃度で添加される、PIPLCの2つの異なる蛍光性基質:4−メチルウンベリフェリル−ミオ−イノシトール1−リン酸および3−クロロ−7−ヒドロキシ−4−メチルクマリンミオ−イノシトールリン酸を用いて行なう。

− 4−メチルウンベリフェリルミオ−イノシトール1−リン酸、N−メチル−モルフォリン塩、Biosynth(Ref.M−5717 ロット20078/1)
− 3−クロロ−7−ヒドロキシ−4−メチルクマリンミオ−イノシトール1−リン酸(PM458.36)
【0068】
3−クロロ−7−ヒドロキシ−4−メチルクマリンミオ−イノシトール1−リン酸の合成
まず、保護されたミオ−イノシトール中間体を、A.V.Rukavishnikov et al.,Chem.Phys.Lipids,89(1997),153-157に従って合成する。
次に、この中間体を、調製された第2の中間体、すなわち、3−クロロ−7−ヒドロキシ−4−メチル−クマリン−ジイソプロピルホスホロアミダイトとカップリングした。所望の産物は、ヨウ化リチウムの存在下におけるカップリング産物の脱メチル化の反応、次のイノシトール部分の脱保護によって得られた(T.O.Zaikova,et al.,Bioconjugate Chem.,12(2001),307−313)。

最終産物のおよび中間体の分子構造をNMRにより解析した。
【0069】
マイクロプレートの播種およびインキュベーション:
108(CFU)/mlの初期濃度の、検査される株を、103CFU/mlの最終濃度を得るように、トリプトン塩ブロス中に希釈する。
10μlのこの細菌懸濁液を200μlの培養培地に添加する。各々の株を、GENios(商標)という名の下でTECAN社により市販されているマイクロプレートリーダー中の培地の各々を用いて、37℃で24時間インキュベートした。
【0070】
播種物の検証:
播種物を検証するために、10mlの103CFU/mlの各々の細菌懸濁液を、ベアド−パーカー+RPF培地(ビオメリュー Ref.:44003)に播種するために使用する。
【0071】
結果:
マイクロプレートにおいて得られた結果を下記の表3にまとめている。+の表示は、バックグラウンドノイズの少なくとも2倍の蛍光の産生を可能にする株に対応する。−の表示は、培地により放出された、バックグラウンドノイズよりも小さいシグナルに対応する。

【0072】
検査された19株のATCCの黄色ブドウ球菌の中で、たった1つだけが、どんな基質を用いても、全くPIPLCシグナルを生じさせなかった(ATCC49775)。17個が、4−メチルウンベリフェリル−ミオ−イノシトール1−リン酸の存在下でPIPLC活性を示し、18個が、3−クロロ−7−ヒドロキシ−4−メチルクマリンミオ−イノシトール1−リン酸の存在下でPIPLC活性を示す。
従って、黄色ブドウ球菌におけるPIPLC活性は、適切に確認される。
【0073】
さらに、PIPLC活性の測定が、(ベアド−パーカー+RPF培地上でコアグラーゼ陽性であることが明らかになった)合計109株の黄色ブドウ球菌と、26株のコアグラーゼ陰性ブドウ球菌とに対して行なわれたことに留意すべきである。得られた結果は下記の表4にまとめられている。

上で提示された結果は、PIPLC活性の測定が黄色ブドウ球菌をコアグラーゼ陰性ブドウ球菌と区別するための非常に意義あるパラメータであることを裏付けている。
【0074】
実施例3:マイクロプレート中の黄色ブドウ球菌のPC−PLC(レシチナーゼ)活性の解析(図1)
2株の黄色ブドウ球菌、ATCC33592およびATCC700699のPC−PLC活性の動力学を以下に示す培地の存在下においてマイクロプレート中で評価した。次に、マイクロプレートの様々なウェルの各々における蛍光の出現の読取りを動的条件下で行なった。
【0075】
1.培地
使用された培地は、以下の組成、pH7.2からなる:

4MU−CPは、M−5528という参照番号の下で、Biosynth社によって製造されている。
【0076】
2.アッセイ
10CFUの黄色ブドウ球菌、ATCC33592およびATCC700699を上記の培地の存在下においてマイクロプレートのウェル中に植菌した。次に、このマイクロプレートを、TECANリーダー中、37℃でインキュベートし、この2株の黄色ブドウ球菌のPC−PLC活性を、4MU−CP基質の加水分解、すなわち、蛍光の出現の動態の形で評価した。
【0077】
3.結果および解釈
4MU−CP基質の加水分解後の蛍光の出現の測定を、検査される2株の黄色ブドウ球菌(STA ATCC33592およびSTA ATCC700699)について、植菌されていない対照培地(ベースライン)と比べて、72時間のインキュベーション時間にわたって行なった。
調査された2株の黄色ブドウ球菌のPC−PLC活性の動態は、図1に示すグラフ上に表示されている。
従って、PC−PLCの蛍光性基質、4MU−CPの使用は、黄色ブドウ球菌の検出および識別を可能にする。
【技術分野】
【0001】
本発明は、一般に、微生物学的分析の分野に関する。特に、本発明は、黄色ブドウ球菌(Staphylococcus aureus)をコアグラーゼ陰性ブドウ球菌と区別することを可能にする、ブドウ球菌の増殖、検出、同定および/または測定のための選択培養培地に関する。
【背景技術】
【0002】
ブドウ球菌(Staphylococcus)属の細菌、すなわちブドウ球菌は、多くの院内感染の原因であり、病院における相当な問題である。これらの細菌はグラム陽性球菌であり、グラム陽性球菌は、血漿の凝固を誘発するタンパク質である、コアグラーゼの産生によって区別される2つの主な群に分類することができる。したがって、区別は、その主な代表が表皮ブドウ球菌(Staphylococcus epidermidis)である、コアグラーゼ陰性ブドウ球菌と、その主な代表が、その毒性で有名な、黄色ブドウ球菌である、コアグラーゼ陽性ブドウ球菌との間で行なわれる。ブドウ球菌は、環境、ヒトおよび動物の皮膚および粘膜において広く発生する。これらの宿主からの定期的に落屑することにより、自然界(水、土壌、大気、食料、物体)に、および衛生の厳格な対策と患者の隔離とが表皮性菌株の拡大を制限するために必要とされる病院環境に広く拡散される。したがって、臨床現場で分離されるブドウ球菌の80〜90%に相当する黄色ブドウ球菌は、特に、院内肺炎、手術創の感染症、火傷の感染症、異物(心臓弁、人工股関節、クランプなど)の感染症、およびしばしば血管内カテーテルの使用が原因であるか、または別の感染の部位からの細菌の伝播が原因である全身感染症または敗血症などの、病院環境における多くの感染症の原因となる主なヒト病原菌である。
【0003】
ブドウ球菌、および特に黄色ブドウ球菌は、食品の分野においても相当な危険性をもたらす。実際、黄色ブドウ球菌の特定の株は腸毒素を産生することができ、消費者によるその摂取は中毒をもたらし、吐き気、腹痛および特に、しばしば下痢を伴う、激しい、反復嘔吐を引き起こす。
【0004】
ブドウ球菌食中毒は、したがって、細菌由来の食中毒の主な形態の1つに相当する。
【0005】
拡散は、通常、病気または健康な保菌者である動物およびヒトにより、生乳(乳腺炎)により、食品や健康または感染保菌者と接触している大気および汚染表面または機器により生じる。
【0006】
食品中のブドウ球菌のおよび特に黄色ブドウ球菌の検出および同定は、それゆえ、主な公衆衛生課題を構成する。
【0007】
ブドウ球菌属の細菌の検出、同定および測定に使用される培養培地の中で、区別は、コロンビア培地またはトリプチケース−ソイ寒天などの非選択培地とチャップマン寒天およびベアド−パーカー寒天などの、選択培地との間で行なわれる。黄色ブドウ球菌は、その形態学的特徴およびその溶血プロファイルによっては、血液寒天上で検出することもできるが、この方法は、感度および特異性があまり高くなく、仮にそうであるとしても、食品業界ではほとんど使用されない。心臓−脳培養液も通常ブドウ球菌の調査に使用される。
【0008】
特定の細菌学的培養培地は特定の微生物の増殖を促進し、その他の増殖を制限する。それらは、標的病原菌以外の微生物の少なくとも1つの阻害剤を含有する。対象の微生物が、生産される食品調製物中で損傷されることがあるので、阻害剤の効果は、前記対象の微生物に限定されたままでなければならない。チャップマン寒天は、その発酵がpH指示薬によって検出される、マンニトールを基質として用いた、普通の栄養基剤上の高塩培地に対応する。前記pH指示薬は、着色指示薬または蛍光指示薬であることができる。ベアド−パーカー培地は、黄色ブドウ球菌を増殖させるのによく用いられる選択剤である、添加されたテルル酸カリウムおよび塩化リチウムを含む富栄養基剤に対応する。塩化リチウムは腸球菌の阻害剤である。他の化学薬品、すなわち、硫酸アンモニウム、ソルビン酸、グリシン、ポリミキシンBを、テルル酸カリウムおよび塩化ナトリウムまたは塩化リチウムと組み合わせることができる。
【0009】
とはいえ、潜在的に毒素原性のブドウ球菌についての食品マトリックスの分析は、臨床実施のために開発された方法の実践的な使用を制限する、特殊な問題を提起する。実際、よく提案される培地は、食品汚染の媒介物とみなされない、コアグラーゼ陰性ブドウ球菌の増殖および、要求される表現型特徴によっては、検出も可能にする。
【0010】
ISO6888−1および6888−2標準に従う参照培地である、ベアド−パーカー+RPF(ウサギ血漿+ウシフィブリノーゲン)培地の場合、いくらかの欠点が一般に観察される。
【0011】
第1に、読取りおよび感度における問題がある。黄色ブドウ球菌の特定の株が、この培地上で発育しないか、またはコアグラーゼ陰性ブドウ球菌の存在を示唆する、非常に弱くかつ遅延したコアグラーゼを示すという事実のために、偽陰性が潜在的に現れる可能性がある。さらに、偽陰性結果は、マトリックスからの干渉のために観察される可能性もある。実際、黄色ブドウ球菌による低レベルの汚染を測定するために、試料の最低限の希釈が行なわれ(1/10)、これは、マトリックス化合物の存在のために、ハローを読み取るときの困難をもたらす(例えば、乳および/または乳製品の試料:カゼインの白色がコアグラーゼを明らかにするハローを隠す)。
【0012】
ベアド−パーカー+RPF培地は、トロンビンの源とプラスミノーゲンの源を組み合わせることを必要とする。後者は、動物の血液から得られるが、このことは、供給の信頼性(品質、量など)の問題を提起する。
さらに、ハローの読取りは、ブロス(液体培地)中では不可能であり、かつハローと培地のコントラストが低下する可能性がある。最後に、コンフルエントなコロニーの場合、ハローを産生するものとそれを産生しないものとを区別するのは困難である。
【0013】
第2に、特異性の問題もあり得る。豊富な付随的細菌叢(例えば、バチルス(Bacillus)属)の存在下で、この種の培地を用いると偽陽性結果が現れることがある。これは、例えば、スタフィロコッカス・キシローサス(Staphylococcus xylosus)をスターターとして用いる特定の肉原料製品(ドライソーセージ)および乳製品(マンステールタイプのチーズ)中の黄色ブドウ球菌を測定する場合に当てはまる。したがって、ハローによって囲まれた黒いコロニー、すなわち、通常はこの培地上の黄色ブドウ球菌の特徴を示すものであるが、実際はスタフィロコッカス・キシローサスの株(ハローのない黒いコロニーを産生する)と、寒天上でハローと認定され得る、濁りを生じさせるバチルスの特定の株との近接した増殖によって生じるコロニーが、ベアドパーカー+RPF培地上に出現する。
【0014】
コアグラーゼ陽性ブドウ球菌とコアグラーゼ陰性ブドウ球菌の類似性がより大きいために、発色性培地などの、代替法の中に、これら2つの群を極めて特異的に識別することを可能にする培地はない。実際、コアグラーゼ陽性ブドウ球菌をコアグラーゼ陰性ブドウ球菌と区別する目的でこの種の培地において利用される区別という概念(すなわち、阻害剤系と組み合わされる、多かれ少なかれ特異的である基質および/または糖)は、非常に多くの場合、複雑であり、特に多様でかつ豊富な微生物叢を含有する食品試料に対する優れた識別を提供しない。
【0015】
コアグラーゼ陽性ブドウ球菌とコアグラーゼ陰性ブドウ球菌(または他の細菌種さえも)の区別のための特異的基質または糖の不在は、偽陰性結果が得られることを潜在的にもたらす、黄色ブドウ球菌の問題となる増殖または酵素活性を変化させ得るかまたは阻害し得る、「積極的な」選択/阻害系を使用することを意味する。
【0016】
マトリックス相互作用を避けるために必要とされる希釈のために、少しの汚染の場合の偽陰性結果が、特定の培地を用いると得られることもある。例えば、3M(商標)ペトリフィルム(商標)Staphエクスプレス測定プレートを用いると、乳製品に存在する高レベルのホスファターゼによってピンク色の着色が生じる。
【0017】
逆に、黄色ブドウ球菌に対する特異性が低い基質の分解または糖の発酵に基づく培地は、十分には選択的でない阻害系と更に組合わせられると、偽陽性結果が得られることになる。
【0018】
最後に、特定の培地は、黄色ブドウ球菌と他のブドウ球菌および細菌種の最適な区別を確実にするために、2つの基質の使用に基づいている。そのような概念の適用は、特に、食品から得られる試料の場合、十分な特異性を提供することなく、培地の費用を増加させる。
【0019】
ホスホリパーゼCタイプの酵素が知られており、多くの微生物中に存在するものとして文献に記載されている。
【0020】
ホスホリパーゼCの中で、黄色ブドウ球菌由来のホスファチジルイノシトールホスホリパーゼC(PIPLC)が精製され、かつ特徴解析されている(Phosphatidylinositol−Specific Phospholipase C from Staphylococcus aureus,METHODS IN ENZYMOLOGY,1981−Vol.71)。
【0021】
この酵素はまた、黄色ブドウ球菌の考えられる毒性因子であると記載されている(JOURNAL OF CLINICAL MICROBIOLOGY,Nov.1989,p.2451−2454−Vol.27,No.11およびINFECTION AND IMMUNITY,Dec.1993,p.5078−5089−Vol.61,No.12)。さらに、黄色ブドウ球菌における活性のあるPIPLCの最大産生を可能にするインビトロでの条件を評価するための研究も発表されている(Marques et al.;Growth in Acidic Media Increases Production of Phosphatidylinositol−Specific Phospholipase C by Staphylococcus aureus;CURRENT MICROBIOLOGY Vol.25(1992),pp.125−128)。
【0022】
文書EP−0 970 239 B1は、様々な微生物によって分泌される、PIPLCの検出を可能にする新規の発色性基質を記載している。示された実施例は、一方で、言及された様々な基質の調製を記載し、他方で、この方法の使用のための最適条件(例えば、基質/酵素濃度、推奨される誘導因子など)を示している。しかしながら、ブドウ球菌の検出を可能にする培養培地はこの文書に記載されていない。
【0023】
文書EP−1 506 309 B1は、PIPLCを産生することができる微生物の検出のための培養培地であって、それらがPIPLCと接触したときに、それぞれ、蛍光と着色を発生させることができる、少なくとも1つの蛍光性化合物と少なくとも1つの発色性化合物の組合せを含有する培養培地を記載している。この培養培地は、阻害剤を添加することなく、リステリア・モノサイトゲネス(Listeria monocytogenes)、リステリア・イバノビイ(Listeria ivanovii)、セレウス菌(Bacillus cereus)、バチルス・チューリンゲンシス(Bacillus thuringiensis)、バチルス・ミコイデス(Bacillus mycoides)、炭疽菌(Bacillus anthracis)、黄色ブドウ球菌、レジオネラ・ニューモフィラ(Legionella pneumophila)、クロストリジウム(Clostridium)の種、ヘリコバクター・ピロリ(Helicobacter pylori)、カンジダ(Candida)の種、およびアスペルギルス(Aspergillus)の種などの、様々な細菌種の検出を可能にするものとして記載されている。しかしながら、黄色ブドウ球菌を検出することを目的とした、そのようなものと同様の培養培地は、この文書に記載されていない。記載されている培養培地は、リステリア・モノサイトゲネスおよびバチルスのセレウス群の検出に関するもののみである。さらに、記載されている全ての培養培地上で、ブドウ球菌の種、および特に黄色ブドウ球菌は増殖しないように思われる。
【0024】
文書EP−0 949 266 B1は、特にリステリア属の細菌活性の指示薬としての、PIPLCに特異的な基質を記載している。該基質は、色または蛍光を生じさせることができる少なくとも1つの化合物を含有する。記載されている培養培地は、リステリア・モノサイトゲネスの検出に関するもののみである。さらに、記載されている全ての培養培地上で、ブドウ球菌の種および特に黄色ブドウ球菌は、それらの阻害のために、増殖しないように思われる。
【0025】
他のホスホリパーゼCと同様に、ホスファチジルコリンホスホリパーゼC(PCPLC)も、黄色ブドウ球菌を含む、様々な細菌に存在するものとして記載されている(J.G.Songer,Trends in Microbiology,Volume 5,Number 4,April 1997,pp.156−161(6))。
【0026】
文書EP−1 219 628は、微生物の検出および同定のための新規の発色基質を記載している。これらの基質は、PCPLCに特異的な基質である。とはいえ、この文書は、黄色ブドウ球菌の検出および同定のための基質も、特異的培養培地も記載していない。
【0027】
このように、25年よりも前に黄色ブドウ球菌由来のPIPLCの特徴解析およびこの細菌種の毒性における潜在的な役割が同定されているにも関わらず、発色性、蛍光性または発光性の、PIPLCに特異的な少なくとも1つの基質の使用に基づく、黄色ブドウ球菌の検出および/または測定に特異的であり、かつブドウ球菌のこの種とその他の種の識別を可能にする培養培地はこれまで記載されていないようなので、記載の培地における黄色ブドウ球菌の株の阻害はそもそも不可能である。さらに、黄色ブドウ球菌を検出または測定するための特異的培養培地における、PCPLCに特異的な発色性、蛍光性または発光性基質の使用、ブドウ球菌のこの種とその他の種の識別を可能にする該基質の使用を記載した文書はない。
【発明の概要】
【発明が解決しようとする課題】
【0028】
上で考慮された当該技術分野の状況によって提起される問題を念頭に置くと、本発明の本質的な目的の1つは、それらを検出するおよび/またはそれらを同定するおよび/またはそれらを測定する、ならびに黄色ブドウ球菌とその他のブドウ球菌の種との識別を可能にする目的のために、ブドウ球菌の増殖を促進する培養培地を供給することである。
【0029】
本発明の別の目的は、特にコアグラーゼ陰性ブドウ球菌による、偽陽性結果の生成を制限する培養培地を供給することである。
【0030】
本発明の別の目的は、特に低レベルの汚染の場合に、減らされた阻害系の使用によって、標的細菌のよりカバーできる培養培地を供給することである。
【0031】
本発明の別の目的は、単一の特異的基質の使用によって、簡単な読取りおよび解釈を可能にする培養培地を供給することである。
【0032】
本発明の別の目的は、読取りの自動化を可能にする培養培地を供給することである。
【0033】
最後に、本発明の最後の目的は、黄色ブドウ球菌の増殖を促進する減らされた選択性のために、結果を返す時間を減らすことを可能にする培養培地を供給することである。
【課題を解決するための手段】
【0034】
これらの目的はとりわけ、本発明によって達成され、本発明は、第1に、黄色ブドウ球菌細菌の増殖、検出、同定および/または測定のための特異的培養培地であって、それがホスホリパーゼCの少なくとも1つの発色性、蛍光性、または発光性基質を含むことを特徴とする培地に関する。
【0035】
「基質」は、微生物の酵素または代謝活性により、直接的にまたは間接的に、検出可能なシグナルを生じさせることができる任意の分子を意味する。
【0036】
基質は、特に酵素基質、すなわち、酵素によって微生物の直接的または間接的な検出を可能にする産物に代謝されることができる基質であることができる。
【0037】
この基質は、特に、検出される酵素活性に特異的な第1の部分と、以下、マーカー部分と呼ばれる、マーカーとしての役割を果たす第2の部分とを含む。このマーカー部分は、発色性、蛍光性、発光性である。好ましくは、本発明において使用される基質は、蛍光性である。本発明者らは、クマリンの誘導体および特にウンベリフェロン、ナフトール、レゾルフィン、フルオレセインについて言及する場合がある。
【0038】
本発明の意味において、この基質は、ホスファチジルイノシトールホスホリパーゼC(PIPLC)の基質であることができる。この場合、培地中のPIPLC基質の濃度は、0.01〜1g/lである。
【0039】
好ましくは、PIPLCの基質は、4−ニトロフェニルミオ−イノシトール1−リン酸、4−メチルウンベリフェリルミオ−イノシトール1−リン酸、3−クロロ−7−ヒドロキシ−4−メチルクマリンミオ−イノシトール1−リン酸、3−エトキシカルボニル−4−メチルクマリンミオ−イノシトール1−リン酸、3−シアノ−4−メチルクマリンミオ−イノシトール1−リン酸を含む群から選ばれる。
【0040】
代わりの方法によれば、基質は、ホスファチジルコリンホスホリパーゼC(PCPLC)の基質であることができる。この場合、培地中のPCPLC基質の濃度は、0.01〜1g/lである。
【0041】
好ましくは、PCPLCの基質は、5−ブロモ−4−クロロ−3−インドキシルコリンリン酸、3−インドキシルコリンリン酸、4−メチルウンベリフェリルコリン−リン酸を含む群から選ばれる。
【0042】
好ましい実施形態では、本発明による培養培地は液体形態である。実際、この形態は、該試料中に潜在的に存在する微生物の放出を可能にするために、培養培地中での固体試料の混合の段階を必要とし得る、食品の微生物学的分析に特に好適である。
【0043】
それでもなお、培養培地は、固体形態(例えば、寒天ベースの培地)であることもできる。液体培地と同じように、ホスホリパーゼC(PIPLCまたはPCPLC)の基質がこれらの固体培地中に存在し、黄色ブドウ球菌の検出、同定、または測定すら可能にすることができる。
【0044】
あるいは、本発明による培養培地は、エステラーゼ(特に、リパーゼまたはホスファターゼ)、コアグラーゼまたはα−グルコシダーゼ活性などの、ホスホリパーゼC活性とは異なる、標的微生物の酵素または代謝活性を検出するのを可能にする基質をさらに含むことができる。直接的な検出のために、この基質を、蛍光または発色性の、マーカーとしての役割を果たす部分に結合させることができる。間接的な検出のために、本発明による培養培地は、基質の消費によって誘導されるpH変化に感受性がありかつ標的微生物の増殖を明らかにする、pH指示薬をさらに含むことができる。該pH指示薬は、発色団または蛍光団であることができる。
【0045】
第1の実施形態によれば、本発明による選択培地は、食品の微生物学的検査において使用される。好ましくは、それは、乳製品中で黄色ブドウ球菌を増殖させて、測定するために使用される。
【0046】
第2の実施形態によれば、本発明による選択培地は、環境の微生物学的モニタリングにおいて使用される。「環境」は、大気の試料、水の試料、または表面からの試料を意味する。表面からの試料の中では、本発明の目的は、院内感染の原因となるコアグラーゼ陽性ブドウ球菌の中で、病院環境における黄色ブドウ球菌の検出に特定の用途を見出すことができる。
【0047】
最後の実施形態によれば、本発明による選択培地は、黄色ブドウ球菌を検出するおよび/または同定するおよび/または測定するための臨床解析において使用される。
【0048】
有利には、本発明による選択培地は、例えば、黄色ブドウ球菌の株のメチシリンに対する耐性の検査の範囲内で、耐性のマーカーをさらに含むことができる。
【0049】
本発明の別の目的は、黄色ブドウ球菌細菌とコアグラーゼ陰性ブドウ球菌との区別のためのホスホリパーゼCの少なくとも1つの発色性、蛍光性、または発光性基質の使用に関する。
【0050】
該使用は、培養培地の製造に限定されない。実際には、ホスホリパーゼC(PIPLCまたはPCPLC)の1以上の基質を有しかつ黄色ブドウ球菌の同定を可能にする同定試薬を作製することが完全に想定される。該試薬を、VITEK(登録商標)カード、API(登録商標)またはRAPiDEC(登録商標)生化学検査キットなどの、本出願人により市販されている製品において使用することができる。
【0051】
本発明の別の目的は、黄色ブドウ球菌細菌の増殖、検出、同定および/または測定のための特異的培養培地を調製するためのホスホリパーゼCの少なくとも1つの基質の使用に関する。
【0052】
本発明の別の目的は、複合試料中の黄色ブドウ球菌細菌を検出するおよび/または同定するおよび/または測定するための、本発明による培養培地の使用に関する。
【0053】
最後に、本発明の最後の目的は、黄色ブドウ球菌細菌の検出および/または同定の方法であって、
a)本発明による培養培地に、黄色ブドウ球菌細菌を含有し得る試料を播種すること;及び
b)該培養培地中の黄色ブドウ球菌細菌の増殖に対応する、培養培地中の蛍光、発光または着色の変化を測定すること
からなる工程を含む、方法に関する。
【0054】
有利には、本発明による方法は、上に述べたように播種された培養培地を、黄色ブドウ球菌細菌の増殖を可能にするのに好適な条件に置くことからなる中間工程a’)を含む。
【0055】
特定の実施形態によれば、本発明による方法は、標的微生物を測定する補足的工程を含むことができる。該測定段階は、好ましくは最確数(MPN)の方法に従って行なわれる。この方法は、本出願人の名における特許EP 1 105 457において説明されている。
【0056】
好ましくは、生物学的試料は、臨床試料、食品試料または環境試料である。
【0057】
本発明による目的の適用は、単一タイプの支持体に限定されるものではないことが最後に留意されるべきである。実際には、インビトロ診断の分野において使用される全てのタイプの支持体、すなわち、マイクロプレート、マイクロチューブ、マイクロカプセル、キャピラリーなどが、使用に好適である。
【0058】
以下の実施例は、図1と併せて、例示の目的のために示されており、決して限定するものではない。これらは本発明を理解することをより容易にするであろう。
【図面の簡単な説明】
【0059】
【図1】2株の黄色ブドウ球菌のPC−PLC(レシチナーゼ)酵素活性を反映する、経時的な蛍光の測定を示す。
【実施例】
【0060】
実施例1:黄色ブドウ球菌におけるPIPLC活性とコアグラーゼの存在との間の相関関係の調査−TEMPO(登録商標)システム/ベアド−パーカー+RPF(BP+RPF)培地の比較
43株の黄色ブドウ球菌および20株のコアグラーゼ陰性ブドウ球菌を、本出願人により市販されているTEMPO(登録商標)システムとともに使用される、ベアド−パーカー+RPF培地(ビオメリュー Ref.:44003)及びオッタビアーニ・アゴスティ寒天培地(OAA)から得られた液体培地に播種することにより検査した。
【0061】
OAAから得られた培地:
使用された培地は以下の組成からなる。

− 0.1MのMOPSバッファー pH6.70(6N HClを用いて調整した)
− 基質:4−メチルウンベリフェリルミオ−イノシトール−1−リン酸、N−メチル−モルフォリン塩、Biosynth、Ref.M−5717 バッチ20078/1)
上記の培養培地は4−メチルウンベリフェリルミオ−イノシトール−1−リン酸を含有しており、増殖と同時に、蛍光の出現による黄色ブドウ球菌の検出を可能にするための栄養基剤と組み合わされる。
【0062】
TEMPO(登録商標)カードの播種およびインキュベーション:
108コロニー形成単位(CFU)/mlの初期濃度の、検査される株を、103CFU/mlの最終濃度を得るように、トリプトン塩ブロス中に希釈する。
50μlのこの細菌懸濁液を4mlの培養培地に添加する。細菌の量が50CFU/カードとなるように、全部をTEMPO(登録商標)カードに充填する。
TEMPO(登録商標)カードを37℃で24時間インキュベートする。
【0063】
ベアド−パーカー+RPF培地の播種およびインキュベーション:
103CFU/mlの細菌懸濁液は、50μlの割合でベアド−パーカー+RPF培地に播種するためにも使用する。
この培地を37℃で24時間インキュベートする。
【0064】
結果:
TEMPO(登録商標)カードを用いて得られた結果を、最確数(MPN)の方法に従って、TEMPO(登録商標)システムにより解析する。蛍光の出現は、蛍光4−メチルウンベリフェロンの放出を導くPIPLCの4−メチルウンベリフェリルミオ−イノシトール1−リン酸に対する触媒活性に直接関連する。
ベアド−パーカー+RPF培地上で得られたコロニーを従来通りに測定する。
【0065】
以下に示す表1および2は、2つの方法により得られた結果をまとめている。
表1:黄色ブドウ球菌におけるPIPLC活性とコアグラーゼの存在との間の相関関係および各々の方法と関連する数(24h)


表2:ブドウ球菌属におけるPIPLC活性とコアグラーゼの不在の間の相関関係および各々の方法と関連する数(40h)

【0066】
− 検査された黄色ブドウ球菌の全ての株がインキュベーションの24時間後にベアド−パーカー+RPF培地上で発育した。それらは全て、コアグラーゼを有している。
− 非黄色ブドウ球菌の中で、S46という株だけが、コアグラーゼの存在を示す。この株に対してAPIキットを用いて行なわれた検査は、それが実際には黄色ブドウ球菌であることを示した。
− S45株は、ベアド−パーカー+RPF上では、コアグラーゼ表現型を有するが、TEMPOを用いると、陽性シグナルが観察される。ディッシュからの単離は、バチルス属による試料の汚染を示した。
− 24時間で、2株の黄色ブドウ球菌(S1およびS15)は、陽性シグナルとバックグラウンドノイズの間にわずかな変化を示す。これは、ベアド−パーカー+RPF上のこれらのコロニーの周辺の明るくなったハローの小さい直径と一致する。長期のインキュベーション(40時間)は、シグナル対ノイズ比が正しいことを裏付けた。
− PIPLC活性を、ベアド−パーカー+RPF上でコアグラーゼが陽性である株の各々について検出する。コアグラーゼ陰性株は、S45を除いて、PIPLC活性の陽性シグナルを誘導しない。
こうして得られた結果は、それゆえ、黄色ブドウ球菌のコアグラーゼ活性とPIPLC活性との間の相関関係をはっきりと示す。
【0067】
実施例2:2つの異なるPIPLC基質を用いたマイクロプレート中の黄色ブドウ球菌におけるPIPLC活性の解析
19株のATCCの黄色ブドウ球菌をマイクロプレート中のそれらのPIPLC活性について検査する。これらの検査を、実施例1に記載のOAA培地から得られる培地の成分に様々な濃度で添加される、PIPLCの2つの異なる蛍光性基質:4−メチルウンベリフェリル−ミオ−イノシトール1−リン酸および3−クロロ−7−ヒドロキシ−4−メチルクマリンミオ−イノシトールリン酸を用いて行なう。

− 4−メチルウンベリフェリルミオ−イノシトール1−リン酸、N−メチル−モルフォリン塩、Biosynth(Ref.M−5717 ロット20078/1)
− 3−クロロ−7−ヒドロキシ−4−メチルクマリンミオ−イノシトール1−リン酸(PM458.36)
【0068】
3−クロロ−7−ヒドロキシ−4−メチルクマリンミオ−イノシトール1−リン酸の合成
まず、保護されたミオ−イノシトール中間体を、A.V.Rukavishnikov et al.,Chem.Phys.Lipids,89(1997),153-157に従って合成する。
次に、この中間体を、調製された第2の中間体、すなわち、3−クロロ−7−ヒドロキシ−4−メチル−クマリン−ジイソプロピルホスホロアミダイトとカップリングした。所望の産物は、ヨウ化リチウムの存在下におけるカップリング産物の脱メチル化の反応、次のイノシトール部分の脱保護によって得られた(T.O.Zaikova,et al.,Bioconjugate Chem.,12(2001),307−313)。

最終産物のおよび中間体の分子構造をNMRにより解析した。
【0069】
マイクロプレートの播種およびインキュベーション:
108(CFU)/mlの初期濃度の、検査される株を、103CFU/mlの最終濃度を得るように、トリプトン塩ブロス中に希釈する。
10μlのこの細菌懸濁液を200μlの培養培地に添加する。各々の株を、GENios(商標)という名の下でTECAN社により市販されているマイクロプレートリーダー中の培地の各々を用いて、37℃で24時間インキュベートした。
【0070】
播種物の検証:
播種物を検証するために、10mlの103CFU/mlの各々の細菌懸濁液を、ベアド−パーカー+RPF培地(ビオメリュー Ref.:44003)に播種するために使用する。
【0071】
結果:
マイクロプレートにおいて得られた結果を下記の表3にまとめている。+の表示は、バックグラウンドノイズの少なくとも2倍の蛍光の産生を可能にする株に対応する。−の表示は、培地により放出された、バックグラウンドノイズよりも小さいシグナルに対応する。

【0072】
検査された19株のATCCの黄色ブドウ球菌の中で、たった1つだけが、どんな基質を用いても、全くPIPLCシグナルを生じさせなかった(ATCC49775)。17個が、4−メチルウンベリフェリル−ミオ−イノシトール1−リン酸の存在下でPIPLC活性を示し、18個が、3−クロロ−7−ヒドロキシ−4−メチルクマリンミオ−イノシトール1−リン酸の存在下でPIPLC活性を示す。
従って、黄色ブドウ球菌におけるPIPLC活性は、適切に確認される。
【0073】
さらに、PIPLC活性の測定が、(ベアド−パーカー+RPF培地上でコアグラーゼ陽性であることが明らかになった)合計109株の黄色ブドウ球菌と、26株のコアグラーゼ陰性ブドウ球菌とに対して行なわれたことに留意すべきである。得られた結果は下記の表4にまとめられている。

上で提示された結果は、PIPLC活性の測定が黄色ブドウ球菌をコアグラーゼ陰性ブドウ球菌と区別するための非常に意義あるパラメータであることを裏付けている。
【0074】
実施例3:マイクロプレート中の黄色ブドウ球菌のPC−PLC(レシチナーゼ)活性の解析(図1)
2株の黄色ブドウ球菌、ATCC33592およびATCC700699のPC−PLC活性の動力学を以下に示す培地の存在下においてマイクロプレート中で評価した。次に、マイクロプレートの様々なウェルの各々における蛍光の出現の読取りを動的条件下で行なった。
【0075】
1.培地
使用された培地は、以下の組成、pH7.2からなる:

4MU−CPは、M−5528という参照番号の下で、Biosynth社によって製造されている。
【0076】
2.アッセイ
10CFUの黄色ブドウ球菌、ATCC33592およびATCC700699を上記の培地の存在下においてマイクロプレートのウェル中に植菌した。次に、このマイクロプレートを、TECANリーダー中、37℃でインキュベートし、この2株の黄色ブドウ球菌のPC−PLC活性を、4MU−CP基質の加水分解、すなわち、蛍光の出現の動態の形で評価した。
【0077】
3.結果および解釈
4MU−CP基質の加水分解後の蛍光の出現の測定を、検査される2株の黄色ブドウ球菌(STA ATCC33592およびSTA ATCC700699)について、植菌されていない対照培地(ベースライン)と比べて、72時間のインキュベーション時間にわたって行なった。
調査された2株の黄色ブドウ球菌のPC−PLC活性の動態は、図1に示すグラフ上に表示されている。
従って、PC−PLCの蛍光性基質、4MU−CPの使用は、黄色ブドウ球菌の検出および識別を可能にする。
【特許請求の範囲】
【請求項1】
黄色ブドウ球菌細菌の増殖、検出、同定および/または測定のための特異的培養培地であって、ホスホリパーゼCの少なくとも1つの蛍光性、発色性、または発光性基質を含むことを特徴とする、培地。
【請求項2】
ホスホリパーゼCの基質がホスファチジルイノシトール・ホスホリパーゼC(PIPLC)の基質であることを特徴とする、請求項1に記載の培養培地。
【請求項3】
PIPLCの基質の濃度が0.01〜1g/lであることを特徴とする、請求項2に記載の培養培地。
【請求項4】
PIPLCの基質が、4-ニトロフェニル・ミヨ-イノシトール-1-リン酸、4-メチルウンベリフェリル・ミオ−イノシトール-1-リン酸、3-クロロ-7-ヒドロキシ-4-メチルクマリン・ミオ-イノシトール-1-リン酸、3-エトキシカルボニル-4-メチルクマリン・ミオ-イノシトール-1-リン酸、3-シアノ-4-メチルクマリン・ミオ-イノシトール-1-リン酸を含む群から選ばれることを特徴とする、請求項2または3に記載の培養培地。
【請求項5】
ホスホリパーゼCの基質がホスファチジルコリン・ホスホリパーゼC(PCPLC)の基質であることを特徴とする、請求項1に記載の培養培地。
【請求項6】
PCPLCの基質の濃度が0.01〜1g/lであることを特徴とする、請求項5に記載の培養培地。
【請求項7】
PCPLCの基質が、5-ブロモ-4-クロロ-3-インドキシル・コリンリン酸、3-インドキシル・コリンリン酸、4-メチルウンベリフェリル・コリンリン酸を含む群から選ばれることを特徴とする、請求項5または6に記載の培養培地。
【請求項8】
コアグラーゼ陰性ブドウ球菌から黄色ブドウ球菌細菌を区別するためのホスホリパーゼCの少なくとも1つの基質の使用。
【請求項9】
黄色ブドウ球菌細菌の増殖、検出、同定および/または測定用の特異的培養培地を調製するためのホスホリパーゼCの少なくとも1つの発色性、蛍光性、または発光性基質の使用。
【請求項10】
複合試料中の黄色ブドウ球菌細菌を検出および/または同定および/または測定するための、請求項1から7の何れか一項に記載の培養培地の使用。
【請求項11】
黄色ブドウ球菌細菌を増殖、検出、同定および/または測定する方法であって、
a)請求項1から7の何れか一項に記載の培養培地に、黄色ブドウ球菌細菌を含有する可能性がある試料を播種する工程、及び
b)前記培養培地中の黄色ブドウ球菌細菌の増殖に対応する、前記培養培地中の蛍光、発光または着色のレベルの変化を測定する工程を
を含む、方法。
【請求項12】
前記播種がされた培養培地を、前記細菌の増殖を可能にするために好適な条件下に置くことからなる中間工程a’)を含む、請求項11に記載の方法。
【請求項13】
黄色ブドウ球菌を測定する補足的工程を含む、請求項12に記載の方法。
【請求項14】
生物学的試料が、臨床試料、食品試料または環境試料であることを特徴とする、請求項11から13の何れか一項に記載の方法。
【請求項1】
黄色ブドウ球菌細菌の増殖、検出、同定および/または測定のための特異的培養培地であって、ホスホリパーゼCの少なくとも1つの蛍光性、発色性、または発光性基質を含むことを特徴とする、培地。
【請求項2】
ホスホリパーゼCの基質がホスファチジルイノシトール・ホスホリパーゼC(PIPLC)の基質であることを特徴とする、請求項1に記載の培養培地。
【請求項3】
PIPLCの基質の濃度が0.01〜1g/lであることを特徴とする、請求項2に記載の培養培地。
【請求項4】
PIPLCの基質が、4-ニトロフェニル・ミヨ-イノシトール-1-リン酸、4-メチルウンベリフェリル・ミオ−イノシトール-1-リン酸、3-クロロ-7-ヒドロキシ-4-メチルクマリン・ミオ-イノシトール-1-リン酸、3-エトキシカルボニル-4-メチルクマリン・ミオ-イノシトール-1-リン酸、3-シアノ-4-メチルクマリン・ミオ-イノシトール-1-リン酸を含む群から選ばれることを特徴とする、請求項2または3に記載の培養培地。
【請求項5】
ホスホリパーゼCの基質がホスファチジルコリン・ホスホリパーゼC(PCPLC)の基質であることを特徴とする、請求項1に記載の培養培地。
【請求項6】
PCPLCの基質の濃度が0.01〜1g/lであることを特徴とする、請求項5に記載の培養培地。
【請求項7】
PCPLCの基質が、5-ブロモ-4-クロロ-3-インドキシル・コリンリン酸、3-インドキシル・コリンリン酸、4-メチルウンベリフェリル・コリンリン酸を含む群から選ばれることを特徴とする、請求項5または6に記載の培養培地。
【請求項8】
コアグラーゼ陰性ブドウ球菌から黄色ブドウ球菌細菌を区別するためのホスホリパーゼCの少なくとも1つの基質の使用。
【請求項9】
黄色ブドウ球菌細菌の増殖、検出、同定および/または測定用の特異的培養培地を調製するためのホスホリパーゼCの少なくとも1つの発色性、蛍光性、または発光性基質の使用。
【請求項10】
複合試料中の黄色ブドウ球菌細菌を検出および/または同定および/または測定するための、請求項1から7の何れか一項に記載の培養培地の使用。
【請求項11】
黄色ブドウ球菌細菌を増殖、検出、同定および/または測定する方法であって、
a)請求項1から7の何れか一項に記載の培養培地に、黄色ブドウ球菌細菌を含有する可能性がある試料を播種する工程、及び
b)前記培養培地中の黄色ブドウ球菌細菌の増殖に対応する、前記培養培地中の蛍光、発光または着色のレベルの変化を測定する工程を
を含む、方法。
【請求項12】
前記播種がされた培養培地を、前記細菌の増殖を可能にするために好適な条件下に置くことからなる中間工程a’)を含む、請求項11に記載の方法。
【請求項13】
黄色ブドウ球菌を測定する補足的工程を含む、請求項12に記載の方法。
【請求項14】
生物学的試料が、臨床試料、食品試料または環境試料であることを特徴とする、請求項11から13の何れか一項に記載の方法。
【図1】




【公表番号】特表2011−530303(P2011−530303A)
【公表日】平成23年12月22日(2011.12.22)
【国際特許分類】
【出願番号】特願2011−522543(P2011−522543)
【出願日】平成21年8月13日(2009.8.13)
【国際出願番号】PCT/FR2009/051588
【国際公開番号】WO2010/018349
【国際公開日】平成22年2月18日(2010.2.18)
【出願人】(504238301)ビオメリュー (74)
【Fターム(参考)】
【公表日】平成23年12月22日(2011.12.22)
【国際特許分類】
【出願日】平成21年8月13日(2009.8.13)
【国際出願番号】PCT/FR2009/051588
【国際公開番号】WO2010/018349
【国際公開日】平成22年2月18日(2010.2.18)
【出願人】(504238301)ビオメリュー (74)
【Fターム(参考)】
[ Back to top ]

