鼻および眼へのコルチコステロイド水溶液送達
本発明は、コルチコステロイドを含む水溶液の製剤を鼻および眼の組織に送達することによる、コルチコステロイド療法に治療的に応答する鼻および/または眼の疾患、症状または障害の治療方法を対象とする。また本発明は、コルチコステロイドおよび抗ヒスタミン剤を含む水溶液の製剤を、鼻、および、眼の組織、涙目に送達するための方法、システム、装置および組成物も対象とする。
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
アレルギー性の症状または障害の治療を必要とする被検者におけるそれらの治療方法であって、該方法は:
該被検者に、治療上有効な量のコルチコステロイド、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を経鼻投与すること、
を含み、ここで該コルチコステロイド溶液は、同じ単位用量のコルチコステロイド懸濁液と比較してより迅速にアレルギー性の症状または障害を緩和する、上記方法。
【請求項2】
アレルギー性の症状または障害の治療を必要とする被検者におけるそれらの治療方法であって、該方法は:
該被検者に、治療上有効な量のコルチコステロイド、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を経鼻投与すること、
を含み、ここで該アレルギー性の症状または障害は、眼の痒み/ごろごろ感、流涙/涙目、眼の赤み/灼熱感、眼および口蓋の痒み、ならびにそれらの組み合わせからなる群より選択される非鼻症状を含む、上記方法。
【請求項3】
眼症状または障害の治療を必要とする被検者においてそれらを治療する方法であって、該方法は:
上記被検者に、治療上有効な量のコルチコステロイド、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を経鼻投与すること、
を含み、ここで上記眼症状または障害は、眼の痒み/ごろごろ感、流涙/涙目、眼の赤み/灼熱感、またはそれらの組み合わせである、上記方法。
【請求項4】
アレルギー性の症状または障害の治療を必要とする被検者においてそれらを治療するシステムであって、該システムは:
治療上有効な量のコルチコステロイド、治療上有効な量の抗ヒスタミン剤、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液、および、
被検者へのコルチコステロイド溶液の経鼻投与のための定量式装置、
を含み、ここで上記装置中に上記コルチコステロイド溶液が提供される、上記システム。
【請求項5】
眼症状または障害の治療を必要とする被検者においてそれらを治療するためのシステムであって、該システムは:
治療上有効な量のコルチコステロイド、治療上有効な量の抗ヒスタミン剤、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液、および、
被検者へのコルチコステロイド溶液の経鼻投与のための定量式装置、
を含み、ここで上記装置中に上記コルチコステロイド溶液が提供される、上記システム。
【請求項6】
治療上有効な量のコルチコステロイド、治療上有効な量の抗ヒスタミン剤、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を含む、経鼻投与のための定量式装置。
【請求項7】
鼻症状または障害の治療を必要とする被検者におけるそれらの治療方法であって、該方法は:
上記被検者に、治療上有効な量のコルチコステロイド、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を経鼻投与すること、
を含み、ここで該症状または障害は、急性または慢性鼻炎、鼻ポリープ、手術後の鼻ポリープ、いびき、群発頭痛、および、それらの組み合わせからなる群より選択される、上記方法。
【請求項8】
鼻症状または障害の治療を必要とする被検者におけるそれらの治療方法であって、該方法は:
上記被検者に、治療上有効な量のコルチコステロイド、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を経鼻投与すること、
を含み、ここで該症状または障害は、閉塞性睡眠時無呼吸、エウスタキー管の機能不全、漿液性中耳炎、睡眠障害、日中の眠気、鼻のフルンケル、鼻出血、鼻粘膜または副鼻腔粘膜の創傷、乾燥性鼻炎症候群、鼻の出血、および、それらの組み合わせからなる群より選択される、上記方法。
【請求項9】
アレルギー性の症状または障害の治療を必要とする被検者におけるそれらの治療方法であって、該方法は:
上記被検者に、治療上有効な量のコルチコステロイド、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を眼内投与すること、
を含み、ここで上記コルチコステロイド溶液は、同じ単位用量のコルチコステロイド懸濁液と比較してより迅速にアレルギー性の症状または障害を緩和する、上記方法。
【請求項10】
眼の炎症の治療を必要とする被検者におけるそれらの治療方法であって、該方法は:
上記被検者に、治療上有効な量のコルチコステロイド、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を眼内投与すること、
を含み、ここで上記コルチコステロイド溶液は、同じ単位用量のコルチコステロイド懸濁液と比較してより迅速に眼の炎症を減少させる、上記方法。
【請求項11】
アレルギー性の症状または障害の治療を必要とする被検者においてそれらを治療するシステムであって、該システムは:
治療上有効な量のコルチコステロイド、治療上有効な量の抗ヒスタミン剤、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液、および、
被検者に上記コルチコステロイド溶液を眼に投与するための装置、
を含み、ここで上記装置中に上記コルチコステロイド溶液が提供される、上記システム。
【請求項12】
治療上有効な量のコルチコステロイド、治療上有効な量の抗ヒスタミン剤、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を含む、眼への投与のための装置。
【請求項13】
治療上有効な量の抗ヒスタミン剤を投与することをさらに含む、請求項1〜3および7〜10のいずれか一項に記載の発明。
【請求項14】
前記定量式装置が、アトマイザー、噴霧器、ポンプスプレー、点滴器、スクイーズチューブ、スクイーズボトル、ピペット、アンプル、鼻カニューレ、定量式装置、鼻内スプレー吸入器、経鼻持続気道陽圧装置、または、呼吸作動式の二方向型送達装置である、請求項4〜6のいずれか一項に記載の発明。
【請求項15】
前記眼への投与のための装置が、点滴器、点滴を計量分配するパッケージ、チューブ、眼用噴霧装置、および、眼の洗浄ユニットからなる群より選択される、請求項11または請求項12に記載の発明。
【請求項16】
前記装置が、単位用量あたり10μl〜500μlの前記コルチコステロイド溶液を放出する、請求項13または請求項14に記載の発明。
【請求項17】
前記装置が、ノズルを含み、ここで該ノズルは、弁を含み、および、ここで該弁は、装置を操作させるごとに該ノズルを介して単位用量あたり体積25μl〜260μlの放出を提供する、請求項4〜6または11〜12のいずれか一項に記載の発明。
【請求項18】
前記コルチコステロイドが、ジプロピオン酸ベクロメタゾン、ベクロメタゾンモノプロピオナート、ベタメタゾン、ブデソニド、シクレソニド、脱イソブチリルシクレソニド、デキサメタゾン、フルニソリド、プロピオン酸フルチカゾン、フロン酸フルチカゾン、フランカルボン酸モメタゾン、トリアムシノロンアセトニド、および、それらの組み合わせからなる群より選択される、請求項1〜17のいずれか一項に記載の発明。
【請求項19】
前記コルチコステロイド溶液が、抗IgE 抗体、抗生物質製剤、抗コリン剤、抗真菌剤、抗炎症薬、抗感染薬物質、抗ヒスタミン剤、鎮痛剤、うっ血除去剤、去痰薬、鎮咳剤、抗菌剤、ロイコトリエン受容体アンタゴニスト、および、それらの組み合わせからなる群より選択される追加の治療上有効な物質をさらに含む、請求項1〜19のいずれか一項に記載の発明。
【請求項20】
前記抗ヒスタミン剤が、ジフェンヒドラミン、クレマスチン、クロルフェニラミン、ブロムフェニラミン、デキスクロルフェニラミン、デキスブロムフェニラミン、トリプロリジン、ドキシラミン、トリペレナミン、ヘプタジン、カルビノキサミン、ブロムジフェンヒドラミン、ヒドロキシジン、ピリラミン、アクリバスチン、AHR−11325、フェニンダミン、アステミゾール、アザタジン、アゼラスチン、セチリジン、エバスチン、フェキソフェナジン、ケトチフェン、ロドキシン(lodoxine)、ロラタジン、デスカルボエトキシロラタジン、レボカバスチン、メキタジン、オキサトミド、セタスチン、タジフィリン(tazifyline)、テメラスチン、テルフェナジン、トリペレナミン、カルボン酸テルフェナジン、フェニルトロキサミン、フェニラミン、および、それらの組み合わせからなる群より選択される、請求項4〜6および11〜13のいずれか一項に記載の発明。
【請求項21】
前記抗ヒスタミン剤が、カレバスチン、エフレチリジン、マピナスチン(mapinastine)、アンタゾリン、ビラスチン(bilastine)、ベシル酸ベポタスチン、ルパタジン、エメダスチン、テカステミゾール(tecastemizole)、エピナスチン、レボセチリジン、ミゾラスチン、ノベラスチン、ノルアステミゾール、オロパタジン、および、それらの組み合わせからなる群より選択される、請求項4〜6および11〜13のいずれか一項に記載の発明。
【請求項22】
前記SAE−CDのコルチコステロイドに対するモル比が、1:1であるか、またはそれより大きい、請求項1〜22のいずれか一項に記載の発明。
【請求項23】
前記SAE−CDの抗ヒスタミン剤に対するモル比が、2:1より大きい、請求項4〜6および11〜22のいずれか一項に記載の発明。
【請求項24】
前記抗ヒスタミン剤が、アゼラスチンである、請求項4〜6、11〜20および22〜23のいずれか一項に記載の発明。
【請求項25】
前記アゼラスチンが、単位用量あたり約30μg〜約275μgの量で存在する、請求項24に記載の発明。
【請求項26】
前記アゼラスチンが、0.5〜10mg/mLの濃度で存在する、請求項24または25に記載の発明。
【請求項27】
前記抗ヒスタミン剤が、オロパタジンである、請求項4〜6、11〜19および21〜23のいずれか一項に記載の発明。
【請求項28】
前記オロパタジンが、単位用量あたり約330μg〜約2660μgの量で存在する、請求項27に記載の発明。
【請求項29】
前記オロパタジンが、1〜15mg/mLの濃度で存在する、請求項27または28に記載の発明。
【請求項30】
前記抗ヒスタミン剤が、セチリジンである、請求項4〜6、11〜20および22〜23のいずれか一項に記載の発明。
【請求項31】
前記セチリジンが、単位用量あたり約0.25mg〜約4.4mgの量で存在する、請求項30に記載の発明。
【請求項32】
前記セチリジンが、0.25〜4.4mg/mLの濃度で存在する、請求項30または31に記載の発明。
【請求項33】
前記投与が、1日1回、または、1日2回行われる、請求項1〜32のいずれか一項に記載の発明。
【請求項34】
前記アレルギー性の症状または障害が、鼻症状、非鼻症状、アレルギー性鼻炎、季節性アレルギー性鼻炎、通年性アレルギー性鼻炎、通年性非アレルギー性鼻炎、花粉症、枯草熱(have fever)、鼻ポリープ、またはそれらの組み合わせであるか、または、それをさらに含む、請求項1、2、4、9または11のいずれか一項に記載の発明。
【請求項35】
前記アレルギー性の症状または障害が、眼症状、細菌性鼻炎、真菌性鼻炎、ウイルス性鼻炎、萎縮性鼻炎、血管運動神経性鼻炎、鼻詰まり、鼻充血、またはそれらの組み合わせであるか、または、それをさらに含む、請求項1、2、4、9または11のいずれか一項に記載の発明。
【請求項36】
前記鼻症状が、鼻漏、鼻充血、鼻の痒み、くしゃみ、鼻閉塞、またはそれらの組み合わせである、請求項34に記載の発明。
【請求項37】
前記非鼻症状が、眼の痒み/ごろごろ感、流涙/涙目、眼の赤み/灼熱感、耳および口蓋の痒み、またはそれらの組み合わせである、請求項34に記載の発明。
【請求項38】
前記コルチコステロイドが、ブデソニドである、請求項1〜38のいずれか一項に記載の発明。
【請求項39】
前記ブデソニドが、単位用量あたり約5μg〜約500μgの量で存在する、請求項38に記載の発明。
【請求項40】
前記ブデソニドが、40〜2000μg/mLの濃度で存在する、請求項38または39に記載の発明。
【請求項41】
前記コルチコステロイドが、プロピオン酸フルチカゾンである、請求項1〜37のいずれか一項に記載の発明。
【請求項42】
前記コルチコステロイドが、フロン酸フルチカゾンである、請求項1〜37のいずれか一項に記載の発明。
【請求項43】
前記コルチコステロイドが、フランカルボン酸モメタゾンである、請求項1〜37のいずれか一項に記載の発明。
【請求項44】
前記コルチコステロイド溶液が:
ブデソニド、プロピオン酸フルチカゾン、フロン酸フルチカゾン、および、フランカルボン酸モメタゾンからなる群より選択されるコルチコステロイド;および、
アゼラスチン、オロパタジン、セチリジン、ロラタジン、デスロラタジン、アジスロマイシン、ボリコナゾール、および、それらの組み合わせからなる群より選択される追加の治療上有効な物質、
を含む、請求項1〜37のいずれか一項に記載の発明。
【請求項45】
前記水性液体キャリアーが、水、緩衝液、アルコール、有機溶媒、グリセリン、プロピレングリコール、ポリ(エチレングリコール)、ポロキサマー、界面活性剤、またはそれらの組み合わせを含む、請求項1〜46のいずれか一項に記載の発明。
【請求項46】
前記水性液体キャリアーが、ポビドン、ポリオール、またはそれらの組み合わせを含む、請求項1〜45のいずれか一項に記載の発明。
【請求項47】
前記SAE−CDが、式1で示される化合物、または、このような化合物の混合物であり:
【化1】

式中:
nは、4、5または6であり;
R1、R2、R3、R4、R5、R6、R7、R8およびR9は、それぞれ独立して、−O−、または、−O−(C2−C6アルキレン)−SO3-基であり、ここでR1〜R9のうち少なくとも1つは、独立して、−O−(C2−C6アルキレン)−SO3-基、−O−(CH2)mSO3-基であり、ここでmは2〜6であり、−OCH2CH2CH2SO3−、または、−OCH2CH2CH2CH2SO3-であり;および、
Sl、S2、S3、S4、S5、S6、S7、S8およびS9は、それぞれ独立して、製薬上許容できるカチオンである、請求項1〜46のいずれか一項に記載の発明。
【請求項48】
前記コルチコステロイド溶液が、保存剤、抗酸化剤、緩衝剤、酸性化物質、アルカリ化剤、溶解促進剤、錯化促進剤、希釈剤、電解質、グルコース、安定剤、充填剤、消泡剤、油、乳化剤、矯味矯臭薬剤、甘味料、味マスキング剤、張度調節物質、表面張力調節剤、粘度調整剤、密度調節剤、および、それらの組み合わせからなる群より選択される1種またはそれより多くの製薬上許容できる賦形剤をさらに含む、請求項1〜47のいずれか一項に記載の発明。
【請求項49】
前記SAE−CDが、コルチコステロイド溶液1mLあたり約10mg〜約500mgのSAE−CD濃度で存在する、請求項1〜48のいずれか一項に記載の発明。
【請求項50】
前記SAE−CDが、単位用量あたり100μg〜1000mgの量で存在する、請求項1〜49のいずれか一項に記載の発明。
【請求項1】
アレルギー性の症状または障害の治療を必要とする被検者におけるそれらの治療方法であって、該方法は:
該被検者に、治療上有効な量のコルチコステロイド、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を経鼻投与すること、
を含み、ここで該コルチコステロイド溶液は、同じ単位用量のコルチコステロイド懸濁液と比較してより迅速にアレルギー性の症状または障害を緩和する、上記方法。
【請求項2】
アレルギー性の症状または障害の治療を必要とする被検者におけるそれらの治療方法であって、該方法は:
該被検者に、治療上有効な量のコルチコステロイド、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を経鼻投与すること、
を含み、ここで該アレルギー性の症状または障害は、眼の痒み/ごろごろ感、流涙/涙目、眼の赤み/灼熱感、眼および口蓋の痒み、ならびにそれらの組み合わせからなる群より選択される非鼻症状を含む、上記方法。
【請求項3】
眼症状または障害の治療を必要とする被検者においてそれらを治療する方法であって、該方法は:
上記被検者に、治療上有効な量のコルチコステロイド、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を経鼻投与すること、
を含み、ここで上記眼症状または障害は、眼の痒み/ごろごろ感、流涙/涙目、眼の赤み/灼熱感、またはそれらの組み合わせである、上記方法。
【請求項4】
アレルギー性の症状または障害の治療を必要とする被検者においてそれらを治療するシステムであって、該システムは:
治療上有効な量のコルチコステロイド、治療上有効な量の抗ヒスタミン剤、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液、および、
被検者へのコルチコステロイド溶液の経鼻投与のための定量式装置、
を含み、ここで上記装置中に上記コルチコステロイド溶液が提供される、上記システム。
【請求項5】
眼症状または障害の治療を必要とする被検者においてそれらを治療するためのシステムであって、該システムは:
治療上有効な量のコルチコステロイド、治療上有効な量の抗ヒスタミン剤、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液、および、
被検者へのコルチコステロイド溶液の経鼻投与のための定量式装置、
を含み、ここで上記装置中に上記コルチコステロイド溶液が提供される、上記システム。
【請求項6】
治療上有効な量のコルチコステロイド、治療上有効な量の抗ヒスタミン剤、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を含む、経鼻投与のための定量式装置。
【請求項7】
鼻症状または障害の治療を必要とする被検者におけるそれらの治療方法であって、該方法は:
上記被検者に、治療上有効な量のコルチコステロイド、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を経鼻投与すること、
を含み、ここで該症状または障害は、急性または慢性鼻炎、鼻ポリープ、手術後の鼻ポリープ、いびき、群発頭痛、および、それらの組み合わせからなる群より選択される、上記方法。
【請求項8】
鼻症状または障害の治療を必要とする被検者におけるそれらの治療方法であって、該方法は:
上記被検者に、治療上有効な量のコルチコステロイド、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を経鼻投与すること、
を含み、ここで該症状または障害は、閉塞性睡眠時無呼吸、エウスタキー管の機能不全、漿液性中耳炎、睡眠障害、日中の眠気、鼻のフルンケル、鼻出血、鼻粘膜または副鼻腔粘膜の創傷、乾燥性鼻炎症候群、鼻の出血、および、それらの組み合わせからなる群より選択される、上記方法。
【請求項9】
アレルギー性の症状または障害の治療を必要とする被検者におけるそれらの治療方法であって、該方法は:
上記被検者に、治療上有効な量のコルチコステロイド、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を眼内投与すること、
を含み、ここで上記コルチコステロイド溶液は、同じ単位用量のコルチコステロイド懸濁液と比較してより迅速にアレルギー性の症状または障害を緩和する、上記方法。
【請求項10】
眼の炎症の治療を必要とする被検者におけるそれらの治療方法であって、該方法は:
上記被検者に、治療上有効な量のコルチコステロイド、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を眼内投与すること、
を含み、ここで上記コルチコステロイド溶液は、同じ単位用量のコルチコステロイド懸濁液と比較してより迅速に眼の炎症を減少させる、上記方法。
【請求項11】
アレルギー性の症状または障害の治療を必要とする被検者においてそれらを治療するシステムであって、該システムは:
治療上有効な量のコルチコステロイド、治療上有効な量の抗ヒスタミン剤、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液、および、
被検者に上記コルチコステロイド溶液を眼に投与するための装置、
を含み、ここで上記装置中に上記コルチコステロイド溶液が提供される、上記システム。
【請求項12】
治療上有効な量のコルチコステロイド、治療上有効な量の抗ヒスタミン剤、SAE−CD、および、製薬上許容できる水性液体キャリアーを含むコルチコステロイド溶液を含む、眼への投与のための装置。
【請求項13】
治療上有効な量の抗ヒスタミン剤を投与することをさらに含む、請求項1〜3および7〜10のいずれか一項に記載の発明。
【請求項14】
前記定量式装置が、アトマイザー、噴霧器、ポンプスプレー、点滴器、スクイーズチューブ、スクイーズボトル、ピペット、アンプル、鼻カニューレ、定量式装置、鼻内スプレー吸入器、経鼻持続気道陽圧装置、または、呼吸作動式の二方向型送達装置である、請求項4〜6のいずれか一項に記載の発明。
【請求項15】
前記眼への投与のための装置が、点滴器、点滴を計量分配するパッケージ、チューブ、眼用噴霧装置、および、眼の洗浄ユニットからなる群より選択される、請求項11または請求項12に記載の発明。
【請求項16】
前記装置が、単位用量あたり10μl〜500μlの前記コルチコステロイド溶液を放出する、請求項13または請求項14に記載の発明。
【請求項17】
前記装置が、ノズルを含み、ここで該ノズルは、弁を含み、および、ここで該弁は、装置を操作させるごとに該ノズルを介して単位用量あたり体積25μl〜260μlの放出を提供する、請求項4〜6または11〜12のいずれか一項に記載の発明。
【請求項18】
前記コルチコステロイドが、ジプロピオン酸ベクロメタゾン、ベクロメタゾンモノプロピオナート、ベタメタゾン、ブデソニド、シクレソニド、脱イソブチリルシクレソニド、デキサメタゾン、フルニソリド、プロピオン酸フルチカゾン、フロン酸フルチカゾン、フランカルボン酸モメタゾン、トリアムシノロンアセトニド、および、それらの組み合わせからなる群より選択される、請求項1〜17のいずれか一項に記載の発明。
【請求項19】
前記コルチコステロイド溶液が、抗IgE 抗体、抗生物質製剤、抗コリン剤、抗真菌剤、抗炎症薬、抗感染薬物質、抗ヒスタミン剤、鎮痛剤、うっ血除去剤、去痰薬、鎮咳剤、抗菌剤、ロイコトリエン受容体アンタゴニスト、および、それらの組み合わせからなる群より選択される追加の治療上有効な物質をさらに含む、請求項1〜19のいずれか一項に記載の発明。
【請求項20】
前記抗ヒスタミン剤が、ジフェンヒドラミン、クレマスチン、クロルフェニラミン、ブロムフェニラミン、デキスクロルフェニラミン、デキスブロムフェニラミン、トリプロリジン、ドキシラミン、トリペレナミン、ヘプタジン、カルビノキサミン、ブロムジフェンヒドラミン、ヒドロキシジン、ピリラミン、アクリバスチン、AHR−11325、フェニンダミン、アステミゾール、アザタジン、アゼラスチン、セチリジン、エバスチン、フェキソフェナジン、ケトチフェン、ロドキシン(lodoxine)、ロラタジン、デスカルボエトキシロラタジン、レボカバスチン、メキタジン、オキサトミド、セタスチン、タジフィリン(tazifyline)、テメラスチン、テルフェナジン、トリペレナミン、カルボン酸テルフェナジン、フェニルトロキサミン、フェニラミン、および、それらの組み合わせからなる群より選択される、請求項4〜6および11〜13のいずれか一項に記載の発明。
【請求項21】
前記抗ヒスタミン剤が、カレバスチン、エフレチリジン、マピナスチン(mapinastine)、アンタゾリン、ビラスチン(bilastine)、ベシル酸ベポタスチン、ルパタジン、エメダスチン、テカステミゾール(tecastemizole)、エピナスチン、レボセチリジン、ミゾラスチン、ノベラスチン、ノルアステミゾール、オロパタジン、および、それらの組み合わせからなる群より選択される、請求項4〜6および11〜13のいずれか一項に記載の発明。
【請求項22】
前記SAE−CDのコルチコステロイドに対するモル比が、1:1であるか、またはそれより大きい、請求項1〜22のいずれか一項に記載の発明。
【請求項23】
前記SAE−CDの抗ヒスタミン剤に対するモル比が、2:1より大きい、請求項4〜6および11〜22のいずれか一項に記載の発明。
【請求項24】
前記抗ヒスタミン剤が、アゼラスチンである、請求項4〜6、11〜20および22〜23のいずれか一項に記載の発明。
【請求項25】
前記アゼラスチンが、単位用量あたり約30μg〜約275μgの量で存在する、請求項24に記載の発明。
【請求項26】
前記アゼラスチンが、0.5〜10mg/mLの濃度で存在する、請求項24または25に記載の発明。
【請求項27】
前記抗ヒスタミン剤が、オロパタジンである、請求項4〜6、11〜19および21〜23のいずれか一項に記載の発明。
【請求項28】
前記オロパタジンが、単位用量あたり約330μg〜約2660μgの量で存在する、請求項27に記載の発明。
【請求項29】
前記オロパタジンが、1〜15mg/mLの濃度で存在する、請求項27または28に記載の発明。
【請求項30】
前記抗ヒスタミン剤が、セチリジンである、請求項4〜6、11〜20および22〜23のいずれか一項に記載の発明。
【請求項31】
前記セチリジンが、単位用量あたり約0.25mg〜約4.4mgの量で存在する、請求項30に記載の発明。
【請求項32】
前記セチリジンが、0.25〜4.4mg/mLの濃度で存在する、請求項30または31に記載の発明。
【請求項33】
前記投与が、1日1回、または、1日2回行われる、請求項1〜32のいずれか一項に記載の発明。
【請求項34】
前記アレルギー性の症状または障害が、鼻症状、非鼻症状、アレルギー性鼻炎、季節性アレルギー性鼻炎、通年性アレルギー性鼻炎、通年性非アレルギー性鼻炎、花粉症、枯草熱(have fever)、鼻ポリープ、またはそれらの組み合わせであるか、または、それをさらに含む、請求項1、2、4、9または11のいずれか一項に記載の発明。
【請求項35】
前記アレルギー性の症状または障害が、眼症状、細菌性鼻炎、真菌性鼻炎、ウイルス性鼻炎、萎縮性鼻炎、血管運動神経性鼻炎、鼻詰まり、鼻充血、またはそれらの組み合わせであるか、または、それをさらに含む、請求項1、2、4、9または11のいずれか一項に記載の発明。
【請求項36】
前記鼻症状が、鼻漏、鼻充血、鼻の痒み、くしゃみ、鼻閉塞、またはそれらの組み合わせである、請求項34に記載の発明。
【請求項37】
前記非鼻症状が、眼の痒み/ごろごろ感、流涙/涙目、眼の赤み/灼熱感、耳および口蓋の痒み、またはそれらの組み合わせである、請求項34に記載の発明。
【請求項38】
前記コルチコステロイドが、ブデソニドである、請求項1〜38のいずれか一項に記載の発明。
【請求項39】
前記ブデソニドが、単位用量あたり約5μg〜約500μgの量で存在する、請求項38に記載の発明。
【請求項40】
前記ブデソニドが、40〜2000μg/mLの濃度で存在する、請求項38または39に記載の発明。
【請求項41】
前記コルチコステロイドが、プロピオン酸フルチカゾンである、請求項1〜37のいずれか一項に記載の発明。
【請求項42】
前記コルチコステロイドが、フロン酸フルチカゾンである、請求項1〜37のいずれか一項に記載の発明。
【請求項43】
前記コルチコステロイドが、フランカルボン酸モメタゾンである、請求項1〜37のいずれか一項に記載の発明。
【請求項44】
前記コルチコステロイド溶液が:
ブデソニド、プロピオン酸フルチカゾン、フロン酸フルチカゾン、および、フランカルボン酸モメタゾンからなる群より選択されるコルチコステロイド;および、
アゼラスチン、オロパタジン、セチリジン、ロラタジン、デスロラタジン、アジスロマイシン、ボリコナゾール、および、それらの組み合わせからなる群より選択される追加の治療上有効な物質、
を含む、請求項1〜37のいずれか一項に記載の発明。
【請求項45】
前記水性液体キャリアーが、水、緩衝液、アルコール、有機溶媒、グリセリン、プロピレングリコール、ポリ(エチレングリコール)、ポロキサマー、界面活性剤、またはそれらの組み合わせを含む、請求項1〜46のいずれか一項に記載の発明。
【請求項46】
前記水性液体キャリアーが、ポビドン、ポリオール、またはそれらの組み合わせを含む、請求項1〜45のいずれか一項に記載の発明。
【請求項47】
前記SAE−CDが、式1で示される化合物、または、このような化合物の混合物であり:
【化1】

式中:
nは、4、5または6であり;
R1、R2、R3、R4、R5、R6、R7、R8およびR9は、それぞれ独立して、−O−、または、−O−(C2−C6アルキレン)−SO3-基であり、ここでR1〜R9のうち少なくとも1つは、独立して、−O−(C2−C6アルキレン)−SO3-基、−O−(CH2)mSO3-基であり、ここでmは2〜6であり、−OCH2CH2CH2SO3−、または、−OCH2CH2CH2CH2SO3-であり;および、
Sl、S2、S3、S4、S5、S6、S7、S8およびS9は、それぞれ独立して、製薬上許容できるカチオンである、請求項1〜46のいずれか一項に記載の発明。
【請求項48】
前記コルチコステロイド溶液が、保存剤、抗酸化剤、緩衝剤、酸性化物質、アルカリ化剤、溶解促進剤、錯化促進剤、希釈剤、電解質、グルコース、安定剤、充填剤、消泡剤、油、乳化剤、矯味矯臭薬剤、甘味料、味マスキング剤、張度調節物質、表面張力調節剤、粘度調整剤、密度調節剤、および、それらの組み合わせからなる群より選択される1種またはそれより多くの製薬上許容できる賦形剤をさらに含む、請求項1〜47のいずれか一項に記載の発明。
【請求項49】
前記SAE−CDが、コルチコステロイド溶液1mLあたり約10mg〜約500mgのSAE−CD濃度で存在する、請求項1〜48のいずれか一項に記載の発明。
【請求項50】
前記SAE−CDが、単位用量あたり100μg〜1000mgの量で存在する、請求項1〜49のいずれか一項に記載の発明。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6A】


【図6B】


【図6C】


【図6D】


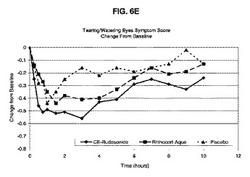
【図6E】


【図6F】


【図7】


【図8】


【図9A】


【図9B】


【図9C】


【図10A】


【図10B】


【図10C】


【図11】


【図12A】


【図12B】


【図12C】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6A】


【図6B】


【図6C】


【図6D】


【図6E】


【図6F】


【図7】


【図8】


【図9A】


【図9B】


【図9C】


【図10A】


【図10B】


【図10C】


【図11】


【図12A】


【図12B】


【図12C】


【図13】


【公表番号】特表2010−531898(P2010−531898A)
【公表日】平成22年9月30日(2010.9.30)
【国際特許分類】
【出願番号】特願2010−515235(P2010−515235)
【出願日】平成20年6月30日(2008.6.30)
【国際出願番号】PCT/US2008/068872
【国際公開番号】WO2009/003199
【国際公開日】平成20年12月31日(2008.12.31)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.テフロン
2.TEFLON
【出願人】(501278788)サイデックス・ファーマシューティカルズ・インコーポレイテッド (18)
【Fターム(参考)】
【公表日】平成22年9月30日(2010.9.30)
【国際特許分類】
【出願日】平成20年6月30日(2008.6.30)
【国際出願番号】PCT/US2008/068872
【国際公開番号】WO2009/003199
【国際公開日】平成20年12月31日(2008.12.31)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.テフロン
2.TEFLON
【出願人】(501278788)サイデックス・ファーマシューティカルズ・インコーポレイテッド (18)
【Fターム(参考)】
[ Back to top ]

