鼻用組成物
【課題】 くしゃみ等の鼻炎症状を有効に抑制し、しかも副作用等の問題のない安全性の高い鼻用組成物の提供。
【解決手段】べにふうきエキスを有効成分とする鼻用組成物である。また、べにふうきのポリフェノール画分を有効成分とする鼻用組成物である。
【解決手段】べにふうきエキスを有効成分とする鼻用組成物である。また、べにふうきのポリフェノール画分を有効成分とする鼻用組成物である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、鼻用組成物に関し、さらに詳細には、べにふうきエキスを有効成分とする鼻用組成物に関する。
【背景技術】
【0002】
鼻炎は急性鼻炎、慢性鼻炎、副鼻腔炎などのウイルス性、細菌性、および真菌性感染あるいはアレルギー反応により誘発される疾患であり、くしゃみ、水性鼻汁(鼻みず)、および鼻閉(鼻づまり)などを主症状とする。これらの鼻炎症状は、患者に著しい不快感を与えるだけでなく、その症状は患者の日常生活に多大な支障をもたらしている。
【0003】
これらの鼻炎症状の緩和のために、ヒスタミンなどのメディエーターを抑制する薬剤が用いられている。例えば、茶葉から抽出した3−O−メチルガロイルエピガロカテキンおよび/または4−O−メチルガロイルエピガロカテキンが、ヒスタミン遊離抑制作用等を有することが報告されている(特許文献1)。また、これらの物質が、IV型アレルギー反応を阻害すること(非特許文献1)、ヒト好塩基球様細胞株KU812のIgEレセプターの発現を抑制すること(非特許文献2)、肥満細胞のプロテインキナーゼを抑制すること(非特許文献3)などが報告されている。さらに、この3−O−メチルガロイルエピガロカテキン等を含む飲食品を摂取することによって、花粉症の症状が改善されることが開示されている(特許文献2)。さらにまた、特定の種類の茶葉を用いた茶を飲用することによって、花粉症の症状が改善されることが開示されている(特許文献3)。しかしながら、これらの文献には、茶葉からの抽出物を外用で適用させることについて具体的な記載はなく、外用剤として用いた場合に鼻炎症状を抑制できるかどうかこれまで知られていなかった。
【0004】
【特許文献1】特開2000−159670号公報
【特許文献2】特開2004−105078号公報
【特許文献3】特開2005−60277号公報
【非特許文献1】ジャーナル・オブ・アグリカルチュラル・アンド・フード・ケミストリー、2000年、第48巻、第5649−5653頁
【非特許文献2】ジャーナル・オブ・アグリカルチュラル・アンド・フード・ケミストリー、2002年、第50巻、第5729−5734頁
【非特許文献3】ザ・ジャーナル・オブ・イムノロジー、2004年、第172巻、第4486−4492頁
【発明の開示】
【発明が解決しようとする課題】
【0005】
したがって、くしゃみ等の鼻炎症状を有効に抑制しうる鼻用組成物の開発が求められており、本発明はかかる鼻用組成物を提供することを課題とする。
【課題を解決するための手段】
【0006】
本発明者らは、鼻炎の症状を抑制する物質について鋭意検討を行った結果、べにふうきのエキスが、点鼻によって、鼻炎症状に対して優れた抑制効果を有することを見出し、本発明を完成するに至った。
【0007】
すなわち本発明は、べにふうきエキスを有効成分とする鼻用組成物である。
【0008】
また本発明は、べにふうきのポリフェノール画分を有効成分とする鼻用組成物である。
【発明の効果】
【0009】
本発明の鼻用組成物は、くしゃみ、水性鼻汁(鼻みず)、および鼻閉(鼻づまり)などの鼻炎症状を抑制することが出来る。
【0010】
また、このものは、飲用される茶の1品種であるべにふうきのエキスを有効成分とするものであるため、長期間使用が可能な、安全性の高いものである。
【発明を実施するための最良の形態】
【0011】
本発明に使用するべにふうきエキスは、茶の品種の一つであるべにふうき種の茶葉から得られたものである。原料であるべにふうきの茶葉は、通常の製法により緑茶に製したもの、生のもの、半発酵または発酵させたもの、乾燥したものあるいは焙煎したもののいずれでも用いることができる。
【0012】
本発明のべにふうきエキスは、上記べにふうきの茶葉を適当な溶媒を用いて抽出することによって得られる。抽出に用いられる溶媒としては、具体的には、水、エタノール、メタノール、アセトン、1,3−ブチレングリコール、グリセリン等の有機溶媒、またはそれらの混液などが挙げられるが、好ましくは、水、水/エタノール混液等である。
【0013】
本発明において使用されるべにふうきエキスの具体的製造法としては、例えば、べにふうきの茶葉1重量部に対し、5ないし100重量部の溶媒を加え、室温ないし100℃程度の温度で、1ないし120分間程度抽出する方法が挙げられる。
【0014】
本発明のべにふうきエキスとしては、上記べにふうき種の茶葉を、直接前記した溶媒によって抽出して得た抽出液の他、当該抽出液を、さらに液−液分配して得られる溶媒画分を利用することもできる。この液−液分配に使用される溶媒としては、酢酸エチル、n−ブタノール等を挙げることができる。または、当該抽出液を吸着樹脂を充填したカラム等に通すことにより得られる画分を利用することもできる。使用される吸着樹脂としては、活性炭、ダイヤイオンHP−20、セファデックスLH−20、ODSゲル等を挙げることができる。
【0015】
上記のようにして得られるべにふうきエキスのうち、ポリフェノール成分を多く含有するポリフェノール画分が、高い抗アレルギー作用を有するため好ましく用いることができる。このようなポリフェノール画分としては、例えば、べにふうきの茶葉を熱水により抽出した抽出液を、さらに、酢酸エチルで液−液分配することによって得られる酢酸エチル画分を例示できる。また、この酢酸エチル画分を水で洗浄することにより、カフェイン含有量を減少させたポリフェノール画分を得ることができる。
【0016】
上記したべにふうきエキスは、そのままの状態で鼻用組成物に使用しても、また、必要により、公知の精製手段により精製したものや、濃縮または希釈したもの、更に必要によりスプレードライや凍結乾燥などの手段で粉末化したものを鼻用組成物に用いても良い。
上記鼻用組成物の製造にあたっては、例えば、前記べにふうきエキスを、製剤全体に対して、0.001〜10%配合することが好ましく、0.01〜1%が更に好ましい。
【0017】
さらに、本発明の鼻用組成物は、上記べにふうきエキスのみを有効成分として配合しても優れた鼻炎症状抑制効果を有するものであるが、必要により、更に他の薬効成分を配合することもできる。この薬効成分としては、例えば、血管収縮剤、殺菌剤、消炎剤、抗ヒスタミン剤、局所麻酔剤、清涼剤、保湿剤等が挙げられる。
【0018】
更にまた、本発明の鼻用組成物は、必要に応じて公知の任意成分、たとえば、炭化水素類、エステル油、エーテル油、高級脂肪酸、高級アルコール、スフィンゴシン誘導体、合成セラミド類似体などの油剤、多価アルコール、皮膜形成剤、保湿剤、抗酸化剤、界面活性剤、抗菌剤、防腐剤、粉体、粘土鉱物、無機塩、色素、溶剤、紫外線防止剤、pH調整剤、粘度調整剤、香料などを配合することができる。
【0019】
本発明の鼻用組成物は、点鼻薬、鼻洗浄剤、鼻軟膏、鼻うがい剤等の鼻腔内および鼻周辺へ適用するものを指し、滴下式、塗布式、エアゾール式、スプレー式、吸入式等の種々の形態をとることができる。
【0020】
本発明の鼻用組成物は、鼻炎疾患の種類や症状の程度に応じて適宜適用することができるが、一般的には、1日あたり0.01〜20mL程度の量を適用すればよい。
【実施例】
【0021】
次に実施例を挙げて、本発明を更に詳しく説明するが、本発明はこれら実施例に何ら制約されるものではない。
【0022】
実 施 例 1
(べにふうきエキスの製造方法)
べにふうき茶葉4kgを40Lの熱水にて30分間抽出し、抽出液を得た。抽出液は濃縮・乾燥した後、水を加えて溶解し、酢酸エチルを加えて振とう抽出を行った。酢酸エチル層を約半量まで減圧下濃縮した後、水を加え洗浄した。洗浄した酢酸エチル層に水を加えながら減圧下濃縮し、溶媒を留去した後、凍結乾燥し、べにふうきエキス約200gを得た。
【0023】
(べにふうきエキスの成分分析)
実施例1で得られたべにふうきエキス中のタンニン含量を、「日本食品標準成分表 分析マニュアル」に記載されている酒石酸鉄吸光光度法により実施例1で得られたべにふうきエキス中のタンニン含量を測定したところ、タンニン含量は91.0%であった。また、ODSカラム(移動相:アセトニトリル/水/リン酸混液(50:330:0.3))を用いた逆相HPLCによって、3−O−メチルガロイルエピガロカテキン及びカフェインの含量を定量した結果、3−O−メチルガロイルエピガロカテキンの含量は10.1%、カフェイン含量は3.4%であった。
【0024】
実 施 例 2
(べにふうきエキスの製造方法)
べにふうき茶葉5kgを50Lのアセトン/水(1:1)混液にて1日室温抽出し、抽出液を得た。抽出液は減圧下濃縮して溶媒を留去した後、吸着剤セファデックスLH−20を充填したカラムに吸着させ、溶離液としてまず水を通液し、その後薄層クロマトグラフィー(TLC)でモニターしながら徐々にメタノール濃度を上げていくことにより、ポリフェノール成分を溶出させた。得られたポリフェノール画分を減圧下濃縮し、溶媒を留去した後、凍結乾燥し、べにふうきエキス約250gを得た。
【0025】
実 施 例 3
(べにふうきエキスの製造方法)
べにふうき茶葉10kgを100Lの熱水にて30分間抽出し、得られた抽出液をクロロホルム洗浄して不要物を除去した。洗浄した水溶液を、吸着剤ダイヤイオンHP−20を充填したカラムに吸着させ、溶離液としてまず水を通液し、その後TLCでモニターしながら徐々にメタノール濃度を上げていくことにより、ポリフェノール成分を溶出させた。得られたポリフェノール画分を減圧下濃縮し、溶媒を留去した後、スプレードライし、べにふうきエキス約500gを得た。
【0026】
試 験 例 1
IgE受容体結合阻害試験
(1)マウス骨髄由来肥満細胞(BMMC)の作製
BALB/cマウスの大腿骨から骨髄を採取し、骨髄細胞をマウスIL−3およびマウスSCFを添加して、高親和性IgE受容体(FcεRI)の発現が一定になるまで継代培養した。
(2)発現誘導に対する阻害作用
(1)で作製したBMMCを96ウェル培養プレートに播種し、実施例1で得られたべにふうきエキスをジメチルスルホキシド(DMSO)溶解後、培地によって種々の濃度に調製した被検物質を添加した。次に、抗TNPマウスIgE抗体を添加して、37℃、5%CO2インキュベーターにて3日間培用した。培養終了後、冷バッファー(0.1%ウシ血清アルブミン(BSA)、0.1%NaN3含有PBS)で洗浄し、次いで冷バッファーで調製したフルオレッセインイソチオシアネート(FITC)抱合抗マウスIgE抗体を添加して4℃で60分間反応させた。反応終了後、細胞を冷バッファーで洗浄し固定した後、冷PBSに懸濁して測定用サンプルとした。IgE受容体に対するIgE結合は、フローサイトメーターFACS calibur(ベックマン・コールター社製)を用いて測定した。なお、陽性対照として、Rose Bengal 3、10、30μg/mLを用いた。結果を表1に示す。
(3)受容体結合阻害作用
冷バッファーで調製したBMMC懸濁液を96ウェルプレートに播種し、同様に冷バッファーで種々の濃度に調製した被検物質を添加した。次に、抗TNPマウスIgE抗体を添加して4℃で120分間反応させた。反応終了後、冷バッファーで洗浄し、FITC抱合マウスIgE抗体を添加して4℃で60分間反応させた。反応終了後、細胞を冷バッファーで洗浄し固定した後、冷PBSに懸濁して測定用サンプルとした。IgE受容体に対するIgE結合は、フローサイトメーターFACS calibur(ベックマン・コールター社製)を用いて測定した。なお、陽性対照として、Rose Bengal 3、10、30μg/mLを用いた。結果を表1に示す。
【0027】
【表1】

【0028】
表1の結果より、べにふうきエキスを30、100及び300μg/mL処置した場合には、IgE受容体とIgE抗体との結合を有意に阻害することが明らかとなった。
【0029】
試 験 例 2
脱顆粒抑制試験
(1)マウス骨髄由来肥満細胞(BMMC)の作製
BALB/cマウスの大腿骨から骨髄を採取し、骨髄細胞をマウスIL−3およびマウスSCFを添加して、高親和性IgE受容体(FcεRI)の発現が一定になるまで継代培養した。
(2)試験方法
脱顆粒の際に放出されるβ−ヘキソサミニダーゼを脱顆粒の指標とした。(1)で調製したBMMCにIgE抗体を添加して3日間培養後、37℃に加温したTyrode’s salt buffer(137mmol/L NaCl、2.7mmol/L KCl、0.31mmol/L NaH2PO4、12mmol/L NaHCO3、1.8mmol/L CaCl2、10mmol/L HEPES、5.6mmol/L glucose、0.1%BSA、pH7.4)中に懸濁した。この細胞懸濁液を96ウェルプレートに播種し、実施例1で得られたべにふうきエキスをDMSO溶解後、Tyrode’s salt bufferによって種々の濃度に希釈した被検物質を添加した。30分後、TNP−BSA抗原溶液を添加した。抗原添加後、5%CO2、37℃で30分間インキュベーションし、細胞を冷却遠心して上清を採取した。この上清を遊離酵素サンプルとし、細胞に0.1%TritonX−100含有Tyrode’s salt bufferを加え細胞溶解したものを細胞内酵素サンプルとした。遊離酵素サンプルならびに細胞内酵素サンプルを96ウェルプレートに添加し、β−ヘキソサミニダーゼ基質[100mg p−ニトロフェニル N−アセチル−β−D−グルコサミニド、90mL β−HEX buffer(0.2mol/L Na2HPO4、0.4mol/L クエン酸、pH 4.5)、135 mL蒸留水]を各ウェルに加え、37℃で1時間酵素反応を行った。次いで0.2mol/L グリシン−NaOH溶液(pH 10.7)を加え、酵素反応によって生産されたp−ニトロフェノール(波長405nm)の吸光度を測定した。β−ヘキソサミニダーゼ遊離率は、下記の式を用いて計算した。また、陽性対照として30、100、300μmol/L フマル酸ケトチフェンを用いた。結果を図1に示す。
β−ヘキソサミニダーゼ遊離率 (%)= A1/(A1+A2)×100
A1:遊離酵素サンプルの吸光度
A2:細胞内酵素サンプルの吸光度
【0030】
図1の結果より、10μg/mL、30μg/mLおよび100μg/mLべにふうきエキス処置群では、有意に脱顆粒を抑制し、その作用は濃度依存的であった。
【0031】
試 験 例 3
マウスPCA反応試験
(1)被検物質の調製
実施例1で得られたべにふうきエキスを50%エタノール溶液で1、5、10w/v%の濃度に溶解して被検物質とした。なお、被検物質は用時調製した。
(2)試験方法
生理食塩水で2μg/mLに希釈した抗TNPマウスIgE抗体をBALB/cマウスの両耳介皮内に10μL注射して感作させた。抗体感作1日後、生理食塩水中に0.5mg/mL TNP−BSA含有1%エバンスブルー(0.45μmフィルトレーション)に調製した抗原含有色素溶液を1匹あたり0.25mL尾静脈注入した。その30分後に、頚椎脱臼によりマウスを屠殺し両耳介を採取して検体とした。採取した耳介にホルムアミドを1mL添加し、72時間55℃で組織からエバンスブルーを抽出した。遠心処理(1500rpm、10min)後、上清を回収し分光光度計を用いて波長620nmの吸光度を測定した。また、滲出エバンスブルー量は、別に作成した検量線から算出した。試験は、抗原チャレンジの9日前から抗原チャレンジの日まで連日10日間、各耳介に50μLずつ塗布した。また、抗体感作および抗原チャレンジの日には、その1時間前に被検物質を塗布した。陽性対照として、5%塩酸ジフェンヒドラミンを同様に反復塗布した。なお、被検物質の塗布初日、5日後、10日後に、各実験群について体重を測定した。滲出エバンスブルー量の結果を図2に、体重変化の結果を図3に示す。抗体を感作させ、被検物質を塗布しない群を感作コントロール、生理食塩水のみを投与し、被検物質を塗布しない群を非感作コントロールとした。
【0032】
図2より、べにふうきエキスを繰り返し塗布した群では、用量依存的に有意に色素漏出量が減少することが示された。また、陽性対照である塩酸ジフェンヒドラミン塗布群においても有意に色素漏出量が減少した。したがって、べにふうきエキスは外用においてもアレルギー反応を抑制することが明らかとなった。また、図3より、塩酸ジフェンヒドラミン塗布群では体重減少が観察されたが、べにふうきエキス塗布群では体重減少は観察されなかったため、べにふうき塗布による有害な影響はないと推察された。
【0033】
試 験 例 4
マウスアレルギー性鼻炎モデル
(1)被検物質の調製
実施例1で得られたべにふうきエキスを生理食塩水で0.03、0.1、0.3w/v%の濃度に溶解して被検物質とした。なお、被検物質は用時調製した。
(2)試験方法
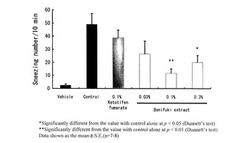
雌性BALB/c系マウス1匹あたりに0.5mg/mL オボアルブミン(OVA)と20mg/mL 水酸化アルミニウムの等量混合抗原溶液を0.2mLずつ腹腔内投与した。初回感作後、7日目および14日目に同様の抗原溶液を腹腔内投与した。21日目からは、20mg/mL OVA溶液を各鼻腔内に5μLずつ7日間毎日点鼻した。28日目に、20mg/mL OVA溶液を各鼻腔内に5μLずつ点鼻し、チャレンジ後のくしゃみの回数を測定した。生理食塩水に溶解した各被検物質は、実験開始14日目から実験終了時まで各鼻腔内に10μLずつ点鼻した。また、同日に被検物質の投与とOVA感作を行う場合は、感作1〜2時間前に被検物質を投与した。さらに、抗原溶液を投与し被検物質を投与しない感作コントロール、抗原溶液を投与しない非感作コントロール、および0.1%フマル酸ケトフェチンを点鼻した陽性コントロールの各群について同様に試験し、また各群について初回感作から7日毎にマウスの体重を測定した。くしゃみ回数の結果について図4に、体重変化の結果について図5に示す。
【0034】
図4より、非感作群に比べ感作群では、明らかにくしゃみの回数が増加した。感作群に比べ0.1%及び0.3%べにふうきエキス点鼻群では有意にくしゃみの回数が減少した。これに対し、陽性対照に用いた0.1%フマル酸ケトチフェン点鼻群では減少傾向は認められるが有意な抑制作用は認められなかった。in vitro(試験例2)において、フマル酸ケトチフェンとべにふうきエキスの脱顆粒抑制作用に大きな違いは認められなかったが、in vivo(本病態モデル)に対してはべにふうきエキスの方が有用であることが明らかとなった。これにより、べにふうきエキスを点鼻することで、抗原感作によるくしゃみが抑制されることが示された。また、図5より体重変化が観察されていないことから、べにふうきエキス点鼻による有害な影響は無いものと推察された。
【0035】
実 施 例 4
( 鼻洗浄液処方 )
べにふうきエキス ・・・・0.10%
パラオキシ安息香酸エステル ・・・・0.08%
精製水 ・・・99.82%
合計 ・・100.00%
( 製法 )
上記鼻洗浄液を常法により製造した後、窒素ガスとともにエアゾール缶に充填し、鼻洗浄製剤を製造した。
【0036】
比 較 例 1
( 鼻洗浄液処方 )
パラオキシ安息香酸エステル ・・・・0.08%
精製水 ・・・99.92%
合計 ・・100.00%
( 製法 )
上記鼻洗浄液を常法により製造した後、窒素ガスとともにエアゾール缶に充填し、鼻洗浄製剤を製造した。
【0037】
試 験 例 4
花粉症の有症者を対象として、実施例4と比較例1の鼻洗浄製剤についてモニターを実施したところ、使用直後は両者ともに症状(くしゃみ、鼻水、鼻閉)の改善が認められたが、比較例1では使用30分後くらいから症状の再発が見られたのに対し、実施例4では使用1時間後でも効果が維持されていた。
【0038】
実 施 例 5
( 鼻洗浄液処方 )
べにふうきエキス ・・・・0.05%
アスコルビン酸ナトリウム ・・・・0.03%
パラオキシ安息香酸エステル ・・・・0.08%
香料 ・・・・0.02%
ポリオキシエチレン硬化ヒマシ油(50E.O.) ・・・・0.10%
精製水 ・・・99.72%
合計 ・・100.00%
( 製法 )
上記鼻洗浄液を常法により製造した後、窒素ガスとともにエアゾール缶に充填し、鼻洗浄製剤を製造した。
【0039】
実 施 例 6
( 軟膏処方 )
ポリエチレングリコール400 ・・・・49.5%
ポリエチレングリコール4000 ・・・・49.5%
べにふうきエキス ・・・・・1.0%
合計 ・・・100.0%
( 製法 )
常法により製造した。
【0040】
実 施 例 7
( 軟膏処方 )
流動パラフィン ・・・・15.0%
べにふうきエキス ・・・・・0.5%
ワセリン ・・・・84.5%
合計 ・・・100.0%
( 製法 )
常法により製造した。
【産業上の利用可能性】
【0041】
上述のとおり、本発明の鼻用組成物を用いた鼻用製剤は、くしゃみ等の鼻炎症状を抑制し、しかも安全性の高いものである。したがって、本製剤は、鼻腔内及び鼻周辺に適用する点鼻薬、鼻洗浄剤、鼻軟膏等として有用なものである。
【図面の簡単な説明】
【0042】
【図1】試験例2におけるべにふうきエキスの脱顆粒抑制作用を示す図である。
【図2】試験例3におけるべにふうきエキス塗布による色素漏出量を示す図である。
【図3】試験例3におけるべにふうきエキス塗布によるマウスの体重変化を示す図である。
【図4】試験例4におけるべにふうきエキスによるくしゃみ抑制作用を示す図である。
【図5】試験例4におけるマウスの体重変化を示す図である。
【技術分野】
【0001】
本発明は、鼻用組成物に関し、さらに詳細には、べにふうきエキスを有効成分とする鼻用組成物に関する。
【背景技術】
【0002】
鼻炎は急性鼻炎、慢性鼻炎、副鼻腔炎などのウイルス性、細菌性、および真菌性感染あるいはアレルギー反応により誘発される疾患であり、くしゃみ、水性鼻汁(鼻みず)、および鼻閉(鼻づまり)などを主症状とする。これらの鼻炎症状は、患者に著しい不快感を与えるだけでなく、その症状は患者の日常生活に多大な支障をもたらしている。
【0003】
これらの鼻炎症状の緩和のために、ヒスタミンなどのメディエーターを抑制する薬剤が用いられている。例えば、茶葉から抽出した3−O−メチルガロイルエピガロカテキンおよび/または4−O−メチルガロイルエピガロカテキンが、ヒスタミン遊離抑制作用等を有することが報告されている(特許文献1)。また、これらの物質が、IV型アレルギー反応を阻害すること(非特許文献1)、ヒト好塩基球様細胞株KU812のIgEレセプターの発現を抑制すること(非特許文献2)、肥満細胞のプロテインキナーゼを抑制すること(非特許文献3)などが報告されている。さらに、この3−O−メチルガロイルエピガロカテキン等を含む飲食品を摂取することによって、花粉症の症状が改善されることが開示されている(特許文献2)。さらにまた、特定の種類の茶葉を用いた茶を飲用することによって、花粉症の症状が改善されることが開示されている(特許文献3)。しかしながら、これらの文献には、茶葉からの抽出物を外用で適用させることについて具体的な記載はなく、外用剤として用いた場合に鼻炎症状を抑制できるかどうかこれまで知られていなかった。
【0004】
【特許文献1】特開2000−159670号公報
【特許文献2】特開2004−105078号公報
【特許文献3】特開2005−60277号公報
【非特許文献1】ジャーナル・オブ・アグリカルチュラル・アンド・フード・ケミストリー、2000年、第48巻、第5649−5653頁
【非特許文献2】ジャーナル・オブ・アグリカルチュラル・アンド・フード・ケミストリー、2002年、第50巻、第5729−5734頁
【非特許文献3】ザ・ジャーナル・オブ・イムノロジー、2004年、第172巻、第4486−4492頁
【発明の開示】
【発明が解決しようとする課題】
【0005】
したがって、くしゃみ等の鼻炎症状を有効に抑制しうる鼻用組成物の開発が求められており、本発明はかかる鼻用組成物を提供することを課題とする。
【課題を解決するための手段】
【0006】
本発明者らは、鼻炎の症状を抑制する物質について鋭意検討を行った結果、べにふうきのエキスが、点鼻によって、鼻炎症状に対して優れた抑制効果を有することを見出し、本発明を完成するに至った。
【0007】
すなわち本発明は、べにふうきエキスを有効成分とする鼻用組成物である。
【0008】
また本発明は、べにふうきのポリフェノール画分を有効成分とする鼻用組成物である。
【発明の効果】
【0009】
本発明の鼻用組成物は、くしゃみ、水性鼻汁(鼻みず)、および鼻閉(鼻づまり)などの鼻炎症状を抑制することが出来る。
【0010】
また、このものは、飲用される茶の1品種であるべにふうきのエキスを有効成分とするものであるため、長期間使用が可能な、安全性の高いものである。
【発明を実施するための最良の形態】
【0011】
本発明に使用するべにふうきエキスは、茶の品種の一つであるべにふうき種の茶葉から得られたものである。原料であるべにふうきの茶葉は、通常の製法により緑茶に製したもの、生のもの、半発酵または発酵させたもの、乾燥したものあるいは焙煎したもののいずれでも用いることができる。
【0012】
本発明のべにふうきエキスは、上記べにふうきの茶葉を適当な溶媒を用いて抽出することによって得られる。抽出に用いられる溶媒としては、具体的には、水、エタノール、メタノール、アセトン、1,3−ブチレングリコール、グリセリン等の有機溶媒、またはそれらの混液などが挙げられるが、好ましくは、水、水/エタノール混液等である。
【0013】
本発明において使用されるべにふうきエキスの具体的製造法としては、例えば、べにふうきの茶葉1重量部に対し、5ないし100重量部の溶媒を加え、室温ないし100℃程度の温度で、1ないし120分間程度抽出する方法が挙げられる。
【0014】
本発明のべにふうきエキスとしては、上記べにふうき種の茶葉を、直接前記した溶媒によって抽出して得た抽出液の他、当該抽出液を、さらに液−液分配して得られる溶媒画分を利用することもできる。この液−液分配に使用される溶媒としては、酢酸エチル、n−ブタノール等を挙げることができる。または、当該抽出液を吸着樹脂を充填したカラム等に通すことにより得られる画分を利用することもできる。使用される吸着樹脂としては、活性炭、ダイヤイオンHP−20、セファデックスLH−20、ODSゲル等を挙げることができる。
【0015】
上記のようにして得られるべにふうきエキスのうち、ポリフェノール成分を多く含有するポリフェノール画分が、高い抗アレルギー作用を有するため好ましく用いることができる。このようなポリフェノール画分としては、例えば、べにふうきの茶葉を熱水により抽出した抽出液を、さらに、酢酸エチルで液−液分配することによって得られる酢酸エチル画分を例示できる。また、この酢酸エチル画分を水で洗浄することにより、カフェイン含有量を減少させたポリフェノール画分を得ることができる。
【0016】
上記したべにふうきエキスは、そのままの状態で鼻用組成物に使用しても、また、必要により、公知の精製手段により精製したものや、濃縮または希釈したもの、更に必要によりスプレードライや凍結乾燥などの手段で粉末化したものを鼻用組成物に用いても良い。
上記鼻用組成物の製造にあたっては、例えば、前記べにふうきエキスを、製剤全体に対して、0.001〜10%配合することが好ましく、0.01〜1%が更に好ましい。
【0017】
さらに、本発明の鼻用組成物は、上記べにふうきエキスのみを有効成分として配合しても優れた鼻炎症状抑制効果を有するものであるが、必要により、更に他の薬効成分を配合することもできる。この薬効成分としては、例えば、血管収縮剤、殺菌剤、消炎剤、抗ヒスタミン剤、局所麻酔剤、清涼剤、保湿剤等が挙げられる。
【0018】
更にまた、本発明の鼻用組成物は、必要に応じて公知の任意成分、たとえば、炭化水素類、エステル油、エーテル油、高級脂肪酸、高級アルコール、スフィンゴシン誘導体、合成セラミド類似体などの油剤、多価アルコール、皮膜形成剤、保湿剤、抗酸化剤、界面活性剤、抗菌剤、防腐剤、粉体、粘土鉱物、無機塩、色素、溶剤、紫外線防止剤、pH調整剤、粘度調整剤、香料などを配合することができる。
【0019】
本発明の鼻用組成物は、点鼻薬、鼻洗浄剤、鼻軟膏、鼻うがい剤等の鼻腔内および鼻周辺へ適用するものを指し、滴下式、塗布式、エアゾール式、スプレー式、吸入式等の種々の形態をとることができる。
【0020】
本発明の鼻用組成物は、鼻炎疾患の種類や症状の程度に応じて適宜適用することができるが、一般的には、1日あたり0.01〜20mL程度の量を適用すればよい。
【実施例】
【0021】
次に実施例を挙げて、本発明を更に詳しく説明するが、本発明はこれら実施例に何ら制約されるものではない。
【0022】
実 施 例 1
(べにふうきエキスの製造方法)
べにふうき茶葉4kgを40Lの熱水にて30分間抽出し、抽出液を得た。抽出液は濃縮・乾燥した後、水を加えて溶解し、酢酸エチルを加えて振とう抽出を行った。酢酸エチル層を約半量まで減圧下濃縮した後、水を加え洗浄した。洗浄した酢酸エチル層に水を加えながら減圧下濃縮し、溶媒を留去した後、凍結乾燥し、べにふうきエキス約200gを得た。
【0023】
(べにふうきエキスの成分分析)
実施例1で得られたべにふうきエキス中のタンニン含量を、「日本食品標準成分表 分析マニュアル」に記載されている酒石酸鉄吸光光度法により実施例1で得られたべにふうきエキス中のタンニン含量を測定したところ、タンニン含量は91.0%であった。また、ODSカラム(移動相:アセトニトリル/水/リン酸混液(50:330:0.3))を用いた逆相HPLCによって、3−O−メチルガロイルエピガロカテキン及びカフェインの含量を定量した結果、3−O−メチルガロイルエピガロカテキンの含量は10.1%、カフェイン含量は3.4%であった。
【0024】
実 施 例 2
(べにふうきエキスの製造方法)
べにふうき茶葉5kgを50Lのアセトン/水(1:1)混液にて1日室温抽出し、抽出液を得た。抽出液は減圧下濃縮して溶媒を留去した後、吸着剤セファデックスLH−20を充填したカラムに吸着させ、溶離液としてまず水を通液し、その後薄層クロマトグラフィー(TLC)でモニターしながら徐々にメタノール濃度を上げていくことにより、ポリフェノール成分を溶出させた。得られたポリフェノール画分を減圧下濃縮し、溶媒を留去した後、凍結乾燥し、べにふうきエキス約250gを得た。
【0025】
実 施 例 3
(べにふうきエキスの製造方法)
べにふうき茶葉10kgを100Lの熱水にて30分間抽出し、得られた抽出液をクロロホルム洗浄して不要物を除去した。洗浄した水溶液を、吸着剤ダイヤイオンHP−20を充填したカラムに吸着させ、溶離液としてまず水を通液し、その後TLCでモニターしながら徐々にメタノール濃度を上げていくことにより、ポリフェノール成分を溶出させた。得られたポリフェノール画分を減圧下濃縮し、溶媒を留去した後、スプレードライし、べにふうきエキス約500gを得た。
【0026】
試 験 例 1
IgE受容体結合阻害試験
(1)マウス骨髄由来肥満細胞(BMMC)の作製
BALB/cマウスの大腿骨から骨髄を採取し、骨髄細胞をマウスIL−3およびマウスSCFを添加して、高親和性IgE受容体(FcεRI)の発現が一定になるまで継代培養した。
(2)発現誘導に対する阻害作用
(1)で作製したBMMCを96ウェル培養プレートに播種し、実施例1で得られたべにふうきエキスをジメチルスルホキシド(DMSO)溶解後、培地によって種々の濃度に調製した被検物質を添加した。次に、抗TNPマウスIgE抗体を添加して、37℃、5%CO2インキュベーターにて3日間培用した。培養終了後、冷バッファー(0.1%ウシ血清アルブミン(BSA)、0.1%NaN3含有PBS)で洗浄し、次いで冷バッファーで調製したフルオレッセインイソチオシアネート(FITC)抱合抗マウスIgE抗体を添加して4℃で60分間反応させた。反応終了後、細胞を冷バッファーで洗浄し固定した後、冷PBSに懸濁して測定用サンプルとした。IgE受容体に対するIgE結合は、フローサイトメーターFACS calibur(ベックマン・コールター社製)を用いて測定した。なお、陽性対照として、Rose Bengal 3、10、30μg/mLを用いた。結果を表1に示す。
(3)受容体結合阻害作用
冷バッファーで調製したBMMC懸濁液を96ウェルプレートに播種し、同様に冷バッファーで種々の濃度に調製した被検物質を添加した。次に、抗TNPマウスIgE抗体を添加して4℃で120分間反応させた。反応終了後、冷バッファーで洗浄し、FITC抱合マウスIgE抗体を添加して4℃で60分間反応させた。反応終了後、細胞を冷バッファーで洗浄し固定した後、冷PBSに懸濁して測定用サンプルとした。IgE受容体に対するIgE結合は、フローサイトメーターFACS calibur(ベックマン・コールター社製)を用いて測定した。なお、陽性対照として、Rose Bengal 3、10、30μg/mLを用いた。結果を表1に示す。
【0027】
【表1】

【0028】
表1の結果より、べにふうきエキスを30、100及び300μg/mL処置した場合には、IgE受容体とIgE抗体との結合を有意に阻害することが明らかとなった。
【0029】
試 験 例 2
脱顆粒抑制試験
(1)マウス骨髄由来肥満細胞(BMMC)の作製
BALB/cマウスの大腿骨から骨髄を採取し、骨髄細胞をマウスIL−3およびマウスSCFを添加して、高親和性IgE受容体(FcεRI)の発現が一定になるまで継代培養した。
(2)試験方法
脱顆粒の際に放出されるβ−ヘキソサミニダーゼを脱顆粒の指標とした。(1)で調製したBMMCにIgE抗体を添加して3日間培養後、37℃に加温したTyrode’s salt buffer(137mmol/L NaCl、2.7mmol/L KCl、0.31mmol/L NaH2PO4、12mmol/L NaHCO3、1.8mmol/L CaCl2、10mmol/L HEPES、5.6mmol/L glucose、0.1%BSA、pH7.4)中に懸濁した。この細胞懸濁液を96ウェルプレートに播種し、実施例1で得られたべにふうきエキスをDMSO溶解後、Tyrode’s salt bufferによって種々の濃度に希釈した被検物質を添加した。30分後、TNP−BSA抗原溶液を添加した。抗原添加後、5%CO2、37℃で30分間インキュベーションし、細胞を冷却遠心して上清を採取した。この上清を遊離酵素サンプルとし、細胞に0.1%TritonX−100含有Tyrode’s salt bufferを加え細胞溶解したものを細胞内酵素サンプルとした。遊離酵素サンプルならびに細胞内酵素サンプルを96ウェルプレートに添加し、β−ヘキソサミニダーゼ基質[100mg p−ニトロフェニル N−アセチル−β−D−グルコサミニド、90mL β−HEX buffer(0.2mol/L Na2HPO4、0.4mol/L クエン酸、pH 4.5)、135 mL蒸留水]を各ウェルに加え、37℃で1時間酵素反応を行った。次いで0.2mol/L グリシン−NaOH溶液(pH 10.7)を加え、酵素反応によって生産されたp−ニトロフェノール(波長405nm)の吸光度を測定した。β−ヘキソサミニダーゼ遊離率は、下記の式を用いて計算した。また、陽性対照として30、100、300μmol/L フマル酸ケトチフェンを用いた。結果を図1に示す。
β−ヘキソサミニダーゼ遊離率 (%)= A1/(A1+A2)×100
A1:遊離酵素サンプルの吸光度
A2:細胞内酵素サンプルの吸光度
【0030】
図1の結果より、10μg/mL、30μg/mLおよび100μg/mLべにふうきエキス処置群では、有意に脱顆粒を抑制し、その作用は濃度依存的であった。
【0031】
試 験 例 3
マウスPCA反応試験
(1)被検物質の調製
実施例1で得られたべにふうきエキスを50%エタノール溶液で1、5、10w/v%の濃度に溶解して被検物質とした。なお、被検物質は用時調製した。
(2)試験方法
生理食塩水で2μg/mLに希釈した抗TNPマウスIgE抗体をBALB/cマウスの両耳介皮内に10μL注射して感作させた。抗体感作1日後、生理食塩水中に0.5mg/mL TNP−BSA含有1%エバンスブルー(0.45μmフィルトレーション)に調製した抗原含有色素溶液を1匹あたり0.25mL尾静脈注入した。その30分後に、頚椎脱臼によりマウスを屠殺し両耳介を採取して検体とした。採取した耳介にホルムアミドを1mL添加し、72時間55℃で組織からエバンスブルーを抽出した。遠心処理(1500rpm、10min)後、上清を回収し分光光度計を用いて波長620nmの吸光度を測定した。また、滲出エバンスブルー量は、別に作成した検量線から算出した。試験は、抗原チャレンジの9日前から抗原チャレンジの日まで連日10日間、各耳介に50μLずつ塗布した。また、抗体感作および抗原チャレンジの日には、その1時間前に被検物質を塗布した。陽性対照として、5%塩酸ジフェンヒドラミンを同様に反復塗布した。なお、被検物質の塗布初日、5日後、10日後に、各実験群について体重を測定した。滲出エバンスブルー量の結果を図2に、体重変化の結果を図3に示す。抗体を感作させ、被検物質を塗布しない群を感作コントロール、生理食塩水のみを投与し、被検物質を塗布しない群を非感作コントロールとした。
【0032】
図2より、べにふうきエキスを繰り返し塗布した群では、用量依存的に有意に色素漏出量が減少することが示された。また、陽性対照である塩酸ジフェンヒドラミン塗布群においても有意に色素漏出量が減少した。したがって、べにふうきエキスは外用においてもアレルギー反応を抑制することが明らかとなった。また、図3より、塩酸ジフェンヒドラミン塗布群では体重減少が観察されたが、べにふうきエキス塗布群では体重減少は観察されなかったため、べにふうき塗布による有害な影響はないと推察された。
【0033】
試 験 例 4
マウスアレルギー性鼻炎モデル
(1)被検物質の調製
実施例1で得られたべにふうきエキスを生理食塩水で0.03、0.1、0.3w/v%の濃度に溶解して被検物質とした。なお、被検物質は用時調製した。
(2)試験方法
雌性BALB/c系マウス1匹あたりに0.5mg/mL オボアルブミン(OVA)と20mg/mL 水酸化アルミニウムの等量混合抗原溶液を0.2mLずつ腹腔内投与した。初回感作後、7日目および14日目に同様の抗原溶液を腹腔内投与した。21日目からは、20mg/mL OVA溶液を各鼻腔内に5μLずつ7日間毎日点鼻した。28日目に、20mg/mL OVA溶液を各鼻腔内に5μLずつ点鼻し、チャレンジ後のくしゃみの回数を測定した。生理食塩水に溶解した各被検物質は、実験開始14日目から実験終了時まで各鼻腔内に10μLずつ点鼻した。また、同日に被検物質の投与とOVA感作を行う場合は、感作1〜2時間前に被検物質を投与した。さらに、抗原溶液を投与し被検物質を投与しない感作コントロール、抗原溶液を投与しない非感作コントロール、および0.1%フマル酸ケトフェチンを点鼻した陽性コントロールの各群について同様に試験し、また各群について初回感作から7日毎にマウスの体重を測定した。くしゃみ回数の結果について図4に、体重変化の結果について図5に示す。
【0034】
図4より、非感作群に比べ感作群では、明らかにくしゃみの回数が増加した。感作群に比べ0.1%及び0.3%べにふうきエキス点鼻群では有意にくしゃみの回数が減少した。これに対し、陽性対照に用いた0.1%フマル酸ケトチフェン点鼻群では減少傾向は認められるが有意な抑制作用は認められなかった。in vitro(試験例2)において、フマル酸ケトチフェンとべにふうきエキスの脱顆粒抑制作用に大きな違いは認められなかったが、in vivo(本病態モデル)に対してはべにふうきエキスの方が有用であることが明らかとなった。これにより、べにふうきエキスを点鼻することで、抗原感作によるくしゃみが抑制されることが示された。また、図5より体重変化が観察されていないことから、べにふうきエキス点鼻による有害な影響は無いものと推察された。
【0035】
実 施 例 4
( 鼻洗浄液処方 )
べにふうきエキス ・・・・0.10%
パラオキシ安息香酸エステル ・・・・0.08%
精製水 ・・・99.82%
合計 ・・100.00%
( 製法 )
上記鼻洗浄液を常法により製造した後、窒素ガスとともにエアゾール缶に充填し、鼻洗浄製剤を製造した。
【0036】
比 較 例 1
( 鼻洗浄液処方 )
パラオキシ安息香酸エステル ・・・・0.08%
精製水 ・・・99.92%
合計 ・・100.00%
( 製法 )
上記鼻洗浄液を常法により製造した後、窒素ガスとともにエアゾール缶に充填し、鼻洗浄製剤を製造した。
【0037】
試 験 例 4
花粉症の有症者を対象として、実施例4と比較例1の鼻洗浄製剤についてモニターを実施したところ、使用直後は両者ともに症状(くしゃみ、鼻水、鼻閉)の改善が認められたが、比較例1では使用30分後くらいから症状の再発が見られたのに対し、実施例4では使用1時間後でも効果が維持されていた。
【0038】
実 施 例 5
( 鼻洗浄液処方 )
べにふうきエキス ・・・・0.05%
アスコルビン酸ナトリウム ・・・・0.03%
パラオキシ安息香酸エステル ・・・・0.08%
香料 ・・・・0.02%
ポリオキシエチレン硬化ヒマシ油(50E.O.) ・・・・0.10%
精製水 ・・・99.72%
合計 ・・100.00%
( 製法 )
上記鼻洗浄液を常法により製造した後、窒素ガスとともにエアゾール缶に充填し、鼻洗浄製剤を製造した。
【0039】
実 施 例 6
( 軟膏処方 )
ポリエチレングリコール400 ・・・・49.5%
ポリエチレングリコール4000 ・・・・49.5%
べにふうきエキス ・・・・・1.0%
合計 ・・・100.0%
( 製法 )
常法により製造した。
【0040】
実 施 例 7
( 軟膏処方 )
流動パラフィン ・・・・15.0%
べにふうきエキス ・・・・・0.5%
ワセリン ・・・・84.5%
合計 ・・・100.0%
( 製法 )
常法により製造した。
【産業上の利用可能性】
【0041】
上述のとおり、本発明の鼻用組成物を用いた鼻用製剤は、くしゃみ等の鼻炎症状を抑制し、しかも安全性の高いものである。したがって、本製剤は、鼻腔内及び鼻周辺に適用する点鼻薬、鼻洗浄剤、鼻軟膏等として有用なものである。
【図面の簡単な説明】
【0042】
【図1】試験例2におけるべにふうきエキスの脱顆粒抑制作用を示す図である。
【図2】試験例3におけるべにふうきエキス塗布による色素漏出量を示す図である。
【図3】試験例3におけるべにふうきエキス塗布によるマウスの体重変化を示す図である。
【図4】試験例4におけるべにふうきエキスによるくしゃみ抑制作用を示す図である。
【図5】試験例4におけるマウスの体重変化を示す図である。
【特許請求の範囲】
【請求項1】
べにふうきエキスを有効成分とする鼻用組成物。
【請求項2】
べにふうきエキスが、べにふうきのポリフェノール画分である請求項第1項記載の鼻用組成物。
【請求項3】
くしゃみの抑制剤である請求項第1項又は第2項記載の鼻用組成物。
【請求項1】
べにふうきエキスを有効成分とする鼻用組成物。
【請求項2】
べにふうきエキスが、べにふうきのポリフェノール画分である請求項第1項記載の鼻用組成物。
【請求項3】
くしゃみの抑制剤である請求項第1項又は第2項記載の鼻用組成物。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2007−77097(P2007−77097A)
【公開日】平成19年3月29日(2007.3.29)
【国際特許分類】
【出願番号】特願2005−268646(P2005−268646)
【出願日】平成17年9月15日(2005.9.15)
【出願人】(000003665)株式会社ツムラ (43)
【出願人】(501203344)独立行政法人農業・食品産業技術総合研究機構 (827)
【Fターム(参考)】
【公開日】平成19年3月29日(2007.3.29)
【国際特許分類】
【出願日】平成17年9月15日(2005.9.15)
【出願人】(000003665)株式会社ツムラ (43)
【出願人】(501203344)独立行政法人農業・食品産業技術総合研究機構 (827)
【Fターム(参考)】
[ Back to top ]

