齧歯動物細胞におけるタンパク質発現
【課題】齧歯動物細胞における異種ポリペプチドの発現のための方法の提供。
【解決手段】エプスタイン-バーウイルス(EBV)のoriP/EBNA-1エピソーム複製および維持系を含む。プロモーターの制御下にあるEBNA-1タンパク質発現カセットの、齧歯動物細胞のゲノム中への安定な組み込みにより、細胞におけるEBNA-Iタンパク質の発現が得られた。異種タンパク質は、EBV複製起点と前記異種タンパク質の機能性発現カセットとを含むエピソームから発現される。形質転換された齧歯動物細胞系、前記細胞系における異種タンパク質の産生のための方法、および前記細胞系の構築のためのキット。
【解決手段】エプスタイン-バーウイルス(EBV)のoriP/EBNA-1エピソーム複製および維持系を含む。プロモーターの制御下にあるEBNA-1タンパク質発現カセットの、齧歯動物細胞のゲノム中への安定な組み込みにより、細胞におけるEBNA-Iタンパク質の発現が得られた。異種タンパク質は、EBV複製起点と前記異種タンパク質の機能性発現カセットとを含むエピソームから発現される。形質転換された齧歯動物細胞系、前記細胞系における異種タンパク質の産生のための方法、および前記細胞系の構築のためのキット。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、齧歯動物細胞における異種タンパク質の発現に関する。エプスタイン-バーウイルスのoriP/EBNA-1系の制御および維持の下にあるエピソーム上にある、タンパク質をコードする核酸であって、oriPおよびEBNA-1の構造遺伝子の両方が細胞内部の異なるエレメント上に位置する核酸が提供される。
【背景技術】
【0002】
技術的背景
バイオテクノロジー的な産生プロセスの役割および影響は近年、重要さを増している。バイオテクノロジープロセスの重要性の高まりと並行して、製造される製品の複雑さも絶え間なく増している。
【0003】
異種タンパク質の発現のために可能性のある宿主細胞には、HEK(Human Embryonic Kidney)、HeLa(Henrietta Lacks)、COS(SV40により形質転換されたアフリカミドリザル腎細胞)およびCHO(Chinese Hamster Ovary)細胞があり、それは、これらの宿主において発現された異種タンパク質が、ヒト細胞におけるパターンに従って、フォールディング、プロセシング、プロテアーゼによる成熟、グリコシル化および硫酸化を受けることができるためである(例えば、Watson, E., et al., Glycobiol. 4 (1994) 227-37(非特許文献1)を参照)。
【0004】
エプスタイン-バーウイルス(EBV)は、ヒトBリンパ球の病原体である。これはヒトヘルペスウイルスの部門(ヘルペスウイルス科)に属する。EBVによって形質転換されたBリンパ球は、無秩序に増殖しうる(Miller, G., in Virology ed. by Fields, B., Raven Press, N.Y. (1985) 563-590(非特許文献2))。EBVにより形質転換された細胞の特有の特徴は、いわゆるエプスタイン-バーウイルス核抗原(EBNA)タンパク質の発現である。これらのうち、6種類の変異体がこれまでに同定されている。
【0005】
EBNA-1タンパク質は、形質転換細胞におけるEBV核酸の複製サイクルにおいて重要な役割を果たす。シス性に作用する第2のEBVエレメントである複製起点(oriP)との組み合わせにより、細胞内でのエピソームの複製および維持が可能となる(Lupton, S., and Levine, A.J., Mol. Cell. Biol. 5 (1985) 2533-2542(非特許文献3);Yates, J.L., et al., Nature (London) 313 (1985) 812-815(非特許文献4))。
【0006】
oriPセグメントは、2つの領域:2回対称エレメントおよび反復配列群から構成される。第1のものは65bpの配列セグメントである。これはウイルスの核酸内で、反復配列群とはおよそ1000bp隔たっている。この第2のセグメントは、20回繰り返される30bp配列から構成される(Hudson, G.S., et al., Virology 147 (1985) 81-98(非特許文献5);Reisman, D., et al., Mol. Cell. Biol. 5 (1985) 1822-1832(非特許文献6))。この30bp単位の反復配列群は転写を増強する能力を有しており、一方、2回対称エレメントは複製において役割を果たす。完全なoriPセグメントはプラスミドの染色体外での維持に関与する。
【0007】
EBNA-1タンパク質、すなわちトランス作用性イニシエータータンパク質と、oriPとの組み合わせは、プラスミドの構築を可能にし、ひとたびそれらが細胞内に導入されると、それらはエピトープとして安定に維持され、細胞増殖時に安定に複製される(例えば、Yates, J.L., et al., Nature (London) 313 (1985) 812-815(非特許文献4);Reisman, D., et al., Mol. Cell. Biol. 5 (1985) 1822-1832(非特許文献6)を参照)。これらの2つのエレメントは、エピソームの複製のために宿主細胞の複製機構を利用する(Bode, J., et al., Gene Ther. Mol. Biol. 6 (2001) 33-46(非特許文献7))。
【0008】
Krysan, P.J.ら (Mol. Cell. Biol. 9 (1989) 1026-1033(非特許文献8))は、EBV複製起点の反復配列群を含むプラスミドが、ヒト細胞の細胞核内に永続的に保たれることを示した。したがって、EBNA-1タンパク質の存在は十分条件であった;EBVの他のエレメントは必要でなかった(Aiyar, A., et al., EMBO J. 17 (1998) 6394-6403(非特許文献9);Hung, S.C., et al., PNAS 98 (2001) 1865-1870(非特許文献10);Yates, J.L., in DNA Replication in Eukaryotic Cells, ed. by DePhamphilis, M.L., Cold Spring Harbor Laboratory, N.Y. (1996) pages 751-774(非特許文献11);Yates, J.L., et al., J. Vir. 74 (2000) 4512-4522(非特許文献12)も参照のこと)。
【0009】
EBNA-1タンパク質はエピソーム複製時にエピソームと宿主細胞の染色体を結び付け、それによって細胞分裂時のエピソームの増殖を確実にする。
【0010】
このような相互関係は他のウイルスに関しても知られており、これには例えば、シミアンウイルス40(SV 40)由来のラージT抗原、およびウシパピローマウイルス(BPV)由来のE1/E2タンパク質がある(例えば、Gilbert, D.M., et al., Cell 50 (1987) 59-68(非特許文献13);DuBridge, R.B., et al., Mutagen. 3 (1988) 1-9(非特許文献14);Lebkowski, J.S., et al., Mol. Cell. Biol. 4 (1984) 1951-1960(非特許文献15)を参照)。
【0011】
EBVのエレメントであるEBNA-1およびoriPは、組み込まれない染色体外性で自律複製性のエピソームの調製のために用いられている。Horlickらは、例えば、EBNA1タンパク質を安定に発現するHEK(Human Embryonic Kidney)細胞を、EBV oriPを含むプラスミドからのCRHR(corticotrophin releasing hormone receptor)の発現のために用いている(Horlick, R.A., et al., Prot. Exp. Purif. 9 (1997) 301-308(非特許文献16))。
【0012】
米国特許第4,686,186号(特許文献1)には、組換えベクターおよびそれによって形質転換された真核生物宿主が報告されている。EBVエレメントであるoriPおよびEBNA-1が組換えベクター上に組み合わされている。
【0013】
国際公開公報第2002/090533号(特許文献2)には、浮遊増殖させたヒト胎児腎臓細胞(293細胞系およびその遺伝的変異体)の一過性トランスフェクションによる組換えタンパク質の産生のためのプロセスが報告されている。EBV複製起点を提供するプラスミドは染色体外に維持されている。
【0014】
国際公開公報第2004/053137号(特許文献3)には、宿主細胞における組換えポリペプチドおよび/または非翻訳RNA分子の産生のための方法が報告されている。国際公開公報第2004/018506号は、哺乳動物宿主細胞に一過性にトランスフェクトされる調節可能な発現系に適用しうる組成物および方法を報告している。
【0015】
米国特許出願第2002/0086419号(特許文献4)は、真核宿主細胞における外因性DNAの安定な存続のための組換えベクター、および宿主細胞における遺伝子産物の長期的で安定な産生のための組換えベクターの使用法を報告している。
【0016】
選択された哺乳動物宿主細胞のトランスフェクションのために有用な発現ベクターが、米国特許第5,707,830号(特許文献5)に報告されている。この発現ベクターは、エプスタイン-バーウイルスの反復配列群、宿主細胞において機能性に発現されうるEBNA-1遺伝子のコピー、ベクターが宿主細胞内で複製する能力を与える真核生物DNA断片、および発現カセットを含む。
【0017】
国際公開公報第2002/027005号(特許文献6)は、エピソーム維持系、強力なプロモーター/エンハンサー、タンパク質トランス活性化系、および異種タンパク質をコードするDNAを含む、強化されたトランスフェクション系を報告している。好ましい細胞系は非齧歯動物性であるべきであり、これはoriPを含むプラスミドが効率的に複製せず、例えばCHO細胞はトランス活性化系のための細胞因子を欠いているためである。
【0018】
Wysokenski, D.A., and Yates, J.L., (J. Vir. 63 (1989) 2657-2666)(非特許文献17)は、EBVプラスミドの複製が、霊長動物の細胞から齧歯動物の細胞への種の境界を越えないことを述べている。これは、DNA複製に関与するある宿主タンパク質との相互作用が、齧歯動物にはそれがないため存在しないことに基づく。
【0019】
Tomiyasu, K-i., et al., Biochem. Biophys. Res. Commun. 253 (1998) 733-738(非特許文献18), Mizuguchi, H., et al., FEBS Letters 472 (2000) 173-178(非特許文献19)、および国際公開公報第2005/024030号(特許文献7)は、oriPおよびEBNA-1構造遺伝子の両方を他のエレメントとともに含むプラスミドを報告している。
【0020】
米国特許第5,976,807号(特許文献8)は、関心対象の複数のタンパク質を発現する組換え真核細胞系を産生するための方法を報告している。EBNA-1タンパク質を発現し、少なくとも2つのトランスフェクトされたエピソームを含む、トランスフェクト細胞が得られている。
【先行技術文献】
【特許文献】
【0021】
【特許文献1】米国特許第4,686,186号
【特許文献2】国際公開公報第2002/090533号
【特許文献3】国際公開公報第2004/053137号
【特許文献4】米国特許出願第2002/0086419号
【特許文献5】米国特許第5,707,830号
【特許文献6】国際公開公報第2002/027005号
【特許文献7】国際公開公報第2005/024030号
【特許文献8】米国特許第5,976,807号
【非特許文献】
【0022】
【非特許文献1】Watson, E., et al., Glycobiol. 4 (1994) 227-37
【非特許文献2】Miller, G., in Virology ed. by Fields, B., Raven Press, N.Y. (1985) 563-590
【非特許文献3】Lupton, S., and Levine, A.J., Mol. Cell. Biol. 5 (1985) 2533-2542
【非特許文献4】Yates, J.L., et al., Nature (London) 313 (1985) 812-815
【非特許文献5】Hudson, G.S., et al., Virology 147 (1985) 81-98
【非特許文献6】Reisman, D., et al., Mol. Cell. Biol. 5 (1985) 1822-1832
【非特許文献7】Bode, J., et al., Gene Ther. Mol. Biol. 6 (2001) 33-46
【非特許文献8】Mol. Cell. Biol. 9 (1989) 1026-1033
【非特許文献9】Aiyar, A., et al., EMBO J. 17 (1998) 6394-6403
【非特許文献10】Hung, S.C., et al., PNAS 98 (2001) 1865-1870
【非特許文献11】Yates, J.L., in DNA Replication in Eukaryotic Cells, ed. by DePhamphilis, M.L., Cold Spring Harbor Laboratory, N.Y. (1996) pages 751-774
【非特許文献12】Yates, J.L., et al., J. Vir. 74 (2000) 4512-4522
【非特許文献13】Gilbert, D.M., et al., Cell 50 (1987) 59-68
【非特許文献14】DuBridge, R.B., et al., Mutagen. 3 (1988) 1-9
【非特許文献15】Lebkowski, J.S., et al., Mol. Cell. Biol. 4 (1984) 1951-1960
【非特許文献16】Horlick, R.A., et al., Prot. Exp. Purif. 9 (1997) 301-308
【非特許文献17】Wysokenski, D.A., and Yates, J.L., (J. Vir. 63 (1989) 2657-2666)
【非特許文献18】Tomiyasu, K-i., et al., Biochem. Biophys. Res. Commun. 253 (1998) 733-738
【非特許文献19】Mizuguchi, H., et al., FEBS Letters 472 (2000) 173-178
【発明の概要】
【0023】
本発明は、齧歯動物細胞系における異種タンパク質の発現のための発現系を提供する。この系は、エプスタイン-バーウイルスのoriP/EBNA-1エピソーム複製および維持系を含む。
【0024】
具体的には、本発明は、エプスタイン-バーウイルス核抗原1(EBNA-1)を発現し、かつエピソームを含む齧歯動物細胞であって、前記エピソームが以下のものを含む齧歯動物細胞を提供する:
a)原核生物複製起点;
b)選択マーカー;
c)エプスタイン-バーウイルス(EBV)複製起点(oriP);
d)前記齧歯動物細胞における異種ポリペプチドの発現のために適した発現カセットであって、プロモーター配列、5'非翻訳領域、前記異種タンパク質をコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、発現カセット。
【0025】
本発明は、以下の段階を含む、本発明による齧歯動物細胞を入手するための方法をさらに提供する:
a)齧歯動物細胞を提供する段階;
b)原核生物複製起点、選択マーカー、およびエプスタイン-バーウイルス核抗原1(EBNA-1)用の機能性発現カセットを含むプラスミドを提供する段階であって、発現カセットが、プロモーター配列、5'非翻訳領域、EBNA-1タンパク質をコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、段階;
c)プラスミドb)を齧歯動物細胞a)に導入する段階;
d)安定に形質転換された齧歯動物細胞を選択する段階;
e)原核生物複製起点、選択マーカー、エプスタイン-バーウイルス(EBV)複製起点(oriP)、および形質転換された齧歯動物細胞における異種タンパク質の発現のために適した発現カセットを含む、1つまたは複数のさらなるプラスミドを提供する段階であって、発現カセットが、プロモーター配列、5'非翻訳領域、異種ポリペプチドをコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、段階;
f)さらなるプラスミドe)を齧歯動物細胞d)に導入する段階;
g)段階e)からf)までを最大5回繰り返す段階。
【0026】
本発明は、以下の段階を含む、異種ポリペプチドの産生のためのプロセスをさらに提供する:
a)本発明による齧歯動物細胞を提供する段階;
b)齧歯動物細胞を、異種ポリペプチドの発現のために適した条件下で培養する段階;
c)異種ポリペプチドを培養物から回収する段階。
【0027】
本発明はまた、以下を含む、本発明による齧歯動物細胞の産生のためのキットも提供する:
a)齧歯動物細胞;
b)原核生物複製起点、選択マーカー、およびエプスタイン-バーウイルス核抗原1(EBNA-1)用の機能性発現カセットを含む第1のプラスミドであって、発現カセットが、プロモーター配列、5'非翻訳領域、EBNA-1タンパク質をコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、第1のプラスミド;
c)原核生物複製起点、選択マーカー、エプスタイン-バーウイルス(EBV)複製起点(oriP)、および齧歯動物細胞における異種ポリペプチドの発現のために適した発現カセットを含む第2のプラスミドであって、発現カセットが、プロモーター配列、核酸配列の導入のためのクローニング部位、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、第2のプラスミド。
【0028】
本発明の1つの態様において、齧歯動物細胞はCHO細胞である。
【0029】
本発明のもう1つの態様において、CHO細胞は、細胞CHO-K1、CHO-DXB11、CHO-DG44、およびEBNA-1タンパク質を発現するCHO細胞を含む群から選択される。
【0030】
本発明のもう1つの態様において、発現させようとする異種ポリペプチドは、プロドラッグ、酵素、酵素断片、酵素阻害物質、酵素活性化物質、生物活性ポリペプチド、ヘッジホッグ(hedgehog)タンパク質、骨形成タンパク質(bone morphogenetic protein)、増殖因子、エリスロポエチン、トロンボポエチン、G-CSF、インターロイキン、インターフェロン、免疫グロブリンまたは免疫グロブリン断片を含む群から選択される。
【0031】
1つの態様において、前記異種ポリペプチドは、免疫グロブリンまたは免疫グロブリン断片である。
【0032】
もう1つの態様において、本発明による異種タンパク質の産生は一過性トランスフェクションの下で行われる。
【0033】
もう1つの態様において、前記異種ポリペプチドは培地中に分泌される。
【0034】
本発明のさらなる態様において、齧歯動物細胞に導入されるプラスミドは、少なくとも2つの選択マーカー、好ましくは少なくとも1つの原核生物選択マーカーおよび少なくとも1つの真核生物選択マーカーを含む。
【0035】
本発明のさらなる態様において、1つの齧歯動物細胞に導入されるプラスミドの数は、プラスミド1つから5つまでの間である。
【0036】
本発明のもう1つの態様において、同一の段階において齧歯動物細胞に導入されるプラスミドの数は、プラスミド1つから3つまでの間、好ましくは1つから2つまでの間である。
【図面の簡単な説明】
【0037】
【図1】プラスミドpcDNA3_EBNA-1;EBNA-1タンパク質用の発現カセットを含むプラスミドのマップである。
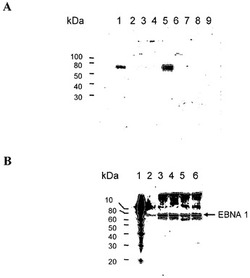
【図2】EBNA-1発現のウエスタンブロット分析である。図2a)についての説明:レーン1:293 EBNA、65μgタンパク質;レーン2:CHO-DG44、100μgタンパク質;レーン3:DG-700-IIH7、100μgタンパク質;レーン4:DG-700-IIID9、100μgタンパク質;レーン5:DG-700-IIIE3、100μgタンパク質;レーン6:DG-700-IIIE8、100μgタンパク質;レーン7:DG-700-IIIF1、100μgタンパク質;レーン8:DG-700-IIIG10、100μgタンパク質;レーン9:DG-700-IIIH8、100μgタンパク質。図2a)についての説明:レーン1:タンパク質標準物質;レーン2:293 EBNA、100μgタンパク質;レーン3:DG-700-IIIE3sub1、第4継代、第6日、100μgタンパク質;レーン4:DG-700-IIIE3sub1、第15継代、第37日、100μgタンパク質;レーン5:DG-700-IIIE3sub1、第18継代、第48日、100μgタンパク質;レーン6:DG-700-IIIE3sub1、第20継代、第54日、100μgタンパク質。
【図3】図3a)はプラスミドp4816-pUC-L-IR18-kappa BsmIのマップである。図3b)はプラスミドp4817-pUC-H-IR18-gamma1 BsmIのマップである。
【図4】図4a)はプラスミドp4818-pUC-Hyg-OriP-Heavy-IR18-BsmIのマップである。図4b)はプラスミドp4819-pUC-Hyg-OriP-Light-IR18-BsmIのマップである。
【図5】プラスミドp4821-pUC-Hyg-OriP-IR18-heavy-light-BsmIのマップである。
【図6】種々の細胞系における種々の発現プラスミドによる抗体の発現の比較である。
【発明を実施するための形態】
【0038】
発明の詳細な説明
本発明は、エプスタイン-バーウイルス核抗原1(EBNA-1)を発現し、かつエピソームを含む齧歯動物細胞であって、前記エピソームが以下のものを含む齧歯動物細胞を提供する:
a)原核生物複製起点;
b)選択マーカー;
c)エプスタイン-バーウイルス(EBV)複製起点(oriP);
d)前記齧歯動物細胞における異種ポリペプチドの発現のために適した発現カセットであって、プロモーター配列、5'非翻訳領域、前記異種ポリペプチドをコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、発現カセット。
【0039】
本発明を実施するために有用な方法および手法は、例えば、Ausubel, F.M., ed., Current Protocols in Molecular Biology, Volumes I to III (1997);Glover, N.D., and Hames, B.D., ed., DNA Cloning: A Practical Approach, Volumes I and II (1995), Oxford University Press;Freshney, R.I. (ed.), Animal Cell Culture - a practical approach, IRL Press (1986);Watson, J.D., et al., Recombinant DNA, Second Edition, CHSL Press (1992);Winnacker, E.L., From Genes to Clones;N.Y., VCH Publishers (1987);Celis, J., ed., Cell Biology, Second Edition, Academic Press (1998);Freshney, R.I., Culture of Animal Cells: A Manual of Basic Techniques, Second Edition, Alan R. Liss, Inc., N.Y. (1987)に記述されている。
【0040】
本明細書で用いる「核酸」という用語は、組換え的に産生することができるポリペプチドをコードする、少なくとも部分的に非天然の核酸を指す。「非天然の」は、個々のヌクレオチドの配列、またはプロモーター、3'非翻訳領域、エンハンサーもしくは複製起点を非限定的に含む、使用される機能性エレメントの組み合わせのいずれかを指すことができる。核酸は、核酸断片、好ましくはDNA断片で構築することができ、それらは単離されたか化学的手段によって合成されたものである。核酸は、別の核酸、例えばプラスミドまたは真核宿主細胞のゲノム/染色体の中に組み込むことができる。プラスミドには特にシャトルベクターおよび発現ベクターが含まれる。典型的には、プラスミドは、複製起点(例えば、ColE1複製起点)および選択用マーカー(例えば、アンピシリンまたはテトラサイクリン耐性遺伝子)を、細菌における複製および選択のそれぞれのために含む、原核生物増殖ユニット(prokaryotic propagation unit)も含む。
【0041】
核酸は同様に、個々のヌクレオチドからなる、その核酸配列によって特徴づけられる。
【0042】
本明細書の中で用いる「核酸配列」という用語は、ペプチド、ポリペプチドもしくはタンパク質またはそれらの機能性変異体、すなわち例えば、異なるアミノ酸配列を有するものの同じ生物学的機能/活性を有するタンパク質をコードする、核酸分子およびその変異体のヌクレオチド配列を指す。これらの改変は例えば、遺伝暗号の縮重、突然変異、例えば点突然変異、欠失、挿入などに起因する。タンパク質の変異体は、親タンパク質配列における1つまたは複数のアミノ酸残基の付加、欠失および/または置換のために、アミノ酸配列の点で、親タンパク質のアミノ酸配列とは異なる。通常、変異体は、親タンパク質配列に対して少なくとも90%、より好ましくは少なくとも95%、最も好ましくは少なくとも99%のアミノ酸配列同一性を有するアミノ酸配列を有すると考えられる。
【0043】
「発現カセット」とは、細胞における、少なくとも、含まれる構造遺伝子の、発現および分泌のために必要なエレメントを含む核酸配列のことを指す。
【0044】
「遺伝子」とは、ペプチド、ポリペプチドまたはタンパク質の発現のために必要な、例えば染色体上またはプラスミド上にある、セグメントのことを指す。遺伝子は、コード領域のほかに、プロモーター、イントロンおよびターミネーターを含む、他の機能性エレメントを含む。
【0045】
「構造遺伝子」とは、シグナル配列を伴わない、遺伝子のコード領域のことを指す。
【0046】
本明細書の中で用いる「プロモーター」という用語は、下流の核酸配列の転写を推し進めるために用いられる調節性核酸配列を指す。プロモーター配列は、サイトメガロウイルス(CMV)、初期および後期シミアンウイルス40(SV40)(Bernoist, C., and Chambon, P., Nature 290 (1981) 304-10)、ラウス肉腫ウイルス(RSV)の3'長末端反復配列に含まれるプロモーター(Yamamoto et al., Cell 22:787-97 (1980) )、グリセリンアルデヒドリン酸デヒドロゲナーゼ(GADPH)、レトロウイルスLTR、伸長因子1α(EF-1α)、ユビキチン、単純ヘルペスウイルスチミジンキナーゼ(HSVTK)(例えば、Lee, A., et al., Mol. Cell. 7 (1997) 495-501, Wagner et al., Proc. Natl. Acad. Sci. U.S.A. 78:1441-45 (1981)も参照のこと)のプロモーター配列、およびメタロチオネイン遺伝子の調節配列(Brinster et al., Nature 296 (1982) 39-42)などを含む群から選択することができる。好ましいものは、アデノウイルスプロモーター(例えば、アデノウイルス主要後期プロモーター)、アルブミンプロモーター、ApoA1プロモーター、βアクチンプロモーター、熱ショックプロモーター、異種プロモーター(例えば、CMV)、ヒトのグロブリンおよび成長ホルモンのプロモーター、誘導性プロモーター(例えば、MMT)、レトロウイルスLTRプロモーター、RSV、ならびにチミジンキナーゼプロモーター(例えば、単純ヘルペスチミジンキナーゼプロモーター)のような強力なプロモーターである。特に好ましいものは、アデノウイルスプロモーター、最初期および後期サイトメガロウイルスプロモーター(CMV;Boshart et al., Cell 41 (1985) 521-30)、マウス乳腺腫瘍ウイルスプロモーター(MMTV)、およびラウス肉腫ウイルスの長末端反復配列由来のプロモーター(LTR-RSV;Gorman et al., Proc. Natl. Acad. Sci. USA 79 (1982) 6777-81)のような強力なウイルスプロモーターである。
【0047】
本明細書の中で用いる「ポリアデニル化シグナル」という用語は、特定の核酸配列セグメントの一次転写物の切断およびポリアデニル化を誘導するために用いられる核酸配列を指す。ポリアデニル化シグナルを含む3'非翻訳領域は、SV40、ウシ成長ホルモン(BGH)の遺伝子、免疫グロブリン遺伝子およびチミジンキナーゼ遺伝子(tk、例えば、単純ヘルペスチミジンキナーゼポリアデニル化シグナル)に由来するポリアデニル化シグナルを含む3'非翻訳領域からなる群より選択することができる。
【0048】
本明細書の中で互換的に用いられる、「耐性遺伝子」または「選択マーカー」とは、対応する選択剤の存在下で、その遺伝子を有する細胞を選択的に選択または除外選択することを可能にする遺伝子のことである。有用な陽性耐性遺伝子には抗生物質耐性遺伝子がある。この選択マーカーは、その遺伝子によって形質転換された細胞を、対応する抗生物質の存在下で陽性選択することを可能にする;形質転換されていない細胞は、選択的培養条件下で増殖または生存することができないと考えられる。選択マーカーは、陽性、陰性または二機能性でありうる。陽性選択マーカーはそのマーカーを保有する細胞の選択を可能にし、一方、陰性選択マーカーはそのマーカーを保有する細胞を選択的に除外することを可能にする。典型的には、選択マーカーは薬物に対する耐性を付与するか、または宿主細胞における代謝的もしくは異化的な欠陥を代償する。原核細胞では特に、アンピシリン、テトラサイクリン、カナマイシンまたはクロラムフェニコールに対する耐性を付与する遺伝子が頻繁に用いられる。真核細胞に有用な耐性遺伝子には、例えば、アミノグリコシドホスホトランスフェラーゼ(APH)、例えばハイグロマイシンホスホトランスフェラーゼ(hyg)、ネオマイシンおよびG418 APHなど、ジヒドロ葉酸レダクターゼ(DHFR)、チミジンキナーゼ(tk)、グルタミンシンテターゼ(GS)、アスパラギンシンテターゼ、トリプトファンシンテターゼ(インドール)、ヒスチジノールデヒドロゲナーゼ(ヒスチジノールD)の遺伝子、ならびにピューロマイシン、ブレオマイシン、フレオマイシン、クロラムフェニコール、Zeocinおよびミコフェノール酸に対する耐性をコードする遺伝子が含まれる。そのほかのマーカー遺伝子は、国際公開公報第92/08796号および国際公開公報第94/28143号に記載されている。
【0049】
対応する選択剤の存在下における選択に加えて、選択マーカーが、細胞内に通常は存在しない分子、例えば、緑色蛍光タンパク質(GFP)をコードする遺伝子を提供することもできる。GFPをコードするそのような遺伝子を有する細胞は、GFPによって放出される蛍光の検出のみにより、この遺伝子を有さない細胞と識別することができる。
【0050】
真核生物発現ベクター/プラスミドは、原核細胞において増殖可能である。このため、真核生物発現ベクター/プラスミドは、複数の耐性遺伝子、すなわち原核細胞選択のために用いうる1つの耐性遺伝子および真核細胞選択のために用いうる1つの耐性遺伝子を保有することが多いと考えられる。
【0051】
本明細書で用いる「調節エレメント」という用語は、関心対象のペプチド、ポリペプチドまたはタンパク質をコードする構造遺伝子の転写および/または翻訳のために必要な、シス性に存在するヌクレオチド配列のことを指す。転写調節エレメントは通常、発現される構造遺伝子の上流にあるプロモーター、転写開始部位および終結部位ならびにポリアデニル化シグナル配列を含む。「転写開始部位」という用語は、一次転写物、すなわちmRNA前駆体に組み入れられる、最初の核酸に対応する遺伝子中の核酸塩基のことを指し;転写開始部位がプロモーター配列と部分的に重複してもよい。「転写終結部位」という用語は、転写される関心対象の遺伝子の3'末端に通常示される、RNAポリメラーゼが転写するのを終結させるヌクレオチド配列のことを指す。ポリアデニル化シグナル配列、またはポリA付加シグナルは、真核生物mRNAの3'末端の特定の部位での切断、および切断された3'末端に対する約100〜200個のアデニンヌクレオチドの配列(ポリA尾部)の核内での転写後付加のためのシグナルを提供する。ポリアデニル化シグナル配列は、切断の部位から約10〜30ヌクレオチド上流に位置するコンセンサス配列AATAAAを含みうる。
【0052】
分泌性のポリペプチドを産生するために、関心対象の構造遺伝子はさらに、シグナル配列/リーダーペプチドをコードするDNAセグメントを含む。シグナル配列は新たに合成されたペプチド、ポリペプチド、またはタンパク質をER膜へと、さらにはそれを通過するように導き、そこでポリペプチドは分泌のために送られる。シグナル配列は、タンパク質がER膜を通過する時にシグナルペプチダーゼによって切断される。シグナル配列の機能に関しては、宿主細胞の分泌機構による認識が不可欠である。したがって、用いられるシグナル配列は、宿主細胞の分泌機構のタンパク質および酵素によって認識されなければならない。
【0053】
翻訳調節エレメントには、翻訳開始(AUG)および終止コドン(TAA、TAGまたはTGA)が含まれる。配列内リボソーム進入部位(IRES)は、いくつかの構築物に含めることができる。
【0054】
「プロモーター」とは、それと機能的に連結されている遺伝子/構造遺伝子または核酸配列の転写を制御するポリヌクレオチド配列のことを指す。プロモーターは、RNAポリメラーゼ結合および転写開始のためのシグナルを含む。用いられるプロモーターは、選択された配列の発現を企図している宿主細胞の細胞種において機能性であると考えられる。多種多様な供給源からの、構成性、誘導性および抑制性のプロモーターを含む数多くのプロモーターが当技術分野で周知であり(およびGenBankなどのデータベース中に同定され)、クローニングされたポリヌクレオチドとして、またはその内部に入手可能である(例えば、ATCCなどの寄託機関、ならびに他の商業的または個別的な供給源から)。「プロモーター」は、構造遺伝子の転写を導くヌクレオチド配列を含む。典型的には、プロモーターは、遺伝子の上流領域(5')に位置し、構造遺伝子の転写開始部位に対して近位にある。転写の開始に働くプロモーター内部の配列エレメントは、しばしばコンセンサスヌクレオチド配列を特徴とする。これらのプロモーターエレメントには、RNAポリメラーゼ結合部位、TATA配列、CAAT配列、分化特異的エレメント(DSE;McGehee, R.E., et al., Mol. Endocrinol. 7 (1993) 551-60)、サイクリックAMP応答エレメント(CRE)、血清応答エレメント(SRE;Treisman, R., Seminars in Cancer Biol. 1 (1990) 47-58)、グルココルチコイド応答エレメント(GRE)、ならびにCRE/ATF(O'Reilly, M.A., et al., J. Biol. Chem. 267 (1992) 19938-43)、AP2 (Ye, J., et al., J. Biol. Chem. 269 (1994) 25728)、SP1、cAMP応答エレメント結合タンパク質(CREB;Loeken, M.R., Gene Expr. 3 (1993) 253-64)およびオクタマー因子(概論については、Watson et al., eds., Molecular Biology of the Gene, 4th ed., The Benjamin/Cummings Publishing Company, Inc. 1987、およびLemaigre, F.P. and Rousseau, G.G., Biochem. J. 303 (1994) 1-14を参照)などの他の転写因子の結合部位が含まれる。プロモーターが誘導性プロモーターであるならば、誘導物質に反応して転写の速度は上昇する。これに対して、プロモーターが構成性プロモーターであるならば、転写の速度は調節されない。抑制性プロモーターも公知である。例えば、c-fosプロモーターは、細胞表面上にあるその受容体に対する成長ホルモンのの結合によって特異的に活性化される。テトラサイクリン(tet)により調節される発現は、例えば、CMVプロモーターの後に2つのTet-オペレーター部位が続くものからなる人工的なハイブリッド型プロモーターによって実現することができる。Tet-リプレッサーは2つのTet-オペレーター部位と結合して転写を阻止する。誘導物質であるテトラサイクリンを添加すると、Tet-リプレッサーがTet-オペレーター部位から放出されて、転写が進行する(Gossen, M. and Bujard, H. PNAS 89 (1992) 5547-5551)。メタロチオネインプロモーターおよび熱ショックプロモーターを含む、他の誘導性プロモーターについては、例えば、Sambrook et al.(前記)およびGossen, M., et al., Curr. Opin. Biotech. 5 (1994) 516-520を参照されたい。高レベル発現のための強力なプロモーターとして同定されている真核生物プロモーターには、SV40初期プロモーター、アデノウイルス主要後期プロモーター、マウスメタロチオネイン-Iプロモーター、ラウス肉腫ウイルス長末端反復配列、チャイニーズハムスター伸長因子1α(CHEF-1、例えば、US 5,888,809号を参照)、ヒトEF-1α、ユビキチンおよびヒトサイトメガロウイルス最初期プロモーター(CMV IE)がある。
【0055】
「プロモーター」は構成性であっても誘導性であってもよい。エンハンサー(すなわち、プロモーターに作用して転写を増大させるシス作用性DNAエレメント)は、プロモーターとともに働いて、プロモーターのみによって得られるよりも発現レベルを高めるために必要である可能性があり、転写調節エレメントとして含まれうる。しばしば、プロモーターを含むポリヌクレオチドセグメントは、エンハンサー配列(例えば、CMVまたはSV40)も同様に含むと考えられる。
【0056】
本明細書で用いる「エンハンサー」とは、それと機能的に連結されている遺伝子またはコード配列の転写を強化するポリヌクレオチド配列のことを指す。プロモーターとは異なり、エンハンサーは配向および位置に対して比較的非依存的であり、転写ユニットに対して5'または3'側(Lusky, M., et al., Mol. Cell Bio., 3 (1983) 1108-22)、イントロン内部(Banerji, J., et al., Cell, 33 (1983) 729-40)ならびにコード配列それ自体の内部に認められる(Osborne, T.F., et al., Mol. Cell Bio., 4 (1984) 1293-305)。このため、エンハンサーは転写開始部位の上流もしくは下流のいずれに位置してもよく、またはプロモーターからかなりの距離をおいて位置してもよいが、実際上はエンハンサーはプロモーターと物理的および機能的に重複しうる。さまざまな供給源からの多数のエンハンサーが当技術分野で周知であり(かつGenBankなどのデータベース中に同定されており、クローニングされたポリヌクレオチドとして、またはその内部に入手可能である(例えば、ATCCなどの寄託機関、ならびに他の商業的または個別的な供給源から)。プロモーター配列(例えば一般的に用いられるCMVプロモーター)を含むさまざまなポリヌクレオチドは、エンハンサー配列も含む。例えば、以上に列記した強力なプロモーターはすべて、強力なエンハンサーも含みうる(例えば、Bendig, M.M., Genetic Engineering, 7(1988) 91-127)。
【0057】
「機能的に連結されている」とは、2つまたはそれ以上の構成要素の並置であって、そのように記載された構成要素がそれらの意図した様式で機能することを許容する関係にあるような並置のことを指す。例えば、プロモーターおよび/またはエンハンサーは、それが、連結している配列の転写を制御または調節するようにシス性に作用するならば、コード配列と機能的に連結されている。一般的には、しかし必ずしもそうではないが、「機能的に連結されている」DNA配列は連続しており、分泌性のリーダーおよびポリペプチドなどの2つのタンパク質コード領域を連結する必要がある場合には、連続しておりかつリーディングフレームが合っている。しかし、機能的に連結されたプロモーターは一般にコード配列の上流に位置するものの、それは必ずしもそれと連続している必要はない。エンハンサーは連続していなくともよい。エンハンサーは、そのエンハンサーがコード配列の転写を増大させるならば、コード配列と機能的に連結されている。機能的に連結されたエンハンサーは、コード配列の上流、内部または下流に、プロモーターからかなりの距離をおいて位置する可能性がある。ポリアデニル化部位は、転写がコード配列を経てポリアデニル化配列へと進行するように、それがコード配列の下流末端に位置するならば、コード配列/構造遺伝子と機能的に連結されている。連結は、当技術分野で公知の組換え方法により、例えば、PCR法を用いて、および/または好都合な制限部位での連結により、実現することができる。好都合な制限部位が存在しないのであれば、合成オリゴヌクレオチドアダプターまたはリンカーを従来の手法を踏まえて用いる。
【0058】
本明細書で用いる「発現」という用語は、宿主細胞内部で起こっている転写および/または翻訳を指す。宿主細胞における所望の産物の転写のレベルは、細胞内に存在する対応するmRNAの量に基づいて決定することができる。例えば、選択された配列から転写されたmRNAを、PCRまたはノーザンハイブリダイゼーションによって定量することができる(Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York (1989)を参照)。選択された配列によってコードされるタンパク質は、さまざまな方法、例えばELISAによって、タンパク質の生物活性をアッセイすることによって、またはタンパク質を認識してそれを結合する抗体を用いるウエスタンブロット法もしくはラジオイムノアッセイといったそのような活性に非依存的なアッセイを用いることによって、定量することができる(Sambrook et al., 1989, 前記を参照)。
【0059】
「宿主細胞」とは、本発明のポリペプチドをコードする遺伝子が導入される細胞のことを指す。宿主細胞には、プラスミド/ベクターの増殖のために用いられる原核細胞、および構造遺伝子の発現用の真核細胞の両方が含まれる。典型的には、真核細胞は哺乳動物細胞である。
【0060】
「ポリペプチド」とは、天然または合成的に産生されたかのいかんを問わず、ペプチド結合によって連結したアミノ酸残基の重合体のことである。約20アミノ酸残基未満のポリペプチドは「ペプチド」と呼んでもよい。
【0061】
「タンパク質」とは、少なくとも1つの鎖が100アミノ酸長またはそれ以上の長さを有する、1つまたは複数のポリペプチド鎖を含む高分子のことである。タンパク質が、炭水化物基などの非ペプチド性構成要素を含んでもよい。炭水化物および他の非ペプチド性置換基は、タンパク質に対して、そのタンパク質が産生される細胞によって付加されてよもく、細胞の種類によってさまざまでありうる。タンパク質は、本明細書において、そのアミノ酸骨格構造によって定義され;炭水化物基などの付加物は一般に特定されないが、それにもかかわらず存在してよい。
【0062】
「異種DNA」または「異種ポリペプチド」とは、所定の宿主細胞の内部に天然では存在しない、DNA分子もしくはポリペプチド、またはDNA分子の集団もしくはポリペプチドの集団のことを指す。特定の宿主細胞に対して異種であるDNA分子は、宿主DNAが非宿主性DNA(すなわち外因性DNA)と組み合わされている限り、宿主細胞種に由来するDNA(すなわち内因性DNA)を含んでもよい。例えば、プロモーターを含む宿主DNAセグメントと機能的に連結されているポリペプチドをコードする非宿主性DNAセグメントを含むDNA分子は、異種DNA分子であるとみなされる。その反対に、異種DNA分子が、外因性プロモーターと機能的に連結された内因性構造遺伝子を含むこともできる。
【0063】
非宿主性DNA分子によってコードされるペプチドまたはポリペプチドは、「異種」ペプチドまたはポリペプチドである。
【0064】
本明細書の中で用いる「プラスミド」および「ベクター」という用語は、遺伝物質の細胞内への移入のための媒体を指す。この物質は、一般的には環状核酸分子であるが、それに限定されるわけではない。プラスミドの意図される目的に応じて、それがさらに、例えば、宿主におけるプラスミドの複製または転写を可能にするための、必要な複製制御セグメントを備えた複製起点を含んでもよい。
【0065】
「クローニングベクター」とは、宿主細胞において自律的に複製する能力を有する、プラスミド、コスミド、ファージミドまたは細菌人工染色体(BAC)などの核酸分子である。クローニングベクターは、典型的には、ベクターの必須な生物学的機能の欠失を伴うことなく、確定可能な様式での核酸分子の挿入を可能にする1つまたは少数の制限エンドヌクレアーゼ認識部位、ならびにクローニングベクターによって形質転換された細胞の同定および選択に用いるのに適した耐性遺伝子をコードするヌクレオチド配列を含む。耐性遺伝子は、典型的には、テトラサイクリン耐性またはアンピシリン耐性を与える遺伝子を含む。
【0066】
「発現プラスミド」とは、宿主細胞において発現させようとするタンパク質をコードする核酸分子のことである。典型的には、発現プラスミドは、原核生物プラスミド増殖ユニット(例えば、大腸菌の場合には複製起点および選択マーカーを含む)、真核生物選択マーカー、および関心対象の構造遺伝子の発現のための1つまたは複数の発現カセットを含む。「発現カセット」は、典型的には、プロモーター、5'非翻訳領域、構造遺伝子、およびポリアデニル化シグナルを含む3'非翻訳領域を含む。遺伝子発現は通常はプロモーターの制御下におかれ、そのような構造遺伝子はプロモーター「に機能的に連結されている」という。同様に、調節エレメントおよびコアプロモーターは、調節エレメントがコアプロモーターの活性を調節するならば、機能的に連結されている。
【0067】
「単離されたポリペプチド」とは、ポリペプチドに天然で随伴する、炭水化物、脂質または他のタンパク質性不純物といった混入性細胞成分を本質的に含まないポリペプチドのことである。典型的には、単離されたポリペプチドの調製物は、ポリペプチドを高度に精製された形態で、すなわち少なくとも約80%の純度、少なくとも約90%の純度、少なくとも約95%の純度、95%を上回る純度、または99%を上回る純度で含む。特定のタンパク質調製物が単離されたポリペプチドを含むことを示すための1つの方法は、タンパク質調製物のドデシル硫酸ナトリウム(SDS)-ポリアクリルアミドゲル電気泳動およびゲルのクーマシーブリリアントブルー染色の後の単一のバンドの出現による。しかし、「単離された」という用語は、二量体、点突然変異などによる突然変異、または代替的にグリコシル化もしくは誘導体化された形態といった、代替的な物理的形態にある同じポリペプチドの存在を除外するものではない。
【0068】
「免疫グロブリン」という用語は、免疫グロブリン遺伝子によって実質的にコードされる1つまたは複数のポリペプチドからなるタンパク質を指す。認知されている免疫グロブリン遺伝子は、種々の定常領域遺伝子、ならびに莫大な数の免疫グロブリン可変領域遺伝子を含む。免疫グロブリンは、例えば、Fv、FabおよびF(ab)2ならびに一本鎖(scFv)を含む、さまざまな型で存在しうる(例えば、Huston, J.S., et al., PNAS USA 85 (1988) 5879-5883;Bird et al., Science 242 (1988) 423-426;および、概論についてはHood, L. E., Weissman, I., Wood, W.B., and Wilson, J. H., Immunology, Benjamin/ Cummings, Menlo Park, California. (1983) and Hunkapiller and Hood, Nature 323 (1986) 15-16)。
【0069】
免疫グロブリンは一般に、少なくとも2つの軽鎖ポリペプチドおよび2つの重鎖ポリペプチドを含む。重鎖および軽鎖ポリペプチドのそれぞれは、抗原と相互作用しうる結合ドメインを含む可変領域(一般にポリペプチド鎖のアミノ末端部分)を含みうる。重鎖および軽鎖ポリペプチドのそれぞれは、定常領域(一般にカルボキシル末端部分)を含む。重鎖の定常領域は、i)Fcγ受容体(FcγR)を有する食細胞などの細胞への、またはii)Brambell受容体としても知られる新生児Fc受容体(FcRn)を有する細胞への、抗体の結合を媒介する。それはまた、補体(C1q)などの古典的補体系の因子を含む、いくつかの因子に対する結合も媒介する。
【0070】
さらに、免疫グロブリンの軽鎖または重鎖の可変ドメインはまた、異なるセグメント、すなわち4つのフレームワーク領域(FR)および3つの超可変領域(CDR)を含む。
【0071】
「免疫グロブリン断片」は、挿入、欠失および/または変異を伴うか、または伴わない、CH1ドメイン、ヒンジ領域、CH2ドメイン、CH3ドメイン、CH4ドメイン、CLドメイン、VHドメイン、VLドメイン、フレームワーク領域1、フレームワーク領域2、フレームワーク領域3、フレームワーク領域4、超可変領域1、超可変領域2および超可変領域3からなる群より選択される、1つまたは複数のセグメントを含むポリペプチドを指す。
【0072】
本明細書の中で示される「ポリアデニル化シグナルを含む3'非翻訳領域」とは、真核生物mRNAの3'末端の特定の部位での切断、および切断された3'末端に対する約100〜200個のアデニンヌクレオチド(ポリA尾部)の核内での転写後付加のためのシグナルを提供する、長さ50〜750塩基対のDNA配列のことである。極めて効率的なポリアデニル化シグナルが推奨されるが、これは非効率的な切断およびポリアデニル化が、望ましくない、例えばプラスミドにコードされた遺伝子発現の理由となりうるオペロン様mRNAの形成をもたらす可能性があるためである。
【0073】
本明細書の中で用いる「宿主」および「細胞」という用語は、本発明によるプラスミドを収容するのに好適である細胞を指す。好ましくは、この細胞は、CHO(Chinese Hamster Ovary)細胞、BHK(Baby Hamster Kidney)細胞および他の齧歯動物細胞を含む群から選択される。好ましいものは、CHO細胞、またはCHO-K1細胞、CHO-DXB11細胞、CHO-DG44細胞、およびEBNA-1タンパク質を発現するCHO細胞を含む、派生CHO細胞である。本発明に従って提供される細胞の子孫も同じく含まれる。突然変異、環境影響または遺伝暗号の縮重性のいずれかのために生じうる改変を連続した世代に有する、本発明に従って提供される細胞の子孫も同じく含まれる。「細胞系」という用語は、特に、特定された期間にわたってインビトロで増殖させることのできる細胞の集団を指す。この期間に、細胞は成長し細胞分裂によって増殖する。
【0074】
本明細書の中で用いる「一過性トランスフェクション」という用語は、細胞に導入された核酸がその細胞のゲノムまたは染色体DNAに組み込まれないプロセスを指す。それは実際には、染色体外エレメント、例えばエピソームとして細胞内に維持される。エピソームの核酸の転写プロセスは影響されず、例えば、エピソームの核酸によってコードされるタンパク質は産生される。
【0075】
本明細書の中で用いる「安定に形質転換された」という用語は、宿主細胞のゲノム/染色体への外因性核酸の遺伝性かつ安定な組み込みを指す。
【0076】
本明細書で用いる「生物活性ポリペプチド」という用語は、有機分子、例えば、細胞系およびウイルスを用いたバイオアッセイ系などの人工的生体系に対して、またはインビボで、鳥類、およびヒトを含む哺乳動物を非限定的に含む動物に対して投与された場合に生物学的影響を引き起こす、ペプチド、タンパク質、核タンパク質、ムコタンパク質、リポタンパク質、合成ポリペプチドまたはタンパク質などの生体高分子のことを指す。この生物学的影響は、酵素の阻害、活性化またはアロステリック修飾、結合部位または周囲での受容体との結合、受容体、シグナル伝達または抗原結合の遮断または活性化でありうるが、それらに限定されるわけではない。
【0077】
EBVの複製起点oriP、EBVの2回対称エレメントおよびEBVの反復配列群の核酸配列は、SEQ ID NO:01からSEQ ID NO:03までに示されており、それらはGenBankエントリーV01555から導き出されている。EBNA-1タンパク質をコードする配列は、SEQ ID NO:04に核酸配列として、SEQ ID NO:05にアミノ酸配列として示されている。これらの配列は、それぞれV01555(GenBank)およびP03211(SwissProt)から導き出されている。
【0078】
タンパク質の精製のためには、種々の方法が十分に確立され、広く用いられており、微生物タンパク質を用いるアフィニティークロマトグラフィー(例えば、プロテインAまたはプロテインGアフィニティークロマトグラフィー)、イオン交換クロマトグラフィー(例えば、陽イオン交換(カルボキシメチル樹脂)、陰イオン交換(アミノエチル樹脂)および混合モード交換)、チオフィリック(thiophilic)吸着(例えば、β-メルカプトエタノールおよび他のSHリガンドを用いる)、疎水性相互作用または芳香族吸着クロマトグラフィー(例えば、フェニル-セファロース、アザ-アレノフィリック樹脂(aza-arenophilic resin)またはm-アミノフェニルボロン酸を用いる)、金属キレートアフィニティークロマトグラフィー(例えば、Ni(II)およびCu(II)-親和性材料を用いる)、サイズ排除クロマトグラフィーおよび電気泳動の方法(ゲル電気泳動、キャピラリー電気泳動など)(Vijayalakshmi, M.A., Appl. Biochem. Biotech. 75 (1998) 93-102)などである。
【0079】
本発明は、齧歯動物細胞における標的ペプチド、ポリペプチドおよびタンパク質の発現のための方法を提供する。本発明はさらに、異種ペプチド、ポリペプチドまたはタンパク質の産生のための齧歯動物細胞であって、異種ペプチド、ポリペプチドまたはタンパク質をコードする構造遺伝子が齧歯動物細胞内のエピソームによって提供される齧歯動物細胞を提供する。2つまたはそれ以上のサブユニットで構成されるポリペプチドまたはタンパク質、すなわち例えば免疫グロブリンを、本発明の方法に従ってかえって好都合に産生することができる。例えば、軽鎖および重鎖の2つの対で構成される免疫グロブリンの場合には、免疫グロブリンの両方の鎖をコードする2つの構造遺伝子を含む1つのエピソームを用いることができる。または、例えば、軽鎖をコードする構造遺伝子を含むものが1つ、および重鎖をコードする構造遺伝子を含むものが1つという、2つのエピソームを用いてもよい。
【0080】
EBNA-1タンパク質の発現に向けられたプロモーターが、本発明において用いられる。強力なプロモーターを用いることが好ましく、強力な異種プロモーター、例えばCMVなどを用いることが好ましい。EBNA-1タンパク質用の発現カセットの染色体DNAへの安定な組み込みは、結果として、EBNA-1タンパク質を発現する改変された齧歯動物細胞をもたらした、すなわちEBNA-1タンパク質をコードする構造遺伝子およびプロモーターが染色体DNA中に機能的に連結されて組み込まれた。
【0081】
本発明の対象を例示するために、本発明を以下に説明する。第1の段階として、EBNA-1タンパク質を発現する基本的な齧歯動物細胞系を構築する。培養下でEBNA-1タンパク質を定常的に発現する、基本的な齧歯動物細胞系を構築することが好ましい。その後に、1つまたは複数の異種ポリペプチド用の発現カセットを含むプラスミドを設計し、基本的な齧歯動物細胞系に導入する。EBNA-1タンパク質を発現し、かつ異種ポリペプチドの発現のためのプラスミドを保有する、得られた細胞系を、異種ポリペプチドの発現のために適した条件下で培養する(実施例1〜4を参照)。
【0082】
以下の説明および例は本発明を例示する目的で提示されており、本発明の範囲を限定することが目的ではない。
【0083】
宿主細胞系の構築
本発明の宿主細胞は、EBNA-1タンパク質をコードする核酸を提供する。
【0084】
EBNA-1タンパク質をコードする構造遺伝子を備えた発現カセットを含むプラスミドの構築は、実施例2a)に記載されている。プラスミドの注釈付きマップは図1に示されている。
【0085】
齧歯動物細胞をこのプラスミドを用いてトランスフェクトした。G418を選択剤として用いる選択的培養条件下でのトランスフェクト細胞の選択の後に、形質転換体を採って増殖させ、EBNA-1タンパク質の産生に関して試験した。
【0086】
基本的な齧歯動物細胞系の形成のために構築されたプラスミドは、EBV oriP配列の機能性コピーを含まないものとする。これは、oriPの両方のエレメント、2回対称エレメントおよび反復配列群を含む。
【0087】
発現プラスミドの構築
異種ペプチド、ポリペプチドまたはタンパク質の発現のためには、対応する構造遺伝子用の発現カセットを含む発現プラスミドを構築しなければならない。
【0088】
タンパク質例として、モノクローナルヒト抗IGF-1R抗体(参照、US 2005/0008642号)を選択した。本発明の基本的な齧歯動物細胞系を用いるHuMab抗IGF-1Rの産生のために、発現プラスミドを構築した(実施例3および図3〜5を参照)。異種ポリペプチドの発現のために構築されたプラスミドは、EBNA-1構造遺伝子の機能性コピーを含まないものとする。
【0089】
一般的に言うと、サブクローニングおよびオーバーラップPCRにより、HuMab抗IGF-1Rの重鎖可変領域(VH)およびヒトγ1重鎖定常領域(CH1-ヒンジ-CH2-CH3)の構造遺伝子と同様に、HuMab抗IGF-1Rの軽鎖可変領域(VL)およびヒトκ-軽鎖定常領域(CL)をコードする構造遺伝子を連結した。続いて、これらの構築物を、EBV oriPを欠くか、または保有するかのいずれかの哺乳動物細胞発現ベクターに挿入した。
【0090】
基本的な齧歯動物細胞系におけるポリペプチドの発現
本発明による基本的な齧歯動物細胞系に対して、構築した発現プラスミドの1つまたは複数をトランスフェクトした。トランスフェクト細胞の培養は、例えば一過性トランスフェクションの下での、異種ポリペプチドの発現のために適した条件下で行った。
【0091】
一般的に言うと、一過性トランスフェクションの下での培養は、選択剤によって課せられる選択圧が存在しないために、トランスフェクトされた発現プラスミドが宿主細胞の染色体に組み込まれないことを可能にする。これらの選択的でない増殖条件のために、発現プラスミドは、培養物のすべての細胞において100%の頻度で複製するわけではない。これは、全体的なタンパク質発現率の緩徐な低下を引き起こす。培養は一般に、培養物中の発現されたタンパク質の濃度が最大値に達するまで行われる。好ましくは、培養は最長で20日間、好ましくは最長で10日間、より好ましくは5〜10日間行われる。
【0092】
この期間の後に、当業者に公知の標準的な手法に従って、上清を分離し、産生された分泌性の免疫グロブリンを単離して精製する。
【0093】
上記のバッチ培養のほかに、スプリット-バッチ(split-batch)プロセスを、細胞の培養のために用いることができる。スプリット-バッチ培養プロセスの際には、培養期間の半分の後に栄養培地を交換する。
【0094】
したがって、本発明の目的は、異種ポリペプチドの発現のための方法であって、哺乳動物細胞、好ましくはヒト細胞のそれと類似したグリコシル化パターンを有する前記異種ポリペプチドを短時間で産生することを可能にする方法を提供することであった。驚いたことに、本発明による方法はこの需要を満たすことが現在では見いだされている
【0095】
この方法が基にしている細胞系は、治療用ポリペプチドおよびタンパク質の産生のための細胞系に関して設定されている規制に準拠する、すなわち、ポリオーマウイルスのラージT抗原などの原癌遺伝子を含まない、齧歯動物細胞、好ましくはCHO細胞である。
【0096】
驚いたことに、EBNA-1タンパク質をコードする構造遺伝子、好ましくはプロモーターと機能的に連結されたものが安定にトランスフェクトされた細胞において、エプスタイン-バーウイルス(EBV)複製起点を有し、かつEBNA-1タンパク質をコードする構造遺伝子を伴わない、すなわち含まない染色体外エレメント、例えば、発現プラスミドが、異種ポリペプチドの発現において機能性であることが見いだされた。一般に、本発明による方法では、エプスタイン-バーウイルス由来の2つのエレメント、複製起点(oriP)およびEBNA-1タンパク質をコードする構造遺伝子を用いる。
【0097】
本発明の1つの局面は、齧歯動物細胞における異種ポリペプチドの発現のための方法であって、以下の段階を含むことを特徴とする方法である:
a)EBNA-1タンパク質をコードする構造遺伝子が安定にトランスフェクトされた齧歯動物細胞を提供する段階、
b)前記齧歯動物細胞に、エプスタイン-バーウイルス(EBV)複製起点(oriP)を含む発現プラスミドをトランスフェクトする段階、
c)前記トランスフェクトされた細胞を、前記異種ポリペプチドの発現のために適した条件下で培養する段階、
d)前記異種ポリペプチドを培養物から回収する段階。
【0098】
1つの態様において、前記異種ポリペプチドは免疫グロブリンまたは免疫グロブリン断片であり、好ましくは、前記免疫グロブリンは免疫グロブリンGまたは免疫グロブリンEである。
【0099】
1つの態様において、前記異種ポリペプチドは分泌性の異種ポリペプチドであり、前記異種ポリペプチドは培地から回収される。
【0100】
1つの態様において、前記齧歯動物細胞はCHO細胞である。
【0101】
1つの態様において、EBNA-1タンパク質をコードする前記構造遺伝子は、プロモーター、好ましくは強力なプロモーター、特に好ましくはCMV由来のプロモーターと機能的に連結されている。
【0102】
1つの態様において、前記発現プラスミドは、単一のEBV由来エレメントとして、エプスタイン-バーウイルス(EBV)複製起点(oriP)を含む。
【0103】
1つの態様において、前記発現プラスミドは、EBNA-1タンパク質をコードする構造遺伝子を全く含まない。
【0104】
1つの態様において、前記発現プラスミドはさらに以下のものを含む:
‐原核生物複製起点
‐選択マーカー
‐前記齧歯動物細胞における異種ポリペプチドの発現のために適した発現カセットであって、プロモーター配列、5'非翻訳領域、前記異種タンパク質をコードする核酸配列(構造遺伝子)、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、発現カセット。
【0105】
1つの態様において、異種ポリペプチドが分泌性の異種ポリペプチドであるならば、前記発現カセットはさらに、前記異種ポリペプチドをコードする構造遺伝子と機能的に連結されているシグナル配列を含む。
【0106】
1つの態様において、異種ポリペプチドの発現のための方法はバッチプロセス、スプリット-バッチプロセス、または連続プロセスとして行われる。好ましい態様において、前記方法はバッチプロセスまたはスプリット-バッチプロセスとして行われる。
【0107】
1つの態様において、異種ポリペプチドの発現のための方法はさらに、段階e)前記異種ポリペプチドを精製する段階を含む。
【0108】
一般的なクロマトグラフィー法およびそれらの使用法は当業者に周知である。例えば、Chromatography, 5th edition, Part A: Fundamentals and Techniques, Heftmann, E. (ed.), Elsevier Science Publishing Company, New York (1992);Advanced Chromatographic and Electromigration Methods in Biosciences, Deyl, Z. (ed.), Elsevier Science BV, Amsterdam, The Netherlands (1998);Chromatography Today, Poole, C. F., and Poole, S. K., Elsevier Science Publishing Company, New York (1991), Scopes, Protein Purification: Principles and Practice (1982);Sambrook, J., et al. (ed.), Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)、または、Current Protocols in Molecular Biology, Ausubel, F. M., et al. (eds)., John Wiley & Sons, Inc., New Yorkを参照のこと。
【0109】
免疫グロブリンの精製プロセスは一般に、多段階クロマトグラフィーの部分を含む。第1の段階では、非免疫グロブリン性のポリペプチドおよびタンパク質を、例えばプロテインAを用いるアフィニティークロマトグラフィーによって、免疫グロブリン画分から分離する。その後に、個々の免疫グロブリンクラスを分離するため、および第1のカラムからともに流出した微量のプロテインAを除去するために、イオン交換クロマトグラフィーを行うことができる。最後に第3のクロマトグラフィー段階が、免疫グロブリン単量体を多量体および同じクラスの断片と分離するために必要である。時には、凝集物の量が多く(5%またはそれ以上)、それらを第3の精製段階で効率的に分離できないために、さらなる精製段階が必要になることがある。
【0110】
特定の免疫グロブリンの組換え産生により、種々の免疫グロブリンクラスの分離のための分離段階が不要になる。このため、組換え的に産生された免疫グロブリンの全精製プロセスは、2回のクロマトグラフィーの段階に減らすことができる。
【0111】
プロテインA溶出液は、一般に、各々の免疫グロブリンタンパク質の等電点以下のpH値にある陽イオン交換材料に対してクロマトグラフィーで処理される。
【0112】
1つの態様において、異種ポリペプチドの発現のための方法は、一過性トランスフェクションの下で行われる。
【0113】
異種ポリペプチドの発現のための前記方法の1つの態様において、EBNA-1タンパク質をコードする構造遺伝子は、EBNA-1タンパク質をコードする完全長構造遺伝子(SEQ ID NO:4)であり、前記発現プラスミドは、EBNA-1タンパク質をコードする完全長構造遺伝子(SEQ ID NO:4)を全く含まない。
【0114】
以下の例、配列表および図は、本発明の理解を助けるために提供され、その真の範囲は添付の特許請求の範囲に示されている。示された手順に、本発明の精神を逸脱することなく、改変を加えうることは理解されるであろう。
【実施例】
【0115】
実施例の説明
実施例1 一般的な手法
実施例2 EBNA-1タンパク質を発現するCHO細胞系の構築
実施例3 EBV oriP、ならびにヒトモノクローナル抗IGF-1R抗体の軽鎖および重鎖用の発現カセットを保有するプラスミドの構築
実施例4 EBNA-1-陽性DG-700-IIIE3sub1細胞による、oriPを保有するプラスミドからの抗体の産生
【0116】
実施例1
一般的な手法
a)組換えDNAの手法
DNAの操作のためには、Sambrook, J., Fritsch, E.F. and Maniatis, T. (1989), Molecular cloning: A laboratory manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New Yorkに記載された通りに標準的な方法を用いた。分子生物学用試薬は、製造元の指示に従って用いた。
【0117】
b)DNA配列の決定
DNA配列は、MediGenomix GmbH(Martinsried, Germany)で行われた二本鎖シークエンシングによって決定された。
【0118】
c)DNAおよびタンパク質の配列解析ならびに配列データの管理
GCG(Genetics Computer Group, Madison, Wisconsin)のソフトウエアパッケージ、バージョン10.2およびInfomax社のVector NTI Advanceスイート、バージョン8.0を、配列の生成、マッピング、解析、注釈付けおよび図示のために用いた。
【0119】
d)細胞培養の手法
Current Protocols in Cell Biology (2000), Bonifacino, J.S., Dasso, M., Harford, J.B., Lippincott-Schwartz, J. and Yamada, K.M. (eds.), John Wiley & Sons, Inc.に記載された通りに、標準的な細胞培養手法を用いた。
【0120】
e)EBNA-1発現のウエスタンブロット分析
細胞を200×gでの遠心によって収集し、PBS(リン酸緩衝食塩水)で洗浄した上で、溶解用緩衝液(50mM Tris*HCl(トリス(ヒドロキシメチル)アミノメタン塩酸)、pH 8.0、120mM NaCl、0.5%(v/v)Nonidet(登録商標)P40、10%(v/v)グリセロール、5mM DTT(ジチオトレイトール)、1mM EGTA(エチレン-ビス(オキシエチレンニトリロ)四酢酸)、1%(v/v)Trasylol(登録商標)、2mM PMSF(フェニルメタンスルホニルフロリド)、50μg/mlロイペプチン)中で氷上にて30分間インキュベートした。13,000×gでの遠心の後に、可溶性上清を収集し、Bio-Radタンパク質アッセイ(カタログ番号:5000-0001)を製造元のプロトコールに従って用いてタンパク質濃度に関して検査した。
【0121】
タンパク質のSDS/ポリアクリルアミドゲル電気泳動(ドデシル硫酸ナトリウム、SDS-PAGE)およびエレクトロブロット法を、NuPAGE(登録商標)ゲルシステム(Invitrogen)を製造元の推奨に従って用いて行った。手短に述べると、タンパク質の溶解物(100μgタンパク質)を、4倍容積の還元性LDS(ドデシル硫酸リチウム)試料用緩衝液と混ぜ合わせ、70℃で10分間インキュベートした上で、10% NuPAGE(登録商標)Novex Bis/Trisゲル(Invitrogen、カタログ番号:NP0301)にローディングした。タンパク質の分離は、還元性NuPAGE(登録商標)MES SDS(4-モルホリノエタンスルホン酸/ドデシル硫酸ナトリウム)泳動緩衝液中で行った。SDS/ポリアクリルアミドゲルからのタンパク質のエレクトロトランスファーには、標準的なナイロン膜を用いた。エレクトロトランスファーの後に、膜を50mM Tris*HCl、pH 7.5、150mM NaCl(TBS、トリス緩衝食塩水)で洗浄し、1%(w/v)Western Blocking Reagent(Roche、カタログ番号:11921673001)を含むTBS中に4℃で一晩おいて、非特異的な結合部位をブロックした。EBNA-1を対象とするマウスモノクローナル抗体E8.26(Oncogene、カタログ番号:DP15L)を一次抗体として、1%(w/v)Western Blocking Solutionを含むTBSで1:1,000に希釈して用いた。TBSで2回、0.05%(v/v)Tween-20を加えたTBS(TBST)で2回洗浄した後に、ペルオキシダーゼを結合させた抗マウス/抗ウサギIgG抗体(Roche、カタログ番号1520709)を二次抗体として、1%(w/v)Western Blocking Solutionを含むTBSで1:10,000に希釈して用いた。TBSTで2回、TBSで3回洗浄した後に、結合したペルオキシダーゼ結合物を、LumiLightPlus基質溶液(Roche、カタログ番号12015196001)およびLumi-Imager F1分析装置(Roche Molecular Biochemicals)を用いる化学発光によって検出した。
【0122】
f)細胞培養上清中の組換え抗体の定量
細胞培養上清中の抗体は、ヒトFc検出キット(Cis Bio、カタログ番号:62HFCPEB)を用いる競合的イムノアッセイによって定量した。本アッセイは、HTRF(登録商標)技術(Homogeneous Time-Resolved Fluorescence)に基づく。手短に述べると、試料を希釈用緩衝液で1:10〜1:100に希釈した。50μlの希釈試料を、96ウェルOptiPlates(Perkin Elmer、カタログ番号:6005279)中にて、25μlの抗ヒトIgG Fcクリプテートおよび25μlのヒトIgG-XL665と混ぜ合わせた。このアッセイ混合物を室温で一晩インキュベートした。320nmで励起した後に、Victor 1420分析装置(Perkin-Elmer)を用いて蛍光発光を620nmおよび665nmで測定した。抗体濃度は、較正曲線を用いた比較により、665nm/620nmの比から推定した。
【0123】
実施例2
EBNA-1タンパク質を発現するCHO細胞系の構築
a)CHO細胞におけるEBNA-1タンパク質の発現のためのプラスミドpcDNA3_EBNA-1の構築
プラスミドpcDNA3.1(Invitrogen、カタログ番号:V790-20)を制限ヌクレアーゼSacIおよびDraIIIで切断し、その結果生じた4715bp断片を、オリゴヌクレオチド1(SEQ ID NO:06)およびオリゴヌクレオチド2(SEQ ID NO:07)のアニーリングによって得られたDNAリンカーと連結させた。その結果生じたプラスミドをHindIIIおよびDraIIIで切断した。この4748bpベクター断片を、pCEP4(Invitrogen、カタログ番号:V044-50)をテンプレートとして、オリゴヌクレオチド3(SEQ ID NO:08)およびオリゴヌクレオチド4(SEQ ID NO:09)をプライマーとして用いるポリメラーゼ連鎖反応によって得られた、EBNA-1をコードするHindIII/DraIII cDNA断片と連結させた。このEBNA-1用の真核生物発現プラスミドをpcDNA3_EBNA-1と命名した(図1)。
【0124】
b)pcDNA3_EBNA-1によるCHO細胞のトランスフェクション、および安定なトランスフェクタントの選択
無血清浮遊培養に対してあらかじめ順化させたCHO-DG44細胞を、DHI培地(Schlaeger, E.J., J. Immunol. Methods 194 (1996) 191-199)を入れたスピナーフラスコ内にて、5%pCO2下にある37℃の加湿インキュベーター内で維持した。
【0125】
トランスフェクションの前に、細胞を24ウェルプレートに1×106個/mlで播いた。トランスフェクションは、LipofectAmine 2000(Invitrogen、カタログ番号:11668-027)を製造元のプロトコールに従って用いて行った。手短に述べると、DNAおよびLipofectAmine 2000をOptiMEM I培地(Invitrogen、カタログ番号:31985-047)で希釈し、DNAのμg数とLipofectAmine 2000のμl数が1:3〜1:6の比になるように混ぜ合わせた。室温での20分間のインキュベーションの後に、この混合物を細胞に添加した。24時間後に細胞をDHI培地で希釈して、96ウェルプレートに細胞300個/ウェルの比で播いた。さらに24時間後に、G418を培地に700μg/mlとして添加した。トランスフェクションから10日後に、G418耐性コロニーを増殖させて、EBNA-1タンパク質の発現に関してウエスタンブロットハイブリダイゼーションによって分析した(図2a))。EBNA-1タンパク質を定常的に発現するHEK 293細胞(HEK 293 EBNAまたはHEK 293E)および非トランスフェクトCHO-DG44細胞を参照標準として用いた。クローンDG-700-IIIE3はEBNA-1に関して強陽性であり、これを限界希釈によってサブクローニングした。EBNA-1陽性サブクローンDG-700-IIIE3sub1を連続培養し、ウエスタンブロットハイブリダイゼーションによってEBNA-1発現に関して調べた(図2b))。図2bに示されているように、EBNA-1タンパク質レベルは54日間の培養期間中変化しなかった。
【0126】
実施例3
EBV oriPならびにヒトモノクローナル抗IGF-1R抗体の軽鎖および重鎖用の発現カセットを保有するプラスミドの構築
サブクローニングおよびオーバーラップPCRにより、抗IGF-1R抗体の重鎖可変(VH)領域およびヒトγ1重鎖定常(CH1-CH2-CH3)領域の遺伝子と同様に、抗IGF-1R抗体の軽鎖可変(VL)領域およびヒトκ軽鎖定常(CL)領域をコードする遺伝子セグメントを正確に連結した。抗IGF-1R抗体の構造遺伝子(κ軽鎖およびγ1重鎖)をコードするDNA配列をDNAシークエンシングによって確認し、その後に、EBV oriPを保有する哺乳動物細胞発現ベクターまたは保有しないそれの中に挿入した。
【0127】
HuMab抗IR18κ軽鎖発現ベクターp4816-pUC-L-IR-18-kappa-BsmI(p4816)は、以下のエレメントから構成される:
‐このプラスミドの大腸菌における複製を可能にする、ベクターpUC18由来の複製起点(pUC ori)
‐大腸菌におけるアンピシリン耐性を付与するβ-ラクタマーゼ遺伝子(Amp)
‐以下のエレメントから構成される、抗IGF-1R抗体κ軽鎖の発現のための転写ユニット:
‐ヒトサイトメガロウイルス由来の主要最初期プロモーターおよびエンハンサー(hCMV IE1)
‐コザック配列を含む合成5'-UTR
‐シグナル配列イントロンを含むネズミ免疫グロブリン重鎖シグナル配列(L1_イントロン_L2)
‐5'末端の一意的なBsmI制限部位ならびに3'末端のスプライスドナー部位および一意的なNotI制限部位を伴って配列された、クローニングされた抗IGF-1R抗体可変軽鎖cDNA(VL)
‐イントロン性のマウスIgκエンハンサーを含む、ゲノム性のヒトκ軽鎖遺伝子定常領域[NotI_マウスIgκエンハンサー-イントロン-2_ヒト-イントロン-2_C-κ]
‐ポリアデニル化シグナル配列を含む、ヒトκ-免疫グロブリン3' UTR(3' UTR C-κ)
‐代替的な発現プラスミドへの発現カセットの移入を可能にするための、それぞれ5'および3'末端にある一意的な制限部位Sse8371IおよびFseI。
【0128】
p4816-pUC-L-IR-18-kappa-BsmIのプラスミドマップは図3a)に示されている。
【0129】
抗IGF-1R抗体γ1重鎖発現ベクターp4817-pUC-H-IR-18-gamma1-BsmI(p4817)は、以下のエレメントから構成される:
‐このプラスミドの大腸菌における複製を可能にする、ベクターpUC18由来の複製起点(pUC ori)
‐大腸菌におけるアンピシリン耐性を付与するβ-ラクタマーゼ遺伝子(Amp)
‐以下のエレメントから構成される、抗IGF-1R抗体γ1重鎖の発現のための転写ユニット:
‐ヒトサイトメガロウイルス由来の主要最初期プロモーターおよびエンハンサー(hCMV IE1)
‐コザック配列を含む合成5'-UTR
‐シグナル配列イントロンを含むネズミ免疫グロブリン重鎖シグナル配列(L1_イントロン_L2)
‐5'末端の一意的なBsmI制限部位ならびに3'末端のスプライスドナー部位および一意的なNotI制限部位を伴って配列された、クローニングされた抗IGF-1R抗体可変重鎖cDNA
‐マウスIg μエンハンサーを含む、ゲノム性のヒトγ1重鎖遺伝子定常領域[介在イントロンを伴うNotI_マウスIg μエンハンサー_ヒト-イントロン-2_CH1-CH2-CH3]
‐ポリアデニル化シグナル配列を含む、ヒトγ1-免疫グロブリン3' UTR
‐代替的な発現プラスミドへの発現カセットの移入を可能にするための、それぞれ5'および3'末端にある一意的な制限部位SgrAIおよびAscI。
【0130】
p4817-pUC-L-IR-18-gamma1-BsmIのプラスミドマップは図3b)に示されている。
【0131】
図4に示されているプラスミドp4818-pUC-Hyg-OriP-Heavy-IR18-BsmI(p4818)およびp4819-pUC-Hyg-OriP-Light-IR18-BsmI(p4819)は、以下の2つのエレメントの導入により、それぞれプラスミドp4817-pUC-H-IR18-gamma1-BsmIおよびp4816-pUC-L-IR18-kappa-BsmIから導き出された:
‐真核細胞における選択用マーカーとして適したハイグロマイシン耐性遺伝子
‐エプスタイン-バーウイルスの複製起点oriP。
【0132】
p4818-pUC-Hyg-OriP-Heavy-IR18-BsmIおよびp4819-pUC-Hyg-OriP-Light-IR18-BsmIのプラスミドマップは図4a)および図4b)に示されている。
【0133】
プラスミドp4821-pUC-Hyg-OriP-IR18-heavy-light-BsmIは、γ1重鎖転写ユニットを含むp4818のSgrAI/AscI断片を、p4819のSgrAIおよびAscI制限部位に導入することによって構築した。その結果生じたプラスミドは、EBV oriPおよびκ軽鎖用の転写ユニットを含む、p4819と同じエレメントに加えて、γ1重鎖転写ユニットも含む。
【0134】
p4821-pUC-Hyg-OriP-IR18-heavy-light-BsmIのプラスミドマップは図5に示されている。
【0135】
実施例4
EBNA-1陽性DG-700-IIIE3sub1細胞によるoriP保有プラスミドからの抗体の産生
DG-700-IIIE3sub1細胞および非改変CHO-DG44型細胞を、ProCHO4-CDM(Cambrex、カタログ番号:BE12-029Q)、2mMグルタミン、2%(v/v)50×HT補給物質(Invitrogen、カタログ番号:41065-012)および300μg/mlのG418中での37℃、5%CO2下の静置培養下にて維持した。トランスフェクションの1時間前に細胞を遠心処理によって収集し、DHI培地(Schlaeger, E.J., J. Immunol. Methods 194 (1996) 191-199)中に0.5×106個/mlで再懸濁させた。
【0136】
トランスフェクションは、LipofectAmine 2000(Invitrogen、カタログ番号:11668-027)を用いて行った。培養容積1mlのトランスフェクションのために、以下の成分を混ぜ合わせた:200μlのOptiMEM I(Invitrogen、カタログ番号:31985-047)、2μgのDNAおよび6μlのLipofectAmine。室温での5〜30分間のインキュベーションの後に、混合物を細胞に添加した。トランスフェクションから5〜10日後に細胞培養上清を採取し、実施例1 f)に記載した通りに抗体濃度に関して検査した。
【0137】
3種の異なるプラスミドのセットを、CHO-DG44細胞系またはEBNA-1を発現するCHO-DG44由来の細胞系DG-700-IIIE3sub1に対してトランスフェクトした。抗体軽鎖の発現用のプラスミドp4816を、抗体重鎖の発現用のp4817とともに同時トランスフェクトした。両方のプラスミドがEBV oriPを欠いている。抗体軽鎖の発現用のプラスミドp4819を、抗体重鎖の発現用のp4818とともに同時トランスフェクトした。両方のプラスミドがEBV oriPを保有する。さらに、抗体軽鎖および重鎖の両方の発現用のプラスミドp4821を単独でトランスフェクトした。プラスミドp4821はEBV oriPを保有する。
【0138】
図6に示されているように、EBNA-1陽性DG-700-IIIE3sub1細胞におけるoriP保有プラスミドp4818およびp4819のトランスフェクションは、同じ細胞系またはEBNA-1陰性CHO-DG44細胞におけるoriPを含まないp4816およびp4817のトランスフェクションと比較して、抗体の2〜3倍の発現上昇をもたらした。DG-700-IIIE3sub1細胞における抗体の発現は、抗体軽鎖および重鎖用の発現カセットをp4821のような単一のoriP保有プラスミド中に組み合わせた場合に、さらに高度であった。これに対して、oriP保有プラスミドp4817/p4818およびp4821は、EBNA-1陰性CHO-DG44細胞において抗体発現レベルの上昇を引き起こさなかった。その結果、免疫グロブリンの最大の発現は、oriP保有プラスミドをEBNA-1陽性CHO細胞にトランスフェクトした場合に達成された。
【配列表フリーテキスト】
【0139】
配列の説明
SEQ ID NO:01
EBV oriPの核酸配列である;V01555(GenBank);Yates, J.L., et al., Proc Natl Acad Sci USA 81 (1984) 3806-3806。
SEQ ID NO:02
EBVの2回対称エレメントの核酸配列である;V01555(GenBank);Reisman, D., et al., Mol. Cell Biol. 5 (1985) 1822-1832。
SEQ ID NO:03
EBVの反復配列群の核酸配列である;V01555(GenBank);Reisman et al., 1985。
SEQ ID NO:04
EBNA-1タンパク質をコードする核酸配列である;V01555(GenBank)。
SEQ ID NO:05
EBNA-1タンパク質のアミノ酸配列である;P03211(SwissProt)。
SEQ ID NO:06
プライマーオリゴヌクレオチド1である。
SEQ ID NO:07
プライマーオリゴヌクレオチド2である。
SEQ ID NO:08
プライマーオリゴヌクレオチド3である。
SEQ ID NO:09
プライマーオリゴヌクレオチド4である。
【技術分野】
【0001】
本発明は、齧歯動物細胞における異種タンパク質の発現に関する。エプスタイン-バーウイルスのoriP/EBNA-1系の制御および維持の下にあるエピソーム上にある、タンパク質をコードする核酸であって、oriPおよびEBNA-1の構造遺伝子の両方が細胞内部の異なるエレメント上に位置する核酸が提供される。
【背景技術】
【0002】
技術的背景
バイオテクノロジー的な産生プロセスの役割および影響は近年、重要さを増している。バイオテクノロジープロセスの重要性の高まりと並行して、製造される製品の複雑さも絶え間なく増している。
【0003】
異種タンパク質の発現のために可能性のある宿主細胞には、HEK(Human Embryonic Kidney)、HeLa(Henrietta Lacks)、COS(SV40により形質転換されたアフリカミドリザル腎細胞)およびCHO(Chinese Hamster Ovary)細胞があり、それは、これらの宿主において発現された異種タンパク質が、ヒト細胞におけるパターンに従って、フォールディング、プロセシング、プロテアーゼによる成熟、グリコシル化および硫酸化を受けることができるためである(例えば、Watson, E., et al., Glycobiol. 4 (1994) 227-37(非特許文献1)を参照)。
【0004】
エプスタイン-バーウイルス(EBV)は、ヒトBリンパ球の病原体である。これはヒトヘルペスウイルスの部門(ヘルペスウイルス科)に属する。EBVによって形質転換されたBリンパ球は、無秩序に増殖しうる(Miller, G., in Virology ed. by Fields, B., Raven Press, N.Y. (1985) 563-590(非特許文献2))。EBVにより形質転換された細胞の特有の特徴は、いわゆるエプスタイン-バーウイルス核抗原(EBNA)タンパク質の発現である。これらのうち、6種類の変異体がこれまでに同定されている。
【0005】
EBNA-1タンパク質は、形質転換細胞におけるEBV核酸の複製サイクルにおいて重要な役割を果たす。シス性に作用する第2のEBVエレメントである複製起点(oriP)との組み合わせにより、細胞内でのエピソームの複製および維持が可能となる(Lupton, S., and Levine, A.J., Mol. Cell. Biol. 5 (1985) 2533-2542(非特許文献3);Yates, J.L., et al., Nature (London) 313 (1985) 812-815(非特許文献4))。
【0006】
oriPセグメントは、2つの領域:2回対称エレメントおよび反復配列群から構成される。第1のものは65bpの配列セグメントである。これはウイルスの核酸内で、反復配列群とはおよそ1000bp隔たっている。この第2のセグメントは、20回繰り返される30bp配列から構成される(Hudson, G.S., et al., Virology 147 (1985) 81-98(非特許文献5);Reisman, D., et al., Mol. Cell. Biol. 5 (1985) 1822-1832(非特許文献6))。この30bp単位の反復配列群は転写を増強する能力を有しており、一方、2回対称エレメントは複製において役割を果たす。完全なoriPセグメントはプラスミドの染色体外での維持に関与する。
【0007】
EBNA-1タンパク質、すなわちトランス作用性イニシエータータンパク質と、oriPとの組み合わせは、プラスミドの構築を可能にし、ひとたびそれらが細胞内に導入されると、それらはエピトープとして安定に維持され、細胞増殖時に安定に複製される(例えば、Yates, J.L., et al., Nature (London) 313 (1985) 812-815(非特許文献4);Reisman, D., et al., Mol. Cell. Biol. 5 (1985) 1822-1832(非特許文献6)を参照)。これらの2つのエレメントは、エピソームの複製のために宿主細胞の複製機構を利用する(Bode, J., et al., Gene Ther. Mol. Biol. 6 (2001) 33-46(非特許文献7))。
【0008】
Krysan, P.J.ら (Mol. Cell. Biol. 9 (1989) 1026-1033(非特許文献8))は、EBV複製起点の反復配列群を含むプラスミドが、ヒト細胞の細胞核内に永続的に保たれることを示した。したがって、EBNA-1タンパク質の存在は十分条件であった;EBVの他のエレメントは必要でなかった(Aiyar, A., et al., EMBO J. 17 (1998) 6394-6403(非特許文献9);Hung, S.C., et al., PNAS 98 (2001) 1865-1870(非特許文献10);Yates, J.L., in DNA Replication in Eukaryotic Cells, ed. by DePhamphilis, M.L., Cold Spring Harbor Laboratory, N.Y. (1996) pages 751-774(非特許文献11);Yates, J.L., et al., J. Vir. 74 (2000) 4512-4522(非特許文献12)も参照のこと)。
【0009】
EBNA-1タンパク質はエピソーム複製時にエピソームと宿主細胞の染色体を結び付け、それによって細胞分裂時のエピソームの増殖を確実にする。
【0010】
このような相互関係は他のウイルスに関しても知られており、これには例えば、シミアンウイルス40(SV 40)由来のラージT抗原、およびウシパピローマウイルス(BPV)由来のE1/E2タンパク質がある(例えば、Gilbert, D.M., et al., Cell 50 (1987) 59-68(非特許文献13);DuBridge, R.B., et al., Mutagen. 3 (1988) 1-9(非特許文献14);Lebkowski, J.S., et al., Mol. Cell. Biol. 4 (1984) 1951-1960(非特許文献15)を参照)。
【0011】
EBVのエレメントであるEBNA-1およびoriPは、組み込まれない染色体外性で自律複製性のエピソームの調製のために用いられている。Horlickらは、例えば、EBNA1タンパク質を安定に発現するHEK(Human Embryonic Kidney)細胞を、EBV oriPを含むプラスミドからのCRHR(corticotrophin releasing hormone receptor)の発現のために用いている(Horlick, R.A., et al., Prot. Exp. Purif. 9 (1997) 301-308(非特許文献16))。
【0012】
米国特許第4,686,186号(特許文献1)には、組換えベクターおよびそれによって形質転換された真核生物宿主が報告されている。EBVエレメントであるoriPおよびEBNA-1が組換えベクター上に組み合わされている。
【0013】
国際公開公報第2002/090533号(特許文献2)には、浮遊増殖させたヒト胎児腎臓細胞(293細胞系およびその遺伝的変異体)の一過性トランスフェクションによる組換えタンパク質の産生のためのプロセスが報告されている。EBV複製起点を提供するプラスミドは染色体外に維持されている。
【0014】
国際公開公報第2004/053137号(特許文献3)には、宿主細胞における組換えポリペプチドおよび/または非翻訳RNA分子の産生のための方法が報告されている。国際公開公報第2004/018506号は、哺乳動物宿主細胞に一過性にトランスフェクトされる調節可能な発現系に適用しうる組成物および方法を報告している。
【0015】
米国特許出願第2002/0086419号(特許文献4)は、真核宿主細胞における外因性DNAの安定な存続のための組換えベクター、および宿主細胞における遺伝子産物の長期的で安定な産生のための組換えベクターの使用法を報告している。
【0016】
選択された哺乳動物宿主細胞のトランスフェクションのために有用な発現ベクターが、米国特許第5,707,830号(特許文献5)に報告されている。この発現ベクターは、エプスタイン-バーウイルスの反復配列群、宿主細胞において機能性に発現されうるEBNA-1遺伝子のコピー、ベクターが宿主細胞内で複製する能力を与える真核生物DNA断片、および発現カセットを含む。
【0017】
国際公開公報第2002/027005号(特許文献6)は、エピソーム維持系、強力なプロモーター/エンハンサー、タンパク質トランス活性化系、および異種タンパク質をコードするDNAを含む、強化されたトランスフェクション系を報告している。好ましい細胞系は非齧歯動物性であるべきであり、これはoriPを含むプラスミドが効率的に複製せず、例えばCHO細胞はトランス活性化系のための細胞因子を欠いているためである。
【0018】
Wysokenski, D.A., and Yates, J.L., (J. Vir. 63 (1989) 2657-2666)(非特許文献17)は、EBVプラスミドの複製が、霊長動物の細胞から齧歯動物の細胞への種の境界を越えないことを述べている。これは、DNA複製に関与するある宿主タンパク質との相互作用が、齧歯動物にはそれがないため存在しないことに基づく。
【0019】
Tomiyasu, K-i., et al., Biochem. Biophys. Res. Commun. 253 (1998) 733-738(非特許文献18), Mizuguchi, H., et al., FEBS Letters 472 (2000) 173-178(非特許文献19)、および国際公開公報第2005/024030号(特許文献7)は、oriPおよびEBNA-1構造遺伝子の両方を他のエレメントとともに含むプラスミドを報告している。
【0020】
米国特許第5,976,807号(特許文献8)は、関心対象の複数のタンパク質を発現する組換え真核細胞系を産生するための方法を報告している。EBNA-1タンパク質を発現し、少なくとも2つのトランスフェクトされたエピソームを含む、トランスフェクト細胞が得られている。
【先行技術文献】
【特許文献】
【0021】
【特許文献1】米国特許第4,686,186号
【特許文献2】国際公開公報第2002/090533号
【特許文献3】国際公開公報第2004/053137号
【特許文献4】米国特許出願第2002/0086419号
【特許文献5】米国特許第5,707,830号
【特許文献6】国際公開公報第2002/027005号
【特許文献7】国際公開公報第2005/024030号
【特許文献8】米国特許第5,976,807号
【非特許文献】
【0022】
【非特許文献1】Watson, E., et al., Glycobiol. 4 (1994) 227-37
【非特許文献2】Miller, G., in Virology ed. by Fields, B., Raven Press, N.Y. (1985) 563-590
【非特許文献3】Lupton, S., and Levine, A.J., Mol. Cell. Biol. 5 (1985) 2533-2542
【非特許文献4】Yates, J.L., et al., Nature (London) 313 (1985) 812-815
【非特許文献5】Hudson, G.S., et al., Virology 147 (1985) 81-98
【非特許文献6】Reisman, D., et al., Mol. Cell. Biol. 5 (1985) 1822-1832
【非特許文献7】Bode, J., et al., Gene Ther. Mol. Biol. 6 (2001) 33-46
【非特許文献8】Mol. Cell. Biol. 9 (1989) 1026-1033
【非特許文献9】Aiyar, A., et al., EMBO J. 17 (1998) 6394-6403
【非特許文献10】Hung, S.C., et al., PNAS 98 (2001) 1865-1870
【非特許文献11】Yates, J.L., in DNA Replication in Eukaryotic Cells, ed. by DePhamphilis, M.L., Cold Spring Harbor Laboratory, N.Y. (1996) pages 751-774
【非特許文献12】Yates, J.L., et al., J. Vir. 74 (2000) 4512-4522
【非特許文献13】Gilbert, D.M., et al., Cell 50 (1987) 59-68
【非特許文献14】DuBridge, R.B., et al., Mutagen. 3 (1988) 1-9
【非特許文献15】Lebkowski, J.S., et al., Mol. Cell. Biol. 4 (1984) 1951-1960
【非特許文献16】Horlick, R.A., et al., Prot. Exp. Purif. 9 (1997) 301-308
【非特許文献17】Wysokenski, D.A., and Yates, J.L., (J. Vir. 63 (1989) 2657-2666)
【非特許文献18】Tomiyasu, K-i., et al., Biochem. Biophys. Res. Commun. 253 (1998) 733-738
【非特許文献19】Mizuguchi, H., et al., FEBS Letters 472 (2000) 173-178
【発明の概要】
【0023】
本発明は、齧歯動物細胞系における異種タンパク質の発現のための発現系を提供する。この系は、エプスタイン-バーウイルスのoriP/EBNA-1エピソーム複製および維持系を含む。
【0024】
具体的には、本発明は、エプスタイン-バーウイルス核抗原1(EBNA-1)を発現し、かつエピソームを含む齧歯動物細胞であって、前記エピソームが以下のものを含む齧歯動物細胞を提供する:
a)原核生物複製起点;
b)選択マーカー;
c)エプスタイン-バーウイルス(EBV)複製起点(oriP);
d)前記齧歯動物細胞における異種ポリペプチドの発現のために適した発現カセットであって、プロモーター配列、5'非翻訳領域、前記異種タンパク質をコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、発現カセット。
【0025】
本発明は、以下の段階を含む、本発明による齧歯動物細胞を入手するための方法をさらに提供する:
a)齧歯動物細胞を提供する段階;
b)原核生物複製起点、選択マーカー、およびエプスタイン-バーウイルス核抗原1(EBNA-1)用の機能性発現カセットを含むプラスミドを提供する段階であって、発現カセットが、プロモーター配列、5'非翻訳領域、EBNA-1タンパク質をコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、段階;
c)プラスミドb)を齧歯動物細胞a)に導入する段階;
d)安定に形質転換された齧歯動物細胞を選択する段階;
e)原核生物複製起点、選択マーカー、エプスタイン-バーウイルス(EBV)複製起点(oriP)、および形質転換された齧歯動物細胞における異種タンパク質の発現のために適した発現カセットを含む、1つまたは複数のさらなるプラスミドを提供する段階であって、発現カセットが、プロモーター配列、5'非翻訳領域、異種ポリペプチドをコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、段階;
f)さらなるプラスミドe)を齧歯動物細胞d)に導入する段階;
g)段階e)からf)までを最大5回繰り返す段階。
【0026】
本発明は、以下の段階を含む、異種ポリペプチドの産生のためのプロセスをさらに提供する:
a)本発明による齧歯動物細胞を提供する段階;
b)齧歯動物細胞を、異種ポリペプチドの発現のために適した条件下で培養する段階;
c)異種ポリペプチドを培養物から回収する段階。
【0027】
本発明はまた、以下を含む、本発明による齧歯動物細胞の産生のためのキットも提供する:
a)齧歯動物細胞;
b)原核生物複製起点、選択マーカー、およびエプスタイン-バーウイルス核抗原1(EBNA-1)用の機能性発現カセットを含む第1のプラスミドであって、発現カセットが、プロモーター配列、5'非翻訳領域、EBNA-1タンパク質をコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、第1のプラスミド;
c)原核生物複製起点、選択マーカー、エプスタイン-バーウイルス(EBV)複製起点(oriP)、および齧歯動物細胞における異種ポリペプチドの発現のために適した発現カセットを含む第2のプラスミドであって、発現カセットが、プロモーター配列、核酸配列の導入のためのクローニング部位、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、第2のプラスミド。
【0028】
本発明の1つの態様において、齧歯動物細胞はCHO細胞である。
【0029】
本発明のもう1つの態様において、CHO細胞は、細胞CHO-K1、CHO-DXB11、CHO-DG44、およびEBNA-1タンパク質を発現するCHO細胞を含む群から選択される。
【0030】
本発明のもう1つの態様において、発現させようとする異種ポリペプチドは、プロドラッグ、酵素、酵素断片、酵素阻害物質、酵素活性化物質、生物活性ポリペプチド、ヘッジホッグ(hedgehog)タンパク質、骨形成タンパク質(bone morphogenetic protein)、増殖因子、エリスロポエチン、トロンボポエチン、G-CSF、インターロイキン、インターフェロン、免疫グロブリンまたは免疫グロブリン断片を含む群から選択される。
【0031】
1つの態様において、前記異種ポリペプチドは、免疫グロブリンまたは免疫グロブリン断片である。
【0032】
もう1つの態様において、本発明による異種タンパク質の産生は一過性トランスフェクションの下で行われる。
【0033】
もう1つの態様において、前記異種ポリペプチドは培地中に分泌される。
【0034】
本発明のさらなる態様において、齧歯動物細胞に導入されるプラスミドは、少なくとも2つの選択マーカー、好ましくは少なくとも1つの原核生物選択マーカーおよび少なくとも1つの真核生物選択マーカーを含む。
【0035】
本発明のさらなる態様において、1つの齧歯動物細胞に導入されるプラスミドの数は、プラスミド1つから5つまでの間である。
【0036】
本発明のもう1つの態様において、同一の段階において齧歯動物細胞に導入されるプラスミドの数は、プラスミド1つから3つまでの間、好ましくは1つから2つまでの間である。
【図面の簡単な説明】
【0037】
【図1】プラスミドpcDNA3_EBNA-1;EBNA-1タンパク質用の発現カセットを含むプラスミドのマップである。
【図2】EBNA-1発現のウエスタンブロット分析である。図2a)についての説明:レーン1:293 EBNA、65μgタンパク質;レーン2:CHO-DG44、100μgタンパク質;レーン3:DG-700-IIH7、100μgタンパク質;レーン4:DG-700-IIID9、100μgタンパク質;レーン5:DG-700-IIIE3、100μgタンパク質;レーン6:DG-700-IIIE8、100μgタンパク質;レーン7:DG-700-IIIF1、100μgタンパク質;レーン8:DG-700-IIIG10、100μgタンパク質;レーン9:DG-700-IIIH8、100μgタンパク質。図2a)についての説明:レーン1:タンパク質標準物質;レーン2:293 EBNA、100μgタンパク質;レーン3:DG-700-IIIE3sub1、第4継代、第6日、100μgタンパク質;レーン4:DG-700-IIIE3sub1、第15継代、第37日、100μgタンパク質;レーン5:DG-700-IIIE3sub1、第18継代、第48日、100μgタンパク質;レーン6:DG-700-IIIE3sub1、第20継代、第54日、100μgタンパク質。
【図3】図3a)はプラスミドp4816-pUC-L-IR18-kappa BsmIのマップである。図3b)はプラスミドp4817-pUC-H-IR18-gamma1 BsmIのマップである。
【図4】図4a)はプラスミドp4818-pUC-Hyg-OriP-Heavy-IR18-BsmIのマップである。図4b)はプラスミドp4819-pUC-Hyg-OriP-Light-IR18-BsmIのマップである。
【図5】プラスミドp4821-pUC-Hyg-OriP-IR18-heavy-light-BsmIのマップである。
【図6】種々の細胞系における種々の発現プラスミドによる抗体の発現の比較である。
【発明を実施するための形態】
【0038】
発明の詳細な説明
本発明は、エプスタイン-バーウイルス核抗原1(EBNA-1)を発現し、かつエピソームを含む齧歯動物細胞であって、前記エピソームが以下のものを含む齧歯動物細胞を提供する:
a)原核生物複製起点;
b)選択マーカー;
c)エプスタイン-バーウイルス(EBV)複製起点(oriP);
d)前記齧歯動物細胞における異種ポリペプチドの発現のために適した発現カセットであって、プロモーター配列、5'非翻訳領域、前記異種ポリペプチドをコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、発現カセット。
【0039】
本発明を実施するために有用な方法および手法は、例えば、Ausubel, F.M., ed., Current Protocols in Molecular Biology, Volumes I to III (1997);Glover, N.D., and Hames, B.D., ed., DNA Cloning: A Practical Approach, Volumes I and II (1995), Oxford University Press;Freshney, R.I. (ed.), Animal Cell Culture - a practical approach, IRL Press (1986);Watson, J.D., et al., Recombinant DNA, Second Edition, CHSL Press (1992);Winnacker, E.L., From Genes to Clones;N.Y., VCH Publishers (1987);Celis, J., ed., Cell Biology, Second Edition, Academic Press (1998);Freshney, R.I., Culture of Animal Cells: A Manual of Basic Techniques, Second Edition, Alan R. Liss, Inc., N.Y. (1987)に記述されている。
【0040】
本明細書で用いる「核酸」という用語は、組換え的に産生することができるポリペプチドをコードする、少なくとも部分的に非天然の核酸を指す。「非天然の」は、個々のヌクレオチドの配列、またはプロモーター、3'非翻訳領域、エンハンサーもしくは複製起点を非限定的に含む、使用される機能性エレメントの組み合わせのいずれかを指すことができる。核酸は、核酸断片、好ましくはDNA断片で構築することができ、それらは単離されたか化学的手段によって合成されたものである。核酸は、別の核酸、例えばプラスミドまたは真核宿主細胞のゲノム/染色体の中に組み込むことができる。プラスミドには特にシャトルベクターおよび発現ベクターが含まれる。典型的には、プラスミドは、複製起点(例えば、ColE1複製起点)および選択用マーカー(例えば、アンピシリンまたはテトラサイクリン耐性遺伝子)を、細菌における複製および選択のそれぞれのために含む、原核生物増殖ユニット(prokaryotic propagation unit)も含む。
【0041】
核酸は同様に、個々のヌクレオチドからなる、その核酸配列によって特徴づけられる。
【0042】
本明細書の中で用いる「核酸配列」という用語は、ペプチド、ポリペプチドもしくはタンパク質またはそれらの機能性変異体、すなわち例えば、異なるアミノ酸配列を有するものの同じ生物学的機能/活性を有するタンパク質をコードする、核酸分子およびその変異体のヌクレオチド配列を指す。これらの改変は例えば、遺伝暗号の縮重、突然変異、例えば点突然変異、欠失、挿入などに起因する。タンパク質の変異体は、親タンパク質配列における1つまたは複数のアミノ酸残基の付加、欠失および/または置換のために、アミノ酸配列の点で、親タンパク質のアミノ酸配列とは異なる。通常、変異体は、親タンパク質配列に対して少なくとも90%、より好ましくは少なくとも95%、最も好ましくは少なくとも99%のアミノ酸配列同一性を有するアミノ酸配列を有すると考えられる。
【0043】
「発現カセット」とは、細胞における、少なくとも、含まれる構造遺伝子の、発現および分泌のために必要なエレメントを含む核酸配列のことを指す。
【0044】
「遺伝子」とは、ペプチド、ポリペプチドまたはタンパク質の発現のために必要な、例えば染色体上またはプラスミド上にある、セグメントのことを指す。遺伝子は、コード領域のほかに、プロモーター、イントロンおよびターミネーターを含む、他の機能性エレメントを含む。
【0045】
「構造遺伝子」とは、シグナル配列を伴わない、遺伝子のコード領域のことを指す。
【0046】
本明細書の中で用いる「プロモーター」という用語は、下流の核酸配列の転写を推し進めるために用いられる調節性核酸配列を指す。プロモーター配列は、サイトメガロウイルス(CMV)、初期および後期シミアンウイルス40(SV40)(Bernoist, C., and Chambon, P., Nature 290 (1981) 304-10)、ラウス肉腫ウイルス(RSV)の3'長末端反復配列に含まれるプロモーター(Yamamoto et al., Cell 22:787-97 (1980) )、グリセリンアルデヒドリン酸デヒドロゲナーゼ(GADPH)、レトロウイルスLTR、伸長因子1α(EF-1α)、ユビキチン、単純ヘルペスウイルスチミジンキナーゼ(HSVTK)(例えば、Lee, A., et al., Mol. Cell. 7 (1997) 495-501, Wagner et al., Proc. Natl. Acad. Sci. U.S.A. 78:1441-45 (1981)も参照のこと)のプロモーター配列、およびメタロチオネイン遺伝子の調節配列(Brinster et al., Nature 296 (1982) 39-42)などを含む群から選択することができる。好ましいものは、アデノウイルスプロモーター(例えば、アデノウイルス主要後期プロモーター)、アルブミンプロモーター、ApoA1プロモーター、βアクチンプロモーター、熱ショックプロモーター、異種プロモーター(例えば、CMV)、ヒトのグロブリンおよび成長ホルモンのプロモーター、誘導性プロモーター(例えば、MMT)、レトロウイルスLTRプロモーター、RSV、ならびにチミジンキナーゼプロモーター(例えば、単純ヘルペスチミジンキナーゼプロモーター)のような強力なプロモーターである。特に好ましいものは、アデノウイルスプロモーター、最初期および後期サイトメガロウイルスプロモーター(CMV;Boshart et al., Cell 41 (1985) 521-30)、マウス乳腺腫瘍ウイルスプロモーター(MMTV)、およびラウス肉腫ウイルスの長末端反復配列由来のプロモーター(LTR-RSV;Gorman et al., Proc. Natl. Acad. Sci. USA 79 (1982) 6777-81)のような強力なウイルスプロモーターである。
【0047】
本明細書の中で用いる「ポリアデニル化シグナル」という用語は、特定の核酸配列セグメントの一次転写物の切断およびポリアデニル化を誘導するために用いられる核酸配列を指す。ポリアデニル化シグナルを含む3'非翻訳領域は、SV40、ウシ成長ホルモン(BGH)の遺伝子、免疫グロブリン遺伝子およびチミジンキナーゼ遺伝子(tk、例えば、単純ヘルペスチミジンキナーゼポリアデニル化シグナル)に由来するポリアデニル化シグナルを含む3'非翻訳領域からなる群より選択することができる。
【0048】
本明細書の中で互換的に用いられる、「耐性遺伝子」または「選択マーカー」とは、対応する選択剤の存在下で、その遺伝子を有する細胞を選択的に選択または除外選択することを可能にする遺伝子のことである。有用な陽性耐性遺伝子には抗生物質耐性遺伝子がある。この選択マーカーは、その遺伝子によって形質転換された細胞を、対応する抗生物質の存在下で陽性選択することを可能にする;形質転換されていない細胞は、選択的培養条件下で増殖または生存することができないと考えられる。選択マーカーは、陽性、陰性または二機能性でありうる。陽性選択マーカーはそのマーカーを保有する細胞の選択を可能にし、一方、陰性選択マーカーはそのマーカーを保有する細胞を選択的に除外することを可能にする。典型的には、選択マーカーは薬物に対する耐性を付与するか、または宿主細胞における代謝的もしくは異化的な欠陥を代償する。原核細胞では特に、アンピシリン、テトラサイクリン、カナマイシンまたはクロラムフェニコールに対する耐性を付与する遺伝子が頻繁に用いられる。真核細胞に有用な耐性遺伝子には、例えば、アミノグリコシドホスホトランスフェラーゼ(APH)、例えばハイグロマイシンホスホトランスフェラーゼ(hyg)、ネオマイシンおよびG418 APHなど、ジヒドロ葉酸レダクターゼ(DHFR)、チミジンキナーゼ(tk)、グルタミンシンテターゼ(GS)、アスパラギンシンテターゼ、トリプトファンシンテターゼ(インドール)、ヒスチジノールデヒドロゲナーゼ(ヒスチジノールD)の遺伝子、ならびにピューロマイシン、ブレオマイシン、フレオマイシン、クロラムフェニコール、Zeocinおよびミコフェノール酸に対する耐性をコードする遺伝子が含まれる。そのほかのマーカー遺伝子は、国際公開公報第92/08796号および国際公開公報第94/28143号に記載されている。
【0049】
対応する選択剤の存在下における選択に加えて、選択マーカーが、細胞内に通常は存在しない分子、例えば、緑色蛍光タンパク質(GFP)をコードする遺伝子を提供することもできる。GFPをコードするそのような遺伝子を有する細胞は、GFPによって放出される蛍光の検出のみにより、この遺伝子を有さない細胞と識別することができる。
【0050】
真核生物発現ベクター/プラスミドは、原核細胞において増殖可能である。このため、真核生物発現ベクター/プラスミドは、複数の耐性遺伝子、すなわち原核細胞選択のために用いうる1つの耐性遺伝子および真核細胞選択のために用いうる1つの耐性遺伝子を保有することが多いと考えられる。
【0051】
本明細書で用いる「調節エレメント」という用語は、関心対象のペプチド、ポリペプチドまたはタンパク質をコードする構造遺伝子の転写および/または翻訳のために必要な、シス性に存在するヌクレオチド配列のことを指す。転写調節エレメントは通常、発現される構造遺伝子の上流にあるプロモーター、転写開始部位および終結部位ならびにポリアデニル化シグナル配列を含む。「転写開始部位」という用語は、一次転写物、すなわちmRNA前駆体に組み入れられる、最初の核酸に対応する遺伝子中の核酸塩基のことを指し;転写開始部位がプロモーター配列と部分的に重複してもよい。「転写終結部位」という用語は、転写される関心対象の遺伝子の3'末端に通常示される、RNAポリメラーゼが転写するのを終結させるヌクレオチド配列のことを指す。ポリアデニル化シグナル配列、またはポリA付加シグナルは、真核生物mRNAの3'末端の特定の部位での切断、および切断された3'末端に対する約100〜200個のアデニンヌクレオチドの配列(ポリA尾部)の核内での転写後付加のためのシグナルを提供する。ポリアデニル化シグナル配列は、切断の部位から約10〜30ヌクレオチド上流に位置するコンセンサス配列AATAAAを含みうる。
【0052】
分泌性のポリペプチドを産生するために、関心対象の構造遺伝子はさらに、シグナル配列/リーダーペプチドをコードするDNAセグメントを含む。シグナル配列は新たに合成されたペプチド、ポリペプチド、またはタンパク質をER膜へと、さらにはそれを通過するように導き、そこでポリペプチドは分泌のために送られる。シグナル配列は、タンパク質がER膜を通過する時にシグナルペプチダーゼによって切断される。シグナル配列の機能に関しては、宿主細胞の分泌機構による認識が不可欠である。したがって、用いられるシグナル配列は、宿主細胞の分泌機構のタンパク質および酵素によって認識されなければならない。
【0053】
翻訳調節エレメントには、翻訳開始(AUG)および終止コドン(TAA、TAGまたはTGA)が含まれる。配列内リボソーム進入部位(IRES)は、いくつかの構築物に含めることができる。
【0054】
「プロモーター」とは、それと機能的に連結されている遺伝子/構造遺伝子または核酸配列の転写を制御するポリヌクレオチド配列のことを指す。プロモーターは、RNAポリメラーゼ結合および転写開始のためのシグナルを含む。用いられるプロモーターは、選択された配列の発現を企図している宿主細胞の細胞種において機能性であると考えられる。多種多様な供給源からの、構成性、誘導性および抑制性のプロモーターを含む数多くのプロモーターが当技術分野で周知であり(およびGenBankなどのデータベース中に同定され)、クローニングされたポリヌクレオチドとして、またはその内部に入手可能である(例えば、ATCCなどの寄託機関、ならびに他の商業的または個別的な供給源から)。「プロモーター」は、構造遺伝子の転写を導くヌクレオチド配列を含む。典型的には、プロモーターは、遺伝子の上流領域(5')に位置し、構造遺伝子の転写開始部位に対して近位にある。転写の開始に働くプロモーター内部の配列エレメントは、しばしばコンセンサスヌクレオチド配列を特徴とする。これらのプロモーターエレメントには、RNAポリメラーゼ結合部位、TATA配列、CAAT配列、分化特異的エレメント(DSE;McGehee, R.E., et al., Mol. Endocrinol. 7 (1993) 551-60)、サイクリックAMP応答エレメント(CRE)、血清応答エレメント(SRE;Treisman, R., Seminars in Cancer Biol. 1 (1990) 47-58)、グルココルチコイド応答エレメント(GRE)、ならびにCRE/ATF(O'Reilly, M.A., et al., J. Biol. Chem. 267 (1992) 19938-43)、AP2 (Ye, J., et al., J. Biol. Chem. 269 (1994) 25728)、SP1、cAMP応答エレメント結合タンパク質(CREB;Loeken, M.R., Gene Expr. 3 (1993) 253-64)およびオクタマー因子(概論については、Watson et al., eds., Molecular Biology of the Gene, 4th ed., The Benjamin/Cummings Publishing Company, Inc. 1987、およびLemaigre, F.P. and Rousseau, G.G., Biochem. J. 303 (1994) 1-14を参照)などの他の転写因子の結合部位が含まれる。プロモーターが誘導性プロモーターであるならば、誘導物質に反応して転写の速度は上昇する。これに対して、プロモーターが構成性プロモーターであるならば、転写の速度は調節されない。抑制性プロモーターも公知である。例えば、c-fosプロモーターは、細胞表面上にあるその受容体に対する成長ホルモンのの結合によって特異的に活性化される。テトラサイクリン(tet)により調節される発現は、例えば、CMVプロモーターの後に2つのTet-オペレーター部位が続くものからなる人工的なハイブリッド型プロモーターによって実現することができる。Tet-リプレッサーは2つのTet-オペレーター部位と結合して転写を阻止する。誘導物質であるテトラサイクリンを添加すると、Tet-リプレッサーがTet-オペレーター部位から放出されて、転写が進行する(Gossen, M. and Bujard, H. PNAS 89 (1992) 5547-5551)。メタロチオネインプロモーターおよび熱ショックプロモーターを含む、他の誘導性プロモーターについては、例えば、Sambrook et al.(前記)およびGossen, M., et al., Curr. Opin. Biotech. 5 (1994) 516-520を参照されたい。高レベル発現のための強力なプロモーターとして同定されている真核生物プロモーターには、SV40初期プロモーター、アデノウイルス主要後期プロモーター、マウスメタロチオネイン-Iプロモーター、ラウス肉腫ウイルス長末端反復配列、チャイニーズハムスター伸長因子1α(CHEF-1、例えば、US 5,888,809号を参照)、ヒトEF-1α、ユビキチンおよびヒトサイトメガロウイルス最初期プロモーター(CMV IE)がある。
【0055】
「プロモーター」は構成性であっても誘導性であってもよい。エンハンサー(すなわち、プロモーターに作用して転写を増大させるシス作用性DNAエレメント)は、プロモーターとともに働いて、プロモーターのみによって得られるよりも発現レベルを高めるために必要である可能性があり、転写調節エレメントとして含まれうる。しばしば、プロモーターを含むポリヌクレオチドセグメントは、エンハンサー配列(例えば、CMVまたはSV40)も同様に含むと考えられる。
【0056】
本明細書で用いる「エンハンサー」とは、それと機能的に連結されている遺伝子またはコード配列の転写を強化するポリヌクレオチド配列のことを指す。プロモーターとは異なり、エンハンサーは配向および位置に対して比較的非依存的であり、転写ユニットに対して5'または3'側(Lusky, M., et al., Mol. Cell Bio., 3 (1983) 1108-22)、イントロン内部(Banerji, J., et al., Cell, 33 (1983) 729-40)ならびにコード配列それ自体の内部に認められる(Osborne, T.F., et al., Mol. Cell Bio., 4 (1984) 1293-305)。このため、エンハンサーは転写開始部位の上流もしくは下流のいずれに位置してもよく、またはプロモーターからかなりの距離をおいて位置してもよいが、実際上はエンハンサーはプロモーターと物理的および機能的に重複しうる。さまざまな供給源からの多数のエンハンサーが当技術分野で周知であり(かつGenBankなどのデータベース中に同定されており、クローニングされたポリヌクレオチドとして、またはその内部に入手可能である(例えば、ATCCなどの寄託機関、ならびに他の商業的または個別的な供給源から)。プロモーター配列(例えば一般的に用いられるCMVプロモーター)を含むさまざまなポリヌクレオチドは、エンハンサー配列も含む。例えば、以上に列記した強力なプロモーターはすべて、強力なエンハンサーも含みうる(例えば、Bendig, M.M., Genetic Engineering, 7(1988) 91-127)。
【0057】
「機能的に連結されている」とは、2つまたはそれ以上の構成要素の並置であって、そのように記載された構成要素がそれらの意図した様式で機能することを許容する関係にあるような並置のことを指す。例えば、プロモーターおよび/またはエンハンサーは、それが、連結している配列の転写を制御または調節するようにシス性に作用するならば、コード配列と機能的に連結されている。一般的には、しかし必ずしもそうではないが、「機能的に連結されている」DNA配列は連続しており、分泌性のリーダーおよびポリペプチドなどの2つのタンパク質コード領域を連結する必要がある場合には、連続しておりかつリーディングフレームが合っている。しかし、機能的に連結されたプロモーターは一般にコード配列の上流に位置するものの、それは必ずしもそれと連続している必要はない。エンハンサーは連続していなくともよい。エンハンサーは、そのエンハンサーがコード配列の転写を増大させるならば、コード配列と機能的に連結されている。機能的に連結されたエンハンサーは、コード配列の上流、内部または下流に、プロモーターからかなりの距離をおいて位置する可能性がある。ポリアデニル化部位は、転写がコード配列を経てポリアデニル化配列へと進行するように、それがコード配列の下流末端に位置するならば、コード配列/構造遺伝子と機能的に連結されている。連結は、当技術分野で公知の組換え方法により、例えば、PCR法を用いて、および/または好都合な制限部位での連結により、実現することができる。好都合な制限部位が存在しないのであれば、合成オリゴヌクレオチドアダプターまたはリンカーを従来の手法を踏まえて用いる。
【0058】
本明細書で用いる「発現」という用語は、宿主細胞内部で起こっている転写および/または翻訳を指す。宿主細胞における所望の産物の転写のレベルは、細胞内に存在する対応するmRNAの量に基づいて決定することができる。例えば、選択された配列から転写されたmRNAを、PCRまたはノーザンハイブリダイゼーションによって定量することができる(Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York (1989)を参照)。選択された配列によってコードされるタンパク質は、さまざまな方法、例えばELISAによって、タンパク質の生物活性をアッセイすることによって、またはタンパク質を認識してそれを結合する抗体を用いるウエスタンブロット法もしくはラジオイムノアッセイといったそのような活性に非依存的なアッセイを用いることによって、定量することができる(Sambrook et al., 1989, 前記を参照)。
【0059】
「宿主細胞」とは、本発明のポリペプチドをコードする遺伝子が導入される細胞のことを指す。宿主細胞には、プラスミド/ベクターの増殖のために用いられる原核細胞、および構造遺伝子の発現用の真核細胞の両方が含まれる。典型的には、真核細胞は哺乳動物細胞である。
【0060】
「ポリペプチド」とは、天然または合成的に産生されたかのいかんを問わず、ペプチド結合によって連結したアミノ酸残基の重合体のことである。約20アミノ酸残基未満のポリペプチドは「ペプチド」と呼んでもよい。
【0061】
「タンパク質」とは、少なくとも1つの鎖が100アミノ酸長またはそれ以上の長さを有する、1つまたは複数のポリペプチド鎖を含む高分子のことである。タンパク質が、炭水化物基などの非ペプチド性構成要素を含んでもよい。炭水化物および他の非ペプチド性置換基は、タンパク質に対して、そのタンパク質が産生される細胞によって付加されてよもく、細胞の種類によってさまざまでありうる。タンパク質は、本明細書において、そのアミノ酸骨格構造によって定義され;炭水化物基などの付加物は一般に特定されないが、それにもかかわらず存在してよい。
【0062】
「異種DNA」または「異種ポリペプチド」とは、所定の宿主細胞の内部に天然では存在しない、DNA分子もしくはポリペプチド、またはDNA分子の集団もしくはポリペプチドの集団のことを指す。特定の宿主細胞に対して異種であるDNA分子は、宿主DNAが非宿主性DNA(すなわち外因性DNA)と組み合わされている限り、宿主細胞種に由来するDNA(すなわち内因性DNA)を含んでもよい。例えば、プロモーターを含む宿主DNAセグメントと機能的に連結されているポリペプチドをコードする非宿主性DNAセグメントを含むDNA分子は、異種DNA分子であるとみなされる。その反対に、異種DNA分子が、外因性プロモーターと機能的に連結された内因性構造遺伝子を含むこともできる。
【0063】
非宿主性DNA分子によってコードされるペプチドまたはポリペプチドは、「異種」ペプチドまたはポリペプチドである。
【0064】
本明細書の中で用いる「プラスミド」および「ベクター」という用語は、遺伝物質の細胞内への移入のための媒体を指す。この物質は、一般的には環状核酸分子であるが、それに限定されるわけではない。プラスミドの意図される目的に応じて、それがさらに、例えば、宿主におけるプラスミドの複製または転写を可能にするための、必要な複製制御セグメントを備えた複製起点を含んでもよい。
【0065】
「クローニングベクター」とは、宿主細胞において自律的に複製する能力を有する、プラスミド、コスミド、ファージミドまたは細菌人工染色体(BAC)などの核酸分子である。クローニングベクターは、典型的には、ベクターの必須な生物学的機能の欠失を伴うことなく、確定可能な様式での核酸分子の挿入を可能にする1つまたは少数の制限エンドヌクレアーゼ認識部位、ならびにクローニングベクターによって形質転換された細胞の同定および選択に用いるのに適した耐性遺伝子をコードするヌクレオチド配列を含む。耐性遺伝子は、典型的には、テトラサイクリン耐性またはアンピシリン耐性を与える遺伝子を含む。
【0066】
「発現プラスミド」とは、宿主細胞において発現させようとするタンパク質をコードする核酸分子のことである。典型的には、発現プラスミドは、原核生物プラスミド増殖ユニット(例えば、大腸菌の場合には複製起点および選択マーカーを含む)、真核生物選択マーカー、および関心対象の構造遺伝子の発現のための1つまたは複数の発現カセットを含む。「発現カセット」は、典型的には、プロモーター、5'非翻訳領域、構造遺伝子、およびポリアデニル化シグナルを含む3'非翻訳領域を含む。遺伝子発現は通常はプロモーターの制御下におかれ、そのような構造遺伝子はプロモーター「に機能的に連結されている」という。同様に、調節エレメントおよびコアプロモーターは、調節エレメントがコアプロモーターの活性を調節するならば、機能的に連結されている。
【0067】
「単離されたポリペプチド」とは、ポリペプチドに天然で随伴する、炭水化物、脂質または他のタンパク質性不純物といった混入性細胞成分を本質的に含まないポリペプチドのことである。典型的には、単離されたポリペプチドの調製物は、ポリペプチドを高度に精製された形態で、すなわち少なくとも約80%の純度、少なくとも約90%の純度、少なくとも約95%の純度、95%を上回る純度、または99%を上回る純度で含む。特定のタンパク質調製物が単離されたポリペプチドを含むことを示すための1つの方法は、タンパク質調製物のドデシル硫酸ナトリウム(SDS)-ポリアクリルアミドゲル電気泳動およびゲルのクーマシーブリリアントブルー染色の後の単一のバンドの出現による。しかし、「単離された」という用語は、二量体、点突然変異などによる突然変異、または代替的にグリコシル化もしくは誘導体化された形態といった、代替的な物理的形態にある同じポリペプチドの存在を除外するものではない。
【0068】
「免疫グロブリン」という用語は、免疫グロブリン遺伝子によって実質的にコードされる1つまたは複数のポリペプチドからなるタンパク質を指す。認知されている免疫グロブリン遺伝子は、種々の定常領域遺伝子、ならびに莫大な数の免疫グロブリン可変領域遺伝子を含む。免疫グロブリンは、例えば、Fv、FabおよびF(ab)2ならびに一本鎖(scFv)を含む、さまざまな型で存在しうる(例えば、Huston, J.S., et al., PNAS USA 85 (1988) 5879-5883;Bird et al., Science 242 (1988) 423-426;および、概論についてはHood, L. E., Weissman, I., Wood, W.B., and Wilson, J. H., Immunology, Benjamin/ Cummings, Menlo Park, California. (1983) and Hunkapiller and Hood, Nature 323 (1986) 15-16)。
【0069】
免疫グロブリンは一般に、少なくとも2つの軽鎖ポリペプチドおよび2つの重鎖ポリペプチドを含む。重鎖および軽鎖ポリペプチドのそれぞれは、抗原と相互作用しうる結合ドメインを含む可変領域(一般にポリペプチド鎖のアミノ末端部分)を含みうる。重鎖および軽鎖ポリペプチドのそれぞれは、定常領域(一般にカルボキシル末端部分)を含む。重鎖の定常領域は、i)Fcγ受容体(FcγR)を有する食細胞などの細胞への、またはii)Brambell受容体としても知られる新生児Fc受容体(FcRn)を有する細胞への、抗体の結合を媒介する。それはまた、補体(C1q)などの古典的補体系の因子を含む、いくつかの因子に対する結合も媒介する。
【0070】
さらに、免疫グロブリンの軽鎖または重鎖の可変ドメインはまた、異なるセグメント、すなわち4つのフレームワーク領域(FR)および3つの超可変領域(CDR)を含む。
【0071】
「免疫グロブリン断片」は、挿入、欠失および/または変異を伴うか、または伴わない、CH1ドメイン、ヒンジ領域、CH2ドメイン、CH3ドメイン、CH4ドメイン、CLドメイン、VHドメイン、VLドメイン、フレームワーク領域1、フレームワーク領域2、フレームワーク領域3、フレームワーク領域4、超可変領域1、超可変領域2および超可変領域3からなる群より選択される、1つまたは複数のセグメントを含むポリペプチドを指す。
【0072】
本明細書の中で示される「ポリアデニル化シグナルを含む3'非翻訳領域」とは、真核生物mRNAの3'末端の特定の部位での切断、および切断された3'末端に対する約100〜200個のアデニンヌクレオチド(ポリA尾部)の核内での転写後付加のためのシグナルを提供する、長さ50〜750塩基対のDNA配列のことである。極めて効率的なポリアデニル化シグナルが推奨されるが、これは非効率的な切断およびポリアデニル化が、望ましくない、例えばプラスミドにコードされた遺伝子発現の理由となりうるオペロン様mRNAの形成をもたらす可能性があるためである。
【0073】
本明細書の中で用いる「宿主」および「細胞」という用語は、本発明によるプラスミドを収容するのに好適である細胞を指す。好ましくは、この細胞は、CHO(Chinese Hamster Ovary)細胞、BHK(Baby Hamster Kidney)細胞および他の齧歯動物細胞を含む群から選択される。好ましいものは、CHO細胞、またはCHO-K1細胞、CHO-DXB11細胞、CHO-DG44細胞、およびEBNA-1タンパク質を発現するCHO細胞を含む、派生CHO細胞である。本発明に従って提供される細胞の子孫も同じく含まれる。突然変異、環境影響または遺伝暗号の縮重性のいずれかのために生じうる改変を連続した世代に有する、本発明に従って提供される細胞の子孫も同じく含まれる。「細胞系」という用語は、特に、特定された期間にわたってインビトロで増殖させることのできる細胞の集団を指す。この期間に、細胞は成長し細胞分裂によって増殖する。
【0074】
本明細書の中で用いる「一過性トランスフェクション」という用語は、細胞に導入された核酸がその細胞のゲノムまたは染色体DNAに組み込まれないプロセスを指す。それは実際には、染色体外エレメント、例えばエピソームとして細胞内に維持される。エピソームの核酸の転写プロセスは影響されず、例えば、エピソームの核酸によってコードされるタンパク質は産生される。
【0075】
本明細書の中で用いる「安定に形質転換された」という用語は、宿主細胞のゲノム/染色体への外因性核酸の遺伝性かつ安定な組み込みを指す。
【0076】
本明細書で用いる「生物活性ポリペプチド」という用語は、有機分子、例えば、細胞系およびウイルスを用いたバイオアッセイ系などの人工的生体系に対して、またはインビボで、鳥類、およびヒトを含む哺乳動物を非限定的に含む動物に対して投与された場合に生物学的影響を引き起こす、ペプチド、タンパク質、核タンパク質、ムコタンパク質、リポタンパク質、合成ポリペプチドまたはタンパク質などの生体高分子のことを指す。この生物学的影響は、酵素の阻害、活性化またはアロステリック修飾、結合部位または周囲での受容体との結合、受容体、シグナル伝達または抗原結合の遮断または活性化でありうるが、それらに限定されるわけではない。
【0077】
EBVの複製起点oriP、EBVの2回対称エレメントおよびEBVの反復配列群の核酸配列は、SEQ ID NO:01からSEQ ID NO:03までに示されており、それらはGenBankエントリーV01555から導き出されている。EBNA-1タンパク質をコードする配列は、SEQ ID NO:04に核酸配列として、SEQ ID NO:05にアミノ酸配列として示されている。これらの配列は、それぞれV01555(GenBank)およびP03211(SwissProt)から導き出されている。
【0078】
タンパク質の精製のためには、種々の方法が十分に確立され、広く用いられており、微生物タンパク質を用いるアフィニティークロマトグラフィー(例えば、プロテインAまたはプロテインGアフィニティークロマトグラフィー)、イオン交換クロマトグラフィー(例えば、陽イオン交換(カルボキシメチル樹脂)、陰イオン交換(アミノエチル樹脂)および混合モード交換)、チオフィリック(thiophilic)吸着(例えば、β-メルカプトエタノールおよび他のSHリガンドを用いる)、疎水性相互作用または芳香族吸着クロマトグラフィー(例えば、フェニル-セファロース、アザ-アレノフィリック樹脂(aza-arenophilic resin)またはm-アミノフェニルボロン酸を用いる)、金属キレートアフィニティークロマトグラフィー(例えば、Ni(II)およびCu(II)-親和性材料を用いる)、サイズ排除クロマトグラフィーおよび電気泳動の方法(ゲル電気泳動、キャピラリー電気泳動など)(Vijayalakshmi, M.A., Appl. Biochem. Biotech. 75 (1998) 93-102)などである。
【0079】
本発明は、齧歯動物細胞における標的ペプチド、ポリペプチドおよびタンパク質の発現のための方法を提供する。本発明はさらに、異種ペプチド、ポリペプチドまたはタンパク質の産生のための齧歯動物細胞であって、異種ペプチド、ポリペプチドまたはタンパク質をコードする構造遺伝子が齧歯動物細胞内のエピソームによって提供される齧歯動物細胞を提供する。2つまたはそれ以上のサブユニットで構成されるポリペプチドまたはタンパク質、すなわち例えば免疫グロブリンを、本発明の方法に従ってかえって好都合に産生することができる。例えば、軽鎖および重鎖の2つの対で構成される免疫グロブリンの場合には、免疫グロブリンの両方の鎖をコードする2つの構造遺伝子を含む1つのエピソームを用いることができる。または、例えば、軽鎖をコードする構造遺伝子を含むものが1つ、および重鎖をコードする構造遺伝子を含むものが1つという、2つのエピソームを用いてもよい。
【0080】
EBNA-1タンパク質の発現に向けられたプロモーターが、本発明において用いられる。強力なプロモーターを用いることが好ましく、強力な異種プロモーター、例えばCMVなどを用いることが好ましい。EBNA-1タンパク質用の発現カセットの染色体DNAへの安定な組み込みは、結果として、EBNA-1タンパク質を発現する改変された齧歯動物細胞をもたらした、すなわちEBNA-1タンパク質をコードする構造遺伝子およびプロモーターが染色体DNA中に機能的に連結されて組み込まれた。
【0081】
本発明の対象を例示するために、本発明を以下に説明する。第1の段階として、EBNA-1タンパク質を発現する基本的な齧歯動物細胞系を構築する。培養下でEBNA-1タンパク質を定常的に発現する、基本的な齧歯動物細胞系を構築することが好ましい。その後に、1つまたは複数の異種ポリペプチド用の発現カセットを含むプラスミドを設計し、基本的な齧歯動物細胞系に導入する。EBNA-1タンパク質を発現し、かつ異種ポリペプチドの発現のためのプラスミドを保有する、得られた細胞系を、異種ポリペプチドの発現のために適した条件下で培養する(実施例1〜4を参照)。
【0082】
以下の説明および例は本発明を例示する目的で提示されており、本発明の範囲を限定することが目的ではない。
【0083】
宿主細胞系の構築
本発明の宿主細胞は、EBNA-1タンパク質をコードする核酸を提供する。
【0084】
EBNA-1タンパク質をコードする構造遺伝子を備えた発現カセットを含むプラスミドの構築は、実施例2a)に記載されている。プラスミドの注釈付きマップは図1に示されている。
【0085】
齧歯動物細胞をこのプラスミドを用いてトランスフェクトした。G418を選択剤として用いる選択的培養条件下でのトランスフェクト細胞の選択の後に、形質転換体を採って増殖させ、EBNA-1タンパク質の産生に関して試験した。
【0086】
基本的な齧歯動物細胞系の形成のために構築されたプラスミドは、EBV oriP配列の機能性コピーを含まないものとする。これは、oriPの両方のエレメント、2回対称エレメントおよび反復配列群を含む。
【0087】
発現プラスミドの構築
異種ペプチド、ポリペプチドまたはタンパク質の発現のためには、対応する構造遺伝子用の発現カセットを含む発現プラスミドを構築しなければならない。
【0088】
タンパク質例として、モノクローナルヒト抗IGF-1R抗体(参照、US 2005/0008642号)を選択した。本発明の基本的な齧歯動物細胞系を用いるHuMab抗IGF-1Rの産生のために、発現プラスミドを構築した(実施例3および図3〜5を参照)。異種ポリペプチドの発現のために構築されたプラスミドは、EBNA-1構造遺伝子の機能性コピーを含まないものとする。
【0089】
一般的に言うと、サブクローニングおよびオーバーラップPCRにより、HuMab抗IGF-1Rの重鎖可変領域(VH)およびヒトγ1重鎖定常領域(CH1-ヒンジ-CH2-CH3)の構造遺伝子と同様に、HuMab抗IGF-1Rの軽鎖可変領域(VL)およびヒトκ-軽鎖定常領域(CL)をコードする構造遺伝子を連結した。続いて、これらの構築物を、EBV oriPを欠くか、または保有するかのいずれかの哺乳動物細胞発現ベクターに挿入した。
【0090】
基本的な齧歯動物細胞系におけるポリペプチドの発現
本発明による基本的な齧歯動物細胞系に対して、構築した発現プラスミドの1つまたは複数をトランスフェクトした。トランスフェクト細胞の培養は、例えば一過性トランスフェクションの下での、異種ポリペプチドの発現のために適した条件下で行った。
【0091】
一般的に言うと、一過性トランスフェクションの下での培養は、選択剤によって課せられる選択圧が存在しないために、トランスフェクトされた発現プラスミドが宿主細胞の染色体に組み込まれないことを可能にする。これらの選択的でない増殖条件のために、発現プラスミドは、培養物のすべての細胞において100%の頻度で複製するわけではない。これは、全体的なタンパク質発現率の緩徐な低下を引き起こす。培養は一般に、培養物中の発現されたタンパク質の濃度が最大値に達するまで行われる。好ましくは、培養は最長で20日間、好ましくは最長で10日間、より好ましくは5〜10日間行われる。
【0092】
この期間の後に、当業者に公知の標準的な手法に従って、上清を分離し、産生された分泌性の免疫グロブリンを単離して精製する。
【0093】
上記のバッチ培養のほかに、スプリット-バッチ(split-batch)プロセスを、細胞の培養のために用いることができる。スプリット-バッチ培養プロセスの際には、培養期間の半分の後に栄養培地を交換する。
【0094】
したがって、本発明の目的は、異種ポリペプチドの発現のための方法であって、哺乳動物細胞、好ましくはヒト細胞のそれと類似したグリコシル化パターンを有する前記異種ポリペプチドを短時間で産生することを可能にする方法を提供することであった。驚いたことに、本発明による方法はこの需要を満たすことが現在では見いだされている
【0095】
この方法が基にしている細胞系は、治療用ポリペプチドおよびタンパク質の産生のための細胞系に関して設定されている規制に準拠する、すなわち、ポリオーマウイルスのラージT抗原などの原癌遺伝子を含まない、齧歯動物細胞、好ましくはCHO細胞である。
【0096】
驚いたことに、EBNA-1タンパク質をコードする構造遺伝子、好ましくはプロモーターと機能的に連結されたものが安定にトランスフェクトされた細胞において、エプスタイン-バーウイルス(EBV)複製起点を有し、かつEBNA-1タンパク質をコードする構造遺伝子を伴わない、すなわち含まない染色体外エレメント、例えば、発現プラスミドが、異種ポリペプチドの発現において機能性であることが見いだされた。一般に、本発明による方法では、エプスタイン-バーウイルス由来の2つのエレメント、複製起点(oriP)およびEBNA-1タンパク質をコードする構造遺伝子を用いる。
【0097】
本発明の1つの局面は、齧歯動物細胞における異種ポリペプチドの発現のための方法であって、以下の段階を含むことを特徴とする方法である:
a)EBNA-1タンパク質をコードする構造遺伝子が安定にトランスフェクトされた齧歯動物細胞を提供する段階、
b)前記齧歯動物細胞に、エプスタイン-バーウイルス(EBV)複製起点(oriP)を含む発現プラスミドをトランスフェクトする段階、
c)前記トランスフェクトされた細胞を、前記異種ポリペプチドの発現のために適した条件下で培養する段階、
d)前記異種ポリペプチドを培養物から回収する段階。
【0098】
1つの態様において、前記異種ポリペプチドは免疫グロブリンまたは免疫グロブリン断片であり、好ましくは、前記免疫グロブリンは免疫グロブリンGまたは免疫グロブリンEである。
【0099】
1つの態様において、前記異種ポリペプチドは分泌性の異種ポリペプチドであり、前記異種ポリペプチドは培地から回収される。
【0100】
1つの態様において、前記齧歯動物細胞はCHO細胞である。
【0101】
1つの態様において、EBNA-1タンパク質をコードする前記構造遺伝子は、プロモーター、好ましくは強力なプロモーター、特に好ましくはCMV由来のプロモーターと機能的に連結されている。
【0102】
1つの態様において、前記発現プラスミドは、単一のEBV由来エレメントとして、エプスタイン-バーウイルス(EBV)複製起点(oriP)を含む。
【0103】
1つの態様において、前記発現プラスミドは、EBNA-1タンパク質をコードする構造遺伝子を全く含まない。
【0104】
1つの態様において、前記発現プラスミドはさらに以下のものを含む:
‐原核生物複製起点
‐選択マーカー
‐前記齧歯動物細胞における異種ポリペプチドの発現のために適した発現カセットであって、プロモーター配列、5'非翻訳領域、前記異種タンパク質をコードする核酸配列(構造遺伝子)、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、発現カセット。
【0105】
1つの態様において、異種ポリペプチドが分泌性の異種ポリペプチドであるならば、前記発現カセットはさらに、前記異種ポリペプチドをコードする構造遺伝子と機能的に連結されているシグナル配列を含む。
【0106】
1つの態様において、異種ポリペプチドの発現のための方法はバッチプロセス、スプリット-バッチプロセス、または連続プロセスとして行われる。好ましい態様において、前記方法はバッチプロセスまたはスプリット-バッチプロセスとして行われる。
【0107】
1つの態様において、異種ポリペプチドの発現のための方法はさらに、段階e)前記異種ポリペプチドを精製する段階を含む。
【0108】
一般的なクロマトグラフィー法およびそれらの使用法は当業者に周知である。例えば、Chromatography, 5th edition, Part A: Fundamentals and Techniques, Heftmann, E. (ed.), Elsevier Science Publishing Company, New York (1992);Advanced Chromatographic and Electromigration Methods in Biosciences, Deyl, Z. (ed.), Elsevier Science BV, Amsterdam, The Netherlands (1998);Chromatography Today, Poole, C. F., and Poole, S. K., Elsevier Science Publishing Company, New York (1991), Scopes, Protein Purification: Principles and Practice (1982);Sambrook, J., et al. (ed.), Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)、または、Current Protocols in Molecular Biology, Ausubel, F. M., et al. (eds)., John Wiley & Sons, Inc., New Yorkを参照のこと。
【0109】
免疫グロブリンの精製プロセスは一般に、多段階クロマトグラフィーの部分を含む。第1の段階では、非免疫グロブリン性のポリペプチドおよびタンパク質を、例えばプロテインAを用いるアフィニティークロマトグラフィーによって、免疫グロブリン画分から分離する。その後に、個々の免疫グロブリンクラスを分離するため、および第1のカラムからともに流出した微量のプロテインAを除去するために、イオン交換クロマトグラフィーを行うことができる。最後に第3のクロマトグラフィー段階が、免疫グロブリン単量体を多量体および同じクラスの断片と分離するために必要である。時には、凝集物の量が多く(5%またはそれ以上)、それらを第3の精製段階で効率的に分離できないために、さらなる精製段階が必要になることがある。
【0110】
特定の免疫グロブリンの組換え産生により、種々の免疫グロブリンクラスの分離のための分離段階が不要になる。このため、組換え的に産生された免疫グロブリンの全精製プロセスは、2回のクロマトグラフィーの段階に減らすことができる。
【0111】
プロテインA溶出液は、一般に、各々の免疫グロブリンタンパク質の等電点以下のpH値にある陽イオン交換材料に対してクロマトグラフィーで処理される。
【0112】
1つの態様において、異種ポリペプチドの発現のための方法は、一過性トランスフェクションの下で行われる。
【0113】
異種ポリペプチドの発現のための前記方法の1つの態様において、EBNA-1タンパク質をコードする構造遺伝子は、EBNA-1タンパク質をコードする完全長構造遺伝子(SEQ ID NO:4)であり、前記発現プラスミドは、EBNA-1タンパク質をコードする完全長構造遺伝子(SEQ ID NO:4)を全く含まない。
【0114】
以下の例、配列表および図は、本発明の理解を助けるために提供され、その真の範囲は添付の特許請求の範囲に示されている。示された手順に、本発明の精神を逸脱することなく、改変を加えうることは理解されるであろう。
【実施例】
【0115】
実施例の説明
実施例1 一般的な手法
実施例2 EBNA-1タンパク質を発現するCHO細胞系の構築
実施例3 EBV oriP、ならびにヒトモノクローナル抗IGF-1R抗体の軽鎖および重鎖用の発現カセットを保有するプラスミドの構築
実施例4 EBNA-1-陽性DG-700-IIIE3sub1細胞による、oriPを保有するプラスミドからの抗体の産生
【0116】
実施例1
一般的な手法
a)組換えDNAの手法
DNAの操作のためには、Sambrook, J., Fritsch, E.F. and Maniatis, T. (1989), Molecular cloning: A laboratory manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New Yorkに記載された通りに標準的な方法を用いた。分子生物学用試薬は、製造元の指示に従って用いた。
【0117】
b)DNA配列の決定
DNA配列は、MediGenomix GmbH(Martinsried, Germany)で行われた二本鎖シークエンシングによって決定された。
【0118】
c)DNAおよびタンパク質の配列解析ならびに配列データの管理
GCG(Genetics Computer Group, Madison, Wisconsin)のソフトウエアパッケージ、バージョン10.2およびInfomax社のVector NTI Advanceスイート、バージョン8.0を、配列の生成、マッピング、解析、注釈付けおよび図示のために用いた。
【0119】
d)細胞培養の手法
Current Protocols in Cell Biology (2000), Bonifacino, J.S., Dasso, M., Harford, J.B., Lippincott-Schwartz, J. and Yamada, K.M. (eds.), John Wiley & Sons, Inc.に記載された通りに、標準的な細胞培養手法を用いた。
【0120】
e)EBNA-1発現のウエスタンブロット分析
細胞を200×gでの遠心によって収集し、PBS(リン酸緩衝食塩水)で洗浄した上で、溶解用緩衝液(50mM Tris*HCl(トリス(ヒドロキシメチル)アミノメタン塩酸)、pH 8.0、120mM NaCl、0.5%(v/v)Nonidet(登録商標)P40、10%(v/v)グリセロール、5mM DTT(ジチオトレイトール)、1mM EGTA(エチレン-ビス(オキシエチレンニトリロ)四酢酸)、1%(v/v)Trasylol(登録商標)、2mM PMSF(フェニルメタンスルホニルフロリド)、50μg/mlロイペプチン)中で氷上にて30分間インキュベートした。13,000×gでの遠心の後に、可溶性上清を収集し、Bio-Radタンパク質アッセイ(カタログ番号:5000-0001)を製造元のプロトコールに従って用いてタンパク質濃度に関して検査した。
【0121】
タンパク質のSDS/ポリアクリルアミドゲル電気泳動(ドデシル硫酸ナトリウム、SDS-PAGE)およびエレクトロブロット法を、NuPAGE(登録商標)ゲルシステム(Invitrogen)を製造元の推奨に従って用いて行った。手短に述べると、タンパク質の溶解物(100μgタンパク質)を、4倍容積の還元性LDS(ドデシル硫酸リチウム)試料用緩衝液と混ぜ合わせ、70℃で10分間インキュベートした上で、10% NuPAGE(登録商標)Novex Bis/Trisゲル(Invitrogen、カタログ番号:NP0301)にローディングした。タンパク質の分離は、還元性NuPAGE(登録商標)MES SDS(4-モルホリノエタンスルホン酸/ドデシル硫酸ナトリウム)泳動緩衝液中で行った。SDS/ポリアクリルアミドゲルからのタンパク質のエレクトロトランスファーには、標準的なナイロン膜を用いた。エレクトロトランスファーの後に、膜を50mM Tris*HCl、pH 7.5、150mM NaCl(TBS、トリス緩衝食塩水)で洗浄し、1%(w/v)Western Blocking Reagent(Roche、カタログ番号:11921673001)を含むTBS中に4℃で一晩おいて、非特異的な結合部位をブロックした。EBNA-1を対象とするマウスモノクローナル抗体E8.26(Oncogene、カタログ番号:DP15L)を一次抗体として、1%(w/v)Western Blocking Solutionを含むTBSで1:1,000に希釈して用いた。TBSで2回、0.05%(v/v)Tween-20を加えたTBS(TBST)で2回洗浄した後に、ペルオキシダーゼを結合させた抗マウス/抗ウサギIgG抗体(Roche、カタログ番号1520709)を二次抗体として、1%(w/v)Western Blocking Solutionを含むTBSで1:10,000に希釈して用いた。TBSTで2回、TBSで3回洗浄した後に、結合したペルオキシダーゼ結合物を、LumiLightPlus基質溶液(Roche、カタログ番号12015196001)およびLumi-Imager F1分析装置(Roche Molecular Biochemicals)を用いる化学発光によって検出した。
【0122】
f)細胞培養上清中の組換え抗体の定量
細胞培養上清中の抗体は、ヒトFc検出キット(Cis Bio、カタログ番号:62HFCPEB)を用いる競合的イムノアッセイによって定量した。本アッセイは、HTRF(登録商標)技術(Homogeneous Time-Resolved Fluorescence)に基づく。手短に述べると、試料を希釈用緩衝液で1:10〜1:100に希釈した。50μlの希釈試料を、96ウェルOptiPlates(Perkin Elmer、カタログ番号:6005279)中にて、25μlの抗ヒトIgG Fcクリプテートおよび25μlのヒトIgG-XL665と混ぜ合わせた。このアッセイ混合物を室温で一晩インキュベートした。320nmで励起した後に、Victor 1420分析装置(Perkin-Elmer)を用いて蛍光発光を620nmおよび665nmで測定した。抗体濃度は、較正曲線を用いた比較により、665nm/620nmの比から推定した。
【0123】
実施例2
EBNA-1タンパク質を発現するCHO細胞系の構築
a)CHO細胞におけるEBNA-1タンパク質の発現のためのプラスミドpcDNA3_EBNA-1の構築
プラスミドpcDNA3.1(Invitrogen、カタログ番号:V790-20)を制限ヌクレアーゼSacIおよびDraIIIで切断し、その結果生じた4715bp断片を、オリゴヌクレオチド1(SEQ ID NO:06)およびオリゴヌクレオチド2(SEQ ID NO:07)のアニーリングによって得られたDNAリンカーと連結させた。その結果生じたプラスミドをHindIIIおよびDraIIIで切断した。この4748bpベクター断片を、pCEP4(Invitrogen、カタログ番号:V044-50)をテンプレートとして、オリゴヌクレオチド3(SEQ ID NO:08)およびオリゴヌクレオチド4(SEQ ID NO:09)をプライマーとして用いるポリメラーゼ連鎖反応によって得られた、EBNA-1をコードするHindIII/DraIII cDNA断片と連結させた。このEBNA-1用の真核生物発現プラスミドをpcDNA3_EBNA-1と命名した(図1)。
【0124】
b)pcDNA3_EBNA-1によるCHO細胞のトランスフェクション、および安定なトランスフェクタントの選択
無血清浮遊培養に対してあらかじめ順化させたCHO-DG44細胞を、DHI培地(Schlaeger, E.J., J. Immunol. Methods 194 (1996) 191-199)を入れたスピナーフラスコ内にて、5%pCO2下にある37℃の加湿インキュベーター内で維持した。
【0125】
トランスフェクションの前に、細胞を24ウェルプレートに1×106個/mlで播いた。トランスフェクションは、LipofectAmine 2000(Invitrogen、カタログ番号:11668-027)を製造元のプロトコールに従って用いて行った。手短に述べると、DNAおよびLipofectAmine 2000をOptiMEM I培地(Invitrogen、カタログ番号:31985-047)で希釈し、DNAのμg数とLipofectAmine 2000のμl数が1:3〜1:6の比になるように混ぜ合わせた。室温での20分間のインキュベーションの後に、この混合物を細胞に添加した。24時間後に細胞をDHI培地で希釈して、96ウェルプレートに細胞300個/ウェルの比で播いた。さらに24時間後に、G418を培地に700μg/mlとして添加した。トランスフェクションから10日後に、G418耐性コロニーを増殖させて、EBNA-1タンパク質の発現に関してウエスタンブロットハイブリダイゼーションによって分析した(図2a))。EBNA-1タンパク質を定常的に発現するHEK 293細胞(HEK 293 EBNAまたはHEK 293E)および非トランスフェクトCHO-DG44細胞を参照標準として用いた。クローンDG-700-IIIE3はEBNA-1に関して強陽性であり、これを限界希釈によってサブクローニングした。EBNA-1陽性サブクローンDG-700-IIIE3sub1を連続培養し、ウエスタンブロットハイブリダイゼーションによってEBNA-1発現に関して調べた(図2b))。図2bに示されているように、EBNA-1タンパク質レベルは54日間の培養期間中変化しなかった。
【0126】
実施例3
EBV oriPならびにヒトモノクローナル抗IGF-1R抗体の軽鎖および重鎖用の発現カセットを保有するプラスミドの構築
サブクローニングおよびオーバーラップPCRにより、抗IGF-1R抗体の重鎖可変(VH)領域およびヒトγ1重鎖定常(CH1-CH2-CH3)領域の遺伝子と同様に、抗IGF-1R抗体の軽鎖可変(VL)領域およびヒトκ軽鎖定常(CL)領域をコードする遺伝子セグメントを正確に連結した。抗IGF-1R抗体の構造遺伝子(κ軽鎖およびγ1重鎖)をコードするDNA配列をDNAシークエンシングによって確認し、その後に、EBV oriPを保有する哺乳動物細胞発現ベクターまたは保有しないそれの中に挿入した。
【0127】
HuMab抗IR18κ軽鎖発現ベクターp4816-pUC-L-IR-18-kappa-BsmI(p4816)は、以下のエレメントから構成される:
‐このプラスミドの大腸菌における複製を可能にする、ベクターpUC18由来の複製起点(pUC ori)
‐大腸菌におけるアンピシリン耐性を付与するβ-ラクタマーゼ遺伝子(Amp)
‐以下のエレメントから構成される、抗IGF-1R抗体κ軽鎖の発現のための転写ユニット:
‐ヒトサイトメガロウイルス由来の主要最初期プロモーターおよびエンハンサー(hCMV IE1)
‐コザック配列を含む合成5'-UTR
‐シグナル配列イントロンを含むネズミ免疫グロブリン重鎖シグナル配列(L1_イントロン_L2)
‐5'末端の一意的なBsmI制限部位ならびに3'末端のスプライスドナー部位および一意的なNotI制限部位を伴って配列された、クローニングされた抗IGF-1R抗体可変軽鎖cDNA(VL)
‐イントロン性のマウスIgκエンハンサーを含む、ゲノム性のヒトκ軽鎖遺伝子定常領域[NotI_マウスIgκエンハンサー-イントロン-2_ヒト-イントロン-2_C-κ]
‐ポリアデニル化シグナル配列を含む、ヒトκ-免疫グロブリン3' UTR(3' UTR C-κ)
‐代替的な発現プラスミドへの発現カセットの移入を可能にするための、それぞれ5'および3'末端にある一意的な制限部位Sse8371IおよびFseI。
【0128】
p4816-pUC-L-IR-18-kappa-BsmIのプラスミドマップは図3a)に示されている。
【0129】
抗IGF-1R抗体γ1重鎖発現ベクターp4817-pUC-H-IR-18-gamma1-BsmI(p4817)は、以下のエレメントから構成される:
‐このプラスミドの大腸菌における複製を可能にする、ベクターpUC18由来の複製起点(pUC ori)
‐大腸菌におけるアンピシリン耐性を付与するβ-ラクタマーゼ遺伝子(Amp)
‐以下のエレメントから構成される、抗IGF-1R抗体γ1重鎖の発現のための転写ユニット:
‐ヒトサイトメガロウイルス由来の主要最初期プロモーターおよびエンハンサー(hCMV IE1)
‐コザック配列を含む合成5'-UTR
‐シグナル配列イントロンを含むネズミ免疫グロブリン重鎖シグナル配列(L1_イントロン_L2)
‐5'末端の一意的なBsmI制限部位ならびに3'末端のスプライスドナー部位および一意的なNotI制限部位を伴って配列された、クローニングされた抗IGF-1R抗体可変重鎖cDNA
‐マウスIg μエンハンサーを含む、ゲノム性のヒトγ1重鎖遺伝子定常領域[介在イントロンを伴うNotI_マウスIg μエンハンサー_ヒト-イントロン-2_CH1-CH2-CH3]
‐ポリアデニル化シグナル配列を含む、ヒトγ1-免疫グロブリン3' UTR
‐代替的な発現プラスミドへの発現カセットの移入を可能にするための、それぞれ5'および3'末端にある一意的な制限部位SgrAIおよびAscI。
【0130】
p4817-pUC-L-IR-18-gamma1-BsmIのプラスミドマップは図3b)に示されている。
【0131】
図4に示されているプラスミドp4818-pUC-Hyg-OriP-Heavy-IR18-BsmI(p4818)およびp4819-pUC-Hyg-OriP-Light-IR18-BsmI(p4819)は、以下の2つのエレメントの導入により、それぞれプラスミドp4817-pUC-H-IR18-gamma1-BsmIおよびp4816-pUC-L-IR18-kappa-BsmIから導き出された:
‐真核細胞における選択用マーカーとして適したハイグロマイシン耐性遺伝子
‐エプスタイン-バーウイルスの複製起点oriP。
【0132】
p4818-pUC-Hyg-OriP-Heavy-IR18-BsmIおよびp4819-pUC-Hyg-OriP-Light-IR18-BsmIのプラスミドマップは図4a)および図4b)に示されている。
【0133】
プラスミドp4821-pUC-Hyg-OriP-IR18-heavy-light-BsmIは、γ1重鎖転写ユニットを含むp4818のSgrAI/AscI断片を、p4819のSgrAIおよびAscI制限部位に導入することによって構築した。その結果生じたプラスミドは、EBV oriPおよびκ軽鎖用の転写ユニットを含む、p4819と同じエレメントに加えて、γ1重鎖転写ユニットも含む。
【0134】
p4821-pUC-Hyg-OriP-IR18-heavy-light-BsmIのプラスミドマップは図5に示されている。
【0135】
実施例4
EBNA-1陽性DG-700-IIIE3sub1細胞によるoriP保有プラスミドからの抗体の産生
DG-700-IIIE3sub1細胞および非改変CHO-DG44型細胞を、ProCHO4-CDM(Cambrex、カタログ番号:BE12-029Q)、2mMグルタミン、2%(v/v)50×HT補給物質(Invitrogen、カタログ番号:41065-012)および300μg/mlのG418中での37℃、5%CO2下の静置培養下にて維持した。トランスフェクションの1時間前に細胞を遠心処理によって収集し、DHI培地(Schlaeger, E.J., J. Immunol. Methods 194 (1996) 191-199)中に0.5×106個/mlで再懸濁させた。
【0136】
トランスフェクションは、LipofectAmine 2000(Invitrogen、カタログ番号:11668-027)を用いて行った。培養容積1mlのトランスフェクションのために、以下の成分を混ぜ合わせた:200μlのOptiMEM I(Invitrogen、カタログ番号:31985-047)、2μgのDNAおよび6μlのLipofectAmine。室温での5〜30分間のインキュベーションの後に、混合物を細胞に添加した。トランスフェクションから5〜10日後に細胞培養上清を採取し、実施例1 f)に記載した通りに抗体濃度に関して検査した。
【0137】
3種の異なるプラスミドのセットを、CHO-DG44細胞系またはEBNA-1を発現するCHO-DG44由来の細胞系DG-700-IIIE3sub1に対してトランスフェクトした。抗体軽鎖の発現用のプラスミドp4816を、抗体重鎖の発現用のp4817とともに同時トランスフェクトした。両方のプラスミドがEBV oriPを欠いている。抗体軽鎖の発現用のプラスミドp4819を、抗体重鎖の発現用のp4818とともに同時トランスフェクトした。両方のプラスミドがEBV oriPを保有する。さらに、抗体軽鎖および重鎖の両方の発現用のプラスミドp4821を単独でトランスフェクトした。プラスミドp4821はEBV oriPを保有する。
【0138】
図6に示されているように、EBNA-1陽性DG-700-IIIE3sub1細胞におけるoriP保有プラスミドp4818およびp4819のトランスフェクションは、同じ細胞系またはEBNA-1陰性CHO-DG44細胞におけるoriPを含まないp4816およびp4817のトランスフェクションと比較して、抗体の2〜3倍の発現上昇をもたらした。DG-700-IIIE3sub1細胞における抗体の発現は、抗体軽鎖および重鎖用の発現カセットをp4821のような単一のoriP保有プラスミド中に組み合わせた場合に、さらに高度であった。これに対して、oriP保有プラスミドp4817/p4818およびp4821は、EBNA-1陰性CHO-DG44細胞において抗体発現レベルの上昇を引き起こさなかった。その結果、免疫グロブリンの最大の発現は、oriP保有プラスミドをEBNA-1陽性CHO細胞にトランスフェクトした場合に達成された。
【配列表フリーテキスト】
【0139】
配列の説明
SEQ ID NO:01
EBV oriPの核酸配列である;V01555(GenBank);Yates, J.L., et al., Proc Natl Acad Sci USA 81 (1984) 3806-3806。
SEQ ID NO:02
EBVの2回対称エレメントの核酸配列である;V01555(GenBank);Reisman, D., et al., Mol. Cell Biol. 5 (1985) 1822-1832。
SEQ ID NO:03
EBVの反復配列群の核酸配列である;V01555(GenBank);Reisman et al., 1985。
SEQ ID NO:04
EBNA-1タンパク質をコードする核酸配列である;V01555(GenBank)。
SEQ ID NO:05
EBNA-1タンパク質のアミノ酸配列である;P03211(SwissProt)。
SEQ ID NO:06
プライマーオリゴヌクレオチド1である。
SEQ ID NO:07
プライマーオリゴヌクレオチド2である。
SEQ ID NO:08
プライマーオリゴヌクレオチド3である。
SEQ ID NO:09
プライマーオリゴヌクレオチド4である。
【特許請求の範囲】
【請求項1】
以下を特徴とする齧歯動物細胞:
a)エプスタイン-バーウイルス核抗原1(EBNA-1)を発現する;
b)以下を含むエピソームを含む:
(i)原核生物複製起点;
(ii)選択マーカー;
(iii)エプスタイン-バーウイルス(EBV)複製起点(oriP);
(iv)該齧歯動物細胞における異種ポリペプチドの発現のために適した発現カセットであって、プロモーター配列、5'非翻訳領域、該異種ポリペプチドをコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、発現カセット。
【請求項2】
以下の段階を含むことを特徴とする、齧歯動物細胞を入手するための方法:
a)齧歯動物細胞を提供する段階;
b)以下を含むプラスミドを提供する段階:
(i)原核生物複製起点;
(ii)選択マーカー;
(iii)エプスタイン-バーウイルス核抗原1(EBNA-1)用の機能性発現カセットであって、プロモーター配列、5'非翻訳領域、EBNA-1をコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳配列を含む、発現カセット;
c)プラスミドb)を齧歯動物細胞a)に導入する段階、および安定に形質転換された齧歯動物細胞を選択する段階;
d)以下を含む、1つから4つまでのさらなるプラスミドを提供する段階:
(i)原核生物複製起点;
(ii)選択マーカー;
(iii)エプスタイン-バーウイルス(EBV)複製起点(oriP);
(iv)該形質転換された齧歯動物細胞における異種ポリペプチドの発現のために適した発現カセットであって、プロモーター配列、5'非翻訳領域、異種ポリペプチドをコードする核酸配列、およびポリアデニル化シグナルを伴う3'非翻訳領域を含む、発現カセット;
e)さらなるプラスミドd)を、該安定に形質転換された齧歯動物細胞に導入する段階。
【請求項3】
以下の段階を含むことを特徴とする、異種ポリペプチドの産生のための方法:
a)請求項1記載の齧歯動物細胞を提供する段階;
b)該齧歯動物細胞を、該異種ポリペプチドの発現のために適した条件下で培養する段階;
c)該ポリペプチドを培養物から回収する段階。
【請求項4】
以下を含むことを特徴とする、請求項1記載の齧歯動物細胞の産生のためのキット:
a)齧歯動物細胞;
b)以下を含む、第1のプラスミド:
(i)原核生物複製起点;
(ii)選択マーカー;
(iii)エプスタイン-バーウイルス核抗原1(EBNA-1)用の機能性発現カセットであって、プロモーター配列、5'非翻訳領域、EBNA-1をコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、発現カセット;
c)以下を含む、第2のプラスミド:
(i)原核生物複製起点;
(ii)選択マーカー;
(iii)エプスタイン-バーウイルス(EBV)複製起点(oriP);
(iv)該齧歯動物細胞における異種ポリペプチドの発現のために適した発現カセットであって、プロモーター配列、5'非翻訳領域、核酸配列の導入のためのクローニング部位、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、発現カセット。
【請求項5】
異種ポリペプチドが、プロドラッグ、酵素、酵素断片、酵素阻害物質、酵素活性化物質、生物活性ポリペプチド、ヘッジホッグ(hedgehog)タンパク質、骨形成タンパク質(bone morphogenetic protein)、増殖因子、エリスロポエチン、トロンボポエチン、G-CSF、インターロイキン、インターフェロン、免疫グロブリンまたは免疫グロブリン断片を含む群から選択されることを特徴とする、請求項2〜3のいずれか一項記載の方法。
【請求項6】
以下の段階を含むことを特徴とする、齧歯動物細胞における異種ポリペプチドの発現のための方法:
a)EBNA-1タンパク質をコードする構造遺伝子で安定にトランスフェクトされた齧歯動物細胞を提供する段階、
b)該齧歯動物細胞に、エプスタイン-バーウイルス(EBV)複製起点(oriP)を含む発現プラスミドをトランスフェクトする段階;
c)該トランスフェクトされた細胞を、該異種ポリペプチドの発現のために適した条件下で培養する段階、
d)該異種ポリペプチドを培養物から回収する段階。
【請求項7】
異種ポリペプチドが、分泌性の異種ポリペプチドであることを特徴とする、請求項2〜3および5〜6のいずれか一項記載の方法。
【請求項8】
発現プラスミドが、EBNA-1タンパク質をコードする構造遺伝子を全く含まないことを特徴とする、請求項2〜3および5〜7のいずれか一項記載の方法。
【請求項9】
培養する段階が一過性トランスフェクション下で行われることを特徴とする、請求項2〜3および5〜8のいずれか一項記載の方法。
【請求項10】
齧歯動物細胞がCHO細胞であることを特徴とする、請求項2〜3および5〜9のいずれか一項記載の方法。
【請求項11】
CHO細胞が、CHO-DBX11細胞、CHO-K1細胞、CHO-DG44細胞、およびEBNA-1を発現するCHO細胞を含む群から選択される、請求項10記載の方法。
【請求項1】
以下を特徴とする齧歯動物細胞:
a)エプスタイン-バーウイルス核抗原1(EBNA-1)を発現する;
b)以下を含むエピソームを含む:
(i)原核生物複製起点;
(ii)選択マーカー;
(iii)エプスタイン-バーウイルス(EBV)複製起点(oriP);
(iv)該齧歯動物細胞における異種ポリペプチドの発現のために適した発現カセットであって、プロモーター配列、5'非翻訳領域、該異種ポリペプチドをコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、発現カセット。
【請求項2】
以下の段階を含むことを特徴とする、齧歯動物細胞を入手するための方法:
a)齧歯動物細胞を提供する段階;
b)以下を含むプラスミドを提供する段階:
(i)原核生物複製起点;
(ii)選択マーカー;
(iii)エプスタイン-バーウイルス核抗原1(EBNA-1)用の機能性発現カセットであって、プロモーター配列、5'非翻訳領域、EBNA-1をコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳配列を含む、発現カセット;
c)プラスミドb)を齧歯動物細胞a)に導入する段階、および安定に形質転換された齧歯動物細胞を選択する段階;
d)以下を含む、1つから4つまでのさらなるプラスミドを提供する段階:
(i)原核生物複製起点;
(ii)選択マーカー;
(iii)エプスタイン-バーウイルス(EBV)複製起点(oriP);
(iv)該形質転換された齧歯動物細胞における異種ポリペプチドの発現のために適した発現カセットであって、プロモーター配列、5'非翻訳領域、異種ポリペプチドをコードする核酸配列、およびポリアデニル化シグナルを伴う3'非翻訳領域を含む、発現カセット;
e)さらなるプラスミドd)を、該安定に形質転換された齧歯動物細胞に導入する段階。
【請求項3】
以下の段階を含むことを特徴とする、異種ポリペプチドの産生のための方法:
a)請求項1記載の齧歯動物細胞を提供する段階;
b)該齧歯動物細胞を、該異種ポリペプチドの発現のために適した条件下で培養する段階;
c)該ポリペプチドを培養物から回収する段階。
【請求項4】
以下を含むことを特徴とする、請求項1記載の齧歯動物細胞の産生のためのキット:
a)齧歯動物細胞;
b)以下を含む、第1のプラスミド:
(i)原核生物複製起点;
(ii)選択マーカー;
(iii)エプスタイン-バーウイルス核抗原1(EBNA-1)用の機能性発現カセットであって、プロモーター配列、5'非翻訳領域、EBNA-1をコードする核酸配列、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、発現カセット;
c)以下を含む、第2のプラスミド:
(i)原核生物複製起点;
(ii)選択マーカー;
(iii)エプスタイン-バーウイルス(EBV)複製起点(oriP);
(iv)該齧歯動物細胞における異種ポリペプチドの発現のために適した発現カセットであって、プロモーター配列、5'非翻訳領域、核酸配列の導入のためのクローニング部位、およびポリアデニル化シグナルを含む3'非翻訳領域を含む、発現カセット。
【請求項5】
異種ポリペプチドが、プロドラッグ、酵素、酵素断片、酵素阻害物質、酵素活性化物質、生物活性ポリペプチド、ヘッジホッグ(hedgehog)タンパク質、骨形成タンパク質(bone morphogenetic protein)、増殖因子、エリスロポエチン、トロンボポエチン、G-CSF、インターロイキン、インターフェロン、免疫グロブリンまたは免疫グロブリン断片を含む群から選択されることを特徴とする、請求項2〜3のいずれか一項記載の方法。
【請求項6】
以下の段階を含むことを特徴とする、齧歯動物細胞における異種ポリペプチドの発現のための方法:
a)EBNA-1タンパク質をコードする構造遺伝子で安定にトランスフェクトされた齧歯動物細胞を提供する段階、
b)該齧歯動物細胞に、エプスタイン-バーウイルス(EBV)複製起点(oriP)を含む発現プラスミドをトランスフェクトする段階;
c)該トランスフェクトされた細胞を、該異種ポリペプチドの発現のために適した条件下で培養する段階、
d)該異種ポリペプチドを培養物から回収する段階。
【請求項7】
異種ポリペプチドが、分泌性の異種ポリペプチドであることを特徴とする、請求項2〜3および5〜6のいずれか一項記載の方法。
【請求項8】
発現プラスミドが、EBNA-1タンパク質をコードする構造遺伝子を全く含まないことを特徴とする、請求項2〜3および5〜7のいずれか一項記載の方法。
【請求項9】
培養する段階が一過性トランスフェクション下で行われることを特徴とする、請求項2〜3および5〜8のいずれか一項記載の方法。
【請求項10】
齧歯動物細胞がCHO細胞であることを特徴とする、請求項2〜3および5〜9のいずれか一項記載の方法。
【請求項11】
CHO細胞が、CHO-DBX11細胞、CHO-K1細胞、CHO-DG44細胞、およびEBNA-1を発現するCHO細胞を含む群から選択される、請求項10記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2012−90633(P2012−90633A)
【公開日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願番号】特願2011−266937(P2011−266937)
【出願日】平成23年12月6日(2011.12.6)
【分割の表示】特願2008−537000(P2008−537000)の分割
【原出願日】平成18年10月26日(2006.10.26)
【出願人】(591003013)エフ.ホフマン−ラ ロシュ アーゲー (1,754)
【氏名又は名称原語表記】F. HOFFMANN−LA ROCHE AKTIENGESELLSCHAFT
【Fターム(参考)】
【公開日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願日】平成23年12月6日(2011.12.6)
【分割の表示】特願2008−537000(P2008−537000)の分割
【原出願日】平成18年10月26日(2006.10.26)
【出願人】(591003013)エフ.ホフマン−ラ ロシュ アーゲー (1,754)
【氏名又は名称原語表記】F. HOFFMANN−LA ROCHE AKTIENGESELLSCHAFT
【Fターム(参考)】
[ Back to top ]

