1本鎖環状RNAおよびその製造方法
【課題】生体への安全性、生体内安定性および徐放性の高い1本鎖環状RNAおよび該1本鎖環状RNAの収率の高い製造方法を提供すること。
【解決手段】センス鎖配列と、該センス鎖配列に相補的なアンチセンス鎖配列と、該センス鎖と該アンチセンス鎖の間に両鎖を結合する同じか又は異なる2つのループ配列とを含み、該センス鎖と該アンチセンス鎖が対合してステムを形成することを特徴とする、持続的又は徐放的RNA干渉作用を有する1本鎖環状RNA。
【解決手段】センス鎖配列と、該センス鎖配列に相補的なアンチセンス鎖配列と、該センス鎖と該アンチセンス鎖の間に両鎖を結合する同じか又は異なる2つのループ配列とを含み、該センス鎖と該アンチセンス鎖が対合してステムを形成することを特徴とする、持続的又は徐放的RNA干渉作用を有する1本鎖環状RNA。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、1本鎖環状RNA、その製造方法および1本鎖環状RNAを用いた医薬組成物に関する。
【背景技術】
【0002】
これまでのRNA干渉法は、化学合成した2本鎖RNAを用いる方法とプラスミドベクターを用いる方法に大別される。後者のプラスミドベクターを用いたRNA干渉技術は、バイオテクノロジーとして汎用され、主に基礎生物学実験に用いられている。しかし、RNA干渉技術を医薬品開発に応用する場合、プラスミドベクターを用いた方法は人体への安全性が問題となるため、前者の化学合成した2本鎖RNAを用いることが望ましいようである。
【0003】
しかしながら、化学合成した2本鎖RNAは、生体内不安定性、すなわち、細胞内の酵素(ヌクレアーゼ)で分解されやすいという問題があった。そこで、細胞内での2本鎖RNAの安定性を高めるために非天然核酸を導入したRNA鎖が開発されたが、安定性は高くなるが、生物活性は下がってしまうことが問題となっていた。さらに、非天然核酸が与える毒性も未知であり、医薬品への応用は難しかった。
【0004】
RNA干渉法に用いる2本鎖RNAの形態は、平滑末端または突出末端を有する2本鎖RNA、2本鎖RNA末端の一方がループ状になっているヘアピン構造を有するRNA(特許文献1)、約19塩基対からなるステムと2個のループを有し、かつ化学修飾ポリヌクレオチドを有する環状RNA(特許文献2)などがある。
【0005】
また、RNA−DNAキメラのダンベル型核酸が開示されているが(特許文献3)、この核酸はRNA干渉に用いられるものではなく、細胞内でダンベル型核酸のRNA部分が酵素で切断されてアンチセンスDNA部分が細胞内のmRNAに結合して阻害するものである。特許文献3には、核酸がダンベル型構造を有することにより、細胞内での核酸分解酵素耐性が高く、リボヌクレアーゼHが作用するまでは細胞内で安定に存在し、リボヌクレアーゼHの作用により相補的RNA部分が切除されて、はじめて、アンチセンスDNA部分を含む1本鎖オリゴヌクレオチドが細胞内に遊離されるので、投与量当たりのアンチセンス効果が高くなると考えられることが開示されている。
【0006】
また、ダンベル型構造の環状核酸の合成方法については、例えば、線状にオリゴヌクレオチドを合成して、ステム部分とヘアピンループ部分を形成させ、目的とする環状ダンベル型オリゴヌクレオチドの1箇所(上記ヘアピンループ部分の反対側の末端)が結合されていないニックダンベル型オリゴヌクレオチドを得、その5’末端をリガーゼでライゲーションさせることにより、環状ダンベル型環状核酸を調製することが開示されている(特許文献3)。
【0007】
【特許文献1】特表2003−502012号公報
【特許文献2】特開2006−271387号公報
【特許文献3】特開平11−137260号公報
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明は、1本鎖環状RNAおよびその製造方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明者らは、相補鎖を形成しない塩基配列を両端に有するセンス鎖とアンチセンス鎖を別々に合成して、両端の塩基にリガーゼを同時に作用させることにより、意外にも、従来の方法に比べて高収率で1本鎖環状RNAを得られることを見出し、かつ、得られた1本鎖環状RNAがRNA干渉作用を持続的、徐放的に発揮することを見出し、本発明を完成した。
【0010】
すなわち、本発明は以下の発明を包含する。
(1)センス鎖配列と、該センス鎖配列に相補的なアンチセンス鎖配列と、該センス鎖と該アンチセンス鎖の間に両鎖を結合する同じか又は異なる2つのループ配列とを含み、該センス鎖と該アンチセンス鎖が対合してステムを形成することを特徴とする、持続的又は徐放的RNA干渉作用を有する1本鎖環状RNA。
(2)対照細胞における標的RNAの発現を1とした場合に、細胞に導入後24時間の標的RNAの発現が0.4以下を示す、(1)に記載の1本鎖環状RNA。
(3)ヒト血清中で8時間経過したときに70%以上が保持されている、(1)または(2)に記載の1本鎖環状RNA。
(4)相補鎖を形成しない塩基配列を5’末端および3’末端に有する、センス鎖およびアンチセンス鎖をそれぞれ合成し、センス鎖が有する相補鎖を形成しない塩基配列の5’末端の塩基とアンチセンス鎖が有する相補鎖を形成しない塩基配列の3’末端の塩基、およびセンス鎖が有する相補鎖を形成しない塩基配列の3’末端の塩基とアンチセンス鎖が有する相補鎖を形成しない塩基配列の5’末端の塩基を、リガーゼで同時に連結することを含み、
その際、センス鎖が5’末端に有する相補鎖を形成しない塩基配列とアンチセンス鎖が3’末端に有する相補鎖を形成しない塩基配列が互いに結合してループを形成し、センス鎖が3’末端に有する相補鎖を形成しない塩基配列とアンチセンス鎖が5’末端に有する相補鎖を形成しない塩基配列が互いに結合してループを形成し、ならびにセンス鎖とアンチセンス鎖が対合してステムを形成する、(1)〜(3)のいずれかに記載の1本鎖環状RNAの製造方法。
(5)センス鎖が有する相補鎖を形成しない塩基配列とアンチセンス鎖が有する相補鎖を形成しない塩基配列の5’末端をリン酸化することを更に含む、(4)に記載の製造方法。
(6)前記ループの配列が互いに同じかまたは異なる、(4)または(5)に記載の製造方法。
(7)前記ループの長さが2〜20塩基である、(4)〜(6)のいずれかに記載の製造方法。
(8)前記ステムの長さが19〜31塩基である、(4)〜(7)のいずれかに記載の製造方法。
(9)(1)〜(3)のいずれかに記載の1本鎖環状RNAをヒト由来の細胞に導入し、標的RNAを不能にしてタンパク質への翻訳を持続的に阻害することを含む、該タンパク質をコードする遺伝子の発現をin vitroで抑制する方法。
(10)(1)〜(3)のいずれかに記載の1本鎖環状RNAを非ヒト動物、植物又はそれの細胞に導入し、標的RNAを不能にしてタンパク質への翻訳を持続的に阻害することを含む、該タンパク質をコードする遺伝子の発現を抑制する方法。
(11)(1)〜(3)のいずれかに記載の1本鎖環状RNAを有効成分として含む、医薬組成物。
【0011】
本明細書において、1本鎖環状RNAは、ダンベル型RNAともいう。ダンベル型RNAとは、センス鎖とアンチセンス鎖が相補的に対合してステムを形成し、ステムの両側に相補鎖を形成しない塩基配列によりループが形成され、1本鎖環状RNAの全体の形状としてダンベル状になっているものをいう。
【発明の効果】
【0012】
本発明により、安定性、持続性および徐放性に優れたダンベル型合成RNAを効率よく作製することができる。
【0013】
特に、RNA干渉法に用いるダンベル型RNAは、2本のRNA鎖を環化することにより作製され、両端がループ状に閉じているために、RNA末端がなくなり、細胞内において、ダイサーなどの特異的酵素以外は、分解酵素エキソヌクレアーゼ(RNase)などの基質となりにくいので、酵素により分解されにくく、細胞内での安定性が飛躍的に増す。そのため、安定性を高めるために非天然型核酸を用いる必要がない。
【0014】
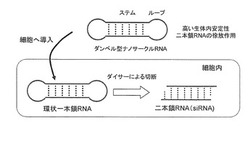
また、ダンベル型RNAは、細胞内で生体内酵素ダイサーなどに特異的に認識されて、両側のループ部が切断されて天然型RNA2本鎖になるため(図1)、2本鎖RNAと同等の活性を持ち得、また、従来の2本鎖RNAによるRNA干渉作用よりも持続的、徐放的な効果がある。
【0015】
更に、本発明のダンベル型RNAは、従来の2本鎖RNAよりもヒト血清中で安定である。
【発明を実施するための最良の形態】
【0016】
本発明の1本鎖環状RNAは、標的RNAの塩基配列又はその一部に相同なセンス鎖配列および該センス鎖配列に相補的でかつ対合可能なアンチセンス鎖配列と、それらの鎖の間に相補鎖を形成しないループ配列を含む。
【0017】
センス鎖とアンチセンス鎖は、対合してステムを形成する。ステムの長さは特に限定されず、標的RNAの種類や構造などに応じて長さを決定すればよいが、例えば19〜31塩基対、好ましくは21〜25塩基対、より好ましくは22〜24塩基対、さらに好ましくは23塩基対からなる。
【0018】
相補鎖を形成しない塩基配列は、センス鎖とアンチセンス鎖のそれぞれ5’末端と3’末端にあって、センス鎖の相補鎖を形成しない塩基配列の5’末端の塩基とアンチセンス鎖の相補鎖を形成しない塩基配列の3’末端の塩基とが連結してループを形成し、センス鎖の相補鎖を形成しない塩基配列の3’末端の塩基とアンチセンス鎖の相補鎖を形成しない塩基配列の5’末端の塩基とが連結してループを形成している。ループの長さは、好ましくは2〜20塩基、より好ましくは6〜12塩基からなる。従って、全体の1本鎖環状RNAは、好ましくは42〜102塩基で形成される。
【0019】
センス鎖の5’末端の相補鎖を形成しない塩基配列をA、アンチセンス鎖の3’末端の相補鎖を形成しない塩基配列をB、センス鎖の3’末端の相補鎖を形成しない塩基配列をC、アンチセンス鎖の5’末端の相補鎖を形成しない塩基配列をDとすると、例えばループの長さが20塩基の場合、Aは1〜19塩基、Bは19〜1塩基、Cは19〜1塩基、Dは1〜19塩基の長さを有し、Aの5’末端の塩基とBの3’末端の塩基が連結して20塩基のループを形成し、Cの3’末端の塩基とDの5’末端の塩基が連結して20塩基のループを形成する。
【0020】
相補鎖を形成しない配列は、AとB間、CとD間で、例えば1塩基、2塩基または3塩基の長さの違いがあるか、または同じ長さであることが好ましい。従って、例えば、ループの長さが8塩基の場合、Aは3〜5塩基、Bは5〜3塩基、Cは5〜3塩基、Dは3〜5塩基の長さであることが好ましい。ループの長さが9塩基の場合、Aは3〜6塩基、Bは6〜3塩基、Cは6〜3塩基、Dは3〜6塩基であることが好ましい。ループの長さが10塩基の場合、Aは4〜6塩基、Bは6〜4塩基、Cは6〜4塩基、Dは4〜6塩基であることが好ましい。
【0021】
なお、AとBで形成されるループとCとDで形成されるループの塩基配列は、同じでも異なっていてもよい。
【0022】
本発明の1本鎖環状RNAは、RNA干渉法に用いることができる。
RNA干渉とは、RNA interference(RNAi)ともいい、標的RNAと相補的な配列を持つ小RNA分子が標的RNAに結合し、それを分解するか又は翻訳を抑制する現象である。
【0023】
ダンベル型RNAのセンス鎖は、標的となるRNA(例えばmRNAまたはその前駆体RNA)に相補的な配列を有する。また、相補鎖を形成しない塩基配列は、特に限定されないが、例えばUUCAAGAGA、またはUGUGCUGUC(M.Miyagishiら、Oligonucleotides 2003,13:1−7)などが挙げられる。
【0024】
更に、ダンベル型RNAのループは化学修飾されていてもよく、例えば分子量約2000〜5000のポリエチレングリコールで修飾すると、生体内でのダンベル型RNAの安定性を向上することができる。細胞内でダイサーなどの酵素によりダンベル型RNAのループが切断され除去されるので、ステムがsiRNA又はmiRNAとしてRNA干渉作用を発揮する際、ポリエチレングリコールが影響を与えることはほとんどないと考えられる。
【0025】
本発明のダンベル型RNAは、対照細胞(ダンベル型RNAが導入されていない)における標的RNAの発現を1とした場合に、該ダンベル型RNAを導入した細胞における細胞導入後24時間での標的RNAの発現が0.4以下を示すことが好ましい。
【0026】
標的RNAの発現は、例えばレポーター遺伝子(ルシフェラーゼ、β−ガラクトシダーゼ、β−グルクロニターゼ、グリーンフルオレッセンスプロテイン(GFP)など)を細胞に形質転換し、レポーター遺伝子のmRNAを標的RNAとして、該標的RNAの発現がダンベル型RNAによってどのくらい阻害されているかを、レポーター遺伝子由来のタンパク質の発色、蛍光を測定することにより確認することができる。
【0027】
更に、本発明のダンベル型RNAは、ヒト血清中で8時間経過したときに70%以上が分解されずに保持されるという特徴を有する。例えばヒト血清中でダンベル型RNAをインキュベーションし、経時的に分解されるかどうかを電気泳動などで分子量を測定することにより確認することができる。
【0028】
本発明のダンベル型1本鎖環状RNAの製造方法は、相補鎖を形成しない塩基配列を5’末端および3’末端に有する、センス鎖およびアンチセンス鎖をそれぞれ合成し、センス鎖が有する相補鎖を形成しない塩基配列の5’末端の塩基とアンチセンス鎖が有する相補鎖を形成しない塩基配列の3’末端の塩基、およびセンス鎖が有する相補鎖を形成しない塩基配列の3’末端の塩基とアンチセンス鎖が有する相補鎖を形成しない塩基配列の5’末端の塩基を、リガーゼで同時に連結することを含む。
【0029】
センス鎖およびアンチセンス鎖は、標的となる遺伝子を抑制できるように、標的遺伝子の塩基配列から設計する。設計は、複数のセンス鎖およびアンチセンス鎖を作製してそれぞれ抑制効率を確認してもよいが、例えばsiRNA設計用アルゴリズムなどによる設計を利用してもよい(参照文献:J.A.Jaeger et al.,Methods in Enzymology(1989) 183:281−306;D.H.Mathews et al.,J.Mol.Biol.(1999) 288:911−940)。設計時には、標的遺伝子と類似した配列を持つ、標的遺伝子以外の遺伝子の発現を抑制すること(Off target効果)がないことが望ましい。センス鎖およびアンチセンス鎖は、特に限定されないが、例えば19〜31塩基、好ましくは21〜25塩基、より好ましくは22〜24塩基、さらに好ましくは23塩基の長さで設計する。
【0030】
標的遺伝子は特に限定されないが、例えば、白血病のabl/bcr遺伝子、加齢性黄斑変性症のVEGF遺伝子、肝炎のHCV遺伝子が挙げられる。
【0031】
後にループを形成する配列、例えば上記配列UUCAAGAGAを任意の箇所で2つに分けて相補鎖を形成しない塩基配列とし(該配列は9塩基であり、2つに分けたときに、上述のように長さの違いが1〜3塩基の範囲にあることが好ましい)、一方をアンチセンス鎖の3’末端、もう一方をセンス鎖の5’末端に連結した配列を設計し、同様にして一方をセンス鎖の3’末端、もう一方をアンチセンス鎖の5’末端に連結した配列を設計する。設計したこれら2つの配列の1本鎖核酸を、それぞれ別に合成する。その際、化学的リン酸化試薬を用いて5’末端のリン酸化を行うことが好ましい。なお、ループを形成したときの長さが、例えば2〜20塩基、好ましくは6〜12塩基になるように設計することが好ましい。
【0032】
核酸合成方法は、in vitro transcription合成方法、プラスミド、ウイルスベクターを用いる方法、PCRカセットによる方法など種々の方法があり、特に限定されないが、純度の高さ、大量合成可能、in vivoでの使用安全性の高さ、化学修飾可能などの点から、化学合成方法が好ましい。化学合成方法は、H−ホスホネート法、ホスホロアミダイト法などがあり、特に限定されず、市販の自動核酸合成機を使用することができる。
【0033】
センス鎖およびアンチセンス鎖の両端にある相補鎖を形成しない塩基配列の末端をリガーゼ(例えばT4 RNAリガーゼ、T4 DNAリガーゼなど)で連結して、2つのループを同時に形成する。反応条件は、例えばポリエチレングリコール(PEG)、BSAなどを含む緩衝液中で低温下20時間インキュベーションすればよい。合成したダンベル型1本鎖環状RNAは、常法で回収・精製(例えば高速液体クロマトグラフィー、PAGE法など)することができる。
【0034】
更に、1本鎖環状RNAをポリエチレングリコール(PEG)などで化学修飾してもよく、化学修飾はループ部分に行うことが好ましい。結合のために、PEGの両末端を改変して、たとえばホルミル基、N−ヒドロキシスクシンイミドエステル基などの、塩基のアミノ基と反応性の官能基を導入する。
【0035】
以下、上記方法で製造したダンベル型RNAを用いた、RNA干渉法について説明する。
本発明によれば、本発明の1本鎖環状RNAを細胞に導入し、標的RNAを不能にしてタンパク質への翻訳を持続的に阻害することができ、前記細胞は、ヒト細胞または非ヒト細胞を用いることができる。
【0036】
in vitroでRNA干渉法を行う場合、ダンベル型RNAを、例えばエレクトロポレーション法、マイクロインジェクション法、リポフェクション法、リン酸カルシウム法などで細胞に導入する。
【0037】
in vivoでRNA干渉法を行う場合、まずダンベル型RNAを含む試料を透析、pH調節などを行って、生体に適合するように調製する。動物又は植物への導入方法は特に限定されず、例えば局所投与、静脈内投与、遺伝子銃を用いる方法などが挙げられ、ヒトに適用する場合、安全性の点から微生物等を用いない方法が好ましい。
【0038】
細胞内に導入されたダンベル型RNAは、細胞内ダイサーにより切断を受けRNA干渉作用のあるRNA2本鎖(siRNA)を細胞内で生じる(図1)。siRNAの末端は、平滑末端または突出末端であり得る。siRNAが1本鎖となり、RNA−ヌクレアーゼ複合体(RNA induced silencing complex(RISC))を形成し、siRNAと相補的な配列の標的mRNAを認識して、mRNAを分解し、標的遺伝子の発現が抑制される。
【0039】
本発明の1本鎖環状RNAは、植物、動物(例えばヒト、ペット、家畜を含む哺乳動物など)、それらの細胞のいずれでも使用可能であり、特に医学、農学分野での広範な応用が期待される。例えば、植物又は動物レベルあるいは植物又は動物細胞レベルでの特定の遺伝子やタンパク質の機能の解明、例えばノックアウト法による機能の解明など、種々の目的のために本発明の1本鎖環状RNAを使用することができる。
【0040】
また、本発明は、1本鎖環状RNAを有効成分として含む医薬組成物を含有する。
1本鎖環状RNAの医薬組成物への配合量は、組成物の種類や目的等によって調整することができ、組成物の全量に対して、例えば1重量%、3重量%、5重量%、10重量%、20重量%、30重量%、40重量%、50重量%、60重量%、70重量%、80重量%、90重量%、100重量%であるが、これらに限定されない。
【0041】
本発明の医薬組成物の剤形として、例えば液体製剤(溶液剤、懸濁剤、乳濁剤など)、固体製剤(用時調製の凍結乾燥剤など)、リポソーム(カチオン性リポソームが好ましい)封入製剤などが挙げられ、また投与経路として、非経口投与が好ましく、例えば患部に直接投与する局所投与、経肺投与、経鼻投与等の経粘膜投与、静脈内投与などが含まれる。
【0042】
本発明の医薬組成物は、製剤化、剤形等に応じて、賦形剤(生理食塩水、滅菌水、リンゲル液など)、緩衝剤、等張化剤、安定化剤などを含めてもよい。
【0043】
また、本発明の医薬組成物の投与量は、患者の性別、体重、年齢、重篤度、症状などに応じて変更し得る。
【0044】
本発明の医薬組成物の適用は、特に限定されないが、例えば、癌などの疾患の治療、例えば癌細胞で特異的に発現する遺伝子やタンパク質の機能の抑制などが挙げられる。
【0045】
以下、実施例により本発明を更に具体的に説明するが、これらの実施例は本発明を限定するものではない。
【実施例1】
【0046】
ダンベル型RNAの作製
ダンベル型RNAの原料となる5’リン酸化RNAは、全てホスホロアミダイト法に基づきDNA合成機(GeneWorld H8−SE)により合成した。RNAアミダイトはTBDMS保護体(Proligo)、5’リン酸化はChemical Phosphorylation Reagent(Glen Research)を用いた。脱保護は定法に従い、PAGE精製した。合成したRNA配列を、配列番号1(センス鎖28mer)、配列番号2(アンチセンス鎖28mer)、配列番号3(56mer)および図2に示す。なお、図2のRNA配列のうち、下線の配列がダンベル型RNAのループ部を形成する配列である。
【0047】
次に、酵素反応を、2μM RNA double strand、2.0units/μl T4 RNAリガーゼ、0.006%BSA、25%PEG6000、50mM Tris−HCl(pH7.5)、10mM MgCl2、10mM DTT、1mM ATPの組成で、反応スケール25μlで行った。
【0048】
具体的には、まず、5’リン酸化RNA2本鎖が4μMとなるよう、100mM Tris−HCl(pH7.5)、20mM MgCl2、20mM DTT、2mM ATP緩衝液中(2x緩衝液)12.5μlに溶解し、65℃で5分間加熱後、室温まで徐冷した。その後、BSA水溶液、PEG6000水溶液、T4 RNAリガーゼ(タカラバイオ)を上記の組成と反応スケールになるように加え、11℃で20時間インキュベートした。エタノール沈殿により、回収したRNAをPAGEにて解析した。
【0049】
図2のPAGEの各レーンのサンプルは以下の通りである。
レーン1:28塩基のセンス鎖および28塩基のアンチセンス鎖の混合物(マーカー)
レーン2:57塩基のRNA(マーカー)
レーン3:28塩基のセンス鎖と28塩基のアンチセンス鎖から形成したダンベル型RNA
レーン4:56塩基(1本鎖)から形成したダンベル型RNA
レーン5:RNAリガーゼで処理した28塩基のセンス鎖(参考)
レーン6:RNAリガーゼで処理した28塩基のアンチセンス鎖(参考)
【0050】
レーン4のダンベル型RNAは、配列番号3の56塩基の1本鎖を合成してステム部分およびヘアピンループ部分を形成し、最初の塩基と最後の塩基をT4リガーゼで結合して作製した。
【0051】
レーン3の丸で囲んだバンドが、本発明の方法で作製したダンベル型RNAであり、その収率は約80%であった。レーン4のダンベル型RNAの収率は約5%以下であった。
【実施例2】
【0052】
ダンベル型RNAのステムの長さの検討
上記DNA合成機で、配列番号4〜13に示すRNAを合成した。配列番号4および5は18塩基対を形成する2本鎖RNA(siRNA−1)、配列番号6および7はステムの長さ19塩基のダンベル型RNA(Db−19)、配列番号8および9はステムの長さ23塩基のダンベル型RNA(Db-23)、配列番号10及び11はステムの長さ27塩基のダンベル型RNA(Db-27)、配列番号12および13はステムの長さ31塩基のダンベル型RNA(Db-31)を形成する(図3)。
【0053】
酵素反応を、2μM RNA double strand、1.0units/μl T4 RNAリガーゼ、0.006%BSA、25%PEG6000、50mM Tris−HCl(pH7.5)、10mM MgCl2、10mM DTT、1mM ATPの組成で、反応スケール1.5〜2.5mlで行った。
【0054】
具体的には、5’リン酸化RNA2本鎖が4μMとなるよう、100mM Tris−HCl(pH7.5)、20mM MgCl2、20mM DTT、2mM ATP緩衝液中(2x緩衝液、最終的な反応液量の半分量)に溶解し、65℃で5分間加熱後、室温まで徐冷した。その後、BSA水溶液、PEG6000水溶液、T4 RNAリガーゼ(タカラバイオ)を加え、11℃で20時間インキュベートした。
【0055】
反応液からアルコール沈殿によりRNAを回収し、PAGEを用いて環化体を単離した。UV shadowing法で目的物を含むバンドを可視化して切り出し、細かく粉砕した後、溶出バッファー(0.2M NaCl、1mM EDTA(pH8.0))4mlで3回抽出した。Sep−Pakカートリッジを用いて脱塩(50%アセトニトリル水6mlで溶出)し、遠心エバポレーターを用いて濃縮し、さらに酢酸アンモニウム存在下アルコール沈殿した。UVスペクトルを測定し得られた目的物を定量した。
【0056】
上記各ダンベル型RNA2μgに20mM Tris−HCl(pH8.5)、150mM NaCl、2.5mM MgCl2緩衝液中ColdShock−DICER(タカラバイオ)2unitsを加え(反応液量20μl)、37℃でインキュベートした。1、6、18時間後に反応液3μlをサンプリングし、120mM EDTA水溶液2μlと混合し、酵素反応を停止した。これを未変性PAGE(10%PAGE、1x TBE)で解析した(1xSYBR GreenIで染色後、BioRad Molecular Imager FXで画像化・定量を行った)。
【0057】
図4に各ダンベル型RNAのPAGEを示す。コントロールとして、ダンベル化反応前の2本鎖RNAを基質とする切断反応も同様に検討した。その結果、Db−19の切断反応は、1時間後に約5%進行し、20塩基長の2本鎖RNAの生成が確認された。Db−19の20塩基前後の切断断片は、6、18時間後とほぼ同程度の濃度を維持した。一方、コントロールの19塩基直鎖(Liner)は、1時間後にほぼ100%切断され20塩基長のRNA2本鎖が観察された。その後、時間とともにその生成物のRNA2本鎖は、分解され消失した。Db−23では、1時間後に約8%切断され20塩基長の2本鎖が生成した。ステムの長さが長くなるに従い、Db−27、Db−31と1時間後の切断速度が10%、20%と速くなることが確認された。18時間後、Db−19では原料が約75%残っているのに対して、Db−31では原料が完全に消失した。このことから、ステムの長さが短い方が酵素に対して安定であることが明らかとなった。
【実施例3】
【0058】
ダンベル型RNAのRNA干渉効果
上記ダンベル型RNA(Db−19、Db−23、Db−27、Db−31)のRNA干渉効果を蛍ルシフェラーゼレポーター遺伝子pGL3の発現阻害実験により評価した。
【0059】
NIH 3T3細胞(RIKEN CELL BANK)を10%FCSを含むDMEM(GIBCO)培地中で37℃、5%CO2下培養し、96穴プレートに、100μlずつ、1.6x104細胞/ウェルとなるよう分注した。さらに37℃、5%CO2下で39時間培養し、約70%コンフルエントの状態で2種のプラスミドベクター(pGL3−Control、pRL−TK(内部標準用)、いずれもPromega)と各種RNAをトランスフェクション試薬GeneSilencer(Genlantis)を用い、トランスフェクション試薬添付のプロトコールに従い、コトランスフェクションした。トランスフェクション時の濃度条件は以下の通りである。
【0060】
0.2μg pGL3−Control/0.02μg pRL−TK/25nM RNA(最終量100μl)
GeneSilencer 1μl
DMEM培地 25μl
siRNA希釈液 2.5μl
DMEM培地 15μl
RNA(5pmol/μl) 0.5μl
pGL3−Control(1μg/μl) 0.2μl
pRL−TK(0.1μg/μl) 0.2μl
44.4μl
【0061】
トランスフェクション後、37℃、5%CO2下4時間インキュベートし、20%血清入りDMEM培地100μlをそれぞれのウェルに加えた。37℃でさらに20時間インキュベート後、Dual−luciferase Reporter Assay System(Promega)を用い、添付のプロトコールに従い細胞を可溶化してルシフェラーゼ発現量を定量した(条件:試薬量30μl、delay time2秒、read time10秒。機器Wallac ARVO SX 1420 Multilabel Counter)。
【0062】
比較として、バッファーのみ(コントロール)の条件も同様に評価した。蛍ルシフェラーゼの発光強度は、内部標準であるレニラルシフェラーゼの発光強度により補正した。その結果を図5に示す。24時間後では、ダンベル型RNAのうち、Db−23の活性が最も高く、0.24まで阻害効果を示した。この結果から、最適な二本鎖長を23塩基とした。
【実施例4】
【0063】
RNA干渉効果の持続性
Db−23とsiRNA−1のRNA干渉効果の持続性について比較した。
NIH 3T3細胞を、10%ウシ仔牛血清(FCS、Invitro/Gibco)を含むダルベッコ改変イーグル培地(DMEM、Gibco)で、5%CO2加湿チャンバーで培養した。約70%コンフルエントの状態のトランスフェクションの40時間前に、細胞を96穴プレートに、100μlずつ、1.6×104細胞/ウェルになるように分注した。レポータープラスミドとRNAのコトランスフェクションをGeneSilencer(Gene Therapy Systems)を用いてNIH 3T3細胞の製造者による説明に従って行った。実施例3と比べてトランスフェクション試薬で10倍に希釈した16ng/mlのpGL3−Control(Promega)、1.6ng/mlのpRL−TK(Promega)および25nMのRNAを、ウェルに100μl適用した。4時間のインキュベーション後、20%FCSを含むDMEMを100μl添加した。更に3日以上インキュベーションを行い、培地を随時交換した。ルシフェラーゼの発現を、Wallac ARVO SX 1420 Multilabel Counter(Perkin−Elmer)に添付の指示書に従い、Dual−Luciferase Reporter Assay System(Promega)で、24時間、72時間、120時間後にモニターした(図6)。RNAの入っていないものをコントロールとした。
【0064】
ルシフェラーゼの活性は、24時間ではDb−23とsiRNA−1ともにほぼ同等の活性を示したが、120時間後では、Db−23がより高い遺伝子発現抑制作用を示した。このことから、ダンベル型RNAの徐放作用、長期活性効果が示された。
【実施例5】
【0065】
ヒト血清中でのダンベル型RNAの安定性
Db-23とsiRNAのヒト血清中での安定性を比較した。
アニーリングバッファー(100mM酢酸カリウム、30mM HEPES−KOH(pH7.4)、2mM酢酸マグネシウム)にアニーリング前のdsRNA(siRNA−1、20μM)またはダンベル型RNA(Db−23、20μM)を加えたその4μlと、PBS32μl、正常ヒト血清(Chemicon International)4μlを混合して37℃でインキュベーションした。アリコート5μlを0.5、1、1.5、3、8および20時間後に採取し、15%nativePAGEで、SYBR Green Iで染色、MolecularImager FX(BioRad)を使用して分析した。
【0066】
その結果、siRNAは、3時間後に50%まで分解されるのに対して、Db−23は依然として80%以上存在し、8時間後でも70%以上存在していた。従って、D−23は、生体内での高い安定性が期待できた。
【産業上の利用可能性】
【0067】
本発明は、生体に適用できる核酸分子として利用可能であり、収率よく該分子を製造できる。
【図面の簡単な説明】
【0068】
【図1】本発明のダンベル型RNAを模式的に示す。
【図2】RNAの構造と各種RNAの電気泳動像を示す。
【図3】siRNAとダンベル型RNAの構造を示す。
【図4】ダイサーで切断したダンベル型RNAの電気泳動像を示す。
【図5】トランスフェクションから24時間後の各ダンベル型RNAの干渉効果を示す。
【図6】ダンベル型RNAの持続的なRNA干渉効果を示す。
【図7】ダンベル型RNAのヒト血清中の安定性を示す。
【技術分野】
【0001】
本発明は、1本鎖環状RNA、その製造方法および1本鎖環状RNAを用いた医薬組成物に関する。
【背景技術】
【0002】
これまでのRNA干渉法は、化学合成した2本鎖RNAを用いる方法とプラスミドベクターを用いる方法に大別される。後者のプラスミドベクターを用いたRNA干渉技術は、バイオテクノロジーとして汎用され、主に基礎生物学実験に用いられている。しかし、RNA干渉技術を医薬品開発に応用する場合、プラスミドベクターを用いた方法は人体への安全性が問題となるため、前者の化学合成した2本鎖RNAを用いることが望ましいようである。
【0003】
しかしながら、化学合成した2本鎖RNAは、生体内不安定性、すなわち、細胞内の酵素(ヌクレアーゼ)で分解されやすいという問題があった。そこで、細胞内での2本鎖RNAの安定性を高めるために非天然核酸を導入したRNA鎖が開発されたが、安定性は高くなるが、生物活性は下がってしまうことが問題となっていた。さらに、非天然核酸が与える毒性も未知であり、医薬品への応用は難しかった。
【0004】
RNA干渉法に用いる2本鎖RNAの形態は、平滑末端または突出末端を有する2本鎖RNA、2本鎖RNA末端の一方がループ状になっているヘアピン構造を有するRNA(特許文献1)、約19塩基対からなるステムと2個のループを有し、かつ化学修飾ポリヌクレオチドを有する環状RNA(特許文献2)などがある。
【0005】
また、RNA−DNAキメラのダンベル型核酸が開示されているが(特許文献3)、この核酸はRNA干渉に用いられるものではなく、細胞内でダンベル型核酸のRNA部分が酵素で切断されてアンチセンスDNA部分が細胞内のmRNAに結合して阻害するものである。特許文献3には、核酸がダンベル型構造を有することにより、細胞内での核酸分解酵素耐性が高く、リボヌクレアーゼHが作用するまでは細胞内で安定に存在し、リボヌクレアーゼHの作用により相補的RNA部分が切除されて、はじめて、アンチセンスDNA部分を含む1本鎖オリゴヌクレオチドが細胞内に遊離されるので、投与量当たりのアンチセンス効果が高くなると考えられることが開示されている。
【0006】
また、ダンベル型構造の環状核酸の合成方法については、例えば、線状にオリゴヌクレオチドを合成して、ステム部分とヘアピンループ部分を形成させ、目的とする環状ダンベル型オリゴヌクレオチドの1箇所(上記ヘアピンループ部分の反対側の末端)が結合されていないニックダンベル型オリゴヌクレオチドを得、その5’末端をリガーゼでライゲーションさせることにより、環状ダンベル型環状核酸を調製することが開示されている(特許文献3)。
【0007】
【特許文献1】特表2003−502012号公報
【特許文献2】特開2006−271387号公報
【特許文献3】特開平11−137260号公報
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明は、1本鎖環状RNAおよびその製造方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明者らは、相補鎖を形成しない塩基配列を両端に有するセンス鎖とアンチセンス鎖を別々に合成して、両端の塩基にリガーゼを同時に作用させることにより、意外にも、従来の方法に比べて高収率で1本鎖環状RNAを得られることを見出し、かつ、得られた1本鎖環状RNAがRNA干渉作用を持続的、徐放的に発揮することを見出し、本発明を完成した。
【0010】
すなわち、本発明は以下の発明を包含する。
(1)センス鎖配列と、該センス鎖配列に相補的なアンチセンス鎖配列と、該センス鎖と該アンチセンス鎖の間に両鎖を結合する同じか又は異なる2つのループ配列とを含み、該センス鎖と該アンチセンス鎖が対合してステムを形成することを特徴とする、持続的又は徐放的RNA干渉作用を有する1本鎖環状RNA。
(2)対照細胞における標的RNAの発現を1とした場合に、細胞に導入後24時間の標的RNAの発現が0.4以下を示す、(1)に記載の1本鎖環状RNA。
(3)ヒト血清中で8時間経過したときに70%以上が保持されている、(1)または(2)に記載の1本鎖環状RNA。
(4)相補鎖を形成しない塩基配列を5’末端および3’末端に有する、センス鎖およびアンチセンス鎖をそれぞれ合成し、センス鎖が有する相補鎖を形成しない塩基配列の5’末端の塩基とアンチセンス鎖が有する相補鎖を形成しない塩基配列の3’末端の塩基、およびセンス鎖が有する相補鎖を形成しない塩基配列の3’末端の塩基とアンチセンス鎖が有する相補鎖を形成しない塩基配列の5’末端の塩基を、リガーゼで同時に連結することを含み、
その際、センス鎖が5’末端に有する相補鎖を形成しない塩基配列とアンチセンス鎖が3’末端に有する相補鎖を形成しない塩基配列が互いに結合してループを形成し、センス鎖が3’末端に有する相補鎖を形成しない塩基配列とアンチセンス鎖が5’末端に有する相補鎖を形成しない塩基配列が互いに結合してループを形成し、ならびにセンス鎖とアンチセンス鎖が対合してステムを形成する、(1)〜(3)のいずれかに記載の1本鎖環状RNAの製造方法。
(5)センス鎖が有する相補鎖を形成しない塩基配列とアンチセンス鎖が有する相補鎖を形成しない塩基配列の5’末端をリン酸化することを更に含む、(4)に記載の製造方法。
(6)前記ループの配列が互いに同じかまたは異なる、(4)または(5)に記載の製造方法。
(7)前記ループの長さが2〜20塩基である、(4)〜(6)のいずれかに記載の製造方法。
(8)前記ステムの長さが19〜31塩基である、(4)〜(7)のいずれかに記載の製造方法。
(9)(1)〜(3)のいずれかに記載の1本鎖環状RNAをヒト由来の細胞に導入し、標的RNAを不能にしてタンパク質への翻訳を持続的に阻害することを含む、該タンパク質をコードする遺伝子の発現をin vitroで抑制する方法。
(10)(1)〜(3)のいずれかに記載の1本鎖環状RNAを非ヒト動物、植物又はそれの細胞に導入し、標的RNAを不能にしてタンパク質への翻訳を持続的に阻害することを含む、該タンパク質をコードする遺伝子の発現を抑制する方法。
(11)(1)〜(3)のいずれかに記載の1本鎖環状RNAを有効成分として含む、医薬組成物。
【0011】
本明細書において、1本鎖環状RNAは、ダンベル型RNAともいう。ダンベル型RNAとは、センス鎖とアンチセンス鎖が相補的に対合してステムを形成し、ステムの両側に相補鎖を形成しない塩基配列によりループが形成され、1本鎖環状RNAの全体の形状としてダンベル状になっているものをいう。
【発明の効果】
【0012】
本発明により、安定性、持続性および徐放性に優れたダンベル型合成RNAを効率よく作製することができる。
【0013】
特に、RNA干渉法に用いるダンベル型RNAは、2本のRNA鎖を環化することにより作製され、両端がループ状に閉じているために、RNA末端がなくなり、細胞内において、ダイサーなどの特異的酵素以外は、分解酵素エキソヌクレアーゼ(RNase)などの基質となりにくいので、酵素により分解されにくく、細胞内での安定性が飛躍的に増す。そのため、安定性を高めるために非天然型核酸を用いる必要がない。
【0014】
また、ダンベル型RNAは、細胞内で生体内酵素ダイサーなどに特異的に認識されて、両側のループ部が切断されて天然型RNA2本鎖になるため(図1)、2本鎖RNAと同等の活性を持ち得、また、従来の2本鎖RNAによるRNA干渉作用よりも持続的、徐放的な効果がある。
【0015】
更に、本発明のダンベル型RNAは、従来の2本鎖RNAよりもヒト血清中で安定である。
【発明を実施するための最良の形態】
【0016】
本発明の1本鎖環状RNAは、標的RNAの塩基配列又はその一部に相同なセンス鎖配列および該センス鎖配列に相補的でかつ対合可能なアンチセンス鎖配列と、それらの鎖の間に相補鎖を形成しないループ配列を含む。
【0017】
センス鎖とアンチセンス鎖は、対合してステムを形成する。ステムの長さは特に限定されず、標的RNAの種類や構造などに応じて長さを決定すればよいが、例えば19〜31塩基対、好ましくは21〜25塩基対、より好ましくは22〜24塩基対、さらに好ましくは23塩基対からなる。
【0018】
相補鎖を形成しない塩基配列は、センス鎖とアンチセンス鎖のそれぞれ5’末端と3’末端にあって、センス鎖の相補鎖を形成しない塩基配列の5’末端の塩基とアンチセンス鎖の相補鎖を形成しない塩基配列の3’末端の塩基とが連結してループを形成し、センス鎖の相補鎖を形成しない塩基配列の3’末端の塩基とアンチセンス鎖の相補鎖を形成しない塩基配列の5’末端の塩基とが連結してループを形成している。ループの長さは、好ましくは2〜20塩基、より好ましくは6〜12塩基からなる。従って、全体の1本鎖環状RNAは、好ましくは42〜102塩基で形成される。
【0019】
センス鎖の5’末端の相補鎖を形成しない塩基配列をA、アンチセンス鎖の3’末端の相補鎖を形成しない塩基配列をB、センス鎖の3’末端の相補鎖を形成しない塩基配列をC、アンチセンス鎖の5’末端の相補鎖を形成しない塩基配列をDとすると、例えばループの長さが20塩基の場合、Aは1〜19塩基、Bは19〜1塩基、Cは19〜1塩基、Dは1〜19塩基の長さを有し、Aの5’末端の塩基とBの3’末端の塩基が連結して20塩基のループを形成し、Cの3’末端の塩基とDの5’末端の塩基が連結して20塩基のループを形成する。
【0020】
相補鎖を形成しない配列は、AとB間、CとD間で、例えば1塩基、2塩基または3塩基の長さの違いがあるか、または同じ長さであることが好ましい。従って、例えば、ループの長さが8塩基の場合、Aは3〜5塩基、Bは5〜3塩基、Cは5〜3塩基、Dは3〜5塩基の長さであることが好ましい。ループの長さが9塩基の場合、Aは3〜6塩基、Bは6〜3塩基、Cは6〜3塩基、Dは3〜6塩基であることが好ましい。ループの長さが10塩基の場合、Aは4〜6塩基、Bは6〜4塩基、Cは6〜4塩基、Dは4〜6塩基であることが好ましい。
【0021】
なお、AとBで形成されるループとCとDで形成されるループの塩基配列は、同じでも異なっていてもよい。
【0022】
本発明の1本鎖環状RNAは、RNA干渉法に用いることができる。
RNA干渉とは、RNA interference(RNAi)ともいい、標的RNAと相補的な配列を持つ小RNA分子が標的RNAに結合し、それを分解するか又は翻訳を抑制する現象である。
【0023】
ダンベル型RNAのセンス鎖は、標的となるRNA(例えばmRNAまたはその前駆体RNA)に相補的な配列を有する。また、相補鎖を形成しない塩基配列は、特に限定されないが、例えばUUCAAGAGA、またはUGUGCUGUC(M.Miyagishiら、Oligonucleotides 2003,13:1−7)などが挙げられる。
【0024】
更に、ダンベル型RNAのループは化学修飾されていてもよく、例えば分子量約2000〜5000のポリエチレングリコールで修飾すると、生体内でのダンベル型RNAの安定性を向上することができる。細胞内でダイサーなどの酵素によりダンベル型RNAのループが切断され除去されるので、ステムがsiRNA又はmiRNAとしてRNA干渉作用を発揮する際、ポリエチレングリコールが影響を与えることはほとんどないと考えられる。
【0025】
本発明のダンベル型RNAは、対照細胞(ダンベル型RNAが導入されていない)における標的RNAの発現を1とした場合に、該ダンベル型RNAを導入した細胞における細胞導入後24時間での標的RNAの発現が0.4以下を示すことが好ましい。
【0026】
標的RNAの発現は、例えばレポーター遺伝子(ルシフェラーゼ、β−ガラクトシダーゼ、β−グルクロニターゼ、グリーンフルオレッセンスプロテイン(GFP)など)を細胞に形質転換し、レポーター遺伝子のmRNAを標的RNAとして、該標的RNAの発現がダンベル型RNAによってどのくらい阻害されているかを、レポーター遺伝子由来のタンパク質の発色、蛍光を測定することにより確認することができる。
【0027】
更に、本発明のダンベル型RNAは、ヒト血清中で8時間経過したときに70%以上が分解されずに保持されるという特徴を有する。例えばヒト血清中でダンベル型RNAをインキュベーションし、経時的に分解されるかどうかを電気泳動などで分子量を測定することにより確認することができる。
【0028】
本発明のダンベル型1本鎖環状RNAの製造方法は、相補鎖を形成しない塩基配列を5’末端および3’末端に有する、センス鎖およびアンチセンス鎖をそれぞれ合成し、センス鎖が有する相補鎖を形成しない塩基配列の5’末端の塩基とアンチセンス鎖が有する相補鎖を形成しない塩基配列の3’末端の塩基、およびセンス鎖が有する相補鎖を形成しない塩基配列の3’末端の塩基とアンチセンス鎖が有する相補鎖を形成しない塩基配列の5’末端の塩基を、リガーゼで同時に連結することを含む。
【0029】
センス鎖およびアンチセンス鎖は、標的となる遺伝子を抑制できるように、標的遺伝子の塩基配列から設計する。設計は、複数のセンス鎖およびアンチセンス鎖を作製してそれぞれ抑制効率を確認してもよいが、例えばsiRNA設計用アルゴリズムなどによる設計を利用してもよい(参照文献:J.A.Jaeger et al.,Methods in Enzymology(1989) 183:281−306;D.H.Mathews et al.,J.Mol.Biol.(1999) 288:911−940)。設計時には、標的遺伝子と類似した配列を持つ、標的遺伝子以外の遺伝子の発現を抑制すること(Off target効果)がないことが望ましい。センス鎖およびアンチセンス鎖は、特に限定されないが、例えば19〜31塩基、好ましくは21〜25塩基、より好ましくは22〜24塩基、さらに好ましくは23塩基の長さで設計する。
【0030】
標的遺伝子は特に限定されないが、例えば、白血病のabl/bcr遺伝子、加齢性黄斑変性症のVEGF遺伝子、肝炎のHCV遺伝子が挙げられる。
【0031】
後にループを形成する配列、例えば上記配列UUCAAGAGAを任意の箇所で2つに分けて相補鎖を形成しない塩基配列とし(該配列は9塩基であり、2つに分けたときに、上述のように長さの違いが1〜3塩基の範囲にあることが好ましい)、一方をアンチセンス鎖の3’末端、もう一方をセンス鎖の5’末端に連結した配列を設計し、同様にして一方をセンス鎖の3’末端、もう一方をアンチセンス鎖の5’末端に連結した配列を設計する。設計したこれら2つの配列の1本鎖核酸を、それぞれ別に合成する。その際、化学的リン酸化試薬を用いて5’末端のリン酸化を行うことが好ましい。なお、ループを形成したときの長さが、例えば2〜20塩基、好ましくは6〜12塩基になるように設計することが好ましい。
【0032】
核酸合成方法は、in vitro transcription合成方法、プラスミド、ウイルスベクターを用いる方法、PCRカセットによる方法など種々の方法があり、特に限定されないが、純度の高さ、大量合成可能、in vivoでの使用安全性の高さ、化学修飾可能などの点から、化学合成方法が好ましい。化学合成方法は、H−ホスホネート法、ホスホロアミダイト法などがあり、特に限定されず、市販の自動核酸合成機を使用することができる。
【0033】
センス鎖およびアンチセンス鎖の両端にある相補鎖を形成しない塩基配列の末端をリガーゼ(例えばT4 RNAリガーゼ、T4 DNAリガーゼなど)で連結して、2つのループを同時に形成する。反応条件は、例えばポリエチレングリコール(PEG)、BSAなどを含む緩衝液中で低温下20時間インキュベーションすればよい。合成したダンベル型1本鎖環状RNAは、常法で回収・精製(例えば高速液体クロマトグラフィー、PAGE法など)することができる。
【0034】
更に、1本鎖環状RNAをポリエチレングリコール(PEG)などで化学修飾してもよく、化学修飾はループ部分に行うことが好ましい。結合のために、PEGの両末端を改変して、たとえばホルミル基、N−ヒドロキシスクシンイミドエステル基などの、塩基のアミノ基と反応性の官能基を導入する。
【0035】
以下、上記方法で製造したダンベル型RNAを用いた、RNA干渉法について説明する。
本発明によれば、本発明の1本鎖環状RNAを細胞に導入し、標的RNAを不能にしてタンパク質への翻訳を持続的に阻害することができ、前記細胞は、ヒト細胞または非ヒト細胞を用いることができる。
【0036】
in vitroでRNA干渉法を行う場合、ダンベル型RNAを、例えばエレクトロポレーション法、マイクロインジェクション法、リポフェクション法、リン酸カルシウム法などで細胞に導入する。
【0037】
in vivoでRNA干渉法を行う場合、まずダンベル型RNAを含む試料を透析、pH調節などを行って、生体に適合するように調製する。動物又は植物への導入方法は特に限定されず、例えば局所投与、静脈内投与、遺伝子銃を用いる方法などが挙げられ、ヒトに適用する場合、安全性の点から微生物等を用いない方法が好ましい。
【0038】
細胞内に導入されたダンベル型RNAは、細胞内ダイサーにより切断を受けRNA干渉作用のあるRNA2本鎖(siRNA)を細胞内で生じる(図1)。siRNAの末端は、平滑末端または突出末端であり得る。siRNAが1本鎖となり、RNA−ヌクレアーゼ複合体(RNA induced silencing complex(RISC))を形成し、siRNAと相補的な配列の標的mRNAを認識して、mRNAを分解し、標的遺伝子の発現が抑制される。
【0039】
本発明の1本鎖環状RNAは、植物、動物(例えばヒト、ペット、家畜を含む哺乳動物など)、それらの細胞のいずれでも使用可能であり、特に医学、農学分野での広範な応用が期待される。例えば、植物又は動物レベルあるいは植物又は動物細胞レベルでの特定の遺伝子やタンパク質の機能の解明、例えばノックアウト法による機能の解明など、種々の目的のために本発明の1本鎖環状RNAを使用することができる。
【0040】
また、本発明は、1本鎖環状RNAを有効成分として含む医薬組成物を含有する。
1本鎖環状RNAの医薬組成物への配合量は、組成物の種類や目的等によって調整することができ、組成物の全量に対して、例えば1重量%、3重量%、5重量%、10重量%、20重量%、30重量%、40重量%、50重量%、60重量%、70重量%、80重量%、90重量%、100重量%であるが、これらに限定されない。
【0041】
本発明の医薬組成物の剤形として、例えば液体製剤(溶液剤、懸濁剤、乳濁剤など)、固体製剤(用時調製の凍結乾燥剤など)、リポソーム(カチオン性リポソームが好ましい)封入製剤などが挙げられ、また投与経路として、非経口投与が好ましく、例えば患部に直接投与する局所投与、経肺投与、経鼻投与等の経粘膜投与、静脈内投与などが含まれる。
【0042】
本発明の医薬組成物は、製剤化、剤形等に応じて、賦形剤(生理食塩水、滅菌水、リンゲル液など)、緩衝剤、等張化剤、安定化剤などを含めてもよい。
【0043】
また、本発明の医薬組成物の投与量は、患者の性別、体重、年齢、重篤度、症状などに応じて変更し得る。
【0044】
本発明の医薬組成物の適用は、特に限定されないが、例えば、癌などの疾患の治療、例えば癌細胞で特異的に発現する遺伝子やタンパク質の機能の抑制などが挙げられる。
【0045】
以下、実施例により本発明を更に具体的に説明するが、これらの実施例は本発明を限定するものではない。
【実施例1】
【0046】
ダンベル型RNAの作製
ダンベル型RNAの原料となる5’リン酸化RNAは、全てホスホロアミダイト法に基づきDNA合成機(GeneWorld H8−SE)により合成した。RNAアミダイトはTBDMS保護体(Proligo)、5’リン酸化はChemical Phosphorylation Reagent(Glen Research)を用いた。脱保護は定法に従い、PAGE精製した。合成したRNA配列を、配列番号1(センス鎖28mer)、配列番号2(アンチセンス鎖28mer)、配列番号3(56mer)および図2に示す。なお、図2のRNA配列のうち、下線の配列がダンベル型RNAのループ部を形成する配列である。
【0047】
次に、酵素反応を、2μM RNA double strand、2.0units/μl T4 RNAリガーゼ、0.006%BSA、25%PEG6000、50mM Tris−HCl(pH7.5)、10mM MgCl2、10mM DTT、1mM ATPの組成で、反応スケール25μlで行った。
【0048】
具体的には、まず、5’リン酸化RNA2本鎖が4μMとなるよう、100mM Tris−HCl(pH7.5)、20mM MgCl2、20mM DTT、2mM ATP緩衝液中(2x緩衝液)12.5μlに溶解し、65℃で5分間加熱後、室温まで徐冷した。その後、BSA水溶液、PEG6000水溶液、T4 RNAリガーゼ(タカラバイオ)を上記の組成と反応スケールになるように加え、11℃で20時間インキュベートした。エタノール沈殿により、回収したRNAをPAGEにて解析した。
【0049】
図2のPAGEの各レーンのサンプルは以下の通りである。
レーン1:28塩基のセンス鎖および28塩基のアンチセンス鎖の混合物(マーカー)
レーン2:57塩基のRNA(マーカー)
レーン3:28塩基のセンス鎖と28塩基のアンチセンス鎖から形成したダンベル型RNA
レーン4:56塩基(1本鎖)から形成したダンベル型RNA
レーン5:RNAリガーゼで処理した28塩基のセンス鎖(参考)
レーン6:RNAリガーゼで処理した28塩基のアンチセンス鎖(参考)
【0050】
レーン4のダンベル型RNAは、配列番号3の56塩基の1本鎖を合成してステム部分およびヘアピンループ部分を形成し、最初の塩基と最後の塩基をT4リガーゼで結合して作製した。
【0051】
レーン3の丸で囲んだバンドが、本発明の方法で作製したダンベル型RNAであり、その収率は約80%であった。レーン4のダンベル型RNAの収率は約5%以下であった。
【実施例2】
【0052】
ダンベル型RNAのステムの長さの検討
上記DNA合成機で、配列番号4〜13に示すRNAを合成した。配列番号4および5は18塩基対を形成する2本鎖RNA(siRNA−1)、配列番号6および7はステムの長さ19塩基のダンベル型RNA(Db−19)、配列番号8および9はステムの長さ23塩基のダンベル型RNA(Db-23)、配列番号10及び11はステムの長さ27塩基のダンベル型RNA(Db-27)、配列番号12および13はステムの長さ31塩基のダンベル型RNA(Db-31)を形成する(図3)。
【0053】
酵素反応を、2μM RNA double strand、1.0units/μl T4 RNAリガーゼ、0.006%BSA、25%PEG6000、50mM Tris−HCl(pH7.5)、10mM MgCl2、10mM DTT、1mM ATPの組成で、反応スケール1.5〜2.5mlで行った。
【0054】
具体的には、5’リン酸化RNA2本鎖が4μMとなるよう、100mM Tris−HCl(pH7.5)、20mM MgCl2、20mM DTT、2mM ATP緩衝液中(2x緩衝液、最終的な反応液量の半分量)に溶解し、65℃で5分間加熱後、室温まで徐冷した。その後、BSA水溶液、PEG6000水溶液、T4 RNAリガーゼ(タカラバイオ)を加え、11℃で20時間インキュベートした。
【0055】
反応液からアルコール沈殿によりRNAを回収し、PAGEを用いて環化体を単離した。UV shadowing法で目的物を含むバンドを可視化して切り出し、細かく粉砕した後、溶出バッファー(0.2M NaCl、1mM EDTA(pH8.0))4mlで3回抽出した。Sep−Pakカートリッジを用いて脱塩(50%アセトニトリル水6mlで溶出)し、遠心エバポレーターを用いて濃縮し、さらに酢酸アンモニウム存在下アルコール沈殿した。UVスペクトルを測定し得られた目的物を定量した。
【0056】
上記各ダンベル型RNA2μgに20mM Tris−HCl(pH8.5)、150mM NaCl、2.5mM MgCl2緩衝液中ColdShock−DICER(タカラバイオ)2unitsを加え(反応液量20μl)、37℃でインキュベートした。1、6、18時間後に反応液3μlをサンプリングし、120mM EDTA水溶液2μlと混合し、酵素反応を停止した。これを未変性PAGE(10%PAGE、1x TBE)で解析した(1xSYBR GreenIで染色後、BioRad Molecular Imager FXで画像化・定量を行った)。
【0057】
図4に各ダンベル型RNAのPAGEを示す。コントロールとして、ダンベル化反応前の2本鎖RNAを基質とする切断反応も同様に検討した。その結果、Db−19の切断反応は、1時間後に約5%進行し、20塩基長の2本鎖RNAの生成が確認された。Db−19の20塩基前後の切断断片は、6、18時間後とほぼ同程度の濃度を維持した。一方、コントロールの19塩基直鎖(Liner)は、1時間後にほぼ100%切断され20塩基長のRNA2本鎖が観察された。その後、時間とともにその生成物のRNA2本鎖は、分解され消失した。Db−23では、1時間後に約8%切断され20塩基長の2本鎖が生成した。ステムの長さが長くなるに従い、Db−27、Db−31と1時間後の切断速度が10%、20%と速くなることが確認された。18時間後、Db−19では原料が約75%残っているのに対して、Db−31では原料が完全に消失した。このことから、ステムの長さが短い方が酵素に対して安定であることが明らかとなった。
【実施例3】
【0058】
ダンベル型RNAのRNA干渉効果
上記ダンベル型RNA(Db−19、Db−23、Db−27、Db−31)のRNA干渉効果を蛍ルシフェラーゼレポーター遺伝子pGL3の発現阻害実験により評価した。
【0059】
NIH 3T3細胞(RIKEN CELL BANK)を10%FCSを含むDMEM(GIBCO)培地中で37℃、5%CO2下培養し、96穴プレートに、100μlずつ、1.6x104細胞/ウェルとなるよう分注した。さらに37℃、5%CO2下で39時間培養し、約70%コンフルエントの状態で2種のプラスミドベクター(pGL3−Control、pRL−TK(内部標準用)、いずれもPromega)と各種RNAをトランスフェクション試薬GeneSilencer(Genlantis)を用い、トランスフェクション試薬添付のプロトコールに従い、コトランスフェクションした。トランスフェクション時の濃度条件は以下の通りである。
【0060】
0.2μg pGL3−Control/0.02μg pRL−TK/25nM RNA(最終量100μl)
GeneSilencer 1μl
DMEM培地 25μl
siRNA希釈液 2.5μl
DMEM培地 15μl
RNA(5pmol/μl) 0.5μl
pGL3−Control(1μg/μl) 0.2μl
pRL−TK(0.1μg/μl) 0.2μl
44.4μl
【0061】
トランスフェクション後、37℃、5%CO2下4時間インキュベートし、20%血清入りDMEM培地100μlをそれぞれのウェルに加えた。37℃でさらに20時間インキュベート後、Dual−luciferase Reporter Assay System(Promega)を用い、添付のプロトコールに従い細胞を可溶化してルシフェラーゼ発現量を定量した(条件:試薬量30μl、delay time2秒、read time10秒。機器Wallac ARVO SX 1420 Multilabel Counter)。
【0062】
比較として、バッファーのみ(コントロール)の条件も同様に評価した。蛍ルシフェラーゼの発光強度は、内部標準であるレニラルシフェラーゼの発光強度により補正した。その結果を図5に示す。24時間後では、ダンベル型RNAのうち、Db−23の活性が最も高く、0.24まで阻害効果を示した。この結果から、最適な二本鎖長を23塩基とした。
【実施例4】
【0063】
RNA干渉効果の持続性
Db−23とsiRNA−1のRNA干渉効果の持続性について比較した。
NIH 3T3細胞を、10%ウシ仔牛血清(FCS、Invitro/Gibco)を含むダルベッコ改変イーグル培地(DMEM、Gibco)で、5%CO2加湿チャンバーで培養した。約70%コンフルエントの状態のトランスフェクションの40時間前に、細胞を96穴プレートに、100μlずつ、1.6×104細胞/ウェルになるように分注した。レポータープラスミドとRNAのコトランスフェクションをGeneSilencer(Gene Therapy Systems)を用いてNIH 3T3細胞の製造者による説明に従って行った。実施例3と比べてトランスフェクション試薬で10倍に希釈した16ng/mlのpGL3−Control(Promega)、1.6ng/mlのpRL−TK(Promega)および25nMのRNAを、ウェルに100μl適用した。4時間のインキュベーション後、20%FCSを含むDMEMを100μl添加した。更に3日以上インキュベーションを行い、培地を随時交換した。ルシフェラーゼの発現を、Wallac ARVO SX 1420 Multilabel Counter(Perkin−Elmer)に添付の指示書に従い、Dual−Luciferase Reporter Assay System(Promega)で、24時間、72時間、120時間後にモニターした(図6)。RNAの入っていないものをコントロールとした。
【0064】
ルシフェラーゼの活性は、24時間ではDb−23とsiRNA−1ともにほぼ同等の活性を示したが、120時間後では、Db−23がより高い遺伝子発現抑制作用を示した。このことから、ダンベル型RNAの徐放作用、長期活性効果が示された。
【実施例5】
【0065】
ヒト血清中でのダンベル型RNAの安定性
Db-23とsiRNAのヒト血清中での安定性を比較した。
アニーリングバッファー(100mM酢酸カリウム、30mM HEPES−KOH(pH7.4)、2mM酢酸マグネシウム)にアニーリング前のdsRNA(siRNA−1、20μM)またはダンベル型RNA(Db−23、20μM)を加えたその4μlと、PBS32μl、正常ヒト血清(Chemicon International)4μlを混合して37℃でインキュベーションした。アリコート5μlを0.5、1、1.5、3、8および20時間後に採取し、15%nativePAGEで、SYBR Green Iで染色、MolecularImager FX(BioRad)を使用して分析した。
【0066】
その結果、siRNAは、3時間後に50%まで分解されるのに対して、Db−23は依然として80%以上存在し、8時間後でも70%以上存在していた。従って、D−23は、生体内での高い安定性が期待できた。
【産業上の利用可能性】
【0067】
本発明は、生体に適用できる核酸分子として利用可能であり、収率よく該分子を製造できる。
【図面の簡単な説明】
【0068】
【図1】本発明のダンベル型RNAを模式的に示す。
【図2】RNAの構造と各種RNAの電気泳動像を示す。
【図3】siRNAとダンベル型RNAの構造を示す。
【図4】ダイサーで切断したダンベル型RNAの電気泳動像を示す。
【図5】トランスフェクションから24時間後の各ダンベル型RNAの干渉効果を示す。
【図6】ダンベル型RNAの持続的なRNA干渉効果を示す。
【図7】ダンベル型RNAのヒト血清中の安定性を示す。
【特許請求の範囲】
【請求項1】
センス鎖配列と、該センス鎖配列に相補的なアンチセンス鎖配列と、該センス鎖と該アンチセンス鎖の間に両鎖を結合する同じか又は異なる2つのループ配列とを含み、該センス鎖と該アンチセンス鎖が対合してステムを形成することを特徴とする、持続的又は徐放的RNA干渉作用を有する1本鎖環状RNA。
【請求項2】
対照細胞における標的RNAの発現を1とした場合に、細胞に導入後24時間の標的RNAの発現が0.4以下を示す、請求項1に記載の1本鎖環状RNA。
【請求項3】
ヒト血清中で8時間経過したときに70%以上が保持されている、請求項1または2に記載の1本鎖環状RNA。
【請求項4】
相補鎖を形成しない塩基配列を5’末端および3’末端に有する、センス鎖およびアンチセンス鎖をそれぞれ合成し、センス鎖が有する相補鎖を形成しない塩基配列の5’末端の塩基とアンチセンス鎖が有する相補鎖を形成しない塩基配列の3’末端の塩基、およびセンス鎖が有する相補鎖を形成しない塩基配列の3’末端の塩基とアンチセンス鎖が有する相補鎖を形成しない塩基配列の5’末端の塩基を、リガーゼで同時に連結することを含み、
その際、センス鎖が5’末端に有する相補鎖を形成しない塩基配列とアンチセンス鎖が3’末端に有する相補鎖を形成しない塩基配列が互いに結合してループを形成し、センス鎖が3’末端に有する相補鎖を形成しない塩基配列とアンチセンス鎖が5’末端に有する相補鎖を形成しない塩基配列が互いに結合してループを形成し、ならびにセンス鎖とアンチセンス鎖が対合してステムを形成する、請求項1〜3のいずれか1項に記載の1本鎖環状RNAの製造方法。
【請求項5】
センス鎖が有する相補鎖を形成しない塩基配列とアンチセンス鎖が有する相補鎖を形成しない塩基配列の5’末端をリン酸化することを更に含む、請求項4に記載の製造方法。
【請求項6】
前記ループの配列が互いに同じかまたは異なる、請求項4または5に記載の製造方法。
【請求項7】
前記ループの長さが2〜20塩基である、請求項4〜6のいずれか1項に記載の製造方法。
【請求項8】
前記ステムの長さが19〜31塩基である、請求項4〜7のいずれか1項に記載の製造方法。
【請求項9】
請求項1〜3のいずれか1項に記載の1本鎖環状RNAをヒト由来の細胞に導入し、標的RNAを不能にしてタンパク質への翻訳を持続的に阻害することを含む、該タンパク質をコードする遺伝子の発現をin vitroで抑制する方法。
【請求項10】
請求項1〜3のいずれか1項に記載の1本鎖環状RNAを非ヒト動物、植物又はそれらの細胞に導入し、標的RNAを不能にしてタンパク質への翻訳を持続的に阻害することを含む、該タンパク質をコードする遺伝子の発現を抑制する方法。
【請求項11】
請求項1〜3のいずれか1項に記載の1本鎖環状RNAを有効成分として含む、医薬組成物。
【請求項1】
センス鎖配列と、該センス鎖配列に相補的なアンチセンス鎖配列と、該センス鎖と該アンチセンス鎖の間に両鎖を結合する同じか又は異なる2つのループ配列とを含み、該センス鎖と該アンチセンス鎖が対合してステムを形成することを特徴とする、持続的又は徐放的RNA干渉作用を有する1本鎖環状RNA。
【請求項2】
対照細胞における標的RNAの発現を1とした場合に、細胞に導入後24時間の標的RNAの発現が0.4以下を示す、請求項1に記載の1本鎖環状RNA。
【請求項3】
ヒト血清中で8時間経過したときに70%以上が保持されている、請求項1または2に記載の1本鎖環状RNA。
【請求項4】
相補鎖を形成しない塩基配列を5’末端および3’末端に有する、センス鎖およびアンチセンス鎖をそれぞれ合成し、センス鎖が有する相補鎖を形成しない塩基配列の5’末端の塩基とアンチセンス鎖が有する相補鎖を形成しない塩基配列の3’末端の塩基、およびセンス鎖が有する相補鎖を形成しない塩基配列の3’末端の塩基とアンチセンス鎖が有する相補鎖を形成しない塩基配列の5’末端の塩基を、リガーゼで同時に連結することを含み、
その際、センス鎖が5’末端に有する相補鎖を形成しない塩基配列とアンチセンス鎖が3’末端に有する相補鎖を形成しない塩基配列が互いに結合してループを形成し、センス鎖が3’末端に有する相補鎖を形成しない塩基配列とアンチセンス鎖が5’末端に有する相補鎖を形成しない塩基配列が互いに結合してループを形成し、ならびにセンス鎖とアンチセンス鎖が対合してステムを形成する、請求項1〜3のいずれか1項に記載の1本鎖環状RNAの製造方法。
【請求項5】
センス鎖が有する相補鎖を形成しない塩基配列とアンチセンス鎖が有する相補鎖を形成しない塩基配列の5’末端をリン酸化することを更に含む、請求項4に記載の製造方法。
【請求項6】
前記ループの配列が互いに同じかまたは異なる、請求項4または5に記載の製造方法。
【請求項7】
前記ループの長さが2〜20塩基である、請求項4〜6のいずれか1項に記載の製造方法。
【請求項8】
前記ステムの長さが19〜31塩基である、請求項4〜7のいずれか1項に記載の製造方法。
【請求項9】
請求項1〜3のいずれか1項に記載の1本鎖環状RNAをヒト由来の細胞に導入し、標的RNAを不能にしてタンパク質への翻訳を持続的に阻害することを含む、該タンパク質をコードする遺伝子の発現をin vitroで抑制する方法。
【請求項10】
請求項1〜3のいずれか1項に記載の1本鎖環状RNAを非ヒト動物、植物又はそれらの細胞に導入し、標的RNAを不能にしてタンパク質への翻訳を持続的に阻害することを含む、該タンパク質をコードする遺伝子の発現を抑制する方法。
【請求項11】
請求項1〜3のいずれか1項に記載の1本鎖環状RNAを有効成分として含む、医薬組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2008−278784(P2008−278784A)
【公開日】平成20年11月20日(2008.11.20)
【国際特許分類】
【出願番号】特願2007−125045(P2007−125045)
【出願日】平成19年5月9日(2007.5.9)
【出願人】(503359821)独立行政法人理化学研究所 (1,056)
【出願人】(000206956)大塚製薬株式会社 (230)
【出願人】(504105737)林化成株式会社 (4)
【Fターム(参考)】
【公開日】平成20年11月20日(2008.11.20)
【国際特許分類】
【出願日】平成19年5月9日(2007.5.9)
【出願人】(503359821)独立行政法人理化学研究所 (1,056)
【出願人】(000206956)大塚製薬株式会社 (230)
【出願人】(504105737)林化成株式会社 (4)
【Fターム(参考)】
[ Back to top ]

