1,3,5−トリアジン誘導体、その製造方法、及びこれを構成成分とする有機電界発光素子
【課題】有機電界発光素子において電子輸送材料として用いることで、駆動電圧を低減し発光効率を高めることのできる化合物を提供する。
【解決手段】一般式(1)

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体を製造し、これを構成成分とする有機電界発光素子を作製する。
【解決手段】一般式(1)

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体を製造し、これを構成成分とする有機電界発光素子を作製する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、1,3,5−トリアジン誘導体とその製造方法、及びそれを含有する有機電界発光素子に関する。さらに詳しくは、有機電界発光素子の構成成分として有用なピラジル基、ピリミジル基、キノキサリル基、キナゾリル基、キノリル基又はイソキノリル基等を有する1,3,5−トリアジン誘導体とその製造方法に関し、本発明の1,3,5−トリアジン誘導体を有機電界発光素子の有機化合物層の少なくとも一層に用いることにより、有機電界発光素子の消費電力の低減、長寿命化を達成することができる。
【背景技術】
【0002】
有機電界発光素子は、発光する化合物を含有する発光層を正孔輸送層と電子輸送層で挟み、さらにその外側に陽極と陰極を取付け、発光層に正孔及び電子を注入して再結合するときに生成する励起子が失活する際の光の放出(蛍光又はりん光)を利用する素子である。近年、有機電界発光素子が、次世代フラットパネルディスプレイの本命と注目されている理由として、薄膜化・軽量化が可能であること、自発光素子であるため消費電力が低いこと、簡単な素子構造なため製造コストが低いこと等が挙げられる。また、その製造方法は、真空蒸着、スピンコート、インクジェット、オフセット印刷、熱転写等、様々な製造技術の応用が可能である。現在、携帯電話、携帯音楽機器、PDA(Personal Digital Assistant)等の携帯機器が実用化されているが、より大型化や高精細化が達成されれば、フラットパネルディスプレイのみならず、面発光光源としての照明、フレキシブル特性を利用したペーパーライクディスプレイ、ウエアラブルディスプレイ、透明性を利用したシースルーディスプレイ等への拡張も可能であり、市場の急速な拡大が期待される。
【0003】
しかし、技術的に超えなければならない課題はまだ多く、特に現状では、駆動電圧が高く効率が低いため、消費電力が高いことが問題である。また同時に、高い駆動電圧は素子の短寿命化を起こす原因にもなり得る。
【0004】
この問題点は、有機電界発光素子を構成する材料、特に電子輸送材料の特性が不十分であることに起因する。正孔輸送材料は、トリアリールアミン誘導体を中心に多種多様な材料が知られているが、電子輸送材料の報告例は少ない。既に実用化されている材料としてトリス(8−キノリノラト)アルミニウム(III)(Alq)があるが、正孔輸送材料、例えばN,N’−ビス(1−ナフチル)−N,N’−ジフェニル−4,4’−ビフェニル(NPD)に比べて性能が低いため、有機電界発光素子の特性を制限していた。
【0005】
他の電子輸送材料の報告例としては、オキサジアゾール誘導体(特許文献1)、キノキサリン誘導体(特許文献2)、トリアゾール誘導体(特許文献3)、シラシクロペンタジエン誘導体(特許文献4)、キノリン誘導体(特許文献5)、ベンゾイミダゾール誘導体(特許文献6)、ベンゾチアゾール誘導体(非特許文献1)等がある。しかしながら駆動電圧が高い、薄膜が結晶化しやすい、寿命が短い等、実用上問題点が多い。
【0006】
また最近、1,3,5−トリアジン誘導体を有機電界発光素子に用いる例が特許文献7及び8に開示されているが、これらのトリアジンはトリアジン環の2,4,6位にベンゾアゾール部位を有するため、本発明の1,3,5−トリアジン誘導体とは全く異なるものである。
【0007】
また、特許文献9〜12には、1,3,5−トリアジンを有機電界発光素子に用いる例が開示されているが、これらのトリアジンにおいて、トリアジン環の2,4,6位に置換するフェニル基が二置換となる場合の置換様式としては、o,p−及びm,p−二置換に限られており、本発明の3,5−二置換フェニル基を有することを特徴とする1,3,5−トリアジン誘導体に関する記述は一切ない。
【0008】
また、特許文献13には、1,3,5−トリアジンを有機電界発光素子に用いる例が開示されているが、これらはトリアジン環の2,4,6位の全てに芳香族複素環基が置換した芳香族炭化水素基を有するトリアジンであり、本発明の1,3,5−トリアジン誘導体とは全く異なるものである。
【0009】
また、特許文献14の27頁には、有機電界発光素子に用いる1,3,5−トリアジン(化合物番号C−8)の1例のみが例示されているが、これはトリアジン環の2,4,6位に同一の芳香族炭化水素基を有するトリアジンであり、本発明の1,3,5−トリアジン誘導体とは全く異なるものである。
【0010】
また、特許文献15の8頁には、有機電界発光素子に用いる1,3,5−トリアジン(化合物番号1)の1例のみが例示されているが、これはトリアジン環の2,4,6位に同一の4−一置換フェニル基を有するトリアジンであり、本発明の1,3,5−トリアジン誘導体とは全く異なるものである。
【0011】
また、特許文献16には、1,3,5−トリアジンを有機電界発光素子に用いる例が開示されているが、これらのトリアジン環の2,4,6位は一置換フェニル基で置換されており、3,5−二置換フェニル基を有することを特徴とする本発明の1,3,5−トリアジン誘導体とは異なるものである。
【0012】
また、特許文献17には、1,3,5−トリアジンを有機電界発光素子に用いる例が開示されているが、トリアジン環の2,4,6位のフェニル基上の置換基の位置は限定されておらず、3,5−二置換フェニル基を有することを特徴とする本発明の1,3,5−トリアジン誘導体は具体的に示されていない。また、本発明の1,3,5−トリアジン誘導体は、トリアジン環の2位に1つの3,5−二置換フェニル基を有することを特徴とすると共に、4,6位に2つの芳香族炭化水素基を有することを特徴とするが、当該特許文献にはこれに関する言及もなく、実施例も示されていない。さらに、当該特許文献の実施例に示された製造法を用いて、本発明の1,3,5−トリアジン誘導体を製造することはできない。
【0013】
【特許文献1】特開平6−136359号公報
【特許文献2】特開平6−207169号公報
【特許文献3】国際公開第95/25097号パンフレット
【特許文献4】特開2005−104986公報
【特許文献5】特開2006−199677公報
【特許文献6】国際公開第2004/080975号パンフレット
【特許文献7】特開平7−157473号公報
【特許文献8】特開2003−303689公報
【特許文献9】米国特許第6057048号明細書
【特許文献10】米国特許第6229012号明細書
【特許文献11】米国特許第6225467号明細書
【特許文献12】特開2004−63465公報
【特許文献13】特開2003−45662公報
【特許文献14】特開2001−143869公報
【特許文献15】特開2003−282270公報
【特許文献16】特許第4106974号明細書
【特許文献17】特開2007−137829公報
【非特許文献1】Applied Physics Letters、89巻、063504、2006年
【発明の開示】
【発明が解決しようとする課題】
【0014】
本発明は、有機電界発光素子の電子輸送層として、素子の低電圧駆動を可能にする新規構造を有する1,3,5−トリアジン誘導体を提供し、さらに当該化合物を用いた長寿命を備えた有機電界発光素子を提供するものである。
【課題を解決するための手段】
【0015】
本発明者らは、先の課題を解決すべく鋭意検討を重ねた結果、本発明の1,3,5−トリアジン誘導体(1)は、真空蒸着及びスピンコートのいずれの方法でも非晶質の薄膜形成が可能であり、またこれらを電子輸送層として用いた有機電界発光素子が、汎用の有機電界発光素子に比べて消費電力の低減、及び長寿命化が達成できることを見出し、本発明を完成するに至った。
【0016】
すなわち本発明は、一般式(1)
【0017】
【化1】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体に関するものである。
【0018】
また本発明は、一般式(2)
【0019】
【化2】

(式中、Xは炭素原子又は窒素原子を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。MはZnR4、MgR5、Sn(R6)3、B(OR7)2を表す。但し、R4及びR5は各々独立して塩素原子、臭素原子又はヨウ素原子を表し、R6は炭素数1〜4のアルキル基又はフェニル基を表し、R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R6及びR7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示される化合物と、一般式(3)
【0020】
【化3】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Y1は塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。)で示される化合物を塩基の存在下若しくは不存在下に、パラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【0021】
【化4】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体の製造方法に関するものである。
【0022】
また本発明は、一般式(4)
【0023】
【化5】

(式中、Xは炭素原子又は窒素原子を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。Y2は、塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。)で示される化合物と、一般式(5)
【0024】
【化6】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示される化合物を塩基及びパラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【0025】
【化7】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体の製造方法に関するものである。
【0026】
さらに本発明は、一般式(1)
【0027】
【化8】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体を構成成分とすることを特徴とする有機電界発光素子に関するものである。
【0028】
以下、本発明を詳細に説明する。
【0029】
R1、R2及びR3は、各々独立して水素原子又はメチル基を表し、有機電界発光素子用材料としての性能がよい点で、水素原子が好ましい。
【0030】
Xは、炭素原子又は窒素原子を表し、有機電界発光素子用材料としての性能がよい点で、炭素原子が好ましい。
【0031】
Ar1で表される置換されていてもよい芳香族炭化水素基としては、置換されていてもよいフェニル基又は置換されていてもよいナフチル基を挙げることができる。以下、さらに具体的な例を挙げるが、本発明はこれらに限定されるものではない。
【0032】
置換されていてもよいフェニル基としては、フェニル基、p−トリル基、m−トリル基、o−トリル基、4−トリフルオロメチルフェニル基、3−トリフルオロメチルフェニル基、2−トリフルオロメチルフェニル基、2,4−ジメチルフェニル基、3,5−ジメチルフェニル基、メシチル基、2−エチルフェニル基、3−エチルフェニル基、4−エチルフェニル基、2,4−ジエチルフェニル基、3,5−ジエチルフェニル基、2−プロピルフェニル基、3−プロピルフェニル基、4−プロピルフェニル基、2,4−ジプロピルフェニル基、3,5−ジプロピルフェニル基、2−イソプロピルフェニル基、3−イソプロピルフェニル基、4−イソプロピルフェニル基、2,4−ジイソプロピルフェニル基、3,5−ジイソプロピルフェニル基、2−ブチルフェニル基、3−ブチルフェニル基、4−ブチルフェニル基、2,4−ジブチルフェニル基、3,5−ジブチルフェニル基、2−tert−ブチルフェニル基、3−tert−ブチルフェニル基、4−tert−ブチルフェニル基、2,4−ジ−tert−ブチルフェニル基、3,5−ジ−tert−ブチルフェニル基、4−ビフェニリル基、3−ビフェニリル基、2−ビフェニリル基、2−メチルビフェニル−4−イル基、3−メチルビフェニル−4−イル基、2’−メチルビフェニル−4−イル基、4’−メチルビフェニル−4−イル基、2,2’−ジメチルビフェニル−4−イル基、2’,4’,6’−トリメチルビフェニル−4−イル基、6−メチルビフェニル−3−イル基、5−メチルビフェニル−3−イル基、2’−メチルビフェニル−3−イル基、4’−メチルビフェニル−3−イル基、6,2’−ジメチルビフェニル−3−イル基、2’,4’,6’−トリメチルビフェニル−3−イル基、5−メチルビフェニル−2−イル基、6−メチルビフェニル−2−イル基、2’−メチルビフェニル−2−イル基、4’−メチルビフェニル−2−イル基、6,2’−ジメチルビフェニル−2−イル基、2’,4’,6’−トリメチルビフェニル−2−イル基、2−トリフルオロメチルビフェニル−4−イル基、3−トリフルオロメチルビフェニル−4−イル基、2’−トリフルオロメチルビフェニル−4−イル基、4’−トリフルオロメチルビフェニル−4−イル基、6−トリフルオロメチルビフェニル−3−イル基、5−トリフルオロメチルビフェニル−3−イル基、2’−トリフルオロメチルビフェニル−3−イル基、4’−トリフルオロメチルビフェニル−3−イル基、5−トリフルオロメチルビフェニル−2−イル基、6−トリフルオロメチルビフェニル−2−イル基、2’−トリフルオロメチルビフェニル−2−イル基、4’−トリフルオロメチルビフェニル−2−イル基、3−エチルビフェニル−4−イル基、4’−エチルビフェニル−4−イル基、2’,4’,6’−トリエチルビフェニル−4−イル基、6−エチルビフェニル−3−イル基、4’−エチルビフェニル−3−イル基、5−エチルビフェニル−2−イル基、4’−エチルビフェニル−2−イル基、2’,4’,6’−トリエチルビフェニル−2−イル基、3−プロピルビフェニル−4−イル基、4’−プロピルビフェニル−4−イル基、2’,4’,6’−トリプロピルビフェニル−4−イル基、6−プロピルビフェニル−3−イル基、4’−プロピルビフェニル−3−イル基、5−プロピルビフェニル−2−イル基、4’−プロピルビフェニル−2−イル基、2’,4’,6’−トリプロピルビフェニル−2−イル基、3−イソプロピルビフェニル−4−イル基、4’−イソプロピルビフェニル−4−イル基、2’,4’,6’−トリイソプロピルビフェニル−4−イル基、6−イソプロピルビフェニル−3−イル基、4’−イソプロピルビフェニル−3−イル基、5−イソプロピルビフェニル−2−イル基、4’−イソプロピルビフェニル−2−イル基、2’,4’,6’−トリイソプロピルビフェニル−2−イル基、3−ブチルビフェニル−4−イル基、4’−ブチルビフェニル−4−イル基、2’,4’,6’−トリブチルビフェニル−4−イル基、6−ブチルビフェニル−3−イル基、4’−ブチルビフェニル−3−イル基、5−ブチルビフェニル−2−イル基、4’−ブチルビフェニル−2−イル基、2’,4’,6’−トリブチルビフェニル−2−イル基、3−tert−ブチルビフェニル−4−イル基、4’−tert−ブチルビフェニル−4−イル基、2’,4’,6’−トリ−tert−ブチルビフェニル−4−イル基、6−tert−ブチルビフェニル−3−イル基、4’−tert−ブチルビフェニル−3−イル基、5−tert−ブチルビフェニル−2−イル基、4’−tert−ブチルビフェニル−2−イル基、2’,4’,6’−トリ−tert−ブチルビフェニル−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、フェニル基、p−トリル基、m−トリル基、o−トリル基、4−ブチルフェニル基又は4−tert−ブチルフェニル基、4−ビフェニリル基、3−ビフェニリル基が好ましく、合成が容易である点でフェニル基、p−トリル基、3−ビフェニリル基が更に好ましい。
【0033】
置換されていてもよいナフチル基としては、1−ナフチル基、4−メチルナフタレン−1−イル基、4−トリフルオロメチルナフタレン−1−イル基、4−エチルナフタレン−1−イル基、4−プロピルナフタレン−1−イル基、4−ブチルナフタレン−1−イル基、4−tert−ブチルナフタレン−1−イル基、5−メチルナフタレン−1−イル基、5−トリフルオロメチルナフタレン−1−イル基、5−エチルナフタレン−1−イル基、5−プロピルナフタレン−1−イル基、5−ブチルナフタレン−1−イル基、5−tert−ブチルナフタレン−1−イル基、2−ナフチル基、6−メチルナフタレン−2−イル基、6−トリフルオロメチルナフタレン−2−イル基、6−エチルナフタレン−2−イル基、6−プロピルナフタレン−2−イル基、6−ブチルナフタレン−2−イル基、6−tert−ブチルナフタレン−2−イル基、7−メチルナフタレン−2−イル基、7−トリフルオロメチルナフタレン−2−イル基、7−エチルナフタレン−2−イル基、7−プロピルナフタレン−2−イル基、7−ブチルナフタレン−2−イル基、7−tert−ブチルナフタレン−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、1−ナフチル基、4−メチルナフタレン−1−イル基、4−tert−ブチルナフタレン−1−イル基、5−メチルナフタレン−1−イル基、5−tert−ブチルナフタレン−1−イル基、2−ナフチル基、6−メチルナフタレン−2−イル基、6−tert−ブチルナフタレン−2−イル基、7−メチルナフタレン−2−イル基又は7−tert−ブチルナフタレン−2−イル基が好ましく、合成が容易である点で2−ナフチル基が更に好ましい。
【0034】
Ar2で表される1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基としては、その置換基に特に制限はないが、炭素数1から4のアルキル基で置換されていてもよいピラジル基、炭素数1から4のアルキル基で置換されていてもよい2−ピリミジル基、炭素数1から4のアルキル基で置換されていてもよい2−キノキサリル基、炭素数1から4のアルキル基で置換されていてもよいキナゾリル基、炭素数1から4のアルキル基で置換されていてもよいキノリル基又は炭素数1から4のアルキル基で置換されていてもよいイソキノリル基等を挙げることができる。以下、さらに具体的な例を挙げるが、本発明はこれらに限定されるものではない。
【0035】
炭素数1から4のアルキル基で置換されていてもよいピラジル基としては、2−ピラジル基、3−メチルピラジン−2−イル基、5−メチルピラジン−2−イル基、6−メチルピラジン−2−イル基、3−tert−ブチルピラジン−2−イル基、5−tert−ブチルピラジン−2−イル基、6−tert−ブチルピラジン−2−イル基、5,6−ジメチルピラジン−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、2−ピラジル基、5,6−ジメチルピラジン−2−イル基が好ましく、合成が容易である点で、2−ピラジル基が更に好ましい。
【0036】
炭素数1から4のアルキル基で置換されていてもよい2−ピリミジル基としては、2−ピリミジル基、4,6−ジメチルピリミジン−2−イル基、4,6−ジ(tert−ブチル)ピリミジン−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、2−ピリミジル基、4,6−ジメチルピリミジン−2−イル基が好ましく、合成が容易である点で、2−ピリミジル基が更に好ましい。
【0037】
炭素数1から4のアルキル基で置換されていてもよい2−キノキサリル基としては、2−キノキサリル基、3−メチルキノキサリン−2−イル基、5−メチルキノキサリン−2−イル基、6−メチルキノキサリン−2−イル基、7−メチルキノキサリン−2−イル基、8−メチルキノキサリン−2−イル基、5,7−ジメチルキノキサリン−2−イル基、5,6,7,8−テトラメチルキノキサリン−2−イル基、3−tert−ブチルキノキサリン−2−イル基、6−tert−ブチルキノキサリン−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、2−キノキサリル基、3−メチルキノキサリン−2−イル基、3−tert−ブチルキノキサリン−2−イル基が好ましく、合成が容易である点で、2−キノキサリル基が更に好ましい。
【0038】
炭素数1から4のアルキル基で置換されていてもよいキナゾリル基としては、2−キナゾリル基、4−メチルキナゾリン−2−イル基、5−メチルキナゾリン−2−イル基、6−メチルキナゾリン−2−イル基、7−メチルキナゾリン−2−イル基、8−メチルキナゾリン−2−イル基、5,7−ジメチルキナゾリン−2−イル基、5,6,7,8−テトラメチルキナゾリン−2−イル基、4−tert−ブチルキナゾリン−2−イル基、6−tert−ブチルキナゾリン−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、2−キナゾリル基、4−メチルキナゾリン−2−イル基、4−tert−ブチルキナゾリン−2−イル基が好ましく、合成が容易である点で、2−キナゾリル基が更に好ましい。
【0039】
炭素数1から4のアルキル基で置換されていてもよいキノリル基としては、2−キノリル基、3−キノリル基、4−キノリル基、3−メチルキノリン−2−イル基、4−メチルキノリン−2−イル基、5−メチルキノリン−2−イル基、6−メチルキノリン−2−イル基、7−メチルキノリン−4−イル基、8−メチルキノリン−2−イル基、5,8−ジメチルキノリン−2−イル基、5,6,7,8−テトラメチルキノリン−2−イル基、4−tert−ブチルキノリン−2−イル基、6−tert−ブチルキノリン−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、2−キノリル基、3−メチルキノリン−2−イル基、4−tert−ブチルキノリン−2−イル基が好ましく、合成が容易である点で、2−キノリル基が更に好ましい。
【0040】
炭素数1から4のアルキル基で置換されていてもよいイソキノリル基としては、1−イソキノリル基、3−イソキノリル基、4−イソキノリル基、3−メチルイソキノリン−1−イル基、4−メチルイソキノリン−1−イル基、5−メチルイソキノリン−1−イル基、6−メチルイソキノリン−1−イル基、7−メチルイソキノリン−1−イル基、8−メチルイソキノリン−1−イル基、1,3−ジメチルイソキノリン−4−イル基、5,8−ジメチルイソキノリン−1−イル基、5,6,7,8−テトラメチルイソキノリン−1−イル基、1−メチルイソキノリン−3−イル基、4−メチルイソキノリン−3−イル基、5−メチルイソキノリン−3−イル基、6−メチルイソキノリン−3−イル基、7−メチルイソキノリン−3−イル基、8−メチルイソキノリン−3−イル基、5,8−ジメチルイソキノリン−3−イル基、5,6,7,8−テトラメチルイソキノリン−3−イル基、1−メチルイソキノリン−4−イル基、3−メチルイソキノリン−4−イル基、5−メチルイソキノリン−4−イル基、6−メチルイソキノリン−4−イル基、7−メチルイソキノリン−4−イル基、8−メチルイソキノリン−4−イル基、5,8−ジメチルイソキノリン−4−イル基、5,6,7,8−テトラメチルイソキノリン−4−イル基、3−tert−ブチルイソキノリン−1−イル基、4−tert−ブチルイソキノリン−1−イル基、6−tert−ブチルイソキノリン−1−イル基、7−tert−ブチルイソキノリン−1−イル基、1−tert−ブチルイソキノリン−3−イル基、4−tert−ブチルイソキノリン−3−イル基、6−tert−ブチルイソキノリン−3−イル基、7−tert−ブチルイソキノリン−3−イル基、1−tert−ブチルイソキノリン−4−イル基、3−tert−ブチルイソキノリン−4−イル基、6−tert−ブチルイソキノリン−4−イル基、7−tert−ブチルイソキノリン−4−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、1−イソキノリル基、3−イソキノリル基、4−イソキノリル基、1,3−ジメチルイソキノリン−4−イル基が好ましく、合成が容易である点で、1−イソキノリル基、4−イソキノリル基が更に好ましい。
【0041】
次に、本発明の製造方法について説明する。
【0042】
一般式(2)で示される化合物の好ましい例としては、次の(I)〜(XXXIII)の基本骨格を例示できるが、本発明はこれらに限定されるものではない。
【0043】
【化9】

【0044】
【化10】

【0045】
【化11】

【0046】
【化12】

Mで表されるZnR4、MgR5としては、ZnCl、ZnBr、ZnI、MgCl、MgBr、MgI等が例示できる。反応収率がよい点でZnClが好ましく、テトラメチルエチレンジアミンが配位しているZnCl(TMEDA)がより好ましい。
【0047】
Mで表されるSn(R6)3としては、SnMe3、SnBu3等が例示できる。
【0048】
Mで表されるB(OR7)2としては、B(OH)2、B(OMe)2、B(O(iso−Pr))2、B(OBu)2等が例示できる。
【0049】
Mで表されるB(OR7)2において、2つのR7が酸素原子を介して結合するホウ素原子と一体となって環を形成した場合のB(OR7)2の例としては、次の(XXXIV)〜(XL)で示される基が例示でき、反応収率がよい点で(XXXV)で示される基が好ましい。
【0050】
【化13】

Y1としては、塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基が例示でき、反応収率及び選択性がよい点で臭素原子が好ましい。
【0051】
一般式(4)で示される化合物の好ましい例としては、次の(XLI)〜(LXXIII)の基本骨格を例示できるが、本発明はこれらに限定されるものではない。
【0052】
【化14】

【0053】
【化15】

【0054】
【化16】

【0055】
【化17】

Y2としては、塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基が例示でき、反応収率及び選択性がよい点で臭素原子が好ましい。
【0056】
本発明の1,3,5−トリアジン誘導体(1)は、次の反応式
【0057】
【化18】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。Xは炭素原子又は窒素原子を表す。Y1は塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。MはZnR4、MgR5、Sn(R6)3、B(OR7)2を表す。但し、R4及びR5は各々独立して塩素原子、臭素原子又はヨウ素原子を表し、R6は炭素数1〜4のアルキル基又はフェニル基を表し、R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R6及びR7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示す方法により製造することができる。
【0058】
「工程1」は、化合物(2)を塩基の存在下若しくは不存在下に、パラジウム触媒の存在下に化合物(3)と反応させて、本発明の1,3,5−トリアジン誘導体(1)を製造する方法であり、鈴木−宮浦反応、根岸反応、玉尾−熊田反応、スティレ反応等の一般的なカップリング反応の反応条件及び触媒を適用することにより、反応収率よく目的物を得ることができる。
【0059】
「工程1」で用いることのできるパラジウム触媒としては、塩化パラジウム、酢酸パラジウム、トリフルオロ酢酸パラジウム、硝酸パラジウム等の塩を例示することができる。さらに、π−アリルパラジウムクロリドダイマー、パラジウムアセチルアセトナト、トリス(ジベンジリデンアセトン)ジパラジウム、ジクロロビス(トリフェニルホスフィン)パラジウム、テトラキス(トリフェニルホスフィン)パラジウム及びジクロロ[1,1’−ビス(ジフェニルホスフィノ)フェロセン]パラジウム等の錯化合物を例示することができる。入手容易であり、反応収率がよい点で、塩化パラジウム、酢酸パラジウム、トリス(ジベンジリデンアセトン)ジパラジウム、ジクロロビス(トリフェニルホスフィン)パラジウム、テトラキス(トリフェニルホスフィン)パラジウムが好ましい。中でも、第三級ホスフィンを配位子として有するパラジウム錯体は反応収率がよい点でさらに好ましい。これらの第三級ホスフィンを配位子として有するパラジウム錯体は、パラジウム塩又は錯化合物に第三級ホスフィンを添加し、反応系中で調整することもできる。
【0060】
このような第三級ホスフィンとしては、トリフェニルホスフィン、トリメチルホスフィン、トリブチルホスフィン、トリ(tert−ブチル)ホスフィン、トリシクロヘキシルホスフィン、tert−ブチルジフェニルホスフィン、9,9−ジメチル−4,5−ビス(ジフェニルホスフィノ)キサンテン、2−(ジフェニルホスフィノ)−2’−(N,N−ジメチルアミノ)ビフェニル、2−(ジ−tert−ブチルホスフィノ)ビフェニル、2−(ジシクロヘキシルホスフィノ)ビフェニル、ビス(ジフェニルホスフィノ)メタン、1,2−ビス(ジフェニルホスフィノ)エタン、1,3−ビス(ジフェニルホスフィノ)プロパン、1,4−ビス(ジフェニルホスフィノ)ブタン、1,1’−ビス(ジフェニルホスフィノ)フェロセン、トリ(2−フリル)ホスフィン、トリ(o−トリル)ホスフィン、トリス(2,5−キシリル)ホスフィン、(±)−2,2’−ビス(ジフェニルホスフィノ)−1,1’−ビナフチル、2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニル等が例示できる。入手容易であり、反応収率がよい点で、トリフェニルホスフィン、トリ(tert−ブチル)ホスフィン、2−(ジ−tert−ブチルホスフィノ)ビフェニル、1,1’−ビス(ジフェニルホスフィノ)フェロセン、2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニルが好ましい。反応に用いるパラジウム触媒と化合物(3)とのモル比は、1:200〜1:2が好ましく、反応収率がよい点で1:100〜1:10がさらに好ましい。また、「工程1」で用いる第三級ホスフィンとパラジウム塩又は錯化合物とのモル比は、1:10〜10:1が好ましく、反応収率がよい点で1:2〜5:1がさらに好ましい。
【0061】
「工程1」で用いることのできる塩基としては、水酸化ナトリウム、水酸化カリウム、炭酸ナトリウム、炭酸カリウム、炭酸リチウム、炭酸セシウム、リン酸カリウム、リン酸ナトリウム、フッ化ナトリウム、フッ化カリウム、フッ化セシウム等を例示することができ、反応収率がよい点で炭酸セシウムが好ましい。塩基と化合物(2)とのモル比は、1:2〜10:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0062】
「工程1」で用いる化合物(2)と化合物(3)とのモル比は、1:1〜5:1が好ましく、反応収率がよい点で2:1〜3:1がさらに好ましい。
【0063】
「工程1」の反応は溶媒中で実施することができる。「工程1」で用いることのできる溶媒として、水、ジメチルスルホキシド、ジメチルホルムアミド、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフランを用いることが好ましい。
【0064】
「工程1」の反応は、0℃〜150℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で50℃〜120℃の範囲で行うことがさらに好ましい。
【0065】
化合物(1)は、「工程1」の終了後に通常の処理を行うことで得ることができる。必要に応じて、再結晶、カラムクロマトグラフィー又は昇華等で精製してもよい。
【0066】
次に、本発明の1,3,5−トリアジン誘導体(1)を製造する「工程1」の原料である化合物(2)は、例えば、次の反応式
【0067】
【化19】

(式中、Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。Xは炭素原子又は窒素原子を表す。Y3は塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。Lは脱離基を表す。MはZnR4、MgR5、Sn(R6)3、B(OR7)2を表す。但し、R4及びR5は各々独立して塩素原子、臭素原子又はヨウ素原子を表し、R6は炭素数1〜4のアルキル基又はフェニル基を表し、R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R6及びR7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示した方法により製造することができる。
【0068】
「工程2」は、一般式(4a)で示される化合物をリチウム試薬と反応させ、一般式(4b)で示されるリチウム化合物を得る工程である。「工程2」で得られた化合物(4b)は、反応後単離してもよいが、単離せずに「工程3」に供してもよい。
【0069】
Y3は塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基等を例示することができるが、反応収率がよい点で臭素原子が好ましい。
【0070】
「工程2」で用いられるリチウム試薬としては、反応収率がよい点でブチルリチウム、tert−ブチルリチウムが好ましい。リチウム試薬と化合物(4a)とのモル比は、1:1〜5:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0071】
「工程2」の反応は溶媒中で実施することができる。「工程2」で反応の際に用いることのできる溶媒として、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフランを用いることが好ましい。
【0072】
「工程2」の反応は、−150℃〜−20℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で−100℃〜−60℃の範囲がさらに好ましい。
【0073】
化合物(4a)は、例えば、J.Tsuji著、「Palladium Reagents and Catalysts,John Wiley & Sons,2004年に記載の汎用的な金属触媒を用いるカップリング反応により容易に得ることができる。
【0074】
「工程3」は、リチウム化合物(4b)と一般式(6)で示されるカップリング用試薬を反応させることにより、「工程1」で用いる一般式(2)で示される化合物を製造する工程である。「工程3」で得られた化合物(2)は、反応後単離してもよいが、単離せずに「工程1」に供してもよい。
【0075】
「工程3」で用いられるカップリング用試薬(6)としては、ジクロロ(テトラメチルエチレンジアミン)亜鉛(II)、塩化亜鉛、臭化亜鉛、ヨウ化亜鉛、塩化トリメチルスズ、塩化トリブチルスズ、ホウ酸トリメチル、ホウ酸トリイソプロピル、(2,3−ジメチルブタン−2,3−ジオキシ)メトキシボラン、(2,3−ジメチルブタン−2,3−ジオキシ)イソプロポキシボラン、1,3−プロパンジオキシボラン等が例示できる。取り扱いが容易である点でジクロロ(テトラメチルエチレンジアミン)亜鉛(II)、ホウ酸トリメチル、ホウ酸トリイソプロピル、(2,3−ジメチルブタン−2,3−ジオキシ)イソプロポキシボランが好ましく、反応収率がよい点でジクロロ(テトラメチルエチレンジアミン)亜鉛(II)がさらに好ましい。Lで表される好適な脱離基としては、Cl、Br、I、MeO、iso−PrOを例示することができる。カップリング用試薬(6)と化合物(4b)とのモル比は、1:1〜10:1が好ましく、反応収率がよい点で1.5:1〜3:1がさらに好ましい。
【0076】
「工程3」の反応は、−150℃〜50℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で−100℃〜30℃の範囲で行うことがさらに好ましい。
【0077】
「工程4」は、化合物(4a)を塩基及びパラジウム触媒の存在下に、一般式(7)で示されるボラン化合物、又は一般式(8)で示されるジボロン化合物と反応させることにより、「工程1」で用いる化合物(2a)を製造する工程であり、例えば、The Journal of Organic Chemistry,60巻,7508−7510,1995年、又はThe Journal of Organic Chemistry,65巻,164−168,2000年に開示されている反応条件及び触媒を適用することにより、反応収率よく目的物を得ることができる。パラジウム触媒と化合物(4a)とのモル比は、1:200〜1:2が好ましく、反応収率がよい点で1:50〜1:10がさらに好ましい。得られた化合物(2a)は、反応後単離してもよいが、単離せずに「工程1」に供してもよい。
【0078】
「工程4」で用いることのできるパラジウム触媒としては、「工程1」で例示したパラジウム触媒を挙げることができるが、入手容易であり、反応収率がよい点で、塩化パラジウム、酢酸パラジウム、トリス(ジベンジリデンアセトン)ジパラジウム、ジクロロビス(トリフェニルホスフィン)パラジウム、テトラキス(トリフェニルホスフィン)パラジウム、ジクロロ[1,1’−ビス(ジフェニルホスフィノ)フェロセン]パラジウムが好ましく、中でも、第三級ホスフィンを配位子として有するパラジウム錯体が反応収率がよい点で好ましい。また、これらのパラジウム錯体は、パラジウム塩又は錯化合物に第三級ホスフィンを添加し、反応系中で調整することもできる。このような第三級ホスフィンとしては、「工程1」で例示した第三級ホスフィンを挙げることができるが、入手容易であり、反応収率がよい点で、トリフェニルホスフィン、1,1’−ビス(ジフェニルホスフィノ)フェロセンが好ましい。第三級ホスフィンとパラジウム塩又は錯化合物とのモル比は、1:10〜10:1が好ましく、反応収率がよい点で1:2〜5:1がさらに好ましい。
【0079】
「工程4」で用いることのできる塩基としては、「工程1」で例示した塩基を挙げることができるが、反応収率がよい点で炭酸カリウム及び炭酸セシウムが特に好ましい。塩基と化合物(4a)とのモル比は、1:2〜10:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0080】
「工程4」で用いるボラン化合物(7)又はジボロン化合物(8)と化合物(4a)とのモル比は、1:1〜5:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0081】
「工程4」で用いることのできる溶媒として、ジメチルスルホキシド、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフラン又はジメチルスルホキシドを用いることが好ましい。
【0082】
「工程4」の反応は、0℃〜150℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で50℃〜120℃の範囲で行うことがさらに好ましい。
【0083】
化合物(2a)は、「工程4」の終了後に通常の処理をすることで得られる。必要に応じて、再結晶、カラムクロマトグラフィー又は昇華等で精製してもよい。
【0084】
一般式(3)で示される化合物は、例えば、特開2006−62962公報に開示されている方法に従って製造することができる。
【0085】
さらに、本発明の1,3,5−トリアジン誘導体(1)は、次の反応式
【0086】
【化20】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。Xは炭素原子又は窒素原子を表す。Y2は塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示した方法によっても製造することができる。
【0087】
「工程5」は、化合物(5)を塩基及びパラジウム触媒の存在下に、化合物(4)と反応させて本発明の1,3,5−トリアジン誘導体(1)を製造する工程であり、一般的な鈴木−宮浦反応の反応条件及び触媒を適用することにより、反応収率よく目的物を得ることができる。パラジウム触媒と化合物(5)とのモル比は、1:200〜1:2が好ましく、反応収率がよい点で1:100〜1:10がさらに好ましい。
【0088】
「工程5」で用いることのできるパラジウム触媒としては、「工程1」で例示したパラジウム触媒を挙げることができるが、入手容易であり、反応収率がよい点で、塩化パラジウム、酢酸パラジウム、トリス(ジベンジリデンアセトン)ジパラジウム、ジクロロビス(トリフェニルホスフィン)パラジウム、テトラキス(トリフェニルホスフィン)パラジウム好ましく、中でも、第三級ホスフィンを配位子として有するパラジウム錯体が反応収率がよい点で好ましい。また、これらのパラジウム錯体は、パラジウム塩又は錯化合物に第三級ホスフィンを添加し、反応系中で調製することもできる。このような第三級ホスフィンとしては、「工程1」で例示した第三級ホスフィンを挙げることができるが、入手容易であり、反応収率がよい点で、トリフェニルホスフィン、トリ(tert−ブチル)ホスフィン、2−(ジ−tert−ブチルホスフィノ)ビフェニル、2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニルが好ましい。第三級ホスフィンとパラジウム塩又は錯化合物とのモル比は、1:10〜10:1が好ましく、反応収率がよい点で1:2〜5:1がさらに好ましい。
【0089】
「工程5」で用いることのできる塩基としては、「工程1」で例示した塩基を挙げることができるが、反応収率がよい点で炭酸セシウムが特に好ましい。塩基と化合物(4)とのモル比は、1:2〜10:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0090】
「工程5」で用いる化合物(4)と化合物(5)とのモル比は、2:1〜5:1が好ましく、反応収率がよい点で2:1〜3:1がさらに好ましい。
【0091】
「工程5」の反応は溶媒中で実施することができる。「工程5」で用いることのできる溶媒として、水、ジメチルスルホキシド、ジメチルホルムアミド、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフランを用いることが好ましい。
【0092】
「工程5」の反応は、0℃〜150℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で50℃〜120℃の範囲で行うことが好ましい。
【0093】
化合物(1)は、「工程5」の終了後に通常の処理を行うことで得られる。必要に応じて、再結晶、カラムクロマトグラフィー又は昇華等で精製してもよい。
【0094】
次に、本発明の1,3,5−トリアジン誘導体(1)を製造する「工程5」の原料である化合物(5)は、例えば、次の反応式
【0095】
【化21】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Y1は塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示した方法により製造することができる。
【0096】
「工程6」は、化合物(3)を塩基及びパラジウム触媒の存在下に、ボラン化合物(7)又はジボロン化合物(8)と反応させることにより、「工程5」で用いる化合物(5)を製造する工程であり、例えば、The Journal of Organic Chemistry,60巻,7508−7510,1995年、又はThe Journal of Organic Chemistry,65巻,164−168,2000年に開示されている反応条件及び触媒を適用することにより、反応収率よく目的物を得ることができる。パラジウム触媒と化合物(3)とのモル比は、1:200〜1:2が好ましく、反応収率がよい点で1:100〜1:10がさらに好ましい。得られた化合物(5)は、反応後単離してもよいが、単離せずに「工程5」に供してもよい。
【0097】
「工程6」で用いることのできるパラジウム触媒としては、「工程1」で例示したパラジウム触媒を挙げることができるが、入手容易であり、反応収率がよい点で、塩化パラジウム、酢酸パラジウム、トリス(ジベンジリデンアセトン)ジパラジウム、ジクロロビス(トリフェニルホスフィン)パラジウム、テトラキス(トリフェニルホスフィン)パラジウム、ジクロロ[1,1’−ビス(ジフェニルホスフィノ)フェロセン]パラジウムが好ましく、中でも、第三級ホスフィンを配位子として有するパラジウム錯体が反応収率がよい点で好ましい。また、これらのパラジウム錯体は、パラジウム塩又は錯化合物に第三級ホスフィンを添加し、反応系中で調製することもできる。このような第三級ホスフィンとしては、「工程1」で例示した第三級ホスフィンを挙げることができるが、入手容易であり、反応収率がよい点で、トリフェニルホスフィン、1,1’−ビス(ジフェニルホスフィノ)フェロセンが好ましい。第三級ホスフィンとパラジウム塩又は錯化合物とのモル比は、1:10〜10:1が好ましく、反応収率がよい点で1:2〜5:1がさらに好ましい。
【0098】
「工程6」で用いることのできる塩基としては、「工程1」で例示した塩基を挙げることができるが、反応収率がよい点で酢酸カリウムが特に好ましい。塩基と化合物(3)とのモル比は、1:2〜10:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0099】
「工程6」で用いるボラン化合物(7)又はジボロン化合物(8)と化合物(3)とのモル比は、1:1〜5:1が好ましく、反応収率がよい点で2:1〜4:1がさらに好ましい。
【0100】
「工程6」の反応は溶媒中で実施することができる。「工程6」で用いることのできる溶媒として、ジメチルスルホキシド、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフランを用いることが好ましい。
【0101】
「工程6」の反応は、0℃〜150℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で50℃〜120℃の範囲で行うことが好ましい。
【0102】
化合物(5)は、「工程6」の終了後に通常の処理を行うことで得られる。必要に応じて、再結晶、カラムクロマトグラフィー又は昇華等で精製してもよい。
【0103】
本発明の1,3,5−トリアジン誘導体(1)から成る有機電界発光素子用薄膜の製造方法は特に限定されないが、真空蒸着法による成膜が可能である。真空蒸着法による成膜は、汎用の真空蒸着装置を用いることにより行うことができる。真空蒸着法で膜を形成する際の真空槽の真空度は、有機電界発光素子作製の製造タクトタイムや製造コストを考慮すると、一般的に用いられる拡散ポンプ、ターボ分子ポンプ、クライオポンプ等により到達し得る1×10−2Pa〜1×10−5Pa程度が好ましい。蒸着速度は、形成する膜の厚さによるが0.005nm/秒〜1.0nm/秒が好ましい。また、1,3,5−トリアジン誘導体(1)は、クロロホルム、ジクロロメタン、1,2−ジクロロエタン、クロロベンゼン、トルエン、酢酸エチル又はテトラヒドロフラン等に対する溶解度が高いため、汎用の装置を用いたスピンコ−ト法、インクジェット法、キャスト法又はディップ法等による成膜も可能である。
【発明の効果】
【0104】
本発明の1,3,5−トリアジン誘導体(1)から成る薄膜は、高い表面平滑性、アモルファス性、耐熱性、電子輸送能、正孔ブロック能、酸化還元耐性、耐水性、耐酸素性、電子注入特性等をもつため、有機電界発光素子の材料として有用であり、とりわけ電子輸送材、正孔ブロック材、発光ホスト材等として用いることができる。従って、本発明の1,3,5−トリアジン誘導体(1)から成る薄膜は、有機電界発光素子の構成成分としての利用が期待される。
【図面の簡単な説明】
【0105】
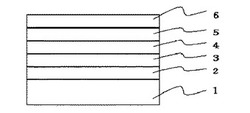
【図1】実施の形態(素子評価)で作製する有機電界発光素子の断面図である。
【符号の説明】
【0106】
1.ITO透明電極付きガラス基板
2.正孔注入層
3.正孔輸送層
4.発光層
5.電子輸送層
6.陰極層
【実施例】
【0107】
実施例−1
【0108】
【化22】

アルゴン気流下、2−(4−ブロモフェニル)キノリン 2.58g(9.09mmol)を20mLのテトラヒドロフランに溶解し、ブチルリチウムを9.70mmol含むヘキサン溶液6.01mLを−78℃で滴下した。混合物を−78℃で15分間攪拌後、ジクロロ(テトラメチルエチレンジアミン)亜鉛(II) 2.45g(9.70mmol)を加え、室温まで昇温した後1.5時間攪拌した。この混合物に2−(3,5−ジブロモフェニル)−4,6−ジ−p−トリル−1,3,5−トリアジン 1.50g(3.03mmol)、テトラキス(トリフェニルホスフィン)パラジウム420mg(0.364mmol)をテトラヒドロフラン30mLに懸濁し、加熱還流下で15時間攪拌した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 メタノール:クロロホルム=1:100〜2:100)で精製し、目的の2−[4,4”−ジ(2−キノリル)−1,1’:3’,1”−テルフェニル−5−イル]−4,6−ジ−p−トリル−1,3,5−トリアジンの白色固体(収量2.03g、収率90%)を得た。
【0109】
1H−NMR(CDCl3):δ2.43(s,6H),7.33(d,J=8.0Hz,4H),7.49(t,J=7.1Hz,2H),7.67−7.72(m,2H),7.79(d,J=7.9Hz,2H),7.93(d,J=8.1Hz,6H),8.12(t,J=1.7Hz,1H),8.14(d,J=5.7Hz,2H),8.21(d,J=8.5Hz,2H),8.32(d,J=8.2Hz,4H),8.64(d,J=8.0Hz,4H),9.01(d,J=1.6Hz,2H).
実施例−2
【0110】
【化23】

アルゴン気流下、4−(5−ブロモピリジン−2−イル)イソキノリン 219mg(0.77mmol)、2−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−4,6−ビス(3−ビフェニリル)−1,3,5−トリアジン 271mg(0.38mmol)、炭酸セシウム251mg(0.77mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム5mg(0.008mmol)を20mLのテトラヒドロフランに懸濁し、65時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 メタノール:クロロホルム=0:100〜2:100)で精製し、目的の2,4−ビス(3−ビフェニリル)−6−{3,5−ビス[6−(4−イソキノリル)ピリジン−3−イル]フェニル}−1,3,5−トリアジンの白色固体(収量151mg、収率46%)を得た。
【0111】
1H−NMR(CDCl3):δ7.31−7.38(m,2H),7.42−7.49(m,4H),7.59−7.68(m,4H),7.67−7.76(m,6H),7.75−7.84(m,4H),8.04(d,J=8.1,2.5Hz,2H),8.17(brs,1H),8.27(dt,J=8.1,3.1Hz,2H),8.32(dd,J=8.4,3.4Hz,2H),8.71(d,J=3.9Hz,2H),8.76(brd,J=7.5Hz,2H),9.00−8.98(m,2H),9.11−9.14(m,2H),9.25(brs,2H),9.29(d,J=3.4Hz,2H).
実施例−3
【0112】
【化24】

アルゴン気流下、2−(3,5−ジブロモフェニル)−4,6−ジ(2−ナフチル)−1,3,5−トリアジン 1.00g(1.76mmol)、1−(4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル)イソキノリン 1.48g(3.88mmol)、炭酸セシウム1.26g(3.87mmol)、酢酸パラジウム17mg(0.078mmol)、2−ジシクロへキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニル 74mg(0.16mmol)をテトラヒドロフラン15mLに懸濁し、12時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルクロマトグラフィー(展開溶媒 クロロホルム)で精製し、2−[4,4”−ジ(1−イソキノリル)−1,1’:3’,1”−テルフェニル−5’−イル]−4,6−ジ(2−ナフチル)−1,3,5−トリアジンの黄色固体(収量501mg、収率35%)を得た。
【0113】
1H−NMR(CDCl3):δ.7.38−7.51(m,4H),7.46−7.63(m,4H),7.64−7.89(m,12H),7.89(d,J=7.8Hz,4H),7.99(s,1H),8.13(d,J=8.3Hz,2H),8.52(d,J=5.8Hz,2H),8.63(d,J=8.3Hz,2H),8.91(brs,2H),9.10(brs,2H).
13C−NMR(CDCl3):δ120.1(CH×2),125.3(CH×2),126.5(CH×2),126.8(quart.×2),127.0(CH×2),127.1(CH×2),127.2(CH×2),127.4(CH×2),127.5(CH×4),127.6(CH×2),127.9(CH×2),128.4(CH×2),129.8(CH×2) ,130.1(CH×2),130.2(CH×2),130.6(CH),130.7(CH×4),133.2(quart.×2),133.6(quart.×2),135.8(quart.×2),137.0(quart.×2),137.7(quart.),139.1(quart.×2),141.1(quart.×2),141.9(quart.×2),142.4(CH×2),160.4(quart.×2),171.4(quart.),171.8(quart.×2).
実施例−4
【0114】
【化25】

アルゴン気流下、1−(4−ブロモフェニル)イソキノリン 1.13g(3.56mmol)、2−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−4,6−ジ−p−トリル−1,3,5−トリアジン 1.00g(1.70mmol)、炭酸セシウム1.11g(3.40mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム100mg(0.14mmol)を40mLのテトラヒドロフランに懸濁し、15時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 クロロホルム)で精製し、目的の2−[4,4”−ジ(1−イソキノリル)−1,1’:3’,1”−テルフェニル−5’−イル]−4,6−ジ−p−トリル−1,3,5−トリアジンの白色固体(収量263mg、収率35%)を得た。
【0115】
1H−NMR(CDCl3):δ2.43(s,6H),7.34(d,J=8.0Hz,4H),7.55(ddd,J=8.4,3.5,1.4Hz,2H),7.61−7.71(m,2),7.63(d,J=5.8Hz,2H),7.81−7.90(m,2H),7.85(d,J=8.3Hz,4H),7.95(d,J=8.3Hz,4H),8.15(t,J=1.8Hz,1H),8.21(d,J=7.8Hz,2H),8.61(d,J=5.8Hz,2H),8.65(d,J=8.3Hz,4H),9.03(d,J=1.8Hz,2H).
実施例−5
【0116】
【化26】

アルゴン気流下、2−[4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]ピリミジン 0.98g(3.48mmol)、2−(3,5−ジブロモフェニル)−4,6−ビス(3−ビフェニリル)−1,3,5−トリアジン 0.98g(1.58mmol)、炭酸セシウム1.13g(3.48mmol)、酢酸パラジウム7.2mg(0.032mmol)、2−ジシクロへキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニル 30.5g(0.031mmol)を95mLのテトラヒドロフランに懸濁し、17時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=1:6)で精製し、目的の2−[4,4”−ジ(2−ピリミジル)−1,1’:3’,1”−テルフェニル−5−イル]−4,6‐ビス(3−ビフェニリル)−1,3,5−トリアジンの白色固体(収量0.85g、収率67%)を得た。
【0117】
1H−NMR(CDCl3):δ7.13(t,J=4.9Hz,2H),7.36(t,J=7.3Hz,2H),7.46(t,J=7.1Hz,4H),7.61(J=7.6Hz,2H),7.65−7.75(m,6H),7.79(d,J=6.3Hz,2H),8.21(bs,1H),8.37(d,J=8.3Hz,4H),8.68−8.83(m,8H),8.94(bs,2H),9.02(bs,2H).
実施例−6
【0118】
【化27】

アルゴン気流下、2−[4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]ピリミジン 1.95g(5.54mmol)、2−(3,5−ジブロモフェニル)−4,6−ジ(p−トリル)−1,3,5−トリアジン 1.34g(2.70mmol)、炭酸セシウム1.81g(5.54mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム(II)38mg(0.054mmol)を100mLのテトラヒドロフランに懸濁し、23時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 メタノール:クロロホルム=1:100)で精製し、目的の2−[4,4”−ジ(2−ピリミジル)−1,1’:3’,1”−テルフェニル−5’−イル]−4,6‐ジ−p−トリル−1,3,5−トリアジンの白色固体(収量1.59g、収率91%)を得た。
【0119】
1H−NMR(CDCl3):δ2.53(s,6H),7.25(t,J=4.9Hz,4H),7.43(d,J=8.0Hz,4H),8.00(d,J=8.3Hz,4H),8.21(bs,1H),8.68(d,J=7.8Hz,4H),8.73(d,J=8.0Hz,4H),8.90(d,J=5.3Hz,4H),9.10(bs,2H).
実施例−7
【0120】
【化28】

アルゴン気流下、2−[4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]ピリミジン 659mg(2.16mmol)、2−(3,5−ジブロモフェニル)−4,6−ジ(2−ナフチル)−1,3,5−トリアジン 596mg(1.05mmol)、炭酸セシウム704mg(2.16mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム(II)15mg(0.021mmol)をテトラヒドロフラン60mLに懸濁し、15時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルクロマトグラフィー(展開溶媒 クロロホルム)で精製し、2−[4,4”−ジ(2−ピリミジル)−1,1’:3’,1”−テルフェニル−5’−イル]−4,6‐ジ(2−ナフチル)−1,3,5−トリアジンの黄色固体(収量539mg、収率72%)を得た。
【0121】
1H−NMR(CDCl3):δ7.17(t,J=4.8Hz,2H),7.50−7.57(m,4H),7.89(d,J=7.5Hz,2H),7.93(d,J=8.3Hz,4H),7.99(d,J=8.6Hz,2H),8.08(d,J=7.4Hz,2H),8.14(t,J=1.7Hz,1H),8.59(d,J=8.3Hz,4H),8.81(d,J=4.8Hz,2H),8.83(dd,J=8.5,1.5Hz,2H),9.09(d,J=1.7Hz,2H),9.34(s,2H).
実施例−8
【0122】
【化29】

アルゴン気流下、2−[4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]ピラジン 289mg(1.03mmol)、2−(3,5−ジブロモフェニル)−4,6−ジ−p−トリル−1,3,5−トリアジン 248mg(0.50mmol)、炭酸セシウム334mg(1.03mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム(II)7mg(0.010mmol)を30mLのテトラヒドロフランに懸濁し、17時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=10:80)で精製し、目的の2−[4,4”−ジ(2−ピラジル)−1,1’:3’,1”−テルフェニル−5’−イル]−4,6‐ジ−p−トリル−1,3,5−トリアジンの白色固体(収量250mg、収率77%)を得た。
【0123】
1H−NMR(CDCl3):δ2.43(s,6H),7.33(d,J=8.0Hz,4H),7.91(d,J=8.3Hz,4H),8.08(t,J=1.8Hz,1H),8.17(d,J=8.3Hz,4H),8.49(d,J=2.5Hz,2H),8.58−8.67(m,6H),8.99(d,J=1.8Hz,2H),9.08(d,J=1.5Hz,2H).
実施例―9
【0124】
【化30】

アルゴン気流下、2−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−4,6−ジフェニル−1,3,5−トリアジン 1.00g(1.78mmol)、2−(4−ブロモフェニル)ピリミジン 0.88g(3.74mmol)、炭酸セシウム 1.16g(3.56mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム105mg(0.150mmol)を35mLのテトラヒドロフランに懸濁し、17時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=50:50)で精製し、目的の2,4−ジフェニル−6−[4,4”−ジ(2−ピリミジル)−1,1’:3’,1”−テルフェニル−5’−イル]−1,3,5−トリアジンの白色固体(収量0.38g、収率29%)を得た。
【0125】
1H−NMR(CDCl3):δ7.16(t,J=4.8Hz,2H),7.50−7.60(m,6H),7.89(d,J=8.3Hz,4H),8.12(t,J=1.6Hz,1H),8.57(d,J=8.3Hz,4H),8.75(dd,J=8.2,1.6Hz,4H),8.79(d,J=4.8Hz,4H),9.01(d,J=1.7Hz,2H).
13C−NMR(CDCl3):δ119.2(CH×2),127.1(CH×2),127.8(CH×4),128.8(CH×4),128.9(CH×4),129.1(CH×4),130.1(CH),132.7(CH×2),136.2(quart.×2),137.2(quart.×2),137.6(quart.),141.8(quart.×2),143.0(quart.×2),157.4(CH×4),164.6(quart.×2),171.5(quart.),171.8(quart.×2).
実施例―10
【0126】
【化31】

アルゴン気流下、2−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−4,6−ジフェニル−1,3,5−トリアジン 1.00g(1.78mmol)、2−(4−ブロモフェニル)キナゾリン 1.27g(4.45mmol)、炭酸セシウム 1.16g(3.56mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム250mg(0.356mmol)を30mLのテトラヒドロフランに懸濁し、65時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=1:4)で精製し、目的の2,4−ジフェニル−6−[4,4”−ジ(2−キナゾリル)−1,1’:3’,1”−テルフェニル−5’−イル]−1,3,5−トリアジンの白色固体(収量0.78g、収率63%)を得た。
【0127】
1H−NMR(CDCl3):δ7.50−7.59(m,6H),7.63−7.78(m,4H),7.99(d,J=7.7Hz,4H),8.10(d,J=8.2Hz,2H),8.15−8.16(m,3H),8.37(d,J=7.8Hz,4H),8.77(d,J=7.4Hz,4H),9.06(s,2H),9.39(s,2H).
実施例―11
【0128】
【化32】

アルゴン気流下、2−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−4,6−ジフェニル−1,3,5−トリアジン 1.00g(1.78mmol)、2−(4−ブロモフェニル)キノキサリン 1.27g(4.45mmol)、炭酸セシウム 1.16g(3.56mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム250mg(0.356mmol)を30mLのテトラヒドロフランに懸濁し、64時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=1:4)で精製し、目的の2,4−ジフェニル−6−[4,4”−ジ(2−キノキサリル)−1,1’:3’,1”−テルフェニル−5’−イル]−1,3,5−トリアジンの白色固体(収量0.70g、収率55%)を得た。
【0129】
1H−NMR(CDCl3):δ7.50−7.59(m,6H),7.63−7.78(m,6H),7.99(d,J=7.7Hz,4H),8.10(d,J=8.2Hz,2H),8.15(t,J=1.8Hz,1H),8.46(d,J=7.7Hz,4H),8.77(d,J=7.6Hz,4H),9.04(s,2H),9.38(s,2H).
参考例−1
【0130】
【化33】

アルゴン気流下、2,4−ビス(3−ビフェニリル)−6−(3,5−ジブロモフェニル)−1,3,5−トリアジン 310mg(0.50mmol)、ビスピナコラートジボロン305mg(1.20mmol)、酢酸カリウム236mg(2.40mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム18mg(0.025mmol)をテトラヒドロフラン20mLに懸濁し、18時間還流した。室温まで冷却後、減圧下で低沸点成分を除去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルクロマトグラフィー(展開溶媒 クロロホルム)で精製し、2,4−ビス(3−ビフェニリル)−6−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−1,3,5−トリアジンの白色固体(収量305mg、収率85%)を得た。
【0131】
1H−NMR(CDCl3):δ1.34(s,24H),7.35(brt,J=7.3Hz,2H),7.45(brt,J=7.3Hz,4H),7.61(t,J=7.7Hz,2H),7.73(brd,J=7.3Hz,4H),7.80(brddd,J=7.7,1.6,1.6Hz,2H),8.45(brs,1H),8.73(brddd,J=7.7,1.6,1.6Hz,2H),9.02(brt,J=1.6Hz,2H),9.22(d,J=1.2Hz,2H).
参考例−2
【0132】
【化34】

アルゴン気流下、2,4−ジ−p−トリル−6−(3,5−ジブロモフェニル)−1,3,5−トリアジン 1.43g(2.88mmol)、ビスピナコラートジボロン3.00g(11.8mmol)、酢酸カリウム1.70g(17.3mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム81mg(0.12mmol)をテトラヒドロフラン30mLに懸濁し、15時間還流した。室温まで冷却後、減圧下で低沸点成分を除去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=1:1)で精製し、2,4−ジ−p−トリル−6−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−1,3,5−トリアジンの白色固体(収量1.68g、収率99%)を得た。
【0133】
1H−NMR(CDCl3):δ1.34(s,24H),2.41(s,6H),7.32(d,J=8.0Hz,4H),8.43(t,J=1.3Hz,1H),8.63(d,J=8.3Hz,4H),9.13(d,J=1.3Hz,2H).
参考例−3
【0134】
【化35】

アルゴン気流下、2−(3,5−ジブロモフェニル)−4,6−ジフェニル−1,3,5−トリアジン 5.00g(10.7mmol)、ビスピナコラートジボロン 5.98g(23.5mmol)、酢酸カリウム 4.62g(47.1mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム300mg(0.428mmol)を30mLのテトラヒドロフランに懸濁し、22時間還流した。室温まで冷却後、減圧下で低沸点成分を除去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=1:1)で精製し、目的の2−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−4,6−ジフェニル−1,3,5−トリアジンの白色固体(収量4.18g、収率70%)を得た。
【0135】
1H−NMR(CDCl3):δ1.34(s,24H),7.47−7.57(m,6H),8.45(t,J=1.3Hz,1H),8.70−8.78(m,4H),9.15(d,J=1.3Hz,2H).
素子実施例1
1,3,5−トリアジンを構成成分とする有機電界発光素子の作製と性能評価
基板には、2mm幅の酸化インジウム−スズ(ITO)膜がストライプ状にパターンされたITO透明電極付きガラス基板を用いた。この基板をイソプロピルアルコールで洗浄した後、オゾン紫外線洗浄にて表面処理を行った。洗浄後の基板に、真空蒸着法で各層の真空蒸着を行い、断面図を図1に示すような発光面積が4mm2の有機電界発光素子を作製した。まず、真空蒸着槽内に前記ガラス基板を導入し、1.0×10−4Paまで減圧した。その後、図1の1で示す前記ガラス基板上に有機化合物層として、正孔注入層2、正孔輸送層3、発光層4及び電子輸送層5を順次成膜し、その後陰極層6を成膜した。正孔注入層2としては、昇華精製したフタロシアニン銅(II)を25nmの膜厚で真空蒸着した。正孔輸送層3としては、N,N’−ジ(ナフチレン−1−イル)−N,N’−ジフェニルベンジジン(NPD)を45nmの膜厚で真空蒸着した。発光層4としては、4,4’−ビス(2,2−ジフェニルエテン−1−イル)ジフェニル(DPVBi)と4,4’−ビス[4−(ジ−p−トリルアミノ)フェニルエテン−1−イル]ビフェニル(DPAVBi)を99:1質量%の割合で40nmの膜厚で真空蒸着した。電子輸送層5としては、本発明の2−[4,4”−ジ(2−キノリル)−1,1’:3’,1”−テルフェニル−5−イル]−4,6−ジ−p−トリル−1,3,5−トリアジンを20nmの膜厚で真空蒸着した。なお、各有機材料は抵抗加熱方式により成膜し、加熱した化合物を0.3nm/秒〜0.5nm/秒の成膜速度で真空蒸着した。最後に、ITOストライプと直行するようにメタルマスクを配し、陰極層6を成膜した。陰極層6は、フッ化リチウムとアルミニウムをそれぞれ0.5nmと100nmの膜厚で真空蒸着し、2層構造とした。それぞれの膜厚は、触針式膜厚測定計(DEKTAK)で測定した。さらに、この素子を酸素及び水分濃度1ppm以下の窒素雰囲気グローブボックス内で封止した。封止は、ガラス製の封止キャップと前記成膜基板エポキシ型紫外線硬化樹脂(ナガセケムテックス社製)を用いた。
【0136】
作製した有機電界発光素子に直流電流を印加し、TOPCON社製のLUMINANCE METER(BM−9)の輝度計を用いて発光特性を評価した。発光特性として、電流密度20mA/cm2を流した時の電圧(V)、輝度(cd/m2)、電流効率(cd/A)、電力効率(lm/W)を測定し、連続点灯時の輝度半減時間を測定した。
【0137】
作製した青色蛍光素子の測定値は、5.8V、2480cd/m2、12.4cd/A、6.7lm/Wであった。またこの素子の輝度半減時間は、182時間であった。
素子実施例2
素子実施例1の発光層4を膜厚40nmのAlqにした以外は、素子実施例1と同様の方法で有機電界発光素子を作製した。
【0138】
作製した緑色蛍光素子の測定値は、5.6V、941cd/m2、4.7cd/A、2.6lm/Wであった。またこの素子の輝度半減時間は、1775時間であった。
素子実施例3
素子実施例1の電子輸送層5を膜厚20nmの2−[4,4”−ジ(2−ピリミジル)−1,1’:3’,1”−テルフェニル−5’−イル]−4,6‐ジ−p−トリル−1,3,5−トリアジンにした以外は、素子実施例1と同様の方法で有機電界発光素子を作製した。
【0139】
作製した青色蛍光素子の測定値は、5.2V、2350cd/m2、11.8cd/A、7.0lm/Wであった。またこの素子の輝度半減時間は、165時間であった。
素子実施例4
素子実施例3の発光層4を膜厚40nmのAlqにした以外は、素子実施例3と同様の方法で有機電界発光素子を作製した。
【0140】
作製した緑色蛍光素子の測定値は、5.0V、941cd/m2、4.7cd/A、2.9lm/Wであった。またこの素子の輝度半減時間は、2662時間であった。
素子比較例1
素子実施例1の電子輸送層5を膜厚20nmのAlqにした以外は、素子実施例1と同様の方法で有機電界発光素子を作製した。
【0141】
作製した青色蛍光素子の測定値は、7.1V、1883cd/m2、9.4cd/A、4.2lm/Wであった。またこの素子の輝度半減時間は、163時間であった。
素子比較例2
素子実施例2の電子輸送層5を膜厚20nmのAlqにした以外は、素子実施例2と同様の方法で有機電界発光素子を作製した。
【0142】
作製した緑色蛍光素子の測定値は、5.8V、882cd/m2、4.4cd/A、2.4lm/Wであった。またこの素子の輝度半減時間は、1462時間であった。
【0143】
以上、本発明の化合物を用いれば、既存材料に比較して、蛍光素子や燐光素子で幅広く、低消費電力化、長寿命化を達成できることを確認した。また本発明の化合物は、本実施例の発光層以外にも、他の蛍光発光材料や燐光材料を用いた有機電界発光素子への適用や塗布系素子への適用も可能である。さらにフラットパネルディスプレイ用途以外にも、低消費電力と長寿命の両立が求められる照明用途などにも効果ある。
【技術分野】
【0001】
本発明は、1,3,5−トリアジン誘導体とその製造方法、及びそれを含有する有機電界発光素子に関する。さらに詳しくは、有機電界発光素子の構成成分として有用なピラジル基、ピリミジル基、キノキサリル基、キナゾリル基、キノリル基又はイソキノリル基等を有する1,3,5−トリアジン誘導体とその製造方法に関し、本発明の1,3,5−トリアジン誘導体を有機電界発光素子の有機化合物層の少なくとも一層に用いることにより、有機電界発光素子の消費電力の低減、長寿命化を達成することができる。
【背景技術】
【0002】
有機電界発光素子は、発光する化合物を含有する発光層を正孔輸送層と電子輸送層で挟み、さらにその外側に陽極と陰極を取付け、発光層に正孔及び電子を注入して再結合するときに生成する励起子が失活する際の光の放出(蛍光又はりん光)を利用する素子である。近年、有機電界発光素子が、次世代フラットパネルディスプレイの本命と注目されている理由として、薄膜化・軽量化が可能であること、自発光素子であるため消費電力が低いこと、簡単な素子構造なため製造コストが低いこと等が挙げられる。また、その製造方法は、真空蒸着、スピンコート、インクジェット、オフセット印刷、熱転写等、様々な製造技術の応用が可能である。現在、携帯電話、携帯音楽機器、PDA(Personal Digital Assistant)等の携帯機器が実用化されているが、より大型化や高精細化が達成されれば、フラットパネルディスプレイのみならず、面発光光源としての照明、フレキシブル特性を利用したペーパーライクディスプレイ、ウエアラブルディスプレイ、透明性を利用したシースルーディスプレイ等への拡張も可能であり、市場の急速な拡大が期待される。
【0003】
しかし、技術的に超えなければならない課題はまだ多く、特に現状では、駆動電圧が高く効率が低いため、消費電力が高いことが問題である。また同時に、高い駆動電圧は素子の短寿命化を起こす原因にもなり得る。
【0004】
この問題点は、有機電界発光素子を構成する材料、特に電子輸送材料の特性が不十分であることに起因する。正孔輸送材料は、トリアリールアミン誘導体を中心に多種多様な材料が知られているが、電子輸送材料の報告例は少ない。既に実用化されている材料としてトリス(8−キノリノラト)アルミニウム(III)(Alq)があるが、正孔輸送材料、例えばN,N’−ビス(1−ナフチル)−N,N’−ジフェニル−4,4’−ビフェニル(NPD)に比べて性能が低いため、有機電界発光素子の特性を制限していた。
【0005】
他の電子輸送材料の報告例としては、オキサジアゾール誘導体(特許文献1)、キノキサリン誘導体(特許文献2)、トリアゾール誘導体(特許文献3)、シラシクロペンタジエン誘導体(特許文献4)、キノリン誘導体(特許文献5)、ベンゾイミダゾール誘導体(特許文献6)、ベンゾチアゾール誘導体(非特許文献1)等がある。しかしながら駆動電圧が高い、薄膜が結晶化しやすい、寿命が短い等、実用上問題点が多い。
【0006】
また最近、1,3,5−トリアジン誘導体を有機電界発光素子に用いる例が特許文献7及び8に開示されているが、これらのトリアジンはトリアジン環の2,4,6位にベンゾアゾール部位を有するため、本発明の1,3,5−トリアジン誘導体とは全く異なるものである。
【0007】
また、特許文献9〜12には、1,3,5−トリアジンを有機電界発光素子に用いる例が開示されているが、これらのトリアジンにおいて、トリアジン環の2,4,6位に置換するフェニル基が二置換となる場合の置換様式としては、o,p−及びm,p−二置換に限られており、本発明の3,5−二置換フェニル基を有することを特徴とする1,3,5−トリアジン誘導体に関する記述は一切ない。
【0008】
また、特許文献13には、1,3,5−トリアジンを有機電界発光素子に用いる例が開示されているが、これらはトリアジン環の2,4,6位の全てに芳香族複素環基が置換した芳香族炭化水素基を有するトリアジンであり、本発明の1,3,5−トリアジン誘導体とは全く異なるものである。
【0009】
また、特許文献14の27頁には、有機電界発光素子に用いる1,3,5−トリアジン(化合物番号C−8)の1例のみが例示されているが、これはトリアジン環の2,4,6位に同一の芳香族炭化水素基を有するトリアジンであり、本発明の1,3,5−トリアジン誘導体とは全く異なるものである。
【0010】
また、特許文献15の8頁には、有機電界発光素子に用いる1,3,5−トリアジン(化合物番号1)の1例のみが例示されているが、これはトリアジン環の2,4,6位に同一の4−一置換フェニル基を有するトリアジンであり、本発明の1,3,5−トリアジン誘導体とは全く異なるものである。
【0011】
また、特許文献16には、1,3,5−トリアジンを有機電界発光素子に用いる例が開示されているが、これらのトリアジン環の2,4,6位は一置換フェニル基で置換されており、3,5−二置換フェニル基を有することを特徴とする本発明の1,3,5−トリアジン誘導体とは異なるものである。
【0012】
また、特許文献17には、1,3,5−トリアジンを有機電界発光素子に用いる例が開示されているが、トリアジン環の2,4,6位のフェニル基上の置換基の位置は限定されておらず、3,5−二置換フェニル基を有することを特徴とする本発明の1,3,5−トリアジン誘導体は具体的に示されていない。また、本発明の1,3,5−トリアジン誘導体は、トリアジン環の2位に1つの3,5−二置換フェニル基を有することを特徴とすると共に、4,6位に2つの芳香族炭化水素基を有することを特徴とするが、当該特許文献にはこれに関する言及もなく、実施例も示されていない。さらに、当該特許文献の実施例に示された製造法を用いて、本発明の1,3,5−トリアジン誘導体を製造することはできない。
【0013】
【特許文献1】特開平6−136359号公報
【特許文献2】特開平6−207169号公報
【特許文献3】国際公開第95/25097号パンフレット
【特許文献4】特開2005−104986公報
【特許文献5】特開2006−199677公報
【特許文献6】国際公開第2004/080975号パンフレット
【特許文献7】特開平7−157473号公報
【特許文献8】特開2003−303689公報
【特許文献9】米国特許第6057048号明細書
【特許文献10】米国特許第6229012号明細書
【特許文献11】米国特許第6225467号明細書
【特許文献12】特開2004−63465公報
【特許文献13】特開2003−45662公報
【特許文献14】特開2001−143869公報
【特許文献15】特開2003−282270公報
【特許文献16】特許第4106974号明細書
【特許文献17】特開2007−137829公報
【非特許文献1】Applied Physics Letters、89巻、063504、2006年
【発明の開示】
【発明が解決しようとする課題】
【0014】
本発明は、有機電界発光素子の電子輸送層として、素子の低電圧駆動を可能にする新規構造を有する1,3,5−トリアジン誘導体を提供し、さらに当該化合物を用いた長寿命を備えた有機電界発光素子を提供するものである。
【課題を解決するための手段】
【0015】
本発明者らは、先の課題を解決すべく鋭意検討を重ねた結果、本発明の1,3,5−トリアジン誘導体(1)は、真空蒸着及びスピンコートのいずれの方法でも非晶質の薄膜形成が可能であり、またこれらを電子輸送層として用いた有機電界発光素子が、汎用の有機電界発光素子に比べて消費電力の低減、及び長寿命化が達成できることを見出し、本発明を完成するに至った。
【0016】
すなわち本発明は、一般式(1)
【0017】
【化1】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体に関するものである。
【0018】
また本発明は、一般式(2)
【0019】
【化2】

(式中、Xは炭素原子又は窒素原子を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。MはZnR4、MgR5、Sn(R6)3、B(OR7)2を表す。但し、R4及びR5は各々独立して塩素原子、臭素原子又はヨウ素原子を表し、R6は炭素数1〜4のアルキル基又はフェニル基を表し、R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R6及びR7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示される化合物と、一般式(3)
【0020】
【化3】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Y1は塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。)で示される化合物を塩基の存在下若しくは不存在下に、パラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【0021】
【化4】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体の製造方法に関するものである。
【0022】
また本発明は、一般式(4)
【0023】
【化5】

(式中、Xは炭素原子又は窒素原子を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。Y2は、塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。)で示される化合物と、一般式(5)
【0024】
【化6】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示される化合物を塩基及びパラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【0025】
【化7】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体の製造方法に関するものである。
【0026】
さらに本発明は、一般式(1)
【0027】
【化8】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体を構成成分とすることを特徴とする有機電界発光素子に関するものである。
【0028】
以下、本発明を詳細に説明する。
【0029】
R1、R2及びR3は、各々独立して水素原子又はメチル基を表し、有機電界発光素子用材料としての性能がよい点で、水素原子が好ましい。
【0030】
Xは、炭素原子又は窒素原子を表し、有機電界発光素子用材料としての性能がよい点で、炭素原子が好ましい。
【0031】
Ar1で表される置換されていてもよい芳香族炭化水素基としては、置換されていてもよいフェニル基又は置換されていてもよいナフチル基を挙げることができる。以下、さらに具体的な例を挙げるが、本発明はこれらに限定されるものではない。
【0032】
置換されていてもよいフェニル基としては、フェニル基、p−トリル基、m−トリル基、o−トリル基、4−トリフルオロメチルフェニル基、3−トリフルオロメチルフェニル基、2−トリフルオロメチルフェニル基、2,4−ジメチルフェニル基、3,5−ジメチルフェニル基、メシチル基、2−エチルフェニル基、3−エチルフェニル基、4−エチルフェニル基、2,4−ジエチルフェニル基、3,5−ジエチルフェニル基、2−プロピルフェニル基、3−プロピルフェニル基、4−プロピルフェニル基、2,4−ジプロピルフェニル基、3,5−ジプロピルフェニル基、2−イソプロピルフェニル基、3−イソプロピルフェニル基、4−イソプロピルフェニル基、2,4−ジイソプロピルフェニル基、3,5−ジイソプロピルフェニル基、2−ブチルフェニル基、3−ブチルフェニル基、4−ブチルフェニル基、2,4−ジブチルフェニル基、3,5−ジブチルフェニル基、2−tert−ブチルフェニル基、3−tert−ブチルフェニル基、4−tert−ブチルフェニル基、2,4−ジ−tert−ブチルフェニル基、3,5−ジ−tert−ブチルフェニル基、4−ビフェニリル基、3−ビフェニリル基、2−ビフェニリル基、2−メチルビフェニル−4−イル基、3−メチルビフェニル−4−イル基、2’−メチルビフェニル−4−イル基、4’−メチルビフェニル−4−イル基、2,2’−ジメチルビフェニル−4−イル基、2’,4’,6’−トリメチルビフェニル−4−イル基、6−メチルビフェニル−3−イル基、5−メチルビフェニル−3−イル基、2’−メチルビフェニル−3−イル基、4’−メチルビフェニル−3−イル基、6,2’−ジメチルビフェニル−3−イル基、2’,4’,6’−トリメチルビフェニル−3−イル基、5−メチルビフェニル−2−イル基、6−メチルビフェニル−2−イル基、2’−メチルビフェニル−2−イル基、4’−メチルビフェニル−2−イル基、6,2’−ジメチルビフェニル−2−イル基、2’,4’,6’−トリメチルビフェニル−2−イル基、2−トリフルオロメチルビフェニル−4−イル基、3−トリフルオロメチルビフェニル−4−イル基、2’−トリフルオロメチルビフェニル−4−イル基、4’−トリフルオロメチルビフェニル−4−イル基、6−トリフルオロメチルビフェニル−3−イル基、5−トリフルオロメチルビフェニル−3−イル基、2’−トリフルオロメチルビフェニル−3−イル基、4’−トリフルオロメチルビフェニル−3−イル基、5−トリフルオロメチルビフェニル−2−イル基、6−トリフルオロメチルビフェニル−2−イル基、2’−トリフルオロメチルビフェニル−2−イル基、4’−トリフルオロメチルビフェニル−2−イル基、3−エチルビフェニル−4−イル基、4’−エチルビフェニル−4−イル基、2’,4’,6’−トリエチルビフェニル−4−イル基、6−エチルビフェニル−3−イル基、4’−エチルビフェニル−3−イル基、5−エチルビフェニル−2−イル基、4’−エチルビフェニル−2−イル基、2’,4’,6’−トリエチルビフェニル−2−イル基、3−プロピルビフェニル−4−イル基、4’−プロピルビフェニル−4−イル基、2’,4’,6’−トリプロピルビフェニル−4−イル基、6−プロピルビフェニル−3−イル基、4’−プロピルビフェニル−3−イル基、5−プロピルビフェニル−2−イル基、4’−プロピルビフェニル−2−イル基、2’,4’,6’−トリプロピルビフェニル−2−イル基、3−イソプロピルビフェニル−4−イル基、4’−イソプロピルビフェニル−4−イル基、2’,4’,6’−トリイソプロピルビフェニル−4−イル基、6−イソプロピルビフェニル−3−イル基、4’−イソプロピルビフェニル−3−イル基、5−イソプロピルビフェニル−2−イル基、4’−イソプロピルビフェニル−2−イル基、2’,4’,6’−トリイソプロピルビフェニル−2−イル基、3−ブチルビフェニル−4−イル基、4’−ブチルビフェニル−4−イル基、2’,4’,6’−トリブチルビフェニル−4−イル基、6−ブチルビフェニル−3−イル基、4’−ブチルビフェニル−3−イル基、5−ブチルビフェニル−2−イル基、4’−ブチルビフェニル−2−イル基、2’,4’,6’−トリブチルビフェニル−2−イル基、3−tert−ブチルビフェニル−4−イル基、4’−tert−ブチルビフェニル−4−イル基、2’,4’,6’−トリ−tert−ブチルビフェニル−4−イル基、6−tert−ブチルビフェニル−3−イル基、4’−tert−ブチルビフェニル−3−イル基、5−tert−ブチルビフェニル−2−イル基、4’−tert−ブチルビフェニル−2−イル基、2’,4’,6’−トリ−tert−ブチルビフェニル−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、フェニル基、p−トリル基、m−トリル基、o−トリル基、4−ブチルフェニル基又は4−tert−ブチルフェニル基、4−ビフェニリル基、3−ビフェニリル基が好ましく、合成が容易である点でフェニル基、p−トリル基、3−ビフェニリル基が更に好ましい。
【0033】
置換されていてもよいナフチル基としては、1−ナフチル基、4−メチルナフタレン−1−イル基、4−トリフルオロメチルナフタレン−1−イル基、4−エチルナフタレン−1−イル基、4−プロピルナフタレン−1−イル基、4−ブチルナフタレン−1−イル基、4−tert−ブチルナフタレン−1−イル基、5−メチルナフタレン−1−イル基、5−トリフルオロメチルナフタレン−1−イル基、5−エチルナフタレン−1−イル基、5−プロピルナフタレン−1−イル基、5−ブチルナフタレン−1−イル基、5−tert−ブチルナフタレン−1−イル基、2−ナフチル基、6−メチルナフタレン−2−イル基、6−トリフルオロメチルナフタレン−2−イル基、6−エチルナフタレン−2−イル基、6−プロピルナフタレン−2−イル基、6−ブチルナフタレン−2−イル基、6−tert−ブチルナフタレン−2−イル基、7−メチルナフタレン−2−イル基、7−トリフルオロメチルナフタレン−2−イル基、7−エチルナフタレン−2−イル基、7−プロピルナフタレン−2−イル基、7−ブチルナフタレン−2−イル基、7−tert−ブチルナフタレン−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、1−ナフチル基、4−メチルナフタレン−1−イル基、4−tert−ブチルナフタレン−1−イル基、5−メチルナフタレン−1−イル基、5−tert−ブチルナフタレン−1−イル基、2−ナフチル基、6−メチルナフタレン−2−イル基、6−tert−ブチルナフタレン−2−イル基、7−メチルナフタレン−2−イル基又は7−tert−ブチルナフタレン−2−イル基が好ましく、合成が容易である点で2−ナフチル基が更に好ましい。
【0034】
Ar2で表される1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基としては、その置換基に特に制限はないが、炭素数1から4のアルキル基で置換されていてもよいピラジル基、炭素数1から4のアルキル基で置換されていてもよい2−ピリミジル基、炭素数1から4のアルキル基で置換されていてもよい2−キノキサリル基、炭素数1から4のアルキル基で置換されていてもよいキナゾリル基、炭素数1から4のアルキル基で置換されていてもよいキノリル基又は炭素数1から4のアルキル基で置換されていてもよいイソキノリル基等を挙げることができる。以下、さらに具体的な例を挙げるが、本発明はこれらに限定されるものではない。
【0035】
炭素数1から4のアルキル基で置換されていてもよいピラジル基としては、2−ピラジル基、3−メチルピラジン−2−イル基、5−メチルピラジン−2−イル基、6−メチルピラジン−2−イル基、3−tert−ブチルピラジン−2−イル基、5−tert−ブチルピラジン−2−イル基、6−tert−ブチルピラジン−2−イル基、5,6−ジメチルピラジン−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、2−ピラジル基、5,6−ジメチルピラジン−2−イル基が好ましく、合成が容易である点で、2−ピラジル基が更に好ましい。
【0036】
炭素数1から4のアルキル基で置換されていてもよい2−ピリミジル基としては、2−ピリミジル基、4,6−ジメチルピリミジン−2−イル基、4,6−ジ(tert−ブチル)ピリミジン−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、2−ピリミジル基、4,6−ジメチルピリミジン−2−イル基が好ましく、合成が容易である点で、2−ピリミジル基が更に好ましい。
【0037】
炭素数1から4のアルキル基で置換されていてもよい2−キノキサリル基としては、2−キノキサリル基、3−メチルキノキサリン−2−イル基、5−メチルキノキサリン−2−イル基、6−メチルキノキサリン−2−イル基、7−メチルキノキサリン−2−イル基、8−メチルキノキサリン−2−イル基、5,7−ジメチルキノキサリン−2−イル基、5,6,7,8−テトラメチルキノキサリン−2−イル基、3−tert−ブチルキノキサリン−2−イル基、6−tert−ブチルキノキサリン−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、2−キノキサリル基、3−メチルキノキサリン−2−イル基、3−tert−ブチルキノキサリン−2−イル基が好ましく、合成が容易である点で、2−キノキサリル基が更に好ましい。
【0038】
炭素数1から4のアルキル基で置換されていてもよいキナゾリル基としては、2−キナゾリル基、4−メチルキナゾリン−2−イル基、5−メチルキナゾリン−2−イル基、6−メチルキナゾリン−2−イル基、7−メチルキナゾリン−2−イル基、8−メチルキナゾリン−2−イル基、5,7−ジメチルキナゾリン−2−イル基、5,6,7,8−テトラメチルキナゾリン−2−イル基、4−tert−ブチルキナゾリン−2−イル基、6−tert−ブチルキナゾリン−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、2−キナゾリル基、4−メチルキナゾリン−2−イル基、4−tert−ブチルキナゾリン−2−イル基が好ましく、合成が容易である点で、2−キナゾリル基が更に好ましい。
【0039】
炭素数1から4のアルキル基で置換されていてもよいキノリル基としては、2−キノリル基、3−キノリル基、4−キノリル基、3−メチルキノリン−2−イル基、4−メチルキノリン−2−イル基、5−メチルキノリン−2−イル基、6−メチルキノリン−2−イル基、7−メチルキノリン−4−イル基、8−メチルキノリン−2−イル基、5,8−ジメチルキノリン−2−イル基、5,6,7,8−テトラメチルキノリン−2−イル基、4−tert−ブチルキノリン−2−イル基、6−tert−ブチルキノリン−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、2−キノリル基、3−メチルキノリン−2−イル基、4−tert−ブチルキノリン−2−イル基が好ましく、合成が容易である点で、2−キノリル基が更に好ましい。
【0040】
炭素数1から4のアルキル基で置換されていてもよいイソキノリル基としては、1−イソキノリル基、3−イソキノリル基、4−イソキノリル基、3−メチルイソキノリン−1−イル基、4−メチルイソキノリン−1−イル基、5−メチルイソキノリン−1−イル基、6−メチルイソキノリン−1−イル基、7−メチルイソキノリン−1−イル基、8−メチルイソキノリン−1−イル基、1,3−ジメチルイソキノリン−4−イル基、5,8−ジメチルイソキノリン−1−イル基、5,6,7,8−テトラメチルイソキノリン−1−イル基、1−メチルイソキノリン−3−イル基、4−メチルイソキノリン−3−イル基、5−メチルイソキノリン−3−イル基、6−メチルイソキノリン−3−イル基、7−メチルイソキノリン−3−イル基、8−メチルイソキノリン−3−イル基、5,8−ジメチルイソキノリン−3−イル基、5,6,7,8−テトラメチルイソキノリン−3−イル基、1−メチルイソキノリン−4−イル基、3−メチルイソキノリン−4−イル基、5−メチルイソキノリン−4−イル基、6−メチルイソキノリン−4−イル基、7−メチルイソキノリン−4−イル基、8−メチルイソキノリン−4−イル基、5,8−ジメチルイソキノリン−4−イル基、5,6,7,8−テトラメチルイソキノリン−4−イル基、3−tert−ブチルイソキノリン−1−イル基、4−tert−ブチルイソキノリン−1−イル基、6−tert−ブチルイソキノリン−1−イル基、7−tert−ブチルイソキノリン−1−イル基、1−tert−ブチルイソキノリン−3−イル基、4−tert−ブチルイソキノリン−3−イル基、6−tert−ブチルイソキノリン−3−イル基、7−tert−ブチルイソキノリン−3−イル基、1−tert−ブチルイソキノリン−4−イル基、3−tert−ブチルイソキノリン−4−イル基、6−tert−ブチルイソキノリン−4−イル基、7−tert−ブチルイソキノリン−4−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、1−イソキノリル基、3−イソキノリル基、4−イソキノリル基、1,3−ジメチルイソキノリン−4−イル基が好ましく、合成が容易である点で、1−イソキノリル基、4−イソキノリル基が更に好ましい。
【0041】
次に、本発明の製造方法について説明する。
【0042】
一般式(2)で示される化合物の好ましい例としては、次の(I)〜(XXXIII)の基本骨格を例示できるが、本発明はこれらに限定されるものではない。
【0043】
【化9】

【0044】
【化10】

【0045】
【化11】

【0046】
【化12】

Mで表されるZnR4、MgR5としては、ZnCl、ZnBr、ZnI、MgCl、MgBr、MgI等が例示できる。反応収率がよい点でZnClが好ましく、テトラメチルエチレンジアミンが配位しているZnCl(TMEDA)がより好ましい。
【0047】
Mで表されるSn(R6)3としては、SnMe3、SnBu3等が例示できる。
【0048】
Mで表されるB(OR7)2としては、B(OH)2、B(OMe)2、B(O(iso−Pr))2、B(OBu)2等が例示できる。
【0049】
Mで表されるB(OR7)2において、2つのR7が酸素原子を介して結合するホウ素原子と一体となって環を形成した場合のB(OR7)2の例としては、次の(XXXIV)〜(XL)で示される基が例示でき、反応収率がよい点で(XXXV)で示される基が好ましい。
【0050】
【化13】

Y1としては、塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基が例示でき、反応収率及び選択性がよい点で臭素原子が好ましい。
【0051】
一般式(4)で示される化合物の好ましい例としては、次の(XLI)〜(LXXIII)の基本骨格を例示できるが、本発明はこれらに限定されるものではない。
【0052】
【化14】

【0053】
【化15】

【0054】
【化16】

【0055】
【化17】

Y2としては、塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基が例示でき、反応収率及び選択性がよい点で臭素原子が好ましい。
【0056】
本発明の1,3,5−トリアジン誘導体(1)は、次の反応式
【0057】
【化18】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。Xは炭素原子又は窒素原子を表す。Y1は塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。MはZnR4、MgR5、Sn(R6)3、B(OR7)2を表す。但し、R4及びR5は各々独立して塩素原子、臭素原子又はヨウ素原子を表し、R6は炭素数1〜4のアルキル基又はフェニル基を表し、R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R6及びR7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示す方法により製造することができる。
【0058】
「工程1」は、化合物(2)を塩基の存在下若しくは不存在下に、パラジウム触媒の存在下に化合物(3)と反応させて、本発明の1,3,5−トリアジン誘導体(1)を製造する方法であり、鈴木−宮浦反応、根岸反応、玉尾−熊田反応、スティレ反応等の一般的なカップリング反応の反応条件及び触媒を適用することにより、反応収率よく目的物を得ることができる。
【0059】
「工程1」で用いることのできるパラジウム触媒としては、塩化パラジウム、酢酸パラジウム、トリフルオロ酢酸パラジウム、硝酸パラジウム等の塩を例示することができる。さらに、π−アリルパラジウムクロリドダイマー、パラジウムアセチルアセトナト、トリス(ジベンジリデンアセトン)ジパラジウム、ジクロロビス(トリフェニルホスフィン)パラジウム、テトラキス(トリフェニルホスフィン)パラジウム及びジクロロ[1,1’−ビス(ジフェニルホスフィノ)フェロセン]パラジウム等の錯化合物を例示することができる。入手容易であり、反応収率がよい点で、塩化パラジウム、酢酸パラジウム、トリス(ジベンジリデンアセトン)ジパラジウム、ジクロロビス(トリフェニルホスフィン)パラジウム、テトラキス(トリフェニルホスフィン)パラジウムが好ましい。中でも、第三級ホスフィンを配位子として有するパラジウム錯体は反応収率がよい点でさらに好ましい。これらの第三級ホスフィンを配位子として有するパラジウム錯体は、パラジウム塩又は錯化合物に第三級ホスフィンを添加し、反応系中で調整することもできる。
【0060】
このような第三級ホスフィンとしては、トリフェニルホスフィン、トリメチルホスフィン、トリブチルホスフィン、トリ(tert−ブチル)ホスフィン、トリシクロヘキシルホスフィン、tert−ブチルジフェニルホスフィン、9,9−ジメチル−4,5−ビス(ジフェニルホスフィノ)キサンテン、2−(ジフェニルホスフィノ)−2’−(N,N−ジメチルアミノ)ビフェニル、2−(ジ−tert−ブチルホスフィノ)ビフェニル、2−(ジシクロヘキシルホスフィノ)ビフェニル、ビス(ジフェニルホスフィノ)メタン、1,2−ビス(ジフェニルホスフィノ)エタン、1,3−ビス(ジフェニルホスフィノ)プロパン、1,4−ビス(ジフェニルホスフィノ)ブタン、1,1’−ビス(ジフェニルホスフィノ)フェロセン、トリ(2−フリル)ホスフィン、トリ(o−トリル)ホスフィン、トリス(2,5−キシリル)ホスフィン、(±)−2,2’−ビス(ジフェニルホスフィノ)−1,1’−ビナフチル、2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニル等が例示できる。入手容易であり、反応収率がよい点で、トリフェニルホスフィン、トリ(tert−ブチル)ホスフィン、2−(ジ−tert−ブチルホスフィノ)ビフェニル、1,1’−ビス(ジフェニルホスフィノ)フェロセン、2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニルが好ましい。反応に用いるパラジウム触媒と化合物(3)とのモル比は、1:200〜1:2が好ましく、反応収率がよい点で1:100〜1:10がさらに好ましい。また、「工程1」で用いる第三級ホスフィンとパラジウム塩又は錯化合物とのモル比は、1:10〜10:1が好ましく、反応収率がよい点で1:2〜5:1がさらに好ましい。
【0061】
「工程1」で用いることのできる塩基としては、水酸化ナトリウム、水酸化カリウム、炭酸ナトリウム、炭酸カリウム、炭酸リチウム、炭酸セシウム、リン酸カリウム、リン酸ナトリウム、フッ化ナトリウム、フッ化カリウム、フッ化セシウム等を例示することができ、反応収率がよい点で炭酸セシウムが好ましい。塩基と化合物(2)とのモル比は、1:2〜10:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0062】
「工程1」で用いる化合物(2)と化合物(3)とのモル比は、1:1〜5:1が好ましく、反応収率がよい点で2:1〜3:1がさらに好ましい。
【0063】
「工程1」の反応は溶媒中で実施することができる。「工程1」で用いることのできる溶媒として、水、ジメチルスルホキシド、ジメチルホルムアミド、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフランを用いることが好ましい。
【0064】
「工程1」の反応は、0℃〜150℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で50℃〜120℃の範囲で行うことがさらに好ましい。
【0065】
化合物(1)は、「工程1」の終了後に通常の処理を行うことで得ることができる。必要に応じて、再結晶、カラムクロマトグラフィー又は昇華等で精製してもよい。
【0066】
次に、本発明の1,3,5−トリアジン誘導体(1)を製造する「工程1」の原料である化合物(2)は、例えば、次の反応式
【0067】
【化19】

(式中、Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。Xは炭素原子又は窒素原子を表す。Y3は塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。Lは脱離基を表す。MはZnR4、MgR5、Sn(R6)3、B(OR7)2を表す。但し、R4及びR5は各々独立して塩素原子、臭素原子又はヨウ素原子を表し、R6は炭素数1〜4のアルキル基又はフェニル基を表し、R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R6及びR7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示した方法により製造することができる。
【0068】
「工程2」は、一般式(4a)で示される化合物をリチウム試薬と反応させ、一般式(4b)で示されるリチウム化合物を得る工程である。「工程2」で得られた化合物(4b)は、反応後単離してもよいが、単離せずに「工程3」に供してもよい。
【0069】
Y3は塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基等を例示することができるが、反応収率がよい点で臭素原子が好ましい。
【0070】
「工程2」で用いられるリチウム試薬としては、反応収率がよい点でブチルリチウム、tert−ブチルリチウムが好ましい。リチウム試薬と化合物(4a)とのモル比は、1:1〜5:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0071】
「工程2」の反応は溶媒中で実施することができる。「工程2」で反応の際に用いることのできる溶媒として、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフランを用いることが好ましい。
【0072】
「工程2」の反応は、−150℃〜−20℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で−100℃〜−60℃の範囲がさらに好ましい。
【0073】
化合物(4a)は、例えば、J.Tsuji著、「Palladium Reagents and Catalysts,John Wiley & Sons,2004年に記載の汎用的な金属触媒を用いるカップリング反応により容易に得ることができる。
【0074】
「工程3」は、リチウム化合物(4b)と一般式(6)で示されるカップリング用試薬を反応させることにより、「工程1」で用いる一般式(2)で示される化合物を製造する工程である。「工程3」で得られた化合物(2)は、反応後単離してもよいが、単離せずに「工程1」に供してもよい。
【0075】
「工程3」で用いられるカップリング用試薬(6)としては、ジクロロ(テトラメチルエチレンジアミン)亜鉛(II)、塩化亜鉛、臭化亜鉛、ヨウ化亜鉛、塩化トリメチルスズ、塩化トリブチルスズ、ホウ酸トリメチル、ホウ酸トリイソプロピル、(2,3−ジメチルブタン−2,3−ジオキシ)メトキシボラン、(2,3−ジメチルブタン−2,3−ジオキシ)イソプロポキシボラン、1,3−プロパンジオキシボラン等が例示できる。取り扱いが容易である点でジクロロ(テトラメチルエチレンジアミン)亜鉛(II)、ホウ酸トリメチル、ホウ酸トリイソプロピル、(2,3−ジメチルブタン−2,3−ジオキシ)イソプロポキシボランが好ましく、反応収率がよい点でジクロロ(テトラメチルエチレンジアミン)亜鉛(II)がさらに好ましい。Lで表される好適な脱離基としては、Cl、Br、I、MeO、iso−PrOを例示することができる。カップリング用試薬(6)と化合物(4b)とのモル比は、1:1〜10:1が好ましく、反応収率がよい点で1.5:1〜3:1がさらに好ましい。
【0076】
「工程3」の反応は、−150℃〜50℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で−100℃〜30℃の範囲で行うことがさらに好ましい。
【0077】
「工程4」は、化合物(4a)を塩基及びパラジウム触媒の存在下に、一般式(7)で示されるボラン化合物、又は一般式(8)で示されるジボロン化合物と反応させることにより、「工程1」で用いる化合物(2a)を製造する工程であり、例えば、The Journal of Organic Chemistry,60巻,7508−7510,1995年、又はThe Journal of Organic Chemistry,65巻,164−168,2000年に開示されている反応条件及び触媒を適用することにより、反応収率よく目的物を得ることができる。パラジウム触媒と化合物(4a)とのモル比は、1:200〜1:2が好ましく、反応収率がよい点で1:50〜1:10がさらに好ましい。得られた化合物(2a)は、反応後単離してもよいが、単離せずに「工程1」に供してもよい。
【0078】
「工程4」で用いることのできるパラジウム触媒としては、「工程1」で例示したパラジウム触媒を挙げることができるが、入手容易であり、反応収率がよい点で、塩化パラジウム、酢酸パラジウム、トリス(ジベンジリデンアセトン)ジパラジウム、ジクロロビス(トリフェニルホスフィン)パラジウム、テトラキス(トリフェニルホスフィン)パラジウム、ジクロロ[1,1’−ビス(ジフェニルホスフィノ)フェロセン]パラジウムが好ましく、中でも、第三級ホスフィンを配位子として有するパラジウム錯体が反応収率がよい点で好ましい。また、これらのパラジウム錯体は、パラジウム塩又は錯化合物に第三級ホスフィンを添加し、反応系中で調整することもできる。このような第三級ホスフィンとしては、「工程1」で例示した第三級ホスフィンを挙げることができるが、入手容易であり、反応収率がよい点で、トリフェニルホスフィン、1,1’−ビス(ジフェニルホスフィノ)フェロセンが好ましい。第三級ホスフィンとパラジウム塩又は錯化合物とのモル比は、1:10〜10:1が好ましく、反応収率がよい点で1:2〜5:1がさらに好ましい。
【0079】
「工程4」で用いることのできる塩基としては、「工程1」で例示した塩基を挙げることができるが、反応収率がよい点で炭酸カリウム及び炭酸セシウムが特に好ましい。塩基と化合物(4a)とのモル比は、1:2〜10:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0080】
「工程4」で用いるボラン化合物(7)又はジボロン化合物(8)と化合物(4a)とのモル比は、1:1〜5:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0081】
「工程4」で用いることのできる溶媒として、ジメチルスルホキシド、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフラン又はジメチルスルホキシドを用いることが好ましい。
【0082】
「工程4」の反応は、0℃〜150℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で50℃〜120℃の範囲で行うことがさらに好ましい。
【0083】
化合物(2a)は、「工程4」の終了後に通常の処理をすることで得られる。必要に応じて、再結晶、カラムクロマトグラフィー又は昇華等で精製してもよい。
【0084】
一般式(3)で示される化合物は、例えば、特開2006−62962公報に開示されている方法に従って製造することができる。
【0085】
さらに、本発明の1,3,5−トリアジン誘導体(1)は、次の反応式
【0086】
【化20】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。Xは炭素原子又は窒素原子を表す。Y2は塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示した方法によっても製造することができる。
【0087】
「工程5」は、化合物(5)を塩基及びパラジウム触媒の存在下に、化合物(4)と反応させて本発明の1,3,5−トリアジン誘導体(1)を製造する工程であり、一般的な鈴木−宮浦反応の反応条件及び触媒を適用することにより、反応収率よく目的物を得ることができる。パラジウム触媒と化合物(5)とのモル比は、1:200〜1:2が好ましく、反応収率がよい点で1:100〜1:10がさらに好ましい。
【0088】
「工程5」で用いることのできるパラジウム触媒としては、「工程1」で例示したパラジウム触媒を挙げることができるが、入手容易であり、反応収率がよい点で、塩化パラジウム、酢酸パラジウム、トリス(ジベンジリデンアセトン)ジパラジウム、ジクロロビス(トリフェニルホスフィン)パラジウム、テトラキス(トリフェニルホスフィン)パラジウム好ましく、中でも、第三級ホスフィンを配位子として有するパラジウム錯体が反応収率がよい点で好ましい。また、これらのパラジウム錯体は、パラジウム塩又は錯化合物に第三級ホスフィンを添加し、反応系中で調製することもできる。このような第三級ホスフィンとしては、「工程1」で例示した第三級ホスフィンを挙げることができるが、入手容易であり、反応収率がよい点で、トリフェニルホスフィン、トリ(tert−ブチル)ホスフィン、2−(ジ−tert−ブチルホスフィノ)ビフェニル、2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニルが好ましい。第三級ホスフィンとパラジウム塩又は錯化合物とのモル比は、1:10〜10:1が好ましく、反応収率がよい点で1:2〜5:1がさらに好ましい。
【0089】
「工程5」で用いることのできる塩基としては、「工程1」で例示した塩基を挙げることができるが、反応収率がよい点で炭酸セシウムが特に好ましい。塩基と化合物(4)とのモル比は、1:2〜10:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0090】
「工程5」で用いる化合物(4)と化合物(5)とのモル比は、2:1〜5:1が好ましく、反応収率がよい点で2:1〜3:1がさらに好ましい。
【0091】
「工程5」の反応は溶媒中で実施することができる。「工程5」で用いることのできる溶媒として、水、ジメチルスルホキシド、ジメチルホルムアミド、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフランを用いることが好ましい。
【0092】
「工程5」の反応は、0℃〜150℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で50℃〜120℃の範囲で行うことが好ましい。
【0093】
化合物(1)は、「工程5」の終了後に通常の処理を行うことで得られる。必要に応じて、再結晶、カラムクロマトグラフィー又は昇華等で精製してもよい。
【0094】
次に、本発明の1,3,5−トリアジン誘導体(1)を製造する「工程5」の原料である化合物(5)は、例えば、次の反応式
【0095】
【化21】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Y1は塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示した方法により製造することができる。
【0096】
「工程6」は、化合物(3)を塩基及びパラジウム触媒の存在下に、ボラン化合物(7)又はジボロン化合物(8)と反応させることにより、「工程5」で用いる化合物(5)を製造する工程であり、例えば、The Journal of Organic Chemistry,60巻,7508−7510,1995年、又はThe Journal of Organic Chemistry,65巻,164−168,2000年に開示されている反応条件及び触媒を適用することにより、反応収率よく目的物を得ることができる。パラジウム触媒と化合物(3)とのモル比は、1:200〜1:2が好ましく、反応収率がよい点で1:100〜1:10がさらに好ましい。得られた化合物(5)は、反応後単離してもよいが、単離せずに「工程5」に供してもよい。
【0097】
「工程6」で用いることのできるパラジウム触媒としては、「工程1」で例示したパラジウム触媒を挙げることができるが、入手容易であり、反応収率がよい点で、塩化パラジウム、酢酸パラジウム、トリス(ジベンジリデンアセトン)ジパラジウム、ジクロロビス(トリフェニルホスフィン)パラジウム、テトラキス(トリフェニルホスフィン)パラジウム、ジクロロ[1,1’−ビス(ジフェニルホスフィノ)フェロセン]パラジウムが好ましく、中でも、第三級ホスフィンを配位子として有するパラジウム錯体が反応収率がよい点で好ましい。また、これらのパラジウム錯体は、パラジウム塩又は錯化合物に第三級ホスフィンを添加し、反応系中で調製することもできる。このような第三級ホスフィンとしては、「工程1」で例示した第三級ホスフィンを挙げることができるが、入手容易であり、反応収率がよい点で、トリフェニルホスフィン、1,1’−ビス(ジフェニルホスフィノ)フェロセンが好ましい。第三級ホスフィンとパラジウム塩又は錯化合物とのモル比は、1:10〜10:1が好ましく、反応収率がよい点で1:2〜5:1がさらに好ましい。
【0098】
「工程6」で用いることのできる塩基としては、「工程1」で例示した塩基を挙げることができるが、反応収率がよい点で酢酸カリウムが特に好ましい。塩基と化合物(3)とのモル比は、1:2〜10:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0099】
「工程6」で用いるボラン化合物(7)又はジボロン化合物(8)と化合物(3)とのモル比は、1:1〜5:1が好ましく、反応収率がよい点で2:1〜4:1がさらに好ましい。
【0100】
「工程6」の反応は溶媒中で実施することができる。「工程6」で用いることのできる溶媒として、ジメチルスルホキシド、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフランを用いることが好ましい。
【0101】
「工程6」の反応は、0℃〜150℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で50℃〜120℃の範囲で行うことが好ましい。
【0102】
化合物(5)は、「工程6」の終了後に通常の処理を行うことで得られる。必要に応じて、再結晶、カラムクロマトグラフィー又は昇華等で精製してもよい。
【0103】
本発明の1,3,5−トリアジン誘導体(1)から成る有機電界発光素子用薄膜の製造方法は特に限定されないが、真空蒸着法による成膜が可能である。真空蒸着法による成膜は、汎用の真空蒸着装置を用いることにより行うことができる。真空蒸着法で膜を形成する際の真空槽の真空度は、有機電界発光素子作製の製造タクトタイムや製造コストを考慮すると、一般的に用いられる拡散ポンプ、ターボ分子ポンプ、クライオポンプ等により到達し得る1×10−2Pa〜1×10−5Pa程度が好ましい。蒸着速度は、形成する膜の厚さによるが0.005nm/秒〜1.0nm/秒が好ましい。また、1,3,5−トリアジン誘導体(1)は、クロロホルム、ジクロロメタン、1,2−ジクロロエタン、クロロベンゼン、トルエン、酢酸エチル又はテトラヒドロフラン等に対する溶解度が高いため、汎用の装置を用いたスピンコ−ト法、インクジェット法、キャスト法又はディップ法等による成膜も可能である。
【発明の効果】
【0104】
本発明の1,3,5−トリアジン誘導体(1)から成る薄膜は、高い表面平滑性、アモルファス性、耐熱性、電子輸送能、正孔ブロック能、酸化還元耐性、耐水性、耐酸素性、電子注入特性等をもつため、有機電界発光素子の材料として有用であり、とりわけ電子輸送材、正孔ブロック材、発光ホスト材等として用いることができる。従って、本発明の1,3,5−トリアジン誘導体(1)から成る薄膜は、有機電界発光素子の構成成分としての利用が期待される。
【図面の簡単な説明】
【0105】
【図1】実施の形態(素子評価)で作製する有機電界発光素子の断面図である。
【符号の説明】
【0106】
1.ITO透明電極付きガラス基板
2.正孔注入層
3.正孔輸送層
4.発光層
5.電子輸送層
6.陰極層
【実施例】
【0107】
実施例−1
【0108】
【化22】

アルゴン気流下、2−(4−ブロモフェニル)キノリン 2.58g(9.09mmol)を20mLのテトラヒドロフランに溶解し、ブチルリチウムを9.70mmol含むヘキサン溶液6.01mLを−78℃で滴下した。混合物を−78℃で15分間攪拌後、ジクロロ(テトラメチルエチレンジアミン)亜鉛(II) 2.45g(9.70mmol)を加え、室温まで昇温した後1.5時間攪拌した。この混合物に2−(3,5−ジブロモフェニル)−4,6−ジ−p−トリル−1,3,5−トリアジン 1.50g(3.03mmol)、テトラキス(トリフェニルホスフィン)パラジウム420mg(0.364mmol)をテトラヒドロフラン30mLに懸濁し、加熱還流下で15時間攪拌した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 メタノール:クロロホルム=1:100〜2:100)で精製し、目的の2−[4,4”−ジ(2−キノリル)−1,1’:3’,1”−テルフェニル−5−イル]−4,6−ジ−p−トリル−1,3,5−トリアジンの白色固体(収量2.03g、収率90%)を得た。
【0109】
1H−NMR(CDCl3):δ2.43(s,6H),7.33(d,J=8.0Hz,4H),7.49(t,J=7.1Hz,2H),7.67−7.72(m,2H),7.79(d,J=7.9Hz,2H),7.93(d,J=8.1Hz,6H),8.12(t,J=1.7Hz,1H),8.14(d,J=5.7Hz,2H),8.21(d,J=8.5Hz,2H),8.32(d,J=8.2Hz,4H),8.64(d,J=8.0Hz,4H),9.01(d,J=1.6Hz,2H).
実施例−2
【0110】
【化23】

アルゴン気流下、4−(5−ブロモピリジン−2−イル)イソキノリン 219mg(0.77mmol)、2−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−4,6−ビス(3−ビフェニリル)−1,3,5−トリアジン 271mg(0.38mmol)、炭酸セシウム251mg(0.77mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム5mg(0.008mmol)を20mLのテトラヒドロフランに懸濁し、65時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 メタノール:クロロホルム=0:100〜2:100)で精製し、目的の2,4−ビス(3−ビフェニリル)−6−{3,5−ビス[6−(4−イソキノリル)ピリジン−3−イル]フェニル}−1,3,5−トリアジンの白色固体(収量151mg、収率46%)を得た。
【0111】
1H−NMR(CDCl3):δ7.31−7.38(m,2H),7.42−7.49(m,4H),7.59−7.68(m,4H),7.67−7.76(m,6H),7.75−7.84(m,4H),8.04(d,J=8.1,2.5Hz,2H),8.17(brs,1H),8.27(dt,J=8.1,3.1Hz,2H),8.32(dd,J=8.4,3.4Hz,2H),8.71(d,J=3.9Hz,2H),8.76(brd,J=7.5Hz,2H),9.00−8.98(m,2H),9.11−9.14(m,2H),9.25(brs,2H),9.29(d,J=3.4Hz,2H).
実施例−3
【0112】
【化24】

アルゴン気流下、2−(3,5−ジブロモフェニル)−4,6−ジ(2−ナフチル)−1,3,5−トリアジン 1.00g(1.76mmol)、1−(4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル)イソキノリン 1.48g(3.88mmol)、炭酸セシウム1.26g(3.87mmol)、酢酸パラジウム17mg(0.078mmol)、2−ジシクロへキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニル 74mg(0.16mmol)をテトラヒドロフラン15mLに懸濁し、12時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルクロマトグラフィー(展開溶媒 クロロホルム)で精製し、2−[4,4”−ジ(1−イソキノリル)−1,1’:3’,1”−テルフェニル−5’−イル]−4,6−ジ(2−ナフチル)−1,3,5−トリアジンの黄色固体(収量501mg、収率35%)を得た。
【0113】
1H−NMR(CDCl3):δ.7.38−7.51(m,4H),7.46−7.63(m,4H),7.64−7.89(m,12H),7.89(d,J=7.8Hz,4H),7.99(s,1H),8.13(d,J=8.3Hz,2H),8.52(d,J=5.8Hz,2H),8.63(d,J=8.3Hz,2H),8.91(brs,2H),9.10(brs,2H).
13C−NMR(CDCl3):δ120.1(CH×2),125.3(CH×2),126.5(CH×2),126.8(quart.×2),127.0(CH×2),127.1(CH×2),127.2(CH×2),127.4(CH×2),127.5(CH×4),127.6(CH×2),127.9(CH×2),128.4(CH×2),129.8(CH×2) ,130.1(CH×2),130.2(CH×2),130.6(CH),130.7(CH×4),133.2(quart.×2),133.6(quart.×2),135.8(quart.×2),137.0(quart.×2),137.7(quart.),139.1(quart.×2),141.1(quart.×2),141.9(quart.×2),142.4(CH×2),160.4(quart.×2),171.4(quart.),171.8(quart.×2).
実施例−4
【0114】
【化25】

アルゴン気流下、1−(4−ブロモフェニル)イソキノリン 1.13g(3.56mmol)、2−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−4,6−ジ−p−トリル−1,3,5−トリアジン 1.00g(1.70mmol)、炭酸セシウム1.11g(3.40mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム100mg(0.14mmol)を40mLのテトラヒドロフランに懸濁し、15時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 クロロホルム)で精製し、目的の2−[4,4”−ジ(1−イソキノリル)−1,1’:3’,1”−テルフェニル−5’−イル]−4,6−ジ−p−トリル−1,3,5−トリアジンの白色固体(収量263mg、収率35%)を得た。
【0115】
1H−NMR(CDCl3):δ2.43(s,6H),7.34(d,J=8.0Hz,4H),7.55(ddd,J=8.4,3.5,1.4Hz,2H),7.61−7.71(m,2),7.63(d,J=5.8Hz,2H),7.81−7.90(m,2H),7.85(d,J=8.3Hz,4H),7.95(d,J=8.3Hz,4H),8.15(t,J=1.8Hz,1H),8.21(d,J=7.8Hz,2H),8.61(d,J=5.8Hz,2H),8.65(d,J=8.3Hz,4H),9.03(d,J=1.8Hz,2H).
実施例−5
【0116】
【化26】

アルゴン気流下、2−[4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]ピリミジン 0.98g(3.48mmol)、2−(3,5−ジブロモフェニル)−4,6−ビス(3−ビフェニリル)−1,3,5−トリアジン 0.98g(1.58mmol)、炭酸セシウム1.13g(3.48mmol)、酢酸パラジウム7.2mg(0.032mmol)、2−ジシクロへキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニル 30.5g(0.031mmol)を95mLのテトラヒドロフランに懸濁し、17時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=1:6)で精製し、目的の2−[4,4”−ジ(2−ピリミジル)−1,1’:3’,1”−テルフェニル−5−イル]−4,6‐ビス(3−ビフェニリル)−1,3,5−トリアジンの白色固体(収量0.85g、収率67%)を得た。
【0117】
1H−NMR(CDCl3):δ7.13(t,J=4.9Hz,2H),7.36(t,J=7.3Hz,2H),7.46(t,J=7.1Hz,4H),7.61(J=7.6Hz,2H),7.65−7.75(m,6H),7.79(d,J=6.3Hz,2H),8.21(bs,1H),8.37(d,J=8.3Hz,4H),8.68−8.83(m,8H),8.94(bs,2H),9.02(bs,2H).
実施例−6
【0118】
【化27】

アルゴン気流下、2−[4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]ピリミジン 1.95g(5.54mmol)、2−(3,5−ジブロモフェニル)−4,6−ジ(p−トリル)−1,3,5−トリアジン 1.34g(2.70mmol)、炭酸セシウム1.81g(5.54mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム(II)38mg(0.054mmol)を100mLのテトラヒドロフランに懸濁し、23時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 メタノール:クロロホルム=1:100)で精製し、目的の2−[4,4”−ジ(2−ピリミジル)−1,1’:3’,1”−テルフェニル−5’−イル]−4,6‐ジ−p−トリル−1,3,5−トリアジンの白色固体(収量1.59g、収率91%)を得た。
【0119】
1H−NMR(CDCl3):δ2.53(s,6H),7.25(t,J=4.9Hz,4H),7.43(d,J=8.0Hz,4H),8.00(d,J=8.3Hz,4H),8.21(bs,1H),8.68(d,J=7.8Hz,4H),8.73(d,J=8.0Hz,4H),8.90(d,J=5.3Hz,4H),9.10(bs,2H).
実施例−7
【0120】
【化28】

アルゴン気流下、2−[4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]ピリミジン 659mg(2.16mmol)、2−(3,5−ジブロモフェニル)−4,6−ジ(2−ナフチル)−1,3,5−トリアジン 596mg(1.05mmol)、炭酸セシウム704mg(2.16mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム(II)15mg(0.021mmol)をテトラヒドロフラン60mLに懸濁し、15時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルクロマトグラフィー(展開溶媒 クロロホルム)で精製し、2−[4,4”−ジ(2−ピリミジル)−1,1’:3’,1”−テルフェニル−5’−イル]−4,6‐ジ(2−ナフチル)−1,3,5−トリアジンの黄色固体(収量539mg、収率72%)を得た。
【0121】
1H−NMR(CDCl3):δ7.17(t,J=4.8Hz,2H),7.50−7.57(m,4H),7.89(d,J=7.5Hz,2H),7.93(d,J=8.3Hz,4H),7.99(d,J=8.6Hz,2H),8.08(d,J=7.4Hz,2H),8.14(t,J=1.7Hz,1H),8.59(d,J=8.3Hz,4H),8.81(d,J=4.8Hz,2H),8.83(dd,J=8.5,1.5Hz,2H),9.09(d,J=1.7Hz,2H),9.34(s,2H).
実施例−8
【0122】
【化29】

アルゴン気流下、2−[4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]ピラジン 289mg(1.03mmol)、2−(3,5−ジブロモフェニル)−4,6−ジ−p−トリル−1,3,5−トリアジン 248mg(0.50mmol)、炭酸セシウム334mg(1.03mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム(II)7mg(0.010mmol)を30mLのテトラヒドロフランに懸濁し、17時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=10:80)で精製し、目的の2−[4,4”−ジ(2−ピラジル)−1,1’:3’,1”−テルフェニル−5’−イル]−4,6‐ジ−p−トリル−1,3,5−トリアジンの白色固体(収量250mg、収率77%)を得た。
【0123】
1H−NMR(CDCl3):δ2.43(s,6H),7.33(d,J=8.0Hz,4H),7.91(d,J=8.3Hz,4H),8.08(t,J=1.8Hz,1H),8.17(d,J=8.3Hz,4H),8.49(d,J=2.5Hz,2H),8.58−8.67(m,6H),8.99(d,J=1.8Hz,2H),9.08(d,J=1.5Hz,2H).
実施例―9
【0124】
【化30】

アルゴン気流下、2−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−4,6−ジフェニル−1,3,5−トリアジン 1.00g(1.78mmol)、2−(4−ブロモフェニル)ピリミジン 0.88g(3.74mmol)、炭酸セシウム 1.16g(3.56mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム105mg(0.150mmol)を35mLのテトラヒドロフランに懸濁し、17時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=50:50)で精製し、目的の2,4−ジフェニル−6−[4,4”−ジ(2−ピリミジル)−1,1’:3’,1”−テルフェニル−5’−イル]−1,3,5−トリアジンの白色固体(収量0.38g、収率29%)を得た。
【0125】
1H−NMR(CDCl3):δ7.16(t,J=4.8Hz,2H),7.50−7.60(m,6H),7.89(d,J=8.3Hz,4H),8.12(t,J=1.6Hz,1H),8.57(d,J=8.3Hz,4H),8.75(dd,J=8.2,1.6Hz,4H),8.79(d,J=4.8Hz,4H),9.01(d,J=1.7Hz,2H).
13C−NMR(CDCl3):δ119.2(CH×2),127.1(CH×2),127.8(CH×4),128.8(CH×4),128.9(CH×4),129.1(CH×4),130.1(CH),132.7(CH×2),136.2(quart.×2),137.2(quart.×2),137.6(quart.),141.8(quart.×2),143.0(quart.×2),157.4(CH×4),164.6(quart.×2),171.5(quart.),171.8(quart.×2).
実施例―10
【0126】
【化31】

アルゴン気流下、2−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−4,6−ジフェニル−1,3,5−トリアジン 1.00g(1.78mmol)、2−(4−ブロモフェニル)キナゾリン 1.27g(4.45mmol)、炭酸セシウム 1.16g(3.56mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム250mg(0.356mmol)を30mLのテトラヒドロフランに懸濁し、65時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=1:4)で精製し、目的の2,4−ジフェニル−6−[4,4”−ジ(2−キナゾリル)−1,1’:3’,1”−テルフェニル−5’−イル]−1,3,5−トリアジンの白色固体(収量0.78g、収率63%)を得た。
【0127】
1H−NMR(CDCl3):δ7.50−7.59(m,6H),7.63−7.78(m,4H),7.99(d,J=7.7Hz,4H),8.10(d,J=8.2Hz,2H),8.15−8.16(m,3H),8.37(d,J=7.8Hz,4H),8.77(d,J=7.4Hz,4H),9.06(s,2H),9.39(s,2H).
実施例―11
【0128】
【化32】

アルゴン気流下、2−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−4,6−ジフェニル−1,3,5−トリアジン 1.00g(1.78mmol)、2−(4−ブロモフェニル)キノキサリン 1.27g(4.45mmol)、炭酸セシウム 1.16g(3.56mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム250mg(0.356mmol)を30mLのテトラヒドロフランに懸濁し、64時間還流した。室温まで冷却後、減圧下で低沸点成分を留去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=1:4)で精製し、目的の2,4−ジフェニル−6−[4,4”−ジ(2−キノキサリル)−1,1’:3’,1”−テルフェニル−5’−イル]−1,3,5−トリアジンの白色固体(収量0.70g、収率55%)を得た。
【0129】
1H−NMR(CDCl3):δ7.50−7.59(m,6H),7.63−7.78(m,6H),7.99(d,J=7.7Hz,4H),8.10(d,J=8.2Hz,2H),8.15(t,J=1.8Hz,1H),8.46(d,J=7.7Hz,4H),8.77(d,J=7.6Hz,4H),9.04(s,2H),9.38(s,2H).
参考例−1
【0130】
【化33】

アルゴン気流下、2,4−ビス(3−ビフェニリル)−6−(3,5−ジブロモフェニル)−1,3,5−トリアジン 310mg(0.50mmol)、ビスピナコラートジボロン305mg(1.20mmol)、酢酸カリウム236mg(2.40mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム18mg(0.025mmol)をテトラヒドロフラン20mLに懸濁し、18時間還流した。室温まで冷却後、減圧下で低沸点成分を除去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルクロマトグラフィー(展開溶媒 クロロホルム)で精製し、2,4−ビス(3−ビフェニリル)−6−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−1,3,5−トリアジンの白色固体(収量305mg、収率85%)を得た。
【0131】
1H−NMR(CDCl3):δ1.34(s,24H),7.35(brt,J=7.3Hz,2H),7.45(brt,J=7.3Hz,4H),7.61(t,J=7.7Hz,2H),7.73(brd,J=7.3Hz,4H),7.80(brddd,J=7.7,1.6,1.6Hz,2H),8.45(brs,1H),8.73(brddd,J=7.7,1.6,1.6Hz,2H),9.02(brt,J=1.6Hz,2H),9.22(d,J=1.2Hz,2H).
参考例−2
【0132】
【化34】

アルゴン気流下、2,4−ジ−p−トリル−6−(3,5−ジブロモフェニル)−1,3,5−トリアジン 1.43g(2.88mmol)、ビスピナコラートジボロン3.00g(11.8mmol)、酢酸カリウム1.70g(17.3mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム81mg(0.12mmol)をテトラヒドロフラン30mLに懸濁し、15時間還流した。室温まで冷却後、減圧下で低沸点成分を除去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=1:1)で精製し、2,4−ジ−p−トリル−6−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−1,3,5−トリアジンの白色固体(収量1.68g、収率99%)を得た。
【0133】
1H−NMR(CDCl3):δ1.34(s,24H),2.41(s,6H),7.32(d,J=8.0Hz,4H),8.43(t,J=1.3Hz,1H),8.63(d,J=8.3Hz,4H),9.13(d,J=1.3Hz,2H).
参考例−3
【0134】
【化35】

アルゴン気流下、2−(3,5−ジブロモフェニル)−4,6−ジフェニル−1,3,5−トリアジン 5.00g(10.7mmol)、ビスピナコラートジボロン 5.98g(23.5mmol)、酢酸カリウム 4.62g(47.1mmol)、ジクロロビス(トリフェニルホスフィン)パラジウム300mg(0.428mmol)を30mLのテトラヒドロフランに懸濁し、22時間還流した。室温まで冷却後、減圧下で低沸点成分を除去した後、メタノールを加え、析出した固体をろ別した。得られた粗生成物をシリカゲルクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=1:1)で精製し、目的の2−[3,5−ビス(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−4,6−ジフェニル−1,3,5−トリアジンの白色固体(収量4.18g、収率70%)を得た。
【0135】
1H−NMR(CDCl3):δ1.34(s,24H),7.47−7.57(m,6H),8.45(t,J=1.3Hz,1H),8.70−8.78(m,4H),9.15(d,J=1.3Hz,2H).
素子実施例1
1,3,5−トリアジンを構成成分とする有機電界発光素子の作製と性能評価
基板には、2mm幅の酸化インジウム−スズ(ITO)膜がストライプ状にパターンされたITO透明電極付きガラス基板を用いた。この基板をイソプロピルアルコールで洗浄した後、オゾン紫外線洗浄にて表面処理を行った。洗浄後の基板に、真空蒸着法で各層の真空蒸着を行い、断面図を図1に示すような発光面積が4mm2の有機電界発光素子を作製した。まず、真空蒸着槽内に前記ガラス基板を導入し、1.0×10−4Paまで減圧した。その後、図1の1で示す前記ガラス基板上に有機化合物層として、正孔注入層2、正孔輸送層3、発光層4及び電子輸送層5を順次成膜し、その後陰極層6を成膜した。正孔注入層2としては、昇華精製したフタロシアニン銅(II)を25nmの膜厚で真空蒸着した。正孔輸送層3としては、N,N’−ジ(ナフチレン−1−イル)−N,N’−ジフェニルベンジジン(NPD)を45nmの膜厚で真空蒸着した。発光層4としては、4,4’−ビス(2,2−ジフェニルエテン−1−イル)ジフェニル(DPVBi)と4,4’−ビス[4−(ジ−p−トリルアミノ)フェニルエテン−1−イル]ビフェニル(DPAVBi)を99:1質量%の割合で40nmの膜厚で真空蒸着した。電子輸送層5としては、本発明の2−[4,4”−ジ(2−キノリル)−1,1’:3’,1”−テルフェニル−5−イル]−4,6−ジ−p−トリル−1,3,5−トリアジンを20nmの膜厚で真空蒸着した。なお、各有機材料は抵抗加熱方式により成膜し、加熱した化合物を0.3nm/秒〜0.5nm/秒の成膜速度で真空蒸着した。最後に、ITOストライプと直行するようにメタルマスクを配し、陰極層6を成膜した。陰極層6は、フッ化リチウムとアルミニウムをそれぞれ0.5nmと100nmの膜厚で真空蒸着し、2層構造とした。それぞれの膜厚は、触針式膜厚測定計(DEKTAK)で測定した。さらに、この素子を酸素及び水分濃度1ppm以下の窒素雰囲気グローブボックス内で封止した。封止は、ガラス製の封止キャップと前記成膜基板エポキシ型紫外線硬化樹脂(ナガセケムテックス社製)を用いた。
【0136】
作製した有機電界発光素子に直流電流を印加し、TOPCON社製のLUMINANCE METER(BM−9)の輝度計を用いて発光特性を評価した。発光特性として、電流密度20mA/cm2を流した時の電圧(V)、輝度(cd/m2)、電流効率(cd/A)、電力効率(lm/W)を測定し、連続点灯時の輝度半減時間を測定した。
【0137】
作製した青色蛍光素子の測定値は、5.8V、2480cd/m2、12.4cd/A、6.7lm/Wであった。またこの素子の輝度半減時間は、182時間であった。
素子実施例2
素子実施例1の発光層4を膜厚40nmのAlqにした以外は、素子実施例1と同様の方法で有機電界発光素子を作製した。
【0138】
作製した緑色蛍光素子の測定値は、5.6V、941cd/m2、4.7cd/A、2.6lm/Wであった。またこの素子の輝度半減時間は、1775時間であった。
素子実施例3
素子実施例1の電子輸送層5を膜厚20nmの2−[4,4”−ジ(2−ピリミジル)−1,1’:3’,1”−テルフェニル−5’−イル]−4,6‐ジ−p−トリル−1,3,5−トリアジンにした以外は、素子実施例1と同様の方法で有機電界発光素子を作製した。
【0139】
作製した青色蛍光素子の測定値は、5.2V、2350cd/m2、11.8cd/A、7.0lm/Wであった。またこの素子の輝度半減時間は、165時間であった。
素子実施例4
素子実施例3の発光層4を膜厚40nmのAlqにした以外は、素子実施例3と同様の方法で有機電界発光素子を作製した。
【0140】
作製した緑色蛍光素子の測定値は、5.0V、941cd/m2、4.7cd/A、2.9lm/Wであった。またこの素子の輝度半減時間は、2662時間であった。
素子比較例1
素子実施例1の電子輸送層5を膜厚20nmのAlqにした以外は、素子実施例1と同様の方法で有機電界発光素子を作製した。
【0141】
作製した青色蛍光素子の測定値は、7.1V、1883cd/m2、9.4cd/A、4.2lm/Wであった。またこの素子の輝度半減時間は、163時間であった。
素子比較例2
素子実施例2の電子輸送層5を膜厚20nmのAlqにした以外は、素子実施例2と同様の方法で有機電界発光素子を作製した。
【0142】
作製した緑色蛍光素子の測定値は、5.8V、882cd/m2、4.4cd/A、2.4lm/Wであった。またこの素子の輝度半減時間は、1462時間であった。
【0143】
以上、本発明の化合物を用いれば、既存材料に比較して、蛍光素子や燐光素子で幅広く、低消費電力化、長寿命化を達成できることを確認した。また本発明の化合物は、本実施例の発光層以外にも、他の蛍光発光材料や燐光材料を用いた有機電界発光素子への適用や塗布系素子への適用も可能である。さらにフラットパネルディスプレイ用途以外にも、低消費電力と長寿命の両立が求められる照明用途などにも効果ある。
【特許請求の範囲】
【請求項1】
一般式(1)
【化1】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体。
【請求項2】
R1、R2及びR3が水素原子である請求項1に記載の1,3,5−トリアジン誘導体。
【請求項3】
Ar2が炭素数1から4のアルキル基で置換されていてもよいピラジル基、炭素数1から4のアルキル基で置換されていてもよい2−ピリミジル基、炭素数1から4のアルキル基で置換されていてもよい2−キノキサリル基、炭素数1から4のアルキル基で置換されていてもよいキナゾリル基、炭素数1から4のアルキル基で置換されていてもよいキノリル基又は炭素数1から4のアルキル基で置換されていてもよいイソキノリル基である請求項1又は2に記載の1,3,5−トリアジン誘導体。
【請求項4】
Ar1が置換されていてもよいフェニル基又は置換されていてもよいナフチル基である請求項1から3のいずれかに記載の1,3,5−トリアジン誘導体。
【請求項5】
Xが炭素原子である請求項1から4のいずれかに記載の1,3,5−トリアジン誘導体。
【請求項6】
一般式(2)
【化2】

(式中、Xは炭素原子又は窒素原子を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。MはZnR4、MgR5、Sn(R6)3、B(OR7)2を表す。但し、R4及びR5は各々独立して塩素原子、臭素原子又はヨウ素原子を表し、R6は炭素数1〜4のアルキル基又はフェニル基を表し、R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R6及びR7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示される化合物と、一般式(3)
【化3】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Y1は塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。)で示される化合物を塩基の存在下若しくは不存在下に、パラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【化4】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体の製造方法。
【請求項7】
一般式(4)
【化5】

(式中、Xは炭素原子又は窒素原子を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。Y2は、塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。)で示される化合物と、一般式(5)
【化6】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示される化合物を塩基及びパラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【化7】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体の製造方法。
【請求項8】
パラジウム触媒が、第三級ホスフィンを配位子として有するパラジウム触媒であることを特徴とする請求項6又は7に記載の1,3,5−トリアジン誘導体の製造方法。
【請求項9】
パラジウム触媒が、トリフェニルホスフィン、1,1’−ビス(ジフェニルホスフィノ)フェロセン又は2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニルを配位子として有するパラジウム触媒であることを特徴とする請求項6から8のいずれかに記載の1,3,5−トリアジン誘導体の製造方法。
【請求項10】
一般式(1)
【化8】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体を構成成分とする有機電界発光素子。
【請求項1】
一般式(1)
【化1】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体。
【請求項2】
R1、R2及びR3が水素原子である請求項1に記載の1,3,5−トリアジン誘導体。
【請求項3】
Ar2が炭素数1から4のアルキル基で置換されていてもよいピラジル基、炭素数1から4のアルキル基で置換されていてもよい2−ピリミジル基、炭素数1から4のアルキル基で置換されていてもよい2−キノキサリル基、炭素数1から4のアルキル基で置換されていてもよいキナゾリル基、炭素数1から4のアルキル基で置換されていてもよいキノリル基又は炭素数1から4のアルキル基で置換されていてもよいイソキノリル基である請求項1又は2に記載の1,3,5−トリアジン誘導体。
【請求項4】
Ar1が置換されていてもよいフェニル基又は置換されていてもよいナフチル基である請求項1から3のいずれかに記載の1,3,5−トリアジン誘導体。
【請求項5】
Xが炭素原子である請求項1から4のいずれかに記載の1,3,5−トリアジン誘導体。
【請求項6】
一般式(2)
【化2】

(式中、Xは炭素原子又は窒素原子を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。MはZnR4、MgR5、Sn(R6)3、B(OR7)2を表す。但し、R4及びR5は各々独立して塩素原子、臭素原子又はヨウ素原子を表し、R6は炭素数1〜4のアルキル基又はフェニル基を表し、R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R6及びR7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示される化合物と、一般式(3)
【化3】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Y1は塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。)で示される化合物を塩基の存在下若しくは不存在下に、パラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【化4】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体の製造方法。
【請求項7】
一般式(4)
【化5】

(式中、Xは炭素原子又は窒素原子を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。Y2は、塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基を表す。)で示される化合物と、一般式(5)
【化6】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。R7は水素原子、炭素数1〜4のアルキル基又はフェニル基を表し、R7は夫々同一又は異なっていてもよい。また、2つのR7は酸素原子を介して結合するホウ素原子と一体となって環を形成することもできる。)で示される化合物を塩基及びパラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【化7】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体の製造方法。
【請求項8】
パラジウム触媒が、第三級ホスフィンを配位子として有するパラジウム触媒であることを特徴とする請求項6又は7に記載の1,3,5−トリアジン誘導体の製造方法。
【請求項9】
パラジウム触媒が、トリフェニルホスフィン、1,1’−ビス(ジフェニルホスフィノ)フェロセン又は2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニルを配位子として有するパラジウム触媒であることを特徴とする請求項6から8のいずれかに記載の1,3,5−トリアジン誘導体の製造方法。
【請求項10】
一般式(1)
【化8】

(式中、R1、R2及びR3は各々独立して水素原子又はメチル基を表す。Xは炭素原子又は窒素原子を表す。Ar1は置換されていてもよい芳香族炭化水素基を表す。Ar2は、1又は2つの窒素原子を有する縮環していてもよい六員芳香族複素環基であり、これらは炭素数1から4のアルキル基で置換されていてもよい。)で示される1,3,5−トリアジン誘導体を構成成分とする有機電界発光素子。
【図1】




【公開番号】特開2010−106018(P2010−106018A)
【公開日】平成22年5月13日(2010.5.13)
【国際特許分類】
【出願番号】特願2009−228113(P2009−228113)
【出願日】平成21年9月30日(2009.9.30)
【出願人】(000003300)東ソー株式会社 (1,901)
【出願人】(000173762)財団法人相模中央化学研究所 (151)
【Fターム(参考)】
【公開日】平成22年5月13日(2010.5.13)
【国際特許分類】
【出願日】平成21年9月30日(2009.9.30)
【出願人】(000003300)東ソー株式会社 (1,901)
【出願人】(000173762)財団法人相模中央化学研究所 (151)
【Fターム(参考)】
[ Back to top ]

