1,3,5−トリアジン誘導体とその製造方法及びそれを含有する有機電界発光素子
【課題】
有機電界発光素子の長期安定駆動を可能にする高いTgを有する1,3,5−トリアジン誘導体と、それを電子輸送材とする長寿命を備えた有機電界発光素子を提供する。
【解決手段】
一般式(1)
【化1】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体を製造し、これを構成成分とする有機電界発光素子を作製する。
有機電界発光素子の長期安定駆動を可能にする高いTgを有する1,3,5−トリアジン誘導体と、それを電子輸送材とする長寿命を備えた有機電界発光素子を提供する。
【解決手段】
一般式(1)
【化1】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体を製造し、これを構成成分とする有機電界発光素子を作製する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、有機電界発光素子の構成成分として有用なアントリル基で置換されたフェニル基又はアクリジニル基で置換されたフェニル基を有する1,3,5−トリアジン誘導体とその製造方法、及びそれを含有する有機電界発光素子に関する。
【背景技術】
【0002】
本発明の1,3,5−トリアジン誘導体は新規であり、トリアジン環の2,4位にアントリル基で置換されたフェニル基又はアクリジニル基で置換されたフェニル基を有することを特徴とすると共に、6位に芳香族炭化水素基を有することを特徴とする。
【0003】
特許文献1〜4には、本発明の化合物と類する1,3,5−トリアジン誘導体を有機電界発光素子に用いた例が開示されている。
【0004】
特許文献1及び2に開示されているトリアジン誘導体は、トリアジン環の2,4,6位に2,4−二置換フェニル基又は3,4−二置換フェニル基を有している点で、本発明の1,3,5−トリアジン誘導体とは異なるものである。
【0005】
また、特許文献3に記載されている1,3,5−トリアジン誘導体はトリアジン環の2,4,6位に同じメチル置換芳香族基を有する点で、本発明の1,3,5−トリアジン誘導体とは異なるものである。
【0006】
また、特許文献4に記載されている1,3,5−トリアジン誘導体は、フェニル基上の置換基の位置が限定されておらず、アントリル基で置換されたフェニル基又はアクリジニル基で置換されたフェニル基を有する本発明の1,3,5−トリアジン誘導体とは異なるものである。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許第6225467号公報
【特許文献2】特開2004−63465号公報
【特許文献3】特許第4106974号公報
【特許文献4】特開2007−137829号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
有機電界発光素子をディスプレー等に利用する際には、素子が長期間、安定に駆動することが望まれる。このためには、素子を構成する有機材料は高いガラス転移温度(Tg)を持つ必要があるが、これまで有機電界発光素子に用いる有機材料として報告されているものは100℃程度のTgを示すものが多く、十分ではなかった。
【課題を解決するための手段】
【0009】
本発明者らは、先の課題を解決すべく鋭意検討を重ねた結果、アントリル基で置換されたフェニル基又はアクリジニル基で置換されたフェニル基を1,3,5−トリアジン環に導入した本発明の1,3,5−トリアジン誘導体(1)が高いTgを示し、真空蒸着等の一般的な方法で非晶質の薄膜形成が可能であり、また、これらを電子輸送層として用いた有機電界発光素子が、汎用の有機電界発光素子に比べて長寿命化が達成できることを見出し、本発明を完成するに至った。
【0010】
すなわち本発明は、一般式(1)
【0011】
【化1】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体に関するものである。
【0012】
また本発明は、一般式(2)
【0013】
【化2】

(式中、Xは炭素原子又は窒素原子を表す。R1は水素原子、炭素数1〜4のアルキル基又はフェニル基を表す。又は、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成することもできる。)で示される有機ホウ素化合物と、一般式(3)
【0014】
【化3】

(式中、Arは置換されていてもよい芳香族炭化水素基を表す。Y1は脱離基を表す。)で示される化合物とを、塩基及びパラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【0015】
【化4】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体の製造方法に関するものである。
【0016】
また本発明は、一般式(4)
【0017】
【化5】

(式中、Xは炭素原子又は窒素原子を表す。Y2は脱離基を表す。)で示される化合物と、一般式(5)
【0018】
【化6】

(式中、Arは置換されていてもよい芳香族炭化水素基を表す。R1は水素原子、炭素数1〜4のアルキル基又はフェニル基を表す。又は、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成することもできる。)で示される化合物とを、塩基及びパラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【0019】
【化7】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体の製造方法に関するものである。
【0020】
さらに本発明は、一般式(1)
【0021】
【化8】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体を構成成分とする有機電界発光素子に関するものである。
【0022】
以下、本発明を詳細に説明する。
【0023】
Arで表される置換されていてもよい芳香族炭化水素基としては、置換されていてもよいフェニル基、置換されていてもよいナフチル基、置換されていてもよいアントリル基、置換されていてもよいペリレニル基又は置換されていてもよいトリフェニレニル基等を挙げることができる。合成容易であり、有機電界発光素子用材料としての性能がよい点で、置換されていてもよいフェニル基又は置換されていてもよいナフチル基が好ましく、さらにフェニル基、炭素数1から4のアルキル基で置換されたフェニル基、アリール基で置換されたフェニル基、又はナフチル基が好ましい。
【0024】
置換されていてもよいフェニル基としては、具体的にはフェニル基、p−トリル基、m−トリル基、o−トリル基、4−トリフルオロメチルフェニル基、3−トリフルオロメチルフェニル基、2−トリフルオロメチルフェニル基、2,4−ジメチルフェニル基、3,5−ジメチルフェニル基、メシチル基、2−エチルフェニル基、3−エチルフェニル基、4−エチルフェニル基、2,4−ジエチルフェニル基、3,5−ジエチルフェニル基、2−プロピルフェニル基、3−プロピルフェニル基、4−プロピルフェニル基、2,4−ジプロピルフェニル基、3,5−ジプロピルフェニル基、2−イソプロピルフェニル基、3−イソプロピルフェニル基、4−イソプロピルフェニル基、2,4−ジイソプロピルフェニル基、3,5−ジイソプロピルフェニル基、2−ブチルフェニル基、3−ブチルフェニル基、4−ブチルフェニル基、2,4−ジブチルフェニル基、3,5−ジブチルフェニル基、2−tert−ブチルフェニル基、3−tert−ブチルフェニル基、4−tert−ブチルフェニル基、2,4−ジ−tert−ブチルフェニル基、3,5−ジ−tert−ブチルフェニル基、3−クロロフェニル基、4−クロロフェニル基、3,4−ジクロロフェニル基、3,5−ジクロロフェニル基、3−ブロモフェニル基、4−ブロモフェニル基、3,4−ジブロモフェニル基、3,5−ジブロモフェニル基、4−ビフェニリル基、3−ビフェニリル基、2−ビフェニリル基、2−メチルビフェニル−4−イル基、3−メチルビフェニル−4−イル基、2’−メチルビフェニル−4−イル基、4’−メチルビフェニル−4−イル基、2,2’−ジメチルビフェニル−4−イル基、2’,4’,6’−トリメチルビフェニル−4−イル基、6−メチルビフェニル−3−イル基、5−メチルビフェニル−3−イル基、2’−メチルビフェニル−3−イル基、4’−メチルビフェニル−3−イル基、6,2’−ジメチルビフェニル−3−イル基、2’,4’,6’−トリメチルビフェニル−3−イル基、5−メチルビフェニル−2−イル基、6−メチルビフェニル−2−イル基、2’−メチルビフェニル−2−イル基、4’−メチルビフェニル−2−イル基、6,2’−ジメチルビフェニル−2−イル基、2’,4’,6’−トリメチルビフェニル−2−イル基、2−トリフルオロメチルビフェニル−4−イル基、3−トリフルオロメチルビフェニル−4−イル基、2’−トリフルオロメチルビフェニル−4−イル基、4’−トリフルオロメチルビフェニル−4−イル基、6−トリフルオロメチルビフェニル−3−イル基、5−トリフルオロメチルビフェニル−3−イル基、2’−トリフルオロメチルビフェニル−3−イル基、4’−トリフルオロメチルビフェニル−3−イル基、5−トリフルオロメチルビフェニル−2−イル基、6−トリフルオロメチルビフェニル−2−イル基、2’−トリフルオロメチルビフェニル−2−イル基、4’−トリフルオロメチルビフェニル−2−イル基、3−エチルビフェニル−4−イル基、4’−エチルビフェニル−4−イル基、2’,4’,6’−トリエチルビフェニル−4−イル基、6−エチルビフェニル−3−イル基、4’−エチルビフェニル−3−イル基、5−エチルビフェニル−2−イル基、4’−エチルビフェニル−2−イル基、2’,4’,6’−トリエチルビフェニル−2−イル基、3−プロピルビフェニル−4−イル基、4’−プロピルビフェニル−4−イル基、2’,4’,6’−トリプロピルビフェニル−4−イル基、6−プロピルビフェニル−3−イル基、4’−プロピルビフェニル−3−イル基、5−プロピルビフェニル−2−イル基、4’−プロピルビフェニル−2−イル基、2’,4’,6’−トリプロピルビフェニル−2−イル基、3−イソプロピルビフェニル−4−イル基、4’−イソプロピルビフェニル−4−イル基、2’,4’,6’−トリイソプロピルビフェニル−4−イル基、6−イソプロピルビフェニル−3−イル基、4’−イソプロピルビフェニル−3−イル基、5−イソプロピルビフェニル−2−イル基、4’−イソプロピルビフェニル−2−イル基、2’,4’,6’−トリイソプロピルビフェニル−2−イル基、3−ブチルビフェニル−4−イル基、4’−ブチルビフェニル−4−イル基、2’,4’,6’−トリブチルビフェニル−4−イル基、6−ブチルビフェニル−3−イル基、4’−ブチルビフェニル−3−イル基、5−ブチルビフェニル−2−イル基、4’−ブチルビフェニル−2−イル基、2’,4’,6’−トリブチルビフェニル−2−イル基、3−tert−ブチルビフェニル−4−イル基、4’−tert−ブチルビフェニル−4−イル基、2’,4’,6’−トリ−tert−ブチルビフェニル−4−イル基、6−tert−ブチルビフェニル−3−イル基、4’−tert−ブチルビフェニル−3−イル基、5−tert−ブチルビフェニル−2−イル基、4’−tert−ブチルビフェニル−2−イル基、2’,4’,6’−トリ−tert−ブチルビフェニル−2−イル基、1,1’:4’,1”−ターフェニル−3−イル基、1,1’:4’,1”−ターフェニル−4−イル基、1,1’:3’,1”−ターフェニル−3−イル基、1,1’:3’,1”−ターフェニル−4−イル基、1,1’:3’,1”−ターフェニル−5’−イル基、1,1’:2’,1”−ターフェニル−3−イル基、1,1’:2’,1”−ターフェニル−4−イル基、1,1’:2’,1”−ターフェニル−4’−イル基、3−(1−ナフチル)フェニル基、4−(1−ナフチル)フェニル基、3−(2−ナフチル)フェニル基、4−(2−ナフチル)フェニル基、3−(1−アントリル)フェニル基、3−(2−アントリル)フェニル基、3−(9−アントリル)フェニル基、4−(1−アントリル)フェニル基、4−(2−アントリル)フェニル基、4−(9−アントリル)フェニル基、3−(1−ペリレニル)フェニル基、3−(2−ペリレニル)フェニル基、4−(1−ペリレニル)フェニル基、4−(2−ペリレニル)フェニル基、3−トリフェニレニルフェニル基、4−トリフェニレニルフェニル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、フェニル基、p−トリル基、m−トリル基、o−トリル基、4−tert−ブチルフェニル基、4−ビフェニリル基、3−ビフェニリル基、1,1’:4’,1”−ターフェニル−4−イル基、1,1’:3’,1”−ターフェニル−5’−イル基、4−(1−ナフチル)フェニル基、4−(9−アントリル)フェニル基等が好ましい。
【0025】
また、置換されていてもよいナフチル基としては、具体的には1−ナフチル基、4−メチルナフタレン−1−イル基、4−トリフルオロメチルナフタレン−1−イル基、4−エチルナフタレン−1−イル基、4−プロピルナフタレン−1−イル基、4−ブチルナフタレン−1−イル基、4−tert−ブチルナフタレン−1−イル基、5−メチルナフタレン−1−イル基、5−トリフルオロメチルナフタレン−1−イル基、5−エチルナフタレン−1−イル基、5−プロピルナフタレン−1−イル基、5−ブチルナフタレン−1−イル基、5−tert−ブチルナフタレン−1−イル基、2−ナフチル基、6−メチルナフタレン−2−イル基、6−トリフルオロメチルナフタレン−2−イル基、6−エチルナフタレン−2−イル基、6−プロピルナフタレン−2−イル基、6−ブチルナフタレン−2−イル基、6−tert−ブチルナフタレン−2−イル基、7−メチルナフタレン−2−イル基、7−トリフルオロメチルナフタレン−2−イル基、7−エチルナフタレン−2−イル基、7−プロピルナフタレン−2−イル基、7−ブチルナフタレン−2−イル基、7−tert−ブチルナフタレン−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、1−ナフチル基、2−ナフチル基が好ましい。
【0026】
置換されていてもよいアントリル基、置換されていてもよいペリレニル基及び置換されていてもよいトリフェニレニル基としては、1−アントリル基、2−アントリル基、9−アントリル基、1−ペリレニル基、2−ペリレニル基又は1−トリフェニレニル基を挙げることができる。
【0027】
Xは、炭素原子又は窒素原子を表す。
【0028】
次に、本発明の製造方法について説明する。
【0029】
本発明の1,3,5−トリアジン誘導体(1)は、次の反応式
【0030】
【化9】

(式中、Arは置換されていてもよい芳香族炭化水素基を表す。Y1は脱離基を表す。R1は水素原子、炭素数1〜4のアルキル基又はフェニル基を表す。又は、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成することもできる。Xは炭素原子又は窒素原子を表す。)で示す方法により製造することができる。
【0031】
一般式(2)で示される有機ホウ素化合物は、例えば、Journal of the American Chemical Society,126巻,6637−6647,2004年に開示されている方法を用いて製造することができる。B(OR1)2としては、B(OH)2、B(OMe)2、B(O(2−プロピル))2、B(OBu)2等が例示できる。また、B(OR1)2において、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成した場合のB(OR1)2の例としては、次の(I)〜(VI)で示される基が例示でき、反応収率がよい点で(II)で示される基が好ましい。
【0032】
【化10】

一般式(3)で示される化合物は、例えば、特開2008−280330号公報(0147)−(0164)に開示されている方法を用いて製造することができる。
【0033】
「工程1」は、有機ホウ素化合物(2)を塩基及びパラジウム触媒の存在下に化合物(3)と反応させ、本発明の1,3,5−トリアジン誘導体(1)を製造する方法であり、鈴木−宮浦反応の一般的な触媒及び反応条件を適用することにより、反応収率よく目的物を得ることができる。反応に用いるパラジウム触媒と化合物(3)とのモル比は、1:200〜1:2が好ましく、反応収率がよい点で1:100〜1:10がさらに好ましい。
【0034】
「工程1」で用いることのできるパラジウム触媒としては、塩化パラジウム、酢酸パラジウム、トリフルオロ酢酸パラジウム、硝酸パラジウム等の塩を例示することができる。さらに、π−アリルパラジウムクロリドダイマー、パラジウムアセチルアセトナト、トリス(ジベンジリデンアセトン)ジパラジウム、ジクロロビス(トリフェニルホスフィン)パラジウム、テトラキス(トリフェニルホスフィン)パラジウム及びジクロロ(1,1’−ビス(ジフェニルホスフィノ)フェロセン)パラジウム等の錯化合物を例示することができる。中でも、第三級ホスフィンを配位子として有するパラジウム錯体は反応収率がよい点で好ましく、入手容易であり、反応収率がよい点で、トリフェニルホスフィン配位子として有するパラジウム錯体が特に好ましい。
【0035】
第三級ホスフィンを配位子として有するパラジウム錯体は、パラジウム塩又は錯化合物に第三級ホスフィンを添加し、反応系中で調製することもできる。この際用いることのできる第三級ホスフィンとしては、トリフェニルホスフィン、トリメチルホスフィン、トリブチルホスフィン、トリ(tert−ブチル)ホスフィン、トリシクロヘキシルホスフィン、tert−ブチルジフェニルホスフィン、9,9−ジメチル−4,5−ビス(ジフェニルホスフィノ)キサンテン、2−(ジフェニルホスフィノ)−2’−(N,N−ジメチルアミノ)ビフェニル、2−(ジ−tert−ブチルホスフィノ)ビフェニル、2−(ジシクロヘキシルホスフィノ)ビフェニル、ビス(ジフェニルホスフィノ)メタン、1,2−ビス(ジフェニルホスフィノ)エタン、1,3−ビス(ジフェニルホスフィノ)プロパン、1,4−ビス(ジフェニルホスフィノ)ブタン、1,1’−ビス(ジフェニルホスフィノ)フェロセン、トリ(2−フリル)ホスフィン、トリ(o−トリル)ホスフィン、トリス(2,5−キシリル)ホスフィン、(±)−2,2’−ビス(ジフェニルホスフィノ)−1,1’−ビナフチル、2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニル等が例示できる。入手容易であり、反応収率がよい点で、トリフェニルホスフィンが好ましい。第三級ホスフィンとパラジウム塩又は錯化合物とのモル比は、1:10〜10:1が好ましく、反応収率がよい点で1:2〜5:1がさらに好ましい。
【0036】
「工程1」で用いることのできる塩基としては、水酸化ナトリウム、水酸化カリウム、炭酸ナトリウム、炭酸カリウム、炭酸リチウム、炭酸セシウム、リン酸カリウム、リン酸ナトリウム、フッ化ナトリウム、フッ化カリウム、フッ化セシウム等を例示することができ、反応収率がよい点で炭酸セシウムが好ましい。塩基と化合物(2)とのモル比は、1:2〜10:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0037】
「工程1」で用いる化合物(2)と化合物(3)とのモル比は、1:1〜5:1が好ましく、反応収率がよい点で2:1〜3:1がさらに好ましい。
【0038】
「工程1」で用いることのできる溶媒として、水、ジメチルスルホキシド、ジメチルホルムアミド、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフランを用いることが好ましい。
【0039】
「工程1」の反応は、0℃〜150℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で50℃〜120℃の範囲で行うことがさらに好ましい。
【0040】
1,3,5−トリアジン誘導体(1)は、「工程1」の終了後に通常の処理を行うことで得ることができる。必要に応じて、再結晶、カラムクロマトグラフィー又は昇華等で精製してもよい。
【0041】
また、本発明の1,3,5−トリアジン誘導体(1)は、次の反応式
【0042】
【化11】

(式中、Arは置換されていてもよい芳香族炭化水素基を表す。R1は水素原子、炭素数1〜4のアルキル基又はフェニル基を表す。又は、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成することもできる。Xは炭素原子又は窒素原子を表す。Y2は脱離基を表す。)で示す方法によっても製造することができる。
【0043】
一般式(4)で示される化合物は、例えば、Journal of the American Chemical Society,127巻,12172−12173,2005年に開示されている方法を用いて製造することができる。
【0044】
Y2で表される脱離基としては、塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基が例示でき、反応収率及び選択性がよい点で臭素原子が好ましい。
【0045】
「工程2」は、有機ホウ素化合物(5)を塩基及びパラジウム触媒の存在下に化合物(4)と反応させ、本発明の1,3,5−トリアジン誘導体(1)を製造する方法であり、鈴木−宮浦反応の一般的な触媒及び反応条件を適用することにより、反応収率よく目的物を得ることができる。反応に用いるパラジウム触媒と化合物(4)とのモル比は、1:200〜1:2が好ましく、反応収率がよい点で1:100〜1:10がさらに好ましい。
【0046】
「工程2」で用いることのできるパラジウム触媒としては、「工程1」で例示したパラジウム触媒を挙げることができるが、中でも、第三級ホスフィンを配位子として有するパラジウム錯体は反応収率がよい点でさらに好ましく、入手容易であり、反応収率がよい点で、トリフェニルホスフィン配位子として有するパラジウム錯体が特に好ましい。
【0047】
第三級ホスフィンを配位子として有するパラジウム錯体は、パラジウム塩又は錯化合物に第三級ホスフィンを添加し、反応系中で調製することもできる。この際用いることのできる第三級ホスフィンとしては、「工程1」で例示した第三級ホスフィンを挙げることができるが、入手容易であり、反応収率がよい点で、トリフェニルホスフィンが好ましい。第三級ホスフィンとパラジウム塩又は錯化合物とのモル比は、1:10〜10:1が好ましく、反応収率がよい点で1:2〜5:1がさらに好ましい。
【0048】
「工程2」で用いることのできる塩基としては、「工程1」で例示した塩基を挙げることができるが、反応収率がよい点で炭酸セシウムが好ましい。塩基と化合物(5)とのモル比は、1:2〜10:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0049】
「工程2」で用いる化合物(5)と化合物(4)とのモル比は、1:1〜1:5が好ましく、反応収率がよい点で1:2〜1:3がさらに好ましい。
【0050】
「工程2」で用いることのできる溶媒として、水、ジメチルスルホキシド、ジメチルホルムアミド、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフランを用いることが好ましい。
【0051】
「工程2」の反応は、0℃〜150℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で50℃〜120℃の範囲で行うことがさらに好ましい。
【0052】
1,3,5−トリアジン誘導体(1)は、「工程2」の終了後に通常の処理を行うことで得ることができる。必要に応じて、再結晶、カラムクロマトグラフィー又は昇華等で精製してもよい。
【0053】
本発明の1,3,5−トリアジン誘導体(1)を製造する「工程2」の原料である化合物(5)は、例えば、次の反応式
【0054】
【化12】

(式中、Arは置換されていてもよい芳香族炭化水素基を表す。Y1は脱離基を表す。R1は水素原子、炭素数1〜4のアルキル基又はフェニル基を表す。又は、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成することもできる。)で示した方法により製造することができる。
【0055】
「工程3」は、化合物(3)を塩基及びパラジウム触媒の存在下に、一般式(6)で示されるボラン化合物、又は一般式(7)で示されるジボロン化合物と反応させることにより、「工程2」で用いる化合物(5)を製造する工程であり、例えば、Journal of Organic Chemistry,60巻,7508−7510,1995年又はJournal of Organic Chemistry,65巻,164−168,2000年に開示されている反応条件及び触媒を適用することにより、反応収率よく目的物を得ることができる。パラジウム触媒と化合物(3)とのモル比は、1:200〜1:2が好ましく、反応収率がよい点で1:50〜1:10がさらに好ましい。得られた化合物(5)は、反応後単離してもよいが、単離せずに「工程2」に供してもよい。
【0056】
「工程3」で用いることのできるパラジウム触媒としては、「工程1」で例示したパラジウム触媒を挙げることができるが、中でも、第三級ホスフィンを配位子として有するパラジウム錯体は反応収率がよい点でさらに好ましく、入手容易であり、反応収率がよい点で、トリフェニルホスフィン配位子として有するパラジウム錯体が特に好ましい。
【0057】
第三級ホスフィンを配位子として有するパラジウム錯体は、パラジウム塩又は錯化合物に第三級ホスフィンを添加し、反応系中で調製することもできる。この際用いることのできる第三級ホスフィンとしては、「工程1」で例示した第三級ホスフィンを挙げることができるが、入手容易であり、反応収率がよい点で、トリフェニルホスフィンが好ましい。第三級ホスフィンとパラジウム塩又は錯化合物とのモル比は、1:10〜10:1が好ましく、反応収率がよい点で1:2〜5:1がさらに好ましい。
【0058】
「工程3」で用いることのできる塩基としては、「工程1」で例示した塩基を挙げることができるが、反応収率がよい点で酢酸カリウムが好ましい。塩基と化合物(5)とのモル比は、1:2〜10:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0059】
「工程3」で用いるボラン化合物(6)又はジボロン化合物(7)と化合物(3)とのモル比は、1:1〜5:1が好ましく、反応収率がよい点で2:1〜3:1がさらに好ましい。
【0060】
「工程3」で用いることのできる溶媒として、水、ジメチルスルホキシド、ジメチルホルムアミド、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフランを用いることが好ましい。
【0061】
「工程3」の反応は、0℃〜150℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で50℃〜120℃の範囲で行うことがさらに好ましい。
【0062】
本発明の1,3,5−トリアジン誘導体(1)から成る有機電界発光素子用薄膜の製造方法に特に限定はないが、真空蒸着法による成膜が可能である。真空蒸着法による成膜は、汎用の真空蒸着装置を用いることにより行うことができる。真空蒸着法で膜を形成する際の真空槽の真空度は、有機電界発光素子作製の製造タクトタイムや製造コストを考慮すると、一般的に用いられる拡散ポンプ、タ−ボ分子ポンプ、クライオポンプ等により到達し得る1×10−2Pa〜1×10−5Pa程度が好ましい。蒸着速度は、形成する膜の厚さによるが0.005nm/秒〜1.0nm/秒が好ましい。また、1,3,5−トリアジン誘導体(1)は、クロロホルム、ジクロロメタン、1,2−ジクロロエタン、クロロベンゼン、トルエン、酢酸エチル又はテトラヒドロフラン等に対する溶解度が高いため、汎用の装置を用いたスピンコ−ト法、インクジェット法、キャスト法又はディップ法等による成膜も可能である。
【発明の効果】
【0063】
本発明の1,3,5−トリアジン誘導体(1)から成る薄膜は、高い表面平滑性、アモルファス性、耐熱性、電子輸送能、正孔ブロック能、酸化還元耐性、耐水性、耐酸素性、電子注入特性等をもつため、有機電界発光素子の材料として有用であり、とりわけ電子輸送材、正孔ブロック材、発光ホスト材等として用いることができる。従って、本発明の1,3,5−トリアジン誘導体(1)から成る薄膜は、低電圧で駆動可能であり、かつ長寿命の有機電界発光素子の構成成分として有用である。
【図面の簡単な説明】
【0064】
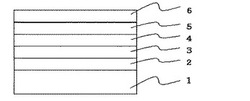
【図1】実施の形態(素子評価)で作製する有機電界発光素子の断面図である。
【実施例】
【0065】
以下、実施例及び参考例を挙げて本発明をさらに詳細に説明するが、本発明はこれらに限定されるものではない。
【0066】
1H−NMRスペクトルの測定には、Bruker社製 DPX250及びDPX500スペクトロメーターを使用した。
【0067】
また、実験で使用した試薬は、Sigma−Aldrich Co.Ltd.、東京化成工業株式会社、和光純薬工業株式会社、関東化学株式会社から購入し、必要に応じて精製したものを使用した。
実施例−1
【0068】
【化13】

アルゴン気流下、2−(9−アントリル)−4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン(3.26g)、2,4−ビス(3−ブロモフェニル)−6−フェニル−1,3,5−トリアジン(2.00g)、炭酸セシウム(3.49g)、ジクロロビストリフェニルホスフィンパラジウム(0.120g)をテトラヒドロフラン(120mL)に懸濁し、19時間還流した。反応混合物を放冷後、低沸点分を減圧留去し、メタノールを加えた。析出した固体をろ別し、シリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=2:1〜1:2)で精製し、目的の2,4−ビス[3−(9−アントリル)フェニル]−6−フェニル−1,3,5−トリアジンの黄色粉末(収量2.14g、反応収率76%)を得た。得られたトリアジン誘導体のTgは157℃であった。
【0069】
1H−NMR(CDCl3):δ7.37(ddd,J=8.4,3.0,1.3Hz,4H),7.45−7.56(m,7H),7.66−7.82(m,8H),8.11(d,J=8.4Hz,4H),8.58(s,2H),8.70(dd,J=8.3,1.7Hz,2H),8.85(t,J=1.5Hz,2H),8.94(brd,J=7.4Hz,2H).
実施例−2
【0070】
【化14】

アルゴン気流下、2−(9−アントリル)−4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン(0.727g)、2,4−ビス(3−ブロモフェニル)−6−(4−tert−ブチルフェニル)−1,3,5−トリアジン(0.500g)、炭酸セシウム(0.779g)、ジクロロビストリフェニルホスフィンパラジウム(26.8mg)をテトラヒドロフラン(20mL)に懸濁し、15時間還流した。反応混合物を放冷後、低沸点分を減圧留去し、メタノールを加えた。析出した固体をろ別し、シリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=3:1〜2:1)で精製し、目的の2,4−ビス[3−(9−アントリル)フェニル]−6−(4−tert−ブチルフェニル)−1,3,5−トリアジンの黄色粉末(収量0.504g、反応収率73%)を得た。
【0071】
1H−NMR(CDCl3):δ1.35(s,9H),7.37(brt,J=7.6Hz,4H),7.47−7.53(m,6H),7.66−7.81(m,8H),8.10(d,J=8.4Hz,4H),8.58(s,2H),8.60(d,J=8.6Hz,2H),8.84(t,J=1.5Hz,2H),8.94(brd,J=7.8Hz,2H).
13C−NMR(CDCl3):δ31.2(CH3×3),35.1(quart.),125.2(CH×4),125.6(CH×6),126.8(CH×4),126.8(CH×2),128.3(CH×2),128.4(CH×4),128.8(CH×2),128.9(CH×2),130.3(quart.×4),131.4(quart.×4),131.6(CH×2),133.4(quart.),135.3(CH×2),136.4(quart.×2),136.7(quart.×2),139.3(quart.×2),156.2(quart.),171.5(quart.×2),171.7(quart.).
実施例−3
【0072】
【化15】

アルゴン気流下、2−(9−アントリル)−4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン(0.420g)、2−(4−ビフェニリル)−4,6−ビス(3−ブロモフェニル)−1,3,5−トリアジン(0.300g)、炭酸セシウム(0.450g)、ジクロロビストリフェニルホスフィンパラジウム(15.5mg)をテトラヒドロフラン(20mL)に懸濁し、17時間還流した。反応混合物を放冷後、低沸点分を減圧留去し、メタノールを加えた。析出した固体をろ別し、シリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=4:1〜1:2)で精製し、目的の2,4−ビス[3−(9−アントリル)フェニル]−6−(4−ビフェニリル)−1,3,5−トリアジンの黄白色粉末(収量0.367g、反応収率90%)を得た。
【0073】
1H−NMR(CDCl3):δ7.35−7.53(m,11H),7.64−7.83(m,12H),8.11(d,J=8.4Hz,4H),8.58(s,2H),8.76(d,J=8.6Hz,2H),8.86(t,J=1.5Hz,2H),8.96(brd,J=7.9Hz,2H).
実施例−4
【0074】
【化16】

アルゴン気流下、2−(9−アントリル)−4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン(0.441g)、2,4−ビス(3−ブロモフェニル)−6−(2−ナフチル)−1,3,5−トリアジン(0.300g)、炭酸セシウム(0.472g)、ジクロロビストリフェニルホスフィンパラジウム(16.3mg)をテトラヒドロフラン(20mL)に懸濁し、19時間還流した。反応混合物を放冷後、低沸点分を減圧留去し、メタノールを加えた。析出した固体をろ別し、シリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=4:1〜1:1)で精製し、目的の2,4−ビス[3−(9−アントリル)フェニル]−6−(2−ナフチル)−1,3,5−トリアジンの黄白色粉末(収量0.378g、反応収率92%)を得た。
【0075】
1H−NMR(CDCl3):δ7.35−7.41(m,4H),7.48−7.57(m,6H),7.67−7.84(m,8H),7.91(t,J=8.5Hz,2H),8.02(d,J=7.3Hz,1H),8.11(d,J=8.4Hz,4H),8.59(s,2H),8.74(dd,J=8.7,1.6Hz,1H),8.89(brs,2H),8.99(brd,J=8.7Hz,2H),9.26(brs,1H).
実施例−5
【0076】
【化17】

アルゴン気流下、2−(9−アントリル)−4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン(0.335g)、2,4−ビス(3−ブロモフェニル)−6−(4−ブロモフェニル)−1,3,5−トリアジン(0.150g)、炭酸セシウム(0.358g)、ジクロロビストリフェニルホスフィンパラジウム(11.6mg)をテトラヒドロフラン(20mL)に懸濁し、26時間還流した。反応混合物を放冷後、低沸点分を減圧留去し、メタノールを加えた。析出した固体をろ別し、シリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=4:1〜1:2)で精製し、目的の2,4−ビス[3−(9−アントリル)フェニル]−6−[4−(9−アントリル)フェニル]−1,3,5−トリアジンの黄白色粉末(収量0.195g、反応収率85%)を得た。
【0077】
1H−NMR(CDCl3):δ7.31−7.54(m,12H),7.58(d,J=8.3Hz,2H),7.66−7.74(m,4H),7.75(d,J=8.7Hz,4H),7.81(t,J=7.8Hz,2H),8.07(d,J=9.0Hz,2H),8.10(d,J=8.6Hz,4H),8.53(s,1H),8.58(s,2H),8.81−8.92(m,2H),8.91(d,J=1.5Hz,2H),9.01(brd,J=7.8Hz,2H).
13C−NMR(CDCl3):δ125.2(CH×2),125.4(CH×4),125.6(CH×2),125.6(CH×4),126.6(CH×2),126.8(CH×4),126.9(CH×2),127.0(CH),128.4(CH×4),128.4(CH×4),128.9(CH×2),129.2(CH×2),130.0(quart.×2),130.4(quart.×4),131.4(quart.×2),131.4(quart.×4),131.6(CH×2),131.7(CH×2),135.3(quart.),135.5(CH×2),136.2(quart.),136.4(quart.×2),136.6(quart.×2),139.5(quart.×2),143.5(quart.),171.9(quart.×2),172.0(quart.).
実施例−6
【0078】
【化18】

アルゴン気流下、9−ブロモアクリジン(3.23g)、2−フェニル−4,6−ビス[3−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−1,3,5−トリアジン(2.81g)、炭酸セシウム(3.26g)、ジクロロビストリフェニルホスフィンパラジウム(0.175g)をテトラヒドロフラン(150mL)に懸濁し、18時間還流した。反応混合物を放冷後、低沸点分を減圧留去し、メタノールを加えた。析出した固体をろ別し、シリカゲルカラムクロマトグラフィー(展開溶媒 メタノール:クロロホルム=0:100〜1:66)で精製し、目的の2,4−ビス[3−(9−アクリジニル)フェニル]−6−フェニル−1,3,5−トリアジンの黄色粉末(収量2.18g、反応収率66%)を得た。得られたトリアジン誘導体のTgは159℃であった。
【0079】
1H−NMR(CDCl3):δ7.45−7.52(m,4H),7.58(brt,J=7.2Hz,1H),7.71(d,J=7.6Hz,2H),7.78(d,J=8.7Hz,4H),7.81−7.85(m,8H),8.35(d,J=8.7Hz,4H),8.70(brd,J=7.1Hz,2H),8.85(brs,2H),9.00(brd,J=7.7Hz,2H).
参考例−1
【0080】
【化19】

アルゴン下、還流管を取り付けた500mL三口反応容器に4−tert−ブチルベンゾイルクロリド(10.1g)と3−ブロモベンゾニトリル(18.6g)を取り、クロロベンゼン(150mL)を加えた。得られた溶液を0℃に冷却し、5塩化アンチモン(15.5g)を滴下した。混合物を室温で20分、さらに100℃で2.5時間還流した。得られた橙色懸濁液を−20℃に冷却し、28%アンモニア水溶液(100mL)を加えた。乳白色懸濁液を自然昇温で一晩攪拌した後、油浴を用いてゆっくり140℃まで加熱し、有機溶媒(100mL)と水(50mL)を留去した。クロロベンゼン(100mL×2)を加え、130℃で加熱ろ過した。ろ液を放冷後、メタノール(300mL)を加えた。析出した固体をろ取し、メタノール(50mL×2)で洗浄した後、乾燥することで2,4−ビス(3−ブロモフェニル)−6−(4−tert−ブチルフェニル)−1,3,5−トリアジンの白色粉末(収量12.5g、反応収率47%)を得た。
【0081】
1H−NMR(CDCl3):δ1.45(s,9H),7.47(t,J=7.9Hz,2H),7.63(d,J=8.4Hz,2H),7.76(brd,J=7.9Hz,2H),8.67(d,J=8.4Hz,2H),8.69(dt,J=7.9,1.3Hz,2H),8.87(t,J=1.7Hz,2H).
13C−NMR(CDCl3):δ31.3(CH3×3),35.2(quart.),123.0(quart.×2),125.8(CH×2),127.6(CH×2),129.0(CH×2),130.2(CH×2),131.9(CH×2),133.0(quart.),135.5(CH×2),138.2(quart.×2),156.7(quart.),170.5(quart.×2),172.0(quart.).
参考例−2
【0082】
【化20】

アルゴン下、還流管を取り付けた500mL三口反応容器に2−ナフトイルクロリド(10.0g)と3−ブロモベンゾニトリル(19.1g)を取り、クロロベンゼン(180mL)を加えた。得られた溶液を0℃に冷却し、5塩化アンチモン(15.7g)を滴下した。混合物を室温で20分、さらに100℃で2.5時間還流した。得られた赤色懸濁液を−20℃に冷却し、28%アンモニア水溶液(80mL)を加えた。乳白色懸濁液を自然昇温で一晩攪拌した後、油浴を用いてゆっくり140℃まで加熱し、有機溶媒(100mL)と水(45mL)を留去した。クロロベンゼン(100mL×2)を加え、130℃で加熱ろ過した。ろ液を放冷後、メタノール(600mL)を加えた。析出した固体をろ取し、メタノール(50mL×2)で洗浄した後、乾燥することで2,4−ビス(3−ブロモフェニル)−6−(2−ナフチル)−1,3,5−トリアジンの白色粉末(収量13.2g、反応収率49%)を得た。
【0083】
1H−NMR(CDCl3):δ7.42(t,J=7.9Hz,2H),7.50−7.58(m,2H),7.70(ddd,J=7.9,2.0,1.0Hz,2H),7.86−7.90(m,1H),7.96(d,J=8.7Hz,1H),8.04−8.08(m,1H),8.66−8.70(m,3H),8.85(t,J=1.7Hz,2H),9.24(s,1H).
13C−NMR(CDCl3):δ122.9(quart.×2),124.9(CH),126.5(CH),127.5(CH×2),127.9(CH),128.1(CH),128.3(CH),129.7(CH),130.1(CH),130.2(CH×2),131.8(CH×2),132.8(quart.),133.0(quart.),135.4(CH×2),135.8(quart.),137.9(quart.×2),170.2(quart.×2),171.7(quart.).
参考例−3
【0084】
【化21】

アルゴン下、還流管を取り付けた500mL三口反応容器に4−ブロモベンゾイルクロリド(10.2g)と3−ブロモベンゾニトリル(17.0g)を取り、クロロベンゼン(180mL)を加えた。得られた溶液を0℃に冷却し、5塩化アンチモン(14.1g)を滴下した。混合物を室温で20分、さらに100℃で2時間還流した。得られた橙色懸濁液を−20℃に冷却し、28%アンモニア水溶液(80mL)を加えた。乳白色懸濁液を自然昇温で一晩攪拌した後、油浴を用いてゆっくり140℃まで加熱し、有機溶媒(100mL)と水(40mL)を留去した。クロロベンゼン(100mL×2)を加え、130℃で加熱ろ過した。ろ液を放冷後、メタノール(200mL)を加えた。析出した固体をろ取し、メタノール(50mL×2)で洗浄した後、乾燥することで2,4−ビス(3−ブロモフェニル)−6−(4−ブロモフェニル)−1,3,5−トリアジンの白色粉末(収量11.1g、反応収率44%)を得た。
【0085】
1H−NMR(CDCl3):δ7.50(t,J=7.9Hz,2H),7.76(d,J=8.7Hz,2H),7.77−7.81(m,2H),8.65(d,J=8.7Hz,2H),8.71(dt,J=7.9,1.3Hz,2H),8.88(t,J=1.7Hz,2H).
13C−NMR(CDCl3):δ123.0(quart.×2),127.6(CH×2),128.0(quart.),130.3(CH×2),130.6(CH×2),131.9(CH×2),132.1(CH×2),134.6(quart.),135.7(CH×2),137.8(quart.×2),170.7(quart.×2),171.2(quart.).
参考例−4
【0086】
【化22】

アルゴン気流下、ビスピナコラートジボロン(7.15g)、2,4−ビス(3−ブロモフェニル)−6−フェニル−1,3,5−トリアジン(6.00g)、酢酸カリウム(5.54g)、ジクロロビストリフェニルホスフィンパラジウム(0.359g)をテトラヒドロフラン(200mL)に懸濁し、17.5時間還流した。反応混合物を放冷後、低沸点分を減圧留去し、クロロホルム(100mL)に溶解し、有機層を水(100mL)で洗浄した後、硫酸マグネシウムを用いて乾燥した。硫酸マグネシウムをろ別し、クロロホルムを減圧留去して得られた固体をシリカゲルカラムクロマトグラフィー(展開溶媒 クロロホルム)で精製し、目的の2−フェニル−4,6−ビス[3−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−1,3,5−トリアジンの白黄色粉末(収量7.10g、反応収率99%)を得た。
【0087】
1H−NMR(CDCl3):δ1.35(s,24H),7.50−7.56(m,5H),7.99(dt,J=7.3,1.2Hz,2H),8.76(brd,J=6.6Hz,2H),8.82(dt,J=7.9,1.6Hz,2H),9.10(brs,2H).
試験例−1
基板には2mm幅のITO(酸化インジウム錫)膜がストライプ状にパターンされた、ITO透明電極付きガラス基板を用いた。この基板をイソプロピルアルコールで洗浄した後、オゾン紫外線洗浄にて表面処理を行った。基板を真空蒸着槽に移し、槽内を3.6×10−6Torrまで減圧した後、抵抗加熱方式により加熱した2,4−ビス[3−(9−アントリル)フェニル]−6−フェニル−1,3,5−トリアジンを3〜5Å/SECの蒸着レートで真空蒸着した。触針式膜厚測定計(DEKTAK)で測定した成膜後の膜厚は1.8μmであった。基板上のITOストライプと直行にメタルマスクを配し、Al膜(2mm幅、膜厚100nm)を真空蒸着することで、移動度測定用の2mm角の動作エリアを得た。この基板を窒素雰囲気グローブボックス内(酸素・水分濃度1ppm以下)で封止し、移動度測定用素子を得た。封止は、エポキシ型紫外線硬化樹脂(ナガセケムテックス社製)を用いた。
【0088】
電荷輸送材料の移動度測定は任意の方法で測定することが出来るが、今回は一般的な測定方法であるタイムオブフライト移動度測定法を用いた。移動度測定装置は、株式会社オプテル社製を用いた。測定は室温で行い、窒素レーザをITO透明電極側から照射した時に発生した電荷のAl電極への移動速度から移動度を求めた。実施例−1で得られた2,4−ビス[3−(9−アントリル)フェニル]−6−フェニル−1,3,5−トリアジンの電子移動度は2.6×10−4cm2/V・SECであった。この値は、特開2002−158091号公報記載の電子輸送材料として一般的なヒドロキシキノリンアルミニウム錯体(Alq)の1×10−6cm2/V・SECと比較して高いものであった。
【0089】
実施の形態
1,3,5−トリアジンを構成成分とする有機電界発光素子の作製と性能評価
基板には、2mm幅の酸化インジウム−スズ(ITO)膜がストライプ状にパターンされたITO透明電極付きガラス基板を用いる。この基板をイソプロピルアルコールで洗浄した後、オゾン紫外線洗浄にて表面処理を行う。洗浄後の基板に、真空蒸着法で各層の真空蒸着を行い、断面図を図1に示すような発光面積が4mm2の有機電界発光素子を作製する。まず、真空蒸着槽内に前記ガラス基板を導入し、1.0×10−4Paまで減圧する。その後、図1の1で示す前記ガラス基板上に有機化合物層として、正孔注入層2、正孔輸送層3、発光層4及び電子輸送層5を順次成膜し、その後陰極層6を成膜する。正孔注入層2としては、昇華精製したフタロシアニン銅(II)を25nmの膜厚で真空蒸着する。正孔輸送層3としては、N,N’−ジ(ナフチレン−1−イル)−N,N’−ジフェニルベンジジン(NPD)を45nmの膜厚で真空蒸着する。発光層4としては、4,4’−ビス(2,2−ジフェニルエテン−1−イル)ジフェニル(DPVBi)と4,4’−ビス[4−(ジ−p−トリルアミノ)フェニルエテン−1−イル]ビフェニル(DPAVBi)を99:1質量%の割合で40nmの膜厚で真空蒸着する。電子輸送層5としては、本発明の1,3,5−トリアジン化合物もしくは既存材料のトリス(8−キノリノラト)アルミニウム(III)(Alq)を20nmの膜厚で真空蒸着する。なお、各有機材料は抵抗加熱方式により成膜し、加熱した化合物を0.3nm/秒〜0.5nm/秒の成膜速度で真空蒸着する。最後に、ITOストライプと直行するようにメタルマスクを配し、陰極層6を成膜する。陰極層6は、フッ化リチウムとアルミニウムをそれぞれ0.5nmと100nmの膜厚で真空蒸着し、2層構造とする。それぞれの膜厚は、触針式膜厚測定計(DEKTAK)で測定することができる。さらに、この素子を酸素及び水分濃度1ppm以下の窒素雰囲気グローブボックス内で封止することができる。封止は、ガラス製の封止キャップと前記成膜基板エポキシ型紫外線硬化樹脂(ナガセケムテックス社製)を用いることができる。
【0090】
作製した有機電界発光素子に直流電流を印加し、TOPCON社製のLUMINANCE METER(BM−9)の輝度計を用いて発光特性を評価する。発光特性として、電流密度20mA/cm2を流した時の電圧(V)、輝度(cd/m2)、電流効率(cd/A)、電力効率(lm/W)を測定し、連続点灯時の輝度半減時間を測定することができる。
【0091】
本発明の化合物を用いれば、既存材料に比較して、低消費電力化、長寿命化が期待される。
【産業上の利用可能性】
【0092】
本発明は、有機電界発光素子の構成成分として有用なアントリル基で置換されたフェニル基又はアクリジニルで置換されたフェニル基を有する1,3,5−トリアジン誘導体とその製造方法、及びそれを含有する有機電界発光素子に関する。
【符号の説明】
【0093】
1.ITO透明電極付きガラス基板
2.正孔注入層
3.正孔輸送層
4.発光層
5.電子輸送層
6.陰極層
【技術分野】
【0001】
本発明は、有機電界発光素子の構成成分として有用なアントリル基で置換されたフェニル基又はアクリジニル基で置換されたフェニル基を有する1,3,5−トリアジン誘導体とその製造方法、及びそれを含有する有機電界発光素子に関する。
【背景技術】
【0002】
本発明の1,3,5−トリアジン誘導体は新規であり、トリアジン環の2,4位にアントリル基で置換されたフェニル基又はアクリジニル基で置換されたフェニル基を有することを特徴とすると共に、6位に芳香族炭化水素基を有することを特徴とする。
【0003】
特許文献1〜4には、本発明の化合物と類する1,3,5−トリアジン誘導体を有機電界発光素子に用いた例が開示されている。
【0004】
特許文献1及び2に開示されているトリアジン誘導体は、トリアジン環の2,4,6位に2,4−二置換フェニル基又は3,4−二置換フェニル基を有している点で、本発明の1,3,5−トリアジン誘導体とは異なるものである。
【0005】
また、特許文献3に記載されている1,3,5−トリアジン誘導体はトリアジン環の2,4,6位に同じメチル置換芳香族基を有する点で、本発明の1,3,5−トリアジン誘導体とは異なるものである。
【0006】
また、特許文献4に記載されている1,3,5−トリアジン誘導体は、フェニル基上の置換基の位置が限定されておらず、アントリル基で置換されたフェニル基又はアクリジニル基で置換されたフェニル基を有する本発明の1,3,5−トリアジン誘導体とは異なるものである。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許第6225467号公報
【特許文献2】特開2004−63465号公報
【特許文献3】特許第4106974号公報
【特許文献4】特開2007−137829号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
有機電界発光素子をディスプレー等に利用する際には、素子が長期間、安定に駆動することが望まれる。このためには、素子を構成する有機材料は高いガラス転移温度(Tg)を持つ必要があるが、これまで有機電界発光素子に用いる有機材料として報告されているものは100℃程度のTgを示すものが多く、十分ではなかった。
【課題を解決するための手段】
【0009】
本発明者らは、先の課題を解決すべく鋭意検討を重ねた結果、アントリル基で置換されたフェニル基又はアクリジニル基で置換されたフェニル基を1,3,5−トリアジン環に導入した本発明の1,3,5−トリアジン誘導体(1)が高いTgを示し、真空蒸着等の一般的な方法で非晶質の薄膜形成が可能であり、また、これらを電子輸送層として用いた有機電界発光素子が、汎用の有機電界発光素子に比べて長寿命化が達成できることを見出し、本発明を完成するに至った。
【0010】
すなわち本発明は、一般式(1)
【0011】
【化1】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体に関するものである。
【0012】
また本発明は、一般式(2)
【0013】
【化2】

(式中、Xは炭素原子又は窒素原子を表す。R1は水素原子、炭素数1〜4のアルキル基又はフェニル基を表す。又は、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成することもできる。)で示される有機ホウ素化合物と、一般式(3)
【0014】
【化3】

(式中、Arは置換されていてもよい芳香族炭化水素基を表す。Y1は脱離基を表す。)で示される化合物とを、塩基及びパラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【0015】
【化4】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体の製造方法に関するものである。
【0016】
また本発明は、一般式(4)
【0017】
【化5】

(式中、Xは炭素原子又は窒素原子を表す。Y2は脱離基を表す。)で示される化合物と、一般式(5)
【0018】
【化6】

(式中、Arは置換されていてもよい芳香族炭化水素基を表す。R1は水素原子、炭素数1〜4のアルキル基又はフェニル基を表す。又は、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成することもできる。)で示される化合物とを、塩基及びパラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【0019】
【化7】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体の製造方法に関するものである。
【0020】
さらに本発明は、一般式(1)
【0021】
【化8】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体を構成成分とする有機電界発光素子に関するものである。
【0022】
以下、本発明を詳細に説明する。
【0023】
Arで表される置換されていてもよい芳香族炭化水素基としては、置換されていてもよいフェニル基、置換されていてもよいナフチル基、置換されていてもよいアントリル基、置換されていてもよいペリレニル基又は置換されていてもよいトリフェニレニル基等を挙げることができる。合成容易であり、有機電界発光素子用材料としての性能がよい点で、置換されていてもよいフェニル基又は置換されていてもよいナフチル基が好ましく、さらにフェニル基、炭素数1から4のアルキル基で置換されたフェニル基、アリール基で置換されたフェニル基、又はナフチル基が好ましい。
【0024】
置換されていてもよいフェニル基としては、具体的にはフェニル基、p−トリル基、m−トリル基、o−トリル基、4−トリフルオロメチルフェニル基、3−トリフルオロメチルフェニル基、2−トリフルオロメチルフェニル基、2,4−ジメチルフェニル基、3,5−ジメチルフェニル基、メシチル基、2−エチルフェニル基、3−エチルフェニル基、4−エチルフェニル基、2,4−ジエチルフェニル基、3,5−ジエチルフェニル基、2−プロピルフェニル基、3−プロピルフェニル基、4−プロピルフェニル基、2,4−ジプロピルフェニル基、3,5−ジプロピルフェニル基、2−イソプロピルフェニル基、3−イソプロピルフェニル基、4−イソプロピルフェニル基、2,4−ジイソプロピルフェニル基、3,5−ジイソプロピルフェニル基、2−ブチルフェニル基、3−ブチルフェニル基、4−ブチルフェニル基、2,4−ジブチルフェニル基、3,5−ジブチルフェニル基、2−tert−ブチルフェニル基、3−tert−ブチルフェニル基、4−tert−ブチルフェニル基、2,4−ジ−tert−ブチルフェニル基、3,5−ジ−tert−ブチルフェニル基、3−クロロフェニル基、4−クロロフェニル基、3,4−ジクロロフェニル基、3,5−ジクロロフェニル基、3−ブロモフェニル基、4−ブロモフェニル基、3,4−ジブロモフェニル基、3,5−ジブロモフェニル基、4−ビフェニリル基、3−ビフェニリル基、2−ビフェニリル基、2−メチルビフェニル−4−イル基、3−メチルビフェニル−4−イル基、2’−メチルビフェニル−4−イル基、4’−メチルビフェニル−4−イル基、2,2’−ジメチルビフェニル−4−イル基、2’,4’,6’−トリメチルビフェニル−4−イル基、6−メチルビフェニル−3−イル基、5−メチルビフェニル−3−イル基、2’−メチルビフェニル−3−イル基、4’−メチルビフェニル−3−イル基、6,2’−ジメチルビフェニル−3−イル基、2’,4’,6’−トリメチルビフェニル−3−イル基、5−メチルビフェニル−2−イル基、6−メチルビフェニル−2−イル基、2’−メチルビフェニル−2−イル基、4’−メチルビフェニル−2−イル基、6,2’−ジメチルビフェニル−2−イル基、2’,4’,6’−トリメチルビフェニル−2−イル基、2−トリフルオロメチルビフェニル−4−イル基、3−トリフルオロメチルビフェニル−4−イル基、2’−トリフルオロメチルビフェニル−4−イル基、4’−トリフルオロメチルビフェニル−4−イル基、6−トリフルオロメチルビフェニル−3−イル基、5−トリフルオロメチルビフェニル−3−イル基、2’−トリフルオロメチルビフェニル−3−イル基、4’−トリフルオロメチルビフェニル−3−イル基、5−トリフルオロメチルビフェニル−2−イル基、6−トリフルオロメチルビフェニル−2−イル基、2’−トリフルオロメチルビフェニル−2−イル基、4’−トリフルオロメチルビフェニル−2−イル基、3−エチルビフェニル−4−イル基、4’−エチルビフェニル−4−イル基、2’,4’,6’−トリエチルビフェニル−4−イル基、6−エチルビフェニル−3−イル基、4’−エチルビフェニル−3−イル基、5−エチルビフェニル−2−イル基、4’−エチルビフェニル−2−イル基、2’,4’,6’−トリエチルビフェニル−2−イル基、3−プロピルビフェニル−4−イル基、4’−プロピルビフェニル−4−イル基、2’,4’,6’−トリプロピルビフェニル−4−イル基、6−プロピルビフェニル−3−イル基、4’−プロピルビフェニル−3−イル基、5−プロピルビフェニル−2−イル基、4’−プロピルビフェニル−2−イル基、2’,4’,6’−トリプロピルビフェニル−2−イル基、3−イソプロピルビフェニル−4−イル基、4’−イソプロピルビフェニル−4−イル基、2’,4’,6’−トリイソプロピルビフェニル−4−イル基、6−イソプロピルビフェニル−3−イル基、4’−イソプロピルビフェニル−3−イル基、5−イソプロピルビフェニル−2−イル基、4’−イソプロピルビフェニル−2−イル基、2’,4’,6’−トリイソプロピルビフェニル−2−イル基、3−ブチルビフェニル−4−イル基、4’−ブチルビフェニル−4−イル基、2’,4’,6’−トリブチルビフェニル−4−イル基、6−ブチルビフェニル−3−イル基、4’−ブチルビフェニル−3−イル基、5−ブチルビフェニル−2−イル基、4’−ブチルビフェニル−2−イル基、2’,4’,6’−トリブチルビフェニル−2−イル基、3−tert−ブチルビフェニル−4−イル基、4’−tert−ブチルビフェニル−4−イル基、2’,4’,6’−トリ−tert−ブチルビフェニル−4−イル基、6−tert−ブチルビフェニル−3−イル基、4’−tert−ブチルビフェニル−3−イル基、5−tert−ブチルビフェニル−2−イル基、4’−tert−ブチルビフェニル−2−イル基、2’,4’,6’−トリ−tert−ブチルビフェニル−2−イル基、1,1’:4’,1”−ターフェニル−3−イル基、1,1’:4’,1”−ターフェニル−4−イル基、1,1’:3’,1”−ターフェニル−3−イル基、1,1’:3’,1”−ターフェニル−4−イル基、1,1’:3’,1”−ターフェニル−5’−イル基、1,1’:2’,1”−ターフェニル−3−イル基、1,1’:2’,1”−ターフェニル−4−イル基、1,1’:2’,1”−ターフェニル−4’−イル基、3−(1−ナフチル)フェニル基、4−(1−ナフチル)フェニル基、3−(2−ナフチル)フェニル基、4−(2−ナフチル)フェニル基、3−(1−アントリル)フェニル基、3−(2−アントリル)フェニル基、3−(9−アントリル)フェニル基、4−(1−アントリル)フェニル基、4−(2−アントリル)フェニル基、4−(9−アントリル)フェニル基、3−(1−ペリレニル)フェニル基、3−(2−ペリレニル)フェニル基、4−(1−ペリレニル)フェニル基、4−(2−ペリレニル)フェニル基、3−トリフェニレニルフェニル基、4−トリフェニレニルフェニル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、フェニル基、p−トリル基、m−トリル基、o−トリル基、4−tert−ブチルフェニル基、4−ビフェニリル基、3−ビフェニリル基、1,1’:4’,1”−ターフェニル−4−イル基、1,1’:3’,1”−ターフェニル−5’−イル基、4−(1−ナフチル)フェニル基、4−(9−アントリル)フェニル基等が好ましい。
【0025】
また、置換されていてもよいナフチル基としては、具体的には1−ナフチル基、4−メチルナフタレン−1−イル基、4−トリフルオロメチルナフタレン−1−イル基、4−エチルナフタレン−1−イル基、4−プロピルナフタレン−1−イル基、4−ブチルナフタレン−1−イル基、4−tert−ブチルナフタレン−1−イル基、5−メチルナフタレン−1−イル基、5−トリフルオロメチルナフタレン−1−イル基、5−エチルナフタレン−1−イル基、5−プロピルナフタレン−1−イル基、5−ブチルナフタレン−1−イル基、5−tert−ブチルナフタレン−1−イル基、2−ナフチル基、6−メチルナフタレン−2−イル基、6−トリフルオロメチルナフタレン−2−イル基、6−エチルナフタレン−2−イル基、6−プロピルナフタレン−2−イル基、6−ブチルナフタレン−2−イル基、6−tert−ブチルナフタレン−2−イル基、7−メチルナフタレン−2−イル基、7−トリフルオロメチルナフタレン−2−イル基、7−エチルナフタレン−2−イル基、7−プロピルナフタレン−2−イル基、7−ブチルナフタレン−2−イル基、7−tert−ブチルナフタレン−2−イル基等が挙げられる。有機電界発光素子用材料としての性能がよい点で、1−ナフチル基、2−ナフチル基が好ましい。
【0026】
置換されていてもよいアントリル基、置換されていてもよいペリレニル基及び置換されていてもよいトリフェニレニル基としては、1−アントリル基、2−アントリル基、9−アントリル基、1−ペリレニル基、2−ペリレニル基又は1−トリフェニレニル基を挙げることができる。
【0027】
Xは、炭素原子又は窒素原子を表す。
【0028】
次に、本発明の製造方法について説明する。
【0029】
本発明の1,3,5−トリアジン誘導体(1)は、次の反応式
【0030】
【化9】

(式中、Arは置換されていてもよい芳香族炭化水素基を表す。Y1は脱離基を表す。R1は水素原子、炭素数1〜4のアルキル基又はフェニル基を表す。又は、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成することもできる。Xは炭素原子又は窒素原子を表す。)で示す方法により製造することができる。
【0031】
一般式(2)で示される有機ホウ素化合物は、例えば、Journal of the American Chemical Society,126巻,6637−6647,2004年に開示されている方法を用いて製造することができる。B(OR1)2としては、B(OH)2、B(OMe)2、B(O(2−プロピル))2、B(OBu)2等が例示できる。また、B(OR1)2において、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成した場合のB(OR1)2の例としては、次の(I)〜(VI)で示される基が例示でき、反応収率がよい点で(II)で示される基が好ましい。
【0032】
【化10】

一般式(3)で示される化合物は、例えば、特開2008−280330号公報(0147)−(0164)に開示されている方法を用いて製造することができる。
【0033】
「工程1」は、有機ホウ素化合物(2)を塩基及びパラジウム触媒の存在下に化合物(3)と反応させ、本発明の1,3,5−トリアジン誘導体(1)を製造する方法であり、鈴木−宮浦反応の一般的な触媒及び反応条件を適用することにより、反応収率よく目的物を得ることができる。反応に用いるパラジウム触媒と化合物(3)とのモル比は、1:200〜1:2が好ましく、反応収率がよい点で1:100〜1:10がさらに好ましい。
【0034】
「工程1」で用いることのできるパラジウム触媒としては、塩化パラジウム、酢酸パラジウム、トリフルオロ酢酸パラジウム、硝酸パラジウム等の塩を例示することができる。さらに、π−アリルパラジウムクロリドダイマー、パラジウムアセチルアセトナト、トリス(ジベンジリデンアセトン)ジパラジウム、ジクロロビス(トリフェニルホスフィン)パラジウム、テトラキス(トリフェニルホスフィン)パラジウム及びジクロロ(1,1’−ビス(ジフェニルホスフィノ)フェロセン)パラジウム等の錯化合物を例示することができる。中でも、第三級ホスフィンを配位子として有するパラジウム錯体は反応収率がよい点で好ましく、入手容易であり、反応収率がよい点で、トリフェニルホスフィン配位子として有するパラジウム錯体が特に好ましい。
【0035】
第三級ホスフィンを配位子として有するパラジウム錯体は、パラジウム塩又は錯化合物に第三級ホスフィンを添加し、反応系中で調製することもできる。この際用いることのできる第三級ホスフィンとしては、トリフェニルホスフィン、トリメチルホスフィン、トリブチルホスフィン、トリ(tert−ブチル)ホスフィン、トリシクロヘキシルホスフィン、tert−ブチルジフェニルホスフィン、9,9−ジメチル−4,5−ビス(ジフェニルホスフィノ)キサンテン、2−(ジフェニルホスフィノ)−2’−(N,N−ジメチルアミノ)ビフェニル、2−(ジ−tert−ブチルホスフィノ)ビフェニル、2−(ジシクロヘキシルホスフィノ)ビフェニル、ビス(ジフェニルホスフィノ)メタン、1,2−ビス(ジフェニルホスフィノ)エタン、1,3−ビス(ジフェニルホスフィノ)プロパン、1,4−ビス(ジフェニルホスフィノ)ブタン、1,1’−ビス(ジフェニルホスフィノ)フェロセン、トリ(2−フリル)ホスフィン、トリ(o−トリル)ホスフィン、トリス(2,5−キシリル)ホスフィン、(±)−2,2’−ビス(ジフェニルホスフィノ)−1,1’−ビナフチル、2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニル等が例示できる。入手容易であり、反応収率がよい点で、トリフェニルホスフィンが好ましい。第三級ホスフィンとパラジウム塩又は錯化合物とのモル比は、1:10〜10:1が好ましく、反応収率がよい点で1:2〜5:1がさらに好ましい。
【0036】
「工程1」で用いることのできる塩基としては、水酸化ナトリウム、水酸化カリウム、炭酸ナトリウム、炭酸カリウム、炭酸リチウム、炭酸セシウム、リン酸カリウム、リン酸ナトリウム、フッ化ナトリウム、フッ化カリウム、フッ化セシウム等を例示することができ、反応収率がよい点で炭酸セシウムが好ましい。塩基と化合物(2)とのモル比は、1:2〜10:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0037】
「工程1」で用いる化合物(2)と化合物(3)とのモル比は、1:1〜5:1が好ましく、反応収率がよい点で2:1〜3:1がさらに好ましい。
【0038】
「工程1」で用いることのできる溶媒として、水、ジメチルスルホキシド、ジメチルホルムアミド、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフランを用いることが好ましい。
【0039】
「工程1」の反応は、0℃〜150℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で50℃〜120℃の範囲で行うことがさらに好ましい。
【0040】
1,3,5−トリアジン誘導体(1)は、「工程1」の終了後に通常の処理を行うことで得ることができる。必要に応じて、再結晶、カラムクロマトグラフィー又は昇華等で精製してもよい。
【0041】
また、本発明の1,3,5−トリアジン誘導体(1)は、次の反応式
【0042】
【化11】

(式中、Arは置換されていてもよい芳香族炭化水素基を表す。R1は水素原子、炭素数1〜4のアルキル基又はフェニル基を表す。又は、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成することもできる。Xは炭素原子又は窒素原子を表す。Y2は脱離基を表す。)で示す方法によっても製造することができる。
【0043】
一般式(4)で示される化合物は、例えば、Journal of the American Chemical Society,127巻,12172−12173,2005年に開示されている方法を用いて製造することができる。
【0044】
Y2で表される脱離基としては、塩素原子、臭素原子、ヨウ素原子又はトリフルオロメタンスルホキシ基が例示でき、反応収率及び選択性がよい点で臭素原子が好ましい。
【0045】
「工程2」は、有機ホウ素化合物(5)を塩基及びパラジウム触媒の存在下に化合物(4)と反応させ、本発明の1,3,5−トリアジン誘導体(1)を製造する方法であり、鈴木−宮浦反応の一般的な触媒及び反応条件を適用することにより、反応収率よく目的物を得ることができる。反応に用いるパラジウム触媒と化合物(4)とのモル比は、1:200〜1:2が好ましく、反応収率がよい点で1:100〜1:10がさらに好ましい。
【0046】
「工程2」で用いることのできるパラジウム触媒としては、「工程1」で例示したパラジウム触媒を挙げることができるが、中でも、第三級ホスフィンを配位子として有するパラジウム錯体は反応収率がよい点でさらに好ましく、入手容易であり、反応収率がよい点で、トリフェニルホスフィン配位子として有するパラジウム錯体が特に好ましい。
【0047】
第三級ホスフィンを配位子として有するパラジウム錯体は、パラジウム塩又は錯化合物に第三級ホスフィンを添加し、反応系中で調製することもできる。この際用いることのできる第三級ホスフィンとしては、「工程1」で例示した第三級ホスフィンを挙げることができるが、入手容易であり、反応収率がよい点で、トリフェニルホスフィンが好ましい。第三級ホスフィンとパラジウム塩又は錯化合物とのモル比は、1:10〜10:1が好ましく、反応収率がよい点で1:2〜5:1がさらに好ましい。
【0048】
「工程2」で用いることのできる塩基としては、「工程1」で例示した塩基を挙げることができるが、反応収率がよい点で炭酸セシウムが好ましい。塩基と化合物(5)とのモル比は、1:2〜10:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0049】
「工程2」で用いる化合物(5)と化合物(4)とのモル比は、1:1〜1:5が好ましく、反応収率がよい点で1:2〜1:3がさらに好ましい。
【0050】
「工程2」で用いることのできる溶媒として、水、ジメチルスルホキシド、ジメチルホルムアミド、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフランを用いることが好ましい。
【0051】
「工程2」の反応は、0℃〜150℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で50℃〜120℃の範囲で行うことがさらに好ましい。
【0052】
1,3,5−トリアジン誘導体(1)は、「工程2」の終了後に通常の処理を行うことで得ることができる。必要に応じて、再結晶、カラムクロマトグラフィー又は昇華等で精製してもよい。
【0053】
本発明の1,3,5−トリアジン誘導体(1)を製造する「工程2」の原料である化合物(5)は、例えば、次の反応式
【0054】
【化12】

(式中、Arは置換されていてもよい芳香族炭化水素基を表す。Y1は脱離基を表す。R1は水素原子、炭素数1〜4のアルキル基又はフェニル基を表す。又は、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成することもできる。)で示した方法により製造することができる。
【0055】
「工程3」は、化合物(3)を塩基及びパラジウム触媒の存在下に、一般式(6)で示されるボラン化合物、又は一般式(7)で示されるジボロン化合物と反応させることにより、「工程2」で用いる化合物(5)を製造する工程であり、例えば、Journal of Organic Chemistry,60巻,7508−7510,1995年又はJournal of Organic Chemistry,65巻,164−168,2000年に開示されている反応条件及び触媒を適用することにより、反応収率よく目的物を得ることができる。パラジウム触媒と化合物(3)とのモル比は、1:200〜1:2が好ましく、反応収率がよい点で1:50〜1:10がさらに好ましい。得られた化合物(5)は、反応後単離してもよいが、単離せずに「工程2」に供してもよい。
【0056】
「工程3」で用いることのできるパラジウム触媒としては、「工程1」で例示したパラジウム触媒を挙げることができるが、中でも、第三級ホスフィンを配位子として有するパラジウム錯体は反応収率がよい点でさらに好ましく、入手容易であり、反応収率がよい点で、トリフェニルホスフィン配位子として有するパラジウム錯体が特に好ましい。
【0057】
第三級ホスフィンを配位子として有するパラジウム錯体は、パラジウム塩又は錯化合物に第三級ホスフィンを添加し、反応系中で調製することもできる。この際用いることのできる第三級ホスフィンとしては、「工程1」で例示した第三級ホスフィンを挙げることができるが、入手容易であり、反応収率がよい点で、トリフェニルホスフィンが好ましい。第三級ホスフィンとパラジウム塩又は錯化合物とのモル比は、1:10〜10:1が好ましく、反応収率がよい点で1:2〜5:1がさらに好ましい。
【0058】
「工程3」で用いることのできる塩基としては、「工程1」で例示した塩基を挙げることができるが、反応収率がよい点で酢酸カリウムが好ましい。塩基と化合物(5)とのモル比は、1:2〜10:1が好ましく、反応収率がよい点で1:1〜3:1がさらに好ましい。
【0059】
「工程3」で用いるボラン化合物(6)又はジボロン化合物(7)と化合物(3)とのモル比は、1:1〜5:1が好ましく、反応収率がよい点で2:1〜3:1がさらに好ましい。
【0060】
「工程3」で用いることのできる溶媒として、水、ジメチルスルホキシド、ジメチルホルムアミド、テトラヒドロフラン、トルエン、ベンゼン、ジエチルエーテル又はキシレン等が例示でき、これらを適宜組み合わせて用いてもよい。反応収率がよい点でテトラヒドロフランを用いることが好ましい。
【0061】
「工程3」の反応は、0℃〜150℃の範囲から適宜選ばれた温度で実施することができ、反応収率がよい点で50℃〜120℃の範囲で行うことがさらに好ましい。
【0062】
本発明の1,3,5−トリアジン誘導体(1)から成る有機電界発光素子用薄膜の製造方法に特に限定はないが、真空蒸着法による成膜が可能である。真空蒸着法による成膜は、汎用の真空蒸着装置を用いることにより行うことができる。真空蒸着法で膜を形成する際の真空槽の真空度は、有機電界発光素子作製の製造タクトタイムや製造コストを考慮すると、一般的に用いられる拡散ポンプ、タ−ボ分子ポンプ、クライオポンプ等により到達し得る1×10−2Pa〜1×10−5Pa程度が好ましい。蒸着速度は、形成する膜の厚さによるが0.005nm/秒〜1.0nm/秒が好ましい。また、1,3,5−トリアジン誘導体(1)は、クロロホルム、ジクロロメタン、1,2−ジクロロエタン、クロロベンゼン、トルエン、酢酸エチル又はテトラヒドロフラン等に対する溶解度が高いため、汎用の装置を用いたスピンコ−ト法、インクジェット法、キャスト法又はディップ法等による成膜も可能である。
【発明の効果】
【0063】
本発明の1,3,5−トリアジン誘導体(1)から成る薄膜は、高い表面平滑性、アモルファス性、耐熱性、電子輸送能、正孔ブロック能、酸化還元耐性、耐水性、耐酸素性、電子注入特性等をもつため、有機電界発光素子の材料として有用であり、とりわけ電子輸送材、正孔ブロック材、発光ホスト材等として用いることができる。従って、本発明の1,3,5−トリアジン誘導体(1)から成る薄膜は、低電圧で駆動可能であり、かつ長寿命の有機電界発光素子の構成成分として有用である。
【図面の簡単な説明】
【0064】
【図1】実施の形態(素子評価)で作製する有機電界発光素子の断面図である。
【実施例】
【0065】
以下、実施例及び参考例を挙げて本発明をさらに詳細に説明するが、本発明はこれらに限定されるものではない。
【0066】
1H−NMRスペクトルの測定には、Bruker社製 DPX250及びDPX500スペクトロメーターを使用した。
【0067】
また、実験で使用した試薬は、Sigma−Aldrich Co.Ltd.、東京化成工業株式会社、和光純薬工業株式会社、関東化学株式会社から購入し、必要に応じて精製したものを使用した。
実施例−1
【0068】
【化13】

アルゴン気流下、2−(9−アントリル)−4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン(3.26g)、2,4−ビス(3−ブロモフェニル)−6−フェニル−1,3,5−トリアジン(2.00g)、炭酸セシウム(3.49g)、ジクロロビストリフェニルホスフィンパラジウム(0.120g)をテトラヒドロフラン(120mL)に懸濁し、19時間還流した。反応混合物を放冷後、低沸点分を減圧留去し、メタノールを加えた。析出した固体をろ別し、シリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=2:1〜1:2)で精製し、目的の2,4−ビス[3−(9−アントリル)フェニル]−6−フェニル−1,3,5−トリアジンの黄色粉末(収量2.14g、反応収率76%)を得た。得られたトリアジン誘導体のTgは157℃であった。
【0069】
1H−NMR(CDCl3):δ7.37(ddd,J=8.4,3.0,1.3Hz,4H),7.45−7.56(m,7H),7.66−7.82(m,8H),8.11(d,J=8.4Hz,4H),8.58(s,2H),8.70(dd,J=8.3,1.7Hz,2H),8.85(t,J=1.5Hz,2H),8.94(brd,J=7.4Hz,2H).
実施例−2
【0070】
【化14】

アルゴン気流下、2−(9−アントリル)−4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン(0.727g)、2,4−ビス(3−ブロモフェニル)−6−(4−tert−ブチルフェニル)−1,3,5−トリアジン(0.500g)、炭酸セシウム(0.779g)、ジクロロビストリフェニルホスフィンパラジウム(26.8mg)をテトラヒドロフラン(20mL)に懸濁し、15時間還流した。反応混合物を放冷後、低沸点分を減圧留去し、メタノールを加えた。析出した固体をろ別し、シリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=3:1〜2:1)で精製し、目的の2,4−ビス[3−(9−アントリル)フェニル]−6−(4−tert−ブチルフェニル)−1,3,5−トリアジンの黄色粉末(収量0.504g、反応収率73%)を得た。
【0071】
1H−NMR(CDCl3):δ1.35(s,9H),7.37(brt,J=7.6Hz,4H),7.47−7.53(m,6H),7.66−7.81(m,8H),8.10(d,J=8.4Hz,4H),8.58(s,2H),8.60(d,J=8.6Hz,2H),8.84(t,J=1.5Hz,2H),8.94(brd,J=7.8Hz,2H).
13C−NMR(CDCl3):δ31.2(CH3×3),35.1(quart.),125.2(CH×4),125.6(CH×6),126.8(CH×4),126.8(CH×2),128.3(CH×2),128.4(CH×4),128.8(CH×2),128.9(CH×2),130.3(quart.×4),131.4(quart.×4),131.6(CH×2),133.4(quart.),135.3(CH×2),136.4(quart.×2),136.7(quart.×2),139.3(quart.×2),156.2(quart.),171.5(quart.×2),171.7(quart.).
実施例−3
【0072】
【化15】

アルゴン気流下、2−(9−アントリル)−4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン(0.420g)、2−(4−ビフェニリル)−4,6−ビス(3−ブロモフェニル)−1,3,5−トリアジン(0.300g)、炭酸セシウム(0.450g)、ジクロロビストリフェニルホスフィンパラジウム(15.5mg)をテトラヒドロフラン(20mL)に懸濁し、17時間還流した。反応混合物を放冷後、低沸点分を減圧留去し、メタノールを加えた。析出した固体をろ別し、シリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=4:1〜1:2)で精製し、目的の2,4−ビス[3−(9−アントリル)フェニル]−6−(4−ビフェニリル)−1,3,5−トリアジンの黄白色粉末(収量0.367g、反応収率90%)を得た。
【0073】
1H−NMR(CDCl3):δ7.35−7.53(m,11H),7.64−7.83(m,12H),8.11(d,J=8.4Hz,4H),8.58(s,2H),8.76(d,J=8.6Hz,2H),8.86(t,J=1.5Hz,2H),8.96(brd,J=7.9Hz,2H).
実施例−4
【0074】
【化16】

アルゴン気流下、2−(9−アントリル)−4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン(0.441g)、2,4−ビス(3−ブロモフェニル)−6−(2−ナフチル)−1,3,5−トリアジン(0.300g)、炭酸セシウム(0.472g)、ジクロロビストリフェニルホスフィンパラジウム(16.3mg)をテトラヒドロフラン(20mL)に懸濁し、19時間還流した。反応混合物を放冷後、低沸点分を減圧留去し、メタノールを加えた。析出した固体をろ別し、シリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=4:1〜1:1)で精製し、目的の2,4−ビス[3−(9−アントリル)フェニル]−6−(2−ナフチル)−1,3,5−トリアジンの黄白色粉末(収量0.378g、反応収率92%)を得た。
【0075】
1H−NMR(CDCl3):δ7.35−7.41(m,4H),7.48−7.57(m,6H),7.67−7.84(m,8H),7.91(t,J=8.5Hz,2H),8.02(d,J=7.3Hz,1H),8.11(d,J=8.4Hz,4H),8.59(s,2H),8.74(dd,J=8.7,1.6Hz,1H),8.89(brs,2H),8.99(brd,J=8.7Hz,2H),9.26(brs,1H).
実施例−5
【0076】
【化17】

アルゴン気流下、2−(9−アントリル)−4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン(0.335g)、2,4−ビス(3−ブロモフェニル)−6−(4−ブロモフェニル)−1,3,5−トリアジン(0.150g)、炭酸セシウム(0.358g)、ジクロロビストリフェニルホスフィンパラジウム(11.6mg)をテトラヒドロフラン(20mL)に懸濁し、26時間還流した。反応混合物を放冷後、低沸点分を減圧留去し、メタノールを加えた。析出した固体をろ別し、シリカゲルカラムクロマトグラフィー(展開溶媒 ヘキサン:クロロホルム=4:1〜1:2)で精製し、目的の2,4−ビス[3−(9−アントリル)フェニル]−6−[4−(9−アントリル)フェニル]−1,3,5−トリアジンの黄白色粉末(収量0.195g、反応収率85%)を得た。
【0077】
1H−NMR(CDCl3):δ7.31−7.54(m,12H),7.58(d,J=8.3Hz,2H),7.66−7.74(m,4H),7.75(d,J=8.7Hz,4H),7.81(t,J=7.8Hz,2H),8.07(d,J=9.0Hz,2H),8.10(d,J=8.6Hz,4H),8.53(s,1H),8.58(s,2H),8.81−8.92(m,2H),8.91(d,J=1.5Hz,2H),9.01(brd,J=7.8Hz,2H).
13C−NMR(CDCl3):δ125.2(CH×2),125.4(CH×4),125.6(CH×2),125.6(CH×4),126.6(CH×2),126.8(CH×4),126.9(CH×2),127.0(CH),128.4(CH×4),128.4(CH×4),128.9(CH×2),129.2(CH×2),130.0(quart.×2),130.4(quart.×4),131.4(quart.×2),131.4(quart.×4),131.6(CH×2),131.7(CH×2),135.3(quart.),135.5(CH×2),136.2(quart.),136.4(quart.×2),136.6(quart.×2),139.5(quart.×2),143.5(quart.),171.9(quart.×2),172.0(quart.).
実施例−6
【0078】
【化18】

アルゴン気流下、9−ブロモアクリジン(3.23g)、2−フェニル−4,6−ビス[3−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−1,3,5−トリアジン(2.81g)、炭酸セシウム(3.26g)、ジクロロビストリフェニルホスフィンパラジウム(0.175g)をテトラヒドロフラン(150mL)に懸濁し、18時間還流した。反応混合物を放冷後、低沸点分を減圧留去し、メタノールを加えた。析出した固体をろ別し、シリカゲルカラムクロマトグラフィー(展開溶媒 メタノール:クロロホルム=0:100〜1:66)で精製し、目的の2,4−ビス[3−(9−アクリジニル)フェニル]−6−フェニル−1,3,5−トリアジンの黄色粉末(収量2.18g、反応収率66%)を得た。得られたトリアジン誘導体のTgは159℃であった。
【0079】
1H−NMR(CDCl3):δ7.45−7.52(m,4H),7.58(brt,J=7.2Hz,1H),7.71(d,J=7.6Hz,2H),7.78(d,J=8.7Hz,4H),7.81−7.85(m,8H),8.35(d,J=8.7Hz,4H),8.70(brd,J=7.1Hz,2H),8.85(brs,2H),9.00(brd,J=7.7Hz,2H).
参考例−1
【0080】
【化19】

アルゴン下、還流管を取り付けた500mL三口反応容器に4−tert−ブチルベンゾイルクロリド(10.1g)と3−ブロモベンゾニトリル(18.6g)を取り、クロロベンゼン(150mL)を加えた。得られた溶液を0℃に冷却し、5塩化アンチモン(15.5g)を滴下した。混合物を室温で20分、さらに100℃で2.5時間還流した。得られた橙色懸濁液を−20℃に冷却し、28%アンモニア水溶液(100mL)を加えた。乳白色懸濁液を自然昇温で一晩攪拌した後、油浴を用いてゆっくり140℃まで加熱し、有機溶媒(100mL)と水(50mL)を留去した。クロロベンゼン(100mL×2)を加え、130℃で加熱ろ過した。ろ液を放冷後、メタノール(300mL)を加えた。析出した固体をろ取し、メタノール(50mL×2)で洗浄した後、乾燥することで2,4−ビス(3−ブロモフェニル)−6−(4−tert−ブチルフェニル)−1,3,5−トリアジンの白色粉末(収量12.5g、反応収率47%)を得た。
【0081】
1H−NMR(CDCl3):δ1.45(s,9H),7.47(t,J=7.9Hz,2H),7.63(d,J=8.4Hz,2H),7.76(brd,J=7.9Hz,2H),8.67(d,J=8.4Hz,2H),8.69(dt,J=7.9,1.3Hz,2H),8.87(t,J=1.7Hz,2H).
13C−NMR(CDCl3):δ31.3(CH3×3),35.2(quart.),123.0(quart.×2),125.8(CH×2),127.6(CH×2),129.0(CH×2),130.2(CH×2),131.9(CH×2),133.0(quart.),135.5(CH×2),138.2(quart.×2),156.7(quart.),170.5(quart.×2),172.0(quart.).
参考例−2
【0082】
【化20】

アルゴン下、還流管を取り付けた500mL三口反応容器に2−ナフトイルクロリド(10.0g)と3−ブロモベンゾニトリル(19.1g)を取り、クロロベンゼン(180mL)を加えた。得られた溶液を0℃に冷却し、5塩化アンチモン(15.7g)を滴下した。混合物を室温で20分、さらに100℃で2.5時間還流した。得られた赤色懸濁液を−20℃に冷却し、28%アンモニア水溶液(80mL)を加えた。乳白色懸濁液を自然昇温で一晩攪拌した後、油浴を用いてゆっくり140℃まで加熱し、有機溶媒(100mL)と水(45mL)を留去した。クロロベンゼン(100mL×2)を加え、130℃で加熱ろ過した。ろ液を放冷後、メタノール(600mL)を加えた。析出した固体をろ取し、メタノール(50mL×2)で洗浄した後、乾燥することで2,4−ビス(3−ブロモフェニル)−6−(2−ナフチル)−1,3,5−トリアジンの白色粉末(収量13.2g、反応収率49%)を得た。
【0083】
1H−NMR(CDCl3):δ7.42(t,J=7.9Hz,2H),7.50−7.58(m,2H),7.70(ddd,J=7.9,2.0,1.0Hz,2H),7.86−7.90(m,1H),7.96(d,J=8.7Hz,1H),8.04−8.08(m,1H),8.66−8.70(m,3H),8.85(t,J=1.7Hz,2H),9.24(s,1H).
13C−NMR(CDCl3):δ122.9(quart.×2),124.9(CH),126.5(CH),127.5(CH×2),127.9(CH),128.1(CH),128.3(CH),129.7(CH),130.1(CH),130.2(CH×2),131.8(CH×2),132.8(quart.),133.0(quart.),135.4(CH×2),135.8(quart.),137.9(quart.×2),170.2(quart.×2),171.7(quart.).
参考例−3
【0084】
【化21】

アルゴン下、還流管を取り付けた500mL三口反応容器に4−ブロモベンゾイルクロリド(10.2g)と3−ブロモベンゾニトリル(17.0g)を取り、クロロベンゼン(180mL)を加えた。得られた溶液を0℃に冷却し、5塩化アンチモン(14.1g)を滴下した。混合物を室温で20分、さらに100℃で2時間還流した。得られた橙色懸濁液を−20℃に冷却し、28%アンモニア水溶液(80mL)を加えた。乳白色懸濁液を自然昇温で一晩攪拌した後、油浴を用いてゆっくり140℃まで加熱し、有機溶媒(100mL)と水(40mL)を留去した。クロロベンゼン(100mL×2)を加え、130℃で加熱ろ過した。ろ液を放冷後、メタノール(200mL)を加えた。析出した固体をろ取し、メタノール(50mL×2)で洗浄した後、乾燥することで2,4−ビス(3−ブロモフェニル)−6−(4−ブロモフェニル)−1,3,5−トリアジンの白色粉末(収量11.1g、反応収率44%)を得た。
【0085】
1H−NMR(CDCl3):δ7.50(t,J=7.9Hz,2H),7.76(d,J=8.7Hz,2H),7.77−7.81(m,2H),8.65(d,J=8.7Hz,2H),8.71(dt,J=7.9,1.3Hz,2H),8.88(t,J=1.7Hz,2H).
13C−NMR(CDCl3):δ123.0(quart.×2),127.6(CH×2),128.0(quart.),130.3(CH×2),130.6(CH×2),131.9(CH×2),132.1(CH×2),134.6(quart.),135.7(CH×2),137.8(quart.×2),170.7(quart.×2),171.2(quart.).
参考例−4
【0086】
【化22】

アルゴン気流下、ビスピナコラートジボロン(7.15g)、2,4−ビス(3−ブロモフェニル)−6−フェニル−1,3,5−トリアジン(6.00g)、酢酸カリウム(5.54g)、ジクロロビストリフェニルホスフィンパラジウム(0.359g)をテトラヒドロフラン(200mL)に懸濁し、17.5時間還流した。反応混合物を放冷後、低沸点分を減圧留去し、クロロホルム(100mL)に溶解し、有機層を水(100mL)で洗浄した後、硫酸マグネシウムを用いて乾燥した。硫酸マグネシウムをろ別し、クロロホルムを減圧留去して得られた固体をシリカゲルカラムクロマトグラフィー(展開溶媒 クロロホルム)で精製し、目的の2−フェニル−4,6−ビス[3−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)フェニル]−1,3,5−トリアジンの白黄色粉末(収量7.10g、反応収率99%)を得た。
【0087】
1H−NMR(CDCl3):δ1.35(s,24H),7.50−7.56(m,5H),7.99(dt,J=7.3,1.2Hz,2H),8.76(brd,J=6.6Hz,2H),8.82(dt,J=7.9,1.6Hz,2H),9.10(brs,2H).
試験例−1
基板には2mm幅のITO(酸化インジウム錫)膜がストライプ状にパターンされた、ITO透明電極付きガラス基板を用いた。この基板をイソプロピルアルコールで洗浄した後、オゾン紫外線洗浄にて表面処理を行った。基板を真空蒸着槽に移し、槽内を3.6×10−6Torrまで減圧した後、抵抗加熱方式により加熱した2,4−ビス[3−(9−アントリル)フェニル]−6−フェニル−1,3,5−トリアジンを3〜5Å/SECの蒸着レートで真空蒸着した。触針式膜厚測定計(DEKTAK)で測定した成膜後の膜厚は1.8μmであった。基板上のITOストライプと直行にメタルマスクを配し、Al膜(2mm幅、膜厚100nm)を真空蒸着することで、移動度測定用の2mm角の動作エリアを得た。この基板を窒素雰囲気グローブボックス内(酸素・水分濃度1ppm以下)で封止し、移動度測定用素子を得た。封止は、エポキシ型紫外線硬化樹脂(ナガセケムテックス社製)を用いた。
【0088】
電荷輸送材料の移動度測定は任意の方法で測定することが出来るが、今回は一般的な測定方法であるタイムオブフライト移動度測定法を用いた。移動度測定装置は、株式会社オプテル社製を用いた。測定は室温で行い、窒素レーザをITO透明電極側から照射した時に発生した電荷のAl電極への移動速度から移動度を求めた。実施例−1で得られた2,4−ビス[3−(9−アントリル)フェニル]−6−フェニル−1,3,5−トリアジンの電子移動度は2.6×10−4cm2/V・SECであった。この値は、特開2002−158091号公報記載の電子輸送材料として一般的なヒドロキシキノリンアルミニウム錯体(Alq)の1×10−6cm2/V・SECと比較して高いものであった。
【0089】
実施の形態
1,3,5−トリアジンを構成成分とする有機電界発光素子の作製と性能評価
基板には、2mm幅の酸化インジウム−スズ(ITO)膜がストライプ状にパターンされたITO透明電極付きガラス基板を用いる。この基板をイソプロピルアルコールで洗浄した後、オゾン紫外線洗浄にて表面処理を行う。洗浄後の基板に、真空蒸着法で各層の真空蒸着を行い、断面図を図1に示すような発光面積が4mm2の有機電界発光素子を作製する。まず、真空蒸着槽内に前記ガラス基板を導入し、1.0×10−4Paまで減圧する。その後、図1の1で示す前記ガラス基板上に有機化合物層として、正孔注入層2、正孔輸送層3、発光層4及び電子輸送層5を順次成膜し、その後陰極層6を成膜する。正孔注入層2としては、昇華精製したフタロシアニン銅(II)を25nmの膜厚で真空蒸着する。正孔輸送層3としては、N,N’−ジ(ナフチレン−1−イル)−N,N’−ジフェニルベンジジン(NPD)を45nmの膜厚で真空蒸着する。発光層4としては、4,4’−ビス(2,2−ジフェニルエテン−1−イル)ジフェニル(DPVBi)と4,4’−ビス[4−(ジ−p−トリルアミノ)フェニルエテン−1−イル]ビフェニル(DPAVBi)を99:1質量%の割合で40nmの膜厚で真空蒸着する。電子輸送層5としては、本発明の1,3,5−トリアジン化合物もしくは既存材料のトリス(8−キノリノラト)アルミニウム(III)(Alq)を20nmの膜厚で真空蒸着する。なお、各有機材料は抵抗加熱方式により成膜し、加熱した化合物を0.3nm/秒〜0.5nm/秒の成膜速度で真空蒸着する。最後に、ITOストライプと直行するようにメタルマスクを配し、陰極層6を成膜する。陰極層6は、フッ化リチウムとアルミニウムをそれぞれ0.5nmと100nmの膜厚で真空蒸着し、2層構造とする。それぞれの膜厚は、触針式膜厚測定計(DEKTAK)で測定することができる。さらに、この素子を酸素及び水分濃度1ppm以下の窒素雰囲気グローブボックス内で封止することができる。封止は、ガラス製の封止キャップと前記成膜基板エポキシ型紫外線硬化樹脂(ナガセケムテックス社製)を用いることができる。
【0090】
作製した有機電界発光素子に直流電流を印加し、TOPCON社製のLUMINANCE METER(BM−9)の輝度計を用いて発光特性を評価する。発光特性として、電流密度20mA/cm2を流した時の電圧(V)、輝度(cd/m2)、電流効率(cd/A)、電力効率(lm/W)を測定し、連続点灯時の輝度半減時間を測定することができる。
【0091】
本発明の化合物を用いれば、既存材料に比較して、低消費電力化、長寿命化が期待される。
【産業上の利用可能性】
【0092】
本発明は、有機電界発光素子の構成成分として有用なアントリル基で置換されたフェニル基又はアクリジニルで置換されたフェニル基を有する1,3,5−トリアジン誘導体とその製造方法、及びそれを含有する有機電界発光素子に関する。
【符号の説明】
【0093】
1.ITO透明電極付きガラス基板
2.正孔注入層
3.正孔輸送層
4.発光層
5.電子輸送層
6.陰極層
【特許請求の範囲】
【請求項1】
一般式(1)
【化1】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体。
【請求項2】
Arが、置換されていてもよいフェニル基又は置換されていてもよいナフチル基である請求項1に記載の1,3,5−トリアジン誘導体。
【請求項3】
Arが、フェニル基、炭素数1から4のアルキル基で置換されたフェニル基、アリール基で置換されたフェニル基、又はナフチル基である請求項1又は2のいずれかに記載の1,3,5−トリアジン誘導体。
【請求項4】
一般式(2)
【化2】

(式中、Xは炭素原子又は窒素原子を表す。R1は水素原子、炭素数1〜4のアルキル基又はフェニル基を表す。又、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成することもできる。)で示される有機ホウ素化合物と、一般式(3)
【化3】

(式中、Arは置換されていてもよい芳香族炭化水素基を表す。Y1は脱離基を表す。)で示される化合物とを、塩基及びパラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【化4】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体の製造方法。
【請求項5】
一般式(4)
【化5】

(式中、Xは炭素原子又は窒素原子を表す。Y2は脱離基を表す。)で示される化合物と、一般式(5)
【化6】

(式中、Arは置換されていてもよい芳香族炭化水素基を表す。R1は水素原子、炭素数1〜4のアルキル基又はフェニル基を表す。又は、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成することもできる。)で示される化合物とを、塩基及びパラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【化7】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体の製造方法。
【請求項6】
パラジウム触媒が、第三級ホスフィンを配位子として有するパラジウム錯体である請求項4又は5に記載の1,3,5−トリアジン誘導体の製造方法。
【請求項7】
第三級ホスフィンが、トリフェニルホスフィンである請求項6に記載の1,3,5−トリアジン誘導体の製造方法。
【請求項8】
一般式(1)
【化8】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体を構成成分とする有機電界発光素子。
【請求項1】
一般式(1)
【化1】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体。
【請求項2】
Arが、置換されていてもよいフェニル基又は置換されていてもよいナフチル基である請求項1に記載の1,3,5−トリアジン誘導体。
【請求項3】
Arが、フェニル基、炭素数1から4のアルキル基で置換されたフェニル基、アリール基で置換されたフェニル基、又はナフチル基である請求項1又は2のいずれかに記載の1,3,5−トリアジン誘導体。
【請求項4】
一般式(2)
【化2】

(式中、Xは炭素原子又は窒素原子を表す。R1は水素原子、炭素数1〜4のアルキル基又はフェニル基を表す。又、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成することもできる。)で示される有機ホウ素化合物と、一般式(3)
【化3】

(式中、Arは置換されていてもよい芳香族炭化水素基を表す。Y1は脱離基を表す。)で示される化合物とを、塩基及びパラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【化4】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体の製造方法。
【請求項5】
一般式(4)
【化5】

(式中、Xは炭素原子又は窒素原子を表す。Y2は脱離基を表す。)で示される化合物と、一般式(5)
【化6】

(式中、Arは置換されていてもよい芳香族炭化水素基を表す。R1は水素原子、炭素数1〜4のアルキル基又はフェニル基を表す。又は、2つのR1は一体となって酸素原子及びホウ素原子を含んで環を形成することもできる。)で示される化合物とを、塩基及びパラジウム触媒の存在下でカップリング反応させることを特徴とする、一般式(1)
【化7】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体の製造方法。
【請求項6】
パラジウム触媒が、第三級ホスフィンを配位子として有するパラジウム錯体である請求項4又は5に記載の1,3,5−トリアジン誘導体の製造方法。
【請求項7】
第三級ホスフィンが、トリフェニルホスフィンである請求項6に記載の1,3,5−トリアジン誘導体の製造方法。
【請求項8】
一般式(1)
【化8】

(式中、Xは炭素原子又は窒素原子を表す。Arは置換されていてもよい芳香族炭化水素基を表す。)で示される1,3,5−トリアジン誘導体を構成成分とする有機電界発光素子。
【図1】




【公開番号】特開2011−93864(P2011−93864A)
【公開日】平成23年5月12日(2011.5.12)
【国際特許分類】
【出願番号】特願2009−251667(P2009−251667)
【出願日】平成21年11月2日(2009.11.2)
【出願人】(000003300)東ソー株式会社 (1,901)
【出願人】(000173762)公益財団法人相模中央化学研究所 (151)
【Fターム(参考)】
【公開日】平成23年5月12日(2011.5.12)
【国際特許分類】
【出願日】平成21年11月2日(2009.11.2)
【出願人】(000003300)東ソー株式会社 (1,901)
【出願人】(000173762)公益財団法人相模中央化学研究所 (151)
【Fターム(参考)】
[ Back to top ]

