2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドのA型結晶及びその製造方法
【課題】 2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの安定性の高い結晶およびその製造方法を提供する。
【解決手段】
上記の課題は、(a)粉末X線回折(Cu−Κα)で、2θ=7.3度、13.2度、19.2度及び21.8度にピークを有する;(b)赤外吸収スペクトルにおいて、特性吸収帯が1492cm−1、1238cm−1、832cm−1及び742cm−1にある;及び(c)示差走査熱量測定の発熱ピークが117〜123℃にあり、吸熱ピークが157〜163℃である2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶などにより解決される。
【解決手段】
上記の課題は、(a)粉末X線回折(Cu−Κα)で、2θ=7.3度、13.2度、19.2度及び21.8度にピークを有する;(b)赤外吸収スペクトルにおいて、特性吸収帯が1492cm−1、1238cm−1、832cm−1及び742cm−1にある;及び(c)示差走査熱量測定の発熱ピークが117〜123℃にあり、吸熱ピークが157〜163℃である2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶などにより解決される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(2’-(4’-Ethylbenzyl)phenyl 5-thio-β-D-glucopyranoside)のA型結晶及びその製造方法などに関するものである。
【背景技術】
【0002】
WO2004−014930号公報(下記特許文献1)及びWO2004−014931号公報(下記特許文献2)に開示されるとおり、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(下記式(I))は、血糖降下作用を有し、たとえば、糖尿病薬として有用な化合物である。それらの公報には、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドを、メタノールと水との混合溶媒により結晶化した例が開示されており、その融点は156.5℃〜157.5℃であるとされている。
【0003】
【化1】

・・・(I)
【0004】
【特許文献1】WO2004−014930号公報
【特許文献2】WO2004−014931号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明者らが、公知の2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶多形について各種検討を行った結果、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドにはいくつかの結晶多形、水和物、および溶媒和物が存在することが明らかとなった。そこで、医薬品として求められる性状を有した特定の結晶型の2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドを効率よく分離する方法を解明することが求められた。
【0006】
本発明は、上記状況に鑑みてなされたものであり、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶及びその製造方法であって、医薬品として使用する環境において安定な結晶及びそのような結晶の製造方法を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは、公知の2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶型について鋭意研究を重ねた。その結果、上記のとおり、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドには、種々の結晶多形、水和物、溶媒和物が存在することが明らかとなった。また、上記特許文献において融点とされていた156.5℃-157.5℃は、C型結晶の融解に起因するものであったが、これは、融点測定の昇温時にC型結晶に転移したものであることが明らかとなった。
【0008】
また、このC型結晶の他に、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドには、A型結晶、B型結晶、D型結晶、B型結晶が吸湿してできる0.5水和物、及びD型結晶が吸湿してできる0.5水和物が存在することが明らかになった。A型結晶は、水に混和する有機溶媒と水との混合溶媒で再結晶し、低温で乾燥することにより得られる結晶型である。B型結晶は、エタノールとヘプタンとの混合溶媒における再結晶で得られる結晶型であり、加温によりC型結晶に転移し、吸湿により前記0.5水和物に転移する。また、D型結晶は、IBA(イソブチルアルコール)溶媒和物を脱溶媒して得られる、融点が約145℃の結晶型である。本発明者らは、これらの結晶型を明らかにするとともに、新規で安定な結晶であるA型結晶を見出し、この知見に基づいて本発明を完成するに至った。
【0009】
すなわち、本発明の第1の側面は、(a)粉末X線回折(Cu−Κα)で、2θ=7.3度、13.2度、19.2度及び21.8度にピークを有する;(b)赤外吸収スペクトルにおいて、特性吸収帯が1492cm−1、1238cm−1、832cm−1及び742cm−1にある;又は(c)示差走査熱量測定の発熱ピークが117〜123℃にあり、吸熱ピークが157〜163℃にある、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶である。このような特性を有する結晶をA型結晶とよぶ。
【0010】
本発明の第2の側面は、有機溶媒と水との混合溶媒に、2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドを溶解させた後、5℃以上40℃以下で結晶化し、得られた結晶を0℃以上65℃以下で乾燥させる2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドのA型結晶の製造方法である。
【0011】
本発明の第3の側面は、有機溶媒と水との混合溶媒又は水に2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドを懸濁させた後、5℃以上30℃以下で維持し、得られた結晶を0℃以上65℃以下で乾燥させる2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドのA型結晶の製造方法である。
【発明の効果】
【0012】
本発明は、上記のとおり、低温で結晶化するか懸濁液を低温として相転移を促した後、あえて低温の乾燥工程を経て2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドの結晶を製造するので、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA型結晶(以下、単に「A型結晶」という)を効率的に得ることができる。そして、A型結晶は、他の結晶型のものに比較して高い安定性を有していることから、このようにして製造されたA型結晶を用いれば、医薬品としての使用環境において良好な安定性を示す固形製剤を製造することができると期待される。
【発明を実施するための最良の形態】
【0013】
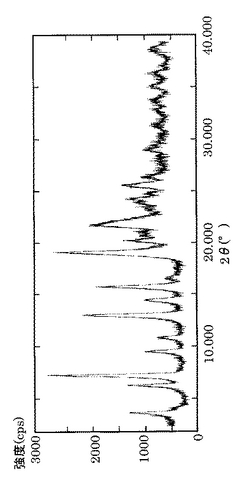
以下、本発明のA型結晶について説明する。本発明のA型結晶は、下記の物性を少なくとも一つ有する、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶である。すなわち、A型結晶の物性は、(a)粉末X線回折(Cu−Κα)で、2θ=7.3度、13.2度、19.2度及び21.8度にピークを有する;(b)赤外吸収スペクトルにおいて、特性吸収帯が1492cm−1、1238cm−1、832cm−1及び742cm−1にある;及び(c)示差走査熱量測定の発熱ピークが117〜123℃にあり、吸熱ピークが157〜163℃にあるというものである。本発明のA型結晶として、これらの物性のうち1つ以上、好ましくは全てを満たすものがあげられる。本発明のA型結晶は、粉末X線回折ピークとして、図1に示される他のピークを含んでもよい。また、本発明のA型結晶は、図2に示される赤外吸収スペクトルの別のピークを含んでもよい。さらに、本発明のA型結晶は、示差走査熱量測定の発熱ピークが119℃〜121℃にあり、吸熱ピークが159℃〜161℃にあるものであってもよい。なお、本発明のA型結晶は、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの水和物の結晶である。
【0014】
図1は、後述の実施例により得られたA型結晶の粉末X線回折パターンである。また、図2は、後述の実施例により得られたA型結晶の赤外吸収スペクトル(KBr法)である。図3は、後述の実施例により得られたA型結晶の示差走査熱量測定パターンである。そして、本発明のA型結晶として、図1で示される粉末X線回折パターンを有する結晶、図2で示される赤外吸収スペクトル(KBr法)、又は図3で示される示差走査熱量測定パターンを有する2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶があげられる。
【0015】
これらの図から分かるように、各物性データからは、有意な量のB型結晶、C型結晶、D型結晶、B型結晶が吸湿してできる0.5水和物、D型結晶が吸湿してできる0.5水和物などの不純物に由来する下記物性データは検出されていない。
【0016】
たとえば、C型結晶の物性データとしては、(a)粉末X線回折(Cu−Κα)で、2θ=8.1度、12.8度、19.6度及び23.4度にピークを有する;(b)赤外吸収スペクトルにおいて、特性吸収帯が1490cm−1、1233cm−1、840cm−1及び745cm−1にある;(c)示差走査熱量測定の吸熱ピークが157℃〜163℃にあるという物性があげられる。
【0017】
以上より、本発明の製造方法により製造されるA型結晶は、基本的に純度の高い結晶であることが分かる。A型結晶の純度は高いものが望ましく、好ましくは他の結晶型のものを実質的に含まないものである。
【0018】
後述の試験例に示されるように、本発明の製造方法により製造されるA型結晶は、特に医薬品として使用される環境において安定な結晶であるから、医薬品の材料として好ましく利用できる。すなわち、本発明によれば、医薬組成物又は医薬品を製造するためのA型結晶の使用をも提供できる。
【0019】
次に、本発明のA型結晶の製造方法について説明する。本発明のA型結晶の製造方法は、基本的には、所定の溶媒に2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドを溶解、又は懸濁させてから結晶を得て、低温にて乾燥する再結晶を行うことにより、A型結晶を得ることができるというものである。なお、再結晶は、1度のみならず2度以上繰り返してもよいが、通常は1度のみ再結晶を行う。
【0020】
以下では、水系溶液からの再結晶法によるA型結晶の製造方法について説明する。この方法は、基本的には、有機溶媒と水との混合溶媒に、2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドを溶解させ、5℃以上40℃以下で結晶化する工程と、得られた結晶を0℃以上65℃以下で乾燥させる工程とを含む。さらに,精製工程など公知の工程が付加されてもよい。
【0021】
溶解工程における溶解方法は、公知の溶解方法を適宜採用できる。溶解工程に用いられる装置も公知の物を用いればよい。そして、原料として用いる2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドは、A型結晶を含むものを用いてもよく、A型結晶、B型結晶、D型結晶などのC型結晶以外の結晶、溶媒和物、又は不定形粉末などを任意の割合で含んでいてもよい。2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの溶媒和物として、たとえば、B型結晶が吸湿してできる0.5水和物、又はD型結晶が吸湿してできる0.5水和物若しくはイソブチルアルコール和物などがあげられる。不定形粉末としては、たとえばアモルファスの2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドがあげられる。これらは、たとえば、WO2004−014930号公報またはWO2004−014931号公報に開示された方法に従って製造できる。また、B型結晶は、たとえばエタノールとヘプタンとの混合溶媒における再結晶により得ることができる。B型結晶を吸湿させることにより前記0.5水和物を得ることができる。C型結晶は、たとえば、水に混和する有機溶媒と水との混合溶媒で再結晶し、高温で乾燥することにより得られる。また、D型結晶は、IBA(イソブチルアルコール)溶媒和物を脱溶媒和して得ることができる。
【0022】
有機溶媒と水との混合溶媒における「有機溶媒」は、たとえば、得られたA型結晶を医療分野で使用する場合を考慮して、医薬品に利用できる有機溶媒(薬理上許容される有機溶媒など)を用いることが好ましい。このような有機溶媒として、メタノ−ル、エタノ−ル、n−プロパノ−ル、イソプロパノ−ル、n−ブタノ−ル、イソブタノ−ル、t−ブタノ−ル、イソアミルアルコ−ル、ジエチレングリコール、グリセリン、オクタノール、シクロヘキサノール、メチルセロソルブのようなアルコ−ル類;ギ酸エチル、酢酸メチル、酢酸エチル、酢酸プロピル、酢酸ブチル、酢酸イソプロピル、炭酸ジエチルのようなエステル類;アセトン、メチルエチルケトン、メチルイソブチルケトンのようなケトン類;ペンタン、ヘキサン、ヘプタンのような脂肪族炭化水素類;ジエチルエーテル、ジイソプロピルエーテル、テトラヒドロフラン、ジメトキシエタン、ジエチレングリコールジメチルエーテルのようなエーテル類;アセトニトリル、イソブチロニトリルのようなニトリル類;ホルムアミド、ジメチルホルムアミド、ジメチルアセトアミドのようなアミド類;
のうち1種又は2種以上を混合して用いることができる。これらのうち、有機溶媒として、好ましくは、C1-C5アルコール、C1-C5ケトン、又はC2-C5エステルであり、より好ましくは、メタノール、エタノール、n−プロパノール、イソプロパノール、n−ブタノール、ペンタノール、酢酸エチル、又はアセトンであり;さらに好ましくはエタノール、n−プロパノール、イソプロパノール、n−ブタノール、ペンタノール、酢酸エチル、又はアセトンである。
【0023】
2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの濃度として、0.01重量%〜50重量%があげられ、好ましくは0.1重量%〜20重量%、さらに好ましくは1重量%〜10重量%である。有機溶媒と水との混合溶媒における「水」は、蒸留水などの精製水などを用いればよい。
【0024】
溶解工程では、たとえば、水に有機溶媒を加えた後、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(原料)を加えて、溶液を得ればよい。溶解工程における溶液の温度として、10℃〜150℃があげられ、好ましくは40℃〜120℃であり、より好ましくは70℃〜90℃であり、さらに好ましくは75℃〜85℃である。そして好ましくは、溶媒の温度を一定に保った状態で、攪拌しながら、又は攪拌せずに原料を添加する。溶解工程では、たとえば、常圧環境下において反応を進めればよい。たとえば、目視により原料が溶解した時点で、溶解工程を終了すればよい。
【0025】
結晶化工程における結晶化方法として、溶液を冷却する方法、溶液の濃度を薄めつつ冷却する方法、溶媒を蒸発させる方法、及びこれらの組み合わせなどがあげられる。これらの中では、溶液を冷却する方法、又は溶液の濃度を薄めつつ冷却する方法が好ましい。溶液の濃度を薄めつつ冷却する方法においては、たとえば、溶液に冷水を加える方法があげられる。また、静置晶析、攪拌晶析又はこれらを組み合わせて結晶化を行ってもよく、工業的には攪拌晶析が好ましい。結晶化工程では、容器の外側から冷却してもよいし、容器内に冷却装置を挿入し内部から冷却してもよい。結晶化工程は、通常65℃以下で行い、溶液を0℃〜65℃とするものがあげられ、好ましくは、5℃〜40℃で行い、より好ましくは10℃〜35℃で行い、さらに好ましくは15℃〜30℃で行う。また、溶液にA型結晶を種晶として加えることにより、結晶化を促進することは、本発明の好ましい実施態様である。結晶化工程における圧力は、常圧で行えばよいが、溶媒を蒸発させることにより結晶化を行う場合は、減圧下(たとえば、0.1気圧〜0.9気圧にて)行うことが好ましい。結晶化時間として、1分〜24時間があげられ、好ましくは5分〜10時間であり、より好ましくは10分〜5時間である。
【0026】
上述した工程により析出したA型結晶をウエット状態で使用する場合には、そのまま分散状態で用いてもよい。また、溶液からろ過、遠心分離などにより溶媒と適度に分離して、用いてもよい。ただし、この場合、A型結晶の純度が高くならない場合がある。そこで、通常は、溶液から結晶をろ過するか又は遠心分離するなどして、結晶を溶媒から分離し、その後乾燥させることによりA型結晶を得る。ろ過方法として、たとえば、フィルターろ過、加圧ろ過、又は減圧ろ過があげられる。
【0027】
得られた結晶を乾燥させる温度は、0℃以上65℃以下があげられ、好ましくは20℃以上50℃以下であり、さらに好ましくは20℃以上40℃以下である。比較的高温で乾燥を行うとC型結晶が得られるが、あえて低い温度で乾燥させることにより、A型結晶を優位に結晶化でき、A型結晶の純度を高めることができる。乾燥時間は、乾燥温度、原料の結晶型、得ようとする結晶の状態(束状態結晶、針状結晶、その平均太さなど)などにより適宜調整すればよく、たとえば、1分〜24時間があげられ、好ましくは5分〜10時間であり、より好ましくは10分〜5時間である。この乾燥工程においても、A型結晶への相転移が進むと考えられ、その進行状況や終点は、結晶の粉末X線回折パターンまたは赤外吸収スペクトルなどを測定することによっても確認することができる。
【0028】
以下、A型結晶の上記とは別の製造方法について説明する。この方法は、溶媒を上記以外の溶媒とする他は、上記したA型結晶の製造方法と同様に行えばよい。有機溶媒と水との混合溶媒、又は水に2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドを懸濁させた後、5℃以上30℃以下で維持し、得られた結晶を0℃以上65℃以下で乾燥させる2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドの結晶の製造方法である。この方法では、懸濁状態にある結晶が、低温で維持されることで相転移を起こすので、効果的にA型結晶を得ることができると考えられる。
【0029】
有機溶媒と水との混合溶媒における「有機溶媒」及び「水」として、先に説明したものを、先に説明したようにして用いればよい。ただし、この製造方法では、懸濁状態とするために、「有機溶媒」及び「水」として、2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドの溶解度が、たとえば2%以下、好ましくは1%以下、さらに好ましくは0.5%以下となるようなものを選択することが好ましい。2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドの濃度として、懸濁液に対し、0.5重量%〜30重量%があげられ、好ましくは1重量%〜15重量%である。そして、好ましくは、溶媒の温度を一定に保った状態で、攪拌しながら、又は攪拌せずに原料を添加する。この懸濁工程では、たとえば、水に有機溶媒を加えた後、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(原料)を加えて、懸濁液を得ればよい。
【0030】
懸濁工程における懸濁液の温度として、0℃〜40℃があげられ、好ましくは5℃〜30℃であり、より好ましくは10℃〜25℃である。このような温度に懸濁液を維持するので、懸濁液中の結晶が相転移を起こし、効果的にA型結晶を得ることができると考えられる。懸濁工程では、たとえば、常圧環境下において反応を進めればよい。懸濁する時間は、溶媒の種類、温度、使用原料の結晶形、その他の条件により必ずしも一定しない。懸濁する時間の例として、1時間〜20日、10時間〜10日、1日〜10日、4日〜6日、1時間〜5時間、又は30分〜1時間があげられる。また、懸濁液中にA形結晶を種晶として加えることにより、結晶転移させる時間を短縮することができる。結晶転移の終点は、懸濁液より一部結晶をろ取して、この結晶の粉末X線回折パターンまたは赤外吸収スペクトルなどを測定することにより確認することができる。また、結晶転移の終点は、上述する再結晶法と同様の乾燥方法を用いて、一部取り出した結晶を乾燥させ、この乾燥結晶の粉末X線回折パターンまたは赤外吸収スペクトルなどを測定することによっても確認することができる。
【0031】
通常は、溶液から結晶をろ過するか又は遠心分離するなどして、結晶を溶媒から分離し、その後乾燥させることによりA型結晶を得る。ろ過方法として、たとえば、フィルターろ過、加圧ろ過、又は減圧ろ過があげられる。乾燥温度は、0℃以上65℃以下があげられ、好ましくは20℃以上50℃以下であり、より好ましくは20℃以上40℃以下であり、さらに好ましくは25℃以上40℃以下である。乾燥させる時間は、使用原料の結晶型、乾燥温度、粒子径、その他の条件により必ずしも一定しない。したがって、乾燥時間は、乾燥温度、原料の結晶型、得ようとする結晶の状態(束状態結晶、針状結晶、その平均太さなど)などにより適宜調整すればよく、たとえば、1分〜24時間があげられ、好ましくは5分〜10時間であり、より好ましくは10分〜5時間である。この乾燥工程においても、A型結晶への相転移が進むと考えられ、その進行状況や終点は、結晶の粉末X線回折パターンまたは赤外吸収スペクトルなどを測定することによっても確認することができる。
【0032】
なお、本実施例における結晶の物性は、以下のように測定した。粉末X線回折測定は、リガク社製パウダーミニ(Powder Mini)を用い、日本薬局方一般試験法、粉末X線回折測定法に基づいて測定した。試料をガラス製ホルダーに詰め、X線はCu管球を使用した加速電圧40kV、電流30mAのCuKα線であり、スタート角3度、ストップ角40度、スキャン速度毎分4度を測定条件とした。
赤外吸収スペクトルは、堀場製作所製FT−720を用い、日本薬局方一般試験法、赤外吸収スペクトル測定法に基づいて測定した。結晶をKBr粉末と混ぜ、圧力をかけて錠剤とした(KBr法)。このKBr錠剤を、大気圧中で10回積算測定(4000cm−1〜400cm−1)した。
示差走査熱量測定は、パーキンエルマー社製パイリス(Pyris)1を用い、日本薬局方一般試験法、熱分析法に基づいて測定した。結晶を採取したアルミ容器を容器ホルダー側に装着し、空の容器を基準ホルダー側に装着した。測定条件としては、窒素を0.15MPaで流入し、30℃に保持した後5℃/minの加熱速度で200℃まで昇温させDSC測定を行った。
【0033】
[製造例1] 原料となる2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの製造
「1,2,3,4,6−ペンタ−O−アセチル−5−チオ−D−グルコピラノース」(1)から「2,3,4,6−テトラ−O−アセチル−5−チオ−D−グルコピラノース」(2)を製造すると共に、「4,6−ジブロモフェノール」(3)と「4−エチルベンジルアルコール」(4)とから「4,6−ジブロモ−2−(4−エチルベンジル)フェノール」(5)を製造した後、これらの製造化合物(2)、(5)から「4’,6’−ジブロモ−2’−(4’−エチルベンジル)フェニル 2,3,4,6−テトラ−O−アセチル−5−チオ−β−D−グルコピラノシド」(6)を製造し、この製造化合物(6)から「2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド」(7)を得た。
【0034】
2,3,4,6−テトラ−O−アセチル−5−チオ−D−グルコピラノース(2)の製造
1,2,3,4,6−ペンタ−O−アセチル−5−チオ−D−グルコピラノース(1)(34.0g,0.0837mol)のN,N−ジメチルホルムアミド(300mL)溶液に、メチルヒドラジン(6.70mL,0.120mmol)、酢酸(15mL,0.120mmol)及びN,N−ジメチルホルムアミド(10mL)の混合物を氷冷下加えた。反応液を室温にて2.5時間攪拌した後に、反応液に0.5M HCl(300mL)を氷冷下にて加え、これを酢酸エチル(250mL)で2回抽出した。合わせた有機相を水(200mL)、飽和NaHCO3水(100mL)、水(100mL)、飽和食塩水(100mL)の順で洗浄し、MgSO4、活性炭(1g)を加えた。不溶物をろ過した後に、ろ液を減圧下濃縮した。得られた残渣をイソプロピルエーテル(70mL)から結晶化し、表題化合物(2)(26.9g,88%)を無色結晶として得た。
【0035】
4,6−ジブロモ−2−(4−エチルベンジル)フェノール(5)の製造方法
4,6−ジブロモフェノール(3)、4−エチルベンジルアルコール(4)及びメタンスルホン酸の混合物を160℃で25分間加熱攪拌した。反応液をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=9:1)にて精製し表題化合物(5)を得た。
【0036】
4’,6’−ジブロモ−2’−(4’−エチルベンジル)フェニル 2,3,4,6−テトラ−O−アセチル−5−チオ−β−D−グルコピラノシド(6)の製造
2,3,4,6−テトラ−O−アセチル−5−チオ−D−グルコピラノース(2)(510mg,1.4mmol)、4,6−ジブロモ−2−(4−エチルベンジル)フェノール(5)(1.05g,2.8mmol)、トリフェニルホスフィン(550mg,2.1mmol)及びトルエン(8mL)の混合物に、氷冷下、ジイソプロピルアゾジカルボキシレート(40%トルエン溶液、1.06g,2.1mmol)をゆっくり滴下した。室温で12時間攪拌した後に、反応液を濃縮し得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=7:3)にて精製し、無色粉末状の表題化合物(6)(550mg,55%)を得た。
【0037】
2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(7)の製造
4’,6’−ジブロモ−2’−(4’−エチルベンジル)フェニル 2,3,4,6−テトラ−O−アセチル−5−チオ−β−D−グルコピラノシド(6)(410mg,0.572mmol)、炭酸カリウム(158mg,1.15mmol)、10%パラジウム活性炭(50%wet、200mg)、メタノール(20mL)の混合物を水素雰囲気下、室温で20時間攪拌した。反応液中の不溶物をセライトを通してろ過し、そのろ液を濃縮した。得られた残渣をメタノール−水から再結晶し、無色粉末状の表題化合物(7)(177mg,79%)を得た。
【0038】
[製造例2] 2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(7)の製造
また、製造例1とは、別の方法により標題化合物(7)を得た、具体的には、「1,2,3,4,6−ペンタ−O−アセチル−5−チオ−D−グルコピラノース」(1)から「2,3,4,6−テトラ−O−アセチル−5−チオ−D−グルコピラノース」(2)を製造すると共に、「フェノール」(8)と「4−エチルベンジルアルコール」(4)とから「2−(4−エチルベンジル)フェノール」(9)を製造した後、これらの製造化合物(2)、(9)から「2’−(4’−エチルベンジル)フェニル 2,3,4,6−テトラ−O−アセチル−5−チオ−β−D−グルコピラノシド」(10)を製造し、この製造化合物(10)から「2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド」(7)を得た。
【0039】
2−(4−エチルベンジル)フェノール(9)の製造
フェノール(8)、4−エチルベンジルアルコール(4)及びメタンスルホン酸の混合物を160℃で25分間加熱攪拌した。反応液をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=9:1)にて精製し、表題化合物(9)を得た。
【0040】
2’−(4’−エチルベンジル)フェニル 2,3,4,6−テトラ−O−アセチル−5−チオ−β−D−グルコピラノシド(10)の製造
2,3,4,6−テトラ−O−アセチル−5−チオ−D−グルコピラノース(2)(100mg,0.274mmol)、2−(4−エチルベンジル)フェノール(9)(117mg,0.551mmol)、トリフェニルホスフィン(144mg,0.548mmol)及びTHF(3mL)の混合物に、室温で、ジエチルアゾジカルボキシレート(40%トルエン溶液、0.24mL)をゆっくり滴下した。室温で20時間攪拌した後に、反応液を濃縮し得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=7:3)にて精製し、無色粉末状の表題化合物(10)(12mg,11%)を得た。
【0041】
2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(7)の製造
2’−(4’−エチルベンジル)フェニル 2,3,4,6−テトラ−O−アセチル−5−チオ−β−D−グルコピラノシド(10)(310mg,0.555mmol)とメタノール(5mL)の混合液にナトリウムメトキシド(30mg,0.555mmol)を加え、室温にて10時間攪拌した。反応液に Dowex-50Wx8 イオン交換樹脂を加えて中和し、混合物を濾過した。得られたろ液を濃縮し、残渣をシリカゲルカラムクロマトグラフィー(クロロホルム:メタノール=20:1)にて精製し、無色粉末状の表題化合物(7)(170mg,78%)を得た。
【実施例1】
【0042】
2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(23.3g)をエタノール−水(1:1)混液に80℃で溶解させた後、撹拌しながら水を加えて25℃に温度を下げて結晶を析出させた。析出した結晶をろ取した後に、50℃で減圧乾燥し、結晶(17.9g)を得た。この結晶の粉末X線回折パターン及び赤外吸収スペクトルを測定したところ、A形結晶であった。
【実施例2】
【0043】
2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのC形結晶(80mg)を水(8mL)中に懸濁させ、室温で5日間振とうした。この振とう後の懸濁液をろ過して結晶をろ別した後に、室温で減圧乾燥し、結晶を得た。この結晶の粉末X線回折パターン及び赤外吸収スペクトルを測定したところ、A形結晶であった。
【0044】
[試験例1]
上述するようにして得られた2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA形結晶(約100mg)を秤量瓶に量りとり、塩化ナトリウムで相対湿度75%(室温)に調湿したデシケータに4週間保存した。保存後の結晶形を粉末X線回折で確認した結果、依然としてA形結晶であり、変化していなかった。
【0045】
[試験例2]
上述するようにして得られた2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA形結晶(約100mg)をガラスに量りとり密栓後、40℃に保存した。保存後3ヶ月で、結晶形を粉末X線回折により確認した。その結果、依然としてA形結晶であり、変化していなかった。
【0046】
[試験例3]
上述するようにして得られた2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA形結晶(50mg)を4mm径の臼に充填後、同じ径の杵を装着したオートグラフ(島津製作所製)により、圧縮圧5000Nで5分間、圧縮を行った。圧縮後の結晶形を粉末X線回折で確認した結果、依然としてA形結晶であり、変化していなかった。
【0047】
[試験例4]
上述するようにして得られた2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA形結晶をピンミル(回転数:12100[rpm]、ファインインパクトミル100UPZ−II,ホソカワミクロン製)を用いて粉砕した。粉砕後の結晶形を粉末X線回折で確認した結果、依然としてA形結晶であり、変化していなかった。
【産業上の利用可能性】
【0048】
本発明の2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶は、所定の薬理効果を有するほか、安定性などに優れるので、医薬品の原料などとして、たとえば医薬品業で利用することができる。
【図面の簡単な説明】
【0049】
【図1】図1は、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA型結晶の粉末X線回折パターンである。
【図2】図2は、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA型結晶の赤外吸収スペクトル(ΚBr法)である。
【図3】図3は、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA型結晶の示差走査熱量測定パターンである。
【技術分野】
【0001】
本発明は、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(2’-(4’-Ethylbenzyl)phenyl 5-thio-β-D-glucopyranoside)のA型結晶及びその製造方法などに関するものである。
【背景技術】
【0002】
WO2004−014930号公報(下記特許文献1)及びWO2004−014931号公報(下記特許文献2)に開示されるとおり、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(下記式(I))は、血糖降下作用を有し、たとえば、糖尿病薬として有用な化合物である。それらの公報には、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドを、メタノールと水との混合溶媒により結晶化した例が開示されており、その融点は156.5℃〜157.5℃であるとされている。
【0003】
【化1】

・・・(I)
【0004】
【特許文献1】WO2004−014930号公報
【特許文献2】WO2004−014931号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明者らが、公知の2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶多形について各種検討を行った結果、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドにはいくつかの結晶多形、水和物、および溶媒和物が存在することが明らかとなった。そこで、医薬品として求められる性状を有した特定の結晶型の2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドを効率よく分離する方法を解明することが求められた。
【0006】
本発明は、上記状況に鑑みてなされたものであり、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶及びその製造方法であって、医薬品として使用する環境において安定な結晶及びそのような結晶の製造方法を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは、公知の2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶型について鋭意研究を重ねた。その結果、上記のとおり、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドには、種々の結晶多形、水和物、溶媒和物が存在することが明らかとなった。また、上記特許文献において融点とされていた156.5℃-157.5℃は、C型結晶の融解に起因するものであったが、これは、融点測定の昇温時にC型結晶に転移したものであることが明らかとなった。
【0008】
また、このC型結晶の他に、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドには、A型結晶、B型結晶、D型結晶、B型結晶が吸湿してできる0.5水和物、及びD型結晶が吸湿してできる0.5水和物が存在することが明らかになった。A型結晶は、水に混和する有機溶媒と水との混合溶媒で再結晶し、低温で乾燥することにより得られる結晶型である。B型結晶は、エタノールとヘプタンとの混合溶媒における再結晶で得られる結晶型であり、加温によりC型結晶に転移し、吸湿により前記0.5水和物に転移する。また、D型結晶は、IBA(イソブチルアルコール)溶媒和物を脱溶媒して得られる、融点が約145℃の結晶型である。本発明者らは、これらの結晶型を明らかにするとともに、新規で安定な結晶であるA型結晶を見出し、この知見に基づいて本発明を完成するに至った。
【0009】
すなわち、本発明の第1の側面は、(a)粉末X線回折(Cu−Κα)で、2θ=7.3度、13.2度、19.2度及び21.8度にピークを有する;(b)赤外吸収スペクトルにおいて、特性吸収帯が1492cm−1、1238cm−1、832cm−1及び742cm−1にある;又は(c)示差走査熱量測定の発熱ピークが117〜123℃にあり、吸熱ピークが157〜163℃にある、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶である。このような特性を有する結晶をA型結晶とよぶ。
【0010】
本発明の第2の側面は、有機溶媒と水との混合溶媒に、2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドを溶解させた後、5℃以上40℃以下で結晶化し、得られた結晶を0℃以上65℃以下で乾燥させる2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドのA型結晶の製造方法である。
【0011】
本発明の第3の側面は、有機溶媒と水との混合溶媒又は水に2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドを懸濁させた後、5℃以上30℃以下で維持し、得られた結晶を0℃以上65℃以下で乾燥させる2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドのA型結晶の製造方法である。
【発明の効果】
【0012】
本発明は、上記のとおり、低温で結晶化するか懸濁液を低温として相転移を促した後、あえて低温の乾燥工程を経て2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドの結晶を製造するので、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA型結晶(以下、単に「A型結晶」という)を効率的に得ることができる。そして、A型結晶は、他の結晶型のものに比較して高い安定性を有していることから、このようにして製造されたA型結晶を用いれば、医薬品としての使用環境において良好な安定性を示す固形製剤を製造することができると期待される。
【発明を実施するための最良の形態】
【0013】
以下、本発明のA型結晶について説明する。本発明のA型結晶は、下記の物性を少なくとも一つ有する、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶である。すなわち、A型結晶の物性は、(a)粉末X線回折(Cu−Κα)で、2θ=7.3度、13.2度、19.2度及び21.8度にピークを有する;(b)赤外吸収スペクトルにおいて、特性吸収帯が1492cm−1、1238cm−1、832cm−1及び742cm−1にある;及び(c)示差走査熱量測定の発熱ピークが117〜123℃にあり、吸熱ピークが157〜163℃にあるというものである。本発明のA型結晶として、これらの物性のうち1つ以上、好ましくは全てを満たすものがあげられる。本発明のA型結晶は、粉末X線回折ピークとして、図1に示される他のピークを含んでもよい。また、本発明のA型結晶は、図2に示される赤外吸収スペクトルの別のピークを含んでもよい。さらに、本発明のA型結晶は、示差走査熱量測定の発熱ピークが119℃〜121℃にあり、吸熱ピークが159℃〜161℃にあるものであってもよい。なお、本発明のA型結晶は、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの水和物の結晶である。
【0014】
図1は、後述の実施例により得られたA型結晶の粉末X線回折パターンである。また、図2は、後述の実施例により得られたA型結晶の赤外吸収スペクトル(KBr法)である。図3は、後述の実施例により得られたA型結晶の示差走査熱量測定パターンである。そして、本発明のA型結晶として、図1で示される粉末X線回折パターンを有する結晶、図2で示される赤外吸収スペクトル(KBr法)、又は図3で示される示差走査熱量測定パターンを有する2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶があげられる。
【0015】
これらの図から分かるように、各物性データからは、有意な量のB型結晶、C型結晶、D型結晶、B型結晶が吸湿してできる0.5水和物、D型結晶が吸湿してできる0.5水和物などの不純物に由来する下記物性データは検出されていない。
【0016】
たとえば、C型結晶の物性データとしては、(a)粉末X線回折(Cu−Κα)で、2θ=8.1度、12.8度、19.6度及び23.4度にピークを有する;(b)赤外吸収スペクトルにおいて、特性吸収帯が1490cm−1、1233cm−1、840cm−1及び745cm−1にある;(c)示差走査熱量測定の吸熱ピークが157℃〜163℃にあるという物性があげられる。
【0017】
以上より、本発明の製造方法により製造されるA型結晶は、基本的に純度の高い結晶であることが分かる。A型結晶の純度は高いものが望ましく、好ましくは他の結晶型のものを実質的に含まないものである。
【0018】
後述の試験例に示されるように、本発明の製造方法により製造されるA型結晶は、特に医薬品として使用される環境において安定な結晶であるから、医薬品の材料として好ましく利用できる。すなわち、本発明によれば、医薬組成物又は医薬品を製造するためのA型結晶の使用をも提供できる。
【0019】
次に、本発明のA型結晶の製造方法について説明する。本発明のA型結晶の製造方法は、基本的には、所定の溶媒に2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドを溶解、又は懸濁させてから結晶を得て、低温にて乾燥する再結晶を行うことにより、A型結晶を得ることができるというものである。なお、再結晶は、1度のみならず2度以上繰り返してもよいが、通常は1度のみ再結晶を行う。
【0020】
以下では、水系溶液からの再結晶法によるA型結晶の製造方法について説明する。この方法は、基本的には、有機溶媒と水との混合溶媒に、2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドを溶解させ、5℃以上40℃以下で結晶化する工程と、得られた結晶を0℃以上65℃以下で乾燥させる工程とを含む。さらに,精製工程など公知の工程が付加されてもよい。
【0021】
溶解工程における溶解方法は、公知の溶解方法を適宜採用できる。溶解工程に用いられる装置も公知の物を用いればよい。そして、原料として用いる2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドは、A型結晶を含むものを用いてもよく、A型結晶、B型結晶、D型結晶などのC型結晶以外の結晶、溶媒和物、又は不定形粉末などを任意の割合で含んでいてもよい。2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの溶媒和物として、たとえば、B型結晶が吸湿してできる0.5水和物、又はD型結晶が吸湿してできる0.5水和物若しくはイソブチルアルコール和物などがあげられる。不定形粉末としては、たとえばアモルファスの2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドがあげられる。これらは、たとえば、WO2004−014930号公報またはWO2004−014931号公報に開示された方法に従って製造できる。また、B型結晶は、たとえばエタノールとヘプタンとの混合溶媒における再結晶により得ることができる。B型結晶を吸湿させることにより前記0.5水和物を得ることができる。C型結晶は、たとえば、水に混和する有機溶媒と水との混合溶媒で再結晶し、高温で乾燥することにより得られる。また、D型結晶は、IBA(イソブチルアルコール)溶媒和物を脱溶媒和して得ることができる。
【0022】
有機溶媒と水との混合溶媒における「有機溶媒」は、たとえば、得られたA型結晶を医療分野で使用する場合を考慮して、医薬品に利用できる有機溶媒(薬理上許容される有機溶媒など)を用いることが好ましい。このような有機溶媒として、メタノ−ル、エタノ−ル、n−プロパノ−ル、イソプロパノ−ル、n−ブタノ−ル、イソブタノ−ル、t−ブタノ−ル、イソアミルアルコ−ル、ジエチレングリコール、グリセリン、オクタノール、シクロヘキサノール、メチルセロソルブのようなアルコ−ル類;ギ酸エチル、酢酸メチル、酢酸エチル、酢酸プロピル、酢酸ブチル、酢酸イソプロピル、炭酸ジエチルのようなエステル類;アセトン、メチルエチルケトン、メチルイソブチルケトンのようなケトン類;ペンタン、ヘキサン、ヘプタンのような脂肪族炭化水素類;ジエチルエーテル、ジイソプロピルエーテル、テトラヒドロフラン、ジメトキシエタン、ジエチレングリコールジメチルエーテルのようなエーテル類;アセトニトリル、イソブチロニトリルのようなニトリル類;ホルムアミド、ジメチルホルムアミド、ジメチルアセトアミドのようなアミド類;
のうち1種又は2種以上を混合して用いることができる。これらのうち、有機溶媒として、好ましくは、C1-C5アルコール、C1-C5ケトン、又はC2-C5エステルであり、より好ましくは、メタノール、エタノール、n−プロパノール、イソプロパノール、n−ブタノール、ペンタノール、酢酸エチル、又はアセトンであり;さらに好ましくはエタノール、n−プロパノール、イソプロパノール、n−ブタノール、ペンタノール、酢酸エチル、又はアセトンである。
【0023】
2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの濃度として、0.01重量%〜50重量%があげられ、好ましくは0.1重量%〜20重量%、さらに好ましくは1重量%〜10重量%である。有機溶媒と水との混合溶媒における「水」は、蒸留水などの精製水などを用いればよい。
【0024】
溶解工程では、たとえば、水に有機溶媒を加えた後、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(原料)を加えて、溶液を得ればよい。溶解工程における溶液の温度として、10℃〜150℃があげられ、好ましくは40℃〜120℃であり、より好ましくは70℃〜90℃であり、さらに好ましくは75℃〜85℃である。そして好ましくは、溶媒の温度を一定に保った状態で、攪拌しながら、又は攪拌せずに原料を添加する。溶解工程では、たとえば、常圧環境下において反応を進めればよい。たとえば、目視により原料が溶解した時点で、溶解工程を終了すればよい。
【0025】
結晶化工程における結晶化方法として、溶液を冷却する方法、溶液の濃度を薄めつつ冷却する方法、溶媒を蒸発させる方法、及びこれらの組み合わせなどがあげられる。これらの中では、溶液を冷却する方法、又は溶液の濃度を薄めつつ冷却する方法が好ましい。溶液の濃度を薄めつつ冷却する方法においては、たとえば、溶液に冷水を加える方法があげられる。また、静置晶析、攪拌晶析又はこれらを組み合わせて結晶化を行ってもよく、工業的には攪拌晶析が好ましい。結晶化工程では、容器の外側から冷却してもよいし、容器内に冷却装置を挿入し内部から冷却してもよい。結晶化工程は、通常65℃以下で行い、溶液を0℃〜65℃とするものがあげられ、好ましくは、5℃〜40℃で行い、より好ましくは10℃〜35℃で行い、さらに好ましくは15℃〜30℃で行う。また、溶液にA型結晶を種晶として加えることにより、結晶化を促進することは、本発明の好ましい実施態様である。結晶化工程における圧力は、常圧で行えばよいが、溶媒を蒸発させることにより結晶化を行う場合は、減圧下(たとえば、0.1気圧〜0.9気圧にて)行うことが好ましい。結晶化時間として、1分〜24時間があげられ、好ましくは5分〜10時間であり、より好ましくは10分〜5時間である。
【0026】
上述した工程により析出したA型結晶をウエット状態で使用する場合には、そのまま分散状態で用いてもよい。また、溶液からろ過、遠心分離などにより溶媒と適度に分離して、用いてもよい。ただし、この場合、A型結晶の純度が高くならない場合がある。そこで、通常は、溶液から結晶をろ過するか又は遠心分離するなどして、結晶を溶媒から分離し、その後乾燥させることによりA型結晶を得る。ろ過方法として、たとえば、フィルターろ過、加圧ろ過、又は減圧ろ過があげられる。
【0027】
得られた結晶を乾燥させる温度は、0℃以上65℃以下があげられ、好ましくは20℃以上50℃以下であり、さらに好ましくは20℃以上40℃以下である。比較的高温で乾燥を行うとC型結晶が得られるが、あえて低い温度で乾燥させることにより、A型結晶を優位に結晶化でき、A型結晶の純度を高めることができる。乾燥時間は、乾燥温度、原料の結晶型、得ようとする結晶の状態(束状態結晶、針状結晶、その平均太さなど)などにより適宜調整すればよく、たとえば、1分〜24時間があげられ、好ましくは5分〜10時間であり、より好ましくは10分〜5時間である。この乾燥工程においても、A型結晶への相転移が進むと考えられ、その進行状況や終点は、結晶の粉末X線回折パターンまたは赤外吸収スペクトルなどを測定することによっても確認することができる。
【0028】
以下、A型結晶の上記とは別の製造方法について説明する。この方法は、溶媒を上記以外の溶媒とする他は、上記したA型結晶の製造方法と同様に行えばよい。有機溶媒と水との混合溶媒、又は水に2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドを懸濁させた後、5℃以上30℃以下で維持し、得られた結晶を0℃以上65℃以下で乾燥させる2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドの結晶の製造方法である。この方法では、懸濁状態にある結晶が、低温で維持されることで相転移を起こすので、効果的にA型結晶を得ることができると考えられる。
【0029】
有機溶媒と水との混合溶媒における「有機溶媒」及び「水」として、先に説明したものを、先に説明したようにして用いればよい。ただし、この製造方法では、懸濁状態とするために、「有機溶媒」及び「水」として、2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドの溶解度が、たとえば2%以下、好ましくは1%以下、さらに好ましくは0.5%以下となるようなものを選択することが好ましい。2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドの濃度として、懸濁液に対し、0.5重量%〜30重量%があげられ、好ましくは1重量%〜15重量%である。そして、好ましくは、溶媒の温度を一定に保った状態で、攪拌しながら、又は攪拌せずに原料を添加する。この懸濁工程では、たとえば、水に有機溶媒を加えた後、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(原料)を加えて、懸濁液を得ればよい。
【0030】
懸濁工程における懸濁液の温度として、0℃〜40℃があげられ、好ましくは5℃〜30℃であり、より好ましくは10℃〜25℃である。このような温度に懸濁液を維持するので、懸濁液中の結晶が相転移を起こし、効果的にA型結晶を得ることができると考えられる。懸濁工程では、たとえば、常圧環境下において反応を進めればよい。懸濁する時間は、溶媒の種類、温度、使用原料の結晶形、その他の条件により必ずしも一定しない。懸濁する時間の例として、1時間〜20日、10時間〜10日、1日〜10日、4日〜6日、1時間〜5時間、又は30分〜1時間があげられる。また、懸濁液中にA形結晶を種晶として加えることにより、結晶転移させる時間を短縮することができる。結晶転移の終点は、懸濁液より一部結晶をろ取して、この結晶の粉末X線回折パターンまたは赤外吸収スペクトルなどを測定することにより確認することができる。また、結晶転移の終点は、上述する再結晶法と同様の乾燥方法を用いて、一部取り出した結晶を乾燥させ、この乾燥結晶の粉末X線回折パターンまたは赤外吸収スペクトルなどを測定することによっても確認することができる。
【0031】
通常は、溶液から結晶をろ過するか又は遠心分離するなどして、結晶を溶媒から分離し、その後乾燥させることによりA型結晶を得る。ろ過方法として、たとえば、フィルターろ過、加圧ろ過、又は減圧ろ過があげられる。乾燥温度は、0℃以上65℃以下があげられ、好ましくは20℃以上50℃以下であり、より好ましくは20℃以上40℃以下であり、さらに好ましくは25℃以上40℃以下である。乾燥させる時間は、使用原料の結晶型、乾燥温度、粒子径、その他の条件により必ずしも一定しない。したがって、乾燥時間は、乾燥温度、原料の結晶型、得ようとする結晶の状態(束状態結晶、針状結晶、その平均太さなど)などにより適宜調整すればよく、たとえば、1分〜24時間があげられ、好ましくは5分〜10時間であり、より好ましくは10分〜5時間である。この乾燥工程においても、A型結晶への相転移が進むと考えられ、その進行状況や終点は、結晶の粉末X線回折パターンまたは赤外吸収スペクトルなどを測定することによっても確認することができる。
【0032】
なお、本実施例における結晶の物性は、以下のように測定した。粉末X線回折測定は、リガク社製パウダーミニ(Powder Mini)を用い、日本薬局方一般試験法、粉末X線回折測定法に基づいて測定した。試料をガラス製ホルダーに詰め、X線はCu管球を使用した加速電圧40kV、電流30mAのCuKα線であり、スタート角3度、ストップ角40度、スキャン速度毎分4度を測定条件とした。
赤外吸収スペクトルは、堀場製作所製FT−720を用い、日本薬局方一般試験法、赤外吸収スペクトル測定法に基づいて測定した。結晶をKBr粉末と混ぜ、圧力をかけて錠剤とした(KBr法)。このKBr錠剤を、大気圧中で10回積算測定(4000cm−1〜400cm−1)した。
示差走査熱量測定は、パーキンエルマー社製パイリス(Pyris)1を用い、日本薬局方一般試験法、熱分析法に基づいて測定した。結晶を採取したアルミ容器を容器ホルダー側に装着し、空の容器を基準ホルダー側に装着した。測定条件としては、窒素を0.15MPaで流入し、30℃に保持した後5℃/minの加熱速度で200℃まで昇温させDSC測定を行った。
【0033】
[製造例1] 原料となる2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの製造
「1,2,3,4,6−ペンタ−O−アセチル−5−チオ−D−グルコピラノース」(1)から「2,3,4,6−テトラ−O−アセチル−5−チオ−D−グルコピラノース」(2)を製造すると共に、「4,6−ジブロモフェノール」(3)と「4−エチルベンジルアルコール」(4)とから「4,6−ジブロモ−2−(4−エチルベンジル)フェノール」(5)を製造した後、これらの製造化合物(2)、(5)から「4’,6’−ジブロモ−2’−(4’−エチルベンジル)フェニル 2,3,4,6−テトラ−O−アセチル−5−チオ−β−D−グルコピラノシド」(6)を製造し、この製造化合物(6)から「2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド」(7)を得た。
【0034】
2,3,4,6−テトラ−O−アセチル−5−チオ−D−グルコピラノース(2)の製造
1,2,3,4,6−ペンタ−O−アセチル−5−チオ−D−グルコピラノース(1)(34.0g,0.0837mol)のN,N−ジメチルホルムアミド(300mL)溶液に、メチルヒドラジン(6.70mL,0.120mmol)、酢酸(15mL,0.120mmol)及びN,N−ジメチルホルムアミド(10mL)の混合物を氷冷下加えた。反応液を室温にて2.5時間攪拌した後に、反応液に0.5M HCl(300mL)を氷冷下にて加え、これを酢酸エチル(250mL)で2回抽出した。合わせた有機相を水(200mL)、飽和NaHCO3水(100mL)、水(100mL)、飽和食塩水(100mL)の順で洗浄し、MgSO4、活性炭(1g)を加えた。不溶物をろ過した後に、ろ液を減圧下濃縮した。得られた残渣をイソプロピルエーテル(70mL)から結晶化し、表題化合物(2)(26.9g,88%)を無色結晶として得た。
【0035】
4,6−ジブロモ−2−(4−エチルベンジル)フェノール(5)の製造方法
4,6−ジブロモフェノール(3)、4−エチルベンジルアルコール(4)及びメタンスルホン酸の混合物を160℃で25分間加熱攪拌した。反応液をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=9:1)にて精製し表題化合物(5)を得た。
【0036】
4’,6’−ジブロモ−2’−(4’−エチルベンジル)フェニル 2,3,4,6−テトラ−O−アセチル−5−チオ−β−D−グルコピラノシド(6)の製造
2,3,4,6−テトラ−O−アセチル−5−チオ−D−グルコピラノース(2)(510mg,1.4mmol)、4,6−ジブロモ−2−(4−エチルベンジル)フェノール(5)(1.05g,2.8mmol)、トリフェニルホスフィン(550mg,2.1mmol)及びトルエン(8mL)の混合物に、氷冷下、ジイソプロピルアゾジカルボキシレート(40%トルエン溶液、1.06g,2.1mmol)をゆっくり滴下した。室温で12時間攪拌した後に、反応液を濃縮し得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=7:3)にて精製し、無色粉末状の表題化合物(6)(550mg,55%)を得た。
【0037】
2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(7)の製造
4’,6’−ジブロモ−2’−(4’−エチルベンジル)フェニル 2,3,4,6−テトラ−O−アセチル−5−チオ−β−D−グルコピラノシド(6)(410mg,0.572mmol)、炭酸カリウム(158mg,1.15mmol)、10%パラジウム活性炭(50%wet、200mg)、メタノール(20mL)の混合物を水素雰囲気下、室温で20時間攪拌した。反応液中の不溶物をセライトを通してろ過し、そのろ液を濃縮した。得られた残渣をメタノール−水から再結晶し、無色粉末状の表題化合物(7)(177mg,79%)を得た。
【0038】
[製造例2] 2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(7)の製造
また、製造例1とは、別の方法により標題化合物(7)を得た、具体的には、「1,2,3,4,6−ペンタ−O−アセチル−5−チオ−D−グルコピラノース」(1)から「2,3,4,6−テトラ−O−アセチル−5−チオ−D−グルコピラノース」(2)を製造すると共に、「フェノール」(8)と「4−エチルベンジルアルコール」(4)とから「2−(4−エチルベンジル)フェノール」(9)を製造した後、これらの製造化合物(2)、(9)から「2’−(4’−エチルベンジル)フェニル 2,3,4,6−テトラ−O−アセチル−5−チオ−β−D−グルコピラノシド」(10)を製造し、この製造化合物(10)から「2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド」(7)を得た。
【0039】
2−(4−エチルベンジル)フェノール(9)の製造
フェノール(8)、4−エチルベンジルアルコール(4)及びメタンスルホン酸の混合物を160℃で25分間加熱攪拌した。反応液をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=9:1)にて精製し、表題化合物(9)を得た。
【0040】
2’−(4’−エチルベンジル)フェニル 2,3,4,6−テトラ−O−アセチル−5−チオ−β−D−グルコピラノシド(10)の製造
2,3,4,6−テトラ−O−アセチル−5−チオ−D−グルコピラノース(2)(100mg,0.274mmol)、2−(4−エチルベンジル)フェノール(9)(117mg,0.551mmol)、トリフェニルホスフィン(144mg,0.548mmol)及びTHF(3mL)の混合物に、室温で、ジエチルアゾジカルボキシレート(40%トルエン溶液、0.24mL)をゆっくり滴下した。室温で20時間攪拌した後に、反応液を濃縮し得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=7:3)にて精製し、無色粉末状の表題化合物(10)(12mg,11%)を得た。
【0041】
2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(7)の製造
2’−(4’−エチルベンジル)フェニル 2,3,4,6−テトラ−O−アセチル−5−チオ−β−D−グルコピラノシド(10)(310mg,0.555mmol)とメタノール(5mL)の混合液にナトリウムメトキシド(30mg,0.555mmol)を加え、室温にて10時間攪拌した。反応液に Dowex-50Wx8 イオン交換樹脂を加えて中和し、混合物を濾過した。得られたろ液を濃縮し、残渣をシリカゲルカラムクロマトグラフィー(クロロホルム:メタノール=20:1)にて精製し、無色粉末状の表題化合物(7)(170mg,78%)を得た。
【実施例1】
【0042】
2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシド(23.3g)をエタノール−水(1:1)混液に80℃で溶解させた後、撹拌しながら水を加えて25℃に温度を下げて結晶を析出させた。析出した結晶をろ取した後に、50℃で減圧乾燥し、結晶(17.9g)を得た。この結晶の粉末X線回折パターン及び赤外吸収スペクトルを測定したところ、A形結晶であった。
【実施例2】
【0043】
2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのC形結晶(80mg)を水(8mL)中に懸濁させ、室温で5日間振とうした。この振とう後の懸濁液をろ過して結晶をろ別した後に、室温で減圧乾燥し、結晶を得た。この結晶の粉末X線回折パターン及び赤外吸収スペクトルを測定したところ、A形結晶であった。
【0044】
[試験例1]
上述するようにして得られた2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA形結晶(約100mg)を秤量瓶に量りとり、塩化ナトリウムで相対湿度75%(室温)に調湿したデシケータに4週間保存した。保存後の結晶形を粉末X線回折で確認した結果、依然としてA形結晶であり、変化していなかった。
【0045】
[試験例2]
上述するようにして得られた2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA形結晶(約100mg)をガラスに量りとり密栓後、40℃に保存した。保存後3ヶ月で、結晶形を粉末X線回折により確認した。その結果、依然としてA形結晶であり、変化していなかった。
【0046】
[試験例3]
上述するようにして得られた2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA形結晶(50mg)を4mm径の臼に充填後、同じ径の杵を装着したオートグラフ(島津製作所製)により、圧縮圧5000Nで5分間、圧縮を行った。圧縮後の結晶形を粉末X線回折で確認した結果、依然としてA形結晶であり、変化していなかった。
【0047】
[試験例4]
上述するようにして得られた2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA形結晶をピンミル(回転数:12100[rpm]、ファインインパクトミル100UPZ−II,ホソカワミクロン製)を用いて粉砕した。粉砕後の結晶形を粉末X線回折で確認した結果、依然としてA形結晶であり、変化していなかった。
【産業上の利用可能性】
【0048】
本発明の2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶は、所定の薬理効果を有するほか、安定性などに優れるので、医薬品の原料などとして、たとえば医薬品業で利用することができる。
【図面の簡単な説明】
【0049】
【図1】図1は、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA型結晶の粉末X線回折パターンである。
【図2】図2は、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA型結晶の赤外吸収スペクトル(ΚBr法)である。
【図3】図3は、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドのA型結晶の示差走査熱量測定パターンである。
【特許請求の範囲】
【請求項1】
下記の物性を少なくとも一つ有する、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶。
(a)粉末X線回折(Cu−Κα)で、2θ=7.3度、13.2度、19.2度及び21.8度にピークを有する;
(b)赤外吸収スペクトルにおいて、特性吸収帯が1492cm−1、1238cm−1、832cm−1及び742cm−1にある;及び
(c)示差走査熱量測定の発熱ピークが117〜123℃にあり、吸熱ピークが157〜163℃にある。
【請求項2】
有機溶媒と水との混合溶媒に、2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドを溶解させた後、5℃以上40℃以下で結晶化し、
得られた結晶を0℃以上65℃以下で乾燥させる請求項1に記載の2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドの結晶の製造方法。
【請求項3】
前記結晶を乾燥させる工程を、20℃以上50℃以下で行う請求項2に記載の2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶の製造方法。
【請求項4】
前記有機溶媒と水との混合溶媒における有機溶媒は、C1-C5アルコール、C1-C5ケトン、又はC2-C5エステルのいずれか又は2種以上である請求項2に記載の2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶の製造方法。
【請求項5】
有機溶媒と水との混合溶媒又は水に2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドを懸濁させた後、5℃以上30℃以下で維持し、
得られた結晶を0℃以上65℃以下で乾燥させる、請求項1に記載の2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドの結晶の製造方法。
【請求項6】
前記結晶を乾燥させる工程を、20℃以上50℃以下で行う請求項5に記載の2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶の製造方法。
【請求項1】
下記の物性を少なくとも一つ有する、2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶。
(a)粉末X線回折(Cu−Κα)で、2θ=7.3度、13.2度、19.2度及び21.8度にピークを有する;
(b)赤外吸収スペクトルにおいて、特性吸収帯が1492cm−1、1238cm−1、832cm−1及び742cm−1にある;及び
(c)示差走査熱量測定の発熱ピークが117〜123℃にあり、吸熱ピークが157〜163℃にある。
【請求項2】
有機溶媒と水との混合溶媒に、2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドを溶解させた後、5℃以上40℃以下で結晶化し、
得られた結晶を0℃以上65℃以下で乾燥させる請求項1に記載の2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドの結晶の製造方法。
【請求項3】
前記結晶を乾燥させる工程を、20℃以上50℃以下で行う請求項2に記載の2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶の製造方法。
【請求項4】
前記有機溶媒と水との混合溶媒における有機溶媒は、C1-C5アルコール、C1-C5ケトン、又はC2-C5エステルのいずれか又は2種以上である請求項2に記載の2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶の製造方法。
【請求項5】
有機溶媒と水との混合溶媒又は水に2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドを懸濁させた後、5℃以上30℃以下で維持し、
得られた結晶を0℃以上65℃以下で乾燥させる、請求項1に記載の2’−(4’−エチルベンジル)フェニル5−チオ−β−D−グルコピラノシドの結晶の製造方法。
【請求項6】
前記結晶を乾燥させる工程を、20℃以上50℃以下で行う請求項5に記載の2’−(4’−エチルベンジル)フェニル 5−チオ−β−D−グルコピラノシドの結晶の製造方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2006−328055(P2006−328055A)
【公開日】平成18年12月7日(2006.12.7)
【国際特許分類】
【出願番号】特願2006−120527(P2006−120527)
【出願日】平成18年4月25日(2006.4.25)
【出願人】(000002819)大正製薬株式会社 (437)
【復代理人】
【識別番号】100092783
【弁理士】
【氏名又は名称】小林 浩
【復代理人】
【識別番号】100095360
【弁理士】
【氏名又は名称】片山 英二
【復代理人】
【識別番号】100093676
【弁理士】
【氏名又は名称】小林 純子
【復代理人】
【識別番号】100116850
【弁理士】
【氏名又は名称】廣瀬 隆行
【Fターム(参考)】
【公開日】平成18年12月7日(2006.12.7)
【国際特許分類】
【出願日】平成18年4月25日(2006.4.25)
【出願人】(000002819)大正製薬株式会社 (437)
【復代理人】
【識別番号】100092783
【弁理士】
【氏名又は名称】小林 浩
【復代理人】
【識別番号】100095360
【弁理士】
【氏名又は名称】片山 英二
【復代理人】
【識別番号】100093676
【弁理士】
【氏名又は名称】小林 純子
【復代理人】
【識別番号】100116850
【弁理士】
【氏名又は名称】廣瀬 隆行
【Fターム(参考)】
[ Back to top ]

