2−アシルアミノチアゾール誘導体固定化マトリックス、及びその製造方法
【課題】 タンパク質の分析又は精製のためのマトリックスを提供すること。
【解決手段】 タンパク質の分析または精製に有用な、一般式(1)
【化1】

(式中、R1及びR2は水素原子又は置換されていてもよい炭素数1から6のアルキル基を表し、R3は酸素原子、メチレン基、硫黄原子、カルボニル基又はイミノキシ基であることを表し、Arは置換されていてもよい芳香族基を表し、nは1から12の整数を表し、Mはマトリックスを表す。)で表されるチアゾール誘導体固定化マトリックスを提供するものである。
【解決手段】 タンパク質の分析または精製に有用な、一般式(1)
【化1】

(式中、R1及びR2は水素原子又は置換されていてもよい炭素数1から6のアルキル基を表し、R3は酸素原子、メチレン基、硫黄原子、カルボニル基又はイミノキシ基であることを表し、Arは置換されていてもよい芳香族基を表し、nは1から12の整数を表し、Mはマトリックスを表す。)で表されるチアゾール誘導体固定化マトリックスを提供するものである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、各種タンパク質、特に免疫グロブリンの分析又は精製に利用可能なチアゾール誘導体を結合させたマトリックス、及びその製造方法に関する。
【背景技術】
【0002】
近年、医療用タンパク質の需要は拡大しつつあり、その簡便で大規模に実施できる工業的精製技術の確立が切望されている。一般にタンパク質精製技術には、ゲル濾過クロマトグラフィー、イオン交換クロマトグラフィー、疎水性相互作用クロマトグラフィー、逆相クロマトグラフィー、およびアフィニティークロマトグラフィーなどのクロマトグラフィー分離技術があるが、医療用タンパク質の精製を工業的に実施する場合には、実験室で用いられるような分離剤や装置を使用したのでは経済性に乏しく、実用的とは言い難い。また、医療用タンパク質を工業的に製造する過程では多種類のタンパク質が混在しているため、上記の中の一つの精製技術を用いて、目的とするタンパク質を純粋に得ることは極めて困難である。そのため通常はいくつかの技術を複合させた精製プロセスが採用されている(特許文献1)。
【0003】
近年、医療用タンパク質の一つである免疫グロブリンを精製するための低分子化合物とそれらが結合したマトリックスが数多く開示されており、スルホン誘導体(特許文献2)、トリアジン誘導体(特許文献3)、メルカプト複素環式化合物(特許文献4)、4−ピリジルエチルチオアルキル誘導体(非特許文献1)等の低分子化合物が結合したマトリックスが知られている。しかしながら、本発明のマトリックスの製造に用いるチアゾール誘導体(1a)が免疫グロブリンを精製するための低分子化合物として有用であると記載した文献はない。また、特許文献5や非特許文献2に本発明のマトリックスの製造に用いるチアゾール誘導体(1a)に類似の化学構造を有するチアゾール誘導体が報告されているものの、これらの文献に記載のチアゾール誘導体の化学構造は、チアゾール環の2位がアミノ基あるいはアルキル基に限定されており、本発明のマトリックスの製造に用いるチアゾール誘導体(1a)のように2位にアリールカルボニルアミノ基を有する化合物についての記載はない。とりわけ非特許文献2に記載の化合物は、本発明のマトリックスの製造に用いるチアゾール誘導体(1a)に類似のチアゾール誘導体ではあるものの、それらの用途はヒスタミンH2レセプターアゴニストに限定されており、免疫グロブリンを精製するための用途についての記載はない。
【0004】
なお、特許文献6にはチアゾール環の2位にベンゾイルアミノ基が置換したチアゾール誘導体が記載されているが、これらの化合物におけるチアゾール環の4位の置換基はカルボニル基、5位は無置換にそれぞれ限定されており、用途も消化管運動改善作用を有する医薬の有効成分である。更には特許文献6の化合物はマトリックスに固定化されたものではなく、免疫グロブリンを精製するための用途についての記載もない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】WO2004/087761号
【特許文献2】米国特許4696980号
【特許文献3】米国特許6117996号
【特許文献4】特許第3844496号
【特許文献5】WO1991/10656号
【特許文献6】WO1998/17654号
【非特許文献】
【0006】
【非特許文献1】Bioseparation,9(4),211−221,2000
【非特許文献2】Journal of Medicinal Chemistry,35(17),3239−3246,1992
【非特許文献3】化学大辞典、7巻、479、共立出版
【非特許文献4】はじめてのリガンドカップリングハンドブック、アマシャムバイオサイエンス社、2005
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明が解決しようとする課題は、タンパク質、特に免疫グロブリンの分析又は精製に有用なチアゾール誘導体を固定化したマトリックス、及びその製造方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、上記課題を解決すべく鋭意検討を重ねた結果、本発明の下記一般式(1)で示されるチアゾール誘導体固定化マトリックスが、タンパク質、特に免疫グロブリンの簡便な分析又は精製を可能にすることを見出し、本発明を完成するに至った。
【0009】
即ち本発明は、一般式(1)
【0010】
【化1】

(式中、R1及びR2は水素原子又は置換されていてもよい炭素数1から6のアルキル基を表し、R3は酸素原子、メチレン基、硫黄原子、カルボニル基又はイミノキシ基(−ONH−)を表し、Arは置換されていてもよい芳香族基を表し、nは1から12の整数を表し、Mはマトリックスを表す。)で表されるチアゾール誘導体固定化マトリックスに関するものである。
【0011】
また本発明は、一般式(1)
【0012】
【化2】

(式中、R1、R2、R3、Ar、n及びMは前記と同じ意味を表す。)において、Mのマトリックスがビニル重合体、多糖、金属酸化物であることを特徴とするチアゾール誘導体固定化マトリックスに関するものである。
【0013】
また本発明は、一般式(1a)
【0014】
【化3】

(式中、R1、R2、Ar及びnは前記と同じ意味を表し、R4はヒドロキシ基、ホルミル基、メルカプト基、カルボキシル基又はアミノキシ基(−ONH2)を表す。)で示されるチアゾール誘導体と、活性化基含有マトリックスとを反応させることを特徴とする、一般式(1)
【0015】
【化4】

(式中、R1、R2、R3、Ar、n及びMは前記と同じ意味を表す。)で示されるチアゾール誘導体固定化マトリックスの製造方法に関するものである。
【0016】
また本発明は、一般式(1)
【0017】
【化5】

(式中、R1、R2、R3、Ar、n及びMは前記と同じ意味を表す。)で示されるチアゾール誘導体固定化マトリックスを使用し、タンパク質の分析又は精製を行なう方法に関するものである。
【0018】
以下、本発明をさらに詳細に説明する。
【0019】
本発明のチアゾール誘導体固定化マトリックスで用いるチアゾール誘導体における、R1、R2、R3、R4、Arで表される置換基の定義を以下に示す。
【0020】
R1及びR2で表される置換されていてもよい炭素数1から6のアルキル基としては、直鎖状もしくは分枝状のいずれであってもよく、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、ペンチル基、イソアミル基、ネオペンチル基、2−ペンチル基、3−ペンチル基、tert−ペンチル基、ヘキシル基、イソヘキシル基、2−ヘキシル基、3−ヘキシル基を例示することができる。また、これらの炭素数1から6のアルキル基はハロゲン原子等で置換されていてもよく、さらに具体的にはジフルオロメチル基、トリフルオロメチル基、2,2,2−トリフルオロエチル基、パーフルオロブチル基、ヒドロキシメチル基、カルボキシメチル基、メチルチオメチル基、4−モルホリノカルボニルメチル基等を例示することができる。免疫グロブリンの分析又は精製において良好な性能を示す点で、R1はメチル基が好ましく、R2は水素原子が好ましい。
【0021】
Arで表される芳香族基は特に制限はないが、フラン−2−イル基、フラン−3−イル基、チオフェン−2−イル基、チオフェン−3−イル基、ピロール−2−イル基、ピロール−3−イル基、ピラゾール−3−イル基、ピラゾール−4−イル基、イソチアゾール−3−イル基、イソチアゾール−4−イル基、イソキサゾール−3−イル基、イソキサゾール−4−イル基、イミダゾール−2−イル基、イミダゾール−4−イル基、イミダゾール−5−イル基、オキサゾール−2−イル基、オキサゾール−4−イル基、オキサゾール−5−イル基、チアゾール−2−イル基、チアゾール−4−イル基、チアゾール−5−イル基、1,2,4−トリアゾール−3−イル基、フェニル基、2−ピリジル基、3−ピリジル基、4−ピリジル基、2−ピリミジル基、4−ピリミジル基、5−ピリミジル基、1,2,4−トリアジン−3−イル基、1,2,4−トリアジン−5−イル基、1,2,4−トリアジン−6−イル基、ベンゾジオキソラン−3−イル基、ベンゾフラン−2−イル基、ベンゾフラン−3−イル基、ベンゾフラン−4−イル基、ベンゾフラン−5−イル基、ベンゾフラン−6−イル基、ベンゾフラン−7−イル基、ベンゾチオフェン−2−イル基、ベンゾチオフェン−3−イル基、ベンゾチオフェン−4−イル基、ベンゾチオフェン−5−イル基、ベンゾチオフェン−6−イル基、ベンゾチオフェン−7−イル基、インドール−2−イル基、インドール−3−イル基、インドール−4−イル基、インドール−5−イル基、インドール−6−イル基、インドール−7−イル基、ベンゾチアゾール−2−イル基、ベンゾチアゾール−4−イル基、ベンゾチアゾール−5−イル基、ベンゾチアゾール−6−イル基、ベンゾチアゾール−7−イル基、インダゾール−3−イル基、インダゾール−4−イル基、インダゾール−5−イル基、インダゾール−6−イル基、インダゾール−7−イル基、ベンズイソキサゾール−3−イル基、ベンズイソキサゾール−4−イル基、ベンズイソキサゾール−5−イル基、ベンズイソキサゾール−6−イル基、ベンズイソキサゾール−7−イル基、ナフタレン−1−イル基、ナフタレン−2−イル基、キノリン−2−イル基、キノリン−3−イル基、キノリン−4−イル基、キノリン−5−イル基、キノリン−6−イル基、キノリン−7−イル基、キノリン−8−イル基、キノキサリニル基、キノキサリン−5−イル基、キノキサリン−6−イル基、キナゾリニル基、キナゾリン−4−イル基、キナゾリン−5−イル基、キナゾリン−6−イル基、キナゾリン−7−イル基、キナゾリン−8−イル基、ベンゾオキサジン−5−イル基、ベンゾオキサジン−6−イル基、ベンゾオキサジン−7−イル基、ベンゾオキサジン−8−イル基、ベンゾチアジン−5−イル基、ベンゾチアジン−6−イル基、ベンゾチアジン−7−イル基、ベンゾチアジン−8−イル基、1,3−ベンゾジオキソール−4−イル基、1,3−ベンゾジオキソール−5−イル基、1,3−ベンゾジオキソール−6−イル基、1,3−ベンゾジオキソール−7−イル基、アントラセン−1−イル基を例示できる。特に、免疫グロブリンの分析又は精製において良好な性能を示す点で、Arはフェニル基、2−ピリジル基、3−ピリジル基、4−ピリジル基又はフラン−2−イル基が好ましい。
【0022】
Arで表される置換されていてもよい芳香族基の置換基としては特に制限はないが、ハロゲン原子、置換されていてもよい炭素数1から6のアルキル基、置換されていてもよい炭素数1から12のアルコキシ基、置換されていてもよい炭素数3から8のシクロアルコキシ基、置換されていてもよい炭素数3から6のアルケニルオキシ基、置換されていてもよい炭素数3から6のアルキニルオキシ基、置換されていてもよい炭素数1から6のアシルオキシ基、置換されていてもよい炭素数1から6のアルキルチオ基、置換されていてもよい炭素数1から6のアルキルスルフィニル基、置換されていてもよい炭素数1から6のアルキルスルホニル基、置換されていてもよい炭素数1から12のアルコキシカルボニル基、カルボキシル基、ニトロ基、置換されていてもよいアミノ基、ヒドロキシ基又はシアノ基が好ましい。
【0023】
Arの置換基としてのハロゲン原子としては、フッ素原子、塩素原子、臭素原子又はヨウ素原子を例示することができる。
【0024】
Arの置換基としての炭素数1から6のアルキル基としては、直鎖状、分枝状もしくは環状のいずれであってもよく、メチル基、エチル基、シクロプロピル基、プロピル基、イソプロピル基、シクロプロピル基、ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、ペンチル基、イソアミル基、ネオペンチル基、2−ペンチル基、3−ペンチル基、2−メチルブチル基、tert−ペンチル基、ヘキシル基、イソヘキシル基、2−ヘキシル基、3−ヘキシル基を例示することができる。また、これらのアルキル基はハロゲン原子、炭素数3から8のシクロアルキル基、炭素数1から6のアルコキシ基、炭素数1から6のアルコキシカルボニル基、カルボキシル基、アシル基、置換されていてもよい芳香族基で1個以上置換されていてもよく、さらに具体的には2−クロロエチル基、3−クロロプロピル基、ジフルオロメチル基、3−フルオロプロピル基、メトキシメチル基、2−エトキシエチル基、シクロプロピルメチル基、シクロペンチルメチル基、シクロヘキシルメチル基、2−メチルチオエチル基、2−エチルチオエチル基、2−アリルチオエチル基、2−プロパルギルチオエチル基、2−ベンジルチオエチル基、2−(2−クロロベンジル)チオエチル基、2−(2,4−ジクロロベンジル)チオエチル基、2−メチルスルフィニルエチル基、2−メチルスルホニルエチル基、メトキシメチル基、エトキシメチル基、2−メトキシエチル基、2−クロロエトキシメチル基、メトキシカルボニルメチル基、エトキシカルボニルメチル基、1−メトキシカルボニルエチル基、1−エトキシカルボニルエチル基、2−エトキシカルボニルエチル基、カルボキシメチル基、アセトニル基、1−アセチルエチル基、3−アセチルプロピル基、フェナシル基、4−クロロフェナシル基、2,4−ジフルオロフェナシル基、4−メチルフェナシル基、4−イソプロピルフェナシル基、4−イソブチルフェナシル基、4−シクロヘキシルフェナシル基、4−シアノフェナシル基、4−ニトロフェナシル基、チオフェン−2−イル基、2−(チオフェン−2−イル)エチル基、2−(チオフェン−3−イル)エチル基、フルフリル基、(5−メチルフラン−2−イル)メチル基、(5−エチルフラン−2−イル)メチル基、(5−クロロフラン−2−イル)メチル基、2−(5−フルオロフラン−2−イル)エチル基、テトラヒドロフルフリル基、2−ピリジルメチル基、3−ピリジルメチル基、4−ピリジルメチル基、2−(ピリジン−2−イル)エチル基、2−(ピリジン−3−イル)エチル基、2−(ピリジン−4−イル)エチル基、3−(ピリジン−2−イル)プロピル基、3−(ピリジン−3−イル)プロピル基、3−(ピリジン−4−イル)プロピル基を例示することができる。
【0025】
Arの置換基としての置換されていてもよい炭素数1から12のアルコキシ基としては、直鎖状もしくは分枝状のいずれであってもよく、メトキシ基、エトキシ基、プロピルオキシ基、イソプロピルオキシ基、ブトキシ基、イソブチルオキシ基、sec−ブチルオキシ基、tert−ブトキシ基、ペンチルオキシ基、イソアミルオキシ基、ネオペンチルオキシ基、2−ペンチルオキシ基、3−ペンチルオキシ基、tert−ペンチルオキシ基、ヘキシルオキシ基、イソヘキシルオキシ基、2−ヘキシルオキシ基、3−ヘキシルオキシ基、デセニルオキシ基を例示することができる。また、これらのアルコキシ基はハロゲン原子、炭素数3から8のシクロアルキル基、炭素数1から6のアルコキシ基、炭素数1から6のアルコキシカルボニル基、カルボキシル基、アシル基、置換されていてもよい芳香族基等で1個以上置換されていてもよく、さらに具体的には2−クロロエトキシ基、3−クロロプロピルオキシ基、ジフルオロメトキシ基、4−トリフルオロメトキシ基、3−フルオロプロピルオキシ基、シクロプロピルメトキシ基、シクロペンチルメトキシ基、シクロヘキシルメトキシ基、2−メチルチオエトキシ基、2−エチルチオエトキシ基、2−アリルチオエトキシ基、2−プロパルギルチオエトキシ基、2−ベンジルチオエトキシ基、2−(2−クロロベンジル)チオエトキシ基、2−(2,4−ジクロロベンジル)チオエトキシ基、2−メチルスルフィニルエトキシ基、2−メチルスルホニルエトキシ基、メトキシメトキシ基、エトキシメトキシ基、2−メトキシエトキシ基、2−クロロエトキシメトキシ基、メトキシカルボニルメトキシ基、エトキシカルボニルメトキシ基、1−メトキシカルボニルエトキシ基、1−エトキシカルボニルエトキシ基、2−エトキシカルボニルエトキシ基、カルボキシメトキシ基、1−アセチルエトキシ基、3−アセチルプロポキシ基、2−ピリジルメトキシ基、3−ピリジルメトキシ基、4−ピリジルメトキシ基、2−(ピリジン−2−イル)エトキシ基、2−(ピリジン−3−イル)エトキシ基、2−(ピリジン−4−イル)エトキシ基、3−(ピリジン−2−イル)プロポキシ基、3−(ピリジン−3−イル)プロポキシ基、ベンジルオキシ基を例示することができる。
【0026】
Arの置換基としての置換されていてもよい炭素数3から8のシクロアルコキシ基としては、シクロプロピルオキシ基、シクロブチルオキシ基、シクロペンチルオキシ基、2−メチルシクロブチルオキシ基、シクロヘキシルオキシ基、2−メチルシクロペンチルオキシ基、3−メチルシクロペンチルオキシ基、4−メチルシクロペンチルオキシ基、シクロオクチルオキシ基を例示することができる。
【0027】
Arの置換基としての置換されていてもよい炭素数3から6のアルケニルオキシ基としては、アリルオキシ基、2−メチル−2−プロペニルオキシ基、2−ブテニルオキシ基、1−ブテン−3−イルオキシ基、3−ブテニルオキシ基、4−ペンテニルオキシ基、5−ヘキセニルオキシ基を例示することができる。これらのアルケニルオキシ基はハロゲン原子等で置換されていてもよく、3,3−ジフルオロアリルオキシ基、3,3−ジクロロアリルオキシ基、3,3−ジブロモアリルオキシ基を例示することができる。
【0028】
Arの置換基としての置換されていてもよい炭素数3から6のアルキニルオキシ基としては、プロパルギルオキシ基、1−ブチン−3−イルオキシ基、2−ブチニルオキシ基、3−ブチニルオキシ基、2−ペンチニルオキシ基、3−ペンチニルオキシ基、4−ペンチニルオキシ基、2−ヘキシニルオキシ基、3−ヘキシニルオキシ基、4−ヘキシニルオキシ基、5−ヘキシニルオキシ基を例示することができ、これらのアルキニルオキシ基はハロゲン原子等で置換されていてもよく、4,4,4−トリフルオロブチン−2−イル基等を例示することができる。
【0029】
Arの置換基としての置換されていてもよい炭素数1から6のアシルオキシ基としては、アセトキシ基、プロピオニルオキシ基を例示することができ、これらのアシルオキシ基はハロゲン原子等で置換されていてもよく、トリフルオロアセトキシ基や2,2,2−トリフルオロプロピオニルオキシ基等を例示することができる。
【0030】
Arの置換基としての置換されていてもよい炭素数1から6のアルキルチオ基としては、メチルチオ基、エチルチオ基、プロピルチオ基、イソプロピルチオ基、ブチルチオ基、イソブチルチオ基、sec−ブチルチオ基、ペンチルチオ基、イソアミルチオ基、ネオペンチルチオ基、2−ペンチルチオ基、3−ペンチルチオ基、2−メチルブチルチオ基、ヘキシルチオ基、イソヘキシルチオ基、3−メチルペンチルチオ基、2−メチルペンチルチオ基を例示することができる。また、これらのアルキルチオ基はハロゲン原子、炭素数3から8のシクロアルキル基等で一個以上置換されていてもよく、さらに具体的には2−クロロエチルチオ基、3−クロロプロピルチオ基、ジフルオロメチルチオ基、3−フルオロプロピルチオ基、シクロプロピルメチルチオ基、シクロペンチルメチルチオ基、シクロヘキシルメチルチオ基を例示することができる。
【0031】
Arの置換基としての置換されていてもよい炭素数1から6のアルキルスルフィニル基としては、メチルスルフィニル基、エチルスルフィニル基、プロピルスルフィニル基、イソプロピルスルフィニル基、ブチルスルフィニル基、イソブチルスルフィニル基、sec−ブチルスルフィニル基、ペンチルスルフィニル基、イソアミルスルフィニル基、ネオペンチルスルフィニル基、2−ペンチルスルフィニル基、3−ペンチルスルフィニル基、2−メチルブチルスルフィニル基、ヘキシルスルフィニル基、イソヘキシルスルフィニル基、3−メチルペンチルスルフィニル基、2−メチルペンチルスルフィニル基を例示することができる。また、これらのアルキルスルフィニル基はハロゲン原子、炭素数3から8のシクロアルキル基等で一個以上置換されていてもよく、さらに具体的には2−クロロエチルスルフィニル基、3−クロロプロピルスルフィニル基、ジフルオロメチルスルフィニル基、3−フルオロプロピルスルフィニル基、シクロプロピルメチルスルフィニル基、シクロペンチルメチルスルフィニル基、シクロヘキシルメチルスルフィニル基を例示することができる。
【0032】
Arの置換基としての置換されていてもよい炭素数1から6のアルキルスルホニル基としては、メチルスルホニル基、エチルスルホニル基、プロピルスルホニル基、イソプロピルスルホニル基、ブチルスルホニル基、イソブチルスルホニル基、sec−ブチルスルホニル基、ペンチルスルホニル基、イソアミルスルホニル基、ネオペンチルスルホニル基、2−ペンチルスルホニル基、3−ペンチルスルホニル基、2−メチルブチルスルホニル基、ヘキシルスルホニル基、イソヘキシルスルホニル基、3−メチルペンチルスルホニル基、2−メチルペンチルスルホニル基を例示することができる。また、これらのアルキルスルホニル基はハロゲン原子、炭素数3から8のシクロアルキル基で一個以上置換されていてもよく、さらに具体的には2−クロロエチルスルホニル基、3−クロロプロピルスルホニル基、ジフルオロメチルスルホニル基、3−フルオロプロピルスルホニル基、シクロプロピルメチルスルホニル基、シクロペンチルメチルスルホニル基、シクロヘキシルメチルスルホニル基を例示することができる。
【0033】
Arの置換基としての置換されていてもよい炭素数1から12のアルコキシカルボニル基としては、メトキシカルボニル基、エトキシカルボニル基、プロポキシカルボニル基、ブトキシカルボニル基、ヘキシルオキシカルボニル基、ドデシルオキシカルボニル基、ベンジルオキシカルボニル基、tert−ブトキシカルボニル基を例示することができ、これらのアルコキシカルボニル基はハロゲン原子等で一個以上置換されていてもよく、さらに具体的にはトリフルオロメトキシカルボニル基、2,2,2−トリフルオロエトキシカルボニル基等を例示することができる。
【0034】
Arの置換基としての置換されていてもよいアミノ基としては、アミノ基、メチルアミノ基、ジメチルアミノ基、エチルアミノ基、N−エチル−N−メチルアミノ基、ジエチルアミノ基、N−メチル−N−プロピルアミノ基、N−エチル−N−プロピルアミノ基、2,2,2−トリフルオロエチルアミノ基、ジプロピルアミノ基、イソプロピルアミノ基、N−メチル−N−イソプロピルアミノ基、ブチルアミノ基、N−ブチル−N−メチルアミノ基、イソブチルアミノ基、sec−ブチルアミノ基、ペンチルアミノ基、イソアミルアミノ基、ネオペンチルアミノ基、2−ペンチルアミノ基、3−ペンチルアミノ基、2−メチルブチルアミノ基、ヘキシルアミノ基、イソヘキシルアミノ基、4−メチルペンチルアミノ基、ベンゼンスルホニルアミノ基、N−ベンゼンスルホニル−N−メチルアミノ基、p−トルエンスルホニルアミノ基、4−クロロベンゼンスルホニルアミノ基、4−ニトロベンゼンスルホニルアミノ基、メチルスルホニルアミノ基、クロロメチルスルホニルアミノ基、トリフルオロメチルスルホニルアミノ基、N−メチルスルホニル−N−メチルアミノ基、N−メチルスルホニル−N−エチルアミノ基、N−メチルスルホニル−N−プロピルアミノ基、エチルスルホニルアミノ基、N−エチルスルホニル−N−メチルアミノ基、N−エチルスルホニル−N−エチルアミノ基、メトキシカルボニルアミノ基、エトキシカルボニルアミノ基を例示することができる。
【0035】
Arで表される置換されていてもよい芳香族基の具体例として、フラン−2−イル基、5−ブロモフラン−2−イル基、5−メチルフラン−2−イル基、フラン−3−イル基、チオフェン−2−イル基、5−クロロチオフェン−2−イル基、5−ブロモチオフェン−2−イル基、5−メチルチオフェン−2−イル基、5−メトキシチオフェン−2−イル基、5−エトキシチオフェン−2−イル基、チオフェン−3−イル基、5−メチルチオフェン−3−イル基、5−メトキシチオフェン−3−イル基、5−エトキシチオフェン−3−イル基、1−メチルピロール−2−イル基、1−メチルピロール−3−イル基、1−エチルピラゾール−3−イル基、ピラゾール−2−イル基、3−エトキシ−1−メチルピラゾール−2−イル基、1−エチル−4−メトキシピラゾール−3−イル基、イソチアゾール−3−イル基、5−メトキシイソチアゾール−3−イル基、イソチアゾール−4−イル基、イソキサゾール−3−イル基、イソキサゾール−4−イル基、1−メチルイミダゾール−2−イル基、1−メチルイミダゾール−4−イル基、1−メチルイミダゾール−5−イル基、オキサゾール−2−イル基、オキサゾール−4−イル基、オキサゾール−5−イル基、チアゾール−2−イル基、3−メトキシチアゾール−2−イル基、4−メトキシチアゾール−2−イル基、チアゾール−4−イル基、チアゾール−5−イル基、1,2,4−トリアゾール−3−イル基、1,2,4−トリアゾール−5−イル基、フェニル基、2−フルオロフェニル基、3−フルオロフェニル基、4−フルオロフェニル基、2,3−ジフルオロフェニル基、3,5−ジフルオロフェニル基、3,4,5−トリフルオロフェニル基、2,3,4,5,6−ペンタフルオロフェニル基、3−フルオロ−4−メチルフェニル基、4−トリフルオロメトキシフェニル基、2−クロロフェニル基、3−クロロフェニル基、4−クロロフェニル基、4−クロロ−3−メチルフェニル基、4−クロロ−3−エチルフェニル基、4−クロロ−3−メトキシフェニル基、4−クロロ−3−エトキシフェニル基、2,3−ジクロロフェニル基、3,5−ジクロロフェニル基、3,4,5−トリクロロフェニル基、3−トリフルオロメチルフェニル基、4−トリフルオロメチルフェニル基、3−ブロモフェニル基、4−ブロモフェニル基、4−ブロモ−3−メチルフェニル基、4−ブロモ−3−エチルフェニル基、4−ブロモ−3−メトキシフェニル基、4−ブロモ−3−エトキシフェニル基、3,5−ジブロモ−4−ヒドロキシフェニル基、3−ヨードフェニル基、4−ヨードフェニル基、4−ヨード−3−メチルフェニル基、4−ヨード−3−エチルフェニル基、4−ヨード−3−メトキシフェニル基、4−ヨード−3−エトキシフェニル基、2−メチルフェニル基、3−メチルフェニル基、4−メチルフェニル基、3,4−ジメチルフェニル基、3,4,5−トリメチルフェニル基、3−ヒドロキシ−4−メチルフェニル基、2−トリフルオロフェニルメチルフェニル基、3−トリフルオロフェニルメチルフェニル基、4−トリフルオロフェニルメチルフェニル基、4−メトキシメチルフェニル基、3,4−ジエトキシフェニル基、3−エチル−4−メチルフェニル基、4−エチル−3−メチルフェニル基、4−エチルフェニル基、3,4−ジエチルフェニル基、4−プロピルフェニル基、4−イソプロピルフェニル基、3−ブチルフェニル基、4−ブチルフェニル基、4−イソブチルフェニル基、4−(sec−ブチル)フェニル基、4−(tert−ブチル)フェニル基、4−ペンチルフェニル基、4−イソアミルフェニル基、4−ネオペンチルフェニル基、4−(2−ペンチル)フェニル基、4−(3−ペンチル)フェニル基、4−(2−メチルブチル)フェニル基、4−(tert−ペンチル)フェニル基、4−ヘキシルフェニル基、4−イソヘキシルフェニル基、4−(2−クロロエチル)フェニル基、4−(3−クロロプロピル)フェニル基、4−(ジフルオロメチル)フェニル基、4−(3−フルオロプロピル)フェニル基、4−メトキシメチルフェニル基、4−エトキシメチルフェニル基、4−シクロプロピルメチルフェニル基、4−シクロペンチルメチルフェニル基、シクロヘキシルメチルフェニル基、4−(2−メチルチオエチル)フェニル基、4−(2−エチルチオエチル)フェニル基、4−(2−アリルチオエチル)フェニル基、4−(2−プロパルギルチオエチル)フェニル基、4−(2−ベンジルチオエチル)フェニル基、3−メトキシフェニル基、3−メトキシ−4−メチルフェニル基、4−エチル−3−メトキシフェニル基、3−メトキシ−4−プロピルフェニル基、4−メトキシフェニル基、4−メトキシ−3−メトキシフェニル基、3,4−ジメトキシフェニル基、3−エトキシ−4−メトキシフェニル基、4−エトキシ−3−メトキシフェニル基、4−イソプロピルオキシ−3−メトキシフェニル基、3−イソプロピルオキシ−4−メトキシフェニル基、3−エトキシフェニル基、4−エトキシフェニル基、4−エトキシ−3−メチルフェニル基、4−エトキシ−3−エチルフェニル基、4−エトキシ−3−プロピルフェニル基、4−エトキシ−3−イソプロピルフェニル基、4−プロピルオキシフェニル基、4−イソプロピルオキシフェニル基、4−ブトキシフェニル基、4−イソブチルオキシフェニル基、4−(sec−ブチルオキシ)フェニル基、3−(2−クロロエトキシ)フェニル基、3−(2−クロロエトキシ)フェニル基、4−(2−クロロエトキシ)フェニル基、3−(3−クロロプロピルオキシ)フェニル基、4−(3−クロロプロピルオキシ)フェニル基、3−ジフルオロメトキシフェニル基、4−ジフルオロメトキシフェニル基、4−(3−フルオロプロピルオキシ)フェニル基、4−シクロプロピルメトキシフェニル基、4−シクロペンチルメトキシ基、4−シクロヘキシルメトキシ基、3−シクロプロピルオキシフェニル基、4−シクロプロピルオキシフェニル基、4−シクロプロピルオキシ−3−メトキシフェニル基、4−シクロプロピルオキシ−3−メチルフェニル基、4−シクロブチルオキシフェニル基、4−シクロペンチルオキシフェニル基、4−(2−メチルシクロブチルオキシ)フェニル基、4−シクロヘキシルオキシフェニル、4−アリルオキシフェニル基、4−(3,3−ジクロロアリルオキシ)フェニル基、4−プロパルギルオキシフェニル基、3−メチル−4−プロパルギルオキシフェニル基、3−エチル−4−プロパルギルオキシフェニル基、3−メトキシ−4−プロパルギルオキシフェニル基、3−エトキシ−4−プロパルギルオキシフェニル基、3−プロポキシ−4−プロパルギルオキシフェニル基、4−(1−ブチン−3−イルオキシ)フェニル基、4−(2−ブチニルオキシ)フェニル基、3−メチルチオフェニル基、4−メチルチオフェニル基、4−メチル−3−メチルチオフェニル基、3−メチル−4−メチルチオフェニル基、4−メトキシ−3−メチルチオフェニル基、3−エトキシ−4−メチルチオフェニル基、4−エトキシ−3−メチルチオフェニル基、3−プロポキシ−4−メチルチオフェニル基、4−エチルチオフェニル基、3−プロピルチオフェニル基、4−イソプロピルチオフェニル基、4−ブチルチオフェニル基、4−イソブチルチオフェニル基、2−(sec−ブチルチオ)フェニル基、2−ペンチルチオフェニル基、2−イソアミルチオフェニル基、4−ネオペンチルチオフェニル基、4−(2−クロロエチルチオ)フェニル基、3−(3−クロロプロピルチオ)フェニル基、ジフルオロメチルチオフェニル基、3−アセトキシフェニル基、4−アセトキシフェニル基、3−メチルスルフィニルフェニル基、4−メチルスルフィニルフェニル基、4−メトキシ−3−メチルスルフィニルフェニル基、3−メトキシ−4−メチルスルフィニルフェニル基、4−エトキシ−3−メチルスルフィニルフェニル基、3−エトキシ−4−メチルスルフィニルフェニル基、4−メチル−3−メチルスルフィニルフェニル基、3−エチル−4−メチルスルフィニルフェニル基、4−(2−クロロエチルスルフィニル)フェニル基、4−(3−クロロプロピルスルフィニル)フェニル基、4−(ジフルオロメチルスルフィニル)フェニル基、3−メチルスルホニルフェニル基、4−メチルスルホニルフェニル基、4−メチル−3−メチルスルホニルフェニル基、4−エチル−3−メチルスルホニルフェニル基、4−メトキシ−3−メチルスルホニルフェニル基、4−エトキシ−3−メチルスルホニルフェニル基、3−メトキシ−4−メチルスルホニルフェニル基、3−エトキシ−4−メチルスルホニルフェニル基、エチルスルホニルフェニル基、プロピルスルホニルフェニル基、イソプロピルスルホニルフェニル基、ブチルスルホニルフェニル基、2−クロロエチルスルホニルフェニル基、3−クロロプロピルスルホニルフェニル基、ジフルオロメチルスルホニルフェニル基、4−カルボキシフェニル基、4−メトキシカルボニルフェニル基、4−エトキシカルボニルフェニル基、3−メチルアミノフェニル基、4−メチルアミノフェニル基、4−メトキシ−3−メチルアミノフェニル基、3−メトキシ−4−メチルアミノフェニル基、4−エトキシ−3−メチルアミノフェニル基、3−エトキシ−4−メチルアミノフェニル基、4−メチル−3−メチルアミノフェニル基、3−メチル−4−メチルアミノフェニル基、4−エチル−3−メチルアミノフェニル基、3−エチル−4−メチルアミノフェニル基、3−ジメチルアミノフェニル基、4−ジメチルアミノフェニル基、4−メトキシ−3−ジメチルアミノフェニル基、3−メトキシ−4−ジメチルアミノフェニル基、4−エトキシ−3−ジメチルアミノフェニル基、3−エトキシ−4−ジメチルアミノフェニル基、4−メチル−3−ジメチルアミノフェニル基、3−メチル−4−ジメチルアミノフェニル基、4−エチル−3−ジメチルアミノフェニル基、3−メチル−4−ジメチルアミノフェニル基、3−(N−エチル−N−メチルアミノ)フェニル基、4−(N−エチル−N−メチルアミノ)フェニル基、4−メトキシ−3−(N−エチル−N−メチルアミノ)フェニル基、3−メトキシ−4−(N−エチル−N−メチルアミノ)フェニル基、4−エトキシ−3−(N−エチル−N−メチルアミノ)フェニル基、3−エトキシ−4−(N−エチル−N−メチルアミノ)フェニル基、4−メチル−3−(N−エチル−N−メチルアミノ)フェニル基、3−メチル−4−(N−エチル−N−メチルアミノ)フェニル基、4−エチル−3−(N−エチル−N−メチルアミノ)フェニル基、3−メチル−4−(N−エチル−N−メチルアミノ)フェニル基、3−ジエチルアミノフェニル基、4−ジエチルアミノフェニル基、4−メトキシ−3−ジエチルアミノフェニル基、3−メトキシ−4−ジエチルアミノフェニル基、4−エトキシ−3−ジエチルアミノフェニル基、3−エトキシ−4−ジエチルアミノフェニル基、4−メチル−3−ジエチルアミノフェニル基、3−メチル−4−ジエチルアミノフェニル基、4−エチル−3−ジエチルアミノフェニル基、3−メチル−4−ジエチルアミノフェニル基、4−メチルスルホニルアミノフェニル基、4−トリフルオロメチルスルホニルアミノフェニル基、4−アセチルアミノフェニル基、2−ヒドロキシフェニル基、3−ヒドロキシフェニル基、4−ヒドロキシフェニル基、3−ヒドロキシ−4−メチルフェニル基、3−ヒドロキシ−4−エチルフェニル基、3−ヒドロキシ−4−メトキシフェニル基、4−ヒドロキシ−3−メチルフェニル基、4−ヒドロキシ−3−エチルフェニル基、4−ヒドロキシ−3−メトキシフェニル基、2−シアノフェニル基、3−シアノフェニル基、4−シアノフェニル基、2−ニトロフェニル基、3−ニトロフェニル基、3−ニトロ−4−メチルフェニル基、4−ニトロフェニル基、ピリジン−2−イル基、5−クロロピリジン−2−イル基、5−メチルピリジン−2−イル基、5−エチルピリジン−2−イル基、5−メトキシピリジン−2−イル基、5−エトキシピリジン−2−イル基、2,3−ジメチルピリジン−6−イル基、2,3−ジメトキシピリジン−6−イル基、ピ
リジル−3−イル基、2−クロロピリジン−5−イル基、2−メチルピリジン−5−イル基、2−エチルピリジン−5−イル基、2−メトキシピリジン−5−イル基、2−エトキシピリジン−5−イル基、2,3−ジメチルピリジン−5−イル基、ピリジル−4−イル基、2−メチルピリジン−4−イル基、2−エチルピリジン−4−イル基、2−メトキシピリジン−4−イル基、2−エトキシピリジン−4−イル基、2−ピリミジル基、5−メチルピリミジン−2−イル基、5−エチルピリミジン−2−イル基、2−エトキシピリジン−5−イル基、2,3−ジメチルピリジン−5−イル基、2−メチルピリジン−4−イル基、2−エチルピリジン−4−イル基、2−メトキシピリジン−4−イル基、2−エトキシピリジン−4−イル基、5−クロロピリミジン−2−イル基、5−ブロモピリミジン−2−イル基、5−メトキシピリミジン−2−イル基、ピリミジル−4−イル基、ピリミジル−5−イル基、1,2,4−トリアジン−3−イル基、1,2,4−トリアジン−5−イル基、1,2,4−トリアジン−6−イル基、ベンゾジオキソラン−3−イル基、ベンゾフラン−2−イル基、ベンゾフラン−3−イル基、ベンゾフラン−4−イル基、ベンゾフラン−5−イル基、ベンゾフラン−6−イル基、ベンゾフラン−7−イル基、ベンゾチオフェン−2−イル基、ベンゾチオフェン−3−イル基、ベンゾチオフェン−4−イル基、ベンゾチオフェン−5−イル基、ベンゾチオフェン−6−イル基、ベンゾチオフェン−7−イル基、1−メチルインドール−2−イル基、ベンゾチアゾール−2−イル基、ベンゾチアゾール−4−イル基、ベンゾチアゾール−5−イル基、ベンゾチアゾール−6−イル基、ベンゾチアゾール−7−イル基、ベンズイソキサゾール−3−イル基、ベンズイソキサゾール4−イル基、ベンズイソキサゾール−5−イル基、ベンズイソキサゾール−6−イル基、ベンズイソキサゾール−7−イル基、ナフタレン−1−イル基、ナフタレン−2−イル基、キノリン−2−イル基、キノリン−3−イル基、キノリン−4−イル基、キノリン−5−イル基、キノリン−6−イル基、キノリン−7−イル基、キノリン−8−イル基、キノキサリン−5−イル基、キノキサリン−6−イル基、キナゾリン−4−イル基、キナゾリン−5−イル基、キナゾリン−6−イル基、キナゾリン−7−イル基、キナゾリン−8−イル基、ベンゾオキサジン−5−イル基、ベンゾオキサジン−6−イル基、ベンゾオキサジン−7−イル基、ベンゾオキサジン−8−イル基、ベンゾチアジン−5−イル基、ベンゾチアジン−6−イル基、ベンゾチアジン−7−イル基、ベンゾチアジン−8−イル基、1,3−ベンゾジオキソール−4−イル基、1,3−ベンゾジオキソール−5−イル基、アントラセン−1−イル基等があげられる。
【0036】
免疫グロブリンの分析又は精製において良好な性能を示す点で、Arは4−メチルフェニル基、4−エチルフェニル基、3,4−ジメチルフェニル基、3−エチル−4−メチルフェニル基、4−エチル−3−メチルフェニル基、4−メトキシフェニル基、4−エトキシフェニル基、3,4−ジメトキシフェニル基、3,4−ジエトキシフェニル基、3−エトキシ−4−メトキシフェニル基、4−エトキシ−3−メトキシフェニル基、4−メトキシ−3−メチルフェニル基、4−メチル−3−エトキシフェニル基、4−ジメチルアミノフェニル基、2−メトキシピリジン−5−イル基、2−エトキシピリジン−5−イル基、2,3−ジメチルピリジン−5−イル基、4−ピリジル基、2−メチルピリジン−4−イル基、2−エチルピリジン−4−イル基、2−メトキシピリジン−4−イル基、2−エトキシピリジン−4−イル基、2−クロロピリジン−5−イル基が好ましい。
【0037】
Mで表されるマトリックスの材質としては特に限定はなく、一般式(1a)に示すチアゾール誘導体と共有結合を形成するものであればよい。該チアゾール誘導体は二価の官能基であるメチレン鎖とR3とを介した共有結合によってマトリックスに固定化される。チアゾール誘導体固定化マトリックスの性能として、タンパク質を含む溶液から分析や精製の対象となるタンパク質を選択的に吸着し、簡単な処理によって該吸着タンパク質を脱離できるものが好ましく選択される。
【0038】
マトリックスの形態としては、前記タンパク質を含む溶液に対して不溶性のゲルが好ましく、前記ゲルであれば粒状物または非粒状物、多孔性または非多孔性、いずれの性質であってもよい。本発明におけるMで表されるマトリックスは有機高分子化合物、無機化合物、又はそれらの複合体の中から適宜選択することができる。なお、前記ゲルは前記タンパク質を含む溶液に懸濁させて用いてもよいし、またカラム管に充填後、前記タンパク質を含む溶液を通液して用いてもよい。
【0039】
有機高分子化合物のゲルとしては、天然高分子であっても合成高分子であってもよい。天然高分子としては、架橋結合アルブミン等のポリペプチドまたはタンパク質、アガロース、アルギネート、カラゲナン、キチン、セルロース、デキストリン、デキストランまたは澱粉等の多糖及びそれらの架橋体があげられる。一方、合成高分子としては、ビニルポリマー、ポリエステル、ポリアミド、ポリエーテルまたはポリウレタン及びそれらの共重合体を例示でき、これらの架橋体を用いてもよい。また、前記重合体の側鎖を反応させたものも、後述する活性化基含有マトリックスとして用いることができる。
【0040】
なお本発明において、ビニルポリマーとは非特許文献3に記載のとおり、ビニルモノマーやビニリデンモノマーの単独重合体、または、それらの共重合体である。前記モノマーとしては、アクリル酸またはメタクリル酸及びそれらのアミド、エステル、アクロレイン、メタクロレイン、各種カルボン酸のビニルエステル、スチレン等があげられる。メタクリル酸のエステルとしては、メタクリル酸−2−ヒドロキシエチルが例示できる。
【0041】
また、天然高分子に合成高分子や天然高分子をグラフト重合したもの、合成高分子に合成高分子や天然高分子をグラフト重合としたもの、無機化合物から有機モノマーの重合鎖を伸ばしたものであっても、本発明におけるMで表されるマトリックスに含まれる。
【0042】
無機化合物のゲルとしては、シリカ、アルミナ、ジルコニアまたは酸化鉄といった金属酸化物、ガラス、多孔質珪藻土等が例示される。また、前記無機化合物にカップリング剤で処理したものも、後述する活性化基含有マトリックスとして用いることができる。前記カップリング剤としては、活性化基又はその前駆体となる官能基を有するシランカップリング剤、アルミネートカップリング剤、チタネートカップリング剤等があげられる。
【0043】
本発明におけるMで表されるマトリックスとしては、操作の容易さや回収率の高さの観点から、アガロース、キトサン、デキストランまたはセルロース等の多糖類、ポリスチレンやトヨパール(商品名)(東ソー株式会社製)等のビニルポリマー及びそれらの架橋体、シリカ等の無機化合物が好ましい。
【0044】
なお、本発明のチアゾール誘導体固定化マトリックスは、タンパク質を含む溶液から特定のタンパク質を吸着した後、分離ができれば、液状であってもよい。例えば、水性二相分配法で使用されるデキストラン、ポリエチレングリコ−ル、ポリビニルアルコール若しくは加水分解澱粉といった水溶性の高分子を包含するマトリックス、又はエマルジョンを形成するのに使用されるペルフルオロデカリン等の化合物を包含するマトリックスがあげられる。
【0045】
本発明のチアゾール誘導体固定化マトリックスにおいて、チアゾール環とMとは、一般式(4)に示すように、メチレン基がnであり、二価の原子あるいは二価の基R3を介して共有結合している。
【0046】
M−R3−(CH2)n−(チアゾール環) (4)
nについては、1から12の整数から適宜選択することができるが、抗体の捕捉能が高く夾雑タンパクとの選択性がよい点で、3、4、5又は6が好ましい。
【0047】
R3の構造は、本発明のチアゾール誘導体固定化マトリックスの製法に依存する。本発明のチアゾール誘導体固定化マトリックスは、一般式(1a)に示すチアゾール誘導体の反応性官能基R4をマトリックスの活性化基と反応させることによって製造される。ここで、R4は、ヒドロキシ基、ホルミル基、メルカプト基、カルボキシル基又はアミノキシ基(−ONH2)からなる群より選択される。
【0048】
次に、本発明のチアゾール誘導体固定化マトリックスの製造方法を詳細に説明する。
【0049】
【化6】

(式中、R1、R2、R3、R4、Ar、M及びnは前記と同じ意味を表す。)
ここで言う活性化基とは、一般式(1a)のR4で定義されるヒドロキシ基、ホルミル基、メルカプト基、カルボキシル基又はアミノキシ基(−ONH2)を必要に応じて塩基や還元剤の存在下に反応させた時に容易に共有結合を形成できる官能基のことで、例えば、スクシンイミドオキシカルボニル基、1−メチルピリジニウム−2−オキシカルボニル基、ホルミル基、カルボキシル基、2,2,2−トリフルオロエチルスルホニルオキシ基(トレシル基)、スルホニル基、トシル基、ビニルスルホニル基、エポキシ基、アミノ基、ジチオ−2−ピリジル基、ヒドラジノ基をあげることができる。中でも導入の容易さの観点から、スクシンイミドオキシカルボニル基、エポキシ基、ホルミル基、アミノ基、ジチオ−2−ピリジル基、ヒドラジノ基、カルボキシル基が好ましい。チアゾール誘導体の固定化反応及び固定化反応によって形成されるR3を一般式(5)から(12)に例示する。これらの式において、M’は活性化基をもつマトリックスのうちの活性化基以外の部分を指し、Rは式(1a)のR4以外の部分を指す。
【0050】
【化7】

【0051】
【化8】

【0052】
【化9】

【0053】
【化10】

【0054】
【化11】

【0055】
【化12】

【0056】
【化13】

【0057】
【化14】

また、コハク酸ジヒドラジド、ピメルイミド酸ジメチル、ジビニルスルホン、カルボニルジイミダゾール等の2官能性試薬を用いてマトリックスの活性化基の種類を変換することもできる。
【0058】
活性化基含有マトリックスにチアゾール誘導体(1a)を固定化して導いたチアゾール誘導体固定化マトリックス(1)は、タンパク質(特に免疫グロブリン)、またはこれらの類縁体、フラグメント、融合体の精製に用いることかできる。特に、本発明のチアゾール誘導体固定化マトリックス(1)は、免疫グロブリンのうち、免疫グロブリンG(IgG)の分析や精製に有用である。
【0059】
次に、本発明のチアゾール誘導体固定化マトリックスを用いてタンパク質を分析、分離、または単離、精製する方法について説明する。
【0060】
本発明のチアゾール誘導体固定化マトリックスをカラム管に充填し、溶離液として緩衝液、金属塩の水溶液、アミノ酸溶液、アルコール溶液等の溶液を通液することで、タンパク質の分析、分離、単離又は精製を行なうことができる。この方法が適用できるタンパク質としては、血漿タンパク質成分や乳タンパク質成分をあげることができ、天然に存在するものでは血漿中の免疫グロブリン、血清アルブミン、血液凝固因子、ラクトアルブミン、ラクトフェリンを例示できる。またペプチドホルモン、インターフェロン、インターロイキン、成長因子、成長抑制因子、ワクチンも例示できる。特に本発明のチアゾール誘導体固定化マトリックスは、免疫グロブリンの精製に好ましい。通液する緩衝液としては、リン酸緩衝液、クエン酸緩衝液、Tris、PIPES、ACES、BES、MOPS、TES、HEPESを例示でき、金属塩としては硫酸ナトリウム、硫酸カリウム、硫酸リチウム、硫酸マグネシウム、硫酸アンモニウム、クエン酸ナトリウム、クエン酸カリウム、塩化ナトリウム、塩化カリウムを例示でき、アミノ酸としてはグリシン、アルギニン、ベータアラニン、ガンマアミノ酪酸を例示でき、アルコールとしてはエタノール、イソプロピルアルコール、グリセロール、エチレングリコールを例示できる。また、これらを混合したものを溶離液として用いることもできる。pHは3から11の範囲内で目的とするタンパク質を分析、分離、単離又は精製することができるが、特に5から9の範囲内で精製することが好ましい。また、AKTAprime plus(商品名)(GEヘルスケアバイオサイエンス社製)等のクロマトグラフィー装置を使用して、タンパク質を分析、分離、単離又は精製することもできる。チアゾール誘導体固定化マトリックスを用いて免疫グロブリン若しくはこれらの類縁体、フラグメント、融合体を分析又は精製する場合は、硫酸ナトリウムや硫酸アンモニウムを含むリン酸緩衝液を通液し、pHは5から9の範囲で、疎水性相互作用を利用したクロマトグラフィーを行なうのが好ましい。ここでいう免疫グロブリンの類縁体とは、免疫グロブリンの構造や機能が少なくとも部分的に保持された天然若しくは人工的に作られたタンパク質又はタンパク質コンジュゲートを指し、免疫グロブリンのフラグメントとは、酵素的な処理又は遺伝子工学的な設計によって作製された免疫グロブリンの部分構造を持ったタンパク質を指し、免疫グロブリンの融合体とは、各種サイトカイン又はサイトカイン受容体等の生物活性をもったタンパク質の機能部分を免疫グロブリンの全部又は一部と遺伝子工学的に融合させて作製したものを指す。
【0061】
本発明のチアゾール誘導体固定化マトリックスは、水酸化ナトリウム水溶液、水酸化カリウム水溶液等のアルカリ性水溶液、塩酸水溶液、硫酸水溶液、硝酸水溶液、リン酸水溶液等の酸性水溶液、塩酸グアニジン水溶液、尿素水溶液等のタンパク変性剤水溶液、アルギニンやヒスチジン等のアミノ酸を含んだ水溶液、SDS、Tween等の界面活性剤水溶液、メタノール、エタノール、イソプロパノール、グリセロール、エチレングリコール等のアルコール溶液、又は、これらを含んだ混合水溶液を用いて洗浄することによって、初期状態に復帰させることができ、繰り返し使用することができる。
【0062】
次に、本発明のチアゾール誘導体固定化マトリックスの製造に用いるチアゾール誘導体の製造方法を詳細に説明する。
【0063】
製造方法1
【0064】
【化15】

(式中、R1、R2、Ar及びnは前記と同じ意味を表し、R3aはフタルイミドオキシ基、アセトキシ基、カルボキシル基又はアルコキシチオカルボニルチオ基を表し、Yはハロゲン原子を表す。)
製造方法1はα−ハロケトン体(2)をアシルチオウレア誘導体(3)と反応させ、チアゾール誘導体(1a’)を製造する方法である。本反応は溶媒中で行なうことが好ましく、反応に害を及ぼさない溶媒であれば使用することができる。溶媒としてはジエチルエーテル、テトラヒドロフラン(THF)、1,2−ジメトキシエタン(DME)、ジオキサン等のエーテル系溶媒、アセトン、メチルエチルケトン等のケトン系溶媒、酢酸エチル、酢酸ブチル等のエステル系溶媒、アセトニトリル、プロピオニトリル等のニトリル類、ベンゼン、トルエン、キシレン、クロロベンゼン等の芳香族炭化水素系溶媒、N,N−ジメチルホルムアミド(DMF)、N−メチルピロリドン等のアミド類、ジメチルスルホキシド(DMSO)、水又はこれらの混合溶媒が例示でき、中でも収率がよい点で、DMFを用いるのが好ましい。反応温度については特に制限はないが、0℃から150℃の範囲から適宜選ばれた温度で反応させることにより目的物を得ることができ、収率がよい点で60℃から150℃の範囲で反応させるのが好ましい。本工程では、塩基存在下に行なうこともでき、塩基としては、水素化ナトリウム、ナトリウムアミド、炭酸ナトリウム、炭酸カリウム、ナトリウムメトキシド、ナトリウムエトキシド、カリウム−tert−ブトキシド、水酸化ナトリウム、水酸化カリウム等のアルカリ金属塩基、トリエチルアミン、トリブチルアミン、N−メチルモルホリン、ピリジン、ジメチルアニリン等の有機アミン類を用いることができる。塩基の使用量は特に制限はないが、反応基質に対して1当量以上用いて反応を実施することにより、収率よく目的物を得ることができる。反応終了後は、通常の後処理操作により目的物を得ることができるが、必要であればカラムクロマトグラフィー又は再結晶等の方法により精製することもできる。
【0065】
製造方法2
【0066】
【化16】

(式中、R1、R2、Ar及びnは前記と同じ意味を表す。)
製造方法2はチアゾール誘導体(1aa)を水存在下にてヘキサカルボニルモリブテンで処理し、5−ヒドロキシアルキルチアゾール誘導体(1ab)を製造する方法である。水及びヘキサカルボニルモリブテンの使用量は反応基質(1aa)に対して1当量以上用いて反応を実施することにより、収率よく目的物(1ab)を得ることができる。本反応は溶媒中で行なうのが好ましく、反応に害を及ぼさない溶媒であれば使用することができる。溶媒としてはジエチルエーテル、THF、DME、ジオキサン等のエーテル系溶媒、アセトン、メチルエチルケトン等のケトン系溶媒、酢酸エチル、酢酸ブチル等のエステル系溶媒、アセトニトリル、プロピオニトリル等のニトリル類、ベンゼン、トルエン、キシレン、クロロベンゼン等の芳香族炭化水素系溶媒、DMF、N−メチルピロリドン等のアミド系溶媒、メタノール、エタノール、イソプロピルアルコール等のアルコール系溶媒、DMSO、又はこれらの混合溶媒が例示でき、中でも収率がよい点や後処理が簡便である点でアセトニトリル、プロピオニトリル等のニトリル類溶媒を用いることが好ましい。反応温度については特に制限はないが、0℃から150℃の範囲から適宜選ばれた温度で反応させることにより目的物を得ることができる。反応終了後は、通常の後処理操作により目的物を得ることができるが、必要であればカラムクロマトグラフィー又は再結晶等の方法により精製することもできる。
【0067】
製造方法3
【0068】
【化17】

(式中、R1、R2、Ar及びnは前記と同じ意味を表し、R5は炭素数1から6のアルキル基を表す。)
製造方法3はチアゾール誘導体(1ac)を塩基で処理し、5−メルカプトアルキルチアゾール誘導体(1ad)を製造する方法である。本反応で用いることができる塩基としては、水素化ナトリウム、ナトリウムアミド、炭酸ナトリウム、炭酸カリウム、ナトリウムメトキシド、ナトリウムエトキシド、カリウム−tert−ブトキシド、水酸化ナトリウム、水酸化カリウム等のアルカリ金属塩基、メチルアミン、エチルアミン、プロピルアミン、ジメチルアミン、ジエチルアミン等の有機アミン類又はアンモニアを用いることができる。塩基の使用量に特に制限はないものの、反応基質(1ac)に対して1当量以上用いて反応を実施することにより、収率よく目的物(1ad)を得ることができる。本反応は溶媒中で行なうことが好ましく、反応に害を及ぼさない溶媒であれば使用することができる。溶媒としてはジエチルエーテル、THF、DME、ジオキサン等のエーテル系溶媒、アセトン、メチルエチルケトン等のケトン系溶媒、酢酸エチル、酢酸ブチル等のエステル系溶媒、アセトニトリル、プロピオニトリル等のニトリル類、ベンゼン、トルエン、キシレン、クロロベンゼン等の芳香族炭化水素系溶媒、DMF、N−メチルピロリドン等のアミド類、DMSO、水又はこれらの混合溶媒が例示でき、中でも収率がよい点で、DMFを用いるのが好ましい。また、塩基としてアンモニアを用い、使用する溶媒として水とエタノールの混合溶媒を用いて実施しても収率がよい点で好ましい。また、反応温度については特に制限はないが、0℃から150℃の範囲から適宜選ばれた温度で反応させることにより目的物を得ることができ、収率がよい点で0℃から100℃の範囲で反応させることが好ましい。反応終了後は、通常の後処理操作により目的物を得ることができるが、必要であればカラムクロマトグラフィー又は再結晶等の方法により精製することもできる。
【0069】
製造方法4
【0070】
【化18】

(式中、R1、R2、Ar及びnは前記と同じ意味を表す。)
製造方法4は5−ヒドロキシアルキルチアゾール誘導体(1ab)のヒドロキシ基を酸化し、5−ホルミルアルキルチアゾール誘導体(1ae)を製造する方法である。本反応は一般的な酸化反応を行なうことによって容易に目的物を得ることができ、酸化剤としては、ピリジニウムクロロクロマート、ピリジニウムジクロロクロマート、二酸化マンガン、過マンガン酸カリウム等があげられる。また、Swern酸化、Corey−Kim酸化、Dess−Martin酸化、向山酸化、Oppenauer酸化、TEMPO酸化、パラジウム錯体を用いた酸素酸化等の酸化反応によっても容易に目的物を得ることができるが、収率がよい点でSwern酸化を用いることが好ましい。本反応は溶媒中で行なうことが好ましく、反応に害を及ぼさない溶媒であれば使用することができる。溶媒としてはジクロロメタン、クロロホルム、1,2−ジクロロエタン等のハロゲン系溶媒、ジエチルエーテル、THF、DME、ジオキサン等のエーテル系溶媒、アセトン、メチルエチルケトン等のケトン系溶媒、酢酸エチル、酢酸ブチル等のエステル系溶媒、アセトニトリル、プロピオニトリル等のニトリル類、ベンゼン、トルエン、キシレン、クロロベンゼン等の芳香族炭化水素系溶媒、DMF、N−メチルピロリドン等のアミド類、DMSO、水又はこれらの混合溶媒が例示でき、中でも収率がよい点で、ジクロロメタン、クロロホルム、1,2−ジクロロエタン等のハロゲン系溶媒を用いるのが好ましい。反応温度については特に制限はないが、−78℃から150℃の範囲から適宜選ばれた温度で反応させることにより目的物を得ることができる。反応終了後は、通常の後処理操作により目的物を得ることができるが、必要であればカラムクロマトグラフィー又は再結晶等により精製することもできる。
【0071】
製造方法5
【0072】
【化19】

(式中、R1、R2、Ar及びnは前記と同じ意味を表す。)
製造方法5はチアゾール誘導体(1aa)を塩基で処理し、5−アミノキシアルキルチアゾール誘導体(1aaa)を製造する方法である。塩基としては、水素化ナトリウム、ナトリウムアミド、炭酸ナトリウム、炭酸カリウム、ナトリウムメトキシド、ナトリウムエトキシド、カリウム−tert−ブトキシド、水酸化ナトリウム、水酸化カリウム等のアルカリ金属塩基、メチルアミン、エチルアミン、ジメチルアミン等の有機アミン類、ヒドラジン類を用いることができ、収率がよい点でヒドラジン又はメチルアミンが好ましい。塩基の使用量は反応基質(1aa)に対して2当量以上用いて反応を実施することにより、収率よく目的物(1aaa)を得ることができる。本反応は溶媒中で行なうことが好ましく、反応に害を及ぼさない溶媒であれば使用することができる。溶媒としてはジエチルエーテル、THF、DME、ジオキサン等のエーテル系溶媒、アセトン、メチルエチルケトン等のケトン系溶媒、酢酸エチル、酢酸ブチル等のエステル系溶媒、アセトニトリル、プロピオニトリル等のニトリル類、ベンゼン、トルエン、キシレン、クロロベンゼン等の芳香族炭化水素系溶媒、DMF、N−メチルピロリドン等のアミド系溶媒、メタノール、エタノール、イソプロピルアルコール等のアルコール系溶媒、DMSO、水又はこれらの混合溶媒が例示でき、中でも収率がよい点や後処理が簡便である点で、メタノールやエタノール等のアルコール系溶媒を用いることが好ましい。反応温度については特に制限はないが、0℃から150℃の範囲から適宜選ばれた温度で反応させることにより目的物を得ることができる。反応終了後は、通常の後処理操作により目的物を得ることができるが、必要であればカラムクロマトグラフィー又は再結晶等の方法により精製することもできる。
【発明の効果】
【0073】
本発明のチアゾール誘導体固定化マトリックスは、タンパク質、特に免疫グロブリンの分析および精製に有用な耐久性に富む選択的な吸脱着剤となることから医療用タンパク質、特に免疫グロブリンの工業的な精製において極めて有用である。
【図面の簡単な説明】
【0074】
【図1】チアゾール誘導体固定化HiTrapカラムを用いた免疫グロブリンのクロマトグラフィー結果(化合物75の結果)。
【図2】チアゾール誘導体固定化ビニルポリマーゲルを用いた免疫グロブリンのクロマトグラフィー結果(化合物95の結果)。
【図3】チアゾール誘導体固定化ビニルポリマーゲルを用いた免疫グロブリンのクロマトグラフィー結果(化合物110の結果)。
【実施例】
【0075】
以下、実施例及び参考例により本発明をさらに詳細に説明するが、本発明がこれらに限定されるものではない。
【0076】
参考例1 チアゾール誘導体の合成
(合成例1)
【0077】
【化20】

N−[(5−オキソヘキサン−1−イル)オキシ]フタルイミド(1.0g,3.83mmol)のTHF(15mL)溶液に臭化銅(II)(1.71g,7.66mmol)を加え、2時間加熱還流した。反応液をセライト濾過により固体を瀘別し、濾液の溶媒を減圧留去して油状物を得た。得られた油状物をDMF(20mL)に溶解し、3,4−ジメトキシベンゾイルチオウレア(0.92g,3.83mmol)を加え、80℃で8時間反応させた。反応終了後、溶媒を減圧留去して得られた粗生成物に1M塩酸(30mL)と酢酸エチル(30mL)を加え固体を析出させた。固体を瀘別し、酢酸エチルとエーテルによって充分洗浄し、灰色固体の3,4−ジメトキシ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミド(0.57g,31%)を得た。
m.p.211℃;1H−NMR(CDCl3,TMS,ppm):δ 2.10(m,2H),2.51(s,3H),3.13(t,J=7.5Hz,2H),3.97(s,3H),4.04(s,3H),4.26(t,J=7.5Hz,2H),7.02(d,J=7.5Hz,1H),7.76から7.88(m,5H),7.99(dd,J=2.5Hz and 7.5Hz,1H)。アミドのプロトンは帰属できなかった。
【0078】
(合成例2)
合成例1と同様にして、3−フルオロ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]−4−メチルベンズアミドを合成した。
灰色固体、46%;m.p.135から137℃;1H−NMR(CDCl3,TMS,ppm):δ 2.04(tt,J=7.5 and 7.5Hz,2H),2.15(s,3H),2.35(d,JHF=1.8Hz,3H),2.99(t,J=7.5Hz,2H),4.22(t,J=7.5Hz,2H),7.28(dd,J=7.5 and 10Hz,1H).7.73から7.88(m,6H)。アミドのプロトンは帰属できなかった。
【0079】
(合成例3)
合成例1と同様にして、2−クロロ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミドを合成した。
白色固体、39%;m.p.175から178℃;1H−NMR(CDCl3,TMS,ppm):δ 2.03(tt,J=7.5 and 7.5Hz,2H),2.19(s,3H),2.97(t,J=7.5Hz,2H),4.24(t,J=7.5Hz,2H),7.32から7.49(m,3H),7.73から7.87(m,5H)。アミドのプロトンは帰属できなかった。
【0080】
(合成例4)
合成例1と同様にして、3−クロロ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミドを合成した。
淡黄色固体、53%;m.p.147から155℃;1H−NMR(CDCl3,TMS,ppm):δ 2.03(tt,J=7.5 and 7.5Hz,2H),2.15(s,3H),2.99(t,J=7.5Hz,2H),4.24(t,J=7.5Hz,2H),7.38(dd,J=7.5 and 7.5Hz,1H),7.50から7.55(d,J=7.5Hz,1H),7.72から7.99(m,6H)。アミドのプロトンは帰属できなかった。
【0081】
(合成例5)
合成例1と同様にして、N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]−4−ヨードベンズアミドを合成した。
淡黄色固体,29%;m.p.192から200℃;1H−NMR(CDCl3,TMS,ppm):δ 2.03(tt,J=7.5 and 7.5Hz,2H),2.18(s,3H),2.99(t,J=7.5Hz,2H),4.23(t,J=7.5Hz,2H),7.60(d,J=7.5Hz,2H),7.74から7.77(d,J=7.5Hz,2H),7.82から7.87(m,4H)。アミドのプロトンは帰属できなかった。
【0082】
(合成例6)
合成例1と同様にして、N−[4−メチル−5−{7−(フタルイミドオキシ)ヘプチル}チアゾール−2−イル]−4−メチルベンズアミドを合成した。
黄色固体、58%;m.p.95から99℃;1H−NMR(CDCl3,TMS,ppm):δ 1.35から1.44(m,4H),1.44から1.57(m,2H),1.57から1.70(m,2H),1.74から1.84(m,2H),2.08(s,3H),2.42(s,3H),2.65(t,J=7.5Hz,2H),4.17(t,J=7.5Hz,2H),7.26(d,J=7.5Hz,2H),7.72から7.85(m,6H)。アミドのプロトンは帰属できなかった。
【0083】
(合成例7)
合成例1と同様にして、4−シクロプロピル−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミドを合成した。
茶色固体;m.p.181から182℃;1H−NMR(CDCl3,TMS,ppm):δ 0.78から0.85(m,2H),1.07から1.14(m,2H),1.94から2.01(m,1H),2.05から2.15(m,2H),2.51(s,3H),3.13(t,J=7.5Hz,2H),4.26(t,J=5.0Hz,2H),7.23(d,J=7.5Hz,2H),7.74から7.88(m,4H),8.19(d,J=7.5Hz,2H)。アミドのプロトンは帰属できなかった。
【0084】
(合成例8)
合成例1と同様にして、4−エトキシ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミドを合成した。
白色固体;m.p.151から154℃;1H−NMR(CDCl3,TMS,ppm):δ 1.46(t,3H),2.10(m,2H),2.51(s,3H),3.12(t,J=7.5Hz,2H),4.13(q,J=7.5Hz,2H),4.26(t,J=7.5Hz,2H),7.03(d,J=7.5Hz,2H),7.76から7.88(m,4H),8.27(d,J=7.5Hz,2H)。アミドのプロトンは帰属できなかった。
【0085】
(合成例9)
合成例1と同様にして、3−エトキシ−4−メトキシ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミドを合成した。
白色固体;m.p.81から88℃;1H−NMR(CDCl3,TMS,ppm):δ 1.48(t,J=7.5Hz,3H),2.06から2.17(m,2H),2.21(s,3H),3.02(t,J=7.5Hz,2H),3.94(s,3H),4.13(q,J=7.5Hz,2H),4.26(t,J=7.5Hz,2H),6.92(d,1H),7.44から7.50(m,2H),7.73から7.87(m,4H)。アミドのプロトンは帰属できなかった。
【0086】
(合成例10)
合成例1と同様にして、4−メチル−3−メトキシ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミドを合成した。
白色固体;m.p.125℃;1H−NMR(CDCl3,TMS,ppm):δ 2.03から2.18(m,2H),2.18(s,3H),2.27(s,3H),3.02(t,J=7.5Hz,2H),3.86(s,3H),4.26(t,J=7.5Hz,2H),7.22(d,J=7.5Hz,1H),7.39(dd,J=2.5 and 7.5Hz,1H),7.48(s,1H),7.73から7.87(m,4H)。アミドのプロトンは帰属できなかった。
【0087】
(合成例11)
合成例1と同様にして、N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ナフタレン−1−カルボキサミドを合成した。
黄色固体、6.3%;m.p.150から152℃;1H−NMR(CDCl3,TMS,ppm):δ 1.83(s,3H),2.01(tt,J=7.5 and 7.5Hz,2H),2.93(t,J=7.5Hz,2H),4.23(t,J=7.5Hz,2H),7.43から7.62(m,3H),7.73から7.81(m,3H),7.83から7.91(m,3H),8.00(dd,J=2.5 and 7.5Hz,1H),8.44(dd,J=2.5 and 7.5Hz,1H)。アミドのプロトンは帰属できなかった。
【0088】
(合成例12)
合成例1と同様にして、N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]チオフェン−2−カルボキサミドを合成した。
灰色固体、42%;m.p.153から155℃;1H−NMR(CDCl3,TMS,ppm):δ 2.03(tt,J=7.5 and 7.5Hz,2H),2.53(s,3H),3.11(t,J=7.5Hz,2H),4.24(t,J=7.5Hz,2H),7.23(d,J=4.8Hz,1H),7.75から7.80(m,3H),7.83から7.89(m,2H),8.49(d,J=7.5Hz,1H)。アミドのプロトンは帰属できなかった。
【0089】
(合成例13)
合成例1と同様にして、N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]フラン−2−カルボキサミドを合成した。
灰色固体、31%;m.p.220から223℃;1H−NMR(CDCl3,TMS,ppm):δ 2.03(tt,J=7.5 and 7.5Hz,2H),2.53(s,3H),3.11(t,J=7.5Hz,2H),4.24(t,J=7.5Hz,2H),6.62から6.67(m,1H),7.73から7.80(m,4H),7.83から7.89(m,2H)。アミドのプロトンは帰属できなかった。
【0090】
(合成例14)
【0091】
【化21】

3,4−ジメトキシ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミド(0.47g,0.98mmol)のアセトニトリル(7.8mL)と水(0.8mL)の混合溶液に、ヘキサカルボニルモリブデン(0.26g,0.98mmol)とトリエチルアミン(2.05mL,14.7mmol)を加え、2時間加熱還流した。反応終了後、反応混合物に1M塩酸(100mL)を加え酢酸エチル(100mL)で2回抽出し、有機層を合わせて飽和食塩水(300mL)で2回洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製することで、白色固体のN−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}−3,4−ジメトキシ−ベンズアミド(0.21g,63%)を得た。
白色固体;m.p.131℃;1H−NMR(CDCl3,TMS,ppm):δ 1.84から1.94(m,2H),2.04(s,3H),2.80(t,J=7.5Hz, 2H),3.71(t,J=7.5Hz,2H),3.86(s,3H),3.94(s,3H),6.90(dd,J=2.5Hz and 7.5Hz,1H),7.50から7.53(m,2H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0092】
(合成例15)
合成例14と同様にして、3−フルオロ−N−{5−(3−ヒドロキシフタルイミドプロピル)−4−メチルチアゾール−2−イル}−4−メチルベンズアミドを合成した。
白色固体、59%;m.p.142から150℃;1H−NMR(CDCl3,TMS,ppm):δ 1.83(tt,J=7.5 and 7.5Hz,2H),2.09(s,3H),2.32(d,JHF=1.8Hz,3H),2.78(t,J=7.5Hz,2H),3.69(t,J=7.5Hz,2H),7.22(dd,J=10 and 10Hz,1H),7.57から7.61(m,2H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0093】
(合成例16)
合成例14と同様にして、2−クロロ−N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}ベンズアミドを合成した。
黄色粘張性、46%;1H−NMR(CDCl3,TMS,ppm):δ 1.82(tt,J=7.5 and 7.5Hz,2H),2.04(s,3H),2.77(t,J=7.5Hz,2H),3.68(t,J=7.5Hz,2H),7.34から7.47(m,3H),7.78(dd,J=1.8 and 7.5Hz,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0094】
(合成例17)
合成例14と同様にして、3−クロロ−N−{5−(3−ヒドロキシフタルイミドプロピル)−4−メチルチアゾール−2−イル}ベンズアミドを合成した。
白色固体、54%;m.p.114から117℃;1H−NMR(CDCl3,TMS,ppm):δ 1.81(tt,J=7.5 and 7.5Hz,2H),2.10(s,3H),2.79(t,J=7.5Hz,2H),3.69(t,J=7.5Hz,2H),7.39(dd,J=8.0 and 8.0Hz,1H),7.47(ddd,J=1.8, 1.8 and 8.0Hz,1H),7.82(ddd,J=1.8, 1.8 and 8.0Hz,1H),7.93(dd,J=1.8 and 1.8Hz,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0095】
(合成例18)
合成例14と同様にして、N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}−4−ヨードベンズアミドを合成した。
黄色粘稠性、55%;1H−NMR(CDCl3,TMS,ppm):δ 1.86(tt,J=7.5 and 7.5Hz,2H),2.03(s,3H),2.78(t,J=7.5Hz,2H),3.69(t,J=7.5Hz,2H),7.62(d,J=7.5Hz,2H),7.79(d,J=7.5Hz,2H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0096】
(合成例19)
合成例14と同様にして、4−シクロプロピル−N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}ベンズアミドを合成した。
白色固体;m.p.118℃;1H−NMR(CDCl3,TMS,ppm):δ 0.74から0.81(m,2H),1.03から1.11(m,2H),1.84から1.97(m,3H),2.11(s,3H),2.81(t,J=7.5Hz,2H),3.71(t,J=7.5Hz,2H),7.15(d,J=7.5Hz,2H),7.79(d,J=7.5Hz,2H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0097】
(合成例20)
合成例14と同様にして、N−{5−(7−ヒドロキシヘプチル)−4−メチルチアゾール−2−イル}−4−メチルベンズアミドを合成した。
白色固体、32%;m.p.135から145℃;1H−NMR(CDCl3,TMS,ppm):δ 1.00から1.39(m,6H),1.50から1.67(m,4H),2.19(s,3H),2.42(s,3H),2.65(t,J=7.5Hz,2H),3.62(t,J=7.5Hz,2H),7.29(d,J=7.5Hz,2H),7.86(d,J=7.5Hz,2H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0098】
(合成例21)
合成例14と同様にして、N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}−3−メトキシ−4−メチルベンズアミドを合成した。
白色固体;m.p.124から127℃;1H−NMR(CDCl3,TMS,ppm):δ 1.82から1.92(m,5H),2.25(s,3H),2.77(t,J=7.5Hz,2H),3.70(t,J=7.5Hz,2H),3.77(s,3H),7.16(d,J=7.5Hz,1H),7.39(d,J=7.5Hz,1H),7.40(s,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0099】
(合成例22)
合成例14と同様にして、4−エトキシ−N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}ベンズアミドを合成した。
白色固体;m.p.149から153℃;1H−NMR(CDCl3,TMS,ppm):δ 1.44(t,J=7.5Hz,3H),1.83から1.94(m,2H),2.06(s,3H),2.80(t,J=7.5Hz,2H),3.71(t,J=7.5Hz,2H),4.09(q,J=7.5Hz,2H),6.93(d,J=10.0Hz,2H),7.88(d,J=10.0Hz,2H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0100】
(合成例23)
合成例14と同様にして、3−エトキシ−N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}−4−メトキシベンズアミドを合成した。
白色固体;m.p.143から144℃;1H−NMR(CDCl3,TMS,ppm):δ 1.45(t,J=7.0Hz,3H),1.83から1.94(m,2H),1.98(s,3H),2.79(t,J=7.5Hz,2H),3.70(t,J=6.25Hz,2H),3.93(s,3H),4.03(q,J=7.0Hz,2H),6.89(d,J=7.5Hz,1H),7.48(s,1H),7.50(d,J=7.5Hz,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0101】
(合成例24)
合成例14と同様にして、N−{5−(3−ヒドロキシフタルイミドプロピル)−4−メチルチアゾール−2−イル}ナフタレン−2−カルボキサミドを合成した。
黄色粘張性、62%;1H−NMR(CDCl3,TMS,ppm):δ 1.74(s,3H),1.81(tt,J=7.5 and 7.5Hz,2H),2.71(t,J=7.5Hz,2H),3.67(t,J=7.5Hz,2H),7.43から7.61(m,3H),7.74(dd,J=1.0 and 7.0Hz,1H),7.86から7.91(m,1H),7.99(dd,J=1.0 and 7.0Hz,1H),8.44から8.49(m,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0102】
(合成例25)
合成例14と同様にして、N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}チオフェン−2−カルボキサミドを合成した。
黄色粘稠性、21%;m.p.142から150℃;1H−NMR(CDCl3,TMS,ppm):δ 1.83(tt,J=7.5 and 7.5Hz,2H),2.20(s,3H),2.78(t,J=7.5Hz,2H),3.69(t,J=7.5Hz,2H),7.10から7.14(m,1H),7.57から7.62(m,1H),7.73から7.75(m,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0103】
(合成例26)
合成例14と同様にして、N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}フラン−2−カルボキサミドを合成した。
黄色粘稠性、13%;1H−NMR(CDCl3,TMS,ppm):δ 1.83(tt,J=7.5 and 7.5Hz,2H),2.26(s,3H),2.79(t,J=7.5Hz,2H),3.68(t,J=7.5Hz,2H),6.57から6.59(m,1H),7.38(dd,J=1.0 and 3.3Hz,1H),7.55から7.60(m,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0104】
(合成例27) N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}−4−メチル−N−メチルベンズアミドの合成
【0105】
【化22】

N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}−4−メチル−N−メチルベンズアミド(300mg,1.03mmol)のDMF(5mL)溶液に、ヨウ化メチル(176mg,1.24mmol)と炭酸カリウム(171mg,1.24mmol)を加え、室温で12時間反応させた。反応終了後、反応混合物に1M塩酸(20mL)を加え酢酸エチル(20mL)で2回抽出し、有機層を合わせて飽和食塩水(30mL)で2回洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製することで、白色固体のN−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}−4−メチル−N−メチルベンズアミド(46mg,15%)を得た。
白色固体;m.p.164から166℃;1H−NMR(CDCl3,TMS,ppm):δ 1.77から1.88(m,2H),2.18(s,3H),2.39(s,3H),2.70(t,J=7.5Hz,2H),3.65(t,J=7.5Hz,2H),3.74(s,3H),7.22(d,J=7.5Hz,2H),8.20(d,J=7.5Hz,2H)。ヒドロキシ基のプロトンは帰属できなかった。
【0106】
(合成例28)
合成例14と同様にして、N−{5−(3−アセトキシプロピル)−4−メチルチアゾール−2−イル}−4−メチルベンズアミドを合成した。
茶褐色油状:1H−NMR(CDCl3,TMS,ppm):δ 1.90から2.01(m,2H),2.04(s,3H),2.07(s,3H),2.42(s,3H),2.78(t,J=7.5Hz,2H),4.09(t,J=7.5Hz,2H),7.28(d,J=7.5Hz,2H),7.81(d,J=7.5Hz,2H)。アミドのプロトンは帰属できなかった。
【0107】
(合成例29) 2,4−ジフルオロ−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}ベンズアミドの合成
【0108】
【化23】

[5−{3−(アセトキシ)プロピル}チアゾール−2−イル]−2,4−ジフルオロベンズアミド(512mg,1.44mmol)のエタノール(5mL)溶液に、炭酸カリウム(597mg,4.32mmol)を加え、30分加熱還流した。反応終了後、反応混合物に1M塩酸(20mL)を加え酢酸エチル(20mL)で2回抽出し、有機層を合わせて飽和食塩水(30mL)で2回洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製することで、黄色固体の2,4−ジフルオロ−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}ベンズアミド(94mg,21%)を得た。
黄色油状;1H−NMR(CDCl3,TMS,ppm):δ 1.84から1.93(m,2H),2.25(s,3H),2.83(t,J=7.5Hz,2H),3.71(t,J=7.5Hz,2H),6.91から7.10(m,2H),8.12から8.22(m,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0109】
(合成例30)
合成例14と同様にして、O−エチル−S−3−[2−(4−ヨードベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートを合成した。
黄色粘稠性、35%;1H−NMR(CDCl3,TMS,ppm):δ 1.39(t,J=7.5Hz,3H),1.98(tt,J=7.5 and 7.5Hz,2H),2.20(s,3H),2.80(t,J=7.5Hz,2H),3.13(t,J=7.5Hz,2H),4.61(q,J=7.5Hz,2H),7.67(d,J=8.8Hz,2H),7.85(d,J=8.8Hz,2H)。アミドのプロトンは帰属できなかった。
【0110】
(合成例31)
合成例14と同様にして、O−エチル−S−3−[2−(4−ブロモベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートを合成した。
黄色固体、53%;m.p.76から80℃;1H−NMR(CDCl3,TMS,ppm):δ 1.39(t,J=7.5Hz,3H),1.98(tt,J=7.5 and 7.5Hz,2H),2.02(s,3H),2.79(t,J=7.5Hz,2H),3.13(t,J=7.5Hz,2H),4.61(q,J=7.5Hz,2H),7.59(d,J=7.5Hz,2H),7.74(d,J=7.5Hz,2H)。アミドのプロトンは帰属できなかった。
【0111】
(合成例32)
合成例14と同様にして、O−エチル−S−3−[2−(2,4−ジフルオロベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートを合成した。
褐色油状物;1H−NMR(CDCl3,TMS,ppm):1.42(t,J=7.5Hz,3H),1.99から2.10(m,2H),2.28(s,3H),2.84(t,J=7.5Hz,2H),3.17(t,J=7.5Hz,2H),4.65(q,J=7.5Hz,2H),6.92から7.00(m,1H),7.01から7.12(m,1H),8.19から8.29(m,1H),9.69(br s,1H)。
【0112】
(合成例33)
合成例14と同様にして、O−エチル−S−3−[2−(4−エトキシベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートを合成した。
褐色油状物;1H−NMR(CDCl3,TMS,ppm):δ 1.39から1.48(m,6H),1.98から2.09(m,2H),2.16(s,3H),2.82(t,J=7.5Hz,2H),3.16(t,J=7.5Hz,2H),4.10(q,J=7.5Hz,2H),4.65(q,J=7.5Hz,2H),6.96(d,J=7.5Hz,2H),7.90(d,J=7.5Hz,2H)。
【0113】
(合成例34)
合成例14と同様にして、O−エチル−S−3−[2−(3−エトキシ−4−メトキシベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートを合成した。
褐色粘稠性;1H−NMR(CDCl3,TMS,ppm):δ 1.42から1.51(m,6H),2.01から2.12(m,2H),2.12(s,3H),2.82(t,J=7.5Hz,2H),3.16(t,J=7.5Hz,2H),3.94(s,3H),4.11(q,J=7.5Hz,2H),4.65(q,J=7.5Hz,2H),6.91(d,J=7.5Hz,1H),7.47(dd,J=2.5 and 7.5Hz,1H),7.49(d,J=2.5Hz,1H)。アミドのプロトンは帰属できなかった。
【0114】
(合成例35) O−エチル−S−3−[2−(4−クロロベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートの合成
【0115】
【化24】

O−エチル−S−3−(2−アミノ−4−メチルチアゾール−5−イル)プロピルジチオカーボネート(0.70g,2.53mmol)のクロロホルム(10mL)溶液に氷冷下4−クロロベンゾイルクロリド(0.42mL,3.29 mmol)を滴下した。次いでトリエチルアミン(0.5mL,7.98mmol)のクロロホルム(5mL)溶液を加え、一晩反応させた。反応終了後、反応混合物を1M塩酸(20mL)で2回洗浄し、飽和食塩水(20mL)で2回洗浄して、有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製し、O−エチル−S−3−[2−(4−クロロベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートの白色固体(0.329g,31%)を得た。
白色固体;1H−NMR(CDCl3,TMS,ppm):δ 1.42(t,J=7.5Hz,3H),1.99から2.05(m,5H),2.81(t,J=7.5Hz,2H),3.16(t,J=7.5Hz,2H),4.65(q,J=7.5Hz,2H),7.43(d,J=7.5Hz,2H),7.83(d,J=7.5Hz,2H),11.18(br s,1H)。
【0116】
(合成例36) O−エチル−S−3−[2−(4−メチルベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートの合成
【0117】
【化25】

O−エチル−S−5−オキシヘキシルチオカーボネート(2.0g,9.08mmol)のTHF(20mL)溶液に臭化銅(II)(3.85g,17.3mmol)を加え1時間加熱還流したところ白色の沈澱物が生成した。沈澱物をろ過し、ろ液をエバポレーターで減圧濃縮し、黄色の油状物を得た。この油状物にエタノール(50mL)とN−4−メチルベンゾイルチオウレア(1.76g,9.08mmol)を加え、80℃で8時間反応させた。反応終了後、沈澱物をろ過し、クロロホルム(20mL)とエタノール(20mL)の混合溶媒で洗浄した。ろ液を合わせて減圧留去し、得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製し、褐色油状のO−エチル−S−3−[2−(4−メチルベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルチオカーボネート(0.436g,12%)を得た。
褐色油状物;1H−NMR(CDCl3,TMS,ppm):1.42(t,J=7.5Hz,3H),2.01から2.09(m,5H),2.42(s,3H),2.81(t,J=7.5Hz,2H),3.16(t,J=7.5Hz,2H),4.65(q,J=7.5Hz,2H),7.26(d,J=7.5Hz,2H),7.79(d,J=7.5Hz,2H)。アミドのプロトンは帰属できなかった。
【0118】
(合成例37) S−3−(2−アミノ−4−メチルチアゾール5−イル)−O−エチルプロピルジチオカーボネートの合成
【0119】
【化26】

O−エチル−S−5−オキシヘキシルチオカーボネート(4.0g,18.2mmol)のTHF(40mL)溶液に臭化銅(II)(7.70g,34.6mmol)を加え1.5時間加熱還流したところ白色の沈澱物が生成した。沈澱物をろ過し、ろ液をエバポレーターで減圧濃縮し、黄色の油状物を得た。この油状物にエタノール(40mL)とチオウレア(1.38g,18.2mmol)を加え、80℃で8時間反応させた。反応終了後、溶媒を減圧留去し,反応混合物に1M塩酸(30mL)を加え酢酸エチル(50mL)で2回抽出し、有機層を合わせて飽和食塩水(30mL)で2回洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製し、得られた白色固体を少量の酢酸エチル/エタノールの混合溶媒で洗浄することによって、白色固体のO−エチル−S−3−(2−アミノ−4−メチルチアゾール−5−イル)プロピルジチオカーボネート(1.56g,31%)を得た。
1H−NMR(CDCl3,TMS,ppm):δ 1.43(t,J=7.5Hz,3H),1.82から2.02(m,2H),2.24(s,3H),2.68(t,J=7.5Hz,2H),3.15(t,J=7.5Hz,2H),4.65(q,J=7.5Hz,2H),8.65(br s,2H)。
【0120】
(合成例38) 4−クロロ−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドの合成
【0121】
【化27】

O−エチル−S−3−[2−(4−クロロベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネート(0.08g,0.241mmol)のエタノール(1mL)溶液に28%アンモニア水(0.8mL)を加え常温で一晩反応させた。反応終了後、4M塩酸(10mL)を加え、酢酸エチル(20mL)で抽出し、有機相を飽和食塩水(20mL)で洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製し、4−クロロ−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドの白色固体(0.043g,55%)を得た。
白色固体;m.p.180から183℃;1H−NMR(CDCl3,TMS,ppm):1.99から2.05(m,5H),2.70(t,J=7.5Hz,2H),2.80(t,J=7.5Hz,2H),7.41(d,J=7.5Hz,2H),7.82(d,J=7.5Hz,2H),10.8(br s,1H)。メルカプト基のプロトンは帰属できなかった。
【0122】
(合成例39)
合成例38と同様にして、2,4−ジフルオロ−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドを合成した。
褐色固体;m.p.151から155℃;1H−NMR(CDCl3,TMS,ppm):δ 1.98から2.14(m,2H),2.26(s,3H),2.72(t,J=7.5Hz,2H),2.84(t,J=7.5Hz,2H),6.91から7.00(m,1H),7.03から7.11(m,1H),8.15から8.27(m,1H),9.88(br s,1H)。メルカプト基のプロトンは帰属できなかった。
【0123】
(合成例40)
合成例38と同様にして、4−エトキシ−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドを合成した。
褐色固体;m.p.180から183℃;1H−NMR(CDCl3,TMS,ppm):δ 1.44(t,J=7.5Hz,3H),2.07から2.14(m,2H),2.17(s,3H),2.70(t,J=7.5Hz,2H),2.80(t,J=7.5Hz,2H),4.09(q,J=7.5Hz,2H),6.93(d,J=7.5Hz,2H),7.87(d,J=7.5Hz,2H)。アミドとメルカプト基のプロトンは帰属できなかった。
【0124】
(合成例41)
合成例38と同様にして、3−エトキシ−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]−4−メトキシベンズアミドを合成した。
白色固体;m.p.89から94℃;1H−NMR(CDCl3,TMS,ppm):δ 1.48(t,J=7.5Hz,3H),1.99から2.10(m,2H),2.16(s,3H),2.71(t,J=7.5Hz,2H),2.81(t,J=7.5Hz,2H),3.93(s,3H),4.12(q,J=7.5Hz,2H),6.90(d,J=7.5Hz,1H),7.45(dd,J=1.0 and 7.5Hz,1H),7.49(d,J=1.0Hz,1H),10.1(br s,1H)。メルカプト基のプロトンは帰属できなかった。
【0125】
(合成例42) N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]−4−メチルベンズアミドの合成
【0126】
【化28】

O−エチル−S−3−[2−(4−メチルベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネート(0.416g,1.05mmol)のエタノール(4mL)溶液に28%アンモニア水(1mL)を加え常温で一晩反応させた。反応終了後、4M塩酸(10mL)を加え、酢酸エチル(20mL)で抽出し、有機相を飽和食塩水(20mL)で洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製し、N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]−4−メチルベンズアミドの白色固体(0.143g,45%)を得た。
白色固体;m.p.180から183℃;1H−NMR(CDCl3,TMS,ppm):δ 1.96から2.14(m,5H),2.42(s,3H),2.70(t,J=7.5Hz,2H),2.80(t,J=7.5Hz,2H),7.28(d,J=7.5Hz,2H),7.79(d,J=7.5Hz,2H),10.2(br s,1H)。メルカプト基のプロトンは帰属できなかった。
【0127】
(合成例43) 4−ヨード−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドの合成
【0128】
【化29】

O−エチル−S−3−[2−(4−ヨードベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネート(0.25g,0.49mmol)のエタノール(2mL)懸濁液に28%アンモニア水(1mL)を加え、室温で一晩撹拌した。反応終了後、反応液に1N塩酸(10mL)と酢酸エチル(10mL)を加えて抽出し、有機層を水(10mL)で洗浄した。得られた有機層に硫酸マグネシウムを加えて乾燥させた後、乾燥剤を濾別し溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製することにより、4−ヨード−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドの淡黄色固体(71%,0.16g)を得た。
m.p.130から140℃;1H−NMR(CDCl3,TMS,ppm):δ 1.99(tt,J=7.5 and 7.5Hz,2H),2.06(s,3H),2.67(t,J=7.5Hz,2H),2.78(t,J=7.5Hz,2H),7.57(d,J=8.8Hz,2H),7.80(d,J=8.8Hz,2H)。メルカプト基のプロトンとアミドのプロトンは帰属できなかった。
【0129】
(合成例44) 4−ブロモ−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドの合成
【0130】
【化30】

O−エチル−S−3−[2−(4−ブロモベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネート(0.30g,0.65mmol)のエタノール(2mL)懸濁液に28%アンモニア水(1mL)を加え、室温で一晩撹拌した。反応終了後、反応液に1N塩酸(10mL)と酢酸エチル(10mL)を加えて抽出し、有機層を水(10mL)で洗浄した。得られた有機層に硫酸マグネシウムを加えて乾燥させた後、乾燥剤を濾別し溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製することにより、4−ブロモ−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドの白色固体(60%,0.15g)を得た。
m.p.99から105℃;1H−NMR(CDCl3,TMS,ppm):δ 1.96(tt,J=7.5 and 7.5Hz,2H),2.10(s,3H),2.67(t,J=7.5Hz,2H),2.78(t,J=7.5Hz,2H),7.59(d,J=8.8Hz,2H),7.74(d,J=8.8Hz,2H)。メルカプト基のプロトンとアミドのプロトンは帰属できなかった。
【0131】
(合成例45) 4−シクロプロピル−N−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}−N−メチルチオメチルベンズアミドの合成
【0132】
【化31】

二塩化オキサリル(416mg,3.28mmol)の塩化メチレン(5mL)溶液にDMSO(176mg,1.24mmol)の塩化メチレン(5mL)溶液を加え、−78℃で30分間撹拌した後、4−シクロプロピル−N−{4−メチル−5−(3−ヒドロキシプロピル)チアゾール−2−イル}ベンズアミド(828mg,2.62mmol)のクロロホルム(20mL)溶液を滴下した。30分間撹拌した後に、トリエチルアミンを(1.46g,14.4mmol)を加えて−78℃で3時間反応させた。反応終了後、反応混合物に1M塩酸(40mL)を加え、クロロホルム(10mL)で2回抽出し、有機層を合わせて飽和食塩水(30mL)で2回洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製することで、黄色油状の4−シクロプロピル−N−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミド(251mg,39%)と黄色油状の4−シクロプロピル−N−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}−N−メチルチオメチルベンズアミド(386mg,30%)を得た。
【0133】
4−シクロプロピル−N−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミド;黄色油状;1H−NMR(CDCl3,TMS,ppm):δ 0.74から0.80(m,2H),1.01から1.08(m,2H),1.91から1.98(m,4H),2.78(t,J=7.5Hz,2H),3.01(t,J=7.5Hz,2H),7.11(d,J=10.0Hz,2H),7.78(d,J=10.0Hz,2H),9.82(s,1H)。アミドのプロトンは帰属できなかった。
【0134】
4−シクロプロピル−N−メチルチオメチル−N−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミド;黄色油状:1H−NMR(CDCl3,TMS,ppm):δ 0.72から0.78(m,2H),1.00から1.08(m,2H),1.88から1.96(m,1H),2.14(s,3H),2.30(s,3H),2.78(t,J=7.5Hz,2H),3.01(t,J=7.5Hz,2H),5.24(s,2H),7.12(d,J=7.5Hz,2H),7.44(d,J=7.5Hz,2H),9.81(s,1H)。
【0135】
(合成例46)
合成例45と同様にして、4−メトキシ−3−エトキシ−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミドを合成した。
黄色油状;1H−NMR(CDCl3,TMS,ppm):δ 1.46(t,J=5.0Hz,3H),2.05(s,3H),2.80(t,J=7.5Hz,2H),3.01(t,J=7.5Hz,2H),3.94(s,3H),4.08(q,J=7.5Hz,2H),6.91(d,J=7.5Hz,1H),7.49(d,J=7.5Hz,1H),7.50(s,1H),9.83(s,1H)。アミドのプロトンは帰属できなかった。
【0136】
(合成例47)
合成例45と同様にして、4−メトキシ−3−エトキシ−N−メチルチオメチル−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミドを合成した。
白色固体;m.p.103℃;1H−NMR(CDCl3,TMS,ppm):δ 1.47(t,J=7.5Hz,3H),2.20(s,3H),2.31(s,3H),2.78(t,J=7.5Hz,2H),3.01(t,J=7.5Hz,2H),3.92(s,3H),4.11(q,J=7.5Hz,2H),5.26(s,2H),6.90(d,J=7.5Hz,1H),7.11から7.18(m,2H),9.81(s,1H)。
【0137】
(合成例48)
合成例45と同様にして、4−エトキシ−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミドを合成した。
黄色固体;m.p.110から114℃;1H−NMR(CDCl3,TMS,ppm):δ 1.44(t,J=7.5Hz,3H),2.03(s,3H),2.80(t,J=7.5Hz,2H),3.00(t,J=7.5Hz,2H),4.10(q,J=7.5Hz,2H),6.93(d,J=10.0Hz,2H),7.91(d,J=10.0Hz,2H),9.82(s,1H)。アミドのプロトンは帰属できなかった。
【0138】
(合成例49)
合成例45と同様にして、4−メチル−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミドを合成した。
白色固体;m.p.133から135℃;1H−NMR(CDCl3,TMS,ppm):δ 2.05(s,3H),2.43(s,3H),2.80(t,J=7.5Hz,2H),3.02(t,J=7.5Hz,2H),7.28(d,J=7.5Hz,2H),7.79(d,J=7.5Hz,2H),9.83(s,1H)。アミドのプロトンは帰属できなかった。
【0139】
(合成例50)
合成例45と同様にして、4−メチル−N−メチルチオメチル−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミドを合成した。
白色固体;m.p.93から99℃;1H−NMR(CDCl3,TMS,ppm):δ 2.14(s,3H),2.30(s,3H),2.40(s,3H),2.78(t,J=7.5Hz,2H),3.02(t,J=7.5Hz,2H),5.24(s,2H),7.25(d,J=7.5Hz,2H),7.44(d,J=7.5Hz,2H),9.81(s,1H)。
【0140】
(合成例51) N−[5−(3−アミノキシプロピル)−4−メチルチアゾール−2−イル]−4−メチルベンズアミドの合成
【0141】
【化32】

N−[5−(3−フタルイミドオキシプロピル)−4−メチルチアゾール−2−イル]4−メチルベンズアミド(1.70g、3.90mmol)のエタノール(20mL)溶液に、ヒドラジン一水和物(0.45mL、89.9mmol)を室温にて加え、一晩撹拌した。反応終了後、反応溶液を減圧留去し、得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製;アミノプロピルシリカゲルを使用)で精製し、N−[5−(3−アミノキシプロピル)−4−メチルチアゾール−2−イル]−4−メチルベンズアミドの淡黄色油状物(0.975g,収率:82%)を得た。
淡黄色油状物;1H−NMR(CDCl3,TMS,ppm):δ 1.84から1.99(m,2H),2.12(s,3H),2.43(s,3H),2.76(t,J=7.5Hz,2H),3.70(t,J=7.5Hz,2H),5.28(br s,2H),7.28(d,J=7.5Hz,2H),7.80(d,J=7.5Hz,2H),10.1(br s,1H)。
【0142】
(合成例52) 8−(2−トルイルアミノ−4−メチルチアゾール−5−イル)オクテン酸の合成
【0143】
【化33】

10−オキソウンデカン酸(1.0g,4.99mmol)のTHF(50mL)溶液に臭化銅(II)(2.23g,9.98mmol)を加え、3時間加熱還流したところ白色の沈澱物が生成した。沈澱物をろ過し、ろ液をエバポレーターで減圧濃縮し、黄色の油状物を得た。この油状物にDMF(20mL)と4−メチルベンゾイルチオウレア(0.775g,3.99mmol)を加え、80℃で12時間反応させた。反応終了後反応混合物に1M塩酸(100mL)を加え酢酸エチル(100mL)で2回抽出し、有機層を合わせて水(200mL)で2回洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去し、固体を析出させた。得られた固体をエーテルで洗浄することによって、白色固体の8−[2−(4−メチルベンゾイル)アミノ−4−メチルチアゾール−5−イル]オクテン酸(0.285g,15%)を得た。
1H−NMR(CDCl3,TMS,ppm):δ 1.30から1.38(m,6H),1.58から1.64(m,4H),2.22(s,3H),2.30(t,J=7.5Hz,2H),2.42(s,3H),2.67(t,J=7.5Hz,3H),7.29(d,J=8.0Hz,2H),7.97(d,J=8.0Hz,2H)。アミドのプロトンとカルボン酸のプロトンは帰属できなかった。
【0144】
(合成例53)
合成例14と同様にして、N−[5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル]−4−メチルベンズアミドを合成した。
灰色固体;m.p.103から105℃;1H−NMR(CDCl3,TMS,ppm):1.83から1.95(m,2H),2.10(s,3H),2.42(s,3H),2.81(t,J=7.5Hz,2H),3.71(t,J=7.5Hz,2H),7.27(d,J=7.5Hz,2H),7.80(d,J=7.5Hz,2H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0145】
前述の合成方法に準じて、表1から10に記載のチアゾール誘導体を得た。
【0146】
【化34】

【0147】
【表1】

【0148】
【表2】

【0149】
【表3】

【0150】
【表4】

【0151】
【表5】

【0152】
【表6】

【0153】
【表7】

【0154】
【表8】

【0155】
【表9】

【0156】
【表10】

以下の実施例では、本発明のチアゾール誘導体を活性化基含有マトリックスに固定化し、免疫グロブリンの分析又は精製を行なった。なお、化合物番号は表1から10記載の化合物番号に対応する。
【0157】
固定化されたチアゾール誘導体量は、固定化反応に用いた溶液中のチアゾール誘導体量と固定化反応後に回収された溶液(洗浄液を含み、以下、回収液という)中のチアゾール誘導体量を測定し、比較することで算出した。チアゾール誘導体の濃度は、U−2900スペクトロフォトメーター(商品名)(日立製作所製)を用いて前記誘導体の紫外吸収極大波長における吸光度を測定して(以下、吸光度法という)、又は高速液体クロマトグラフィーを用いて前記誘導体の紫外吸収クロマトグラムにおけるピーク面積を測定して(以下、HPLC法という)求めた。HPLC法では、カラムとしてTSK−GEL ODS−80TM(商品名)(東ソー社製)を用い、溶離液としてアセトニトリル/水/トリフルオロ酢酸=45/55/0.05(体積比)(以下、単に溶離液という)を用いた。
【0158】
実施例1 化合物75のアガロースゲルへの固定化(その1)
N−ヒドロキシスクシンイミド(以下、NHSという)で活性化されたアガロースゲルであるHiTrap NHS−activated HPカラム(1mL)(商品名)(GEヘルスケアバイオサイエンス社製、スクシンイミドオキシカルボニル基含量:10μmol/mL(gel)、以下、HiTrapカラムという)を活性化基含有マトリックス充填カラムとして用いた。
【0159】
HiTrapカラムに、まず氷冷した1mM HClを5mL通液した。コハク酸ジヒドラジドを100mMになるように0.5M NaClを含む0.2M炭酸ナトリウム緩衝液(pH8.3)に溶解し、その2mLをHiTrapカラムに通液した。1時間静置後、10mLの0.5M NaClを含む0.2M 炭酸ナトリウム緩衝液(pH8.3)を通液した。次に純水10mLを通液した後、DMSOを5mL通液した。次いで、化合物75を10mMになるようにDMSOに溶解し、その2mLを通液した。2時間静置後、3mLのDMSOを通液した。次にピリジン−ボランのDMSO溶液(20mM)2mLを通液し、14時間静置した後、5mLのDMSOを通液した。最後にカラムに純水10mLを通液することで、化合物75を固定化したゲルを得た。
【0160】
化合物75の固定化量は、カラムに添加した化合物75の量(20μmol)からカラムから回収された化合物75の量を減ずることより算出した。吸光度法(検出波長306nm)によって測定した化合物75の固定化量は7.3μmol/mL(gel)であった。
【0161】
実施例2 化合物75を固定化したアガロースゲルを用いた免疫グロブリンの吸脱着
実施例1に記載の方法にて調製した、化合物75を固定化したHiTrapカラムを、クロマトグラフィー装置であるAKTAprime plus(商品名)(GEヘルスケアバイオサイエンス社製)に取り付け、0.7M硫酸ナトリウムを含む10mMリン酸ナトリウム−10mMクエン酸ナトリウム緩衝液(pH7.5)(以下、緩衝液Aという)を流速1mL/minで通液してカラムを平衡化した。次に緩衝液Aに溶解した1mg/mLヒト血漿由来免疫グロブリン製剤(化血研製)0.5mLをカラムに添加して、緩衝液Aを10mL通液後、緩衝液Aから10mMリン酸ナトリウム−10mMクエン酸ナトリウム緩衝液(pH7.5)への硫酸ナトリウムの濃度勾配クロマトグラフィーを行なった。
【0162】
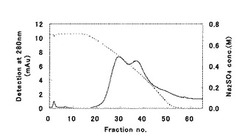
カラムから溶出された免疫グロブリンの検出は、280nmにおける吸光度を測定することにより行なった。溶出液は1mLずつ分画し、U−2900スペクトロフォトメーター(商品名)(日立製作所製)により各フラクションの280nmにおける吸光度を測定し、それらを合算した値をカラムに添加した免疫グロブリンの280nmにおける吸光度と比較することにより回収率を算出した。クロマトグラフィーの結果を図1に示す。このクロマトグラフィーにおける免疫グロブリンの回収率は100%であった。
【0163】
吸脱着操作後、0.1M水酸化ナトリウムを10mL通液してカラムの再生を行なった。化合物75を固定化したHiTrapカラムは前記再生処理によって初期状態に復帰させることができ、繰り返し使用によってもその特性は変化しなかった。
【0164】
実施例3 化合物75のビニルポリマーゲルへの固定化
TOYOPEARL AF−Amino−650M(商品名)(東ソー社製、アミノ基含量:89μmol/mL(gel))を活性化基含有マトリックスとして用いて化合物75の固定化を行なった。
【0165】
0.1M N−シクロヘキシル−2−アミノエタンスルホン酸(以下、CHESという)−NaOH緩衝液(pH9.0)とアセトニトリルとの混合溶媒(体積比1:1)に化合物75を22mMになるよう溶解し、この溶液9.0mLとTOYOPEARL AF−Amino−650Mゲル2.0mLを混合して振とうした。30分振とう後、ピリジン−ボランを0.11mL(1.1mmol)添加し、更に25℃で16時間振とうし、吸引濾過で固定化反応後のゲルを濾別した。濾別したゲルを5mLのアセトニトリルで5回洗浄することにより、化合物75を固定化したゲルを得た。なお、この濾液と洗浄液とをあわせたものを回収液とした。
【0166】
別途、ピリジン−ボランと化合物75とを含む溶液を溶離液で希釈し、HPLC法で分析したところ、化合物75は還元されて化合物67となっていた。このことに留意して、反応液をHPLC法(検出波長300nm)で分析した。その結果、回収液中に化合物67が90μmol存在することが分かった。すなわち、固定化反応によって消費された化合物75は108μmolであり、化合物75の固定化量は54μmol/mL(gel)であった。
【0167】
実施例4 化合物75のアガロースゲルへの固定化(その2)
EAH Sepharose 4B(商品名)(GEヘルスケアバイオサイエンス社製、アミノ基含量:12μmol/mL(gel))を活性化基含有マトリックスとして用いて化合物75の固定化を行なった。
【0168】
EAH Sepharose 4Bゲル3.2mLに、実施例3と同じ組成からなる化合物75の溶液を5mL加え、更にピリジン−ボランを0.29mL(2.9mmol)加えた後、25℃で8時間振とうした。固定化反応後のゲルを吸引濾過で濾別し、そのゲルを5mLのアセトニトリルで5回洗浄することで、化合物75を固定化したゲルを得た。
【0169】
濾液及び洗浄液をあわせた回収液を実施例3と同じ方法で分析した結果、化合物75の固定化量は27μmol/mL(gel)であった。
【0170】
実施例5 化合物95のビニルポリマーゲルへの固定化
TOYOPEARL AF−Epoxy−650M(商品名)(東ソー社製、エポキシ基含量:50μmol/mL(gel))を活性化基含有マトリックスとして用いて化合物95の固定化を行なった。
【0171】
化合物95(50.6mg)にDMSO(5.5mL)、蒸留水(4.18mL)、1M NaOH水溶液(1.32mL)を添加して、化合物95を15mM含有する溶液を調製した。この溶液10mLとTOYOPEARL AF−Epoxy−650Mゲル3mLを遠沈管中で混合し、40℃で70時間振とうした。反応後、遠沈管を1分間遠心(100×g)し、ゲルと上清を分離した。上清を除いた後、ゲルに10mLのDMSOを添加し撹拌混合後、1分間遠心(100×g)し、ゲルと上清を分離することでゲルの洗浄を行ない、前記操作を3回行なった。反応液上清と洗浄液を混合し、DMSOにより40mLにメスアップしたものを回収液とした。DMSOで洗浄した後のゲルに蒸留水(30mL)を添加し撹拌混合後、1分間遠心(100×g)し、ゲルと上清を分離後、上清を吸引除去した。前記操作を5回行ない、化合物95を固定化したゲルを得た。
【0172】
吸光度法(検出波長348nm)によって測定した化合物95の固定化量は30μmol/mL(gel)であった。
【0173】
実施例6 化合物95を固定化したビニルポリマーゲルを用いた免疫グロブリンの吸脱着
実施例5に記載の方法にて調製した、化合物95を固定化したTOYOPEARL AF−Epoxy−650Mゲル1mLをTRICORNカラム(商品名)(GEヘルスケアバイオサイエンス社製)に充填し、AKTAprime plus(商品名)(GEヘルスケアバイオサイエンス社製)に取り付け、実施例2と同様、0.5mgのヒト血漿由来免疫グロブリン製剤を硫酸ナトリウム濃度勾配のクロマトグラフィーで分離した。クロマトグラフィーの結果を図2に示す。
【0174】
吸脱着操作後、0.1M水酸化ナトリウムを10mL通液してカラムの再生を行なった。化合物95を固定化したエポキシトヨパールゲルはこの再生処理によって初期状態に復帰させることができ、繰り返し使用によってもその特性は変化しなかった。
【0175】
実施例7 化合物95のアガロースゲルへの固定化
Epoxy−activated Sepharose 6B(商品名)(GEヘルスケアバイオサイエンス社製、エポキシ基含量:19から40μmol/mL(gel))を活性化基含有マトリックスとして用いて化合物95の固定化を行なった。
【0176】
70mM水酸化ナトリウムとN,N−ジメチルアセトアミドの混合溶媒(体積比1:1)に化合物95を16mMになるように溶解し、この溶液6.0mLとEpoxy−activated Sepharose 6Bゲル3.1mLを混合して40℃で2時間振とうした。反応後、ゲルを吸引濾過で濾別し、そのゲルを5mLの前記混合溶媒で5回洗浄した。これらの濾液及び洗浄液をあわせて回収液とした。前記混合溶媒で洗浄後のゲルは更に10mLの水で2回洗浄することで、化合物95を固定化したゲルを得た。
【0177】
吸光度法(検出波長305nm)によって測定した化合物95の固定化量は32μmol/mL(gel)であった。
【0178】
実施例8 化合物107のビニルポリマーゲルへの固定化
TOYOPEARL AF−Amino−650M(商品名)(東ソー社製、アミノ基含量:89μmol/mL(gel))を活性化基含有マトリックスとして用いて化合物107の固定化を行なった。
【0179】
脱水DMF(和光純薬社製)に化合物107が21mM、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩が41mM、NHSが42mMになるように溶解し、この溶液15mLとTOYOPEARL AF−Amino−650Mゲル2.1mLを混合して25℃で4日間振とうした。反応後、ゲルを吸引濾過で濾別し、5mLのDMFによる洗浄を5回行なった。この濾液と洗浄液とをあわせて回収液とした。洗浄後のゲルを無水酢酸のDMF溶液(無水酢酸/DMF溶液=1/4(体積比))5mLに懸濁して、25℃で2時間振とうした。次にゲルを吸引濾過、水洗することにより、化合物107を固定化したゲルを得た。
【0180】
吸光度法(検出波長305nm)によって測定した化合物107の固定化量は11μmol/mL(gel)であった。
【0181】
実施例9 化合物110のアガロースゲルへの固定化
HiTrapカラムにDMSOを5mL通液した後、化合物110が10mM、トリエチルアミンが40mMになるようにDMSOに溶解した溶液2mLを通液した。1時間静置後、3mLのDMSOを通液し、未反応の化合物110を除去した。反応に用いた化合物110溶液のカラムからの漏出液と、洗浄に用いたDMSOのカラムからの漏出液をあわせて回収液とした。
【0182】
化合物110の固定化量は、カラムに添加した化合物110の量(20μmol)からカラムから回収された化合物110の量を減ずることより算出した。固定化前に調製した化合物110のDMSO溶液及び回収液を、非特許文献4に記載された方法のうち「B.酸性条件法」に従って適宜希釈し306nmにおける吸光度を測定した。この方法より、HiTrapカラムに固定化された化合物110の量は、2.3μmol/mL(gel)であった。
【0183】
実施例10 化合物110のビニルポリマーゲルへの固定化
TOYOPEARL AF−Formyl−650M(商品名、東ソー社製、ホルミル基含量60μmol/mL(gel))を活性化基含有マトリックスとして用いて化合物110の固定化を行なった。
【0184】
0.1M CHES−NaOH緩衝液(pH9.0)とアセトニトリルとの混合溶媒(体積比1:1)に化合物110を36mMになるように溶解し、この溶液5.8mLとTOYOPEARL AF−Formyl−650Mゲル3.0mLを混合して振とうし、30分後にピリジン−ボラン0.17mL(1.7mmol)を添加して25℃で16時間振とうすることで反応後、ゲルを吸引濾過で濾別し、濾別したゲルを5mLのアセトニトリルで5回洗浄した。前記濾液と洗浄液とをあわせたものを回収液とした。前記洗浄後のゲルは更に10mLの水で2回洗浄することで、化合物110を固定化したゲルを得た。
【0185】
HPLC法(検出波長254nm)によって測定した化合物107の固定化量は40μmol/mL(gel)であった。
【0186】
実施例11 化合物110を固定化したビニルポリマーゲルを用いた免疫グロブリンの吸脱着
実施例10に記載の方法にて調製した、化合物110を固定化したTOYOPEARL AF−Formyl−650Mゲル1mLをTRICORNカラムに充填し、AKTAprime plus(商品名)(GEヘルスケアバイオサイエンス社製)に取り付け、実施例2と同様にして、0.5mgのヒト血漿由来免疫グロブリン製剤を硫酸ナトリウム濃度勾配のクロマトグラフィーで分離した。クロマトグラフィーの結果を図3に示す。
【0187】
吸脱着操作後に0.1M水酸化ナトリウムを10mL通液してカラムの再生を行なった。化合物110を固定化したTOYOPEARL AF−Formyl−650Mゲルはこの再生処理によって初期状態に復帰させることができ、繰り返し使用によってもその特性は変化しなかった。
【技術分野】
【0001】
本発明は、各種タンパク質、特に免疫グロブリンの分析又は精製に利用可能なチアゾール誘導体を結合させたマトリックス、及びその製造方法に関する。
【背景技術】
【0002】
近年、医療用タンパク質の需要は拡大しつつあり、その簡便で大規模に実施できる工業的精製技術の確立が切望されている。一般にタンパク質精製技術には、ゲル濾過クロマトグラフィー、イオン交換クロマトグラフィー、疎水性相互作用クロマトグラフィー、逆相クロマトグラフィー、およびアフィニティークロマトグラフィーなどのクロマトグラフィー分離技術があるが、医療用タンパク質の精製を工業的に実施する場合には、実験室で用いられるような分離剤や装置を使用したのでは経済性に乏しく、実用的とは言い難い。また、医療用タンパク質を工業的に製造する過程では多種類のタンパク質が混在しているため、上記の中の一つの精製技術を用いて、目的とするタンパク質を純粋に得ることは極めて困難である。そのため通常はいくつかの技術を複合させた精製プロセスが採用されている(特許文献1)。
【0003】
近年、医療用タンパク質の一つである免疫グロブリンを精製するための低分子化合物とそれらが結合したマトリックスが数多く開示されており、スルホン誘導体(特許文献2)、トリアジン誘導体(特許文献3)、メルカプト複素環式化合物(特許文献4)、4−ピリジルエチルチオアルキル誘導体(非特許文献1)等の低分子化合物が結合したマトリックスが知られている。しかしながら、本発明のマトリックスの製造に用いるチアゾール誘導体(1a)が免疫グロブリンを精製するための低分子化合物として有用であると記載した文献はない。また、特許文献5や非特許文献2に本発明のマトリックスの製造に用いるチアゾール誘導体(1a)に類似の化学構造を有するチアゾール誘導体が報告されているものの、これらの文献に記載のチアゾール誘導体の化学構造は、チアゾール環の2位がアミノ基あるいはアルキル基に限定されており、本発明のマトリックスの製造に用いるチアゾール誘導体(1a)のように2位にアリールカルボニルアミノ基を有する化合物についての記載はない。とりわけ非特許文献2に記載の化合物は、本発明のマトリックスの製造に用いるチアゾール誘導体(1a)に類似のチアゾール誘導体ではあるものの、それらの用途はヒスタミンH2レセプターアゴニストに限定されており、免疫グロブリンを精製するための用途についての記載はない。
【0004】
なお、特許文献6にはチアゾール環の2位にベンゾイルアミノ基が置換したチアゾール誘導体が記載されているが、これらの化合物におけるチアゾール環の4位の置換基はカルボニル基、5位は無置換にそれぞれ限定されており、用途も消化管運動改善作用を有する医薬の有効成分である。更には特許文献6の化合物はマトリックスに固定化されたものではなく、免疫グロブリンを精製するための用途についての記載もない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】WO2004/087761号
【特許文献2】米国特許4696980号
【特許文献3】米国特許6117996号
【特許文献4】特許第3844496号
【特許文献5】WO1991/10656号
【特許文献6】WO1998/17654号
【非特許文献】
【0006】
【非特許文献1】Bioseparation,9(4),211−221,2000
【非特許文献2】Journal of Medicinal Chemistry,35(17),3239−3246,1992
【非特許文献3】化学大辞典、7巻、479、共立出版
【非特許文献4】はじめてのリガンドカップリングハンドブック、アマシャムバイオサイエンス社、2005
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明が解決しようとする課題は、タンパク質、特に免疫グロブリンの分析又は精製に有用なチアゾール誘導体を固定化したマトリックス、及びその製造方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、上記課題を解決すべく鋭意検討を重ねた結果、本発明の下記一般式(1)で示されるチアゾール誘導体固定化マトリックスが、タンパク質、特に免疫グロブリンの簡便な分析又は精製を可能にすることを見出し、本発明を完成するに至った。
【0009】
即ち本発明は、一般式(1)
【0010】
【化1】

(式中、R1及びR2は水素原子又は置換されていてもよい炭素数1から6のアルキル基を表し、R3は酸素原子、メチレン基、硫黄原子、カルボニル基又はイミノキシ基(−ONH−)を表し、Arは置換されていてもよい芳香族基を表し、nは1から12の整数を表し、Mはマトリックスを表す。)で表されるチアゾール誘導体固定化マトリックスに関するものである。
【0011】
また本発明は、一般式(1)
【0012】
【化2】

(式中、R1、R2、R3、Ar、n及びMは前記と同じ意味を表す。)において、Mのマトリックスがビニル重合体、多糖、金属酸化物であることを特徴とするチアゾール誘導体固定化マトリックスに関するものである。
【0013】
また本発明は、一般式(1a)
【0014】
【化3】

(式中、R1、R2、Ar及びnは前記と同じ意味を表し、R4はヒドロキシ基、ホルミル基、メルカプト基、カルボキシル基又はアミノキシ基(−ONH2)を表す。)で示されるチアゾール誘導体と、活性化基含有マトリックスとを反応させることを特徴とする、一般式(1)
【0015】
【化4】

(式中、R1、R2、R3、Ar、n及びMは前記と同じ意味を表す。)で示されるチアゾール誘導体固定化マトリックスの製造方法に関するものである。
【0016】
また本発明は、一般式(1)
【0017】
【化5】

(式中、R1、R2、R3、Ar、n及びMは前記と同じ意味を表す。)で示されるチアゾール誘導体固定化マトリックスを使用し、タンパク質の分析又は精製を行なう方法に関するものである。
【0018】
以下、本発明をさらに詳細に説明する。
【0019】
本発明のチアゾール誘導体固定化マトリックスで用いるチアゾール誘導体における、R1、R2、R3、R4、Arで表される置換基の定義を以下に示す。
【0020】
R1及びR2で表される置換されていてもよい炭素数1から6のアルキル基としては、直鎖状もしくは分枝状のいずれであってもよく、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、ペンチル基、イソアミル基、ネオペンチル基、2−ペンチル基、3−ペンチル基、tert−ペンチル基、ヘキシル基、イソヘキシル基、2−ヘキシル基、3−ヘキシル基を例示することができる。また、これらの炭素数1から6のアルキル基はハロゲン原子等で置換されていてもよく、さらに具体的にはジフルオロメチル基、トリフルオロメチル基、2,2,2−トリフルオロエチル基、パーフルオロブチル基、ヒドロキシメチル基、カルボキシメチル基、メチルチオメチル基、4−モルホリノカルボニルメチル基等を例示することができる。免疫グロブリンの分析又は精製において良好な性能を示す点で、R1はメチル基が好ましく、R2は水素原子が好ましい。
【0021】
Arで表される芳香族基は特に制限はないが、フラン−2−イル基、フラン−3−イル基、チオフェン−2−イル基、チオフェン−3−イル基、ピロール−2−イル基、ピロール−3−イル基、ピラゾール−3−イル基、ピラゾール−4−イル基、イソチアゾール−3−イル基、イソチアゾール−4−イル基、イソキサゾール−3−イル基、イソキサゾール−4−イル基、イミダゾール−2−イル基、イミダゾール−4−イル基、イミダゾール−5−イル基、オキサゾール−2−イル基、オキサゾール−4−イル基、オキサゾール−5−イル基、チアゾール−2−イル基、チアゾール−4−イル基、チアゾール−5−イル基、1,2,4−トリアゾール−3−イル基、フェニル基、2−ピリジル基、3−ピリジル基、4−ピリジル基、2−ピリミジル基、4−ピリミジル基、5−ピリミジル基、1,2,4−トリアジン−3−イル基、1,2,4−トリアジン−5−イル基、1,2,4−トリアジン−6−イル基、ベンゾジオキソラン−3−イル基、ベンゾフラン−2−イル基、ベンゾフラン−3−イル基、ベンゾフラン−4−イル基、ベンゾフラン−5−イル基、ベンゾフラン−6−イル基、ベンゾフラン−7−イル基、ベンゾチオフェン−2−イル基、ベンゾチオフェン−3−イル基、ベンゾチオフェン−4−イル基、ベンゾチオフェン−5−イル基、ベンゾチオフェン−6−イル基、ベンゾチオフェン−7−イル基、インドール−2−イル基、インドール−3−イル基、インドール−4−イル基、インドール−5−イル基、インドール−6−イル基、インドール−7−イル基、ベンゾチアゾール−2−イル基、ベンゾチアゾール−4−イル基、ベンゾチアゾール−5−イル基、ベンゾチアゾール−6−イル基、ベンゾチアゾール−7−イル基、インダゾール−3−イル基、インダゾール−4−イル基、インダゾール−5−イル基、インダゾール−6−イル基、インダゾール−7−イル基、ベンズイソキサゾール−3−イル基、ベンズイソキサゾール−4−イル基、ベンズイソキサゾール−5−イル基、ベンズイソキサゾール−6−イル基、ベンズイソキサゾール−7−イル基、ナフタレン−1−イル基、ナフタレン−2−イル基、キノリン−2−イル基、キノリン−3−イル基、キノリン−4−イル基、キノリン−5−イル基、キノリン−6−イル基、キノリン−7−イル基、キノリン−8−イル基、キノキサリニル基、キノキサリン−5−イル基、キノキサリン−6−イル基、キナゾリニル基、キナゾリン−4−イル基、キナゾリン−5−イル基、キナゾリン−6−イル基、キナゾリン−7−イル基、キナゾリン−8−イル基、ベンゾオキサジン−5−イル基、ベンゾオキサジン−6−イル基、ベンゾオキサジン−7−イル基、ベンゾオキサジン−8−イル基、ベンゾチアジン−5−イル基、ベンゾチアジン−6−イル基、ベンゾチアジン−7−イル基、ベンゾチアジン−8−イル基、1,3−ベンゾジオキソール−4−イル基、1,3−ベンゾジオキソール−5−イル基、1,3−ベンゾジオキソール−6−イル基、1,3−ベンゾジオキソール−7−イル基、アントラセン−1−イル基を例示できる。特に、免疫グロブリンの分析又は精製において良好な性能を示す点で、Arはフェニル基、2−ピリジル基、3−ピリジル基、4−ピリジル基又はフラン−2−イル基が好ましい。
【0022】
Arで表される置換されていてもよい芳香族基の置換基としては特に制限はないが、ハロゲン原子、置換されていてもよい炭素数1から6のアルキル基、置換されていてもよい炭素数1から12のアルコキシ基、置換されていてもよい炭素数3から8のシクロアルコキシ基、置換されていてもよい炭素数3から6のアルケニルオキシ基、置換されていてもよい炭素数3から6のアルキニルオキシ基、置換されていてもよい炭素数1から6のアシルオキシ基、置換されていてもよい炭素数1から6のアルキルチオ基、置換されていてもよい炭素数1から6のアルキルスルフィニル基、置換されていてもよい炭素数1から6のアルキルスルホニル基、置換されていてもよい炭素数1から12のアルコキシカルボニル基、カルボキシル基、ニトロ基、置換されていてもよいアミノ基、ヒドロキシ基又はシアノ基が好ましい。
【0023】
Arの置換基としてのハロゲン原子としては、フッ素原子、塩素原子、臭素原子又はヨウ素原子を例示することができる。
【0024】
Arの置換基としての炭素数1から6のアルキル基としては、直鎖状、分枝状もしくは環状のいずれであってもよく、メチル基、エチル基、シクロプロピル基、プロピル基、イソプロピル基、シクロプロピル基、ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、ペンチル基、イソアミル基、ネオペンチル基、2−ペンチル基、3−ペンチル基、2−メチルブチル基、tert−ペンチル基、ヘキシル基、イソヘキシル基、2−ヘキシル基、3−ヘキシル基を例示することができる。また、これらのアルキル基はハロゲン原子、炭素数3から8のシクロアルキル基、炭素数1から6のアルコキシ基、炭素数1から6のアルコキシカルボニル基、カルボキシル基、アシル基、置換されていてもよい芳香族基で1個以上置換されていてもよく、さらに具体的には2−クロロエチル基、3−クロロプロピル基、ジフルオロメチル基、3−フルオロプロピル基、メトキシメチル基、2−エトキシエチル基、シクロプロピルメチル基、シクロペンチルメチル基、シクロヘキシルメチル基、2−メチルチオエチル基、2−エチルチオエチル基、2−アリルチオエチル基、2−プロパルギルチオエチル基、2−ベンジルチオエチル基、2−(2−クロロベンジル)チオエチル基、2−(2,4−ジクロロベンジル)チオエチル基、2−メチルスルフィニルエチル基、2−メチルスルホニルエチル基、メトキシメチル基、エトキシメチル基、2−メトキシエチル基、2−クロロエトキシメチル基、メトキシカルボニルメチル基、エトキシカルボニルメチル基、1−メトキシカルボニルエチル基、1−エトキシカルボニルエチル基、2−エトキシカルボニルエチル基、カルボキシメチル基、アセトニル基、1−アセチルエチル基、3−アセチルプロピル基、フェナシル基、4−クロロフェナシル基、2,4−ジフルオロフェナシル基、4−メチルフェナシル基、4−イソプロピルフェナシル基、4−イソブチルフェナシル基、4−シクロヘキシルフェナシル基、4−シアノフェナシル基、4−ニトロフェナシル基、チオフェン−2−イル基、2−(チオフェン−2−イル)エチル基、2−(チオフェン−3−イル)エチル基、フルフリル基、(5−メチルフラン−2−イル)メチル基、(5−エチルフラン−2−イル)メチル基、(5−クロロフラン−2−イル)メチル基、2−(5−フルオロフラン−2−イル)エチル基、テトラヒドロフルフリル基、2−ピリジルメチル基、3−ピリジルメチル基、4−ピリジルメチル基、2−(ピリジン−2−イル)エチル基、2−(ピリジン−3−イル)エチル基、2−(ピリジン−4−イル)エチル基、3−(ピリジン−2−イル)プロピル基、3−(ピリジン−3−イル)プロピル基、3−(ピリジン−4−イル)プロピル基を例示することができる。
【0025】
Arの置換基としての置換されていてもよい炭素数1から12のアルコキシ基としては、直鎖状もしくは分枝状のいずれであってもよく、メトキシ基、エトキシ基、プロピルオキシ基、イソプロピルオキシ基、ブトキシ基、イソブチルオキシ基、sec−ブチルオキシ基、tert−ブトキシ基、ペンチルオキシ基、イソアミルオキシ基、ネオペンチルオキシ基、2−ペンチルオキシ基、3−ペンチルオキシ基、tert−ペンチルオキシ基、ヘキシルオキシ基、イソヘキシルオキシ基、2−ヘキシルオキシ基、3−ヘキシルオキシ基、デセニルオキシ基を例示することができる。また、これらのアルコキシ基はハロゲン原子、炭素数3から8のシクロアルキル基、炭素数1から6のアルコキシ基、炭素数1から6のアルコキシカルボニル基、カルボキシル基、アシル基、置換されていてもよい芳香族基等で1個以上置換されていてもよく、さらに具体的には2−クロロエトキシ基、3−クロロプロピルオキシ基、ジフルオロメトキシ基、4−トリフルオロメトキシ基、3−フルオロプロピルオキシ基、シクロプロピルメトキシ基、シクロペンチルメトキシ基、シクロヘキシルメトキシ基、2−メチルチオエトキシ基、2−エチルチオエトキシ基、2−アリルチオエトキシ基、2−プロパルギルチオエトキシ基、2−ベンジルチオエトキシ基、2−(2−クロロベンジル)チオエトキシ基、2−(2,4−ジクロロベンジル)チオエトキシ基、2−メチルスルフィニルエトキシ基、2−メチルスルホニルエトキシ基、メトキシメトキシ基、エトキシメトキシ基、2−メトキシエトキシ基、2−クロロエトキシメトキシ基、メトキシカルボニルメトキシ基、エトキシカルボニルメトキシ基、1−メトキシカルボニルエトキシ基、1−エトキシカルボニルエトキシ基、2−エトキシカルボニルエトキシ基、カルボキシメトキシ基、1−アセチルエトキシ基、3−アセチルプロポキシ基、2−ピリジルメトキシ基、3−ピリジルメトキシ基、4−ピリジルメトキシ基、2−(ピリジン−2−イル)エトキシ基、2−(ピリジン−3−イル)エトキシ基、2−(ピリジン−4−イル)エトキシ基、3−(ピリジン−2−イル)プロポキシ基、3−(ピリジン−3−イル)プロポキシ基、ベンジルオキシ基を例示することができる。
【0026】
Arの置換基としての置換されていてもよい炭素数3から8のシクロアルコキシ基としては、シクロプロピルオキシ基、シクロブチルオキシ基、シクロペンチルオキシ基、2−メチルシクロブチルオキシ基、シクロヘキシルオキシ基、2−メチルシクロペンチルオキシ基、3−メチルシクロペンチルオキシ基、4−メチルシクロペンチルオキシ基、シクロオクチルオキシ基を例示することができる。
【0027】
Arの置換基としての置換されていてもよい炭素数3から6のアルケニルオキシ基としては、アリルオキシ基、2−メチル−2−プロペニルオキシ基、2−ブテニルオキシ基、1−ブテン−3−イルオキシ基、3−ブテニルオキシ基、4−ペンテニルオキシ基、5−ヘキセニルオキシ基を例示することができる。これらのアルケニルオキシ基はハロゲン原子等で置換されていてもよく、3,3−ジフルオロアリルオキシ基、3,3−ジクロロアリルオキシ基、3,3−ジブロモアリルオキシ基を例示することができる。
【0028】
Arの置換基としての置換されていてもよい炭素数3から6のアルキニルオキシ基としては、プロパルギルオキシ基、1−ブチン−3−イルオキシ基、2−ブチニルオキシ基、3−ブチニルオキシ基、2−ペンチニルオキシ基、3−ペンチニルオキシ基、4−ペンチニルオキシ基、2−ヘキシニルオキシ基、3−ヘキシニルオキシ基、4−ヘキシニルオキシ基、5−ヘキシニルオキシ基を例示することができ、これらのアルキニルオキシ基はハロゲン原子等で置換されていてもよく、4,4,4−トリフルオロブチン−2−イル基等を例示することができる。
【0029】
Arの置換基としての置換されていてもよい炭素数1から6のアシルオキシ基としては、アセトキシ基、プロピオニルオキシ基を例示することができ、これらのアシルオキシ基はハロゲン原子等で置換されていてもよく、トリフルオロアセトキシ基や2,2,2−トリフルオロプロピオニルオキシ基等を例示することができる。
【0030】
Arの置換基としての置換されていてもよい炭素数1から6のアルキルチオ基としては、メチルチオ基、エチルチオ基、プロピルチオ基、イソプロピルチオ基、ブチルチオ基、イソブチルチオ基、sec−ブチルチオ基、ペンチルチオ基、イソアミルチオ基、ネオペンチルチオ基、2−ペンチルチオ基、3−ペンチルチオ基、2−メチルブチルチオ基、ヘキシルチオ基、イソヘキシルチオ基、3−メチルペンチルチオ基、2−メチルペンチルチオ基を例示することができる。また、これらのアルキルチオ基はハロゲン原子、炭素数3から8のシクロアルキル基等で一個以上置換されていてもよく、さらに具体的には2−クロロエチルチオ基、3−クロロプロピルチオ基、ジフルオロメチルチオ基、3−フルオロプロピルチオ基、シクロプロピルメチルチオ基、シクロペンチルメチルチオ基、シクロヘキシルメチルチオ基を例示することができる。
【0031】
Arの置換基としての置換されていてもよい炭素数1から6のアルキルスルフィニル基としては、メチルスルフィニル基、エチルスルフィニル基、プロピルスルフィニル基、イソプロピルスルフィニル基、ブチルスルフィニル基、イソブチルスルフィニル基、sec−ブチルスルフィニル基、ペンチルスルフィニル基、イソアミルスルフィニル基、ネオペンチルスルフィニル基、2−ペンチルスルフィニル基、3−ペンチルスルフィニル基、2−メチルブチルスルフィニル基、ヘキシルスルフィニル基、イソヘキシルスルフィニル基、3−メチルペンチルスルフィニル基、2−メチルペンチルスルフィニル基を例示することができる。また、これらのアルキルスルフィニル基はハロゲン原子、炭素数3から8のシクロアルキル基等で一個以上置換されていてもよく、さらに具体的には2−クロロエチルスルフィニル基、3−クロロプロピルスルフィニル基、ジフルオロメチルスルフィニル基、3−フルオロプロピルスルフィニル基、シクロプロピルメチルスルフィニル基、シクロペンチルメチルスルフィニル基、シクロヘキシルメチルスルフィニル基を例示することができる。
【0032】
Arの置換基としての置換されていてもよい炭素数1から6のアルキルスルホニル基としては、メチルスルホニル基、エチルスルホニル基、プロピルスルホニル基、イソプロピルスルホニル基、ブチルスルホニル基、イソブチルスルホニル基、sec−ブチルスルホニル基、ペンチルスルホニル基、イソアミルスルホニル基、ネオペンチルスルホニル基、2−ペンチルスルホニル基、3−ペンチルスルホニル基、2−メチルブチルスルホニル基、ヘキシルスルホニル基、イソヘキシルスルホニル基、3−メチルペンチルスルホニル基、2−メチルペンチルスルホニル基を例示することができる。また、これらのアルキルスルホニル基はハロゲン原子、炭素数3から8のシクロアルキル基で一個以上置換されていてもよく、さらに具体的には2−クロロエチルスルホニル基、3−クロロプロピルスルホニル基、ジフルオロメチルスルホニル基、3−フルオロプロピルスルホニル基、シクロプロピルメチルスルホニル基、シクロペンチルメチルスルホニル基、シクロヘキシルメチルスルホニル基を例示することができる。
【0033】
Arの置換基としての置換されていてもよい炭素数1から12のアルコキシカルボニル基としては、メトキシカルボニル基、エトキシカルボニル基、プロポキシカルボニル基、ブトキシカルボニル基、ヘキシルオキシカルボニル基、ドデシルオキシカルボニル基、ベンジルオキシカルボニル基、tert−ブトキシカルボニル基を例示することができ、これらのアルコキシカルボニル基はハロゲン原子等で一個以上置換されていてもよく、さらに具体的にはトリフルオロメトキシカルボニル基、2,2,2−トリフルオロエトキシカルボニル基等を例示することができる。
【0034】
Arの置換基としての置換されていてもよいアミノ基としては、アミノ基、メチルアミノ基、ジメチルアミノ基、エチルアミノ基、N−エチル−N−メチルアミノ基、ジエチルアミノ基、N−メチル−N−プロピルアミノ基、N−エチル−N−プロピルアミノ基、2,2,2−トリフルオロエチルアミノ基、ジプロピルアミノ基、イソプロピルアミノ基、N−メチル−N−イソプロピルアミノ基、ブチルアミノ基、N−ブチル−N−メチルアミノ基、イソブチルアミノ基、sec−ブチルアミノ基、ペンチルアミノ基、イソアミルアミノ基、ネオペンチルアミノ基、2−ペンチルアミノ基、3−ペンチルアミノ基、2−メチルブチルアミノ基、ヘキシルアミノ基、イソヘキシルアミノ基、4−メチルペンチルアミノ基、ベンゼンスルホニルアミノ基、N−ベンゼンスルホニル−N−メチルアミノ基、p−トルエンスルホニルアミノ基、4−クロロベンゼンスルホニルアミノ基、4−ニトロベンゼンスルホニルアミノ基、メチルスルホニルアミノ基、クロロメチルスルホニルアミノ基、トリフルオロメチルスルホニルアミノ基、N−メチルスルホニル−N−メチルアミノ基、N−メチルスルホニル−N−エチルアミノ基、N−メチルスルホニル−N−プロピルアミノ基、エチルスルホニルアミノ基、N−エチルスルホニル−N−メチルアミノ基、N−エチルスルホニル−N−エチルアミノ基、メトキシカルボニルアミノ基、エトキシカルボニルアミノ基を例示することができる。
【0035】
Arで表される置換されていてもよい芳香族基の具体例として、フラン−2−イル基、5−ブロモフラン−2−イル基、5−メチルフラン−2−イル基、フラン−3−イル基、チオフェン−2−イル基、5−クロロチオフェン−2−イル基、5−ブロモチオフェン−2−イル基、5−メチルチオフェン−2−イル基、5−メトキシチオフェン−2−イル基、5−エトキシチオフェン−2−イル基、チオフェン−3−イル基、5−メチルチオフェン−3−イル基、5−メトキシチオフェン−3−イル基、5−エトキシチオフェン−3−イル基、1−メチルピロール−2−イル基、1−メチルピロール−3−イル基、1−エチルピラゾール−3−イル基、ピラゾール−2−イル基、3−エトキシ−1−メチルピラゾール−2−イル基、1−エチル−4−メトキシピラゾール−3−イル基、イソチアゾール−3−イル基、5−メトキシイソチアゾール−3−イル基、イソチアゾール−4−イル基、イソキサゾール−3−イル基、イソキサゾール−4−イル基、1−メチルイミダゾール−2−イル基、1−メチルイミダゾール−4−イル基、1−メチルイミダゾール−5−イル基、オキサゾール−2−イル基、オキサゾール−4−イル基、オキサゾール−5−イル基、チアゾール−2−イル基、3−メトキシチアゾール−2−イル基、4−メトキシチアゾール−2−イル基、チアゾール−4−イル基、チアゾール−5−イル基、1,2,4−トリアゾール−3−イル基、1,2,4−トリアゾール−5−イル基、フェニル基、2−フルオロフェニル基、3−フルオロフェニル基、4−フルオロフェニル基、2,3−ジフルオロフェニル基、3,5−ジフルオロフェニル基、3,4,5−トリフルオロフェニル基、2,3,4,5,6−ペンタフルオロフェニル基、3−フルオロ−4−メチルフェニル基、4−トリフルオロメトキシフェニル基、2−クロロフェニル基、3−クロロフェニル基、4−クロロフェニル基、4−クロロ−3−メチルフェニル基、4−クロロ−3−エチルフェニル基、4−クロロ−3−メトキシフェニル基、4−クロロ−3−エトキシフェニル基、2,3−ジクロロフェニル基、3,5−ジクロロフェニル基、3,4,5−トリクロロフェニル基、3−トリフルオロメチルフェニル基、4−トリフルオロメチルフェニル基、3−ブロモフェニル基、4−ブロモフェニル基、4−ブロモ−3−メチルフェニル基、4−ブロモ−3−エチルフェニル基、4−ブロモ−3−メトキシフェニル基、4−ブロモ−3−エトキシフェニル基、3,5−ジブロモ−4−ヒドロキシフェニル基、3−ヨードフェニル基、4−ヨードフェニル基、4−ヨード−3−メチルフェニル基、4−ヨード−3−エチルフェニル基、4−ヨード−3−メトキシフェニル基、4−ヨード−3−エトキシフェニル基、2−メチルフェニル基、3−メチルフェニル基、4−メチルフェニル基、3,4−ジメチルフェニル基、3,4,5−トリメチルフェニル基、3−ヒドロキシ−4−メチルフェニル基、2−トリフルオロフェニルメチルフェニル基、3−トリフルオロフェニルメチルフェニル基、4−トリフルオロフェニルメチルフェニル基、4−メトキシメチルフェニル基、3,4−ジエトキシフェニル基、3−エチル−4−メチルフェニル基、4−エチル−3−メチルフェニル基、4−エチルフェニル基、3,4−ジエチルフェニル基、4−プロピルフェニル基、4−イソプロピルフェニル基、3−ブチルフェニル基、4−ブチルフェニル基、4−イソブチルフェニル基、4−(sec−ブチル)フェニル基、4−(tert−ブチル)フェニル基、4−ペンチルフェニル基、4−イソアミルフェニル基、4−ネオペンチルフェニル基、4−(2−ペンチル)フェニル基、4−(3−ペンチル)フェニル基、4−(2−メチルブチル)フェニル基、4−(tert−ペンチル)フェニル基、4−ヘキシルフェニル基、4−イソヘキシルフェニル基、4−(2−クロロエチル)フェニル基、4−(3−クロロプロピル)フェニル基、4−(ジフルオロメチル)フェニル基、4−(3−フルオロプロピル)フェニル基、4−メトキシメチルフェニル基、4−エトキシメチルフェニル基、4−シクロプロピルメチルフェニル基、4−シクロペンチルメチルフェニル基、シクロヘキシルメチルフェニル基、4−(2−メチルチオエチル)フェニル基、4−(2−エチルチオエチル)フェニル基、4−(2−アリルチオエチル)フェニル基、4−(2−プロパルギルチオエチル)フェニル基、4−(2−ベンジルチオエチル)フェニル基、3−メトキシフェニル基、3−メトキシ−4−メチルフェニル基、4−エチル−3−メトキシフェニル基、3−メトキシ−4−プロピルフェニル基、4−メトキシフェニル基、4−メトキシ−3−メトキシフェニル基、3,4−ジメトキシフェニル基、3−エトキシ−4−メトキシフェニル基、4−エトキシ−3−メトキシフェニル基、4−イソプロピルオキシ−3−メトキシフェニル基、3−イソプロピルオキシ−4−メトキシフェニル基、3−エトキシフェニル基、4−エトキシフェニル基、4−エトキシ−3−メチルフェニル基、4−エトキシ−3−エチルフェニル基、4−エトキシ−3−プロピルフェニル基、4−エトキシ−3−イソプロピルフェニル基、4−プロピルオキシフェニル基、4−イソプロピルオキシフェニル基、4−ブトキシフェニル基、4−イソブチルオキシフェニル基、4−(sec−ブチルオキシ)フェニル基、3−(2−クロロエトキシ)フェニル基、3−(2−クロロエトキシ)フェニル基、4−(2−クロロエトキシ)フェニル基、3−(3−クロロプロピルオキシ)フェニル基、4−(3−クロロプロピルオキシ)フェニル基、3−ジフルオロメトキシフェニル基、4−ジフルオロメトキシフェニル基、4−(3−フルオロプロピルオキシ)フェニル基、4−シクロプロピルメトキシフェニル基、4−シクロペンチルメトキシ基、4−シクロヘキシルメトキシ基、3−シクロプロピルオキシフェニル基、4−シクロプロピルオキシフェニル基、4−シクロプロピルオキシ−3−メトキシフェニル基、4−シクロプロピルオキシ−3−メチルフェニル基、4−シクロブチルオキシフェニル基、4−シクロペンチルオキシフェニル基、4−(2−メチルシクロブチルオキシ)フェニル基、4−シクロヘキシルオキシフェニル、4−アリルオキシフェニル基、4−(3,3−ジクロロアリルオキシ)フェニル基、4−プロパルギルオキシフェニル基、3−メチル−4−プロパルギルオキシフェニル基、3−エチル−4−プロパルギルオキシフェニル基、3−メトキシ−4−プロパルギルオキシフェニル基、3−エトキシ−4−プロパルギルオキシフェニル基、3−プロポキシ−4−プロパルギルオキシフェニル基、4−(1−ブチン−3−イルオキシ)フェニル基、4−(2−ブチニルオキシ)フェニル基、3−メチルチオフェニル基、4−メチルチオフェニル基、4−メチル−3−メチルチオフェニル基、3−メチル−4−メチルチオフェニル基、4−メトキシ−3−メチルチオフェニル基、3−エトキシ−4−メチルチオフェニル基、4−エトキシ−3−メチルチオフェニル基、3−プロポキシ−4−メチルチオフェニル基、4−エチルチオフェニル基、3−プロピルチオフェニル基、4−イソプロピルチオフェニル基、4−ブチルチオフェニル基、4−イソブチルチオフェニル基、2−(sec−ブチルチオ)フェニル基、2−ペンチルチオフェニル基、2−イソアミルチオフェニル基、4−ネオペンチルチオフェニル基、4−(2−クロロエチルチオ)フェニル基、3−(3−クロロプロピルチオ)フェニル基、ジフルオロメチルチオフェニル基、3−アセトキシフェニル基、4−アセトキシフェニル基、3−メチルスルフィニルフェニル基、4−メチルスルフィニルフェニル基、4−メトキシ−3−メチルスルフィニルフェニル基、3−メトキシ−4−メチルスルフィニルフェニル基、4−エトキシ−3−メチルスルフィニルフェニル基、3−エトキシ−4−メチルスルフィニルフェニル基、4−メチル−3−メチルスルフィニルフェニル基、3−エチル−4−メチルスルフィニルフェニル基、4−(2−クロロエチルスルフィニル)フェニル基、4−(3−クロロプロピルスルフィニル)フェニル基、4−(ジフルオロメチルスルフィニル)フェニル基、3−メチルスルホニルフェニル基、4−メチルスルホニルフェニル基、4−メチル−3−メチルスルホニルフェニル基、4−エチル−3−メチルスルホニルフェニル基、4−メトキシ−3−メチルスルホニルフェニル基、4−エトキシ−3−メチルスルホニルフェニル基、3−メトキシ−4−メチルスルホニルフェニル基、3−エトキシ−4−メチルスルホニルフェニル基、エチルスルホニルフェニル基、プロピルスルホニルフェニル基、イソプロピルスルホニルフェニル基、ブチルスルホニルフェニル基、2−クロロエチルスルホニルフェニル基、3−クロロプロピルスルホニルフェニル基、ジフルオロメチルスルホニルフェニル基、4−カルボキシフェニル基、4−メトキシカルボニルフェニル基、4−エトキシカルボニルフェニル基、3−メチルアミノフェニル基、4−メチルアミノフェニル基、4−メトキシ−3−メチルアミノフェニル基、3−メトキシ−4−メチルアミノフェニル基、4−エトキシ−3−メチルアミノフェニル基、3−エトキシ−4−メチルアミノフェニル基、4−メチル−3−メチルアミノフェニル基、3−メチル−4−メチルアミノフェニル基、4−エチル−3−メチルアミノフェニル基、3−エチル−4−メチルアミノフェニル基、3−ジメチルアミノフェニル基、4−ジメチルアミノフェニル基、4−メトキシ−3−ジメチルアミノフェニル基、3−メトキシ−4−ジメチルアミノフェニル基、4−エトキシ−3−ジメチルアミノフェニル基、3−エトキシ−4−ジメチルアミノフェニル基、4−メチル−3−ジメチルアミノフェニル基、3−メチル−4−ジメチルアミノフェニル基、4−エチル−3−ジメチルアミノフェニル基、3−メチル−4−ジメチルアミノフェニル基、3−(N−エチル−N−メチルアミノ)フェニル基、4−(N−エチル−N−メチルアミノ)フェニル基、4−メトキシ−3−(N−エチル−N−メチルアミノ)フェニル基、3−メトキシ−4−(N−エチル−N−メチルアミノ)フェニル基、4−エトキシ−3−(N−エチル−N−メチルアミノ)フェニル基、3−エトキシ−4−(N−エチル−N−メチルアミノ)フェニル基、4−メチル−3−(N−エチル−N−メチルアミノ)フェニル基、3−メチル−4−(N−エチル−N−メチルアミノ)フェニル基、4−エチル−3−(N−エチル−N−メチルアミノ)フェニル基、3−メチル−4−(N−エチル−N−メチルアミノ)フェニル基、3−ジエチルアミノフェニル基、4−ジエチルアミノフェニル基、4−メトキシ−3−ジエチルアミノフェニル基、3−メトキシ−4−ジエチルアミノフェニル基、4−エトキシ−3−ジエチルアミノフェニル基、3−エトキシ−4−ジエチルアミノフェニル基、4−メチル−3−ジエチルアミノフェニル基、3−メチル−4−ジエチルアミノフェニル基、4−エチル−3−ジエチルアミノフェニル基、3−メチル−4−ジエチルアミノフェニル基、4−メチルスルホニルアミノフェニル基、4−トリフルオロメチルスルホニルアミノフェニル基、4−アセチルアミノフェニル基、2−ヒドロキシフェニル基、3−ヒドロキシフェニル基、4−ヒドロキシフェニル基、3−ヒドロキシ−4−メチルフェニル基、3−ヒドロキシ−4−エチルフェニル基、3−ヒドロキシ−4−メトキシフェニル基、4−ヒドロキシ−3−メチルフェニル基、4−ヒドロキシ−3−エチルフェニル基、4−ヒドロキシ−3−メトキシフェニル基、2−シアノフェニル基、3−シアノフェニル基、4−シアノフェニル基、2−ニトロフェニル基、3−ニトロフェニル基、3−ニトロ−4−メチルフェニル基、4−ニトロフェニル基、ピリジン−2−イル基、5−クロロピリジン−2−イル基、5−メチルピリジン−2−イル基、5−エチルピリジン−2−イル基、5−メトキシピリジン−2−イル基、5−エトキシピリジン−2−イル基、2,3−ジメチルピリジン−6−イル基、2,3−ジメトキシピリジン−6−イル基、ピ
リジル−3−イル基、2−クロロピリジン−5−イル基、2−メチルピリジン−5−イル基、2−エチルピリジン−5−イル基、2−メトキシピリジン−5−イル基、2−エトキシピリジン−5−イル基、2,3−ジメチルピリジン−5−イル基、ピリジル−4−イル基、2−メチルピリジン−4−イル基、2−エチルピリジン−4−イル基、2−メトキシピリジン−4−イル基、2−エトキシピリジン−4−イル基、2−ピリミジル基、5−メチルピリミジン−2−イル基、5−エチルピリミジン−2−イル基、2−エトキシピリジン−5−イル基、2,3−ジメチルピリジン−5−イル基、2−メチルピリジン−4−イル基、2−エチルピリジン−4−イル基、2−メトキシピリジン−4−イル基、2−エトキシピリジン−4−イル基、5−クロロピリミジン−2−イル基、5−ブロモピリミジン−2−イル基、5−メトキシピリミジン−2−イル基、ピリミジル−4−イル基、ピリミジル−5−イル基、1,2,4−トリアジン−3−イル基、1,2,4−トリアジン−5−イル基、1,2,4−トリアジン−6−イル基、ベンゾジオキソラン−3−イル基、ベンゾフラン−2−イル基、ベンゾフラン−3−イル基、ベンゾフラン−4−イル基、ベンゾフラン−5−イル基、ベンゾフラン−6−イル基、ベンゾフラン−7−イル基、ベンゾチオフェン−2−イル基、ベンゾチオフェン−3−イル基、ベンゾチオフェン−4−イル基、ベンゾチオフェン−5−イル基、ベンゾチオフェン−6−イル基、ベンゾチオフェン−7−イル基、1−メチルインドール−2−イル基、ベンゾチアゾール−2−イル基、ベンゾチアゾール−4−イル基、ベンゾチアゾール−5−イル基、ベンゾチアゾール−6−イル基、ベンゾチアゾール−7−イル基、ベンズイソキサゾール−3−イル基、ベンズイソキサゾール4−イル基、ベンズイソキサゾール−5−イル基、ベンズイソキサゾール−6−イル基、ベンズイソキサゾール−7−イル基、ナフタレン−1−イル基、ナフタレン−2−イル基、キノリン−2−イル基、キノリン−3−イル基、キノリン−4−イル基、キノリン−5−イル基、キノリン−6−イル基、キノリン−7−イル基、キノリン−8−イル基、キノキサリン−5−イル基、キノキサリン−6−イル基、キナゾリン−4−イル基、キナゾリン−5−イル基、キナゾリン−6−イル基、キナゾリン−7−イル基、キナゾリン−8−イル基、ベンゾオキサジン−5−イル基、ベンゾオキサジン−6−イル基、ベンゾオキサジン−7−イル基、ベンゾオキサジン−8−イル基、ベンゾチアジン−5−イル基、ベンゾチアジン−6−イル基、ベンゾチアジン−7−イル基、ベンゾチアジン−8−イル基、1,3−ベンゾジオキソール−4−イル基、1,3−ベンゾジオキソール−5−イル基、アントラセン−1−イル基等があげられる。
【0036】
免疫グロブリンの分析又は精製において良好な性能を示す点で、Arは4−メチルフェニル基、4−エチルフェニル基、3,4−ジメチルフェニル基、3−エチル−4−メチルフェニル基、4−エチル−3−メチルフェニル基、4−メトキシフェニル基、4−エトキシフェニル基、3,4−ジメトキシフェニル基、3,4−ジエトキシフェニル基、3−エトキシ−4−メトキシフェニル基、4−エトキシ−3−メトキシフェニル基、4−メトキシ−3−メチルフェニル基、4−メチル−3−エトキシフェニル基、4−ジメチルアミノフェニル基、2−メトキシピリジン−5−イル基、2−エトキシピリジン−5−イル基、2,3−ジメチルピリジン−5−イル基、4−ピリジル基、2−メチルピリジン−4−イル基、2−エチルピリジン−4−イル基、2−メトキシピリジン−4−イル基、2−エトキシピリジン−4−イル基、2−クロロピリジン−5−イル基が好ましい。
【0037】
Mで表されるマトリックスの材質としては特に限定はなく、一般式(1a)に示すチアゾール誘導体と共有結合を形成するものであればよい。該チアゾール誘導体は二価の官能基であるメチレン鎖とR3とを介した共有結合によってマトリックスに固定化される。チアゾール誘導体固定化マトリックスの性能として、タンパク質を含む溶液から分析や精製の対象となるタンパク質を選択的に吸着し、簡単な処理によって該吸着タンパク質を脱離できるものが好ましく選択される。
【0038】
マトリックスの形態としては、前記タンパク質を含む溶液に対して不溶性のゲルが好ましく、前記ゲルであれば粒状物または非粒状物、多孔性または非多孔性、いずれの性質であってもよい。本発明におけるMで表されるマトリックスは有機高分子化合物、無機化合物、又はそれらの複合体の中から適宜選択することができる。なお、前記ゲルは前記タンパク質を含む溶液に懸濁させて用いてもよいし、またカラム管に充填後、前記タンパク質を含む溶液を通液して用いてもよい。
【0039】
有機高分子化合物のゲルとしては、天然高分子であっても合成高分子であってもよい。天然高分子としては、架橋結合アルブミン等のポリペプチドまたはタンパク質、アガロース、アルギネート、カラゲナン、キチン、セルロース、デキストリン、デキストランまたは澱粉等の多糖及びそれらの架橋体があげられる。一方、合成高分子としては、ビニルポリマー、ポリエステル、ポリアミド、ポリエーテルまたはポリウレタン及びそれらの共重合体を例示でき、これらの架橋体を用いてもよい。また、前記重合体の側鎖を反応させたものも、後述する活性化基含有マトリックスとして用いることができる。
【0040】
なお本発明において、ビニルポリマーとは非特許文献3に記載のとおり、ビニルモノマーやビニリデンモノマーの単独重合体、または、それらの共重合体である。前記モノマーとしては、アクリル酸またはメタクリル酸及びそれらのアミド、エステル、アクロレイン、メタクロレイン、各種カルボン酸のビニルエステル、スチレン等があげられる。メタクリル酸のエステルとしては、メタクリル酸−2−ヒドロキシエチルが例示できる。
【0041】
また、天然高分子に合成高分子や天然高分子をグラフト重合したもの、合成高分子に合成高分子や天然高分子をグラフト重合としたもの、無機化合物から有機モノマーの重合鎖を伸ばしたものであっても、本発明におけるMで表されるマトリックスに含まれる。
【0042】
無機化合物のゲルとしては、シリカ、アルミナ、ジルコニアまたは酸化鉄といった金属酸化物、ガラス、多孔質珪藻土等が例示される。また、前記無機化合物にカップリング剤で処理したものも、後述する活性化基含有マトリックスとして用いることができる。前記カップリング剤としては、活性化基又はその前駆体となる官能基を有するシランカップリング剤、アルミネートカップリング剤、チタネートカップリング剤等があげられる。
【0043】
本発明におけるMで表されるマトリックスとしては、操作の容易さや回収率の高さの観点から、アガロース、キトサン、デキストランまたはセルロース等の多糖類、ポリスチレンやトヨパール(商品名)(東ソー株式会社製)等のビニルポリマー及びそれらの架橋体、シリカ等の無機化合物が好ましい。
【0044】
なお、本発明のチアゾール誘導体固定化マトリックスは、タンパク質を含む溶液から特定のタンパク質を吸着した後、分離ができれば、液状であってもよい。例えば、水性二相分配法で使用されるデキストラン、ポリエチレングリコ−ル、ポリビニルアルコール若しくは加水分解澱粉といった水溶性の高分子を包含するマトリックス、又はエマルジョンを形成するのに使用されるペルフルオロデカリン等の化合物を包含するマトリックスがあげられる。
【0045】
本発明のチアゾール誘導体固定化マトリックスにおいて、チアゾール環とMとは、一般式(4)に示すように、メチレン基がnであり、二価の原子あるいは二価の基R3を介して共有結合している。
【0046】
M−R3−(CH2)n−(チアゾール環) (4)
nについては、1から12の整数から適宜選択することができるが、抗体の捕捉能が高く夾雑タンパクとの選択性がよい点で、3、4、5又は6が好ましい。
【0047】
R3の構造は、本発明のチアゾール誘導体固定化マトリックスの製法に依存する。本発明のチアゾール誘導体固定化マトリックスは、一般式(1a)に示すチアゾール誘導体の反応性官能基R4をマトリックスの活性化基と反応させることによって製造される。ここで、R4は、ヒドロキシ基、ホルミル基、メルカプト基、カルボキシル基又はアミノキシ基(−ONH2)からなる群より選択される。
【0048】
次に、本発明のチアゾール誘導体固定化マトリックスの製造方法を詳細に説明する。
【0049】
【化6】

(式中、R1、R2、R3、R4、Ar、M及びnは前記と同じ意味を表す。)
ここで言う活性化基とは、一般式(1a)のR4で定義されるヒドロキシ基、ホルミル基、メルカプト基、カルボキシル基又はアミノキシ基(−ONH2)を必要に応じて塩基や還元剤の存在下に反応させた時に容易に共有結合を形成できる官能基のことで、例えば、スクシンイミドオキシカルボニル基、1−メチルピリジニウム−2−オキシカルボニル基、ホルミル基、カルボキシル基、2,2,2−トリフルオロエチルスルホニルオキシ基(トレシル基)、スルホニル基、トシル基、ビニルスルホニル基、エポキシ基、アミノ基、ジチオ−2−ピリジル基、ヒドラジノ基をあげることができる。中でも導入の容易さの観点から、スクシンイミドオキシカルボニル基、エポキシ基、ホルミル基、アミノ基、ジチオ−2−ピリジル基、ヒドラジノ基、カルボキシル基が好ましい。チアゾール誘導体の固定化反応及び固定化反応によって形成されるR3を一般式(5)から(12)に例示する。これらの式において、M’は活性化基をもつマトリックスのうちの活性化基以外の部分を指し、Rは式(1a)のR4以外の部分を指す。
【0050】
【化7】

【0051】
【化8】

【0052】
【化9】

【0053】
【化10】

【0054】
【化11】

【0055】
【化12】

【0056】
【化13】

【0057】
【化14】

また、コハク酸ジヒドラジド、ピメルイミド酸ジメチル、ジビニルスルホン、カルボニルジイミダゾール等の2官能性試薬を用いてマトリックスの活性化基の種類を変換することもできる。
【0058】
活性化基含有マトリックスにチアゾール誘導体(1a)を固定化して導いたチアゾール誘導体固定化マトリックス(1)は、タンパク質(特に免疫グロブリン)、またはこれらの類縁体、フラグメント、融合体の精製に用いることかできる。特に、本発明のチアゾール誘導体固定化マトリックス(1)は、免疫グロブリンのうち、免疫グロブリンG(IgG)の分析や精製に有用である。
【0059】
次に、本発明のチアゾール誘導体固定化マトリックスを用いてタンパク質を分析、分離、または単離、精製する方法について説明する。
【0060】
本発明のチアゾール誘導体固定化マトリックスをカラム管に充填し、溶離液として緩衝液、金属塩の水溶液、アミノ酸溶液、アルコール溶液等の溶液を通液することで、タンパク質の分析、分離、単離又は精製を行なうことができる。この方法が適用できるタンパク質としては、血漿タンパク質成分や乳タンパク質成分をあげることができ、天然に存在するものでは血漿中の免疫グロブリン、血清アルブミン、血液凝固因子、ラクトアルブミン、ラクトフェリンを例示できる。またペプチドホルモン、インターフェロン、インターロイキン、成長因子、成長抑制因子、ワクチンも例示できる。特に本発明のチアゾール誘導体固定化マトリックスは、免疫グロブリンの精製に好ましい。通液する緩衝液としては、リン酸緩衝液、クエン酸緩衝液、Tris、PIPES、ACES、BES、MOPS、TES、HEPESを例示でき、金属塩としては硫酸ナトリウム、硫酸カリウム、硫酸リチウム、硫酸マグネシウム、硫酸アンモニウム、クエン酸ナトリウム、クエン酸カリウム、塩化ナトリウム、塩化カリウムを例示でき、アミノ酸としてはグリシン、アルギニン、ベータアラニン、ガンマアミノ酪酸を例示でき、アルコールとしてはエタノール、イソプロピルアルコール、グリセロール、エチレングリコールを例示できる。また、これらを混合したものを溶離液として用いることもできる。pHは3から11の範囲内で目的とするタンパク質を分析、分離、単離又は精製することができるが、特に5から9の範囲内で精製することが好ましい。また、AKTAprime plus(商品名)(GEヘルスケアバイオサイエンス社製)等のクロマトグラフィー装置を使用して、タンパク質を分析、分離、単離又は精製することもできる。チアゾール誘導体固定化マトリックスを用いて免疫グロブリン若しくはこれらの類縁体、フラグメント、融合体を分析又は精製する場合は、硫酸ナトリウムや硫酸アンモニウムを含むリン酸緩衝液を通液し、pHは5から9の範囲で、疎水性相互作用を利用したクロマトグラフィーを行なうのが好ましい。ここでいう免疫グロブリンの類縁体とは、免疫グロブリンの構造や機能が少なくとも部分的に保持された天然若しくは人工的に作られたタンパク質又はタンパク質コンジュゲートを指し、免疫グロブリンのフラグメントとは、酵素的な処理又は遺伝子工学的な設計によって作製された免疫グロブリンの部分構造を持ったタンパク質を指し、免疫グロブリンの融合体とは、各種サイトカイン又はサイトカイン受容体等の生物活性をもったタンパク質の機能部分を免疫グロブリンの全部又は一部と遺伝子工学的に融合させて作製したものを指す。
【0061】
本発明のチアゾール誘導体固定化マトリックスは、水酸化ナトリウム水溶液、水酸化カリウム水溶液等のアルカリ性水溶液、塩酸水溶液、硫酸水溶液、硝酸水溶液、リン酸水溶液等の酸性水溶液、塩酸グアニジン水溶液、尿素水溶液等のタンパク変性剤水溶液、アルギニンやヒスチジン等のアミノ酸を含んだ水溶液、SDS、Tween等の界面活性剤水溶液、メタノール、エタノール、イソプロパノール、グリセロール、エチレングリコール等のアルコール溶液、又は、これらを含んだ混合水溶液を用いて洗浄することによって、初期状態に復帰させることができ、繰り返し使用することができる。
【0062】
次に、本発明のチアゾール誘導体固定化マトリックスの製造に用いるチアゾール誘導体の製造方法を詳細に説明する。
【0063】
製造方法1
【0064】
【化15】

(式中、R1、R2、Ar及びnは前記と同じ意味を表し、R3aはフタルイミドオキシ基、アセトキシ基、カルボキシル基又はアルコキシチオカルボニルチオ基を表し、Yはハロゲン原子を表す。)
製造方法1はα−ハロケトン体(2)をアシルチオウレア誘導体(3)と反応させ、チアゾール誘導体(1a’)を製造する方法である。本反応は溶媒中で行なうことが好ましく、反応に害を及ぼさない溶媒であれば使用することができる。溶媒としてはジエチルエーテル、テトラヒドロフラン(THF)、1,2−ジメトキシエタン(DME)、ジオキサン等のエーテル系溶媒、アセトン、メチルエチルケトン等のケトン系溶媒、酢酸エチル、酢酸ブチル等のエステル系溶媒、アセトニトリル、プロピオニトリル等のニトリル類、ベンゼン、トルエン、キシレン、クロロベンゼン等の芳香族炭化水素系溶媒、N,N−ジメチルホルムアミド(DMF)、N−メチルピロリドン等のアミド類、ジメチルスルホキシド(DMSO)、水又はこれらの混合溶媒が例示でき、中でも収率がよい点で、DMFを用いるのが好ましい。反応温度については特に制限はないが、0℃から150℃の範囲から適宜選ばれた温度で反応させることにより目的物を得ることができ、収率がよい点で60℃から150℃の範囲で反応させるのが好ましい。本工程では、塩基存在下に行なうこともでき、塩基としては、水素化ナトリウム、ナトリウムアミド、炭酸ナトリウム、炭酸カリウム、ナトリウムメトキシド、ナトリウムエトキシド、カリウム−tert−ブトキシド、水酸化ナトリウム、水酸化カリウム等のアルカリ金属塩基、トリエチルアミン、トリブチルアミン、N−メチルモルホリン、ピリジン、ジメチルアニリン等の有機アミン類を用いることができる。塩基の使用量は特に制限はないが、反応基質に対して1当量以上用いて反応を実施することにより、収率よく目的物を得ることができる。反応終了後は、通常の後処理操作により目的物を得ることができるが、必要であればカラムクロマトグラフィー又は再結晶等の方法により精製することもできる。
【0065】
製造方法2
【0066】
【化16】

(式中、R1、R2、Ar及びnは前記と同じ意味を表す。)
製造方法2はチアゾール誘導体(1aa)を水存在下にてヘキサカルボニルモリブテンで処理し、5−ヒドロキシアルキルチアゾール誘導体(1ab)を製造する方法である。水及びヘキサカルボニルモリブテンの使用量は反応基質(1aa)に対して1当量以上用いて反応を実施することにより、収率よく目的物(1ab)を得ることができる。本反応は溶媒中で行なうのが好ましく、反応に害を及ぼさない溶媒であれば使用することができる。溶媒としてはジエチルエーテル、THF、DME、ジオキサン等のエーテル系溶媒、アセトン、メチルエチルケトン等のケトン系溶媒、酢酸エチル、酢酸ブチル等のエステル系溶媒、アセトニトリル、プロピオニトリル等のニトリル類、ベンゼン、トルエン、キシレン、クロロベンゼン等の芳香族炭化水素系溶媒、DMF、N−メチルピロリドン等のアミド系溶媒、メタノール、エタノール、イソプロピルアルコール等のアルコール系溶媒、DMSO、又はこれらの混合溶媒が例示でき、中でも収率がよい点や後処理が簡便である点でアセトニトリル、プロピオニトリル等のニトリル類溶媒を用いることが好ましい。反応温度については特に制限はないが、0℃から150℃の範囲から適宜選ばれた温度で反応させることにより目的物を得ることができる。反応終了後は、通常の後処理操作により目的物を得ることができるが、必要であればカラムクロマトグラフィー又は再結晶等の方法により精製することもできる。
【0067】
製造方法3
【0068】
【化17】

(式中、R1、R2、Ar及びnは前記と同じ意味を表し、R5は炭素数1から6のアルキル基を表す。)
製造方法3はチアゾール誘導体(1ac)を塩基で処理し、5−メルカプトアルキルチアゾール誘導体(1ad)を製造する方法である。本反応で用いることができる塩基としては、水素化ナトリウム、ナトリウムアミド、炭酸ナトリウム、炭酸カリウム、ナトリウムメトキシド、ナトリウムエトキシド、カリウム−tert−ブトキシド、水酸化ナトリウム、水酸化カリウム等のアルカリ金属塩基、メチルアミン、エチルアミン、プロピルアミン、ジメチルアミン、ジエチルアミン等の有機アミン類又はアンモニアを用いることができる。塩基の使用量に特に制限はないものの、反応基質(1ac)に対して1当量以上用いて反応を実施することにより、収率よく目的物(1ad)を得ることができる。本反応は溶媒中で行なうことが好ましく、反応に害を及ぼさない溶媒であれば使用することができる。溶媒としてはジエチルエーテル、THF、DME、ジオキサン等のエーテル系溶媒、アセトン、メチルエチルケトン等のケトン系溶媒、酢酸エチル、酢酸ブチル等のエステル系溶媒、アセトニトリル、プロピオニトリル等のニトリル類、ベンゼン、トルエン、キシレン、クロロベンゼン等の芳香族炭化水素系溶媒、DMF、N−メチルピロリドン等のアミド類、DMSO、水又はこれらの混合溶媒が例示でき、中でも収率がよい点で、DMFを用いるのが好ましい。また、塩基としてアンモニアを用い、使用する溶媒として水とエタノールの混合溶媒を用いて実施しても収率がよい点で好ましい。また、反応温度については特に制限はないが、0℃から150℃の範囲から適宜選ばれた温度で反応させることにより目的物を得ることができ、収率がよい点で0℃から100℃の範囲で反応させることが好ましい。反応終了後は、通常の後処理操作により目的物を得ることができるが、必要であればカラムクロマトグラフィー又は再結晶等の方法により精製することもできる。
【0069】
製造方法4
【0070】
【化18】

(式中、R1、R2、Ar及びnは前記と同じ意味を表す。)
製造方法4は5−ヒドロキシアルキルチアゾール誘導体(1ab)のヒドロキシ基を酸化し、5−ホルミルアルキルチアゾール誘導体(1ae)を製造する方法である。本反応は一般的な酸化反応を行なうことによって容易に目的物を得ることができ、酸化剤としては、ピリジニウムクロロクロマート、ピリジニウムジクロロクロマート、二酸化マンガン、過マンガン酸カリウム等があげられる。また、Swern酸化、Corey−Kim酸化、Dess−Martin酸化、向山酸化、Oppenauer酸化、TEMPO酸化、パラジウム錯体を用いた酸素酸化等の酸化反応によっても容易に目的物を得ることができるが、収率がよい点でSwern酸化を用いることが好ましい。本反応は溶媒中で行なうことが好ましく、反応に害を及ぼさない溶媒であれば使用することができる。溶媒としてはジクロロメタン、クロロホルム、1,2−ジクロロエタン等のハロゲン系溶媒、ジエチルエーテル、THF、DME、ジオキサン等のエーテル系溶媒、アセトン、メチルエチルケトン等のケトン系溶媒、酢酸エチル、酢酸ブチル等のエステル系溶媒、アセトニトリル、プロピオニトリル等のニトリル類、ベンゼン、トルエン、キシレン、クロロベンゼン等の芳香族炭化水素系溶媒、DMF、N−メチルピロリドン等のアミド類、DMSO、水又はこれらの混合溶媒が例示でき、中でも収率がよい点で、ジクロロメタン、クロロホルム、1,2−ジクロロエタン等のハロゲン系溶媒を用いるのが好ましい。反応温度については特に制限はないが、−78℃から150℃の範囲から適宜選ばれた温度で反応させることにより目的物を得ることができる。反応終了後は、通常の後処理操作により目的物を得ることができるが、必要であればカラムクロマトグラフィー又は再結晶等により精製することもできる。
【0071】
製造方法5
【0072】
【化19】

(式中、R1、R2、Ar及びnは前記と同じ意味を表す。)
製造方法5はチアゾール誘導体(1aa)を塩基で処理し、5−アミノキシアルキルチアゾール誘導体(1aaa)を製造する方法である。塩基としては、水素化ナトリウム、ナトリウムアミド、炭酸ナトリウム、炭酸カリウム、ナトリウムメトキシド、ナトリウムエトキシド、カリウム−tert−ブトキシド、水酸化ナトリウム、水酸化カリウム等のアルカリ金属塩基、メチルアミン、エチルアミン、ジメチルアミン等の有機アミン類、ヒドラジン類を用いることができ、収率がよい点でヒドラジン又はメチルアミンが好ましい。塩基の使用量は反応基質(1aa)に対して2当量以上用いて反応を実施することにより、収率よく目的物(1aaa)を得ることができる。本反応は溶媒中で行なうことが好ましく、反応に害を及ぼさない溶媒であれば使用することができる。溶媒としてはジエチルエーテル、THF、DME、ジオキサン等のエーテル系溶媒、アセトン、メチルエチルケトン等のケトン系溶媒、酢酸エチル、酢酸ブチル等のエステル系溶媒、アセトニトリル、プロピオニトリル等のニトリル類、ベンゼン、トルエン、キシレン、クロロベンゼン等の芳香族炭化水素系溶媒、DMF、N−メチルピロリドン等のアミド系溶媒、メタノール、エタノール、イソプロピルアルコール等のアルコール系溶媒、DMSO、水又はこれらの混合溶媒が例示でき、中でも収率がよい点や後処理が簡便である点で、メタノールやエタノール等のアルコール系溶媒を用いることが好ましい。反応温度については特に制限はないが、0℃から150℃の範囲から適宜選ばれた温度で反応させることにより目的物を得ることができる。反応終了後は、通常の後処理操作により目的物を得ることができるが、必要であればカラムクロマトグラフィー又は再結晶等の方法により精製することもできる。
【発明の効果】
【0073】
本発明のチアゾール誘導体固定化マトリックスは、タンパク質、特に免疫グロブリンの分析および精製に有用な耐久性に富む選択的な吸脱着剤となることから医療用タンパク質、特に免疫グロブリンの工業的な精製において極めて有用である。
【図面の簡単な説明】
【0074】
【図1】チアゾール誘導体固定化HiTrapカラムを用いた免疫グロブリンのクロマトグラフィー結果(化合物75の結果)。
【図2】チアゾール誘導体固定化ビニルポリマーゲルを用いた免疫グロブリンのクロマトグラフィー結果(化合物95の結果)。
【図3】チアゾール誘導体固定化ビニルポリマーゲルを用いた免疫グロブリンのクロマトグラフィー結果(化合物110の結果)。
【実施例】
【0075】
以下、実施例及び参考例により本発明をさらに詳細に説明するが、本発明がこれらに限定されるものではない。
【0076】
参考例1 チアゾール誘導体の合成
(合成例1)
【0077】
【化20】

N−[(5−オキソヘキサン−1−イル)オキシ]フタルイミド(1.0g,3.83mmol)のTHF(15mL)溶液に臭化銅(II)(1.71g,7.66mmol)を加え、2時間加熱還流した。反応液をセライト濾過により固体を瀘別し、濾液の溶媒を減圧留去して油状物を得た。得られた油状物をDMF(20mL)に溶解し、3,4−ジメトキシベンゾイルチオウレア(0.92g,3.83mmol)を加え、80℃で8時間反応させた。反応終了後、溶媒を減圧留去して得られた粗生成物に1M塩酸(30mL)と酢酸エチル(30mL)を加え固体を析出させた。固体を瀘別し、酢酸エチルとエーテルによって充分洗浄し、灰色固体の3,4−ジメトキシ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミド(0.57g,31%)を得た。
m.p.211℃;1H−NMR(CDCl3,TMS,ppm):δ 2.10(m,2H),2.51(s,3H),3.13(t,J=7.5Hz,2H),3.97(s,3H),4.04(s,3H),4.26(t,J=7.5Hz,2H),7.02(d,J=7.5Hz,1H),7.76から7.88(m,5H),7.99(dd,J=2.5Hz and 7.5Hz,1H)。アミドのプロトンは帰属できなかった。
【0078】
(合成例2)
合成例1と同様にして、3−フルオロ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]−4−メチルベンズアミドを合成した。
灰色固体、46%;m.p.135から137℃;1H−NMR(CDCl3,TMS,ppm):δ 2.04(tt,J=7.5 and 7.5Hz,2H),2.15(s,3H),2.35(d,JHF=1.8Hz,3H),2.99(t,J=7.5Hz,2H),4.22(t,J=7.5Hz,2H),7.28(dd,J=7.5 and 10Hz,1H).7.73から7.88(m,6H)。アミドのプロトンは帰属できなかった。
【0079】
(合成例3)
合成例1と同様にして、2−クロロ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミドを合成した。
白色固体、39%;m.p.175から178℃;1H−NMR(CDCl3,TMS,ppm):δ 2.03(tt,J=7.5 and 7.5Hz,2H),2.19(s,3H),2.97(t,J=7.5Hz,2H),4.24(t,J=7.5Hz,2H),7.32から7.49(m,3H),7.73から7.87(m,5H)。アミドのプロトンは帰属できなかった。
【0080】
(合成例4)
合成例1と同様にして、3−クロロ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミドを合成した。
淡黄色固体、53%;m.p.147から155℃;1H−NMR(CDCl3,TMS,ppm):δ 2.03(tt,J=7.5 and 7.5Hz,2H),2.15(s,3H),2.99(t,J=7.5Hz,2H),4.24(t,J=7.5Hz,2H),7.38(dd,J=7.5 and 7.5Hz,1H),7.50から7.55(d,J=7.5Hz,1H),7.72から7.99(m,6H)。アミドのプロトンは帰属できなかった。
【0081】
(合成例5)
合成例1と同様にして、N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]−4−ヨードベンズアミドを合成した。
淡黄色固体,29%;m.p.192から200℃;1H−NMR(CDCl3,TMS,ppm):δ 2.03(tt,J=7.5 and 7.5Hz,2H),2.18(s,3H),2.99(t,J=7.5Hz,2H),4.23(t,J=7.5Hz,2H),7.60(d,J=7.5Hz,2H),7.74から7.77(d,J=7.5Hz,2H),7.82から7.87(m,4H)。アミドのプロトンは帰属できなかった。
【0082】
(合成例6)
合成例1と同様にして、N−[4−メチル−5−{7−(フタルイミドオキシ)ヘプチル}チアゾール−2−イル]−4−メチルベンズアミドを合成した。
黄色固体、58%;m.p.95から99℃;1H−NMR(CDCl3,TMS,ppm):δ 1.35から1.44(m,4H),1.44から1.57(m,2H),1.57から1.70(m,2H),1.74から1.84(m,2H),2.08(s,3H),2.42(s,3H),2.65(t,J=7.5Hz,2H),4.17(t,J=7.5Hz,2H),7.26(d,J=7.5Hz,2H),7.72から7.85(m,6H)。アミドのプロトンは帰属できなかった。
【0083】
(合成例7)
合成例1と同様にして、4−シクロプロピル−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミドを合成した。
茶色固体;m.p.181から182℃;1H−NMR(CDCl3,TMS,ppm):δ 0.78から0.85(m,2H),1.07から1.14(m,2H),1.94から2.01(m,1H),2.05から2.15(m,2H),2.51(s,3H),3.13(t,J=7.5Hz,2H),4.26(t,J=5.0Hz,2H),7.23(d,J=7.5Hz,2H),7.74から7.88(m,4H),8.19(d,J=7.5Hz,2H)。アミドのプロトンは帰属できなかった。
【0084】
(合成例8)
合成例1と同様にして、4−エトキシ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミドを合成した。
白色固体;m.p.151から154℃;1H−NMR(CDCl3,TMS,ppm):δ 1.46(t,3H),2.10(m,2H),2.51(s,3H),3.12(t,J=7.5Hz,2H),4.13(q,J=7.5Hz,2H),4.26(t,J=7.5Hz,2H),7.03(d,J=7.5Hz,2H),7.76から7.88(m,4H),8.27(d,J=7.5Hz,2H)。アミドのプロトンは帰属できなかった。
【0085】
(合成例9)
合成例1と同様にして、3−エトキシ−4−メトキシ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミドを合成した。
白色固体;m.p.81から88℃;1H−NMR(CDCl3,TMS,ppm):δ 1.48(t,J=7.5Hz,3H),2.06から2.17(m,2H),2.21(s,3H),3.02(t,J=7.5Hz,2H),3.94(s,3H),4.13(q,J=7.5Hz,2H),4.26(t,J=7.5Hz,2H),6.92(d,1H),7.44から7.50(m,2H),7.73から7.87(m,4H)。アミドのプロトンは帰属できなかった。
【0086】
(合成例10)
合成例1と同様にして、4−メチル−3−メトキシ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミドを合成した。
白色固体;m.p.125℃;1H−NMR(CDCl3,TMS,ppm):δ 2.03から2.18(m,2H),2.18(s,3H),2.27(s,3H),3.02(t,J=7.5Hz,2H),3.86(s,3H),4.26(t,J=7.5Hz,2H),7.22(d,J=7.5Hz,1H),7.39(dd,J=2.5 and 7.5Hz,1H),7.48(s,1H),7.73から7.87(m,4H)。アミドのプロトンは帰属できなかった。
【0087】
(合成例11)
合成例1と同様にして、N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ナフタレン−1−カルボキサミドを合成した。
黄色固体、6.3%;m.p.150から152℃;1H−NMR(CDCl3,TMS,ppm):δ 1.83(s,3H),2.01(tt,J=7.5 and 7.5Hz,2H),2.93(t,J=7.5Hz,2H),4.23(t,J=7.5Hz,2H),7.43から7.62(m,3H),7.73から7.81(m,3H),7.83から7.91(m,3H),8.00(dd,J=2.5 and 7.5Hz,1H),8.44(dd,J=2.5 and 7.5Hz,1H)。アミドのプロトンは帰属できなかった。
【0088】
(合成例12)
合成例1と同様にして、N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]チオフェン−2−カルボキサミドを合成した。
灰色固体、42%;m.p.153から155℃;1H−NMR(CDCl3,TMS,ppm):δ 2.03(tt,J=7.5 and 7.5Hz,2H),2.53(s,3H),3.11(t,J=7.5Hz,2H),4.24(t,J=7.5Hz,2H),7.23(d,J=4.8Hz,1H),7.75から7.80(m,3H),7.83から7.89(m,2H),8.49(d,J=7.5Hz,1H)。アミドのプロトンは帰属できなかった。
【0089】
(合成例13)
合成例1と同様にして、N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]フラン−2−カルボキサミドを合成した。
灰色固体、31%;m.p.220から223℃;1H−NMR(CDCl3,TMS,ppm):δ 2.03(tt,J=7.5 and 7.5Hz,2H),2.53(s,3H),3.11(t,J=7.5Hz,2H),4.24(t,J=7.5Hz,2H),6.62から6.67(m,1H),7.73から7.80(m,4H),7.83から7.89(m,2H)。アミドのプロトンは帰属できなかった。
【0090】
(合成例14)
【0091】
【化21】

3,4−ジメトキシ−N−[4−メチル−5−{3−(フタルイミドオキシ)プロピル}チアゾール−2−イル]ベンズアミド(0.47g,0.98mmol)のアセトニトリル(7.8mL)と水(0.8mL)の混合溶液に、ヘキサカルボニルモリブデン(0.26g,0.98mmol)とトリエチルアミン(2.05mL,14.7mmol)を加え、2時間加熱還流した。反応終了後、反応混合物に1M塩酸(100mL)を加え酢酸エチル(100mL)で2回抽出し、有機層を合わせて飽和食塩水(300mL)で2回洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製することで、白色固体のN−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}−3,4−ジメトキシ−ベンズアミド(0.21g,63%)を得た。
白色固体;m.p.131℃;1H−NMR(CDCl3,TMS,ppm):δ 1.84から1.94(m,2H),2.04(s,3H),2.80(t,J=7.5Hz, 2H),3.71(t,J=7.5Hz,2H),3.86(s,3H),3.94(s,3H),6.90(dd,J=2.5Hz and 7.5Hz,1H),7.50から7.53(m,2H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0092】
(合成例15)
合成例14と同様にして、3−フルオロ−N−{5−(3−ヒドロキシフタルイミドプロピル)−4−メチルチアゾール−2−イル}−4−メチルベンズアミドを合成した。
白色固体、59%;m.p.142から150℃;1H−NMR(CDCl3,TMS,ppm):δ 1.83(tt,J=7.5 and 7.5Hz,2H),2.09(s,3H),2.32(d,JHF=1.8Hz,3H),2.78(t,J=7.5Hz,2H),3.69(t,J=7.5Hz,2H),7.22(dd,J=10 and 10Hz,1H),7.57から7.61(m,2H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0093】
(合成例16)
合成例14と同様にして、2−クロロ−N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}ベンズアミドを合成した。
黄色粘張性、46%;1H−NMR(CDCl3,TMS,ppm):δ 1.82(tt,J=7.5 and 7.5Hz,2H),2.04(s,3H),2.77(t,J=7.5Hz,2H),3.68(t,J=7.5Hz,2H),7.34から7.47(m,3H),7.78(dd,J=1.8 and 7.5Hz,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0094】
(合成例17)
合成例14と同様にして、3−クロロ−N−{5−(3−ヒドロキシフタルイミドプロピル)−4−メチルチアゾール−2−イル}ベンズアミドを合成した。
白色固体、54%;m.p.114から117℃;1H−NMR(CDCl3,TMS,ppm):δ 1.81(tt,J=7.5 and 7.5Hz,2H),2.10(s,3H),2.79(t,J=7.5Hz,2H),3.69(t,J=7.5Hz,2H),7.39(dd,J=8.0 and 8.0Hz,1H),7.47(ddd,J=1.8, 1.8 and 8.0Hz,1H),7.82(ddd,J=1.8, 1.8 and 8.0Hz,1H),7.93(dd,J=1.8 and 1.8Hz,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0095】
(合成例18)
合成例14と同様にして、N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}−4−ヨードベンズアミドを合成した。
黄色粘稠性、55%;1H−NMR(CDCl3,TMS,ppm):δ 1.86(tt,J=7.5 and 7.5Hz,2H),2.03(s,3H),2.78(t,J=7.5Hz,2H),3.69(t,J=7.5Hz,2H),7.62(d,J=7.5Hz,2H),7.79(d,J=7.5Hz,2H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0096】
(合成例19)
合成例14と同様にして、4−シクロプロピル−N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}ベンズアミドを合成した。
白色固体;m.p.118℃;1H−NMR(CDCl3,TMS,ppm):δ 0.74から0.81(m,2H),1.03から1.11(m,2H),1.84から1.97(m,3H),2.11(s,3H),2.81(t,J=7.5Hz,2H),3.71(t,J=7.5Hz,2H),7.15(d,J=7.5Hz,2H),7.79(d,J=7.5Hz,2H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0097】
(合成例20)
合成例14と同様にして、N−{5−(7−ヒドロキシヘプチル)−4−メチルチアゾール−2−イル}−4−メチルベンズアミドを合成した。
白色固体、32%;m.p.135から145℃;1H−NMR(CDCl3,TMS,ppm):δ 1.00から1.39(m,6H),1.50から1.67(m,4H),2.19(s,3H),2.42(s,3H),2.65(t,J=7.5Hz,2H),3.62(t,J=7.5Hz,2H),7.29(d,J=7.5Hz,2H),7.86(d,J=7.5Hz,2H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0098】
(合成例21)
合成例14と同様にして、N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}−3−メトキシ−4−メチルベンズアミドを合成した。
白色固体;m.p.124から127℃;1H−NMR(CDCl3,TMS,ppm):δ 1.82から1.92(m,5H),2.25(s,3H),2.77(t,J=7.5Hz,2H),3.70(t,J=7.5Hz,2H),3.77(s,3H),7.16(d,J=7.5Hz,1H),7.39(d,J=7.5Hz,1H),7.40(s,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0099】
(合成例22)
合成例14と同様にして、4−エトキシ−N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}ベンズアミドを合成した。
白色固体;m.p.149から153℃;1H−NMR(CDCl3,TMS,ppm):δ 1.44(t,J=7.5Hz,3H),1.83から1.94(m,2H),2.06(s,3H),2.80(t,J=7.5Hz,2H),3.71(t,J=7.5Hz,2H),4.09(q,J=7.5Hz,2H),6.93(d,J=10.0Hz,2H),7.88(d,J=10.0Hz,2H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0100】
(合成例23)
合成例14と同様にして、3−エトキシ−N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}−4−メトキシベンズアミドを合成した。
白色固体;m.p.143から144℃;1H−NMR(CDCl3,TMS,ppm):δ 1.45(t,J=7.0Hz,3H),1.83から1.94(m,2H),1.98(s,3H),2.79(t,J=7.5Hz,2H),3.70(t,J=6.25Hz,2H),3.93(s,3H),4.03(q,J=7.0Hz,2H),6.89(d,J=7.5Hz,1H),7.48(s,1H),7.50(d,J=7.5Hz,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0101】
(合成例24)
合成例14と同様にして、N−{5−(3−ヒドロキシフタルイミドプロピル)−4−メチルチアゾール−2−イル}ナフタレン−2−カルボキサミドを合成した。
黄色粘張性、62%;1H−NMR(CDCl3,TMS,ppm):δ 1.74(s,3H),1.81(tt,J=7.5 and 7.5Hz,2H),2.71(t,J=7.5Hz,2H),3.67(t,J=7.5Hz,2H),7.43から7.61(m,3H),7.74(dd,J=1.0 and 7.0Hz,1H),7.86から7.91(m,1H),7.99(dd,J=1.0 and 7.0Hz,1H),8.44から8.49(m,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0102】
(合成例25)
合成例14と同様にして、N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}チオフェン−2−カルボキサミドを合成した。
黄色粘稠性、21%;m.p.142から150℃;1H−NMR(CDCl3,TMS,ppm):δ 1.83(tt,J=7.5 and 7.5Hz,2H),2.20(s,3H),2.78(t,J=7.5Hz,2H),3.69(t,J=7.5Hz,2H),7.10から7.14(m,1H),7.57から7.62(m,1H),7.73から7.75(m,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0103】
(合成例26)
合成例14と同様にして、N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}フラン−2−カルボキサミドを合成した。
黄色粘稠性、13%;1H−NMR(CDCl3,TMS,ppm):δ 1.83(tt,J=7.5 and 7.5Hz,2H),2.26(s,3H),2.79(t,J=7.5Hz,2H),3.68(t,J=7.5Hz,2H),6.57から6.59(m,1H),7.38(dd,J=1.0 and 3.3Hz,1H),7.55から7.60(m,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0104】
(合成例27) N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}−4−メチル−N−メチルベンズアミドの合成
【0105】
【化22】

N−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}−4−メチル−N−メチルベンズアミド(300mg,1.03mmol)のDMF(5mL)溶液に、ヨウ化メチル(176mg,1.24mmol)と炭酸カリウム(171mg,1.24mmol)を加え、室温で12時間反応させた。反応終了後、反応混合物に1M塩酸(20mL)を加え酢酸エチル(20mL)で2回抽出し、有機層を合わせて飽和食塩水(30mL)で2回洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製することで、白色固体のN−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}−4−メチル−N−メチルベンズアミド(46mg,15%)を得た。
白色固体;m.p.164から166℃;1H−NMR(CDCl3,TMS,ppm):δ 1.77から1.88(m,2H),2.18(s,3H),2.39(s,3H),2.70(t,J=7.5Hz,2H),3.65(t,J=7.5Hz,2H),3.74(s,3H),7.22(d,J=7.5Hz,2H),8.20(d,J=7.5Hz,2H)。ヒドロキシ基のプロトンは帰属できなかった。
【0106】
(合成例28)
合成例14と同様にして、N−{5−(3−アセトキシプロピル)−4−メチルチアゾール−2−イル}−4−メチルベンズアミドを合成した。
茶褐色油状:1H−NMR(CDCl3,TMS,ppm):δ 1.90から2.01(m,2H),2.04(s,3H),2.07(s,3H),2.42(s,3H),2.78(t,J=7.5Hz,2H),4.09(t,J=7.5Hz,2H),7.28(d,J=7.5Hz,2H),7.81(d,J=7.5Hz,2H)。アミドのプロトンは帰属できなかった。
【0107】
(合成例29) 2,4−ジフルオロ−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}ベンズアミドの合成
【0108】
【化23】

[5−{3−(アセトキシ)プロピル}チアゾール−2−イル]−2,4−ジフルオロベンズアミド(512mg,1.44mmol)のエタノール(5mL)溶液に、炭酸カリウム(597mg,4.32mmol)を加え、30分加熱還流した。反応終了後、反応混合物に1M塩酸(20mL)を加え酢酸エチル(20mL)で2回抽出し、有機層を合わせて飽和食塩水(30mL)で2回洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製することで、黄色固体の2,4−ジフルオロ−{5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル}ベンズアミド(94mg,21%)を得た。
黄色油状;1H−NMR(CDCl3,TMS,ppm):δ 1.84から1.93(m,2H),2.25(s,3H),2.83(t,J=7.5Hz,2H),3.71(t,J=7.5Hz,2H),6.91から7.10(m,2H),8.12から8.22(m,1H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0109】
(合成例30)
合成例14と同様にして、O−エチル−S−3−[2−(4−ヨードベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートを合成した。
黄色粘稠性、35%;1H−NMR(CDCl3,TMS,ppm):δ 1.39(t,J=7.5Hz,3H),1.98(tt,J=7.5 and 7.5Hz,2H),2.20(s,3H),2.80(t,J=7.5Hz,2H),3.13(t,J=7.5Hz,2H),4.61(q,J=7.5Hz,2H),7.67(d,J=8.8Hz,2H),7.85(d,J=8.8Hz,2H)。アミドのプロトンは帰属できなかった。
【0110】
(合成例31)
合成例14と同様にして、O−エチル−S−3−[2−(4−ブロモベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートを合成した。
黄色固体、53%;m.p.76から80℃;1H−NMR(CDCl3,TMS,ppm):δ 1.39(t,J=7.5Hz,3H),1.98(tt,J=7.5 and 7.5Hz,2H),2.02(s,3H),2.79(t,J=7.5Hz,2H),3.13(t,J=7.5Hz,2H),4.61(q,J=7.5Hz,2H),7.59(d,J=7.5Hz,2H),7.74(d,J=7.5Hz,2H)。アミドのプロトンは帰属できなかった。
【0111】
(合成例32)
合成例14と同様にして、O−エチル−S−3−[2−(2,4−ジフルオロベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートを合成した。
褐色油状物;1H−NMR(CDCl3,TMS,ppm):1.42(t,J=7.5Hz,3H),1.99から2.10(m,2H),2.28(s,3H),2.84(t,J=7.5Hz,2H),3.17(t,J=7.5Hz,2H),4.65(q,J=7.5Hz,2H),6.92から7.00(m,1H),7.01から7.12(m,1H),8.19から8.29(m,1H),9.69(br s,1H)。
【0112】
(合成例33)
合成例14と同様にして、O−エチル−S−3−[2−(4−エトキシベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートを合成した。
褐色油状物;1H−NMR(CDCl3,TMS,ppm):δ 1.39から1.48(m,6H),1.98から2.09(m,2H),2.16(s,3H),2.82(t,J=7.5Hz,2H),3.16(t,J=7.5Hz,2H),4.10(q,J=7.5Hz,2H),4.65(q,J=7.5Hz,2H),6.96(d,J=7.5Hz,2H),7.90(d,J=7.5Hz,2H)。
【0113】
(合成例34)
合成例14と同様にして、O−エチル−S−3−[2−(3−エトキシ−4−メトキシベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートを合成した。
褐色粘稠性;1H−NMR(CDCl3,TMS,ppm):δ 1.42から1.51(m,6H),2.01から2.12(m,2H),2.12(s,3H),2.82(t,J=7.5Hz,2H),3.16(t,J=7.5Hz,2H),3.94(s,3H),4.11(q,J=7.5Hz,2H),4.65(q,J=7.5Hz,2H),6.91(d,J=7.5Hz,1H),7.47(dd,J=2.5 and 7.5Hz,1H),7.49(d,J=2.5Hz,1H)。アミドのプロトンは帰属できなかった。
【0114】
(合成例35) O−エチル−S−3−[2−(4−クロロベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートの合成
【0115】
【化24】

O−エチル−S−3−(2−アミノ−4−メチルチアゾール−5−イル)プロピルジチオカーボネート(0.70g,2.53mmol)のクロロホルム(10mL)溶液に氷冷下4−クロロベンゾイルクロリド(0.42mL,3.29 mmol)を滴下した。次いでトリエチルアミン(0.5mL,7.98mmol)のクロロホルム(5mL)溶液を加え、一晩反応させた。反応終了後、反応混合物を1M塩酸(20mL)で2回洗浄し、飽和食塩水(20mL)で2回洗浄して、有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製し、O−エチル−S−3−[2−(4−クロロベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートの白色固体(0.329g,31%)を得た。
白色固体;1H−NMR(CDCl3,TMS,ppm):δ 1.42(t,J=7.5Hz,3H),1.99から2.05(m,5H),2.81(t,J=7.5Hz,2H),3.16(t,J=7.5Hz,2H),4.65(q,J=7.5Hz,2H),7.43(d,J=7.5Hz,2H),7.83(d,J=7.5Hz,2H),11.18(br s,1H)。
【0116】
(合成例36) O−エチル−S−3−[2−(4−メチルベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネートの合成
【0117】
【化25】

O−エチル−S−5−オキシヘキシルチオカーボネート(2.0g,9.08mmol)のTHF(20mL)溶液に臭化銅(II)(3.85g,17.3mmol)を加え1時間加熱還流したところ白色の沈澱物が生成した。沈澱物をろ過し、ろ液をエバポレーターで減圧濃縮し、黄色の油状物を得た。この油状物にエタノール(50mL)とN−4−メチルベンゾイルチオウレア(1.76g,9.08mmol)を加え、80℃で8時間反応させた。反応終了後、沈澱物をろ過し、クロロホルム(20mL)とエタノール(20mL)の混合溶媒で洗浄した。ろ液を合わせて減圧留去し、得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製し、褐色油状のO−エチル−S−3−[2−(4−メチルベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルチオカーボネート(0.436g,12%)を得た。
褐色油状物;1H−NMR(CDCl3,TMS,ppm):1.42(t,J=7.5Hz,3H),2.01から2.09(m,5H),2.42(s,3H),2.81(t,J=7.5Hz,2H),3.16(t,J=7.5Hz,2H),4.65(q,J=7.5Hz,2H),7.26(d,J=7.5Hz,2H),7.79(d,J=7.5Hz,2H)。アミドのプロトンは帰属できなかった。
【0118】
(合成例37) S−3−(2−アミノ−4−メチルチアゾール5−イル)−O−エチルプロピルジチオカーボネートの合成
【0119】
【化26】

O−エチル−S−5−オキシヘキシルチオカーボネート(4.0g,18.2mmol)のTHF(40mL)溶液に臭化銅(II)(7.70g,34.6mmol)を加え1.5時間加熱還流したところ白色の沈澱物が生成した。沈澱物をろ過し、ろ液をエバポレーターで減圧濃縮し、黄色の油状物を得た。この油状物にエタノール(40mL)とチオウレア(1.38g,18.2mmol)を加え、80℃で8時間反応させた。反応終了後、溶媒を減圧留去し,反応混合物に1M塩酸(30mL)を加え酢酸エチル(50mL)で2回抽出し、有機層を合わせて飽和食塩水(30mL)で2回洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製し、得られた白色固体を少量の酢酸エチル/エタノールの混合溶媒で洗浄することによって、白色固体のO−エチル−S−3−(2−アミノ−4−メチルチアゾール−5−イル)プロピルジチオカーボネート(1.56g,31%)を得た。
1H−NMR(CDCl3,TMS,ppm):δ 1.43(t,J=7.5Hz,3H),1.82から2.02(m,2H),2.24(s,3H),2.68(t,J=7.5Hz,2H),3.15(t,J=7.5Hz,2H),4.65(q,J=7.5Hz,2H),8.65(br s,2H)。
【0120】
(合成例38) 4−クロロ−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドの合成
【0121】
【化27】

O−エチル−S−3−[2−(4−クロロベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネート(0.08g,0.241mmol)のエタノール(1mL)溶液に28%アンモニア水(0.8mL)を加え常温で一晩反応させた。反応終了後、4M塩酸(10mL)を加え、酢酸エチル(20mL)で抽出し、有機相を飽和食塩水(20mL)で洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製し、4−クロロ−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドの白色固体(0.043g,55%)を得た。
白色固体;m.p.180から183℃;1H−NMR(CDCl3,TMS,ppm):1.99から2.05(m,5H),2.70(t,J=7.5Hz,2H),2.80(t,J=7.5Hz,2H),7.41(d,J=7.5Hz,2H),7.82(d,J=7.5Hz,2H),10.8(br s,1H)。メルカプト基のプロトンは帰属できなかった。
【0122】
(合成例39)
合成例38と同様にして、2,4−ジフルオロ−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドを合成した。
褐色固体;m.p.151から155℃;1H−NMR(CDCl3,TMS,ppm):δ 1.98から2.14(m,2H),2.26(s,3H),2.72(t,J=7.5Hz,2H),2.84(t,J=7.5Hz,2H),6.91から7.00(m,1H),7.03から7.11(m,1H),8.15から8.27(m,1H),9.88(br s,1H)。メルカプト基のプロトンは帰属できなかった。
【0123】
(合成例40)
合成例38と同様にして、4−エトキシ−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドを合成した。
褐色固体;m.p.180から183℃;1H−NMR(CDCl3,TMS,ppm):δ 1.44(t,J=7.5Hz,3H),2.07から2.14(m,2H),2.17(s,3H),2.70(t,J=7.5Hz,2H),2.80(t,J=7.5Hz,2H),4.09(q,J=7.5Hz,2H),6.93(d,J=7.5Hz,2H),7.87(d,J=7.5Hz,2H)。アミドとメルカプト基のプロトンは帰属できなかった。
【0124】
(合成例41)
合成例38と同様にして、3−エトキシ−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]−4−メトキシベンズアミドを合成した。
白色固体;m.p.89から94℃;1H−NMR(CDCl3,TMS,ppm):δ 1.48(t,J=7.5Hz,3H),1.99から2.10(m,2H),2.16(s,3H),2.71(t,J=7.5Hz,2H),2.81(t,J=7.5Hz,2H),3.93(s,3H),4.12(q,J=7.5Hz,2H),6.90(d,J=7.5Hz,1H),7.45(dd,J=1.0 and 7.5Hz,1H),7.49(d,J=1.0Hz,1H),10.1(br s,1H)。メルカプト基のプロトンは帰属できなかった。
【0125】
(合成例42) N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]−4−メチルベンズアミドの合成
【0126】
【化28】

O−エチル−S−3−[2−(4−メチルベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネート(0.416g,1.05mmol)のエタノール(4mL)溶液に28%アンモニア水(1mL)を加え常温で一晩反応させた。反応終了後、4M塩酸(10mL)を加え、酢酸エチル(20mL)で抽出し、有機相を飽和食塩水(20mL)で洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製し、N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]−4−メチルベンズアミドの白色固体(0.143g,45%)を得た。
白色固体;m.p.180から183℃;1H−NMR(CDCl3,TMS,ppm):δ 1.96から2.14(m,5H),2.42(s,3H),2.70(t,J=7.5Hz,2H),2.80(t,J=7.5Hz,2H),7.28(d,J=7.5Hz,2H),7.79(d,J=7.5Hz,2H),10.2(br s,1H)。メルカプト基のプロトンは帰属できなかった。
【0127】
(合成例43) 4−ヨード−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドの合成
【0128】
【化29】

O−エチル−S−3−[2−(4−ヨードベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネート(0.25g,0.49mmol)のエタノール(2mL)懸濁液に28%アンモニア水(1mL)を加え、室温で一晩撹拌した。反応終了後、反応液に1N塩酸(10mL)と酢酸エチル(10mL)を加えて抽出し、有機層を水(10mL)で洗浄した。得られた有機層に硫酸マグネシウムを加えて乾燥させた後、乾燥剤を濾別し溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製することにより、4−ヨード−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドの淡黄色固体(71%,0.16g)を得た。
m.p.130から140℃;1H−NMR(CDCl3,TMS,ppm):δ 1.99(tt,J=7.5 and 7.5Hz,2H),2.06(s,3H),2.67(t,J=7.5Hz,2H),2.78(t,J=7.5Hz,2H),7.57(d,J=8.8Hz,2H),7.80(d,J=8.8Hz,2H)。メルカプト基のプロトンとアミドのプロトンは帰属できなかった。
【0129】
(合成例44) 4−ブロモ−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドの合成
【0130】
【化30】

O−エチル−S−3−[2−(4−ブロモベンゾイルアミノ)−4−メチルチアゾール−5−イル]プロピルジチオカーボネート(0.30g,0.65mmol)のエタノール(2mL)懸濁液に28%アンモニア水(1mL)を加え、室温で一晩撹拌した。反応終了後、反応液に1N塩酸(10mL)と酢酸エチル(10mL)を加えて抽出し、有機層を水(10mL)で洗浄した。得られた有機層に硫酸マグネシウムを加えて乾燥させた後、乾燥剤を濾別し溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィーで精製することにより、4−ブロモ−N−[5−(3−メルカプトプロピル)−4−メチルチアゾール−2−イル]ベンズアミドの白色固体(60%,0.15g)を得た。
m.p.99から105℃;1H−NMR(CDCl3,TMS,ppm):δ 1.96(tt,J=7.5 and 7.5Hz,2H),2.10(s,3H),2.67(t,J=7.5Hz,2H),2.78(t,J=7.5Hz,2H),7.59(d,J=8.8Hz,2H),7.74(d,J=8.8Hz,2H)。メルカプト基のプロトンとアミドのプロトンは帰属できなかった。
【0131】
(合成例45) 4−シクロプロピル−N−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}−N−メチルチオメチルベンズアミドの合成
【0132】
【化31】

二塩化オキサリル(416mg,3.28mmol)の塩化メチレン(5mL)溶液にDMSO(176mg,1.24mmol)の塩化メチレン(5mL)溶液を加え、−78℃で30分間撹拌した後、4−シクロプロピル−N−{4−メチル−5−(3−ヒドロキシプロピル)チアゾール−2−イル}ベンズアミド(828mg,2.62mmol)のクロロホルム(20mL)溶液を滴下した。30分間撹拌した後に、トリエチルアミンを(1.46g,14.4mmol)を加えて−78℃で3時間反応させた。反応終了後、反応混合物に1M塩酸(40mL)を加え、クロロホルム(10mL)で2回抽出し、有機層を合わせて飽和食塩水(30mL)で2回洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去した。得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製)で精製することで、黄色油状の4−シクロプロピル−N−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミド(251mg,39%)と黄色油状の4−シクロプロピル−N−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}−N−メチルチオメチルベンズアミド(386mg,30%)を得た。
【0133】
4−シクロプロピル−N−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミド;黄色油状;1H−NMR(CDCl3,TMS,ppm):δ 0.74から0.80(m,2H),1.01から1.08(m,2H),1.91から1.98(m,4H),2.78(t,J=7.5Hz,2H),3.01(t,J=7.5Hz,2H),7.11(d,J=10.0Hz,2H),7.78(d,J=10.0Hz,2H),9.82(s,1H)。アミドのプロトンは帰属できなかった。
【0134】
4−シクロプロピル−N−メチルチオメチル−N−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミド;黄色油状:1H−NMR(CDCl3,TMS,ppm):δ 0.72から0.78(m,2H),1.00から1.08(m,2H),1.88から1.96(m,1H),2.14(s,3H),2.30(s,3H),2.78(t,J=7.5Hz,2H),3.01(t,J=7.5Hz,2H),5.24(s,2H),7.12(d,J=7.5Hz,2H),7.44(d,J=7.5Hz,2H),9.81(s,1H)。
【0135】
(合成例46)
合成例45と同様にして、4−メトキシ−3−エトキシ−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミドを合成した。
黄色油状;1H−NMR(CDCl3,TMS,ppm):δ 1.46(t,J=5.0Hz,3H),2.05(s,3H),2.80(t,J=7.5Hz,2H),3.01(t,J=7.5Hz,2H),3.94(s,3H),4.08(q,J=7.5Hz,2H),6.91(d,J=7.5Hz,1H),7.49(d,J=7.5Hz,1H),7.50(s,1H),9.83(s,1H)。アミドのプロトンは帰属できなかった。
【0136】
(合成例47)
合成例45と同様にして、4−メトキシ−3−エトキシ−N−メチルチオメチル−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミドを合成した。
白色固体;m.p.103℃;1H−NMR(CDCl3,TMS,ppm):δ 1.47(t,J=7.5Hz,3H),2.20(s,3H),2.31(s,3H),2.78(t,J=7.5Hz,2H),3.01(t,J=7.5Hz,2H),3.92(s,3H),4.11(q,J=7.5Hz,2H),5.26(s,2H),6.90(d,J=7.5Hz,1H),7.11から7.18(m,2H),9.81(s,1H)。
【0137】
(合成例48)
合成例45と同様にして、4−エトキシ−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミドを合成した。
黄色固体;m.p.110から114℃;1H−NMR(CDCl3,TMS,ppm):δ 1.44(t,J=7.5Hz,3H),2.03(s,3H),2.80(t,J=7.5Hz,2H),3.00(t,J=7.5Hz,2H),4.10(q,J=7.5Hz,2H),6.93(d,J=10.0Hz,2H),7.91(d,J=10.0Hz,2H),9.82(s,1H)。アミドのプロトンは帰属できなかった。
【0138】
(合成例49)
合成例45と同様にして、4−メチル−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミドを合成した。
白色固体;m.p.133から135℃;1H−NMR(CDCl3,TMS,ppm):δ 2.05(s,3H),2.43(s,3H),2.80(t,J=7.5Hz,2H),3.02(t,J=7.5Hz,2H),7.28(d,J=7.5Hz,2H),7.79(d,J=7.5Hz,2H),9.83(s,1H)。アミドのプロトンは帰属できなかった。
【0139】
(合成例50)
合成例45と同様にして、4−メチル−N−メチルチオメチル−{4−メチル−5−(2−ホルミルエチル)チアゾール−2−イル}ベンズアミドを合成した。
白色固体;m.p.93から99℃;1H−NMR(CDCl3,TMS,ppm):δ 2.14(s,3H),2.30(s,3H),2.40(s,3H),2.78(t,J=7.5Hz,2H),3.02(t,J=7.5Hz,2H),5.24(s,2H),7.25(d,J=7.5Hz,2H),7.44(d,J=7.5Hz,2H),9.81(s,1H)。
【0140】
(合成例51) N−[5−(3−アミノキシプロピル)−4−メチルチアゾール−2−イル]−4−メチルベンズアミドの合成
【0141】
【化32】

N−[5−(3−フタルイミドオキシプロピル)−4−メチルチアゾール−2−イル]4−メチルベンズアミド(1.70g、3.90mmol)のエタノール(20mL)溶液に、ヒドラジン一水和物(0.45mL、89.9mmol)を室温にて加え、一晩撹拌した。反応終了後、反応溶液を減圧留去し、得られた混合物を自動設定中圧カラムクロマトグラフィーシステム(山善社製;アミノプロピルシリカゲルを使用)で精製し、N−[5−(3−アミノキシプロピル)−4−メチルチアゾール−2−イル]−4−メチルベンズアミドの淡黄色油状物(0.975g,収率:82%)を得た。
淡黄色油状物;1H−NMR(CDCl3,TMS,ppm):δ 1.84から1.99(m,2H),2.12(s,3H),2.43(s,3H),2.76(t,J=7.5Hz,2H),3.70(t,J=7.5Hz,2H),5.28(br s,2H),7.28(d,J=7.5Hz,2H),7.80(d,J=7.5Hz,2H),10.1(br s,1H)。
【0142】
(合成例52) 8−(2−トルイルアミノ−4−メチルチアゾール−5−イル)オクテン酸の合成
【0143】
【化33】

10−オキソウンデカン酸(1.0g,4.99mmol)のTHF(50mL)溶液に臭化銅(II)(2.23g,9.98mmol)を加え、3時間加熱還流したところ白色の沈澱物が生成した。沈澱物をろ過し、ろ液をエバポレーターで減圧濃縮し、黄色の油状物を得た。この油状物にDMF(20mL)と4−メチルベンゾイルチオウレア(0.775g,3.99mmol)を加え、80℃で12時間反応させた。反応終了後反応混合物に1M塩酸(100mL)を加え酢酸エチル(100mL)で2回抽出し、有機層を合わせて水(200mL)で2回洗浄した。有機層を無水硫酸マグネシウムで乾燥した後、乾燥剤を濾別し溶媒を減圧留去し、固体を析出させた。得られた固体をエーテルで洗浄することによって、白色固体の8−[2−(4−メチルベンゾイル)アミノ−4−メチルチアゾール−5−イル]オクテン酸(0.285g,15%)を得た。
1H−NMR(CDCl3,TMS,ppm):δ 1.30から1.38(m,6H),1.58から1.64(m,4H),2.22(s,3H),2.30(t,J=7.5Hz,2H),2.42(s,3H),2.67(t,J=7.5Hz,3H),7.29(d,J=8.0Hz,2H),7.97(d,J=8.0Hz,2H)。アミドのプロトンとカルボン酸のプロトンは帰属できなかった。
【0144】
(合成例53)
合成例14と同様にして、N−[5−(3−ヒドロキシプロピル)−4−メチルチアゾール−2−イル]−4−メチルベンズアミドを合成した。
灰色固体;m.p.103から105℃;1H−NMR(CDCl3,TMS,ppm):1.83から1.95(m,2H),2.10(s,3H),2.42(s,3H),2.81(t,J=7.5Hz,2H),3.71(t,J=7.5Hz,2H),7.27(d,J=7.5Hz,2H),7.80(d,J=7.5Hz,2H)。アミドのプロトンとヒドロキシ基のプロトンは帰属できなかった。
【0145】
前述の合成方法に準じて、表1から10に記載のチアゾール誘導体を得た。
【0146】
【化34】

【0147】
【表1】

【0148】
【表2】

【0149】
【表3】

【0150】
【表4】

【0151】
【表5】

【0152】
【表6】

【0153】
【表7】

【0154】
【表8】

【0155】
【表9】

【0156】
【表10】

以下の実施例では、本発明のチアゾール誘導体を活性化基含有マトリックスに固定化し、免疫グロブリンの分析又は精製を行なった。なお、化合物番号は表1から10記載の化合物番号に対応する。
【0157】
固定化されたチアゾール誘導体量は、固定化反応に用いた溶液中のチアゾール誘導体量と固定化反応後に回収された溶液(洗浄液を含み、以下、回収液という)中のチアゾール誘導体量を測定し、比較することで算出した。チアゾール誘導体の濃度は、U−2900スペクトロフォトメーター(商品名)(日立製作所製)を用いて前記誘導体の紫外吸収極大波長における吸光度を測定して(以下、吸光度法という)、又は高速液体クロマトグラフィーを用いて前記誘導体の紫外吸収クロマトグラムにおけるピーク面積を測定して(以下、HPLC法という)求めた。HPLC法では、カラムとしてTSK−GEL ODS−80TM(商品名)(東ソー社製)を用い、溶離液としてアセトニトリル/水/トリフルオロ酢酸=45/55/0.05(体積比)(以下、単に溶離液という)を用いた。
【0158】
実施例1 化合物75のアガロースゲルへの固定化(その1)
N−ヒドロキシスクシンイミド(以下、NHSという)で活性化されたアガロースゲルであるHiTrap NHS−activated HPカラム(1mL)(商品名)(GEヘルスケアバイオサイエンス社製、スクシンイミドオキシカルボニル基含量:10μmol/mL(gel)、以下、HiTrapカラムという)を活性化基含有マトリックス充填カラムとして用いた。
【0159】
HiTrapカラムに、まず氷冷した1mM HClを5mL通液した。コハク酸ジヒドラジドを100mMになるように0.5M NaClを含む0.2M炭酸ナトリウム緩衝液(pH8.3)に溶解し、その2mLをHiTrapカラムに通液した。1時間静置後、10mLの0.5M NaClを含む0.2M 炭酸ナトリウム緩衝液(pH8.3)を通液した。次に純水10mLを通液した後、DMSOを5mL通液した。次いで、化合物75を10mMになるようにDMSOに溶解し、その2mLを通液した。2時間静置後、3mLのDMSOを通液した。次にピリジン−ボランのDMSO溶液(20mM)2mLを通液し、14時間静置した後、5mLのDMSOを通液した。最後にカラムに純水10mLを通液することで、化合物75を固定化したゲルを得た。
【0160】
化合物75の固定化量は、カラムに添加した化合物75の量(20μmol)からカラムから回収された化合物75の量を減ずることより算出した。吸光度法(検出波長306nm)によって測定した化合物75の固定化量は7.3μmol/mL(gel)であった。
【0161】
実施例2 化合物75を固定化したアガロースゲルを用いた免疫グロブリンの吸脱着
実施例1に記載の方法にて調製した、化合物75を固定化したHiTrapカラムを、クロマトグラフィー装置であるAKTAprime plus(商品名)(GEヘルスケアバイオサイエンス社製)に取り付け、0.7M硫酸ナトリウムを含む10mMリン酸ナトリウム−10mMクエン酸ナトリウム緩衝液(pH7.5)(以下、緩衝液Aという)を流速1mL/minで通液してカラムを平衡化した。次に緩衝液Aに溶解した1mg/mLヒト血漿由来免疫グロブリン製剤(化血研製)0.5mLをカラムに添加して、緩衝液Aを10mL通液後、緩衝液Aから10mMリン酸ナトリウム−10mMクエン酸ナトリウム緩衝液(pH7.5)への硫酸ナトリウムの濃度勾配クロマトグラフィーを行なった。
【0162】
カラムから溶出された免疫グロブリンの検出は、280nmにおける吸光度を測定することにより行なった。溶出液は1mLずつ分画し、U−2900スペクトロフォトメーター(商品名)(日立製作所製)により各フラクションの280nmにおける吸光度を測定し、それらを合算した値をカラムに添加した免疫グロブリンの280nmにおける吸光度と比較することにより回収率を算出した。クロマトグラフィーの結果を図1に示す。このクロマトグラフィーにおける免疫グロブリンの回収率は100%であった。
【0163】
吸脱着操作後、0.1M水酸化ナトリウムを10mL通液してカラムの再生を行なった。化合物75を固定化したHiTrapカラムは前記再生処理によって初期状態に復帰させることができ、繰り返し使用によってもその特性は変化しなかった。
【0164】
実施例3 化合物75のビニルポリマーゲルへの固定化
TOYOPEARL AF−Amino−650M(商品名)(東ソー社製、アミノ基含量:89μmol/mL(gel))を活性化基含有マトリックスとして用いて化合物75の固定化を行なった。
【0165】
0.1M N−シクロヘキシル−2−アミノエタンスルホン酸(以下、CHESという)−NaOH緩衝液(pH9.0)とアセトニトリルとの混合溶媒(体積比1:1)に化合物75を22mMになるよう溶解し、この溶液9.0mLとTOYOPEARL AF−Amino−650Mゲル2.0mLを混合して振とうした。30分振とう後、ピリジン−ボランを0.11mL(1.1mmol)添加し、更に25℃で16時間振とうし、吸引濾過で固定化反応後のゲルを濾別した。濾別したゲルを5mLのアセトニトリルで5回洗浄することにより、化合物75を固定化したゲルを得た。なお、この濾液と洗浄液とをあわせたものを回収液とした。
【0166】
別途、ピリジン−ボランと化合物75とを含む溶液を溶離液で希釈し、HPLC法で分析したところ、化合物75は還元されて化合物67となっていた。このことに留意して、反応液をHPLC法(検出波長300nm)で分析した。その結果、回収液中に化合物67が90μmol存在することが分かった。すなわち、固定化反応によって消費された化合物75は108μmolであり、化合物75の固定化量は54μmol/mL(gel)であった。
【0167】
実施例4 化合物75のアガロースゲルへの固定化(その2)
EAH Sepharose 4B(商品名)(GEヘルスケアバイオサイエンス社製、アミノ基含量:12μmol/mL(gel))を活性化基含有マトリックスとして用いて化合物75の固定化を行なった。
【0168】
EAH Sepharose 4Bゲル3.2mLに、実施例3と同じ組成からなる化合物75の溶液を5mL加え、更にピリジン−ボランを0.29mL(2.9mmol)加えた後、25℃で8時間振とうした。固定化反応後のゲルを吸引濾過で濾別し、そのゲルを5mLのアセトニトリルで5回洗浄することで、化合物75を固定化したゲルを得た。
【0169】
濾液及び洗浄液をあわせた回収液を実施例3と同じ方法で分析した結果、化合物75の固定化量は27μmol/mL(gel)であった。
【0170】
実施例5 化合物95のビニルポリマーゲルへの固定化
TOYOPEARL AF−Epoxy−650M(商品名)(東ソー社製、エポキシ基含量:50μmol/mL(gel))を活性化基含有マトリックスとして用いて化合物95の固定化を行なった。
【0171】
化合物95(50.6mg)にDMSO(5.5mL)、蒸留水(4.18mL)、1M NaOH水溶液(1.32mL)を添加して、化合物95を15mM含有する溶液を調製した。この溶液10mLとTOYOPEARL AF−Epoxy−650Mゲル3mLを遠沈管中で混合し、40℃で70時間振とうした。反応後、遠沈管を1分間遠心(100×g)し、ゲルと上清を分離した。上清を除いた後、ゲルに10mLのDMSOを添加し撹拌混合後、1分間遠心(100×g)し、ゲルと上清を分離することでゲルの洗浄を行ない、前記操作を3回行なった。反応液上清と洗浄液を混合し、DMSOにより40mLにメスアップしたものを回収液とした。DMSOで洗浄した後のゲルに蒸留水(30mL)を添加し撹拌混合後、1分間遠心(100×g)し、ゲルと上清を分離後、上清を吸引除去した。前記操作を5回行ない、化合物95を固定化したゲルを得た。
【0172】
吸光度法(検出波長348nm)によって測定した化合物95の固定化量は30μmol/mL(gel)であった。
【0173】
実施例6 化合物95を固定化したビニルポリマーゲルを用いた免疫グロブリンの吸脱着
実施例5に記載の方法にて調製した、化合物95を固定化したTOYOPEARL AF−Epoxy−650Mゲル1mLをTRICORNカラム(商品名)(GEヘルスケアバイオサイエンス社製)に充填し、AKTAprime plus(商品名)(GEヘルスケアバイオサイエンス社製)に取り付け、実施例2と同様、0.5mgのヒト血漿由来免疫グロブリン製剤を硫酸ナトリウム濃度勾配のクロマトグラフィーで分離した。クロマトグラフィーの結果を図2に示す。
【0174】
吸脱着操作後、0.1M水酸化ナトリウムを10mL通液してカラムの再生を行なった。化合物95を固定化したエポキシトヨパールゲルはこの再生処理によって初期状態に復帰させることができ、繰り返し使用によってもその特性は変化しなかった。
【0175】
実施例7 化合物95のアガロースゲルへの固定化
Epoxy−activated Sepharose 6B(商品名)(GEヘルスケアバイオサイエンス社製、エポキシ基含量:19から40μmol/mL(gel))を活性化基含有マトリックスとして用いて化合物95の固定化を行なった。
【0176】
70mM水酸化ナトリウムとN,N−ジメチルアセトアミドの混合溶媒(体積比1:1)に化合物95を16mMになるように溶解し、この溶液6.0mLとEpoxy−activated Sepharose 6Bゲル3.1mLを混合して40℃で2時間振とうした。反応後、ゲルを吸引濾過で濾別し、そのゲルを5mLの前記混合溶媒で5回洗浄した。これらの濾液及び洗浄液をあわせて回収液とした。前記混合溶媒で洗浄後のゲルは更に10mLの水で2回洗浄することで、化合物95を固定化したゲルを得た。
【0177】
吸光度法(検出波長305nm)によって測定した化合物95の固定化量は32μmol/mL(gel)であった。
【0178】
実施例8 化合物107のビニルポリマーゲルへの固定化
TOYOPEARL AF−Amino−650M(商品名)(東ソー社製、アミノ基含量:89μmol/mL(gel))を活性化基含有マトリックスとして用いて化合物107の固定化を行なった。
【0179】
脱水DMF(和光純薬社製)に化合物107が21mM、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩が41mM、NHSが42mMになるように溶解し、この溶液15mLとTOYOPEARL AF−Amino−650Mゲル2.1mLを混合して25℃で4日間振とうした。反応後、ゲルを吸引濾過で濾別し、5mLのDMFによる洗浄を5回行なった。この濾液と洗浄液とをあわせて回収液とした。洗浄後のゲルを無水酢酸のDMF溶液(無水酢酸/DMF溶液=1/4(体積比))5mLに懸濁して、25℃で2時間振とうした。次にゲルを吸引濾過、水洗することにより、化合物107を固定化したゲルを得た。
【0180】
吸光度法(検出波長305nm)によって測定した化合物107の固定化量は11μmol/mL(gel)であった。
【0181】
実施例9 化合物110のアガロースゲルへの固定化
HiTrapカラムにDMSOを5mL通液した後、化合物110が10mM、トリエチルアミンが40mMになるようにDMSOに溶解した溶液2mLを通液した。1時間静置後、3mLのDMSOを通液し、未反応の化合物110を除去した。反応に用いた化合物110溶液のカラムからの漏出液と、洗浄に用いたDMSOのカラムからの漏出液をあわせて回収液とした。
【0182】
化合物110の固定化量は、カラムに添加した化合物110の量(20μmol)からカラムから回収された化合物110の量を減ずることより算出した。固定化前に調製した化合物110のDMSO溶液及び回収液を、非特許文献4に記載された方法のうち「B.酸性条件法」に従って適宜希釈し306nmにおける吸光度を測定した。この方法より、HiTrapカラムに固定化された化合物110の量は、2.3μmol/mL(gel)であった。
【0183】
実施例10 化合物110のビニルポリマーゲルへの固定化
TOYOPEARL AF−Formyl−650M(商品名、東ソー社製、ホルミル基含量60μmol/mL(gel))を活性化基含有マトリックスとして用いて化合物110の固定化を行なった。
【0184】
0.1M CHES−NaOH緩衝液(pH9.0)とアセトニトリルとの混合溶媒(体積比1:1)に化合物110を36mMになるように溶解し、この溶液5.8mLとTOYOPEARL AF−Formyl−650Mゲル3.0mLを混合して振とうし、30分後にピリジン−ボラン0.17mL(1.7mmol)を添加して25℃で16時間振とうすることで反応後、ゲルを吸引濾過で濾別し、濾別したゲルを5mLのアセトニトリルで5回洗浄した。前記濾液と洗浄液とをあわせたものを回収液とした。前記洗浄後のゲルは更に10mLの水で2回洗浄することで、化合物110を固定化したゲルを得た。
【0185】
HPLC法(検出波長254nm)によって測定した化合物107の固定化量は40μmol/mL(gel)であった。
【0186】
実施例11 化合物110を固定化したビニルポリマーゲルを用いた免疫グロブリンの吸脱着
実施例10に記載の方法にて調製した、化合物110を固定化したTOYOPEARL AF−Formyl−650Mゲル1mLをTRICORNカラムに充填し、AKTAprime plus(商品名)(GEヘルスケアバイオサイエンス社製)に取り付け、実施例2と同様にして、0.5mgのヒト血漿由来免疫グロブリン製剤を硫酸ナトリウム濃度勾配のクロマトグラフィーで分離した。クロマトグラフィーの結果を図3に示す。
【0187】
吸脱着操作後に0.1M水酸化ナトリウムを10mL通液してカラムの再生を行なった。化合物110を固定化したTOYOPEARL AF−Formyl−650Mゲルはこの再生処理によって初期状態に復帰させることができ、繰り返し使用によってもその特性は変化しなかった。
【特許請求の範囲】
【請求項1】
一般式(1)
【化1】

(式中、R1及びR2は水素原子又は置換されていてもよい炭素数1から6のアルキル基を表し、R3は酸素原子、メチレン基、硫黄原子、カルボニル基又はイミノキシ基(−ONH−)を表し、Arは置換されていてもよい芳香族基を表し、nは1から12の整数を表し、Mはマトリックスを表す。)で表されるチアゾール誘導体固定化マトリックス。
【請求項2】
Arの置換基が、ハロゲン原子、置換されていてもよい炭素数1から6のアルキル基、置換されていてもよい炭素数1から12のアルコキシ基、置換されていてもよい炭素数3から8のシクロアルコキシ基、置換されていてもよい炭素数3から6のアルケニルオキシ基、置換されていてもよい炭素数3から6のアルキニルオキシ基、置換されていてもよい炭素数1から6のアシルオキシ基、置換されていてもよい炭素数1から6のアルキルチオ基、置換されていてもよい炭素数1から6のアルキルスルフィニル基、置換されていてもよい炭素数1から6のアルキルスルホニル基、置換されていてもよい炭素数1から12のアルコキシカルボニル基、カルボキシル基、ニトロ基、置換されていてもよいアミノ基、ヒドロキシ基又はシアノ基である請求項1に記載のチアゾール誘導体固定化マトリックス。
【請求項3】
Arが、ハロゲン原子、置換されていてもよい炭素数1から6のアルキル基、置換されていてもよい炭素数1から12のアルコキシ基、置換されていてもよい炭素数3から8のシクロアルコキシ基、置換されていてもよい炭素数3から6のアルケニルオキシ基、置換されていてもよい炭素数3から6のアルキニルオキシ基、置換されていてもよい炭素数1から6のアシルオキシ基、置換されていてもよい炭素数1から6のアルキルチオ基、置換されていてもよい炭素数1から6のアルキルスルフィニル基、置換されていてもよい炭素数1から6のアルキルスルホニル基、置換されていてもよい炭素数1から12のアルコキシカルボニル基、カルボキシル基、ニトロ基、置換されていてもよいアミノ基、ヒドロキシ基又はシアノ基から選ばれた1つ以上の置換基で置換されていてもよい請求項1に記載のチアゾール誘導体固定化マトリックス。
【請求項4】
一般式(1)
【化2】

(式中、R1及びR2は水素原子又は置換されていてもよい炭素数1から6のアルキル基を表し、R3は酸素原子、メチレン基、硫黄原子、カルボニル基又はイミノキシ基(−ONH−)を表し、Arは置換されていてもよい芳香族基を表し、nは1から12の整数を表し、Mはマトリックスを表す。)においてMのマトリックスがビニル重合体、多糖、金属酸化物であることを特徴とする請求項1から3に記載のチアゾール誘導体固定化マトリックス。
【請求項5】
一般式(1a)
【化3】

(式中、R1及びR2は水素原子又は置換されていてもよい炭素数1から6のアルキル基を表し、Arは置換されていてもよい芳香族基を表し、nは1から12の整数を表し、R4はヒドロキシ基、ホルミル基、メルカプト基、カルボキシル基又はアミノキシ基(−ONH2)を表す。)で示されるチアゾール誘導体と、活性化基含有マトリックスとを反応させることを特徴とする、一般式(1)
【化4】

(式中、R1、R2、Ar、n及びMは前記と同じ意味を表し、R3は酸素原子、メチレン基、硫黄原子、カルボニル基又はイミノキシ基(−ONH−)を表す。)で示されるチアゾール誘導体固定化マトリックスの製造方法。
【請求項6】
活性化基含有マトリックスの活性化基がスクシンイミドオキシカルボニル基、エポキシ基、ホルミル基、アミノ基、ジチオ−2−ピリジル基、ヒドラジノ基、カルボキシル基のいずれかであることを特徴とする請求項5に記載のチアゾール誘導体固定化マトリックスの製造方法。
【請求項7】
一般式(1)
【化5】

(式中、R1及びR2は水素原子又は置換されていてもよい炭素数1から6のアルキル基を表し、R3は酸素原子、メチレン基、硫黄原子、カルボニル基又はイミノキシ基(−ONH−)を表し、Arは置換されていてもよい芳香族基を表し、nは1から12の整数を表し、Mはマトリックスを表す。)で示されるチアゾール誘導体固定化マトリックスを使用し、タンパク質の分析または精製を行なう方法。
【請求項8】
タンパク質が免疫グロブリン、またはこれらの類縁体、フラグメント、融合体であることを特徴とする請求項7に記載の方法。
【請求項9】
免疫グロブリンが免疫グロブリンG(IgG)であることを特徴とする請求項8に記載の方法。
【請求項1】
一般式(1)
【化1】

(式中、R1及びR2は水素原子又は置換されていてもよい炭素数1から6のアルキル基を表し、R3は酸素原子、メチレン基、硫黄原子、カルボニル基又はイミノキシ基(−ONH−)を表し、Arは置換されていてもよい芳香族基を表し、nは1から12の整数を表し、Mはマトリックスを表す。)で表されるチアゾール誘導体固定化マトリックス。
【請求項2】
Arの置換基が、ハロゲン原子、置換されていてもよい炭素数1から6のアルキル基、置換されていてもよい炭素数1から12のアルコキシ基、置換されていてもよい炭素数3から8のシクロアルコキシ基、置換されていてもよい炭素数3から6のアルケニルオキシ基、置換されていてもよい炭素数3から6のアルキニルオキシ基、置換されていてもよい炭素数1から6のアシルオキシ基、置換されていてもよい炭素数1から6のアルキルチオ基、置換されていてもよい炭素数1から6のアルキルスルフィニル基、置換されていてもよい炭素数1から6のアルキルスルホニル基、置換されていてもよい炭素数1から12のアルコキシカルボニル基、カルボキシル基、ニトロ基、置換されていてもよいアミノ基、ヒドロキシ基又はシアノ基である請求項1に記載のチアゾール誘導体固定化マトリックス。
【請求項3】
Arが、ハロゲン原子、置換されていてもよい炭素数1から6のアルキル基、置換されていてもよい炭素数1から12のアルコキシ基、置換されていてもよい炭素数3から8のシクロアルコキシ基、置換されていてもよい炭素数3から6のアルケニルオキシ基、置換されていてもよい炭素数3から6のアルキニルオキシ基、置換されていてもよい炭素数1から6のアシルオキシ基、置換されていてもよい炭素数1から6のアルキルチオ基、置換されていてもよい炭素数1から6のアルキルスルフィニル基、置換されていてもよい炭素数1から6のアルキルスルホニル基、置換されていてもよい炭素数1から12のアルコキシカルボニル基、カルボキシル基、ニトロ基、置換されていてもよいアミノ基、ヒドロキシ基又はシアノ基から選ばれた1つ以上の置換基で置換されていてもよい請求項1に記載のチアゾール誘導体固定化マトリックス。
【請求項4】
一般式(1)
【化2】

(式中、R1及びR2は水素原子又は置換されていてもよい炭素数1から6のアルキル基を表し、R3は酸素原子、メチレン基、硫黄原子、カルボニル基又はイミノキシ基(−ONH−)を表し、Arは置換されていてもよい芳香族基を表し、nは1から12の整数を表し、Mはマトリックスを表す。)においてMのマトリックスがビニル重合体、多糖、金属酸化物であることを特徴とする請求項1から3に記載のチアゾール誘導体固定化マトリックス。
【請求項5】
一般式(1a)
【化3】

(式中、R1及びR2は水素原子又は置換されていてもよい炭素数1から6のアルキル基を表し、Arは置換されていてもよい芳香族基を表し、nは1から12の整数を表し、R4はヒドロキシ基、ホルミル基、メルカプト基、カルボキシル基又はアミノキシ基(−ONH2)を表す。)で示されるチアゾール誘導体と、活性化基含有マトリックスとを反応させることを特徴とする、一般式(1)
【化4】

(式中、R1、R2、Ar、n及びMは前記と同じ意味を表し、R3は酸素原子、メチレン基、硫黄原子、カルボニル基又はイミノキシ基(−ONH−)を表す。)で示されるチアゾール誘導体固定化マトリックスの製造方法。
【請求項6】
活性化基含有マトリックスの活性化基がスクシンイミドオキシカルボニル基、エポキシ基、ホルミル基、アミノ基、ジチオ−2−ピリジル基、ヒドラジノ基、カルボキシル基のいずれかであることを特徴とする請求項5に記載のチアゾール誘導体固定化マトリックスの製造方法。
【請求項7】
一般式(1)
【化5】

(式中、R1及びR2は水素原子又は置換されていてもよい炭素数1から6のアルキル基を表し、R3は酸素原子、メチレン基、硫黄原子、カルボニル基又はイミノキシ基(−ONH−)を表し、Arは置換されていてもよい芳香族基を表し、nは1から12の整数を表し、Mはマトリックスを表す。)で示されるチアゾール誘導体固定化マトリックスを使用し、タンパク質の分析または精製を行なう方法。
【請求項8】
タンパク質が免疫グロブリン、またはこれらの類縁体、フラグメント、融合体であることを特徴とする請求項7に記載の方法。
【請求項9】
免疫グロブリンが免疫グロブリンG(IgG)であることを特徴とする請求項8に記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2011−51934(P2011−51934A)
【公開日】平成23年3月17日(2011.3.17)
【国際特許分類】
【出願番号】特願2009−202469(P2009−202469)
【出願日】平成21年9月2日(2009.9.2)
【出願人】(000173762)公益財団法人相模中央化学研究所 (151)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成23年3月17日(2011.3.17)
【国際特許分類】
【出願日】平成21年9月2日(2009.9.2)
【出願人】(000173762)公益財団法人相模中央化学研究所 (151)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

