2−デオキシグルコース類を用いた肥満予防および肥満改善の方法
【課題】 肥満の原因となる摂取された糖質からの脂質合成や、ダイエットなどにつき物であるグリセロールや遊離脂肪酸による脂質代謝のフィードバック調節を阻害させる、肥満予防および肥満改善の方法を提供する。
【解決手段】 細胞内において糖質代謝を調節する解糖系のヘキソキナーゼを、2−デオキシグルコースやその化合物を用いてアロステリックに阻害させるほか、細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階や、GLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコースやその化合物(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いて阻害させることにより、前記課題を解決させることを特徴とする。
【解決手段】 細胞内において糖質代謝を調節する解糖系のヘキソキナーゼを、2−デオキシグルコースやその化合物を用いてアロステリックに阻害させるほか、細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階や、GLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコースやその化合物(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いて阻害させることにより、前記課題を解決させることを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、2−デオキシグルコース類やその化合物を用いることを特徴とした、肥満予防や肥満改善の方法に関するものである。
【背景技術】
【0002】
従来の2−デオキシグルコース類を用いた先行技術には、フッ素同位体などの放射性物質を用いて、2−デオキシグルコース(2−デオキシ−D−グルコース)を標識することにより、糖輸送・糖利用能・ATP欠乏の影響などの研究や、糖代謝の活発な癌細胞や脳の活動部位などの、局所的な組織の活動状態を画像として反映させ、癌細胞の診断や脳の機能解析などを目的として用いられているものなどがある。
【0003】
また、肥満や糖尿病の症状を改善させることを目的とするものや、加齢・肥満・スポーツなどによって摩耗した軟骨の再生を促し、関節痛や関節炎などの症状を改善させることを目的として、2−アミノ−2−デオキシグルコース(グルコサミン)や、N−アセチル−2−アミノ−2−デオキシグルコース(N−アセチルグルコサミン)などの、2−デオキシグルコース類を用いた先行技術がある。この他、痛風・潰瘍性大腸炎・炎症性消化器疾患などの症状が改善されたとの報告がある。
【0004】
なお、本発明に関連する公知技術として次の特許文献1.2.3.4及び非特許文献1.2.3.4を挙げることができる。
【0005】
【特許文献1】 特開2007−500216号公報。
【特許文献2】 特開WO99/34670号公報。
【特許文献3】 特開2002−154969号公報。
【特許文献4】 特開2005−513078号公報。
【非特許文献1】 「医学書院 医学大辞典」、総編集/伊藤正男・井村裕夫・高久史麿、発行者/株式会社医学書院、発行日/2003年3月1日、第1版第1刷、p1700。
【非特許文献2】 「がんの診断と治療を革新する新しい画像診断」、http://www.antm.or.jp/06koenkai/koenkai02/02_1itoh.pdf。
【非特許文献3】 「改訂増補版 機能性食品素材便覧」、編著者/清水俊雄、発行者/株式会社薬事日報社、発行日/2006年9月25日、第1刷、p200、p213〜p214。
【非特許文献4】 「Glycogenes/Beyond Glycogenes」、http://www.glycoforum.gr.jp/science/glycogenes/15/15j.html。
【発明の開示】
【発明が解決しようとする課題】
【0006】
上述の2−デオキシグルコース類を用いた先行技術は、糖輸送・糖利用能・ATP欠乏の影響・癌細胞の診断・脳の機能解析などの研究や、肥満・糖尿病・関節痛・関節炎・痛風・潰瘍性大腸炎・炎症性消化器疾患などの症状を改善させることを目的として用いられているものであり、本発明の課題である糖質からの脂質合成や、脂質代謝のフィードバック調節を阻害させることを目的として用いられているものではない。
【0007】
特に2−アミノ−2−デオキシグルコースを用いた、特許文献3の肥満を改善させる先行技術については、1日あたり1g〜5gを有効量とするもので、血糖値を低下させて糖尿病に対する効果も奏するというものである。これに対し本発明は、糖質からの脂質合成や脂質代謝のフィードバック調節を阻害させることを目的とし、1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量を用いて、細胞膜における糖質の取り込みを阻害して血糖値を上昇させるものであるから、先行技術とは課題や作用効果が異なるものである。
【0008】
また、2−デオキシグルコース類をあつかった刊行物中においても、本課題に対する有効性の記述はおろか、その可能性を示唆する記述すら見られないのが現状である。本発明は、肥満予防や肥満改善における以下の課題を解決させることを目的として、2−デオキシグルコース類を用いることを特徴とするものである。
【0009】
本発明は、肥満の原因となる摂取された糖質からの、アシル−CoAの生成やグリセロール3−リン酸の生成、ひいてはこれら脂質のエステル化による、トリアシルグリセロールの合成を阻害させることを目的とするものである。
【0010】
また本発明は、ダイエットなどにつき物である脂質代謝のフィードバック調節による、グリセロールからの糖新生や遊離脂肪酸によって節約された糖質が、筋肉や脂肪組織などに取り込まれてグリセロール3−リン酸の生成に利用されることを阻害し、ひいてはアシル−CoAとの再エステル化による、トリアシルグリセロールの合成を阻害させることを目的とするものである。
【課題を解決するための手段】
【0011】
細胞内において糖質代謝を調節する解糖系のヘキソキナーゼを、2−デオキシグルコースを用いてアロステリックに阻害させる、肥満予防の方法を特徴とする。
【0012】
前記2−デオキシグルコース類のほか、2−デオキシグルコースからなる化合物を用いる、0011記載の肥満予防の方法を特徴とする。
【0013】
細胞内において糖質代謝を調節する解糖系のヘキソキナーゼを、2−デオキシグルコースを用いてアロステリックに阻害させる、肥満改善の方法を特徴とする。
【0014】
前記2−デオキシグルコース類のほか、2−デオキシグルコースからなる化合物を用いる、0013記載の肥満改善の方法を特徴とする。
【0015】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日につき体重1kgあたり2.5g〜5gの量)を用いて阻害させる、肥満予防の方法を特徴とする。
【0016】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日につき体重1kgあたり2.5g〜5gの量)を用いる、0015記載の肥満予防の方法を特徴とする。
【0017】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日につき体重1kgあたり2.5g〜5gの量)を用いて阻害させる、肥満改善の方法を特徴とする。
【0018】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日につき体重1kgあたり2.5g〜5gの量)を用いる、0017記載の肥満改善の方法を特徴とする。
【0019】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いて阻害させる、肥満予防の方法を特徴とする。
【0020】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いる、0019記載の肥満予防の方法を特徴とする。
【0021】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いて阻害させる、肥満改善の方法を特徴とする。
【0022】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いる、0021記載の肥満改善の方法を特徴とする。
【発明の効果】
【0023】
以上のように本発明によれば、細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階や、GLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース、または2−アミノ−2−デオキシグルコースからなる化合物を用いて阻害させるほか、
【0024】
細胞内において糖質代謝を調節する解糖系のヘキソキナーゼを、2−デオキシグルコース、または2−デオキシグルコースからなる化合物を用いてアロステリックに阻害させることにより、
【0025】
肥満の原因となる摂取された糖質からの、アシル−CoAの生成やグリセロール3−リン酸の生成、ひいてはこれら脂質のエステル化による、トリアシルグリセロールの合成を効果的に阻害させることが可能となるほか、
【0026】
ダイエットなどにつき物である脂質代謝のフィードバック調節による、グリセロールからの糖新生や遊離脂肪酸によって節約された糖質が、筋肉や脂肪組織などに取り込まれてグリセロール3−リン酸の生成に利用されることを阻害し、ひいてはアシル−CoAとの再エステル化による、トリアシルグリセロールの合成を効果的に阻害させることが可能となるのである。
【0027】
また、摂取された糖質であれ、糖新生や節約された糖質であれ、このように糖質からトリアシルグリセロールの合成が阻害されることにより、生理的にはトリアシルグリセロールの分解が促進し、グリセロールや遊離脂肪酸などの脂質代謝を促進させることが可能となるのである。
【0028】
特にこれらの効果は、グリセロールキナーゼを持たない筋肉や脂肪組織などにおいては極めて有効である。なぜならば、これら組織におけるグリセロール3−リン酸の生成が、グリセロールからではなく糖質に依存して生成されるからであり、この反応が細胞膜における糖質の取り込みや、解糖系のヘキソキナーゼの段階において阻害されるために、アシル−CoAとのエステル化または再エステル化による、トリアシルグリセロールの合成を効果的に阻害させることが可能となるからである。
【0029】
このように、糖質からトリアシルグリセロールが合成される重要な段階を、2−デオキシグルコース類やその化合物を用いて阻害させることにより、食事などによって糖質を摂取しても太りにくい生理的な環境を提供することが可能となるほか、ダイエットなどを行っても脂質代謝のフィードバック調節を誘起させることなく、より痩せやすい生理的な環境を提供することが可能となるのである。
【発明を実施するための最良の形態】
【0030】
以下、本発明の実施の形態を図面に基づき詳細に説明する。
【0031】
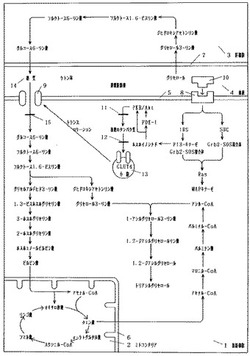
図1〜図3は本発明の実施の形態に係わり、図1は2−デオキシグルコース類の作用段階や脂質合成経路を表した図である。図2は2−アミノ−2−デオキシグルコースの化学構造図、図3は2−デオキシグルコースの化学構造図である。
【0032】
図1で示すように、インスリンが特定の膜受容体に結合すると、チロシンキナーゼが活性化してIRSのチロシン残基がリン酸化される。リン酸化されたIRSにPI3−キナーゼやGrb2・SOS複合体が結合し、PI3−キナーゼを活性化させる。活性化されたPI3−キナーゼによってホスホイノシチドが増加し、PKB/AktやPDK−1に結合する。ホスホイノシチドとの結合によりPDK−1は細胞膜に移動し、PKB/Aktのセリンおよびスレオニン残基をリン酸化する。このホスホイノシチドとの結合や、PDK−1によるリン酸化により活性化されたPKB/Aktは、細胞膜を離れて複数のタンパク質のセリンおよびスレオニン残基をリン酸化する。その結果、GLUT4の細胞膜へのトランスロケーションが引き起こされる。細胞膜に到達したGLUT4は細胞膜と融合し、細胞内への糖質の取り込みを促進させる。取り込まれた糖質は、解糖系のヘキソキナーゼによってリン酸化されてグルコース6−リン酸となり、グリコーゲン合成、クエン酸回路による酸化、脂質合成などの糖質代謝に利用される。
【0033】
本発明に係わる、このインスリンによるシグナル伝達経路を、PKB/Aktの段階においてリン酸化される複数のタンパク質の、セリンおよびスレオニン残基の水酸基あるいはその近傍への、N−アセチル−2−アミノ−2−デオキシグルコースのO−グリコシド結合によって阻害(図1の11)させる。
【0034】
本発明に係わる、このGLUT4のトランスロケーションを、GLUT4小胞のセリンおよびスレオニン残基の水酸基あるいはその近傍への、N−アセチル−2−アミノ−2−デオキシグルコースのO−グリコシド結合によって阻害(図1の12)させる。
【0035】
また、2−アミノ−2−デオキシグルコースと、その化合物である2−アミノ−2−デオキシグルコース塩酸塩、2−アミノ−2−デオキシグルコース硫酸塩なども、摂取後の生体内においてN−アセチル化されるため、上述の機序に準ずる。なお、2−アミノ−2−デオキシグルコースからなる化合物は、これらに限定されるものではない。
【0036】
本発明に係わる、2−デオキシグルコースには2位の水酸基がないため、ひとたびリン酸化されるとそれ以上の酵素反応を受けずに細胞内に蓄積する。この性質を利用して細胞内において糖質代謝を調節する解糖系のヘキソキナーゼを、2−デオキシグルコースを用いてアロステリックに阻害(図1の15)させる。
【0037】
また、2−デオキシグルコースの化合物である、18F標識−2−デオキシグルコース、11C標識−2−デオキシグルコース、13N標識−2−デオキシグルコースなども、2位の水酸基がないため上述の機序に準ずる。なお、2−デオキシグルコースからなる化合物は、これらに限定されるものではない。
【0038】
因みに、本発明の作用機序を理解するための一助として、2−アミノ−2−デオキシグルコースと2−デオキシグルコースの化学構造を、図2および図3に記載した。
【0039】
以上のように本発明によれば、細胞膜における糖質の取り込みや解糖系のヘキソキナーゼの段階を、2−デオキシグルコースや2−アミノ−2−デオキシグルコース、またはそれらからなる化合物を用いて阻害させることにより、図1で示すような、肥満の原因となる摂取された糖質(図1の14)からの、(イ)アシル−CoAの生成や(ロ)グリセロール3−リン酸の生成、ひいてはこれら脂質のエステル化による、(ハ)トリアシルグリセロールの合成を阻害させることが可能となるのである。
【0040】
(イ)細胞質ゾルの解糖系の酵素群により(糖質→グルコース6−リン酸→フルクトース6−リン酸→フルクトース1,6−ビスリン酸→グリセルアルデヒド3−リン酸→1,3−ビスホスホグリセリン酸→3−ホスホグリセリン酸→2−ホスホグリセリン酸→ホスホエノールピルビン酸→ピルビン酸)が生成され、続いてミトコンドリアに移行して器官内の酵素群により(ピルビン酸→アセチル−CoA→クエン酸)が生成され、再び細胞質ゾルに移行して脂質合成系の酵素群により(クエン酸→アセチル−CoA→マロニル−CoA→パルミチン酸→パルミチル−CoA→アシル−CoA)が生成される。
(ロ)細胞質ゾルの解糖系の酵素群により(糖質→グルコース6−リン酸→フルクトース6−リン酸→フルクトース1,6−ビスリン酸→ジヒドロキシアセトンリン酸)が生成され、続いて脂質合成系の酵素により(ジヒドロキシアセトンリン酸→グリセロール3−リン酸)が生成される。
(ハ)こうして生成されたアシル−CoAとグリセロール3−リン酸が、細胞質ゾルのグリセロールリン酸系の酵素群により(アシル−CoA+グリセロール3−リン酸→1−アシルグリセロール3−リン酸→1,2−ジアシルグリセロールリン酸→1,2−ジアシルグリセロール→トリアシルグリセロール)に合成される。
この他、アシル−CoAと2−モノアシルグリセロールが、モノアシルグリセロール系の酵素群により(アシル−CoA+2−モノアシルグリセロール→1,2−ジアシルグリセロール→トリアシルグリセロール)に合成される経路もある。
【0041】
また、図1で示すような、ダイエットなどにつき物である脂質代謝のフィードバック調節による、(ニ)グリセロールからの糖新生や(ホ)遊離脂肪酸によって節約された糖質(図1の14)が、筋肉や脂肪組織などに取り込まれてグリセロール3−リン酸の生成に利用されることを阻害し、ひいてはアシル−CoAとの再エステル化による、トリアシルグリセロールの合成を阻害させることが可能となるのである。
【0042】
(ニ)ダイエットなどの脂肪分解が亢進する生理的環境下においては、放出されたグリセロールが肝臓や腎臓に取り込まれ、細胞質ゾルの糖新生系の酵素群により(グリセロール→グリセロール3−リン酸→ジヒドロキシアセトンリン酸→フルクトース1,6−ビスリン酸→フルクトース6−リン酸→グルコース6−リン酸→糖質)に転換されると、再び筋肉や脂肪組織に取り込まれ、細胞質ゾルの解糖系や脂質合成系の酵素群により(糖質→グルコース6−リン酸→フルクトース6−リン酸→フルクトース1,6−ビスリン酸→ジヒドロキシアセトンリン酸→グリセロール3−リン酸)が生成され、ひいてはグリセロールリン酸系の酵素群によって再エステル化を受け(アシル−CoA+グリセロール3−リン酸→1−アシルグリセロール3−リン酸→1,2−ジアシルグリセロールリン酸→1,2−ジアシルグリセロール→トリアシルグリセロール)が合成されるという、グリセロールによるフィードバック調節が引き起こされる。
(ホ)また、このような生理的環境下では脳・肝臓・筋肉などの組織においても、ケトン体や遊離脂肪酸などの利用が増加して糖質の利用が節約されるほか、これら代謝産物が膵臟のインスリン分泌を促すことにより、節約された糖質の多くが筋肉や脂肪組織に取り込まれ、細胞質ゾルの解糖系の酵素群により(糖質→グルコース6−リン酸→フルクトース6−リン酸→フルクトース1,6−ビスリン酸→ジヒドロキシアセトンリン酸)が生成され、続いて脂質合成系の酵素により(ジヒドロキシアセトンリン酸→グリセロール3−リン酸)が生成され、ひいてはグリセロールリン酸系の酵素群によって再エステル化を受け(アシル−CoA+グリセロール3−リン酸→1−アシルグリセロール3−リン酸→1,2−ジアシルグリセロールリン酸→1,2−ジアシルグリセロール→トリアシルグリセロール)が合成されるという、遊離脂肪酸によるフィードバック調節が引き起こされる。
【0043】
2−デオキシグルコースの摂取量の基準となる製薬会社(東京化成工業(株))のラットを用いた実験により、体重1kgあたり2g以上の量で毒性を示すことが確認されている。このことから、過剰摂取による健康被害への懸念や糖尿病への影響を鑑みて、1日の摂取許容量を体重1kgあたり2g以下とすることが求められる。また、今回実施したマウスを用いた実験(実施例1)では、体重1kgあたり1g以上の経口投与から、解糖系のヘキソキナーゼが阻害されたことを示す有意な血糖値の低下を確認できたことから、目的の肥満予防や肥満改善効果を奏するに理想的な1日の摂取量は、体重1kgあたり1g〜2gと結論することができる。
【0044】
また、2−デオキシグルコースにおいては、F−18.C−11.N−13などの放射性同位体で標識された化合物として、既にヒトやその他の哺乳動物に対する投与が医療現場や研究機関などにおいて実施されており、製薬会社の製品安全シート(東京化成工業(株)ホームページ)においても特別な有害性の報告もないことから、錠剤・粉末剤・カプセルなどで直接経口摂取するか、あるいは薬剤・サプリメント・食品・飲料・甘味料などの、組成物から経口摂取するのが簡易で理想的な実施形態といえる。この他、生理食塩水に溶かして注射や点滴などを用いて静脈投与するなどの形態にも使用できる。なお、組成物やその実施形態は、これらに限定されるものではない。特に、放射性同位体で標識された2−デオキシグルコースにおいては、本発明の実施形態に必ずしも適しているとはいえないものの、被曝量を考慮して適切に用いれば2−デオキシグルコースと同様の作用効果を有するので、ここでは一例として記載した。
【0045】
2−アミノ−2−デオキシグルコースの摂取量の基準となるラットを用いた他の実験(最新版からだに効く栄養成分バイブル/主婦と生活社/中村丁次)により、体重1kgあたり5g以上の量で毒性を示すことが確認されている。このことから、過剰摂取による健康被害への懸念や糖尿病への影響を鑑みて、1日の摂取許容量を体重1kgあたり5g以下とすることが求められる。また、今回実施したマウスを用いた実験(実施例1)では、体重1kgあたり1.5g以上の経口投与から、細胞膜において糖質の取り込みが阻害されたことを示す有意な血糖値の上昇を確認できたことから、目的の肥満予防や肥満改善効果を奏するに理想的な摂取量は、体重1kgあたり1.5g〜5g前後と結論することができる。これは1日で摂取しても10日以内の複数日にわけて摂取しても構わない。
【0046】
また、2−アミノ−2−デオキシグルコースにおいては、その化合物である2−アミノ−2−デオキシグルコース塩酸塩、2−アミノ−2−デオキシグルコース硫酸塩、N−アセチル−2−アミノ−2−デオキシグルコースとして、既にヒトやその他の哺乳動物における経口摂取が一般的に実施されており、その安全性も確認されているため、錠剤・粉末剤・カプセルなどで直接経口摂取するか、あるいは薬剤・サプリメント・食品・飲料・甘味料などの、組成物から経口摂取するのが簡易で理想的な実施形態といえる。この他、生理食塩水に溶かして注射や点滴などを用いて静脈投与するなどの形態にも使用できる。なお、組成物やその実施形態は、これらに限定されるものではない。
【実施例1】
【0047】
表1で示すように、2−デオキシグルコース類の投与による血糖値の変化をマウスを用いて測定した。血糖値の測定にはテルモ株式会社のメディセーフ〔登録商標〕ミニ、血糖測定セット〔商品名〕を用いた。マウス6匹を12時間絶食させて血糖値を測定し、2−デオキシグルコース類を各々1ccの水道水に溶かして水溶液をつくり、スポイトを用いてマウスにそれぞれ経口投与した。投与量については表1に記載された通り、マウスごとに変えて投与した。なお、マウスGの投与量については、特許文献3に記載された投与量の最大値である5gを、体重1kgあたりの投与量に換算(当該文献の表2に記載された平均体重80.6kgを参考)したものである。
【0048】
60分後に再び血糖値を測定したところ、2−デオキシグルコースにおいては体重1kgあたり1g以上の投与から、解糖系のヘキソキナーゼが阻害されたことを示す有意な血糖値の低下を確認することができた。これに対して体重1kgあたり0.5gの投与では、有意な血糖値の低下を確認することはできなかった。また、2−アミノ−2−デオキシグルコースにおいては体重1kgあたり1.5g以上の投与から、細胞膜において糖質の取り込みが阻害されたことを示す有意な血糖値の上昇を確認することができた。これに対して体重1kgあたり0.06gの投与では、有意な血糖値の上昇を確認することはできなかった。このことから、先行技術の投与量では本発明の作用効果を奏さないことがあきらかとなった。
【表1】

【0049】
表には記載していないが、2−アミノ−2−デオキシグルコースを体重1kgあたり1.25gの量でマウスに投与したものの、血糖値の上昇を確認することはできなかった。このことから、少なくとも体重1kgあたり1.25g以下の投与については、本発明の作用効果を奏さないことがあきらかとなった。これに対し、体重1kgあたり1.5g以下の近傍値(1.35g〜1.5g)や5g以上(5g〜10g)の量を投与したマウスにおいては、数値の差こそあるがいずれも血糖値の上昇を確認することができた。このことから、1.5g以下の近傍値は勿論、毒性を考慮しなければ5g以上の投与についても本発明の作用効果を奏するものといえる。また、有効量を一度に投与したマウスは、その後の投与なしに最長で8日間も高い血糖状態を維持したことから、2−アミノ−2−デオキシグルコース類が標的とするタンパク質と結合することで代謝を免れたか、あるいは有効となる基質量に対してヘキソサミン代謝経路の活性が低いなどの理由により、作用効果が持続されたものと推測される。因に、2−デオキシグルコースにおいては、このような特異な持続効果はみられなかった。
【実施例2】
【0050】
表2で示すように、2−デオキシグルコース類の投与による体重の変化をマウスを用いて測定した。実験前、マウスに市販の配合餌(株式会社大創産業 ハムスターの主食〔商品名〕)を1日あたり3,000mg与えて1週間予備飼育した。実験には同程度の体重(22g〜23g)のマウス8匹を用い、それぞれ過食マウスA.B.C.D、節食マウスE.F.G.Hとした。過食マウスのグループには、1日あたり精白米(生米)1,000mgと配合餌2,300mgの、高炭水化物の食餌を与えた。節食マウスのグループには、1日あたり配合餌2,500mgのみの、低カロリーの食餌を与えた。食餌は12時間サイクルとし、水は自由摂取させた。2−デオキシグルコース類の投与については、表2に記載された量を1ccの水道水に溶かして水溶液をつくり、各食餌の60分前にスポイトを用いて経口投与した。なお、実験は23℃の室温の中で7日間行い、期間中は運動などの身体活動をともなうような行為を課すことはしなかった。
【0051】
7日間の実験を終了し、各マウスの体重を実験開始時の体重と比較したところ、2−デオキシグルコースを投与した過食マウスBにおいては、投与しなかった過食マウスAと比較して体重の増加が有意に抑えられ、目的とする肥満予防効果を確認することができた。同様に、2−デオキシグルコースを投与した節食マウスFにおいては、投与しなかった節食マウスEと比較して体重の減少が有意に進み、目的とする肥満改善効果を確認することができた。また、2−アミノ−2−デオキシグルコースを、本発明の数値範囲内の量で投与した過食マウスCにおいては、先行技術の最大値(実施例1のマウスGの投与量)の量を投与した過食マウスDと比較して体重の増加が有意に抑えられ、先行技術にはない肥満予防効果を確認することができた。同様に、本発明の数値範囲内の量を投与した節食マウスGにおいては、先行技術の最大値の量を投与した節食マウスHと比較して体重の減少が有意に進み、先行技術とは異なる肥満改善効果を確認することができた。
【表2】


【実施例3】
【0052】
表3で示すように、実施例2で用いたマウスを実験終了直後に屠殺し、水中体重秤量法を用いて各マウスの体脂肪率を測定した。測定には、温水を入れた水槽の上にデジタル計量器を設置し、計量皿に棒を渡してナイロン製の糸でマウスを吊るし、各マウスの体積を測定するようにした。得られた体積から体密度を算出し、Siriの計算式を用いて体脂肪率を算出した。なお、肺の残気量や腸間ガス量については、推定式を用いて補正した。また、測定に用いた温水の温度は屠殺後のマウスの体温と合わせ、マウスの体毛に付着した気泡については十分に除去するよう注意した。
【0053】
測定の結果、実施例2において2−デオキシグルコースを投与した過食マウスBにおいては、投与しなかった過食マウスAと比較して有意に体脂肪率が低く、本発明によってトリアシルグリセロールの合成が抑制されたことが裏づけられ、目的とする肥満予防効果を確認することができた。同様に、2−デオキシグルコースを投与した節食マウスFにおいては、投与しなかった節食マウスEと比較して有意に体脂肪率が低く、本発明によってトリアシルグリセロールの分解が促進されたことが裏づけられ、目的とする肥満改善効果を確認することができた。また、2−アミノ−2−デオキシグルコースを、本発明の数値範囲内の量で投与した過食マウスCにおいては、先行技術の最大値(実施例1のマウスGの投与量)の量を投与した過食マウスDと比較して有意に体脂肪率が低く、本発明によってトリアシルグリセロールの合成が抑制されたことが裏づけられ、先行技術にはない肥満予防効果を確認することができた。同様に、本発明の数値範囲内の量を投与した節食マウスGにおいては、先行技術の最大値の量を投与した節食マウスHと比較して有意に体脂肪率が低く、本発明によってトリアシルグリセロールの分解が促進されたことが裏づけられ、先行技術とは異なる肥満改善効果を確認することができた。
【表3】

【実施例4】
【0054】
表4で示すように、2−アミノ−2−デオキシグルコース塩酸塩の投与による血糖値・体重・体脂肪率の変化を、20〜50歳代の男女6人を被験者として盲検法にて測定した。各測定は朝食前の空腹時に行ない、その際実施例1で用いた血糖測定セットと株式会社タニタのInnerScan〔登録商標〕50V BC−621〔商品名〕を用いた。被験者A〜Fにおいては、偽薬を投与する被験者2名・先行技術の最大値の量を投与する被験者2名・本発明の数値範囲内の量を投与する被験者2名の、合計6名の被験者を無作為に選び、各々の投与物を1日3回各食事の60分前に飲物に溶かして経口投与した。この際どの被験者になにが投与されたかについては、被験者はもちろん試験担当者にもわからないよう注意した。また被験者A〜Cについては、1日のエネルギー所要量の1,35倍の高炭水化物(糖質65% 蛋白質15% 脂質20%)の食事を、1日3回朝・昼・晩に分けて摂取させた。同様に被験者D〜Fについても、1日のエネルギー所要量の0,85倍の低カロリー(糖質45% 蛋白質25% 脂質30%)の食事を、1日3回朝・昼・晩に分けて摂取させた。因に、先行技術の最大値の量とは特許文献3の1日5gのことであり、本発明の数値範囲内の量とは7日間で体重1kgあたり1,5g投与できる量のことである。また、エネルギー所要量の算出については「女子栄養大学出版部 香川芳子五訂増補食品成分表2008(資料編)」を参考にした。なお、試験は26℃の室温の中で21日間実施し、期間中は運動などの強い身体活動を伴うような行為は禁止した。
【0055】
21日間の試験を終了し、各被験者の血糖値・体重・体脂肪率を試験前と比較したところ、本発明の数値範囲内の量を投与した被験者Cにおいては、偽薬を投与した被験者Aおよび先行技術の最大値の量を投与した被験者Bと比較して、血糖値は有意に上昇し、体重・体脂肪率の増加も有意に抑えられたことから、先行技術にはない肥満予防効果を確認することができた。同様に、本発明の数値範囲内の量を投与した被験者Eにおいては、偽薬を投与した被験者Fおよび先行技術の最大値の量を投与した被験者Dと比較して、血糖値は有意に上昇し、体重・体脂肪率の減少も有意に進んだことから、先行技術とは異なる肥満改善効果を確認することができた。因に、被験者C.Eにおいては有効量を7日間に分けて投与したため、血糖値・体重・体脂肪率の有意な変化は8日以降から観察された。これにより、有効量を分量にて投与しても効果が得られることが確認された。
【表4】

【0056】
表には記載していないが、一部の被験者においては有効量を12日間に分けて投与しても上記と同様の結果が得られた。このことから、有効量を分量にて投与できる期間は年齢・性別・体重などの個人差によっても異なるが、凡そ10日前後と結論することができる。この特異な持続効果は、2−アミノ−2−デオキシグルコース類が標的とするタンパク質と特異的に結合することによって達成されるものと考えられるが、有効となる基質量に対してヘキソサミン代謝経路の活性が低い可能性も考えられる。因に、試験において1名の被験者が副作用とみられる下痢を訴えたので、当被験者を試験から除外したことを付け加えておく。
【産業上の利用可能性】
【0057】
本発明は、ヒトおよび哺乳動物における肥満予防や肥満改善用の薬剤・サプリメント・食品・飲料・甘味料などを製造、販売する産業分野で利用することができる。
【図面の簡単な説明】
【0058】
【図1】 本発明に係わる、2−デオキシグルコース類の作用段階や、摂取された糖質や脂質代謝のフィードバック調節による脂質合成経路を表した図である。
【図2】 本発明に係わる、2−アミノ−2−デオキシグルコースの化学構造を表した図である。
【図3】 本発明に係わる、2−デオキシグルコースの化学構造を表した図である。
【技術分野】
【0001】
本発明は、2−デオキシグルコース類やその化合物を用いることを特徴とした、肥満予防や肥満改善の方法に関するものである。
【背景技術】
【0002】
従来の2−デオキシグルコース類を用いた先行技術には、フッ素同位体などの放射性物質を用いて、2−デオキシグルコース(2−デオキシ−D−グルコース)を標識することにより、糖輸送・糖利用能・ATP欠乏の影響などの研究や、糖代謝の活発な癌細胞や脳の活動部位などの、局所的な組織の活動状態を画像として反映させ、癌細胞の診断や脳の機能解析などを目的として用いられているものなどがある。
【0003】
また、肥満や糖尿病の症状を改善させることを目的とするものや、加齢・肥満・スポーツなどによって摩耗した軟骨の再生を促し、関節痛や関節炎などの症状を改善させることを目的として、2−アミノ−2−デオキシグルコース(グルコサミン)や、N−アセチル−2−アミノ−2−デオキシグルコース(N−アセチルグルコサミン)などの、2−デオキシグルコース類を用いた先行技術がある。この他、痛風・潰瘍性大腸炎・炎症性消化器疾患などの症状が改善されたとの報告がある。
【0004】
なお、本発明に関連する公知技術として次の特許文献1.2.3.4及び非特許文献1.2.3.4を挙げることができる。
【0005】
【特許文献1】 特開2007−500216号公報。
【特許文献2】 特開WO99/34670号公報。
【特許文献3】 特開2002−154969号公報。
【特許文献4】 特開2005−513078号公報。
【非特許文献1】 「医学書院 医学大辞典」、総編集/伊藤正男・井村裕夫・高久史麿、発行者/株式会社医学書院、発行日/2003年3月1日、第1版第1刷、p1700。
【非特許文献2】 「がんの診断と治療を革新する新しい画像診断」、http://www.antm.or.jp/06koenkai/koenkai02/02_1itoh.pdf。
【非特許文献3】 「改訂増補版 機能性食品素材便覧」、編著者/清水俊雄、発行者/株式会社薬事日報社、発行日/2006年9月25日、第1刷、p200、p213〜p214。
【非特許文献4】 「Glycogenes/Beyond Glycogenes」、http://www.glycoforum.gr.jp/science/glycogenes/15/15j.html。
【発明の開示】
【発明が解決しようとする課題】
【0006】
上述の2−デオキシグルコース類を用いた先行技術は、糖輸送・糖利用能・ATP欠乏の影響・癌細胞の診断・脳の機能解析などの研究や、肥満・糖尿病・関節痛・関節炎・痛風・潰瘍性大腸炎・炎症性消化器疾患などの症状を改善させることを目的として用いられているものであり、本発明の課題である糖質からの脂質合成や、脂質代謝のフィードバック調節を阻害させることを目的として用いられているものではない。
【0007】
特に2−アミノ−2−デオキシグルコースを用いた、特許文献3の肥満を改善させる先行技術については、1日あたり1g〜5gを有効量とするもので、血糖値を低下させて糖尿病に対する効果も奏するというものである。これに対し本発明は、糖質からの脂質合成や脂質代謝のフィードバック調節を阻害させることを目的とし、1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量を用いて、細胞膜における糖質の取り込みを阻害して血糖値を上昇させるものであるから、先行技術とは課題や作用効果が異なるものである。
【0008】
また、2−デオキシグルコース類をあつかった刊行物中においても、本課題に対する有効性の記述はおろか、その可能性を示唆する記述すら見られないのが現状である。本発明は、肥満予防や肥満改善における以下の課題を解決させることを目的として、2−デオキシグルコース類を用いることを特徴とするものである。
【0009】
本発明は、肥満の原因となる摂取された糖質からの、アシル−CoAの生成やグリセロール3−リン酸の生成、ひいてはこれら脂質のエステル化による、トリアシルグリセロールの合成を阻害させることを目的とするものである。
【0010】
また本発明は、ダイエットなどにつき物である脂質代謝のフィードバック調節による、グリセロールからの糖新生や遊離脂肪酸によって節約された糖質が、筋肉や脂肪組織などに取り込まれてグリセロール3−リン酸の生成に利用されることを阻害し、ひいてはアシル−CoAとの再エステル化による、トリアシルグリセロールの合成を阻害させることを目的とするものである。
【課題を解決するための手段】
【0011】
細胞内において糖質代謝を調節する解糖系のヘキソキナーゼを、2−デオキシグルコースを用いてアロステリックに阻害させる、肥満予防の方法を特徴とする。
【0012】
前記2−デオキシグルコース類のほか、2−デオキシグルコースからなる化合物を用いる、0011記載の肥満予防の方法を特徴とする。
【0013】
細胞内において糖質代謝を調節する解糖系のヘキソキナーゼを、2−デオキシグルコースを用いてアロステリックに阻害させる、肥満改善の方法を特徴とする。
【0014】
前記2−デオキシグルコース類のほか、2−デオキシグルコースからなる化合物を用いる、0013記載の肥満改善の方法を特徴とする。
【0015】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日につき体重1kgあたり2.5g〜5gの量)を用いて阻害させる、肥満予防の方法を特徴とする。
【0016】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日につき体重1kgあたり2.5g〜5gの量)を用いる、0015記載の肥満予防の方法を特徴とする。
【0017】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日につき体重1kgあたり2.5g〜5gの量)を用いて阻害させる、肥満改善の方法を特徴とする。
【0018】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日につき体重1kgあたり2.5g〜5gの量)を用いる、0017記載の肥満改善の方法を特徴とする。
【0019】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いて阻害させる、肥満予防の方法を特徴とする。
【0020】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いる、0019記載の肥満予防の方法を特徴とする。
【0021】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いて阻害させる、肥満改善の方法を特徴とする。
【0022】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いる、0021記載の肥満改善の方法を特徴とする。
【発明の効果】
【0023】
以上のように本発明によれば、細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階や、GLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース、または2−アミノ−2−デオキシグルコースからなる化合物を用いて阻害させるほか、
【0024】
細胞内において糖質代謝を調節する解糖系のヘキソキナーゼを、2−デオキシグルコース、または2−デオキシグルコースからなる化合物を用いてアロステリックに阻害させることにより、
【0025】
肥満の原因となる摂取された糖質からの、アシル−CoAの生成やグリセロール3−リン酸の生成、ひいてはこれら脂質のエステル化による、トリアシルグリセロールの合成を効果的に阻害させることが可能となるほか、
【0026】
ダイエットなどにつき物である脂質代謝のフィードバック調節による、グリセロールからの糖新生や遊離脂肪酸によって節約された糖質が、筋肉や脂肪組織などに取り込まれてグリセロール3−リン酸の生成に利用されることを阻害し、ひいてはアシル−CoAとの再エステル化による、トリアシルグリセロールの合成を効果的に阻害させることが可能となるのである。
【0027】
また、摂取された糖質であれ、糖新生や節約された糖質であれ、このように糖質からトリアシルグリセロールの合成が阻害されることにより、生理的にはトリアシルグリセロールの分解が促進し、グリセロールや遊離脂肪酸などの脂質代謝を促進させることが可能となるのである。
【0028】
特にこれらの効果は、グリセロールキナーゼを持たない筋肉や脂肪組織などにおいては極めて有効である。なぜならば、これら組織におけるグリセロール3−リン酸の生成が、グリセロールからではなく糖質に依存して生成されるからであり、この反応が細胞膜における糖質の取り込みや、解糖系のヘキソキナーゼの段階において阻害されるために、アシル−CoAとのエステル化または再エステル化による、トリアシルグリセロールの合成を効果的に阻害させることが可能となるからである。
【0029】
このように、糖質からトリアシルグリセロールが合成される重要な段階を、2−デオキシグルコース類やその化合物を用いて阻害させることにより、食事などによって糖質を摂取しても太りにくい生理的な環境を提供することが可能となるほか、ダイエットなどを行っても脂質代謝のフィードバック調節を誘起させることなく、より痩せやすい生理的な環境を提供することが可能となるのである。
【発明を実施するための最良の形態】
【0030】
以下、本発明の実施の形態を図面に基づき詳細に説明する。
【0031】
図1〜図3は本発明の実施の形態に係わり、図1は2−デオキシグルコース類の作用段階や脂質合成経路を表した図である。図2は2−アミノ−2−デオキシグルコースの化学構造図、図3は2−デオキシグルコースの化学構造図である。
【0032】
図1で示すように、インスリンが特定の膜受容体に結合すると、チロシンキナーゼが活性化してIRSのチロシン残基がリン酸化される。リン酸化されたIRSにPI3−キナーゼやGrb2・SOS複合体が結合し、PI3−キナーゼを活性化させる。活性化されたPI3−キナーゼによってホスホイノシチドが増加し、PKB/AktやPDK−1に結合する。ホスホイノシチドとの結合によりPDK−1は細胞膜に移動し、PKB/Aktのセリンおよびスレオニン残基をリン酸化する。このホスホイノシチドとの結合や、PDK−1によるリン酸化により活性化されたPKB/Aktは、細胞膜を離れて複数のタンパク質のセリンおよびスレオニン残基をリン酸化する。その結果、GLUT4の細胞膜へのトランスロケーションが引き起こされる。細胞膜に到達したGLUT4は細胞膜と融合し、細胞内への糖質の取り込みを促進させる。取り込まれた糖質は、解糖系のヘキソキナーゼによってリン酸化されてグルコース6−リン酸となり、グリコーゲン合成、クエン酸回路による酸化、脂質合成などの糖質代謝に利用される。
【0033】
本発明に係わる、このインスリンによるシグナル伝達経路を、PKB/Aktの段階においてリン酸化される複数のタンパク質の、セリンおよびスレオニン残基の水酸基あるいはその近傍への、N−アセチル−2−アミノ−2−デオキシグルコースのO−グリコシド結合によって阻害(図1の11)させる。
【0034】
本発明に係わる、このGLUT4のトランスロケーションを、GLUT4小胞のセリンおよびスレオニン残基の水酸基あるいはその近傍への、N−アセチル−2−アミノ−2−デオキシグルコースのO−グリコシド結合によって阻害(図1の12)させる。
【0035】
また、2−アミノ−2−デオキシグルコースと、その化合物である2−アミノ−2−デオキシグルコース塩酸塩、2−アミノ−2−デオキシグルコース硫酸塩なども、摂取後の生体内においてN−アセチル化されるため、上述の機序に準ずる。なお、2−アミノ−2−デオキシグルコースからなる化合物は、これらに限定されるものではない。
【0036】
本発明に係わる、2−デオキシグルコースには2位の水酸基がないため、ひとたびリン酸化されるとそれ以上の酵素反応を受けずに細胞内に蓄積する。この性質を利用して細胞内において糖質代謝を調節する解糖系のヘキソキナーゼを、2−デオキシグルコースを用いてアロステリックに阻害(図1の15)させる。
【0037】
また、2−デオキシグルコースの化合物である、18F標識−2−デオキシグルコース、11C標識−2−デオキシグルコース、13N標識−2−デオキシグルコースなども、2位の水酸基がないため上述の機序に準ずる。なお、2−デオキシグルコースからなる化合物は、これらに限定されるものではない。
【0038】
因みに、本発明の作用機序を理解するための一助として、2−アミノ−2−デオキシグルコースと2−デオキシグルコースの化学構造を、図2および図3に記載した。
【0039】
以上のように本発明によれば、細胞膜における糖質の取り込みや解糖系のヘキソキナーゼの段階を、2−デオキシグルコースや2−アミノ−2−デオキシグルコース、またはそれらからなる化合物を用いて阻害させることにより、図1で示すような、肥満の原因となる摂取された糖質(図1の14)からの、(イ)アシル−CoAの生成や(ロ)グリセロール3−リン酸の生成、ひいてはこれら脂質のエステル化による、(ハ)トリアシルグリセロールの合成を阻害させることが可能となるのである。
【0040】
(イ)細胞質ゾルの解糖系の酵素群により(糖質→グルコース6−リン酸→フルクトース6−リン酸→フルクトース1,6−ビスリン酸→グリセルアルデヒド3−リン酸→1,3−ビスホスホグリセリン酸→3−ホスホグリセリン酸→2−ホスホグリセリン酸→ホスホエノールピルビン酸→ピルビン酸)が生成され、続いてミトコンドリアに移行して器官内の酵素群により(ピルビン酸→アセチル−CoA→クエン酸)が生成され、再び細胞質ゾルに移行して脂質合成系の酵素群により(クエン酸→アセチル−CoA→マロニル−CoA→パルミチン酸→パルミチル−CoA→アシル−CoA)が生成される。
(ロ)細胞質ゾルの解糖系の酵素群により(糖質→グルコース6−リン酸→フルクトース6−リン酸→フルクトース1,6−ビスリン酸→ジヒドロキシアセトンリン酸)が生成され、続いて脂質合成系の酵素により(ジヒドロキシアセトンリン酸→グリセロール3−リン酸)が生成される。
(ハ)こうして生成されたアシル−CoAとグリセロール3−リン酸が、細胞質ゾルのグリセロールリン酸系の酵素群により(アシル−CoA+グリセロール3−リン酸→1−アシルグリセロール3−リン酸→1,2−ジアシルグリセロールリン酸→1,2−ジアシルグリセロール→トリアシルグリセロール)に合成される。
この他、アシル−CoAと2−モノアシルグリセロールが、モノアシルグリセロール系の酵素群により(アシル−CoA+2−モノアシルグリセロール→1,2−ジアシルグリセロール→トリアシルグリセロール)に合成される経路もある。
【0041】
また、図1で示すような、ダイエットなどにつき物である脂質代謝のフィードバック調節による、(ニ)グリセロールからの糖新生や(ホ)遊離脂肪酸によって節約された糖質(図1の14)が、筋肉や脂肪組織などに取り込まれてグリセロール3−リン酸の生成に利用されることを阻害し、ひいてはアシル−CoAとの再エステル化による、トリアシルグリセロールの合成を阻害させることが可能となるのである。
【0042】
(ニ)ダイエットなどの脂肪分解が亢進する生理的環境下においては、放出されたグリセロールが肝臓や腎臓に取り込まれ、細胞質ゾルの糖新生系の酵素群により(グリセロール→グリセロール3−リン酸→ジヒドロキシアセトンリン酸→フルクトース1,6−ビスリン酸→フルクトース6−リン酸→グルコース6−リン酸→糖質)に転換されると、再び筋肉や脂肪組織に取り込まれ、細胞質ゾルの解糖系や脂質合成系の酵素群により(糖質→グルコース6−リン酸→フルクトース6−リン酸→フルクトース1,6−ビスリン酸→ジヒドロキシアセトンリン酸→グリセロール3−リン酸)が生成され、ひいてはグリセロールリン酸系の酵素群によって再エステル化を受け(アシル−CoA+グリセロール3−リン酸→1−アシルグリセロール3−リン酸→1,2−ジアシルグリセロールリン酸→1,2−ジアシルグリセロール→トリアシルグリセロール)が合成されるという、グリセロールによるフィードバック調節が引き起こされる。
(ホ)また、このような生理的環境下では脳・肝臓・筋肉などの組織においても、ケトン体や遊離脂肪酸などの利用が増加して糖質の利用が節約されるほか、これら代謝産物が膵臟のインスリン分泌を促すことにより、節約された糖質の多くが筋肉や脂肪組織に取り込まれ、細胞質ゾルの解糖系の酵素群により(糖質→グルコース6−リン酸→フルクトース6−リン酸→フルクトース1,6−ビスリン酸→ジヒドロキシアセトンリン酸)が生成され、続いて脂質合成系の酵素により(ジヒドロキシアセトンリン酸→グリセロール3−リン酸)が生成され、ひいてはグリセロールリン酸系の酵素群によって再エステル化を受け(アシル−CoA+グリセロール3−リン酸→1−アシルグリセロール3−リン酸→1,2−ジアシルグリセロールリン酸→1,2−ジアシルグリセロール→トリアシルグリセロール)が合成されるという、遊離脂肪酸によるフィードバック調節が引き起こされる。
【0043】
2−デオキシグルコースの摂取量の基準となる製薬会社(東京化成工業(株))のラットを用いた実験により、体重1kgあたり2g以上の量で毒性を示すことが確認されている。このことから、過剰摂取による健康被害への懸念や糖尿病への影響を鑑みて、1日の摂取許容量を体重1kgあたり2g以下とすることが求められる。また、今回実施したマウスを用いた実験(実施例1)では、体重1kgあたり1g以上の経口投与から、解糖系のヘキソキナーゼが阻害されたことを示す有意な血糖値の低下を確認できたことから、目的の肥満予防や肥満改善効果を奏するに理想的な1日の摂取量は、体重1kgあたり1g〜2gと結論することができる。
【0044】
また、2−デオキシグルコースにおいては、F−18.C−11.N−13などの放射性同位体で標識された化合物として、既にヒトやその他の哺乳動物に対する投与が医療現場や研究機関などにおいて実施されており、製薬会社の製品安全シート(東京化成工業(株)ホームページ)においても特別な有害性の報告もないことから、錠剤・粉末剤・カプセルなどで直接経口摂取するか、あるいは薬剤・サプリメント・食品・飲料・甘味料などの、組成物から経口摂取するのが簡易で理想的な実施形態といえる。この他、生理食塩水に溶かして注射や点滴などを用いて静脈投与するなどの形態にも使用できる。なお、組成物やその実施形態は、これらに限定されるものではない。特に、放射性同位体で標識された2−デオキシグルコースにおいては、本発明の実施形態に必ずしも適しているとはいえないものの、被曝量を考慮して適切に用いれば2−デオキシグルコースと同様の作用効果を有するので、ここでは一例として記載した。
【0045】
2−アミノ−2−デオキシグルコースの摂取量の基準となるラットを用いた他の実験(最新版からだに効く栄養成分バイブル/主婦と生活社/中村丁次)により、体重1kgあたり5g以上の量で毒性を示すことが確認されている。このことから、過剰摂取による健康被害への懸念や糖尿病への影響を鑑みて、1日の摂取許容量を体重1kgあたり5g以下とすることが求められる。また、今回実施したマウスを用いた実験(実施例1)では、体重1kgあたり1.5g以上の経口投与から、細胞膜において糖質の取り込みが阻害されたことを示す有意な血糖値の上昇を確認できたことから、目的の肥満予防や肥満改善効果を奏するに理想的な摂取量は、体重1kgあたり1.5g〜5g前後と結論することができる。これは1日で摂取しても10日以内の複数日にわけて摂取しても構わない。
【0046】
また、2−アミノ−2−デオキシグルコースにおいては、その化合物である2−アミノ−2−デオキシグルコース塩酸塩、2−アミノ−2−デオキシグルコース硫酸塩、N−アセチル−2−アミノ−2−デオキシグルコースとして、既にヒトやその他の哺乳動物における経口摂取が一般的に実施されており、その安全性も確認されているため、錠剤・粉末剤・カプセルなどで直接経口摂取するか、あるいは薬剤・サプリメント・食品・飲料・甘味料などの、組成物から経口摂取するのが簡易で理想的な実施形態といえる。この他、生理食塩水に溶かして注射や点滴などを用いて静脈投与するなどの形態にも使用できる。なお、組成物やその実施形態は、これらに限定されるものではない。
【実施例1】
【0047】
表1で示すように、2−デオキシグルコース類の投与による血糖値の変化をマウスを用いて測定した。血糖値の測定にはテルモ株式会社のメディセーフ〔登録商標〕ミニ、血糖測定セット〔商品名〕を用いた。マウス6匹を12時間絶食させて血糖値を測定し、2−デオキシグルコース類を各々1ccの水道水に溶かして水溶液をつくり、スポイトを用いてマウスにそれぞれ経口投与した。投与量については表1に記載された通り、マウスごとに変えて投与した。なお、マウスGの投与量については、特許文献3に記載された投与量の最大値である5gを、体重1kgあたりの投与量に換算(当該文献の表2に記載された平均体重80.6kgを参考)したものである。
【0048】
60分後に再び血糖値を測定したところ、2−デオキシグルコースにおいては体重1kgあたり1g以上の投与から、解糖系のヘキソキナーゼが阻害されたことを示す有意な血糖値の低下を確認することができた。これに対して体重1kgあたり0.5gの投与では、有意な血糖値の低下を確認することはできなかった。また、2−アミノ−2−デオキシグルコースにおいては体重1kgあたり1.5g以上の投与から、細胞膜において糖質の取り込みが阻害されたことを示す有意な血糖値の上昇を確認することができた。これに対して体重1kgあたり0.06gの投与では、有意な血糖値の上昇を確認することはできなかった。このことから、先行技術の投与量では本発明の作用効果を奏さないことがあきらかとなった。
【表1】

【0049】
表には記載していないが、2−アミノ−2−デオキシグルコースを体重1kgあたり1.25gの量でマウスに投与したものの、血糖値の上昇を確認することはできなかった。このことから、少なくとも体重1kgあたり1.25g以下の投与については、本発明の作用効果を奏さないことがあきらかとなった。これに対し、体重1kgあたり1.5g以下の近傍値(1.35g〜1.5g)や5g以上(5g〜10g)の量を投与したマウスにおいては、数値の差こそあるがいずれも血糖値の上昇を確認することができた。このことから、1.5g以下の近傍値は勿論、毒性を考慮しなければ5g以上の投与についても本発明の作用効果を奏するものといえる。また、有効量を一度に投与したマウスは、その後の投与なしに最長で8日間も高い血糖状態を維持したことから、2−アミノ−2−デオキシグルコース類が標的とするタンパク質と結合することで代謝を免れたか、あるいは有効となる基質量に対してヘキソサミン代謝経路の活性が低いなどの理由により、作用効果が持続されたものと推測される。因に、2−デオキシグルコースにおいては、このような特異な持続効果はみられなかった。
【実施例2】
【0050】
表2で示すように、2−デオキシグルコース類の投与による体重の変化をマウスを用いて測定した。実験前、マウスに市販の配合餌(株式会社大創産業 ハムスターの主食〔商品名〕)を1日あたり3,000mg与えて1週間予備飼育した。実験には同程度の体重(22g〜23g)のマウス8匹を用い、それぞれ過食マウスA.B.C.D、節食マウスE.F.G.Hとした。過食マウスのグループには、1日あたり精白米(生米)1,000mgと配合餌2,300mgの、高炭水化物の食餌を与えた。節食マウスのグループには、1日あたり配合餌2,500mgのみの、低カロリーの食餌を与えた。食餌は12時間サイクルとし、水は自由摂取させた。2−デオキシグルコース類の投与については、表2に記載された量を1ccの水道水に溶かして水溶液をつくり、各食餌の60分前にスポイトを用いて経口投与した。なお、実験は23℃の室温の中で7日間行い、期間中は運動などの身体活動をともなうような行為を課すことはしなかった。
【0051】
7日間の実験を終了し、各マウスの体重を実験開始時の体重と比較したところ、2−デオキシグルコースを投与した過食マウスBにおいては、投与しなかった過食マウスAと比較して体重の増加が有意に抑えられ、目的とする肥満予防効果を確認することができた。同様に、2−デオキシグルコースを投与した節食マウスFにおいては、投与しなかった節食マウスEと比較して体重の減少が有意に進み、目的とする肥満改善効果を確認することができた。また、2−アミノ−2−デオキシグルコースを、本発明の数値範囲内の量で投与した過食マウスCにおいては、先行技術の最大値(実施例1のマウスGの投与量)の量を投与した過食マウスDと比較して体重の増加が有意に抑えられ、先行技術にはない肥満予防効果を確認することができた。同様に、本発明の数値範囲内の量を投与した節食マウスGにおいては、先行技術の最大値の量を投与した節食マウスHと比較して体重の減少が有意に進み、先行技術とは異なる肥満改善効果を確認することができた。
【表2】


【実施例3】
【0052】
表3で示すように、実施例2で用いたマウスを実験終了直後に屠殺し、水中体重秤量法を用いて各マウスの体脂肪率を測定した。測定には、温水を入れた水槽の上にデジタル計量器を設置し、計量皿に棒を渡してナイロン製の糸でマウスを吊るし、各マウスの体積を測定するようにした。得られた体積から体密度を算出し、Siriの計算式を用いて体脂肪率を算出した。なお、肺の残気量や腸間ガス量については、推定式を用いて補正した。また、測定に用いた温水の温度は屠殺後のマウスの体温と合わせ、マウスの体毛に付着した気泡については十分に除去するよう注意した。
【0053】
測定の結果、実施例2において2−デオキシグルコースを投与した過食マウスBにおいては、投与しなかった過食マウスAと比較して有意に体脂肪率が低く、本発明によってトリアシルグリセロールの合成が抑制されたことが裏づけられ、目的とする肥満予防効果を確認することができた。同様に、2−デオキシグルコースを投与した節食マウスFにおいては、投与しなかった節食マウスEと比較して有意に体脂肪率が低く、本発明によってトリアシルグリセロールの分解が促進されたことが裏づけられ、目的とする肥満改善効果を確認することができた。また、2−アミノ−2−デオキシグルコースを、本発明の数値範囲内の量で投与した過食マウスCにおいては、先行技術の最大値(実施例1のマウスGの投与量)の量を投与した過食マウスDと比較して有意に体脂肪率が低く、本発明によってトリアシルグリセロールの合成が抑制されたことが裏づけられ、先行技術にはない肥満予防効果を確認することができた。同様に、本発明の数値範囲内の量を投与した節食マウスGにおいては、先行技術の最大値の量を投与した節食マウスHと比較して有意に体脂肪率が低く、本発明によってトリアシルグリセロールの分解が促進されたことが裏づけられ、先行技術とは異なる肥満改善効果を確認することができた。
【表3】

【実施例4】
【0054】
表4で示すように、2−アミノ−2−デオキシグルコース塩酸塩の投与による血糖値・体重・体脂肪率の変化を、20〜50歳代の男女6人を被験者として盲検法にて測定した。各測定は朝食前の空腹時に行ない、その際実施例1で用いた血糖測定セットと株式会社タニタのInnerScan〔登録商標〕50V BC−621〔商品名〕を用いた。被験者A〜Fにおいては、偽薬を投与する被験者2名・先行技術の最大値の量を投与する被験者2名・本発明の数値範囲内の量を投与する被験者2名の、合計6名の被験者を無作為に選び、各々の投与物を1日3回各食事の60分前に飲物に溶かして経口投与した。この際どの被験者になにが投与されたかについては、被験者はもちろん試験担当者にもわからないよう注意した。また被験者A〜Cについては、1日のエネルギー所要量の1,35倍の高炭水化物(糖質65% 蛋白質15% 脂質20%)の食事を、1日3回朝・昼・晩に分けて摂取させた。同様に被験者D〜Fについても、1日のエネルギー所要量の0,85倍の低カロリー(糖質45% 蛋白質25% 脂質30%)の食事を、1日3回朝・昼・晩に分けて摂取させた。因に、先行技術の最大値の量とは特許文献3の1日5gのことであり、本発明の数値範囲内の量とは7日間で体重1kgあたり1,5g投与できる量のことである。また、エネルギー所要量の算出については「女子栄養大学出版部 香川芳子五訂増補食品成分表2008(資料編)」を参考にした。なお、試験は26℃の室温の中で21日間実施し、期間中は運動などの強い身体活動を伴うような行為は禁止した。
【0055】
21日間の試験を終了し、各被験者の血糖値・体重・体脂肪率を試験前と比較したところ、本発明の数値範囲内の量を投与した被験者Cにおいては、偽薬を投与した被験者Aおよび先行技術の最大値の量を投与した被験者Bと比較して、血糖値は有意に上昇し、体重・体脂肪率の増加も有意に抑えられたことから、先行技術にはない肥満予防効果を確認することができた。同様に、本発明の数値範囲内の量を投与した被験者Eにおいては、偽薬を投与した被験者Fおよび先行技術の最大値の量を投与した被験者Dと比較して、血糖値は有意に上昇し、体重・体脂肪率の減少も有意に進んだことから、先行技術とは異なる肥満改善効果を確認することができた。因に、被験者C.Eにおいては有効量を7日間に分けて投与したため、血糖値・体重・体脂肪率の有意な変化は8日以降から観察された。これにより、有効量を分量にて投与しても効果が得られることが確認された。
【表4】

【0056】
表には記載していないが、一部の被験者においては有効量を12日間に分けて投与しても上記と同様の結果が得られた。このことから、有効量を分量にて投与できる期間は年齢・性別・体重などの個人差によっても異なるが、凡そ10日前後と結論することができる。この特異な持続効果は、2−アミノ−2−デオキシグルコース類が標的とするタンパク質と特異的に結合することによって達成されるものと考えられるが、有効となる基質量に対してヘキソサミン代謝経路の活性が低い可能性も考えられる。因に、試験において1名の被験者が副作用とみられる下痢を訴えたので、当被験者を試験から除外したことを付け加えておく。
【産業上の利用可能性】
【0057】
本発明は、ヒトおよび哺乳動物における肥満予防や肥満改善用の薬剤・サプリメント・食品・飲料・甘味料などを製造、販売する産業分野で利用することができる。
【図面の簡単な説明】
【0058】
【図1】 本発明に係わる、2−デオキシグルコース類の作用段階や、摂取された糖質や脂質代謝のフィードバック調節による脂質合成経路を表した図である。
【図2】 本発明に係わる、2−アミノ−2−デオキシグルコースの化学構造を表した図である。
【図3】 本発明に係わる、2−デオキシグルコースの化学構造を表した図である。
【特許請求の範囲】
【請求項1】
細胞内において糖質代謝を調節する解糖系のヘキソキナーゼを、2−デオキシグルコースを用いてアロステリックに阻害させることを特徴とした肥満予防の方法。
【請求項2】
前記2−デオキシグルコース類のほか、2−デオキシグルコースからなる化合物を用いることを特徴とした、請求項1記載の肥満予防の方法。
【請求項3】
細胞内において糖質代謝を調節する解糖系のヘキソキナーゼを、2−デオキシグルコースを用いてアロステリックに阻害させることを特徴とした肥満改善の方法。
【請求項4】
前記2−デオキシグルコース類のほか、2−デオキシグルコースからなる化合物を用いることを特徴とした、請求項3記載の肥満改善の方法。
【請求項5】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日につき体重1kgあたり2.5g〜5gの量)を用いて阻害させることを特徴とした肥満予防の方法。
【請求項6】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日につき体重1kgあたり2.5g〜5gの量)を用いることを特徴とした、請求項5記載の肥満予防の方法。
【請求項7】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日につき体重1kgあたり2.5g〜5gの量)を用いて阻害させることを特徴とした肥満改善の方法。
【請求項8】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日につき体重1kgあたり2.5g〜5gの量)を用いることを特徴とした、請求項7記載の肥満改善の方法。
【請求項9】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いて阻害させることを特徴とした肥満予防の方法。
【請求項10】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いることを特徴とした、請求項9記載の肥満予防の方法。
【請求項11】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いて阻害させることを特徴とした肥満改善の方法。
【請求項12】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いることを特徴とした、請求項11記載の肥満改善の方法。
【請求項1】
細胞内において糖質代謝を調節する解糖系のヘキソキナーゼを、2−デオキシグルコースを用いてアロステリックに阻害させることを特徴とした肥満予防の方法。
【請求項2】
前記2−デオキシグルコース類のほか、2−デオキシグルコースからなる化合物を用いることを特徴とした、請求項1記載の肥満予防の方法。
【請求項3】
細胞内において糖質代謝を調節する解糖系のヘキソキナーゼを、2−デオキシグルコースを用いてアロステリックに阻害させることを特徴とした肥満改善の方法。
【請求項4】
前記2−デオキシグルコース類のほか、2−デオキシグルコースからなる化合物を用いることを特徴とした、請求項3記載の肥満改善の方法。
【請求項5】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日につき体重1kgあたり2.5g〜5gの量)を用いて阻害させることを特徴とした肥満予防の方法。
【請求項6】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日につき体重1kgあたり2.5g〜5gの量)を用いることを特徴とした、請求項5記載の肥満予防の方法。
【請求項7】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日につき体重1kgあたり2.5g〜5gの量)を用いて阻害させることを特徴とした肥満改善の方法。
【請求項8】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日につき体重1kgあたり2.5g〜5gの量)を用いることを特徴とした、請求項7記載の肥満改善の方法。
【請求項9】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いて阻害させることを特徴とした肥満予防の方法。
【請求項10】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いることを特徴とした、請求項9記載の肥満予防の方法。
【請求項11】
細胞膜における糖質の取り込みを、インスリンによるシグナル伝達経路の段階、またはGLUT4のトランスロケーションの段階において、2−アミノ−2−デオキシグルコース(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いて阻害させることを特徴とした肥満改善の方法。
【請求項12】
前記2−デオキシグルコース類のほか、2−アミノ−2−デオキシグルコースからなる化合物(1日または10日以内の複数日にわたり体重1kgあたり1.5g〜5g前後の量)を用いることを特徴とした、請求項11記載の肥満改善の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2009−209141(P2009−209141A)
【公開日】平成21年9月17日(2009.9.17)
【国際特許分類】
【出願番号】特願2009−41430(P2009−41430)
【出願日】平成21年1月30日(2009.1.30)
【出願人】(307027197)
【Fターム(参考)】
【公開日】平成21年9月17日(2009.9.17)
【国際特許分類】
【出願日】平成21年1月30日(2009.1.30)
【出願人】(307027197)

【Fターム(参考)】
[ Back to top ]

