2−ヒドロキシ−5−フェニル安息香酸誘導体の処方および使用
【課題】総メサラミン(5−ASAおよびNASA)の全身のレベルを減少させ、かつ全身の循環において5−ASAのレベル(例えば、5−ASAに対するNASAの比)の減少を犠牲にしてNASAの全身のレベルを増大する用法を提供する。
【解決手段】5−アミノサリチル酸化合物のバイオアベイラビリティを食物と一緒の経口投与型の投与によって増大する方法、ならびに適切な容器中に5−アミノサリチル酸化合物の経口投与型を含む製品、およびそれに関連する、食品とともに摂取された場合その容器中の医薬のバイオアベイラビリティの増大を記載する印刷された表示が提供される。
【解決手段】5−アミノサリチル酸化合物のバイオアベイラビリティを食物と一緒の経口投与型の投与によって増大する方法、ならびに適切な容器中に5−アミノサリチル酸化合物の経口投与型を含む製品、およびそれに関連する、食品とともに摂取された場合その容器中の医薬のバイオアベイラビリティの増大を記載する印刷された表示が提供される。
【発明の詳細な説明】
【背景技術】
【0001】
バルサラジド二ナトリウムは、基準のブランド薬COLAZAL(登録商標)の製剤原料である。COLAZALは、消化器系の疾患、例えば軽度から中度の活動性の潰瘍性大腸炎、放射線性直腸S状結腸炎および結腸癌の処置に指示される(特許文献1を参照のこと)。バルサラジドは、結腸特異的、非ステロイド性、抗炎症性アミノサリチル酸誘導体である。バルサラジドはまた、ジアゾ結合によって4−アミノベンゾイル−β−アラニン(「4−ABA」)に結合された5−ASAを含むプロドラッグである。5−ASAはバルサラジドの活性な治療性部分であるが、これは粘膜中の代謝性N−アセチル−5−ASA(NASA)に急速に変換される(非特許文献1)。全身に吸収される5−ASAの経口用量のうち2%未満というのに比較して、血中ではこの代謝物として経口用量のうち約12%が測定され得る(COLAZAL、2006年9月、添付文書)。NASAは結腸中で低い抗炎症性活性であることが公知であり(非特許文献2)、従って、全身に循環されるとき毒性が低いと考えられる。
【0002】
5−アミノサリチル酸化合物、例えば、バルサラジドの薬物動態に対する食物の影響を評価するような薬物動態学的研究は以前には行われていない。発現の速度および治療効果の大きさをともに増大させるためには、製剤原料のバイオアベイラビリティがより大きくかつ全身の吸着がより少ないことが求められている。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】国際公開第95/18622号パンフレット
【非特許文献】
【0004】
【非特許文献1】Allgayer H、Ahnfelt NO,Kruis Wら,Gastroenterology.1989;97;38〜41
【非特許文献2】van Hogezand RA,van Hees PA,van Gorp JP,van Lier HJ,Bakker JH,Double−blind comparison of 5−aminosalicylic acid and acetyl−5−aminosalicylic acid suppositories in subjects with idiopathic proctitis.Aliment Pharmacol.Ther.1988:Feb;2(1):33〜40
【発明の概要】
【発明が解決しようとする課題】
【0005】
従って、総メサラミン(5−ASAおよびNASA)の全身のレベルを減少させ、かつ全身の循環において5−ASAのレベル(例えば、5−ASAに対するNASAの比)の減少を犠牲にしてNASAの全身のレベルを増大する用法が必要である。結腸において5−ASAの移行を遅らせる用法も当該分野では必要である。なぜなら、この用法によって、結腸粘膜との接触時間の延長および薬物の有効性の増大が得られるからである。
【課題を解決するための手段】
【0006】
本発明は、消化器系の障害を処置、予防、または寛解するためのバルサラジドの使用に関する。さらに詳細には、本発明は、潰瘍性大腸炎、放射線腸炎、過敏性腸症候群、ならびにメサラミンおよびバルサジドに応答する他の非炎症性消化器(GI)状態を処置するための5−アミノサリチル酸化合物、例えば、バルサラジドの使用に関する(参照によっ
て本明細書に援用される、米国特許第326,364号;同第6,551,632号;6,475,518号;同第6,426,338号;同第6,277,836号;同第5,519,014号;同第5,476,669号;同第5,196,205号および同第6,645,530号)。本発明はまた、消化器系疾患を処置するためのバルサラジドの使用であって、単独または他の治療剤と組み合わせた使用に関する。
【0007】
本発明は、バルサラジドを食物とともに投与することが、ヒト被験体において経口型を介する5−ASAのバイオアベイラビリティを増大し、かつ全身吸着を減らすという予期されない知見に部分的には起因する。
【0008】
一局面では、本明細書で提供されるのは、被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する、5−アミノサリチル酸化合物のバイオアベイラビリティを増大する方法である。
【0009】
一実施形態では、5−アミノサリチル酸化合物のバイオアベイラビリティは、5−アミノサリチル酸化合物を食物なしに投与することと比較して増大されている。
【0010】
一局面では、被験体の結腸に対する5−ASAのバイオアベイラビリティを増大する方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する方法が本明細書において提供される。
【0011】
別の実施形態では、5−ASAのバイオアベイラビリティは、5−アミノサリチル酸化合物を食物なしに投与することと比較して増大される。
【0012】
一局面では、被験体の結腸における5−ASAの通過を遅らせる方法であって、治療上有効な量の5−アミノサリチル酸化合物をその必要な被験体に対して食物とともに投与することを包含する方法が提供される。
【0013】
一実施形態によれば、5−ASAの通過は、5−アミノサリチル酸化合物を食物なしに投与することと比較して増大される。
【0014】
一局面では、被験体における5−ASAの全身のレベルを減少させる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する方法が提供される。
【0015】
別の実施形態によれば、5−ASAの全身のレベルは、5−アミノサリチル酸化合物を食物なしに投与することと比較して減少される。
【0016】
一局面では、被験体における5−アミノサリチル酸化合物の最大血漿濃度(Cmax)を減少させる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する方法が本明細書において提供される。
【0017】
別の実施形態によれば、5−アミノサリチル酸化合物のCmaxは、5−アミノサリチル酸化合物を食物なしに投与することと比較して減少される。
【0018】
一局面では、被験体における5−アミノサリチル酸化合物のTmaxを遅らせる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する方法が本明細書において提供される。
【0019】
一実施形態によれば、5−アミノサリチル酸化合物のTmaxは、5−アミノサリチル酸化合物を食物なしに投与することと比較して遅延される。
【0020】
一局面では、被験体における5−アミノサリチル酸化合物の吸収の程度(AUClast)を遅らせる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する方法が本明細書において提供される。
【0021】
別の実施形態によれば、5−アミノサリチル酸化合物のAUClastは、5−アミノサリチル酸化合物を食物なしに投与することと比較して低下される。
【0022】
一局面では、被験体における5−ASAに対するNASAの全身比を増大する方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する方法が本明細書において提供される。
【0023】
一実施形態によれば、5−ASAに対するNASAの全身比は、5−アミノサリチル酸化合物を食物なしに投与することに比較して増大される。
【0024】
一局面では、被験体における5−ASAからNASAへの変換を増大する方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する方法が本明細書において提供される。
【0025】
別の実施形態によれば、5−ASAからNASAへの変換は、5−アミノサリチル酸を食物なしに投与することに比較して、治療上有効な量の5−アミノサリチル酸化合物を投与された被験体において増大される。
【0026】
別の実施形態では、5−アミノサリチル酸化合物は、メサラミン、スルファサラジン、オルサラジン、イプサラジン、サリチルアゾ安息香酸、またはバルサラジドのうちの1つ以上を含む。
【0027】
一実施形態では、5−アミノサリチル酸化合物は、式IVの化合物を含む。
【0028】
【化1】

一実施形態では、この治療上有効な量は、約6.25mg〜約7000mg/日を含む。
【0029】
別の実施形態では、この治療上有効な量は、約750mg〜約6750mg/日を含む。
【0030】
一実施形態では、この治療上有効な量は、毎日3回3錠剤の処方物の用法であって、各々の錠剤は、約750mgの5−アミノサリチル酸化合物を含む。
【0031】
別の実施形態では、この治療上有効な量は、毎日3回2錠剤の処方物の用法であって、各々の錠剤は、約1125mgの5−アミノサリチル酸化合物を含む。
【0032】
別の実施形態では、この治療上有効な量は、毎日3回1錠剤の用法であって、各々の錠剤は、約2250mgの5−アミノサリチル酸化合物を含む。
【0033】
別の実施形態では、この治療上有効な量とは、1日あたり体重70kgあたり約1〜約14gの間におよぶ用法である。
【0034】
別の実施形態では、被験体に対する投与は、食物消費前約30分から食物消費後約2時間の間に行う。一実施形態によれば、被験体に対する投与は食物の消費と実質的に同じ時点である。別の実施形態では、被験体に対する投与は食物の消費の直後から消費の約1時間後までである。
【0035】
別の実施形態では、この治療上有効な量は、錠剤、カプセル、液体、懸濁液、坐剤または浣腸の形態で薬学的組成物を含む。
【0036】
一局面では、被験体において経時的に血流中で得られる薬物の濃度またはその代謝物によって測定される、バルサラジドの経口剤形の吸収の速度および程度を減少させる方法であって、この被験体に対して治療上有効な量のバルサラジドを薬学的組成物中で食物とともに投与することを包含する方法が本明細書で提供される。
【0037】
一局面では、このバルサラジドは、食物とともに投与することが食物なしでの投与に比較して、バルサラジドの最大血漿濃度(Cmax)および吸収の程度(AUClast)の減少を生じるということを告知する表示を備える容器由来である。
【0038】
一局面では、消化器系疾患の処置においてバルサラジドを用いる方法であって、治療上有効な量のバルサラジドを食物とともに投与することが、食物なしの投与と比較してバルサラジドのCmax、AUClast、または全身の吸着のうちの少なくとも1つにおける低下を生じるという情報を消化器系の疾患を有する被験体に伝える工程を包含する、方法が本明細書で提供される。
【0039】
一局面では、消化器系障害の処置においてバルサラジドを用いる方法であって:バルサラジドを食物とともに投与することが食物なしの投与と比較して被験体の結腸に対するバルサラジドまたはその代謝物のバイオアベイラビリティを増大するという情報を備える容器からバルサラジドを得る工程と、このバルサラジドを食物とともに摂取する工程とによって、バルサラジドの経口バイオアベイラビリティを変更する工程を包含する、方法が本明細書で提供される。
【0040】
一局面では、消化器系障害の処置においてバルサラジドを用いる方法であって:処置の必要な被験体に対して治療上有効な量のバルサラジドを食物とともに投与することであって、このバルサラジドの食物との投与が、絶食状態におけるバルサラジドの投与と比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける低下を生じる工程と;治療上有効な量のバルサラジドの薬学的組成物中での食物との投与が、絶食状態における投与に比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける1つ以上の低下を生じるという情報をこの被験体に伝える工程とを包含する、方法が本明細書で提供される。
【0041】
35別の実施形態では、上記バルサラジドは、食物との投与が絶食状態での投与に比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける低下を生じるということを告知する印刷された表示を有する容器由来である。
【0042】
別の実施形態では、上記バルサラジドは錠剤型で提供される。
【0043】
別の実施形態では、上記バルサラジドは750mgの錠剤型で提供される。
【0044】
別の実施形態では、上記印刷された表示は、バルサラジドと食物との投与がCmaxの約10〜約70%の低下を生じるということを告知する。関連の実施形態では、バルサラジドと食物との投与はCmaxの約20〜約60%の低下を生じる。関連の実施形態では、バルサラジドと食物との投与はCmaxの約30〜約50%の低下を生じる。関連の実施形態ではバルサラジドと食物との投与はCmaxの約45〜約55%の低下を生じる。
【0045】
別の実施形態では、上記印刷された表示は、バルサラジドと食物との投与がAUClastの約10〜約70%の低下を生じるということを告知する。関連の実施形態では、バルサラジドと食物との投与はAUClastの約20〜約60%の低下を生じる。関連の実施形態では、バルサラジドと食物との投与はAUClastの約30〜約50%の低下を生じる。関連の実施形態ではバルサラジドと食物との投与はAUClastの約45〜約55%の低下を生じる。
【0046】
別の実施形態では、上記印刷された表示は、バルサラジドと食物との投与が5−ASAに対するNASAの全身比の約10〜約100%の増大を生じるということをさらに告知する。関連の実施形態では、バルサラジドと食物との投与が5−ASAに対するNASAの全身比の約20〜約90%の増大を生じる。関連の実施形態では、バルサラジドと食物は5−ASAに対するNASAの全身比の約30〜約80%の増大を生じる。関連の実施形態では、バルサラジドと食物とは5−ASAに対するNASAの全身比の約30〜約70%の増大を生じる。関連の実施形態では、バルサラジドと食物とは5−ASAに対するNASAの全身比の約40〜約60%の増大を生じる。関連の実施形態では、バルサラジドと食物とは5−ASAに対するNASAの全身比の約50%の増大を生じる。
【0047】
一局面では、本明細書では、ヒト被験体における細菌種の増殖を阻害する方法であって、細菌感染または異常増殖を有するヒト被験体に対して、ヒト被験体中で細菌種の増殖を阻害するのに有効な用量で5−アミノサリチル酸化合物を含む薬学的に受容可能な組成物と食物とを投与すること、を包含する方法が提供される。
【0048】
一実施形態によれば、上記5−アミノサリチル酸化合物は、メサラミン、スルファサラジン、オルサラジン、イプサラジン、サリチルアゾ安息香酸、バルサラジド、または抱合胆汁酸を含む。
【0049】
一実施形態によれば、上記細菌種は、Clostridium種、嫌気性細菌、または好気性細菌のうちの1つ以上を含む。
【0050】
一実施形態によれば、上記Clostridium種はClostridium perfringens、Clostridium difficile、Clostridium botulinum、またはClostridium tetaniである。本発明の他の実施形態は以下に開示される。
本発明はまた、以下の項目を提供する。
(項目1)
5−アミノサリチル酸化合物のバイオアベイラビリティを増大する方法であって、治療上有効な量の該5−アミノサリチル酸化合物を食物とともに被験体に投与することを包含する方法。
(項目2)
上記5−アミノサリチル酸化合物のバイオアベイラビリティが、該5−アミノサリチル酸化合物を食物なしに投与することと比較して増大される、項目1に記載の方法。
(項目3)
被験体の結腸に対する5−ASAのバイオアベイラビリティを増大する方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要がある被験体に投与することを包含する方法。
(項目4)
上記5−ASAのバイオアベイラビリティが、該5−アミノサリチル酸化合物を食物なしに投与することと比較して増大されている、項目3に記載の方法。
(項目5)
被験体の結腸における5−ASAの通過を遅らせる方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要な被験体に投与することを包含する方法。
(項目6)
上記5−ASAの通過が、該5−アミノサリチル酸化合物を食物なしに投与することと比較して増大されている、項目5に記載の方法。
(項目7)
被験体における5−ASAの全身のレベルを減少させる方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要な被験体に投与することを包含する方法。
(項目8)
上記5−ASAの全身のレベルが、該5−アミノサリチル酸化合物を食物なしに投与することと比較して減少されている、項目7に記載の方法。
(項目9)
被験体における5−アミノサリチル酸化合物の最大血漿濃度(Cmax)を減少させる方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要な被験体に投与することを包含する方法。
(項目10)
上記5−アミノサリチル酸化合物のCmaxが、該5−アミノサリチル酸化合物を食物なしに投与することと比較して減少されている、項目9に記載の方法。
(項目11)
被験体における5−アミノサリチル酸化合物のTmaxを遅らせる方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要な被験体に投与することを包含する方法。
(項目12)
上記5−アミノサリチル酸化合物のTmaxが、該5−アミノサリチル酸化合物を食物なしに投与することと比較して遅延されている、項目11に記載の方法。
(項目13)
被験体における5−アミノサリチル酸化合物の吸収の程度(AUClast)を遅らせる方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要な被験体に投与することを包含する方法。
(項目14)
上記5−アミノサリチル酸化合物のAUClastが、該5−アミノサリチル酸化合物を食物なしに投与することと比較して低下されている、項目13に記載の方法。
(項目15)
被験体における5−ASAに対するNASAの全身比を増大する方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要な被験体に投与することを包含する方法。
(項目16)
上記5−ASAに対するNASAの上記全身比が、該5−アミノサリチル酸化合物を食物なしに投与することに比較して増大されている、項目15に記載の方法。
(項目17)
被験体における5−ASAからNASAへの変換を増大する方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要な被験体に投与することを包含する方法。
(項目18)
5−ASAからNASAへの上記変換が、該5−アミノサリチル酸化合物を食物なしに投与することに比較して、治療上有効な量の5−アミノサリチル酸化合物を投与された上記被験体において増大されている、項目17に記載の方法。
(項目19)
上記5−アミノサリチル酸化合物が、メサラミン、スルファサラジン、オルサラジン、イプサラジン、サリチルアゾ安息香酸、またはバルサラジドのうちの1つ以上を含む、項目1〜18のうちのいずれか1項に記載の方法。
(項目20)
上記治療上有効な量が、約6.25mg/日と約7000mg/日の間を含む、項目1〜18のいずれか1項に記載の方法。
(項目21)
上記治療上有効な量が、約750mg/日と約6750mg/日の間を含む、項目1〜18のいずれか1項に記載の方法。
(項目22)
上記治療上有効な量が、毎日3回3錠剤の処方物の用法であって、各々の錠剤が、約750mgの上記5−アミノサリチル酸化合物を含む、項目1〜18のいずれか1項に記載の方法。
(項目23)
上記治療上有効な量が、毎日3回2錠剤の処方物の用法であって、各々の錠剤が、約1125mgの上記5−アミノサリチル酸化合物を含む、項目1〜18のいずれか1項に記載の方法。
(項目24)
上記治療上有効な量が、毎日3回1錠剤の用法であって、各々の錠剤が、約2250mgの5−アミノサリチル酸化合物を含む、項目1〜18のいずれか1項に記載の方法。
(項目25)
上記治療上有効な量が、1日あたり体重70kgあたり約1g〜約14gの間におよぶ用法である、項目1〜18のいずれか1項に記載の方法。
(項目26)
上記被験体に対する投与が、食物消費前約30分から食物消費後約2時間の間に行われる、項目1〜18のいずれか1項に記載の方法。
(項目27)
上記被験体に対する投与が食物の消費と実質的に同じ時点である、項目1〜18のいずれか1項に記載の方法。
(項目28)
上記被験体に対する投与が食物の消費の直後から消費の約1時間後までである、項目1〜18のいずれか1項に記載の方法。
(項目29)
上記治療上有効な量が、錠剤、カプセル、液体、懸濁液、坐剤または浣腸の形態で薬学的組成物に含まれる、項目1〜18のいずれか1項に記載の方法。
(項目30)
被験体において経時的に血流中で得られる薬物の濃度またはその代謝物によって測定される、バルサラジドの経口剤形の吸収の速度および程度を減少させる方法であって、治療上有効な量の薬学的組成物中のバルサラジドを食物とともに該被験体に投与することを包含する方法。
(項目31)
食物とともに投与することが、食物なしでの投与に比較して、バルサラジドの最大血漿濃度(Cmax)および吸収の程度(AUClast)の減少を生じるということを告知する表示を備える容器に上記バルサラジドが由来する、項目30に記載の方法。
(項目32)
消化器系疾患の処置においてバルサラジドを用いる方法であって:治療上有効な量のバルサラジドを食物とともに投与することが、食物なしの投与と比較してバルサラジドのCmax、AUClast、または全身の吸着のうちの少なくとも1つにおける低下を生じるという情報を被験体に伝える工程を包含する、方法。
(項目33)
消化器系障害の処置においてバルサラジドを用いる方法であって:バルサラジドを食物とともに投与することが食物なしの投与と比較して被験体の結腸に対するバルサラジドまたはその代謝物のバイオアベイラビリティを増大するという情報を備える容器からバルサラジドを得る工程と、該バルサラジドを食物とともに摂取する工程とによって、バルサラジドの経口バイオアベイラビリティを変更する工程を包含する、方法。
(項目34)
消化器系障害の処置においてバルサラジドを用いる方法であって:処置の必要な被験体に対して治療上有効な量のバルサラジドを食物とともに投与する工程であって、該バルサラジドの食物との投与が、絶食状態におけるバルサラジドの投与と比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける低下を生じる工程と;治療上有効な量の薬学的組成物中のバルサラジドの食物との投与が、絶食状態における投与に比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける1つ以上の低下を生じるという情報を該被験体に伝える工程とを包含する、方法。
(項目35)
上記バルサラジドが、食物とともに投与することが絶食状態での投与に比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける低下を生じるということを告知する印刷された表示を有する容器由来である、項目34に記載の方法。
(項目36)
上記バルサラジドが錠剤型で提供される、項目35に記載の方法。
(項目37)
上記バルサラジドが750mgの錠剤型で提供される、項目36に記載の方法。
(項目38)
上記印刷された表示が、上記バルサラジドと食物との投与がCmaxの約10%〜約70%の低下を生じるということを告知する、項目35に記載の方法。
(項目39)
上記印刷された表示が、上記バルサラジドと食物との投与がAUClastの約10%〜約70%の低下を生じるということを告知する、項目35に記載の方法。
(項目40)
上記印刷された表示が、バルサラジドと食物との投与が5−ASAに対するNASAの全身比の約10〜約100%の増大を生じるということをさらに告知する、項目35に記載の方法。
(項目41)
ヒト被験体における細菌種の増殖を阻害する方法であって:
細菌感染または異常増殖を有するヒト被験体に対して、該ヒト被験体中で細菌種の増殖を阻害するのに有効な用量で5−アミノサリチル酸化合物を含む薬学的に受容可能な組成物と食物とを投与すること、を包含する方法。
(項目42)
上記、5−アミノサリチル酸化合物が、メサラミン、スルファサラジン、オルサラジン、イプサラジン、サリチルアゾ安息香酸、バルサラジド、または抱合胆汁酸である、項目41に記載の方法。
(項目43)
上記細菌種が、Clostridium種、嫌気性細菌、または好気性細菌のうちの1つ以上を含む、項目42に記載の方法。
(項目44)
上記Clostridium種がClostridium perfringens,Clostridium difficile,Clostridium botulinum、またはClostridium tetaniである、項目43に記載の方法。
【図面の簡単な説明】
【0051】
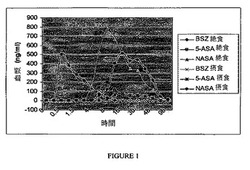
【図1】図1は、絶食状態および摂食状態におけるヒト被験体に投与された場合のバルサラジドおよびその重要な代謝物の薬物動態学的プロフィールを示す。
【図2】図2は、絶食状態および摂食状態における血漿の5−ASAに対するNASAの比をCmaxおよびAUClastについて示す。
【発明を実施するための形態】
【0052】
本明細書に開示されるのは、5−アミノサリチル酸化合物の組成物を食物とともに投与することにより、この化合物のバイオアベイラビリティを増大することによって消化器系の障害を処置する組成物および方法である。
【0053】
本発明のさらなる説明の前に、かつ本発明がさらに容易に理解され得るように、特定の用語を最初に規定し、かつ本明細書において便宜のために収集する。
【0054】
本明細書で用いられる共通の薬理学的用語は以下のとおりである:Tmax(最大濃度までの時間);Cmax(観察される最大濃度);kel(濃度/時間の曲線の終末直線部分の勾配);T1/2(以下のように算出された5−アミノサリチル酸化合物の半減期:0.693/Kel);AUC(last)(台形法則によって測定した最終の定量化可能濃度に対する曲線下面積);およびAUC(inf)(以下のように算出されたインフィニティに対して外挿されたAUC値:AUC(inf)=AUC(last)+C(t)last/Kel、ここでC(t)lastは最終の測定可能な濃度である)。
【0055】
「投与」または「投与すること」という用語は、被験体に対して5−アミノサリチル酸化合物を導入してその意図する機能を果たす経路を包含する。用いられ得る投与経路の例としては、注射(皮下、静脈内、非経口、腹腔内、クモ膜下腔内)、経口、吸入、直腸および経皮が挙げられる。薬学的調製物は、各々の投与経路に適切な形態で与えられてもよい。例えば、これらの調製物は、錠剤型またはカプセル型で、注射、吸入、眼薬、点眼液、軟膏、坐剤など、注射による投与、注入または吸入によって;ローションまたは軟膏による局所投与;ならびに坐剤により直腸に投与される。経口投与が好ましい。注射はボーラスであってもよいし、または連続インフュージョン(注入)であってもよい。投与経路次第で、5−アミノサリチル酸化合物を、コーティングするか、または選択された物質中に配置させて、それを、その意図される機能を果たす能力を有害に果たし得る天然の条件から防御してもよい。5−アミノサリチル酸化合物は、単独で投与されてもよいし、または上記のような別の薬剤(単数または複数)と、もしくは薬学的に受容可能なキャリアと、またはその両方と組み合わせて投与されてもよい。5−アミノサリチル酸化合物は、他の薬剤の投与の前に、その薬剤と同時に、またはその薬剤の投与後に投与されてもよい。さらに、5−アミノサリチル酸化合物はまた、その活性な代謝物、またはさらに活性な代謝物へとインビボで変換されるプレ型で投与されてもよい。
【0056】
「化学療法」とは本明細書において用いる場合、新生物の疾患経過(一般にはガン)の処置のために全身投与される治療を包含し、例えば、生物学的な治療剤、例えば、低分子インヒビター、モノクローナル抗体(例えば、Iressa、Tarceva,Erubitux)、または本明細書に記載される症状などを生じ得る類似の目的物とともに投与される他の生物製剤、例えば、下痢の不均衡な頻度または下痢のリスクの増大を生じるものを包含し得る。
【0057】
「有効な量」という用語は、所望の結果を達成するために必要な、例えば、細菌またはウイルスの感染を処置または予防するために十分な、用量かつ時間で有効な量を包含する。5−アミノサリチル酸化合物の有効量は、被験体の疾患の状態、年齢および体重などの因子、ならびに5−アミノサリチル酸化合物が被験体において所望の応答を惹起するための能力に従って変化し得る。用法は、最適の治療応答を得るために調節されてもよい。有効量とはまた、5−アミノサリチル酸化合物の任意の毒性または有害な効果(例えば、副作用)を、治療上有益な効果が上回る量である。
【0058】
「寛解させる」、「寛解」、「改善」などは、例えば、被験体において、または被験体の少なくともわずかで、例えば、少なくとも約2%、5%、10%、15%、20%、25%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、98%、100%において、またはこれらの値のうちのおよその任意の2つの間の範囲で生じる改善と一致する、検出可能な改善または検出可能な変化を指す。このような改善または変化は、バルサラジドで処置されていない被験体に比較して処置された被験体で観察され得、ここでこの未処置の被験体は、同じもしくは類似の疾患、状態、症状などを有するか、または発症しやすい。疾患、状態、症状もしくはアッセイパラメータの寛解は、主観的に、または客観的に、例えば、被験体(単数または複数)による自己評価、臨床医の評価によって、または適切なアッセイもしくは測定(生活の質の評価、疾患(単数または複数)もしくは状態(単数または複数)の進行、疾患(単数または複数)もしくは状態(単数または複数)の重篤度の低下、または生体分子(単数または複数)、細胞(単数または複数)のレベルもしくは活性(単数または複数)の適切なアッセイ(単数または複数)を包含する)を行うことによって、または被験体内の腸炎もしくは下痢の検出によって、決定され得る。寛解は、一過性であっても、長期であっても、もしくは永続的であってもよいし、あるいは5−アミノサリチル酸化合物が被験体に投与されるかまたは本明細書もしくは引用文献に記載されるアッセイもしくは他の方法で用いられる間にもしくは後に、関連時間で、例えば、以下に記載される時間枠内で、または5−アミノサリチル酸化合物の投与もしくは使用の約1時間後から被験体(単数または複数)が5−アミノサリチル酸化合物を与えられた後約、3、6、9カ月以上まで、変化してもよい。
【0059】
本明細書において用いる場合、「旅行(travel)」または「リスク条件で(at
risk conditions)」とは、下痢を起こし得る出発、および到着、および目的地にあること、あるいは下痢の原因もしくは潰瘍性大腸炎を起こすかもしくは増悪し得る状態と被験体を接触させる行動、あるいは消化器系のガンのリスクに、例えば、遺伝性素因に、または環境的原因もしくは他の原因にあることを包含するものとする。
【0060】
本明細書において用いる場合、「食物とともに投与される」とは、例えば、任意の食品、固体もしくは液体と、カロリーのある内容物とをいう。好ましくは、食物とは、十分なバルクおよび脂肪含量の固形食品であって、胃に急速に溶解および吸収されない食品である。さらに好ましくは、食物とは、食事、例えば、朝食、昼食、または夕食である。5−アミノサリチル酸化合物の投薬量は、被験体に対して、例えば、食事の約30分前〜約2時間後に投与され得、最も有利には、この投薬量は、食事を食べた15分内に投与される。「食物なし」、「絶食された」および「空の胃」という用語は、例えば、このような消費の約1時間前から約2時間後まで固形の食物を与えられていない状態をいう。
【0061】
例えば、症状、分子の値もしくは生物学的活性などの「調節」とは、例えば、症状または活性などが、検出可能な増大または減少をされることをいう。このような増大または減少は、5−アミノサリチル酸化合物で処置されていない被験体に比較して処置された被験体で観察され得、この未処置の被験体は同じまたは同様の疾患、状態、症状などを有するかまたは発症しやすい。このような増大または減少は、少なくとも約2%、5%、10%、15%、20%、25%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、98%、100%、150%、200%、250%、300%、400%、500%、1000%以上であっても、またはこれらの値の任意の2つの間の任意の範囲内であってもよい。調節は、主観的にまたは客観的に、例えば、被験体の自己評価によって、臨床医の評価によって、または適切なアッセイもしくは測定(例えば、生活の質の評価、または被験体内の分子、細胞、細胞遊走の値もしくは活性の適切なアッセイを含む)を行うことによって、決定され得る。調節は、一過性であっても、長期であっても、もしくは永続的であってもよいし、あるいは5−アミノサリチル酸化合物が被験体に投与されるかまたは本明細書もしくは引用文献に記載されるアッセイもしくは他の方法で用いられる間にもしくは後に、関連時間で、例えば、以下に記載される時間内で、または5−アミノサリチル酸化合物の投与もしくは使用の約1時間後から被験体(単数または複数)が5−アミノサリチル酸化合物を与えられた後約、3、6、9カ月以上まで変化してもよい。「調節する」という用語はまた、5−アミノサリチル酸化合物に対する暴露に対する応答において細胞の活性における増大または減少、例えば、所望の最終結果が達成されるような、動物における細胞の少なくとも小集団の増殖および/または分化の誘導の阻害をいい、例えば、処置の用いられる5−アミノサリチル酸化合物の治療結果が、特定の処置の経過にわたって増大しても減少してもよい。
【0062】
「5−アミノサリチル酸化合物を得る」という場合の「得る(obtaining)」という用語は、5−アミノサリチル酸化合物を購入するか、合成するか、そうでなければ獲得する工程を包含するものとする。
【0063】
「非経口投与」および「非経口的に投与される」という句は、本明細書において用いる場合、例えば、通常は注射による、腸内および局所投与以外の投与の方式を包含し、そして限定はしないが、静脈内、筋肉内、動脈内、クモ膜下腔内、関節内、眼窩内、心臓内、皮内、腹腔内、経気管、皮下、表皮下、関節内、被膜下、クモ膜下、脊髄内、および胸骨内の注射および注入が挙げられる。
【0064】
化合物の「予防上有効な量」という言葉は、被験体に対する単回または複数回の用量の際に、腸炎および/または下痢を予防または処置するのに有効である5−アミノサリチル酸化合物の量をいう。
【0065】
「全身投与」、「全身的に投与される」、「末梢投与」、および「末梢に投与される」という句は、本明細書において用いる場合、5−アミノサリチル酸化合物、薬物または他の物質の投与であって、その結果被験体の系に入り、従って、代謝および他の同様のプロセスに供される投与、例えば、皮下投与を意味する。
【0066】
5−アミノサリチル酸化合物の「治療上有効な量」という言葉は、被験体に対する単回または複数回の用量の際、細菌の増殖および/もしくは浸潤を阻害するのに、または被験体における細菌感染(このような細菌感染は、処置のない場合には予想されるよりはやい)の症状の軽減に有効である5−アミノサリチル酸化合物の量をいう。「治療上有効な量」とはまた、治療(例えば、5−アミノサリチル酸化合物を含む組成物)の量であって、腸炎および/または下痢の重篤度を軽減する、腸炎および/または下痢の期間を短くする、腸炎および/または下痢の進行を妨げる、腸炎および/または下痢の回帰を生じる、腸炎および/または下痢に関連する1つ以上の症状を緩和する、あるいは別の治療の治療効果(単数または複数)を増強、促進、または改善するのに十分な量をいう。
【0067】
本明細書において用いる場合、「予防する」、「予防すること」および「予防」という用語は、腹骨盤治療の投与から、または旅行から生じる被験体における腸炎および/もしくは下痢、またはその1つ以上の症状の再発、発現または発症の予防をいう。予防(すること)としては、放射線誘発性腸炎に対する防御、結腸の粘膜に対する放射線誘発性損傷に対する防御、放射線誘発性結腸直腸炎症に対する防御、および/または消化管の他の部分の放射線誘発性炎症もしくは細菌浸潤が挙げられる。例えば、5−アミノサリチル酸化合物は、放射線誘発性食道炎または他の放射線誘発性粘膜炎を処置または緩和するための口腔洗浄液として処方されてもよい。例えば、5−アミノサリチル酸化合物は、腸炎または下痢を軽減または予防するために旅行の前に旅行者に与えてもよい。
【0068】
本明細書において用いる場合、「予防上有効な量」という用語は、治療(例えば、5−アミノサリチル酸化合物を含む組成物)の量であって、腸炎および/もしくは下痢またはその1つ以上の症状の発症、再発、または発現の予防を生じるのに、あるいは別の治療の予防的効果(単数または複数)を増強または改善するのに十分な量をいう。
【0069】
本明細書において用いる場合、「被験体(subject)(単数および複数)」という用語は、腸炎および/または下痢に罹患し得るか、または本発明の5−アミノサチリル酸化合物の投与から利益を得ることができる生物体を包含し、動物、好ましくは哺乳動物を指し、この哺乳動物には非霊長類(例えば、ウシ、ブタ、ウマ、ネコまたはイヌ)、霊長類(例えば、サル、チンパンジー、またはヒト)、およびさらに好ましくはヒトが包含される。特定の実施形態では、被験体とは哺乳動物、好ましくはヒトであって、腸炎および/または下痢を誘発し得る侵襲(例えば、放射線、化学療法、または化学兵器、または旅行の間に遭遇した病原体)に曝されたか、またはそれに曝されている。別の実施形態では、この被験体は家畜(例えば、ウマ、ブタ、またはウシ)、またはペット(例えば、イヌまたはネコ)であって、同様の侵襲に曝されたか、または曝されている。
【0070】
消化器系疾患、例えば、腸炎、下痢、結腸癌、大腸炎に対する感受性としては、消化器系疾患を発症するリスクのある被験体、例えば、腹骨盤療法を受けているか受けようとしている被験体、旅行しようとしている被験体、または旅行中であるかまたはそうでなければ病原体もしくは状態、例えば、自然災害、例えば、洪水、ハリケーン、地震、ツナミなどに曝されているリスクの被験体、過去に腸炎に罹患した被験体、結腸炎もしくはガンの家族歴を有する被験体などを包含することが意味される。
【0071】
本明細書において用いる場合、「放射線」、「放射線療法(radiation therapy)」、「放射線治療(radiotherapy)」および「照射」という用語は、意図的または非意図的、悪意または治療的のいずれであろうと、電離放射線に対する任意の暴露を指し、例えば、外部ビーム放射線、光子照射療法、電子照射治療、陽子放射線療法、炭素イオン照射療法、リチウムイオン照射療法、ケイ素イオン照射療法、ヘリウムイオン照射療法、他の形態のハドロン療法または他の粒子治療、近接照射療法、放射性同位体療法、注射用同位体、例えば、任意の種類のマトリックスに固定されるかその中であるかもしくはそれと混合された同位体、または、使用される薬剤(単数または複数)とは独立した、任意の放射線暴露(意図的でないか悪意のある)を包含し得る。
【0072】
本明細書において用いる場合、「処置する、治療する」、「処置、治療」および「処置すること、治療すること」という用語は、腸炎および/もしくは下痢の進行、重篤度および/もしくは期間の軽減、またはその1つ以上の症状の緩和を指し、このような減少および/または緩和は、1つ以上の治療剤(例えば、5−アミノサリチル酸化合物を含む組成物)の投与から生じる。
【0073】
「腹骨盤治療」としては、例えば、放射線療法、化学療法、手術、またはそれらの組み合わせが挙げられる。治療は、同時に与えられても、または例えば、医療従事者によって決定される任意の時間枠内で一方の後に投与されてもよい。
【0074】
放射線は、例えば、放射線療法、偶発的な放射線暴露、およびテロリストの攻撃による放射線暴露の結果であり得る。例えば、Moulder,Int.J.Radiat.Biol.80:3〜10(2004)を参照のこと。化学的な侵襲とは一般には化学療法由来である。腸炎(腸、特に小腸の粘膜の粘膜炎)は、胃または骨盤の放射線療法、細胞傷害剤、またはそれらの組み合わせを受ける被験体に共通である。主な症状は悪心、胃痛、腫脹および下痢である。放射線誘発性の下痢はしばしば、放射線療法の開始後最初の2週間に起きる。いかなる特定の科学理論にも束縛されないが、放射線誘発性の下痢の機構は、胃腸管の上皮腺窩細胞に対する急性の機械的損傷を包含する。このような障害は、細胞死(壊死性またはアポトーシス性機構のいずれかを介する)、炎症、および腸粘膜の潰瘍を生じ、これが次に刺激性の胆汁酸塩に曝されて、日和見感染に罹り易くなる。例えば、Gwede,Seminars in Oncology Nursing 19:6〜10(2003)を参照のこと。一般的に下痢を伴う化学療法剤としては限定はしないが、フルオロピリミジン類(例えば、5−フルオロウラシルおよびさらに近年に開発されたプロドラッグカペシタビン)、トポイソメラーゼIインヒビター(例えば、イリノテカン、トポテカン)、および他の薬剤(例えば、シスプラチン、オキサリプラチン、シタラビン)が挙げられる。例えば、Viele,Seminars in Oncology
Nursing 19:2〜5(2003)を参照のこと。慢性の腸毒性はまた、放射線療法後に、通常は治療の6ヶ月〜3年後に生じ得る。被験体はしばしば間欠的に便秘および下痢になり、栄養失調および電解質の乱れを生じ得る。いくつかの場合には、急性の腸閉塞、瘻管、または腸穿孔が生じ得る。例えば、Keefeら、Seminars in Oncology 20:38〜47(2004)を参照のこと。放射線療法および放射線治療は本明細書では交換可能に用い、外部照射および内部照射を包含し、また近接照射療法、腹腔内近接照射療法、または間質放射線療法とも呼ばれる。考慮される線源としては、純粋なγ放出体、純粋なβ放出体、α放出体、中性子放出体、他のイオン放出体、および混合照射法が挙げられる。
【0075】
その必要な被験体を決定することは、水素呼吸試験、症状分析、または医学的評価および下記の他の方法のうちの1つ以上によってもよい。
【0076】
本明細書において用いる場合、「化学療法」および「化学療法剤」という用語は、交換可能に用いて、抗ガン効果を示し、悪性腫瘍の処置に用いられる化学療法剤または薬物を指す。
【0077】
本発明者らは、驚くべきことに、放射線誘発性腸炎を被っている被験体に対する5−アミノサリチル酸化合物の投与が、その状態の症状を軽減するということ、および食物との投与が、消化管に対する5−アミノサリチル酸化合物のバイオアベイラビリティを増大するということを見出した。これによって、症状の原因の標的を大きくすることが可能になり、かつ症状の寛解の有効性の改善が生じるが、同時に、伝統的な抗下痢薬などの支援方法で一般にみられるような、有害効果は少なくなる。放射線誘発性腸炎を処置するための5−アミノサリチル酸化合物の使用は特に有益である。なぜなら、腸に投与される場合、薬物の実質的な吸収には関係せず、従って、薬物間の相互作用(化学療法および/または放射線療法に対する被験体またはガンを有する被験体で一般的である)の可能性を減じるからである。これは、治療の標的が大きいこと、薬物相互作用が少ないこと、および治療に対する耐性の改善に関して見られる。特定の利点がこの治療で見られる。なぜなら、この治療は、そうでなければ処置における中断を要する症状を予防または寛解して、被験体がその症状から回復することを可能にし得るからである。処置中断は、処置有効性の減少に関連しており、従って間接的には、本発明は、処置に対する耐性の改善の機構を通じて、ガンまたは他の新生物性疾患の治癒率を改善すると考えられる。
【0078】
本明細書において用いる場合、放射線誘発性腸炎としては、例えば、腹骨盤領域の照射に由来する腹骨盤領域に対する放射線誘発性の損傷が挙げられる。照射はしばしば、急性の放射線による食道炎、胃腸炎、腸炎または結腸直腸毒性を生じる。症状としては嚥下障害、嚥下痛、下痢、消化不良、直腸炎、便失禁、痙性腹痛、腫脹、悪心、軟便、1日排便回数増加、テネスムス、粘液生産、腹骨盤疼痛、および直腸周囲不快感を挙げることができる。急性の放射線腸炎および/または直腸S状結腸炎は、ほとんど小腸、S状結腸および直腸の刺激から生じる。
【0079】
本明細書において用いる場合、「化学療法」および「化学療法剤」という用語は、交換可能に用いられて、抗ガン効果を示す化学療法剤または薬物を指し、かつ悪性腫瘍の処置に用いられる。
【0080】
放射線誘発性腸炎を被っている被験体に対する5−アミノサリチル酸化合物の投与は、その状態の症状を軽減するということが驚くべきことに見出された。放射線腸炎の処置における、例えば、バルサラジドの成功は、他の関連の5−ASA薬物(例えば、オサラジンおよびメサラミン)が臨床試験で失敗しているので驚くべきことである。
【0081】
バルサラジドは、2−ヒドロキシ−5−フェニル安息香酸誘導体の一般名であって、ここではアミノサリチル酸部分、5−アミノサリチル酸(5−ASA)(メサラミン)が、キャリア分子、4−アミノベンゾイル−*−アラニン(4−ABA)に対して、アゾ結合によって連結されている。バルサラジド二ナトリウムは極めて水溶性であって、結腸で切断されて、メサラミン(この分子の治療上活性な部分である)、および4−アミノベンゾール−アラニン(キャリア部分である)を放出する。メサラミンは、5−アミノサリチル酸であって、局所的に作用すると考えられる。
【0082】
消化器系障害を処置するためのバルサラジドの使用は特に有益である。なぜなら、腸内ミクロフローラによって活性型5−ASAへ代謝され、これによって腸管へさらに近位に吸収を介して損失なしに腸への活性薬物の最適の送達をすることが確実になるからである。バルサラジドはまた、他の5−ASAプロドラッグよりも少ない副作用を示し、サルファのアレルギーを有する被験体に投与され得る。バルサラジドはまた、有効成分が、フリーラジカルを直接スカベンジすることが実証されており、これがその後の炎症反応を減じ得るので有益である。いかなる特定の理論によっても拘束されることは望まないが、本発明者らは、バルサラジドが、直腸粘膜において炎症のメディエーターおよびフリーラジカルの放出をブロックすることによって放射線誘発性腸炎に対して防御し得ると考えている。
【0083】
本明細書において用いる場合、「放射線誘発性腸炎」としては、骨盤領域の照射に由来する骨盤領域に対する放射線誘発性の損傷が挙げられる。照射はしばしば、急性の放射線腸炎または結腸直腸毒性を生じる。症状としては、下痢、直腸炎、便失禁、軟便、1日排便回数増加、テネスムス、粘液生産、腹骨盤疼痛、および直腸周囲不快感を挙げることができる。急性の放射線腸炎はほとんどS状結腸および直腸の刺激から生じる。
【0084】
投薬量は、特定の好ましい実施形態によれば、5−アミノサチリル酸化合物の毎日投与約3,000mg〜約7000mgにおよぶ。例えば、2250mgという用量を1日2回被験体に投与してもよい。本発明に従う方法の他の適切な投薬量は、保険医療の専門家によってまたは被験体によって決定され得る。毎日投与される5−アミノサチリル酸化合物の量は、被験体の体重、健康、性別または医学的状態に依存して増大されても減少されてもよい。当業者は、本開示に基づいて被験体の適切な用量を決定できる。
【0085】
(処置の方法)
本明細書においては、1つ以上の5−アミノサリチル酸化合物を食物とともに被験体に投与することによって消化器系の障害に罹患しているか、または罹りやすい被験体を処置する方法が記載される。5−アミノサチリル酸化合物の食物との投与は、その化合物のバイオアベイラビリティおよび有効性を増大する。食物の投与はまた、下に記載されるとおり、被験体の結腸に対する5−ASAのバイオアベイラビリティを増大し、同様に、被験体の結腸における5−ASAの通過を遅らせ、被験体における5−ASAの全身レベルを減少して、副作用を少なくしかつ処置に対する被験体のコンプライアンスを大きくし得る。
【0086】
一局面によれば、本明細書において、5−アミノサリチル酸化合物のバイオアベイラビリティを増大する方法であって、治療上有効な量の5−アミノサリチル酸化合物と食物とを被験体に投与することを包含し、ここでこの5−アミノサリチル酸化合物のバイオアベイラビリティは、食物なしで5−アミノサリチル酸化合物を投与することに比較して増大されている方法が提供される。いかなる特定の理論にも拘束されないが、5−アミノサリチル酸化合物のバイオアベイラビリティは、代謝物5−ASAの通過における遅延および5−ASAに対する消化器管の暴露の増大に起因する。これはまた、全身吸着された5−ASAの量を減らすという利点を有し、これによって副作用を減じ、かつ患者のコンプライアンスを大きくする。
【0087】
一局面によれば、本明細書においては、被験体の結腸に対する5−ASAのバイオアベイラビリティを増大する方法であって、その必要な被験体に対して治療上有効な量の5−アミノサチリル酸化合物を食物とともに投与することを包含し、この5−ASAのバイオアベイラビリティが、5−アミノサリチル酸化合物を食物なしに投与することと比較して増大されている方法が提供される。
【0088】
一局面によれば、本明細書において、被験体の結腸における5−ASAの通過を遅らせる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサチリル酸化合物を食物とともに投与することを包含し、この5−ASAの通過が、5−アミノサリチル酸化合物を食物なしに投与することと比較して増大されている、方法が提供される。いかなる特定の理論によって拘束されることも望まないが、5−アミノサリチル酸化合物と食物との投与に起因する5−ASAの通過の遅延は、5−ASAに対する消化器官の暴露を増大し、かつ全身吸収される量を減少し、それによって副作用を減少しかつ患者のコンプライアンスを増大する。
【0089】
一局面によれば、本明細書において、被験体における5−ASAの全身レベルを減少するための方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含し、ここで5−ASAの全身のレベルは、5−アミノサリチル酸化合物を食物なしに投与することと比較して減少されている方法が提供される。5−アミノサリチル酸化合物と食物との投与の際の5−ASAの全身レベルの減少は、副作用を低下させて、被験体のコンプライアンスを増大する。
【0090】
一局面によれば、本明細書において、被験体における5−アミノサリチル酸化合物の最大血漿濃度(Cmax)を減少させる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含し、ここで5−アミノサリチル酸化合物のCmaxが、5−アミノサリチル酸化合物を食物なしに投与することと比較して増大されている、方法が提供される。
【0091】
一局面によれば、本明細書においては、被験体における5−アミノサリチル酸化合物のTmaxを遅らせる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含し、ここでこの5−アミノサリチル酸化合物のTmaxが、5−アミノサリチル酸化合物を食物なしに投与することと比較して遅延されている方法が提供される。
【0092】
一局面によれば、本明細書においては、被験体における5−アミノサリチル酸化合物の吸収の程度(AUClast)を遅らせる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含し、ここで5−アミノサリチル酸化合物のAUClastが、5−アミノサリチル酸化合物を食物なしに投与することと比較して低下されている方法が提供される。
【0093】
一局面によれば、本明細書においては、被験体における5−ASAに対するNASAの全身比を増大する方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含し、ここで5−ASAに対するNASAの全身比が、5−アミノサリチル酸化合物を食物なしで投与することに比較して増大されている、方法が提供される。
【0094】
一局面によれば、本明細書においては、被験体における5−ASAからNASAへの変換を増大する方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含し、ここで5−ASAからNASAへの上記変換が、5−アミノサリチル酸化合物を食物なしに投与することに比較して、治療上有効な量の5−アミノサリチル酸化合物を投与された被験体において増大されている、方法が提供される。
【0095】
本明細書に記載される方法によれば、前記5−アミノサリチル酸化合物は、例えば、メサラミン、スルファサラジン、オルサラジン、イプサラジン、サリチルアゾ安息香酸、またはバルサラジドのうちの1つ以上を含む。
【0096】
治療上有効な量とは、本明細書に記載の方法によれば、約6.25mg〜約7000mg/日の用量を含む。治療上有効な量はまた、約750mg〜約6750mg/日の間を含む。治療上有効な量および用法としては、毎日3回3錠剤の処方物を投与すること、各々の錠剤が、約750mgの5−アミノサリチル酸化合物を含む、投与が挙げられる。治療上有効な用法としてはまた、例えば、毎日3回の2錠剤の処方であって、各々の錠剤が、約1125mgの5−アミノサリチル酸化合物を含むものが挙げられる。治療上有効な量および用法としてはさらに、例えば、毎日3回の1錠剤であって、各々の錠剤が、約2250mgの5−アミノサリチル酸化合物を含むものが挙げられる。本明細書に記載の方法に従って有用な他の用法例としては、例えば、1日あたり体重70kgあたり約1〜約14gの間におよぶ用法が挙げられる。
【0097】
上記被験体に対する投与は、例えば、食物消費前約30分〜食物消費後約2時間の間に行われる。食物との投与はまた、食物の消費と同時であってもよい。また、上記被験体に対する投与は例えば、食物の消費の直後から消費の約1時間後までであってもよい。
【0098】
5−アミノサリチル酸化合物は、1つ以上の非全身送達経路によって、または全身送達経路によって投与されてもよい。非全身送達経路としては、例えば、1つ以上のコロニー送達経路、摂食送達経路、クリーム、ゲルおよび/または軟膏の局所適用が挙げられる。全身送達経路としては、例えば、摂食、注射、静脈内点滴、移植、経皮送達経路、および/または経粘膜送達経路が挙げられる。
【0099】
一局面によれば、本明細書においては、被験体において経時的に血流中で得られる薬物の濃度またはその代謝物によって測定される、バルサラジドの経口剤形の吸収の速度および程度を減少させる方法であって、この被験体に対して治療上有効な量のバルサラジドを薬学的組成物中で食物とともに投与することを包含する方法が提供される。例えば、5−ASAの全身レベルは低下されて、一方NASAの全身レベルは増大されてもよい。
【0100】
一実施形態では、バルサラジドは、食物とともに投与することが、食物なしでの投与に比較して、バルサラジドの最大血漿濃度(Cmax)および吸収の程度(AUClast)の減少を生じるということを告知する表示を備える容器に由来する。
【0101】
一局面によれば、本明細書においては、消化器系疾患の処置においてバルサラジドを用いる方法であって、治療上有効な量のバルサラジドを食物とともに投与することが、食物なしの投与と比較して5−ASAのCmax、AUClast、または全身の吸着のうちの少なくとも1つにおける低下を生じるという情報を消化器系疾患を有する被験体に伝える工程を包含する、方法が提供される。
【0102】
一局面によれば、本明細書においては、消化器系障害の処置においてバルサラジドを用いる方法であって、バルサラジドを食物とともに投与することが食物なしの投与と比較して被験体の結腸に対するバルサラジドまたはその代謝物のバイオアベイラビリティを増大するという情報を示している容器からバルサラジドを得る工程と、このバルサラジドを食物とともに摂取する工程とによって、バルサラジドの経口バイオアベイラビリティを変更する工程を包含する、方法が提供される。
【0103】
一局面によれば、本明細書においては、消化器系障害の処置においてバルサラジドを用いる方法であって、処置の必要な被験体に対して治療上有効な量のバルサラジドを食物とともに投与することであって、ここでバルサラジドと食物との投与が、絶食状態におけるバルサラジドの投与と比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける低下を生じる工程と、治療上有効な量のバルサラジドの薬学的組成物中での食物との投与が、絶食状態における投与に比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける1つ以上の低下を生じるという情報をこの被験体に伝える工程とを包含する、方法が提供される。
【0104】
上記バルサラジドは、食物とともに投与することが絶食状態での投与に比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける低下を生じるということを告知する印刷された表示を有する容器に例えば由来する。バルサラジドは、例えば、錠剤、カプセル、粘着性のない粉末(loose powder)、子袋(sachet)などとして提供され得る。例えば、バルサラジドは750mgの錠剤型で提供される。
【0105】
上記印刷された表示は、バルサラジドと食物との投与がCmaxの約10〜約70%、または約20〜約50%の低下を生じるということを告知し得る。上記印刷された表示はまた、バルサラジドと食物との投与がAUClastの約10〜約70%の低下を生じるということを告知し得る。この表示はさらに、例えば、バルサラジドと食物との投与が5−ASAに対するNASAの全身比の約10〜約100%、または約20〜約80%の増大を生じるということをさらに告知し得る。例えば、5−ASAに対するNASAの比は、食物なしの投与に比較して6倍〜約8倍増大されてもよい。
【0106】
一局面によれば、本明細書では、ヒト被験体における細菌種の増殖を阻害する方法であって、細菌感染または異常増殖を有するヒト被験体に対して、ヒト被験体中で細菌種の増殖を阻害するのに有効な用量で5−アミノサリチル酸化合物を含む薬学的に受容可能な組成物と食物とを投与すること、を包含する方法が提供される。
【0107】
上記、5−アミノサリチル酸化合物は、特定の実施形態によれば、メサラミン、スルファサラジン、オルサラジン、イプサラジン、サリチルアゾ安息香酸、バルサラジド、抱合胆汁酸、および/または式I〜IIIの化合物のうちの1つ以上であってもよい。感染が減少されるか、または根絶され得る細菌種としては、例えば、Clostridium種、または嫌気性細菌、もしくは好気性細菌の種のうちの1つ以上が挙げられる。Clostridium種としては、例えば、Clostridium perfringens、Clostridium difficile、Clostridium botulinum、および/またはClostridium tetaniが挙げられる。
【0108】
一局面によれば、消化器系疾患に罹患している被験体を処置する方法は、この被験体に対して治療上有効な量の処方物を投与すること、式Iまたはその誘導体の化合物と食物とを投与することを包含する。一実施形態では、式Iの化合物は、バルサラジドナトリウム二水和物である。一実施形態では、この薬学的組成物は、2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の活性代謝物の酸化生成物、または2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の塩の活性代謝物の酸化生成物の1日あたり体重70kgあたり1〜14gにおよぶ一日用量で、消化管障害に罹患しているかまたは発症するリスクのある個体に対して経口投与される。
【0109】
一局面によれば、式IIの化合物のバイオアベイラビリティを増大する方法は、式IIの化合物の治療上有効な量と食物とを被験体に投与する工程を包含する。一実施形態では、式IIの化合物は、バルサラジドナトリウム二水和物である。
【0110】
一局面によれば、消化器系疾患に罹患している被験体を処置する方法は、式IIの化合物またはその誘導体を含む治療上有効な量の処方物を食物とともに被験体に投与することを包含する。一実施形態では、式IIIの化合物は、バルサラジドナトリウム二水和物である。別の実施形態では、消化器系疾患は、活動的な潰瘍性腸炎である。さらに別の実施形態では、この消化器系疾患は結腸癌である。
【0111】
一局面では、本明細書においては、食物とともに、2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の活性代謝物の次亜塩素酸ナトリウムもしくは過酸化水素酸化生成物、または2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の非毒性の薬理学的に受容可能な塩の活性代謝物の次亜塩素酸ナトリウムもしくは過酸化水素酸化生成物を投与する工程を包含する、消化器系障害のために被験体を処置する方法が提供される。一実施形態では、2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体はバルサラジドである。別の実施形態では、活性な代謝物は5−ASAである。別の実施形態では、活性な代謝物の次亜塩素酸ナトリウムもしくは過酸化水素酸化生成物は、5−ASAの酸化生成物である。一実施形態では、5−ASAの酸化生成物は、ゲンチシン酸である。さらに別の実施形態では、5−ASAの酸化生成物は5−ニトロ−サチリル酸塩である。
【0112】
別の実施形態では、細菌種とは偏性嫌気性菌である。関連の実施形態では、細菌種は、Clostridium種である。別の関連の実施形態では、細菌種は、Clostridium perfringens、Clostridium difficile、Clostridium tetaniおよび/またはClostridium botulinumである。一実施形態では、5−アミノサリチル酸化合物は、1日あたり6.25〜150mg/日の用量を送達するように送達系に処方される。別の実施形態では、その用量は、1日あたり約12.5〜約200mg/日を含む。別の実施形態では、5−アミノサリチル酸化合物は1日あたり6,450mgを超える用量を送達するように送達系に処方される。
【0113】
特定の実施形態では、5−アミノサチリル酸化合物の薬学的組成物は、例えば、ヒト、小児、獣医の使用のため(例えば、家畜または畜産動物、非ヒト哺乳動物、鳥類、非ヒト霊長類、マウス、ラット、ウサギ、スナネズミ、ハムスター、イヌ、ネコ、ヒツジ、ウシ、ブタ、厚皮動物、ウマ、海洋哺乳類、アヒル、ニワトリ、ガチョウ、シチメンチョウ、ダチョウ、エミュー、ハト(dove)、ハト(pigeon)、ウズラ、キジ、クジャクまたはホロホロ鳥)に処方される。
【0114】
本発明のなお別の局面は、処方医、および経口剤形の治療効果を最大にするのに有用な5−アミノサリチル酸塩化合物療法を与えられている被験体に対して、5−アミノサリチル酸化合物が約30分間の食物消費において摂取されることを推奨することによって、情報を提供する。
【0115】
5−アミノサリチル酸化合物吸収に対する食物の効果は、食物の有無において健常なボランティアに対して薬品を投与して、処方物中の5−アミノサチリル酸化合物のバイオアベイラビリティを比較するように設計された研究において特定された。
【0116】
本発明のさらに別の局面は、5−アミノサチリル酸化合物を用いてその必要な被験体を処置する方法に関する。このような処置の必要な被験体を特定することは、被験体または保険医療の専門家の判定であってもよく、主観的(例えば、意見)であっても、または客観的(例えば、試験または診断方法によって測定可能)であってもよい。
【0117】
5−アミノサリチル酸化合物は、処置の治療または旅行または他のリスク状態に対する暴露の前、間、および/または後に投与されてもよい。5−アミノサリチル酸化合物は、例えば、1日1回、1日2回、1日3回、または1日4回投与されてもよい。5−アミノサリチル酸化合物は、例えば、約3375mgのBID〜約2250mgのTIDという用量で投与されてもよい。別の例は、約100mg/日〜約7000mg/日の5−アミノサリチル酸化合物を投与することである。5−アミノサチリル酸化合物は、例えば、錠剤型、粉末型、液体またはカプセルで投与されてもよい。
【0118】
その必要な被験体としては、放射線療法を、単独でまたは他の骨盤療法(腸炎または消化管の一部の炎症を誘発し得る)と組み合わせて受ける被験体が挙げられる。この必要性は、放射線療法、化学療法、骨盤手術手技または治療の組み合わせを受ける前に;被験体が放射線療法、化学療法、骨盤手術、または治療の組み合わせを受けている間に;および被験体が放射線療法、化学療法、骨盤手術、または治療の組み合わせを受けた後に明白になり得る。例えば、被験体は、化学療法または外科的手術と組み合わせて放射線療法を受けようとされてもよいし、受けてもよいし、または受けている。
【0119】
また、腸炎であるか、腸炎に罹りやすい可能性のある被験体も包含される。被験体は、例えば、消化器系の悪性腫瘍(結腸直腸、虫垂、肛門、膵臓、肝胆道、食道、胃、胃食道接合部または小腸の癌;泌尿生殖器悪性腫瘍(前立腺、膀胱、精巣または陰茎の癌を含む);婦人科の悪性腫瘍(子宮頸部、子宮内膜、卵巣、膣または外陰部の癌を含む);または骨原性および他の肉腫変性の悪性腫瘍(腹骨盤構造が関与する)に罹患していてもよいし、あるいは被験体は、病原体もしくは旅行者の下痢をもたらし得る他の条件に接触しやすい場合がある位置への旅行にあってもよいし、または旅行しようとしていてもよい。
【0120】
本明細書において用いる場合、治療上有効な量とは、ヒトまたは非ヒト被験体に投与された場合、症状の寛解などの治療的利益をもたらすのに有効な量、例えば、急性の放射線腸炎の症状を軽減させるのに有効な量を意味する。
【0121】
特定の実施形態によれば、5−アミノサリチル酸化合物は、放射線療法の前に投与してもよい。5−アミノサリチル酸化合物は、例えば、被験体の放射線療法の初回投与の少なくとも1日前、被験体の放射線療法の初回投与の少なくとも5日前、放射線療法の間、放射線療法の休止後少なくとも1日間、放射線療法の休止後14日間、または前、間および後の組み合わせで投与されてもよい。これらの時間枠は一般の言及についてであって、処置の期間は、被験体ごとを基準に医療従事者によって決定され得る。治療の少なくとも5日前の投与とは、毎日投与、骨盤療法前に毎日、治療前にほぼ毎日投与、治療日に投与、または治療日投与なしを包含する。
【0122】
特定の好ましい実施形態としては、放射線療法の初回投与の少なくとも1日前から放射線療法の休止後少なくとも1日までの5−アミノサリチル酸化合物の投与が挙げられる。放射線療法の前の処置によって、5−アミノサリチル酸化合物が損傷の原因の間にその作用部位に存在することが可能になる。
【0123】
特定の実施形態では、5−アミノサリチル酸化合物は、約2週間〜約6週間の期間、約8週間〜約12週間の期間、または1日〜約7日の期間、被験体に投与される。5−アミノサリチル酸化合物は、処置の経過の間、間欠的にまたは連続的に投与され得る。処置の長さは、放射線療法、化学療法のタイプおよび長さに依存して変化し得、そして/または外科手技のタイプおよび処置の適切な長さは、本開示の恩典を有する当業者によって容易に決定され得る。
【0124】
任意の実施形態について、5−アミノサリチル酸化合物は、被験体に対して、例えば、1日1回、1日2回、1日3回、または1日4回投与され得る。本発明のある特に好ましい方法では、5−アミノサリチル酸化合物を被験体に対して1日2回投与することを包含する、なぜなら、これによって、例えば、副作用を最小にして、被験体のコンプライアンスを増大し得るからである。
【0125】
投薬量は、特定の好ましい実施形態によれば、毎日投与される5−アミノサリチル酸化合物の約100mg〜約7000mgの間におよぶ。本発明による方法のための他の適切な投薬量は、保険医療の専門家によって、または被験体によって決定され得る。毎日投与される5−アミノサリチル酸化合物の量は、被験体の体重、年齢、健康度、性別または医学的状態に基づいて増大されても、または減少されてもよい。当業者は、本開示に基づいて被験体に適切な用量を決定することができる。
【0126】
複数の治療を受けている被験体については、5−アミノサリチル酸化合物は、例えば、被験体の放射線療法、化学療法の初回投与の少なくとも1日前、および/または外科手技を受ける前に投与されても;被験体の放射線療法、化学療法の初回投与の少なくとも5日前、および/または外科手技を受ける前に投与されても;放射線療法、化学療法および/または外科手技の間に投与されても;放射線療法、化学療法の中断の少なくとも1日後、または外科手技後に投与されても;放射線療法、化学療法の中断後14日間、または外科手技後に投与されてもよい。
【0127】
処置の前に、処置の間に、および処置の中断後に被験体に5−アミノサリチル酸化合物を投与することがしばしば好ましい。例えば、5−アミノサリチル酸化合物は、放射線療法、化学療法の初回投与の少なくとも1日前、および/または外科手技を受ける前、放射線療法、化学療法、または外科手技の中断後少なくとも1日まで投与されてもよい。
【0128】
適応症としては、子宮頸癌、前立腺癌、虫垂癌、結腸癌、腸の癌、直腸癌、膵臓癌、肝臓癌、小腸の癌、食道癌、胃癌、胃食道接合部癌、もしくは他の消化器系の悪性腫瘍、または前立腺切除の処置の結果として、放射線療法、化学療法および/または外科手技を受けている被験体が挙げられる。
【0129】
特定の実施形態によれば、5−アミノサリチル酸化合物は、例えば、化学療法剤、抗炎症剤、抗発熱剤 増感剤、放射線防護剤、泌尿器剤、制吐剤、および/または抗下痢剤を含む他の化合物と組み合わせて投与されてもよい。例えば、シスプラチン、カルボプラチン、ドセタキセル、パクリタキセル、フルオロウラシル、カペシタビン、ゲムシタビン、イリノテカン、トポテカン、エトポシド、マイトマイシン、ゲフィニチブ、エルロチニブ、セツキシマブ、ベバシズマブ、イレッサ、タラバ(tarava)、エルビタックス、ビンクリスチン、ビンブラスチン、ドキソルビシン、シクロホスファミド、セレコキシブ、ロフェコキシブ、バルデコキシブ、イブプロフェン、ナプロキセン、ケトプロフェン、デキサメタゾン、プレドニゾン、プレドニゾロン、ヒドロコルチゾン、アセトアミノフェン、ミソニダゾール、アミフォスチン(amifostine)、タムソロシン、フェナゾピリジン、オンダンセトロン、グラニセトロン、アロステロン、パロノセトロン、プロメタジン、プロクロルペラジン、トリメトベンズアミド、アプレピタント、リファキシミン、ジフェノキシレートとアトロピン、および/またはロペラミド。
【0130】
本明細書に開示される方法はまた、放射線誘発性腸炎、または他の消化管炎症に対して、5−アミノサリチル酸化合物の治療上有効な量を、その必要な被験体に対して投与することによって防御するために有用である。例えば、予防的な用量は、放射線を与えられる前に被験体に投与されてもよい。
【0131】
本明細書に開示される方法は結腸の粘膜に対する放射線誘発性の損傷に対して、および放射線誘発性の結腸直腸炎または他の消化器の粘膜炎に対して、治療上有効な量の5−アミノサリチル酸化合物をその必要な被験体に投与することによって、被験体を防御するのに有用である。
【0132】
さらに別の局面では、腸炎および/または下痢に罹患しているかまたは罹患しやすい被験体を処置する方法であって、その必要な被験体に対して、治療上有効な量の5−アミノサリチル酸化合物の処方物を投与することを包含し、それによってその被験体を処置する方法。腸炎および/もしくは下痢、例えば、放射線誘発性の腸炎もしくは旅行者の下痢に罹患しているか、または罹患しやすい被験体の特定の際に、5−アミノサチリル酸化合物が投与される。
【0133】
被験体における処置の有効性を評価する方法は、腸内細菌の異常増殖または下痢の前処置値を、当該分野で周知の方法(例えば、水素呼気検査、メタン呼気検査、生検、腸内細菌のサンプリング、排便の量または頻度またはタイプの測定など)によって決定する工程、次いでこの被験体に対して治療上有効な量の5−アミノサチリル酸化合物を投与する工程を包含する。5−アミノサリチル酸化合物の投与の後、適切な期間後(例えば、処置の初期期間後)例えば、2時間、4時間、8時間、12時間または72時間後、細菌の異常増殖および/または下痢のレベルを再度測定する。細菌値または下痢の調節は処置の有効性を示す。細菌の異常増殖および/または下痢のレベルは、処置を通じて周期的に決定され得る。例えば、細菌の異常増殖または下痢を、2〜3時間ごと、2〜3日ごと、または2〜3週ごとにチエックして、処置のさらなる有効性を評価してもよい。細菌の異常増殖または下痢における減少は、処置が有効であるということを示す。記載される方法を5−アミノサチリル酸化合物での処置から利点があり得る被験体をスクリーニングまたは選択するために用いてもよい。
【0134】
処置の有効性は、例えば、細菌の異常増殖の減少によって測定され得る。有効性はまた、腸炎および/もしくは下痢に関連する症状の低減、症状の安定化、または腸炎および/もしくは下痢に関連する症状の休止、例えば、悪心、腫脹、疼痛、排便の頻度などの軽減に関して測定され得る。
【0135】
一局面では、5−アミノサリチル酸化合物の処方物で処置されている被験体の進行をモニタリングする方法は、細菌の過剰増殖または下痢の前処置値を決定する工程と、治療上有効な量の5−アミノサリチル酸化合物をこの被験体に投与する工程と、5−アミノサリチル酸化合物での処置の最初の期間後の細菌過剰増殖および/または下痢のレベルを決定する工程とを包含し、ここでこの細菌の過剰増殖の調節が処置の有効性を示す。
【0136】
種々の実施形態では、治療(例えば、予防剤または治療剤)は5分未満離れて、30分未満離れて、1時間離れて、約1時間離れて、約1〜約2時間離れて、約2時間〜約3時間離れて、約3時間〜約4時間離れて、約4時間〜約5時間離れて、約5時間〜約6時間離れて、約6時間〜約7時間離れて、約7時間〜約8時間離れて、約8時間〜約9時間離れて、約9時間〜約10時間離れて、約10時間〜約11時間離れて、約11時間〜約12時間離れて、約12時間〜約18時間離れて、約18時間〜約24時間離れて、約24時間〜約36時間離れて、36時間〜48時間離れて、48時間〜52時間離れて、52時間〜約60時間離れて、60時間〜72時間離れて、72時間〜84時間離れて、84時間〜96時間離れて、または96時間〜120時間離れて与えられる。好ましい実施形態では、胃耐性の5−アミノサリチル酸化合物の処方物が1日2回投与される。他の実施形態では、この胃耐性5−アミノサリチル酸化合物の処方物は、約1日〜約7日間、例えば、約7日/月の間、約1月〜約36ヶ月の間、または約1月〜約36ヶ月の間毎日1回もしくは2回投与される。
【0137】
特定の実施形態では、本発明の1つ以上の処方物および1つ以上の他の治療剤(例えば、予防剤または治療剤)が臨床投与される。循環療法は、ある期間の間の初回の治療(例えば、最初の予防剤または治療剤)の投与、続いて、ある期間の間の第二の治療(例えば、第2の予防剤または治療剤)の投与、必要に応じてそれに続く、ある期間の間の三回目の治療(例えば、予防剤または治療剤)の投与など、ならびに治療のうちの1つの副作用を回避もしくは軽減するため、および/または治療の有効性を改善するために、この一連の投与を繰り返す工程(例えば、治療の1つに対する耐性の発達を軽減するためのサイクル)を包含する。
【0138】
特定の実施形態では、本発明の同じ処方物の投与が反復されてもよく、そして投与は、少なくとも1日、2日、3日、5日、10日、15日、30日、45日、2ヶ月、75日、3ヶ月、または少なくとも6ヶ月隔てられてもよい。他の実施形態では、胃耐性の5−アミノサリチル酸化合物の処方物以外の同じ治療の投与(例えば、予防剤または治療剤)を繰り返してもよく、その投与は、少なくとも1日、2日、3日、5日、10日、15日、30日、45日、2ヶ月、75日、3ヶ月、または少なくとも6ヶ月隔てられてもよい。
【0139】
特定の適応にはより長い処置時間が必要であり得る。短時間処置としては、例えば、1〜約7日の処置が挙げられる。5−アミノサリチル酸化合物での長期処置としては、例えば、15日間、3ヶ月間、9ヶ月間、3ヶ月間の7日/1月、3〜12月間の7日/1月、またはその間もしくはより長い任意の時間が挙げられる。本開示の恩典を有する当業者は、特定の被験体または意図される結果に関して投薬量を変化する方法を理解する。用法は、被験体の年齢、サイズおよび状態に依存して変化する。例えば、疾患の重篤度、または損傷が新しい疾患状態であるか、または再燃(relapse)もしくは再発(recurrence)などであるかに依存する。
【0140】
本発明の予防的および/または治療的なプロトコールの毒性および有効性は、例えば、LD50(集団の50%致死用量)およびED50(集団の50%に治療上有効な用量)を決定するための、細胞培養物または実験動物における標準的な薬学的手順によって決定され得る。毒性効果と治療効果との間の用量比は、治療係数であって、LD50/ED50の比として表されてもよい。大きい治療係数を示す予防剤および/または治療剤が好ましい。毒性の副作用を示す予防剤および/または治療剤が用いられることもあるが、未感染の細胞に対する潜在的な損傷を最小限にして、これによって副作用を減じるためには、罹患した組織の部位に対してこのような剤を標的する送達系をデザインするように注意すべきである。
【0141】
細胞培養アッセイ、動物の研究およびヒトの研究から得たデータを、ヒトでの使用のための予防剤および/または治療剤のある範囲の投与量を処方するのに用いてもよい。このような薬剤の投薬量は好ましくは、毒性をほとんどまたは全く有さない、ED50を含むある範囲の循環濃度内で好ましい。この投薬量は、使用される投薬量および利用される投与経路に依存してこの範囲内で変化し得る。本発明の方法で用いられる任意の薬剤については、治療上有効な用量は、細胞培養アッセイから最初に見積もることができる。ある用量を、細胞培養中で決定されるIC50(例えば、症状の最大半分阻害を達成する試験化合物の濃度)を含む循環血漿濃度範囲を達成するように、動物モデルで処方してもよい。このような情報は、ヒトにおいて有用な用量をさらに正確に決定するために用いられ得る。血漿中のレベルは、例えば、高速液体クロマトグラフィーによって測定してもよい。
【0142】
特定の障害または状態の処置において有効である本発明の組成物の量は、障害または状態の性質に依存し、標準的な臨床技術によって決定され得る。処方物中で使用されるべき正確な用量はまた、投与経路、および疾患または障害の重篤度に依存し、施術者の判定および各々の被験体の状況に従って決定されるべきである。
【0143】
5−アミノサリチル酸化合物の処方物、例えば、バルサラジドの合計一日用量は、約25mg〜約7000mgに及んでもよい。例えば、一般には、本発明の処方物中のバルサラジドの成体の合計一日用量は、約300mg〜約2000mg、約750〜約6750mg、約6000〜約7000mg、またはその間の任意の全ての数または分数の値に及ぶ。単回用量は、約250、275、400、600、525、550、575、750、800または1000mgのバルサラジドを含むように処方されてもよい。一実施形態では、単回用量は、約750mgのバルサラジドを含む。
【0144】
5−アミノサリチル酸化合物は、放出の改変された処方物として、または膜制御(membrane−controlled)処方物として提供され得る。本発明の膜制御処方物は、急速放出コア(これはモノリシック型(例えば錠剤)であっても、または多ユニット型(例えば、ペレット)であってもよい)を調製すること、およびこのコアを膜でコーティングすることによって作製されてもよい。次いで、この膜制御コアはさらに機能的なコーティングでコーティングされてもよい。この膜制御コアと機能的コーティングとの間には、バリアまたはシーラント(封止剤)が適用されてもよい。このバリアまたはシーラントは別々に、または追加して、急速放出コアと膜コーティングとの間に設けられてもよい。
【0145】
5−アミノサリチル酸化合物の処方物は、5−アミノサリチル酸化合物の任意の多形であってもまたは非結晶型であってもよい。
【0146】
ある実施形態では、5−アミノサリチル酸化合物は、薬学的に受容可能な処方物、例えば、この薬学的に受容可能な処方物が被験体に投与された後、少なくとも12時間、24時間、36時間、48時間、1週、2週、3週、または4週の間、被験体へ5−アミノサリチル酸化合物の徐放性の送達をもたらす、薬学的に受容可能な処方物を用いて被験体に投与される。
【0147】
いくつかの実施形態では、本発明の薬学的組成物を、処置の必要な領域に対して局所的に投与することが所望され得る。これは、例えば、手術、または局所適用の間の局所注入によって、例えば、手術後の創傷への包帯と組み合わせて、注射によって、カテーテルによって、坐剤によって、またはインプラント(インプラントは多孔性、非多孔性、またはゼラチン物質であり、これには膜、例えば、シラスティック(sialastic)膜、またはファイバーを含む)によって達成されてもよい。一実施形態では、投与は、侵害、例えば、放射線、化学療法、または化学/生物学的な戦闘剤(warfare agent)に最も感受性である急速増殖組織の部位(または前者の部位)に直接注射であってもよい。別の実施形態では、5−アミノサリチル酸化合物は、経口投与のための粘性または非粘性の溶液中で処方されてもよい。別の実施形態では、5−アミノサリチル酸化合物は、放射線誘発性の口腔粘膜炎または食道炎を寛解するために、疼痛救済剤(pain reliever)、例えば、リドカインを含む粘性または粘性でない混合物中に処方してもよい。別の実施形態では、5−アミノサリチル酸化合物は、放射線誘発性の口腔粘膜炎または食道炎を寛解するために例えばスクラルファートを含む粘性または非粘性の混合物中に処方されてもよい。別の実施形態では、5−アミノサリチル酸化合物は、放射線誘発性の口腔粘膜炎または食道炎を寛解するために、例えばナイスタチンを含む粘性または非粘性の混合物中に処方されてもよい。別の実施形態では、5−アミノサリチル酸化合物は、放射線誘発性の口腔粘膜炎または食道炎を寛解するために、上記の組み合わせなどを含む粘性または非粘性の混合物中に処方されてもよい。
【0148】
特定の実施形態では、5−アミノサリチル酸化合物のこれらの薬学的組成物は、被験体に対する局所的投与または経口投与に適切である。他の実施形態では、下に詳細に記載のとおり、本発明の薬学的組成物は、以下に適合したものを含む、固体型または液体型での投与のために特別に処方されてもよい:(1)経口投与、例えば、ドレンチ(drenches)(水性または非水性の溶液または懸濁液)、錠剤、ボーラス、粉末、顆粒剤、ペースト;(2)非経口投与、例えば、滅菌の溶液または懸濁液としての、例えば、皮下、筋肉内、または静脈内の注射による;(3)局所適用、例えば、皮膚に適用される、クリーム、軟膏、またはスプレーとして;(4)膣内にまたは直腸内に、例えば、ペッサリー、クリームまたは泡状物として;または(5)エアロゾル、例えば、水性のエアロゾル、リポソーム調製物、または固体粒子(化合物を含む)。
【0149】
「薬学的に受容可能な」という句は、合理的な利益/リスク比と釣り合った、過度の毒性、刺激作用、アレルギー応答、または他の問題もしくは合併症なしにヒトおよび動物の組織と接触した使用に適切な、妥当な医学的判断の範囲内である、このような化合物を含む組成物および/または剤形を指す。
【0150】
(5−アミノサリチル酸化合物および薬学的組成物)
本明細書において用いる場合、「5−アミノサリチル酸化合物」とは、例えば、下記の式I〜IIIの化合物、ならびに、メサラミン、スルファサラジン、オルサラジン、イプサラジン、サリチルアゾ安息香酸およびバルサラジドをいう。バルサラジドは、Colazal(登録商標)の一般名である。5−アミノサリチル酸化合物の使用および製造の例は、例えば、米国特許第6,197,341号;同第5,905,073号;同第5,498,608号;および同第6,326,364号(その全体が参照によって本明細書に援用される)に見出され得る。5−アミノサリチル酸化合物は、そのバイオアベイラビリティおよび有効性を増大するために本明細書に記載の方法で有用である。
【0151】
薬物生成物、COLAZALは、経口送達のための硬ゼラチンカプセル中に750mgのバルサラジド二ナトリウムを含む。経口的に摂取した場合、プロドラッグのバルサラジドの99%が結腸に達し、ここで結腸の細菌のアゾリダクターゼ酵素の存在がジアゾ結合を減じ、それによって結腸の局所活性のために5−ASAを放出させる(Colazal(登録商標)バルサラジド二ナトリウム)カプセル750mg Package Insert 0004.1/July 2000)。この放出された4−ABAキャリア成分は、吸収が劣り、糞便中にほとんど排出される(Ragunath KおよびWilliams JG.Aliment Pharmacol.Ther.2001;15:1549〜1554)。5−ASAの局所的存在は、このクラスの薬物の有効性の基礎であって、粘膜の5−ASAの濃度は、UC疾患活性と逆相関する(Frieri G,Giacomelli R,Pimpo Mら、Gut 2000;47:410〜414)。5−ASAの正確な作用機序は、完全には理解されないが、5−ASAの全身暴露は、処置に関連する副作用を担うと考えられる。バルサラジドでの研究において最も広がっているのは頭痛であり(Green JB Gastroenterology 1999;117:1513〜1514)、5−ASAの全身レベルが低いほど、いくつかのトライアルで観察されるように、頭痛の頻度の少なさに寄与し得る(Levine DS、Riff DS、Pruitt Rら、Am.J.Gastroenterol.2002;9:1398〜1407)。従って、活性な治療部分の局所粘膜濃度を増大し、5−ASAの全身吸収を減少する用法が好ましい。
【0152】
5−ASAはバルサラジドの活性な治療部分であるが、これは粘膜において代謝物N−アセチル−5−ASA(NASA)に急速に変換される(Allgayer H、Ahnfelt NO、Kruis Wら、Gastroenterology.1989;97;38〜41)。全身に吸収される5−ASAの口腔用量のうちの2%未満というのに比べて、口腔用量のうちおよそ12%が血中でこの代謝物として測定され得る(van Hogezand RA、van Hees PA、van Gorp JP、van Lier HJ、Bakker JH、Double−blind comparison of 5−aminosalicylic acid and acetyl−5−aminosalicylic acid suppositories in subjects with idiopathic proctitis.Aliment Pharmacol Ther.1988 Feb;2(1)33〜40)。NASAは、結腸で低い抗炎症性活性であることが公知であり(Colazal(登録商標)(バルサラジド二ナトリウム)カプセル750mg添付文書2006年9月)、従って、全身循環の場合には毒性が低いと考えられる。従って、総メサラミン(5−ASAおよびNASA)の全身レベルを減らし、全身循環において5−ASAのレベルの減少を犠牲にしてNASAの全身レベル(すなわち、5−ASAに対するNASAの比)を増やす用法が好ましい。結腸における5−ASAの通過を遅らせる用法はまた、結腸粘膜との接触時間の増大を生じ、従って、薬物の有効性を増大し得る。この結腸粘膜との接触時間の増大はまた、5−ASAに対するNASAの全身比の増大を生じる。メサラミンのpH依存性放出処方物に対してバルサラジドを比較する以前の研究では、炎症の粘膜のS状結腸検査スコアリングによって測定した場合、有効性が大きいほど、5−ASAの全身レベルの低さおよび全身の5−ASAに対するNASAの比の高さと関連していることが示された(Levine DS,Riff DS、Pruitt Rら、Am.J.Gastroenterol.2002;9;1398〜1407)。本開示によって、摂食状態でヒト被験体にバルサラジドを与えることがこれらの目標を達成する用法であるということが示される。
【0153】
本発明による適切な組成物はまた、下記のような式I〜IIIの化合物を含む。
【0154】
【化2】

ここで、Xは、SO2またはCOであり;
R1はフェニル、カルボキシメチルフェニル、または−R2Yであり;
R2は(CH2)nまたはベンジル−(CH2)nであり、ここでアルキレン部分の1つ以上の水素原子は、C1−6アルキル、NH2、NH(C1−6−アルキル)、またはN(C1−6−アルキル)2基によって置換されてもよく;
YはCOOH、SO3H、OH、NH2、NHR3またはN(R3)2であり;
R3はカルボン酸またはスルホン酸基によって必要に応じて置換されているC1−6−アルキルであり;そしてnは1〜6の整数であって;
この誘導体は、エステル、活性代謝物、および非毒性の薬学的に受容可能な塩からなる群より選択され;
1つ以上の薬学的に受容可能な賦形剤または結合剤と組み合わされ;
ここでこの処方物は、少なくとも0.9mg/mm3の密度を有する錠剤の形態である。
【0155】
特定の実施形態では、式Iは、バルサラジドナトリウム二水和物を含む。本明細書に記載の方法によれば、この薬学的組成物は、2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の活性な代謝物の酸化生成物、または2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の塩の活性な代謝物の酸化生成物の1日あたり70kgの体重あたり1〜14gにおよぶ1日用量で、消化器系の障害に罹患しているか、またはその発症のリスクのある個体に経口投与されてもよい。
【0156】
【化3】

ここで、Xは、SO2またはCOであり;
R1はフェニル、カルボキシメチルフェニル、または−R2Yであり;
R2は(CH2)nまたはベンジル−(CH2)nであり、ここでアルキレン部分の1つ以上の水素原子は、C1−6アルキル、NH2、NH(C1−6−アルキル)、またはN(C1−6−アルキル)2基によって置換されてもよく;
YはCOOH、SO3H、OH、NH2、NHR3またはN(R3)2であり;
R3はカルボン酸またはスルホン酸基によって必要に応じて置換されているC1−6−アルキルであり;そしてnは1〜6の整数である;
またはそのエステル;またはその活性な代謝物;またはその非毒性の薬学的に受容可能な塩であって;
1つ以上の薬学的に受容可能な賦形剤または結合剤と組み合わされ;
例えば、式IIの化合物は、バルサラジドナトリウム二水和物である。
【0157】
【化4】

ここで、Xは、SO2またはCOであり;
R1はフェニル、カルボキシメチルフェニル、または−R2Yであり;
R2は(CH2)nまたはベンジル−(CH2)nであり、ここでアルキレン部分の1つ以上の水素原子は、C1−6アルキル、NH2、NH(C1−6−アルキル)、またはN(C1−6−アルキル)2基によって置換されてもよく;
YはCOOH、SO3H、OH、NH2、NHR3またはN(R3)2であり;
R3はカルボン酸またはスルホン酸基によって必要に応じて置換されているC1−6−アルキルであり;そしてnは1〜6の整数である。
【0158】
特定の実施形態では、誘導体は、エステル、活性代謝物、および非毒性の薬学的に受容可能な塩を含む群から選択される。この化合物はさらに、1つ以上の薬学的に受容可能な賦形剤または結合剤を含む。例えば、式IIIの化合物はバルサラジドナトリウム二水和物である。
【0159】
本明細書に記載の方法でまた有用なのは、2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の活性な代謝物の次亜塩素酸ナトリウムもしくは過酸化水素酸化生成物、または2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の非毒性の薬理学的に受容可能な塩の活性な代謝物の次亜塩素酸ナトリウムもしくは過酸化水素酸化生成物、でありこの誘導体は、一般式Iを有し、ここでXは、−SO2−または−CO−基であり、R1はフェニルもしくはカルボキシメチルフェニルラジカルのいずれかであり、または式−(CH2)n−Yのラジカルであり、Yはヒドロキシル基、アミノ基、モノアルキル−またはジアルキル−アミノ基であり、そのアルキル基は、最大6個の炭素原子、またはカルボン酸基もしくはスルホン酸基を含み、nは1〜6の整数であり、アルキレンラジカルの水素原子のうちの1つ以上がアミノ基、モノアルキル−またはジアルキル−アミノ基によって置換されてもよく、そのアルキル部分は、最大6個の炭素原子、またはアルキルラジカルを含み、ここで−(CH2)n−Yラジカルは、窒素原子またはベンゼン環を介して直接結合され、ただしこれはR−NH−Xが−CO−NH−CH2−COOHラジカル以外である条件下である。例えば、2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体はバルサラジドである。その有効な代謝物は、例えば、5−ASAである。活性代謝物の次亜塩素酸ナトリウムまたは過酸化水素酸化生成物は、例えば、5−ASAの酸化生成物である。
【0160】
(製品)
製品は、例えば、5−アミノサリチル酸化合物の経口投与に適した即時放出の薬学的組成物を保持する容器を、特定の剤形が食品とともに投与されるべきであるとき、および空の胃に摂取されるべきであるときの考慮を示す印字された表示の指示と組み合わせて備える。例示的な剤形および投与のプロトコールが以下に記載される。この組成物は、剤形を保持しかつ分配し得、この組成物と有意に相互作用せず、適切な表示を物理的に備えている任意の適切な容器に含まれる。この表示の説明は、本明細書において前に記載された処置の方法と一致している。この表示は、2つの物理的な近接性を維持する任意の手段によって容器と結び付けられてもよく、限定しない例としては、それらの表示は、包装材料、例えば、箱またはプラスチックのシュリンクラップに備えられてもよいし、または容器に結合されている説明書に対して、表示の説明を目立たなくすることのない接着剤または他の結合もしくは保持の手段を用いて結びつられてもよい。
【0161】
本発明の別の局面は、5−アミノサリチル酸化合物を含む薬学的組成物を含む容器を備える製品であって、この容器は好ましくは、5−アミノサリチル酸化合物の組成物を単位剤形で保持し、かつこの薬学的組成物が食物の有無とともに摂取されるとき、吸収が異なることを告知する印刷された表示の説明書を備える。
【0162】
「薬学的に受容可能なキャリア」という句は、身体の1つの器官または一部から身体の別の器官または一部に本発明の化合物を運ぶことまたは輸送することに関与する、薬学的に受容可能な物質、組成物またはビヒクル、例えば、液体または固体の充填剤、希釈剤、賦形剤、溶媒またはカプセル化剤を包含する。各々のキャリアは、その処方物の他の成分と適合性であり、かつ被験体に有害ではないという意味で「受容可能(acceptable)」である。薬学的に許容されるキャリアとして働き得る物質のいくつかの例としては以下が挙げられる:(1)糖、例えば、ラクトース、グルコースおよびスクロース;(2)デンプン、例えば、コーンスターチ、およびジャガイモデンプン;(3)セルロースおよびその誘導体、例えば、カルボキシルメチル・セルロース・ナトリウム、エチルセルロース、および酢酸セルロース;(4)粉末トラガカント;(5)モルト(麦芽);(6)ゼラチン;(7)滑石;(8)賦形剤、例えば、ココアバターおよび坐剤ワックス;(9)油状物、例えば、ピーナツオイル、綿実油、サフラワー油、ゴマ油、オリーブ油、コーン油、およびダイズ油;(10)グリコール、例えば、プロピレングリコール;(11)ポリオール、例えば、グリセリン、ソルビトール、マンニトール、およびポリエチレングリコール;(12)エステル、例えば、オレイン酸エチル、およびラウリン酸エチル;(13)寒天;(14)緩衝化剤、例えば、水酸化マグネシウムおよび水酸化アルミニウム;(15)アルギン酸;(16)パイロジェン・フリー水;(17)等張食塩水;(18)リンゲル溶液;(19)エチルアルコール;(20)リン酸緩衝化溶液;および(21)薬学的処方物中で使用される他の非毒性の適合物質。
【0163】
湿潤剤、乳化剤および潤滑剤、例えば、ラウリル硫酸ナトリウムおよびステアリン酸マグネシウム、ならびに着色剤、離型剤、コーティング剤、甘味剤、香味剤および芳香剤、防腐剤、および抗酸化剤もこの組成物中に存在してもよい。
【0164】
薬学的に受容可能な抗酸化剤の例としては、以下が挙げられる:(1)水溶性の抗酸化剤、例えば、アスコルビン酸、システイン塩酸塩、重硫酸ナトリウム、メタ重亜硫酸ナトリウム、亜硫酸ナトリウムなど;(2)脂溶性抗酸化剤、例えば、パルミチン酸アスコルビル、ブチル化ヒドロキシアニソール(BHA)、ブチル化ヒドロキシトルエン(BHT)、レシチン、没食子酸プロピル、αトコフェロールなど;ならびに(3)金属キレート剤、例えば、クエン酸、エチレンジアミン四酢酸(EDTA)、ソルビトール、酒石酸、リン酸など。
【0165】
5−アミノサリチル酸化合物を含む組成物としては、例えば、経口、鼻腔、局所(口腔内および舌下を含む)、直腸、経膣、エアロゾル、経皮的、および/または非経口な投与に適切な組成物が挙げられる。例えば、感染した外部胆道ドレーンを処置するために、5−アミノサリチル酸化合物を、そのドレーンを介して経皮投与して、これによって「胆管内」投与を得てもよい。この組成物は、単位剤形で便利に与えられてもよいし、薬学の当該分野で周知の任意の方法によって調製されてもよい。単一剤形を得るためにキャリア物質と組み合わされ得る有効成分の量は、処置されているホスト、特定の投与方式に依存して変化してもよい。単一剤形を得るためにキャリア物質と組み合わされ得る有効成分の量は一般には、治療効果を生じる化合物の量である。一般には、100%のうち、この量は、有効成分の約1%〜約99%、好ましくは有効成分の約5%〜約70%、さらに好ましくは約10%〜約30%におよぶ。
【0166】
これらの5−アミノサリチル酸化合物の組成物を調製する方法は、5−アミノサリチル酸化合物とキャリアとを、および必要に応じて、1つ以上の補助の成分とを組み合わせる工程を包含する。一般には、この処方物は、5−アミノサリチル酸化合物と液体キャリア、もしくは微粉化された固体キャリア、またはその両方との会合を均一かつ最初にもたらすこと、次いで、必要に応じて、その生成物を成形することによって調製される。
【0167】
経口投与に適切な5−アミノサリチル酸化合物の組成物は、カプセル(capsules)、カプセル(cachets)、丸剤、錠剤、トローチ剤(lozenges)(香味基剤、通常のスクロース、およびアカシアまたはトラガカントを用いる)、粉末、顆粒の形態であっても、または水性もしくは非水性の液体中の溶液もしくは懸濁液として、または水中油型もしくは油中水型の液体エマルジョンとして、またはエリキシルもしくはシロップとして、またはトローチ(pastilles)(不活性な基剤、例えば、ゼラチンおよびグリセリン、またはスクロース、およびアカシアを用いる)として、および/または洗口剤など(各々が所定の量の5−アミノサリチル酸化合物を有効成分として含む)であってもよい。化合物はまた、ボーラス、舐剤またはペーストとして投与されてもよい。
【0168】
経口投与のための固体剤形(カプセル、錠剤、丸剤、糖衣錠、粉末、顆粒など)では、有効成分を1つ以上の薬学的に受容可能なキャリア、例えば、クエン酸ナトリウム、またはリン酸二カルシウム、および/または任意の以下と混合する:(1)充填剤または増量剤、例えば、デンプン、ラクトース、スクロース、グルコース、マンニトール、および/またはケイ酸;(2)結合剤、例えば、カルボキシメチルセルロース、アルギン酸塩、ゼラチン、ポリビニルピロリドン、スクロースおよび/またはアカシアなど;(3)保湿剤、例えば、グリセロール;(4)崩壊剤、例えば、寒天、炭酸カルシウム、ジャガイモもしくはタピオカデンプン、アルギン酸、特定のケイ酸塩、および炭酸ナトリウム;(5)溶液緩染剤、例えば、パラフィン;(6)吸収促進物質、例えば、四級アンモニウム化合物;(7)保湿剤、例えば、アセチルアルコールおよびモノステアリン酸グリセロールなど;(8)吸収剤、例えば、カオリンおよびベントナイト粘土;(9)潤滑剤、例えば、滑石、ステアリン酸カルシウム、ステアリン酸マグネシウム、固体ポリエチレングリコール、ラウリル硫酸ナトリウムおよびそれらの混合物;ならびに(10)着色剤。カプセル、錠剤および丸剤の場合、薬学的組成物はまた、緩衝化剤を含んでもよい。同様のタイプの固体組成物はまた、充填剤として軟質および硬質充填ゼラチンカプセル中に、賦形剤、例えば、ラクトースまたは乳糖を、ならびに高分子量ポリエチレングリコールなどを用いて使用されてもよい。
【0169】
錠剤は、圧縮または成型によって、必要に応じて1つ以上の補助成分とともに作製され得る。圧縮された錠剤は、結合剤(例えば、ゼラチンまたはヒドロキシプロピルメチルセルロース)、滑沢剤、不活性希釈剤、防腐剤、崩壊剤(例えば、グリコール酸ナトリウムスターチまたは架橋化カルボキシメチル・セルロース・ナトリウム)、界面活性剤または分散剤を用いて調製してもよい。成形される錠剤は、不活性な液体希釈剤で湿らせた粉末の有効成分の混合物を適切な機械で成形することによって作製してもよい。
【0170】
本発明の薬学的組成物の錠剤および他の固体剤形、例えば、糖衣錠、カプセル、丸薬および顆粒は、必要に応じて、コーティング(被覆剤)およびシェル(shell)、例えば、腸溶性コーティングおよび医薬製剤分野において周知である他のコーティングを用いて獲得しても、または調製してもよい。錠剤はまた、例えば、所望の放出プロフィールを提供するために種々の割合のヒドロキシプロピルメチルセルロース、他のポリマーマトリックス、リポソームおよび/またはマイクロスフェアを用いて、錠剤中の有効成分の徐放性または放出制御を提供するように調合されてもよい。錠剤は、例えば、細菌保持フィルターを通過させる濾過によって、または使用直前に滅菌水もしくはある種の他の滅菌した注入可能な媒体に溶解可能である、無菌の固体組成物の形態で、滅菌している薬物を導入することによって無菌にしてもよい。これらの組成物はまた、必要に応じて、乳白剤を含んでもよく、有効成分(単数または複数)だけ、または優先的に、胃腸管のある種の部分で、場合により遅延されるように放出する組成物であってもよい。使用することができる埋め込み組成物の例には、重合物質およびワックスが挙げられる。有効成分はまた、該当する場合には1つ以上の上述した賦形剤を含む、マイクロカプセル化形態であってもよい。
【0171】
5−アミノサリチル酸化合物の経口投与のための液体の剤形としては、薬学的に受容可能なエマルジョン、マイクロエマルジョン、溶液、懸濁液、シロップおよびエリキシルが挙げられる。活性成分に加えて、液体剤形は、当該分野で一般に用いられる不活性な希釈剤、例えば、水または他の溶媒、可溶化剤および乳化剤、例えば、エチルアルコール、イソプロピルアルコール、炭酸エチル、酢酸エチル、ベンジルアルコール、安息香酸ベンジル、プロピレングリコール、1,3−ブチレングリコール、オイル(詳細には、綿実油、ラッカセイ油、コーン油、胚芽油、オリーブ油、ヒマシ油およびゴマ油)、グリセロール、テトラヒドロフリルアルコール、ポリエチレングリコールおよびソルビタンの脂肪酸エステル、ならびにその混合物などを含んでもよい。
【0172】
不活性な希釈剤に加えて、経口組成物としては、アジュバント、例えば、保湿剤、乳化剤および懸濁剤、甘味剤、香味剤、着色剤、芳香剤、および防腐剤を挙げることができる。
【0173】
懸濁剤は、活性な5−アミノサリチル酸化合物に加えて、懸濁剤、例えば、エトキシル化イソステアリルアルコール、ポリオキシエチレンソルビトールおよびソルビタンエステル、微結晶性セルロース、アルミニウムメタ水酸化物(metahydroxide)、ベントナイト、寒天およびトラガカント、ならびにこれらの混合物などを含んでもよい。
【0174】
直腸または経膣投与のための本発明の薬学的組成物は、坐剤として与えられてもよく、この坐剤は、5−アミノサリチル酸化合物と1つ以上の適切な非刺激性の賦形剤またはキャリア(例えば、ココアバター、ポリエチレングリコール、坐剤ワックスまたはサリチル酸塩を含む)とを混合することによって調製してもよく、室温では固体であるが、体温では液体であり、従って、直腸および膣腔では融解して、活性薬剤を放出する。
【0175】
本発明の組成物は、経膣投与に適切であり、またこれにはペッサリー、タンポン、クリーム、ゲル、ペースト、泡状物またはスプレー処方物(適切であることが当該分野で公知であるキャリアを含む)を含む。
【0176】
5−アミノサリチル酸化合物の局所投与または経皮投与のための剤形としては、粉末、スプレー、軟膏、ペースト、クリーム、ローション、ゲル、溶液、パッチおよび吸入薬が挙げられる。5−アミノサリチル酸化合物は、無菌条件下で薬学的に受容可能なキャリアと、および必要であり得る任意の防腐剤、緩衝液または噴霧剤と混合されてもよい。
【0177】
軟膏、ペースト、クリーム、およびゲルは、本発明の5−アミノサリチル酸化合物に加えて、賦形剤、例えば、動物および植物の脂肪、オイル、ワックス、パラフィン、デンプン、トラガカント、セルロース誘導体、ポリエチレングリコール、シリコーン、ベントナイト、ケイ酸、滑石および酸化亜鉛、またはその混合物を含んでもよい。
【0178】
粉末およびスプレーは、5−アミノサリチル酸化合物に加えて、賦形剤、例えば、ラクトース、滑石、ケイ酸、水酸化アルミニウム、ケイ酸カルシウムおよびポリアミド粉末、またはこれらの物質の混合物を含んでもよい。スプレーはさらに、慣用的な噴霧剤、例えば、クロロフルオロヒドロカルボン、および揮発性の非置換炭化水素、例えば、ブタンおよびプロパンを含んでもよい。
【0179】
5−アミノサリチル酸化合物は代わりに、エアロゾルによって投与されてもよい。これは、例えば、水性のエアロゾル、リポソーム調製物、またはこの化合物を含む固体粒子を調製することによって達成される。非水性(例えば、フルオロカーボン噴霧剤)懸濁液を用いてもよい。超音波噴霧器は、薬剤が剪断(化合物の分解を生じ得る)に曝されることを最小限にするので好ましい。
【0180】
通常には、水性のエアロゾルは、従来の薬学的に受容可能なキャリアおよび安定化剤と一緒に薬剤の水溶液または懸濁液を調合することによって作成される。このキャリアおよび安定化剤は、特定の化合物の要件で変化するが、ただし代表的には、非イオン性の界面活性剤(Tweens、Pluronicsまたはポリエチレングリコール)、血清アルブミンなどの非侵害性タンパク質、ソルビタンエステル、オレイン酸、レシチン、アミノ酸、例えば、グリシン、緩衝液、塩、糖または糖アルコールを含む。エアロゾルは一般には、等張液から調製される。
【0181】
経皮パッチは、身体に対する5−アミノサリチル酸化合物の制御された送達をもたらすという追加の利点を有する。このような剤形は、適切な媒体中に薬剤を溶解または分散することによって作製され得る。吸収促進剤をまた、皮膚を横切る有効成分の流れを増大するように用いてもよい。このような流れの速度は、速度制御膜を設けること、またはポリマーマトリックスもしくはゲル中に有効成分を分散させることのいずれかによって制御され得る。
【0182】
経口投与に適切な本発明の薬学的組成物は、1つ以上の5−アミノサリチル酸化合物を、1つ以上の薬学的に許容される無菌の等張性の水溶液または非水性の溶液、分散液、懸濁液もしくはエマルジョン、または無菌の粉末(使用直前に無菌の注射用液または分散液中に再構成され得る)(抗酸化剤、緩衝液、静菌薬、意図されるレシピエントの血液と処方物を等張にする溶質、または懸濁剤もしくは増粘剤を含んでもよい)と組み合わせて含む。
【0183】
本発明の薬学的組成物中で使用され得る適切な水性および非水性のキャリアの例としては、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、ポリエチレングリコールなど)、およびその適切な混合物、植物油、例えば、オリーブ油、および注射用有機エステル、例えば、オレイン酸エチルが挙げられる。適切な流動性は、例えば、レシチンなどのコーティング物質の使用によって、分散の場合には必要な粒子サイズの維持によって、および界面活性剤の使用によって維持され得る。
【0184】
これらの組成物はまた、アジュバント、例えば、防腐剤、保湿剤、乳化剤、および分散剤を含んでもよい。微生物の作用の予防は、種々の抗菌剤および抗真菌剤、例えば、パラベン、クロロブタノール、フェノールソルビン酸などを含むことによって保証され得る。等張剤、例えば、糖、塩化ナトリウムなどをこの組成物に含むことも所望され得る。さらに、注射用の医薬品剤形の長期の吸収は、モノステアリン酸アルミニウムおよびゼラチンなどの吸収を遅らせる剤の包含によってもたらされてもよい。
【0185】
ある場合には、薬物の効果を延長するために、皮下または筋肉内注射からの薬物の吸収を遅らせることが所望される。これは結晶性物質または非結晶性物質(水溶性が低い)の液体懸濁物の使用によって達成され得る。順次、薬物の吸収の速度は、溶解の速度に依存し、溶解の速度は、結晶の大きさおよび結晶型に依存し得る。あるいは、非経口投与された薬物型の遅延吸収は、油状ビヒクルに薬物を溶解または懸濁することによって達成される。
【0186】
注射可能なデポ型は、ポリラクチド−ポリグリコリドなどの生分解性ポリマー中に5−アミノサリチル酸化合物のマイクロカプセルマトリックスを形成することによって作成される。ポリマーに対する薬物の比、および使用される特定のポリマーの性質次第で、薬物放出の速度は、制御され得る。他の生分解性ポリマーの例としては、ポリ(オルトエステル)およびポリ(無水物)が挙げられる。デポの注射用処方物はまた、身体の組織と適合性であるリポソームまたはマイクロエマルジョン中に薬物を捕捉することによって調製される。
【0187】
5−アミノサリチル酸化合物がヒトおよび動物に対して薬剤として投与される場合、それらは、それ自体で与えられても、または薬学的に受容可能なキャリアと組み合わせて、例えば、0.1〜99.5%(さらに好ましくは、0.5〜90%)という有効成分を含む薬学的組成物として与えられてもよい。
【0188】
ある場合には、5−アミノサリチル酸化合物が投与される状態に関連する状態、例えば、疼痛、カンジダ、嚥下障害、嚥下痛、粘膜炎、食道炎、肺炎、胃炎または口内乾燥を例えば同時に寛解させるために、5−アミノサリチル酸化合物を、限定はしないが、ナイスタチン、ケトコナゾール、フルコナゾール、リドカイン、ベンゾカイン、ジフェンヒドラ
ミン、ジメンヒドリナート、アゼラスチン、セトリジン、ヒドロコルチゾン、プレドニゾン、プレドニゾロン、デキサメタゾン、トリアムシノロン、ベクロメタゾン、ブデソニド、モメタゾン、または他のステロイド、局所麻酔薬、抗真菌剤または抗ヒスタミン剤を含む他の適切な薬剤との組み合わせとして処方してもよい。この処方物は、粘性または非粘性の液体、局所適用化合物、エアロゾルまたは注射剤の形態をとってもよい。
【0189】
選択される投与経路にかかわらず、5−アミノサリチル酸化合物(適切な水和型で用いられ得る)、および/または本発明の薬学的組成物は、当業者に公知の従来の方法によって薬学的に受容可能な剤形に調合される。
【0190】
本発明の薬学的組成物中の有効成分の投与の正確な投薬レベルおよび時間経過は、特定の被験体、組成物および投与方式について、被験体に対する毒性なしに、所望の治療応答を得るのに有効であるその有効成分の量を得るために変化されてもよい。例示的な剤形を下に開示する。
【0191】
(キット)
キットも本明細書で提供され、例えば、被験体における腸炎および/または下痢を処置するためのキットが提供される。このキットは例えば、5−アミノサリチル酸化合物の組成物およびその使用説明書を備えてもよい。使用の説明書は、処方情報、投薬情報、保管情報、などを含んでもよい。
【0192】
包装された組成物も提供され、そして治療上有効な量の5−アミノサリチル酸化合物を含んでもよい。5−アミノサリチル酸化合物および薬学的に受容可能なキャリアまたは希釈剤は、この組成物が、腸の障害に罹患しているか、または罹りやすい被験体を処置するために調合され、腸の障害に罹患しているか、または罹りやすい被験体を処置するための説明書とともにパッケージングされる。
【実施例】
【0193】
本発明は、ここに記載されている実施例に限定されると解釈されるべきではないことが理解されるべきである;そうではなく、本発明は、当業者の技術の範囲内である、本明細書に提供される任意のかつ全ての適用ならびに等価なバリエーションを含むと解釈されるべきである。
【0194】
バルサラジド、5−ASAおよびNASAの全身レベルは、(1)一晩の絶食後にインタクトなカプセルとして、または(2)高脂肪の朝食後のインタクトなカプセルとして、投与されるバルサラジド二ナトリウムの2.25g(3×750mg)の単回経口用量後に測定した。18〜45歳の健康な男性被験体(試験前少なくとも2年間非喫煙者であり、かつ選択された乱用薬物についての尿検査で陰性であって、アルコール(ETOH)陰性である)を用いた。研究期間は、最少4日で分けた。標準的な薬物動態学的パラメータを、プロトコールどおり2つの研究期間について完了した17例の被験体について、バルサラジドおよびその代謝物(5−ASA、N−Ac−5−ASA、4−ABAおよびN−Ac−4−ABA)についての血漿濃度(Cmax、TmaxおよびAUClast)および尿濃度(排泄%およびClr)から計算した。これらの2つの条件下で投与について観察された全薬物動態学的プロフィールを図1に示す。5−ASAおよびNASAの出現の遅れおよびレベルの低さが明瞭に観察され得る。標準的な薬物動態学的パラメータが表1の両方の投薬条件について示される。
【0195】
【表1−1】

【0196】
【表1−2】

標準的な高脂肪食餌を与えられた場合、Cmaxパラメータによって測定して、5−ASAおよびNASAの全身レベルに有意な低下がみられた。有意な低下は、AUClastによって測定した5−ASAの全身レベルにも観察された。従って、食物を与えることにより、バルサラジドの副作用プロフィールを減らすのに好ましい、総メサラミン生成物5−ASAおよびNASAの全身暴露の少ないことが可能になる。表1ではまた、食物を与えることが、5−ASA(8.2時間対22.0時間)およびNASA(9.9時間対20.2時間)の血漿における出現までの時間の指標であるTmaxを有意に遅らせることが示される。この遅れは、GI管を通る薬物の通過が遅いことの指標である。
【0197】
食物効果の研究からのデータはまた、摂食状態で観察される値を絶食状態で観察される値で割った比として表2に示される。CmaxおよびAUClastの減少の大きさは、このデータ提示で明確に確認できる。
【0198】
【表2】

a処置A=絶食;処置B=高脂肪朝食;処置C=アップルソースがけ
b比評価および対数変換した値を用いるANOVAフィッティング混合モデルからの90%CI:対数(パラメータ)=研究群期間処置被験体(研究群)、被験体(研究群)が変量効果の場合であって、これは、高脂肪食餌対絶食、ソースがけ対絶食、およびソースがけ対高脂肪食餌を比較。
【0199】
観察されたTmaxの延長、従ってGIを通る緩徐な通過が、治療上活性な5−ASAに対する結腸粘膜の暴露の増大を生じ得る。これが観察される場合、当業者は、血漿で示されるように、ASAに対するNASAの比の変化を予期する。この可能性を試験するために、5−ASAに対するNASAの血漿比を試験した。これらのデータを図2に示す。
【0200】
図2のデータによって、5−ASAに対するNASAの全身比が、バルサラジドが絶食されている被験体に比較して摂食させられている被験体に与えられたとき増大するということが示される。従って、食物の存在下での被験体に対するバルサラジドの投与は、結腸における5−ASAの通過を延長し、NASAに対する5−ASAの大きい変換を可能にするということが結論される。結腸粘膜との5−ASAの接触の増大は、薬物の有効性を増大し得る。全身の5−ASAレベルが低いほど、副作用のプロフィールは減少し得る。従って、UC被験体にバルサラジドを食物と同時に投与することは、好ましいが、予期されない用法である。
【背景技術】
【0001】
バルサラジド二ナトリウムは、基準のブランド薬COLAZAL(登録商標)の製剤原料である。COLAZALは、消化器系の疾患、例えば軽度から中度の活動性の潰瘍性大腸炎、放射線性直腸S状結腸炎および結腸癌の処置に指示される(特許文献1を参照のこと)。バルサラジドは、結腸特異的、非ステロイド性、抗炎症性アミノサリチル酸誘導体である。バルサラジドはまた、ジアゾ結合によって4−アミノベンゾイル−β−アラニン(「4−ABA」)に結合された5−ASAを含むプロドラッグである。5−ASAはバルサラジドの活性な治療性部分であるが、これは粘膜中の代謝性N−アセチル−5−ASA(NASA)に急速に変換される(非特許文献1)。全身に吸収される5−ASAの経口用量のうち2%未満というのに比較して、血中ではこの代謝物として経口用量のうち約12%が測定され得る(COLAZAL、2006年9月、添付文書)。NASAは結腸中で低い抗炎症性活性であることが公知であり(非特許文献2)、従って、全身に循環されるとき毒性が低いと考えられる。
【0002】
5−アミノサリチル酸化合物、例えば、バルサラジドの薬物動態に対する食物の影響を評価するような薬物動態学的研究は以前には行われていない。発現の速度および治療効果の大きさをともに増大させるためには、製剤原料のバイオアベイラビリティがより大きくかつ全身の吸着がより少ないことが求められている。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】国際公開第95/18622号パンフレット
【非特許文献】
【0004】
【非特許文献1】Allgayer H、Ahnfelt NO,Kruis Wら,Gastroenterology.1989;97;38〜41
【非特許文献2】van Hogezand RA,van Hees PA,van Gorp JP,van Lier HJ,Bakker JH,Double−blind comparison of 5−aminosalicylic acid and acetyl−5−aminosalicylic acid suppositories in subjects with idiopathic proctitis.Aliment Pharmacol.Ther.1988:Feb;2(1):33〜40
【発明の概要】
【発明が解決しようとする課題】
【0005】
従って、総メサラミン(5−ASAおよびNASA)の全身のレベルを減少させ、かつ全身の循環において5−ASAのレベル(例えば、5−ASAに対するNASAの比)の減少を犠牲にしてNASAの全身のレベルを増大する用法が必要である。結腸において5−ASAの移行を遅らせる用法も当該分野では必要である。なぜなら、この用法によって、結腸粘膜との接触時間の延長および薬物の有効性の増大が得られるからである。
【課題を解決するための手段】
【0006】
本発明は、消化器系の障害を処置、予防、または寛解するためのバルサラジドの使用に関する。さらに詳細には、本発明は、潰瘍性大腸炎、放射線腸炎、過敏性腸症候群、ならびにメサラミンおよびバルサジドに応答する他の非炎症性消化器(GI)状態を処置するための5−アミノサリチル酸化合物、例えば、バルサラジドの使用に関する(参照によっ
て本明細書に援用される、米国特許第326,364号;同第6,551,632号;6,475,518号;同第6,426,338号;同第6,277,836号;同第5,519,014号;同第5,476,669号;同第5,196,205号および同第6,645,530号)。本発明はまた、消化器系疾患を処置するためのバルサラジドの使用であって、単独または他の治療剤と組み合わせた使用に関する。
【0007】
本発明は、バルサラジドを食物とともに投与することが、ヒト被験体において経口型を介する5−ASAのバイオアベイラビリティを増大し、かつ全身吸着を減らすという予期されない知見に部分的には起因する。
【0008】
一局面では、本明細書で提供されるのは、被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する、5−アミノサリチル酸化合物のバイオアベイラビリティを増大する方法である。
【0009】
一実施形態では、5−アミノサリチル酸化合物のバイオアベイラビリティは、5−アミノサリチル酸化合物を食物なしに投与することと比較して増大されている。
【0010】
一局面では、被験体の結腸に対する5−ASAのバイオアベイラビリティを増大する方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する方法が本明細書において提供される。
【0011】
別の実施形態では、5−ASAのバイオアベイラビリティは、5−アミノサリチル酸化合物を食物なしに投与することと比較して増大される。
【0012】
一局面では、被験体の結腸における5−ASAの通過を遅らせる方法であって、治療上有効な量の5−アミノサリチル酸化合物をその必要な被験体に対して食物とともに投与することを包含する方法が提供される。
【0013】
一実施形態によれば、5−ASAの通過は、5−アミノサリチル酸化合物を食物なしに投与することと比較して増大される。
【0014】
一局面では、被験体における5−ASAの全身のレベルを減少させる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する方法が提供される。
【0015】
別の実施形態によれば、5−ASAの全身のレベルは、5−アミノサリチル酸化合物を食物なしに投与することと比較して減少される。
【0016】
一局面では、被験体における5−アミノサリチル酸化合物の最大血漿濃度(Cmax)を減少させる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する方法が本明細書において提供される。
【0017】
別の実施形態によれば、5−アミノサリチル酸化合物のCmaxは、5−アミノサリチル酸化合物を食物なしに投与することと比較して減少される。
【0018】
一局面では、被験体における5−アミノサリチル酸化合物のTmaxを遅らせる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する方法が本明細書において提供される。
【0019】
一実施形態によれば、5−アミノサリチル酸化合物のTmaxは、5−アミノサリチル酸化合物を食物なしに投与することと比較して遅延される。
【0020】
一局面では、被験体における5−アミノサリチル酸化合物の吸収の程度(AUClast)を遅らせる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する方法が本明細書において提供される。
【0021】
別の実施形態によれば、5−アミノサリチル酸化合物のAUClastは、5−アミノサリチル酸化合物を食物なしに投与することと比較して低下される。
【0022】
一局面では、被験体における5−ASAに対するNASAの全身比を増大する方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する方法が本明細書において提供される。
【0023】
一実施形態によれば、5−ASAに対するNASAの全身比は、5−アミノサリチル酸化合物を食物なしに投与することに比較して増大される。
【0024】
一局面では、被験体における5−ASAからNASAへの変換を増大する方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含する方法が本明細書において提供される。
【0025】
別の実施形態によれば、5−ASAからNASAへの変換は、5−アミノサリチル酸を食物なしに投与することに比較して、治療上有効な量の5−アミノサリチル酸化合物を投与された被験体において増大される。
【0026】
別の実施形態では、5−アミノサリチル酸化合物は、メサラミン、スルファサラジン、オルサラジン、イプサラジン、サリチルアゾ安息香酸、またはバルサラジドのうちの1つ以上を含む。
【0027】
一実施形態では、5−アミノサリチル酸化合物は、式IVの化合物を含む。
【0028】
【化1】

一実施形態では、この治療上有効な量は、約6.25mg〜約7000mg/日を含む。
【0029】
別の実施形態では、この治療上有効な量は、約750mg〜約6750mg/日を含む。
【0030】
一実施形態では、この治療上有効な量は、毎日3回3錠剤の処方物の用法であって、各々の錠剤は、約750mgの5−アミノサリチル酸化合物を含む。
【0031】
別の実施形態では、この治療上有効な量は、毎日3回2錠剤の処方物の用法であって、各々の錠剤は、約1125mgの5−アミノサリチル酸化合物を含む。
【0032】
別の実施形態では、この治療上有効な量は、毎日3回1錠剤の用法であって、各々の錠剤は、約2250mgの5−アミノサリチル酸化合物を含む。
【0033】
別の実施形態では、この治療上有効な量とは、1日あたり体重70kgあたり約1〜約14gの間におよぶ用法である。
【0034】
別の実施形態では、被験体に対する投与は、食物消費前約30分から食物消費後約2時間の間に行う。一実施形態によれば、被験体に対する投与は食物の消費と実質的に同じ時点である。別の実施形態では、被験体に対する投与は食物の消費の直後から消費の約1時間後までである。
【0035】
別の実施形態では、この治療上有効な量は、錠剤、カプセル、液体、懸濁液、坐剤または浣腸の形態で薬学的組成物を含む。
【0036】
一局面では、被験体において経時的に血流中で得られる薬物の濃度またはその代謝物によって測定される、バルサラジドの経口剤形の吸収の速度および程度を減少させる方法であって、この被験体に対して治療上有効な量のバルサラジドを薬学的組成物中で食物とともに投与することを包含する方法が本明細書で提供される。
【0037】
一局面では、このバルサラジドは、食物とともに投与することが食物なしでの投与に比較して、バルサラジドの最大血漿濃度(Cmax)および吸収の程度(AUClast)の減少を生じるということを告知する表示を備える容器由来である。
【0038】
一局面では、消化器系疾患の処置においてバルサラジドを用いる方法であって、治療上有効な量のバルサラジドを食物とともに投与することが、食物なしの投与と比較してバルサラジドのCmax、AUClast、または全身の吸着のうちの少なくとも1つにおける低下を生じるという情報を消化器系の疾患を有する被験体に伝える工程を包含する、方法が本明細書で提供される。
【0039】
一局面では、消化器系障害の処置においてバルサラジドを用いる方法であって:バルサラジドを食物とともに投与することが食物なしの投与と比較して被験体の結腸に対するバルサラジドまたはその代謝物のバイオアベイラビリティを増大するという情報を備える容器からバルサラジドを得る工程と、このバルサラジドを食物とともに摂取する工程とによって、バルサラジドの経口バイオアベイラビリティを変更する工程を包含する、方法が本明細書で提供される。
【0040】
一局面では、消化器系障害の処置においてバルサラジドを用いる方法であって:処置の必要な被験体に対して治療上有効な量のバルサラジドを食物とともに投与することであって、このバルサラジドの食物との投与が、絶食状態におけるバルサラジドの投与と比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける低下を生じる工程と;治療上有効な量のバルサラジドの薬学的組成物中での食物との投与が、絶食状態における投与に比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける1つ以上の低下を生じるという情報をこの被験体に伝える工程とを包含する、方法が本明細書で提供される。
【0041】
35別の実施形態では、上記バルサラジドは、食物との投与が絶食状態での投与に比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける低下を生じるということを告知する印刷された表示を有する容器由来である。
【0042】
別の実施形態では、上記バルサラジドは錠剤型で提供される。
【0043】
別の実施形態では、上記バルサラジドは750mgの錠剤型で提供される。
【0044】
別の実施形態では、上記印刷された表示は、バルサラジドと食物との投与がCmaxの約10〜約70%の低下を生じるということを告知する。関連の実施形態では、バルサラジドと食物との投与はCmaxの約20〜約60%の低下を生じる。関連の実施形態では、バルサラジドと食物との投与はCmaxの約30〜約50%の低下を生じる。関連の実施形態ではバルサラジドと食物との投与はCmaxの約45〜約55%の低下を生じる。
【0045】
別の実施形態では、上記印刷された表示は、バルサラジドと食物との投与がAUClastの約10〜約70%の低下を生じるということを告知する。関連の実施形態では、バルサラジドと食物との投与はAUClastの約20〜約60%の低下を生じる。関連の実施形態では、バルサラジドと食物との投与はAUClastの約30〜約50%の低下を生じる。関連の実施形態ではバルサラジドと食物との投与はAUClastの約45〜約55%の低下を生じる。
【0046】
別の実施形態では、上記印刷された表示は、バルサラジドと食物との投与が5−ASAに対するNASAの全身比の約10〜約100%の増大を生じるということをさらに告知する。関連の実施形態では、バルサラジドと食物との投与が5−ASAに対するNASAの全身比の約20〜約90%の増大を生じる。関連の実施形態では、バルサラジドと食物は5−ASAに対するNASAの全身比の約30〜約80%の増大を生じる。関連の実施形態では、バルサラジドと食物とは5−ASAに対するNASAの全身比の約30〜約70%の増大を生じる。関連の実施形態では、バルサラジドと食物とは5−ASAに対するNASAの全身比の約40〜約60%の増大を生じる。関連の実施形態では、バルサラジドと食物とは5−ASAに対するNASAの全身比の約50%の増大を生じる。
【0047】
一局面では、本明細書では、ヒト被験体における細菌種の増殖を阻害する方法であって、細菌感染または異常増殖を有するヒト被験体に対して、ヒト被験体中で細菌種の増殖を阻害するのに有効な用量で5−アミノサリチル酸化合物を含む薬学的に受容可能な組成物と食物とを投与すること、を包含する方法が提供される。
【0048】
一実施形態によれば、上記5−アミノサリチル酸化合物は、メサラミン、スルファサラジン、オルサラジン、イプサラジン、サリチルアゾ安息香酸、バルサラジド、または抱合胆汁酸を含む。
【0049】
一実施形態によれば、上記細菌種は、Clostridium種、嫌気性細菌、または好気性細菌のうちの1つ以上を含む。
【0050】
一実施形態によれば、上記Clostridium種はClostridium perfringens、Clostridium difficile、Clostridium botulinum、またはClostridium tetaniである。本発明の他の実施形態は以下に開示される。
本発明はまた、以下の項目を提供する。
(項目1)
5−アミノサリチル酸化合物のバイオアベイラビリティを増大する方法であって、治療上有効な量の該5−アミノサリチル酸化合物を食物とともに被験体に投与することを包含する方法。
(項目2)
上記5−アミノサリチル酸化合物のバイオアベイラビリティが、該5−アミノサリチル酸化合物を食物なしに投与することと比較して増大される、項目1に記載の方法。
(項目3)
被験体の結腸に対する5−ASAのバイオアベイラビリティを増大する方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要がある被験体に投与することを包含する方法。
(項目4)
上記5−ASAのバイオアベイラビリティが、該5−アミノサリチル酸化合物を食物なしに投与することと比較して増大されている、項目3に記載の方法。
(項目5)
被験体の結腸における5−ASAの通過を遅らせる方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要な被験体に投与することを包含する方法。
(項目6)
上記5−ASAの通過が、該5−アミノサリチル酸化合物を食物なしに投与することと比較して増大されている、項目5に記載の方法。
(項目7)
被験体における5−ASAの全身のレベルを減少させる方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要な被験体に投与することを包含する方法。
(項目8)
上記5−ASAの全身のレベルが、該5−アミノサリチル酸化合物を食物なしに投与することと比較して減少されている、項目7に記載の方法。
(項目9)
被験体における5−アミノサリチル酸化合物の最大血漿濃度(Cmax)を減少させる方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要な被験体に投与することを包含する方法。
(項目10)
上記5−アミノサリチル酸化合物のCmaxが、該5−アミノサリチル酸化合物を食物なしに投与することと比較して減少されている、項目9に記載の方法。
(項目11)
被験体における5−アミノサリチル酸化合物のTmaxを遅らせる方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要な被験体に投与することを包含する方法。
(項目12)
上記5−アミノサリチル酸化合物のTmaxが、該5−アミノサリチル酸化合物を食物なしに投与することと比較して遅延されている、項目11に記載の方法。
(項目13)
被験体における5−アミノサリチル酸化合物の吸収の程度(AUClast)を遅らせる方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要な被験体に投与することを包含する方法。
(項目14)
上記5−アミノサリチル酸化合物のAUClastが、該5−アミノサリチル酸化合物を食物なしに投与することと比較して低下されている、項目13に記載の方法。
(項目15)
被験体における5−ASAに対するNASAの全身比を増大する方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要な被験体に投与することを包含する方法。
(項目16)
上記5−ASAに対するNASAの上記全身比が、該5−アミノサリチル酸化合物を食物なしに投与することに比較して増大されている、項目15に記載の方法。
(項目17)
被験体における5−ASAからNASAへの変換を増大する方法であって、治療上有効な量の5−アミノサリチル酸化合物を食物とともにその必要な被験体に投与することを包含する方法。
(項目18)
5−ASAからNASAへの上記変換が、該5−アミノサリチル酸化合物を食物なしに投与することに比較して、治療上有効な量の5−アミノサリチル酸化合物を投与された上記被験体において増大されている、項目17に記載の方法。
(項目19)
上記5−アミノサリチル酸化合物が、メサラミン、スルファサラジン、オルサラジン、イプサラジン、サリチルアゾ安息香酸、またはバルサラジドのうちの1つ以上を含む、項目1〜18のうちのいずれか1項に記載の方法。
(項目20)
上記治療上有効な量が、約6.25mg/日と約7000mg/日の間を含む、項目1〜18のいずれか1項に記載の方法。
(項目21)
上記治療上有効な量が、約750mg/日と約6750mg/日の間を含む、項目1〜18のいずれか1項に記載の方法。
(項目22)
上記治療上有効な量が、毎日3回3錠剤の処方物の用法であって、各々の錠剤が、約750mgの上記5−アミノサリチル酸化合物を含む、項目1〜18のいずれか1項に記載の方法。
(項目23)
上記治療上有効な量が、毎日3回2錠剤の処方物の用法であって、各々の錠剤が、約1125mgの上記5−アミノサリチル酸化合物を含む、項目1〜18のいずれか1項に記載の方法。
(項目24)
上記治療上有効な量が、毎日3回1錠剤の用法であって、各々の錠剤が、約2250mgの5−アミノサリチル酸化合物を含む、項目1〜18のいずれか1項に記載の方法。
(項目25)
上記治療上有効な量が、1日あたり体重70kgあたり約1g〜約14gの間におよぶ用法である、項目1〜18のいずれか1項に記載の方法。
(項目26)
上記被験体に対する投与が、食物消費前約30分から食物消費後約2時間の間に行われる、項目1〜18のいずれか1項に記載の方法。
(項目27)
上記被験体に対する投与が食物の消費と実質的に同じ時点である、項目1〜18のいずれか1項に記載の方法。
(項目28)
上記被験体に対する投与が食物の消費の直後から消費の約1時間後までである、項目1〜18のいずれか1項に記載の方法。
(項目29)
上記治療上有効な量が、錠剤、カプセル、液体、懸濁液、坐剤または浣腸の形態で薬学的組成物に含まれる、項目1〜18のいずれか1項に記載の方法。
(項目30)
被験体において経時的に血流中で得られる薬物の濃度またはその代謝物によって測定される、バルサラジドの経口剤形の吸収の速度および程度を減少させる方法であって、治療上有効な量の薬学的組成物中のバルサラジドを食物とともに該被験体に投与することを包含する方法。
(項目31)
食物とともに投与することが、食物なしでの投与に比較して、バルサラジドの最大血漿濃度(Cmax)および吸収の程度(AUClast)の減少を生じるということを告知する表示を備える容器に上記バルサラジドが由来する、項目30に記載の方法。
(項目32)
消化器系疾患の処置においてバルサラジドを用いる方法であって:治療上有効な量のバルサラジドを食物とともに投与することが、食物なしの投与と比較してバルサラジドのCmax、AUClast、または全身の吸着のうちの少なくとも1つにおける低下を生じるという情報を被験体に伝える工程を包含する、方法。
(項目33)
消化器系障害の処置においてバルサラジドを用いる方法であって:バルサラジドを食物とともに投与することが食物なしの投与と比較して被験体の結腸に対するバルサラジドまたはその代謝物のバイオアベイラビリティを増大するという情報を備える容器からバルサラジドを得る工程と、該バルサラジドを食物とともに摂取する工程とによって、バルサラジドの経口バイオアベイラビリティを変更する工程を包含する、方法。
(項目34)
消化器系障害の処置においてバルサラジドを用いる方法であって:処置の必要な被験体に対して治療上有効な量のバルサラジドを食物とともに投与する工程であって、該バルサラジドの食物との投与が、絶食状態におけるバルサラジドの投与と比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける低下を生じる工程と;治療上有効な量の薬学的組成物中のバルサラジドの食物との投与が、絶食状態における投与に比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける1つ以上の低下を生じるという情報を該被験体に伝える工程とを包含する、方法。
(項目35)
上記バルサラジドが、食物とともに投与することが絶食状態での投与に比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける低下を生じるということを告知する印刷された表示を有する容器由来である、項目34に記載の方法。
(項目36)
上記バルサラジドが錠剤型で提供される、項目35に記載の方法。
(項目37)
上記バルサラジドが750mgの錠剤型で提供される、項目36に記載の方法。
(項目38)
上記印刷された表示が、上記バルサラジドと食物との投与がCmaxの約10%〜約70%の低下を生じるということを告知する、項目35に記載の方法。
(項目39)
上記印刷された表示が、上記バルサラジドと食物との投与がAUClastの約10%〜約70%の低下を生じるということを告知する、項目35に記載の方法。
(項目40)
上記印刷された表示が、バルサラジドと食物との投与が5−ASAに対するNASAの全身比の約10〜約100%の増大を生じるということをさらに告知する、項目35に記載の方法。
(項目41)
ヒト被験体における細菌種の増殖を阻害する方法であって:
細菌感染または異常増殖を有するヒト被験体に対して、該ヒト被験体中で細菌種の増殖を阻害するのに有効な用量で5−アミノサリチル酸化合物を含む薬学的に受容可能な組成物と食物とを投与すること、を包含する方法。
(項目42)
上記、5−アミノサリチル酸化合物が、メサラミン、スルファサラジン、オルサラジン、イプサラジン、サリチルアゾ安息香酸、バルサラジド、または抱合胆汁酸である、項目41に記載の方法。
(項目43)
上記細菌種が、Clostridium種、嫌気性細菌、または好気性細菌のうちの1つ以上を含む、項目42に記載の方法。
(項目44)
上記Clostridium種がClostridium perfringens,Clostridium difficile,Clostridium botulinum、またはClostridium tetaniである、項目43に記載の方法。
【図面の簡単な説明】
【0051】
【図1】図1は、絶食状態および摂食状態におけるヒト被験体に投与された場合のバルサラジドおよびその重要な代謝物の薬物動態学的プロフィールを示す。
【図2】図2は、絶食状態および摂食状態における血漿の5−ASAに対するNASAの比をCmaxおよびAUClastについて示す。
【発明を実施するための形態】
【0052】
本明細書に開示されるのは、5−アミノサリチル酸化合物の組成物を食物とともに投与することにより、この化合物のバイオアベイラビリティを増大することによって消化器系の障害を処置する組成物および方法である。
【0053】
本発明のさらなる説明の前に、かつ本発明がさらに容易に理解され得るように、特定の用語を最初に規定し、かつ本明細書において便宜のために収集する。
【0054】
本明細書で用いられる共通の薬理学的用語は以下のとおりである:Tmax(最大濃度までの時間);Cmax(観察される最大濃度);kel(濃度/時間の曲線の終末直線部分の勾配);T1/2(以下のように算出された5−アミノサリチル酸化合物の半減期:0.693/Kel);AUC(last)(台形法則によって測定した最終の定量化可能濃度に対する曲線下面積);およびAUC(inf)(以下のように算出されたインフィニティに対して外挿されたAUC値:AUC(inf)=AUC(last)+C(t)last/Kel、ここでC(t)lastは最終の測定可能な濃度である)。
【0055】
「投与」または「投与すること」という用語は、被験体に対して5−アミノサリチル酸化合物を導入してその意図する機能を果たす経路を包含する。用いられ得る投与経路の例としては、注射(皮下、静脈内、非経口、腹腔内、クモ膜下腔内)、経口、吸入、直腸および経皮が挙げられる。薬学的調製物は、各々の投与経路に適切な形態で与えられてもよい。例えば、これらの調製物は、錠剤型またはカプセル型で、注射、吸入、眼薬、点眼液、軟膏、坐剤など、注射による投与、注入または吸入によって;ローションまたは軟膏による局所投与;ならびに坐剤により直腸に投与される。経口投与が好ましい。注射はボーラスであってもよいし、または連続インフュージョン(注入)であってもよい。投与経路次第で、5−アミノサリチル酸化合物を、コーティングするか、または選択された物質中に配置させて、それを、その意図される機能を果たす能力を有害に果たし得る天然の条件から防御してもよい。5−アミノサリチル酸化合物は、単独で投与されてもよいし、または上記のような別の薬剤(単数または複数)と、もしくは薬学的に受容可能なキャリアと、またはその両方と組み合わせて投与されてもよい。5−アミノサリチル酸化合物は、他の薬剤の投与の前に、その薬剤と同時に、またはその薬剤の投与後に投与されてもよい。さらに、5−アミノサリチル酸化合物はまた、その活性な代謝物、またはさらに活性な代謝物へとインビボで変換されるプレ型で投与されてもよい。
【0056】
「化学療法」とは本明細書において用いる場合、新生物の疾患経過(一般にはガン)の処置のために全身投与される治療を包含し、例えば、生物学的な治療剤、例えば、低分子インヒビター、モノクローナル抗体(例えば、Iressa、Tarceva,Erubitux)、または本明細書に記載される症状などを生じ得る類似の目的物とともに投与される他の生物製剤、例えば、下痢の不均衡な頻度または下痢のリスクの増大を生じるものを包含し得る。
【0057】
「有効な量」という用語は、所望の結果を達成するために必要な、例えば、細菌またはウイルスの感染を処置または予防するために十分な、用量かつ時間で有効な量を包含する。5−アミノサリチル酸化合物の有効量は、被験体の疾患の状態、年齢および体重などの因子、ならびに5−アミノサリチル酸化合物が被験体において所望の応答を惹起するための能力に従って変化し得る。用法は、最適の治療応答を得るために調節されてもよい。有効量とはまた、5−アミノサリチル酸化合物の任意の毒性または有害な効果(例えば、副作用)を、治療上有益な効果が上回る量である。
【0058】
「寛解させる」、「寛解」、「改善」などは、例えば、被験体において、または被験体の少なくともわずかで、例えば、少なくとも約2%、5%、10%、15%、20%、25%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、98%、100%において、またはこれらの値のうちのおよその任意の2つの間の範囲で生じる改善と一致する、検出可能な改善または検出可能な変化を指す。このような改善または変化は、バルサラジドで処置されていない被験体に比較して処置された被験体で観察され得、ここでこの未処置の被験体は、同じもしくは類似の疾患、状態、症状などを有するか、または発症しやすい。疾患、状態、症状もしくはアッセイパラメータの寛解は、主観的に、または客観的に、例えば、被験体(単数または複数)による自己評価、臨床医の評価によって、または適切なアッセイもしくは測定(生活の質の評価、疾患(単数または複数)もしくは状態(単数または複数)の進行、疾患(単数または複数)もしくは状態(単数または複数)の重篤度の低下、または生体分子(単数または複数)、細胞(単数または複数)のレベルもしくは活性(単数または複数)の適切なアッセイ(単数または複数)を包含する)を行うことによって、または被験体内の腸炎もしくは下痢の検出によって、決定され得る。寛解は、一過性であっても、長期であっても、もしくは永続的であってもよいし、あるいは5−アミノサリチル酸化合物が被験体に投与されるかまたは本明細書もしくは引用文献に記載されるアッセイもしくは他の方法で用いられる間にもしくは後に、関連時間で、例えば、以下に記載される時間枠内で、または5−アミノサリチル酸化合物の投与もしくは使用の約1時間後から被験体(単数または複数)が5−アミノサリチル酸化合物を与えられた後約、3、6、9カ月以上まで、変化してもよい。
【0059】
本明細書において用いる場合、「旅行(travel)」または「リスク条件で(at
risk conditions)」とは、下痢を起こし得る出発、および到着、および目的地にあること、あるいは下痢の原因もしくは潰瘍性大腸炎を起こすかもしくは増悪し得る状態と被験体を接触させる行動、あるいは消化器系のガンのリスクに、例えば、遺伝性素因に、または環境的原因もしくは他の原因にあることを包含するものとする。
【0060】
本明細書において用いる場合、「食物とともに投与される」とは、例えば、任意の食品、固体もしくは液体と、カロリーのある内容物とをいう。好ましくは、食物とは、十分なバルクおよび脂肪含量の固形食品であって、胃に急速に溶解および吸収されない食品である。さらに好ましくは、食物とは、食事、例えば、朝食、昼食、または夕食である。5−アミノサリチル酸化合物の投薬量は、被験体に対して、例えば、食事の約30分前〜約2時間後に投与され得、最も有利には、この投薬量は、食事を食べた15分内に投与される。「食物なし」、「絶食された」および「空の胃」という用語は、例えば、このような消費の約1時間前から約2時間後まで固形の食物を与えられていない状態をいう。
【0061】
例えば、症状、分子の値もしくは生物学的活性などの「調節」とは、例えば、症状または活性などが、検出可能な増大または減少をされることをいう。このような増大または減少は、5−アミノサリチル酸化合物で処置されていない被験体に比較して処置された被験体で観察され得、この未処置の被験体は同じまたは同様の疾患、状態、症状などを有するかまたは発症しやすい。このような増大または減少は、少なくとも約2%、5%、10%、15%、20%、25%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、98%、100%、150%、200%、250%、300%、400%、500%、1000%以上であっても、またはこれらの値の任意の2つの間の任意の範囲内であってもよい。調節は、主観的にまたは客観的に、例えば、被験体の自己評価によって、臨床医の評価によって、または適切なアッセイもしくは測定(例えば、生活の質の評価、または被験体内の分子、細胞、細胞遊走の値もしくは活性の適切なアッセイを含む)を行うことによって、決定され得る。調節は、一過性であっても、長期であっても、もしくは永続的であってもよいし、あるいは5−アミノサリチル酸化合物が被験体に投与されるかまたは本明細書もしくは引用文献に記載されるアッセイもしくは他の方法で用いられる間にもしくは後に、関連時間で、例えば、以下に記載される時間内で、または5−アミノサリチル酸化合物の投与もしくは使用の約1時間後から被験体(単数または複数)が5−アミノサリチル酸化合物を与えられた後約、3、6、9カ月以上まで変化してもよい。「調節する」という用語はまた、5−アミノサリチル酸化合物に対する暴露に対する応答において細胞の活性における増大または減少、例えば、所望の最終結果が達成されるような、動物における細胞の少なくとも小集団の増殖および/または分化の誘導の阻害をいい、例えば、処置の用いられる5−アミノサリチル酸化合物の治療結果が、特定の処置の経過にわたって増大しても減少してもよい。
【0062】
「5−アミノサリチル酸化合物を得る」という場合の「得る(obtaining)」という用語は、5−アミノサリチル酸化合物を購入するか、合成するか、そうでなければ獲得する工程を包含するものとする。
【0063】
「非経口投与」および「非経口的に投与される」という句は、本明細書において用いる場合、例えば、通常は注射による、腸内および局所投与以外の投与の方式を包含し、そして限定はしないが、静脈内、筋肉内、動脈内、クモ膜下腔内、関節内、眼窩内、心臓内、皮内、腹腔内、経気管、皮下、表皮下、関節内、被膜下、クモ膜下、脊髄内、および胸骨内の注射および注入が挙げられる。
【0064】
化合物の「予防上有効な量」という言葉は、被験体に対する単回または複数回の用量の際に、腸炎および/または下痢を予防または処置するのに有効である5−アミノサリチル酸化合物の量をいう。
【0065】
「全身投与」、「全身的に投与される」、「末梢投与」、および「末梢に投与される」という句は、本明細書において用いる場合、5−アミノサリチル酸化合物、薬物または他の物質の投与であって、その結果被験体の系に入り、従って、代謝および他の同様のプロセスに供される投与、例えば、皮下投与を意味する。
【0066】
5−アミノサリチル酸化合物の「治療上有効な量」という言葉は、被験体に対する単回または複数回の用量の際、細菌の増殖および/もしくは浸潤を阻害するのに、または被験体における細菌感染(このような細菌感染は、処置のない場合には予想されるよりはやい)の症状の軽減に有効である5−アミノサリチル酸化合物の量をいう。「治療上有効な量」とはまた、治療(例えば、5−アミノサリチル酸化合物を含む組成物)の量であって、腸炎および/または下痢の重篤度を軽減する、腸炎および/または下痢の期間を短くする、腸炎および/または下痢の進行を妨げる、腸炎および/または下痢の回帰を生じる、腸炎および/または下痢に関連する1つ以上の症状を緩和する、あるいは別の治療の治療効果(単数または複数)を増強、促進、または改善するのに十分な量をいう。
【0067】
本明細書において用いる場合、「予防する」、「予防すること」および「予防」という用語は、腹骨盤治療の投与から、または旅行から生じる被験体における腸炎および/もしくは下痢、またはその1つ以上の症状の再発、発現または発症の予防をいう。予防(すること)としては、放射線誘発性腸炎に対する防御、結腸の粘膜に対する放射線誘発性損傷に対する防御、放射線誘発性結腸直腸炎症に対する防御、および/または消化管の他の部分の放射線誘発性炎症もしくは細菌浸潤が挙げられる。例えば、5−アミノサリチル酸化合物は、放射線誘発性食道炎または他の放射線誘発性粘膜炎を処置または緩和するための口腔洗浄液として処方されてもよい。例えば、5−アミノサリチル酸化合物は、腸炎または下痢を軽減または予防するために旅行の前に旅行者に与えてもよい。
【0068】
本明細書において用いる場合、「予防上有効な量」という用語は、治療(例えば、5−アミノサリチル酸化合物を含む組成物)の量であって、腸炎および/もしくは下痢またはその1つ以上の症状の発症、再発、または発現の予防を生じるのに、あるいは別の治療の予防的効果(単数または複数)を増強または改善するのに十分な量をいう。
【0069】
本明細書において用いる場合、「被験体(subject)(単数および複数)」という用語は、腸炎および/または下痢に罹患し得るか、または本発明の5−アミノサチリル酸化合物の投与から利益を得ることができる生物体を包含し、動物、好ましくは哺乳動物を指し、この哺乳動物には非霊長類(例えば、ウシ、ブタ、ウマ、ネコまたはイヌ)、霊長類(例えば、サル、チンパンジー、またはヒト)、およびさらに好ましくはヒトが包含される。特定の実施形態では、被験体とは哺乳動物、好ましくはヒトであって、腸炎および/または下痢を誘発し得る侵襲(例えば、放射線、化学療法、または化学兵器、または旅行の間に遭遇した病原体)に曝されたか、またはそれに曝されている。別の実施形態では、この被験体は家畜(例えば、ウマ、ブタ、またはウシ)、またはペット(例えば、イヌまたはネコ)であって、同様の侵襲に曝されたか、または曝されている。
【0070】
消化器系疾患、例えば、腸炎、下痢、結腸癌、大腸炎に対する感受性としては、消化器系疾患を発症するリスクのある被験体、例えば、腹骨盤療法を受けているか受けようとしている被験体、旅行しようとしている被験体、または旅行中であるかまたはそうでなければ病原体もしくは状態、例えば、自然災害、例えば、洪水、ハリケーン、地震、ツナミなどに曝されているリスクの被験体、過去に腸炎に罹患した被験体、結腸炎もしくはガンの家族歴を有する被験体などを包含することが意味される。
【0071】
本明細書において用いる場合、「放射線」、「放射線療法(radiation therapy)」、「放射線治療(radiotherapy)」および「照射」という用語は、意図的または非意図的、悪意または治療的のいずれであろうと、電離放射線に対する任意の暴露を指し、例えば、外部ビーム放射線、光子照射療法、電子照射治療、陽子放射線療法、炭素イオン照射療法、リチウムイオン照射療法、ケイ素イオン照射療法、ヘリウムイオン照射療法、他の形態のハドロン療法または他の粒子治療、近接照射療法、放射性同位体療法、注射用同位体、例えば、任意の種類のマトリックスに固定されるかその中であるかもしくはそれと混合された同位体、または、使用される薬剤(単数または複数)とは独立した、任意の放射線暴露(意図的でないか悪意のある)を包含し得る。
【0072】
本明細書において用いる場合、「処置する、治療する」、「処置、治療」および「処置すること、治療すること」という用語は、腸炎および/もしくは下痢の進行、重篤度および/もしくは期間の軽減、またはその1つ以上の症状の緩和を指し、このような減少および/または緩和は、1つ以上の治療剤(例えば、5−アミノサリチル酸化合物を含む組成物)の投与から生じる。
【0073】
「腹骨盤治療」としては、例えば、放射線療法、化学療法、手術、またはそれらの組み合わせが挙げられる。治療は、同時に与えられても、または例えば、医療従事者によって決定される任意の時間枠内で一方の後に投与されてもよい。
【0074】
放射線は、例えば、放射線療法、偶発的な放射線暴露、およびテロリストの攻撃による放射線暴露の結果であり得る。例えば、Moulder,Int.J.Radiat.Biol.80:3〜10(2004)を参照のこと。化学的な侵襲とは一般には化学療法由来である。腸炎(腸、特に小腸の粘膜の粘膜炎)は、胃または骨盤の放射線療法、細胞傷害剤、またはそれらの組み合わせを受ける被験体に共通である。主な症状は悪心、胃痛、腫脹および下痢である。放射線誘発性の下痢はしばしば、放射線療法の開始後最初の2週間に起きる。いかなる特定の科学理論にも束縛されないが、放射線誘発性の下痢の機構は、胃腸管の上皮腺窩細胞に対する急性の機械的損傷を包含する。このような障害は、細胞死(壊死性またはアポトーシス性機構のいずれかを介する)、炎症、および腸粘膜の潰瘍を生じ、これが次に刺激性の胆汁酸塩に曝されて、日和見感染に罹り易くなる。例えば、Gwede,Seminars in Oncology Nursing 19:6〜10(2003)を参照のこと。一般的に下痢を伴う化学療法剤としては限定はしないが、フルオロピリミジン類(例えば、5−フルオロウラシルおよびさらに近年に開発されたプロドラッグカペシタビン)、トポイソメラーゼIインヒビター(例えば、イリノテカン、トポテカン)、および他の薬剤(例えば、シスプラチン、オキサリプラチン、シタラビン)が挙げられる。例えば、Viele,Seminars in Oncology
Nursing 19:2〜5(2003)を参照のこと。慢性の腸毒性はまた、放射線療法後に、通常は治療の6ヶ月〜3年後に生じ得る。被験体はしばしば間欠的に便秘および下痢になり、栄養失調および電解質の乱れを生じ得る。いくつかの場合には、急性の腸閉塞、瘻管、または腸穿孔が生じ得る。例えば、Keefeら、Seminars in Oncology 20:38〜47(2004)を参照のこと。放射線療法および放射線治療は本明細書では交換可能に用い、外部照射および内部照射を包含し、また近接照射療法、腹腔内近接照射療法、または間質放射線療法とも呼ばれる。考慮される線源としては、純粋なγ放出体、純粋なβ放出体、α放出体、中性子放出体、他のイオン放出体、および混合照射法が挙げられる。
【0075】
その必要な被験体を決定することは、水素呼吸試験、症状分析、または医学的評価および下記の他の方法のうちの1つ以上によってもよい。
【0076】
本明細書において用いる場合、「化学療法」および「化学療法剤」という用語は、交換可能に用いて、抗ガン効果を示し、悪性腫瘍の処置に用いられる化学療法剤または薬物を指す。
【0077】
本発明者らは、驚くべきことに、放射線誘発性腸炎を被っている被験体に対する5−アミノサリチル酸化合物の投与が、その状態の症状を軽減するということ、および食物との投与が、消化管に対する5−アミノサリチル酸化合物のバイオアベイラビリティを増大するということを見出した。これによって、症状の原因の標的を大きくすることが可能になり、かつ症状の寛解の有効性の改善が生じるが、同時に、伝統的な抗下痢薬などの支援方法で一般にみられるような、有害効果は少なくなる。放射線誘発性腸炎を処置するための5−アミノサリチル酸化合物の使用は特に有益である。なぜなら、腸に投与される場合、薬物の実質的な吸収には関係せず、従って、薬物間の相互作用(化学療法および/または放射線療法に対する被験体またはガンを有する被験体で一般的である)の可能性を減じるからである。これは、治療の標的が大きいこと、薬物相互作用が少ないこと、および治療に対する耐性の改善に関して見られる。特定の利点がこの治療で見られる。なぜなら、この治療は、そうでなければ処置における中断を要する症状を予防または寛解して、被験体がその症状から回復することを可能にし得るからである。処置中断は、処置有効性の減少に関連しており、従って間接的には、本発明は、処置に対する耐性の改善の機構を通じて、ガンまたは他の新生物性疾患の治癒率を改善すると考えられる。
【0078】
本明細書において用いる場合、放射線誘発性腸炎としては、例えば、腹骨盤領域の照射に由来する腹骨盤領域に対する放射線誘発性の損傷が挙げられる。照射はしばしば、急性の放射線による食道炎、胃腸炎、腸炎または結腸直腸毒性を生じる。症状としては嚥下障害、嚥下痛、下痢、消化不良、直腸炎、便失禁、痙性腹痛、腫脹、悪心、軟便、1日排便回数増加、テネスムス、粘液生産、腹骨盤疼痛、および直腸周囲不快感を挙げることができる。急性の放射線腸炎および/または直腸S状結腸炎は、ほとんど小腸、S状結腸および直腸の刺激から生じる。
【0079】
本明細書において用いる場合、「化学療法」および「化学療法剤」という用語は、交換可能に用いられて、抗ガン効果を示す化学療法剤または薬物を指し、かつ悪性腫瘍の処置に用いられる。
【0080】
放射線誘発性腸炎を被っている被験体に対する5−アミノサリチル酸化合物の投与は、その状態の症状を軽減するということが驚くべきことに見出された。放射線腸炎の処置における、例えば、バルサラジドの成功は、他の関連の5−ASA薬物(例えば、オサラジンおよびメサラミン)が臨床試験で失敗しているので驚くべきことである。
【0081】
バルサラジドは、2−ヒドロキシ−5−フェニル安息香酸誘導体の一般名であって、ここではアミノサリチル酸部分、5−アミノサリチル酸(5−ASA)(メサラミン)が、キャリア分子、4−アミノベンゾイル−*−アラニン(4−ABA)に対して、アゾ結合によって連結されている。バルサラジド二ナトリウムは極めて水溶性であって、結腸で切断されて、メサラミン(この分子の治療上活性な部分である)、および4−アミノベンゾール−アラニン(キャリア部分である)を放出する。メサラミンは、5−アミノサリチル酸であって、局所的に作用すると考えられる。
【0082】
消化器系障害を処置するためのバルサラジドの使用は特に有益である。なぜなら、腸内ミクロフローラによって活性型5−ASAへ代謝され、これによって腸管へさらに近位に吸収を介して損失なしに腸への活性薬物の最適の送達をすることが確実になるからである。バルサラジドはまた、他の5−ASAプロドラッグよりも少ない副作用を示し、サルファのアレルギーを有する被験体に投与され得る。バルサラジドはまた、有効成分が、フリーラジカルを直接スカベンジすることが実証されており、これがその後の炎症反応を減じ得るので有益である。いかなる特定の理論によっても拘束されることは望まないが、本発明者らは、バルサラジドが、直腸粘膜において炎症のメディエーターおよびフリーラジカルの放出をブロックすることによって放射線誘発性腸炎に対して防御し得ると考えている。
【0083】
本明細書において用いる場合、「放射線誘発性腸炎」としては、骨盤領域の照射に由来する骨盤領域に対する放射線誘発性の損傷が挙げられる。照射はしばしば、急性の放射線腸炎または結腸直腸毒性を生じる。症状としては、下痢、直腸炎、便失禁、軟便、1日排便回数増加、テネスムス、粘液生産、腹骨盤疼痛、および直腸周囲不快感を挙げることができる。急性の放射線腸炎はほとんどS状結腸および直腸の刺激から生じる。
【0084】
投薬量は、特定の好ましい実施形態によれば、5−アミノサチリル酸化合物の毎日投与約3,000mg〜約7000mgにおよぶ。例えば、2250mgという用量を1日2回被験体に投与してもよい。本発明に従う方法の他の適切な投薬量は、保険医療の専門家によってまたは被験体によって決定され得る。毎日投与される5−アミノサチリル酸化合物の量は、被験体の体重、健康、性別または医学的状態に依存して増大されても減少されてもよい。当業者は、本開示に基づいて被験体の適切な用量を決定できる。
【0085】
(処置の方法)
本明細書においては、1つ以上の5−アミノサリチル酸化合物を食物とともに被験体に投与することによって消化器系の障害に罹患しているか、または罹りやすい被験体を処置する方法が記載される。5−アミノサチリル酸化合物の食物との投与は、その化合物のバイオアベイラビリティおよび有効性を増大する。食物の投与はまた、下に記載されるとおり、被験体の結腸に対する5−ASAのバイオアベイラビリティを増大し、同様に、被験体の結腸における5−ASAの通過を遅らせ、被験体における5−ASAの全身レベルを減少して、副作用を少なくしかつ処置に対する被験体のコンプライアンスを大きくし得る。
【0086】
一局面によれば、本明細書において、5−アミノサリチル酸化合物のバイオアベイラビリティを増大する方法であって、治療上有効な量の5−アミノサリチル酸化合物と食物とを被験体に投与することを包含し、ここでこの5−アミノサリチル酸化合物のバイオアベイラビリティは、食物なしで5−アミノサリチル酸化合物を投与することに比較して増大されている方法が提供される。いかなる特定の理論にも拘束されないが、5−アミノサリチル酸化合物のバイオアベイラビリティは、代謝物5−ASAの通過における遅延および5−ASAに対する消化器管の暴露の増大に起因する。これはまた、全身吸着された5−ASAの量を減らすという利点を有し、これによって副作用を減じ、かつ患者のコンプライアンスを大きくする。
【0087】
一局面によれば、本明細書においては、被験体の結腸に対する5−ASAのバイオアベイラビリティを増大する方法であって、その必要な被験体に対して治療上有効な量の5−アミノサチリル酸化合物を食物とともに投与することを包含し、この5−ASAのバイオアベイラビリティが、5−アミノサリチル酸化合物を食物なしに投与することと比較して増大されている方法が提供される。
【0088】
一局面によれば、本明細書において、被験体の結腸における5−ASAの通過を遅らせる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサチリル酸化合物を食物とともに投与することを包含し、この5−ASAの通過が、5−アミノサリチル酸化合物を食物なしに投与することと比較して増大されている、方法が提供される。いかなる特定の理論によって拘束されることも望まないが、5−アミノサリチル酸化合物と食物との投与に起因する5−ASAの通過の遅延は、5−ASAに対する消化器官の暴露を増大し、かつ全身吸収される量を減少し、それによって副作用を減少しかつ患者のコンプライアンスを増大する。
【0089】
一局面によれば、本明細書において、被験体における5−ASAの全身レベルを減少するための方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含し、ここで5−ASAの全身のレベルは、5−アミノサリチル酸化合物を食物なしに投与することと比較して減少されている方法が提供される。5−アミノサリチル酸化合物と食物との投与の際の5−ASAの全身レベルの減少は、副作用を低下させて、被験体のコンプライアンスを増大する。
【0090】
一局面によれば、本明細書において、被験体における5−アミノサリチル酸化合物の最大血漿濃度(Cmax)を減少させる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含し、ここで5−アミノサリチル酸化合物のCmaxが、5−アミノサリチル酸化合物を食物なしに投与することと比較して増大されている、方法が提供される。
【0091】
一局面によれば、本明細書においては、被験体における5−アミノサリチル酸化合物のTmaxを遅らせる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含し、ここでこの5−アミノサリチル酸化合物のTmaxが、5−アミノサリチル酸化合物を食物なしに投与することと比較して遅延されている方法が提供される。
【0092】
一局面によれば、本明細書においては、被験体における5−アミノサリチル酸化合物の吸収の程度(AUClast)を遅らせる方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含し、ここで5−アミノサリチル酸化合物のAUClastが、5−アミノサリチル酸化合物を食物なしに投与することと比較して低下されている方法が提供される。
【0093】
一局面によれば、本明細書においては、被験体における5−ASAに対するNASAの全身比を増大する方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含し、ここで5−ASAに対するNASAの全身比が、5−アミノサリチル酸化合物を食物なしで投与することに比較して増大されている、方法が提供される。
【0094】
一局面によれば、本明細書においては、被験体における5−ASAからNASAへの変換を増大する方法であって、その必要な被験体に対して治療上有効な量の5−アミノサリチル酸化合物を食物とともに投与することを包含し、ここで5−ASAからNASAへの上記変換が、5−アミノサリチル酸化合物を食物なしに投与することに比較して、治療上有効な量の5−アミノサリチル酸化合物を投与された被験体において増大されている、方法が提供される。
【0095】
本明細書に記載される方法によれば、前記5−アミノサリチル酸化合物は、例えば、メサラミン、スルファサラジン、オルサラジン、イプサラジン、サリチルアゾ安息香酸、またはバルサラジドのうちの1つ以上を含む。
【0096】
治療上有効な量とは、本明細書に記載の方法によれば、約6.25mg〜約7000mg/日の用量を含む。治療上有効な量はまた、約750mg〜約6750mg/日の間を含む。治療上有効な量および用法としては、毎日3回3錠剤の処方物を投与すること、各々の錠剤が、約750mgの5−アミノサリチル酸化合物を含む、投与が挙げられる。治療上有効な用法としてはまた、例えば、毎日3回の2錠剤の処方であって、各々の錠剤が、約1125mgの5−アミノサリチル酸化合物を含むものが挙げられる。治療上有効な量および用法としてはさらに、例えば、毎日3回の1錠剤であって、各々の錠剤が、約2250mgの5−アミノサリチル酸化合物を含むものが挙げられる。本明細書に記載の方法に従って有用な他の用法例としては、例えば、1日あたり体重70kgあたり約1〜約14gの間におよぶ用法が挙げられる。
【0097】
上記被験体に対する投与は、例えば、食物消費前約30分〜食物消費後約2時間の間に行われる。食物との投与はまた、食物の消費と同時であってもよい。また、上記被験体に対する投与は例えば、食物の消費の直後から消費の約1時間後までであってもよい。
【0098】
5−アミノサリチル酸化合物は、1つ以上の非全身送達経路によって、または全身送達経路によって投与されてもよい。非全身送達経路としては、例えば、1つ以上のコロニー送達経路、摂食送達経路、クリーム、ゲルおよび/または軟膏の局所適用が挙げられる。全身送達経路としては、例えば、摂食、注射、静脈内点滴、移植、経皮送達経路、および/または経粘膜送達経路が挙げられる。
【0099】
一局面によれば、本明細書においては、被験体において経時的に血流中で得られる薬物の濃度またはその代謝物によって測定される、バルサラジドの経口剤形の吸収の速度および程度を減少させる方法であって、この被験体に対して治療上有効な量のバルサラジドを薬学的組成物中で食物とともに投与することを包含する方法が提供される。例えば、5−ASAの全身レベルは低下されて、一方NASAの全身レベルは増大されてもよい。
【0100】
一実施形態では、バルサラジドは、食物とともに投与することが、食物なしでの投与に比較して、バルサラジドの最大血漿濃度(Cmax)および吸収の程度(AUClast)の減少を生じるということを告知する表示を備える容器に由来する。
【0101】
一局面によれば、本明細書においては、消化器系疾患の処置においてバルサラジドを用いる方法であって、治療上有効な量のバルサラジドを食物とともに投与することが、食物なしの投与と比較して5−ASAのCmax、AUClast、または全身の吸着のうちの少なくとも1つにおける低下を生じるという情報を消化器系疾患を有する被験体に伝える工程を包含する、方法が提供される。
【0102】
一局面によれば、本明細書においては、消化器系障害の処置においてバルサラジドを用いる方法であって、バルサラジドを食物とともに投与することが食物なしの投与と比較して被験体の結腸に対するバルサラジドまたはその代謝物のバイオアベイラビリティを増大するという情報を示している容器からバルサラジドを得る工程と、このバルサラジドを食物とともに摂取する工程とによって、バルサラジドの経口バイオアベイラビリティを変更する工程を包含する、方法が提供される。
【0103】
一局面によれば、本明細書においては、消化器系障害の処置においてバルサラジドを用いる方法であって、処置の必要な被験体に対して治療上有効な量のバルサラジドを食物とともに投与することであって、ここでバルサラジドと食物との投与が、絶食状態におけるバルサラジドの投与と比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける低下を生じる工程と、治療上有効な量のバルサラジドの薬学的組成物中での食物との投与が、絶食状態における投与に比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける1つ以上の低下を生じるという情報をこの被験体に伝える工程とを包含する、方法が提供される。
【0104】
上記バルサラジドは、食物とともに投与することが絶食状態での投与に比較してバルサラジドのCmaxおよびAUClastのうちの少なくとも1つにおける低下を生じるということを告知する印刷された表示を有する容器に例えば由来する。バルサラジドは、例えば、錠剤、カプセル、粘着性のない粉末(loose powder)、子袋(sachet)などとして提供され得る。例えば、バルサラジドは750mgの錠剤型で提供される。
【0105】
上記印刷された表示は、バルサラジドと食物との投与がCmaxの約10〜約70%、または約20〜約50%の低下を生じるということを告知し得る。上記印刷された表示はまた、バルサラジドと食物との投与がAUClastの約10〜約70%の低下を生じるということを告知し得る。この表示はさらに、例えば、バルサラジドと食物との投与が5−ASAに対するNASAの全身比の約10〜約100%、または約20〜約80%の増大を生じるということをさらに告知し得る。例えば、5−ASAに対するNASAの比は、食物なしの投与に比較して6倍〜約8倍増大されてもよい。
【0106】
一局面によれば、本明細書では、ヒト被験体における細菌種の増殖を阻害する方法であって、細菌感染または異常増殖を有するヒト被験体に対して、ヒト被験体中で細菌種の増殖を阻害するのに有効な用量で5−アミノサリチル酸化合物を含む薬学的に受容可能な組成物と食物とを投与すること、を包含する方法が提供される。
【0107】
上記、5−アミノサリチル酸化合物は、特定の実施形態によれば、メサラミン、スルファサラジン、オルサラジン、イプサラジン、サリチルアゾ安息香酸、バルサラジド、抱合胆汁酸、および/または式I〜IIIの化合物のうちの1つ以上であってもよい。感染が減少されるか、または根絶され得る細菌種としては、例えば、Clostridium種、または嫌気性細菌、もしくは好気性細菌の種のうちの1つ以上が挙げられる。Clostridium種としては、例えば、Clostridium perfringens、Clostridium difficile、Clostridium botulinum、および/またはClostridium tetaniが挙げられる。
【0108】
一局面によれば、消化器系疾患に罹患している被験体を処置する方法は、この被験体に対して治療上有効な量の処方物を投与すること、式Iまたはその誘導体の化合物と食物とを投与することを包含する。一実施形態では、式Iの化合物は、バルサラジドナトリウム二水和物である。一実施形態では、この薬学的組成物は、2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の活性代謝物の酸化生成物、または2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の塩の活性代謝物の酸化生成物の1日あたり体重70kgあたり1〜14gにおよぶ一日用量で、消化管障害に罹患しているかまたは発症するリスクのある個体に対して経口投与される。
【0109】
一局面によれば、式IIの化合物のバイオアベイラビリティを増大する方法は、式IIの化合物の治療上有効な量と食物とを被験体に投与する工程を包含する。一実施形態では、式IIの化合物は、バルサラジドナトリウム二水和物である。
【0110】
一局面によれば、消化器系疾患に罹患している被験体を処置する方法は、式IIの化合物またはその誘導体を含む治療上有効な量の処方物を食物とともに被験体に投与することを包含する。一実施形態では、式IIIの化合物は、バルサラジドナトリウム二水和物である。別の実施形態では、消化器系疾患は、活動的な潰瘍性腸炎である。さらに別の実施形態では、この消化器系疾患は結腸癌である。
【0111】
一局面では、本明細書においては、食物とともに、2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の活性代謝物の次亜塩素酸ナトリウムもしくは過酸化水素酸化生成物、または2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の非毒性の薬理学的に受容可能な塩の活性代謝物の次亜塩素酸ナトリウムもしくは過酸化水素酸化生成物を投与する工程を包含する、消化器系障害のために被験体を処置する方法が提供される。一実施形態では、2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体はバルサラジドである。別の実施形態では、活性な代謝物は5−ASAである。別の実施形態では、活性な代謝物の次亜塩素酸ナトリウムもしくは過酸化水素酸化生成物は、5−ASAの酸化生成物である。一実施形態では、5−ASAの酸化生成物は、ゲンチシン酸である。さらに別の実施形態では、5−ASAの酸化生成物は5−ニトロ−サチリル酸塩である。
【0112】
別の実施形態では、細菌種とは偏性嫌気性菌である。関連の実施形態では、細菌種は、Clostridium種である。別の関連の実施形態では、細菌種は、Clostridium perfringens、Clostridium difficile、Clostridium tetaniおよび/またはClostridium botulinumである。一実施形態では、5−アミノサリチル酸化合物は、1日あたり6.25〜150mg/日の用量を送達するように送達系に処方される。別の実施形態では、その用量は、1日あたり約12.5〜約200mg/日を含む。別の実施形態では、5−アミノサリチル酸化合物は1日あたり6,450mgを超える用量を送達するように送達系に処方される。
【0113】
特定の実施形態では、5−アミノサチリル酸化合物の薬学的組成物は、例えば、ヒト、小児、獣医の使用のため(例えば、家畜または畜産動物、非ヒト哺乳動物、鳥類、非ヒト霊長類、マウス、ラット、ウサギ、スナネズミ、ハムスター、イヌ、ネコ、ヒツジ、ウシ、ブタ、厚皮動物、ウマ、海洋哺乳類、アヒル、ニワトリ、ガチョウ、シチメンチョウ、ダチョウ、エミュー、ハト(dove)、ハト(pigeon)、ウズラ、キジ、クジャクまたはホロホロ鳥)に処方される。
【0114】
本発明のなお別の局面は、処方医、および経口剤形の治療効果を最大にするのに有用な5−アミノサリチル酸塩化合物療法を与えられている被験体に対して、5−アミノサリチル酸化合物が約30分間の食物消費において摂取されることを推奨することによって、情報を提供する。
【0115】
5−アミノサリチル酸化合物吸収に対する食物の効果は、食物の有無において健常なボランティアに対して薬品を投与して、処方物中の5−アミノサチリル酸化合物のバイオアベイラビリティを比較するように設計された研究において特定された。
【0116】
本発明のさらに別の局面は、5−アミノサチリル酸化合物を用いてその必要な被験体を処置する方法に関する。このような処置の必要な被験体を特定することは、被験体または保険医療の専門家の判定であってもよく、主観的(例えば、意見)であっても、または客観的(例えば、試験または診断方法によって測定可能)であってもよい。
【0117】
5−アミノサリチル酸化合物は、処置の治療または旅行または他のリスク状態に対する暴露の前、間、および/または後に投与されてもよい。5−アミノサリチル酸化合物は、例えば、1日1回、1日2回、1日3回、または1日4回投与されてもよい。5−アミノサリチル酸化合物は、例えば、約3375mgのBID〜約2250mgのTIDという用量で投与されてもよい。別の例は、約100mg/日〜約7000mg/日の5−アミノサリチル酸化合物を投与することである。5−アミノサチリル酸化合物は、例えば、錠剤型、粉末型、液体またはカプセルで投与されてもよい。
【0118】
その必要な被験体としては、放射線療法を、単独でまたは他の骨盤療法(腸炎または消化管の一部の炎症を誘発し得る)と組み合わせて受ける被験体が挙げられる。この必要性は、放射線療法、化学療法、骨盤手術手技または治療の組み合わせを受ける前に;被験体が放射線療法、化学療法、骨盤手術、または治療の組み合わせを受けている間に;および被験体が放射線療法、化学療法、骨盤手術、または治療の組み合わせを受けた後に明白になり得る。例えば、被験体は、化学療法または外科的手術と組み合わせて放射線療法を受けようとされてもよいし、受けてもよいし、または受けている。
【0119】
また、腸炎であるか、腸炎に罹りやすい可能性のある被験体も包含される。被験体は、例えば、消化器系の悪性腫瘍(結腸直腸、虫垂、肛門、膵臓、肝胆道、食道、胃、胃食道接合部または小腸の癌;泌尿生殖器悪性腫瘍(前立腺、膀胱、精巣または陰茎の癌を含む);婦人科の悪性腫瘍(子宮頸部、子宮内膜、卵巣、膣または外陰部の癌を含む);または骨原性および他の肉腫変性の悪性腫瘍(腹骨盤構造が関与する)に罹患していてもよいし、あるいは被験体は、病原体もしくは旅行者の下痢をもたらし得る他の条件に接触しやすい場合がある位置への旅行にあってもよいし、または旅行しようとしていてもよい。
【0120】
本明細書において用いる場合、治療上有効な量とは、ヒトまたは非ヒト被験体に投与された場合、症状の寛解などの治療的利益をもたらすのに有効な量、例えば、急性の放射線腸炎の症状を軽減させるのに有効な量を意味する。
【0121】
特定の実施形態によれば、5−アミノサリチル酸化合物は、放射線療法の前に投与してもよい。5−アミノサリチル酸化合物は、例えば、被験体の放射線療法の初回投与の少なくとも1日前、被験体の放射線療法の初回投与の少なくとも5日前、放射線療法の間、放射線療法の休止後少なくとも1日間、放射線療法の休止後14日間、または前、間および後の組み合わせで投与されてもよい。これらの時間枠は一般の言及についてであって、処置の期間は、被験体ごとを基準に医療従事者によって決定され得る。治療の少なくとも5日前の投与とは、毎日投与、骨盤療法前に毎日、治療前にほぼ毎日投与、治療日に投与、または治療日投与なしを包含する。
【0122】
特定の好ましい実施形態としては、放射線療法の初回投与の少なくとも1日前から放射線療法の休止後少なくとも1日までの5−アミノサリチル酸化合物の投与が挙げられる。放射線療法の前の処置によって、5−アミノサリチル酸化合物が損傷の原因の間にその作用部位に存在することが可能になる。
【0123】
特定の実施形態では、5−アミノサリチル酸化合物は、約2週間〜約6週間の期間、約8週間〜約12週間の期間、または1日〜約7日の期間、被験体に投与される。5−アミノサリチル酸化合物は、処置の経過の間、間欠的にまたは連続的に投与され得る。処置の長さは、放射線療法、化学療法のタイプおよび長さに依存して変化し得、そして/または外科手技のタイプおよび処置の適切な長さは、本開示の恩典を有する当業者によって容易に決定され得る。
【0124】
任意の実施形態について、5−アミノサリチル酸化合物は、被験体に対して、例えば、1日1回、1日2回、1日3回、または1日4回投与され得る。本発明のある特に好ましい方法では、5−アミノサリチル酸化合物を被験体に対して1日2回投与することを包含する、なぜなら、これによって、例えば、副作用を最小にして、被験体のコンプライアンスを増大し得るからである。
【0125】
投薬量は、特定の好ましい実施形態によれば、毎日投与される5−アミノサリチル酸化合物の約100mg〜約7000mgの間におよぶ。本発明による方法のための他の適切な投薬量は、保険医療の専門家によって、または被験体によって決定され得る。毎日投与される5−アミノサリチル酸化合物の量は、被験体の体重、年齢、健康度、性別または医学的状態に基づいて増大されても、または減少されてもよい。当業者は、本開示に基づいて被験体に適切な用量を決定することができる。
【0126】
複数の治療を受けている被験体については、5−アミノサリチル酸化合物は、例えば、被験体の放射線療法、化学療法の初回投与の少なくとも1日前、および/または外科手技を受ける前に投与されても;被験体の放射線療法、化学療法の初回投与の少なくとも5日前、および/または外科手技を受ける前に投与されても;放射線療法、化学療法および/または外科手技の間に投与されても;放射線療法、化学療法の中断の少なくとも1日後、または外科手技後に投与されても;放射線療法、化学療法の中断後14日間、または外科手技後に投与されてもよい。
【0127】
処置の前に、処置の間に、および処置の中断後に被験体に5−アミノサリチル酸化合物を投与することがしばしば好ましい。例えば、5−アミノサリチル酸化合物は、放射線療法、化学療法の初回投与の少なくとも1日前、および/または外科手技を受ける前、放射線療法、化学療法、または外科手技の中断後少なくとも1日まで投与されてもよい。
【0128】
適応症としては、子宮頸癌、前立腺癌、虫垂癌、結腸癌、腸の癌、直腸癌、膵臓癌、肝臓癌、小腸の癌、食道癌、胃癌、胃食道接合部癌、もしくは他の消化器系の悪性腫瘍、または前立腺切除の処置の結果として、放射線療法、化学療法および/または外科手技を受けている被験体が挙げられる。
【0129】
特定の実施形態によれば、5−アミノサリチル酸化合物は、例えば、化学療法剤、抗炎症剤、抗発熱剤 増感剤、放射線防護剤、泌尿器剤、制吐剤、および/または抗下痢剤を含む他の化合物と組み合わせて投与されてもよい。例えば、シスプラチン、カルボプラチン、ドセタキセル、パクリタキセル、フルオロウラシル、カペシタビン、ゲムシタビン、イリノテカン、トポテカン、エトポシド、マイトマイシン、ゲフィニチブ、エルロチニブ、セツキシマブ、ベバシズマブ、イレッサ、タラバ(tarava)、エルビタックス、ビンクリスチン、ビンブラスチン、ドキソルビシン、シクロホスファミド、セレコキシブ、ロフェコキシブ、バルデコキシブ、イブプロフェン、ナプロキセン、ケトプロフェン、デキサメタゾン、プレドニゾン、プレドニゾロン、ヒドロコルチゾン、アセトアミノフェン、ミソニダゾール、アミフォスチン(amifostine)、タムソロシン、フェナゾピリジン、オンダンセトロン、グラニセトロン、アロステロン、パロノセトロン、プロメタジン、プロクロルペラジン、トリメトベンズアミド、アプレピタント、リファキシミン、ジフェノキシレートとアトロピン、および/またはロペラミド。
【0130】
本明細書に開示される方法はまた、放射線誘発性腸炎、または他の消化管炎症に対して、5−アミノサリチル酸化合物の治療上有効な量を、その必要な被験体に対して投与することによって防御するために有用である。例えば、予防的な用量は、放射線を与えられる前に被験体に投与されてもよい。
【0131】
本明細書に開示される方法は結腸の粘膜に対する放射線誘発性の損傷に対して、および放射線誘発性の結腸直腸炎または他の消化器の粘膜炎に対して、治療上有効な量の5−アミノサリチル酸化合物をその必要な被験体に投与することによって、被験体を防御するのに有用である。
【0132】
さらに別の局面では、腸炎および/または下痢に罹患しているかまたは罹患しやすい被験体を処置する方法であって、その必要な被験体に対して、治療上有効な量の5−アミノサリチル酸化合物の処方物を投与することを包含し、それによってその被験体を処置する方法。腸炎および/もしくは下痢、例えば、放射線誘発性の腸炎もしくは旅行者の下痢に罹患しているか、または罹患しやすい被験体の特定の際に、5−アミノサチリル酸化合物が投与される。
【0133】
被験体における処置の有効性を評価する方法は、腸内細菌の異常増殖または下痢の前処置値を、当該分野で周知の方法(例えば、水素呼気検査、メタン呼気検査、生検、腸内細菌のサンプリング、排便の量または頻度またはタイプの測定など)によって決定する工程、次いでこの被験体に対して治療上有効な量の5−アミノサチリル酸化合物を投与する工程を包含する。5−アミノサリチル酸化合物の投与の後、適切な期間後(例えば、処置の初期期間後)例えば、2時間、4時間、8時間、12時間または72時間後、細菌の異常増殖および/または下痢のレベルを再度測定する。細菌値または下痢の調節は処置の有効性を示す。細菌の異常増殖および/または下痢のレベルは、処置を通じて周期的に決定され得る。例えば、細菌の異常増殖または下痢を、2〜3時間ごと、2〜3日ごと、または2〜3週ごとにチエックして、処置のさらなる有効性を評価してもよい。細菌の異常増殖または下痢における減少は、処置が有効であるということを示す。記載される方法を5−アミノサチリル酸化合物での処置から利点があり得る被験体をスクリーニングまたは選択するために用いてもよい。
【0134】
処置の有効性は、例えば、細菌の異常増殖の減少によって測定され得る。有効性はまた、腸炎および/もしくは下痢に関連する症状の低減、症状の安定化、または腸炎および/もしくは下痢に関連する症状の休止、例えば、悪心、腫脹、疼痛、排便の頻度などの軽減に関して測定され得る。
【0135】
一局面では、5−アミノサリチル酸化合物の処方物で処置されている被験体の進行をモニタリングする方法は、細菌の過剰増殖または下痢の前処置値を決定する工程と、治療上有効な量の5−アミノサリチル酸化合物をこの被験体に投与する工程と、5−アミノサリチル酸化合物での処置の最初の期間後の細菌過剰増殖および/または下痢のレベルを決定する工程とを包含し、ここでこの細菌の過剰増殖の調節が処置の有効性を示す。
【0136】
種々の実施形態では、治療(例えば、予防剤または治療剤)は5分未満離れて、30分未満離れて、1時間離れて、約1時間離れて、約1〜約2時間離れて、約2時間〜約3時間離れて、約3時間〜約4時間離れて、約4時間〜約5時間離れて、約5時間〜約6時間離れて、約6時間〜約7時間離れて、約7時間〜約8時間離れて、約8時間〜約9時間離れて、約9時間〜約10時間離れて、約10時間〜約11時間離れて、約11時間〜約12時間離れて、約12時間〜約18時間離れて、約18時間〜約24時間離れて、約24時間〜約36時間離れて、36時間〜48時間離れて、48時間〜52時間離れて、52時間〜約60時間離れて、60時間〜72時間離れて、72時間〜84時間離れて、84時間〜96時間離れて、または96時間〜120時間離れて与えられる。好ましい実施形態では、胃耐性の5−アミノサリチル酸化合物の処方物が1日2回投与される。他の実施形態では、この胃耐性5−アミノサリチル酸化合物の処方物は、約1日〜約7日間、例えば、約7日/月の間、約1月〜約36ヶ月の間、または約1月〜約36ヶ月の間毎日1回もしくは2回投与される。
【0137】
特定の実施形態では、本発明の1つ以上の処方物および1つ以上の他の治療剤(例えば、予防剤または治療剤)が臨床投与される。循環療法は、ある期間の間の初回の治療(例えば、最初の予防剤または治療剤)の投与、続いて、ある期間の間の第二の治療(例えば、第2の予防剤または治療剤)の投与、必要に応じてそれに続く、ある期間の間の三回目の治療(例えば、予防剤または治療剤)の投与など、ならびに治療のうちの1つの副作用を回避もしくは軽減するため、および/または治療の有効性を改善するために、この一連の投与を繰り返す工程(例えば、治療の1つに対する耐性の発達を軽減するためのサイクル)を包含する。
【0138】
特定の実施形態では、本発明の同じ処方物の投与が反復されてもよく、そして投与は、少なくとも1日、2日、3日、5日、10日、15日、30日、45日、2ヶ月、75日、3ヶ月、または少なくとも6ヶ月隔てられてもよい。他の実施形態では、胃耐性の5−アミノサリチル酸化合物の処方物以外の同じ治療の投与(例えば、予防剤または治療剤)を繰り返してもよく、その投与は、少なくとも1日、2日、3日、5日、10日、15日、30日、45日、2ヶ月、75日、3ヶ月、または少なくとも6ヶ月隔てられてもよい。
【0139】
特定の適応にはより長い処置時間が必要であり得る。短時間処置としては、例えば、1〜約7日の処置が挙げられる。5−アミノサリチル酸化合物での長期処置としては、例えば、15日間、3ヶ月間、9ヶ月間、3ヶ月間の7日/1月、3〜12月間の7日/1月、またはその間もしくはより長い任意の時間が挙げられる。本開示の恩典を有する当業者は、特定の被験体または意図される結果に関して投薬量を変化する方法を理解する。用法は、被験体の年齢、サイズおよび状態に依存して変化する。例えば、疾患の重篤度、または損傷が新しい疾患状態であるか、または再燃(relapse)もしくは再発(recurrence)などであるかに依存する。
【0140】
本発明の予防的および/または治療的なプロトコールの毒性および有効性は、例えば、LD50(集団の50%致死用量)およびED50(集団の50%に治療上有効な用量)を決定するための、細胞培養物または実験動物における標準的な薬学的手順によって決定され得る。毒性効果と治療効果との間の用量比は、治療係数であって、LD50/ED50の比として表されてもよい。大きい治療係数を示す予防剤および/または治療剤が好ましい。毒性の副作用を示す予防剤および/または治療剤が用いられることもあるが、未感染の細胞に対する潜在的な損傷を最小限にして、これによって副作用を減じるためには、罹患した組織の部位に対してこのような剤を標的する送達系をデザインするように注意すべきである。
【0141】
細胞培養アッセイ、動物の研究およびヒトの研究から得たデータを、ヒトでの使用のための予防剤および/または治療剤のある範囲の投与量を処方するのに用いてもよい。このような薬剤の投薬量は好ましくは、毒性をほとんどまたは全く有さない、ED50を含むある範囲の循環濃度内で好ましい。この投薬量は、使用される投薬量および利用される投与経路に依存してこの範囲内で変化し得る。本発明の方法で用いられる任意の薬剤については、治療上有効な用量は、細胞培養アッセイから最初に見積もることができる。ある用量を、細胞培養中で決定されるIC50(例えば、症状の最大半分阻害を達成する試験化合物の濃度)を含む循環血漿濃度範囲を達成するように、動物モデルで処方してもよい。このような情報は、ヒトにおいて有用な用量をさらに正確に決定するために用いられ得る。血漿中のレベルは、例えば、高速液体クロマトグラフィーによって測定してもよい。
【0142】
特定の障害または状態の処置において有効である本発明の組成物の量は、障害または状態の性質に依存し、標準的な臨床技術によって決定され得る。処方物中で使用されるべき正確な用量はまた、投与経路、および疾患または障害の重篤度に依存し、施術者の判定および各々の被験体の状況に従って決定されるべきである。
【0143】
5−アミノサリチル酸化合物の処方物、例えば、バルサラジドの合計一日用量は、約25mg〜約7000mgに及んでもよい。例えば、一般には、本発明の処方物中のバルサラジドの成体の合計一日用量は、約300mg〜約2000mg、約750〜約6750mg、約6000〜約7000mg、またはその間の任意の全ての数または分数の値に及ぶ。単回用量は、約250、275、400、600、525、550、575、750、800または1000mgのバルサラジドを含むように処方されてもよい。一実施形態では、単回用量は、約750mgのバルサラジドを含む。
【0144】
5−アミノサリチル酸化合物は、放出の改変された処方物として、または膜制御(membrane−controlled)処方物として提供され得る。本発明の膜制御処方物は、急速放出コア(これはモノリシック型(例えば錠剤)であっても、または多ユニット型(例えば、ペレット)であってもよい)を調製すること、およびこのコアを膜でコーティングすることによって作製されてもよい。次いで、この膜制御コアはさらに機能的なコーティングでコーティングされてもよい。この膜制御コアと機能的コーティングとの間には、バリアまたはシーラント(封止剤)が適用されてもよい。このバリアまたはシーラントは別々に、または追加して、急速放出コアと膜コーティングとの間に設けられてもよい。
【0145】
5−アミノサリチル酸化合物の処方物は、5−アミノサリチル酸化合物の任意の多形であってもまたは非結晶型であってもよい。
【0146】
ある実施形態では、5−アミノサリチル酸化合物は、薬学的に受容可能な処方物、例えば、この薬学的に受容可能な処方物が被験体に投与された後、少なくとも12時間、24時間、36時間、48時間、1週、2週、3週、または4週の間、被験体へ5−アミノサリチル酸化合物の徐放性の送達をもたらす、薬学的に受容可能な処方物を用いて被験体に投与される。
【0147】
いくつかの実施形態では、本発明の薬学的組成物を、処置の必要な領域に対して局所的に投与することが所望され得る。これは、例えば、手術、または局所適用の間の局所注入によって、例えば、手術後の創傷への包帯と組み合わせて、注射によって、カテーテルによって、坐剤によって、またはインプラント(インプラントは多孔性、非多孔性、またはゼラチン物質であり、これには膜、例えば、シラスティック(sialastic)膜、またはファイバーを含む)によって達成されてもよい。一実施形態では、投与は、侵害、例えば、放射線、化学療法、または化学/生物学的な戦闘剤(warfare agent)に最も感受性である急速増殖組織の部位(または前者の部位)に直接注射であってもよい。別の実施形態では、5−アミノサリチル酸化合物は、経口投与のための粘性または非粘性の溶液中で処方されてもよい。別の実施形態では、5−アミノサリチル酸化合物は、放射線誘発性の口腔粘膜炎または食道炎を寛解するために、疼痛救済剤(pain reliever)、例えば、リドカインを含む粘性または粘性でない混合物中に処方してもよい。別の実施形態では、5−アミノサリチル酸化合物は、放射線誘発性の口腔粘膜炎または食道炎を寛解するために例えばスクラルファートを含む粘性または非粘性の混合物中に処方されてもよい。別の実施形態では、5−アミノサリチル酸化合物は、放射線誘発性の口腔粘膜炎または食道炎を寛解するために、例えばナイスタチンを含む粘性または非粘性の混合物中に処方されてもよい。別の実施形態では、5−アミノサリチル酸化合物は、放射線誘発性の口腔粘膜炎または食道炎を寛解するために、上記の組み合わせなどを含む粘性または非粘性の混合物中に処方されてもよい。
【0148】
特定の実施形態では、5−アミノサリチル酸化合物のこれらの薬学的組成物は、被験体に対する局所的投与または経口投与に適切である。他の実施形態では、下に詳細に記載のとおり、本発明の薬学的組成物は、以下に適合したものを含む、固体型または液体型での投与のために特別に処方されてもよい:(1)経口投与、例えば、ドレンチ(drenches)(水性または非水性の溶液または懸濁液)、錠剤、ボーラス、粉末、顆粒剤、ペースト;(2)非経口投与、例えば、滅菌の溶液または懸濁液としての、例えば、皮下、筋肉内、または静脈内の注射による;(3)局所適用、例えば、皮膚に適用される、クリーム、軟膏、またはスプレーとして;(4)膣内にまたは直腸内に、例えば、ペッサリー、クリームまたは泡状物として;または(5)エアロゾル、例えば、水性のエアロゾル、リポソーム調製物、または固体粒子(化合物を含む)。
【0149】
「薬学的に受容可能な」という句は、合理的な利益/リスク比と釣り合った、過度の毒性、刺激作用、アレルギー応答、または他の問題もしくは合併症なしにヒトおよび動物の組織と接触した使用に適切な、妥当な医学的判断の範囲内である、このような化合物を含む組成物および/または剤形を指す。
【0150】
(5−アミノサリチル酸化合物および薬学的組成物)
本明細書において用いる場合、「5−アミノサリチル酸化合物」とは、例えば、下記の式I〜IIIの化合物、ならびに、メサラミン、スルファサラジン、オルサラジン、イプサラジン、サリチルアゾ安息香酸およびバルサラジドをいう。バルサラジドは、Colazal(登録商標)の一般名である。5−アミノサリチル酸化合物の使用および製造の例は、例えば、米国特許第6,197,341号;同第5,905,073号;同第5,498,608号;および同第6,326,364号(その全体が参照によって本明細書に援用される)に見出され得る。5−アミノサリチル酸化合物は、そのバイオアベイラビリティおよび有効性を増大するために本明細書に記載の方法で有用である。
【0151】
薬物生成物、COLAZALは、経口送達のための硬ゼラチンカプセル中に750mgのバルサラジド二ナトリウムを含む。経口的に摂取した場合、プロドラッグのバルサラジドの99%が結腸に達し、ここで結腸の細菌のアゾリダクターゼ酵素の存在がジアゾ結合を減じ、それによって結腸の局所活性のために5−ASAを放出させる(Colazal(登録商標)バルサラジド二ナトリウム)カプセル750mg Package Insert 0004.1/July 2000)。この放出された4−ABAキャリア成分は、吸収が劣り、糞便中にほとんど排出される(Ragunath KおよびWilliams JG.Aliment Pharmacol.Ther.2001;15:1549〜1554)。5−ASAの局所的存在は、このクラスの薬物の有効性の基礎であって、粘膜の5−ASAの濃度は、UC疾患活性と逆相関する(Frieri G,Giacomelli R,Pimpo Mら、Gut 2000;47:410〜414)。5−ASAの正確な作用機序は、完全には理解されないが、5−ASAの全身暴露は、処置に関連する副作用を担うと考えられる。バルサラジドでの研究において最も広がっているのは頭痛であり(Green JB Gastroenterology 1999;117:1513〜1514)、5−ASAの全身レベルが低いほど、いくつかのトライアルで観察されるように、頭痛の頻度の少なさに寄与し得る(Levine DS、Riff DS、Pruitt Rら、Am.J.Gastroenterol.2002;9:1398〜1407)。従って、活性な治療部分の局所粘膜濃度を増大し、5−ASAの全身吸収を減少する用法が好ましい。
【0152】
5−ASAはバルサラジドの活性な治療部分であるが、これは粘膜において代謝物N−アセチル−5−ASA(NASA)に急速に変換される(Allgayer H、Ahnfelt NO、Kruis Wら、Gastroenterology.1989;97;38〜41)。全身に吸収される5−ASAの口腔用量のうちの2%未満というのに比べて、口腔用量のうちおよそ12%が血中でこの代謝物として測定され得る(van Hogezand RA、van Hees PA、van Gorp JP、van Lier HJ、Bakker JH、Double−blind comparison of 5−aminosalicylic acid and acetyl−5−aminosalicylic acid suppositories in subjects with idiopathic proctitis.Aliment Pharmacol Ther.1988 Feb;2(1)33〜40)。NASAは、結腸で低い抗炎症性活性であることが公知であり(Colazal(登録商標)(バルサラジド二ナトリウム)カプセル750mg添付文書2006年9月)、従って、全身循環の場合には毒性が低いと考えられる。従って、総メサラミン(5−ASAおよびNASA)の全身レベルを減らし、全身循環において5−ASAのレベルの減少を犠牲にしてNASAの全身レベル(すなわち、5−ASAに対するNASAの比)を増やす用法が好ましい。結腸における5−ASAの通過を遅らせる用法はまた、結腸粘膜との接触時間の増大を生じ、従って、薬物の有効性を増大し得る。この結腸粘膜との接触時間の増大はまた、5−ASAに対するNASAの全身比の増大を生じる。メサラミンのpH依存性放出処方物に対してバルサラジドを比較する以前の研究では、炎症の粘膜のS状結腸検査スコアリングによって測定した場合、有効性が大きいほど、5−ASAの全身レベルの低さおよび全身の5−ASAに対するNASAの比の高さと関連していることが示された(Levine DS,Riff DS、Pruitt Rら、Am.J.Gastroenterol.2002;9;1398〜1407)。本開示によって、摂食状態でヒト被験体にバルサラジドを与えることがこれらの目標を達成する用法であるということが示される。
【0153】
本発明による適切な組成物はまた、下記のような式I〜IIIの化合物を含む。
【0154】
【化2】

ここで、Xは、SO2またはCOであり;
R1はフェニル、カルボキシメチルフェニル、または−R2Yであり;
R2は(CH2)nまたはベンジル−(CH2)nであり、ここでアルキレン部分の1つ以上の水素原子は、C1−6アルキル、NH2、NH(C1−6−アルキル)、またはN(C1−6−アルキル)2基によって置換されてもよく;
YはCOOH、SO3H、OH、NH2、NHR3またはN(R3)2であり;
R3はカルボン酸またはスルホン酸基によって必要に応じて置換されているC1−6−アルキルであり;そしてnは1〜6の整数であって;
この誘導体は、エステル、活性代謝物、および非毒性の薬学的に受容可能な塩からなる群より選択され;
1つ以上の薬学的に受容可能な賦形剤または結合剤と組み合わされ;
ここでこの処方物は、少なくとも0.9mg/mm3の密度を有する錠剤の形態である。
【0155】
特定の実施形態では、式Iは、バルサラジドナトリウム二水和物を含む。本明細書に記載の方法によれば、この薬学的組成物は、2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の活性な代謝物の酸化生成物、または2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の塩の活性な代謝物の酸化生成物の1日あたり70kgの体重あたり1〜14gにおよぶ1日用量で、消化器系の障害に罹患しているか、またはその発症のリスクのある個体に経口投与されてもよい。
【0156】
【化3】

ここで、Xは、SO2またはCOであり;
R1はフェニル、カルボキシメチルフェニル、または−R2Yであり;
R2は(CH2)nまたはベンジル−(CH2)nであり、ここでアルキレン部分の1つ以上の水素原子は、C1−6アルキル、NH2、NH(C1−6−アルキル)、またはN(C1−6−アルキル)2基によって置換されてもよく;
YはCOOH、SO3H、OH、NH2、NHR3またはN(R3)2であり;
R3はカルボン酸またはスルホン酸基によって必要に応じて置換されているC1−6−アルキルであり;そしてnは1〜6の整数である;
またはそのエステル;またはその活性な代謝物;またはその非毒性の薬学的に受容可能な塩であって;
1つ以上の薬学的に受容可能な賦形剤または結合剤と組み合わされ;
例えば、式IIの化合物は、バルサラジドナトリウム二水和物である。
【0157】
【化4】

ここで、Xは、SO2またはCOであり;
R1はフェニル、カルボキシメチルフェニル、または−R2Yであり;
R2は(CH2)nまたはベンジル−(CH2)nであり、ここでアルキレン部分の1つ以上の水素原子は、C1−6アルキル、NH2、NH(C1−6−アルキル)、またはN(C1−6−アルキル)2基によって置換されてもよく;
YはCOOH、SO3H、OH、NH2、NHR3またはN(R3)2であり;
R3はカルボン酸またはスルホン酸基によって必要に応じて置換されているC1−6−アルキルであり;そしてnは1〜6の整数である。
【0158】
特定の実施形態では、誘導体は、エステル、活性代謝物、および非毒性の薬学的に受容可能な塩を含む群から選択される。この化合物はさらに、1つ以上の薬学的に受容可能な賦形剤または結合剤を含む。例えば、式IIIの化合物はバルサラジドナトリウム二水和物である。
【0159】
本明細書に記載の方法でまた有用なのは、2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の活性な代謝物の次亜塩素酸ナトリウムもしくは過酸化水素酸化生成物、または2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体の非毒性の薬理学的に受容可能な塩の活性な代謝物の次亜塩素酸ナトリウムもしくは過酸化水素酸化生成物、でありこの誘導体は、一般式Iを有し、ここでXは、−SO2−または−CO−基であり、R1はフェニルもしくはカルボキシメチルフェニルラジカルのいずれかであり、または式−(CH2)n−Yのラジカルであり、Yはヒドロキシル基、アミノ基、モノアルキル−またはジアルキル−アミノ基であり、そのアルキル基は、最大6個の炭素原子、またはカルボン酸基もしくはスルホン酸基を含み、nは1〜6の整数であり、アルキレンラジカルの水素原子のうちの1つ以上がアミノ基、モノアルキル−またはジアルキル−アミノ基によって置換されてもよく、そのアルキル部分は、最大6個の炭素原子、またはアルキルラジカルを含み、ここで−(CH2)n−Yラジカルは、窒素原子またはベンゼン環を介して直接結合され、ただしこれはR−NH−Xが−CO−NH−CH2−COOHラジカル以外である条件下である。例えば、2−ヒドロキシ−5−フェニルアゾ安息香酸誘導体はバルサラジドである。その有効な代謝物は、例えば、5−ASAである。活性代謝物の次亜塩素酸ナトリウムまたは過酸化水素酸化生成物は、例えば、5−ASAの酸化生成物である。
【0160】
(製品)
製品は、例えば、5−アミノサリチル酸化合物の経口投与に適した即時放出の薬学的組成物を保持する容器を、特定の剤形が食品とともに投与されるべきであるとき、および空の胃に摂取されるべきであるときの考慮を示す印字された表示の指示と組み合わせて備える。例示的な剤形および投与のプロトコールが以下に記載される。この組成物は、剤形を保持しかつ分配し得、この組成物と有意に相互作用せず、適切な表示を物理的に備えている任意の適切な容器に含まれる。この表示の説明は、本明細書において前に記載された処置の方法と一致している。この表示は、2つの物理的な近接性を維持する任意の手段によって容器と結び付けられてもよく、限定しない例としては、それらの表示は、包装材料、例えば、箱またはプラスチックのシュリンクラップに備えられてもよいし、または容器に結合されている説明書に対して、表示の説明を目立たなくすることのない接着剤または他の結合もしくは保持の手段を用いて結びつられてもよい。
【0161】
本発明の別の局面は、5−アミノサリチル酸化合物を含む薬学的組成物を含む容器を備える製品であって、この容器は好ましくは、5−アミノサリチル酸化合物の組成物を単位剤形で保持し、かつこの薬学的組成物が食物の有無とともに摂取されるとき、吸収が異なることを告知する印刷された表示の説明書を備える。
【0162】
「薬学的に受容可能なキャリア」という句は、身体の1つの器官または一部から身体の別の器官または一部に本発明の化合物を運ぶことまたは輸送することに関与する、薬学的に受容可能な物質、組成物またはビヒクル、例えば、液体または固体の充填剤、希釈剤、賦形剤、溶媒またはカプセル化剤を包含する。各々のキャリアは、その処方物の他の成分と適合性であり、かつ被験体に有害ではないという意味で「受容可能(acceptable)」である。薬学的に許容されるキャリアとして働き得る物質のいくつかの例としては以下が挙げられる:(1)糖、例えば、ラクトース、グルコースおよびスクロース;(2)デンプン、例えば、コーンスターチ、およびジャガイモデンプン;(3)セルロースおよびその誘導体、例えば、カルボキシルメチル・セルロース・ナトリウム、エチルセルロース、および酢酸セルロース;(4)粉末トラガカント;(5)モルト(麦芽);(6)ゼラチン;(7)滑石;(8)賦形剤、例えば、ココアバターおよび坐剤ワックス;(9)油状物、例えば、ピーナツオイル、綿実油、サフラワー油、ゴマ油、オリーブ油、コーン油、およびダイズ油;(10)グリコール、例えば、プロピレングリコール;(11)ポリオール、例えば、グリセリン、ソルビトール、マンニトール、およびポリエチレングリコール;(12)エステル、例えば、オレイン酸エチル、およびラウリン酸エチル;(13)寒天;(14)緩衝化剤、例えば、水酸化マグネシウムおよび水酸化アルミニウム;(15)アルギン酸;(16)パイロジェン・フリー水;(17)等張食塩水;(18)リンゲル溶液;(19)エチルアルコール;(20)リン酸緩衝化溶液;および(21)薬学的処方物中で使用される他の非毒性の適合物質。
【0163】
湿潤剤、乳化剤および潤滑剤、例えば、ラウリル硫酸ナトリウムおよびステアリン酸マグネシウム、ならびに着色剤、離型剤、コーティング剤、甘味剤、香味剤および芳香剤、防腐剤、および抗酸化剤もこの組成物中に存在してもよい。
【0164】
薬学的に受容可能な抗酸化剤の例としては、以下が挙げられる:(1)水溶性の抗酸化剤、例えば、アスコルビン酸、システイン塩酸塩、重硫酸ナトリウム、メタ重亜硫酸ナトリウム、亜硫酸ナトリウムなど;(2)脂溶性抗酸化剤、例えば、パルミチン酸アスコルビル、ブチル化ヒドロキシアニソール(BHA)、ブチル化ヒドロキシトルエン(BHT)、レシチン、没食子酸プロピル、αトコフェロールなど;ならびに(3)金属キレート剤、例えば、クエン酸、エチレンジアミン四酢酸(EDTA)、ソルビトール、酒石酸、リン酸など。
【0165】
5−アミノサリチル酸化合物を含む組成物としては、例えば、経口、鼻腔、局所(口腔内および舌下を含む)、直腸、経膣、エアロゾル、経皮的、および/または非経口な投与に適切な組成物が挙げられる。例えば、感染した外部胆道ドレーンを処置するために、5−アミノサリチル酸化合物を、そのドレーンを介して経皮投与して、これによって「胆管内」投与を得てもよい。この組成物は、単位剤形で便利に与えられてもよいし、薬学の当該分野で周知の任意の方法によって調製されてもよい。単一剤形を得るためにキャリア物質と組み合わされ得る有効成分の量は、処置されているホスト、特定の投与方式に依存して変化してもよい。単一剤形を得るためにキャリア物質と組み合わされ得る有効成分の量は一般には、治療効果を生じる化合物の量である。一般には、100%のうち、この量は、有効成分の約1%〜約99%、好ましくは有効成分の約5%〜約70%、さらに好ましくは約10%〜約30%におよぶ。
【0166】
これらの5−アミノサリチル酸化合物の組成物を調製する方法は、5−アミノサリチル酸化合物とキャリアとを、および必要に応じて、1つ以上の補助の成分とを組み合わせる工程を包含する。一般には、この処方物は、5−アミノサリチル酸化合物と液体キャリア、もしくは微粉化された固体キャリア、またはその両方との会合を均一かつ最初にもたらすこと、次いで、必要に応じて、その生成物を成形することによって調製される。
【0167】
経口投与に適切な5−アミノサリチル酸化合物の組成物は、カプセル(capsules)、カプセル(cachets)、丸剤、錠剤、トローチ剤(lozenges)(香味基剤、通常のスクロース、およびアカシアまたはトラガカントを用いる)、粉末、顆粒の形態であっても、または水性もしくは非水性の液体中の溶液もしくは懸濁液として、または水中油型もしくは油中水型の液体エマルジョンとして、またはエリキシルもしくはシロップとして、またはトローチ(pastilles)(不活性な基剤、例えば、ゼラチンおよびグリセリン、またはスクロース、およびアカシアを用いる)として、および/または洗口剤など(各々が所定の量の5−アミノサリチル酸化合物を有効成分として含む)であってもよい。化合物はまた、ボーラス、舐剤またはペーストとして投与されてもよい。
【0168】
経口投与のための固体剤形(カプセル、錠剤、丸剤、糖衣錠、粉末、顆粒など)では、有効成分を1つ以上の薬学的に受容可能なキャリア、例えば、クエン酸ナトリウム、またはリン酸二カルシウム、および/または任意の以下と混合する:(1)充填剤または増量剤、例えば、デンプン、ラクトース、スクロース、グルコース、マンニトール、および/またはケイ酸;(2)結合剤、例えば、カルボキシメチルセルロース、アルギン酸塩、ゼラチン、ポリビニルピロリドン、スクロースおよび/またはアカシアなど;(3)保湿剤、例えば、グリセロール;(4)崩壊剤、例えば、寒天、炭酸カルシウム、ジャガイモもしくはタピオカデンプン、アルギン酸、特定のケイ酸塩、および炭酸ナトリウム;(5)溶液緩染剤、例えば、パラフィン;(6)吸収促進物質、例えば、四級アンモニウム化合物;(7)保湿剤、例えば、アセチルアルコールおよびモノステアリン酸グリセロールなど;(8)吸収剤、例えば、カオリンおよびベントナイト粘土;(9)潤滑剤、例えば、滑石、ステアリン酸カルシウム、ステアリン酸マグネシウム、固体ポリエチレングリコール、ラウリル硫酸ナトリウムおよびそれらの混合物;ならびに(10)着色剤。カプセル、錠剤および丸剤の場合、薬学的組成物はまた、緩衝化剤を含んでもよい。同様のタイプの固体組成物はまた、充填剤として軟質および硬質充填ゼラチンカプセル中に、賦形剤、例えば、ラクトースまたは乳糖を、ならびに高分子量ポリエチレングリコールなどを用いて使用されてもよい。
【0169】
錠剤は、圧縮または成型によって、必要に応じて1つ以上の補助成分とともに作製され得る。圧縮された錠剤は、結合剤(例えば、ゼラチンまたはヒドロキシプロピルメチルセルロース)、滑沢剤、不活性希釈剤、防腐剤、崩壊剤(例えば、グリコール酸ナトリウムスターチまたは架橋化カルボキシメチル・セルロース・ナトリウム)、界面活性剤または分散剤を用いて調製してもよい。成形される錠剤は、不活性な液体希釈剤で湿らせた粉末の有効成分の混合物を適切な機械で成形することによって作製してもよい。
【0170】
本発明の薬学的組成物の錠剤および他の固体剤形、例えば、糖衣錠、カプセル、丸薬および顆粒は、必要に応じて、コーティング(被覆剤)およびシェル(shell)、例えば、腸溶性コーティングおよび医薬製剤分野において周知である他のコーティングを用いて獲得しても、または調製してもよい。錠剤はまた、例えば、所望の放出プロフィールを提供するために種々の割合のヒドロキシプロピルメチルセルロース、他のポリマーマトリックス、リポソームおよび/またはマイクロスフェアを用いて、錠剤中の有効成分の徐放性または放出制御を提供するように調合されてもよい。錠剤は、例えば、細菌保持フィルターを通過させる濾過によって、または使用直前に滅菌水もしくはある種の他の滅菌した注入可能な媒体に溶解可能である、無菌の固体組成物の形態で、滅菌している薬物を導入することによって無菌にしてもよい。これらの組成物はまた、必要に応じて、乳白剤を含んでもよく、有効成分(単数または複数)だけ、または優先的に、胃腸管のある種の部分で、場合により遅延されるように放出する組成物であってもよい。使用することができる埋め込み組成物の例には、重合物質およびワックスが挙げられる。有効成分はまた、該当する場合には1つ以上の上述した賦形剤を含む、マイクロカプセル化形態であってもよい。
【0171】
5−アミノサリチル酸化合物の経口投与のための液体の剤形としては、薬学的に受容可能なエマルジョン、マイクロエマルジョン、溶液、懸濁液、シロップおよびエリキシルが挙げられる。活性成分に加えて、液体剤形は、当該分野で一般に用いられる不活性な希釈剤、例えば、水または他の溶媒、可溶化剤および乳化剤、例えば、エチルアルコール、イソプロピルアルコール、炭酸エチル、酢酸エチル、ベンジルアルコール、安息香酸ベンジル、プロピレングリコール、1,3−ブチレングリコール、オイル(詳細には、綿実油、ラッカセイ油、コーン油、胚芽油、オリーブ油、ヒマシ油およびゴマ油)、グリセロール、テトラヒドロフリルアルコール、ポリエチレングリコールおよびソルビタンの脂肪酸エステル、ならびにその混合物などを含んでもよい。
【0172】
不活性な希釈剤に加えて、経口組成物としては、アジュバント、例えば、保湿剤、乳化剤および懸濁剤、甘味剤、香味剤、着色剤、芳香剤、および防腐剤を挙げることができる。
【0173】
懸濁剤は、活性な5−アミノサリチル酸化合物に加えて、懸濁剤、例えば、エトキシル化イソステアリルアルコール、ポリオキシエチレンソルビトールおよびソルビタンエステル、微結晶性セルロース、アルミニウムメタ水酸化物(metahydroxide)、ベントナイト、寒天およびトラガカント、ならびにこれらの混合物などを含んでもよい。
【0174】
直腸または経膣投与のための本発明の薬学的組成物は、坐剤として与えられてもよく、この坐剤は、5−アミノサリチル酸化合物と1つ以上の適切な非刺激性の賦形剤またはキャリア(例えば、ココアバター、ポリエチレングリコール、坐剤ワックスまたはサリチル酸塩を含む)とを混合することによって調製してもよく、室温では固体であるが、体温では液体であり、従って、直腸および膣腔では融解して、活性薬剤を放出する。
【0175】
本発明の組成物は、経膣投与に適切であり、またこれにはペッサリー、タンポン、クリーム、ゲル、ペースト、泡状物またはスプレー処方物(適切であることが当該分野で公知であるキャリアを含む)を含む。
【0176】
5−アミノサリチル酸化合物の局所投与または経皮投与のための剤形としては、粉末、スプレー、軟膏、ペースト、クリーム、ローション、ゲル、溶液、パッチおよび吸入薬が挙げられる。5−アミノサリチル酸化合物は、無菌条件下で薬学的に受容可能なキャリアと、および必要であり得る任意の防腐剤、緩衝液または噴霧剤と混合されてもよい。
【0177】
軟膏、ペースト、クリーム、およびゲルは、本発明の5−アミノサリチル酸化合物に加えて、賦形剤、例えば、動物および植物の脂肪、オイル、ワックス、パラフィン、デンプン、トラガカント、セルロース誘導体、ポリエチレングリコール、シリコーン、ベントナイト、ケイ酸、滑石および酸化亜鉛、またはその混合物を含んでもよい。
【0178】
粉末およびスプレーは、5−アミノサリチル酸化合物に加えて、賦形剤、例えば、ラクトース、滑石、ケイ酸、水酸化アルミニウム、ケイ酸カルシウムおよびポリアミド粉末、またはこれらの物質の混合物を含んでもよい。スプレーはさらに、慣用的な噴霧剤、例えば、クロロフルオロヒドロカルボン、および揮発性の非置換炭化水素、例えば、ブタンおよびプロパンを含んでもよい。
【0179】
5−アミノサリチル酸化合物は代わりに、エアロゾルによって投与されてもよい。これは、例えば、水性のエアロゾル、リポソーム調製物、またはこの化合物を含む固体粒子を調製することによって達成される。非水性(例えば、フルオロカーボン噴霧剤)懸濁液を用いてもよい。超音波噴霧器は、薬剤が剪断(化合物の分解を生じ得る)に曝されることを最小限にするので好ましい。
【0180】
通常には、水性のエアロゾルは、従来の薬学的に受容可能なキャリアおよび安定化剤と一緒に薬剤の水溶液または懸濁液を調合することによって作成される。このキャリアおよび安定化剤は、特定の化合物の要件で変化するが、ただし代表的には、非イオン性の界面活性剤(Tweens、Pluronicsまたはポリエチレングリコール)、血清アルブミンなどの非侵害性タンパク質、ソルビタンエステル、オレイン酸、レシチン、アミノ酸、例えば、グリシン、緩衝液、塩、糖または糖アルコールを含む。エアロゾルは一般には、等張液から調製される。
【0181】
経皮パッチは、身体に対する5−アミノサリチル酸化合物の制御された送達をもたらすという追加の利点を有する。このような剤形は、適切な媒体中に薬剤を溶解または分散することによって作製され得る。吸収促進剤をまた、皮膚を横切る有効成分の流れを増大するように用いてもよい。このような流れの速度は、速度制御膜を設けること、またはポリマーマトリックスもしくはゲル中に有効成分を分散させることのいずれかによって制御され得る。
【0182】
経口投与に適切な本発明の薬学的組成物は、1つ以上の5−アミノサリチル酸化合物を、1つ以上の薬学的に許容される無菌の等張性の水溶液または非水性の溶液、分散液、懸濁液もしくはエマルジョン、または無菌の粉末(使用直前に無菌の注射用液または分散液中に再構成され得る)(抗酸化剤、緩衝液、静菌薬、意図されるレシピエントの血液と処方物を等張にする溶質、または懸濁剤もしくは増粘剤を含んでもよい)と組み合わせて含む。
【0183】
本発明の薬学的組成物中で使用され得る適切な水性および非水性のキャリアの例としては、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、ポリエチレングリコールなど)、およびその適切な混合物、植物油、例えば、オリーブ油、および注射用有機エステル、例えば、オレイン酸エチルが挙げられる。適切な流動性は、例えば、レシチンなどのコーティング物質の使用によって、分散の場合には必要な粒子サイズの維持によって、および界面活性剤の使用によって維持され得る。
【0184】
これらの組成物はまた、アジュバント、例えば、防腐剤、保湿剤、乳化剤、および分散剤を含んでもよい。微生物の作用の予防は、種々の抗菌剤および抗真菌剤、例えば、パラベン、クロロブタノール、フェノールソルビン酸などを含むことによって保証され得る。等張剤、例えば、糖、塩化ナトリウムなどをこの組成物に含むことも所望され得る。さらに、注射用の医薬品剤形の長期の吸収は、モノステアリン酸アルミニウムおよびゼラチンなどの吸収を遅らせる剤の包含によってもたらされてもよい。
【0185】
ある場合には、薬物の効果を延長するために、皮下または筋肉内注射からの薬物の吸収を遅らせることが所望される。これは結晶性物質または非結晶性物質(水溶性が低い)の液体懸濁物の使用によって達成され得る。順次、薬物の吸収の速度は、溶解の速度に依存し、溶解の速度は、結晶の大きさおよび結晶型に依存し得る。あるいは、非経口投与された薬物型の遅延吸収は、油状ビヒクルに薬物を溶解または懸濁することによって達成される。
【0186】
注射可能なデポ型は、ポリラクチド−ポリグリコリドなどの生分解性ポリマー中に5−アミノサリチル酸化合物のマイクロカプセルマトリックスを形成することによって作成される。ポリマーに対する薬物の比、および使用される特定のポリマーの性質次第で、薬物放出の速度は、制御され得る。他の生分解性ポリマーの例としては、ポリ(オルトエステル)およびポリ(無水物)が挙げられる。デポの注射用処方物はまた、身体の組織と適合性であるリポソームまたはマイクロエマルジョン中に薬物を捕捉することによって調製される。
【0187】
5−アミノサリチル酸化合物がヒトおよび動物に対して薬剤として投与される場合、それらは、それ自体で与えられても、または薬学的に受容可能なキャリアと組み合わせて、例えば、0.1〜99.5%(さらに好ましくは、0.5〜90%)という有効成分を含む薬学的組成物として与えられてもよい。
【0188】
ある場合には、5−アミノサリチル酸化合物が投与される状態に関連する状態、例えば、疼痛、カンジダ、嚥下障害、嚥下痛、粘膜炎、食道炎、肺炎、胃炎または口内乾燥を例えば同時に寛解させるために、5−アミノサリチル酸化合物を、限定はしないが、ナイスタチン、ケトコナゾール、フルコナゾール、リドカイン、ベンゾカイン、ジフェンヒドラ
ミン、ジメンヒドリナート、アゼラスチン、セトリジン、ヒドロコルチゾン、プレドニゾン、プレドニゾロン、デキサメタゾン、トリアムシノロン、ベクロメタゾン、ブデソニド、モメタゾン、または他のステロイド、局所麻酔薬、抗真菌剤または抗ヒスタミン剤を含む他の適切な薬剤との組み合わせとして処方してもよい。この処方物は、粘性または非粘性の液体、局所適用化合物、エアロゾルまたは注射剤の形態をとってもよい。
【0189】
選択される投与経路にかかわらず、5−アミノサリチル酸化合物(適切な水和型で用いられ得る)、および/または本発明の薬学的組成物は、当業者に公知の従来の方法によって薬学的に受容可能な剤形に調合される。
【0190】
本発明の薬学的組成物中の有効成分の投与の正確な投薬レベルおよび時間経過は、特定の被験体、組成物および投与方式について、被験体に対する毒性なしに、所望の治療応答を得るのに有効であるその有効成分の量を得るために変化されてもよい。例示的な剤形を下に開示する。
【0191】
(キット)
キットも本明細書で提供され、例えば、被験体における腸炎および/または下痢を処置するためのキットが提供される。このキットは例えば、5−アミノサリチル酸化合物の組成物およびその使用説明書を備えてもよい。使用の説明書は、処方情報、投薬情報、保管情報、などを含んでもよい。
【0192】
包装された組成物も提供され、そして治療上有効な量の5−アミノサリチル酸化合物を含んでもよい。5−アミノサリチル酸化合物および薬学的に受容可能なキャリアまたは希釈剤は、この組成物が、腸の障害に罹患しているか、または罹りやすい被験体を処置するために調合され、腸の障害に罹患しているか、または罹りやすい被験体を処置するための説明書とともにパッケージングされる。
【実施例】
【0193】
本発明は、ここに記載されている実施例に限定されると解釈されるべきではないことが理解されるべきである;そうではなく、本発明は、当業者の技術の範囲内である、本明細書に提供される任意のかつ全ての適用ならびに等価なバリエーションを含むと解釈されるべきである。
【0194】
バルサラジド、5−ASAおよびNASAの全身レベルは、(1)一晩の絶食後にインタクトなカプセルとして、または(2)高脂肪の朝食後のインタクトなカプセルとして、投与されるバルサラジド二ナトリウムの2.25g(3×750mg)の単回経口用量後に測定した。18〜45歳の健康な男性被験体(試験前少なくとも2年間非喫煙者であり、かつ選択された乱用薬物についての尿検査で陰性であって、アルコール(ETOH)陰性である)を用いた。研究期間は、最少4日で分けた。標準的な薬物動態学的パラメータを、プロトコールどおり2つの研究期間について完了した17例の被験体について、バルサラジドおよびその代謝物(5−ASA、N−Ac−5−ASA、4−ABAおよびN−Ac−4−ABA)についての血漿濃度(Cmax、TmaxおよびAUClast)および尿濃度(排泄%およびClr)から計算した。これらの2つの条件下で投与について観察された全薬物動態学的プロフィールを図1に示す。5−ASAおよびNASAの出現の遅れおよびレベルの低さが明瞭に観察され得る。標準的な薬物動態学的パラメータが表1の両方の投薬条件について示される。
【0195】
【表1−1】

【0196】
【表1−2】

標準的な高脂肪食餌を与えられた場合、Cmaxパラメータによって測定して、5−ASAおよびNASAの全身レベルに有意な低下がみられた。有意な低下は、AUClastによって測定した5−ASAの全身レベルにも観察された。従って、食物を与えることにより、バルサラジドの副作用プロフィールを減らすのに好ましい、総メサラミン生成物5−ASAおよびNASAの全身暴露の少ないことが可能になる。表1ではまた、食物を与えることが、5−ASA(8.2時間対22.0時間)およびNASA(9.9時間対20.2時間)の血漿における出現までの時間の指標であるTmaxを有意に遅らせることが示される。この遅れは、GI管を通る薬物の通過が遅いことの指標である。
【0197】
食物効果の研究からのデータはまた、摂食状態で観察される値を絶食状態で観察される値で割った比として表2に示される。CmaxおよびAUClastの減少の大きさは、このデータ提示で明確に確認できる。
【0198】
【表2】

a処置A=絶食;処置B=高脂肪朝食;処置C=アップルソースがけ
b比評価および対数変換した値を用いるANOVAフィッティング混合モデルからの90%CI:対数(パラメータ)=研究群期間処置被験体(研究群)、被験体(研究群)が変量効果の場合であって、これは、高脂肪食餌対絶食、ソースがけ対絶食、およびソースがけ対高脂肪食餌を比較。
【0199】
観察されたTmaxの延長、従ってGIを通る緩徐な通過が、治療上活性な5−ASAに対する結腸粘膜の暴露の増大を生じ得る。これが観察される場合、当業者は、血漿で示されるように、ASAに対するNASAの比の変化を予期する。この可能性を試験するために、5−ASAに対するNASAの血漿比を試験した。これらのデータを図2に示す。
【0200】
図2のデータによって、5−ASAに対するNASAの全身比が、バルサラジドが絶食されている被験体に比較して摂食させられている被験体に与えられたとき増大するということが示される。従って、食物の存在下での被験体に対するバルサラジドの投与は、結腸における5−ASAの通過を延長し、NASAに対する5−ASAの大きい変換を可能にするということが結論される。結腸粘膜との5−ASAの接触の増大は、薬物の有効性を増大し得る。全身の5−ASAレベルが低いほど、副作用のプロフィールは減少し得る。従って、UC被験体にバルサラジドを食物と同時に投与することは、好ましいが、予期されない用法である。
【特許請求の範囲】
【請求項1】
明細書中に記載の発明。
【請求項1】
明細書中に記載の発明。
【図1】


【図2】




【図2】


【公開番号】特開2013−32395(P2013−32395A)
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−248573(P2012−248573)
【出願日】平成24年11月12日(2012.11.12)
【分割の表示】特願2009−536219(P2009−536219)の分割
【原出願日】平成19年3月23日(2007.3.23)
【出願人】(506275586)サリックス ファーマシューティカルズ, インコーポレイテッド (12)
【Fターム(参考)】
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願番号】特願2012−248573(P2012−248573)
【出願日】平成24年11月12日(2012.11.12)
【分割の表示】特願2009−536219(P2009−536219)の分割
【原出願日】平成19年3月23日(2007.3.23)
【出願人】(506275586)サリックス ファーマシューティカルズ, インコーポレイテッド (12)
【Fターム(参考)】
[ Back to top ]

