2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体、その製造方法およびそれをオリゴヌクレオチドプローブとして用いる核酸の検出方法
【課題】 ストークスシフトが大きく、かつ、相補的なヌクレオチド配列を有する標的核酸存在下における蛍光強度値が大きく、蛍光増感率も高い、オリゴヌクレオチド誘導体を提供すること。
【解決手段】 一般式(1a)
【化1】

で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体により前記課題を解決する。
【解決手段】 一般式(1a)
【化1】

で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体により前記課題を解決する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、オリゴヌクレオチドと2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合することで得られるオリゴヌクレオチド誘導体、該誘導体の製造方法、および該誘導体を用いた、該誘導体が有するヌクレオチド配列と相補的な配列を有する核酸の検出方法に関するものである。
【背景技術】
【0002】
近年、遺伝子診断技術の発達に伴い、遺伝子を検出する技術の重要性が増している。二本鎖DNAやDNA−RNAハイブリッド等の二本鎖核酸の検出には、従来よりエチジウムブロミドやオキサゾールイエロー等の蛍光色素を用いた検出が用いられている(非特許文献1)。また、それらの蛍光色素とオリゴヌクレオチドを化学結合で結合したオリゴヌクレオチド誘導体は、該誘導体が有するヌクレオチド配列と相補的な配列を有するオリゴヌクレオチドまたはポリヌクレオチド(標的核酸)と二本鎖核酸を形成することができ、該二本鎖核酸の形成に伴い蛍光増感を示すことから、遺伝子診断において遺伝子やウイルス等の検出に用いられる(特許文献1)。特に、エチジウムブロミド類縁体である3,8−ジアミノ−6−フェニルフェナントリジニウム塩を化学結合で結合したオリゴヌクレオチド誘導体は、該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸を検出するためのオリゴヌクレオチドプローブとして広く用いられている。(特許文献2、非特許文献1)。
【0003】
なお、2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合した、本発明のオリゴヌクレオチド誘導体はこれまでに全く報告されておらず、新規の化合物である。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2001−13147号公報
【特許文献2】国際特許公開WO97/27329号
【特許文献3】特開2000−316587号公報
【特許文献4】特許第2650159号公報
【特許文献5】欧州公開特許第373960号公報
【特許文献6】特開平8−211050号公報
【特許文献7】特開2000−14400号公報
【特許文献8】特開2001−037500号公報
【非特許文献】
【0005】
【非特許文献1】Nucleic Acids Research,22,920−928(1994)
【非特許文献2】Dyes and Pigments,11,21−35(1989)
【非特許文献3】Anal. Biochem.,314,1247−1252(2003)
【発明の概要】
【発明が解決しようとする課題】
【0006】
前述したように、エチジウムブロミド類縁体である3,8−ジアミノ−6−フェニルフェナントリジニウム塩を化学結合で結合したオリゴヌクレオチド誘導体は、該誘導体が有するヌクレオチド配列と相補的な配列を有するオリゴヌクレオチドまたはポリヌクレオチド(標的核酸)を検出するためのオリゴヌクレオチドプローブとして従来より用いられているものの、蛍光強度値が小さく、二本鎖核酸の形成に伴う蛍光強度値の増加割合、いわゆる蛍光増感率が低いという問題点があった。
【0007】
そこで本発明の課題は、ストークスシフトが大きく、かつ、相補的なヌクレオチド配列を有する標的核酸存在下における蛍光強度値が大きく、蛍光増感率も高い、オリゴヌクレオチド誘導体を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、前記課題を鑑み鋭意検討を重ねた結果、本発明の2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体が、ストークスシフトが大きく、かつ、該誘導体が有するヌクレオチド配列と相補的な配列を有するオリゴヌクレオチドまたはポリヌクレオチド(標的核酸)存在下における蛍光強度値が大きく、蛍光増感率も高いため、該標的核酸を検出するためのオリゴヌクレオチドプローブとして有用であることを見出し、本発明を完成するに至った。
【0009】
すなわち本発明は、一般式(1a)
【0010】
【化1】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、R7およびR8は各々独立に9−アデニル基、9−グアニル基、1−シトシニル基または1−チミニル基を表し、X−は対アニオンを表す。lは1から8の整数を表し、mは1から4の整数を表し、nは1から4の整数を表す。B1はアデニン、グアニン、シトシンまたはチミンを表し、qは0から30の整数を表し、qが2以上の時、複数のB1は同一または相異なっていてもよい。B2はアデニン、グアニン、シトシンまたはチミンを表し、rは0から30の整数を表し、rが2以上の時、複数のB2は同一または相異なっていてもよい。ただし、qとrの和は15以上30以下である。Zは水酸基またはアミノ基を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体に関する。
【0011】
また本発明は、一般式(1c)
【0012】
【化2】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、R7−1およびR8−1は各々独立に9−アデニル基または1−チミニル基を表し、X−は対アニオンを表し、lは1から8の整数を表す。B3はアデニン、グアニン、シトシンまたはチミンを表し、sは0から27の整数を表し、sが2以上の時、複数のB3は同一または相異なっていてもよい。B6はアデニン、グアニン、シトシンまたはチミンを表し、tは0から27の整数を表し、tが2以上の時、複数のB6は同一または相異なっていてもよい。ただし、sとtの和は9以上24以下である。B4は同一または相異なってアデニンまたはチミンを表し、B5は同一または相異なってアデニンまたはチミンを表す。Zは水酸基またはアミノ基を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体に関する。
【0013】
また本発明は、一般式(1b)
【0014】
【化3】

(式中、R6−1およびR6−4は各々独立に水素原子またはメトキシ基を表し、X−は対アニオンを表し、lは1から8の整数を表し、Zは水酸基またはアミノ基を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体に関する。
【0015】
また本発明は、一般式(2d)
【0016】
【化4】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、Yはヨウ素原子、臭素原子または塩素原子を表し、X1はハロゲン原子、炭素数1から8のアルコキシスルホニルオキシ基、メチルスルホニルオキシ基またはトリフルオロメチルスルホニルオキシ基を表し、lは1から8の整数を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を、一般式(6)
【0017】
【化5】

(式中、R7およびR8は各々独立に9−アデニル基、9−グアニル基、1−シトシニル基または1−チミニル基を表し、mは1から4の整数を表し、nは1から4の整数を表す。B1はアデニン、グアニン、シトシンまたはチミンを表し、qは0から30の整数を表し、qが2以上の時、複数のB1は同一または相異なっていてもよい。B2はアデニン、グアニン、シトシンまたはチミンを表し、rは0から30の整数を表し、rが2以上の時、複数のB2は同一または相異なっていてもよい。ただし、qとrの和は15以上30以下である。Zは水酸基またはアミノ基を表す。)で表されるオリゴヌクレオチド誘導体と、還元剤の存在下反応させることを特徴とする、一般式(1a)
【0018】
【化6】

(式中、R6−1、R6−2、R6−3、R6−4、R7、R8、l、m、n、q、r、Z、B1およびB2は前記と同じ意味を表し、X−は対アニオンを表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体の製造方法に関する。
【0019】
また本発明は、本発明の2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体と、該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸とで二本鎖核酸を形成させ、該二本鎖核酸の形成に伴う前記オリゴヌクレオチド誘導体の蛍光特性の変化を測定することで標的核酸を検出する方法に関する。
【0020】
また本発明は、本発明の2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体と、該誘導体が有するヌクレオチド配列と相補的な配列を有する第一の標的核酸とで二本鎖核酸を形成させるとともに、一般式(2d)
【0021】
【化7】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、Yはヨウ素原子、臭素原子または塩素原子を表し、X1はハロゲン原子、炭素数1から8のアルコキシスルホニルオキシ基、メチルスルホニルオキシ基またはトリフルオロメチルスルホニルオキシ基を表し、lは1から8の整数を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩とは異なる蛍光波長を示す蛍光色素を化学結合で結合したオリゴヌクレオチド誘導体と、該誘導体が有するヌクレオチド配列と相補的な配列を有する第二の標的核酸とで二本鎖核酸を形成させ、前記二本鎖核酸の形成に伴う各オリゴヌクレオチド誘導体の蛍光特性の変化を測定することで標的核酸を検出する方法に関する。
【発明の効果】
【0022】
本発明の2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体は、該誘導体が有するヌクレオチド配列と相補的な配列を有するオリゴヌクレオチドまたはポリヌクレオチド(標的核酸)と二本鎖核酸を形成することで蛍光増感を示すことから、前記標的核酸を特異的に検出するオリゴヌクレオチドプローブとして用いることができる。
【0023】
本発明のオリゴヌクレオチド誘導体が有する蛍光特性は、同一波長領域で励起することができ、かつ、従来よりオリゴヌクレオチドプローブとして用いられている、3,8−ジアミノ−6−フェニルフェナントリジニウム塩を化学結合で結合したオリゴヌクレオチド誘導体よりも、蛍光強度値が顕著に高く、蛍光増感率も大きい。よって、本発明のオリゴヌクレオチド誘導体は標的核酸を検出する上で極めて有用な新規化合物であり、遺伝子診断等の臨床診断分野での利用に有用である。
【図面の簡単な説明】
【0024】
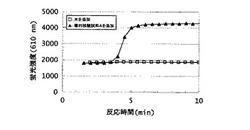
【図1】実施例8にて、化合物1−1をオリゴヌクレオチド誘導体として用いたときの、核酸増幅反応に伴う蛍光強度(610nm)の経時変化を示す図。
【図2】実施例8にて、化合物1−3をオリゴヌクレオチド誘導体として用いたときの、核酸増幅反応に伴う蛍光強度(610nm)の経時変化を示す図。
【図3】実施例9にて、化合物1−1をオリゴヌクレオチド誘導体として用いたときの、核酸増幅反応に伴う蛍光強度(610nm)の経時変化を示す図。
【図4】実施例9にて、化合物1−4をオリゴヌクレオチド誘導体として用いたときの、核酸増幅反応に伴う蛍光強度(610nm)の経時変化を示す図。
【図5】実施例9にて、化合物1−5をオリゴヌクレオチド誘導体として用いたときの、核酸増幅反応に伴う蛍光強度(610nm)の経時変化を示す図。
【図6】実施例9にて、化合物1−6をオリゴヌクレオチド誘導体として用いたときの、核酸増幅反応に伴う蛍光強度(610nm)の経時変化を示す図。
【図7】実施例10にて、化合物1−1とプローブBを添加した核酸増幅反応における蛍光強度(520nm)の経時変化を示す図。
【図8】実施例10にて、化合物1−1とプローブBを添加した核酸増幅反応における蛍光強度(610nm)の経時変化を示す図。
【図9】実施例10にて、化合物1−3とプローブBを添加した核酸増幅反応における蛍光強度(520nm)の経時変化を示す図。
【図10】実施例10にて、化合物1−3とプローブBを添加した核酸増幅反応における蛍光強度(610nm)の経時変化を示す図。
【発明を実施するための形態】
【0025】
以下に、本発明を詳細に説明する。
【0026】
本発明の2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体(以下、本発明のオリゴヌクレオチド誘導体という)中、R6−1、R6−2、R6−3およびR6−4は水素原子またはメトキシ基を表す。中でもR6−2およびR6−3は蛍光強度が強い点で水素原子が好ましい。
【0027】
本発明のオリゴヌクレオチド誘導体中、R7は9−アデニル基、9−グアニル基、1−シトシニル基、1−チミニル基のいずれかを表す。中でも蛍光強度が強い点で9−アデニル基または1−チミニル基が好ましく、1−チミニル基がさらに好ましい。
【0028】
本発明のオリゴヌクレオチド誘導体中、R8は9−アデニル基、9−グアニル基、1−シトシニル基、1−チミニル基のいずれかを表す。中でも蛍光強度が強い点で9−アデニル基または1−チミニル基が好ましく、9−アデニル基がさらに好ましい。
【0029】
本発明のオリゴヌクレオチド誘導体中、X−で表される対アニオンとしては、塩素アニオン、臭素アニオン、ヨウ素アニオン等のハロゲンアニオン、メトキシスルホニルオキシアニオン、エトキシスルホニルオキシアニオン、プロポキシスルホニルオキシアニオン、ブトキシスルホニルオキシアニオン、ペントキシスルホニルオキシアニオン、ヘキサノキシスルホニルオキシアニオン、ヘプタノキシスルホニルオキシアニオン、オクタノキシスルホニルオキシアニオン等の炭素数1から8のアルコキシスルホニルオキシアニオン、メチルスルホニルオキシアニオン、トリフルオロメチルスルホニルオキシアニオン、酢酸アニオン、リン酸アニオン、水酸化物イオン、4−(2−ヒドロキシエチル)−1−ピペラジンエチルスルホニルオキシアニオンを例示することができる。なお、分子内のカルボン酸アニオンまたはリン酸アニオンが対アニオンになっていてもよい。
【0030】
本発明のオリゴヌクレオチド誘導体中、lは1から8の整数のいずれかを表す。中でも蛍光強度が強い点でlは3から6のいずれかが好ましく、特に4が好ましい。
【0031】
本発明のオリゴヌクレオチド誘導体中、mは1から4の整数のいずれかを表す。中でも蛍光強度が強い点でmは2が好ましい。
【0032】
本発明のオリゴヌクレオチド誘導体中、nは1から4の整数のいずれかを表す。中でも蛍光強度が強い点でnは2が好ましい。
【0033】
次に、本発明のオリゴヌクレオチド誘導体(1a)の製造方法について詳細に説明する。本発明のオリゴヌクレオチド誘導体(1a)は、下記スキームにより製造することができる。
【0034】
【化8】

(式中、R6−1、R6−2、R6−3、R6−4、R7、R8、X−、l、m、nは前記と同じ意味を表す。X1はハロゲン原子、炭素数1から8のアルコキシスルホニルオキシ基、メチルスルホニルオキシ基またはトリフルオロメチルスルホニルオキシ基を表し、Yはヨウ素原子、臭素原子または塩素原子を表す。B1はアデニン、グアニン、シトシンまたはチミンを表す。qは0から30の整数を表し、qが2以上の時、複数のB1は同一または相異なっていてもよい。B2はアデニン、グアニン、シトシンまたはチミンを表す。rは0から30の整数を表し、rが2以上の時、複数のB2は同一または相異なっていてもよい。ただし、qとrの和は15以上30以下である。Zは水酸基またはアミノ基を表す。)
前記スキームのうち、X1で表されるハロゲン原子としては、塩素原子、臭素原子、ヨウ素原子を例示することができる。また、X1で表される炭素数1から8のアルコキシスルホニルオキシ基としては、メトキシスルホニルオキシ基、エトキシスルホニルオキシ基、プロポキシスルホニルオキシ基、ブトキシスルホニルオキシ基、ペントキシスルホニルオキシ基、ヘキサノキシスルホニルオキシ基、ヘプタノキシスルホニルオキシ基、オクタノキシスルホニルオキシ基を例示することができる。中でも調製が容易な点でヨウ素原子がX1として好ましい。
【0035】
前記スキームのうち、Yはヨウ素原子、臭素原子または塩素原子を表す。中でも収率がよい点でヨウ素原子がYとして好ましい。
【0036】
前記スキームのうち工程−1は、2−メチルベンゾチアゾリウム塩(4a)と4−(ジメチルアミノ)ベンズアルデヒド(5a)を縮合させ、2−(4−アミノスチリル)ベンゾチアゾリウム塩(2d)を製造する工程である。
【0037】
工程−1の原料である2−メチルベンゾチアゾリウム塩(4a)は、例えば文献記載の方法(Dyes and Pigments,11,21−35(1989):非特許文献2)を参考に、対応する2−メチルベンゾチアゾール誘導体から調製することができる。
【0038】
工程−1の反応は、縮合剤の存在下に行なうことが必須である。縮合剤としては、塩基または脱水剤を用いることができる。本工程の縮合剤として用いることができる塩基としては、ピペリジン、ピロリジン、モルフォリン等の有機塩基を例示することができる。また、本工程の縮合剤として用いることのできる脱水剤としては、無水酢酸、無水トリフルオロ酢酸等の酸無水物を例示することができる。中でも収率のよい点で、ピペリジンまたは無水酢酸が縮合剤として好ましい。
【0039】
工程−1の反応は反応を阻害しない溶媒であれば、溶媒中で行なってもよい。本工程で用いることができる溶媒として、具体的には、テトラヒドロフラン、ジエチルエーテル、1,4−ジオキサン、メチル−tert−ブチルエーテル、1,2−ジメトキシエタン、シクロペンチルメチルエーテル等のエーテル系溶媒、ヘキサン、ペンタン、ヘプタン、シクロヘキサン等の炭化水素系溶媒、ベンゼン、トルエン、キシレン等の芳香族炭化水素系溶媒、ジクロロメタン、クロロホルム、四塩化炭素、1,2−ジクロロエタン等のハロゲン系溶媒、アセトニトリル、ジメチルスルホキシド、ジメチルホルムアミド、N−メチル−2−ピロリドン、1,3−ジメチル−3,4,5,6−テトラヒドロ−2(1H)−ピリミジノン等の非プロトン性極性溶媒、メタノール、エタノール、tert−ブチルアルコール等のアルコール系溶媒、水を例示することができ、これらの溶媒の中から2種類以上を混合して用いてよい。また前述した縮合剤である、ピペリジン、ピロリジン、モルフォリン等の有機塩基、無水酢酸、無水トリフルオロ酢酸等の酸無水物を溶媒として用いてもよい。
【0040】
工程−1の反応で、2−メチルベンゾチアゾリウム塩(4a)と4−(ジメチルアミノ)ベンズアルデヒド(5a)とのモル比に特に制限はないが、1:1から1:10の範囲が好ましく、中でも収率がよい点で1:1から1:3の範囲がさらに好ましい。
【0041】
工程−1の反応において、2−メチルベンゾチアゾリウム塩(4a)と縮合剤とのモル比に特に制限はないが、縮合剤を溶媒として用いない場合には、1:1から1:10の範囲が好ましく、中でも収率がよい点で1:1から1:3の範囲がさらに好ましい。
【0042】
工程−1の反応において、反応温度は−78℃から150℃の範囲から適宜選ばれた温度で行なうことができる。中でも収率がよい点で室温から120℃の範囲が好ましい。
【0043】
工程−1の反応で得られる2−(4−アミノスチリル)ベンゾチアゾリウム塩(2d)は、必要に応じて反応終了後、反応溶液から精製することができる。精製する方法には特に限定はないが、溶媒抽出、シリカゲルカラムクロマトグラフィー、分取薄層クロマトグラフィー、分取液体クロマトグラフィー、再結晶または昇華等の汎用的な方法で目的物を精製することができる。
【0044】
工程−2は、2−(4−アミノスチリル)ベンゾチアゾリウム塩(2d)とオリゴヌクレオチド誘導体(6)とを反応させ、本発明の2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体(1a)を製造する工程である。
【0045】
工程−2の原料であるオリゴヌクレオチド誘導体(6)は、例えば文献記載の方法(特開2000−316587号公報:特許文献3)を参考に、下記スキームにより調製することができる。化合物(13)から化合物(14)への変換工程の条件を選ぶことにより、オリゴヌクレオチド誘導体(6)の置換基Zは、水酸基またはアミノ基に作り分けることができる。
【0046】
【化9】

(式中、R7、R8、m、n、q、r、B1、B2およびZは前記と同じ意味を表す。)
工程−2の反応は、還元剤の存在下に行なうことが必須であり、還元剤としては、水素化ホウ素ナトリウム、2−メルカプトエタノール、ジチオスレイトール、2−メルカプトエチルアミン、ジチオエリスリトール、還元型グルタチオン、システイン、モノチオリン酸および亜硫酸塩等を用いることができる。
【0047】
工程−2の反応は反応を阻害しない溶媒であれば、溶媒中で行なってもよい。工程−2で用いることができる溶媒としては、トリス−塩酸緩衝液、酢酸ナトリウム緩衝液、HEPES−KOH緩衝液、リン酸ナトリウム緩衝液、リン酸カリウム緩衝液等の緩衝液を例示することができる。また、これらの緩衝液に、0%から80%の割合でジメチルスルホキシド、メタノール、エタノール、ヘキサメチルリン酸トリアミド、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、1,4−ジオキサン、テトラヒドロフラン等、水と混和可能な有機溶媒を混合して用いてもよい。なお、前記有機溶媒の割合を0%から20%の範囲とすると好ましい。
【0048】
工程−2の反応において、2−(4−アミノスチリル)ベンゾチアゾリウム塩(2d)とオリゴヌクレオチド誘導体(6)とのモル比に特に制限はなく、2−(4−アミノスチリル)ベンゾチアゾリウム塩(2d)を大過剰に用いてもよい。
【0049】
工程−2の反応において、オリゴヌクレオチド誘導体(6)と還元剤とのモル比に特に制限はなく、還元剤を大過剰に用いてもよい。
【0050】
工程−2の反応において、反応温度は0℃から100℃の範囲から適宜選ばれた温度で行なうことができる。中でも収率がよい点で室温から60℃の範囲が好ましい。
【0051】
工程−2で得られた本発明のオリゴヌクレオチド誘導体(1a)は、必要に応じて反応終了後、反応溶液から精製することができる。精製する方法には特に限定はないが、溶媒抽出、シリカゲルカラムクロマトグラフィー、分取薄層クロマトグラフィー、分取液体クロマトグラフィー、再結晶または昇華等の汎用的な方法で目的物を精製することができる。
【0052】
なお、本発明のオリゴヌクレオチド誘導体(1a)のカウンターアニオン(X−)は、工程−2の反応において、反応に用いる緩衝液中の陰イオンまたは分子内の陰イオンとアニオン交換反応が起こる場合がある。しかしながら、いずれのカウンターアニオン(X−)であっても、オリゴヌクレオチドプローブとしての性能に影響はない。
【0053】
本発明のオリゴヌクレオチド誘導体(1a)は、該誘導体が有するヌクレオチド配列と相補的な配列を有するオリゴヌクレオチドまたはポリヌクレオチド(標的核酸)と二本鎖核酸を形成することで、形成前と比較し蛍光特性が変化する(すなわち、蛍光強度値が増大する)ため、該標的核酸を特異的に検出するためのオリゴヌクレオチドプローブとして用いることができる。なお該標的核酸の由来に特に限定はなく、例えば、PCR等に代表される核酸増幅反応により合成されたポリヌクレオチドであってもよいし、化学的に合成されたオリゴヌクレオチドであってもよいし、血液、組織、細胞等から抽出されたポリヌクレオチドであってもよいし、食品、土壌、排水等から抽出されたポリヌクレオチドであってもよい。
【0054】
本発明のオリゴヌクレオチド誘導体と標的核酸とで二本鎖核酸を形成させる際の溶媒に特に制限はないものの、緩衝液を用いることが好ましい。用いることのできる緩衝液としては、トリス−塩酸緩衝液、酢酸ナトリウム緩衝液、HEPES−KOH緩衝液、リン酸ナトリウム緩衝液、リン酸カリウム緩衝液を例示することができる。なお、本発明のオリゴヌクレオチド誘導体と標的核酸とで形成される二本鎖核酸の熱的安定性を向上させるために、前述の緩衝液に任意の濃度で無機塩またはカルボン酸塩を添加してもよい。該無機塩としては、塩化ナトリウム、塩化マグネシウム、塩化カリウム、臭化ナトリウム、臭化マグネシウム、臭化カリウム、ヨウ化ナトリウム、ヨウ化カリウムを例示することができ、該カルボン酸塩としては、酢酸マグネシウム、酢酸マンガンを例示することができる。これらの無機塩およびカルボン酸塩のうち2種類以上を混合して用いてもよい。無機塩またはカルボン酸塩の添加濃度は0Mから5Mの範囲が好ましい。さらに、緩衝液に混和可能な有機溶媒を0%から80%の割合で添加してもよい。該有機溶媒としては、ジメチルスルホキシド、メタノール、エタノール、ヘキサメチルリン酸トリアミド、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、1,4−ジオキサン、テトラヒドロフラン、エチレングリコール、グリセリンを例示することができ、これらの有機溶媒のうち2種類以上を混合して用いてもよい。有機溶媒の割合は、本発明のオリゴヌクレオチド誘導体と標的核酸とで安定的に二本鎖核酸を形成できる点で、0%から20%の範囲が好ましい。
【0055】
本発明のオリゴヌクレオチド誘導体と標的核酸とで二本鎖核酸を形成させる温度は、形成される二本鎖核酸の融解温度(Tm値)以下であればよく、具体的には、一般的な標的核酸の場合、0℃から80℃の範囲の中から、形成される二本鎖核酸のヌクレオチド配列および二本鎖核酸を形成させる際の溶媒の組成を考慮の上、適宜設定すればよい。
【0056】
本発明のオリゴヌクレオチド誘導体の蛍光特性は、蛍光色素部位、すなわち2−(4−アミノスチリル)ベンゾチアゾリウム塩部位に依存し、400nmから600nmの非常に幅広い波長領域で励起可能であり、その際、525nmから675nmの波長領域の蛍光を生じる。なお、最大励起波長は540nm付近であり、最大蛍光波長は590nm付近である。
【0057】
本発明のオリゴヌクレオチド誘導体は、標的核酸の増幅反応を行なう際、増幅反応液中に共存させることができる。これにより、該標的核酸を増幅させながら本発明のオリゴヌクレオチド誘導体と二本鎖核酸を形成させることができ、該二本鎖核酸の形成に伴う本発明のオリゴヌクレオチド誘導体が有する蛍光特性の変化(蛍光強度値の変化)を経時的に測定することで、該標的核酸のリアルタイム検出が可能となる。標的核酸のリアルタイム検出方法の一例として、標的核酸増幅反応中のある時点で測定した反応液中の蛍光強度値を反応前の反応液中の蛍光強度値で割った値(蛍光増感率)が一定の値(しきい値)を超えた場合、標的核酸検出と判定する方法がある。
【0058】
また本発明のオリゴヌクレオチド誘導体を用いた標的核酸のリアルタイム検出は、密閉容器内にて一段階で行なうことができる。すなわち標的核酸のリアルタイム検出を行なう際、当該検出に必要な試薬(標的核酸増幅試薬および標的核酸を検出するためのオリゴヌクレオチドプローブ)の全てを容器内に収容し、標的核酸を含む試料を添加した後、当該容器を密閉することで、後から試薬を添加する操作や不要な試薬を除去する操作なしに、標的核酸をリアルタイムに検出(標的核酸の増幅および検出)することができる。
【0059】
本発明のオリゴヌクレオチド誘導体を用いた標的核酸のリアルタイム検出における、標的核酸の増幅方法に特に制限はなく、一例として特許文献4から6に記載された方法を採用することができる。さらに具体的には、標的RNAに対し相同的なヌクレオチド配列を有する第一のプライマーと、標的RNAに対し相補的なヌクレオチド配列を有する第二のプライマー(該プライマーのうちいずれか一方は、その5’末端にプロモーター配列が付加されている)からなるプライマーの組合せを用いて、
(1)逆転写酵素によりプロモーター配列を含む二本鎖DNAを生成し、
(2)当該二本鎖DNAを鋳型としてRNAポリメラーゼによりRNA逆転写産物を生成し、
(3)当該RNA転写産物が引き続き前記逆転写酵素によるDNA合成の鋳型となって前記二本鎖DNAを生成する、
RNA増幅反応させる際に、本発明のオリゴヌクレオチド誘導体を当該増幅反応系中に共存させ、当該誘導体が有する蛍光特性の変化(蛍光強度値の変化)を経時的に測定することで、標的RNAをリアルタイム検出することができる。
【0060】
本発明のオリゴヌクレオチド誘導体(第一のオリゴヌクレオチド誘導体)に、本発明のオリゴヌクレオチド誘導体とは蛍光波長の異なる蛍光色素を化学結合で結合したオリゴヌクレオチド誘導体(第二のオリゴヌクレオチド誘導体)をさらに添加することで、第一のオリゴヌクレオチド誘導体が有するヌクレオチド配列と相補的な配列を有する第一の標的核酸と、第二のオリゴヌクレオチド誘導体が有するヌクレオチド配列と相補的な配列を有する第二の標的核酸を同時に検出することができる。なお、第一および第二の標的核酸をリアルタイム検出することも可能であり、その具体例として、第一の標的RNAに対し相同的なヌクレオチド配列を有する第一のプライマーと第一の標的RNAに対し相補的なヌクレオチド配列を有する第二のプライマー(該プライマーのいずれか一方は、その5’末端にプロモーター配列が付加されている)からなるプライマーの組合せと、第二の標的RNAに対し相同的なヌクレオチド配列を有する第一のプライマーと第二の標的RNAに対し相補的なヌクレオチド配列を有する第二のプライマー(該プライマーのいずれか一方は、その5’末端にプロモーター配列が付加されている)からなるプライマーの組合せとを用いて、前記(1)から(3)に記載のRNA増幅反応させる際に、第一および第二のオリゴヌクレオチド誘導体を増幅反応系中に共存させ、各誘導体が有する蛍光特性の変化(蛍光強度値の変化)をそれぞれ経時的に測定することで、第一および第二の標的RNAを独立にリアルタイム検出することができる。
【0061】
第二のオリゴヌクレオチド誘導体において、化学結合で結合する蛍光色素に特に制限はなく、例えばオキサゾールイエローやチアゾールオレンジがあげられる。中でも検出感度が良い点で、オキサゾールイエローが蛍光色素として好ましい。
【実施例】
【0062】
次に本発明を実施例および参考例によってさらに詳細に説明するが、本発明はこれらに限定されるものではない。
【0063】
実施例1
【0064】
【化10】

一本鎖オリゴヌクレオチド(化合物6−1)(配列番号1)(4.4nmol)を0.1Mトリス−塩酸緩衝液(pH5.1)275μLに溶解し、1Mジチオスレイトール水溶液25μLを添加した。1時間後、反応液に(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4−メトキシベンゾチアゾリウム=ヨージドのDMF−0.1Mリン酸ナトリウム緩衝液(pH9.5)溶液(1mg/mL,500μL)を添加した。2時間後、反応液をn−ブタノールで洗浄し、得られた水層を濃縮した後、エタノールを添加し、−78℃で30分静置した。析出した固体を遠心濃縮により集めた。得られた沈殿物をHPLC(ODS−120T、東ソー株式会社製)により精製し、目的の化合物(化合物1−1)(2.4nmol)を得た。得られた化合物1−1のTOF−Mass測定を行なったところ、化合物1−1のカチオン部位の分子量:7557.41に対応するピークが7557.60に観測され、目的とするオリゴヌクレオチド誘導体の生成を確認した。
【0065】
実施例2
【0066】
【化11】

(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4−メトキシベンゾチアゾリウム=ヨージドの代わりに(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4,7−ジメトキシベンゾチアゾリウム=ヨージドを用いた以外は実施例1と同様の反応を行ない、目的とするオリゴヌクレオチド誘導体(化合物1−2)(1.9nmol)を得た。
【0067】
実施例3
【0068】
【化12】

(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4−メトキシベンゾチアゾリウム=ヨージドの代わりに(E)−2−[2−(4−ジメチルアミノ)スチリル]−3−(4−ヨードブチル)ベンゾチアゾリウム=ヨージドを用いた以外は実施例1と同様の反応を行ない、目的の化合物(化合物1−3)(0.9nmol)を得た。得られた化合物1−3のTOF−Mass測定を行なったところ、化合物1−3のカチオン部位の分子量:7527.40に対応するピークが7528.34に観測され、目的物とするオリゴヌクレオチド誘導体を確認した。
【0069】
実施例4
【0070】
【化13】

(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4−メトキシベンゾチアゾリウム=ヨージドの代わりに(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードプロピル)−4−メトキシベンゾチアゾリウム=ヨージドを用いた以外は実施例1と同様の反応を行ない、目的とするオリゴヌクレオチド誘導体(化合物1−4)(1.0nmol)を得た。
【0071】
実施例5
【0072】
【化14】

(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4−メトキシベンゾチアゾリウム=ヨージドの代わりに(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードペンチル)−4−メトキシベンゾチアゾリウム=ヨージドを用いた以外は実施例1と同様の反応を行ない、目的とするオリゴヌクレオチド誘導体(化合物1−5)(0.6nmol)を得た。
【0073】
実施例6
【0074】
【化15】

(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4−メトキシベンゾチアゾリウム=ヨージドの代わりに(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードヘキシル)−4−メトキシベンゾチアゾリウム=ヨージドを用いた以外は実施例1と同様の反応を行ない、目的とするオリゴヌクレオチド誘導体(化合物1−6)(0.4nmol)を得た。
【0075】
実施例7 標的核酸の検出
実施例1から3で合成した本発明のオリゴヌクレオチド誘導体(化合物1−1、化合物1−2、化合物1−3)を用いて、標的核酸(DNAまたはRNA)の検出を行なった。
【0076】
a)方法
以下の組成の測定条件で、本発明のオリゴヌクレオチド誘導体(化合物1−1、化合物1−2、化合物1−3)に、標的核酸D(DNA1、配列番号2)または標的核酸E(RNA1、配列番号3)をそれぞれ添加し、蛍光スペクトルを測定した。また同様に、一本鎖オリゴヌクレオチド(配列番号4)と3,8−ジアミノ−6−フェニルフェナントリジニウム塩を化学結合で結合することで得られるオリゴヌクレオチド誘導体(プローブA)に、標的核酸F(DNA2、配列番号5)または標的核酸G(RNA2、配列番号6)をそれぞれ添加し、同様の条件で蛍光スペクトルを測定し、これを本発明のオリゴヌクレオチド誘導体の比較対照とした。
【0077】
【化16】

標的核酸D(DNA1)の塩基配列:
5’−d(GTCGTATGGTATTATTTAGGGGC)−3’
(配列番号2)
標的核酸E(RNA1)の塩基配列:
5’−r(GUCGUAUGGUAUUAUUUAGGGGC)−3’
(配列番号3)
標的核酸F(DNA2)の塩基配列:
5’−d(CTGCTATCCACCCTCAAACA)−3’
(配列番号5)
標的核酸G(RNA2)の塩基配列:
5’−r(CUGCUAUCCACCCUCAAACA)−3’
(配列番号6)
測定溶液:
リン酸バッファー(pH7.4)(137mM NaCl、2.68mM KCl
、8.1mM Na2HPO4、1.47mM KH2PO4)
オリゴヌクレオチド誘導体の濃度:0.1μM
標的核酸の濃度:0.1μM
測定温度:43℃
b)結果
本発明のオリゴヌクレオチド誘導体(化合物1−1、化合物1−2、化合物1−3)および比較対照のオリゴヌクレオチド誘導体(プローブA)のみでの最大励起波長、最大蛍光波長および蛍光強度、ならびに標的核酸(DNAまたはRNA)添加時の各オリゴヌクレオチド誘導体の最大蛍光波長、蛍光強度、蛍光増感率(標的核酸添加時の蛍光強度値をオリゴヌクレオチド誘導体のみでの蛍光強度値で割った値)を表1に示す。
【0078】
【表1】

本発明のオリゴヌクレオチド誘導体は、該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸の添加により大きな蛍光増感を示すことがわかる。具体的には、本発明のオリゴヌクレオチド誘導体(化合物1−1、化合物1−2、化合物1−3)に該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸を添加したときの蛍光強度値は、本発明のオリゴヌクレオチド誘導体のみのときと比較し増大しており、その蛍光増感率は、標的核酸が一本鎖DNAのときでそれぞれ3.3倍、2.0倍、2.8倍であり、標的核酸が一本鎖RNAのときでそれぞれ2.4倍、2.5倍、3.1倍であった。また、本発明のオリゴヌクレオチド誘導体(化合物1−1、化合物1−2、化合物1−3)は、比較対照のオリゴヌクレオチド誘導体(プローブA)との比較で、蛍光強度値が著しく増大しており、蛍光増感率も増大していた。
【0079】
以上の結果より、本発明のオリゴヌクレオチド誘導体は、従来より核酸検出に用いられた蛍光色素である、3,8−ジアミノ−6−フェニルフェナントリジニウム塩をオリゴヌクレオチドと化学結合で結合して得られたオリゴヌクレオチド誘導体(プローブA)と比較し、オリゴヌクレオチド誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸の添加による、蛍光強度値の有意な増大および蛍光増感率の増加が確認できる。
【0080】
実施例8 核酸増幅反応系における標的核酸のリアルタイム検出
実施例1および3で合成した本発明のオリゴヌクレオチド誘導体(化合物1−1および1−3)を用いて、核酸増幅反応により増幅した標的核酸のリアルタイム検出を行なった。核酸増幅反応にはTRC法(特許文献7、特許文献8および非特許文献3)を用いた。
【0081】
a)方法
a−1)化学合成した標的核酸A(配列番号7)を希釈液(10mM Tris−HCl緩衝液(pH8.0)、1mM EDTA)を用いて、104コピー/5μLになるように希釈し、これを標的核酸試料Aとして用いた。
【0082】
標的核酸Aの塩基配列:
5’−d(ATCCCACACCGCTAAAGCGCATAGCCCCTAAA
TAATACCATACGACTACCTGCCCCTAAATAATACCAT
ACGATTGTATCTCCGAAGAGACCTTTCCG)−3’
(配列番号7)
a−2)以下の組成からなる反応液20μLを0.5mL容量PCRチューブ(Individual Dome Cap PCR Tube、SSI製)に分注し、これに前記の標的核酸試料Aまたは水を5μL添加した。
【0083】
反応液の組成:濃度は酵素液添加後(30μL中)の最終濃度
60mM Tris−HCl緩衝液(pH8.6)
17mM 塩化マグネシウム
100mM 塩化カリウム
1mM DTT
各0.25mM dATP、dCTP、dGTP、dTTP
各3.0mM ATP、CTP、GTP、UTP
3.6mM ITP
1μM 第一のプライマー(配列番号8)
1μM 第二のプライマー(配列番号9)
80nM オリゴヌクレオチド誘導体(化合物1−1または1−3)
10% DMSO
0.01% コール酸ナトリウム
第一のプライマーの配列:
5’−d(AATTCTAATACGACTCACTATAGGGAGACGGA
AAGGTCTCTTCGGACATAC)−3’
(配列番号8)
第二のプライマーの配列:
5’−d(CCCACACCGCTAAAGCGC)−3’
(配列番号9)
a−3)前記反応液を46℃で5分間保温後、あらかじめ43℃で2分間保温した以下の組成からなる酵素液5μLを添加した。
【0084】
酵素液の組成
2.0% ソルビトール
6.4U AMV逆転写酵素
142U T7 RNAポリメラーゼ
3.6μg 牛血清アルブミン
a−4)引き続きPCRチューブを直接測定可能な温調機能つき蛍光分光光度計を用いて46℃で反応させると同時に、反応溶液の蛍光強度(励起波長470nm、蛍光波長610nm)を経時的に10分間測定した。
【0085】
b)結果
化合物1−1または1−3を添加したときの、核酸増幅反応に伴う蛍光強度の経時変化を示した図をそれぞれ図1および2に示す。なお図1および2において、白四角は試料として水を添加したときの蛍光強度を、黒三角は試料として標的核酸試料Aを添加したときの蛍光強度を、それぞれ示している。いずれの化合物を用いた場合も、試料として水を添加したときは蛍光強度の変化が確認できなかったのに対し、標的核酸試料Aを添加したときは標的核酸の増幅に伴い蛍光強度が増大した。酵素液添加10分後の蛍光増感率(酵素液添加10分後の溶液の蛍光強度値を酵素液添加前の溶液の蛍光強度値で割った値)は化合物1−1を用いたときで3.1倍、化合物1−3を用いたときで3.3倍であり、標的核酸の有無により蛍光強度値の明確な差が確認できた。このことから、本発明のオリゴヌクレオチド誘導体は、核酸増幅反応により増幅された、該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸をリアルタイムに検出できることがわかる。
【0086】
実施例9 核酸増幅反応系における標的核酸のリアルタイム検出
実施例1、4、5および6で合成した本発明のオリゴヌクレオチド誘導体(化合物1−1、1−4、1−5および1−6)を用いて、核酸増幅反応により増幅した標的核酸のリアルタイム検出を行なった。核酸増幅反応には実施例8と同様、TRC法を用いた。
【0087】
a)方法
a−1)以下の組成からなる反応液20μLを0.5mL容量PCRチューブ(Individual Dome Cap PCR Tube、SSI製)に分注し、これに実施例8のa−1)で調製した標的核酸試料Aまたは水を5μL添加した。
【0088】
反応液の組成:濃度は酵素液添加後(30μL中)の最終濃度
60mM Tris−HCl緩衝液(pH8.6)
17mM 塩化マグネシウム
100mM 塩化カリウム
1mM DTT
各0.25mM dATP、dCTP、dGTP、dTTP
各3.0mM ATP、CTP、GTP、UTP
3.6mM ITP
1μM 第一のプライマー(配列番号8)
1μM 第二のプライマー(配列番号9)
80nM オリゴヌクレオチド誘導体(化合物1−1、1−4、1−5または1−
6)
13% DMSO
a−2)上記反応液を43℃で5分間保温後、あらかじめ43℃で2分間保温した、実施例8のa−3)に記載の酵素液5μLを添加した。
【0089】
a−3)引き続きPCRチューブを直接測定可能な温調機能つき蛍光分光光度計を用いて43℃で反応させると同時に、反応溶液の蛍光強度(励起波長470nm、蛍光波長610nm)を経時的に10分間測定した。
【0090】
b)結果
化合物1−1、1−4、1−5または1−6を添加したときの、核酸増幅反応に伴う蛍光強度の経時変化を示した図をそれぞれ図3から6に示す。なお図3から6において、白四角は試料として水を添加したときの蛍光強度を、黒三角は試料として標的核酸試料Aを添加したときの蛍光強度を、それぞれ示している。いずれの化合物を用いた場合も、試料として水を添加したときは蛍光強度の変化が確認できなかったのに対し、標的核酸試料Aを添加したときは標的核酸の増幅に伴い蛍光強度が増大した。酵素液添加10分後の蛍光増感率(酵素液添加10分後の溶液の蛍光強度値を酵素液添加前の溶液の蛍光強度値で割った値)は化合物1−1を用いたときで2.3倍、化合物1−4を用いたときで1.8倍、化合物1−5を用いたときで2.0倍、化合物1−6を用いたときで2.0倍であり、標的核酸の有無により蛍光強度値の明確な差が確認できた。このことから、本発明のオリゴヌクレオチド誘導体は、核酸増幅反応により増幅された、該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸をリアルタイムに検出できることがわかる。
【0091】
実施例10 核酸増幅反応系における2種類の標的核酸の同時検出
実施例1および3で合成した本発明のオリゴヌクレオチド誘導体(化合物1−1および1−3)と、オキサゾールイエローを化学結合で結合したオリゴヌクレオチド誘導体(プローブB、配列番号10)とを用いて、核酸増幅反応により増幅した二種類の標的核酸のリアルタイム検出を行なった。核酸増幅反応には実施例8と同様、TRC法を用いた。
【0092】
【化17】

a)方法
a−1)標的核酸試料として、下記3種類の標的核酸試料を用意した。
【0093】
(i)実施例8のa−1)で調製した標的核酸試料A、
(ii)標的核酸B(配列番号11)を希釈液(10mM Tris−HCl緩衝液(pH8.0)、1mM EDTA)を用いて、104コピー/5μLになるように希釈した標的核酸試料B、
標的核酸Bの塩基配列:
5’−(ATCCCACACCGCTAAAGCGCATAGGAAAAGCA
AAAGGATACGAGTACCTGGAAAAGCAAAAGGATACG
AGTTGTATCTCCGAAGAGACCTTTCCG)−3’
(配列番号11)
(iii)標的核酸A(配列番号7)と標的核酸B(配列番号11)を希釈液(10mM Tris−HCl緩衝液(pH8.0)、1mM EDTA)を用いて、各核酸の終濃度が104コピー/5μLになるように混合/希釈した標的核酸試料C
a−2)以下の組成の反応液20μLを0.5mL容量PCRチューブ(Indicidual Dome Cap PCR Tube、SSI製)に分注し、これに標的核酸試料A、標的核酸試料B、標的核酸試料Cまたは水を5μL添加した。
【0094】
反応液の組成:濃度は酵素液添加後(30μL中)の最終濃度
60mM Tris−HCl緩衝液(pH8.6)
17mM 塩化マグネシウム
100mM 塩化カリウム
1mM DTT
各0.25mM dATP、dCTP、dGTP、dTTP
各3mM ATP、CTP、GTP、UTP
3.6mM ITP
1μM 第一のプライマー(配列番号8)
1μM 第二のプライマー(配列番号9)
20nM オリゴヌクレオチド誘導体(プローブB)
80nM オリゴヌクレオチド誘導体(化合物1−1または1−3)
10% DMSO
0.01% コール酸ナトリウム
a−3)上記反応液を46℃で5分間保温後、あらかじめ40℃で2分間保温した、実施例8のa−3)に記載の酵素液5μLを添加した。
【0095】
a−4)引き続きPCRチューブを直接測定可能な温調機能つき蛍光分光光度計を用いて46℃で反応させると同時に、反応溶液の蛍光強度(励起波長:470nm、蛍光波長A:520nm、蛍光波長B:610nm)を経時的に10分間測定した。
【0096】
b)結果
化合物1−1およびプローブBを添加したときの核酸増幅反応に伴う蛍光強度の経時変化を示した図をそれぞれ図7(蛍光波長A)および8(蛍光波長B)に示し、化合物1−3およびプローブBを添加したときの核酸増幅反応に伴う蛍光強度の経時変化を示した図をそれぞれ図9(蛍光波長A)および10(蛍光波長B)に示す。なお図7から10において、白四角は試料として水を添加したときの蛍光強度を、黒三角は試料として標的核酸試料Aを添加したときの蛍光強度を、黒丸は試料として標的核酸試料Bを添加したときの蛍光強度を、×は試料として標的核酸試料Cを添加したときの蛍光強度を、それぞれ示している。いずれの場合も、試料として水を添加したときは蛍光強度の変化が確認できなかったのに対し、標的核酸試料Aを添加したときは標的核酸の増幅に伴い蛍光波長Bの蛍光強度のみが増大し、標的核酸試料Bを添加したときは標的核酸の増幅に伴い蛍光波長Aの蛍光強度のみが増大し、標的核酸試料Cを添加したときは標的核酸の増幅に伴い蛍光波長Aの蛍光強度と蛍光波長Bの蛍光強度がともに増大した。蛍光波長Aの蛍光強度はプローブBに対して相補的なヌクレオチド配列を有する標的核酸Bに由来する蛍光強度であり、蛍光波長Bの蛍光強度は本発明のオリゴヌクレオチド誘導体に対して相補的なヌクレオチド配列を有する標的核酸Aに由来する蛍光強度である。各オリゴヌクレオチド誘導体(本発明のオリゴヌクレオチド誘導体およびプローブB)が有するヌクレオチド配列と相補的な配列を有する標的核酸(標的核酸Aおよび標的核酸B)の有無により、各蛍光波長(蛍光波長Aおよび蛍光波長B)における蛍光強度値に明確な差がみられたことから、本発明のオリゴヌクレオチド誘導体は、該誘導体と蛍光波長が異なる蛍光色素を化学結合で結合したオリゴヌクレオチド誘導体と併用することで、核酸増幅反応にて増幅された二種類の標的核酸を、それぞれ独立してリアルタイム検出できることが示された。
【0097】
参考例1
【0098】
【化18】

アルゴン雰囲気下、3−(3−ヨードプロピル)−4−メトキシ−2−メチルベンゾチアゾリウム=ヨージド(35.9mg,0.076mmol)、4−(ジメチルアミノ)ベンズアルデヒド(14.0mg,0.094mmol)と無水酢酸(1.0mL)の混合物を、110℃で一晩撹拌した。反応混合物にトルエン(5.0mL)を加えて減圧濃縮を行ない、得られた粗生成物をシリカゲルカラムクロマトグラフィー[クロロホルム−メタノール(10:1)]で精製することにより、(E)−2−[4−(ジメチルアミノ)スチリル]−3−(3−ヨードプロピル)−4−メトキシベンゾチアゾリウム=ヨージド(16.7mg,収率36%)を黒紫色の固体として得た。
1H−NMR(400MHz,DMSO−d6):δ 8.04(d,J=15.3Hz,1H),7.91(d,J=9.6Hz,2H),7.84(d,J=8.1Hz,1H),7.62(t,J=8.1Hz,1H),7.52(d,J=15.3Hz,1H),7.42(d,J=8.1Hz,1H),6.89(d,J=9.6Hz,2H),5.10−4.90(m,2H),4.09(s,3H),3.47(t,J=7.4Hz,2H),3.12(s,6H),2.41−2.37(m,2H).
参考例2
【0099】
【化19】

アルゴン雰囲気下、3−(4−ヨードブチル)−4−メトキシ−2−メチルベンゾチアゾリウム=ヨージド(1.36g,2.78mmol)、4−(ジメチルアミノ)ベンズアルデヒド(416.6mg,2.79mmol)と無水酢酸(12.0mL)の混合物を、110℃で一晩撹拌した。反応混合物にトルエン(5.0mL)を加えて減圧濃縮を行ない、得られた粗生成物をシリカゲルカラムクロマトグラフィー[クロロホルム−メタノール(10:1)]で精製することにより、(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4−メトキシベンゾチアゾリウム=ヨージド(1.41g,収率82%)を紫色の固体として得た。
1H−NMR(400MHz,DMSO−d6):δ 8.07(d,J=15.2Hz,1H),7.91(d,J=9.0Hz,2H),7.83(d,J=8.1Hz,1H),7.62(d,J=8.1Hz,1H),7.54(d,J=15.2Hz,1H),7.39(d,J=8.1Hz,1H),6.84(d,J=9.0Hz,2H)5.10−5.00(m,2H),4.07(s,3H),3.40−3.35(m,2H),3.11(s,6H),2.00−1.90(m,4H).
参考例3
【0100】
【化20】

アルゴン雰囲気下、3−(5−ヨードペンチル)−4−メトキシ−2−メチルベンゾチアゾリウム=ヨージド(39.6mg,0.073mmol)、4−(ジメチルアミノ)ベンズアルデヒド(20.2mg,0.14mmol)と無水酢酸(1.0mL)の混合物を、110℃で一晩撹拌した。反応混合物にトルエン(2.0mL)を加えて減圧濃縮を行ない、得られた粗生成物をシリカゲルカラムクロマトグラフィー[クロロホルム−メタノール(10:1)]で精製することにより、(E)−2−[4−(ジメチルアミノ)スチリル]−3−(5−ヨードペンチル)−4−メトキシベンゾチアゾリウム=ヨージド(11.2mg,収率24%)を黒紫色の固体として得た。
1H−NMR(400MHz,DMSO−d6):δ 8.06(d,J=15.3Hz,1H),7.91(d,J=9.2Hz,2H),7.83(d,J=8.2Hz,1H),7.63(t,J=8.2Hz,1H),7.56(d,J=15.3Hz,1H),7.39(d,J=8.2Hz,1H),6.83(d,J=9.2Hz,2H),4.96−4.93(m,2H),4.06(s,3H),3.30−3.29(m,2H),3.11(s,6H),1.90−1.80(m,4H),1.60−1.50(m,2H).
参考例4
【0101】
【化21】

アルゴン雰囲気下、3−(6−ヨードヘキシル)−4−メトキシ−2−メチルベンゾチアゾリウム=ヨージド(38.6mg,0.075mmol)、4−(ジメチルアミノ)ベンズアルデヒド(16.6mg,0.11mmol)と無水酢酸(1.0mL)の混合物を、110℃で一晩撹拌した。反応混合物にトルエン(2.0mL)を加えて減圧濃縮を行ない、得られた粗生成物をシリカゲルカラムクロマトグラフィー[クロロホルム−メタノール(10:1)]で精製することにより、(E)−2−[4−(ジメチルアミノ)スチリル]−3−(6−ヨードヘキシル)−4−メトキシベンゾチアゾリウム=ヨージド(12.9mg,収率27%)を黒紫色の固体として得た。
1H−NMR(400MHz,DMSO−d6):δ 8.03(d,J=15.3Hz,1H),7.91(d,J=9.0Hz,2H),7.83(d,J=8.1Hz,1H),7.62(t,J=8.1Hz,1H),7.56(d,J=15.3Hz,1H),7.40(d,J=8.1Hz,1H),6.85(d,J=9.0Hz,2H),4.94(t,J=8.0Hz,2H),4.07(s,3H),3.29(t,J=6.8Hz,2H),3.12(s,6H),1.90−1.70(m,4H),1.52−1.40(m,4H).
参考例5
【0102】
【化22】

アルゴン雰囲気下、3−(4−ヨードブチル)−4,7−ジメトキシ−2−メチルベンゾチアゾリウム=ヨージド(201mg,0.39mmol)と4−(ジメチルアミノ)ベンズアルデヒド(59.0mg,0.39mmol)の無水酢酸(1.0mL)懸濁液を、110℃で一晩撹拌を行なった。反応混合物を室温に戻した後減圧濃縮を行ない、得られた粗成生物をシリカゲルカラムクロマトグラフィー[クロロホルム−メタノール(10:1)]により精製することで、(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4,7−ジメトキシベンゾチアゾリウム=ヨージド(225mg,収率89%)を暗赤色粉状として得た。
1H−NMR(400MHz,DMSO−d6)1H−NMR(400MHz,CDCl3):δ 8.13(d,J=15.2Hz,1H),7.90(d,J=9.0Hz,2H),7.55(d,J=15.2Hz,1H),7.34(d,J=9.0Hz,1H),7.22(d,J=9.0Hz,1H),6.84(d,J=9.0Hz,2H),4.94(m,2H),4.00(s,3H),3.99(s,3H),3.38−3.35(m,2H),3.11(s,6H),1.96−1.80(m,4H).
参考例6
【0103】
【化23】

アルゴン雰囲気下、3−(4−ヨードブチル)−2−メチルベンゾチアゾリウム=ヨージド(103.4mg,0.23mmol)と4−(ジメチルアミノ)ベンズアルデヒド(40.2mg,0.27mmol)の無水酢酸(2.0mL)溶液を、110℃で一晩撹拌を行なった。反応混合物を室温に戻した後減圧濃縮を行ない、得られた粗成生物をシリカゲルカラムクロマトグラフィー[クロロホルム−メタノール(10:1)]により精製することで、(E)−2−[2−(4−ジメチルアミノ)スチリル]−3−(4−ヨードブチル)ベンゾチアゾリウム=ヨージド(46.8mg,収率35%)を紫色の固体として得た。
1H−NMR(400MHz,DMSO−d6):δ 8.31(d,J=8.1Hz,1H),8.16(d,J=8.1Hz,1H),8.10(d,J=15.2Hz,1H),7.93(d,J=9.1Hz,2H),7.78(t,J=7.3Hz,1H),7.68(t,J=7.3Hz,1H),7.60(d,J=15.2Hz,1H),6.86(d,J=9.1Hz,2H),4.83(t,J=7.1Hz,2H),3.36(t,J=6.6Hz,2H),3.12(s,6H),1.96−1.91(m,4H).
【技術分野】
【0001】
本発明は、オリゴヌクレオチドと2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合することで得られるオリゴヌクレオチド誘導体、該誘導体の製造方法、および該誘導体を用いた、該誘導体が有するヌクレオチド配列と相補的な配列を有する核酸の検出方法に関するものである。
【背景技術】
【0002】
近年、遺伝子診断技術の発達に伴い、遺伝子を検出する技術の重要性が増している。二本鎖DNAやDNA−RNAハイブリッド等の二本鎖核酸の検出には、従来よりエチジウムブロミドやオキサゾールイエロー等の蛍光色素を用いた検出が用いられている(非特許文献1)。また、それらの蛍光色素とオリゴヌクレオチドを化学結合で結合したオリゴヌクレオチド誘導体は、該誘導体が有するヌクレオチド配列と相補的な配列を有するオリゴヌクレオチドまたはポリヌクレオチド(標的核酸)と二本鎖核酸を形成することができ、該二本鎖核酸の形成に伴い蛍光増感を示すことから、遺伝子診断において遺伝子やウイルス等の検出に用いられる(特許文献1)。特に、エチジウムブロミド類縁体である3,8−ジアミノ−6−フェニルフェナントリジニウム塩を化学結合で結合したオリゴヌクレオチド誘導体は、該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸を検出するためのオリゴヌクレオチドプローブとして広く用いられている。(特許文献2、非特許文献1)。
【0003】
なお、2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合した、本発明のオリゴヌクレオチド誘導体はこれまでに全く報告されておらず、新規の化合物である。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2001−13147号公報
【特許文献2】国際特許公開WO97/27329号
【特許文献3】特開2000−316587号公報
【特許文献4】特許第2650159号公報
【特許文献5】欧州公開特許第373960号公報
【特許文献6】特開平8−211050号公報
【特許文献7】特開2000−14400号公報
【特許文献8】特開2001−037500号公報
【非特許文献】
【0005】
【非特許文献1】Nucleic Acids Research,22,920−928(1994)
【非特許文献2】Dyes and Pigments,11,21−35(1989)
【非特許文献3】Anal. Biochem.,314,1247−1252(2003)
【発明の概要】
【発明が解決しようとする課題】
【0006】
前述したように、エチジウムブロミド類縁体である3,8−ジアミノ−6−フェニルフェナントリジニウム塩を化学結合で結合したオリゴヌクレオチド誘導体は、該誘導体が有するヌクレオチド配列と相補的な配列を有するオリゴヌクレオチドまたはポリヌクレオチド(標的核酸)を検出するためのオリゴヌクレオチドプローブとして従来より用いられているものの、蛍光強度値が小さく、二本鎖核酸の形成に伴う蛍光強度値の増加割合、いわゆる蛍光増感率が低いという問題点があった。
【0007】
そこで本発明の課題は、ストークスシフトが大きく、かつ、相補的なヌクレオチド配列を有する標的核酸存在下における蛍光強度値が大きく、蛍光増感率も高い、オリゴヌクレオチド誘導体を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、前記課題を鑑み鋭意検討を重ねた結果、本発明の2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体が、ストークスシフトが大きく、かつ、該誘導体が有するヌクレオチド配列と相補的な配列を有するオリゴヌクレオチドまたはポリヌクレオチド(標的核酸)存在下における蛍光強度値が大きく、蛍光増感率も高いため、該標的核酸を検出するためのオリゴヌクレオチドプローブとして有用であることを見出し、本発明を完成するに至った。
【0009】
すなわち本発明は、一般式(1a)
【0010】
【化1】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、R7およびR8は各々独立に9−アデニル基、9−グアニル基、1−シトシニル基または1−チミニル基を表し、X−は対アニオンを表す。lは1から8の整数を表し、mは1から4の整数を表し、nは1から4の整数を表す。B1はアデニン、グアニン、シトシンまたはチミンを表し、qは0から30の整数を表し、qが2以上の時、複数のB1は同一または相異なっていてもよい。B2はアデニン、グアニン、シトシンまたはチミンを表し、rは0から30の整数を表し、rが2以上の時、複数のB2は同一または相異なっていてもよい。ただし、qとrの和は15以上30以下である。Zは水酸基またはアミノ基を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体に関する。
【0011】
また本発明は、一般式(1c)
【0012】
【化2】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、R7−1およびR8−1は各々独立に9−アデニル基または1−チミニル基を表し、X−は対アニオンを表し、lは1から8の整数を表す。B3はアデニン、グアニン、シトシンまたはチミンを表し、sは0から27の整数を表し、sが2以上の時、複数のB3は同一または相異なっていてもよい。B6はアデニン、グアニン、シトシンまたはチミンを表し、tは0から27の整数を表し、tが2以上の時、複数のB6は同一または相異なっていてもよい。ただし、sとtの和は9以上24以下である。B4は同一または相異なってアデニンまたはチミンを表し、B5は同一または相異なってアデニンまたはチミンを表す。Zは水酸基またはアミノ基を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体に関する。
【0013】
また本発明は、一般式(1b)
【0014】
【化3】

(式中、R6−1およびR6−4は各々独立に水素原子またはメトキシ基を表し、X−は対アニオンを表し、lは1から8の整数を表し、Zは水酸基またはアミノ基を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体に関する。
【0015】
また本発明は、一般式(2d)
【0016】
【化4】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、Yはヨウ素原子、臭素原子または塩素原子を表し、X1はハロゲン原子、炭素数1から8のアルコキシスルホニルオキシ基、メチルスルホニルオキシ基またはトリフルオロメチルスルホニルオキシ基を表し、lは1から8の整数を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を、一般式(6)
【0017】
【化5】

(式中、R7およびR8は各々独立に9−アデニル基、9−グアニル基、1−シトシニル基または1−チミニル基を表し、mは1から4の整数を表し、nは1から4の整数を表す。B1はアデニン、グアニン、シトシンまたはチミンを表し、qは0から30の整数を表し、qが2以上の時、複数のB1は同一または相異なっていてもよい。B2はアデニン、グアニン、シトシンまたはチミンを表し、rは0から30の整数を表し、rが2以上の時、複数のB2は同一または相異なっていてもよい。ただし、qとrの和は15以上30以下である。Zは水酸基またはアミノ基を表す。)で表されるオリゴヌクレオチド誘導体と、還元剤の存在下反応させることを特徴とする、一般式(1a)
【0018】
【化6】

(式中、R6−1、R6−2、R6−3、R6−4、R7、R8、l、m、n、q、r、Z、B1およびB2は前記と同じ意味を表し、X−は対アニオンを表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体の製造方法に関する。
【0019】
また本発明は、本発明の2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体と、該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸とで二本鎖核酸を形成させ、該二本鎖核酸の形成に伴う前記オリゴヌクレオチド誘導体の蛍光特性の変化を測定することで標的核酸を検出する方法に関する。
【0020】
また本発明は、本発明の2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体と、該誘導体が有するヌクレオチド配列と相補的な配列を有する第一の標的核酸とで二本鎖核酸を形成させるとともに、一般式(2d)
【0021】
【化7】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、Yはヨウ素原子、臭素原子または塩素原子を表し、X1はハロゲン原子、炭素数1から8のアルコキシスルホニルオキシ基、メチルスルホニルオキシ基またはトリフルオロメチルスルホニルオキシ基を表し、lは1から8の整数を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩とは異なる蛍光波長を示す蛍光色素を化学結合で結合したオリゴヌクレオチド誘導体と、該誘導体が有するヌクレオチド配列と相補的な配列を有する第二の標的核酸とで二本鎖核酸を形成させ、前記二本鎖核酸の形成に伴う各オリゴヌクレオチド誘導体の蛍光特性の変化を測定することで標的核酸を検出する方法に関する。
【発明の効果】
【0022】
本発明の2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体は、該誘導体が有するヌクレオチド配列と相補的な配列を有するオリゴヌクレオチドまたはポリヌクレオチド(標的核酸)と二本鎖核酸を形成することで蛍光増感を示すことから、前記標的核酸を特異的に検出するオリゴヌクレオチドプローブとして用いることができる。
【0023】
本発明のオリゴヌクレオチド誘導体が有する蛍光特性は、同一波長領域で励起することができ、かつ、従来よりオリゴヌクレオチドプローブとして用いられている、3,8−ジアミノ−6−フェニルフェナントリジニウム塩を化学結合で結合したオリゴヌクレオチド誘導体よりも、蛍光強度値が顕著に高く、蛍光増感率も大きい。よって、本発明のオリゴヌクレオチド誘導体は標的核酸を検出する上で極めて有用な新規化合物であり、遺伝子診断等の臨床診断分野での利用に有用である。
【図面の簡単な説明】
【0024】
【図1】実施例8にて、化合物1−1をオリゴヌクレオチド誘導体として用いたときの、核酸増幅反応に伴う蛍光強度(610nm)の経時変化を示す図。
【図2】実施例8にて、化合物1−3をオリゴヌクレオチド誘導体として用いたときの、核酸増幅反応に伴う蛍光強度(610nm)の経時変化を示す図。
【図3】実施例9にて、化合物1−1をオリゴヌクレオチド誘導体として用いたときの、核酸増幅反応に伴う蛍光強度(610nm)の経時変化を示す図。
【図4】実施例9にて、化合物1−4をオリゴヌクレオチド誘導体として用いたときの、核酸増幅反応に伴う蛍光強度(610nm)の経時変化を示す図。
【図5】実施例9にて、化合物1−5をオリゴヌクレオチド誘導体として用いたときの、核酸増幅反応に伴う蛍光強度(610nm)の経時変化を示す図。
【図6】実施例9にて、化合物1−6をオリゴヌクレオチド誘導体として用いたときの、核酸増幅反応に伴う蛍光強度(610nm)の経時変化を示す図。
【図7】実施例10にて、化合物1−1とプローブBを添加した核酸増幅反応における蛍光強度(520nm)の経時変化を示す図。
【図8】実施例10にて、化合物1−1とプローブBを添加した核酸増幅反応における蛍光強度(610nm)の経時変化を示す図。
【図9】実施例10にて、化合物1−3とプローブBを添加した核酸増幅反応における蛍光強度(520nm)の経時変化を示す図。
【図10】実施例10にて、化合物1−3とプローブBを添加した核酸増幅反応における蛍光強度(610nm)の経時変化を示す図。
【発明を実施するための形態】
【0025】
以下に、本発明を詳細に説明する。
【0026】
本発明の2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体(以下、本発明のオリゴヌクレオチド誘導体という)中、R6−1、R6−2、R6−3およびR6−4は水素原子またはメトキシ基を表す。中でもR6−2およびR6−3は蛍光強度が強い点で水素原子が好ましい。
【0027】
本発明のオリゴヌクレオチド誘導体中、R7は9−アデニル基、9−グアニル基、1−シトシニル基、1−チミニル基のいずれかを表す。中でも蛍光強度が強い点で9−アデニル基または1−チミニル基が好ましく、1−チミニル基がさらに好ましい。
【0028】
本発明のオリゴヌクレオチド誘導体中、R8は9−アデニル基、9−グアニル基、1−シトシニル基、1−チミニル基のいずれかを表す。中でも蛍光強度が強い点で9−アデニル基または1−チミニル基が好ましく、9−アデニル基がさらに好ましい。
【0029】
本発明のオリゴヌクレオチド誘導体中、X−で表される対アニオンとしては、塩素アニオン、臭素アニオン、ヨウ素アニオン等のハロゲンアニオン、メトキシスルホニルオキシアニオン、エトキシスルホニルオキシアニオン、プロポキシスルホニルオキシアニオン、ブトキシスルホニルオキシアニオン、ペントキシスルホニルオキシアニオン、ヘキサノキシスルホニルオキシアニオン、ヘプタノキシスルホニルオキシアニオン、オクタノキシスルホニルオキシアニオン等の炭素数1から8のアルコキシスルホニルオキシアニオン、メチルスルホニルオキシアニオン、トリフルオロメチルスルホニルオキシアニオン、酢酸アニオン、リン酸アニオン、水酸化物イオン、4−(2−ヒドロキシエチル)−1−ピペラジンエチルスルホニルオキシアニオンを例示することができる。なお、分子内のカルボン酸アニオンまたはリン酸アニオンが対アニオンになっていてもよい。
【0030】
本発明のオリゴヌクレオチド誘導体中、lは1から8の整数のいずれかを表す。中でも蛍光強度が強い点でlは3から6のいずれかが好ましく、特に4が好ましい。
【0031】
本発明のオリゴヌクレオチド誘導体中、mは1から4の整数のいずれかを表す。中でも蛍光強度が強い点でmは2が好ましい。
【0032】
本発明のオリゴヌクレオチド誘導体中、nは1から4の整数のいずれかを表す。中でも蛍光強度が強い点でnは2が好ましい。
【0033】
次に、本発明のオリゴヌクレオチド誘導体(1a)の製造方法について詳細に説明する。本発明のオリゴヌクレオチド誘導体(1a)は、下記スキームにより製造することができる。
【0034】
【化8】

(式中、R6−1、R6−2、R6−3、R6−4、R7、R8、X−、l、m、nは前記と同じ意味を表す。X1はハロゲン原子、炭素数1から8のアルコキシスルホニルオキシ基、メチルスルホニルオキシ基またはトリフルオロメチルスルホニルオキシ基を表し、Yはヨウ素原子、臭素原子または塩素原子を表す。B1はアデニン、グアニン、シトシンまたはチミンを表す。qは0から30の整数を表し、qが2以上の時、複数のB1は同一または相異なっていてもよい。B2はアデニン、グアニン、シトシンまたはチミンを表す。rは0から30の整数を表し、rが2以上の時、複数のB2は同一または相異なっていてもよい。ただし、qとrの和は15以上30以下である。Zは水酸基またはアミノ基を表す。)
前記スキームのうち、X1で表されるハロゲン原子としては、塩素原子、臭素原子、ヨウ素原子を例示することができる。また、X1で表される炭素数1から8のアルコキシスルホニルオキシ基としては、メトキシスルホニルオキシ基、エトキシスルホニルオキシ基、プロポキシスルホニルオキシ基、ブトキシスルホニルオキシ基、ペントキシスルホニルオキシ基、ヘキサノキシスルホニルオキシ基、ヘプタノキシスルホニルオキシ基、オクタノキシスルホニルオキシ基を例示することができる。中でも調製が容易な点でヨウ素原子がX1として好ましい。
【0035】
前記スキームのうち、Yはヨウ素原子、臭素原子または塩素原子を表す。中でも収率がよい点でヨウ素原子がYとして好ましい。
【0036】
前記スキームのうち工程−1は、2−メチルベンゾチアゾリウム塩(4a)と4−(ジメチルアミノ)ベンズアルデヒド(5a)を縮合させ、2−(4−アミノスチリル)ベンゾチアゾリウム塩(2d)を製造する工程である。
【0037】
工程−1の原料である2−メチルベンゾチアゾリウム塩(4a)は、例えば文献記載の方法(Dyes and Pigments,11,21−35(1989):非特許文献2)を参考に、対応する2−メチルベンゾチアゾール誘導体から調製することができる。
【0038】
工程−1の反応は、縮合剤の存在下に行なうことが必須である。縮合剤としては、塩基または脱水剤を用いることができる。本工程の縮合剤として用いることができる塩基としては、ピペリジン、ピロリジン、モルフォリン等の有機塩基を例示することができる。また、本工程の縮合剤として用いることのできる脱水剤としては、無水酢酸、無水トリフルオロ酢酸等の酸無水物を例示することができる。中でも収率のよい点で、ピペリジンまたは無水酢酸が縮合剤として好ましい。
【0039】
工程−1の反応は反応を阻害しない溶媒であれば、溶媒中で行なってもよい。本工程で用いることができる溶媒として、具体的には、テトラヒドロフラン、ジエチルエーテル、1,4−ジオキサン、メチル−tert−ブチルエーテル、1,2−ジメトキシエタン、シクロペンチルメチルエーテル等のエーテル系溶媒、ヘキサン、ペンタン、ヘプタン、シクロヘキサン等の炭化水素系溶媒、ベンゼン、トルエン、キシレン等の芳香族炭化水素系溶媒、ジクロロメタン、クロロホルム、四塩化炭素、1,2−ジクロロエタン等のハロゲン系溶媒、アセトニトリル、ジメチルスルホキシド、ジメチルホルムアミド、N−メチル−2−ピロリドン、1,3−ジメチル−3,4,5,6−テトラヒドロ−2(1H)−ピリミジノン等の非プロトン性極性溶媒、メタノール、エタノール、tert−ブチルアルコール等のアルコール系溶媒、水を例示することができ、これらの溶媒の中から2種類以上を混合して用いてよい。また前述した縮合剤である、ピペリジン、ピロリジン、モルフォリン等の有機塩基、無水酢酸、無水トリフルオロ酢酸等の酸無水物を溶媒として用いてもよい。
【0040】
工程−1の反応で、2−メチルベンゾチアゾリウム塩(4a)と4−(ジメチルアミノ)ベンズアルデヒド(5a)とのモル比に特に制限はないが、1:1から1:10の範囲が好ましく、中でも収率がよい点で1:1から1:3の範囲がさらに好ましい。
【0041】
工程−1の反応において、2−メチルベンゾチアゾリウム塩(4a)と縮合剤とのモル比に特に制限はないが、縮合剤を溶媒として用いない場合には、1:1から1:10の範囲が好ましく、中でも収率がよい点で1:1から1:3の範囲がさらに好ましい。
【0042】
工程−1の反応において、反応温度は−78℃から150℃の範囲から適宜選ばれた温度で行なうことができる。中でも収率がよい点で室温から120℃の範囲が好ましい。
【0043】
工程−1の反応で得られる2−(4−アミノスチリル)ベンゾチアゾリウム塩(2d)は、必要に応じて反応終了後、反応溶液から精製することができる。精製する方法には特に限定はないが、溶媒抽出、シリカゲルカラムクロマトグラフィー、分取薄層クロマトグラフィー、分取液体クロマトグラフィー、再結晶または昇華等の汎用的な方法で目的物を精製することができる。
【0044】
工程−2は、2−(4−アミノスチリル)ベンゾチアゾリウム塩(2d)とオリゴヌクレオチド誘導体(6)とを反応させ、本発明の2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体(1a)を製造する工程である。
【0045】
工程−2の原料であるオリゴヌクレオチド誘導体(6)は、例えば文献記載の方法(特開2000−316587号公報:特許文献3)を参考に、下記スキームにより調製することができる。化合物(13)から化合物(14)への変換工程の条件を選ぶことにより、オリゴヌクレオチド誘導体(6)の置換基Zは、水酸基またはアミノ基に作り分けることができる。
【0046】
【化9】

(式中、R7、R8、m、n、q、r、B1、B2およびZは前記と同じ意味を表す。)
工程−2の反応は、還元剤の存在下に行なうことが必須であり、還元剤としては、水素化ホウ素ナトリウム、2−メルカプトエタノール、ジチオスレイトール、2−メルカプトエチルアミン、ジチオエリスリトール、還元型グルタチオン、システイン、モノチオリン酸および亜硫酸塩等を用いることができる。
【0047】
工程−2の反応は反応を阻害しない溶媒であれば、溶媒中で行なってもよい。工程−2で用いることができる溶媒としては、トリス−塩酸緩衝液、酢酸ナトリウム緩衝液、HEPES−KOH緩衝液、リン酸ナトリウム緩衝液、リン酸カリウム緩衝液等の緩衝液を例示することができる。また、これらの緩衝液に、0%から80%の割合でジメチルスルホキシド、メタノール、エタノール、ヘキサメチルリン酸トリアミド、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、1,4−ジオキサン、テトラヒドロフラン等、水と混和可能な有機溶媒を混合して用いてもよい。なお、前記有機溶媒の割合を0%から20%の範囲とすると好ましい。
【0048】
工程−2の反応において、2−(4−アミノスチリル)ベンゾチアゾリウム塩(2d)とオリゴヌクレオチド誘導体(6)とのモル比に特に制限はなく、2−(4−アミノスチリル)ベンゾチアゾリウム塩(2d)を大過剰に用いてもよい。
【0049】
工程−2の反応において、オリゴヌクレオチド誘導体(6)と還元剤とのモル比に特に制限はなく、還元剤を大過剰に用いてもよい。
【0050】
工程−2の反応において、反応温度は0℃から100℃の範囲から適宜選ばれた温度で行なうことができる。中でも収率がよい点で室温から60℃の範囲が好ましい。
【0051】
工程−2で得られた本発明のオリゴヌクレオチド誘導体(1a)は、必要に応じて反応終了後、反応溶液から精製することができる。精製する方法には特に限定はないが、溶媒抽出、シリカゲルカラムクロマトグラフィー、分取薄層クロマトグラフィー、分取液体クロマトグラフィー、再結晶または昇華等の汎用的な方法で目的物を精製することができる。
【0052】
なお、本発明のオリゴヌクレオチド誘導体(1a)のカウンターアニオン(X−)は、工程−2の反応において、反応に用いる緩衝液中の陰イオンまたは分子内の陰イオンとアニオン交換反応が起こる場合がある。しかしながら、いずれのカウンターアニオン(X−)であっても、オリゴヌクレオチドプローブとしての性能に影響はない。
【0053】
本発明のオリゴヌクレオチド誘導体(1a)は、該誘導体が有するヌクレオチド配列と相補的な配列を有するオリゴヌクレオチドまたはポリヌクレオチド(標的核酸)と二本鎖核酸を形成することで、形成前と比較し蛍光特性が変化する(すなわち、蛍光強度値が増大する)ため、該標的核酸を特異的に検出するためのオリゴヌクレオチドプローブとして用いることができる。なお該標的核酸の由来に特に限定はなく、例えば、PCR等に代表される核酸増幅反応により合成されたポリヌクレオチドであってもよいし、化学的に合成されたオリゴヌクレオチドであってもよいし、血液、組織、細胞等から抽出されたポリヌクレオチドであってもよいし、食品、土壌、排水等から抽出されたポリヌクレオチドであってもよい。
【0054】
本発明のオリゴヌクレオチド誘導体と標的核酸とで二本鎖核酸を形成させる際の溶媒に特に制限はないものの、緩衝液を用いることが好ましい。用いることのできる緩衝液としては、トリス−塩酸緩衝液、酢酸ナトリウム緩衝液、HEPES−KOH緩衝液、リン酸ナトリウム緩衝液、リン酸カリウム緩衝液を例示することができる。なお、本発明のオリゴヌクレオチド誘導体と標的核酸とで形成される二本鎖核酸の熱的安定性を向上させるために、前述の緩衝液に任意の濃度で無機塩またはカルボン酸塩を添加してもよい。該無機塩としては、塩化ナトリウム、塩化マグネシウム、塩化カリウム、臭化ナトリウム、臭化マグネシウム、臭化カリウム、ヨウ化ナトリウム、ヨウ化カリウムを例示することができ、該カルボン酸塩としては、酢酸マグネシウム、酢酸マンガンを例示することができる。これらの無機塩およびカルボン酸塩のうち2種類以上を混合して用いてもよい。無機塩またはカルボン酸塩の添加濃度は0Mから5Mの範囲が好ましい。さらに、緩衝液に混和可能な有機溶媒を0%から80%の割合で添加してもよい。該有機溶媒としては、ジメチルスルホキシド、メタノール、エタノール、ヘキサメチルリン酸トリアミド、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、1,4−ジオキサン、テトラヒドロフラン、エチレングリコール、グリセリンを例示することができ、これらの有機溶媒のうち2種類以上を混合して用いてもよい。有機溶媒の割合は、本発明のオリゴヌクレオチド誘導体と標的核酸とで安定的に二本鎖核酸を形成できる点で、0%から20%の範囲が好ましい。
【0055】
本発明のオリゴヌクレオチド誘導体と標的核酸とで二本鎖核酸を形成させる温度は、形成される二本鎖核酸の融解温度(Tm値)以下であればよく、具体的には、一般的な標的核酸の場合、0℃から80℃の範囲の中から、形成される二本鎖核酸のヌクレオチド配列および二本鎖核酸を形成させる際の溶媒の組成を考慮の上、適宜設定すればよい。
【0056】
本発明のオリゴヌクレオチド誘導体の蛍光特性は、蛍光色素部位、すなわち2−(4−アミノスチリル)ベンゾチアゾリウム塩部位に依存し、400nmから600nmの非常に幅広い波長領域で励起可能であり、その際、525nmから675nmの波長領域の蛍光を生じる。なお、最大励起波長は540nm付近であり、最大蛍光波長は590nm付近である。
【0057】
本発明のオリゴヌクレオチド誘導体は、標的核酸の増幅反応を行なう際、増幅反応液中に共存させることができる。これにより、該標的核酸を増幅させながら本発明のオリゴヌクレオチド誘導体と二本鎖核酸を形成させることができ、該二本鎖核酸の形成に伴う本発明のオリゴヌクレオチド誘導体が有する蛍光特性の変化(蛍光強度値の変化)を経時的に測定することで、該標的核酸のリアルタイム検出が可能となる。標的核酸のリアルタイム検出方法の一例として、標的核酸増幅反応中のある時点で測定した反応液中の蛍光強度値を反応前の反応液中の蛍光強度値で割った値(蛍光増感率)が一定の値(しきい値)を超えた場合、標的核酸検出と判定する方法がある。
【0058】
また本発明のオリゴヌクレオチド誘導体を用いた標的核酸のリアルタイム検出は、密閉容器内にて一段階で行なうことができる。すなわち標的核酸のリアルタイム検出を行なう際、当該検出に必要な試薬(標的核酸増幅試薬および標的核酸を検出するためのオリゴヌクレオチドプローブ)の全てを容器内に収容し、標的核酸を含む試料を添加した後、当該容器を密閉することで、後から試薬を添加する操作や不要な試薬を除去する操作なしに、標的核酸をリアルタイムに検出(標的核酸の増幅および検出)することができる。
【0059】
本発明のオリゴヌクレオチド誘導体を用いた標的核酸のリアルタイム検出における、標的核酸の増幅方法に特に制限はなく、一例として特許文献4から6に記載された方法を採用することができる。さらに具体的には、標的RNAに対し相同的なヌクレオチド配列を有する第一のプライマーと、標的RNAに対し相補的なヌクレオチド配列を有する第二のプライマー(該プライマーのうちいずれか一方は、その5’末端にプロモーター配列が付加されている)からなるプライマーの組合せを用いて、
(1)逆転写酵素によりプロモーター配列を含む二本鎖DNAを生成し、
(2)当該二本鎖DNAを鋳型としてRNAポリメラーゼによりRNA逆転写産物を生成し、
(3)当該RNA転写産物が引き続き前記逆転写酵素によるDNA合成の鋳型となって前記二本鎖DNAを生成する、
RNA増幅反応させる際に、本発明のオリゴヌクレオチド誘導体を当該増幅反応系中に共存させ、当該誘導体が有する蛍光特性の変化(蛍光強度値の変化)を経時的に測定することで、標的RNAをリアルタイム検出することができる。
【0060】
本発明のオリゴヌクレオチド誘導体(第一のオリゴヌクレオチド誘導体)に、本発明のオリゴヌクレオチド誘導体とは蛍光波長の異なる蛍光色素を化学結合で結合したオリゴヌクレオチド誘導体(第二のオリゴヌクレオチド誘導体)をさらに添加することで、第一のオリゴヌクレオチド誘導体が有するヌクレオチド配列と相補的な配列を有する第一の標的核酸と、第二のオリゴヌクレオチド誘導体が有するヌクレオチド配列と相補的な配列を有する第二の標的核酸を同時に検出することができる。なお、第一および第二の標的核酸をリアルタイム検出することも可能であり、その具体例として、第一の標的RNAに対し相同的なヌクレオチド配列を有する第一のプライマーと第一の標的RNAに対し相補的なヌクレオチド配列を有する第二のプライマー(該プライマーのいずれか一方は、その5’末端にプロモーター配列が付加されている)からなるプライマーの組合せと、第二の標的RNAに対し相同的なヌクレオチド配列を有する第一のプライマーと第二の標的RNAに対し相補的なヌクレオチド配列を有する第二のプライマー(該プライマーのいずれか一方は、その5’末端にプロモーター配列が付加されている)からなるプライマーの組合せとを用いて、前記(1)から(3)に記載のRNA増幅反応させる際に、第一および第二のオリゴヌクレオチド誘導体を増幅反応系中に共存させ、各誘導体が有する蛍光特性の変化(蛍光強度値の変化)をそれぞれ経時的に測定することで、第一および第二の標的RNAを独立にリアルタイム検出することができる。
【0061】
第二のオリゴヌクレオチド誘導体において、化学結合で結合する蛍光色素に特に制限はなく、例えばオキサゾールイエローやチアゾールオレンジがあげられる。中でも検出感度が良い点で、オキサゾールイエローが蛍光色素として好ましい。
【実施例】
【0062】
次に本発明を実施例および参考例によってさらに詳細に説明するが、本発明はこれらに限定されるものではない。
【0063】
実施例1
【0064】
【化10】

一本鎖オリゴヌクレオチド(化合物6−1)(配列番号1)(4.4nmol)を0.1Mトリス−塩酸緩衝液(pH5.1)275μLに溶解し、1Mジチオスレイトール水溶液25μLを添加した。1時間後、反応液に(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4−メトキシベンゾチアゾリウム=ヨージドのDMF−0.1Mリン酸ナトリウム緩衝液(pH9.5)溶液(1mg/mL,500μL)を添加した。2時間後、反応液をn−ブタノールで洗浄し、得られた水層を濃縮した後、エタノールを添加し、−78℃で30分静置した。析出した固体を遠心濃縮により集めた。得られた沈殿物をHPLC(ODS−120T、東ソー株式会社製)により精製し、目的の化合物(化合物1−1)(2.4nmol)を得た。得られた化合物1−1のTOF−Mass測定を行なったところ、化合物1−1のカチオン部位の分子量:7557.41に対応するピークが7557.60に観測され、目的とするオリゴヌクレオチド誘導体の生成を確認した。
【0065】
実施例2
【0066】
【化11】

(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4−メトキシベンゾチアゾリウム=ヨージドの代わりに(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4,7−ジメトキシベンゾチアゾリウム=ヨージドを用いた以外は実施例1と同様の反応を行ない、目的とするオリゴヌクレオチド誘導体(化合物1−2)(1.9nmol)を得た。
【0067】
実施例3
【0068】
【化12】

(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4−メトキシベンゾチアゾリウム=ヨージドの代わりに(E)−2−[2−(4−ジメチルアミノ)スチリル]−3−(4−ヨードブチル)ベンゾチアゾリウム=ヨージドを用いた以外は実施例1と同様の反応を行ない、目的の化合物(化合物1−3)(0.9nmol)を得た。得られた化合物1−3のTOF−Mass測定を行なったところ、化合物1−3のカチオン部位の分子量:7527.40に対応するピークが7528.34に観測され、目的物とするオリゴヌクレオチド誘導体を確認した。
【0069】
実施例4
【0070】
【化13】

(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4−メトキシベンゾチアゾリウム=ヨージドの代わりに(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードプロピル)−4−メトキシベンゾチアゾリウム=ヨージドを用いた以外は実施例1と同様の反応を行ない、目的とするオリゴヌクレオチド誘導体(化合物1−4)(1.0nmol)を得た。
【0071】
実施例5
【0072】
【化14】

(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4−メトキシベンゾチアゾリウム=ヨージドの代わりに(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードペンチル)−4−メトキシベンゾチアゾリウム=ヨージドを用いた以外は実施例1と同様の反応を行ない、目的とするオリゴヌクレオチド誘導体(化合物1−5)(0.6nmol)を得た。
【0073】
実施例6
【0074】
【化15】

(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4−メトキシベンゾチアゾリウム=ヨージドの代わりに(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードヘキシル)−4−メトキシベンゾチアゾリウム=ヨージドを用いた以外は実施例1と同様の反応を行ない、目的とするオリゴヌクレオチド誘導体(化合物1−6)(0.4nmol)を得た。
【0075】
実施例7 標的核酸の検出
実施例1から3で合成した本発明のオリゴヌクレオチド誘導体(化合物1−1、化合物1−2、化合物1−3)を用いて、標的核酸(DNAまたはRNA)の検出を行なった。
【0076】
a)方法
以下の組成の測定条件で、本発明のオリゴヌクレオチド誘導体(化合物1−1、化合物1−2、化合物1−3)に、標的核酸D(DNA1、配列番号2)または標的核酸E(RNA1、配列番号3)をそれぞれ添加し、蛍光スペクトルを測定した。また同様に、一本鎖オリゴヌクレオチド(配列番号4)と3,8−ジアミノ−6−フェニルフェナントリジニウム塩を化学結合で結合することで得られるオリゴヌクレオチド誘導体(プローブA)に、標的核酸F(DNA2、配列番号5)または標的核酸G(RNA2、配列番号6)をそれぞれ添加し、同様の条件で蛍光スペクトルを測定し、これを本発明のオリゴヌクレオチド誘導体の比較対照とした。
【0077】
【化16】

標的核酸D(DNA1)の塩基配列:
5’−d(GTCGTATGGTATTATTTAGGGGC)−3’
(配列番号2)
標的核酸E(RNA1)の塩基配列:
5’−r(GUCGUAUGGUAUUAUUUAGGGGC)−3’
(配列番号3)
標的核酸F(DNA2)の塩基配列:
5’−d(CTGCTATCCACCCTCAAACA)−3’
(配列番号5)
標的核酸G(RNA2)の塩基配列:
5’−r(CUGCUAUCCACCCUCAAACA)−3’
(配列番号6)
測定溶液:
リン酸バッファー(pH7.4)(137mM NaCl、2.68mM KCl
、8.1mM Na2HPO4、1.47mM KH2PO4)
オリゴヌクレオチド誘導体の濃度:0.1μM
標的核酸の濃度:0.1μM
測定温度:43℃
b)結果
本発明のオリゴヌクレオチド誘導体(化合物1−1、化合物1−2、化合物1−3)および比較対照のオリゴヌクレオチド誘導体(プローブA)のみでの最大励起波長、最大蛍光波長および蛍光強度、ならびに標的核酸(DNAまたはRNA)添加時の各オリゴヌクレオチド誘導体の最大蛍光波長、蛍光強度、蛍光増感率(標的核酸添加時の蛍光強度値をオリゴヌクレオチド誘導体のみでの蛍光強度値で割った値)を表1に示す。
【0078】
【表1】

本発明のオリゴヌクレオチド誘導体は、該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸の添加により大きな蛍光増感を示すことがわかる。具体的には、本発明のオリゴヌクレオチド誘導体(化合物1−1、化合物1−2、化合物1−3)に該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸を添加したときの蛍光強度値は、本発明のオリゴヌクレオチド誘導体のみのときと比較し増大しており、その蛍光増感率は、標的核酸が一本鎖DNAのときでそれぞれ3.3倍、2.0倍、2.8倍であり、標的核酸が一本鎖RNAのときでそれぞれ2.4倍、2.5倍、3.1倍であった。また、本発明のオリゴヌクレオチド誘導体(化合物1−1、化合物1−2、化合物1−3)は、比較対照のオリゴヌクレオチド誘導体(プローブA)との比較で、蛍光強度値が著しく増大しており、蛍光増感率も増大していた。
【0079】
以上の結果より、本発明のオリゴヌクレオチド誘導体は、従来より核酸検出に用いられた蛍光色素である、3,8−ジアミノ−6−フェニルフェナントリジニウム塩をオリゴヌクレオチドと化学結合で結合して得られたオリゴヌクレオチド誘導体(プローブA)と比較し、オリゴヌクレオチド誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸の添加による、蛍光強度値の有意な増大および蛍光増感率の増加が確認できる。
【0080】
実施例8 核酸増幅反応系における標的核酸のリアルタイム検出
実施例1および3で合成した本発明のオリゴヌクレオチド誘導体(化合物1−1および1−3)を用いて、核酸増幅反応により増幅した標的核酸のリアルタイム検出を行なった。核酸増幅反応にはTRC法(特許文献7、特許文献8および非特許文献3)を用いた。
【0081】
a)方法
a−1)化学合成した標的核酸A(配列番号7)を希釈液(10mM Tris−HCl緩衝液(pH8.0)、1mM EDTA)を用いて、104コピー/5μLになるように希釈し、これを標的核酸試料Aとして用いた。
【0082】
標的核酸Aの塩基配列:
5’−d(ATCCCACACCGCTAAAGCGCATAGCCCCTAAA
TAATACCATACGACTACCTGCCCCTAAATAATACCAT
ACGATTGTATCTCCGAAGAGACCTTTCCG)−3’
(配列番号7)
a−2)以下の組成からなる反応液20μLを0.5mL容量PCRチューブ(Individual Dome Cap PCR Tube、SSI製)に分注し、これに前記の標的核酸試料Aまたは水を5μL添加した。
【0083】
反応液の組成:濃度は酵素液添加後(30μL中)の最終濃度
60mM Tris−HCl緩衝液(pH8.6)
17mM 塩化マグネシウム
100mM 塩化カリウム
1mM DTT
各0.25mM dATP、dCTP、dGTP、dTTP
各3.0mM ATP、CTP、GTP、UTP
3.6mM ITP
1μM 第一のプライマー(配列番号8)
1μM 第二のプライマー(配列番号9)
80nM オリゴヌクレオチド誘導体(化合物1−1または1−3)
10% DMSO
0.01% コール酸ナトリウム
第一のプライマーの配列:
5’−d(AATTCTAATACGACTCACTATAGGGAGACGGA
AAGGTCTCTTCGGACATAC)−3’
(配列番号8)
第二のプライマーの配列:
5’−d(CCCACACCGCTAAAGCGC)−3’
(配列番号9)
a−3)前記反応液を46℃で5分間保温後、あらかじめ43℃で2分間保温した以下の組成からなる酵素液5μLを添加した。
【0084】
酵素液の組成
2.0% ソルビトール
6.4U AMV逆転写酵素
142U T7 RNAポリメラーゼ
3.6μg 牛血清アルブミン
a−4)引き続きPCRチューブを直接測定可能な温調機能つき蛍光分光光度計を用いて46℃で反応させると同時に、反応溶液の蛍光強度(励起波長470nm、蛍光波長610nm)を経時的に10分間測定した。
【0085】
b)結果
化合物1−1または1−3を添加したときの、核酸増幅反応に伴う蛍光強度の経時変化を示した図をそれぞれ図1および2に示す。なお図1および2において、白四角は試料として水を添加したときの蛍光強度を、黒三角は試料として標的核酸試料Aを添加したときの蛍光強度を、それぞれ示している。いずれの化合物を用いた場合も、試料として水を添加したときは蛍光強度の変化が確認できなかったのに対し、標的核酸試料Aを添加したときは標的核酸の増幅に伴い蛍光強度が増大した。酵素液添加10分後の蛍光増感率(酵素液添加10分後の溶液の蛍光強度値を酵素液添加前の溶液の蛍光強度値で割った値)は化合物1−1を用いたときで3.1倍、化合物1−3を用いたときで3.3倍であり、標的核酸の有無により蛍光強度値の明確な差が確認できた。このことから、本発明のオリゴヌクレオチド誘導体は、核酸増幅反応により増幅された、該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸をリアルタイムに検出できることがわかる。
【0086】
実施例9 核酸増幅反応系における標的核酸のリアルタイム検出
実施例1、4、5および6で合成した本発明のオリゴヌクレオチド誘導体(化合物1−1、1−4、1−5および1−6)を用いて、核酸増幅反応により増幅した標的核酸のリアルタイム検出を行なった。核酸増幅反応には実施例8と同様、TRC法を用いた。
【0087】
a)方法
a−1)以下の組成からなる反応液20μLを0.5mL容量PCRチューブ(Individual Dome Cap PCR Tube、SSI製)に分注し、これに実施例8のa−1)で調製した標的核酸試料Aまたは水を5μL添加した。
【0088】
反応液の組成:濃度は酵素液添加後(30μL中)の最終濃度
60mM Tris−HCl緩衝液(pH8.6)
17mM 塩化マグネシウム
100mM 塩化カリウム
1mM DTT
各0.25mM dATP、dCTP、dGTP、dTTP
各3.0mM ATP、CTP、GTP、UTP
3.6mM ITP
1μM 第一のプライマー(配列番号8)
1μM 第二のプライマー(配列番号9)
80nM オリゴヌクレオチド誘導体(化合物1−1、1−4、1−5または1−
6)
13% DMSO
a−2)上記反応液を43℃で5分間保温後、あらかじめ43℃で2分間保温した、実施例8のa−3)に記載の酵素液5μLを添加した。
【0089】
a−3)引き続きPCRチューブを直接測定可能な温調機能つき蛍光分光光度計を用いて43℃で反応させると同時に、反応溶液の蛍光強度(励起波長470nm、蛍光波長610nm)を経時的に10分間測定した。
【0090】
b)結果
化合物1−1、1−4、1−5または1−6を添加したときの、核酸増幅反応に伴う蛍光強度の経時変化を示した図をそれぞれ図3から6に示す。なお図3から6において、白四角は試料として水を添加したときの蛍光強度を、黒三角は試料として標的核酸試料Aを添加したときの蛍光強度を、それぞれ示している。いずれの化合物を用いた場合も、試料として水を添加したときは蛍光強度の変化が確認できなかったのに対し、標的核酸試料Aを添加したときは標的核酸の増幅に伴い蛍光強度が増大した。酵素液添加10分後の蛍光増感率(酵素液添加10分後の溶液の蛍光強度値を酵素液添加前の溶液の蛍光強度値で割った値)は化合物1−1を用いたときで2.3倍、化合物1−4を用いたときで1.8倍、化合物1−5を用いたときで2.0倍、化合物1−6を用いたときで2.0倍であり、標的核酸の有無により蛍光強度値の明確な差が確認できた。このことから、本発明のオリゴヌクレオチド誘導体は、核酸増幅反応により増幅された、該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸をリアルタイムに検出できることがわかる。
【0091】
実施例10 核酸増幅反応系における2種類の標的核酸の同時検出
実施例1および3で合成した本発明のオリゴヌクレオチド誘導体(化合物1−1および1−3)と、オキサゾールイエローを化学結合で結合したオリゴヌクレオチド誘導体(プローブB、配列番号10)とを用いて、核酸増幅反応により増幅した二種類の標的核酸のリアルタイム検出を行なった。核酸増幅反応には実施例8と同様、TRC法を用いた。
【0092】
【化17】

a)方法
a−1)標的核酸試料として、下記3種類の標的核酸試料を用意した。
【0093】
(i)実施例8のa−1)で調製した標的核酸試料A、
(ii)標的核酸B(配列番号11)を希釈液(10mM Tris−HCl緩衝液(pH8.0)、1mM EDTA)を用いて、104コピー/5μLになるように希釈した標的核酸試料B、
標的核酸Bの塩基配列:
5’−(ATCCCACACCGCTAAAGCGCATAGGAAAAGCA
AAAGGATACGAGTACCTGGAAAAGCAAAAGGATACG
AGTTGTATCTCCGAAGAGACCTTTCCG)−3’
(配列番号11)
(iii)標的核酸A(配列番号7)と標的核酸B(配列番号11)を希釈液(10mM Tris−HCl緩衝液(pH8.0)、1mM EDTA)を用いて、各核酸の終濃度が104コピー/5μLになるように混合/希釈した標的核酸試料C
a−2)以下の組成の反応液20μLを0.5mL容量PCRチューブ(Indicidual Dome Cap PCR Tube、SSI製)に分注し、これに標的核酸試料A、標的核酸試料B、標的核酸試料Cまたは水を5μL添加した。
【0094】
反応液の組成:濃度は酵素液添加後(30μL中)の最終濃度
60mM Tris−HCl緩衝液(pH8.6)
17mM 塩化マグネシウム
100mM 塩化カリウム
1mM DTT
各0.25mM dATP、dCTP、dGTP、dTTP
各3mM ATP、CTP、GTP、UTP
3.6mM ITP
1μM 第一のプライマー(配列番号8)
1μM 第二のプライマー(配列番号9)
20nM オリゴヌクレオチド誘導体(プローブB)
80nM オリゴヌクレオチド誘導体(化合物1−1または1−3)
10% DMSO
0.01% コール酸ナトリウム
a−3)上記反応液を46℃で5分間保温後、あらかじめ40℃で2分間保温した、実施例8のa−3)に記載の酵素液5μLを添加した。
【0095】
a−4)引き続きPCRチューブを直接測定可能な温調機能つき蛍光分光光度計を用いて46℃で反応させると同時に、反応溶液の蛍光強度(励起波長:470nm、蛍光波長A:520nm、蛍光波長B:610nm)を経時的に10分間測定した。
【0096】
b)結果
化合物1−1およびプローブBを添加したときの核酸増幅反応に伴う蛍光強度の経時変化を示した図をそれぞれ図7(蛍光波長A)および8(蛍光波長B)に示し、化合物1−3およびプローブBを添加したときの核酸増幅反応に伴う蛍光強度の経時変化を示した図をそれぞれ図9(蛍光波長A)および10(蛍光波長B)に示す。なお図7から10において、白四角は試料として水を添加したときの蛍光強度を、黒三角は試料として標的核酸試料Aを添加したときの蛍光強度を、黒丸は試料として標的核酸試料Bを添加したときの蛍光強度を、×は試料として標的核酸試料Cを添加したときの蛍光強度を、それぞれ示している。いずれの場合も、試料として水を添加したときは蛍光強度の変化が確認できなかったのに対し、標的核酸試料Aを添加したときは標的核酸の増幅に伴い蛍光波長Bの蛍光強度のみが増大し、標的核酸試料Bを添加したときは標的核酸の増幅に伴い蛍光波長Aの蛍光強度のみが増大し、標的核酸試料Cを添加したときは標的核酸の増幅に伴い蛍光波長Aの蛍光強度と蛍光波長Bの蛍光強度がともに増大した。蛍光波長Aの蛍光強度はプローブBに対して相補的なヌクレオチド配列を有する標的核酸Bに由来する蛍光強度であり、蛍光波長Bの蛍光強度は本発明のオリゴヌクレオチド誘導体に対して相補的なヌクレオチド配列を有する標的核酸Aに由来する蛍光強度である。各オリゴヌクレオチド誘導体(本発明のオリゴヌクレオチド誘導体およびプローブB)が有するヌクレオチド配列と相補的な配列を有する標的核酸(標的核酸Aおよび標的核酸B)の有無により、各蛍光波長(蛍光波長Aおよび蛍光波長B)における蛍光強度値に明確な差がみられたことから、本発明のオリゴヌクレオチド誘導体は、該誘導体と蛍光波長が異なる蛍光色素を化学結合で結合したオリゴヌクレオチド誘導体と併用することで、核酸増幅反応にて増幅された二種類の標的核酸を、それぞれ独立してリアルタイム検出できることが示された。
【0097】
参考例1
【0098】
【化18】

アルゴン雰囲気下、3−(3−ヨードプロピル)−4−メトキシ−2−メチルベンゾチアゾリウム=ヨージド(35.9mg,0.076mmol)、4−(ジメチルアミノ)ベンズアルデヒド(14.0mg,0.094mmol)と無水酢酸(1.0mL)の混合物を、110℃で一晩撹拌した。反応混合物にトルエン(5.0mL)を加えて減圧濃縮を行ない、得られた粗生成物をシリカゲルカラムクロマトグラフィー[クロロホルム−メタノール(10:1)]で精製することにより、(E)−2−[4−(ジメチルアミノ)スチリル]−3−(3−ヨードプロピル)−4−メトキシベンゾチアゾリウム=ヨージド(16.7mg,収率36%)を黒紫色の固体として得た。
1H−NMR(400MHz,DMSO−d6):δ 8.04(d,J=15.3Hz,1H),7.91(d,J=9.6Hz,2H),7.84(d,J=8.1Hz,1H),7.62(t,J=8.1Hz,1H),7.52(d,J=15.3Hz,1H),7.42(d,J=8.1Hz,1H),6.89(d,J=9.6Hz,2H),5.10−4.90(m,2H),4.09(s,3H),3.47(t,J=7.4Hz,2H),3.12(s,6H),2.41−2.37(m,2H).
参考例2
【0099】
【化19】

アルゴン雰囲気下、3−(4−ヨードブチル)−4−メトキシ−2−メチルベンゾチアゾリウム=ヨージド(1.36g,2.78mmol)、4−(ジメチルアミノ)ベンズアルデヒド(416.6mg,2.79mmol)と無水酢酸(12.0mL)の混合物を、110℃で一晩撹拌した。反応混合物にトルエン(5.0mL)を加えて減圧濃縮を行ない、得られた粗生成物をシリカゲルカラムクロマトグラフィー[クロロホルム−メタノール(10:1)]で精製することにより、(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4−メトキシベンゾチアゾリウム=ヨージド(1.41g,収率82%)を紫色の固体として得た。
1H−NMR(400MHz,DMSO−d6):δ 8.07(d,J=15.2Hz,1H),7.91(d,J=9.0Hz,2H),7.83(d,J=8.1Hz,1H),7.62(d,J=8.1Hz,1H),7.54(d,J=15.2Hz,1H),7.39(d,J=8.1Hz,1H),6.84(d,J=9.0Hz,2H)5.10−5.00(m,2H),4.07(s,3H),3.40−3.35(m,2H),3.11(s,6H),2.00−1.90(m,4H).
参考例3
【0100】
【化20】

アルゴン雰囲気下、3−(5−ヨードペンチル)−4−メトキシ−2−メチルベンゾチアゾリウム=ヨージド(39.6mg,0.073mmol)、4−(ジメチルアミノ)ベンズアルデヒド(20.2mg,0.14mmol)と無水酢酸(1.0mL)の混合物を、110℃で一晩撹拌した。反応混合物にトルエン(2.0mL)を加えて減圧濃縮を行ない、得られた粗生成物をシリカゲルカラムクロマトグラフィー[クロロホルム−メタノール(10:1)]で精製することにより、(E)−2−[4−(ジメチルアミノ)スチリル]−3−(5−ヨードペンチル)−4−メトキシベンゾチアゾリウム=ヨージド(11.2mg,収率24%)を黒紫色の固体として得た。
1H−NMR(400MHz,DMSO−d6):δ 8.06(d,J=15.3Hz,1H),7.91(d,J=9.2Hz,2H),7.83(d,J=8.2Hz,1H),7.63(t,J=8.2Hz,1H),7.56(d,J=15.3Hz,1H),7.39(d,J=8.2Hz,1H),6.83(d,J=9.2Hz,2H),4.96−4.93(m,2H),4.06(s,3H),3.30−3.29(m,2H),3.11(s,6H),1.90−1.80(m,4H),1.60−1.50(m,2H).
参考例4
【0101】
【化21】

アルゴン雰囲気下、3−(6−ヨードヘキシル)−4−メトキシ−2−メチルベンゾチアゾリウム=ヨージド(38.6mg,0.075mmol)、4−(ジメチルアミノ)ベンズアルデヒド(16.6mg,0.11mmol)と無水酢酸(1.0mL)の混合物を、110℃で一晩撹拌した。反応混合物にトルエン(2.0mL)を加えて減圧濃縮を行ない、得られた粗生成物をシリカゲルカラムクロマトグラフィー[クロロホルム−メタノール(10:1)]で精製することにより、(E)−2−[4−(ジメチルアミノ)スチリル]−3−(6−ヨードヘキシル)−4−メトキシベンゾチアゾリウム=ヨージド(12.9mg,収率27%)を黒紫色の固体として得た。
1H−NMR(400MHz,DMSO−d6):δ 8.03(d,J=15.3Hz,1H),7.91(d,J=9.0Hz,2H),7.83(d,J=8.1Hz,1H),7.62(t,J=8.1Hz,1H),7.56(d,J=15.3Hz,1H),7.40(d,J=8.1Hz,1H),6.85(d,J=9.0Hz,2H),4.94(t,J=8.0Hz,2H),4.07(s,3H),3.29(t,J=6.8Hz,2H),3.12(s,6H),1.90−1.70(m,4H),1.52−1.40(m,4H).
参考例5
【0102】
【化22】

アルゴン雰囲気下、3−(4−ヨードブチル)−4,7−ジメトキシ−2−メチルベンゾチアゾリウム=ヨージド(201mg,0.39mmol)と4−(ジメチルアミノ)ベンズアルデヒド(59.0mg,0.39mmol)の無水酢酸(1.0mL)懸濁液を、110℃で一晩撹拌を行なった。反応混合物を室温に戻した後減圧濃縮を行ない、得られた粗成生物をシリカゲルカラムクロマトグラフィー[クロロホルム−メタノール(10:1)]により精製することで、(E)−2−[4−(ジメチルアミノ)スチリル]−3−(4−ヨードブチル)−4,7−ジメトキシベンゾチアゾリウム=ヨージド(225mg,収率89%)を暗赤色粉状として得た。
1H−NMR(400MHz,DMSO−d6)1H−NMR(400MHz,CDCl3):δ 8.13(d,J=15.2Hz,1H),7.90(d,J=9.0Hz,2H),7.55(d,J=15.2Hz,1H),7.34(d,J=9.0Hz,1H),7.22(d,J=9.0Hz,1H),6.84(d,J=9.0Hz,2H),4.94(m,2H),4.00(s,3H),3.99(s,3H),3.38−3.35(m,2H),3.11(s,6H),1.96−1.80(m,4H).
参考例6
【0103】
【化23】

アルゴン雰囲気下、3−(4−ヨードブチル)−2−メチルベンゾチアゾリウム=ヨージド(103.4mg,0.23mmol)と4−(ジメチルアミノ)ベンズアルデヒド(40.2mg,0.27mmol)の無水酢酸(2.0mL)溶液を、110℃で一晩撹拌を行なった。反応混合物を室温に戻した後減圧濃縮を行ない、得られた粗成生物をシリカゲルカラムクロマトグラフィー[クロロホルム−メタノール(10:1)]により精製することで、(E)−2−[2−(4−ジメチルアミノ)スチリル]−3−(4−ヨードブチル)ベンゾチアゾリウム=ヨージド(46.8mg,収率35%)を紫色の固体として得た。
1H−NMR(400MHz,DMSO−d6):δ 8.31(d,J=8.1Hz,1H),8.16(d,J=8.1Hz,1H),8.10(d,J=15.2Hz,1H),7.93(d,J=9.1Hz,2H),7.78(t,J=7.3Hz,1H),7.68(t,J=7.3Hz,1H),7.60(d,J=15.2Hz,1H),6.86(d,J=9.1Hz,2H),4.83(t,J=7.1Hz,2H),3.36(t,J=6.6Hz,2H),3.12(s,6H),1.96−1.91(m,4H).
【特許請求の範囲】
【請求項1】
一般式(1a)
【化1】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、R7およびR8は各々独立に9−アデニル基、9−グアニル基、1−シトシニル基または1−チミニル基を表し、X−は対アニオンを表す。lは1から8の整数を表し、mは1から4の整数を表し、nは1から4の整数を表す。B1はアデニン、グアニン、シトシンまたはチミンを表し、qは0から30の整数を表し、qが2以上の時、複数のB1は同一または相異なっていてもよい。B2はアデニン、グアニン、シトシンまたはチミンを表し、rは0から30の整数を表し、rが2以上の時、複数のB2は同一または相異なっていてもよい。ただし、qとrの和は15以上30以下である。Zは水酸基またはアミノ基を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体。
【請求項2】
一般式(1a)が、下記一般式(1c)
【化2】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、R7−1およびR8−1は各々独立に9−アデニル基または1−チミニル基を表し、X−は対アニオンを表し、lは1から8の整数を表す。B3はアデニン、グアニン、シトシンまたはチミンを表し、sは0から27の整数を表し、sが2以上の時、複数のB3は同一または相異なっていてもよい。B6はアデニン、グアニン、シトシンまたはチミンを表し、tは0から27の整数を表し、tが2以上の時、複数のB6は同一または相異なっていてもよい。ただし、sとtの和は9以上24以下である。B4は同一または相異なってアデニンまたはチミンを表し、B5は同一または相異なってアデニンまたはチミンを表す。Zは水酸基またはアミノ基を表す。)で表される、請求項1に記載のオリゴヌクレオチド誘導体。
【請求項3】
R6−1、R6−2およびR6−3が水素原子であり、R6−4がメトキシ基である、請求項1または2に記載のオリゴヌクレオチド誘導体。
【請求項4】
R6−1、R6−2、R6−3およびR6−4が水素原子である、請求項1または2に記載のオリゴヌクレオチド誘導体。
【請求項5】
R6−1およびR6−4がメトキシ基であり、R6−2およびR6−3が水素原子である、請求項1または2に記載のオリゴヌクレオチド誘導体。
【請求項6】
一般式(1a)が、下記一般式(1b)
【化3】

(式中、R6−1およびR6−4は各々独立に水素原子またはメトキシ基を表し、X−は対アニオンを表し、lは1から8の整数を表し、Zは水酸基またはアミノ基を表す。)で表される請求項1に記載のオリゴヌクレオチド誘導体。
【請求項7】
lが4である、請求項6に記載のオリゴヌクレオチド誘導体。
【請求項8】
R6−1が水素原子で、R6−4がメトキシ基である、請求項6または7に記載のオリゴヌクレオチド誘導体。
【請求項9】
R6−1およびR6−4が水素原子である、請求項6または7に記載のオリゴヌクレオチド誘導体。
【請求項10】
R6−1およびR6−4がメトキシ基である、請求項6または7に記載のオリゴヌクレオチド誘導体。
【請求項11】
一般式(2d)
【化4】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、Yはヨウ素原子、臭素原子または塩素原子を表し、X1はハロゲン原子、炭素数1から8のアルコキシスルホニルオキシ基、メチルスルホニルオキシ基またはトリフルオロメチルスルホニルオキシ基を表し、lは1から8の整数を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を、一般式(6)
【化5】

(式中、R7およびR8は各々独立に9−アデニル基、9−グアニル基、1−シトシニル基または1−チミニル基を表し、mは1から4の整数を表し、nは1から4の整数を表す。B1はアデニン、グアニン、シトシンまたはチミンを表し、qは0から30の整数を表し、qが2以上の時、複数のB1は同一または相異なっていてもよい。B2はアデニン、グアニン、シトシンまたはチミンを表し、rは0から30の整数を表し、rが2以上の時、複数のB2は同一または相異なっていてもよい。ただし、qとrの和は15以上30以下である。Zは水酸基またはアミノ基を表す。)で表されるオリゴヌクレオチド誘導体と、還元剤の存在下反応させることを特徴とする、一般式(1a)
【化6】

(式中、R6−1、R6−2、R6−3、R6−4、R7、R8、l、m、n、q、r、Z、B1およびB2は前記と同じ意味を表し、X−は対アニオンを表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体の製造方法。
【請求項12】
請求項1から10のいずれかに記載のオリゴヌクレオチド誘導体と、該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸とで二本鎖核酸を形成させ、
該二本鎖核酸の形成に伴う前記オリゴヌクレオチド誘導体の蛍光特性の変化を測定する、標的核酸の検出方法。
【請求項13】
請求項1から10のいずれかに記載の第一のオリゴヌクレオチド誘導体と、該誘導体が有するヌクレオチド配列と相補的な配列を有する第一の標的核酸とで二本鎖核酸を形成させるとともに、
一般式(2d)
【化7】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、Yはヨウ素原子、臭素原子または塩素原子を表し、X1はハロゲン原子、炭素数1から8のアルコキシスルホニルオキシ基、メチルスルホニルオキシ基またはトリフルオロメチルスルホニルオキシ基を表し、lは1から8の整数を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩とは異なる蛍光波長を示す蛍光色素を化学結合で結合した第二のオリゴヌクレオチド誘導体と、該誘導体が有するヌクレオチド配列と相補的な配列を有する第二の標的核酸とで二本鎖核酸を形成させ、
前記二本鎖核酸の形成に伴う第一および第二のオリゴヌクレオチド誘導体の蛍光特性の変化を測定する、
第一および第二の標的核酸の検出方法。
【請求項14】
第二のオリゴヌクレオチド誘導体における、化学結合で結合した蛍光色素がオキサゾールイエローである、請求項13に記載の方法。
【請求項15】
オリゴヌクレオチド誘導体と、該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸とで二本鎖核酸を形成させる際、該標的核酸を増幅させながら二本鎖核酸を形成させ、前記オリゴヌクレオチド誘導体が有する蛍光特性の変化を経時的に測定する、請求項12から14のいずれかに記載の方法。
【請求項1】
一般式(1a)
【化1】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、R7およびR8は各々独立に9−アデニル基、9−グアニル基、1−シトシニル基または1−チミニル基を表し、X−は対アニオンを表す。lは1から8の整数を表し、mは1から4の整数を表し、nは1から4の整数を表す。B1はアデニン、グアニン、シトシンまたはチミンを表し、qは0から30の整数を表し、qが2以上の時、複数のB1は同一または相異なっていてもよい。B2はアデニン、グアニン、シトシンまたはチミンを表し、rは0から30の整数を表し、rが2以上の時、複数のB2は同一または相異なっていてもよい。ただし、qとrの和は15以上30以下である。Zは水酸基またはアミノ基を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体。
【請求項2】
一般式(1a)が、下記一般式(1c)
【化2】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、R7−1およびR8−1は各々独立に9−アデニル基または1−チミニル基を表し、X−は対アニオンを表し、lは1から8の整数を表す。B3はアデニン、グアニン、シトシンまたはチミンを表し、sは0から27の整数を表し、sが2以上の時、複数のB3は同一または相異なっていてもよい。B6はアデニン、グアニン、シトシンまたはチミンを表し、tは0から27の整数を表し、tが2以上の時、複数のB6は同一または相異なっていてもよい。ただし、sとtの和は9以上24以下である。B4は同一または相異なってアデニンまたはチミンを表し、B5は同一または相異なってアデニンまたはチミンを表す。Zは水酸基またはアミノ基を表す。)で表される、請求項1に記載のオリゴヌクレオチド誘導体。
【請求項3】
R6−1、R6−2およびR6−3が水素原子であり、R6−4がメトキシ基である、請求項1または2に記載のオリゴヌクレオチド誘導体。
【請求項4】
R6−1、R6−2、R6−3およびR6−4が水素原子である、請求項1または2に記載のオリゴヌクレオチド誘導体。
【請求項5】
R6−1およびR6−4がメトキシ基であり、R6−2およびR6−3が水素原子である、請求項1または2に記載のオリゴヌクレオチド誘導体。
【請求項6】
一般式(1a)が、下記一般式(1b)
【化3】

(式中、R6−1およびR6−4は各々独立に水素原子またはメトキシ基を表し、X−は対アニオンを表し、lは1から8の整数を表し、Zは水酸基またはアミノ基を表す。)で表される請求項1に記載のオリゴヌクレオチド誘導体。
【請求項7】
lが4である、請求項6に記載のオリゴヌクレオチド誘導体。
【請求項8】
R6−1が水素原子で、R6−4がメトキシ基である、請求項6または7に記載のオリゴヌクレオチド誘導体。
【請求項9】
R6−1およびR6−4が水素原子である、請求項6または7に記載のオリゴヌクレオチド誘導体。
【請求項10】
R6−1およびR6−4がメトキシ基である、請求項6または7に記載のオリゴヌクレオチド誘導体。
【請求項11】
一般式(2d)
【化4】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、Yはヨウ素原子、臭素原子または塩素原子を表し、X1はハロゲン原子、炭素数1から8のアルコキシスルホニルオキシ基、メチルスルホニルオキシ基またはトリフルオロメチルスルホニルオキシ基を表し、lは1から8の整数を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を、一般式(6)
【化5】

(式中、R7およびR8は各々独立に9−アデニル基、9−グアニル基、1−シトシニル基または1−チミニル基を表し、mは1から4の整数を表し、nは1から4の整数を表す。B1はアデニン、グアニン、シトシンまたはチミンを表し、qは0から30の整数を表し、qが2以上の時、複数のB1は同一または相異なっていてもよい。B2はアデニン、グアニン、シトシンまたはチミンを表し、rは0から30の整数を表し、rが2以上の時、複数のB2は同一または相異なっていてもよい。ただし、qとrの和は15以上30以下である。Zは水酸基またはアミノ基を表す。)で表されるオリゴヌクレオチド誘導体と、還元剤の存在下反応させることを特徴とする、一般式(1a)
【化6】

(式中、R6−1、R6−2、R6−3、R6−4、R7、R8、l、m、n、q、r、Z、B1およびB2は前記と同じ意味を表し、X−は対アニオンを表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩を化学結合で結合したオリゴヌクレオチド誘導体の製造方法。
【請求項12】
請求項1から10のいずれかに記載のオリゴヌクレオチド誘導体と、該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸とで二本鎖核酸を形成させ、
該二本鎖核酸の形成に伴う前記オリゴヌクレオチド誘導体の蛍光特性の変化を測定する、標的核酸の検出方法。
【請求項13】
請求項1から10のいずれかに記載の第一のオリゴヌクレオチド誘導体と、該誘導体が有するヌクレオチド配列と相補的な配列を有する第一の標的核酸とで二本鎖核酸を形成させるとともに、
一般式(2d)
【化7】

(式中、R6−1、R6−2、R6−3およびR6−4は各々独立に水素原子またはメトキシ基を表し、Yはヨウ素原子、臭素原子または塩素原子を表し、X1はハロゲン原子、炭素数1から8のアルコキシスルホニルオキシ基、メチルスルホニルオキシ基またはトリフルオロメチルスルホニルオキシ基を表し、lは1から8の整数を表す。)で表される2−(4−アミノスチリル)ベンゾチアゾリウム塩とは異なる蛍光波長を示す蛍光色素を化学結合で結合した第二のオリゴヌクレオチド誘導体と、該誘導体が有するヌクレオチド配列と相補的な配列を有する第二の標的核酸とで二本鎖核酸を形成させ、
前記二本鎖核酸の形成に伴う第一および第二のオリゴヌクレオチド誘導体の蛍光特性の変化を測定する、
第一および第二の標的核酸の検出方法。
【請求項14】
第二のオリゴヌクレオチド誘導体における、化学結合で結合した蛍光色素がオキサゾールイエローである、請求項13に記載の方法。
【請求項15】
オリゴヌクレオチド誘導体と、該誘導体が有するヌクレオチド配列と相補的な配列を有する標的核酸とで二本鎖核酸を形成させる際、該標的核酸を増幅させながら二本鎖核酸を形成させ、前記オリゴヌクレオチド誘導体が有する蛍光特性の変化を経時的に測定する、請求項12から14のいずれかに記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2013−46586(P2013−46586A)
【公開日】平成25年3月7日(2013.3.7)
【国際特許分類】
【出願番号】特願2011−186337(P2011−186337)
【出願日】平成23年8月29日(2011.8.29)
【出願人】(000003300)東ソー株式会社 (1,901)
【出願人】(000173762)公益財団法人相模中央化学研究所 (151)
【Fターム(参考)】
【公開日】平成25年3月7日(2013.3.7)
【国際特許分類】
【出願日】平成23年8月29日(2011.8.29)
【出願人】(000003300)東ソー株式会社 (1,901)
【出願人】(000173762)公益財団法人相模中央化学研究所 (151)
【Fターム(参考)】
[ Back to top ]

