3−シアノ−4−(4−フェニル−ピペリジン−1−イル)−ピリジン−2−オン誘導体
【課題】
【解決手段】本発明は新規な化合物、特に、新規な式(I)のピリジノン誘導体(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物に関する。
【化59】

式中の全てのラジカルは明細書および請求項において定義されている。本発明の化合物は、代謝型グルタミン酸受容体サブタイプ2(「mGluR2」)のポジティブアロステリックモジュレーターであり、グルタミン酸機能障害と関連する神経障害および精神障害ならびに代謝型受容体のmGluR2サブタイプが関与する疾患の治療または予防に有用である。特に、このような疾患は、不安、統合失調症、片頭痛、うつ病およびてんかんからなる群から選ばれる中枢神経系障害である。本発明はまた、医薬組成物、このような化合物およびこのような組成物の調製方法、ならびにmGluR2が関与するこのような疾患の予防または治療のためのこのような化合物の使用に関する。
【解決手段】本発明は新規な化合物、特に、新規な式(I)のピリジノン誘導体(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物に関する。
【化59】

式中の全てのラジカルは明細書および請求項において定義されている。本発明の化合物は、代謝型グルタミン酸受容体サブタイプ2(「mGluR2」)のポジティブアロステリックモジュレーターであり、グルタミン酸機能障害と関連する神経障害および精神障害ならびに代謝型受容体のmGluR2サブタイプが関与する疾患の治療または予防に有用である。特に、このような疾患は、不安、統合失調症、片頭痛、うつ病およびてんかんからなる群から選ばれる中枢神経系障害である。本発明はまた、医薬組成物、このような化合物およびこのような組成物の調製方法、ならびにmGluR2が関与するこのような疾患の予防または治療のためのこのような化合物の使用に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、代謝型グルタミン酸受容体サブタイプ2(「mGluR2」)のポジティブアロステリックモジュレーターであり、かつグルタミン酸機能障害と関連する神経および精神障害ならびに代謝型受容体のmGluR2サブタイプが関与する疾患の治療または予防に有用である新規なピリジン−2−オン誘導体に関する。本発明はまた、このような化合物を含む医薬組成物、このような化合物およびこのような組成物の調製方法、ならびにmGluR2が関与する神経障害および精神障害および疾病の予防または治療のためのこのような化合物の使用に関する。
【背景技術】
【0002】
グルタミン酸塩(エステル)は、哺乳類の中枢神経系における主要なアミノ酸神経伝達物質である。グルタミン酸塩(エステル)は、学習および記憶だけでなく、知覚、シナプス可塑性の発達、運動制御、呼吸、および心臓血管機能の調節などの多くの生理機能に大きな役割を果たす。さらにグルタミン酸塩(エステル)は、グルタミン酸神経伝達の不均衡が存在する様々な神経疾患および精神病の中核をなす。
【0003】
グルタミン酸塩(エステル)は、イオンチャネル型グルタミン酸受容体チャネル(iGluR)ならびに急速な興奮性伝達に関与するNMDA受容体、AMPA受容体およびカイニン酸受容体の活性化を通じてシナプス神経伝達を仲介する。
【0004】
加えて、グルタミン酸塩(エステル)は、シナプス効果の微調整に寄与するさらに修飾的な役割を有する代謝型グルタミン酸受容体(mGluR)を活性化する。
【0005】
グルタミン酸塩(エステル)は、本明細書ではオルソステリック結合部位と呼ばれる受容体の大きな細胞外N末端ドメインへ結合することによってmGluRを活性化する。この結合は受容体における構造変化を引き起こし、Gタンパク質および細胞内シグナル伝達経路の活性化をもたらす。
【0006】
mGluR2サブタイプは、Gαiタンパク質の活性化を介してアデニル酸シクラーゼと負の結合(negatively coupled)をし、その活性化はシナプスにおけるグルタミン酸放出の阻害を引き起こす。中枢神経系(CNS)において、mGluR2受容体は主に、皮質、視床領域、副嗅球、海馬、扁桃、尾状核被殻および側坐核にわたって豊富にある。
【0007】
mGluR2の活性化は不安障害の治療に効果的であることが臨床試験で示された。さらに、様々な動物モデルにおいてmGluR2の活性化が有効なことが示され、したがって、統合失調症、てんかん、中毒/薬物依存症、パーキンソン病、疼痛、睡眠障害およびハンチングトン病の新規な治療手段である可能性があることを示している。
【0008】
現在まで、mGluRを標的とする利用可能な薬理学的手段のほとんどは、mGluRファミリーのいくらかのメンバーを活性化するオルソステリックリガンド(グルタミン酸塩(エステル)の構造的アナログであるので)である。
【0009】
mGluRにおいて作用する選択的化合物を開発するための新規な経路としては、高度に保存されたオルソステリック結合部位とは異なる部位に結合することによって受容体を修飾するアロステリック機構を通して作用する化合物を同定することである。
【0010】
mGluRのポジティブアロステリックモジュレーターは、新規な薬理学的存在として最近になって出現し、この魅力的な選択肢を提供している。種々の化合物がmGluRのポジティブアロステリックモジュレーターとして記載されている。
【0011】
WO2004/092135(NPS社およびアストラゼネカ社)(特許文献1)、WO2004/018386(特許文献2)、WO2006/014918(特許文献3)およびWO2006/015158(メルク社)(特許文献4)、WO2001/56990(イーライリリー社)(特許文献5)ならびにWO2006/030032(アデックス社およびヤンセンファーマ社)(特許文献6)は、それぞれフェニルスルホンアミド、アセトフェノン、インダノン、ピリジルメチルスルホンアミドおよびピリジノン誘導体をmGluR2のポジティブアロステリックモジュレーターとして記載している。具体的に開示された化合物はいずれも本発明の化合物とは構造的に関連していない。
【0012】
WO2007/104783(特許文献7)は、代謝型受容体サブタイプ2(「mGluR2」)のポジティブアロステリックモジュレーターである1,4−二置換3−シアノ−ピリドン誘導体を記載している。
【0013】
このような化合物は、自身は受容体を活性化しないことが示され、むしろ、このような化合物は、受容体のみでは最小応答が誘発されるグルタミン酸塩(エステル)濃度に対して最大応答を受容体に奏させることができる。変異解析では、mGluR2のポジティブアロステリックモジュレーターの結合はオルソステリック部位では起こらず、むしろ受容体の7回膜貫通型領域内に位置するアロステリック部位で起きることがはっきりと示された。
【0014】
動物データは、mGluR2のポジティブアロステリックモジュレーターが不安症および精神病モデルにおいて、オルソステリックアゴニストで得られたものに類似する効果があることを示唆している。mGluR2のアロステリックモジュレーターは、恐怖増強的驚愕、およびストレス誘発性異常高熱の不安症モデルにおいて活性があることが示された。さらに、このような化合物は、ケタミンまたはアンフェタミン誘発性の運動過剰の改善ならびにアンフェタミン誘発性の聴覚性驚愕効果のプレパルス阻害の破壊を伴う統合失調症モデルの改善において活性があることが示された(「ジャーナル・オブ・ファーマコロジー・アンド・エクスペリメンタルセラピーズ(J. Pharmacol. Exp. Ther.)」2006年、318、173〜185(非特許文献1);「サイコファーマコロジー(Psychopharmacology)」2005年、179、271〜283)(非特許文献2)。
【0015】
最近の動物研究はさらに、代謝型グルタミン酸受容体サブタイプ2であるビフェニル−インダノン(BINA)の選択的なポジティブアロステリックモジュレーターは幻覚剤の精神病モデルをブロックすることを示し、これは統合失調症におけるグルタミン酸作動性機能障害の治療のためのmGluR2受容体を標的化する戦略をサポートするものである(「モレキュラーファーマコロジー(Mol. Pharmacol.)」2007年、72、477〜484(非特許文献3))。
【先行技術文献】
【特許文献】
【0016】
【特許文献1】国際公開第2004/092135号パンフレット
【特許文献2】国際公開第2004/018386号パンフレット
【特許文献3】国際公開第2006/014918号パンフレット
【特許文献4】国際公開第2006/015158号パンフレット
【特許文献5】国際公開第2001/56990号パンフレット
【特許文献6】国際公開第2006/030032号パンフレット
【特許文献7】国際公開第2007/104783号パンフレット
【非特許文献】
【0017】
【非特許文献1】ジャーナル・オブ・ファーマコロジー・アンド・エクスペリメンタルセラピーズ(J. Pharmacol. Exp. Ther.)、2006年、318、173〜185.
【非特許文献2】サイコファーマコロジー(Psychopharmacology)、2005年、179、271〜283.
【非特許文献3】モレキュラーファーマコロジー(Mol. Pharmacol.)、2007年、72、477〜484
【発明の概要】
【発明が解決しようとする課題】
【0018】
ポジティブアロステリックモジュレーターは、グルタミン酸塩(エステル)応答を増強できるが、LY379268またはDCG−IVなどのオルソステリックmGluR2アゴニストに対する応答を増強することも示されている。これらのデータは、mGluR2が関連する上記の神経障害および精神障害を治療するための、mGluR2のポジティブアロステリックモジュレーターとmGluR2のオルソステリックアゴニストとの組み合わせを用いるさらに別の新規な治療手法の根拠を示す。
【課題を解決するための手段】
【0019】
本発明の化合物は、3位がシアノそして4位がピペリジン−1−イル(このピペリジン−1−イルの4位はフェニルで置換されている)で置換された中心にあるピリジン−2−オン部分を特徴とする。本発明の化合物は、強力なmGluR2のポジティブアロステリックモジュレーターである。
【0020】
発明の説明
本発明は、代謝型グルタミン酸受容体2修飾活性を有する化合物に関する。本発明は式(I)の化合物(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物を提供し、
【0021】
【化1】

【0022】
式中、R1はC4-6アルキル、またはC3-7シクロアルキルで置換されたC1-3アルキルであり;
R2は水素;フルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシである。
【発明を実施するための形態】
【0023】
本発明はまた、ヒトを含む哺乳類における症状の治療または予防(特に治療)用薬剤の製造のための式(I)の化合物あるいはその任意のサブグループの使用に関し、この症状の治療または予防は、mGluR2のアロステリックモジュレーター(特にポジティブアロステリックモジュレーター)の神経修飾効果により作用されるかまたは促進される。
【0024】
本発明の一実施形態は、式(I)の化合物(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物であり、
【0025】
【化2】

【0026】
式中、R1はC4-6アルキル、またはC3-7シクロアルキルで置換されたC1-3アルキルであり、
R2は水素;フルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシであるが、但し上記化合物は下記のもの以外である。
【0027】
【化3】

【0028】
および
【0029】
【化4】

【0030】
本発明の一実施形態は、R1がC4-6アルキル、特にC4-5アルキル、例えば、1−ブチル、2−メチル−1−プロピル、3−メチル−1−ブチル、特に1−ブチルである式(I)の化合物である。
【0031】
本発明の一実施形態は、R1がC3-7シクロアルキルで置換されたC1-3アルキル、特にシクロプロピルメチルまたは2−(シクロプロピル)−1−エチルである式(I)の化合物である。
【0032】
本発明の一実施形態は、R2が水素である、実施形態として上記された式(I)の化合物またはその任意のサブグループである。
【0033】
本発明の一実施形態は、R2がフルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシである、実施形態として上記された式(I)の化合物または、可能な場合は常に、その任意のサブグループである。
【0034】
本発明の一実施形態は、R2が水素;フルオロ;またはフルオロで置換されたC1-4アルキルオキシであり;特にR2がフルオロまたはフルオロで置換されたC1-4アルキルオキシである、実施形態として上記された式(I)の化合物または、可能な場合は常に、その任意のサブグループである。
【0035】
本発明の一実施形態は、R2がフルオロである、実施形態として上記された式(I)の化合物またはその任意のサブグループである。
【0036】
本発明の一実施形態は、R2がヒドロキシルで置換されたC1-4アルキル、特にR2がヒドロキシルで置換されたメチルである、実施形態として上記された式(I)の化合物または、可能な場合は常に、その任意のサブグループである。
【0037】
本発明の一実施形態は、R2がフルオロで置換されたC1-4アルキル、特にR2がフルオロで置換されたメチルである、実施形態として上記された式(I)の化合物または、可能な場合は常に、その任意のサブグループである。
【0038】
本発明の一実施形態は、R2がフルオロで置換されたC1-4アルキルオキシ、特にR2がフルオロで置換されたエチルオキシである、実施形態として上記された式(I)の化合物または、可能な場合は常に、その任意のサブグループである。
【0039】
本発明の一実施形態は、R1がC4-6アルキル、特に1−ブチルもしくは3−メチル−1−ブチル;またはC3-7シクロアルキルで置換されたC1-3アルキル、特にシクロプロピルメチルであり;
R2が水素;フルオロ;ヒドロキシルで置換されたC1-4アルキル、特にヒドロキシルで置換されたメチル;フルオロで置換されたC1-4アルキル、特にフルオロで置換されたメチル;またはフルオロで置換されたC1-4アルキルオキシ、特にフルオロで置換されたエチルオキシである、式(I)の化合物あるいはその薬学的に許容される塩またはその溶媒和物である。
【0040】
本発明の一実施形態は、R1がC4-6アルキル、特に1−ブチル;またはC3-7シクロアルキルで置換されたC1-3アルキル、特にシクロプロピルメチルであり;
R2がフルオロ;ヒドロキシルで置換されたC1-4アルキル、特にヒドロキシルで置換されたメチル;またはフルオロで置換されたC1-4アルキル、特にフルオロで置換されたメチル;またはフルオロで置換されたC1-4アルキルオキシ、特にフルオロで置換されたエチルオキシである、式(I)の化合物あるいはその薬学的に許容される塩またはその溶媒和物である。
【0041】
本発明の一実施形態は下記から選ばれる式(I)の化合物あるいはその薬学的に許容される塩またはその溶媒和物である。
【0042】
【化5】

【0043】
【表1】

【0044】
本発明の一実施形態は下記から選ばれる式(I)の化合物あるいはその薬学的に許容される塩またはその溶媒和物である。
【0045】
【化6】

【0046】
【表2】

【0047】
上記または下記に用いられるように、基または基の一部としてのC1-3アルキルなる記載は、メチル、エチル、1−プロピルおよび1−メチル−1−エチルなどの、飽和し、直鎖または分岐鎖であり、1〜3個の炭素原子を有する炭化水素ラジカルを規定する。
【0048】
上記または下記に用いられるように、基または基の一部としてのC1-4アルキルなる記載は、メチル、エチル、プロピル、1−メチル−1−エチル、1−ブチル、2−メチル−1−プロピルなどの、飽和し、直鎖または分岐鎖であり、1〜4個の炭素原子を有する炭化水素ラジカルを規定する。好ましくは、C1-4アルキルはメチルを表す。
【0049】
上記または下記に用いられるように、基または基の一部としてのC4-6アルキルなる記載は、1−ブチル、2−メチル−1−プロピル、1−ペンチル、2−メチル−1−ブチル、3−メチル−1−ブチル、1−ヘキシルなどの、飽和し、直鎖または分岐鎖であり、4〜6個の炭素原子を有する炭化水素ラジカルを規定する。
【0050】
上記または下記に用いられるように、基または基の一部としてのC4-5アルキルなる記載は、1−ブチル、2−メチル−1−プロピル、1−ペンチル、2−メチル−1−ブチル、3−メチル−1−ブチルなどの、飽和し、直鎖または分岐鎖であり、4個または5個の炭素原子を有する炭化水素ラジカルを規定する。
【0051】
上記または下記に用いられるように、C3-7シクロアルキルなる記載は、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシルおよびシクロヘプチルなどの、飽和した3〜7個の炭素原子を有する環式炭化水素ラジカルを規定する。好ましくは、C3-7シクロアルキルはシクロプロピルを表す。
【0052】
治療上の使用に関して、式(I)の化合物の塩とは、対イオンが薬学的に許容されるものである。しかしながら、薬学的に許容されるものではない酸および塩基の塩もまた、例えば、薬学的に許容される化合物の調製または精製に用いられる可能性がある。薬学的に許容されてもされなくても塩はすべて本発明の範囲内に包含される。
【0053】
上記薬学的に許容できる塩は、式(I)の化合物が形成することができる治療上効果のある非毒性の酸付加塩形態を含むと定義される。当該塩は、式(I)の化合物の塩基形態を適切な酸、例えば、無機酸(例えば、ハロゲン化水素酸、特に、塩化水素酸、臭化水素酸、硫酸、硝酸およびリン酸);有機酸(例えば、酢酸、ヒドロキシ酢酸、プロパン酸、乳酸、ピルビン酸、シュウ酸、マロン酸、コハク酸、マレイン酸、フマル酸、リンゴ酸、酒石酸、クエン酸、メタンスルホン酸、エタンスルホン酸、ベンゼンスルホン酸、p−トルエンスルホン酸、シクラミン酸、サリチル酸、p−アミノサリチル酸およびパモ酸)で処理することにより得ることができる。
【0054】
逆に、当該酸性塩形態は、適切な塩基で処理することにより遊離塩基形態に変換することができる。
【0055】
酸性プロトンを含む式(I)の化合物はまた、適切な有機および無機塩基で処理することにより、治療効果があり非毒性であるそれらの塩基性塩形態に変換され得る。適切な塩基性塩形態としては、例えば、アンモニウム塩、アルカリおよびアルカリ土類金属塩(特に、リチウム、ナトリウム、カリウム、マグネシウムおよびカルシウム塩)、有機塩基(例えば、ベンザチン、N−メチル−D−グルカミン)との塩、ヒブラミン塩、ならびにアミノ酸(例えば、アルギニンおよびリジン)との塩が挙げられる。
【0056】
逆に、当該塩基性塩形態は、適切な酸で処理することにより遊離酸形態に変換することができる。
【0057】
式(I)の化合物の薬学的に許容される酸付加塩形態は、式(I)の化合物の薬学的に許容される好ましい塩形態である。
【0058】
溶媒和物なる語は、式(I)の化合物が形成することができる溶媒付加形態およびその薬学的に許容される塩形態を包含する。このような溶媒付加形態の例としては、例えば、水和物、アルコラートなどが挙げられる。
【0059】
なお、式(I)化合物ならびにその塩および溶媒和物のうちのいくつかは、1つ以上のキラル中心を含み立体化学的異性体形態として存在し得る。
【0060】
上記に用いられるような「立体化学的異性体形態」なる語は、式(I)の化合物が有し得る考えられる異性体をすべて規定する。特に記載または表示が無ければ、化合物の化学名称は、考えられるすべての立体化学的異性体形態の混合物を表わし、当該混合物は、基本となる分子構造のジアステレオマーおよびエナンチオマーをすべて含む。しかし本発明はまた、他の異性体を実質的に含まない(すなわち、10%未満、好ましくは5%未満、特に2%未満、最も好ましくは1%未満の他の異性体を伴う)式(I)の単一の異性体形態およびその塩または溶媒和物のそれぞれも包含する。したがって、式(I)の化合物が例えば(R)と明記される場合、これはこの化合物が(S)異性体を実質的に含まないことを意味する。
【0061】
特に、立体中心はR配置またはS配置を有する可能性があり、二価の環式(部分)飽和ラジカル上の置換基はシス配置またはトランス配置のいずれかを有する可能性がある。
【0062】
CAS命名法の取り決めに従って、化合物中に既知の絶対配置の立体中心が2つ存在する場合、最も小さい数字のキラル中心(すなわち標準となる中心)に対してRまたはSの表示が割り当てられる(カーン−インゴールド−プレログ順位則に基づく)。第2の立体中心の配置は、相対的な記述子[R*、R*]または[R*、S*]を用いて示され、ここでR*は常に標準となる中心として特定され、[R*、R*]は同一のキラリティーの中心を示し、[R*、S*]は異なるキラリティーの中心を示す。例えば、化合物中の最も数字の小さいキラル中心がS配置をとり2番目の中心がR配置の場合、その立体表示は、S−[R*、S*]と特定されることになる。「α」および「β」が用いられる場合、最も少ない環番号を有する環系における非対称炭素原子上の最も優先順位が高い置換基の位置は、任意的に常に環系により決定される平均面の「α」位置にある。環系におけるもう一方の非対称炭素原子上の優先順位が最も高い置換基(式(I)の化合物における水素原子)の位置は、基準原子上における優先順位が最も高い置換基の位置に対して、それが環系により決定される平均面の同じ側にある場合、「α」と特定され、またはそれが環系により決定される平均面の反対側にある場合、「β」と特定される。
【0063】
「式(I)の化合物」なる語またはその任意のサブグループは、以下で用いられる場合は常にそれらの立体化学的異性体形態、それらの薬学的に許容される塩およびそれらの溶媒和物も含むように意図されている。立体化学的に純粋な式(I)の化合物が特に興味深い。
【0064】
本出願の範囲内では、元素(特に、式(I)の化合物に関して言及された場合)はこの元素の全ての同位体および同位体混合物を包含し、天然に存在しても合成されても、天然に豊富にあってもまた同位体的に濃縮された形態であってもよい。特に、水素に言及する場合、1H、2H、3Hまたはこれらの混合物を指すと理解され、炭素に言及する場合、11C、12C、13C、14Cまたはこれらの混合物を指すと理解され、窒素に言及する場合、13N、14N、15Nまたはこれらの混合物を指すと理解され、酸素に言及する場合、14O、15O、16O、17O、18Oまたはこれらの混合物を指すと理解され、かつフルオロに言及する場合、18F、19Fまたはこれらの混合物を指すと理解される。したがって本発明の化合物はまた、1種以上の元素の1種以上の同位体を有する化合物およびその混合物を包含する(1個以上の非放射性原子がその放射性同位体の1個以上と置換されている放射性標識化合物とも呼ばれる放射性化合物を含む)。特に、放射性原子は、水素、炭素、窒素、硫黄、酸素およびハロゲンからなる群から選ばれる。好ましくは放射性原子は、水素、炭素およびハロゲンからなる群から選ばれる。特に、放射性同位体は、3H、11C、18F、122I、123I、125I、131I、75Br、76Br、77Brおよび82Brからなる群から選ばれる。好ましくは放射性同位体は、3H、11Cおよび18Fからなる群から選ばれる。
【0065】
定義のものの一覧から置換基をそれぞれ独立して選択することができるということが上記または下記に適用される場合は常に、化学的に可能性のあるすべての組み合わせが意図される。
【0066】
一般に、式(I)の化合物は下記の実験手順1〜4に従って調製することができる。
【0067】
[実験手順1]
式(I)の化合物は、反応スキーム(1)に従って式(II)の中間体(式中Yは、例えば、F3C−S(=O)2−O−またはハロ(例えば、臭素など)などの適切な脱離基を表す)を式(III)の中間体と反応させることにより調製することができる。この反応は、適切な反応不活性溶媒(例えば、ジメトキシエタンまたはアセトニトリルなど)中で適切な塩基(例えば、Cs2CO3またはN、N−ジイソプロピルエチルアミンなど)の存在下で加熱条件下(例えば、150℃でマイクロ波照射下で15分間反応混合物を加熱する)で行うことができる。
【0068】
反応スキーム(1)に記載の反応はまた、適切な反応不活性溶媒(例えば、1,4−ジオキサンなど)中で適切な塩基(例えば、K3PO4など)および適切な触媒(例えば
【0069】
【化7】

【0070】
などのPd錯体触媒)の存在下で加熱条件下(例えば、80℃で12時間反応混合物を加熱する)で行うことができる。
【0071】
反応スキーム(1)では、すべての変数は式(I)に関してと同様に規定される。
【0072】
【化8】

【0073】
[実験手順2]
R2がフルオロで置換されたC1-4アルキルを表し、このC1-4アルキルがLで表される式(I)の化合物(当該化合物は式(I−a)で表される)は、R2がヒドロキシルで置換されたC1-4アルキルを表す式(I)の化合物(当該化合物は式(I−b)で表される)を適切なフッ素化剤(例えば、三フッ化(ジエチルアミノ)硫黄[CAS:38078−09−0]など)と反応させることにより調製することができる。この反応は、適切な反応不活性溶媒(例えば、ジクロロメタンなど)中で適度な低温(例えば、−78℃〜30℃の範囲の温度)で、例えば、0.5〜12時間行うことができる。
【0074】
反応スキーム(2)では、すべての変数は式(I)に関してと同様に規定される。
【0075】
【化9】

【0076】
[実験手順3]
R2がフルオロを表す式(I)の化合物(当該化合物は式(I−c)で表される)は、式(IV)の中間体を適切なフッ素化剤(例えば、三フッ化(ジエチルアミノ)硫黄など)と反応させることにより調製することができる。この反応は、適切な反応不活性溶媒(例えば、ジクロロメタンなど)中で適度な低温(例えば、−78℃〜30℃の範囲の温度)で、例えば、0.5〜12時間行うことができる。
【0077】
反応スキーム(3)では、すべての変数は式(I)に関してと同様に規定される。
【0078】
【化10】

【0079】
[実験手順4]
R2がフルオロで置換されたC1-4アルキルオキシを表す式(I)の化合物(このR2はR’2で表され、当該化合物は式(I−d)で表される)は、反応スキーム(4)に従って式(XIV)の中間体を水素化することにより調製することができる。この反応は、適切な溶媒(例えば、アルコール(例えば、メタノール)など)中で適切な触媒(例えば、パラジウム活性炭など)および適切な塩基(例えば、トリエチルアミンなど)の存在下で行うことができる。反応スキーム(4)では、すべての変数は式(I)に関してと同様に規定される。
【0080】
【化11】

【0081】
本発明における式(I)の化合物および中間体のいくつかは不斉炭素原子を含む可能性がある。これら化合物および中間体の純粋な立体化学的異性体形態は、当該技術分野で公知の手順を適用することにより得ることができる。例えば、ジアステレオマーは、選択的結晶化またはクロマトグラフ法(例えば、向流分配、キラル液体クロマトグラフィー等の方法)などの物理的方法により分離することができる。エナンチオマーは、まず適切な分割剤(例えば、キラル酸など)でラセミ混合物をジアステレオマー塩または化合物の混合物に変換し、例えば、選択的結晶化またはクロマトグラフ法(例えば、液体クロマトグラフィー等の方法)により当該ジアステレオマー塩または化合物の混合物を物理的に分離し、最後に分離されたジアステレオマー塩または化合物を対応するエナンチオマーに変換することにより当該ラセミ混合物から得ることができる。純粋な立体化学的異性体形態はまた、介在する反応が立体特異的に起こるという条件で、純粋な立体化学的異性体形態の適切な中間体および出発物質から得られ得る。
【0082】
エナンチオマー形態の式(I)の化合物および中間体を分割する別の方法は、特にキラル固定相を用いる液体クロマトグラフィーまたはSCF(超臨界流体)クロマトグラフィーを含む。
【0083】
中間体および出発物質のいくつかは公知の化合物であり、市販されている可能性があり、また当該技術分野で公知の手順に従って調製されてもよい。
【0084】
中間体はまた下記の実験手順5〜13に従って調製することができる。
【0085】
[実験手順5]
Yがハロを表す式(II)の中間体(当該中間体は式(II−a)で表される)は、反応スキーム(5)に従って式(V)の中間体を適切なハロゲン化剤(P(=O)Br3など)と反応させることにより調製することができる。この反応は、適切な反応不活性溶媒(例えば、DMFなど)中でやや高温(例えば、110℃)で行うことができる。反応スキーム(5)では、すべての変数は式(I)に関してと同様に規定される。
【0086】
【化12】

【0087】
[実験手順6]
YがF3C−S(=O)2−O−を表す式(II)の中間体(当該中間体は式(II−b)で表される)は、反応スキーム(6)に従って式(V)の中間体をトリフル酸無水物(トリフルオロメタンスルホン酸無水物とも呼ばれる)と反応させることにより調製することができる。この反応は、適切な反応不活性溶媒(例えば、ジクロロメタンなど)中で適切な塩基(例えば、ピリジンなど)の存在下で低温(例えば、−78℃)で行うことができる。反応スキーム(6)では、すべての変数は式(I)に関してと同様に規定される。
【0088】
【化13】

【0089】
[実験手順7]
式(V)の中間体は、反応スキーム(7)に従って当該技術分野で公知の手順により式(VI)の中間体を適切なメチルエーテル開裂試薬(例えば、NaOHなど)と反応させることにより調製することができる。この反応は、適切な溶媒(例えば、水など)中でやや高温(例えば、100℃)で行うことができる。反応スキーム(6)では、すべての変数は式(I)に関してと同様に規定される。
【0090】
【化14】

【0091】
[実験手順8]
式(VI)の中間体は、反応スキーム(8)に従って当該技術分野で公知の手順により市販の4−メトキシ−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリルを式(VII)のアルキル化剤(式中Zは、例えば、ハロ(例えば、臭素)などの適切な脱離基を表す)と反応させることにより調製することができる。式(VII)のアルキル化剤の例としてはシクロプロピルメチルブロミドがある。この反応は、不活性溶媒(例えば、アセトニトリルなど)中で適切な塩基(例えば、K2CO3など)および必要に応じてヨウ素塩(KIなど)を用いてやや高温(例えば、120℃)で行うことができる。反応スキーム(8)では、すべての変数は式(I)に関してと同様に規定される。
【0092】
【化15】

【0093】
[実験手順9]
式(III)の中間体は、反応スキーム(9)に従って当該技術分野で公知の手順を適用して、Xがピペリジン誘導体の窒素原子の適切な保護基(例えば、tert−ブトキシカルボニル、エトキシカルボニル、ベンジルオキシカルボニル、ベンジルおよびメチルなど)を表す式(VIII)の中間体中のピペリジン窒素を脱保護することにより調製することができる。例えば、Xがベンジルを表す場合、この脱保護反応はアルコール(例えば、メタノール)および1,4−シクロヘキサジエンなどの適切な溶媒中で適切な触媒(例えば、パラジウム炭素など)の存在下でやや高温(100℃)で行なわれてもよい。例えば、Xがエステルを表す場合、上記脱保護反応は適切な溶媒(例えば、ジオキサンなど)中で適切な酸(例えば、塩化水素酸など)との反応により行うことができる。反応スキーム(9)では、すべての変数は式(I)に関してと同様に規定される。
【0094】
【化16】

【0095】
[実験手順10]
R2がフルオロもしくはフルオロで置換されたC1-4アルキルを表わし、当該R2が−L1−F(ここでL1はC1-4アルキルまたは共有結合を表す)で表される式(III)の中間体(当該中間体は式(III−a)で表される)は、反応スキーム(10)のステップ(a)に従って当該技術分野で公知の手順により式(IX)の中間体(式中Xは、ピペリジン部分の窒素原子の適切な保護基(例えば、tert−ブトキシカルボニル、エトキシカルボニル、ベンジルオキシカルボニル、ベンジルおよびメチルなど)を表す)を適切なフッ素化剤(例えば、三フッ化(ジエチルアミノ)硫黄[CAS:38078−09−0]など)と反応させることにより調製することができ、式(X)の中間体が得られる。この反応は、適切な反応不活性溶媒(例えば、ジクロロメタンなど)中で適度な低温(例えば、−78℃〜30℃の範囲の温度)で、例えば、0.5〜12時間行なってもよい。次いで、得られた式(X)の中間体を反応スキーム(10)のステップ(b)に従って、例えば、上記実験手順9に記載のものなどの当該技術分野で公知の手順を適用してピペリジン窒素の脱保護により式(III−a)の中間体に変換することができる。反応スキーム(10)では、すべての変数は式(I)に関してと同様に規定される。
【0096】
【化17】

【0097】
[実験手順11]
R2がフルオロで置換されたC1-4アルキルオキシを表わし、当該C1-4アルキルオキシが式Qで表され、当該R2が−Q−Fで表される式(III)の中間体(当該中間体は式(III−b)で表される)は、反応スキーム(11)のステップ(a)に従って当該技術分野で公知の手順により式(XI)のヒドロキシル置換中間体(式中Xは、ピペリジン部分の窒素原子の適切な保護基(例えば、tert−ブトキシカルボニル、エトキシカルボニル、ベンジルオキシカルボニル、ベンジルおよびメチルなど)を表す)を適切なフッ素化剤(例えば、三フッ化(ジエチルアミノ)硫黄[CAS:38078−09−0]など)と反応させることにより調製することができ、式(XII)の中間体が得られる。この反応は、適切な反応不活性溶媒(例えば、ジクロロメタンなど)中で適度な低温(例えば、−78℃〜30℃の範囲の温度)で、例えば、0.5〜12時間行うことができる。次いで、式(XII)の中間体を、反応スキーム(11)のステップ(b)に従って、例えば、上記実験手順9に記載のものなど当該技術分野で公知の手順を適用してピペリジン窒素の脱保護により式(III−b)の中間体に変換することができる。反応スキーム(11)では、すべての変数は式(I)に関してと同様に規定される。
【0098】
【化18】

【0099】
[実験手順12]
L1がCH2を表す式(IX)の中間体(当該中間体は式(IX−a)で表される)は、反応スキーム(12)に従って式(XIII)の中間体(式中Xは、ピペリジン部分の窒素原子の適切な保護基(例えば、tert−ブトキシカルボニル、エトキシカルボニル、ベンジルオキシカルボニル、ベンジルおよびメチルなど)を表す)を適切な還元剤(例えば、水素化アルミニウムリチウムなど)と反応させることにより調製することができる。この反応は、適切な溶媒(例えば、テトラヒドロフランなど)中でやや低温(例えば、−20℃)で行うことができる。
【0100】
反応スキーム(12)では、すべての変数は式(I)に関してと同様に規定される。
【0101】
【化19】

【0102】
[実験手順13]
式(XIV)の中間体は、反応スキーム(13)に従って式(XV)の中間体をC1-4フルオロアルキル−4−トルエンスルホン酸と反応させることにより調製することができる。この反応は、適切な溶媒(例えば、DMEなど)中でNaHの存在下で行うことができる。
【0103】
反応スキーム(13)では、すべての変数は式(I)に関してと同様に規定され、R’2は上記で規定されたとおりである。
【0104】
【化20】

【0105】
式(IV)および式(XV)の中間体はまた、mGluR2のポジティブアロステリックモジュレーターとしての活性を示す。したがって本発明はまた、式(I’)の化合物(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物に関する。
【0106】
【化21】

【0107】
式中、R1はC4-6アルキル、特に1−ブチル;またはC3-7シクロアルキルで置換されたC1-3アルキル、特にシクロプロピルメチルであり;
R3は水素またはハロ;特に水素、フルオロまたはクロロである。
【0108】
本発明の一実施形態は、R1がC4-6アルキル、特にC4-5アルキル、例えば、1−ブチル、2−メチル−1−プロピル、3−メチル−1−ブチル;特に1−ブチルである式(I’)の化合物である。
【0109】
本発明の一実施形態は、R1がC3-7シクロアルキルで置換されたC1-3アルキル、特にシクロプロピルメチルまたは2−(シクロプロピル)−1−エチルである式(I’)の化合物である。
【0110】
興味深い実施形態としては、R3が水素である式(I’)の化合物である。
【0111】
興味深い実施形態としては、R3がハロ、特にクロロまたはフルオロである式(I’)の化合物である。
【0112】
興味深い実施形態としては、R1が1−ブチルまたはシクロプロピルメチルであり;R2が水素、フルオロまたはクロロである式(I’)の化合物である。
【0113】
式(I’)の化合物は、例えば、下記のものあるいはその薬学的に許容される塩またはその溶媒和物である。
【0114】
【表3】

【0115】
当該式(I’)の化合物は、式(IV)または(XV)の中間体の調製に関して上記されたように調製することができる。下記実施例A13もまた参照される。
【0116】
本発明はまた、ヒトを含む哺乳類における症状の治療または予防(特に治療)用薬剤の製造のための式(I’)の化合物あるいはその任意のサブグループの使用に関し、この症状の治療または予防は、mGluR2のアロステリックモジュレーター(特にポジティブアロステリックモジュレーター)の神経修飾効果により作用されるかまたは促進される。
【0117】
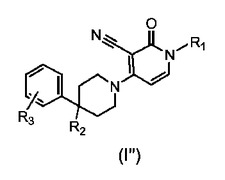
式(I)および式(I’)の化合物はいずれもmGluR2のポジティブアロステリックモジュレーターなので、本発明はまた式(I’’)の化合物(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物に関する。
【0118】
【化22】

【0119】
式中、R1はC4-6アルキル、またはC3-7シクロアルキルで置換されたC1-3アルキルであり、
R2は水素;ヒドロキシル;フルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシであり、
R3は水素またはハロであるが、但し、R3がハロの場合R2はヒドロキシルである。
【0120】
本発明の一実施形態は、R1がC4-6アルキル、特にC4-5アルキル、例えば、1−ブチル、2−メチル−1−プロピル、3−メチル−1−ブチル;特に1−ブチルである式(I’’)の化合物である。
【0121】
本発明の一実施形態は、R1がC3-7シクロアルキルで置換されたC1-3アルキル、特に、シクロプロピルメチルまたは2−(シクロプロピル)−1−エチルである式(I’’)の化合物である。
【0122】
本発明の一実施形態は、R2が水素である、実施形態として上記された式(I’’)の化合物またはその任意のサブグループである。
【0123】
本発明の一実施形態は、R2がフルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシである、実施形態として上記された式(I’’)の化合物または、可能な場合は常に、その任意のサブグループである。
【0124】
本発明の一実施形態は、R2が水素;フルオロ;またはフルオロで置換されたC1-4アルキルオキシ;特にR2がフルオロまたはフルオロで置換されたC1-4アルキルオキシである、実施形態として上記された式(I’’)の化合物または、可能な場合は常に、その任意のサブグループである。
【0125】
本発明の一実施形態は、R2がフルオロである、実施形態として上記された式(I’’)の化合物またはその任意のサブグループである。
【0126】
本発明の一実施形態は、R2がヒドロキシルで置換されたC1-4アルキルであり、特にR2がヒドロキシルで置換されたメチルである、実施形態として上記された式(I’’)の化合物または、可能な場合は常に、その任意のサブグループである。
【0127】
本発明の一実施形態は、R2がフルオロで置換されたC1-4アルキルであり、特にR2がフルオロで置換されたメチルである、実施形態として上記された式(I’’)の化合物または、可能な場合は常に、その任意のサブグループである。
【0128】
本発明の一実施形態は、R2がフルオロで置換されたC1-4アルキルオキシであり、特にR2がフルオロで置換されたエチルオキシである、実施形態として上記された式(I’’)の化合物または、可能な場合は常に、その任意のサブグループである。
【0129】
本発明の一実施形態は、R2がヒドロキシルである、実施形態として上記された式(I’’)の化合物または、可能な場合は常に、その任意のサブグループである。
【0130】
本発明はまた、ヒトを含む哺乳類における症状の治療または予防(特に治療)用薬剤の製造のための式(I’’)の化合物あるいはその任意のサブグループの使用に関し、この症状の治療または予防はmGluR2のアロステリックモジュレーター(特にポジティブアロステリックモジュレーター)の神経修飾効果により作用されるかまたは促進される。
【0131】
[薬理]
本発明で提供される化合物は代謝型グルタミン酸受容体のポジティブアロステリックモジュレーターであり、特にmGluR2のポジティブアロステリックモジュレーターである。本発明の化合物は、グルタミン酸認識部位(オルソステリックリガンド部位)へ結合するのではなく、むしろ受容体の7回膜貫通型領域内のアロステリック部位に結合するようである。グルタミン酸塩(エステル)またはmGluR2のアゴニストの存在下では、本発明の化合物はmGluR2応答を増加させる。本発明で提供される化合物は、グルタミン酸塩(エステル)またはmGluR2アゴニストに対するこのような受容体の応答を増加させる能力によりmGluR2において効果がある(これにより受容体の応答が増強される)と予想される。したがって本発明は、薬として用いられる本発明の化合物、ならびにヒトを含む哺乳類における症状の治療または予防(特に治療)用薬剤の製造のための本発明の化合物または本発明の医薬組成物の使用に関し、この症状の治療または予防はmGluR2のアロステリックモジュレーター(特にそのポジティブアロステリックモジュレーター)の神経修飾効果により作用されるかまたは促進される。本発明はまた、ヒトを含む哺乳類における症状の治療または予防(特に治療)用薬剤の製造で用いる本発明の化合物あるいは本発明の医薬組成物に関し、この症状の治療または予防はmGluR2のアロステリックモジュレーター(特にそのポジティブアロステリックモジュレーター)の神経修飾効果により作用されるかまたは促進される。本発明はまた、ヒトを含む哺乳類における症状の治療または予防(特に治療)のための本発明の化合物あるいは本発明の医薬組成物に関し、この症状の治療または予防はmGluR2のアロステリックモジュレーター(特にそのポジティブアロステリックモジュレーター)の神経修飾効果により作用されるかまたは促進される。
【0132】
また、本発明はヒトを含む哺乳類におけるグルタミン酸機能障害と関連する様々な神経障害および精神障害の治療、予防、改善、制御、またはその危険性の減少用薬剤の製造のための本発明の化合物あるいは本発明の医薬組成物の使用に関し、この症状の治療または予防はmGluR2のポジティブアロステリックモジュレーターの神経修飾効果により作用されるかまたは促進される。
【0133】
本発明が薬剤(例えば、哺乳類の治療用)の製造のための本発明の化合物または組成物の使用に関すると記載されている場合、特定の司法権限の管轄域ではこのような使用は、例えば、このような治療を必要とする哺乳類に有効量の本発明の化合物または組成物を投与することを含む、例えば、哺乳類の治療方法として理解される。
【0134】
特に、グルタミン酸機能障害と関連する神経障害および精神障害としては、以下の1種以上の症状または疾患が挙げられる。心臓バイパス手術および移植後の脳欠損などの急性神経障害および急性精神障害、卒中、脳虚血、脊髄損傷、頭部外傷、周生期低酸素症 、心停止、低血糖性神経細胞損傷、認知症(エイズ誘発認知症を含む)、アルツハイマー病、ハンチントン舞踏病、筋萎縮性側索硬化症、視覚障害、網膜症、認識障害、特発性および薬物誘発性パーキンソン病、振戦を含む筋痙直と関連する筋肉痙攣および障害、てんかん、痙攣、片頭痛(片頭痛性の頭痛を含む)、尿失禁、物質耐性、物質禁断症状(アヘン剤、ニコチン、タバコ製品、アルコール、ベンゾジアゼピン、コカイン、鎮静剤、睡眠薬などの物質を含む)、精神病、統合失調症、不安症(全般性不安障害、パニック障害、および強迫観念障害を含む)、気分障害(うつ病、躁病、両相性障害)、三叉神経痛、難聴、耳鳴り、眼の黄斑変性症、嘔吐、脳浮腫、疼痛(急性および慢性の状態、激痛、難治性疼痛、神経因性疼痛、および外傷後の疼痛を含む)、遅発性ジスキネジア、睡眠障害(ナルコレプシーを含む)、注意欠陥/多動性障害および行為障害。
【0135】
特に本発明は、不安障害、精神障害、人格障害、物質関連障害、摂食障害、気分障害、片頭痛、てんかんまたは痙攣性障害、幼児期障害、認知障害、神経変性、神経毒症状および虚血からなる群から選ばれる中枢神経系障害の治療または予防(特に、治療)用薬剤の製造のための式(I)の化合物の使用に関する。
【0136】
上記中枢神経系障害は好ましくは、広場恐怖症、全般性不安障害(GAD)、強迫観念障害(OCD)、パニック障害、心的外傷後ストレス障害(PTSD)、対人恐怖および他の恐怖症からなる群から選ばれる不安障害である。
【0137】
上記中枢神経系障害は好ましくは、統合失調症、妄想性障害、統合失調性感情障害、統合失調症様障害および物質誘発性精神障害からなる群から選ばれる精神障害である。
【0138】
上記中枢神経系障害は好ましくは、強迫性人格障害および統合失調症、統合失調型障害からなる群から選ばれる人格障害である。
【0139】
上記中枢神経系障害は好ましくは、アルコール乱用、アルコール依存症、アルコール禁断症状、アルコール禁断せん妄、アルコール誘発性精神障害、アンフェタミン依存症、アンフェタミン禁断症状、コカイン依存症、コカイン禁断症状、ニコチン依存症、ニコチン禁断症状、オピオイド依存症およびオピオイド禁断症状からなる群から選ばれる物質関連障害である。
【0140】
上記中枢神経系障害は好ましくは、神経性食欲不振症および神経性過食症からなる群から選ばれる摂食障害である。
【0141】
上記中枢神経系障害は好ましくは、両相性障害(IおよびII)、気分循環性障害、うつ病、気分変調性障害、大うつ病性障害および物質誘発性気分障害からなる群から選ばれる気分障害である。
【0142】
上記中枢神経系障害は好ましくは、片頭痛である。
【0143】
上記中枢神経系障害は好ましくは、非痙攣性全般てんかん、痙攣性全般てんかん、小発作性てんかん重積、大発作性てんかん重積、意識障害を伴うかまたは伴わない部分てんかん、幼児痙攣症、持続性部分てんかんおよび他の形態のてんかんからなる群から選ばれるてんかんまたは痙攣性の障害である。
【0144】
上記中枢神経系障害は好ましくは、注意欠陥/多動性障害である。
【0145】
上記中枢神経系障害は好ましくは、せん妄、物質誘発持続性せん妄、認知症、HIV疾患による認知症、ハンチントン病による認知症、パーキンソン病による認知症、アルツハイマー型認知症、物質誘発持続性認知症および軽度認知障害からなる群から選ばれる認知障害である。
【0146】
上記障害のうち、不安症、統合失調症、片頭痛、うつ病およびてんかんの治療が特に重要である。
【0147】
現時点では、米国精神医学会(American Psychiatric Association)の「精神障害の診断と統計の手引き(Diagnostic & Statistical Manual of Mental Disorders)」第4版(DSM−IV)が本明細書に記載の障害を識別するための診断用手段を提供している。当業者であれば、本明細書に記載した神経障害および精神障害について別の命名法、疾病分類および分類体系が存在すること、そしてこれらは医学および科学の進歩とともに発展することを認識しているであろう。
【0148】
式(I)の化合物を含むこのようなmGluR2のポジティブアロステリックモジュレーターはグルタミン酸塩(エステル)に対するmGluR2の応答を増強させるため、本発明の方法は内因性のグルタミン酸塩(エステル)を利用するのが有利である。
【0149】
式(I)の化合物を含むmGluR2のポジティブアロステリックモジュレーターはアゴニストに対するmGluR2の応答を増強させるため、本発明は、有効量のmGluR2のポジティブアロステリックモジュレーター(式(I)の化合物を含む)をmGluR2アゴニストと組合せて投与することによりグルタミン酸機能障害と関連する神経障害および精神障害を治療することにまで及ぶと理解される。
【0150】
本発明の化合物は、薬剤を互いに組み合わせたものがいずれかの薬剤単独よりも安全であるかまたはより有効である場合、式(I)の化合物または他の薬剤が効用を有する疾患または症状の治療、予防、制御、改善、またはその危険性の低減において1種以上の薬剤と組み合わせて利用されてもよい。
【0151】
[医薬組成物]
本発明はまた、薬学的に許容される担体または希釈剤と、有効成分として治療上有効な量の本発明の化合物、特に式(I)の化合物(その立体化学的異性体形態またはその薬学的に許容される塩もしくはその溶媒和物を含む)とを含有する医薬組成物に関する。
【0152】
本発明の化合物、特に式(I)の化合物(その立体化学的異性体形態、またはその薬学的に許容される塩もしくはその溶媒和物、またはその任意のサブグループもしくは組み合わせを含む)は、投与目的に関して種々の剤型に処方されてもよい。適切な組成物としては薬剤を全身投与するために通常用いられる全ての組成物が挙げられる。
【0153】
本発明の医薬組成物を調製するため、有効成分として有効な量の特定の化合物(必要に応じて塩形態)は薬学的に許容される担体または希釈剤と完全な混合物として組み合わされる。この担体または希釈剤は投与に関して所望される剤型に応じて種々様々の形態であってもよい。上記医薬組成物は、特に、注射または吸入による経口、経直腸、経皮投与に適切な単回投与形態であることが望ましい。例えば、経口投薬形態に組成物を調製する際、例えば、懸濁剤、シロップ剤、エリキシル剤、乳剤および液剤などの経口液体製剤の場合は、例えば、水、グリコール、オイル、アルコールなど;あるいは散剤、丸剤、カプセル剤および錠剤の場合は、例えば、デンプン、糖、カオリン、希釈剤、滑沢剤、結合剤、崩壊剤などの固体担体などの通常の製剤媒体のいずれが使用されてもよい。投与の容易さのため、経口投与が好ましく、錠剤およびカプセル剤が最も有利な経口投薬単位形態であり、この場合言うまでもなく固体医薬担体が用いられる。非経口組成物に関して、担体は通常少なくとも大部分が滅菌水を含むことになるが、例えば、溶解性を増加させるため他の成分が含まれもよい。例えば、担体が食塩水、グルコース溶液、または食塩水とグルコース溶液との混合物を含む注射液が調製されてもよい。注射用懸濁液が調製されてもよく、この場合適切な液体担体、懸濁化剤などが用いられてもよい。また使用直前に液体形態の製剤に変換されることが意図される固体形態の製剤も含まれる。経皮投与に適した組成物において、担体は必要に応じて浸透促進剤および/または適切な湿潤剤を含んでもよく、任意の性質を有する適切な添加剤(この添加剤は皮膚に著しい有害作用をもたらさない)と低い割合で必要に応じて組み合わされてもよい。当該添加剤は、皮膚への投与を容易にしかつ/または所望の組成物の調製に役立つ可能性がある。これら組成物は様々な様式、例えば、経皮パッチとして、スポットオンとして、軟膏として投与されてもよい。
【0154】
投与のしやすさおよび用量の均一性のため、上記医薬組成物を単位用量形態に処方することが特に有利である。本明細書では単位用量形態とは、単一の用量として適切な物理的に別々の単位を指し、各単位は必要な製剤担体と関連して所望の治療効果を生むように計算された所定量の有効成分を含む。このような単位用量形態の例としては、錠剤(刻線付き錠剤またはコーティングされた錠剤を含む)、カプセル剤、丸剤、散剤包、ウエハー、坐剤、注射液または注射用懸濁液など、ならびにそれらの分割された複数回分が挙げられる。
【0155】
正確な用量および投与頻度は、当業者に周知のように、使用される特定の式(I)の化合物、治療されている特定の症状、治療されている症状の重症度、年齢、体重、性別、障害の程度、および特定の患者の全身的な健康状態、そして個体が服用している可能性のある他の薬剤によって異なる。さらに、上記の有効な1日量は、治療されている被験者の応答に応じておよび/または本発明の化合物を処方する医師の評価に応じて減量または増量されてもよいことは明らかである。
【0156】
投与様式によっては、上記医薬組成物は、有効成分を0.05〜99重量%、好ましくは0.1〜70重量%、より好ましくは0.1〜50重量%、そして薬学的に許容される担体を1〜99.95重量%、好ましくは30〜99.9重量%、より好ましくは50〜99.9重量%を含むこととなる。ここでパーセントは全て組成物の全重量に基づいている。
【0157】
上述のように、本発明はまた、式(I)の化合物または他の薬物が効用を有する可能性のある疾患または症状の治療、予防、制御、改善、あるいはその危険性の低減における、本発明の化合物と1種以上の他の薬物とを含む医薬組成物に関し、そして薬剤の製造のためのそのような化合物の使用に関する。本発明はまた、本発明の化合物とmGluR2のオルソステリックアゴニストとの組み合わせに関する。本発明はまた、薬として用いられるこのような組み合わせに関する。本発明はまた、ヒトを含む哺乳類における症状の治療または予防における、同時に、個別にまたは順次に使用される併用薬剤として(a)本発明の化合物、その薬学的に許容される塩またはその溶媒和物と(b)mGluR2のオルソステリックアゴニストとを含む製品に関し、この治療または予防はmGluR2のアロステリックモジュレーター(特にポジティブアロステリックモジュレーター)の神経修飾効果により作用されるかまたは促進される。このような組み合わせまたは製品中の異なる薬物は、薬学的に許容される担体または希釈剤と共に単一の製剤中で組み合わされてもよいし、それぞれ薬学的に許容される担体または希釈剤と共に別々の製剤中に存在してもよい。
【0158】
下記実施例により本発明の範囲を示すことが意図されるが、本発明の範囲を制限するものではない。
【0159】
[実験の部]
下記実施例において本発明の化合物を調製するためのいくつかの方法が示される。特に明記しない場合、出発物質はすべて商業的供給業者から入手され、さらなる精製を行わないで使用された。特に、以下の略称が実施例および明細書全体にわたって使用される場合がある。
【0160】
【表4】

【0161】
塩水に対する言及はすべて飽和NaCl水溶液を指す。特に明記しない場合、温度はすべて℃(摂氏)で表される。特に明記しない場合、反応はすべて室温で不活性雰囲気下でない条件で行われる。
【0162】
マイクロ波を使った反応は、単一モード反応器であるEmrys(登録商標)Optimizerマイクロ波反応器(パーソナルケミストリー社(Personal Chemistry A.B.)、現在はバイオタージ社)またはマルチモード反応器であるMicroSYNTH Labstation(マイルストーン社(Milestone, Inc.))中で行った。
【0163】
[A.中間体の調製]
[実施例A.1]
1−シクロプロピルメチル−4−メトキシ−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(中間体1)
【0164】
【化23】

【0165】
アセトニトリル(250ml)中の4−メトキシ−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(12.2g、81.48mmol)の溶液に、ブロモメチル−シクロプロパン(11g、81.48mmol)および炭酸カリウム(22.48g、162.9mmol)を加え、この混合物を110℃で24時間加熱した。この混合物を室温まで冷却し、固形物をろ去した。ろ液を蒸発乾固させ、次いで、得られた粗残渣をジエチルエーテルでトリチューレションして純粋な中間体1(15.72g、94%)を白色の固形物として得た。
【0166】
[実施例A.2]
1−ブチル−4−メトキシ−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(中間体2)
【0167】
【化24】

【0168】
アセトニトリル(800ml)中の4−メトキシ−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(20g、133mmol)の溶液に、1−ブロモブタン(15.8g、146mmol)および炭酸カリウム(36.7g、266mmol)を加え、この混合物を110℃で24時間加熱した。この混合物を室温まで冷却し、固形物をろ去した。ろ液を蒸発乾固させ、次いで、得られた粗残渣をジエチルエーテルでトリチューレションして純粋な中間体2(27.39g、>99%)を白色の固形物として得た。
【0169】
[実施例A.3]
1−シクロプロピルメチル−4−ヒドロキシ−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(中間体3)
【0170】
【化25】

【0171】
中間体1(15.7g、76.8mmol)を室温で水酸化ナトリウムの1N水溶液(300ml)とTHF(50ml)に加えた。反応混合物を140℃(油浴温度)で16時間加熱した。この混合物を室温まで冷却し、THFをほぼ真空蒸発させた。水層を0℃まで冷却し、2N HCl水溶液を加えて酸性化させてpHを約3まで調節すると、この時点で白色の固形物が析出した。この固形物をろ去し、Et2Oで洗浄し、真空乾燥させて、中間体3を白色の固形物(10.44g、71%)として得、これをさらなる精製をしないで使用した。
【0172】
[実施例A.4]
1−ブチル−4−ヒドロキシ−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(中間体4)
【0173】
【化26】

【0174】
中間体2(27.39g、133mmol)を室温で水酸化ナトリウムの1N水溶液(500ml)とTHF(100ml)に加えた。反応混合物を110℃(油浴温度)で24時間加熱した。この混合物を室温まで冷却し、容量がほぼ250mlに減少するまで溶媒を真空蒸発させた。次いで、水層を0℃まで冷却し、2N HCl水溶液を加えて酸性化させてpHを約3まで調節すると、この時点で白色の固形物が析出した。この固形物をろ去し、Et2Oで洗浄し、真空乾燥させて、中間体4を白色の固形物(25g、98%)として得、これをさらなる精製をしないで使用した。
【0175】
[実施例A.5]
4−ブロモ−1−シクロプロピルメチル−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(中間体5)
【0176】
【化27】

【0177】
DMF(250ml)中の中間体3(10.4g、54.67mmol)の溶液にP(=O)Br3(31.3g、109.3mmol)を加え、この混合物を110℃で1.5時間加熱した。氷浴中で冷却後、溶液を水とEtOAcで分液した。EtOAcで3回抽出後、合わせた有機画分を塩水で洗浄し、MgSO4で乾燥させ、溶媒を真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル、溶離液としてDCM)により精製した。所望の画分を採取し、真空蒸発させて、中間体5(8.83g、64%)を得た。
【0178】
[実施例A.6]
4−ブロモ−1−ブチル−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(中間体6)
【0179】
【化28】

【0180】
DMF(600ml)中の中間体4(39g、203mmol)の溶液にP(=O)Br3(116g、406mmol)を加え、この混合物を110℃で1.5時間加熱した。氷浴中で冷却後、溶液を水とEtOAcで分液した。EtOAcで3回抽出後、合わせた有機画分を塩水で洗浄し、Na2SO4で乾燥させ、溶媒を真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル、溶離液としてDCM)により精製した。所望の画分を採取し、真空蒸発させて、中間体6(36.7g、72%)を得た。
【0181】
[実施例A.7]
4−ヒドロキシ−4−フェニル−ピペリジン−1−カルボン酸tert−ブチルエステル(中間体7)
【0182】
【化29】

【0183】
ジクロロメタン(50ml)中の4−ヒドロキシ−4−フェニルピペリジン(2g、11.28mmol)の溶液に室温で重炭酸ジ−tert−ブチル(2.95g、13.53mmol)を加えた。得られた混合物を室温で5時間撹拌した。揮発性分を真空蒸発させて粗中間体7を得、これをさらなる精製をしないで使用した(3.12g、100%)。
【0184】
[実施例A.8]
4−フルオロ−4−フェニル−ピペリジン−1−カルボン酸tert−ブチルエステル(中間体8)
【0185】
【化30】

【0186】
反応を窒素雰囲気下で行った。予め−78℃まで冷却したジクロロメタン(30ml)中の三フッ化(ジエチルアミノ)硫黄(0.74ml、5.67mmol)の溶液にジクロロメタン(30ml)中の中間体7(1.5g、5.4mmol)の溶液を滴下した。次いで、得られた混合物を−78℃で1時間撹拌し、次いで、この反応混合物を室温まで温めさらに30分間撹拌した。NaHCO3(飽和水溶液、90ml)を加え、この混合物を15分間撹拌した。有機層を分離し、3−クロロペルオキシ安息香酸(0.2g、1.18mmol)で処理し、30分間撹拌した。反応混合物をNaHCO3(飽和水溶液)、水および塩水で順次洗浄した。有機層をNa2SO4で乾燥させ、真空蒸発させて粗中間体8を得、これをさらなる精製をしないで使用した(1.5g、100%)。
【0187】
[実施例A.9]
4−フルオロ−4−フェニル−ピペリジン塩酸塩(中間体9)
【0188】
【化31】

【0189】
中間体8(1.5g、5.37mmol)を塩化水素酸(1、4−ジオキサン中4N、20ml)中に溶解し、得られた溶液を室温で2時間撹拌した。揮発性分を真空蒸発させ、こうして得られた残渣をジエチルエーテルで処理して、中間体9を固形物として得た(1.15g、100%、HCl)。
【0190】
[実施例A.10]
1−ベンジル−4−フェニル−ピペリジン−4−カルボン酸ベンジルエステル(中間体10)
【0191】
【化32】

【0192】
4−フェニル−4−ピペリジンカルボン酸4−メチルベンゼンスルホン酸塩(CAS83949−32−0)(2g、5.3mmol)、臭化ベンジル(0.76ml、6.36mmol)および炭酸カリウム(2.92g、21.2mmol)をアセトニトリル(6ml)中に懸濁し、15分間マイクロ波照射下で130℃で加熱した。冷却した反応物をケイソウ土のパッドに通してろ過した。このケイソウ土のパッドをアセトニトリル、EtOAcおよびジクロロメタンで洗浄した。合わせた有機ろ液を真空蒸発させて粗中間体10(2.04g、100%)を得、これをさらなる精製をしないで使用した。
【0193】
[実施例A.11]
(1−ベンジル−4−フェニル−ピペリジン−4−イル)−メタノール(中間体11)
【0194】
【化33】

【0195】
反応を窒素雰囲気下で行った。中間体10(2.04g、5.3mmol)を無水テトラヒドロフラン(25ml)中に懸濁し、この混合物を−78℃まで冷却した。水素化アルミニウムリチウム(テトラヒドロフラン中1M、7.95ml、7.95mmol)を滴下した。得られた反応混合物を徐々に室温まで温め、さらに2時間撹拌した。NH4Cl(飽和水溶液)を加え、反応混合物をまずはEtOAcで、次いで1−ヒドロキシブタンで抽出した。合わせた有機抽出物をNa2SO4で乾燥させ、真空蒸発させて粗中間体11(0.65g、43%)を得、これをさらなる精製をしないで使用した。
【0196】
[実施例A.12]
(4−フェニル−ピペリジン−4−イル)−メタノール(中間体12)
【0197】
【化34】

【0198】
反応を窒素雰囲気下で行った。中間体11(0.65g、2.31mmol)をメタノール(10ml)中に懸濁し、次いで、1,4−シクロヘキサジエン(2.17ml、23.1mmol)および10%パラジウム活性炭(0.65g)を加えた。得られた混合物を100℃で24時間シールドチューブ内で加熱した。冷却した反応混合物をケイソウ土のパッドに通してろ過した。このケイソウ土のパッドをメタノールとアンモニアで飽和させたメタノールの7N溶液とで順次洗浄した。合わせた有機ろ液を真空蒸発させて粗中間体12(0.47g、100%)を得、これをさらなる精製をしないで使用した。
【0199】
[実施例A.13]
1’−ブチル−4−ヒドロキシ−2’−オキソ−4−(4−クロロフェニル)−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(中間体13)
【0200】
【化35】

【0201】
アセトニトリル(2.5ml)中の中間体6(0.255g、1.39mmol)と4−(4−クロロフェニル)−4−ヒドロキシピペリジン(C.A.S.39512−49−7)(0.265g、1.25mmol)とN,N−ジイソプロピルエチルアミン(0.348ml、2mmol)との混合物に150℃で10分間マイクロ波照射した。この反応混合物をNaHCO3(飽和水溶液)で希釈し、DCMで抽出した。有機層をNa2SO4で乾燥させ、真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル;DCM〜DCM/EtOAc、9:1〜1:9)により精製した。所望の画分を採取し真空蒸発させて、中間体13(0.357g、93%)を得た。
【0202】
1’−ブチル−4−ヒドロキシ−2’−オキソ−4−(3−クロロフェニル)−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(中間体13a)
【0203】
【化36】

【0204】
中間体13aは、4−(3−クロロフェニル)−4−ヒドロキシピペリジンから開始したこと以外は、中間体13に関してのプロトコルに従って調製した。
【0205】
[実施例A.14]
1’−ブチル−4−フルオロエチルオキシ−2’−オキソ−4−(4−クロロフェニル)−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(中間体14)
【0206】
【化37】

【0207】
NaH(0.020g、0.5mmol、鉱油中60%)に0℃でDME(2ml)中の4−トルエンスルホン酸フルオロエチル(C.A.S.383−50−3)(0.063g、0.029mmol)を滴下した。この混合物を室温で15分撹拌した。次いで、DME(1ml)中の中間体13(0.1g、0.26mmol)を加え、反応物に150℃で15分間マイクロ波照射した。次いで、NH4Cl(飽和水溶液)を加えた。得られた混合物をAcOEtで抽出した。有機層をNa2SO4で乾燥させ、真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル;DCM〜DCM/EtOAc、9:1)により精製した。所望の画分を採取し、真空蒸発させて、中間体14(0.038g、34%)を得た。
【0208】
1’−ブチル−4−フルオロエチルオキシ−2’−オキソ−4−(3−クロロフェニル)−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(中間体14a)を調製するため、中間体14の調製に関するプロトコルに従って中間体13aを反応させる。
【0209】
[B.最終化合物の調製]
[実施例B.1]
1’−シクロプロピルメチル−4−フルオロ−2’−オキソ−4−フェニル−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(化合物1)
【0210】
【化38】

【0211】
アセトニトリル(3ml)中の中間体5(1.0g、4.84mmol)と中間体9(1.15g、5.33mmol)とN,N−ジイソプロピルエチルアミン(3.3ml、19.36mmol)との混合物に150℃で15分間マイクロ波照射した。この混合物を室温まで冷却し、溶媒を真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル;溶離液としてDCM〜DCM/MeOH(NH3)、5%まで)により精製した。所望の画分を採取し、真空蒸発させて、化合物1を淡い黄色の固形物として得た(0.874g、51%)。
【0212】
[実施例B.2]
1’−ブチル−4−フルオロ−2’−オキソ−4−フェニル−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(化合物2)
【0213】
【化39】

【0214】
アセトニトリル(3ml)中の中間体6(0.354g、1.39mmol)と中間体9(0.3g、1.39mmol)とN,N−ジイソプロピルエチルアミン(0.72ml、4.17mmol)との混合物に150℃で15分間マイクロ波照射した。この混合物を室温まで冷却し、溶媒を真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル;溶離液としてDCM〜DCM/MeOH(NH3)、10%まで)により精製した。所望の画分を採取し、真空蒸発させて、化合物2を淡いピンク色の固形物として得た(0.104g、21%)。
【0215】
[実施例B.3]
1’−シクロプロピルメチル−4−ヒドロキシメチル−2’−オキソ−4−フェニル−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(化合物3)
【0216】
【化40】

【0217】
アセトニトリル(3ml)中の中間体5(0.32g、1.3mmol)と中間体12(0.25g、1.3mmol)とN,N−ジイソプロピルエチルアミン(0.45ml、2.6mmol)との混合物に150℃で15分間マイクロ波照射した。この混合物を室温まで冷却し、溶媒を真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル;溶離液としてDCM〜DCM/MeOH(NH3)、10%まで)により精製した。所望の画分を採取し、真空蒸発させて、化合物3を油状物として得た(0.385g、81%)。
【0218】
[実施例B.4]
1’−ブチル−4−ヒドロキシメチル−2’−オキソ−4−フェニル−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(化合物4)
【0219】
【化41】

【0220】
アセトニトリル(2ml)中の中間体6(0.267g、1.04mmol)と中間体12(0.2g、1.04mmol)とN,N−ジイソプロピルエチルアミン(0.54ml、3.12mmol)との混合物に150℃で15分間マイクロ波照射した。この混合物を室温まで冷却し、溶媒を真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル;溶離液としてDCM〜DCM/MeOH(NH3)、10%まで)により精製した。所望の画分を採取し、真空蒸発させて、化合物4を淡い茶色の固形物として得た(0.100g、26%)。
【0221】
[実施例B.5]
1’−シクロプロピルメチル−4−フルオロメチル−2’−オキソ−4−フェニル−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(化合物5)
【0222】
【化42】

【0223】
反応を窒素雰囲気下で行った。予め−78℃まで冷却したジクロロメタン(30ml)中の三フッ化(ジエチルアミノ)硫黄(0.145ml、1.11mmol)の溶液にジクロロメタン(30ml)中の化合物3(0.385g、1.06mmol)の溶液を滴下した。次いで、得られた混合物を−78℃で1時間撹拌し、次いで、この反応混合物を室温まで温め、さらに30分間撹拌した。NaHCO3(飽和水溶液、90ml)を加え、この混合物を15分間撹拌した。有機層を分離し、3−クロロペルオキシ安息香酸(0.047g、0.27mmol)で処理し、30分間撹拌した。この反応混合物をNaHCO3(飽和水溶液)、水および塩水で順次洗浄した。有機層をNa2SO4で乾燥させ、真空蒸発させた。粗生成物を逆相分取HPLCにより精製し、化合物5(0.112g、29%)を得た。
【0224】
[実施例B.6]
1’−ブチル−4−フルオロメチル−2’−オキソ−4−フェニル−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(化合物6)
【0225】
【化43】

【0226】
反応を窒素雰囲気下で行った。予め−78℃まで冷却したジクロロメタン(15ml)中の三フッ化(ジエチルアミノ)硫黄(0.075ml、0.57mmol)の溶液にジクロロメタン(15ml)中の化合物4(0.20g、0.54mmol)の溶液を滴下した。次いで、得られた混合物を−78℃で1時間撹拌し、次いで、この反応混合物を室温まで温め、さらに30分間撹拌した。NaHCO3(飽和水溶液、90ml)を加え、この混合物を15分間撹拌した。有機層を分離し、3−クロロペルオキシ安息香酸(0.024g、0.14mmol)で処理し、30分間撹拌した。反応混合物をNaHCO3(飽和水溶液)、水および塩水で順次洗浄した。有機層をNa2SO4で乾燥させ、真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル;溶離液としてDCM〜DCM/EtOAc、20%まで)により精製した。所望の画分を採取し、真空蒸発させて、化合物6を白色の固形物として得た(0.035g、17%)。
【0227】
[実施例B.7]
1’−ブチル−4−フルオロエチルオキシ−2’−オキソ−4−フェニル−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(化合物7)
【0228】
【化44】

【0229】
メタノール(2ml)中の中間体14(0.038g、0.09mmol)およびトリエチルアミン(0.025ml、0.18mmol)の溶液を、室温で10%パラジウム活性炭(0.005g)の存在下で2時間水素化した。固形物をろ去し、ろ液を蒸発乾固させた。次いで、この粗反応混合物をカラムクロマトグラフィー(シリカゲル;溶離液としてDCM〜DCM/MeOH、1%まで)により精製した。所望の画分を採取し、真空蒸発させて、化合物7(0.019g、53%)を得た。
【0230】
化合物7を調製する別の方法として、上記プロトコルに従って中間体14aを反応させる。
【0231】
[実施例B.8]
3−シアノ−1−シクロプロピルメチル−4−(4−フェニル−ピペリジン−1−イル)−ピリジン−2(1H)−オン(化合物8)
【0232】
【化45】

【0233】
アセトニトリル(5ml)中の中間体5(0.3g、1.18mmol)と4−フェニルピペリジン(0.286g、1.77mmol)とジイソプロピルエチルアミン(0.615ml、3.54mmol)との混合物に150℃で20分間マイクロ波照射した。この混合物を室温まで冷却し、溶媒を真空蒸発させた。こうして得られた残渣をフラッシュクロマトグラフィー(SiO2、DCM/MeOH(NH3)混合物)により精製して所望の化合物を得た。次いで、この化合物をエチルエーテルから再結晶させて化合物8を得た(0.29g、73%)。
【0234】
化合物9は、化合物8に関して記載のプロトコルに従って調製した。
【0235】
表1は、上記の実施例の1つ(実施例番号)に従って調製された式(I)の化合物を記載している。
【0236】
【化46】

【0237】
【表5】

【0238】
[C.分析の部]
本発明の化合物のLCMS特性解析に関して下記の方法を使用した。
【0239】
[LCMS−基本手順]
HPLC測定は、下記それぞれの方法において規定されているように脱気装置付きポンプ(クォータナリまたはバイナリ)、オートサンプラー、カラムオーブン、ダイオードアレー検出器(DAD)およびカラムを有するアジレントテクノロジー社(Agilent Technologies)からのHP1100を用いて行った。カラムからの流れはMS検出器に分配された。このMS検出器はエレクトロスプレーイオン化源が装備されていた。窒素をネブライザーガスとして使用した。イオン化源温度を140℃に維持した。データ収集はMassLynx−Openlynxソフトウェアで行った。
【0240】
[方法1]
上記基本手順に加えて、アギレント社(Agilent)からのXDB−C18カートリッジ(1.8μm、2.1×30mm)上で1ml/分の流量および60℃で逆相HPLCを行なった。用いた勾配条件は次のとおりである。A(0.5g/lの酢酸アンモニウム溶液)を90%、B(アセトニトリル)を5%、C(メタノール)を5%から、6.5分でBを50%およびCを50%まで、7分時点でBを100%まで、そして7.5分時点で初期条件まで平衡化し9.0分まで維持した。注入量は2μlであった。高分解能質量スペクトル(飛行時間、TOF)は、0.1秒の滞留時間を用いて0.5秒で100から750まで走査することにより陽イオン化モードでのみ得られた。キャピラリーニードル電圧は2.5kVであり、コーン電圧は20Vであった。ロイシン−エンケファリンが質量較正(ロックマス)に用いた標準物質であった。
【0241】
[方法2]
上記基本手順に加えて、フェノメネックス社(Phenomenex)からのLUNA−C18カラム(2.5μm、2.1×30mm)上で1.0ml/分の流量および60℃で逆相HPLCを行なった。用いた勾配条件は次のとおりである。A(0.5g/lの酢酸アンモニウム溶液)を90%、B(アセトニトリル)を5%、C(メタノール)を5%から、6.5分でBを50%およびCを50%まで、7分時点でBを100%まで、そして7.5分時点で初期条件まで平衡化し9.0分まで維持した。注入量は5μlであった。高分解能質量スペクトル(飛行時間、TOF)は、0.1秒の滞留時間を用いて0.5秒で100から750まで走査することにより陽イオン化モードでのみ得られた。キャピラリーニードル電圧は陽イオン化モード用では2.5kVであり、コーン電圧は20Vであった。ロイシン−エンケファリンが質量較正(ロックマス)に用いた標準物質であった。
【0242】
[方法3]
上記基本手順に加えて、アドバンスドクロマトグラフィーテクノロジーズ社(Advanced Chromatography Technologies)からのACE−C18カラム(3.0μm、4.6×30mm)上で1.5ml/分の流量および40℃で逆相HPLCを行った。用いた勾配条件は次のとおりである。A(0.5g/lの酢酸アンモニウム溶液)を80%、B(アセトニトリル)を10%、C(メタノール)を10%から、6.5分でBを50%およびCを50%まで、7分時点でBを100%まで、そして7.5分時点で初期条件まで平衡化し9.0分まで維持した。注入量は5μlであった。高分解能質量スペクトル(飛行時間、TOF)は、0.1秒の滞留時間を用いて0.5秒で100から750まで走査することにより陽イオン化モードでのみ得られた。キャピラリーニードル電圧は陽イオン化モード用では2.5kVであり、コーン電圧は20Vであった。ロイシン−エンケファリンが質量較正(ロックマス)に用いた標準物質であった。
【0243】
[融点測定]
融点測定はメトラーFP62装置上で行なわれた。
【0244】
【表6】

【0245】
[D.薬理例]
本発明で提供される化合物は、mGluR2のポジティブアロステリックモジュレーターである。当該化合物は、グルタミン酸塩(エステル)結合部位以外のアロステリック部位に結合することによりグルタミン酸塩(エステル)応答を増強させると考えられる。式(I)の化合物が存在すると、グルタミン酸塩(エステル)濃度に対応するmGluR2の応答が増加される。式(I)の化合物は、受容体の機能を増強する能力によって実質的にmGluR2においてその効果を有すると考えられる。下記の[35S]GTPγS結合アッセイ法を用いてmGluR2において試験されたポジティブアロステリックモジュレーターの挙動を表3に示す。このアッセイ法は、そのような化合物(特に式(I)の化合物)の同定に適している。
【0246】
[35S]GTPγS結合アッセイ
[35S]GTPγS結合アッセイは、Gタンパク質共役型受容体(GPCR)の機能の研究に用いられる機能性の細胞膜に基づくアッセイであり、これによりGTPの非加水分解性形態である[35S]GTPγS(ガンマ線を放射する35Sで標識されたグアノシン5’−三リン酸)の取り込みが測定される。Gタンパク質γサブユニットは、グアノシン三リン酸(GTP)によりグアノシン5’−二リン酸(GDP)の交換を触媒し、アゴニスト([35S]GTPγS)によりGPCRが活性化された場合に取り込まれて交換サイクルを継続するための開裂ができなくなる(ハーパー(Harper)(1998年)「カレントプロトコルズ・イン・ファーマコロジー(Current Protocols in Pharmacology)」2.6.1−10、ジョンワイリーアンドサンズ社(John Wiley & Sons, Inc.))。放射性[35S]GTPγSの取り込み量はGタンパク質の活性の直接的な尺度であり、したがってアゴニストの活性を測定できる。mGluR2受容体は、Gγiタンパク質に優先的に共役することが示されており(本方法のための優先的な共役)、したがって組み換え細胞株中そして組織中の両方でmGluR2受容体の受容体活性化を研究するために広く使用されている(シャフハウザー(Schaffhauser)ら(2003年)、ピンカートン(Pinkerton)ら(2004年)、ムテル(Mutel)ら1998年「ジャーナル・オブ・ニューロケミストリー(Journal of Neurochemistry)」71:2558〜64;シャフハウザーら(1998年)「モレキュラーファーマコロジー(Molecular Pharmacology)」53:228〜33)。ここでは、我々は、本発明の化合物のポジティブアロステリック修飾(PAM)特性を検出するために、ヒトmGluR2受容体でトランスフェクトされシャフハウザーら(2003年)「(モレキュラーファーマコロジー」4:798〜810から作成された細胞に由来する細胞膜を用いた[35S]GTPγS結合アッセイの使用を記載する。
【0247】
[細胞膜調製]
CHO細胞をプレコンフルエントまで培養し5mMの酪酸で24時間刺激した後、PBS中で洗浄し、次いで、均質化用緩衝液(50mMトリス−HCl緩衝液、pH7.4、4℃)中ですくい取って採取した。細胞溶解物をウルトラタラックスホモジナイザーを用いて短時間(15秒)均質化した。ホモジネートを23500×gで10分間遠心分離し、そして上清を廃棄した。ペレットを5mMトリス−HCl(pH7.4)に再懸濁し、再び遠心分離した(30000×g、20分、4℃)。最終的なペレットを50mM HEPES(pH7.4)に再懸濁し、使用前は適切なアリコート中で−80℃で保存した。タンパク質濃度をウシ血清アルブミンを標準としてブラッドフォード法(バイオラッド社(Bio-Rad)、米国)により測定した。
【0248】
[35S]GTPγS結合アッセイ
ヒトmGluR2を含む細胞膜における試験化合物のmGluR2のポジティブアロステリック修飾活性の測定は、前培養前に解凍され短時間均質化された凍結細胞膜を用いて、96ウェルマイクロプレート(15μg/アッセイウェル、30分、30℃)中でポジティブアロステリックモジュレーターの濃度を増加させながら(0.3nMから50μMまで)所定の最小濃度のグルタミン酸塩(エステル)を加える(PAMアッセイ)かまたはグルタミン酸塩(エステル)を加えないでアッセイ緩衝液(50mM HEPES(pH7.4)、100mM NaCl、3mM MgCl2、50μM GDP、10μg/mlサポニン)中で行った。このPAMアッセイのため、細胞膜はEC25の濃度(すなわちグルタミン酸塩(エステル)の最大応答の25%が得られ、出版済みデータ(ピン(Pin)ら(1999年)ヨーロピアン・ジャーナル・オブ・ファーマコロジー(Eur. J. Pharmacol.)375:277〜294)と一致する濃度)のグルタミン酸塩(エステル)で前培養された。[35S]GTPγS(0.1nM、f.c.)を加えて総反応容量を200μlとした後、マイクロプレートを短時間振とうし、さらに培養して、活性化させて[35S]GTPγSを取り込ませた(30分、30℃)。96ウェルプレートセルハーベスター(フィルターメート、パーキンエルマー社、米国)を用いてグラスファイバーフィルタープレート(ユニフィルター96ウェルGF/Bフィルタープレート、パーキンエルマー社、ダウナーズグローヴ、米国)マイクロプレート上で急速に真空ろ過し、次いで、300μlの氷冷した洗浄用緩衝液(10mM Na2PO4・2H2O、10mM NaH2PO4・H2O、pH7.4)で3回洗浄することにより反応を停止させた。次いで、フィルターを風乾し、各ウェルに40μlの液体シンチレーションカクテル(Microscint-O)を加え、細胞膜に結合した[35S]GTPγSを96ウェルシンチレーションプレートリーダー(トップカウント、パーキンエルマー社、米国)中で測定した。非特異的[35S]GTPγS結合は、10μMの冷GTPの存在下で測定される。各曲線は、データ点毎に試料をデュプリケートで用いて11種類の濃度で少なくとも1度作成した。
【0249】
[データ分析]
ポジティブアロステリック修飾(PAM)を調べるため、添加されたEC25のmGluR2アゴニストグルタミン酸の存在下での本発明の代表的な化合物の濃度応答曲線をプリズムグラフパッドソフトウェア(グラフパッド社(GraphPad)、サンディエゴ、米国)を用いて作成した。当該曲線は4変数ロジスティック方程式
【0250】
【数1】

【0251】
にフィッティングされ、EC50値が決定された。EC50は、グルタミン酸塩(エステル)応答の増強の最大半量をもたらす化合物濃度である。これは、ポジティブアロステリックモジュレーターの非存在下のグルタミン酸塩(エステル)応答から完全飽和濃度のポジティブアロステリックモジュレーターの存在下のグルタミン酸塩(エステル)の最大応答を引くことにより計算される。次いで、最大半量効果を生む濃度をEC50として求める。
【0252】
[表3:本発明の化合物に関する薬理学的データ]
すべての化合物を所定のEC25濃度のmGluR2アゴニスト(グルタミン酸塩(エステル))の存在下で試験して、ポジティブアロステリック修飾(GTPγS−PAM)を調べた。示されている値は、少なくとも1つの実験からの11種類の濃度応答曲線のデュプリケートの値の平均である。試験化合物はすべて5.0を超えるpEC50(−logEC50)値を示した。1実験におけるpEC50値の測定誤差は約0.3log単位であると推測される。
【0253】
【表7】

【0254】
[E.組成物例]
これらの実施例にわたって用いられる「有効成分」は、式(I)の最終化合物、その薬学的に許容される塩、その溶媒和物および立体化学的異性体形態に関する。
【0255】
本発明の製剤の代表的な処方例は以下のとおりである。
【0256】
1.錠剤
有効成分 5〜50mg
第二リン酸カルシウム 20mg
ラクトース 30mg
滑石 10mg
ステアリン酸マグネシウム 5mg
バレイショデンプン 200mgまで
この実施例において、有効成分は、同じ量の本発明の化合物のいずれとも、特に、同じ量の例示された化合物のいずれとも置き換えられ得る。
【0257】
2.懸濁剤
1ミリリットル毎に有効化合物1種を1〜5mg、カルボキシルメチルセルロースナトリウムを50mg、安息香酸ナトリウムを1mg、ソルビトールを500mg、および水を1mlまで含むように経口投与用水性懸濁剤が調製される。
【0258】
3.注射剤
非経口組成物は、10容量%のプロピレングリコール水溶液中で1.5重量%の本発明の有効成分を撹拌することにより調製される。
【0259】
4.軟膏
有効成分 5〜1000mg
ステアリルアルコール 3g
ラノリン 5g
白色ワセリン 15g
水 100gまで
この実施例において、有効成分は、同じ量の本発明の化合物のいずれとも、特に、同じ量の例示された化合物のいずれとも置き換えられ得る。
【0260】
妥当な変更は本発明の範囲から逸脱すると見なされるべきではない。上記発明は当業者によって様々に変更される可能性があることは明らかである。
【技術分野】
【0001】
本発明は、代謝型グルタミン酸受容体サブタイプ2(「mGluR2」)のポジティブアロステリックモジュレーターであり、かつグルタミン酸機能障害と関連する神経および精神障害ならびに代謝型受容体のmGluR2サブタイプが関与する疾患の治療または予防に有用である新規なピリジン−2−オン誘導体に関する。本発明はまた、このような化合物を含む医薬組成物、このような化合物およびこのような組成物の調製方法、ならびにmGluR2が関与する神経障害および精神障害および疾病の予防または治療のためのこのような化合物の使用に関する。
【背景技術】
【0002】
グルタミン酸塩(エステル)は、哺乳類の中枢神経系における主要なアミノ酸神経伝達物質である。グルタミン酸塩(エステル)は、学習および記憶だけでなく、知覚、シナプス可塑性の発達、運動制御、呼吸、および心臓血管機能の調節などの多くの生理機能に大きな役割を果たす。さらにグルタミン酸塩(エステル)は、グルタミン酸神経伝達の不均衡が存在する様々な神経疾患および精神病の中核をなす。
【0003】
グルタミン酸塩(エステル)は、イオンチャネル型グルタミン酸受容体チャネル(iGluR)ならびに急速な興奮性伝達に関与するNMDA受容体、AMPA受容体およびカイニン酸受容体の活性化を通じてシナプス神経伝達を仲介する。
【0004】
加えて、グルタミン酸塩(エステル)は、シナプス効果の微調整に寄与するさらに修飾的な役割を有する代謝型グルタミン酸受容体(mGluR)を活性化する。
【0005】
グルタミン酸塩(エステル)は、本明細書ではオルソステリック結合部位と呼ばれる受容体の大きな細胞外N末端ドメインへ結合することによってmGluRを活性化する。この結合は受容体における構造変化を引き起こし、Gタンパク質および細胞内シグナル伝達経路の活性化をもたらす。
【0006】
mGluR2サブタイプは、Gαiタンパク質の活性化を介してアデニル酸シクラーゼと負の結合(negatively coupled)をし、その活性化はシナプスにおけるグルタミン酸放出の阻害を引き起こす。中枢神経系(CNS)において、mGluR2受容体は主に、皮質、視床領域、副嗅球、海馬、扁桃、尾状核被殻および側坐核にわたって豊富にある。
【0007】
mGluR2の活性化は不安障害の治療に効果的であることが臨床試験で示された。さらに、様々な動物モデルにおいてmGluR2の活性化が有効なことが示され、したがって、統合失調症、てんかん、中毒/薬物依存症、パーキンソン病、疼痛、睡眠障害およびハンチングトン病の新規な治療手段である可能性があることを示している。
【0008】
現在まで、mGluRを標的とする利用可能な薬理学的手段のほとんどは、mGluRファミリーのいくらかのメンバーを活性化するオルソステリックリガンド(グルタミン酸塩(エステル)の構造的アナログであるので)である。
【0009】
mGluRにおいて作用する選択的化合物を開発するための新規な経路としては、高度に保存されたオルソステリック結合部位とは異なる部位に結合することによって受容体を修飾するアロステリック機構を通して作用する化合物を同定することである。
【0010】
mGluRのポジティブアロステリックモジュレーターは、新規な薬理学的存在として最近になって出現し、この魅力的な選択肢を提供している。種々の化合物がmGluRのポジティブアロステリックモジュレーターとして記載されている。
【0011】
WO2004/092135(NPS社およびアストラゼネカ社)(特許文献1)、WO2004/018386(特許文献2)、WO2006/014918(特許文献3)およびWO2006/015158(メルク社)(特許文献4)、WO2001/56990(イーライリリー社)(特許文献5)ならびにWO2006/030032(アデックス社およびヤンセンファーマ社)(特許文献6)は、それぞれフェニルスルホンアミド、アセトフェノン、インダノン、ピリジルメチルスルホンアミドおよびピリジノン誘導体をmGluR2のポジティブアロステリックモジュレーターとして記載している。具体的に開示された化合物はいずれも本発明の化合物とは構造的に関連していない。
【0012】
WO2007/104783(特許文献7)は、代謝型受容体サブタイプ2(「mGluR2」)のポジティブアロステリックモジュレーターである1,4−二置換3−シアノ−ピリドン誘導体を記載している。
【0013】
このような化合物は、自身は受容体を活性化しないことが示され、むしろ、このような化合物は、受容体のみでは最小応答が誘発されるグルタミン酸塩(エステル)濃度に対して最大応答を受容体に奏させることができる。変異解析では、mGluR2のポジティブアロステリックモジュレーターの結合はオルソステリック部位では起こらず、むしろ受容体の7回膜貫通型領域内に位置するアロステリック部位で起きることがはっきりと示された。
【0014】
動物データは、mGluR2のポジティブアロステリックモジュレーターが不安症および精神病モデルにおいて、オルソステリックアゴニストで得られたものに類似する効果があることを示唆している。mGluR2のアロステリックモジュレーターは、恐怖増強的驚愕、およびストレス誘発性異常高熱の不安症モデルにおいて活性があることが示された。さらに、このような化合物は、ケタミンまたはアンフェタミン誘発性の運動過剰の改善ならびにアンフェタミン誘発性の聴覚性驚愕効果のプレパルス阻害の破壊を伴う統合失調症モデルの改善において活性があることが示された(「ジャーナル・オブ・ファーマコロジー・アンド・エクスペリメンタルセラピーズ(J. Pharmacol. Exp. Ther.)」2006年、318、173〜185(非特許文献1);「サイコファーマコロジー(Psychopharmacology)」2005年、179、271〜283)(非特許文献2)。
【0015】
最近の動物研究はさらに、代謝型グルタミン酸受容体サブタイプ2であるビフェニル−インダノン(BINA)の選択的なポジティブアロステリックモジュレーターは幻覚剤の精神病モデルをブロックすることを示し、これは統合失調症におけるグルタミン酸作動性機能障害の治療のためのmGluR2受容体を標的化する戦略をサポートするものである(「モレキュラーファーマコロジー(Mol. Pharmacol.)」2007年、72、477〜484(非特許文献3))。
【先行技術文献】
【特許文献】
【0016】
【特許文献1】国際公開第2004/092135号パンフレット
【特許文献2】国際公開第2004/018386号パンフレット
【特許文献3】国際公開第2006/014918号パンフレット
【特許文献4】国際公開第2006/015158号パンフレット
【特許文献5】国際公開第2001/56990号パンフレット
【特許文献6】国際公開第2006/030032号パンフレット
【特許文献7】国際公開第2007/104783号パンフレット
【非特許文献】
【0017】
【非特許文献1】ジャーナル・オブ・ファーマコロジー・アンド・エクスペリメンタルセラピーズ(J. Pharmacol. Exp. Ther.)、2006年、318、173〜185.
【非特許文献2】サイコファーマコロジー(Psychopharmacology)、2005年、179、271〜283.
【非特許文献3】モレキュラーファーマコロジー(Mol. Pharmacol.)、2007年、72、477〜484
【発明の概要】
【発明が解決しようとする課題】
【0018】
ポジティブアロステリックモジュレーターは、グルタミン酸塩(エステル)応答を増強できるが、LY379268またはDCG−IVなどのオルソステリックmGluR2アゴニストに対する応答を増強することも示されている。これらのデータは、mGluR2が関連する上記の神経障害および精神障害を治療するための、mGluR2のポジティブアロステリックモジュレーターとmGluR2のオルソステリックアゴニストとの組み合わせを用いるさらに別の新規な治療手法の根拠を示す。
【課題を解決するための手段】
【0019】
本発明の化合物は、3位がシアノそして4位がピペリジン−1−イル(このピペリジン−1−イルの4位はフェニルで置換されている)で置換された中心にあるピリジン−2−オン部分を特徴とする。本発明の化合物は、強力なmGluR2のポジティブアロステリックモジュレーターである。
【0020】
発明の説明
本発明は、代謝型グルタミン酸受容体2修飾活性を有する化合物に関する。本発明は式(I)の化合物(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物を提供し、
【0021】
【化1】

【0022】
式中、R1はC4-6アルキル、またはC3-7シクロアルキルで置換されたC1-3アルキルであり;
R2は水素;フルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシである。
【発明を実施するための形態】
【0023】
本発明はまた、ヒトを含む哺乳類における症状の治療または予防(特に治療)用薬剤の製造のための式(I)の化合物あるいはその任意のサブグループの使用に関し、この症状の治療または予防は、mGluR2のアロステリックモジュレーター(特にポジティブアロステリックモジュレーター)の神経修飾効果により作用されるかまたは促進される。
【0024】
本発明の一実施形態は、式(I)の化合物(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物であり、
【0025】
【化2】

【0026】
式中、R1はC4-6アルキル、またはC3-7シクロアルキルで置換されたC1-3アルキルであり、
R2は水素;フルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシであるが、但し上記化合物は下記のもの以外である。
【0027】
【化3】

【0028】
および
【0029】
【化4】

【0030】
本発明の一実施形態は、R1がC4-6アルキル、特にC4-5アルキル、例えば、1−ブチル、2−メチル−1−プロピル、3−メチル−1−ブチル、特に1−ブチルである式(I)の化合物である。
【0031】
本発明の一実施形態は、R1がC3-7シクロアルキルで置換されたC1-3アルキル、特にシクロプロピルメチルまたは2−(シクロプロピル)−1−エチルである式(I)の化合物である。
【0032】
本発明の一実施形態は、R2が水素である、実施形態として上記された式(I)の化合物またはその任意のサブグループである。
【0033】
本発明の一実施形態は、R2がフルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシである、実施形態として上記された式(I)の化合物または、可能な場合は常に、その任意のサブグループである。
【0034】
本発明の一実施形態は、R2が水素;フルオロ;またはフルオロで置換されたC1-4アルキルオキシであり;特にR2がフルオロまたはフルオロで置換されたC1-4アルキルオキシである、実施形態として上記された式(I)の化合物または、可能な場合は常に、その任意のサブグループである。
【0035】
本発明の一実施形態は、R2がフルオロである、実施形態として上記された式(I)の化合物またはその任意のサブグループである。
【0036】
本発明の一実施形態は、R2がヒドロキシルで置換されたC1-4アルキル、特にR2がヒドロキシルで置換されたメチルである、実施形態として上記された式(I)の化合物または、可能な場合は常に、その任意のサブグループである。
【0037】
本発明の一実施形態は、R2がフルオロで置換されたC1-4アルキル、特にR2がフルオロで置換されたメチルである、実施形態として上記された式(I)の化合物または、可能な場合は常に、その任意のサブグループである。
【0038】
本発明の一実施形態は、R2がフルオロで置換されたC1-4アルキルオキシ、特にR2がフルオロで置換されたエチルオキシである、実施形態として上記された式(I)の化合物または、可能な場合は常に、その任意のサブグループである。
【0039】
本発明の一実施形態は、R1がC4-6アルキル、特に1−ブチルもしくは3−メチル−1−ブチル;またはC3-7シクロアルキルで置換されたC1-3アルキル、特にシクロプロピルメチルであり;
R2が水素;フルオロ;ヒドロキシルで置換されたC1-4アルキル、特にヒドロキシルで置換されたメチル;フルオロで置換されたC1-4アルキル、特にフルオロで置換されたメチル;またはフルオロで置換されたC1-4アルキルオキシ、特にフルオロで置換されたエチルオキシである、式(I)の化合物あるいはその薬学的に許容される塩またはその溶媒和物である。
【0040】
本発明の一実施形態は、R1がC4-6アルキル、特に1−ブチル;またはC3-7シクロアルキルで置換されたC1-3アルキル、特にシクロプロピルメチルであり;
R2がフルオロ;ヒドロキシルで置換されたC1-4アルキル、特にヒドロキシルで置換されたメチル;またはフルオロで置換されたC1-4アルキル、特にフルオロで置換されたメチル;またはフルオロで置換されたC1-4アルキルオキシ、特にフルオロで置換されたエチルオキシである、式(I)の化合物あるいはその薬学的に許容される塩またはその溶媒和物である。
【0041】
本発明の一実施形態は下記から選ばれる式(I)の化合物あるいはその薬学的に許容される塩またはその溶媒和物である。
【0042】
【化5】

【0043】
【表1】

【0044】
本発明の一実施形態は下記から選ばれる式(I)の化合物あるいはその薬学的に許容される塩またはその溶媒和物である。
【0045】
【化6】

【0046】
【表2】

【0047】
上記または下記に用いられるように、基または基の一部としてのC1-3アルキルなる記載は、メチル、エチル、1−プロピルおよび1−メチル−1−エチルなどの、飽和し、直鎖または分岐鎖であり、1〜3個の炭素原子を有する炭化水素ラジカルを規定する。
【0048】
上記または下記に用いられるように、基または基の一部としてのC1-4アルキルなる記載は、メチル、エチル、プロピル、1−メチル−1−エチル、1−ブチル、2−メチル−1−プロピルなどの、飽和し、直鎖または分岐鎖であり、1〜4個の炭素原子を有する炭化水素ラジカルを規定する。好ましくは、C1-4アルキルはメチルを表す。
【0049】
上記または下記に用いられるように、基または基の一部としてのC4-6アルキルなる記載は、1−ブチル、2−メチル−1−プロピル、1−ペンチル、2−メチル−1−ブチル、3−メチル−1−ブチル、1−ヘキシルなどの、飽和し、直鎖または分岐鎖であり、4〜6個の炭素原子を有する炭化水素ラジカルを規定する。
【0050】
上記または下記に用いられるように、基または基の一部としてのC4-5アルキルなる記載は、1−ブチル、2−メチル−1−プロピル、1−ペンチル、2−メチル−1−ブチル、3−メチル−1−ブチルなどの、飽和し、直鎖または分岐鎖であり、4個または5個の炭素原子を有する炭化水素ラジカルを規定する。
【0051】
上記または下記に用いられるように、C3-7シクロアルキルなる記載は、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシルおよびシクロヘプチルなどの、飽和した3〜7個の炭素原子を有する環式炭化水素ラジカルを規定する。好ましくは、C3-7シクロアルキルはシクロプロピルを表す。
【0052】
治療上の使用に関して、式(I)の化合物の塩とは、対イオンが薬学的に許容されるものである。しかしながら、薬学的に許容されるものではない酸および塩基の塩もまた、例えば、薬学的に許容される化合物の調製または精製に用いられる可能性がある。薬学的に許容されてもされなくても塩はすべて本発明の範囲内に包含される。
【0053】
上記薬学的に許容できる塩は、式(I)の化合物が形成することができる治療上効果のある非毒性の酸付加塩形態を含むと定義される。当該塩は、式(I)の化合物の塩基形態を適切な酸、例えば、無機酸(例えば、ハロゲン化水素酸、特に、塩化水素酸、臭化水素酸、硫酸、硝酸およびリン酸);有機酸(例えば、酢酸、ヒドロキシ酢酸、プロパン酸、乳酸、ピルビン酸、シュウ酸、マロン酸、コハク酸、マレイン酸、フマル酸、リンゴ酸、酒石酸、クエン酸、メタンスルホン酸、エタンスルホン酸、ベンゼンスルホン酸、p−トルエンスルホン酸、シクラミン酸、サリチル酸、p−アミノサリチル酸およびパモ酸)で処理することにより得ることができる。
【0054】
逆に、当該酸性塩形態は、適切な塩基で処理することにより遊離塩基形態に変換することができる。
【0055】
酸性プロトンを含む式(I)の化合物はまた、適切な有機および無機塩基で処理することにより、治療効果があり非毒性であるそれらの塩基性塩形態に変換され得る。適切な塩基性塩形態としては、例えば、アンモニウム塩、アルカリおよびアルカリ土類金属塩(特に、リチウム、ナトリウム、カリウム、マグネシウムおよびカルシウム塩)、有機塩基(例えば、ベンザチン、N−メチル−D−グルカミン)との塩、ヒブラミン塩、ならびにアミノ酸(例えば、アルギニンおよびリジン)との塩が挙げられる。
【0056】
逆に、当該塩基性塩形態は、適切な酸で処理することにより遊離酸形態に変換することができる。
【0057】
式(I)の化合物の薬学的に許容される酸付加塩形態は、式(I)の化合物の薬学的に許容される好ましい塩形態である。
【0058】
溶媒和物なる語は、式(I)の化合物が形成することができる溶媒付加形態およびその薬学的に許容される塩形態を包含する。このような溶媒付加形態の例としては、例えば、水和物、アルコラートなどが挙げられる。
【0059】
なお、式(I)化合物ならびにその塩および溶媒和物のうちのいくつかは、1つ以上のキラル中心を含み立体化学的異性体形態として存在し得る。
【0060】
上記に用いられるような「立体化学的異性体形態」なる語は、式(I)の化合物が有し得る考えられる異性体をすべて規定する。特に記載または表示が無ければ、化合物の化学名称は、考えられるすべての立体化学的異性体形態の混合物を表わし、当該混合物は、基本となる分子構造のジアステレオマーおよびエナンチオマーをすべて含む。しかし本発明はまた、他の異性体を実質的に含まない(すなわち、10%未満、好ましくは5%未満、特に2%未満、最も好ましくは1%未満の他の異性体を伴う)式(I)の単一の異性体形態およびその塩または溶媒和物のそれぞれも包含する。したがって、式(I)の化合物が例えば(R)と明記される場合、これはこの化合物が(S)異性体を実質的に含まないことを意味する。
【0061】
特に、立体中心はR配置またはS配置を有する可能性があり、二価の環式(部分)飽和ラジカル上の置換基はシス配置またはトランス配置のいずれかを有する可能性がある。
【0062】
CAS命名法の取り決めに従って、化合物中に既知の絶対配置の立体中心が2つ存在する場合、最も小さい数字のキラル中心(すなわち標準となる中心)に対してRまたはSの表示が割り当てられる(カーン−インゴールド−プレログ順位則に基づく)。第2の立体中心の配置は、相対的な記述子[R*、R*]または[R*、S*]を用いて示され、ここでR*は常に標準となる中心として特定され、[R*、R*]は同一のキラリティーの中心を示し、[R*、S*]は異なるキラリティーの中心を示す。例えば、化合物中の最も数字の小さいキラル中心がS配置をとり2番目の中心がR配置の場合、その立体表示は、S−[R*、S*]と特定されることになる。「α」および「β」が用いられる場合、最も少ない環番号を有する環系における非対称炭素原子上の最も優先順位が高い置換基の位置は、任意的に常に環系により決定される平均面の「α」位置にある。環系におけるもう一方の非対称炭素原子上の優先順位が最も高い置換基(式(I)の化合物における水素原子)の位置は、基準原子上における優先順位が最も高い置換基の位置に対して、それが環系により決定される平均面の同じ側にある場合、「α」と特定され、またはそれが環系により決定される平均面の反対側にある場合、「β」と特定される。
【0063】
「式(I)の化合物」なる語またはその任意のサブグループは、以下で用いられる場合は常にそれらの立体化学的異性体形態、それらの薬学的に許容される塩およびそれらの溶媒和物も含むように意図されている。立体化学的に純粋な式(I)の化合物が特に興味深い。
【0064】
本出願の範囲内では、元素(特に、式(I)の化合物に関して言及された場合)はこの元素の全ての同位体および同位体混合物を包含し、天然に存在しても合成されても、天然に豊富にあってもまた同位体的に濃縮された形態であってもよい。特に、水素に言及する場合、1H、2H、3Hまたはこれらの混合物を指すと理解され、炭素に言及する場合、11C、12C、13C、14Cまたはこれらの混合物を指すと理解され、窒素に言及する場合、13N、14N、15Nまたはこれらの混合物を指すと理解され、酸素に言及する場合、14O、15O、16O、17O、18Oまたはこれらの混合物を指すと理解され、かつフルオロに言及する場合、18F、19Fまたはこれらの混合物を指すと理解される。したがって本発明の化合物はまた、1種以上の元素の1種以上の同位体を有する化合物およびその混合物を包含する(1個以上の非放射性原子がその放射性同位体の1個以上と置換されている放射性標識化合物とも呼ばれる放射性化合物を含む)。特に、放射性原子は、水素、炭素、窒素、硫黄、酸素およびハロゲンからなる群から選ばれる。好ましくは放射性原子は、水素、炭素およびハロゲンからなる群から選ばれる。特に、放射性同位体は、3H、11C、18F、122I、123I、125I、131I、75Br、76Br、77Brおよび82Brからなる群から選ばれる。好ましくは放射性同位体は、3H、11Cおよび18Fからなる群から選ばれる。
【0065】
定義のものの一覧から置換基をそれぞれ独立して選択することができるということが上記または下記に適用される場合は常に、化学的に可能性のあるすべての組み合わせが意図される。
【0066】
一般に、式(I)の化合物は下記の実験手順1〜4に従って調製することができる。
【0067】
[実験手順1]
式(I)の化合物は、反応スキーム(1)に従って式(II)の中間体(式中Yは、例えば、F3C−S(=O)2−O−またはハロ(例えば、臭素など)などの適切な脱離基を表す)を式(III)の中間体と反応させることにより調製することができる。この反応は、適切な反応不活性溶媒(例えば、ジメトキシエタンまたはアセトニトリルなど)中で適切な塩基(例えば、Cs2CO3またはN、N−ジイソプロピルエチルアミンなど)の存在下で加熱条件下(例えば、150℃でマイクロ波照射下で15分間反応混合物を加熱する)で行うことができる。
【0068】
反応スキーム(1)に記載の反応はまた、適切な反応不活性溶媒(例えば、1,4−ジオキサンなど)中で適切な塩基(例えば、K3PO4など)および適切な触媒(例えば
【0069】
【化7】

【0070】
などのPd錯体触媒)の存在下で加熱条件下(例えば、80℃で12時間反応混合物を加熱する)で行うことができる。
【0071】
反応スキーム(1)では、すべての変数は式(I)に関してと同様に規定される。
【0072】
【化8】

【0073】
[実験手順2]
R2がフルオロで置換されたC1-4アルキルを表し、このC1-4アルキルがLで表される式(I)の化合物(当該化合物は式(I−a)で表される)は、R2がヒドロキシルで置換されたC1-4アルキルを表す式(I)の化合物(当該化合物は式(I−b)で表される)を適切なフッ素化剤(例えば、三フッ化(ジエチルアミノ)硫黄[CAS:38078−09−0]など)と反応させることにより調製することができる。この反応は、適切な反応不活性溶媒(例えば、ジクロロメタンなど)中で適度な低温(例えば、−78℃〜30℃の範囲の温度)で、例えば、0.5〜12時間行うことができる。
【0074】
反応スキーム(2)では、すべての変数は式(I)に関してと同様に規定される。
【0075】
【化9】

【0076】
[実験手順3]
R2がフルオロを表す式(I)の化合物(当該化合物は式(I−c)で表される)は、式(IV)の中間体を適切なフッ素化剤(例えば、三フッ化(ジエチルアミノ)硫黄など)と反応させることにより調製することができる。この反応は、適切な反応不活性溶媒(例えば、ジクロロメタンなど)中で適度な低温(例えば、−78℃〜30℃の範囲の温度)で、例えば、0.5〜12時間行うことができる。
【0077】
反応スキーム(3)では、すべての変数は式(I)に関してと同様に規定される。
【0078】
【化10】

【0079】
[実験手順4]
R2がフルオロで置換されたC1-4アルキルオキシを表す式(I)の化合物(このR2はR’2で表され、当該化合物は式(I−d)で表される)は、反応スキーム(4)に従って式(XIV)の中間体を水素化することにより調製することができる。この反応は、適切な溶媒(例えば、アルコール(例えば、メタノール)など)中で適切な触媒(例えば、パラジウム活性炭など)および適切な塩基(例えば、トリエチルアミンなど)の存在下で行うことができる。反応スキーム(4)では、すべての変数は式(I)に関してと同様に規定される。
【0080】
【化11】

【0081】
本発明における式(I)の化合物および中間体のいくつかは不斉炭素原子を含む可能性がある。これら化合物および中間体の純粋な立体化学的異性体形態は、当該技術分野で公知の手順を適用することにより得ることができる。例えば、ジアステレオマーは、選択的結晶化またはクロマトグラフ法(例えば、向流分配、キラル液体クロマトグラフィー等の方法)などの物理的方法により分離することができる。エナンチオマーは、まず適切な分割剤(例えば、キラル酸など)でラセミ混合物をジアステレオマー塩または化合物の混合物に変換し、例えば、選択的結晶化またはクロマトグラフ法(例えば、液体クロマトグラフィー等の方法)により当該ジアステレオマー塩または化合物の混合物を物理的に分離し、最後に分離されたジアステレオマー塩または化合物を対応するエナンチオマーに変換することにより当該ラセミ混合物から得ることができる。純粋な立体化学的異性体形態はまた、介在する反応が立体特異的に起こるという条件で、純粋な立体化学的異性体形態の適切な中間体および出発物質から得られ得る。
【0082】
エナンチオマー形態の式(I)の化合物および中間体を分割する別の方法は、特にキラル固定相を用いる液体クロマトグラフィーまたはSCF(超臨界流体)クロマトグラフィーを含む。
【0083】
中間体および出発物質のいくつかは公知の化合物であり、市販されている可能性があり、また当該技術分野で公知の手順に従って調製されてもよい。
【0084】
中間体はまた下記の実験手順5〜13に従って調製することができる。
【0085】
[実験手順5]
Yがハロを表す式(II)の中間体(当該中間体は式(II−a)で表される)は、反応スキーム(5)に従って式(V)の中間体を適切なハロゲン化剤(P(=O)Br3など)と反応させることにより調製することができる。この反応は、適切な反応不活性溶媒(例えば、DMFなど)中でやや高温(例えば、110℃)で行うことができる。反応スキーム(5)では、すべての変数は式(I)に関してと同様に規定される。
【0086】
【化12】

【0087】
[実験手順6]
YがF3C−S(=O)2−O−を表す式(II)の中間体(当該中間体は式(II−b)で表される)は、反応スキーム(6)に従って式(V)の中間体をトリフル酸無水物(トリフルオロメタンスルホン酸無水物とも呼ばれる)と反応させることにより調製することができる。この反応は、適切な反応不活性溶媒(例えば、ジクロロメタンなど)中で適切な塩基(例えば、ピリジンなど)の存在下で低温(例えば、−78℃)で行うことができる。反応スキーム(6)では、すべての変数は式(I)に関してと同様に規定される。
【0088】
【化13】

【0089】
[実験手順7]
式(V)の中間体は、反応スキーム(7)に従って当該技術分野で公知の手順により式(VI)の中間体を適切なメチルエーテル開裂試薬(例えば、NaOHなど)と反応させることにより調製することができる。この反応は、適切な溶媒(例えば、水など)中でやや高温(例えば、100℃)で行うことができる。反応スキーム(6)では、すべての変数は式(I)に関してと同様に規定される。
【0090】
【化14】

【0091】
[実験手順8]
式(VI)の中間体は、反応スキーム(8)に従って当該技術分野で公知の手順により市販の4−メトキシ−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリルを式(VII)のアルキル化剤(式中Zは、例えば、ハロ(例えば、臭素)などの適切な脱離基を表す)と反応させることにより調製することができる。式(VII)のアルキル化剤の例としてはシクロプロピルメチルブロミドがある。この反応は、不活性溶媒(例えば、アセトニトリルなど)中で適切な塩基(例えば、K2CO3など)および必要に応じてヨウ素塩(KIなど)を用いてやや高温(例えば、120℃)で行うことができる。反応スキーム(8)では、すべての変数は式(I)に関してと同様に規定される。
【0092】
【化15】

【0093】
[実験手順9]
式(III)の中間体は、反応スキーム(9)に従って当該技術分野で公知の手順を適用して、Xがピペリジン誘導体の窒素原子の適切な保護基(例えば、tert−ブトキシカルボニル、エトキシカルボニル、ベンジルオキシカルボニル、ベンジルおよびメチルなど)を表す式(VIII)の中間体中のピペリジン窒素を脱保護することにより調製することができる。例えば、Xがベンジルを表す場合、この脱保護反応はアルコール(例えば、メタノール)および1,4−シクロヘキサジエンなどの適切な溶媒中で適切な触媒(例えば、パラジウム炭素など)の存在下でやや高温(100℃)で行なわれてもよい。例えば、Xがエステルを表す場合、上記脱保護反応は適切な溶媒(例えば、ジオキサンなど)中で適切な酸(例えば、塩化水素酸など)との反応により行うことができる。反応スキーム(9)では、すべての変数は式(I)に関してと同様に規定される。
【0094】
【化16】

【0095】
[実験手順10]
R2がフルオロもしくはフルオロで置換されたC1-4アルキルを表わし、当該R2が−L1−F(ここでL1はC1-4アルキルまたは共有結合を表す)で表される式(III)の中間体(当該中間体は式(III−a)で表される)は、反応スキーム(10)のステップ(a)に従って当該技術分野で公知の手順により式(IX)の中間体(式中Xは、ピペリジン部分の窒素原子の適切な保護基(例えば、tert−ブトキシカルボニル、エトキシカルボニル、ベンジルオキシカルボニル、ベンジルおよびメチルなど)を表す)を適切なフッ素化剤(例えば、三フッ化(ジエチルアミノ)硫黄[CAS:38078−09−0]など)と反応させることにより調製することができ、式(X)の中間体が得られる。この反応は、適切な反応不活性溶媒(例えば、ジクロロメタンなど)中で適度な低温(例えば、−78℃〜30℃の範囲の温度)で、例えば、0.5〜12時間行なってもよい。次いで、得られた式(X)の中間体を反応スキーム(10)のステップ(b)に従って、例えば、上記実験手順9に記載のものなどの当該技術分野で公知の手順を適用してピペリジン窒素の脱保護により式(III−a)の中間体に変換することができる。反応スキーム(10)では、すべての変数は式(I)に関してと同様に規定される。
【0096】
【化17】

【0097】
[実験手順11]
R2がフルオロで置換されたC1-4アルキルオキシを表わし、当該C1-4アルキルオキシが式Qで表され、当該R2が−Q−Fで表される式(III)の中間体(当該中間体は式(III−b)で表される)は、反応スキーム(11)のステップ(a)に従って当該技術分野で公知の手順により式(XI)のヒドロキシル置換中間体(式中Xは、ピペリジン部分の窒素原子の適切な保護基(例えば、tert−ブトキシカルボニル、エトキシカルボニル、ベンジルオキシカルボニル、ベンジルおよびメチルなど)を表す)を適切なフッ素化剤(例えば、三フッ化(ジエチルアミノ)硫黄[CAS:38078−09−0]など)と反応させることにより調製することができ、式(XII)の中間体が得られる。この反応は、適切な反応不活性溶媒(例えば、ジクロロメタンなど)中で適度な低温(例えば、−78℃〜30℃の範囲の温度)で、例えば、0.5〜12時間行うことができる。次いで、式(XII)の中間体を、反応スキーム(11)のステップ(b)に従って、例えば、上記実験手順9に記載のものなど当該技術分野で公知の手順を適用してピペリジン窒素の脱保護により式(III−b)の中間体に変換することができる。反応スキーム(11)では、すべての変数は式(I)に関してと同様に規定される。
【0098】
【化18】

【0099】
[実験手順12]
L1がCH2を表す式(IX)の中間体(当該中間体は式(IX−a)で表される)は、反応スキーム(12)に従って式(XIII)の中間体(式中Xは、ピペリジン部分の窒素原子の適切な保護基(例えば、tert−ブトキシカルボニル、エトキシカルボニル、ベンジルオキシカルボニル、ベンジルおよびメチルなど)を表す)を適切な還元剤(例えば、水素化アルミニウムリチウムなど)と反応させることにより調製することができる。この反応は、適切な溶媒(例えば、テトラヒドロフランなど)中でやや低温(例えば、−20℃)で行うことができる。
【0100】
反応スキーム(12)では、すべての変数は式(I)に関してと同様に規定される。
【0101】
【化19】

【0102】
[実験手順13]
式(XIV)の中間体は、反応スキーム(13)に従って式(XV)の中間体をC1-4フルオロアルキル−4−トルエンスルホン酸と反応させることにより調製することができる。この反応は、適切な溶媒(例えば、DMEなど)中でNaHの存在下で行うことができる。
【0103】
反応スキーム(13)では、すべての変数は式(I)に関してと同様に規定され、R’2は上記で規定されたとおりである。
【0104】
【化20】

【0105】
式(IV)および式(XV)の中間体はまた、mGluR2のポジティブアロステリックモジュレーターとしての活性を示す。したがって本発明はまた、式(I’)の化合物(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物に関する。
【0106】
【化21】

【0107】
式中、R1はC4-6アルキル、特に1−ブチル;またはC3-7シクロアルキルで置換されたC1-3アルキル、特にシクロプロピルメチルであり;
R3は水素またはハロ;特に水素、フルオロまたはクロロである。
【0108】
本発明の一実施形態は、R1がC4-6アルキル、特にC4-5アルキル、例えば、1−ブチル、2−メチル−1−プロピル、3−メチル−1−ブチル;特に1−ブチルである式(I’)の化合物である。
【0109】
本発明の一実施形態は、R1がC3-7シクロアルキルで置換されたC1-3アルキル、特にシクロプロピルメチルまたは2−(シクロプロピル)−1−エチルである式(I’)の化合物である。
【0110】
興味深い実施形態としては、R3が水素である式(I’)の化合物である。
【0111】
興味深い実施形態としては、R3がハロ、特にクロロまたはフルオロである式(I’)の化合物である。
【0112】
興味深い実施形態としては、R1が1−ブチルまたはシクロプロピルメチルであり;R2が水素、フルオロまたはクロロである式(I’)の化合物である。
【0113】
式(I’)の化合物は、例えば、下記のものあるいはその薬学的に許容される塩またはその溶媒和物である。
【0114】
【表3】

【0115】
当該式(I’)の化合物は、式(IV)または(XV)の中間体の調製に関して上記されたように調製することができる。下記実施例A13もまた参照される。
【0116】
本発明はまた、ヒトを含む哺乳類における症状の治療または予防(特に治療)用薬剤の製造のための式(I’)の化合物あるいはその任意のサブグループの使用に関し、この症状の治療または予防は、mGluR2のアロステリックモジュレーター(特にポジティブアロステリックモジュレーター)の神経修飾効果により作用されるかまたは促進される。
【0117】
式(I)および式(I’)の化合物はいずれもmGluR2のポジティブアロステリックモジュレーターなので、本発明はまた式(I’’)の化合物(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物に関する。
【0118】
【化22】

【0119】
式中、R1はC4-6アルキル、またはC3-7シクロアルキルで置換されたC1-3アルキルであり、
R2は水素;ヒドロキシル;フルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシであり、
R3は水素またはハロであるが、但し、R3がハロの場合R2はヒドロキシルである。
【0120】
本発明の一実施形態は、R1がC4-6アルキル、特にC4-5アルキル、例えば、1−ブチル、2−メチル−1−プロピル、3−メチル−1−ブチル;特に1−ブチルである式(I’’)の化合物である。
【0121】
本発明の一実施形態は、R1がC3-7シクロアルキルで置換されたC1-3アルキル、特に、シクロプロピルメチルまたは2−(シクロプロピル)−1−エチルである式(I’’)の化合物である。
【0122】
本発明の一実施形態は、R2が水素である、実施形態として上記された式(I’’)の化合物またはその任意のサブグループである。
【0123】
本発明の一実施形態は、R2がフルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシである、実施形態として上記された式(I’’)の化合物または、可能な場合は常に、その任意のサブグループである。
【0124】
本発明の一実施形態は、R2が水素;フルオロ;またはフルオロで置換されたC1-4アルキルオキシ;特にR2がフルオロまたはフルオロで置換されたC1-4アルキルオキシである、実施形態として上記された式(I’’)の化合物または、可能な場合は常に、その任意のサブグループである。
【0125】
本発明の一実施形態は、R2がフルオロである、実施形態として上記された式(I’’)の化合物またはその任意のサブグループである。
【0126】
本発明の一実施形態は、R2がヒドロキシルで置換されたC1-4アルキルであり、特にR2がヒドロキシルで置換されたメチルである、実施形態として上記された式(I’’)の化合物または、可能な場合は常に、その任意のサブグループである。
【0127】
本発明の一実施形態は、R2がフルオロで置換されたC1-4アルキルであり、特にR2がフルオロで置換されたメチルである、実施形態として上記された式(I’’)の化合物または、可能な場合は常に、その任意のサブグループである。
【0128】
本発明の一実施形態は、R2がフルオロで置換されたC1-4アルキルオキシであり、特にR2がフルオロで置換されたエチルオキシである、実施形態として上記された式(I’’)の化合物または、可能な場合は常に、その任意のサブグループである。
【0129】
本発明の一実施形態は、R2がヒドロキシルである、実施形態として上記された式(I’’)の化合物または、可能な場合は常に、その任意のサブグループである。
【0130】
本発明はまた、ヒトを含む哺乳類における症状の治療または予防(特に治療)用薬剤の製造のための式(I’’)の化合物あるいはその任意のサブグループの使用に関し、この症状の治療または予防はmGluR2のアロステリックモジュレーター(特にポジティブアロステリックモジュレーター)の神経修飾効果により作用されるかまたは促進される。
【0131】
[薬理]
本発明で提供される化合物は代謝型グルタミン酸受容体のポジティブアロステリックモジュレーターであり、特にmGluR2のポジティブアロステリックモジュレーターである。本発明の化合物は、グルタミン酸認識部位(オルソステリックリガンド部位)へ結合するのではなく、むしろ受容体の7回膜貫通型領域内のアロステリック部位に結合するようである。グルタミン酸塩(エステル)またはmGluR2のアゴニストの存在下では、本発明の化合物はmGluR2応答を増加させる。本発明で提供される化合物は、グルタミン酸塩(エステル)またはmGluR2アゴニストに対するこのような受容体の応答を増加させる能力によりmGluR2において効果がある(これにより受容体の応答が増強される)と予想される。したがって本発明は、薬として用いられる本発明の化合物、ならびにヒトを含む哺乳類における症状の治療または予防(特に治療)用薬剤の製造のための本発明の化合物または本発明の医薬組成物の使用に関し、この症状の治療または予防はmGluR2のアロステリックモジュレーター(特にそのポジティブアロステリックモジュレーター)の神経修飾効果により作用されるかまたは促進される。本発明はまた、ヒトを含む哺乳類における症状の治療または予防(特に治療)用薬剤の製造で用いる本発明の化合物あるいは本発明の医薬組成物に関し、この症状の治療または予防はmGluR2のアロステリックモジュレーター(特にそのポジティブアロステリックモジュレーター)の神経修飾効果により作用されるかまたは促進される。本発明はまた、ヒトを含む哺乳類における症状の治療または予防(特に治療)のための本発明の化合物あるいは本発明の医薬組成物に関し、この症状の治療または予防はmGluR2のアロステリックモジュレーター(特にそのポジティブアロステリックモジュレーター)の神経修飾効果により作用されるかまたは促進される。
【0132】
また、本発明はヒトを含む哺乳類におけるグルタミン酸機能障害と関連する様々な神経障害および精神障害の治療、予防、改善、制御、またはその危険性の減少用薬剤の製造のための本発明の化合物あるいは本発明の医薬組成物の使用に関し、この症状の治療または予防はmGluR2のポジティブアロステリックモジュレーターの神経修飾効果により作用されるかまたは促進される。
【0133】
本発明が薬剤(例えば、哺乳類の治療用)の製造のための本発明の化合物または組成物の使用に関すると記載されている場合、特定の司法権限の管轄域ではこのような使用は、例えば、このような治療を必要とする哺乳類に有効量の本発明の化合物または組成物を投与することを含む、例えば、哺乳類の治療方法として理解される。
【0134】
特に、グルタミン酸機能障害と関連する神経障害および精神障害としては、以下の1種以上の症状または疾患が挙げられる。心臓バイパス手術および移植後の脳欠損などの急性神経障害および急性精神障害、卒中、脳虚血、脊髄損傷、頭部外傷、周生期低酸素症 、心停止、低血糖性神経細胞損傷、認知症(エイズ誘発認知症を含む)、アルツハイマー病、ハンチントン舞踏病、筋萎縮性側索硬化症、視覚障害、網膜症、認識障害、特発性および薬物誘発性パーキンソン病、振戦を含む筋痙直と関連する筋肉痙攣および障害、てんかん、痙攣、片頭痛(片頭痛性の頭痛を含む)、尿失禁、物質耐性、物質禁断症状(アヘン剤、ニコチン、タバコ製品、アルコール、ベンゾジアゼピン、コカイン、鎮静剤、睡眠薬などの物質を含む)、精神病、統合失調症、不安症(全般性不安障害、パニック障害、および強迫観念障害を含む)、気分障害(うつ病、躁病、両相性障害)、三叉神経痛、難聴、耳鳴り、眼の黄斑変性症、嘔吐、脳浮腫、疼痛(急性および慢性の状態、激痛、難治性疼痛、神経因性疼痛、および外傷後の疼痛を含む)、遅発性ジスキネジア、睡眠障害(ナルコレプシーを含む)、注意欠陥/多動性障害および行為障害。
【0135】
特に本発明は、不安障害、精神障害、人格障害、物質関連障害、摂食障害、気分障害、片頭痛、てんかんまたは痙攣性障害、幼児期障害、認知障害、神経変性、神経毒症状および虚血からなる群から選ばれる中枢神経系障害の治療または予防(特に、治療)用薬剤の製造のための式(I)の化合物の使用に関する。
【0136】
上記中枢神経系障害は好ましくは、広場恐怖症、全般性不安障害(GAD)、強迫観念障害(OCD)、パニック障害、心的外傷後ストレス障害(PTSD)、対人恐怖および他の恐怖症からなる群から選ばれる不安障害である。
【0137】
上記中枢神経系障害は好ましくは、統合失調症、妄想性障害、統合失調性感情障害、統合失調症様障害および物質誘発性精神障害からなる群から選ばれる精神障害である。
【0138】
上記中枢神経系障害は好ましくは、強迫性人格障害および統合失調症、統合失調型障害からなる群から選ばれる人格障害である。
【0139】
上記中枢神経系障害は好ましくは、アルコール乱用、アルコール依存症、アルコール禁断症状、アルコール禁断せん妄、アルコール誘発性精神障害、アンフェタミン依存症、アンフェタミン禁断症状、コカイン依存症、コカイン禁断症状、ニコチン依存症、ニコチン禁断症状、オピオイド依存症およびオピオイド禁断症状からなる群から選ばれる物質関連障害である。
【0140】
上記中枢神経系障害は好ましくは、神経性食欲不振症および神経性過食症からなる群から選ばれる摂食障害である。
【0141】
上記中枢神経系障害は好ましくは、両相性障害(IおよびII)、気分循環性障害、うつ病、気分変調性障害、大うつ病性障害および物質誘発性気分障害からなる群から選ばれる気分障害である。
【0142】
上記中枢神経系障害は好ましくは、片頭痛である。
【0143】
上記中枢神経系障害は好ましくは、非痙攣性全般てんかん、痙攣性全般てんかん、小発作性てんかん重積、大発作性てんかん重積、意識障害を伴うかまたは伴わない部分てんかん、幼児痙攣症、持続性部分てんかんおよび他の形態のてんかんからなる群から選ばれるてんかんまたは痙攣性の障害である。
【0144】
上記中枢神経系障害は好ましくは、注意欠陥/多動性障害である。
【0145】
上記中枢神経系障害は好ましくは、せん妄、物質誘発持続性せん妄、認知症、HIV疾患による認知症、ハンチントン病による認知症、パーキンソン病による認知症、アルツハイマー型認知症、物質誘発持続性認知症および軽度認知障害からなる群から選ばれる認知障害である。
【0146】
上記障害のうち、不安症、統合失調症、片頭痛、うつ病およびてんかんの治療が特に重要である。
【0147】
現時点では、米国精神医学会(American Psychiatric Association)の「精神障害の診断と統計の手引き(Diagnostic & Statistical Manual of Mental Disorders)」第4版(DSM−IV)が本明細書に記載の障害を識別するための診断用手段を提供している。当業者であれば、本明細書に記載した神経障害および精神障害について別の命名法、疾病分類および分類体系が存在すること、そしてこれらは医学および科学の進歩とともに発展することを認識しているであろう。
【0148】
式(I)の化合物を含むこのようなmGluR2のポジティブアロステリックモジュレーターはグルタミン酸塩(エステル)に対するmGluR2の応答を増強させるため、本発明の方法は内因性のグルタミン酸塩(エステル)を利用するのが有利である。
【0149】
式(I)の化合物を含むmGluR2のポジティブアロステリックモジュレーターはアゴニストに対するmGluR2の応答を増強させるため、本発明は、有効量のmGluR2のポジティブアロステリックモジュレーター(式(I)の化合物を含む)をmGluR2アゴニストと組合せて投与することによりグルタミン酸機能障害と関連する神経障害および精神障害を治療することにまで及ぶと理解される。
【0150】
本発明の化合物は、薬剤を互いに組み合わせたものがいずれかの薬剤単独よりも安全であるかまたはより有効である場合、式(I)の化合物または他の薬剤が効用を有する疾患または症状の治療、予防、制御、改善、またはその危険性の低減において1種以上の薬剤と組み合わせて利用されてもよい。
【0151】
[医薬組成物]
本発明はまた、薬学的に許容される担体または希釈剤と、有効成分として治療上有効な量の本発明の化合物、特に式(I)の化合物(その立体化学的異性体形態またはその薬学的に許容される塩もしくはその溶媒和物を含む)とを含有する医薬組成物に関する。
【0152】
本発明の化合物、特に式(I)の化合物(その立体化学的異性体形態、またはその薬学的に許容される塩もしくはその溶媒和物、またはその任意のサブグループもしくは組み合わせを含む)は、投与目的に関して種々の剤型に処方されてもよい。適切な組成物としては薬剤を全身投与するために通常用いられる全ての組成物が挙げられる。
【0153】
本発明の医薬組成物を調製するため、有効成分として有効な量の特定の化合物(必要に応じて塩形態)は薬学的に許容される担体または希釈剤と完全な混合物として組み合わされる。この担体または希釈剤は投与に関して所望される剤型に応じて種々様々の形態であってもよい。上記医薬組成物は、特に、注射または吸入による経口、経直腸、経皮投与に適切な単回投与形態であることが望ましい。例えば、経口投薬形態に組成物を調製する際、例えば、懸濁剤、シロップ剤、エリキシル剤、乳剤および液剤などの経口液体製剤の場合は、例えば、水、グリコール、オイル、アルコールなど;あるいは散剤、丸剤、カプセル剤および錠剤の場合は、例えば、デンプン、糖、カオリン、希釈剤、滑沢剤、結合剤、崩壊剤などの固体担体などの通常の製剤媒体のいずれが使用されてもよい。投与の容易さのため、経口投与が好ましく、錠剤およびカプセル剤が最も有利な経口投薬単位形態であり、この場合言うまでもなく固体医薬担体が用いられる。非経口組成物に関して、担体は通常少なくとも大部分が滅菌水を含むことになるが、例えば、溶解性を増加させるため他の成分が含まれもよい。例えば、担体が食塩水、グルコース溶液、または食塩水とグルコース溶液との混合物を含む注射液が調製されてもよい。注射用懸濁液が調製されてもよく、この場合適切な液体担体、懸濁化剤などが用いられてもよい。また使用直前に液体形態の製剤に変換されることが意図される固体形態の製剤も含まれる。経皮投与に適した組成物において、担体は必要に応じて浸透促進剤および/または適切な湿潤剤を含んでもよく、任意の性質を有する適切な添加剤(この添加剤は皮膚に著しい有害作用をもたらさない)と低い割合で必要に応じて組み合わされてもよい。当該添加剤は、皮膚への投与を容易にしかつ/または所望の組成物の調製に役立つ可能性がある。これら組成物は様々な様式、例えば、経皮パッチとして、スポットオンとして、軟膏として投与されてもよい。
【0154】
投与のしやすさおよび用量の均一性のため、上記医薬組成物を単位用量形態に処方することが特に有利である。本明細書では単位用量形態とは、単一の用量として適切な物理的に別々の単位を指し、各単位は必要な製剤担体と関連して所望の治療効果を生むように計算された所定量の有効成分を含む。このような単位用量形態の例としては、錠剤(刻線付き錠剤またはコーティングされた錠剤を含む)、カプセル剤、丸剤、散剤包、ウエハー、坐剤、注射液または注射用懸濁液など、ならびにそれらの分割された複数回分が挙げられる。
【0155】
正確な用量および投与頻度は、当業者に周知のように、使用される特定の式(I)の化合物、治療されている特定の症状、治療されている症状の重症度、年齢、体重、性別、障害の程度、および特定の患者の全身的な健康状態、そして個体が服用している可能性のある他の薬剤によって異なる。さらに、上記の有効な1日量は、治療されている被験者の応答に応じておよび/または本発明の化合物を処方する医師の評価に応じて減量または増量されてもよいことは明らかである。
【0156】
投与様式によっては、上記医薬組成物は、有効成分を0.05〜99重量%、好ましくは0.1〜70重量%、より好ましくは0.1〜50重量%、そして薬学的に許容される担体を1〜99.95重量%、好ましくは30〜99.9重量%、より好ましくは50〜99.9重量%を含むこととなる。ここでパーセントは全て組成物の全重量に基づいている。
【0157】
上述のように、本発明はまた、式(I)の化合物または他の薬物が効用を有する可能性のある疾患または症状の治療、予防、制御、改善、あるいはその危険性の低減における、本発明の化合物と1種以上の他の薬物とを含む医薬組成物に関し、そして薬剤の製造のためのそのような化合物の使用に関する。本発明はまた、本発明の化合物とmGluR2のオルソステリックアゴニストとの組み合わせに関する。本発明はまた、薬として用いられるこのような組み合わせに関する。本発明はまた、ヒトを含む哺乳類における症状の治療または予防における、同時に、個別にまたは順次に使用される併用薬剤として(a)本発明の化合物、その薬学的に許容される塩またはその溶媒和物と(b)mGluR2のオルソステリックアゴニストとを含む製品に関し、この治療または予防はmGluR2のアロステリックモジュレーター(特にポジティブアロステリックモジュレーター)の神経修飾効果により作用されるかまたは促進される。このような組み合わせまたは製品中の異なる薬物は、薬学的に許容される担体または希釈剤と共に単一の製剤中で組み合わされてもよいし、それぞれ薬学的に許容される担体または希釈剤と共に別々の製剤中に存在してもよい。
【0158】
下記実施例により本発明の範囲を示すことが意図されるが、本発明の範囲を制限するものではない。
【0159】
[実験の部]
下記実施例において本発明の化合物を調製するためのいくつかの方法が示される。特に明記しない場合、出発物質はすべて商業的供給業者から入手され、さらなる精製を行わないで使用された。特に、以下の略称が実施例および明細書全体にわたって使用される場合がある。
【0160】
【表4】

【0161】
塩水に対する言及はすべて飽和NaCl水溶液を指す。特に明記しない場合、温度はすべて℃(摂氏)で表される。特に明記しない場合、反応はすべて室温で不活性雰囲気下でない条件で行われる。
【0162】
マイクロ波を使った反応は、単一モード反応器であるEmrys(登録商標)Optimizerマイクロ波反応器(パーソナルケミストリー社(Personal Chemistry A.B.)、現在はバイオタージ社)またはマルチモード反応器であるMicroSYNTH Labstation(マイルストーン社(Milestone, Inc.))中で行った。
【0163】
[A.中間体の調製]
[実施例A.1]
1−シクロプロピルメチル−4−メトキシ−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(中間体1)
【0164】
【化23】

【0165】
アセトニトリル(250ml)中の4−メトキシ−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(12.2g、81.48mmol)の溶液に、ブロモメチル−シクロプロパン(11g、81.48mmol)および炭酸カリウム(22.48g、162.9mmol)を加え、この混合物を110℃で24時間加熱した。この混合物を室温まで冷却し、固形物をろ去した。ろ液を蒸発乾固させ、次いで、得られた粗残渣をジエチルエーテルでトリチューレションして純粋な中間体1(15.72g、94%)を白色の固形物として得た。
【0166】
[実施例A.2]
1−ブチル−4−メトキシ−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(中間体2)
【0167】
【化24】

【0168】
アセトニトリル(800ml)中の4−メトキシ−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(20g、133mmol)の溶液に、1−ブロモブタン(15.8g、146mmol)および炭酸カリウム(36.7g、266mmol)を加え、この混合物を110℃で24時間加熱した。この混合物を室温まで冷却し、固形物をろ去した。ろ液を蒸発乾固させ、次いで、得られた粗残渣をジエチルエーテルでトリチューレションして純粋な中間体2(27.39g、>99%)を白色の固形物として得た。
【0169】
[実施例A.3]
1−シクロプロピルメチル−4−ヒドロキシ−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(中間体3)
【0170】
【化25】

【0171】
中間体1(15.7g、76.8mmol)を室温で水酸化ナトリウムの1N水溶液(300ml)とTHF(50ml)に加えた。反応混合物を140℃(油浴温度)で16時間加熱した。この混合物を室温まで冷却し、THFをほぼ真空蒸発させた。水層を0℃まで冷却し、2N HCl水溶液を加えて酸性化させてpHを約3まで調節すると、この時点で白色の固形物が析出した。この固形物をろ去し、Et2Oで洗浄し、真空乾燥させて、中間体3を白色の固形物(10.44g、71%)として得、これをさらなる精製をしないで使用した。
【0172】
[実施例A.4]
1−ブチル−4−ヒドロキシ−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(中間体4)
【0173】
【化26】

【0174】
中間体2(27.39g、133mmol)を室温で水酸化ナトリウムの1N水溶液(500ml)とTHF(100ml)に加えた。反応混合物を110℃(油浴温度)で24時間加熱した。この混合物を室温まで冷却し、容量がほぼ250mlに減少するまで溶媒を真空蒸発させた。次いで、水層を0℃まで冷却し、2N HCl水溶液を加えて酸性化させてpHを約3まで調節すると、この時点で白色の固形物が析出した。この固形物をろ去し、Et2Oで洗浄し、真空乾燥させて、中間体4を白色の固形物(25g、98%)として得、これをさらなる精製をしないで使用した。
【0175】
[実施例A.5]
4−ブロモ−1−シクロプロピルメチル−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(中間体5)
【0176】
【化27】

【0177】
DMF(250ml)中の中間体3(10.4g、54.67mmol)の溶液にP(=O)Br3(31.3g、109.3mmol)を加え、この混合物を110℃で1.5時間加熱した。氷浴中で冷却後、溶液を水とEtOAcで分液した。EtOAcで3回抽出後、合わせた有機画分を塩水で洗浄し、MgSO4で乾燥させ、溶媒を真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル、溶離液としてDCM)により精製した。所望の画分を採取し、真空蒸発させて、中間体5(8.83g、64%)を得た。
【0178】
[実施例A.6]
4−ブロモ−1−ブチル−2−オキソ−1,2−ジヒドロ−ピリジン−3−カルボニトリル(中間体6)
【0179】
【化28】

【0180】
DMF(600ml)中の中間体4(39g、203mmol)の溶液にP(=O)Br3(116g、406mmol)を加え、この混合物を110℃で1.5時間加熱した。氷浴中で冷却後、溶液を水とEtOAcで分液した。EtOAcで3回抽出後、合わせた有機画分を塩水で洗浄し、Na2SO4で乾燥させ、溶媒を真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル、溶離液としてDCM)により精製した。所望の画分を採取し、真空蒸発させて、中間体6(36.7g、72%)を得た。
【0181】
[実施例A.7]
4−ヒドロキシ−4−フェニル−ピペリジン−1−カルボン酸tert−ブチルエステル(中間体7)
【0182】
【化29】

【0183】
ジクロロメタン(50ml)中の4−ヒドロキシ−4−フェニルピペリジン(2g、11.28mmol)の溶液に室温で重炭酸ジ−tert−ブチル(2.95g、13.53mmol)を加えた。得られた混合物を室温で5時間撹拌した。揮発性分を真空蒸発させて粗中間体7を得、これをさらなる精製をしないで使用した(3.12g、100%)。
【0184】
[実施例A.8]
4−フルオロ−4−フェニル−ピペリジン−1−カルボン酸tert−ブチルエステル(中間体8)
【0185】
【化30】

【0186】
反応を窒素雰囲気下で行った。予め−78℃まで冷却したジクロロメタン(30ml)中の三フッ化(ジエチルアミノ)硫黄(0.74ml、5.67mmol)の溶液にジクロロメタン(30ml)中の中間体7(1.5g、5.4mmol)の溶液を滴下した。次いで、得られた混合物を−78℃で1時間撹拌し、次いで、この反応混合物を室温まで温めさらに30分間撹拌した。NaHCO3(飽和水溶液、90ml)を加え、この混合物を15分間撹拌した。有機層を分離し、3−クロロペルオキシ安息香酸(0.2g、1.18mmol)で処理し、30分間撹拌した。反応混合物をNaHCO3(飽和水溶液)、水および塩水で順次洗浄した。有機層をNa2SO4で乾燥させ、真空蒸発させて粗中間体8を得、これをさらなる精製をしないで使用した(1.5g、100%)。
【0187】
[実施例A.9]
4−フルオロ−4−フェニル−ピペリジン塩酸塩(中間体9)
【0188】
【化31】

【0189】
中間体8(1.5g、5.37mmol)を塩化水素酸(1、4−ジオキサン中4N、20ml)中に溶解し、得られた溶液を室温で2時間撹拌した。揮発性分を真空蒸発させ、こうして得られた残渣をジエチルエーテルで処理して、中間体9を固形物として得た(1.15g、100%、HCl)。
【0190】
[実施例A.10]
1−ベンジル−4−フェニル−ピペリジン−4−カルボン酸ベンジルエステル(中間体10)
【0191】
【化32】

【0192】
4−フェニル−4−ピペリジンカルボン酸4−メチルベンゼンスルホン酸塩(CAS83949−32−0)(2g、5.3mmol)、臭化ベンジル(0.76ml、6.36mmol)および炭酸カリウム(2.92g、21.2mmol)をアセトニトリル(6ml)中に懸濁し、15分間マイクロ波照射下で130℃で加熱した。冷却した反応物をケイソウ土のパッドに通してろ過した。このケイソウ土のパッドをアセトニトリル、EtOAcおよびジクロロメタンで洗浄した。合わせた有機ろ液を真空蒸発させて粗中間体10(2.04g、100%)を得、これをさらなる精製をしないで使用した。
【0193】
[実施例A.11]
(1−ベンジル−4−フェニル−ピペリジン−4−イル)−メタノール(中間体11)
【0194】
【化33】

【0195】
反応を窒素雰囲気下で行った。中間体10(2.04g、5.3mmol)を無水テトラヒドロフラン(25ml)中に懸濁し、この混合物を−78℃まで冷却した。水素化アルミニウムリチウム(テトラヒドロフラン中1M、7.95ml、7.95mmol)を滴下した。得られた反応混合物を徐々に室温まで温め、さらに2時間撹拌した。NH4Cl(飽和水溶液)を加え、反応混合物をまずはEtOAcで、次いで1−ヒドロキシブタンで抽出した。合わせた有機抽出物をNa2SO4で乾燥させ、真空蒸発させて粗中間体11(0.65g、43%)を得、これをさらなる精製をしないで使用した。
【0196】
[実施例A.12]
(4−フェニル−ピペリジン−4−イル)−メタノール(中間体12)
【0197】
【化34】

【0198】
反応を窒素雰囲気下で行った。中間体11(0.65g、2.31mmol)をメタノール(10ml)中に懸濁し、次いで、1,4−シクロヘキサジエン(2.17ml、23.1mmol)および10%パラジウム活性炭(0.65g)を加えた。得られた混合物を100℃で24時間シールドチューブ内で加熱した。冷却した反応混合物をケイソウ土のパッドに通してろ過した。このケイソウ土のパッドをメタノールとアンモニアで飽和させたメタノールの7N溶液とで順次洗浄した。合わせた有機ろ液を真空蒸発させて粗中間体12(0.47g、100%)を得、これをさらなる精製をしないで使用した。
【0199】
[実施例A.13]
1’−ブチル−4−ヒドロキシ−2’−オキソ−4−(4−クロロフェニル)−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(中間体13)
【0200】
【化35】

【0201】
アセトニトリル(2.5ml)中の中間体6(0.255g、1.39mmol)と4−(4−クロロフェニル)−4−ヒドロキシピペリジン(C.A.S.39512−49−7)(0.265g、1.25mmol)とN,N−ジイソプロピルエチルアミン(0.348ml、2mmol)との混合物に150℃で10分間マイクロ波照射した。この反応混合物をNaHCO3(飽和水溶液)で希釈し、DCMで抽出した。有機層をNa2SO4で乾燥させ、真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル;DCM〜DCM/EtOAc、9:1〜1:9)により精製した。所望の画分を採取し真空蒸発させて、中間体13(0.357g、93%)を得た。
【0202】
1’−ブチル−4−ヒドロキシ−2’−オキソ−4−(3−クロロフェニル)−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(中間体13a)
【0203】
【化36】

【0204】
中間体13aは、4−(3−クロロフェニル)−4−ヒドロキシピペリジンから開始したこと以外は、中間体13に関してのプロトコルに従って調製した。
【0205】
[実施例A.14]
1’−ブチル−4−フルオロエチルオキシ−2’−オキソ−4−(4−クロロフェニル)−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(中間体14)
【0206】
【化37】

【0207】
NaH(0.020g、0.5mmol、鉱油中60%)に0℃でDME(2ml)中の4−トルエンスルホン酸フルオロエチル(C.A.S.383−50−3)(0.063g、0.029mmol)を滴下した。この混合物を室温で15分撹拌した。次いで、DME(1ml)中の中間体13(0.1g、0.26mmol)を加え、反応物に150℃で15分間マイクロ波照射した。次いで、NH4Cl(飽和水溶液)を加えた。得られた混合物をAcOEtで抽出した。有機層をNa2SO4で乾燥させ、真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル;DCM〜DCM/EtOAc、9:1)により精製した。所望の画分を採取し、真空蒸発させて、中間体14(0.038g、34%)を得た。
【0208】
1’−ブチル−4−フルオロエチルオキシ−2’−オキソ−4−(3−クロロフェニル)−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(中間体14a)を調製するため、中間体14の調製に関するプロトコルに従って中間体13aを反応させる。
【0209】
[B.最終化合物の調製]
[実施例B.1]
1’−シクロプロピルメチル−4−フルオロ−2’−オキソ−4−フェニル−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(化合物1)
【0210】
【化38】

【0211】
アセトニトリル(3ml)中の中間体5(1.0g、4.84mmol)と中間体9(1.15g、5.33mmol)とN,N−ジイソプロピルエチルアミン(3.3ml、19.36mmol)との混合物に150℃で15分間マイクロ波照射した。この混合物を室温まで冷却し、溶媒を真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル;溶離液としてDCM〜DCM/MeOH(NH3)、5%まで)により精製した。所望の画分を採取し、真空蒸発させて、化合物1を淡い黄色の固形物として得た(0.874g、51%)。
【0212】
[実施例B.2]
1’−ブチル−4−フルオロ−2’−オキソ−4−フェニル−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(化合物2)
【0213】
【化39】

【0214】
アセトニトリル(3ml)中の中間体6(0.354g、1.39mmol)と中間体9(0.3g、1.39mmol)とN,N−ジイソプロピルエチルアミン(0.72ml、4.17mmol)との混合物に150℃で15分間マイクロ波照射した。この混合物を室温まで冷却し、溶媒を真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル;溶離液としてDCM〜DCM/MeOH(NH3)、10%まで)により精製した。所望の画分を採取し、真空蒸発させて、化合物2を淡いピンク色の固形物として得た(0.104g、21%)。
【0215】
[実施例B.3]
1’−シクロプロピルメチル−4−ヒドロキシメチル−2’−オキソ−4−フェニル−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(化合物3)
【0216】
【化40】

【0217】
アセトニトリル(3ml)中の中間体5(0.32g、1.3mmol)と中間体12(0.25g、1.3mmol)とN,N−ジイソプロピルエチルアミン(0.45ml、2.6mmol)との混合物に150℃で15分間マイクロ波照射した。この混合物を室温まで冷却し、溶媒を真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル;溶離液としてDCM〜DCM/MeOH(NH3)、10%まで)により精製した。所望の画分を採取し、真空蒸発させて、化合物3を油状物として得た(0.385g、81%)。
【0218】
[実施例B.4]
1’−ブチル−4−ヒドロキシメチル−2’−オキソ−4−フェニル−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(化合物4)
【0219】
【化41】

【0220】
アセトニトリル(2ml)中の中間体6(0.267g、1.04mmol)と中間体12(0.2g、1.04mmol)とN,N−ジイソプロピルエチルアミン(0.54ml、3.12mmol)との混合物に150℃で15分間マイクロ波照射した。この混合物を室温まで冷却し、溶媒を真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル;溶離液としてDCM〜DCM/MeOH(NH3)、10%まで)により精製した。所望の画分を採取し、真空蒸発させて、化合物4を淡い茶色の固形物として得た(0.100g、26%)。
【0221】
[実施例B.5]
1’−シクロプロピルメチル−4−フルオロメチル−2’−オキソ−4−フェニル−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(化合物5)
【0222】
【化42】

【0223】
反応を窒素雰囲気下で行った。予め−78℃まで冷却したジクロロメタン(30ml)中の三フッ化(ジエチルアミノ)硫黄(0.145ml、1.11mmol)の溶液にジクロロメタン(30ml)中の化合物3(0.385g、1.06mmol)の溶液を滴下した。次いで、得られた混合物を−78℃で1時間撹拌し、次いで、この反応混合物を室温まで温め、さらに30分間撹拌した。NaHCO3(飽和水溶液、90ml)を加え、この混合物を15分間撹拌した。有機層を分離し、3−クロロペルオキシ安息香酸(0.047g、0.27mmol)で処理し、30分間撹拌した。この反応混合物をNaHCO3(飽和水溶液)、水および塩水で順次洗浄した。有機層をNa2SO4で乾燥させ、真空蒸発させた。粗生成物を逆相分取HPLCにより精製し、化合物5(0.112g、29%)を得た。
【0224】
[実施例B.6]
1’−ブチル−4−フルオロメチル−2’−オキソ−4−フェニル−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(化合物6)
【0225】
【化43】

【0226】
反応を窒素雰囲気下で行った。予め−78℃まで冷却したジクロロメタン(15ml)中の三フッ化(ジエチルアミノ)硫黄(0.075ml、0.57mmol)の溶液にジクロロメタン(15ml)中の化合物4(0.20g、0.54mmol)の溶液を滴下した。次いで、得られた混合物を−78℃で1時間撹拌し、次いで、この反応混合物を室温まで温め、さらに30分間撹拌した。NaHCO3(飽和水溶液、90ml)を加え、この混合物を15分間撹拌した。有機層を分離し、3−クロロペルオキシ安息香酸(0.024g、0.14mmol)で処理し、30分間撹拌した。反応混合物をNaHCO3(飽和水溶液)、水および塩水で順次洗浄した。有機層をNa2SO4で乾燥させ、真空蒸発させた。粗生成物をカラムクロマトグラフィー(シリカゲル;溶離液としてDCM〜DCM/EtOAc、20%まで)により精製した。所望の画分を採取し、真空蒸発させて、化合物6を白色の固形物として得た(0.035g、17%)。
【0227】
[実施例B.7]
1’−ブチル−4−フルオロエチルオキシ−2’−オキソ−4−フェニル−3,4,5,6,1’,2’−ヘキサヒドロ−2H−[1,4’]ビピリジニル−3’−カルボニトリル(化合物7)
【0228】
【化44】

【0229】
メタノール(2ml)中の中間体14(0.038g、0.09mmol)およびトリエチルアミン(0.025ml、0.18mmol)の溶液を、室温で10%パラジウム活性炭(0.005g)の存在下で2時間水素化した。固形物をろ去し、ろ液を蒸発乾固させた。次いで、この粗反応混合物をカラムクロマトグラフィー(シリカゲル;溶離液としてDCM〜DCM/MeOH、1%まで)により精製した。所望の画分を採取し、真空蒸発させて、化合物7(0.019g、53%)を得た。
【0230】
化合物7を調製する別の方法として、上記プロトコルに従って中間体14aを反応させる。
【0231】
[実施例B.8]
3−シアノ−1−シクロプロピルメチル−4−(4−フェニル−ピペリジン−1−イル)−ピリジン−2(1H)−オン(化合物8)
【0232】
【化45】

【0233】
アセトニトリル(5ml)中の中間体5(0.3g、1.18mmol)と4−フェニルピペリジン(0.286g、1.77mmol)とジイソプロピルエチルアミン(0.615ml、3.54mmol)との混合物に150℃で20分間マイクロ波照射した。この混合物を室温まで冷却し、溶媒を真空蒸発させた。こうして得られた残渣をフラッシュクロマトグラフィー(SiO2、DCM/MeOH(NH3)混合物)により精製して所望の化合物を得た。次いで、この化合物をエチルエーテルから再結晶させて化合物8を得た(0.29g、73%)。
【0234】
化合物9は、化合物8に関して記載のプロトコルに従って調製した。
【0235】
表1は、上記の実施例の1つ(実施例番号)に従って調製された式(I)の化合物を記載している。
【0236】
【化46】

【0237】
【表5】

【0238】
[C.分析の部]
本発明の化合物のLCMS特性解析に関して下記の方法を使用した。
【0239】
[LCMS−基本手順]
HPLC測定は、下記それぞれの方法において規定されているように脱気装置付きポンプ(クォータナリまたはバイナリ)、オートサンプラー、カラムオーブン、ダイオードアレー検出器(DAD)およびカラムを有するアジレントテクノロジー社(Agilent Technologies)からのHP1100を用いて行った。カラムからの流れはMS検出器に分配された。このMS検出器はエレクトロスプレーイオン化源が装備されていた。窒素をネブライザーガスとして使用した。イオン化源温度を140℃に維持した。データ収集はMassLynx−Openlynxソフトウェアで行った。
【0240】
[方法1]
上記基本手順に加えて、アギレント社(Agilent)からのXDB−C18カートリッジ(1.8μm、2.1×30mm)上で1ml/分の流量および60℃で逆相HPLCを行なった。用いた勾配条件は次のとおりである。A(0.5g/lの酢酸アンモニウム溶液)を90%、B(アセトニトリル)を5%、C(メタノール)を5%から、6.5分でBを50%およびCを50%まで、7分時点でBを100%まで、そして7.5分時点で初期条件まで平衡化し9.0分まで維持した。注入量は2μlであった。高分解能質量スペクトル(飛行時間、TOF)は、0.1秒の滞留時間を用いて0.5秒で100から750まで走査することにより陽イオン化モードでのみ得られた。キャピラリーニードル電圧は2.5kVであり、コーン電圧は20Vであった。ロイシン−エンケファリンが質量較正(ロックマス)に用いた標準物質であった。
【0241】
[方法2]
上記基本手順に加えて、フェノメネックス社(Phenomenex)からのLUNA−C18カラム(2.5μm、2.1×30mm)上で1.0ml/分の流量および60℃で逆相HPLCを行なった。用いた勾配条件は次のとおりである。A(0.5g/lの酢酸アンモニウム溶液)を90%、B(アセトニトリル)を5%、C(メタノール)を5%から、6.5分でBを50%およびCを50%まで、7分時点でBを100%まで、そして7.5分時点で初期条件まで平衡化し9.0分まで維持した。注入量は5μlであった。高分解能質量スペクトル(飛行時間、TOF)は、0.1秒の滞留時間を用いて0.5秒で100から750まで走査することにより陽イオン化モードでのみ得られた。キャピラリーニードル電圧は陽イオン化モード用では2.5kVであり、コーン電圧は20Vであった。ロイシン−エンケファリンが質量較正(ロックマス)に用いた標準物質であった。
【0242】
[方法3]
上記基本手順に加えて、アドバンスドクロマトグラフィーテクノロジーズ社(Advanced Chromatography Technologies)からのACE−C18カラム(3.0μm、4.6×30mm)上で1.5ml/分の流量および40℃で逆相HPLCを行った。用いた勾配条件は次のとおりである。A(0.5g/lの酢酸アンモニウム溶液)を80%、B(アセトニトリル)を10%、C(メタノール)を10%から、6.5分でBを50%およびCを50%まで、7分時点でBを100%まで、そして7.5分時点で初期条件まで平衡化し9.0分まで維持した。注入量は5μlであった。高分解能質量スペクトル(飛行時間、TOF)は、0.1秒の滞留時間を用いて0.5秒で100から750まで走査することにより陽イオン化モードでのみ得られた。キャピラリーニードル電圧は陽イオン化モード用では2.5kVであり、コーン電圧は20Vであった。ロイシン−エンケファリンが質量較正(ロックマス)に用いた標準物質であった。
【0243】
[融点測定]
融点測定はメトラーFP62装置上で行なわれた。
【0244】
【表6】

【0245】
[D.薬理例]
本発明で提供される化合物は、mGluR2のポジティブアロステリックモジュレーターである。当該化合物は、グルタミン酸塩(エステル)結合部位以外のアロステリック部位に結合することによりグルタミン酸塩(エステル)応答を増強させると考えられる。式(I)の化合物が存在すると、グルタミン酸塩(エステル)濃度に対応するmGluR2の応答が増加される。式(I)の化合物は、受容体の機能を増強する能力によって実質的にmGluR2においてその効果を有すると考えられる。下記の[35S]GTPγS結合アッセイ法を用いてmGluR2において試験されたポジティブアロステリックモジュレーターの挙動を表3に示す。このアッセイ法は、そのような化合物(特に式(I)の化合物)の同定に適している。
【0246】
[35S]GTPγS結合アッセイ
[35S]GTPγS結合アッセイは、Gタンパク質共役型受容体(GPCR)の機能の研究に用いられる機能性の細胞膜に基づくアッセイであり、これによりGTPの非加水分解性形態である[35S]GTPγS(ガンマ線を放射する35Sで標識されたグアノシン5’−三リン酸)の取り込みが測定される。Gタンパク質γサブユニットは、グアノシン三リン酸(GTP)によりグアノシン5’−二リン酸(GDP)の交換を触媒し、アゴニスト([35S]GTPγS)によりGPCRが活性化された場合に取り込まれて交換サイクルを継続するための開裂ができなくなる(ハーパー(Harper)(1998年)「カレントプロトコルズ・イン・ファーマコロジー(Current Protocols in Pharmacology)」2.6.1−10、ジョンワイリーアンドサンズ社(John Wiley & Sons, Inc.))。放射性[35S]GTPγSの取り込み量はGタンパク質の活性の直接的な尺度であり、したがってアゴニストの活性を測定できる。mGluR2受容体は、Gγiタンパク質に優先的に共役することが示されており(本方法のための優先的な共役)、したがって組み換え細胞株中そして組織中の両方でmGluR2受容体の受容体活性化を研究するために広く使用されている(シャフハウザー(Schaffhauser)ら(2003年)、ピンカートン(Pinkerton)ら(2004年)、ムテル(Mutel)ら1998年「ジャーナル・オブ・ニューロケミストリー(Journal of Neurochemistry)」71:2558〜64;シャフハウザーら(1998年)「モレキュラーファーマコロジー(Molecular Pharmacology)」53:228〜33)。ここでは、我々は、本発明の化合物のポジティブアロステリック修飾(PAM)特性を検出するために、ヒトmGluR2受容体でトランスフェクトされシャフハウザーら(2003年)「(モレキュラーファーマコロジー」4:798〜810から作成された細胞に由来する細胞膜を用いた[35S]GTPγS結合アッセイの使用を記載する。
【0247】
[細胞膜調製]
CHO細胞をプレコンフルエントまで培養し5mMの酪酸で24時間刺激した後、PBS中で洗浄し、次いで、均質化用緩衝液(50mMトリス−HCl緩衝液、pH7.4、4℃)中ですくい取って採取した。細胞溶解物をウルトラタラックスホモジナイザーを用いて短時間(15秒)均質化した。ホモジネートを23500×gで10分間遠心分離し、そして上清を廃棄した。ペレットを5mMトリス−HCl(pH7.4)に再懸濁し、再び遠心分離した(30000×g、20分、4℃)。最終的なペレットを50mM HEPES(pH7.4)に再懸濁し、使用前は適切なアリコート中で−80℃で保存した。タンパク質濃度をウシ血清アルブミンを標準としてブラッドフォード法(バイオラッド社(Bio-Rad)、米国)により測定した。
【0248】
[35S]GTPγS結合アッセイ
ヒトmGluR2を含む細胞膜における試験化合物のmGluR2のポジティブアロステリック修飾活性の測定は、前培養前に解凍され短時間均質化された凍結細胞膜を用いて、96ウェルマイクロプレート(15μg/アッセイウェル、30分、30℃)中でポジティブアロステリックモジュレーターの濃度を増加させながら(0.3nMから50μMまで)所定の最小濃度のグルタミン酸塩(エステル)を加える(PAMアッセイ)かまたはグルタミン酸塩(エステル)を加えないでアッセイ緩衝液(50mM HEPES(pH7.4)、100mM NaCl、3mM MgCl2、50μM GDP、10μg/mlサポニン)中で行った。このPAMアッセイのため、細胞膜はEC25の濃度(すなわちグルタミン酸塩(エステル)の最大応答の25%が得られ、出版済みデータ(ピン(Pin)ら(1999年)ヨーロピアン・ジャーナル・オブ・ファーマコロジー(Eur. J. Pharmacol.)375:277〜294)と一致する濃度)のグルタミン酸塩(エステル)で前培養された。[35S]GTPγS(0.1nM、f.c.)を加えて総反応容量を200μlとした後、マイクロプレートを短時間振とうし、さらに培養して、活性化させて[35S]GTPγSを取り込ませた(30分、30℃)。96ウェルプレートセルハーベスター(フィルターメート、パーキンエルマー社、米国)を用いてグラスファイバーフィルタープレート(ユニフィルター96ウェルGF/Bフィルタープレート、パーキンエルマー社、ダウナーズグローヴ、米国)マイクロプレート上で急速に真空ろ過し、次いで、300μlの氷冷した洗浄用緩衝液(10mM Na2PO4・2H2O、10mM NaH2PO4・H2O、pH7.4)で3回洗浄することにより反応を停止させた。次いで、フィルターを風乾し、各ウェルに40μlの液体シンチレーションカクテル(Microscint-O)を加え、細胞膜に結合した[35S]GTPγSを96ウェルシンチレーションプレートリーダー(トップカウント、パーキンエルマー社、米国)中で測定した。非特異的[35S]GTPγS結合は、10μMの冷GTPの存在下で測定される。各曲線は、データ点毎に試料をデュプリケートで用いて11種類の濃度で少なくとも1度作成した。
【0249】
[データ分析]
ポジティブアロステリック修飾(PAM)を調べるため、添加されたEC25のmGluR2アゴニストグルタミン酸の存在下での本発明の代表的な化合物の濃度応答曲線をプリズムグラフパッドソフトウェア(グラフパッド社(GraphPad)、サンディエゴ、米国)を用いて作成した。当該曲線は4変数ロジスティック方程式
【0250】
【数1】

【0251】
にフィッティングされ、EC50値が決定された。EC50は、グルタミン酸塩(エステル)応答の増強の最大半量をもたらす化合物濃度である。これは、ポジティブアロステリックモジュレーターの非存在下のグルタミン酸塩(エステル)応答から完全飽和濃度のポジティブアロステリックモジュレーターの存在下のグルタミン酸塩(エステル)の最大応答を引くことにより計算される。次いで、最大半量効果を生む濃度をEC50として求める。
【0252】
[表3:本発明の化合物に関する薬理学的データ]
すべての化合物を所定のEC25濃度のmGluR2アゴニスト(グルタミン酸塩(エステル))の存在下で試験して、ポジティブアロステリック修飾(GTPγS−PAM)を調べた。示されている値は、少なくとも1つの実験からの11種類の濃度応答曲線のデュプリケートの値の平均である。試験化合物はすべて5.0を超えるpEC50(−logEC50)値を示した。1実験におけるpEC50値の測定誤差は約0.3log単位であると推測される。
【0253】
【表7】

【0254】
[E.組成物例]
これらの実施例にわたって用いられる「有効成分」は、式(I)の最終化合物、その薬学的に許容される塩、その溶媒和物および立体化学的異性体形態に関する。
【0255】
本発明の製剤の代表的な処方例は以下のとおりである。
【0256】
1.錠剤
有効成分 5〜50mg
第二リン酸カルシウム 20mg
ラクトース 30mg
滑石 10mg
ステアリン酸マグネシウム 5mg
バレイショデンプン 200mgまで
この実施例において、有効成分は、同じ量の本発明の化合物のいずれとも、特に、同じ量の例示された化合物のいずれとも置き換えられ得る。
【0257】
2.懸濁剤
1ミリリットル毎に有効化合物1種を1〜5mg、カルボキシルメチルセルロースナトリウムを50mg、安息香酸ナトリウムを1mg、ソルビトールを500mg、および水を1mlまで含むように経口投与用水性懸濁剤が調製される。
【0258】
3.注射剤
非経口組成物は、10容量%のプロピレングリコール水溶液中で1.5重量%の本発明の有効成分を撹拌することにより調製される。
【0259】
4.軟膏
有効成分 5〜1000mg
ステアリルアルコール 3g
ラノリン 5g
白色ワセリン 15g
水 100gまで
この実施例において、有効成分は、同じ量の本発明の化合物のいずれとも、特に、同じ量の例示された化合物のいずれとも置き換えられ得る。
【0260】
妥当な変更は本発明の範囲から逸脱すると見なされるべきではない。上記発明は当業者によって様々に変更される可能性があることは明らかである。
【特許請求の範囲】
【請求項1】
式(I’’)の化合物(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物
【化47】

(式中、R1はC4-6アルキル、またはC3-7シクロアルキルで置換されたC1-3アルキルであり、
R2は水素;ヒドロキシル;フルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシであり、
R3は水素またはハロであるが、但しR3がハロの場合R2はヒドロキシルである)。
【請求項2】
下記式で表される請求項1に記載の化合物(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物
【化48】

(式中、R1はC4-6アルキル、またはC3-7シクロアルキルで置換されたC1-3アルキルであり、
R2は水素;フルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシである)。
【請求項3】
下記のもの以外である請求項2に記載の化合物。
【化49】

および
【化50】

【請求項4】
R2がフルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシである、請求項2または3に記載の化合物。
【請求項5】
R1がC4-6アルキルである、請求項1〜4のいずれか1項に記載の化合物。
【請求項6】
R1が1−ブチルである、請求項5に記載の化合物。
【請求項7】
R1がC3-7シクロアルキルで置換されたC1-3アルキルである、請求項1〜4のいずれか1項に記載の化合物。
【請求項8】
R1がシクロプロピルメチルである、請求項7に記載の化合物。
【請求項9】
R2がフルオロである、請求項1〜8のいずれか1項に記載の化合物。
【請求項10】
R2がヒドロキシルで置換されたC1-4アルキルである、請求項1〜8のいずれか1項に記載の化合物。
【請求項11】
R2がヒドロキシルで置換されたメチルである、請求項10に記載の化合物。
【請求項12】
R2がフルオロで置換されたC1-4アルキルである、請求項1〜8のいずれか1項に記載の化合物。
【請求項13】
R2がフルオロで置換されたメチルである、請求項12に記載の化合物。
【請求項14】
R2がフルオロで置換されたC1-4アルキルオキシである、請求項1〜8のいずれか1項に記載の化合物。
【請求項15】
R2がフルオロで置換されたエチルオキシである、請求項14に記載の化合物。
【請求項16】
R2が水素;フルオロ;またはフルオロで置換されたC1-4アルキルオキシである、請求項1、2、3、5〜7のいずれか1項に記載の化合物。
【請求項17】
R2がフルオロまたはフルオロで置換されたC1-4アルキルオキシである、請求項16に記載の化合物。
【請求項18】
下記式で表される請求項1に記載の化合物(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物
【化51】

(式中、R1はC4-6アルキル、またはC3-7シクロアルキルで置換されたC1-3アルキルであり、
R3は水素またはハロである)。
【請求項19】
R3がハロである、請求項18に記載の化合物。
【請求項20】
R3がクロロである、請求項18に記載の化合物。
【請求項21】
下記式で表される請求項20に記載の化合物あるいはその薬学的に許容される塩またはその溶媒和物。
【化52】

【請求項22】
R1が1−ブチル、3−メチル−1−ブチルまたはシクロプロピルメチルであり;R2が水素;フルオロ;ヒドロキシルで置換されたメチル;フルオロで置換されたメチル;フルオロで置換されたエチルオキシである、請求項1に記載の化合物。
【請求項23】
R1が1−ブチルまたはシクロプロピルメチルであり;R2がフルオロ;ヒドロキシルで置換されたメチル;フルオロで置換されたメチル;フルオロで置換されたエチルオキシである、請求項1に記載の化合物。
【請求項24】
R1が1−ブチルまたはシクロプロピルメチルであり;R2が水素、フルオロまたはクロロである、請求項18に記載の化合物。
【請求項25】
下記から選ばれる請求項1に記載の化合物あるいはその薬学的に許容される塩またはその溶媒和物。
【化53】

【表8】

【請求項26】
下記から選ばれる請求項1に記載の化合物あるいはその薬学的に許容される塩またはその溶媒和物。
【化54】

【表9】

【請求項27】
薬として用いられる請求項1〜26のいずれか1項に記載の化合物。
【請求項28】
治療上有効な量の請求項1〜26のいずれか1項に記載の化合物と、薬学的に許容される担体または希釈剤とを含む医薬組成物。
【請求項29】
ヒトを含む哺乳類における症状の治療または予防のための請求項1〜26のいずれか1項に記載の化合物あるいは請求項28に記載の医薬組成物であって、前記症状の治療または予防がmGluR2のポジティブアロステリックモジュレーターの神経修飾効果により作用されるかまたは促進されることを特徴とする化合物あるいは医薬組成物。
【請求項30】
ヒトを含む哺乳類における症状の治療または予防用薬剤の製造のための請求項1〜26のいずれか1項に記載の化合物あるいは請求項28に記載の医薬組成物の使用であって、前記症状の治療または予防がmGluR2のポジティブアロステリックモジュレーターの神経修飾効果により作用されるかまたは促進されることを特徴とする使用。
【請求項31】
不安障害、精神障害、人格障害、物質関連障害、摂食障害、気分障害、片頭痛、てんかんもしくは痙攣性障害、幼児期障害、認知障害、神経変性、神経毒症状および虚血からなる群から選ばれる中枢神経系障害の治療または予防用薬剤の製造のための請求項1〜26のいずれか1項に記載の化合物あるいは請求項28に記載の医薬組成物の使用。
【請求項32】
前記中枢神経系障害が、広場恐怖症、全般性不安障害(GAD)、強迫観念障害(OCD)、パニック障害、心的外傷後ストレス障害(PTSD)、対人恐怖および他の恐怖症からなる群から選ばれる不安障害である、請求項31に記載の使用。
【請求項33】
前記中枢神経系障害が、統合失調症、妄想性障害、統合失調性感情障害、統合失調症様障害および物質誘発性精神障害からなる群から選ばれる精神障害である、請求項31に記載の使用。
【請求項34】
前記中枢神経系障害が、強迫性人格障害および統合失調症、統合失調型障害からなる群から選ばれる人格障害である、請求項31に記載の使用。
【請求項35】
前記中枢神経系障害が、アルコール乱用、アルコール依存症、アルコール禁断症状、アルコール禁断せん妄、アルコール誘発性精神障害、アンフェタミン依存症、アンフェタミン禁断症状、コカイン依存症、コカイン禁断症状、ニコチン依存症、ニコチン禁断症状、オピオイド依存症およびオピオイド禁断症状からなる群から選ばれる物質関連障害である、請求項31に記載の使用。
【請求項36】
前記中枢神経系障害が、神経性食欲不振症および神経性過食症からなる群から選ばれる摂食障害である、請求項31に記載の使用。
【請求項37】
前記中枢神経系障害が、両相性障害(IおよびII)、気分循環性障害、うつ病、気分変調性障害、大うつ病性障害および物質誘発性気分障害からなる群から選ばれる気分障害である、請求項31に記載の使用。
【請求項38】
前記中枢神経系障害が片頭痛である、請求項31に記載の使用。
【請求項39】
前記中枢神経系障害が、非痙攣性全般てんかん、痙攣性全般てんかん、小発作性てんかん重積、大発作性てんかん重積、意識障害を伴うかまたは伴わない部分てんかん、幼児痙攣症、持続性部分てんかんおよび他の形態のてんかんからなる群から選ばれるてんかんまたは痙攣性の障害である、請求項31に記載の使用。
【請求項40】
前記中枢神経系障害が幼児期障害である、請求項31に記載の使用。
【請求項41】
前記幼児期障害が注意欠陥/多動性障害である、請求項40に記載の使用。
【請求項42】
前記中枢神経系障害が、せん妄、物質誘発持続性せん妄、認知症、HIV疾患による認知症、ハンチントン病による認知症、パーキンソン病による認知症、アルツハイマー型認知症、物質誘発持続性認知症および軽度認知障害からなる群から選ばれる認知障害である、請求項31に記載の使用。
【請求項43】
前記中枢神経系障害が、不安症、統合失調症、片頭痛、うつ病およびてんかんからなる群から選ばれる、請求項31に記載の使用。
【請求項44】
ヒトを含む哺乳類における請求項30〜43のいずれか1項に記載の症状の治療または予防用薬剤の製造のための、mGluR2のオルソステリックアゴニストと組み合わせた請求項1〜26のいずれか1項に記載の化合物の使用。
【請求項45】
前記症状または障害の治療のための、請求項1〜26のいずれか1項に記載の化合物の請求項30〜43のいずれか1項に記載の使用。
【請求項46】
a)Yが適切な脱離基を表す式(II)の中間体を、適切な反応不活性溶媒中で適切な塩基の存在下および加熱条件下で式(III)の中間体と反応させるか、または式(II)の中間体を、適切な反応不活性溶媒中で適切な塩基および適切な触媒の存在下ならびに加熱条件下で式(III)の中間体と反応させること
【化55】

(R1およびR2は請求項1で規定されたとおりである);
b)式(I−b)の化合物を、適切な反応不活性溶媒中で適度な低温で適切なフッ素化剤と反応させること
【化56】

(LはC1-4アルキルを表し、R1は請求項1で規定されたとおりである);
c)式(IV)の中間体を、適切な反応不活性溶媒中で適度な低温で適切なフッ素化剤と反応させること
【化57】

(R1は請求項1で規定されたとおりである);
d)式(XIV)の中間体を、適切な溶媒中で適切な触媒および適切な塩基の存在下で水素化させること
【化58】

(R1は請求項1で規定されたとおりであり、R’2はフルオロで置換されたC1-4アルキルオキシを表す);
あるいは、所望であれば、式(I)の化合物をさらに当該技術分野で公知の転換法に従って互いに変換すること;あるいはさらに、所望であれば、式(I)の化合物を酸で処理することによって治療効果のある非毒性の酸付加塩に変換すること、または逆に酸付加塩形態をアルカリで処理することによって遊離塩基に変換すること;あるいは、所望であれば、その立体化学的異性体形態を調製することを特徴とする、請求項1に記載の化合物の調製方法。
【請求項1】
式(I’’)の化合物(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物
【化47】

(式中、R1はC4-6アルキル、またはC3-7シクロアルキルで置換されたC1-3アルキルであり、
R2は水素;ヒドロキシル;フルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシであり、
R3は水素またはハロであるが、但しR3がハロの場合R2はヒドロキシルである)。
【請求項2】
下記式で表される請求項1に記載の化合物(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物
【化48】

(式中、R1はC4-6アルキル、またはC3-7シクロアルキルで置換されたC1-3アルキルであり、
R2は水素;フルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシである)。
【請求項3】
下記のもの以外である請求項2に記載の化合物。
【化49】

および
【化50】

【請求項4】
R2がフルオロ;ヒドロキシルで置換されたC1-4アルキル;フルオロで置換されたC1-4アルキル;またはフルオロで置換されたC1-4アルキルオキシである、請求項2または3に記載の化合物。
【請求項5】
R1がC4-6アルキルである、請求項1〜4のいずれか1項に記載の化合物。
【請求項6】
R1が1−ブチルである、請求項5に記載の化合物。
【請求項7】
R1がC3-7シクロアルキルで置換されたC1-3アルキルである、請求項1〜4のいずれか1項に記載の化合物。
【請求項8】
R1がシクロプロピルメチルである、請求項7に記載の化合物。
【請求項9】
R2がフルオロである、請求項1〜8のいずれか1項に記載の化合物。
【請求項10】
R2がヒドロキシルで置換されたC1-4アルキルである、請求項1〜8のいずれか1項に記載の化合物。
【請求項11】
R2がヒドロキシルで置換されたメチルである、請求項10に記載の化合物。
【請求項12】
R2がフルオロで置換されたC1-4アルキルである、請求項1〜8のいずれか1項に記載の化合物。
【請求項13】
R2がフルオロで置換されたメチルである、請求項12に記載の化合物。
【請求項14】
R2がフルオロで置換されたC1-4アルキルオキシである、請求項1〜8のいずれか1項に記載の化合物。
【請求項15】
R2がフルオロで置換されたエチルオキシである、請求項14に記載の化合物。
【請求項16】
R2が水素;フルオロ;またはフルオロで置換されたC1-4アルキルオキシである、請求項1、2、3、5〜7のいずれか1項に記載の化合物。
【請求項17】
R2がフルオロまたはフルオロで置換されたC1-4アルキルオキシである、請求項16に記載の化合物。
【請求項18】
下記式で表される請求項1に記載の化合物(その任意の立体化学的異性体形態も含む)あるいはその薬学的に許容される塩またはその溶媒和物
【化51】

(式中、R1はC4-6アルキル、またはC3-7シクロアルキルで置換されたC1-3アルキルであり、
R3は水素またはハロである)。
【請求項19】
R3がハロである、請求項18に記載の化合物。
【請求項20】
R3がクロロである、請求項18に記載の化合物。
【請求項21】
下記式で表される請求項20に記載の化合物あるいはその薬学的に許容される塩またはその溶媒和物。
【化52】

【請求項22】
R1が1−ブチル、3−メチル−1−ブチルまたはシクロプロピルメチルであり;R2が水素;フルオロ;ヒドロキシルで置換されたメチル;フルオロで置換されたメチル;フルオロで置換されたエチルオキシである、請求項1に記載の化合物。
【請求項23】
R1が1−ブチルまたはシクロプロピルメチルであり;R2がフルオロ;ヒドロキシルで置換されたメチル;フルオロで置換されたメチル;フルオロで置換されたエチルオキシである、請求項1に記載の化合物。
【請求項24】
R1が1−ブチルまたはシクロプロピルメチルであり;R2が水素、フルオロまたはクロロである、請求項18に記載の化合物。
【請求項25】
下記から選ばれる請求項1に記載の化合物あるいはその薬学的に許容される塩またはその溶媒和物。
【化53】

【表8】

【請求項26】
下記から選ばれる請求項1に記載の化合物あるいはその薬学的に許容される塩またはその溶媒和物。
【化54】

【表9】

【請求項27】
薬として用いられる請求項1〜26のいずれか1項に記載の化合物。
【請求項28】
治療上有効な量の請求項1〜26のいずれか1項に記載の化合物と、薬学的に許容される担体または希釈剤とを含む医薬組成物。
【請求項29】
ヒトを含む哺乳類における症状の治療または予防のための請求項1〜26のいずれか1項に記載の化合物あるいは請求項28に記載の医薬組成物であって、前記症状の治療または予防がmGluR2のポジティブアロステリックモジュレーターの神経修飾効果により作用されるかまたは促進されることを特徴とする化合物あるいは医薬組成物。
【請求項30】
ヒトを含む哺乳類における症状の治療または予防用薬剤の製造のための請求項1〜26のいずれか1項に記載の化合物あるいは請求項28に記載の医薬組成物の使用であって、前記症状の治療または予防がmGluR2のポジティブアロステリックモジュレーターの神経修飾効果により作用されるかまたは促進されることを特徴とする使用。
【請求項31】
不安障害、精神障害、人格障害、物質関連障害、摂食障害、気分障害、片頭痛、てんかんもしくは痙攣性障害、幼児期障害、認知障害、神経変性、神経毒症状および虚血からなる群から選ばれる中枢神経系障害の治療または予防用薬剤の製造のための請求項1〜26のいずれか1項に記載の化合物あるいは請求項28に記載の医薬組成物の使用。
【請求項32】
前記中枢神経系障害が、広場恐怖症、全般性不安障害(GAD)、強迫観念障害(OCD)、パニック障害、心的外傷後ストレス障害(PTSD)、対人恐怖および他の恐怖症からなる群から選ばれる不安障害である、請求項31に記載の使用。
【請求項33】
前記中枢神経系障害が、統合失調症、妄想性障害、統合失調性感情障害、統合失調症様障害および物質誘発性精神障害からなる群から選ばれる精神障害である、請求項31に記載の使用。
【請求項34】
前記中枢神経系障害が、強迫性人格障害および統合失調症、統合失調型障害からなる群から選ばれる人格障害である、請求項31に記載の使用。
【請求項35】
前記中枢神経系障害が、アルコール乱用、アルコール依存症、アルコール禁断症状、アルコール禁断せん妄、アルコール誘発性精神障害、アンフェタミン依存症、アンフェタミン禁断症状、コカイン依存症、コカイン禁断症状、ニコチン依存症、ニコチン禁断症状、オピオイド依存症およびオピオイド禁断症状からなる群から選ばれる物質関連障害である、請求項31に記載の使用。
【請求項36】
前記中枢神経系障害が、神経性食欲不振症および神経性過食症からなる群から選ばれる摂食障害である、請求項31に記載の使用。
【請求項37】
前記中枢神経系障害が、両相性障害(IおよびII)、気分循環性障害、うつ病、気分変調性障害、大うつ病性障害および物質誘発性気分障害からなる群から選ばれる気分障害である、請求項31に記載の使用。
【請求項38】
前記中枢神経系障害が片頭痛である、請求項31に記載の使用。
【請求項39】
前記中枢神経系障害が、非痙攣性全般てんかん、痙攣性全般てんかん、小発作性てんかん重積、大発作性てんかん重積、意識障害を伴うかまたは伴わない部分てんかん、幼児痙攣症、持続性部分てんかんおよび他の形態のてんかんからなる群から選ばれるてんかんまたは痙攣性の障害である、請求項31に記載の使用。
【請求項40】
前記中枢神経系障害が幼児期障害である、請求項31に記載の使用。
【請求項41】
前記幼児期障害が注意欠陥/多動性障害である、請求項40に記載の使用。
【請求項42】
前記中枢神経系障害が、せん妄、物質誘発持続性せん妄、認知症、HIV疾患による認知症、ハンチントン病による認知症、パーキンソン病による認知症、アルツハイマー型認知症、物質誘発持続性認知症および軽度認知障害からなる群から選ばれる認知障害である、請求項31に記載の使用。
【請求項43】
前記中枢神経系障害が、不安症、統合失調症、片頭痛、うつ病およびてんかんからなる群から選ばれる、請求項31に記載の使用。
【請求項44】
ヒトを含む哺乳類における請求項30〜43のいずれか1項に記載の症状の治療または予防用薬剤の製造のための、mGluR2のオルソステリックアゴニストと組み合わせた請求項1〜26のいずれか1項に記載の化合物の使用。
【請求項45】
前記症状または障害の治療のための、請求項1〜26のいずれか1項に記載の化合物の請求項30〜43のいずれか1項に記載の使用。
【請求項46】
a)Yが適切な脱離基を表す式(II)の中間体を、適切な反応不活性溶媒中で適切な塩基の存在下および加熱条件下で式(III)の中間体と反応させるか、または式(II)の中間体を、適切な反応不活性溶媒中で適切な塩基および適切な触媒の存在下ならびに加熱条件下で式(III)の中間体と反応させること
【化55】

(R1およびR2は請求項1で規定されたとおりである);
b)式(I−b)の化合物を、適切な反応不活性溶媒中で適度な低温で適切なフッ素化剤と反応させること
【化56】

(LはC1-4アルキルを表し、R1は請求項1で規定されたとおりである);
c)式(IV)の中間体を、適切な反応不活性溶媒中で適度な低温で適切なフッ素化剤と反応させること
【化57】

(R1は請求項1で規定されたとおりである);
d)式(XIV)の中間体を、適切な溶媒中で適切な触媒および適切な塩基の存在下で水素化させること
【化58】

(R1は請求項1で規定されたとおりであり、R’2はフルオロで置換されたC1-4アルキルオキシを表す);
あるいは、所望であれば、式(I)の化合物をさらに当該技術分野で公知の転換法に従って互いに変換すること;あるいはさらに、所望であれば、式(I)の化合物を酸で処理することによって治療効果のある非毒性の酸付加塩に変換すること、または逆に酸付加塩形態をアルカリで処理することによって遊離塩基に変換すること;あるいは、所望であれば、その立体化学的異性体形態を調製することを特徴とする、請求項1に記載の化合物の調製方法。
【公表番号】特表2010−520263(P2010−520263A)
【公表日】平成22年6月10日(2010.6.10)
【国際特許分類】
【出願番号】特願2009−552214(P2009−552214)
【出願日】平成20年3月7日(2008.3.7)
【国際出願番号】PCT/EP2008/052766
【国際公開番号】WO2008/107479
【国際公開日】平成20年9月12日(2008.9.12)
【出願人】(509067496)オルソ−マクニール−ジャンセン ファーマシューティカルズ, インコーポレイテッド (4)
【出願人】(506417670)アデックス ファーマ ソシエテ アノニム (13)
【Fターム(参考)】
【公表日】平成22年6月10日(2010.6.10)
【国際特許分類】
【出願日】平成20年3月7日(2008.3.7)
【国際出願番号】PCT/EP2008/052766
【国際公開番号】WO2008/107479
【国際公開日】平成20年9月12日(2008.9.12)
【出願人】(509067496)オルソ−マクニール−ジャンセン ファーマシューティカルズ, インコーポレイテッド (4)
【出願人】(506417670)アデックス ファーマ ソシエテ アノニム (13)
【Fターム(参考)】
[ Back to top ]

