3−ヒドロキシアルカン酸オリゴマーの栄養的および治療的使用
【課題】哺乳動物の血液中のケトン体レベルを増加させるための栄養組成物または治療組成物を提供する。
【解決手段】3−ヒドロキシ酸(ここで、該3−ヒドロキシ酸は3−ヒドロキシ酪酸ではない)、を活性成分として含有する、経口摂取したときに血液ケトンレベルを増加するための栄養または治療食物組成物であって、ここで該3−ヒドロキシ酸は、a)アセトアセテートと組み合わせた3−ヒドロキシ酸の直鎖オリゴマー、b)3−ヒドロキシ酸の環式オリゴライド、c)アセトアセテートと組み合わせた3−ヒドロキシ酸のエステル、d)アセトアセテートと組み合わせた3−ヒドロキシ酸の直鎖オリゴマーおよび環式オリゴライドのエステル、ならびにe)それらの組み合わせ、からなる群から選択される形態である組成物。該組成物は、強心効果の増大、糖尿病およびインスリン抵抗状態の処置、神経変性障害の作用およびてんかんの処置に有用である。
【解決手段】3−ヒドロキシ酸(ここで、該3−ヒドロキシ酸は3−ヒドロキシ酪酸ではない)、を活性成分として含有する、経口摂取したときに血液ケトンレベルを増加するための栄養または治療食物組成物であって、ここで該3−ヒドロキシ酸は、a)アセトアセテートと組み合わせた3−ヒドロキシ酸の直鎖オリゴマー、b)3−ヒドロキシ酸の環式オリゴライド、c)アセトアセテートと組み合わせた3−ヒドロキシ酸のエステル、d)アセトアセテートと組み合わせた3−ヒドロキシ酸の直鎖オリゴマーおよび環式オリゴライドのエステル、ならびにe)それらの組み合わせ、からなる群から選択される形態である組成物。該組成物は、強心効果の増大、糖尿病およびインスリン抵抗状態の処置、神経変性障害の作用およびてんかんの処置に有用である。
【発明の詳細な説明】
【背景技術】
【0001】
(発明の背景)
本発明は、一般的に、ヒトおよび他の哺乳動物のケトンレベルの調節のための栄養用および治療用組成物の分野内である。
【0002】
ヒトまたは動物の身体におけるケトン体のレベルを増加させることが望ましい、ヒトおよび動物の状態が多く存在する。例には、発作の制御、特定の代謝性障害の処置、タンパク質異化の減少、減量時の食欲抑制、および非経口の栄養摂取が挙げられる。
【0003】
てんかん患者の発作制御のために、多くの処置が存在する。抗発作医薬が普及している;しかし、これらは、必ずしも効果的であるとは限らず、所望でない副作用を引き起こし得る。ケトン誘発食は、今世紀の変わり目から使用されているが、抗発作医薬の開発についての好意は失われている。ケトン誘発食は、最近、特定の形態のてんかんならびに他の医学的状態の処置について新たな興味を引き寄せている。典型的には、注意深く制御され、医者が管理する食餌は、脂肪カロリーが非常に高く、炭水化物が低い。食餌療法は、エネルギーを得るために炭水化物の代わりに脂肪を代謝させることを身体に強い、それによって血中のアセトアセテートおよびD−3−ヒドロキシブチレートのレベルを上昇させる。これらの化合物は、「ケトン体」と呼ばれ、従って、用語「ケトン体生成(ケトン誘発)(ketogenic)」は、食餌療法を説明するために使用される。
【0004】
ケトン誘発食の作用の正確なメカニズムは、十分には分かっていないが、ケトン体の上昇した血液レベルは、発作を防ぐのに役立つ鎮静作用を有すると考えられる。しかし、この目的に有効であるために、患者は食餌療法を厳しく守らなければならない。ビタミンおよびミネラル補助食品が、食餌を栄養的に完全にするために食餌中に含まれる。なぜなら、この食餌は、脂肪が非常に高く、タンパク質は低く、炭水化物をほぼ除去することを必要とするからである。各患者の食餌は、患者の年齢、大きさ、および活性のレベルに基づいて数学的に計算される。患者は、1〜2年の間、規則通りに食餌療法に従い、この時点で、患者は、徐々に普通の食餌に戻される。食餌療法は、てんかんの子供に特に効果的であることが見出されている。大きな欠点は、食餌があまり口に合わず、患者のコンプライアンスは、患者の一部およびその家族に完全な義務を要求する。さらに、この食餌の高い脂肪含量は、アテローム性硬化症などの血管疾患の危険を増加させ得る。
【0005】
特定の食餌療法は、ある人が、例えば、手術の前または肥満症由来の合併症のために、というような健康の理由のために至急に体重の減少を必要とする場合にも使用される。この場合、医者は、その人のカロリー摂取を非常に制限する食餌療法を処方し得る。カロリー摂取量が減少すると、身体はエネルギーを得るために貯蔵の蓄えを代謝することが強いられる。身体は、脂肪および骨格組織(例えば、筋肉およびタンパク質)からエネルギーを導き得る。しかし、タンパク質よりも脂肪組織が使用されることが好ましい。なぜなら、タンパク質の分解(すなわち「異化」)は、筋萎縮、免疫抑制、および低下した創傷治癒を望ましくなく生じ得る。ヒドロキシ酪酸を用いる食餌補助は、低エネルギーの食餌の被験体においてタンパク質異化を減少することが示された(PawanおよびSemple、Lancet 8:15(1983))。3−ヒドロキシブチレートが食欲を有利に抑制することも報告されている。
【0006】
完全非経口栄養法(「TPN」)は、腸管不全の場合のように、経口的に食べ物を摂取することができない患者に栄養素を提供するために使用される。この状態の通常の原因には、胃腸管の炎症性障害(例えば、クローン病)、放射線腸炎、および壊死した腸または疾患を患っている腸の外科的切断に由来する短腸が挙げられる。約22,000人の外来患者および150,000人の入院患者が、米国だけでTPNを現在受けている(PR Newswire:Orphan Medical Announcement、1995年6月9日)。患者は、典型的には濃縮脂肪乳濁液である栄養素を、静脈に直接受ける。栄養組成物は、例えば、Changらの米国特許第4,563,354号;EP 0321428 A1;Wretlindらの米国特許第5,093,044号;PCT WO 88/08301;PCT WO90/02548;PCT WO 90/02549;およびPCT WO 90/11753に記載される。しかし、脂肪乳濁液を用いる非経口的な処置は、カテーテル閉塞、高脂肪血、血小板障害、脂肪過負荷症候群(fat overload syndrome)、および脂肪塞栓症のような深刻な副作用を有し得る(Desrochersら、J.Nutr.Biochem.6:111−18(1995))。従って、長期間の静脈給食に使用され得る、高エネルギー、水溶性栄養素を開発することは、非常に利益がある。
【0007】
大体において、ケトン抗体のR−3−ヒドロキシブチレートおよびアセトアセテート(これらはヒト血清の天然成分である)は、脂肪乳濁液の代わりに静脈摂取のために使用され得る。これらの化合物は、長期の飢餓の間および糖尿病性ケトアシドーシスを除いて、末梢組織の良い燃料(fuel)であり、最終的に二酸化炭素に酸化される。不運なことに、これらの酸の形態でのこれらの化合物の投与は、静脈に刺激を引き起こし得、ナトリウム塩としての化合物の注入は、危険なナトリウムの過負荷となり得る(Desrochersら、J.Nutr.Biochem.6:111−18(1995))。これらの問題を解決するために、研究者らは、塩基性アミノ酸塩を有するR−3−ヒドロキシブチレートの投与を調査した(Beylotら、Crit.Care Med22:1091−98(1994):Lammerantら、J.Mol.Cell.Cardiol.17:421−33(1985))。しかし、このような処置は、血液脳関門を横切るアミノ酸の輸送を妨害し得、そして/または患者の肝臓または腎臓の病理に干渉し得る(Desrocherら、J.Nutr.Biochem.6:111−18(1995))。他は、ケトン体に対する塩の比を減少させるために、栄養素として3−ヒドロキシ酪酸オリゴマーのナトリウム塩の使用を記載している(Hiraideらの日本特許第94,321,778号)。
【0008】
栄養素としてケトン体を使用する別のアプローチは、アセトアセテートのグリセロールモノエステルの合成に焦点が当てられており、これは、血漿および組織中でグリセロールおよびアセトアセテートに加水分解される(BirkhahnおよびBorder、Am.J.Clin.Nutr.31:436−41(1978);Birkhahanら、J.Nutr.109:1168−74(1979))。この組成物は、大量のナトリウム負荷のない、大量のケトン体をの投与を提供する最初のものであった。
【0009】
研究者らはまた、ケトン体への前駆体の使用を調査している。例えば、R,S−1,3−ブタンジオールは、水溶性前駆体であり、これは肝臓でR,S−3−ヒドロキシブチレートに代謝される(Desrochersら、J.Nutr.Biochem.6:111−18(1995))。しかし、このジオールは、静脈栄養素としての使用に適切ではない。なぜなら、このジオールは、オスモル当たりのカロリー密度が低く、肝臓でのジオールの酸化は、[NADH]/[NAD+]比を著しく増加し、これはアルコール性低血糖を誘発し得る。これらの問題に取り組むための1つの努力は、R,S−1,3−ブタンジオールのアセトアセテートを使用することに焦点が当てられており、その結果、エステラーゼによって遊離されるアセトアセテートがこのジオールの酸化によって肝臓で生成される還元等価物を捕捉し得る(Desrochersら、J.Nutr.Biochem.6:111−18(1995))。
【0010】
ケトン体レベルを調節することはまた、食肉産業のための動物の生産において有用である。Stahlyの米国特許第4,329,359号および第4,423,072号は、生まれたてのブタの代謝の安定性を改善するために、妊娠中の雌ブタにジヒドロキシアルカノールおよびトリグリセリドを給食することを開示する。これらの組成物は、雌ブタにおけるケトン体を増加するために機能する。次いで、ケトン体は、胎盤を通って移動され、発育中の胎仔に補助的なエネルギー源を提供する。
【0011】
British Technology Group LtdによるPCT
WO 98/41200およびPCT WO 98/41201は、栄養および治療組成物中に、アセトアセテートと、ポリD−β−ヒドロキシブチレートまたはそのエステルまたはオリゴマー、ならびに/あるいは代謝前駆体またはその塩とを組み合わせた使用が開示され、これは、心臓の効率を増加するため、糖尿病およびインシュリン抵抗性状態の処置のため、および神経変性障害およびてんかんの効果の処置のために、血液中のケトン体のレベルを上昇させる。これらの適用は、ケトンレベルがこれらの障害を処置するために上昇され得るメカニズムを提供するが、有用な化合物の数は、アセトアセテートと、D−β−ヒドロキシブチレートの前駆体、またはオリゴマー、またはエステルのいずれかとの組み合わせに限定される。
【0012】
従って、経口または非経口投与に適した、ヒトおよび他の動物の身体におけるケトンレベルを上昇させるための改善された組成物または代替の組成物を提供することが、本発明の目的である。
【0013】
より良いまたはより長いバイオアベイラビリティを有するか、あるいは異なる代謝生成物を有する組成物を提供し、そして発作制御、代謝病制御、タンパク質異化の減少、食欲の抑制、非経口の栄養素、心臓効率の増加、糖尿病の処置、神経変性障害またはヒトおよび他の動物のケトンレベルに影響する状態もしくはそのケトンレベルによって生じる状態の効果の処置のために、それらの使用方法を提供することが本発明のさらなる目的である。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】米国特許第4,563,354号明細書
【特許文献2】欧州特許第0321428号明細書
【特許文献3】米国特許第5,093,044号明細書
【特許文献4】国際公開第88/08301号
【特許文献5】国際公開第90/02548号
【特許文献6】国際公開第90/02549号
【特許文献7】国際公開第90/11753号
【特許文献8】日本特許第94,321,778号
【特許文献9】米国特許第4,329,359号明細書
【特許文献10】米国特許第4,423,072号明細書
【特許文献11】国際公開第98/41200号
【特許文献12】国際公開第98/41201号
【非特許文献】
【0015】
【非特許文献1】PawanおよびSemple、Lancet 8:15(1983)
【非特許文献2】Desrochersら、J.Nutr.Biochem.6:111−18(1995)
【非特許文献3】Beylotら、Crit.Care Med22:1091−98(1994)
【非特許文献4】Lammerantら、J.Mol.Cell.Cardiol.17:421−33(1985)
【非特許文献5】BirkhahnおよびBorder、Am.J.Clin.Nutr.31:436−41(1978)
【非特許文献6】Birkhahanら、J.Nutr.109:1168−74(1979)
【発明の概要】
【0016】
(発明の要旨)
栄養または治療組成物は、3−ヒドロキシ酸の直線または環状オリゴマーおよび/あるいは誘導体の形態でケトン体源を提供することによって、哺乳動物におけるケトン体レベルを増加させるために提供される。3−ヒドロキシ酸は、アセトアセテート、3−ヒドロキシ酸の環状オリゴマー、直線または環状オリゴマーのエステル、3−ヒドロキシ酪酸以外の3−ヒドロキシ酸のエステル、およびその組み合わせと合わせて投与される場合、3−ヒドロキシ酪酸の直線ホモオリゴマー以外の3−ヒドロキシ酸の直線オリゴマーの形態であり得る。オリゴマーは、一般的に、3個以上のヒドロキシ酸のポリマーを示す。好ましい3−ヒドロキ酸には、3−ヒドロキシブチレート、3−ヒドロキシバレレート(hydroxyvalerate)、3−ヒドロキシヘキサノエート、および3−ヒドロキシヘプタノエートが挙げられる。3−ヒドロキシバレレートのような奇数の炭素数の3−ヒドロキシ酸のオリゴマーは、偶数の炭素を有する3−ヒドロキシ酸のオリゴマーよりもより高いエネルギー含量を有するので有利である。環状オリゴマーは、ある期間の時間に渡って維持されたそして/または制御されたケトン血液レベルを生じるので、有利な性質を有する。
【0017】
この組成物は、経口的に(例えば、栄養用または食餌用補助食品として)、あるいは静脈的に投与され得る。血液ケトンレベルを増加させることは、発作制御、代謝病制御、タンパク質異化の減少、食欲の抑制、非経口の栄養素、心臓効率の増加、糖尿病およびインシュリン抵抗性状態の処置、ならびに神経変性障害およびてんかんの効果の処置に有用である。
【0018】
(発明の詳細な説明)
特定のヒドロキシ酸、誘導体、オリゴマーおよびそのエステルは、哺乳類の血中ケトン体レベルを調節するために、ケトン体の供給源を提供し得、そして生物学的に産生されるポリヒドロキシアルカノエートは、これらのヒドロキシ酸のための優れた供給源であることが発見された。これらのオリゴマーおよび/または3−ヒドロキシ酸の誘導体は、ケトンレベルを上昇させるための公知の方法および組成物に関係する欠点のない、多くの栄養および治療組成物を生成するために容易に適合され得る。
【0019】
(I.3−ヒドロキシ酸の栄養および治療組成物)
組成物には、3−ヒドロキシ酸、その直鎖または環状オリゴマー、3−ヒドロキシ酸またはオリゴマーのエステル、3−ヒドロキシ酸の誘導体およびその組合わせが挙げられる。1つの好ましい実施態様において、この組成物は、3、4または5個のモノマーサブユニットを含むR−3−ヒドロキシ酸の環状マクロライドを含有する。好ましい3−ヒドロキシ酸には、3−ヒドロキシ酪酸、3−ヒドロキシ吉草酸、3−ヒドロキシヘキサン酸および3−ヒドロキシヘプタン酸が挙げられる。好ましいオリゴマーの長さは、その誘導体が、モノマーの持続放出において適切な消化速度を有するような長さであるべきである。別の好ましい実施態様において、環状三量体(トリオライド)は、他の環状オリゴライドまたは直鎖エステルおよび/または両方の混合物との組合わせで、使用される。
【0020】
3−ヒドロキシ酸に対する一般式は以下:
【0021】
【化1】

であり、ここで、
R1は、水素、メチル、アルキル、アルケニル、アリール、アリールアルキル、ヘテロアルキル、ヘテロアリール、チオール、ジスルフィド、エーテル、チオ
ールエーテル、アミン、アミド、ハロゲンから選択され、
R2およびR3は、水素、メチル、アルキル、アルケニル、アリール、アリールアルキル、ヘテロアルキル、ヘテロアリール、チオール、ジスルフィド、エーテル、チオールエーテル、アミン、アミド、ハロゲン、ヒドロキシ、エステル、窒素置換された基、および/または酸素置換された基から独立して選択され、
R4は、水素、アルキル、アルケニル、アリール、アリールアルキル、ヘテロアルキル、ヘテロアリール、チオール、ジスルフィド、エーテル、チオールエーテル、アミン、アミド、ハロゲン、ヒドロキシ、エステル、窒素置換された基、および/または酸素置換された基から選択され、
さらに、R4が水素またはハロゲンでない場合、R3は直接R4に結合され得、そしてR4はメチルであり得る。
【0022】
以下の定義が、本明細書を通して使用され得る。
【0023】
用語「アルキル」は、C2-15直鎖、分枝または環状のアルキル基を指す。
【0024】
用語「アルケニル」は、1つ以上の炭素−炭素二重結合をさらに含む分枝または直鎖C2〜C77(15)炭化水素を指す。
【0025】
用語「アリール」は、1つ以上の芳香環を含む基を指す。アリール基は、非置換であり得るか、またはアルキル、ハロアルキル、アルコキシ、アミノ、アルキルアミノ、ジアルキルアミノ、ヒドロキシ、ハロおよびニトロから独立して選択される置換基で置換され得る。
【0026】
用語「アリールアルキル」は、アリール基が付加されるアルキル基(上で定義されたような)を指す。
【0027】
用語「ヘテロアルキル」は、1つ以上の炭素原子が、非炭素原子(例えば、酸素、窒素、硫黄など)で置換されるアルキル基(上で定義されたような)を指す。
【0028】
用語「ヘテロアリール」は、芳香環中の原子の少なくも1つは炭素ではない、1つ以上の芳香環を含む基を指す。ヘテロアリール基は、非置換であり得るか、あるいはアルキル、ハロアルキル、アルコキシ、アミノ、アルキルアミノ、ジアルキルアミノ、ヒドロキシ、ハロおよびニトロから独立して選択される置換基で置換され得る。
【0029】
用語「チオール」は、RSHを指し、ここでRは、アルキル、アルケニル、ア
リール、アリールアルキル、ヘテロアルキル、またはヘテロアリール(上で定義されたような)を指す。
【0030】
用語「ジスルフィド」は、硫黄−硫黄結合を含む基を指す。
【0031】
用語「エーテル」は、C−O−Cユニットを含む基を指す。
【0032】
(ヒドロキシ酸オリゴマー)
1つの好ましい実施態様において、組成物は、5〜10個の炭素原子を有する3−ヒドロキシ酸の直鎖オリゴマーを含む。本明細書中で使用される場合、用語「オリゴマー」は、約2000g/mol未満の、好ましくは約1000g/mol未満の重量平均分子量を有するか、または約100個未満のモノマーサブユニットを有するポリマーを意味する。代表的な例には、3−ヒドロキシバレレート、3−ヒドロキシヘキサノエート、3−ヒドロキシへプタノエート、3−ヒドロキシオクタノエートおよびそれらの組合わせが挙げられる。本明細書で使用される場合、ホモオリゴマーは1種類のタイプの3−ヒドロキシ酸のみを含み、一方、オリゴマーは1種類以上の3−ヒドロキシ酸を含むホモオリゴマーまたはヘテロオリゴマーのいずれかを指し得る。
【0033】
別の好ましい実施態様において、組成物は、奇数個の炭素を有する3−ヒドロキシ酸を含み、この3−ヒドロキシ酸は、偶数個の炭素を有する3−ヒドロキシ酸よりも高いカロリー値を有する。例えば、3−ヒドロキシバレレートのオリゴマーエステル(単独、または他のヒドロキシアルカノエートと混合される)は、奇数個に数えら得るヒドロキシ酸、3−ヒドロキシバレレートを誘導するために、使用され得る。
【0034】
さらなる別の好ましい実施態様において、組成物は、4〜10個の炭素原子の3−ヒドロキシ酸を含む、3−ヒドロキシアルカン酸の環状オリゴマーまたは3−ヒドロキシアルカノエートオリゴマーエステルを含む。このヒドロキシ酸は、エステル形態の消化または代謝の結果、遊離される。ヒドロキシ酸をエステル形態で提供することによって、これらの組生物は、ヒドロキシ酸の酸または塩形態での送達によって引き起こされる複雑化を排除し得る。
【0035】
以下の実施例によって説明されるように、環状オリゴマーは、ケトン体レベルが、摂取後少なくとも数時間の長期間に渡って高いままに保たれるという利点を有する。例えば、3−ヒドロキシブチレートのトリオライドのような環状3−ヒドロキシブチレートのエステルは、ケトン体の持続放出を提供し得る。モノマーの徐放は、ケトン体(例えば、3−ヒドロキシブチレート)のより一定したレベルを、長期間に渡って身体に提供するので、徐放は先行技術の組成物を超す主要な利点を提供する。この放出プロフィールは、特定のケトン体濃度を維持するために必要とされる投薬頻度を減少させ、これは、この物質を投与することが困難である睡眠中のような期間の間で特に重要である。
【0036】
(誘導ヒドロキシ酸)
PHAのファミリーは側鎖置換基を変化させた非常に多くのヒドロキシ酸を含むので、3−ヒドロキシ酸のタイプの賢明な選択は、pcr酸基準の発熱密度(caloric density on a pcr acid)を増加させるか、または奇数の鎖長を有する酸を提供する手段を提供する。好ましい誘導体は、上記の式のR基がエチルまたはメチルであるようなものである。
【0037】
(3−ヒドロキシ酸またはオリゴマーのエステル)
組成物はまた、3−ヒドロキシ酸のエステルあるいは直鎖または環状3−ヒドロキシ酸オリゴマーのいずれかのエステルを含み得る。別の好ましい実施態様において、組成物は、例えば1,3−ブタンジオールへのエステル結合で終結したR−3ヒドロキシアルカノエートオリゴマーを含む。オリゴマーの長さは、好ましくは、誘導体が静脈投与において適切である溶解度を有するような長さである。この1,3−ブタンジオールは、ヒドロキシ酸オリゴマーに、第1級アルコール、第2級アルコールおよび/または両方の混合物によって結合され得る。続くオリゴマーエステル、非R−3ヒドロキシユニットの非経口(例えば、静脈)投与は、それがオリゴマーエステルから放出された後、身体内で、容易に受容され、そして代謝されるべきである。
【0038】
好ましくは、ヒドロキシ酸オリゴマーはまた、所望される物理的および栄養特性(例えば、水溶解性およびカロリー給付(calorific benefit basis))を含むように選択される。
【0039】
(ヒドロキシ酸組成物の供給源)
ヒドロキシ酸およびヒドロキシ酸オリゴマーの有用な供給源は、細菌貯蔵ポリエステル、ポリヒドロキシアルカノエートのファミリーであり、これらは、多くの微生物によって細胞間に蓄積され得る。ポリ[(R)−3−ヒドロキシアルカノエート](PHA)は、再生可能資源から製造され、広範囲の工業的かつ生物医学的な応用における、生分解性かつ生体適合性の熱可塑性物質である(Williams&Peoples,CHEMTECH26:38−44(1996))。
【0040】
近年、PHA生体高分子は、単一のホモポリマー、ポリ−3−ヒドロキシブチレート(PHB)であると本来考えられたものから、広い種類の異なるモノマー組成を有するポリエステルのクラスへと脱却してきている。現在のところ、約100種の異なるモノマーがPHA高分子に組み込まれてきた(Steinbuchel&Valentin,FEMS Microbiol.Lett.128:219−28(1995))。本明細書に記載されるように、これらの天然ポリエステルは、栄養および治療用途のために適切な誘導体へ転換され得る。
【0041】
(ヒドロキシ酸オリゴマーおよび誘導体を製造するための方法)
本明細書中に記載されるヒドロキシ酸オリゴマー誘導体を調製するための代表的な方法には、以下が挙げられる:ポリヒドロキシアルカノエートのオリゴマー誘導体への直接分解;3−ヒドロキシアルカノエートの環状オリゴマーの開環;ヒドロキシアルカノエートまたはその誘導体の重合;そして末端ヒドロキシアルカノエートの単位の修飾とともに開始するか、または終了する、ヒドロキシアルカノエートオリゴマーの段階合成。このような合成は、当該分野で公知の方法を使用して容易に実施され得る。アルコールへのエステル結合で終了されるヒドロキシ酸オリゴマーの合成に関する本方法の好ましい実施態様において、プロセスは以下を包含し得る:アルコールを用いるポリヒドロキシアルカノエートの直接分解;アルコールを用いるヒドロキシアルカノエートの環状オリゴマーの開環;および、アルコールによる末端ヒドロキシアルカノエート単位のエステル化で開始するか、または終了する、ヒドロキシアルカノエートオリゴマーの段階合成。
このような合成は、当該分野に公知の方法を使用して実施され得る。
【0042】
(R)−3−ヒドロキシブチル酸の環状オリゴライドは、多数の公知の方法によって調製され得る。例えば、これらの方法は、Seebachら、Angew.Chem.Int.Eng.Ed.、4:434−35(1992);Seebachら、Helv.Chim.Acta.71:155−67(1988);Seebachら、Helv.Chim.Acta.、72:1704−17(1989);およびMuellerら、Chima45:376(1991)に記載される。これらの方法は、細菌から誘導したポリエステル、ポリ−(R)−3−ヒドロキシブチレート(PHB)からの変換、または成分の酸(R)−3−ヒドロキシブチレートまたはそのエステルからのマクロライド形成を包含する。大半の直接経路は、酸触媒条件下でのPHBの直鎖オリゴマーと環状オリゴマーの混合物への分解である。オリゴライドおよびオリゴマーは、従来の洗浄、抽出、および蒸留工程によって粗混合物から単離され得、精製物質を得る。
【0043】
(II.栄養摂取および調食組成物)
これらの組成物は、腸内または非経口的な投与(例えば、組成物を適切な送達ビヒクルと合せることによって)に適合され得る。腸内投与に関して、組成物は、例えば、食餌補給として食物または飲料に添加され得る。あるいは、これらの組成物は、非経口的に(例えば、注射用の生理食塩水溶液に溶解することによって)送達され得る。遺伝子操作技術を技術を使用すると、植物は適切な3−ヒドロキシ酸または3−ヒドロキシ酸のオリゴマーを発現するように操作され得る。適切な手段および方法は、MetabolixによるWO97/15681およびPCT/US99/04999に記載される。
【0044】
ヒドロキシ酸処方物は、単独で、乾燥またはパウダー形態で、キャリア中の溶液(例えば、水、ノーマルセーライン、またはリン酸緩衝化生理食塩水)で投与され得るか、あるいは、血中ケトンを高める他の物質(例えば、単独あるいはタンパク質または炭水化物と組み合せた、遊離脂肪酸、トリグリセリド)と混合され得る。伝統的なケトン誘発食(例えば、Marriott Corp.Health Care Services,Pediatric Diet Manual,Revised August 1987によって推奨される食餌)は、合わせた炭水化物およびタンパク質1gに対して3:1〜4:1gの脂肪を含む。脂肪は代謝されて3−ヒドロキシ酸およびアセトアセテートを生じるので、所望のレベルは、少なくとも約1〜2mMから最大約7.5mMまで(肥満個体の長期の空腹の間に達成される)の範囲であるが、範囲は0.3〜20mMであり得、3−ヒドロキシ酸を含有する組成物が処方されて、伝統的なケトン誘発食の値と同様の値を得、この収量は3−ヒドロキシ酸が直接投与される場合により有効であることが見て分かる。
【0045】
これらの組成物は、実施例で例証されるように肉または炭水化物と混合され得、好ましくは、炭水化物もしくはタンパク質の量に対して過剰量の3−ヒドロキシ酸を維持する。
【0046】
(III.組成物の適用)
本明細書中に記載される組成物は、種々の栄養および治療用途に容易に使用され得る。当業者は、投与のための適切なヒドロキシ酸オリゴマーまたは誘導体、ならびにその量を容易に選択し得る。使用される特定の組成物は、(特定の患者に必要とされる)標的ケトン血中レベルならびに投与経路および投与頻度に依存する。すべての場合において、これらの化合物の消化および代謝は、有利にケトン体の徐放を提供する。
【0047】
本明細書中に記載される組成物の代表的な使用は、以下に規定される:
本明細書中に記載されるヒドロキシ酸オリゴマー誘導体を使用して、ケトーシスを維持することが可能であると同時に、ケトン誘発食の欠点を克服する。これらの化合物の正常な摂取および代謝の間に、ケトン体(例えば、3−ヒドロキシブチレートおよびアセトアセテート)は血中に放出される。ケトン体の血中レベルは、ケトーシスの実施、および発作(これは、例えば、癲癇に関連する)の減少に必要なレベルで維持され得る。本明細書中に記載されるヒドロキシ酸オリゴマー誘導体はまた、タンパク質の異化を減少し、かつ食欲抑制を提供するために必要なレベルでケトン体の血中レベルを維持するために投与され得、その結果、体重減少に役立つ。
【0048】
したがって、これらのケトン体生成化合物の食餌への添加は、ケトン誘発食のいくつかの効果を模倣するように機能する。得られる好ましい血中レベルは、3−ヒドロキシ酸が2〜3mMの範囲である。ケトン体のカロリー値は、1gの脂肪あたり約1.5gのケトン(1.5g of ketone/eg of fat)である。本明細書中に記載されるヒドロキシ酸オリゴマー誘導体は、身体に養分を提供するために必要なレベルでケトン体の血中レベルを維持するように、哺乳動物、典型的にはヒトに非経口的に投与され得る。これらの組成物は、経口的に食物を摂取できないか、またはそうでなければ完全経口栄養法を必要とする患者に特に有用であるべきである。これらの組成物は、長期静脈内供給に適した高エネルギー水溶性養分を提供するように処方され得る。
【0049】
本明細書中に記載されるヒドロキシ酸オリゴマー誘導体は、代謝障害(例えば、インスリン欠乏、またはインスリン抵抗状態)によって引き起こされる欠乏を克服するために必要なレベルで、ケトン体の血中レベルを維持するように投与され得る。本明細書中に記載されるヒドロキシ酸オリゴマー誘導体は、インスリン抵抗(インスリン抵抗において、正常なインスリンのシグナル伝達経路は障害される)および心臓(液圧作用(hydraulic work))効率が代謝的理由に起因して減少する状態を処置するための必要なレベルで、ケトン体の血中レベルを維持するように投与され得、PCT WO98/41200およびPCT WO98/41201(これらは、本明細書中で参考として援用される)に記載される。
【0050】
本明細書中に記載されるヒドロキシ酸オリゴマー誘導体はまた、種々の神経変性疾患(特に、神経毒プラーク(例えば、アミロイドプラーク)を含む疾患)を処置するために必要なレベルで、ケトン体の血中レベルを維持するように、哺乳動物、典型的にはヒトに投与され得る。本明細書中に記載される組成物が処置の際に役立ち得る、神経変性疾患の例には、以下が挙げられる:アルツハイマー病、ピック病関連前頭側頭骨変性疾患、血管性痴呆、レーヴィ体型の老年痴呆、前頭萎縮を伴う振せん麻痺(パーキンソン症候群)の痴呆、進行性核上性麻痺および皮質基底(corticobasal)の変性、ダウン症候群関連アルツハイマー病、重症筋無力症および筋ジストロフィー。例えば、British Technology Group,Ltd.,によるPCT WO98/41200およびPCT WO98/41201を参照のこと。これは、上昇したレベルのケトン体が、細胞のエネルギー生成を高めることによって少なくとも部分的に、神経細胞の機能および増殖を向上し得ることを開示する。神経変性疾患の処置のための好ましいケトン血中レベルは、食餌療法または発作に対するレベルよりも高く、より典型的には、7.5mMの範囲である。
【0051】
(家畜用補給エネルギー源)
本明細書中に記載されるヒドロキシ酸オリゴマー誘導体は、補給エネルギー源を提供し、かつ生まれたての動物の代謝安定性をできる限り向上させるために、動物(例えば、ブタ、特に妊娠中の雌ブタ)に投与され得る。例えば、妊娠中の雌ブタにおけるケトン体レベルを上昇させることによって、ケトン体は胎盤を越えて移動され、補給エネルギー源を発育中の胎仔に提供する。
【図面の簡単な説明】
【0052】
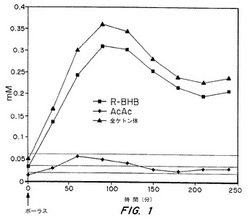
【図1】図1は、1日のカロリー要求量の5%で単回経口ボーラスのトリオライドが与えられたイヌからの全血漿ケトン体(nm)の、R−BHB(四角)、アセトアセテート(菱形、対照)、および全ケトン体(三角)における、時間(分)に対するグラフである。
【0053】
本明細中に記載される組成物および方法は、以下の制限しない実施例によってさらに説明される。
【0054】
(実施例1: (R,R,R)−4,8,12−トリメチル−1,5,9−トリオキサドデカ−2,6,10−トリオン、すなわち、(R)−3−ヒドロキシ酪酸のトリオライド(triolide)の調製)
PHB(20g)を、p−トルエンスルホン酸一水和物(4g)および濃硫酸(5mL)を含有するジオキサン(700mL)に溶解した。4日間還流した後に、この反応は、トリオライドへの転換を40%達成した(ガスクロマトグラフィー(GC)分析により決定した)(RiisおよびMai、J.Chromatography 445:285〜89(1998))。この反応混合物を室温まで冷却し、そして重炭酸ナトリウム飽和溶液でクエンチした。ジオキサンを、ロータリーエバポレーターにより除去した。その残渣を酢酸エチル(400mL)で抽出し、ブラインで洗浄し、そしてオイルになるまで濃縮した。減圧蒸留により、純粋なトリオライド(4g)を得た。
【0055】
(実施例2: 3−ヒドロキシアルカン酸オリゴライドの、腸内栄養としての使用)
雑種犬(21kg)を一晩絶食させ、そしてゼラチン中のトリオライド((R,R,R)−4,8,12−トリメチル−1,5,9−トリオキサドデカ−2,6,10−トリオン、10g)の経口ボーラスを与えた。この量のトリオライドは、一日のカロリー所要量の5%と等価である。血液サンプルを、0、15、30、45、および60分、ならびにその後の30分ごとに、合計6時間にわたって採取した。
【0056】
この血液サンプルを、グルコースについて酵素アッセイによって分析し、そしてアセトアセテートおよび3−ヒドロキシブチレートについてGC−質量分析(GC−MS)アッセイによって分析した。図1に示すように、90分以内で、3−ヒドロキシブチレートおよびアセトアセテートの血中濃度は、0.3mMおよび0.05mMに達し、そして血液中の全ケトン体は、0.36mMであった。4時間後以降は、全ケトン体濃度は、0.24mMに上昇したままであった。血液中のグルコース濃度は、この実験中に、6.5mMから5mMまで低下した。
【0057】
これらの結果は、3−ヒドロキシアルカン酸オリゴライドの経口投与が、血液中のケトン体濃度を増大させ得ることを示す。重大な知見は、ケトン体濃度が投薬後の数時間は上昇したままであることであり、このことは、トリオライドがケトン体の遅い放出に有用であることを実証する。
【0058】
(実施例3: 3−ヒドロキシアルカン酸オリゴライドの、腸内栄養としての使用)
雑種犬(25.5kg)を一晩絶食させ、そして肉(111g)とトリオライド((R,R,R)−4,8,12−トリメチル−1,5,9−トリオキサドデカ−2,6,10−トリオン、23.5g)との混合物を与えた。この量のトリオライドは、一日のカロリー所要量の10%と等価である。同じ量の肉およびトリオライドを、0、120、360および540分の時点で与えた。血液サンプルを、一定の間隔で12時間にわたって採取した。
【0059】
この実験を通して、このイヌは、窮迫;異常な(unusual)振舞い;または下痢、吐き気、嘔吐、もしくは頻尿などの異常な(abnormal)身体機能の兆候を示さなかった。血液サンプルを、アセトアセテートおよび3−ヒドロキシブチレートについて分析した。30分以内に、3−ヒドロキシブチレートおよびアセトアセテートの濃度は、それぞれ0.85mMおよび0.15mMに達した。血液中の全ケトン体は、1.0mMであった。トリオライドの3回目の投与の後は、全ケトン体濃度は上昇したままであり、約0.6mMで一定であった。血液中のグルコース濃度は、正常な範囲である3.1〜5.9mMのままであった。他の臨床化学プロフィールは、この実験を通して正常なままであった。
翌朝までに、血液中のケトン体濃度は、正常値である0.02mMに戻った。
【0060】
これらの結果は、トリオライドがイヌによって消化され、その結果として血中ケトン体濃度が上昇して維持されることを示す。重要なことに、このケトン体濃度は、難治性癲癇の栄養処置において使用されるケトン誘発食によって達成される範囲内である。さらに、トリオライドがイヌによって十分に受容されることがわかった。このイヌは、窮迫の兆候を示さず、そして臨床化学パラメータの動揺を示さなかった。これらの結果は、トリオライドがケトン体の遅い放出に有用であることを、さらに実証する。
【0061】
(実施例4: アルキルエステル末端を有する3−ヒドロキシアルカノエートオリゴマーの合成)
オリゴマー(R)−3−ヒドロキシブチレートを、メチル(R)−3−ヒドロキシブチレートの縮合反応によって調製した。具体的には、メチル(R)−3−ヒドロキシブチレート(250μl)を、ジブチルスズオキシド(2mg)と共に、110℃で72時間加熱した。この反応バイアルは、これによってメタノールの除去が可能であるように、大気に対して解放したままにした。冷却後、この反応系は結晶(白色固体物質)を形成し、これをメタノールで洗浄し、そして空気乾燥させた。NMR分析は、約1,700g/molの分子量を有するオリゴマー(R)−3−ヒドロキシブチレートの形成を示した。ゲル電気泳動クロマトグラフィー(GPC)分析により、約2,000g/molのMwを確認した。
NMR分析はまた、末端メチルエステルの存在を実証した。
【0062】
(実施例5: ブタンジオールエステル末端を有する3−ヒドロキシアルカノエートオリゴマーの合成)
オリゴマー(R)−3−ヒドロキシブチレートブタンジオールエステルを、微生物ポリエステルであるポリ[(R)−3−ヒドロキシブチレート]と、1,3−ブタンジオールとの、制御されたエステル交換反応により、調製した。具体的には、PHB(10g、Mw600,000)を、200mLのジオキサンおよび1,3−ブタンジオール(2.1mL)に、加熱して溶解した。溶解後、この反応混合物を冷却し、そして濃硫酸(1mL)をゆっくりと添加した。この反応混合物を48時間加熱還流した。サンプルを周期的に取り出し、そして水中に沈殿させた。6時間後、95%の生成物を回収した。この生成物は、GPC分析によれば、4,300DaのMwを有した。45時間後、52%の生成物を回収した。この生成物は、GPC分析によれば、2,000DaのMwを有した。NMR分析は、約1,000g/molの3−ヒドロキシブチレートオリゴマーを示し、そして末端1,3−ブタンジオールエステルの存在を実証した。
【0063】
(実施例6: 3−ヒドロキシアルカノエートオリゴマーの合成)
オリゴマー(R)−3−ヒドロキシブチレートを、微生物ポリエステルであるポリ[(R)−3−ヒドロキシブチレート]の制御された加水分解により、調製した。具体的には、PHB(150g)を、2Lの氷酢酸に、加熱して溶解した。水(350ml)を、粘性の溶液が単一の相を形成するまで、ゆっくりと添加した。この反応混合物を、18時間加熱還流した。約55℃まで冷却した後に、この混合物を、手早く撹拌しながら9Lの水に添加した。白色沈殿を回収し、水で洗浄して、乾燥後に92gの3−ヒドロキシブチレートオリゴマーを得た。NMR分析は、末端がクロトン化していない、約1,000g/molの3−ヒドロキシブチレートオリゴマーを示した。GPC分析により、1,000g/molの分子量を確認した。
【0064】
塩酸を添加したことを除き、同様の手順を使用して、より分子量の小さい(約200g/mol)3−ヒドロキシブチレートオリゴマーを生成した。オリゴマー(R)−3−ヒドロキシバレレートを、同じアプローチを使用して、ポリ(3−ヒドロキシバレレート)(これは、Chromobacter violaceum(Steinbuchelら、Appl.Microbiol.Biotechnol.39:443〜49(1993))を使用する醗酵により得られ得る)から調製し得る。
【0065】
(実施例7: 3−ヒドロキシアルカン酸オリゴマーの、腸内栄養としての使用)
Sprague−Dawleyラットに、市販のラットの餌を10日間にわたって与え、次いで、デンプンからのカロリー75%、カゼインとして20%、およびポリ不飽和油として5%、ならびに鉱物混合物および肝臓抽出物補給を含有する、コントロール食に切り換えた。15日後、2グループのラットに、3−ヒドロキシブチレートオリゴマーからのカロリー25%を含有する実験食を与えた。2つの異なるオリゴマー(短いものと中程度のもの、それぞれ200g/molまたは1000g/molのいずれかの分子量を有する)を使用した。コントロールグループには、オリゴマーを含まないコントロール食を続けた。
【0066】
各ラットの体重を毎日測定した。尿試料を毎日収集し、そして3−ヒドロキシブチレートについて、GC−MSにより分析した。実験食における5日後、これらのラットを安楽死させ、血液試料を収集して、3−ヒドロキシブチレートおよびアセトアセテートについて、GC−MSにより分析した。
【0067】
コントロールグループの体重は、この実験を通して均等に増加し、そして中程度のHBオリゴマーを含有する実験食を与えたラットの体重もまた増加した。短いHBを含有する実験食を与えたラットの体重は、この実験食を続ける間にわずかに減少した。
【0068】
安楽死のときに収集したラットの血漿中の、ケトン体の濃度を、GC−MSにより測定した。コントロールグループは、3−ヒドロキシブチレートおよびアセトアセテートの、正常な濃度(それぞれ0.07mMおよび0.02mM)を示した。短いHBオリゴマーを与えたラットは、それぞれ0.65mMおよび0.05mMの、3−ヒドロキシブチレート濃度およびアセトアセテート濃度であったが、一方で中程度のオリゴマーを与えたラットは、それぞれ0.15mMおよび0.04mMの濃度であった。これらの結果は、3−ヒドロキシブチレートオリゴマーを与えたラットにおいては、その血液中で、ケトン体のレベルが増加したことを示す。
【0069】
短いオリゴマーおよび中程度のオリゴマーを与えたラットの尿中の、3−ヒドロキシブチレートの濃度は、GC−MSにより、それぞれ約3.5mMおよび1.0mMであることが決定された。3−ヒドロキシブチレートは、コントロールラットの尿中では、検出不可能であった。これらの結果は、3−ヒドロキシブチレートオリゴマーの経口投与が、血液中および尿中でのケトン体濃度を増加させることを示す。
【背景技術】
【0001】
(発明の背景)
本発明は、一般的に、ヒトおよび他の哺乳動物のケトンレベルの調節のための栄養用および治療用組成物の分野内である。
【0002】
ヒトまたは動物の身体におけるケトン体のレベルを増加させることが望ましい、ヒトおよび動物の状態が多く存在する。例には、発作の制御、特定の代謝性障害の処置、タンパク質異化の減少、減量時の食欲抑制、および非経口の栄養摂取が挙げられる。
【0003】
てんかん患者の発作制御のために、多くの処置が存在する。抗発作医薬が普及している;しかし、これらは、必ずしも効果的であるとは限らず、所望でない副作用を引き起こし得る。ケトン誘発食は、今世紀の変わり目から使用されているが、抗発作医薬の開発についての好意は失われている。ケトン誘発食は、最近、特定の形態のてんかんならびに他の医学的状態の処置について新たな興味を引き寄せている。典型的には、注意深く制御され、医者が管理する食餌は、脂肪カロリーが非常に高く、炭水化物が低い。食餌療法は、エネルギーを得るために炭水化物の代わりに脂肪を代謝させることを身体に強い、それによって血中のアセトアセテートおよびD−3−ヒドロキシブチレートのレベルを上昇させる。これらの化合物は、「ケトン体」と呼ばれ、従って、用語「ケトン体生成(ケトン誘発)(ketogenic)」は、食餌療法を説明するために使用される。
【0004】
ケトン誘発食の作用の正確なメカニズムは、十分には分かっていないが、ケトン体の上昇した血液レベルは、発作を防ぐのに役立つ鎮静作用を有すると考えられる。しかし、この目的に有効であるために、患者は食餌療法を厳しく守らなければならない。ビタミンおよびミネラル補助食品が、食餌を栄養的に完全にするために食餌中に含まれる。なぜなら、この食餌は、脂肪が非常に高く、タンパク質は低く、炭水化物をほぼ除去することを必要とするからである。各患者の食餌は、患者の年齢、大きさ、および活性のレベルに基づいて数学的に計算される。患者は、1〜2年の間、規則通りに食餌療法に従い、この時点で、患者は、徐々に普通の食餌に戻される。食餌療法は、てんかんの子供に特に効果的であることが見出されている。大きな欠点は、食餌があまり口に合わず、患者のコンプライアンスは、患者の一部およびその家族に完全な義務を要求する。さらに、この食餌の高い脂肪含量は、アテローム性硬化症などの血管疾患の危険を増加させ得る。
【0005】
特定の食餌療法は、ある人が、例えば、手術の前または肥満症由来の合併症のために、というような健康の理由のために至急に体重の減少を必要とする場合にも使用される。この場合、医者は、その人のカロリー摂取を非常に制限する食餌療法を処方し得る。カロリー摂取量が減少すると、身体はエネルギーを得るために貯蔵の蓄えを代謝することが強いられる。身体は、脂肪および骨格組織(例えば、筋肉およびタンパク質)からエネルギーを導き得る。しかし、タンパク質よりも脂肪組織が使用されることが好ましい。なぜなら、タンパク質の分解(すなわち「異化」)は、筋萎縮、免疫抑制、および低下した創傷治癒を望ましくなく生じ得る。ヒドロキシ酪酸を用いる食餌補助は、低エネルギーの食餌の被験体においてタンパク質異化を減少することが示された(PawanおよびSemple、Lancet 8:15(1983))。3−ヒドロキシブチレートが食欲を有利に抑制することも報告されている。
【0006】
完全非経口栄養法(「TPN」)は、腸管不全の場合のように、経口的に食べ物を摂取することができない患者に栄養素を提供するために使用される。この状態の通常の原因には、胃腸管の炎症性障害(例えば、クローン病)、放射線腸炎、および壊死した腸または疾患を患っている腸の外科的切断に由来する短腸が挙げられる。約22,000人の外来患者および150,000人の入院患者が、米国だけでTPNを現在受けている(PR Newswire:Orphan Medical Announcement、1995年6月9日)。患者は、典型的には濃縮脂肪乳濁液である栄養素を、静脈に直接受ける。栄養組成物は、例えば、Changらの米国特許第4,563,354号;EP 0321428 A1;Wretlindらの米国特許第5,093,044号;PCT WO 88/08301;PCT WO90/02548;PCT WO 90/02549;およびPCT WO 90/11753に記載される。しかし、脂肪乳濁液を用いる非経口的な処置は、カテーテル閉塞、高脂肪血、血小板障害、脂肪過負荷症候群(fat overload syndrome)、および脂肪塞栓症のような深刻な副作用を有し得る(Desrochersら、J.Nutr.Biochem.6:111−18(1995))。従って、長期間の静脈給食に使用され得る、高エネルギー、水溶性栄養素を開発することは、非常に利益がある。
【0007】
大体において、ケトン抗体のR−3−ヒドロキシブチレートおよびアセトアセテート(これらはヒト血清の天然成分である)は、脂肪乳濁液の代わりに静脈摂取のために使用され得る。これらの化合物は、長期の飢餓の間および糖尿病性ケトアシドーシスを除いて、末梢組織の良い燃料(fuel)であり、最終的に二酸化炭素に酸化される。不運なことに、これらの酸の形態でのこれらの化合物の投与は、静脈に刺激を引き起こし得、ナトリウム塩としての化合物の注入は、危険なナトリウムの過負荷となり得る(Desrochersら、J.Nutr.Biochem.6:111−18(1995))。これらの問題を解決するために、研究者らは、塩基性アミノ酸塩を有するR−3−ヒドロキシブチレートの投与を調査した(Beylotら、Crit.Care Med22:1091−98(1994):Lammerantら、J.Mol.Cell.Cardiol.17:421−33(1985))。しかし、このような処置は、血液脳関門を横切るアミノ酸の輸送を妨害し得、そして/または患者の肝臓または腎臓の病理に干渉し得る(Desrocherら、J.Nutr.Biochem.6:111−18(1995))。他は、ケトン体に対する塩の比を減少させるために、栄養素として3−ヒドロキシ酪酸オリゴマーのナトリウム塩の使用を記載している(Hiraideらの日本特許第94,321,778号)。
【0008】
栄養素としてケトン体を使用する別のアプローチは、アセトアセテートのグリセロールモノエステルの合成に焦点が当てられており、これは、血漿および組織中でグリセロールおよびアセトアセテートに加水分解される(BirkhahnおよびBorder、Am.J.Clin.Nutr.31:436−41(1978);Birkhahanら、J.Nutr.109:1168−74(1979))。この組成物は、大量のナトリウム負荷のない、大量のケトン体をの投与を提供する最初のものであった。
【0009】
研究者らはまた、ケトン体への前駆体の使用を調査している。例えば、R,S−1,3−ブタンジオールは、水溶性前駆体であり、これは肝臓でR,S−3−ヒドロキシブチレートに代謝される(Desrochersら、J.Nutr.Biochem.6:111−18(1995))。しかし、このジオールは、静脈栄養素としての使用に適切ではない。なぜなら、このジオールは、オスモル当たりのカロリー密度が低く、肝臓でのジオールの酸化は、[NADH]/[NAD+]比を著しく増加し、これはアルコール性低血糖を誘発し得る。これらの問題に取り組むための1つの努力は、R,S−1,3−ブタンジオールのアセトアセテートを使用することに焦点が当てられており、その結果、エステラーゼによって遊離されるアセトアセテートがこのジオールの酸化によって肝臓で生成される還元等価物を捕捉し得る(Desrochersら、J.Nutr.Biochem.6:111−18(1995))。
【0010】
ケトン体レベルを調節することはまた、食肉産業のための動物の生産において有用である。Stahlyの米国特許第4,329,359号および第4,423,072号は、生まれたてのブタの代謝の安定性を改善するために、妊娠中の雌ブタにジヒドロキシアルカノールおよびトリグリセリドを給食することを開示する。これらの組成物は、雌ブタにおけるケトン体を増加するために機能する。次いで、ケトン体は、胎盤を通って移動され、発育中の胎仔に補助的なエネルギー源を提供する。
【0011】
British Technology Group LtdによるPCT
WO 98/41200およびPCT WO 98/41201は、栄養および治療組成物中に、アセトアセテートと、ポリD−β−ヒドロキシブチレートまたはそのエステルまたはオリゴマー、ならびに/あるいは代謝前駆体またはその塩とを組み合わせた使用が開示され、これは、心臓の効率を増加するため、糖尿病およびインシュリン抵抗性状態の処置のため、および神経変性障害およびてんかんの効果の処置のために、血液中のケトン体のレベルを上昇させる。これらの適用は、ケトンレベルがこれらの障害を処置するために上昇され得るメカニズムを提供するが、有用な化合物の数は、アセトアセテートと、D−β−ヒドロキシブチレートの前駆体、またはオリゴマー、またはエステルのいずれかとの組み合わせに限定される。
【0012】
従って、経口または非経口投与に適した、ヒトおよび他の動物の身体におけるケトンレベルを上昇させるための改善された組成物または代替の組成物を提供することが、本発明の目的である。
【0013】
より良いまたはより長いバイオアベイラビリティを有するか、あるいは異なる代謝生成物を有する組成物を提供し、そして発作制御、代謝病制御、タンパク質異化の減少、食欲の抑制、非経口の栄養素、心臓効率の増加、糖尿病の処置、神経変性障害またはヒトおよび他の動物のケトンレベルに影響する状態もしくはそのケトンレベルによって生じる状態の効果の処置のために、それらの使用方法を提供することが本発明のさらなる目的である。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】米国特許第4,563,354号明細書
【特許文献2】欧州特許第0321428号明細書
【特許文献3】米国特許第5,093,044号明細書
【特許文献4】国際公開第88/08301号
【特許文献5】国際公開第90/02548号
【特許文献6】国際公開第90/02549号
【特許文献7】国際公開第90/11753号
【特許文献8】日本特許第94,321,778号
【特許文献9】米国特許第4,329,359号明細書
【特許文献10】米国特許第4,423,072号明細書
【特許文献11】国際公開第98/41200号
【特許文献12】国際公開第98/41201号
【非特許文献】
【0015】
【非特許文献1】PawanおよびSemple、Lancet 8:15(1983)
【非特許文献2】Desrochersら、J.Nutr.Biochem.6:111−18(1995)
【非特許文献3】Beylotら、Crit.Care Med22:1091−98(1994)
【非特許文献4】Lammerantら、J.Mol.Cell.Cardiol.17:421−33(1985)
【非特許文献5】BirkhahnおよびBorder、Am.J.Clin.Nutr.31:436−41(1978)
【非特許文献6】Birkhahanら、J.Nutr.109:1168−74(1979)
【発明の概要】
【0016】
(発明の要旨)
栄養または治療組成物は、3−ヒドロキシ酸の直線または環状オリゴマーおよび/あるいは誘導体の形態でケトン体源を提供することによって、哺乳動物におけるケトン体レベルを増加させるために提供される。3−ヒドロキシ酸は、アセトアセテート、3−ヒドロキシ酸の環状オリゴマー、直線または環状オリゴマーのエステル、3−ヒドロキシ酪酸以外の3−ヒドロキシ酸のエステル、およびその組み合わせと合わせて投与される場合、3−ヒドロキシ酪酸の直線ホモオリゴマー以外の3−ヒドロキシ酸の直線オリゴマーの形態であり得る。オリゴマーは、一般的に、3個以上のヒドロキシ酸のポリマーを示す。好ましい3−ヒドロキ酸には、3−ヒドロキシブチレート、3−ヒドロキシバレレート(hydroxyvalerate)、3−ヒドロキシヘキサノエート、および3−ヒドロキシヘプタノエートが挙げられる。3−ヒドロキシバレレートのような奇数の炭素数の3−ヒドロキシ酸のオリゴマーは、偶数の炭素を有する3−ヒドロキシ酸のオリゴマーよりもより高いエネルギー含量を有するので有利である。環状オリゴマーは、ある期間の時間に渡って維持されたそして/または制御されたケトン血液レベルを生じるので、有利な性質を有する。
【0017】
この組成物は、経口的に(例えば、栄養用または食餌用補助食品として)、あるいは静脈的に投与され得る。血液ケトンレベルを増加させることは、発作制御、代謝病制御、タンパク質異化の減少、食欲の抑制、非経口の栄養素、心臓効率の増加、糖尿病およびインシュリン抵抗性状態の処置、ならびに神経変性障害およびてんかんの効果の処置に有用である。
【0018】
(発明の詳細な説明)
特定のヒドロキシ酸、誘導体、オリゴマーおよびそのエステルは、哺乳類の血中ケトン体レベルを調節するために、ケトン体の供給源を提供し得、そして生物学的に産生されるポリヒドロキシアルカノエートは、これらのヒドロキシ酸のための優れた供給源であることが発見された。これらのオリゴマーおよび/または3−ヒドロキシ酸の誘導体は、ケトンレベルを上昇させるための公知の方法および組成物に関係する欠点のない、多くの栄養および治療組成物を生成するために容易に適合され得る。
【0019】
(I.3−ヒドロキシ酸の栄養および治療組成物)
組成物には、3−ヒドロキシ酸、その直鎖または環状オリゴマー、3−ヒドロキシ酸またはオリゴマーのエステル、3−ヒドロキシ酸の誘導体およびその組合わせが挙げられる。1つの好ましい実施態様において、この組成物は、3、4または5個のモノマーサブユニットを含むR−3−ヒドロキシ酸の環状マクロライドを含有する。好ましい3−ヒドロキシ酸には、3−ヒドロキシ酪酸、3−ヒドロキシ吉草酸、3−ヒドロキシヘキサン酸および3−ヒドロキシヘプタン酸が挙げられる。好ましいオリゴマーの長さは、その誘導体が、モノマーの持続放出において適切な消化速度を有するような長さであるべきである。別の好ましい実施態様において、環状三量体(トリオライド)は、他の環状オリゴライドまたは直鎖エステルおよび/または両方の混合物との組合わせで、使用される。
【0020】
3−ヒドロキシ酸に対する一般式は以下:
【0021】
【化1】

であり、ここで、
R1は、水素、メチル、アルキル、アルケニル、アリール、アリールアルキル、ヘテロアルキル、ヘテロアリール、チオール、ジスルフィド、エーテル、チオ
ールエーテル、アミン、アミド、ハロゲンから選択され、
R2およびR3は、水素、メチル、アルキル、アルケニル、アリール、アリールアルキル、ヘテロアルキル、ヘテロアリール、チオール、ジスルフィド、エーテル、チオールエーテル、アミン、アミド、ハロゲン、ヒドロキシ、エステル、窒素置換された基、および/または酸素置換された基から独立して選択され、
R4は、水素、アルキル、アルケニル、アリール、アリールアルキル、ヘテロアルキル、ヘテロアリール、チオール、ジスルフィド、エーテル、チオールエーテル、アミン、アミド、ハロゲン、ヒドロキシ、エステル、窒素置換された基、および/または酸素置換された基から選択され、
さらに、R4が水素またはハロゲンでない場合、R3は直接R4に結合され得、そしてR4はメチルであり得る。
【0022】
以下の定義が、本明細書を通して使用され得る。
【0023】
用語「アルキル」は、C2-15直鎖、分枝または環状のアルキル基を指す。
【0024】
用語「アルケニル」は、1つ以上の炭素−炭素二重結合をさらに含む分枝または直鎖C2〜C77(15)炭化水素を指す。
【0025】
用語「アリール」は、1つ以上の芳香環を含む基を指す。アリール基は、非置換であり得るか、またはアルキル、ハロアルキル、アルコキシ、アミノ、アルキルアミノ、ジアルキルアミノ、ヒドロキシ、ハロおよびニトロから独立して選択される置換基で置換され得る。
【0026】
用語「アリールアルキル」は、アリール基が付加されるアルキル基(上で定義されたような)を指す。
【0027】
用語「ヘテロアルキル」は、1つ以上の炭素原子が、非炭素原子(例えば、酸素、窒素、硫黄など)で置換されるアルキル基(上で定義されたような)を指す。
【0028】
用語「ヘテロアリール」は、芳香環中の原子の少なくも1つは炭素ではない、1つ以上の芳香環を含む基を指す。ヘテロアリール基は、非置換であり得るか、あるいはアルキル、ハロアルキル、アルコキシ、アミノ、アルキルアミノ、ジアルキルアミノ、ヒドロキシ、ハロおよびニトロから独立して選択される置換基で置換され得る。
【0029】
用語「チオール」は、RSHを指し、ここでRは、アルキル、アルケニル、ア
リール、アリールアルキル、ヘテロアルキル、またはヘテロアリール(上で定義されたような)を指す。
【0030】
用語「ジスルフィド」は、硫黄−硫黄結合を含む基を指す。
【0031】
用語「エーテル」は、C−O−Cユニットを含む基を指す。
【0032】
(ヒドロキシ酸オリゴマー)
1つの好ましい実施態様において、組成物は、5〜10個の炭素原子を有する3−ヒドロキシ酸の直鎖オリゴマーを含む。本明細書中で使用される場合、用語「オリゴマー」は、約2000g/mol未満の、好ましくは約1000g/mol未満の重量平均分子量を有するか、または約100個未満のモノマーサブユニットを有するポリマーを意味する。代表的な例には、3−ヒドロキシバレレート、3−ヒドロキシヘキサノエート、3−ヒドロキシへプタノエート、3−ヒドロキシオクタノエートおよびそれらの組合わせが挙げられる。本明細書で使用される場合、ホモオリゴマーは1種類のタイプの3−ヒドロキシ酸のみを含み、一方、オリゴマーは1種類以上の3−ヒドロキシ酸を含むホモオリゴマーまたはヘテロオリゴマーのいずれかを指し得る。
【0033】
別の好ましい実施態様において、組成物は、奇数個の炭素を有する3−ヒドロキシ酸を含み、この3−ヒドロキシ酸は、偶数個の炭素を有する3−ヒドロキシ酸よりも高いカロリー値を有する。例えば、3−ヒドロキシバレレートのオリゴマーエステル(単独、または他のヒドロキシアルカノエートと混合される)は、奇数個に数えら得るヒドロキシ酸、3−ヒドロキシバレレートを誘導するために、使用され得る。
【0034】
さらなる別の好ましい実施態様において、組成物は、4〜10個の炭素原子の3−ヒドロキシ酸を含む、3−ヒドロキシアルカン酸の環状オリゴマーまたは3−ヒドロキシアルカノエートオリゴマーエステルを含む。このヒドロキシ酸は、エステル形態の消化または代謝の結果、遊離される。ヒドロキシ酸をエステル形態で提供することによって、これらの組生物は、ヒドロキシ酸の酸または塩形態での送達によって引き起こされる複雑化を排除し得る。
【0035】
以下の実施例によって説明されるように、環状オリゴマーは、ケトン体レベルが、摂取後少なくとも数時間の長期間に渡って高いままに保たれるという利点を有する。例えば、3−ヒドロキシブチレートのトリオライドのような環状3−ヒドロキシブチレートのエステルは、ケトン体の持続放出を提供し得る。モノマーの徐放は、ケトン体(例えば、3−ヒドロキシブチレート)のより一定したレベルを、長期間に渡って身体に提供するので、徐放は先行技術の組成物を超す主要な利点を提供する。この放出プロフィールは、特定のケトン体濃度を維持するために必要とされる投薬頻度を減少させ、これは、この物質を投与することが困難である睡眠中のような期間の間で特に重要である。
【0036】
(誘導ヒドロキシ酸)
PHAのファミリーは側鎖置換基を変化させた非常に多くのヒドロキシ酸を含むので、3−ヒドロキシ酸のタイプの賢明な選択は、pcr酸基準の発熱密度(caloric density on a pcr acid)を増加させるか、または奇数の鎖長を有する酸を提供する手段を提供する。好ましい誘導体は、上記の式のR基がエチルまたはメチルであるようなものである。
【0037】
(3−ヒドロキシ酸またはオリゴマーのエステル)
組成物はまた、3−ヒドロキシ酸のエステルあるいは直鎖または環状3−ヒドロキシ酸オリゴマーのいずれかのエステルを含み得る。別の好ましい実施態様において、組成物は、例えば1,3−ブタンジオールへのエステル結合で終結したR−3ヒドロキシアルカノエートオリゴマーを含む。オリゴマーの長さは、好ましくは、誘導体が静脈投与において適切である溶解度を有するような長さである。この1,3−ブタンジオールは、ヒドロキシ酸オリゴマーに、第1級アルコール、第2級アルコールおよび/または両方の混合物によって結合され得る。続くオリゴマーエステル、非R−3ヒドロキシユニットの非経口(例えば、静脈)投与は、それがオリゴマーエステルから放出された後、身体内で、容易に受容され、そして代謝されるべきである。
【0038】
好ましくは、ヒドロキシ酸オリゴマーはまた、所望される物理的および栄養特性(例えば、水溶解性およびカロリー給付(calorific benefit basis))を含むように選択される。
【0039】
(ヒドロキシ酸組成物の供給源)
ヒドロキシ酸およびヒドロキシ酸オリゴマーの有用な供給源は、細菌貯蔵ポリエステル、ポリヒドロキシアルカノエートのファミリーであり、これらは、多くの微生物によって細胞間に蓄積され得る。ポリ[(R)−3−ヒドロキシアルカノエート](PHA)は、再生可能資源から製造され、広範囲の工業的かつ生物医学的な応用における、生分解性かつ生体適合性の熱可塑性物質である(Williams&Peoples,CHEMTECH26:38−44(1996))。
【0040】
近年、PHA生体高分子は、単一のホモポリマー、ポリ−3−ヒドロキシブチレート(PHB)であると本来考えられたものから、広い種類の異なるモノマー組成を有するポリエステルのクラスへと脱却してきている。現在のところ、約100種の異なるモノマーがPHA高分子に組み込まれてきた(Steinbuchel&Valentin,FEMS Microbiol.Lett.128:219−28(1995))。本明細書に記載されるように、これらの天然ポリエステルは、栄養および治療用途のために適切な誘導体へ転換され得る。
【0041】
(ヒドロキシ酸オリゴマーおよび誘導体を製造するための方法)
本明細書中に記載されるヒドロキシ酸オリゴマー誘導体を調製するための代表的な方法には、以下が挙げられる:ポリヒドロキシアルカノエートのオリゴマー誘導体への直接分解;3−ヒドロキシアルカノエートの環状オリゴマーの開環;ヒドロキシアルカノエートまたはその誘導体の重合;そして末端ヒドロキシアルカノエートの単位の修飾とともに開始するか、または終了する、ヒドロキシアルカノエートオリゴマーの段階合成。このような合成は、当該分野で公知の方法を使用して容易に実施され得る。アルコールへのエステル結合で終了されるヒドロキシ酸オリゴマーの合成に関する本方法の好ましい実施態様において、プロセスは以下を包含し得る:アルコールを用いるポリヒドロキシアルカノエートの直接分解;アルコールを用いるヒドロキシアルカノエートの環状オリゴマーの開環;および、アルコールによる末端ヒドロキシアルカノエート単位のエステル化で開始するか、または終了する、ヒドロキシアルカノエートオリゴマーの段階合成。
このような合成は、当該分野に公知の方法を使用して実施され得る。
【0042】
(R)−3−ヒドロキシブチル酸の環状オリゴライドは、多数の公知の方法によって調製され得る。例えば、これらの方法は、Seebachら、Angew.Chem.Int.Eng.Ed.、4:434−35(1992);Seebachら、Helv.Chim.Acta.71:155−67(1988);Seebachら、Helv.Chim.Acta.、72:1704−17(1989);およびMuellerら、Chima45:376(1991)に記載される。これらの方法は、細菌から誘導したポリエステル、ポリ−(R)−3−ヒドロキシブチレート(PHB)からの変換、または成分の酸(R)−3−ヒドロキシブチレートまたはそのエステルからのマクロライド形成を包含する。大半の直接経路は、酸触媒条件下でのPHBの直鎖オリゴマーと環状オリゴマーの混合物への分解である。オリゴライドおよびオリゴマーは、従来の洗浄、抽出、および蒸留工程によって粗混合物から単離され得、精製物質を得る。
【0043】
(II.栄養摂取および調食組成物)
これらの組成物は、腸内または非経口的な投与(例えば、組成物を適切な送達ビヒクルと合せることによって)に適合され得る。腸内投与に関して、組成物は、例えば、食餌補給として食物または飲料に添加され得る。あるいは、これらの組成物は、非経口的に(例えば、注射用の生理食塩水溶液に溶解することによって)送達され得る。遺伝子操作技術を技術を使用すると、植物は適切な3−ヒドロキシ酸または3−ヒドロキシ酸のオリゴマーを発現するように操作され得る。適切な手段および方法は、MetabolixによるWO97/15681およびPCT/US99/04999に記載される。
【0044】
ヒドロキシ酸処方物は、単独で、乾燥またはパウダー形態で、キャリア中の溶液(例えば、水、ノーマルセーライン、またはリン酸緩衝化生理食塩水)で投与され得るか、あるいは、血中ケトンを高める他の物質(例えば、単独あるいはタンパク質または炭水化物と組み合せた、遊離脂肪酸、トリグリセリド)と混合され得る。伝統的なケトン誘発食(例えば、Marriott Corp.Health Care Services,Pediatric Diet Manual,Revised August 1987によって推奨される食餌)は、合わせた炭水化物およびタンパク質1gに対して3:1〜4:1gの脂肪を含む。脂肪は代謝されて3−ヒドロキシ酸およびアセトアセテートを生じるので、所望のレベルは、少なくとも約1〜2mMから最大約7.5mMまで(肥満個体の長期の空腹の間に達成される)の範囲であるが、範囲は0.3〜20mMであり得、3−ヒドロキシ酸を含有する組成物が処方されて、伝統的なケトン誘発食の値と同様の値を得、この収量は3−ヒドロキシ酸が直接投与される場合により有効であることが見て分かる。
【0045】
これらの組成物は、実施例で例証されるように肉または炭水化物と混合され得、好ましくは、炭水化物もしくはタンパク質の量に対して過剰量の3−ヒドロキシ酸を維持する。
【0046】
(III.組成物の適用)
本明細書中に記載される組成物は、種々の栄養および治療用途に容易に使用され得る。当業者は、投与のための適切なヒドロキシ酸オリゴマーまたは誘導体、ならびにその量を容易に選択し得る。使用される特定の組成物は、(特定の患者に必要とされる)標的ケトン血中レベルならびに投与経路および投与頻度に依存する。すべての場合において、これらの化合物の消化および代謝は、有利にケトン体の徐放を提供する。
【0047】
本明細書中に記載される組成物の代表的な使用は、以下に規定される:
本明細書中に記載されるヒドロキシ酸オリゴマー誘導体を使用して、ケトーシスを維持することが可能であると同時に、ケトン誘発食の欠点を克服する。これらの化合物の正常な摂取および代謝の間に、ケトン体(例えば、3−ヒドロキシブチレートおよびアセトアセテート)は血中に放出される。ケトン体の血中レベルは、ケトーシスの実施、および発作(これは、例えば、癲癇に関連する)の減少に必要なレベルで維持され得る。本明細書中に記載されるヒドロキシ酸オリゴマー誘導体はまた、タンパク質の異化を減少し、かつ食欲抑制を提供するために必要なレベルでケトン体の血中レベルを維持するために投与され得、その結果、体重減少に役立つ。
【0048】
したがって、これらのケトン体生成化合物の食餌への添加は、ケトン誘発食のいくつかの効果を模倣するように機能する。得られる好ましい血中レベルは、3−ヒドロキシ酸が2〜3mMの範囲である。ケトン体のカロリー値は、1gの脂肪あたり約1.5gのケトン(1.5g of ketone/eg of fat)である。本明細書中に記載されるヒドロキシ酸オリゴマー誘導体は、身体に養分を提供するために必要なレベルでケトン体の血中レベルを維持するように、哺乳動物、典型的にはヒトに非経口的に投与され得る。これらの組成物は、経口的に食物を摂取できないか、またはそうでなければ完全経口栄養法を必要とする患者に特に有用であるべきである。これらの組成物は、長期静脈内供給に適した高エネルギー水溶性養分を提供するように処方され得る。
【0049】
本明細書中に記載されるヒドロキシ酸オリゴマー誘導体は、代謝障害(例えば、インスリン欠乏、またはインスリン抵抗状態)によって引き起こされる欠乏を克服するために必要なレベルで、ケトン体の血中レベルを維持するように投与され得る。本明細書中に記載されるヒドロキシ酸オリゴマー誘導体は、インスリン抵抗(インスリン抵抗において、正常なインスリンのシグナル伝達経路は障害される)および心臓(液圧作用(hydraulic work))効率が代謝的理由に起因して減少する状態を処置するための必要なレベルで、ケトン体の血中レベルを維持するように投与され得、PCT WO98/41200およびPCT WO98/41201(これらは、本明細書中で参考として援用される)に記載される。
【0050】
本明細書中に記載されるヒドロキシ酸オリゴマー誘導体はまた、種々の神経変性疾患(特に、神経毒プラーク(例えば、アミロイドプラーク)を含む疾患)を処置するために必要なレベルで、ケトン体の血中レベルを維持するように、哺乳動物、典型的にはヒトに投与され得る。本明細書中に記載される組成物が処置の際に役立ち得る、神経変性疾患の例には、以下が挙げられる:アルツハイマー病、ピック病関連前頭側頭骨変性疾患、血管性痴呆、レーヴィ体型の老年痴呆、前頭萎縮を伴う振せん麻痺(パーキンソン症候群)の痴呆、進行性核上性麻痺および皮質基底(corticobasal)の変性、ダウン症候群関連アルツハイマー病、重症筋無力症および筋ジストロフィー。例えば、British Technology Group,Ltd.,によるPCT WO98/41200およびPCT WO98/41201を参照のこと。これは、上昇したレベルのケトン体が、細胞のエネルギー生成を高めることによって少なくとも部分的に、神経細胞の機能および増殖を向上し得ることを開示する。神経変性疾患の処置のための好ましいケトン血中レベルは、食餌療法または発作に対するレベルよりも高く、より典型的には、7.5mMの範囲である。
【0051】
(家畜用補給エネルギー源)
本明細書中に記載されるヒドロキシ酸オリゴマー誘導体は、補給エネルギー源を提供し、かつ生まれたての動物の代謝安定性をできる限り向上させるために、動物(例えば、ブタ、特に妊娠中の雌ブタ)に投与され得る。例えば、妊娠中の雌ブタにおけるケトン体レベルを上昇させることによって、ケトン体は胎盤を越えて移動され、補給エネルギー源を発育中の胎仔に提供する。
【図面の簡単な説明】
【0052】
【図1】図1は、1日のカロリー要求量の5%で単回経口ボーラスのトリオライドが与えられたイヌからの全血漿ケトン体(nm)の、R−BHB(四角)、アセトアセテート(菱形、対照)、および全ケトン体(三角)における、時間(分)に対するグラフである。
【0053】
本明細中に記載される組成物および方法は、以下の制限しない実施例によってさらに説明される。
【0054】
(実施例1: (R,R,R)−4,8,12−トリメチル−1,5,9−トリオキサドデカ−2,6,10−トリオン、すなわち、(R)−3−ヒドロキシ酪酸のトリオライド(triolide)の調製)
PHB(20g)を、p−トルエンスルホン酸一水和物(4g)および濃硫酸(5mL)を含有するジオキサン(700mL)に溶解した。4日間還流した後に、この反応は、トリオライドへの転換を40%達成した(ガスクロマトグラフィー(GC)分析により決定した)(RiisおよびMai、J.Chromatography 445:285〜89(1998))。この反応混合物を室温まで冷却し、そして重炭酸ナトリウム飽和溶液でクエンチした。ジオキサンを、ロータリーエバポレーターにより除去した。その残渣を酢酸エチル(400mL)で抽出し、ブラインで洗浄し、そしてオイルになるまで濃縮した。減圧蒸留により、純粋なトリオライド(4g)を得た。
【0055】
(実施例2: 3−ヒドロキシアルカン酸オリゴライドの、腸内栄養としての使用)
雑種犬(21kg)を一晩絶食させ、そしてゼラチン中のトリオライド((R,R,R)−4,8,12−トリメチル−1,5,9−トリオキサドデカ−2,6,10−トリオン、10g)の経口ボーラスを与えた。この量のトリオライドは、一日のカロリー所要量の5%と等価である。血液サンプルを、0、15、30、45、および60分、ならびにその後の30分ごとに、合計6時間にわたって採取した。
【0056】
この血液サンプルを、グルコースについて酵素アッセイによって分析し、そしてアセトアセテートおよび3−ヒドロキシブチレートについてGC−質量分析(GC−MS)アッセイによって分析した。図1に示すように、90分以内で、3−ヒドロキシブチレートおよびアセトアセテートの血中濃度は、0.3mMおよび0.05mMに達し、そして血液中の全ケトン体は、0.36mMであった。4時間後以降は、全ケトン体濃度は、0.24mMに上昇したままであった。血液中のグルコース濃度は、この実験中に、6.5mMから5mMまで低下した。
【0057】
これらの結果は、3−ヒドロキシアルカン酸オリゴライドの経口投与が、血液中のケトン体濃度を増大させ得ることを示す。重大な知見は、ケトン体濃度が投薬後の数時間は上昇したままであることであり、このことは、トリオライドがケトン体の遅い放出に有用であることを実証する。
【0058】
(実施例3: 3−ヒドロキシアルカン酸オリゴライドの、腸内栄養としての使用)
雑種犬(25.5kg)を一晩絶食させ、そして肉(111g)とトリオライド((R,R,R)−4,8,12−トリメチル−1,5,9−トリオキサドデカ−2,6,10−トリオン、23.5g)との混合物を与えた。この量のトリオライドは、一日のカロリー所要量の10%と等価である。同じ量の肉およびトリオライドを、0、120、360および540分の時点で与えた。血液サンプルを、一定の間隔で12時間にわたって採取した。
【0059】
この実験を通して、このイヌは、窮迫;異常な(unusual)振舞い;または下痢、吐き気、嘔吐、もしくは頻尿などの異常な(abnormal)身体機能の兆候を示さなかった。血液サンプルを、アセトアセテートおよび3−ヒドロキシブチレートについて分析した。30分以内に、3−ヒドロキシブチレートおよびアセトアセテートの濃度は、それぞれ0.85mMおよび0.15mMに達した。血液中の全ケトン体は、1.0mMであった。トリオライドの3回目の投与の後は、全ケトン体濃度は上昇したままであり、約0.6mMで一定であった。血液中のグルコース濃度は、正常な範囲である3.1〜5.9mMのままであった。他の臨床化学プロフィールは、この実験を通して正常なままであった。
翌朝までに、血液中のケトン体濃度は、正常値である0.02mMに戻った。
【0060】
これらの結果は、トリオライドがイヌによって消化され、その結果として血中ケトン体濃度が上昇して維持されることを示す。重要なことに、このケトン体濃度は、難治性癲癇の栄養処置において使用されるケトン誘発食によって達成される範囲内である。さらに、トリオライドがイヌによって十分に受容されることがわかった。このイヌは、窮迫の兆候を示さず、そして臨床化学パラメータの動揺を示さなかった。これらの結果は、トリオライドがケトン体の遅い放出に有用であることを、さらに実証する。
【0061】
(実施例4: アルキルエステル末端を有する3−ヒドロキシアルカノエートオリゴマーの合成)
オリゴマー(R)−3−ヒドロキシブチレートを、メチル(R)−3−ヒドロキシブチレートの縮合反応によって調製した。具体的には、メチル(R)−3−ヒドロキシブチレート(250μl)を、ジブチルスズオキシド(2mg)と共に、110℃で72時間加熱した。この反応バイアルは、これによってメタノールの除去が可能であるように、大気に対して解放したままにした。冷却後、この反応系は結晶(白色固体物質)を形成し、これをメタノールで洗浄し、そして空気乾燥させた。NMR分析は、約1,700g/molの分子量を有するオリゴマー(R)−3−ヒドロキシブチレートの形成を示した。ゲル電気泳動クロマトグラフィー(GPC)分析により、約2,000g/molのMwを確認した。
NMR分析はまた、末端メチルエステルの存在を実証した。
【0062】
(実施例5: ブタンジオールエステル末端を有する3−ヒドロキシアルカノエートオリゴマーの合成)
オリゴマー(R)−3−ヒドロキシブチレートブタンジオールエステルを、微生物ポリエステルであるポリ[(R)−3−ヒドロキシブチレート]と、1,3−ブタンジオールとの、制御されたエステル交換反応により、調製した。具体的には、PHB(10g、Mw600,000)を、200mLのジオキサンおよび1,3−ブタンジオール(2.1mL)に、加熱して溶解した。溶解後、この反応混合物を冷却し、そして濃硫酸(1mL)をゆっくりと添加した。この反応混合物を48時間加熱還流した。サンプルを周期的に取り出し、そして水中に沈殿させた。6時間後、95%の生成物を回収した。この生成物は、GPC分析によれば、4,300DaのMwを有した。45時間後、52%の生成物を回収した。この生成物は、GPC分析によれば、2,000DaのMwを有した。NMR分析は、約1,000g/molの3−ヒドロキシブチレートオリゴマーを示し、そして末端1,3−ブタンジオールエステルの存在を実証した。
【0063】
(実施例6: 3−ヒドロキシアルカノエートオリゴマーの合成)
オリゴマー(R)−3−ヒドロキシブチレートを、微生物ポリエステルであるポリ[(R)−3−ヒドロキシブチレート]の制御された加水分解により、調製した。具体的には、PHB(150g)を、2Lの氷酢酸に、加熱して溶解した。水(350ml)を、粘性の溶液が単一の相を形成するまで、ゆっくりと添加した。この反応混合物を、18時間加熱還流した。約55℃まで冷却した後に、この混合物を、手早く撹拌しながら9Lの水に添加した。白色沈殿を回収し、水で洗浄して、乾燥後に92gの3−ヒドロキシブチレートオリゴマーを得た。NMR分析は、末端がクロトン化していない、約1,000g/molの3−ヒドロキシブチレートオリゴマーを示した。GPC分析により、1,000g/molの分子量を確認した。
【0064】
塩酸を添加したことを除き、同様の手順を使用して、より分子量の小さい(約200g/mol)3−ヒドロキシブチレートオリゴマーを生成した。オリゴマー(R)−3−ヒドロキシバレレートを、同じアプローチを使用して、ポリ(3−ヒドロキシバレレート)(これは、Chromobacter violaceum(Steinbuchelら、Appl.Microbiol.Biotechnol.39:443〜49(1993))を使用する醗酵により得られ得る)から調製し得る。
【0065】
(実施例7: 3−ヒドロキシアルカン酸オリゴマーの、腸内栄養としての使用)
Sprague−Dawleyラットに、市販のラットの餌を10日間にわたって与え、次いで、デンプンからのカロリー75%、カゼインとして20%、およびポリ不飽和油として5%、ならびに鉱物混合物および肝臓抽出物補給を含有する、コントロール食に切り換えた。15日後、2グループのラットに、3−ヒドロキシブチレートオリゴマーからのカロリー25%を含有する実験食を与えた。2つの異なるオリゴマー(短いものと中程度のもの、それぞれ200g/molまたは1000g/molのいずれかの分子量を有する)を使用した。コントロールグループには、オリゴマーを含まないコントロール食を続けた。
【0066】
各ラットの体重を毎日測定した。尿試料を毎日収集し、そして3−ヒドロキシブチレートについて、GC−MSにより分析した。実験食における5日後、これらのラットを安楽死させ、血液試料を収集して、3−ヒドロキシブチレートおよびアセトアセテートについて、GC−MSにより分析した。
【0067】
コントロールグループの体重は、この実験を通して均等に増加し、そして中程度のHBオリゴマーを含有する実験食を与えたラットの体重もまた増加した。短いHBを含有する実験食を与えたラットの体重は、この実験食を続ける間にわずかに減少した。
【0068】
安楽死のときに収集したラットの血漿中の、ケトン体の濃度を、GC−MSにより測定した。コントロールグループは、3−ヒドロキシブチレートおよびアセトアセテートの、正常な濃度(それぞれ0.07mMおよび0.02mM)を示した。短いHBオリゴマーを与えたラットは、それぞれ0.65mMおよび0.05mMの、3−ヒドロキシブチレート濃度およびアセトアセテート濃度であったが、一方で中程度のオリゴマーを与えたラットは、それぞれ0.15mMおよび0.04mMの濃度であった。これらの結果は、3−ヒドロキシブチレートオリゴマーを与えたラットにおいては、その血液中で、ケトン体のレベルが増加したことを示す。
【0069】
短いオリゴマーおよび中程度のオリゴマーを与えたラットの尿中の、3−ヒドロキシブチレートの濃度は、GC−MSにより、それぞれ約3.5mMおよび1.0mMであることが決定された。3−ヒドロキシブチレートは、コントロールラットの尿中では、検出不可能であった。これらの結果は、3−ヒドロキシブチレートオリゴマーの経口投与が、血液中および尿中でのケトン体濃度を増加させることを示す。
【特許請求の範囲】
【請求項1】
哺乳動物において、血液ケトン体レベルを調節するために、有効量および生体適合量の3−ヒドロキシ酸を含有する、栄養または治療食物組成物であって、ここで該3−ヒドロキシ酸は、以下:
a)アセトアセテートと組み合わせられた、3−ヒドロキシ酪酸の直鎖ホモオリゴマー以外の3−ヒドロキシ酸の直鎖オリゴマー、
b)3−ヒドロキシ酸の環式オリゴマー、
c)アセトアセテートと組み合わせられた、3−ヒドロキシ酪酸以外の3−ヒドロキシ酸のエステル、
d)アセトアセテートと組み合わせられた、3−ヒドロキシ酪酸の直鎖ホモオリゴマー以外の3−ヒドロキシ酸の直鎖および環式オリゴマーのエステル、ならびに
e)それらの組み合わせ、からなる群から選択される形態である、組成物。
【請求項2】
前記ヒドロキシ酸が塩ではない、請求項1に記載の組成物。
【請求項3】
前記3−ヒドロキシ酸が環式オリゴマーである、請求項1に
記載の組成物。
【請求項4】
前記3−ヒドロキシ酸が3−ヒドロキシ酪酸である、請求項
3に記載の組成物。
【請求項5】
前記3−ヒドロキシ酸が、3−ヒドロキシバレレート、3−ヒドロキシヘキサノエート、3−ヒドロキシヘプタノエート、3−ヒドロキシオクタノエートおよびそれらの組み合わせからなる群から選択される、請求項1に記載の組成物。
【請求項6】
前記3−ヒドロキシ酸エステルが環式エステルである、請求項1に記載の組成物。
【請求項7】
前記環式エステルが3−ヒドロキシブチレートのトリオライド(triolide)である、請求項6に記載の組成物。
【請求項8】
前記環式オリゴマーが、3、4または5個のモノマーサブユニットを含有するR−3−ヒドロキシ酸の環式マクロライドを含む、請求項3に記載の組成物。
【請求項9】
前記3−ヒドロキシ酸が、3−ヒドロキシ酪酸、3−ヒドロキシ吉草酸、3−ヒドロキシヘキサン酸、3−ヒドロキシヘプタン酸およびそれらの組み合わせからなる群から選択される、請求項8に記載の組成物。
【請求項10】
前記3−ヒドロキシ酸オリゴマーが、エステル結合で終結したR−3−ヒドロキシアルカン酸オリゴマーを含む、請求項1に記載の組成物。
【請求項11】
前記オリゴマーが1,3−ブタンジオールで終結する、請求項10に記載の組成物。
【請求項12】
哺乳動物への静脈内投与に適切な処方物中の、請求項1に記載の組成物。
【請求項13】
前記3−ヒドロキシ酸が植物または細菌バイオマスに由来する、請求項1に記載の組成物。
【請求項14】
経口摂取用の食物処方物中の、請求項1に記載の組成物。
【請求項15】
家畜への投与のための食物処方物中の、請求項14に記載の組成物。
【請求項16】
哺乳動物において、血液ケトンレベルを調節する方法であって、該方法は、該哺乳動物に、有効量および生体適合量の3−ヒドロキシ酸を含有する、有効量の栄養または治療食物組成物を投与し、哺乳動物の血液ケトン体レベルを調節する工程を包含し、ここで、該3−ヒドロキシ酸は、以下:
a)アセトアセテートと組み合わせられた、3−ヒドロキシ酪酸の直鎖ホモオリゴマー以外の3−ヒドロキシ酸の直鎖オリゴマー、
b)3−ヒドロキシ酸の環式オリゴマー、
c)アセトアセテートと組み合わせられた、3−ヒドロキシ酪酸以外の3−ヒドロキシ酸のエステル、
d)アセトアセテートと組み合わせられた、3−ヒドロキシ酪酸の直鎖ホモオリゴマー以外の3−ヒドロキシ酸の直鎖および環式オリゴマーのエステル、ならびに
e)それらの組み合わせ、からなる群から選択される形態である、方法。
【請求項17】
前記血液ケトンレベルが発作を制御するのに有効である、請求項16に記載の方法。
【請求項18】
前記血液ケトンレベルが、ケトン体の合成および代謝に関与する代謝疾患を制御するのに有効である、請求項16に記載の方法。
【請求項19】
前記血液ケトンレベルが、前記哺乳動物においてタンパク質異化を軽減し、そして/または食欲を抑えるのに有効である、請求項16に記載の方法。
【請求項20】
前記血液ケトンレベルが、前記哺乳動物の強心効果を高めるのに有効である、請求項16に記載の方法。
【請求項21】
前記血液ケトンレベルが、糖尿病および他のインスリン抵抗状態、神経変性障害ならびにてんかんからなる群から選択される疾患を処置するのに有効である、請求項16に記載の方法。
【請求項22】
前記神経変性疾患が、アルツハイマー病、ピック病関連前頭側頭骨変性、血管性痴呆、レーヴィ体型の老人性痴呆、前頭萎縮を伴う振せん麻痺の痴呆、進行性核上性麻痺および大脳皮質基底核変性症、ダウン症候群関連アルツハイマー、重症筋無力症ならびに筋ジストロフィーからなる群から選択される、請求項21に記載の方法。
【請求項23】
前記哺乳動物がヒトまたは家畜動物である、請求項16に記載の方法。
【請求項24】
前記組成物が非経口的に投与される、請求項16に記載の方法。
【請求項25】
前記組成物が食物組成物または栄養組成物として経口的に投与される、請求項16に記載の方法。
【請求項1】
哺乳動物において、血液ケトン体レベルを調節するために、有効量および生体適合量の3−ヒドロキシ酸を含有する、栄養または治療食物組成物であって、ここで該3−ヒドロキシ酸は、以下:
a)アセトアセテートと組み合わせられた、3−ヒドロキシ酪酸の直鎖ホモオリゴマー以外の3−ヒドロキシ酸の直鎖オリゴマー、
b)3−ヒドロキシ酸の環式オリゴマー、
c)アセトアセテートと組み合わせられた、3−ヒドロキシ酪酸以外の3−ヒドロキシ酸のエステル、
d)アセトアセテートと組み合わせられた、3−ヒドロキシ酪酸の直鎖ホモオリゴマー以外の3−ヒドロキシ酸の直鎖および環式オリゴマーのエステル、ならびに
e)それらの組み合わせ、からなる群から選択される形態である、組成物。
【請求項2】
前記ヒドロキシ酸が塩ではない、請求項1に記載の組成物。
【請求項3】
前記3−ヒドロキシ酸が環式オリゴマーである、請求項1に
記載の組成物。
【請求項4】
前記3−ヒドロキシ酸が3−ヒドロキシ酪酸である、請求項
3に記載の組成物。
【請求項5】
前記3−ヒドロキシ酸が、3−ヒドロキシバレレート、3−ヒドロキシヘキサノエート、3−ヒドロキシヘプタノエート、3−ヒドロキシオクタノエートおよびそれらの組み合わせからなる群から選択される、請求項1に記載の組成物。
【請求項6】
前記3−ヒドロキシ酸エステルが環式エステルである、請求項1に記載の組成物。
【請求項7】
前記環式エステルが3−ヒドロキシブチレートのトリオライド(triolide)である、請求項6に記載の組成物。
【請求項8】
前記環式オリゴマーが、3、4または5個のモノマーサブユニットを含有するR−3−ヒドロキシ酸の環式マクロライドを含む、請求項3に記載の組成物。
【請求項9】
前記3−ヒドロキシ酸が、3−ヒドロキシ酪酸、3−ヒドロキシ吉草酸、3−ヒドロキシヘキサン酸、3−ヒドロキシヘプタン酸およびそれらの組み合わせからなる群から選択される、請求項8に記載の組成物。
【請求項10】
前記3−ヒドロキシ酸オリゴマーが、エステル結合で終結したR−3−ヒドロキシアルカン酸オリゴマーを含む、請求項1に記載の組成物。
【請求項11】
前記オリゴマーが1,3−ブタンジオールで終結する、請求項10に記載の組成物。
【請求項12】
哺乳動物への静脈内投与に適切な処方物中の、請求項1に記載の組成物。
【請求項13】
前記3−ヒドロキシ酸が植物または細菌バイオマスに由来する、請求項1に記載の組成物。
【請求項14】
経口摂取用の食物処方物中の、請求項1に記載の組成物。
【請求項15】
家畜への投与のための食物処方物中の、請求項14に記載の組成物。
【請求項16】
哺乳動物において、血液ケトンレベルを調節する方法であって、該方法は、該哺乳動物に、有効量および生体適合量の3−ヒドロキシ酸を含有する、有効量の栄養または治療食物組成物を投与し、哺乳動物の血液ケトン体レベルを調節する工程を包含し、ここで、該3−ヒドロキシ酸は、以下:
a)アセトアセテートと組み合わせられた、3−ヒドロキシ酪酸の直鎖ホモオリゴマー以外の3−ヒドロキシ酸の直鎖オリゴマー、
b)3−ヒドロキシ酸の環式オリゴマー、
c)アセトアセテートと組み合わせられた、3−ヒドロキシ酪酸以外の3−ヒドロキシ酸のエステル、
d)アセトアセテートと組み合わせられた、3−ヒドロキシ酪酸の直鎖ホモオリゴマー以外の3−ヒドロキシ酸の直鎖および環式オリゴマーのエステル、ならびに
e)それらの組み合わせ、からなる群から選択される形態である、方法。
【請求項17】
前記血液ケトンレベルが発作を制御するのに有効である、請求項16に記載の方法。
【請求項18】
前記血液ケトンレベルが、ケトン体の合成および代謝に関与する代謝疾患を制御するのに有効である、請求項16に記載の方法。
【請求項19】
前記血液ケトンレベルが、前記哺乳動物においてタンパク質異化を軽減し、そして/または食欲を抑えるのに有効である、請求項16に記載の方法。
【請求項20】
前記血液ケトンレベルが、前記哺乳動物の強心効果を高めるのに有効である、請求項16に記載の方法。
【請求項21】
前記血液ケトンレベルが、糖尿病および他のインスリン抵抗状態、神経変性障害ならびにてんかんからなる群から選択される疾患を処置するのに有効である、請求項16に記載の方法。
【請求項22】
前記神経変性疾患が、アルツハイマー病、ピック病関連前頭側頭骨変性、血管性痴呆、レーヴィ体型の老人性痴呆、前頭萎縮を伴う振せん麻痺の痴呆、進行性核上性麻痺および大脳皮質基底核変性症、ダウン症候群関連アルツハイマー、重症筋無力症ならびに筋ジストロフィーからなる群から選択される、請求項21に記載の方法。
【請求項23】
前記哺乳動物がヒトまたは家畜動物である、請求項16に記載の方法。
【請求項24】
前記組成物が非経口的に投与される、請求項16に記載の方法。
【請求項25】
前記組成物が食物組成物または栄養組成物として経口的に投与される、請求項16に記載の方法。
【図1】




【公開番号】特開2012−72148(P2012−72148A)
【公開日】平成24年4月12日(2012.4.12)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−231730(P2011−231730)
【出願日】平成23年10月21日(2011.10.21)
【分割の表示】特願2000−560888(P2000−560888)の分割
【原出願日】平成11年7月22日(1999.7.22)
【出願人】(398055233)メタボリックス,インコーポレイテッド (18)
【Fターム(参考)】
【公開日】平成24年4月12日(2012.4.12)
【国際特許分類】
【出願番号】特願2011−231730(P2011−231730)
【出願日】平成23年10月21日(2011.10.21)
【分割の表示】特願2000−560888(P2000−560888)の分割
【原出願日】平成11年7月22日(1999.7.22)
【出願人】(398055233)メタボリックス,インコーポレイテッド (18)
【Fターム(参考)】
[ Back to top ]

