3次元細胞培養方法及び細胞移植用組成物
【課題】再生医療に必要な体性細胞の高い増殖率で培養することができ、且つ人体に対する安全性が高く、さらには生体内での生着性及び細胞生存性を顕著に高めること。
【解決手段】再生医療に用いる間葉系幹細胞や腫瘍細胞を含む接着性細胞と、低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、接着性細胞の用途に応じて任意に選択されるサイトカインと、容積比0.5〜25%のヒト血漿と、で構成されるゲル状の細胞移植用組成物内で接着性細胞の培養を行う。
【解決手段】再生医療に用いる間葉系幹細胞や腫瘍細胞を含む接着性細胞と、低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、接着性細胞の用途に応じて任意に選択されるサイトカインと、容積比0.5〜25%のヒト血漿と、で構成されるゲル状の細胞移植用組成物内で接着性細胞の培養を行う。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、マイクロ粒子と血漿添加による各種体性多能性細胞の細胞培養方法及び細胞移植用組成物に係り、詳細には低分子ヘパリンとプロタミンとから構成されるマイクロ粒子と、細胞増殖又は分化誘導を促進させるサイトカインと、血漿添加によるゲル化培地を用いた接着性細胞及び造血系浮遊細胞等の体外3次元細胞培養方法及び再生医療等に用いられる細胞移植用組成物に関するものである。
【背景技術】
【0002】
相応する電荷を有する高分子間静電反応により生じる多重電解質複合体は、電荷を帯びた生体高分子の生体内挙動の研究モデルとなる。さらに、ユニークな組成や構造からなる多重電解質複合体は、可溶性ナノ粒子の形成、複合化マイクロ粒子の形成(コアセルベーション)、非結晶性沈殿物等を形成し、バイオテクノロジーや医学の分野での適用が可能である。例えば、タンパク質と核酸よりなる複合体形成は転写過程に影響を及ぼすと考えられる。また、低分子ヘパリン/プロタミン マイクロ粒子(LH/P MPs)に加えて、DNA・キトサン複合体マイクロ(ナノ)粒子がそれぞれ遺伝子キャリア及び薬剤キャリアとして記述された。
【0003】
ところで、骨髄や脂肪組織を含んだ多くを生体組織には、組織の維持や修復のため多分化能を保持した前駆体細胞である生体幹細胞が含まれていることが知られている。特に骨髄細胞は造血系幹細胞や間葉系幹細胞を含み、各種血液細胞のみならず、皮膚、骨、軟骨、血管、筋肉の細胞に分化しそれぞれの組織再生を促進する。同様に、脂肪組織由来間葉系細胞も皮膚、骨、軟骨、血管、筋肉の細胞に分化することが知られており、人において豊富な幹細胞資源となる脂肪組織に大きな注目が集まっている。
【0004】
しかしながら、各種体性幹細胞や前駆体細胞の収率は低く、培養には高濃度(10%以上)の異種動物の血清、フィーダー細胞、そしてコラーゲンや腫瘍生成基底膜であるマトリゲルをマトリックスとして使用する必要があり、ウィルスや未知病原体による感染及び抗原性付与の問題が避けられない。よって、上記体性幹細胞や前駆体細胞を効率的、且つ安全に異種動物の血清培地、フィーダー細胞、そしてコラーゲンやマトリゲルを使用しないマトリックス内で増殖させる培養法が求められている。さらに再生医療における細胞移植には、生体内でのその生着性及び増殖性を高める有効な細胞キャリアを併用する必要がある。
【0005】
ところで、血液を凝固させ血小板や血液凝固因子(フィブリノーゲン等) を除いたものが血清(serum) であり、血漿は抗凝固剤(クエン酸等)入りの採血管を用いて採血した血液を遠心分離して細胞成分(赤血球や白血球)を除いたものが血小板を含んだ血漿(プラズマ) である。この血漿を添加した培地は、混合後10分以内に室温で容易にゲル化することが見出されている。
【0006】
そこで、近年では、血漿の添加によるゲル化に着目した血漿ゲル(Plasma gel)は、細胞増殖及び分化誘導を促進する様々な増殖因子やサイトカイン等の生理活性物質を含有し運搬する血小板を多く含み、再生医療等多くの分野で様々な応用研究が進められている。
【0007】
これらの血小板に運搬される生理活性物質は、血小板由来増殖因子(PDGFs)、線維芽増殖因子(FGFs)、肝細胞増殖因子(HGF)、トランスフォーミング増殖因子(TGFs)、血管内皮増殖因子(VEGFs)等20を超え、これらのほとんどはヘパリン結合性であることが知られている。さらに、形成外科の分野でも創傷治癒、変形の改善(含雛取り)、育毛等幅広い臨床応用が期待されており、また血管新生療法や再生医療等の臨床の場でも既に適用されているが、その効果はさほど高くないのが現状である。
【0008】
このように各分野において、血漿ゲルの有効性をさらに高めるため、貴重な患者本人の血液製剤である血漿に含有されている生理活性物質の活性を維持したまま、より有効に局所に保持、徐放が可能な、安全な薬剤キャリアの出現が求められていた。
【0009】
そこで、本発明者等は、鋭意研究の結果、低分子へパリン(LH)とプロタミン(P)との組み合わせを用いることにより、簡便に平均粒径1.5μm程度(0.5μm以上3μm未満)から、さらには平均粒径100nmの微粒子を作成でき、得られた微粒子をコートしたプレートが徐放性の薬物包接或いは細胞接着マトリックスとして使用できることを見出した(詳細は、特許文献1及び非特許文献1〜5を参照)。
【0010】
すなわち、このLH/P MPs−コートマトリックスが、塩基性線維芽細胞増殖因子(FGF)−2及び血小板に含まれる様々なヘパリン結合性増殖因子やサイトカイン等の生理活性物質を吸着してそれらの活性を保護し、徐放するマトリックスとして有効であること、また上記LH/P MPsに吸着・保護され活性を保持した生理活性物質が、生体内で生理活性物質含有LH/P MPs複合体の生分解に伴い周辺部位へ徐放され、生体局所での血管新生や肉芽形成の促進に寄与することを実証した。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2011−219428号公報
【非特許文献】
【0012】
【非特許文献1】Journal of Controlled Release, Cytokine-immobilized microparticle-coated plates for culturing hematopoietic progenitor cells. 133, 185-190, 2009.
【非特許文献2】International Journal of Nanomedicine, Preparation and characterization of low-molecular-weight heparin/protamine nanoparticles (LMW-H/P NPs) as FGF-2 carrier. 5, 147-155, 2010.
【非特許文献3】Artificial Organs, Fragmin/protamine microparticle-coated matrix immobilized cytokines to stimulate various cell proliferation with low serum media. 33, 431-438, 2009.
【非特許文献4】Journal of Biomedical Materials Research (Part B), Enhancement of vascularization and granulation tissue formation by growth factors in human platelet-rich plasma-containing fragmin/protamine microparticles. 97B, 373-380, 2011.
【非特許文献5】Journal of Biomedical Materials Research (Part A), Controlled release of FGF-2 using fragmin/protamine microparticles and effect on neovascularization. 91A, 814-823, 2009.
【発明の概要】
【発明が解決しようとする課題】
【0013】
ところで、近年ヒトや動物の細胞を生体外で培養し増幅及び分化誘導を行い、その機能を利用して人工臓器や人工組織として利用する研究が活発に行なわれている。しかしながら、各種細胞の中でも、特に再生医療での移植用細胞として需要の大きい骨髄及び脂肪組織由来の間葉系幹細胞については、ウィルスや未知病原体による感染、抗原性付与の問題を有する異種動物の血清、フィーダー細胞、そしてコラーゲンやマトリゲル等のマトリックスとしての使用を排除し、多分化能を維持したまま安全に増幅する培養法が未だ確立されていない。
【0014】
特に、造血系前駆体細胞或いは血管内皮前駆体細胞として機能することが知られているCD34陽性造血系前駆体細胞についての体外増幅についての確立された方法はなく、その需要に比して採取できる量が非常に少ないため、成人に移植することが困難となっていた。従って、安全性や安定した供給等の問題点から異種動物の血清、フィーダー細胞、そしてコラーゲンやマトリゲル等のマトリックスとしての使用を排除した体外大量増幅システムの開発が必要である。
【0015】
さらに細胞移植は、細胞の有する脆弱性や分散性により、必要な場所に有効に移植細胞を生着、増殖させることに困難を極めているのが現状であり、安全で有効な細胞運搬システムの出現が求められている。
【0016】
そこで、本発明は上記問題点に鑑みてなされたものであり、骨髄由来間葉系幹細胞や脂肪組織由来間葉系細胞、CD34陽性造血系前駆体細胞、植皮用皮膚構築に不可欠な線維芽細胞、末梢血流障害の治療に応用が期待される血管内皮細胞等の再生医療に必要な接着性細胞又は造血系浮遊細胞を高い増殖率で培養することができ、且つ人体に対する安全性が高く、さらには生体内での生着性及び細胞生存性を顕著に高めた3次元細胞培養方法及び細胞移植用組成物を提供することを目的とするものである。
【課題を解決するための手段】
【0017】
上記した目的を達成するため、請求項1記載の3次元細胞培養方法は、再生医療に用いる間葉系幹細胞や腫瘍細胞を含む接着性細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記接着性細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物内で前記接着性細胞の培養を行うことを特徴とする。
【0018】
請求項2記載の細胞移植用組成物は、再生医療に用いる間葉系幹細胞や腫瘍細胞を含む接着性細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記接着性細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物であることを特徴とする。
【0019】
請求項3記載の3次元細胞培養方法は、再生医療に用いるCD34陽性造血系前駆体細胞を含む造血系浮遊細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記造血系浮遊細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物内で前記造血系浮遊細胞の培養を行うことを特徴とする。
【0020】
請求項4記載の細胞移植用組成物は、再生医療に用いるCD34陽性造血系前駆体細胞を含む造血系浮遊細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記造血系浮遊細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物であることを特徴とする。
【発明の効果】
【0021】
本発明によれば、再生医療に用いられる接着性細胞や造血系浮遊細胞と、低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、使用する細胞の用途に応じて任意に選択されるサイトカインと、容積比0.5〜25%のヒト血漿とで構成されるゲル状の細胞移植用組成物を用いるため、細針を装着したシリンジでも注入可能となる。
【0022】
また、局所への移植後、適度な粘稠性により注入箇所に留まり、また各種接着性細胞や各種造血系浮遊細胞の分散を限定するとともに、生着性、増殖性及び多分化能に優れた局所細胞移植のための運搬システムとして適用することができる。
【図面の簡単な説明】
【0023】
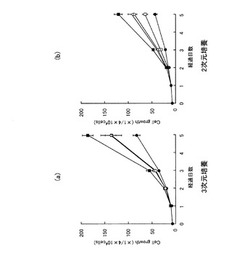
【図1】(a)は本発明に係る細胞移植用組成物によるヒト脂肪組織由来間葉系細胞の3次元細胞培養時における細胞増幅結果を示すグラフであり、(b)は比較用組成物によるヒト脂肪組織由来間葉系幹細胞の2次元細胞培養時における細胞増幅結果を示すグラフである
【図2】(a)は本発明に係る細胞移植用組成物を用いて体外3次元培養により増幅したヒト脂肪組織由来間葉系細胞の電子顕微鏡写真であり、(b)は比較組成物を用いて2次元細胞培養により増幅したヒト脂肪組織由来間葉系細胞の電子顕微鏡写真である。
【図3】(a)は本発明に係る細胞移植用組成物によるヒト骨髄由来間葉系幹細胞の3次元細胞培養時における細胞増幅結果を示すグラフであり、(b)は比較用組成物によるヒト骨髄由来間葉系幹細胞の2次元細胞培養時における細胞増幅結果を示すグラフである。
【図4】(a)は本発明に係る細胞移植用組成物を用いて体外3次元培養により増幅したヒト骨髄由来間葉系幹細胞の電子顕微鏡写真であり、(b)は比較組成物を用いて2次元細胞培養により増幅したヒト骨髄由来間葉系幹細胞の電子顕微鏡写真である。
【図5】(a)は本発明に係る細胞移植用組成物を用いたヒト骨髄由来間葉系幹細胞の脂肪細胞への分化誘導による分化能を示す写真であり、(b)は本発明に係る細胞移植用組成物を用いたヒト脂肪組織由来間葉系細胞の脂肪細胞への分化誘導による分化能を示す写真である。
【図6】(a)は本発明に係る細胞移植用組成物を用いたヒト骨髄由来間葉系幹細胞の骨芽細胞への分化誘導による分化能を示す写真であり、(b)は本発明に係る細胞移植用組成物を用いたヒト脂肪組織由来間葉系細胞の骨芽細胞への分化誘導による分化能を示す写真である。
【図7】(a)は本発明に係る細胞移植用組成物によるヒト皮膚線維芽細胞の3次元細胞培養時における細胞増幅結果を示すグラフであり、(b)は比較用組成物によるヒト皮膚線維芽細胞の2次元細胞培養時における細胞増幅結果を示すグラフである。
【図8】(a)は本発明に係る細胞移植用組成物を用いて体外3次元培養により増幅したヒト皮膚線維芽細胞の電子顕微鏡写真であり、(b)は比較組成物を用いて2次元細胞培養により増幅したヒト皮膚線維芽細胞の電子顕微鏡写真である。
【図9】(a)は本発明に係る細胞移植用組成物によるヒト皮膚毛細血管内皮細胞の3次元細胞培養時における細胞増幅結果を示すグラフであり、(b)は比較用組成物によるヒト皮膚毛細血管内皮細胞の2次元細胞培養時における細胞増幅結果を示すグラフである。
【図10】(a)は本発明に係る細胞移植用組成物を用いて体外3次元培養により増幅したヒト皮膚毛細血管内皮細胞の電子顕微鏡写真であり、(b)は比較組成物を用いて2次元細胞培養により増幅したヒト皮膚毛細血管内皮細胞の電子顕微鏡写真である。
【図11】本発明に係る細胞移植用組成物によるヒト骨髄由来CD34陽性造血系前駆体細胞の3次元細胞培養時における細胞増幅結果を示すグラフである。
【図12】本発明の細胞移植用組成物により増殖中のヒト骨髄由来CD34陽性造血系前駆体細胞のフローサイトメトリーによるCD34陽性率を示すグラフである。
【図13】(a)は本発明に係る細胞移植用組成物を用いて体外3次元培養により増幅したヒト骨髄由来CD34陽性造血系前駆体細胞の電子顕微鏡写真であり、(b)は比較組成物を用いて2次元細胞培養により増幅したヒト骨髄由来CD34陽性造血系前駆体細胞の電子顕微鏡写真である。
【図14】本発明に係る細胞移植用組成物によるヒトTF−1細胞の3次元細胞培養時における細胞増幅結果を示すグラフである。
【図15】(a)は本発明に係る細胞移植用組成物を用いて体外3次元培養により増幅したヒトTF−1細胞の電子顕微鏡写真である(b)は比較組成物を用いて2次元細胞培養により増幅したヒトTF−1細胞の電子顕微鏡写真である。
【図16】(a)は本発明に係る細胞移植用組成物で培養した肝癌細胞株をヌードマウス皮下へ投与した際の該細胞における腫傷サイズを比較したグラフであり、(b)は図16(a)における肝癌細胞株の細胞数を変更して培養したものをヌードマウス皮下へ投与した際の該細胞における腫瘍サイズを比較したグラフである。
【発明を実施するための形態】
【0024】
以下、本発明を実施するための形態について、添付した図面を参照しながら詳細に説明する。また、この実施の形態によりこの発明が限定されるものではなく、この形態に基づいて当業者などによりなされる実施可能な他の形態、実施例及び運用技術などはすべて本発明の範疇に含まれる。
【0025】
本発明に係る3次元細胞培養方法は、再生医療に用いられる各種細胞(接着性細胞又は造血系浮遊細胞、より好ましくは移植対象となる患者の自己細胞)と、低分子ヘパリンとプロタミンから構成されるLH/P MPsと、同種血漿(好ましくは自己血漿)及び用途に応じて適宜選択される適切なサイトカインを含有した培地からなる血漿ゲルと、で構成されている。
【0026】
再生医療に用いられる細胞としては、「接着性細胞」と「造血系浮遊細胞」とに大別される。
「接着性細胞」としては、例えばヒト脂肪組織由来間葉系細胞やヒト骨髄由来間葉系幹細胞等の種々の間葉系幹細胞及び血管内皮細胞及びその前駆体細胞、線維芽細胞及びその前駆体細胞、血管内皮細胞及びその前駆体細胞、肝実質細胞及びその前駆体細胞、滕β細胞及びその前駆体細胞、平滑筋細胞及びその前駆体細胞、軟骨細胞及びその前駆体細胞、筋芽細胞、骨芽細胞、癌細胞等の種々の腫瘍細胞(例えばヒト肝癌細胞株(Huh7))がある。
また、「造血系浮遊細胞」としては、例えばヒト赤血白血病細胞(TF−1)やヒト骨髄由来CD34造血系前駆体細胞等の種々の造血系前駆体細胞、胚性幹細胞(Embryonic stem cells:ES細胞) 、人工多能性幹細胞(Induced pluripotent stem cells:iPS細胞)等がある。
なお、上記各種細胞は、用途に応じて適宜選択又は任意に組み合わせて使用することができる。
【0027】
低分子ヘパリン/プロタミン マイクロ粒子(LH/P MPs)は、低分子ヘパリンとプロタミンとを含むマイクロ粒子である。本発明で用いられる低分子ヘパリンは、一般に天然ヘパリン(分子量15000〜20000Da程度)を解重合して得られる低分子量のヘパリンである。その平均分子量の上限は、プロタミンと混合することにより微粒子を形成できる程度のものであればよく、一般的には10000、好ましくは9000、より好ましくは8000、さらに好ましくは6000であり、数平均分子量の下限は、通常は1000、好ましくは3000、より好ましくは4000である。
【0028】
なお、数平均分子量において通常(天然)のヘパリンと区別できれば十分であり、例えば、10000以上、或いは20000以上の分子量を持つ分画を含んでいても、全体として平均分子量が約10000未満であれば本発明における低分子ヘパリンとして使用できる。本発明では、ヘパリンの平均分子量として、分子量が既知の標準物質を用いたゲル浸透クロマトグラフィー法によって測定される数平均分子量を用いる。
【0029】
例えば、ブタの小腸粘膜由来のヘパリンを亜硝酸分解して得られる解重合ヘパリン(ダルテパリン)は、フラグミン(商品名)として市販されており、4000〜6000の平均分子量を有する。同様に、ブタの小腸粘膜由来のヘパリンを亜硝酸分解して得られる解重合ヘパリン(レビパリン)はローモリン(商品名)として市販されている。また、ウシ又はブタ腸粘膜由来のヘパリンを過酸化水素と酢酸第二銅により分解して得られる解重合ヘパリン(パルナパリン)は、ローヘパ(商品名)として市販されており、これらは何れも本発明における低分子ヘパリンとして使用できる。
【0030】
ヘパリンは単独では抗凝固作用を持たず、血漿中のATIII と結合することによってその作用を発揮し、第IIa 因子、第XIIa因子、第XIa 因子、第Xa因子、第IXa 因子などの凝固系酵素を阻害、不活化する。一方、本発明で使用する低分子ヘパリンは抗第XIIa、抗第Xa因子活性を持つものの、第IIa 因子、第XIa 因子、第IXa 因子に対する阻害活性は軽微であることが医薬品として明らかにされているので、創傷部位に注入しても当該部位における出血傾向を助長することなく使用できる。
【0031】
低分子ヘパリンとしては、上記の市販されているものを使用してもよいし、或いは、過ヨウ素酸酸化により低分子化したヘパリンや、特異的脱硫酸化ヘパリンなども好適に用いることができる。このような低分子量のヘパリンを使用することにより、プロタミンと混合した際に好適な微粒子を得ることができる。
【0032】
本発明で用いるプロタミンは、動物の精子の核中でDNAと結合して存在する塩基性の高いタンパク質として知られている。一般的には、27〜65残基からなる低分子量タンパク質であり、アミノ酸の40〜70%をアルギニンが占めると言われている。プロタミンも医薬品として市販されており、本発明では市販のプロタミンをそのまま使用することができる。
【0033】
本発明の好適態様では、低分子ヘパリン溶液にプロタミン溶液を滴下して低分子ヘパリンとプロタミンとを含む粒子を生成させる。例えば、ダルテパリン等の低分子ヘパリンの水溶液に、プロタミン水溶液を後述する割合になるよう滴下し、ボルテックスなどでさらに攪拌することによって粒子を得る。低分子ヘパリンおよびプロタミンの濃度は各々設定することができ、好適にはそれぞれ0.01〜30mg/mlである。このとき、低分子ヘパリンおよびプロタミンの濃度を調節することによって、得られる粒子のサイズを制御することができる。
【0034】
例えば、低分子ヘパリンおよびプロタミンの濃度がそれぞれ1〜20mg/ml程度の溶液を用いると、0.5〜10μm程度の平均粒子径をもつ粒子を得ることができ、低分子ヘパリンおよびプロタミンの濃度がそれぞれ0.05〜0.5mg/ml程度の溶液を用いると、50〜200nm程度の平均粒子径をもつ粒子を得ることができる。
【0035】
低分子ヘパリンとプロタミンとの混合重量比については、プロタミンに対する低分子ヘパリンの重量を等量、或いはやや過剰することが、粒子の収率向上の点で好ましく、過剰なプロタミンの存在は不溶性のペースト状沈殿物が生成する懸念がある。従って、低分子ヘパリンの溶液にプロタミンの溶液を滴下する場合には、滴下後の溶液内における低分子ヘパリン/プロタミンの重量比は、好ましくは1/1〜5/1であり、より好ましくは1/1〜2/1である。
【0036】
すなわち、上記低分子ヘパリン溶液に含まれる低分子ヘパリン1重量部に対して、好ましくは0.2〜1重量部、より好ましくは0.5〜1重量部のプロタミンが添加されるようにプロタミン溶液が滴下される。
【0037】
このように作成されたLH/P MPsは、血漿中に含まれる多くのへパリン結合性増殖因子やサイトカイン等生理活性物質を担持することができ、担持された生理活性物質を熱やトリプシン等タンパク質分解酵素による不活化要因から保護して活性を維持延長することができ、さらに骨髄や脂肪組織由来の間葉系幹細胞等様々な接着性細胞の表面に接合し、細胞凝集体(スフェロイド)を形成する。
【0038】
ヒト血漿は、健常ボランティアから0.1〜8m1の2%クエン酸溶液の入った採血管に血液を採血し、所定条件(例えば、15分間、1700rpm(Table Top 冷却遠心機 2800,ローター:RS 240,クボタ))で遠心し、生じた3つの層、底部の赤(白)血球画分、赤(白)血球画分から上部(1cm)を多血小板血漿(Platelet Rich Plasma :PRP)画分、さらに上部を少血小板血漿(Platelet Poor Plasma :PPP)として採取し、PRPとPPPを合わせたものである。
【0039】
なお、本発明では、採血した血液の有効利用とゲル形成効率の観点から培地・血漿ゲル化剤としてヒト血漿を使用したが、血小板とともにそこに包含されたサイトカインが濃縮されているPRP或いは血漿ゲル化に優れたPPPの用途別使用も可能である。また、安全性の面からヒトへの臨床適用には、自己(autogenous)血漿の使用が望ましい。
【0040】
サイトカインとしては、一例としてインターロイキン(Interleukin :IL)、幹細胞因子(Stem cell factor:SCF)、上皮増殖因子(Epidermal Growth Factor :EGF)、線維芽細胞増殖因子(Fibroblast Growth Factor:FGF)、塩基性線維芽細胞増殖因子(basic fibroblast growth factor:FGF−2)、血小板由来増殖因子(Platelet-Derived Growth Factor:PDGF)、肝細胞増殖因子(Hepatocyto Growth Factor:HGF)、トランスフォーミング増殖因子(Transforming growth factor:TGF)、トロンボポエチン(Thrombopoietin:TPO)、コロニー刺激因子(Coloney-Stimulating Factor:CSF)、顆粒球コロニー刺激因子(Granulocyte-Coloney-Stimulating Factor:G−CSF)、顆粒球マクロファージコロニー刺激因子(Granulocyte-macrophage-colony stimulating factor:GM−CSF)、FLt3−ligand(Human Fms-related tyrosin kinase 3 ligand )等があり、使用する接着性細胞又は造血系浮遊細胞に応じて任意に選択して添加する。
【0041】
培地としては、用途に応じて選択された各種細胞に適切なサイトカインに応じて選択される細胞培養培地として、例えばDMEM(Dulbecco's Modified Eagle Medium)、HPGM(Hematopoietic Progenitor Growth Medium)等を使用する。
【0042】
本発明の細胞移植用組成物におけるゲル化の条件としては、血小板及び血液凝固因子(フィブリノーゲン等)を含めた血漿を用いているため、採血時に採血管に入れる抗凝固剤としてのクエン酸(2%液)を採血量に対して1〜2%に制限、或いは添加するLH/P MPsを0.2mg/ml以下に制限することによって適度な粘稠性を有するとともに増殖した細胞の分散性を限定し、生着性及び増殖性に優れた組成物を得ることができる。 なお、このゲル化メカニズムは、人体が怪我をしたときに出血した血液が凝固(ゲル化)する血液凝固作用と同一である。
【0043】
以上説明したように、本発明の細胞移植用組成物は、適切なサイトカイン及びLH/P MPsを添加した血漿(より好ましく自己血漿)からなるゲル状を成しているため、接着性或いは造血性浮遊性細胞に対して、安全性の面で問題のある異種動物の血清、フィーダー細胞、そしてコラーゲンやマトリゲル等のマトリックスとしての使用を排除し、対象として、骨髄由来間葉系幹細胞及び脂肪組織由来間葉系細胞及び血管内皮細胞及びその前駆体細胞、線維芽細胞及びその前駆体細胞、肝実質細胞及びその前駆体細胞、膵β細胞及びその前駆体細胞、平滑筋細胞及びその前駆体細胞、軟骨細胞及びその前駆体細胞等の接着性・体性細胞全般に有効である。さらに、ヒト骨髄由来CD34陽性造血系前駆体細胞或いはTF−1細胞等の造血系浮遊細胞に加えて、躋帯血や末梢血由来CD34陽性造血系前駆体細胞、骨髄や末梢血中の単核球細胞の選択的増幅及び分化誘導に適切なサイトカインの添加を伴う適応が可能である。
【0044】
また、本発明の細胞増殖用組成物を用いた3次元細胞培養方法は、用途に応じた所望の細胞及びμm〜nmオーダーの微粒子を血漿ゲルに包含させた軟ゲル状の複合体という形態的特徴を有するので、特に注射器やカテーテルなどを介して、容易に体内に注入する細胞運搬用組成物としても機能する。さらに、適度な粘稠性と徐放性を有するため、生体局所に注入した際に、組成物内で3次元的に増殖した状態で局所に組成物を留まらせつつ、サイトカインにより分化・増殖した細胞及び細胞が生成した有効成分を周辺部位に徐放させることができる。
【0045】
また、本発明の細胞増殖用組成物によって増幅させた各種細胞は、トリプシン/EDTA溶液による所定時間(10分以内)溶解することで容易に回収することができる。
【0046】
ところで、上述した形態において、細胞移植用組成物に含有させる細胞は特に制限はないが、本培地・血漿ゲル包接担体に担持されやすく、体内において生着及び増殖が望まれる再生医療に有用な同種移植用細胞(より好ましくは自己細胞)とするのが好ましい。また、異種移植用細胞導入への適用も可能である。例えば、後述する実施例7で示すように、ヒト肝癌細胞(Huh7)を免疫不全マウス(ヌードマウス)に移植する際に、本細胞移植用組成物の使用は、腫癌細胞の生着性・成長性を大きく高めることが確認された。
【0047】
また、本発明の細胞移植用組成物に添加されるサイトカインは、LH/P MPsの構成成分である低分子へパリン又はプロタミンとの親和性が高い薬物、例えばFGF−2等のへパリン結合性増殖因子又はサイトカインから選択される活性物質を含有させるのが好ましい。特に、ヒト血漿は患者自身から採血した血液から調製できるもので、そこに含まれる増殖因子やサイトカインは、殆どがヘパリン結合性であることが知られている。また、本発明の細胞移植用組成物において、使用する媒体としては水性媒体が好ましい。
【0048】
さらに、上述した細胞移植用組成物を用いた3次元細胞培養方法は、ヒト骨髄由来間葉系幹細胞やヒト脂肪組織由来間葉系細胞を含む接着性細胞、TF−1やヒト骨髄由来CD34造血系前駆体細胞を含む造血系浮遊細胞に限定されるものではなく、同種血漿、望ましくは自己血漿を用いることで、例えば躋帯血や末梢血由来CD34陽性造血系前駆体細胞、マウス、ラット、兎等他種動物の骨髄由来間葉系幹細胞及び脂肪組織由来間葉系細胞及び血管内皮細胞及びその前駆体細胞、線維芽細胞及びその前駆体細胞、血管内皮細胞及びその前駆体細胞、肝実質細胞及びその前駆体細胞、肺β細胞及びその前駆体細胞、平滑筋細胞及びその前駆体細胞、軟骨細胞及びその前駆体細胞、筋芽細胞、骨芽細胞等の様々な接着細胞に適切な増殖因子やサイトカイン等の生理活性物質の添加を伴う適応が可能である。
【実施例】
【0049】
以下、本発明による実施例を示す。なお、本発明はこれらの実施例に記載された態様に限定されるわけではなく、前・後記の趣旨に照らし合わせて設計変更することは何れも本発明の技術的範囲に含まれるものである。
【0050】
[低分子ヘパリン/プロタミン マイクロ粒子(LP/P MPs)の作製]
低分子ヘパリンとして、市販のダルテパリンであるフラグミン注射液(商品名)(6.4mg/ml、1000IU/ml、ヘパリンの数平均分子量は約5000、キッセイ薬品工業株式会社)を使用した。この低分子ヘパリン溶液に対して、市販のプロタミン注射液(10mg/ml:持田製薬株式会社) をボルテックスで撹拌しながら7 :3 の容積比になるまで滴下し混合することで得た。
【0051】
[ヒト血漿の採取]
健常ボランティアから0.1〜8m1の2%クエン酸溶液の入った採血管に40mlの血液を採血し、15分間、1700rpm(Table Top 冷却遠心機 2800,ローター:RS 240,クボタ)で遠心した。生じた3つの層、底部の赤(白)血球画分、赤(白)血球画分から上部(1cm)を多血小板血漿(Platelet Rich Plasma :PRP)画分、さらに上部を少血小板血漿(Platelet Poor Plasma :PPP)として採取した。PRPとPPPを合わせたがヒト血漿である。なお、40mlのヒト血液から4〜5mlのPRP、15〜20mlのPPP、20〜24mlのヒト血漿が得られた。PRPの血小板濃度は79.6±10.2×104 /μl、PPPは3.6±0.6×104 /μl、血漿は18.2±3.6×104 /μlであった。
【0052】
[実施例1]
作製したLH/P MPs(0.1mg/ml)と、サイトカインとしてFGF−2(5ng/ml)を含む無血清DMEM培地と、ヒト血漿(容積比4%)とを加えて作製したゲル状の細胞移植用組成物内を用いて、ヒト骨髄由来間葉系幹細胞及びヒト脂肪組織由来間葉系細胞に対する体外3次元培養増幅を実施した。
【0053】
図1(a)に示すように、24ウエル組織培養プレートに、約50,000のヒト骨髄由来間葉系幹細胞を作製した細胞移植用組成物内に加えて播種し、5日間体外3次元培養を行った(図中「■」)。比較対象として、FGF−2(5ng/ml)のみを含むヒト血漿(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血漿(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血漿(容積比4%)DMEM(図中「●」)を3次元培養ネガティブコントロールとし、5日間の細胞増殖を比較した。
また、他の比較対象として、図1(b)に示すように、LH/P MPs及びFGF−2を含む無血清DMEM培地においてヒト血漿に代えてヒト血清(容積比4%)を加えたDMEM(図中「■」)、FGF−2(5ng/ml)のみを含むヒト血清(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血清(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血清(容積比10%)DMEM(図中「○」)、ヒト血清(容積比4%)DMEM(図中「●」)を用いて、上記ヒト骨髄由来間葉系幹細胞を体外2次元培養し、5日間の細胞増殖を比較した。なお、各図中の縦軸は、細胞増幅(Cell growth )を示す。
【0054】
図2(a)は、ヒト骨髄由来間葉系幹細胞について上記作製した細胞移植用組成物内での体外3次元培養の培養3日目の顕微鏡写真であり、図2(b)はLH/P MPs、FGF−2及びヒト血清(容積比4%)を加えた2次元培養の培養3日目の顕微鏡写真である。
【0055】
また、図3(a)に示すように、24ウエル組織培養プレートに、約50,000のヒト脂肪組織由来間葉系細胞を作製した細胞移植用組成物内に加えて播種し、5日間体外3次元培養を行った(図中「■」)。比較対象として、FGF−2(5ng/ml)のみを含むヒト血漿(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血漿(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血漿(容積比4%)DMEM(図中「●」)を3次元培養ネガティブコントロールとし、5日間の細胞増殖を比較した。
また、他の比較対象として、図3(b)に示すように、LH/P MPs及びFGF−2を含む無血清DMEM培地においてヒト血漿に代えてヒト血清(容積比4%)を加えたDMEM(図中「■」)、FGF−2(5ng/ml)のみを含むヒト血清(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血清(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血清(容積比10%)DMEM(図中「○」)、ヒト血清(容積比4%)DMEM(図中「●」)を用いて、上記ヒト脂肪組織由来間葉系細胞を体外2次元培養し、5日間の細胞増殖を比較した。なお、各図中の縦軸は、細胞増幅(Cell growth )を示す。
【0056】
図4(a)は、ヒト脂肪組織由来間葉系細胞について上記作製した細胞移植用組成物内での体外3次元培養の培養3日目の顕微鏡写真であり、図4(b)はLH/P MPs、FGF−2及びヒト血清(容積比4%)を加えた2次元培養の培養3日目の顕微鏡写真である。
【0057】
なお、本実施例では、細胞培養後の細胞移植用組成物に対し、トリプシン・EDTA溶液で10分以内に溶解してその中の増殖細胞を分雛し、血球計測器を用いて細胞数を計測した。
【0058】
図1〜4に示すように、比較結果として、両細胞ともLH/P MPs及びFGF−2を含む無血清DMEM培地にヒト血漿(容積比4%)を加えた本発明の細胞移植用組成物内において最大の細胞増殖を示した。
【0059】
[実施例2]
作製したLH/P MPs(0.1mg/ml)と、FGF−2(5ng/ml)を含む無血清DMEMと、ヒト血漿(容積比4%)とを加えて作製した本発明に係る細胞移植用組成物内で、体外3次元培養増幅させたヒト骨髄由来間葉系幹細胞及びヒト脂肪組織由来間葉系細胞の分化能を確認するため、脂肪細胞への分化誘導を行った。脂肪細胞への分化誘導には市販培地(Lonza Walkersville, Inc., MD)を使用し、両細胞を脂肪細胞誘導培地で4日間、続いて維持培地で3日間培養するサイクルを3回実施した後、両細胞を維持培地でさらに7日間培養した。また、脂肪滴の確認のため、 Oil Red O染色(和光純薬工業(株))を施した。
【0060】
図5(a)は、3次元培養増幅したヒト骨髄由来間葉系幹細胞の脂肪細胞への分化誘導の試験結果であり、48ウエルプレートの最初のP列は、購入細胞の分化誘導、2番目のN列は分化誘導培地を用いず、維持培地のみで培養したもの、3、4番目の−列は、体外2次元培養で増幅した細胞の分化能、5、6番目の+列は体外3次元培養で増幅した細胞を示している。また、図5(b)は、3次元培養増幅したヒト脂肪組織由来間葉系細胞の脂肪細胞への分化誘導の試験結果であり、48ウエルプレートの最初のP列は、購入細胞の分化誘導、2番目のN列は分化誘導培地を用いず、維持培地のみで培養したもの、3、4番目の−列は、体外2次元培養で増幅した細胞の分化能、5、6番目の+列は体外3次元培養で増幅した細胞を示している。
【0061】
培養したヒト骨髄由来間葉系幹細胞及びヒト脂肪組織由来間葉系細胞は、何れも脂肪細胞に良好に分化誘導する分化能を保持していることが確認された。
【0062】
[実施例3]
作製したLH/P MPs(0.1mg/ml)と、FGF−2(5ng/ml)を含む無血清DMEMと、ヒト血漿(容積比4%)とを加えて作製した本発明に係る細胞移植用組成物内で、体外3次元培養増幅させたヒト骨髄由来間葉系幹細胞及びヒト脂肪組織由来間葉系細胞の分化能を確認するため、骨芽細胞への分化誘導を行った。骨芽細胞への分化誘導には市販培地(Lonza Walkersville, Inc., MD)を使用し、両細胞を脂肪細胞誘導培地で4日間、続いて維持培地で3日間培養するサイクルを3回実施した後、両細胞を維持培地でさらに7日間培養した。また、骨芽細胞の誘導では、骨芽細胞のアルカリフォスファターゼ活性を調べるため、ALP染色を実施した。
【0063】
図6(a)は、3次元培養増幅したヒト骨髄由来間葉系幹細胞の骨芽細胞への分化誘導の試験結果であり、48ウエルプレートの最初のP列は、購入細胞の分化誘導、2番目のN列は分化誘導培地を用いず、維持培地のみで培養したもの、3、4番目の−列は、体外2次元培養で増幅した細胞の分化能、5、6番目の+列は体外3次元培養で増幅した細胞を示している。また、図5(b)は、3次元培養増幅したヒト脂肪組織由来間葉系細胞の骨芽細胞への分化誘導の試験結果であり、48ウエルプレートの最初のP列は、購入細胞の分化誘導、2番目のN列は分化誘導培地を用いず、維持培地のみで培養したもの、3、4番目の−列は、体外2次元培養で増幅した細胞の分化能、5、6番目の+列は体外3次元培養で増幅した細胞を示している。
【0064】
培養したヒト骨髄由来間葉系幹細胞及びヒト脂肪組織由来間葉系細胞は、何れも骨芽細胞に良好に分化誘導する分化能を保持していることが確認された。
【0065】
加えて、培地・血漿ゲル内でのヒト皮膚線維芽細胞3次元培養は、5日目以降顕著な血漿ゲル収縮とともに肉芽組織様形態を示した。また、ヒト皮膚毛細血管内皮細胞3次元培養は、24時間以内に毛細血管様組織形成が観察された。
【0066】
[実施例4]
作製したLH/P MPs(0.1mg/ml)と、サイトカインとしてFGF−2(5ng/ml)を含む無血清DMEM培地と、ヒト血漿(容積比4%)とを加えて作製したゲル状の細胞移植用組成物内を用いて、ヒト皮膚線維芽細胞及びヒト皮膚毛細血管内皮細胞に対する体外3次元培養増幅を実施した。
【0067】
図7(a)に示すように、24ウエル組織培養プレートに、約50,000のヒト皮膚線維芽細胞を作製した細胞移植用組成物内に加えて播種し、5日間体外3次元培養を行った(図中「■」)。比較対象として、比較対象として、FGF−2(5ng/ml)のみを含むヒト血漿(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血漿(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血漿(容積比4%)DMEM(図中「●」)を3次元培養ネガティブコントロールとし、5日間の細胞増殖を比較した。
また、他の比較対象として、図7(b)に示すように、LH/P MPs及びFGF−2を含む無血清DMEM培地においてヒト血漿に代えてヒト血清(容積比4%)を加えたDMEM(図中「■」)、FGF−2(5ng/ml)のみを含むヒト血清(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血清(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血清(容積比10%)DMEM(図中「○」)、ヒト血清(容積比4%)DMEM(図中「●」)を用いて、上記ヒト皮膚線維芽細胞を体外2次元培養し、5日間の細胞増殖を比較した。なお、各図中の縦軸は、細胞増幅(Cell growth )を示す。
【0068】
図8(a)は、ヒト皮膚線維芽細胞について上記作製した細胞移植用組成物内での体外3次元培養の培養3日目の顕微鏡写真であり、図8(b)はLH/P MPs、FGF−2及びヒト血清(容積比4%)を加えた2次元培養の培養3日目の顕微鏡写真である。
【0069】
図9(a)に示すように、24ウエル組織培養プレートに、約50,000のヒト皮膚毛細血管内皮細胞を作製した細胞移植用組成物内に加えて播種し、5日間体外3次元培養を行った(図中「■」)。比較対象として、比較対象として、FGF−2(5ng/ml)のみを含むヒト血漿(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血漿(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血漿(容積比4%)DMEM(図中「●」)を3次元培養ネガティブコントロールとし、5日間の細胞増殖を比較した。
また、他の比較対象として、図9(b)に示すように、LH/P MPs及びFGF−2を含む無血清DMEM培地においてヒト血漿に代えてヒト血清(容積比4%)を加えたDMEM(図中「■」)、FGF−2(5ng/ml)のみを含むヒト血清(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血清(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血清(容積比10%)DMEM(図中「○」)、ヒト血清(容積比4%)DMEM(図中「●」)を用いて、上記ヒト皮膚毛細血管内皮細胞を体外2次元培養し、5日間の細胞増殖を比較した。なお、各図中の縦軸は、細胞増幅(Cell growth )を示す。
【0070】
図10(a)は、ヒト皮膚毛細血管内皮細胞について上記作製した細胞移植用組成物内での体外3次元培養の培養3日目の顕微鏡写真であり、図4(b)はLH/P MPs、FGF−2及びヒト血清(容積比4%)を加えた2次元培養の培養3日目の顕微鏡写真である。
【0071】
なお、本実施例では、細胞培養後の細胞移植用組成物に対し、トリプシン・EDTA溶液で10分以内に溶解してその中の増殖細胞を分雛し、血球計測器を用いて細胞数を計測した。
【0072】
図7〜10に示すように、比較結果として、両細胞ともLH/P MPs及びFGF−2を含む無血清DMEM培地にヒト血漿(容積比4%)を加えた本発明の細胞移植用組成物内において最大の細胞増殖を示した。
【0073】
[実施例5]
作製したLH/P MPs(0.1mg/ml)と、1/4濃度のSCF(5ng/ml)・TPO(10ng/ml)・Flt−3ligand(10ng/ml)の造血細胞増幅用サイトカインを含む無血清HPGMと、ヒト血漿(容積比4%)とを加えて作製したゲル状の細胞移植用組成物内を用いて、ヒト骨髄由来CD34陽性造血系前駆体細胞の3次元培養を実施した。
【0074】
図11に示すように、上記細胞移植用組成物を用いてヒト骨髄由来CD34陽性造血系前駆体細胞について10日間体外3次元培養を行った(図中「◆」)。比較対象として、ヒト血漿(HP:2%)を含む無血清HPGMからなる培地・血漿ゲル(図中「■」) 、LH/P MPs(0.1mg/ml)及びHPを含む無血清HPGMからなる培地・血漿ゲル(図中「△」)、SCF(1/4X;5ng/ml)・TPO(1/4X;10ng/ml)・Flt−3 ligand(1/4X;10ng/ml)とヒト血漿を含む無血清HPGMからなる培地・血漿ゲル内(図中「▲」)を3次元培養ネガティブコントロールとし、10日間の細胞増殖を比較した。
また、他の比較対象として、SCF(1X;20ng/ml)・TPO(1X;40ng/ml・Flt−3 ligand(1X;40ng/ml)のみを含んだHPGM(図中「○」)、SFC(1/4X)・TPO(1/4X)・Flt−3 ligand(1/4X)のみを含んだHPGM(図中「●」)、LH/P MPsと、SFC(1/4X)・TPO(1/4X)・Flt−3 ligand(1/4X)のみを含んだHPGM(図中「□」)を体外2次元培養し、10日間の細胞増殖を比較した。なお、各図中の縦軸は、細胞増幅(Cell growth )を示す。
【0075】
また、図12に示すように、上記細部移植用組成物内で増殖中のヒト骨髄由来CD34陽性造血系前駆体細胞における0、4、10日目にCD34陽性率をPEラベルヒート抗CD34(BD Biosciences Pharmigen, USA )を用いてEPICSRXL(Beckman Coulter, USA)によりフローサイトメトリーの計測結果である。図中「黒」は、LH/P MPs(0.1mg/ml)とSFC(1/4X;5ng/ml)・TPO(1/4X;10ng/ml)・Flt−3 ligand(1/4X;10ng/ml)を含む無血清HPGMと、ヒト血漿(容積比3%)からなる細胞移植用組成物の3次元培養の結果であり、図中「灰色」は、LH/P MPs(0.1mg/ml)とSFC(1/4X;5ng/ml)・TPO(1/4X;10ng/ml)・Flt−3 ligand(1/4X;10ng/ml)を含む無血清HPGMと、ヒト血清(容積比3%)からなる培地・血漿ゲルの2次元培養の結果であり、図中「白」は、コントロールとしてSFC(1/4X;5ng/ml)・TPO(1/4X;10ng/ml)・Flt−3 ligand(1/4X;10ng/ml)のみを含む無血清HPGMの体外2次元培養の結果である。
【0076】
図13(a)はヒト骨髄由来CD34陽性造血系前駆体細胞について上記細胞移植用組成物内での体外3次元培養の培養6日目の電子顕微鏡写真であり、図13(b)はヒト骨髄由来CD34陽性造血系前駆体細胞についてヒト血清(容積比4%)を含む培地による2次元培養の培養6日目の電子顕微鏡写真である。
【0077】
図11〜13に示すように、本発明に係る細胞移植用組成物を用いた3次元細胞培養方法によるヒト骨髄由来CD34陽性造血系前駆体細胞の培養では、ヒト骨髄由来CD34陽性造血系前駆体細胞のコロニー形成を促進して最適な3次元増幅が行え、ヒト血漿に代えて等量の血清を添加した同じ培地を用いた2次元培養よりも有意に高い増殖率を得ることができた。また、3次元細胞培養方法で増幅させたヒト骨髄由来CD34陽性造血系前駆体細胞は、同じ培地に等量の同種血清を添加した2次元培養よりも有意に高いCD34陽性率を維持した。
【0078】
[実施例6]
作製したLH/P MPs(0.1mg/ml)に、サイトカインとしてIL−3(5ng/ml)・GM−CSF(5ng/ml)を含む無血清DMEMにヒト血漿(容積比4%)を加えて作製したゲル状の細胞移植用組成物内を用いて、ヒトTF−1細胞の3次元培養を実施した。
【0079】
図14に示すように、上記細胞移植用組成物を用いてヒトTF−1細胞について10日間3次元培養を行った(図中「◆」)。比較対象として、ヒト血漿(HP:2%)を含む無血清DMEMからなる培地・血漿ゲル(図中「■」) 、LH/P MPs(0.1mg/ml)及びHPを含む無血清DMEMからなる培地・血漿ゲル(図中「△」)、IL−3(5ng/ml)・GM−CSF(5ng/ml)とヒト血漿を含む無血清DMEMからなる培地・血漿ゲル内(図中「▲」)を3次元培養ネガティブコントロールとし、3日間の細胞増殖を比較した。
また、他の比較対象として、10%ヒト血清(HS)のみを含んだDMEM(図中「○」)、IL−3(5ng/ml)・GM−CSF(5ng/ml)のみを含んだ無血清DMEM(図中「●」)、10%HS及びIL−3(5ng/ml)・GM−CSF(5ng/ml)のみを含んだDMEM(図中「□」)を体外2次元培養し、3日間の細胞増殖を比較した。なお、各図中の縦軸は、細胞増幅(Cell growth )を示す。
【0080】
図15(a)はヒトTF−1細胞について上記細胞移植用組成物内での体外3次元培養の培養2日目の電子顕微鏡写真であり、図15(b)はヒトTF−1細胞についてヒト血清(容積比4%)を含む培地による2次元培養の培養2日目の電子顕微鏡写真である。
【0081】
図14、15に示すように、本発明に係る細胞移植用組成物を用いた3次元細胞培養方法によるヒトTF−1細胞の培養では、ヒトTF−1細胞のコロニー形成を促進して最適な3次元増幅が行え、ヒト血漿に代えて等量の血清を添加した同じ培地を用いた2次元培養よりも有意に高い増殖率を得ることができた。
【0082】
[実施例7]
ヒト肝癌細胞株(Huh7:500,000cells 及びHuh7:5, 000, 000cells )を、LH/P MPs(5mg/ml)及びFGF−2(10μg/ml)を含む無血清DMEMにヒト血漿(容積比5%)を加えて作製した細胞用移植用組成物に添加し、ヌードマウス皮下へ200μl投与した異種腫瘍細胞移植実験を実施した。比較対象として、LH/P MPs(5mg/ml)を腫瘍細胞浮遊液に加えた移植した(図中「+LH/P MPs」)。また、FGF−2(10μg/ml)を腫瘍細胞浮遊液に加えた移植した(図中「+FGF−2」)。さらに、ヒト血漿(容積比5%)を腫瘍細胞浮遊液に加えた移植した(図中「+HP」)。また、ヒト血漿(容積比5%)及びLH/P MPs(5mg/ml)を腫瘍細胞浮遊液に加え移植した(図中「+HP+LH/P MPs」)。さらに、ヒト血漿(容積比5%)とLH/P MPs(5mg/ml)とFGF−2(10μg/ml)を腫瘍細胞浮遊液に加え移植した(図中「+HP+LH/P MPs+FGF−2」)。コントロールとして、上記腫瘍細胞を生理食塩水に浮遊させ移植した(図中「Control」)。
なお、腫傷サイズは、経時的に小型ノギスを用いて、縦・横・高さを測定し算出し、縦軸は成長した腫瘍容量(cm3 )を示す。
【0083】
図16(a)に示すように、Huh7細胞のみと、Huh7細胞+FGF−2投与群では、腫傷の生着及び成長は観察されなかったが、Huh7細胞を添加した上記細胞移植用組成物のヌードマウス皮下へ投与では、最適な生着及び腫傷成長を認められた。また、図16(b)に示すように、Huh7細胞(5, 000, 000cells /200μl)の移植実験では、コントロールでも細胞の生着は認められるものの、Huh7細胞を添加した上記細胞移植用組成物のヌードマウス皮下へ投与は、最適な腫癌成長を認められた。
【0084】
[実施例8]
本発明による3次元細胞培養方法により増幅させたマウス骨髄由来CD34陽性造血系前駆体細胞を含んだ細胞移植用組成物をX線照射により骨髄死を引き起こしたマウスの骨内へ投与した。その結果、末梢血での白血球や血小板の有意に高い回復が観察され、優れた骨内造血系前駆体細胞移植のための運搬システムとして適用の可能性が示された。
【産業上の利用可能性】
【0085】
本発明は、用途に応じて任意に選択される接着性細胞や造血系浮遊細胞等の各種細胞と、安全性が確認されている低分子へパリンとプロタミンとから構成される平均粒径が0.1μm〜5μm未満のLH/P MPsと、適切なサイトカイン、培地及びヒト血漿を含んでなるゲル状の細胞移植用組成物を用いた3次元細胞培養方法により、特にCD34陽性造血系前駆体細胞の体外大量増幅システムとしての有用性が極めて高い。また、細胞移植用組成物は、注射器やカテーテル等を介して、生体局所に投与する医療用途へ安定的に供給する細胞運搬法として適用することができる。
【0086】
さらに、血漿中に含まれる生理活性物質を安定に保持し、目的部位で担持した活性分子を徐放できるドラッグデリバリー用薬物包接担体としても使用できる。また、ヌードマウス等に局所注入した細胞移植用組成物内で癌細胞等の腫瘍細胞を担持した状態で効率よく増幅させることができるため、抗ガン剤等の新薬の開発に大きく貢献できる。そして、ヒト自己骨髄間葉系幹細胞或いは自己脂肪組織由来間葉系細胞に本細胞デリバリー担体を適用することで、美容形成外科領域の育毛剤及び雛取り等美容形成治療法への適用に加え、血管新生促進製剤、皮膚等の難治性創傷治癒促進剤として、さらには他の細胞導入を伴う再生医療への応用が可能となる。
【技術分野】
【0001】
本発明は、マイクロ粒子と血漿添加による各種体性多能性細胞の細胞培養方法及び細胞移植用組成物に係り、詳細には低分子ヘパリンとプロタミンとから構成されるマイクロ粒子と、細胞増殖又は分化誘導を促進させるサイトカインと、血漿添加によるゲル化培地を用いた接着性細胞及び造血系浮遊細胞等の体外3次元細胞培養方法及び再生医療等に用いられる細胞移植用組成物に関するものである。
【背景技術】
【0002】
相応する電荷を有する高分子間静電反応により生じる多重電解質複合体は、電荷を帯びた生体高分子の生体内挙動の研究モデルとなる。さらに、ユニークな組成や構造からなる多重電解質複合体は、可溶性ナノ粒子の形成、複合化マイクロ粒子の形成(コアセルベーション)、非結晶性沈殿物等を形成し、バイオテクノロジーや医学の分野での適用が可能である。例えば、タンパク質と核酸よりなる複合体形成は転写過程に影響を及ぼすと考えられる。また、低分子ヘパリン/プロタミン マイクロ粒子(LH/P MPs)に加えて、DNA・キトサン複合体マイクロ(ナノ)粒子がそれぞれ遺伝子キャリア及び薬剤キャリアとして記述された。
【0003】
ところで、骨髄や脂肪組織を含んだ多くを生体組織には、組織の維持や修復のため多分化能を保持した前駆体細胞である生体幹細胞が含まれていることが知られている。特に骨髄細胞は造血系幹細胞や間葉系幹細胞を含み、各種血液細胞のみならず、皮膚、骨、軟骨、血管、筋肉の細胞に分化しそれぞれの組織再生を促進する。同様に、脂肪組織由来間葉系細胞も皮膚、骨、軟骨、血管、筋肉の細胞に分化することが知られており、人において豊富な幹細胞資源となる脂肪組織に大きな注目が集まっている。
【0004】
しかしながら、各種体性幹細胞や前駆体細胞の収率は低く、培養には高濃度(10%以上)の異種動物の血清、フィーダー細胞、そしてコラーゲンや腫瘍生成基底膜であるマトリゲルをマトリックスとして使用する必要があり、ウィルスや未知病原体による感染及び抗原性付与の問題が避けられない。よって、上記体性幹細胞や前駆体細胞を効率的、且つ安全に異種動物の血清培地、フィーダー細胞、そしてコラーゲンやマトリゲルを使用しないマトリックス内で増殖させる培養法が求められている。さらに再生医療における細胞移植には、生体内でのその生着性及び増殖性を高める有効な細胞キャリアを併用する必要がある。
【0005】
ところで、血液を凝固させ血小板や血液凝固因子(フィブリノーゲン等) を除いたものが血清(serum) であり、血漿は抗凝固剤(クエン酸等)入りの採血管を用いて採血した血液を遠心分離して細胞成分(赤血球や白血球)を除いたものが血小板を含んだ血漿(プラズマ) である。この血漿を添加した培地は、混合後10分以内に室温で容易にゲル化することが見出されている。
【0006】
そこで、近年では、血漿の添加によるゲル化に着目した血漿ゲル(Plasma gel)は、細胞増殖及び分化誘導を促進する様々な増殖因子やサイトカイン等の生理活性物質を含有し運搬する血小板を多く含み、再生医療等多くの分野で様々な応用研究が進められている。
【0007】
これらの血小板に運搬される生理活性物質は、血小板由来増殖因子(PDGFs)、線維芽増殖因子(FGFs)、肝細胞増殖因子(HGF)、トランスフォーミング増殖因子(TGFs)、血管内皮増殖因子(VEGFs)等20を超え、これらのほとんどはヘパリン結合性であることが知られている。さらに、形成外科の分野でも創傷治癒、変形の改善(含雛取り)、育毛等幅広い臨床応用が期待されており、また血管新生療法や再生医療等の臨床の場でも既に適用されているが、その効果はさほど高くないのが現状である。
【0008】
このように各分野において、血漿ゲルの有効性をさらに高めるため、貴重な患者本人の血液製剤である血漿に含有されている生理活性物質の活性を維持したまま、より有効に局所に保持、徐放が可能な、安全な薬剤キャリアの出現が求められていた。
【0009】
そこで、本発明者等は、鋭意研究の結果、低分子へパリン(LH)とプロタミン(P)との組み合わせを用いることにより、簡便に平均粒径1.5μm程度(0.5μm以上3μm未満)から、さらには平均粒径100nmの微粒子を作成でき、得られた微粒子をコートしたプレートが徐放性の薬物包接或いは細胞接着マトリックスとして使用できることを見出した(詳細は、特許文献1及び非特許文献1〜5を参照)。
【0010】
すなわち、このLH/P MPs−コートマトリックスが、塩基性線維芽細胞増殖因子(FGF)−2及び血小板に含まれる様々なヘパリン結合性増殖因子やサイトカイン等の生理活性物質を吸着してそれらの活性を保護し、徐放するマトリックスとして有効であること、また上記LH/P MPsに吸着・保護され活性を保持した生理活性物質が、生体内で生理活性物質含有LH/P MPs複合体の生分解に伴い周辺部位へ徐放され、生体局所での血管新生や肉芽形成の促進に寄与することを実証した。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2011−219428号公報
【非特許文献】
【0012】
【非特許文献1】Journal of Controlled Release, Cytokine-immobilized microparticle-coated plates for culturing hematopoietic progenitor cells. 133, 185-190, 2009.
【非特許文献2】International Journal of Nanomedicine, Preparation and characterization of low-molecular-weight heparin/protamine nanoparticles (LMW-H/P NPs) as FGF-2 carrier. 5, 147-155, 2010.
【非特許文献3】Artificial Organs, Fragmin/protamine microparticle-coated matrix immobilized cytokines to stimulate various cell proliferation with low serum media. 33, 431-438, 2009.
【非特許文献4】Journal of Biomedical Materials Research (Part B), Enhancement of vascularization and granulation tissue formation by growth factors in human platelet-rich plasma-containing fragmin/protamine microparticles. 97B, 373-380, 2011.
【非特許文献5】Journal of Biomedical Materials Research (Part A), Controlled release of FGF-2 using fragmin/protamine microparticles and effect on neovascularization. 91A, 814-823, 2009.
【発明の概要】
【発明が解決しようとする課題】
【0013】
ところで、近年ヒトや動物の細胞を生体外で培養し増幅及び分化誘導を行い、その機能を利用して人工臓器や人工組織として利用する研究が活発に行なわれている。しかしながら、各種細胞の中でも、特に再生医療での移植用細胞として需要の大きい骨髄及び脂肪組織由来の間葉系幹細胞については、ウィルスや未知病原体による感染、抗原性付与の問題を有する異種動物の血清、フィーダー細胞、そしてコラーゲンやマトリゲル等のマトリックスとしての使用を排除し、多分化能を維持したまま安全に増幅する培養法が未だ確立されていない。
【0014】
特に、造血系前駆体細胞或いは血管内皮前駆体細胞として機能することが知られているCD34陽性造血系前駆体細胞についての体外増幅についての確立された方法はなく、その需要に比して採取できる量が非常に少ないため、成人に移植することが困難となっていた。従って、安全性や安定した供給等の問題点から異種動物の血清、フィーダー細胞、そしてコラーゲンやマトリゲル等のマトリックスとしての使用を排除した体外大量増幅システムの開発が必要である。
【0015】
さらに細胞移植は、細胞の有する脆弱性や分散性により、必要な場所に有効に移植細胞を生着、増殖させることに困難を極めているのが現状であり、安全で有効な細胞運搬システムの出現が求められている。
【0016】
そこで、本発明は上記問題点に鑑みてなされたものであり、骨髄由来間葉系幹細胞や脂肪組織由来間葉系細胞、CD34陽性造血系前駆体細胞、植皮用皮膚構築に不可欠な線維芽細胞、末梢血流障害の治療に応用が期待される血管内皮細胞等の再生医療に必要な接着性細胞又は造血系浮遊細胞を高い増殖率で培養することができ、且つ人体に対する安全性が高く、さらには生体内での生着性及び細胞生存性を顕著に高めた3次元細胞培養方法及び細胞移植用組成物を提供することを目的とするものである。
【課題を解決するための手段】
【0017】
上記した目的を達成するため、請求項1記載の3次元細胞培養方法は、再生医療に用いる間葉系幹細胞や腫瘍細胞を含む接着性細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記接着性細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物内で前記接着性細胞の培養を行うことを特徴とする。
【0018】
請求項2記載の細胞移植用組成物は、再生医療に用いる間葉系幹細胞や腫瘍細胞を含む接着性細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記接着性細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物であることを特徴とする。
【0019】
請求項3記載の3次元細胞培養方法は、再生医療に用いるCD34陽性造血系前駆体細胞を含む造血系浮遊細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記造血系浮遊細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物内で前記造血系浮遊細胞の培養を行うことを特徴とする。
【0020】
請求項4記載の細胞移植用組成物は、再生医療に用いるCD34陽性造血系前駆体細胞を含む造血系浮遊細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記造血系浮遊細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物であることを特徴とする。
【発明の効果】
【0021】
本発明によれば、再生医療に用いられる接着性細胞や造血系浮遊細胞と、低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、使用する細胞の用途に応じて任意に選択されるサイトカインと、容積比0.5〜25%のヒト血漿とで構成されるゲル状の細胞移植用組成物を用いるため、細針を装着したシリンジでも注入可能となる。
【0022】
また、局所への移植後、適度な粘稠性により注入箇所に留まり、また各種接着性細胞や各種造血系浮遊細胞の分散を限定するとともに、生着性、増殖性及び多分化能に優れた局所細胞移植のための運搬システムとして適用することができる。
【図面の簡単な説明】
【0023】
【図1】(a)は本発明に係る細胞移植用組成物によるヒト脂肪組織由来間葉系細胞の3次元細胞培養時における細胞増幅結果を示すグラフであり、(b)は比較用組成物によるヒト脂肪組織由来間葉系幹細胞の2次元細胞培養時における細胞増幅結果を示すグラフである
【図2】(a)は本発明に係る細胞移植用組成物を用いて体外3次元培養により増幅したヒト脂肪組織由来間葉系細胞の電子顕微鏡写真であり、(b)は比較組成物を用いて2次元細胞培養により増幅したヒト脂肪組織由来間葉系細胞の電子顕微鏡写真である。
【図3】(a)は本発明に係る細胞移植用組成物によるヒト骨髄由来間葉系幹細胞の3次元細胞培養時における細胞増幅結果を示すグラフであり、(b)は比較用組成物によるヒト骨髄由来間葉系幹細胞の2次元細胞培養時における細胞増幅結果を示すグラフである。
【図4】(a)は本発明に係る細胞移植用組成物を用いて体外3次元培養により増幅したヒト骨髄由来間葉系幹細胞の電子顕微鏡写真であり、(b)は比較組成物を用いて2次元細胞培養により増幅したヒト骨髄由来間葉系幹細胞の電子顕微鏡写真である。
【図5】(a)は本発明に係る細胞移植用組成物を用いたヒト骨髄由来間葉系幹細胞の脂肪細胞への分化誘導による分化能を示す写真であり、(b)は本発明に係る細胞移植用組成物を用いたヒト脂肪組織由来間葉系細胞の脂肪細胞への分化誘導による分化能を示す写真である。
【図6】(a)は本発明に係る細胞移植用組成物を用いたヒト骨髄由来間葉系幹細胞の骨芽細胞への分化誘導による分化能を示す写真であり、(b)は本発明に係る細胞移植用組成物を用いたヒト脂肪組織由来間葉系細胞の骨芽細胞への分化誘導による分化能を示す写真である。
【図7】(a)は本発明に係る細胞移植用組成物によるヒト皮膚線維芽細胞の3次元細胞培養時における細胞増幅結果を示すグラフであり、(b)は比較用組成物によるヒト皮膚線維芽細胞の2次元細胞培養時における細胞増幅結果を示すグラフである。
【図8】(a)は本発明に係る細胞移植用組成物を用いて体外3次元培養により増幅したヒト皮膚線維芽細胞の電子顕微鏡写真であり、(b)は比較組成物を用いて2次元細胞培養により増幅したヒト皮膚線維芽細胞の電子顕微鏡写真である。
【図9】(a)は本発明に係る細胞移植用組成物によるヒト皮膚毛細血管内皮細胞の3次元細胞培養時における細胞増幅結果を示すグラフであり、(b)は比較用組成物によるヒト皮膚毛細血管内皮細胞の2次元細胞培養時における細胞増幅結果を示すグラフである。
【図10】(a)は本発明に係る細胞移植用組成物を用いて体外3次元培養により増幅したヒト皮膚毛細血管内皮細胞の電子顕微鏡写真であり、(b)は比較組成物を用いて2次元細胞培養により増幅したヒト皮膚毛細血管内皮細胞の電子顕微鏡写真である。
【図11】本発明に係る細胞移植用組成物によるヒト骨髄由来CD34陽性造血系前駆体細胞の3次元細胞培養時における細胞増幅結果を示すグラフである。
【図12】本発明の細胞移植用組成物により増殖中のヒト骨髄由来CD34陽性造血系前駆体細胞のフローサイトメトリーによるCD34陽性率を示すグラフである。
【図13】(a)は本発明に係る細胞移植用組成物を用いて体外3次元培養により増幅したヒト骨髄由来CD34陽性造血系前駆体細胞の電子顕微鏡写真であり、(b)は比較組成物を用いて2次元細胞培養により増幅したヒト骨髄由来CD34陽性造血系前駆体細胞の電子顕微鏡写真である。
【図14】本発明に係る細胞移植用組成物によるヒトTF−1細胞の3次元細胞培養時における細胞増幅結果を示すグラフである。
【図15】(a)は本発明に係る細胞移植用組成物を用いて体外3次元培養により増幅したヒトTF−1細胞の電子顕微鏡写真である(b)は比較組成物を用いて2次元細胞培養により増幅したヒトTF−1細胞の電子顕微鏡写真である。
【図16】(a)は本発明に係る細胞移植用組成物で培養した肝癌細胞株をヌードマウス皮下へ投与した際の該細胞における腫傷サイズを比較したグラフであり、(b)は図16(a)における肝癌細胞株の細胞数を変更して培養したものをヌードマウス皮下へ投与した際の該細胞における腫瘍サイズを比較したグラフである。
【発明を実施するための形態】
【0024】
以下、本発明を実施するための形態について、添付した図面を参照しながら詳細に説明する。また、この実施の形態によりこの発明が限定されるものではなく、この形態に基づいて当業者などによりなされる実施可能な他の形態、実施例及び運用技術などはすべて本発明の範疇に含まれる。
【0025】
本発明に係る3次元細胞培養方法は、再生医療に用いられる各種細胞(接着性細胞又は造血系浮遊細胞、より好ましくは移植対象となる患者の自己細胞)と、低分子ヘパリンとプロタミンから構成されるLH/P MPsと、同種血漿(好ましくは自己血漿)及び用途に応じて適宜選択される適切なサイトカインを含有した培地からなる血漿ゲルと、で構成されている。
【0026】
再生医療に用いられる細胞としては、「接着性細胞」と「造血系浮遊細胞」とに大別される。
「接着性細胞」としては、例えばヒト脂肪組織由来間葉系細胞やヒト骨髄由来間葉系幹細胞等の種々の間葉系幹細胞及び血管内皮細胞及びその前駆体細胞、線維芽細胞及びその前駆体細胞、血管内皮細胞及びその前駆体細胞、肝実質細胞及びその前駆体細胞、滕β細胞及びその前駆体細胞、平滑筋細胞及びその前駆体細胞、軟骨細胞及びその前駆体細胞、筋芽細胞、骨芽細胞、癌細胞等の種々の腫瘍細胞(例えばヒト肝癌細胞株(Huh7))がある。
また、「造血系浮遊細胞」としては、例えばヒト赤血白血病細胞(TF−1)やヒト骨髄由来CD34造血系前駆体細胞等の種々の造血系前駆体細胞、胚性幹細胞(Embryonic stem cells:ES細胞) 、人工多能性幹細胞(Induced pluripotent stem cells:iPS細胞)等がある。
なお、上記各種細胞は、用途に応じて適宜選択又は任意に組み合わせて使用することができる。
【0027】
低分子ヘパリン/プロタミン マイクロ粒子(LH/P MPs)は、低分子ヘパリンとプロタミンとを含むマイクロ粒子である。本発明で用いられる低分子ヘパリンは、一般に天然ヘパリン(分子量15000〜20000Da程度)を解重合して得られる低分子量のヘパリンである。その平均分子量の上限は、プロタミンと混合することにより微粒子を形成できる程度のものであればよく、一般的には10000、好ましくは9000、より好ましくは8000、さらに好ましくは6000であり、数平均分子量の下限は、通常は1000、好ましくは3000、より好ましくは4000である。
【0028】
なお、数平均分子量において通常(天然)のヘパリンと区別できれば十分であり、例えば、10000以上、或いは20000以上の分子量を持つ分画を含んでいても、全体として平均分子量が約10000未満であれば本発明における低分子ヘパリンとして使用できる。本発明では、ヘパリンの平均分子量として、分子量が既知の標準物質を用いたゲル浸透クロマトグラフィー法によって測定される数平均分子量を用いる。
【0029】
例えば、ブタの小腸粘膜由来のヘパリンを亜硝酸分解して得られる解重合ヘパリン(ダルテパリン)は、フラグミン(商品名)として市販されており、4000〜6000の平均分子量を有する。同様に、ブタの小腸粘膜由来のヘパリンを亜硝酸分解して得られる解重合ヘパリン(レビパリン)はローモリン(商品名)として市販されている。また、ウシ又はブタ腸粘膜由来のヘパリンを過酸化水素と酢酸第二銅により分解して得られる解重合ヘパリン(パルナパリン)は、ローヘパ(商品名)として市販されており、これらは何れも本発明における低分子ヘパリンとして使用できる。
【0030】
ヘパリンは単独では抗凝固作用を持たず、血漿中のATIII と結合することによってその作用を発揮し、第IIa 因子、第XIIa因子、第XIa 因子、第Xa因子、第IXa 因子などの凝固系酵素を阻害、不活化する。一方、本発明で使用する低分子ヘパリンは抗第XIIa、抗第Xa因子活性を持つものの、第IIa 因子、第XIa 因子、第IXa 因子に対する阻害活性は軽微であることが医薬品として明らかにされているので、創傷部位に注入しても当該部位における出血傾向を助長することなく使用できる。
【0031】
低分子ヘパリンとしては、上記の市販されているものを使用してもよいし、或いは、過ヨウ素酸酸化により低分子化したヘパリンや、特異的脱硫酸化ヘパリンなども好適に用いることができる。このような低分子量のヘパリンを使用することにより、プロタミンと混合した際に好適な微粒子を得ることができる。
【0032】
本発明で用いるプロタミンは、動物の精子の核中でDNAと結合して存在する塩基性の高いタンパク質として知られている。一般的には、27〜65残基からなる低分子量タンパク質であり、アミノ酸の40〜70%をアルギニンが占めると言われている。プロタミンも医薬品として市販されており、本発明では市販のプロタミンをそのまま使用することができる。
【0033】
本発明の好適態様では、低分子ヘパリン溶液にプロタミン溶液を滴下して低分子ヘパリンとプロタミンとを含む粒子を生成させる。例えば、ダルテパリン等の低分子ヘパリンの水溶液に、プロタミン水溶液を後述する割合になるよう滴下し、ボルテックスなどでさらに攪拌することによって粒子を得る。低分子ヘパリンおよびプロタミンの濃度は各々設定することができ、好適にはそれぞれ0.01〜30mg/mlである。このとき、低分子ヘパリンおよびプロタミンの濃度を調節することによって、得られる粒子のサイズを制御することができる。
【0034】
例えば、低分子ヘパリンおよびプロタミンの濃度がそれぞれ1〜20mg/ml程度の溶液を用いると、0.5〜10μm程度の平均粒子径をもつ粒子を得ることができ、低分子ヘパリンおよびプロタミンの濃度がそれぞれ0.05〜0.5mg/ml程度の溶液を用いると、50〜200nm程度の平均粒子径をもつ粒子を得ることができる。
【0035】
低分子ヘパリンとプロタミンとの混合重量比については、プロタミンに対する低分子ヘパリンの重量を等量、或いはやや過剰することが、粒子の収率向上の点で好ましく、過剰なプロタミンの存在は不溶性のペースト状沈殿物が生成する懸念がある。従って、低分子ヘパリンの溶液にプロタミンの溶液を滴下する場合には、滴下後の溶液内における低分子ヘパリン/プロタミンの重量比は、好ましくは1/1〜5/1であり、より好ましくは1/1〜2/1である。
【0036】
すなわち、上記低分子ヘパリン溶液に含まれる低分子ヘパリン1重量部に対して、好ましくは0.2〜1重量部、より好ましくは0.5〜1重量部のプロタミンが添加されるようにプロタミン溶液が滴下される。
【0037】
このように作成されたLH/P MPsは、血漿中に含まれる多くのへパリン結合性増殖因子やサイトカイン等生理活性物質を担持することができ、担持された生理活性物質を熱やトリプシン等タンパク質分解酵素による不活化要因から保護して活性を維持延長することができ、さらに骨髄や脂肪組織由来の間葉系幹細胞等様々な接着性細胞の表面に接合し、細胞凝集体(スフェロイド)を形成する。
【0038】
ヒト血漿は、健常ボランティアから0.1〜8m1の2%クエン酸溶液の入った採血管に血液を採血し、所定条件(例えば、15分間、1700rpm(Table Top 冷却遠心機 2800,ローター:RS 240,クボタ))で遠心し、生じた3つの層、底部の赤(白)血球画分、赤(白)血球画分から上部(1cm)を多血小板血漿(Platelet Rich Plasma :PRP)画分、さらに上部を少血小板血漿(Platelet Poor Plasma :PPP)として採取し、PRPとPPPを合わせたものである。
【0039】
なお、本発明では、採血した血液の有効利用とゲル形成効率の観点から培地・血漿ゲル化剤としてヒト血漿を使用したが、血小板とともにそこに包含されたサイトカインが濃縮されているPRP或いは血漿ゲル化に優れたPPPの用途別使用も可能である。また、安全性の面からヒトへの臨床適用には、自己(autogenous)血漿の使用が望ましい。
【0040】
サイトカインとしては、一例としてインターロイキン(Interleukin :IL)、幹細胞因子(Stem cell factor:SCF)、上皮増殖因子(Epidermal Growth Factor :EGF)、線維芽細胞増殖因子(Fibroblast Growth Factor:FGF)、塩基性線維芽細胞増殖因子(basic fibroblast growth factor:FGF−2)、血小板由来増殖因子(Platelet-Derived Growth Factor:PDGF)、肝細胞増殖因子(Hepatocyto Growth Factor:HGF)、トランスフォーミング増殖因子(Transforming growth factor:TGF)、トロンボポエチン(Thrombopoietin:TPO)、コロニー刺激因子(Coloney-Stimulating Factor:CSF)、顆粒球コロニー刺激因子(Granulocyte-Coloney-Stimulating Factor:G−CSF)、顆粒球マクロファージコロニー刺激因子(Granulocyte-macrophage-colony stimulating factor:GM−CSF)、FLt3−ligand(Human Fms-related tyrosin kinase 3 ligand )等があり、使用する接着性細胞又は造血系浮遊細胞に応じて任意に選択して添加する。
【0041】
培地としては、用途に応じて選択された各種細胞に適切なサイトカインに応じて選択される細胞培養培地として、例えばDMEM(Dulbecco's Modified Eagle Medium)、HPGM(Hematopoietic Progenitor Growth Medium)等を使用する。
【0042】
本発明の細胞移植用組成物におけるゲル化の条件としては、血小板及び血液凝固因子(フィブリノーゲン等)を含めた血漿を用いているため、採血時に採血管に入れる抗凝固剤としてのクエン酸(2%液)を採血量に対して1〜2%に制限、或いは添加するLH/P MPsを0.2mg/ml以下に制限することによって適度な粘稠性を有するとともに増殖した細胞の分散性を限定し、生着性及び増殖性に優れた組成物を得ることができる。 なお、このゲル化メカニズムは、人体が怪我をしたときに出血した血液が凝固(ゲル化)する血液凝固作用と同一である。
【0043】
以上説明したように、本発明の細胞移植用組成物は、適切なサイトカイン及びLH/P MPsを添加した血漿(より好ましく自己血漿)からなるゲル状を成しているため、接着性或いは造血性浮遊性細胞に対して、安全性の面で問題のある異種動物の血清、フィーダー細胞、そしてコラーゲンやマトリゲル等のマトリックスとしての使用を排除し、対象として、骨髄由来間葉系幹細胞及び脂肪組織由来間葉系細胞及び血管内皮細胞及びその前駆体細胞、線維芽細胞及びその前駆体細胞、肝実質細胞及びその前駆体細胞、膵β細胞及びその前駆体細胞、平滑筋細胞及びその前駆体細胞、軟骨細胞及びその前駆体細胞等の接着性・体性細胞全般に有効である。さらに、ヒト骨髄由来CD34陽性造血系前駆体細胞或いはTF−1細胞等の造血系浮遊細胞に加えて、躋帯血や末梢血由来CD34陽性造血系前駆体細胞、骨髄や末梢血中の単核球細胞の選択的増幅及び分化誘導に適切なサイトカインの添加を伴う適応が可能である。
【0044】
また、本発明の細胞増殖用組成物を用いた3次元細胞培養方法は、用途に応じた所望の細胞及びμm〜nmオーダーの微粒子を血漿ゲルに包含させた軟ゲル状の複合体という形態的特徴を有するので、特に注射器やカテーテルなどを介して、容易に体内に注入する細胞運搬用組成物としても機能する。さらに、適度な粘稠性と徐放性を有するため、生体局所に注入した際に、組成物内で3次元的に増殖した状態で局所に組成物を留まらせつつ、サイトカインにより分化・増殖した細胞及び細胞が生成した有効成分を周辺部位に徐放させることができる。
【0045】
また、本発明の細胞増殖用組成物によって増幅させた各種細胞は、トリプシン/EDTA溶液による所定時間(10分以内)溶解することで容易に回収することができる。
【0046】
ところで、上述した形態において、細胞移植用組成物に含有させる細胞は特に制限はないが、本培地・血漿ゲル包接担体に担持されやすく、体内において生着及び増殖が望まれる再生医療に有用な同種移植用細胞(より好ましくは自己細胞)とするのが好ましい。また、異種移植用細胞導入への適用も可能である。例えば、後述する実施例7で示すように、ヒト肝癌細胞(Huh7)を免疫不全マウス(ヌードマウス)に移植する際に、本細胞移植用組成物の使用は、腫癌細胞の生着性・成長性を大きく高めることが確認された。
【0047】
また、本発明の細胞移植用組成物に添加されるサイトカインは、LH/P MPsの構成成分である低分子へパリン又はプロタミンとの親和性が高い薬物、例えばFGF−2等のへパリン結合性増殖因子又はサイトカインから選択される活性物質を含有させるのが好ましい。特に、ヒト血漿は患者自身から採血した血液から調製できるもので、そこに含まれる増殖因子やサイトカインは、殆どがヘパリン結合性であることが知られている。また、本発明の細胞移植用組成物において、使用する媒体としては水性媒体が好ましい。
【0048】
さらに、上述した細胞移植用組成物を用いた3次元細胞培養方法は、ヒト骨髄由来間葉系幹細胞やヒト脂肪組織由来間葉系細胞を含む接着性細胞、TF−1やヒト骨髄由来CD34造血系前駆体細胞を含む造血系浮遊細胞に限定されるものではなく、同種血漿、望ましくは自己血漿を用いることで、例えば躋帯血や末梢血由来CD34陽性造血系前駆体細胞、マウス、ラット、兎等他種動物の骨髄由来間葉系幹細胞及び脂肪組織由来間葉系細胞及び血管内皮細胞及びその前駆体細胞、線維芽細胞及びその前駆体細胞、血管内皮細胞及びその前駆体細胞、肝実質細胞及びその前駆体細胞、肺β細胞及びその前駆体細胞、平滑筋細胞及びその前駆体細胞、軟骨細胞及びその前駆体細胞、筋芽細胞、骨芽細胞等の様々な接着細胞に適切な増殖因子やサイトカイン等の生理活性物質の添加を伴う適応が可能である。
【実施例】
【0049】
以下、本発明による実施例を示す。なお、本発明はこれらの実施例に記載された態様に限定されるわけではなく、前・後記の趣旨に照らし合わせて設計変更することは何れも本発明の技術的範囲に含まれるものである。
【0050】
[低分子ヘパリン/プロタミン マイクロ粒子(LP/P MPs)の作製]
低分子ヘパリンとして、市販のダルテパリンであるフラグミン注射液(商品名)(6.4mg/ml、1000IU/ml、ヘパリンの数平均分子量は約5000、キッセイ薬品工業株式会社)を使用した。この低分子ヘパリン溶液に対して、市販のプロタミン注射液(10mg/ml:持田製薬株式会社) をボルテックスで撹拌しながら7 :3 の容積比になるまで滴下し混合することで得た。
【0051】
[ヒト血漿の採取]
健常ボランティアから0.1〜8m1の2%クエン酸溶液の入った採血管に40mlの血液を採血し、15分間、1700rpm(Table Top 冷却遠心機 2800,ローター:RS 240,クボタ)で遠心した。生じた3つの層、底部の赤(白)血球画分、赤(白)血球画分から上部(1cm)を多血小板血漿(Platelet Rich Plasma :PRP)画分、さらに上部を少血小板血漿(Platelet Poor Plasma :PPP)として採取した。PRPとPPPを合わせたがヒト血漿である。なお、40mlのヒト血液から4〜5mlのPRP、15〜20mlのPPP、20〜24mlのヒト血漿が得られた。PRPの血小板濃度は79.6±10.2×104 /μl、PPPは3.6±0.6×104 /μl、血漿は18.2±3.6×104 /μlであった。
【0052】
[実施例1]
作製したLH/P MPs(0.1mg/ml)と、サイトカインとしてFGF−2(5ng/ml)を含む無血清DMEM培地と、ヒト血漿(容積比4%)とを加えて作製したゲル状の細胞移植用組成物内を用いて、ヒト骨髄由来間葉系幹細胞及びヒト脂肪組織由来間葉系細胞に対する体外3次元培養増幅を実施した。
【0053】
図1(a)に示すように、24ウエル組織培養プレートに、約50,000のヒト骨髄由来間葉系幹細胞を作製した細胞移植用組成物内に加えて播種し、5日間体外3次元培養を行った(図中「■」)。比較対象として、FGF−2(5ng/ml)のみを含むヒト血漿(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血漿(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血漿(容積比4%)DMEM(図中「●」)を3次元培養ネガティブコントロールとし、5日間の細胞増殖を比較した。
また、他の比較対象として、図1(b)に示すように、LH/P MPs及びFGF−2を含む無血清DMEM培地においてヒト血漿に代えてヒト血清(容積比4%)を加えたDMEM(図中「■」)、FGF−2(5ng/ml)のみを含むヒト血清(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血清(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血清(容積比10%)DMEM(図中「○」)、ヒト血清(容積比4%)DMEM(図中「●」)を用いて、上記ヒト骨髄由来間葉系幹細胞を体外2次元培養し、5日間の細胞増殖を比較した。なお、各図中の縦軸は、細胞増幅(Cell growth )を示す。
【0054】
図2(a)は、ヒト骨髄由来間葉系幹細胞について上記作製した細胞移植用組成物内での体外3次元培養の培養3日目の顕微鏡写真であり、図2(b)はLH/P MPs、FGF−2及びヒト血清(容積比4%)を加えた2次元培養の培養3日目の顕微鏡写真である。
【0055】
また、図3(a)に示すように、24ウエル組織培養プレートに、約50,000のヒト脂肪組織由来間葉系細胞を作製した細胞移植用組成物内に加えて播種し、5日間体外3次元培養を行った(図中「■」)。比較対象として、FGF−2(5ng/ml)のみを含むヒト血漿(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血漿(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血漿(容積比4%)DMEM(図中「●」)を3次元培養ネガティブコントロールとし、5日間の細胞増殖を比較した。
また、他の比較対象として、図3(b)に示すように、LH/P MPs及びFGF−2を含む無血清DMEM培地においてヒト血漿に代えてヒト血清(容積比4%)を加えたDMEM(図中「■」)、FGF−2(5ng/ml)のみを含むヒト血清(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血清(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血清(容積比10%)DMEM(図中「○」)、ヒト血清(容積比4%)DMEM(図中「●」)を用いて、上記ヒト脂肪組織由来間葉系細胞を体外2次元培養し、5日間の細胞増殖を比較した。なお、各図中の縦軸は、細胞増幅(Cell growth )を示す。
【0056】
図4(a)は、ヒト脂肪組織由来間葉系細胞について上記作製した細胞移植用組成物内での体外3次元培養の培養3日目の顕微鏡写真であり、図4(b)はLH/P MPs、FGF−2及びヒト血清(容積比4%)を加えた2次元培養の培養3日目の顕微鏡写真である。
【0057】
なお、本実施例では、細胞培養後の細胞移植用組成物に対し、トリプシン・EDTA溶液で10分以内に溶解してその中の増殖細胞を分雛し、血球計測器を用いて細胞数を計測した。
【0058】
図1〜4に示すように、比較結果として、両細胞ともLH/P MPs及びFGF−2を含む無血清DMEM培地にヒト血漿(容積比4%)を加えた本発明の細胞移植用組成物内において最大の細胞増殖を示した。
【0059】
[実施例2]
作製したLH/P MPs(0.1mg/ml)と、FGF−2(5ng/ml)を含む無血清DMEMと、ヒト血漿(容積比4%)とを加えて作製した本発明に係る細胞移植用組成物内で、体外3次元培養増幅させたヒト骨髄由来間葉系幹細胞及びヒト脂肪組織由来間葉系細胞の分化能を確認するため、脂肪細胞への分化誘導を行った。脂肪細胞への分化誘導には市販培地(Lonza Walkersville, Inc., MD)を使用し、両細胞を脂肪細胞誘導培地で4日間、続いて維持培地で3日間培養するサイクルを3回実施した後、両細胞を維持培地でさらに7日間培養した。また、脂肪滴の確認のため、 Oil Red O染色(和光純薬工業(株))を施した。
【0060】
図5(a)は、3次元培養増幅したヒト骨髄由来間葉系幹細胞の脂肪細胞への分化誘導の試験結果であり、48ウエルプレートの最初のP列は、購入細胞の分化誘導、2番目のN列は分化誘導培地を用いず、維持培地のみで培養したもの、3、4番目の−列は、体外2次元培養で増幅した細胞の分化能、5、6番目の+列は体外3次元培養で増幅した細胞を示している。また、図5(b)は、3次元培養増幅したヒト脂肪組織由来間葉系細胞の脂肪細胞への分化誘導の試験結果であり、48ウエルプレートの最初のP列は、購入細胞の分化誘導、2番目のN列は分化誘導培地を用いず、維持培地のみで培養したもの、3、4番目の−列は、体外2次元培養で増幅した細胞の分化能、5、6番目の+列は体外3次元培養で増幅した細胞を示している。
【0061】
培養したヒト骨髄由来間葉系幹細胞及びヒト脂肪組織由来間葉系細胞は、何れも脂肪細胞に良好に分化誘導する分化能を保持していることが確認された。
【0062】
[実施例3]
作製したLH/P MPs(0.1mg/ml)と、FGF−2(5ng/ml)を含む無血清DMEMと、ヒト血漿(容積比4%)とを加えて作製した本発明に係る細胞移植用組成物内で、体外3次元培養増幅させたヒト骨髄由来間葉系幹細胞及びヒト脂肪組織由来間葉系細胞の分化能を確認するため、骨芽細胞への分化誘導を行った。骨芽細胞への分化誘導には市販培地(Lonza Walkersville, Inc., MD)を使用し、両細胞を脂肪細胞誘導培地で4日間、続いて維持培地で3日間培養するサイクルを3回実施した後、両細胞を維持培地でさらに7日間培養した。また、骨芽細胞の誘導では、骨芽細胞のアルカリフォスファターゼ活性を調べるため、ALP染色を実施した。
【0063】
図6(a)は、3次元培養増幅したヒト骨髄由来間葉系幹細胞の骨芽細胞への分化誘導の試験結果であり、48ウエルプレートの最初のP列は、購入細胞の分化誘導、2番目のN列は分化誘導培地を用いず、維持培地のみで培養したもの、3、4番目の−列は、体外2次元培養で増幅した細胞の分化能、5、6番目の+列は体外3次元培養で増幅した細胞を示している。また、図5(b)は、3次元培養増幅したヒト脂肪組織由来間葉系細胞の骨芽細胞への分化誘導の試験結果であり、48ウエルプレートの最初のP列は、購入細胞の分化誘導、2番目のN列は分化誘導培地を用いず、維持培地のみで培養したもの、3、4番目の−列は、体外2次元培養で増幅した細胞の分化能、5、6番目の+列は体外3次元培養で増幅した細胞を示している。
【0064】
培養したヒト骨髄由来間葉系幹細胞及びヒト脂肪組織由来間葉系細胞は、何れも骨芽細胞に良好に分化誘導する分化能を保持していることが確認された。
【0065】
加えて、培地・血漿ゲル内でのヒト皮膚線維芽細胞3次元培養は、5日目以降顕著な血漿ゲル収縮とともに肉芽組織様形態を示した。また、ヒト皮膚毛細血管内皮細胞3次元培養は、24時間以内に毛細血管様組織形成が観察された。
【0066】
[実施例4]
作製したLH/P MPs(0.1mg/ml)と、サイトカインとしてFGF−2(5ng/ml)を含む無血清DMEM培地と、ヒト血漿(容積比4%)とを加えて作製したゲル状の細胞移植用組成物内を用いて、ヒト皮膚線維芽細胞及びヒト皮膚毛細血管内皮細胞に対する体外3次元培養増幅を実施した。
【0067】
図7(a)に示すように、24ウエル組織培養プレートに、約50,000のヒト皮膚線維芽細胞を作製した細胞移植用組成物内に加えて播種し、5日間体外3次元培養を行った(図中「■」)。比較対象として、比較対象として、FGF−2(5ng/ml)のみを含むヒト血漿(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血漿(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血漿(容積比4%)DMEM(図中「●」)を3次元培養ネガティブコントロールとし、5日間の細胞増殖を比較した。
また、他の比較対象として、図7(b)に示すように、LH/P MPs及びFGF−2を含む無血清DMEM培地においてヒト血漿に代えてヒト血清(容積比4%)を加えたDMEM(図中「■」)、FGF−2(5ng/ml)のみを含むヒト血清(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血清(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血清(容積比10%)DMEM(図中「○」)、ヒト血清(容積比4%)DMEM(図中「●」)を用いて、上記ヒト皮膚線維芽細胞を体外2次元培養し、5日間の細胞増殖を比較した。なお、各図中の縦軸は、細胞増幅(Cell growth )を示す。
【0068】
図8(a)は、ヒト皮膚線維芽細胞について上記作製した細胞移植用組成物内での体外3次元培養の培養3日目の顕微鏡写真であり、図8(b)はLH/P MPs、FGF−2及びヒト血清(容積比4%)を加えた2次元培養の培養3日目の顕微鏡写真である。
【0069】
図9(a)に示すように、24ウエル組織培養プレートに、約50,000のヒト皮膚毛細血管内皮細胞を作製した細胞移植用組成物内に加えて播種し、5日間体外3次元培養を行った(図中「■」)。比較対象として、比較対象として、FGF−2(5ng/ml)のみを含むヒト血漿(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血漿(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血漿(容積比4%)DMEM(図中「●」)を3次元培養ネガティブコントロールとし、5日間の細胞増殖を比較した。
また、他の比較対象として、図9(b)に示すように、LH/P MPs及びFGF−2を含む無血清DMEM培地においてヒト血漿に代えてヒト血清(容積比4%)を加えたDMEM(図中「■」)、FGF−2(5ng/ml)のみを含むヒト血清(容積比4%)DMEM(図中「□」)、LH/P MPsのみを含むヒト血清(容積比4%)DMEM(図中「△」)、LH/P MPs及びFGF−2の両者を含まないヒト血清(容積比10%)DMEM(図中「○」)、ヒト血清(容積比4%)DMEM(図中「●」)を用いて、上記ヒト皮膚毛細血管内皮細胞を体外2次元培養し、5日間の細胞増殖を比較した。なお、各図中の縦軸は、細胞増幅(Cell growth )を示す。
【0070】
図10(a)は、ヒト皮膚毛細血管内皮細胞について上記作製した細胞移植用組成物内での体外3次元培養の培養3日目の顕微鏡写真であり、図4(b)はLH/P MPs、FGF−2及びヒト血清(容積比4%)を加えた2次元培養の培養3日目の顕微鏡写真である。
【0071】
なお、本実施例では、細胞培養後の細胞移植用組成物に対し、トリプシン・EDTA溶液で10分以内に溶解してその中の増殖細胞を分雛し、血球計測器を用いて細胞数を計測した。
【0072】
図7〜10に示すように、比較結果として、両細胞ともLH/P MPs及びFGF−2を含む無血清DMEM培地にヒト血漿(容積比4%)を加えた本発明の細胞移植用組成物内において最大の細胞増殖を示した。
【0073】
[実施例5]
作製したLH/P MPs(0.1mg/ml)と、1/4濃度のSCF(5ng/ml)・TPO(10ng/ml)・Flt−3ligand(10ng/ml)の造血細胞増幅用サイトカインを含む無血清HPGMと、ヒト血漿(容積比4%)とを加えて作製したゲル状の細胞移植用組成物内を用いて、ヒト骨髄由来CD34陽性造血系前駆体細胞の3次元培養を実施した。
【0074】
図11に示すように、上記細胞移植用組成物を用いてヒト骨髄由来CD34陽性造血系前駆体細胞について10日間体外3次元培養を行った(図中「◆」)。比較対象として、ヒト血漿(HP:2%)を含む無血清HPGMからなる培地・血漿ゲル(図中「■」) 、LH/P MPs(0.1mg/ml)及びHPを含む無血清HPGMからなる培地・血漿ゲル(図中「△」)、SCF(1/4X;5ng/ml)・TPO(1/4X;10ng/ml)・Flt−3 ligand(1/4X;10ng/ml)とヒト血漿を含む無血清HPGMからなる培地・血漿ゲル内(図中「▲」)を3次元培養ネガティブコントロールとし、10日間の細胞増殖を比較した。
また、他の比較対象として、SCF(1X;20ng/ml)・TPO(1X;40ng/ml・Flt−3 ligand(1X;40ng/ml)のみを含んだHPGM(図中「○」)、SFC(1/4X)・TPO(1/4X)・Flt−3 ligand(1/4X)のみを含んだHPGM(図中「●」)、LH/P MPsと、SFC(1/4X)・TPO(1/4X)・Flt−3 ligand(1/4X)のみを含んだHPGM(図中「□」)を体外2次元培養し、10日間の細胞増殖を比較した。なお、各図中の縦軸は、細胞増幅(Cell growth )を示す。
【0075】
また、図12に示すように、上記細部移植用組成物内で増殖中のヒト骨髄由来CD34陽性造血系前駆体細胞における0、4、10日目にCD34陽性率をPEラベルヒート抗CD34(BD Biosciences Pharmigen, USA )を用いてEPICSRXL(Beckman Coulter, USA)によりフローサイトメトリーの計測結果である。図中「黒」は、LH/P MPs(0.1mg/ml)とSFC(1/4X;5ng/ml)・TPO(1/4X;10ng/ml)・Flt−3 ligand(1/4X;10ng/ml)を含む無血清HPGMと、ヒト血漿(容積比3%)からなる細胞移植用組成物の3次元培養の結果であり、図中「灰色」は、LH/P MPs(0.1mg/ml)とSFC(1/4X;5ng/ml)・TPO(1/4X;10ng/ml)・Flt−3 ligand(1/4X;10ng/ml)を含む無血清HPGMと、ヒト血清(容積比3%)からなる培地・血漿ゲルの2次元培養の結果であり、図中「白」は、コントロールとしてSFC(1/4X;5ng/ml)・TPO(1/4X;10ng/ml)・Flt−3 ligand(1/4X;10ng/ml)のみを含む無血清HPGMの体外2次元培養の結果である。
【0076】
図13(a)はヒト骨髄由来CD34陽性造血系前駆体細胞について上記細胞移植用組成物内での体外3次元培養の培養6日目の電子顕微鏡写真であり、図13(b)はヒト骨髄由来CD34陽性造血系前駆体細胞についてヒト血清(容積比4%)を含む培地による2次元培養の培養6日目の電子顕微鏡写真である。
【0077】
図11〜13に示すように、本発明に係る細胞移植用組成物を用いた3次元細胞培養方法によるヒト骨髄由来CD34陽性造血系前駆体細胞の培養では、ヒト骨髄由来CD34陽性造血系前駆体細胞のコロニー形成を促進して最適な3次元増幅が行え、ヒト血漿に代えて等量の血清を添加した同じ培地を用いた2次元培養よりも有意に高い増殖率を得ることができた。また、3次元細胞培養方法で増幅させたヒト骨髄由来CD34陽性造血系前駆体細胞は、同じ培地に等量の同種血清を添加した2次元培養よりも有意に高いCD34陽性率を維持した。
【0078】
[実施例6]
作製したLH/P MPs(0.1mg/ml)に、サイトカインとしてIL−3(5ng/ml)・GM−CSF(5ng/ml)を含む無血清DMEMにヒト血漿(容積比4%)を加えて作製したゲル状の細胞移植用組成物内を用いて、ヒトTF−1細胞の3次元培養を実施した。
【0079】
図14に示すように、上記細胞移植用組成物を用いてヒトTF−1細胞について10日間3次元培養を行った(図中「◆」)。比較対象として、ヒト血漿(HP:2%)を含む無血清DMEMからなる培地・血漿ゲル(図中「■」) 、LH/P MPs(0.1mg/ml)及びHPを含む無血清DMEMからなる培地・血漿ゲル(図中「△」)、IL−3(5ng/ml)・GM−CSF(5ng/ml)とヒト血漿を含む無血清DMEMからなる培地・血漿ゲル内(図中「▲」)を3次元培養ネガティブコントロールとし、3日間の細胞増殖を比較した。
また、他の比較対象として、10%ヒト血清(HS)のみを含んだDMEM(図中「○」)、IL−3(5ng/ml)・GM−CSF(5ng/ml)のみを含んだ無血清DMEM(図中「●」)、10%HS及びIL−3(5ng/ml)・GM−CSF(5ng/ml)のみを含んだDMEM(図中「□」)を体外2次元培養し、3日間の細胞増殖を比較した。なお、各図中の縦軸は、細胞増幅(Cell growth )を示す。
【0080】
図15(a)はヒトTF−1細胞について上記細胞移植用組成物内での体外3次元培養の培養2日目の電子顕微鏡写真であり、図15(b)はヒトTF−1細胞についてヒト血清(容積比4%)を含む培地による2次元培養の培養2日目の電子顕微鏡写真である。
【0081】
図14、15に示すように、本発明に係る細胞移植用組成物を用いた3次元細胞培養方法によるヒトTF−1細胞の培養では、ヒトTF−1細胞のコロニー形成を促進して最適な3次元増幅が行え、ヒト血漿に代えて等量の血清を添加した同じ培地を用いた2次元培養よりも有意に高い増殖率を得ることができた。
【0082】
[実施例7]
ヒト肝癌細胞株(Huh7:500,000cells 及びHuh7:5, 000, 000cells )を、LH/P MPs(5mg/ml)及びFGF−2(10μg/ml)を含む無血清DMEMにヒト血漿(容積比5%)を加えて作製した細胞用移植用組成物に添加し、ヌードマウス皮下へ200μl投与した異種腫瘍細胞移植実験を実施した。比較対象として、LH/P MPs(5mg/ml)を腫瘍細胞浮遊液に加えた移植した(図中「+LH/P MPs」)。また、FGF−2(10μg/ml)を腫瘍細胞浮遊液に加えた移植した(図中「+FGF−2」)。さらに、ヒト血漿(容積比5%)を腫瘍細胞浮遊液に加えた移植した(図中「+HP」)。また、ヒト血漿(容積比5%)及びLH/P MPs(5mg/ml)を腫瘍細胞浮遊液に加え移植した(図中「+HP+LH/P MPs」)。さらに、ヒト血漿(容積比5%)とLH/P MPs(5mg/ml)とFGF−2(10μg/ml)を腫瘍細胞浮遊液に加え移植した(図中「+HP+LH/P MPs+FGF−2」)。コントロールとして、上記腫瘍細胞を生理食塩水に浮遊させ移植した(図中「Control」)。
なお、腫傷サイズは、経時的に小型ノギスを用いて、縦・横・高さを測定し算出し、縦軸は成長した腫瘍容量(cm3 )を示す。
【0083】
図16(a)に示すように、Huh7細胞のみと、Huh7細胞+FGF−2投与群では、腫傷の生着及び成長は観察されなかったが、Huh7細胞を添加した上記細胞移植用組成物のヌードマウス皮下へ投与では、最適な生着及び腫傷成長を認められた。また、図16(b)に示すように、Huh7細胞(5, 000, 000cells /200μl)の移植実験では、コントロールでも細胞の生着は認められるものの、Huh7細胞を添加した上記細胞移植用組成物のヌードマウス皮下へ投与は、最適な腫癌成長を認められた。
【0084】
[実施例8]
本発明による3次元細胞培養方法により増幅させたマウス骨髄由来CD34陽性造血系前駆体細胞を含んだ細胞移植用組成物をX線照射により骨髄死を引き起こしたマウスの骨内へ投与した。その結果、末梢血での白血球や血小板の有意に高い回復が観察され、優れた骨内造血系前駆体細胞移植のための運搬システムとして適用の可能性が示された。
【産業上の利用可能性】
【0085】
本発明は、用途に応じて任意に選択される接着性細胞や造血系浮遊細胞等の各種細胞と、安全性が確認されている低分子へパリンとプロタミンとから構成される平均粒径が0.1μm〜5μm未満のLH/P MPsと、適切なサイトカイン、培地及びヒト血漿を含んでなるゲル状の細胞移植用組成物を用いた3次元細胞培養方法により、特にCD34陽性造血系前駆体細胞の体外大量増幅システムとしての有用性が極めて高い。また、細胞移植用組成物は、注射器やカテーテル等を介して、生体局所に投与する医療用途へ安定的に供給する細胞運搬法として適用することができる。
【0086】
さらに、血漿中に含まれる生理活性物質を安定に保持し、目的部位で担持した活性分子を徐放できるドラッグデリバリー用薬物包接担体としても使用できる。また、ヌードマウス等に局所注入した細胞移植用組成物内で癌細胞等の腫瘍細胞を担持した状態で効率よく増幅させることができるため、抗ガン剤等の新薬の開発に大きく貢献できる。そして、ヒト自己骨髄間葉系幹細胞或いは自己脂肪組織由来間葉系細胞に本細胞デリバリー担体を適用することで、美容形成外科領域の育毛剤及び雛取り等美容形成治療法への適用に加え、血管新生促進製剤、皮膚等の難治性創傷治癒促進剤として、さらには他の細胞導入を伴う再生医療への応用が可能となる。
【特許請求の範囲】
【請求項1】
再生医療に用いる間葉系幹細胞や腫瘍細胞を含む接着性細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記接着性細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物内で前記接着性細胞の培養を行うことを特徴とする3次元細胞培養方法。
【請求項2】
再生医療に用いる間葉系幹細胞や腫瘍細胞を含む接着性細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記接着性細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物であることを特徴とする細胞移植用組成物。
【請求項3】
再生医療に用いるCD34陽性造血系前駆体細胞を含む造血系浮遊細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記造血系浮遊細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物内で前記造血系浮遊細胞の培養を行うことを特徴とする3次元細胞培養方法。
【請求項4】
再生医療に用いるCD34陽性造血系前駆体細胞を含む造血系浮遊細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記造血系浮遊細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物であることを特徴とする細胞移植用組成物。
【請求項1】
再生医療に用いる間葉系幹細胞や腫瘍細胞を含む接着性細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記接着性細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物内で前記接着性細胞の培養を行うことを特徴とする3次元細胞培養方法。
【請求項2】
再生医療に用いる間葉系幹細胞や腫瘍細胞を含む接着性細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記接着性細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物であることを特徴とする細胞移植用組成物。
【請求項3】
再生医療に用いるCD34陽性造血系前駆体細胞を含む造血系浮遊細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記造血系浮遊細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物内で前記造血系浮遊細胞の培養を行うことを特徴とする3次元細胞培養方法。
【請求項4】
再生医療に用いるCD34陽性造血系前駆体細胞を含む造血系浮遊細胞と、
低分子ヘパリンとプロタミンとからなる平均粒径が0.1〜5μmであるLH/P MPsと、
前記造血系浮遊細胞の用途に応じて任意に選択されるサイトカインと、
容積比0.5〜25%のヒト血漿と、
で構成されるゲル状組成物であることを特徴とする細胞移植用組成物。
【図1】


【図3】


【図7】


【図9】


【図11】


【図14】


【図2】


【図4】


【図5】


【図6】


【図8】


【図10】


【図12】


【図13】


【図15】


【図16】




【図3】


【図7】


【図9】


【図11】


【図14】


【図2】


【図4】


【図5】


【図6】


【図8】


【図10】


【図12】


【図13】


【図15】


【図16】


【公開番号】特開2012−205599(P2012−205599A)
【公開日】平成24年10月25日(2012.10.25)
【国際特許分類】
【公開請求】
【出願番号】特願2012−171027(P2012−171027)
【出願日】平成24年8月1日(2012.8.1)
【出願人】(390014306)防衛省技術研究本部長 (169)
【Fターム(参考)】
【公開日】平成24年10月25日(2012.10.25)
【国際特許分類】
【出願番号】特願2012−171027(P2012−171027)
【出願日】平成24年8月1日(2012.8.1)
【出願人】(390014306)防衛省技術研究本部長 (169)
【Fターム(参考)】
[ Back to top ]

