3,3−ジフェニルプロピルアミン類の新規誘導体の安定な塩
【課題】塩の形態での3,3−ジフェニルプロピルアミン誘導体の高純度で、結晶性の安定な化合物およびその製造方法を提供する。
【解決手段】3,3−ジフェニルプロピルアミン類のフェノールモノエステル類を提供する。好適な化合物は、R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルの塩である。
【解決手段】3,3−ジフェニルプロピルアミン類のフェノールモノエステル類を提供する。好適な化合物は、R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルの塩である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、3,3−ジフェニルプロピルアミン類の新規誘導体の塩の、高純度、結晶性、かつ安定な化合物、その製造方法、並びに高純度で安定な中間体生成物に関する。
【背景技術】
【0002】
特許文献1の出願書類から、3,3−ジフェニルプロピルアミン類の新規誘導体は公知である。
その誘導体は、尿失禁および他の痙攣性の病訴の治療において有用なプロドラッグであり、現在使用可能な活性物質の欠点、すなわち生体膜による活性物質の不十分な吸収や活性物質の好ましくない代謝を克服するものである。
【0003】
さらにその新規プロドラッグは、オキシブチニンおよびトルテロジンと比較して、薬物動態特性が改善されている。
3,3−ジフェニルプロピルアミン類の新規誘導体群のうち、好適な化合物は、下記に示した化学式Aの構造を有する脂肪族または芳香族カルボン酸のエステルである。
【0004】
【化1】

【0005】
式中、RはC1〜C6アルキル、C3〜C10シクロアルキルまたは未置換もしくは置換フェニルを表す。これらは、ラセミ混合物としての光学異性体の形態で、さらにはそれらの個々のエナンチオマーの形態で生じ得る。
【0006】
しかしながら、化学式Aの構造を有する化合物は、水に対する溶解度が低い。それによって、経口での生体内利用率が制限される。
最後に、化学式Aで示した構造のモノエステルは、分子間エステル交換反応を起こす傾向を有する。
【0007】
従って、長期間保存すると、化学式Aの構造を有する化合物の含有量が低下するに連れて、ジエステルや遊離ジオールの増加が検出される場合がある。
基本的に、化学式Aの化合物の塩は、式Aの化合物(塩基性成分)の溶液を、好適な溶媒中で酸の溶液で精製する場合に得ることができる。しかし、固体の形態で得られる塩は、非晶質ないし吸湿性である場合があり、しかも通常の溶媒からは直接結晶化できない。
そのような塩は、貴重な医薬活性物質として製剤処理するためには不適切な化学的安定性を有する。
【0008】
驚くべきことに、化学式Aの構造を有する化合物を特殊な反応工程下で製造すると、化学式H−Xを有する生理適合的な無機酸もしくは有機酸によって、下記化学式Iを有する個別の塩に変換した場合には、上記の欠点を回避できることが認められた。ここで、−Xは個々の酸残基を表す。
【化2】

【先行技術文献】
【特許文献】
【0009】
【特許文献1】PCT/EP99/03212
【発明の概要】
【発明が解決しようとする課題】
【0010】
従って本発明における課題は、上記の欠点を回避し、医薬製剤での使用に十分に適合し、これら製剤に加工可能な塩の形態をなす3,3−ジフェニルプロピルアミン類の新規誘導体の高純度、結晶性かつ安定な化合物を提供することにある。
【0011】
本発明におけるさらに別の課題は、塩の形でのそのような高純度、結晶性、かつ安定な化合物、ならびに高純度かつ安定な中間体生成物を製造する方法を提供することにある。
本発明のさらなる課題は、上記化合物の製造方法であって、この方法による生成物の高収率、および、化学選択的または位置選択的に得ることができる個々の中間体生成物を提供する方法にある。
【課題を解決するための手段】
【0012】
上記課題は、下記化学式Iを有する塩の形態での3,3−ジフェニルプロピルアミン類の高純度、結晶性、かつ安定な化合物が提供されることにより解決される。
【0013】
【化3】

【0014】
式中、RはC1〜C6アルキル、C3〜C10シクロアルキル、置換もしくは未置換フェニルを表し、X−は生理適合性を有する無機酸もしくは有機酸の酸残基である。
本発明の態様によれば、化学式Iの塩は、塩酸、臭化水素酸、リン酸、硫酸、硝酸、酢酸、プロピオン酸、パルミチン酸、ステアリン酸、マレイン酸、フマル酸、シュウ酸、コハク酸、DL−リンゴ酸、L−(−)−リンゴ酸、D−(+)−リンゴ酸、DL−酒石酸、L−(+)−酒石酸、D−(−)−酒石酸、クエン酸、L−アスパラギン酸、L−(+)−アスコルビン酸、D−(+)−グルクロン酸、2−オキソプロピオン酸(ピルビン酸)、フラン−2−カルボン酸(粘液酸)、安息香酸、4−ヒドロキシ安息香酸、サリチル酸、バニリン酸、4−ヒドロキシケイ皮酸、没食子酸、馬尿酸(N−ベンゾイル−グリシン)、アセツル酸(Acetursaure)(N−アセチルグリシン)、フロレチン酸(Phloretinsaure)(3−(4−ヒドロキシルフェニル)−プロピオン酸)、フタル酸、メタンスルホン酸またはオロチン酸という酸の個々の酸残基X−を有し得る。
【0015】
本発明の別の態様によれば、以下の化学式2を有するR−配置化合物が提供される。
【0016】
【化4】

【0017】
式中、RはC1〜C6アルキル、C3〜C10シクロアルキル、置換もしくは未置換フェニルを表し、X−は生理的適合性を有する無機酸もしくは有機酸の残基である。
本発明の有利な態様によれば、化学式2の化合物の塩は、塩酸、臭化水素酸、リン酸、硫酸、硝酸、酢酸、プロピオン酸、パルミチン酸、ステアリン酸、マレイン酸、フマル酸、シュウ酸、コハク酸、DL−リンゴ酸、L−(−)−リンゴ酸、D−(+)−リンゴ酸、DL−酒石酸、L−(+)−酒石酸、D−(−)−酒石酸、クエン酸、L−アスパラギン酸、L−(+)−アスコルビン酸、D−(+)−グルクロン酸、2−オキソプロピオン酸(ピルビン酸)、フラン−2−カルボン酸(粘液酸)、安息香酸、4−ヒドロキシ安息香酸、サリチル酸、バニリン酸、4−ヒドロキシケイ皮酸、没食子酸、馬尿酸(N−ベンゾイル−グリシン)、アセツル酸(N−アセチルグリシン)、フロレチン酸(3−(4−ヒドロキシルフェニル)−プロピオン酸)、フタル酸、メタンスルホン酸またはオロチン酸という酸の個々の酸残基X−を有することができる。
【0018】
本発明の好適な化合物は、R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル・フマル酸水素塩、および、R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル塩酸塩水和物といった塩である。
【0019】
さらに、Rがシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、4−(1−シクロプロピル−メタノイルオキシ)−フェニル、4−(1−シクロブチル−メタノイルオキシ)−フェニル、4−(1−シクロヘキシル−メタノイルオキシ)−フェニル、または4−(2,2−ジメチル−プロパノイルオキシ)−フェニルを表し、X−が塩素イオンを表す化合物が好ましい。
【0020】
特に好ましいものとしては、[(R)−3−(2−{1−[4−(1−シクロプロピル−メタノイルオキシ)−フェニル]−メタノイルオキシ}−5−ヒドロキシメチル−フェニル)−3−フェニルプロピル]−ジイソプロピル−アンモニウムクロライド、[(R)−3−(2−{1−[4−(1−シクロブチル−メタノイルオキシ)−フェニル]−メタノイルオキシ}−5−ヒドロキシメチル−フェニル)−3−フェニルプロピル]−ジイソプロピル−アンモニウムクロライド、[(R)−3−(2−{1−[4−(1−シクロヘキシル−メタノイルオキシ)−フェニル]−メタノイルオキシ}−5−ヒドロキシメチル−フェニル)−3−フェニル−プロピル]−ジイソプロピル−アンモニウムクロライド、[(R)−3−(2−{1−[4−(2,2−ジメチル−プロパノイルオキシ)−フェニル]−メタノイルオキシ}−5−ヒドロキシメチル−フェニル)−3−フェニル−プロピル]−ジイソプロピル−アンモニウムクロライド、{(R)−3−[2−(1−シクロプロピル−メタノイルオキシ)−5−ヒドロキシメチル−フェニル]−3−フェニル−プロピル}−ジイソプロピル−アンモニウムクロライド、{(R)−3−[2−(1−シクロブチル−メタノイルオキシ)−5−ヒドロキシメチル−フェニル]−3−フェニル−プロピル}−ジイソプロピル−アンモニウムクロライド、{(R)−3−[2−(1−シクロペンチル−メタノイルオキシ)−5−ヒドロキシメチル−フェニル]−3−フェニル−プロピル}−ジイソプロピル−アンモニウムクロライド、および、{(R)−3−[2−(1−シクロヘキシル−メタノイルオキシ)−5−ヒドロキシメチル−フェニル]−3−フェニル−プロピル}−ジイソプロピル−アンモニウムクロライドがある。
【図面の簡単な説明】
【0021】
【図1】本発明による化合物を塩の形態で得る際の反応式を示す概念図。
【発明を実施するための形態】
【0022】
本発明の化合物において、「アルキル」の文言は好適には、炭素原子数1〜6個を有する直鎖または分岐の炭化水素基を示す。特に好ましいものとしては、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、ペンチルおよびヘキシルがある。「シクロアルキル」の文言は、水素原子3〜10個を有し、その水素原子に代えて好適な置換基を有することもできる環状の炭化水素基を示す。
【0023】
「フェニル」の文言は、置換または未置換であることが可能な−C6H5を指す。好適な置換基には例えば、アルキル、アルコキシ、ハロゲン、ニトロおよびアミンがあり得る。「アルコキシ」の文言は、アルキル基に関しては、「アルキル」について前述のものと同じ意味を有する。好適なハロゲンは、フッ素、塩素、臭素およびヨウ素原子である。
【0024】
本発明はさらに、化学式Iの本発明による化合物ならびに有用な中間体生成物の製造方法をも含むものである。
その方法は、化学的選択性および位置選択性を特徴とする。
【0025】
以下の化学式I
【0026】
【化5】

【0027】
を有し、式中、RはC1〜C6アルキル、C3〜C10シクロアルキル、置換もしくは未置換フェニルを表し、X−は生理的適合性を有する無機酸もしくは有機酸の酸残基である化合物は、
a)以下の化学式IIIの化合物
【0028】
【化6】

【0029】
を水素化剤で開裂させて、以下の化学式Vの化合物
【0030】
【化7】

【0031】
を形成する工程と、
b)これにより得られた式Vの化合物を還元剤で変換して、下記式VIの化合物
【0032】
【化8】

【0033】
を得る工程と、
c)それをアシル化剤で変換して、以下の化学式A
【0034】
【化9】

【0035】
を有し、式中、Rは上記の意味を有する化合物を得る工程と、
d)それを、生理的適合性を有する無機酸または有機塩で変換して、下記式I
【0036】
【化10】

【0037】
を有し、式中、RはC1〜C6アルキル、C3〜C10シクロアルキル、置換もしくは未置換フェニルを表し、X−は生理的適合性を有した無機酸もしくは有機酸の酸残基である化合物を形成する工程とにより製造される。
【0038】
本発明によれば、化学式Iの化合物の製造において、塩酸、臭化水素酸、リン酸、硫酸、硝酸、酢酸、プロピオン酸、パルミチン酸、ステアリン酸、マレイン酸、フマル酸、シュウ酸、コハク酸、DL−リンゴ酸、L−(−)−リンゴ酸、D−(+)−リンゴ酸、DL−酒石酸、L−(+)−酒石酸、D−(−)−酒石酸、クエン酸、L−アスパラギン酸、L−(+)−アスコルビン酸、D−(+)−グルクロン酸、2−オキソプロピオン酸(ピルビン酸)、フラン−2−カルボン酸(粘液酸)、安息香酸、4−ヒドロキシ安息香酸、サリチル酸、バニリン酸、4−ヒドロキシケイ皮酸、没食子酸、馬尿酸(N−ベンゾイル−グリシン)、アセツル酸(N−アセチルグリシン)、フロレチン酸(3−(4−ヒドロキシルフェニル)−プロピオン酸)、フタル酸、メタンスルホン酸またはオロチン酸を用いる。
【0039】
本発明の有利な別の展開によれば、化学式2
【0040】
【化11】

【0041】
を有し、式中、RはC1〜C6アルキル、C3〜C10シクロアルキル、置換もしくは未置換フェニルを表し、X−は生理的適合性を有する無機酸もしくは有機酸の酸残基である、R−配置化合物の製造方法が記載される。この方法は、a)以下の化学式3の化合物
【0042】
【化12】

【0043】
を水素化剤で開裂させて、以下の化学式5の化合物
【0044】
【化13】

【0045】
を形成する工程と、
b)そうして得られた化学式5の化合物を還元剤で変換して、以下の化学式6の化合物
【0046】
【化14】

【0047】
を得る工程と、
c)それをアシル化剤で変換して、以下の化学式1
【0048】
【化15】

【0049】
を有し、式中、Rは上記の意味を有する化合物を得る工程と、
d)それを、生理的適合性を有する無機酸または有機塩で変換して、以下の化学式2
【0050】
【化16】

【0051】
を有し、式中、RはC1〜C6アルキル、C3〜C10シクロアルキル、置換もしくは未置換フェニルを表し、X−は生理的適合性を有する無機酸もしくは有機酸の酸残基である化合物を形成する方法が示される。
【0052】
前記方法に従って化学式2の化合物を得る上で有利には、塩酸、臭化水素酸、リン酸、硫酸、硝酸、酢酸、プロピオン酸、パルミチン酸、ステアリン酸、マレイン酸、フマル酸、シュウ酸、コハク酸、DL−リンゴ酸、L−(−)−リンゴ酸、D−(+)−リンゴ酸、DL−酒石酸、L−(+)−酒石酸、D−(−)−酒石酸、クエン酸、L−アスパラギン酸、L−(+)−アスコルビン酸、D−(+)−グルクロン酸、2−オキソプロピオン酸(ピルビン酸)、フラン−2−カルボン酸(粘液酸)、安息香酸、4−ヒドロキシ安息香酸、サリチル酸、バニリン酸、4−ヒドロキシケイ皮酸、没食子酸、馬尿酸(N−ベンゾイル−グリシン)、アセツル酸(N−アセチルグリシン)、フロレチン酸(3−(4−ヒドロキシルフェニル)−プロピオン酸)、フタル酸、メタンスルホン酸またはオロチン酸を用いる。
【0053】
特に有利には、結晶性のR−(−)−4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)安息香酸メチルエステルから、高純度の結晶性中間体生成物R−(−)−3−(3−ジイソプロピルアミノ−フェニル−プロピル)−4−ヒドロキシ安息香酸メチルエステルを製造し、それを還元してR−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノールを得て、それを最後に好適な形でアシル化し、次に自然結晶化条件下で生理的適合性を有する無機酸または有機酸によって、個々の高純度で結晶性の安定な塩に変換する。
【0054】
使用される酸塩化物に応じて、以下の化学式1の化合物が得られる。
【0055】
【化17】

【0056】
式中、RはC1〜C6アルキル、特にはイソプロピル、C3〜C10シクロアルキル、置換もしくは未置換フェニルを表す。
本発明による化合物を塩の形態で得るには、特定の中間段階および個別に同定可能な中間体生成物による特別な反応工程が必須である。
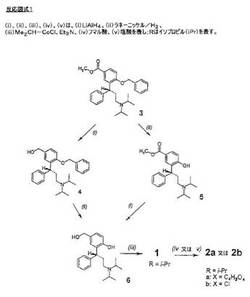
【0057】
それは、反応図式1(図1参照)を用いて説明される。図中ではR−配置化合物を用いる変換について示してあるが、それに限定されるものではない。
その図において、3=R−(−)−4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)安息香酸メチルエステル;
4=R−(+)−[4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)−フェニル]−メタノール;
5=R−(−)−3−(3−ジイソプロピルアミノ−フェニル−プロピル)−4−ヒドロキシ安息香酸メチルエステル;
6=R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール;
1=R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニル−イソブチレートエステル;
2a=R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル・フマル酸水素塩;
2b=R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル塩酸塩水和物である。
【0058】
この実施形態に記載の反応工程によれば、予備段階化合物3(R−(−)−4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)安息香酸メチルエステル)は、純粋な結晶として製造される。
【0059】
BBr3、AlCl3などの通常の方法を用いることで、しかしながら好ましくは室温で(RT)溶媒としてのメタノール中ラネーニッケルを介して水素によって、予備段階化合物3を開裂させて5(R−(−)−3−(3−ジイソプロピルアミノ−フェニル−プロピル)−4−ヒドロキシ安息香酸メチルエステル)とする。それは高純度の結晶として得られる(融点:143.7℃)。
【0060】
最後に、NaBH4/EtOH、好ましくはLiAlH4などの好適な還元剤を用いて、5を低温下の(−78℃〜+10℃)不活性溶媒中で還元して、化合物6(R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール)を得る。化合物6は高純度で得られ、酢酸エチルなどの適切な溶媒から結晶化させることができる。得られる無色の微粒子は融点102.3℃を有する。驚くべき点として、当業界において化合物6は非晶質固体と記載されている。
【0061】
次に化合物6を、非常に良好な収率ならびに位置選択性および化学選択性でアシル化して、フェノールエステルとする。その反応は、適切な溶媒中で塩基存在下に、当量の酸塩化物を用いて、室温以下の温度で行う。適切な溶媒は、エチルアセテート、ジクロロメタン、テトラヒドロフラン、アセトニトリルまたはトルエンである。
【0062】
この反応は好ましくは、上記の温度で、酸塩化物としてイソブチリルクロライドを、および塩基としてトリエチルアミンを用いて行う。このようにして得られる1(R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル)は、適切な溶媒に対するフマル酸溶液により、自然結晶化が生じてフマル酸水素塩2aが形成されるような純度で得られる。
【0063】
この塩は103℃という高い融点を有し、室温で安定であり、非吸湿性であり、結晶化剤(Kristallosemittel )を含まない。それは所望に応じて再結晶し得る。
フマル酸に代えて無水塩酸を用いる場合も(例えばエーテル溶液として)、塩形成が起こり、結晶生成物2b(R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル塩酸塩水和物が得られる。
【0064】
さらに再結晶を行った後、生成物2bは97〜106℃の融点範囲を有する。
最後に、生成物2bは特に有利には、反応図式1の化合物6を原料とする反転反応の下記の変形例によって得ることができる。そうすることで生成物2bは、以下に記載のように、外部酸捕捉塩基を加えることなく得ることができる。
【0065】
6(R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール)の溶液を、イソブチレートクロライドに滴下すると、好適な極性条件下で無水生成物2bが急速に結晶化する。2bは非常に吸湿性である。
【0066】
上記の反応を、少なくとも1モル当量の水を含む含水溶媒中で行うと、安定で結晶性の含水生成物2bが得られ、それは上記の融解特性を有する。
化学式1および2の本発明による化合物は、バルク材料に適合する。
【0067】
特に有利なものとしては、得ることが可能な化学式III,V,VI,3,5,6,7の高純度化合物がある。
式IIIの化合物
【0068】
【化18】

【0069】
式Vの化合物
【0070】
【化19】

【0071】
式VIの化合物
【0072】
【化20】

【0073】
式3の化合物
【0074】
【化21】

【0075】
式5の化合物
【0076】
【化22】

【0077】
式6の化合物
【0078】
【化23】

【0079】
式7の化合物
【0080】
【化24】

【0081】
[(R)−3−(2−{1−[4−(2,2−ジメチル−プロパノイルオキシ)−フェニル]−メタン−オイルオキシ}−5−{1−[4−(2,2−ジメチル−プロパノイルオキシ)−フェニル]−メタン−オイルオキシメチル}−フェニル)−3−フェニル−プロピル]−ジイソプロピル−アンモニウムクロライド
上記化合物III,V,VI,3,5,6,7は、各場合において製薬上有用な化合物の製造において、高純度、結晶性、かつ安定な中間体生成物として使用することに特に適合する。
【0082】
特に有利なものは、R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル・フマル酸水素塩およびR−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル塩酸塩水和物の製造における中間体生成物として使用される化合物である。
【0083】
最後に前記方法は、エチルアセテート、ジクロロメタン、テトラヒドロフラン、アセトニトリルまたはトルエンという個々の溶媒のいずれかを使用するトリエチルアミン存在下で、当量のイソブチリルクロライドで化学式6の化合物を、R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルに変換することによって(反応図式1参照)、特に有利な方式に行うことが可能である。
【0084】
本発明によれば、R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルは、フマル酸または塩酸塩で変換して個々の塩を形成する際に特に適切である。
【0085】
以下の実施形態により、本発明を説明する。
実験
I.全般
化合物はいずれも、1Hおよび13C NMRスペクトル測定(Bruker DPX200 )によって十分に特定されている。13C−NMRスペクトラムで記載の化学シフト(50MHz、記載のppm値)は、CDCl3の溶媒共鳴(77.10ppm)を基準としたものである。1H NMRデータ(CDCl3;200MHz、ppm)は、内部テトラメチルシランを基準としたものである。
【0086】
薄層クロマトグラフィー(DC、Rf値を記載)は、5×10cmのメルク社(E. Merck)シリカゲル薄膜(60F254)で行い、蛍光消去またはアルカリ性過マンガン酸カリウム溶液噴霧によって着色して肉眼で視認可能とした。
【0087】
吸収剤は(1)n−ヘキサン/アセトン/トリエチルアミン(70/20/10、体積%);(2)トルエン/アセトン/メタノール/酢酸(70/5/20/5、体積%)とした。
【0088】
旋光度は、溶媒としてエタノールを用い、室温で波長589.3nm(ナトリムD線)で測定した(装置:パーキン・エルマー(Perkin Elmer)旋光計241型)。融点(℃表示)は未補正であり、メトラー(Mettler)FP装置で、あるいは「パイリス(Pyris)」評価ソフトウェアを用いるパーキン・エルマーDSC7型での示差熱分析(DSC)によって測定した。
【0089】
UV/VIS測定は、層厚1cmにて分光光度計λ7型(パーキン・エルマー)で行った。記載の具体的な吸収は1%溶液についてのものである(A1%1cm)。
IRスペクトラムは、パーキン・エルマーFTIRスペクトル装置1610シリーズ(分解能4cm−1)で記録した。
【0090】
ガスクロマトグラフィー質量分析(GC−MS、m/z値およびベースイオンに関しての相対強度(%))は、反応ガスとしてメタンまたはアンモニウムを用いるか、または電子衝撃イオン化を介しての陽性(P−CI)または陰性(N−CI)化学イオン化測定モードで、フィニガン(Finnigan)TSQ700トリプル(Triple)質量分析装置で行った。ヒドロキシ化合物は、トリメチルシリルエーテル誘導体として測定した。
【0091】
連結液体クロマトグラフィー質量分析(LC−MS)(ウォーターズWaters)積算システム、サーマビーム(Thermabeam)質量検出器(EI、70eV)、m/z値および相対強度(%))は、50〜500a.m.uの量範囲で得られるものである。
【0092】
II.実施形態
括弧内のアラビア数字(3)、(4)、(5)、(6)は、反応図式1での同様の呼称を指す。
【0093】
1.R−(−)−4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)安息香酸メチルエステル(3)の製造
【0094】
【化25】

【0095】
R−(−)−4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)安息香酸塩酸塩(2.30kg、4.77mol)のメタノール(26.4リットル)および濃硫酸(0.25リットル)溶液を、16時間加熱還流する。次に、溶媒の1/3を留去し、冷却し、撹拌下に氷5kgおよび25%炭酸ナトリウム水溶液2.5リットルと混合する。沈殿を最初に塩化メチレン15リットルで抽出し、次に同溶媒5リットルで抽出する。有機相を精製し、ロータリーエバポレータで濃縮乾固する。純度約90%(DC、NMR)の暗黄色油状物1.99kg(理論量の90.7%)を得る。
【0096】
DC(1):0.58。
13C−NMR(CDCl3):20.55、20.65、36.83、41.84、43.83、51.82、70.12、111.09、122.46、125.28、127.49、128.02、128.35、128.50、129.22、129.49、133.20、136.39、144.51、159.87、167.09。
【0097】
再結晶
油状原料69.0gを沸騰メタノール150mLに溶解させる。蒸留水15mLを加えた後、それを0℃で放置すると、無色結晶が沈殿する。それを濾過し、少量の冷却メタノールで洗浄し、真空乾燥する。収量:融点89.8℃の無色結晶41.8g(理論量の60.6%);[I]D20=−30.7(c=1.0、エタノール)。
【0098】
2.R−(+)−[4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)−フェニル]−メタノール(4)の製造
【0099】
【化26】

【0100】
原料(3)(28g)を純粋なジエチルエーテル230mLに溶解し、撹拌しながら、水素化リチウムアルミニウム1.8gのジエチルエーテル(140mL)懸濁液に滴下する。室温で18時間撹拌後、水4.7mLを滴下する。有機相を分液し、無水硫酸ナトリウムで脱水し、濾過し、ロータリーエバポレータで濃縮乾固する。R−(+)−[4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)−フェニル]−メタノール(4)26g(理論量の98.9%)を無色油状物として得る。
【0101】
DC(2):0.32;[I]D20=+6.3(c=1.0、エタノール)。
13C−NMR(CDCl3):20.53、20.61、36.87、41.65、44.14、48.82、65.12、70.09、111.80、125.77、125.97、126.94、127.55、128.08、128.37、128.44、133.27、134.05、134.27、137.21、144.84。
【0102】
3.R−(−)−3−(3−ジイソプロピルアミノ−フェニル−プロピル)−4−ヒドロキシ安息香酸メチルエステル(5)の製造
【0103】
【化27】

【0104】
ラネーニッケル5g(水洗後、メタノールで洗浄したもの)のメタノール(200mL)中懸濁液を撹拌しながら、それにR−(−)−4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)安息香酸メチルエステル(3)10g(21.8mmol)を加える。全量(3)を完全に溶解させるため短時間加熱した後、装置を水素ガス雰囲気に放置する。常圧および室温で3時間撹拌した後、薄層クロマトグラフィーによって、変換完了が示される。取得液に窒素ガスを通し、少量の活性炭を加えた後に濾過する。メタノール溶液をロータリーエバポレータで濃縮した後に、R−(−)−3−(3−ジイソプロピルアミノ−フェニル−プロピル)−4−ヒドロキシ安息香酸メチルエステル(5)6.0g(理論量の75%)が、純度99.6%(HPLC)の無色結晶として残る。
【0105】
融点143.7℃;DSC:144.7g。
[I]D20=−26.6(c=0.93、エタノール)。
13C−NMR(CDCl3):18.74、19.21、19.62、33.12、39.68、42.36、48.64、51.42、117.99、120.32、126.23、127.81、128.85、129.39、130.26、132.21、144.06、162.43、167.35。
【0106】
4.R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール(6)の製造
【0107】
【化28】

【0108】
a)中間体段階(4)R−(+)−[4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)−フェニル]−メタノールを原料とする方法 R−(+)−[4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)−フェニル]−メタノール(19.7g、45.7mmol)をメタノール220mLおよびラネーニッケル(5g)に溶かす。装置に水素ガスを通し、取得液を室温で2日間撹拌する。追加のラネーニッケル5gを加えた後、室温でのさらに2日間の撹拌を水素雰囲気下で行い、次に触媒を濾去し、ロータリーエバポレータで濃縮乾固させる。油状の淡黄色残留物をジエチルエーテル100mLに溶かし、各回100mLの水で2回洗浄し、硫酸ナトリウムで脱水し、濾過し、濃縮乾固させる。R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール14.1g(理論量の90.4%)を、クリーム色非晶質固体の形で得る。再結晶についてはc)の項を参照する。
【0109】
b)中間段階(5)R−(−)−3−(3−ジイソプロピルアミノ−フェニル−プロピル)−4−ヒドロキシ安息香酸メチルエステルを原料とする方法
R−(−)−3−(3−ジイソプロピルアミノ−フェニル−プロピル)−4−ヒドロキシ安息香酸メチルエステル370mg(1.0mmol)の脱水テトラヒドロフラン(20mL)溶液を、脱水テトラヒドロフラン(10mL)および水素化リチウムアルミニウムの1Mテトラヒドロフラン溶液(3mL)の混合物に、室温でゆっくり加える(窒素保護ガス雰囲気下)。飽和炭酸ナトリウム溶液を滴下することで、過剰の水素化物を分解する。有機相を分液後、それをロータリーエバポレータで濃縮し、真空乾燥する。淡黄色油状物274mg(理論量の74%)が得られ、それはゆっくり固化して非晶質塊となる。
【0110】
c)再結晶
粗生成物6(1.0g)を酢酸エチルに溶解し、再度ロータリーエバポレータで濃縮する。このようにして異種溶媒(ジエチルエーテルまたはテトラヒドロフラン、上記参照)から析出したジオールに、軽く加熱しながら酢酸エチル1.5mLを加える。透明溶液が得られるまで撹拌を行い、次に室温で冷却し、シードとなる結晶数個を加える。その結晶は、HPLCによって粗取得物6を精製し、主分画を回収し、それを濃縮し、残留物を高真空下に長時間乾燥することで得られるものである。透明結晶形成が明らかに開始したら、それを−10℃で放置する。結晶を冷却下に吸引し、真空乾燥する。無色結晶を収率84%で得る。
【0111】
融点:102.3℃。
DC(1):0.57。
[I]D20=+21.3(c=1.0、エタノール)。
【0112】
13C−NMR(CDCl3):19.58、19.96、33.30、39.52、42.10、48.00、65.40、118.58、126.31、126.57、127.16、127.54、128.57、132.63、132.83、144.55、155.52。
【0113】
5.R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル(1)の製造
【0114】
【化29】

【0115】
R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール(6)(65.0g、190.3mmol)およびトリエチルアミン(20.4g、201.7mmol)の塩化メチレン(750mL)溶液に、イソブチレートクロライド(23.4g、201.7mmol)の塩化メチレン(250mL)溶液を、撹拌および冷却下に加える。添加後、撹拌を0℃でさらに15分間、次に室温で30分間行い、次に水(250mL)および5%炭酸水素ナトリウム水溶液の順で洗浄する。有機相を分液し、ロータリーエバポレータで濃縮乾固する。エステルR−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルが、無色粘稠油状物として得られる。収量:77.1g(理論量の98.4%)。
【0116】
DC(1):0.26;[I]D22=+2.7(c=1.0、エタノール)。
13C−NMR(CDCl3):19.01、19.95、20.59、21.12、34.28、36.89、41.88、42.32、43.90、48.78、64.68、122.57、125.59、126.16、126.86、127.96、128.54、136.88、138.82、143.92、147.90、175.96。
【0117】
6.R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル・フマル酸水素塩の製造
【0118】
【化30】

【0119】
R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニル−イソブチレートエステル41.87g(102mmol)の2−ブタノン(90mL)溶液に、フマル酸(11.81g、102mmol)を加熱しながら加える。酸を溶解させた後、シクロヘキサン(20〜30mL)を、混濁が開始するまで、撹拌下にゆっくり加える。無色の均一取得液を最初に室温で18時間放置し、次に0℃で数時間放置する。沈殿した無色結晶を吸引し、少量のシクロヘキサン/2−ブタノン(90:10、体積%)で洗浄し、30℃で真空乾燥する。無色フレークの形のR−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルのフマル酸水素塩44.6g(理論量の83.1%)が得られる。
【0120】
融点:98.8℃。同じ溶媒混合液からの2回目の再結晶によって、融点103℃の生成物が得られる。
[I]D20=+6.0(c=1.0、エタノール)。
【0121】
元素分析:C30H41NO7(分子量527.66)の理論値はC68.29%、H7.83%、N2.65%、O21.2%であり、実測値はC68.29%、H7.90%、N2.72%、O21.0%である。
【0122】
nm単位のΣでのUV/VIS(A1%1cm):191(1306)、193(1305)、200(1143)、220(456)。
IR:3380、2978、2939、2878、2692、2514、1756、1702、1680、1618、1496、1468、1226、1040、1019、806.
【0123】
1H−NMR(CDCl3):1.198、1.285、1.287(CH3);2.541(CHC=O);3.583(NCH);4.585(CH2OH);6.832(=CH、フマル酸);6.84〜7.62(アリール、=CH)。
【0124】
13C−NMR(CDCl3):17.79、18.95、19.16(CH3);31.63(CHCH2);34.09(CH−C=O);41.87(CHCH2);45.83(NCH2);54.29(NCH);63.78(OCH2);122.23、126.48、126.77、127.56、140.46、140.52、142.35、147.54(アリールCH);135.54(=CH、フマル酸);170.48(C=O、フマル酸);175.62(i−Pr−C=O)。
【0125】
直接導入でのMS、m/z(%):411(1)、396(9)、380(1)、223(2)、165(2)、114(100)、98(4)、91(3)、84(3)、72(10)、56(7)。
【0126】
7.R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル塩酸塩水和物の製造
【0127】
【化31】

【0128】
R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル(8.54g、25.0mmol)の塩化メチレン(50mL)溶液を、イソブチレートクロライド(2.66g、25.0mmol)の塩化メチレン(100mL)溶液を撹拌したものに0℃でゆっくり滴下する。1時間後、冷却を外し、再度の撹拌をさらに1時間行う。ロータリーエバポレータでの真空下で揮発性成分を除去した後、無色非晶質固体泡状物が残る。その残留物を水0.45〜0.50gを含むアセトン(17mL)に溶かし、明瞭な混濁開始があるまでジエチルエーテルを加える(約20〜25mL)。超音波で短時間処理すると、結晶化が自然に開始し、撹拌下に追加のジエチルエーテル80mLをゆっくり加える。沈殿無色結晶を吸引し、五塩化リンを介して終夜真空乾燥する。純度97.0%(HPLC)のR−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル塩酸塩水和物10.5g(理論量の93.7%)が得られる。
【0129】
融点:97.1℃。
[I]D20=+4.3(c=1.0、エタノール)。
13C−NMR(CDCl3):16.94、17.35、18.24、18.40、18.87、19.05、31.20、33.99、41.64、45.41、54.18、54.42、63.83、122.25、126.50、126.70、126.96、127.34、128.60、133.80、140.55、142.17、147.68、175.79。
【0130】
8.フェノールモノエステル
【0131】
【化32】

【0132】
フェノールモノエステル類製造の一般的作業説明
R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール(6)120.3mg(0.352mmol)の塩化メチレン(5mL)溶液を0℃で撹拌しながら、それに酸塩化物(0.352mmol)の塩化メチレン(2mL)溶液を滴下する。次に、トリエチルアミン−塩化メチレン(49.1μL/0.353mmol−2mL)を加える。室温で18時間後、薄層クロマトグラフィーで、変換が完了していることが示される。取得液を水5mL、0.1N塩酸水溶液、5%炭酸水素ナトリウム水溶液5mL、水5mLの順で洗浄し、硫酸ナトリウムで脱水し、濾過してから、濃縮乾固させる。それを、恒量となるまで高真空下で乾燥させる。
【0133】
この方法を用いて、以下に例示の化合物が製造される。
R=CH2CH(CH3)2
(R−(+)−3−メチル酪酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル)
収率70%で純度>95%(NMR)の無色油状物。
【0134】
13C−NMR(CDCl3):20.45、20.59、22.54、25.70、36.74、42.18、43.27、43.96、48.90、64.67、122.66、125.60、126.20、126.79、127.95、128.37、136.83、138.86、143.83、147.82、171.37。
【0135】
DC(1);0.76。
R=CH2C(CH3)3
(R−(+)−3,3−ジメチル酪酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル、遊離塩基)
収率69.7%、純度>95%(NMR)の無色油状物。
【0136】
13C−NMR(CDCl3):20.40、20.53、29.73、30.99、36.62、42.17、44.01、47.60、49.01、64.65、122.64、125.60、126.20、126.80、127.96、128.36、136.85、138.90、143.80、147.82、170.55。
【0137】
DC(1):0.75。
R=(CH3)3C
(R−(+)−3−ピバリン酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色結晶、融点:165〜6℃。
【0138】
13C−NMR(DMSO−d6=39.7ppm):16.52、16.68、17.98、18.11、26.87、31.46、41.71、45.33、53.89、53.98、62.65、122.61、122.97、125.94、126.09、126.57、126.75、127.87、128.58、131.80、134.94、141.02、142.69、147.17、155.32、163.92、176.21。
【0139】
R=c−C3H5
(R−(+)−シクロプロパンカルボン酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色ロウ状物質。
【0140】
13C−NMR(DMSO−d6=39.7ppm):173.02、172.49、172.37、153.10、147.12、142.72、142.03、140.78、136.60、134.79、134.35、129.55、129.13、128.80、128.67、127.87、126.96、126.74、125.94、125.84、124.37、123.71、122.80、62.64、53.92、45.34、41.65、31.44、18.05、16.66、12.84、9.58、9.28、8.49、7.89。
【0141】
R=c−C4H7
(R−(+)−シクロブタンカルボン酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色ロウ状物質。
【0142】
13C−NMR(DMSO−d6=39.7ppm):173.53、147.12、142.81、140.74、134.77、128.65、127.81、126.74、125.99、125.87、122.75、62.63、53.92、45.34、41.42、37.38、31.54、25.04、24.92、18.03、16.68、16.61。
【0143】
R=c−C5H9
(R−(+)−シクロペンタンカルボン酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色ロウ状物質。
【0144】
13C−NMR(DMSO−d6=39.7ppm):174.80、147.22、142.86、140.76、134.72、128.66、127.80、126.73、126.04、125.88、122、71、62.62、53.94、45.37、43.24、41.39、31.54、29.78、29.59、25.64、25.59、18.07、16.64。
【0145】
R=c−C6H11
(R−(+)−シクロヘキサンカルボン酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色ロウ状物質。
【0146】
13C−NMR(DMSO−d6=39.7ppm):174.08、147.15、142.85、140.77、134.78、l28.66、l27.77、126.74、126.06、125.87、122.69、62.61、53.91、45.36、42.26、41.24、31.53、28.74、28.62、25.48、25.04、24.98、18.05、16.67、16.60。
【0147】
R=4−(C2H5CO2)−C6H4
(R−(+)−4−エチルカルボニルオキシ安息香酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色結晶、融点:195〜8℃。
【0148】
1H−NMR(DMSO−d6):9.87(s、D2Oで置換可能な1H、NH)、8.19〜8.12(m、2H、フェニル−H)、7.55(d、J=1.0Hz、1H、フェニル−H3)、7.41〜7.13(m、9H、フェニル−H)、5.28(brs、D2Oで置換可能な1H、OH)、4.53(s、2H、CH2)、4.23(t、J=7.6Hz、1H、CH)、3.61〜3.50(m、2H、2×CH(CH3)2)、2.97〜2.74(m、2H、CH2)、2.67(q、=7.4Hz、2H、CH2)、2.56〜2.43(m、2H、CH2)、1.23〜1.13(m、15H、2×CH(CH3)2、CH3)。
【0149】
R=4−(i−C3H7CO2)−C6H4
R−(+)−4−(イソプロピルカルボニルオキシ)安息香酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩
無色結晶、融点:202〜4℃。
【0150】
1H−NMR(DMSO−d6):9.73(s、D2Oで置換可能な1H、NH)、8.19〜8.12(m、2H、フェニル−H)、7.55(d、J=1.4Hz、lH、フェニル−H3)、7.42〜7.14(m、9H、フェニル−H)、5.27(brs、D2Oで置換可能な1H、OH)、4.53(s、2H、CH2)、4.23(t、J=7.5Hz、1H、CH)、3.61〜3.50(m、2H、2×CH(CH3)2)、2.99〜2.78(m、3H、CH2、CH(CH3)2)、2.54〜2.47(m、2H、CH2)、1.29〜1.13(m、18H、3×CH(CH3)2)。
【0151】
R=4−(t−C4H9CO2)−C6H4
(R−(+)−4−(t−ブチルカルボニルオキシ)安息香酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル、遊離塩基)
無色油状物。
【0152】
1H−NMR(DMSO−d6):8.19〜8.12(m、2H、フェニル−H)、7.45〜7.33(m、3H、フェニル−H)、7.25〜7.09(m、7H、フェニル−H)、5.20(t、J=5.6Hz、1H、OH)、4.50(d、J=5.6Hz、2H、CH2)、4.20(t、J=7.5Hz、1H、CH)、2.95〜2.80(m、2H、2×CH(CH3)2)、2.38〜2.25(m、2H、CH2)、2.09〜2.03(m、2H、CH2)、1.33(s、9H、(CH3)3)、0.82〜0.76(m、12H、2×CH(CH3)2)。
【0153】
塩酸塩:無色結晶、融点165〜6℃。
1H−NMR(CDCl3):8.22〜8.16(m、2H、フェニル−H)、8.02(d、J=1.8Hz、1H、フェニル−H)、7.27〜7.02(m、9H、フェニル−H)、4.83〜4.60(「m」、2H、CH2)、4.01〜3.94(m、1H、CH)、3.66〜3.54(m、2H)、3.18〜2.80(m、3H)、2.53〜2.44(m、1H)(2×CH2、2×CH(CH3)2)、1.43〜1.25(m、21H、(CH3)3、2×CH(CH3)2)。
【0154】
R=4−(c−C3H5CO2)−C6H4
(R−(+)−4−(シクロプロピルカルボニルオキシ)安息香酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色結晶、融点:208〜213℃。
【0155】
1H−NMR(DMSO−d6):9.04(s、D2Oで置換可能な1H、NH)、8.15〜8.09(m、2H、フェニル−H)、7.53(「d」、1H、フェニル−H3)、7.42〜7.13(m、9H、フェニル−H)、5.25(brs、D2Oで置換可能な1H、OH)、4.52(s、2H、CH2)、4.23(t、J=7.5Hz、1H、CH)、3.62〜3.53(m、2H、2×CH(CH3)2)、3.05〜2.70(m、2H、CH2)、2.51〜2.37(m、2H、CH2)、2.01〜1.89(m、1H、シクロプロピル−CH)、1.20〜1.05(m、16H、2×CH(CH3)2、2×シクロプロピル−CH2)。
【0156】
13C−NMR(DMSO−d6=39.7ppm):172.71、163.93、154.92、147.16、142.69、141.03、134.97、131.76、128.60、127.86、126.76、126.56、126.06、125.94、122.95、122.65、62.65、54.00、53.89、45.33、41.63、31.49、18.10、17.98、16.69、16.51、12.86、9.52。
【0157】
R=4−(c−C4H7CO2)−C6H4
(R−(+)−4−(シクロブチルカルボニルオキシ)安息香酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色結晶、融点:201〜6℃。
【0158】
1H−NMR(DMSO−d6):9.50(s、D2Oで置換可能な1H、NH)、8.17〜8.12(m、2H、フェニル−H)、7.54(d、J=1.4Hz、lH、フェニル−H3)、7.42〜7.14(m、9H、フェニル−H)、5.25(brs、D2Oで置換可能な1H、OH)、4.52(s、2H、CH2)、4.23(t、J=7.5Hz、1H、CH)、3.62〜3.47(m、3H、シクロブチル−CH)、2×CH(CH3)2)、3.00〜2.70(m、2H、CH2)、2.51〜2.26(m、6H、CH2、2×シクロブチル−CH2)、2.10〜1.85(m、2H、シクロブチル−CH2)、1.22〜1.12(m、12H、2×CH(CH3)2)
。
【0159】
R=4−(c−C6H11CO2)−C6H4
(R−(+)−4−(シクロヘキシルカルボニルオキシ)安息香酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色結晶、融点:212〜217℃。
【0160】
1H−NMR(DMSO−d6):9.34(s、D2Oで置換可能な1H、NH)、8.16〜8.12(m、2H、フェニル−H)、7.54(d、J=1.4Hz、1H、フェニル−H3)、7.39〜7.14(m、9H、フェニル−H)、5.26(「t」、D2Oで置換可能な1H、OH)、4.53(d、J=4、2Hz、2H、CH2)、4.22(t、J=7.5Hz、1H、CH)、3.62〜3.48(m、2H、2×CH(CH3)2)、3.00〜2.60(m、3H、シクロヘキシル−CH)、CH2)、2.51〜2.40(m、2H、CH2)、2.07〜1.98(m、2H、シクロヘキシル−CH2)、1.80〜1.11(m、20H、4×シクロヘキシル−CH2)、2×CH(CH3)2)。
【0161】
9.同一ジエステル類
【0162】
【化33】

【0163】
同一ジエステル類製造の一般的作業説明
R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール(6)7.30g(21.4mmol)の塩化メチレン(100mL)溶液を0℃で撹拌しながら、酸塩化物(49.2mmol)の塩化メチレン(50mL)溶液を滴下する。トリエチルアミン−塩化メチレン(6.86mL/49.2mmol−50mL)を加える。室温で1〜3時間後、薄層クロマトグラフィーで、変換が完了したことが示される。取得液を水および0.1N塩酸水溶液各100mL、5%炭酸水素ナトリウム水溶液5mL、水5mLの順で洗浄し、硫酸ナトリウムで脱水し、濾過した後、濃縮乾固させる。それを恒量となるまで高真空乾燥する。
【0164】
この方法を用いて、以下に例示の化合物が製造される。
R=メチル
(R−(−)−酢酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル、遊離塩基)
淡黄色油状物、純度(HPLC):95.2%。
【0165】
13C−NMR(CDCl3):20.36、20.69、20.94、20.99、36.41、42.27、43.69、48.79、65.89、122.89、126.28、127.17、127.92、128.36、133.69、136.95、143.61、148.46、168.97、170.76。
【0166】
LC−MS:425(15%、M+・)、410(97%)、382(4%)、308(3%)、266(7%)、223(27%)、195(13%)、165(8%)、114(l00%)。
【0167】
[α]D20=−33.1(c=1、CH3CN)。
DC(1):0.79。
R=シクロヘキシル
(R−(+)−シクロヘキサンカルボン酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル)
淡黄色油状物、純度(HPLC):>95%。
【0168】
13C−NMR(CDCl3):20.30、25.17、25.58、25.73、28.97、29.12、41.70、43.15、44.03、48.64、65.37、122.67、125.88、126.24、127.06、127.31、127.90、128.37、134、03、136.85、143.55、148.33、174.20、175.72。
【0169】
DC(1):0.96。
R=イソプロピル
(R−(+)−イソブチレート−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル)
遊離塩基:淡黄色油状物、純度(HPLC):95.6%。
【0170】
13C−NMR(CDCl3):18.96、19.08、20.59、33.98、34.20、36.86、41.72、43.72、48.72、65.58、122.65、126.19、126.73、127.91、128.11、128.36、133.91、136.96、143.81、148.41、175.15、176.77。
【0171】
DC(1):0.74。
フマル酸水素塩:無色シロップ、94.4%HPLC純度。
13C−NMR(CDCl3):17.89、18.07、18.94、18.97、19.07、31.22、33.93、34.13、41.78、45.62、53.93、65.33、122.93、126.82、127.45、127.53、127.91、128.75、134.74、135.29、135.42、142.04、148.44、170.24、175.71、176.79。
【0172】
R=4−(t−C4H9CO2)−C6H4
(R−4−(t−ブチルカルボニルオキシ)安息香酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−(4−t−ブチルカルボニルオキシメチル安息香酸)−フェニルエステル塩酸塩)
無色結晶、融点:105〜7℃。
【0173】
13C−NMR(DMSO−d6):16.49、16.71、17.97、18.06、26.84、31.36、38.45、41.70、45.24、53.79、53.96、55.09、66.11、122.47、122.62、123.59、126.42、126.83、127.21、127.70、127.88、128.02、128.62、131.17、131.86、134.48、135.64、142.52、148.35、154.86、155.39、163.80、165.09、176.14、176.19。
【0174】
10.混合ジエステル類
【0175】
【化34】

【0176】
混合ジエステル類製造の一般的作業説明
化学式Aのフェノールモノエステル5.30mmolの塩化メチレン(40mL)溶液を0℃で撹拌しながら、それに酸塩化物(5.83mmol)の塩化メチレン(15mL)溶液を滴下する。トリエチルアミン−塩化メチレン(0.589g/5.82mmol−15mL)を加える。室温で18時間後、薄層クロマトグラフィーで、変換が完了したことが示される。取得液を水50mL、0.1N塩酸水溶液、5%炭酸水素ナトリウム水溶液5mL、水5mLの順で洗浄し、硫酸ナトリウムで脱水し、濾過した後、濃縮乾固させる。それを恒量となるまで高真空乾燥する。
【0177】
この方法を用いて、以下に例示の化合物が製造される。
R′=CH(CH3)2
R″=CH3
(R−(+)−イソブチレート−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−アセトキシメチル−フェニルエステル)
無色油状物。
【0178】
DC(1):0.56。
13C−NMR(CDCl3):19.12、20.65、21.05、34.24、37.02、41.79、43.79、48.72、65.98、122.75、125.98、126.22、127.94、128.39、128.84、133.55、137.04、143.84、148.58、170.84、175.18。
【0179】
塩酸塩:無色結晶。
13C−NMR(CDCl3):16.89、17.04、18.31、18.92、20.95、31.49、34.07、41.64、46.17、54.55、65.49、122.91、126.61、126.93、127.48、127.83、128.74、134.50、134.88、141.61、148.44、170.67、175.63。
【0180】
[α]D20=+14.6(c=1、CHCl3)。
【技術分野】
【0001】
本発明は、3,3−ジフェニルプロピルアミン類の新規誘導体の塩の、高純度、結晶性、かつ安定な化合物、その製造方法、並びに高純度で安定な中間体生成物に関する。
【背景技術】
【0002】
特許文献1の出願書類から、3,3−ジフェニルプロピルアミン類の新規誘導体は公知である。
その誘導体は、尿失禁および他の痙攣性の病訴の治療において有用なプロドラッグであり、現在使用可能な活性物質の欠点、すなわち生体膜による活性物質の不十分な吸収や活性物質の好ましくない代謝を克服するものである。
【0003】
さらにその新規プロドラッグは、オキシブチニンおよびトルテロジンと比較して、薬物動態特性が改善されている。
3,3−ジフェニルプロピルアミン類の新規誘導体群のうち、好適な化合物は、下記に示した化学式Aの構造を有する脂肪族または芳香族カルボン酸のエステルである。
【0004】
【化1】

【0005】
式中、RはC1〜C6アルキル、C3〜C10シクロアルキルまたは未置換もしくは置換フェニルを表す。これらは、ラセミ混合物としての光学異性体の形態で、さらにはそれらの個々のエナンチオマーの形態で生じ得る。
【0006】
しかしながら、化学式Aの構造を有する化合物は、水に対する溶解度が低い。それによって、経口での生体内利用率が制限される。
最後に、化学式Aで示した構造のモノエステルは、分子間エステル交換反応を起こす傾向を有する。
【0007】
従って、長期間保存すると、化学式Aの構造を有する化合物の含有量が低下するに連れて、ジエステルや遊離ジオールの増加が検出される場合がある。
基本的に、化学式Aの化合物の塩は、式Aの化合物(塩基性成分)の溶液を、好適な溶媒中で酸の溶液で精製する場合に得ることができる。しかし、固体の形態で得られる塩は、非晶質ないし吸湿性である場合があり、しかも通常の溶媒からは直接結晶化できない。
そのような塩は、貴重な医薬活性物質として製剤処理するためには不適切な化学的安定性を有する。
【0008】
驚くべきことに、化学式Aの構造を有する化合物を特殊な反応工程下で製造すると、化学式H−Xを有する生理適合的な無機酸もしくは有機酸によって、下記化学式Iを有する個別の塩に変換した場合には、上記の欠点を回避できることが認められた。ここで、−Xは個々の酸残基を表す。
【化2】

【先行技術文献】
【特許文献】
【0009】
【特許文献1】PCT/EP99/03212
【発明の概要】
【発明が解決しようとする課題】
【0010】
従って本発明における課題は、上記の欠点を回避し、医薬製剤での使用に十分に適合し、これら製剤に加工可能な塩の形態をなす3,3−ジフェニルプロピルアミン類の新規誘導体の高純度、結晶性かつ安定な化合物を提供することにある。
【0011】
本発明におけるさらに別の課題は、塩の形でのそのような高純度、結晶性、かつ安定な化合物、ならびに高純度かつ安定な中間体生成物を製造する方法を提供することにある。
本発明のさらなる課題は、上記化合物の製造方法であって、この方法による生成物の高収率、および、化学選択的または位置選択的に得ることができる個々の中間体生成物を提供する方法にある。
【課題を解決するための手段】
【0012】
上記課題は、下記化学式Iを有する塩の形態での3,3−ジフェニルプロピルアミン類の高純度、結晶性、かつ安定な化合物が提供されることにより解決される。
【0013】
【化3】

【0014】
式中、RはC1〜C6アルキル、C3〜C10シクロアルキル、置換もしくは未置換フェニルを表し、X−は生理適合性を有する無機酸もしくは有機酸の酸残基である。
本発明の態様によれば、化学式Iの塩は、塩酸、臭化水素酸、リン酸、硫酸、硝酸、酢酸、プロピオン酸、パルミチン酸、ステアリン酸、マレイン酸、フマル酸、シュウ酸、コハク酸、DL−リンゴ酸、L−(−)−リンゴ酸、D−(+)−リンゴ酸、DL−酒石酸、L−(+)−酒石酸、D−(−)−酒石酸、クエン酸、L−アスパラギン酸、L−(+)−アスコルビン酸、D−(+)−グルクロン酸、2−オキソプロピオン酸(ピルビン酸)、フラン−2−カルボン酸(粘液酸)、安息香酸、4−ヒドロキシ安息香酸、サリチル酸、バニリン酸、4−ヒドロキシケイ皮酸、没食子酸、馬尿酸(N−ベンゾイル−グリシン)、アセツル酸(Acetursaure)(N−アセチルグリシン)、フロレチン酸(Phloretinsaure)(3−(4−ヒドロキシルフェニル)−プロピオン酸)、フタル酸、メタンスルホン酸またはオロチン酸という酸の個々の酸残基X−を有し得る。
【0015】
本発明の別の態様によれば、以下の化学式2を有するR−配置化合物が提供される。
【0016】
【化4】

【0017】
式中、RはC1〜C6アルキル、C3〜C10シクロアルキル、置換もしくは未置換フェニルを表し、X−は生理的適合性を有する無機酸もしくは有機酸の残基である。
本発明の有利な態様によれば、化学式2の化合物の塩は、塩酸、臭化水素酸、リン酸、硫酸、硝酸、酢酸、プロピオン酸、パルミチン酸、ステアリン酸、マレイン酸、フマル酸、シュウ酸、コハク酸、DL−リンゴ酸、L−(−)−リンゴ酸、D−(+)−リンゴ酸、DL−酒石酸、L−(+)−酒石酸、D−(−)−酒石酸、クエン酸、L−アスパラギン酸、L−(+)−アスコルビン酸、D−(+)−グルクロン酸、2−オキソプロピオン酸(ピルビン酸)、フラン−2−カルボン酸(粘液酸)、安息香酸、4−ヒドロキシ安息香酸、サリチル酸、バニリン酸、4−ヒドロキシケイ皮酸、没食子酸、馬尿酸(N−ベンゾイル−グリシン)、アセツル酸(N−アセチルグリシン)、フロレチン酸(3−(4−ヒドロキシルフェニル)−プロピオン酸)、フタル酸、メタンスルホン酸またはオロチン酸という酸の個々の酸残基X−を有することができる。
【0018】
本発明の好適な化合物は、R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル・フマル酸水素塩、および、R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル塩酸塩水和物といった塩である。
【0019】
さらに、Rがシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、4−(1−シクロプロピル−メタノイルオキシ)−フェニル、4−(1−シクロブチル−メタノイルオキシ)−フェニル、4−(1−シクロヘキシル−メタノイルオキシ)−フェニル、または4−(2,2−ジメチル−プロパノイルオキシ)−フェニルを表し、X−が塩素イオンを表す化合物が好ましい。
【0020】
特に好ましいものとしては、[(R)−3−(2−{1−[4−(1−シクロプロピル−メタノイルオキシ)−フェニル]−メタノイルオキシ}−5−ヒドロキシメチル−フェニル)−3−フェニルプロピル]−ジイソプロピル−アンモニウムクロライド、[(R)−3−(2−{1−[4−(1−シクロブチル−メタノイルオキシ)−フェニル]−メタノイルオキシ}−5−ヒドロキシメチル−フェニル)−3−フェニルプロピル]−ジイソプロピル−アンモニウムクロライド、[(R)−3−(2−{1−[4−(1−シクロヘキシル−メタノイルオキシ)−フェニル]−メタノイルオキシ}−5−ヒドロキシメチル−フェニル)−3−フェニル−プロピル]−ジイソプロピル−アンモニウムクロライド、[(R)−3−(2−{1−[4−(2,2−ジメチル−プロパノイルオキシ)−フェニル]−メタノイルオキシ}−5−ヒドロキシメチル−フェニル)−3−フェニル−プロピル]−ジイソプロピル−アンモニウムクロライド、{(R)−3−[2−(1−シクロプロピル−メタノイルオキシ)−5−ヒドロキシメチル−フェニル]−3−フェニル−プロピル}−ジイソプロピル−アンモニウムクロライド、{(R)−3−[2−(1−シクロブチル−メタノイルオキシ)−5−ヒドロキシメチル−フェニル]−3−フェニル−プロピル}−ジイソプロピル−アンモニウムクロライド、{(R)−3−[2−(1−シクロペンチル−メタノイルオキシ)−5−ヒドロキシメチル−フェニル]−3−フェニル−プロピル}−ジイソプロピル−アンモニウムクロライド、および、{(R)−3−[2−(1−シクロヘキシル−メタノイルオキシ)−5−ヒドロキシメチル−フェニル]−3−フェニル−プロピル}−ジイソプロピル−アンモニウムクロライドがある。
【図面の簡単な説明】
【0021】
【図1】本発明による化合物を塩の形態で得る際の反応式を示す概念図。
【発明を実施するための形態】
【0022】
本発明の化合物において、「アルキル」の文言は好適には、炭素原子数1〜6個を有する直鎖または分岐の炭化水素基を示す。特に好ましいものとしては、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、ペンチルおよびヘキシルがある。「シクロアルキル」の文言は、水素原子3〜10個を有し、その水素原子に代えて好適な置換基を有することもできる環状の炭化水素基を示す。
【0023】
「フェニル」の文言は、置換または未置換であることが可能な−C6H5を指す。好適な置換基には例えば、アルキル、アルコキシ、ハロゲン、ニトロおよびアミンがあり得る。「アルコキシ」の文言は、アルキル基に関しては、「アルキル」について前述のものと同じ意味を有する。好適なハロゲンは、フッ素、塩素、臭素およびヨウ素原子である。
【0024】
本発明はさらに、化学式Iの本発明による化合物ならびに有用な中間体生成物の製造方法をも含むものである。
その方法は、化学的選択性および位置選択性を特徴とする。
【0025】
以下の化学式I
【0026】
【化5】

【0027】
を有し、式中、RはC1〜C6アルキル、C3〜C10シクロアルキル、置換もしくは未置換フェニルを表し、X−は生理的適合性を有する無機酸もしくは有機酸の酸残基である化合物は、
a)以下の化学式IIIの化合物
【0028】
【化6】

【0029】
を水素化剤で開裂させて、以下の化学式Vの化合物
【0030】
【化7】

【0031】
を形成する工程と、
b)これにより得られた式Vの化合物を還元剤で変換して、下記式VIの化合物
【0032】
【化8】

【0033】
を得る工程と、
c)それをアシル化剤で変換して、以下の化学式A
【0034】
【化9】

【0035】
を有し、式中、Rは上記の意味を有する化合物を得る工程と、
d)それを、生理的適合性を有する無機酸または有機塩で変換して、下記式I
【0036】
【化10】

【0037】
を有し、式中、RはC1〜C6アルキル、C3〜C10シクロアルキル、置換もしくは未置換フェニルを表し、X−は生理的適合性を有した無機酸もしくは有機酸の酸残基である化合物を形成する工程とにより製造される。
【0038】
本発明によれば、化学式Iの化合物の製造において、塩酸、臭化水素酸、リン酸、硫酸、硝酸、酢酸、プロピオン酸、パルミチン酸、ステアリン酸、マレイン酸、フマル酸、シュウ酸、コハク酸、DL−リンゴ酸、L−(−)−リンゴ酸、D−(+)−リンゴ酸、DL−酒石酸、L−(+)−酒石酸、D−(−)−酒石酸、クエン酸、L−アスパラギン酸、L−(+)−アスコルビン酸、D−(+)−グルクロン酸、2−オキソプロピオン酸(ピルビン酸)、フラン−2−カルボン酸(粘液酸)、安息香酸、4−ヒドロキシ安息香酸、サリチル酸、バニリン酸、4−ヒドロキシケイ皮酸、没食子酸、馬尿酸(N−ベンゾイル−グリシン)、アセツル酸(N−アセチルグリシン)、フロレチン酸(3−(4−ヒドロキシルフェニル)−プロピオン酸)、フタル酸、メタンスルホン酸またはオロチン酸を用いる。
【0039】
本発明の有利な別の展開によれば、化学式2
【0040】
【化11】

【0041】
を有し、式中、RはC1〜C6アルキル、C3〜C10シクロアルキル、置換もしくは未置換フェニルを表し、X−は生理的適合性を有する無機酸もしくは有機酸の酸残基である、R−配置化合物の製造方法が記載される。この方法は、a)以下の化学式3の化合物
【0042】
【化12】

【0043】
を水素化剤で開裂させて、以下の化学式5の化合物
【0044】
【化13】

【0045】
を形成する工程と、
b)そうして得られた化学式5の化合物を還元剤で変換して、以下の化学式6の化合物
【0046】
【化14】

【0047】
を得る工程と、
c)それをアシル化剤で変換して、以下の化学式1
【0048】
【化15】

【0049】
を有し、式中、Rは上記の意味を有する化合物を得る工程と、
d)それを、生理的適合性を有する無機酸または有機塩で変換して、以下の化学式2
【0050】
【化16】

【0051】
を有し、式中、RはC1〜C6アルキル、C3〜C10シクロアルキル、置換もしくは未置換フェニルを表し、X−は生理的適合性を有する無機酸もしくは有機酸の酸残基である化合物を形成する方法が示される。
【0052】
前記方法に従って化学式2の化合物を得る上で有利には、塩酸、臭化水素酸、リン酸、硫酸、硝酸、酢酸、プロピオン酸、パルミチン酸、ステアリン酸、マレイン酸、フマル酸、シュウ酸、コハク酸、DL−リンゴ酸、L−(−)−リンゴ酸、D−(+)−リンゴ酸、DL−酒石酸、L−(+)−酒石酸、D−(−)−酒石酸、クエン酸、L−アスパラギン酸、L−(+)−アスコルビン酸、D−(+)−グルクロン酸、2−オキソプロピオン酸(ピルビン酸)、フラン−2−カルボン酸(粘液酸)、安息香酸、4−ヒドロキシ安息香酸、サリチル酸、バニリン酸、4−ヒドロキシケイ皮酸、没食子酸、馬尿酸(N−ベンゾイル−グリシン)、アセツル酸(N−アセチルグリシン)、フロレチン酸(3−(4−ヒドロキシルフェニル)−プロピオン酸)、フタル酸、メタンスルホン酸またはオロチン酸を用いる。
【0053】
特に有利には、結晶性のR−(−)−4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)安息香酸メチルエステルから、高純度の結晶性中間体生成物R−(−)−3−(3−ジイソプロピルアミノ−フェニル−プロピル)−4−ヒドロキシ安息香酸メチルエステルを製造し、それを還元してR−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノールを得て、それを最後に好適な形でアシル化し、次に自然結晶化条件下で生理的適合性を有する無機酸または有機酸によって、個々の高純度で結晶性の安定な塩に変換する。
【0054】
使用される酸塩化物に応じて、以下の化学式1の化合物が得られる。
【0055】
【化17】

【0056】
式中、RはC1〜C6アルキル、特にはイソプロピル、C3〜C10シクロアルキル、置換もしくは未置換フェニルを表す。
本発明による化合物を塩の形態で得るには、特定の中間段階および個別に同定可能な中間体生成物による特別な反応工程が必須である。
【0057】
それは、反応図式1(図1参照)を用いて説明される。図中ではR−配置化合物を用いる変換について示してあるが、それに限定されるものではない。
その図において、3=R−(−)−4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)安息香酸メチルエステル;
4=R−(+)−[4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)−フェニル]−メタノール;
5=R−(−)−3−(3−ジイソプロピルアミノ−フェニル−プロピル)−4−ヒドロキシ安息香酸メチルエステル;
6=R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール;
1=R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニル−イソブチレートエステル;
2a=R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル・フマル酸水素塩;
2b=R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル塩酸塩水和物である。
【0058】
この実施形態に記載の反応工程によれば、予備段階化合物3(R−(−)−4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)安息香酸メチルエステル)は、純粋な結晶として製造される。
【0059】
BBr3、AlCl3などの通常の方法を用いることで、しかしながら好ましくは室温で(RT)溶媒としてのメタノール中ラネーニッケルを介して水素によって、予備段階化合物3を開裂させて5(R−(−)−3−(3−ジイソプロピルアミノ−フェニル−プロピル)−4−ヒドロキシ安息香酸メチルエステル)とする。それは高純度の結晶として得られる(融点:143.7℃)。
【0060】
最後に、NaBH4/EtOH、好ましくはLiAlH4などの好適な還元剤を用いて、5を低温下の(−78℃〜+10℃)不活性溶媒中で還元して、化合物6(R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール)を得る。化合物6は高純度で得られ、酢酸エチルなどの適切な溶媒から結晶化させることができる。得られる無色の微粒子は融点102.3℃を有する。驚くべき点として、当業界において化合物6は非晶質固体と記載されている。
【0061】
次に化合物6を、非常に良好な収率ならびに位置選択性および化学選択性でアシル化して、フェノールエステルとする。その反応は、適切な溶媒中で塩基存在下に、当量の酸塩化物を用いて、室温以下の温度で行う。適切な溶媒は、エチルアセテート、ジクロロメタン、テトラヒドロフラン、アセトニトリルまたはトルエンである。
【0062】
この反応は好ましくは、上記の温度で、酸塩化物としてイソブチリルクロライドを、および塩基としてトリエチルアミンを用いて行う。このようにして得られる1(R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル)は、適切な溶媒に対するフマル酸溶液により、自然結晶化が生じてフマル酸水素塩2aが形成されるような純度で得られる。
【0063】
この塩は103℃という高い融点を有し、室温で安定であり、非吸湿性であり、結晶化剤(Kristallosemittel )を含まない。それは所望に応じて再結晶し得る。
フマル酸に代えて無水塩酸を用いる場合も(例えばエーテル溶液として)、塩形成が起こり、結晶生成物2b(R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル塩酸塩水和物が得られる。
【0064】
さらに再結晶を行った後、生成物2bは97〜106℃の融点範囲を有する。
最後に、生成物2bは特に有利には、反応図式1の化合物6を原料とする反転反応の下記の変形例によって得ることができる。そうすることで生成物2bは、以下に記載のように、外部酸捕捉塩基を加えることなく得ることができる。
【0065】
6(R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール)の溶液を、イソブチレートクロライドに滴下すると、好適な極性条件下で無水生成物2bが急速に結晶化する。2bは非常に吸湿性である。
【0066】
上記の反応を、少なくとも1モル当量の水を含む含水溶媒中で行うと、安定で結晶性の含水生成物2bが得られ、それは上記の融解特性を有する。
化学式1および2の本発明による化合物は、バルク材料に適合する。
【0067】
特に有利なものとしては、得ることが可能な化学式III,V,VI,3,5,6,7の高純度化合物がある。
式IIIの化合物
【0068】
【化18】

【0069】
式Vの化合物
【0070】
【化19】

【0071】
式VIの化合物
【0072】
【化20】

【0073】
式3の化合物
【0074】
【化21】

【0075】
式5の化合物
【0076】
【化22】

【0077】
式6の化合物
【0078】
【化23】

【0079】
式7の化合物
【0080】
【化24】

【0081】
[(R)−3−(2−{1−[4−(2,2−ジメチル−プロパノイルオキシ)−フェニル]−メタン−オイルオキシ}−5−{1−[4−(2,2−ジメチル−プロパノイルオキシ)−フェニル]−メタン−オイルオキシメチル}−フェニル)−3−フェニル−プロピル]−ジイソプロピル−アンモニウムクロライド
上記化合物III,V,VI,3,5,6,7は、各場合において製薬上有用な化合物の製造において、高純度、結晶性、かつ安定な中間体生成物として使用することに特に適合する。
【0082】
特に有利なものは、R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル・フマル酸水素塩およびR−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル塩酸塩水和物の製造における中間体生成物として使用される化合物である。
【0083】
最後に前記方法は、エチルアセテート、ジクロロメタン、テトラヒドロフラン、アセトニトリルまたはトルエンという個々の溶媒のいずれかを使用するトリエチルアミン存在下で、当量のイソブチリルクロライドで化学式6の化合物を、R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルに変換することによって(反応図式1参照)、特に有利な方式に行うことが可能である。
【0084】
本発明によれば、R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルは、フマル酸または塩酸塩で変換して個々の塩を形成する際に特に適切である。
【0085】
以下の実施形態により、本発明を説明する。
実験
I.全般
化合物はいずれも、1Hおよび13C NMRスペクトル測定(Bruker DPX200 )によって十分に特定されている。13C−NMRスペクトラムで記載の化学シフト(50MHz、記載のppm値)は、CDCl3の溶媒共鳴(77.10ppm)を基準としたものである。1H NMRデータ(CDCl3;200MHz、ppm)は、内部テトラメチルシランを基準としたものである。
【0086】
薄層クロマトグラフィー(DC、Rf値を記載)は、5×10cmのメルク社(E. Merck)シリカゲル薄膜(60F254)で行い、蛍光消去またはアルカリ性過マンガン酸カリウム溶液噴霧によって着色して肉眼で視認可能とした。
【0087】
吸収剤は(1)n−ヘキサン/アセトン/トリエチルアミン(70/20/10、体積%);(2)トルエン/アセトン/メタノール/酢酸(70/5/20/5、体積%)とした。
【0088】
旋光度は、溶媒としてエタノールを用い、室温で波長589.3nm(ナトリムD線)で測定した(装置:パーキン・エルマー(Perkin Elmer)旋光計241型)。融点(℃表示)は未補正であり、メトラー(Mettler)FP装置で、あるいは「パイリス(Pyris)」評価ソフトウェアを用いるパーキン・エルマーDSC7型での示差熱分析(DSC)によって測定した。
【0089】
UV/VIS測定は、層厚1cmにて分光光度計λ7型(パーキン・エルマー)で行った。記載の具体的な吸収は1%溶液についてのものである(A1%1cm)。
IRスペクトラムは、パーキン・エルマーFTIRスペクトル装置1610シリーズ(分解能4cm−1)で記録した。
【0090】
ガスクロマトグラフィー質量分析(GC−MS、m/z値およびベースイオンに関しての相対強度(%))は、反応ガスとしてメタンまたはアンモニウムを用いるか、または電子衝撃イオン化を介しての陽性(P−CI)または陰性(N−CI)化学イオン化測定モードで、フィニガン(Finnigan)TSQ700トリプル(Triple)質量分析装置で行った。ヒドロキシ化合物は、トリメチルシリルエーテル誘導体として測定した。
【0091】
連結液体クロマトグラフィー質量分析(LC−MS)(ウォーターズWaters)積算システム、サーマビーム(Thermabeam)質量検出器(EI、70eV)、m/z値および相対強度(%))は、50〜500a.m.uの量範囲で得られるものである。
【0092】
II.実施形態
括弧内のアラビア数字(3)、(4)、(5)、(6)は、反応図式1での同様の呼称を指す。
【0093】
1.R−(−)−4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)安息香酸メチルエステル(3)の製造
【0094】
【化25】

【0095】
R−(−)−4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)安息香酸塩酸塩(2.30kg、4.77mol)のメタノール(26.4リットル)および濃硫酸(0.25リットル)溶液を、16時間加熱還流する。次に、溶媒の1/3を留去し、冷却し、撹拌下に氷5kgおよび25%炭酸ナトリウム水溶液2.5リットルと混合する。沈殿を最初に塩化メチレン15リットルで抽出し、次に同溶媒5リットルで抽出する。有機相を精製し、ロータリーエバポレータで濃縮乾固する。純度約90%(DC、NMR)の暗黄色油状物1.99kg(理論量の90.7%)を得る。
【0096】
DC(1):0.58。
13C−NMR(CDCl3):20.55、20.65、36.83、41.84、43.83、51.82、70.12、111.09、122.46、125.28、127.49、128.02、128.35、128.50、129.22、129.49、133.20、136.39、144.51、159.87、167.09。
【0097】
再結晶
油状原料69.0gを沸騰メタノール150mLに溶解させる。蒸留水15mLを加えた後、それを0℃で放置すると、無色結晶が沈殿する。それを濾過し、少量の冷却メタノールで洗浄し、真空乾燥する。収量:融点89.8℃の無色結晶41.8g(理論量の60.6%);[I]D20=−30.7(c=1.0、エタノール)。
【0098】
2.R−(+)−[4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)−フェニル]−メタノール(4)の製造
【0099】
【化26】

【0100】
原料(3)(28g)を純粋なジエチルエーテル230mLに溶解し、撹拌しながら、水素化リチウムアルミニウム1.8gのジエチルエーテル(140mL)懸濁液に滴下する。室温で18時間撹拌後、水4.7mLを滴下する。有機相を分液し、無水硫酸ナトリウムで脱水し、濾過し、ロータリーエバポレータで濃縮乾固する。R−(+)−[4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)−フェニル]−メタノール(4)26g(理論量の98.9%)を無色油状物として得る。
【0101】
DC(2):0.32;[I]D20=+6.3(c=1.0、エタノール)。
13C−NMR(CDCl3):20.53、20.61、36.87、41.65、44.14、48.82、65.12、70.09、111.80、125.77、125.97、126.94、127.55、128.08、128.37、128.44、133.27、134.05、134.27、137.21、144.84。
【0102】
3.R−(−)−3−(3−ジイソプロピルアミノ−フェニル−プロピル)−4−ヒドロキシ安息香酸メチルエステル(5)の製造
【0103】
【化27】

【0104】
ラネーニッケル5g(水洗後、メタノールで洗浄したもの)のメタノール(200mL)中懸濁液を撹拌しながら、それにR−(−)−4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)安息香酸メチルエステル(3)10g(21.8mmol)を加える。全量(3)を完全に溶解させるため短時間加熱した後、装置を水素ガス雰囲気に放置する。常圧および室温で3時間撹拌した後、薄層クロマトグラフィーによって、変換完了が示される。取得液に窒素ガスを通し、少量の活性炭を加えた後に濾過する。メタノール溶液をロータリーエバポレータで濃縮した後に、R−(−)−3−(3−ジイソプロピルアミノ−フェニル−プロピル)−4−ヒドロキシ安息香酸メチルエステル(5)6.0g(理論量の75%)が、純度99.6%(HPLC)の無色結晶として残る。
【0105】
融点143.7℃;DSC:144.7g。
[I]D20=−26.6(c=0.93、エタノール)。
13C−NMR(CDCl3):18.74、19.21、19.62、33.12、39.68、42.36、48.64、51.42、117.99、120.32、126.23、127.81、128.85、129.39、130.26、132.21、144.06、162.43、167.35。
【0106】
4.R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール(6)の製造
【0107】
【化28】

【0108】
a)中間体段階(4)R−(+)−[4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)−フェニル]−メタノールを原料とする方法 R−(+)−[4−ベンジルオキシ−3−(3−ジイソプロピルアミノ−1−フェニル−プロピル)−フェニル]−メタノール(19.7g、45.7mmol)をメタノール220mLおよびラネーニッケル(5g)に溶かす。装置に水素ガスを通し、取得液を室温で2日間撹拌する。追加のラネーニッケル5gを加えた後、室温でのさらに2日間の撹拌を水素雰囲気下で行い、次に触媒を濾去し、ロータリーエバポレータで濃縮乾固させる。油状の淡黄色残留物をジエチルエーテル100mLに溶かし、各回100mLの水で2回洗浄し、硫酸ナトリウムで脱水し、濾過し、濃縮乾固させる。R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール14.1g(理論量の90.4%)を、クリーム色非晶質固体の形で得る。再結晶についてはc)の項を参照する。
【0109】
b)中間段階(5)R−(−)−3−(3−ジイソプロピルアミノ−フェニル−プロピル)−4−ヒドロキシ安息香酸メチルエステルを原料とする方法
R−(−)−3−(3−ジイソプロピルアミノ−フェニル−プロピル)−4−ヒドロキシ安息香酸メチルエステル370mg(1.0mmol)の脱水テトラヒドロフラン(20mL)溶液を、脱水テトラヒドロフラン(10mL)および水素化リチウムアルミニウムの1Mテトラヒドロフラン溶液(3mL)の混合物に、室温でゆっくり加える(窒素保護ガス雰囲気下)。飽和炭酸ナトリウム溶液を滴下することで、過剰の水素化物を分解する。有機相を分液後、それをロータリーエバポレータで濃縮し、真空乾燥する。淡黄色油状物274mg(理論量の74%)が得られ、それはゆっくり固化して非晶質塊となる。
【0110】
c)再結晶
粗生成物6(1.0g)を酢酸エチルに溶解し、再度ロータリーエバポレータで濃縮する。このようにして異種溶媒(ジエチルエーテルまたはテトラヒドロフラン、上記参照)から析出したジオールに、軽く加熱しながら酢酸エチル1.5mLを加える。透明溶液が得られるまで撹拌を行い、次に室温で冷却し、シードとなる結晶数個を加える。その結晶は、HPLCによって粗取得物6を精製し、主分画を回収し、それを濃縮し、残留物を高真空下に長時間乾燥することで得られるものである。透明結晶形成が明らかに開始したら、それを−10℃で放置する。結晶を冷却下に吸引し、真空乾燥する。無色結晶を収率84%で得る。
【0111】
融点:102.3℃。
DC(1):0.57。
[I]D20=+21.3(c=1.0、エタノール)。
【0112】
13C−NMR(CDCl3):19.58、19.96、33.30、39.52、42.10、48.00、65.40、118.58、126.31、126.57、127.16、127.54、128.57、132.63、132.83、144.55、155.52。
【0113】
5.R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル(1)の製造
【0114】
【化29】

【0115】
R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール(6)(65.0g、190.3mmol)およびトリエチルアミン(20.4g、201.7mmol)の塩化メチレン(750mL)溶液に、イソブチレートクロライド(23.4g、201.7mmol)の塩化メチレン(250mL)溶液を、撹拌および冷却下に加える。添加後、撹拌を0℃でさらに15分間、次に室温で30分間行い、次に水(250mL)および5%炭酸水素ナトリウム水溶液の順で洗浄する。有機相を分液し、ロータリーエバポレータで濃縮乾固する。エステルR−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルが、無色粘稠油状物として得られる。収量:77.1g(理論量の98.4%)。
【0116】
DC(1):0.26;[I]D22=+2.7(c=1.0、エタノール)。
13C−NMR(CDCl3):19.01、19.95、20.59、21.12、34.28、36.89、41.88、42.32、43.90、48.78、64.68、122.57、125.59、126.16、126.86、127.96、128.54、136.88、138.82、143.92、147.90、175.96。
【0117】
6.R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル・フマル酸水素塩の製造
【0118】
【化30】

【0119】
R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニル−イソブチレートエステル41.87g(102mmol)の2−ブタノン(90mL)溶液に、フマル酸(11.81g、102mmol)を加熱しながら加える。酸を溶解させた後、シクロヘキサン(20〜30mL)を、混濁が開始するまで、撹拌下にゆっくり加える。無色の均一取得液を最初に室温で18時間放置し、次に0℃で数時間放置する。沈殿した無色結晶を吸引し、少量のシクロヘキサン/2−ブタノン(90:10、体積%)で洗浄し、30℃で真空乾燥する。無色フレークの形のR−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルのフマル酸水素塩44.6g(理論量の83.1%)が得られる。
【0120】
融点:98.8℃。同じ溶媒混合液からの2回目の再結晶によって、融点103℃の生成物が得られる。
[I]D20=+6.0(c=1.0、エタノール)。
【0121】
元素分析:C30H41NO7(分子量527.66)の理論値はC68.29%、H7.83%、N2.65%、O21.2%であり、実測値はC68.29%、H7.90%、N2.72%、O21.0%である。
【0122】
nm単位のΣでのUV/VIS(A1%1cm):191(1306)、193(1305)、200(1143)、220(456)。
IR:3380、2978、2939、2878、2692、2514、1756、1702、1680、1618、1496、1468、1226、1040、1019、806.
【0123】
1H−NMR(CDCl3):1.198、1.285、1.287(CH3);2.541(CHC=O);3.583(NCH);4.585(CH2OH);6.832(=CH、フマル酸);6.84〜7.62(アリール、=CH)。
【0124】
13C−NMR(CDCl3):17.79、18.95、19.16(CH3);31.63(CHCH2);34.09(CH−C=O);41.87(CHCH2);45.83(NCH2);54.29(NCH);63.78(OCH2);122.23、126.48、126.77、127.56、140.46、140.52、142.35、147.54(アリールCH);135.54(=CH、フマル酸);170.48(C=O、フマル酸);175.62(i−Pr−C=O)。
【0125】
直接導入でのMS、m/z(%):411(1)、396(9)、380(1)、223(2)、165(2)、114(100)、98(4)、91(3)、84(3)、72(10)、56(7)。
【0126】
7.R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル塩酸塩水和物の製造
【0127】
【化31】

【0128】
R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル(8.54g、25.0mmol)の塩化メチレン(50mL)溶液を、イソブチレートクロライド(2.66g、25.0mmol)の塩化メチレン(100mL)溶液を撹拌したものに0℃でゆっくり滴下する。1時間後、冷却を外し、再度の撹拌をさらに1時間行う。ロータリーエバポレータでの真空下で揮発性成分を除去した後、無色非晶質固体泡状物が残る。その残留物を水0.45〜0.50gを含むアセトン(17mL)に溶かし、明瞭な混濁開始があるまでジエチルエーテルを加える(約20〜25mL)。超音波で短時間処理すると、結晶化が自然に開始し、撹拌下に追加のジエチルエーテル80mLをゆっくり加える。沈殿無色結晶を吸引し、五塩化リンを介して終夜真空乾燥する。純度97.0%(HPLC)のR−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステル塩酸塩水和物10.5g(理論量の93.7%)が得られる。
【0129】
融点:97.1℃。
[I]D20=+4.3(c=1.0、エタノール)。
13C−NMR(CDCl3):16.94、17.35、18.24、18.40、18.87、19.05、31.20、33.99、41.64、45.41、54.18、54.42、63.83、122.25、126.50、126.70、126.96、127.34、128.60、133.80、140.55、142.17、147.68、175.79。
【0130】
8.フェノールモノエステル
【0131】
【化32】

【0132】
フェノールモノエステル類製造の一般的作業説明
R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール(6)120.3mg(0.352mmol)の塩化メチレン(5mL)溶液を0℃で撹拌しながら、それに酸塩化物(0.352mmol)の塩化メチレン(2mL)溶液を滴下する。次に、トリエチルアミン−塩化メチレン(49.1μL/0.353mmol−2mL)を加える。室温で18時間後、薄層クロマトグラフィーで、変換が完了していることが示される。取得液を水5mL、0.1N塩酸水溶液、5%炭酸水素ナトリウム水溶液5mL、水5mLの順で洗浄し、硫酸ナトリウムで脱水し、濾過してから、濃縮乾固させる。それを、恒量となるまで高真空下で乾燥させる。
【0133】
この方法を用いて、以下に例示の化合物が製造される。
R=CH2CH(CH3)2
(R−(+)−3−メチル酪酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル)
収率70%で純度>95%(NMR)の無色油状物。
【0134】
13C−NMR(CDCl3):20.45、20.59、22.54、25.70、36.74、42.18、43.27、43.96、48.90、64.67、122.66、125.60、126.20、126.79、127.95、128.37、136.83、138.86、143.83、147.82、171.37。
【0135】
DC(1);0.76。
R=CH2C(CH3)3
(R−(+)−3,3−ジメチル酪酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル、遊離塩基)
収率69.7%、純度>95%(NMR)の無色油状物。
【0136】
13C−NMR(CDCl3):20.40、20.53、29.73、30.99、36.62、42.17、44.01、47.60、49.01、64.65、122.64、125.60、126.20、126.80、127.96、128.36、136.85、138.90、143.80、147.82、170.55。
【0137】
DC(1):0.75。
R=(CH3)3C
(R−(+)−3−ピバリン酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色結晶、融点:165〜6℃。
【0138】
13C−NMR(DMSO−d6=39.7ppm):16.52、16.68、17.98、18.11、26.87、31.46、41.71、45.33、53.89、53.98、62.65、122.61、122.97、125.94、126.09、126.57、126.75、127.87、128.58、131.80、134.94、141.02、142.69、147.17、155.32、163.92、176.21。
【0139】
R=c−C3H5
(R−(+)−シクロプロパンカルボン酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色ロウ状物質。
【0140】
13C−NMR(DMSO−d6=39.7ppm):173.02、172.49、172.37、153.10、147.12、142.72、142.03、140.78、136.60、134.79、134.35、129.55、129.13、128.80、128.67、127.87、126.96、126.74、125.94、125.84、124.37、123.71、122.80、62.64、53.92、45.34、41.65、31.44、18.05、16.66、12.84、9.58、9.28、8.49、7.89。
【0141】
R=c−C4H7
(R−(+)−シクロブタンカルボン酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色ロウ状物質。
【0142】
13C−NMR(DMSO−d6=39.7ppm):173.53、147.12、142.81、140.74、134.77、128.65、127.81、126.74、125.99、125.87、122.75、62.63、53.92、45.34、41.42、37.38、31.54、25.04、24.92、18.03、16.68、16.61。
【0143】
R=c−C5H9
(R−(+)−シクロペンタンカルボン酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色ロウ状物質。
【0144】
13C−NMR(DMSO−d6=39.7ppm):174.80、147.22、142.86、140.76、134.72、128.66、127.80、126.73、126.04、125.88、122、71、62.62、53.94、45.37、43.24、41.39、31.54、29.78、29.59、25.64、25.59、18.07、16.64。
【0145】
R=c−C6H11
(R−(+)−シクロヘキサンカルボン酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色ロウ状物質。
【0146】
13C−NMR(DMSO−d6=39.7ppm):174.08、147.15、142.85、140.77、134.78、l28.66、l27.77、126.74、126.06、125.87、122.69、62.61、53.91、45.36、42.26、41.24、31.53、28.74、28.62、25.48、25.04、24.98、18.05、16.67、16.60。
【0147】
R=4−(C2H5CO2)−C6H4
(R−(+)−4−エチルカルボニルオキシ安息香酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色結晶、融点:195〜8℃。
【0148】
1H−NMR(DMSO−d6):9.87(s、D2Oで置換可能な1H、NH)、8.19〜8.12(m、2H、フェニル−H)、7.55(d、J=1.0Hz、1H、フェニル−H3)、7.41〜7.13(m、9H、フェニル−H)、5.28(brs、D2Oで置換可能な1H、OH)、4.53(s、2H、CH2)、4.23(t、J=7.6Hz、1H、CH)、3.61〜3.50(m、2H、2×CH(CH3)2)、2.97〜2.74(m、2H、CH2)、2.67(q、=7.4Hz、2H、CH2)、2.56〜2.43(m、2H、CH2)、1.23〜1.13(m、15H、2×CH(CH3)2、CH3)。
【0149】
R=4−(i−C3H7CO2)−C6H4
R−(+)−4−(イソプロピルカルボニルオキシ)安息香酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩
無色結晶、融点:202〜4℃。
【0150】
1H−NMR(DMSO−d6):9.73(s、D2Oで置換可能な1H、NH)、8.19〜8.12(m、2H、フェニル−H)、7.55(d、J=1.4Hz、lH、フェニル−H3)、7.42〜7.14(m、9H、フェニル−H)、5.27(brs、D2Oで置換可能な1H、OH)、4.53(s、2H、CH2)、4.23(t、J=7.5Hz、1H、CH)、3.61〜3.50(m、2H、2×CH(CH3)2)、2.99〜2.78(m、3H、CH2、CH(CH3)2)、2.54〜2.47(m、2H、CH2)、1.29〜1.13(m、18H、3×CH(CH3)2)。
【0151】
R=4−(t−C4H9CO2)−C6H4
(R−(+)−4−(t−ブチルカルボニルオキシ)安息香酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル、遊離塩基)
無色油状物。
【0152】
1H−NMR(DMSO−d6):8.19〜8.12(m、2H、フェニル−H)、7.45〜7.33(m、3H、フェニル−H)、7.25〜7.09(m、7H、フェニル−H)、5.20(t、J=5.6Hz、1H、OH)、4.50(d、J=5.6Hz、2H、CH2)、4.20(t、J=7.5Hz、1H、CH)、2.95〜2.80(m、2H、2×CH(CH3)2)、2.38〜2.25(m、2H、CH2)、2.09〜2.03(m、2H、CH2)、1.33(s、9H、(CH3)3)、0.82〜0.76(m、12H、2×CH(CH3)2)。
【0153】
塩酸塩:無色結晶、融点165〜6℃。
1H−NMR(CDCl3):8.22〜8.16(m、2H、フェニル−H)、8.02(d、J=1.8Hz、1H、フェニル−H)、7.27〜7.02(m、9H、フェニル−H)、4.83〜4.60(「m」、2H、CH2)、4.01〜3.94(m、1H、CH)、3.66〜3.54(m、2H)、3.18〜2.80(m、3H)、2.53〜2.44(m、1H)(2×CH2、2×CH(CH3)2)、1.43〜1.25(m、21H、(CH3)3、2×CH(CH3)2)。
【0154】
R=4−(c−C3H5CO2)−C6H4
(R−(+)−4−(シクロプロピルカルボニルオキシ)安息香酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色結晶、融点:208〜213℃。
【0155】
1H−NMR(DMSO−d6):9.04(s、D2Oで置換可能な1H、NH)、8.15〜8.09(m、2H、フェニル−H)、7.53(「d」、1H、フェニル−H3)、7.42〜7.13(m、9H、フェニル−H)、5.25(brs、D2Oで置換可能な1H、OH)、4.52(s、2H、CH2)、4.23(t、J=7.5Hz、1H、CH)、3.62〜3.53(m、2H、2×CH(CH3)2)、3.05〜2.70(m、2H、CH2)、2.51〜2.37(m、2H、CH2)、2.01〜1.89(m、1H、シクロプロピル−CH)、1.20〜1.05(m、16H、2×CH(CH3)2、2×シクロプロピル−CH2)。
【0156】
13C−NMR(DMSO−d6=39.7ppm):172.71、163.93、154.92、147.16、142.69、141.03、134.97、131.76、128.60、127.86、126.76、126.56、126.06、125.94、122.95、122.65、62.65、54.00、53.89、45.33、41.63、31.49、18.10、17.98、16.69、16.51、12.86、9.52。
【0157】
R=4−(c−C4H7CO2)−C6H4
(R−(+)−4−(シクロブチルカルボニルオキシ)安息香酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色結晶、融点:201〜6℃。
【0158】
1H−NMR(DMSO−d6):9.50(s、D2Oで置換可能な1H、NH)、8.17〜8.12(m、2H、フェニル−H)、7.54(d、J=1.4Hz、lH、フェニル−H3)、7.42〜7.14(m、9H、フェニル−H)、5.25(brs、D2Oで置換可能な1H、OH)、4.52(s、2H、CH2)、4.23(t、J=7.5Hz、1H、CH)、3.62〜3.47(m、3H、シクロブチル−CH)、2×CH(CH3)2)、3.00〜2.70(m、2H、CH2)、2.51〜2.26(m、6H、CH2、2×シクロブチル−CH2)、2.10〜1.85(m、2H、シクロブチル−CH2)、1.22〜1.12(m、12H、2×CH(CH3)2)
。
【0159】
R=4−(c−C6H11CO2)−C6H4
(R−(+)−4−(シクロヘキシルカルボニルオキシ)安息香酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル塩酸塩)
無色結晶、融点:212〜217℃。
【0160】
1H−NMR(DMSO−d6):9.34(s、D2Oで置換可能な1H、NH)、8.16〜8.12(m、2H、フェニル−H)、7.54(d、J=1.4Hz、1H、フェニル−H3)、7.39〜7.14(m、9H、フェニル−H)、5.26(「t」、D2Oで置換可能な1H、OH)、4.53(d、J=4、2Hz、2H、CH2)、4.22(t、J=7.5Hz、1H、CH)、3.62〜3.48(m、2H、2×CH(CH3)2)、3.00〜2.60(m、3H、シクロヘキシル−CH)、CH2)、2.51〜2.40(m、2H、CH2)、2.07〜1.98(m、2H、シクロヘキシル−CH2)、1.80〜1.11(m、20H、4×シクロヘキシル−CH2)、2×CH(CH3)2)。
【0161】
9.同一ジエステル類
【0162】
【化33】

【0163】
同一ジエステル類製造の一般的作業説明
R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェノール(6)7.30g(21.4mmol)の塩化メチレン(100mL)溶液を0℃で撹拌しながら、酸塩化物(49.2mmol)の塩化メチレン(50mL)溶液を滴下する。トリエチルアミン−塩化メチレン(6.86mL/49.2mmol−50mL)を加える。室温で1〜3時間後、薄層クロマトグラフィーで、変換が完了したことが示される。取得液を水および0.1N塩酸水溶液各100mL、5%炭酸水素ナトリウム水溶液5mL、水5mLの順で洗浄し、硫酸ナトリウムで脱水し、濾過した後、濃縮乾固させる。それを恒量となるまで高真空乾燥する。
【0164】
この方法を用いて、以下に例示の化合物が製造される。
R=メチル
(R−(−)−酢酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル、遊離塩基)
淡黄色油状物、純度(HPLC):95.2%。
【0165】
13C−NMR(CDCl3):20.36、20.69、20.94、20.99、36.41、42.27、43.69、48.79、65.89、122.89、126.28、127.17、127.92、128.36、133.69、136.95、143.61、148.46、168.97、170.76。
【0166】
LC−MS:425(15%、M+・)、410(97%)、382(4%)、308(3%)、266(7%)、223(27%)、195(13%)、165(8%)、114(l00%)。
【0167】
[α]D20=−33.1(c=1、CH3CN)。
DC(1):0.79。
R=シクロヘキシル
(R−(+)−シクロヘキサンカルボン酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル)
淡黄色油状物、純度(HPLC):>95%。
【0168】
13C−NMR(CDCl3):20.30、25.17、25.58、25.73、28.97、29.12、41.70、43.15、44.03、48.64、65.37、122.67、125.88、126.24、127.06、127.31、127.90、128.37、134、03、136.85、143.55、148.33、174.20、175.72。
【0169】
DC(1):0.96。
R=イソプロピル
(R−(+)−イソブチレート−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルエステル)
遊離塩基:淡黄色油状物、純度(HPLC):95.6%。
【0170】
13C−NMR(CDCl3):18.96、19.08、20.59、33.98、34.20、36.86、41.72、43.72、48.72、65.58、122.65、126.19、126.73、127.91、128.11、128.36、133.91、136.96、143.81、148.41、175.15、176.77。
【0171】
DC(1):0.74。
フマル酸水素塩:無色シロップ、94.4%HPLC純度。
13C−NMR(CDCl3):17.89、18.07、18.94、18.97、19.07、31.22、33.93、34.13、41.78、45.62、53.93、65.33、122.93、126.82、127.45、127.53、127.91、128.75、134.74、135.29、135.42、142.04、148.44、170.24、175.71、176.79。
【0172】
R=4−(t−C4H9CO2)−C6H4
(R−4−(t−ブチルカルボニルオキシ)安息香酸−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−(4−t−ブチルカルボニルオキシメチル安息香酸)−フェニルエステル塩酸塩)
無色結晶、融点:105〜7℃。
【0173】
13C−NMR(DMSO−d6):16.49、16.71、17.97、18.06、26.84、31.36、38.45、41.70、45.24、53.79、53.96、55.09、66.11、122.47、122.62、123.59、126.42、126.83、127.21、127.70、127.88、128.02、128.62、131.17、131.86、134.48、135.64、142.52、148.35、154.86、155.39、163.80、165.09、176.14、176.19。
【0174】
10.混合ジエステル類
【0175】
【化34】

【0176】
混合ジエステル類製造の一般的作業説明
化学式Aのフェノールモノエステル5.30mmolの塩化メチレン(40mL)溶液を0℃で撹拌しながら、それに酸塩化物(5.83mmol)の塩化メチレン(15mL)溶液を滴下する。トリエチルアミン−塩化メチレン(0.589g/5.82mmol−15mL)を加える。室温で18時間後、薄層クロマトグラフィーで、変換が完了したことが示される。取得液を水50mL、0.1N塩酸水溶液、5%炭酸水素ナトリウム水溶液5mL、水5mLの順で洗浄し、硫酸ナトリウムで脱水し、濾過した後、濃縮乾固させる。それを恒量となるまで高真空乾燥する。
【0177】
この方法を用いて、以下に例示の化合物が製造される。
R′=CH(CH3)2
R″=CH3
(R−(+)−イソブチレート−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−アセトキシメチル−フェニルエステル)
無色油状物。
【0178】
DC(1):0.56。
13C−NMR(CDCl3):19.12、20.65、21.05、34.24、37.02、41.79、43.79、48.72、65.98、122.75、125.98、126.22、127.94、128.39、128.84、133.55、137.04、143.84、148.58、170.84、175.18。
【0179】
塩酸塩:無色結晶。
13C−NMR(CDCl3):16.89、17.04、18.31、18.92、20.95、31.49、34.07、41.64、46.17、54.55、65.49、122.91、126.61、126.93、127.48、127.83、128.74、134.50、134.88、141.61、148.44、170.67、175.63。
【0180】
[α]D20=+14.6(c=1、CHCl3)。
【特許請求の範囲】
【請求項1】
(±)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルまたはR−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルと、生理的適合性を有する酸との塩。
【請求項2】
生理的適合性を有する酸が有機酸である、請求項1の塩。
【請求項3】
結晶形態にある、請求項1または2の塩。
【請求項4】
(±)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルと生理的適合性を有する酸との塩の製造法であって、
a)以下の化学式III
【化1】

を有する化合物を水素化剤で開裂させて、以下の化学式V
【化2】

を有する化合物を形成する工程;
b)このように得られた化学式Vの化合物を還元剤で変換して、以下の化学式VI
【化3】

を有する化合物を与える工程;
c)前記工程b)で得られた化合物をイソブチリルハライドであるアシル化剤で変換して、以下の化学式A
【化4】

[式中、Rはイソプロピルを示す]を有する化合物を与える工程;および
d)前記工程c)で得られた化合物を、生理的適合性の塩と反応させる工程、
を含む、上記塩の製造法。
【請求項5】
R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルと生理的適合性を有する酸との塩の製造法であって、
a)以下の化学式3
【化5】

を有する化合物を水素化剤で開裂させて、以下の化学式5
【化6】

を有する化合物を形成する工程;
b)このように得られた化学式5の化合物を還元剤で変換して、以下の化学式6
【化7】

を有する化合物を与える工程;
c)前記工程b)で得られた化合物をイソブチリルハライドであるアシル化剤で変換して、以下の化学式1
【化8】

[式中、Rはイソプロピルを示す]を有する化合物を与える工程;および
d)前記工程c)で得られた化合物を、生理的適合性の塩と反応させる工程、
を含む、上記塩の製造法。
【請求項6】
生理的適合性を有する酸が有機酸である、請求項4または5の塩の製造法。
【請求項7】
塩が結晶形態にある、請求項4から6のいずれかの塩の製造法。
【請求項8】
水素化剤として、メタノールを溶媒とするラネーニッケル/H2を使用する、請求項4から7のいずれかの塩の製造法。
【請求項9】
還元剤として、NaBH4/EtOHまたはLiAlH4を使用する、請求項4から8のいずれかの塩の製造法。
【請求項10】
エチルアセテート、ジクロロメタン、テトラヒドロフラン、アセトニトリルまたはトルエンの個々の溶媒のうちのいずれかを使用したトリエチルアミン存在下にて、当量のイソブチリルクロライドで化学式6の化合物を位置選択的および化学選択的に、R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルに変換する請求項5から9のいずれかの塩の製造法。
【請求項1】
(±)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルまたはR−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルと、生理的適合性を有する酸との塩。
【請求項2】
生理的適合性を有する酸が有機酸である、請求項1の塩。
【請求項3】
結晶形態にある、請求項1または2の塩。
【請求項4】
(±)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルと生理的適合性を有する酸との塩の製造法であって、
a)以下の化学式III
【化1】

を有する化合物を水素化剤で開裂させて、以下の化学式V
【化2】

を有する化合物を形成する工程;
b)このように得られた化学式Vの化合物を還元剤で変換して、以下の化学式VI
【化3】

を有する化合物を与える工程;
c)前記工程b)で得られた化合物をイソブチリルハライドであるアシル化剤で変換して、以下の化学式A
【化4】

[式中、Rはイソプロピルを示す]を有する化合物を与える工程;および
d)前記工程c)で得られた化合物を、生理的適合性の塩と反応させる工程、
を含む、上記塩の製造法。
【請求項5】
R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルと生理的適合性を有する酸との塩の製造法であって、
a)以下の化学式3
【化5】

を有する化合物を水素化剤で開裂させて、以下の化学式5
【化6】

を有する化合物を形成する工程;
b)このように得られた化学式5の化合物を還元剤で変換して、以下の化学式6
【化7】

を有する化合物を与える工程;
c)前記工程b)で得られた化合物をイソブチリルハライドであるアシル化剤で変換して、以下の化学式1
【化8】

[式中、Rはイソプロピルを示す]を有する化合物を与える工程;および
d)前記工程c)で得られた化合物を、生理的適合性の塩と反応させる工程、
を含む、上記塩の製造法。
【請求項6】
生理的適合性を有する酸が有機酸である、請求項4または5の塩の製造法。
【請求項7】
塩が結晶形態にある、請求項4から6のいずれかの塩の製造法。
【請求項8】
水素化剤として、メタノールを溶媒とするラネーニッケル/H2を使用する、請求項4から7のいずれかの塩の製造法。
【請求項9】
還元剤として、NaBH4/EtOHまたはLiAlH4を使用する、請求項4から8のいずれかの塩の製造法。
【請求項10】
エチルアセテート、ジクロロメタン、テトラヒドロフラン、アセトニトリルまたはトルエンの個々の溶媒のうちのいずれかを使用したトリエチルアミン存在下にて、当量のイソブチリルクロライドで化学式6の化合物を位置選択的および化学選択的に、R−(+)−2−(3−ジイソプロピルアミノ−1−フェニルプロピル)−4−ヒドロキシメチルフェニルイソブチレートエステルに変換する請求項5から9のいずれかの塩の製造法。
【図1】




【公開番号】特開2011−148824(P2011−148824A)
【公開日】平成23年8月4日(2011.8.4)
【国際特許分類】
【出願番号】特願2011−96911(P2011−96911)
【出願日】平成23年4月25日(2011.4.25)
【分割の表示】特願2010−98844(P2010−98844)の分割
【原出願日】平成12年11月15日(2000.11.15)
【出願人】(591071997)ウーツェーベー ファルマ ゲーエムベーハー (39)
【氏名又は名称原語表記】UCB PHARMA GMBH
【住所又は居所原語表記】Alfred−Nobel−Strasse 10, D−40789 Monheim, Germany
【Fターム(参考)】
【公開日】平成23年8月4日(2011.8.4)
【国際特許分類】
【出願日】平成23年4月25日(2011.4.25)
【分割の表示】特願2010−98844(P2010−98844)の分割
【原出願日】平成12年11月15日(2000.11.15)
【出願人】(591071997)ウーツェーベー ファルマ ゲーエムベーハー (39)
【氏名又は名称原語表記】UCB PHARMA GMBH
【住所又は居所原語表記】Alfred−Nobel−Strasse 10, D−40789 Monheim, Germany
【Fターム(参考)】
[ Back to top ]

