5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタート及びソラノンの製造法
【課題】 ソラノンの重要中間体である5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを入手容易な出発原料を用いて、実用的に製造する方法、ひいては、ソラノンを実用的に製造する方法を提供する。
【解決手段】 リモネンオキサイドを出発原料として、過ヨウ素酸での酸化的開裂、ジメチルアセタール保護、還元、水酸基のアセチル化、接触水素添加を逐次行うことによって5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを得ることを特徴とする5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートの製造方法。
【解決手段】 リモネンオキサイドを出発原料として、過ヨウ素酸での酸化的開裂、ジメチルアセタール保護、還元、水酸基のアセチル化、接触水素添加を逐次行うことによって5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを得ることを特徴とする5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートの製造方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、タバコ香料の香喫味成分の一つであるソラノンの合成中間体である5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートの製造法、及び該中間体からのソラノンの製造法に関する。
【背景技術】
【0002】
以下のような構造を有するソラノン((E)−5−イソプロピル−8−メチルノナ−6,8−ジエン−2−オン)はタバコから単離されたテルペノイドであり、タバコの香喫味に大きく影響を与えるタバコ香料として知られている。
【0003】
【化1】

【0004】
ソラノンの製造法としては、下記に示される製造法などが知られている。
【0005】
The Journal of Organic Chemistry, 1965年, 第30巻, 2918〜2921頁に記載のようにイソバレルアルデヒドを出発原料とし、数工程の後に得られる2−イソプロピル−4−シアノブチルアルデヒドに対してウィッティヒ反応する工程を経由する製造法(製造法1)。
【0006】
Journal of the Chemical Society, Chemical Communications, 1981年, 951〜952頁に記載されているp−メンテンを光酸化して、ジクロロケトン化合物とし、数段階の後にアセチレンアセタール化合物を経由する製造法(製造法2)。
【0007】
Bulletin of the Korean Chemical Society, 1993年、第14巻, 639〜641頁に記載のようにエチル=イソバレラートをエノール化して3−ブロモプロパンニトリルと反応させてエチル=2−(2´−シアノエチル)−3−メチルブタノアートとし、4工程の後に得られるジエンニトリル化合物をグリニヤール反応させてソラノンを得る製造法(製造法3)。
【0008】
特開昭64−66137号公報に記載のようにp−メンテンをオゾン酸化、還元、アセタール化して得られる5−イソプロピル−7,7−ジメトキシヘプタン−2−オンを水素化し、続いて生じたアルコールをアセチル化した5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを経由する製造法(製造法4)。
【発明の概要】
【発明が解決しようとする課題】
【0009】
しかしながら、製造法1には、原料のイソバレルアルデヒドに特有の強い悪臭がソラノンに移ってしまい、香料としての価値を著しく低下させてしまうという問題点がある。
【0010】
製造法2には、現在、入手が困難なp−メンテンを出発原料に用いているという問題点や工業的に不利な光酸化反応を使っているという問題点がある。
【0011】
製造法3には、エチル=2−(2´−シアノエチル)−3−メチルブタノアートを得る工程で発がん性が指摘されているヘキサメチルリン酸トリアミドを使用し、また、グリニヤール反応で発がん性を疑われるベンゼンを使用しているため安全面と環境面に問題点がある。
【0012】
製造法4には、ソラノンの製造方法で重要な中間体の一つである5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを合成する過程で、現在、入手が困難なp−メンテンを出発原料に用いているという問題点や爆発の危険性を有するオゾニドが生成するオゾン反応を用いているため、安全面、設備面の負担が大きいという問題点がある。
【0013】
上記4つの製造法は、ソラノンやソラノン製造の中間体5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを製造する過程で様々な問題点があり、実用的な製造法としては不十分である。
【0014】
したがって、本発明の目的は、ソラノンの重要中間体である5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを入手容易な出発原料を用いて、実用的に製造できる方法を提供することにある。また、5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートが実用的に製造できることにより、ソラノンを実用的に製造することを可能にする。
【0015】
なお、本発明によって得られた5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートは、公知の方法によって、例えば、特許文献1に記載の方法によって容易にソラノンへ導くことが出来る。具体例を挙げると、まず、5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを酸存在下で加水分解した後に、イソプロペニルマグネシウムブロミドと反応させて7−ヒドロキシ−5−イソプロピル−8−メチルノナ−8−エン−2−イル=アセタートとする。次に、7−ヒドロキシ−5−イソプロピル−8−メチルノナ−8−エン−2−イル=アセタートを塩基存在下、メシルクロリドと反応させた後に、極性有機溶媒中で3級アミンの存在下で過熱反応させて、5−イソプロピル−8−メチルノナ−6,8−ジエン−2−イル=アセタートを得る。最後に、5−イソプロピル−8−メチルノナ−6,8−ジエン−2−イル=アセタートをアルカリの存在下で加水分解し、酸化剤の存在下で酸化するとソラノンを得ることが出来る。
【課題を解決するための手段】
【0016】
本発明者は、上記課題を解決するために鋭意検討を行った結果、出発原料として、リモネンオキサイドを用いることにより、実用的に、かつ、オゾン反応を使用しないことにより安全で設備のコスト負担を低く抑えて、5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを製造することができ、ひいては、ソラノンを実用的に製造することができることを見出し、本発明を完成するに至った。
【0017】
詳細には、本発明者は、リモネンオキサイドを出発原料として、過ヨウ素酸での酸化的開裂、ジメチルアセタール保護、還元、水酸基のアセチル化、接触水素添加を逐次行うことによって、5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを得ることができることを見出した。
【0018】
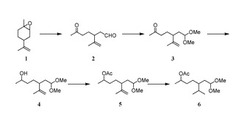
より具体的には、本発明者は、図1に示すようにリモネンオキサイド(式1)を過ヨウ素酸で酸化的に開裂させて6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナール(式2)を得る第1工程、6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナールをジメチルアセタール保護して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オン(式3)を得る第2工程、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オンを還元して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オール(式4)を得る第3工程、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールの水酸基をアセチル化して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタート(式5)を得る第4工程、及び5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートを接触水素添加によって5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタート(式6)を得る第5工程の全5工程で5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを製造できることを見出した。
【0019】
以下、本発明にかかる5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートの製造法についてさらに詳細に説明する。
【0020】
第1工程は、リモネンオキサイドを過ヨウ素酸で酸化的に開裂させて6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナールを得る。出発原料として使用するリモネンオキサイドは、市販されており入手が容易であり、実用的な製造法に適した原料である。過ヨウ素酸の使用量は、リモネンオキサイドに対して若干多く使用するのが望ましく、具体的には、リモネンオキサイドに対してモル比で1.01〜1.50当量使用する。溶媒は、反応に影響を与えず、過ヨウ素酸を可溶する溶媒を用いる。好ましくは、例えば、テトラヒドロフランなどのエーテル系の溶媒が使用できる。反応温度は、通常低温で行ない、具体的には0〜15℃の範囲で行なう。反応時間は、反応の進行状況によるが、一般的に30分から2時間程度要する。反応終了後、有機溶剤で抽出し、有機層を洗浄し、減圧濃縮を行なうと、6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナールが得られる。必要に応じて、蒸留あるいはカラムクロマトグラフィー等で精製できる。
【0021】
第2工程は、6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナールをジメチルアセタール保護して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オンを得る。この保護反応は、酸触媒存在下、メタノール溶媒中で反応させることにより行なう。酸触媒としては、例えば、蟻酸、酢酸、プロピオン酸、p−トルエンスルホン酸、塩酸、硫酸、リン酸、塩化アンモニウムなどが利用できる。酸触媒の使用量は、6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナールに対して、モル比で0.01〜0.5当量の範囲である。反応温度は、0〜60℃の範囲であり、一般的には反応温度が高くなるにつれて反応時間は短くなる。反応時間は、反応温度や触媒量等に影響を受けるが、30分〜8時間程度となる。反応終了後、有機溶剤で抽出し、有機層を洗浄し、減圧濃縮を行なうと、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オンが得られる。必要に応じて、蒸留あるいはカラムクロマトグラフィー等で精製できる。
【0022】
第3工程は、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オンを還元して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールを得る。この還元反応で使用する還元剤は、水素化ホウ素ナトリウム、水素化アルミニウムリチウム、水素化ジイソブチルアルミニウム等が望ましい。還元剤の使用量は、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オンに対して、モル比で1〜2当量の範囲である。使用する溶媒は、還元剤により好適な溶媒は変わるが、例えば、エタノール、ジエチルエーテル、テトラヒドロフラン、トルエン、ジクロロメタン等の中から適宜選択できる。反応温度は、一般的に低温であり、望ましくは0〜30℃の範囲である。反応時間は、還元剤の種類や使用量等により変化するが、1〜8時間程度である。反応終了後、有機溶剤で抽出し、有機層を洗浄し、減圧濃縮を行なうと、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールが得られる。必要に応じて、蒸留あるいはカラムクロマトグラフィー等で精製できる。
【0023】
第4工程は、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールの水酸基をアセチル化して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートを得る。このアセチル化反応は、塩基存在下、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールにアセチル化剤を加えることにより反応する。使用できるアセチル化剤は、無水酢酸や塩化アセチル等がある。アセチル化剤の使用量は、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールより過剰に使用するのが望ましく、好ましくは5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールに対して、モル比で1.1〜2当量である。塩基としては、ピリジンやトリエチルアミン等が使用でき、4−ジメチルアミノピリジンを添加することにより反応速度が速くなることがある。
【0024】
塩基の使用量は、アセチル化剤より過剰に用いる必要があり、具体的にはアセチル化剤に対して、モル比で1.5〜10当量程度使用するのが望ましい。この反応で使用できる溶媒は、反応を妨げるものでなければ任意に使用でき、また、溶媒を使用しなくても反応は進行する。反応温度は、0〜30℃の範囲が好適である。反応終了後、有機溶剤で抽出し、有機層を洗浄し、減圧濃縮を行なうと、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートが得られる。必要に応じて、蒸留あるいはカラムクロマトグラフィー等で精製できる。
【0025】
第5工程は、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートを接触水素添加によって5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを得る。接触水素添加反応は、触媒と溶媒の懸濁液に5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートを加え、反応系内を水素で充填することで行なわれる。使用する触媒は、ラネーニッケル、ラネーコバルト、パラジウムカーボン、酸化白金等が使用できる。触媒の使用量は、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートに対して、重量比で0.01〜0.2当量である。使用する溶媒は、メタノール、エタノール、酢酸エチル等が好適であり、溶媒の使用量は任意に決めることができる。反応温度は、5〜50℃程度が好適である。水素圧は、1〜10気圧程度の範囲が好適である。反応終了後、ろ過し、ろ液を減圧濃縮すると、5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートが得られる。必要に応じて、蒸留あるいはカラムクロマトグラフィー等で精製できる。
【発明の効果】
【0026】
本発明によれば、入手容易な出発物質リモネンオキサイドを使用することにより実用的製造を可能にし、また、オゾン反応を使用しないことにより、安全で設備のコスト負担を低く抑えて5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを製造することが可能となり、ソラノンを実用的に製造することができるようになる。
【図面の簡単な説明】
【0027】
【図1】本発明に係る5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートの製造工程を示した図。
【発明を実施するための形態】
【0028】
以下に実施例を用いて本発明を詳細に説明するが、本発明はこれに限定されるものではない。
【実施例】
【0029】
(第1工程)
過ヨウ素酸二水和物(35.8g)のテトラヒドロフラン(300ml)溶液を入れた反応容器を氷水で冷却し、リモネンオキサイド(20.0g)のジエチルエーテル(50ml)溶液をゆっくりと滴下した。滴下後、1時間攪拌し、飽和炭酸水素ナトリウム水溶液を加え、反応を終了させた。ジエチルエーテルで抽出し、有機層をチオ硫酸水溶液、飽和塩化ナトリウム水溶液の順に洗浄し、無水硫酸マグネシウムで乾燥し、減圧濃縮することにより、6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナール(16.1g)を得た。
【0030】
(第2工程)
6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナール(16.1g)のメタノール(200ml)溶液に塩化アンモニウム(2.0g)を加え、50℃で1時間攪拌した。反応溶液を室温まで冷却した後に、水で希釈し、ジエチルエーテルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液の順に洗浄し、無水硫酸マグネシウムで乾燥し、減圧濃縮することにより、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オン(20.0g)を得た。
【0031】
(第3工程)
5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オン(20.0g)のメタノール(100ml)溶液を氷水で冷却し、水素化ホウ素ナトリウム(4.3g)を数回に分けて加えた。自然と室温まで昇温させながら2時間攪拌した後、水を加えて反応を終了させた。ジエチルエーテルで抽出し、有機層を飽和塩化ナトリウム水溶液で洗浄し、無水硫酸マグネシウムで乾燥し、減圧濃縮することにより、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オール(16.8g)を得た。
【0032】
(第4工程)
5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オール(16.8g)のピリジン(80ml)溶液を氷水で冷却し、無水酢酸(12.6g)と4−ジメチルアミノピリジン(500mg)を加え、自然と室温まで昇温させながら終夜攪拌した。飽和炭酸水素水溶液を加えて反応を終了させた後、ジエチルエーテルで抽出した。得られた有機層を飽和硫酸銅(II)水溶液、水、飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液の順に洗浄し、無水硫酸マグネシウムで乾燥し、減圧濃縮した。得られた残渣をシリカゲルクロマトグラフィーによって精製し、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタート(16.7g)を得た。
【0033】
(第5工程)
10%パラジウム―炭素(1.0g)のメタノール(80ml)懸濁液に5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタート(16.7g)加え、反応容器を水素に置換した。水素雰囲気下、室温で7時間激しく攪拌を行い、反応液をろ過した。ろ液を減圧濃縮することにより、5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタート(16.7g)を得た。
【符号の説明】
【0034】
1 リモネンオキサイド
2 6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナール
3 5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オン
4 5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オール
5 5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタート
6 5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタート
【先行技術文献】
【特許文献】
【0035】
【特許文献1】特開昭64−66137号公報
【非特許文献】
【0036】
【非特許文献1】The Journal of Organic Chemistry, 1965年, 第30巻, 2918〜2921頁
【非特許文献2】Journal of the Chemical Society, Chemical Communications, 1981年, 951〜952頁
【非特許文献3】Bulletin of the Korean Chemical Society, 1993年、第14巻, 639〜641頁
【技術分野】
【0001】
本発明は、タバコ香料の香喫味成分の一つであるソラノンの合成中間体である5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートの製造法、及び該中間体からのソラノンの製造法に関する。
【背景技術】
【0002】
以下のような構造を有するソラノン((E)−5−イソプロピル−8−メチルノナ−6,8−ジエン−2−オン)はタバコから単離されたテルペノイドであり、タバコの香喫味に大きく影響を与えるタバコ香料として知られている。
【0003】
【化1】

【0004】
ソラノンの製造法としては、下記に示される製造法などが知られている。
【0005】
The Journal of Organic Chemistry, 1965年, 第30巻, 2918〜2921頁に記載のようにイソバレルアルデヒドを出発原料とし、数工程の後に得られる2−イソプロピル−4−シアノブチルアルデヒドに対してウィッティヒ反応する工程を経由する製造法(製造法1)。
【0006】
Journal of the Chemical Society, Chemical Communications, 1981年, 951〜952頁に記載されているp−メンテンを光酸化して、ジクロロケトン化合物とし、数段階の後にアセチレンアセタール化合物を経由する製造法(製造法2)。
【0007】
Bulletin of the Korean Chemical Society, 1993年、第14巻, 639〜641頁に記載のようにエチル=イソバレラートをエノール化して3−ブロモプロパンニトリルと反応させてエチル=2−(2´−シアノエチル)−3−メチルブタノアートとし、4工程の後に得られるジエンニトリル化合物をグリニヤール反応させてソラノンを得る製造法(製造法3)。
【0008】
特開昭64−66137号公報に記載のようにp−メンテンをオゾン酸化、還元、アセタール化して得られる5−イソプロピル−7,7−ジメトキシヘプタン−2−オンを水素化し、続いて生じたアルコールをアセチル化した5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを経由する製造法(製造法4)。
【発明の概要】
【発明が解決しようとする課題】
【0009】
しかしながら、製造法1には、原料のイソバレルアルデヒドに特有の強い悪臭がソラノンに移ってしまい、香料としての価値を著しく低下させてしまうという問題点がある。
【0010】
製造法2には、現在、入手が困難なp−メンテンを出発原料に用いているという問題点や工業的に不利な光酸化反応を使っているという問題点がある。
【0011】
製造法3には、エチル=2−(2´−シアノエチル)−3−メチルブタノアートを得る工程で発がん性が指摘されているヘキサメチルリン酸トリアミドを使用し、また、グリニヤール反応で発がん性を疑われるベンゼンを使用しているため安全面と環境面に問題点がある。
【0012】
製造法4には、ソラノンの製造方法で重要な中間体の一つである5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを合成する過程で、現在、入手が困難なp−メンテンを出発原料に用いているという問題点や爆発の危険性を有するオゾニドが生成するオゾン反応を用いているため、安全面、設備面の負担が大きいという問題点がある。
【0013】
上記4つの製造法は、ソラノンやソラノン製造の中間体5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを製造する過程で様々な問題点があり、実用的な製造法としては不十分である。
【0014】
したがって、本発明の目的は、ソラノンの重要中間体である5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを入手容易な出発原料を用いて、実用的に製造できる方法を提供することにある。また、5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートが実用的に製造できることにより、ソラノンを実用的に製造することを可能にする。
【0015】
なお、本発明によって得られた5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートは、公知の方法によって、例えば、特許文献1に記載の方法によって容易にソラノンへ導くことが出来る。具体例を挙げると、まず、5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを酸存在下で加水分解した後に、イソプロペニルマグネシウムブロミドと反応させて7−ヒドロキシ−5−イソプロピル−8−メチルノナ−8−エン−2−イル=アセタートとする。次に、7−ヒドロキシ−5−イソプロピル−8−メチルノナ−8−エン−2−イル=アセタートを塩基存在下、メシルクロリドと反応させた後に、極性有機溶媒中で3級アミンの存在下で過熱反応させて、5−イソプロピル−8−メチルノナ−6,8−ジエン−2−イル=アセタートを得る。最後に、5−イソプロピル−8−メチルノナ−6,8−ジエン−2−イル=アセタートをアルカリの存在下で加水分解し、酸化剤の存在下で酸化するとソラノンを得ることが出来る。
【課題を解決するための手段】
【0016】
本発明者は、上記課題を解決するために鋭意検討を行った結果、出発原料として、リモネンオキサイドを用いることにより、実用的に、かつ、オゾン反応を使用しないことにより安全で設備のコスト負担を低く抑えて、5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを製造することができ、ひいては、ソラノンを実用的に製造することができることを見出し、本発明を完成するに至った。
【0017】
詳細には、本発明者は、リモネンオキサイドを出発原料として、過ヨウ素酸での酸化的開裂、ジメチルアセタール保護、還元、水酸基のアセチル化、接触水素添加を逐次行うことによって、5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを得ることができることを見出した。
【0018】
より具体的には、本発明者は、図1に示すようにリモネンオキサイド(式1)を過ヨウ素酸で酸化的に開裂させて6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナール(式2)を得る第1工程、6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナールをジメチルアセタール保護して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オン(式3)を得る第2工程、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オンを還元して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オール(式4)を得る第3工程、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールの水酸基をアセチル化して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタート(式5)を得る第4工程、及び5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートを接触水素添加によって5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタート(式6)を得る第5工程の全5工程で5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを製造できることを見出した。
【0019】
以下、本発明にかかる5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートの製造法についてさらに詳細に説明する。
【0020】
第1工程は、リモネンオキサイドを過ヨウ素酸で酸化的に開裂させて6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナールを得る。出発原料として使用するリモネンオキサイドは、市販されており入手が容易であり、実用的な製造法に適した原料である。過ヨウ素酸の使用量は、リモネンオキサイドに対して若干多く使用するのが望ましく、具体的には、リモネンオキサイドに対してモル比で1.01〜1.50当量使用する。溶媒は、反応に影響を与えず、過ヨウ素酸を可溶する溶媒を用いる。好ましくは、例えば、テトラヒドロフランなどのエーテル系の溶媒が使用できる。反応温度は、通常低温で行ない、具体的には0〜15℃の範囲で行なう。反応時間は、反応の進行状況によるが、一般的に30分から2時間程度要する。反応終了後、有機溶剤で抽出し、有機層を洗浄し、減圧濃縮を行なうと、6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナールが得られる。必要に応じて、蒸留あるいはカラムクロマトグラフィー等で精製できる。
【0021】
第2工程は、6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナールをジメチルアセタール保護して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オンを得る。この保護反応は、酸触媒存在下、メタノール溶媒中で反応させることにより行なう。酸触媒としては、例えば、蟻酸、酢酸、プロピオン酸、p−トルエンスルホン酸、塩酸、硫酸、リン酸、塩化アンモニウムなどが利用できる。酸触媒の使用量は、6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナールに対して、モル比で0.01〜0.5当量の範囲である。反応温度は、0〜60℃の範囲であり、一般的には反応温度が高くなるにつれて反応時間は短くなる。反応時間は、反応温度や触媒量等に影響を受けるが、30分〜8時間程度となる。反応終了後、有機溶剤で抽出し、有機層を洗浄し、減圧濃縮を行なうと、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オンが得られる。必要に応じて、蒸留あるいはカラムクロマトグラフィー等で精製できる。
【0022】
第3工程は、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オンを還元して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールを得る。この還元反応で使用する還元剤は、水素化ホウ素ナトリウム、水素化アルミニウムリチウム、水素化ジイソブチルアルミニウム等が望ましい。還元剤の使用量は、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オンに対して、モル比で1〜2当量の範囲である。使用する溶媒は、還元剤により好適な溶媒は変わるが、例えば、エタノール、ジエチルエーテル、テトラヒドロフラン、トルエン、ジクロロメタン等の中から適宜選択できる。反応温度は、一般的に低温であり、望ましくは0〜30℃の範囲である。反応時間は、還元剤の種類や使用量等により変化するが、1〜8時間程度である。反応終了後、有機溶剤で抽出し、有機層を洗浄し、減圧濃縮を行なうと、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールが得られる。必要に応じて、蒸留あるいはカラムクロマトグラフィー等で精製できる。
【0023】
第4工程は、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールの水酸基をアセチル化して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートを得る。このアセチル化反応は、塩基存在下、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールにアセチル化剤を加えることにより反応する。使用できるアセチル化剤は、無水酢酸や塩化アセチル等がある。アセチル化剤の使用量は、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールより過剰に使用するのが望ましく、好ましくは5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールに対して、モル比で1.1〜2当量である。塩基としては、ピリジンやトリエチルアミン等が使用でき、4−ジメチルアミノピリジンを添加することにより反応速度が速くなることがある。
【0024】
塩基の使用量は、アセチル化剤より過剰に用いる必要があり、具体的にはアセチル化剤に対して、モル比で1.5〜10当量程度使用するのが望ましい。この反応で使用できる溶媒は、反応を妨げるものでなければ任意に使用でき、また、溶媒を使用しなくても反応は進行する。反応温度は、0〜30℃の範囲が好適である。反応終了後、有機溶剤で抽出し、有機層を洗浄し、減圧濃縮を行なうと、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートが得られる。必要に応じて、蒸留あるいはカラムクロマトグラフィー等で精製できる。
【0025】
第5工程は、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートを接触水素添加によって5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを得る。接触水素添加反応は、触媒と溶媒の懸濁液に5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートを加え、反応系内を水素で充填することで行なわれる。使用する触媒は、ラネーニッケル、ラネーコバルト、パラジウムカーボン、酸化白金等が使用できる。触媒の使用量は、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートに対して、重量比で0.01〜0.2当量である。使用する溶媒は、メタノール、エタノール、酢酸エチル等が好適であり、溶媒の使用量は任意に決めることができる。反応温度は、5〜50℃程度が好適である。水素圧は、1〜10気圧程度の範囲が好適である。反応終了後、ろ過し、ろ液を減圧濃縮すると、5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートが得られる。必要に応じて、蒸留あるいはカラムクロマトグラフィー等で精製できる。
【発明の効果】
【0026】
本発明によれば、入手容易な出発物質リモネンオキサイドを使用することにより実用的製造を可能にし、また、オゾン反応を使用しないことにより、安全で設備のコスト負担を低く抑えて5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを製造することが可能となり、ソラノンを実用的に製造することができるようになる。
【図面の簡単な説明】
【0027】
【図1】本発明に係る5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートの製造工程を示した図。
【発明を実施するための形態】
【0028】
以下に実施例を用いて本発明を詳細に説明するが、本発明はこれに限定されるものではない。
【実施例】
【0029】
(第1工程)
過ヨウ素酸二水和物(35.8g)のテトラヒドロフラン(300ml)溶液を入れた反応容器を氷水で冷却し、リモネンオキサイド(20.0g)のジエチルエーテル(50ml)溶液をゆっくりと滴下した。滴下後、1時間攪拌し、飽和炭酸水素ナトリウム水溶液を加え、反応を終了させた。ジエチルエーテルで抽出し、有機層をチオ硫酸水溶液、飽和塩化ナトリウム水溶液の順に洗浄し、無水硫酸マグネシウムで乾燥し、減圧濃縮することにより、6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナール(16.1g)を得た。
【0030】
(第2工程)
6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナール(16.1g)のメタノール(200ml)溶液に塩化アンモニウム(2.0g)を加え、50℃で1時間攪拌した。反応溶液を室温まで冷却した後に、水で希釈し、ジエチルエーテルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液の順に洗浄し、無水硫酸マグネシウムで乾燥し、減圧濃縮することにより、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オン(20.0g)を得た。
【0031】
(第3工程)
5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オン(20.0g)のメタノール(100ml)溶液を氷水で冷却し、水素化ホウ素ナトリウム(4.3g)を数回に分けて加えた。自然と室温まで昇温させながら2時間攪拌した後、水を加えて反応を終了させた。ジエチルエーテルで抽出し、有機層を飽和塩化ナトリウム水溶液で洗浄し、無水硫酸マグネシウムで乾燥し、減圧濃縮することにより、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オール(16.8g)を得た。
【0032】
(第4工程)
5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オール(16.8g)のピリジン(80ml)溶液を氷水で冷却し、無水酢酸(12.6g)と4−ジメチルアミノピリジン(500mg)を加え、自然と室温まで昇温させながら終夜攪拌した。飽和炭酸水素水溶液を加えて反応を終了させた後、ジエチルエーテルで抽出した。得られた有機層を飽和硫酸銅(II)水溶液、水、飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液の順に洗浄し、無水硫酸マグネシウムで乾燥し、減圧濃縮した。得られた残渣をシリカゲルクロマトグラフィーによって精製し、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタート(16.7g)を得た。
【0033】
(第5工程)
10%パラジウム―炭素(1.0g)のメタノール(80ml)懸濁液に5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタート(16.7g)加え、反応容器を水素に置換した。水素雰囲気下、室温で7時間激しく攪拌を行い、反応液をろ過した。ろ液を減圧濃縮することにより、5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタート(16.7g)を得た。
【符号の説明】
【0034】
1 リモネンオキサイド
2 6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナール
3 5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オン
4 5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オール
5 5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタート
6 5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタート
【先行技術文献】
【特許文献】
【0035】
【特許文献1】特開昭64−66137号公報
【非特許文献】
【0036】
【非特許文献1】The Journal of Organic Chemistry, 1965年, 第30巻, 2918〜2921頁
【非特許文献2】Journal of the Chemical Society, Chemical Communications, 1981年, 951〜952頁
【非特許文献3】Bulletin of the Korean Chemical Society, 1993年、第14巻, 639〜641頁
【特許請求の範囲】
【請求項1】
リモネンオキサイドを出発原料として、5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを得ることを特徴とする5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートの製造方法。
【請求項2】
リモネンオキサイドを出発原料として、過ヨウ素酸での酸化的開裂、ジメチルアセタール保護、還元、水酸基のアセチル化、接触水素添加を逐次行うことによって5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを得ることを特徴とする5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートの製造方法。
【請求項3】
リモネンオキサイドを過ヨウ素酸で酸化的に開裂させて6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナールを得る第1工程、6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナールをジメチルアセタール保護して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オンを得る第2工程、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オンを還元して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールを得る第3工程、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールの水酸基をアセチル化して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートを得る第4工程、及び5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートを接触水素添加によって5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを得る第5工程からなることを特徴とする5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートの製造方法。
【請求項4】
請求項1〜3のいずれか一つに記載の製造方法により製造した5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを用いたソラノンの製造方法。
【請求項1】
リモネンオキサイドを出発原料として、5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを得ることを特徴とする5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートの製造方法。
【請求項2】
リモネンオキサイドを出発原料として、過ヨウ素酸での酸化的開裂、ジメチルアセタール保護、還元、水酸基のアセチル化、接触水素添加を逐次行うことによって5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを得ることを特徴とする5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートの製造方法。
【請求項3】
リモネンオキサイドを過ヨウ素酸で酸化的に開裂させて6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナールを得る第1工程、6−オキソ−3−(プロパ−1−エン−2−イル)ヘプタナールをジメチルアセタール保護して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オンを得る第2工程、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オンを還元して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールを得る第3工程、5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−オールの水酸基をアセチル化して5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートを得る第4工程、及び5−(2,2−ジメトキシエチル)−6−メチルヘプタ−6−エン−2−イル=アセタートを接触水素添加によって5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを得る第5工程からなることを特徴とする5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートの製造方法。
【請求項4】
請求項1〜3のいずれか一つに記載の製造方法により製造した5−イソプロピル−7,7−ジメトキシヘプタン−2−イル=アセタートを用いたソラノンの製造方法。
【図1】




【公開番号】特開2013−1695(P2013−1695A)
【公開日】平成25年1月7日(2013.1.7)
【国際特許分類】
【出願番号】特願2011−136873(P2011−136873)
【出願日】平成23年6月21日(2011.6.21)
【出願人】(391020584)富士フレーバー株式会社 (16)
【Fターム(参考)】
【公開日】平成25年1月7日(2013.1.7)
【国際特許分類】
【出願日】平成23年6月21日(2011.6.21)
【出願人】(391020584)富士フレーバー株式会社 (16)
【Fターム(参考)】
[ Back to top ]

