8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オンの塩および多形体
【課題】信頼できる製剤化および製造に適している特性を持つ結晶性の塩およびその多形性形態を有すること。
【解決手段】本発明は、8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オンの新規な多形性形態、およびそれらを調製するためのプロセスに関する。そのような多形性形態は、医薬組成物の構成成分であってよく、癌などの疾患状態を包含するポリ(ADP−リボース)ポリメラーゼ活性により仲介される哺乳動物の疾患状態を治療するために使用することができる。
【解決手段】本発明は、8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オンの新規な多形性形態、およびそれらを調製するためのプロセスに関する。そのような多形性形態は、医薬組成物の構成成分であってよく、癌などの疾患状態を包含するポリ(ADP−リボース)ポリメラーゼ活性により仲介される哺乳動物の疾患状態を治療するために使用することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、その全体として参照により本明細書に組み込まれている2010年2月12日出願の米国特許出願第61/304,277号の利益を主張するものである。
【0002】
本発明は、8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オンの新規な多形性の塩、およびそれらを調製するための方法に関する。本発明は、少なくとも1つの多形性形態を含有する医薬組成物ならびにそのような多形性形態および組成物の治療的使用および/または予防的使用も対象とする。
【背景技術】
【0003】
化合物8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オン(「化合物1」)
【0004】
【化1】

は、ポリ(ADP−リボース)ポリメラーゼ(PARP)の小分子阻害剤である。化合物1、およびそれを製造する方法は、米国特許第6,495,541号、第6,977,298号、第7,429,578号および第7,323,562号に記載されている。化合物1のある種の塩およびそれらの多形体は、米国特許第7,268,126号および国際特許公開第WO04/087713号に開示されている。化合物1およびその使用について記載している他の刊行物は、米国特許出願公開第2006−0074073号、ならびに米国特許第7,351,701号および第7,531,530号を包含する。
【0005】
PARPは、ADP−リボシル化(翻訳後タンパク質修飾)を担う核酵素のファミリーであり、その中で、ポリ(ADP−リボシル)トランスフェラーゼは、ヒストンおよびDNA修復酵素などの核標的タンパク質上の特異的なアミノ酸側鎖上および/または既に接続しているADP−リボース単位上へNAD+からADP−リボース部分を転移させる。ヒトにおいて、PARPファミリーは、17種の酵素を包含し、そのうちで、PARP−1は、最もよく特徴がわかっている(Otto H、Reche PA、Bazan Fら、In silico characterization of the family of PARP−like poly(ADP−ribosyl)transferases(pARTs)、BMC Genomics 2005;6:139)。薬理学研究は、化合物1が、PARP−1(Ki=1.4nM)およびPARP−2(Ki=0.17nM)の阻害剤であることを明らかにした。
【0006】
PARP−1は、DNA切断部位と結合してDNA損傷部位にDNA修復タンパク質を引き寄せることを通してDNAホメオスタシスに関与している。PARP−1は、標的タンパク質上のADP−リボース単位の付加を通して、クロマチン弛緩およびDNA修復プロセスに必要なエネルギー資源を提供する。これらの作用は、DNA修復を促進しかつ容易にする。DNA損傷の程度に応じて、PARP−1活性化およびそれに続くポリ(ADP−リボシル)化は、損傷されたDNAの修復を仲介するか細胞死を誘導する。DNA損傷が中程度である場合、PARP−1は、DNA修復プロセスにおいて重要な役割を果たす。逆に、大規模なDNA損傷の場合、PARP−1の過剰な活性化は、細胞ATPプールを枯渇させ、これは、最終的に、壊死による細胞死をもたらす(Tentori L、Portarena I、Graziani G、Potential applications of poly(ADP−ribose)polymerase(PARP)inhibitors、Pharmacol Res 2002;45:73〜85)。
【0007】
癌療法において、多くの有用な薬物ならびにイオン化放射線は、DNA損傷を通してそれらの治療効果を発揮する。一本鎖または二本鎖のDNA切断部位の酵素仲介修復は、その作用機構がDNA損傷によって左右される放射線療法または細胞傷害性薬物に対する潜在的な耐性機構である。すなわち、DNA修復経路酵素の阻害は、抗癌剤の増強作用のための戦略である。PARP−1の阻害は、インビボおよびインビトロにおいてDNA損傷剤およびイオン化放射線の活性を増強することが明らかにされている。したがって、PARPは、DNA損傷剤と組み合わせる癌療法のための治療標的として同定されている。(Tentori L、Leonetti C、Scarsella M、ら Systemic administration of GPA 15427,a novel poly(ADP−ribose)polymerase−1 inhibitor,increases the antitumor activity of temozolomide against intracranial melanoma,glioma,lymphoma、Clin Cancer Res 2003;9:5370〜9。Satoh MS、Poirier GG、Lindahl T、NAD(+)−dependent repair of damaged DNA by human cell extracts、J Biol Chem 1993;268:5480〜7。)
【0008】
化学増強剤(chemopotentiator)または放射線増感剤としての潜在的役割に加えて、PARP阻害剤単独に対する、BRCA1変異かBRCA2変異のどちらかについてホモ接合である細胞系の感受性を示す最近の証拠が浮上している。(Bryant HE、Schultz N、Thomas HD、ら Specific killing of BRCA−2 deficient tumors with inhibitors of poly(ADP−ribose)polymerase、Nature 2005;434:913〜7。Farmer H、McCabe N、Lord CJ、ら Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy、Nature 2005;434:917〜21。)単剤PARP阻害剤を使った第1相試験からの予備的臨床データが最近公開されている(Yap TA、Boss DS、Fong M、ら First in human phase I pharmacokinetic(PK) and pharmacodynamic(PD)study of KU−0059436(Ku),a small molecule inhibitor of poly ADP−ribose polymerase(PARP) in cancer patients(p) including BRCA 1/2 mutation carriers、(J Clin Oncol 2007;25(Supplement June 20):3529)。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】米国特許出願第61/304,277号
【特許文献2】米国特許第6,495,541号
【特許文献3】米国特許第6,977,298号
【特許文献4】米国特許第7,429,578号
【特許文献5】米国特許第7,323,562号
【特許文献6】米国特許第7,268,126号
【特許文献7】国際特許公開第WO04/087713号
【特許文献8】米国特許出願公開第2006−0074073号
【特許文献9】米国特許第7,351,701号
【特許文献10】米国特許第7,531,530号
【特許文献11】米国仮特許出願第60/612,458号
【特許文献12】PCT公開第WO00/38715号
【特許文献13】PCT公開第WO00/38716号
【特許文献14】PCT公開第WO00/38717号
【特許文献15】PCT公開第WO00/38718号
【特許文献16】PCT公開第WO00/38719号
【特許文献17】PCT公開第WO00/38730号
【特許文献18】PCT公開第WO00/38665号
【特許文献19】PCT公開第WO00/37107号
【特許文献20】PCT公開第WO00/38786号
【特許文献21】欧州特許出願第239362号
【特許文献22】WO96/33172
【特許文献23】WO96/27583
【特許文献24】欧州特許出願第97304971.1号
【特許文献25】欧州特許出願第99308617.2号
【特許文献26】WO98/07697
【特許文献27】WO98/03516
【特許文献28】WO98/34918
【特許文献29】WO98/34915
【特許文献30】WO98/33768
【特許文献31】WO98/30566
【特許文献32】欧州特許公開第606,046号
【特許文献33】欧州特許公開第931,788号
【特許文献34】WO90/05719
【特許文献35】WO99/52910
【特許文献36】WO99/52889
【特許文献37】WO99/29667
【特許文献38】PCT国際出願第PCT/IB98/01113号
【特許文献39】欧州特許出願第99302232.1号
【特許文献40】英国特許出願第9912961.1号
【特許文献41】米国仮出願第60/148,464号
【特許文献42】米国特許第5,863,949号
【特許文献43】米国特許第5,861,510号
【特許文献44】欧州特許公開第780,386号
【特許文献45】WO95/19970
【特許文献46】WO98/14451
【特許文献47】WO98/02434
【特許文献48】米国特許第5,747,498号
【特許文献49】WO99/24440
【特許文献50】PCT国際出願PCT/IB99/00797
【特許文献51】WO95/21613
【特許文献52】WO99/61422
【特許文献53】米国特許第5,834,504号
【特許文献54】WO98/50356
【特許文献55】米国特許第5,883,113号
【特許文献56】米国特許第5,886,020号
【特許文献57】米国特許第5,792,783号
【特許文献58】WO99/10349
【特許文献59】WO97/32856
【特許文献60】WO97/22596
【特許文献61】WO98/54093
【特許文献62】WO98/02438
【特許文献63】WO99/16755
【特許文献64】WO98/02437
【特許文献65】WO99/35146
【特許文献66】WO99/35132
【特許文献67】WO97/13760
【特許文献68】米国特許第5,587,458号
【特許文献69】米国特許第5,877,305号
【特許文献70】米国仮出願第60/117,341号
【特許文献71】米国仮出願第60/117,346号
【特許文献72】米国特許出願第09/221946号
【特許文献73】米国特許出願第09/454058号
【特許文献74】米国特許出願第09/501163号
【特許文献75】米国特許出願第09/539930号
【特許文献76】米国特許出願第09/202796号
【特許文献77】米国特許出願第09/384339号
【特許文献78】米国特許出願第09/383755号
【特許文献79】米国仮特許出願第60/168207号
【特許文献80】米国仮特許出願第60/170119号
【特許文献81】米国仮特許出願第60/177718号
【特許文献82】米国仮特許出願第60/168217号
【特許文献83】米国仮特許出願第60/200834号
【特許文献84】米国仮特許出願第60/113,647号
【非特許文献】
【0010】
【非特許文献1】Otto H、Reche PA、Bazan Fら、In silico characterization of the family of PARP−like poly(ADP−ribosyl)transferases(pARTs)、BMC Genomics 2005;6:139
【非特許文献2】Tentori L、Portarena I、Graziani G、Potential applications of poly(ADP−ribose)polymerase(PARP)inhibitors、Pharmacol Res 2002;45:73〜85
【非特許文献3】Tentori L、Leonetti C、Scarsella M、ら Systemic administration of GPA 15427,a novel poly(ADP−ribose)polymerase−1 inhibitor,increases the antitumor activity of temozolomide against intracranial melanoma,glioma,lymphoma、Clin Cancer Res 2003;9:5370〜9
【非特許文献4】Satoh MS、Poirier GG、Lindahl T、NAD(+)−dependent repair of damaged DNA by human cell extracts、J Biol Chem 1993;268:5480〜7
【非特許文献5】Bryant HE、Schultz N、Thomas HD、ら Specific killing of BRCA−2 deficient tumors with inhibitors of poly(ADP−ribose)polymerase、Nature 2005;434:913〜7
【非特許文献6】Farmer H、McCabe N、Lord CJ、ら Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy、Nature 2005;434:917〜21
【非特許文献7】Yap TA、Boss DS、Fong M、ら First in human phase I pharmacokinetic(PK) and pharmacodynamic(PD)study of KU−0059436(Ku),a small molecule inhibitor of poly ADP−ribose polymerase(PARP) in cancer patients(p) including BRCA 1/2 mutation carriers、(J Clin Oncol 2007;25(Supplement June 20):3529
【非特許文献8】S.Byrnら、Pharmaceutical Solids:A Strategic Approach to Regulatory Considerations、Pharmaceutical research、Vol.12、No.7、p.945〜954、1995
【非特許文献9】J.K.HeleblianおよびW.McCrone、Pharmacetical Applications of Polymorphism、Journal of Pharmaceutical Sciences、Vol.58、No.8、p.911〜929、1969
【非特許文献10】Chenら、J Pharmaceutical and Biomedical Analysis 26:63(2001)
【非特許文献11】Remington:The Science & Practice of Pharmacy、第19版、Williams & Williams、(1995)
【非特許文献12】「Physician’s Desk Reference」、第52版、Medical Economics、Montvale、NJ(1998)
【非特許文献13】Handbook of Pharmaceutical Excipients、第3版、A.H.Kibbe編、Pharmaceutical Press、2000
【発明の概要】
【発明が解決しようとする課題】
【0011】
信頼できる製剤化および製造に適している特性を持つ結晶性の塩およびその多形性形態を有することが望ましい。
【課題を解決するための手段】
【0012】
本明細書に開示されている一部の実施形態は、8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オンのマレイン酸塩を提供する。一部の実施形態において、マレイン酸塩は、結晶性である。一部の実施形態において、マレイン酸塩は、結晶性無水塩である。
【0013】
一部の実施形態において、マレイン酸塩は、6.0±0.2、20.3±0.2、および21.7±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上のピークを含む粉末X線回折パターンを有する。一部の実施形態において、前記粉末X線回折パターンは、1.5406オングストロームの波長において銅K−α1X線を使用して得られる。一部の実施形態において、マレイン酸塩は、6.0±0.2、20.3±0.2、および21.7±0.2の回折角(2θ)におけるピークを含む粉末X線回折パターンを有し、前記粉末X線回折パターンは、1.5406オングストロームの波長において銅K−α1X線を使用して得られる。さらなる実施形態において、塩は、図1に示されているのと本質的に同じ回折角(2θ)におけるピークを含む粉末X線回折パターンを有する。追加の実施形態において、塩は、図2に示されているのと本質的に同じ示差走査熱量測定サーモグラムを有する。一部の実施形態において、塩は、マレイン酸塩多形体A形の実質的に純粋な多形体である。
【0014】
一部の実施形態において、マレイン酸塩は、7.5±0.2、11.3±0.2、および24.3±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上のピークを含む粉末X線回折パターンを有する。一部の実施形態において、前記粉末X線回折パターンは、1.5406オングストロームの波長において銅K−α1X線を使用して得られる。一部の実施形態において、マレイン酸塩は、7.5±0.2、11.3±0.2、および24.3±0.2の回折角(2θ)におけるピークを含む粉末X線回折パターンを有し、前記粉末X線回折パターンは、1.5406オングストロームの波長において銅K−α1X線を使用して得られる。さらなる実施形態において、マレイン酸塩は、図3または図4に示されているのと本質的に同じ回折角(2θ)におけるピークを含む粉末X線回折パターンを有する。一部の実施形態において、マレイン酸塩は、171.3±0.2、112.4±0.2、および43.8±0.2ppmからなる群から選択される1つもしくは複数または2つ以上の13C化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、マレイン酸塩は、171.3±0.2、112.4±0.2、および43.8±0.2ppmにおける13C化学シフトを含む固体NMRスペクトルを有する。さらなる実施形態において、マレイン酸塩は、図5に示されているのと本質的に同じ位置における13C化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、マレイン酸塩は、−123.1±0.2ppmにおける19F化学シフトを含む固体NMRスペクトルを有する。さらなる実施形態において、マレイン酸塩は、図6に示されているのと本質的に同じ位置における19F化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、マレイン酸塩は、1.5406オングストロームの波長において銅K−α1X線を使用して得られる7.5±0.2、11.3±0.2、および24.3±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つのピークを含む粉末X線回折パターン;ならびに1)171.3±0.2、112.4±0.2、および43.8±0.2ppmからなる群から選択される1つもしくは複数または2つ以上または3つの13C化学シフトを含む固体NMRスペクトル;および/または2)−123.1±0.2ppmにおける19F化学シフトを含む固体NMRスペクトルを有する。追加の実施形態において、塩は、図7に示されているのと本質的に同じ示差走査熱量測定サーモグラムを有する。追加の実施形態において、塩は、図8に示されているのと本質的に同じ動的蒸気収着等温線を有する。一部の実施形態において、マレイン酸塩は、表6に示されているような1つまたは複数のFT−IRスペクトルピークを有する。一部の実施形態において、マレイン酸塩は、表7に示されているような1つまたは複数のFT−ラマンスペクトルピークを有する。一部の実施形態において、マレイン酸塩は、マレイン酸塩多形体B形の実質的に純粋な多形体である。一部の実施形態は、マレイン酸塩多形体A形とマレイン酸塩多形体B形の混合物を提供する。
【0015】
追加の実施形態は、マレイン酸塩(例えば、マレイン酸塩多形体A形もしくはマレイン酸塩多形体B形またはそれらの混合物)を含む医薬組成物を提供する。一部の実施形態において、医薬組成物は、固体剤形(例えば、錠剤)を含む。一部の実施形態において、医薬組成物は、マレイン酸塩おおよそ10%〜25%、微結晶性セルロースおおよそ45%〜60%、無水リン酸二カルシウムおおよそ20%〜35%、デンプングリコール酸ナトリウム(タイプA)おおよそ0.1%〜5%、およびステアリン酸マグネシウムおおよそ0.1%〜5%を含む。一部の実施形態において、医薬組成物は、マレイン酸塩おおよそ17.18%、微結晶性セルロースおおよそ52.55%、無水リン酸二カルシウムおおよそ26.27%、デンプングリコール酸ナトリウム(タイプA)おおよそ3%、およびステアリン酸マグネシウムおおよそ1%を含む。一部の実施形態は、ポリ(ADP−リボース)ポリメラーゼ活性により仲介される哺乳動物の疾患状態を治療する方法であって、マレイン酸塩(例えば、マレイン酸塩多形体A形もしくはマレイン酸塩多形体B形またはそれらの混合物)を含む治療有効量の医薬組成物を、それを必要としている哺乳動物に投与することを含む方法を提供する。一部の実施形態は、哺乳動物において癌を治療する方法であって、マレイン酸塩(例えば、マレイン酸塩多形体A形もしくはマレイン酸塩多形体B形またはそれらの混合物)を含む治療有効量の医薬組成物を、哺乳動物に投与することを含む方法を提供する。
【0016】
本明細書に開示されている一部の実施形態は、8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オンのカンシル酸塩に関する。一部の実施形態において、カンシル酸塩は、結晶性である。一部の実施形態において、カンシル酸塩は、結晶性無水塩である。一部の実施形態において、カンシル酸塩は、S−カンシル酸塩である。他の実施形態において、カンシル酸塩は、R−カンシル酸塩である。
【0017】
一部の実施形態において、カンシル酸塩は、6.0±0.2、12.2±0.2、12.7±0.2、14.8±0.2、16.7±0.2、および22.4±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つ以上または4つ以上のピークを含む粉末X線回折パターンを有する。一部の実施形態において、カンシル酸塩は、12.2±0.2、14.8±0.2、および22.4±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つのピークを含む粉末X線回折パターンを有する。一部の実施形態において、粉末X線回折パターンは、1.5406オングストロームの波長において銅K−α1X線を使用して得られる。さらなる実施形態において、カンシル酸塩は、図9または図10に示されているのと本質的に同じ回折角(2θ)におけるピークを含む粉末X線回折パターンを有する。一部の実施形態において、カンシル酸塩は、213.4±0.2、171.8±0.2、および17.3±0.2ppmからなる群から選択される1つもしくは複数または2つ以上の13C化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、213.4±0.2、171.8±0.2、および17.3±0.2ppmにおける13C化学シフトを含む固体NMRスペクトルを有する。さらなる実施形態において、カンシル酸塩は、図11に示されているのと本質的に同じ位置における13C化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、−118.9±0.2および−119.7±0.2ppmからなる群から選択される1つまたは複数の19F化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、−118.9±0.2および−119.7±0.2ppmにおける19F化学シフトを含む固体NMRスペクトルを有する。さらなる実施形態において、カンシル酸塩は、図12に示されているのと本質的に同じ位置における19F化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、1.5406オングストロームの波長において銅K−α1X線を使用して得られる6.0±0.2、12.2±0.2、12.7±0.2、14.8±0.2、16.7±0.2、および22.4±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つ以上または4つ以上または5つのピークを含む粉末X線回折パターン;ならびに1)213.4±0.2、171.8±0.2、および17.3±0.2ppmからなる群から選択される1つもしくは複数または2つ以上または3つの13C化学シフトを含む固体NMRスペクトル;および/または2)−118.9±0.2および−119.7±0.2ppmからなる群から選択される1つもしくは複数または2つの19F化学シフトを含む固体NMRスペクトルを有する。追加の実施形態において、塩は、図13に示されているのと本質的に同じ示差走査熱量測定サーモグラムを有する。追加の実施形態において、塩は、図14に示されているのと本質的に同じ動的蒸気収着等温線を有する。一部の実施形態において、カンシル酸塩は、表12に示されているような1つまたは複数のFT−IRスペクトルピークを有する。一部の実施形態において、カンシル酸塩は、表13に示されているような1つまたは複数のFT−ラマンスペクトルピークを有する。一部の実施形態において、塩は、S−カンシル酸塩多形体A形の実質的に純粋な多形体である。
【0018】
一部の実施形態において、カンシル酸塩は、図15に示されているのと本質的に同じ回折角(2θ)におけるピークを含む粉末X線回折パターンを有する。一部の実施形態において、塩は、S−カンシル酸塩多形体B形の実質的に純粋な多形体である。一部の実施形態は、S−カンシル酸塩多形体A形とS−カンシル酸塩多形体B形の混合物を提供する。
【0019】
一部の実施形態において、カンシル酸塩は、図18に示されているのと本質的に同じ回折角(2θ)におけるピークを含む粉末X線回折パターンを有する。一部の実施形態において、カンシル酸塩は、15.0±0.2、21.8±0.2、および24.7±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つのピークを含む粉末X線回折パターンを有する。一部の実施形態において、カンシル酸塩は、表16に示されているような1つまたは複数の13C化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、表17に示されているような1つまたは複数の19F化学シフトを有する。一部の実施形態において、カンシル酸塩は、211.7±0.2、132.5±0.2、および19.4±0.2ppmからなる群から選択される2つ以上の13C化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、211.7±0.2、132.5±0.2、および19.4±0.2ppmにおける13C化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、−118.5±0.2ppmにおける19F化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、表18に示されているような1つまたは複数のFT−IRスペクトルピークを有する。一部の実施形態において、カンシル酸塩は、表19に示されているような1つまたは複数のFT−ラマンスペクトルピークを有する。一部の実施形態において、塩は、S−カンシル酸塩多形体C形の実質的に純粋な多形体である。一部の実施形態は、S−カンシル酸塩多形体A形、S−カンシル酸塩多形体B形およびS−カンシル酸塩多形体C形のうちの2つ以上の混合物を提供する。
【0020】
一部の実施形態において、塩は、R−カンシル酸塩多形体A形の実質的に純粋な多形体である。さらなる実施形態は、追加カンシル酸塩を提供する。塩は、カンファースルホン酸の様々なR:S比、例えば、1R:1S−カンシル酸塩、1R:9S−カンシル酸塩、1R:3S−カンシル酸塩、および1R:7S−カンシル酸塩を有することができる。
【0021】
さらなる実施形態は、化合物1のS−カンシル酸塩の非晶性形態を提供する。
【0022】
追加の実施形態は、本明細書に記載されているカンシル酸塩(例えば、S−カンシル酸塩多形体A形、S−カンシル酸塩多形体B形、S−カンシル酸塩多形体C形、R−カンシル酸塩多形体A形またはそれらの混合物)を含む医薬組成物を提供する。一部の実施形態において、医薬組成物は、固体剤形(例えば、錠剤)を含む。一部の実施形態において、医薬組成物は、カンシル酸塩おおよそ10%〜25%、微結晶性セルロースおおよそ45%〜60%、無水リン酸二カルシウムおおよそ20%〜35%、デンプングリコール酸ナトリウム(タイプA)おおよそ0.1%〜5%、およびステアリン酸マグネシウムおおよそ0.1%〜5%を含む。一部の実施形態において、医薬組成物は、カンシル酸塩おおよそ17.18%、微結晶性セルロースおおよそ52.55%、無水リン酸二カルシウムおおよそ26.27%、デンプングリコール酸ナトリウム(タイプA)おおよそ3%、およびステアリン酸マグネシウムおおよそ1%を含む。一部の実施形態は、ポリ(ADP−リボース)ポリメラーゼ活性により仲介される哺乳動物の疾患状態を治療する方法であって、本明細書に記載されているカンシル酸塩(例えば、S−カンシル酸塩多形体A形、S−カンシル酸塩多形体B形、S−カンシル酸塩多形体C形、R−カンシル酸塩多形体A形またはそれらの混合物)を含む治療有効量の医薬組成物を、それを必要としている哺乳動物に投与することを含む方法を提供する。一部の実施形態は、哺乳動物において癌を治療する方法であって、本明細書に記載されているS−カンシル酸塩(例えば、S−カンシル酸塩多形体A形、S−カンシル酸塩多形体B形、S−カンシル酸塩多形体C形、R−カンシル酸塩多形体A形またはそれらの混合物)を含む治療有効量の医薬組成物を、哺乳動物に投与することを含む方法を提供する。
【0023】
さらなる実施形態は、本明細書に記載されている2つ以上の多形体形態または塩を含む医薬組成物を提供する。
【0024】
追加の実施形態は、ポリ(ADP−リボース)ポリメラーゼ活性により仲介される哺乳動物の疾患状態を治療する方法であって、治療有効量の抗腫瘍剤、抗血管新生剤、シグナル伝達阻害剤、および抗増殖剤、有糸分裂阻害剤、アルキル化剤、代謝拮抗剤、挿入性抗生物質、成長因子阻害剤、細胞周期阻害剤、酵素、トポイソメラーゼ阻害剤、生物学的応答調整剤、抗体、細胞傷害剤、抗ホルモン剤、および抗アンドロゲン剤などの1つまたは複数の物質と組み合わせた本明細書に記載されている治療有効量の医薬組成物を、それを必要としている哺乳動物に投与することを含む方法を提供する。一部の実施形態は、哺乳動物において癌を治療する方法であって、治療有効量の抗腫瘍剤、抗血管新生剤、シグナル伝達阻害剤、および抗増殖剤、有糸分裂阻害剤、アルキル化剤、代謝拮抗剤、挿入性抗生物質、成長因子阻害剤、細胞周期阻害剤、酵素、トポイソメラーゼ阻害剤、生物学的応答調整剤、抗体、細胞傷害剤、抗ホルモン剤、および抗アンドロゲン剤などの1つまたは複数の物質と組み合わせた本明細書に記載されている治療有効量の医薬組成物を、哺乳動物に投与することを含む方法を提供する。
【0025】
定義
本明細書で使用されるように、「化合物1」という用語は、構造式
【0026】
【化2】

によっても表される化合物8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オンを指す。
【0027】
「活性剤」または「活性成分」という用語は、化合物1の多形性形態、または化合物1の2つ以上の多形性形態もしくは非晶性形態を含む固体形態を指す。
【0028】
本明細書で使用されるように、化合物1の特定の多形性形態(または、2つ以上の多形性形態の混合物)に関して「実質的に純粋な」という用語は、その多形性形態(または混合物)が、化合物1の他の多形性形態を包含する不純物の重量で10%未満、好ましくは、5%未満、好ましくは、3%未満、好ましくは、1%未満を包含することを示す。そのような純度は、例えば、粉末X線回折により決定することができる。
【0029】
本明細書で使用されるように、「多形体」という用語は、同じ化合物の異なる結晶性形態ならびに同じ化合物の水和物(例えば、結晶構造中に存在する結合水)および溶媒和物(例えば、水以外の結合溶媒)などの疑似多形体を包含する他の固体分子形態を指す。異なる結晶性多形体は、格子における分子の異なる充填に起因する異なる結晶構造を有する。このことは、異なる結晶対称および/または結晶もしくは粉末のX線回折特性のようなその物理的特性に直接影響を与える単位セルパラメーターをもたらす。例えば、異なる多形体は、一般に、一連の異なる角度において回折し、強度について異なる値を与えるはずである。したがって、X線粉末回折を使用し、再現可能でかつ信頼できる方法で、異なる多形体、または2つ以上の多形体を含む固体形態を識別することができる(S.Byrnら、Pharmaceutical Solids:A Strategic Approach to Regulatory Considerations、Pharmaceutical research、Vol.12、No.7、p.945〜954、1995;J.K.HeleblianおよびW.McCrone、Pharmaceutical Applications of Polymorphism、Journal of Pharmaceutical Sciences、Vol.58、No.8、p.911〜929、1969)。結晶性多形性形態は、医薬産業および、特に、適当な剤形の開発に関わる医薬産業にとって興味深い。多形性形態が、臨床試験または安定性試験中に一定に保たれない場合、使用または試験される正確な剤形は、ロット毎に同等でないことがある。不純物の存在は、望ましくない毒物学的効果を生み出すことがあるため、化合物が臨床試験または市販製品で使用される場合に、選択された多形性形態の化合物を高純度で製造するためのプロセスを有することも望ましい。ある種の多形性形態は、熱力学的安定性の増強を示すか大量に高純度でより容易に製造されることがあるため、医薬製剤への包含により適している。ある種の多形体は、吸湿傾向の欠如、溶解性の改善、および異なる格子エネルギーに起因する溶解速度の増大などの他の有利な物理的特性を示すことがある。
【0030】
「粉末X線回折パターン」または「PXRDパターン」という用語は、実験的に観察されたディフラクトグラムまたはそれから誘導されるパラメーターを指す。粉末X線回折パターンは、典型的には、ピーク位置(横軸)およびピーク強度(縦軸)により特徴付けられる。「ピーク強度」という用語は、所与のX線回折パターン内の相対シグナル強度を指す。相対ピーク強度に影響を及ぼすことがある要因は、サンプル厚および好ましい配向(すなわち、結晶性粒子は、ランダムには分布されない)である。本明細書で使用されるような「ピーク位置」という用語は、粉末X線回折実験において測定されかつ観察されるようなX線反射位置を指す。ピーク位置は、単位セルの寸法に直接関連している。それらのそれぞれのピーク位置により同定されるピークは、化合物1の塩の様々な多形性形態について回折パターンから抽出されている。
【0031】
「2θ値」または「2θ」という用語は、X線回折実験の実験セットアップに基づくピーク位置(゜)を指し、回折パターンにおける共通の横軸単位である。一般に、実験セットアップは、反射光が回折され、入射ビームが、ある格子面と角θ(θ)を形成する場合、反射ビームが、角2θ(2θ)において記録されることを必要とする。具体的な多形性形態についての具体的な2θ値への本明細書における言及は、本明細書に記載されているようなX線回折実験条件を使用して測定されるような2θ値(゜)を意味することが意図されていることが理解されるべきである。
【0032】
「非晶性の」という用語は、(i)三次元における秩序を欠くか、(ii)三次元未満における秩序、短距離(例えば、10Å未満)を超えるに過ぎない秩序、または両方を示す任意の固体物質を指す。すなわち、非晶性物質は、例えば、一次元または二次元の並進秩序(液晶)、配向無秩序(配向的に無秩序な結晶)、または立体配置無秩序(立体配置的に無秩序な結晶)のある部分的結晶性材料および結晶性中間相を包含する。非晶性固体は、粉末X線粉末回折(PXRD)結晶学、固体核磁気共鳴(ssNMR)分光法、示差走査熱量測定(DSC)、またはそれらの技法の一部の組合せを包含する、知られている技法により特徴付けることができる。非晶性固体は、典型的には、1つまたは2つのブロードなピーク(すなわち、約5゜2θ以上のベース幅を有するピーク)からなる拡散PXRDパターンを与える。
【0033】
「結晶性の」という用語は、三次元秩序を示す任意の固体物質を指し、非晶性固体物質とは対照的に、輪郭のはっきりしたピークの独特なPXRDパターンを与える。
【0034】
「周囲温度」という用語は、実験室環境で典型的に遭遇する温度条件を指す。これは、約20〜約30℃のおおよその温度範囲を包含する。
【0035】
「検出可能量」という用語は、X線粉末回折、示差走査熱量測定、HPLC、フーリエ変換赤外分光法(FT−IR)、ラマン分光法などの従来の技法を使用して検出することができる量または単位体積当たりの量を指す。
【0036】
「溶媒和物」という用語は、薬物物質および化学量論的または非化学量論的量の1つまたは複数の溶媒分子(例えば、エタノール)を含む分子錯体について説明している。溶媒が、薬物と強固に結合している場合、得られる錯体は、湿度と無関係な明確な化学量論を有するはずである。しかしながら、溶媒が、チャネル溶媒和物および吸湿性化合物におけるように弱く結合している場合、溶媒含量は、湿度および乾燥条件によって左右されるはずである。そのような場合、錯体は、非化学量論的であることが多いはずである。
【0037】
「水和物」という用語は、薬物物質および化学量論的または非化学量論的量の水を含む溶媒和物について説明している。
【0038】
「相対湿度」という用語は、百分率として表される、所与の温度における空気中の水蒸気の量の、その温度および圧力において保持することができる水蒸気の最大量に対する割合を指す。
【0039】
「相対強度」という用語は、サンプルX線回折パターンから誘導される強度値を指す。回折パターンのための完全な縦軸範囲スケールは、100という値を割り当てられる。このスケール強度上で約50%〜約100%に入る強度を有するピークは、極めて強い(vs)と称され、約50%〜約25%に入る強度を有するピークは、強い(s)と称される。典型的な回折パターンには追加の弱めのピークが存在し、所与の多形体の特徴でもある。
【0040】
「スラリー」という用語は、液体媒質、典型的には、水または有機溶媒中に懸濁している固体物質を指す。
【0041】
「真空下で」という用語は、実験室の油を使用するか油を使用しないダイヤフラム式真空ポンプにより得ることができる典型的な圧力を指す。
【0042】
「医薬組成物」という用語は、本明細書に記載されている化合物1の塩の多形性形態のうちの1つまたは複数、および生理学的/薬学的に許容できる担体、希釈剤、ビヒクルおよび/または賦形剤などの他の化学的構成成分を含む組成物を指す。医薬組成物の目的は、ヒトまたは他の哺乳動物などの生物体への化合物の投与を容易にすることである。
【0043】
「薬学的に許容できる」「担体」、「希釈剤」、「ビヒクル」、または「賦形剤」という用語は、医薬組成物を形成するために特定の医薬剤と共に含まれていてもよい材料(または複数の材料)を指し、固体または液体であってよい。例示的な固体担体は、ラクトース、スクロース、タルク、ゼラチン、寒天、ペクチン、アカシア、ステアリン酸マグネシウム、ステアリン酸などである。例示的な液体担体は、シロップ、ピーナッツ油、オリーブ油、水などである。同様に、担体または希釈剤は、単独またはワックスと一緒のモノステアリン酸グリセリルもしくはジステアリン酸グリセリル、エチルセルロース、ヒドロキシプロピルメチルセルロース、メタクリル酸メチルなどの当技術分野において知られている時間遅延または時間放出材料を包含することがある。
【0044】
「ポリ(ADP−リボース)ポリメラーゼ(PARP)活性により仲介される」という用語は、PARP活性により調節、変調、または阻害される生物学的または分子プロセスを指す。ある応用例について、癌に関係するPARP活性の阻害が好ましい。本明細書に開示されている実施形態は、化合物1の多形性塩形態、または化合物1の2つ以上の多形性塩形態を含む固体形態を投与することにより、例えば、哺乳動物において、PARP活性を変調または阻害する方法を包含する。化合物1の多形性塩形態、または2つ以上のそのような形態を含む固体形態の活性または有効性は、例えば、それらの開示がそれらの全体として参照により本明細書に組み込まれている米国特許第6,495,541号および米国特許出願公開第2006−0074073号に記載されているように測定することができる。
【0045】
「治療すること」という用語は、本明細書で使用されているように、他に指示がない限り、そのような用語があてはまる障害もしくは状態の進行を逆転、緩和、阻害すること、またはそのような用語があてはまる障害もしくは状態を予防すること、またはそのような障害もしくは状態の1つまたは複数の症状の進行を逆転、緩和、阻害すること、またはそのような障害もしくは状態の1つまたは複数の症状を予防することを意味する。「治療」という用語は、本明細書で使用されているように、他に指示がない限り、直ぐ上で定義されているような「治療すること」の行為を指す。例えば、「治療する」、「治療すること」および「治療」という用語は、過増殖性障害(例えば、癌)および/またはその付随症状のうちの1つまたは複数を緩和または抑止する方法を指すことがある。特に癌に関して、これらの用語は、癌に罹患している個人の平均余命が増加するであろうこと、または疾患の症状のうちの1つまたは複数が軽減されるであろうことを示すことがある。
【0046】
「有効量」とは、真核細胞、例えば、哺乳動物、昆虫、植物または真菌細胞の増殖を有意に阻害しかつ/またはそれらの脱分化を妨げ、指示された有用性、例えば、具体的な治療処置に有効である薬剤の量を指す。
【0047】
「治療有効量」という用語は、治療されている障害の症状のうちの1つまたは複数をある程度軽減することができる投与されている化合物または多形体の量を指す。癌の治療に関して、治療有効量は、例えば、下記の効果:
(1)腫瘍のサイズを縮小すること、
(2)腫瘍転移を阻害する(すなわち、ある程度遅くする、好ましくは、停止する)こと、
(3)腫瘍成長をある程度阻害する(すなわち、ある程度遅くする、好ましくは、停止する)こと、および
(4)癌に伴う1つまたは複数の症状をある程度軽減する(または、好ましくは、取り除く)こと
のうちの少なくとも1つを有する量を指す。
【図面の簡単な説明】
【0048】
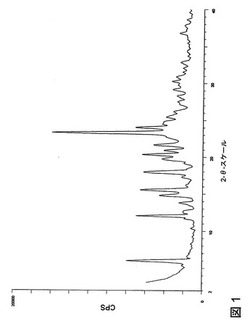
【図1】1.5406ÅにおいてCuKα放射線を使用する、化合物1のマレイン酸塩、多形体A形の粉末X線回折(PXRD)パターンを示す図である。
【図2】化合物1のマレイン酸塩、多形体A形の示差走査熱量測定(DSC)サーモグラムを示す図である。
【図3】1.5406ÅにおいてCuKα放射線を使用する、化合物1のマレイン酸塩、多形体B形の模擬PXRDパターンを示す図である。
【図4】1.5406ÅにおいてCuKα放射線を使用する、化合物1のマレイン酸塩、多形体B形の実験PXRDパターンを示す図である。
【図5】化合物1のマレイン酸塩、多形体B形の13C固体核磁気共鳴(NMR)スペクトルを示す図である。
【図6】化合物1のマレイン酸塩、多形体B形の19F固体NMRスペクトルを示す図である。
【図7】化合物1のマレイン酸塩、多形体B形のDSCサーモグラムを示す図である。
【図8】化合物1のマレイン酸塩、多形体B形の動的蒸気收着等温線を示す図である。
【図9】1.5406ÅにおいてCuKα放射線を使用する、化合物1のS−カンシル酸塩、多形体A形の模擬PXRDパターンを示す図である。
【図10】1.5406ÅにおいてCuKα放射線を使用する、化合物1のS−カンシル酸塩、多形体A形の実験PXRDパターンを示す図である。
【図11】化合物1のS−カンシル酸塩、多形体A形の13C固体NMRスペクトルを示す図である。
【図12】化合物1のS−カンシル酸塩、多形体A形の19F固体NMRスペクトルを示す図である。
【図13】化合物1のS−カンシル酸塩、多形体A形のDSCサーモグラムを示す図である。
【図14】化合物1のS−カンシル酸塩、S−カンシル酸塩多形体A形の動的蒸気收着等温線を示す図である。
【図15】1.5406ÅにおいてCuKα放射線を使用する、化合物1のS−カンシル酸塩、多形体B形のPXRDパターンを示す図である。
【図16】化合物1のS−カンシル酸塩、多形体A形を含有する製剤化組成物の実験PXRDパターンを示す図である。
【図17】1.5406ÅにおいてCuKα放射線を使用する、化合物1の塩酸塩三水和物の模擬PXRDパターンを示す図である。
【図18】1.5406ÅにおいてCuKα放射線を使用する、化合物1のS−カンシル酸塩、多形体C形の実験PXRDパターンを示す図である。
【図19】1.5406ÅにおいてCuKα放射線を使用する、1R:1S−カンシル酸塩の実験PXRDパターンを示す図である。
【図20】1.5406ÅにおいてCuKα放射線を使用する、1R:9S−カンシル酸塩の実験PXRDパターンを示す図である。
【図21】1.5406ÅにおいてCuKα放射線を使用する、1R:3S−カンシル酸塩の実験PXRDパターンを示す図である。
【図22】1.5406ÅにおいてCuKα放射線を使用する、1R:7S−カンシル酸塩の実験PXRDパターンを示す図である。
【図23】1.5406ÅにおいてCuKα放射線を使用する、化合物1のR−カンシル酸塩、多形体A形の実験PXRDパターンを示す図である。
【図24】化合物1のS−カンシル酸塩、多形体C形のDSCサーモグラムを示す図である。
【図25】1R:1S−カンシル酸塩のDSCサーモグラムを示す図である。
【図26】1R:9S−カンシル酸塩のDSCサーモグラムを示す図である。
【図27】化合物1のR−カンシル酸塩、多形体A形のDSCサーモグラムを示す図である。
【図28】化合物1のS−カンシル酸塩、多形体C形の13C固体NMRスペクトルを示す図である。
【図29】化合物1のS−カンシル酸塩、多形体C形の19F固体NMRスペクトルを示す図である。
【図30】1R:1S−カンシル酸塩の13C固体NMRスペクトルを示す図である。
【図31】1R:1S−カンシル酸塩の19F固体NMRスペクトルを示す図である。
【図32】1R:9S−カンシル酸塩の13C固体NMRスペクトルを示す図である。
【図33】1R:9S−カンシル酸塩の19F固体NMRスペクトルを示す図である。
【図34】化合物1のS−カンシル酸塩の非晶性形態の実験PXRDパターンを示す図である。
【図35】化合物1のS−カンシル酸塩の非晶性形態の13C固体NMRスペクトルを示す図である。
【図36】化合物1のS−カンシル酸塩の非晶性形態の19F固体NMRスペクトルを示す図である。
【図37】化合物1のS−カンシル酸塩の非晶性形態のラマンスペクトルを示す図である。
【図38】化合物1のS−カンシル酸塩の非晶性形態のDSCサーモグラムを示す図である。
【発明を実施するための形態】
【0049】
今回、化合物1のいくつかの独特な物理的形態が製造された。化合物1、およびそれを製造する方法は、それらの全体として参照により本明細書に組み込まれている米国特許第6,495,541号、第6,977,298号、第7,429,578号および第7,323,562号に記載されている。化合物1のある種の塩およびそれらの多形体は、それらの全体として参照により本明細書に組み込まれている米国特許第7,268,126号および国際特許公開第WO04/087713号に開示されている。
【0050】
本明細書に記載されているように、化合物1は、マレイン酸塩形態およびカンシル酸塩形態などの複数の結晶性塩形態で存在することができることが判明した。これらの形態は、癌を包含する、ポリ(ADP−リボース)ポリメラーゼ(PARP)活性により仲介される哺乳動物の疾患状態を治療するための製剤化製品において使用することができる。各形態は、生物学的利用能、安定性、および製造可能性などの特性という点で他の形態を上回る利点を有することがある。他の形態よりも大量調製および取り扱いについてより適している可能性が高い化合物1の新規な結晶性塩形態が発見されている。例えば、化合物1のリン酸塩は、例えば、静脈内剤形に特に適しているものの、その水和の影響を受けやすいことのために固体剤形に適していない可能性がある。本明細書に記載されているマレイン酸塩およびカンシル酸塩形態(例えば、マレイン酸塩多形体B形およびS−カンシル酸塩多形体A形)は、物理的に安定な形態として存在し、化合物1の他の塩形態と比較して水和の影響を受けにくく、固体剤形の調製に特に適したものにしている。さらに、本明細書に記載されているマレイン酸塩およびカンシル酸塩は、合成プロセスにおいて他の塩形態より少ないステップで単離することができ、結晶化を制御するためのより大きな範囲を可能にしている。制御された結晶化を使用し、例えば、制御された粒子サイズ、結晶化度および結晶形状などの固体剤形にとって有利である特性を持つAPI粒子を提供することができる。化合物1の他の多形性形態を実質的に含まない、化合物1の各多形性塩形態を調製するためのプロセスも本明細書に記載されている。さらに、異なる多形性形態で化合物1の結晶性塩を含む医薬製剤、およびそのような医薬製剤を投与することにより過増殖性状態を治療する方法が本明細書に記載されている。さらに、異なる多形性形態で化合物1の結晶性塩を含む医薬製剤、およびそのような医薬製剤を投与することによりポリ(ADP−リボース)ポリメラーゼ(PARP)活性により仲介される哺乳動物の疾患状態(例えば、癌)を治療する方法が本明細書に記載されている。
【0051】
I.化合物1の結晶性塩形態
化合物1のいくつかの結晶性形態が本明細書に記載されている。化合物1の各結晶性塩形態は、下記の粉末X線回折パターン(例えば、様々な回折角(2θ)におけるX線回折ピーク);固体核磁気共鳴(NMR)スペクトルパターン;示差走査熱量測定(DSC)サーモグラムの吸熱により説明されるような融点開始(および水和形態については脱水の開始);動的蒸気收着測定により説明されるような吸湿性;FT−IRスペクトルダイヤグラムパターン;ラマンスペクトルダイヤグラムパターン;水溶性;International Conference on Harmonization(ICH)高強度光条件下の光安定性ならびに当技術分野において知られているか本明細書に記載されている方法による物理的および化学的な保存安定性のうちの1つまたは複数により特徴付けることができる。例えば、化合物1のマレイン酸塩多形体A形、マレイン酸塩多形体B形、S−カンシル酸塩多形体A形、およびS−カンシル酸塩多形体B形は、各々、それらの粉末X線回折パターンにおけるピークの位置および相対強度により特徴付けられた。粉末X線回折パラメーターは、化合物1の多形性形態の各々について異なる。したがって、例えば、化合物1のマレイン酸塩多形体A形、マレイン酸塩多形体B形、S−カンシル酸塩多形体A形、およびS−カンシル酸塩多形体B形は、粉末X線回折を使用することによりお互いとおよび化合物1の他の多形性形態と区別することができる。
【0052】
化合物1の異なる多形性形態(例えば、マレイン酸塩多形体A形、マレイン酸塩多形体B形、S−カンシル酸塩多形体A形、およびS−カンシル酸塩多形体B形)の粉末X線回折パターンは、1.5406ÅにおいてCuKα放射線を使用する実施例6〜8に記載されている手順に従って決定された。マレイン酸塩多形体A形、マレイン酸塩多形体B形、S−カンシル酸塩多形体A形、およびS−カンシル酸塩多形体B形について得られたPXRDパターンについてのピークは、1の閾値および0.3゜2−θのピーク幅でBruker−AXS Ltd.Evaluationソフトウェアを使用して選択された。S−カンシル酸塩多形体B形を除いて、データは、21℃にて集められた。
【0053】
本明細書に報告されている測定のために使用されるBrukerシステムのようなBragg−Brentano機器でX線回折測定を行うため、サンプルを、典型的には、空洞を有するホルダーの中に入れる。サンプル粉末をガラススライドまたは等価物により押し付け、ランダムな表面および適切なサンプル高を確保する。次いで、サンプルホルダーを機器の中に入れる。入射X線ビームを、初めはホルダー面に対して小さな角度でサンプルに向け、次いで、入射ビームとホルダー面の間の角度を連続的に増加させる円弧に沿って移動させる。そのようなX線粉末分析に関連した測定差は、(a)サンプル調製における誤差(例えば、サンプル高)、(b)機器誤差(例えば、平面サンプル誤差)、(c)較正誤差、(d)操作者誤差(ピーク位置を決定する場合に存在する誤差を包含する)、および(e)材料の性質(例えば、好ましい配向性および透明度誤差)を包含する様々な要因に起因することがある。較正誤差およびサンプル高誤差は、同じ方向ですべてのピークのシフトをもたらすことが多い。平面ホルダーを使用する場合のサンプル高における小さな差は、PXRDピーク位置における大きな移動につながるであろう。系統的な研究は、典型的なBragg−Brentano配置でShimadzu XRD−6000を使用すると、1mmのサンプル高差が、1゜(2θ)と同じ高さのピークシフトにつながることを明らかにした(Chenら、J Pharmaceutical and Biomedical Analysis 26:63(2001))。これらのシフトは、X線ディフラクトグラムから識別することができ、シフトについて補正する(系統的な補正係数をすべてのピーク位置値に適用すること)か、機器を再較正することにより除去することができる。ピーク位置を一致させるために系統的な補正係数を適用することにより、様々な機械からの測定値を修正することが可能である。一般に、この補正係数は、Brukerからの測定ピーク位置を、期待されるピーク位置と一致させるであろうし、0〜0.2゜(2θ)の範囲であってよい。
【0054】
当業者は、ピーク位置(2θ)が、例えば、使用されている溶媒および/または回折を測定するために使用されている装置に応じて、典型的には、0.1〜0.2゜(2θ)程度の一部の変動を示すことを理解しているであろう。したがって、ピーク位置(2θ)が報告されている場合、当業者は、そのような数字がそのような変動を包含していることが意図されていることを認識しているであろう。さらに、本発明の多形体が、所与の図に示されているものと本質的に同じ粉末X線回折パターンを有すると記載されている場合、「本質的に同じ」という用語は、回折ピーク位置におけるそのような変動を包含することも意図されている。さらに、当業者は、相対ピーク強度が、装置間変動ならびに結晶化度、好ましい配向、調製されたサンプル表面、分析されているサンプルの純度、および当業者に知られている他の要因に起因する変動を示し、定性的尺度としてのみ受け止めるべきであることを理解しているであろう。当業者は、異なる波長を使用して測定すると、ブラッグの式−nλ=2dsinθに従って異なるシフトが得られることを理解しているであろう。代わりの波長の使用によりもたらされるそのようなさらなるPXRDパターンは、本明細書に記載されている実施形態の結晶性材料のPXRDパターンの代替表示であると見なされ、したがって、本実施形態の範囲内にある。
【0055】
本明細書に記載されている異なる多形体は、当技術分野において知られているか本明細書に記載されている方法に従って固体NMR分光法を使用して特徴付けることもできる。例えば、13C固体スペクトルおよび19F固体スペクトルは、実施例9〜10に記載されている手順に従って集めることができる。固体NMRにおいて測定される13Cまたは19F化学シフトは、典型的には、明確なピークについては0.2ppmまでの、ブロードな線についてはより大きな変動を有することが留意されるべきである。
【0056】
化合物1の異なる結晶性塩形態は、実施例に記載されている手順に従って示差走査熱量測定(DSC)を使用しても区別された。DSCは、温度の上昇によるサンプルと適切な基準との間の熱エネルギー取り込みの差を測定する。例えば、固体粉末サンプルの測定については、基準は、サンプルの調製において使用されるタイプの空のサンプルパンであってよい。DSCサーモグラムは、典型的には、サンプルが加熱される時の、吸熱(エネルギー取り込みを示す)および発熱(エネルギー放出を示す)により特徴付けることができる。いくつか要因に応じて、示される吸熱は、添付の図に描かれているものなどの、吸熱の上または下で融解する結晶多形体について約0.01〜5℃変動することがある。そのような分散の原因となる要因は、例えば、DSC分析が行われる加熱速度(例えば、スキャン速度)、DSC開始温度が規定および決定される方法、使用される較正標準、機器較正、相対湿度およびサンプルの化学的純度を包含する。任意の所与サンプルについて、観察される吸熱は、機器毎に異なることもあるが、一般的に、機器が同じように較正されているという条件で、本明細書に記載されている範囲内にあるであろう。
【0057】
ある化合物の異なる多形性形態は、異なる吸湿性を有することがある。例えば、化合物1の塩は、実施例12に記載されている手順に従って動的蒸気收着測定を使用するそれらの吸湿性に基づいて特徴付けられた。
【0058】
一部の実施形態において、固体形態は、2つ以上の多形性形態を含むこともある。当業者は、所与の化合物の結晶性形態が、単一の多形体の実質的に純粋な形態で存在することがあるが、2つ以上の異なる多形体または非晶性形態の混合物を含む結晶性形態で存在することもあることも認識しているであろう。固体形態が、2つ以上の多形体を含む場合、X線回折パターンは、典型的には、個々の多形体の各々に特徴的なピークを有するはずである。例えば、2つの多形体を含む固体形態は、典型的には、実質的に純粋な多形性形態に対応する2つのX線回折パターンの合積である粉末X線回折パターンを有するはずである。例えば、化合物1またはその塩の固体形態は、第一および第二の多形性形態を含有することがあり、固体形態は、第一の多形体を重量で少なくとも10%含有する。さらなる実施形態において、固体形態は、第一の多形体を重量で少なくとも20%含有することがある。さらなる実施例は、第一の多形体を重量で少なくとも30%、少なくとも40%、または少なくとも50%含有する。当業者は、様々な量のいくつかの個々の多形体および非晶性形態の多くのそのような組合せが可能であることを認識しているであろう。
【0059】
化合物1のマレイン酸塩の2つの多形性形態が、図1〜8に示されているように識別されかつ特徴付けられており、マレイン酸塩多形体A形およびマレイン酸塩多形体B形として表されている。さらに、化合物1のカンシル酸塩の多形性形態およびカンファースルホン酸の異なるR:S比を含有する様々な塩が、図9〜33に示されているように識別されかつ特徴付けられており、S−カンシル酸塩多形体A形、S−カンシル酸塩多形体B形、S−カンシル酸塩多形体C形、R−カンシル酸塩多形体A形、またはカンファースルホン酸の指定されたR:S比を持つ塩として表されている。さらに、化合物1のS−カンシル酸塩の非晶性形態が、図34〜38に示されているように識別されかつ特徴付けられている。本明細書で使用されるように、「カンシル酸塩」という用語は、S−カンシル酸塩、R−カンシル酸塩、または特定のR:S比のカンファースルホン酸との塩を指す。多形体、1つまたは複数の多形体を包含する医薬組成物、ならびに多形体およびそれらの医薬組成物を使用する方法は、下記の項および実施例においてより詳細に説明される。
【0060】
A.化合物1のマレイン酸塩、多形体A形
化合物1のマレイン酸塩、マレイン酸塩多形体A形は、実施例1に記載されているように製造することができる。
【0061】
マレイン酸塩多形体A形は、図1に示されかつ実施例7に記載されているPXRDパターンにより特徴付けられた。1.5406ÅにおいてCuKα放射線によりBruker D5000回折計で測定され、相対強度が15.0%以上の゜(2θ)および相対強度に関して表されるマレイン酸塩多形体A形のPXRDパターンは、表1にも示されている。
【0062】
【表1】

【0063】
図2に示されておりかつ実施例11に記載されているマレイン酸塩多形体A形についてのDSCサーモグラムは、220.36℃における吸熱開始を示している。
【0064】
B.化合物1のマレイン酸塩、マレイン酸塩多形体B形
化合物1のマレイン酸塩、マレイン酸塩多形体B形は、合成スキームにおいてエタノールを使用し、実施例2に記載されているように製造することができる。化合物1のマレイン酸塩、マレイン酸塩多形体B形は、合成スキームにおいてイソプロピルアルコールを使用し、実施例3に記載されているように製造することもできる。
【0065】
マレイン酸塩多形体B形は、図3に示されているように、単一結晶構造から計算される模擬PXRDパターンにより特徴付けられた。Accelrys MS Modeling(商標)[バージョン4.4]の「Reflex Powder Diffraction」モジュールを使用してマレイン酸塩B形の単一結晶構造から計算され、相対強度が5.0%以上の゜(2θ)および相対強度に関して表されるマレイン酸塩多形体B形の模擬PXRDパターンは、表2にも示されている。適切なシミュレーションパラメーターは、1.5406Åの波長(CuKα)および0.5の偏光因子を包含していた。
【0066】
【表2】

【0067】
マレイン酸塩多形体B形は、マレイン酸塩多形体B形の特定のバッチについてPXRDパターンを測定することによっても特徴付けられた。この実験PXRDパターンは、図4に示されており、実施例6に記載されている。1.5406ÅにおいてCuKα放射線によりBruker−AXS Ltd.、D4回折計で測定され、相対強度が5.0%以上の゜(2θ)および相対強度に関して表されるマレイン酸塩多形体B形の実験PXRDパターンは、表3にも示されている。
【0068】
【表3】

【0069】
模擬および実験PXRDパターンについてのピーク位置が、極めてよく一致していることがわかる。ピーク位置、相対強度および回折ピークの幅における任意の差は、例えば、装置間変動ならびに結晶化度、好ましい配向、調製されたサンプル表面、分析されているサンプルの純度、および当業者に知られている他の要因に起因する変動に起因することがある。
【0070】
化合物1のマレイン酸塩多形体B形は、実施例9に記載されているようなワイドボア(wide−bore)Bruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図5に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のマレイン酸塩多形体B形の13C化学シフトは、表4に示されている。
【0071】
【表4】

【0072】
化合物1のマレイン酸塩多形体B形は、実施例9に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図6に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のマレイン酸塩多形体B形の19F化学シフトは、表5に示されている。
【0073】
【表5】

【0074】
図7に示されているマレイン酸塩多形体B形についてのDSCサーモグラムは、228.0℃における吸熱開始を示している。マレイン酸塩多形体B形についての動的蒸気收着等温線は、図8に示されている。動的蒸気收着等温線は、マレイン酸塩多形体B形が非吸湿性であることを示している。
【0075】
化合物1のマレイン酸塩多形体B形は、実施例25に記載されているようなフーリエ変換赤外分光法(FT−IR)によっても特徴付けられ、スペクトルピークは、表6に示されている。吸収バンド振動数が列挙されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、ピーク位置上の*誤差がかなり大きい可能性があることを除き、±2cm−1である。
【0076】
【表6】

【0077】
化合物1のマレイン酸塩多形体B形は、実施例26に記載されているようなフーリエ変換−ラマン分光法(FT−ラマン)によっても特徴付けられ、スペクトルピークは、表7に示されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、±2cm−1である。
【0078】
【表7−1】

【0079】
【表7−2】

【0080】
C.化合物1のS−カンシル酸塩、S−カンシル酸塩多形体A形
化合物1のS−カンシル酸塩、S−カンシル酸塩多形体A形は、合成スキームにおいてテトラヒドロフランを使用し、実施例4に記載されているように製造することができる。化合物1のS−カンシル酸塩、S−カンシル酸塩多形体A形は、合成スキームにおいてイソプロピルアルコールを使用し、実施例5に記載されているように製造することもできる。
【0081】
S−カンシル酸塩多形体A形は、図9に示されているように、単一結晶構造から計算される模擬PXRDパターンにより特徴付けられた。Accelrys MS Modeling(商標)[バージョン4.4]の「Reflex Powder Diffraction」モジュールを使用してカンシル酸塩A形の単一結晶構造から計算され、相対強度が15.0%以上の゜(2θ)および相対強度に関して表されるS−カンシル酸塩多形体A形の模擬PXRDパターンは、表8にも示されている。適切なシミュレーションパラメーターは、1.5406Åの波長(CuKα)および0.5の偏光因子を包含していた。
【0082】
【表8】

【0083】
S−カンシル酸塩多形体A形は、S−カンシル酸塩多形体A形の特定のバッチについてPXRDパターンを測定することによっても特徴付けられた。この実験PXRDパターンは、図10に示されている。1.5406ÅにおいてCuKα放射線によりBruker−AXS Ltd.、D4回折計で測定され、相対強度が10.0%以上の゜(2θ)および相対強度に関して表されるS−カンシル酸塩多形体A形の実験PXRDパターンは、表9にも示されている。
【0084】
【表9】

【0085】
模擬および実験PXRDパターンについてのピーク位置が、極めてよく一致していることがわかる。ピーク位置、相対強度および回折ピークの幅における任意の差は、例えば、装置間変動ならびに結晶化度、好ましい配向、調製されたサンプル表面、分析されているサンプルの純度、および当業者に知られている他の要因に起因する変動に起因することがある。
【0086】
化合物1のS−カンシル酸塩多形体A形は、実施例10に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図11に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のS−カンシル酸塩多形体A形の13C化学シフトは、表10に示されている。
【0087】
【表10】

【0088】
化合物1のS−カンシル酸塩多形体A形は、実施例10に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図12に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のS−カンシル酸塩多形体A形の19F化学シフトは、表11に示されている。
【0089】
【表11】

【0090】
図13に示されているS−カンシル酸塩多形体A形についてのDSCサーモグラムは、303.2℃における吸熱開始を示している。S−カンシル酸塩多形体A形についての動的蒸気收着等温線は、図14に示されている。動的蒸気收着等温線は、S−カンシル酸塩多形体A形が非吸湿性であることを示している。
【0091】
化合物1のS−カンシル酸塩多形体A形は、実施例25に記載されているようなフーリエ変換赤外分光法(FT−IR)によっても特徴付けられ、スペクトルピークは、表12に示されている。吸収バンド振動数が列挙されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、ピーク位置上の*誤差がかなり大きい可能性があることを除き、±2cm−1である。
【0092】
【表12】

【0093】
化合物1のS−カンシル酸塩多形体A形は、実施例26に記載されているようなフーリエ変換−ラマン分光法(FT−ラマン)によっても特徴付けられ、スペクトルピークは、表13に示されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、±2cm−1である。
【0094】
【表13−1】

【0095】
【表13−2】

【0096】
D.化合物1のS−カンシル酸塩、S−カンシル酸塩多形体B形
化合物1のS−カンシル酸塩、S−カンシル酸塩多形体B形は、図15に示されているPXRDパターンにより特徴付けられた。
【0097】
E.化合物1の塩酸塩三水和物多形体
化合物1の塩酸塩三水和物多形体は、1.5406ÅにおいてCuKα放射線を使用し、図17に示されているように、単一結晶構造から計算される模擬PXRDパターンにより特徴付けられた。相対強度が15.0%以上の゜(2θ)および相対強度に関して表される塩酸塩三水和物多形体の模擬PXRDパターンは、表14にも示されている。
【0098】
【表14−1】

【0099】
【表14−2】

【0100】
F.化合物1のS−カンシル酸塩、S−カンシル酸塩多形体C形
化合物1のS−カンシル酸塩、S−カンシル酸塩多形体C形は、実施例16に記載されているように製造することができる。
【0101】
S−カンシル酸塩多形体C形は、S−カンシル酸塩多形体C形の特定のバッチについてPXRDパターンを測定することにより特徴付けられた。この実験PXRDパターンは、図18に示されている。1.5406ÅにおいてCuKα放射線によりBruker−AXS Ltd.、D4回折計で測定され、相対強度が10.0%を超える゜(2θ)および相対強度に関して表されるS−カンシル酸塩多形体C形の実験PXRDパターンは、表15にも示されている。
【0102】
【表15】

【0103】
化合物1のS−カンシル酸塩多形体C形は、実施例23に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図28に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のS−カンシル酸塩多形体A形の13C化学シフトは、表16に示されている。
【0104】
【表16】

【0105】
化合物1のS−カンシル酸塩多形体C形は、実施例23に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図29に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のS−カンシル酸塩多形体A形の19F化学シフトは、表17に示されている。
【0106】
【表17】

【0107】
図24に示されているS−カンシル酸塩多形体C形についてのDSCサーモグラムは、291.9℃における吸熱開始を示している。
【0108】
化合物1のS−カンシル酸塩多形体C形は、実施例25に記載されているようなフーリエ変換赤外分光法(FT−IR)によっても特徴付けられ、スペクトルピークは、表18に示されている。吸収バンド振動数が列挙されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、ピーク位置上の*誤差がかなり大きい可能性があることを除き、±2cm−1である。
【0109】
【表18】

【0110】
化合物1のS−カンシル酸塩多形体C形は、実施例26に記載されているようなフーリエ変換−ラマン分光法(FT−ラマン)によっても特徴付けられ、スペクトルピークは、表19に示されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、±2cm−1である。
【0111】
【表19−1】

【0112】
【表19−2】

【0113】
G.R−カンシル酸塩およびS−カンシル酸塩
カンファースルホン酸のR;S比が異なる様々なカンシル酸塩が製造されかつ特徴付けられた。1R:1S−カンシル酸塩、1R:9S−カンシル酸塩、1R:3S−カンシル酸塩、および1R:7S−カンシル酸塩は、実施例17〜20に記載されているように製造することができる。
【0114】
1R:1S−カンシル酸塩、1R:9S−カンシル酸塩、1R:3S−カンシル酸塩、および1R:7S−カンシル酸塩は、各塩の特定のバッチについてのPXRDパターンを測定することにより特徴付けられた。これらの実験PXRDパターンは、図19〜22に示されている。これらの塩についてのPXRDパターンは、これらの混合塩の結晶格子内の分子の充填が、ほぼ等価であることを示している。分子充填密度の小さな変化は、格子におけるSおよびRカンファースルホン酸の異なる比に適合する結果となった。充填密度のこの変化は、PXRDパターンにおけるあるピークについてピーク位置の小さなシフトをもたらした。本明細書に記載されているものと異なる比のRおよびSカンファースルホン酸を含有するカンシル酸塩も形成させることができ、それらの塩は、ほぼ等価な結晶格子を有するであろう。
【0115】
1.5406ÅにおいてCuKα放射線によりBruker−AXS Ltd.、D4回折計で測定され、相対強度が10.0%を超える゜(2θ)および相対強度に関して表される1R:1S−カンシル酸塩の実験PXRDパターンは、表20にも示されている。
【0116】
【表20】

【0117】
1R:1S−カンシル酸塩および1R:9S−カンシル酸塩は、実施例24に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図30および32に示されている固体NMRスペクトルパターンによっても特徴付けられた。1R:1S−カンシル酸塩の13C化学シフトは、表21に示されている。
【0118】
【表21】

【0119】
1R:9S−カンシル酸塩の13C化学シフトは、表22に示されている。
【0120】
【表22】

【0121】
1R:1S−カンシル酸塩および1R:9S−カンシル酸塩は、実施例23に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図31および33に示されている固体NMRスペクトルパターンによっても特徴付けられた。1R:1S−カンシル酸塩の19F化学シフトは、表23に示されている。
【0122】
【表23】

【0123】
1R:9S−カンシル酸塩の19F化学シフトは、表24に示されている。
【0124】
【表24】

【0125】
図25および26に示されている1R:1S−カンシル酸塩および1R:9S−カンシル酸塩についてのDSCサーモグラムは、1R:1S−カンシル酸塩については303.2℃における吸熱開始および1R:9S−カンシル酸塩については301.2℃における吸熱開始を示している。
【0126】
1R:1S−カンシル酸塩は、実施例25に記載されているようなフーリエ変換赤外分光法(FT−IR)によっても特徴付けられ、スペクトルピークは、表25に示されている。吸収バンド振動数が列挙されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、ピーク位置上の*誤差がかなり大きい可能性があることを除き、±2cm−1である。
【0127】
【表25】

【0128】
1R:1S−カンシル酸塩は、実施例26に記載されているようなフーリエ変換−ラマン分光法(FT−ラマン)によっても特徴付けられ、スペクトルピークは、表26に示されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、±2cm−1である。
【0129】
【表26−1】

【0130】
【表26−2】

【0131】
H.化合物1のR−カンシル酸塩、R−カンシル酸塩多形体A形
化合物1のR−カンシル酸塩、R−カンシル酸塩多形体A形は、実施例21に記載されているように製造することができる。
【0132】
R−カンシル酸塩多形体A形は、R−カンシル酸塩多形体A形の特定のバッチについてPXRDパターンを測定することにより特徴付けられた。この実験PXRDパターンは、図23に示されている。1.5406ÅにおいてCuKα放射線によりBruker−AXS Ltd.、D4回折計で測定され、相対強度が10.0%を超える゜(2θ)および相対強度に関して表されるR−カンシル酸塩多形体A形の実験PXRDパターンは、表27にも示されている。
【0133】
【表27】

【0134】
図27に示されているR−カンシル酸塩多形体A形についてのDSCサーモグラムは、301.0℃における吸熱開始を示している。
【0135】
R−カンシル酸塩多形体A形は、実施例25に記載されているようなフーリエ変換赤外分光法(FT−IR)によっても特徴付けられ、スペクトルピークは、表28に示されている。吸収バンド振動数が列挙されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、ピーク位置上の*誤差がかなり大きい可能性があることを除き、±2cm−1である。
【0136】
【表28】

【0137】
R−カンシル酸塩多形体A形は、実施例26に記載されているようなフーリエ変換−ラマン分光法(FT−ラマン)によっても特徴付けられ、スペクトルピークは、表29に示されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、±2cm−1である。
【0138】
【表29−1】

【0139】
【表29−2】

【0140】
R−カンシル酸塩多形体B形およびC形も、上に記載されている方法に従って製造しかつ特徴付けることができる。
【0141】
II.化合物1のS−カンシル酸塩の非晶性形態
化合物1のS−カンシル酸塩の非晶性形態は、実施例27に記載されているように製造することができる。
【0142】
化合物1のS−カンシル酸塩の非晶性形態は、実施例28に記載されているように、化合物1のS−カンシル酸塩の非晶性形態の特定のバッチについてPXRDパターンを測定することにより特徴付けられた。この実験PXRDパターンは、図34に示されている。
【0143】
化合物1のS−カンシル酸塩の非晶性形態は、実施例29に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図35に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のS−カンシル酸塩の非晶性形態の13C化学シフトは、表30に示されている。
【0144】
【表30】

【0145】
化合物1のS−カンシル酸塩の非晶性形態は、実施例29に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図36に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のS−カンシル酸塩の非晶性形態の19F化学シフトは、表31に示されている。
【0146】
【表31】

【0147】
図38に示されている化合物1のS−カンシル酸塩の非晶性形態のDSCサーモグラムは、156.5℃のガラス転移温度(Tg)を示している。
【0148】
III.本発明の医薬組成物
本明細書に記載されている活性剤(例えば、化合物1の結晶性塩形態または2つ以上のそのような形態を含む固体形態)は、哺乳動物の医学的使用に適している医薬組成物に製剤化することができる。任意の適当な投与経路を、有効用量の化合物1の多形性形態のうちのいずれかを患者に提供するために用いることができる。例えば、経口または非経口製剤などを用いることができる。剤形は、カプセル剤、錠剤、分散剤、懸濁剤など、例えば、腸溶コーティングされたカプセル剤および/または錠剤、化合物1の腸溶コーティングされたペレット剤を含有するカプセル剤および/または錠剤を包含する。すべての剤形において、化合物1の多形性形態は、他の適当な構成要素と混ぜ合わせることができる。組成物は、単位剤形で好都合に提供し、医薬技術において知られている任意の方法により調製することができる。本発明の医薬組成物は、典型的には、治療有効量の活性剤および1つまたは複数の不活性な薬学的に許容できる担体、および、場合により、任意の他の治療成分、安定剤などを包含する。1つまたは複数の担体は、典型的には、製剤の他の成分と適合しており、そのレシピエントに対して過度に有害ではないという意味で薬学的に許容できる。組成物は、希釈剤、緩衝剤、結合剤、崩壊剤、増粘剤、滑沢剤、保存剤(抗酸化剤を包含する)、矯味剤、味覚マスキング剤、無機塩(例えば、塩化ナトリウム)、抗菌剤(例えば、塩化ベンザルコニウム)、甘味料、帯電防止剤、界面活性剤(例えば、BASFから入手可能な「TWEEN 20」および「TWEEN 80」などのポリソルベート、ならびにF68およびF88などのプルロニック)、ソルビタンエステル、脂質(例えば、レシチンおよび他のホスファチジルコリンなどのリン脂質、ホスファチジルエタノールアミン、脂肪酸および脂肪酸エステル、ステロイド(例えば、コレステロール))、およびキレート化剤(例えば、EDTA、亜鉛および他のそのような適切なカチオン)をさらに包含することがある。本発明による組成物において使用するのに適している他の医薬賦形剤および/または添加剤は、Remington:The Science & Practice of Pharmacy、第19版、Williams & Williams、(1995)、および「Physician’s Desk Reference」、第52版、Medical Economics、Montvale、NJ(1998)、およびHandbook of Pharmaceutical Excipients、第3版、A.H.Kibbe編、Pharmaceutical Press、2000に列挙されている。本発明の活性剤は、経口、直腸、局所、鼻腔、眼、または非経口(腹腔内、静脈内、皮下、または筋肉内注射を包含する)投与に適しているものを包含する組成物に製剤化することができる。
【0149】
製剤中の活性剤の量は、剤形、治療されることになる状態、標的患者集団、および他の考慮すべき事柄などの様々な要因に応じて変わることがあり、一般的に、当業者により容易に決定されるはずである。治療有効量は、典型的には、PARP酵素を変調、調節、または阻害するのに必要な量であろう。実際に、これは、例えば、特定の活性剤、治療されることになる状態の重症度、患者集団、製剤の安定性などに応じて幅広く変わることがある。組成物は、一般的に、活性剤約0.001重量%〜約99重量%、好ましくは、活性剤約0.01重量%〜約5重量%、より好ましくは、活性剤約0.01重量%〜2重量%をどこでも含有するはずであり、組成物に含有される賦形剤/添加剤の相対量によって左右されることもある。
【0150】
一部の実施形態において、医薬組成物は、従来の手順に従って治療有効量の活性成分としての活性剤を1つまたは複数の適切な医薬担体と混ぜ合わせることにより調製される従来の剤形で投与することができる。これらの手順は、望ましい調製物に適しているような成分を混ぜ、顆粒化して圧縮するか溶かすものであってよい。
【0151】
用いられる1つまたは複数の医薬担体は、固体か液体のどちらかであってよい。例示的な固体担体は、ラクトース、スクロース、タルク、ゼラチン、寒天、ペクチン、アカシア、ステアリン酸マグネシウム、ステアリン酸などを包含するが、それらに限定されるものではない。例示的な液体担体は、シロップ、ピーナッツ油、オリーブ油、水などを包含する。同様に、1つまたは複数の担体は、単独またはワックスと一緒のモノステアリン酸グリセリルもしくはジステアリン酸グリセリル、エチルセルロース、ヒドロキシプロピルメチルセルロース、メタクリル酸メチルなどの当技術分野において知られている時間遅延または時間放出材料を包含することがある。
【0152】
様々な医薬形態を用いることができる。例えば、固体担体が使用される場合、調製物は、錠剤化するか、粉末もしくはペレット形態で硬質ゼラチンカプセルに入れるか、トローチもしくはロゼンジの形態であってよい。固体担体の量は、変わることがあるが、一般的に、約25mg〜約1gであろう。液体担体が使用される場合、調製物は、シロップ、エマルジョン、軟質ゼラチンカプセル、アンプルもしくはバイアル中の無菌注射用溶液もしくは懸濁液または非水性液体懸濁液の形態であってよい。
【0153】
安定な水溶性剤形を得るために、活性剤の薬学的に許容できる塩を、コハク酸またはクエン酸の0.3M溶液などの有機または無機酸の水溶液に溶かすことができる。可溶性塩形態が入手できない場合、活性剤を、適当な共溶媒または共溶媒の組合せに溶かすことができる。適当な共溶媒の例は、総体積の約0〜約60%の範囲である濃度のアルコール、プロピレングリコール、ポリエチレングリコール300、ポリソルベート80、グリセリンなどを包含するが、それらに限定されるものではない。組成物は、水または等張食塩水またはブドウ糖溶液などの適切な水性ビヒクル中の活性剤の塩形態の溶液の形態であってもよい。
【0154】
本発明の組成物において使用される化合物1の実際の用量は、使用されている特定の多形性形態、製剤化される特定の組成物、投与様式ならびに治療されている特定の部位、宿主および疾患に従って変わることがあることは理解されているであろう。薬剤についての実験データに鑑みて従来の用量決定試験を使用する当業者は、所与の一連の状態についての最適な用量を確認することができる。経口投与については、一般的に用いられる例示的1日投与量は、体重1kg当たり約0.001〜約1000mg、より好ましくは、体重1kg当たり約0.001〜約50mgであり、治療の過程は、適切な間隔で繰り返すことができる。プロドラッグの投与は、典型的には、完全に活性な形態の重量レベルと化学的に等価である重量レベルにて投与される。本発明の実施において、最も適当な投与経路ならびに治療投与量の大きさは、治療されることになる疾患の性質および重症度によって左右されるであろう。投与量、および投薬回数は、個々の患者の年齢、体重、および応答に従って変わることもある。一般に、適当な経口剤形は、1つの単一投与量または均等分割投与量で投与される活性成分1日総投与量0.5mg〜100mgの投与量範囲をカバーすることができる。そのような製剤における化合物1の好ましい量は、約1mg〜約10mgまたは約1mg〜約5mgなどの約0.5mg〜約20mgである。
【0155】
本発明の組成物は、医薬組成物を調製するための一般的に知られている方法で、例えば、混合、溶解、顆粒化、糖剤製造(dragee−making)、研和(levigating)、乳化、カプセル化、封入または凍結乾燥などの従来の技法を使用して製造することができる。医薬組成物は、薬学的に使用することができる調製物への活性化合物の加工を容易にする賦形剤および助剤から選択することができる1つまたは複数の生理学的に許容できる担体を使用する従来の方式で製剤化することができる。
【0156】
経口投与の場合、化合物1の多形性形態は、活性剤を当技術分野において知られている薬学的に許容できる担体と混ぜ合わせることにより容易に製剤化することができる。そのような担体は、治療されることになる患者による経口摂取のために、錠剤、丸剤、糖剤、カプセル剤、ゲル剤、シロップ剤、スラリー剤、懸濁剤などとして本発明の化合物を製剤化することを可能にする。経口使用のための医薬調製物は、活性剤との混合物中の固体賦形剤を使用し、場合により、得られる混合物を粉砕し、望ましい場合に、適当な助剤を加えた後で顆粒の混合物を加工し、錠剤または糖剤コアを得ることで得ることができる。適当な賦形剤は、ラクトース、スクロース、マンニトール、またはソルビトールを包含する糖などの充填剤;およびセルロース調製物、例えば、トウモロコシデンプン、小麦デンプン、米デンプン、ジャガイモデンプン、ゼラチン、ガム、メチルセルロース、ヒドロキシプロピルメチル−セルロース、カルボキシメチルセルロースナトリウム、またはポリビニルピロリドン(PVP)を包含する。望ましい場合、架橋ポリビニルピロリドン、寒天、またはアルギン酸もしくはアルギン酸ナトリウムなどのその塩などの崩壊剤を加えることができる。
【0157】
糖剤コアは、適当なコーティングと共に提供される。この目的のために、アラビアゴム、ポリビニルピロリドン、カルボポールゲル、ポリエチレングリコール、および/または二酸化チタン、ラッカー溶液、および適当な有機溶媒または溶媒混合物を含有していてもよい濃縮糖溶液を使用することができる。染料または顔料を、識別のため、または活性剤の異なる組合せを特徴付けるために錠剤または糖剤コーティングに加えることができる。
【0158】
経口で使用することができる医薬調製物は、ゼラチンでできている押し込み式カプセル剤、ならびにゼラチンおよびグリセロールまたはソルビトールなどの可塑剤でできている軟質の密閉カプセル剤を包含する。押し込み式カプセル剤は、ラクトースなどの充填剤、デンプンなどの結合剤、および/またはタルクまたはステアリン酸マグネシウムなどの滑沢剤、および、場合により、安定剤との混合物中に活性成分を含有することができる。軟質カプセル剤において、活性剤は、脂肪油、流動パラフィン、または液体ポリエチレングリコールなどの適当な液体に溶解または懸濁させることができる。さらに、安定剤を加えることができる。経口投与のためのすべての製剤は、そのような投与に適している用量であるべきである。口腔投与の場合、組成物は、従来の方式で製剤化される錠剤またはロゼンジ剤の形態を取ることができる。
【0159】
鼻腔内または吸入による投与の場合、化合物は、適当な噴射剤、例えば、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素または他の適当なガスを使用して、加圧パックまたはネブライザーからエアゾールスプレー提供の形態で好都合に送達することができる。加圧エアゾールの場合、用量単位は、一定量を送達するためのバルブを提供することにより決定することができる。インヘイラーまたはインサフレーターなどにおいて使用するためのゼラチンのカプセル剤およびカートリッジ剤は、化合物およびラクトースまたはデンプンなどの適当な粉末基剤の粉末ミックスを含有して製剤化することができる。
【0160】
活性剤は、注射による、例えば、ボーラス注射または連続注入による非経口投与のために製剤化することができる。注射のための製剤は、保存剤を加え、例えば、アンプルまたはマルチドーズ容器中の単位剤形で提供することができる。組成物は、油性または水性ビヒクル中の懸濁剤、溶液剤または乳剤などの形態を取ることができ、懸濁化剤、安定化剤および/または分散剤などの製剤化剤を含有することができる。
【0161】
非経口投与のための医薬製剤は、例えば、活性剤の懸濁剤を包含し、適切な油性注射懸濁剤として調製することができる。適当な親油性の溶媒またはビヒクルは、ゴマ油、またはオレイン酸エチルもしくはトリグリセリドなどの合成脂肪酸エステルなどの脂肪油、またはリポソームを包含する。水性注射懸濁剤は、カルボキシメチルセルロースナトリウム、ソルビトール、またはデキストランなどの懸濁液の粘度を高める物質を含有することがある。場合により、懸濁液は、適当な安定剤または活性剤の溶解性を高めて高濃度溶液剤の調製を可能にする試剤を含有することもある。
【0162】
眼への投与の場合、活性剤は、例えば、前房、後房、硝子体、房水、硝子体液、角膜、虹彩/毛様体、水晶体、脈絡膜/網膜および強膜を包含する眼の角膜および内部領域に化合物を浸透させるために十分な時間にわたって化合物を眼表面に接触させて維持するような薬学的に許容できる眼科用ビヒクルで送達することができる。薬学的に許容できる眼科用ビヒクルは、例えば、軟膏、植物油、またはカプセル化材料であってよい。本発明の活性剤は、硝子体液および房水内またはテノン嚢下に直接注射することもできる。
【0163】
あるいは、活性成分は、使用前に、適当なビヒクル、例えば、無菌の発熱物質含まない水による再構成のための粉末形態であってよい。化合物は、例えば、カカオ脂または他のグリセリドなどの従来の坐剤基剤を含有する坐剤または保留浣腸などの直腸または膣組成物にも製剤化することができる。
【0164】
上に記載されている製剤に加えて、多形性形態は、デポー調製物として製剤化することもできる。そのような長時間作用型製剤は、埋め込みにより(例えば、皮下または筋内に)または筋肉内注射により投与することができる。すなわち、例えば、多形性形態は、適当なポリマー材料もしくは疎水性材料(例えば、許容できる油中のエマルジョンとして)またはイオン交換樹脂と共に、または難溶性の誘導体として、例えば、難溶性の塩として製剤化することができる。
【0165】
さらに、化合物1の多形性形態は、治療剤を含有する固体疎水性ポリマーの半透性マトリックスなどの持続放出系を使用して送達することができる。様々な持続放出材料が確立されており、当業者により知られている。持続放出カプセル剤は、それらの化学的性質に応じて、数週間にわたって100日を超えるまで化合物を放出することができる。
【0166】
医薬組成物は、適当な固相またはゲル相の担体または賦形剤を含むこともある。そのような担体または賦形剤の例は、炭酸カルシウム、リン酸カルシウム、糖、デンプン、セルロース誘導体、ゼラチン、およびポリエチレングリコールなどのポリマーを包含する。
【0167】
IV.本発明の多形体を使用する方法
化合物1の結晶性塩の多形性形態は、ポリ(ADP−リボース)ポリメラーゼ(PARP)の活性を仲介するのに有用である可能性がある。より詳細には、これらの多形性形態は、その機構がDNA損傷によって左右される放射線療法または細胞傷害性薬物の有効性を増強する化学増感剤(chemosensitizer)として有用である可能性がある。これらの薬物は、テモゾロマイド(SCHERING)、イリノテカン(PFIZER)、トポテカン(GLAXO SMITHKLINE)、シスプラチン(BRISTOL MEYERS SQUIBB;AM PHARM PARTNERS;BEDFORD;GENSIA SICOR PHARMS;PHARMACHEMIE)、およびドキソルビシン塩酸塩(AM PHARM PARTNERS;BEDFORD;GENSIA:SICOR PHARMS;PHARMACHEMIE;ADRIA;ALZA)を包含するが、それらに限定されるものではない。
【0168】
化合物1の多形性塩形態は、β細胞中のReg遺伝子およびHGF遺伝子の発現の誘導を増強し、したがって、ランゲルハンス島の膵臓β細胞の増殖を促進し、細胞のアポトーシスを抑制するのにも有用である可能性がある。さらに、本発明の化合物1の多形性塩形態は、化粧品を調製するために、例えば、アフターサンローション剤において有用である可能性がある。
【0169】
治療有効量の本発明の薬剤は、PARPの変調または調製により仲介される疾患を治療するために、典型的には、医薬組成物の形態で投与することができる。「有効量」とは、そのような治療を必要としているヒトを包含する哺乳動物に投与された場合、1つまたは複数のPARP酵素の活性により仲介される疾患についての治療を行うのに十分である薬剤の量を指す。すなわち、ある化合物の治療有効量とは、その活性により仲介される疾患状態が低減または緩和されるように1つまたは複数のPARP酵素の活性を変調、調節、または阻害するのに十分な量を指す。所与の化合物の有効量は、疾患状態およびその重症度ならびに治療を必要としている哺乳動物の独自性および状態(例えば、体重)などの要因に応じて変わることがあるが、当業者によりルーチンに決定することができる。「治療すること」とは、1つまたは複数のPARP酵素の活性により少なくとも部分的に影響を受ける、ヒトを包含する哺乳動物におけるある疾患状態の少なくとも緩和を指し、哺乳動物において、特に、その哺乳動物が、その疾患状態を有する傾向があるが、それを有するといまだ診断されたことがない場合にその疾患状態を予防すること;疾患状態を変調および/または阻害すること;および/または疾患状態を緩和することを包含する。例示的疾患状態は、糖尿病性網膜症、血管新生緑内障、関節リウマチ、乾癬、加齢性黄斑変性症(AMD)、および癌などの異常細胞成長を包含する。癌は、中皮腫、肝胆道の(胆道および胆管)、原発性または続発性CNS腫瘍、原発性または続発性脳腫瘍、肺癌(NSCLCおよびSCLC)、骨癌、膵臓癌、皮膚癌、頭部または頚部の癌、皮膚または眼内の黒色腫、卵巣癌、結腸癌、直腸癌、肛門部の癌、胃癌、胃腸の(胃の、結腸直腸の、および十二指腸の)癌、乳癌、子宮癌、卵管の癌、子宮内膜の癌腫、子宮頚部の癌腫、膣の癌腫、外陰部の癌腫、ホジキン病、食道の癌、小腸の癌、内分泌系の癌、甲状腺の癌、副甲状腺の癌、副腎腺の癌、軟組織の肉腫、尿道の癌、陰茎の癌、前立腺癌、精巣癌、慢性または急性の白血病、慢性骨髄性白血病、リンパ球性リンパ腫、膀胱の癌、腎臓または尿管の癌、腎細胞癌腫、腎盂の癌腫、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、非ホジキンリンパ腫、脊髄軸腫瘍、脳幹神経膠腫、下垂体腺腫、副腎皮質癌、胆嚢癌、多発性骨髄腫、胆管癌、線維肉腫、神経芽細胞腫、網膜芽細胞腫、または以上の癌のうちの1つまたは複数の組合せを包含するが、それらに限定されるものではない。
【0170】
異常細胞成長は、乾癬、良性前立腺肥大症または再狭窄を包含するがそれらに限定されない、良性増殖性疾患を包含するが、それに限定されるものではない。
【0171】
PARP活性のモジュレーターとしての化合物1の多形性塩形態の活性は、インビボおよび/またはインビトロのアッセイを包含する当業者が利用できる方法のうちのいずれかにより測定することができる。活性測定のための適当なアッセイの例は、それらの開示がそれらの全体として参照により本明細書に組み込まれている米国特許第6,495,541号および米国仮特許出願第60/612,458号に記載されているものを包含する。
【0172】
一部の実施形態は、PARP活性により仲介される疾患状態、例えば、癌ならびに酸化的または酸化窒素誘発性のストレスおよびそれに続くPARP過剰活性化が関わる様々な疾患および毒性状態を処置する治療方法も対象とする。そのような状態は、神経学的および神経変性障害(例えば、パーキンソン病、アルツハイマー病)、心臓血管障害(例えば、心筋梗塞、虚血−再灌流傷害)、糖尿病性血管機能障害、シスプラチン誘発性腎毒性を包含するが、それらに限定されるものではない。一部の実施形態において、治療方法は、治療有効量の、多形性形態のうちのいずれかを包含する医薬組成物、または本明細書で議論されている医薬組成物を、それを必要としている哺乳動物に投与することを包含する。
【0173】
一部の実施形態は、PARP活性により仲介される疾患状態を処置する組合せ治療方法であって、治療有効量の抗腫瘍剤、抗血管新生剤、シグナル伝達阻害剤、および抗増殖剤、有糸分裂阻害剤、アルキル化剤、代謝拮抗剤、挿入性抗生物質、成長因子阻害剤、細胞周期阻害剤、酵素、トポイソメラーゼ阻害剤、生物学的応答調整剤、抗体、細胞傷害剤、抗ホルモン剤、および抗アンドロゲン剤などの1つまたは複数の物質と組み合わせて、治療有効量の、多形性形態のうちのいずれかを含む医薬組成物、または本明細書で議論されている医薬組成物を、それを必要としている哺乳動物に投与することを含む方法も対象とする。そのような物質は、それらの開示がそれらの全体として参照により本明細書に組み込まれているPCT公開第WO00/38715号、第WO00/38716号、第WO00/38717号、第WO00/38718号、第WO00/38719号、第WO00/38730号、第WO00/38665号、第WO00/37107号、および第WO00/38786号に開示されているものを包含するが、それらに限定されるものではない。
【0174】
抗腫瘍剤の例は、テモゾロマイド(SCHERING)、イリノテカン(PFIZER)、トポテカン(GLAXO SMITHKLINE)、シスプラチン(BRISTOL MEYERS SQUIBB;AM PHARM PARTNERS;BEDFORD;GENSIA SICOR PHARMS;PHARMACHEMIE)、およびドキソルビシン塩酸塩(AM PHARM PARTNERS;BEDFORD;GENSIA;SICOR PHARMS;PHARMACHEMIE;ADRIA;ALZA)を包含する。
【0175】
抗腫瘍剤の追加例は、有糸分裂阻害剤、例えば、ビンブラスチン、ビノレルビン、ビンデシンおよびビンクリスチンなどのビンカアルカロイド誘導体;コルヒチン、アロコルヒチン、ハリコンドリン、N−ベンゾイルトリメチル−メチルエーテルコルヒチン酸、ドラスタチン10、メイタンシン、リゾキシン、タキソール(パクリタキセル)、ドセタキセル(Taxotere)、2’−N−[3−(ジメチルアミノ)プロピル]グルタラメート(glutaramate)(タキソール誘導体)などのタキサン、チオコルヒチン、トリチルシステイン、テニポシド、メトトレキセート、アザチオプリン、フルオロウラシル、シトシンアラビノシド、2’,2’−ジフルオロデオキシシチジン(ゲムシタビン)、アドリアマイシンおよびマイトマイシン;アルキル化剤、例えば、カルボプラチン、オキサリプラチン、イプロプラチン、N−アセチル−DL−サルコシル−L−ロイシンのエチルエステル(AsaleyまたはAsalex)、1,4−シクロヘキサジン−1,4−ジカルバミン酸、2,5−ビス(1−アジリジニル)−3,6−ジオキソ−、ジエチルエステル(ジアジクォン)、1,4−ビス(メタンスルホニルオキシ)ブタン(ブスルファンまたはロイコスルファン(leucosulfan))、クロロゾトシン、クロメソン、シアノモルホリノドキソルビシン、シクロジソン、ジアンヒドロガラクチトール、フルオロドパン、ヘプスルファム、マイトマイシンC、ヒカンテオネマイトマイシン(hycantheonemitomycin)C、ミトゾラミド(mitozolamide)、1−(2−クロロエチル)−4−(3−クロロプロピル)−ピペラジン二塩酸塩、ピペラジンジオン、ピポブロマン、ポルフィロマイシン、スピロヒダントインマスタード、テロキシロン、テトラプラチン(tetraplatin)、チオテパ、トリエチレンメラミン、ウラシルナイトロジェンマスタード、ビス(3−メシルオキシプロピル)アミン塩酸塩、マイトマイシン、シクロヘキシル−クロロエチルニトロソ尿素、メチルシクロヘキシル−クロロエチルニトロソ尿素、1−(2−クロロエチル)−3−(2,6−ジオキソ−3−ピペリジル)−1−ニトロソ−尿素、ビス(2−クロロエチル)ニトロソ尿素などのニトロソ尿素剤、プロカルバジン、ダカルバジン、メクロレタミン、シクロホスファミド、イホスファミド、メルファラン、クロラムブシル、リン酸エストラムスチンナトリウム、およびストレプトゾシンなどのナイトロジェンマスタード関連化合物;DNA代謝拮抗剤、例えば、5−フルオロウラシル、シトシンアラビノシド、ヒドロキシ尿素、2−[(3−ヒドロキシ−2−ピリノジニル(pyrinodinyl))メチレン]−ヒドラジンカルボチオアミド、デオキシフルオロウリジン、5−ヒドロキシ−2−ホルミルピリジンチオセミカルバゾン、α−2’−デオキシ−6−チオグアノシン、グリシン酸アフィジコリン、5−アザデオキシシチジン、β−チオグアニンデオキシリボシド、サイクロシチジン、グアナゾール、イノシングリコジアルデヒド(glycodialdehyde)、マクベシンII、ピラゾールイミダゾール(pyrazolimidazole)、クラドリビン、ペントスタチン、チオグアニン、メルカプトプリン、ブレオマイシン、2−クロロデオキシアデノシン、ラルチトレキセドおよびペメトレキセド二ナトリウムなどのチミジル酸合成酵素阻害剤、クロファラビン、フロクスウリジンおよびフルダラビン;DNA/RNA代謝拮抗剤、例えば、L−アラノシン、5−アザシチジン、アシビシン、アミノプテリンおよびN−[2−クロロ−5−[[(2,4−ジアミノ−5−メチル−6−キナゾリニル)メチル]アミノ]ベンゾイル]−L−アスパラギン酸、N−[4−[[(2,4−ジアミノ−5−エチル−6−キナゾリニル)メチル]アミノ]ベンゾイル]−L−アスパラギン酸、N−[2−クロロ−4−[[(2,4−ジアミノプテリジニル)メチル]アミノ]ベンゾイル]−L−アスパラギン酸などのその誘導体、可溶性ベイカーズアンチフォル(Baker’s antifol)、ジクロロアリルローソン、ブレキナル、フトラフール、ジヒドロ−5−アザシチジン、メトトレキセート、N−(ホスホノアセチル)−L−アスパラギン酸四ナトリウム塩、ピラゾフリン、トリメトレキセート、プリカマイシン、アクチノマイシンD、クリプトフィシン、およびクリプトフィシン−52などの類似体、または、例えば、N−(5−[N−(3,4−ジヒドロ−2−メチル−4−オキソキナゾリン−6−イルメチル)−N−メチルアミノ]−2−テノイル)−L−グルタミン酸などの欧州特許出願第239362号に開示されている好ましい代謝拮抗剤のうちの1つ;成長因子阻害剤;細胞周期阻害剤;挿入性抗生物質、例えば、アドリアマイシンおよびブレオマイシン;タンパク質、例えば、インターフェロン;および、抗ホルモン剤、例えばNolvadex(商標)(タモキシフェン)などの抗エストロゲン剤、または、例えば、Casodex(商標)(4’−シアノ−3−(4−フルオロフェニルスルホニル)−2−ヒドロキシ−2−メチル−3’−(トリフルオロメチル)プロピオンアニリド)などの抗アンドロゲン剤を包含する。そのような結合治療は、治療の個々の構成成分の同時、順次、または個別投薬により達成することができる。
【0176】
抗血管新生剤は、MMP−2(マトリックス−メタロプロテイナーゼ2)阻害剤、MMP−9(マトリックス−メタロプロテイナーゼ9)阻害剤、およびCOX−II(シクロオキシゲナーゼII)阻害剤を包含する。有用なCOX−II阻害剤の例は、CELEBREX(商標)(アレコキシブ(alecoxib))、バルデコキシブ、およびロフェコキシブを包含する。有用なマトリックスメタロプロテイナーゼ阻害剤の例は、それらのすべてが全体として参照により本明細書に組み込まれているWO96/33172(1996年10月24日公開)、WO96/27583(1996年3月7日公開)、欧州特許出願第97304971.1号(1997年7月8日出願)、欧州特許出願第99308617.2号(1999年10月29日出願)、WO98/07697(1998年2月26日公開)、WO98/03516(1998年1月29日公開)、WO98/34918(1998年8月13日公開)、WO98/34915(1998年8月13日公開)、WO98/33768(1998年8月6日公開)、WO98/30566(1998年7月16日公開)、欧州特許公開第606,046号(1994年7月13日公開)、欧州特許公開第931,788号(1999年7月28日公開)、WO90/05719(1990年5月31日公開)、WO99/52910(1999年10月21日公開)、WO99/52889(1999年10月21日公開)、WO99/29667(1999年6月17日公開)、PCT国際出願第PCT/IB98/01113号(1998年7月21日出願)、欧州特許出願第99302232.1号(1999年3月25日出願)、英国特許出願第9912961.1号(1999年6月3日出願)、米国仮出願第60/148,464号(1999年8月12日出願)、米国特許第5,863,949号(1999年1月26日発行)、米国特許第5,861,510号(1999年1月19日発行)、および欧州特許公開第780,386号(1997年6月25日公開)に記載されている。好ましいMMP−2およびMMP−9阻害剤は、MMP−1を阻害する活性をほとんどまたはまったく有していないものである。他のマトリックス−メタロプロテイナーゼ(すなわち、MMP−1、MMP−3、MMP−4、MMP−5、MMP−6、MMP−7、MMP−8、MMP−10、MMP−11、MMP−12、およびMMP−13)と比べて、MMP−2および/またはMMP−9を選択的に阻害するものがより好ましい。
【0177】
MMP阻害剤の例は、AG−3340、RO32−3555、RS13−0830、および下記の化合物:3−[[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニル]−(1−ヒドロキシカルバモイル−シクロペンチル)−アミノ]−プロピオン酸;3−エキソ−3−[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニルアミノ]−8−オキサ−ビシクロ[3.2.1]オクタン−3−カルボン酸ヒドロキシアミド;(2R,3R)1−[4−(2−クロロ−4−フルオロ−ベンジルオキシ)−ベンゼンスルホニル]−3−ヒドロキシ−3−メチル−ピペリジン−2−カルボン酸ヒドロキシアミド;4−[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニルアミノ]−テトラヒドロ−ピラン−4−カルボン酸ヒドロキシアミド;3−[[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニル]−(1−ヒドロキシカルバモイル−シクロブチル)−アミノ]−プロピオン酸;4−[4−(4−クロロ−フェノキシ)−ベンゼンスルホニルアミノ]−テトラヒドロ−ピラン−4−カルボン酸ヒドロキシアミド;3−[4−(4−クロロ−フェノキシ)−ベンゼンスルホニルアミノ]−テトラヒドロ−ピラン−3−カルボン酸ヒドロキシアミド;(2R,3R)1−[4−(4−フルオロ−2−メチル−ベンジルオキシ)−ベンゼンスルホニル]−3−ヒドロキシ−3−メチル−ピペリジン−2−カルボン酸ヒドロキシアミド;3−[[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニル]−(1−ヒドロキシカルバモイル−1−メチル−エチル)−アミノ]−プロピオン酸;3−[[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニル]−(4−ヒドロキシカルバモイル−テトラヒドロ−ピラン−4−イル)−アミノ]−プロピオン酸;3−エキソ−3−[4−(4−クロロ−フェノキシ)−ベンゼンスルホニルアミノ]−8−オキサ−ビシクロ[3.2.1]オクタン−3−カルボン酸ヒドロキシアミド;3−エンド−3−[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニルアミノ]−8−オキサ−ビシクロ[3.2.1]オクタン−3−カルボン酸ヒドロキシアミド;3−[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニルアミノ]−テトラヒドロ−フラン−3−カルボン酸ヒドロキシアミド;および薬学的に許容できるそれらの塩、溶媒和物および水和物を包含する。
【0178】
シグナル伝達阻害剤の例は、EGFR抗体、EGF抗体、およびEGFR阻害剤である分子などのEGFR(上皮成長因子受容体)応答を阻害することができる薬剤;VEGF(血管内皮成長因子)阻害剤;ならびにerbB2受容体と結合する有機分子または抗体などのerbB2受容体阻害剤、例えば、HERCEPTIN(商標)(South San Francisco、California、USAのGenentech,Inc.)を包含する。
【0179】
EGFR阻害剤は、例えば、WO95/19970(1995年7月27日公開)、WO98/14451(1998年4月9日公開)、WO98/02434(1998年1月22日公開)、および米国特許第5,747,498号(1998年5月5日発行)に記載されているものを包含する。EGFR阻害剤は、モノクローナル抗体C225および抗EGFR22Mab(New York、New York、USAのImClone Systems Incorporated)、化合物ZD−1839(AstraZeneca)、BIBX−1382(Boehringer Ingelheim)、MDX−447(Annandale、New Jersey、USAのMedarex Inc.)、およびOLX−103(Whitehouse Station、New Jersey、USAのMerck & Co.)、VRCTC−310(Ventech Research)ならびにEGF融合毒素(Hopkinton、MassachusettsのSeragen Inc.)を包含するが、それらに限定されるものではない。
【0180】
VEGF阻害剤、例えば、SU−5416およびSU−6668(South San Francisco、California、USAのSugen Inc.)も、組成物と組み合わせるか同時投与することができる。VEGF阻害剤の例は、例えば、それらのすべてが全体として参照により本明細書に組み込まれているWO99/24440(1999年5月20日公開)、PCT国際出願PCT/IB99/00797(1999年5月3日出願)、WO95/21613(1995年8月17日公開)、WO99/61422(1999年12月2日公開)、米国特許第5,834,504号(1998年11月10日発行)、WO98/50356(1998年11月12日公開)、米国特許第5,883,113号(1999年3月16日発行)、米国特許第5,886,020号(1999年3月23日発行)、米国特許第5,792,783号(1998年8月11日発行)、WO99/10349(1999年3月4日公開)、WO97/32856(1997年9月12日公開)、WO97/22596(1997年6月26日公開)、WO98/54093(1998年12月3日公開)、WO98/02438(1998年1月22日公開)、WO99/16755(1999年4月8日公開)、およびWO98/02437(1998年1月22日公開)に記載されている。一部の特異的VEGF阻害剤の他の例は、IM862(Kirkland、Washington、USAのCytran Inc.);抗VEGFモノクローナル抗体ベバシツマブ(South San Francisco、CaliforniaのGenentech,Inc.);ならびに、Ribozyme(Boulder、Colorado)からの合成リボザイム、アンギオザイム(angiozyme)およびChiron(Emeryville、California)である。
【0181】
GW−282974(Glaxo Wellcome plc)、ならびにモノクローナル抗体AR−209(The Woodlands、Texas、USAのAronex Pharmaceuticals Inc.)および2B−1(Chiron)などのerbB2受容体阻害剤は、組成物と組み合わせて投与することができる。そのようなerbB2阻害剤は、それらの各々がその全体として参照により本明細書に組み込まれているWO98/02434(1998年1月22日公開)、WO99/35146(1999年7月15日公開)、WO99/35132(1999年7月15日公開)、WO98/02437(1998年1月22日公開)、WO97/13760(1997年4月17日公開)、WO95/19970(1995年7月27日公開)、米国特許第5,587,458号(1996年12月24日発行)、および米国特許第5,877,305号(1999年3月2日発行)に記載されているものを包含するが、それらに限定されるものではない。本発明において有用なerbB2受容体阻害剤は、それらの両方がそれらの全体として参照により本明細書に組み込まれている1999年1月27日出願の米国仮出願第60/117,341号、および1999年1月27日出願の米国仮出願第60/117,346号にも記載されている。
【0182】
使用することができる他の抗増殖剤は、下記の米国特許出願:09/221946(1998年12月28日出願);09/454058(1999年12月2日出願);09/501163(2000年2月9日出願);09/539930(2000年3月31日出願);09/202796(1997年5月22日出願);09/384339(1999年8月26日出願);および09/383755(1999年8月26日出願)に開示および特許請求の範囲に記載されている化合物;ならびに下記の米国仮特許出願:60/168207(1999年11月30日出願);60/170119(1999年12月10日出願);60/177718(2000年1月21日出願);60/168217(1999年11月30日出願);および60/200834(2000年5月1日出願)に開示および特許請求の範囲に記載されている化合物を包含する酵素ファルネシルタンパク質トランスフェラーゼの阻害剤および受容体チロシンキナーゼPDGFrの阻害剤を包含するが、それらに限定されるものではない。以上の特許出願および仮特許出願の各々は、それらの全体として参照により本明細書に組み込まれるものとする。
【0183】
本発明の組成物は、CTLA4(細胞傷害性リンパ球抗原4)抗体などの抗腫瘍免疫応答を増強することができる薬剤、およびCTLA4をブロックすることができる他の薬剤;ならびに他のファルネシルタンパク質トランスフェラーゼ阻害剤などの抗増殖剤を包含するがそれらに限定されない、異常細胞成長または癌を治療するのに有用な他の薬剤と共に使用することもできる。本発明において使用することができる具体的なCTLA4抗体は、その全体として参照により本明細書に組み込まれている米国仮特許出願第60/113,647号(1998年12月23日出願)に記載されるものを包含する。
【0184】
すべての引用されている参考文献の開示は、それらの全体として参照により本明細書に組み込まれるものとする。
【0185】
実施例
続く実施例は、化合物1の相異なる多形性塩形態の調製および特徴付けをさらに説明しているが、本明細書に記載されているか本明細書で特許請求の範囲に記載されているような本発明の範囲を限定することは意図されていない。他に指示がない限り、すべての温度は、℃で示され、すべての部および百分率は、重量による。
【実施例1】
【0186】
化合物1のマレイン酸塩、マレイン酸塩多形体A形の調製。
80/20v/vイソプロピルアルコール/水(25mL)中の化合物1(100.8mg;0.31mmol)の溶液を、周囲条件(20〜25℃)にて撹拌しながら液体媒質に固体を溶かすことにより調製した。最小体積の80/20v/vイソプロピルアルコール/水中のマレイン酸(25.13mg;0.22mmol)の溶液を、上のように調製した。化合物1の溶液17.26mLを、周囲条件にて撹拌しながらマレイン酸溶液にゆっくりと加え、化合物1とマレイン酸の等モル溶液を得た。得られた溶液を、周囲条件にて24時間にわたって撹拌させ、続いて、ヘキサン(6mL)を加え、24時間にわたって−20℃にて保存すると、その間に結晶化が起きた。濾過して80/20v/vイソプロピルアルコール/水で洗浄した後、生成物を40℃にて真空下で乾燥すると、結晶性材料おおよそ100mgが得られた。
【実施例2】
【0187】
エタノールを使用する化合物1のマレイン酸塩、マレイン酸塩多形体B形の調製。
エタノール(450mL)中の化合物1(10g;30.9mmol)の溶液を、オーバーヘッド撹拌しながらジャケット付き反応容器中で還流状態まで加熱することにより調製した。エタノール(20mL)中のマレイン酸(3.95g;1.1当量)の溶液を、80℃にて1時間かけて滴加すると、その間に結晶化が起きた。懸濁液を0.5℃/分にて冷却し、1時間の顆粒化後に0℃にて単離した。濾過してエタノール(50mL)で洗浄した後、生成物を50℃にて真空下で乾燥すると、結晶性生成物12g(89%理論収率)が得られた。
【実施例3】
【0188】
イソプロピルアルコールを使用する化合物1のマレイン酸塩、マレイン酸塩多形体B形の調製。
イソプロピルアルコール(1500mL)中の化合物1(18g;55.7mmol)の溶液を、オーバーヘッド撹拌しながらジャケット付き反応容器中で加熱することにより調製した。イソプロピルアルコール(100mL)中のマレイン酸(7.11g;1.1当量)の溶液を調製し、滴加し(1時間かけて)、続いて、表題化合物の種結晶(45mg)を加えた。添加が終了したら直ぐに、懸濁液を0℃まで(自然の速度にて)冷却し、2日にわたって顆粒化させた。濾過した後、生成物を50℃にて真空下で乾燥すると、結晶性生成物23.7g(97%理論収率)が得られた。
【実施例4】
【0189】
テトラヒドロフランを使用する化合物1のS−カンシル酸塩、S−カンシル酸塩多形体A形の調製。
化合物1(20g)を、オーバーヘッド撹拌しながらジャケット付き反応容器中のテトラヒドロフラン(42mL)および水(40mL)中で還流状態にてスラリー化し、遊離塩基スラリーとして留めた。S−カンファースルホン酸溶液(水20mL中17.25g)をおおよそ10分かけてゆっくりと加え、澄明な黄色溶液を形成させ、30分にわたって還流状態に保った。次いで、おおよそ20分かけて水(135mL)を加え、還流を維持した。得られた黄色がかったスラリーを10℃まで冷却し、この温度にて顆粒化させ、適当な時間にわたって結晶化度および収率を改善した。適当な顆粒化時間は、当業者が選択することができる。典型的な顆粒化時間は、例えば、約1時間〜約48時間であってよい。濾過した固体を冷水(20mL)で洗浄し、50℃にて真空下で乾燥すると、最終生成物が得られた。
【実施例5】
【0190】
イソプロピルアルコールを使用する化合物1のS−カンシル酸塩、S−カンシル酸塩多形体A形の調製。
イソプロピルアルコール(225mL)中の化合物1(982.5mg;3.03mmol)の溶液を、周囲条件(20〜25℃)にて撹拌しながら液体媒質に固体を溶かすことにより調製した。最小体積のイソプロピルアルコール中のS−カンファースルホン酸(53.81mg)の溶液を上のように調製した。化合物1溶液17.16mLを、周囲条件にて撹拌しながらマレイン酸溶液にゆっくりと加え、化合物1とS−カンファースルホン酸の等モル溶液を得た。得られた溶液を、周囲条件にて48時間にわたって撹拌させると、その間に結晶化が起きた。濾過してイソプロピルアルコールで洗浄した後、生成物を40℃にて真空下で乾燥すると、結晶性材料おおよそ75mgが得られた。
【実施例6】
【0191】
粉末X線回折(PXRD)による化合物1のS−カンシル酸塩、多形体A形および化合物1のマレイン酸塩、多形体B形の特徴付け。
粉末X線回折パターンは、図3、4、9、および10に示されているように、自動サンプルチェンジャー、θ−θゴニオメーター、自動ビーム発散スリット、およびPSD Vantec−1検出器を取り付けたBruker−AXS Ltd.D4粉末X線回折計を使用して決定した。サンプルは、低バックグランドのキャビティーシリコンウエハー試料台上に設置することにより分析用に調製した。試料を、40kV/35mAで作動するX線管により銅K−α1X線(波長=1.5406Å)を照射しながら回転させた。分析は、2°〜55°の2θ範囲にわたり、0.018°のステップ毎に0.2秒カウントに設定した連続モードで実行するゴニオメーターで行った。ピークは、計算された模擬粉末パターンのピークに対して割り付けられた。
【実施例7】
【0192】
粉末X線回折(PXRD)による化合物1のマレイン酸塩、多形体A形の特徴付け。
粉末X線回折(PXRD)パターン測定は、図1に示されているように、銅放射線(CuKα、波長:1.54056Å)を使用するBruker D5000回折計で行った。管の電圧およびアンペア数は、それぞれ40kVおよび40mAに設定した。発散および散乱スリットは1mmに設定し、受光スリットは0.6mmに設定した。回折された放射線は、Kevex PSI検出器により検出した。3.0から40゜2θまでの2.4゜/分(1秒/0.04゜ステップ)におけるθ−2θ連続スキャンを使用した。アルミナ標準品を分析し、機器アラインメントをチェックした。サンプルは、それらを石英ホルダーに入れることにより調製した。
【実施例8】
【0193】
粉末X線回折(PXRD)による化合物1のS−カンシル酸塩、多形体B形の特徴付け。
粉末X線回折パターンは、図15に示されているように、Gobelミラー光学、単一サンプル加熱ステージおよび位置敏感型検出器(PSD)を取り付けたBruker AXS Ltd.D8 Advance粉末X線回折計を使用して得た。各試料に、40kV/40mAで作動するX線管により銅K−α1X線(波長=1.5406Å)を照射した。分析は、3°〜35°2θの範囲にわたり、0.014°ステップ毎に0.2秒カウントに設定した連続スキャンモードで実行するゴニオメーターで行った。測定は、Ansyco sycos−H−HOT温度コントローラーを使用して温度を制御しながら150℃にて行った。
【実施例9】
【0194】
固体核磁気共鳴(SSNMR)による化合物1のマレイン酸塩、多形体B形の特徴付け。
スペクトルは、ワイドボアBruker−Biospin DSX 500MHz(1H周波数)NMR分光計内に配置されたBruker−Biospin 4mm BL CPMASプローブで周囲温度および圧力にて集めた。充填されたローターをマジック角に置き、15.0kHzにて回転させた。13C固体スペクトルは、図5に示されているように、プロトンデカップルド交差分極マジック角回転(CPMAS)を使用して集めた。交差分極接触時間は、2.0msに設定した。おおよそ85kHzのプロトンデカップリング磁界を適用した。14秒のリサイクルディレイで4096のスキャンを集めた。炭素スペクトルは、その高磁場共鳴が29.5ppmに設定されている結晶性アダマンタンの外部標準を使用して参照した。19F固体スペクトルは、図6に示されているように、プロトンデカップルドマジック角回転実験(MAS)を使用して集めた。おおよそ85kHzのプロトンデカップリング磁界を適用した。140秒のリサイクルディレイで128のスキャンを集めた。フッ素スペクトルは、その共鳴が−76.54ppmに設定されているトリフルオロ酢酸(H2O中50%V/V)の外部標準を使用して参照した。
【実施例10】
【0195】
固体核磁気共鳴(SSNMR)による化合物1のS−カンシル酸塩、多形体A形の特徴付け。
サンプルおおよそ80mgを、4mmZrO2ローターにきつく充填した。スペクトルは、ワイドボアBruker−Biospin DSX 500MHz(1H周波数)NMR分光計内に配置されたBruker−Biospin 4mm BL CPMASプローブで周囲温度および圧力にて集めた。充填されたローターをマジック角に置き、15.0kHzにて回転させた。13C固体スペクトルは、図11に示されているように、プロトンデカップルド交差分極マジック角回転(CPMAS)を使用して集めた。交差分極接触時間は、2.0msに設定した。おおよそ85kHzのプロトンデカップリング磁界を適用した。6秒のリサイクルディレイで2048のスキャンを集めた。炭素スペクトルは、その高磁場共鳴が29.5ppmに設定されている結晶性アダマンタンの外部標準を使用して参照した。19F固体スペクトルは、図12に示されているように、プロトンデカップルドマジック角回転実験(MAS)を使用して集めた。おおよそ85kHzのプロトンデカップリング磁界を適用した。28秒のリサイクルディレイで256のスキャンを集めた。フッ素スペクトルは、その共鳴が−76.54ppmに設定されているトリフルオロ酢酸(H2O中50%V/V)の外部標準を使用して参照した。
【実施例11】
【0196】
示差走査熱量測定(DSC)による化合物1の多形体の特徴付け。
様々な多形体の示差走査熱量測定は、図2、7、13、および24〜27に示されているように、TA Instruments Q1000またはMettler Instruments DSC822を使用して行った。サンプル(1〜2mg)を、約320℃程度まで、窒素ガスをパージしながら毎分10℃にて20℃からひだ付きアルミニウムパンの中で加熱した。
【実施例12】
【0197】
動的蒸気收着(DVS)による化合物1の多形体の特徴付け。
吸湿性は、図8および14に示されているように、Surface Measurements Systems Ltd.UK製のAutomated Sorption Analyser Model DVS−1を使用して測定した。固体(20〜25mg)を、制御された相対湿度(%RH)および温度環境(30℃)に曝露し、重量変化を経時的に記録した。湿度は、15%RH間隔で0から90%RHまで進めた。10分にわたって平均された0.0005%/分の收着速度が、この方法で次の湿度に曝露する前に各湿度にて達成された。
【実施例13】
【0198】
化合物1のS−カンシル酸塩、多形体A形の固体剤形の調製。
化合物1のS−カンシル酸塩多形体A形を、即時放出錠剤に製剤化した。製剤化された組成物は、下記の構成成分を含有した。
【0199】
【表32】

【0200】
製剤化された組成物は、図16に示されているPXRDパターンにより特徴付けられた。
【0201】
上と同じか類似した製剤は、同じか類似した量の遊離塩基薬物濃度が上の製剤におけるようにマレイン酸塩製剤で維持されるように、マレイン酸塩多形体を使用して製造することができる。
【実施例14】
【0202】
マレイン酸塩多形体B形の物理的安定性。
マレイン酸塩多形体B形についてのPXRDパターンを、1)初期時点および2)75%相対湿度(RH)で70℃における保存後から2週後に測定した。マレイン酸塩多形体B形のPXRDパターンは、75%相対湿度で70℃における保存2週後に有意に変化しなかった。このことは、マレイン酸塩多形体B形が物理的に安定な形態で存在することを証明している。
【実施例15】
【0203】
S−カンシル酸塩多形体A形の物理的安定性。
S−カンシル酸塩多形体A形についてのPXRDパターンを、1)初期時点および2)75%相対湿度(RH)で70℃における保存から2週後に測定した。S−カンシル酸塩多形体A形のPXRDパターンは、75%相対湿度で70℃における保存2週後に有意に変化しなかった。このことは、S−カンシル酸塩多形体A形が物理的に安定な形態で存在することを証明している。
【0204】
本発明を、具体的かつ好ましい実施形態を参照することにより説明してきたが、当業者は、本発明のルーチンな実験および実施を通して変形および修正が可能であることを認識しているであろう。すなわち、本発明は、上述の説明により限定されないが、添付の特許請求の範囲およびそれらの等価物により規定されることが意図されている。
【実施例16】
【0205】
化合物1のS−カンシル酸塩、S−カンシル酸塩多形体C形の調製。
S−カンシル酸塩多形体A形(1g)のスラリーを、イソプロピルアルコール:水(10mL;40:60%v/v)中で調製した。スラリーを10分間かけて70℃まで加熱すると、溶液が得られた。溶液を25℃まで冷却すると、過飽和溶液が得られた。イソプロピルアルコール:水(25mL;10:90%v/v)および水(30mL)を加えた。得られた過飽和溶液をローターリーエバポレーターに移し、溶媒を、70℃にて真空下(50ミリバール)で除去した。沈殿が形成され単離された(0.6g)。
【実施例17】
【0206】
1R:1S−カンシル酸塩の調製。
化合物1(1.5g)のスラリーを、イソプロピルアルコール:水(25mL;40:60%v/v)中で調製した。R−カンファースルホン酸(0.65g)およびS−カンファースルホン酸(0.65g)を、水(1.5mL)中の溶液として加えた。スラリーを10分間かけて70℃まで加熱した。得られた溶液を10分間かけて0℃まで冷却した。固体は、1時間にわたって0℃の温度にてこの溶液を保った後に結晶化した。これによりスラリーが形成した。このスラリーを、合計36時間にわたって顆粒化させた。結晶を濾過し、水で洗浄し、次いで、50℃にて一晩にわたって乾燥すると、淡黄色の粉末(1.9g)が得られた。
【実施例18】
【0207】
1R:9S−カンシル酸塩の調製。
化合物1(1.5g)のスラリーを、イソプロピルアルコール:水(25mL;40:60%v/v)中で調製した。R−カンファースルホン酸(0.13g)およびS−カンファースルホン酸(1.17g)を、水(1.5mL)中の溶液として加えた。スラリーを10分間かけて70℃まで加熱した。得られた溶液を10分間かけて10℃まで冷却した。固体は、1時間にわたって10℃の温度にてこの溶液を保った後に結晶化した。これによりスラリーが形成した。このスラリーを、合計48時間にわたって顆粒化させた。結晶を濾過し、水で洗浄し、次いで、50℃にて一晩にわたって乾燥すると、淡黄色の粉末が得られた。
【実施例19】
【0208】
1R:3S−カンシル酸塩の調製。
化合物1(1.5g)のスラリーを、イソプロピルアルコール:水(25mL;40:60%v/v)中で調製した。R−カンファースルホン酸(0.325g)およびS−カンファースルホン酸(0.975g)を、水(1.5mL)中の溶液として加えた。スラリーを10分間かけて70℃まで加熱した。得られた溶液を10分間かけて10℃まで冷却した。固体は、10℃の温度にてこの溶液を保った後に結晶化した。これによりスラリーが形成した。このスラリーを、合計4時間にわたって顆粒化させた。結晶を濾過し、水で洗浄し、次いで、50℃にて一晩にわたって乾燥すると、淡黄色の粉末が得られた。
【実施例20】
【0209】
1R:7S−カンシル酸塩の調製。
化合物1(1.5g)のスラリーを、イソプロピルアルコール:水(25mL;40:60%v/v)中で調製した。R−カンファースルホン酸(0.16g)およびS−カンファースルホン酸(1.14g)を、水(1.5mL)中の溶液として加えた。スラリーを10分間かけて70℃まで加熱した。得られた溶液を10分間かけて10℃まで冷却した。固体は、10℃の温度にてこの溶液を保った後に結晶化した。これによりスラリーが形成した。このスラリーを、合計4時間にわたって顆粒化させた。結晶を濾過し、水で洗浄し、次いで、50℃にて一晩にわたって乾燥すると、淡黄色の粉末が得られた。
【実施例21】
【0210】
化合物1のR−カンシル酸塩、R−カンシル酸塩多形体A形の調製。
化合物1(1.5g)のスラリーを、イソプロピルアルコール:水(25mL;40:60%v/v)中で調製した。R−カンファースルホン酸(1.3g)を、水(1.5mL)中の溶液として加えた。スラリーを10分間かけて70℃まで加熱した。得られた溶液を10分間かけて10℃まで冷却した。固体は、10℃の温度にてこの溶液を保った後に結晶化した。これによりスラリーが形成した。このスラリーを、合計4時間にわたって顆粒化させた。結晶を濾過し、水で洗浄し、次いで、50℃にて一晩にわたって乾燥すると、淡黄色の粉末が得られた。
【実施例22】
【0211】
粉末X線回折(PXRD)による化合物1のS−カンシル酸塩、多形体C形、1R:1S−カンシル酸塩、1R:9S−カンシル酸塩、1R:3S−カンシル酸塩、1R:7S−カンシル酸塩、および化合物1のR−カンシル酸塩、R−カンシル酸塩多形体A形の特徴付け。
粉末X線回折パターンは、図18〜23に示されているように、自動サンプルチェンジャー、θ−θゴニオメーター、自動ビーム発散スリット、およびPSD Vantec−1検出器を取り付けたBruker−AXS Ltd.D4粉末X線回折計を使用して決定した。サンプルは、低バックグランドのキャビティーシリコンウエハー試料台上に設置することにより分析用に調製した。試料を、40kV/35mAで作動するX線管により銅K−α1X線(波長=1.5406Å)を照射しながら回転させた。分析は、2°〜55°の2θ範囲にわたり、0.018°のステップ毎に0.2秒カウントに設定した連続モードで実行するゴニオメーターで行った。ピークは、可能な場合に、計算された模擬粉末パターンのピークに対して割り付けられた。あるいは、ピークは、分析に先立って粉末サンプルと混合されるケイ素またはコランダム(Al2O3)などの内部基準材料を使用して割り付けられた。
【実施例23】
【0212】
固体核磁気共鳴(SSNMR)による化合物1のS−カンシル酸塩、多形体C形の特徴付け。
各サンプルおおよそ80mgを、4mmZrO2ローターにきつく充填した。スペクトルは、ワイドボアBruker−Biospin DSX 500MHz(1H周波数)NMR分光計内に配置されたBruker−Biospin 4mm BL CPMASプローブで周囲条件にて集めた。充填されたローターをマジック角に置き、15.0kHzにて回転させた。13C固体スペクトルは、図28に示されているように、プロトンデカップルド交差分極マジック角回転(CPMAS)実験を使用して集めた。交差分極接触時間は、2.0msに設定した。おおよそ85kHzのプロトンデカップリング磁界を取得中に適用した。7秒のリサイクルディレイで最低限2048のスキャンを集めた。炭素スペクトルは、その高磁場共鳴が29.5ppmに設定されている結晶性アダマンタンの外部標準を使用して参照した。19F固体スペクトルは、図29に示されているように、プロトンデカップルドマジック角回転(MAS)実験を使用して集めた。おおよそ85kHzのプロトンデカップリング磁界を取得中に適用した。おおよそ30秒のリサイクルディレイで最低限128のスキャンを集めた。フッ素スペクトルは、その共鳴が−76.54ppmに設定されているトリフルオロ酢酸(H2O中50%V/V)の外部標準を使用して参照した。
【実施例24】
【0213】
固体核磁気共鳴(SSNMR)による1R:1S−カンシル酸塩および1R:9S−カンシル酸塩の特徴付け。
各サンプルおおよそ80mgを、4mmZrO2ローターにきつく充填した。スペクトルは、ワイドボアBruker−Biospin DSX 500MHz(1H周波数)NMR分光計内に配置されたBruker−Biospin 4mm BL CPMASプローブで周囲条件にて集めた。充填されたローターをマジック角に置き、15.0kHzにて回転させた。13C固体スペクトルは、図30および32に示されているように、プロトンデカップルド交差分極マジック角回転(CPMAS)実験を使用して集めた。交差分極接触時間は、2.0msに設定した。おおよそ85kHzのプロトンデカップリング磁界を取得中に適用した。6秒のリサイクルディレイで最低限2048のスキャンを集めた。炭素スペクトルは、その高磁場共鳴が29.5ppmに設定されている結晶性アダマンタンの外部標準を使用して参照した。19F固体スペクトルは、図31および33に示されているように、プロトンデカップルドマジック角回転(MAS)実験を使用して集めた。おおよそ85kHzのプロトンデカップリング磁界を取得中に適用した。おおよそ30秒のリサイクルディレイで最低限128のスキャンを集めた。フッ素スペクトルは、その共鳴が−76.54ppmに設定されているトリフルオロ酢酸(H2O中50%V/V)の外部標準を使用して参照した。
【実施例25】
【0214】
フーリエ変換−赤外分光法(FT−IR)による化合物1の塩および多形体の特徴付け。
IRスペクトルは、「DurasamplIR」単反射ATRアクセサリー(セレン化亜鉛基板上のダイヤモンド表面)およびd−TGS KBr検出器を取り付けたThermoNicolet Nexus FTIR分光計を使用して取得した。スペクトルは、2cm−1の分解能および512スキャンの同時加算(co−addition)にて集めた。Happ−Genzelアポダイゼーションを使用した。FT−IRスペクトルは、単反射ATRを使用して記録したため、サンプル調製は必要なかった。ATR FT−IRを使用することは、典型的には、赤外バンドの相対強度が、KBrディスクまたはヌジョールムルサンプル調製を使用する透過FT−IRスペクトルにおいて見られる赤外バントと異なる原因になるであろう。ATR FT−IRの性質のため、低めの波数におけるバンドは、典型的には、高めの波数におけるバンドよりも強い。他に指示がない限り、実験誤差は、±2cm−1であった。
【実施例26】
【0215】
フーリエ変換−ラマン分光法(FT−ラマン)による化合物1の塩および多形体の特徴付け。
ラマンスペクトルは、1064nmのNdYAGレーザーおよびLN−Germanium検出器を取り付けたRamIIラマンモジュール付きのBruker Vertex70 FT−IR分光計を使用して集めた。すべてのスペクトルは、2cm−1の分解能およびBlackman−Harris 4−タームアポダイゼーションを使用して記録した。レーザー出力は250mWとし、1024のスキャンを同時加算した。
【実施例27】
【0216】
化合物1のS−カンシル酸塩の非晶性形態の調製。
S−カンシル酸塩多形体A形(150mg)の溶液を、室温にてtBA:水(50ml;60:40%v/v)中で調製した。溶液を、4〜5分間かけてドライアイス−アセトン浴上で旋回させることにより凍結させると、サンプルフラスコの側面に厚い凍結層が得られた。凍結乾燥機の凝縮器を−100℃まで冷却し、真空をスイッチオンした。凍結溶液のサンプルフラスコを、マニホールドチャンバーまたはドライングチャンバーのポートに素早く接続した。真空を、チャンバーへの出口を開けることにより作り出した。化合物1のS−カンシル酸塩の非晶性形態は、室温にて一夜にわたって乾燥した後に単離された。
【実施例28】
【0217】
粉末X線回折(PXRD)による化合物1のS−カンシル酸塩の非晶性形態の特徴付け。
粉末X線回折パターンは、自動サンプルチェンジャー、θ−θゴニオメーター、自動ビーム発散スリット、およびLynxEye検出器を取り付けたBruker−AXS Ltd.D4粉末X線回折計を使用して得た。サンプルは、低バックグランドのキャビティーシリコンウエハー試料台上に設置することにより分析用に調製した。試料を、40kV/40mAで作動するX線管により銅K−α1X線(波長=1.5406Å)を照射しながら回転させた。分析は、3°〜40°の2θ範囲にわたり、0.020°のステップ毎に0.3秒カウントに設定した連続モードで実行するゴニオメーターで行った。PXRDディフラクトグラムは、図34に示されているように、約5゜2θから約40゜2θにかけて広がる基線を有するブロードなピークを示す。
【実施例29】
【0218】
固体核磁気共鳴(SSNMR)による化合物1のS−カンシル酸塩の非晶性形態の特徴付け。
サンプルおおよそ80mgを、4mmZrO2ローターにきつく充填した。スペクトルは、ワイドボアBruker−Biospin DSX 500MHz(1H周波数)NMR分光計内に配置されたBruker−Biospin 4mm BL CPMASプローブで集めた。充填されたローターをマジック角に置き、15.0kHzにて回転させた。ローターは、0℃の出力温度を有する窒素の直接流で冷却した。13C固体スペクトルは、図35に示されているように、プロトンデカップルド交差分極マジック角回転(CPMAS)実験を使用して集めた。交差分極接触時間は、2.0msに設定した。おおよそ85kHzのプロトンデカップリング磁界を取得中に適用した。5.5秒のリサイクルディレイで10240のスキャンを集めた。炭素スペクトルは、その高磁場共鳴が29.5ppmに設定されている結晶性アダマンタンの外部標準を使用して参照した。19F固体スペクトルは、図36に示されているように、プロトンデカップルドマジック角回転(MAS)実験を使用して集めた。おおよそ85kHzのプロトンデカップリング磁界を取得中に適用した。5.5秒のリサイクルディレイで512のスキャンを集めた。フッ素スペクトルは、その共鳴が−76.54ppmに設定されているトリフルオロ酢酸(H2O中50%V/V)の外部標準を使用して参照した。
【実施例30】
【0219】
ラマン分光法による化合物1のS−カンシル酸塩の非晶性形態の特徴付け。
ラマンスペクトルは、FT−IRベンチに接続されているNicolet NXR FT−ラマンアクセサリーを使用して集めた。分光計には、1064nmのNd:YAGレーザーおよび液体窒素冷却Germanium検出器を取り付けた。データ取得に先立って、機器性能および較正検証を、ポリスチレンを使用して行った。サンプルは、スペクトル収集中に回転させるガラスのNMR管内で分析した。スペクトルは、0.5Wのレーザー出力および100の同時加算スキャンを使用して集めた。収集範囲は、3700〜300cm−1とした。すべてのスペクトルは、4cm−1の分解能およびHapp−Genzelアポダイゼーションを使用して記録した。
【0220】
2つの別々のスペクトルを各サンプルについて記録し、それに続いて平均し、ピークピッキングに先立って強度を正規化した。ピークは、Thermo Nicolet Omnic7.3aソフトウェアを使用して手作業で識別した。ピーク位置は、ピーク最大値にてピッキングし、ピークは、各々の側に傾斜がある場合にのみ識別したため、ピーク上の肩は含めなかった。ピーク位置は、最も近い整数に切り上げた。
【実施例31】
【0221】
示差走査熱量測定(DSC)による化合物1のS−カンシル酸塩の非晶性形態の特徴付け。
示差走査熱量測定(DSC)は、図38に示されているように、TA DSC(Q1000)で行った。おおよそ5mgのサンプルを、Perkin Elmer密封アルミニウムパン(40μl)中に秤量した。ガラス転移温度(Tg)測定は、−50〜200℃における1℃の振幅および100秒の周波数で2℃/分の加熱速度にて行った。窒素パージは、他に指示がない限り、50mL/分とした。温度は、インジウムを使用して較正した。
【0222】
得られた156.5℃のTgは、リバーシングシグナル中の半高におけるステップ遷移の中点である。Tgは、水および/または溶媒含有量の関数として変化することがある。
【技術分野】
【0001】
本出願は、その全体として参照により本明細書に組み込まれている2010年2月12日出願の米国特許出願第61/304,277号の利益を主張するものである。
【0002】
本発明は、8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オンの新規な多形性の塩、およびそれらを調製するための方法に関する。本発明は、少なくとも1つの多形性形態を含有する医薬組成物ならびにそのような多形性形態および組成物の治療的使用および/または予防的使用も対象とする。
【背景技術】
【0003】
化合物8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オン(「化合物1」)
【0004】
【化1】

は、ポリ(ADP−リボース)ポリメラーゼ(PARP)の小分子阻害剤である。化合物1、およびそれを製造する方法は、米国特許第6,495,541号、第6,977,298号、第7,429,578号および第7,323,562号に記載されている。化合物1のある種の塩およびそれらの多形体は、米国特許第7,268,126号および国際特許公開第WO04/087713号に開示されている。化合物1およびその使用について記載している他の刊行物は、米国特許出願公開第2006−0074073号、ならびに米国特許第7,351,701号および第7,531,530号を包含する。
【0005】
PARPは、ADP−リボシル化(翻訳後タンパク質修飾)を担う核酵素のファミリーであり、その中で、ポリ(ADP−リボシル)トランスフェラーゼは、ヒストンおよびDNA修復酵素などの核標的タンパク質上の特異的なアミノ酸側鎖上および/または既に接続しているADP−リボース単位上へNAD+からADP−リボース部分を転移させる。ヒトにおいて、PARPファミリーは、17種の酵素を包含し、そのうちで、PARP−1は、最もよく特徴がわかっている(Otto H、Reche PA、Bazan Fら、In silico characterization of the family of PARP−like poly(ADP−ribosyl)transferases(pARTs)、BMC Genomics 2005;6:139)。薬理学研究は、化合物1が、PARP−1(Ki=1.4nM)およびPARP−2(Ki=0.17nM)の阻害剤であることを明らかにした。
【0006】
PARP−1は、DNA切断部位と結合してDNA損傷部位にDNA修復タンパク質を引き寄せることを通してDNAホメオスタシスに関与している。PARP−1は、標的タンパク質上のADP−リボース単位の付加を通して、クロマチン弛緩およびDNA修復プロセスに必要なエネルギー資源を提供する。これらの作用は、DNA修復を促進しかつ容易にする。DNA損傷の程度に応じて、PARP−1活性化およびそれに続くポリ(ADP−リボシル)化は、損傷されたDNAの修復を仲介するか細胞死を誘導する。DNA損傷が中程度である場合、PARP−1は、DNA修復プロセスにおいて重要な役割を果たす。逆に、大規模なDNA損傷の場合、PARP−1の過剰な活性化は、細胞ATPプールを枯渇させ、これは、最終的に、壊死による細胞死をもたらす(Tentori L、Portarena I、Graziani G、Potential applications of poly(ADP−ribose)polymerase(PARP)inhibitors、Pharmacol Res 2002;45:73〜85)。
【0007】
癌療法において、多くの有用な薬物ならびにイオン化放射線は、DNA損傷を通してそれらの治療効果を発揮する。一本鎖または二本鎖のDNA切断部位の酵素仲介修復は、その作用機構がDNA損傷によって左右される放射線療法または細胞傷害性薬物に対する潜在的な耐性機構である。すなわち、DNA修復経路酵素の阻害は、抗癌剤の増強作用のための戦略である。PARP−1の阻害は、インビボおよびインビトロにおいてDNA損傷剤およびイオン化放射線の活性を増強することが明らかにされている。したがって、PARPは、DNA損傷剤と組み合わせる癌療法のための治療標的として同定されている。(Tentori L、Leonetti C、Scarsella M、ら Systemic administration of GPA 15427,a novel poly(ADP−ribose)polymerase−1 inhibitor,increases the antitumor activity of temozolomide against intracranial melanoma,glioma,lymphoma、Clin Cancer Res 2003;9:5370〜9。Satoh MS、Poirier GG、Lindahl T、NAD(+)−dependent repair of damaged DNA by human cell extracts、J Biol Chem 1993;268:5480〜7。)
【0008】
化学増強剤(chemopotentiator)または放射線増感剤としての潜在的役割に加えて、PARP阻害剤単独に対する、BRCA1変異かBRCA2変異のどちらかについてホモ接合である細胞系の感受性を示す最近の証拠が浮上している。(Bryant HE、Schultz N、Thomas HD、ら Specific killing of BRCA−2 deficient tumors with inhibitors of poly(ADP−ribose)polymerase、Nature 2005;434:913〜7。Farmer H、McCabe N、Lord CJ、ら Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy、Nature 2005;434:917〜21。)単剤PARP阻害剤を使った第1相試験からの予備的臨床データが最近公開されている(Yap TA、Boss DS、Fong M、ら First in human phase I pharmacokinetic(PK) and pharmacodynamic(PD)study of KU−0059436(Ku),a small molecule inhibitor of poly ADP−ribose polymerase(PARP) in cancer patients(p) including BRCA 1/2 mutation carriers、(J Clin Oncol 2007;25(Supplement June 20):3529)。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】米国特許出願第61/304,277号
【特許文献2】米国特許第6,495,541号
【特許文献3】米国特許第6,977,298号
【特許文献4】米国特許第7,429,578号
【特許文献5】米国特許第7,323,562号
【特許文献6】米国特許第7,268,126号
【特許文献7】国際特許公開第WO04/087713号
【特許文献8】米国特許出願公開第2006−0074073号
【特許文献9】米国特許第7,351,701号
【特許文献10】米国特許第7,531,530号
【特許文献11】米国仮特許出願第60/612,458号
【特許文献12】PCT公開第WO00/38715号
【特許文献13】PCT公開第WO00/38716号
【特許文献14】PCT公開第WO00/38717号
【特許文献15】PCT公開第WO00/38718号
【特許文献16】PCT公開第WO00/38719号
【特許文献17】PCT公開第WO00/38730号
【特許文献18】PCT公開第WO00/38665号
【特許文献19】PCT公開第WO00/37107号
【特許文献20】PCT公開第WO00/38786号
【特許文献21】欧州特許出願第239362号
【特許文献22】WO96/33172
【特許文献23】WO96/27583
【特許文献24】欧州特許出願第97304971.1号
【特許文献25】欧州特許出願第99308617.2号
【特許文献26】WO98/07697
【特許文献27】WO98/03516
【特許文献28】WO98/34918
【特許文献29】WO98/34915
【特許文献30】WO98/33768
【特許文献31】WO98/30566
【特許文献32】欧州特許公開第606,046号
【特許文献33】欧州特許公開第931,788号
【特許文献34】WO90/05719
【特許文献35】WO99/52910
【特許文献36】WO99/52889
【特許文献37】WO99/29667
【特許文献38】PCT国際出願第PCT/IB98/01113号
【特許文献39】欧州特許出願第99302232.1号
【特許文献40】英国特許出願第9912961.1号
【特許文献41】米国仮出願第60/148,464号
【特許文献42】米国特許第5,863,949号
【特許文献43】米国特許第5,861,510号
【特許文献44】欧州特許公開第780,386号
【特許文献45】WO95/19970
【特許文献46】WO98/14451
【特許文献47】WO98/02434
【特許文献48】米国特許第5,747,498号
【特許文献49】WO99/24440
【特許文献50】PCT国際出願PCT/IB99/00797
【特許文献51】WO95/21613
【特許文献52】WO99/61422
【特許文献53】米国特許第5,834,504号
【特許文献54】WO98/50356
【特許文献55】米国特許第5,883,113号
【特許文献56】米国特許第5,886,020号
【特許文献57】米国特許第5,792,783号
【特許文献58】WO99/10349
【特許文献59】WO97/32856
【特許文献60】WO97/22596
【特許文献61】WO98/54093
【特許文献62】WO98/02438
【特許文献63】WO99/16755
【特許文献64】WO98/02437
【特許文献65】WO99/35146
【特許文献66】WO99/35132
【特許文献67】WO97/13760
【特許文献68】米国特許第5,587,458号
【特許文献69】米国特許第5,877,305号
【特許文献70】米国仮出願第60/117,341号
【特許文献71】米国仮出願第60/117,346号
【特許文献72】米国特許出願第09/221946号
【特許文献73】米国特許出願第09/454058号
【特許文献74】米国特許出願第09/501163号
【特許文献75】米国特許出願第09/539930号
【特許文献76】米国特許出願第09/202796号
【特許文献77】米国特許出願第09/384339号
【特許文献78】米国特許出願第09/383755号
【特許文献79】米国仮特許出願第60/168207号
【特許文献80】米国仮特許出願第60/170119号
【特許文献81】米国仮特許出願第60/177718号
【特許文献82】米国仮特許出願第60/168217号
【特許文献83】米国仮特許出願第60/200834号
【特許文献84】米国仮特許出願第60/113,647号
【非特許文献】
【0010】
【非特許文献1】Otto H、Reche PA、Bazan Fら、In silico characterization of the family of PARP−like poly(ADP−ribosyl)transferases(pARTs)、BMC Genomics 2005;6:139
【非特許文献2】Tentori L、Portarena I、Graziani G、Potential applications of poly(ADP−ribose)polymerase(PARP)inhibitors、Pharmacol Res 2002;45:73〜85
【非特許文献3】Tentori L、Leonetti C、Scarsella M、ら Systemic administration of GPA 15427,a novel poly(ADP−ribose)polymerase−1 inhibitor,increases the antitumor activity of temozolomide against intracranial melanoma,glioma,lymphoma、Clin Cancer Res 2003;9:5370〜9
【非特許文献4】Satoh MS、Poirier GG、Lindahl T、NAD(+)−dependent repair of damaged DNA by human cell extracts、J Biol Chem 1993;268:5480〜7
【非特許文献5】Bryant HE、Schultz N、Thomas HD、ら Specific killing of BRCA−2 deficient tumors with inhibitors of poly(ADP−ribose)polymerase、Nature 2005;434:913〜7
【非特許文献6】Farmer H、McCabe N、Lord CJ、ら Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy、Nature 2005;434:917〜21
【非特許文献7】Yap TA、Boss DS、Fong M、ら First in human phase I pharmacokinetic(PK) and pharmacodynamic(PD)study of KU−0059436(Ku),a small molecule inhibitor of poly ADP−ribose polymerase(PARP) in cancer patients(p) including BRCA 1/2 mutation carriers、(J Clin Oncol 2007;25(Supplement June 20):3529
【非特許文献8】S.Byrnら、Pharmaceutical Solids:A Strategic Approach to Regulatory Considerations、Pharmaceutical research、Vol.12、No.7、p.945〜954、1995
【非特許文献9】J.K.HeleblianおよびW.McCrone、Pharmacetical Applications of Polymorphism、Journal of Pharmaceutical Sciences、Vol.58、No.8、p.911〜929、1969
【非特許文献10】Chenら、J Pharmaceutical and Biomedical Analysis 26:63(2001)
【非特許文献11】Remington:The Science & Practice of Pharmacy、第19版、Williams & Williams、(1995)
【非特許文献12】「Physician’s Desk Reference」、第52版、Medical Economics、Montvale、NJ(1998)
【非特許文献13】Handbook of Pharmaceutical Excipients、第3版、A.H.Kibbe編、Pharmaceutical Press、2000
【発明の概要】
【発明が解決しようとする課題】
【0011】
信頼できる製剤化および製造に適している特性を持つ結晶性の塩およびその多形性形態を有することが望ましい。
【課題を解決するための手段】
【0012】
本明細書に開示されている一部の実施形態は、8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オンのマレイン酸塩を提供する。一部の実施形態において、マレイン酸塩は、結晶性である。一部の実施形態において、マレイン酸塩は、結晶性無水塩である。
【0013】
一部の実施形態において、マレイン酸塩は、6.0±0.2、20.3±0.2、および21.7±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上のピークを含む粉末X線回折パターンを有する。一部の実施形態において、前記粉末X線回折パターンは、1.5406オングストロームの波長において銅K−α1X線を使用して得られる。一部の実施形態において、マレイン酸塩は、6.0±0.2、20.3±0.2、および21.7±0.2の回折角(2θ)におけるピークを含む粉末X線回折パターンを有し、前記粉末X線回折パターンは、1.5406オングストロームの波長において銅K−α1X線を使用して得られる。さらなる実施形態において、塩は、図1に示されているのと本質的に同じ回折角(2θ)におけるピークを含む粉末X線回折パターンを有する。追加の実施形態において、塩は、図2に示されているのと本質的に同じ示差走査熱量測定サーモグラムを有する。一部の実施形態において、塩は、マレイン酸塩多形体A形の実質的に純粋な多形体である。
【0014】
一部の実施形態において、マレイン酸塩は、7.5±0.2、11.3±0.2、および24.3±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上のピークを含む粉末X線回折パターンを有する。一部の実施形態において、前記粉末X線回折パターンは、1.5406オングストロームの波長において銅K−α1X線を使用して得られる。一部の実施形態において、マレイン酸塩は、7.5±0.2、11.3±0.2、および24.3±0.2の回折角(2θ)におけるピークを含む粉末X線回折パターンを有し、前記粉末X線回折パターンは、1.5406オングストロームの波長において銅K−α1X線を使用して得られる。さらなる実施形態において、マレイン酸塩は、図3または図4に示されているのと本質的に同じ回折角(2θ)におけるピークを含む粉末X線回折パターンを有する。一部の実施形態において、マレイン酸塩は、171.3±0.2、112.4±0.2、および43.8±0.2ppmからなる群から選択される1つもしくは複数または2つ以上の13C化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、マレイン酸塩は、171.3±0.2、112.4±0.2、および43.8±0.2ppmにおける13C化学シフトを含む固体NMRスペクトルを有する。さらなる実施形態において、マレイン酸塩は、図5に示されているのと本質的に同じ位置における13C化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、マレイン酸塩は、−123.1±0.2ppmにおける19F化学シフトを含む固体NMRスペクトルを有する。さらなる実施形態において、マレイン酸塩は、図6に示されているのと本質的に同じ位置における19F化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、マレイン酸塩は、1.5406オングストロームの波長において銅K−α1X線を使用して得られる7.5±0.2、11.3±0.2、および24.3±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つのピークを含む粉末X線回折パターン;ならびに1)171.3±0.2、112.4±0.2、および43.8±0.2ppmからなる群から選択される1つもしくは複数または2つ以上または3つの13C化学シフトを含む固体NMRスペクトル;および/または2)−123.1±0.2ppmにおける19F化学シフトを含む固体NMRスペクトルを有する。追加の実施形態において、塩は、図7に示されているのと本質的に同じ示差走査熱量測定サーモグラムを有する。追加の実施形態において、塩は、図8に示されているのと本質的に同じ動的蒸気収着等温線を有する。一部の実施形態において、マレイン酸塩は、表6に示されているような1つまたは複数のFT−IRスペクトルピークを有する。一部の実施形態において、マレイン酸塩は、表7に示されているような1つまたは複数のFT−ラマンスペクトルピークを有する。一部の実施形態において、マレイン酸塩は、マレイン酸塩多形体B形の実質的に純粋な多形体である。一部の実施形態は、マレイン酸塩多形体A形とマレイン酸塩多形体B形の混合物を提供する。
【0015】
追加の実施形態は、マレイン酸塩(例えば、マレイン酸塩多形体A形もしくはマレイン酸塩多形体B形またはそれらの混合物)を含む医薬組成物を提供する。一部の実施形態において、医薬組成物は、固体剤形(例えば、錠剤)を含む。一部の実施形態において、医薬組成物は、マレイン酸塩おおよそ10%〜25%、微結晶性セルロースおおよそ45%〜60%、無水リン酸二カルシウムおおよそ20%〜35%、デンプングリコール酸ナトリウム(タイプA)おおよそ0.1%〜5%、およびステアリン酸マグネシウムおおよそ0.1%〜5%を含む。一部の実施形態において、医薬組成物は、マレイン酸塩おおよそ17.18%、微結晶性セルロースおおよそ52.55%、無水リン酸二カルシウムおおよそ26.27%、デンプングリコール酸ナトリウム(タイプA)おおよそ3%、およびステアリン酸マグネシウムおおよそ1%を含む。一部の実施形態は、ポリ(ADP−リボース)ポリメラーゼ活性により仲介される哺乳動物の疾患状態を治療する方法であって、マレイン酸塩(例えば、マレイン酸塩多形体A形もしくはマレイン酸塩多形体B形またはそれらの混合物)を含む治療有効量の医薬組成物を、それを必要としている哺乳動物に投与することを含む方法を提供する。一部の実施形態は、哺乳動物において癌を治療する方法であって、マレイン酸塩(例えば、マレイン酸塩多形体A形もしくはマレイン酸塩多形体B形またはそれらの混合物)を含む治療有効量の医薬組成物を、哺乳動物に投与することを含む方法を提供する。
【0016】
本明細書に開示されている一部の実施形態は、8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オンのカンシル酸塩に関する。一部の実施形態において、カンシル酸塩は、結晶性である。一部の実施形態において、カンシル酸塩は、結晶性無水塩である。一部の実施形態において、カンシル酸塩は、S−カンシル酸塩である。他の実施形態において、カンシル酸塩は、R−カンシル酸塩である。
【0017】
一部の実施形態において、カンシル酸塩は、6.0±0.2、12.2±0.2、12.7±0.2、14.8±0.2、16.7±0.2、および22.4±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つ以上または4つ以上のピークを含む粉末X線回折パターンを有する。一部の実施形態において、カンシル酸塩は、12.2±0.2、14.8±0.2、および22.4±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つのピークを含む粉末X線回折パターンを有する。一部の実施形態において、粉末X線回折パターンは、1.5406オングストロームの波長において銅K−α1X線を使用して得られる。さらなる実施形態において、カンシル酸塩は、図9または図10に示されているのと本質的に同じ回折角(2θ)におけるピークを含む粉末X線回折パターンを有する。一部の実施形態において、カンシル酸塩は、213.4±0.2、171.8±0.2、および17.3±0.2ppmからなる群から選択される1つもしくは複数または2つ以上の13C化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、213.4±0.2、171.8±0.2、および17.3±0.2ppmにおける13C化学シフトを含む固体NMRスペクトルを有する。さらなる実施形態において、カンシル酸塩は、図11に示されているのと本質的に同じ位置における13C化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、−118.9±0.2および−119.7±0.2ppmからなる群から選択される1つまたは複数の19F化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、−118.9±0.2および−119.7±0.2ppmにおける19F化学シフトを含む固体NMRスペクトルを有する。さらなる実施形態において、カンシル酸塩は、図12に示されているのと本質的に同じ位置における19F化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、1.5406オングストロームの波長において銅K−α1X線を使用して得られる6.0±0.2、12.2±0.2、12.7±0.2、14.8±0.2、16.7±0.2、および22.4±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つ以上または4つ以上または5つのピークを含む粉末X線回折パターン;ならびに1)213.4±0.2、171.8±0.2、および17.3±0.2ppmからなる群から選択される1つもしくは複数または2つ以上または3つの13C化学シフトを含む固体NMRスペクトル;および/または2)−118.9±0.2および−119.7±0.2ppmからなる群から選択される1つもしくは複数または2つの19F化学シフトを含む固体NMRスペクトルを有する。追加の実施形態において、塩は、図13に示されているのと本質的に同じ示差走査熱量測定サーモグラムを有する。追加の実施形態において、塩は、図14に示されているのと本質的に同じ動的蒸気収着等温線を有する。一部の実施形態において、カンシル酸塩は、表12に示されているような1つまたは複数のFT−IRスペクトルピークを有する。一部の実施形態において、カンシル酸塩は、表13に示されているような1つまたは複数のFT−ラマンスペクトルピークを有する。一部の実施形態において、塩は、S−カンシル酸塩多形体A形の実質的に純粋な多形体である。
【0018】
一部の実施形態において、カンシル酸塩は、図15に示されているのと本質的に同じ回折角(2θ)におけるピークを含む粉末X線回折パターンを有する。一部の実施形態において、塩は、S−カンシル酸塩多形体B形の実質的に純粋な多形体である。一部の実施形態は、S−カンシル酸塩多形体A形とS−カンシル酸塩多形体B形の混合物を提供する。
【0019】
一部の実施形態において、カンシル酸塩は、図18に示されているのと本質的に同じ回折角(2θ)におけるピークを含む粉末X線回折パターンを有する。一部の実施形態において、カンシル酸塩は、15.0±0.2、21.8±0.2、および24.7±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つのピークを含む粉末X線回折パターンを有する。一部の実施形態において、カンシル酸塩は、表16に示されているような1つまたは複数の13C化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、表17に示されているような1つまたは複数の19F化学シフトを有する。一部の実施形態において、カンシル酸塩は、211.7±0.2、132.5±0.2、および19.4±0.2ppmからなる群から選択される2つ以上の13C化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、211.7±0.2、132.5±0.2、および19.4±0.2ppmにおける13C化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、−118.5±0.2ppmにおける19F化学シフトを含む固体NMRスペクトルを有する。一部の実施形態において、カンシル酸塩は、表18に示されているような1つまたは複数のFT−IRスペクトルピークを有する。一部の実施形態において、カンシル酸塩は、表19に示されているような1つまたは複数のFT−ラマンスペクトルピークを有する。一部の実施形態において、塩は、S−カンシル酸塩多形体C形の実質的に純粋な多形体である。一部の実施形態は、S−カンシル酸塩多形体A形、S−カンシル酸塩多形体B形およびS−カンシル酸塩多形体C形のうちの2つ以上の混合物を提供する。
【0020】
一部の実施形態において、塩は、R−カンシル酸塩多形体A形の実質的に純粋な多形体である。さらなる実施形態は、追加カンシル酸塩を提供する。塩は、カンファースルホン酸の様々なR:S比、例えば、1R:1S−カンシル酸塩、1R:9S−カンシル酸塩、1R:3S−カンシル酸塩、および1R:7S−カンシル酸塩を有することができる。
【0021】
さらなる実施形態は、化合物1のS−カンシル酸塩の非晶性形態を提供する。
【0022】
追加の実施形態は、本明細書に記載されているカンシル酸塩(例えば、S−カンシル酸塩多形体A形、S−カンシル酸塩多形体B形、S−カンシル酸塩多形体C形、R−カンシル酸塩多形体A形またはそれらの混合物)を含む医薬組成物を提供する。一部の実施形態において、医薬組成物は、固体剤形(例えば、錠剤)を含む。一部の実施形態において、医薬組成物は、カンシル酸塩おおよそ10%〜25%、微結晶性セルロースおおよそ45%〜60%、無水リン酸二カルシウムおおよそ20%〜35%、デンプングリコール酸ナトリウム(タイプA)おおよそ0.1%〜5%、およびステアリン酸マグネシウムおおよそ0.1%〜5%を含む。一部の実施形態において、医薬組成物は、カンシル酸塩おおよそ17.18%、微結晶性セルロースおおよそ52.55%、無水リン酸二カルシウムおおよそ26.27%、デンプングリコール酸ナトリウム(タイプA)おおよそ3%、およびステアリン酸マグネシウムおおよそ1%を含む。一部の実施形態は、ポリ(ADP−リボース)ポリメラーゼ活性により仲介される哺乳動物の疾患状態を治療する方法であって、本明細書に記載されているカンシル酸塩(例えば、S−カンシル酸塩多形体A形、S−カンシル酸塩多形体B形、S−カンシル酸塩多形体C形、R−カンシル酸塩多形体A形またはそれらの混合物)を含む治療有効量の医薬組成物を、それを必要としている哺乳動物に投与することを含む方法を提供する。一部の実施形態は、哺乳動物において癌を治療する方法であって、本明細書に記載されているS−カンシル酸塩(例えば、S−カンシル酸塩多形体A形、S−カンシル酸塩多形体B形、S−カンシル酸塩多形体C形、R−カンシル酸塩多形体A形またはそれらの混合物)を含む治療有効量の医薬組成物を、哺乳動物に投与することを含む方法を提供する。
【0023】
さらなる実施形態は、本明細書に記載されている2つ以上の多形体形態または塩を含む医薬組成物を提供する。
【0024】
追加の実施形態は、ポリ(ADP−リボース)ポリメラーゼ活性により仲介される哺乳動物の疾患状態を治療する方法であって、治療有効量の抗腫瘍剤、抗血管新生剤、シグナル伝達阻害剤、および抗増殖剤、有糸分裂阻害剤、アルキル化剤、代謝拮抗剤、挿入性抗生物質、成長因子阻害剤、細胞周期阻害剤、酵素、トポイソメラーゼ阻害剤、生物学的応答調整剤、抗体、細胞傷害剤、抗ホルモン剤、および抗アンドロゲン剤などの1つまたは複数の物質と組み合わせた本明細書に記載されている治療有効量の医薬組成物を、それを必要としている哺乳動物に投与することを含む方法を提供する。一部の実施形態は、哺乳動物において癌を治療する方法であって、治療有効量の抗腫瘍剤、抗血管新生剤、シグナル伝達阻害剤、および抗増殖剤、有糸分裂阻害剤、アルキル化剤、代謝拮抗剤、挿入性抗生物質、成長因子阻害剤、細胞周期阻害剤、酵素、トポイソメラーゼ阻害剤、生物学的応答調整剤、抗体、細胞傷害剤、抗ホルモン剤、および抗アンドロゲン剤などの1つまたは複数の物質と組み合わせた本明細書に記載されている治療有効量の医薬組成物を、哺乳動物に投与することを含む方法を提供する。
【0025】
定義
本明細書で使用されるように、「化合物1」という用語は、構造式
【0026】
【化2】

によっても表される化合物8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オンを指す。
【0027】
「活性剤」または「活性成分」という用語は、化合物1の多形性形態、または化合物1の2つ以上の多形性形態もしくは非晶性形態を含む固体形態を指す。
【0028】
本明細書で使用されるように、化合物1の特定の多形性形態(または、2つ以上の多形性形態の混合物)に関して「実質的に純粋な」という用語は、その多形性形態(または混合物)が、化合物1の他の多形性形態を包含する不純物の重量で10%未満、好ましくは、5%未満、好ましくは、3%未満、好ましくは、1%未満を包含することを示す。そのような純度は、例えば、粉末X線回折により決定することができる。
【0029】
本明細書で使用されるように、「多形体」という用語は、同じ化合物の異なる結晶性形態ならびに同じ化合物の水和物(例えば、結晶構造中に存在する結合水)および溶媒和物(例えば、水以外の結合溶媒)などの疑似多形体を包含する他の固体分子形態を指す。異なる結晶性多形体は、格子における分子の異なる充填に起因する異なる結晶構造を有する。このことは、異なる結晶対称および/または結晶もしくは粉末のX線回折特性のようなその物理的特性に直接影響を与える単位セルパラメーターをもたらす。例えば、異なる多形体は、一般に、一連の異なる角度において回折し、強度について異なる値を与えるはずである。したがって、X線粉末回折を使用し、再現可能でかつ信頼できる方法で、異なる多形体、または2つ以上の多形体を含む固体形態を識別することができる(S.Byrnら、Pharmaceutical Solids:A Strategic Approach to Regulatory Considerations、Pharmaceutical research、Vol.12、No.7、p.945〜954、1995;J.K.HeleblianおよびW.McCrone、Pharmaceutical Applications of Polymorphism、Journal of Pharmaceutical Sciences、Vol.58、No.8、p.911〜929、1969)。結晶性多形性形態は、医薬産業および、特に、適当な剤形の開発に関わる医薬産業にとって興味深い。多形性形態が、臨床試験または安定性試験中に一定に保たれない場合、使用または試験される正確な剤形は、ロット毎に同等でないことがある。不純物の存在は、望ましくない毒物学的効果を生み出すことがあるため、化合物が臨床試験または市販製品で使用される場合に、選択された多形性形態の化合物を高純度で製造するためのプロセスを有することも望ましい。ある種の多形性形態は、熱力学的安定性の増強を示すか大量に高純度でより容易に製造されることがあるため、医薬製剤への包含により適している。ある種の多形体は、吸湿傾向の欠如、溶解性の改善、および異なる格子エネルギーに起因する溶解速度の増大などの他の有利な物理的特性を示すことがある。
【0030】
「粉末X線回折パターン」または「PXRDパターン」という用語は、実験的に観察されたディフラクトグラムまたはそれから誘導されるパラメーターを指す。粉末X線回折パターンは、典型的には、ピーク位置(横軸)およびピーク強度(縦軸)により特徴付けられる。「ピーク強度」という用語は、所与のX線回折パターン内の相対シグナル強度を指す。相対ピーク強度に影響を及ぼすことがある要因は、サンプル厚および好ましい配向(すなわち、結晶性粒子は、ランダムには分布されない)である。本明細書で使用されるような「ピーク位置」という用語は、粉末X線回折実験において測定されかつ観察されるようなX線反射位置を指す。ピーク位置は、単位セルの寸法に直接関連している。それらのそれぞれのピーク位置により同定されるピークは、化合物1の塩の様々な多形性形態について回折パターンから抽出されている。
【0031】
「2θ値」または「2θ」という用語は、X線回折実験の実験セットアップに基づくピーク位置(゜)を指し、回折パターンにおける共通の横軸単位である。一般に、実験セットアップは、反射光が回折され、入射ビームが、ある格子面と角θ(θ)を形成する場合、反射ビームが、角2θ(2θ)において記録されることを必要とする。具体的な多形性形態についての具体的な2θ値への本明細書における言及は、本明細書に記載されているようなX線回折実験条件を使用して測定されるような2θ値(゜)を意味することが意図されていることが理解されるべきである。
【0032】
「非晶性の」という用語は、(i)三次元における秩序を欠くか、(ii)三次元未満における秩序、短距離(例えば、10Å未満)を超えるに過ぎない秩序、または両方を示す任意の固体物質を指す。すなわち、非晶性物質は、例えば、一次元または二次元の並進秩序(液晶)、配向無秩序(配向的に無秩序な結晶)、または立体配置無秩序(立体配置的に無秩序な結晶)のある部分的結晶性材料および結晶性中間相を包含する。非晶性固体は、粉末X線粉末回折(PXRD)結晶学、固体核磁気共鳴(ssNMR)分光法、示差走査熱量測定(DSC)、またはそれらの技法の一部の組合せを包含する、知られている技法により特徴付けることができる。非晶性固体は、典型的には、1つまたは2つのブロードなピーク(すなわち、約5゜2θ以上のベース幅を有するピーク)からなる拡散PXRDパターンを与える。
【0033】
「結晶性の」という用語は、三次元秩序を示す任意の固体物質を指し、非晶性固体物質とは対照的に、輪郭のはっきりしたピークの独特なPXRDパターンを与える。
【0034】
「周囲温度」という用語は、実験室環境で典型的に遭遇する温度条件を指す。これは、約20〜約30℃のおおよその温度範囲を包含する。
【0035】
「検出可能量」という用語は、X線粉末回折、示差走査熱量測定、HPLC、フーリエ変換赤外分光法(FT−IR)、ラマン分光法などの従来の技法を使用して検出することができる量または単位体積当たりの量を指す。
【0036】
「溶媒和物」という用語は、薬物物質および化学量論的または非化学量論的量の1つまたは複数の溶媒分子(例えば、エタノール)を含む分子錯体について説明している。溶媒が、薬物と強固に結合している場合、得られる錯体は、湿度と無関係な明確な化学量論を有するはずである。しかしながら、溶媒が、チャネル溶媒和物および吸湿性化合物におけるように弱く結合している場合、溶媒含量は、湿度および乾燥条件によって左右されるはずである。そのような場合、錯体は、非化学量論的であることが多いはずである。
【0037】
「水和物」という用語は、薬物物質および化学量論的または非化学量論的量の水を含む溶媒和物について説明している。
【0038】
「相対湿度」という用語は、百分率として表される、所与の温度における空気中の水蒸気の量の、その温度および圧力において保持することができる水蒸気の最大量に対する割合を指す。
【0039】
「相対強度」という用語は、サンプルX線回折パターンから誘導される強度値を指す。回折パターンのための完全な縦軸範囲スケールは、100という値を割り当てられる。このスケール強度上で約50%〜約100%に入る強度を有するピークは、極めて強い(vs)と称され、約50%〜約25%に入る強度を有するピークは、強い(s)と称される。典型的な回折パターンには追加の弱めのピークが存在し、所与の多形体の特徴でもある。
【0040】
「スラリー」という用語は、液体媒質、典型的には、水または有機溶媒中に懸濁している固体物質を指す。
【0041】
「真空下で」という用語は、実験室の油を使用するか油を使用しないダイヤフラム式真空ポンプにより得ることができる典型的な圧力を指す。
【0042】
「医薬組成物」という用語は、本明細書に記載されている化合物1の塩の多形性形態のうちの1つまたは複数、および生理学的/薬学的に許容できる担体、希釈剤、ビヒクルおよび/または賦形剤などの他の化学的構成成分を含む組成物を指す。医薬組成物の目的は、ヒトまたは他の哺乳動物などの生物体への化合物の投与を容易にすることである。
【0043】
「薬学的に許容できる」「担体」、「希釈剤」、「ビヒクル」、または「賦形剤」という用語は、医薬組成物を形成するために特定の医薬剤と共に含まれていてもよい材料(または複数の材料)を指し、固体または液体であってよい。例示的な固体担体は、ラクトース、スクロース、タルク、ゼラチン、寒天、ペクチン、アカシア、ステアリン酸マグネシウム、ステアリン酸などである。例示的な液体担体は、シロップ、ピーナッツ油、オリーブ油、水などである。同様に、担体または希釈剤は、単独またはワックスと一緒のモノステアリン酸グリセリルもしくはジステアリン酸グリセリル、エチルセルロース、ヒドロキシプロピルメチルセルロース、メタクリル酸メチルなどの当技術分野において知られている時間遅延または時間放出材料を包含することがある。
【0044】
「ポリ(ADP−リボース)ポリメラーゼ(PARP)活性により仲介される」という用語は、PARP活性により調節、変調、または阻害される生物学的または分子プロセスを指す。ある応用例について、癌に関係するPARP活性の阻害が好ましい。本明細書に開示されている実施形態は、化合物1の多形性塩形態、または化合物1の2つ以上の多形性塩形態を含む固体形態を投与することにより、例えば、哺乳動物において、PARP活性を変調または阻害する方法を包含する。化合物1の多形性塩形態、または2つ以上のそのような形態を含む固体形態の活性または有効性は、例えば、それらの開示がそれらの全体として参照により本明細書に組み込まれている米国特許第6,495,541号および米国特許出願公開第2006−0074073号に記載されているように測定することができる。
【0045】
「治療すること」という用語は、本明細書で使用されているように、他に指示がない限り、そのような用語があてはまる障害もしくは状態の進行を逆転、緩和、阻害すること、またはそのような用語があてはまる障害もしくは状態を予防すること、またはそのような障害もしくは状態の1つまたは複数の症状の進行を逆転、緩和、阻害すること、またはそのような障害もしくは状態の1つまたは複数の症状を予防することを意味する。「治療」という用語は、本明細書で使用されているように、他に指示がない限り、直ぐ上で定義されているような「治療すること」の行為を指す。例えば、「治療する」、「治療すること」および「治療」という用語は、過増殖性障害(例えば、癌)および/またはその付随症状のうちの1つまたは複数を緩和または抑止する方法を指すことがある。特に癌に関して、これらの用語は、癌に罹患している個人の平均余命が増加するであろうこと、または疾患の症状のうちの1つまたは複数が軽減されるであろうことを示すことがある。
【0046】
「有効量」とは、真核細胞、例えば、哺乳動物、昆虫、植物または真菌細胞の増殖を有意に阻害しかつ/またはそれらの脱分化を妨げ、指示された有用性、例えば、具体的な治療処置に有効である薬剤の量を指す。
【0047】
「治療有効量」という用語は、治療されている障害の症状のうちの1つまたは複数をある程度軽減することができる投与されている化合物または多形体の量を指す。癌の治療に関して、治療有効量は、例えば、下記の効果:
(1)腫瘍のサイズを縮小すること、
(2)腫瘍転移を阻害する(すなわち、ある程度遅くする、好ましくは、停止する)こと、
(3)腫瘍成長をある程度阻害する(すなわち、ある程度遅くする、好ましくは、停止する)こと、および
(4)癌に伴う1つまたは複数の症状をある程度軽減する(または、好ましくは、取り除く)こと
のうちの少なくとも1つを有する量を指す。
【図面の簡単な説明】
【0048】
【図1】1.5406ÅにおいてCuKα放射線を使用する、化合物1のマレイン酸塩、多形体A形の粉末X線回折(PXRD)パターンを示す図である。
【図2】化合物1のマレイン酸塩、多形体A形の示差走査熱量測定(DSC)サーモグラムを示す図である。
【図3】1.5406ÅにおいてCuKα放射線を使用する、化合物1のマレイン酸塩、多形体B形の模擬PXRDパターンを示す図である。
【図4】1.5406ÅにおいてCuKα放射線を使用する、化合物1のマレイン酸塩、多形体B形の実験PXRDパターンを示す図である。
【図5】化合物1のマレイン酸塩、多形体B形の13C固体核磁気共鳴(NMR)スペクトルを示す図である。
【図6】化合物1のマレイン酸塩、多形体B形の19F固体NMRスペクトルを示す図である。
【図7】化合物1のマレイン酸塩、多形体B形のDSCサーモグラムを示す図である。
【図8】化合物1のマレイン酸塩、多形体B形の動的蒸気收着等温線を示す図である。
【図9】1.5406ÅにおいてCuKα放射線を使用する、化合物1のS−カンシル酸塩、多形体A形の模擬PXRDパターンを示す図である。
【図10】1.5406ÅにおいてCuKα放射線を使用する、化合物1のS−カンシル酸塩、多形体A形の実験PXRDパターンを示す図である。
【図11】化合物1のS−カンシル酸塩、多形体A形の13C固体NMRスペクトルを示す図である。
【図12】化合物1のS−カンシル酸塩、多形体A形の19F固体NMRスペクトルを示す図である。
【図13】化合物1のS−カンシル酸塩、多形体A形のDSCサーモグラムを示す図である。
【図14】化合物1のS−カンシル酸塩、S−カンシル酸塩多形体A形の動的蒸気收着等温線を示す図である。
【図15】1.5406ÅにおいてCuKα放射線を使用する、化合物1のS−カンシル酸塩、多形体B形のPXRDパターンを示す図である。
【図16】化合物1のS−カンシル酸塩、多形体A形を含有する製剤化組成物の実験PXRDパターンを示す図である。
【図17】1.5406ÅにおいてCuKα放射線を使用する、化合物1の塩酸塩三水和物の模擬PXRDパターンを示す図である。
【図18】1.5406ÅにおいてCuKα放射線を使用する、化合物1のS−カンシル酸塩、多形体C形の実験PXRDパターンを示す図である。
【図19】1.5406ÅにおいてCuKα放射線を使用する、1R:1S−カンシル酸塩の実験PXRDパターンを示す図である。
【図20】1.5406ÅにおいてCuKα放射線を使用する、1R:9S−カンシル酸塩の実験PXRDパターンを示す図である。
【図21】1.5406ÅにおいてCuKα放射線を使用する、1R:3S−カンシル酸塩の実験PXRDパターンを示す図である。
【図22】1.5406ÅにおいてCuKα放射線を使用する、1R:7S−カンシル酸塩の実験PXRDパターンを示す図である。
【図23】1.5406ÅにおいてCuKα放射線を使用する、化合物1のR−カンシル酸塩、多形体A形の実験PXRDパターンを示す図である。
【図24】化合物1のS−カンシル酸塩、多形体C形のDSCサーモグラムを示す図である。
【図25】1R:1S−カンシル酸塩のDSCサーモグラムを示す図である。
【図26】1R:9S−カンシル酸塩のDSCサーモグラムを示す図である。
【図27】化合物1のR−カンシル酸塩、多形体A形のDSCサーモグラムを示す図である。
【図28】化合物1のS−カンシル酸塩、多形体C形の13C固体NMRスペクトルを示す図である。
【図29】化合物1のS−カンシル酸塩、多形体C形の19F固体NMRスペクトルを示す図である。
【図30】1R:1S−カンシル酸塩の13C固体NMRスペクトルを示す図である。
【図31】1R:1S−カンシル酸塩の19F固体NMRスペクトルを示す図である。
【図32】1R:9S−カンシル酸塩の13C固体NMRスペクトルを示す図である。
【図33】1R:9S−カンシル酸塩の19F固体NMRスペクトルを示す図である。
【図34】化合物1のS−カンシル酸塩の非晶性形態の実験PXRDパターンを示す図である。
【図35】化合物1のS−カンシル酸塩の非晶性形態の13C固体NMRスペクトルを示す図である。
【図36】化合物1のS−カンシル酸塩の非晶性形態の19F固体NMRスペクトルを示す図である。
【図37】化合物1のS−カンシル酸塩の非晶性形態のラマンスペクトルを示す図である。
【図38】化合物1のS−カンシル酸塩の非晶性形態のDSCサーモグラムを示す図である。
【発明を実施するための形態】
【0049】
今回、化合物1のいくつかの独特な物理的形態が製造された。化合物1、およびそれを製造する方法は、それらの全体として参照により本明細書に組み込まれている米国特許第6,495,541号、第6,977,298号、第7,429,578号および第7,323,562号に記載されている。化合物1のある種の塩およびそれらの多形体は、それらの全体として参照により本明細書に組み込まれている米国特許第7,268,126号および国際特許公開第WO04/087713号に開示されている。
【0050】
本明細書に記載されているように、化合物1は、マレイン酸塩形態およびカンシル酸塩形態などの複数の結晶性塩形態で存在することができることが判明した。これらの形態は、癌を包含する、ポリ(ADP−リボース)ポリメラーゼ(PARP)活性により仲介される哺乳動物の疾患状態を治療するための製剤化製品において使用することができる。各形態は、生物学的利用能、安定性、および製造可能性などの特性という点で他の形態を上回る利点を有することがある。他の形態よりも大量調製および取り扱いについてより適している可能性が高い化合物1の新規な結晶性塩形態が発見されている。例えば、化合物1のリン酸塩は、例えば、静脈内剤形に特に適しているものの、その水和の影響を受けやすいことのために固体剤形に適していない可能性がある。本明細書に記載されているマレイン酸塩およびカンシル酸塩形態(例えば、マレイン酸塩多形体B形およびS−カンシル酸塩多形体A形)は、物理的に安定な形態として存在し、化合物1の他の塩形態と比較して水和の影響を受けにくく、固体剤形の調製に特に適したものにしている。さらに、本明細書に記載されているマレイン酸塩およびカンシル酸塩は、合成プロセスにおいて他の塩形態より少ないステップで単離することができ、結晶化を制御するためのより大きな範囲を可能にしている。制御された結晶化を使用し、例えば、制御された粒子サイズ、結晶化度および結晶形状などの固体剤形にとって有利である特性を持つAPI粒子を提供することができる。化合物1の他の多形性形態を実質的に含まない、化合物1の各多形性塩形態を調製するためのプロセスも本明細書に記載されている。さらに、異なる多形性形態で化合物1の結晶性塩を含む医薬製剤、およびそのような医薬製剤を投与することにより過増殖性状態を治療する方法が本明細書に記載されている。さらに、異なる多形性形態で化合物1の結晶性塩を含む医薬製剤、およびそのような医薬製剤を投与することによりポリ(ADP−リボース)ポリメラーゼ(PARP)活性により仲介される哺乳動物の疾患状態(例えば、癌)を治療する方法が本明細書に記載されている。
【0051】
I.化合物1の結晶性塩形態
化合物1のいくつかの結晶性形態が本明細書に記載されている。化合物1の各結晶性塩形態は、下記の粉末X線回折パターン(例えば、様々な回折角(2θ)におけるX線回折ピーク);固体核磁気共鳴(NMR)スペクトルパターン;示差走査熱量測定(DSC)サーモグラムの吸熱により説明されるような融点開始(および水和形態については脱水の開始);動的蒸気收着測定により説明されるような吸湿性;FT−IRスペクトルダイヤグラムパターン;ラマンスペクトルダイヤグラムパターン;水溶性;International Conference on Harmonization(ICH)高強度光条件下の光安定性ならびに当技術分野において知られているか本明細書に記載されている方法による物理的および化学的な保存安定性のうちの1つまたは複数により特徴付けることができる。例えば、化合物1のマレイン酸塩多形体A形、マレイン酸塩多形体B形、S−カンシル酸塩多形体A形、およびS−カンシル酸塩多形体B形は、各々、それらの粉末X線回折パターンにおけるピークの位置および相対強度により特徴付けられた。粉末X線回折パラメーターは、化合物1の多形性形態の各々について異なる。したがって、例えば、化合物1のマレイン酸塩多形体A形、マレイン酸塩多形体B形、S−カンシル酸塩多形体A形、およびS−カンシル酸塩多形体B形は、粉末X線回折を使用することによりお互いとおよび化合物1の他の多形性形態と区別することができる。
【0052】
化合物1の異なる多形性形態(例えば、マレイン酸塩多形体A形、マレイン酸塩多形体B形、S−カンシル酸塩多形体A形、およびS−カンシル酸塩多形体B形)の粉末X線回折パターンは、1.5406ÅにおいてCuKα放射線を使用する実施例6〜8に記載されている手順に従って決定された。マレイン酸塩多形体A形、マレイン酸塩多形体B形、S−カンシル酸塩多形体A形、およびS−カンシル酸塩多形体B形について得られたPXRDパターンについてのピークは、1の閾値および0.3゜2−θのピーク幅でBruker−AXS Ltd.Evaluationソフトウェアを使用して選択された。S−カンシル酸塩多形体B形を除いて、データは、21℃にて集められた。
【0053】
本明細書に報告されている測定のために使用されるBrukerシステムのようなBragg−Brentano機器でX線回折測定を行うため、サンプルを、典型的には、空洞を有するホルダーの中に入れる。サンプル粉末をガラススライドまたは等価物により押し付け、ランダムな表面および適切なサンプル高を確保する。次いで、サンプルホルダーを機器の中に入れる。入射X線ビームを、初めはホルダー面に対して小さな角度でサンプルに向け、次いで、入射ビームとホルダー面の間の角度を連続的に増加させる円弧に沿って移動させる。そのようなX線粉末分析に関連した測定差は、(a)サンプル調製における誤差(例えば、サンプル高)、(b)機器誤差(例えば、平面サンプル誤差)、(c)較正誤差、(d)操作者誤差(ピーク位置を決定する場合に存在する誤差を包含する)、および(e)材料の性質(例えば、好ましい配向性および透明度誤差)を包含する様々な要因に起因することがある。較正誤差およびサンプル高誤差は、同じ方向ですべてのピークのシフトをもたらすことが多い。平面ホルダーを使用する場合のサンプル高における小さな差は、PXRDピーク位置における大きな移動につながるであろう。系統的な研究は、典型的なBragg−Brentano配置でShimadzu XRD−6000を使用すると、1mmのサンプル高差が、1゜(2θ)と同じ高さのピークシフトにつながることを明らかにした(Chenら、J Pharmaceutical and Biomedical Analysis 26:63(2001))。これらのシフトは、X線ディフラクトグラムから識別することができ、シフトについて補正する(系統的な補正係数をすべてのピーク位置値に適用すること)か、機器を再較正することにより除去することができる。ピーク位置を一致させるために系統的な補正係数を適用することにより、様々な機械からの測定値を修正することが可能である。一般に、この補正係数は、Brukerからの測定ピーク位置を、期待されるピーク位置と一致させるであろうし、0〜0.2゜(2θ)の範囲であってよい。
【0054】
当業者は、ピーク位置(2θ)が、例えば、使用されている溶媒および/または回折を測定するために使用されている装置に応じて、典型的には、0.1〜0.2゜(2θ)程度の一部の変動を示すことを理解しているであろう。したがって、ピーク位置(2θ)が報告されている場合、当業者は、そのような数字がそのような変動を包含していることが意図されていることを認識しているであろう。さらに、本発明の多形体が、所与の図に示されているものと本質的に同じ粉末X線回折パターンを有すると記載されている場合、「本質的に同じ」という用語は、回折ピーク位置におけるそのような変動を包含することも意図されている。さらに、当業者は、相対ピーク強度が、装置間変動ならびに結晶化度、好ましい配向、調製されたサンプル表面、分析されているサンプルの純度、および当業者に知られている他の要因に起因する変動を示し、定性的尺度としてのみ受け止めるべきであることを理解しているであろう。当業者は、異なる波長を使用して測定すると、ブラッグの式−nλ=2dsinθに従って異なるシフトが得られることを理解しているであろう。代わりの波長の使用によりもたらされるそのようなさらなるPXRDパターンは、本明細書に記載されている実施形態の結晶性材料のPXRDパターンの代替表示であると見なされ、したがって、本実施形態の範囲内にある。
【0055】
本明細書に記載されている異なる多形体は、当技術分野において知られているか本明細書に記載されている方法に従って固体NMR分光法を使用して特徴付けることもできる。例えば、13C固体スペクトルおよび19F固体スペクトルは、実施例9〜10に記載されている手順に従って集めることができる。固体NMRにおいて測定される13Cまたは19F化学シフトは、典型的には、明確なピークについては0.2ppmまでの、ブロードな線についてはより大きな変動を有することが留意されるべきである。
【0056】
化合物1の異なる結晶性塩形態は、実施例に記載されている手順に従って示差走査熱量測定(DSC)を使用しても区別された。DSCは、温度の上昇によるサンプルと適切な基準との間の熱エネルギー取り込みの差を測定する。例えば、固体粉末サンプルの測定については、基準は、サンプルの調製において使用されるタイプの空のサンプルパンであってよい。DSCサーモグラムは、典型的には、サンプルが加熱される時の、吸熱(エネルギー取り込みを示す)および発熱(エネルギー放出を示す)により特徴付けることができる。いくつか要因に応じて、示される吸熱は、添付の図に描かれているものなどの、吸熱の上または下で融解する結晶多形体について約0.01〜5℃変動することがある。そのような分散の原因となる要因は、例えば、DSC分析が行われる加熱速度(例えば、スキャン速度)、DSC開始温度が規定および決定される方法、使用される較正標準、機器較正、相対湿度およびサンプルの化学的純度を包含する。任意の所与サンプルについて、観察される吸熱は、機器毎に異なることもあるが、一般的に、機器が同じように較正されているという条件で、本明細書に記載されている範囲内にあるであろう。
【0057】
ある化合物の異なる多形性形態は、異なる吸湿性を有することがある。例えば、化合物1の塩は、実施例12に記載されている手順に従って動的蒸気收着測定を使用するそれらの吸湿性に基づいて特徴付けられた。
【0058】
一部の実施形態において、固体形態は、2つ以上の多形性形態を含むこともある。当業者は、所与の化合物の結晶性形態が、単一の多形体の実質的に純粋な形態で存在することがあるが、2つ以上の異なる多形体または非晶性形態の混合物を含む結晶性形態で存在することもあることも認識しているであろう。固体形態が、2つ以上の多形体を含む場合、X線回折パターンは、典型的には、個々の多形体の各々に特徴的なピークを有するはずである。例えば、2つの多形体を含む固体形態は、典型的には、実質的に純粋な多形性形態に対応する2つのX線回折パターンの合積である粉末X線回折パターンを有するはずである。例えば、化合物1またはその塩の固体形態は、第一および第二の多形性形態を含有することがあり、固体形態は、第一の多形体を重量で少なくとも10%含有する。さらなる実施形態において、固体形態は、第一の多形体を重量で少なくとも20%含有することがある。さらなる実施例は、第一の多形体を重量で少なくとも30%、少なくとも40%、または少なくとも50%含有する。当業者は、様々な量のいくつかの個々の多形体および非晶性形態の多くのそのような組合せが可能であることを認識しているであろう。
【0059】
化合物1のマレイン酸塩の2つの多形性形態が、図1〜8に示されているように識別されかつ特徴付けられており、マレイン酸塩多形体A形およびマレイン酸塩多形体B形として表されている。さらに、化合物1のカンシル酸塩の多形性形態およびカンファースルホン酸の異なるR:S比を含有する様々な塩が、図9〜33に示されているように識別されかつ特徴付けられており、S−カンシル酸塩多形体A形、S−カンシル酸塩多形体B形、S−カンシル酸塩多形体C形、R−カンシル酸塩多形体A形、またはカンファースルホン酸の指定されたR:S比を持つ塩として表されている。さらに、化合物1のS−カンシル酸塩の非晶性形態が、図34〜38に示されているように識別されかつ特徴付けられている。本明細書で使用されるように、「カンシル酸塩」という用語は、S−カンシル酸塩、R−カンシル酸塩、または特定のR:S比のカンファースルホン酸との塩を指す。多形体、1つまたは複数の多形体を包含する医薬組成物、ならびに多形体およびそれらの医薬組成物を使用する方法は、下記の項および実施例においてより詳細に説明される。
【0060】
A.化合物1のマレイン酸塩、多形体A形
化合物1のマレイン酸塩、マレイン酸塩多形体A形は、実施例1に記載されているように製造することができる。
【0061】
マレイン酸塩多形体A形は、図1に示されかつ実施例7に記載されているPXRDパターンにより特徴付けられた。1.5406ÅにおいてCuKα放射線によりBruker D5000回折計で測定され、相対強度が15.0%以上の゜(2θ)および相対強度に関して表されるマレイン酸塩多形体A形のPXRDパターンは、表1にも示されている。
【0062】
【表1】

【0063】
図2に示されておりかつ実施例11に記載されているマレイン酸塩多形体A形についてのDSCサーモグラムは、220.36℃における吸熱開始を示している。
【0064】
B.化合物1のマレイン酸塩、マレイン酸塩多形体B形
化合物1のマレイン酸塩、マレイン酸塩多形体B形は、合成スキームにおいてエタノールを使用し、実施例2に記載されているように製造することができる。化合物1のマレイン酸塩、マレイン酸塩多形体B形は、合成スキームにおいてイソプロピルアルコールを使用し、実施例3に記載されているように製造することもできる。
【0065】
マレイン酸塩多形体B形は、図3に示されているように、単一結晶構造から計算される模擬PXRDパターンにより特徴付けられた。Accelrys MS Modeling(商標)[バージョン4.4]の「Reflex Powder Diffraction」モジュールを使用してマレイン酸塩B形の単一結晶構造から計算され、相対強度が5.0%以上の゜(2θ)および相対強度に関して表されるマレイン酸塩多形体B形の模擬PXRDパターンは、表2にも示されている。適切なシミュレーションパラメーターは、1.5406Åの波長(CuKα)および0.5の偏光因子を包含していた。
【0066】
【表2】

【0067】
マレイン酸塩多形体B形は、マレイン酸塩多形体B形の特定のバッチについてPXRDパターンを測定することによっても特徴付けられた。この実験PXRDパターンは、図4に示されており、実施例6に記載されている。1.5406ÅにおいてCuKα放射線によりBruker−AXS Ltd.、D4回折計で測定され、相対強度が5.0%以上の゜(2θ)および相対強度に関して表されるマレイン酸塩多形体B形の実験PXRDパターンは、表3にも示されている。
【0068】
【表3】

【0069】
模擬および実験PXRDパターンについてのピーク位置が、極めてよく一致していることがわかる。ピーク位置、相対強度および回折ピークの幅における任意の差は、例えば、装置間変動ならびに結晶化度、好ましい配向、調製されたサンプル表面、分析されているサンプルの純度、および当業者に知られている他の要因に起因する変動に起因することがある。
【0070】
化合物1のマレイン酸塩多形体B形は、実施例9に記載されているようなワイドボア(wide−bore)Bruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図5に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のマレイン酸塩多形体B形の13C化学シフトは、表4に示されている。
【0071】
【表4】

【0072】
化合物1のマレイン酸塩多形体B形は、実施例9に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図6に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のマレイン酸塩多形体B形の19F化学シフトは、表5に示されている。
【0073】
【表5】

【0074】
図7に示されているマレイン酸塩多形体B形についてのDSCサーモグラムは、228.0℃における吸熱開始を示している。マレイン酸塩多形体B形についての動的蒸気收着等温線は、図8に示されている。動的蒸気收着等温線は、マレイン酸塩多形体B形が非吸湿性であることを示している。
【0075】
化合物1のマレイン酸塩多形体B形は、実施例25に記載されているようなフーリエ変換赤外分光法(FT−IR)によっても特徴付けられ、スペクトルピークは、表6に示されている。吸収バンド振動数が列挙されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、ピーク位置上の*誤差がかなり大きい可能性があることを除き、±2cm−1である。
【0076】
【表6】

【0077】
化合物1のマレイン酸塩多形体B形は、実施例26に記載されているようなフーリエ変換−ラマン分光法(FT−ラマン)によっても特徴付けられ、スペクトルピークは、表7に示されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、±2cm−1である。
【0078】
【表7−1】

【0079】
【表7−2】

【0080】
C.化合物1のS−カンシル酸塩、S−カンシル酸塩多形体A形
化合物1のS−カンシル酸塩、S−カンシル酸塩多形体A形は、合成スキームにおいてテトラヒドロフランを使用し、実施例4に記載されているように製造することができる。化合物1のS−カンシル酸塩、S−カンシル酸塩多形体A形は、合成スキームにおいてイソプロピルアルコールを使用し、実施例5に記載されているように製造することもできる。
【0081】
S−カンシル酸塩多形体A形は、図9に示されているように、単一結晶構造から計算される模擬PXRDパターンにより特徴付けられた。Accelrys MS Modeling(商標)[バージョン4.4]の「Reflex Powder Diffraction」モジュールを使用してカンシル酸塩A形の単一結晶構造から計算され、相対強度が15.0%以上の゜(2θ)および相対強度に関して表されるS−カンシル酸塩多形体A形の模擬PXRDパターンは、表8にも示されている。適切なシミュレーションパラメーターは、1.5406Åの波長(CuKα)および0.5の偏光因子を包含していた。
【0082】
【表8】

【0083】
S−カンシル酸塩多形体A形は、S−カンシル酸塩多形体A形の特定のバッチについてPXRDパターンを測定することによっても特徴付けられた。この実験PXRDパターンは、図10に示されている。1.5406ÅにおいてCuKα放射線によりBruker−AXS Ltd.、D4回折計で測定され、相対強度が10.0%以上の゜(2θ)および相対強度に関して表されるS−カンシル酸塩多形体A形の実験PXRDパターンは、表9にも示されている。
【0084】
【表9】

【0085】
模擬および実験PXRDパターンについてのピーク位置が、極めてよく一致していることがわかる。ピーク位置、相対強度および回折ピークの幅における任意の差は、例えば、装置間変動ならびに結晶化度、好ましい配向、調製されたサンプル表面、分析されているサンプルの純度、および当業者に知られている他の要因に起因する変動に起因することがある。
【0086】
化合物1のS−カンシル酸塩多形体A形は、実施例10に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図11に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のS−カンシル酸塩多形体A形の13C化学シフトは、表10に示されている。
【0087】
【表10】

【0088】
化合物1のS−カンシル酸塩多形体A形は、実施例10に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図12に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のS−カンシル酸塩多形体A形の19F化学シフトは、表11に示されている。
【0089】
【表11】

【0090】
図13に示されているS−カンシル酸塩多形体A形についてのDSCサーモグラムは、303.2℃における吸熱開始を示している。S−カンシル酸塩多形体A形についての動的蒸気收着等温線は、図14に示されている。動的蒸気收着等温線は、S−カンシル酸塩多形体A形が非吸湿性であることを示している。
【0091】
化合物1のS−カンシル酸塩多形体A形は、実施例25に記載されているようなフーリエ変換赤外分光法(FT−IR)によっても特徴付けられ、スペクトルピークは、表12に示されている。吸収バンド振動数が列挙されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、ピーク位置上の*誤差がかなり大きい可能性があることを除き、±2cm−1である。
【0092】
【表12】

【0093】
化合物1のS−カンシル酸塩多形体A形は、実施例26に記載されているようなフーリエ変換−ラマン分光法(FT−ラマン)によっても特徴付けられ、スペクトルピークは、表13に示されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、±2cm−1である。
【0094】
【表13−1】

【0095】
【表13−2】

【0096】
D.化合物1のS−カンシル酸塩、S−カンシル酸塩多形体B形
化合物1のS−カンシル酸塩、S−カンシル酸塩多形体B形は、図15に示されているPXRDパターンにより特徴付けられた。
【0097】
E.化合物1の塩酸塩三水和物多形体
化合物1の塩酸塩三水和物多形体は、1.5406ÅにおいてCuKα放射線を使用し、図17に示されているように、単一結晶構造から計算される模擬PXRDパターンにより特徴付けられた。相対強度が15.0%以上の゜(2θ)および相対強度に関して表される塩酸塩三水和物多形体の模擬PXRDパターンは、表14にも示されている。
【0098】
【表14−1】

【0099】
【表14−2】

【0100】
F.化合物1のS−カンシル酸塩、S−カンシル酸塩多形体C形
化合物1のS−カンシル酸塩、S−カンシル酸塩多形体C形は、実施例16に記載されているように製造することができる。
【0101】
S−カンシル酸塩多形体C形は、S−カンシル酸塩多形体C形の特定のバッチについてPXRDパターンを測定することにより特徴付けられた。この実験PXRDパターンは、図18に示されている。1.5406ÅにおいてCuKα放射線によりBruker−AXS Ltd.、D4回折計で測定され、相対強度が10.0%を超える゜(2θ)および相対強度に関して表されるS−カンシル酸塩多形体C形の実験PXRDパターンは、表15にも示されている。
【0102】
【表15】

【0103】
化合物1のS−カンシル酸塩多形体C形は、実施例23に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図28に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のS−カンシル酸塩多形体A形の13C化学シフトは、表16に示されている。
【0104】
【表16】

【0105】
化合物1のS−カンシル酸塩多形体C形は、実施例23に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図29に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のS−カンシル酸塩多形体A形の19F化学シフトは、表17に示されている。
【0106】
【表17】

【0107】
図24に示されているS−カンシル酸塩多形体C形についてのDSCサーモグラムは、291.9℃における吸熱開始を示している。
【0108】
化合物1のS−カンシル酸塩多形体C形は、実施例25に記載されているようなフーリエ変換赤外分光法(FT−IR)によっても特徴付けられ、スペクトルピークは、表18に示されている。吸収バンド振動数が列挙されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、ピーク位置上の*誤差がかなり大きい可能性があることを除き、±2cm−1である。
【0109】
【表18】

【0110】
化合物1のS−カンシル酸塩多形体C形は、実施例26に記載されているようなフーリエ変換−ラマン分光法(FT−ラマン)によっても特徴付けられ、スペクトルピークは、表19に示されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、±2cm−1である。
【0111】
【表19−1】

【0112】
【表19−2】

【0113】
G.R−カンシル酸塩およびS−カンシル酸塩
カンファースルホン酸のR;S比が異なる様々なカンシル酸塩が製造されかつ特徴付けられた。1R:1S−カンシル酸塩、1R:9S−カンシル酸塩、1R:3S−カンシル酸塩、および1R:7S−カンシル酸塩は、実施例17〜20に記載されているように製造することができる。
【0114】
1R:1S−カンシル酸塩、1R:9S−カンシル酸塩、1R:3S−カンシル酸塩、および1R:7S−カンシル酸塩は、各塩の特定のバッチについてのPXRDパターンを測定することにより特徴付けられた。これらの実験PXRDパターンは、図19〜22に示されている。これらの塩についてのPXRDパターンは、これらの混合塩の結晶格子内の分子の充填が、ほぼ等価であることを示している。分子充填密度の小さな変化は、格子におけるSおよびRカンファースルホン酸の異なる比に適合する結果となった。充填密度のこの変化は、PXRDパターンにおけるあるピークについてピーク位置の小さなシフトをもたらした。本明細書に記載されているものと異なる比のRおよびSカンファースルホン酸を含有するカンシル酸塩も形成させることができ、それらの塩は、ほぼ等価な結晶格子を有するであろう。
【0115】
1.5406ÅにおいてCuKα放射線によりBruker−AXS Ltd.、D4回折計で測定され、相対強度が10.0%を超える゜(2θ)および相対強度に関して表される1R:1S−カンシル酸塩の実験PXRDパターンは、表20にも示されている。
【0116】
【表20】

【0117】
1R:1S−カンシル酸塩および1R:9S−カンシル酸塩は、実施例24に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図30および32に示されている固体NMRスペクトルパターンによっても特徴付けられた。1R:1S−カンシル酸塩の13C化学シフトは、表21に示されている。
【0118】
【表21】

【0119】
1R:9S−カンシル酸塩の13C化学シフトは、表22に示されている。
【0120】
【表22】

【0121】
1R:1S−カンシル酸塩および1R:9S−カンシル酸塩は、実施例23に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図31および33に示されている固体NMRスペクトルパターンによっても特徴付けられた。1R:1S−カンシル酸塩の19F化学シフトは、表23に示されている。
【0122】
【表23】

【0123】
1R:9S−カンシル酸塩の19F化学シフトは、表24に示されている。
【0124】
【表24】

【0125】
図25および26に示されている1R:1S−カンシル酸塩および1R:9S−カンシル酸塩についてのDSCサーモグラムは、1R:1S−カンシル酸塩については303.2℃における吸熱開始および1R:9S−カンシル酸塩については301.2℃における吸熱開始を示している。
【0126】
1R:1S−カンシル酸塩は、実施例25に記載されているようなフーリエ変換赤外分光法(FT−IR)によっても特徴付けられ、スペクトルピークは、表25に示されている。吸収バンド振動数が列挙されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、ピーク位置上の*誤差がかなり大きい可能性があることを除き、±2cm−1である。
【0127】
【表25】

【0128】
1R:1S−カンシル酸塩は、実施例26に記載されているようなフーリエ変換−ラマン分光法(FT−ラマン)によっても特徴付けられ、スペクトルピークは、表26に示されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、±2cm−1である。
【0129】
【表26−1】

【0130】
【表26−2】

【0131】
H.化合物1のR−カンシル酸塩、R−カンシル酸塩多形体A形
化合物1のR−カンシル酸塩、R−カンシル酸塩多形体A形は、実施例21に記載されているように製造することができる。
【0132】
R−カンシル酸塩多形体A形は、R−カンシル酸塩多形体A形の特定のバッチについてPXRDパターンを測定することにより特徴付けられた。この実験PXRDパターンは、図23に示されている。1.5406ÅにおいてCuKα放射線によりBruker−AXS Ltd.、D4回折計で測定され、相対強度が10.0%を超える゜(2θ)および相対強度に関して表されるR−カンシル酸塩多形体A形の実験PXRDパターンは、表27にも示されている。
【0133】
【表27】

【0134】
図27に示されているR−カンシル酸塩多形体A形についてのDSCサーモグラムは、301.0℃における吸熱開始を示している。
【0135】
R−カンシル酸塩多形体A形は、実施例25に記載されているようなフーリエ変換赤外分光法(FT−IR)によっても特徴付けられ、スペクトルピークは、表28に示されている。吸収バンド振動数が列挙されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、ピーク位置上の*誤差がかなり大きい可能性があることを除き、±2cm−1である。
【0136】
【表28】

【0137】
R−カンシル酸塩多形体A形は、実施例26に記載されているようなフーリエ変換−ラマン分光法(FT−ラマン)によっても特徴付けられ、スペクトルピークは、表29に示されている。(w:弱い、m:中間の、s:強い、vs:極めて強い)。実験誤差は、±2cm−1である。
【0138】
【表29−1】

【0139】
【表29−2】

【0140】
R−カンシル酸塩多形体B形およびC形も、上に記載されている方法に従って製造しかつ特徴付けることができる。
【0141】
II.化合物1のS−カンシル酸塩の非晶性形態
化合物1のS−カンシル酸塩の非晶性形態は、実施例27に記載されているように製造することができる。
【0142】
化合物1のS−カンシル酸塩の非晶性形態は、実施例28に記載されているように、化合物1のS−カンシル酸塩の非晶性形態の特定のバッチについてPXRDパターンを測定することにより特徴付けられた。この実験PXRDパターンは、図34に示されている。
【0143】
化合物1のS−カンシル酸塩の非晶性形態は、実施例29に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図35に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のS−カンシル酸塩の非晶性形態の13C化学シフトは、表30に示されている。
【0144】
【表30】

【0145】
化合物1のS−カンシル酸塩の非晶性形態は、実施例29に記載されているようなワイドボアBruker−Biospin DSX 500MHz NMR分光計内に配置されたBruker−Biospin 4 mm BL CPMASプローブで行われる、図36に示されている固体NMRスペクトルパターンによっても特徴付けられた。化合物1のS−カンシル酸塩の非晶性形態の19F化学シフトは、表31に示されている。
【0146】
【表31】

【0147】
図38に示されている化合物1のS−カンシル酸塩の非晶性形態のDSCサーモグラムは、156.5℃のガラス転移温度(Tg)を示している。
【0148】
III.本発明の医薬組成物
本明細書に記載されている活性剤(例えば、化合物1の結晶性塩形態または2つ以上のそのような形態を含む固体形態)は、哺乳動物の医学的使用に適している医薬組成物に製剤化することができる。任意の適当な投与経路を、有効用量の化合物1の多形性形態のうちのいずれかを患者に提供するために用いることができる。例えば、経口または非経口製剤などを用いることができる。剤形は、カプセル剤、錠剤、分散剤、懸濁剤など、例えば、腸溶コーティングされたカプセル剤および/または錠剤、化合物1の腸溶コーティングされたペレット剤を含有するカプセル剤および/または錠剤を包含する。すべての剤形において、化合物1の多形性形態は、他の適当な構成要素と混ぜ合わせることができる。組成物は、単位剤形で好都合に提供し、医薬技術において知られている任意の方法により調製することができる。本発明の医薬組成物は、典型的には、治療有効量の活性剤および1つまたは複数の不活性な薬学的に許容できる担体、および、場合により、任意の他の治療成分、安定剤などを包含する。1つまたは複数の担体は、典型的には、製剤の他の成分と適合しており、そのレシピエントに対して過度に有害ではないという意味で薬学的に許容できる。組成物は、希釈剤、緩衝剤、結合剤、崩壊剤、増粘剤、滑沢剤、保存剤(抗酸化剤を包含する)、矯味剤、味覚マスキング剤、無機塩(例えば、塩化ナトリウム)、抗菌剤(例えば、塩化ベンザルコニウム)、甘味料、帯電防止剤、界面活性剤(例えば、BASFから入手可能な「TWEEN 20」および「TWEEN 80」などのポリソルベート、ならびにF68およびF88などのプルロニック)、ソルビタンエステル、脂質(例えば、レシチンおよび他のホスファチジルコリンなどのリン脂質、ホスファチジルエタノールアミン、脂肪酸および脂肪酸エステル、ステロイド(例えば、コレステロール))、およびキレート化剤(例えば、EDTA、亜鉛および他のそのような適切なカチオン)をさらに包含することがある。本発明による組成物において使用するのに適している他の医薬賦形剤および/または添加剤は、Remington:The Science & Practice of Pharmacy、第19版、Williams & Williams、(1995)、および「Physician’s Desk Reference」、第52版、Medical Economics、Montvale、NJ(1998)、およびHandbook of Pharmaceutical Excipients、第3版、A.H.Kibbe編、Pharmaceutical Press、2000に列挙されている。本発明の活性剤は、経口、直腸、局所、鼻腔、眼、または非経口(腹腔内、静脈内、皮下、または筋肉内注射を包含する)投与に適しているものを包含する組成物に製剤化することができる。
【0149】
製剤中の活性剤の量は、剤形、治療されることになる状態、標的患者集団、および他の考慮すべき事柄などの様々な要因に応じて変わることがあり、一般的に、当業者により容易に決定されるはずである。治療有効量は、典型的には、PARP酵素を変調、調節、または阻害するのに必要な量であろう。実際に、これは、例えば、特定の活性剤、治療されることになる状態の重症度、患者集団、製剤の安定性などに応じて幅広く変わることがある。組成物は、一般的に、活性剤約0.001重量%〜約99重量%、好ましくは、活性剤約0.01重量%〜約5重量%、より好ましくは、活性剤約0.01重量%〜2重量%をどこでも含有するはずであり、組成物に含有される賦形剤/添加剤の相対量によって左右されることもある。
【0150】
一部の実施形態において、医薬組成物は、従来の手順に従って治療有効量の活性成分としての活性剤を1つまたは複数の適切な医薬担体と混ぜ合わせることにより調製される従来の剤形で投与することができる。これらの手順は、望ましい調製物に適しているような成分を混ぜ、顆粒化して圧縮するか溶かすものであってよい。
【0151】
用いられる1つまたは複数の医薬担体は、固体か液体のどちらかであってよい。例示的な固体担体は、ラクトース、スクロース、タルク、ゼラチン、寒天、ペクチン、アカシア、ステアリン酸マグネシウム、ステアリン酸などを包含するが、それらに限定されるものではない。例示的な液体担体は、シロップ、ピーナッツ油、オリーブ油、水などを包含する。同様に、1つまたは複数の担体は、単独またはワックスと一緒のモノステアリン酸グリセリルもしくはジステアリン酸グリセリル、エチルセルロース、ヒドロキシプロピルメチルセルロース、メタクリル酸メチルなどの当技術分野において知られている時間遅延または時間放出材料を包含することがある。
【0152】
様々な医薬形態を用いることができる。例えば、固体担体が使用される場合、調製物は、錠剤化するか、粉末もしくはペレット形態で硬質ゼラチンカプセルに入れるか、トローチもしくはロゼンジの形態であってよい。固体担体の量は、変わることがあるが、一般的に、約25mg〜約1gであろう。液体担体が使用される場合、調製物は、シロップ、エマルジョン、軟質ゼラチンカプセル、アンプルもしくはバイアル中の無菌注射用溶液もしくは懸濁液または非水性液体懸濁液の形態であってよい。
【0153】
安定な水溶性剤形を得るために、活性剤の薬学的に許容できる塩を、コハク酸またはクエン酸の0.3M溶液などの有機または無機酸の水溶液に溶かすことができる。可溶性塩形態が入手できない場合、活性剤を、適当な共溶媒または共溶媒の組合せに溶かすことができる。適当な共溶媒の例は、総体積の約0〜約60%の範囲である濃度のアルコール、プロピレングリコール、ポリエチレングリコール300、ポリソルベート80、グリセリンなどを包含するが、それらに限定されるものではない。組成物は、水または等張食塩水またはブドウ糖溶液などの適切な水性ビヒクル中の活性剤の塩形態の溶液の形態であってもよい。
【0154】
本発明の組成物において使用される化合物1の実際の用量は、使用されている特定の多形性形態、製剤化される特定の組成物、投与様式ならびに治療されている特定の部位、宿主および疾患に従って変わることがあることは理解されているであろう。薬剤についての実験データに鑑みて従来の用量決定試験を使用する当業者は、所与の一連の状態についての最適な用量を確認することができる。経口投与については、一般的に用いられる例示的1日投与量は、体重1kg当たり約0.001〜約1000mg、より好ましくは、体重1kg当たり約0.001〜約50mgであり、治療の過程は、適切な間隔で繰り返すことができる。プロドラッグの投与は、典型的には、完全に活性な形態の重量レベルと化学的に等価である重量レベルにて投与される。本発明の実施において、最も適当な投与経路ならびに治療投与量の大きさは、治療されることになる疾患の性質および重症度によって左右されるであろう。投与量、および投薬回数は、個々の患者の年齢、体重、および応答に従って変わることもある。一般に、適当な経口剤形は、1つの単一投与量または均等分割投与量で投与される活性成分1日総投与量0.5mg〜100mgの投与量範囲をカバーすることができる。そのような製剤における化合物1の好ましい量は、約1mg〜約10mgまたは約1mg〜約5mgなどの約0.5mg〜約20mgである。
【0155】
本発明の組成物は、医薬組成物を調製するための一般的に知られている方法で、例えば、混合、溶解、顆粒化、糖剤製造(dragee−making)、研和(levigating)、乳化、カプセル化、封入または凍結乾燥などの従来の技法を使用して製造することができる。医薬組成物は、薬学的に使用することができる調製物への活性化合物の加工を容易にする賦形剤および助剤から選択することができる1つまたは複数の生理学的に許容できる担体を使用する従来の方式で製剤化することができる。
【0156】
経口投与の場合、化合物1の多形性形態は、活性剤を当技術分野において知られている薬学的に許容できる担体と混ぜ合わせることにより容易に製剤化することができる。そのような担体は、治療されることになる患者による経口摂取のために、錠剤、丸剤、糖剤、カプセル剤、ゲル剤、シロップ剤、スラリー剤、懸濁剤などとして本発明の化合物を製剤化することを可能にする。経口使用のための医薬調製物は、活性剤との混合物中の固体賦形剤を使用し、場合により、得られる混合物を粉砕し、望ましい場合に、適当な助剤を加えた後で顆粒の混合物を加工し、錠剤または糖剤コアを得ることで得ることができる。適当な賦形剤は、ラクトース、スクロース、マンニトール、またはソルビトールを包含する糖などの充填剤;およびセルロース調製物、例えば、トウモロコシデンプン、小麦デンプン、米デンプン、ジャガイモデンプン、ゼラチン、ガム、メチルセルロース、ヒドロキシプロピルメチル−セルロース、カルボキシメチルセルロースナトリウム、またはポリビニルピロリドン(PVP)を包含する。望ましい場合、架橋ポリビニルピロリドン、寒天、またはアルギン酸もしくはアルギン酸ナトリウムなどのその塩などの崩壊剤を加えることができる。
【0157】
糖剤コアは、適当なコーティングと共に提供される。この目的のために、アラビアゴム、ポリビニルピロリドン、カルボポールゲル、ポリエチレングリコール、および/または二酸化チタン、ラッカー溶液、および適当な有機溶媒または溶媒混合物を含有していてもよい濃縮糖溶液を使用することができる。染料または顔料を、識別のため、または活性剤の異なる組合せを特徴付けるために錠剤または糖剤コーティングに加えることができる。
【0158】
経口で使用することができる医薬調製物は、ゼラチンでできている押し込み式カプセル剤、ならびにゼラチンおよびグリセロールまたはソルビトールなどの可塑剤でできている軟質の密閉カプセル剤を包含する。押し込み式カプセル剤は、ラクトースなどの充填剤、デンプンなどの結合剤、および/またはタルクまたはステアリン酸マグネシウムなどの滑沢剤、および、場合により、安定剤との混合物中に活性成分を含有することができる。軟質カプセル剤において、活性剤は、脂肪油、流動パラフィン、または液体ポリエチレングリコールなどの適当な液体に溶解または懸濁させることができる。さらに、安定剤を加えることができる。経口投与のためのすべての製剤は、そのような投与に適している用量であるべきである。口腔投与の場合、組成物は、従来の方式で製剤化される錠剤またはロゼンジ剤の形態を取ることができる。
【0159】
鼻腔内または吸入による投与の場合、化合物は、適当な噴射剤、例えば、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素または他の適当なガスを使用して、加圧パックまたはネブライザーからエアゾールスプレー提供の形態で好都合に送達することができる。加圧エアゾールの場合、用量単位は、一定量を送達するためのバルブを提供することにより決定することができる。インヘイラーまたはインサフレーターなどにおいて使用するためのゼラチンのカプセル剤およびカートリッジ剤は、化合物およびラクトースまたはデンプンなどの適当な粉末基剤の粉末ミックスを含有して製剤化することができる。
【0160】
活性剤は、注射による、例えば、ボーラス注射または連続注入による非経口投与のために製剤化することができる。注射のための製剤は、保存剤を加え、例えば、アンプルまたはマルチドーズ容器中の単位剤形で提供することができる。組成物は、油性または水性ビヒクル中の懸濁剤、溶液剤または乳剤などの形態を取ることができ、懸濁化剤、安定化剤および/または分散剤などの製剤化剤を含有することができる。
【0161】
非経口投与のための医薬製剤は、例えば、活性剤の懸濁剤を包含し、適切な油性注射懸濁剤として調製することができる。適当な親油性の溶媒またはビヒクルは、ゴマ油、またはオレイン酸エチルもしくはトリグリセリドなどの合成脂肪酸エステルなどの脂肪油、またはリポソームを包含する。水性注射懸濁剤は、カルボキシメチルセルロースナトリウム、ソルビトール、またはデキストランなどの懸濁液の粘度を高める物質を含有することがある。場合により、懸濁液は、適当な安定剤または活性剤の溶解性を高めて高濃度溶液剤の調製を可能にする試剤を含有することもある。
【0162】
眼への投与の場合、活性剤は、例えば、前房、後房、硝子体、房水、硝子体液、角膜、虹彩/毛様体、水晶体、脈絡膜/網膜および強膜を包含する眼の角膜および内部領域に化合物を浸透させるために十分な時間にわたって化合物を眼表面に接触させて維持するような薬学的に許容できる眼科用ビヒクルで送達することができる。薬学的に許容できる眼科用ビヒクルは、例えば、軟膏、植物油、またはカプセル化材料であってよい。本発明の活性剤は、硝子体液および房水内またはテノン嚢下に直接注射することもできる。
【0163】
あるいは、活性成分は、使用前に、適当なビヒクル、例えば、無菌の発熱物質含まない水による再構成のための粉末形態であってよい。化合物は、例えば、カカオ脂または他のグリセリドなどの従来の坐剤基剤を含有する坐剤または保留浣腸などの直腸または膣組成物にも製剤化することができる。
【0164】
上に記載されている製剤に加えて、多形性形態は、デポー調製物として製剤化することもできる。そのような長時間作用型製剤は、埋め込みにより(例えば、皮下または筋内に)または筋肉内注射により投与することができる。すなわち、例えば、多形性形態は、適当なポリマー材料もしくは疎水性材料(例えば、許容できる油中のエマルジョンとして)またはイオン交換樹脂と共に、または難溶性の誘導体として、例えば、難溶性の塩として製剤化することができる。
【0165】
さらに、化合物1の多形性形態は、治療剤を含有する固体疎水性ポリマーの半透性マトリックスなどの持続放出系を使用して送達することができる。様々な持続放出材料が確立されており、当業者により知られている。持続放出カプセル剤は、それらの化学的性質に応じて、数週間にわたって100日を超えるまで化合物を放出することができる。
【0166】
医薬組成物は、適当な固相またはゲル相の担体または賦形剤を含むこともある。そのような担体または賦形剤の例は、炭酸カルシウム、リン酸カルシウム、糖、デンプン、セルロース誘導体、ゼラチン、およびポリエチレングリコールなどのポリマーを包含する。
【0167】
IV.本発明の多形体を使用する方法
化合物1の結晶性塩の多形性形態は、ポリ(ADP−リボース)ポリメラーゼ(PARP)の活性を仲介するのに有用である可能性がある。より詳細には、これらの多形性形態は、その機構がDNA損傷によって左右される放射線療法または細胞傷害性薬物の有効性を増強する化学増感剤(chemosensitizer)として有用である可能性がある。これらの薬物は、テモゾロマイド(SCHERING)、イリノテカン(PFIZER)、トポテカン(GLAXO SMITHKLINE)、シスプラチン(BRISTOL MEYERS SQUIBB;AM PHARM PARTNERS;BEDFORD;GENSIA SICOR PHARMS;PHARMACHEMIE)、およびドキソルビシン塩酸塩(AM PHARM PARTNERS;BEDFORD;GENSIA:SICOR PHARMS;PHARMACHEMIE;ADRIA;ALZA)を包含するが、それらに限定されるものではない。
【0168】
化合物1の多形性塩形態は、β細胞中のReg遺伝子およびHGF遺伝子の発現の誘導を増強し、したがって、ランゲルハンス島の膵臓β細胞の増殖を促進し、細胞のアポトーシスを抑制するのにも有用である可能性がある。さらに、本発明の化合物1の多形性塩形態は、化粧品を調製するために、例えば、アフターサンローション剤において有用である可能性がある。
【0169】
治療有効量の本発明の薬剤は、PARPの変調または調製により仲介される疾患を治療するために、典型的には、医薬組成物の形態で投与することができる。「有効量」とは、そのような治療を必要としているヒトを包含する哺乳動物に投与された場合、1つまたは複数のPARP酵素の活性により仲介される疾患についての治療を行うのに十分である薬剤の量を指す。すなわち、ある化合物の治療有効量とは、その活性により仲介される疾患状態が低減または緩和されるように1つまたは複数のPARP酵素の活性を変調、調節、または阻害するのに十分な量を指す。所与の化合物の有効量は、疾患状態およびその重症度ならびに治療を必要としている哺乳動物の独自性および状態(例えば、体重)などの要因に応じて変わることがあるが、当業者によりルーチンに決定することができる。「治療すること」とは、1つまたは複数のPARP酵素の活性により少なくとも部分的に影響を受ける、ヒトを包含する哺乳動物におけるある疾患状態の少なくとも緩和を指し、哺乳動物において、特に、その哺乳動物が、その疾患状態を有する傾向があるが、それを有するといまだ診断されたことがない場合にその疾患状態を予防すること;疾患状態を変調および/または阻害すること;および/または疾患状態を緩和することを包含する。例示的疾患状態は、糖尿病性網膜症、血管新生緑内障、関節リウマチ、乾癬、加齢性黄斑変性症(AMD)、および癌などの異常細胞成長を包含する。癌は、中皮腫、肝胆道の(胆道および胆管)、原発性または続発性CNS腫瘍、原発性または続発性脳腫瘍、肺癌(NSCLCおよびSCLC)、骨癌、膵臓癌、皮膚癌、頭部または頚部の癌、皮膚または眼内の黒色腫、卵巣癌、結腸癌、直腸癌、肛門部の癌、胃癌、胃腸の(胃の、結腸直腸の、および十二指腸の)癌、乳癌、子宮癌、卵管の癌、子宮内膜の癌腫、子宮頚部の癌腫、膣の癌腫、外陰部の癌腫、ホジキン病、食道の癌、小腸の癌、内分泌系の癌、甲状腺の癌、副甲状腺の癌、副腎腺の癌、軟組織の肉腫、尿道の癌、陰茎の癌、前立腺癌、精巣癌、慢性または急性の白血病、慢性骨髄性白血病、リンパ球性リンパ腫、膀胱の癌、腎臓または尿管の癌、腎細胞癌腫、腎盂の癌腫、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、非ホジキンリンパ腫、脊髄軸腫瘍、脳幹神経膠腫、下垂体腺腫、副腎皮質癌、胆嚢癌、多発性骨髄腫、胆管癌、線維肉腫、神経芽細胞腫、網膜芽細胞腫、または以上の癌のうちの1つまたは複数の組合せを包含するが、それらに限定されるものではない。
【0170】
異常細胞成長は、乾癬、良性前立腺肥大症または再狭窄を包含するがそれらに限定されない、良性増殖性疾患を包含するが、それに限定されるものではない。
【0171】
PARP活性のモジュレーターとしての化合物1の多形性塩形態の活性は、インビボおよび/またはインビトロのアッセイを包含する当業者が利用できる方法のうちのいずれかにより測定することができる。活性測定のための適当なアッセイの例は、それらの開示がそれらの全体として参照により本明細書に組み込まれている米国特許第6,495,541号および米国仮特許出願第60/612,458号に記載されているものを包含する。
【0172】
一部の実施形態は、PARP活性により仲介される疾患状態、例えば、癌ならびに酸化的または酸化窒素誘発性のストレスおよびそれに続くPARP過剰活性化が関わる様々な疾患および毒性状態を処置する治療方法も対象とする。そのような状態は、神経学的および神経変性障害(例えば、パーキンソン病、アルツハイマー病)、心臓血管障害(例えば、心筋梗塞、虚血−再灌流傷害)、糖尿病性血管機能障害、シスプラチン誘発性腎毒性を包含するが、それらに限定されるものではない。一部の実施形態において、治療方法は、治療有効量の、多形性形態のうちのいずれかを包含する医薬組成物、または本明細書で議論されている医薬組成物を、それを必要としている哺乳動物に投与することを包含する。
【0173】
一部の実施形態は、PARP活性により仲介される疾患状態を処置する組合せ治療方法であって、治療有効量の抗腫瘍剤、抗血管新生剤、シグナル伝達阻害剤、および抗増殖剤、有糸分裂阻害剤、アルキル化剤、代謝拮抗剤、挿入性抗生物質、成長因子阻害剤、細胞周期阻害剤、酵素、トポイソメラーゼ阻害剤、生物学的応答調整剤、抗体、細胞傷害剤、抗ホルモン剤、および抗アンドロゲン剤などの1つまたは複数の物質と組み合わせて、治療有効量の、多形性形態のうちのいずれかを含む医薬組成物、または本明細書で議論されている医薬組成物を、それを必要としている哺乳動物に投与することを含む方法も対象とする。そのような物質は、それらの開示がそれらの全体として参照により本明細書に組み込まれているPCT公開第WO00/38715号、第WO00/38716号、第WO00/38717号、第WO00/38718号、第WO00/38719号、第WO00/38730号、第WO00/38665号、第WO00/37107号、および第WO00/38786号に開示されているものを包含するが、それらに限定されるものではない。
【0174】
抗腫瘍剤の例は、テモゾロマイド(SCHERING)、イリノテカン(PFIZER)、トポテカン(GLAXO SMITHKLINE)、シスプラチン(BRISTOL MEYERS SQUIBB;AM PHARM PARTNERS;BEDFORD;GENSIA SICOR PHARMS;PHARMACHEMIE)、およびドキソルビシン塩酸塩(AM PHARM PARTNERS;BEDFORD;GENSIA;SICOR PHARMS;PHARMACHEMIE;ADRIA;ALZA)を包含する。
【0175】
抗腫瘍剤の追加例は、有糸分裂阻害剤、例えば、ビンブラスチン、ビノレルビン、ビンデシンおよびビンクリスチンなどのビンカアルカロイド誘導体;コルヒチン、アロコルヒチン、ハリコンドリン、N−ベンゾイルトリメチル−メチルエーテルコルヒチン酸、ドラスタチン10、メイタンシン、リゾキシン、タキソール(パクリタキセル)、ドセタキセル(Taxotere)、2’−N−[3−(ジメチルアミノ)プロピル]グルタラメート(glutaramate)(タキソール誘導体)などのタキサン、チオコルヒチン、トリチルシステイン、テニポシド、メトトレキセート、アザチオプリン、フルオロウラシル、シトシンアラビノシド、2’,2’−ジフルオロデオキシシチジン(ゲムシタビン)、アドリアマイシンおよびマイトマイシン;アルキル化剤、例えば、カルボプラチン、オキサリプラチン、イプロプラチン、N−アセチル−DL−サルコシル−L−ロイシンのエチルエステル(AsaleyまたはAsalex)、1,4−シクロヘキサジン−1,4−ジカルバミン酸、2,5−ビス(1−アジリジニル)−3,6−ジオキソ−、ジエチルエステル(ジアジクォン)、1,4−ビス(メタンスルホニルオキシ)ブタン(ブスルファンまたはロイコスルファン(leucosulfan))、クロロゾトシン、クロメソン、シアノモルホリノドキソルビシン、シクロジソン、ジアンヒドロガラクチトール、フルオロドパン、ヘプスルファム、マイトマイシンC、ヒカンテオネマイトマイシン(hycantheonemitomycin)C、ミトゾラミド(mitozolamide)、1−(2−クロロエチル)−4−(3−クロロプロピル)−ピペラジン二塩酸塩、ピペラジンジオン、ピポブロマン、ポルフィロマイシン、スピロヒダントインマスタード、テロキシロン、テトラプラチン(tetraplatin)、チオテパ、トリエチレンメラミン、ウラシルナイトロジェンマスタード、ビス(3−メシルオキシプロピル)アミン塩酸塩、マイトマイシン、シクロヘキシル−クロロエチルニトロソ尿素、メチルシクロヘキシル−クロロエチルニトロソ尿素、1−(2−クロロエチル)−3−(2,6−ジオキソ−3−ピペリジル)−1−ニトロソ−尿素、ビス(2−クロロエチル)ニトロソ尿素などのニトロソ尿素剤、プロカルバジン、ダカルバジン、メクロレタミン、シクロホスファミド、イホスファミド、メルファラン、クロラムブシル、リン酸エストラムスチンナトリウム、およびストレプトゾシンなどのナイトロジェンマスタード関連化合物;DNA代謝拮抗剤、例えば、5−フルオロウラシル、シトシンアラビノシド、ヒドロキシ尿素、2−[(3−ヒドロキシ−2−ピリノジニル(pyrinodinyl))メチレン]−ヒドラジンカルボチオアミド、デオキシフルオロウリジン、5−ヒドロキシ−2−ホルミルピリジンチオセミカルバゾン、α−2’−デオキシ−6−チオグアノシン、グリシン酸アフィジコリン、5−アザデオキシシチジン、β−チオグアニンデオキシリボシド、サイクロシチジン、グアナゾール、イノシングリコジアルデヒド(glycodialdehyde)、マクベシンII、ピラゾールイミダゾール(pyrazolimidazole)、クラドリビン、ペントスタチン、チオグアニン、メルカプトプリン、ブレオマイシン、2−クロロデオキシアデノシン、ラルチトレキセドおよびペメトレキセド二ナトリウムなどのチミジル酸合成酵素阻害剤、クロファラビン、フロクスウリジンおよびフルダラビン;DNA/RNA代謝拮抗剤、例えば、L−アラノシン、5−アザシチジン、アシビシン、アミノプテリンおよびN−[2−クロロ−5−[[(2,4−ジアミノ−5−メチル−6−キナゾリニル)メチル]アミノ]ベンゾイル]−L−アスパラギン酸、N−[4−[[(2,4−ジアミノ−5−エチル−6−キナゾリニル)メチル]アミノ]ベンゾイル]−L−アスパラギン酸、N−[2−クロロ−4−[[(2,4−ジアミノプテリジニル)メチル]アミノ]ベンゾイル]−L−アスパラギン酸などのその誘導体、可溶性ベイカーズアンチフォル(Baker’s antifol)、ジクロロアリルローソン、ブレキナル、フトラフール、ジヒドロ−5−アザシチジン、メトトレキセート、N−(ホスホノアセチル)−L−アスパラギン酸四ナトリウム塩、ピラゾフリン、トリメトレキセート、プリカマイシン、アクチノマイシンD、クリプトフィシン、およびクリプトフィシン−52などの類似体、または、例えば、N−(5−[N−(3,4−ジヒドロ−2−メチル−4−オキソキナゾリン−6−イルメチル)−N−メチルアミノ]−2−テノイル)−L−グルタミン酸などの欧州特許出願第239362号に開示されている好ましい代謝拮抗剤のうちの1つ;成長因子阻害剤;細胞周期阻害剤;挿入性抗生物質、例えば、アドリアマイシンおよびブレオマイシン;タンパク質、例えば、インターフェロン;および、抗ホルモン剤、例えばNolvadex(商標)(タモキシフェン)などの抗エストロゲン剤、または、例えば、Casodex(商標)(4’−シアノ−3−(4−フルオロフェニルスルホニル)−2−ヒドロキシ−2−メチル−3’−(トリフルオロメチル)プロピオンアニリド)などの抗アンドロゲン剤を包含する。そのような結合治療は、治療の個々の構成成分の同時、順次、または個別投薬により達成することができる。
【0176】
抗血管新生剤は、MMP−2(マトリックス−メタロプロテイナーゼ2)阻害剤、MMP−9(マトリックス−メタロプロテイナーゼ9)阻害剤、およびCOX−II(シクロオキシゲナーゼII)阻害剤を包含する。有用なCOX−II阻害剤の例は、CELEBREX(商標)(アレコキシブ(alecoxib))、バルデコキシブ、およびロフェコキシブを包含する。有用なマトリックスメタロプロテイナーゼ阻害剤の例は、それらのすべてが全体として参照により本明細書に組み込まれているWO96/33172(1996年10月24日公開)、WO96/27583(1996年3月7日公開)、欧州特許出願第97304971.1号(1997年7月8日出願)、欧州特許出願第99308617.2号(1999年10月29日出願)、WO98/07697(1998年2月26日公開)、WO98/03516(1998年1月29日公開)、WO98/34918(1998年8月13日公開)、WO98/34915(1998年8月13日公開)、WO98/33768(1998年8月6日公開)、WO98/30566(1998年7月16日公開)、欧州特許公開第606,046号(1994年7月13日公開)、欧州特許公開第931,788号(1999年7月28日公開)、WO90/05719(1990年5月31日公開)、WO99/52910(1999年10月21日公開)、WO99/52889(1999年10月21日公開)、WO99/29667(1999年6月17日公開)、PCT国際出願第PCT/IB98/01113号(1998年7月21日出願)、欧州特許出願第99302232.1号(1999年3月25日出願)、英国特許出願第9912961.1号(1999年6月3日出願)、米国仮出願第60/148,464号(1999年8月12日出願)、米国特許第5,863,949号(1999年1月26日発行)、米国特許第5,861,510号(1999年1月19日発行)、および欧州特許公開第780,386号(1997年6月25日公開)に記載されている。好ましいMMP−2およびMMP−9阻害剤は、MMP−1を阻害する活性をほとんどまたはまったく有していないものである。他のマトリックス−メタロプロテイナーゼ(すなわち、MMP−1、MMP−3、MMP−4、MMP−5、MMP−6、MMP−7、MMP−8、MMP−10、MMP−11、MMP−12、およびMMP−13)と比べて、MMP−2および/またはMMP−9を選択的に阻害するものがより好ましい。
【0177】
MMP阻害剤の例は、AG−3340、RO32−3555、RS13−0830、および下記の化合物:3−[[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニル]−(1−ヒドロキシカルバモイル−シクロペンチル)−アミノ]−プロピオン酸;3−エキソ−3−[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニルアミノ]−8−オキサ−ビシクロ[3.2.1]オクタン−3−カルボン酸ヒドロキシアミド;(2R,3R)1−[4−(2−クロロ−4−フルオロ−ベンジルオキシ)−ベンゼンスルホニル]−3−ヒドロキシ−3−メチル−ピペリジン−2−カルボン酸ヒドロキシアミド;4−[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニルアミノ]−テトラヒドロ−ピラン−4−カルボン酸ヒドロキシアミド;3−[[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニル]−(1−ヒドロキシカルバモイル−シクロブチル)−アミノ]−プロピオン酸;4−[4−(4−クロロ−フェノキシ)−ベンゼンスルホニルアミノ]−テトラヒドロ−ピラン−4−カルボン酸ヒドロキシアミド;3−[4−(4−クロロ−フェノキシ)−ベンゼンスルホニルアミノ]−テトラヒドロ−ピラン−3−カルボン酸ヒドロキシアミド;(2R,3R)1−[4−(4−フルオロ−2−メチル−ベンジルオキシ)−ベンゼンスルホニル]−3−ヒドロキシ−3−メチル−ピペリジン−2−カルボン酸ヒドロキシアミド;3−[[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニル]−(1−ヒドロキシカルバモイル−1−メチル−エチル)−アミノ]−プロピオン酸;3−[[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニル]−(4−ヒドロキシカルバモイル−テトラヒドロ−ピラン−4−イル)−アミノ]−プロピオン酸;3−エキソ−3−[4−(4−クロロ−フェノキシ)−ベンゼンスルホニルアミノ]−8−オキサ−ビシクロ[3.2.1]オクタン−3−カルボン酸ヒドロキシアミド;3−エンド−3−[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニルアミノ]−8−オキサ−ビシクロ[3.2.1]オクタン−3−カルボン酸ヒドロキシアミド;3−[4−(4−フルオロ−フェノキシ)−ベンゼンスルホニルアミノ]−テトラヒドロ−フラン−3−カルボン酸ヒドロキシアミド;および薬学的に許容できるそれらの塩、溶媒和物および水和物を包含する。
【0178】
シグナル伝達阻害剤の例は、EGFR抗体、EGF抗体、およびEGFR阻害剤である分子などのEGFR(上皮成長因子受容体)応答を阻害することができる薬剤;VEGF(血管内皮成長因子)阻害剤;ならびにerbB2受容体と結合する有機分子または抗体などのerbB2受容体阻害剤、例えば、HERCEPTIN(商標)(South San Francisco、California、USAのGenentech,Inc.)を包含する。
【0179】
EGFR阻害剤は、例えば、WO95/19970(1995年7月27日公開)、WO98/14451(1998年4月9日公開)、WO98/02434(1998年1月22日公開)、および米国特許第5,747,498号(1998年5月5日発行)に記載されているものを包含する。EGFR阻害剤は、モノクローナル抗体C225および抗EGFR22Mab(New York、New York、USAのImClone Systems Incorporated)、化合物ZD−1839(AstraZeneca)、BIBX−1382(Boehringer Ingelheim)、MDX−447(Annandale、New Jersey、USAのMedarex Inc.)、およびOLX−103(Whitehouse Station、New Jersey、USAのMerck & Co.)、VRCTC−310(Ventech Research)ならびにEGF融合毒素(Hopkinton、MassachusettsのSeragen Inc.)を包含するが、それらに限定されるものではない。
【0180】
VEGF阻害剤、例えば、SU−5416およびSU−6668(South San Francisco、California、USAのSugen Inc.)も、組成物と組み合わせるか同時投与することができる。VEGF阻害剤の例は、例えば、それらのすべてが全体として参照により本明細書に組み込まれているWO99/24440(1999年5月20日公開)、PCT国際出願PCT/IB99/00797(1999年5月3日出願)、WO95/21613(1995年8月17日公開)、WO99/61422(1999年12月2日公開)、米国特許第5,834,504号(1998年11月10日発行)、WO98/50356(1998年11月12日公開)、米国特許第5,883,113号(1999年3月16日発行)、米国特許第5,886,020号(1999年3月23日発行)、米国特許第5,792,783号(1998年8月11日発行)、WO99/10349(1999年3月4日公開)、WO97/32856(1997年9月12日公開)、WO97/22596(1997年6月26日公開)、WO98/54093(1998年12月3日公開)、WO98/02438(1998年1月22日公開)、WO99/16755(1999年4月8日公開)、およびWO98/02437(1998年1月22日公開)に記載されている。一部の特異的VEGF阻害剤の他の例は、IM862(Kirkland、Washington、USAのCytran Inc.);抗VEGFモノクローナル抗体ベバシツマブ(South San Francisco、CaliforniaのGenentech,Inc.);ならびに、Ribozyme(Boulder、Colorado)からの合成リボザイム、アンギオザイム(angiozyme)およびChiron(Emeryville、California)である。
【0181】
GW−282974(Glaxo Wellcome plc)、ならびにモノクローナル抗体AR−209(The Woodlands、Texas、USAのAronex Pharmaceuticals Inc.)および2B−1(Chiron)などのerbB2受容体阻害剤は、組成物と組み合わせて投与することができる。そのようなerbB2阻害剤は、それらの各々がその全体として参照により本明細書に組み込まれているWO98/02434(1998年1月22日公開)、WO99/35146(1999年7月15日公開)、WO99/35132(1999年7月15日公開)、WO98/02437(1998年1月22日公開)、WO97/13760(1997年4月17日公開)、WO95/19970(1995年7月27日公開)、米国特許第5,587,458号(1996年12月24日発行)、および米国特許第5,877,305号(1999年3月2日発行)に記載されているものを包含するが、それらに限定されるものではない。本発明において有用なerbB2受容体阻害剤は、それらの両方がそれらの全体として参照により本明細書に組み込まれている1999年1月27日出願の米国仮出願第60/117,341号、および1999年1月27日出願の米国仮出願第60/117,346号にも記載されている。
【0182】
使用することができる他の抗増殖剤は、下記の米国特許出願:09/221946(1998年12月28日出願);09/454058(1999年12月2日出願);09/501163(2000年2月9日出願);09/539930(2000年3月31日出願);09/202796(1997年5月22日出願);09/384339(1999年8月26日出願);および09/383755(1999年8月26日出願)に開示および特許請求の範囲に記載されている化合物;ならびに下記の米国仮特許出願:60/168207(1999年11月30日出願);60/170119(1999年12月10日出願);60/177718(2000年1月21日出願);60/168217(1999年11月30日出願);および60/200834(2000年5月1日出願)に開示および特許請求の範囲に記載されている化合物を包含する酵素ファルネシルタンパク質トランスフェラーゼの阻害剤および受容体チロシンキナーゼPDGFrの阻害剤を包含するが、それらに限定されるものではない。以上の特許出願および仮特許出願の各々は、それらの全体として参照により本明細書に組み込まれるものとする。
【0183】
本発明の組成物は、CTLA4(細胞傷害性リンパ球抗原4)抗体などの抗腫瘍免疫応答を増強することができる薬剤、およびCTLA4をブロックすることができる他の薬剤;ならびに他のファルネシルタンパク質トランスフェラーゼ阻害剤などの抗増殖剤を包含するがそれらに限定されない、異常細胞成長または癌を治療するのに有用な他の薬剤と共に使用することもできる。本発明において使用することができる具体的なCTLA4抗体は、その全体として参照により本明細書に組み込まれている米国仮特許出願第60/113,647号(1998年12月23日出願)に記載されるものを包含する。
【0184】
すべての引用されている参考文献の開示は、それらの全体として参照により本明細書に組み込まれるものとする。
【0185】
実施例
続く実施例は、化合物1の相異なる多形性塩形態の調製および特徴付けをさらに説明しているが、本明細書に記載されているか本明細書で特許請求の範囲に記載されているような本発明の範囲を限定することは意図されていない。他に指示がない限り、すべての温度は、℃で示され、すべての部および百分率は、重量による。
【実施例1】
【0186】
化合物1のマレイン酸塩、マレイン酸塩多形体A形の調製。
80/20v/vイソプロピルアルコール/水(25mL)中の化合物1(100.8mg;0.31mmol)の溶液を、周囲条件(20〜25℃)にて撹拌しながら液体媒質に固体を溶かすことにより調製した。最小体積の80/20v/vイソプロピルアルコール/水中のマレイン酸(25.13mg;0.22mmol)の溶液を、上のように調製した。化合物1の溶液17.26mLを、周囲条件にて撹拌しながらマレイン酸溶液にゆっくりと加え、化合物1とマレイン酸の等モル溶液を得た。得られた溶液を、周囲条件にて24時間にわたって撹拌させ、続いて、ヘキサン(6mL)を加え、24時間にわたって−20℃にて保存すると、その間に結晶化が起きた。濾過して80/20v/vイソプロピルアルコール/水で洗浄した後、生成物を40℃にて真空下で乾燥すると、結晶性材料おおよそ100mgが得られた。
【実施例2】
【0187】
エタノールを使用する化合物1のマレイン酸塩、マレイン酸塩多形体B形の調製。
エタノール(450mL)中の化合物1(10g;30.9mmol)の溶液を、オーバーヘッド撹拌しながらジャケット付き反応容器中で還流状態まで加熱することにより調製した。エタノール(20mL)中のマレイン酸(3.95g;1.1当量)の溶液を、80℃にて1時間かけて滴加すると、その間に結晶化が起きた。懸濁液を0.5℃/分にて冷却し、1時間の顆粒化後に0℃にて単離した。濾過してエタノール(50mL)で洗浄した後、生成物を50℃にて真空下で乾燥すると、結晶性生成物12g(89%理論収率)が得られた。
【実施例3】
【0188】
イソプロピルアルコールを使用する化合物1のマレイン酸塩、マレイン酸塩多形体B形の調製。
イソプロピルアルコール(1500mL)中の化合物1(18g;55.7mmol)の溶液を、オーバーヘッド撹拌しながらジャケット付き反応容器中で加熱することにより調製した。イソプロピルアルコール(100mL)中のマレイン酸(7.11g;1.1当量)の溶液を調製し、滴加し(1時間かけて)、続いて、表題化合物の種結晶(45mg)を加えた。添加が終了したら直ぐに、懸濁液を0℃まで(自然の速度にて)冷却し、2日にわたって顆粒化させた。濾過した後、生成物を50℃にて真空下で乾燥すると、結晶性生成物23.7g(97%理論収率)が得られた。
【実施例4】
【0189】
テトラヒドロフランを使用する化合物1のS−カンシル酸塩、S−カンシル酸塩多形体A形の調製。
化合物1(20g)を、オーバーヘッド撹拌しながらジャケット付き反応容器中のテトラヒドロフラン(42mL)および水(40mL)中で還流状態にてスラリー化し、遊離塩基スラリーとして留めた。S−カンファースルホン酸溶液(水20mL中17.25g)をおおよそ10分かけてゆっくりと加え、澄明な黄色溶液を形成させ、30分にわたって還流状態に保った。次いで、おおよそ20分かけて水(135mL)を加え、還流を維持した。得られた黄色がかったスラリーを10℃まで冷却し、この温度にて顆粒化させ、適当な時間にわたって結晶化度および収率を改善した。適当な顆粒化時間は、当業者が選択することができる。典型的な顆粒化時間は、例えば、約1時間〜約48時間であってよい。濾過した固体を冷水(20mL)で洗浄し、50℃にて真空下で乾燥すると、最終生成物が得られた。
【実施例5】
【0190】
イソプロピルアルコールを使用する化合物1のS−カンシル酸塩、S−カンシル酸塩多形体A形の調製。
イソプロピルアルコール(225mL)中の化合物1(982.5mg;3.03mmol)の溶液を、周囲条件(20〜25℃)にて撹拌しながら液体媒質に固体を溶かすことにより調製した。最小体積のイソプロピルアルコール中のS−カンファースルホン酸(53.81mg)の溶液を上のように調製した。化合物1溶液17.16mLを、周囲条件にて撹拌しながらマレイン酸溶液にゆっくりと加え、化合物1とS−カンファースルホン酸の等モル溶液を得た。得られた溶液を、周囲条件にて48時間にわたって撹拌させると、その間に結晶化が起きた。濾過してイソプロピルアルコールで洗浄した後、生成物を40℃にて真空下で乾燥すると、結晶性材料おおよそ75mgが得られた。
【実施例6】
【0191】
粉末X線回折(PXRD)による化合物1のS−カンシル酸塩、多形体A形および化合物1のマレイン酸塩、多形体B形の特徴付け。
粉末X線回折パターンは、図3、4、9、および10に示されているように、自動サンプルチェンジャー、θ−θゴニオメーター、自動ビーム発散スリット、およびPSD Vantec−1検出器を取り付けたBruker−AXS Ltd.D4粉末X線回折計を使用して決定した。サンプルは、低バックグランドのキャビティーシリコンウエハー試料台上に設置することにより分析用に調製した。試料を、40kV/35mAで作動するX線管により銅K−α1X線(波長=1.5406Å)を照射しながら回転させた。分析は、2°〜55°の2θ範囲にわたり、0.018°のステップ毎に0.2秒カウントに設定した連続モードで実行するゴニオメーターで行った。ピークは、計算された模擬粉末パターンのピークに対して割り付けられた。
【実施例7】
【0192】
粉末X線回折(PXRD)による化合物1のマレイン酸塩、多形体A形の特徴付け。
粉末X線回折(PXRD)パターン測定は、図1に示されているように、銅放射線(CuKα、波長:1.54056Å)を使用するBruker D5000回折計で行った。管の電圧およびアンペア数は、それぞれ40kVおよび40mAに設定した。発散および散乱スリットは1mmに設定し、受光スリットは0.6mmに設定した。回折された放射線は、Kevex PSI検出器により検出した。3.0から40゜2θまでの2.4゜/分(1秒/0.04゜ステップ)におけるθ−2θ連続スキャンを使用した。アルミナ標準品を分析し、機器アラインメントをチェックした。サンプルは、それらを石英ホルダーに入れることにより調製した。
【実施例8】
【0193】
粉末X線回折(PXRD)による化合物1のS−カンシル酸塩、多形体B形の特徴付け。
粉末X線回折パターンは、図15に示されているように、Gobelミラー光学、単一サンプル加熱ステージおよび位置敏感型検出器(PSD)を取り付けたBruker AXS Ltd.D8 Advance粉末X線回折計を使用して得た。各試料に、40kV/40mAで作動するX線管により銅K−α1X線(波長=1.5406Å)を照射した。分析は、3°〜35°2θの範囲にわたり、0.014°ステップ毎に0.2秒カウントに設定した連続スキャンモードで実行するゴニオメーターで行った。測定は、Ansyco sycos−H−HOT温度コントローラーを使用して温度を制御しながら150℃にて行った。
【実施例9】
【0194】
固体核磁気共鳴(SSNMR)による化合物1のマレイン酸塩、多形体B形の特徴付け。
スペクトルは、ワイドボアBruker−Biospin DSX 500MHz(1H周波数)NMR分光計内に配置されたBruker−Biospin 4mm BL CPMASプローブで周囲温度および圧力にて集めた。充填されたローターをマジック角に置き、15.0kHzにて回転させた。13C固体スペクトルは、図5に示されているように、プロトンデカップルド交差分極マジック角回転(CPMAS)を使用して集めた。交差分極接触時間は、2.0msに設定した。おおよそ85kHzのプロトンデカップリング磁界を適用した。14秒のリサイクルディレイで4096のスキャンを集めた。炭素スペクトルは、その高磁場共鳴が29.5ppmに設定されている結晶性アダマンタンの外部標準を使用して参照した。19F固体スペクトルは、図6に示されているように、プロトンデカップルドマジック角回転実験(MAS)を使用して集めた。おおよそ85kHzのプロトンデカップリング磁界を適用した。140秒のリサイクルディレイで128のスキャンを集めた。フッ素スペクトルは、その共鳴が−76.54ppmに設定されているトリフルオロ酢酸(H2O中50%V/V)の外部標準を使用して参照した。
【実施例10】
【0195】
固体核磁気共鳴(SSNMR)による化合物1のS−カンシル酸塩、多形体A形の特徴付け。
サンプルおおよそ80mgを、4mmZrO2ローターにきつく充填した。スペクトルは、ワイドボアBruker−Biospin DSX 500MHz(1H周波数)NMR分光計内に配置されたBruker−Biospin 4mm BL CPMASプローブで周囲温度および圧力にて集めた。充填されたローターをマジック角に置き、15.0kHzにて回転させた。13C固体スペクトルは、図11に示されているように、プロトンデカップルド交差分極マジック角回転(CPMAS)を使用して集めた。交差分極接触時間は、2.0msに設定した。おおよそ85kHzのプロトンデカップリング磁界を適用した。6秒のリサイクルディレイで2048のスキャンを集めた。炭素スペクトルは、その高磁場共鳴が29.5ppmに設定されている結晶性アダマンタンの外部標準を使用して参照した。19F固体スペクトルは、図12に示されているように、プロトンデカップルドマジック角回転実験(MAS)を使用して集めた。おおよそ85kHzのプロトンデカップリング磁界を適用した。28秒のリサイクルディレイで256のスキャンを集めた。フッ素スペクトルは、その共鳴が−76.54ppmに設定されているトリフルオロ酢酸(H2O中50%V/V)の外部標準を使用して参照した。
【実施例11】
【0196】
示差走査熱量測定(DSC)による化合物1の多形体の特徴付け。
様々な多形体の示差走査熱量測定は、図2、7、13、および24〜27に示されているように、TA Instruments Q1000またはMettler Instruments DSC822を使用して行った。サンプル(1〜2mg)を、約320℃程度まで、窒素ガスをパージしながら毎分10℃にて20℃からひだ付きアルミニウムパンの中で加熱した。
【実施例12】
【0197】
動的蒸気收着(DVS)による化合物1の多形体の特徴付け。
吸湿性は、図8および14に示されているように、Surface Measurements Systems Ltd.UK製のAutomated Sorption Analyser Model DVS−1を使用して測定した。固体(20〜25mg)を、制御された相対湿度(%RH)および温度環境(30℃)に曝露し、重量変化を経時的に記録した。湿度は、15%RH間隔で0から90%RHまで進めた。10分にわたって平均された0.0005%/分の收着速度が、この方法で次の湿度に曝露する前に各湿度にて達成された。
【実施例13】
【0198】
化合物1のS−カンシル酸塩、多形体A形の固体剤形の調製。
化合物1のS−カンシル酸塩多形体A形を、即時放出錠剤に製剤化した。製剤化された組成物は、下記の構成成分を含有した。
【0199】
【表32】

【0200】
製剤化された組成物は、図16に示されているPXRDパターンにより特徴付けられた。
【0201】
上と同じか類似した製剤は、同じか類似した量の遊離塩基薬物濃度が上の製剤におけるようにマレイン酸塩製剤で維持されるように、マレイン酸塩多形体を使用して製造することができる。
【実施例14】
【0202】
マレイン酸塩多形体B形の物理的安定性。
マレイン酸塩多形体B形についてのPXRDパターンを、1)初期時点および2)75%相対湿度(RH)で70℃における保存後から2週後に測定した。マレイン酸塩多形体B形のPXRDパターンは、75%相対湿度で70℃における保存2週後に有意に変化しなかった。このことは、マレイン酸塩多形体B形が物理的に安定な形態で存在することを証明している。
【実施例15】
【0203】
S−カンシル酸塩多形体A形の物理的安定性。
S−カンシル酸塩多形体A形についてのPXRDパターンを、1)初期時点および2)75%相対湿度(RH)で70℃における保存から2週後に測定した。S−カンシル酸塩多形体A形のPXRDパターンは、75%相対湿度で70℃における保存2週後に有意に変化しなかった。このことは、S−カンシル酸塩多形体A形が物理的に安定な形態で存在することを証明している。
【0204】
本発明を、具体的かつ好ましい実施形態を参照することにより説明してきたが、当業者は、本発明のルーチンな実験および実施を通して変形および修正が可能であることを認識しているであろう。すなわち、本発明は、上述の説明により限定されないが、添付の特許請求の範囲およびそれらの等価物により規定されることが意図されている。
【実施例16】
【0205】
化合物1のS−カンシル酸塩、S−カンシル酸塩多形体C形の調製。
S−カンシル酸塩多形体A形(1g)のスラリーを、イソプロピルアルコール:水(10mL;40:60%v/v)中で調製した。スラリーを10分間かけて70℃まで加熱すると、溶液が得られた。溶液を25℃まで冷却すると、過飽和溶液が得られた。イソプロピルアルコール:水(25mL;10:90%v/v)および水(30mL)を加えた。得られた過飽和溶液をローターリーエバポレーターに移し、溶媒を、70℃にて真空下(50ミリバール)で除去した。沈殿が形成され単離された(0.6g)。
【実施例17】
【0206】
1R:1S−カンシル酸塩の調製。
化合物1(1.5g)のスラリーを、イソプロピルアルコール:水(25mL;40:60%v/v)中で調製した。R−カンファースルホン酸(0.65g)およびS−カンファースルホン酸(0.65g)を、水(1.5mL)中の溶液として加えた。スラリーを10分間かけて70℃まで加熱した。得られた溶液を10分間かけて0℃まで冷却した。固体は、1時間にわたって0℃の温度にてこの溶液を保った後に結晶化した。これによりスラリーが形成した。このスラリーを、合計36時間にわたって顆粒化させた。結晶を濾過し、水で洗浄し、次いで、50℃にて一晩にわたって乾燥すると、淡黄色の粉末(1.9g)が得られた。
【実施例18】
【0207】
1R:9S−カンシル酸塩の調製。
化合物1(1.5g)のスラリーを、イソプロピルアルコール:水(25mL;40:60%v/v)中で調製した。R−カンファースルホン酸(0.13g)およびS−カンファースルホン酸(1.17g)を、水(1.5mL)中の溶液として加えた。スラリーを10分間かけて70℃まで加熱した。得られた溶液を10分間かけて10℃まで冷却した。固体は、1時間にわたって10℃の温度にてこの溶液を保った後に結晶化した。これによりスラリーが形成した。このスラリーを、合計48時間にわたって顆粒化させた。結晶を濾過し、水で洗浄し、次いで、50℃にて一晩にわたって乾燥すると、淡黄色の粉末が得られた。
【実施例19】
【0208】
1R:3S−カンシル酸塩の調製。
化合物1(1.5g)のスラリーを、イソプロピルアルコール:水(25mL;40:60%v/v)中で調製した。R−カンファースルホン酸(0.325g)およびS−カンファースルホン酸(0.975g)を、水(1.5mL)中の溶液として加えた。スラリーを10分間かけて70℃まで加熱した。得られた溶液を10分間かけて10℃まで冷却した。固体は、10℃の温度にてこの溶液を保った後に結晶化した。これによりスラリーが形成した。このスラリーを、合計4時間にわたって顆粒化させた。結晶を濾過し、水で洗浄し、次いで、50℃にて一晩にわたって乾燥すると、淡黄色の粉末が得られた。
【実施例20】
【0209】
1R:7S−カンシル酸塩の調製。
化合物1(1.5g)のスラリーを、イソプロピルアルコール:水(25mL;40:60%v/v)中で調製した。R−カンファースルホン酸(0.16g)およびS−カンファースルホン酸(1.14g)を、水(1.5mL)中の溶液として加えた。スラリーを10分間かけて70℃まで加熱した。得られた溶液を10分間かけて10℃まで冷却した。固体は、10℃の温度にてこの溶液を保った後に結晶化した。これによりスラリーが形成した。このスラリーを、合計4時間にわたって顆粒化させた。結晶を濾過し、水で洗浄し、次いで、50℃にて一晩にわたって乾燥すると、淡黄色の粉末が得られた。
【実施例21】
【0210】
化合物1のR−カンシル酸塩、R−カンシル酸塩多形体A形の調製。
化合物1(1.5g)のスラリーを、イソプロピルアルコール:水(25mL;40:60%v/v)中で調製した。R−カンファースルホン酸(1.3g)を、水(1.5mL)中の溶液として加えた。スラリーを10分間かけて70℃まで加熱した。得られた溶液を10分間かけて10℃まで冷却した。固体は、10℃の温度にてこの溶液を保った後に結晶化した。これによりスラリーが形成した。このスラリーを、合計4時間にわたって顆粒化させた。結晶を濾過し、水で洗浄し、次いで、50℃にて一晩にわたって乾燥すると、淡黄色の粉末が得られた。
【実施例22】
【0211】
粉末X線回折(PXRD)による化合物1のS−カンシル酸塩、多形体C形、1R:1S−カンシル酸塩、1R:9S−カンシル酸塩、1R:3S−カンシル酸塩、1R:7S−カンシル酸塩、および化合物1のR−カンシル酸塩、R−カンシル酸塩多形体A形の特徴付け。
粉末X線回折パターンは、図18〜23に示されているように、自動サンプルチェンジャー、θ−θゴニオメーター、自動ビーム発散スリット、およびPSD Vantec−1検出器を取り付けたBruker−AXS Ltd.D4粉末X線回折計を使用して決定した。サンプルは、低バックグランドのキャビティーシリコンウエハー試料台上に設置することにより分析用に調製した。試料を、40kV/35mAで作動するX線管により銅K−α1X線(波長=1.5406Å)を照射しながら回転させた。分析は、2°〜55°の2θ範囲にわたり、0.018°のステップ毎に0.2秒カウントに設定した連続モードで実行するゴニオメーターで行った。ピークは、可能な場合に、計算された模擬粉末パターンのピークに対して割り付けられた。あるいは、ピークは、分析に先立って粉末サンプルと混合されるケイ素またはコランダム(Al2O3)などの内部基準材料を使用して割り付けられた。
【実施例23】
【0212】
固体核磁気共鳴(SSNMR)による化合物1のS−カンシル酸塩、多形体C形の特徴付け。
各サンプルおおよそ80mgを、4mmZrO2ローターにきつく充填した。スペクトルは、ワイドボアBruker−Biospin DSX 500MHz(1H周波数)NMR分光計内に配置されたBruker−Biospin 4mm BL CPMASプローブで周囲条件にて集めた。充填されたローターをマジック角に置き、15.0kHzにて回転させた。13C固体スペクトルは、図28に示されているように、プロトンデカップルド交差分極マジック角回転(CPMAS)実験を使用して集めた。交差分極接触時間は、2.0msに設定した。おおよそ85kHzのプロトンデカップリング磁界を取得中に適用した。7秒のリサイクルディレイで最低限2048のスキャンを集めた。炭素スペクトルは、その高磁場共鳴が29.5ppmに設定されている結晶性アダマンタンの外部標準を使用して参照した。19F固体スペクトルは、図29に示されているように、プロトンデカップルドマジック角回転(MAS)実験を使用して集めた。おおよそ85kHzのプロトンデカップリング磁界を取得中に適用した。おおよそ30秒のリサイクルディレイで最低限128のスキャンを集めた。フッ素スペクトルは、その共鳴が−76.54ppmに設定されているトリフルオロ酢酸(H2O中50%V/V)の外部標準を使用して参照した。
【実施例24】
【0213】
固体核磁気共鳴(SSNMR)による1R:1S−カンシル酸塩および1R:9S−カンシル酸塩の特徴付け。
各サンプルおおよそ80mgを、4mmZrO2ローターにきつく充填した。スペクトルは、ワイドボアBruker−Biospin DSX 500MHz(1H周波数)NMR分光計内に配置されたBruker−Biospin 4mm BL CPMASプローブで周囲条件にて集めた。充填されたローターをマジック角に置き、15.0kHzにて回転させた。13C固体スペクトルは、図30および32に示されているように、プロトンデカップルド交差分極マジック角回転(CPMAS)実験を使用して集めた。交差分極接触時間は、2.0msに設定した。おおよそ85kHzのプロトンデカップリング磁界を取得中に適用した。6秒のリサイクルディレイで最低限2048のスキャンを集めた。炭素スペクトルは、その高磁場共鳴が29.5ppmに設定されている結晶性アダマンタンの外部標準を使用して参照した。19F固体スペクトルは、図31および33に示されているように、プロトンデカップルドマジック角回転(MAS)実験を使用して集めた。おおよそ85kHzのプロトンデカップリング磁界を取得中に適用した。おおよそ30秒のリサイクルディレイで最低限128のスキャンを集めた。フッ素スペクトルは、その共鳴が−76.54ppmに設定されているトリフルオロ酢酸(H2O中50%V/V)の外部標準を使用して参照した。
【実施例25】
【0214】
フーリエ変換−赤外分光法(FT−IR)による化合物1の塩および多形体の特徴付け。
IRスペクトルは、「DurasamplIR」単反射ATRアクセサリー(セレン化亜鉛基板上のダイヤモンド表面)およびd−TGS KBr検出器を取り付けたThermoNicolet Nexus FTIR分光計を使用して取得した。スペクトルは、2cm−1の分解能および512スキャンの同時加算(co−addition)にて集めた。Happ−Genzelアポダイゼーションを使用した。FT−IRスペクトルは、単反射ATRを使用して記録したため、サンプル調製は必要なかった。ATR FT−IRを使用することは、典型的には、赤外バンドの相対強度が、KBrディスクまたはヌジョールムルサンプル調製を使用する透過FT−IRスペクトルにおいて見られる赤外バントと異なる原因になるであろう。ATR FT−IRの性質のため、低めの波数におけるバンドは、典型的には、高めの波数におけるバンドよりも強い。他に指示がない限り、実験誤差は、±2cm−1であった。
【実施例26】
【0215】
フーリエ変換−ラマン分光法(FT−ラマン)による化合物1の塩および多形体の特徴付け。
ラマンスペクトルは、1064nmのNdYAGレーザーおよびLN−Germanium検出器を取り付けたRamIIラマンモジュール付きのBruker Vertex70 FT−IR分光計を使用して集めた。すべてのスペクトルは、2cm−1の分解能およびBlackman−Harris 4−タームアポダイゼーションを使用して記録した。レーザー出力は250mWとし、1024のスキャンを同時加算した。
【実施例27】
【0216】
化合物1のS−カンシル酸塩の非晶性形態の調製。
S−カンシル酸塩多形体A形(150mg)の溶液を、室温にてtBA:水(50ml;60:40%v/v)中で調製した。溶液を、4〜5分間かけてドライアイス−アセトン浴上で旋回させることにより凍結させると、サンプルフラスコの側面に厚い凍結層が得られた。凍結乾燥機の凝縮器を−100℃まで冷却し、真空をスイッチオンした。凍結溶液のサンプルフラスコを、マニホールドチャンバーまたはドライングチャンバーのポートに素早く接続した。真空を、チャンバーへの出口を開けることにより作り出した。化合物1のS−カンシル酸塩の非晶性形態は、室温にて一夜にわたって乾燥した後に単離された。
【実施例28】
【0217】
粉末X線回折(PXRD)による化合物1のS−カンシル酸塩の非晶性形態の特徴付け。
粉末X線回折パターンは、自動サンプルチェンジャー、θ−θゴニオメーター、自動ビーム発散スリット、およびLynxEye検出器を取り付けたBruker−AXS Ltd.D4粉末X線回折計を使用して得た。サンプルは、低バックグランドのキャビティーシリコンウエハー試料台上に設置することにより分析用に調製した。試料を、40kV/40mAで作動するX線管により銅K−α1X線(波長=1.5406Å)を照射しながら回転させた。分析は、3°〜40°の2θ範囲にわたり、0.020°のステップ毎に0.3秒カウントに設定した連続モードで実行するゴニオメーターで行った。PXRDディフラクトグラムは、図34に示されているように、約5゜2θから約40゜2θにかけて広がる基線を有するブロードなピークを示す。
【実施例29】
【0218】
固体核磁気共鳴(SSNMR)による化合物1のS−カンシル酸塩の非晶性形態の特徴付け。
サンプルおおよそ80mgを、4mmZrO2ローターにきつく充填した。スペクトルは、ワイドボアBruker−Biospin DSX 500MHz(1H周波数)NMR分光計内に配置されたBruker−Biospin 4mm BL CPMASプローブで集めた。充填されたローターをマジック角に置き、15.0kHzにて回転させた。ローターは、0℃の出力温度を有する窒素の直接流で冷却した。13C固体スペクトルは、図35に示されているように、プロトンデカップルド交差分極マジック角回転(CPMAS)実験を使用して集めた。交差分極接触時間は、2.0msに設定した。おおよそ85kHzのプロトンデカップリング磁界を取得中に適用した。5.5秒のリサイクルディレイで10240のスキャンを集めた。炭素スペクトルは、その高磁場共鳴が29.5ppmに設定されている結晶性アダマンタンの外部標準を使用して参照した。19F固体スペクトルは、図36に示されているように、プロトンデカップルドマジック角回転(MAS)実験を使用して集めた。おおよそ85kHzのプロトンデカップリング磁界を取得中に適用した。5.5秒のリサイクルディレイで512のスキャンを集めた。フッ素スペクトルは、その共鳴が−76.54ppmに設定されているトリフルオロ酢酸(H2O中50%V/V)の外部標準を使用して参照した。
【実施例30】
【0219】
ラマン分光法による化合物1のS−カンシル酸塩の非晶性形態の特徴付け。
ラマンスペクトルは、FT−IRベンチに接続されているNicolet NXR FT−ラマンアクセサリーを使用して集めた。分光計には、1064nmのNd:YAGレーザーおよび液体窒素冷却Germanium検出器を取り付けた。データ取得に先立って、機器性能および較正検証を、ポリスチレンを使用して行った。サンプルは、スペクトル収集中に回転させるガラスのNMR管内で分析した。スペクトルは、0.5Wのレーザー出力および100の同時加算スキャンを使用して集めた。収集範囲は、3700〜300cm−1とした。すべてのスペクトルは、4cm−1の分解能およびHapp−Genzelアポダイゼーションを使用して記録した。
【0220】
2つの別々のスペクトルを各サンプルについて記録し、それに続いて平均し、ピークピッキングに先立って強度を正規化した。ピークは、Thermo Nicolet Omnic7.3aソフトウェアを使用して手作業で識別した。ピーク位置は、ピーク最大値にてピッキングし、ピークは、各々の側に傾斜がある場合にのみ識別したため、ピーク上の肩は含めなかった。ピーク位置は、最も近い整数に切り上げた。
【実施例31】
【0221】
示差走査熱量測定(DSC)による化合物1のS−カンシル酸塩の非晶性形態の特徴付け。
示差走査熱量測定(DSC)は、図38に示されているように、TA DSC(Q1000)で行った。おおよそ5mgのサンプルを、Perkin Elmer密封アルミニウムパン(40μl)中に秤量した。ガラス転移温度(Tg)測定は、−50〜200℃における1℃の振幅および100秒の周波数で2℃/分の加熱速度にて行った。窒素パージは、他に指示がない限り、50mL/分とした。温度は、インジウムを使用して較正した。
【0222】
得られた156.5℃のTgは、リバーシングシグナル中の半高におけるステップ遷移の中点である。Tgは、水および/または溶媒含有量の関数として変化することがある。
【特許請求の範囲】
【請求項1】
8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オンのマレイン酸塩。
【請求項2】
結晶性である、請求項1に記載の塩。
【請求項3】
結晶性無水塩である、請求項1に記載の塩。
【請求項4】
6.0±0.2、20.3±0.2、および21.7±0.2の回折角(2θ)におけるピークを含む粉末X線回折パターンを有し、前記粉末X線回折パターンが、1.5406オングストロームの波長において銅K−α1X線を使用して得られる、請求項1から3のいずれか一項に記載の塩。
【請求項5】
マレイン酸塩多形体A形の実質的に純粋な多形体である、請求項1から4のいずれか一項に記載の塩。
【請求項6】
7.5±0.2、11.3±0.2、および24.3±0.2の回折角(2θ)におけるピークを含む粉末X線回折パターンを有し、前記粉末X線回折パターンが、1.5406オングストロームの波長において銅K−α1X線を使用して得られる、請求項1から3のいずれか一項に記載の塩。
【請求項7】
171.3±0.2、112.4±0.2、および43.8±0.2ppmからなる群から選択される1つまたは複数の13C化学シフトを含む固体NMRスペクトルを有する、請求項1から3および6のいずれか一項に記載の塩。
【請求項8】
−123.1±0.2ppmにおける19F化学シフトを含む固体NMRスペクトルを有する、請求項1から3および6から7のいずれか一項に記載の塩。
【請求項9】
1.5406オングストロームの波長において銅K−α1X線を使用して得られる7.5±0.2、11.3±0.2、および24.3±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つのピークを含む粉末X線回折パターン;171.3±0.2、112.4±0.2、および43.8±0.2ppmからなる群から選択される1つもしくは複数または2つ以上または3つの13C化学シフトを含む固体NMRスペクトル;ならびに−123.1±0.2ppmにおける19F化学シフトを含む固体NMRスペクトルを有する、請求項1から3および6から8のいずれか一項に記載の塩。
【請求項10】
マレイン酸塩多形体B形の実質的に純粋な多形体である、請求項1から3および6から9のいずれか一項に記載の塩。
【請求項11】
8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オンのカンシル酸塩。
【請求項12】
結晶性である、請求項11に記載の塩。
【請求項13】
結晶性無水塩である、請求項11に記載の塩。
【請求項14】
カンシル酸塩が、S−カンシル酸塩である、請求項11から13のいずれか一項に記載の塩。
【請求項15】
カンシル酸塩が、R−カンシル酸塩である、請求項11から13のいずれか一項に記載の塩。
【請求項16】
12.2±0.2、14.8±0.2、および22.4±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つのピークを含む粉末X線回折パターンを有し、前記粉末X線回折パターンが、1.5406オングストロームの波長において銅K−α1X線を使用して得られる、請求項11から15のいずれか一項に記載の塩。
【請求項17】
213.4±0.2、171.8±0.2、および17.3±0.2ppmからなる群から選択される1つもしくは複数の13C化学シフトを含む固体NMRスペクトルを有する、請求項11から16のいずれか一項に記載の塩。
【請求項18】
−118.9±0.2および−119.7ppm±0.2からなる群から選択される1つまたは複数の19F化学シフトを含む固体NMRスペクトルを有する、請求項11から17のいずれか一項に記載の塩。
【請求項19】
1.5406オングストロームの波長において銅K−α1X線を使用して得られる12.2±0.2、14.8±0.2および22.4±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つのピークを含む粉末X線回折パターン;213.4±0.2、171.8±0.2、および17.3±0.2ppmからなる群から選択される1つもしくは複数または2つ以上または3つの13C化学シフトを含む固体NMRスペクトル;ならびに−118.9±0.2および−119.7±0.2ppmからなる群から選択される1つもしくは複数または2つの19F化学シフトを含む固体NMRスペクトルを有する、請求項11から18のいずれか一項に記載の塩。
【請求項20】
S−カンシル酸塩多形体A形の実質的に純粋な多形体である、請求項11から19のいずれか一項に記載の塩。
【請求項21】
S−カンシル酸塩多形体B形の実質的に純粋な多形体またはS−カンシル酸塩多形体C形の実質的に純粋な多形体である、請求項11から13のいずれか一項に記載の塩。
【請求項22】
請求項1から21のいずれかに記載の塩を含む医薬組成物。
【請求項23】
ポリ(ADP−リボース)ポリメラーゼ活性により仲介される哺乳動物の疾患状態を治療する方法であって、治療有効量の請求項22に記載の医薬組成物を、それを必要としている哺乳動物に投与することを含む方法。
【請求項24】
哺乳動物において癌を治療する方法であって、治療有効量の請求項22に記載の医薬組成物を、哺乳動物に投与することを含む方法。
【請求項25】
癌を治療するための医薬品の製造における請求項11から21のいずれか一項に記載の塩の使用。
【請求項1】
8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オンのマレイン酸塩。
【請求項2】
結晶性である、請求項1に記載の塩。
【請求項3】
結晶性無水塩である、請求項1に記載の塩。
【請求項4】
6.0±0.2、20.3±0.2、および21.7±0.2の回折角(2θ)におけるピークを含む粉末X線回折パターンを有し、前記粉末X線回折パターンが、1.5406オングストロームの波長において銅K−α1X線を使用して得られる、請求項1から3のいずれか一項に記載の塩。
【請求項5】
マレイン酸塩多形体A形の実質的に純粋な多形体である、請求項1から4のいずれか一項に記載の塩。
【請求項6】
7.5±0.2、11.3±0.2、および24.3±0.2の回折角(2θ)におけるピークを含む粉末X線回折パターンを有し、前記粉末X線回折パターンが、1.5406オングストロームの波長において銅K−α1X線を使用して得られる、請求項1から3のいずれか一項に記載の塩。
【請求項7】
171.3±0.2、112.4±0.2、および43.8±0.2ppmからなる群から選択される1つまたは複数の13C化学シフトを含む固体NMRスペクトルを有する、請求項1から3および6のいずれか一項に記載の塩。
【請求項8】
−123.1±0.2ppmにおける19F化学シフトを含む固体NMRスペクトルを有する、請求項1から3および6から7のいずれか一項に記載の塩。
【請求項9】
1.5406オングストロームの波長において銅K−α1X線を使用して得られる7.5±0.2、11.3±0.2、および24.3±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つのピークを含む粉末X線回折パターン;171.3±0.2、112.4±0.2、および43.8±0.2ppmからなる群から選択される1つもしくは複数または2つ以上または3つの13C化学シフトを含む固体NMRスペクトル;ならびに−123.1±0.2ppmにおける19F化学シフトを含む固体NMRスペクトルを有する、請求項1から3および6から8のいずれか一項に記載の塩。
【請求項10】
マレイン酸塩多形体B形の実質的に純粋な多形体である、請求項1から3および6から9のいずれか一項に記載の塩。
【請求項11】
8−フルオロ−2−{4−[(メチルアミノ)メチル]フェニル}−1,3,4,5−テトラヒドロ−6H−アゼピノ[5,4,3−cd]インドール−6−オンのカンシル酸塩。
【請求項12】
結晶性である、請求項11に記載の塩。
【請求項13】
結晶性無水塩である、請求項11に記載の塩。
【請求項14】
カンシル酸塩が、S−カンシル酸塩である、請求項11から13のいずれか一項に記載の塩。
【請求項15】
カンシル酸塩が、R−カンシル酸塩である、請求項11から13のいずれか一項に記載の塩。
【請求項16】
12.2±0.2、14.8±0.2、および22.4±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つのピークを含む粉末X線回折パターンを有し、前記粉末X線回折パターンが、1.5406オングストロームの波長において銅K−α1X線を使用して得られる、請求項11から15のいずれか一項に記載の塩。
【請求項17】
213.4±0.2、171.8±0.2、および17.3±0.2ppmからなる群から選択される1つもしくは複数の13C化学シフトを含む固体NMRスペクトルを有する、請求項11から16のいずれか一項に記載の塩。
【請求項18】
−118.9±0.2および−119.7ppm±0.2からなる群から選択される1つまたは複数の19F化学シフトを含む固体NMRスペクトルを有する、請求項11から17のいずれか一項に記載の塩。
【請求項19】
1.5406オングストロームの波長において銅K−α1X線を使用して得られる12.2±0.2、14.8±0.2および22.4±0.2からなる群から選択される回折角(2θ)における1つもしくは複数または2つ以上または3つのピークを含む粉末X線回折パターン;213.4±0.2、171.8±0.2、および17.3±0.2ppmからなる群から選択される1つもしくは複数または2つ以上または3つの13C化学シフトを含む固体NMRスペクトル;ならびに−118.9±0.2および−119.7±0.2ppmからなる群から選択される1つもしくは複数または2つの19F化学シフトを含む固体NMRスペクトルを有する、請求項11から18のいずれか一項に記載の塩。
【請求項20】
S−カンシル酸塩多形体A形の実質的に純粋な多形体である、請求項11から19のいずれか一項に記載の塩。
【請求項21】
S−カンシル酸塩多形体B形の実質的に純粋な多形体またはS−カンシル酸塩多形体C形の実質的に純粋な多形体である、請求項11から13のいずれか一項に記載の塩。
【請求項22】
請求項1から21のいずれかに記載の塩を含む医薬組成物。
【請求項23】
ポリ(ADP−リボース)ポリメラーゼ活性により仲介される哺乳動物の疾患状態を治療する方法であって、治療有効量の請求項22に記載の医薬組成物を、それを必要としている哺乳動物に投与することを含む方法。
【請求項24】
哺乳動物において癌を治療する方法であって、治療有効量の請求項22に記載の医薬組成物を、哺乳動物に投与することを含む方法。
【請求項25】
癌を治療するための医薬品の製造における請求項11から21のいずれか一項に記載の塩の使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【公開番号】特開2011−168587(P2011−168587A)
【公開日】平成23年9月1日(2011.9.1)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−26718(P2011−26718)
【出願日】平成23年2月10日(2011.2.10)
【出願人】(593141953)ファイザー・インク (302)
【Fターム(参考)】
【公開日】平成23年9月1日(2011.9.1)
【国際特許分類】
【出願番号】特願2011−26718(P2011−26718)
【出願日】平成23年2月10日(2011.2.10)
【出願人】(593141953)ファイザー・インク (302)
【Fターム(参考)】
[ Back to top ]

