ADAM作用阻害物質のスクリーニング方法、仮足の保持方法、仮足保持剤、仮足の制御物質のスクリーニング方法、及びADAM作用阻害剤
【課題】有用なADAM作用阻害物質のスクリーニング方法、仮足の保持方法、仮足保持剤、仮足の制御物質のスクリーニング方法、及びADAM作用阻害剤を提供すること。
【解決手段】イソキノリン骨格に対して、リンカーを介在させて又は介在させずに、アルキルポリアミン又はその誘導体における一個のアミノ基を構成する窒素原子が結合した構造を有する化合物及びその塩から選ばれる1種以上を有効成分として含有することを特徴とするADAM作用阻害剤。
【解決手段】イソキノリン骨格に対して、リンカーを介在させて又は介在させずに、アルキルポリアミン又はその誘導体における一個のアミノ基を構成する窒素原子が結合した構造を有する化合物及びその塩から選ばれる1種以上を有効成分として含有することを特徴とするADAM作用阻害剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ADAM作用阻害物質のスクリーニング方法、仮足の保持方法、仮足保持剤、仮足の制御物質のスクリーニング方法、及びADAM作用阻害剤に関する。
【背景技術】
【0002】
ヘビ毒は大別して2種存在し、ガラガラヘビ等が有する出血性ヘビ毒とコブラ等が有する神経性ヘビ毒がある。
【0003】
下記の非特許文献1〜4に開示されているように、vascular apoptosis−inducing protein(以下、VAPと称する)1及び2は、出血性ヘビ毒素として本願発明者らによってガラガラヘビ毒から単離された蛋白質であり、血管内皮細胞に対して激しいアポトーシス小胞の生成を伴うアポトーシスを誘導する。また、本願発明者らは、VAP1、VAP2がADAMファミリーのホモログであることも確認している。
【0004】
ADAMとは、a−disintegrin and metalloproteaseの略称であり、ディスインテグリンドメイン及びメタロプロテアーゼドメインを有する蛋白質である。Matrix metalloprotease(以下、MMPと称する)もメタロプロテアーゼドメインを有する蛋白質であり、創傷治癒等に関与すると考えられている。これらの蛋白質のメタロプロテアーゼ部位は活性中心に金属イオンを有しており、活性化されて蛋白質の切断を行う。また、下記特許文献1〜3におけるADAM阻害剤が開示されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特表2005−533789号公報 この特許文献1は、ADAM−10蛋白質の阻害に有用な化合物を開示する。
【特許文献2】特開2008−184387号公報 この特許文献2は、アスコルビン酸誘導体であるADAM阻害剤を開示する。
【特許文献3】特開2008−201772号公報 この特許文献3は、アルキルグルコシドであるADAM阻害剤を開示する。
【非特許文献】
【0006】
【非特許文献1】Masuda, S., Hayashi, H., Araki, S., 1998. Two vascularapoptosis-inducing proteins from snake venom are members of the metalloprotease/disintegrin family. Eur. J. Biochem. 253, 36-41.
【非特許文献2】Masuda, S., Ohta, T., Kaji,K., Fox, J.W., Hayashi, H., Araki, S., 2000. cDNAcloning and characterization of vascular apoptosis-inducing protein 1. Biochem. Biophys. Res. Commun. 278, 197-204.
【非特許文献3】Maruyama, J., Hayashi, H., Miao, J., Sawada, H., Araki, S., 2005.Severe cell fragmentation in the endothelial cell apoptosis induced by snakeapoptosis toxin VAP1 is an apoptotic characteristic controlled by caspases. Toxicon 46, 1-6.
【非特許文献4】Kikushima, Y.,Nakamura, S., Ohshima, Y., Shibuya, T., Miao, J.Y., Hayashi, H., Nikai, T., Araki, S., 2008. Hemorrhagic activity of thevascular apoptosis-inducing proteins VAP1 and VAP2 from Crotalus atrox.Toxicon 52, 589-593.
【発明の開示】
【発明が解決しようとする課題】
【0007】
ADAMは種々の疾患に関与していることが明らかになっておりADAM阻害剤による当該疾患の治療が行われているが、従来のADAM阻害剤では以下のような問題があった。
【0008】
なお、本願において、ADAMのメタロプロテアーゼ部位によるプロテアーゼ反応をシグナル伝達の過程に含むシグナル伝達系をADAMシグナル伝達系と称する。当該ADAMシグナル伝達系は、ADAMを投与・導入等することで引き起こされるシグナルの伝達系も含む。ADAMの上流とは、ADAMシグナル伝達系において、ADAMによるプロテアーゼ反応より前の段階を指す。同様にADAMの下流とは、ADAMによるプロテアーゼ反応より後の段階を指す。
【0009】
まず、標的となるADAMのメタロプロテアーゼ部位は、MMP等の他の蛋白質のメタロプロテアーゼ部位と非常に相同性が高く、ADAMのメタロプロテアーゼ特異的阻害剤の創製は困難であった。その一方で、各メタロプロテアーゼ部位を有する蛋白質は生体内における発現部位、量、時期等が厳密に調節され、恒常性が維持されている。
【0010】
ADAMのメタロプロテアーゼ部位の直接的な阻害剤としては、例えば上記特許文献1に開示されているヒドロキサム酸のような金属イオンキレート部を含むペプチド様構造を持つ化合物がある。当該直接的な阻害剤は、ADAMのメタロプロテアーゼ部位のみでなくMMP等の他の蛋白質のメタロプロテアーゼ部位にも直接的に作用するため当該他の蛋白質の働きが阻害されてしまい、副作用が大きいという問題があった。
【0011】
ADAMの間接的な阻害剤としては、例えば上記特許文献2及び特許文献3に記載のADAM阻害剤がある。これらはTNF−αの遊離阻害効果を評価したものであり、ADAMの上流のシグナル伝達を阻害するものである。このようなADAMの上流のシグナル伝達を阻害する場合、ADAMの直接作用の一つである細胞増殖因子の遊離が抑制され、正常の細胞増殖を抑制するなどの副作用が起こるという問題があった。
【0012】
以上のように、従来、ADAMの下流に働きかけてADAM作用を阻害するという阻害剤の開示はなかった。また、ヘビ毒が引き起こす出血に関しては、メタロプロテアーゼが血管蛋白質を分解することが原因と考えられてきた。
【0013】
上述の問題を解決するため鋭意研究を重ねた結果、本願発明者は、ガラガラヘビ毒が引き起こす出血は単に血管を構成する蛋白質の分解によって引き起こされるのではなく、ADAMのホモログであるVAPの関与するシグナル伝達の結果であることを突き止めた。このことから、例えば、ADAMシグナル伝達系によるシグナル伝達の結果である複数の作用は、ADAMの下流のシグナル伝達系の制御によりそれぞれ別個に阻害することができると推測された。そして、本願発明者はADAMの下流のシグナル伝達を阻害する物質を見出し、更には、ADAM作用を特異的に阻害する物質を見出した。即ち、ADAM上流のシグナル伝達を阻害せず、また、MMP等の他の蛋白質のメタロプロテアーゼ部位の活性を残存させたままADAMの作用を阻害できることを見出した。
【0014】
また、本願発明者はVAP1、VAP2の引き起こすアポトーシスについての研究を重ねていく上で、VAPの引き起こすアポトーシスにおいては仮足が保持されるという興味深い知見を得た。ゆえに、ADAMは、仮足についての研究、特に仮足の制御物質のスクリーニングにも有用であることを見出した。
【0015】
本願発明者はこれらの研究に基づき、本発明を完成させた。そこで、ADAM作用阻害物質のスクリーニング方法、仮足の保持方法、仮足保持剤、仮足の制御物質のスクリーニング方法、及びADAM作用阻害剤を提供することを本発明が解決すべき課題とする。
【0016】
なお、本願においてADAMの作用(以下、ADAM作用とも称する)とは、第1に、ADAMシグナル伝達系によるシグナル伝達の結果である作用を指す。例えば、上述のADAMのホモログであるVAP1及びVAP2においては、「激しいアポトーシス小胞の生成」や「仮足の保持」はADAMの作用に該当する。後述の通り、VAP1及びVAP2をマウス皮内に投与すると投与部位において出血が引き起こされるが、「出血」もADAMの作用に該当する。第2に、ADAMの量や活性の変化に起因する場合は、シグナル伝達系におけるシグナルの増幅や減少により引き起こされる作用も含む。また、VAP1及びVAP2はヘビ毒に由来する物質であるので、「激しいアポトーシス小胞の生成」や「仮足の保持」はヘビ毒の作用でもある。
【0017】
本願発明においてADAMの作用の阻害(以下、ADAM作用阻害とも称する)とは、1以上のADAM作用を阻害することに加え、ADAM作用を軽減・抑制することを含む概念である。同様にヘビ毒の作用の阻害とは、1以上のヘビ毒の作用を阻害することに加え、ヘビ毒の作用を軽減・抑制することを含む概念である。
【課題を解決するための手段】
【0018】
(第1発明)
上記課題を解決するための本願第1発明の構成は、
以下のa)工程とb)工程からADAMのプロテアーゼの反応進行が確認され、かつ、以下のa)工程とc)工程からADAM作用の阻害が確認された物質をADAM作用阻害物質と判定する、ADAM作用阻害物質のスクリーニング方法である。
a)ADAMのプロテアーゼ活性を備え又はADAMのプロテアーゼ活性を備えさせる検体にスクリーニング対象物質を投与又は導入する工程。
b)上記a)工程によってADAMのプロテアーゼ活性及びスクリーニング対象物質を備えた検体において、ADAMのプロテアーゼの反応進行を確認する工程。
c)上記a)工程によってADAMのプロテアーゼ活性及びスクリーニング対象物質を備えた検体において、ADAM作用の阻害を確認する工程。
【0019】
第1発明はa)〜c)の各工程を少なくとも1回ずつ含むものであればよい。例えば、a)、b)、c)又はa)、c)、b)の順序で各工程を行い、そのa)及びb)工程からADAMのプロテアーゼの反応進行を確認し、a)及びc)工程からADAM作用の阻害を確認しても良い。また、実験系を2つに別け、a)とb)工程からADAMのプロテアーゼの反応進行を確認し、a)とc)工程からADAM作用の阻害を確認し、これらの結果を総合してADAM作用阻害物質を判定しても良い。
【0020】
(第2発明)
上記課題を解決するための本願第2発明の構成は、
前記a)工程における検体が、細胞、器官、組織、又は個体であって、c)工程におけるADAM作用の阻害が、仮足の保持阻害又は仮足の形成阻害である、第1発明に記載のADAM作用阻害物質のスクリーニング方法である。
【0021】
(第3発明)
上記課題を解決するための本願第3発明の構成は、
前記a)工程における検体が、器官、組織、又は個体であって、c)工程におけるADAM作用の阻害が、出血の阻害である、第1発明に記載のADAM作用阻害物質のスクリーニング方法である。
【0022】
(第4発明)
上記課題を解決するための本願第4発明の構成は、
前記ADAM作用阻害物質のスクリーニング方法が、前記a)工程と以下のd)工程からADAM特異性を確認することを含む、第1発明〜第3発明のいずれかに記載のADAM作用阻害物質のスクリーニング方法である。
d)スクリーニング対象物質が投与又は導入された検体におけるADAMではないプロテアーゼのプロテアーゼ活性の残存を確認する工程。
【0023】
第4発明は、a)〜d)の各工程を少なくとも1回ずつ含むものであればよい。例えば、a)工程の後、b)〜d)の各工程を順序不同で行い、そのa)及びb)工程からADAMのプロテアーゼの反応進行を確認し、a)及びc)工程からADAM作用の阻害を確認し、a)及びd)工程からADAM特異性を確認しても良い。また、実験系を複数に別けてもよいことは、上述の第1発明と同様である。
【0024】
(第5発明)
上記課題を解決するための本願第5発明の構成は、仮足を形成可能である検体に対して、ヘビ毒を用いる仮足の保持方法である。
【0025】
(第6発明)
上記課題を解決するための本願第6発明の構成は、ヘビ毒を有効成分とする仮足保持剤である。
【0026】
(第7発明)
上記課題を解決するための本願第7発明の構成は、
以下のe)及びf)の各工程を順序不同で含む処理工程を行い、その後以下のg)工程を含む確認工程により仮足の制御が確認された物質を仮足の制御物質と判定する、仮足の制御物質のスクリーニング方法である。
e)検体である細胞、器官、組織、又は個体にヘビ毒を投与又は導入する工程。
f)検体である細胞、器官、組織、又は個体にスクリーニング対象物質を投与又は導入する工程。
g)仮足の制御を確認する工程。
【0027】
第7発明はe)〜g)の各工程を少なくとも1回ずつ含むものであればよい。処理工程は、e)及びf)工程を同時に行っても良いし、いずれか一方を先に行い、他の一方を後に行ってもよい。検体にはヘビ毒及びスクリーニング対象物質が投与又は導入される。
【0028】
(第8発明)
上記課題を解決するための本願第8発明の構成は、
イソキノリン骨格に対して、リンカーを介在させて又は介在させずに、アルキルポリアミン又はその誘導体における一個のアミノ基を構成する窒素原子が結合した構造を有する化合物及びその塩から選ばれる1種以上を有効成分として含有する、ADAM作用阻害剤である。
【0029】
(第9発明)
上記課題を解決するための本願第9発明の構成は、
前記リンカーが、硫黄又はりんのオキソ酸から選ばれるものである、第8発明に記載のADAM作用阻害剤である。
【0030】
(第10発明)
上記課題を解決するための本願第10発明の構成は、
前記リンカーが、あるいはリンカーが介在しない場合にはアルキルポリアミン又はその誘導体が、イソキノリン骨格の5位の炭素原子に結合している、第8発明又は第9発明に記載のADAM作用阻害剤である。
【0031】
(第11発明)
上記課題を解決するための本願第11発明の構成は、
前記ADAM作用阻害剤の有効成分である化合物が、下記一般式(I)で示される構造を有する化合物である、第8発明〜第10発明のいずれかに記載のADAM作用阻害剤である。
〔一般式(I)〕

[一般式(I)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;
R1は以下の(イ)又は(ロ)を示し;
(イ)水素、ハロゲン、水酸基、チオール基、アルデヒド基、カルボキシル基、シアノ基又はニトロ基。
(ロ)炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基であって、これらの基は炭素数1〜5の直鎖の又は分岐を有する飽和又は不飽和のものであり、かつハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
R2は炭素数1〜5の直鎖の又は分岐を有する飽和又は不飽和炭化水素基を示し;
R3は下記一般式(II)、一般式(III)又は一般式(IV)で示される置換基を示す。
〔一般式(II)〕

(一般式(II)中、R4及びR5はそれぞれ以下の(ハ)〜(ヘ)のいずれかを示し、R4とR5は同一であってもよく、相違していてもよい。
(ハ)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基もしくはフラニル基。
(ニ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(ホ)置換基を有し又は有さないアリール基、ナフチル基もしくはアントラセニル基。
(ヘ)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜20の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(ホ)及び(ヘ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基であり、
その中でも、(ホ)にいう「置換基」では、上記の選択肢に加え、更に、炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基、チオエステル基が含まれ、これらの基は、炭素数1〜5であり、飽和又は不飽和の直鎖状又は分岐状であり、かつ、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化、又はニトロ化されていてもよい。)
〔一般式(III)〕

(一般式(III)中、R6及びR7はそれぞれ、R6とR7が1以上の箇所で互いに結合を形成できる、一般式(II)におけるR4、R5が選択しうる基を示す)。
〔一般式(IV)〕

(一般式(IV)中、R8は以下の(ト)〜(リ)のいずれかを示す。
(ト)水素、ハロゲン、水酸基、チオール基、ピリジル基、ピロリジニル基、チエニル基、もしくはフラニル基。
(チ)置換基を有し又は有さないアリール基、ナフチル基、もしくはアントラセニル基。
(リ)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜20の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(チ)及び(リ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基であり、
その中でも、(チ)にいう「置換基」では、上記の選択肢に加え、更に、炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基及びチオエステル基が含まれ、これらの基は、炭素数1〜5であり、飽和又は不飽和の直鎖状又は分岐状であり、かつ、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化、又はニトロ化されていてもよい。)]
【0032】
(第12発明)
上記課題を解決するための本願第12発明の構成は、
イソキノリン骨格に対して、リンカーを介在させて又は介在させずに、互いに1位と4位の関係にある2個の窒素原子を含む含窒素6員環構造体又はその誘導体の一方の前記窒素原子が結合した構造を有する化合物及びその塩から選ばれる1種以上を有効成分として含有する、ADAM作用阻害剤である。
【0033】
(第13発明)
上記課題を解決するための本願第13発明の構成は、
前記リンカーが、硫黄又はりんのオキソ酸から選ばれるものである、第12発明に記載のADAM作用阻害剤である。
【0034】
(第14発明)
上記課題を解決するための本願第14発明の構成は、
前記リンカーが、あるいはリンカーが介在しない場合には前記含窒素6員環構造体又はその誘導体が、イソキノリン骨格の5位の炭素原子に結合している、第12発明又は第13発明に記載のADAM作用阻害剤である。
【0035】
(第15発明)
上記課題を解決するための本願第15発明の構成は、
前記ADAM作用阻害剤の有効成分である化合物が、下記一般式(V)で示される構造を有する化合物である、第12発明〜第14発明のいずれかに記載のADAM作用阻害剤である。
〔一般式(V)〕

[一般式(V)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;
R11は下記一般式(VI)、一般式(VII)又は一般式(VIII)で示される置換基を示す。
〔一般式(VI)〕

(一般式(VI)中、R21〜R29は単結合でも、以下に挙げる二重結合であってもよく、R21〜R29が単結合で結合している場合は、R21〜R29はそれぞれ以下の(い)〜(は)のいずれかを示し、R21〜R29はそれぞれ互いに同一であってもよく、相違していてもよい。
(い)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、もしくはニトロ基。
(ろ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(は)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜10の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
R21とR22、R23とR24、R26とR27、R28とR29が二重結合で結合している場合は、R21とR22、R23とR24、R26とR27、R28とR29はそれぞれ以下の(に)〜(ほ)のいずれかを示し、R21とR22、R23とR24、R26とR27、R28とR29はそれぞれ互いに同一であってもよく、相違していてもよい。
(に)オキソ基もしくはチオキシ基。
(ほ)置換基を有し又は有さないヒドロキシイミノ基もしくはヒドラゾノ基。
なお、(は)及び(ほ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、又はカルボキシル基である。)
〔一般式(VII)〕

(一般式(VII)中、R31〜R37は単結合でも、以下に挙げる二重結合であってもよく、R31〜R37が単結合で結合している場合は、R31〜R37はそれぞれ上記一般式(VI)における(い)〜(は)のいずれかを示し、R31〜R37はそれぞれ互いに同一であってもよく、相違していてもよい。
R34とR35、R36とR37が二重結合で結合している場合は、R34とR35、R36とR37はそれぞれ上記一般式(VI)における(に)〜(ほ)のいずれかを示し、R34とR35、R36とR37は同一であってもよく、相違していてもよい。
なお、「置換基」に関しても上記一般式(VI)と同様である。)
〔一般式(VIII)〕

(一般式(VIII)中、R41〜R45はそれぞれ、上記一般式(VI)における(い)〜(は)のいずれかを示し、R41〜R45はそれぞれ互いに同一であってもよく、相違していてもよい。
なお、「置換基」に関しても上記一般式(VI)と同様である。)]
【0036】
(第16発明)
上記課題を解決するための本願第16発明の構成は、
第1発明〜第4発明のいずれかに記載のADAM作用阻害物質のスクリーニング方法を用いて選抜される物質が、下記一般式(IX)又は一般式(X)に該当する化合物であり、これらの化合物及びその塩から選ばれる1種以上を有効成分として含有する、ADAM作用阻害剤である。
〔一般式(IX)〕

(一般式(IX)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;R51及びR52はそれぞれ水素又は任意の置換基である。)
〔一般式(X)〕

(一般式(X)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;R61〜R69はそれぞれ水素又は任意の置換基である。)
【発明の効果】
【0037】
(第1発明)
第1発明によって、ADAMの下流に働きかけてADAM作用を阻害する物質のスクリーニング方法が提供される。
【0038】
(第2発明)
第2発明によって、仮足の保持阻害又は仮足の形成阻害活性を指標としたADAM作用阻害物質のスクリーニング方法が提供される。ADAMのホモログであるVAPは血管内皮細胞に対してアポトーシスを引き起こし、当該アポトーシスにおいては仮足が形成・保持される。よって、仮足の形成、仮足の保持はADAM作用であるので、仮足の保持阻害、仮足の形成阻害をする物質は、ADAM作用を阻害する物質である。
【0039】
(第3発明)
第3発明によって、出血の阻害、特に血液凝固系ではなく血管に働きかけることによる出血の阻害活性を指標としたADAM作用阻害物質のスクリーニング方法が提供される。ADAMのホモログであるVAPは細胞間マトリックスであるコラーゲンは分解しないが、血管内皮細胞のアポトーシスを誘導する。更に、従来はプロテアーゼが血管蛋白質を分解することにより出血すると考えられてきたのであるが、VAPのプロテアーゼ反応は進行しても出血は抑止されるという本願発明者による新たな知見により、ADAM下流の信号伝達系が出血、特に血管に原因を有する出血に関与することが明らかとなった。よって、血管に原因を有する出血はADAM作用であるので、ADAM下流に働きかけ、かつ、出血を阻害する物質は、ADAM作用を阻害する。
【0040】
(第4発明)
第4発明によって、ADAM特異性のあるADAM作用阻害物質のスクリーニング方法が提供される。従来から、ADAMのメタロプロテアーゼ特異的阻害剤の創製は困難であったが、ADAM下流に働きかけてADAM作用を阻害し、かつ、ADAM特異性を有する物質は、ADAMのメタロプロテアーゼ特異的阻害剤に近似した効果を有することが期待できる。言い換えれば、ADAMではないプロテアーゼのプロテアーゼ活性が残存することは副作用が少ないことを意味する。
【0041】
(第5発明、第6発明)
第5発明によって、有用な仮足の保持方法が提供される。また、第6発明によって、有用な仮足保持剤が提供される。
本願発明者はヘビ毒の引き起こすアポトーシスにおいては、仮足の形成の他、仮足が保持されることを見出し、この点に特に着目した。通常、仮足は動的に形成・消失等の変化をする。仮足の静的な状態を作り出すことにより、仮足の構造の研究や、仮足を維持することの効果の研究、仮足の制御剤の開発等の途が提供される。
ヘビ毒の他、ADAMを用いても仮足の形成、仮足の保持がされる。よって、ADAMを用いた場合でも、ヘビ毒を用いた場合と同様の効果が得られる。
【0042】
(第7発明)
第7発明によって、有用な仮足の制御物質のスクリーニング方法が提供される。仮足は動的に形成・消失等の変化をするが、ヘビ毒は仮足を保持する、即ち、仮足の静的な状態を作り出すことができる。これにより、まず、制御物質のスクリーニング系を長時間安定して保つことが可能となる。更に、当該静的な状態からの変化は、スクリーニング対象物質が有する仮足の制御効果として認識することができる。
ヘビ毒の他、ADAMを用いても仮足の形成、仮足の保持がされる。よって、ADAMを用いた場合でも、ヘビ毒を用いた場合と同様の効果が得られる。
【0043】
(第8発明〜第11発明、第12発明〜第15発明及び第16発明)
本願第8発明〜第11発明、第12発明〜第15発明及び第16発明によって、有用なADAM作用阻害剤が提供される。これらのADAM作用阻害剤は、ADAMのプロテアーゼ反応を阻害せずにADAMの作用を阻害する。即ち、ADAMの下流のシグナル伝達に働きかけると考えられえる。これによって従来のADAM阻害剤における副作用の問題が解消される。
更には、MMP等の他の蛋白質のプロテアーゼ活性が残存する場合は、特異性の高いADAM阻害剤が提供される。
その他、従来有効なADAM阻害剤が殆ど提供されていなかったため、ADAMの関与が示唆されながらも見出されていなかったヘビ咬症出血阻害剤などのように、ADAM作用が関与する疾患において従来に治療薬が存在しなかった疾患に対する治療薬が提供される。
【図面の簡単な説明】
【0044】
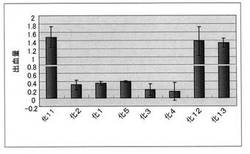
【図1】化1〜5及び化11〜13についての出血量を、コントロールに対する相対比で示す棒グラフである(コントロールの表示は省略)。
【図2】化14及び化15についての出血量を、コントロールに対する相対比で示す棒グラフである。
【図3】化11及び化16〜化19についての出血量を、コントロールに対する相対比で示す棒グラフである。
【図4】化4及び化3の投与結果を示す写真である。
【図5】化11及び化16〜化19の投与結果を示す写真である。
【図6】VAPの反応進行に対して、化4が与える影響を調べた結果を示す。
【図7】生存因子除去によるアポトーシス及びヘビ毒ADAMによる仮足の保持の過程を経時的に示す。
【図8】化6の影響を示す写真である。
【図9】VAP1はコラーゲンを分解しないことを示す。
【図10】ヘビ毒ADAMが引き起こす出血についての、推測モデルを示す。
【図11】コラゲナーゼの作用に対する、ADAM作用阻害物質の影響を示す。
【図12】ヘビ毒による突起状の仮足の形成・保持と、化2による仮足の形成抑制を示す。
【発明を実施するための形態】
【0045】
次に、本発明を実施するための形態を、その最良の形態を含めて説明する。
【0046】
〔ADAM作用阻害物質のスクリーニング方法〕
本発明のADAM作用阻害物質のスクリーニング方法は、以下のa)工程とb)工程からADAMのプロテアーゼの反応進行が確認され、かつ、以下のa)工程とc)工程からADAM作用の阻害が確認された物質をADAM作用阻害物質と判定するものである。
a)ADAMのプロテアーゼ活性を備え又はADAMのプロテアーゼ活性を備えさせる検体にスクリーニング対象物質を投与又は導入する工程。
b)上記a)工程によってADAMのプロテアーゼ活性及びスクリーニング対象物質を備えた検体において、ADAMのプロテアーゼの反応進行を確認する工程。
c)上記a)工程によってADAMのプロテアーゼ活性及びスクリーニング対象物質を備えた検体において、ADAM作用の阻害を確認する工程。
【0047】
本発明のADAM作用阻害物質のスクリーニング方法において、検体は特に限定されない。細胞、器官、組織、又は個体を含む他、ADAMシグナル伝達系を構築又は再現したin vitro の系も検体とすることができる。これらのうち、細胞、器官、組織、個体を好ましい検体として例示でき、細胞、個体を更に好ましい検体として例示できる。
【0048】
細胞は特に限定されないが、血管内皮細胞、白血球細胞等を例示することができる。
【0049】
器官は特に限定されないが、血管、脳、肝臓、肺等を例示することができる。
【0050】
組織は特に限定されないが、上皮組織、結合組織、筋組織等を例示することができる。
【0051】
個体は特に限定されないが、マウス、ラット、ヒト等を例示することができる。
後述のように仮足がポドソームを伴う仮足である場合、検体としては、白血球、マクロファージ、血管内皮細胞、破骨細胞、であることが好ましく、血管内皮細胞、マクロファージ、であることがより好ましい。
【0052】
上記した検体は、ADAMのプロテアーゼ活性を備え又はADAMのプロテアーゼ活性を備えさせることが必要となる。言い換えれば、検体はADAMのプロテアーゼ活性を有することが必要であるが、検体へのスクリーニング対象物質の投与や導入と、検体がADAMのプロテアーゼ活性を備えることの順序は特に限定されない。
【0053】
検体がADAMのプロテアーゼ活性を備える方法は特に限定されない。検体にADAMそのものを添加、混合しても良いし、投与しても良いし、遺伝子発現を利用して検体にADAMを導入しても良い。検体そのものがADAMのプロテアーゼ活性を有し、ADAM作用が備わっている場合は特に検体を操作する必要はない。
【0054】
ADAMは特に限定されないが、ヘビ毒ADAM、ヒトADAM、マウスADAMを例示することができ、ヘビ毒ADAM、ヒトADAMを好ましく例示することができ、ヘビ毒ADAMにおいても出血性ヘビ毒ADAMを特に好ましく例示することができる。ヘビ毒ADAMは、VAP1及びVAP2等の出血性ヘビ毒素を含む概念である。
【0055】
ADAM作用は特に限定されないが、出血、血管退縮、仮足の形成、仮足の保持、激しいアポトーシス小胞の生成などを例示することができる。
【0056】
ADAM作用の阻害は特に限定されないが、出血阻害、血管強化、仮足の形成阻害、仮足の保持阻害、アポトーシス抑制などを例示することができる。出血阻害、仮足の保持阻害、仮足の形成阻害を好ましく例示することができ、出血阻害、仮足の保持阻害を特に好ましく例示することができる。
【0057】
仮足とは、細胞質の突出によって形成される部位をいう。通常、仮足は動的に形成・消失等の変化をする。仮足は、ポドソームを伴う仮足となる場合がある。ポドソームは浸潤のためにプロテアーゼの放出を行うことが知られている。
【0058】
仮足の形成阻害とは、仮足を形成しないということの他、形成される仮足の数、仮足の伸張・拡大の抑制を含む概念である。
【0059】
仮足の保持とは、形成された仮足が突出を維持すること、及び仮足の形成されている時間が長期化することを含む概念である。生存因子の除去により引き起こされるアポトーシスにおいては、アポトーシスが始まると仮足が形成される一方で、仮足は形成後1時間で消失してしまう。一方、ヘビ毒においては、一度形成された仮足が1時間のみならず6時間を越えても保持される。即ち、仮足の保持は、仮足の形成されている時間が長期化することを含む。
【0060】
仮足の保持阻害とは、形成された仮足が突出を維持すること、及び仮足の形成されている時間が長期化することの阻害を指す。即ち、保持阻害の結果、仮足は再び動的な変化を見せることとなる。ADAM作用阻害物質をスクリーニングする観点からは、仮足の保持が阻害された結果、仮足が結果的に消失していくことが好ましい。
【0061】
ADAM作用阻害物質のスクリーニング方法においては、スクリーニング系のコントロールの仮足の保持は、少なくとも1時間あれば良い。例えば、ヘビ毒ADAM、VAP1又はVAP2を用いることによって実現できる。仮に、スクリーニング対象物質の影響で仮足が保持時間の経過前、上記の例であれば1時間以内に消失すれば、仮足の保持阻害であるとすることができる。一方、後述の仮足保持方法、仮足保持剤に関しては、保持時間が1時間以上であることが好ましく、更に、3時間以上、6時間以上、24時間以上など、保持時間が長いことがより好ましい。仮足の保持時間は、実質的なADAMの投与量により調節可能である。
【0062】
当該仮足の形成や保持の阻害を確認する方法としては、顕微鏡を用いた経時観察が例示できる。例えば、培養細胞にVAPを投与した場合は当該細胞の挙動を観察すればよいし、個体であるマウスにVAPを投与してADAMのプロテアーゼ活性を備えさせた場合、VAPの投与部位を切除して、当該切除部位を顕微鏡を用いて観察することにより、仮足の形成阻害又は仮足の保持阻害を確認することができる。
【0063】
ADAM作用の阻害が、出血の阻害である場合、出血の阻害とは、出血を未然に防ぐ他、出血量を抑制する等、出血を抑える概念を含むものである。この場合、検体をマウスを含む個体とすることが特に好ましい。出血阻害の判定については、例えば後述の実施例に記載の方法が好ましい。出血の阻害活性を指標とする場合、スクリーニング対象物質投与区とコントロール区を分けることが好ましい。また、スクリーニング対象物質とADAMのプロテアーゼ活性の具備はほぼ同時であることが好ましい。
【0064】
即ち、ADAM作用阻害物質は、出血阻害物質、血管強化物質、仮足の形成阻害物質、仮足の保持阻害物質、アポトーシス小胞形成阻害物質などを含む概念である。
【0065】
スクリーニング対象物質は特に限定されない。好ましくは、化合物、蛋白質、核酸、抗体、抗原、糖質脂質等を例示することができ、更に好ましくは、化合物、蛋白質、核酸、抗体を例示することができ、特に好ましくは化合物、蛋白質を例示することができる。
【0066】
これらスクリーニング対象物質を投与・導入する方法も特に限定されない。投与においては、添加、混合、経口投与、経皮投与、血管投与、皮下注射、腹腔内投与、皮内注射、筋肉注射を例示することができ、導入においては、検体に遺伝子を備えさせ、又は予め備えている遺伝子を用いて、スクリーニング対象物質を発現させたり、代謝などにより生産させたりすることもできる。
【0067】
ADAMのプロテアーゼの反応進行を確認する方法は特に限定されない。好ましくは、プロテアーゼ反応の結果物を検出する方法、プロテアーゼ反応の基質の減少を確認する方法などを例示することができる。
【0068】
本発明のADAM作用阻害物質のスクリーニング方法は更に、前記a)工程と以下のd)工程からADAM特異性を確認することを含むものとしても良い。
d)スクリーニング対象物質が投与又は導入された検体におけるADAMではないプロテアーゼのプロテアーゼ活性の残存を確認する工程。
【0069】
ADAM以外のプロテアーゼのプロテアーゼ活性の残存とは、当該プロテアーゼ活性が弱まることを含む概念であるが、活性が消失することは含まない。
【0070】
上記ADAM以外のプロテアーゼは特に限定されないが、MMP、コラゲナーゼ、アグリカナーゼ、エラスターゼ等を好ましく例示することができる。また、検体はこれらの酵素のいずれか1以上を備えることが好ましい。
【0071】
〔仮足の保持方法、仮足保持剤〕
本発明の仮足の保持方法、仮足保持剤はADAMを用いる。検体にADAMそのものを添加、混合しても良いし、投与しても良いし、遺伝子発現を利用して検体にADAMを導入しても良い。ADAMは特に限定されないが、ヘビ毒ADAM、ヒトADAM、マウスADAMを例示することができ、ヘビ毒ADAM、ヒトADAMを好ましく例示することができる。ヒトADAMとしては、ADAM28、ADAM12、ADAM9が好ましく、ADAM28がより好ましい。
本発明の仮足の保持方法、仮足保持剤はポドソームを伴う仮足を形成・保持する場合がある。ポドソームは浸潤のためにプロテアーゼの放出を行うことが知られている。ポドソームを伴う仮足の構造の研究や、仮足を維持することの効果の研究、仮足の制御剤の開発等の途も提供される。
【0072】
ヘビ毒は特に限定されないが、出血性ヘビ毒が好ましい。出血性ヘビ毒としては、ガラガラヘビ毒、ハブ毒、マムシ毒等を好ましく例示することができ、ガラガラヘビ毒を特に好ましく例示することができる。更に、当該ヘビ毒は、出血性ヘビ毒素であるVAP1及びVAP2を含む概念である。
【0073】
ヘビ毒は、ガラガラヘビ等の個体であるヘビから取得しても良いし、市販品であるヘビ毒を購入しても良い。また、VAP1及びVAP2は、ガラガラヘビ毒(購入元:Sigma、和光純薬など)から上記した非特許文献4に記載の方法により取得することができる。ヒトADAMはEnzo Life Sciences、R&D Systemsなどから入手可能である。
【0074】
仮足、仮足の保持については、上記ADAM作用阻害物質のスクリーニング方法に記載の内容と同様である。
【0075】
仮足を形成可能である検体は特に限定されないが、細胞を有する検体であることが好ましく、細胞、器官、組織、個体を例示することができる。これらについては、上記ADAM作用阻害物質のスクリーニング方法に記載の内容と同様である。ポドソームを伴う仮足の保持方法とする場合、検体としては、白血球、マクロファージ、血管内皮細胞、破骨細胞、であることが好ましく、血管内皮細胞、マクロファージ、であることがより好ましい。
【0076】
〔仮足の制御物質のスクリーニング方法〕
本発明の仮足の制御物質のスクリーニング方法は、以下のe)及びf)の各工程を順序不同で含む処理工程を行い、その後以下のg)工程を含む確認工程により仮足の制御が確認された物質を仮足の制御物質と判定するものである。
e)検体である細胞、器官、組織、又は個体にADAMを投与又は導入する工程。
f)検体である細胞、器官、組織、又は個体にスクリーニング対象物質を投与又は導入する工程。
g)仮足の制御を確認する工程。
【0077】
仮足、細胞、器官、組織、個体、ADAM、スクリーニング対象物質、投与、導入に関しては、上記ADAM作用阻害物質のスクリーニング方法に記載の内容と同様である。ヘビ毒に関しては、上記仮足の保持方法、仮足保持剤に記載の内容と同様である。なお、検体としては細胞又は個体が好ましく、細胞が特に好ましい。当該細胞は、仮足を形成可能であることが要件であるが、その能力は潜在的に備えていれば足りる。
加えて、仮足は、ポドソームを伴う仮足であることが好ましい。検体は、ポドソームを伴う仮足を形成できることが好ましい。白血球、マクロファージ、血管内皮細胞、破骨細胞、であることが好ましく、血管内皮細胞、マクロファージ、であることがより好ましい。ヒトADAMを用いる場合は、ADAM28、ADAM12、ADAM9、が好ましく、ADAM28、ADAM12がより好ましい。ヒトADAMはEnzo Life Sciences、R&D Systemsなどから入手可能である。
【0078】
仮足の制御とは、動的に形成・消失等の変化をする仮足の、当該動的な変化を制御することを指す。好ましくは、仮足の形成阻害、仮足の保持阻害、仮足の伸張・変形や消失、仮足の接着性の変化等を例示することができる。
【0079】
即ち、仮足の制御物質とは、仮足の動的な変化を制御する物質である。例えば、仮足の形成阻害物質、仮足の保持阻害物質、仮足の伸張物質、仮足の変形物質、仮足を消失させる物質、仮足の接着性を変化させる物質等を例示することができる。
【0080】
当該仮足の制御を確認する方法としては、上述のような顕微鏡を用いた経時観察が例示できるほか、抗体による仮足保持細胞の検出(染色・フローサイトメトリー含む)、酵素学的検出等によっても確認することができる。アクチン染色、フォスファチジルイノシトール2リン酸(PIP2)抗体染色、を例示することができる。
【0081】
〔ADAM作用阻害剤〕
ADAM作用阻害剤は特に限定されないが、出血阻害剤、血管強化剤、仮足の形成阻害剤、仮足の保持阻害剤を例示することができ、出血阻害剤、仮足の形成阻害剤、仮足の保持阻害剤のいずれかを好ましく例示できる。出血阻害剤としては、抗出血性ヘビ毒咬症剤を好ましく例示できる。
【0082】
塩は特に限定されないが、薬学的に許容される塩が好ましい。薬学的に許容される塩は、アルカリ金属塩(例えば、リチウム塩、ナトリウム塩、カリウム塩)、アルカリ土類金属塩(例えば、マグネシウム塩、カルシウム塩)、アンモニウム塩、コリン塩、有機アミン塩、鉄塩、亜鉛塩、銅塩、マンガン塩、アルミニウム塩等が挙げられる。このうち、アルカリ金属塩、アルカリ土類金属塩、アンモニウム塩、コリン塩、有機アミン塩が好ましい。さらに、ナトリウム塩、カリウム塩、カルシウム塩、アンモニウム塩、コリン塩、有機アミン塩が特に好ましい。
【0083】
本発明のADAM作用阻害剤は、イソキノリン骨格に対して、リンカーを介在させて又は介在させずに、アルキルポリアミン又はその誘導体における一個のアミノ基を構成する窒素原子が結合した構造を有する化合物及びその塩から選ばれる1種以上を有効成分として含有するものである。
【0084】
アルキルポリアミン及びその誘導体は、2以上のアミノ基を有している。即ち、ここにいう「ポリ」とは「2以上」の意味である。また、アミノ基は、置換基を有するアミノ基を含む概念である。
【0085】
イソキノリン骨格は、少なくともイソキノリンを有し、当該骨格におけるイソキノリンに対して、アルキルポリアミン、アルキルポリアミン誘導体、又はそれらのいずれかが結合したリンカー、が結合する。
【0086】
イソキノリンの5位は、後述する一般式(I)においてXが結合している部位である。
【0087】
リンカーは特に限定されないが、硫黄又はりんのオキソ酸から選ばれるものが好ましい。硫黄(S)又はりん(P)のオキソ酸は特に限定されず、硫酸、スルフィン酸、スルフェン酸、りん酸、亜りん酸などを含む。これらがリンカーとなる場合は、硫黄原子(S)、りん原子(P)又は酸素原子(O)がアルキルポリアミン又はその誘導体、及びイソキノリン骨格と結合する。例えば、スルフェン酸がリンカーであれば、−SO2−となりスルフェン酸の硫黄原子がアルキルポリアミン又はその誘導体とイソキノリン骨格とを結ぶ。
【0088】
更に、ADAM作用阻害剤の有効成分である化合物が、下記一般式(I)で示される構造を有する化合物であることが好ましい。
〔一般式(I)〕

[一般式(I)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;
R1は以下の(イ)又は(ロ)を示し;
(イ)水素、ハロゲン、水酸基、チオール基、アルデヒド基、カルボキシル基、シアノ基又はニトロ基。
(ロ)炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基であって、これらの基は炭素数1〜5の直鎖の又は分岐を有する飽和又は不飽和のものであり、かつハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
R2は炭素数1〜5の直鎖の又は分岐を有する飽和又は不飽和炭化水素基を示し;
R3は下記一般式(II)、一般式(III)又は一般式(IV)で示される置換基を示す。
〔一般式(II)〕

(一般式(II)中、R4及びR5はそれぞれ以下の(ハ)〜(ヘ)のいずれかを示し、R4とR5は同一であってもよく、相違していてもよい。
(ハ)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基もしくはフラニル基。
(ニ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(ホ)置換基を有し又は有さないアリール基、ナフチル基もしくはアントラセニル基。
(ヘ)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜20の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(ホ)及び(ヘ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基であり、
その中でも、(ホ)にいう「置換基」では、上記の選択肢に加え、更に、炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基、チオエステル基が含まれ、これらの基は、炭素数1〜5であり、飽和又は不飽和の直鎖状又は分岐状であり、かつ、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化、又はニトロ化されていてもよい。)
【0089】
上記(ヘ)において、「置換基を有し又は有しない・・・飽和又は不飽和の」は、それに続く「炭化水素基、・・・もしくはチオエステル基」に係る。
【0090】
〔一般式(III)〕

(一般式(III)中、R6及びR7はそれぞれ、R6とR7が1以上の箇所で互いに結合を形成できる、一般式(II)におけるR4、R5が選択しうる基を示す)。
〔一般式(IV)〕

(一般式(IV)中、R8は以下の(ト)〜(リ)のいずれかを示す。
(ト)水素、ハロゲン、水酸基、チオール基、ピリジル基、ピロリジニル基、チエニル基、もしくはフラニル基。
(チ)置換基を有し又は有さないアリール基、ナフチル基、もしくはアントラセニル基。
(リ)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜20の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(チ)及び(リ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基であり、
その中でも、(チ)にいう「置換基」では、上記の選択肢に加え、更に、炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基及びチオエステル基が含まれ、これらの基は、炭素数1〜5であり、飽和又は不飽和の直鎖状又は分岐状であり、かつ、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化、又はニトロ化されていてもよい。)]
【0091】
上記(リ)において、「置換基を有し又は有しない・・・飽和又は不飽和の」は、それに続く「炭化水素基、・・・もしくはチオエステル基」に係る。
【0092】
一般式(III)における「R6とR7が1以上の箇所で互いに結合を形成できる」とは、脱水素、脱水などにより結合を形成できるという意味である。酵素などを利用して結合を形成しても良いし、化学的な反応を経て結合を形成しても良い。
【0093】
上記の「飽和」「不飽和」は炭化水素部分をあらわすものであり、例えば「不飽和アルコキシ基」とは、アルコキシ基のうち、アルキル部位に不飽和結合を有することを意味する。
【0094】
上記一般式(I)において、XはSO2が好ましい。
【0095】
上記一般式(I)において、R1は水素、ハロゲン、水酸基、アルデヒド基又はカルボキシル基が好ましく、水素、水酸基又はアルデヒド基が更に好ましく、水素が特に好ましい。
【0096】
R2は炭素数1〜3の直鎖の又は分岐を有する飽和又は不飽和炭化水素基が好ましく、炭素数2の飽和炭化水素基(−CH2CH2−)が特に好ましい。
【0097】
R3は上記した一般式(II)又は一般式(III)で示される置換基が好ましく、一般式(II)で示される置換基が特に好ましい。
【0098】
上記した一般式(II)においては、好ましくはR4及びR5はそれぞれ、以下に示す(ハ)、(ニ)又は(ヘ)の基である。
(ハ)水素、水酸基、アルデヒド基又はカルボキシル基。
(ニ)アミジノ基、グアニジノ基又はウレイド基。
(ヘ)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜10の飽和又は不飽和の炭化水素基。
なお、(ヘ)にいう置換基はフェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基である。
【0099】
上記した一般式(II)においては、更に好ましくはR4は水素、水酸基、アルデヒド基又はカルボキシル基であり、R5は以下に示す(ハ)、(ニ)又は(ヘ)の基である。
(ハ)水素。
(ニ)アミジノ基、グアニジノ基又はウレイド基。
(ヘ)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜5、好ましくは1〜3の飽和又は不飽和の炭化水素基。
なお、(ヘ)にいう置換基はフェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基である。
【0100】
上記した一般式(IV)においては、R8は水素、ハロゲン、水酸基、チオール基、ピリジル基、ピロリジニル基、チエニル基、もしくはフラニル基、置換基を有し又は有さないアリール基、ナフチル基、もしくはアントラセニル基が好ましく、水素、ハロゲン、水酸基、チオール基、ピリジル基、ピロリジニル基、チエニル基、もしくはフラニル基が特に好ましい。当該好ましい置換基は、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基である。
【0101】
なお、上記の「置換基を有し又は有さない」は、それに続く「アリール基、ナフチル基、もしくはアントラセニル基」に係る。
【0102】
より具体的には、ADAM作用阻害剤の有効成分である化合物が、後述の実施例において使用される以下の化1〜化5であることが好ましい。化1〜化5の化合物は適宜市販品の購入により入手可能である。
【0103】
【化1】

【0104】
【化2】

【0105】
【化3】

【0106】
【化4】

【0107】
【化5】

【0108】
また、本発明のADAM作用阻害剤は、イソキノリン骨格に対して、リンカーを介在させて又は介在させずに、互いに1位と4位の関係にある2個の窒素原子を含む含窒素6員環構造体又はその誘導体の一方の前記窒素原子が結合した構造を有する化合物及びその塩から選ばれる1種以上を有効成分として含有するものとすることもできる。
【0109】
イソキノリン骨格、リンカー、塩、ADAM作用阻害剤に関する記載は、上述した記載と同様である。但し、「アルキルポリアミン」に該当する部分は、「含窒素6員環構造体」となる。
【0110】
含窒素6員環構造体は、互いに1位と4位の関係にある2個の窒素原子を含むものである。即ち、1つの窒素原子を1位とした場合に、他の1つの窒素原子は4位に位置する(ベンゼン環に例えればパラ位である。)。
【0111】
イソキノリンの5位は、後述する一般式(V)においてXが結合している部位である。
【0112】
更に、ADAM作用阻害剤の有効成分である化合物が、下記一般式(V)で示される構造を有する化合物であることも好ましい。
〔一般式(V)〕

[一般式(V)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;
R11は下記一般式(VI)、一般式(VII)又は一般式(VIII)で示される置換基を示す。
〔一般式(VI)〕

(一般式(VI)中、R21〜R29は単結合でも、以下に挙げる二重結合であってもよく、R21〜R29が単結合で結合している場合は、R21〜R29はそれぞれ以下の(い)〜(は)のいずれかを示し、R21〜R29はそれぞれ互いに同一であってもよく、相違していてもよい。
(い)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、もしくはニトロ基。
(ろ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(は)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜10の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
上記(は)において、「置換基を有し又は有しない・・・飽和又は不飽和の」は、それに続く「炭化水素基、・・・もしくはチオエステル基」に係る。
R21とR22、R23とR24、R26とR27、R28とR29が二重結合で結合している場合は、R21とR22、R23とR24、R26とR27、R28とR29はそれぞれ以下の(に)〜(ほ)のいずれかを示し、R21とR22、R23とR24、R26とR27、R28とR29はそれぞれ互いに同一であってもよく、相違していてもよい。
(に)オキソ基もしくはチオキシ基。
(ほ)置換基を有し又は有さないヒドロキシイミノ基もしくはヒドラゾノ基。
なお、(は)及び(ほ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、又はカルボキシル基である。)
〔一般式(VII)〕

(一般式(VII)中、R31〜R37は単結合でも、以下に挙げる二重結合であってもよく、R31〜R37が単結合で結合している場合は、R31〜R37はそれぞれ上記一般式(VI)における(い)〜(は)のいずれかを示し、R31〜R37はそれぞれ互いに同一であってもよく、相違していてもよい。
R34とR35、R36とR37が二重結合で結合している場合は、R34とR35、R36とR37はそれぞれ上記一般式(VI)における(に)〜(ほ)のいずれかを示し、R34とR35、R36とR37は同一であってもよく、相違していてもよい。
なお、「置換基」に関しても上記一般式(VI)と同様である。)
〔一般式(VIII)〕

(一般式(VIII)中、R41〜R45はそれぞれ、上記一般式(VI)における(い)〜(は)のいずれかを示し、R41〜R45はそれぞれ互いに同一であってもよく、相違していてもよい。
なお、「置換基」に関しても上記一般式(VI)と同様である。)]
【0113】
また、例えば一般式(VI)において、R21〜R29はすべて単結合であっても良いし、二重結合を形成できる部位においては二重結合を形成していても良い。これらの組み合わせは特に限定されない。一般式(VII)においても同様である。
【0114】
一般式(V)において、XはSO2が好ましい。
【0115】
上記した一般式(VI)においてR21〜R29が単結合で結合している場合は、好ましくはR21〜R29はそれぞれ、以下に示す(い)又は(は)の基である。
(い)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基又はカルボキシル基。
(は)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜5の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(は)にいう置換基はハロゲン、水酸基、アルデヒド基、又はカルボキシル基である。
【0116】
上記した一般式(VI)においてR21〜R29が単結合で結合している場合は、より好ましくはR21〜R29はそれぞれ、以下に示す(い)又は(は)の基である。
(い)水素、水酸基、アルデヒド基又はカルボキシル基。
(は)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜3の飽和又は不飽和の炭化水素基。
なお、(は)にいう置換基はハロゲン、水酸基、アルデヒド基、又はカルボキシル基である。
【0117】
これらの好ましい、より好ましい置換基については、一般式(VII)、一般式(VIII)においても同様である。
【0118】
上記した一般式(VI)においてR21とR22、R23とR24、R26とR27、R28とR29が二重結合で結合している場合、一般式(VII)においてR34とR35、R36とR37が二重結合で結合している場合は、オキソ基であることが好ましい。
【0119】
より具体的には、ADAM作用阻害剤の有効成分である化合物が、後述の実施例において使用される以下の化6であることが好ましい。化6は市販品の購入により入手可能である。例えば、Sigma社製H−7(商品番号:I6891)を用いても良い。
【0120】
【化6】

【0121】
また、本発明のADAM作用阻害剤は、上記したADAM作用阻害物質のスクリーニング方法を用いて選抜される物質が、下記一般式(IX)又は一般式(X)に該当する化合物であり、これらの化合物及びその塩から選ばれる1種以上を有効成分として含有するものとすることもできる。
【0122】
〔一般式(IX)〕

(一般式(IX)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;R51及びR52はそれぞれ水素又は任意の置換基である。)
【0123】
上記化1〜化5はADAM作用の阻害活性である出血阻害活性及び仮足の形成、保持阻害活性を有し、一般式(IX)に示す共通の構造が見受けられる。一方で、後述の化11〜化19である化合物は一般式(IX)で表される構造を有さず、かつ、ADAM作用阻害活性も有しない。即ち、一般式(IX)で表される共通構造を有する化合物はADAM作用阻害活性を有すると推測される。
【0124】
一般式(IX)において、XはSO2が好ましい。
【0125】
上記一般式(IX)におけるR51及びR52はそれぞれ水素又は任意の置換基である。好ましくは、R51及びR52はそれぞれ以下の(ハ)〜(ヘ)のいずれかを示し、R51とR52は同一であってもよく、相違していてもよい。
(ハ)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基もしくはフラニル基。
(ニ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(ホ)置換基を有し又は有さないアリール基、ナフチル基もしくはアントラセニル基。
(ヘ)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜20の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(ホ)及び(ヘ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基であり、
その中でも、(ホ)にいう「置換基」では、上記の選択肢に加え、更に、炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基、チオエステル基が含まれ、これらの基は、炭素数1〜5であり、飽和又は不飽和の直鎖状又は分岐状であり、かつ、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化、又はニトロ化されていてもよい。)
【0126】
上記(ヘ)において、「置換基を有し又は有しない・・・飽和又は不飽和の」は、それに続く「炭化水素基、・・・もしくはチオエステル基」に係る。
【0127】
上記の「飽和」「不飽和」は炭化水素部分をあらわすものであり、例えば「不飽和アルコキシ基」とは、アルコキシ基のうち、アルキル部位に不飽和結合を有することを意味する。
【0128】
上記した一般式(IX)においては、好ましくはR51及びR52はそれぞれ、以下に示す(ハ)、(ニ)又は(ヘ)の基である。
(ハ)水素、水酸基、アルデヒド基又はカルボキシル基。
(ニ)アミジノ基、グアニジノ基又はウレイド基。
(ヘ)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜10の飽和又は不飽和の炭化水素基。
なお、(ヘ)にいう置換基はフェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基である。
【0129】
上記した一般式(IX)においては、更に好ましくはR51は水素、水酸基、アルデヒド基又はカルボキシル基であり、R52は以下に示す(ハ)、(ニ)又は(ヘ)の基である。
(ハ)水素。
(ニ)アミジノ基、グアニジノ基又はウレイド基。
(ヘ)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜5、好ましくは1〜3の飽和又は不飽和の炭化水素基。
なお、(ヘ)にいう置換基はフェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基である。
【0130】
より具体的には、有効成分である化合物が、上記化1〜化5であることが好ましい。
【0131】
〔一般式(X)〕

(一般式(X)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;R61〜R69はそれぞれ水素又は任意の置換基である。)
【0132】
上記化6と、後述の化12を対比すると、化6は6員環であるのに対し化12は7員環である点で大きく異なっている。また、化6はADAM作用の阻害活性である出血阻害活性及び仮足の形成、保持阻害活性を有する。一方で化12はADAM作用阻害活性を有しない。よって、一般式(X)で表される構造を有する化合物はADAM作用阻害活性を有することが推測される。
【0133】
一般式(X)において、XはSO2が好ましい。
【0134】
上記一般式(X)におけるR61〜R69はそれぞれ水素又は任意の置換基である。好ましくは、R61〜R69は単結合でも、以下に挙げる二重結合であってもよく、R61〜R69が単結合で結合している場合は、R61〜R69はそれぞれ以下の(い)〜(は)のいずれかを示し、R61〜R69はそれぞれ互いに同一であってもよく、相違していてもよい。
(い)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、もしくはニトロ基。
(ろ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(は)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜10の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
【0135】
上記(は)において、「置換基を有し又は有しない・・・飽和又は不飽和の」は、それに続く「炭化水素基、・・・もしくはチオエステル基」に係る。
【0136】
R61とR62、R63とR64、R66とR67、R68とR69が二重結合で結合している場合は、R61とR62、R63とR64、R66とR67、R68とR69はそれぞれ以下の(に)〜(ほ)のいずれかを示し、R61とR62、R63とR64、R66とR67、R68とR69はそれぞれ互いに同一であってもよく、相違していてもよい。
(に)オキソ基もしくはチオキシ基。
(ほ)置換基を有し又は有さないヒドロキシイミノ基もしくはヒドラゾノ基。
なお、(は)及び(ほ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、又はカルボキシル基である。)
【0137】
上記した一般式(X)においてR61〜R69が単結合で結合している場合は、好ましくはR61〜R69はそれぞれ、以下に示す基のいずれかである。
(い)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基又はカルボキシル基。
(は)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜5の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(は)にいう置換基はハロゲン、水酸基、アルデヒド基、又はカルボキシル基である。
【0138】
上記した一般式(X)においてR61〜R69が単結合で結合している場合は、より好ましくはR61〜R69はそれぞれ、以下に示す基のいずれかである。
(い)水素、水酸基、アルデヒド基又はカルボキシル基。
(は)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜3の飽和又は不飽和の炭化水素基。
なお、(は)にいう置換基はハロゲン、水酸基、アルデヒド基、又はカルボキシル基である。
【0139】
上記した一般式(X)においてR61とR62、R63とR64、R66とR67、R68とR69が二重結合で結合している場合、オキソ基であることが好ましい。
【0140】
より具体的には、有効成分である化合物が、上記化6であることが好ましい。
【0141】
塩及びADAM作用阻害剤に関する記載は、上述した記載と同様である。
【0142】
〔その他〕
ADAM作用阻害剤の有効成分である化合物は周知の方法を適宜組み合わせることによって化学的に合成することが可能である。また、周知の方法により、当該化合物の塩を得ることができる。上述した化1〜化6に記載の化合物及びその塩は、適宜市販品を用いることができる。
【0143】
上記有効成分は液体、固体等の公知の各種担体と混合し、また必要に応じて安定化剤、着色剤、矯味剤、矯臭剤、賦形剤、溶剤、界面活性剤、乳化剤、懸濁化剤、分散剤、保存剤、溶解補助剤、等張化剤、緩衝剤、無痛化剤、保湿剤、結合剤、被覆剤、潤沢剤、崩壊剤、などを加え、液剤、経口投与剤、錠剤、粉剤、坐剤、外用剤、軟膏、貼布剤、点眼剤、注射剤、散剤、顆粒剤、糖衣剤、カプセル剤、ピル、懸濁剤、アンプル、注射液、などあらゆる剤としての製剤が可能である。また、薬学的に許容される剤を上記有効成分に加えることにより、医薬とすることも可能である。
【0144】
ADAM作用阻害剤の投与量は、投与対象、年齢、性別、体重、剤形あるいは投与形式等により異なるが、投与対象が哺乳類、特にヒトの成人である場合、週1日以上、投与日1日当たり有効成分換算で1〜100mg/kg投与することが好ましい。
ADAM作用阻害剤が出血阻害剤、血管強化剤、仮足の形成阻害剤、仮足の保持阻害剤の場合も上記と同様である。
【0145】
また、ADAM作用阻害剤における「有効成分換算」とは、例えば、剤に含まれる有効成分が化合物である場合はその有効成分の質量であり、塩である場合は化合物の質量に換算して計算することを意味する。
【0146】
仮足保持剤の有効成分であるADAMは適宜市販品を用いることができる。ヘビ毒は、ガラガラヘビ等の個体であるヘビから取得しても良いし、市販品であるヘビ毒を購入しても良い。また、VAP1及びVAP2は、ガラガラヘビ毒(購入元:Sigma、和光純薬など)から上記した非特許文献4に記載の方法により取得することができる。
【0147】
上記有効成分は液体、固体等の公知の各種担体と混合し、また必要に応じて安定化剤、着色剤、矯味剤、矯臭剤、賦形剤、溶剤、界面活性剤、乳化剤、懸濁化剤、分散剤、保存剤、溶解補助剤、等張化剤、緩衝剤、無痛化剤、保湿剤、結合剤、被覆剤、潤沢剤、崩壊剤、などを加え、液剤、経口投与剤、錠剤、粉剤、坐剤、外用剤、軟膏、貼布剤、点眼剤、注射剤、散剤、顆粒剤、糖衣剤、カプセル剤、ピル、懸濁剤、アンプル、注射液、などあらゆる剤としての製剤が可能である。また、薬学的に許容される剤を上記有効成分に加えることにより、医薬とすることも可能である。
【0148】
仮足保持剤の投与量は、投与対象、年齢、性別、体重、剤形あるいは投与形式等により異なるが、投与対象が哺乳類、特にヒトの成人である場合、週1日以上、投与日1日当たり有効成分の質量で0.1〜1mg/kg投与することが好ましい。
【0149】
上述の各剤の投与回数は1回または数回に分けて投与することができる。投与計画としては、連日投与、間欠投与又はこれらの組み合わせがある。これらの投与においては医師の判断によることが必要である。
【0150】
上述の各剤の投与対象が細胞、器官、組織などである場合は投与量は特に限定されないが、投与対象に対してADAM作用阻害剤では有効成分換算で1〜100μg/ml投与が好ましい。仮足保持剤では有効性分の質量で0.1〜10μg/ml投与が好ましい。
【実施例】
【0151】
(VAP1の取得)
非特許文献2に記載の増田らのVAP1の精製法に則り、ニシダイヤガラガラヘビ(C.atrox)の粗毒(SIGMA社製:製品名Snake venom,Crotalus atrox (V7000))を25mM NaCl buffer(25mM NaCl,10mM Tris−HCl(pH 7.0),1mM CaCl2)に溶解し、CM−Sephadex C25(SIGMA−ALDRICH)column(1.5cm×9cm)を用いて精製を行い、NaCl濃度勾配(25mM−500mM,150ml)により溶出を行った。得られた各画分を非還元条件下でSDS−PAGE(10%ポリアクリルアミドゲル(分離ゲル9.73%Acrylamide(Sigma社A8887),0,27%Bis−acrylamide(Sigma社M7279)、0.1%SDS,0.375M Tris−HCl(pH8.8)の溶液10mlに10%過硫酸アンモニウム0.04mlとTEMED0.005mlを添加してゲル化)、ゲルサイズ横90mmx縦80mmx厚さ1mmに対し、泳動バッファ(0.025M Tris,0.192Mグリシン、0.1%SDS)で20mAの定電流で泳動。分子量マーカーはSigma社製 Kit for Molecular Weights 30,000−200,000 for SDS−PAGE(MWSDS200) を使用。)を行い、銀染色によって110kDaにバンドの検出が確認された画分をVAP1の溶出画分とした。さらにhydroxyapatite(生化学工業)column(1.5cm×8.5cm)を用い、上記の溶出画分に等量の25mM sodium phosphate buffer(pH7.0)を混和し、カラムに添加した。Sodium phosphate濃度勾配(0.25mM−500mM,150ml)により溶出を行った。得られた各画分を上述と同様の非還元条件下でSDS−PAGEを行い、銀染色によって110kDaにVAP1の単一なバンドを確認した。この110kDaのバンドを含む画分を精製VAP1標品として用いた。
【0152】
(VAP2の取得)
VAP1精製一段階目のCM−Sephadex C25 columnで得られた各画分を非還元条件下でSDS−PAGEを行い、銀染色によって60kDaのバンドが検出された画分をVAP2溶出画分として用いた。さらに精製を行うために、非特許文献1に記載の増田らのVAP2の精製法に則って、Phenyl Sepharose CL−4B column(0.8cm×3cm)を用いて行った。VAP2溶出画分に等量の1M ammonium sulfate buffer(1M ammonium sulfate,10mM Tris−HCl(pH7.0),1mM CaCl2)を混和し、カラムに添加した。Ammonium sulfate濃度勾配(500mM−0mM)により溶出を行った。得られた各画分を上記VAP1の取得と同様の非還元条件下でSDS−PAGEを行い、銀染色によって60kDaにVAP2のバンドを確認した。この60kDaのバンドを含む画分を精製VAP2標品として用いた。
【0153】
(VAP1、VAP2及びヒトADAMのホモロジー)
VAP1及びVAP2のアミノ酸配列は本願発明者が特定しており、下記の文献に記載されている。
VAP1:非特許文献2、VAP2:Masuda
S, Maeda H, Miao JY, Hayashi H, Araki S. cDNA
Cloning and Some Additional Peptide Characterization of a Single-Chain Vascular
Apoptosis-Inducing Protein, VAP2. Endothelium. 2007; 14(2):89-96.
【0154】
VAP1、VAP2とヒトADAM28は、アミノ酸配列の一致度はそれぞれ41%、42%である(BLASTホモロジー検索より)。この数値は、ヒトADAM28と最も近いヒトADAMは順にヒトADAM7、ヒトADAM12で、アミノ酸配列の一致度はそれぞれ41%、36%であることを考えれば、VAP1、VAP2はヒトADAMの強いホモログであると言える。また立体構造に関しては、プロテアーゼドメインの立体構造偏差は、立体構造の分かっているヒトADAM33と比べて、VAP1との立体構造偏差RMSD(Root Mean Square Deviation)は0.987Å(オングストローム)であり、非常に高い構造の一致を示している。したがってVAP1,VAP2はADAMファミリーのホモログであることが非常に強く示唆される。
【0155】
(ADAM作用阻害物質の探索)
VAPの引き起こす出血をADAM作用とし、上記化1〜化6及び以下の化11〜化19についてADAM作用の阻害活性を測定した。以降の実施例において、これらの化合物は適宜市販品を購入して用いた。
【0156】
【化11】

【0157】
【化12】

【0158】
【化13】

【0159】
【化14】

【0160】
【化15】

【0161】
【化16】

【0162】
【化17】

【0163】
【化18】

【0164】
【化19】

【0165】
VAPの引き起こす出血活性は以下のように測定した。動物は、ICRマウスの成体(2カ月齢以降)を用いた。マウスの背中の皮膚は出血を見るのに適しており、ヘビ毒の活性を見るのによく利用される。マウスの背中の皮膚内に皮内注射をすることにより、VAPの出血活性を測定した。
【0166】
マウスの尻尾を固定し、マウスを落ち着かせたのち、背中の毛を丁寧にはさみで切り、毛刈部位を4×4cmの大きさにした。当該毛刈部位をエタノールで消毒したのち、注射器(テルモシリンジ1ml、テルモ注射針27G×3/4’’)を用いて注射液を注入した。注射液は1mg/mlの精製VAP1標品溶液10μlと10mMの各化合物溶液(なお、コントロールにはリン酸緩衝生理食塩水(PBS―)またはジメチルスルフォキシド(DMSO)を用い、VAP1のみの投与となるようにした)10μlを混合したものを用いた。注入4時間後にジエチルエーテルによって犠牲にし、背中から出血斑のある部分の皮膚を剥ぎとり観察した。
【0167】
各化合物について試験は3連行い、出血量の平均値は、コントロールに対する相対比で化1が0.36、化2が0.32、化3が0.21、化4が0.16、化5が0.40、化6が0.38、化11が1.48、化12が1.38、化13が1.33、化14が1.20、化15が1.48、化16が1.26、化17が1.30、化18が1.13、化19が1.36であった。
【0168】
図1は、化1〜5及び化11〜13についての出血量を、コントロールに対する相対比で示す棒グラフであり、1となっているのはVAP1のみを投与したコントロールの出血量である。図2は、化14及び化15についての出血量を、コントロールに対する相対比で示す棒グラフである。図3は、化11及び化16〜化19についての出血量を、コントロールに対する相対比で示す棒グラフである。各バーには、標準偏差も示してある。なお、化6については図示を省略する。
【0169】
次に、上述の注射実験と同様の手順で、化3及び化4についてVAP2を用いた出血活性の測定を行った。注射液には精製VAP1標品ではなく精製VAP2標品を混合した。図4は化4(上段)及び化3(下段)の投与結果を示す写真である。左側はVAP2のみを投与(コントロール)した結果であり、右側はVAP2と化4又は化3の混合剤を投与した結果である。化3及び化4は出血阻害活性を示した。
【0170】
図5は、化11及び化16〜化19の投与結果を示す写真である。図4同様、左側はVAP1のみを投与(コントロール)した結果であり、右側はVAP1と各化合物の混合剤を投与した結果である。化11及び化16〜化19は、出血阻害活性を示さなかった。
【0171】
実験結果より、化1〜化6は出血阻害活性が認められた。上述のようにVAP1及びVAP2はADAMのホモログであるので、化1〜化6はADAM作用阻害活性を示す物質である。化1〜化6はイソキノリンに対し、リンカーであるスルフェン酸(−SO2−)を介して窒素原子が結合するという共通の構造が見受けられる。
【0172】
(ADAMの下流の確認)
化合物がVAPのタンパク質分解活性を直接阻害していないかどうかを以下の方法により調べた。切断はVAP1の分解基質の1つであるフィブロネクチンが切断されるか否かによって判断した。なお、DMSOは溶液中に化4を溶かし込む目的で使用した。
【0173】
(1)コントロールとして、フィブロネクチン(図6中では「fib」とも表現する)又はVAP1のみ、(2)1mg/mlの精製VAP1標品50mMリン酸緩衝液溶液10μl及びフィブロネクチン200μgを混合したもの(実験結果は図6中左から3列目に示す)、(3)1mg/mlの精製VAP1標品50mMリン酸緩衝液溶液10μlとDMSO 10μlの混合物をフィブロネクチン200μgと混合したもの(実験結果は図6中左から4列目に示す)、(4)1mg/mlの精製VAP1標品50mMリン酸緩衝液溶液10μlと「化4」5.2mg/mlのDMSO溶液10μlの混合物とフィブロネクチン200μgを混合したもの(実験結果は図6中最も右側の列に示し、図中ではDMSOの記載は省略する)をそれぞれリン酸緩衝生理食塩水(PBS―)(pH7.0))100μl中で、それぞれ24時間、37℃でインキュベートした。これらの混合液を回収しSDS−PAGEを行ったあと、銀染色を施した。
【0174】
実験結果を図6に示す。上記(2)〜(4)の結果から明らかであるように化4が存在しても、VAP1の反応が進行することが確認できた。化1〜化6の他の化合物についても同様の結果を得た。
【0175】
また、VAP1とVAP2のホモロジー及び上述したADAM作用阻害物質の探索の実験結果から、VAP2においても同様の現象が見られることが推測された。
【0176】
即ち、化1〜化6はADAMシグナル伝達系におけるADAMの下流に働きかけることが示された。
【0177】
(VAPと仮足)
ヘビ毒ADAMであるVAP1と血管内皮細胞を用いて、VAPの引き起こす仮足の形成、保持について調べた。
【0178】
細胞はJaffeらの方法(Jaffe,
E. A., Nachman, R. L., Becher,
C. G., and Minick, R. C. (1973) Culture of human
endothelial cells derived from umbilical veins. J. Clin. Invest. 52,
2745-2756.)によって得たヒト臍帯血管内皮細胞(HUVEC)を使用した。培養液はMCDB105培養液(Sigma社製)に、混合後の最終濃度でウシ胎仔血清を10%(v/v)および、FGF 70ng/ml (LobbおよびFettの方法 (Lobb,
R. R., and Fett, J. W. (1984) Purification of two
distinct growth factors bovine neural tissue by heparin affinity
chromatography. Biochemistry 23,
6295-6299) でウシの脳より抽出) 、ヘパリン100μg/mlを加えた物を用いた。培養条件としては、HUVECを0.1%ゼラチンコートしたプラスチックディッシュ上にまき、培養液により37℃、5%CO2、95% airの条件で培養を行った。
【0179】
生存因子の除去は、血清・FGF無添加の培養液に培養液を交換することにより行った。一方、ヘビ毒によるアポトーシスにおいて添加する毒素は上述のニシダイヤガラガラヘビ(C.atrox)の粗毒を用い、最終濃度1μg/mlになるように添加した。上記培養液の交換直後にニシダイヤガラガラヘビの粗毒を添加し、細胞をタイムラプスビデオ(位相差顕微鏡を使用)により撮影した。
【0180】
実験結果を図7に示す。A〜Cは生存因子除去によるアポトーシスの過程を経時的に示すものである。0時間の細胞(A)は、生存因子除去後24時間程度でアポトーシスが始まると仮足を形成する(細胞体に比して小さなでこぼこは仮足の形成を示す)が(B)、仮足形成1時間後には仮足は消失して球形になり(C)、以降もこのままの形態である。
なお、アポトーシスで見られるのと同様なブレッビング(小胞)が仮足の形態の一つであるということは、最近の知見で分かってきたことである。例えば、以下の文献に記載されている:参考文献G.T.Charras、A Short History of Blebbing. Journal of Microscopy,231:466−478(2008)
【0181】
D〜Fは、上述のニシダイヤガラガラヘビ粗毒による仮足の変化の過程を経時的に示すものである。0時間の細胞(D)は、生存因子除去及びニシダイヤガラガラヘビ粗毒添加後24時間程度で、生存因子除去の場合と同様に仮足を形成するが(E)、仮足形成後6時間以上経過しても仮足は消失せず保持されたまま(F)、以降もこのままの形態を保つ。
【0182】
VAP1、VAP2についても同様の実験結果を得た。
即ち、ヘビ毒を用いるという簡便な方法で仮足の形成、仮足の保持ができることが示された。
【0183】
(ヘビ毒ADAMとADAM作用阻害物質)
ヘビ毒ADAMであるVAP1とADAM作用阻害物質である化6を用いて、仮足の形成、保持に対する化6の効果を調べた。
【0184】
上述と同様の方法により調製したヒト臍帯血管内皮細胞(HUVEC)及び培養液を用いた。培養条件としては、HUVECを0.1%ゼラチンコートしたプラスチックディッシュ上にまき、培養液により37℃、5%CO2、95%airの条件で培養を行った。
【0185】
血清・FGF無添加の培養液に培養液を交換し、コントロールは培養液の交換直後に精製した標品であるVAP1を最終濃度10μg/mlになるように添加し、24時間培養を続けた。一方、化6投与区は最終濃度でVAP1が10μg/ml、及び化6が30μMになるように添加し、24時間培養を続けた。
【0186】
実験結果を図8に示す。図8Aはコントロールの結果であり、VAP1の添加後24時間の細胞を示す。細胞体に比して小さなでこぼこは仮足の形成を示し、24時間後も保持されている様子が分かる。図8BはVAP1及び化6の投与後24時間の細胞を示す。細胞体は滑らかな球状になり、仮足が見られない。
また、図示は省略するが、VAP1を添加して細胞に仮足を形成させ、その後化6を投与すると、仮足が消失した。化1〜化6の他の化合物についても、同様の結果を得た。
【0187】
即ち、ヘビ毒ADAMによる仮足保持は、化1〜化6によって阻害された。また、化1〜化6によりVAPによる仮足の形成が阻害された。即ち、化1〜化6はADAM作用阻害活性を示した。また、化1〜化6は仮足の制御活性をも示した。
【0188】
(ヘビ毒ADAMの血管への作用)
以下の論文により、ヘビ毒ADAMは血管に作用することが示されている。
Araki
S, Masuda S, Maeda H, Ying MJ, Hayashi H. Involvement of specific integrins in apoptosis induced by vascular
apoptosis-inducing protein 1. Toxicon.
2002 May;40(5):535-42.
【0189】
図9上段(コラーゲン溶液の分解)について説明する。コラーゲン50μgを0.2μgの精製した標品であるVAP1またはガラガラヘビ毒2μgと37℃で24時間インキュベートした。反応液は10mMTris−HCl(pH7.0)、1mMCaCl2、2.5mg/ml α―gelatin(シグマ)にVAP1を10μg/mlまたはガラガラヘビ毒100μg/mlを添加した。各サンプルをポリアクリルアミドSDS電気泳動で分画し、クーマシーブリリアントブルーで染色し、検出した。図9左側(レーン1)はコラーゲンのみインキュベートしたもの、図9中央(レーン2)はコラーゲンとVAP1をインキュベートしたもの、図9右側(レーン3)はコラーゲンとガラガラヘビ毒をインキュベートしたものである。
【0190】
図9下段(培養皿ゼラチンコートの分解)について説明する。コラーゲンコートされた培養皿をVAP1またはガラガラヘビ毒で5日間インキュベートし、後にヒトさい帯血管内皮細胞を植えることにより、コラーゲンの接着能力が棄損されているかどうかを調べた。コラーゲンコートした培養皿を、培養液(A)、ガラガラヘビ毒素(10μg/ml)添加培養液(B)、VAP1(1μg/ml)添加培養液(C)で5日間インキュベートし、後にヒトさい帯血管内皮細胞を植えて6時間後の様子を光学顕微鏡で撮影した。
【0191】
図9に示すように、VAP1はコラーゲンを分解しないことが示されている。即ち、VAP1は血管の細胞外マトリックスは分解しない。
ヘビ毒ADAMは血管内皮細胞のアポトーシスを引き起こす一方で、血管の細胞外マトリックスは分解しないことが明らかとなった。よって、図10に示すような出血モデルを推測することができる。上記した化1〜化6は、図10中の「信号伝達阻害物質」に該当すると推測される。
【0192】
(MMPであるコラゲナーゼとADAM作用阻害物質)
コラゲナーゼ出血へのADAM作用阻害物質の影響を以下のように測定した。動物は、ICRマウスの成体(2カ月齢以降)を用い、マウスの背中の皮膚内に皮内注射をすることにより、コラゲナーゼの出血活性を測定した。マウスの尻尾を固定し、マウスを落ち着かせたのち、背中の毛を丁寧にはさみで切り、毛刈部位を4×4cmの大きさにした。当該毛刈部位をエタノールで消毒したのち、注射器(テルモシリンジ1ml、テルモ注射針27G×3/4’’)を用いて注射液を注入した。注射液は0.8mg/mlのコラゲナーゼ(Sigma社製、製品名Collagenase from Clostridium histolyticum(C0130))10μlと10mMの「化4」溶液(なお、コントロールには溶媒ジメチルスルフォキシドを用い、投与物質がコラゲナーゼのみとなるようにした)10μlを混合したものを用いた。注入4時間後にジエチルエーテルによって犠牲にし、背中から出血斑のある部分の皮膚を剥ぎとり観察した。
【0193】
実験結果を図11に示す。左側はコラゲナーゼのみを投与(コントロール)した結果であり、右側はコラゲナーゼと化4の混合剤を投与した結果である。また、化1〜化6の他の化合物についても同様の結果を得た。
【0194】
即ち、ADAM作用阻害物質はMMPであるコラゲナーゼの作用である出血を阻害できないことが示された。これは、ADAM作用阻害物質が他のプロテアーゼの作用を阻害しないことを示す。言い換えれば、ADAMの下流に作用するADAM作用阻害物質は副作用が少ない。また、コラゲナーゼの作用である出血を阻害できないことから、ADAM作用阻害物質を加えてもコラゲナーゼのプロテアーゼ活性が残存していることが合理的に推測される。
【0195】
(VAPと仮足−2−)
ヘビ毒及びヘビ毒ADAMであるVAP2と、化2を用いて、仮足の形成、保持に対する化2の効果を確認的に検討した。
【0196】
上述の「(VAPと仮足)」と同様の方法により調製したヒト臍帯血管内皮細胞(HUVEC)及び培養液を用いた。培養条件としては、HUVECを0.1%ゼラチンコートしたスライドガラスを置いたプラスチックディッシュ上に撒き、培養液により37℃、5%CO2,95%airの条件で培養を行った。
【0197】
血清・FGF無添加の培養液に培養液を交換し、培養液の交換直後に上述の「(VAP1の取得)」、「(VAP2の取得)」に用いたニシダイヤガラガラヘビの粗毒又は精製した標品であるVAP2を最終濃度10μg/mlになるように添加し、4時間培養を続けた。また、化2投与区は最終濃度で上記ヘビ毒又はVAP2が10μg/ml、及び化2が10μMになるように添加し、4時間培養を続けた。コントロールは、培養液の交換後ニシダイヤガラガラヘビの粗毒、VAP2、及び化2の添加をせず、そのまま4時間培養を続けた。
【0198】
4時間培養後、細胞を4%パラホルムアルデヒドで固定し、100倍希釈したAlexaFluor488ファロイジン(Molecular Probe社)で1時間、アクチンを染色し、その後洗浄して蛍光観察した。蛍光観察は蛍光顕微鏡BZ−9000(KEYENCE社)を用い、励起波長470nm、吸収波長535nm、対物レンズ40倍で観察・撮影した。
上述の「(VAPと仮足)」の実施例においては、生存因子の除去/ニシダイヤガラガラヘビの粗毒・VAPを添加した後24時間程度経てからアポトーシスが始まった。パラホルムアルデヒドによる固定は生存因子の除去/ニシダイヤガラガラヘビの粗毒・VAPを添加した後4時間の時点で行ったので、アポトーシスは始まっていなかった。
【0199】
ニシダイヤガラガラヘビの粗毒を使用した実験結果を図12に示す。図12Aは培養液交換後4時間のコントロールの実験結果であり、繊維状のアクチン蛋白質の骨格が見られ、際立った仮足の形成は見られない。
【0200】
図12Bは、ニシダイヤガラガラヘビの粗毒添加後4時間の細胞を示す。骨格タンパク質であるアクチンを染色しているので、強い蛍光を示す部位はアクチンの集積を意味する。細胞の先端にアクチンの集積を伴う細長い突起状の仮足が形成されている。仮足には顆粒状またはリング状のポドソームが見られるものも多い。図12Bは上記ヘビ毒添加4時間後の仮足で、この仮足は上記ヘビ毒の添加後30分後に観察され24時間程度まで続いた。24時間程度すると仮足がつぶつぶしてきて、図7Eや図8Aのようになった。
【0201】
図12Cは上記ヘビ毒及び化2の添加後4時間の細胞を示す。12Bに比べて突起状の仮足は少なくアクチンの集積が弱まっており、仮足の形成が抑制された。
【0202】
ヘビ毒ADAMであるVAP2についても同様の結果を得た。上述の通り、VAP2はヒトADAMのホモログである。よって、ヘビ毒ADAMやヒトADAMの投与・導入等により、仮足の形成、仮足の保持ができることが有効に推測される。
【産業上の利用可能性】
【0203】
本発明によって、有用なADAM作用阻害物質のスクリーニング方法、仮足の保持方法、仮足保持剤、仮足の制御物質のスクリーニング方法、及びADAM作用阻害剤が提供される。
【技術分野】
【0001】
本発明は、ADAM作用阻害物質のスクリーニング方法、仮足の保持方法、仮足保持剤、仮足の制御物質のスクリーニング方法、及びADAM作用阻害剤に関する。
【背景技術】
【0002】
ヘビ毒は大別して2種存在し、ガラガラヘビ等が有する出血性ヘビ毒とコブラ等が有する神経性ヘビ毒がある。
【0003】
下記の非特許文献1〜4に開示されているように、vascular apoptosis−inducing protein(以下、VAPと称する)1及び2は、出血性ヘビ毒素として本願発明者らによってガラガラヘビ毒から単離された蛋白質であり、血管内皮細胞に対して激しいアポトーシス小胞の生成を伴うアポトーシスを誘導する。また、本願発明者らは、VAP1、VAP2がADAMファミリーのホモログであることも確認している。
【0004】
ADAMとは、a−disintegrin and metalloproteaseの略称であり、ディスインテグリンドメイン及びメタロプロテアーゼドメインを有する蛋白質である。Matrix metalloprotease(以下、MMPと称する)もメタロプロテアーゼドメインを有する蛋白質であり、創傷治癒等に関与すると考えられている。これらの蛋白質のメタロプロテアーゼ部位は活性中心に金属イオンを有しており、活性化されて蛋白質の切断を行う。また、下記特許文献1〜3におけるADAM阻害剤が開示されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特表2005−533789号公報 この特許文献1は、ADAM−10蛋白質の阻害に有用な化合物を開示する。
【特許文献2】特開2008−184387号公報 この特許文献2は、アスコルビン酸誘導体であるADAM阻害剤を開示する。
【特許文献3】特開2008−201772号公報 この特許文献3は、アルキルグルコシドであるADAM阻害剤を開示する。
【非特許文献】
【0006】
【非特許文献1】Masuda, S., Hayashi, H., Araki, S., 1998. Two vascularapoptosis-inducing proteins from snake venom are members of the metalloprotease/disintegrin family. Eur. J. Biochem. 253, 36-41.
【非特許文献2】Masuda, S., Ohta, T., Kaji,K., Fox, J.W., Hayashi, H., Araki, S., 2000. cDNAcloning and characterization of vascular apoptosis-inducing protein 1. Biochem. Biophys. Res. Commun. 278, 197-204.
【非特許文献3】Maruyama, J., Hayashi, H., Miao, J., Sawada, H., Araki, S., 2005.Severe cell fragmentation in the endothelial cell apoptosis induced by snakeapoptosis toxin VAP1 is an apoptotic characteristic controlled by caspases. Toxicon 46, 1-6.
【非特許文献4】Kikushima, Y.,Nakamura, S., Ohshima, Y., Shibuya, T., Miao, J.Y., Hayashi, H., Nikai, T., Araki, S., 2008. Hemorrhagic activity of thevascular apoptosis-inducing proteins VAP1 and VAP2 from Crotalus atrox.Toxicon 52, 589-593.
【発明の開示】
【発明が解決しようとする課題】
【0007】
ADAMは種々の疾患に関与していることが明らかになっておりADAM阻害剤による当該疾患の治療が行われているが、従来のADAM阻害剤では以下のような問題があった。
【0008】
なお、本願において、ADAMのメタロプロテアーゼ部位によるプロテアーゼ反応をシグナル伝達の過程に含むシグナル伝達系をADAMシグナル伝達系と称する。当該ADAMシグナル伝達系は、ADAMを投与・導入等することで引き起こされるシグナルの伝達系も含む。ADAMの上流とは、ADAMシグナル伝達系において、ADAMによるプロテアーゼ反応より前の段階を指す。同様にADAMの下流とは、ADAMによるプロテアーゼ反応より後の段階を指す。
【0009】
まず、標的となるADAMのメタロプロテアーゼ部位は、MMP等の他の蛋白質のメタロプロテアーゼ部位と非常に相同性が高く、ADAMのメタロプロテアーゼ特異的阻害剤の創製は困難であった。その一方で、各メタロプロテアーゼ部位を有する蛋白質は生体内における発現部位、量、時期等が厳密に調節され、恒常性が維持されている。
【0010】
ADAMのメタロプロテアーゼ部位の直接的な阻害剤としては、例えば上記特許文献1に開示されているヒドロキサム酸のような金属イオンキレート部を含むペプチド様構造を持つ化合物がある。当該直接的な阻害剤は、ADAMのメタロプロテアーゼ部位のみでなくMMP等の他の蛋白質のメタロプロテアーゼ部位にも直接的に作用するため当該他の蛋白質の働きが阻害されてしまい、副作用が大きいという問題があった。
【0011】
ADAMの間接的な阻害剤としては、例えば上記特許文献2及び特許文献3に記載のADAM阻害剤がある。これらはTNF−αの遊離阻害効果を評価したものであり、ADAMの上流のシグナル伝達を阻害するものである。このようなADAMの上流のシグナル伝達を阻害する場合、ADAMの直接作用の一つである細胞増殖因子の遊離が抑制され、正常の細胞増殖を抑制するなどの副作用が起こるという問題があった。
【0012】
以上のように、従来、ADAMの下流に働きかけてADAM作用を阻害するという阻害剤の開示はなかった。また、ヘビ毒が引き起こす出血に関しては、メタロプロテアーゼが血管蛋白質を分解することが原因と考えられてきた。
【0013】
上述の問題を解決するため鋭意研究を重ねた結果、本願発明者は、ガラガラヘビ毒が引き起こす出血は単に血管を構成する蛋白質の分解によって引き起こされるのではなく、ADAMのホモログであるVAPの関与するシグナル伝達の結果であることを突き止めた。このことから、例えば、ADAMシグナル伝達系によるシグナル伝達の結果である複数の作用は、ADAMの下流のシグナル伝達系の制御によりそれぞれ別個に阻害することができると推測された。そして、本願発明者はADAMの下流のシグナル伝達を阻害する物質を見出し、更には、ADAM作用を特異的に阻害する物質を見出した。即ち、ADAM上流のシグナル伝達を阻害せず、また、MMP等の他の蛋白質のメタロプロテアーゼ部位の活性を残存させたままADAMの作用を阻害できることを見出した。
【0014】
また、本願発明者はVAP1、VAP2の引き起こすアポトーシスについての研究を重ねていく上で、VAPの引き起こすアポトーシスにおいては仮足が保持されるという興味深い知見を得た。ゆえに、ADAMは、仮足についての研究、特に仮足の制御物質のスクリーニングにも有用であることを見出した。
【0015】
本願発明者はこれらの研究に基づき、本発明を完成させた。そこで、ADAM作用阻害物質のスクリーニング方法、仮足の保持方法、仮足保持剤、仮足の制御物質のスクリーニング方法、及びADAM作用阻害剤を提供することを本発明が解決すべき課題とする。
【0016】
なお、本願においてADAMの作用(以下、ADAM作用とも称する)とは、第1に、ADAMシグナル伝達系によるシグナル伝達の結果である作用を指す。例えば、上述のADAMのホモログであるVAP1及びVAP2においては、「激しいアポトーシス小胞の生成」や「仮足の保持」はADAMの作用に該当する。後述の通り、VAP1及びVAP2をマウス皮内に投与すると投与部位において出血が引き起こされるが、「出血」もADAMの作用に該当する。第2に、ADAMの量や活性の変化に起因する場合は、シグナル伝達系におけるシグナルの増幅や減少により引き起こされる作用も含む。また、VAP1及びVAP2はヘビ毒に由来する物質であるので、「激しいアポトーシス小胞の生成」や「仮足の保持」はヘビ毒の作用でもある。
【0017】
本願発明においてADAMの作用の阻害(以下、ADAM作用阻害とも称する)とは、1以上のADAM作用を阻害することに加え、ADAM作用を軽減・抑制することを含む概念である。同様にヘビ毒の作用の阻害とは、1以上のヘビ毒の作用を阻害することに加え、ヘビ毒の作用を軽減・抑制することを含む概念である。
【課題を解決するための手段】
【0018】
(第1発明)
上記課題を解決するための本願第1発明の構成は、
以下のa)工程とb)工程からADAMのプロテアーゼの反応進行が確認され、かつ、以下のa)工程とc)工程からADAM作用の阻害が確認された物質をADAM作用阻害物質と判定する、ADAM作用阻害物質のスクリーニング方法である。
a)ADAMのプロテアーゼ活性を備え又はADAMのプロテアーゼ活性を備えさせる検体にスクリーニング対象物質を投与又は導入する工程。
b)上記a)工程によってADAMのプロテアーゼ活性及びスクリーニング対象物質を備えた検体において、ADAMのプロテアーゼの反応進行を確認する工程。
c)上記a)工程によってADAMのプロテアーゼ活性及びスクリーニング対象物質を備えた検体において、ADAM作用の阻害を確認する工程。
【0019】
第1発明はa)〜c)の各工程を少なくとも1回ずつ含むものであればよい。例えば、a)、b)、c)又はa)、c)、b)の順序で各工程を行い、そのa)及びb)工程からADAMのプロテアーゼの反応進行を確認し、a)及びc)工程からADAM作用の阻害を確認しても良い。また、実験系を2つに別け、a)とb)工程からADAMのプロテアーゼの反応進行を確認し、a)とc)工程からADAM作用の阻害を確認し、これらの結果を総合してADAM作用阻害物質を判定しても良い。
【0020】
(第2発明)
上記課題を解決するための本願第2発明の構成は、
前記a)工程における検体が、細胞、器官、組織、又は個体であって、c)工程におけるADAM作用の阻害が、仮足の保持阻害又は仮足の形成阻害である、第1発明に記載のADAM作用阻害物質のスクリーニング方法である。
【0021】
(第3発明)
上記課題を解決するための本願第3発明の構成は、
前記a)工程における検体が、器官、組織、又は個体であって、c)工程におけるADAM作用の阻害が、出血の阻害である、第1発明に記載のADAM作用阻害物質のスクリーニング方法である。
【0022】
(第4発明)
上記課題を解決するための本願第4発明の構成は、
前記ADAM作用阻害物質のスクリーニング方法が、前記a)工程と以下のd)工程からADAM特異性を確認することを含む、第1発明〜第3発明のいずれかに記載のADAM作用阻害物質のスクリーニング方法である。
d)スクリーニング対象物質が投与又は導入された検体におけるADAMではないプロテアーゼのプロテアーゼ活性の残存を確認する工程。
【0023】
第4発明は、a)〜d)の各工程を少なくとも1回ずつ含むものであればよい。例えば、a)工程の後、b)〜d)の各工程を順序不同で行い、そのa)及びb)工程からADAMのプロテアーゼの反応進行を確認し、a)及びc)工程からADAM作用の阻害を確認し、a)及びd)工程からADAM特異性を確認しても良い。また、実験系を複数に別けてもよいことは、上述の第1発明と同様である。
【0024】
(第5発明)
上記課題を解決するための本願第5発明の構成は、仮足を形成可能である検体に対して、ヘビ毒を用いる仮足の保持方法である。
【0025】
(第6発明)
上記課題を解決するための本願第6発明の構成は、ヘビ毒を有効成分とする仮足保持剤である。
【0026】
(第7発明)
上記課題を解決するための本願第7発明の構成は、
以下のe)及びf)の各工程を順序不同で含む処理工程を行い、その後以下のg)工程を含む確認工程により仮足の制御が確認された物質を仮足の制御物質と判定する、仮足の制御物質のスクリーニング方法である。
e)検体である細胞、器官、組織、又は個体にヘビ毒を投与又は導入する工程。
f)検体である細胞、器官、組織、又は個体にスクリーニング対象物質を投与又は導入する工程。
g)仮足の制御を確認する工程。
【0027】
第7発明はe)〜g)の各工程を少なくとも1回ずつ含むものであればよい。処理工程は、e)及びf)工程を同時に行っても良いし、いずれか一方を先に行い、他の一方を後に行ってもよい。検体にはヘビ毒及びスクリーニング対象物質が投与又は導入される。
【0028】
(第8発明)
上記課題を解決するための本願第8発明の構成は、
イソキノリン骨格に対して、リンカーを介在させて又は介在させずに、アルキルポリアミン又はその誘導体における一個のアミノ基を構成する窒素原子が結合した構造を有する化合物及びその塩から選ばれる1種以上を有効成分として含有する、ADAM作用阻害剤である。
【0029】
(第9発明)
上記課題を解決するための本願第9発明の構成は、
前記リンカーが、硫黄又はりんのオキソ酸から選ばれるものである、第8発明に記載のADAM作用阻害剤である。
【0030】
(第10発明)
上記課題を解決するための本願第10発明の構成は、
前記リンカーが、あるいはリンカーが介在しない場合にはアルキルポリアミン又はその誘導体が、イソキノリン骨格の5位の炭素原子に結合している、第8発明又は第9発明に記載のADAM作用阻害剤である。
【0031】
(第11発明)
上記課題を解決するための本願第11発明の構成は、
前記ADAM作用阻害剤の有効成分である化合物が、下記一般式(I)で示される構造を有する化合物である、第8発明〜第10発明のいずれかに記載のADAM作用阻害剤である。
〔一般式(I)〕

[一般式(I)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;
R1は以下の(イ)又は(ロ)を示し;
(イ)水素、ハロゲン、水酸基、チオール基、アルデヒド基、カルボキシル基、シアノ基又はニトロ基。
(ロ)炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基であって、これらの基は炭素数1〜5の直鎖の又は分岐を有する飽和又は不飽和のものであり、かつハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
R2は炭素数1〜5の直鎖の又は分岐を有する飽和又は不飽和炭化水素基を示し;
R3は下記一般式(II)、一般式(III)又は一般式(IV)で示される置換基を示す。
〔一般式(II)〕

(一般式(II)中、R4及びR5はそれぞれ以下の(ハ)〜(ヘ)のいずれかを示し、R4とR5は同一であってもよく、相違していてもよい。
(ハ)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基もしくはフラニル基。
(ニ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(ホ)置換基を有し又は有さないアリール基、ナフチル基もしくはアントラセニル基。
(ヘ)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜20の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(ホ)及び(ヘ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基であり、
その中でも、(ホ)にいう「置換基」では、上記の選択肢に加え、更に、炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基、チオエステル基が含まれ、これらの基は、炭素数1〜5であり、飽和又は不飽和の直鎖状又は分岐状であり、かつ、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化、又はニトロ化されていてもよい。)
〔一般式(III)〕

(一般式(III)中、R6及びR7はそれぞれ、R6とR7が1以上の箇所で互いに結合を形成できる、一般式(II)におけるR4、R5が選択しうる基を示す)。
〔一般式(IV)〕

(一般式(IV)中、R8は以下の(ト)〜(リ)のいずれかを示す。
(ト)水素、ハロゲン、水酸基、チオール基、ピリジル基、ピロリジニル基、チエニル基、もしくはフラニル基。
(チ)置換基を有し又は有さないアリール基、ナフチル基、もしくはアントラセニル基。
(リ)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜20の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(チ)及び(リ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基であり、
その中でも、(チ)にいう「置換基」では、上記の選択肢に加え、更に、炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基及びチオエステル基が含まれ、これらの基は、炭素数1〜5であり、飽和又は不飽和の直鎖状又は分岐状であり、かつ、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化、又はニトロ化されていてもよい。)]
【0032】
(第12発明)
上記課題を解決するための本願第12発明の構成は、
イソキノリン骨格に対して、リンカーを介在させて又は介在させずに、互いに1位と4位の関係にある2個の窒素原子を含む含窒素6員環構造体又はその誘導体の一方の前記窒素原子が結合した構造を有する化合物及びその塩から選ばれる1種以上を有効成分として含有する、ADAM作用阻害剤である。
【0033】
(第13発明)
上記課題を解決するための本願第13発明の構成は、
前記リンカーが、硫黄又はりんのオキソ酸から選ばれるものである、第12発明に記載のADAM作用阻害剤である。
【0034】
(第14発明)
上記課題を解決するための本願第14発明の構成は、
前記リンカーが、あるいはリンカーが介在しない場合には前記含窒素6員環構造体又はその誘導体が、イソキノリン骨格の5位の炭素原子に結合している、第12発明又は第13発明に記載のADAM作用阻害剤である。
【0035】
(第15発明)
上記課題を解決するための本願第15発明の構成は、
前記ADAM作用阻害剤の有効成分である化合物が、下記一般式(V)で示される構造を有する化合物である、第12発明〜第14発明のいずれかに記載のADAM作用阻害剤である。
〔一般式(V)〕

[一般式(V)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;
R11は下記一般式(VI)、一般式(VII)又は一般式(VIII)で示される置換基を示す。
〔一般式(VI)〕

(一般式(VI)中、R21〜R29は単結合でも、以下に挙げる二重結合であってもよく、R21〜R29が単結合で結合している場合は、R21〜R29はそれぞれ以下の(い)〜(は)のいずれかを示し、R21〜R29はそれぞれ互いに同一であってもよく、相違していてもよい。
(い)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、もしくはニトロ基。
(ろ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(は)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜10の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
R21とR22、R23とR24、R26とR27、R28とR29が二重結合で結合している場合は、R21とR22、R23とR24、R26とR27、R28とR29はそれぞれ以下の(に)〜(ほ)のいずれかを示し、R21とR22、R23とR24、R26とR27、R28とR29はそれぞれ互いに同一であってもよく、相違していてもよい。
(に)オキソ基もしくはチオキシ基。
(ほ)置換基を有し又は有さないヒドロキシイミノ基もしくはヒドラゾノ基。
なお、(は)及び(ほ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、又はカルボキシル基である。)
〔一般式(VII)〕

(一般式(VII)中、R31〜R37は単結合でも、以下に挙げる二重結合であってもよく、R31〜R37が単結合で結合している場合は、R31〜R37はそれぞれ上記一般式(VI)における(い)〜(は)のいずれかを示し、R31〜R37はそれぞれ互いに同一であってもよく、相違していてもよい。
R34とR35、R36とR37が二重結合で結合している場合は、R34とR35、R36とR37はそれぞれ上記一般式(VI)における(に)〜(ほ)のいずれかを示し、R34とR35、R36とR37は同一であってもよく、相違していてもよい。
なお、「置換基」に関しても上記一般式(VI)と同様である。)
〔一般式(VIII)〕

(一般式(VIII)中、R41〜R45はそれぞれ、上記一般式(VI)における(い)〜(は)のいずれかを示し、R41〜R45はそれぞれ互いに同一であってもよく、相違していてもよい。
なお、「置換基」に関しても上記一般式(VI)と同様である。)]
【0036】
(第16発明)
上記課題を解決するための本願第16発明の構成は、
第1発明〜第4発明のいずれかに記載のADAM作用阻害物質のスクリーニング方法を用いて選抜される物質が、下記一般式(IX)又は一般式(X)に該当する化合物であり、これらの化合物及びその塩から選ばれる1種以上を有効成分として含有する、ADAM作用阻害剤である。
〔一般式(IX)〕

(一般式(IX)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;R51及びR52はそれぞれ水素又は任意の置換基である。)
〔一般式(X)〕

(一般式(X)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;R61〜R69はそれぞれ水素又は任意の置換基である。)
【発明の効果】
【0037】
(第1発明)
第1発明によって、ADAMの下流に働きかけてADAM作用を阻害する物質のスクリーニング方法が提供される。
【0038】
(第2発明)
第2発明によって、仮足の保持阻害又は仮足の形成阻害活性を指標としたADAM作用阻害物質のスクリーニング方法が提供される。ADAMのホモログであるVAPは血管内皮細胞に対してアポトーシスを引き起こし、当該アポトーシスにおいては仮足が形成・保持される。よって、仮足の形成、仮足の保持はADAM作用であるので、仮足の保持阻害、仮足の形成阻害をする物質は、ADAM作用を阻害する物質である。
【0039】
(第3発明)
第3発明によって、出血の阻害、特に血液凝固系ではなく血管に働きかけることによる出血の阻害活性を指標としたADAM作用阻害物質のスクリーニング方法が提供される。ADAMのホモログであるVAPは細胞間マトリックスであるコラーゲンは分解しないが、血管内皮細胞のアポトーシスを誘導する。更に、従来はプロテアーゼが血管蛋白質を分解することにより出血すると考えられてきたのであるが、VAPのプロテアーゼ反応は進行しても出血は抑止されるという本願発明者による新たな知見により、ADAM下流の信号伝達系が出血、特に血管に原因を有する出血に関与することが明らかとなった。よって、血管に原因を有する出血はADAM作用であるので、ADAM下流に働きかけ、かつ、出血を阻害する物質は、ADAM作用を阻害する。
【0040】
(第4発明)
第4発明によって、ADAM特異性のあるADAM作用阻害物質のスクリーニング方法が提供される。従来から、ADAMのメタロプロテアーゼ特異的阻害剤の創製は困難であったが、ADAM下流に働きかけてADAM作用を阻害し、かつ、ADAM特異性を有する物質は、ADAMのメタロプロテアーゼ特異的阻害剤に近似した効果を有することが期待できる。言い換えれば、ADAMではないプロテアーゼのプロテアーゼ活性が残存することは副作用が少ないことを意味する。
【0041】
(第5発明、第6発明)
第5発明によって、有用な仮足の保持方法が提供される。また、第6発明によって、有用な仮足保持剤が提供される。
本願発明者はヘビ毒の引き起こすアポトーシスにおいては、仮足の形成の他、仮足が保持されることを見出し、この点に特に着目した。通常、仮足は動的に形成・消失等の変化をする。仮足の静的な状態を作り出すことにより、仮足の構造の研究や、仮足を維持することの効果の研究、仮足の制御剤の開発等の途が提供される。
ヘビ毒の他、ADAMを用いても仮足の形成、仮足の保持がされる。よって、ADAMを用いた場合でも、ヘビ毒を用いた場合と同様の効果が得られる。
【0042】
(第7発明)
第7発明によって、有用な仮足の制御物質のスクリーニング方法が提供される。仮足は動的に形成・消失等の変化をするが、ヘビ毒は仮足を保持する、即ち、仮足の静的な状態を作り出すことができる。これにより、まず、制御物質のスクリーニング系を長時間安定して保つことが可能となる。更に、当該静的な状態からの変化は、スクリーニング対象物質が有する仮足の制御効果として認識することができる。
ヘビ毒の他、ADAMを用いても仮足の形成、仮足の保持がされる。よって、ADAMを用いた場合でも、ヘビ毒を用いた場合と同様の効果が得られる。
【0043】
(第8発明〜第11発明、第12発明〜第15発明及び第16発明)
本願第8発明〜第11発明、第12発明〜第15発明及び第16発明によって、有用なADAM作用阻害剤が提供される。これらのADAM作用阻害剤は、ADAMのプロテアーゼ反応を阻害せずにADAMの作用を阻害する。即ち、ADAMの下流のシグナル伝達に働きかけると考えられえる。これによって従来のADAM阻害剤における副作用の問題が解消される。
更には、MMP等の他の蛋白質のプロテアーゼ活性が残存する場合は、特異性の高いADAM阻害剤が提供される。
その他、従来有効なADAM阻害剤が殆ど提供されていなかったため、ADAMの関与が示唆されながらも見出されていなかったヘビ咬症出血阻害剤などのように、ADAM作用が関与する疾患において従来に治療薬が存在しなかった疾患に対する治療薬が提供される。
【図面の簡単な説明】
【0044】
【図1】化1〜5及び化11〜13についての出血量を、コントロールに対する相対比で示す棒グラフである(コントロールの表示は省略)。
【図2】化14及び化15についての出血量を、コントロールに対する相対比で示す棒グラフである。
【図3】化11及び化16〜化19についての出血量を、コントロールに対する相対比で示す棒グラフである。
【図4】化4及び化3の投与結果を示す写真である。
【図5】化11及び化16〜化19の投与結果を示す写真である。
【図6】VAPの反応進行に対して、化4が与える影響を調べた結果を示す。
【図7】生存因子除去によるアポトーシス及びヘビ毒ADAMによる仮足の保持の過程を経時的に示す。
【図8】化6の影響を示す写真である。
【図9】VAP1はコラーゲンを分解しないことを示す。
【図10】ヘビ毒ADAMが引き起こす出血についての、推測モデルを示す。
【図11】コラゲナーゼの作用に対する、ADAM作用阻害物質の影響を示す。
【図12】ヘビ毒による突起状の仮足の形成・保持と、化2による仮足の形成抑制を示す。
【発明を実施するための形態】
【0045】
次に、本発明を実施するための形態を、その最良の形態を含めて説明する。
【0046】
〔ADAM作用阻害物質のスクリーニング方法〕
本発明のADAM作用阻害物質のスクリーニング方法は、以下のa)工程とb)工程からADAMのプロテアーゼの反応進行が確認され、かつ、以下のa)工程とc)工程からADAM作用の阻害が確認された物質をADAM作用阻害物質と判定するものである。
a)ADAMのプロテアーゼ活性を備え又はADAMのプロテアーゼ活性を備えさせる検体にスクリーニング対象物質を投与又は導入する工程。
b)上記a)工程によってADAMのプロテアーゼ活性及びスクリーニング対象物質を備えた検体において、ADAMのプロテアーゼの反応進行を確認する工程。
c)上記a)工程によってADAMのプロテアーゼ活性及びスクリーニング対象物質を備えた検体において、ADAM作用の阻害を確認する工程。
【0047】
本発明のADAM作用阻害物質のスクリーニング方法において、検体は特に限定されない。細胞、器官、組織、又は個体を含む他、ADAMシグナル伝達系を構築又は再現したin vitro の系も検体とすることができる。これらのうち、細胞、器官、組織、個体を好ましい検体として例示でき、細胞、個体を更に好ましい検体として例示できる。
【0048】
細胞は特に限定されないが、血管内皮細胞、白血球細胞等を例示することができる。
【0049】
器官は特に限定されないが、血管、脳、肝臓、肺等を例示することができる。
【0050】
組織は特に限定されないが、上皮組織、結合組織、筋組織等を例示することができる。
【0051】
個体は特に限定されないが、マウス、ラット、ヒト等を例示することができる。
後述のように仮足がポドソームを伴う仮足である場合、検体としては、白血球、マクロファージ、血管内皮細胞、破骨細胞、であることが好ましく、血管内皮細胞、マクロファージ、であることがより好ましい。
【0052】
上記した検体は、ADAMのプロテアーゼ活性を備え又はADAMのプロテアーゼ活性を備えさせることが必要となる。言い換えれば、検体はADAMのプロテアーゼ活性を有することが必要であるが、検体へのスクリーニング対象物質の投与や導入と、検体がADAMのプロテアーゼ活性を備えることの順序は特に限定されない。
【0053】
検体がADAMのプロテアーゼ活性を備える方法は特に限定されない。検体にADAMそのものを添加、混合しても良いし、投与しても良いし、遺伝子発現を利用して検体にADAMを導入しても良い。検体そのものがADAMのプロテアーゼ活性を有し、ADAM作用が備わっている場合は特に検体を操作する必要はない。
【0054】
ADAMは特に限定されないが、ヘビ毒ADAM、ヒトADAM、マウスADAMを例示することができ、ヘビ毒ADAM、ヒトADAMを好ましく例示することができ、ヘビ毒ADAMにおいても出血性ヘビ毒ADAMを特に好ましく例示することができる。ヘビ毒ADAMは、VAP1及びVAP2等の出血性ヘビ毒素を含む概念である。
【0055】
ADAM作用は特に限定されないが、出血、血管退縮、仮足の形成、仮足の保持、激しいアポトーシス小胞の生成などを例示することができる。
【0056】
ADAM作用の阻害は特に限定されないが、出血阻害、血管強化、仮足の形成阻害、仮足の保持阻害、アポトーシス抑制などを例示することができる。出血阻害、仮足の保持阻害、仮足の形成阻害を好ましく例示することができ、出血阻害、仮足の保持阻害を特に好ましく例示することができる。
【0057】
仮足とは、細胞質の突出によって形成される部位をいう。通常、仮足は動的に形成・消失等の変化をする。仮足は、ポドソームを伴う仮足となる場合がある。ポドソームは浸潤のためにプロテアーゼの放出を行うことが知られている。
【0058】
仮足の形成阻害とは、仮足を形成しないということの他、形成される仮足の数、仮足の伸張・拡大の抑制を含む概念である。
【0059】
仮足の保持とは、形成された仮足が突出を維持すること、及び仮足の形成されている時間が長期化することを含む概念である。生存因子の除去により引き起こされるアポトーシスにおいては、アポトーシスが始まると仮足が形成される一方で、仮足は形成後1時間で消失してしまう。一方、ヘビ毒においては、一度形成された仮足が1時間のみならず6時間を越えても保持される。即ち、仮足の保持は、仮足の形成されている時間が長期化することを含む。
【0060】
仮足の保持阻害とは、形成された仮足が突出を維持すること、及び仮足の形成されている時間が長期化することの阻害を指す。即ち、保持阻害の結果、仮足は再び動的な変化を見せることとなる。ADAM作用阻害物質をスクリーニングする観点からは、仮足の保持が阻害された結果、仮足が結果的に消失していくことが好ましい。
【0061】
ADAM作用阻害物質のスクリーニング方法においては、スクリーニング系のコントロールの仮足の保持は、少なくとも1時間あれば良い。例えば、ヘビ毒ADAM、VAP1又はVAP2を用いることによって実現できる。仮に、スクリーニング対象物質の影響で仮足が保持時間の経過前、上記の例であれば1時間以内に消失すれば、仮足の保持阻害であるとすることができる。一方、後述の仮足保持方法、仮足保持剤に関しては、保持時間が1時間以上であることが好ましく、更に、3時間以上、6時間以上、24時間以上など、保持時間が長いことがより好ましい。仮足の保持時間は、実質的なADAMの投与量により調節可能である。
【0062】
当該仮足の形成や保持の阻害を確認する方法としては、顕微鏡を用いた経時観察が例示できる。例えば、培養細胞にVAPを投与した場合は当該細胞の挙動を観察すればよいし、個体であるマウスにVAPを投与してADAMのプロテアーゼ活性を備えさせた場合、VAPの投与部位を切除して、当該切除部位を顕微鏡を用いて観察することにより、仮足の形成阻害又は仮足の保持阻害を確認することができる。
【0063】
ADAM作用の阻害が、出血の阻害である場合、出血の阻害とは、出血を未然に防ぐ他、出血量を抑制する等、出血を抑える概念を含むものである。この場合、検体をマウスを含む個体とすることが特に好ましい。出血阻害の判定については、例えば後述の実施例に記載の方法が好ましい。出血の阻害活性を指標とする場合、スクリーニング対象物質投与区とコントロール区を分けることが好ましい。また、スクリーニング対象物質とADAMのプロテアーゼ活性の具備はほぼ同時であることが好ましい。
【0064】
即ち、ADAM作用阻害物質は、出血阻害物質、血管強化物質、仮足の形成阻害物質、仮足の保持阻害物質、アポトーシス小胞形成阻害物質などを含む概念である。
【0065】
スクリーニング対象物質は特に限定されない。好ましくは、化合物、蛋白質、核酸、抗体、抗原、糖質脂質等を例示することができ、更に好ましくは、化合物、蛋白質、核酸、抗体を例示することができ、特に好ましくは化合物、蛋白質を例示することができる。
【0066】
これらスクリーニング対象物質を投与・導入する方法も特に限定されない。投与においては、添加、混合、経口投与、経皮投与、血管投与、皮下注射、腹腔内投与、皮内注射、筋肉注射を例示することができ、導入においては、検体に遺伝子を備えさせ、又は予め備えている遺伝子を用いて、スクリーニング対象物質を発現させたり、代謝などにより生産させたりすることもできる。
【0067】
ADAMのプロテアーゼの反応進行を確認する方法は特に限定されない。好ましくは、プロテアーゼ反応の結果物を検出する方法、プロテアーゼ反応の基質の減少を確認する方法などを例示することができる。
【0068】
本発明のADAM作用阻害物質のスクリーニング方法は更に、前記a)工程と以下のd)工程からADAM特異性を確認することを含むものとしても良い。
d)スクリーニング対象物質が投与又は導入された検体におけるADAMではないプロテアーゼのプロテアーゼ活性の残存を確認する工程。
【0069】
ADAM以外のプロテアーゼのプロテアーゼ活性の残存とは、当該プロテアーゼ活性が弱まることを含む概念であるが、活性が消失することは含まない。
【0070】
上記ADAM以外のプロテアーゼは特に限定されないが、MMP、コラゲナーゼ、アグリカナーゼ、エラスターゼ等を好ましく例示することができる。また、検体はこれらの酵素のいずれか1以上を備えることが好ましい。
【0071】
〔仮足の保持方法、仮足保持剤〕
本発明の仮足の保持方法、仮足保持剤はADAMを用いる。検体にADAMそのものを添加、混合しても良いし、投与しても良いし、遺伝子発現を利用して検体にADAMを導入しても良い。ADAMは特に限定されないが、ヘビ毒ADAM、ヒトADAM、マウスADAMを例示することができ、ヘビ毒ADAM、ヒトADAMを好ましく例示することができる。ヒトADAMとしては、ADAM28、ADAM12、ADAM9が好ましく、ADAM28がより好ましい。
本発明の仮足の保持方法、仮足保持剤はポドソームを伴う仮足を形成・保持する場合がある。ポドソームは浸潤のためにプロテアーゼの放出を行うことが知られている。ポドソームを伴う仮足の構造の研究や、仮足を維持することの効果の研究、仮足の制御剤の開発等の途も提供される。
【0072】
ヘビ毒は特に限定されないが、出血性ヘビ毒が好ましい。出血性ヘビ毒としては、ガラガラヘビ毒、ハブ毒、マムシ毒等を好ましく例示することができ、ガラガラヘビ毒を特に好ましく例示することができる。更に、当該ヘビ毒は、出血性ヘビ毒素であるVAP1及びVAP2を含む概念である。
【0073】
ヘビ毒は、ガラガラヘビ等の個体であるヘビから取得しても良いし、市販品であるヘビ毒を購入しても良い。また、VAP1及びVAP2は、ガラガラヘビ毒(購入元:Sigma、和光純薬など)から上記した非特許文献4に記載の方法により取得することができる。ヒトADAMはEnzo Life Sciences、R&D Systemsなどから入手可能である。
【0074】
仮足、仮足の保持については、上記ADAM作用阻害物質のスクリーニング方法に記載の内容と同様である。
【0075】
仮足を形成可能である検体は特に限定されないが、細胞を有する検体であることが好ましく、細胞、器官、組織、個体を例示することができる。これらについては、上記ADAM作用阻害物質のスクリーニング方法に記載の内容と同様である。ポドソームを伴う仮足の保持方法とする場合、検体としては、白血球、マクロファージ、血管内皮細胞、破骨細胞、であることが好ましく、血管内皮細胞、マクロファージ、であることがより好ましい。
【0076】
〔仮足の制御物質のスクリーニング方法〕
本発明の仮足の制御物質のスクリーニング方法は、以下のe)及びf)の各工程を順序不同で含む処理工程を行い、その後以下のg)工程を含む確認工程により仮足の制御が確認された物質を仮足の制御物質と判定するものである。
e)検体である細胞、器官、組織、又は個体にADAMを投与又は導入する工程。
f)検体である細胞、器官、組織、又は個体にスクリーニング対象物質を投与又は導入する工程。
g)仮足の制御を確認する工程。
【0077】
仮足、細胞、器官、組織、個体、ADAM、スクリーニング対象物質、投与、導入に関しては、上記ADAM作用阻害物質のスクリーニング方法に記載の内容と同様である。ヘビ毒に関しては、上記仮足の保持方法、仮足保持剤に記載の内容と同様である。なお、検体としては細胞又は個体が好ましく、細胞が特に好ましい。当該細胞は、仮足を形成可能であることが要件であるが、その能力は潜在的に備えていれば足りる。
加えて、仮足は、ポドソームを伴う仮足であることが好ましい。検体は、ポドソームを伴う仮足を形成できることが好ましい。白血球、マクロファージ、血管内皮細胞、破骨細胞、であることが好ましく、血管内皮細胞、マクロファージ、であることがより好ましい。ヒトADAMを用いる場合は、ADAM28、ADAM12、ADAM9、が好ましく、ADAM28、ADAM12がより好ましい。ヒトADAMはEnzo Life Sciences、R&D Systemsなどから入手可能である。
【0078】
仮足の制御とは、動的に形成・消失等の変化をする仮足の、当該動的な変化を制御することを指す。好ましくは、仮足の形成阻害、仮足の保持阻害、仮足の伸張・変形や消失、仮足の接着性の変化等を例示することができる。
【0079】
即ち、仮足の制御物質とは、仮足の動的な変化を制御する物質である。例えば、仮足の形成阻害物質、仮足の保持阻害物質、仮足の伸張物質、仮足の変形物質、仮足を消失させる物質、仮足の接着性を変化させる物質等を例示することができる。
【0080】
当該仮足の制御を確認する方法としては、上述のような顕微鏡を用いた経時観察が例示できるほか、抗体による仮足保持細胞の検出(染色・フローサイトメトリー含む)、酵素学的検出等によっても確認することができる。アクチン染色、フォスファチジルイノシトール2リン酸(PIP2)抗体染色、を例示することができる。
【0081】
〔ADAM作用阻害剤〕
ADAM作用阻害剤は特に限定されないが、出血阻害剤、血管強化剤、仮足の形成阻害剤、仮足の保持阻害剤を例示することができ、出血阻害剤、仮足の形成阻害剤、仮足の保持阻害剤のいずれかを好ましく例示できる。出血阻害剤としては、抗出血性ヘビ毒咬症剤を好ましく例示できる。
【0082】
塩は特に限定されないが、薬学的に許容される塩が好ましい。薬学的に許容される塩は、アルカリ金属塩(例えば、リチウム塩、ナトリウム塩、カリウム塩)、アルカリ土類金属塩(例えば、マグネシウム塩、カルシウム塩)、アンモニウム塩、コリン塩、有機アミン塩、鉄塩、亜鉛塩、銅塩、マンガン塩、アルミニウム塩等が挙げられる。このうち、アルカリ金属塩、アルカリ土類金属塩、アンモニウム塩、コリン塩、有機アミン塩が好ましい。さらに、ナトリウム塩、カリウム塩、カルシウム塩、アンモニウム塩、コリン塩、有機アミン塩が特に好ましい。
【0083】
本発明のADAM作用阻害剤は、イソキノリン骨格に対して、リンカーを介在させて又は介在させずに、アルキルポリアミン又はその誘導体における一個のアミノ基を構成する窒素原子が結合した構造を有する化合物及びその塩から選ばれる1種以上を有効成分として含有するものである。
【0084】
アルキルポリアミン及びその誘導体は、2以上のアミノ基を有している。即ち、ここにいう「ポリ」とは「2以上」の意味である。また、アミノ基は、置換基を有するアミノ基を含む概念である。
【0085】
イソキノリン骨格は、少なくともイソキノリンを有し、当該骨格におけるイソキノリンに対して、アルキルポリアミン、アルキルポリアミン誘導体、又はそれらのいずれかが結合したリンカー、が結合する。
【0086】
イソキノリンの5位は、後述する一般式(I)においてXが結合している部位である。
【0087】
リンカーは特に限定されないが、硫黄又はりんのオキソ酸から選ばれるものが好ましい。硫黄(S)又はりん(P)のオキソ酸は特に限定されず、硫酸、スルフィン酸、スルフェン酸、りん酸、亜りん酸などを含む。これらがリンカーとなる場合は、硫黄原子(S)、りん原子(P)又は酸素原子(O)がアルキルポリアミン又はその誘導体、及びイソキノリン骨格と結合する。例えば、スルフェン酸がリンカーであれば、−SO2−となりスルフェン酸の硫黄原子がアルキルポリアミン又はその誘導体とイソキノリン骨格とを結ぶ。
【0088】
更に、ADAM作用阻害剤の有効成分である化合物が、下記一般式(I)で示される構造を有する化合物であることが好ましい。
〔一般式(I)〕

[一般式(I)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;
R1は以下の(イ)又は(ロ)を示し;
(イ)水素、ハロゲン、水酸基、チオール基、アルデヒド基、カルボキシル基、シアノ基又はニトロ基。
(ロ)炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基であって、これらの基は炭素数1〜5の直鎖の又は分岐を有する飽和又は不飽和のものであり、かつハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
R2は炭素数1〜5の直鎖の又は分岐を有する飽和又は不飽和炭化水素基を示し;
R3は下記一般式(II)、一般式(III)又は一般式(IV)で示される置換基を示す。
〔一般式(II)〕

(一般式(II)中、R4及びR5はそれぞれ以下の(ハ)〜(ヘ)のいずれかを示し、R4とR5は同一であってもよく、相違していてもよい。
(ハ)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基もしくはフラニル基。
(ニ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(ホ)置換基を有し又は有さないアリール基、ナフチル基もしくはアントラセニル基。
(ヘ)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜20の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(ホ)及び(ヘ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基であり、
その中でも、(ホ)にいう「置換基」では、上記の選択肢に加え、更に、炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基、チオエステル基が含まれ、これらの基は、炭素数1〜5であり、飽和又は不飽和の直鎖状又は分岐状であり、かつ、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化、又はニトロ化されていてもよい。)
【0089】
上記(ヘ)において、「置換基を有し又は有しない・・・飽和又は不飽和の」は、それに続く「炭化水素基、・・・もしくはチオエステル基」に係る。
【0090】
〔一般式(III)〕

(一般式(III)中、R6及びR7はそれぞれ、R6とR7が1以上の箇所で互いに結合を形成できる、一般式(II)におけるR4、R5が選択しうる基を示す)。
〔一般式(IV)〕

(一般式(IV)中、R8は以下の(ト)〜(リ)のいずれかを示す。
(ト)水素、ハロゲン、水酸基、チオール基、ピリジル基、ピロリジニル基、チエニル基、もしくはフラニル基。
(チ)置換基を有し又は有さないアリール基、ナフチル基、もしくはアントラセニル基。
(リ)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜20の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(チ)及び(リ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基であり、
その中でも、(チ)にいう「置換基」では、上記の選択肢に加え、更に、炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基及びチオエステル基が含まれ、これらの基は、炭素数1〜5であり、飽和又は不飽和の直鎖状又は分岐状であり、かつ、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化、又はニトロ化されていてもよい。)]
【0091】
上記(リ)において、「置換基を有し又は有しない・・・飽和又は不飽和の」は、それに続く「炭化水素基、・・・もしくはチオエステル基」に係る。
【0092】
一般式(III)における「R6とR7が1以上の箇所で互いに結合を形成できる」とは、脱水素、脱水などにより結合を形成できるという意味である。酵素などを利用して結合を形成しても良いし、化学的な反応を経て結合を形成しても良い。
【0093】
上記の「飽和」「不飽和」は炭化水素部分をあらわすものであり、例えば「不飽和アルコキシ基」とは、アルコキシ基のうち、アルキル部位に不飽和結合を有することを意味する。
【0094】
上記一般式(I)において、XはSO2が好ましい。
【0095】
上記一般式(I)において、R1は水素、ハロゲン、水酸基、アルデヒド基又はカルボキシル基が好ましく、水素、水酸基又はアルデヒド基が更に好ましく、水素が特に好ましい。
【0096】
R2は炭素数1〜3の直鎖の又は分岐を有する飽和又は不飽和炭化水素基が好ましく、炭素数2の飽和炭化水素基(−CH2CH2−)が特に好ましい。
【0097】
R3は上記した一般式(II)又は一般式(III)で示される置換基が好ましく、一般式(II)で示される置換基が特に好ましい。
【0098】
上記した一般式(II)においては、好ましくはR4及びR5はそれぞれ、以下に示す(ハ)、(ニ)又は(ヘ)の基である。
(ハ)水素、水酸基、アルデヒド基又はカルボキシル基。
(ニ)アミジノ基、グアニジノ基又はウレイド基。
(ヘ)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜10の飽和又は不飽和の炭化水素基。
なお、(ヘ)にいう置換基はフェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基である。
【0099】
上記した一般式(II)においては、更に好ましくはR4は水素、水酸基、アルデヒド基又はカルボキシル基であり、R5は以下に示す(ハ)、(ニ)又は(ヘ)の基である。
(ハ)水素。
(ニ)アミジノ基、グアニジノ基又はウレイド基。
(ヘ)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜5、好ましくは1〜3の飽和又は不飽和の炭化水素基。
なお、(ヘ)にいう置換基はフェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基である。
【0100】
上記した一般式(IV)においては、R8は水素、ハロゲン、水酸基、チオール基、ピリジル基、ピロリジニル基、チエニル基、もしくはフラニル基、置換基を有し又は有さないアリール基、ナフチル基、もしくはアントラセニル基が好ましく、水素、ハロゲン、水酸基、チオール基、ピリジル基、ピロリジニル基、チエニル基、もしくはフラニル基が特に好ましい。当該好ましい置換基は、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基である。
【0101】
なお、上記の「置換基を有し又は有さない」は、それに続く「アリール基、ナフチル基、もしくはアントラセニル基」に係る。
【0102】
より具体的には、ADAM作用阻害剤の有効成分である化合物が、後述の実施例において使用される以下の化1〜化5であることが好ましい。化1〜化5の化合物は適宜市販品の購入により入手可能である。
【0103】
【化1】

【0104】
【化2】

【0105】
【化3】

【0106】
【化4】

【0107】
【化5】

【0108】
また、本発明のADAM作用阻害剤は、イソキノリン骨格に対して、リンカーを介在させて又は介在させずに、互いに1位と4位の関係にある2個の窒素原子を含む含窒素6員環構造体又はその誘導体の一方の前記窒素原子が結合した構造を有する化合物及びその塩から選ばれる1種以上を有効成分として含有するものとすることもできる。
【0109】
イソキノリン骨格、リンカー、塩、ADAM作用阻害剤に関する記載は、上述した記載と同様である。但し、「アルキルポリアミン」に該当する部分は、「含窒素6員環構造体」となる。
【0110】
含窒素6員環構造体は、互いに1位と4位の関係にある2個の窒素原子を含むものである。即ち、1つの窒素原子を1位とした場合に、他の1つの窒素原子は4位に位置する(ベンゼン環に例えればパラ位である。)。
【0111】
イソキノリンの5位は、後述する一般式(V)においてXが結合している部位である。
【0112】
更に、ADAM作用阻害剤の有効成分である化合物が、下記一般式(V)で示される構造を有する化合物であることも好ましい。
〔一般式(V)〕

[一般式(V)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;
R11は下記一般式(VI)、一般式(VII)又は一般式(VIII)で示される置換基を示す。
〔一般式(VI)〕

(一般式(VI)中、R21〜R29は単結合でも、以下に挙げる二重結合であってもよく、R21〜R29が単結合で結合している場合は、R21〜R29はそれぞれ以下の(い)〜(は)のいずれかを示し、R21〜R29はそれぞれ互いに同一であってもよく、相違していてもよい。
(い)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、もしくはニトロ基。
(ろ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(は)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜10の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
上記(は)において、「置換基を有し又は有しない・・・飽和又は不飽和の」は、それに続く「炭化水素基、・・・もしくはチオエステル基」に係る。
R21とR22、R23とR24、R26とR27、R28とR29が二重結合で結合している場合は、R21とR22、R23とR24、R26とR27、R28とR29はそれぞれ以下の(に)〜(ほ)のいずれかを示し、R21とR22、R23とR24、R26とR27、R28とR29はそれぞれ互いに同一であってもよく、相違していてもよい。
(に)オキソ基もしくはチオキシ基。
(ほ)置換基を有し又は有さないヒドロキシイミノ基もしくはヒドラゾノ基。
なお、(は)及び(ほ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、又はカルボキシル基である。)
〔一般式(VII)〕

(一般式(VII)中、R31〜R37は単結合でも、以下に挙げる二重結合であってもよく、R31〜R37が単結合で結合している場合は、R31〜R37はそれぞれ上記一般式(VI)における(い)〜(は)のいずれかを示し、R31〜R37はそれぞれ互いに同一であってもよく、相違していてもよい。
R34とR35、R36とR37が二重結合で結合している場合は、R34とR35、R36とR37はそれぞれ上記一般式(VI)における(に)〜(ほ)のいずれかを示し、R34とR35、R36とR37は同一であってもよく、相違していてもよい。
なお、「置換基」に関しても上記一般式(VI)と同様である。)
〔一般式(VIII)〕

(一般式(VIII)中、R41〜R45はそれぞれ、上記一般式(VI)における(い)〜(は)のいずれかを示し、R41〜R45はそれぞれ互いに同一であってもよく、相違していてもよい。
なお、「置換基」に関しても上記一般式(VI)と同様である。)]
【0113】
また、例えば一般式(VI)において、R21〜R29はすべて単結合であっても良いし、二重結合を形成できる部位においては二重結合を形成していても良い。これらの組み合わせは特に限定されない。一般式(VII)においても同様である。
【0114】
一般式(V)において、XはSO2が好ましい。
【0115】
上記した一般式(VI)においてR21〜R29が単結合で結合している場合は、好ましくはR21〜R29はそれぞれ、以下に示す(い)又は(は)の基である。
(い)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基又はカルボキシル基。
(は)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜5の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(は)にいう置換基はハロゲン、水酸基、アルデヒド基、又はカルボキシル基である。
【0116】
上記した一般式(VI)においてR21〜R29が単結合で結合している場合は、より好ましくはR21〜R29はそれぞれ、以下に示す(い)又は(は)の基である。
(い)水素、水酸基、アルデヒド基又はカルボキシル基。
(は)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜3の飽和又は不飽和の炭化水素基。
なお、(は)にいう置換基はハロゲン、水酸基、アルデヒド基、又はカルボキシル基である。
【0117】
これらの好ましい、より好ましい置換基については、一般式(VII)、一般式(VIII)においても同様である。
【0118】
上記した一般式(VI)においてR21とR22、R23とR24、R26とR27、R28とR29が二重結合で結合している場合、一般式(VII)においてR34とR35、R36とR37が二重結合で結合している場合は、オキソ基であることが好ましい。
【0119】
より具体的には、ADAM作用阻害剤の有効成分である化合物が、後述の実施例において使用される以下の化6であることが好ましい。化6は市販品の購入により入手可能である。例えば、Sigma社製H−7(商品番号:I6891)を用いても良い。
【0120】
【化6】

【0121】
また、本発明のADAM作用阻害剤は、上記したADAM作用阻害物質のスクリーニング方法を用いて選抜される物質が、下記一般式(IX)又は一般式(X)に該当する化合物であり、これらの化合物及びその塩から選ばれる1種以上を有効成分として含有するものとすることもできる。
【0122】
〔一般式(IX)〕

(一般式(IX)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;R51及びR52はそれぞれ水素又は任意の置換基である。)
【0123】
上記化1〜化5はADAM作用の阻害活性である出血阻害活性及び仮足の形成、保持阻害活性を有し、一般式(IX)に示す共通の構造が見受けられる。一方で、後述の化11〜化19である化合物は一般式(IX)で表される構造を有さず、かつ、ADAM作用阻害活性も有しない。即ち、一般式(IX)で表される共通構造を有する化合物はADAM作用阻害活性を有すると推測される。
【0124】
一般式(IX)において、XはSO2が好ましい。
【0125】
上記一般式(IX)におけるR51及びR52はそれぞれ水素又は任意の置換基である。好ましくは、R51及びR52はそれぞれ以下の(ハ)〜(ヘ)のいずれかを示し、R51とR52は同一であってもよく、相違していてもよい。
(ハ)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基もしくはフラニル基。
(ニ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(ホ)置換基を有し又は有さないアリール基、ナフチル基もしくはアントラセニル基。
(ヘ)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜20の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(ホ)及び(ヘ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基であり、
その中でも、(ホ)にいう「置換基」では、上記の選択肢に加え、更に、炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基、チオエステル基が含まれ、これらの基は、炭素数1〜5であり、飽和又は不飽和の直鎖状又は分岐状であり、かつ、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化、又はニトロ化されていてもよい。)
【0126】
上記(ヘ)において、「置換基を有し又は有しない・・・飽和又は不飽和の」は、それに続く「炭化水素基、・・・もしくはチオエステル基」に係る。
【0127】
上記の「飽和」「不飽和」は炭化水素部分をあらわすものであり、例えば「不飽和アルコキシ基」とは、アルコキシ基のうち、アルキル部位に不飽和結合を有することを意味する。
【0128】
上記した一般式(IX)においては、好ましくはR51及びR52はそれぞれ、以下に示す(ハ)、(ニ)又は(ヘ)の基である。
(ハ)水素、水酸基、アルデヒド基又はカルボキシル基。
(ニ)アミジノ基、グアニジノ基又はウレイド基。
(ヘ)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜10の飽和又は不飽和の炭化水素基。
なお、(ヘ)にいう置換基はフェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基である。
【0129】
上記した一般式(IX)においては、更に好ましくはR51は水素、水酸基、アルデヒド基又はカルボキシル基であり、R52は以下に示す(ハ)、(ニ)又は(ヘ)の基である。
(ハ)水素。
(ニ)アミジノ基、グアニジノ基又はウレイド基。
(ヘ)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜5、好ましくは1〜3の飽和又は不飽和の炭化水素基。
なお、(ヘ)にいう置換基はフェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基である。
【0130】
より具体的には、有効成分である化合物が、上記化1〜化5であることが好ましい。
【0131】
〔一般式(X)〕

(一般式(X)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;R61〜R69はそれぞれ水素又は任意の置換基である。)
【0132】
上記化6と、後述の化12を対比すると、化6は6員環であるのに対し化12は7員環である点で大きく異なっている。また、化6はADAM作用の阻害活性である出血阻害活性及び仮足の形成、保持阻害活性を有する。一方で化12はADAM作用阻害活性を有しない。よって、一般式(X)で表される構造を有する化合物はADAM作用阻害活性を有することが推測される。
【0133】
一般式(X)において、XはSO2が好ましい。
【0134】
上記一般式(X)におけるR61〜R69はそれぞれ水素又は任意の置換基である。好ましくは、R61〜R69は単結合でも、以下に挙げる二重結合であってもよく、R61〜R69が単結合で結合している場合は、R61〜R69はそれぞれ以下の(い)〜(は)のいずれかを示し、R61〜R69はそれぞれ互いに同一であってもよく、相違していてもよい。
(い)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、もしくはニトロ基。
(ろ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(は)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜10の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
【0135】
上記(は)において、「置換基を有し又は有しない・・・飽和又は不飽和の」は、それに続く「炭化水素基、・・・もしくはチオエステル基」に係る。
【0136】
R61とR62、R63とR64、R66とR67、R68とR69が二重結合で結合している場合は、R61とR62、R63とR64、R66とR67、R68とR69はそれぞれ以下の(に)〜(ほ)のいずれかを示し、R61とR62、R63とR64、R66とR67、R68とR69はそれぞれ互いに同一であってもよく、相違していてもよい。
(に)オキソ基もしくはチオキシ基。
(ほ)置換基を有し又は有さないヒドロキシイミノ基もしくはヒドラゾノ基。
なお、(は)及び(ほ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、又はカルボキシル基である。)
【0137】
上記した一般式(X)においてR61〜R69が単結合で結合している場合は、好ましくはR61〜R69はそれぞれ、以下に示す基のいずれかである。
(い)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基又はカルボキシル基。
(は)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜5の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(は)にいう置換基はハロゲン、水酸基、アルデヒド基、又はカルボキシル基である。
【0138】
上記した一般式(X)においてR61〜R69が単結合で結合している場合は、より好ましくはR61〜R69はそれぞれ、以下に示す基のいずれかである。
(い)水素、水酸基、アルデヒド基又はカルボキシル基。
(は)置換基を有し又は有しない直鎖状又は分岐状の炭素数1〜3の飽和又は不飽和の炭化水素基。
なお、(は)にいう置換基はハロゲン、水酸基、アルデヒド基、又はカルボキシル基である。
【0139】
上記した一般式(X)においてR61とR62、R63とR64、R66とR67、R68とR69が二重結合で結合している場合、オキソ基であることが好ましい。
【0140】
より具体的には、有効成分である化合物が、上記化6であることが好ましい。
【0141】
塩及びADAM作用阻害剤に関する記載は、上述した記載と同様である。
【0142】
〔その他〕
ADAM作用阻害剤の有効成分である化合物は周知の方法を適宜組み合わせることによって化学的に合成することが可能である。また、周知の方法により、当該化合物の塩を得ることができる。上述した化1〜化6に記載の化合物及びその塩は、適宜市販品を用いることができる。
【0143】
上記有効成分は液体、固体等の公知の各種担体と混合し、また必要に応じて安定化剤、着色剤、矯味剤、矯臭剤、賦形剤、溶剤、界面活性剤、乳化剤、懸濁化剤、分散剤、保存剤、溶解補助剤、等張化剤、緩衝剤、無痛化剤、保湿剤、結合剤、被覆剤、潤沢剤、崩壊剤、などを加え、液剤、経口投与剤、錠剤、粉剤、坐剤、外用剤、軟膏、貼布剤、点眼剤、注射剤、散剤、顆粒剤、糖衣剤、カプセル剤、ピル、懸濁剤、アンプル、注射液、などあらゆる剤としての製剤が可能である。また、薬学的に許容される剤を上記有効成分に加えることにより、医薬とすることも可能である。
【0144】
ADAM作用阻害剤の投与量は、投与対象、年齢、性別、体重、剤形あるいは投与形式等により異なるが、投与対象が哺乳類、特にヒトの成人である場合、週1日以上、投与日1日当たり有効成分換算で1〜100mg/kg投与することが好ましい。
ADAM作用阻害剤が出血阻害剤、血管強化剤、仮足の形成阻害剤、仮足の保持阻害剤の場合も上記と同様である。
【0145】
また、ADAM作用阻害剤における「有効成分換算」とは、例えば、剤に含まれる有効成分が化合物である場合はその有効成分の質量であり、塩である場合は化合物の質量に換算して計算することを意味する。
【0146】
仮足保持剤の有効成分であるADAMは適宜市販品を用いることができる。ヘビ毒は、ガラガラヘビ等の個体であるヘビから取得しても良いし、市販品であるヘビ毒を購入しても良い。また、VAP1及びVAP2は、ガラガラヘビ毒(購入元:Sigma、和光純薬など)から上記した非特許文献4に記載の方法により取得することができる。
【0147】
上記有効成分は液体、固体等の公知の各種担体と混合し、また必要に応じて安定化剤、着色剤、矯味剤、矯臭剤、賦形剤、溶剤、界面活性剤、乳化剤、懸濁化剤、分散剤、保存剤、溶解補助剤、等張化剤、緩衝剤、無痛化剤、保湿剤、結合剤、被覆剤、潤沢剤、崩壊剤、などを加え、液剤、経口投与剤、錠剤、粉剤、坐剤、外用剤、軟膏、貼布剤、点眼剤、注射剤、散剤、顆粒剤、糖衣剤、カプセル剤、ピル、懸濁剤、アンプル、注射液、などあらゆる剤としての製剤が可能である。また、薬学的に許容される剤を上記有効成分に加えることにより、医薬とすることも可能である。
【0148】
仮足保持剤の投与量は、投与対象、年齢、性別、体重、剤形あるいは投与形式等により異なるが、投与対象が哺乳類、特にヒトの成人である場合、週1日以上、投与日1日当たり有効成分の質量で0.1〜1mg/kg投与することが好ましい。
【0149】
上述の各剤の投与回数は1回または数回に分けて投与することができる。投与計画としては、連日投与、間欠投与又はこれらの組み合わせがある。これらの投与においては医師の判断によることが必要である。
【0150】
上述の各剤の投与対象が細胞、器官、組織などである場合は投与量は特に限定されないが、投与対象に対してADAM作用阻害剤では有効成分換算で1〜100μg/ml投与が好ましい。仮足保持剤では有効性分の質量で0.1〜10μg/ml投与が好ましい。
【実施例】
【0151】
(VAP1の取得)
非特許文献2に記載の増田らのVAP1の精製法に則り、ニシダイヤガラガラヘビ(C.atrox)の粗毒(SIGMA社製:製品名Snake venom,Crotalus atrox (V7000))を25mM NaCl buffer(25mM NaCl,10mM Tris−HCl(pH 7.0),1mM CaCl2)に溶解し、CM−Sephadex C25(SIGMA−ALDRICH)column(1.5cm×9cm)を用いて精製を行い、NaCl濃度勾配(25mM−500mM,150ml)により溶出を行った。得られた各画分を非還元条件下でSDS−PAGE(10%ポリアクリルアミドゲル(分離ゲル9.73%Acrylamide(Sigma社A8887),0,27%Bis−acrylamide(Sigma社M7279)、0.1%SDS,0.375M Tris−HCl(pH8.8)の溶液10mlに10%過硫酸アンモニウム0.04mlとTEMED0.005mlを添加してゲル化)、ゲルサイズ横90mmx縦80mmx厚さ1mmに対し、泳動バッファ(0.025M Tris,0.192Mグリシン、0.1%SDS)で20mAの定電流で泳動。分子量マーカーはSigma社製 Kit for Molecular Weights 30,000−200,000 for SDS−PAGE(MWSDS200) を使用。)を行い、銀染色によって110kDaにバンドの検出が確認された画分をVAP1の溶出画分とした。さらにhydroxyapatite(生化学工業)column(1.5cm×8.5cm)を用い、上記の溶出画分に等量の25mM sodium phosphate buffer(pH7.0)を混和し、カラムに添加した。Sodium phosphate濃度勾配(0.25mM−500mM,150ml)により溶出を行った。得られた各画分を上述と同様の非還元条件下でSDS−PAGEを行い、銀染色によって110kDaにVAP1の単一なバンドを確認した。この110kDaのバンドを含む画分を精製VAP1標品として用いた。
【0152】
(VAP2の取得)
VAP1精製一段階目のCM−Sephadex C25 columnで得られた各画分を非還元条件下でSDS−PAGEを行い、銀染色によって60kDaのバンドが検出された画分をVAP2溶出画分として用いた。さらに精製を行うために、非特許文献1に記載の増田らのVAP2の精製法に則って、Phenyl Sepharose CL−4B column(0.8cm×3cm)を用いて行った。VAP2溶出画分に等量の1M ammonium sulfate buffer(1M ammonium sulfate,10mM Tris−HCl(pH7.0),1mM CaCl2)を混和し、カラムに添加した。Ammonium sulfate濃度勾配(500mM−0mM)により溶出を行った。得られた各画分を上記VAP1の取得と同様の非還元条件下でSDS−PAGEを行い、銀染色によって60kDaにVAP2のバンドを確認した。この60kDaのバンドを含む画分を精製VAP2標品として用いた。
【0153】
(VAP1、VAP2及びヒトADAMのホモロジー)
VAP1及びVAP2のアミノ酸配列は本願発明者が特定しており、下記の文献に記載されている。
VAP1:非特許文献2、VAP2:Masuda
S, Maeda H, Miao JY, Hayashi H, Araki S. cDNA
Cloning and Some Additional Peptide Characterization of a Single-Chain Vascular
Apoptosis-Inducing Protein, VAP2. Endothelium. 2007; 14(2):89-96.
【0154】
VAP1、VAP2とヒトADAM28は、アミノ酸配列の一致度はそれぞれ41%、42%である(BLASTホモロジー検索より)。この数値は、ヒトADAM28と最も近いヒトADAMは順にヒトADAM7、ヒトADAM12で、アミノ酸配列の一致度はそれぞれ41%、36%であることを考えれば、VAP1、VAP2はヒトADAMの強いホモログであると言える。また立体構造に関しては、プロテアーゼドメインの立体構造偏差は、立体構造の分かっているヒトADAM33と比べて、VAP1との立体構造偏差RMSD(Root Mean Square Deviation)は0.987Å(オングストローム)であり、非常に高い構造の一致を示している。したがってVAP1,VAP2はADAMファミリーのホモログであることが非常に強く示唆される。
【0155】
(ADAM作用阻害物質の探索)
VAPの引き起こす出血をADAM作用とし、上記化1〜化6及び以下の化11〜化19についてADAM作用の阻害活性を測定した。以降の実施例において、これらの化合物は適宜市販品を購入して用いた。
【0156】
【化11】

【0157】
【化12】

【0158】
【化13】

【0159】
【化14】

【0160】
【化15】

【0161】
【化16】

【0162】
【化17】

【0163】
【化18】

【0164】
【化19】

【0165】
VAPの引き起こす出血活性は以下のように測定した。動物は、ICRマウスの成体(2カ月齢以降)を用いた。マウスの背中の皮膚は出血を見るのに適しており、ヘビ毒の活性を見るのによく利用される。マウスの背中の皮膚内に皮内注射をすることにより、VAPの出血活性を測定した。
【0166】
マウスの尻尾を固定し、マウスを落ち着かせたのち、背中の毛を丁寧にはさみで切り、毛刈部位を4×4cmの大きさにした。当該毛刈部位をエタノールで消毒したのち、注射器(テルモシリンジ1ml、テルモ注射針27G×3/4’’)を用いて注射液を注入した。注射液は1mg/mlの精製VAP1標品溶液10μlと10mMの各化合物溶液(なお、コントロールにはリン酸緩衝生理食塩水(PBS―)またはジメチルスルフォキシド(DMSO)を用い、VAP1のみの投与となるようにした)10μlを混合したものを用いた。注入4時間後にジエチルエーテルによって犠牲にし、背中から出血斑のある部分の皮膚を剥ぎとり観察した。
【0167】
各化合物について試験は3連行い、出血量の平均値は、コントロールに対する相対比で化1が0.36、化2が0.32、化3が0.21、化4が0.16、化5が0.40、化6が0.38、化11が1.48、化12が1.38、化13が1.33、化14が1.20、化15が1.48、化16が1.26、化17が1.30、化18が1.13、化19が1.36であった。
【0168】
図1は、化1〜5及び化11〜13についての出血量を、コントロールに対する相対比で示す棒グラフであり、1となっているのはVAP1のみを投与したコントロールの出血量である。図2は、化14及び化15についての出血量を、コントロールに対する相対比で示す棒グラフである。図3は、化11及び化16〜化19についての出血量を、コントロールに対する相対比で示す棒グラフである。各バーには、標準偏差も示してある。なお、化6については図示を省略する。
【0169】
次に、上述の注射実験と同様の手順で、化3及び化4についてVAP2を用いた出血活性の測定を行った。注射液には精製VAP1標品ではなく精製VAP2標品を混合した。図4は化4(上段)及び化3(下段)の投与結果を示す写真である。左側はVAP2のみを投与(コントロール)した結果であり、右側はVAP2と化4又は化3の混合剤を投与した結果である。化3及び化4は出血阻害活性を示した。
【0170】
図5は、化11及び化16〜化19の投与結果を示す写真である。図4同様、左側はVAP1のみを投与(コントロール)した結果であり、右側はVAP1と各化合物の混合剤を投与した結果である。化11及び化16〜化19は、出血阻害活性を示さなかった。
【0171】
実験結果より、化1〜化6は出血阻害活性が認められた。上述のようにVAP1及びVAP2はADAMのホモログであるので、化1〜化6はADAM作用阻害活性を示す物質である。化1〜化6はイソキノリンに対し、リンカーであるスルフェン酸(−SO2−)を介して窒素原子が結合するという共通の構造が見受けられる。
【0172】
(ADAMの下流の確認)
化合物がVAPのタンパク質分解活性を直接阻害していないかどうかを以下の方法により調べた。切断はVAP1の分解基質の1つであるフィブロネクチンが切断されるか否かによって判断した。なお、DMSOは溶液中に化4を溶かし込む目的で使用した。
【0173】
(1)コントロールとして、フィブロネクチン(図6中では「fib」とも表現する)又はVAP1のみ、(2)1mg/mlの精製VAP1標品50mMリン酸緩衝液溶液10μl及びフィブロネクチン200μgを混合したもの(実験結果は図6中左から3列目に示す)、(3)1mg/mlの精製VAP1標品50mMリン酸緩衝液溶液10μlとDMSO 10μlの混合物をフィブロネクチン200μgと混合したもの(実験結果は図6中左から4列目に示す)、(4)1mg/mlの精製VAP1標品50mMリン酸緩衝液溶液10μlと「化4」5.2mg/mlのDMSO溶液10μlの混合物とフィブロネクチン200μgを混合したもの(実験結果は図6中最も右側の列に示し、図中ではDMSOの記載は省略する)をそれぞれリン酸緩衝生理食塩水(PBS―)(pH7.0))100μl中で、それぞれ24時間、37℃でインキュベートした。これらの混合液を回収しSDS−PAGEを行ったあと、銀染色を施した。
【0174】
実験結果を図6に示す。上記(2)〜(4)の結果から明らかであるように化4が存在しても、VAP1の反応が進行することが確認できた。化1〜化6の他の化合物についても同様の結果を得た。
【0175】
また、VAP1とVAP2のホモロジー及び上述したADAM作用阻害物質の探索の実験結果から、VAP2においても同様の現象が見られることが推測された。
【0176】
即ち、化1〜化6はADAMシグナル伝達系におけるADAMの下流に働きかけることが示された。
【0177】
(VAPと仮足)
ヘビ毒ADAMであるVAP1と血管内皮細胞を用いて、VAPの引き起こす仮足の形成、保持について調べた。
【0178】
細胞はJaffeらの方法(Jaffe,
E. A., Nachman, R. L., Becher,
C. G., and Minick, R. C. (1973) Culture of human
endothelial cells derived from umbilical veins. J. Clin. Invest. 52,
2745-2756.)によって得たヒト臍帯血管内皮細胞(HUVEC)を使用した。培養液はMCDB105培養液(Sigma社製)に、混合後の最終濃度でウシ胎仔血清を10%(v/v)および、FGF 70ng/ml (LobbおよびFettの方法 (Lobb,
R. R., and Fett, J. W. (1984) Purification of two
distinct growth factors bovine neural tissue by heparin affinity
chromatography. Biochemistry 23,
6295-6299) でウシの脳より抽出) 、ヘパリン100μg/mlを加えた物を用いた。培養条件としては、HUVECを0.1%ゼラチンコートしたプラスチックディッシュ上にまき、培養液により37℃、5%CO2、95% airの条件で培養を行った。
【0179】
生存因子の除去は、血清・FGF無添加の培養液に培養液を交換することにより行った。一方、ヘビ毒によるアポトーシスにおいて添加する毒素は上述のニシダイヤガラガラヘビ(C.atrox)の粗毒を用い、最終濃度1μg/mlになるように添加した。上記培養液の交換直後にニシダイヤガラガラヘビの粗毒を添加し、細胞をタイムラプスビデオ(位相差顕微鏡を使用)により撮影した。
【0180】
実験結果を図7に示す。A〜Cは生存因子除去によるアポトーシスの過程を経時的に示すものである。0時間の細胞(A)は、生存因子除去後24時間程度でアポトーシスが始まると仮足を形成する(細胞体に比して小さなでこぼこは仮足の形成を示す)が(B)、仮足形成1時間後には仮足は消失して球形になり(C)、以降もこのままの形態である。
なお、アポトーシスで見られるのと同様なブレッビング(小胞)が仮足の形態の一つであるということは、最近の知見で分かってきたことである。例えば、以下の文献に記載されている:参考文献G.T.Charras、A Short History of Blebbing. Journal of Microscopy,231:466−478(2008)
【0181】
D〜Fは、上述のニシダイヤガラガラヘビ粗毒による仮足の変化の過程を経時的に示すものである。0時間の細胞(D)は、生存因子除去及びニシダイヤガラガラヘビ粗毒添加後24時間程度で、生存因子除去の場合と同様に仮足を形成するが(E)、仮足形成後6時間以上経過しても仮足は消失せず保持されたまま(F)、以降もこのままの形態を保つ。
【0182】
VAP1、VAP2についても同様の実験結果を得た。
即ち、ヘビ毒を用いるという簡便な方法で仮足の形成、仮足の保持ができることが示された。
【0183】
(ヘビ毒ADAMとADAM作用阻害物質)
ヘビ毒ADAMであるVAP1とADAM作用阻害物質である化6を用いて、仮足の形成、保持に対する化6の効果を調べた。
【0184】
上述と同様の方法により調製したヒト臍帯血管内皮細胞(HUVEC)及び培養液を用いた。培養条件としては、HUVECを0.1%ゼラチンコートしたプラスチックディッシュ上にまき、培養液により37℃、5%CO2、95%airの条件で培養を行った。
【0185】
血清・FGF無添加の培養液に培養液を交換し、コントロールは培養液の交換直後に精製した標品であるVAP1を最終濃度10μg/mlになるように添加し、24時間培養を続けた。一方、化6投与区は最終濃度でVAP1が10μg/ml、及び化6が30μMになるように添加し、24時間培養を続けた。
【0186】
実験結果を図8に示す。図8Aはコントロールの結果であり、VAP1の添加後24時間の細胞を示す。細胞体に比して小さなでこぼこは仮足の形成を示し、24時間後も保持されている様子が分かる。図8BはVAP1及び化6の投与後24時間の細胞を示す。細胞体は滑らかな球状になり、仮足が見られない。
また、図示は省略するが、VAP1を添加して細胞に仮足を形成させ、その後化6を投与すると、仮足が消失した。化1〜化6の他の化合物についても、同様の結果を得た。
【0187】
即ち、ヘビ毒ADAMによる仮足保持は、化1〜化6によって阻害された。また、化1〜化6によりVAPによる仮足の形成が阻害された。即ち、化1〜化6はADAM作用阻害活性を示した。また、化1〜化6は仮足の制御活性をも示した。
【0188】
(ヘビ毒ADAMの血管への作用)
以下の論文により、ヘビ毒ADAMは血管に作用することが示されている。
Araki
S, Masuda S, Maeda H, Ying MJ, Hayashi H. Involvement of specific integrins in apoptosis induced by vascular
apoptosis-inducing protein 1. Toxicon.
2002 May;40(5):535-42.
【0189】
図9上段(コラーゲン溶液の分解)について説明する。コラーゲン50μgを0.2μgの精製した標品であるVAP1またはガラガラヘビ毒2μgと37℃で24時間インキュベートした。反応液は10mMTris−HCl(pH7.0)、1mMCaCl2、2.5mg/ml α―gelatin(シグマ)にVAP1を10μg/mlまたはガラガラヘビ毒100μg/mlを添加した。各サンプルをポリアクリルアミドSDS電気泳動で分画し、クーマシーブリリアントブルーで染色し、検出した。図9左側(レーン1)はコラーゲンのみインキュベートしたもの、図9中央(レーン2)はコラーゲンとVAP1をインキュベートしたもの、図9右側(レーン3)はコラーゲンとガラガラヘビ毒をインキュベートしたものである。
【0190】
図9下段(培養皿ゼラチンコートの分解)について説明する。コラーゲンコートされた培養皿をVAP1またはガラガラヘビ毒で5日間インキュベートし、後にヒトさい帯血管内皮細胞を植えることにより、コラーゲンの接着能力が棄損されているかどうかを調べた。コラーゲンコートした培養皿を、培養液(A)、ガラガラヘビ毒素(10μg/ml)添加培養液(B)、VAP1(1μg/ml)添加培養液(C)で5日間インキュベートし、後にヒトさい帯血管内皮細胞を植えて6時間後の様子を光学顕微鏡で撮影した。
【0191】
図9に示すように、VAP1はコラーゲンを分解しないことが示されている。即ち、VAP1は血管の細胞外マトリックスは分解しない。
ヘビ毒ADAMは血管内皮細胞のアポトーシスを引き起こす一方で、血管の細胞外マトリックスは分解しないことが明らかとなった。よって、図10に示すような出血モデルを推測することができる。上記した化1〜化6は、図10中の「信号伝達阻害物質」に該当すると推測される。
【0192】
(MMPであるコラゲナーゼとADAM作用阻害物質)
コラゲナーゼ出血へのADAM作用阻害物質の影響を以下のように測定した。動物は、ICRマウスの成体(2カ月齢以降)を用い、マウスの背中の皮膚内に皮内注射をすることにより、コラゲナーゼの出血活性を測定した。マウスの尻尾を固定し、マウスを落ち着かせたのち、背中の毛を丁寧にはさみで切り、毛刈部位を4×4cmの大きさにした。当該毛刈部位をエタノールで消毒したのち、注射器(テルモシリンジ1ml、テルモ注射針27G×3/4’’)を用いて注射液を注入した。注射液は0.8mg/mlのコラゲナーゼ(Sigma社製、製品名Collagenase from Clostridium histolyticum(C0130))10μlと10mMの「化4」溶液(なお、コントロールには溶媒ジメチルスルフォキシドを用い、投与物質がコラゲナーゼのみとなるようにした)10μlを混合したものを用いた。注入4時間後にジエチルエーテルによって犠牲にし、背中から出血斑のある部分の皮膚を剥ぎとり観察した。
【0193】
実験結果を図11に示す。左側はコラゲナーゼのみを投与(コントロール)した結果であり、右側はコラゲナーゼと化4の混合剤を投与した結果である。また、化1〜化6の他の化合物についても同様の結果を得た。
【0194】
即ち、ADAM作用阻害物質はMMPであるコラゲナーゼの作用である出血を阻害できないことが示された。これは、ADAM作用阻害物質が他のプロテアーゼの作用を阻害しないことを示す。言い換えれば、ADAMの下流に作用するADAM作用阻害物質は副作用が少ない。また、コラゲナーゼの作用である出血を阻害できないことから、ADAM作用阻害物質を加えてもコラゲナーゼのプロテアーゼ活性が残存していることが合理的に推測される。
【0195】
(VAPと仮足−2−)
ヘビ毒及びヘビ毒ADAMであるVAP2と、化2を用いて、仮足の形成、保持に対する化2の効果を確認的に検討した。
【0196】
上述の「(VAPと仮足)」と同様の方法により調製したヒト臍帯血管内皮細胞(HUVEC)及び培養液を用いた。培養条件としては、HUVECを0.1%ゼラチンコートしたスライドガラスを置いたプラスチックディッシュ上に撒き、培養液により37℃、5%CO2,95%airの条件で培養を行った。
【0197】
血清・FGF無添加の培養液に培養液を交換し、培養液の交換直後に上述の「(VAP1の取得)」、「(VAP2の取得)」に用いたニシダイヤガラガラヘビの粗毒又は精製した標品であるVAP2を最終濃度10μg/mlになるように添加し、4時間培養を続けた。また、化2投与区は最終濃度で上記ヘビ毒又はVAP2が10μg/ml、及び化2が10μMになるように添加し、4時間培養を続けた。コントロールは、培養液の交換後ニシダイヤガラガラヘビの粗毒、VAP2、及び化2の添加をせず、そのまま4時間培養を続けた。
【0198】
4時間培養後、細胞を4%パラホルムアルデヒドで固定し、100倍希釈したAlexaFluor488ファロイジン(Molecular Probe社)で1時間、アクチンを染色し、その後洗浄して蛍光観察した。蛍光観察は蛍光顕微鏡BZ−9000(KEYENCE社)を用い、励起波長470nm、吸収波長535nm、対物レンズ40倍で観察・撮影した。
上述の「(VAPと仮足)」の実施例においては、生存因子の除去/ニシダイヤガラガラヘビの粗毒・VAPを添加した後24時間程度経てからアポトーシスが始まった。パラホルムアルデヒドによる固定は生存因子の除去/ニシダイヤガラガラヘビの粗毒・VAPを添加した後4時間の時点で行ったので、アポトーシスは始まっていなかった。
【0199】
ニシダイヤガラガラヘビの粗毒を使用した実験結果を図12に示す。図12Aは培養液交換後4時間のコントロールの実験結果であり、繊維状のアクチン蛋白質の骨格が見られ、際立った仮足の形成は見られない。
【0200】
図12Bは、ニシダイヤガラガラヘビの粗毒添加後4時間の細胞を示す。骨格タンパク質であるアクチンを染色しているので、強い蛍光を示す部位はアクチンの集積を意味する。細胞の先端にアクチンの集積を伴う細長い突起状の仮足が形成されている。仮足には顆粒状またはリング状のポドソームが見られるものも多い。図12Bは上記ヘビ毒添加4時間後の仮足で、この仮足は上記ヘビ毒の添加後30分後に観察され24時間程度まで続いた。24時間程度すると仮足がつぶつぶしてきて、図7Eや図8Aのようになった。
【0201】
図12Cは上記ヘビ毒及び化2の添加後4時間の細胞を示す。12Bに比べて突起状の仮足は少なくアクチンの集積が弱まっており、仮足の形成が抑制された。
【0202】
ヘビ毒ADAMであるVAP2についても同様の結果を得た。上述の通り、VAP2はヒトADAMのホモログである。よって、ヘビ毒ADAMやヒトADAMの投与・導入等により、仮足の形成、仮足の保持ができることが有効に推測される。
【産業上の利用可能性】
【0203】
本発明によって、有用なADAM作用阻害物質のスクリーニング方法、仮足の保持方法、仮足保持剤、仮足の制御物質のスクリーニング方法、及びADAM作用阻害剤が提供される。
【特許請求の範囲】
【請求項1】
以下のa)工程とb)工程からADAMのプロテアーゼの反応進行が確認され、かつ、以下のa)工程とc)工程からADAM作用の阻害が確認された物質をADAM作用阻害物質と判定することを特徴とするADAM作用阻害物質のスクリーニング方法。
a)ADAMのプロテアーゼ活性を備え又はADAMのプロテアーゼ活性を備えさせる検体にスクリーニング対象物質を投与又は導入する工程。
b)上記a)工程によってADAMのプロテアーゼ活性及びスクリーニング対象物質を備えた検体において、ADAMのプロテアーゼの反応進行を確認する工程。
c)上記a)工程によってADAMのプロテアーゼ活性及びスクリーニング対象物質を備えた検体において、仮足の保持阻害又は仮足の形成阻害を確認する工程。
【請求項2】
前記a)工程における検体が、細胞、器官、組織、又は個体であることを特徴とする請求項1に記載のADAM作用阻害物質のスクリーニング方法。
【請求項3】
前記ADAMが、ヒトADAM又はヘビ毒ADAMであることを特徴とする、請求項1又は請求項2に記載のADAM作用阻害物質のスクリーニング方法。
【請求項4】
前記ADAM作用阻害物質のスクリーニング方法が、前記a)工程と以下のd)工程からADAM特異性を確認することを含むことを特徴とする請求項1〜請求項3のいずれかに記載のADAM作用阻害物質のスクリーニング方法。
d)スクリーニング対象物質が投与又は導入された検体におけるADAM以外のプロテアーゼのプロテアーゼ活性の残存を確認する工程。
【請求項5】
仮足を形成可能である検体に対して、ADAMを用いることを特徴とする仮足の保持方法。
【請求項6】
ADAMを有効成分とすることを特徴とする仮足保持剤。
【請求項7】
以下のe)及びf)の各工程を順序不同で含む処理工程を行い、その後以下のg)工程を含む確認工程により仮足の制御が確認された物質を仮足の制御物質と判定することを特徴とする仮足の制御物質のスクリーニング方法。
e)検体である細胞、器官、組織、又は個体にADAMを投与又は導入する工程。
f)検体である細胞、器官、組織、又は個体にスクリーニング対象物質を投与又は導入する工程。
g)仮足の制御を確認する工程。
【請求項8】
イソキノリン骨格に対して、リンカーを介在させて又は介在させずに、アルキルポリアミン又はその誘導体における一個のアミノ基を構成する窒素原子が結合した構造を有する化合物及びその塩から選ばれる1種以上を有効成分として含有することを特徴とするADAM作用阻害剤。
【請求項9】
前記リンカーが、硫黄又はりんのオキソ酸から選ばれるものであることを特徴とする請求項8に記載のADAM作用阻害剤。
【請求項10】
前記リンカーが、あるいはリンカーが介在しない場合にはアルキルポリアミン又はその誘導体が、イソキノリン骨格の5位の炭素原子に結合していることを特徴とする請求項8又は請求項9に記載のADAM作用阻害剤。
【請求項11】
前記ADAM作用阻害剤の有効成分である化合物が、下記一般式(I)で示される構造を有する化合物であることを特徴とする請求項8〜請求項10のいずれかに記載のADAM作用阻害剤。
〔一般式(I)〕
【化1】

[一般式(I)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;
R1は以下の(イ)又は(ロ)を示し;
(イ)水素、ハロゲン、水酸基、チオール基、アルデヒド基、カルボキシル基、シアノ基又はニトロ基。
(ロ)炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基であって、これらの基は炭素数1〜5の直鎖の又は分岐を有する飽和又は不飽和のものであり、かつハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
R2は炭素数1〜5の直鎖の又は分岐を有する飽和又は不飽和炭化水素基を示し;
R3は下記一般式(II)、一般式(III)又は一般式(IV)で示される置換基を示す。
〔一般式(II)〕
【化2】

(一般式(II)中、R4及びR5はそれぞれ以下の(ハ)〜(ヘ)のいずれかを示し、R4とR5は同一であってもよく、相違していてもよい。
(ハ)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基もしくはフラニル基。
(ニ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(ホ)置換基を有し又は有さないアリール基、ナフチル基もしくはアントラセニル基。
(ヘ)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜20の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(ホ)及び(ヘ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基であり、
その中でも、(ホ)にいう「置換基」では、上記の選択肢に加え、更に、炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基、チオエステル基が含まれ、これらの基は、炭素数1〜5であり、飽和又は不飽和の直鎖状又は分岐状であり、かつ、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化、又はニトロ化されていてもよい。)
〔一般式(III)〕
【化3】

(一般式(III)中、R6及びR7はそれぞれ、R6とR7が1以上の箇所で互いに結合を形成できる、一般式(II)におけるR4、R5が選択しうる基を示す)。
〔一般式(IV)〕
【化4】

(一般式(IV)中、R8は以下の(ト)〜(リ)のいずれかを示す。
(ト)水素、ハロゲン、水酸基、チオール基、ピリジル基、ピロリジニル基、チエニル基、もしくはフラニル基。
(チ)置換基を有し又は有さないアリール基、ナフチル基、もしくはアントラセニル基。
(リ)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜20の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(チ)及び(リ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基であり、
その中でも、(チ)にいう「置換基」では、上記の選択肢に加え、更に、炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基及びチオエステル基が含まれ、これらの基は、炭素数1〜5であり、飽和又は不飽和の直鎖状又は分岐状であり、かつ、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化、又はニトロ化されていてもよい。)]
【請求項12】
イソキノリン骨格に対して、リンカーを介在させて又は介在させずに、互いに1位と4位の関係にある2個の窒素原子を含む含窒素6員環構造体又はその誘導体の一方の前記窒素原子が結合した構造を有する化合物及びその塩から選ばれる1種以上を有効成分として含有することを特徴とするADAM作用阻害剤。
【請求項13】
前記リンカーが、硫黄又はりんのオキソ酸から選ばれるものであることを特徴とする請求項12に記載のADAM作用阻害剤。
【請求項14】
前記リンカーが、あるいはリンカーが介在しない場合には前記含窒素6員環構造体又はその誘導体が、イソキノリン骨格の5位の炭素原子に結合していることを特徴とする請求項12又は請求項13に記載のADAM作用阻害剤。
【請求項15】
前記ADAM作用阻害剤の有効成分である化合物が、下記一般式(V)で示される構造を有する化合物であることを特徴とする請求項12〜請求項14のいずれかに記載のADAM作用阻害剤。
〔一般式(V)〕
【化5】

[一般式(V)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;
R11は下記一般式(VI)、一般式(VII)又は一般式(VIII)で示される置換基を示す。
〔一般式(VI)〕
【化6】

(一般式(VI)中、R21〜R29は単結合でも、以下に挙げる二重結合であってもよく、R21〜R29が単結合で結合している場合は、R21〜R29はそれぞれ以下の(い)〜(は)のいずれかを示し、R21〜R29はそれぞれ互いに同一であってもよく、相違していてもよい。
(い)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、もしくはニトロ基。
(ろ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(は)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜10の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
R21とR22、R23とR24、R26とR27、R28とR29が二重結合で結合している場合は、R21とR22、R23とR24、R26とR27、R28とR29はそれぞれ以下の(に)〜(ほ)のいずれかを示し、R21とR22、R23とR24、R26とR27、R28とR29はそれぞれ互いに同一であってもよく、相違していてもよい。
(に)オキソ基もしくはチオキシ基。
(ほ)置換基を有し又は有さないヒドロキシイミノ基もしくはヒドラゾノ基。
なお、(は)及び(ほ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、又はカルボキシル基である。)
〔一般式(VII)〕
【化7】

(一般式(VII)中、R31〜R37は単結合でも、以下に挙げる二重結合であってもよく、R31〜R37が単結合で結合している場合は、R31〜R37はそれぞれ上記一般式(VI)における(い)〜(は)のいずれかを示し、R31〜R37はそれぞれ互いに同一であってもよく、相違していてもよい。
R34とR35、R36とR37が二重結合で結合している場合は、R34とR35、R36とR37はそれぞれ上記一般式(VI)における(に)〜(ほ)のいずれかを示し、R34とR35、R36とR37は同一であってもよく、相違していてもよい。
なお、「置換基」に関しても上記一般式(VI)と同様である。)
〔一般式(VIII)〕
【化8】

(一般式(VIII)中、R41〜R45はそれぞれ、上記一般式(VI)における(い)〜(は)のいずれかを示し、R41〜R45はそれぞれ互いに同一であってもよく、相違していてもよい。
なお、「置換基」に関しても上記一般式(VI)と同様である。)]
【請求項16】
請求項1〜請求項4のいずれかに記載のADAM作用阻害物質のスクリーニング方法を用いて選抜される物質が、下記一般式(IX)又は一般式(X)に該当する化合物であり、これらの化合物及びその塩から選ばれる1種以上を有効成分として含有することを特徴とするADAM作用阻害剤。
〔一般式(IX)〕
【化9】

(一般式(IX)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;R51及びR52はそれぞれ水素又は任意の置換基である。)
〔一般式(X)〕
【化10】

(一般式(X)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;R61〜R69はそれぞれ水素又は任意の置換基である。)
【請求項1】
以下のa)工程とb)工程からADAMのプロテアーゼの反応進行が確認され、かつ、以下のa)工程とc)工程からADAM作用の阻害が確認された物質をADAM作用阻害物質と判定することを特徴とするADAM作用阻害物質のスクリーニング方法。
a)ADAMのプロテアーゼ活性を備え又はADAMのプロテアーゼ活性を備えさせる検体にスクリーニング対象物質を投与又は導入する工程。
b)上記a)工程によってADAMのプロテアーゼ活性及びスクリーニング対象物質を備えた検体において、ADAMのプロテアーゼの反応進行を確認する工程。
c)上記a)工程によってADAMのプロテアーゼ活性及びスクリーニング対象物質を備えた検体において、仮足の保持阻害又は仮足の形成阻害を確認する工程。
【請求項2】
前記a)工程における検体が、細胞、器官、組織、又は個体であることを特徴とする請求項1に記載のADAM作用阻害物質のスクリーニング方法。
【請求項3】
前記ADAMが、ヒトADAM又はヘビ毒ADAMであることを特徴とする、請求項1又は請求項2に記載のADAM作用阻害物質のスクリーニング方法。
【請求項4】
前記ADAM作用阻害物質のスクリーニング方法が、前記a)工程と以下のd)工程からADAM特異性を確認することを含むことを特徴とする請求項1〜請求項3のいずれかに記載のADAM作用阻害物質のスクリーニング方法。
d)スクリーニング対象物質が投与又は導入された検体におけるADAM以外のプロテアーゼのプロテアーゼ活性の残存を確認する工程。
【請求項5】
仮足を形成可能である検体に対して、ADAMを用いることを特徴とする仮足の保持方法。
【請求項6】
ADAMを有効成分とすることを特徴とする仮足保持剤。
【請求項7】
以下のe)及びf)の各工程を順序不同で含む処理工程を行い、その後以下のg)工程を含む確認工程により仮足の制御が確認された物質を仮足の制御物質と判定することを特徴とする仮足の制御物質のスクリーニング方法。
e)検体である細胞、器官、組織、又は個体にADAMを投与又は導入する工程。
f)検体である細胞、器官、組織、又は個体にスクリーニング対象物質を投与又は導入する工程。
g)仮足の制御を確認する工程。
【請求項8】
イソキノリン骨格に対して、リンカーを介在させて又は介在させずに、アルキルポリアミン又はその誘導体における一個のアミノ基を構成する窒素原子が結合した構造を有する化合物及びその塩から選ばれる1種以上を有効成分として含有することを特徴とするADAM作用阻害剤。
【請求項9】
前記リンカーが、硫黄又はりんのオキソ酸から選ばれるものであることを特徴とする請求項8に記載のADAM作用阻害剤。
【請求項10】
前記リンカーが、あるいはリンカーが介在しない場合にはアルキルポリアミン又はその誘導体が、イソキノリン骨格の5位の炭素原子に結合していることを特徴とする請求項8又は請求項9に記載のADAM作用阻害剤。
【請求項11】
前記ADAM作用阻害剤の有効成分である化合物が、下記一般式(I)で示される構造を有する化合物であることを特徴とする請求項8〜請求項10のいずれかに記載のADAM作用阻害剤。
〔一般式(I)〕
【化1】

[一般式(I)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;
R1は以下の(イ)又は(ロ)を示し;
(イ)水素、ハロゲン、水酸基、チオール基、アルデヒド基、カルボキシル基、シアノ基又はニトロ基。
(ロ)炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基であって、これらの基は炭素数1〜5の直鎖の又は分岐を有する飽和又は不飽和のものであり、かつハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
R2は炭素数1〜5の直鎖の又は分岐を有する飽和又は不飽和炭化水素基を示し;
R3は下記一般式(II)、一般式(III)又は一般式(IV)で示される置換基を示す。
〔一般式(II)〕
【化2】

(一般式(II)中、R4及びR5はそれぞれ以下の(ハ)〜(ヘ)のいずれかを示し、R4とR5は同一であってもよく、相違していてもよい。
(ハ)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基もしくはフラニル基。
(ニ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(ホ)置換基を有し又は有さないアリール基、ナフチル基もしくはアントラセニル基。
(ヘ)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜20の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(ホ)及び(ヘ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基であり、
その中でも、(ホ)にいう「置換基」では、上記の選択肢に加え、更に、炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基、チオエステル基が含まれ、これらの基は、炭素数1〜5であり、飽和又は不飽和の直鎖状又は分岐状であり、かつ、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化、又はニトロ化されていてもよい。)
〔一般式(III)〕
【化3】

(一般式(III)中、R6及びR7はそれぞれ、R6とR7が1以上の箇所で互いに結合を形成できる、一般式(II)におけるR4、R5が選択しうる基を示す)。
〔一般式(IV)〕
【化4】

(一般式(IV)中、R8は以下の(ト)〜(リ)のいずれかを示す。
(ト)水素、ハロゲン、水酸基、チオール基、ピリジル基、ピロリジニル基、チエニル基、もしくはフラニル基。
(チ)置換基を有し又は有さないアリール基、ナフチル基、もしくはアントラセニル基。
(リ)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜20の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
なお、(チ)及び(リ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、ニトロ基、ピリジル基、ピロリジニル基、チエニル基、フラニル基、フェニル基、ハロゲン化フェニル基、ベンジル基、ハロゲン化ベンジル基、ベンゾイル基又はハロゲン化ベンゾイル基であり、
その中でも、(チ)にいう「置換基」では、上記の選択肢に加え、更に、炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基及びチオエステル基が含まれ、これらの基は、炭素数1〜5であり、飽和又は不飽和の直鎖状又は分岐状であり、かつ、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化、又はニトロ化されていてもよい。)]
【請求項12】
イソキノリン骨格に対して、リンカーを介在させて又は介在させずに、互いに1位と4位の関係にある2個の窒素原子を含む含窒素6員環構造体又はその誘導体の一方の前記窒素原子が結合した構造を有する化合物及びその塩から選ばれる1種以上を有効成分として含有することを特徴とするADAM作用阻害剤。
【請求項13】
前記リンカーが、硫黄又はりんのオキソ酸から選ばれるものであることを特徴とする請求項12に記載のADAM作用阻害剤。
【請求項14】
前記リンカーが、あるいはリンカーが介在しない場合には前記含窒素6員環構造体又はその誘導体が、イソキノリン骨格の5位の炭素原子に結合していることを特徴とする請求項12又は請求項13に記載のADAM作用阻害剤。
【請求項15】
前記ADAM作用阻害剤の有効成分である化合物が、下記一般式(V)で示される構造を有する化合物であることを特徴とする請求項12〜請求項14のいずれかに記載のADAM作用阻害剤。
〔一般式(V)〕
【化5】

[一般式(V)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;
R11は下記一般式(VI)、一般式(VII)又は一般式(VIII)で示される置換基を示す。
〔一般式(VI)〕
【化6】

(一般式(VI)中、R21〜R29は単結合でも、以下に挙げる二重結合であってもよく、R21〜R29が単結合で結合している場合は、R21〜R29はそれぞれ以下の(い)〜(は)のいずれかを示し、R21〜R29はそれぞれ互いに同一であってもよく、相違していてもよい。
(い)水素、ハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、カルボキシル基、シアノ基、アジド基、もしくはニトロ基。
(ろ)アミノ基、アミジノ基、グアニジノ基、ウレイド基、ヒドラジノ基、ジアゼニル基もしくはヒドロキシアミノ基であって、これらの基は、第1に炭素数1〜5の直鎖の又は分岐の飽和又は不飽和の炭化水素基を有してもよく、第2に、第1に記載した炭化水素基も含めて、ハロゲン化、水酸化、チオール化、アルデヒド化、オキソ化、カルボキシル化、シアノ化又はニトロ化されていてもよい。
(は)置換基を有し又は有しない直鎖、分岐又は環状の炭素数1〜10の飽和又は不飽和の炭化水素基、アルコキシ基、チオアルコキシ基、アリルオキシ基、アリルチオ基、エーテル基、チオエーテル基、エステル基もしくはチオエステル基。
R21とR22、R23とR24、R26とR27、R28とR29が二重結合で結合している場合は、R21とR22、R23とR24、R26とR27、R28とR29はそれぞれ以下の(に)〜(ほ)のいずれかを示し、R21とR22、R23とR24、R26とR27、R28とR29はそれぞれ互いに同一であってもよく、相違していてもよい。
(に)オキソ基もしくはチオキシ基。
(ほ)置換基を有し又は有さないヒドロキシイミノ基もしくはヒドラゾノ基。
なお、(は)及び(ほ)にいう「置換基」はハロゲン、水酸基、チオール基、アルデヒド基、チオアルデヒド基、又はカルボキシル基である。)
〔一般式(VII)〕
【化7】

(一般式(VII)中、R31〜R37は単結合でも、以下に挙げる二重結合であってもよく、R31〜R37が単結合で結合している場合は、R31〜R37はそれぞれ上記一般式(VI)における(い)〜(は)のいずれかを示し、R31〜R37はそれぞれ互いに同一であってもよく、相違していてもよい。
R34とR35、R36とR37が二重結合で結合している場合は、R34とR35、R36とR37はそれぞれ上記一般式(VI)における(に)〜(ほ)のいずれかを示し、R34とR35、R36とR37は同一であってもよく、相違していてもよい。
なお、「置換基」に関しても上記一般式(VI)と同様である。)
〔一般式(VIII)〕
【化8】

(一般式(VIII)中、R41〜R45はそれぞれ、上記一般式(VI)における(い)〜(は)のいずれかを示し、R41〜R45はそれぞれ互いに同一であってもよく、相違していてもよい。
なお、「置換基」に関しても上記一般式(VI)と同様である。)]
【請求項16】
請求項1〜請求項4のいずれかに記載のADAM作用阻害物質のスクリーニング方法を用いて選抜される物質が、下記一般式(IX)又は一般式(X)に該当する化合物であり、これらの化合物及びその塩から選ばれる1種以上を有効成分として含有することを特徴とするADAM作用阻害剤。
〔一般式(IX)〕
【化9】

(一般式(IX)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;R51及びR52はそれぞれ水素又は任意の置換基である。)
〔一般式(X)〕
【化10】

(一般式(X)中、XはSO2又はPO2Hを示し、当該硫黄原子またはりん原子にイソキノリン及び窒素原子が結合しており;R61〜R69はそれぞれ水素又は任意の置換基である。)
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2011−244814(P2011−244814A)
【公開日】平成23年12月8日(2011.12.8)
【国際特許分類】
【出願番号】特願2011−99107(P2011−99107)
【出願日】平成23年4月27日(2011.4.27)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【Fターム(参考)】
【公開日】平成23年12月8日(2011.12.8)
【国際特許分類】
【出願日】平成23年4月27日(2011.4.27)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【Fターム(参考)】
[ Back to top ]

