B型肝炎ウィルス感染モデルヒト肝細胞
【課題】ヒト生体でのHBV感染を再現したHBV感染モデルヒト肝細胞であって、安定供給できる細胞を提供する。
【解決手段】免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を分離する第2工程と、分離したヒト肝細胞にHBVを感染させる第3工程とを含む方法により得られるB型肝炎ウィルス感染モデル細胞。更に、被験物質の供給により培養上清中又は細胞内のB型肝炎ウィルス量が50%以下になる被験物質を選択する第3工程とを含むB型肝炎の予防又は治療剤のスクリーニング方法。
【解決手段】免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を分離する第2工程と、分離したヒト肝細胞にHBVを感染させる第3工程とを含む方法により得られるB型肝炎ウィルス感染モデル細胞。更に、被験物質の供給により培養上清中又は細胞内のB型肝炎ウィルス量が50%以下になる被験物質を選択する第3工程とを含むB型肝炎の予防又は治療剤のスクリーニング方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、B型肝炎ウィルス(HBV)感染モデルヒト肝細胞、このモデル細胞を製造するためのヒト肝細胞、これらの細胞を用いたB型肝炎の予防又は治療剤のスクリーニング方法に関する。
【背景技術】
【0002】
現在、全世界に、3億5千万人以上のB型肝炎ウィルス(以下、「HBV」ということもある)感染者が存在すると推定されている。HBVのスクリーニング検査方法が確立された現在においてもHBV感染による急性肝炎が問題となっている。また、日本国内においてもいまだ100万人以上存在するといわれているHBV持続感染者は、慢性肝炎を発症し、さらに肝硬変、肝細胞ガンに移行する危険を負っている。従って、HBVの複製や感染のメカニズムを解明し、HBV感染の有効な予防又は治療薬を開発することが求められている。
HBVの複製や感染のメカニズムには不明点が多い。HBV感染の分子レベルでの解析が進まない理由の一つに、in vitro感染モデルが確立されていないことが挙げられる。従来、in vitroでのHBV産生モデル、又はHBV感染モデルとして以下のものが知られている。しかし、それぞれに難点があり、HBV感染モデルヒト肝細胞として実用できるものは知られていない。
【0003】
例えば、ヒト肝ガン細胞HepG2のゲノムにHBVゲノムを組み込んだHBV産生モデル細胞が知られている(非特許文献1)。この細胞は、細胞のゲノムにHBVゲノムが組み込まれているため、半永久的にHBVを産生することができるが、その産生を制御できない。また、細胞表面にHBVレセプターを有さないため、HBVを感染させることはできない。
実際の肝臓へのHBVの感染は、一部の肝細胞にHBVが感染し、その細胞から放出された新たなHBVが別の肝細胞に感染し、これを繰り返すことにより進行する。従って、HBVを産生するだけで感染させることができない細胞ではHBV感染モデル細胞としては使用できない。
さらに、HepG2はガン細胞であって、正常な肝細胞とは性質が異なるため、正常な肝臓へのHBV感染を再現したモデル細胞にはなり得ない。
【0004】
また、ヒト肝ガン細胞HepG2に、HBV発現ベクターを導入した一過的なHBV産生モデル細胞が知られている(非特許文献2)。この細胞では、HBV産生がベクターにより制御されているので、HBV産生のオンオフを制御できる。しかし、細胞表面にHBVレセプターを有さないため、HBVを感染させることはできない。また、HepG2はガン細胞であって、正常な肝細胞とは性質が異なる。従って、HBV感染モデル細胞としては使用できない。
【0005】
また、ヒト肝ガン細胞HepaRGは、高分子化合物であるPEG8000の存在下で、HBVを感染させることができる(非特許文献3)。この細胞は、PEG8000の存在下という生体内ではあり得ない条件でのみHBVを感染させることができるため、生体内でのHBV感染を再現したモデルにはならない。PEG8000存在下でのHBV感染は、レセプターを介さない細胞へのHBVの物理的付着を介したものである可能性があり、特にこの点で、実際の生体でのHBV感染を再現したものではない可能性がある。さらに、HepaRG細胞にHBV感染させるためには、肝細胞以外の細胞を共培養する必要があり、この点でも、生体内でのHBV感染を再現したモデルにはならない。さらに、HepaRG細胞はガン細胞であって、正常な肝細胞とは性質が異なる。
【0006】
また、ヒト肝臓から単離した初代肝細胞は、PEG8000非存在下でもHBVを感染させることができる(非特許文献4)。しかし、その感染効率は極めて低い。また、この細胞はガン化していない正常な肝細胞であるというメリットがあるが、その都度ヒトから単離しなければならないため、細胞の性質の個体差が大きく、また細胞の安定供給が困難である。従って、HBV感染モデル細胞として実用できるものではない。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】J. Gener. Virol. 75: 2681-2689, 1994
【非特許文献2】Lab. Invest. 59:173-180, 1988
【非特許文献3】Proc. Natl. Acad. Sci. 26:15655-15660. 2002
【非特許文献4】J. Virol. 62:4136-4143. 1988
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、ヒト生体でのHBV感染を再現したHBV感染モデルヒト肝細胞であって、安定供給できる細胞を提供することを主な課題とする。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するために研究を重ね、以下の知見を得た。
(i) 肝障害免疫不全非ヒト動物にヒト肝細胞を移植して、この非ヒト動物体内でヒト肝細胞を増殖させて初代キメラ非ヒト動物を作製した場合、このキメラ非ヒト動物から分離したヒト肝細胞は、HBVを感染させると、長期にわたり感染状態を維持できる。
(ii) キメラ非ヒト動物体内で増殖したヒト肝細胞にin vitroでHBVを感染させ、感染細胞から培養上清に放出されたHBVは、最初の感染源となったHBVと同等の感染性と増殖能力を有している。即ち、HBVに感染したキメラ非ヒト動物ヒト肝細胞は、正常な感染性、及び増殖能力をもつHBVを産生する能力がある。また、このHBV産生能力を長期にわたり維持する。
(iii) キメラ非ヒト動物体内で増殖したヒト肝細胞は、長期にわたりin vitroで培養した後にHBVを感染させても、感染を成立させることができる。即ち、キメラ非ヒト動物体内で増殖したヒト肝細胞は、長期にわたりHBV感染能を維持する。
(iv) キメラ非ヒト動物体内で増殖したヒト肝細胞にin vitroでHBVを感染させて得られる感染細胞は、既存の抗HBV薬によりHBVの産生が抑制される。即ち、この感染細胞は抗HBV薬のスクリーニングに使用できる。
【0010】
本発明は、上記知見に基づき完成されたものであり、以下のHBV感染モデルヒト肝細胞などを提供する。
項1. 免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を回収する第2工程と、回収したヒト肝細胞にB型肝炎ウィルスを感染させる第3工程とを含む方法により得られるB型肝炎ウィルス感染モデル細胞。
項2. 免疫不全肝障害非ヒト動物が、uPA/SCID、uPA/Rag2(KO)、uPA/NOG、又はFah(KO)/Rag2(KO)/Il2rg(KO)の非ヒト動物である項1に記載の細胞。
項3. 免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を分離する第2工程とを含む方法により得られるB型肝炎ウィルス感染モデル細胞の製造用細胞。
項4. 免疫不全肝障害非ヒト動物が、uPA/SCID、uPA/Rag2(KO)、uPA/NOG、又はFah(KO)/Rag2(KO)/Il2rg(KO)非ヒト動物である項3に記載の細胞。
項5. 免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を回収する第2工程と、回収したヒト肝細胞にB型肝炎ウィルスを添加し、培養することにより、B型肝炎ウィルスが感染したヒト肝細胞を得る第3工程とを含む、B型肝炎ウィルス感染モデル細胞の製造方法。
項6. 免疫不全肝障害非ヒト動物が、uPA/SCID、uPA/Rag2(KO)、uPA/NOG、又はFah(KO)/Rag2(KO)/Il2rg(KO)の非ヒト動物である項5に記載の製造方法。
項7. 第3工程において、回収したヒト肝細胞を0.5〜7×105 cells/cm2の密度で培地に播種し、播種後24時間以上培養したヒト肝細胞1個当たりに対して、約1/10〜1000コピーのHBVを添加し、培養することにより感染させる項5又は6に記載の製造方法。
項8. (1) (a)項1又は2に記載のB型肝炎ウィルス感染モデル細胞に被験物質を供給するか、
(b)項3又は4に記載のB型肝炎ウィルス感染モデル細胞の製造用の細胞にB型肝炎ウィルスを感染させると同時に被験物質を供給するか、
(c) 項3又は4に記載のB型肝炎ウィルス感染モデル細胞の製造用の細胞に被験物質を供給した後にB型肝炎ウィルスを感染させるか、又は
(d) B型肝炎ウィルスに被検物質を供給した後に、このB型肝炎ウィルスを項3又は4に記載のB型肝炎ウィルス感染モデル細胞の製造用の細胞に感染させる
第1工程と、
(2) 被験物質供給群と被験物質非供給群との間で、培養上清中又は細胞内のB型肝炎ウィルス量を比較する第2工程と、
(3) 被験物質の供給により培養上清中又は細胞内の B型肝炎ウィルス量が50%以下になる被験物質を選択する第3工程とを含むB型肝炎の予防又は治療剤のスクリーニング方法。
項9. 第1工程で(a)、(b)、又は(c)を行い、かつ第1工程において、細胞培養液中の濃度が1 pM〜100 mMになるように、被験物質を細胞に供給する項8に記載の方法。
項10. 第1工程で(d)を行い、かつ第1工程において、B型肝炎ウィルスを含む液中の濃度が1 pM〜100 mMになるように、被験物質をB型肝炎ウィルスに供給する項8に記載の方法。
【発明の効果】
【0011】
キメラ非ヒト動物体内で増殖したヒト肝細胞は、長期にわたりHBVの感染能を維持するとともに、一旦HBVが感染すると、長期にわたり、その感染状態を維持できる。さらに、長期にわたり、HBVに新たに感染できる能力を維持できる。また、HBVを感染させたキメラ非ヒト動物ヒト肝細胞で新たに産生され培養上清に放出されたHBVは、キメラ非ヒト動物ヒト肝細胞に感染させる前のHBVと同等の感染性を有する。このように、キメラ非ヒト動物体内で増殖したヒト肝細胞にHBVを感染させると、in vitroで自立的な再感染が起きるため、HBV感染モデルヒト肝細胞として実用できる。
【0012】
また、HBVを感染させたキメラ非ヒト動物ヒト肝細胞は、PEG8000のような特殊な試薬を用いなくても、in vitroで高効率でHBVを感染させることができる。また、ガン化した細胞ではなく正常なヒト肝細胞である。従って、生体内でのHBVの肝細胞への感染を再現したモデル細胞になり得る。
また、キメラ非ヒト動物体内で増殖したヒト肝細胞は、非ヒト動物内で増殖させた細胞であるため、安定に大量供給することができる。また、必要時に新鮮な細胞を供給できる。さらに、同一ヒト個体の肝細胞を大量供給できるため、条件統一が求められる実験や評価、再現性を確認する実験に好適に使用できる。
【0013】
これらの点で、キメラ非ヒト動物ヒト肝細胞、及びHBVを感染させたキメラ非ヒト動物ヒト肝細胞は、研究ツールや、B型肝炎の予防又は治療剤のスクリーニングツール等として極めて有用である。
具体的には、生体での肝細胞へのHBVの感染や複製のメカニズムの解明に好適に使用できる。PEG8000の存在下でのHBVの肝細胞への感染は肝細胞への物理的な付着を介したものである可能性があるが、PEG8000非存在下でのHBV感染はレセプターを介していると考えられる。従って、本発明により、未だ発見されていないHBVレセプターの同定への道が開けた。
また、HBVを感染させたキメラ非ヒト動物ヒト肝細胞は、生体内でのHBVの感染や複製に近い状態を再現したものであるから、この細胞を用いれば、現実のHBVの感染や複製を効果的に抑制できる薬剤を効率よくスクリーニングすることができる。
さらに、従来のように、HBV感染能を有さずHBV産生するだけのモデル細胞では、HBV複製を抑制する薬剤しかスクリーニングすることができないが、HBVを感染させたキメラ非ヒト動物ヒト肝細胞を用いれば、HBV感染を抑制する薬剤もスクリーニングすることができる。
【図面の簡単な説明】
【0014】
【図1】初代キメラマウスから単離したヒト肝細胞にHBVを感染させた後2,8,24,47日目の細胞を倒立光学顕微鏡で観察した写真である。
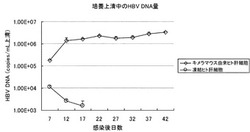
【図2】初代キメラマウスから単離したヒト肝細胞、及びヒト肝臓から単離した初代凍結肝細胞にHBVを感染させた場合の、培養上清中のHBV DNAコピー数を比較した図である。
【図3】初代キメラマウスから単離したヒト肝細胞に感染させたHBVの増殖を、抗HBV薬ラミブジンが濃度依存的に抑制したことを示す図である。
【図4】初代キメラマウスから単離したヒト肝細胞は、培養期間にわたってヒト肝細胞が放出したHBVに感染できる能力を維持していることを示す図である。
【図5】HBVを感染させた初代キメラマウスの血清と、初代キメラマウスのヒト肝細胞にin vitroでHBVを感染させた場合の培養上清との間で、マウスへの感染性を比較した図である。
【発明を実施するための形態】
【0015】
以下、本発明を詳細に説明する。
(1)HBV感染モデル細胞を製造するための細胞
本発明のHBV感染モデル細胞の製造用細胞は、免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を回収する第2工程とを含む方法により得られる細胞である。
【0016】
非ヒト動物
本発明において、非ヒト動物(以下、「動物」と略称することもある)は、哺乳動物であることが好ましく、げっ歯類であることがより好ましい。げっ歯類動物としては、マウス、ラットのようなネズミ、モルモット、リス、ハムスターなどが挙げられるが、実験動物として汎用されているマウス、ラットのようなネズミが使用し易い。
【0017】
免疫不全肝障害非ヒト動物
免疫不全肝障害非ヒト動物は、異種動物由来の細胞に対して拒絶反応を示さない免疫不全であるとともに、その非ヒト動物本来の肝臓の細胞が障害を受けている動物である。その動物本来の細胞が障害を受けていることにより、ヒト肝細胞を移植すれば、その肝機能は移植されたヒト肝細胞によって保たれ、ヒト肝細胞の個体内機能を正確に反映した動物となる。また、移植するヒト肝細胞が増殖し易くなる。
【0018】
免疫不全肝障害動物は、同一個体に、肝障害誘発処理を施すとともに、免疫不全誘発処理を施すことにより作製することができる。肝障害誘発処理としては、四塩化炭素、黄リン、D-ガラクトサミン、2-アセチルアミノフルオレン、ピロロジンアルカロイドのような肝障害誘発物質の投与や、外科的な肝臓の部分切除などが挙げられる。免疫不全誘発処理としては、免疫抑制剤の投与や胸腺摘出などが挙げられる。
【0019】
また、免疫不全肝障害動物は、遺伝的免疫不全症の動物に、肝障害誘発処理を施すことによっても作製できる。遺伝的免疫不全症動物としては、T細胞系不全を示す重症複合免疫不全症(SCID:severe combined immunodeficiency)の動物、遺伝的な胸腺の欠損によりT細胞機能を失った動物、RAG2遺伝子を公知のジーンターゲッティング法(Science,244:1288-1292,1989)によりノックアウトした動物などが挙げられる。具体的には、SCIDマウス、NUDEマウス、RAG2ノックアウトマウスなどが挙げられる。
【0020】
また、免疫不全肝障害動物は、遺伝的肝障害動物に免疫不全誘発処理を施すことによっても作製できる。遺伝的肝障害動物としては、肝細胞特異的に発現するタンパク質のエンハンサー、及び/又はプロモーターの支配下に連結された肝障害誘発タンパク質遺伝子を用い、公知のトランスジェニック法(Proc. Natl. Acad. Sci. 77;7380-7384, 1980)により作製したトランスジェニック動物が挙げられる。このような動物では、肝障害誘発タンパク質が肝臓特異的に発現するため、肝障害を有するものとなる。肝臓特異的に発現するタンパク質としては、血清アルブミン、コリンエステラーゼ、ハーゲマン因子などが挙げられる。肝障害誘発タンパク質としては、ウロキナーゼプラスミノーゲンアクチベーター(uPA)、ティッシュープラスミノーゲンアクチベーター(tPA)などが挙げられる。また、例えばフマリルアセト酢酸ヒドラーゼ遺伝子のような肝機能を担う遺伝子をノックアウトすることによっても遺伝的肝障害を有する動物を得ることができる。
【0021】
さらに、免疫不全肝障害動物は、遺伝的免疫不全動物と、それと同種の遺伝的肝障害動物とを交配させることによっても作製することができる。
【0022】
遺伝的免疫不全肝障害動物としては、肝障害遺伝子がホモ接合体である動物を用いることが好ましい。このようなホモ接合体動物は正常な肝細胞がほとんど増殖しないため、その動物の肝細胞がヒト肝細胞の増殖を妨げることがない。
【0023】
免疫不全肝障害動物の具体例としては、uPA/SCIDマウス、uPA/Rag2(KO)マウス(Hepatology. 33:981-988. 2001)、uPA/NOGマウス(Biochem. Biophys. Res. Commun. 377:248-52. 2008)、Fah(KO)/Rag2(KO)/Il2rg(KO) (FRG) マウス (Nature Biotech. 25:903-910, 2007;J Clin. Invest. 120:924-930, 2010)などが挙げられる。
【0024】
ヒト肝細胞
移植に用いるヒト肝細胞は、正常なヒト肝組織から、コラゲナーゼ灌流法のような常法によって単離したものを用いることができる。また、分離した肝細胞を一旦冷凍保存した後解凍して用いることもできる。
【0025】
肝細胞を分離するヒトの年齢は特に制限されないが、例えば14歳以下の小児のヒトの肝細胞を使用することにより、ヒト肝細胞による高置換率が達成される。
【0026】
また、in vivoで活発な増殖能を有する増殖性肝細胞を使用することもできる。本発明において、「増殖性ヒト肝細胞」とは、培養条件下(in vitro)において、単一細胞種の集団としてのコロニーを形成し、そのコロニーを増大させるように増殖するヒト肝細胞を意味する。また、その増殖は、コロニー構成細胞が単一種であるという点において「クローン性増殖」という場合もある。さらに、このような細胞は、継代培養によって細胞数をさらに増加することができる細胞である。
【0027】
このような増殖性ヒト肝細胞は、一例として、本発明者らが発明したヒト小型肝細胞(特開平8-112092号公報;日本特許第3266766号;米国特許第6,004,810号、特開平10-179148号公報:日本特許第3211941号、特開平7-274951公報;日本特許第3157984号、特開平9-313172号公報;日本特許第3014322号)を用いることができる。このヒト小型肝細胞は、その優れた増殖能によって、レシピエントの体内で急速に増殖し、正常な肝機能を発揮しうるヒト肝細胞集団を短時間で形成することができる。
【0028】
このような小型肝細胞の採取は、前記公報に記載されているような遠心分離を用いた方法の他、エルトリエーターやFACS等の細胞分画装置によっても採取することができる。さらには、コロニーを形成しながら増殖する肝細胞を特異的に認識するモノクローナル抗体によって採取することもできる。In vitroで増殖させたヒト肝細胞、凍結保存肝細胞、テロメラーゼ遺伝子等の導入により不死化させた肝細胞、これらの肝細胞と非実質細胞を混合させたものも使用できる。
【0029】
初代キメラ動物の作製
このようなヒト肝細胞は、免疫不全肝障害動物の脾臓を経由して肝臓へ移植することができる。また、直接門脈から移植することもできる。移植するヒト肝細胞の数は、1〜200万個程度、好ましくは20万〜100万個程度とすることができる。
【0030】
免疫不全肝障害動物の性別は特に限定されない。また、移植時の免疫不全肝障害動物の日齢は、特に限定されないが、マウスが低週齢のときにヒト肝細胞を移植すると、マウスの成長とともにヒト肝細胞がより活発に増殖することができる点で、生後0〜40日程度、中でも生後8〜40日程度の動物を使用するのが好ましい。
【0031】
移植後の動物を、常法により、飼育すればよい。非ヒト動物体内で増殖したヒト肝細胞であれば、本発明の細胞として用いることができるため、飼育期間は特に限定されない。しかし、1匹のキメラ非ヒト動物から大量のヒト肝細胞を単離するためには、キメラ非ヒト動物の肝臓がヒト肝細胞で高置換されていることが望ましい。従って、例えば移植後30〜200日間程度、好ましくは40〜100日間程度飼育することが好ましく、これにより、肝細胞の一部又は全部がヒト肝細胞で置換された初代キメラ動物が得られる。マウスの場合は、ヒト肝細胞を2〜10×105個程度移植した場合、40〜100日間程度飼育することにより、下記の血中ヒトアルブミン濃度が得られる。
【0032】
また、キメラ非ヒト動物の血中ヒトアルブミン濃度が6mg/ml以上になるまで飼育することが好ましく、10mg/ml以上になるまで飼育することがより好ましい。キメラ非ヒト動物の血中ヒトアルブミン濃度は、ヒト肝細胞による置換率を示す。上記のヒトアルブミン濃度であれば、キメラ動物の肝臓が十分にヒト肝細胞により置換されており、後工程で、このキメラ動物から分離した肝細胞中にヒト肝細胞が高率で含まれ、ヒト肝細胞を効率的に単離することができる。
【0033】
キメラ非ヒト動物からのヒト肝細胞の分離・回収
キメラ動物体内で増殖したヒト肝細胞は、例えば、キメラ動物の肝臓組織をコラゲナーゼ処理することにより分離又は回収することができる。コラゲナーゼの細胞毒性は、非ヒト動物肝細胞に対する方が、ヒト肝細胞に対するより高いため、コラゲナーゼ処理時間を調節することにより、キメラ動物の肝細胞に障害を与え、実質的にヒト肝細胞をより多く分離することができる。コラゲナーゼ処理時間は、ヒト肝細胞と非ヒト肝細胞との存在割合によって異なるが、例えば、血中アルブミン濃度が1〜20mg/ml程度の場合は、濃度0.01〜0.1重量%程度のコラゲナーゼ溶液で5〜30分間程度処理を行えばよい。回収された肝細胞の中には、キメラ動物体内で増殖したヒト肝細胞の他、肝非実質細胞が少量含まれる。さらに、非ヒト動物自身の肝細胞も少量含まれる。
【0034】
回収した肝細胞をそのまま培養に使用してもよいが、ヒト肝細胞又は非ヒト動物肝細胞を特異的に認識するモノクローナル抗体を用いてヒト肝細胞の純度を上げることもできる。分離した肝細胞をヒト肝細胞特異抗体と反応させる場合は、反応した細胞をフローサイトメーター(FACS)や磁気細胞分離装置(MACS)で回収すればよい。また、分離した肝細胞を非ヒト動物肝細胞特異的抗体と反応させる場合は、反応しなかった細胞をFACSやMACSを用いて回収すればよい。
【0035】
マウス肝細胞を特異的に認識するモノクローナル抗体としては、本発明者らが作製したハイブリドーマ66Z株細胞を培養することによって得たもの、又はこのハイブリドーマ細胞をマウス腹腔内に注射し、腹水から採取したものが挙げられる。ヒト肝細胞を特異的に認識するモノクローナル抗体としては、本発明者らが作製したハイブリドーマK8216株細胞を培養することによって得たもの、又はこのハイブリドーマ細胞をマウス腹腔内に注射し、腹水から採取したものが挙げられる。
【0036】
本発明の細胞の生育方法
上記のようにして分離したヒト肝細胞は、動物細胞の培地として従来公知の培地を用いて培養し、又は生育させておくことができる。
このような公知の培地として、例えば、DMEM培地、WEM培地、CS-C培地、肝細胞専用培地キットHCMTMBulletKit (BioWhittaker, Inc.社製)、L-15培地、William's E培地、Waymouth's MB 752/1培地、イーグル基礎培地(Basal Media Eagle; BME)、DMEM/F-12培地(DMEM:F-12=1:1(v/v))、199培地、F-12培地、F-10培地、MEM培地、RPMI1640培地などが挙げられる。これらは、ギブコー社(Gibco-BRL/Life Technologies Inc.)、バイオフィッカー社(BioWhittaker)、タカラ社などから購入できる。中でも、DMEM培地、WEM培地が好ましい。
培地には、ウシ胎児血清、炭素源、窒素源、無機塩、アミノ酸、微量金属元素、微量栄養素、抗生物質、脂肪酸、ビタミン類、浸透圧調整剤、pH指示薬などを添加して補足してもよい。また、HGF/SF、EGFおよびTGF-αなどの成長因子を添加して補足してもよい。
培養は、通常、約35〜39℃で、3〜7%CO2を含む空気雰囲気下で行えばよい。
また、本発明の細胞は凍結保存することもできる。
【0037】
HBV感染
現在、HBVは、ジェノタイプA〜Hの8種が知られている。本発明の細胞は、これらを含む何れのタイプのHBVを感染させるための細胞としても使用できる。
キメラ非ヒト動物から分離したヒト肝細胞へのHBVの感染は、従来公知の方法で行うことができる。キメラ非ヒト動物から分離したヒト肝細胞を、例えば、上記した培地に懸濁して播種する。ヒト肝細胞の播種密度は、約0.5〜7×105 cells/cm2が好ましく、約1〜3×105 cells/cm2がより好ましい。播種後、通常約0〜120時間、好ましくは約24〜72時間培養したヒト肝細胞1個当たりに対して、約1/10〜1000個、好ましくは約1〜100個のHBVを添加又は混合し、培養することにより感染させればよい。感染は、PEG8000などの高分子化合物を含まない培養液中で行うことができる。また、キメラ非ヒト動物から分離したヒト肝細胞以外の細胞の非存在下で行うことができる。細胞の培養は、例えば、約35〜39℃で、約3〜7%のCO2を含む空気雰囲気下で行えばよい。これにより、細胞から細胞へと感染が進み、HBVに感染した細胞集団が得られる。
【0038】
細胞集団にHBVが感染したことは、培養上清中のHBV量を定量することで確認できる。HBV量の定量法としては、例えば、当該細胞の培養上清中に存在するHBVのDNAのコピー数のリアルタイムPCR法による測定(J. Clin. Microbiol.37:2899-2903, 1999)、培養上清のサザンブロッティング解析、ELISAによる培養上清中のウイルスCoreタンパクやSタンパクの定量等が挙げられる。具体的には、スマイテストEX-R&D(医学生物学研究所)で培養上清からDNAを抽出し、培養上清中に存在するHBV DNAのコピー数を、リアルタイムPCR法(J. Clin. Microbiol.37:2899-2903, 1999)により測定し、HBVを感染させて12日目以降に培養上清1mLあたり400コピー以上のHBV DNAが検出された場合に、細胞集団にHBVが感染したと判断することができる。
【0039】
細胞集団にHBVが感染したことは、細胞内のHBV量を定量することによっても確認できる。細胞内のHBV量の定量法としては、例えば上記のようなリアルタイムPCRやサザンブロッティング、ELISA等が挙げられる。具体的には、ヒト肝細胞を0.25%トリプシン−1 mM EDTA(Gibco-BRL/Life Technologies Inc.)で回収した後、スマイテストEX-R&Dで細胞からDNAを抽出し、細胞内のHBV DNAのコピー数をリアルタイムPCR法(J. Clin. Microbiol.37:2899-2903, 1999)により測定し、DNA 50 ngあたり10コピー以上のHBV DNAが検出された場合に、細胞集団にHBVが感染したと判断することができる。
【0040】
(2)HBV感染モデル細胞
本発明のHBV感染モデル細胞は、免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を回収する第2工程と、回収したヒト肝細胞にHBVを添加又は混合し、培養することにより感染させる第3工程とを含む方法により得られる細胞である。
免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する方法、キメラ非ヒト動物体内で増殖したヒト肝細胞を回収する方法、回収したヒト肝細胞にHBVを感染させる方法は、前述した通りである。
第3工程では、回収したヒト肝細胞にHBVを添加又は混合してから、即ち感染操作を行ってから、約0〜50日間培養することが好ましく、約12〜30日間培養することがより好ましい。上記範囲であれば、細胞集団が十分にHBVに感染した状態となる。また、上記範囲であれば、HBV感染状態が維持されている。
本発明のHBV感染モデル細胞は、B型肝炎の予防又は治療剤のスクリーニングや、HBVのヒト肝細胞への感染や複製のメカニズムの解明、特にHBVレセプターの特定のための研究に好適に使用できる。
【0041】
(3)B型肝炎の予防又は治療剤のスクリーニング方法
本発明のB型肝炎の予防又は治療剤のスクリーニング方法は、
(1) (a)上記説明した本発明のHBV感染モデル細胞に被験物質を供給するか、
(b)上記説明した本発明のHBV感染モデル細胞の製造用の細胞(キメラ非ヒト動物から分離したヒト肝細胞)にHBVを感染させると同時に被験物質を供給するか、
(c)上記説明した本発明のHBV感染モデル細胞の製造用の細胞(キメラ非ヒト動物から分離したヒト肝細胞)に被験物質を供給した後にHBVを感染させるか、又は
(d)HBVに被検物質を供給した後に、このHBVを上記説明した本発明のHBV感染モデル細胞の製造用の細胞(キメラ非ヒト動物から分離したヒト肝細胞)に感染させる
第1工程と、
(2) 被験物質供給群と被験物質非供給群との間で、培養上清中又は細胞内のHBV量を比較する第2工程と、
(3) 被験物質の供給により培養上清中又は細胞内のHBV量が50%以下になる被験物質を選択する第3工程とを含む方法である。
【0042】
第1工程で(a)〜(c)を行う場合
第1工程で(a)〜(c)を行う場合は、被験物質を供給する際の、培地中のヒト肝細胞の密度は、約0.1〜7×105 cells/cm2程度が好ましく、約0.5〜2×105 cells/cm2程度がより好ましい。
HBV感染は、ヒト肝細胞1個当たり、約1/10〜1000コピー、好ましくは約1〜100コピーのHBVを添加又は混合し、培養することにより行えばよい。感染は、PEG8000などの高分子化合物を含まない培養液中で行うことができる。また、キメラ非ヒト動物から分離したヒト肝細胞以外の細胞の非存在下で行うことができる。
被験物質を供給する前、及び供給した後は、約35〜39℃(特に、約37℃)で、約3〜7%(特に、約5%)のCO2を含む空気雰囲気下で細胞を培養し、または生育させておけばよい。即ち、通常、細胞を培地中で生育させた状態で被験物質を供給すればよい。
【0043】
被験物質は特に限定されず、低分子化合物、ペプチド、核酸、天然物からの抽出物、無機化合物などが挙げられる。被験物質の細胞培養液(培地)中の濃度が1 pM〜100 mM程度になるように被験物質を添加することが好ましく、1 nM〜1 mM程度になるように被験物質を添加することがより好ましい。
第1工程で(a)、(b)、及び(c)のいずれを行う場合も、第2工程では、例えば被験物質を供給してから約1〜50日後、特に約7〜20日後の細胞培養上清中又は細胞内のHBV量を、被験物質を供給していない細胞の上清中又は細胞内のHBV 量と比較すればよい。細胞内のHBV量は、例えば、細胞を一定量のバッファー等の中でホモジナイズし、ホモジネート中のHBV量を比較すればよい。
第3工程では、被験物質の供給により、培養上清中又は細胞内のHBV 量が非供給群の約40%以下になる被験物質を選択することが好ましく、約10%以下になる被験物質を選択することがより好ましい。
この方法により、B型肝炎の予防又は治療剤を選択できる。
【0044】
第1工程で(d)を行う場合
第1工程で(d)を行なう場合は、例えばHBVを含む培地に被験物質を添加すればよい。培地は、例えば、細胞培養用の培地として例示したものを使用できる。被験物質は特に限定されず、低分子化合物、ペプチド、核酸、天然物からの抽出物、無機化合物などが挙げられる。HBVを含む液(例えば、培地)中の被験物質の濃度が1 pM〜100 mM程度になるように被験物質を添加することが好ましく、1 nM〜1 mM程度になるように被験物質を添加することがより好ましい。HBVに対する被験物質の処理は、例えば約4〜45℃、好ましくは約15〜40℃で、例えば約10秒〜48時間、好ましくは約1分〜24時間行なえばよい。
【0045】
次いで、被験物質処理したHBVを、ヒト肝細胞に添加又は混合し、培養することにより感染させればよい。被検物質で処理されたHBVを用いて感染させる際の培地中のヒト肝細胞の密度は、約0.1〜7×105 cells/cm2程度が好ましく、約0.5〜2×105 cells/cm2程度がより好ましい。感染させるHBV量は、ヒト肝細胞1個当たり、約1/10〜1000コピー、好ましくは約1〜100コピーのHBVとすればよい。感染は、PEG8000などの高分子化合物を含まない培養液中で行うことができる。また、キメラ非ヒト動物から分離したヒト肝細胞以外の細胞の非存在下で行うことができる。
HBVを感染させる前、及び感染させた後は、約35〜39℃(特に、約37℃)で、約3〜7%(特に、約5%)のCO2を含む空気雰囲気下で細胞を培養し、または生育させておけばよい。
【0046】
第2工程では、例えば被検物質が添加されたHBVを細胞に感染させてから、約1〜50日後、特に約7〜20日後の細胞培養上清中又は細胞内のHBV量を、被験物質が添加されていないHBVを感染させた細胞の上清中又は細胞内のHBV量と比較すればよい。細胞内のHBV量は、例えば、細胞を一定量のバッファー等の中でホモジナイズし、ホモジネート中のHBV量を比較すればよい。
第3工程では、被験物質の供給により、培養上清中又は細胞内のHBV 量が非供給群の約40%以下になる被験物質を選択することが好ましく、約10%以下になる被験物質を選択することがより好ましい。
この方法により、B型肝炎の予防又は治療剤を選択できる。
【実施例】
【0047】
以下、本発明を実施例を挙げて、さらに詳細に説明するが、本発明はこれらに限定されるものではない。
(1)キメラマウスの作製
(1-1)免疫不全肝障害マウス
レシピエント動物として使用したuPA-Tg(+/+)/SCID(+/+)マウスは、株式会社フェニックスバイオにて繁殖させたものを用いた。
【0048】
このマウスは、次のようにして作製したものである。uPA-Tgマウス(hemizygote, +/-)とSCIDc.b.-17マウス(homozygote, +/+)とを掛け合せ、両方の形質を持つマウスuPA-Tg(+/-)/SCID(+/-)を35.2%の確率で得た。uPA-Tg(+/-)とuPA-Tg(-/-)の識別は、uPA遺伝子に特異的な配列をプライマーに用い、ゲノムPCR法により行った。また、SCID(+/-)とSCID(-/-)の識別は、PCR-RFLP法により行った。
【0049】
次に、得られたuPA-Tg(+/-)/SCID(+/-)をSCID(+/+)と戻し交配させ、uPA-Tg(+/-)/SCID(+/+)を得た。その結果、uPA-Tg(+/-)は37.9%出現し、SCID(+/+)は52.8%出現した。uPA-Tg(+/-)/SCID(+/+)同士を交配させ、uPA-Tg(+/-)/SCID(+/+)、及び目的のuPA-Tg(+/+)/SCID(+/+)を得た。
【0050】
なお、uPA遺伝子の(-/-), (+/-), (+/+)の識別は以下の方法で行った。生後8〜10日目のマウスの尾を約5 mm切断し、30 μlのDNA lysis buffer {50 mM Tris (pH 8), 50 mM EDTA (pH 8), 1% SDS, 2 mg/ml Proteinase K}を添加後55℃で2〜3時間インキュベートした。インキュベート後、15秒間激しく懸濁し、蒸留水170 μlを添加し、95℃で10分間インキュベートすることによってProteinase Kを不活性化させた。これをPCRのテンプレートとして用いた。テンプレート 1μl、10 x Buffer (Mg+) 2μl、dNTP Mix (2.5 mM) 1.6μl、蒸留水 11.4 μl、uPA-del-Fプライマー (10 pmol/μl) 0.4μl、uPA-del-Rプライマー (10 pmol/μl) 0.4 μl、Tg-Fプライマー (10 pmol/μl) 0.4μl、uPA-high-R1 (10 pmol/μl) 0.4 μl、MgCl2 (25mM) 2 μl、Tween20 (50%) 0.2 μl、rTaq 0.2 μlを混合し、94℃・5分、次いで(94℃・30秒、62℃・30秒、72℃・30秒)x 35〜40サイクルの条件でPCRを行った。2%アガロースゲルを用いて電気泳動を行い、300 bp付近にバンドが検出された場合uPA(-/-)、150 bpに検出された場合はuPA(+/+)、300 bpと150 bp両方に検出された場合uPA(+/-)として判定した。用いたプライマーの配列は以下の通りである。
uPA-del-F
5’-TTCTCTTCTCTTGCCCTCTCACA-3’(配列番号1)
uPA-del-R
5’-TTGAGACCCTCAAGACAGCCA-3’ (配列番号2)
Tg-F
5’-ATCCCTGTGACCCCTCCC-3’ (配列番号3)
uPA-high-R1
5’-CTCCATACCACCCCCCTC-3’ (配列番号4)
【0051】
(1-2)ヒト肝細胞移植
ヒト肝細胞としては、BD Bioscience社より購入した肝細胞(Lot No.BD85、男児、5才)を使用した。この凍結肝細胞はChise Tateno, Yasumi Yoshizane, Naomi Saito, Miho Kataoka, Rie Utoh, Chihiro Yamasaki, Asato Tachibana, Yoshinori Soeno, Kinji Asahina, Hiroshi Hino, Toshimasa Asahara, Tsuyoshi Yokoi, Toshinori Furukawa, Katsutoshi Yoshizato: Near-completely humanized liver in mice shows human-type metabolic responses to drugs. Am J Pathol 165:901-912, 2004に記載の方法に従って融解して用いた。
生後3〜5週齢のuPA-Tg(+/+) /SCID(+/+)マウスをエーテルで麻酔し、わき腹を約5 mm切開し、脾頭より2.5x105個のヒト肝細胞を注入した後、脾臓を腹腔に戻し縫合した。
【0052】
(1-3)初代キメラマウスからのヒト肝細胞の分離
移植後、ビタミンC 0.1%含有CRF-1(オリエンタル酵母株式会社)、次亜塩素酸ナトリウム溶液0.012%添加水道水の自由摂取により飼育した。
週に1回マウス尾静脈より採血し、マウス血中のヒトアルブミン濃度を栄研化学株式会社のラテックス試薬‘栄研’ALB-IIを用い、免疫比濁法により測定した。測定条件は同試薬の添付マニュアルに従った。
【0053】
初代キメラマウスの血中アルブミン濃度が10 mg/mlを超えた高置換マウス(生後98〜112日)6匹を用い、二段階コラゲナーゼ灌流法により肝細胞を分離した。コラゲナーゼ濃度は0.05%、処理時間は5〜25分間とした。肝細胞にはヒト肝細胞とマウス肝細胞が混在しているが、コラゲナーゼによる毒性はヒト肝細胞に対するよりマウス肝細胞に対する方が高いため、ヒト肝細胞の比率の高い肝細胞が得られる。
【0054】
(2)HBV感染細胞の顕微鏡観察
高置換マウスから二段階コラゲナーゼ灌流法により回収されたヒト肝細胞を、10%のウシ胎児血清と抗生物質(ペニシリン100単位、ストレプトマイシン100 μg/ml単位)を含むDMEM(Gibco-BRL/Life Technologies Inc.NIBCO)に懸濁し、3×105 cells/wellの割合でコラーゲン(KOKEN)をコートした24 well plate (BD FALCON)に播種した。
播種24時間後に古い培地を除去した後に、発明者らが既に報告している培地(dHCGM培地、J. Hepatol. 44:749-757. 2006)に、well当たり3×106 コピーのHBV DNAを含むHBV感染キメラマウス血清を加えたものを添加し、24時間培養を行なった。dHCGM培地で3回wellを洗った後、更にdHCGM培地を添加して24時間培養を行なった。それ以降は5日毎に培地を交換し、交換の度に上清中のHBV DNAコピー数の測定用に古い培地を100μl回収した。ヒト肝細胞の培養は5%CO2、37℃で行なった。
図1は、HBV感染処理後、2、8、24、47日目のヒト肝細胞を、倒立顕微鏡を用いて観察した結果である。これらの期間を通じて、ヒト肝細胞が良く形態を維持していることが分かる。
【0055】
(3)HBV感染後のHBV産生状態の測定
キメラマウス由来ヒト肝細胞と、キメラマウスの作製に使用した市販の凍結ヒト肝細胞であるBD85(BD Bioscience、5歳、アフリカンアメリカン、男児)に対して、HBVを感染させて7日目以降の培養上清を5日毎に回収し、既知の条件(J. Clin. Microbiol. 37:2899-2903. 1999)でリアルタイムPCRを行ない、HBV DNAコピー数を測定した。キメラマウス由来ヒト肝細胞および、市販の凍結ヒト肝細胞の培養並びにHBV感染は、上記(2)の項目に記載した条件で行なった。
結果を図2に示す。市販の凍結ヒト肝細胞では7日目以降培養上清中のHBV DNAコピー数が低下したのに対して、キメラマウス由来のヒト肝細胞の場合は、7日目から12日目にかけて上清中のHBV DNAコピー数が10倍以上に増加した。また12日目以降も、緩やかではあるが上清中のHBV DNAコピー数の上昇が確認された。
【0056】
(4)抗HBV薬ラミブジンによるHBV増殖抑制
上記の(2)の項目に記載した条件で、キメラマウス由来のヒト肝細胞に対してHBVを感染させるのと同時に、一般的なHBV複製阻害剤であるラミブジン(東京化成工業)の継続的な処理を開始した。その後は上記(2)の項目に記載した条件で培地交換並びに培養上清の回収を行い、上清中のHBV DNAコピー数に対する影響を検討した。
結果を図3に示す。処理するラミブジン濃度が高くなるにつれて、上清中のHBV DNAコピー数が減少していることが分かる。
【0057】
(5)培養期間における肝細胞のHBV感染能の維持確認
培養ヒト肝細胞のHBVに対する感染能と、培養上清中のHBVの感染性を検討するために、以下の実験を行なった。キメラマウスから回収されたヒト肝細胞を二つのグループに分け、一方のグループのみに対して(2)の項目に記載した条件で、HBV感染処理を行なった。感染処理後22日目の培養上清を回収し、HBVが感染していることを確認した。感染が確認された培養上清を、同じ期間HBVが感染していない状態で維持されていた、もう一方のグループの細胞に培養液に添加した。添加後は他の感染実験と同様に、5日毎に培地を交換し、培地交換直前の培養上清中のHBV DNAコピー数を解析した。
結果を図4に示す。図4が示すように、22日間非感染状態で培養されていたヒト肝細胞(2例)に対して、HBV感染細胞の上清を処理すると、HBVの感染が成立することが明らかとなった。そのHBV産生量は、培養初期からHBVに感染させたものと比べても大きな違いが無かったことから、ヒト肝細胞のHBVに対する感染能は、培養期間を通じてよく維持されていること、及びHBV感染細胞の上清中には感染性の粒子が存在することが分かった。
【0058】
(6)培養上清中に存在するHBVの感染性の検討
キメラマウスから分離した培養ヒト肝細胞で産生されたHBVの感染性と、キメラマウス肝臓中のヒト肝細胞で産生されたHBVの感染性を、キメラマウスを用いて比較した。
即ち、上記(2)の条件で培養及びHBV感染させた、HBV感染後22日目の培養ヒト肝細胞の培養上清と、培養ヒト肝細胞に対して感染源として用いたHBV感染キメラマウスの血清を、それぞれ104コピーHBV DNA/匹の割合でキメラマウスに対して眼窩静脈より接種した。接種後は週1回の割合で採血を行い、血清中のHBV DNAコピー数をリアルタイムPCRで経時的に測定した。
結果を図5に示す。図5から明らかなように、HBV感染培養ヒト肝細胞の上清中にあるHBVの感染性は、HBV感染キメラマウス血清中のHBVの感染性と同等であることが示された。
【産業上の利用可能性】
【0059】
本発明のHBV感染モデル細胞、及びこのモデル細胞の製造用細胞は、B型肝炎の予防又は治療剤のスクリーニングや、HBVのヒト肝細胞への感染や複製メカニズムの解明、特にHBVレセプターの特定のための研究に好適に使用できる。
【技術分野】
【0001】
本発明は、B型肝炎ウィルス(HBV)感染モデルヒト肝細胞、このモデル細胞を製造するためのヒト肝細胞、これらの細胞を用いたB型肝炎の予防又は治療剤のスクリーニング方法に関する。
【背景技術】
【0002】
現在、全世界に、3億5千万人以上のB型肝炎ウィルス(以下、「HBV」ということもある)感染者が存在すると推定されている。HBVのスクリーニング検査方法が確立された現在においてもHBV感染による急性肝炎が問題となっている。また、日本国内においてもいまだ100万人以上存在するといわれているHBV持続感染者は、慢性肝炎を発症し、さらに肝硬変、肝細胞ガンに移行する危険を負っている。従って、HBVの複製や感染のメカニズムを解明し、HBV感染の有効な予防又は治療薬を開発することが求められている。
HBVの複製や感染のメカニズムには不明点が多い。HBV感染の分子レベルでの解析が進まない理由の一つに、in vitro感染モデルが確立されていないことが挙げられる。従来、in vitroでのHBV産生モデル、又はHBV感染モデルとして以下のものが知られている。しかし、それぞれに難点があり、HBV感染モデルヒト肝細胞として実用できるものは知られていない。
【0003】
例えば、ヒト肝ガン細胞HepG2のゲノムにHBVゲノムを組み込んだHBV産生モデル細胞が知られている(非特許文献1)。この細胞は、細胞のゲノムにHBVゲノムが組み込まれているため、半永久的にHBVを産生することができるが、その産生を制御できない。また、細胞表面にHBVレセプターを有さないため、HBVを感染させることはできない。
実際の肝臓へのHBVの感染は、一部の肝細胞にHBVが感染し、その細胞から放出された新たなHBVが別の肝細胞に感染し、これを繰り返すことにより進行する。従って、HBVを産生するだけで感染させることができない細胞ではHBV感染モデル細胞としては使用できない。
さらに、HepG2はガン細胞であって、正常な肝細胞とは性質が異なるため、正常な肝臓へのHBV感染を再現したモデル細胞にはなり得ない。
【0004】
また、ヒト肝ガン細胞HepG2に、HBV発現ベクターを導入した一過的なHBV産生モデル細胞が知られている(非特許文献2)。この細胞では、HBV産生がベクターにより制御されているので、HBV産生のオンオフを制御できる。しかし、細胞表面にHBVレセプターを有さないため、HBVを感染させることはできない。また、HepG2はガン細胞であって、正常な肝細胞とは性質が異なる。従って、HBV感染モデル細胞としては使用できない。
【0005】
また、ヒト肝ガン細胞HepaRGは、高分子化合物であるPEG8000の存在下で、HBVを感染させることができる(非特許文献3)。この細胞は、PEG8000の存在下という生体内ではあり得ない条件でのみHBVを感染させることができるため、生体内でのHBV感染を再現したモデルにはならない。PEG8000存在下でのHBV感染は、レセプターを介さない細胞へのHBVの物理的付着を介したものである可能性があり、特にこの点で、実際の生体でのHBV感染を再現したものではない可能性がある。さらに、HepaRG細胞にHBV感染させるためには、肝細胞以外の細胞を共培養する必要があり、この点でも、生体内でのHBV感染を再現したモデルにはならない。さらに、HepaRG細胞はガン細胞であって、正常な肝細胞とは性質が異なる。
【0006】
また、ヒト肝臓から単離した初代肝細胞は、PEG8000非存在下でもHBVを感染させることができる(非特許文献4)。しかし、その感染効率は極めて低い。また、この細胞はガン化していない正常な肝細胞であるというメリットがあるが、その都度ヒトから単離しなければならないため、細胞の性質の個体差が大きく、また細胞の安定供給が困難である。従って、HBV感染モデル細胞として実用できるものではない。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】J. Gener. Virol. 75: 2681-2689, 1994
【非特許文献2】Lab. Invest. 59:173-180, 1988
【非特許文献3】Proc. Natl. Acad. Sci. 26:15655-15660. 2002
【非特許文献4】J. Virol. 62:4136-4143. 1988
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、ヒト生体でのHBV感染を再現したHBV感染モデルヒト肝細胞であって、安定供給できる細胞を提供することを主な課題とする。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するために研究を重ね、以下の知見を得た。
(i) 肝障害免疫不全非ヒト動物にヒト肝細胞を移植して、この非ヒト動物体内でヒト肝細胞を増殖させて初代キメラ非ヒト動物を作製した場合、このキメラ非ヒト動物から分離したヒト肝細胞は、HBVを感染させると、長期にわたり感染状態を維持できる。
(ii) キメラ非ヒト動物体内で増殖したヒト肝細胞にin vitroでHBVを感染させ、感染細胞から培養上清に放出されたHBVは、最初の感染源となったHBVと同等の感染性と増殖能力を有している。即ち、HBVに感染したキメラ非ヒト動物ヒト肝細胞は、正常な感染性、及び増殖能力をもつHBVを産生する能力がある。また、このHBV産生能力を長期にわたり維持する。
(iii) キメラ非ヒト動物体内で増殖したヒト肝細胞は、長期にわたりin vitroで培養した後にHBVを感染させても、感染を成立させることができる。即ち、キメラ非ヒト動物体内で増殖したヒト肝細胞は、長期にわたりHBV感染能を維持する。
(iv) キメラ非ヒト動物体内で増殖したヒト肝細胞にin vitroでHBVを感染させて得られる感染細胞は、既存の抗HBV薬によりHBVの産生が抑制される。即ち、この感染細胞は抗HBV薬のスクリーニングに使用できる。
【0010】
本発明は、上記知見に基づき完成されたものであり、以下のHBV感染モデルヒト肝細胞などを提供する。
項1. 免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を回収する第2工程と、回収したヒト肝細胞にB型肝炎ウィルスを感染させる第3工程とを含む方法により得られるB型肝炎ウィルス感染モデル細胞。
項2. 免疫不全肝障害非ヒト動物が、uPA/SCID、uPA/Rag2(KO)、uPA/NOG、又はFah(KO)/Rag2(KO)/Il2rg(KO)の非ヒト動物である項1に記載の細胞。
項3. 免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を分離する第2工程とを含む方法により得られるB型肝炎ウィルス感染モデル細胞の製造用細胞。
項4. 免疫不全肝障害非ヒト動物が、uPA/SCID、uPA/Rag2(KO)、uPA/NOG、又はFah(KO)/Rag2(KO)/Il2rg(KO)非ヒト動物である項3に記載の細胞。
項5. 免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を回収する第2工程と、回収したヒト肝細胞にB型肝炎ウィルスを添加し、培養することにより、B型肝炎ウィルスが感染したヒト肝細胞を得る第3工程とを含む、B型肝炎ウィルス感染モデル細胞の製造方法。
項6. 免疫不全肝障害非ヒト動物が、uPA/SCID、uPA/Rag2(KO)、uPA/NOG、又はFah(KO)/Rag2(KO)/Il2rg(KO)の非ヒト動物である項5に記載の製造方法。
項7. 第3工程において、回収したヒト肝細胞を0.5〜7×105 cells/cm2の密度で培地に播種し、播種後24時間以上培養したヒト肝細胞1個当たりに対して、約1/10〜1000コピーのHBVを添加し、培養することにより感染させる項5又は6に記載の製造方法。
項8. (1) (a)項1又は2に記載のB型肝炎ウィルス感染モデル細胞に被験物質を供給するか、
(b)項3又は4に記載のB型肝炎ウィルス感染モデル細胞の製造用の細胞にB型肝炎ウィルスを感染させると同時に被験物質を供給するか、
(c) 項3又は4に記載のB型肝炎ウィルス感染モデル細胞の製造用の細胞に被験物質を供給した後にB型肝炎ウィルスを感染させるか、又は
(d) B型肝炎ウィルスに被検物質を供給した後に、このB型肝炎ウィルスを項3又は4に記載のB型肝炎ウィルス感染モデル細胞の製造用の細胞に感染させる
第1工程と、
(2) 被験物質供給群と被験物質非供給群との間で、培養上清中又は細胞内のB型肝炎ウィルス量を比較する第2工程と、
(3) 被験物質の供給により培養上清中又は細胞内の B型肝炎ウィルス量が50%以下になる被験物質を選択する第3工程とを含むB型肝炎の予防又は治療剤のスクリーニング方法。
項9. 第1工程で(a)、(b)、又は(c)を行い、かつ第1工程において、細胞培養液中の濃度が1 pM〜100 mMになるように、被験物質を細胞に供給する項8に記載の方法。
項10. 第1工程で(d)を行い、かつ第1工程において、B型肝炎ウィルスを含む液中の濃度が1 pM〜100 mMになるように、被験物質をB型肝炎ウィルスに供給する項8に記載の方法。
【発明の効果】
【0011】
キメラ非ヒト動物体内で増殖したヒト肝細胞は、長期にわたりHBVの感染能を維持するとともに、一旦HBVが感染すると、長期にわたり、その感染状態を維持できる。さらに、長期にわたり、HBVに新たに感染できる能力を維持できる。また、HBVを感染させたキメラ非ヒト動物ヒト肝細胞で新たに産生され培養上清に放出されたHBVは、キメラ非ヒト動物ヒト肝細胞に感染させる前のHBVと同等の感染性を有する。このように、キメラ非ヒト動物体内で増殖したヒト肝細胞にHBVを感染させると、in vitroで自立的な再感染が起きるため、HBV感染モデルヒト肝細胞として実用できる。
【0012】
また、HBVを感染させたキメラ非ヒト動物ヒト肝細胞は、PEG8000のような特殊な試薬を用いなくても、in vitroで高効率でHBVを感染させることができる。また、ガン化した細胞ではなく正常なヒト肝細胞である。従って、生体内でのHBVの肝細胞への感染を再現したモデル細胞になり得る。
また、キメラ非ヒト動物体内で増殖したヒト肝細胞は、非ヒト動物内で増殖させた細胞であるため、安定に大量供給することができる。また、必要時に新鮮な細胞を供給できる。さらに、同一ヒト個体の肝細胞を大量供給できるため、条件統一が求められる実験や評価、再現性を確認する実験に好適に使用できる。
【0013】
これらの点で、キメラ非ヒト動物ヒト肝細胞、及びHBVを感染させたキメラ非ヒト動物ヒト肝細胞は、研究ツールや、B型肝炎の予防又は治療剤のスクリーニングツール等として極めて有用である。
具体的には、生体での肝細胞へのHBVの感染や複製のメカニズムの解明に好適に使用できる。PEG8000の存在下でのHBVの肝細胞への感染は肝細胞への物理的な付着を介したものである可能性があるが、PEG8000非存在下でのHBV感染はレセプターを介していると考えられる。従って、本発明により、未だ発見されていないHBVレセプターの同定への道が開けた。
また、HBVを感染させたキメラ非ヒト動物ヒト肝細胞は、生体内でのHBVの感染や複製に近い状態を再現したものであるから、この細胞を用いれば、現実のHBVの感染や複製を効果的に抑制できる薬剤を効率よくスクリーニングすることができる。
さらに、従来のように、HBV感染能を有さずHBV産生するだけのモデル細胞では、HBV複製を抑制する薬剤しかスクリーニングすることができないが、HBVを感染させたキメラ非ヒト動物ヒト肝細胞を用いれば、HBV感染を抑制する薬剤もスクリーニングすることができる。
【図面の簡単な説明】
【0014】
【図1】初代キメラマウスから単離したヒト肝細胞にHBVを感染させた後2,8,24,47日目の細胞を倒立光学顕微鏡で観察した写真である。
【図2】初代キメラマウスから単離したヒト肝細胞、及びヒト肝臓から単離した初代凍結肝細胞にHBVを感染させた場合の、培養上清中のHBV DNAコピー数を比較した図である。
【図3】初代キメラマウスから単離したヒト肝細胞に感染させたHBVの増殖を、抗HBV薬ラミブジンが濃度依存的に抑制したことを示す図である。
【図4】初代キメラマウスから単離したヒト肝細胞は、培養期間にわたってヒト肝細胞が放出したHBVに感染できる能力を維持していることを示す図である。
【図5】HBVを感染させた初代キメラマウスの血清と、初代キメラマウスのヒト肝細胞にin vitroでHBVを感染させた場合の培養上清との間で、マウスへの感染性を比較した図である。
【発明を実施するための形態】
【0015】
以下、本発明を詳細に説明する。
(1)HBV感染モデル細胞を製造するための細胞
本発明のHBV感染モデル細胞の製造用細胞は、免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を回収する第2工程とを含む方法により得られる細胞である。
【0016】
非ヒト動物
本発明において、非ヒト動物(以下、「動物」と略称することもある)は、哺乳動物であることが好ましく、げっ歯類であることがより好ましい。げっ歯類動物としては、マウス、ラットのようなネズミ、モルモット、リス、ハムスターなどが挙げられるが、実験動物として汎用されているマウス、ラットのようなネズミが使用し易い。
【0017】
免疫不全肝障害非ヒト動物
免疫不全肝障害非ヒト動物は、異種動物由来の細胞に対して拒絶反応を示さない免疫不全であるとともに、その非ヒト動物本来の肝臓の細胞が障害を受けている動物である。その動物本来の細胞が障害を受けていることにより、ヒト肝細胞を移植すれば、その肝機能は移植されたヒト肝細胞によって保たれ、ヒト肝細胞の個体内機能を正確に反映した動物となる。また、移植するヒト肝細胞が増殖し易くなる。
【0018】
免疫不全肝障害動物は、同一個体に、肝障害誘発処理を施すとともに、免疫不全誘発処理を施すことにより作製することができる。肝障害誘発処理としては、四塩化炭素、黄リン、D-ガラクトサミン、2-アセチルアミノフルオレン、ピロロジンアルカロイドのような肝障害誘発物質の投与や、外科的な肝臓の部分切除などが挙げられる。免疫不全誘発処理としては、免疫抑制剤の投与や胸腺摘出などが挙げられる。
【0019】
また、免疫不全肝障害動物は、遺伝的免疫不全症の動物に、肝障害誘発処理を施すことによっても作製できる。遺伝的免疫不全症動物としては、T細胞系不全を示す重症複合免疫不全症(SCID:severe combined immunodeficiency)の動物、遺伝的な胸腺の欠損によりT細胞機能を失った動物、RAG2遺伝子を公知のジーンターゲッティング法(Science,244:1288-1292,1989)によりノックアウトした動物などが挙げられる。具体的には、SCIDマウス、NUDEマウス、RAG2ノックアウトマウスなどが挙げられる。
【0020】
また、免疫不全肝障害動物は、遺伝的肝障害動物に免疫不全誘発処理を施すことによっても作製できる。遺伝的肝障害動物としては、肝細胞特異的に発現するタンパク質のエンハンサー、及び/又はプロモーターの支配下に連結された肝障害誘発タンパク質遺伝子を用い、公知のトランスジェニック法(Proc. Natl. Acad. Sci. 77;7380-7384, 1980)により作製したトランスジェニック動物が挙げられる。このような動物では、肝障害誘発タンパク質が肝臓特異的に発現するため、肝障害を有するものとなる。肝臓特異的に発現するタンパク質としては、血清アルブミン、コリンエステラーゼ、ハーゲマン因子などが挙げられる。肝障害誘発タンパク質としては、ウロキナーゼプラスミノーゲンアクチベーター(uPA)、ティッシュープラスミノーゲンアクチベーター(tPA)などが挙げられる。また、例えばフマリルアセト酢酸ヒドラーゼ遺伝子のような肝機能を担う遺伝子をノックアウトすることによっても遺伝的肝障害を有する動物を得ることができる。
【0021】
さらに、免疫不全肝障害動物は、遺伝的免疫不全動物と、それと同種の遺伝的肝障害動物とを交配させることによっても作製することができる。
【0022】
遺伝的免疫不全肝障害動物としては、肝障害遺伝子がホモ接合体である動物を用いることが好ましい。このようなホモ接合体動物は正常な肝細胞がほとんど増殖しないため、その動物の肝細胞がヒト肝細胞の増殖を妨げることがない。
【0023】
免疫不全肝障害動物の具体例としては、uPA/SCIDマウス、uPA/Rag2(KO)マウス(Hepatology. 33:981-988. 2001)、uPA/NOGマウス(Biochem. Biophys. Res. Commun. 377:248-52. 2008)、Fah(KO)/Rag2(KO)/Il2rg(KO) (FRG) マウス (Nature Biotech. 25:903-910, 2007;J Clin. Invest. 120:924-930, 2010)などが挙げられる。
【0024】
ヒト肝細胞
移植に用いるヒト肝細胞は、正常なヒト肝組織から、コラゲナーゼ灌流法のような常法によって単離したものを用いることができる。また、分離した肝細胞を一旦冷凍保存した後解凍して用いることもできる。
【0025】
肝細胞を分離するヒトの年齢は特に制限されないが、例えば14歳以下の小児のヒトの肝細胞を使用することにより、ヒト肝細胞による高置換率が達成される。
【0026】
また、in vivoで活発な増殖能を有する増殖性肝細胞を使用することもできる。本発明において、「増殖性ヒト肝細胞」とは、培養条件下(in vitro)において、単一細胞種の集団としてのコロニーを形成し、そのコロニーを増大させるように増殖するヒト肝細胞を意味する。また、その増殖は、コロニー構成細胞が単一種であるという点において「クローン性増殖」という場合もある。さらに、このような細胞は、継代培養によって細胞数をさらに増加することができる細胞である。
【0027】
このような増殖性ヒト肝細胞は、一例として、本発明者らが発明したヒト小型肝細胞(特開平8-112092号公報;日本特許第3266766号;米国特許第6,004,810号、特開平10-179148号公報:日本特許第3211941号、特開平7-274951公報;日本特許第3157984号、特開平9-313172号公報;日本特許第3014322号)を用いることができる。このヒト小型肝細胞は、その優れた増殖能によって、レシピエントの体内で急速に増殖し、正常な肝機能を発揮しうるヒト肝細胞集団を短時間で形成することができる。
【0028】
このような小型肝細胞の採取は、前記公報に記載されているような遠心分離を用いた方法の他、エルトリエーターやFACS等の細胞分画装置によっても採取することができる。さらには、コロニーを形成しながら増殖する肝細胞を特異的に認識するモノクローナル抗体によって採取することもできる。In vitroで増殖させたヒト肝細胞、凍結保存肝細胞、テロメラーゼ遺伝子等の導入により不死化させた肝細胞、これらの肝細胞と非実質細胞を混合させたものも使用できる。
【0029】
初代キメラ動物の作製
このようなヒト肝細胞は、免疫不全肝障害動物の脾臓を経由して肝臓へ移植することができる。また、直接門脈から移植することもできる。移植するヒト肝細胞の数は、1〜200万個程度、好ましくは20万〜100万個程度とすることができる。
【0030】
免疫不全肝障害動物の性別は特に限定されない。また、移植時の免疫不全肝障害動物の日齢は、特に限定されないが、マウスが低週齢のときにヒト肝細胞を移植すると、マウスの成長とともにヒト肝細胞がより活発に増殖することができる点で、生後0〜40日程度、中でも生後8〜40日程度の動物を使用するのが好ましい。
【0031】
移植後の動物を、常法により、飼育すればよい。非ヒト動物体内で増殖したヒト肝細胞であれば、本発明の細胞として用いることができるため、飼育期間は特に限定されない。しかし、1匹のキメラ非ヒト動物から大量のヒト肝細胞を単離するためには、キメラ非ヒト動物の肝臓がヒト肝細胞で高置換されていることが望ましい。従って、例えば移植後30〜200日間程度、好ましくは40〜100日間程度飼育することが好ましく、これにより、肝細胞の一部又は全部がヒト肝細胞で置換された初代キメラ動物が得られる。マウスの場合は、ヒト肝細胞を2〜10×105個程度移植した場合、40〜100日間程度飼育することにより、下記の血中ヒトアルブミン濃度が得られる。
【0032】
また、キメラ非ヒト動物の血中ヒトアルブミン濃度が6mg/ml以上になるまで飼育することが好ましく、10mg/ml以上になるまで飼育することがより好ましい。キメラ非ヒト動物の血中ヒトアルブミン濃度は、ヒト肝細胞による置換率を示す。上記のヒトアルブミン濃度であれば、キメラ動物の肝臓が十分にヒト肝細胞により置換されており、後工程で、このキメラ動物から分離した肝細胞中にヒト肝細胞が高率で含まれ、ヒト肝細胞を効率的に単離することができる。
【0033】
キメラ非ヒト動物からのヒト肝細胞の分離・回収
キメラ動物体内で増殖したヒト肝細胞は、例えば、キメラ動物の肝臓組織をコラゲナーゼ処理することにより分離又は回収することができる。コラゲナーゼの細胞毒性は、非ヒト動物肝細胞に対する方が、ヒト肝細胞に対するより高いため、コラゲナーゼ処理時間を調節することにより、キメラ動物の肝細胞に障害を与え、実質的にヒト肝細胞をより多く分離することができる。コラゲナーゼ処理時間は、ヒト肝細胞と非ヒト肝細胞との存在割合によって異なるが、例えば、血中アルブミン濃度が1〜20mg/ml程度の場合は、濃度0.01〜0.1重量%程度のコラゲナーゼ溶液で5〜30分間程度処理を行えばよい。回収された肝細胞の中には、キメラ動物体内で増殖したヒト肝細胞の他、肝非実質細胞が少量含まれる。さらに、非ヒト動物自身の肝細胞も少量含まれる。
【0034】
回収した肝細胞をそのまま培養に使用してもよいが、ヒト肝細胞又は非ヒト動物肝細胞を特異的に認識するモノクローナル抗体を用いてヒト肝細胞の純度を上げることもできる。分離した肝細胞をヒト肝細胞特異抗体と反応させる場合は、反応した細胞をフローサイトメーター(FACS)や磁気細胞分離装置(MACS)で回収すればよい。また、分離した肝細胞を非ヒト動物肝細胞特異的抗体と反応させる場合は、反応しなかった細胞をFACSやMACSを用いて回収すればよい。
【0035】
マウス肝細胞を特異的に認識するモノクローナル抗体としては、本発明者らが作製したハイブリドーマ66Z株細胞を培養することによって得たもの、又はこのハイブリドーマ細胞をマウス腹腔内に注射し、腹水から採取したものが挙げられる。ヒト肝細胞を特異的に認識するモノクローナル抗体としては、本発明者らが作製したハイブリドーマK8216株細胞を培養することによって得たもの、又はこのハイブリドーマ細胞をマウス腹腔内に注射し、腹水から採取したものが挙げられる。
【0036】
本発明の細胞の生育方法
上記のようにして分離したヒト肝細胞は、動物細胞の培地として従来公知の培地を用いて培養し、又は生育させておくことができる。
このような公知の培地として、例えば、DMEM培地、WEM培地、CS-C培地、肝細胞専用培地キットHCMTMBulletKit (BioWhittaker, Inc.社製)、L-15培地、William's E培地、Waymouth's MB 752/1培地、イーグル基礎培地(Basal Media Eagle; BME)、DMEM/F-12培地(DMEM:F-12=1:1(v/v))、199培地、F-12培地、F-10培地、MEM培地、RPMI1640培地などが挙げられる。これらは、ギブコー社(Gibco-BRL/Life Technologies Inc.)、バイオフィッカー社(BioWhittaker)、タカラ社などから購入できる。中でも、DMEM培地、WEM培地が好ましい。
培地には、ウシ胎児血清、炭素源、窒素源、無機塩、アミノ酸、微量金属元素、微量栄養素、抗生物質、脂肪酸、ビタミン類、浸透圧調整剤、pH指示薬などを添加して補足してもよい。また、HGF/SF、EGFおよびTGF-αなどの成長因子を添加して補足してもよい。
培養は、通常、約35〜39℃で、3〜7%CO2を含む空気雰囲気下で行えばよい。
また、本発明の細胞は凍結保存することもできる。
【0037】
HBV感染
現在、HBVは、ジェノタイプA〜Hの8種が知られている。本発明の細胞は、これらを含む何れのタイプのHBVを感染させるための細胞としても使用できる。
キメラ非ヒト動物から分離したヒト肝細胞へのHBVの感染は、従来公知の方法で行うことができる。キメラ非ヒト動物から分離したヒト肝細胞を、例えば、上記した培地に懸濁して播種する。ヒト肝細胞の播種密度は、約0.5〜7×105 cells/cm2が好ましく、約1〜3×105 cells/cm2がより好ましい。播種後、通常約0〜120時間、好ましくは約24〜72時間培養したヒト肝細胞1個当たりに対して、約1/10〜1000個、好ましくは約1〜100個のHBVを添加又は混合し、培養することにより感染させればよい。感染は、PEG8000などの高分子化合物を含まない培養液中で行うことができる。また、キメラ非ヒト動物から分離したヒト肝細胞以外の細胞の非存在下で行うことができる。細胞の培養は、例えば、約35〜39℃で、約3〜7%のCO2を含む空気雰囲気下で行えばよい。これにより、細胞から細胞へと感染が進み、HBVに感染した細胞集団が得られる。
【0038】
細胞集団にHBVが感染したことは、培養上清中のHBV量を定量することで確認できる。HBV量の定量法としては、例えば、当該細胞の培養上清中に存在するHBVのDNAのコピー数のリアルタイムPCR法による測定(J. Clin. Microbiol.37:2899-2903, 1999)、培養上清のサザンブロッティング解析、ELISAによる培養上清中のウイルスCoreタンパクやSタンパクの定量等が挙げられる。具体的には、スマイテストEX-R&D(医学生物学研究所)で培養上清からDNAを抽出し、培養上清中に存在するHBV DNAのコピー数を、リアルタイムPCR法(J. Clin. Microbiol.37:2899-2903, 1999)により測定し、HBVを感染させて12日目以降に培養上清1mLあたり400コピー以上のHBV DNAが検出された場合に、細胞集団にHBVが感染したと判断することができる。
【0039】
細胞集団にHBVが感染したことは、細胞内のHBV量を定量することによっても確認できる。細胞内のHBV量の定量法としては、例えば上記のようなリアルタイムPCRやサザンブロッティング、ELISA等が挙げられる。具体的には、ヒト肝細胞を0.25%トリプシン−1 mM EDTA(Gibco-BRL/Life Technologies Inc.)で回収した後、スマイテストEX-R&Dで細胞からDNAを抽出し、細胞内のHBV DNAのコピー数をリアルタイムPCR法(J. Clin. Microbiol.37:2899-2903, 1999)により測定し、DNA 50 ngあたり10コピー以上のHBV DNAが検出された場合に、細胞集団にHBVが感染したと判断することができる。
【0040】
(2)HBV感染モデル細胞
本発明のHBV感染モデル細胞は、免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を回収する第2工程と、回収したヒト肝細胞にHBVを添加又は混合し、培養することにより感染させる第3工程とを含む方法により得られる細胞である。
免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する方法、キメラ非ヒト動物体内で増殖したヒト肝細胞を回収する方法、回収したヒト肝細胞にHBVを感染させる方法は、前述した通りである。
第3工程では、回収したヒト肝細胞にHBVを添加又は混合してから、即ち感染操作を行ってから、約0〜50日間培養することが好ましく、約12〜30日間培養することがより好ましい。上記範囲であれば、細胞集団が十分にHBVに感染した状態となる。また、上記範囲であれば、HBV感染状態が維持されている。
本発明のHBV感染モデル細胞は、B型肝炎の予防又は治療剤のスクリーニングや、HBVのヒト肝細胞への感染や複製のメカニズムの解明、特にHBVレセプターの特定のための研究に好適に使用できる。
【0041】
(3)B型肝炎の予防又は治療剤のスクリーニング方法
本発明のB型肝炎の予防又は治療剤のスクリーニング方法は、
(1) (a)上記説明した本発明のHBV感染モデル細胞に被験物質を供給するか、
(b)上記説明した本発明のHBV感染モデル細胞の製造用の細胞(キメラ非ヒト動物から分離したヒト肝細胞)にHBVを感染させると同時に被験物質を供給するか、
(c)上記説明した本発明のHBV感染モデル細胞の製造用の細胞(キメラ非ヒト動物から分離したヒト肝細胞)に被験物質を供給した後にHBVを感染させるか、又は
(d)HBVに被検物質を供給した後に、このHBVを上記説明した本発明のHBV感染モデル細胞の製造用の細胞(キメラ非ヒト動物から分離したヒト肝細胞)に感染させる
第1工程と、
(2) 被験物質供給群と被験物質非供給群との間で、培養上清中又は細胞内のHBV量を比較する第2工程と、
(3) 被験物質の供給により培養上清中又は細胞内のHBV量が50%以下になる被験物質を選択する第3工程とを含む方法である。
【0042】
第1工程で(a)〜(c)を行う場合
第1工程で(a)〜(c)を行う場合は、被験物質を供給する際の、培地中のヒト肝細胞の密度は、約0.1〜7×105 cells/cm2程度が好ましく、約0.5〜2×105 cells/cm2程度がより好ましい。
HBV感染は、ヒト肝細胞1個当たり、約1/10〜1000コピー、好ましくは約1〜100コピーのHBVを添加又は混合し、培養することにより行えばよい。感染は、PEG8000などの高分子化合物を含まない培養液中で行うことができる。また、キメラ非ヒト動物から分離したヒト肝細胞以外の細胞の非存在下で行うことができる。
被験物質を供給する前、及び供給した後は、約35〜39℃(特に、約37℃)で、約3〜7%(特に、約5%)のCO2を含む空気雰囲気下で細胞を培養し、または生育させておけばよい。即ち、通常、細胞を培地中で生育させた状態で被験物質を供給すればよい。
【0043】
被験物質は特に限定されず、低分子化合物、ペプチド、核酸、天然物からの抽出物、無機化合物などが挙げられる。被験物質の細胞培養液(培地)中の濃度が1 pM〜100 mM程度になるように被験物質を添加することが好ましく、1 nM〜1 mM程度になるように被験物質を添加することがより好ましい。
第1工程で(a)、(b)、及び(c)のいずれを行う場合も、第2工程では、例えば被験物質を供給してから約1〜50日後、特に約7〜20日後の細胞培養上清中又は細胞内のHBV量を、被験物質を供給していない細胞の上清中又は細胞内のHBV 量と比較すればよい。細胞内のHBV量は、例えば、細胞を一定量のバッファー等の中でホモジナイズし、ホモジネート中のHBV量を比較すればよい。
第3工程では、被験物質の供給により、培養上清中又は細胞内のHBV 量が非供給群の約40%以下になる被験物質を選択することが好ましく、約10%以下になる被験物質を選択することがより好ましい。
この方法により、B型肝炎の予防又は治療剤を選択できる。
【0044】
第1工程で(d)を行う場合
第1工程で(d)を行なう場合は、例えばHBVを含む培地に被験物質を添加すればよい。培地は、例えば、細胞培養用の培地として例示したものを使用できる。被験物質は特に限定されず、低分子化合物、ペプチド、核酸、天然物からの抽出物、無機化合物などが挙げられる。HBVを含む液(例えば、培地)中の被験物質の濃度が1 pM〜100 mM程度になるように被験物質を添加することが好ましく、1 nM〜1 mM程度になるように被験物質を添加することがより好ましい。HBVに対する被験物質の処理は、例えば約4〜45℃、好ましくは約15〜40℃で、例えば約10秒〜48時間、好ましくは約1分〜24時間行なえばよい。
【0045】
次いで、被験物質処理したHBVを、ヒト肝細胞に添加又は混合し、培養することにより感染させればよい。被検物質で処理されたHBVを用いて感染させる際の培地中のヒト肝細胞の密度は、約0.1〜7×105 cells/cm2程度が好ましく、約0.5〜2×105 cells/cm2程度がより好ましい。感染させるHBV量は、ヒト肝細胞1個当たり、約1/10〜1000コピー、好ましくは約1〜100コピーのHBVとすればよい。感染は、PEG8000などの高分子化合物を含まない培養液中で行うことができる。また、キメラ非ヒト動物から分離したヒト肝細胞以外の細胞の非存在下で行うことができる。
HBVを感染させる前、及び感染させた後は、約35〜39℃(特に、約37℃)で、約3〜7%(特に、約5%)のCO2を含む空気雰囲気下で細胞を培養し、または生育させておけばよい。
【0046】
第2工程では、例えば被検物質が添加されたHBVを細胞に感染させてから、約1〜50日後、特に約7〜20日後の細胞培養上清中又は細胞内のHBV量を、被験物質が添加されていないHBVを感染させた細胞の上清中又は細胞内のHBV量と比較すればよい。細胞内のHBV量は、例えば、細胞を一定量のバッファー等の中でホモジナイズし、ホモジネート中のHBV量を比較すればよい。
第3工程では、被験物質の供給により、培養上清中又は細胞内のHBV 量が非供給群の約40%以下になる被験物質を選択することが好ましく、約10%以下になる被験物質を選択することがより好ましい。
この方法により、B型肝炎の予防又は治療剤を選択できる。
【実施例】
【0047】
以下、本発明を実施例を挙げて、さらに詳細に説明するが、本発明はこれらに限定されるものではない。
(1)キメラマウスの作製
(1-1)免疫不全肝障害マウス
レシピエント動物として使用したuPA-Tg(+/+)/SCID(+/+)マウスは、株式会社フェニックスバイオにて繁殖させたものを用いた。
【0048】
このマウスは、次のようにして作製したものである。uPA-Tgマウス(hemizygote, +/-)とSCIDc.b.-17マウス(homozygote, +/+)とを掛け合せ、両方の形質を持つマウスuPA-Tg(+/-)/SCID(+/-)を35.2%の確率で得た。uPA-Tg(+/-)とuPA-Tg(-/-)の識別は、uPA遺伝子に特異的な配列をプライマーに用い、ゲノムPCR法により行った。また、SCID(+/-)とSCID(-/-)の識別は、PCR-RFLP法により行った。
【0049】
次に、得られたuPA-Tg(+/-)/SCID(+/-)をSCID(+/+)と戻し交配させ、uPA-Tg(+/-)/SCID(+/+)を得た。その結果、uPA-Tg(+/-)は37.9%出現し、SCID(+/+)は52.8%出現した。uPA-Tg(+/-)/SCID(+/+)同士を交配させ、uPA-Tg(+/-)/SCID(+/+)、及び目的のuPA-Tg(+/+)/SCID(+/+)を得た。
【0050】
なお、uPA遺伝子の(-/-), (+/-), (+/+)の識別は以下の方法で行った。生後8〜10日目のマウスの尾を約5 mm切断し、30 μlのDNA lysis buffer {50 mM Tris (pH 8), 50 mM EDTA (pH 8), 1% SDS, 2 mg/ml Proteinase K}を添加後55℃で2〜3時間インキュベートした。インキュベート後、15秒間激しく懸濁し、蒸留水170 μlを添加し、95℃で10分間インキュベートすることによってProteinase Kを不活性化させた。これをPCRのテンプレートとして用いた。テンプレート 1μl、10 x Buffer (Mg+) 2μl、dNTP Mix (2.5 mM) 1.6μl、蒸留水 11.4 μl、uPA-del-Fプライマー (10 pmol/μl) 0.4μl、uPA-del-Rプライマー (10 pmol/μl) 0.4 μl、Tg-Fプライマー (10 pmol/μl) 0.4μl、uPA-high-R1 (10 pmol/μl) 0.4 μl、MgCl2 (25mM) 2 μl、Tween20 (50%) 0.2 μl、rTaq 0.2 μlを混合し、94℃・5分、次いで(94℃・30秒、62℃・30秒、72℃・30秒)x 35〜40サイクルの条件でPCRを行った。2%アガロースゲルを用いて電気泳動を行い、300 bp付近にバンドが検出された場合uPA(-/-)、150 bpに検出された場合はuPA(+/+)、300 bpと150 bp両方に検出された場合uPA(+/-)として判定した。用いたプライマーの配列は以下の通りである。
uPA-del-F
5’-TTCTCTTCTCTTGCCCTCTCACA-3’(配列番号1)
uPA-del-R
5’-TTGAGACCCTCAAGACAGCCA-3’ (配列番号2)
Tg-F
5’-ATCCCTGTGACCCCTCCC-3’ (配列番号3)
uPA-high-R1
5’-CTCCATACCACCCCCCTC-3’ (配列番号4)
【0051】
(1-2)ヒト肝細胞移植
ヒト肝細胞としては、BD Bioscience社より購入した肝細胞(Lot No.BD85、男児、5才)を使用した。この凍結肝細胞はChise Tateno, Yasumi Yoshizane, Naomi Saito, Miho Kataoka, Rie Utoh, Chihiro Yamasaki, Asato Tachibana, Yoshinori Soeno, Kinji Asahina, Hiroshi Hino, Toshimasa Asahara, Tsuyoshi Yokoi, Toshinori Furukawa, Katsutoshi Yoshizato: Near-completely humanized liver in mice shows human-type metabolic responses to drugs. Am J Pathol 165:901-912, 2004に記載の方法に従って融解して用いた。
生後3〜5週齢のuPA-Tg(+/+) /SCID(+/+)マウスをエーテルで麻酔し、わき腹を約5 mm切開し、脾頭より2.5x105個のヒト肝細胞を注入した後、脾臓を腹腔に戻し縫合した。
【0052】
(1-3)初代キメラマウスからのヒト肝細胞の分離
移植後、ビタミンC 0.1%含有CRF-1(オリエンタル酵母株式会社)、次亜塩素酸ナトリウム溶液0.012%添加水道水の自由摂取により飼育した。
週に1回マウス尾静脈より採血し、マウス血中のヒトアルブミン濃度を栄研化学株式会社のラテックス試薬‘栄研’ALB-IIを用い、免疫比濁法により測定した。測定条件は同試薬の添付マニュアルに従った。
【0053】
初代キメラマウスの血中アルブミン濃度が10 mg/mlを超えた高置換マウス(生後98〜112日)6匹を用い、二段階コラゲナーゼ灌流法により肝細胞を分離した。コラゲナーゼ濃度は0.05%、処理時間は5〜25分間とした。肝細胞にはヒト肝細胞とマウス肝細胞が混在しているが、コラゲナーゼによる毒性はヒト肝細胞に対するよりマウス肝細胞に対する方が高いため、ヒト肝細胞の比率の高い肝細胞が得られる。
【0054】
(2)HBV感染細胞の顕微鏡観察
高置換マウスから二段階コラゲナーゼ灌流法により回収されたヒト肝細胞を、10%のウシ胎児血清と抗生物質(ペニシリン100単位、ストレプトマイシン100 μg/ml単位)を含むDMEM(Gibco-BRL/Life Technologies Inc.NIBCO)に懸濁し、3×105 cells/wellの割合でコラーゲン(KOKEN)をコートした24 well plate (BD FALCON)に播種した。
播種24時間後に古い培地を除去した後に、発明者らが既に報告している培地(dHCGM培地、J. Hepatol. 44:749-757. 2006)に、well当たり3×106 コピーのHBV DNAを含むHBV感染キメラマウス血清を加えたものを添加し、24時間培養を行なった。dHCGM培地で3回wellを洗った後、更にdHCGM培地を添加して24時間培養を行なった。それ以降は5日毎に培地を交換し、交換の度に上清中のHBV DNAコピー数の測定用に古い培地を100μl回収した。ヒト肝細胞の培養は5%CO2、37℃で行なった。
図1は、HBV感染処理後、2、8、24、47日目のヒト肝細胞を、倒立顕微鏡を用いて観察した結果である。これらの期間を通じて、ヒト肝細胞が良く形態を維持していることが分かる。
【0055】
(3)HBV感染後のHBV産生状態の測定
キメラマウス由来ヒト肝細胞と、キメラマウスの作製に使用した市販の凍結ヒト肝細胞であるBD85(BD Bioscience、5歳、アフリカンアメリカン、男児)に対して、HBVを感染させて7日目以降の培養上清を5日毎に回収し、既知の条件(J. Clin. Microbiol. 37:2899-2903. 1999)でリアルタイムPCRを行ない、HBV DNAコピー数を測定した。キメラマウス由来ヒト肝細胞および、市販の凍結ヒト肝細胞の培養並びにHBV感染は、上記(2)の項目に記載した条件で行なった。
結果を図2に示す。市販の凍結ヒト肝細胞では7日目以降培養上清中のHBV DNAコピー数が低下したのに対して、キメラマウス由来のヒト肝細胞の場合は、7日目から12日目にかけて上清中のHBV DNAコピー数が10倍以上に増加した。また12日目以降も、緩やかではあるが上清中のHBV DNAコピー数の上昇が確認された。
【0056】
(4)抗HBV薬ラミブジンによるHBV増殖抑制
上記の(2)の項目に記載した条件で、キメラマウス由来のヒト肝細胞に対してHBVを感染させるのと同時に、一般的なHBV複製阻害剤であるラミブジン(東京化成工業)の継続的な処理を開始した。その後は上記(2)の項目に記載した条件で培地交換並びに培養上清の回収を行い、上清中のHBV DNAコピー数に対する影響を検討した。
結果を図3に示す。処理するラミブジン濃度が高くなるにつれて、上清中のHBV DNAコピー数が減少していることが分かる。
【0057】
(5)培養期間における肝細胞のHBV感染能の維持確認
培養ヒト肝細胞のHBVに対する感染能と、培養上清中のHBVの感染性を検討するために、以下の実験を行なった。キメラマウスから回収されたヒト肝細胞を二つのグループに分け、一方のグループのみに対して(2)の項目に記載した条件で、HBV感染処理を行なった。感染処理後22日目の培養上清を回収し、HBVが感染していることを確認した。感染が確認された培養上清を、同じ期間HBVが感染していない状態で維持されていた、もう一方のグループの細胞に培養液に添加した。添加後は他の感染実験と同様に、5日毎に培地を交換し、培地交換直前の培養上清中のHBV DNAコピー数を解析した。
結果を図4に示す。図4が示すように、22日間非感染状態で培養されていたヒト肝細胞(2例)に対して、HBV感染細胞の上清を処理すると、HBVの感染が成立することが明らかとなった。そのHBV産生量は、培養初期からHBVに感染させたものと比べても大きな違いが無かったことから、ヒト肝細胞のHBVに対する感染能は、培養期間を通じてよく維持されていること、及びHBV感染細胞の上清中には感染性の粒子が存在することが分かった。
【0058】
(6)培養上清中に存在するHBVの感染性の検討
キメラマウスから分離した培養ヒト肝細胞で産生されたHBVの感染性と、キメラマウス肝臓中のヒト肝細胞で産生されたHBVの感染性を、キメラマウスを用いて比較した。
即ち、上記(2)の条件で培養及びHBV感染させた、HBV感染後22日目の培養ヒト肝細胞の培養上清と、培養ヒト肝細胞に対して感染源として用いたHBV感染キメラマウスの血清を、それぞれ104コピーHBV DNA/匹の割合でキメラマウスに対して眼窩静脈より接種した。接種後は週1回の割合で採血を行い、血清中のHBV DNAコピー数をリアルタイムPCRで経時的に測定した。
結果を図5に示す。図5から明らかなように、HBV感染培養ヒト肝細胞の上清中にあるHBVの感染性は、HBV感染キメラマウス血清中のHBVの感染性と同等であることが示された。
【産業上の利用可能性】
【0059】
本発明のHBV感染モデル細胞、及びこのモデル細胞の製造用細胞は、B型肝炎の予防又は治療剤のスクリーニングや、HBVのヒト肝細胞への感染や複製メカニズムの解明、特にHBVレセプターの特定のための研究に好適に使用できる。
【特許請求の範囲】
【請求項1】
免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を回収する第2工程と、回収したヒト肝細胞にB型肝炎ウィルスを感染させる第3工程とを含む方法により得られるB型肝炎ウィルス感染モデル細胞。
【請求項2】
免疫不全肝障害非ヒト動物が、uPA/SCID、uPA/Rag2(KO)、uPA/NOG、又はFah(KO)/Rag2(KO)/Il2rg(KO)の非ヒト動物である請求項1に記載の細胞。
【請求項3】
免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を分離する第2工程とを含む方法により得られるB型肝炎ウィルス感染モデル細胞の製造用細胞。
【請求項4】
免疫不全肝障害非ヒト動物が、uPA/SCID、uPA/Rag2(KO)、uPA/NOG、又はFah(KO)/Rag2(KO)/Il2rg(KO)非ヒト動物である請求項3に記載の細胞。
【請求項5】
免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を回収する第2工程と、回収したヒト肝細胞にB型肝炎ウィルスを添加し、培養することにより、B型肝炎ウィルスが感染したヒト肝細胞を得る第3工程とを含む、B型肝炎ウィルス感染モデル細胞の製造方法。
【請求項6】
免疫不全肝障害非ヒト動物が、uPA/SCID、uPA/Rag2(KO)、uPA/NOG、又はFah(KO)/Rag2(KO)/Il2rg(KO)の非ヒト動物である請求項5に記載の製造方法。
【請求項7】
第3工程において、回収したヒト肝細胞を0.5〜7×105 cells/cm2の密度で培地に播種し、播種後24時間以上培養したヒト肝細胞1個当たりに対して、約1/10〜1000コピーのHBVを添加し、培養することにより感染させる請求項5又は6に記載の製造方法。
【請求項8】
(1) (a)請求項1又は2に記載のB型肝炎ウィルス感染モデル細胞に被験物質を供給するか、
(b)請求項3又は4に記載のB型肝炎ウィルス感染モデル細胞の製造用の細胞にB型肝炎ウィルスを感染させると同時に被験物質を供給するか、
(c) 請求項3又は4に記載のB型肝炎ウィルス感染モデル細胞の製造用の細胞に被験物質を供給した後にB型肝炎ウィルスを感染させるか、又は
(d) B型肝炎ウィルスに被検物質を供給した後に、このB型肝炎ウィルスを請求項3又は4に記載のB型肝炎ウィルス感染モデル細胞の製造用の細胞に感染させる
第1工程と、
(2) 被験物質供給群と被験物質非供給群との間で、培養上清中又は細胞内のB型肝炎ウィルス量を比較する第2工程と、
(3) 被験物質の供給により培養上清中又は細胞内の B型肝炎ウィルス量が50%以下になる被験物質を選択する第3工程とを含むB型肝炎の予防又は治療剤のスクリーニング方法。
【請求項9】
第1工程で(a)、(b)、又は(c)を行い、かつ第1工程において、細胞培養液中の濃度が1 pM〜100 mMになるように、被験物質を細胞に供給する請求項8に記載の方法。
【請求項10】
第1工程で(d)を行い、かつ第1工程において、B型肝炎ウィルスを含む液中の濃度が1 pM〜100 mMになるように、被験物質をB型肝炎ウィルスに供給する請求項8に記載の方法。
【請求項1】
免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を回収する第2工程と、回収したヒト肝細胞にB型肝炎ウィルスを感染させる第3工程とを含む方法により得られるB型肝炎ウィルス感染モデル細胞。
【請求項2】
免疫不全肝障害非ヒト動物が、uPA/SCID、uPA/Rag2(KO)、uPA/NOG、又はFah(KO)/Rag2(KO)/Il2rg(KO)の非ヒト動物である請求項1に記載の細胞。
【請求項3】
免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を分離する第2工程とを含む方法により得られるB型肝炎ウィルス感染モデル細胞の製造用細胞。
【請求項4】
免疫不全肝障害非ヒト動物が、uPA/SCID、uPA/Rag2(KO)、uPA/NOG、又はFah(KO)/Rag2(KO)/Il2rg(KO)非ヒト動物である請求項3に記載の細胞。
【請求項5】
免疫不全肝障害非ヒト動物にヒト肝細胞を移植してキメラ非ヒト動物を作製する第1工程と、キメラ非ヒト動物体内で増殖したヒト肝細胞を回収する第2工程と、回収したヒト肝細胞にB型肝炎ウィルスを添加し、培養することにより、B型肝炎ウィルスが感染したヒト肝細胞を得る第3工程とを含む、B型肝炎ウィルス感染モデル細胞の製造方法。
【請求項6】
免疫不全肝障害非ヒト動物が、uPA/SCID、uPA/Rag2(KO)、uPA/NOG、又はFah(KO)/Rag2(KO)/Il2rg(KO)の非ヒト動物である請求項5に記載の製造方法。
【請求項7】
第3工程において、回収したヒト肝細胞を0.5〜7×105 cells/cm2の密度で培地に播種し、播種後24時間以上培養したヒト肝細胞1個当たりに対して、約1/10〜1000コピーのHBVを添加し、培養することにより感染させる請求項5又は6に記載の製造方法。
【請求項8】
(1) (a)請求項1又は2に記載のB型肝炎ウィルス感染モデル細胞に被験物質を供給するか、
(b)請求項3又は4に記載のB型肝炎ウィルス感染モデル細胞の製造用の細胞にB型肝炎ウィルスを感染させると同時に被験物質を供給するか、
(c) 請求項3又は4に記載のB型肝炎ウィルス感染モデル細胞の製造用の細胞に被験物質を供給した後にB型肝炎ウィルスを感染させるか、又は
(d) B型肝炎ウィルスに被検物質を供給した後に、このB型肝炎ウィルスを請求項3又は4に記載のB型肝炎ウィルス感染モデル細胞の製造用の細胞に感染させる
第1工程と、
(2) 被験物質供給群と被験物質非供給群との間で、培養上清中又は細胞内のB型肝炎ウィルス量を比較する第2工程と、
(3) 被験物質の供給により培養上清中又は細胞内の B型肝炎ウィルス量が50%以下になる被験物質を選択する第3工程とを含むB型肝炎の予防又は治療剤のスクリーニング方法。
【請求項9】
第1工程で(a)、(b)、又は(c)を行い、かつ第1工程において、細胞培養液中の濃度が1 pM〜100 mMになるように、被験物質を細胞に供給する請求項8に記載の方法。
【請求項10】
第1工程で(d)を行い、かつ第1工程において、B型肝炎ウィルスを含む液中の濃度が1 pM〜100 mMになるように、被験物質をB型肝炎ウィルスに供給する請求項8に記載の方法。
【図2】


【図3】


【図4】


【図5】


【図1】




【図3】


【図4】


【図5】


【図1】


【公開番号】特開2012−39888(P2012−39888A)
【公開日】平成24年3月1日(2012.3.1)
【国際特許分類】
【出願番号】特願2010−181121(P2010−181121)
【出願日】平成22年8月12日(2010.8.12)
【出願人】(503449018)株式会社フェニックスバイオ (7)
【Fターム(参考)】
【公開日】平成24年3月1日(2012.3.1)
【国際特許分類】
【出願日】平成22年8月12日(2010.8.12)
【出願人】(503449018)株式会社フェニックスバイオ (7)
【Fターム(参考)】
[ Back to top ]

