B型肝炎表面抗原に対するウサギモノクローナル抗体およびそれを使用する方法
【課題】B型肝炎ウイルス(HBV)感染の正確な検出のための試薬、方法、および免疫診断検査キットの提供。。
【解決手段】この方法およびキットは、HBV表面抗原(HBsAg)を指向する新規のウサギモノクローナル抗体を利用し、この新規のウサギモノクローナル抗体は、HBsAgの「a」決定基領域に変異を有する。本発明は、HBV感染の簡便で、正確かつ効率的な診断のために、免疫反応性の高いモノクローナル抗体を提供する。この抗体は、ウサギハイブリドーマから産生され、そして種々の変異体HBV株に対して免疫反応性である。
【解決手段】この方法およびキットは、HBV表面抗原(HBsAg)を指向する新規のウサギモノクローナル抗体を利用し、この新規のウサギモノクローナル抗体は、HBsAgの「a」決定基領域に変異を有する。本発明は、HBV感染の簡便で、正確かつ効率的な診断のために、免疫反応性の高いモノクローナル抗体を提供する。この抗体は、ウサギハイブリドーマから産生され、そして種々の変異体HBV株に対して免疫反応性である。
【発明の詳細な説明】
【技術分野】
【0001】
(技術分野)
本発明は、一般的に、B型肝炎ウイルス(HBV)に関係する。特に、本発明は、HBV表面抗原を指向するウサギモノクローナル抗体およびHBV感染の診断のためのその使用の方法に関する。
【背景技術】
【0002】
(背景)
B型肝炎ウイルス(HBV)は、肝臓の持続的な非細胞変性(noncytopathic)の感染を引き起こす小さいDNA含有ウイルスの群の一員である。ヒトにおけるHBV感染は、重篤な黄疸、肝変性および死を引き起こし得る。HBVは、主に非経口的経路によって進入し、60〜160日間の特徴的な潜伏期間を有し、そして慢性的キャリアにおいて血中に長年にわたって存続し得る。HBVは、ヒトにおける慢性肝疾患(例えば、肝臓癌)の最も一般的な原因の1つであるので、医学的に非常に重要である。感染した肝細胞は、頻繁にウイルス粒子を分泌し、このウイルス粒子は血中に高レベルに蓄積する。さらに、人口の約6〜7%が感染していると推定され、この感染のレベルは、東南アジアおよびサハラ以南のアフリカの特定の地域で、人口の20%と高い。
【0003】
数種の検査が、血清および他の体液中のHBV成分の存在を検出するために利用されてきた。これらの検査は、原理において主に免疫学的であり、そしてヒトまたは動物において産生される、特定のウイルスタンパク質(例えば、B型肝炎表面抗原(HBsAg)、B型肝炎コア(ヌクレオカプシド)抗原(HBcAg)またはB型肝炎「E」抗原(HBeAg))を検出する抗体の存在に依存する。しかし、血清学的なHBsAg診断アッセイまたは血液スクリーニングアッセイにおいて偽陰性の産物に関連した、改変体HBsAgの寄与に対する懸念の増加が存在する。
【0004】
特に、HBVは、ゲノム以前(pre−genomic)のRNAの逆転写による複製の様式に起因して、他のDNAウイルスよりも高い割合の変異を有する。アミノ酸置換は、全てのHBV DNAがコードするウイルスタンパク質(例えば、ポリメラーゼ、HBcAgおよびHBsAg)において記載されてきた。HBVの群特異的な「a」決定基領域(HBsAgのS部分に対して番号付けされたアミノ酸124〜147)は、最も注目を集めてきた。なぜなら、この領域における変異は、ワクチン回避体(vaccine escapee)の10〜20%において見出され、そして市販されている最近の血清学的アッセイを使用してでさえも、改変体HBVの誤診をもたらしてきたからである。したがって、血液製剤および血漿製剤、または人同士の密接な接触によるこのウイルスの伝染を予防するために、ウイルスの血液サンプルにおいて、HBVを検出する確実な診断的検査の開発に対する必要性が存在する。
【0005】
ウサギ−ウサギハイブリドーマおよびウサギ−マウスハイブリドーマは、増加した免疫反応性を有するモノクローナル抗体を産生する試みにおいて使用されてきた。例えば、特許文献1;特許文献2;特許文献3;特許文献4;非特許文献1を参照のこと。ウサギモノクローナル抗体は、いくつかの理由から望ましい。第1に、ウサギは、マウスまたはラット(モノクローナル抗体が通常産生される2つの種)において免疫原性でない抗原およびエピトープを認識し得る。さらに、ウサギ抗体は、一般的に、高親和性である。特許文献5は、ウサギ−ウサギ融合体を使用した、HBsAgに対するウサギモノクローナル抗体の産生を記載する。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】米国特許第4,977,081号明細書
【特許文献2】米国特許第4,859,595号明細書
【特許文献3】米国特許第5,472,868号明細書
【特許文献4】米国特許第5,675,063号明細書
【特許文献5】米国特許第4,859,595号明細書
【非特許文献】
【0007】
【非特許文献1】Spieker−Poletら、「Proc.Natl.Acad.Sci.USA」、1995年、第92巻、p.9348−9352
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかし、種々のHBsAg変異体に対する幅広い免疫反応性を有するモノクローナル抗体を使用する、改良された免疫アッセイに対する必要性が存在し続ける。HBV感染に対する正確かつ有効なアッセイにおいて使用するための広範な利用可能性の試薬が、非常に望まれている。
【課題を解決するための手段】
【0009】
本発明は、HBV感染の簡便で、正確かつ効率的な診断のために、免疫反応性の高いモノクローナル抗体を提供する。この抗体は、ウサギハイブリドーマから産生され、そして種々の変異体HBV株に対して免疫反応性である。したがって、このウサギモノクローナル抗体を使用したアッセイ方法は、より正確であり、そして他の血清学的検査によって認められる偽陰性の数は、減少する。したがって、この抗体を使用するアッセイは、種々のHBV変異体によって引き起こされるHBV感染の検出を可能にし、そして感染が検出される場合、その個体は、肝臓の損傷および死の予防を支援するために、適時、適切な処置を施され得る。
【0010】
したがって、1つの実施形態において、本発明は、「a」決定基領域に変異を有するHBsAg変異体を認識する抗HBVウサギモノクローナル抗体、またはその免疫反応性フラグメント(例えば、Fabフラグメント、F(ab’)2フラグメント、FvフラグメントまたはsFvフラグメント)に関する。特定の実施形態において、この抗体は、「a」決定基領域に変異を有する1つより多くのHBsAg変異体を認識する。さらなる実施形態において、この抗体はまた、野生型HBsAgを認識する。よりさらなる実施形態において、このHBsAg変異体は、変異体sAg(例えば、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tの「a」決定基領域の配列を含む変異体)である。さらなる実施形態において、この抗体は、F134A、F134S、G145R、S143L、P142SおよびQ129R/M133Tからなる群より選択されるHBsAgおよび/または1つもしくは少なくとも2つの変異体HBSAgを認識する。上記の抗体のいずれかは、ウサギ−ウサギハイブリドーマまたはウサギ−マウスハイブリドーマを使用して産生され得る。
【0011】
さらなる実施形態において、本発明は、ハイブリドーマ99S6(ATCC受託番号PTA−6015)およびハイブリドーマ99S9(ATCC受託番号PTA−6014)ならびにこれらのハイブリドーマによって産生される抗体に関する。さらなる実施形態において、本発明は、ハイブリドーマ99S6および/またはハイブリドーマ99S9によって産生される抗体と同じエピトープを認識するウサギモノクローナル抗体に関する。
【0012】
さらなる実施形態において、本発明は、生物学的サンプル中のHBV表面抗原を検出する方法に関する。この方法は、以下を包含する:
HBV抗原が、この生物学的サンプル中に存在する場合に、HBV抗原が上記の実施形態のいずれかに従う少なくとも1つのウサギモノクローナル抗体に結合して抗体/抗原複合体を形成することを可能にする条件下で、この生物学的サンプルとこの抗体とを接触させる工程;および
この抗体/抗原複合体の存在または非存在を検出し、それによってこのサンプル中のHBV表面抗原の存在または非存在を検出する工程。
【0013】
上記の方法の好ましい実施形態において、この少なくとも1つのウサギモノクローナル抗体は、ハイブリドーマ99S6またはハイブリドーマ99S9によって産生される抗体である。特定の実施形態において、少なくとも1つのウサギモノクローナル抗体は、検出可能に標識される。特定の実施形態において、この方法は、生物学的サンプルと、野生型HBsAgまたは「a」決定基領域に変異を有するHBsAg変異体を指向する1つ以上のさらなる抗体とを反応させる工程をさらに包含する。この1つ以上のさらなる抗体は、さらなるモノクローナル抗体(例えば、マウスモノクローナル抗体)を含み得る。
【0014】
さらなる実施形態において、本発明は、HBV感染を検出するための免疫診断検査キットに関する。この検査キットは、以下を備える:上記の実施形態のいずれかに従う少なくとも1つのウサギモノクローナル抗体、またはその免疫反応性フラグメント;および
免疫診断検査を行うための説明書。
【0015】
上記の方法の好ましい実施形態において、この少なくとも1つのウサギモノクローナル抗体は、ハイブリドーマ99S6またはハイブリドーマ99S9によって産生される抗体である。特定の実施形態において、この検査キットは、野生型HBsAgまたは「a」決定基領域に変異を有するHBsAg変異体を指向する1つ以上のさらなる抗体をさらに備える。この1つ以上のさらなる抗体は、さらなるモノクローナル抗体(例えば、マウスモノクローナル抗体)を含み得る。
【0016】
さらなる実施形態において、本発明は、上記の実施形態のいずれかに従う少なくとも1つのウサギモノクローナル抗体またはその免疫反応性フラグメントを備える固体支持体に関する。この固体支持体の好ましい実施形態において、この少なくとも1つのウサギモノクローナル抗体は、ハイブリドーマ99S6またはハイブリドーマ99S9によって産生される抗体である。特定の実施形態において、この支持体は、野生型HBsAgまたは「a」決定基領域に変異を有するHBsAg変異体を指向する1つ以上のさらなる抗体をさらに備える。この1つ以上のさらなる抗体は、さらなるモノクローナル抗体(例えば、マウスモノクローナル抗体)を含み得る。さらなる実施形態において、この固体支持体は、少なくとも2つの内部コントロールをさらに備え、このコントロールの一方が、この固体支持体を使用した免疫アッセイにおけるポジティブな結果についての、より低い検出限界を規定し、そして他方のコントロールは、この固体支持体を使用した免疫アッセイにおける極めてポジティブな結果を規定する。いくつかの実施形態において、この固体支持体は、ニトロセルロースストリップである。
【0017】
よりさらなる実施形態において、本発明は、HBVを検出するための免疫診断検査キットに関する。この検査キットは、以下を備える:
(a)上記の実施形態のいずれかに従う固体支持体;および
(b)免疫診断検査を行うための説明書。
【0018】
さらなる実施形態において、本発明は、生物学的サンプル中のHBV表面抗原の存在を検出する方法に関する。この方法は、以下を包含する:
(a)生物学的サンプルを提供する工程;
(b)上に記載されるような固体支持体を提供する工程;
(c)HBV抗原がこの生物学的サンプル中に存在する場合に、HBV抗原がウサギモノクローナル抗体の少なくとも1つに結合して抗体/抗原複合体を形成することを可能にする条件下で、この生物学的サンプルとこの固体支持体とを接触させる工程;および
(d)この抗体/抗原複合体の存在を検出し、それによって該生物学的サンプル中のHBV表面抗原の存在を検出する工程。
【0019】
特定の実施形態において、この方法は、以下をさらに包含する:
(e)結合していないHBV抗原を除去する工程;
(f)この抗体/抗原複合体と結合し得る1つ以上の部分を提供する工程;および
(g)この1つ以上の部分の存在を検出し、それによってこの生物学的サンプル中のHBV表面抗原の存在を検出する工程。
【0020】
この方法のさらなる実施形態において、この1つ以上の部分は、検出可能に標識されたHBV抗体(例えば、「a」決定基領域に変異を有するHBsAg変異体を認識する検出可能に標識されたウサギモノクローナル抗体)、またはその免疫反応性フラグメントを含む。この検出可能な標識は、酵素であり得る。さらに、この生物学的サンプルは、ヒト血液サンプルに由来し得る。
【0021】
さらなる実施形態において、本発明は、生物学的サンプル中の抗HBsAg抗体の存在を検出する方法に関する。この方法は、以下を包含する:
(a)上に記載されるような固体支持体を提供する工程;
(b)1つ以上のHBsAgがウサギモノクローナル抗体の少なくとも1つに結合して、抗体/抗原複合体を形成することのできる条件下で、この固体支持体と1つ以上のHBsAgとを接触させる工程;
(d)抗HBsAg抗体がこの生物学的サンプル中に存在する場合に、抗HBsAg抗体がこの抗体/抗原複合体に結合して、抗体/抗原/抗体複合体を形成することのできる条件下で、この抗体/抗原複合体を有する固体支持体と生物学的サンプルとを接触させる工程;および
(e)この抗体/抗原/抗体複合体の存在を検出し、それによってこの生物学的サンプル中の抗HBsAg抗体の存在を検出する工程。
【0022】
さらなる実施形態において、この方法は、以下をさらに包含する:
(f)結合していない抗体を除去する工程;
(g)この抗体/抗原/抗体複合体と結合し得る1つ以上の部分(例えば、検出可能に標識された免疫グロブリン分子を含む1つ以上の部分)を提供する工程;および
(h)この1つ以上の部分の存在を検出し、それによってこの生物学的サンプル中の抗HBsAg抗体の存在を検出する工程。
【0023】
さらなる実施形態において、本発明は、HBVを実質的に含まない全血、血小板、血漿または血清を含む血液供給物を調製する方法に関する。この方法は、以下を包含する:
(a)上記の方法によって収集される血液サンプル由来の全血、血小板、血漿または血清のアリコートをスクリーニングする工程;
(b)HBV抗原が検出されるあらゆるサンプルを除去する工程;および
(c)HBV抗原が検出されないサンプルを合わせて、HBVを実質的に含まない血液供給物を提供する工程。
【0024】
さらなる実施形態において、本発明は、HBVを実質的に含まない全血、血小板、血漿または血清を含む血液供給物を調製する方法に関する。この方法は、以下を包含する:
(a)上記の方法によって収集される血液サンプル由来の全血、血小板、血漿または血清のアリコートをスクリーニングする工程;
(b)抗HBsAg抗体が検出されるあらゆるサンプルを除去する工程;および
(c)抗HBsAg抗体が検出されないサンプルを合わせて、HBVを実質的に含まない血液供給物を提供する工程。
【0025】
よりさらなる実施形態において、本発明は、移植の前に供与された組織または供与された器官をスクリーニングしてHBVを実質的に含まない組織または器官を提供する方法に関する。この方法は、以下を包含する:
(a)上記の方法によってこの組織またはこの器官由来のサンプルをスクリーニングする工程;
(b)HBV抗原が検出される組織または器官を除去して、HBVを実質的に含まない組織または器官を提供する工程。
【0026】
さらなる実施形態において、本発明は、移植の前に供与された組織または供与された器官をスクリーニングしてHBVを実質的に含まない組織または器官を提供する方法に関する。この方法は、以下を包含する:
(a)上記の方法によってこの組織またはこの器官由来のサンプルをスクリーニングする工程;
(b)抗HBsAg抗体が検出される組織または器官を除去して、HBVを実質的に含まない組織または器官を提供する工程。
【0027】
よりさらなる実施形態において、本発明は、抗HBVウサギモノクローナル抗体を調製する方法に関する。この方法は、以下を包含する:
(a)「a」決定基領域に変異を有するHBsAg変異体によってウサギを免疫化する工程;
(b)このウサギ由来のHBsAg変異体に対する抗体を産生する細胞と、不死化した細胞株由来の細胞とを融合して、ハイブリドーマを産生する工程;
(c)このハイブリドーマを選択する工程;
(d)この選択したハイブリドーマを培養する工程;および
(e)この培養したハイブリドーマによって分泌されるこの抗体を収集する工程。
【0028】
特定の実施形態において、この免疫化する工程は、1つより多くのHBsAg変異体によってウサギを免疫化する工程を包含する。特定の実施形態において、この抗体を産生する細胞は、ウサギ脾細胞である。この脾細胞は、不死化したウサギ細胞株(例えば、ウサギプラズマ細胞腫)由来の細胞と融合されてウサギ−ウサギハイブリドーマを産生し得るか、または不死化したマウス細胞株由来の細胞と融合されてウサギ−マウスハイブリドーマを産生し得る。
【0029】
上記の方法の特定の実施形態において、このHBsAg変異体は、変異体sAg(例えば、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tの「a」決定基領域の配列を含む変異体)である。他の実施形態において、このHBsAg変異体は、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tを含む。よりさらなる実施形態において、このウサギは、この「a」決定基領域に異なる変異を有する少なくとも2つのHBsAg変異体(例えば、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tからなる群より選択される少なくとも2つのHBsAg変異体)によって免疫化される。さらなる実施形態において、このウサギは、HBsAg変異体であるF134A、F134S、G145R、S143L、P142SおよびQ129R/M133Tによって免疫化される。さらなる実施形態において、このウサギは、野生型HBsAgによってさらに免疫化される。
【0030】
さらなる実施形態において、本発明は、上記の方法によって産生される抗HBVウサギモノクローナル抗体に関する。
【0031】
よりさらなる実施形態において、本発明は、ウサギ−ウサギハイブリドーマを調製する方法に関する。この方法は、以下を包含する:
(a)「a」決定基領域に変異を有するHBsAg変異体によってウサギを免疫化する工程;
(b)このウサギ由来のHBsAg変異体に対する抗体を産生する脾細胞と、ウサギプラズマ細胞腫由来の細胞とを融合する工程;
(c)この抗体を分泌する細胞を選択する工程。
【0032】
さらなる実施形態において、本発明は、上に記載されるようなウサギモノクローナル抗体またはその免疫反応性フラグメント(例えば、Fabフラグメント、F(ab’)2フラグメント、FvフラグメントまたはsFvフラグメント)をコードするポリヌクレオチドに関する。
【0033】
当業者は、本明細書中の開示を考慮して、本発明のこれらの実施形態および他の実施形態に容易に想到する。
例えば、本願発明は以下の項目を提供する。
(項目1)
「a」決定基領域に変異を有するHBsAg変異体を認識する、B型肝炎ウイルス(HBV)ウサギモノクローナル抗体、またはその免疫反応性フラグメント。
(項目2)
前記抗体は、「a」決定基領域に変異を有する1つより多くのHBsAg変異体を認識する、項目1に記載のウサギモノクローナル抗体。
(項目3)
前記抗体はまた、野生型HBsAgを認識する、項目1に記載のウサギモノクローナル抗体。
(項目4)
前記HBsAg変異体は、変異体sAgである、項目1に記載のウサギモノクローナル抗体。
(項目5)
前記HBsAg変異体は、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tの「a」決定基領域の配列を含む、項目4に記載のウサギモノクローナル抗体。
(項目6)
前記抗体は、F134A、F134S、G145R、S143L、P142SおよびQ129R/M133Tからなる群より選択されるHBsAgを認識する、項目5に記載のウサギモノクローナル抗体。
(項目7)
前記抗体は、F134A、F134S、G145R、S143L、P142SおよびQ129R/M133Tからなる群より選択される少なくとも2つの変異体HBsAgを認識する、項目5に記載のウサギモノクローナル抗体。
(項目8)
前記抗体は、変異体HBsAgであるF134A、F134S、G145R、S143L、P142SおよびQ129R/M133Tを認識する、項目5に記載のウサギモノクローナル抗体。
(項目9)
前記抗体は、前記抗体は、ウサギ−ウサギハイブリドーマを使用して産生される、項目1〜8のいずれか1項に記載のウサギモノクローナル抗体。
(項目10)
前記抗体は、ウサギ−マウスハイブリドーマを使用して産生される、項目1〜8のいずれか1項に記載のウサギモノクローナル抗体。
(項目11)
ハイブリドーマ99S6(ATCC受託番号PTA−6015)。
(項目12)
ハイブリドーマ99S9(ATCC受託番号PTA−6014)。
(項目13)
ハイブリドーマ99S6(ATCC受託番号PTA−6015)によって産生される抗体。
(項目14)
ハイブリドーマ99S9(ATCC受託番号PTA−6014)によって産生される抗体。
(項目15)
前記フラグメントは、Fabフラグメント、F(ab’)2フラグメント、FvフラグメントまたはsFvフラグメントである、項目1に記載のフラグメント。
(項目16)
ハイブリドーマ99S6(ATTC受託番号PTA−6015)またはハイブリドーマ99S9(ATCC受託番号PTA−6014)によって産生される抗体と同じエピトープを認識する、ウサギモノクローナル抗体。
(項目17)
生物学的サンプル中のHBV表面抗原を検出する方法であって、以下:
(a)HBV抗原が該生物学的サンプル中に存在する場合に、該HBV抗原が、項目1〜10、項目13、項目14、項目16、または項目59のいずれか1項に記載の少なくとも1つのウサギモノクローナル抗体に結合して抗体/抗原複合体を形成することを可能にする条件下で、該生物学的サンプルと該抗体とを接触させる工程;および
(b)該抗体/抗原複合体の存在または非存在を検出し、それによって該サンプル中のHBV表面抗原の存在または非存在を検出する工程、
を包含する、方法。
(項目18)
前記少なくとも1つのウサギモノクローナル抗体は、検出可能に標識される、項目17に記載の方法。
(項目19)
前記方法は、前記生物学的サンプルと、野生型HBsAgまたは「a」決定基領域に変異を有するHBsAg変異体を指向する1つ以上のさらなる抗体とを反応させる工程を包含する、項目17に記載の方法。
(項目20)
前記1つ以上のさらなる抗体は、さらなるモノクローナル抗体を含む、項目19に記載の方法。
(項目21)
前記1つ以上のさらなる抗体は、マウスモノクローナル抗体を含む、項目20に記載の方法。
(項目22)
HBV感染を検出するための免疫診断検査キットであって、該検査キットは、以下:
(a)項目1に記載の少なくとも1つのウサギモノクローナル抗体、またはその免疫反応性フラグメント;および
(b)免疫診断検査を行うための説明書、
を備える、免疫診断検査キット。
(項目23)
前記検査キットは、野生型HBsAgまたは「a」決定基領域に変異を有するHBsAg変異体を指向する1つ以上のさらなる抗体をさらに備える、項目22に記載の免疫診断検査キット。
(項目24)
前記1つ以上のさらなる抗体は、さらなるモノクローナル抗体を含む、項目23に記載の免疫診断検査キット。
(項目25)
前記1つ以上のさらなる抗体は、マウスモノクローナル抗体を含む、項目24に記載の免疫診断検査キット。
(項目26)
項目1に記載の少なくとも1つのウサギモノクローナル抗体またはその免疫反応性フラグメントを備える、固体支持体。
(項目27)
前記支持体は、野生型HBsAgまたは「a」決定基領域に変異を有するHBsAg変異体を指向する1つ以上のさらなる抗体をさらに備える、項目26に記載の固体支持体。
(項目28)
前記1つ以上のさらなる抗体は、さらなるモノクローナル抗体を含む、項目27に記載の固体支持体。
(項目29)
前記1つ以上のさらなる抗体は、マウスモノクローナル抗体を含む、項目28に記載の固体支持体。
(項目30)
項目26に記載の固体支持体であって、少なくとも2つの内部コントロールをさらに備え、該コントロールの一方が、該固体支持体を使用した免疫アッセイにおけるポジティブな結果についてのより低い検出限界を規定し、そして他方のコントロールは、該固体支持体を使用した免疫アッセイにおける極めてポジティブな結果を規定する、固体支持体。
(項目31)
前記固体支持体は、ニトロセルロースストリップである、項目26に記載の固体支持体。
(項目32)
HBVを検出するための免疫診断検査キットであって、該検査キットは、以下:
(a)項目26〜31のいずれか1項に記載の固体支持体;および
(b)免疫診断検査を行うための説明書
を備える、免疫診断検査キット。
(項目33)
生物学的サンプル中のHBV表面抗原の存在を検出する方法であって、該方法は、以下:
(a)生物学的サンプルを提供する工程;
(b)項目26〜31のいずれか1項に記載の固体支持体を提供する工程;
(c)HBV抗原がこの生物学的サンプル中に存在する場合に、該HBV抗原がウサギモノクローナル抗体の少なくとも1つに結合して抗体/抗原複合体を形成することを可能にする条件下で、該生物学的サンプルと該固体支持体とを接触させる工程;および
(d)該抗体/抗原複合体の存在を検出し、それによって該生物学的サンプル中のHBV表面抗原の存在を検出する工程、
を包含する、方法。
(項目34)
項目33に記載の方法であって、以下:
(e)結合していないHBV抗原を除去する工程;
(f)前記抗体/抗原複合体と結合し得る1つ以上の部分を提供する工程;および
(g)該1つ以上の部分の存在を検出し、それによって前記生物学的サンプル中のHBV表面抗原の存在を検出する工程、
をさらに包含する、方法。
(項目35)
前記1つ以上の部分は、検出可能に標識されたHBV抗体である、項目34に記載の方法。
(項目36)
前記検出可能に標識されたHBV抗体は、「a」決定基領域に変異を有するHBsAg変異体を認識するウサギモノクローナル抗体、またはその免疫反応性フラグメントである、項目35に記載の方法。
(項目37)
前記検出可能な標識は、酵素である、項目35に記載の方法。
(項目38)
前記生物学的サンプルは、ヒト血液サンプルに由来する、項目17に記載の方法。
(項目39)
生物学的サンプル中の抗HBsAg抗体の存在を検出する方法であって、該方法は、以下:
(a)項目26〜31のいずれか1項に記載の固体支持体を提供する工程;
(b)1つ以上のHBsAgがウサギモノクローナル抗体の少なくとも1つに結合して、抗体/抗原複合体を形成することのできる条件下で、該固体支持体と該1つ以上のHBsAgとを接触させる工程;
(d)抗HBsAg抗体が該生物学的サンプル中に存在する場合に、該抗HBsAg抗体が該抗体/抗原複合体に結合して、抗体/抗原/抗体複合体を形成することのできる条件下で、該抗体/抗原複合体を有する固体支持体と該生物学的サンプルとを接触させる工程;および
(e)該抗体/抗原/抗体複合体の存在を検出し、それによって該生物学的サンプル中の抗HBsAg抗体の存在を検出する工程、
を包含する、方法。
(項目40)
項目39に記載の方法であって、以下:
(f)結合していない抗体を除去する工程;
(g)前記抗体/抗原/抗体複合体と結合し得る1つ以上の部分を提供する工程;および
(h)該1つ以上の部分の存在を検出し、それによって前記生物学的サンプル中の抗HBsAg抗体の存在を検出する工程、
をさらに包含する、方法。
(項目41)
前記1つ以上の部分は、検出可能に標識された免疫グロブリン分子を含む、項目40に記載の方法。
(項目42)
HBVを実質的に含まない全血、血小板、血漿または血清を含む血液供給物を調製する方法であって、以下:
(a)項目38に記載の方法によって収集される血液サンプル由来の全血、血小板、血漿または血清のアリコートをスクリーニングする工程;
(b)HBV抗原が検出されるあらゆるサンプルを除去する工程;および
(c)HBV抗原が検出されないサンプルを合わせて、HBVを実質的に含まない血液供給物を提供する工程、
を包含する、方法。
(項目43)
HBVを実質的に含まない全血、血小板、血漿または血清を含む血液供給物を調製する方法であって、以下:
(a)項目39に記載の方法によって収集される血液サンプル由来の全血、血小板、血漿または血清のアリコートをスクリーニングする工程;
(b)抗HBsAg抗体が検出されるあらゆるサンプルを除去する工程;および
(c)抗HBsAg抗体が検出されないサンプルを合わせて、HBVを実質的に含まない血液供給物を提供する工程、
を包含する、方法。
(項目44)
移植の前に供与された組織または供与された器官をスクリーニングしてHBVを実質的に含まない組織または器官を提供する方法であって、以下:
(a)項目17に記載の方法によって該組織または該器官由来のサンプルをスクリーニングする工程;
(b)HBV抗原が検出される組織または器官を除去して、HBVを実質的に含まない組織または器官を提供する工程、
を包含する、方法。
(項目45)
移植の前に供与された組織または供与された器官をスクリーニングしてHBVを実質的に含まない組織または器官を提供する方法であって、以下:
(a)項目39に記載の方法によって該組織または該器官由来のサンプルをスクリーニングする工程;
(b)抗HBsAg抗体が検出される組織または器官を除去して、HBVを実質的に含まない組織または器官を提供する工程、
を包含する、方法。
(項目46)
抗HBVウサギモノクローナル抗体を調製する方法であって、該方法は、以下:
(a)「a」決定基領域に変異を有するHBsAg変異体によってウサギを免疫化する工程;
(b)該ウサギ由来のHBsAg変異体に対する抗体を産生する細胞と、不死化した細胞株由来の細胞とを融合して、ハイブリドーマを産生する工程;
(c)該ハイブリドーマを選択する工程;
(d)該選択したハイブリドーマを培養する工程;および
(e)該培養したハイブリドーマによって分泌される該抗体を収集する工程、
を包含する、方法。
(項目47)
前記免疫化する工程は、1つより多くのHBsAg変異体によってウサギを免疫化する工程を包含する、項目46に記載の方法。
(項目48)
前記抗体を産生する細胞は、ウサギ脾細胞である、項目46に記載の方法。
(項目49)
前記脾細胞は、不死化したウサギ細胞株由来の細胞と融合されて、ウサギ−ウサギハイブリドーマを産生する、項目48に記載の方法。
(項目50)
前記不死化したウサギ細胞株は、ウサギプラズマ細胞腫である、項目49に記載の方法。
(項目51)
前記脾細胞は、不死化したマウス細胞株の細胞と融合されて、ウサギ−マウスハイブリドーマを産生する、項目48に記載の方法。
(項目52)
前記HBsAg変異体は、変異体sAgである、項目46に記載の方法。
(項目53)
前記HBsAg変異体は、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tの前記「a」決定基領域の配列を含む、項目52に記載の方法。
(項目54)
前記HBsAg変異体は、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tを含む、項目53に記載の方法。
(項目55)
前記ウサギは、前記「a」決定基領域に異なる変異を有する少なくとも2つのHBsAg変異体によって免疫化される、項目46に記載の方法。
(項目56)
前記ウサギは、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tからなる群より選択される少なくとも2つのHBsAg変異体によって免疫化される、項目53に記載の方法。
(項目57)
前記ウサギは、HBsAg変異体であるF134A、F134S、G145R、S143L、P142SおよびQ129R/M133Tによって免疫化される、項目53に記載の方法。
(項目58)
前記ウサギは、野生型HBsAgによってさらに免疫化される、項目46に記載の方法。
(項目59)
項目46に記載の方法によって産生される抗HBVウサギモノクローナル抗体。
(項目60)
ウサギ−ウサギハイブリドーマを調製する方法であって、以下:
(a)「a」決定基領域に変異を有するHBsAg変異体によってウサギを免疫化する工程;
(b)該ウサギ由来のHBsAg変異体に対する抗体を産生する脾細胞と、ウサギプラズマ細胞腫由来の細胞とを融合する工程;
(c)該抗体を分泌する細胞を選択する工程、
を包含する、方法。
(項目61)
項目1に記載のウサギモノクローナル抗体またはその免疫反応性フラグメントをコードする、ポリヌクレオチド。
(項目62)
前記ポリヌクレオチドによってコードされる免疫反応性フラグメントは、Fabフラグメント、F(ab’)2フラグメント、FvフラグメントまたはsFvフラグメントである、項目61に記載のポリヌクレオチド。
(項目63)
生物学的サンプル中のHBV表面抗原を検出する方法における、項目1〜10、項目13、項目14、項目16または項目59のいずれか1項に記載のウサギモノクローナル抗体の使用。
(項目64)
生物学的サンプル中のHBV表面抗原および/またはHBsAg抗体の存在を検出する方法における、項目26〜31のいずれか1項に記載の固体支持体の使用。
(項目65)
HBVを実質的に含まない全血、血小板、血漿または血清を含む血液供給物を調製する方法における、項目1〜10、項目13、項目14、項目16または項目59のいずれか1項に記載のウサギモノクローナル抗体の使用。
(項目66)
移植の前に供与された組織または供与された器官をスクリーニングしてHBVを実質的に含まない組織または器官を提供する方法における、項目1〜10、項目13、項目14、項目16または項目59のいずれか1項に記載のウサギモノクローナル抗体の使用。
【図面の簡単な説明】
【0034】
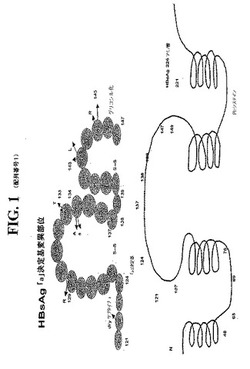
【図1】図1は、タンパク質の高次構造を示すHBV表面抗原の概略図(下のパネル、実線)および「a」決定基(アミノ酸121〜147、上のパネル、円の中)の周りのアミノ酸配列(配列番号1)を示す。矢印は、種々の公知のHBsAg改変体の位置および置換を示す。
【図2】図2Aおよび2B(配列番号2および3)は、それぞれ、sAg野生型adw抗原およびsAg野生型ayw抗原についてのアミノ酸配列を示す。
【図3A】図3A〜3Dは、上に記載されるパネルのHBV変異体に対するマウス抗体mMAb1(図3C)およびmMAb2(図3A)と比較して、99S6(図3B)および99S9(図3D)由来のウサギモノクローナル抗体の免疫反応性を示す。
【図3B】図3A〜3Dは、上に記載されるパネルのHBV変異体に対するマウス抗体mMAb1(図3C)およびmMAb2(図3A)と比較して、99S6(図3B)および99S9(図3D)由来のウサギモノクローナル抗体の免疫反応性を示す。
【図3C】図3A〜3Dは、上に記載されるパネルのHBV変異体に対するマウス抗体mMAb1(図3C)およびmMAb2(図3A)と比較して、99S6(図3B)および99S9(図3D)由来のウサギモノクローナル抗体の免疫反応性を示す。
【図3D】図3A〜3Dは、上に記載されるパネルのHBV変異体に対するマウス抗体mMAb1(図3C)およびmMAb2(図3A)と比較して、99S6(図3B)および99S9(図3D)由来のウサギモノクローナル抗体の免疫反応性を示す。
【発明を実施するための形態】
【0035】
(発明の詳細な説明)
本発明の実施は、特に明記されない限り、当業者の技術の範囲内の従来のウイルス学的方法、化学的方法、生物化学的方法、組換えDNA技術による方法および免疫学的方法を使用する。このような技術は、文献中に完全に説明されている。例えば、Fundamental Virology、第3版、第I巻および第II巻(B.N.FieldsおよびD.M.Knipe編);Handbook of Experimental Immunology、第I巻〜第IV巻(D.M.WeirおよびCC.Blackwell編、Blackwell Scientific Publications);T.E.Creighton、Proteins:Structures and Molecular Properties(W.H.Freeman and Company、1993);A.L.Lehninger、Biochemistry(Worth
Publishers,Inc.、current addition);Sambrookら、Molecular Cloning:A Laboratory Manual(第2版、1989);Methods In Enzymology(S.ColowickおよびN.Kaplan編、Academic Press,Inc.)を参照のこと。
【0036】
以下のアミノ酸の略語は、本明細書を通して使用される:
アラニン:Ala(A) アルギニン:Arg(R)
アスパラギン:Asn(N) アスパラギン酸:Asp(D)
システイン:Cys(C) グルタミン:Gln(Q)
グルタミン酸:Glu(E) グリシン:Gly(G)
ヒスチジン:His(H) イソロイシン:Ile(I)
ロイシン:Leu(L) リジン:Lys(K)
メチオニン:Met(M) フェニルアラニン:Phe(F)
プロリン:Pro(P) セリン:Ser(S)
トレオニン:Thr(T) トリプトファン:Trp(W)
チロシン:Tyr(Y) バリン:Val(V)。
【0037】
(1.定義)
本発明の記載において、以下の用語が使用され、そして以下で示すように定義されることを意図する。
【0038】
本明細書および添付の特許請求の範囲で使用される、単数形「a」、「an」、および「the」には、文脈中で明らかに別のものを示さない限り、複数形が含まれることを留意しなければならない。したがって、例えば、「ウサギモノクローナル抗体(a rabbit monoclonal antibody)」への言及は、2つ以上のこのようなポリペプチドの混合物などを含む。
【0039】
用語「ポリペプチド」および「タンパク質」とは、アミノ酸残基のポリマーをいい、産物の長さの下限に制限されない。したがって、ペプチド、オリゴペプチド、ダイマー、および多量体などは、この定義の範囲内に含まれる。全長タンパク質およびそのフラグメントの両方は、この定義に含まれる。この用語はまた、ポリペプチドの発現後修飾(例えば、グリコシル化、アセチル化、およびリン酸化など)を含む。さらに、本発明の目的のために、「ポリペプチド」とは、タンパク質が所望の活性を保持する限り、ネイティブな配列の改変(例えば、欠失、付加、および置換(一般に、天然において保存的である))を含むタンパク質をいう。これらの改変は部位特異的変異誘発による意図的なものであっても、タンパク質を産生する宿主への変異またはPCR増幅に起因するエラーなどによる偶発的なものであってもよい。
【0040】
用語「抗原」とは、抗体を認識する1つ以上のエピトープを含むポリペプチド(ネイティブであるか、組換えであるかまたは合成であるかにかかわらず)をいう。当該抗原は、参照分子の全長アミノ酸配列を含む必要はないが、目的の免疫学的応答をもたらすため(すなわち、この抗原が、抗体を産生するために使用される場合)か、または目的のHBV抗体と反応させるため(すなわち、この抗原が、アッセイにおいて検出される)に必要な分子の限られた量を含み得る。したがって、参照分子のただ1つまたはいくつかのエピトープが存在する必要がある。さらに、この抗原は、全長参照分子またはその参照分子のフラグメントと別のタンパク質(例えば、別のHBV抗原および/またはHBV抗原の反応性を乱さないタンパク質)との間の融合タンパク質を含み得る。したがって、この抗原は、参照分子の全長配列、フラグメント、短縮された配列および部分的な配列、ならびにアナログ、ムテインおよび前駆体形態を含み得ることが、容易に明らかである。この用語はまた、この抗原が抗体の産生を刺激しそして/またはHBV抗体と反応する能力を保持する限り、参照配列に対する欠失、付加、および置換を意図する。
【0041】
このことに関して、天然のバリエーションは、特定のHBV株内の単離物から生じる。したがって、この用語は、このようなバリエーション、および特に、そのアミノ酸組成において参照抗原と異なる(約20%以下、より好ましくは約10%〜15%以下、および最も好ましくは約5%以下)抗原を包含することを意図する。したがって、実質的に参照分子と同じアミノ酸配列を有するが、実質的にこの抗原の抗体結合能に影響しない少数のアミノ酸置換を保有するタンパク質は、参照ポリペプチドの定義の範囲内である。
【0042】
HBV株またはHBV単離物「に由来する」抗原は、参照HBVゲノムによってコードされる抗原の1つ以上の領域または領域の部分の配列を含む抗原を意図する。代表的に、この抗原は、下で定義されるように、エピトープを含む領域、または領域の部分から構成され、そして一般的に、参照ポリペプチドと実質的に相同であるアミノ酸配列を有する。したがって、用語「に由来する」は、分子の元の供給源を同定するために使用されるが、例えば、この分子が作製される方法(例えば、この方法は化学合成または組換え手段であり得る)を限定することは意味しない。
【0043】
用語「アナログ」および「ムテイン」とは、所望の活性(例えば、本明細書中に記載されるアッセイにおける免疫反応性)を保持する参照分子の生物学的に活性な誘導体をいう。一般的に、用語「アナログ」とは、改変が免疫原性活性を破壊せず、そして下で定義されるように、参照分子と「実質的に相同」である限り、ネイティブの分子に関して、1つ以上のアミノ酸付加、置換(一般的に、天然において保存的である)、および/または欠失を有するネイティブのポリペプチド配列および構造を有する化合物をいう。多くの保存領域および可変領域は、種々の単離物の間で公知であり、そして一般的に、これらの領域に由来するエピトープのアミノ酸配列は高い程度の配列相同性(例えば、2つの配列を並べる場合、50%より大きく、一般的に60%超〜70%のアミノ酸配列相同性)を有する。用語「ムテイン」とは、1種以上のペプチド模倣物(「ペプトイド」)を有するペプチドをいう。好ましくは、アナログまたはムテインは、少なくともネイティブな分子と同一の免疫反応性を有する。ポリペプチドアナログおよびムテインを作製するための方法は、当該分野で公知であり、そして下でさらに記載される。
【0044】
用語「アナログ」および「ムテイン」はまた、参照分子へなされる意図的な変異を包含する。特に好ましいアナログは、天然において保存的な置換(すなわち、その側鎖に関連するアミノ酸のファミリー内で起こる置換)を含む。具体的には、アミノ酸は、一般的に、以下の4つのファミリーに分類される:(1)酸性−−アスパラギン酸およびグルタミン酸;(2)塩基性−−リジン、アルギニン、ヒスチジン;(3)非極性−−アラニン、バリン、ロイシン、イソロイシン、プロリン、フェニルアラニン、メチオニン、トリプトファン;および(4)非荷電極性−−グリシン、アスパラギン、グルタミン、システイン、セリン、トレオニン、チロシン。フェニルアラニン、トリプトファン、およびチロシンは、ときとして、芳香族アミノ酸として分類される。例えば、ロイシンのイソロイシンまたはバリンへの単独置換、アスパラギン酸のグルタミン酸への単独置換、トレオニンのセリンへの単独置換、または同様の、構造的に関連するアミノ酸へのアミノ酸の保存的置換は、生物活性に大きな影響を与えないことが容易に予想される。例えば、目的の抗原は、この分子の所望の機能がインタクトなままである限り、約5〜10個までの保存的アミノ酸置換もしくは非保存的アミノ酸置換、またはさらに約15〜25個まで、約15〜50個まで、もしくは約15〜75個までの保存的アミノ酸置換もしくは非保存的アミノ酸置換、または5〜75の間の任意の整数の保存的アミノ酸置換もしくは非保存的アミノ酸置換を含み得る。当業者は、当該分野で周知のHopp/WoodsおよびKyte−Doolittleプロットを参照することにより、変化を許容し得る、目的の分子の領域を容易に決定し得る。
【0045】
「抗原フラグメント」は、インタクトな全長抗原ポリペプチド配列および全長抗原ポリペプチド構造の一部のみから構成される抗原を意図する。このフラグメントは、ネイティブなポリペプチドのC末端欠失、N末端欠失、および/または内部欠失を含み得る。「免疫原性フラグメント」は、1つ以上のエピトープを含み、したがって本明細書中に記載される免疫学的応答の1つ以上を誘発するポリペプチドのフラグメントを意味する。特定のHBVタンパク質の「免疫原性フラグメント」は、一般的に、全長分子の少なくとも約5〜10個連続するアミノ酸残基、好ましくは全長分子の少なくとも約15〜25個連続するアミノ酸残基、および最も好ましくは全長分子の少なくとも約20〜50個以上連続するアミノ酸残基を含み、このアミノ酸残基は、当該フラグメントが本明細書中に定義されるような免疫学的応答を誘発する能力を保持する限り、エピトープ(または5アミノ酸と全長配列との間の任意の整数)を規定する。
【0046】
「HBsAg」は、種々のHBV株およびHBV単離物のいずれかに由来するHBV表面抗原を意味する。この用語は、HBsAgポリペプチドの実質的に完全なSドメイン(本明細書中で「sAg」と称される)を含む表面抗原、およびその免疫原性フラグメントを意図する。HBsAgのSドメインは、それが、N末端領域もしくはC末端領域のいずれか、またはそのポリペプチド内からの、1個または数個のアミノ酸の少量の欠失を伴うか、またはそれを伴わないポリペプチドのネイティブな配列を有する場合、「実質的に完全」である。例えば、HBsAg Sドメインは、その免疫原性に大きく影響せずに、数個のアミノ酸(すなわち、約3個まで、5個まで、7個まで、または10個までのアミノ酸)を短縮され得る。本明細書中で使用するためのHBsAg抗原は、一般的に、sAgに対して番号付けられたアミノ酸124位〜147位において見出される「a」決定基に対応する領域を含む。この領域は、下でさらに記載される。この用語はまた、Sドメインに加えて、プレS2(以前はプレSと称された)ドメインを含むか、またはSドメインに加えて、HBsAgのプレS2ドメインおよびプレS1ドメインの両方を含む抗原を意図する。Valenzuelaら、(1982)、Nature 298:347−350は、代表的なHBsAgについての遺伝子を記載する。Valenzuelaら、(1979)、Nature 280:815−819をまた参照のこと。
【0047】
本明細書中で使用される場合、「変異体」HBsAg分子とは、上で定義されるような、野生型HBsAgのアナログをいう。本発明の目的のために、「野生型HBsAg」は、aywサブタイプおよびadwサブタイプ由来のHBsAgを意味する。これらのアナログは、(例えば、回避変異体(escape mutant)の場合において)天然の変異事象によって生じ得るか、または意図的に作製され得る。代表的な変異体HBsAg配列は、本明細書中で図1に示される。さらなる天然に存在する変異体は、当該分野において公知であり、そしてこれらの変異体由来の表面抗原についてのヌクレオチド配列および対応するアミノ酸配列は、GenBankによって寄託されてきた。例えば、NCBI登録番号AY341335(sAgの「a」決定基に複数の変異を有する、天然に存在する表面変異体)、X59795(aywサブタイプ由来の天然に存在する変異体);AF01360およびAF013629(adwサブタイプ由来の天然に存在する変異体)ならびにZuckermanら、1999(J.Med Virol.58:193)を参照のこと。
【0048】
HBsAgの「免疫原性」配列は、HBsAg分子が、適切な宿主において抗体の産生を刺激し得るように、少なくとも1つのエピトープを有するアミノ酸配列を含むHBsAg分子を意味する。「エピトープ」は、当該HBVエピトープに抗体産生を刺激させ得る、特定のB細胞および/またはT細胞が応答する抗原上の部位を意味する。この用語はまた、「抗原決定基」または「抗原決定部位」と交換可能に使用される。エピトープは、そのエピトープに固有の空間的コンホメーションで3個以上のアミノ酸を含み得る。一般的に、エピトープは、少なくとも5個のこのようなアミノ酸から構成され、そしてより通常には、少なくとも8〜10個以上のこのようなアミノ酸から構成される。
【0049】
エピトープを含む所与のポリペプチド領域は、当該分野で周知の多くのエピトープマッピング技術を使用して同定することができる。例えば、Epitope Mapping
Protocols in Methods in Molecular Biology、第66巻(Glenn E.Morris,編、1996)、Humana Press、Totowa、New Jerseyを参照のこと。例えば、線状エピトープは、例えば、固体支持体上で多数のペプチド(このタンパク質分子の一部に対応するペプチド)を同時に合成し、そしてこれらのペプチドが依然として支持体に結合している間に、これらのペプチドと抗体とを反応させることによって決定され得る。このような技術は当該分野で公知であり、そして例えば、米国特許第4,708,871号;Geysenら、(1984)、Proc.Natl.Acad.Sci.USA 81:3998−4002;Geysenら、(1985)、Proc.Natl.Acad.Sci.USA 82:178−182;Geysenら、(1986)、Molec.Immunol.23:709−715に記載される。同様に、高次構造的なエピトープは、例えば、X線結晶学および二次元核磁気共鳴などによるアミノ酸の空間的コンホメーションの決定によって容易に同定される。例えば、Epitope Mapping Protocols、前出を参照のこと。タンパク質の抗原性領域はまた、標準的な抗原性プロットおよびハイドロパシープロット(例えば、Oxford Molecular Groupから利用可能なOmigaバージョン1.0ソフトウェアプログラムを使用して計算したものなど)を使用して同定され得る。このコンピュータプログラムは、抗原性プロフィールを決定するためのHopp/Woods法(Hoppら、Proc.Natl.Acad.Sci USA(1981)、78:3824−3828)およびハイドロパシープロットのためのKyte−Doolittle技術(Kyteら、J.Mol.Biol.(1982)、157:105−132)を使用する。
【0050】
「免疫原性組成物」は、少なくとも1つの免疫原性ポリペプチド(例えば、HBsAg抗原またはHBsAg抗体)を含有する組成物である。
【0051】
「実質的に精製された」とは、一般的に、物質(化合物、ポリヌクレオチド、タンパク質、ポリペプチド、ポリペプチド組成物)の単離をいい、単離の結果、この物質が、その物質の存在するサンプルの大部分の%を構成する。代表的に、サンプルにおいて、実質的に精製された成分は、そのサンプルの50%、好ましくは80%〜85%、より好ましくは90%〜95%を構成する。目的のポリヌクレオチドおよびポリペプチドを精製するための技術は、当該分野において周知であり、そしてこれらとしては、例えば、イオン交換クロマトグラフィー、アフィニティークロマトグラフィーおよび密度による沈降が挙げられる。
【0052】
「単離された」とは、ポリペプチドを指す場合、示した分子が完全な生物から別れて分離しており、この分子が、同じ型の他の生物学的高分子が実質的に存在しない状況において、天然に見出されるかまたは存在することを意味する。ポリヌクレオチドに関する用語「単離された」とは、通常は天然において結合している配列の全部または一部を欠く核酸分子、天然において存在するが、異種配列が結合した配列、あるいは染色体から解離した分子である。
【0053】
「等価な抗原決定基」は、HBVの異なる単離物または株に由来する抗原決定基を意味し、抗原決定基は、配列の変化に起因して必ずしも同一でなくて良いが、目的のHBV配列中の等価な位置に生じる。一般に、等価な抗原決定基のアミノ酸配列は、2つの配列を並べる場合、高い程度の配列相同性(例えば、30%より高く、通常は40%より高く(例えば、60%より高い)、そしてさらに80〜90%より高いアミノ酸配列相同性)を有する。
【0054】
「相同性」とは、2つのポリヌクレオチド部分または2つのポリペプチド部分の間の%同一性をいう。2つの核酸配列または2つのポリペプチド配列は、定義した長さの分子にわたって、これらの配列が少なくとも約50%、好ましくは少なくとも約75%、より好ましくは少なくとも約80〜85%、好ましくは少なくとも約90%、および最も好ましくは少なくとも約95%〜98%またはそれ以上の配列同一性を示す場合、互いに「実質的に相同」である。本明細書中で使用される場合、実質的に相同とはまた、特定の配列に対する完全な同一性を示す配列をいう。
【0055】
一般的に、「同一性」とは、それぞれ、2つのポリヌクレオチド配列または2つのポリペプチド配列の正確なヌクレオチド−ヌクレオチドまたはアミノ酸−アミノ酸の一致をいう。%同一性は、2つの分子(参照配列および参照配列に対する未知の%同一性を有する配列)間の配列情報の直接比較によって決定され得、このことは、配列を並べ、この2つの並べた配列間の正確な一致を数え、参照配列の長さで割り、そしてこの結果に100を掛けることによる。容易に利用可能なコンピュータープログラム(例えば、ペプチド分析用のSmith and Watermanの局所的相同性アルゴリズム(Advances in Appl.Math.2:482−489,1981)に適合するALIGN(Dayhoff,M.O.in Atlas of Protein Sequence and Structure M.O.Dayhoff編、第5補遺.3:353−358,National biomedical Research Foundation、Washington、DC))が、分析を補助するために使用され得る。ヌクレオチド配列の同一性を決定するためのプログラムは、Wisconsin Sequence Analysis Package,Version 8(Genetics
Computer Group,Madison,WIから利用可能)で利用可能である(例えば、Smith and Watermanアルゴリズムにも依存するBESTFIT、FASTA、およびGAPプログラム)。これらのプログラムは、製造者によって推奨され、かつ上記で言及したWisconsin Sequence Analysis Packageに記載される初期設定のパラメータを使用して容易に利用される。例えば、参照配列に対する特定のヌクレオチド配列の%同一性は、初期設定のスコアリング表および6つのヌクレオチドの位置でのギャップペナルティを使用したSmith and Watermanの相同性アルゴリズムを使用して決定され得る。
【0056】
本発明の文脈中における%同一性を確立する別の方法は、エディンバラ大学が著作権を有し、John F.CollinsおよびShane S.Sturrokによって開発され、そしてIntelliGenetics,Inc.(Mountain View,CA)から販売されているプログラムのMPSRCHパッケージを使用することである。このパッケージ一式から、スコアリング表のために初期設定のパラメータを使用するSmith−Watermanアルゴリズムが、使用され得る(例えば、12のギャップオープンペナルティ、1のギャップ伸長ペナルティ、および6のギャップ)。作成されたデータから、「一致」値は、「配列同一性」を反映する。配列間の%同一性または%類似性を計算するための他の適切なプログラムは、一般的に、当該分野で公知であり、例えば、別のアラインメントプログラムは、初期設定のパラメータを使用したBLASTである。例えば、BLASTNおよびBLASTPは、以下の初期設定のパラメータを使用して使用され得る:遺伝コード=標準;フィルタ=なし;鎖=両方;カットオフ=60;期待値=10;行列=BLOSUM62;記載=50配列;分類=ハイスコア;データベース=非重複、GenBank+EMBL+DDBJ+PDB+GenBank CDS翻訳物+Swiss protein+Spupdate+PIR。これらのプログラムの詳細は、容易に見出され得る。
【0057】
あるいは、相同性は、相同領域間で安定な二重鎖を形成する条件下でのポリヌクレオチドのハイブリダイゼーション、その後の一本鎖特異的ヌクレアーゼでの消化、および消化フラグメントのサイズ決定によって決定され得る。実質的に相同なDNA配列は、例えば、特定の系について規定したストリンジェントな条件下でのサザンハイブリダイゼーション実験で同定され得る。適切なハイブリダイゼーション条件を規定することは、当業者の範囲内である。例えば、Sambrookら、前出;DNA Cloning、前出;Nucleic Acid Hybridization、前出を参照のこと。
【0058】
本明細書中で核酸分子を記載するために使用される場合、「組換え体」は、ゲノム、cDNA、ウイルス、半合成または合成由来(これはこの起源または操作によって、天然で関連するポリヌクレオチドの全てまたは一部と関連しない)のポリヌクレオチドを意味する。タンパク質またはポリペプチドに関して使用される場合、用語「組換え体」とは、組換えポリヌクレオチドの発現によって産生されるポリペプチドを意味する。一般的に、目的の遺伝子は、クローニングされ、次いで、以下にさらに記載されるように、形質転換された生物において発現される。宿主生物は、発現条件下でタンパク質を産生する外来遺伝子を発現する。
【0059】
「抗体」は、抗原に存在する目的のエピトープを「認識する」(すなわち、特異的に結合する)分子を意図する。「特異的結合」は、抗体と、例えば、抗体が反応する検査物質を含む混合物中の成分との間に生じ得る非特異的な結合とは対照的に、抗体が、抗原と抗体との間の複合体を形成する「ロックアンドキー(lock and key)」型の相互作用でエピトープと相互作用することを意味する。したがって、抗HBV抗体は、HBVタンパク質のエピトープに特異的に結合する分子である。本明細書中で使用される場合、用語「抗体」は、ポリクローナル調製物およびモノクローナル調製物の両方から得られる抗体、ならびに以下を包含する:ハイブリッド(キメラ)抗体分子(例えば、Winterら、Nature、(1991)、349:293−299;および米国特許第4,816,567号);F(ab’)2およびF(ab)フラグメント;Fv分子(非共有結合性ヘテロダイマー)(例えば、Inbarら、Proc Natl Acad Sci USA、(1972)、69:2659−2662;およびEhrlichら、Biochem、(1980)、19:4091−4096を参照のこと);単鎖Fv分子(sFv)(例えば、Hustonら、Proc Natl Acad Sci USA、(1988)、85:5879−5883を参照のこと);二量体および三量体の抗体フラグメント構築物;ミニボディー(minibody)(例えば、Packら、Biochem、(1992)、31:1579−1584;Cumberら、J Immunology、(1992)、149B:120−126を参照のこと);ヒト化抗体分子(例えば、Riechmannら、Nature、(1988)、332:323−327;Verhoeyanら、Science、(1988)、239:1534−1536;および英国特許公開番号第GB 2,276,169号(1994年9月21日公開);ならびに、このような分子から得られる任意の機能的フラグメント(このようなフラグメントは、親抗体分子の免疫学的結合特性を保持する)。
【0060】
本明細書中で使用される場合、用語「モノクローナル抗体」とは、同種抗体の集団を有する抗体組成物をいう。この用語は、抗体の種または供給源に関して限定されず、抗体が作製される様式によっても限定されることを意図しない。この用語は、完全な免疫グロブリンおよびフラグメント(例えば、Fabフラグメント、F(ab’)2フラグメント、Fvフラグメント、および他のフラグメント)、ならびに親モノクローナル抗体分子の免疫学的結合特性を示すキメラ同種抗体およびヒト化同種抗体の集団を包含する。
【0061】
本明細書中で使用される場合、用語「ウサギモノクローナル抗体」とは、目的の抗原(例えば、変異体HBsAg)を用いてウサギを免疫化することによって産生される、上で定義されるようなモノクローナル抗体をいう。「ウサギモノクローナル抗体」は、下でより十分に説明されるように、ウサギ−ウサギハイブリドーマ(すなわち、免疫化したウサギ由来の抗体産生細胞とウサギ由来の不死化細胞との間の融合体)、ウサギ−マウスハイブリドーマ(すなわち、免疫化したウサギ由来の抗体産生細胞とマウス由来の不死化細胞との間の融合体の間の融合体)などを使用して産生され得る。
【0062】
「マウスモノクローナル抗体」とは、目的の抗原(例えば、変異体HBsAg)を用いてマウスを免疫化することによって産生される、上で定義されるようなモノクローナル抗体をいう。「マウスモノクローナル抗体」は、下でより十分に説明されるように、マウス−マウスハイブリドーマから、当該分野で周知である従来の方法を使用して産生される。
【0063】
本明細書中で使用される場合、「固体支持体」とは、高分子(例えば、抗体、タンパク質、ポリペプチド、ペプチド、ポリヌクレオチド)が結合し得る、固体表面(例えば、磁性ビーズ、ラテックスビーズ、マイクロタイタープレートウェル、ガラスプレート、ナイロン、アガロース、ポリアクリルアミド、シリカ粒子、ニトロセルロース膜など)をいう。
【0064】
「免疫学的に反応性」とは、当該抗体が、HBVに感染した個体由来の生物学的サンプル中に存在するHBV抗原と特異的に反応することを意味する。
【0065】
抗体の「免疫反応性フラグメント」は、インタクトな抗体の配列および構造の一部のみから構成され、そして上で定義されるように、免疫学的に反応性である分子である。このような免疫反応性フラグメントの非限定的な例としては、F(ab’)2分子、Fv分子、およびsFv分子が挙げられ、これらの分子は、それが得られる親抗体分子の免疫学的結合特性を示し得る。
【0066】
「免疫複合体」は、抗体が抗原上のエピトープに結合する場合に形成される組み合わせを意図する。
【0067】
本明細書中で使用される場合、「生物学的サンプル」とは、被験体から単離される組織または流体のサンプル(例えば、血液、血漿、血小板、血清、糞便、尿、骨髄、胆汁、髄液、リンパ液、脳脊髄液、皮膚のサンプル、皮膚、気道、腸管および尿生殖路の分泌物、涙液、唾液、乳汁、血球、器官、生検であるが、これらに限定されない)をいい、そしてまた、インビトロ細胞培養の構成物のサンプルをいい、このサンプルとしては、培養培地における細胞および組織の増殖から生じる培養上清(例えば、組換え細胞、および細胞成分)が挙げられるが、これらに限定されない。上で詳述されるサンプルは、必ずしもその供給源から直接得られる形態である必要はない。例えば、このサンプルは、例えば、分析前の加熱、遠心分離などによるように、使用する前に処理され得る。
【0068】
本明細書中で使用される場合、用語「標識」および「検出可能な標識」とは、検出の可能な分子をいい、この分子としては、放射性同位元素、蛍光物質(fluorescer)、半導体ナノ結晶、化学発光物質(chemiluminescer)、発色団、酵素、酵素基質、酵素補因子、酵素インヒビター、色素、金属イオン、金属ゾル、リガンド(例えば、ビオチン、ストレプトアビジンまたはハプテン)などが挙げられるが、これらに限定されない。用語「蛍光物質」とは、検出可能な範囲の蛍光を示し得る物質またはその部分をいう。本発明のもとで使用され得る標識の特定の例としては、西洋西洋ワサビペルオキシダーゼ(HRP)、フルオレセイン、FITC、ローダミン、ダンシル、ウンベリフェロン、ジメチルアクリジニウムエステル(DMAE)、テキサスレッド、ルミノール、NADPHおよびα−β−ガラクトシダーゼが挙げられるが、これらに限定されない。
【0069】
(II.発明を実施するための形態)
本発明を詳細に記載する前に、本発明は特定の処方物またはプロセスパラメータに限定されず、したがって当然に本発明は変化し得ることが、理解されるべきである。本明細書中で使用される専門用語は、本発明の特定の実施形態を記載することのみを目的とし、制限することを意図しないこともまた、理解されるべきである。
【0070】
本明細書中に記載のものに類似するか、またはそれらと等価な多数の方法および材料が、本発明の実施に使用され得るが、好ましい材料および方法は、本明細書中に記載される。
【0071】
本発明は、変異体HBsAgを指向する新規のウサギモノクローナル抗体が、従来のマウスモノクローナル抗体より、HBV感染を検出するためのアッセイにおいてはるかに高く免疫反応性であるという知見に基づく。本発明のウサギモノクローナル抗体は、従来のマウスモノクローナル抗体よりも広範囲のHBsAg変異体と反応性である。さらに、本発明のウサギモノクローナル抗体はまた、代表的に、野生型HBsAgと反応性である。実際に、本発明に従う単一のウサギモノクローナル抗体は、HBV感染を示し得るHBV抗原の存在を検出するために、複数のマウスモノクローナル抗体を使用することと同程度に有効である。したがって、本発明のウサギモノクローナル抗体は、例えば、マウスモノクローナル抗体を使用するアッセイによって得られる偽陰性の数を減少させ、したがってHBV感染を正確に検出するための診断方法において有用である。本発明のアッセイはまた、さらなる抗体(例えば、さらなるマウスモノクローナル抗体)を利用して、広範な種々の単離物および回避変異体からのHBV感染を診断する能力を提供する。
【0072】
上記方法は、特に、HBV抗原またはHBV抗体の存在を検出することによって、ヒトにおいてHBV感染を検出すること、ならびに血液サンプル(全血、血清、血小板、および血漿を含むが、これらに限定されない)、移植のための組織および器官においてHBV感染を検出するのに有用である。したがって、この方法は、被験体(例えば、ヒト被験体)においてHBV感染を診断するため、および供与された血液サンプルにおけるHBV汚染を検出するために使用され得る。個々の供与されたサンプルまたはプールされたサンプルのアリコートは、HBVの存在についてスクリーニングされ得、そしてHBVによって汚染されたそれらのサンプルまたはプールされたサンプルは、それらが混合される前に排除され得る。このようにして、HBV汚染を実質的に含まない血液供給が、提供され得る。同様に、移植において使用される組織および器官から得たサンプルはまた、汚染された標本を排除するためにスクリーニングされ得る。
【0073】
本発明のさらなる理解のために、本発明で使用するためのHBV抗原、抗体および診断方法に関して、より詳細な考察が、下に提供される。
【0074】
(HBV表面抗原)
B型肝炎表面抗原は、カルボキシ末端配列を共有する3種のサイズ分類のタンパク質から構成される。これらのタンパク質としては、大(L、プレS2ドメイン)、中(M、プレS1ドメイン)、および小(S、sAgドメイン)が挙げられる。全ての3種のタンパク質は、42nmの球体として感染した患者の血清から回収される感染性のビリオン(多くの場合、Dane粒子といわれる)中に見出される。血清サンプルはまた、主にSクラスのタンパク質(sAg)を含む、平均して22nmの空の球状粒子を含む。sAgタンパク質をコードするDNAのみによってトランスフェクトされた哺乳動物細胞株は、感染した細胞由来の球体と同様の20nmの空の球体を放出する。さらに、同じ遺伝子によってトランスフェクトされた酵母細胞は、感染した細胞由来の22nmの球体と同様に免疫原性であることが見出される、類似の球体を形成する。例えば、HBV構造の考察については「HBV Vaccines−from the laboratory to license:a case study」、Mackett,M.およびWilliamson,J.D.、Human Vaccines and Vaccination、pp.159−176;そして種々のHBV粒子の組換え生産の説明については米国特許第4,722,840号、同第5,098,704号、同第5,324,513号、同第5,965,140号、Beamesら、J.Virol.、(1995)、69:6833−6838、Birnbaumら、J.Virol.、(1990)、64:3319−3330、Zhouら、J.Virol.、(1991)、65:5457−5464を参照のこと。
【0075】
したがって、上で説明される通り、本発明のウサギモノクローナル抗体を産生するのに使用するためのHBsAgとしては、sAg、プレS1および/またはプレS2の免疫原性領域、ならびに上記の任意の組み合わせ(例えば、sAg/プレS1、sAg/プレS2、およびsAg/プレS1/プレS2)由来の免疫原性領域が挙げられ得る。必要に応じて、HBsAgポリペプチドは、1つより多いsAgポリペプチド、プレS1ポリペプチド、またはプレS2ポリペプチドを含み得る。さらに、sAgポリペプチド、プレS1ポリペプチド、およびプレS2ポリペプチドは、HBVの同一の単離物または異なる単離物に由来し得る。これらのポリペプチドはまた、融合タンパク質または別々のポリペプチドとして提供され得る。何百もの異なるHBV単離物からのHBsAgの配列は、公知であり、そしてNCBIデータベースから容易に入手され得る。
【0076】
本発明において使用するための好ましいHBsAgは、少なくともHBVの「a」決定基領域のアミノ酸の配列(sAgに対して番号付けされたアミノ酸124〜147)を含む。この領域についての代表的な野生型配列は、CTTPAQGNSMFPSCCCTKPSDGNC(配列番号4、adw野生型);およびCMTTAQGTSMYPSCCCTKPSDGNC(配列番号5、ayw野生型)である。sAgのこの領域における変異は、多数のHBVワクチン回避体において認められてきた。多くのHBsAg改変体の説明については、Ashton−Richardt PG、Murray K.、(1989)、Mutants of the hepatitis B virus surface antigen and define some antigenically essential residues in the immunodominant「a」region.J.Medical Virology 29:196−203;Norder H.Courouce A M、Magnius L、(1992)、Molecular basis of hepatitis B virus serotype variation within the four major subtype.、J.General Virology 73: 3141−3145;Carman WF,Zanetti ARら、(1990)、Vaccine−induced escape mutant of hepatitis B virus.、Lancet 336:325−329;Fujii H.Moriyama K.ら、GIy 145 to Arg substitution in HBs antigen of immune escape mutant of hepatitis B virus.Biochem.、Biophys Res Comm 184:1152−1157;Carman,W.、Vaccine−associated mutants of hepatitis B virus.、Viral Hepatitis and Liver Disease、(1945)、pp: 243−247、(編:K.Nishioka、H.Suzuki、S.Mishiro、T.Oda)を参照のこと。
【0077】
したがって、この領域に変異を含むHBsAgは、本明細書中で特に有用である。この領域についての代表的な変異体としては、F134A、F134S、G145R、S143L、P142SおよびQ129R/M133Tが挙げられる。この変異体の表示の各々において、番号は、置換されたアミノ酸の位置を示し、番号の前の文字は、WT配列中のその位置におけるアミノ酸を示し、そして番号の後の文字は、変異体のその位置におけるアミノ酸を示す。これらの変異体は、単なる代表であり、そして本発明による用途を見出される、多数のさらなる変異体が天然に存在することが理解されるべきである。さらに、「a」決定基領域に変異を有する合成の変異体もまた、本明細書中で用途を見出される。上に定義されるような「a」決定基領域以外の領域に変異を有する改変体はまた、本発明における用途を見出される。例えば、アミノ酸120位にてPのQへの置換を有する改変体(P120Q)は、モノクローナル抗体を産生するための抗原としての用途を見出される。
【0078】
本発明によって使用するための抗原は、標準的な技術を使用して得られ得る。このHBV抗原は、当該分野において周知である組換え方法を使用して都合よく産生される。例えば、HBV抗原の組換え生産の説明については、米国特許第4,722,840号、同第5,098,704号、同第5,324,513号、同第5,965,140号および同第6,306,625号を参照のこと。例えば、HBsAg Sタンパク質コード配列は、米国特許第4,710,463号に記載されるような当該分野において公知の方法を使用して、感染したヒトの血清中に存在するDane粒子からのDNAのフェノール抽出によって単離され得る。次いでこの単離されたDNAは、制限エンドヌクレアーゼによって消化され得る。エンドヌクレアーゼの選択は、部分的に、特定のDane粒子に依存する。例えば、adw血清型の特定のDane粒子のHBV DNAのHBsAgコード配列は、単一のBamHIフラグメントとして単離され得;ayw血清型の特定のDane粒子のHBV DNAのHBsAgコード配列は、HhaIフラグメントとして単離され得る。同じ血清型のDane粒子のHBV DNAはまた、異なるパターンの制限酵素認識部位を示し得る。
【0079】
オリゴヌクレオチドプローブは、HBVゲノムの公知の配列に基づいて考案され得、そして本発明において有用な抗原をコードするHBV遺伝子についてのゲノムライブラリーまたはcDNAライブラリーを探索するために使用され得る。その後これらの遺伝子は、標準的な技術を使用して、さらに単離され得、そして所望される場合、制限酵素を利用して、全長配列の所望の部分でこの遺伝子を変異させる。例えば、DNAを入手および単離するために使用される技術の説明については、Sambrookら、前出を参照のこと。
【0080】
最後に、上記HBV抗原をコードする遺伝子は、公知の配列に基づいて合成的に産生され得る。このヌクレオチド配列は、所望される特定のアミノ酸配列のために、適切なコドンを用いて設計され得る。一般的に、この配列を発現する意図された宿主に対して、好ましいコドンを選択する。この完全な配列は、一般的に、標準的な方法によって調製されるオーバーラップするオリゴヌクレオチドから構築され、そして完全なコード配列中に構築される。例えば、Edge、Nature、(1981)、292:756;Nambairら、Science、(1984)、223:1299;Jayら、J.Biol.Chem.、(1984)、259:6311を参照のこと。
【0081】
ポリヌクレオチドは、天然に存在するか、または天然に存在しない人工の配列を含み得る種々のポリペプチドについてのコード配列を含み得る。これらのポリヌクレオチドは、所望される場合、標準的な分子生物学技術を使用して、融合タンパク質についてのコード配列を形成するために連結され得る。
【0082】
一旦コード配列が、調製されるか、または単離されると、このような配列は、任意の適切なベクターまたはレプリコン中にクローニングされ得る。多数のクローニングベクターは、当業者に公知であり、そして適切なクローニングベクターの選択は、好みの問題である。適切なベクターとしては、適切な制御エレメントと結合した場合に複製可能である、プラスミド、ファージ、トランスポゾン、コスミド、染色体またはウイルスが挙げられるが、これらに限定されない。次いでこのコード配列は、発現のために使用される系に依存して、適切な制御エレメントの制御下におかれる。したがって、このコード配列は、目的のDNA配列が、適切な形質転換体によってRNAに転写されるように、プロモーター、リボソーム結合部位(細菌の発現のための)および必要に応じて、オペレーターの制御下におかれ得る。このコード配列は、翻訳後のプロセシングにおいて宿主によって後に除去され得る、シグナルペプチドまたはリーダー配列を含んでも含まなくてもよい。例えば、米国特許第4,431,739号;同第4,425,437号;同第4,338,397号を参照のこと。
【0083】
存在する場合、シグナル配列は、目的のHBV抗原と関連して見出される、ネイティブなリーダーであり得る。あるいは、分泌の効率を増加させ得る異種シグナル配列が、存在し得る。多くの代表的なリーダー配列は、当該分野において公知であり、そしてこれらのリーダー配列としては、酵母α−因子リーダー、TPAシグナルペプチド、Igシグナルペプチドなどが挙げられるが、これらに限定されない。これらおよび他のリーダー配列についての配列は、当該分野において周知である。
【0084】
制御配列に加えて、宿主細胞の増殖に関連して、この配列の発現の調節を可能にする調節塩基配列を付加することが、望まれ得る。調節塩基配列は、当業者に公知であり、そして例としては、調節化合物の存在を含む、化学的刺激または物理的刺激に応答して、遺伝子の発現のオンまたはオフを引き起こすものが挙げられる。他の型の調節エレメントはまた、そのベクター中に存在し得る。例えば、エンハンサーエレメントが本明細書中で使用されて、その構築物の発現レベルを増加させ得る。例としては、SV40初期遺伝子エンハンサー(Dijkemaら、(1985)、EMBO J.、4:761)、ラウス肉腫ウイルスの長い末端反復配列(LTR)に由来するエンハンサー/プロモーター(Gormanら、(1982)、Proc.Natl.Acad.Sci.USA、79:6777)およびヒトCMVに由来するエレメント(Boshartら、(1985)、Cell 41:521)(例えば、CMVイントロンA配列中に含まれるエレメント(米国特許第5,688,688号))が挙げられる。発現カセットは、適切な宿主細胞の自律増殖のための複製起点、1つ以上の選択可能マーカー、1つ以上の制限酵素認識部位、高いコピー数についての可能性および強力なプロモーターを、さらに含み得る。
【0085】
発現ベクターは、特定のコード配列が、適切な調節塩基配列、制御配列に対するコード配列の位置決めおよび方向を有するベクター中に配置され、その結果、このコード配列が制御配列の「制御」の下で転写される(すなわち、DNA分子の制御配列に結合するRNAポリメラーゼが、このコード配列を転写する)ように構築される。目的の分子をコードする配列の改変は、この目標を達成するために所望され得る。例えば、いくつかの場合において、適切な方向で制御配列に結合する(すなわち、その読み取り枠を維持する)ようにその配列を改変することが、必要であり得る。この制御配列および他の調節塩基配列は、ベクターへの挿入の前にこのコード配列に連結され得る。あるいは、このコード配列は、既に制御配列および適切な制限酵素認識部位を含む発現ベクター中に、直接クローニングされ得る。
【0086】
あらゆる適切な発現ベクターを構築または利用し得、本発明のHBsAgのあらゆる形態が発現され得る。例示的なベクターは、pCMVII(哺乳動物細胞における発現のために設計されたpUC19ベースのクローニングベクター)である。pCMVIIは、以下のエレメントを備える:ヒトCMV IEエンハンサー/プロモーター、ヒトCMVイントロンA、ヒト組織プラスミノゲン活性化因子(tPA)リーダー、ウシ成長ホルモンポリAターミネーター(BGHt)、ColE1複製起点、およびAmp Rアンピシリン耐性遺伝子。例えば、pCMVII−pS2−sAgは、プレS2−sAgの発現のために使用され得る。このベクターにおいて、HBsAgのsAgドメインおよびプレS2ドメインについてのコード配列は、pCMVII中のCMVイントロンAとBGHtとの間に挿入されている。このベクターはまた、例えば、プレS2ドメインを除去するか、またはプレS1ドメインについてのコード配列を付加することによって改変され得る。これらのベクターは、実施例の方法によって提供され、そして本発明の範囲を限定することを意図しない。上記のベクターは、米国特許第6,740,323号に詳細に記載される。
【0087】
上で説明される通り、目的のポリペプチドの変異体またはアナログを産生することがまた、所望され得る。本発明の組成物において使用するためのHBVポリペプチドの変異体またはアナログは、目的の分子をコードする配列の一部の欠失、配列の挿入、および/またはその配列内の1つ以上のヌクレオチドの置換によって調製され得る。ヌクレオチド配列を改変するための技術(例えば、部位特異的突然変異誘発など)は、当業者に周知である。例えば、Sambrookら、前出;Kunkel,T.A.、(1985)、Proc.Natl.Acad.Sci.USA、(1985)、82:448;Geisselsoderら、(1987)、BioTechniques 5:786;ZollerおよびSmith、(1983)、Methods Enzymol.100:468;Dalbie−McFarlandら、(1982)、Proc.Natl.Acad.Sci USA 79:6409を参照のこと。
【0088】
上記分子は、広範な種々の系において発現され得、この系としては、昆虫発現系、哺乳動物発現系、細菌発現系、ウイルス発現系および酵母発現系が挙げられる(当該分野において全て周知である)。例えば、昆虫細胞発現系(例えば、バキュロウイルス系)は、当業者に公知であり、そして例えば、SummersおよびSmith、Texas Agricultural Experiment Station Bulletin No.1555、(1987)に記載される。バキュロウイルス/昆虫細胞発現系のための材料および方法は、とりわけ、Invitrogen、San Diego CAからキット形態(「MaxBac」キット)で市販されている。同様に、細菌発現系および哺乳動物細胞発現系は、当該分野において周知であり、そして例えば、Sambrookら、前出に記載される。酵母発現系はまた、当該分野において公知であり、そして例えば、Yeast Genetic Engineering(Barrら編、1989)、Butterworths、Londonに記載される。
【0089】
上記の系によって使用するための多くの適切な宿主細胞もまた、公知である。例えば、哺乳動物細胞株は、当該分野において公知であり、そしてこれらの細胞株としては、American Type Culture Collection(ATCC)から入手可能な不死化細胞株(例えば、チャイニーズハムスター卵巣(CHO)細胞、HeLa細胞、ベビーハムスター腎臓(BHK)細胞、サル腎臓細胞(COS)、ヒト胎児性腎臓細胞、ヒト肝細胞癌細胞(例えば、Hep G2)、Madin−Darbyウシ腎臓(「MDBK」)細胞およびその他であるが、これらに限定されない)が挙げられる。同様に、細菌宿主(例えば、E.coli、Bacillus subtilis、およびStreptococcus種)は、本発明の発現構築物による用途を見出される。本発明において有用な酵母宿主としては、とりわけ、Saccharomyces cerevisiae、Candida albicans、Candida maltosa、Hansenula polymorpha、Kluyveromyces fragilis、Kluyveromyces lactis、Pichia guillerimondii、Pichia pastoris、Schizosaccharomyces
pombeおよびYarrowia lipolyticaが挙げられる。バキュロウイルス発現ベクターと使用するための昆虫細胞としては、とりわけ、Aedes aegypti、Autographa californica、Bombyx mori、Drosophila melanogaster、Spodoptera frugiperda、およびTrichoplusia niが挙げられる。
【0090】
目的のヌクレオチド配列を含む核酸分子は、適切な宿主細胞中で当該分野において周知である種々の遺伝子送達技術を使用して、宿主細胞ゲノム中に安定して組み込まれ得るか、または安定なエピソームエレメント上に維持され得る。例えば、米国特許第5,399,346号を参照のこと。
【0091】
選択される発現系および宿主に依存して、上記分子は、タンパク質が発現される条件下で、上に記載される発現ベクターを用いて形質転換された宿主細胞を増殖させることによって産生される。次いで発現したタンパク質は、その宿主細胞から単離され、そして精製される。この発現系が増殖培地中にそのタンパク質を分泌する場合、この産物は、その培地から直接精製され得る。そのタンパク質が分泌されない場合、このタンパク質は、細胞溶解物から単離され得る。適切な増殖条件および回収方法の選択は、当業者の技術範囲内である。
【0092】
上記HBV抗原はまた、化学的なポリマー合成(例えば、固相ペプチド合成)を使用して合成され得る。このような方法は、当業者に公知である。例えば、固相ペプチド合成技術については、J.M.StewartおよびJ.D.Young、Solid Phase Peptide Synthesis、第2版、Pierce Chemical
Co.、Rockford,IL、(1984)、ならびにG.BaranyおよびR.B.Merrifield、The Peptides:Analysis,Synthesis,Biology,editors E.Gross and J.Meienhofer、第2巻、Academic Press、New York、(1980)、pp.3−254を参照のこと。
【0093】
その後、上に記載されるように得られるHBV抗原を使用して、診断薬において使用するためのウサギモノクローナル抗体が産生される。
【0094】
(抗HBV抗体)
上記HBV抗原は、診断アッセイおよび検出アッセイにおいて使用するためのHBV特異的なポリクローナル抗体およびモノクローナル抗体を産生するために使用され得る。HBV特異的なポリクローナル抗体およびモノクローナル抗体は、HBV抗原に対して特異的に結合する。特に、このHBV抗原は、哺乳動物(例えば、マウス、ラット、ウサギ、ヤギ、またはウマ)にこのHBV抗原を投与することによってポリクローナル抗体を産生するために使用され得る。免疫化された動物から得た血清は、収集され、そしてその抗体は、例えば、硫酸アンモニウムによって沈殿させ、次いでクロマトグラフィー(好ましくは、アフィニティークロマトグラフィー)することによって血漿から精製される。ポリクローナル抗血清を産生し、そして加工するための技術は、当該分野において公知である。
【0095】
上記タンパク質中に存在するHBV特異的エピトープを指向するウサギモノクローナル抗体およびマウスモノクローナル抗体もまた、容易に産生され得る。このようなモノクローナル抗体を産生するために、目的の哺乳動物(例えば、ウサギまたはマウス)は、例えば、生理食塩水(好ましくは、フロイント完全アジュバント(「FCA」)のようなアジュバントに)にこの抗原を混合するか、または乳化し、そして非経口的(一般的には、皮下または筋肉内)にこの混合物またはエマルションを注射することによって免疫化される。この動物は、一般的に、好ましくは、フロイント不完全アジュバント(「FIA」)を使用して、生理食塩水中のこの抗原の1回以上の注射によって2〜6週間後に追加免疫される。1つの実施形態において、この動物は、1つ以上のHBsAg変異体(好ましくは、2〜5種の異なるHBsAg変異体の混合物が使用される)によって免疫化される。野生型HBsAgはまた、免疫原に含められ得る。好ましいレジメンにおいて、この動物(好ましくは、ウサギ)は、野生型HBsAgによって最初に免疫化され、その後、1つ以上のHBsAg変異体によって追加免疫される。天然に存在することが見出されたHBsAg変異体(例えば、下でさらに記載されるD3、D2、D1、Y1、Y2)は、免疫原として特に有用である。抗体はまた、当該分野において公知の方法を使用して、インビトロの免疫化によって産生され得る。例えば、Jamesら、J.Immunol.Meth.、(1987)、100:5−40を参照のこと。
【0096】
その後、ポリクローナル抗血清は、免疫化された動物から得られる。しかし、この動物を出血させて血清を抽出する以外に、その脾臓(および必要に応じて、いくつかの大きいリンパ節)が、取り出され、そして単細胞へと解離される。所望される場合、これらの脾臓細胞(脾細胞)は、(接着細胞を非特異的に除去した後に)上記抗原によってコーティングしたプレートまたはウェルに細胞懸濁物を適用することによってスクリーニングされ得る。この抗原に特異的な膜結合型免疫グロブリンを発現するB細胞は、このプレートに結合し、そしてその残りの懸濁物によって洗い流されない。次いで得られたB細胞、または解離した脾細胞は、不死化した細胞株由来の細胞(「融合パートナー」とも称される)と融合するように誘導されて、ハイブリドーマを形成する。代表的に、この融合パートナーは、得られたハイブリドーマの、特定の媒体を使用した選択を可能にする特性を含む。例えば、融合パートナーは、ヒポキサンチン/アミノプテリン/チミジン(HAT)依存であり得る。
【0097】
ウサギ−ウサギハイブリドーマが所望される場合、上記不死化した細胞株は、ウサギから得られる。このようなウサギ由来の融合パートナーは、当該分野において公知であり、そしてこの融合パートナーとしては、例えば、リンパ系起源の細胞(例えば、Spieker−Poletら、Proc.Natl.Acad.Sci.USA、(1995)、92:9348−9352および米国特許第5,675,063号に記載されるようなウサギプラズマ細胞腫から得た細胞)、または米国特許第4,859,595号に記載されるTP−3融合パートナーが挙げられる。ウサギ−マウスハイブリドーマまたはラット−マウスハイブリドーマまたははマウス−マウスハイブリドーマなどが所望される場合、マウス融合パートナーは、マウスから得た不死化した細胞株(例えば、リンパ系起源の細胞(代表的には、マウス骨髄腫細胞株))に由来する。多くのこのような細胞株は、当該分野において公知であり、そしてATCCから入手可能である。
【0098】
融合は、当該分野において周知の技術を使用して達成される。融合を促進する化学物質は、一般に融合因子(fusogen)といわれる。これらの因子は、非常に親水性であり、そして膜の接触を容易にする。細胞融合の1つの特に好ましい方法は、ポリエチレングリコール(PEG)を使用する。細胞融合の別の方法は、電気融合である。この方法において、細胞は、細胞膜電位を変化させる所定の放電に曝される。細胞融合のためのさらなる方法としては、架橋融合(bridged−fusion)法が挙げられる。この方法において、抗原は、ビオチン化され、そして融合パートナーは、アビジン化(avidinylate)される。細胞が一緒に加えられる場合、抗原反応性のB細胞抗原−ビオチン−アビジン融合パートナーの架橋が、形成される。これは、抗原反応性細胞と不死化細胞との特異的な融合を可能にする。さらに、この方法は、細胞融合を容易にする化学的手段または電気的手段を利用し得る。
【0099】
融合の後、上記細胞は、選択培地(例えば、HAT培地)において培養される。抗体の分泌を増強するために、分泌刺激効果を有する因子(例えば、IL−6)が、必要に応じて使用され得る。例えば、Liguoriら、Hybridoma、(2001)、20:189−198を参照のこと。得られたハイブリドーマは、限界希釈によってプレートされ得、そして免疫化する抗原に対して特異的に結合する(および関係ない抗原に結合しない)抗体の産生についてアッセイされる。次いで選択したモノクローナル抗体を分泌するハイブリドーマは、インビトロ(例えば、組織培養ビンまたは中空線維反応器において)、またはインビボ(例えば、マウス中の腹水として)のいずれかで培養される。例えば、HBV特異的抗体を産生するハイブリドーマは、RIAまたはELISAを使用して同定され得、そして半流動アガロース中におけるクローニングによってか、または限界希釈によって単離され得る。HBV特異的抗体を産生するクローンは、スクリーニングの別のラウンドによって単離され得る。
【0100】
本発明のウサギモノクローナル抗体を産生するための代替的な技術は、選択リンパ球抗体法(SLAM)である。この方法は、リンパ系細胞の多くの集団内の所望の特異性または機能によって、抗体を産生する単一のリンパ球を同定する工程を包含する。その後、抗体の特異性をコードする遺伝情報(すなわち、免疫グロブリンVH DNAおよび免疫グロブリンVL DNA)は、レスキューされ(rescued)、そしてクローニングされる。例えば、この方法の説明については、Babcookら、Proc.Natl.Acad.Sci.USA、(1996)、93:7843−7848を参照のこと。
【0101】
ウサギモノクローナル抗体、およびウサギ−ウサギ融合体およびウサギ−マウス融合体からウサギモノクローナル抗体を作製する方法のさらなる説明については、例えば、米国特許第5,675,063号(ウサギ−ウサギ);同第4,859,595号(ウサギ−ウサギ);同第5,472,868号(ウサギ−マウス);および同第4,977,081号(ウサギ−マウス)を参照のこと。従来のマウスモノクローナル抗体の産生の説明については、例えば、KohlerおよびMilstein、Nature、(1975)、256:495−497を参照のこと。
【0102】
キメラ抗体を提供することが、所望され得る。ヒトアミノ酸配列および非ヒトアミノ酸配列から構成されるキメラ抗体は、ヒトにおけるその免疫原性を減少させるために、上に記載されるモノクローナル抗体分子から形成され得る(Winterら、(1991)、Nature 349:293;Lobuglioら、(1989)、Proc.Nat.Acad.Sci.USA 86:4220;Shawら、(1987)、J.Immunol.138:4534;およびBrownら、(1987)、Cancer Res.47:3577;Riechmannら、(1988)、Nature 332:323;Verhoeyenら、(1988)、Science 239:1534;およびJonesら、(1986)、Nature 321:522;欧州特許公開第519,596号(1992年12月23日公開);および英国特許公開第GB 2,276,169号(1994年9月21日公開))。
【0103】
親モノクローナル抗体分子の免疫学的結合特性を示し得る抗体分子フラグメント(例えば、F(ab’)2分子、Fv分子、およびsFv分子)は、公知の技術を使用して産生され得る。Inbarら、(1972)、Proc.Nat.Acad.Sci.USA
69:2659;Hochmanら、(1976)、Biochem 15:2706;Ehrlichら、(1980)、Biochem 19:4091;Hustonら、(1988)、Proc.Nat.Acad.Sci.USA 85(16):5879;ならびにHustonらに対する米国特許第5,091,513号および同第5,132,405号;およびLadnerらに対する米国特許第4,946,778号。
【0104】
代替手段において、ファージディスプレイシステムが、インビトロでモノクローナル抗体分子の集団を拡大するために使用され得る。Saikiら、(1986)、Nature 324:163;Scharfら、(1986)、Science 233:1076;米国特許第4,683,195号および同第4,683,202号;Yangら、(1995)、J Mol Biol 254:392;Barbas,IIIら、(1995)、Methods:Comp.Meth Enzymol 8:94;Barbas,IIIら、(1991)、Proc Natl Acad Sci USA 88:7978。
【0105】
一旦産生されると、このファージディスプレイライブラリーは、公知の技術を使用して、上記Fab分子の免疫学的な結合親和性を改良するために使用され得る。例えば、Figiniら、(1994)、J.Mol.Biol.239:68を参照のこと。このファージディスプレイライブラリーから選択されたFab分子の重鎖部分および軽鎖部分についてのコード配列は、単離されても合成されてもよく、そして発現のために、任意の適切なベクターまたはレプリコン中にクローニングされ得る。上に記載されるものを含む任意の適切な発現系が、使用され得る。
【0106】
上に記載されるウサギモノクローナル抗体およびその免疫反応性フラグメントをコードするポリヌクレオチド配列は、当該分野において周知である標準的な技術(例えば、HBsAgに関して上に記載される技術)を使用して容易に得られる。
【0107】
HBVエピトープを指向する抗体は、サンプル(例えば、HBVに感染したヒト由来の血清サンプル)中のHBVまたはHBV抗原の存在を検出するために特に有用である。HBV抗原に対する免疫アッセイは、単独もしくはHBV抗原との組み合わせのいずれかで、1つの抗体またはいくつかの抗体を利用し得る。HBV抗原に対する免疫アッセイは、、例えば、HBVエピトープに向かうモノクローナル抗体、1つのHBVポリペプチドのエピトープに向かうモノクローナル抗体の組み合わせ、異なるHBVポリペプチドのエピトープに向かうモノクローナル抗体、同じHBV抗原に向かうポリクローナル抗体、異なるHBV抗原に向かうポリクローナル抗体、またはモノクローナル抗体とポリクローナル抗体との組み合わせを使用し得る。例えば、ウサギモノクローナル抗体およびマウスモノクローナル抗体の両方が、本発明のアッセイにおいて使用され得る。免疫アッセイプロトコルは、例えば、標識された抗体を使用する、例えば、競合型アッセイ、直接反応型アッセイ、またはサンドイッチ型アッセイに基づき得、そして免疫アッセイプロトコルは、下に記載される。この標識は、例えば、蛍光性、化学発光性、または放射性であり得る。
【0108】
上記抗HBV抗体は、免疫親和性カラムによってHBV粒子またはHBV抗原を単離するために、さらに使用され得る。この抗体は、この抗体がその免疫選択活性を保持するように、例えば、吸着または共有結合によって固体支持体に固定され得る。必要に応じて、スペーサー基は、この抗体の抗原結合部位が接近可能なままであるように含まれ得る。次いで固定化した抗体は、生物学的サンプル(例えば、血液または血漿)からHBV粒子またはHBV抗原を結合するために使用され得る。結合されたHBV粒子またはHBV抗原は、例えば、pHの変化によってカラムマトリックスから回収される。
【0109】
好ましい抗HBV抗体は、ハイブリドーマ細胞株99S9(CMCC #12336)およびハイブリドーマ細胞株99S6(CMCC #12337)(それぞれ、ATCC受託番号PTA−6014およびPTA−6015)によって産生されるもの、ならびにそれらから得られる抗体フラグメント(例えばFab、F(ab’)2、Fv、sFv)およびキメラ抗体またはヒト化抗体である。
【0110】
(HBV診断アッセイ)
上で説明される通り、上で記載されるように産生される抗HBV抗体は、HBV感染を同定するアッセイにおいて使用され得る。この抗HBV抗体は、下で記載されるように、このアッセイにおいて捕捉成分および/または検出成分のいずれかとして使用され得る。したがって、生物学的サンプル中のHBVの存在は、そのサンプル中のHBVの指標としての、HBV抗原および/または抗HBV抗体の存在によって決定され得る。上記モノクローナル抗体は、血液サンプル(全血、血清、血小板、および血漿が挙げられるが、これらに限定されない)中のHBVを検出するために使用され得る。この抗体は、使用されるアッセイに依存して、HBV抗原(特に、HBsAg)およびHBV抗体の存在を検出することによって、被験体(例えば、ヒト被験体)においてHBV感染を検出するため、および供与された血液サンプルにおけるHBV汚染を検出するために使用され得る。したがって、個々の供与されたサンプルまたはプールされたサンプルのアリコートは、HBVの存在についてスクリーニングされ得、そしてHBVによって汚染されたそれらのサンプルまたはプールされたサンプルは、それらが混合される前に排除され得る。このようにして、HBV汚染を実質的に含まない血液供給物が、提供され得る。「HBVを実質的に含まない」は、HBVの存在が本明細書中に記載されるアッセイを使用して検出されないことを意味する。同様に、本発明の方法は、移植について可能な組織サンプルおよび器官サンプルをスクリーニングするために使用され得、そして汚染された組織および器官は、処分され得る。
【0111】
本明細書中で使用するためのアッセイとしては、ウェスタンブロット;凝集試験;酵素標識性および酵素媒介性の免疫アッセイ(例えば、ELISA);ビオチン/アビジン型アッセイおよびビオチン−ストレプトアビジン型アッセイ;プロテインA媒介性免疫アッセイまたはプロテインG媒介性免疫アッセイ;放射免疫アッセイ;免疫電気泳動;免疫沈降、ストリップ免疫ブロット(strip immunoblot)などが挙げられる。これらの反応は、一般的に、検出可能な標識(例えば、蛍光標識、化学発光標識、放射性標識、酵素標識または色素分子)、またはサンプル中に存在するHBV抗原と、抗体もしくはそれと共に接触した抗体との間の複合体の形成を検出するための他の方法を含む。
【0112】
上述のアッセイは、一般的に、抗原−抗体複合体が結合される固相支持体からの液相中の結合していない抗体または抗原の分離を包含する。本発明の実施に使用され得る固体支持体としては、以下のような基材が挙げられる:(例えば、膜形態またはマイクロタイターウェル形態の)ニトロセルロース;塩化ポリビニル(例えば、シートまたはマイクロタイターウェル);ポリスチレンラテックス(例えば、ビーズまたはマイクロタイタープレート);フッ化ポリビニリデン(polyvinylidine fluoride);ジアゾ化した紙;ナイロン膜;活性化ビーズ、磁気反応性ビーズなど。
【0113】
本発明のひとつの局面において、抗HBsAg抗体(例えば、本明細書中に記載されるウサギモノクローナル抗体)は、サンプル中のHBV抗原(特に、HBsAg)を、捕捉するか、または検出するか、またはそれらを両方行うために使用される。上に記載されるように産生されるHBsAgに対する抗体は、サンプル中のHBV抗原を、捕捉するか、または検出するか、またはそれらを両方行うために使用され得る。分析物(ここでは、サンプル中のHBV抗原)の「捕捉」は、その分析物が、この捕捉分子の結合の効力によってそのサンプルの他の成分から分離され得ること意味する。代表的に、この捕捉分子は、直接的または間接的のいずれかで、固体支持体と結合する。代表的に、この検出分子は、直接的または間接的のいずれかで、検出可能な標識と結合する。
【0114】
代表的に、固体支持体は、最初に、適切な結合条件下でこの固相成分(例えば、上記抗HBV抗体の1つ以上)と反応し、その結果、固相成分がこの固体支持体に十分に固定化される。ときとして、この支持体に対する固定化は、より良好な結合特性を有するタンパク質に対する最初のカップリングによって増強され得る。適切なカップリングタンパク質としては、プロテインAまたはプロテインG、高分子(例えば、ウシ血清アルブミン(BSA)が挙げられる血清アルブミン)、キーホールリンペットヘモシアニン、免疫グロブリン分子、サイログロブリン、オボアルブミン、および当業者に周知な他のタンパク質が挙げられるが、これらに限定されない。あるいは、ストレプトアビジンコーティングの固体支持体またはアビジンコーティングの固体支持体は、ビオチン化した抗体を固定化するために使用され得る。この支持体にこの抗体を結合するために使用され得る他の分子としては、多糖類、ポリ乳酸、ポリグリコール酸、ポリマー性アミノ酸、アミノ酸コポリマーなどが挙げられる。このような分子およびこれらの分子をカップリングする方法は、当業者に周知である。例えば、Brinkley,M.A.、Bioconjugate Chem.、(1992)、3:2−13;Hashidaら、J.Appl.Biochem.、(1984)、6:56−63;およびAnjaneyuluおよびStaros、International J.of Peptide and Protein
Res.、(1987)、30:117−124を参照のこと。
【0115】
上記固体支持体と上記固相成分との反応後、任意の固定化されていない固相成分は、洗浄によってこの支持体から除去され、次いで支持体に結合した成分は、適切な結合条件下で、上記分析物(例えば、HBV抗原)を含むことが推定される生物学的サンプルと接触させられる。洗浄して任意の結合していない分析物を除去した後、第二の結合因子部分が、適切な結合条件下で添加され、この第二の結合因子は、結合されたリガンドと選択的に会合し得る。次いで第二の結合因子の存在は、当該分野において周知である技術を使用して検出され得る。
【0116】
さらに詳しくは、ELISA法が使用され得、そのマイクロタイタープレートのウェルは、本発明によるウサギ抗HBV抗体を用いて、直接的または間接的にコーティングされる。上に記載されるような1つ以上のHBV変異体を指向するウサギ抗HBV抗体が、使用され得る。好ましくは、ハイブリドーマ株99S9またはハイブリドーマ株99S6によって産生されるウサギモノクローナル抗体が、使用される。さらに、さらなるマウスモノクローナル抗体は野生型HBsAgまたはHBsAg変異体を指向し得るので、野生型HBsAgを指向する他の抗HBV抗体がまた、存在し得る。その後、HBV抗原を含むことが推定される生物学的サンプルは、このコーティングされたウェルに添加される。抗原−抗体結合を可能にするのに十分なインキュベーション期間の後、このプレートは、結合していない部分を除去するために洗浄され得、そして検出可能に標識された第二の結合分子が、添加される得る。この第二の結合分子は、任意の捕捉されたサンプルと反応し得、洗浄されたプレートおよび第二の結合分子の存在は、当該分野で周知の方法を使用して検出される。
【0117】
1つの特定の形式において、ELISA抗原サンドイッチ形式が、使用される。この場合において、上記固体支持体は、上に記載されるような1つ以上のHBV変異体を指向する抗HBV抗体によってコーティングされる。野生型HBsAgを指向する抗HBV抗体がまた、存在し得る。その後このサンプルは、HBV抗原(存在する場合)を上記抗体の1つ以上に結合させて抗原/抗体複合体を形成する条件下で、この支持体と接触させられる。結合されていない抗原は、除去され、この結合された抗原/抗体複合体と反応する酵素標識された抗体(例えば、標識された抗HBsAg抗体)が、添加される。酵素基質は、シグナルを発生するために使用される。この特定の実施形態において、この固体支持体上にコーティングされる抗HBV抗体は、本発明のウサギモノクローナル抗体(好ましくは、ハイブリドーマ99S9もしくはハイブリドーマ99S6またはその両方によって産生される抗体)であり得る。あるいは(またはさらに)、この検出可能に標識された抗体は、本発明のウサギモノクローナル抗体(好ましくは、ハイブリドーマ99S9もしくはハイブリドーマ99S6またはその両方によって産生される抗体)であり得る。
【0118】
別の実施形態において、生物学的サンプルから結合されたHBV分析物の存在は、抗原リガンドを指向する抗体を含む第二の結合因子を使用して容易に検出され得る。当業者に公知である方法を使用して検出可能な酵素標識(例えば、西洋ワサビペルオキシダーゼ、アルカリ性ホスファターゼまたはウレアーゼ)に容易に結合体化され得る、多くの抗ヒト免疫グロブリン(Ig)分子が、当該分野において公知である。次いで適切な酵素基質は、検出可能なシグナルを発生するために使用される。他の関連する実施形態において、競合型ELISA技術は、当業者に公知の方法を使用して実施され得る。
【0119】
本発明のウサギ抗HBV抗体はまた、以下のような間接型ELISA(例えば、間接型IgG ELISA)において使用され得る。HBV表面抗原に特異的な抗体は、固体支持体に結合される。プロテインAまたはプロテインGは、この固体支持体上にこの抗体を固定化するために使用され得る。次いでこの支持体は、この支持体に結合された抗HBV抗体に対する結合を可能にして抗体/抗原複合体を形成する条件下で、HBsAgと接触させられる。結合されていない抗原は、除去され、そしてこの固体支持体は、抗体/抗原複合体中の抗原に対するヒト抗HBV IgG(存在する場合)の結合を可能にする条件下で、HBVに対するヒトIgGの存在について検査されるサンプルと接触させられる。結合された抗HBV IgGの存在は、検出可能に標識された抗ヒトIgG抗体を使用して検出され得る。この様式において、HBVに対するヒトIgMの存在は、抗体/抗原複合体に結合する標識された抗ヒトIgMを使用することによって検出され得る。
【0120】
本発明のウサギ抗HBV抗体はまた、以下のような捕捉ELISA(例えば、IgM捕捉ELISA)において使用され得る。抗ヒトIgM抗体(例えば、ヤギ抗ヒトIgM抗体)は、固体支持体に結合され、この支持体は、この固体支持体に結合される抗ヒトIgM抗体の1つ以上に対する抗HBV IgM(存在する場合)の結合を可能にして抗体/抗体複合体を形成する条件下で、HBVに対するヒトIgMの存在について検査されるサンプルと接触させられる。HBsAg(例えば、変異体および/または野生型)は、この抗体/抗体複合体中の抗HBV IgMに対する結合を可能にして抗体/抗体/抗原複合体を形成する条件下で添加される。結合されていない抗原は、除去され、そして上に記載されるように産生される検出可能に標識された抗HBV抗体は、この結合された抗原対する結合を可能にする条件下で添加される。このサンプル中のHBVに対するIgMの存在は、この固体支持体に結合した、結合された抗ヒトIgM Ab/ヒト抗HBV IgM/抗原複合体に対する検出可能に結合された抗HBV抗体の存在によって決定される。
【0121】
前述のアッセイ形式のいくつかが「ELISA」(酵素結合イムノソルベント検定法)アッセイと称される一方で、「酵素結合した」結合部分以外の検出可能な標識の使用が可能でり、そして多くの状況において所望され得ることが、当業者に明らかである。他の適切な検出可能な標識は、本明細書中に記載され、そして当該分野において周知である。
【0122】
上記HBV抗原またはHBV抗体およびこれらの分子に特異的なリガンドが、沈殿する条件下で複合体を形成するように、アッセイはまた、溶液中で行われ得る。1つの特定の実施形態において、これらの分子は、当該分野で公知のカップリング技術(例えば、直接の化学的なカップリングまたは間接的なカップリングによる)を使用して、固相粒子(例えば、アガロースビーズなど)に結合され得る。次いでコーティングされた粒子は、HBV抗体またはHBV抗原を含むことが推定される生物学的サンプルと、適切な結合条件下で接触させられる。結合された抗体の間の架橋は、沈殿され得、そして洗浄および/または遠心分離を使用してこのサンプルから分離され得る複合体の凝集体の形成を引き起こす。反応混合物は、多くの標準的な方法のいずれか(例えば、上に記載されるような免疫診断法)を使用して、複合体の存在または非存在を決定するために分析され得る。
【0123】
よりさらなる実施形態において、免疫親和性マトリックスが、提供され得、例えば、HBV抗体が含まれることが推定される生物学的サンプルから得た抗体のポリクローナル集団は、基材に固定化される。このサンプルの最初のアフィニティー精製は、固定化した抗原を使用して実施され得る。したがって、得られるサンプル調製物は、そのアフィニティー支持体における強力な非特異的結合特性を回避する抗HBV部分を含むのみである。高収率および抗原結合活性の良好な保持率にて免疫グロブリン(インタクトであるか、または特定のフラグメントであるかのいずれか)を固定化する多くの方法は、当該分野において公知である。例えば、プロテインAまたはプロテインGは、この固体支持体に免疫グロブリン分子を固定化するために使用され得る。一旦この免疫グロブリン分子が免疫親和性マトリックスを提供するために固定化されると、HBV抗原(例えば、HBsAg)は、適切な結合条件下で、結合された抗体と接触させられる。任意の非特異的に結合されたHBV抗原が免疫親和性支持体から洗浄された後、結合された抗原の存在は、当該分野で公知の方法を使用して、標識についてアッセイすることによって決定され得る。例えば、上に記載されるように産生される、結合された抗原/抗体複合体と反応する酵素的に標識された抗体(例えば、標識された抗HBsAg抗体)が、添加される。酵素基質は、シグナルを発生するために使用される。
【0124】
本発明の別の実施形態において、ストリップ免疫ブロットアッセイ(SIA)が、生物学的サンプル中のHBV抗原を検出するために使用される。例えば、上に記載されるウサギモノクローナル抗体の1つ以上、および必要に応じて、HBsAgを指向するマウスモノクローナル抗体は、捕捉試薬として検査ストリップ上に固定化され得る。SIA技術は、当該分野において周知であり、そして伝統的なウェスタンブロッティング技術およびドットブロッティング技術を併用する(例えば、RIBA(登録商標)(Chiron Corp.、Emeryville、CA)SIA)。これらのアッセイにおいて、この抗体は、個別の、分散した部分として(例えば、バンドまたはドットとして)、膜状の支持体上に固定化されるか、または単一部分において混合物として固定化され得る。したがって、膜の支持体上に「分散して固定化された」は、存在する捕捉試薬の各々による反応性またはその欠如が評価され得るように、この抗体が、別個の成分として存在し、そして混合されないことを意味する。次いでHBV抗原を含むことが推定される生物学的サンプルは、検査膜と反応する。この生物学的サンプルにおける反応性の可視化は、比色定量の酵素基質と共に抗HBV抗体の酵素−結合体を使用して達成され得る。あるいは、上に記載されるウサギモノクローナル抗体は、結合された抗体−抗原複合体の可視化のために使用され得る。この代替的な実施形態のための検査ストリップは、例えば、HBsAgを指向するマウスモノクローナル抗体を使用して調製され得る。このアッセイは、手動で行われてもよいし、自動化された形式で使用されてもよい。
【0125】
上記ストリップ免疫ブロットアッセイの実施において使用され得る固体支持体としては、セルロース、ポリアミド(ナイロン)、ポリアクリロニトリル、二フッ化ポリビニリデン、ポリスルホン、ポリプロピレン、ポリエステル、ポリエチレンおよび上に記載されるものの組成物または誘導体からなる複合樹脂を含む多くの主要なポリマーから誘導される膜支持体が挙げられるが、これに限定されない。セルロースから誘導される支持体(例えば、ニトロセルロース膜、およびナイロン膜)が、特に好ましい。この基材は、一般的に、支持体として不活性なプラスチックの裏層を有する所望の膜を含む。
【0126】
本明細書中に記載されるウサギモノクローナル抗体および/またはHBsAg、結合された試薬を有する固体支持体、ならびに他の検出試薬を含む上記のアッセイ試薬は、上に記載されるようなアッセイを行うために、適切な説明書および他の必要な試薬と一緒にキット中に提供され得る。このキットはまた、コントロール処方物(ポジティブおよび/またはネガティブ)、標識された試薬(そのアッセイ形式が標識された試薬を必要とする場合)およびシグナル発生試薬(例えば、酵素基質)(この標識がシグナルを直接発生しない場合)を備え得る。通常、アッセイを実施するための説明書(例えば、文書、テープ、VCR、CD−ROMなど)は、このキット中に含まれる。このキットはまた、使用される特定のアッセイに依存して、他のパッケージ化された試薬および材料(すなわち、洗浄緩衝液など)を含み得る。標準的なアッセイ(例えば、上に記載されるもの)は、これらのキットを使用して行われ得る。
【0127】
(III.実験)
以下は、本発明を実施するための特定の実施形態の例である。これらの実施例は、例示目的のみのために提供され、そして決して本発明の範囲を限定することを意図しない。
【0128】
使用される数(例えば、量、温度など)に関する精度を保証するために努力がなされたが、ある程度の実験的な誤差および偏差は、当然に考慮されるべきである。
【実施例】
【0129】
(実施例1.ウサギモノクローナル抗体の調製)
目的の種々の変異体に十分な免疫反応性を与えるモノクローナル抗体、および野生型HBsAgを産生するために、3羽の白色の雌成体ニュージーランドウサギを、野生型HBsAg(adw)抗原および野生型HBsAg(ayw)抗原(それぞれ、図2Aおよび2Bに示す)によって免疫化し、次いで野生型抗原と5種の主なHBV組換え変異体抗原(名称D1(アミノ酸134位にFからAへの置換を有する)、名称D2(アミノ酸134位にFからSへの置換を有する)、名称D3(アミノ酸145にGからRへの置換を有する)、名称Y1(アミノ酸143にSからLへの置換を有する)、および名称Y2(アミノ酸129にQからRへの置換を有し、そしてアミノ酸133にMからTへの置換を有する))とのカクテルによって2週間毎に追加免疫した。
【0130】
本質的にSpieker−Poletら、Proc.Natl.Acad.Sci.USA、(1995)、92:9348−9352に記載されるように、最も免疫反応性であるウサギの脾臓由来の免疫B細胞を、ウサギプラズマ細胞腫細胞に融合して、ハイブリドーマを産生した。簡単にいうと、免疫化されたウサギから得た1.5×108〜3×108個のリンパ球を、無血清培地中で37℃にて50%のPEG 4000を用いて2:1の比で、ウサギプラズマ細胞腫細胞株(例えば、米国特許第5,675,063号;Spieker−Poletら、Proc.Natl.Acad.Sci.USA、(1995)、92:9348−9352に記載される240E 1−1−2)に由来する融合パートナーと融合した。この細胞を、15%のFBS(またはFCS)を含む培地において、ウェル1つあたり約1×105個のリンパ球にて96ウェル細胞培養プレート中に分配した。48時間後、HAT培地を、添加した。培地を、スクリーニング前に、2〜3回交換した。通常、ハイブリドーマのコロニーは、3〜5週間でスクリーニングできる状態であった。上清を、ELISAによって、免疫原に対して特異的な抗体の存在について検査した。免疫組織化学を、第二のスクリーニングアッセイとして使用した。これらのハイブリドーマを、限界希釈によってサブクローニングした。支持細胞に対して、ウェル1つあたり2×104個の細胞にて融合パートナーを使用した。
【0131】
合計で3000個のクローンを、スクリーニングし、そして38個のクローン(表1)を、さらなる研究に対する有力候補として同定した。次いでこれらのクローンを、サブクローニングし、そして抗原カクテル、変異体および野生型の両方(表1を参照のこと)のために使用される全7種のHBV表面抗原に対して最も良好な反応性を有する抗体の産生について検査した。これらの結果は、評価した38個のクローンの結果を示し、4個のクローン(表1において強調されるような)は、HBsAg変異体に対して最も広範な免疫反応性を有した。したがって、これら4個のHBVウサギハイブリドーマを、スケールアップし、精製し、そしてさらに評価した。
【0132】
選択した38個のHBVハイブリドーマクローンの大規模な分析後、2つのクローン(99S9(ATCC受託番号PTA−6014)および99S6(ATCC受託番号PTA 6015))が、HBV表面Ag変異体パネルに対して非常に広い免疫反応性を有する抗体を産生することを示した。具体的には、ELISAを、上に記載される種々の変異体HBsAgを用いて99S9ハイブリドーマ細胞株および99S6ハイブリドーマ細胞株によって産生される、2つのマウスモノクローナル抗体(mMAb1およびmMAb2)(HBsAgを指向するマウスモノクローナル抗体)およびウサギモノクローナル抗体の免疫反応性を比較するために使用した。さらに、ハイブリドーマ99S6およびハイブリドーマ99S9由来のマウスモノクローナル抗体ならびにウサギモノクローナル抗体を、BIACORE 3000システム(Biacore AB、Piscataway、NJ)を使用して検査した。このシステムは、表面プラスモン共鳴(SPR)技術を使用してリアルタイムの生体分子相互作用分析(BIA)を提供する。SPRベースのバイオセンサーは、表面に近い生体分子の質量濃度を測定することによって相互作用をモニタリングする。この表面は、相互作用するパートナーの1つを結合することによって特異的に作製される。他のパートナーを含むサンプルは、表面上を流れる。サンプル由来の分子が、この表面に結合した相互作用因子に結合する場合、局所濃度は変化し、そしてSPR反応が、測定される。この反応は、その表面に結合する分子の質量に正比例する。この場合において、ヤギ抗ウサギIgG抗体(このウサギモノクローナル抗体の免疫反応性を検査するため)、またはヤギ抗マウスIgG(このマウスモノクローナル抗体の免疫反応性を検査するため)を、センサーチップ上に固定化して、表面を捕捉する抗体を提供した。次いで、上に記載されるウサギモノクローナル抗体またはマウスモノクローナル抗体(リガンド)を、この表面を捕捉する抗体によって捕捉した。次いで、この変異体HBsAgおよび野生型HBsAg(分析物)を、この表面に通過させ、そしてその抗体/抗原相互作用を、BIACORE SPR光学デバイスを使用して検出し、そして測定した。
【0133】
図3A〜3Dおよび表2は、マウス抗体mMAb1(図3C)およびmMAb2(図3A)と比較して、99S6(図3B)および99S9(図3D)由来のウサギモノクローナル抗体のBIACORE分析結果を要約する。これらの研究および以下の研究に関して、HBsAgに対する多くの異なるマウスモノクローナル抗体を、使用した(mMAb1、mMAb2、mMAb3、mMAb4、mMAb5、およびmMAb6)。数種の市販されているマウスモノクローナル抗体をまた、使用した。図3A〜3Dに示す通り、マウスモノクローナル抗体mMAb2が、変異体D3に対する結合を欠き、そしてmMAb1が、変異体D3およびY1に対する結合を欠く一方で、両方のウサギハイブリドーマクローン99S9および99S6は、D3およびY1を含めて、7種全ての抗原に対する有意な結合活性を有する抗体を産生した。さらに、BIACOREの結果はまた、変異体D3およびY1に対するウサギモノクローナル抗体(ハイブリドーマクローン99S9由来およびハイブリドーマクローン99S6由来)の結合が、非常に安定であったことを証明した(図3)。これらの結果は、2つのマウスモノクローナル抗体と比較して、クローン99S9およびクローン99S6由来のウサギモノクローナル抗体が、他の抗原に対する免疫反応性を保持しつつ、変異体抗原D3およびY1に対するずっと強い免疫反応性を有したことを示し、したがってウサギ抗体は、種々のHBsAg変異体に対するずっと広い免疫反応性を有したことを示した。
【0134】
HBV改変体(すなわち、変異体)の検出についてのウサギモノクローナル抗体の利点をさらに示すために、HBsAgの野生型および改変体の検出のためのサンドイッチELISAアッセイにおいて捕捉抗体または検出抗体として、99S9由来のウサギモノクローナル抗体を、マウスモノクローナル抗体と比較して試験した。これらの実験において、2セットのELISAプレートを、単一のウサギモノクローナル抗体(99S9)または2つの抗HBsAgマウスモノクローナル抗体(mMAb2および160S11)(BD
Biosciences Pharmingen(San Diego、CA))のカクテルのいずれかによってコーティングした。これら2セットの捕捉プレートを、単一の99S9西洋ワサビペルオキシダーゼ(HRP)検出システム、または4つのHRP標識抗HBsAg MAbs(mMAb1、M01077(Fitzgerald Industries International、Concord、MA)、M01079(Fitzgerald Industries International、Concord、MA)、およびmMAb3)の混合物を含むマウスモノクローナル抗体カクテルと対にした。
【0135】
これらの結果は、BIACORE分析研究からの結果と一致した。99S9由来のウサギモノクローナル抗体は、上記マウスモノクローナル抗体と比較して、より広い免疫反応性を有した。99S9を、唯一の捕捉抗体および検出抗体(捕捉抗体として99S9および検出抗体としてHRP−99S9)として試験した場合、99S9は、7種全ての抗原を検出し得たが、マウスモノクローナル抗体カクテル(捕捉抗体としてmMAb2/160S11および検出抗体としてHRP−mMAb1/M77/M79/2D11)は、D3抗原を検出できなかった(表3)。これらの結果は、単一のウサギモノクローナル抗体が、いくつかの主要な回避した変異体の検出のために使用されるELISAアッセイにおいて、複数のマウスモノクローナル抗体を十分に置換し得ることを示した。
【0136】
上記の実験を要約すると、ウサギモノクローナル抗体99S9は、試験した7種の抗原に対する親和性を有し、そして7種の抗原の全て(特に、D3およびY1)に対するずっと遅い解離速度(off−rate)を示した(図3および表2)。マウスモノクローナルmMAb1は、変異体D1、D2、ならびに野生型adwおよび野生型aywについて有意により高い親和性を有し、マウスモノクローナルmMAb1は、変異体抗原D3およびY1に結合できないようである(図3および表2)。マウスモノクローナル抗体mMAb2は、ほとんどのHBV変異体抗原について全体的により低い親和性を有し、そして変異体抗原D3に結合できなかった(図3および表2)。ウサギモノクローナル抗体99S9単独は、変異体D3のより有効な捕捉および/または検出に関して、複数のマウスモノクローナル抗体の組み合わせを置換するのに十分であった(表3)。
【0137】
上記ウサギモノクローナル抗体の他のHBsAg改変体を検出する能力を検査するために、さらなるELISAを、HBsAgに対してマウスモノクローナル抗体のみ(mMAb ELISA)か、またはHBsAgに対してマウスモノクローナルとウサギモノクローナルとの組み合わせ(rMAb ELISA)のいずれかを使用して実施した。mMAb ELISAに関して、5種の異なる抗HBsAgマウスモノクローナル抗体を使用した(捕捉のために2種(mMAb2およびmMAb4)および検出のために3種(mMAb1、mMAb5およびmMAb6)。rMAb ELISAに関して、検出のために使用される2種のマウスモノクローナル抗体(mMAb5およびmMAb6)を、単一のウサギモノクローナル抗体(99S9)によって置換した。この捕捉抗体を、ビオチン化し、そしてストレプトアビジンコーティングのウェル上に固定化した。この検出抗体を、西洋ワサビペルオキシダーゼ(HRP)と結合体化した。表4は、多くのHBsAg改変体による結果を示す。rMAb ELISAは、mMAb ELISAにおいて検出された全ての改変体を検出し、そしてさらに、mMAb ELISAにおいて検出されなかった2種の改変体(P120Q改変体およびP142S改変体)を検出した。したがって、このウサギモノクローナル抗体(99S9)を使用するELISAは、このマウスモノクローナル抗体のみを使用するELISAより、少ない抗体を使用して、より多くのHBsAg改変体を検出し得た。
【0138】
したがって、ウサギモノクローナル抗体は、HBV改変体抗原の、より良好な検出のための強力な手段を提供する。
【0139】
したがって、新規のモノクローナル抗体およびHBV感染を検出するための方法が、開示される。本発明の好ましい実施形態は、ある程度詳細に記載されているが、明らかな変更は特許請求の範囲に定義されるような本発明の精神および範囲から逸脱することなくなされ得ることが、理解される。
【0140】
【表1】

【0141】
【表2】

【0142】
【表3】

【0143】
【表4】

【0144】
(本発明の実施に有用な株の寄託)
以下の株の生物学的に純粋な培養物の寄託は、American Type Culture Collection(ATCC)、10801 University Boulevard、Manassas、VAによって行われた。示した受託番号は、生死判別試験が成功し、そして必要な手数料が、支払われた後に割り当てられた。この寄託は、Budapest Treaty on the International Recognition of the Deposit of Microorganisms for the Purpose of Patent Procedure and the Regulations thereunder(Budapest Treaty)の規定の下で行われた。これは、寄託の日から30(30)年間、および少なくとも寄託者による、寄託サンプルの供給に対する最も最近の要求の後、5(5)年間、生存可能な培養物の維持を保障する。この生物体は、米国特許法§122およびそれに準拠するCommissioner’s規則(37 C.F.R.§1.12を含む)によって資格を与えられたU.S.Commissioner of Patents and Trademarksによって決定された者に対するこの培養物の半永久的かつ非制限的な利用可能性を保障する、ブダペスト条約の条件の下でATCCで入手可能にされる。特許の付与の際に、この寄託された培養物の公衆に対する利用可能性に対する全ての制限事項は、取り消し不能に取り除かれる。
【0145】
これらの寄託物は、単に当業者に対する便宜のために提供され、そして寄託物が米国特許法§112に基づいて要求されることを承認しない。これらのプラスミドの核酸配列、およびそれによってコードされるポリペプチドのアミノ酸配列は、本明細書中に参考として援用され、そして本明細書中の記載についての任意の矛盾する事象における統制である。ライセンスが、この寄託された材料を作製するか、使用するか、または販売するためには必要とされ得、そしてこのようなライセンスは本明細書中では与えられない。
【0146】
【表5】

【化1】

【化2】

【化3】

【化4】

【化5】

【技術分野】
【0001】
(技術分野)
本発明は、一般的に、B型肝炎ウイルス(HBV)に関係する。特に、本発明は、HBV表面抗原を指向するウサギモノクローナル抗体およびHBV感染の診断のためのその使用の方法に関する。
【背景技術】
【0002】
(背景)
B型肝炎ウイルス(HBV)は、肝臓の持続的な非細胞変性(noncytopathic)の感染を引き起こす小さいDNA含有ウイルスの群の一員である。ヒトにおけるHBV感染は、重篤な黄疸、肝変性および死を引き起こし得る。HBVは、主に非経口的経路によって進入し、60〜160日間の特徴的な潜伏期間を有し、そして慢性的キャリアにおいて血中に長年にわたって存続し得る。HBVは、ヒトにおける慢性肝疾患(例えば、肝臓癌)の最も一般的な原因の1つであるので、医学的に非常に重要である。感染した肝細胞は、頻繁にウイルス粒子を分泌し、このウイルス粒子は血中に高レベルに蓄積する。さらに、人口の約6〜7%が感染していると推定され、この感染のレベルは、東南アジアおよびサハラ以南のアフリカの特定の地域で、人口の20%と高い。
【0003】
数種の検査が、血清および他の体液中のHBV成分の存在を検出するために利用されてきた。これらの検査は、原理において主に免疫学的であり、そしてヒトまたは動物において産生される、特定のウイルスタンパク質(例えば、B型肝炎表面抗原(HBsAg)、B型肝炎コア(ヌクレオカプシド)抗原(HBcAg)またはB型肝炎「E」抗原(HBeAg))を検出する抗体の存在に依存する。しかし、血清学的なHBsAg診断アッセイまたは血液スクリーニングアッセイにおいて偽陰性の産物に関連した、改変体HBsAgの寄与に対する懸念の増加が存在する。
【0004】
特に、HBVは、ゲノム以前(pre−genomic)のRNAの逆転写による複製の様式に起因して、他のDNAウイルスよりも高い割合の変異を有する。アミノ酸置換は、全てのHBV DNAがコードするウイルスタンパク質(例えば、ポリメラーゼ、HBcAgおよびHBsAg)において記載されてきた。HBVの群特異的な「a」決定基領域(HBsAgのS部分に対して番号付けされたアミノ酸124〜147)は、最も注目を集めてきた。なぜなら、この領域における変異は、ワクチン回避体(vaccine escapee)の10〜20%において見出され、そして市販されている最近の血清学的アッセイを使用してでさえも、改変体HBVの誤診をもたらしてきたからである。したがって、血液製剤および血漿製剤、または人同士の密接な接触によるこのウイルスの伝染を予防するために、ウイルスの血液サンプルにおいて、HBVを検出する確実な診断的検査の開発に対する必要性が存在する。
【0005】
ウサギ−ウサギハイブリドーマおよびウサギ−マウスハイブリドーマは、増加した免疫反応性を有するモノクローナル抗体を産生する試みにおいて使用されてきた。例えば、特許文献1;特許文献2;特許文献3;特許文献4;非特許文献1を参照のこと。ウサギモノクローナル抗体は、いくつかの理由から望ましい。第1に、ウサギは、マウスまたはラット(モノクローナル抗体が通常産生される2つの種)において免疫原性でない抗原およびエピトープを認識し得る。さらに、ウサギ抗体は、一般的に、高親和性である。特許文献5は、ウサギ−ウサギ融合体を使用した、HBsAgに対するウサギモノクローナル抗体の産生を記載する。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】米国特許第4,977,081号明細書
【特許文献2】米国特許第4,859,595号明細書
【特許文献3】米国特許第5,472,868号明細書
【特許文献4】米国特許第5,675,063号明細書
【特許文献5】米国特許第4,859,595号明細書
【非特許文献】
【0007】
【非特許文献1】Spieker−Poletら、「Proc.Natl.Acad.Sci.USA」、1995年、第92巻、p.9348−9352
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかし、種々のHBsAg変異体に対する幅広い免疫反応性を有するモノクローナル抗体を使用する、改良された免疫アッセイに対する必要性が存在し続ける。HBV感染に対する正確かつ有効なアッセイにおいて使用するための広範な利用可能性の試薬が、非常に望まれている。
【課題を解決するための手段】
【0009】
本発明は、HBV感染の簡便で、正確かつ効率的な診断のために、免疫反応性の高いモノクローナル抗体を提供する。この抗体は、ウサギハイブリドーマから産生され、そして種々の変異体HBV株に対して免疫反応性である。したがって、このウサギモノクローナル抗体を使用したアッセイ方法は、より正確であり、そして他の血清学的検査によって認められる偽陰性の数は、減少する。したがって、この抗体を使用するアッセイは、種々のHBV変異体によって引き起こされるHBV感染の検出を可能にし、そして感染が検出される場合、その個体は、肝臓の損傷および死の予防を支援するために、適時、適切な処置を施され得る。
【0010】
したがって、1つの実施形態において、本発明は、「a」決定基領域に変異を有するHBsAg変異体を認識する抗HBVウサギモノクローナル抗体、またはその免疫反応性フラグメント(例えば、Fabフラグメント、F(ab’)2フラグメント、FvフラグメントまたはsFvフラグメント)に関する。特定の実施形態において、この抗体は、「a」決定基領域に変異を有する1つより多くのHBsAg変異体を認識する。さらなる実施形態において、この抗体はまた、野生型HBsAgを認識する。よりさらなる実施形態において、このHBsAg変異体は、変異体sAg(例えば、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tの「a」決定基領域の配列を含む変異体)である。さらなる実施形態において、この抗体は、F134A、F134S、G145R、S143L、P142SおよびQ129R/M133Tからなる群より選択されるHBsAgおよび/または1つもしくは少なくとも2つの変異体HBSAgを認識する。上記の抗体のいずれかは、ウサギ−ウサギハイブリドーマまたはウサギ−マウスハイブリドーマを使用して産生され得る。
【0011】
さらなる実施形態において、本発明は、ハイブリドーマ99S6(ATCC受託番号PTA−6015)およびハイブリドーマ99S9(ATCC受託番号PTA−6014)ならびにこれらのハイブリドーマによって産生される抗体に関する。さらなる実施形態において、本発明は、ハイブリドーマ99S6および/またはハイブリドーマ99S9によって産生される抗体と同じエピトープを認識するウサギモノクローナル抗体に関する。
【0012】
さらなる実施形態において、本発明は、生物学的サンプル中のHBV表面抗原を検出する方法に関する。この方法は、以下を包含する:
HBV抗原が、この生物学的サンプル中に存在する場合に、HBV抗原が上記の実施形態のいずれかに従う少なくとも1つのウサギモノクローナル抗体に結合して抗体/抗原複合体を形成することを可能にする条件下で、この生物学的サンプルとこの抗体とを接触させる工程;および
この抗体/抗原複合体の存在または非存在を検出し、それによってこのサンプル中のHBV表面抗原の存在または非存在を検出する工程。
【0013】
上記の方法の好ましい実施形態において、この少なくとも1つのウサギモノクローナル抗体は、ハイブリドーマ99S6またはハイブリドーマ99S9によって産生される抗体である。特定の実施形態において、少なくとも1つのウサギモノクローナル抗体は、検出可能に標識される。特定の実施形態において、この方法は、生物学的サンプルと、野生型HBsAgまたは「a」決定基領域に変異を有するHBsAg変異体を指向する1つ以上のさらなる抗体とを反応させる工程をさらに包含する。この1つ以上のさらなる抗体は、さらなるモノクローナル抗体(例えば、マウスモノクローナル抗体)を含み得る。
【0014】
さらなる実施形態において、本発明は、HBV感染を検出するための免疫診断検査キットに関する。この検査キットは、以下を備える:上記の実施形態のいずれかに従う少なくとも1つのウサギモノクローナル抗体、またはその免疫反応性フラグメント;および
免疫診断検査を行うための説明書。
【0015】
上記の方法の好ましい実施形態において、この少なくとも1つのウサギモノクローナル抗体は、ハイブリドーマ99S6またはハイブリドーマ99S9によって産生される抗体である。特定の実施形態において、この検査キットは、野生型HBsAgまたは「a」決定基領域に変異を有するHBsAg変異体を指向する1つ以上のさらなる抗体をさらに備える。この1つ以上のさらなる抗体は、さらなるモノクローナル抗体(例えば、マウスモノクローナル抗体)を含み得る。
【0016】
さらなる実施形態において、本発明は、上記の実施形態のいずれかに従う少なくとも1つのウサギモノクローナル抗体またはその免疫反応性フラグメントを備える固体支持体に関する。この固体支持体の好ましい実施形態において、この少なくとも1つのウサギモノクローナル抗体は、ハイブリドーマ99S6またはハイブリドーマ99S9によって産生される抗体である。特定の実施形態において、この支持体は、野生型HBsAgまたは「a」決定基領域に変異を有するHBsAg変異体を指向する1つ以上のさらなる抗体をさらに備える。この1つ以上のさらなる抗体は、さらなるモノクローナル抗体(例えば、マウスモノクローナル抗体)を含み得る。さらなる実施形態において、この固体支持体は、少なくとも2つの内部コントロールをさらに備え、このコントロールの一方が、この固体支持体を使用した免疫アッセイにおけるポジティブな結果についての、より低い検出限界を規定し、そして他方のコントロールは、この固体支持体を使用した免疫アッセイにおける極めてポジティブな結果を規定する。いくつかの実施形態において、この固体支持体は、ニトロセルロースストリップである。
【0017】
よりさらなる実施形態において、本発明は、HBVを検出するための免疫診断検査キットに関する。この検査キットは、以下を備える:
(a)上記の実施形態のいずれかに従う固体支持体;および
(b)免疫診断検査を行うための説明書。
【0018】
さらなる実施形態において、本発明は、生物学的サンプル中のHBV表面抗原の存在を検出する方法に関する。この方法は、以下を包含する:
(a)生物学的サンプルを提供する工程;
(b)上に記載されるような固体支持体を提供する工程;
(c)HBV抗原がこの生物学的サンプル中に存在する場合に、HBV抗原がウサギモノクローナル抗体の少なくとも1つに結合して抗体/抗原複合体を形成することを可能にする条件下で、この生物学的サンプルとこの固体支持体とを接触させる工程;および
(d)この抗体/抗原複合体の存在を検出し、それによって該生物学的サンプル中のHBV表面抗原の存在を検出する工程。
【0019】
特定の実施形態において、この方法は、以下をさらに包含する:
(e)結合していないHBV抗原を除去する工程;
(f)この抗体/抗原複合体と結合し得る1つ以上の部分を提供する工程;および
(g)この1つ以上の部分の存在を検出し、それによってこの生物学的サンプル中のHBV表面抗原の存在を検出する工程。
【0020】
この方法のさらなる実施形態において、この1つ以上の部分は、検出可能に標識されたHBV抗体(例えば、「a」決定基領域に変異を有するHBsAg変異体を認識する検出可能に標識されたウサギモノクローナル抗体)、またはその免疫反応性フラグメントを含む。この検出可能な標識は、酵素であり得る。さらに、この生物学的サンプルは、ヒト血液サンプルに由来し得る。
【0021】
さらなる実施形態において、本発明は、生物学的サンプル中の抗HBsAg抗体の存在を検出する方法に関する。この方法は、以下を包含する:
(a)上に記載されるような固体支持体を提供する工程;
(b)1つ以上のHBsAgがウサギモノクローナル抗体の少なくとも1つに結合して、抗体/抗原複合体を形成することのできる条件下で、この固体支持体と1つ以上のHBsAgとを接触させる工程;
(d)抗HBsAg抗体がこの生物学的サンプル中に存在する場合に、抗HBsAg抗体がこの抗体/抗原複合体に結合して、抗体/抗原/抗体複合体を形成することのできる条件下で、この抗体/抗原複合体を有する固体支持体と生物学的サンプルとを接触させる工程;および
(e)この抗体/抗原/抗体複合体の存在を検出し、それによってこの生物学的サンプル中の抗HBsAg抗体の存在を検出する工程。
【0022】
さらなる実施形態において、この方法は、以下をさらに包含する:
(f)結合していない抗体を除去する工程;
(g)この抗体/抗原/抗体複合体と結合し得る1つ以上の部分(例えば、検出可能に標識された免疫グロブリン分子を含む1つ以上の部分)を提供する工程;および
(h)この1つ以上の部分の存在を検出し、それによってこの生物学的サンプル中の抗HBsAg抗体の存在を検出する工程。
【0023】
さらなる実施形態において、本発明は、HBVを実質的に含まない全血、血小板、血漿または血清を含む血液供給物を調製する方法に関する。この方法は、以下を包含する:
(a)上記の方法によって収集される血液サンプル由来の全血、血小板、血漿または血清のアリコートをスクリーニングする工程;
(b)HBV抗原が検出されるあらゆるサンプルを除去する工程;および
(c)HBV抗原が検出されないサンプルを合わせて、HBVを実質的に含まない血液供給物を提供する工程。
【0024】
さらなる実施形態において、本発明は、HBVを実質的に含まない全血、血小板、血漿または血清を含む血液供給物を調製する方法に関する。この方法は、以下を包含する:
(a)上記の方法によって収集される血液サンプル由来の全血、血小板、血漿または血清のアリコートをスクリーニングする工程;
(b)抗HBsAg抗体が検出されるあらゆるサンプルを除去する工程;および
(c)抗HBsAg抗体が検出されないサンプルを合わせて、HBVを実質的に含まない血液供給物を提供する工程。
【0025】
よりさらなる実施形態において、本発明は、移植の前に供与された組織または供与された器官をスクリーニングしてHBVを実質的に含まない組織または器官を提供する方法に関する。この方法は、以下を包含する:
(a)上記の方法によってこの組織またはこの器官由来のサンプルをスクリーニングする工程;
(b)HBV抗原が検出される組織または器官を除去して、HBVを実質的に含まない組織または器官を提供する工程。
【0026】
さらなる実施形態において、本発明は、移植の前に供与された組織または供与された器官をスクリーニングしてHBVを実質的に含まない組織または器官を提供する方法に関する。この方法は、以下を包含する:
(a)上記の方法によってこの組織またはこの器官由来のサンプルをスクリーニングする工程;
(b)抗HBsAg抗体が検出される組織または器官を除去して、HBVを実質的に含まない組織または器官を提供する工程。
【0027】
よりさらなる実施形態において、本発明は、抗HBVウサギモノクローナル抗体を調製する方法に関する。この方法は、以下を包含する:
(a)「a」決定基領域に変異を有するHBsAg変異体によってウサギを免疫化する工程;
(b)このウサギ由来のHBsAg変異体に対する抗体を産生する細胞と、不死化した細胞株由来の細胞とを融合して、ハイブリドーマを産生する工程;
(c)このハイブリドーマを選択する工程;
(d)この選択したハイブリドーマを培養する工程;および
(e)この培養したハイブリドーマによって分泌されるこの抗体を収集する工程。
【0028】
特定の実施形態において、この免疫化する工程は、1つより多くのHBsAg変異体によってウサギを免疫化する工程を包含する。特定の実施形態において、この抗体を産生する細胞は、ウサギ脾細胞である。この脾細胞は、不死化したウサギ細胞株(例えば、ウサギプラズマ細胞腫)由来の細胞と融合されてウサギ−ウサギハイブリドーマを産生し得るか、または不死化したマウス細胞株由来の細胞と融合されてウサギ−マウスハイブリドーマを産生し得る。
【0029】
上記の方法の特定の実施形態において、このHBsAg変異体は、変異体sAg(例えば、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tの「a」決定基領域の配列を含む変異体)である。他の実施形態において、このHBsAg変異体は、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tを含む。よりさらなる実施形態において、このウサギは、この「a」決定基領域に異なる変異を有する少なくとも2つのHBsAg変異体(例えば、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tからなる群より選択される少なくとも2つのHBsAg変異体)によって免疫化される。さらなる実施形態において、このウサギは、HBsAg変異体であるF134A、F134S、G145R、S143L、P142SおよびQ129R/M133Tによって免疫化される。さらなる実施形態において、このウサギは、野生型HBsAgによってさらに免疫化される。
【0030】
さらなる実施形態において、本発明は、上記の方法によって産生される抗HBVウサギモノクローナル抗体に関する。
【0031】
よりさらなる実施形態において、本発明は、ウサギ−ウサギハイブリドーマを調製する方法に関する。この方法は、以下を包含する:
(a)「a」決定基領域に変異を有するHBsAg変異体によってウサギを免疫化する工程;
(b)このウサギ由来のHBsAg変異体に対する抗体を産生する脾細胞と、ウサギプラズマ細胞腫由来の細胞とを融合する工程;
(c)この抗体を分泌する細胞を選択する工程。
【0032】
さらなる実施形態において、本発明は、上に記載されるようなウサギモノクローナル抗体またはその免疫反応性フラグメント(例えば、Fabフラグメント、F(ab’)2フラグメント、FvフラグメントまたはsFvフラグメント)をコードするポリヌクレオチドに関する。
【0033】
当業者は、本明細書中の開示を考慮して、本発明のこれらの実施形態および他の実施形態に容易に想到する。
例えば、本願発明は以下の項目を提供する。
(項目1)
「a」決定基領域に変異を有するHBsAg変異体を認識する、B型肝炎ウイルス(HBV)ウサギモノクローナル抗体、またはその免疫反応性フラグメント。
(項目2)
前記抗体は、「a」決定基領域に変異を有する1つより多くのHBsAg変異体を認識する、項目1に記載のウサギモノクローナル抗体。
(項目3)
前記抗体はまた、野生型HBsAgを認識する、項目1に記載のウサギモノクローナル抗体。
(項目4)
前記HBsAg変異体は、変異体sAgである、項目1に記載のウサギモノクローナル抗体。
(項目5)
前記HBsAg変異体は、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tの「a」決定基領域の配列を含む、項目4に記載のウサギモノクローナル抗体。
(項目6)
前記抗体は、F134A、F134S、G145R、S143L、P142SおよびQ129R/M133Tからなる群より選択されるHBsAgを認識する、項目5に記載のウサギモノクローナル抗体。
(項目7)
前記抗体は、F134A、F134S、G145R、S143L、P142SおよびQ129R/M133Tからなる群より選択される少なくとも2つの変異体HBsAgを認識する、項目5に記載のウサギモノクローナル抗体。
(項目8)
前記抗体は、変異体HBsAgであるF134A、F134S、G145R、S143L、P142SおよびQ129R/M133Tを認識する、項目5に記載のウサギモノクローナル抗体。
(項目9)
前記抗体は、前記抗体は、ウサギ−ウサギハイブリドーマを使用して産生される、項目1〜8のいずれか1項に記載のウサギモノクローナル抗体。
(項目10)
前記抗体は、ウサギ−マウスハイブリドーマを使用して産生される、項目1〜8のいずれか1項に記載のウサギモノクローナル抗体。
(項目11)
ハイブリドーマ99S6(ATCC受託番号PTA−6015)。
(項目12)
ハイブリドーマ99S9(ATCC受託番号PTA−6014)。
(項目13)
ハイブリドーマ99S6(ATCC受託番号PTA−6015)によって産生される抗体。
(項目14)
ハイブリドーマ99S9(ATCC受託番号PTA−6014)によって産生される抗体。
(項目15)
前記フラグメントは、Fabフラグメント、F(ab’)2フラグメント、FvフラグメントまたはsFvフラグメントである、項目1に記載のフラグメント。
(項目16)
ハイブリドーマ99S6(ATTC受託番号PTA−6015)またはハイブリドーマ99S9(ATCC受託番号PTA−6014)によって産生される抗体と同じエピトープを認識する、ウサギモノクローナル抗体。
(項目17)
生物学的サンプル中のHBV表面抗原を検出する方法であって、以下:
(a)HBV抗原が該生物学的サンプル中に存在する場合に、該HBV抗原が、項目1〜10、項目13、項目14、項目16、または項目59のいずれか1項に記載の少なくとも1つのウサギモノクローナル抗体に結合して抗体/抗原複合体を形成することを可能にする条件下で、該生物学的サンプルと該抗体とを接触させる工程;および
(b)該抗体/抗原複合体の存在または非存在を検出し、それによって該サンプル中のHBV表面抗原の存在または非存在を検出する工程、
を包含する、方法。
(項目18)
前記少なくとも1つのウサギモノクローナル抗体は、検出可能に標識される、項目17に記載の方法。
(項目19)
前記方法は、前記生物学的サンプルと、野生型HBsAgまたは「a」決定基領域に変異を有するHBsAg変異体を指向する1つ以上のさらなる抗体とを反応させる工程を包含する、項目17に記載の方法。
(項目20)
前記1つ以上のさらなる抗体は、さらなるモノクローナル抗体を含む、項目19に記載の方法。
(項目21)
前記1つ以上のさらなる抗体は、マウスモノクローナル抗体を含む、項目20に記載の方法。
(項目22)
HBV感染を検出するための免疫診断検査キットであって、該検査キットは、以下:
(a)項目1に記載の少なくとも1つのウサギモノクローナル抗体、またはその免疫反応性フラグメント;および
(b)免疫診断検査を行うための説明書、
を備える、免疫診断検査キット。
(項目23)
前記検査キットは、野生型HBsAgまたは「a」決定基領域に変異を有するHBsAg変異体を指向する1つ以上のさらなる抗体をさらに備える、項目22に記載の免疫診断検査キット。
(項目24)
前記1つ以上のさらなる抗体は、さらなるモノクローナル抗体を含む、項目23に記載の免疫診断検査キット。
(項目25)
前記1つ以上のさらなる抗体は、マウスモノクローナル抗体を含む、項目24に記載の免疫診断検査キット。
(項目26)
項目1に記載の少なくとも1つのウサギモノクローナル抗体またはその免疫反応性フラグメントを備える、固体支持体。
(項目27)
前記支持体は、野生型HBsAgまたは「a」決定基領域に変異を有するHBsAg変異体を指向する1つ以上のさらなる抗体をさらに備える、項目26に記載の固体支持体。
(項目28)
前記1つ以上のさらなる抗体は、さらなるモノクローナル抗体を含む、項目27に記載の固体支持体。
(項目29)
前記1つ以上のさらなる抗体は、マウスモノクローナル抗体を含む、項目28に記載の固体支持体。
(項目30)
項目26に記載の固体支持体であって、少なくとも2つの内部コントロールをさらに備え、該コントロールの一方が、該固体支持体を使用した免疫アッセイにおけるポジティブな結果についてのより低い検出限界を規定し、そして他方のコントロールは、該固体支持体を使用した免疫アッセイにおける極めてポジティブな結果を規定する、固体支持体。
(項目31)
前記固体支持体は、ニトロセルロースストリップである、項目26に記載の固体支持体。
(項目32)
HBVを検出するための免疫診断検査キットであって、該検査キットは、以下:
(a)項目26〜31のいずれか1項に記載の固体支持体;および
(b)免疫診断検査を行うための説明書
を備える、免疫診断検査キット。
(項目33)
生物学的サンプル中のHBV表面抗原の存在を検出する方法であって、該方法は、以下:
(a)生物学的サンプルを提供する工程;
(b)項目26〜31のいずれか1項に記載の固体支持体を提供する工程;
(c)HBV抗原がこの生物学的サンプル中に存在する場合に、該HBV抗原がウサギモノクローナル抗体の少なくとも1つに結合して抗体/抗原複合体を形成することを可能にする条件下で、該生物学的サンプルと該固体支持体とを接触させる工程;および
(d)該抗体/抗原複合体の存在を検出し、それによって該生物学的サンプル中のHBV表面抗原の存在を検出する工程、
を包含する、方法。
(項目34)
項目33に記載の方法であって、以下:
(e)結合していないHBV抗原を除去する工程;
(f)前記抗体/抗原複合体と結合し得る1つ以上の部分を提供する工程;および
(g)該1つ以上の部分の存在を検出し、それによって前記生物学的サンプル中のHBV表面抗原の存在を検出する工程、
をさらに包含する、方法。
(項目35)
前記1つ以上の部分は、検出可能に標識されたHBV抗体である、項目34に記載の方法。
(項目36)
前記検出可能に標識されたHBV抗体は、「a」決定基領域に変異を有するHBsAg変異体を認識するウサギモノクローナル抗体、またはその免疫反応性フラグメントである、項目35に記載の方法。
(項目37)
前記検出可能な標識は、酵素である、項目35に記載の方法。
(項目38)
前記生物学的サンプルは、ヒト血液サンプルに由来する、項目17に記載の方法。
(項目39)
生物学的サンプル中の抗HBsAg抗体の存在を検出する方法であって、該方法は、以下:
(a)項目26〜31のいずれか1項に記載の固体支持体を提供する工程;
(b)1つ以上のHBsAgがウサギモノクローナル抗体の少なくとも1つに結合して、抗体/抗原複合体を形成することのできる条件下で、該固体支持体と該1つ以上のHBsAgとを接触させる工程;
(d)抗HBsAg抗体が該生物学的サンプル中に存在する場合に、該抗HBsAg抗体が該抗体/抗原複合体に結合して、抗体/抗原/抗体複合体を形成することのできる条件下で、該抗体/抗原複合体を有する固体支持体と該生物学的サンプルとを接触させる工程;および
(e)該抗体/抗原/抗体複合体の存在を検出し、それによって該生物学的サンプル中の抗HBsAg抗体の存在を検出する工程、
を包含する、方法。
(項目40)
項目39に記載の方法であって、以下:
(f)結合していない抗体を除去する工程;
(g)前記抗体/抗原/抗体複合体と結合し得る1つ以上の部分を提供する工程;および
(h)該1つ以上の部分の存在を検出し、それによって前記生物学的サンプル中の抗HBsAg抗体の存在を検出する工程、
をさらに包含する、方法。
(項目41)
前記1つ以上の部分は、検出可能に標識された免疫グロブリン分子を含む、項目40に記載の方法。
(項目42)
HBVを実質的に含まない全血、血小板、血漿または血清を含む血液供給物を調製する方法であって、以下:
(a)項目38に記載の方法によって収集される血液サンプル由来の全血、血小板、血漿または血清のアリコートをスクリーニングする工程;
(b)HBV抗原が検出されるあらゆるサンプルを除去する工程;および
(c)HBV抗原が検出されないサンプルを合わせて、HBVを実質的に含まない血液供給物を提供する工程、
を包含する、方法。
(項目43)
HBVを実質的に含まない全血、血小板、血漿または血清を含む血液供給物を調製する方法であって、以下:
(a)項目39に記載の方法によって収集される血液サンプル由来の全血、血小板、血漿または血清のアリコートをスクリーニングする工程;
(b)抗HBsAg抗体が検出されるあらゆるサンプルを除去する工程;および
(c)抗HBsAg抗体が検出されないサンプルを合わせて、HBVを実質的に含まない血液供給物を提供する工程、
を包含する、方法。
(項目44)
移植の前に供与された組織または供与された器官をスクリーニングしてHBVを実質的に含まない組織または器官を提供する方法であって、以下:
(a)項目17に記載の方法によって該組織または該器官由来のサンプルをスクリーニングする工程;
(b)HBV抗原が検出される組織または器官を除去して、HBVを実質的に含まない組織または器官を提供する工程、
を包含する、方法。
(項目45)
移植の前に供与された組織または供与された器官をスクリーニングしてHBVを実質的に含まない組織または器官を提供する方法であって、以下:
(a)項目39に記載の方法によって該組織または該器官由来のサンプルをスクリーニングする工程;
(b)抗HBsAg抗体が検出される組織または器官を除去して、HBVを実質的に含まない組織または器官を提供する工程、
を包含する、方法。
(項目46)
抗HBVウサギモノクローナル抗体を調製する方法であって、該方法は、以下:
(a)「a」決定基領域に変異を有するHBsAg変異体によってウサギを免疫化する工程;
(b)該ウサギ由来のHBsAg変異体に対する抗体を産生する細胞と、不死化した細胞株由来の細胞とを融合して、ハイブリドーマを産生する工程;
(c)該ハイブリドーマを選択する工程;
(d)該選択したハイブリドーマを培養する工程;および
(e)該培養したハイブリドーマによって分泌される該抗体を収集する工程、
を包含する、方法。
(項目47)
前記免疫化する工程は、1つより多くのHBsAg変異体によってウサギを免疫化する工程を包含する、項目46に記載の方法。
(項目48)
前記抗体を産生する細胞は、ウサギ脾細胞である、項目46に記載の方法。
(項目49)
前記脾細胞は、不死化したウサギ細胞株由来の細胞と融合されて、ウサギ−ウサギハイブリドーマを産生する、項目48に記載の方法。
(項目50)
前記不死化したウサギ細胞株は、ウサギプラズマ細胞腫である、項目49に記載の方法。
(項目51)
前記脾細胞は、不死化したマウス細胞株の細胞と融合されて、ウサギ−マウスハイブリドーマを産生する、項目48に記載の方法。
(項目52)
前記HBsAg変異体は、変異体sAgである、項目46に記載の方法。
(項目53)
前記HBsAg変異体は、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tの前記「a」決定基領域の配列を含む、項目52に記載の方法。
(項目54)
前記HBsAg変異体は、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tを含む、項目53に記載の方法。
(項目55)
前記ウサギは、前記「a」決定基領域に異なる変異を有する少なくとも2つのHBsAg変異体によって免疫化される、項目46に記載の方法。
(項目56)
前記ウサギは、F134A、F134S、G145R、S143L、P142SまたはQ129R/M133Tからなる群より選択される少なくとも2つのHBsAg変異体によって免疫化される、項目53に記載の方法。
(項目57)
前記ウサギは、HBsAg変異体であるF134A、F134S、G145R、S143L、P142SおよびQ129R/M133Tによって免疫化される、項目53に記載の方法。
(項目58)
前記ウサギは、野生型HBsAgによってさらに免疫化される、項目46に記載の方法。
(項目59)
項目46に記載の方法によって産生される抗HBVウサギモノクローナル抗体。
(項目60)
ウサギ−ウサギハイブリドーマを調製する方法であって、以下:
(a)「a」決定基領域に変異を有するHBsAg変異体によってウサギを免疫化する工程;
(b)該ウサギ由来のHBsAg変異体に対する抗体を産生する脾細胞と、ウサギプラズマ細胞腫由来の細胞とを融合する工程;
(c)該抗体を分泌する細胞を選択する工程、
を包含する、方法。
(項目61)
項目1に記載のウサギモノクローナル抗体またはその免疫反応性フラグメントをコードする、ポリヌクレオチド。
(項目62)
前記ポリヌクレオチドによってコードされる免疫反応性フラグメントは、Fabフラグメント、F(ab’)2フラグメント、FvフラグメントまたはsFvフラグメントである、項目61に記載のポリヌクレオチド。
(項目63)
生物学的サンプル中のHBV表面抗原を検出する方法における、項目1〜10、項目13、項目14、項目16または項目59のいずれか1項に記載のウサギモノクローナル抗体の使用。
(項目64)
生物学的サンプル中のHBV表面抗原および/またはHBsAg抗体の存在を検出する方法における、項目26〜31のいずれか1項に記載の固体支持体の使用。
(項目65)
HBVを実質的に含まない全血、血小板、血漿または血清を含む血液供給物を調製する方法における、項目1〜10、項目13、項目14、項目16または項目59のいずれか1項に記載のウサギモノクローナル抗体の使用。
(項目66)
移植の前に供与された組織または供与された器官をスクリーニングしてHBVを実質的に含まない組織または器官を提供する方法における、項目1〜10、項目13、項目14、項目16または項目59のいずれか1項に記載のウサギモノクローナル抗体の使用。
【図面の簡単な説明】
【0034】
【図1】図1は、タンパク質の高次構造を示すHBV表面抗原の概略図(下のパネル、実線)および「a」決定基(アミノ酸121〜147、上のパネル、円の中)の周りのアミノ酸配列(配列番号1)を示す。矢印は、種々の公知のHBsAg改変体の位置および置換を示す。
【図2】図2Aおよび2B(配列番号2および3)は、それぞれ、sAg野生型adw抗原およびsAg野生型ayw抗原についてのアミノ酸配列を示す。
【図3A】図3A〜3Dは、上に記載されるパネルのHBV変異体に対するマウス抗体mMAb1(図3C)およびmMAb2(図3A)と比較して、99S6(図3B)および99S9(図3D)由来のウサギモノクローナル抗体の免疫反応性を示す。
【図3B】図3A〜3Dは、上に記載されるパネルのHBV変異体に対するマウス抗体mMAb1(図3C)およびmMAb2(図3A)と比較して、99S6(図3B)および99S9(図3D)由来のウサギモノクローナル抗体の免疫反応性を示す。
【図3C】図3A〜3Dは、上に記載されるパネルのHBV変異体に対するマウス抗体mMAb1(図3C)およびmMAb2(図3A)と比較して、99S6(図3B)および99S9(図3D)由来のウサギモノクローナル抗体の免疫反応性を示す。
【図3D】図3A〜3Dは、上に記載されるパネルのHBV変異体に対するマウス抗体mMAb1(図3C)およびmMAb2(図3A)と比較して、99S6(図3B)および99S9(図3D)由来のウサギモノクローナル抗体の免疫反応性を示す。
【発明を実施するための形態】
【0035】
(発明の詳細な説明)
本発明の実施は、特に明記されない限り、当業者の技術の範囲内の従来のウイルス学的方法、化学的方法、生物化学的方法、組換えDNA技術による方法および免疫学的方法を使用する。このような技術は、文献中に完全に説明されている。例えば、Fundamental Virology、第3版、第I巻および第II巻(B.N.FieldsおよびD.M.Knipe編);Handbook of Experimental Immunology、第I巻〜第IV巻(D.M.WeirおよびCC.Blackwell編、Blackwell Scientific Publications);T.E.Creighton、Proteins:Structures and Molecular Properties(W.H.Freeman and Company、1993);A.L.Lehninger、Biochemistry(Worth
Publishers,Inc.、current addition);Sambrookら、Molecular Cloning:A Laboratory Manual(第2版、1989);Methods In Enzymology(S.ColowickおよびN.Kaplan編、Academic Press,Inc.)を参照のこと。
【0036】
以下のアミノ酸の略語は、本明細書を通して使用される:
アラニン:Ala(A) アルギニン:Arg(R)
アスパラギン:Asn(N) アスパラギン酸:Asp(D)
システイン:Cys(C) グルタミン:Gln(Q)
グルタミン酸:Glu(E) グリシン:Gly(G)
ヒスチジン:His(H) イソロイシン:Ile(I)
ロイシン:Leu(L) リジン:Lys(K)
メチオニン:Met(M) フェニルアラニン:Phe(F)
プロリン:Pro(P) セリン:Ser(S)
トレオニン:Thr(T) トリプトファン:Trp(W)
チロシン:Tyr(Y) バリン:Val(V)。
【0037】
(1.定義)
本発明の記載において、以下の用語が使用され、そして以下で示すように定義されることを意図する。
【0038】
本明細書および添付の特許請求の範囲で使用される、単数形「a」、「an」、および「the」には、文脈中で明らかに別のものを示さない限り、複数形が含まれることを留意しなければならない。したがって、例えば、「ウサギモノクローナル抗体(a rabbit monoclonal antibody)」への言及は、2つ以上のこのようなポリペプチドの混合物などを含む。
【0039】
用語「ポリペプチド」および「タンパク質」とは、アミノ酸残基のポリマーをいい、産物の長さの下限に制限されない。したがって、ペプチド、オリゴペプチド、ダイマー、および多量体などは、この定義の範囲内に含まれる。全長タンパク質およびそのフラグメントの両方は、この定義に含まれる。この用語はまた、ポリペプチドの発現後修飾(例えば、グリコシル化、アセチル化、およびリン酸化など)を含む。さらに、本発明の目的のために、「ポリペプチド」とは、タンパク質が所望の活性を保持する限り、ネイティブな配列の改変(例えば、欠失、付加、および置換(一般に、天然において保存的である))を含むタンパク質をいう。これらの改変は部位特異的変異誘発による意図的なものであっても、タンパク質を産生する宿主への変異またはPCR増幅に起因するエラーなどによる偶発的なものであってもよい。
【0040】
用語「抗原」とは、抗体を認識する1つ以上のエピトープを含むポリペプチド(ネイティブであるか、組換えであるかまたは合成であるかにかかわらず)をいう。当該抗原は、参照分子の全長アミノ酸配列を含む必要はないが、目的の免疫学的応答をもたらすため(すなわち、この抗原が、抗体を産生するために使用される場合)か、または目的のHBV抗体と反応させるため(すなわち、この抗原が、アッセイにおいて検出される)に必要な分子の限られた量を含み得る。したがって、参照分子のただ1つまたはいくつかのエピトープが存在する必要がある。さらに、この抗原は、全長参照分子またはその参照分子のフラグメントと別のタンパク質(例えば、別のHBV抗原および/またはHBV抗原の反応性を乱さないタンパク質)との間の融合タンパク質を含み得る。したがって、この抗原は、参照分子の全長配列、フラグメント、短縮された配列および部分的な配列、ならびにアナログ、ムテインおよび前駆体形態を含み得ることが、容易に明らかである。この用語はまた、この抗原が抗体の産生を刺激しそして/またはHBV抗体と反応する能力を保持する限り、参照配列に対する欠失、付加、および置換を意図する。
【0041】
このことに関して、天然のバリエーションは、特定のHBV株内の単離物から生じる。したがって、この用語は、このようなバリエーション、および特に、そのアミノ酸組成において参照抗原と異なる(約20%以下、より好ましくは約10%〜15%以下、および最も好ましくは約5%以下)抗原を包含することを意図する。したがって、実質的に参照分子と同じアミノ酸配列を有するが、実質的にこの抗原の抗体結合能に影響しない少数のアミノ酸置換を保有するタンパク質は、参照ポリペプチドの定義の範囲内である。
【0042】
HBV株またはHBV単離物「に由来する」抗原は、参照HBVゲノムによってコードされる抗原の1つ以上の領域または領域の部分の配列を含む抗原を意図する。代表的に、この抗原は、下で定義されるように、エピトープを含む領域、または領域の部分から構成され、そして一般的に、参照ポリペプチドと実質的に相同であるアミノ酸配列を有する。したがって、用語「に由来する」は、分子の元の供給源を同定するために使用されるが、例えば、この分子が作製される方法(例えば、この方法は化学合成または組換え手段であり得る)を限定することは意味しない。
【0043】
用語「アナログ」および「ムテイン」とは、所望の活性(例えば、本明細書中に記載されるアッセイにおける免疫反応性)を保持する参照分子の生物学的に活性な誘導体をいう。一般的に、用語「アナログ」とは、改変が免疫原性活性を破壊せず、そして下で定義されるように、参照分子と「実質的に相同」である限り、ネイティブの分子に関して、1つ以上のアミノ酸付加、置換(一般的に、天然において保存的である)、および/または欠失を有するネイティブのポリペプチド配列および構造を有する化合物をいう。多くの保存領域および可変領域は、種々の単離物の間で公知であり、そして一般的に、これらの領域に由来するエピトープのアミノ酸配列は高い程度の配列相同性(例えば、2つの配列を並べる場合、50%より大きく、一般的に60%超〜70%のアミノ酸配列相同性)を有する。用語「ムテイン」とは、1種以上のペプチド模倣物(「ペプトイド」)を有するペプチドをいう。好ましくは、アナログまたはムテインは、少なくともネイティブな分子と同一の免疫反応性を有する。ポリペプチドアナログおよびムテインを作製するための方法は、当該分野で公知であり、そして下でさらに記載される。
【0044】
用語「アナログ」および「ムテイン」はまた、参照分子へなされる意図的な変異を包含する。特に好ましいアナログは、天然において保存的な置換(すなわち、その側鎖に関連するアミノ酸のファミリー内で起こる置換)を含む。具体的には、アミノ酸は、一般的に、以下の4つのファミリーに分類される:(1)酸性−−アスパラギン酸およびグルタミン酸;(2)塩基性−−リジン、アルギニン、ヒスチジン;(3)非極性−−アラニン、バリン、ロイシン、イソロイシン、プロリン、フェニルアラニン、メチオニン、トリプトファン;および(4)非荷電極性−−グリシン、アスパラギン、グルタミン、システイン、セリン、トレオニン、チロシン。フェニルアラニン、トリプトファン、およびチロシンは、ときとして、芳香族アミノ酸として分類される。例えば、ロイシンのイソロイシンまたはバリンへの単独置換、アスパラギン酸のグルタミン酸への単独置換、トレオニンのセリンへの単独置換、または同様の、構造的に関連するアミノ酸へのアミノ酸の保存的置換は、生物活性に大きな影響を与えないことが容易に予想される。例えば、目的の抗原は、この分子の所望の機能がインタクトなままである限り、約5〜10個までの保存的アミノ酸置換もしくは非保存的アミノ酸置換、またはさらに約15〜25個まで、約15〜50個まで、もしくは約15〜75個までの保存的アミノ酸置換もしくは非保存的アミノ酸置換、または5〜75の間の任意の整数の保存的アミノ酸置換もしくは非保存的アミノ酸置換を含み得る。当業者は、当該分野で周知のHopp/WoodsおよびKyte−Doolittleプロットを参照することにより、変化を許容し得る、目的の分子の領域を容易に決定し得る。
【0045】
「抗原フラグメント」は、インタクトな全長抗原ポリペプチド配列および全長抗原ポリペプチド構造の一部のみから構成される抗原を意図する。このフラグメントは、ネイティブなポリペプチドのC末端欠失、N末端欠失、および/または内部欠失を含み得る。「免疫原性フラグメント」は、1つ以上のエピトープを含み、したがって本明細書中に記載される免疫学的応答の1つ以上を誘発するポリペプチドのフラグメントを意味する。特定のHBVタンパク質の「免疫原性フラグメント」は、一般的に、全長分子の少なくとも約5〜10個連続するアミノ酸残基、好ましくは全長分子の少なくとも約15〜25個連続するアミノ酸残基、および最も好ましくは全長分子の少なくとも約20〜50個以上連続するアミノ酸残基を含み、このアミノ酸残基は、当該フラグメントが本明細書中に定義されるような免疫学的応答を誘発する能力を保持する限り、エピトープ(または5アミノ酸と全長配列との間の任意の整数)を規定する。
【0046】
「HBsAg」は、種々のHBV株およびHBV単離物のいずれかに由来するHBV表面抗原を意味する。この用語は、HBsAgポリペプチドの実質的に完全なSドメイン(本明細書中で「sAg」と称される)を含む表面抗原、およびその免疫原性フラグメントを意図する。HBsAgのSドメインは、それが、N末端領域もしくはC末端領域のいずれか、またはそのポリペプチド内からの、1個または数個のアミノ酸の少量の欠失を伴うか、またはそれを伴わないポリペプチドのネイティブな配列を有する場合、「実質的に完全」である。例えば、HBsAg Sドメインは、その免疫原性に大きく影響せずに、数個のアミノ酸(すなわち、約3個まで、5個まで、7個まで、または10個までのアミノ酸)を短縮され得る。本明細書中で使用するためのHBsAg抗原は、一般的に、sAgに対して番号付けられたアミノ酸124位〜147位において見出される「a」決定基に対応する領域を含む。この領域は、下でさらに記載される。この用語はまた、Sドメインに加えて、プレS2(以前はプレSと称された)ドメインを含むか、またはSドメインに加えて、HBsAgのプレS2ドメインおよびプレS1ドメインの両方を含む抗原を意図する。Valenzuelaら、(1982)、Nature 298:347−350は、代表的なHBsAgについての遺伝子を記載する。Valenzuelaら、(1979)、Nature 280:815−819をまた参照のこと。
【0047】
本明細書中で使用される場合、「変異体」HBsAg分子とは、上で定義されるような、野生型HBsAgのアナログをいう。本発明の目的のために、「野生型HBsAg」は、aywサブタイプおよびadwサブタイプ由来のHBsAgを意味する。これらのアナログは、(例えば、回避変異体(escape mutant)の場合において)天然の変異事象によって生じ得るか、または意図的に作製され得る。代表的な変異体HBsAg配列は、本明細書中で図1に示される。さらなる天然に存在する変異体は、当該分野において公知であり、そしてこれらの変異体由来の表面抗原についてのヌクレオチド配列および対応するアミノ酸配列は、GenBankによって寄託されてきた。例えば、NCBI登録番号AY341335(sAgの「a」決定基に複数の変異を有する、天然に存在する表面変異体)、X59795(aywサブタイプ由来の天然に存在する変異体);AF01360およびAF013629(adwサブタイプ由来の天然に存在する変異体)ならびにZuckermanら、1999(J.Med Virol.58:193)を参照のこと。
【0048】
HBsAgの「免疫原性」配列は、HBsAg分子が、適切な宿主において抗体の産生を刺激し得るように、少なくとも1つのエピトープを有するアミノ酸配列を含むHBsAg分子を意味する。「エピトープ」は、当該HBVエピトープに抗体産生を刺激させ得る、特定のB細胞および/またはT細胞が応答する抗原上の部位を意味する。この用語はまた、「抗原決定基」または「抗原決定部位」と交換可能に使用される。エピトープは、そのエピトープに固有の空間的コンホメーションで3個以上のアミノ酸を含み得る。一般的に、エピトープは、少なくとも5個のこのようなアミノ酸から構成され、そしてより通常には、少なくとも8〜10個以上のこのようなアミノ酸から構成される。
【0049】
エピトープを含む所与のポリペプチド領域は、当該分野で周知の多くのエピトープマッピング技術を使用して同定することができる。例えば、Epitope Mapping
Protocols in Methods in Molecular Biology、第66巻(Glenn E.Morris,編、1996)、Humana Press、Totowa、New Jerseyを参照のこと。例えば、線状エピトープは、例えば、固体支持体上で多数のペプチド(このタンパク質分子の一部に対応するペプチド)を同時に合成し、そしてこれらのペプチドが依然として支持体に結合している間に、これらのペプチドと抗体とを反応させることによって決定され得る。このような技術は当該分野で公知であり、そして例えば、米国特許第4,708,871号;Geysenら、(1984)、Proc.Natl.Acad.Sci.USA 81:3998−4002;Geysenら、(1985)、Proc.Natl.Acad.Sci.USA 82:178−182;Geysenら、(1986)、Molec.Immunol.23:709−715に記載される。同様に、高次構造的なエピトープは、例えば、X線結晶学および二次元核磁気共鳴などによるアミノ酸の空間的コンホメーションの決定によって容易に同定される。例えば、Epitope Mapping Protocols、前出を参照のこと。タンパク質の抗原性領域はまた、標準的な抗原性プロットおよびハイドロパシープロット(例えば、Oxford Molecular Groupから利用可能なOmigaバージョン1.0ソフトウェアプログラムを使用して計算したものなど)を使用して同定され得る。このコンピュータプログラムは、抗原性プロフィールを決定するためのHopp/Woods法(Hoppら、Proc.Natl.Acad.Sci USA(1981)、78:3824−3828)およびハイドロパシープロットのためのKyte−Doolittle技術(Kyteら、J.Mol.Biol.(1982)、157:105−132)を使用する。
【0050】
「免疫原性組成物」は、少なくとも1つの免疫原性ポリペプチド(例えば、HBsAg抗原またはHBsAg抗体)を含有する組成物である。
【0051】
「実質的に精製された」とは、一般的に、物質(化合物、ポリヌクレオチド、タンパク質、ポリペプチド、ポリペプチド組成物)の単離をいい、単離の結果、この物質が、その物質の存在するサンプルの大部分の%を構成する。代表的に、サンプルにおいて、実質的に精製された成分は、そのサンプルの50%、好ましくは80%〜85%、より好ましくは90%〜95%を構成する。目的のポリヌクレオチドおよびポリペプチドを精製するための技術は、当該分野において周知であり、そしてこれらとしては、例えば、イオン交換クロマトグラフィー、アフィニティークロマトグラフィーおよび密度による沈降が挙げられる。
【0052】
「単離された」とは、ポリペプチドを指す場合、示した分子が完全な生物から別れて分離しており、この分子が、同じ型の他の生物学的高分子が実質的に存在しない状況において、天然に見出されるかまたは存在することを意味する。ポリヌクレオチドに関する用語「単離された」とは、通常は天然において結合している配列の全部または一部を欠く核酸分子、天然において存在するが、異種配列が結合した配列、あるいは染色体から解離した分子である。
【0053】
「等価な抗原決定基」は、HBVの異なる単離物または株に由来する抗原決定基を意味し、抗原決定基は、配列の変化に起因して必ずしも同一でなくて良いが、目的のHBV配列中の等価な位置に生じる。一般に、等価な抗原決定基のアミノ酸配列は、2つの配列を並べる場合、高い程度の配列相同性(例えば、30%より高く、通常は40%より高く(例えば、60%より高い)、そしてさらに80〜90%より高いアミノ酸配列相同性)を有する。
【0054】
「相同性」とは、2つのポリヌクレオチド部分または2つのポリペプチド部分の間の%同一性をいう。2つの核酸配列または2つのポリペプチド配列は、定義した長さの分子にわたって、これらの配列が少なくとも約50%、好ましくは少なくとも約75%、より好ましくは少なくとも約80〜85%、好ましくは少なくとも約90%、および最も好ましくは少なくとも約95%〜98%またはそれ以上の配列同一性を示す場合、互いに「実質的に相同」である。本明細書中で使用される場合、実質的に相同とはまた、特定の配列に対する完全な同一性を示す配列をいう。
【0055】
一般的に、「同一性」とは、それぞれ、2つのポリヌクレオチド配列または2つのポリペプチド配列の正確なヌクレオチド−ヌクレオチドまたはアミノ酸−アミノ酸の一致をいう。%同一性は、2つの分子(参照配列および参照配列に対する未知の%同一性を有する配列)間の配列情報の直接比較によって決定され得、このことは、配列を並べ、この2つの並べた配列間の正確な一致を数え、参照配列の長さで割り、そしてこの結果に100を掛けることによる。容易に利用可能なコンピュータープログラム(例えば、ペプチド分析用のSmith and Watermanの局所的相同性アルゴリズム(Advances in Appl.Math.2:482−489,1981)に適合するALIGN(Dayhoff,M.O.in Atlas of Protein Sequence and Structure M.O.Dayhoff編、第5補遺.3:353−358,National biomedical Research Foundation、Washington、DC))が、分析を補助するために使用され得る。ヌクレオチド配列の同一性を決定するためのプログラムは、Wisconsin Sequence Analysis Package,Version 8(Genetics
Computer Group,Madison,WIから利用可能)で利用可能である(例えば、Smith and Watermanアルゴリズムにも依存するBESTFIT、FASTA、およびGAPプログラム)。これらのプログラムは、製造者によって推奨され、かつ上記で言及したWisconsin Sequence Analysis Packageに記載される初期設定のパラメータを使用して容易に利用される。例えば、参照配列に対する特定のヌクレオチド配列の%同一性は、初期設定のスコアリング表および6つのヌクレオチドの位置でのギャップペナルティを使用したSmith and Watermanの相同性アルゴリズムを使用して決定され得る。
【0056】
本発明の文脈中における%同一性を確立する別の方法は、エディンバラ大学が著作権を有し、John F.CollinsおよびShane S.Sturrokによって開発され、そしてIntelliGenetics,Inc.(Mountain View,CA)から販売されているプログラムのMPSRCHパッケージを使用することである。このパッケージ一式から、スコアリング表のために初期設定のパラメータを使用するSmith−Watermanアルゴリズムが、使用され得る(例えば、12のギャップオープンペナルティ、1のギャップ伸長ペナルティ、および6のギャップ)。作成されたデータから、「一致」値は、「配列同一性」を反映する。配列間の%同一性または%類似性を計算するための他の適切なプログラムは、一般的に、当該分野で公知であり、例えば、別のアラインメントプログラムは、初期設定のパラメータを使用したBLASTである。例えば、BLASTNおよびBLASTPは、以下の初期設定のパラメータを使用して使用され得る:遺伝コード=標準;フィルタ=なし;鎖=両方;カットオフ=60;期待値=10;行列=BLOSUM62;記載=50配列;分類=ハイスコア;データベース=非重複、GenBank+EMBL+DDBJ+PDB+GenBank CDS翻訳物+Swiss protein+Spupdate+PIR。これらのプログラムの詳細は、容易に見出され得る。
【0057】
あるいは、相同性は、相同領域間で安定な二重鎖を形成する条件下でのポリヌクレオチドのハイブリダイゼーション、その後の一本鎖特異的ヌクレアーゼでの消化、および消化フラグメントのサイズ決定によって決定され得る。実質的に相同なDNA配列は、例えば、特定の系について規定したストリンジェントな条件下でのサザンハイブリダイゼーション実験で同定され得る。適切なハイブリダイゼーション条件を規定することは、当業者の範囲内である。例えば、Sambrookら、前出;DNA Cloning、前出;Nucleic Acid Hybridization、前出を参照のこと。
【0058】
本明細書中で核酸分子を記載するために使用される場合、「組換え体」は、ゲノム、cDNA、ウイルス、半合成または合成由来(これはこの起源または操作によって、天然で関連するポリヌクレオチドの全てまたは一部と関連しない)のポリヌクレオチドを意味する。タンパク質またはポリペプチドに関して使用される場合、用語「組換え体」とは、組換えポリヌクレオチドの発現によって産生されるポリペプチドを意味する。一般的に、目的の遺伝子は、クローニングされ、次いで、以下にさらに記載されるように、形質転換された生物において発現される。宿主生物は、発現条件下でタンパク質を産生する外来遺伝子を発現する。
【0059】
「抗体」は、抗原に存在する目的のエピトープを「認識する」(すなわち、特異的に結合する)分子を意図する。「特異的結合」は、抗体と、例えば、抗体が反応する検査物質を含む混合物中の成分との間に生じ得る非特異的な結合とは対照的に、抗体が、抗原と抗体との間の複合体を形成する「ロックアンドキー(lock and key)」型の相互作用でエピトープと相互作用することを意味する。したがって、抗HBV抗体は、HBVタンパク質のエピトープに特異的に結合する分子である。本明細書中で使用される場合、用語「抗体」は、ポリクローナル調製物およびモノクローナル調製物の両方から得られる抗体、ならびに以下を包含する:ハイブリッド(キメラ)抗体分子(例えば、Winterら、Nature、(1991)、349:293−299;および米国特許第4,816,567号);F(ab’)2およびF(ab)フラグメント;Fv分子(非共有結合性ヘテロダイマー)(例えば、Inbarら、Proc Natl Acad Sci USA、(1972)、69:2659−2662;およびEhrlichら、Biochem、(1980)、19:4091−4096を参照のこと);単鎖Fv分子(sFv)(例えば、Hustonら、Proc Natl Acad Sci USA、(1988)、85:5879−5883を参照のこと);二量体および三量体の抗体フラグメント構築物;ミニボディー(minibody)(例えば、Packら、Biochem、(1992)、31:1579−1584;Cumberら、J Immunology、(1992)、149B:120−126を参照のこと);ヒト化抗体分子(例えば、Riechmannら、Nature、(1988)、332:323−327;Verhoeyanら、Science、(1988)、239:1534−1536;および英国特許公開番号第GB 2,276,169号(1994年9月21日公開);ならびに、このような分子から得られる任意の機能的フラグメント(このようなフラグメントは、親抗体分子の免疫学的結合特性を保持する)。
【0060】
本明細書中で使用される場合、用語「モノクローナル抗体」とは、同種抗体の集団を有する抗体組成物をいう。この用語は、抗体の種または供給源に関して限定されず、抗体が作製される様式によっても限定されることを意図しない。この用語は、完全な免疫グロブリンおよびフラグメント(例えば、Fabフラグメント、F(ab’)2フラグメント、Fvフラグメント、および他のフラグメント)、ならびに親モノクローナル抗体分子の免疫学的結合特性を示すキメラ同種抗体およびヒト化同種抗体の集団を包含する。
【0061】
本明細書中で使用される場合、用語「ウサギモノクローナル抗体」とは、目的の抗原(例えば、変異体HBsAg)を用いてウサギを免疫化することによって産生される、上で定義されるようなモノクローナル抗体をいう。「ウサギモノクローナル抗体」は、下でより十分に説明されるように、ウサギ−ウサギハイブリドーマ(すなわち、免疫化したウサギ由来の抗体産生細胞とウサギ由来の不死化細胞との間の融合体)、ウサギ−マウスハイブリドーマ(すなわち、免疫化したウサギ由来の抗体産生細胞とマウス由来の不死化細胞との間の融合体の間の融合体)などを使用して産生され得る。
【0062】
「マウスモノクローナル抗体」とは、目的の抗原(例えば、変異体HBsAg)を用いてマウスを免疫化することによって産生される、上で定義されるようなモノクローナル抗体をいう。「マウスモノクローナル抗体」は、下でより十分に説明されるように、マウス−マウスハイブリドーマから、当該分野で周知である従来の方法を使用して産生される。
【0063】
本明細書中で使用される場合、「固体支持体」とは、高分子(例えば、抗体、タンパク質、ポリペプチド、ペプチド、ポリヌクレオチド)が結合し得る、固体表面(例えば、磁性ビーズ、ラテックスビーズ、マイクロタイタープレートウェル、ガラスプレート、ナイロン、アガロース、ポリアクリルアミド、シリカ粒子、ニトロセルロース膜など)をいう。
【0064】
「免疫学的に反応性」とは、当該抗体が、HBVに感染した個体由来の生物学的サンプル中に存在するHBV抗原と特異的に反応することを意味する。
【0065】
抗体の「免疫反応性フラグメント」は、インタクトな抗体の配列および構造の一部のみから構成され、そして上で定義されるように、免疫学的に反応性である分子である。このような免疫反応性フラグメントの非限定的な例としては、F(ab’)2分子、Fv分子、およびsFv分子が挙げられ、これらの分子は、それが得られる親抗体分子の免疫学的結合特性を示し得る。
【0066】
「免疫複合体」は、抗体が抗原上のエピトープに結合する場合に形成される組み合わせを意図する。
【0067】
本明細書中で使用される場合、「生物学的サンプル」とは、被験体から単離される組織または流体のサンプル(例えば、血液、血漿、血小板、血清、糞便、尿、骨髄、胆汁、髄液、リンパ液、脳脊髄液、皮膚のサンプル、皮膚、気道、腸管および尿生殖路の分泌物、涙液、唾液、乳汁、血球、器官、生検であるが、これらに限定されない)をいい、そしてまた、インビトロ細胞培養の構成物のサンプルをいい、このサンプルとしては、培養培地における細胞および組織の増殖から生じる培養上清(例えば、組換え細胞、および細胞成分)が挙げられるが、これらに限定されない。上で詳述されるサンプルは、必ずしもその供給源から直接得られる形態である必要はない。例えば、このサンプルは、例えば、分析前の加熱、遠心分離などによるように、使用する前に処理され得る。
【0068】
本明細書中で使用される場合、用語「標識」および「検出可能な標識」とは、検出の可能な分子をいい、この分子としては、放射性同位元素、蛍光物質(fluorescer)、半導体ナノ結晶、化学発光物質(chemiluminescer)、発色団、酵素、酵素基質、酵素補因子、酵素インヒビター、色素、金属イオン、金属ゾル、リガンド(例えば、ビオチン、ストレプトアビジンまたはハプテン)などが挙げられるが、これらに限定されない。用語「蛍光物質」とは、検出可能な範囲の蛍光を示し得る物質またはその部分をいう。本発明のもとで使用され得る標識の特定の例としては、西洋西洋ワサビペルオキシダーゼ(HRP)、フルオレセイン、FITC、ローダミン、ダンシル、ウンベリフェロン、ジメチルアクリジニウムエステル(DMAE)、テキサスレッド、ルミノール、NADPHおよびα−β−ガラクトシダーゼが挙げられるが、これらに限定されない。
【0069】
(II.発明を実施するための形態)
本発明を詳細に記載する前に、本発明は特定の処方物またはプロセスパラメータに限定されず、したがって当然に本発明は変化し得ることが、理解されるべきである。本明細書中で使用される専門用語は、本発明の特定の実施形態を記載することのみを目的とし、制限することを意図しないこともまた、理解されるべきである。
【0070】
本明細書中に記載のものに類似するか、またはそれらと等価な多数の方法および材料が、本発明の実施に使用され得るが、好ましい材料および方法は、本明細書中に記載される。
【0071】
本発明は、変異体HBsAgを指向する新規のウサギモノクローナル抗体が、従来のマウスモノクローナル抗体より、HBV感染を検出するためのアッセイにおいてはるかに高く免疫反応性であるという知見に基づく。本発明のウサギモノクローナル抗体は、従来のマウスモノクローナル抗体よりも広範囲のHBsAg変異体と反応性である。さらに、本発明のウサギモノクローナル抗体はまた、代表的に、野生型HBsAgと反応性である。実際に、本発明に従う単一のウサギモノクローナル抗体は、HBV感染を示し得るHBV抗原の存在を検出するために、複数のマウスモノクローナル抗体を使用することと同程度に有効である。したがって、本発明のウサギモノクローナル抗体は、例えば、マウスモノクローナル抗体を使用するアッセイによって得られる偽陰性の数を減少させ、したがってHBV感染を正確に検出するための診断方法において有用である。本発明のアッセイはまた、さらなる抗体(例えば、さらなるマウスモノクローナル抗体)を利用して、広範な種々の単離物および回避変異体からのHBV感染を診断する能力を提供する。
【0072】
上記方法は、特に、HBV抗原またはHBV抗体の存在を検出することによって、ヒトにおいてHBV感染を検出すること、ならびに血液サンプル(全血、血清、血小板、および血漿を含むが、これらに限定されない)、移植のための組織および器官においてHBV感染を検出するのに有用である。したがって、この方法は、被験体(例えば、ヒト被験体)においてHBV感染を診断するため、および供与された血液サンプルにおけるHBV汚染を検出するために使用され得る。個々の供与されたサンプルまたはプールされたサンプルのアリコートは、HBVの存在についてスクリーニングされ得、そしてHBVによって汚染されたそれらのサンプルまたはプールされたサンプルは、それらが混合される前に排除され得る。このようにして、HBV汚染を実質的に含まない血液供給が、提供され得る。同様に、移植において使用される組織および器官から得たサンプルはまた、汚染された標本を排除するためにスクリーニングされ得る。
【0073】
本発明のさらなる理解のために、本発明で使用するためのHBV抗原、抗体および診断方法に関して、より詳細な考察が、下に提供される。
【0074】
(HBV表面抗原)
B型肝炎表面抗原は、カルボキシ末端配列を共有する3種のサイズ分類のタンパク質から構成される。これらのタンパク質としては、大(L、プレS2ドメイン)、中(M、プレS1ドメイン)、および小(S、sAgドメイン)が挙げられる。全ての3種のタンパク質は、42nmの球体として感染した患者の血清から回収される感染性のビリオン(多くの場合、Dane粒子といわれる)中に見出される。血清サンプルはまた、主にSクラスのタンパク質(sAg)を含む、平均して22nmの空の球状粒子を含む。sAgタンパク質をコードするDNAのみによってトランスフェクトされた哺乳動物細胞株は、感染した細胞由来の球体と同様の20nmの空の球体を放出する。さらに、同じ遺伝子によってトランスフェクトされた酵母細胞は、感染した細胞由来の22nmの球体と同様に免疫原性であることが見出される、類似の球体を形成する。例えば、HBV構造の考察については「HBV Vaccines−from the laboratory to license:a case study」、Mackett,M.およびWilliamson,J.D.、Human Vaccines and Vaccination、pp.159−176;そして種々のHBV粒子の組換え生産の説明については米国特許第4,722,840号、同第5,098,704号、同第5,324,513号、同第5,965,140号、Beamesら、J.Virol.、(1995)、69:6833−6838、Birnbaumら、J.Virol.、(1990)、64:3319−3330、Zhouら、J.Virol.、(1991)、65:5457−5464を参照のこと。
【0075】
したがって、上で説明される通り、本発明のウサギモノクローナル抗体を産生するのに使用するためのHBsAgとしては、sAg、プレS1および/またはプレS2の免疫原性領域、ならびに上記の任意の組み合わせ(例えば、sAg/プレS1、sAg/プレS2、およびsAg/プレS1/プレS2)由来の免疫原性領域が挙げられ得る。必要に応じて、HBsAgポリペプチドは、1つより多いsAgポリペプチド、プレS1ポリペプチド、またはプレS2ポリペプチドを含み得る。さらに、sAgポリペプチド、プレS1ポリペプチド、およびプレS2ポリペプチドは、HBVの同一の単離物または異なる単離物に由来し得る。これらのポリペプチドはまた、融合タンパク質または別々のポリペプチドとして提供され得る。何百もの異なるHBV単離物からのHBsAgの配列は、公知であり、そしてNCBIデータベースから容易に入手され得る。
【0076】
本発明において使用するための好ましいHBsAgは、少なくともHBVの「a」決定基領域のアミノ酸の配列(sAgに対して番号付けされたアミノ酸124〜147)を含む。この領域についての代表的な野生型配列は、CTTPAQGNSMFPSCCCTKPSDGNC(配列番号4、adw野生型);およびCMTTAQGTSMYPSCCCTKPSDGNC(配列番号5、ayw野生型)である。sAgのこの領域における変異は、多数のHBVワクチン回避体において認められてきた。多くのHBsAg改変体の説明については、Ashton−Richardt PG、Murray K.、(1989)、Mutants of the hepatitis B virus surface antigen and define some antigenically essential residues in the immunodominant「a」region.J.Medical Virology 29:196−203;Norder H.Courouce A M、Magnius L、(1992)、Molecular basis of hepatitis B virus serotype variation within the four major subtype.、J.General Virology 73: 3141−3145;Carman WF,Zanetti ARら、(1990)、Vaccine−induced escape mutant of hepatitis B virus.、Lancet 336:325−329;Fujii H.Moriyama K.ら、GIy 145 to Arg substitution in HBs antigen of immune escape mutant of hepatitis B virus.Biochem.、Biophys Res Comm 184:1152−1157;Carman,W.、Vaccine−associated mutants of hepatitis B virus.、Viral Hepatitis and Liver Disease、(1945)、pp: 243−247、(編:K.Nishioka、H.Suzuki、S.Mishiro、T.Oda)を参照のこと。
【0077】
したがって、この領域に変異を含むHBsAgは、本明細書中で特に有用である。この領域についての代表的な変異体としては、F134A、F134S、G145R、S143L、P142SおよびQ129R/M133Tが挙げられる。この変異体の表示の各々において、番号は、置換されたアミノ酸の位置を示し、番号の前の文字は、WT配列中のその位置におけるアミノ酸を示し、そして番号の後の文字は、変異体のその位置におけるアミノ酸を示す。これらの変異体は、単なる代表であり、そして本発明による用途を見出される、多数のさらなる変異体が天然に存在することが理解されるべきである。さらに、「a」決定基領域に変異を有する合成の変異体もまた、本明細書中で用途を見出される。上に定義されるような「a」決定基領域以外の領域に変異を有する改変体はまた、本発明における用途を見出される。例えば、アミノ酸120位にてPのQへの置換を有する改変体(P120Q)は、モノクローナル抗体を産生するための抗原としての用途を見出される。
【0078】
本発明によって使用するための抗原は、標準的な技術を使用して得られ得る。このHBV抗原は、当該分野において周知である組換え方法を使用して都合よく産生される。例えば、HBV抗原の組換え生産の説明については、米国特許第4,722,840号、同第5,098,704号、同第5,324,513号、同第5,965,140号および同第6,306,625号を参照のこと。例えば、HBsAg Sタンパク質コード配列は、米国特許第4,710,463号に記載されるような当該分野において公知の方法を使用して、感染したヒトの血清中に存在するDane粒子からのDNAのフェノール抽出によって単離され得る。次いでこの単離されたDNAは、制限エンドヌクレアーゼによって消化され得る。エンドヌクレアーゼの選択は、部分的に、特定のDane粒子に依存する。例えば、adw血清型の特定のDane粒子のHBV DNAのHBsAgコード配列は、単一のBamHIフラグメントとして単離され得;ayw血清型の特定のDane粒子のHBV DNAのHBsAgコード配列は、HhaIフラグメントとして単離され得る。同じ血清型のDane粒子のHBV DNAはまた、異なるパターンの制限酵素認識部位を示し得る。
【0079】
オリゴヌクレオチドプローブは、HBVゲノムの公知の配列に基づいて考案され得、そして本発明において有用な抗原をコードするHBV遺伝子についてのゲノムライブラリーまたはcDNAライブラリーを探索するために使用され得る。その後これらの遺伝子は、標準的な技術を使用して、さらに単離され得、そして所望される場合、制限酵素を利用して、全長配列の所望の部分でこの遺伝子を変異させる。例えば、DNAを入手および単離するために使用される技術の説明については、Sambrookら、前出を参照のこと。
【0080】
最後に、上記HBV抗原をコードする遺伝子は、公知の配列に基づいて合成的に産生され得る。このヌクレオチド配列は、所望される特定のアミノ酸配列のために、適切なコドンを用いて設計され得る。一般的に、この配列を発現する意図された宿主に対して、好ましいコドンを選択する。この完全な配列は、一般的に、標準的な方法によって調製されるオーバーラップするオリゴヌクレオチドから構築され、そして完全なコード配列中に構築される。例えば、Edge、Nature、(1981)、292:756;Nambairら、Science、(1984)、223:1299;Jayら、J.Biol.Chem.、(1984)、259:6311を参照のこと。
【0081】
ポリヌクレオチドは、天然に存在するか、または天然に存在しない人工の配列を含み得る種々のポリペプチドについてのコード配列を含み得る。これらのポリヌクレオチドは、所望される場合、標準的な分子生物学技術を使用して、融合タンパク質についてのコード配列を形成するために連結され得る。
【0082】
一旦コード配列が、調製されるか、または単離されると、このような配列は、任意の適切なベクターまたはレプリコン中にクローニングされ得る。多数のクローニングベクターは、当業者に公知であり、そして適切なクローニングベクターの選択は、好みの問題である。適切なベクターとしては、適切な制御エレメントと結合した場合に複製可能である、プラスミド、ファージ、トランスポゾン、コスミド、染色体またはウイルスが挙げられるが、これらに限定されない。次いでこのコード配列は、発現のために使用される系に依存して、適切な制御エレメントの制御下におかれる。したがって、このコード配列は、目的のDNA配列が、適切な形質転換体によってRNAに転写されるように、プロモーター、リボソーム結合部位(細菌の発現のための)および必要に応じて、オペレーターの制御下におかれ得る。このコード配列は、翻訳後のプロセシングにおいて宿主によって後に除去され得る、シグナルペプチドまたはリーダー配列を含んでも含まなくてもよい。例えば、米国特許第4,431,739号;同第4,425,437号;同第4,338,397号を参照のこと。
【0083】
存在する場合、シグナル配列は、目的のHBV抗原と関連して見出される、ネイティブなリーダーであり得る。あるいは、分泌の効率を増加させ得る異種シグナル配列が、存在し得る。多くの代表的なリーダー配列は、当該分野において公知であり、そしてこれらのリーダー配列としては、酵母α−因子リーダー、TPAシグナルペプチド、Igシグナルペプチドなどが挙げられるが、これらに限定されない。これらおよび他のリーダー配列についての配列は、当該分野において周知である。
【0084】
制御配列に加えて、宿主細胞の増殖に関連して、この配列の発現の調節を可能にする調節塩基配列を付加することが、望まれ得る。調節塩基配列は、当業者に公知であり、そして例としては、調節化合物の存在を含む、化学的刺激または物理的刺激に応答して、遺伝子の発現のオンまたはオフを引き起こすものが挙げられる。他の型の調節エレメントはまた、そのベクター中に存在し得る。例えば、エンハンサーエレメントが本明細書中で使用されて、その構築物の発現レベルを増加させ得る。例としては、SV40初期遺伝子エンハンサー(Dijkemaら、(1985)、EMBO J.、4:761)、ラウス肉腫ウイルスの長い末端反復配列(LTR)に由来するエンハンサー/プロモーター(Gormanら、(1982)、Proc.Natl.Acad.Sci.USA、79:6777)およびヒトCMVに由来するエレメント(Boshartら、(1985)、Cell 41:521)(例えば、CMVイントロンA配列中に含まれるエレメント(米国特許第5,688,688号))が挙げられる。発現カセットは、適切な宿主細胞の自律増殖のための複製起点、1つ以上の選択可能マーカー、1つ以上の制限酵素認識部位、高いコピー数についての可能性および強力なプロモーターを、さらに含み得る。
【0085】
発現ベクターは、特定のコード配列が、適切な調節塩基配列、制御配列に対するコード配列の位置決めおよび方向を有するベクター中に配置され、その結果、このコード配列が制御配列の「制御」の下で転写される(すなわち、DNA分子の制御配列に結合するRNAポリメラーゼが、このコード配列を転写する)ように構築される。目的の分子をコードする配列の改変は、この目標を達成するために所望され得る。例えば、いくつかの場合において、適切な方向で制御配列に結合する(すなわち、その読み取り枠を維持する)ようにその配列を改変することが、必要であり得る。この制御配列および他の調節塩基配列は、ベクターへの挿入の前にこのコード配列に連結され得る。あるいは、このコード配列は、既に制御配列および適切な制限酵素認識部位を含む発現ベクター中に、直接クローニングされ得る。
【0086】
あらゆる適切な発現ベクターを構築または利用し得、本発明のHBsAgのあらゆる形態が発現され得る。例示的なベクターは、pCMVII(哺乳動物細胞における発現のために設計されたpUC19ベースのクローニングベクター)である。pCMVIIは、以下のエレメントを備える:ヒトCMV IEエンハンサー/プロモーター、ヒトCMVイントロンA、ヒト組織プラスミノゲン活性化因子(tPA)リーダー、ウシ成長ホルモンポリAターミネーター(BGHt)、ColE1複製起点、およびAmp Rアンピシリン耐性遺伝子。例えば、pCMVII−pS2−sAgは、プレS2−sAgの発現のために使用され得る。このベクターにおいて、HBsAgのsAgドメインおよびプレS2ドメインについてのコード配列は、pCMVII中のCMVイントロンAとBGHtとの間に挿入されている。このベクターはまた、例えば、プレS2ドメインを除去するか、またはプレS1ドメインについてのコード配列を付加することによって改変され得る。これらのベクターは、実施例の方法によって提供され、そして本発明の範囲を限定することを意図しない。上記のベクターは、米国特許第6,740,323号に詳細に記載される。
【0087】
上で説明される通り、目的のポリペプチドの変異体またはアナログを産生することがまた、所望され得る。本発明の組成物において使用するためのHBVポリペプチドの変異体またはアナログは、目的の分子をコードする配列の一部の欠失、配列の挿入、および/またはその配列内の1つ以上のヌクレオチドの置換によって調製され得る。ヌクレオチド配列を改変するための技術(例えば、部位特異的突然変異誘発など)は、当業者に周知である。例えば、Sambrookら、前出;Kunkel,T.A.、(1985)、Proc.Natl.Acad.Sci.USA、(1985)、82:448;Geisselsoderら、(1987)、BioTechniques 5:786;ZollerおよびSmith、(1983)、Methods Enzymol.100:468;Dalbie−McFarlandら、(1982)、Proc.Natl.Acad.Sci USA 79:6409を参照のこと。
【0088】
上記分子は、広範な種々の系において発現され得、この系としては、昆虫発現系、哺乳動物発現系、細菌発現系、ウイルス発現系および酵母発現系が挙げられる(当該分野において全て周知である)。例えば、昆虫細胞発現系(例えば、バキュロウイルス系)は、当業者に公知であり、そして例えば、SummersおよびSmith、Texas Agricultural Experiment Station Bulletin No.1555、(1987)に記載される。バキュロウイルス/昆虫細胞発現系のための材料および方法は、とりわけ、Invitrogen、San Diego CAからキット形態(「MaxBac」キット)で市販されている。同様に、細菌発現系および哺乳動物細胞発現系は、当該分野において周知であり、そして例えば、Sambrookら、前出に記載される。酵母発現系はまた、当該分野において公知であり、そして例えば、Yeast Genetic Engineering(Barrら編、1989)、Butterworths、Londonに記載される。
【0089】
上記の系によって使用するための多くの適切な宿主細胞もまた、公知である。例えば、哺乳動物細胞株は、当該分野において公知であり、そしてこれらの細胞株としては、American Type Culture Collection(ATCC)から入手可能な不死化細胞株(例えば、チャイニーズハムスター卵巣(CHO)細胞、HeLa細胞、ベビーハムスター腎臓(BHK)細胞、サル腎臓細胞(COS)、ヒト胎児性腎臓細胞、ヒト肝細胞癌細胞(例えば、Hep G2)、Madin−Darbyウシ腎臓(「MDBK」)細胞およびその他であるが、これらに限定されない)が挙げられる。同様に、細菌宿主(例えば、E.coli、Bacillus subtilis、およびStreptococcus種)は、本発明の発現構築物による用途を見出される。本発明において有用な酵母宿主としては、とりわけ、Saccharomyces cerevisiae、Candida albicans、Candida maltosa、Hansenula polymorpha、Kluyveromyces fragilis、Kluyveromyces lactis、Pichia guillerimondii、Pichia pastoris、Schizosaccharomyces
pombeおよびYarrowia lipolyticaが挙げられる。バキュロウイルス発現ベクターと使用するための昆虫細胞としては、とりわけ、Aedes aegypti、Autographa californica、Bombyx mori、Drosophila melanogaster、Spodoptera frugiperda、およびTrichoplusia niが挙げられる。
【0090】
目的のヌクレオチド配列を含む核酸分子は、適切な宿主細胞中で当該分野において周知である種々の遺伝子送達技術を使用して、宿主細胞ゲノム中に安定して組み込まれ得るか、または安定なエピソームエレメント上に維持され得る。例えば、米国特許第5,399,346号を参照のこと。
【0091】
選択される発現系および宿主に依存して、上記分子は、タンパク質が発現される条件下で、上に記載される発現ベクターを用いて形質転換された宿主細胞を増殖させることによって産生される。次いで発現したタンパク質は、その宿主細胞から単離され、そして精製される。この発現系が増殖培地中にそのタンパク質を分泌する場合、この産物は、その培地から直接精製され得る。そのタンパク質が分泌されない場合、このタンパク質は、細胞溶解物から単離され得る。適切な増殖条件および回収方法の選択は、当業者の技術範囲内である。
【0092】
上記HBV抗原はまた、化学的なポリマー合成(例えば、固相ペプチド合成)を使用して合成され得る。このような方法は、当業者に公知である。例えば、固相ペプチド合成技術については、J.M.StewartおよびJ.D.Young、Solid Phase Peptide Synthesis、第2版、Pierce Chemical
Co.、Rockford,IL、(1984)、ならびにG.BaranyおよびR.B.Merrifield、The Peptides:Analysis,Synthesis,Biology,editors E.Gross and J.Meienhofer、第2巻、Academic Press、New York、(1980)、pp.3−254を参照のこと。
【0093】
その後、上に記載されるように得られるHBV抗原を使用して、診断薬において使用するためのウサギモノクローナル抗体が産生される。
【0094】
(抗HBV抗体)
上記HBV抗原は、診断アッセイおよび検出アッセイにおいて使用するためのHBV特異的なポリクローナル抗体およびモノクローナル抗体を産生するために使用され得る。HBV特異的なポリクローナル抗体およびモノクローナル抗体は、HBV抗原に対して特異的に結合する。特に、このHBV抗原は、哺乳動物(例えば、マウス、ラット、ウサギ、ヤギ、またはウマ)にこのHBV抗原を投与することによってポリクローナル抗体を産生するために使用され得る。免疫化された動物から得た血清は、収集され、そしてその抗体は、例えば、硫酸アンモニウムによって沈殿させ、次いでクロマトグラフィー(好ましくは、アフィニティークロマトグラフィー)することによって血漿から精製される。ポリクローナル抗血清を産生し、そして加工するための技術は、当該分野において公知である。
【0095】
上記タンパク質中に存在するHBV特異的エピトープを指向するウサギモノクローナル抗体およびマウスモノクローナル抗体もまた、容易に産生され得る。このようなモノクローナル抗体を産生するために、目的の哺乳動物(例えば、ウサギまたはマウス)は、例えば、生理食塩水(好ましくは、フロイント完全アジュバント(「FCA」)のようなアジュバントに)にこの抗原を混合するか、または乳化し、そして非経口的(一般的には、皮下または筋肉内)にこの混合物またはエマルションを注射することによって免疫化される。この動物は、一般的に、好ましくは、フロイント不完全アジュバント(「FIA」)を使用して、生理食塩水中のこの抗原の1回以上の注射によって2〜6週間後に追加免疫される。1つの実施形態において、この動物は、1つ以上のHBsAg変異体(好ましくは、2〜5種の異なるHBsAg変異体の混合物が使用される)によって免疫化される。野生型HBsAgはまた、免疫原に含められ得る。好ましいレジメンにおいて、この動物(好ましくは、ウサギ)は、野生型HBsAgによって最初に免疫化され、その後、1つ以上のHBsAg変異体によって追加免疫される。天然に存在することが見出されたHBsAg変異体(例えば、下でさらに記載されるD3、D2、D1、Y1、Y2)は、免疫原として特に有用である。抗体はまた、当該分野において公知の方法を使用して、インビトロの免疫化によって産生され得る。例えば、Jamesら、J.Immunol.Meth.、(1987)、100:5−40を参照のこと。
【0096】
その後、ポリクローナル抗血清は、免疫化された動物から得られる。しかし、この動物を出血させて血清を抽出する以外に、その脾臓(および必要に応じて、いくつかの大きいリンパ節)が、取り出され、そして単細胞へと解離される。所望される場合、これらの脾臓細胞(脾細胞)は、(接着細胞を非特異的に除去した後に)上記抗原によってコーティングしたプレートまたはウェルに細胞懸濁物を適用することによってスクリーニングされ得る。この抗原に特異的な膜結合型免疫グロブリンを発現するB細胞は、このプレートに結合し、そしてその残りの懸濁物によって洗い流されない。次いで得られたB細胞、または解離した脾細胞は、不死化した細胞株由来の細胞(「融合パートナー」とも称される)と融合するように誘導されて、ハイブリドーマを形成する。代表的に、この融合パートナーは、得られたハイブリドーマの、特定の媒体を使用した選択を可能にする特性を含む。例えば、融合パートナーは、ヒポキサンチン/アミノプテリン/チミジン(HAT)依存であり得る。
【0097】
ウサギ−ウサギハイブリドーマが所望される場合、上記不死化した細胞株は、ウサギから得られる。このようなウサギ由来の融合パートナーは、当該分野において公知であり、そしてこの融合パートナーとしては、例えば、リンパ系起源の細胞(例えば、Spieker−Poletら、Proc.Natl.Acad.Sci.USA、(1995)、92:9348−9352および米国特許第5,675,063号に記載されるようなウサギプラズマ細胞腫から得た細胞)、または米国特許第4,859,595号に記載されるTP−3融合パートナーが挙げられる。ウサギ−マウスハイブリドーマまたはラット−マウスハイブリドーマまたははマウス−マウスハイブリドーマなどが所望される場合、マウス融合パートナーは、マウスから得た不死化した細胞株(例えば、リンパ系起源の細胞(代表的には、マウス骨髄腫細胞株))に由来する。多くのこのような細胞株は、当該分野において公知であり、そしてATCCから入手可能である。
【0098】
融合は、当該分野において周知の技術を使用して達成される。融合を促進する化学物質は、一般に融合因子(fusogen)といわれる。これらの因子は、非常に親水性であり、そして膜の接触を容易にする。細胞融合の1つの特に好ましい方法は、ポリエチレングリコール(PEG)を使用する。細胞融合の別の方法は、電気融合である。この方法において、細胞は、細胞膜電位を変化させる所定の放電に曝される。細胞融合のためのさらなる方法としては、架橋融合(bridged−fusion)法が挙げられる。この方法において、抗原は、ビオチン化され、そして融合パートナーは、アビジン化(avidinylate)される。細胞が一緒に加えられる場合、抗原反応性のB細胞抗原−ビオチン−アビジン融合パートナーの架橋が、形成される。これは、抗原反応性細胞と不死化細胞との特異的な融合を可能にする。さらに、この方法は、細胞融合を容易にする化学的手段または電気的手段を利用し得る。
【0099】
融合の後、上記細胞は、選択培地(例えば、HAT培地)において培養される。抗体の分泌を増強するために、分泌刺激効果を有する因子(例えば、IL−6)が、必要に応じて使用され得る。例えば、Liguoriら、Hybridoma、(2001)、20:189−198を参照のこと。得られたハイブリドーマは、限界希釈によってプレートされ得、そして免疫化する抗原に対して特異的に結合する(および関係ない抗原に結合しない)抗体の産生についてアッセイされる。次いで選択したモノクローナル抗体を分泌するハイブリドーマは、インビトロ(例えば、組織培養ビンまたは中空線維反応器において)、またはインビボ(例えば、マウス中の腹水として)のいずれかで培養される。例えば、HBV特異的抗体を産生するハイブリドーマは、RIAまたはELISAを使用して同定され得、そして半流動アガロース中におけるクローニングによってか、または限界希釈によって単離され得る。HBV特異的抗体を産生するクローンは、スクリーニングの別のラウンドによって単離され得る。
【0100】
本発明のウサギモノクローナル抗体を産生するための代替的な技術は、選択リンパ球抗体法(SLAM)である。この方法は、リンパ系細胞の多くの集団内の所望の特異性または機能によって、抗体を産生する単一のリンパ球を同定する工程を包含する。その後、抗体の特異性をコードする遺伝情報(すなわち、免疫グロブリンVH DNAおよび免疫グロブリンVL DNA)は、レスキューされ(rescued)、そしてクローニングされる。例えば、この方法の説明については、Babcookら、Proc.Natl.Acad.Sci.USA、(1996)、93:7843−7848を参照のこと。
【0101】
ウサギモノクローナル抗体、およびウサギ−ウサギ融合体およびウサギ−マウス融合体からウサギモノクローナル抗体を作製する方法のさらなる説明については、例えば、米国特許第5,675,063号(ウサギ−ウサギ);同第4,859,595号(ウサギ−ウサギ);同第5,472,868号(ウサギ−マウス);および同第4,977,081号(ウサギ−マウス)を参照のこと。従来のマウスモノクローナル抗体の産生の説明については、例えば、KohlerおよびMilstein、Nature、(1975)、256:495−497を参照のこと。
【0102】
キメラ抗体を提供することが、所望され得る。ヒトアミノ酸配列および非ヒトアミノ酸配列から構成されるキメラ抗体は、ヒトにおけるその免疫原性を減少させるために、上に記載されるモノクローナル抗体分子から形成され得る(Winterら、(1991)、Nature 349:293;Lobuglioら、(1989)、Proc.Nat.Acad.Sci.USA 86:4220;Shawら、(1987)、J.Immunol.138:4534;およびBrownら、(1987)、Cancer Res.47:3577;Riechmannら、(1988)、Nature 332:323;Verhoeyenら、(1988)、Science 239:1534;およびJonesら、(1986)、Nature 321:522;欧州特許公開第519,596号(1992年12月23日公開);および英国特許公開第GB 2,276,169号(1994年9月21日公開))。
【0103】
親モノクローナル抗体分子の免疫学的結合特性を示し得る抗体分子フラグメント(例えば、F(ab’)2分子、Fv分子、およびsFv分子)は、公知の技術を使用して産生され得る。Inbarら、(1972)、Proc.Nat.Acad.Sci.USA
69:2659;Hochmanら、(1976)、Biochem 15:2706;Ehrlichら、(1980)、Biochem 19:4091;Hustonら、(1988)、Proc.Nat.Acad.Sci.USA 85(16):5879;ならびにHustonらに対する米国特許第5,091,513号および同第5,132,405号;およびLadnerらに対する米国特許第4,946,778号。
【0104】
代替手段において、ファージディスプレイシステムが、インビトロでモノクローナル抗体分子の集団を拡大するために使用され得る。Saikiら、(1986)、Nature 324:163;Scharfら、(1986)、Science 233:1076;米国特許第4,683,195号および同第4,683,202号;Yangら、(1995)、J Mol Biol 254:392;Barbas,IIIら、(1995)、Methods:Comp.Meth Enzymol 8:94;Barbas,IIIら、(1991)、Proc Natl Acad Sci USA 88:7978。
【0105】
一旦産生されると、このファージディスプレイライブラリーは、公知の技術を使用して、上記Fab分子の免疫学的な結合親和性を改良するために使用され得る。例えば、Figiniら、(1994)、J.Mol.Biol.239:68を参照のこと。このファージディスプレイライブラリーから選択されたFab分子の重鎖部分および軽鎖部分についてのコード配列は、単離されても合成されてもよく、そして発現のために、任意の適切なベクターまたはレプリコン中にクローニングされ得る。上に記載されるものを含む任意の適切な発現系が、使用され得る。
【0106】
上に記載されるウサギモノクローナル抗体およびその免疫反応性フラグメントをコードするポリヌクレオチド配列は、当該分野において周知である標準的な技術(例えば、HBsAgに関して上に記載される技術)を使用して容易に得られる。
【0107】
HBVエピトープを指向する抗体は、サンプル(例えば、HBVに感染したヒト由来の血清サンプル)中のHBVまたはHBV抗原の存在を検出するために特に有用である。HBV抗原に対する免疫アッセイは、単独もしくはHBV抗原との組み合わせのいずれかで、1つの抗体またはいくつかの抗体を利用し得る。HBV抗原に対する免疫アッセイは、、例えば、HBVエピトープに向かうモノクローナル抗体、1つのHBVポリペプチドのエピトープに向かうモノクローナル抗体の組み合わせ、異なるHBVポリペプチドのエピトープに向かうモノクローナル抗体、同じHBV抗原に向かうポリクローナル抗体、異なるHBV抗原に向かうポリクローナル抗体、またはモノクローナル抗体とポリクローナル抗体との組み合わせを使用し得る。例えば、ウサギモノクローナル抗体およびマウスモノクローナル抗体の両方が、本発明のアッセイにおいて使用され得る。免疫アッセイプロトコルは、例えば、標識された抗体を使用する、例えば、競合型アッセイ、直接反応型アッセイ、またはサンドイッチ型アッセイに基づき得、そして免疫アッセイプロトコルは、下に記載される。この標識は、例えば、蛍光性、化学発光性、または放射性であり得る。
【0108】
上記抗HBV抗体は、免疫親和性カラムによってHBV粒子またはHBV抗原を単離するために、さらに使用され得る。この抗体は、この抗体がその免疫選択活性を保持するように、例えば、吸着または共有結合によって固体支持体に固定され得る。必要に応じて、スペーサー基は、この抗体の抗原結合部位が接近可能なままであるように含まれ得る。次いで固定化した抗体は、生物学的サンプル(例えば、血液または血漿)からHBV粒子またはHBV抗原を結合するために使用され得る。結合されたHBV粒子またはHBV抗原は、例えば、pHの変化によってカラムマトリックスから回収される。
【0109】
好ましい抗HBV抗体は、ハイブリドーマ細胞株99S9(CMCC #12336)およびハイブリドーマ細胞株99S6(CMCC #12337)(それぞれ、ATCC受託番号PTA−6014およびPTA−6015)によって産生されるもの、ならびにそれらから得られる抗体フラグメント(例えばFab、F(ab’)2、Fv、sFv)およびキメラ抗体またはヒト化抗体である。
【0110】
(HBV診断アッセイ)
上で説明される通り、上で記載されるように産生される抗HBV抗体は、HBV感染を同定するアッセイにおいて使用され得る。この抗HBV抗体は、下で記載されるように、このアッセイにおいて捕捉成分および/または検出成分のいずれかとして使用され得る。したがって、生物学的サンプル中のHBVの存在は、そのサンプル中のHBVの指標としての、HBV抗原および/または抗HBV抗体の存在によって決定され得る。上記モノクローナル抗体は、血液サンプル(全血、血清、血小板、および血漿が挙げられるが、これらに限定されない)中のHBVを検出するために使用され得る。この抗体は、使用されるアッセイに依存して、HBV抗原(特に、HBsAg)およびHBV抗体の存在を検出することによって、被験体(例えば、ヒト被験体)においてHBV感染を検出するため、および供与された血液サンプルにおけるHBV汚染を検出するために使用され得る。したがって、個々の供与されたサンプルまたはプールされたサンプルのアリコートは、HBVの存在についてスクリーニングされ得、そしてHBVによって汚染されたそれらのサンプルまたはプールされたサンプルは、それらが混合される前に排除され得る。このようにして、HBV汚染を実質的に含まない血液供給物が、提供され得る。「HBVを実質的に含まない」は、HBVの存在が本明細書中に記載されるアッセイを使用して検出されないことを意味する。同様に、本発明の方法は、移植について可能な組織サンプルおよび器官サンプルをスクリーニングするために使用され得、そして汚染された組織および器官は、処分され得る。
【0111】
本明細書中で使用するためのアッセイとしては、ウェスタンブロット;凝集試験;酵素標識性および酵素媒介性の免疫アッセイ(例えば、ELISA);ビオチン/アビジン型アッセイおよびビオチン−ストレプトアビジン型アッセイ;プロテインA媒介性免疫アッセイまたはプロテインG媒介性免疫アッセイ;放射免疫アッセイ;免疫電気泳動;免疫沈降、ストリップ免疫ブロット(strip immunoblot)などが挙げられる。これらの反応は、一般的に、検出可能な標識(例えば、蛍光標識、化学発光標識、放射性標識、酵素標識または色素分子)、またはサンプル中に存在するHBV抗原と、抗体もしくはそれと共に接触した抗体との間の複合体の形成を検出するための他の方法を含む。
【0112】
上述のアッセイは、一般的に、抗原−抗体複合体が結合される固相支持体からの液相中の結合していない抗体または抗原の分離を包含する。本発明の実施に使用され得る固体支持体としては、以下のような基材が挙げられる:(例えば、膜形態またはマイクロタイターウェル形態の)ニトロセルロース;塩化ポリビニル(例えば、シートまたはマイクロタイターウェル);ポリスチレンラテックス(例えば、ビーズまたはマイクロタイタープレート);フッ化ポリビニリデン(polyvinylidine fluoride);ジアゾ化した紙;ナイロン膜;活性化ビーズ、磁気反応性ビーズなど。
【0113】
本発明のひとつの局面において、抗HBsAg抗体(例えば、本明細書中に記載されるウサギモノクローナル抗体)は、サンプル中のHBV抗原(特に、HBsAg)を、捕捉するか、または検出するか、またはそれらを両方行うために使用される。上に記載されるように産生されるHBsAgに対する抗体は、サンプル中のHBV抗原を、捕捉するか、または検出するか、またはそれらを両方行うために使用され得る。分析物(ここでは、サンプル中のHBV抗原)の「捕捉」は、その分析物が、この捕捉分子の結合の効力によってそのサンプルの他の成分から分離され得ること意味する。代表的に、この捕捉分子は、直接的または間接的のいずれかで、固体支持体と結合する。代表的に、この検出分子は、直接的または間接的のいずれかで、検出可能な標識と結合する。
【0114】
代表的に、固体支持体は、最初に、適切な結合条件下でこの固相成分(例えば、上記抗HBV抗体の1つ以上)と反応し、その結果、固相成分がこの固体支持体に十分に固定化される。ときとして、この支持体に対する固定化は、より良好な結合特性を有するタンパク質に対する最初のカップリングによって増強され得る。適切なカップリングタンパク質としては、プロテインAまたはプロテインG、高分子(例えば、ウシ血清アルブミン(BSA)が挙げられる血清アルブミン)、キーホールリンペットヘモシアニン、免疫グロブリン分子、サイログロブリン、オボアルブミン、および当業者に周知な他のタンパク質が挙げられるが、これらに限定されない。あるいは、ストレプトアビジンコーティングの固体支持体またはアビジンコーティングの固体支持体は、ビオチン化した抗体を固定化するために使用され得る。この支持体にこの抗体を結合するために使用され得る他の分子としては、多糖類、ポリ乳酸、ポリグリコール酸、ポリマー性アミノ酸、アミノ酸コポリマーなどが挙げられる。このような分子およびこれらの分子をカップリングする方法は、当業者に周知である。例えば、Brinkley,M.A.、Bioconjugate Chem.、(1992)、3:2−13;Hashidaら、J.Appl.Biochem.、(1984)、6:56−63;およびAnjaneyuluおよびStaros、International J.of Peptide and Protein
Res.、(1987)、30:117−124を参照のこと。
【0115】
上記固体支持体と上記固相成分との反応後、任意の固定化されていない固相成分は、洗浄によってこの支持体から除去され、次いで支持体に結合した成分は、適切な結合条件下で、上記分析物(例えば、HBV抗原)を含むことが推定される生物学的サンプルと接触させられる。洗浄して任意の結合していない分析物を除去した後、第二の結合因子部分が、適切な結合条件下で添加され、この第二の結合因子は、結合されたリガンドと選択的に会合し得る。次いで第二の結合因子の存在は、当該分野において周知である技術を使用して検出され得る。
【0116】
さらに詳しくは、ELISA法が使用され得、そのマイクロタイタープレートのウェルは、本発明によるウサギ抗HBV抗体を用いて、直接的または間接的にコーティングされる。上に記載されるような1つ以上のHBV変異体を指向するウサギ抗HBV抗体が、使用され得る。好ましくは、ハイブリドーマ株99S9またはハイブリドーマ株99S6によって産生されるウサギモノクローナル抗体が、使用される。さらに、さらなるマウスモノクローナル抗体は野生型HBsAgまたはHBsAg変異体を指向し得るので、野生型HBsAgを指向する他の抗HBV抗体がまた、存在し得る。その後、HBV抗原を含むことが推定される生物学的サンプルは、このコーティングされたウェルに添加される。抗原−抗体結合を可能にするのに十分なインキュベーション期間の後、このプレートは、結合していない部分を除去するために洗浄され得、そして検出可能に標識された第二の結合分子が、添加される得る。この第二の結合分子は、任意の捕捉されたサンプルと反応し得、洗浄されたプレートおよび第二の結合分子の存在は、当該分野で周知の方法を使用して検出される。
【0117】
1つの特定の形式において、ELISA抗原サンドイッチ形式が、使用される。この場合において、上記固体支持体は、上に記載されるような1つ以上のHBV変異体を指向する抗HBV抗体によってコーティングされる。野生型HBsAgを指向する抗HBV抗体がまた、存在し得る。その後このサンプルは、HBV抗原(存在する場合)を上記抗体の1つ以上に結合させて抗原/抗体複合体を形成する条件下で、この支持体と接触させられる。結合されていない抗原は、除去され、この結合された抗原/抗体複合体と反応する酵素標識された抗体(例えば、標識された抗HBsAg抗体)が、添加される。酵素基質は、シグナルを発生するために使用される。この特定の実施形態において、この固体支持体上にコーティングされる抗HBV抗体は、本発明のウサギモノクローナル抗体(好ましくは、ハイブリドーマ99S9もしくはハイブリドーマ99S6またはその両方によって産生される抗体)であり得る。あるいは(またはさらに)、この検出可能に標識された抗体は、本発明のウサギモノクローナル抗体(好ましくは、ハイブリドーマ99S9もしくはハイブリドーマ99S6またはその両方によって産生される抗体)であり得る。
【0118】
別の実施形態において、生物学的サンプルから結合されたHBV分析物の存在は、抗原リガンドを指向する抗体を含む第二の結合因子を使用して容易に検出され得る。当業者に公知である方法を使用して検出可能な酵素標識(例えば、西洋ワサビペルオキシダーゼ、アルカリ性ホスファターゼまたはウレアーゼ)に容易に結合体化され得る、多くの抗ヒト免疫グロブリン(Ig)分子が、当該分野において公知である。次いで適切な酵素基質は、検出可能なシグナルを発生するために使用される。他の関連する実施形態において、競合型ELISA技術は、当業者に公知の方法を使用して実施され得る。
【0119】
本発明のウサギ抗HBV抗体はまた、以下のような間接型ELISA(例えば、間接型IgG ELISA)において使用され得る。HBV表面抗原に特異的な抗体は、固体支持体に結合される。プロテインAまたはプロテインGは、この固体支持体上にこの抗体を固定化するために使用され得る。次いでこの支持体は、この支持体に結合された抗HBV抗体に対する結合を可能にして抗体/抗原複合体を形成する条件下で、HBsAgと接触させられる。結合されていない抗原は、除去され、そしてこの固体支持体は、抗体/抗原複合体中の抗原に対するヒト抗HBV IgG(存在する場合)の結合を可能にする条件下で、HBVに対するヒトIgGの存在について検査されるサンプルと接触させられる。結合された抗HBV IgGの存在は、検出可能に標識された抗ヒトIgG抗体を使用して検出され得る。この様式において、HBVに対するヒトIgMの存在は、抗体/抗原複合体に結合する標識された抗ヒトIgMを使用することによって検出され得る。
【0120】
本発明のウサギ抗HBV抗体はまた、以下のような捕捉ELISA(例えば、IgM捕捉ELISA)において使用され得る。抗ヒトIgM抗体(例えば、ヤギ抗ヒトIgM抗体)は、固体支持体に結合され、この支持体は、この固体支持体に結合される抗ヒトIgM抗体の1つ以上に対する抗HBV IgM(存在する場合)の結合を可能にして抗体/抗体複合体を形成する条件下で、HBVに対するヒトIgMの存在について検査されるサンプルと接触させられる。HBsAg(例えば、変異体および/または野生型)は、この抗体/抗体複合体中の抗HBV IgMに対する結合を可能にして抗体/抗体/抗原複合体を形成する条件下で添加される。結合されていない抗原は、除去され、そして上に記載されるように産生される検出可能に標識された抗HBV抗体は、この結合された抗原対する結合を可能にする条件下で添加される。このサンプル中のHBVに対するIgMの存在は、この固体支持体に結合した、結合された抗ヒトIgM Ab/ヒト抗HBV IgM/抗原複合体に対する検出可能に結合された抗HBV抗体の存在によって決定される。
【0121】
前述のアッセイ形式のいくつかが「ELISA」(酵素結合イムノソルベント検定法)アッセイと称される一方で、「酵素結合した」結合部分以外の検出可能な標識の使用が可能でり、そして多くの状況において所望され得ることが、当業者に明らかである。他の適切な検出可能な標識は、本明細書中に記載され、そして当該分野において周知である。
【0122】
上記HBV抗原またはHBV抗体およびこれらの分子に特異的なリガンドが、沈殿する条件下で複合体を形成するように、アッセイはまた、溶液中で行われ得る。1つの特定の実施形態において、これらの分子は、当該分野で公知のカップリング技術(例えば、直接の化学的なカップリングまたは間接的なカップリングによる)を使用して、固相粒子(例えば、アガロースビーズなど)に結合され得る。次いでコーティングされた粒子は、HBV抗体またはHBV抗原を含むことが推定される生物学的サンプルと、適切な結合条件下で接触させられる。結合された抗体の間の架橋は、沈殿され得、そして洗浄および/または遠心分離を使用してこのサンプルから分離され得る複合体の凝集体の形成を引き起こす。反応混合物は、多くの標準的な方法のいずれか(例えば、上に記載されるような免疫診断法)を使用して、複合体の存在または非存在を決定するために分析され得る。
【0123】
よりさらなる実施形態において、免疫親和性マトリックスが、提供され得、例えば、HBV抗体が含まれることが推定される生物学的サンプルから得た抗体のポリクローナル集団は、基材に固定化される。このサンプルの最初のアフィニティー精製は、固定化した抗原を使用して実施され得る。したがって、得られるサンプル調製物は、そのアフィニティー支持体における強力な非特異的結合特性を回避する抗HBV部分を含むのみである。高収率および抗原結合活性の良好な保持率にて免疫グロブリン(インタクトであるか、または特定のフラグメントであるかのいずれか)を固定化する多くの方法は、当該分野において公知である。例えば、プロテインAまたはプロテインGは、この固体支持体に免疫グロブリン分子を固定化するために使用され得る。一旦この免疫グロブリン分子が免疫親和性マトリックスを提供するために固定化されると、HBV抗原(例えば、HBsAg)は、適切な結合条件下で、結合された抗体と接触させられる。任意の非特異的に結合されたHBV抗原が免疫親和性支持体から洗浄された後、結合された抗原の存在は、当該分野で公知の方法を使用して、標識についてアッセイすることによって決定され得る。例えば、上に記載されるように産生される、結合された抗原/抗体複合体と反応する酵素的に標識された抗体(例えば、標識された抗HBsAg抗体)が、添加される。酵素基質は、シグナルを発生するために使用される。
【0124】
本発明の別の実施形態において、ストリップ免疫ブロットアッセイ(SIA)が、生物学的サンプル中のHBV抗原を検出するために使用される。例えば、上に記載されるウサギモノクローナル抗体の1つ以上、および必要に応じて、HBsAgを指向するマウスモノクローナル抗体は、捕捉試薬として検査ストリップ上に固定化され得る。SIA技術は、当該分野において周知であり、そして伝統的なウェスタンブロッティング技術およびドットブロッティング技術を併用する(例えば、RIBA(登録商標)(Chiron Corp.、Emeryville、CA)SIA)。これらのアッセイにおいて、この抗体は、個別の、分散した部分として(例えば、バンドまたはドットとして)、膜状の支持体上に固定化されるか、または単一部分において混合物として固定化され得る。したがって、膜の支持体上に「分散して固定化された」は、存在する捕捉試薬の各々による反応性またはその欠如が評価され得るように、この抗体が、別個の成分として存在し、そして混合されないことを意味する。次いでHBV抗原を含むことが推定される生物学的サンプルは、検査膜と反応する。この生物学的サンプルにおける反応性の可視化は、比色定量の酵素基質と共に抗HBV抗体の酵素−結合体を使用して達成され得る。あるいは、上に記載されるウサギモノクローナル抗体は、結合された抗体−抗原複合体の可視化のために使用され得る。この代替的な実施形態のための検査ストリップは、例えば、HBsAgを指向するマウスモノクローナル抗体を使用して調製され得る。このアッセイは、手動で行われてもよいし、自動化された形式で使用されてもよい。
【0125】
上記ストリップ免疫ブロットアッセイの実施において使用され得る固体支持体としては、セルロース、ポリアミド(ナイロン)、ポリアクリロニトリル、二フッ化ポリビニリデン、ポリスルホン、ポリプロピレン、ポリエステル、ポリエチレンおよび上に記載されるものの組成物または誘導体からなる複合樹脂を含む多くの主要なポリマーから誘導される膜支持体が挙げられるが、これに限定されない。セルロースから誘導される支持体(例えば、ニトロセルロース膜、およびナイロン膜)が、特に好ましい。この基材は、一般的に、支持体として不活性なプラスチックの裏層を有する所望の膜を含む。
【0126】
本明細書中に記載されるウサギモノクローナル抗体および/またはHBsAg、結合された試薬を有する固体支持体、ならびに他の検出試薬を含む上記のアッセイ試薬は、上に記載されるようなアッセイを行うために、適切な説明書および他の必要な試薬と一緒にキット中に提供され得る。このキットはまた、コントロール処方物(ポジティブおよび/またはネガティブ)、標識された試薬(そのアッセイ形式が標識された試薬を必要とする場合)およびシグナル発生試薬(例えば、酵素基質)(この標識がシグナルを直接発生しない場合)を備え得る。通常、アッセイを実施するための説明書(例えば、文書、テープ、VCR、CD−ROMなど)は、このキット中に含まれる。このキットはまた、使用される特定のアッセイに依存して、他のパッケージ化された試薬および材料(すなわち、洗浄緩衝液など)を含み得る。標準的なアッセイ(例えば、上に記載されるもの)は、これらのキットを使用して行われ得る。
【0127】
(III.実験)
以下は、本発明を実施するための特定の実施形態の例である。これらの実施例は、例示目的のみのために提供され、そして決して本発明の範囲を限定することを意図しない。
【0128】
使用される数(例えば、量、温度など)に関する精度を保証するために努力がなされたが、ある程度の実験的な誤差および偏差は、当然に考慮されるべきである。
【実施例】
【0129】
(実施例1.ウサギモノクローナル抗体の調製)
目的の種々の変異体に十分な免疫反応性を与えるモノクローナル抗体、および野生型HBsAgを産生するために、3羽の白色の雌成体ニュージーランドウサギを、野生型HBsAg(adw)抗原および野生型HBsAg(ayw)抗原(それぞれ、図2Aおよび2Bに示す)によって免疫化し、次いで野生型抗原と5種の主なHBV組換え変異体抗原(名称D1(アミノ酸134位にFからAへの置換を有する)、名称D2(アミノ酸134位にFからSへの置換を有する)、名称D3(アミノ酸145にGからRへの置換を有する)、名称Y1(アミノ酸143にSからLへの置換を有する)、および名称Y2(アミノ酸129にQからRへの置換を有し、そしてアミノ酸133にMからTへの置換を有する))とのカクテルによって2週間毎に追加免疫した。
【0130】
本質的にSpieker−Poletら、Proc.Natl.Acad.Sci.USA、(1995)、92:9348−9352に記載されるように、最も免疫反応性であるウサギの脾臓由来の免疫B細胞を、ウサギプラズマ細胞腫細胞に融合して、ハイブリドーマを産生した。簡単にいうと、免疫化されたウサギから得た1.5×108〜3×108個のリンパ球を、無血清培地中で37℃にて50%のPEG 4000を用いて2:1の比で、ウサギプラズマ細胞腫細胞株(例えば、米国特許第5,675,063号;Spieker−Poletら、Proc.Natl.Acad.Sci.USA、(1995)、92:9348−9352に記載される240E 1−1−2)に由来する融合パートナーと融合した。この細胞を、15%のFBS(またはFCS)を含む培地において、ウェル1つあたり約1×105個のリンパ球にて96ウェル細胞培養プレート中に分配した。48時間後、HAT培地を、添加した。培地を、スクリーニング前に、2〜3回交換した。通常、ハイブリドーマのコロニーは、3〜5週間でスクリーニングできる状態であった。上清を、ELISAによって、免疫原に対して特異的な抗体の存在について検査した。免疫組織化学を、第二のスクリーニングアッセイとして使用した。これらのハイブリドーマを、限界希釈によってサブクローニングした。支持細胞に対して、ウェル1つあたり2×104個の細胞にて融合パートナーを使用した。
【0131】
合計で3000個のクローンを、スクリーニングし、そして38個のクローン(表1)を、さらなる研究に対する有力候補として同定した。次いでこれらのクローンを、サブクローニングし、そして抗原カクテル、変異体および野生型の両方(表1を参照のこと)のために使用される全7種のHBV表面抗原に対して最も良好な反応性を有する抗体の産生について検査した。これらの結果は、評価した38個のクローンの結果を示し、4個のクローン(表1において強調されるような)は、HBsAg変異体に対して最も広範な免疫反応性を有した。したがって、これら4個のHBVウサギハイブリドーマを、スケールアップし、精製し、そしてさらに評価した。
【0132】
選択した38個のHBVハイブリドーマクローンの大規模な分析後、2つのクローン(99S9(ATCC受託番号PTA−6014)および99S6(ATCC受託番号PTA 6015))が、HBV表面Ag変異体パネルに対して非常に広い免疫反応性を有する抗体を産生することを示した。具体的には、ELISAを、上に記載される種々の変異体HBsAgを用いて99S9ハイブリドーマ細胞株および99S6ハイブリドーマ細胞株によって産生される、2つのマウスモノクローナル抗体(mMAb1およびmMAb2)(HBsAgを指向するマウスモノクローナル抗体)およびウサギモノクローナル抗体の免疫反応性を比較するために使用した。さらに、ハイブリドーマ99S6およびハイブリドーマ99S9由来のマウスモノクローナル抗体ならびにウサギモノクローナル抗体を、BIACORE 3000システム(Biacore AB、Piscataway、NJ)を使用して検査した。このシステムは、表面プラスモン共鳴(SPR)技術を使用してリアルタイムの生体分子相互作用分析(BIA)を提供する。SPRベースのバイオセンサーは、表面に近い生体分子の質量濃度を測定することによって相互作用をモニタリングする。この表面は、相互作用するパートナーの1つを結合することによって特異的に作製される。他のパートナーを含むサンプルは、表面上を流れる。サンプル由来の分子が、この表面に結合した相互作用因子に結合する場合、局所濃度は変化し、そしてSPR反応が、測定される。この反応は、その表面に結合する分子の質量に正比例する。この場合において、ヤギ抗ウサギIgG抗体(このウサギモノクローナル抗体の免疫反応性を検査するため)、またはヤギ抗マウスIgG(このマウスモノクローナル抗体の免疫反応性を検査するため)を、センサーチップ上に固定化して、表面を捕捉する抗体を提供した。次いで、上に記載されるウサギモノクローナル抗体またはマウスモノクローナル抗体(リガンド)を、この表面を捕捉する抗体によって捕捉した。次いで、この変異体HBsAgおよび野生型HBsAg(分析物)を、この表面に通過させ、そしてその抗体/抗原相互作用を、BIACORE SPR光学デバイスを使用して検出し、そして測定した。
【0133】
図3A〜3Dおよび表2は、マウス抗体mMAb1(図3C)およびmMAb2(図3A)と比較して、99S6(図3B)および99S9(図3D)由来のウサギモノクローナル抗体のBIACORE分析結果を要約する。これらの研究および以下の研究に関して、HBsAgに対する多くの異なるマウスモノクローナル抗体を、使用した(mMAb1、mMAb2、mMAb3、mMAb4、mMAb5、およびmMAb6)。数種の市販されているマウスモノクローナル抗体をまた、使用した。図3A〜3Dに示す通り、マウスモノクローナル抗体mMAb2が、変異体D3に対する結合を欠き、そしてmMAb1が、変異体D3およびY1に対する結合を欠く一方で、両方のウサギハイブリドーマクローン99S9および99S6は、D3およびY1を含めて、7種全ての抗原に対する有意な結合活性を有する抗体を産生した。さらに、BIACOREの結果はまた、変異体D3およびY1に対するウサギモノクローナル抗体(ハイブリドーマクローン99S9由来およびハイブリドーマクローン99S6由来)の結合が、非常に安定であったことを証明した(図3)。これらの結果は、2つのマウスモノクローナル抗体と比較して、クローン99S9およびクローン99S6由来のウサギモノクローナル抗体が、他の抗原に対する免疫反応性を保持しつつ、変異体抗原D3およびY1に対するずっと強い免疫反応性を有したことを示し、したがってウサギ抗体は、種々のHBsAg変異体に対するずっと広い免疫反応性を有したことを示した。
【0134】
HBV改変体(すなわち、変異体)の検出についてのウサギモノクローナル抗体の利点をさらに示すために、HBsAgの野生型および改変体の検出のためのサンドイッチELISAアッセイにおいて捕捉抗体または検出抗体として、99S9由来のウサギモノクローナル抗体を、マウスモノクローナル抗体と比較して試験した。これらの実験において、2セットのELISAプレートを、単一のウサギモノクローナル抗体(99S9)または2つの抗HBsAgマウスモノクローナル抗体(mMAb2および160S11)(BD
Biosciences Pharmingen(San Diego、CA))のカクテルのいずれかによってコーティングした。これら2セットの捕捉プレートを、単一の99S9西洋ワサビペルオキシダーゼ(HRP)検出システム、または4つのHRP標識抗HBsAg MAbs(mMAb1、M01077(Fitzgerald Industries International、Concord、MA)、M01079(Fitzgerald Industries International、Concord、MA)、およびmMAb3)の混合物を含むマウスモノクローナル抗体カクテルと対にした。
【0135】
これらの結果は、BIACORE分析研究からの結果と一致した。99S9由来のウサギモノクローナル抗体は、上記マウスモノクローナル抗体と比較して、より広い免疫反応性を有した。99S9を、唯一の捕捉抗体および検出抗体(捕捉抗体として99S9および検出抗体としてHRP−99S9)として試験した場合、99S9は、7種全ての抗原を検出し得たが、マウスモノクローナル抗体カクテル(捕捉抗体としてmMAb2/160S11および検出抗体としてHRP−mMAb1/M77/M79/2D11)は、D3抗原を検出できなかった(表3)。これらの結果は、単一のウサギモノクローナル抗体が、いくつかの主要な回避した変異体の検出のために使用されるELISAアッセイにおいて、複数のマウスモノクローナル抗体を十分に置換し得ることを示した。
【0136】
上記の実験を要約すると、ウサギモノクローナル抗体99S9は、試験した7種の抗原に対する親和性を有し、そして7種の抗原の全て(特に、D3およびY1)に対するずっと遅い解離速度(off−rate)を示した(図3および表2)。マウスモノクローナルmMAb1は、変異体D1、D2、ならびに野生型adwおよび野生型aywについて有意により高い親和性を有し、マウスモノクローナルmMAb1は、変異体抗原D3およびY1に結合できないようである(図3および表2)。マウスモノクローナル抗体mMAb2は、ほとんどのHBV変異体抗原について全体的により低い親和性を有し、そして変異体抗原D3に結合できなかった(図3および表2)。ウサギモノクローナル抗体99S9単独は、変異体D3のより有効な捕捉および/または検出に関して、複数のマウスモノクローナル抗体の組み合わせを置換するのに十分であった(表3)。
【0137】
上記ウサギモノクローナル抗体の他のHBsAg改変体を検出する能力を検査するために、さらなるELISAを、HBsAgに対してマウスモノクローナル抗体のみ(mMAb ELISA)か、またはHBsAgに対してマウスモノクローナルとウサギモノクローナルとの組み合わせ(rMAb ELISA)のいずれかを使用して実施した。mMAb ELISAに関して、5種の異なる抗HBsAgマウスモノクローナル抗体を使用した(捕捉のために2種(mMAb2およびmMAb4)および検出のために3種(mMAb1、mMAb5およびmMAb6)。rMAb ELISAに関して、検出のために使用される2種のマウスモノクローナル抗体(mMAb5およびmMAb6)を、単一のウサギモノクローナル抗体(99S9)によって置換した。この捕捉抗体を、ビオチン化し、そしてストレプトアビジンコーティングのウェル上に固定化した。この検出抗体を、西洋ワサビペルオキシダーゼ(HRP)と結合体化した。表4は、多くのHBsAg改変体による結果を示す。rMAb ELISAは、mMAb ELISAにおいて検出された全ての改変体を検出し、そしてさらに、mMAb ELISAにおいて検出されなかった2種の改変体(P120Q改変体およびP142S改変体)を検出した。したがって、このウサギモノクローナル抗体(99S9)を使用するELISAは、このマウスモノクローナル抗体のみを使用するELISAより、少ない抗体を使用して、より多くのHBsAg改変体を検出し得た。
【0138】
したがって、ウサギモノクローナル抗体は、HBV改変体抗原の、より良好な検出のための強力な手段を提供する。
【0139】
したがって、新規のモノクローナル抗体およびHBV感染を検出するための方法が、開示される。本発明の好ましい実施形態は、ある程度詳細に記載されているが、明らかな変更は特許請求の範囲に定義されるような本発明の精神および範囲から逸脱することなくなされ得ることが、理解される。
【0140】
【表1】

【0141】
【表2】

【0142】
【表3】

【0143】
【表4】

【0144】
(本発明の実施に有用な株の寄託)
以下の株の生物学的に純粋な培養物の寄託は、American Type Culture Collection(ATCC)、10801 University Boulevard、Manassas、VAによって行われた。示した受託番号は、生死判別試験が成功し、そして必要な手数料が、支払われた後に割り当てられた。この寄託は、Budapest Treaty on the International Recognition of the Deposit of Microorganisms for the Purpose of Patent Procedure and the Regulations thereunder(Budapest Treaty)の規定の下で行われた。これは、寄託の日から30(30)年間、および少なくとも寄託者による、寄託サンプルの供給に対する最も最近の要求の後、5(5)年間、生存可能な培養物の維持を保障する。この生物体は、米国特許法§122およびそれに準拠するCommissioner’s規則(37 C.F.R.§1.12を含む)によって資格を与えられたU.S.Commissioner of Patents and Trademarksによって決定された者に対するこの培養物の半永久的かつ非制限的な利用可能性を保障する、ブダペスト条約の条件の下でATCCで入手可能にされる。特許の付与の際に、この寄託された培養物の公衆に対する利用可能性に対する全ての制限事項は、取り消し不能に取り除かれる。
【0145】
これらの寄託物は、単に当業者に対する便宜のために提供され、そして寄託物が米国特許法§112に基づいて要求されることを承認しない。これらのプラスミドの核酸配列、およびそれによってコードされるポリペプチドのアミノ酸配列は、本明細書中に参考として援用され、そして本明細書中の記載についての任意の矛盾する事象における統制である。ライセンスが、この寄託された材料を作製するか、使用するか、または販売するためには必要とされ得、そしてこのようなライセンスは本明細書中では与えられない。
【0146】
【表5】

【化1】

【化2】

【化3】

【化4】

【化5】

【特許請求の範囲】
【請求項1】
本願明細書に記載された発明。
【請求項1】
本願明細書に記載された発明。
【図1】


【図2】


【図3A】


【図3B】


【図3C】


【図3D】




【図2】


【図3A】


【図3B】


【図3C】


【図3D】


【公開番号】特開2012−143251(P2012−143251A)
【公開日】平成24年8月2日(2012.8.2)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−106831(P2012−106831)
【出願日】平成24年5月8日(2012.5.8)
【分割の表示】特願2007−527715(P2007−527715)の分割
【原出願日】平成17年6月7日(2005.6.7)
【出願人】(507251918)ノバルティス ヴァクシンズ アンド ダイアグノスティクス インコーポレイテッド (17)
【Fターム(参考)】
【公開日】平成24年8月2日(2012.8.2)
【国際特許分類】
【出願番号】特願2012−106831(P2012−106831)
【出願日】平成24年5月8日(2012.5.8)
【分割の表示】特願2007−527715(P2007−527715)の分割
【原出願日】平成17年6月7日(2005.6.7)
【出願人】(507251918)ノバルティス ヴァクシンズ アンド ダイアグノスティクス インコーポレイテッド (17)
【Fターム(参考)】
[ Back to top ]

