BCRP及び/又はP−GPを阻害する新規なアザペプチド化合物又はアザペプチド模倣化合物
【課題】BCRP及び/又はP−GPを阻害する新規なアザペプチド化合物又はアザペプチド模倣化合物の提供。
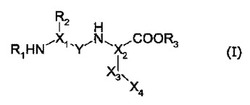
【解決手段】本発明は、式(I):
[化1]

(式中、R1、R2、R3、X1、X2、X3、X4及びYは請求項1と同様に定義される)で表されるアザペプチド化合物又はアザペプチド模倣化合物、それらを含有する医薬組成物、及び、抗ガン剤用又は抗感染剤用アジュバントとしての上記化合物に関する。
【解決手段】本発明は、式(I):
[化1]

(式中、R1、R2、R3、X1、X2、X3、X4及びYは請求項1と同様に定義される)で表されるアザペプチド化合物又はアザペプチド模倣化合物、それらを含有する医薬組成物、及び、抗ガン剤用又は抗感染剤用アジュバントとしての上記化合物に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は概して治療化学分野に関し、特に化学療法的治療、なかでも癌腫学的治療の有効性を改善するのに用いられる。具体的には、本発明の主題は、BCRP(乳ガン耐性タンパク質;ABCG2としても公知である)やP−gp(多面発現性糖タンパク質;ABCB1としても公知)等、ある種の排出タンパク質に対する阻害剤として作用するアザペプチド化合物又はアザペプチド模倣化合物に関する。
【背景技術】
【0002】
ガン、及び、ウイルス性、細菌性、真菌性又は寄生虫性の感染症に対して化学療法的治療を行う際に直面する問題としては、悪性細胞又は細菌、真菌、ウイルス若しくは寄生虫の初期耐性又は獲得耐性が主に挙げられる。獲得耐性現象としては多剤耐性が挙げられ、これは、目的の腫瘍細胞又は感染因子(ウイルス、細菌、真菌、寄生虫等)に感染した細胞から化学療法剤を排出させてしまうABC(ATP結合カセット)輸送タンパク質が過剰に発現されて、化学療法剤の細胞内濃度が減少することによるものである。これらのタンパク質はまた、特に消化管及び血液脳関門において、生理的に発現する。
【0003】
多剤耐性という概念は、投与された化学療法剤だけでなく、構造上無関係な多くの分子に対しても細胞が耐性を示すようになるという事実から生まれた。このような排除は主に排出ポンプの作用で起こり、そのうち主要な三つはヒトで確認される。これらの排出ポンプはABCB1、ABCC1及びABCG2であり、それぞれ、P−gp(1976年、Juliano及びLingが発見;非特許文献1);MRP1(多剤耐性タンパク質1;16年後にCole及びDeeleyが肺ガン中に発見;非特許文献2);及び、BCRP又はMXR(ミトキサントロン耐性;更に近年にRossら(非特許文献3)及びBatesら(非特許文献4)が発見)としても知られている。これらの排出タンパク質は、大きな細胞内ドメインと結合した膜貫通ドメインを介して、原形質膜に挿入される。上記細胞内ドメインは、二つのヌクレオチド結合部位(ヌクレオチド結合ドメイン、NBD)で構成される。小さなドメインは、これらのタンパク質の細胞外面に存在する。このようなタンパク質の構造は、原核生物の二種類の排出タンパク質Sav1866(非特許文献5)及びMsbA(非特許文献6)と同様であると考えられる。これらにより、様々な化学療法剤がATP依存的に細胞から排出される。
【0004】
これらの輸送タンパク質の活性を調整することで、薬剤として有効な濃度を回復し、MDR現象に起因する化学療法の失敗を抑えることができる。このような状況から、これらのタンパク質が有する排出機能をブロックする阻害剤を得るために多くの研究が行われてきた。このような活性を有する薬剤は、化学療法増感剤として知られている。だが、今まで、有効性、非毒性及び選択性の基準を満たすものはなかった。ここで、上記選択性とは、他の輸送タンパク質が有する生理的機能を妨害しないということである。また、大半は競合的阻害剤であり、輸送部位において基質と競合する。従って、これらは偽基質として機能し、結果的に、トランスポーターが他の基質と適合可能であることから、同種のトランスポーターの基質となり得る。以上より、非競合的阻害剤を選択することが重要である。
【0005】
また、最初に抗ガン剤耐性の過程で発見されたこれらの排出タンパク質は、近年では、抗ウイルス治療に対する耐性の発現とも関連付けられている。例えば、ABCB1は、プロテアーゼ阻害剤の経口による生物学的利用能及びその中枢神経系への浸透を調整する(非特許文献7)。同様に、ABCG2は、ジドブジン/AZT、ラミブジン/エピビル、及び、アバカビル/ザイアジェンを排出する(非特許文献8及び9)。これらのタンパク質が示す輸送スペクトルは非常に広く、そのために様々な化学構造の化合物を多く排出でき、例えば、ガンを含む様々な病変を治療するのに使用できる。
【0006】
これらの排出タンパク質は、当然、正常組織で発現されて、細胞(例えば、肺、腎臓及び肝臓)で産生された毒素及び老廃物を排出する。また、血液脳関門でも産生されて、毒素が脳へ侵入するのを防ぐ。MDR表現型を逆にするためには、化学療法剤と排出タンパク質阻害剤とを同時に投与することが一つの手段として考えられる。複数の分子がこの目的で開発されている。このようなタンパク質の排出活性をブロックするために開発されてきた、三世代にわたる阻害剤を表1に示す。
【0007】
表1a、1b:各記号は、特定のトランスポーターに対して阻害剤が活性を有する(+)又は不活性である(−)こと、あるいは、効果が不明である(?)ことを示す。表は非特許文献10から引用した。
【0008】
表1a
【0009】
【表1a】

【0010】
表1b
【0011】
【表1b】

【0012】
タリキダル等、ある種の阻害剤は、複数のタンパク質と相互作用する。特に、それらの阻害剤は、ABCB1及び/又はABCG2に加え、ABCC1を著しく阻害する。ただし、これは必ずしも利点とは言えない。というのも、克服剤(reversing agent)はただ一つの排出タンパク質のみを標的として、健康な細胞においては他のタンパク質が有する生理的機能を維持することが理想だからである。また、近年では、ゾスキダル等、他の薬剤についても、悪影響があるとの理由から第III相で試験が中止された。これらの例から、強力且つ特異的であり、悪影響も最小限であるような新種の克服能を有する薬剤を見つけ出すのは難しいことが分かる。
【先行技術文献】
【非特許文献】
【0013】
【非特許文献1】Juliano及びLing,「Biochim.Biophys.Acta」,1976年,455,152−162
【非特許文献2】Cole及びDeeley,「Science」,1992年,258,1650−1654
【非特許文献3】Rossら,「J.Natl Cancer Inst.」,1999年,91,429−433
【非特許文献4】Batesら,「J.Cell Sci.」,2000年,113(Pt11),2011−2021
【非特許文献5】Dawson及びLocher,「Nature」,2006年,443(7108),180−5
【非特許文献6】Wardら,「Proc.Natl.Acad.Sci.」,米国,2007年,104(48),19005−10
【非特許文献7】Kim,「Top HIV Med.」,2003年,11,136−139
【非特許文献8】Wangら,「Mol.Pharmacol.」,2003年,63,65−72
【非特許文献9】Weissら,「J.Antimicrob.Chemother.」,2007年,dkl474
【非特許文献10】「Current Opinion in Pharmacology」,2006年,6,350−354
【発明の概要】
【課題を解決するための手段】
【0014】
本発明は、ABCG2及び/又はABCB1阻害剤として作用する新規なアザペプチド化合物又はアザペプチド模倣化合物を提供するものである。また、本発明の別の目的は、ABCC1阻害能がそれほど強力でないABCG2及び/又はABCB1阻害剤を提供することである。本発明の化合物の中には、ABCG2若しくはABCB1に対して高い親和性と、多くの場合は選択性とを示し、且つ/又は、非競合的阻害剤として作用するものもある。
【0015】
本発明の別の目的は、非細胞毒性である新規な化合物を提供することである。
【0016】
本発明の別の目的は、比較的容易に製造でき、且つ、原価がそれほど高くならない新規な化合物を提供することである。
【0017】
以上を鑑みて、本発明の一主題は、純粋な光学異性体、又は光学異性体混合物、又はその塩、溶媒和物若しくは水和物の形態である、式(I)で表されるアザペプチド化合物又はアザペプチド模倣化合物である。
【0018】
【化1】

【0019】
(式中、
・R1は、アミノ基の保護基、好ましくは−C(O)OR’1基(R’1は、炭素数1〜12のアルキル基、又は−(CH2)m1R”1基(R”1はアリール基(例えばフェニル)、シクロアルキル基又はフルオレニル基;m1は0、1、2又は3))であり;
・X1及びX2は、同じか又は異なっていて、−N−又は−CH−であり、少なくとも一方は−N−であり;
・R2は、保護された形態であってもよい、アミノ酸若しくはアミノ酸類似体の側鎖であるか、又は、置換されていてもよいアリール基(例えばフェニル)、若しくは、置換されていてもよいヘテロアリール基であり;
・Yは、−CH2−又は−C(O)−であり;
・−X3−X4は、−(CH2)n−NHR4基(nは3、4、5又は6)、又は、
【0020】
【化2】

【0021】
(R4はアミノ基の保護基、好ましくは−C(O)OR’4基(R’4は、炭素数1〜12のアルキル基、又は−(CH2)m4R”4基(R”4はアリール基(例えばフェニル)又はシクロアルキル基;m4は0、1、2又は3))である)から選択される基であり;
・R3は、炭素数1〜12のアルキル基、又は−(CH2)m3R”3基(R”3はシクロアルキル基又はアリール基(例えばフェニル)であって、上記シクロアルキル基及びアリール基は、非置換でも、−CH3、−CF3、−COOH、−NO2、−Cl及びNH2から選択される1以上の基で置換されていてもよく;m3は0、1、2又は3)である。)
【0022】
一変更実施形態によれば、上で定義された式(I)の化合物は、置換基R2として、−L−COOR’2基(Lは、アリール基、好ましくはフェニル基であるか、又は、−(CH2)m2−鎖(m2は1、2又は3)であり、R’2は、炭素数1〜12のアルキル基、又は−(CH2)m’2R”2基(R”2は、置換されていてもよいアリール基(例えばフェニル)又はシクロアルキル基;m’2は0、1、2又は3))を有する。
【0023】
本発明に係る化合物の一下位グループは、純粋な異性体、又は異性体混合物、又はその塩、溶媒和物若しくは水和物の形態である式(IA)の化合物で構成される。
【0024】
【化3】

【0025】
(式中、R5は、−NH2、−NO2、−OH、炭素数1〜8の−O−アルキル、O−(CH2)m5R’5(R’5はアリール基(例えばフェニル);m5は0又は1)、又は、−COOR”5基(R”5は、炭素数1〜12のアルキル基、又は−(CH2)m’5R’’’5基(R’’’5はアリール基(例えばフェニル)又はシクロアルキル基;m’5は0、1、2又は3));R1、X1、Y、X2、X3、X4及びR3は、式(I)と同義。)
【0026】
式(IA)の化合物は、以下の特徴のどれか、又は、相互に排他的でない場合は、これらの特徴を一部若しくは全て組み合わせたものを満たすことが好ましい:
・R5は−COOR”5基(R”5はエチル基、ベンジル基又は−CH[CH(CH3)2]2基)である;
・R5はメタ位であり、この場合、BCRP選択性が好ましい;
・R5基はパラ位であり、この場合、P−gp選択性が好ましい;
・X1は−N−であり、X2は−CH−である;
・X1及びX2はNである;
・Yは−C(O)−である;
・−X3−X4は、−(CH2)n−NHR4基(nは4又は6;R4は式(I)と同義)である。
【0027】
本発明に係る化合物の一下位グループは、純粋な異性体、又は異性体混合物、又はその塩、溶媒和物若しくは水和物の形態である式(IB)の化合物で構成される。
【0028】
【化4】

【0029】
(式中、mは1、2又は3;R6は、炭素数1〜12のアルキル基、又は−(CH2)m6R’6基(R’6はシクロアルキル基又はアリール基(例えばフェニル)であって、上記シクロアルキル基及びアリール基(例えばフェニル)は、非置換でも、−CH3、−CF3、−COOH、−NO2、−Cl及びNH2から選択される1以上の基で置換されていてもよく;m6は0、1、2又は3);R1、X1、Y、X2、X3、X4及びR3は式(I)と同義。)
【0030】
式(IB)の化合物は、以下の特徴のどれか、又は、相互に排他的でない場合は、これらの特徴を一部若しくは全て組み合わせたものを満たすことが好ましい:
・mは1又は2である;
・R6はエチル基、ベンジル基又は−CH[CH(CH3)2]2基である;
・X1は−CH−であり、X2は−N−である;
・X1は−N−であり、X2は−CH−である;
・−X3−X4は、−(CH2)n−NHR4基(nは6;R4は式(I)と同義)である。
【0031】
また、式(I)、(IA)又は(IB)の化合物は、以下の特徴の一つ、二つ又は三つを満たすことが好ましい:
・R1は−COOR’1基(R’1はtert−ブチル基又はベンジル基)である;
・R3はtert−ブチル基又はベンジル基である;
・R4は−C(O)OR’4基(R’4はベンジル基又はtert−ブチル基)である。
【0032】
本発明に係る化合物の具体例としては、
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(2’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.1);
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.2);
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(4’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.3);
・(2R)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のベンジルエステル(IA.4);
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のベンジルエステル(IA.5);
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(フェニルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.6);
・2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニル]−1−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノカルボン酸のベンジルエステル(IA.7);
・2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニル]−1−(6−tert−ブチルオキシカルボニルアミノヘキシル)ヒドラジノカルボン酸のベンジルエステル(IA.8);
・(3S)−4−[2−(6−ベンジルオキシカルボニルアミノヘキシル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.1);
・(3S)−4−[2−(3−ベンジルオキシカルボニルアミノプロピル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.2);
・(3S)−4−[2−(4−ベンジルオキシカルボニルアミノフェニル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.3);
・(4S)−5−[2−(4−ベンジルオキシカルボニルアミノフェニル)−2−tert−ブトキシカルボニルヒドラジノ]−4−tert−ブトキシカルボニルアミノ−5−オキソペンタン酸のベンジルエステル(IB.4);
・(3S)−4−[2−(5−ベンジルオキシカルボニルアミノペンチル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.5);
・4−[2−((2S)−3−ベンジルオキシカルボニル−2−tert−ブトキシカルボニルアミノプロピル)−1−tert−ブトキシカルボニルヒドラジノメチル]ピペリジン−1−カルボン酸のベンジルエステル(IB.6);
・4−[2−((2S)−3−ベンジルオキシカルボニル−2−tert−ブトキシカルボニルアミノプロピオニル)−1−tert−ブトキシカルボニルヒドラジノメチル]ピペリジン−1−カルボン酸のベンジルエステル(IB.7);
・(3S)−4−[2−(5−ベンジルオキシカルボニルアミノペンチル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.8);
・(3S)−4−[2−(6−ベンジルオキシカルボニルアミノヘキシル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.9);
・(3S)−3−tert−ブトキシカルボニルアミノ−4−[2−tert−ブトキシカルボニル−2−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジノ]酪酸のベンジルエステル(IB.10);
・(3S)−4−[2−ベンジルオキシカルボニル−2−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.11);
・(3S)−3−ベンジルオキシカルボニルアミノ−4−[2−ベンジルオキシカルボニル−2−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノ]酪酸のベンジルエステル(IB.12);
・(3S)−4−[2−ベンジルオキシカルボニル−2−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.13);
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(ベンジルオキシカルボニルメチル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IB.14)、並びに、
その塩、溶媒和物及び/又は水和物、特にその薬学的に許容される形態から選択されるアザペプチド化合物又はアザペプチド模倣化合物が挙げられる。
【0033】
本発明に係る合成アザペプチド化合物又はアザペプチド模倣化合物は、BCRP/ABCG2及び/又はP−gp/ABCB1に対して阻害性を有する。本発明に係る化合物は、これら二種類のタンパク質のうち少なくとも一方に対して、2μM、更には0.3μM以下にもなり得る低いIC50値を有する。IC50は、治療剤の放出を50%ブロックできる、化合物の半数濃度と定義される。化合物の活性を測定するのに採用する試験については、実施例における「生物活性」の項で詳述する。本発明に係る化合物は、ABCC1阻害性をそれほど強くは示さない。特に、本発明に係る化合物の大半について、このタンパク質に対する10μMでの有効性(%)は15%未満である。化合物(IA.2)及び(IA.3)等、ある種の化合物は、タンパク質BCRP又はP−gpに対して選択性を有することが証明された。また、化合物(IA.2)及び(IB.11)等については、非競合性が証明された。
【0034】
本発明に係る化合物は、第一に、安定性及び生物学的利用能を向上する目的で、第二に、最も効率的な分子の活性立体配座を促進/安定化する目的で、N末端アミノ酸(N−アザ)又はC末端アミノ酸(C−アザ)においてCHαの代わりに窒素原子が導入された疎水性アザペプチド又はアザペプチド模倣物である。本発明に係る化合物は、化学療法的治療中に増幅されたABCトランスポーターの排出機能をブロックできる。ABCは、抗ガン剤、抗ウイルス剤、抗細菌剤、抗真菌剤若しくは抗寄生虫剤であっても、又は、所定の病変についてより広く使用される薬剤であっても、輸送/排出/拒絶を通じて、薬剤の薬物動態を変化させる。
【0035】
従って、本発明の別の主題は、治療患者の身体が耐性を発現する、患者に施される化学療法のためのアジュバントとして使用され、治療活性を回復させることを目的とする上記化合物に関する。なかでも、本発明に係る化合物は、抗ガン剤用又は抗感染剤用アジュバントとして使用できる。
【0036】
本発明に係る化合物は、下記薬剤用のアジュバントであることが好ましい:
・アントラサイクリン、トポイソメラーゼ阻害剤、代謝拮抗剤(抗葉酸剤)、チロシンキナーゼ阻害剤、抗ウイルス剤(逆転写酵素阻害剤)、抗寄生虫剤、及び、抗真菌剤から選択される薬剤;又は、
・ダウノルビシン、ドキソルビシン、ミトキサントロン、カンプトテシン及びその誘導体、イリノテカン、トポテカン、インドロカルバゾール、メトトレキセート、イマチニブ、ゲフィチニブ、ジドブジン、ラミブジン、アバカビル、イベルメクチン、アルベンダゾール、オクスフェンダゾール、並びに、ケトコナゾールから選択される薬剤。
【0037】
本発明の別の態様によれば、本発明は、水和物、溶媒和物、又は、薬学的に許容される塩の形態であってもよい上記式(I)、(IA)又は(IB)の化合物の、化学療法、特に癌腫学における化学療法の効果を向上させる薬剤の製造への使用に関する。
【0038】
本発明は、本発明に係る化合物(i)と、治療が望まれるガン又は病気に効果的な化学療法剤(ii)とを、別々に又は一緒に含む薬剤に関する。本発明の特定の一実施形態によれば、薬剤は、本発明に係る化合物(i)と、治療が望まれるガン又は病気に効果的な化学療法剤(ii)とを同じ製剤中に組み合わせた単一の医薬組成物の形態である。
【0039】
従って、本発明の主題はまた、治療が望まれるガン又は病気に効果的な化学療法剤と共に、ガン治療又は抗感染治療に用いられる、薬学的に許容される塩、溶媒和物若しくは水和物の形態であってもよい上記式(I)、(IA)又は(IB)の化合物を含む医薬組成物に関する。
【図面の簡単な説明】
【0040】
【図1】一般的なABCトランスポーターによって誘導される基質の排出を示す図である。
【図2A】化合物(I.A.2)の阻害の種類を表す。
【図2B】化合物(I.A.2)の阻害の種類を表す。
【図2C】化合物(I.A.2)の阻害の種類を表す。
【図2D】化合物(I.A.2)の阻害の種類を表す。
【図2E】化合物(I.A.2)の阻害の種類を表す。
【図3】化合物(IA.2)による、ABCG2を発現するHEK−293細胞の化学増感を表す。
【図4】化合物(IA.2)の、HEK−293細胞に対する無害性を表す。
【図5】化合物(IA.1)による、ABCG2を発現するHEK−293細胞の化学増感を表す。
【図6】化合物(IA.1)の、HEK−293細胞に対する無害性を表す。
【図7】化合物(IB.1)による、HEK−293細胞の化学増感を表す。
【図8】化合物(IB.1)の、HEK−293細胞に対する無害性を表す。
【図9】化合物(IB.1)の、NIH−3T3細胞に対する無害性を表す。
【図10】化合物(IB.11)の、HEK293細胞に対する無害性を表す。
【図11】化合物(I.A.3)の阻害の種類を表す。
【図12】化合物(IA.2)がABCG2発現レベルを減少させることを表す。
【発明を実施するための形態】
【0041】
以下の記載により、本発明をさらに詳細に理解できる。初めに、いくつかの定義を確認する。
【0042】
「アルキル基」とは、直鎖状又は分枝状の飽和炭化水素系鎖を意味する。炭素数1から12、好ましくは炭素数1から7のアルキル基としては、メチル、エチル、n−プロピル、iso−プロピル、n−ブチル、tert−ブチル、sec−ブチル、n−ペンチル、n−ヘキシル、n−ヘプチル及び−CH[CH(CH3)2]2基等が挙げられる。
【0043】
「シクロアルキル基」とは、炭素数3から7の飽和環状炭化水素系鎖を表す。シクロアルキル基としては、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル及びシクロヘプチル基等が挙げられる。
【0044】
「アリール基」とは、好ましくは炭素数6から12であり、フェニル、シンナミル又はナフチルラジカル等の芳香族基を少なくとも1つ有する、単環式、二環式又は多環式の炭素環を表す。アリール基としては、フェニル基が特に好ましい。
【0045】
「ヘテロアリール基」とは、窒素、酸素及び硫黄原子から選択される1以上のヘテロ原子が原子間に介在するアリール基を意味し、例えば、ピリジル、フリル、チエニル、イソキサゾリル、オキサジアゾリル、オキサゾリル、ベンズイミダゾール、インドリル及びベンゾフリル基等から選択される。
【0046】
「置換アリール又はヘテロアリール基」とは、例えば、ハロゲン原子;−CF3、−NH2、−OH若しくは−COOH基;炭素数1から12のアルキル基;炭素数1〜8のO−アルキル基;(CH2)pR’基若しくは−O−(CH2)pR’基(R’はアリール基又はシクロアルキル基;pは0又は1);ニトロ官能基;又は、−COOR基(Rは炭素数1〜12のアルキル基、又は(CH2)pR’基(R’はアリール基又はシクロアルキル基;pは0、1、2又は3))で置換された一置換体又は多置換体、特に二置換体、である基などを意味する。
【0047】
「アミノ酸」は、以下の構造を有する有機化合物に対応する。
【0048】
【化5】

【0049】
従って、「アミノ酸側鎖」とは、特に下記のアミノ酸におけるR基を意味する:グリシン、トレオニン、セリン、アスパラギン酸、アスパラギン、システイン、アラニン、プロリン、バリン、イソロイシン、ヒスチジン、ロイシン、メチオニン、フェニルアラニン、グルタミン酸、グルタミン、リシン、アルギニン、トリプトファン及びチロシン。なかでも、酸、アミン又はアルコール官能基は、保護された形態であることが好ましい。アミノ酸側鎖の保護基は当業者に周知であり、特に「Chem.Rev.」(2009年,109,2455−2504)に記載されている。該文献は、参照により本願に組み込まれる。
【0050】
一般に、アミノ基の保護基は当業者に周知であり、特に、上記出版物並びに「Protective Groups in Organic Synthesis」(Greene T.W.及びWuts P.G.M.,John Wiley&Sons社,2006年)及び「Protecting Groups」(Kocienski P.J.,1994年,Georg Thieme Verlag社)に記載されている。このような基としては、Boc(tert−ブチルオキシカルボニル)、Fmoc(9−フルオレニルメトキシカルボニル)及びZ(ベンジルオキシカルボニル)基等が挙げられる。置換基R1にこのような基があると、分子の疎水性が向上する。
【0051】
本発明で使用されるアミノ酸類似体としては、ホモグルタミン酸及びホモセリンが挙げられるが、これらに限定されない。
【0052】
「アザペプチド又はアザペプチド模倣」とは、CHαがNで置換されたペプチド又はペプチド模倣物を意味する。「ペプチド模倣物」とは、ペプチド結合、すなわち、一方のアミノ酸が有するアミン基と、他方のアミノ酸が有するカルボン酸基との間で水を除去して形成された、二つのアミノ酸の結合を等配電子結合によって置換したものを意味し、例えば、メチルアミノ(−CH2−NH−)等である。「ガン」とは、一般的には細胞増殖が制御できなくなった病状をいう。ガンとしては、癌腫、リンパ腫、芽細胞腫、肉腫及び白血病等が挙げられ、より具体的には、肺類表皮ガン、結腸腺ガン、神経膠腫、中皮腫、乳腺ガン、黒色腫、腎明細胞ガン、前立腺ガン、肝細胞ガン及び多発性骨髄腫等が挙げられる。
【0053】
「治療」とは、望ましい臨床効果又は有益な効果をもたらす、疾患又は障害を予防又は抑制する治療処置を表し、特に、1以上の症状を排除若しくは低減すること、又は、ガン若しくはそれに伴う障害の進行を退行、遅延若しくは停止させることを含む。
【0054】
「治療上有効な量」とは、ガンに特徴的なパラメータのうち1以上のパラメータを改善するような組成物の量を表す。
【0055】
以下、式(I)で表される化合物の合成を詳述する。
【0056】
X1=N且つY=C(O)である式(I)の化合物は、スキーム1に示した式(II)の化合物と式(III)の化合物とのカップリング反応で得られる。ここで、R2、R3、X2、X3及びX4は式(I)と同義であり、R2が、置換されていてもよいアリール基又はヘテロアリール基の場合、R1PはそのままR1基を表し、R2が、保護された形態であってもよい、アミノ酸又はアミノ酸類似体の側鎖の場合、R1Pは水素原子を表す。
【0057】
スキーム1
【0058】
【化6】

【0059】
酸塩化物(II)は、トリホスゲンの作用によりin situで生成され、文献(「Journal of Peptide Science」、1997年、3、429−441)に記載の方法で、化合物(III)と結合させる。ここで化合物(III)は、X2=CHの場合、酸官能基(−COOR3)と側鎖(−X3−X4)に存在してもよいアミン官能基とが保護されているD−又はL−アミノ酸に対応し、X2=Nの場合、酸官能基(−COOR3)と側鎖(−X3−X4)に存在してもよいアミン官能基とが保護されているアザ−アミノ酸に対応する。
【0060】
R2が、置換されていてもよいアリール基又はヘテロアリール基の場合、式(II)の化合物は当業者に周知の方法で調製される。
【0061】
スキーム2は、式(IA)の化合物を調製する場合の合成を示し、R2は−COOR”5基で置換されたフェニルである。スキーム2中、R1及びR5は式(I)と同義であり、R5pは、R5基又はR5基の前駆体、例えば−COOHである。
【0062】
スキーム2
【0063】
【化7】

【0064】
まず、ヒドラジノ安息香酸(VIA)を位置選択的にアシル化する(「J.Med.Chem.」,1996年,39,1172−1188)。R5基の性質に応じて、特にR5=−COOR”5(R”5は式(IA)の化合物と同義)の場合、R5p=−COOHである中間化合物(IV’A)を形成し、それを、例えばワング法(「J.Org.Chem.」,1977年,42,1286−1290)によりエステル化して-COOR”5とする。次に、トリホスゲンの作用で酸塩化物(II)をin situで生成し、化合物(III)とカップリングする。
【0065】
R2が、保護された形態であってもよい、アミノ酸又はアミノ酸類似体の側鎖の場合、式(II)の化合物もまた、R2が−(CH2)m−COOR6基(m及びR6は式(IB)の化合物と同義)の場合を表した式(IVB)の化合物を出発材料として、当業者に周知の方法で調製される。
【0066】
【化8】

【0067】
スキーム3は、式(IB)の化合物を調製する場合の合成を示し、R2は−CH2COOBnである。
【0068】
スキーム3
【0069】
【化9】

【0070】
Bocヒドラジン(1)からNβBocヒドラジノアセテート(IVB.1)を調製する。第一段階では、Boc−ヒドラジン(1)の1級アミンをアセトンで保護して、イミン(2)を形成する。続いて、Meyer(K.Meyer Synlett,2004年,2355−2356)の方法に基づいた方法に従って、ブロモアセテートを用いたアルキル化反応により、アルキル化合物(3)を導く。同時に二つのアミンを脱保護するため、好ましくはpara−トルエンスルホン酸を用いて化合物(VIB.1)を得る。化合物(IVA)の場合と同様の方法により、1級アミンを保護して化合物(IVB.1)を生成し、酸塩化物に変換し、化合物(III)とカップリングする。
【0071】
式(III)の化合物自体は、特に下記いずれかの方法で調製できる。
・Pati(「Synthetic Communications」,2004年,34,933−40)の方法に基づいた方法に従ってヨードアニリン(4)から得られる好適に保護されたヨードアニリン(5)とBoc−ヒドラジンとをブッフバルト(Buchwald)反応(「Org.Lett.」,2001年,3,3803−3805)させ、対応する化合物(III)を得る。下記スキーム4は、X2=N、R3=tert−ブチル、及び、X3−X4=
【0072】
【化10】

である場合の、化合物(III.1)の調製方法を示す。
【0073】
スキーム4
【0074】
【化11】

【0075】
・文献(「Tetrahedron」,1989年,45,6319−6330及び「J.Org.Chem.」,2001年,66,2869−2873)に記載された手順に従い、フタロイル基でβ保護され、且つ、カルバメート基でα保護されたヒドラジンと、好ましい基によりアミン官能基上で保護された保護アミノアルコールとを光延反応させる。アミン官能基上で保護されたアミノアルコールは、文献(「Tetrahedron」,1989年,45,6319−6330及び「Tetrahedron Asymmetry」,2003年,14,139−143)に記載された方法に従って調製する。以下のスキーム5は、X2=N、−COOR3=Boc、及び、X3−X4=−(CH2)6NHZである場合の上記調製方法を示す。
【0076】
スキーム5
【0077】
【化12】

【0078】
アミン(6)は、アミノアルコール(7)として保護される。同時に、Boc−ヒドラジン(8)は、フタロイル基で保護されて化合物(9)を形成する。保護されたヒドラジン(9)とアミノアルコール(7)とを光延反応させた後、アザ−アミノ酸を脱保護して化合物(III.2)を得る。
【0079】
下記スキーム6に示した通り、好適に保護されたアミノアルデヒド(V)と上述の化合物(III)とを、Martinezらの方法(「J.Med.Chem.」,1985年,28,273−278)に従って還元的にアミノ化し、X1=CH、X2=N、及びY=CH2である式(I)の化合物を調製する。
【0080】
スキーム6(式中、R1、R2、R3、X3及びX4は式(I)と同義である)
【0081】
【化13】

【0082】
アミノアルデヒド(V)は、Z.Guoらの方法(「Bioorg.Med.Chem.」,2001年,9,99−106)に従って調製してもよい。スキーム7は、R1=Boc及びR2=CH2−CO2Bnである場合のこれらの化合物の調製手順を示す。化合物(V.1)は、アミノ酸(11)をアミノアルコール(12)に還元し、続いてこれを酸化させることで得られる。
【0083】
スキーム7
【0084】
【化14】

【0085】
下記スキーム8に示した通り、Bouillonらの方法(「Tetrahedron」,2007年,63,223−2234)に従って、好適に保護されたアミノ酸(VII)と上記化合物(III)とをペプチドカップリング反応し、X1=CH、X2=N、及びY=COである式(I)の化合物を調製する。
【0086】
スキーム8(式中、R1、R2、R3、X3及びX4は式(I)と同義である)
【0087】
【化15】

【0088】
本発明に係る化合物の塩は、当業者に周知の方法で調製される。本発明に係る式(I)の化合物の塩は、式(I)の化合物及び薬学的に許容されるその塩を好適に分離又は結晶化できる無機又は有機の酸又は塩基を用いて構成される。好ましい酸としては、シュウ酸又は光学活性酸(例えば、酒石酸、ジベンゾイル酒石酸、マンデル酸若しくはカンファースルホン酸等)、及び、生理的に許容される塩(例えば、塩酸塩、臭化水素酸塩、硫酸塩、硫酸水素塩、リン酸二水素塩、マレイン酸塩、フマル酸塩、2−ナフタレンスルホン酸塩、para−トルエンスルホン酸塩、メシル酸塩、ベシル酸塩若しくはイセチオン酸塩等)を形成するものが挙げられる。好ましい塩基としては、リシン、アルギニン、メグルミン、ベネタミン及びベンザチン、並びに、生理的に受容される塩(ナトリウム、カリウム又はカルシウム塩等)を形成するものが挙げられる。
【0089】
水和物の形態の化合物としては、半水和物及び一水和物等も含まれる。
【0090】
本発明に係る化合物が1以上の不斉炭素を含む場合、この化合物の光学異性体は本発明の一部である。本発明は、式(I)の化合物を純粋な異性体として含んでもよく、任意の割合の異性体混合物として含んでもよい。化合物(I)は、例えば、その原理が周知である、光学活性酸若しくは塩基を用いたラセミ塩の分別再結晶といった標準的な分離方法、又は、キラル若しくはアキラル相を用いた標準的なクロマトグラフィー法により、純粋な異性体として単離される。
【0091】
上記式(I)の化合物は、1以上の水素、炭素又はハロゲン原子(特に塩素又はフッ素)が、例えば三重水素や炭素14等の放射性同位体に置換されたものも含む。そのように標識化した化合物は、調査、代謝若しくは薬物動態の研究、又は、生化学試験に有用である。
【0092】
式(I)の化合物の分子及び反応中間体内に存在する官能基は、所望の化合物を確実に合成できる保護基で不変的又は一時的に保護してもよい。保護・脱保護反応は、当業者に周知の方法で行われる。「アミン、アルコール又はカルボン酸の一時的又は不変的な保護基」とは、「Protective Groups in Organic Synthesis」(Greene T.W.及びWuts P.G.M.,John Wiley&Sons社,2006年)及び「Protecting Groups」(Kocienski P.J.,1994年,Georg Thieme Verlag社)等に記載されたような保護基を意味する。
【0093】
上述した式(I)の化合物は、1以上の排出タンパク質P−gp及び/又はBCRPに対して阻害作用を示し、この作用は下記の試験で実証できる。また、これらの化合物について、薬理学的に有効な投与量では毒性の兆候は観察されず、従って、その毒性は薬剤としての使用に適合する。
【0094】
従って、上記化合物は、上述の排出機構により耐性株に対して不活性となった化学療法剤、特に抗感染剤又は抗ガン剤の効果を増強、すなわち向上させるのに使用できる。「増強」とは、式(I)の化合物と抗感染剤又は抗ガン剤とを組み合わせることで、上記化合物のいずれかを用いて得られる効果よりも高く、且つ、別々に得られた効果を足し合わせたものよりもはるかに高い治療効果が得られることを意味する。
【0095】
従って、本発明に係る式(I)、(IA)及び(IB)の化合物、並びに、その塩、溶媒和物又は水和物は、治療を受けた身体がMDR型耐性を発現する、抗ガン剤若しくは抗感染剤、又は、医学及び/若しくは獣医学における他の化学療法のためのアジュバントとして使用でき、それらの活性を回復できる。
【0096】
二種類の治療、すなわち式(I)の化合物を用いた治療及び化学療法剤を用いた治療は、同時的、逐次的、連続的、又は、時間に対して割り振られたものであってもよい。二つの有効成分は、それぞれ別の医薬組成物として別々に投与されてもよく、この場合、投与は同時であっても時間に対して割り振られていてもよい。あるいは、単一の医薬組成物として一緒に投与されてもよく、この場合、投与は同時である。
【0097】
時間に対して割り振られた投与の場合、様々な投与又は治療順序が想定される。式(I)の化合物は、化学療法剤が投与される前(例えば、5分、15分、30分、45分、1時間、2時間、4時間、6時間、12時間、24時間、48時間、72時間、96時間、1週、2週、3週、4週、5週、6週、8週又は12週前)に投与されてもよく、また同時に、化学療法剤が投与された後(例えば、5分、15分、30分、45分、1時間、2時間、4時間、6時間、12時間、24時間、48時間、72時間、96時間、1週、2週、3週、4週、5週、6週、8週又は12週後)に投与されてもよい。
【0098】
また、本発明の主題は、有効量の本発明に係る化合物又はその受容される塩、溶媒和物若しくは水和物と好適な賦形剤とを含む、動物(ヒトを含む)に投与できる組成物の薬剤としての、式(I)の化合物及びその薬学的に適合する塩又は場合によっては溶媒和物若しくは水和物に関する。
【0099】
本発明の主題は、好適な賦形剤とともに、薬学的に許容される塩、溶媒和物又は水和物の形態であってもよい式(I)、(IA)又は(IB)の化合物と、好ましくはアントラサイクリン、トポイソメラーゼ阻害剤、代謝拮抗剤(抗葉酸剤)、チロシンキナーゼ阻害剤、抗ウイルス剤(逆転写酵素阻害剤)、抗寄生虫剤及び抗真菌剤から選択される化学療法剤とをそれぞれ有効量で、別々に又は単一の製剤中に含む医薬組成物にも関する。
【0100】
上記賦形剤は、剤形及び望まれる投与方法に従って選択される。
【0101】
経口、舌下、皮下、筋肉内、静脈内、局部、気管内、鼻腔内、経皮、直腸又は眼内投与用の本発明に係る医薬組成物において、上記式(I)の有効成分又はその考えられる塩、溶媒和物及び水和物は、上記疾患又は障害を予防又は治療するために、薬学的に標準的な基剤との混合物として、単位投与形態で、動物及びヒトに投与されてもよい。適切な単位投与形態としては、錠剤、ゲルカプセル、粉末剤、顆粒剤及び経口溶液又は懸濁液等の経口投与形態;舌下、頬側、気管内又は鼻腔内投与形態;皮下、筋肉内又は静脈内投与形態;並びに、直腸投与形態が挙げられる。局部投与の場合、本発明に係る化合物は、クリーム、軟膏、ローション又は点眼剤として使用されてもよい。
【0102】
効果を得るためには、有効成分の投与量が体重1kg当たり1日1〜100mgの範囲であることが好ましい。化合物(I)と、効果が増強される抗感染剤又は抗ガン剤とは、4:1の比で投与されることが好ましい。
【0103】
固体組成物が錠剤形態で調製される場合、有効成分は、ゼラチン、デンプン、ラクトース、ステアリン酸マグネシウム、タルク、アラビアゴム等の薬学的ビヒクルと混合される。錠剤は、スクロース、セルロース誘導体又はその他の好適な材料で被覆してもよい。あるいは、持続性又は遅延性活性を有するように、また、所定量の有効成分を連続的に放出するように処理されてもよい。
【0104】
ゲルカプセル製剤は、有効成分を希釈剤と混合し、得られた混合物をソフト又はハードゲルカプセルに注入して得られる。
【0105】
本発明の化合物を含有する医薬組成物は、溶液、乳液、懸濁液又はシロップ等の液体形態であってもよい。適切な液体形態としては、水、グリセリンやグリコール等の有機溶媒、及び、これらの混合物の、様々な割合での水溶液が挙げられる。
【0106】
滴剤として投与するためのシロップ又はエリキシル剤状製剤は、有効成分とともに、甘味料、好ましくはカロリーフリー甘味料、殺菌剤としてのメチルパラベン及びプロピルパラベン、並びに、香料及び好適な着色料を含有してもよい。水分散性の粉末剤又は顆粒剤は、分散剤若しくは湿潤剤又は懸濁剤(ポリビニルピロリドン等)との混合物として、更には甘味料又は調味料とともに、有効成分を含有してもよい。
【0107】
従って、本発明の主題は、いくつかの有効成分を組み合わせて含有し、そのうちの一つが化合物(I)であり、その他が上述の抗感染剤又は抗ガン剤であるような医薬組成物にも関する。
【0108】
また、通常、これらの化合物を含む薬剤及び使用にも、必要な変更を加えた上で、化合物(I)及び組成物について上述したのと同様のことが適用できる。
【0109】
以下の表2〜5にまとめた実施例により本発明を説明するが、本発明はこれらに限定されない。
【0110】
以下の略号が使用される。
Et=エチル
Ac=アセチル
Bn=ベンジル
Z=−C(O)OCH2Ph
Boc=tert−ブチルオキシカルボニル
tBu=tert−ブチル
Ph=フェニル
EtOAc:酢酸エチル
DCM:ジクロロメタン
DMF:ジメチルホルムアミド
DMSO:ジメチルスルホキシド
P.E.:石油エーテル
NMM:N−メチルモルホリン
eq.:当量
IR:赤外
Rf:フロント比
DBAD:ジ−tert−ブチルアジドジカルボキシレート
DEAD:ジエチルアジドジカルボキシレート
DIAD:ジイソプロピルアジドジカルボキシレート
Asp:アスパラギン酸
Glu:グルタミン酸
Lys:リシン
EDCI:N−(3−ジメチルアミノプロピル)−N’−エチルカルボジイミド
HOBt:1−ヒドロキシベンゾトリアゾール
DCC:ジシクロヘキシルカルボジイミド
DMAP:4−ジメチルアミノピリジン
【0111】
表2
【0112】
【化16】

X1=N、Y=−C(O)−、X2=−CH−、R5=−COOR”5、−X3−X4−=−(CH2)4−NHR4である化合物(IA)
【0113】
【表2】

【0114】
表3
【0115】
【化17】

X1=N、Y=−C(O)−、X2=N、R5=−COOR”5、−X3−X4−=−(CH2)6−NHR4である化合物(IA)
【0116】
【表3】

【0117】
表4
【0118】
【化18】

X1=CH、X2=N、R6=Bn、立体配置:L体である化合物(IB)
【0119】
【表4】

【0120】
表5
【0121】
【化19】

X1=N、X2=CH、R6=Bnである化合物(IB)
【0122】
【表5】

【実施例】
【0123】
I.実験の項
化合物の合成例
【0124】
一般的な方法
・アルミホイルをシリカ(60F254、メルク社)で被覆したプレートで、薄層分析クロマトグラフィーを行う。UV(254nm)下で、ニンヒドリンのエタノール溶液又は酸性アニスアルデヒド溶液を噴霧して曝露し、検出を行う。
・60Åシリカゲル(メルク社、40〜63μm)でフラッシュクロマトグラフィー精製を行う。
・加熱ブロック融点測定器Electrothermal9200で融点を測定する。
・ADP220旋光計(Bellingham+Stanley社)又はP−1010旋光計(Jasco社)を用いて、旋光度を測定する。
・油状物の場合は塩化ナトリウムペレット上の膜として、固形物の場合は臭化カリウム中でペレット化して、赤外スペクトルを得る。測定器としては、Spectrum One FT−IR分光計(パーキンエルマー社)を用いる。
・ALS300装置(300MHz、ブルカー社)を用いて、カッコ内に記載した溶媒でプロトン核磁気共鳴(NMR)スペクトルを得る。DRX300装置(75MHz、ブルカー社)を用いて炭素スペクトルを記録する。化学シフト(δ)はppm(パーツ・パー・ミリオン)で表す。多重度は、一重線(s)、二重線(d)、三重線(t)、四重線(q)及び多重線(m)で表す。
・マススペクトルは、ジクロロメタンを溶媒とし、LCQ−Advantage装置(Thermo−Finnegan社)を用いて、エレクトロスプレーモードで得た。
【0125】
実施例1
(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(2’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.1)
a)2−[2−(tert−ブトキシカルボニル)ヒドラジノ]安息香酸(IV’A.1)
2−ヒドラジノ安息香酸塩酸塩3g(16mmol、1eq.)のジオキサン溶液(1mL/mmol)に、Boc2O3.81g(17.5mmol、1.1eq.)のジオキサン溶液(0.4mL/mmol)を添加する。溶液を0℃に冷却し、Na2CO3の5%水溶液を滴下してpHを8〜9とする。溶液を室温まで温め、24時間攪拌を継続する。ジオキサンを留去する。媒体を水に溶解し、1NのHCl溶液で酸性化してpHを1とする。混合物を酢酸エチルで三回抽出する。合わせた有機相を硫酸ナトリウムで乾燥させ、ろ過、蒸発乾固する。得られた粉末を石油エーテル中で摩砕し、真空下で乾燥させて、化合物(IV’A.1)3.75gを得る(収率93%)。
【0126】
1H NMR(300MHz,DMSO):δ(ppm)=1.41(s、9H、C(CH3)3);6.75(t,J=7.5Hz,1H,H3);6.86(d,J=8.1Hz,1H、H5);7.43(t、J=7.8Hz、1H、H4);7.81(d、J=8.1Hz、1H、H6);8.88(s、1H、NH);9.05(s、1H、NH);13(s、1H、COOH)
IR(KBr):νNH=3381.6cm−1;νCsp3−H=2971.7cm−1;νC=O=1697.6cm−1及び1676.7cm−1;νC=C=1609.1cm−1及び1587.2cm−1
融点=146℃
【0127】
b)2−[2−(tert−ブトキシカルボニル)ヒドラジノ]安息香酸のベンジルエステル(IVA.1)
Nβ−Boc−ヒドラジノ安息香酸(IV’A.1)1.5g(5.94mmol、1eq.)をメタノール(4.2mL/mmol)及び水(0.42mL/mmol)に溶解させる。CsCO3の20%水溶液を添加して、pHを7とする。溶媒を留去し、残渣をDMF(1mL/酸100mg)に二回溶解させてから、再留去する。単離されたセシウム塩をDMF(2mL/酸100mg)で希釈し、臭化ベンジル0.78mL(6.54mmol、1.1eq.)を添加する。反応混合物を室温で4時間攪拌し続ける。DMFを留去し、得られた混合物を大量の水に溶解し、酢酸エチルで抽出する。有機相を水、更にはNaCl飽和溶液で洗浄し、硫酸ナトリウムで乾燥させ、ろ過、蒸発乾固する。シリカゲルフラッシュクロマトグラフィー(DCM/P.E.混合物(体積比3/1)で溶離)によって粗生成物を精製し、1.88gの淡黄色油状物を得る(収率96%)。
【0128】
1H NMR(300MHz,DMSO):δ(ppm)=1.41(s,9H,C(CH3)3);5.34(s,2H,CH2);6.75−7.89(m,9H,Harom);8.73(s,1H,NH);9.10(s,1H,NH)
IR(NaCl):νNH=3346.2cm−1;νCsp2−H=3066.3cm−1及び3034.8cm−1;νCsp3−H=2978.4cm−1及び2934.6cm−1;νC=O=1722.9cm−1及び1692cm−1;νC=C=1606.4cm−1及び1585.6cm−1
【0129】
c)ヒドラジノエステル(IVA.1)250mg(0.73mmol、1eq.)の蒸留DCM溶液(4mL/mmol)に、トリホスゲン0.35eq.を添加する。反応媒体の温度を−10℃まで低下させ、NMM(1.08eq.)の蒸留DCM溶液(0.5mL/mmol)を導入する。反応媒体を−10℃で1時間攪拌する。H−Lys(Z)−OtBu270mg(0.73mmol、1eq.)とNMM(1.08eq.)の蒸留DCM溶液(0.5mL/mmol)とを添加する。温度を−10℃にして2時間保持し、徐々に室温まで温める。室温で20時間後、DCM(30mL/mmol(ヒドラジノエステル))を添加して媒体を希釈し、ろ過する。有機相を0.5MのKHSO4溶液、更には水で洗浄し、硫酸ナトリウムで乾燥させ、ろ過、蒸発する。シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1/2)で溶離)によって粗生成物を精製する。250mgの黄色油状物を得る(収率45%)。
【0130】
1H NMR(300MHz,CDCl3):δ(ppm)=0.87(m,2H,CH2−CHα);1.44(s,9H,C(CH3)3);1.48(s,9H,C(CH3)3);1.7(m,4H,CH2−(CH2)2−CH2);3.18(m,2H,CH2−NHZ);4.46(m,1H,CHα);5.02(s,broad,1H,NH);5.08(s,2H,CH2−C6H5);5.36(s,2H,CH2−C6H5);6.12(s,broad,1H,NH);7.12(s,broad,1H,NH);7.38−8.2(m,14H,Harom)
13C NMR(75MHz,CDCl3):δ(ppm)=11.37;14.61;21.45;22.39;28.42;29.6;30.1;33.1;41.19;53.92;60.78;66.83;67.58;77.1;77.53;77.73;77.95;82.27;127.6;128.36;128.44;128.65;128.75;128.85;129.1;132.01;133.98;135.8;137.18;141.64;155.08;156.61;156.86;166.13;171.53;172.13
IR(NaCl):νNH=3349.2cm−1;νCsp2−H=3066.1cm−1及び3033.8cm−1;νCsp3−H=2978.3cm−1及び2934.1cm−1;νC=O=1725.6cm−1,1713.6cm−1,1700.9cm−1及び1681.7cm−1;νC=C=1599.8cm−1及び1578.2cm−1
[α]D25℃=+1.68°(16.8g.L−1,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C38H48N4O9,727.3319;exp.,727.3324
【0131】
実施例2
(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.2)
a)3−[2−(tert−ブトキシカルボニル)ヒドラジノ]安息香酸(IV’A.2)
化合物(IV’A.1)で記載されたのと同様の手順に従い、3−ヒドラジノ安息香酸2.4g(16mmol、1eq.)をBoc2O3.8g(17mmol、1.1eq.)と反応させ、3.96gの酸(IV’A.2)を得る(収率98%)。
【0132】
1H NMR(300MHz,DMSO):δ(ppm)=1.42(s,9H,C(CH3)3);6.88(m,1H,H4);7.27(m,3H,H2−H5−H6);7.83(s,1H,NH);8.86(s,1H,NH);12.78(s,1H,COOH)
IR(KBr):νNH=3315.6cm−1;νCsp3−H=2982.0cm−1;νC=O=1706.4cm−1及び1689.2cm−1;νC=C=1611.2cm−1及び1594.4cm−1
融点=150℃
【0133】
b)3−[2−(tert−ブトキシカルボニル)ヒドラジノ]安息香酸のベンジルエステル(IVA.2)
化合物(IVA.1)で記載されたのと同様の手順に従い、化合物(IV’A.2)406mg(1.61mmol、1eq.)及び臭化ベンジル0.211mL(1.77mmol、1.1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1:5)で溶離)による精製を経て、283mgの黄色油状物を得る(収率51%)。
【0134】
1H NMR(300MHz,DMSO):δ(ppm)=1.40(s,9H,C(CH3)3);5.32(s,2H,CH2);7.25−7.50(m,9H,Harom);7.90(s,1H,NH);8.88(s,1H,NH)
IR(NaCl):νNH=3334.5cm−1;νCsp2−H=3066.1cm−1及び3034.5cm−1;νCsp3−H=2979.2cm−1及び2934.7cm−1;νC=O=1714.9cm−1及び1699.1cm−1;νC=C=1608.2cm−1及び1595.1cm−1
【0135】
c)化合物(IA.1)で記載されたのと同様の手順に従い、ヒドラジノエステル(IVA.2)270mg(0.79mmol、1eq.)及びH−Lys(Z)−OtBu295mg(0.79mmol、1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1/3、次いで1/2)で溶離)による精製を経て、220mgの黄色油状物を得る(収率40%)。
【0136】
1H NMR(300MHz,CDCl3):δ(ppm)=1.18(m,2H,CH2−CHα);1.35(s,9H,C(CH3)3);1.38(s,9H,C(CH3)3);1.40−1.62(m,4H,CH2−(CH2)2−CH2);3.10(m,2H,CH2−NHZ);4.35(m,1H,CHα);5.02(s,2H,CH2−C6H5);5.28(s,2H,CH2−C6H5);5.85(s,broad,1H,NH);6.95(s,broad,1H,NH);7.2−8.0(m,14H,Harom)
13C NMR(75MHz,CDCl3):δ(ppm)=22.14;28.05;28.09;29.34;32.49;40.75;53.71;66.58;66.92;82.18;82.56;127.25;128.07;128.30;128.52;128.63;129.00;129.14;130.99;135.92;136.72;142.06;154.75;155.29;156.57;165.88;171.93
IR(NaCl):νNH=3334cm−1;νCsp2−H=3066.1cm−1及び3034.3cm−1;νCsp3−H=2978.3cm−1及び2927.4cm−1;νC=O=1726.6cm−1,1714.9cm−1,1695.5cm−1及び1679.1cm−1;νC=C=1604.5cm−1及び1587.8cm−1
[α]D25.7℃=+4°(10g.L−1,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C38H48N4O9,727.3319;exp.,727.3324
【0137】
実施例3
(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(4’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.3)
a)4−[2−(tert−ブトキシカルボニル)ヒドラジノ]安息香酸(IVA’.3)
化合物(IV’A.1)で記載されたのと同様の手順に従い、4−ヒドラジノ安息香酸5g(26mmol、1eq.)をBoc2O6.54g(30mmol、1.1eq.)と反応させ、6.7gの酸(IVA’.3)を得る(収率100%)。
【0138】
1H NMR(300MHz,DMSO):δ(ppm)=1.42(s,9H,C(CH3)3);6.65(d,J=8.7Hz,2H,H3,H5);7.74(d,J=8.4Hz,2H,H2,H6);8.24(s,1H,NH);8.92(s,1H,NH);12.23(s,1H,COOH)
IR(KBr):νNH=3401.4cm−1;νCsp3−H=2981.5cm−1;νC=O=1700.9cm−1及び1683.2cm−1;νC=C=1606.2cm−1
融点=144℃
【0139】
b)4−[2−(tert−ブトキシカルボニル)ヒドラジノ]安息香酸のベンジルエステル(IVA.3)
化合物(IVA.1)で記載されたのと同様の手順に従い、化合物(IVA’.3)1g(3.96mmol、1eq.)及び臭化ベンジル0.51mL(4.36mmol、1.1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1/2)で溶離)による精製を経て、800mgの黄色油状物を得る(収率58%)。
【0140】
1H NMR(300MHz,DMSO):δ(ppm)=1.42(s,9H,C(CH3)3);5.28(s,2H,CH2);6.67−7.84(m,9H,Harom);8.35(s,1H,NH);9(s,1H,NH)
IR(NaCl):νNH=3313.9cm−1;νCsp2−H=3067cm−1及び3034.5cm−1;νCsp3−H=2983cm−1及び2934.6cm−1;νC=O=1709.1cm−1及び1688.9cm−1;νC=C=1609.4cm−1
【0141】
c)化合物(IA.1)で記載されたのと同様の手順に従い、ヒドラジノエステル(IVA.3)244mg(0.71mmol、1eq.)及びH−Lys(Z)−OtBu260mg(0.71mmol、1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1/2)で溶離)による精製を経て、150mgのベージュ色粉末を得る(収率30%)。
【0142】
1H NMR(300MHz,CDCl3):δ(ppm)=0.89(m,2H,CH2−CHα);1.48(s,18H,C(CH3)3,C(CH3)3);1.68(m,4H,CH2−(CH2)2−CH2);3.18(m,2H,CH2−NHZ);4.46(m,1H,CHα);5.0(s,broad,1H,NH);5.09(s,2H,CH2−C6H5);5.36(s,2H,CH2−C6H5);6.1(s,broad,1H,NH);7.08(s,broad,1H,NH);7.8−8.1(m,14H,Harom)
13C NMR(75MHz,CDCl3):δ(ppm)=14.60;21.46;22.44;28.21;28.40;28.45;29.69;30.09;31.84;32.69;36.89;41.06;54.05;60.81;66.92;66.99;77.10;77.53;77.73;77.95;82.58;82.92;121.85;126.53;128.43;128.53;128.60;128.88;128.98;130.86;136.49;137.03;146.45;154.97;155.36;156.96;163.05;166.3;172.28
IR(KBr):νNH=3389.9cm−1;νCsp2−H=3068.2cm−1及び3035.4cm−1;νCsp3−H=2978.1cm−1及び2932.6cm−1;νC=O=1719.3cm−1,1705.5cm−1,1672.2cm−1及び1665.2cm−1;νC=C=1607.4cm−1
[α]D25℃=+2.15°(13.9g.L−1,DCM)
融点=106℃
HRMS−ESI(m/z):[M+Na]calc.for C38H48N4O9,727.3319;exp.,727.3315
【0143】
実施例4
(2R)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のベンジルエステル(IA.4)
ヒドラジノエステル(IVA.2)500mg(1.46mmol、1eq.)の蒸留DCM溶液(4mL/mmol)にトリホスゲン0.35eq.を添加する。反応媒体の温度を−10℃まで低下させ、NMM(2eq.)の蒸留DCM溶液(0.5mL/mmol)を導入する。反応媒体を−10℃で1時間攪拌する。次いで、HCl.H−D−Lys(Z)−OBn600mg(1.46mmol、1eq.)とNMM(2eq.)の蒸留DCM溶液(0.5mL/mmol)とを添加する。温度を−10℃にして2時間保持し、徐々に室温まで温める。室温で20時間後、DCM(30mL/mmol(ヒドラジノエステル))を添加して媒体を希釈し、ろ過する。有機相を0.5MのKHSO4溶液、更には水で洗浄し、硫酸ナトリウムで乾燥させ、ろ過、蒸発する。シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)によって、粗生成物を精製する。362mgの黄色ペースト状物質を得る(収率34%)。
【0144】
1H NMR(300MHz,DMSO):δ(ppm)=0.88−1.20(m,2H,CH2−CHα);1.40(s,9H,COO(CH3)3);1.60−1.93(m,4H,CH2−(CH2)2−CHα);3.07−3.14(m,2H,CH2−NHZ);4.55−4.63(m,1H,CHα);5.06(s,2H,CH2−Ph);5.17(s,2H,CH2−Ph);5.33(s,2H,CH2−Ph);5.35(s,2H,CH2Ph);7.12(s broad,1H,NH);7.30−7.43(m,20H,Harom);7.70(s broad,1H,NH)
13C NMR(75MHz,DMSO):δ(ppm)=28.73;29.80;30.48;31.11;40.94;54.24;65.97;66.66;67.14;81.28;125.55;127.48;128.57;128.81;128.88;128.93;129.09;129.18;129.26;129.36;129.38;129.54;130.56;136.91;138.13;143.79;150.01;155.32;156.44;156.91;166.25;173.29
IR(KBr):νNH=3344cm−1;νCsp2 Harom=3065cm−1及び3033cm−1;νC=O=1715cm−1;νC−O ester=1248cm−1及び1158cm−1
[α]D25℃=+3°(5g.L−1,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C41H46N4O9,761.3162;exp.,761.3163
【0145】
実施例5
(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のベンジルエステル(IA.5)
化合物(IA.4)で記載されたのと同様の手順に従い、ヒドラジノエステル(IVA.2)500mg(1.46mmol、1eq.)及びHCl.H−Lys(Z)−OBn610mg(1.46mmol、1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、320mgの黄色ペースト状物質を得る(収率30%)。
【0146】
1H NMR(300MHz,DMSO):δ(ppm)=1.31(m,2H,CH2−CHα);1.38(s,9H,COO(CH3)3);1.61−1.77(m,4H,CH2−(CH2)2−CHα);2.94−2.96(m,2H,CH2−NHZ);4.19−4.21(m,1H,CHα);4.99(s,2H,CH2−Ph);5.13(s,2H,CH2−Ph);5.35(s,2H,CH2Ph);7.21−7.72(m,19H,Harom)
13C NMR(75MHz,DMSO):δ(ppm)=27.21;28.13;28.73;29.80;30.48;31.10;40.93;54.23;65.97;66.66;67.14;81.27;128.57;128.81;128.88;128.93;129.00;129.18;129.23;129.26;129.38;130.27;130.56;136.79;136.91;138.13;143.79;155.32;156.45;156.91;166.25;173.04
IR(KBr):νNH=3354cm−1;νCsp2 Harom=3066cm−1及び3034cm−1;νC=O=1723cm−1;νC−O ester=1248cm−1及び1156cm−1
[α]D25℃=−3°(5g.L−1,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C41H46N4O9,761.3162;exp.,761.3160
【0147】
実施例6
(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(フェニルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.6)
a)3−(2−tert−ブトキシカルボニルヒドラジノ)安息香酸のフェニルエステル(IVA.6)
化合物(IV’A.2)780mg(3mmol、1eq.)のDCM(3mL/mmol)及びDMF(溶解するのに最低限の量)溶液に、DCC618mg(3mmol、1eq.)及びフェノール873mg(9mmol、3eq.)を添加する。室温で15分攪拌し、DMAP18mg(0.15mmol、0.05eq.)を導入する。反応混合物を室温で4時間攪拌し、ろ過する。ろ液を蒸発乾固し、30mLのEtOAcに溶解する。有機相を0.1NのHCl溶液、0.1NのNaHCO3溶液、及びNaCl飽和溶液で二回洗浄し、硫酸ナトリウムで乾燥させ、ろ過、蒸発する。シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比1/9)で溶離)によって、粗生成物を精製する。
【0148】
1H NMR(300MHz,DMSO):δ(ppm)=1.41(s,9H,C(CH3)3);6.98−7.50(m,9H,Harom);7.97(s,1H,NH);8.93(s,1H,NH)
【0149】
b)化合物(IA.1)で記載されたのと同様の手順に従い、ヒドラジノエステル(IVA.6)300mg(0.9mmol、1eq.)及びH−Lys(Z)−OtBu340mg(0.9mmol、1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、130mgの黄色固体を得る。
【0150】
1H NMR(300MHz,CDCl3):δ(ppm)=1.19(m,2H,CH2−CHα);1.39(s,9H,C(CH3)3);1.41(s,9H,C(CH3)3);1.50−1.72(m,4H,CH2−(CH2)2−CH2);2.97(m,2H,CH2−NHZ);4.04(m,1H,CHα);4.99(s,2H,CH2−C6H5);7.23−7.94(m,14H,Harom);8.14(s,broad,1H,NH)
IR(KBr):νNH=3378.6cm−1;νCsp2 Harom=3066cm−1及び3034cm−1;νCsp3−H=2978.2cm−1及び2931.7cm−1;νC=O=1737.6cm−1及び1700.9cm−1;νC−O ester=1246.2cm−1及び1158.4cm−1
[α]D25℃=0.3°(5g.L−1,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C37H46N4O9,713.3162;exp.,713.3162
【0151】
実施例7
2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニル]−1−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノカルボン酸のベンジルエステル(IA.7)
a)1−ベンジルオキシカルボニル−1−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジン(III.3)
化合物(III.3)は、以下に記載する化合物(III.2)の合成と同様の手順に従い、ベンジルオキシカルボニルヒドラジン及び6−(ベンジルオキシカルボニルアミノ)ヘキサノールを出発材料として使用することで得られる。
【0152】
1H NMR(300MHz,DMSO):δ(ppm)=1.39−1.34(m,6H,(CH2)3);1.51−1.46(m,2H,CH2);2.98−2.92(q,2H,CH2−NHZ);3.31−3.26(t,2H,CH2−N−NH2);4.57(s,2H,NH2);5.00(s,2H,CH2−Ph);5.06(s,2H,CH2−Ph);7.37−7.20(m,10H,Harom)
IR(KBr):νNH=3306cm−1;νCsp2 Harom=3061cm−1及び3030cm−1;νC=O=1676cm−1;νC=C=1535cm−1;νC−O ester=1257cm−1及び1190cm−1
【0153】
b)化合物(IA.4)で記載されたのと同様の手順に従い、ヒドラジノエステル(IVA.2)850mg(2.5mmol、1eq.)及び化合物(III.3)990mg(2.5mmol、1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、244mgの油状物を得る。
【0154】
1H NMR(300MHz,DMSO):δ(ppm)=1.19−1.30(m,6H,(CH2)3);1.38(s,9H,COO(CH3)3);1.49(m,2H,CH2);2.98−2.92(q,2H,CH2−NHZ);3.41(t,2H,CH2−N−NH2);4.99(s,2H,CH2−Ph);5.10(s,2H,CH2−Ph);5.35(s,2H,CH2Ph);7.33−7.50(m,19H,Harom)
IR(NaCl):νNH=3308.0cm−1;νCsp2 Harom=3065.9cm−1及び3034.0cm−1;νCsp3−H=2978.2cm−1及び2932.8cm−1;νC=O=1715.3cm−1;νC−O ester=1251.3cm−1及び1161.1cm−1
HRMS−ESI(m/z):[M+Na]calc.for C42H49N5O9,790.3428;exp.,790.3429
【0155】
実施例8
2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニル]−1−(6−tert−ブチルオキシカルボニルアミノヘキシル)ヒドラジノカルボン酸のベンジルエステル(IA.8)
a)1−ベンジルオキシカルボニル−1−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジン(III.4)
化合物(III.4)は、以下に記載する化合物(III.2)の合成と同様の手順に従い、ベンジルオキシカルボニルヒドラジン及び6−(tert−ブトキシカルボニルアミノ)ヘキサノールを出発材料として使用し、且つ、光延反応においてDIADをDBADに置き換えることで得られる。
【0156】
1H NMR(300MHz,DMSO):δ(ppm)=1.35(s,9H,COO(CH3)3);1.20−1.50(m,8H,CH2−(CH2)4−CH2);2.87(q,2H,CH2−NHZ);3.28(t,2H,CH2−N−NH2);4.57(s,2H,NH2);5.06(s,2H,CH2−Ph);6.75(s,1H,NH);7.33(m,5H,Harom)
IR(KBr):νNH=3345cm−1;νCsp2 Harom=3065cm−1及び3033cm−1;νCsp3=2975cm−1及び2933cm−1;νC=O=1696cm−1;νC=C=1523cm−1;νC−O ester=1250cm−1及び1174cm−1
【0157】
b)化合物(IA.4)で記載されたのと同様の手順に従い、ヒドラジノエステル(IVA.2)850mg(2.5mmol、1eq.)及び化合物(III.4)913mg(2.5mmol、1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、50mgの茶色ペースト状物質を得る。
【0158】
1H NMR(300MHz,DMSO):δ(ppm)=1.23−1.30(m,6H,(CH2)3);1.36(s,9H,COO(CH3)3);1.39(s,9H,COO(CH3)3);1.48(m,2H,CH2);2.86(q,2H,CH2−NHZ);3.41(t,2H,CH2−N−NH2);5.09(s,2H,CH2−Ph);5.35(s,2H,CH2−Ph);7.28−7.47(m,14H,Harom)
IR(NaCl):νNH=3325.0cm−1;νCsp2 Harom=3065.9cm−1及び3027.4cm−1;νCsp3−H=2920.8cm−1;νC=O=1704.9cm−1及び1684.5cm−1
HRMS−ESI(m/z):[M+Na]calc.for C39H51N5O9,756.3584;exp.,756.3585
【0159】
実施例9
(3S)−4−[2−(6−ベンジルオキシカルボニルアミノヘキシル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.1)
a)6−ベンジルオキシカルボニルアミノヘキサン−1−オール(7)
6−アミノヘキサノール(6)1g(8.53mmol、1eq.)及びNa2CO3466mg(4.4mmol、2.2eq.)を水8mL及びTHF4mLに溶解させる。媒体を5℃に冷却する。次いで、THF2.5mLに溶解したクロロぎ酸ベンジル1.33mL(9.4mmol、1.1eq.)を滴下する。室温で2時間45分、攪拌しながら反応させる。THFを留去する。生成された固体を真空下でろ別し、水で洗浄し、更に真空下で乾燥させて、1.848gの白色固体を得る(収率86%)。
【0160】
1H NMR(300MHz,CDCl3):δ(ppm)=1.20−1.50(m,8H,CH2−(CH2)4−CH2);3.14(m,2H,CH2−NH);3.55(m,2H,CH2−OH);4.70(s,broad,1H,NH);5.05(s,2H,CH2Ph);7.30(m,5H,aromatic)
IR(KBr):νOH=3384cm−1;νNH=3335cm−1;νCsp2 Harom=3061cm−1及び3030cm−1;νCsp3=2942cm−1及び2859cm−1;νC=O=1685cm−1;νC=C=1530cm−1及び1464cm−1;νC−O ester=1290cm−1及び1253cm−1
融点=86℃
【0161】
b)N−(tert−ブトキシカルボニルアミノ)フタルイミド(9)
ディーン・スターク装置を備えた一口丸底フラスコ内で、無水フタル酸(3.36g、22.7mmol、1eq.)及びカルバジン酸tert−ブチル(3g、22.7mmol、1eq.)をトルエン65mL中に配置する。溶液を加熱して還流させる。2時間30分後、反応媒体を室温まで冷やし、次いで0℃まで冷やす。沈殿した生成物を、真空下でろ別する。続いて、生成物を酢酸エチルで再結晶させ、5.6gの半透明の白色結晶固体を得る(収率94%)。
【0162】
1H NMR(300MHz,CDCl3):δ(ppm)=1.52(s,9H,COOC(CH3)3);6.57(s,1H,NH);7.87(m,4H,aromatic)
IR(KBr):νNH=3323cm−1;νCsp2 Harom=3092cm−1;νCsp3=2984cm−1;νC=O=1798cm−1及び1736cm−1;νC=C=1530cm−1
融点=188−190℃(lit.:184−186℃)
【0163】
c)N−[(6−ベンジルオキシカルボニルアミノヘキシル)(tert−ブトキシカルボニル)アミノ]フタルイミド(10)
N−(tert−ブトキシカルボニルアミノ)フタルイミド(9)(1.86g、7.10mmol、1eq.)、保護されたアミノアルコール(7)(1.78g、7.10mmol、1eq.)、及びトリフェニルホスフィン(1.5eq.)を、0℃、アルゴン下で無水THF(10mL/mmol(フタルイミド))に溶解させる。DIAD1.5eq.を添加する。0℃で30分間、更には室温で攪拌を続ける。その後、THFを留去する。シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.:体積比1/1)で残渣を精製して、2.71gの橙色油状物を得る(収率77%)。
【0164】
1H NMR(300MHz,CDCl3):δ(ppm)=1.10−1.30(m,8H,CH2−(CH2)4−CH2);1.40(s,9H,COOC(CH3)3);3.10(m,2H,CH2−NH);3.55(m,2H,CH2−N−N);4.05(m,1H,NH);5.05(s,2H,CH2−Ph);6.30(s,broad,1H,NH);7.30(m,5H,phenyl);7.75(m,4H,aromatic phthalyl)
IR(NaCl):νNH=3347cm−1;νCsp2 Harom=3065cm−1及び3032cm−1;νCsp3=2980cm−1及び2936cm−1;νC=O=1796cm−1及び1737cm−1;νC=C=1530cm−1;νC−O ester=1246cm−1及び1157cm−1
【0165】
d)1−tert−ブチルオキシカルボニル−1−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジン(III.2)
フタロイル誘導体(10)(1.5g、3.03mmol、1eq.)をEtOH(1mL/60mg)に溶解させる。媒体を−20℃まで冷却する。次いで、ヒドラジン一水和物(1.5eq.)を添加する。−20℃で30分間、更に室温で3時間、媒体を攪拌し続ける。生成された白色固体をろ別する。ろ液を蒸発させ、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.:体積比4/6)で精製して、734mgの黄色油状物を得る(収率67%)。
【0166】
1H NMR(300MHz,CDCl3):δ(ppm)=1.15−1.50(m,18H,CH2−(CH2)4−CH2及びCOOC(CH3)3);3.10(q,J=6.8Hz及びJ=6.4Hz,2H,CH2−NHZ);3.28(t,J=6.8Hz,2H,CH2−N−NH2);3.85(s,broad,2H,NH2);4.72(s,broad,1H,NHZ);5.03(s,2H,CH2Ph);7.30(m,5H,aromatic)
IR(NaCl):νNH=3335cm−1;νCsp2 Harom=3065cm−1及び3033cm−1;νCsp3=2975cm−1及び2933cm−1;νC=O=1694cm−1;νC=C=1532cm−1及び1455cm−1;νC−O ester=1255cm−1,1167cm−1及び1141cm−1
【0167】
e)3−tert−ブトキシカルボニルアミノ−4−ヒドロキシブタン酸のベンジルエステル(12)
Boc−Asp(OBn)−OH(11)2g(6.2mmol、1eq.)を、無水THF100mLに溶解させる。媒体をアルゴン下に置き、−15℃まで冷却する。次いで、トリエチルアミン3.5mL(24.8mmol、4eq.)及びクロロぎ酸イソブチル854μL(6.2mmol、1eq.)を添加する。20分攪拌後、THF40mL及びMeOH10mLに溶解させたNaBH4(400mg、10.54mmol、1.7eq.)の溶液に、−78℃、アルゴン下で反応媒体を滴下する。媒体を2時間攪拌し続ける。次いで、1MのHCl溶液150mLを添加する。水相をEtOAcで三回抽出する。有機相をNa2CO3飽和溶液で三回洗浄し、無水硫酸ナトリウムで乾燥させ、蒸発させ、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.:溶出勾配1/3から1/1(体積比))で精製して、1.043gの橙/茶色油状物を得る(収率56%)。
【0168】
1H NMR(300MHz,CDCl3):δ(ppm)=1.38(s,9H,COOC(CH3)3);2.44(s,broad,1H,OH);2.62(d,J=6.4Hz,2H,CH2COO);3.62(s,2H,CH2OH);3.95(m,1H,CHα);5.05(s,2H,CH2Ph);5.15(s,broad,1H,NH);7.28(m,5H,aromatic)
IR(NaCl):νNH and OH=3380cm−1;νCsp2 Harom=3066cm−1及び3034cm−1;νCsp3=2977cm−1及び2933cm−1;νC=O=1713cm−1;νC=C=1515cm−1及び1456cm−1;νC−O ester=1249cm−1及び1166cm−1
【0169】
f)3−tert−ブトキシカルボニルアミノ−4−オキソブタン酸のベンジルエステル(V.1)
蒸留したばかりのDCM9mLに塩化オキサリル(11.75mmol、2.5eq.)1.03mLを入れて調製した溶液に、−78℃、アルゴン下で、DMSO1.67mL(23.5mmol、5eq.)を滴下する。このような条件下、媒体を15分間攪拌し続ける。蒸留したばかりのDCM20mLに溶解させた化合物(12)1.45g(4.70mmol、1eq.)を添加する。同じ条件下で、攪拌を1時間続ける。続いて、蒸留したばかりのトリエチルアミン5.9mL(42.3mmol、9eq.)を滴下する。−78℃で30分間、更に室温で15分間、攪拌し続ける。DCM及びH2Oを添加して媒体を希釈する。水相をDCMで二回抽出する。有機相を合わせて、無水硫酸ナトリウムで乾燥させ、蒸発させる。シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.:3/7+0.1%v/vのトリエチルアミン)で精製して、1.3gの淡黄色油状物を得る(収率85%)。
【0170】
1H NMR(300MHz,CDCl3):δ(ppm)=1.45(s,9H,COOC(CH3)3);2.90(dd,J=4.9Hz及びJ=17.6Hz,1H,CH2COO);3.10(dd,J=4.9Hz及びJ=17.7Hz,1H,CH2COO);4.40(m,1H,CαH);5.15(s,2H,CH2Ph);5.62(d,J=8.3Hz,1H,NH);7.37(m,5H,aromatic);9.70(s,1H,CHO)
IR(NaCl):νNH=3376cm−1;νCsp2 Harom=3066cm−1及び3034cm−1;νCsp3=2978cm−1及び2933cm−1;νC=O=1731cm−1;νC=C=1499cm−1及び1455cm−1;νC−O ester=1253cm−1及び1165cm−1
[α]D26.6℃=−3.88°(0.1g/L,DCM)
【0171】
g)アルデヒド(V.I)304mg(0.99mmol、1.67eq.)及びアザ−アミノ酸(III.2)216mg(0.59mmol、1eq.)を、MeOH/AcOH混合物:99/1(1mL/40mg(アルデヒド))に溶解させる。この溶液に、シアノ水素化ホウ素ナトリウム1.33eq.を、5〜6mgずつ45分かけて添加する。媒体を、室温で一晩攪拌し続ける。次に、フラスコを氷冷浴中に浸し、NaHCO3飽和溶液(1mL/10mg(アルデヒド))をゆっくりと添加する。水相をEtOAcで三回抽出する。有機相をNaHCO3飽和溶液で三回洗浄し、無水硫酸ナトリウムで乾燥させ、蒸発させる。更に、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.:体積比3/7)で精製して、265mgの黄色油状物を得る(収率41%)。
【0172】
1H NMR(300MHz,CDCl3):δ(ppm)=1.44(s,9H,COOC(CH3)3);1.56−1.46(m,17H,CH2−(CH2)4−CH2及びCOOC(CH3)3);2.65(m,2H,CH2COOBn);2.95(m,2H,CH2−NH);3.18(m,2H,CH2−N−N);3.25(m,2H,CH2−N−N);4.00(m,1H,CHα);4.30(s,broad,1H,NH);4.85(s,broad,1H,NH);5.12(d,J=6.0Hz,4H,CH2−Ph);5.15(m,1H,NH);7.45−7.30(m,10H,aromatic)
13C NMR(75MHz,DMSO):δ(ppm)=26.23;26.34;28.41;28.28;29.89;37.46;40.98;49.16;53.47;66.60;66.50;80.55;79.55;128.62;128.53;128.33;128.28;128.09;136.74;135.74;155.38;156.48;156.30;171.30
IR(NaCl):νNH=3339cm−1;νCsp2 Harom=3065cm−1及び3033cm−1;νCsp3=2976cm−1及び2933cm−1;νC=O=1696cm−1;νC=C=1523cm−1及び1455cm−1;νC−O ester=1248cm−1及び1166cm−1
[α]D25℃=−0.61°(18.9g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C35H52N4O8,679.3683;exp.,679.3688
【0173】
実施例10
(3S)−4−[2−(3−ベンジルオキシカルボニルアミノプロピル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.2)
a)1−tert−ブトキシカルボニル−1−(3−ベンジルオキシカルボニルアミノプロピル)ヒドラジン(III.5)
化合物(III.5)は、化合物(III.2)の合成と同様の手順に従い、tert−ブトキシカルボニルヒドラジン及び3−(ベンジルオキシカルボニルアミノ)プロパノールを出発材料として使用し、且つ、光延反応においてDIADをDEADと置き換えることで得られる。
【0174】
1H NMR(300MHz,CDCl3):δ(ppm)=1.50(s,9H,COOC(CH3)3);1.80(quint,J=19.2Hz,J=13.2Hz及びJ=6.4Hz,2H,CH2−CH2−CH2);3.25(q,J=6.4Hz及びJ=12.8Hz,2H,CH2NH);3.50(t,J=6.4Hz,2H,N−N−CH2);5.10(s,2H,COOCH2−Ph);6.50(s,broad,1H,NH);7.40(m,5H,phenyl)
IR(NaCl):νNH=3335cm−1;νCsp2 Harom=3066cm−1及び3035cm−1;νCsp3=2977cm−1及び2934cm−1;νC=O=1694cm−1;νC−O ester=1250cm−1及び1143cm−1
【0175】
b)アスパラギン酸(20mg、0.17mmol、1.1eq.)のDMF溶液(2mL/0.1mmol(アスパラギン酸))に、HOBt1.3eq.、更にはEDCI1.3eq.を添加する。次いで、アザ−アミノ酸(III.5)(50mg、0.15mmol、1eq.)を添加する。溶液を室温で一晩攪拌する。溶液を酢酸エチルで希釈し、続いて、NaHCO3飽和溶液、更に1NのHClで三回洗浄する。有機相を無水硫酸ナトリウムで乾燥させ、蒸発させる。残渣をシリカゲルクロマトグラフィー(MeOH/DCM:体積比1/99)にかけ、20mgの淡黄色油状物を得る(収率20%)。
【0176】
1H NMR(300MHz,CDCl3):δ(ppm)=1.40(s,9H,COOC(CH3)3);1.45(s,9H,COOC(CH3)3);1.70(m,2H,CH2−CH2−CH2);2.80(dd,J=17.5Hz及びJ=4.5Hz,1H,CH2COOBn);3.00(dd,J=17.5Hz及びJ=4.5Hz,1H,CH2COOBn);3.30(m,2H,CH2NH);3.50(m,2H,N−N−CH2);4.60(m,1H,CαH);5.12(s,2H,CH2Ph);5.15(s,2H,CH2Ph);5.62(d,1H,NH);7.40(m,10H,aromatic);8.40(s,1H,CONHN)
13C NMR(75MHz,CDCl3):27.96(1C,CH2−CH2−CH2−NHZ);28.50(3C,COOC(CH3)3);28.69(3C,COOC(CH3)3);36.20(1C,CH2 asp);38.39(1C,CH2−CH2−CH2NHZ);47.00(1C,N−N−CH2−CH2−CH2−NHZ);49.73(1C,CαH);66.94(1C,CH2−PH);67.38(1C,CH2−PH);77.04(1C,COOC(CH3)3);77.88(1C,COOC(CH3)3);128.39(2C,CHar);128.48(2C,CHar);128.68(1C,CHar);128.86(1C,CHar);129.02(2C,CHar);129.14(2C,CHar);135.67(1C,CIVar);137.12(1C,CIVar);153.25(NHCOO);155.98(1C,NHCOO);157.04(1C,CH2COO);169.80(1C,CONHN);171.88(1C,CONNH)
[α]D22.6℃=+7.14°(2.8g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C32H44N4O9,651.3006;exp.,651.3010
【0177】
実施例11
(3S)−4−[2−(4−ベンジルオキシカルボニルアミノフェニル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.3)
a)(4−ヨードフェニル)カルバミン酸のベンジルエステル(5)
4−ヨードアニリン(4)0.5g(2.28mmol、1eq.)をDCM20mLに溶解させる。蒸留トリエチルアミン1mLを添加し、混合物を0℃に冷却する。クロロぎ酸ベンジル(1.95mL、13.7mmol、6eq.)のDCM(20mL)溶液を、攪拌しながら滴下する。添加が完了したら、混合物を0℃で15分間静置し、その後、室温まで温める。そして、反応媒体を20時間還流させる。室温まで冷却後、反応混合物を1MのHCl溶液に注ぐ。DCMで希釈後、有機相を回収する。更にNa2CO3飽和溶液で洗浄し、Na2SO4で乾燥させ、ろ過、蒸発乾固する。得られた粗生成物をシリカゲルクロマトグラフィー(DCM/P.E.混合物(体積比3/2)で溶離)にかけて、白色粉末(m=460mg)を得る(収率60%)。
【0178】
1H NMR(300MHz,DMSO):δ(ppm)=5.14(s,2H,CH2−C6H5);7.28−7.69(m,9H,Harom);9.89(s,1H,NH)
IR(KBr):νNH=3322cm−1;νCsp2 Harom=3034cm−1;νC=O=1701cm−1;νC=C=1528cm−1;νC−O ester=1236cm−1
融点=130℃
【0179】
b)1−(4−ベンジルオキシカルボニルアミノフェニル)ヒドラジンカルボン酸のtert−ブチルエステル(III.1)
丸底フラスコに蒸留DMF(4.5mL)を導入する。「凍結−真空−解凍」サイクルを四回繰り返す。アルゴン雰囲気下に配置して、化合物(5)1g(2.83mmol、1eq.)、CuI54mg(0.283mmol、0.1eq.)、1,10−フェナンスロリン51mg(0.283mmol、0.1eq.)、Cs2CO31.29g(3.96mmol、1.4eq.)及びカルバジン酸tert−ブチル450mg(3.39mmol、1.2eq.)を導入する。「凍結−真空−解凍」サイクルを更に四回繰り返し、媒体をアルゴン雰囲気下に配置して80℃まで加熱する。20分後にアルゴン気流を停止する。80℃で18時間反応させる。室温まで冷却後、酢酸エチルですすぎながら、焼結体上で厚さ1cmのシリカ層を通じて媒体をろ過する。酢酸エチル及びDMFを留去して粗生成物を得る。それをシリカゲルクロマトグラフィー(P.E./EtOAc:体積比(2/1)から(1/1)の展開勾配)にかけ、100mgの麦わら色粉末を得る(収率10%)。
【0180】
1H NMR(300MHz,CDCl3):δ(ppm)=1.43(s,9H,C(CH3)3);5.00(sl,2H,NH2);5.14(s,2H,CH2−C6H5);7.29−7.55(m,9H,Harom);9.7(s,1H,NH)
13C NMR(75MHz,CDCl3):δ(ppm)=28.63;28.72;28.76;68.36;71.73;113.21;113.3;117.43;122.06;122.13;129.63;129.74;129.98;131.16;138.04;138.94;153.54;155.92
IR(KBr):νNH=3323cm−1;νCsp3=2978cm−1;νC=O=1699cm−1及び1603cm−1;νC=C=1538cm−1
【0181】
c)化合物(IB.2)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.1)100mg(0.27mmol、1eq.)及びBoc−Asp(OBn)−OH100mg(0.31mmol、1.1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1/1)で溶離)による精製を経て、120mgの麦わら色粉末を得る(収率64%)。
【0182】
1H NMR(300MHz,DMSO):δ(ppm)=1.4(s,18H,C(CH3)3);4.1(m,2H,CH2β);4.41(m,1H,CHα);5.18(s,2H,CH2−C6H5);5.76(s,2H,CH2−C6H5);7.2−7.6(m,14H,Harom);9.8(s,1H,NH);10.6(s,1H,NH)
13C NMR(75MHz,CDCl3):δ(ppm)=14.6;21.46;28.28;28.50;28.69;28.75;30.1;36.24;49.74;60.84;67.36;77.10;77.52;77.95;81.15;82.73;84.32;119.19;125.29;128.69;128.71;128.79;129.00;135.73;136.27;136.50;137.26;150.52;153.36;153.82;156.04;169.54;170.55;171.66;171.8
IR(KBr):νNH=3347cm−1;νCsp3=2980cm−1;νC=O=1721cm−1,1703cm−1及び1676cm−1;νC−O ester=1162cm−1
融点=109℃
HRMS−ESI(m/z):[M+Na]calc.for C35H42N4O9,685.2849;exp.,685.2854
【0183】
実施例12
(4S)−5−[2−(4−ベンジルオキシカルボニルアミノフェニル)−2−tert−ブトキシカルボニルヒドラジノ]−4−tert−ブトキシカルボニルアミノ−5−オキソペンタン酸のベンジルエステル(IB.4)
化合物(IB.2)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.1)100mg(0.27mmol、1eq.)及びBoc−Glu(OBn)−OH105mg(0.31mmol、1.1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1/1)で溶離)による精製を経て、60mgの麦わら色粉末を得る(収率32%)。
【0184】
1H NMR(300MHz,CDCl3):δ(ppm)=1.46(s,9H,C(CH3));1.48(s,9H,C(CH3));1.7(m,2H,CH2);2.6(m,2H,CH2);4.3(m,1H,CHα);5.15(s,2H,CH2−C6H5);5.21(s,2H,CH2−C6H5);6.7(s,1H,NH);7.3−7.5(m,14H,Harom);8.6(s,1H,NH)
13C NMR(75MHz,CDCl3):δ(ppm)=28.04;28.53;28.68;30.11;30.74;52.26;65.71;67.03;67.44;77.03;77.45;77.65;77.87;80.86;82.83;119.21;125.48;127.4;128.67;128.73;128.76;129.02;136.06;136.23;136.40;137.40;138.14;153.43;153.77;156.26;171.28;173.55
IR(KBr):νNH=3350cm−1;νCsp3=2981cm−1;νC=O=1703cm−1,1724cm−1及び1676cm−1;νC=C=1530cm−1;νC−O ester=1164cm−1
融点=115℃
HRMS−ESI(m/z):[M+Na]calc.for C36H44N4O9,699.3006;exp.,699.3010
【0185】
実施例13
(3S)−4−[2−(5−ベンジルオキシカルボニルアミノペンチル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.5)
a)1−(5−ベンジルオキシカルボニルアミノペンチル)ヒドラジンカルボン酸のtert−ブチルエステル(III.6)
化合物(III.6)は、化合物(III.2)の合成と同様の手順に従い、tert−ブトキシカルボニルヒドラジン及び5−(ベンジルオキシカルボニルアミノ)ペンタノールを出発材料として使用し、且つ、光延反応においてDIADをDBADに置き換えることで得られる。
【0186】
1H NMR(300MHz,CDCl3):δ(ppm)=1.40−1.70m,15H,CH2−(CH2)3−CH2及びCOOC(CH3)3);3.20(q,J=6.8Hz及びJ=6.4Hz,2H,CH2−NHZ);3.35(t,J=7.2Hz,2H,CH2−N−N);4.00(s,2H,NH2);4.80(s,broad,1H,NHZ);5.10(s,2H,CH2Ph);7.36(m,5H,aromatic)
IR(NaCl):νNH=3340cm−1;νCsp2 Harom=3065cm−1及び3033cm−1;νCsp3=2975cm−1及び2933cm−1;νC=O=1694cm−1;νC−O ester=1251cm−1及び1143cm−1
【0187】
b)化合物(IB.2)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.6)120mg(0.34mmol、1eq.)及びBoc−Asp(OBn)−OH120mg(0.37mmol、1.1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比4:6)で溶離)による精製を経て、136mgの黄色油状物を得る(収率61%)。
【0188】
1H NMR(300MHz,CDCl3):δ(ppm)=1.10−1.30(m,24H,CH2−(CH2)3−CH2及びCOOC(CH3)3);2.66−2.94(m,2H,CH2COOBn);3.12(m,2H,CH2−NHZ);3.36(t,J=6.4Hz,2H,CH2−N−N);4.50(s,broad,1H,CHα);4.85(s,broad,1H,NH);5.05(d,J=12.8Hz,4H,CH2−Ph);5.60(s,broad,1H,NH);7.30(m,10H,aromatic);8.30(s,1H,CO−NH−N)
13C NMR(75MHz,CDCl3):δ(ppm)=26.19;27.27;28.20;28.33;29.73;35.91;40.83;49.36;66.60;66.95;80.76;81.27;128.08;128.28;128.44;128.53;128.64;135.38;136.75;154.67;155.59;156.5;171.51
IR(NaCl):νNH=3323cm−1;νCsp2 Harom=3034cm−1;νCsp3=2978cm−1及び2934cm−1;νC=O=1694cm−1;νC−O ester=1250cm−1及び1161cm−1
[α]D24.3℃=−13°(10g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C34H48N4O9,679.3319;exp.,679.3329
【0189】
実施例14
4−[2−((2S)−3−ベンジルオキシカルボニル−2−tert−ブトキシカルボニルアミノプロピル)−1−tert−ブトキシカルボニルヒドラジノメチル]ピペリジン−1−カルボン酸のベンジルエステル(IB.6)
a)4−(1−tert−ブトキシカルボニルヒドラジノメチル)ピペリジン−1−カルボン酸のベンジルエステル(III.7)
化合物(III.7)は、化合物(III.2)の合成と同様の手順に従い、tert−ブトキシカルボニルヒドラジン及び4−ヒドロキシメチルピペリジン−1−カルボン酸のベンジルエステルを出発材料として使用し、且つ、光延反応においてDIADをDBADに置き換えることで得られる。
【0190】
1H NMR(300MHz,CDCl3):δ(ppm)=1.38(s,9H,COOC(CH3)3);1.50−1.65(m,4H,CH2−CH2−N);1.82(m,1H,CHα);2.70(m,2H,CH2−N−NH2);3.18(d,J=7.2Hz,2H,CH2−CH2−N);3.90(s,2H,NH2);4.10(s,2H,CH2−CH2−N);5.05(s,2H,CH2Ph);7.30(m,5H,aromatic)
IR(NaCl):νNH=3500cm−1及び3334cm−1;νCsp2 Harom=3065cm−1;νCsp3=2974cm−1及び2927cm−1;νC=O=1694cm−1及び1682cm−1;νC−O ester=1278cm−1及び1220cm−1
【0191】
b)化合物(IB.1)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.7)116mg(0.34mmol、1eq.)及び化合物(V.1)162mg(0.53mmol、1.5eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、167mgの黄色油状物を得る(収率80%)。
【0192】
1H NMR(300MHz,CDCl3):δ(ppm)=1.30−1.40(m,18H,COOC(CH3)3);1.50−1.70(m,4H,CH2−CH2−N);1.78(m,1H,CHα);2.55(d,J=5.7Hz,2H,CH2−COOBn);2.70(m,2H,CH2−NH−N);2.90(m,2H,CH2−N−NH);3.10(m,2H,CH2−CH2−N);3.90(s,broad,1H,NH);4.08(m,2H,CH2−CH2−N);5.05(m,4H,CH2Ph);5.10(m,1H,NH);7.28(m,10H,aromatic)
13C NMR(75MHz,CDCl3):δ(ppm )26.95;28.27;28.42;29.68;34.73;37.47;43.89;46.70;53.25;54.34;66.57;67.07;80.89;127.89;128.31;128.40;128.52;128.65;135.67;136.93;155.34;155.41;170.63;171.25
IR(NaCl):νNH=3334cm−1;νCsp2 Harom=3091cm−1及び3033cm−1;νCsp3=2976cm−1及び2929cm−1;νC=O=1695cm−1;νC−O ester=1278cm−1及び1249cm−1
[α]D25℃=−0.80°(7.1g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C35H50N4O8,677.3526;exp.,677.3532
【0193】
実施例15
4−[2−((2S)−3−ベンジルオキシカルボニル−2−tert−ブトキシカルボニルアミノプロピオニル)−1−tert−ブトキシカルボニルヒドラジノメチル]ピペリジン−1−カルボン酸のベンジルエステル(IB.7)
化合物(IB.2)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.7)145mg(0.45mmol、1eq.)及びBoc−Asp(OBn)−OH160mg(0.49mmol、1.1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、210mgの黄色油状物を得る(収率77%)。
【0194】
1H NMR(300MHz,CDCl3):δ(ppm)=1.45(m,18H,COOC(CH3)3);1.60−1.80(m,5H,CHα及びCH2−CH2−N);2.70−3.05(m,4H,CH2−COOBn及びCH2−N−NH);3.35(m,2H,CH2−CH2−N);4.20(m,2H,CH2−CH2−N);4.55(s,broad,1H,CHα);5.15(d,J=6.4Hz,4H,CH2Ph);5.68(s,broad,1H,NH);7.38(m,10H,aromatic);8.30(s,1H,CONHN)
13C NMR(75MHz,CDCl3):δ(ppm)=26.96;28.18;28.34;29.69;34.85;43.85;49.39;55.00;67.04;80.87;81.57;127.88;127.97;128.26;128.51;128.66;135.34;136.96;155.29;155.66;171.54
IR(NaCl):νNH=3306cm−1;νCsp2 Harom=3034cm−1;νCsp3=2922cm−1及び2853cm−1;νC=O=1701cm−1
[α]D25℃=−19.31°(14.1g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C35H48N4O9,691.3319;exp.,691.3322
【0195】
実施例16
(3S)−4−[2−(5−ベンジルオキシカルボニルアミノペンチル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.8)
化合物(IB.1)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.6)192mg(0.54mmol、1eq.)及び化合物(V.1)280mg(0.91mmol、1.6eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比3/7)で溶離)による精製を経て、295mgの黄色油状物を得る(収率85%)。
【0196】
1H NMR(300MHz,CDCl3):δ(ppm)=1.32−1.40(m,18H,COOC(CH3)3);1.41−1.52(m,6H,CH2−(CH2)3−CH2);2.60(m,2H,CH2COOBn);2.95(m,2H,CH2−NH);3.12(m,2H,CH2−N−N);3.25(m,2H,CH2−N−N);3.95(m,1H,CHα);4.65(s,broad,1H,NH);4.80(s,broad,1H,NH);5.05(d,J=7.9Hz,4H,CH2−Ph);5.15(s,1H,broad,NH);7.20−7.35(m,10H,aromatic)
13C NMR(75MHz,CDCl3):δ(ppm)=23.77;28.29;28.41;28.45;29.57;37.42;40.98;49.08;53.46;66.51;66.62;79.56;80.63;128.10;128.20;128.29;128.34;128.53;128.62;135.74;136.71;155.38;156.50;171.14;171.31
IR(NaCl):νNH=3344cm−1;νCsp2 Harom=3065cm−1及び3034cm−1;νCsp3=2977cm−1及び2934cm−1;νC=O=1694cm−1;νC=C=1520cm−1及び1455cm−1;νC−O ester=1250cm−1及び1167cm−1
[α]D25℃=−1.04°(18.2g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C34H50N4O8,665.3526;exp.,665.3527
【0197】
実施例17
(3S)−4−[2−(6−ベンジルオキシカルボニルアミノヘキシル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.9)
化合物(IB.2)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.2)120mg(0.55mmol、1eq.)及びBoc−Asp(OBn)−OH196mg(0.60mmol、1.1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比4:6)で溶離)による精製を経て、297mgの黄色油状物を得る(収率80%)。
【0198】
1H NMR(300MHz,CDCl3):δ(ppm)=1.15−1.30(m,26H,CH2−(CH2)4−CH2及びCOOC(CH3)3);2.60−2.96(m,2H,CH2COOBn);3.10(m,2H,CH2−NHZ);3.38(m,2H,CH2−N−N);4.50(s,broad,1H,CHα);4.80(s,broad,1H,NH);5.05(d,4H,CH2Ph);5.65(s,broad,1H,NH);7.30(m,10H,aromatic);8.20(s,1H,CONHN)
13C NMR(75MHz,CDCl3):δ(ppm)=23.43;26.83;28.20;28.33;29.44;40.48;49.44;66.65;66.95;80.73;81.31;128.07;128.13;128.29;128.43;128.52;128.64;135.39;136.71;154.71;156.63;171.47
IR(NaCl):νNH=3320cm−1;νCsp2 Harom=3034cm−1;νCsp3=2977cm−1及び2933cm−1;νC=O=1691cm−1;νC=C=1524cm−1及び1455cm−1;νC−O ester=1250cm−1及び1159cm−1
[α]D24.9℃=−10°(10g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C35H50N4O9,693.3475;exp.,693.3669
【0199】
実施例18
(3S)−3−tert−ブトキシカルボニルアミノ−4−[2−tert−ブトキシカルボニル−2−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジノ]酪酸のベンジルエステル(IB.10)
a)1−tert−ブトキシカルボニル−1−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジン(III.8)
化合物(III.8)は、化合物(III.2)の合成と同様の手順に従い、tert−ブトキシカルボニルヒドラジン及び6−(Boc−アミノ)ヘキサノールを出発材料として使用し、且つ、光延反応においてDIADをDBADに置き換えることで得られる。
【0200】
1H NMR(300MHz,CDCl3):δ(ppm)=1.36(s,9H,COO(CH3)3);1.39(s,9H,COO(CH3)3);1.19−1.48(m,8H,CH2−(CH2)4−CH2);2.89(q,2H,CH2−NHBoc);3.21(t,2H,CH2−N−NH2);4.38(s,2H,NH2);6.76(s,1H,NH)
IR(KBr):νNH=3342cm−1;νCsp3=2976cm−1及び2932cm−1;νC=O=1690cm−1;νC=C=1525cm−1;νC−O ester=1250cm−1及び1170cm−1
【0201】
b)化合物(IB.1)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.8)130mg(0.4mmol、1eq.)及び化合物(V.1)200mg(0.7mmol、1.67eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、190mgの無色油状物を得る。
【0202】
1H NMR(300MHz,CDCl3):δ(ppm)=1.35(s,9H,COO(CH3)3);1.38(s,9H,COO(CH3)3);1.39(s,9H,COO(CH3)3);1.23−1.45(m,8H,CH2−(CH2)4−CH2);2.63−2.83(m,4H,CH2−NHZ及びCH2COOBn);2.88(m,2H,CH2−NH−N);3.18(m,2H,CH2−N−NH);3.87(m,1H,CHα);5.05(s,2H,CH2Ph);6.75(m,1H,NH);7.36−7.30(m,5H,Harom)
IR(NaCl):νNH=3353cm−1;νCsp2 Harom=3065cm−1及び3027cm−1;νCsp3=2977cm−1及び2932cm−1;νC=O=1694cm−1;νC−O ester=1250cm−1及び1167cm−1
HRMS−ESI(m/z):[M+Na]calc.for C32H54N4O8,645.3839;exp.,645.3834
【0203】
実施例19
(3S)−4−[2−ベンジルオキシカルボニル−2−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.11)
化合物(IB.1)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.3)130mg(0.4mmol、1eq.)及び化合物(V.1)200mg(0.7mmol、1.67eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、120mgの白色固体を得る。
【0204】
1H NMR(300MHz,CDCl3):δ(ppm)=1.35(s,9H,COO(CH3)3);1.30−1.46(m,8H,CH2−(CH2)4−CH2);2.52−2.83(m,4H,CH2−NHZ及びCH2COOBn);2.94(m,2H,CH2−NH−N);3.25(m,2H,CH2−N−NH);3.87(m,1H,CHα);4.99(s,2H,CH2−Ph);5.04(s,2H,CH2−Ph);5.06(s,2H,CH2Ph);7.20−7.38(m,15H,Harom)
HRMS−ESI(m/z):[M+Na]calc.for C38H50N4O9,713.3526;exp.,713.3520
【0205】
実施例20
(3S)−3−ベンジルオキシカルボニルアミノ−4−[2−ベンジルオキシカルボニル−2−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノ]酪酸のベンジルエステル(IB.12)
a)3−ベンジルオキシカルボニルアミノ−4−オキソブタン酸のベンジルエステル(V.2)
化合物(V.2)は、化合物(V.1)の合成と同様の手順に従い、Z−Asp(OBn)−OHを出発材料として用いて得られる。
【0206】
IR(NaCl):νNH=3354cm−1;νCsp2 Harom=3065cm−1及び3034cm−1;νCsp3=2931cm−1;νC=O=1731cm−1,1715cm−1及び1693cm−1;νC=C=1528cm−1;νC−O ester=1259cm−1
【0207】
b)化合物(IB.1)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.3)28mg(0.07mmol、1eq.)及び化合物(V.2)45mg(0.13mmol、1.67eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、20mgの黄色油状物を得る。
【0208】
1H NMR(300MHz,CDCl3):δ(ppm)=1.10−1.46(m,8H,CH2−(CH2)4−CH2);2.60−2.70(m,4H,CH2−NHZ及びCH2COOBn);2.94(m,2H,CH2−NH−N);3.25(m,2H,CH2−N−NH);3.95(m,1H,CHα);4.96−5.12(s,8H,4×CH2−Ph);7.20−7.40(m,20H,Harom)
IR(NaCl):νNH=3333cm−1;νCsp2 Harom=3065cm−1及び3034cm−1;νCsp3=2932cm−1及び2857cm−1;νC=O=1695cm−1;νC=C=1531cm−1;νC−O ester=1254cm−1及び1174cm−1
[α]D25℃=−0.06°(5g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C40H48N4O6,747.3370;exp.,747.3369
【0209】
実施例21
(3S)−4−[2−ベンジルオキシカルボニル−2−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.13)
化合物(IB.1)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.4)153mg(0.4mmol、1eq.)及び化合物(V.1)200mg(0.7mmol、1.67eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、130mgの黄色油状物を得る。
【0210】
1H NMR(300MHz,DMSO):δ(ppm)=1.35(s,18H,2×COO(CH3)3);1.29−1.49(m,8H,CH2−(CH2)4−CH2);2.41−2.86(m,4H,CH2−NHBoc及びCH2COOBn);2.88(m,2H,CH2−NH−N);3.25(m,2H,CH2−N−NH);3.86(m,1H,CHα);5.05(s,2H,CH2−Ph);5.07(s,2H,CH2−Ph);7.29−7.36(m,10H,Harom)
HRMS−ESI(m/z):[M+Na]calc.for C38H50N4O9,679.3683;exp.,679.3659
【0211】
実施例22
(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(ベンジルオキシカルボニルメチル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IB.14)
a)2−イソプロピリデンヒドラジンカルボン酸のtert−ブチルエステル(2)
Boc−ヒドラジン(4g、30.3mmol、1eq.)のアセトン(55mL)溶液に、無水MgSO41.35g及び酢酸4滴を添加する。混合物を2時間還流させる。硫酸マグネシウムをろ別し、溶媒を留去して、4.96gの白色固体を得る(収率95%)。
【0212】
1H NMR(300MHz,CDCl3):δ(ppm)=1.53(s,9H,COOC(CH3)3);1.80(s,3H,CH3);2.05(s,3H,CH3);7.37(s,1H,NH)
IR(KBr):νNH=3348cm−1;νCsp3=2981cm−1及び2920cm−1;νC=O=1725cm−1;νC=N=1648cm−1
融点:87℃
【0213】
b)ベンジル(1−tert−ブトキシカルボニル−2−イソプロピリデンヒドラジノ)アセテート(3)
化合物(2)4.9g(28.5mmol、1eq.)を、N2下で無水DMF60mLに溶解させる。NaH1.4g(60%ミネラルオイル溶液、34mmol、1.2eq.)を少しずつ導入する。気体の発生及び固体化が観察される。無水DMF60mL、次いでブロモ酢酸ベンジル5mL(31.4mmol、1.1eq.)をゆっくりと添加する。溶液が暗橙色になる。1時間後、水をゆっくりと添加して、過剰量のNaHを加水分解する。EtOAc90mLを用いて溶液を二回抽出する。水90mL、次いでNaCl飽和溶液90mLで有機相を洗浄し、無水Na2SO4で乾燥させ、蒸発させる。残渣をシリカゲルクロマトグラフィー(EtOAc/P.E.混合物(体積比1/2)で溶離)にかけ、8.4gの黄色油状物を得る(収率92%)。
【0214】
1H NMR(300MHz,CDCl3):δ(ppm)=1.45(s,9H,COOC(CH3)3);1.95(s,3H,CH3);2.05(s,3H,CH3);4.35(s,2H,N−CH2);5.20(s,2H,CH2);7.37(m,5H,Harom)
IR(NaCl):νCsp2 Harom=3066cm−1及び3034cm−1;νCsp3=2977cm−1及び2932cm−1;νC=O=1754cm−1及び1710cm−1
【0215】
c)ベンジルヒドラジノアセテートジトシレート(VIB.1)
化合物(3)1g(3.13mmol、1eq.)のエタノール(10mL)及び水(100μL)混合溶液に、para−トルエンスルホン酸1.19g(6.25mmol、2eq.)を添加する。溶液を5時間還流させる。溶媒を留去して、1.64gの桃色ゲルを得る。このゲルは、これ以上精製しないで使用する(収率100%)。
【0216】
1H NMR(300MHz,CDCl3):δ(ppm)=2.45(s,6H,2PhCH3);νC=O=1724cm−1;2.45(m,2H,N−CH2);5.10(s,2H,CH2Ph);7.10(d,J=8.3Hz,4H,Harom APTS);7.40(m,5H,Harom benzyl);7.70(d,J=8.3Hz,4H,Harom APTS);8.60(bs,5H,NH2+及びNH3+)
IR(NaCl):νNH=3337cm−1;νCsp2 Harom=3066cm−1及び3034cm−1;νCsp3=2978cm−1及び2935cm−1;νC=O=1724cm−1;νS=O=1052cm−1
【0217】
d)ベンジル(2−tert−ブトキシカルボニルヒドラジノ)アセテート(IVB.1)
ベンジルヒドラジノアセテートジトシレート330mg(0.63mmol、1eq.)のEtOH/H2O(体積比1/1、7mL)溶液に、0℃で、NMM139μL(1.26mmol、2eq.)を添加する。(Boc)2O151mg(0.69mmol、1.1eq.)を導入する。溶液を0℃で15分、次いで室温で2時間攪拌する。エチルエーテルを添加して得られた有機溶液をKH2PO4飽和溶液で洗浄する。水相をエーテルで再抽出し、合わせた有機相を無水Na2SO4で乾燥させ、留去して、128mgの黄色液体を得る(収率66%)。
【0218】
1H NMR(300MHz,CDCl3):δ(ppm)=1.35(s,9H,COOC(CH3)3);4.10(s,2H,N−CH2);5.10(s,2H,CH2Ph);7.20(m,5H,Harom)
IR(NaCl):νNH=3349cm−1;νCsp2 Harom=3070cm−1及び3035cm−1;νCsp3=2980cm−1及び2935cm−1;νC=O=1749cm−1及び1708cm−1
【0219】
e)化合物(IA.4)で記載されたのと同様の手順に従い、ヒドラジノエステル(IVB.1)105mg(0.37mmol、1eq.)及びHCl.H−Lys(Z)−OtBu155mg(0.37mmol、1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1/2)で溶離)による精製を経て、70mgの黄色油状物を得る(収率30%)。
【0220】
1H NMR(300MHz,CDCl3):δ(ppm)=1.20(m,2H,CH2−CH2−CH2−CH2NHZ);1.35(s,9H,COOC(CH3)3);1.40(s,9H,COOC(CH3)3);1.50−1.60(m,4H,CH2−CH2−CH2−CH2NHZ);3.10(q,J=7.5Hz及びJ=14.3Hz,2H,CH2NHZ);4.10(s,2H,N−N−CH2);4.30(m,1H,CHα);5.00(s,2H,CH2Ph);5.15(s,2H,CH2Ph);6.30(bs,1H,NH);6.60(bs,1H,NH);7.35(m,10H,Harom)
HRMS−ESI(m/z):[M+Na]calc.for C33H46N4O9,665.3162;exp.,665.3168
【0221】
II.生物活性
この項は化合物の生物活性に関し、添付の図面を参照する。
図1は、一般的なABCトランスポーターによって誘導される基質の排出を示す図である。
図2は、化合物(I.A.2)の阻害の種類を表す。
図3は、化合物(IA.2)による、ABCG2を発現するHEK−293細胞の化学増感を表す。
図4は、化合物(IA.2)の、HEK−293細胞に対する無害性を表す。
図5は、化合物(IA.1)による、ABCG2を発現するHEK−293細胞の化学増感を表す。
図6は、化合物(IA.1)の、HEK−293細胞に対する無害性を表す。
図7は、化合物(IB.1)による、HEK−293細胞の化学増感を表す。
図8は、化合物(IB.1)の、HEK−293細胞に対する無害性を表す。
図9は、化合物(IB.1)の、NIH−3T3細胞に対する無害性を表す。
図10は、化合物(IB.11)の、HEK−293細胞に対する無害性を表す。
図11は、化合物(I.A.3)の阻害の種類を表す。
図12は、化合物(IA.2)がABCG2発現レベルを減少させることを表す。
【0222】
方法
細胞培養
ABCG2をコードする遺伝子を含む又は含まないpcDNA3.1ベクターでトランスフェクトしたヒト繊維芽細胞系HEK−293(Robey,R.W.,Honjo,Y.,Morisaki,K.,Nadjem,T.A.,Runge,S.,Risbood,M.,Poruchynsky,M.S.,Bates,S.E.,「Br.J.Cancer」,89(10),1971−1978,2003年)を使用して、ABCG2に対する生成物の有効性をテストした。そのままの(ネガティブコントロール)、又は、ABCC1をコードする遺伝子を発現するpNUT−MRP/Hisベクターでトランスフェクトした、新生ハムスターの腎細胞系BHK21(Chang,Xiu−Bao,Hou,Yue−Xian,Riordan,John R.,「J.Biol.Chem.」,272(49),30962−30968,1997年)を使用して、ABCC1に対する生成物の有効性をテストした。そのままの、又は、ABCB1を発現するpHaMDR1/Aベクターでトランスフェクトした、細胞系NIH3T3(Cardarelli,Carol O.,Aksentijevich,Ivan,Pastan,Ira,Gottesman,Michael M.,「Cancer Res.」,55,1086−1091,1995年)を使用して、ABCB1に対する化合物の有効性をテストした。上述のプロトコルに従って、様々な種類の細胞を培養する(HEK293系:Robey,R.W.,Honjo,Y.,Morisaki,K.,Nadjem,T.A.,Runge,S.,Risbood,M.,Poruchynsky,M.S.,Bates,S.E.,「Br.J.Cancer」,89(10),1971−1978,2003年;BHK21系:Chang,Xiu−Bao,Hou,Yue−Xian,Riordan,John R.,「J.Biol.Chem.」,272(49),30962−30968,1997年;NIH3T3系:Cardarelli,Carol O.,Aksentijevich,Ivan,Pastan,Ira,Gottesman,Michael M.,「Cancer Res.」,55,1086−1091,1995年)。
【0223】
ABCG2発現レベルの推定
HEK293 pcDNA3.1細胞又はHEK293 pcDNA3.1 BCRP細胞を16枚の6cm2ペトリ皿に接種し、5%CO2下、37℃で24時間培養する。培養後、種々のウェルにDMSO(コントロール)又はDMSOに溶解させた化合物(IA.2)(希釈後の最終濃度は5μM)を30μL添加する。3時間、24時間、48時間又は72時間培養後、細胞をトリプシン処理し、200Gで5分間遠心する。低張溶解バッファ(10mMのTris−Cl(pH7.5)、10mMのNaCl、1mMのMgCl2、1mMのDTT、プロテアーゼ阻害剤)でタンパク質画分を抽出し、ビシンコニン酸(シグマ−アルドリッチ社)で分析する。この画分10μgを、Laemmli型のポリアクリルアミドゲル(U.K.Laemmli,「Nature」,1970年,227,680)に沈着させてタンパク質を分離し、次いで、このタンパク質を10mMのCAPS溶解バッファ(pH11.1、10%メタノール、シグマ−アルドリッチ社)を使用し、100mAで60分間ポリフッ化ビニル(pvdf)膜に転写する。pvdf膜を、脱脂粉乳の1%(w/v)TBSTバッファ(トリス緩衝生理食塩水1X、Tween20 0.1%)溶液に30分間浸す。膜をTBSTで素早くすすいだ後、1%TBSTミルクで1/250まで希釈した抗BCRP BXP−21モノクローナル抗体(サンタクルズ社)又は抗チューブリンモノクローナル抗体(サンタクルズ社)とともに、攪拌下、室温で1時間培養する。膜をTBSTを用いて15分間×三回洗浄した後、1%TBSTミルクで1/5000まで希釈したペルオキシダーゼ結合抗マウス二次モノクローナル抗体(サンタクルズ社)とともに1時間培養する。その後、TBSTを用いて膜を15分間×三回洗浄する。「イモビロンウェスタン(immobilon western)」キット(ミリポア社)とQuantityOneソフトウェア(バイオ・ラッド社)とを用いて解析する。
【0224】
図1は、一般的なABCトランスポーターによって誘導される基質の排出を模式的に表す。ABCG2及びABCB1によって排出されるミトキサントロン又はABCC1によって排出されるダウノルビシン等の基質Sが細胞中に蓄積され、トランスポーターTによって排出されることで、細胞内蛍光が減少する。生成物が、一般的には排出タンパク質の阻害によって、蓄積される場合、細胞内蛍光は増加する。
【0225】
フローサイトメトリー
第一段階では、トランスフェクトされた又はされていないHEK−293細胞及びBHK−21細胞を、基質(トランスポーターに応じて、5μMミトキサントロン又は1μMダウノルビシン)と接触するよう配置する。基質は、最終DMSO濃度を0.5%とした各種濃度のテスト分子の存在下又は非存在下で、37℃で30分間蓄積する。PBSで洗浄後、上記と同じ濃度のテスト分子を含む媒体中、37℃で1時間、細胞を培養する。薬剤の細胞内蛍光は、FACscanフローサイトメーター(ベクトン・ディッキンソン社、マウンテンビュー、カリフォルニア)で測定する。蛍光基質は488nmで励起する。ミトキサントロン(MTX)の蛍光放射は650nmで観察され、ダウノルビシンは530nmで観察される。テスト分子の有効性は、式1により概算する。
有効性(%)=100×(FA−FBG)/(FC−FBG)・・・式1
式中、
・FAは、トランスポーターTを過剰発現している細胞内で測定された細胞内基質レベルに対応する(阻害剤非存在下での最低蛍光レベルに対応する);
・FCは、テストトランスポーターを発現していないコントロール細胞内での蛍光に対応し、従って、細胞内での基質蓄積量が最大である;
・FBGは、基質非存在下且つ阻害剤存在下で測定された蛍光に対応する。
【0226】
細胞増殖テスト
細胞を96ウェルプレートに接種(10,000個/ウェル)し、5%CO2下、37℃で24時間培養する。続いて、様々な濃度のミトキサントロン(0〜20μM、一定の最終体積100μL)に、同体積の各テスト化合物を添加する。その後、細胞を72時間放置して分裂させる。細胞毒性は、3−(4,5−ジメチルチアゾール−2−イル)−2,5−ジフェニルテトラゾリウムブロミド(MTT)を用いて、比色分析により評価する。
【0227】
A.アザジペプチドによるヒト排出タンパク質ABC阻害の有効性
上述したように、表2〜5に示した化合物について、排出タンパク質ABCG2、ABCB1又はABCC1を選択的に発現する哺乳動物細胞系においてフローサイトメトリーによりテストした。
【0228】
表6及び6aは、ヒトABCポンプによる抗ガン剤の排出に対するアザジペプチド(IA.1)、(IA.2)、(IA.3)、(IB.1)及び(IB.11)の阻害有効性を示す。
【0229】
【表6】

【0230】
【表6a】

【0231】
ABCG2又はABCB1に誘導されるミトキサントロン排出及びABCC1に誘導されるダウノルビシン排出は、各テスト化合物について10μMで、更に、10μMで少なくとも80%有効性を示した化合物については2μMで、上記フローサイトメトリーにより評価する。50%阻害(IC50)を起こす濃度は、最も有効なアザ誘導体について評価した。独立した三つの実験により値を得て、SigmaPlotソフトウェアにより調整した。
【0232】
このテストにより、生成物が(ABCG2又はABCB1による)ミトキサントロン排出又は(ABCC1による)ダウノルビシン排出をブロックする能力が示される。
【0233】
表6に示す通り、化合物(IA.3)がABCB1をブロックするのに最も有効である(IC50:0.33μM)が、そのABCG2阻害有効性は低い(10μMで38%)。化合物(IA.2)についてはその反対で、ABCG2に対するIC50が1μMであり、ABCB1ブロック有効性は10μMで50%未満である。化合物(IA.1)は、ABCB1との親和性がより良好で、IC50が0.5μM程度である一方、ABCG2については2μMである。化合物(IB.1)及び化合物(IB.11)は、二種類のトランスポーターについて、どちらの場合もマイクロモル又はマイクロモル未満のIC50値を示し、同じ有効性を有する。これらの化合物はいずれも、排出タンパク質ABCC1に対しては効果が無いようである。
【0234】
B.化合物(IA.2)は強力な非競合性ABCG2阻害剤である
図2は、化合物(IA.2)が非競合性ABCG2阻害剤であることを示す。ABCG2によるミトキサントロン排出は、基質濃度を0〜20μM(パネルA〜C)とし、濃度を0〜20μM(パネルD、E)の間で一定とした化合物(IA.2)の存在下又は非存在下で測定した。図2には、阻害剤濃度を変えて得られた結果を示し、パネルAはdirect、パネルBはLineweaver−Burke、パネルCはEadie−Hofsteeで表記されている。基質濃度を変えて得られた結果は、リニア(パネルD)又はログ(パネルE)X軸スケールで表されている。曲線は、SigmaPlotソフトウェアで調整した。
【0235】
図2Aにdirect表記した、各濃度でのミトキサントロンの排出の結果から、得られた各曲線が到達する平坦域は化合物(IA.2)の所定濃度によって異なる一方、ミトキサントロンの半数最大蓄積濃度は阻害剤濃度に関係なく同じままであることが分かる。このようなデータは、非競合的阻害の特徴である。これは、Lineweaver−Burke及びEadie−Hofsteeでそれぞれ表記した図2B及び図2Cで確認できる。これら二つのグラフに表されたものは、このような阻害の特徴である。化合物(IA.2)の阻害定数Kiは、図2D又は図2Eにおける点の調整から、約1μMと推定される。
【0236】
C.化合物(IA.2)による、ABCG2を発現するHEK−293細胞の化学増感
ABCG2を発現している又は発現しておらず、且つ、化合物(IA.2)5μMで処理した又は処理していないHEK−293細胞に、ミトキサントロン(MTX)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図3に示す。図中、ABCG2を発現している細胞は丸、発現していないものは四角で表し、化合物(IA.2)5μM、すなわち、そのIC50の5倍で処理したものは白記号で表し、化合物(IA.2)で処理していないものは黒記号で表す。図3より、ABCG2を過剰に発現しているHEK−293細胞を化合物(IA.2)とともに培養すると、ABCG2が発現していないコントロール細胞において観察されたのと同程度までミトキサントロン感度が回復することが分かる。従って、化合物(IA.2)は化学療法増感剤として非常に有効であることが分かる。
【0237】
D.化合物(IA.2)の、ヒトHEK−293細胞の細胞増殖に対する非細胞毒性
ABCG2を発現している又は発現していないHEK−293細胞に化合物(IA.2)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図4に示す。図中、ABCG2を発現している細胞は白丸、発現していないものは黒丸で表す。結果から、ABCG2を発現しているか否かに関わらず、化合物(IA.2)はHEK−293細胞に対して全く細胞毒性を示さないことが分かる。このような非毒性は、例えばIC50値の40倍にあたる40μMという非常に高い濃度においても観察される。
【0238】
E.化合物(IA.1)による、ABCG2を発現するHEK−293細胞の化学増感
ABCG2を発現している又は発現しておらず、且つ、化合物(IA.1)5μMで処理した又は処理していないHEK−293細胞に、ミトキサントロン(MTX)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図5に示す。図中、ABCG2を発現している細胞は丸、発現していないものは四角で表し、化合物(IA.1)5μM、すなわち、そのIC50の2.5倍で処理したものは白記号、化合物(IA.1)で処理していないものは黒記号で表す。結果より、化合物(IA.1)によって、ABCG2を過剰発現している細胞のミトキサントロン感度が、トランスポーターを発現していない細胞で観察されるのと同レベルにまで、ほぼ十分に回復することが分かる。耐性が残っているのは、IC50の2.5倍にしか相当しない生成物の濃度、すなわち5μMでは、得られる増感性がおそらく不十分であることに起因する。従って、化合物(IA.1)は、それ自体も有効な化学療法増感剤である。
【0239】
F.化合物(IA.1)の、細胞増殖に対する非細胞毒性
ABCG2を発現している又は発現していないHEK−293細胞に、化合物(IA.1)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図6に示す。図中、ABCG2を発現している細胞は白丸、発現していないものは黒丸で表す。
【0240】
結果より、化合物(IA.1)は、ABCG2が発現しているか否かに関わらず、テストされた濃度範囲では、たとえそのIC50の10倍を超える濃度であっても細胞毒性を示さないことが分かる。
【0241】
G.化合物(IB.1)による、ABCG2を発現するHEK−293細胞の化学増感
ABCG2を発現している又は発現しておらず、且つ、化合物(IB.1)5μMで処理した又は処理していないHEK−293細胞に、ミトキサントロン(MTX)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図7に示す。図中、ABCG2を発現している細胞は丸、発現していないものは四角で表し、化合物(IB.1)5μM、すなわち、そのIC50の5倍で処理したものは白記号、化合物(IB.1)で処理していないものは黒記号で表す。結果より、ABCG2を過剰発現しているHEK−293細胞を化合物(IB.1)とともに培養すると、ミトキサントロン感度が、トランスポーターを発現していない細胞で観察されるのと近いレベルまで、ほぼ十分に回復することが分かる。従って、化合物(IB.1)は、それ自体も有効な化学療法増感剤である。
【0242】
H.化合物(IB.1)の、細胞増殖に対する非細胞毒性
ABCG2を発現している又は発現していないHEK−293細胞に、化合物(IB.1)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図8に示す。図中、ABCG2を発現している細胞は白丸、発現していないものは黒丸で表す。結果より、化合物(IB.1)は、ABCG2が発現しているか否かに関わらず、そのIC50の20倍に等しい濃度まで細胞毒性を示さないことが分かる。IC50の40倍では、相対的に見れば細胞毒性といえる結果が現れる。
【0243】
I.化合物(IB.1)の、NIH−3T3細胞の細胞増殖に対する限定的な細胞毒性
ABCB1を発現している又は発現していないNIH−3T3細胞に化合物(IB.1)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図9に示す。図中、ABCB1を発現している細胞は白丸、発現していないものは黒丸で表す。結果より、化合物(IB.1)の細胞毒性は、そのIC50(1μM)の5倍までは無視できる程度であることが分かる。その後、30〜40%増加するが、ABCB1が発現しているか否かに関わらず、そのIC50の40倍に等しい濃度までは、その値に限定されたままである。
【0244】
J.化合物(IB.11)の、細胞増殖に対する限定的な細胞毒性
ABCG2を発現している又は発現していないHEK−293細胞に、化合物(IB.11)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図10に示す。図中、ABCG2を発現している細胞は白丸、発現していないものは黒丸で表す。結果より、化合物(IB.11)は、ABCG2が発現しているか否かに関わらず、テストされた濃度範囲では、たとえそのIC50の80倍を超える濃度であっても細胞毒性を示さないことが分かる。
【0245】
K.化合物(IA.3)は強力な非競合性ABCB1阻害剤である
図11において、ダウノルビシン排出をその各種濃度に対してdirect表記した結果より、得られた各曲線が到達する平坦域は化合物(IA.3)の所定濃度により異なる一方、ダウノルビシンの半数最大蓄積濃度は阻害剤濃度に関係なく同じままであることが分かる。このようなデータは、非競合的阻害の特徴である。また、このような種類の阻害剤がABCB1及びABCG2に対して概して非競合性であることを示している(図2及び上記パラグラフB参照)。
【0246】
L.化合物(IA.2)は、阻害対象であるタンパク質ABCG2の発現レベルを減少させる
図12は、阻害剤(IA.2)によりABCG2発現レベルが変化することを示す。BCRPを発現している又は発現していないHEK293細胞(それぞれ「HEK293 BCRP」、「HEK293 pcDNA3」)を、化合物(IA.2)又はDMSO(ネガティブコントロール)の存在下で、指定時間培養する。その後、採取、分画して、ABCG2量及びチューブリン量を分析する。後者は、「方法」の項で詳述した通り、コントロールとして使用する。
【0247】
図12に示した結果より、化合物(IA.2)は、ABCG2に対して阻害作用を有するだけでなく、コントロールとして従来使用されてきたタンパク質、すなわちチューブリンには影響を及ぼすことなく、前者のタンパク質発現レベルを減少させることが分かる。従って、化合物(IA.2)は、ABCG2の活性だけでなく、その発現レベルも調整でき、その作用が比例的に増強される。
【技術分野】
【0001】
本発明は概して治療化学分野に関し、特に化学療法的治療、なかでも癌腫学的治療の有効性を改善するのに用いられる。具体的には、本発明の主題は、BCRP(乳ガン耐性タンパク質;ABCG2としても公知である)やP−gp(多面発現性糖タンパク質;ABCB1としても公知)等、ある種の排出タンパク質に対する阻害剤として作用するアザペプチド化合物又はアザペプチド模倣化合物に関する。
【背景技術】
【0002】
ガン、及び、ウイルス性、細菌性、真菌性又は寄生虫性の感染症に対して化学療法的治療を行う際に直面する問題としては、悪性細胞又は細菌、真菌、ウイルス若しくは寄生虫の初期耐性又は獲得耐性が主に挙げられる。獲得耐性現象としては多剤耐性が挙げられ、これは、目的の腫瘍細胞又は感染因子(ウイルス、細菌、真菌、寄生虫等)に感染した細胞から化学療法剤を排出させてしまうABC(ATP結合カセット)輸送タンパク質が過剰に発現されて、化学療法剤の細胞内濃度が減少することによるものである。これらのタンパク質はまた、特に消化管及び血液脳関門において、生理的に発現する。
【0003】
多剤耐性という概念は、投与された化学療法剤だけでなく、構造上無関係な多くの分子に対しても細胞が耐性を示すようになるという事実から生まれた。このような排除は主に排出ポンプの作用で起こり、そのうち主要な三つはヒトで確認される。これらの排出ポンプはABCB1、ABCC1及びABCG2であり、それぞれ、P−gp(1976年、Juliano及びLingが発見;非特許文献1);MRP1(多剤耐性タンパク質1;16年後にCole及びDeeleyが肺ガン中に発見;非特許文献2);及び、BCRP又はMXR(ミトキサントロン耐性;更に近年にRossら(非特許文献3)及びBatesら(非特許文献4)が発見)としても知られている。これらの排出タンパク質は、大きな細胞内ドメインと結合した膜貫通ドメインを介して、原形質膜に挿入される。上記細胞内ドメインは、二つのヌクレオチド結合部位(ヌクレオチド結合ドメイン、NBD)で構成される。小さなドメインは、これらのタンパク質の細胞外面に存在する。このようなタンパク質の構造は、原核生物の二種類の排出タンパク質Sav1866(非特許文献5)及びMsbA(非特許文献6)と同様であると考えられる。これらにより、様々な化学療法剤がATP依存的に細胞から排出される。
【0004】
これらの輸送タンパク質の活性を調整することで、薬剤として有効な濃度を回復し、MDR現象に起因する化学療法の失敗を抑えることができる。このような状況から、これらのタンパク質が有する排出機能をブロックする阻害剤を得るために多くの研究が行われてきた。このような活性を有する薬剤は、化学療法増感剤として知られている。だが、今まで、有効性、非毒性及び選択性の基準を満たすものはなかった。ここで、上記選択性とは、他の輸送タンパク質が有する生理的機能を妨害しないということである。また、大半は競合的阻害剤であり、輸送部位において基質と競合する。従って、これらは偽基質として機能し、結果的に、トランスポーターが他の基質と適合可能であることから、同種のトランスポーターの基質となり得る。以上より、非競合的阻害剤を選択することが重要である。
【0005】
また、最初に抗ガン剤耐性の過程で発見されたこれらの排出タンパク質は、近年では、抗ウイルス治療に対する耐性の発現とも関連付けられている。例えば、ABCB1は、プロテアーゼ阻害剤の経口による生物学的利用能及びその中枢神経系への浸透を調整する(非特許文献7)。同様に、ABCG2は、ジドブジン/AZT、ラミブジン/エピビル、及び、アバカビル/ザイアジェンを排出する(非特許文献8及び9)。これらのタンパク質が示す輸送スペクトルは非常に広く、そのために様々な化学構造の化合物を多く排出でき、例えば、ガンを含む様々な病変を治療するのに使用できる。
【0006】
これらの排出タンパク質は、当然、正常組織で発現されて、細胞(例えば、肺、腎臓及び肝臓)で産生された毒素及び老廃物を排出する。また、血液脳関門でも産生されて、毒素が脳へ侵入するのを防ぐ。MDR表現型を逆にするためには、化学療法剤と排出タンパク質阻害剤とを同時に投与することが一つの手段として考えられる。複数の分子がこの目的で開発されている。このようなタンパク質の排出活性をブロックするために開発されてきた、三世代にわたる阻害剤を表1に示す。
【0007】
表1a、1b:各記号は、特定のトランスポーターに対して阻害剤が活性を有する(+)又は不活性である(−)こと、あるいは、効果が不明である(?)ことを示す。表は非特許文献10から引用した。
【0008】
表1a
【0009】
【表1a】

【0010】
表1b
【0011】
【表1b】

【0012】
タリキダル等、ある種の阻害剤は、複数のタンパク質と相互作用する。特に、それらの阻害剤は、ABCB1及び/又はABCG2に加え、ABCC1を著しく阻害する。ただし、これは必ずしも利点とは言えない。というのも、克服剤(reversing agent)はただ一つの排出タンパク質のみを標的として、健康な細胞においては他のタンパク質が有する生理的機能を維持することが理想だからである。また、近年では、ゾスキダル等、他の薬剤についても、悪影響があるとの理由から第III相で試験が中止された。これらの例から、強力且つ特異的であり、悪影響も最小限であるような新種の克服能を有する薬剤を見つけ出すのは難しいことが分かる。
【先行技術文献】
【非特許文献】
【0013】
【非特許文献1】Juliano及びLing,「Biochim.Biophys.Acta」,1976年,455,152−162
【非特許文献2】Cole及びDeeley,「Science」,1992年,258,1650−1654
【非特許文献3】Rossら,「J.Natl Cancer Inst.」,1999年,91,429−433
【非特許文献4】Batesら,「J.Cell Sci.」,2000年,113(Pt11),2011−2021
【非特許文献5】Dawson及びLocher,「Nature」,2006年,443(7108),180−5
【非特許文献6】Wardら,「Proc.Natl.Acad.Sci.」,米国,2007年,104(48),19005−10
【非特許文献7】Kim,「Top HIV Med.」,2003年,11,136−139
【非特許文献8】Wangら,「Mol.Pharmacol.」,2003年,63,65−72
【非特許文献9】Weissら,「J.Antimicrob.Chemother.」,2007年,dkl474
【非特許文献10】「Current Opinion in Pharmacology」,2006年,6,350−354
【発明の概要】
【課題を解決するための手段】
【0014】
本発明は、ABCG2及び/又はABCB1阻害剤として作用する新規なアザペプチド化合物又はアザペプチド模倣化合物を提供するものである。また、本発明の別の目的は、ABCC1阻害能がそれほど強力でないABCG2及び/又はABCB1阻害剤を提供することである。本発明の化合物の中には、ABCG2若しくはABCB1に対して高い親和性と、多くの場合は選択性とを示し、且つ/又は、非競合的阻害剤として作用するものもある。
【0015】
本発明の別の目的は、非細胞毒性である新規な化合物を提供することである。
【0016】
本発明の別の目的は、比較的容易に製造でき、且つ、原価がそれほど高くならない新規な化合物を提供することである。
【0017】
以上を鑑みて、本発明の一主題は、純粋な光学異性体、又は光学異性体混合物、又はその塩、溶媒和物若しくは水和物の形態である、式(I)で表されるアザペプチド化合物又はアザペプチド模倣化合物である。
【0018】
【化1】

【0019】
(式中、
・R1は、アミノ基の保護基、好ましくは−C(O)OR’1基(R’1は、炭素数1〜12のアルキル基、又は−(CH2)m1R”1基(R”1はアリール基(例えばフェニル)、シクロアルキル基又はフルオレニル基;m1は0、1、2又は3))であり;
・X1及びX2は、同じか又は異なっていて、−N−又は−CH−であり、少なくとも一方は−N−であり;
・R2は、保護された形態であってもよい、アミノ酸若しくはアミノ酸類似体の側鎖であるか、又は、置換されていてもよいアリール基(例えばフェニル)、若しくは、置換されていてもよいヘテロアリール基であり;
・Yは、−CH2−又は−C(O)−であり;
・−X3−X4は、−(CH2)n−NHR4基(nは3、4、5又は6)、又は、
【0020】
【化2】

【0021】
(R4はアミノ基の保護基、好ましくは−C(O)OR’4基(R’4は、炭素数1〜12のアルキル基、又は−(CH2)m4R”4基(R”4はアリール基(例えばフェニル)又はシクロアルキル基;m4は0、1、2又は3))である)から選択される基であり;
・R3は、炭素数1〜12のアルキル基、又は−(CH2)m3R”3基(R”3はシクロアルキル基又はアリール基(例えばフェニル)であって、上記シクロアルキル基及びアリール基は、非置換でも、−CH3、−CF3、−COOH、−NO2、−Cl及びNH2から選択される1以上の基で置換されていてもよく;m3は0、1、2又は3)である。)
【0022】
一変更実施形態によれば、上で定義された式(I)の化合物は、置換基R2として、−L−COOR’2基(Lは、アリール基、好ましくはフェニル基であるか、又は、−(CH2)m2−鎖(m2は1、2又は3)であり、R’2は、炭素数1〜12のアルキル基、又は−(CH2)m’2R”2基(R”2は、置換されていてもよいアリール基(例えばフェニル)又はシクロアルキル基;m’2は0、1、2又は3))を有する。
【0023】
本発明に係る化合物の一下位グループは、純粋な異性体、又は異性体混合物、又はその塩、溶媒和物若しくは水和物の形態である式(IA)の化合物で構成される。
【0024】
【化3】

【0025】
(式中、R5は、−NH2、−NO2、−OH、炭素数1〜8の−O−アルキル、O−(CH2)m5R’5(R’5はアリール基(例えばフェニル);m5は0又は1)、又は、−COOR”5基(R”5は、炭素数1〜12のアルキル基、又は−(CH2)m’5R’’’5基(R’’’5はアリール基(例えばフェニル)又はシクロアルキル基;m’5は0、1、2又は3));R1、X1、Y、X2、X3、X4及びR3は、式(I)と同義。)
【0026】
式(IA)の化合物は、以下の特徴のどれか、又は、相互に排他的でない場合は、これらの特徴を一部若しくは全て組み合わせたものを満たすことが好ましい:
・R5は−COOR”5基(R”5はエチル基、ベンジル基又は−CH[CH(CH3)2]2基)である;
・R5はメタ位であり、この場合、BCRP選択性が好ましい;
・R5基はパラ位であり、この場合、P−gp選択性が好ましい;
・X1は−N−であり、X2は−CH−である;
・X1及びX2はNである;
・Yは−C(O)−である;
・−X3−X4は、−(CH2)n−NHR4基(nは4又は6;R4は式(I)と同義)である。
【0027】
本発明に係る化合物の一下位グループは、純粋な異性体、又は異性体混合物、又はその塩、溶媒和物若しくは水和物の形態である式(IB)の化合物で構成される。
【0028】
【化4】

【0029】
(式中、mは1、2又は3;R6は、炭素数1〜12のアルキル基、又は−(CH2)m6R’6基(R’6はシクロアルキル基又はアリール基(例えばフェニル)であって、上記シクロアルキル基及びアリール基(例えばフェニル)は、非置換でも、−CH3、−CF3、−COOH、−NO2、−Cl及びNH2から選択される1以上の基で置換されていてもよく;m6は0、1、2又は3);R1、X1、Y、X2、X3、X4及びR3は式(I)と同義。)
【0030】
式(IB)の化合物は、以下の特徴のどれか、又は、相互に排他的でない場合は、これらの特徴を一部若しくは全て組み合わせたものを満たすことが好ましい:
・mは1又は2である;
・R6はエチル基、ベンジル基又は−CH[CH(CH3)2]2基である;
・X1は−CH−であり、X2は−N−である;
・X1は−N−であり、X2は−CH−である;
・−X3−X4は、−(CH2)n−NHR4基(nは6;R4は式(I)と同義)である。
【0031】
また、式(I)、(IA)又は(IB)の化合物は、以下の特徴の一つ、二つ又は三つを満たすことが好ましい:
・R1は−COOR’1基(R’1はtert−ブチル基又はベンジル基)である;
・R3はtert−ブチル基又はベンジル基である;
・R4は−C(O)OR’4基(R’4はベンジル基又はtert−ブチル基)である。
【0032】
本発明に係る化合物の具体例としては、
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(2’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.1);
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.2);
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(4’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.3);
・(2R)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のベンジルエステル(IA.4);
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のベンジルエステル(IA.5);
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(フェニルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.6);
・2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニル]−1−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノカルボン酸のベンジルエステル(IA.7);
・2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニル]−1−(6−tert−ブチルオキシカルボニルアミノヘキシル)ヒドラジノカルボン酸のベンジルエステル(IA.8);
・(3S)−4−[2−(6−ベンジルオキシカルボニルアミノヘキシル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.1);
・(3S)−4−[2−(3−ベンジルオキシカルボニルアミノプロピル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.2);
・(3S)−4−[2−(4−ベンジルオキシカルボニルアミノフェニル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.3);
・(4S)−5−[2−(4−ベンジルオキシカルボニルアミノフェニル)−2−tert−ブトキシカルボニルヒドラジノ]−4−tert−ブトキシカルボニルアミノ−5−オキソペンタン酸のベンジルエステル(IB.4);
・(3S)−4−[2−(5−ベンジルオキシカルボニルアミノペンチル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.5);
・4−[2−((2S)−3−ベンジルオキシカルボニル−2−tert−ブトキシカルボニルアミノプロピル)−1−tert−ブトキシカルボニルヒドラジノメチル]ピペリジン−1−カルボン酸のベンジルエステル(IB.6);
・4−[2−((2S)−3−ベンジルオキシカルボニル−2−tert−ブトキシカルボニルアミノプロピオニル)−1−tert−ブトキシカルボニルヒドラジノメチル]ピペリジン−1−カルボン酸のベンジルエステル(IB.7);
・(3S)−4−[2−(5−ベンジルオキシカルボニルアミノペンチル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.8);
・(3S)−4−[2−(6−ベンジルオキシカルボニルアミノヘキシル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.9);
・(3S)−3−tert−ブトキシカルボニルアミノ−4−[2−tert−ブトキシカルボニル−2−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジノ]酪酸のベンジルエステル(IB.10);
・(3S)−4−[2−ベンジルオキシカルボニル−2−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.11);
・(3S)−3−ベンジルオキシカルボニルアミノ−4−[2−ベンジルオキシカルボニル−2−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノ]酪酸のベンジルエステル(IB.12);
・(3S)−4−[2−ベンジルオキシカルボニル−2−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.13);
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(ベンジルオキシカルボニルメチル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IB.14)、並びに、
その塩、溶媒和物及び/又は水和物、特にその薬学的に許容される形態から選択されるアザペプチド化合物又はアザペプチド模倣化合物が挙げられる。
【0033】
本発明に係る合成アザペプチド化合物又はアザペプチド模倣化合物は、BCRP/ABCG2及び/又はP−gp/ABCB1に対して阻害性を有する。本発明に係る化合物は、これら二種類のタンパク質のうち少なくとも一方に対して、2μM、更には0.3μM以下にもなり得る低いIC50値を有する。IC50は、治療剤の放出を50%ブロックできる、化合物の半数濃度と定義される。化合物の活性を測定するのに採用する試験については、実施例における「生物活性」の項で詳述する。本発明に係る化合物は、ABCC1阻害性をそれほど強くは示さない。特に、本発明に係る化合物の大半について、このタンパク質に対する10μMでの有効性(%)は15%未満である。化合物(IA.2)及び(IA.3)等、ある種の化合物は、タンパク質BCRP又はP−gpに対して選択性を有することが証明された。また、化合物(IA.2)及び(IB.11)等については、非競合性が証明された。
【0034】
本発明に係る化合物は、第一に、安定性及び生物学的利用能を向上する目的で、第二に、最も効率的な分子の活性立体配座を促進/安定化する目的で、N末端アミノ酸(N−アザ)又はC末端アミノ酸(C−アザ)においてCHαの代わりに窒素原子が導入された疎水性アザペプチド又はアザペプチド模倣物である。本発明に係る化合物は、化学療法的治療中に増幅されたABCトランスポーターの排出機能をブロックできる。ABCは、抗ガン剤、抗ウイルス剤、抗細菌剤、抗真菌剤若しくは抗寄生虫剤であっても、又は、所定の病変についてより広く使用される薬剤であっても、輸送/排出/拒絶を通じて、薬剤の薬物動態を変化させる。
【0035】
従って、本発明の別の主題は、治療患者の身体が耐性を発現する、患者に施される化学療法のためのアジュバントとして使用され、治療活性を回復させることを目的とする上記化合物に関する。なかでも、本発明に係る化合物は、抗ガン剤用又は抗感染剤用アジュバントとして使用できる。
【0036】
本発明に係る化合物は、下記薬剤用のアジュバントであることが好ましい:
・アントラサイクリン、トポイソメラーゼ阻害剤、代謝拮抗剤(抗葉酸剤)、チロシンキナーゼ阻害剤、抗ウイルス剤(逆転写酵素阻害剤)、抗寄生虫剤、及び、抗真菌剤から選択される薬剤;又は、
・ダウノルビシン、ドキソルビシン、ミトキサントロン、カンプトテシン及びその誘導体、イリノテカン、トポテカン、インドロカルバゾール、メトトレキセート、イマチニブ、ゲフィチニブ、ジドブジン、ラミブジン、アバカビル、イベルメクチン、アルベンダゾール、オクスフェンダゾール、並びに、ケトコナゾールから選択される薬剤。
【0037】
本発明の別の態様によれば、本発明は、水和物、溶媒和物、又は、薬学的に許容される塩の形態であってもよい上記式(I)、(IA)又は(IB)の化合物の、化学療法、特に癌腫学における化学療法の効果を向上させる薬剤の製造への使用に関する。
【0038】
本発明は、本発明に係る化合物(i)と、治療が望まれるガン又は病気に効果的な化学療法剤(ii)とを、別々に又は一緒に含む薬剤に関する。本発明の特定の一実施形態によれば、薬剤は、本発明に係る化合物(i)と、治療が望まれるガン又は病気に効果的な化学療法剤(ii)とを同じ製剤中に組み合わせた単一の医薬組成物の形態である。
【0039】
従って、本発明の主題はまた、治療が望まれるガン又は病気に効果的な化学療法剤と共に、ガン治療又は抗感染治療に用いられる、薬学的に許容される塩、溶媒和物若しくは水和物の形態であってもよい上記式(I)、(IA)又は(IB)の化合物を含む医薬組成物に関する。
【図面の簡単な説明】
【0040】
【図1】一般的なABCトランスポーターによって誘導される基質の排出を示す図である。
【図2A】化合物(I.A.2)の阻害の種類を表す。
【図2B】化合物(I.A.2)の阻害の種類を表す。
【図2C】化合物(I.A.2)の阻害の種類を表す。
【図2D】化合物(I.A.2)の阻害の種類を表す。
【図2E】化合物(I.A.2)の阻害の種類を表す。
【図3】化合物(IA.2)による、ABCG2を発現するHEK−293細胞の化学増感を表す。
【図4】化合物(IA.2)の、HEK−293細胞に対する無害性を表す。
【図5】化合物(IA.1)による、ABCG2を発現するHEK−293細胞の化学増感を表す。
【図6】化合物(IA.1)の、HEK−293細胞に対する無害性を表す。
【図7】化合物(IB.1)による、HEK−293細胞の化学増感を表す。
【図8】化合物(IB.1)の、HEK−293細胞に対する無害性を表す。
【図9】化合物(IB.1)の、NIH−3T3細胞に対する無害性を表す。
【図10】化合物(IB.11)の、HEK293細胞に対する無害性を表す。
【図11】化合物(I.A.3)の阻害の種類を表す。
【図12】化合物(IA.2)がABCG2発現レベルを減少させることを表す。
【発明を実施するための形態】
【0041】
以下の記載により、本発明をさらに詳細に理解できる。初めに、いくつかの定義を確認する。
【0042】
「アルキル基」とは、直鎖状又は分枝状の飽和炭化水素系鎖を意味する。炭素数1から12、好ましくは炭素数1から7のアルキル基としては、メチル、エチル、n−プロピル、iso−プロピル、n−ブチル、tert−ブチル、sec−ブチル、n−ペンチル、n−ヘキシル、n−ヘプチル及び−CH[CH(CH3)2]2基等が挙げられる。
【0043】
「シクロアルキル基」とは、炭素数3から7の飽和環状炭化水素系鎖を表す。シクロアルキル基としては、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル及びシクロヘプチル基等が挙げられる。
【0044】
「アリール基」とは、好ましくは炭素数6から12であり、フェニル、シンナミル又はナフチルラジカル等の芳香族基を少なくとも1つ有する、単環式、二環式又は多環式の炭素環を表す。アリール基としては、フェニル基が特に好ましい。
【0045】
「ヘテロアリール基」とは、窒素、酸素及び硫黄原子から選択される1以上のヘテロ原子が原子間に介在するアリール基を意味し、例えば、ピリジル、フリル、チエニル、イソキサゾリル、オキサジアゾリル、オキサゾリル、ベンズイミダゾール、インドリル及びベンゾフリル基等から選択される。
【0046】
「置換アリール又はヘテロアリール基」とは、例えば、ハロゲン原子;−CF3、−NH2、−OH若しくは−COOH基;炭素数1から12のアルキル基;炭素数1〜8のO−アルキル基;(CH2)pR’基若しくは−O−(CH2)pR’基(R’はアリール基又はシクロアルキル基;pは0又は1);ニトロ官能基;又は、−COOR基(Rは炭素数1〜12のアルキル基、又は(CH2)pR’基(R’はアリール基又はシクロアルキル基;pは0、1、2又は3))で置換された一置換体又は多置換体、特に二置換体、である基などを意味する。
【0047】
「アミノ酸」は、以下の構造を有する有機化合物に対応する。
【0048】
【化5】

【0049】
従って、「アミノ酸側鎖」とは、特に下記のアミノ酸におけるR基を意味する:グリシン、トレオニン、セリン、アスパラギン酸、アスパラギン、システイン、アラニン、プロリン、バリン、イソロイシン、ヒスチジン、ロイシン、メチオニン、フェニルアラニン、グルタミン酸、グルタミン、リシン、アルギニン、トリプトファン及びチロシン。なかでも、酸、アミン又はアルコール官能基は、保護された形態であることが好ましい。アミノ酸側鎖の保護基は当業者に周知であり、特に「Chem.Rev.」(2009年,109,2455−2504)に記載されている。該文献は、参照により本願に組み込まれる。
【0050】
一般に、アミノ基の保護基は当業者に周知であり、特に、上記出版物並びに「Protective Groups in Organic Synthesis」(Greene T.W.及びWuts P.G.M.,John Wiley&Sons社,2006年)及び「Protecting Groups」(Kocienski P.J.,1994年,Georg Thieme Verlag社)に記載されている。このような基としては、Boc(tert−ブチルオキシカルボニル)、Fmoc(9−フルオレニルメトキシカルボニル)及びZ(ベンジルオキシカルボニル)基等が挙げられる。置換基R1にこのような基があると、分子の疎水性が向上する。
【0051】
本発明で使用されるアミノ酸類似体としては、ホモグルタミン酸及びホモセリンが挙げられるが、これらに限定されない。
【0052】
「アザペプチド又はアザペプチド模倣」とは、CHαがNで置換されたペプチド又はペプチド模倣物を意味する。「ペプチド模倣物」とは、ペプチド結合、すなわち、一方のアミノ酸が有するアミン基と、他方のアミノ酸が有するカルボン酸基との間で水を除去して形成された、二つのアミノ酸の結合を等配電子結合によって置換したものを意味し、例えば、メチルアミノ(−CH2−NH−)等である。「ガン」とは、一般的には細胞増殖が制御できなくなった病状をいう。ガンとしては、癌腫、リンパ腫、芽細胞腫、肉腫及び白血病等が挙げられ、より具体的には、肺類表皮ガン、結腸腺ガン、神経膠腫、中皮腫、乳腺ガン、黒色腫、腎明細胞ガン、前立腺ガン、肝細胞ガン及び多発性骨髄腫等が挙げられる。
【0053】
「治療」とは、望ましい臨床効果又は有益な効果をもたらす、疾患又は障害を予防又は抑制する治療処置を表し、特に、1以上の症状を排除若しくは低減すること、又は、ガン若しくはそれに伴う障害の進行を退行、遅延若しくは停止させることを含む。
【0054】
「治療上有効な量」とは、ガンに特徴的なパラメータのうち1以上のパラメータを改善するような組成物の量を表す。
【0055】
以下、式(I)で表される化合物の合成を詳述する。
【0056】
X1=N且つY=C(O)である式(I)の化合物は、スキーム1に示した式(II)の化合物と式(III)の化合物とのカップリング反応で得られる。ここで、R2、R3、X2、X3及びX4は式(I)と同義であり、R2が、置換されていてもよいアリール基又はヘテロアリール基の場合、R1PはそのままR1基を表し、R2が、保護された形態であってもよい、アミノ酸又はアミノ酸類似体の側鎖の場合、R1Pは水素原子を表す。
【0057】
スキーム1
【0058】
【化6】

【0059】
酸塩化物(II)は、トリホスゲンの作用によりin situで生成され、文献(「Journal of Peptide Science」、1997年、3、429−441)に記載の方法で、化合物(III)と結合させる。ここで化合物(III)は、X2=CHの場合、酸官能基(−COOR3)と側鎖(−X3−X4)に存在してもよいアミン官能基とが保護されているD−又はL−アミノ酸に対応し、X2=Nの場合、酸官能基(−COOR3)と側鎖(−X3−X4)に存在してもよいアミン官能基とが保護されているアザ−アミノ酸に対応する。
【0060】
R2が、置換されていてもよいアリール基又はヘテロアリール基の場合、式(II)の化合物は当業者に周知の方法で調製される。
【0061】
スキーム2は、式(IA)の化合物を調製する場合の合成を示し、R2は−COOR”5基で置換されたフェニルである。スキーム2中、R1及びR5は式(I)と同義であり、R5pは、R5基又はR5基の前駆体、例えば−COOHである。
【0062】
スキーム2
【0063】
【化7】

【0064】
まず、ヒドラジノ安息香酸(VIA)を位置選択的にアシル化する(「J.Med.Chem.」,1996年,39,1172−1188)。R5基の性質に応じて、特にR5=−COOR”5(R”5は式(IA)の化合物と同義)の場合、R5p=−COOHである中間化合物(IV’A)を形成し、それを、例えばワング法(「J.Org.Chem.」,1977年,42,1286−1290)によりエステル化して-COOR”5とする。次に、トリホスゲンの作用で酸塩化物(II)をin situで生成し、化合物(III)とカップリングする。
【0065】
R2が、保護された形態であってもよい、アミノ酸又はアミノ酸類似体の側鎖の場合、式(II)の化合物もまた、R2が−(CH2)m−COOR6基(m及びR6は式(IB)の化合物と同義)の場合を表した式(IVB)の化合物を出発材料として、当業者に周知の方法で調製される。
【0066】
【化8】

【0067】
スキーム3は、式(IB)の化合物を調製する場合の合成を示し、R2は−CH2COOBnである。
【0068】
スキーム3
【0069】
【化9】

【0070】
Bocヒドラジン(1)からNβBocヒドラジノアセテート(IVB.1)を調製する。第一段階では、Boc−ヒドラジン(1)の1級アミンをアセトンで保護して、イミン(2)を形成する。続いて、Meyer(K.Meyer Synlett,2004年,2355−2356)の方法に基づいた方法に従って、ブロモアセテートを用いたアルキル化反応により、アルキル化合物(3)を導く。同時に二つのアミンを脱保護するため、好ましくはpara−トルエンスルホン酸を用いて化合物(VIB.1)を得る。化合物(IVA)の場合と同様の方法により、1級アミンを保護して化合物(IVB.1)を生成し、酸塩化物に変換し、化合物(III)とカップリングする。
【0071】
式(III)の化合物自体は、特に下記いずれかの方法で調製できる。
・Pati(「Synthetic Communications」,2004年,34,933−40)の方法に基づいた方法に従ってヨードアニリン(4)から得られる好適に保護されたヨードアニリン(5)とBoc−ヒドラジンとをブッフバルト(Buchwald)反応(「Org.Lett.」,2001年,3,3803−3805)させ、対応する化合物(III)を得る。下記スキーム4は、X2=N、R3=tert−ブチル、及び、X3−X4=
【0072】
【化10】

である場合の、化合物(III.1)の調製方法を示す。
【0073】
スキーム4
【0074】
【化11】

【0075】
・文献(「Tetrahedron」,1989年,45,6319−6330及び「J.Org.Chem.」,2001年,66,2869−2873)に記載された手順に従い、フタロイル基でβ保護され、且つ、カルバメート基でα保護されたヒドラジンと、好ましい基によりアミン官能基上で保護された保護アミノアルコールとを光延反応させる。アミン官能基上で保護されたアミノアルコールは、文献(「Tetrahedron」,1989年,45,6319−6330及び「Tetrahedron Asymmetry」,2003年,14,139−143)に記載された方法に従って調製する。以下のスキーム5は、X2=N、−COOR3=Boc、及び、X3−X4=−(CH2)6NHZである場合の上記調製方法を示す。
【0076】
スキーム5
【0077】
【化12】

【0078】
アミン(6)は、アミノアルコール(7)として保護される。同時に、Boc−ヒドラジン(8)は、フタロイル基で保護されて化合物(9)を形成する。保護されたヒドラジン(9)とアミノアルコール(7)とを光延反応させた後、アザ−アミノ酸を脱保護して化合物(III.2)を得る。
【0079】
下記スキーム6に示した通り、好適に保護されたアミノアルデヒド(V)と上述の化合物(III)とを、Martinezらの方法(「J.Med.Chem.」,1985年,28,273−278)に従って還元的にアミノ化し、X1=CH、X2=N、及びY=CH2である式(I)の化合物を調製する。
【0080】
スキーム6(式中、R1、R2、R3、X3及びX4は式(I)と同義である)
【0081】
【化13】

【0082】
アミノアルデヒド(V)は、Z.Guoらの方法(「Bioorg.Med.Chem.」,2001年,9,99−106)に従って調製してもよい。スキーム7は、R1=Boc及びR2=CH2−CO2Bnである場合のこれらの化合物の調製手順を示す。化合物(V.1)は、アミノ酸(11)をアミノアルコール(12)に還元し、続いてこれを酸化させることで得られる。
【0083】
スキーム7
【0084】
【化14】

【0085】
下記スキーム8に示した通り、Bouillonらの方法(「Tetrahedron」,2007年,63,223−2234)に従って、好適に保護されたアミノ酸(VII)と上記化合物(III)とをペプチドカップリング反応し、X1=CH、X2=N、及びY=COである式(I)の化合物を調製する。
【0086】
スキーム8(式中、R1、R2、R3、X3及びX4は式(I)と同義である)
【0087】
【化15】

【0088】
本発明に係る化合物の塩は、当業者に周知の方法で調製される。本発明に係る式(I)の化合物の塩は、式(I)の化合物及び薬学的に許容されるその塩を好適に分離又は結晶化できる無機又は有機の酸又は塩基を用いて構成される。好ましい酸としては、シュウ酸又は光学活性酸(例えば、酒石酸、ジベンゾイル酒石酸、マンデル酸若しくはカンファースルホン酸等)、及び、生理的に許容される塩(例えば、塩酸塩、臭化水素酸塩、硫酸塩、硫酸水素塩、リン酸二水素塩、マレイン酸塩、フマル酸塩、2−ナフタレンスルホン酸塩、para−トルエンスルホン酸塩、メシル酸塩、ベシル酸塩若しくはイセチオン酸塩等)を形成するものが挙げられる。好ましい塩基としては、リシン、アルギニン、メグルミン、ベネタミン及びベンザチン、並びに、生理的に受容される塩(ナトリウム、カリウム又はカルシウム塩等)を形成するものが挙げられる。
【0089】
水和物の形態の化合物としては、半水和物及び一水和物等も含まれる。
【0090】
本発明に係る化合物が1以上の不斉炭素を含む場合、この化合物の光学異性体は本発明の一部である。本発明は、式(I)の化合物を純粋な異性体として含んでもよく、任意の割合の異性体混合物として含んでもよい。化合物(I)は、例えば、その原理が周知である、光学活性酸若しくは塩基を用いたラセミ塩の分別再結晶といった標準的な分離方法、又は、キラル若しくはアキラル相を用いた標準的なクロマトグラフィー法により、純粋な異性体として単離される。
【0091】
上記式(I)の化合物は、1以上の水素、炭素又はハロゲン原子(特に塩素又はフッ素)が、例えば三重水素や炭素14等の放射性同位体に置換されたものも含む。そのように標識化した化合物は、調査、代謝若しくは薬物動態の研究、又は、生化学試験に有用である。
【0092】
式(I)の化合物の分子及び反応中間体内に存在する官能基は、所望の化合物を確実に合成できる保護基で不変的又は一時的に保護してもよい。保護・脱保護反応は、当業者に周知の方法で行われる。「アミン、アルコール又はカルボン酸の一時的又は不変的な保護基」とは、「Protective Groups in Organic Synthesis」(Greene T.W.及びWuts P.G.M.,John Wiley&Sons社,2006年)及び「Protecting Groups」(Kocienski P.J.,1994年,Georg Thieme Verlag社)等に記載されたような保護基を意味する。
【0093】
上述した式(I)の化合物は、1以上の排出タンパク質P−gp及び/又はBCRPに対して阻害作用を示し、この作用は下記の試験で実証できる。また、これらの化合物について、薬理学的に有効な投与量では毒性の兆候は観察されず、従って、その毒性は薬剤としての使用に適合する。
【0094】
従って、上記化合物は、上述の排出機構により耐性株に対して不活性となった化学療法剤、特に抗感染剤又は抗ガン剤の効果を増強、すなわち向上させるのに使用できる。「増強」とは、式(I)の化合物と抗感染剤又は抗ガン剤とを組み合わせることで、上記化合物のいずれかを用いて得られる効果よりも高く、且つ、別々に得られた効果を足し合わせたものよりもはるかに高い治療効果が得られることを意味する。
【0095】
従って、本発明に係る式(I)、(IA)及び(IB)の化合物、並びに、その塩、溶媒和物又は水和物は、治療を受けた身体がMDR型耐性を発現する、抗ガン剤若しくは抗感染剤、又は、医学及び/若しくは獣医学における他の化学療法のためのアジュバントとして使用でき、それらの活性を回復できる。
【0096】
二種類の治療、すなわち式(I)の化合物を用いた治療及び化学療法剤を用いた治療は、同時的、逐次的、連続的、又は、時間に対して割り振られたものであってもよい。二つの有効成分は、それぞれ別の医薬組成物として別々に投与されてもよく、この場合、投与は同時であっても時間に対して割り振られていてもよい。あるいは、単一の医薬組成物として一緒に投与されてもよく、この場合、投与は同時である。
【0097】
時間に対して割り振られた投与の場合、様々な投与又は治療順序が想定される。式(I)の化合物は、化学療法剤が投与される前(例えば、5分、15分、30分、45分、1時間、2時間、4時間、6時間、12時間、24時間、48時間、72時間、96時間、1週、2週、3週、4週、5週、6週、8週又は12週前)に投与されてもよく、また同時に、化学療法剤が投与された後(例えば、5分、15分、30分、45分、1時間、2時間、4時間、6時間、12時間、24時間、48時間、72時間、96時間、1週、2週、3週、4週、5週、6週、8週又は12週後)に投与されてもよい。
【0098】
また、本発明の主題は、有効量の本発明に係る化合物又はその受容される塩、溶媒和物若しくは水和物と好適な賦形剤とを含む、動物(ヒトを含む)に投与できる組成物の薬剤としての、式(I)の化合物及びその薬学的に適合する塩又は場合によっては溶媒和物若しくは水和物に関する。
【0099】
本発明の主題は、好適な賦形剤とともに、薬学的に許容される塩、溶媒和物又は水和物の形態であってもよい式(I)、(IA)又は(IB)の化合物と、好ましくはアントラサイクリン、トポイソメラーゼ阻害剤、代謝拮抗剤(抗葉酸剤)、チロシンキナーゼ阻害剤、抗ウイルス剤(逆転写酵素阻害剤)、抗寄生虫剤及び抗真菌剤から選択される化学療法剤とをそれぞれ有効量で、別々に又は単一の製剤中に含む医薬組成物にも関する。
【0100】
上記賦形剤は、剤形及び望まれる投与方法に従って選択される。
【0101】
経口、舌下、皮下、筋肉内、静脈内、局部、気管内、鼻腔内、経皮、直腸又は眼内投与用の本発明に係る医薬組成物において、上記式(I)の有効成分又はその考えられる塩、溶媒和物及び水和物は、上記疾患又は障害を予防又は治療するために、薬学的に標準的な基剤との混合物として、単位投与形態で、動物及びヒトに投与されてもよい。適切な単位投与形態としては、錠剤、ゲルカプセル、粉末剤、顆粒剤及び経口溶液又は懸濁液等の経口投与形態;舌下、頬側、気管内又は鼻腔内投与形態;皮下、筋肉内又は静脈内投与形態;並びに、直腸投与形態が挙げられる。局部投与の場合、本発明に係る化合物は、クリーム、軟膏、ローション又は点眼剤として使用されてもよい。
【0102】
効果を得るためには、有効成分の投与量が体重1kg当たり1日1〜100mgの範囲であることが好ましい。化合物(I)と、効果が増強される抗感染剤又は抗ガン剤とは、4:1の比で投与されることが好ましい。
【0103】
固体組成物が錠剤形態で調製される場合、有効成分は、ゼラチン、デンプン、ラクトース、ステアリン酸マグネシウム、タルク、アラビアゴム等の薬学的ビヒクルと混合される。錠剤は、スクロース、セルロース誘導体又はその他の好適な材料で被覆してもよい。あるいは、持続性又は遅延性活性を有するように、また、所定量の有効成分を連続的に放出するように処理されてもよい。
【0104】
ゲルカプセル製剤は、有効成分を希釈剤と混合し、得られた混合物をソフト又はハードゲルカプセルに注入して得られる。
【0105】
本発明の化合物を含有する医薬組成物は、溶液、乳液、懸濁液又はシロップ等の液体形態であってもよい。適切な液体形態としては、水、グリセリンやグリコール等の有機溶媒、及び、これらの混合物の、様々な割合での水溶液が挙げられる。
【0106】
滴剤として投与するためのシロップ又はエリキシル剤状製剤は、有効成分とともに、甘味料、好ましくはカロリーフリー甘味料、殺菌剤としてのメチルパラベン及びプロピルパラベン、並びに、香料及び好適な着色料を含有してもよい。水分散性の粉末剤又は顆粒剤は、分散剤若しくは湿潤剤又は懸濁剤(ポリビニルピロリドン等)との混合物として、更には甘味料又は調味料とともに、有効成分を含有してもよい。
【0107】
従って、本発明の主題は、いくつかの有効成分を組み合わせて含有し、そのうちの一つが化合物(I)であり、その他が上述の抗感染剤又は抗ガン剤であるような医薬組成物にも関する。
【0108】
また、通常、これらの化合物を含む薬剤及び使用にも、必要な変更を加えた上で、化合物(I)及び組成物について上述したのと同様のことが適用できる。
【0109】
以下の表2〜5にまとめた実施例により本発明を説明するが、本発明はこれらに限定されない。
【0110】
以下の略号が使用される。
Et=エチル
Ac=アセチル
Bn=ベンジル
Z=−C(O)OCH2Ph
Boc=tert−ブチルオキシカルボニル
tBu=tert−ブチル
Ph=フェニル
EtOAc:酢酸エチル
DCM:ジクロロメタン
DMF:ジメチルホルムアミド
DMSO:ジメチルスルホキシド
P.E.:石油エーテル
NMM:N−メチルモルホリン
eq.:当量
IR:赤外
Rf:フロント比
DBAD:ジ−tert−ブチルアジドジカルボキシレート
DEAD:ジエチルアジドジカルボキシレート
DIAD:ジイソプロピルアジドジカルボキシレート
Asp:アスパラギン酸
Glu:グルタミン酸
Lys:リシン
EDCI:N−(3−ジメチルアミノプロピル)−N’−エチルカルボジイミド
HOBt:1−ヒドロキシベンゾトリアゾール
DCC:ジシクロヘキシルカルボジイミド
DMAP:4−ジメチルアミノピリジン
【0111】
表2
【0112】
【化16】

X1=N、Y=−C(O)−、X2=−CH−、R5=−COOR”5、−X3−X4−=−(CH2)4−NHR4である化合物(IA)
【0113】
【表2】

【0114】
表3
【0115】
【化17】

X1=N、Y=−C(O)−、X2=N、R5=−COOR”5、−X3−X4−=−(CH2)6−NHR4である化合物(IA)
【0116】
【表3】

【0117】
表4
【0118】
【化18】

X1=CH、X2=N、R6=Bn、立体配置:L体である化合物(IB)
【0119】
【表4】

【0120】
表5
【0121】
【化19】

X1=N、X2=CH、R6=Bnである化合物(IB)
【0122】
【表5】

【実施例】
【0123】
I.実験の項
化合物の合成例
【0124】
一般的な方法
・アルミホイルをシリカ(60F254、メルク社)で被覆したプレートで、薄層分析クロマトグラフィーを行う。UV(254nm)下で、ニンヒドリンのエタノール溶液又は酸性アニスアルデヒド溶液を噴霧して曝露し、検出を行う。
・60Åシリカゲル(メルク社、40〜63μm)でフラッシュクロマトグラフィー精製を行う。
・加熱ブロック融点測定器Electrothermal9200で融点を測定する。
・ADP220旋光計(Bellingham+Stanley社)又はP−1010旋光計(Jasco社)を用いて、旋光度を測定する。
・油状物の場合は塩化ナトリウムペレット上の膜として、固形物の場合は臭化カリウム中でペレット化して、赤外スペクトルを得る。測定器としては、Spectrum One FT−IR分光計(パーキンエルマー社)を用いる。
・ALS300装置(300MHz、ブルカー社)を用いて、カッコ内に記載した溶媒でプロトン核磁気共鳴(NMR)スペクトルを得る。DRX300装置(75MHz、ブルカー社)を用いて炭素スペクトルを記録する。化学シフト(δ)はppm(パーツ・パー・ミリオン)で表す。多重度は、一重線(s)、二重線(d)、三重線(t)、四重線(q)及び多重線(m)で表す。
・マススペクトルは、ジクロロメタンを溶媒とし、LCQ−Advantage装置(Thermo−Finnegan社)を用いて、エレクトロスプレーモードで得た。
【0125】
実施例1
(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(2’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.1)
a)2−[2−(tert−ブトキシカルボニル)ヒドラジノ]安息香酸(IV’A.1)
2−ヒドラジノ安息香酸塩酸塩3g(16mmol、1eq.)のジオキサン溶液(1mL/mmol)に、Boc2O3.81g(17.5mmol、1.1eq.)のジオキサン溶液(0.4mL/mmol)を添加する。溶液を0℃に冷却し、Na2CO3の5%水溶液を滴下してpHを8〜9とする。溶液を室温まで温め、24時間攪拌を継続する。ジオキサンを留去する。媒体を水に溶解し、1NのHCl溶液で酸性化してpHを1とする。混合物を酢酸エチルで三回抽出する。合わせた有機相を硫酸ナトリウムで乾燥させ、ろ過、蒸発乾固する。得られた粉末を石油エーテル中で摩砕し、真空下で乾燥させて、化合物(IV’A.1)3.75gを得る(収率93%)。
【0126】
1H NMR(300MHz,DMSO):δ(ppm)=1.41(s、9H、C(CH3)3);6.75(t,J=7.5Hz,1H,H3);6.86(d,J=8.1Hz,1H、H5);7.43(t、J=7.8Hz、1H、H4);7.81(d、J=8.1Hz、1H、H6);8.88(s、1H、NH);9.05(s、1H、NH);13(s、1H、COOH)
IR(KBr):νNH=3381.6cm−1;νCsp3−H=2971.7cm−1;νC=O=1697.6cm−1及び1676.7cm−1;νC=C=1609.1cm−1及び1587.2cm−1
融点=146℃
【0127】
b)2−[2−(tert−ブトキシカルボニル)ヒドラジノ]安息香酸のベンジルエステル(IVA.1)
Nβ−Boc−ヒドラジノ安息香酸(IV’A.1)1.5g(5.94mmol、1eq.)をメタノール(4.2mL/mmol)及び水(0.42mL/mmol)に溶解させる。CsCO3の20%水溶液を添加して、pHを7とする。溶媒を留去し、残渣をDMF(1mL/酸100mg)に二回溶解させてから、再留去する。単離されたセシウム塩をDMF(2mL/酸100mg)で希釈し、臭化ベンジル0.78mL(6.54mmol、1.1eq.)を添加する。反応混合物を室温で4時間攪拌し続ける。DMFを留去し、得られた混合物を大量の水に溶解し、酢酸エチルで抽出する。有機相を水、更にはNaCl飽和溶液で洗浄し、硫酸ナトリウムで乾燥させ、ろ過、蒸発乾固する。シリカゲルフラッシュクロマトグラフィー(DCM/P.E.混合物(体積比3/1)で溶離)によって粗生成物を精製し、1.88gの淡黄色油状物を得る(収率96%)。
【0128】
1H NMR(300MHz,DMSO):δ(ppm)=1.41(s,9H,C(CH3)3);5.34(s,2H,CH2);6.75−7.89(m,9H,Harom);8.73(s,1H,NH);9.10(s,1H,NH)
IR(NaCl):νNH=3346.2cm−1;νCsp2−H=3066.3cm−1及び3034.8cm−1;νCsp3−H=2978.4cm−1及び2934.6cm−1;νC=O=1722.9cm−1及び1692cm−1;νC=C=1606.4cm−1及び1585.6cm−1
【0129】
c)ヒドラジノエステル(IVA.1)250mg(0.73mmol、1eq.)の蒸留DCM溶液(4mL/mmol)に、トリホスゲン0.35eq.を添加する。反応媒体の温度を−10℃まで低下させ、NMM(1.08eq.)の蒸留DCM溶液(0.5mL/mmol)を導入する。反応媒体を−10℃で1時間攪拌する。H−Lys(Z)−OtBu270mg(0.73mmol、1eq.)とNMM(1.08eq.)の蒸留DCM溶液(0.5mL/mmol)とを添加する。温度を−10℃にして2時間保持し、徐々に室温まで温める。室温で20時間後、DCM(30mL/mmol(ヒドラジノエステル))を添加して媒体を希釈し、ろ過する。有機相を0.5MのKHSO4溶液、更には水で洗浄し、硫酸ナトリウムで乾燥させ、ろ過、蒸発する。シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1/2)で溶離)によって粗生成物を精製する。250mgの黄色油状物を得る(収率45%)。
【0130】
1H NMR(300MHz,CDCl3):δ(ppm)=0.87(m,2H,CH2−CHα);1.44(s,9H,C(CH3)3);1.48(s,9H,C(CH3)3);1.7(m,4H,CH2−(CH2)2−CH2);3.18(m,2H,CH2−NHZ);4.46(m,1H,CHα);5.02(s,broad,1H,NH);5.08(s,2H,CH2−C6H5);5.36(s,2H,CH2−C6H5);6.12(s,broad,1H,NH);7.12(s,broad,1H,NH);7.38−8.2(m,14H,Harom)
13C NMR(75MHz,CDCl3):δ(ppm)=11.37;14.61;21.45;22.39;28.42;29.6;30.1;33.1;41.19;53.92;60.78;66.83;67.58;77.1;77.53;77.73;77.95;82.27;127.6;128.36;128.44;128.65;128.75;128.85;129.1;132.01;133.98;135.8;137.18;141.64;155.08;156.61;156.86;166.13;171.53;172.13
IR(NaCl):νNH=3349.2cm−1;νCsp2−H=3066.1cm−1及び3033.8cm−1;νCsp3−H=2978.3cm−1及び2934.1cm−1;νC=O=1725.6cm−1,1713.6cm−1,1700.9cm−1及び1681.7cm−1;νC=C=1599.8cm−1及び1578.2cm−1
[α]D25℃=+1.68°(16.8g.L−1,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C38H48N4O9,727.3319;exp.,727.3324
【0131】
実施例2
(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.2)
a)3−[2−(tert−ブトキシカルボニル)ヒドラジノ]安息香酸(IV’A.2)
化合物(IV’A.1)で記載されたのと同様の手順に従い、3−ヒドラジノ安息香酸2.4g(16mmol、1eq.)をBoc2O3.8g(17mmol、1.1eq.)と反応させ、3.96gの酸(IV’A.2)を得る(収率98%)。
【0132】
1H NMR(300MHz,DMSO):δ(ppm)=1.42(s,9H,C(CH3)3);6.88(m,1H,H4);7.27(m,3H,H2−H5−H6);7.83(s,1H,NH);8.86(s,1H,NH);12.78(s,1H,COOH)
IR(KBr):νNH=3315.6cm−1;νCsp3−H=2982.0cm−1;νC=O=1706.4cm−1及び1689.2cm−1;νC=C=1611.2cm−1及び1594.4cm−1
融点=150℃
【0133】
b)3−[2−(tert−ブトキシカルボニル)ヒドラジノ]安息香酸のベンジルエステル(IVA.2)
化合物(IVA.1)で記載されたのと同様の手順に従い、化合物(IV’A.2)406mg(1.61mmol、1eq.)及び臭化ベンジル0.211mL(1.77mmol、1.1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1:5)で溶離)による精製を経て、283mgの黄色油状物を得る(収率51%)。
【0134】
1H NMR(300MHz,DMSO):δ(ppm)=1.40(s,9H,C(CH3)3);5.32(s,2H,CH2);7.25−7.50(m,9H,Harom);7.90(s,1H,NH);8.88(s,1H,NH)
IR(NaCl):νNH=3334.5cm−1;νCsp2−H=3066.1cm−1及び3034.5cm−1;νCsp3−H=2979.2cm−1及び2934.7cm−1;νC=O=1714.9cm−1及び1699.1cm−1;νC=C=1608.2cm−1及び1595.1cm−1
【0135】
c)化合物(IA.1)で記載されたのと同様の手順に従い、ヒドラジノエステル(IVA.2)270mg(0.79mmol、1eq.)及びH−Lys(Z)−OtBu295mg(0.79mmol、1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1/3、次いで1/2)で溶離)による精製を経て、220mgの黄色油状物を得る(収率40%)。
【0136】
1H NMR(300MHz,CDCl3):δ(ppm)=1.18(m,2H,CH2−CHα);1.35(s,9H,C(CH3)3);1.38(s,9H,C(CH3)3);1.40−1.62(m,4H,CH2−(CH2)2−CH2);3.10(m,2H,CH2−NHZ);4.35(m,1H,CHα);5.02(s,2H,CH2−C6H5);5.28(s,2H,CH2−C6H5);5.85(s,broad,1H,NH);6.95(s,broad,1H,NH);7.2−8.0(m,14H,Harom)
13C NMR(75MHz,CDCl3):δ(ppm)=22.14;28.05;28.09;29.34;32.49;40.75;53.71;66.58;66.92;82.18;82.56;127.25;128.07;128.30;128.52;128.63;129.00;129.14;130.99;135.92;136.72;142.06;154.75;155.29;156.57;165.88;171.93
IR(NaCl):νNH=3334cm−1;νCsp2−H=3066.1cm−1及び3034.3cm−1;νCsp3−H=2978.3cm−1及び2927.4cm−1;νC=O=1726.6cm−1,1714.9cm−1,1695.5cm−1及び1679.1cm−1;νC=C=1604.5cm−1及び1587.8cm−1
[α]D25.7℃=+4°(10g.L−1,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C38H48N4O9,727.3319;exp.,727.3324
【0137】
実施例3
(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(4’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.3)
a)4−[2−(tert−ブトキシカルボニル)ヒドラジノ]安息香酸(IVA’.3)
化合物(IV’A.1)で記載されたのと同様の手順に従い、4−ヒドラジノ安息香酸5g(26mmol、1eq.)をBoc2O6.54g(30mmol、1.1eq.)と反応させ、6.7gの酸(IVA’.3)を得る(収率100%)。
【0138】
1H NMR(300MHz,DMSO):δ(ppm)=1.42(s,9H,C(CH3)3);6.65(d,J=8.7Hz,2H,H3,H5);7.74(d,J=8.4Hz,2H,H2,H6);8.24(s,1H,NH);8.92(s,1H,NH);12.23(s,1H,COOH)
IR(KBr):νNH=3401.4cm−1;νCsp3−H=2981.5cm−1;νC=O=1700.9cm−1及び1683.2cm−1;νC=C=1606.2cm−1
融点=144℃
【0139】
b)4−[2−(tert−ブトキシカルボニル)ヒドラジノ]安息香酸のベンジルエステル(IVA.3)
化合物(IVA.1)で記載されたのと同様の手順に従い、化合物(IVA’.3)1g(3.96mmol、1eq.)及び臭化ベンジル0.51mL(4.36mmol、1.1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1/2)で溶離)による精製を経て、800mgの黄色油状物を得る(収率58%)。
【0140】
1H NMR(300MHz,DMSO):δ(ppm)=1.42(s,9H,C(CH3)3);5.28(s,2H,CH2);6.67−7.84(m,9H,Harom);8.35(s,1H,NH);9(s,1H,NH)
IR(NaCl):νNH=3313.9cm−1;νCsp2−H=3067cm−1及び3034.5cm−1;νCsp3−H=2983cm−1及び2934.6cm−1;νC=O=1709.1cm−1及び1688.9cm−1;νC=C=1609.4cm−1
【0141】
c)化合物(IA.1)で記載されたのと同様の手順に従い、ヒドラジノエステル(IVA.3)244mg(0.71mmol、1eq.)及びH−Lys(Z)−OtBu260mg(0.71mmol、1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1/2)で溶離)による精製を経て、150mgのベージュ色粉末を得る(収率30%)。
【0142】
1H NMR(300MHz,CDCl3):δ(ppm)=0.89(m,2H,CH2−CHα);1.48(s,18H,C(CH3)3,C(CH3)3);1.68(m,4H,CH2−(CH2)2−CH2);3.18(m,2H,CH2−NHZ);4.46(m,1H,CHα);5.0(s,broad,1H,NH);5.09(s,2H,CH2−C6H5);5.36(s,2H,CH2−C6H5);6.1(s,broad,1H,NH);7.08(s,broad,1H,NH);7.8−8.1(m,14H,Harom)
13C NMR(75MHz,CDCl3):δ(ppm)=14.60;21.46;22.44;28.21;28.40;28.45;29.69;30.09;31.84;32.69;36.89;41.06;54.05;60.81;66.92;66.99;77.10;77.53;77.73;77.95;82.58;82.92;121.85;126.53;128.43;128.53;128.60;128.88;128.98;130.86;136.49;137.03;146.45;154.97;155.36;156.96;163.05;166.3;172.28
IR(KBr):νNH=3389.9cm−1;νCsp2−H=3068.2cm−1及び3035.4cm−1;νCsp3−H=2978.1cm−1及び2932.6cm−1;νC=O=1719.3cm−1,1705.5cm−1,1672.2cm−1及び1665.2cm−1;νC=C=1607.4cm−1
[α]D25℃=+2.15°(13.9g.L−1,DCM)
融点=106℃
HRMS−ESI(m/z):[M+Na]calc.for C38H48N4O9,727.3319;exp.,727.3315
【0143】
実施例4
(2R)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のベンジルエステル(IA.4)
ヒドラジノエステル(IVA.2)500mg(1.46mmol、1eq.)の蒸留DCM溶液(4mL/mmol)にトリホスゲン0.35eq.を添加する。反応媒体の温度を−10℃まで低下させ、NMM(2eq.)の蒸留DCM溶液(0.5mL/mmol)を導入する。反応媒体を−10℃で1時間攪拌する。次いで、HCl.H−D−Lys(Z)−OBn600mg(1.46mmol、1eq.)とNMM(2eq.)の蒸留DCM溶液(0.5mL/mmol)とを添加する。温度を−10℃にして2時間保持し、徐々に室温まで温める。室温で20時間後、DCM(30mL/mmol(ヒドラジノエステル))を添加して媒体を希釈し、ろ過する。有機相を0.5MのKHSO4溶液、更には水で洗浄し、硫酸ナトリウムで乾燥させ、ろ過、蒸発する。シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)によって、粗生成物を精製する。362mgの黄色ペースト状物質を得る(収率34%)。
【0144】
1H NMR(300MHz,DMSO):δ(ppm)=0.88−1.20(m,2H,CH2−CHα);1.40(s,9H,COO(CH3)3);1.60−1.93(m,4H,CH2−(CH2)2−CHα);3.07−3.14(m,2H,CH2−NHZ);4.55−4.63(m,1H,CHα);5.06(s,2H,CH2−Ph);5.17(s,2H,CH2−Ph);5.33(s,2H,CH2−Ph);5.35(s,2H,CH2Ph);7.12(s broad,1H,NH);7.30−7.43(m,20H,Harom);7.70(s broad,1H,NH)
13C NMR(75MHz,DMSO):δ(ppm)=28.73;29.80;30.48;31.11;40.94;54.24;65.97;66.66;67.14;81.28;125.55;127.48;128.57;128.81;128.88;128.93;129.09;129.18;129.26;129.36;129.38;129.54;130.56;136.91;138.13;143.79;150.01;155.32;156.44;156.91;166.25;173.29
IR(KBr):νNH=3344cm−1;νCsp2 Harom=3065cm−1及び3033cm−1;νC=O=1715cm−1;νC−O ester=1248cm−1及び1158cm−1
[α]D25℃=+3°(5g.L−1,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C41H46N4O9,761.3162;exp.,761.3163
【0145】
実施例5
(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のベンジルエステル(IA.5)
化合物(IA.4)で記載されたのと同様の手順に従い、ヒドラジノエステル(IVA.2)500mg(1.46mmol、1eq.)及びHCl.H−Lys(Z)−OBn610mg(1.46mmol、1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、320mgの黄色ペースト状物質を得る(収率30%)。
【0146】
1H NMR(300MHz,DMSO):δ(ppm)=1.31(m,2H,CH2−CHα);1.38(s,9H,COO(CH3)3);1.61−1.77(m,4H,CH2−(CH2)2−CHα);2.94−2.96(m,2H,CH2−NHZ);4.19−4.21(m,1H,CHα);4.99(s,2H,CH2−Ph);5.13(s,2H,CH2−Ph);5.35(s,2H,CH2Ph);7.21−7.72(m,19H,Harom)
13C NMR(75MHz,DMSO):δ(ppm)=27.21;28.13;28.73;29.80;30.48;31.10;40.93;54.23;65.97;66.66;67.14;81.27;128.57;128.81;128.88;128.93;129.00;129.18;129.23;129.26;129.38;130.27;130.56;136.79;136.91;138.13;143.79;155.32;156.45;156.91;166.25;173.04
IR(KBr):νNH=3354cm−1;νCsp2 Harom=3066cm−1及び3034cm−1;νC=O=1723cm−1;νC−O ester=1248cm−1及び1156cm−1
[α]D25℃=−3°(5g.L−1,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C41H46N4O9,761.3162;exp.,761.3160
【0147】
実施例6
(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(フェニルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.6)
a)3−(2−tert−ブトキシカルボニルヒドラジノ)安息香酸のフェニルエステル(IVA.6)
化合物(IV’A.2)780mg(3mmol、1eq.)のDCM(3mL/mmol)及びDMF(溶解するのに最低限の量)溶液に、DCC618mg(3mmol、1eq.)及びフェノール873mg(9mmol、3eq.)を添加する。室温で15分攪拌し、DMAP18mg(0.15mmol、0.05eq.)を導入する。反応混合物を室温で4時間攪拌し、ろ過する。ろ液を蒸発乾固し、30mLのEtOAcに溶解する。有機相を0.1NのHCl溶液、0.1NのNaHCO3溶液、及びNaCl飽和溶液で二回洗浄し、硫酸ナトリウムで乾燥させ、ろ過、蒸発する。シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比1/9)で溶離)によって、粗生成物を精製する。
【0148】
1H NMR(300MHz,DMSO):δ(ppm)=1.41(s,9H,C(CH3)3);6.98−7.50(m,9H,Harom);7.97(s,1H,NH);8.93(s,1H,NH)
【0149】
b)化合物(IA.1)で記載されたのと同様の手順に従い、ヒドラジノエステル(IVA.6)300mg(0.9mmol、1eq.)及びH−Lys(Z)−OtBu340mg(0.9mmol、1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、130mgの黄色固体を得る。
【0150】
1H NMR(300MHz,CDCl3):δ(ppm)=1.19(m,2H,CH2−CHα);1.39(s,9H,C(CH3)3);1.41(s,9H,C(CH3)3);1.50−1.72(m,4H,CH2−(CH2)2−CH2);2.97(m,2H,CH2−NHZ);4.04(m,1H,CHα);4.99(s,2H,CH2−C6H5);7.23−7.94(m,14H,Harom);8.14(s,broad,1H,NH)
IR(KBr):νNH=3378.6cm−1;νCsp2 Harom=3066cm−1及び3034cm−1;νCsp3−H=2978.2cm−1及び2931.7cm−1;νC=O=1737.6cm−1及び1700.9cm−1;νC−O ester=1246.2cm−1及び1158.4cm−1
[α]D25℃=0.3°(5g.L−1,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C37H46N4O9,713.3162;exp.,713.3162
【0151】
実施例7
2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニル]−1−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノカルボン酸のベンジルエステル(IA.7)
a)1−ベンジルオキシカルボニル−1−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジン(III.3)
化合物(III.3)は、以下に記載する化合物(III.2)の合成と同様の手順に従い、ベンジルオキシカルボニルヒドラジン及び6−(ベンジルオキシカルボニルアミノ)ヘキサノールを出発材料として使用することで得られる。
【0152】
1H NMR(300MHz,DMSO):δ(ppm)=1.39−1.34(m,6H,(CH2)3);1.51−1.46(m,2H,CH2);2.98−2.92(q,2H,CH2−NHZ);3.31−3.26(t,2H,CH2−N−NH2);4.57(s,2H,NH2);5.00(s,2H,CH2−Ph);5.06(s,2H,CH2−Ph);7.37−7.20(m,10H,Harom)
IR(KBr):νNH=3306cm−1;νCsp2 Harom=3061cm−1及び3030cm−1;νC=O=1676cm−1;νC=C=1535cm−1;νC−O ester=1257cm−1及び1190cm−1
【0153】
b)化合物(IA.4)で記載されたのと同様の手順に従い、ヒドラジノエステル(IVA.2)850mg(2.5mmol、1eq.)及び化合物(III.3)990mg(2.5mmol、1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、244mgの油状物を得る。
【0154】
1H NMR(300MHz,DMSO):δ(ppm)=1.19−1.30(m,6H,(CH2)3);1.38(s,9H,COO(CH3)3);1.49(m,2H,CH2);2.98−2.92(q,2H,CH2−NHZ);3.41(t,2H,CH2−N−NH2);4.99(s,2H,CH2−Ph);5.10(s,2H,CH2−Ph);5.35(s,2H,CH2Ph);7.33−7.50(m,19H,Harom)
IR(NaCl):νNH=3308.0cm−1;νCsp2 Harom=3065.9cm−1及び3034.0cm−1;νCsp3−H=2978.2cm−1及び2932.8cm−1;νC=O=1715.3cm−1;νC−O ester=1251.3cm−1及び1161.1cm−1
HRMS−ESI(m/z):[M+Na]calc.for C42H49N5O9,790.3428;exp.,790.3429
【0155】
実施例8
2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニル]−1−(6−tert−ブチルオキシカルボニルアミノヘキシル)ヒドラジノカルボン酸のベンジルエステル(IA.8)
a)1−ベンジルオキシカルボニル−1−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジン(III.4)
化合物(III.4)は、以下に記載する化合物(III.2)の合成と同様の手順に従い、ベンジルオキシカルボニルヒドラジン及び6−(tert−ブトキシカルボニルアミノ)ヘキサノールを出発材料として使用し、且つ、光延反応においてDIADをDBADに置き換えることで得られる。
【0156】
1H NMR(300MHz,DMSO):δ(ppm)=1.35(s,9H,COO(CH3)3);1.20−1.50(m,8H,CH2−(CH2)4−CH2);2.87(q,2H,CH2−NHZ);3.28(t,2H,CH2−N−NH2);4.57(s,2H,NH2);5.06(s,2H,CH2−Ph);6.75(s,1H,NH);7.33(m,5H,Harom)
IR(KBr):νNH=3345cm−1;νCsp2 Harom=3065cm−1及び3033cm−1;νCsp3=2975cm−1及び2933cm−1;νC=O=1696cm−1;νC=C=1523cm−1;νC−O ester=1250cm−1及び1174cm−1
【0157】
b)化合物(IA.4)で記載されたのと同様の手順に従い、ヒドラジノエステル(IVA.2)850mg(2.5mmol、1eq.)及び化合物(III.4)913mg(2.5mmol、1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、50mgの茶色ペースト状物質を得る。
【0158】
1H NMR(300MHz,DMSO):δ(ppm)=1.23−1.30(m,6H,(CH2)3);1.36(s,9H,COO(CH3)3);1.39(s,9H,COO(CH3)3);1.48(m,2H,CH2);2.86(q,2H,CH2−NHZ);3.41(t,2H,CH2−N−NH2);5.09(s,2H,CH2−Ph);5.35(s,2H,CH2−Ph);7.28−7.47(m,14H,Harom)
IR(NaCl):νNH=3325.0cm−1;νCsp2 Harom=3065.9cm−1及び3027.4cm−1;νCsp3−H=2920.8cm−1;νC=O=1704.9cm−1及び1684.5cm−1
HRMS−ESI(m/z):[M+Na]calc.for C39H51N5O9,756.3584;exp.,756.3585
【0159】
実施例9
(3S)−4−[2−(6−ベンジルオキシカルボニルアミノヘキシル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.1)
a)6−ベンジルオキシカルボニルアミノヘキサン−1−オール(7)
6−アミノヘキサノール(6)1g(8.53mmol、1eq.)及びNa2CO3466mg(4.4mmol、2.2eq.)を水8mL及びTHF4mLに溶解させる。媒体を5℃に冷却する。次いで、THF2.5mLに溶解したクロロぎ酸ベンジル1.33mL(9.4mmol、1.1eq.)を滴下する。室温で2時間45分、攪拌しながら反応させる。THFを留去する。生成された固体を真空下でろ別し、水で洗浄し、更に真空下で乾燥させて、1.848gの白色固体を得る(収率86%)。
【0160】
1H NMR(300MHz,CDCl3):δ(ppm)=1.20−1.50(m,8H,CH2−(CH2)4−CH2);3.14(m,2H,CH2−NH);3.55(m,2H,CH2−OH);4.70(s,broad,1H,NH);5.05(s,2H,CH2Ph);7.30(m,5H,aromatic)
IR(KBr):νOH=3384cm−1;νNH=3335cm−1;νCsp2 Harom=3061cm−1及び3030cm−1;νCsp3=2942cm−1及び2859cm−1;νC=O=1685cm−1;νC=C=1530cm−1及び1464cm−1;νC−O ester=1290cm−1及び1253cm−1
融点=86℃
【0161】
b)N−(tert−ブトキシカルボニルアミノ)フタルイミド(9)
ディーン・スターク装置を備えた一口丸底フラスコ内で、無水フタル酸(3.36g、22.7mmol、1eq.)及びカルバジン酸tert−ブチル(3g、22.7mmol、1eq.)をトルエン65mL中に配置する。溶液を加熱して還流させる。2時間30分後、反応媒体を室温まで冷やし、次いで0℃まで冷やす。沈殿した生成物を、真空下でろ別する。続いて、生成物を酢酸エチルで再結晶させ、5.6gの半透明の白色結晶固体を得る(収率94%)。
【0162】
1H NMR(300MHz,CDCl3):δ(ppm)=1.52(s,9H,COOC(CH3)3);6.57(s,1H,NH);7.87(m,4H,aromatic)
IR(KBr):νNH=3323cm−1;νCsp2 Harom=3092cm−1;νCsp3=2984cm−1;νC=O=1798cm−1及び1736cm−1;νC=C=1530cm−1
融点=188−190℃(lit.:184−186℃)
【0163】
c)N−[(6−ベンジルオキシカルボニルアミノヘキシル)(tert−ブトキシカルボニル)アミノ]フタルイミド(10)
N−(tert−ブトキシカルボニルアミノ)フタルイミド(9)(1.86g、7.10mmol、1eq.)、保護されたアミノアルコール(7)(1.78g、7.10mmol、1eq.)、及びトリフェニルホスフィン(1.5eq.)を、0℃、アルゴン下で無水THF(10mL/mmol(フタルイミド))に溶解させる。DIAD1.5eq.を添加する。0℃で30分間、更には室温で攪拌を続ける。その後、THFを留去する。シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.:体積比1/1)で残渣を精製して、2.71gの橙色油状物を得る(収率77%)。
【0164】
1H NMR(300MHz,CDCl3):δ(ppm)=1.10−1.30(m,8H,CH2−(CH2)4−CH2);1.40(s,9H,COOC(CH3)3);3.10(m,2H,CH2−NH);3.55(m,2H,CH2−N−N);4.05(m,1H,NH);5.05(s,2H,CH2−Ph);6.30(s,broad,1H,NH);7.30(m,5H,phenyl);7.75(m,4H,aromatic phthalyl)
IR(NaCl):νNH=3347cm−1;νCsp2 Harom=3065cm−1及び3032cm−1;νCsp3=2980cm−1及び2936cm−1;νC=O=1796cm−1及び1737cm−1;νC=C=1530cm−1;νC−O ester=1246cm−1及び1157cm−1
【0165】
d)1−tert−ブチルオキシカルボニル−1−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジン(III.2)
フタロイル誘導体(10)(1.5g、3.03mmol、1eq.)をEtOH(1mL/60mg)に溶解させる。媒体を−20℃まで冷却する。次いで、ヒドラジン一水和物(1.5eq.)を添加する。−20℃で30分間、更に室温で3時間、媒体を攪拌し続ける。生成された白色固体をろ別する。ろ液を蒸発させ、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.:体積比4/6)で精製して、734mgの黄色油状物を得る(収率67%)。
【0166】
1H NMR(300MHz,CDCl3):δ(ppm)=1.15−1.50(m,18H,CH2−(CH2)4−CH2及びCOOC(CH3)3);3.10(q,J=6.8Hz及びJ=6.4Hz,2H,CH2−NHZ);3.28(t,J=6.8Hz,2H,CH2−N−NH2);3.85(s,broad,2H,NH2);4.72(s,broad,1H,NHZ);5.03(s,2H,CH2Ph);7.30(m,5H,aromatic)
IR(NaCl):νNH=3335cm−1;νCsp2 Harom=3065cm−1及び3033cm−1;νCsp3=2975cm−1及び2933cm−1;νC=O=1694cm−1;νC=C=1532cm−1及び1455cm−1;νC−O ester=1255cm−1,1167cm−1及び1141cm−1
【0167】
e)3−tert−ブトキシカルボニルアミノ−4−ヒドロキシブタン酸のベンジルエステル(12)
Boc−Asp(OBn)−OH(11)2g(6.2mmol、1eq.)を、無水THF100mLに溶解させる。媒体をアルゴン下に置き、−15℃まで冷却する。次いで、トリエチルアミン3.5mL(24.8mmol、4eq.)及びクロロぎ酸イソブチル854μL(6.2mmol、1eq.)を添加する。20分攪拌後、THF40mL及びMeOH10mLに溶解させたNaBH4(400mg、10.54mmol、1.7eq.)の溶液に、−78℃、アルゴン下で反応媒体を滴下する。媒体を2時間攪拌し続ける。次いで、1MのHCl溶液150mLを添加する。水相をEtOAcで三回抽出する。有機相をNa2CO3飽和溶液で三回洗浄し、無水硫酸ナトリウムで乾燥させ、蒸発させ、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.:溶出勾配1/3から1/1(体積比))で精製して、1.043gの橙/茶色油状物を得る(収率56%)。
【0168】
1H NMR(300MHz,CDCl3):δ(ppm)=1.38(s,9H,COOC(CH3)3);2.44(s,broad,1H,OH);2.62(d,J=6.4Hz,2H,CH2COO);3.62(s,2H,CH2OH);3.95(m,1H,CHα);5.05(s,2H,CH2Ph);5.15(s,broad,1H,NH);7.28(m,5H,aromatic)
IR(NaCl):νNH and OH=3380cm−1;νCsp2 Harom=3066cm−1及び3034cm−1;νCsp3=2977cm−1及び2933cm−1;νC=O=1713cm−1;νC=C=1515cm−1及び1456cm−1;νC−O ester=1249cm−1及び1166cm−1
【0169】
f)3−tert−ブトキシカルボニルアミノ−4−オキソブタン酸のベンジルエステル(V.1)
蒸留したばかりのDCM9mLに塩化オキサリル(11.75mmol、2.5eq.)1.03mLを入れて調製した溶液に、−78℃、アルゴン下で、DMSO1.67mL(23.5mmol、5eq.)を滴下する。このような条件下、媒体を15分間攪拌し続ける。蒸留したばかりのDCM20mLに溶解させた化合物(12)1.45g(4.70mmol、1eq.)を添加する。同じ条件下で、攪拌を1時間続ける。続いて、蒸留したばかりのトリエチルアミン5.9mL(42.3mmol、9eq.)を滴下する。−78℃で30分間、更に室温で15分間、攪拌し続ける。DCM及びH2Oを添加して媒体を希釈する。水相をDCMで二回抽出する。有機相を合わせて、無水硫酸ナトリウムで乾燥させ、蒸発させる。シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.:3/7+0.1%v/vのトリエチルアミン)で精製して、1.3gの淡黄色油状物を得る(収率85%)。
【0170】
1H NMR(300MHz,CDCl3):δ(ppm)=1.45(s,9H,COOC(CH3)3);2.90(dd,J=4.9Hz及びJ=17.6Hz,1H,CH2COO);3.10(dd,J=4.9Hz及びJ=17.7Hz,1H,CH2COO);4.40(m,1H,CαH);5.15(s,2H,CH2Ph);5.62(d,J=8.3Hz,1H,NH);7.37(m,5H,aromatic);9.70(s,1H,CHO)
IR(NaCl):νNH=3376cm−1;νCsp2 Harom=3066cm−1及び3034cm−1;νCsp3=2978cm−1及び2933cm−1;νC=O=1731cm−1;νC=C=1499cm−1及び1455cm−1;νC−O ester=1253cm−1及び1165cm−1
[α]D26.6℃=−3.88°(0.1g/L,DCM)
【0171】
g)アルデヒド(V.I)304mg(0.99mmol、1.67eq.)及びアザ−アミノ酸(III.2)216mg(0.59mmol、1eq.)を、MeOH/AcOH混合物:99/1(1mL/40mg(アルデヒド))に溶解させる。この溶液に、シアノ水素化ホウ素ナトリウム1.33eq.を、5〜6mgずつ45分かけて添加する。媒体を、室温で一晩攪拌し続ける。次に、フラスコを氷冷浴中に浸し、NaHCO3飽和溶液(1mL/10mg(アルデヒド))をゆっくりと添加する。水相をEtOAcで三回抽出する。有機相をNaHCO3飽和溶液で三回洗浄し、無水硫酸ナトリウムで乾燥させ、蒸発させる。更に、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.:体積比3/7)で精製して、265mgの黄色油状物を得る(収率41%)。
【0172】
1H NMR(300MHz,CDCl3):δ(ppm)=1.44(s,9H,COOC(CH3)3);1.56−1.46(m,17H,CH2−(CH2)4−CH2及びCOOC(CH3)3);2.65(m,2H,CH2COOBn);2.95(m,2H,CH2−NH);3.18(m,2H,CH2−N−N);3.25(m,2H,CH2−N−N);4.00(m,1H,CHα);4.30(s,broad,1H,NH);4.85(s,broad,1H,NH);5.12(d,J=6.0Hz,4H,CH2−Ph);5.15(m,1H,NH);7.45−7.30(m,10H,aromatic)
13C NMR(75MHz,DMSO):δ(ppm)=26.23;26.34;28.41;28.28;29.89;37.46;40.98;49.16;53.47;66.60;66.50;80.55;79.55;128.62;128.53;128.33;128.28;128.09;136.74;135.74;155.38;156.48;156.30;171.30
IR(NaCl):νNH=3339cm−1;νCsp2 Harom=3065cm−1及び3033cm−1;νCsp3=2976cm−1及び2933cm−1;νC=O=1696cm−1;νC=C=1523cm−1及び1455cm−1;νC−O ester=1248cm−1及び1166cm−1
[α]D25℃=−0.61°(18.9g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C35H52N4O8,679.3683;exp.,679.3688
【0173】
実施例10
(3S)−4−[2−(3−ベンジルオキシカルボニルアミノプロピル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.2)
a)1−tert−ブトキシカルボニル−1−(3−ベンジルオキシカルボニルアミノプロピル)ヒドラジン(III.5)
化合物(III.5)は、化合物(III.2)の合成と同様の手順に従い、tert−ブトキシカルボニルヒドラジン及び3−(ベンジルオキシカルボニルアミノ)プロパノールを出発材料として使用し、且つ、光延反応においてDIADをDEADと置き換えることで得られる。
【0174】
1H NMR(300MHz,CDCl3):δ(ppm)=1.50(s,9H,COOC(CH3)3);1.80(quint,J=19.2Hz,J=13.2Hz及びJ=6.4Hz,2H,CH2−CH2−CH2);3.25(q,J=6.4Hz及びJ=12.8Hz,2H,CH2NH);3.50(t,J=6.4Hz,2H,N−N−CH2);5.10(s,2H,COOCH2−Ph);6.50(s,broad,1H,NH);7.40(m,5H,phenyl)
IR(NaCl):νNH=3335cm−1;νCsp2 Harom=3066cm−1及び3035cm−1;νCsp3=2977cm−1及び2934cm−1;νC=O=1694cm−1;νC−O ester=1250cm−1及び1143cm−1
【0175】
b)アスパラギン酸(20mg、0.17mmol、1.1eq.)のDMF溶液(2mL/0.1mmol(アスパラギン酸))に、HOBt1.3eq.、更にはEDCI1.3eq.を添加する。次いで、アザ−アミノ酸(III.5)(50mg、0.15mmol、1eq.)を添加する。溶液を室温で一晩攪拌する。溶液を酢酸エチルで希釈し、続いて、NaHCO3飽和溶液、更に1NのHClで三回洗浄する。有機相を無水硫酸ナトリウムで乾燥させ、蒸発させる。残渣をシリカゲルクロマトグラフィー(MeOH/DCM:体積比1/99)にかけ、20mgの淡黄色油状物を得る(収率20%)。
【0176】
1H NMR(300MHz,CDCl3):δ(ppm)=1.40(s,9H,COOC(CH3)3);1.45(s,9H,COOC(CH3)3);1.70(m,2H,CH2−CH2−CH2);2.80(dd,J=17.5Hz及びJ=4.5Hz,1H,CH2COOBn);3.00(dd,J=17.5Hz及びJ=4.5Hz,1H,CH2COOBn);3.30(m,2H,CH2NH);3.50(m,2H,N−N−CH2);4.60(m,1H,CαH);5.12(s,2H,CH2Ph);5.15(s,2H,CH2Ph);5.62(d,1H,NH);7.40(m,10H,aromatic);8.40(s,1H,CONHN)
13C NMR(75MHz,CDCl3):27.96(1C,CH2−CH2−CH2−NHZ);28.50(3C,COOC(CH3)3);28.69(3C,COOC(CH3)3);36.20(1C,CH2 asp);38.39(1C,CH2−CH2−CH2NHZ);47.00(1C,N−N−CH2−CH2−CH2−NHZ);49.73(1C,CαH);66.94(1C,CH2−PH);67.38(1C,CH2−PH);77.04(1C,COOC(CH3)3);77.88(1C,COOC(CH3)3);128.39(2C,CHar);128.48(2C,CHar);128.68(1C,CHar);128.86(1C,CHar);129.02(2C,CHar);129.14(2C,CHar);135.67(1C,CIVar);137.12(1C,CIVar);153.25(NHCOO);155.98(1C,NHCOO);157.04(1C,CH2COO);169.80(1C,CONHN);171.88(1C,CONNH)
[α]D22.6℃=+7.14°(2.8g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C32H44N4O9,651.3006;exp.,651.3010
【0177】
実施例11
(3S)−4−[2−(4−ベンジルオキシカルボニルアミノフェニル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.3)
a)(4−ヨードフェニル)カルバミン酸のベンジルエステル(5)
4−ヨードアニリン(4)0.5g(2.28mmol、1eq.)をDCM20mLに溶解させる。蒸留トリエチルアミン1mLを添加し、混合物を0℃に冷却する。クロロぎ酸ベンジル(1.95mL、13.7mmol、6eq.)のDCM(20mL)溶液を、攪拌しながら滴下する。添加が完了したら、混合物を0℃で15分間静置し、その後、室温まで温める。そして、反応媒体を20時間還流させる。室温まで冷却後、反応混合物を1MのHCl溶液に注ぐ。DCMで希釈後、有機相を回収する。更にNa2CO3飽和溶液で洗浄し、Na2SO4で乾燥させ、ろ過、蒸発乾固する。得られた粗生成物をシリカゲルクロマトグラフィー(DCM/P.E.混合物(体積比3/2)で溶離)にかけて、白色粉末(m=460mg)を得る(収率60%)。
【0178】
1H NMR(300MHz,DMSO):δ(ppm)=5.14(s,2H,CH2−C6H5);7.28−7.69(m,9H,Harom);9.89(s,1H,NH)
IR(KBr):νNH=3322cm−1;νCsp2 Harom=3034cm−1;νC=O=1701cm−1;νC=C=1528cm−1;νC−O ester=1236cm−1
融点=130℃
【0179】
b)1−(4−ベンジルオキシカルボニルアミノフェニル)ヒドラジンカルボン酸のtert−ブチルエステル(III.1)
丸底フラスコに蒸留DMF(4.5mL)を導入する。「凍結−真空−解凍」サイクルを四回繰り返す。アルゴン雰囲気下に配置して、化合物(5)1g(2.83mmol、1eq.)、CuI54mg(0.283mmol、0.1eq.)、1,10−フェナンスロリン51mg(0.283mmol、0.1eq.)、Cs2CO31.29g(3.96mmol、1.4eq.)及びカルバジン酸tert−ブチル450mg(3.39mmol、1.2eq.)を導入する。「凍結−真空−解凍」サイクルを更に四回繰り返し、媒体をアルゴン雰囲気下に配置して80℃まで加熱する。20分後にアルゴン気流を停止する。80℃で18時間反応させる。室温まで冷却後、酢酸エチルですすぎながら、焼結体上で厚さ1cmのシリカ層を通じて媒体をろ過する。酢酸エチル及びDMFを留去して粗生成物を得る。それをシリカゲルクロマトグラフィー(P.E./EtOAc:体積比(2/1)から(1/1)の展開勾配)にかけ、100mgの麦わら色粉末を得る(収率10%)。
【0180】
1H NMR(300MHz,CDCl3):δ(ppm)=1.43(s,9H,C(CH3)3);5.00(sl,2H,NH2);5.14(s,2H,CH2−C6H5);7.29−7.55(m,9H,Harom);9.7(s,1H,NH)
13C NMR(75MHz,CDCl3):δ(ppm)=28.63;28.72;28.76;68.36;71.73;113.21;113.3;117.43;122.06;122.13;129.63;129.74;129.98;131.16;138.04;138.94;153.54;155.92
IR(KBr):νNH=3323cm−1;νCsp3=2978cm−1;νC=O=1699cm−1及び1603cm−1;νC=C=1538cm−1
【0181】
c)化合物(IB.2)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.1)100mg(0.27mmol、1eq.)及びBoc−Asp(OBn)−OH100mg(0.31mmol、1.1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1/1)で溶離)による精製を経て、120mgの麦わら色粉末を得る(収率64%)。
【0182】
1H NMR(300MHz,DMSO):δ(ppm)=1.4(s,18H,C(CH3)3);4.1(m,2H,CH2β);4.41(m,1H,CHα);5.18(s,2H,CH2−C6H5);5.76(s,2H,CH2−C6H5);7.2−7.6(m,14H,Harom);9.8(s,1H,NH);10.6(s,1H,NH)
13C NMR(75MHz,CDCl3):δ(ppm)=14.6;21.46;28.28;28.50;28.69;28.75;30.1;36.24;49.74;60.84;67.36;77.10;77.52;77.95;81.15;82.73;84.32;119.19;125.29;128.69;128.71;128.79;129.00;135.73;136.27;136.50;137.26;150.52;153.36;153.82;156.04;169.54;170.55;171.66;171.8
IR(KBr):νNH=3347cm−1;νCsp3=2980cm−1;νC=O=1721cm−1,1703cm−1及び1676cm−1;νC−O ester=1162cm−1
融点=109℃
HRMS−ESI(m/z):[M+Na]calc.for C35H42N4O9,685.2849;exp.,685.2854
【0183】
実施例12
(4S)−5−[2−(4−ベンジルオキシカルボニルアミノフェニル)−2−tert−ブトキシカルボニルヒドラジノ]−4−tert−ブトキシカルボニルアミノ−5−オキソペンタン酸のベンジルエステル(IB.4)
化合物(IB.2)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.1)100mg(0.27mmol、1eq.)及びBoc−Glu(OBn)−OH105mg(0.31mmol、1.1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1/1)で溶離)による精製を経て、60mgの麦わら色粉末を得る(収率32%)。
【0184】
1H NMR(300MHz,CDCl3):δ(ppm)=1.46(s,9H,C(CH3));1.48(s,9H,C(CH3));1.7(m,2H,CH2);2.6(m,2H,CH2);4.3(m,1H,CHα);5.15(s,2H,CH2−C6H5);5.21(s,2H,CH2−C6H5);6.7(s,1H,NH);7.3−7.5(m,14H,Harom);8.6(s,1H,NH)
13C NMR(75MHz,CDCl3):δ(ppm)=28.04;28.53;28.68;30.11;30.74;52.26;65.71;67.03;67.44;77.03;77.45;77.65;77.87;80.86;82.83;119.21;125.48;127.4;128.67;128.73;128.76;129.02;136.06;136.23;136.40;137.40;138.14;153.43;153.77;156.26;171.28;173.55
IR(KBr):νNH=3350cm−1;νCsp3=2981cm−1;νC=O=1703cm−1,1724cm−1及び1676cm−1;νC=C=1530cm−1;νC−O ester=1164cm−1
融点=115℃
HRMS−ESI(m/z):[M+Na]calc.for C36H44N4O9,699.3006;exp.,699.3010
【0185】
実施例13
(3S)−4−[2−(5−ベンジルオキシカルボニルアミノペンチル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.5)
a)1−(5−ベンジルオキシカルボニルアミノペンチル)ヒドラジンカルボン酸のtert−ブチルエステル(III.6)
化合物(III.6)は、化合物(III.2)の合成と同様の手順に従い、tert−ブトキシカルボニルヒドラジン及び5−(ベンジルオキシカルボニルアミノ)ペンタノールを出発材料として使用し、且つ、光延反応においてDIADをDBADに置き換えることで得られる。
【0186】
1H NMR(300MHz,CDCl3):δ(ppm)=1.40−1.70m,15H,CH2−(CH2)3−CH2及びCOOC(CH3)3);3.20(q,J=6.8Hz及びJ=6.4Hz,2H,CH2−NHZ);3.35(t,J=7.2Hz,2H,CH2−N−N);4.00(s,2H,NH2);4.80(s,broad,1H,NHZ);5.10(s,2H,CH2Ph);7.36(m,5H,aromatic)
IR(NaCl):νNH=3340cm−1;νCsp2 Harom=3065cm−1及び3033cm−1;νCsp3=2975cm−1及び2933cm−1;νC=O=1694cm−1;νC−O ester=1251cm−1及び1143cm−1
【0187】
b)化合物(IB.2)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.6)120mg(0.34mmol、1eq.)及びBoc−Asp(OBn)−OH120mg(0.37mmol、1.1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比4:6)で溶離)による精製を経て、136mgの黄色油状物を得る(収率61%)。
【0188】
1H NMR(300MHz,CDCl3):δ(ppm)=1.10−1.30(m,24H,CH2−(CH2)3−CH2及びCOOC(CH3)3);2.66−2.94(m,2H,CH2COOBn);3.12(m,2H,CH2−NHZ);3.36(t,J=6.4Hz,2H,CH2−N−N);4.50(s,broad,1H,CHα);4.85(s,broad,1H,NH);5.05(d,J=12.8Hz,4H,CH2−Ph);5.60(s,broad,1H,NH);7.30(m,10H,aromatic);8.30(s,1H,CO−NH−N)
13C NMR(75MHz,CDCl3):δ(ppm)=26.19;27.27;28.20;28.33;29.73;35.91;40.83;49.36;66.60;66.95;80.76;81.27;128.08;128.28;128.44;128.53;128.64;135.38;136.75;154.67;155.59;156.5;171.51
IR(NaCl):νNH=3323cm−1;νCsp2 Harom=3034cm−1;νCsp3=2978cm−1及び2934cm−1;νC=O=1694cm−1;νC−O ester=1250cm−1及び1161cm−1
[α]D24.3℃=−13°(10g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C34H48N4O9,679.3319;exp.,679.3329
【0189】
実施例14
4−[2−((2S)−3−ベンジルオキシカルボニル−2−tert−ブトキシカルボニルアミノプロピル)−1−tert−ブトキシカルボニルヒドラジノメチル]ピペリジン−1−カルボン酸のベンジルエステル(IB.6)
a)4−(1−tert−ブトキシカルボニルヒドラジノメチル)ピペリジン−1−カルボン酸のベンジルエステル(III.7)
化合物(III.7)は、化合物(III.2)の合成と同様の手順に従い、tert−ブトキシカルボニルヒドラジン及び4−ヒドロキシメチルピペリジン−1−カルボン酸のベンジルエステルを出発材料として使用し、且つ、光延反応においてDIADをDBADに置き換えることで得られる。
【0190】
1H NMR(300MHz,CDCl3):δ(ppm)=1.38(s,9H,COOC(CH3)3);1.50−1.65(m,4H,CH2−CH2−N);1.82(m,1H,CHα);2.70(m,2H,CH2−N−NH2);3.18(d,J=7.2Hz,2H,CH2−CH2−N);3.90(s,2H,NH2);4.10(s,2H,CH2−CH2−N);5.05(s,2H,CH2Ph);7.30(m,5H,aromatic)
IR(NaCl):νNH=3500cm−1及び3334cm−1;νCsp2 Harom=3065cm−1;νCsp3=2974cm−1及び2927cm−1;νC=O=1694cm−1及び1682cm−1;νC−O ester=1278cm−1及び1220cm−1
【0191】
b)化合物(IB.1)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.7)116mg(0.34mmol、1eq.)及び化合物(V.1)162mg(0.53mmol、1.5eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、167mgの黄色油状物を得る(収率80%)。
【0192】
1H NMR(300MHz,CDCl3):δ(ppm)=1.30−1.40(m,18H,COOC(CH3)3);1.50−1.70(m,4H,CH2−CH2−N);1.78(m,1H,CHα);2.55(d,J=5.7Hz,2H,CH2−COOBn);2.70(m,2H,CH2−NH−N);2.90(m,2H,CH2−N−NH);3.10(m,2H,CH2−CH2−N);3.90(s,broad,1H,NH);4.08(m,2H,CH2−CH2−N);5.05(m,4H,CH2Ph);5.10(m,1H,NH);7.28(m,10H,aromatic)
13C NMR(75MHz,CDCl3):δ(ppm )26.95;28.27;28.42;29.68;34.73;37.47;43.89;46.70;53.25;54.34;66.57;67.07;80.89;127.89;128.31;128.40;128.52;128.65;135.67;136.93;155.34;155.41;170.63;171.25
IR(NaCl):νNH=3334cm−1;νCsp2 Harom=3091cm−1及び3033cm−1;νCsp3=2976cm−1及び2929cm−1;νC=O=1695cm−1;νC−O ester=1278cm−1及び1249cm−1
[α]D25℃=−0.80°(7.1g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C35H50N4O8,677.3526;exp.,677.3532
【0193】
実施例15
4−[2−((2S)−3−ベンジルオキシカルボニル−2−tert−ブトキシカルボニルアミノプロピオニル)−1−tert−ブトキシカルボニルヒドラジノメチル]ピペリジン−1−カルボン酸のベンジルエステル(IB.7)
化合物(IB.2)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.7)145mg(0.45mmol、1eq.)及びBoc−Asp(OBn)−OH160mg(0.49mmol、1.1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、210mgの黄色油状物を得る(収率77%)。
【0194】
1H NMR(300MHz,CDCl3):δ(ppm)=1.45(m,18H,COOC(CH3)3);1.60−1.80(m,5H,CHα及びCH2−CH2−N);2.70−3.05(m,4H,CH2−COOBn及びCH2−N−NH);3.35(m,2H,CH2−CH2−N);4.20(m,2H,CH2−CH2−N);4.55(s,broad,1H,CHα);5.15(d,J=6.4Hz,4H,CH2Ph);5.68(s,broad,1H,NH);7.38(m,10H,aromatic);8.30(s,1H,CONHN)
13C NMR(75MHz,CDCl3):δ(ppm)=26.96;28.18;28.34;29.69;34.85;43.85;49.39;55.00;67.04;80.87;81.57;127.88;127.97;128.26;128.51;128.66;135.34;136.96;155.29;155.66;171.54
IR(NaCl):νNH=3306cm−1;νCsp2 Harom=3034cm−1;νCsp3=2922cm−1及び2853cm−1;νC=O=1701cm−1
[α]D25℃=−19.31°(14.1g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C35H48N4O9,691.3319;exp.,691.3322
【0195】
実施例16
(3S)−4−[2−(5−ベンジルオキシカルボニルアミノペンチル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.8)
化合物(IB.1)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.6)192mg(0.54mmol、1eq.)及び化合物(V.1)280mg(0.91mmol、1.6eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比3/7)で溶離)による精製を経て、295mgの黄色油状物を得る(収率85%)。
【0196】
1H NMR(300MHz,CDCl3):δ(ppm)=1.32−1.40(m,18H,COOC(CH3)3);1.41−1.52(m,6H,CH2−(CH2)3−CH2);2.60(m,2H,CH2COOBn);2.95(m,2H,CH2−NH);3.12(m,2H,CH2−N−N);3.25(m,2H,CH2−N−N);3.95(m,1H,CHα);4.65(s,broad,1H,NH);4.80(s,broad,1H,NH);5.05(d,J=7.9Hz,4H,CH2−Ph);5.15(s,1H,broad,NH);7.20−7.35(m,10H,aromatic)
13C NMR(75MHz,CDCl3):δ(ppm)=23.77;28.29;28.41;28.45;29.57;37.42;40.98;49.08;53.46;66.51;66.62;79.56;80.63;128.10;128.20;128.29;128.34;128.53;128.62;135.74;136.71;155.38;156.50;171.14;171.31
IR(NaCl):νNH=3344cm−1;νCsp2 Harom=3065cm−1及び3034cm−1;νCsp3=2977cm−1及び2934cm−1;νC=O=1694cm−1;νC=C=1520cm−1及び1455cm−1;νC−O ester=1250cm−1及び1167cm−1
[α]D25℃=−1.04°(18.2g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C34H50N4O8,665.3526;exp.,665.3527
【0197】
実施例17
(3S)−4−[2−(6−ベンジルオキシカルボニルアミノヘキシル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.9)
化合物(IB.2)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.2)120mg(0.55mmol、1eq.)及びBoc−Asp(OBn)−OH196mg(0.60mmol、1.1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比4:6)で溶離)による精製を経て、297mgの黄色油状物を得る(収率80%)。
【0198】
1H NMR(300MHz,CDCl3):δ(ppm)=1.15−1.30(m,26H,CH2−(CH2)4−CH2及びCOOC(CH3)3);2.60−2.96(m,2H,CH2COOBn);3.10(m,2H,CH2−NHZ);3.38(m,2H,CH2−N−N);4.50(s,broad,1H,CHα);4.80(s,broad,1H,NH);5.05(d,4H,CH2Ph);5.65(s,broad,1H,NH);7.30(m,10H,aromatic);8.20(s,1H,CONHN)
13C NMR(75MHz,CDCl3):δ(ppm)=23.43;26.83;28.20;28.33;29.44;40.48;49.44;66.65;66.95;80.73;81.31;128.07;128.13;128.29;128.43;128.52;128.64;135.39;136.71;154.71;156.63;171.47
IR(NaCl):νNH=3320cm−1;νCsp2 Harom=3034cm−1;νCsp3=2977cm−1及び2933cm−1;νC=O=1691cm−1;νC=C=1524cm−1及び1455cm−1;νC−O ester=1250cm−1及び1159cm−1
[α]D24.9℃=−10°(10g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C35H50N4O9,693.3475;exp.,693.3669
【0199】
実施例18
(3S)−3−tert−ブトキシカルボニルアミノ−4−[2−tert−ブトキシカルボニル−2−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジノ]酪酸のベンジルエステル(IB.10)
a)1−tert−ブトキシカルボニル−1−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジン(III.8)
化合物(III.8)は、化合物(III.2)の合成と同様の手順に従い、tert−ブトキシカルボニルヒドラジン及び6−(Boc−アミノ)ヘキサノールを出発材料として使用し、且つ、光延反応においてDIADをDBADに置き換えることで得られる。
【0200】
1H NMR(300MHz,CDCl3):δ(ppm)=1.36(s,9H,COO(CH3)3);1.39(s,9H,COO(CH3)3);1.19−1.48(m,8H,CH2−(CH2)4−CH2);2.89(q,2H,CH2−NHBoc);3.21(t,2H,CH2−N−NH2);4.38(s,2H,NH2);6.76(s,1H,NH)
IR(KBr):νNH=3342cm−1;νCsp3=2976cm−1及び2932cm−1;νC=O=1690cm−1;νC=C=1525cm−1;νC−O ester=1250cm−1及び1170cm−1
【0201】
b)化合物(IB.1)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.8)130mg(0.4mmol、1eq.)及び化合物(V.1)200mg(0.7mmol、1.67eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、190mgの無色油状物を得る。
【0202】
1H NMR(300MHz,CDCl3):δ(ppm)=1.35(s,9H,COO(CH3)3);1.38(s,9H,COO(CH3)3);1.39(s,9H,COO(CH3)3);1.23−1.45(m,8H,CH2−(CH2)4−CH2);2.63−2.83(m,4H,CH2−NHZ及びCH2COOBn);2.88(m,2H,CH2−NH−N);3.18(m,2H,CH2−N−NH);3.87(m,1H,CHα);5.05(s,2H,CH2Ph);6.75(m,1H,NH);7.36−7.30(m,5H,Harom)
IR(NaCl):νNH=3353cm−1;νCsp2 Harom=3065cm−1及び3027cm−1;νCsp3=2977cm−1及び2932cm−1;νC=O=1694cm−1;νC−O ester=1250cm−1及び1167cm−1
HRMS−ESI(m/z):[M+Na]calc.for C32H54N4O8,645.3839;exp.,645.3834
【0203】
実施例19
(3S)−4−[2−ベンジルオキシカルボニル−2−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.11)
化合物(IB.1)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.3)130mg(0.4mmol、1eq.)及び化合物(V.1)200mg(0.7mmol、1.67eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、120mgの白色固体を得る。
【0204】
1H NMR(300MHz,CDCl3):δ(ppm)=1.35(s,9H,COO(CH3)3);1.30−1.46(m,8H,CH2−(CH2)4−CH2);2.52−2.83(m,4H,CH2−NHZ及びCH2COOBn);2.94(m,2H,CH2−NH−N);3.25(m,2H,CH2−N−NH);3.87(m,1H,CHα);4.99(s,2H,CH2−Ph);5.04(s,2H,CH2−Ph);5.06(s,2H,CH2Ph);7.20−7.38(m,15H,Harom)
HRMS−ESI(m/z):[M+Na]calc.for C38H50N4O9,713.3526;exp.,713.3520
【0205】
実施例20
(3S)−3−ベンジルオキシカルボニルアミノ−4−[2−ベンジルオキシカルボニル−2−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノ]酪酸のベンジルエステル(IB.12)
a)3−ベンジルオキシカルボニルアミノ−4−オキソブタン酸のベンジルエステル(V.2)
化合物(V.2)は、化合物(V.1)の合成と同様の手順に従い、Z−Asp(OBn)−OHを出発材料として用いて得られる。
【0206】
IR(NaCl):νNH=3354cm−1;νCsp2 Harom=3065cm−1及び3034cm−1;νCsp3=2931cm−1;νC=O=1731cm−1,1715cm−1及び1693cm−1;νC=C=1528cm−1;νC−O ester=1259cm−1
【0207】
b)化合物(IB.1)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.3)28mg(0.07mmol、1eq.)及び化合物(V.2)45mg(0.13mmol、1.67eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、20mgの黄色油状物を得る。
【0208】
1H NMR(300MHz,CDCl3):δ(ppm)=1.10−1.46(m,8H,CH2−(CH2)4−CH2);2.60−2.70(m,4H,CH2−NHZ及びCH2COOBn);2.94(m,2H,CH2−NH−N);3.25(m,2H,CH2−N−NH);3.95(m,1H,CHα);4.96−5.12(s,8H,4×CH2−Ph);7.20−7.40(m,20H,Harom)
IR(NaCl):νNH=3333cm−1;νCsp2 Harom=3065cm−1及び3034cm−1;νCsp3=2932cm−1及び2857cm−1;νC=O=1695cm−1;νC=C=1531cm−1;νC−O ester=1254cm−1及び1174cm−1
[α]D25℃=−0.06°(5g/L,DCM)
HRMS−ESI(m/z):[M+Na]calc.for C40H48N4O6,747.3370;exp.,747.3369
【0209】
実施例21
(3S)−4−[2−ベンジルオキシカルボニル−2−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.13)
化合物(IB.1)で記載されたのと同様の手順に従い、アザ−アミノ酸(III.4)153mg(0.4mmol、1eq.)及び化合物(V.1)200mg(0.7mmol、1.67eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/シクロヘキサン混合物(体積比3/7)で溶離)による精製を経て、130mgの黄色油状物を得る。
【0210】
1H NMR(300MHz,DMSO):δ(ppm)=1.35(s,18H,2×COO(CH3)3);1.29−1.49(m,8H,CH2−(CH2)4−CH2);2.41−2.86(m,4H,CH2−NHBoc及びCH2COOBn);2.88(m,2H,CH2−NH−N);3.25(m,2H,CH2−N−NH);3.86(m,1H,CHα);5.05(s,2H,CH2−Ph);5.07(s,2H,CH2−Ph);7.29−7.36(m,10H,Harom)
HRMS−ESI(m/z):[M+Na]calc.for C38H50N4O9,679.3683;exp.,679.3659
【0211】
実施例22
(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(ベンジルオキシカルボニルメチル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IB.14)
a)2−イソプロピリデンヒドラジンカルボン酸のtert−ブチルエステル(2)
Boc−ヒドラジン(4g、30.3mmol、1eq.)のアセトン(55mL)溶液に、無水MgSO41.35g及び酢酸4滴を添加する。混合物を2時間還流させる。硫酸マグネシウムをろ別し、溶媒を留去して、4.96gの白色固体を得る(収率95%)。
【0212】
1H NMR(300MHz,CDCl3):δ(ppm)=1.53(s,9H,COOC(CH3)3);1.80(s,3H,CH3);2.05(s,3H,CH3);7.37(s,1H,NH)
IR(KBr):νNH=3348cm−1;νCsp3=2981cm−1及び2920cm−1;νC=O=1725cm−1;νC=N=1648cm−1
融点:87℃
【0213】
b)ベンジル(1−tert−ブトキシカルボニル−2−イソプロピリデンヒドラジノ)アセテート(3)
化合物(2)4.9g(28.5mmol、1eq.)を、N2下で無水DMF60mLに溶解させる。NaH1.4g(60%ミネラルオイル溶液、34mmol、1.2eq.)を少しずつ導入する。気体の発生及び固体化が観察される。無水DMF60mL、次いでブロモ酢酸ベンジル5mL(31.4mmol、1.1eq.)をゆっくりと添加する。溶液が暗橙色になる。1時間後、水をゆっくりと添加して、過剰量のNaHを加水分解する。EtOAc90mLを用いて溶液を二回抽出する。水90mL、次いでNaCl飽和溶液90mLで有機相を洗浄し、無水Na2SO4で乾燥させ、蒸発させる。残渣をシリカゲルクロマトグラフィー(EtOAc/P.E.混合物(体積比1/2)で溶離)にかけ、8.4gの黄色油状物を得る(収率92%)。
【0214】
1H NMR(300MHz,CDCl3):δ(ppm)=1.45(s,9H,COOC(CH3)3);1.95(s,3H,CH3);2.05(s,3H,CH3);4.35(s,2H,N−CH2);5.20(s,2H,CH2);7.37(m,5H,Harom)
IR(NaCl):νCsp2 Harom=3066cm−1及び3034cm−1;νCsp3=2977cm−1及び2932cm−1;νC=O=1754cm−1及び1710cm−1
【0215】
c)ベンジルヒドラジノアセテートジトシレート(VIB.1)
化合物(3)1g(3.13mmol、1eq.)のエタノール(10mL)及び水(100μL)混合溶液に、para−トルエンスルホン酸1.19g(6.25mmol、2eq.)を添加する。溶液を5時間還流させる。溶媒を留去して、1.64gの桃色ゲルを得る。このゲルは、これ以上精製しないで使用する(収率100%)。
【0216】
1H NMR(300MHz,CDCl3):δ(ppm)=2.45(s,6H,2PhCH3);νC=O=1724cm−1;2.45(m,2H,N−CH2);5.10(s,2H,CH2Ph);7.10(d,J=8.3Hz,4H,Harom APTS);7.40(m,5H,Harom benzyl);7.70(d,J=8.3Hz,4H,Harom APTS);8.60(bs,5H,NH2+及びNH3+)
IR(NaCl):νNH=3337cm−1;νCsp2 Harom=3066cm−1及び3034cm−1;νCsp3=2978cm−1及び2935cm−1;νC=O=1724cm−1;νS=O=1052cm−1
【0217】
d)ベンジル(2−tert−ブトキシカルボニルヒドラジノ)アセテート(IVB.1)
ベンジルヒドラジノアセテートジトシレート330mg(0.63mmol、1eq.)のEtOH/H2O(体積比1/1、7mL)溶液に、0℃で、NMM139μL(1.26mmol、2eq.)を添加する。(Boc)2O151mg(0.69mmol、1.1eq.)を導入する。溶液を0℃で15分、次いで室温で2時間攪拌する。エチルエーテルを添加して得られた有機溶液をKH2PO4飽和溶液で洗浄する。水相をエーテルで再抽出し、合わせた有機相を無水Na2SO4で乾燥させ、留去して、128mgの黄色液体を得る(収率66%)。
【0218】
1H NMR(300MHz,CDCl3):δ(ppm)=1.35(s,9H,COOC(CH3)3);4.10(s,2H,N−CH2);5.10(s,2H,CH2Ph);7.20(m,5H,Harom)
IR(NaCl):νNH=3349cm−1;νCsp2 Harom=3070cm−1及び3035cm−1;νCsp3=2980cm−1及び2935cm−1;νC=O=1749cm−1及び1708cm−1
【0219】
e)化合物(IA.4)で記載されたのと同様の手順に従い、ヒドラジノエステル(IVB.1)105mg(0.37mmol、1eq.)及びHCl.H−Lys(Z)−OtBu155mg(0.37mmol、1eq.)から、シリカゲルフラッシュクロマトグラフィー(EtOAc/P.E.混合物(体積比1/2)で溶離)による精製を経て、70mgの黄色油状物を得る(収率30%)。
【0220】
1H NMR(300MHz,CDCl3):δ(ppm)=1.20(m,2H,CH2−CH2−CH2−CH2NHZ);1.35(s,9H,COOC(CH3)3);1.40(s,9H,COOC(CH3)3);1.50−1.60(m,4H,CH2−CH2−CH2−CH2NHZ);3.10(q,J=7.5Hz及びJ=14.3Hz,2H,CH2NHZ);4.10(s,2H,N−N−CH2);4.30(m,1H,CHα);5.00(s,2H,CH2Ph);5.15(s,2H,CH2Ph);6.30(bs,1H,NH);6.60(bs,1H,NH);7.35(m,10H,Harom)
HRMS−ESI(m/z):[M+Na]calc.for C33H46N4O9,665.3162;exp.,665.3168
【0221】
II.生物活性
この項は化合物の生物活性に関し、添付の図面を参照する。
図1は、一般的なABCトランスポーターによって誘導される基質の排出を示す図である。
図2は、化合物(I.A.2)の阻害の種類を表す。
図3は、化合物(IA.2)による、ABCG2を発現するHEK−293細胞の化学増感を表す。
図4は、化合物(IA.2)の、HEK−293細胞に対する無害性を表す。
図5は、化合物(IA.1)による、ABCG2を発現するHEK−293細胞の化学増感を表す。
図6は、化合物(IA.1)の、HEK−293細胞に対する無害性を表す。
図7は、化合物(IB.1)による、HEK−293細胞の化学増感を表す。
図8は、化合物(IB.1)の、HEK−293細胞に対する無害性を表す。
図9は、化合物(IB.1)の、NIH−3T3細胞に対する無害性を表す。
図10は、化合物(IB.11)の、HEK−293細胞に対する無害性を表す。
図11は、化合物(I.A.3)の阻害の種類を表す。
図12は、化合物(IA.2)がABCG2発現レベルを減少させることを表す。
【0222】
方法
細胞培養
ABCG2をコードする遺伝子を含む又は含まないpcDNA3.1ベクターでトランスフェクトしたヒト繊維芽細胞系HEK−293(Robey,R.W.,Honjo,Y.,Morisaki,K.,Nadjem,T.A.,Runge,S.,Risbood,M.,Poruchynsky,M.S.,Bates,S.E.,「Br.J.Cancer」,89(10),1971−1978,2003年)を使用して、ABCG2に対する生成物の有効性をテストした。そのままの(ネガティブコントロール)、又は、ABCC1をコードする遺伝子を発現するpNUT−MRP/Hisベクターでトランスフェクトした、新生ハムスターの腎細胞系BHK21(Chang,Xiu−Bao,Hou,Yue−Xian,Riordan,John R.,「J.Biol.Chem.」,272(49),30962−30968,1997年)を使用して、ABCC1に対する生成物の有効性をテストした。そのままの、又は、ABCB1を発現するpHaMDR1/Aベクターでトランスフェクトした、細胞系NIH3T3(Cardarelli,Carol O.,Aksentijevich,Ivan,Pastan,Ira,Gottesman,Michael M.,「Cancer Res.」,55,1086−1091,1995年)を使用して、ABCB1に対する化合物の有効性をテストした。上述のプロトコルに従って、様々な種類の細胞を培養する(HEK293系:Robey,R.W.,Honjo,Y.,Morisaki,K.,Nadjem,T.A.,Runge,S.,Risbood,M.,Poruchynsky,M.S.,Bates,S.E.,「Br.J.Cancer」,89(10),1971−1978,2003年;BHK21系:Chang,Xiu−Bao,Hou,Yue−Xian,Riordan,John R.,「J.Biol.Chem.」,272(49),30962−30968,1997年;NIH3T3系:Cardarelli,Carol O.,Aksentijevich,Ivan,Pastan,Ira,Gottesman,Michael M.,「Cancer Res.」,55,1086−1091,1995年)。
【0223】
ABCG2発現レベルの推定
HEK293 pcDNA3.1細胞又はHEK293 pcDNA3.1 BCRP細胞を16枚の6cm2ペトリ皿に接種し、5%CO2下、37℃で24時間培養する。培養後、種々のウェルにDMSO(コントロール)又はDMSOに溶解させた化合物(IA.2)(希釈後の最終濃度は5μM)を30μL添加する。3時間、24時間、48時間又は72時間培養後、細胞をトリプシン処理し、200Gで5分間遠心する。低張溶解バッファ(10mMのTris−Cl(pH7.5)、10mMのNaCl、1mMのMgCl2、1mMのDTT、プロテアーゼ阻害剤)でタンパク質画分を抽出し、ビシンコニン酸(シグマ−アルドリッチ社)で分析する。この画分10μgを、Laemmli型のポリアクリルアミドゲル(U.K.Laemmli,「Nature」,1970年,227,680)に沈着させてタンパク質を分離し、次いで、このタンパク質を10mMのCAPS溶解バッファ(pH11.1、10%メタノール、シグマ−アルドリッチ社)を使用し、100mAで60分間ポリフッ化ビニル(pvdf)膜に転写する。pvdf膜を、脱脂粉乳の1%(w/v)TBSTバッファ(トリス緩衝生理食塩水1X、Tween20 0.1%)溶液に30分間浸す。膜をTBSTで素早くすすいだ後、1%TBSTミルクで1/250まで希釈した抗BCRP BXP−21モノクローナル抗体(サンタクルズ社)又は抗チューブリンモノクローナル抗体(サンタクルズ社)とともに、攪拌下、室温で1時間培養する。膜をTBSTを用いて15分間×三回洗浄した後、1%TBSTミルクで1/5000まで希釈したペルオキシダーゼ結合抗マウス二次モノクローナル抗体(サンタクルズ社)とともに1時間培養する。その後、TBSTを用いて膜を15分間×三回洗浄する。「イモビロンウェスタン(immobilon western)」キット(ミリポア社)とQuantityOneソフトウェア(バイオ・ラッド社)とを用いて解析する。
【0224】
図1は、一般的なABCトランスポーターによって誘導される基質の排出を模式的に表す。ABCG2及びABCB1によって排出されるミトキサントロン又はABCC1によって排出されるダウノルビシン等の基質Sが細胞中に蓄積され、トランスポーターTによって排出されることで、細胞内蛍光が減少する。生成物が、一般的には排出タンパク質の阻害によって、蓄積される場合、細胞内蛍光は増加する。
【0225】
フローサイトメトリー
第一段階では、トランスフェクトされた又はされていないHEK−293細胞及びBHK−21細胞を、基質(トランスポーターに応じて、5μMミトキサントロン又は1μMダウノルビシン)と接触するよう配置する。基質は、最終DMSO濃度を0.5%とした各種濃度のテスト分子の存在下又は非存在下で、37℃で30分間蓄積する。PBSで洗浄後、上記と同じ濃度のテスト分子を含む媒体中、37℃で1時間、細胞を培養する。薬剤の細胞内蛍光は、FACscanフローサイトメーター(ベクトン・ディッキンソン社、マウンテンビュー、カリフォルニア)で測定する。蛍光基質は488nmで励起する。ミトキサントロン(MTX)の蛍光放射は650nmで観察され、ダウノルビシンは530nmで観察される。テスト分子の有効性は、式1により概算する。
有効性(%)=100×(FA−FBG)/(FC−FBG)・・・式1
式中、
・FAは、トランスポーターTを過剰発現している細胞内で測定された細胞内基質レベルに対応する(阻害剤非存在下での最低蛍光レベルに対応する);
・FCは、テストトランスポーターを発現していないコントロール細胞内での蛍光に対応し、従って、細胞内での基質蓄積量が最大である;
・FBGは、基質非存在下且つ阻害剤存在下で測定された蛍光に対応する。
【0226】
細胞増殖テスト
細胞を96ウェルプレートに接種(10,000個/ウェル)し、5%CO2下、37℃で24時間培養する。続いて、様々な濃度のミトキサントロン(0〜20μM、一定の最終体積100μL)に、同体積の各テスト化合物を添加する。その後、細胞を72時間放置して分裂させる。細胞毒性は、3−(4,5−ジメチルチアゾール−2−イル)−2,5−ジフェニルテトラゾリウムブロミド(MTT)を用いて、比色分析により評価する。
【0227】
A.アザジペプチドによるヒト排出タンパク質ABC阻害の有効性
上述したように、表2〜5に示した化合物について、排出タンパク質ABCG2、ABCB1又はABCC1を選択的に発現する哺乳動物細胞系においてフローサイトメトリーによりテストした。
【0228】
表6及び6aは、ヒトABCポンプによる抗ガン剤の排出に対するアザジペプチド(IA.1)、(IA.2)、(IA.3)、(IB.1)及び(IB.11)の阻害有効性を示す。
【0229】
【表6】

【0230】
【表6a】

【0231】
ABCG2又はABCB1に誘導されるミトキサントロン排出及びABCC1に誘導されるダウノルビシン排出は、各テスト化合物について10μMで、更に、10μMで少なくとも80%有効性を示した化合物については2μMで、上記フローサイトメトリーにより評価する。50%阻害(IC50)を起こす濃度は、最も有効なアザ誘導体について評価した。独立した三つの実験により値を得て、SigmaPlotソフトウェアにより調整した。
【0232】
このテストにより、生成物が(ABCG2又はABCB1による)ミトキサントロン排出又は(ABCC1による)ダウノルビシン排出をブロックする能力が示される。
【0233】
表6に示す通り、化合物(IA.3)がABCB1をブロックするのに最も有効である(IC50:0.33μM)が、そのABCG2阻害有効性は低い(10μMで38%)。化合物(IA.2)についてはその反対で、ABCG2に対するIC50が1μMであり、ABCB1ブロック有効性は10μMで50%未満である。化合物(IA.1)は、ABCB1との親和性がより良好で、IC50が0.5μM程度である一方、ABCG2については2μMである。化合物(IB.1)及び化合物(IB.11)は、二種類のトランスポーターについて、どちらの場合もマイクロモル又はマイクロモル未満のIC50値を示し、同じ有効性を有する。これらの化合物はいずれも、排出タンパク質ABCC1に対しては効果が無いようである。
【0234】
B.化合物(IA.2)は強力な非競合性ABCG2阻害剤である
図2は、化合物(IA.2)が非競合性ABCG2阻害剤であることを示す。ABCG2によるミトキサントロン排出は、基質濃度を0〜20μM(パネルA〜C)とし、濃度を0〜20μM(パネルD、E)の間で一定とした化合物(IA.2)の存在下又は非存在下で測定した。図2には、阻害剤濃度を変えて得られた結果を示し、パネルAはdirect、パネルBはLineweaver−Burke、パネルCはEadie−Hofsteeで表記されている。基質濃度を変えて得られた結果は、リニア(パネルD)又はログ(パネルE)X軸スケールで表されている。曲線は、SigmaPlotソフトウェアで調整した。
【0235】
図2Aにdirect表記した、各濃度でのミトキサントロンの排出の結果から、得られた各曲線が到達する平坦域は化合物(IA.2)の所定濃度によって異なる一方、ミトキサントロンの半数最大蓄積濃度は阻害剤濃度に関係なく同じままであることが分かる。このようなデータは、非競合的阻害の特徴である。これは、Lineweaver−Burke及びEadie−Hofsteeでそれぞれ表記した図2B及び図2Cで確認できる。これら二つのグラフに表されたものは、このような阻害の特徴である。化合物(IA.2)の阻害定数Kiは、図2D又は図2Eにおける点の調整から、約1μMと推定される。
【0236】
C.化合物(IA.2)による、ABCG2を発現するHEK−293細胞の化学増感
ABCG2を発現している又は発現しておらず、且つ、化合物(IA.2)5μMで処理した又は処理していないHEK−293細胞に、ミトキサントロン(MTX)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図3に示す。図中、ABCG2を発現している細胞は丸、発現していないものは四角で表し、化合物(IA.2)5μM、すなわち、そのIC50の5倍で処理したものは白記号で表し、化合物(IA.2)で処理していないものは黒記号で表す。図3より、ABCG2を過剰に発現しているHEK−293細胞を化合物(IA.2)とともに培養すると、ABCG2が発現していないコントロール細胞において観察されたのと同程度までミトキサントロン感度が回復することが分かる。従って、化合物(IA.2)は化学療法増感剤として非常に有効であることが分かる。
【0237】
D.化合物(IA.2)の、ヒトHEK−293細胞の細胞増殖に対する非細胞毒性
ABCG2を発現している又は発現していないHEK−293細胞に化合物(IA.2)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図4に示す。図中、ABCG2を発現している細胞は白丸、発現していないものは黒丸で表す。結果から、ABCG2を発現しているか否かに関わらず、化合物(IA.2)はHEK−293細胞に対して全く細胞毒性を示さないことが分かる。このような非毒性は、例えばIC50値の40倍にあたる40μMという非常に高い濃度においても観察される。
【0238】
E.化合物(IA.1)による、ABCG2を発現するHEK−293細胞の化学増感
ABCG2を発現している又は発現しておらず、且つ、化合物(IA.1)5μMで処理した又は処理していないHEK−293細胞に、ミトキサントロン(MTX)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図5に示す。図中、ABCG2を発現している細胞は丸、発現していないものは四角で表し、化合物(IA.1)5μM、すなわち、そのIC50の2.5倍で処理したものは白記号、化合物(IA.1)で処理していないものは黒記号で表す。結果より、化合物(IA.1)によって、ABCG2を過剰発現している細胞のミトキサントロン感度が、トランスポーターを発現していない細胞で観察されるのと同レベルにまで、ほぼ十分に回復することが分かる。耐性が残っているのは、IC50の2.5倍にしか相当しない生成物の濃度、すなわち5μMでは、得られる増感性がおそらく不十分であることに起因する。従って、化合物(IA.1)は、それ自体も有効な化学療法増感剤である。
【0239】
F.化合物(IA.1)の、細胞増殖に対する非細胞毒性
ABCG2を発現している又は発現していないHEK−293細胞に、化合物(IA.1)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図6に示す。図中、ABCG2を発現している細胞は白丸、発現していないものは黒丸で表す。
【0240】
結果より、化合物(IA.1)は、ABCG2が発現しているか否かに関わらず、テストされた濃度範囲では、たとえそのIC50の10倍を超える濃度であっても細胞毒性を示さないことが分かる。
【0241】
G.化合物(IB.1)による、ABCG2を発現するHEK−293細胞の化学増感
ABCG2を発現している又は発現しておらず、且つ、化合物(IB.1)5μMで処理した又は処理していないHEK−293細胞に、ミトキサントロン(MTX)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図7に示す。図中、ABCG2を発現している細胞は丸、発現していないものは四角で表し、化合物(IB.1)5μM、すなわち、そのIC50の5倍で処理したものは白記号、化合物(IB.1)で処理していないものは黒記号で表す。結果より、ABCG2を過剰発現しているHEK−293細胞を化合物(IB.1)とともに培養すると、ミトキサントロン感度が、トランスポーターを発現していない細胞で観察されるのと近いレベルまで、ほぼ十分に回復することが分かる。従って、化合物(IB.1)は、それ自体も有効な化学療法増感剤である。
【0242】
H.化合物(IB.1)の、細胞増殖に対する非細胞毒性
ABCG2を発現している又は発現していないHEK−293細胞に、化合物(IB.1)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図8に示す。図中、ABCG2を発現している細胞は白丸、発現していないものは黒丸で表す。結果より、化合物(IB.1)は、ABCG2が発現しているか否かに関わらず、そのIC50の20倍に等しい濃度まで細胞毒性を示さないことが分かる。IC50の40倍では、相対的に見れば細胞毒性といえる結果が現れる。
【0243】
I.化合物(IB.1)の、NIH−3T3細胞の細胞増殖に対する限定的な細胞毒性
ABCB1を発現している又は発現していないNIH−3T3細胞に化合物(IB.1)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図9に示す。図中、ABCB1を発現している細胞は白丸、発現していないものは黒丸で表す。結果より、化合物(IB.1)の細胞毒性は、そのIC50(1μM)の5倍までは無視できる程度であることが分かる。その後、30〜40%増加するが、ABCB1が発現しているか否かに関わらず、そのIC50の40倍に等しい濃度までは、その値に限定されたままである。
【0244】
J.化合物(IB.11)の、細胞増殖に対する限定的な細胞毒性
ABCG2を発現している又は発現していないHEK−293細胞に、化合物(IB.11)の濃度を漸増させて適用し、その残活性を、処理72時間後にMTTテストにより評価する。結果を図10に示す。図中、ABCG2を発現している細胞は白丸、発現していないものは黒丸で表す。結果より、化合物(IB.11)は、ABCG2が発現しているか否かに関わらず、テストされた濃度範囲では、たとえそのIC50の80倍を超える濃度であっても細胞毒性を示さないことが分かる。
【0245】
K.化合物(IA.3)は強力な非競合性ABCB1阻害剤である
図11において、ダウノルビシン排出をその各種濃度に対してdirect表記した結果より、得られた各曲線が到達する平坦域は化合物(IA.3)の所定濃度により異なる一方、ダウノルビシンの半数最大蓄積濃度は阻害剤濃度に関係なく同じままであることが分かる。このようなデータは、非競合的阻害の特徴である。また、このような種類の阻害剤がABCB1及びABCG2に対して概して非競合性であることを示している(図2及び上記パラグラフB参照)。
【0246】
L.化合物(IA.2)は、阻害対象であるタンパク質ABCG2の発現レベルを減少させる
図12は、阻害剤(IA.2)によりABCG2発現レベルが変化することを示す。BCRPを発現している又は発現していないHEK293細胞(それぞれ「HEK293 BCRP」、「HEK293 pcDNA3」)を、化合物(IA.2)又はDMSO(ネガティブコントロール)の存在下で、指定時間培養する。その後、採取、分画して、ABCG2量及びチューブリン量を分析する。後者は、「方法」の項で詳述した通り、コントロールとして使用する。
【0247】
図12に示した結果より、化合物(IA.2)は、ABCG2に対して阻害作用を有するだけでなく、コントロールとして従来使用されてきたタンパク質、すなわちチューブリンには影響を及ぼすことなく、前者のタンパク質発現レベルを減少させることが分かる。従って、化合物(IA.2)は、ABCG2の活性だけでなく、その発現レベルも調整でき、その作用が比例的に増強される。
【特許請求の範囲】
【請求項1】
純粋な光学異性体、又は光学異性体混合物、又はその塩、溶媒和物若しくは水和物の形態である、式(I)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【化1】

(式中、
・R1は、アミノ基の保護基、好ましくは−C(O)OR’1基(R’1は、炭素数1〜12のアルキル基、又は−(CH2)m1R”1基(R”1はアリール基、シクロアルキル基又はフルオレニル基;m1は0、1、2又は3))であり;
・X1及びX2は、同じか又は異なっていて、−N−又は−CH−であり、少なくとも一方は−N−であり;
・R2は、保護された形態であってもよい、アミノ酸若しくはアミノ酸類似体の側鎖であるか、又は、置換されていてもよいアリール基、若しくは、置換されていてもよいヘテロアリール基であり;
・Yは、−CH2−又は−C(O)−であり;
・−X3−X4は、−(CH2)n−NHR4基(nは3、4、5又は6)、又は、
【化2】

(R4は、アミノ基の保護基、好ましくは−COOR’4基(R’4は、炭素数1〜12のアルキル基、又は−(CH2)m4R”4基(R”4はアリール基又はシクロアルキル基;m4は0、1、2又は3))である)から選択される基であり;
・R3は、炭素数1〜12のアルキル基、又は−(CH2)m3R”3基(R”3はシクロアルキル基又はアリール基であって、前記シクロアルキル基及びアリール基は、非置換でも、−CH3、−CF3、−COOH、−NO2、−Cl及びNH2から選択される1以上の基で置換されていてもよく;m3は0、1、2又は3)である。)
【請求項2】
R2は、−L−COOR’2基(Lは、アリール基、好ましくはフェニル基であるか、又は、−(CH2)m2−鎖(m2は1、2又は3)であり、R’2は、炭素数1〜12のアルキル基、又は−(CH2)m’2R”2基(R”2は、置換されていてもよいアリール基又はシクロアルキル基;m’2は0、1、2又は3))である、請求項1に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【請求項3】
純粋な異性体、又は異性体混合物、又はその塩、溶媒和物若しくは水和物の形態であり、式(IA)で表される、請求項1に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【化3】

(式中、R5は、−NH2、−NO2、−OH、炭素数1〜8の−O−アルキル、O−(CH2)m5R’5(R’5はアリール基;m5は0又は1)、又は、−COOR”5基(R”5は、炭素数1〜12のアルキル基、又は−(CH2)m’5R’’’5基(R’’’5はアリール基又はシクロアルキル基;m’5は0、1、2又は3));R1、X1、Y、X2、X3、X4及びR3は、請求項1の式(I)と同義。)
【請求項4】
R5は−COOR”5基(R”5はエチル基、ベンジル基又は−CH[CH(CH3)2]2基)である、請求項3に記載の式(IA)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項5】
R5基はメタ位である、請求項3又は4に記載の式(IA)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項6】
R5基はパラ位である、請求項3又は4に記載の式(IA)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項7】
X1は−N−であり、X2は−CH−である、請求項3〜6のいずれか1項に記載の式(IA)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項8】
X1及びX2はNである、請求項3〜6のいずれか1項に記載の式(IA)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項9】
Yは−C(O)−である、請求項3〜8のいずれか1項に記載の式(IA)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項10】
−X3−X4は、−(CH2)n−NHR4基(nは4又は6;R4は請求項1の式(I)と同義)である、請求項3〜9のいずれか1項に記載の式(IA)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項11】
純粋な異性体、又は異性体混合物、又はその塩、溶媒和物若しくは水和物の形態であり、式(IB)で表される、請求項1に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【化4】

(式中、mは1、2又は3;R6は、炭素数1〜12のアルキル基、又は−(CH2)m6R’6基(R’6はシクロアルキル基又はアリール基であって、前記シクロアルキル基及びアリール基は、非置換でも、−CH3、−CF3、−COOH、−NO2、−Cl及びNH2から選択される1以上の基で置換されていてもよく;m6は0、1、2又は3);R1、X1、Y、X2、X3、X4及びR3は請求項1の式(I)と同義。)
【請求項12】
mは1又は2である、請求項11に記載の式(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項13】
R6はエチル基、ベンジル基又は−CH[CH(CH3)2]2基である、請求項11又は12に記載の式(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項14】
X1は−CH−である、請求項11〜13のいずれか1項に記載の式(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項15】
X2は−N−である、請求項11〜14のいずれか1項に記載の式(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項16】
−X3−X4は、−(CH2)n−NHR4基(nは6;R4は請求項1の式(I)と同義)である、請求項11〜15のいずれか1項に記載の式(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項17】
R1は−COOR’1基(R’1はtert−ブチル基又はベンジル基)である、請求項1〜16のいずれか1項に記載の式(I)、(IA)又は(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項18】
R3はtert−ブチル基又はベンジル基である、請求項1〜17のいずれか1項に記載の式(I)、(IA)又は(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項19】
R4は−COOR’4(R’4はベンジル基又はtert−ブチル基)である、請求項1〜18のいずれか1項に記載の式(I)、(IA)又は(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項20】
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(2’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.1)
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.2)
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(4’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.3)
・(2R)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のベンジルエステル(IA.4)
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のベンジルエステル(IA.5)
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(フェニルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.6)
・2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニル]−1−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノカルボン酸のベンジルエステル(IA.7)
・2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニル]−1−(6−tert−ブチルオキシカルボニルアミノヘキシル)ヒドラジノカルボン酸のベンジルエステル(IA.8)
・(3S)−4−[2−(6−ベンジルオキシカルボニルアミノヘキシル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.1)
・(3S)−4−[2−(3−ベンジルオキシカルボニルアミノプロピル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.2)
・(3S)−4−[2−(4−ベンジルオキシカルボニルアミノフェニル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.3)
・(4S)−5−[2−(4−ベンジルオキシカルボニルアミノフェニル)−2−tert−ブトキシカルボニルヒドラジノ]−4−tert−ブトキシカルボニルアミノ−5−オキソペンタン酸のベンジルエステル(IB.4)
・(3S)−4−[2−(5−ベンジルオキシカルボニルアミノペンチル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.5)
・4−[2−((2S)−3−ベンジルオキシカルボニル−2−tert−ブトキシカルボニルアミノプロピル)−1−tert−ブトキシカルボニルヒドラジノメチル]ピペリジン−1−カルボン酸のベンジルエステル(IB.6)
・4−[2−((2S)−3−ベンジルオキシカルボニル−2−tert−ブトキシカルボニル−アミノプロピオニル)−1−tert−ブトキシカルボニルヒドラジノメチル]ピペリジン−1−カルボン酸のベンジルエステル(IB.7)
・(3S)−4−[2−(5−ベンジルオキシカルボニルアミノペンチル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.8)
・(3S)−4−[2−(6−ベンジルオキシカルボニルアミノヘキシル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.9)
・(3S)−3−tert−ブトキシカルボニルアミノ−4−[2−tert−ブトキシカルボニル−2−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジノ]酪酸のベンジルエステル(IB.10)
・(3S)−4−[2−ベンジルオキシカルボニル−2−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.11)
・(3S)−3−ベンジルオキシカルボニルアミノ−4−[2−ベンジルオキシカルボニル−2−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノ]酪酸のベンジルエステル(IB.12)
・(3S)−4−[2−ベンジルオキシカルボニル−2−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.13)
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(ベンジルオキシカルボニルメチル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IB.14)、並びに、
その塩、溶媒和物及び/又は水和物、特にその薬学的に許容される形態
から選択される、請求項1に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【請求項21】
治療患者の身体が耐性を発現する、患者に施される治療のためのアジュバントとして使用され、治療活性を回復させることを目的とする、請求項1〜20のいずれか1項に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【請求項22】
抗がん剤用又は抗感染剤用アジュバントとして使用される、請求項1〜21のいずれか1項に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【請求項23】
アントラサイクリン、トポイソメラーゼ阻害剤、代謝拮抗剤(抗葉酸剤)、チロシンキナーゼ阻害剤、抗ウイルス剤(逆転写酵素阻害剤)及び抗寄生虫剤から選択される薬剤用のアジュバントとして使用される、請求項1〜22のいずれか1項に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【請求項24】
ダウノルビシン、ドキソルビシン、ミトキサントロン、カンプトテシン及びその誘導体、イリノテカン、トポテカン、インドロカルバゾール、メトトレキセート、イマチニブ、ゲフィチニブ、ジドブジン、ラミブジン、アバカビル、イベルメクチン、アルベンダゾール、オクスフェンダゾール並びにケトコナゾールから選択される薬剤用のアジュバントとして使用される、請求項1〜23のいずれか1項に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【請求項1】
純粋な光学異性体、又は光学異性体混合物、又はその塩、溶媒和物若しくは水和物の形態である、式(I)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【化1】

(式中、
・R1は、アミノ基の保護基、好ましくは−C(O)OR’1基(R’1は、炭素数1〜12のアルキル基、又は−(CH2)m1R”1基(R”1はアリール基、シクロアルキル基又はフルオレニル基;m1は0、1、2又は3))であり;
・X1及びX2は、同じか又は異なっていて、−N−又は−CH−であり、少なくとも一方は−N−であり;
・R2は、保護された形態であってもよい、アミノ酸若しくはアミノ酸類似体の側鎖であるか、又は、置換されていてもよいアリール基、若しくは、置換されていてもよいヘテロアリール基であり;
・Yは、−CH2−又は−C(O)−であり;
・−X3−X4は、−(CH2)n−NHR4基(nは3、4、5又は6)、又は、
【化2】

(R4は、アミノ基の保護基、好ましくは−COOR’4基(R’4は、炭素数1〜12のアルキル基、又は−(CH2)m4R”4基(R”4はアリール基又はシクロアルキル基;m4は0、1、2又は3))である)から選択される基であり;
・R3は、炭素数1〜12のアルキル基、又は−(CH2)m3R”3基(R”3はシクロアルキル基又はアリール基であって、前記シクロアルキル基及びアリール基は、非置換でも、−CH3、−CF3、−COOH、−NO2、−Cl及びNH2から選択される1以上の基で置換されていてもよく;m3は0、1、2又は3)である。)
【請求項2】
R2は、−L−COOR’2基(Lは、アリール基、好ましくはフェニル基であるか、又は、−(CH2)m2−鎖(m2は1、2又は3)であり、R’2は、炭素数1〜12のアルキル基、又は−(CH2)m’2R”2基(R”2は、置換されていてもよいアリール基又はシクロアルキル基;m’2は0、1、2又は3))である、請求項1に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【請求項3】
純粋な異性体、又は異性体混合物、又はその塩、溶媒和物若しくは水和物の形態であり、式(IA)で表される、請求項1に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【化3】

(式中、R5は、−NH2、−NO2、−OH、炭素数1〜8の−O−アルキル、O−(CH2)m5R’5(R’5はアリール基;m5は0又は1)、又は、−COOR”5基(R”5は、炭素数1〜12のアルキル基、又は−(CH2)m’5R’’’5基(R’’’5はアリール基又はシクロアルキル基;m’5は0、1、2又は3));R1、X1、Y、X2、X3、X4及びR3は、請求項1の式(I)と同義。)
【請求項4】
R5は−COOR”5基(R”5はエチル基、ベンジル基又は−CH[CH(CH3)2]2基)である、請求項3に記載の式(IA)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項5】
R5基はメタ位である、請求項3又は4に記載の式(IA)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項6】
R5基はパラ位である、請求項3又は4に記載の式(IA)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項7】
X1は−N−であり、X2は−CH−である、請求項3〜6のいずれか1項に記載の式(IA)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項8】
X1及びX2はNである、請求項3〜6のいずれか1項に記載の式(IA)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項9】
Yは−C(O)−である、請求項3〜8のいずれか1項に記載の式(IA)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項10】
−X3−X4は、−(CH2)n−NHR4基(nは4又は6;R4は請求項1の式(I)と同義)である、請求項3〜9のいずれか1項に記載の式(IA)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項11】
純粋な異性体、又は異性体混合物、又はその塩、溶媒和物若しくは水和物の形態であり、式(IB)で表される、請求項1に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【化4】

(式中、mは1、2又は3;R6は、炭素数1〜12のアルキル基、又は−(CH2)m6R’6基(R’6はシクロアルキル基又はアリール基であって、前記シクロアルキル基及びアリール基は、非置換でも、−CH3、−CF3、−COOH、−NO2、−Cl及びNH2から選択される1以上の基で置換されていてもよく;m6は0、1、2又は3);R1、X1、Y、X2、X3、X4及びR3は請求項1の式(I)と同義。)
【請求項12】
mは1又は2である、請求項11に記載の式(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項13】
R6はエチル基、ベンジル基又は−CH[CH(CH3)2]2基である、請求項11又は12に記載の式(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項14】
X1は−CH−である、請求項11〜13のいずれか1項に記載の式(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項15】
X2は−N−である、請求項11〜14のいずれか1項に記載の式(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項16】
−X3−X4は、−(CH2)n−NHR4基(nは6;R4は請求項1の式(I)と同義)である、請求項11〜15のいずれか1項に記載の式(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項17】
R1は−COOR’1基(R’1はtert−ブチル基又はベンジル基)である、請求項1〜16のいずれか1項に記載の式(I)、(IA)又は(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項18】
R3はtert−ブチル基又はベンジル基である、請求項1〜17のいずれか1項に記載の式(I)、(IA)又は(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項19】
R4は−COOR’4(R’4はベンジル基又はtert−ブチル基)である、請求項1〜18のいずれか1項に記載の式(I)、(IA)又は(IB)で表されるアザペプチド化合物又はアザペプチド模倣化合物。
【請求項20】
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(2’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.1)
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.2)
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(4’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.3)
・(2R)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のベンジルエステル(IA.4)
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のベンジルエステル(IA.5)
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(3’−(フェニルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IA.6)
・2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニル]−1−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノカルボン酸のベンジルエステル(IA.7)
・2−[1−(3’−(ベンジルオキシカルボニル)フェニル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニル]−1−(6−tert−ブチルオキシカルボニルアミノヘキシル)ヒドラジノカルボン酸のベンジルエステル(IA.8)
・(3S)−4−[2−(6−ベンジルオキシカルボニルアミノヘキシル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.1)
・(3S)−4−[2−(3−ベンジルオキシカルボニルアミノプロピル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.2)
・(3S)−4−[2−(4−ベンジルオキシカルボニルアミノフェニル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.3)
・(4S)−5−[2−(4−ベンジルオキシカルボニルアミノフェニル)−2−tert−ブトキシカルボニルヒドラジノ]−4−tert−ブトキシカルボニルアミノ−5−オキソペンタン酸のベンジルエステル(IB.4)
・(3S)−4−[2−(5−ベンジルオキシカルボニルアミノペンチル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.5)
・4−[2−((2S)−3−ベンジルオキシカルボニル−2−tert−ブトキシカルボニルアミノプロピル)−1−tert−ブトキシカルボニルヒドラジノメチル]ピペリジン−1−カルボン酸のベンジルエステル(IB.6)
・4−[2−((2S)−3−ベンジルオキシカルボニル−2−tert−ブトキシカルボニル−アミノプロピオニル)−1−tert−ブトキシカルボニルヒドラジノメチル]ピペリジン−1−カルボン酸のベンジルエステル(IB.7)
・(3S)−4−[2−(5−ベンジルオキシカルボニルアミノペンチル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.8)
・(3S)−4−[2−(6−ベンジルオキシカルボニルアミノヘキシル)−2−tert−ブトキシカルボニルヒドラジノ]−3−tert−ブトキシカルボニルアミノ−4−オキソ酪酸のベンジルエステル(IB.9)
・(3S)−3−tert−ブトキシカルボニルアミノ−4−[2−tert−ブトキシカルボニル−2−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジノ]酪酸のベンジルエステル(IB.10)
・(3S)−4−[2−ベンジルオキシカルボニル−2−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.11)
・(3S)−3−ベンジルオキシカルボニルアミノ−4−[2−ベンジルオキシカルボニル−2−(6−ベンジルオキシカルボニルアミノヘキシル)ヒドラジノ]酪酸のベンジルエステル(IB.12)
・(3S)−4−[2−ベンジルオキシカルボニル−2−(6−tert−ブトキシカルボニルアミノヘキシル)ヒドラジノ]−3−tert−ブトキシカルボニルアミノ酪酸のベンジルエステル(IB.13)
・(2S)−6−(ベンジルオキシカルボニルアミノ)−2−[1−(ベンジルオキシカルボニルメチル)−2−(tert−ブトキシカルボニル)ヒドラジノカルボニルアミノ]ヘキサン酸のtert−ブチルエステル(IB.14)、並びに、
その塩、溶媒和物及び/又は水和物、特にその薬学的に許容される形態
から選択される、請求項1に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【請求項21】
治療患者の身体が耐性を発現する、患者に施される治療のためのアジュバントとして使用され、治療活性を回復させることを目的とする、請求項1〜20のいずれか1項に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【請求項22】
抗がん剤用又は抗感染剤用アジュバントとして使用される、請求項1〜21のいずれか1項に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【請求項23】
アントラサイクリン、トポイソメラーゼ阻害剤、代謝拮抗剤(抗葉酸剤)、チロシンキナーゼ阻害剤、抗ウイルス剤(逆転写酵素阻害剤)及び抗寄生虫剤から選択される薬剤用のアジュバントとして使用される、請求項1〜22のいずれか1項に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【請求項24】
ダウノルビシン、ドキソルビシン、ミトキサントロン、カンプトテシン及びその誘導体、イリノテカン、トポテカン、インドロカルバゾール、メトトレキセート、イマチニブ、ゲフィチニブ、ジドブジン、ラミブジン、アバカビル、イベルメクチン、アルベンダゾール、オクスフェンダゾール並びにケトコナゾールから選択される薬剤用のアジュバントとして使用される、請求項1〜23のいずれか1項に記載のアザペプチド化合物又はアザペプチド模倣化合物。
【図1】


【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公表番号】特表2012−515750(P2012−515750A)
【公表日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願番号】特願2011−546915(P2011−546915)
【出願日】平成22年1月25日(2010.1.25)
【国際出願番号】PCT/FR2010/050107
【国際公開番号】WO2010/084292
【国際公開日】平成22年7月29日(2010.7.29)
【出願人】(508019311)ユニヴェルシテ クロード ベルナール リヨン 1 (6)
【出願人】(305023584)サントル・ナシオナル・ド・ラ・ルシェルシュ・シアンティフィック (8)
【氏名又は名称原語表記】CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE
【住所又は居所原語表記】3 rue Michel Ange, 75794 PARIS CEDEX 16, France
【Fターム(参考)】
【公表日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願日】平成22年1月25日(2010.1.25)
【国際出願番号】PCT/FR2010/050107
【国際公開番号】WO2010/084292
【国際公開日】平成22年7月29日(2010.7.29)
【出願人】(508019311)ユニヴェルシテ クロード ベルナール リヨン 1 (6)
【出願人】(305023584)サントル・ナシオナル・ド・ラ・ルシェルシュ・シアンティフィック (8)
【氏名又は名称原語表記】CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE
【住所又は居所原語表記】3 rue Michel Ange, 75794 PARIS CEDEX 16, France
【Fターム(参考)】
[ Back to top ]

