BOB−1特異的T細胞及び使用法
【課題】
【解決手段】
本発明は、Bob-1特異的又はBob-1交差反応性T細胞、好ましくは細胞傷害性Tリンパ球(CTL)及びCD4+ Tヘルパー細胞を特定、誘発、及び/又は単離するために、Bob-1タンパク質、その断片又はエピトープ、及び/又は、関連配列を用いる用法に関する。本発明によるT細胞を用いて、Bob-1タンパク質発現によって影響される様々な疾患特定し、診断することが可能である。本発明は更に、医薬品又はワクチンとして、且つ、Bob-1発現腫瘍、リンパ腫、及び自己免疫疾患の治療用として、Bob-1特異的及び/又はBob-1交差反応性T細胞を始め、Bob-1特異的及び/又はBob-1交差反応性T細胞を誘発するためのペプチド及び/又は核酸配列も提供する。
【解決手段】
本発明は、Bob-1特異的又はBob-1交差反応性T細胞、好ましくは細胞傷害性Tリンパ球(CTL)及びCD4+ Tヘルパー細胞を特定、誘発、及び/又は単離するために、Bob-1タンパク質、その断片又はエピトープ、及び/又は、関連配列を用いる用法に関する。本発明によるT細胞を用いて、Bob-1タンパク質発現によって影響される様々な疾患特定し、診断することが可能である。本発明は更に、医薬品又はワクチンとして、且つ、Bob-1発現腫瘍、リンパ腫、及び自己免疫疾患の治療用として、Bob-1特異的及び/又はBob-1交差反応性T細胞を始め、Bob-1特異的及び/又はBob-1交差反応性T細胞を誘発するためのペプチド及び/又は核酸配列も提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、Bob-1特異的又はBob-1交差反応性T細胞、好ましくは細胞傷害性Tリンパ球(CTL)及びCD4+ Tヘルパー細胞を特定、誘発及び/又は単離するための方法における、Bob-1タンパク質、その断片又はエピトープ、及び/又は関連配列の使用に関する。本発明によるT細胞は、Bob-1タンパク質発現によって影響される各種疾患を特定、診断するために使用することが可能である。本発明は更に、Bob-1特異的及び/又はBob-1交差反応性T細胞を始め、Bob-1特異的及び/又はBob-1交差反応性T細胞を誘発するためのペプチド及び/又は核酸配列を、Bob-1発現腫瘍、リンパ腫、及び自己免疫疾患治療用医薬品又はワクチンとして提供する。
【背景技術】
【0002】
OBF-1又はOCA-Bとも呼ばれるBob-1タンパク質は、最初、オクタマーの結合転写因子Oct1及びOct2と相互作用を持ち、オクタマーモチーフ含有プロモーターにおける転写活性を上昇させる、B細胞限定コアクチベーター(Swissprot, アクセス番号Q16633)と特定された。このオクタマーモチーフ含有プロモーターは、主に、B細胞特異的免疫グロブリン(Ig)遺伝子プロモーターの中に認められる。
【0003】
Bob-1そのものは直接DNAには結合せず、オクタマーモチーフ含有プロモーターにおける転写活性は、少なくとも1個の特異的コアクチベーター、例えば、Bob-1と、Oct1又はOct2転写因子との機能的相互作用を必要とすることが記載された。オクタマーモチーフは、ほとんど全ての免疫グロブリン(Ig)遺伝子プロモーターに保存されるので、Bob-1は免疫グロブリン(Ig)遺伝子発現にとって必須であると考えられている。
【0004】
更に、最近の研究によって、Bob-1はまた、B細胞発達の全ての段階、特に胚中心の形成に関与することが明らかにされた。
【0005】
Bob-1欠乏マウスから得られたB前駆細胞系統におけるオクタマー依存性転写は、Bob-1は、オクタマーモチーフ含有プロモーターにおける転写にとって必須の、非冗長成分であることを証明することが示された(非特許文献1)。
【0006】
Bob-1欠乏マウスが、抗原依存性B細胞分化において重篤な欠損症を呈すること、早期のB細胞集団及び胚中心においてBob-1が正規に発現すること、遺伝子プロモーターにおけるオクタマーモチーフの優勢を始めとして、オクタマー依存性転写におけるBob-1の必須の役割という事実がある以上、Bob-1は、抗原によって駆動される、B細胞成熟及び活性化の全ての段階において必須の役割を果たしていることが予想される。
【0007】
Bob-1タンパク質、そのコード配列、コード配列を含むベクター、及び該タンパク質を含む組成物は、特許文献1を参照して知ることができる。従来から、Bob-1については、特異的抗Bob-1抗体生産のための使用が示唆されている。なぜなら、そのような抗体は、組織におけるBob-1の局在を特定するのに有用と考えられるからである。特許文献1は更に、概略的な表現で、単離されたBob-1タンパク質を、Bob-1発現が不足する障害又は疾患に対する交換療法としての使用を述べている。
【0008】
Bob-1発現の不足は、正常なB細胞の発達及び活性に対する重大な作用、例えば、免疫不全及び関連疾患を含む作用を招く可能性がある。Bob-1発現の上方調整も何らかの疾患又は障害を招く可能性があるのかどうかに関しては長い間不明であった。
【0009】
ほんの最近、非特許文献2において、バーキットリンパ腫、濾胞性リンパ腫、又はきわめて悪性度の高いリンパ腫の90%以上、及び調べたB細胞リンパ腫の50%を超えるものがBob-1タンパク質を過剰に発現することが示された。
【0010】
更に、Bob-1タンパク質は、T細胞由来腫瘍、例えば、T細胞白血病由来のJurkat T細胞系統において発現されることが明らかにされている(非特許文献3)。
【0011】
本発明の意図内容において使用される「リンパ腫」という用語は、B細胞又はT細胞由来の、造血系の、全ての良性又は悪性のガンを含む。特に、リンパ腫という用語は、ホジキンリンパ腫(HL)及び非ホジキンリンパ腫(NHL)、例えば、バーキット、濾胞性、又は瀰漫性リンパ腫をまとめたものである。本発明の意図内容において、リンパ腫という用語は更に、特に、リンパ腫の変異種であって、例えば、Bob-1タンパク質を発現する、又は過剰発現する変異種を指す。
【0012】
本明細書で用いる「過剰発現」という用語は、Bob-1タンパク質の発現量、又はBob-1タンパク質発現の時間プロフィールのいずれかにおける、任意の非生理的数値を記述する。
【0013】
これまで、非ホジキンリンパ腫(NHL)の大部分に対し十分な治療が与えられていない。NHLは、年間人口10万人当たり8−18人の発生率で起こり、その率は増加しつつあるが、ホジキンリンパ腫の下位分類、ホジキン及び非ホジキンリンパ腫は今でも、化学療法、放射線療法、骨髄移植、及び特異的抗体による治療を含む併用療法によって治療される。
【0014】
思い切った化学療法によっても、局所的ホジキンリンパ腫の患者では最大90%であるが、瀰漫性ホジキンリンパ腫では、下位分類及び危険因子にもよるが、僅かに約50%、高度のリンパ腫では最大で僅かに50%が治癒されるに過ぎない。化学療法は、それと判る確かな副作用をもたらし、更に長期の毒性、例えば、生き延びた患者において不妊をもたらす。特に、老人、及び併発疾患を抱える患者にとって治療選択肢は限定される。一方、稀な下位分類、例えば、ヘアリーセル白血病を除いては、低度の非ホジキン白血病は化学療法では治療することができない。非ホジキンリンパ腫のいくつかの下位分類、例えば、I及びII度の濾胞性リンパ腫は、早期段階(Ann-Arbor分類の段階I又はII)では放射線療法によって治療することが可能であるが、進んだ段階の病気に対しては治療法は無い。残念ながら、低度のリンパ腫の大部分は、治療法がもはや無くなった段階で診断される。従って、現在の治療選択肢、例えば、化学療法又は免疫療法は、ほんの一過性の寛解又は緩和を達成することができるにすぎない。これが、低度の非ホジキンリンパ腫の多くの下位分類、例えば、I及びII度の濾胞性リンパ腫、又は慢性リンパ球白血病において、臨床症状が現れるまで化学療法が延期される理由である。
【0015】
最近、HL及びNHLリンパ腫処置のための治療戦略が、Genentech社から販売されるリツキサン(Rituxan、登録商標)及びIDEC社から販売されるゼバリン(Zevalin、登録商標)の服用によって与えられた。前者は、B細胞を特異的に破壊する抗体であり、後者は、放射標識されたモノクロナール抗体であり、これもB細胞を欠乏させる。これら抗体療法の主要な欠点は、抗体は、患者の中の全てのB細胞を悉く、胚中心にあるものを始め、抹消にあるものまでも破壊することである。従って、この治療法は、免疫グロブリンの低下を招き、これは次に、免疫不全を避けるために免疫グロブリンの輸液によって処置しなければならない。
【特許文献1】国際公開第95/32284号
【非特許文献1】Laumen, H., P.J. Nielsen, and T. Wirth, 2000. Eur. J. Immunol. 30:458−469
【非特許文献2】American Journal of Pathology 2000,156:501−507
【非特許文献3】Zwilling S. Dieckmann A, Pfisterer P, Angel P, Wirth T, Inducible expression and phosphorylation of coactivator BOB.1/OBF.1 in T-cells. Science1997,277:221−225
【発明の開示】
【0016】
以上から、リンパ腫、例えば、HL及びNHL、更に、Bob-1タンパク質の発現、又は過剰発現によって特徴づけられる腫瘍又はリンパ腫を治療することが本発明の目的である。
【0017】
特に、悪性リンパ腫の治療効果を改善すること、同時に、従来の治療法の一つの大きな重荷である副作用を低減することが、本発明の目的である。
【0018】
更に、Bob-1タンパク質の発現又は過剰発現と相関する自己抗体の生産によって特徴づけられる、自己免疫疾患及び障害を治療する手段及び方法を提供することが本発明の目的である。
【0019】
更に、Bob-1タンパク質発現の生理的又は非生理的レベルの認識に依存する、又は該認識によって影響される、障害又は疾患を診断する、又は新たに特定する手段及び方法を提供することが本発明の目的である。
【0020】
更に、細胞傷害性T細胞による、Bob-1タンパク質発現細胞の認識及び破壊によって特徴づけられる障害又は疾患の治療手段及び方法を提供することが本発明の目的である。このような疾患としては、ヒト免疫不全ウィルス1及び2による感染、及びその関連疾患を始めとして、CTLによるB細胞の破壊によって特徴づけられる、他の免疫不全疾患、例えば、分類不能型免疫不全(CVID)が挙げられる。
【発明を実施するための最良の形態】
【0021】
上記背景において、本発明者達が、Bob-1発現細胞の細胞表面においてHLA分子によって提示されるBob由来ペプチドに対し、きわめて特異的な指向性を持つ、或いは、きわめて特異的な交差反応性を持つ、T細胞(TC)、特に細胞傷害性Tリンパ球(CTL)及びCD4+ Tヘルパー細胞を特定することができたのは彼等の目覚しい成功と見なすことができる。
【0022】
しかしながら、本発明者達は、T細胞(TC)、特に細胞傷害性Tリンパ球(CTL)及びCD4+ Tヘルパー細胞は、いずれもT細胞全体集団の下位分画ではあるが、本発明によれば、Bob由来ペプチドに対して特異的な指向性を持つ、又はきわめて特異的な交差性反応を持つ細胞であり、それらの細胞を単に特定したばかりでなく、本発明者は更に、そのようなBob-1特異的、及びBob-1交差反応的T細胞の誘発、発生、及び単離を可能としたのである。
【0023】
「T細胞」又は「Tリンパ球」という用語は、本明細書では、造血系由来の細胞、正常では、白血球細胞数の4分の1を占める:多くは小型の、顆粒非含有の白血球で、胸腺で発達し、感染又は悪性腫瘍の存在下に増加することのある細胞を記述するものと理解される。T細胞の主要機能は、タンパク質抗原に対する全ての免疫反応を調整すること、及び、細胞内微生物を除去するためのエフェクター細胞として働くことである。T細胞には様々な亜種がある。例えば、CD4+ Tヘルパー細胞(CD4+ 細胞)、細胞傷害性T細胞(CTL)、又は、ガンマ−デルタT細胞である。これらは、正常時には、定められた表面構造によって特徴づけられる。例えば、ヘルパーT細胞ではCD4抗原、或いは、細胞傷害性T細胞ではCD8抗原である。
【0024】
「細胞傷害性」及び、別名「細胞分解性」という用語は、本出願の意図内容では、細胞表面のHLAクラスI分子に結合するペプチド抗原を認識する、CD8陽性T細胞と理解される。細胞表面のHLAクラスI分子によって提示されるこのペプチド抗原は、その細胞の細胞質内部で合成される処理タンパク質に由来する。そのT細胞受容体が、HLAクラスI分子に結合するペプチド抗原と特異的相互作用を持った後、細胞傷害性T細胞は、そのペプチド抗原提示細胞を殺すことが可能になる。
【0025】
CD4+ Tヘルパー細胞は、抗原提示細胞表面のHLAクラスII分子に結合するペプチド抗原を特異的に認識する。これらのペプチドは、通常、専門的抗原提示細胞、例えば、樹状細胞(DC)、マクロファージ、及びB細胞によって摂取され、処理された外来抗原から得られる。この抗原を認識した後、CD4+ Tヘルパー細胞は活性化され、様々のサイトカイン及びケモカインを分泌することによって、CTL及び他の免疫エフェクター細胞、例えば、B細胞、マクロファージ、及びNK細胞に対して重要な支援を提供する。動物モデルにおいて、悪性腫瘍及び感染症のいずれの場合でも、最適免疫反応は、抗原特異的CD8+ CTL及びCD4+ T細胞の両方を刺激することによって誘発されることが明らかにされている。
【0026】
この高度に特異的なTC、すなわちCTL及びCD4+ Tヘルパー細胞によって、本発明者等は始めて、Bob-1発現細胞に対する免疫反応によって特徴づけられる、病気診断のためのツールを手に入れた。
【0027】
更に、本発明者等の知識によって、Bob-1タンパク質に対して特異的なTC、すなわちCTL及びCD4+ Tヘルパー細胞の両方を、インビトロ発生させるのみならず、インビボ誘発することが始めて可能となった。
【0028】
本発明に従って人工的に生産される、又は誘発されるT細胞は、Bob-1タンパク質の発現又は過剰発現と相関する障害又は疾患を治療するための、きわめて特異的な手段を提供する。
【0029】
例えば、このようなBob-1特異的CTLは、表面の受容体に結合したBob-1断片すなわちエピトープを提示する細胞を特異的に認識する。このBob-1特異的CTLは更に、そのようなBob-1発現細胞に特異的に結合し、更にそのようなBob-1発現細胞を破壊又は殺戮する能力を持つ。このようなBob-1発現細胞の典型例としては、悪性リンパ腫由来のB細胞及びT細胞、又は抗体を生産するB細胞が挙げられるが、ただしこれらに限定されない。
【0030】
更に別の例として、Bob-1特異的CD4+ Tヘルパー細胞(別名CD4+-細胞、又はCD4+)も、抗原提示細胞によって提示されるBob-1由来ペプチドの認識後活性化される。活性化されたBob-1特異的CD4+細胞は、CTL及び、他の免疫エフェクター細胞、例えば、NK細胞又はマクロファージの、Bob-1発現細胞に対する殺活性に対して重要な支援を提供する。
【0031】
従って、Bob-1タンパク質に対して高い特異性、又は交差反応性を持つT細胞を活性化又は誘発することが可能な手段及び方法を実現したことは、本発明者等の並外れた達成であった。
【0032】
このために、本発明は、Bob-1タンパク質、又はBob-1修飾タンパク質のエピトープから得られた、又は該エピトープに関連するペプチドを提供する。
【0033】
好ましくはBob-1特異的T細胞、主にCTL及び/又はCD4+ Tヘルパー細胞を刺激するいくつかのペプチドが提供される。
【0034】
一の実施例によれば、Bob-1特異的CTLを誘発することが可能な群のペプチドは、一般的な配列
X1X2KX3PX4X5X6X7、
式中、
X1は、任意の天然アミノ酸、特に、アルギニン(R)、イソロイシン(I)、フェニルアラニン(F)、チロシン(T)、又はセリン(S)を含む群から選択され、
X2は、メチオニン(M)、バリン(V)、ロイシン(L)、又はイソロイシン(I)であり、
X3は、グルタミン酸(E)、又はアスパラギン酸(D)であり、
X4は、任意の天然アミノ酸、特に、バリン(V)、ロイシン(L)、イソロイシン(I)、又はアラニン(A)を含む群から選択され、
X5は、任意の天然アミノ酸、特に、ヒスチジン(H)又はロイシン(L)を含む群から選択され、
X6は、任意の天然アミノ酸、特に、グルタミン酸(E)又はグリシン(G)を含む群から選択され、且つ、
X7は、メチオニン(M)、バリン(V)、ロイシン(L)、イソロイシン(I)、又はアラニン(A)である、によって要約することが可能である。
【0035】
更に別の実施例によれば、この群のペプチドは、HLA A2の結合因子であり、従って、X2の位置にアミノ酸M、L、V、又はI、及びX7の位置にアミノ酸V、L、又はMを持つのが好ましい。
【0036】
本発明の更に別の実施例によれば、Bob-1特異的、Bob-1交差反応性TC、CTL、又はCD4+を誘発するためのペプチドは、ペプチド類FLKEPVKEV, SLKEPVKEL, YLKEPVKEL, FLKEPVKEL, ILKEPVHEV, ILKEPVHGV, RVKEPVKEL, DSDAYALNHTLSVEGF, AYALNHTLSVEGF, YALNHTLSVEGF, YALNHTLSVEG, ALNHTLSVEGF, TYASPPLITNVTTRSSATPA, AALCAGWLSQPTPATLQPLA, MLWQKPTAPEQAPAPARPYQ, QAPAPARPYQGVRVKEPVKE, GVRVKEPVKELLRRKRGHAS, LLRRKRGHASSGAAPAPTAV, SGAAPAPTAVVLPHQPLATY, VLPHQPLATYTTVGPSCLDM, TTVGPSCLDMEGSVSAVTEE, EGSVSAVTEEAALCAGWLSQ, AALCAGWLSQPTPATLQPLA, PTPATLQPLAPWTPYTEYVP, PWTPYTEYVPHEAVSCPYSA, HEAVSCPYSADMYVQPVCPS, DMYVQPVCPSYTVVGPSSVL, YTVVGPSSVLTYASPPLITN, TYASPPLITNVTTRSSATPA, VTTRSSATPAVGPPLEGPEH, VGPPLEGPEHQAPLTYFPWP, QAPLTYFPWPQPLSTLPTST, QPLSTLPTSTLQYQPPAPAL, LQYQPPAPALPGPQFVQLPI, PGPQFVQLPISIPEPVLQDM, SIPEPVLQDMEDPRRAASSL, EDPRRAASSLTIDKLLLEEE, TIDKLLLEEEDSDAYALNHT、又はDSDAYALNHTLSVEGF
を含む群から選択される。
【0037】
これらの配列全てが、Bob-1タンパク質に対して特異的であるか、又は、Bob-1タンパク質に対して高度の交差反応性を持つT細胞を誘発するという共通の特徴を持つということは特に興味深い。
【0038】
本発明の意図内容では、Bob-1発現細胞のHLAクラスI又はHLAクラスII分子に結合する特定のペプチドに対して特異的なT細胞、そのようなペプチドをT細胞受容体を通じて認識するT細胞が提供される。T細胞受容体の結合部位は、その特異的T細胞によって特異的に認識される、アミノ酸配列を持つ特定のペプチドのみに結合するやり方で形成される。その結合は、その結合によってそのT細胞が活性化される場合、特異的と判断される。活性化は通常、その特異的結合T細胞の増幅をもたらす。
【0039】
驚くべきことに、Bob-1タンパク質由来のペプチドだけが、Bob-1特異的T細胞を誘発することができるのではない。興味あることに、本発明者等は、無関係のタンパク質から得られたペプチドではあるが、Bob-1タンパク質と特異的相互作用を持つT細胞を誘発することができるペプチドを特定することができた。Bob-1タンパク質由来ではないペプチドで、修飾Bob-1タンパク質又は任意の無関係なタンパク質由来であるペプチドによって誘発されるT細胞については、本明細書の意図内容では、Bob-1タンパク質に対して「交差反応的である」という用語が用いられる。
【0040】
特に有用なのは、修飾Bob-1タンパク質から得られたもので、驚くべきことに、Bob-1由来ペプチド、例えば、RVKEPVKELよりも優るT細胞誘発能力を示すペプチドFLKEPVKEVである。
【0041】
これらのペプチドに関しては更に驚くべきことであるが、完全に無関係な供給源、例えば、HIVから得られたペプチド、すなわち、ILKEPVHEV, ILKEPVHGV、又はILKDPVHGVでも、Bob-1特異的T細胞、又は交差反応性T細胞、好ましくはCTLを誘発するのに使用が可能である。
【0042】
Bob由来T細胞誘発性ペプチドのもう一つの例は、ペプチドALNHTLSVEGFである。このペプチドは、Bob-1特異的及び/又は交差反応性T細胞、好ましくはCD4+ 細胞を刺激することが可能である。更に別の例として、ALNHTLSVEGFペプチドの若干の修飾版、すなわち、ペプチドDSDAYALNHTLSVEGF, AYALNHTLSVEGF, YALNHTLSVEGF, YALNHTLSVEGもBob-1特異的及び/又は交差反応性T細胞、好ましくはCD4+ 細胞を刺激し、発生させるのにきわめて有用である。これらのペプチドは、HLAクラスII限定的であって、好ましくは、HLA DQ分子、より好ましくはHLA DQ0604分子の上に提示される。更に、これらのペプチドはまた、HLA DP、好ましくはHLA DP04分子の上にも提示される。
【0043】
ペプチドDSDAYALNHTLSVEGFから得られたペプチドの内、ペプチドALNHTLSVEGFは、Bob-1特異的、又は交差反応性T細胞を誘発する点で最高能力を持つことが示された。ペプチドYALNHTLSVEGF及びYALNHTLSVEGは依然として認識されるが、T細胞の誘発は、ALNHTLSVEGFによる誘発よりも有効ではない。
【0044】
更に別の実施態様によれば、ペプチドTYASPPLITNVTTRSSATPA, AALCAGWLSQPTPATLQPLA、及び、これらのペプチドの9個以上のアミノ酸を有するペプチドも、Bob-1特異的及び/又は交差反応性T細胞を刺激及び発生にきわめて有用である。これらのペプチドは、患者においてCD4+ を誘発するのに特に有用であるばかりでなく、CD8+ 細胞を誘発するのにも有効である。
【0045】
更に別の例では、きわめて免疫原性の高いBob-1タンパク質から得られる、下記に列挙されるペプチド:
MLWQKPTAPEQAPAPARPYQ (1-20), QAPAPARPYQGVRVKEPVKE (11-30), GVRVKEPVKELLRRKRGHAS (21-40), LLRRKRGHASSGAAPAPTAV (31-50), SGAAPAPTAVVLPHQPLATY (41-60), VLPHQPLATYTTVGPSCLDM (51-70), TTVGPSCLDMEGSVSAVTEE (61-80), EGSVSAVTEEAALCAGWLSQ (71-90), AALCAGWLSQPTPATLQPLA (81-100), PTPATLQPLAPWTPYTEYVP (91-110), PWTPYTEYVPHEAVSCPYSA (101-120), HEAVSCPYSADMYVQPVCPS (111-130), DMYVQPVCPSYTVVGPSSVL (121-140), YTVVGPSSVLTYASPPLITN (131-150), TYASPPLITNVTTRSSATPA (141-160), VTTRSSATPAVGPPLEGPEH (151-170), VGPPLEGPEHQAPLTYFPWP (161-180), QAPLTYFPWPQPLSTLPTST (171-190), QPLSTLPTSTLQYQPPAPAL (181-200), LQYQPPAPALPGPQFVQLPI (191-210), PGPQFVQLPISIPEPVLQDM (201-220), SIPEPVLQDMEDPRRAASSL (211-231), EDPRRAASSLTIDKLLLEEE (221-241), TIDKLLLEEEDSDA YALNHT (231-251)及び、DSDAYALNHTLSVEGF (241-256)
も、本発明に従ってBob-1特異的T細胞を効率的に誘発するのに使用することが可能である。
【0046】
前述のペプチドは全て、Bob-1タンパク質のエピトープ又は断片に対して特異的であるか、又は交差反応性であるT細胞の特定のために有用である。更に、これらのペプチドはまた、Bob-1タンパク質のエピトープ又は断片に対して特異的であるか、又は交差反応性であるT細胞の誘発及び単離のためには特に有用である。
【0047】
このため、Bob-1タンパク質のエピトープ又は断片に対して特異的であるか、又は交差反応性であるT細胞の誘発のために、本発明によるペプチドは、混合リンパ球集団、好ましくは末梢血単核球(PBMC)を刺激するために使用される。この混合リンパ球又はPBMCは、既知の標準技術、例えば、Ficoll-Hypaque密度勾配遠心法(Pharmacia、ウプサラ、スウェーデン)によって患者の血液から単離することが可能である。次に、この単離された混合リンパ球又はPBMCを、刺激のために、本発明によるペプチドとインキュベートし、更に選択的に、免疫ホルモン、例えば、インターロイキン−2ともインキュベートする。2週間後、刺激されたT細胞は、混合リンパ球の培養体を上回って増殖する。過剰増殖される抗原特異的細胞は、標準的ELISPOTアッセイを用い、単一細胞レベルで抗原誘発性サイトカイン分泌を分析することによって特定することが可能である。このELISPOTアッセイを用い、抗原特異的T細胞の数を、細胞培養体におけるスポット形成単位をビデオ画像分析することによって定量することが可能である。
【0048】
本発明の意図内容における「スポット」又は「スポット形成単位」という用語は、抗原、例えば、合成ペプチド、タンパク質、又は細胞のような抗原による刺激後、ガンマIFNを分泌するT細胞を指す。T細胞誘発条件下における細胞の集積は、抗原刺激細胞の特異的過剰増殖によるものであり、従って増加した細胞数である。このような集積は、顕微鏡下に特定することが可能であり、既知の技術によって染色することが可能である。各スポットは、本発明に従って刺激され、誘発された個々のT細胞クローンであり、従って、Bob-1特異的又は交差反応性T細胞クローンである。
【0049】
この過剰増殖細胞を、Bob-1エピトープの特異的認識について、又は該エピトープに対する交差反応性について、標準アッセイ、例えば、クロム放出アッセイ又はELISPOTを用いて試験した。例えば、ELISPOTアッセイでは、Bob-1の特異的認識、又はBob-1に対する交差反応性に関する読み取り値を、インターフェロン・ガンマ特異的抗体(例えば、1-D1K:Mabtech、ストックホルム、スウェーデン)によって検出されるインターフェロン・ガンマの放出量と相関させる。この方法は、単一細胞レベルで抗原特異的T細胞の高感度検出を可能とする。
【0050】
本発明者等は、本発明による刺激によって、Bob-1タンパク質のエピトープ又は断片に対して特異的な、又は交差反応性を示すT細胞を、驚くほど効率的に過剰増殖させることが可能であることを示すことができた。
【0051】
Bob-1タンパク質のエピトープ又は断片に対して特異的な、又は交差反応性のT細胞を、更に実験するために、又は何かの治療方策のために必要とする場合、そうしたT細胞は、可溶性HLA・ペプチド複合体、例えば、特異的ペプチドを抱えるHLA・テトラマー(Proimmune、オックスフォード、英国)又はHLA・ストレプタマー(IBA GmbH、ゲッチンゲン、ドイツ)を用いるFACSソーティング、或いは、ガンマIFN分泌アッセイ(Miltenyi, Bergisch-Gladbach、ドイツ)によって単離することが可能である。従って、本発明はまた、Bob-1タンパク質、その断片又はエピトープ、或いは、本発明によるペプチドの内の少なくとも一つに対して特異的又は交差反応性を持つ、TC、CTLとCD4+ Tヘルパー細胞の両方等の単離細胞も提供する。
【0052】
本発明による、Bob-1特異的又は交差反応性TCは、Bob-1発現、又はBob-1過剰発現によって特徴づけられる腫瘍又はリンパ腫を抱える患者を治療するには特に有用である。
【0053】
このような治療の背景となる一般的原理は、TC、CD4+、又はCTLの、Bob-1エピトープ又は断片に対する特異性又は交差反応性であって、該エピトープ又は断片は、細胞表面に提示され、本発明のTCによって発見され、最終的には除去されることを可能とする特異性又は交差反応性に帰着する。特に、腫瘍細胞又はリンパ球の調節不能増殖に悩まされる患者、従って、リンパ腫患者の場合、このような調節不能な増殖を行う細胞又はリンパ球を破壊し、除去することはきわめて望ましい。
【0054】
多くの腫瘍、及び大抵のリンパ腫では、Bob-1発現の増加が認められることが明らかにされているので、本発明によるTCは、そのようなBob-1発現細胞を除去するにはきわめて有用である。
【0055】
本発明によるTCは、リンパ腫細胞を破壊する他の治療方策と比べてもう一つの利点を有する。Genentech (Rituxan)又はIDEC (Zevalin)から市販される既知の抗体も、B細胞に対する一般的特異性に基づいて、リンパ節の末梢部のみならず胚中心を含め、患者の全てのB細胞を確かに除去する。これとは対照的に、本発明によるTC、CD4+、又はCTLは、Bob-1発現の増加を示す細胞のみを除去する。主に、胚中心のB細胞はBob-1を発現するが、末梢部のB細胞は発現しないことが知られており、更に、多くの悪性リンパ腫はBob-1を過剰発現することが知られるので、本発明のTCは、患者の全てのB細胞をことごとく奪うことはせず、Bob-1タンパク質を発現、又は過剰発現する細胞を好んで除去する。
【0056】
従って、本発明による治療法の副作用は、これまでに知られるいずれの治療方策と比べても明らかに低減される。
【0057】
リンパ腫細胞以外にも、若干の正常B細胞がBob-1を発現することがあるが、そのような場合でも、本発明のTCによる治療はきわめて有利である。なぜならば、正常B細胞に比べて、悪性腫瘍又はリンパ腫細胞の除去の割合が患者にとってきわめて好ましいからである。更に、B細胞の除去は、血清における抗体レベルの著明な低下をもたらす可能性があるが、そのような場合でも、その体液性免疫欠陥を補正するために、市販の免疫グロブリン調剤によってその患者を追加治療することは容易であり、一般にも容認されている。
【0058】
本発明は更に、Bob-1タンパク質の発現増加によって特徴づけられる腫瘍又はリンパ腫、特にリンパ腫を治療する療法に有用な、TC、CTLとCD4+ Tヘルパー細胞の両方の単離細胞も提供する。
【0059】
このために先ず、PBMCを患者から単離し、これらのPBMCを、本発明のペプチドの内の少なくとも一つによって、すなわち、Bob-1タンパク質、その断片又はエピトープ、或いは、修飾Bob-1タンパク質断片、又はそのエピトープによって誘発し、Bob-1特異的又はBob-1交差反応性TC、CTLとCD4+ Tヘルパー細胞の両方を過剰増殖させる。
【0060】
選択的に、誘発反応に免疫ホルモンを加える。典型的には、免疫ホルモンとして、インターロイキン2、IL−7、gm-CSF、IL−12、IL−18、及びアルファIFNが用いられる。
【0061】
次に、この過剰増殖T細胞を単離するか、或いは、既知の標準技法を用いて少なくとも濃縮する。次に、治療法のために、この単離細胞又は濃縮細胞を患者に再度投与する。典型的投与法は、皮内、皮下、筋肉内、静脈内、又はリンパ系内注入である。
【0062】
Bob-1特異的Tヘルパー細胞の活性によって支持される再投与濃縮TCは、Bob-1発現腫瘍及び/又はリンパ腫細胞を効率的に除去する。
【0063】
更に追加の免疫療法、又は免疫交換療法を、前記治療法と組み合わせてもよい。
【0064】
前述の治療のためには、個別の患者のPBMCを用いることが好ましいが、異種PBMC、すなわち異なる患者のPBMCを用いて、Bob-1特異的TC、CD4+細胞又はCTLを過剰増殖し、任意の患者に再投与することが可能な細胞を調製することも可能である。この場合、再投与されたTCについて現れると予想される免疫拒絶反応は、移植医学において標準的な慣行に従って調節することが望ましい。
【0065】
それとは別に、本発明の別態様では、Bob-1発現増加で特徴づけられる、腫瘍又はリンパ腫患者は、Bob-1特異的又は交差反応性TC、CTL、又はCD4+細胞の、インビボ誘発方法によって治療される。
【0066】
このために、患者には、本発明のペプチドの内の少なくとも一つ、Bob-1タンパク質、その断片又はエピトープ、或いは、修飾Bob-1タンパク質、その断片又はエピトープを接種し、Bob-1タンパク質又は修飾Bob-1タンパク質のエピトープ又は断片に対して特異的又は交差反応性を持つT細胞をインビボで誘発する。
【0067】
この治療法では、本発明によるペプチドは、生きている動物又はヒトに直接投与される。ペプチドは、皮内、皮下、筋肉内、又は静脈内に投与されることが好ましいが、ただしこれらに限定されない。
【0068】
免疫化のための典型的用量は、体重kg当たり約0.001から約1mg (mg/kg)のタンパク質又はペプチド、更に詳細には約0.01から約0.1mg/kgの範囲を持ってもよい。用量は、1回投与当たり50μgから1mgの範囲のタンパク質又はペプチドであることが好ましい。
【0069】
選択的に、ペプチド、又はタンパク質断片に対する反応を増すために、免疫ホルモン、アジュバント、又は免疫抑制を阻止する因子が更に投与される。免疫化の効率を向上させるために、ペプチドの投与を、2から3回、2から8週の時間間隔で繰り返すのが有用である。
【0070】
更に、ワクチン開発におけるよく知られる経験に基づいて、Bob-1特異的CTLの誘発は、Bob-1特異的CD4+細胞の平行的誘発によって強化される。従って、それに加えて、或いはそれとは別に、Bob-1特異的CD4+細胞を誘発するのはこの治療法にとって、きわめて興味あることである。このことは、全Bob-1タンパク質、又は、長さが少なくとも10アミノ酸長を持つ、それより短いアミノ酸及びペプチドを患者に投与することによって実現することが可能である。このタンパク質又はペプチドは、皮内、皮下、筋肉内、又は静脈内に投与することが可能である。このタンパク質又はペプチドは、抗原提示細胞によって摂取される。これらの細胞は、その受容体の上に該タンパク質又はペプチドを発現し、免疫細胞、特にCD4+細胞を刺激する。免疫細胞の刺激は、特に刺激された細胞タイプの過剰増殖をもたらす。
【0071】
免疫化のための典型的用量は、体重kg当たり約0.001から約1mg (mg/kg)のタンパク質又はペプチド、更に詳細には約0.01から約0.1mg/kgの範囲を持ってもよい。用量は、1回投与当たり50μgから1mgの範囲のタンパク質又はペプチドであることが好ましい。
【0072】
選択的に、ペプチド、又はタンパク質断片に対する反応を増すために、免疫ホルモン、アジュバント、又は免疫抑制を阻止する因子が更に投与される。免疫化の効率を向上させるために、ペプチドの投与を、2から3回、2から8週の時間間隔で繰り返すのが有用である。
【0073】
Bob-1特異的CD4+ Tヘルパー細胞は、Bob-1特異的CTLばかりでなく、同じ腫瘍細胞由来の他の腫瘍抗原に対して特異性を持つ他のCTLにも支援を与えることが可能である。
【0074】
前述の方法によれば、本発明は更に、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープ、及び、選択的に製薬学的に受容可能な担体又は希釈剤を含む組成物、或いは製薬組成物を提供する。
【0075】
典型的には、この「製薬学的に受容可能な担体」とは、薬剤の生物学的活性(例えば、結合特異性、親和性、又は安定性)を大きく損なうことのないように選択される担体及び希釈剤であって、例えば、水、生食液、リンゲル液、デキストロース液、5%ヒト血清アルブミン、不揮発性油、オレイン酸エチル、又はリポソームである。受容可能な担体としては、生体適合性、不活性、又は生体吸収性塩、バッファー剤、オリゴ又はポリサッカリド、ポリマー、ヒアルロン酸のような粘弾性化合物、粘度改善剤、防腐剤等が挙げられる。更に、この製薬組成物又は処方はまた、他の担体、アジュバント、又は、非毒性、非治療的、非免疫原性安定剤等を含んでもよい。
【0076】
更に、本発明は、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープ、及び、選択的に、1種以上の免疫ホルモン、アジュバント、又は免疫抑制を阻止する因子を含むアジュバントを提供する。
【0077】
このワクチンは、皮内、皮下、筋肉内、静脈内、鼻腔内、又はリンパ系内注入として投与することが可能である。
【0078】
ワクチン接種のための典型的用量は、体重kg当たり約0.001から約1mg (mg/kg)のタンパク質又はペプチド、更に詳細には約0.01から約0.1mg/kgの範囲を持つ。
【0079】
典型的には、選択的に投与される免疫ホルモン、アジュバント、又は免疫抑制を阻止する因子は、サイトカイン類、例えば、インターロイキン2、インターロイキン18、インターフェロン・ガンマ、インターフェロン・アルファ、又はgm-CSF、或いは、免疫刺激性分子、例えば、RNA分子(例えば、ポリ-I-ポリ-C(Ampligen)、又はキャップ付着及びポリアデニル化メッセンジャーRNA、例えば、CureVac GmbH、チュービンゲン、ドイツから市販されるRNActive(登録商標))、又は短いDNA分子、例えば。CPGオリゴヌクレオチド(例えば、Coley Pharmaceutical Group, Wellesley、マサチューセッツ州、米国によって現在ワクチンの臨床治験に使用されているCPG7909)である。
【0080】
本発明の更に別の実施例によれば、Bob-1タンパク質の発現増加を示す腫瘍又はリンパ腫を抱える患者は、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープを、単独で又は組み合わせてコードする核酸配列を該患者に直接投与することによって治療することが可能である。この方法によれば、その配列は、樹状細胞及び単球によって摂取される。次いで、配列は、ペプチド又はタンパク質に翻訳され、次に、MHC I及びMHC II複合体を介して免疫系、特にTCに提示される。これらの特異的ペプチド又はタンパク質断片の提示は、TC刺激を誘発し、従って、Bob-1タンパク質に対して特異的、又は交差反応性を示すTC、すなわちCD4+又はCTLの過剰増殖を招く。次いで、これらの特異的TCは、Bob-1タンパク質を発現する腫瘍又はリンパ腫細胞を破壊する。
【0081】
また、前述したように、重篤な免疫欠陥を補うための、追加の免疫グロブリン交換療法を、選択的に、運用することが可能である。
【0082】
本発明による核酸配列は、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープを、単独で又は組み合わせてコードするDNA又はRNA分子である。
【0083】
別の例では、上記DNA又はRNA分子は、単一核酸分子の間にリンカーを入れて、及び/又は、入れずに接続されて、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープをコードする。
【0084】
上記核酸配列は、裸のDNAとして、リポソームのような粒子に含まれるDNAとして、プラスミドに含まれるDNAとして、ベクター、例えば、組み換えワクシニアウィルス、又は組み換えMVAベクター(修飾ワクシニアウィルスアンカラ)のようなベクターに含まれるDNAとして、皮内、皮下、筋肉内、又は鼻腔内に投与することが可能である。更に、適当な担体に溶解したDNAを直接皮膚に塗布することも可能である。核酸配列はまた、RNアーゼによる変性を避けるように化学的に修飾されたRNA分子(例えば、キャップされ、ポリアデニル化されたメッセンジャーRNA、例えば、CureVac GmbH、チュービンゲン、ドイツから市販されるRNActive(登録商標))の形で運用することも可能である。
【0085】
更に別の実施例によれば、治療の必要な患者は、体外で発生させた樹状細胞によってワクチン接種することも可能である。樹状細胞は、gm-CSF、IL4、TNF-アルファ、プロスタグランジンE2、及びIL-6を含むサイトカイン混合液によって単球又は造血幹細胞をインキュベートすることによって発生させることが可能である。成熟樹状細胞には、本発明に従って、ペプチド、タンパク質、DNA又はRNA分子のような核酸を付加させ、成熟後、それらの細胞を患者に投与することが可能である。自己起源及び異系起源両方のHLA適合樹状細胞を用いることが可能である。
【0086】
前述に従って、本発明は、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープ、本発明の1種以上の核酸配列、及び、選択的に、担体、希釈剤、1種以上の免疫ホルモン、1種以上のアジュバント、又は、免疫抑制を阻止する1種以上の因子を含むワクチンを提供する。
【0087】
ワクチンの調製について、本発明によるペプチド、タンパク質又は核酸配列は、生理的に受容可能な形に変換される。従って、典型的には、約1000μgのペプチド、タンパク質、又は核酸配列は、1mlのリン酸バッファー生食液(PBS)において、選択的に2%ペプトン及び1%ヒトアルブミンの存在下に、アンプル、好ましくはガラスアンプル中で凍結乾燥される。この凍結乾燥物は、増量剤(例えば、マンニトール、デキストラン、糖、グリシン、ラクトース、又はポリビニールピロリドン)、又は、非経口投与のための適当な他の支援剤(例えば、抗酸化剤、安定剤等)を含んでもよい。次に、ガラスアンプルを封印すると、これは、好ましくは−20oC未満に保つと、数ヶ月保存することが可能である。ワクチン接種又は治療のためには、凍結乾燥物を、0.1から1mlの水溶液、好ましくは生理的食塩水に溶解し、非経口的に、例えば、筋肉内接種、又は局所接種によって投与することが可能である。本発明によるワクチン又は治療薬は、筋肉内又は皮下に注射することが好ましいが、担体によっては、ワクチンはまた、他のルートに投与してもよく、例えば、DNA-、又はRNA-ワクチンの場合は表皮、皮内、又は鼻腔内に、樹状突起細胞又はMVAのようなベクターの場合は皮内に、組み換えベクターの場合は経口又は鼻腔ルートに、或いは、樹状細胞の場合は皮下又は静脈内に投与することが可能である。
【0088】
投与方式、及び、投与用量及び数は、当業者には既知のやり方に従って最適化することが可能である。本発明による薬剤に対して適当な免疫反応を獲得するためには、適当であれば、ワクチンを、長期に渡って数回投与することは好都合である。
【0089】
更に別の実施例によれば、本発明は、Bob-1発現及び/又はBob-1特異的T細胞と相関する疾患又は障害を診断する方法を提供する。このために、Bob-1特異的T細胞を、いくつかの方法を用いてPBMCにおいて、又はリンパ節懸濁液において検出する。一つの例示の方法によれば、T細胞の最適エピトープに相当する短いペプチド、例えば、RVKEPVKELを、可溶性HLA複合体を形成するために用いることが可能である。この複合体は、Bob-1特異的TCRに特異的に結合することが可能なので、Bob-1特異的T細胞の直接的、及び特異的染色を可能とする。市販のHLA複合体の例としては、HLAテトラマー及びHLAペンタマー(Proimmune、オックスフォード、英国)、HLAストレプタマー(Iba、GmbH、ゲッチンゲン)、HLAダイマー(Bekton Dickinson、Franklin Lakes、ニュージャージー州、米国)、及び、ペプチドと、フィコエリスリンのような染色分子と結合させたβ-2-マイクログロブリン分子とを組み合わせた可溶性HLA分子がある。
【0090】
もう一つの診断法は、患者から単離したPBMCのようなリンパ球を、本発明によるペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープとインキュベートすることである。特異的T細胞の活性化及び/又は増殖を可能とするインキュベーション時間後、Bob-1特異的T細胞の活性化又は増殖を、適当な定量法、好ましくはELISPOTアッセイによって分析する。或いは、他の定量法、例えば、細胞内サイトカイン染色アッセイ(例えば、Bekton Dickinson, Franklin Lakes、ニュージャージー州、米国によって販売されるアッセイ)、又は、サイトカイン分泌アッセイ(例えば、Miltenyl Biotech GmbH、Bergisch-Gladbach、ドイツ)、クロム放出アッセイ、リンパ球増殖アッセイ、又は、可溶性HLA-ペプチド複合体、例えば、HLAテトラマー、HLAペンタマー、HLAダイマー、又はHLAストレプタマーを用いる直接染色アッセイの使用も可能である。
【0091】
健康人の循環PBMCにおいてBob-1特異的T細胞を検出することが可能である一方で、低頻度でありさえすれば、本発明の方法によって、患者においてもBob-1特異的TCを検出し、特定し、定量し、且つ、記載することはもちろん可能である。これによって、Bob-1依存性障害又は疾患を診断し、記載することが可能である。
【0092】
この診断法は、Bob-1関連性腫瘍、リンパ腫、又は自己免疫疾患の診断に使用が可能であるばかりでなく、Bob-1特異的T細胞を、それを必要とする患者において誘発する目的でワクチン投与した後Bob-1特異的T細胞を監視するためにも使用することが可能である。
【0093】
更に別の実施例では、本発明は、診断用キットを提供する。このキットは、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープ、本発明の1種以上の核酸配列を、患者から単離されるPMBCと接触させるのに好適なやり方で容器に充填させて含む。
【0094】
更に別の実施例では、この診断法及びキットは、Bob-1関連自己免疫障害又は疾患の診断に特に有用である。
【0095】
更に、別の実施例によれば、本発明によるペプチド、タンパク質、タンパク質断片、エピトープ、又は配列も、自己免疫障害又は疾患全般の治療に特に有用である。
【0096】
本出願の意図内容における「自己免疫障害又は疾患」は、自己反応性T細胞及び/又はB細胞であって、それぞれ、生体の自己構造体をそのT細胞受容体(TCR)又はB細胞受容体によって認識するT細胞及び/又はB細胞の生産によって特徴づけられる疾患を含む。自己反応性T細胞又はB細胞によって様々な自己組織又は自己分子が標的とされる。例えば、糖尿病の場合には膵臓、多発性硬化症の場合にはミエリン基礎タンパク質、全身性エリテマトーデスの場合にはDNA、ヴェーゲナー病の場合にはプロテイナーゼ3、バセドー病の場合にはTSH-受容体が標的とされる。T細胞による自己反応性は、標的細胞及び組織の破壊、及び、自己反応性T細胞による各種サイトカイン放出を原因とする炎症をもたらす。B細胞による自己反応性は通常、自己分子に結合する自己抗体の生産と関連し、そのために、傷害が誘発される。例えば、細胞死、炎症の誘発、受容体のブロック、又は、バセドー病のTSH受容体結合抗体の場合のように非生理的受容体起動のような傷害が起こることさえある。
【0097】
自己免疫障害又は疾患の治療のためには、本発明によるペプチド、タンパク質、タンパク質断片、エピトープ、又は配列を用いてBob-1特異的T細胞を誘発すると、これが、自己抗原に向けられた抗体又は免疫グロブリンを生産するB細胞を破壊する。別態様として、自己反応性T細胞を体外で誘発増殖して、次に、それを必要とする患者に投与することも可能である。これによって抗体生産は減衰されるので、自己抗体関連の症状は減退する。この治療の副作用は、追加の、よく知られる免疫グロブリン交換療法によって簡単に補償することが可能である。
【0098】
自己免疫疾患の治療のために体液性免疫不全を誘発するこの対処法が実行可能であることは、肺線維症を含む重篤なMCTD(混合結合組織病)を患う男性患者において本発明者等によって証明された。すなわち、この患者は、血清における免疫グロブリンレベルの低下、及び、同時に起こった、抗核抗体又はn-RNP抗体のような自己抗体の消失を伴う分類不能型免疫不全(CVID)を発症した後、この自己免疫の治癒を見たのである。
【0099】
この患者において、本発明者等は更に、HLAクラスII限定ペプチドDSDAYALNHTLSVEGF及びHLAクラスI限定ペプチドRVKEPVKELの両方を認識するBob-1特異的T細胞の存在を検出することができた。患者のBob-1特異的T細胞による、Bob-1発現性B細胞の破壊による免疫グロブリン生産の抑制は、自己抗体の生産を抑え、患者の危機的なリューマチ疾患の治癒を可能とした。免疫グロブリンの置換以外には、患者は、混合結合組織病に対し他には何も免疫抑制療法を必要としなかった。この患者は、Bob-1特異的T細胞の発達は、自己抗体によって引き起こされる自己免疫疾患を治癒することが可能であることを立証する。
【0100】
この背景において、ヒトでは、Bob-1を特異的に認識するB細胞に対する、Bob-1特異的T細胞による自己免疫反応は、Bob-1発現B細胞の破壊によってもたらされる抗体不足を原因とする免疫不全誘発によって特徴づけられる自己免疫疾患をもたらす可能性のあることが本発明者等によって示された。
【0101】
B細胞破壊という病理学的原因を持つ分類不能型免疫不全(CVID)患者という重要なサブ群についてその病因を明らかにしたのは本発明者達の功績である。通常20歳から40歳の患者に現れるこの免疫不全は、免疫グロブリンの漸次的消失によって特徴づけられるが、これは、重篤な感染を伴う。この、異質の原因から成る疾患のサブ群では、CD40-リガンド又はIcosのような分子の遺伝的欠損が報告されているけれども、患者の大多数におけるその病気の病因は、本発明の前には未解決であった。
【0102】
本発明者達はまた、患者の少なくとも一つのサブ群において、この病気はBob-1特異的T細胞の存在を伴い、このBob-1特異的T細胞が、リンパ節中に存在して体液性免疫反応誘発のために決定的に重要な細胞となる、Bob-1特異的B細胞を死滅させることを始めて明らかにすることができた。
【0103】
更に、HIV-1感染患者におけるBob-1特異的T細胞を分析して、本発明者達は、Bob-1特異的T細胞がHIV-1反応の病因において重要な役割を演じていることを明らかにすることができた。二十年に渡って、HIV-1感染におけるリンパ節病理の重要な特徴は、CD8+ T細胞によるB細胞リンパ小節への侵入であることが知られていた。通常、B細胞リンパ小節は、B細胞、小節局在樹状細胞、及び若干のCD4+ T細胞から成る。CD8+ T細胞による小節の侵入、及び、CTLによる小節の破壊は、HIV-1感染の標識であり、その他の障害ではめったに見られない。HIV-1によって感染されるのは、仮令あったとしても、ごく僅かな小節の樹状細胞及びB細胞だけであるから、CTLによる小節の破壊はずっと謎であった。小節内部では、相当数のHIV-1粒子が、補体受容体を介して小節樹状細胞に結合する。HIV-1は、CD4+及びCD8+ T細胞に対して走化性を持つ、そのエンベロープの糖タンパク質gp120を放出することが知られている。我々の発明によれば、HIV-1病因の重要因子は下記によって説明される。HIV-1は、放出gp120を介して、CD8+ T細胞を引き付けて、通常CD8+ T細胞が検出されないリンパ小節の中に導くことが可能である。HIV-1 gp120の、この走化性作用によって、Bob-1特異的T細胞もリンパ節を指向し、そこにおいて、Bob-1を発現することが知られる活性化B細胞を殺戮する。これは、HIV-1患者は、新規抗原に対して免疫反応を惹起しない、また、HIV-1感染患者では中和抗体の生産が阻害されるという以前から知られる事実を説明する。なぜなら、中和抗体の生産は、小節内におけるB細胞によるHIV-1粒子の認識に依存するからである。従って、本発明は、Bob-1特異的T細胞の反応性は、HIV-1病因に対する重要な貢献因子であることを示す重要な証拠を提供する。
【0104】
腫瘍、リンパ腫、又は自己免疫疾患を治療するための、前述の治療方策では、本発明は、Bob-1発現細胞を消失させる特異的T細胞を誘発するための手段及び方法を提供するが、本発明はまた、Bob-1タンパク質に対して特異性を有する、既存のTC又はCTLを逼塞させる−言い換えれば、アネルギー化する−能力を持つ。
【0105】
このTC又はCTLを逼塞又はアネルギー化することは、Bob-1特異的B細胞の消失が阻止されるという効果を持つ。従って、患者は、Bob-1依存性免疫不全から快復する。
【0106】
従って、もう一つの実施態様では、本発明のペプチド、タンパク質、タンパク質断片、エピトープ、配列、組成物、又はワクチンを用い、Bob-1タンパク質を指向する天然のT細胞のアネルギーを誘発することによってBob-1依存性免疫不全が治療される。
【0107】
本明細書で用いる「アネルギー」という用語は、部分的T細胞活性化によって得られる一つの結果を定義する。T細胞アネルギーは、低親和度の認識相互作用をもたらす抗原の微妙な変化、又は、十分な共同刺激の不足のいずれかによって起こる。アネルギーT細胞の信号伝達欠陥は部分的に定義されており、T細胞受容体(TCR)の下流欠陥のみならず上流欠陥も、T細胞の活性化能力を負の方向に調整することを示唆する。もっとも重要なことは、TCRトランスジェニックマウスを用いることによって、アネルギーはインビボ現象であって、単にインビトロのアーチファクトではないことを示す強力な証拠が得られたことである。げっ歯類及びヒトにおける研究から、アネルギーT細胞は調整性質を獲得すること、すなわち、アネルギーT細胞の調整作用は細胞対細胞接触を必要とし、抗原提示細胞免の疫原性の抑制によって仲介されることが示唆された。アネルギーT細胞と、マウスにおいて自己免疫抑制に働く自発性調整細胞の内、最近定義されたCD4+ CD25+集団との間には緊密な相似が存在する。
【0108】
本発明に従ってT細胞をアネルギー化するには、Bob-1由来HLAクラスI又はBob-1由来HLAクラスII限定エピトープを提示する、未熟な、又は半成熟の樹状細胞が患者に投与される。未熟、又は半熟樹状細胞はBob-1 T細胞を不活性化することが可能である。なぜなら、この種の樹状細胞は、共同刺激分子を持たず、また、アネルギー化陰性信号を配送することによってT細胞をアネルギー化することが可能だからである。
【0109】
未熟及び半熟樹状細胞は、生体を、自己免疫から保護する重要な調節細胞である(Immature, semi-mature and fully mature dendritic cells: which signals induce tolerance or immunity?; M. Lutz and G. Schuler. Trends in Immunology, 23巻、9号、445ページに総説が記載される)。T細胞を直接アネルギー化することの他に、これらの樹状細胞は、特異的サプレッサーT細胞及び調節T細胞を誘発することが可能である。寛容原樹状細胞によるプログラム設定によって、これらのサプレッサー又は調節T細胞は、IL-10及びTGFベータのような免疫調節性サイトカインを分泌し、これらのサイトカインが自己反応性T細胞反応を抑える。抗原特異的免疫反応の抑制における半熟又は未熟樹状細胞使用の効力がいくつかの群によって報告されている(例えば、Lutz MB, Suri RM, Niimi M, Ogilvie AL, Kukutsch NA, Rossner S, Schuler G, Austyn JM. Immature dendritic cells generated with low doses of GM-CSF in the absence of IL-4 are maturation resistant and prolong allograft survival in vivo. Eur. J. Immunol. 2000 Jul; 30(7):1813-22; Madhav V. Dhodapkar and Ralph M. Steinman. Blood, 2002年7月1日、100巻、1号、174-177ページ、Antigen-bearing immature dendritic cells induce peptide-specific CD8+ regulatory T cells in vivo in humans)。
【0110】
従って、本発明の更に別の実施態様においてT細胞をアネルギー化するために、未熟又は半熟樹状細胞を、単球から、或いは、低用量のgm-CSFと共に、IL-10添加又は無添加においてインキュベートすることによって造血幹細胞から生成させることが可能である。次に得られた細胞をインキュベートし、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープ、本発明の1種以上の核酸配列をインビトロで負荷する。その後、患者のT細胞をアネルギー化する方法に従って、前述のように負荷又は刺激した樹状細胞を、皮内、皮下、筋肉内、静脈内、又は、リンパ系内注入のいずれかによって患者に投与する。
【0111】
本発明によるペプチド、タンパク質、タンパク質断片、エピトープによって負荷又は刺激された未熟樹状細胞による、このようなワクチン接種は、自己反応性T細胞をアネルギー化するために使用される。
【0112】
更に、本発明によるペプチド、タンパク質、タンパク質断片、エピトープによって負荷又は刺激された未熟樹状細胞による、このようなワクチン接種は、免疫調節性、抗原特異的サプレッサーT細胞を誘発するのに使用することが可能である。これらの免疫調節T細胞は、CD4及びCD25両分子の発現によって特徴づけられるが、T細胞反応の強力なサプレッサーである。
【0113】
T細胞をアネルギー化するもう一つの方法は、これはBob-1特異的T細胞のアネルギー化をもたらす過程であるが、Bob-1由来ペプチドに対して修飾を担い、そのためにT細胞の部分的活性化しかもたらさない拮抗的ペプチドを使用することである。これらのペプチドは、患者に対して直接に、又は、未熟又は半熟樹状細胞負荷後に、皮内、皮下、又は、筋肉内に投与してよい。
【0114】
この方法は、T細胞活性化における共通の現象に基づく。T細胞受容体を、必要なトリガー閾値未満にしか活性化しない修飾ペプチドは、アネルギー、或いはアポトーシスを誘発することすらある(Sloan-Lancaster, J., B.D. Evavold, P.M. Allen. 1993. Induction of T-cell anergy by altered T-cell receptor ligand on live antigen-presenting cells. Nature 363:156、或いは、Brocke, S., K. Gijbels, M. Allegretta, I. Ferber, C. Piercy, T. Blankenstein, R. Martin, U. Utz, N. Karin, D. Mitchell, et al 1996. Treatment of experimental encephalomyelitis with a peptide analogue of myelin basic protein. Nature 379:343)。従って、修飾Bob-1タンパク質、その断片又はエピトープは、Bob-1タンパク質に対して特異的なT細胞をアネルギー化するために、場合によってはBob-1タンパク質発現に対して特異的なT細胞のアポトーシスをトリガーするのに特に有用である。
【実施例】
【0115】
1.HIV-1感染患者におけるBob-1交差反応性T細胞の特定及び単離
T細胞分析アッセイを用いて、本発明者達は、数人のHIV-1感染患者において、HIV-1特異的T細胞エピトープILKEPHGV、又は天然に生じるその変異種を特異的に認識し、同時に、1種以上のBob-1エピトープに対して交差反応性、及び著明な特異性を示すT細胞を特定することができた。
【0116】
更に、本発明者達は、HIV感染を持たず、HLA陰性で、分類不能型免疫不全を患う患者においても、エピトープRVKEVPKEL、及びBob-1内の他のエピトープを認識するBob-1特異的T細胞を特定することができた。エピトープRVKEVPKELは、HLA A2陰性患者によっても認識された。これは、このエピトープが、HLA A2以外の他のエピトープによっても認識されることを示す。
【0117】
好ましいT細胞分析アッセイはELISPOTアッセイであった。これは進化を遂げ、免疫学において抗原特異的T細胞検出のための標準的アッセイとなっている。ELISPOTアッセイは、添加物を伴うRPMI 1640、及び5%ヒトAB血清(Sigma-Aldrich, Steinheim、ドイツ)から成るR5AB培養液を用いて行った。抹消血又はリンパ節から新たに単離したリンパ球(PBMC)、及び、ペプチド刺激PBMCの両方を用いた。ニトロセスロース・フィルター基板マイクロタイター・プレート(96ウェル、MAHA-S-4510、Millipore、Molsheim、ドイツ)に、50μlのインターフェロンγ抗体1-D1K(Mabtech、ストックホルム、スウェーデン)を10μg/mlの濃度で塗布した。PBSで4回洗浄し、R5ABでブロックした後、100μlのR5ABに懸濁させた5x105のPBMCをあらかじめコートしたウェルに二重に加えた。ペプチドを、最終濃度40μg/mlとなるように直接ウェルに添加し、プレートを、5%CO2において37oCで10時間インキュベートした。0.05%Tween 20(PBS/T 0.05%)を含むPBSで6回洗浄後、100μlのビオチニル化インターフェロンγモノクロナール抗体7-B6-1(Mabtech)を、最終濃度2μg/mlにて5%CO2において37oCで2時間インキュベートした。0.05%PBS/T、100μlのアビジン/ペルオキシダーゼ溶液(Vectastain ABC-Kit, Vector Laboratories、カリフォルニア州、米国)を各ウェルに加えた。室温で1時間インキュベートし、0.05% PBSTで3回、及びPBSで3回洗浄後、0.01%H2Oを含む100μlのAEC基質(3-amino-9-ethylcar-bazole, Sigma-Aldrich)を色素源として加え、スポットを4分以内に現像した。比色反応は、プレートを蒸留水で洗浄することによって停止させ、次にプレートを空気乾燥させた。ビデオによるELISPOT自動読み取り器(AID Autoimmun Diagnostika、ストラスブルグ、ドイツ)を用いてスポットをカウントした。
【0118】
クロム放出アッセイでは、更に、これらのBob-1交差反応性CTLは、Bob-1発現、HIV陰性細胞にも特異的に結合し、破壊することが可能であることが示された。
【0119】
このために、PBMCを、10U/mlのインターロイキン-2を添加した1mlのR 10培養液において最終濃度2μg/mlの本発明の合成ペプチドによって感作した。2週間後、標準的クロム放出アッセイにおいて、増殖細胞を、ペプチドパルス負荷PBMCの特異的認識に関して試験した。ペプチド特異的CTL細胞系統を、2週間に1回、ペプチドパルス被爆PBMC(60Gyによる被爆)、及び被爆異種フィーダー細胞(40Gyによる被爆)によって再刺激した。
【0120】
II.免疫グロブリン欠如患者におけるBob-1交差反応性T細胞の特定及び分離
T細胞分析アッセイを用いて、本発明者達は、免疫グロブリン(Ig)を欠如する患者において、1種以上のBob-1エピトープに対して著明な特異性を示すT細胞を特定することができた。
【0121】
次に、クロム放出アッセイにおいて、これらのBob-1特異的T細胞は、エプスタインバー・ウィルス(EBV)によって変形された自己B細胞に特異的に結合し破壊することが可能であることが示された。この方法は、Bob-1発現性B細胞の、T細胞誘発による自己免疫性喪失に苦しむ患者を特定し、その特性を解明するための診断ツールとなった。この新たに発見された自己免疫疾患は、「Bob-1関連T細胞自己免疫」と名づけられた。
【0122】
同じ背景において、Bob-1発現B細胞に対するこの自己免疫反応は、患者におけるIgレベルの低下と相関することが示された。従って、Bob-1タンパク質に対する自己免疫反応は、体液性免疫欠陥、中でも、リンパ小節B細胞の破壊によって特徴づけられる体液性免疫欠陥を引き起こす可能性のあることが示された。一方、このような患者では、末梢のB細胞数はまったく正常である場合があるのに、免疫グロブリンレベルが低下する。これは、安静な循環B細胞に比べて、リンパ小節中心部のB細胞におけるBob-1発現はより高レベルであることによって説明される。免疫グロブリンの漸次的低下は、多くの患者において感染合併症の出現を伴う。Bob-1関連T細胞自己免疫の発見によって、一般に「分類不能型免疫不全」と呼ばれるこの疾患を持つ患者の少なくとも一つのサブ群の病因が初めて本発明者達によって説明された。
【0123】
本発明は、「分類不能型免疫不全症候群」を持つ患者の病因ばかりでなく、他の重要な疾患、例えば、”MGUS”(意義不明モノクロナール免疫グロブリン血症)及び形質細胞腫(多発性骨髄腫)の病因の探求にも貢献する。
【0124】
MGUS及び形質細胞腫患者は、その血清の中に、拡大B細胞クローン由来のモノクロナール免疫グロブリンである副次タンパク質を持つ。MGUSは最大3%の発生率を持つ主に老人に見られる一般的疾患であるが、MGUS患者は、非ホジキン型リンパ腫に分類される悪性腫瘍である形質細胞腫を発症する危険性がきわめて高い。
【0125】
本発明者達は、MGUS及び形質細胞腫は、Bob-1関連T細胞自己免疫を持つ患者に出現する可能性のあることを立証することができた。リンパ小節中心部の、正常なBob-1発現B細胞の、自己反応性T細胞による破壊は、B細胞免疫反応の制御不能、及び、リンパ臓器におけるB細胞ゾーンの消失を招き、そのために、Bob-1特異的CTL活性に対して耐性を持つ、遺伝的損傷を被り、修飾されたB細胞クローンの発達及びクローン拡大の機会が与えられることになる。本発明は、MGUS及び形質細胞腫の病因について重要な見解を提供する。すなわち、これらの障害において通常観察される正常免疫グロブリンの欠如は、モノクロナールB細胞集団の拡大の結果ではなく、逆に、自己反応性B細胞によるリンパ小節B細胞の減衰が、MGUS及び形質細胞腫発症の前提要件となっている。
【0126】
これらの事実の結果、本発明の方法に従って、Bob-1特異的TC又はCTLをアネルギー化する、或いは、抑制することによってCVID、MGUS、及び形質細胞腫を治療することが可能な方策と考えられる。この状況下では、正常なB細胞集団が回復し、それは、正常な免疫グロブリンの生産を取り戻し、モノクロナールB細胞クローンの現状以上の拡大を阻止すると考えられる。
【0127】
III.各種ペプチドによるTC誘発の特異性を試験するためのクロム放出アッセイ
HIV患者から単離されたT細胞を、ペプチドILKDPVHGV及び小用量のインターロイキン2によってペプチド刺激した。次に、過剰増殖したCTLを、クロム放出アッセイにおいてそのペプチド特異的分解について試験した。
【0128】
このために、B細胞とT細胞の融合であり、TAPトランスポーター欠陥を持ち、従って内部のBob-1タンパク質を提示することができない特異的HLA-A2陽性T細胞を、放射標識クロム及び各種ペプチドと共にインキュベートした。次いで、数回の洗浄工程の後、CTLを、この標識及びペプチド提示T2細胞とインキュベートし、クロムの放出を測定した。
【0129】
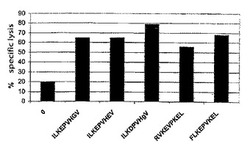
図1に示すように、HIV患者から単離されたCTLは、ペプチド提示T2細胞を特異的に認識し、破壊する。
【0130】
修飾Bob-1タンパク質由来のペプチドは、正常なBob-1タンパク質由来ペプチドに比べて優れた成績を示すことが明らかになった。これは、修正ペプチドは、本発明者等によって、HLA A2分子に対する結合が最適となるように修飾されたという事実による。
【0131】
IV.各種ペプチドによるTC誘発の特異性を試験するためのクロム放出アッセイ
体液性免疫欠陥を抱える患者から単離されたT細胞を、HIV由来ペプチドILKDPVHGVと、小用量のインターロイキン2と共にインキュベートした。次に、過剰増殖CTLにおいて、5時間クロムアッセイにおいて、そのペプチド特異的細胞分解について試験した。
【0132】
このために、B細胞とT細胞の融合であり、TAPトランスポーター欠陥を持ち、従って内部のBob-1タンパク質を提示することができない特異的HLA-A2陽性T細胞を、放射標識クロム及び各種ペプチドと共にインキュベートした。次いで、数回の洗浄工程の後、増殖CTLを、この標識及びペプチド提示T2細胞とインキュベートし、クロムの放出を測定した。
【0133】
図2に示すように、患者から単離されたCTLは、HIV由来ペプチドILKDPVHGVを提示するT2細胞を特異的に認識し、更に、Bob-1由来ペプチドRVKEVPKEL、又は修飾Bob-1由来ペプチドFLKEPVKELに対して高い交差反応性を示す。
【0134】
V.各種ペプチドによる誘発CTLの交差反応性を分析するELISPOTアッセイ
一方のELISPOTアッセイでは(図3a参照)、体液性免疫欠陥を持つ患者から単離したPBMCを、HIV由来ペプチドILKDPVHGVで刺激し、次に、増殖した特異的CTLを、HIV由来ペプチドILKDPVHGVを特異的に認識し、更に、Bob-1由来ペプチドFLKEPVKELに対して交差反応する能力について分析した。第2のELISPOTアッセイでは(図3b参照)、体液性免疫欠陥を持つ患者から単離したPBMCを、Bob-1由来ペプチドFLKEPVKELで刺激し、次に、増殖した特異的CTLを、Bob-1由来ペプチドFLKEPVKELを特異的に認識し、更に、HIV由来ペプチドILKDPVHGVに対して交差反応する能力について分析した。
【0135】
結果は、Bob-1由来ペプチドFLKEPVKELと、HIV由来ペプチドILKDPVHGVとの間には強力な交差反応性のあることをはっきりと示す。
【0136】
VI.分類不能型免疫不全患者から得られたBob-1特異的CD4 Tヘルパー細胞の単離と特性解明
HIV-1陰性の、分類不能型免疫不全患者において、本発明は、Bob-1特異的T細胞を特定することができた。例えば、このタイプの免疫不全を持つ患者から得られたCD4+ Tヘルパー細胞は、Bob-1由来ペプチドDSDAYALNHTLSVEGFを特異的に認識した。
【0137】
分類不能型免疫不全で、IgG、IgA、及びIgMの血清レベル低下による反復的感染によって特徴づけられる患者から得られたPBMCを、全体Bob-1タンパク質に延長する、重複ペプチドプールによって刺激した。5種のペプチドプールはそれぞれ、10アミノ酸が重複する、5種類の16から20アミノ酸長ペプチドを含んでいた。ガンマIFN ELISPOTによって分析した増殖細胞は、Bob-1タンパク質のアミノ酸201から256に対応する5種類のペプチドを含むペプチドプール5に対して特異的認識を示した(図4)。
【0138】
個々のペプチドについて更に分析したところ、Bob-1タンパク質のアミノ酸241から256に対応する配列DSDAYALNHTLSVEGFを持つペプチド25の認識が示された。
【0139】
更に別の実験で、CD4+又はCD8+ T細胞を、DSDAYALNHTLSVEGF特異的細胞系統から脱落させた。脱落は、標準的磁気細胞分離法を用い(Easy Sep登録商標、Stem Cell Technologies、バンクーバー、ブリティシュ・コロンビア)、磁気ビーズに結合するCD4又はCD8特異的モノクロナール抗体によって行った。
【0140】
この実験は、この患者から得られたBob-1ペプチド25特異的T細胞はCD4 Tヘルパー細胞であることをはっきりと証明した。
【0141】
更に別のELISPOT実験において、DSDAYALNHTLSVEGF特異的細胞系統に更に欠失ペプチドの特徴を付与した。この実験では、50000個の細胞を欠失ペプチドと一晩インキュベートし、標準ELISPOTアッセイにおいてガンマIFN生産について分析した。これらの実験は、DSDAYALNHTLSVEGF特異的細胞はペプチドALNHTLSVEGFを依然として認識するが、一方、ペプチドYALNHTLSVEGはあまりよく認識されず、C末端のGを省略したペプチドは認識されなかった。これは、最適エピトープは、ペプチドALNHTLSVEGF(アミノ酸246−アミノ酸256)であることを示す(図5)。更にその後の実験によって、DSDAYALNHTLSVEGF特異的細胞のHLAタイプが明らかにされた(図6及び7)。
【0142】
同じ患者で、アミノ酸51から110に広がる、5種の20アミノ酸長ペプチドを含むペプチドプール2でPBMCを刺激し、ELISPOT分析で調べたところ、ペプチドaa81-aa100を特異的に認識するT細胞の増殖が明らかにされた(図8)。
【0143】
アミノ酸101から160に広がる、5種の20アミノ酸長ペプチドを含むペプチドプール3でPBMCを刺激し、ELISPOT分析で調べたところ、ペプチドaa141-aa160を特異的に認識するT細胞の増殖が明らかにされた(図9)。
【0144】
もっとも驚くべきことは、患者の内のあるものは、Bob-1特異的T細胞、特に、DSDAYALNHTLSVEGF特異細胞を誘発することによって、そのリューマチ性自己免疫疾患の治癒を見たことである。
【0145】
更に、そのような患者は、他のBob-1由来ペプチド、例えば、TYASPPLITNVTTRSSATPA、及びAALCAGWLSQPTPATLQPLAも認識した。これは、これらのペプチドも、Bob-1依存性疾患又は障害、例えば、腫瘍、リンパ腫、又は自己免疫疾患の治療に有用であることを示す。
【0146】
VII.HIV-1及びHIV-2感染患者から得られたBob-1特異的CD8細胞(CTL)の単離と特性解明
HIV-1患者において、本発明者達は、Bob-1由来ペプチドに対して特異的な様々なT細胞を特定することができた。様々な患者において、特異的T細胞が特異性を示す各種ペプチドの要約を図10において見て取ることができる。
【0147】
この分析のために、3百万個のPBMCをそれぞれ、4−5種のBob-1ペプチドから成るプールで刺激し、2−3週間後、増殖細胞を、標準的ガンマIFN-ELISPOTアッセイにおいてBobプールの認識に関して試験した。次に、ペプチドプールを認識するPBMCを、第2ELISPOTアッセイにおいて個々のペプチドについて試験した。図10において、個々のペプチドに対する反応性を×でマークして示す。使用したペプチドは、Bob-1タンパク質に基づいて番号付けしたアミノ酸を持つBob-1由来ペプチドである。
【0148】
HIV感染患者において、主にCTL、又はCD8+ T細胞が特定されたが、CD4+ T細胞も特定されたことは注目すべきである。
【0149】
これらの結果は、HIV-1感染の病因に関する長い間の謎を解明するのに役立つ。HIV-1感染におけるリンパ節病理の重要な特徴は、CD8+ T細胞がB細胞小節に侵入することであることが20年来知られている。通常、B細胞小節は、B細胞、小節樹状細胞、及び若干のCD4+ T細胞から成る。CD8+ T細胞によるリンパ小節の侵入、及びCTLによる小節の破壊は、HIV-1感染の標識であり、他の疾患ではめったに見られない。HIV-1によって感染されるのは、仮令あったとしても、ごく僅かな小節の樹状細胞及びB細胞だけであるから、CTLによる小節の破壊はずっと謎であった。小節内部では、相当数のHIV-1粒子が、補体受容体を介して小節樹状細胞に結合する。一方、HIV-1は、CD4+及びCD8+ T細胞に対して走化性を持つ、そのエンベロープの糖タンパク質gp120を放出することが知られている。現在本発明によれば、HIV-1病因の重要因子は下記のように説明される。HIV-1は、放出gp120を介して、CD8+ T細胞を引き付けて、通常CD8+ T細胞が検出されないリンパ小節の中に導くことが可能である。HIV-1 gp120の、この走化性作用によって、Bob-1特異的T細胞もリンパ節を指向し、そこにおいて、Bob-1を発現することが知られる活性化B細胞を殺戮する。これは、HIV-1患者は、新規抗原に対して免疫反応を惹起しない、また、HIV-1感染患者では中和抗体の生産が阻害されるという以前から知られる事実を説明する。なぜなら、中和抗体の生産は、小節内におけるB細胞によるHIV-1粒子の認識に依存するからである。従って、本発明は、Bob-1特異的T細胞の反応性は、HIV-1病因に対する重要な貢献因子であることを示す重要な証拠を提供する。
【0150】
これらの所見はHIV-2感染にとっても重要である。なぜなら、HIV-2感染患者からもBob-1特異的T細胞を単離することが可能だからである(図12)。
【0151】
Bob-1発現B細胞の特異的殺作用を更に明らかにするために、Bob-1特異的CTL細胞系統(ペプチドaa71-90(Bob 8クローン)、aa91-110(Bob10クローン)、及びaa210-220(Bobクローン)に対して特異的)を、標準的クロム放出アッセイにおいて自己EBV変形B-LCLの認識について試験した。これらのCTLは全て、それぞれの特異的ペプチドによって感作されたB細胞は殺したが、特異的ペプチド無しのB細胞は殺さなかった(図11)。これは、Bob-1ペプチドの特異的認識を示す。3種のCTL細胞系統は全て、CD8特異的抗体で染色したところCD8+ T細胞であることが示された。
【0152】
これらの結果は、Bob由来ペプチドに対して特異的なCTL細胞系統は効率が高いことを示す。HIV感染におけるリンパ節障害の原因にはこのようなBob-1特異的CTL細胞系統が関与すると思われるが、これらの細胞系統は、Bob-1発現細胞を除去する効率が高く、Bob-1発現性リンパ腫を始め、Bob-1タンパク質の発現と相関する疾患又は障害の治療のため薬剤として使用することが可能である。
【0153】
Bob-1特異的T細胞反応の大きさを、HIV-1特異的T細胞反応と比較するために、我々は、HLA B27陽性、HIV-1感染患者において、Bob-1ペプチドプールによる刺激、又は、免疫主体HLA B27限定HIV-1 gagペプチドKRWIILGLNKによる刺激のいずれかによるペプチド刺激T細胞系統のELIPOT反応を比較した。この実験の結果(図13)は、Bob-1ペプチドの認識は、HIV-1ペプチドの認識と同様の大きさで起こることを示す。
【0154】
IX.Bob-1特異的T細胞誘発のためのワクチン作用モデルとしてのインビトロ刺激
更に別の一組の実験において、本発明者達は、健康人においても、Bob-1特異的T細胞誘発を刺激することが可能であることを証明した。
【0155】
このために、健康人のPBMCを、前述のように、Bob-1由来ペプチドの内から選択された1ペプチドを負荷した自己樹状細胞によって刺激した。この樹状細胞は、PBMCを、gm-CSF及びIL4と共に5日間インキュベートし、更に、標準プロトコール(Berger TG, Feuerstein B, Strasser E, Hirsch U, Schreiner D, Schuler G, Schuler-Thurner B. Large-scale generation of mature monocyte-derived dendritic cells for clinical application in cell factories. Journal of immunological methods 2002, 268:131-140)に従って複数サイトカインの混合液とインキュベートすることによって成熟させるという標準プロトコールに従って生成した。樹状細胞は、Bob-1由来ペプチドの内から選択された1ペプチドと2時間インキュベートし、2回洗浄し、3百万個の自己PBMCに加えた。図14に、Bob-1特異的T細胞の増殖に対するこの刺激の効率が示される。このインビトロ免疫化は、インビボ免疫化のモデル反応を表すが、Bob-1特異的T細胞の著明な誘発を招くことが見て取れる。
【0156】
従って、上記結果は、Bob-1由来ペプチドによるインビボ免疫化は、インビボにおいてBob-1特異的T細胞の誘発及び刺激を招く可能性のあることを示す。従って、Bob-1特異的T細胞を用いることによって、インビボにおいて、Bob-1発現リンパ腫のみならず、Bob-1タンパク質発現と相関する疾患又は障害を治療することも可能である。
【図面の簡単な説明】
【0157】
【図1】図1は、HLA-A2-陽性T2細胞を、放射標識クロム及び各種ペプチドとインキュベートした、クロム放出アッセイの結果を示す。数回の洗浄工程の後、HIV患者から単離し、ペプチドILKDPVHGVに対して特異性を持つCTLの過剰増殖刺激を受けたCTLを、標識された、ペプチド提示T2細胞と共にインキュベートし、クロムの放出を測定する。提示された各種ペプチドに依存する特異的細胞分解を示す。HIV由来ペプチドILKDPVHGV と、Bob-1由来ペプチドFLKEPVKEL、又は修飾Bob-1由来ペプチドRVKEVPKELとの間の交差反応性も示される。
【図2】図2は、特異的HLA-A2-陽性T2細胞を、放射標識クロム及び各種ペプチドとインキュベートした、クロム放出アッセイの結果を示す。数回の洗浄工程の後、体液性免疫欠陥を持つ患者から単離し、ペプチドILKDPVHGVに対して特異性を持つCTLの過剰増殖刺激を受けたCTLを、標識された、ペプチド提示T2細胞と共にインキュベートし、クロムの放出を測定する。提示された各種ペプチドに依存する特異的細胞分解を示す。HIV由来ペプチドILKDPVHGV と、Bob-1由来ペプチドFLKEPVKEL、又は修飾Bob-1由来ペプチドRVKEVPKELとの間の交差反応性も示される。
【図3a】図3aは、ELISPOTアッセイにおいて、体液性免疫欠陥を持つ患者から単離したPBMCを、HIV由来ペプチドILKDPVHGVで刺激し、次に、増殖した特異的CTLを、HIV由来ペプチドILKDPVHGVを特異的に認識する能力、及び、Bob-1由来ペプチドFLKEPVKELに対して交差反応する能力について分析した。
【図3b】図3bは、ELISPOTアッセイにおいて、体液性免疫欠陥を持つ患者から単離したPBMCを、Bob-1由来ペプチドFLKEPVKELで刺激し、次に、増殖した特異的CTLを、Bob-1由来ペプチドFLKEPVKELを特異的に認識を特異的に認識する能力、及び、HIV由来ペプチドILKDPVHGVに対して交差反応する能力について分析した。
【図4】図4は、ELISPOTアッセイにおいて、分類不能型免疫不全(CVID)を抱えるHIV-1陰性患者から単離したPBMCを、5種類のペプチドプールであって、それぞれ、10アミノ酸が重複する、5種類の16から20アミノ酸長ペプチドを含むプールで刺激した。これら5種類のプールに含まれる25種のペプチドは、ヒトBob-1全タンパク質に広がる、10アミノ酸長の重複を持つ1組の重複ペプチドから得られたものであった。ガンマIFN ELISPOTで試験した増殖した特異的T細胞は、Bob-1タンパク質のアミノ酸201から256に広がる5種類のペプチドを含むペプチドプール5に対して特異的認識を示した。更に分析したところ、ペプチドプール5に対して特異的なT細胞は、ペプチドDSDAYALNHTLSVEGF(Bob-1のアミノ酸241から256)を特異的に認識するが、このプール内の他のペプチドは認識しないことが明らかになった。
【図5】図5は、分類不能型免疫不全患者から得られたBob特異的CD4細胞のエピトープ分析を示す。分類不能型免疫不全患者由来のPBMCをBob-1ペプチド25(= DSDAYALNHTLSVEGFで、Bob-1のアミノ酸241から256に対応)で刺激した。Bobペプチド25を特異的に認識する増殖細胞を更に、二重の50000個細胞、及び欠失させた合成ペプチドを用いたガンマIFN-ELISPOTアッセイにて分析した。この実験によって、Bob特異的細胞系統は、ペプチドALNHTLSVEGFを特異的に認識するが、C末端のFを欠失したペプチドでは効率が下がり、C末端のGを欠失するといずれのペプチドも効力を失うことが示された。
【図6】図6は、分類不能型免疫不全患者から得られたBob特異的CD4細胞のエピトープ分析を示す。分類不能型免疫不全患者由来のPBMCをBobペプチド25(= DSDAYALNHTLSVEGFで、Bobのアミノ酸241から256に対応)で刺激した。Bobペプチド25を特異的に認識する増殖細胞を更にガンマIFN-ELISPOTアッセイにて分析した。分析には、二重の50000個細胞、及びEBV変形自己B細胞(B-LCL)を、Bobペプチド25、及びHLAクラスII DR、DQ、又はDP Bob-25に対する抗体を添加して、又は無添加でインキュベートしたものを用いた。Bob25誘発ガンマインターフェロン生産は、HLA DQに対する抗体とインキュベートすることによって抑制されたが、HLA DR及びDP分子にたいする抗体によっては抑制されなかった。これは、Bobペプチド25はHLA DQによって提示されることを示す。
【図7】図7は、分類不能型免疫不全患者から得られたBob特異的CD4細胞のエピトープ分析を示す。分類不能型免疫不全患者由来のPBMCをBobペプチド25(= DSDAYALNHTLSVEGFで、Bobのアミノ酸241から256に対応)で刺激した。その患者のHLAクラスIIタイプは、DR11、DR13、DQ0301、DQ0604である。Bobペプチド25を特異的に認識する増殖細胞を更にガンマIFN-ELISPOTアッセイにて分析した。分析には、二重の50000個細胞、及び、自己、及びHLAクラスII適合EBV変形B細胞(B-LCL)を、Bobペプチド25を添加して、又は無添加でインキュベートしたものを用いた。Bob25誘発ガンマインターフェロン生産は、DQ0604を発現する、Bobペプチド25とインキュベートしたB細胞系統によって刺激されたが、DQ0301又はDR11を発現するB細胞系統によっては刺激されなかった。これは、分類不能型免疫不全患者では、HLA DQ0604分子がBobペプチド25に特異的に結合し、且つ、Bobペプチド25をCD4+ T細胞に提示することを示す。
【図8】図8は、分類不能型免疫不全患者から得られたBob特異的CD4細胞のエピトープ分析を示す。分類不能型免疫不全患者由来のPBMCを、Bob-1のアミノ酸51から110に対応する、10アミノ酸長の重複を持つ5種の20アミノ酸(aa)長ペプチドを含むペプチドプールで刺激した。二重の50000個細胞及び合成欠失ペプチドを用いたガンマIFN-ELISPOTアッセイにおいて、増殖細胞はBobペプチドaa81-100を特異的に認識した。この実験は、Bob特異的細胞系統は、AALCAGWLSQPTPATLQPLA(アミノ酸81−100に対応)を特異的に認識することを示す。
【図9】図9は、分類不能型免疫不全患者から得られたBob特異的CD4細胞のエピトープ分析を示す。分類不能型免疫不全患者由来のPBMCを、Bob-1のアミノ酸101から160に対応する、10アミノ酸長の重複を持つ5種の20アミノ酸(aa)長ペプチドを含むペプチドプールで刺激した。二重の50000個細胞及び合成欠失ペプチドを用いたガンマIFN-ELISPOTアッセイにおいて、増殖細胞はBobペプチド141−160を特異的に認識した。この実験は、Bob特異的細胞系統は、TYASPPLITNVTTRSSATPA(アミノ酸141−160に対応)を特異的に認識することを示す。
【図10】図10は、HIV-1感染患者から得られたペプチド刺激PBMCによる、Bob-1重複ペプチドの認識を表として示す。患者#14はHIV-2感染であり、他の患者は全てHIV-1感染である。表の最上段には、Bob-1タンパク質に基づいて番号付けしたアミノ酸を持つ重複ペプチドが示される。3百万個のPBMCをそれぞれ、4−5種のBob-1ペプチドから成るプールで刺激し、2−3週間後、増殖細胞を、標準的ガンマIFN-ELISPOTアッセイにおいてBobプールの認識に関して試験した。次に、ペプチドプールを認識するPBMCを、第2ELISPOTアッセイにおいて個々のペプチドについて試験した。個々のペプチドに対する反応性を×でマークして示した。
【図11】図11は、Bob-1特異的CTL細胞系統(ペプチドaa71-90(Bob 8クローン)、aa91-110(Bob10クローン)、及びaa210-220(Bobクローン)に対して特異的)によるBob-1発現B細胞の特異的殺作用を示す。これらの細胞系統を、標準的クロム放出アッセイにおいて自己EBV変形B-LCLの認識について試験した。これらのCTLは全て、それぞれの特異的ペプチドによって感作されたB細胞は殺したが、特異的ペプチド無しのB細胞は殺さなかった。これは、Bob-1ペプチドの特異的認識を示す。3種のCTL細胞系統は全て、CD8特異的抗体で染色したところCD8+ T細胞であることが示された。
【図12】図12は、HIV-2感染患者から得られたT細胞系統による、Bob-1特異的ペプチドaa171-190の認識を示す。この患者からのPBMCを、Bob-1配列のaa151-210に広がる5種の重複ペプチドのプールで刺激した。増殖細胞を、ガンマインターフェロンELIPOTアッセイにおいて、aa151-210及び個々のペプチドから成るペプチドプールの認識について試験した。実験は、細胞系統によってペプチドaa171-190が特異的に認識されることを示した。
【図13】図13は、HIV-1感染患者から得られたCTL細胞系統による、HIV-1特異的ペプチドKRWIILGLNK(KK10)と比べた場合の、Bob-1特異的ペプチドの認識を示す。患者のPBMCを、Bob-1特異的ペプチドプール及びペプチドKK10によって刺激した。各プールは、10アミノ酸重複を持つ、5種の20アミノ酸長ペプチドを含む。PBMCを、10% FCS及び10単位のインターロイキン2を添加した、1ml RPMI培養液において24ウェルプレートにてペプチド(それぞれ1μg/mlの濃度で)とインキュベートした。増殖細胞系統を、ガンマIFN-ELISPOTにおいて特異的認識について試験した。この実験は、Bob-1特異液ペプチドプールaa101-160、及びペプチドプールaa51-aa110の特異的認識は、免疫主体HLA B27限定gagエピトープKRWIILGLNKの認識と同様の大きさであることを示す。SFU=スポット形成単位。
【図14】図14は、あらかじめBob-1ペプチドによってPBMCを刺激された健康人において生成されたT細胞系統によるガンマIFN-ELISPOTアッセイの結果を示す。プール1特異的、又は、プール4特異的細胞系統において、それぞれのプール及び表示のペプチドによる刺激後に得られるペプチド特異的T細胞数が示される。プール1による刺激後に生成したT細胞系統は、Bob-1ペプチドaa21-40に対して特異的認識を示し(図14の上段)、プール4による刺激後に生成したT細胞系統は、Bob-1ペプチドaa171-190に対して特異的認識を示した(図14の下段)。T細胞系統は、Bob-1タンパク質のaa1-aa256に対応する、それぞれが、10アミノ酸長の重複を持つ、5種の20アミノ酸(aa)長ペプチドを含む、異なる5種のプールで、末梢血単核球(PBMC)を刺激することによって生成した。ペプチドプールは、標準プロトコール(Berger TG, Feuerstein B, Strasser E, Hirsch U, Schreiner D, Schuler G, Schuler-Thurner B. Large-scale generation of mature monocyte-derived dendritic cells for clinical application in cell factories. Journal of immunological methods 2002, 268:131-140)に従って生成した自己樹状細胞によって提示させた。この実験は、健康人のPBMCのインビトロ刺激も、Bob-1特異的T細胞の著明な増殖をもたらすことを証明した。従って、これは、Bob-1特異的T細胞反応のインビトロ誘発のためのモデルとなる。
【技術分野】
【0001】
本発明は、Bob-1特異的又はBob-1交差反応性T細胞、好ましくは細胞傷害性Tリンパ球(CTL)及びCD4+ Tヘルパー細胞を特定、誘発及び/又は単離するための方法における、Bob-1タンパク質、その断片又はエピトープ、及び/又は関連配列の使用に関する。本発明によるT細胞は、Bob-1タンパク質発現によって影響される各種疾患を特定、診断するために使用することが可能である。本発明は更に、Bob-1特異的及び/又はBob-1交差反応性T細胞を始め、Bob-1特異的及び/又はBob-1交差反応性T細胞を誘発するためのペプチド及び/又は核酸配列を、Bob-1発現腫瘍、リンパ腫、及び自己免疫疾患治療用医薬品又はワクチンとして提供する。
【背景技術】
【0002】
OBF-1又はOCA-Bとも呼ばれるBob-1タンパク質は、最初、オクタマーの結合転写因子Oct1及びOct2と相互作用を持ち、オクタマーモチーフ含有プロモーターにおける転写活性を上昇させる、B細胞限定コアクチベーター(Swissprot, アクセス番号Q16633)と特定された。このオクタマーモチーフ含有プロモーターは、主に、B細胞特異的免疫グロブリン(Ig)遺伝子プロモーターの中に認められる。
【0003】
Bob-1そのものは直接DNAには結合せず、オクタマーモチーフ含有プロモーターにおける転写活性は、少なくとも1個の特異的コアクチベーター、例えば、Bob-1と、Oct1又はOct2転写因子との機能的相互作用を必要とすることが記載された。オクタマーモチーフは、ほとんど全ての免疫グロブリン(Ig)遺伝子プロモーターに保存されるので、Bob-1は免疫グロブリン(Ig)遺伝子発現にとって必須であると考えられている。
【0004】
更に、最近の研究によって、Bob-1はまた、B細胞発達の全ての段階、特に胚中心の形成に関与することが明らかにされた。
【0005】
Bob-1欠乏マウスから得られたB前駆細胞系統におけるオクタマー依存性転写は、Bob-1は、オクタマーモチーフ含有プロモーターにおける転写にとって必須の、非冗長成分であることを証明することが示された(非特許文献1)。
【0006】
Bob-1欠乏マウスが、抗原依存性B細胞分化において重篤な欠損症を呈すること、早期のB細胞集団及び胚中心においてBob-1が正規に発現すること、遺伝子プロモーターにおけるオクタマーモチーフの優勢を始めとして、オクタマー依存性転写におけるBob-1の必須の役割という事実がある以上、Bob-1は、抗原によって駆動される、B細胞成熟及び活性化の全ての段階において必須の役割を果たしていることが予想される。
【0007】
Bob-1タンパク質、そのコード配列、コード配列を含むベクター、及び該タンパク質を含む組成物は、特許文献1を参照して知ることができる。従来から、Bob-1については、特異的抗Bob-1抗体生産のための使用が示唆されている。なぜなら、そのような抗体は、組織におけるBob-1の局在を特定するのに有用と考えられるからである。特許文献1は更に、概略的な表現で、単離されたBob-1タンパク質を、Bob-1発現が不足する障害又は疾患に対する交換療法としての使用を述べている。
【0008】
Bob-1発現の不足は、正常なB細胞の発達及び活性に対する重大な作用、例えば、免疫不全及び関連疾患を含む作用を招く可能性がある。Bob-1発現の上方調整も何らかの疾患又は障害を招く可能性があるのかどうかに関しては長い間不明であった。
【0009】
ほんの最近、非特許文献2において、バーキットリンパ腫、濾胞性リンパ腫、又はきわめて悪性度の高いリンパ腫の90%以上、及び調べたB細胞リンパ腫の50%を超えるものがBob-1タンパク質を過剰に発現することが示された。
【0010】
更に、Bob-1タンパク質は、T細胞由来腫瘍、例えば、T細胞白血病由来のJurkat T細胞系統において発現されることが明らかにされている(非特許文献3)。
【0011】
本発明の意図内容において使用される「リンパ腫」という用語は、B細胞又はT細胞由来の、造血系の、全ての良性又は悪性のガンを含む。特に、リンパ腫という用語は、ホジキンリンパ腫(HL)及び非ホジキンリンパ腫(NHL)、例えば、バーキット、濾胞性、又は瀰漫性リンパ腫をまとめたものである。本発明の意図内容において、リンパ腫という用語は更に、特に、リンパ腫の変異種であって、例えば、Bob-1タンパク質を発現する、又は過剰発現する変異種を指す。
【0012】
本明細書で用いる「過剰発現」という用語は、Bob-1タンパク質の発現量、又はBob-1タンパク質発現の時間プロフィールのいずれかにおける、任意の非生理的数値を記述する。
【0013】
これまで、非ホジキンリンパ腫(NHL)の大部分に対し十分な治療が与えられていない。NHLは、年間人口10万人当たり8−18人の発生率で起こり、その率は増加しつつあるが、ホジキンリンパ腫の下位分類、ホジキン及び非ホジキンリンパ腫は今でも、化学療法、放射線療法、骨髄移植、及び特異的抗体による治療を含む併用療法によって治療される。
【0014】
思い切った化学療法によっても、局所的ホジキンリンパ腫の患者では最大90%であるが、瀰漫性ホジキンリンパ腫では、下位分類及び危険因子にもよるが、僅かに約50%、高度のリンパ腫では最大で僅かに50%が治癒されるに過ぎない。化学療法は、それと判る確かな副作用をもたらし、更に長期の毒性、例えば、生き延びた患者において不妊をもたらす。特に、老人、及び併発疾患を抱える患者にとって治療選択肢は限定される。一方、稀な下位分類、例えば、ヘアリーセル白血病を除いては、低度の非ホジキン白血病は化学療法では治療することができない。非ホジキンリンパ腫のいくつかの下位分類、例えば、I及びII度の濾胞性リンパ腫は、早期段階(Ann-Arbor分類の段階I又はII)では放射線療法によって治療することが可能であるが、進んだ段階の病気に対しては治療法は無い。残念ながら、低度のリンパ腫の大部分は、治療法がもはや無くなった段階で診断される。従って、現在の治療選択肢、例えば、化学療法又は免疫療法は、ほんの一過性の寛解又は緩和を達成することができるにすぎない。これが、低度の非ホジキンリンパ腫の多くの下位分類、例えば、I及びII度の濾胞性リンパ腫、又は慢性リンパ球白血病において、臨床症状が現れるまで化学療法が延期される理由である。
【0015】
最近、HL及びNHLリンパ腫処置のための治療戦略が、Genentech社から販売されるリツキサン(Rituxan、登録商標)及びIDEC社から販売されるゼバリン(Zevalin、登録商標)の服用によって与えられた。前者は、B細胞を特異的に破壊する抗体であり、後者は、放射標識されたモノクロナール抗体であり、これもB細胞を欠乏させる。これら抗体療法の主要な欠点は、抗体は、患者の中の全てのB細胞を悉く、胚中心にあるものを始め、抹消にあるものまでも破壊することである。従って、この治療法は、免疫グロブリンの低下を招き、これは次に、免疫不全を避けるために免疫グロブリンの輸液によって処置しなければならない。
【特許文献1】国際公開第95/32284号
【非特許文献1】Laumen, H., P.J. Nielsen, and T. Wirth, 2000. Eur. J. Immunol. 30:458−469
【非特許文献2】American Journal of Pathology 2000,156:501−507
【非特許文献3】Zwilling S. Dieckmann A, Pfisterer P, Angel P, Wirth T, Inducible expression and phosphorylation of coactivator BOB.1/OBF.1 in T-cells. Science1997,277:221−225
【発明の開示】
【0016】
以上から、リンパ腫、例えば、HL及びNHL、更に、Bob-1タンパク質の発現、又は過剰発現によって特徴づけられる腫瘍又はリンパ腫を治療することが本発明の目的である。
【0017】
特に、悪性リンパ腫の治療効果を改善すること、同時に、従来の治療法の一つの大きな重荷である副作用を低減することが、本発明の目的である。
【0018】
更に、Bob-1タンパク質の発現又は過剰発現と相関する自己抗体の生産によって特徴づけられる、自己免疫疾患及び障害を治療する手段及び方法を提供することが本発明の目的である。
【0019】
更に、Bob-1タンパク質発現の生理的又は非生理的レベルの認識に依存する、又は該認識によって影響される、障害又は疾患を診断する、又は新たに特定する手段及び方法を提供することが本発明の目的である。
【0020】
更に、細胞傷害性T細胞による、Bob-1タンパク質発現細胞の認識及び破壊によって特徴づけられる障害又は疾患の治療手段及び方法を提供することが本発明の目的である。このような疾患としては、ヒト免疫不全ウィルス1及び2による感染、及びその関連疾患を始めとして、CTLによるB細胞の破壊によって特徴づけられる、他の免疫不全疾患、例えば、分類不能型免疫不全(CVID)が挙げられる。
【発明を実施するための最良の形態】
【0021】
上記背景において、本発明者達が、Bob-1発現細胞の細胞表面においてHLA分子によって提示されるBob由来ペプチドに対し、きわめて特異的な指向性を持つ、或いは、きわめて特異的な交差反応性を持つ、T細胞(TC)、特に細胞傷害性Tリンパ球(CTL)及びCD4+ Tヘルパー細胞を特定することができたのは彼等の目覚しい成功と見なすことができる。
【0022】
しかしながら、本発明者達は、T細胞(TC)、特に細胞傷害性Tリンパ球(CTL)及びCD4+ Tヘルパー細胞は、いずれもT細胞全体集団の下位分画ではあるが、本発明によれば、Bob由来ペプチドに対して特異的な指向性を持つ、又はきわめて特異的な交差性反応を持つ細胞であり、それらの細胞を単に特定したばかりでなく、本発明者は更に、そのようなBob-1特異的、及びBob-1交差反応的T細胞の誘発、発生、及び単離を可能としたのである。
【0023】
「T細胞」又は「Tリンパ球」という用語は、本明細書では、造血系由来の細胞、正常では、白血球細胞数の4分の1を占める:多くは小型の、顆粒非含有の白血球で、胸腺で発達し、感染又は悪性腫瘍の存在下に増加することのある細胞を記述するものと理解される。T細胞の主要機能は、タンパク質抗原に対する全ての免疫反応を調整すること、及び、細胞内微生物を除去するためのエフェクター細胞として働くことである。T細胞には様々な亜種がある。例えば、CD4+ Tヘルパー細胞(CD4+ 細胞)、細胞傷害性T細胞(CTL)、又は、ガンマ−デルタT細胞である。これらは、正常時には、定められた表面構造によって特徴づけられる。例えば、ヘルパーT細胞ではCD4抗原、或いは、細胞傷害性T細胞ではCD8抗原である。
【0024】
「細胞傷害性」及び、別名「細胞分解性」という用語は、本出願の意図内容では、細胞表面のHLAクラスI分子に結合するペプチド抗原を認識する、CD8陽性T細胞と理解される。細胞表面のHLAクラスI分子によって提示されるこのペプチド抗原は、その細胞の細胞質内部で合成される処理タンパク質に由来する。そのT細胞受容体が、HLAクラスI分子に結合するペプチド抗原と特異的相互作用を持った後、細胞傷害性T細胞は、そのペプチド抗原提示細胞を殺すことが可能になる。
【0025】
CD4+ Tヘルパー細胞は、抗原提示細胞表面のHLAクラスII分子に結合するペプチド抗原を特異的に認識する。これらのペプチドは、通常、専門的抗原提示細胞、例えば、樹状細胞(DC)、マクロファージ、及びB細胞によって摂取され、処理された外来抗原から得られる。この抗原を認識した後、CD4+ Tヘルパー細胞は活性化され、様々のサイトカイン及びケモカインを分泌することによって、CTL及び他の免疫エフェクター細胞、例えば、B細胞、マクロファージ、及びNK細胞に対して重要な支援を提供する。動物モデルにおいて、悪性腫瘍及び感染症のいずれの場合でも、最適免疫反応は、抗原特異的CD8+ CTL及びCD4+ T細胞の両方を刺激することによって誘発されることが明らかにされている。
【0026】
この高度に特異的なTC、すなわちCTL及びCD4+ Tヘルパー細胞によって、本発明者等は始めて、Bob-1発現細胞に対する免疫反応によって特徴づけられる、病気診断のためのツールを手に入れた。
【0027】
更に、本発明者等の知識によって、Bob-1タンパク質に対して特異的なTC、すなわちCTL及びCD4+ Tヘルパー細胞の両方を、インビトロ発生させるのみならず、インビボ誘発することが始めて可能となった。
【0028】
本発明に従って人工的に生産される、又は誘発されるT細胞は、Bob-1タンパク質の発現又は過剰発現と相関する障害又は疾患を治療するための、きわめて特異的な手段を提供する。
【0029】
例えば、このようなBob-1特異的CTLは、表面の受容体に結合したBob-1断片すなわちエピトープを提示する細胞を特異的に認識する。このBob-1特異的CTLは更に、そのようなBob-1発現細胞に特異的に結合し、更にそのようなBob-1発現細胞を破壊又は殺戮する能力を持つ。このようなBob-1発現細胞の典型例としては、悪性リンパ腫由来のB細胞及びT細胞、又は抗体を生産するB細胞が挙げられるが、ただしこれらに限定されない。
【0030】
更に別の例として、Bob-1特異的CD4+ Tヘルパー細胞(別名CD4+-細胞、又はCD4+)も、抗原提示細胞によって提示されるBob-1由来ペプチドの認識後活性化される。活性化されたBob-1特異的CD4+細胞は、CTL及び、他の免疫エフェクター細胞、例えば、NK細胞又はマクロファージの、Bob-1発現細胞に対する殺活性に対して重要な支援を提供する。
【0031】
従って、Bob-1タンパク質に対して高い特異性、又は交差反応性を持つT細胞を活性化又は誘発することが可能な手段及び方法を実現したことは、本発明者等の並外れた達成であった。
【0032】
このために、本発明は、Bob-1タンパク質、又はBob-1修飾タンパク質のエピトープから得られた、又は該エピトープに関連するペプチドを提供する。
【0033】
好ましくはBob-1特異的T細胞、主にCTL及び/又はCD4+ Tヘルパー細胞を刺激するいくつかのペプチドが提供される。
【0034】
一の実施例によれば、Bob-1特異的CTLを誘発することが可能な群のペプチドは、一般的な配列
X1X2KX3PX4X5X6X7、
式中、
X1は、任意の天然アミノ酸、特に、アルギニン(R)、イソロイシン(I)、フェニルアラニン(F)、チロシン(T)、又はセリン(S)を含む群から選択され、
X2は、メチオニン(M)、バリン(V)、ロイシン(L)、又はイソロイシン(I)であり、
X3は、グルタミン酸(E)、又はアスパラギン酸(D)であり、
X4は、任意の天然アミノ酸、特に、バリン(V)、ロイシン(L)、イソロイシン(I)、又はアラニン(A)を含む群から選択され、
X5は、任意の天然アミノ酸、特に、ヒスチジン(H)又はロイシン(L)を含む群から選択され、
X6は、任意の天然アミノ酸、特に、グルタミン酸(E)又はグリシン(G)を含む群から選択され、且つ、
X7は、メチオニン(M)、バリン(V)、ロイシン(L)、イソロイシン(I)、又はアラニン(A)である、によって要約することが可能である。
【0035】
更に別の実施例によれば、この群のペプチドは、HLA A2の結合因子であり、従って、X2の位置にアミノ酸M、L、V、又はI、及びX7の位置にアミノ酸V、L、又はMを持つのが好ましい。
【0036】
本発明の更に別の実施例によれば、Bob-1特異的、Bob-1交差反応性TC、CTL、又はCD4+を誘発するためのペプチドは、ペプチド類FLKEPVKEV, SLKEPVKEL, YLKEPVKEL, FLKEPVKEL, ILKEPVHEV, ILKEPVHGV, RVKEPVKEL, DSDAYALNHTLSVEGF, AYALNHTLSVEGF, YALNHTLSVEGF, YALNHTLSVEG, ALNHTLSVEGF, TYASPPLITNVTTRSSATPA, AALCAGWLSQPTPATLQPLA, MLWQKPTAPEQAPAPARPYQ, QAPAPARPYQGVRVKEPVKE, GVRVKEPVKELLRRKRGHAS, LLRRKRGHASSGAAPAPTAV, SGAAPAPTAVVLPHQPLATY, VLPHQPLATYTTVGPSCLDM, TTVGPSCLDMEGSVSAVTEE, EGSVSAVTEEAALCAGWLSQ, AALCAGWLSQPTPATLQPLA, PTPATLQPLAPWTPYTEYVP, PWTPYTEYVPHEAVSCPYSA, HEAVSCPYSADMYVQPVCPS, DMYVQPVCPSYTVVGPSSVL, YTVVGPSSVLTYASPPLITN, TYASPPLITNVTTRSSATPA, VTTRSSATPAVGPPLEGPEH, VGPPLEGPEHQAPLTYFPWP, QAPLTYFPWPQPLSTLPTST, QPLSTLPTSTLQYQPPAPAL, LQYQPPAPALPGPQFVQLPI, PGPQFVQLPISIPEPVLQDM, SIPEPVLQDMEDPRRAASSL, EDPRRAASSLTIDKLLLEEE, TIDKLLLEEEDSDAYALNHT、又はDSDAYALNHTLSVEGF
を含む群から選択される。
【0037】
これらの配列全てが、Bob-1タンパク質に対して特異的であるか、又は、Bob-1タンパク質に対して高度の交差反応性を持つT細胞を誘発するという共通の特徴を持つということは特に興味深い。
【0038】
本発明の意図内容では、Bob-1発現細胞のHLAクラスI又はHLAクラスII分子に結合する特定のペプチドに対して特異的なT細胞、そのようなペプチドをT細胞受容体を通じて認識するT細胞が提供される。T細胞受容体の結合部位は、その特異的T細胞によって特異的に認識される、アミノ酸配列を持つ特定のペプチドのみに結合するやり方で形成される。その結合は、その結合によってそのT細胞が活性化される場合、特異的と判断される。活性化は通常、その特異的結合T細胞の増幅をもたらす。
【0039】
驚くべきことに、Bob-1タンパク質由来のペプチドだけが、Bob-1特異的T細胞を誘発することができるのではない。興味あることに、本発明者等は、無関係のタンパク質から得られたペプチドではあるが、Bob-1タンパク質と特異的相互作用を持つT細胞を誘発することができるペプチドを特定することができた。Bob-1タンパク質由来ではないペプチドで、修飾Bob-1タンパク質又は任意の無関係なタンパク質由来であるペプチドによって誘発されるT細胞については、本明細書の意図内容では、Bob-1タンパク質に対して「交差反応的である」という用語が用いられる。
【0040】
特に有用なのは、修飾Bob-1タンパク質から得られたもので、驚くべきことに、Bob-1由来ペプチド、例えば、RVKEPVKELよりも優るT細胞誘発能力を示すペプチドFLKEPVKEVである。
【0041】
これらのペプチドに関しては更に驚くべきことであるが、完全に無関係な供給源、例えば、HIVから得られたペプチド、すなわち、ILKEPVHEV, ILKEPVHGV、又はILKDPVHGVでも、Bob-1特異的T細胞、又は交差反応性T細胞、好ましくはCTLを誘発するのに使用が可能である。
【0042】
Bob由来T細胞誘発性ペプチドのもう一つの例は、ペプチドALNHTLSVEGFである。このペプチドは、Bob-1特異的及び/又は交差反応性T細胞、好ましくはCD4+ 細胞を刺激することが可能である。更に別の例として、ALNHTLSVEGFペプチドの若干の修飾版、すなわち、ペプチドDSDAYALNHTLSVEGF, AYALNHTLSVEGF, YALNHTLSVEGF, YALNHTLSVEGもBob-1特異的及び/又は交差反応性T細胞、好ましくはCD4+ 細胞を刺激し、発生させるのにきわめて有用である。これらのペプチドは、HLAクラスII限定的であって、好ましくは、HLA DQ分子、より好ましくはHLA DQ0604分子の上に提示される。更に、これらのペプチドはまた、HLA DP、好ましくはHLA DP04分子の上にも提示される。
【0043】
ペプチドDSDAYALNHTLSVEGFから得られたペプチドの内、ペプチドALNHTLSVEGFは、Bob-1特異的、又は交差反応性T細胞を誘発する点で最高能力を持つことが示された。ペプチドYALNHTLSVEGF及びYALNHTLSVEGは依然として認識されるが、T細胞の誘発は、ALNHTLSVEGFによる誘発よりも有効ではない。
【0044】
更に別の実施態様によれば、ペプチドTYASPPLITNVTTRSSATPA, AALCAGWLSQPTPATLQPLA、及び、これらのペプチドの9個以上のアミノ酸を有するペプチドも、Bob-1特異的及び/又は交差反応性T細胞を刺激及び発生にきわめて有用である。これらのペプチドは、患者においてCD4+ を誘発するのに特に有用であるばかりでなく、CD8+ 細胞を誘発するのにも有効である。
【0045】
更に別の例では、きわめて免疫原性の高いBob-1タンパク質から得られる、下記に列挙されるペプチド:
MLWQKPTAPEQAPAPARPYQ (1-20), QAPAPARPYQGVRVKEPVKE (11-30), GVRVKEPVKELLRRKRGHAS (21-40), LLRRKRGHASSGAAPAPTAV (31-50), SGAAPAPTAVVLPHQPLATY (41-60), VLPHQPLATYTTVGPSCLDM (51-70), TTVGPSCLDMEGSVSAVTEE (61-80), EGSVSAVTEEAALCAGWLSQ (71-90), AALCAGWLSQPTPATLQPLA (81-100), PTPATLQPLAPWTPYTEYVP (91-110), PWTPYTEYVPHEAVSCPYSA (101-120), HEAVSCPYSADMYVQPVCPS (111-130), DMYVQPVCPSYTVVGPSSVL (121-140), YTVVGPSSVLTYASPPLITN (131-150), TYASPPLITNVTTRSSATPA (141-160), VTTRSSATPAVGPPLEGPEH (151-170), VGPPLEGPEHQAPLTYFPWP (161-180), QAPLTYFPWPQPLSTLPTST (171-190), QPLSTLPTSTLQYQPPAPAL (181-200), LQYQPPAPALPGPQFVQLPI (191-210), PGPQFVQLPISIPEPVLQDM (201-220), SIPEPVLQDMEDPRRAASSL (211-231), EDPRRAASSLTIDKLLLEEE (221-241), TIDKLLLEEEDSDA YALNHT (231-251)及び、DSDAYALNHTLSVEGF (241-256)
も、本発明に従ってBob-1特異的T細胞を効率的に誘発するのに使用することが可能である。
【0046】
前述のペプチドは全て、Bob-1タンパク質のエピトープ又は断片に対して特異的であるか、又は交差反応性であるT細胞の特定のために有用である。更に、これらのペプチドはまた、Bob-1タンパク質のエピトープ又は断片に対して特異的であるか、又は交差反応性であるT細胞の誘発及び単離のためには特に有用である。
【0047】
このため、Bob-1タンパク質のエピトープ又は断片に対して特異的であるか、又は交差反応性であるT細胞の誘発のために、本発明によるペプチドは、混合リンパ球集団、好ましくは末梢血単核球(PBMC)を刺激するために使用される。この混合リンパ球又はPBMCは、既知の標準技術、例えば、Ficoll-Hypaque密度勾配遠心法(Pharmacia、ウプサラ、スウェーデン)によって患者の血液から単離することが可能である。次に、この単離された混合リンパ球又はPBMCを、刺激のために、本発明によるペプチドとインキュベートし、更に選択的に、免疫ホルモン、例えば、インターロイキン−2ともインキュベートする。2週間後、刺激されたT細胞は、混合リンパ球の培養体を上回って増殖する。過剰増殖される抗原特異的細胞は、標準的ELISPOTアッセイを用い、単一細胞レベルで抗原誘発性サイトカイン分泌を分析することによって特定することが可能である。このELISPOTアッセイを用い、抗原特異的T細胞の数を、細胞培養体におけるスポット形成単位をビデオ画像分析することによって定量することが可能である。
【0048】
本発明の意図内容における「スポット」又は「スポット形成単位」という用語は、抗原、例えば、合成ペプチド、タンパク質、又は細胞のような抗原による刺激後、ガンマIFNを分泌するT細胞を指す。T細胞誘発条件下における細胞の集積は、抗原刺激細胞の特異的過剰増殖によるものであり、従って増加した細胞数である。このような集積は、顕微鏡下に特定することが可能であり、既知の技術によって染色することが可能である。各スポットは、本発明に従って刺激され、誘発された個々のT細胞クローンであり、従って、Bob-1特異的又は交差反応性T細胞クローンである。
【0049】
この過剰増殖細胞を、Bob-1エピトープの特異的認識について、又は該エピトープに対する交差反応性について、標準アッセイ、例えば、クロム放出アッセイ又はELISPOTを用いて試験した。例えば、ELISPOTアッセイでは、Bob-1の特異的認識、又はBob-1に対する交差反応性に関する読み取り値を、インターフェロン・ガンマ特異的抗体(例えば、1-D1K:Mabtech、ストックホルム、スウェーデン)によって検出されるインターフェロン・ガンマの放出量と相関させる。この方法は、単一細胞レベルで抗原特異的T細胞の高感度検出を可能とする。
【0050】
本発明者等は、本発明による刺激によって、Bob-1タンパク質のエピトープ又は断片に対して特異的な、又は交差反応性を示すT細胞を、驚くほど効率的に過剰増殖させることが可能であることを示すことができた。
【0051】
Bob-1タンパク質のエピトープ又は断片に対して特異的な、又は交差反応性のT細胞を、更に実験するために、又は何かの治療方策のために必要とする場合、そうしたT細胞は、可溶性HLA・ペプチド複合体、例えば、特異的ペプチドを抱えるHLA・テトラマー(Proimmune、オックスフォード、英国)又はHLA・ストレプタマー(IBA GmbH、ゲッチンゲン、ドイツ)を用いるFACSソーティング、或いは、ガンマIFN分泌アッセイ(Miltenyi, Bergisch-Gladbach、ドイツ)によって単離することが可能である。従って、本発明はまた、Bob-1タンパク質、その断片又はエピトープ、或いは、本発明によるペプチドの内の少なくとも一つに対して特異的又は交差反応性を持つ、TC、CTLとCD4+ Tヘルパー細胞の両方等の単離細胞も提供する。
【0052】
本発明による、Bob-1特異的又は交差反応性TCは、Bob-1発現、又はBob-1過剰発現によって特徴づけられる腫瘍又はリンパ腫を抱える患者を治療するには特に有用である。
【0053】
このような治療の背景となる一般的原理は、TC、CD4+、又はCTLの、Bob-1エピトープ又は断片に対する特異性又は交差反応性であって、該エピトープ又は断片は、細胞表面に提示され、本発明のTCによって発見され、最終的には除去されることを可能とする特異性又は交差反応性に帰着する。特に、腫瘍細胞又はリンパ球の調節不能増殖に悩まされる患者、従って、リンパ腫患者の場合、このような調節不能な増殖を行う細胞又はリンパ球を破壊し、除去することはきわめて望ましい。
【0054】
多くの腫瘍、及び大抵のリンパ腫では、Bob-1発現の増加が認められることが明らかにされているので、本発明によるTCは、そのようなBob-1発現細胞を除去するにはきわめて有用である。
【0055】
本発明によるTCは、リンパ腫細胞を破壊する他の治療方策と比べてもう一つの利点を有する。Genentech (Rituxan)又はIDEC (Zevalin)から市販される既知の抗体も、B細胞に対する一般的特異性に基づいて、リンパ節の末梢部のみならず胚中心を含め、患者の全てのB細胞を確かに除去する。これとは対照的に、本発明によるTC、CD4+、又はCTLは、Bob-1発現の増加を示す細胞のみを除去する。主に、胚中心のB細胞はBob-1を発現するが、末梢部のB細胞は発現しないことが知られており、更に、多くの悪性リンパ腫はBob-1を過剰発現することが知られるので、本発明のTCは、患者の全てのB細胞をことごとく奪うことはせず、Bob-1タンパク質を発現、又は過剰発現する細胞を好んで除去する。
【0056】
従って、本発明による治療法の副作用は、これまでに知られるいずれの治療方策と比べても明らかに低減される。
【0057】
リンパ腫細胞以外にも、若干の正常B細胞がBob-1を発現することがあるが、そのような場合でも、本発明のTCによる治療はきわめて有利である。なぜならば、正常B細胞に比べて、悪性腫瘍又はリンパ腫細胞の除去の割合が患者にとってきわめて好ましいからである。更に、B細胞の除去は、血清における抗体レベルの著明な低下をもたらす可能性があるが、そのような場合でも、その体液性免疫欠陥を補正するために、市販の免疫グロブリン調剤によってその患者を追加治療することは容易であり、一般にも容認されている。
【0058】
本発明は更に、Bob-1タンパク質の発現増加によって特徴づけられる腫瘍又はリンパ腫、特にリンパ腫を治療する療法に有用な、TC、CTLとCD4+ Tヘルパー細胞の両方の単離細胞も提供する。
【0059】
このために先ず、PBMCを患者から単離し、これらのPBMCを、本発明のペプチドの内の少なくとも一つによって、すなわち、Bob-1タンパク質、その断片又はエピトープ、或いは、修飾Bob-1タンパク質断片、又はそのエピトープによって誘発し、Bob-1特異的又はBob-1交差反応性TC、CTLとCD4+ Tヘルパー細胞の両方を過剰増殖させる。
【0060】
選択的に、誘発反応に免疫ホルモンを加える。典型的には、免疫ホルモンとして、インターロイキン2、IL−7、gm-CSF、IL−12、IL−18、及びアルファIFNが用いられる。
【0061】
次に、この過剰増殖T細胞を単離するか、或いは、既知の標準技法を用いて少なくとも濃縮する。次に、治療法のために、この単離細胞又は濃縮細胞を患者に再度投与する。典型的投与法は、皮内、皮下、筋肉内、静脈内、又はリンパ系内注入である。
【0062】
Bob-1特異的Tヘルパー細胞の活性によって支持される再投与濃縮TCは、Bob-1発現腫瘍及び/又はリンパ腫細胞を効率的に除去する。
【0063】
更に追加の免疫療法、又は免疫交換療法を、前記治療法と組み合わせてもよい。
【0064】
前述の治療のためには、個別の患者のPBMCを用いることが好ましいが、異種PBMC、すなわち異なる患者のPBMCを用いて、Bob-1特異的TC、CD4+細胞又はCTLを過剰増殖し、任意の患者に再投与することが可能な細胞を調製することも可能である。この場合、再投与されたTCについて現れると予想される免疫拒絶反応は、移植医学において標準的な慣行に従って調節することが望ましい。
【0065】
それとは別に、本発明の別態様では、Bob-1発現増加で特徴づけられる、腫瘍又はリンパ腫患者は、Bob-1特異的又は交差反応性TC、CTL、又はCD4+細胞の、インビボ誘発方法によって治療される。
【0066】
このために、患者には、本発明のペプチドの内の少なくとも一つ、Bob-1タンパク質、その断片又はエピトープ、或いは、修飾Bob-1タンパク質、その断片又はエピトープを接種し、Bob-1タンパク質又は修飾Bob-1タンパク質のエピトープ又は断片に対して特異的又は交差反応性を持つT細胞をインビボで誘発する。
【0067】
この治療法では、本発明によるペプチドは、生きている動物又はヒトに直接投与される。ペプチドは、皮内、皮下、筋肉内、又は静脈内に投与されることが好ましいが、ただしこれらに限定されない。
【0068】
免疫化のための典型的用量は、体重kg当たり約0.001から約1mg (mg/kg)のタンパク質又はペプチド、更に詳細には約0.01から約0.1mg/kgの範囲を持ってもよい。用量は、1回投与当たり50μgから1mgの範囲のタンパク質又はペプチドであることが好ましい。
【0069】
選択的に、ペプチド、又はタンパク質断片に対する反応を増すために、免疫ホルモン、アジュバント、又は免疫抑制を阻止する因子が更に投与される。免疫化の効率を向上させるために、ペプチドの投与を、2から3回、2から8週の時間間隔で繰り返すのが有用である。
【0070】
更に、ワクチン開発におけるよく知られる経験に基づいて、Bob-1特異的CTLの誘発は、Bob-1特異的CD4+細胞の平行的誘発によって強化される。従って、それに加えて、或いはそれとは別に、Bob-1特異的CD4+細胞を誘発するのはこの治療法にとって、きわめて興味あることである。このことは、全Bob-1タンパク質、又は、長さが少なくとも10アミノ酸長を持つ、それより短いアミノ酸及びペプチドを患者に投与することによって実現することが可能である。このタンパク質又はペプチドは、皮内、皮下、筋肉内、又は静脈内に投与することが可能である。このタンパク質又はペプチドは、抗原提示細胞によって摂取される。これらの細胞は、その受容体の上に該タンパク質又はペプチドを発現し、免疫細胞、特にCD4+細胞を刺激する。免疫細胞の刺激は、特に刺激された細胞タイプの過剰増殖をもたらす。
【0071】
免疫化のための典型的用量は、体重kg当たり約0.001から約1mg (mg/kg)のタンパク質又はペプチド、更に詳細には約0.01から約0.1mg/kgの範囲を持ってもよい。用量は、1回投与当たり50μgから1mgの範囲のタンパク質又はペプチドであることが好ましい。
【0072】
選択的に、ペプチド、又はタンパク質断片に対する反応を増すために、免疫ホルモン、アジュバント、又は免疫抑制を阻止する因子が更に投与される。免疫化の効率を向上させるために、ペプチドの投与を、2から3回、2から8週の時間間隔で繰り返すのが有用である。
【0073】
Bob-1特異的CD4+ Tヘルパー細胞は、Bob-1特異的CTLばかりでなく、同じ腫瘍細胞由来の他の腫瘍抗原に対して特異性を持つ他のCTLにも支援を与えることが可能である。
【0074】
前述の方法によれば、本発明は更に、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープ、及び、選択的に製薬学的に受容可能な担体又は希釈剤を含む組成物、或いは製薬組成物を提供する。
【0075】
典型的には、この「製薬学的に受容可能な担体」とは、薬剤の生物学的活性(例えば、結合特異性、親和性、又は安定性)を大きく損なうことのないように選択される担体及び希釈剤であって、例えば、水、生食液、リンゲル液、デキストロース液、5%ヒト血清アルブミン、不揮発性油、オレイン酸エチル、又はリポソームである。受容可能な担体としては、生体適合性、不活性、又は生体吸収性塩、バッファー剤、オリゴ又はポリサッカリド、ポリマー、ヒアルロン酸のような粘弾性化合物、粘度改善剤、防腐剤等が挙げられる。更に、この製薬組成物又は処方はまた、他の担体、アジュバント、又は、非毒性、非治療的、非免疫原性安定剤等を含んでもよい。
【0076】
更に、本発明は、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープ、及び、選択的に、1種以上の免疫ホルモン、アジュバント、又は免疫抑制を阻止する因子を含むアジュバントを提供する。
【0077】
このワクチンは、皮内、皮下、筋肉内、静脈内、鼻腔内、又はリンパ系内注入として投与することが可能である。
【0078】
ワクチン接種のための典型的用量は、体重kg当たり約0.001から約1mg (mg/kg)のタンパク質又はペプチド、更に詳細には約0.01から約0.1mg/kgの範囲を持つ。
【0079】
典型的には、選択的に投与される免疫ホルモン、アジュバント、又は免疫抑制を阻止する因子は、サイトカイン類、例えば、インターロイキン2、インターロイキン18、インターフェロン・ガンマ、インターフェロン・アルファ、又はgm-CSF、或いは、免疫刺激性分子、例えば、RNA分子(例えば、ポリ-I-ポリ-C(Ampligen)、又はキャップ付着及びポリアデニル化メッセンジャーRNA、例えば、CureVac GmbH、チュービンゲン、ドイツから市販されるRNActive(登録商標))、又は短いDNA分子、例えば。CPGオリゴヌクレオチド(例えば、Coley Pharmaceutical Group, Wellesley、マサチューセッツ州、米国によって現在ワクチンの臨床治験に使用されているCPG7909)である。
【0080】
本発明の更に別の実施例によれば、Bob-1タンパク質の発現増加を示す腫瘍又はリンパ腫を抱える患者は、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープを、単独で又は組み合わせてコードする核酸配列を該患者に直接投与することによって治療することが可能である。この方法によれば、その配列は、樹状細胞及び単球によって摂取される。次いで、配列は、ペプチド又はタンパク質に翻訳され、次に、MHC I及びMHC II複合体を介して免疫系、特にTCに提示される。これらの特異的ペプチド又はタンパク質断片の提示は、TC刺激を誘発し、従って、Bob-1タンパク質に対して特異的、又は交差反応性を示すTC、すなわちCD4+又はCTLの過剰増殖を招く。次いで、これらの特異的TCは、Bob-1タンパク質を発現する腫瘍又はリンパ腫細胞を破壊する。
【0081】
また、前述したように、重篤な免疫欠陥を補うための、追加の免疫グロブリン交換療法を、選択的に、運用することが可能である。
【0082】
本発明による核酸配列は、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープを、単独で又は組み合わせてコードするDNA又はRNA分子である。
【0083】
別の例では、上記DNA又はRNA分子は、単一核酸分子の間にリンカーを入れて、及び/又は、入れずに接続されて、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープをコードする。
【0084】
上記核酸配列は、裸のDNAとして、リポソームのような粒子に含まれるDNAとして、プラスミドに含まれるDNAとして、ベクター、例えば、組み換えワクシニアウィルス、又は組み換えMVAベクター(修飾ワクシニアウィルスアンカラ)のようなベクターに含まれるDNAとして、皮内、皮下、筋肉内、又は鼻腔内に投与することが可能である。更に、適当な担体に溶解したDNAを直接皮膚に塗布することも可能である。核酸配列はまた、RNアーゼによる変性を避けるように化学的に修飾されたRNA分子(例えば、キャップされ、ポリアデニル化されたメッセンジャーRNA、例えば、CureVac GmbH、チュービンゲン、ドイツから市販されるRNActive(登録商標))の形で運用することも可能である。
【0085】
更に別の実施例によれば、治療の必要な患者は、体外で発生させた樹状細胞によってワクチン接種することも可能である。樹状細胞は、gm-CSF、IL4、TNF-アルファ、プロスタグランジンE2、及びIL-6を含むサイトカイン混合液によって単球又は造血幹細胞をインキュベートすることによって発生させることが可能である。成熟樹状細胞には、本発明に従って、ペプチド、タンパク質、DNA又はRNA分子のような核酸を付加させ、成熟後、それらの細胞を患者に投与することが可能である。自己起源及び異系起源両方のHLA適合樹状細胞を用いることが可能である。
【0086】
前述に従って、本発明は、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープ、本発明の1種以上の核酸配列、及び、選択的に、担体、希釈剤、1種以上の免疫ホルモン、1種以上のアジュバント、又は、免疫抑制を阻止する1種以上の因子を含むワクチンを提供する。
【0087】
ワクチンの調製について、本発明によるペプチド、タンパク質又は核酸配列は、生理的に受容可能な形に変換される。従って、典型的には、約1000μgのペプチド、タンパク質、又は核酸配列は、1mlのリン酸バッファー生食液(PBS)において、選択的に2%ペプトン及び1%ヒトアルブミンの存在下に、アンプル、好ましくはガラスアンプル中で凍結乾燥される。この凍結乾燥物は、増量剤(例えば、マンニトール、デキストラン、糖、グリシン、ラクトース、又はポリビニールピロリドン)、又は、非経口投与のための適当な他の支援剤(例えば、抗酸化剤、安定剤等)を含んでもよい。次に、ガラスアンプルを封印すると、これは、好ましくは−20oC未満に保つと、数ヶ月保存することが可能である。ワクチン接種又は治療のためには、凍結乾燥物を、0.1から1mlの水溶液、好ましくは生理的食塩水に溶解し、非経口的に、例えば、筋肉内接種、又は局所接種によって投与することが可能である。本発明によるワクチン又は治療薬は、筋肉内又は皮下に注射することが好ましいが、担体によっては、ワクチンはまた、他のルートに投与してもよく、例えば、DNA-、又はRNA-ワクチンの場合は表皮、皮内、又は鼻腔内に、樹状突起細胞又はMVAのようなベクターの場合は皮内に、組み換えベクターの場合は経口又は鼻腔ルートに、或いは、樹状細胞の場合は皮下又は静脈内に投与することが可能である。
【0088】
投与方式、及び、投与用量及び数は、当業者には既知のやり方に従って最適化することが可能である。本発明による薬剤に対して適当な免疫反応を獲得するためには、適当であれば、ワクチンを、長期に渡って数回投与することは好都合である。
【0089】
更に別の実施例によれば、本発明は、Bob-1発現及び/又はBob-1特異的T細胞と相関する疾患又は障害を診断する方法を提供する。このために、Bob-1特異的T細胞を、いくつかの方法を用いてPBMCにおいて、又はリンパ節懸濁液において検出する。一つの例示の方法によれば、T細胞の最適エピトープに相当する短いペプチド、例えば、RVKEPVKELを、可溶性HLA複合体を形成するために用いることが可能である。この複合体は、Bob-1特異的TCRに特異的に結合することが可能なので、Bob-1特異的T細胞の直接的、及び特異的染色を可能とする。市販のHLA複合体の例としては、HLAテトラマー及びHLAペンタマー(Proimmune、オックスフォード、英国)、HLAストレプタマー(Iba、GmbH、ゲッチンゲン)、HLAダイマー(Bekton Dickinson、Franklin Lakes、ニュージャージー州、米国)、及び、ペプチドと、フィコエリスリンのような染色分子と結合させたβ-2-マイクログロブリン分子とを組み合わせた可溶性HLA分子がある。
【0090】
もう一つの診断法は、患者から単離したPBMCのようなリンパ球を、本発明によるペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープとインキュベートすることである。特異的T細胞の活性化及び/又は増殖を可能とするインキュベーション時間後、Bob-1特異的T細胞の活性化又は増殖を、適当な定量法、好ましくはELISPOTアッセイによって分析する。或いは、他の定量法、例えば、細胞内サイトカイン染色アッセイ(例えば、Bekton Dickinson, Franklin Lakes、ニュージャージー州、米国によって販売されるアッセイ)、又は、サイトカイン分泌アッセイ(例えば、Miltenyl Biotech GmbH、Bergisch-Gladbach、ドイツ)、クロム放出アッセイ、リンパ球増殖アッセイ、又は、可溶性HLA-ペプチド複合体、例えば、HLAテトラマー、HLAペンタマー、HLAダイマー、又はHLAストレプタマーを用いる直接染色アッセイの使用も可能である。
【0091】
健康人の循環PBMCにおいてBob-1特異的T細胞を検出することが可能である一方で、低頻度でありさえすれば、本発明の方法によって、患者においてもBob-1特異的TCを検出し、特定し、定量し、且つ、記載することはもちろん可能である。これによって、Bob-1依存性障害又は疾患を診断し、記載することが可能である。
【0092】
この診断法は、Bob-1関連性腫瘍、リンパ腫、又は自己免疫疾患の診断に使用が可能であるばかりでなく、Bob-1特異的T細胞を、それを必要とする患者において誘発する目的でワクチン投与した後Bob-1特異的T細胞を監視するためにも使用することが可能である。
【0093】
更に別の実施例では、本発明は、診断用キットを提供する。このキットは、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープ、本発明の1種以上の核酸配列を、患者から単離されるPMBCと接触させるのに好適なやり方で容器に充填させて含む。
【0094】
更に別の実施例では、この診断法及びキットは、Bob-1関連自己免疫障害又は疾患の診断に特に有用である。
【0095】
更に、別の実施例によれば、本発明によるペプチド、タンパク質、タンパク質断片、エピトープ、又は配列も、自己免疫障害又は疾患全般の治療に特に有用である。
【0096】
本出願の意図内容における「自己免疫障害又は疾患」は、自己反応性T細胞及び/又はB細胞であって、それぞれ、生体の自己構造体をそのT細胞受容体(TCR)又はB細胞受容体によって認識するT細胞及び/又はB細胞の生産によって特徴づけられる疾患を含む。自己反応性T細胞又はB細胞によって様々な自己組織又は自己分子が標的とされる。例えば、糖尿病の場合には膵臓、多発性硬化症の場合にはミエリン基礎タンパク質、全身性エリテマトーデスの場合にはDNA、ヴェーゲナー病の場合にはプロテイナーゼ3、バセドー病の場合にはTSH-受容体が標的とされる。T細胞による自己反応性は、標的細胞及び組織の破壊、及び、自己反応性T細胞による各種サイトカイン放出を原因とする炎症をもたらす。B細胞による自己反応性は通常、自己分子に結合する自己抗体の生産と関連し、そのために、傷害が誘発される。例えば、細胞死、炎症の誘発、受容体のブロック、又は、バセドー病のTSH受容体結合抗体の場合のように非生理的受容体起動のような傷害が起こることさえある。
【0097】
自己免疫障害又は疾患の治療のためには、本発明によるペプチド、タンパク質、タンパク質断片、エピトープ、又は配列を用いてBob-1特異的T細胞を誘発すると、これが、自己抗原に向けられた抗体又は免疫グロブリンを生産するB細胞を破壊する。別態様として、自己反応性T細胞を体外で誘発増殖して、次に、それを必要とする患者に投与することも可能である。これによって抗体生産は減衰されるので、自己抗体関連の症状は減退する。この治療の副作用は、追加の、よく知られる免疫グロブリン交換療法によって簡単に補償することが可能である。
【0098】
自己免疫疾患の治療のために体液性免疫不全を誘発するこの対処法が実行可能であることは、肺線維症を含む重篤なMCTD(混合結合組織病)を患う男性患者において本発明者等によって証明された。すなわち、この患者は、血清における免疫グロブリンレベルの低下、及び、同時に起こった、抗核抗体又はn-RNP抗体のような自己抗体の消失を伴う分類不能型免疫不全(CVID)を発症した後、この自己免疫の治癒を見たのである。
【0099】
この患者において、本発明者等は更に、HLAクラスII限定ペプチドDSDAYALNHTLSVEGF及びHLAクラスI限定ペプチドRVKEPVKELの両方を認識するBob-1特異的T細胞の存在を検出することができた。患者のBob-1特異的T細胞による、Bob-1発現性B細胞の破壊による免疫グロブリン生産の抑制は、自己抗体の生産を抑え、患者の危機的なリューマチ疾患の治癒を可能とした。免疫グロブリンの置換以外には、患者は、混合結合組織病に対し他には何も免疫抑制療法を必要としなかった。この患者は、Bob-1特異的T細胞の発達は、自己抗体によって引き起こされる自己免疫疾患を治癒することが可能であることを立証する。
【0100】
この背景において、ヒトでは、Bob-1を特異的に認識するB細胞に対する、Bob-1特異的T細胞による自己免疫反応は、Bob-1発現B細胞の破壊によってもたらされる抗体不足を原因とする免疫不全誘発によって特徴づけられる自己免疫疾患をもたらす可能性のあることが本発明者等によって示された。
【0101】
B細胞破壊という病理学的原因を持つ分類不能型免疫不全(CVID)患者という重要なサブ群についてその病因を明らかにしたのは本発明者達の功績である。通常20歳から40歳の患者に現れるこの免疫不全は、免疫グロブリンの漸次的消失によって特徴づけられるが、これは、重篤な感染を伴う。この、異質の原因から成る疾患のサブ群では、CD40-リガンド又はIcosのような分子の遺伝的欠損が報告されているけれども、患者の大多数におけるその病気の病因は、本発明の前には未解決であった。
【0102】
本発明者達はまた、患者の少なくとも一つのサブ群において、この病気はBob-1特異的T細胞の存在を伴い、このBob-1特異的T細胞が、リンパ節中に存在して体液性免疫反応誘発のために決定的に重要な細胞となる、Bob-1特異的B細胞を死滅させることを始めて明らかにすることができた。
【0103】
更に、HIV-1感染患者におけるBob-1特異的T細胞を分析して、本発明者達は、Bob-1特異的T細胞がHIV-1反応の病因において重要な役割を演じていることを明らかにすることができた。二十年に渡って、HIV-1感染におけるリンパ節病理の重要な特徴は、CD8+ T細胞によるB細胞リンパ小節への侵入であることが知られていた。通常、B細胞リンパ小節は、B細胞、小節局在樹状細胞、及び若干のCD4+ T細胞から成る。CD8+ T細胞による小節の侵入、及び、CTLによる小節の破壊は、HIV-1感染の標識であり、その他の障害ではめったに見られない。HIV-1によって感染されるのは、仮令あったとしても、ごく僅かな小節の樹状細胞及びB細胞だけであるから、CTLによる小節の破壊はずっと謎であった。小節内部では、相当数のHIV-1粒子が、補体受容体を介して小節樹状細胞に結合する。HIV-1は、CD4+及びCD8+ T細胞に対して走化性を持つ、そのエンベロープの糖タンパク質gp120を放出することが知られている。我々の発明によれば、HIV-1病因の重要因子は下記によって説明される。HIV-1は、放出gp120を介して、CD8+ T細胞を引き付けて、通常CD8+ T細胞が検出されないリンパ小節の中に導くことが可能である。HIV-1 gp120の、この走化性作用によって、Bob-1特異的T細胞もリンパ節を指向し、そこにおいて、Bob-1を発現することが知られる活性化B細胞を殺戮する。これは、HIV-1患者は、新規抗原に対して免疫反応を惹起しない、また、HIV-1感染患者では中和抗体の生産が阻害されるという以前から知られる事実を説明する。なぜなら、中和抗体の生産は、小節内におけるB細胞によるHIV-1粒子の認識に依存するからである。従って、本発明は、Bob-1特異的T細胞の反応性は、HIV-1病因に対する重要な貢献因子であることを示す重要な証拠を提供する。
【0104】
腫瘍、リンパ腫、又は自己免疫疾患を治療するための、前述の治療方策では、本発明は、Bob-1発現細胞を消失させる特異的T細胞を誘発するための手段及び方法を提供するが、本発明はまた、Bob-1タンパク質に対して特異性を有する、既存のTC又はCTLを逼塞させる−言い換えれば、アネルギー化する−能力を持つ。
【0105】
このTC又はCTLを逼塞又はアネルギー化することは、Bob-1特異的B細胞の消失が阻止されるという効果を持つ。従って、患者は、Bob-1依存性免疫不全から快復する。
【0106】
従って、もう一つの実施態様では、本発明のペプチド、タンパク質、タンパク質断片、エピトープ、配列、組成物、又はワクチンを用い、Bob-1タンパク質を指向する天然のT細胞のアネルギーを誘発することによってBob-1依存性免疫不全が治療される。
【0107】
本明細書で用いる「アネルギー」という用語は、部分的T細胞活性化によって得られる一つの結果を定義する。T細胞アネルギーは、低親和度の認識相互作用をもたらす抗原の微妙な変化、又は、十分な共同刺激の不足のいずれかによって起こる。アネルギーT細胞の信号伝達欠陥は部分的に定義されており、T細胞受容体(TCR)の下流欠陥のみならず上流欠陥も、T細胞の活性化能力を負の方向に調整することを示唆する。もっとも重要なことは、TCRトランスジェニックマウスを用いることによって、アネルギーはインビボ現象であって、単にインビトロのアーチファクトではないことを示す強力な証拠が得られたことである。げっ歯類及びヒトにおける研究から、アネルギーT細胞は調整性質を獲得すること、すなわち、アネルギーT細胞の調整作用は細胞対細胞接触を必要とし、抗原提示細胞免の疫原性の抑制によって仲介されることが示唆された。アネルギーT細胞と、マウスにおいて自己免疫抑制に働く自発性調整細胞の内、最近定義されたCD4+ CD25+集団との間には緊密な相似が存在する。
【0108】
本発明に従ってT細胞をアネルギー化するには、Bob-1由来HLAクラスI又はBob-1由来HLAクラスII限定エピトープを提示する、未熟な、又は半成熟の樹状細胞が患者に投与される。未熟、又は半熟樹状細胞はBob-1 T細胞を不活性化することが可能である。なぜなら、この種の樹状細胞は、共同刺激分子を持たず、また、アネルギー化陰性信号を配送することによってT細胞をアネルギー化することが可能だからである。
【0109】
未熟及び半熟樹状細胞は、生体を、自己免疫から保護する重要な調節細胞である(Immature, semi-mature and fully mature dendritic cells: which signals induce tolerance or immunity?; M. Lutz and G. Schuler. Trends in Immunology, 23巻、9号、445ページに総説が記載される)。T細胞を直接アネルギー化することの他に、これらの樹状細胞は、特異的サプレッサーT細胞及び調節T細胞を誘発することが可能である。寛容原樹状細胞によるプログラム設定によって、これらのサプレッサー又は調節T細胞は、IL-10及びTGFベータのような免疫調節性サイトカインを分泌し、これらのサイトカインが自己反応性T細胞反応を抑える。抗原特異的免疫反応の抑制における半熟又は未熟樹状細胞使用の効力がいくつかの群によって報告されている(例えば、Lutz MB, Suri RM, Niimi M, Ogilvie AL, Kukutsch NA, Rossner S, Schuler G, Austyn JM. Immature dendritic cells generated with low doses of GM-CSF in the absence of IL-4 are maturation resistant and prolong allograft survival in vivo. Eur. J. Immunol. 2000 Jul; 30(7):1813-22; Madhav V. Dhodapkar and Ralph M. Steinman. Blood, 2002年7月1日、100巻、1号、174-177ページ、Antigen-bearing immature dendritic cells induce peptide-specific CD8+ regulatory T cells in vivo in humans)。
【0110】
従って、本発明の更に別の実施態様においてT細胞をアネルギー化するために、未熟又は半熟樹状細胞を、単球から、或いは、低用量のgm-CSFと共に、IL-10添加又は無添加においてインキュベートすることによって造血幹細胞から生成させることが可能である。次に得られた細胞をインキュベートし、本発明のペプチドの1種以上、Bob-1タンパク質、その断片又はエピトープ、又は、修飾Bob-1タンパク質、その断片又はエピトープ、本発明の1種以上の核酸配列をインビトロで負荷する。その後、患者のT細胞をアネルギー化する方法に従って、前述のように負荷又は刺激した樹状細胞を、皮内、皮下、筋肉内、静脈内、又は、リンパ系内注入のいずれかによって患者に投与する。
【0111】
本発明によるペプチド、タンパク質、タンパク質断片、エピトープによって負荷又は刺激された未熟樹状細胞による、このようなワクチン接種は、自己反応性T細胞をアネルギー化するために使用される。
【0112】
更に、本発明によるペプチド、タンパク質、タンパク質断片、エピトープによって負荷又は刺激された未熟樹状細胞による、このようなワクチン接種は、免疫調節性、抗原特異的サプレッサーT細胞を誘発するのに使用することが可能である。これらの免疫調節T細胞は、CD4及びCD25両分子の発現によって特徴づけられるが、T細胞反応の強力なサプレッサーである。
【0113】
T細胞をアネルギー化するもう一つの方法は、これはBob-1特異的T細胞のアネルギー化をもたらす過程であるが、Bob-1由来ペプチドに対して修飾を担い、そのためにT細胞の部分的活性化しかもたらさない拮抗的ペプチドを使用することである。これらのペプチドは、患者に対して直接に、又は、未熟又は半熟樹状細胞負荷後に、皮内、皮下、又は、筋肉内に投与してよい。
【0114】
この方法は、T細胞活性化における共通の現象に基づく。T細胞受容体を、必要なトリガー閾値未満にしか活性化しない修飾ペプチドは、アネルギー、或いはアポトーシスを誘発することすらある(Sloan-Lancaster, J., B.D. Evavold, P.M. Allen. 1993. Induction of T-cell anergy by altered T-cell receptor ligand on live antigen-presenting cells. Nature 363:156、或いは、Brocke, S., K. Gijbels, M. Allegretta, I. Ferber, C. Piercy, T. Blankenstein, R. Martin, U. Utz, N. Karin, D. Mitchell, et al 1996. Treatment of experimental encephalomyelitis with a peptide analogue of myelin basic protein. Nature 379:343)。従って、修飾Bob-1タンパク質、その断片又はエピトープは、Bob-1タンパク質に対して特異的なT細胞をアネルギー化するために、場合によってはBob-1タンパク質発現に対して特異的なT細胞のアポトーシスをトリガーするのに特に有用である。
【実施例】
【0115】
1.HIV-1感染患者におけるBob-1交差反応性T細胞の特定及び単離
T細胞分析アッセイを用いて、本発明者達は、数人のHIV-1感染患者において、HIV-1特異的T細胞エピトープILKEPHGV、又は天然に生じるその変異種を特異的に認識し、同時に、1種以上のBob-1エピトープに対して交差反応性、及び著明な特異性を示すT細胞を特定することができた。
【0116】
更に、本発明者達は、HIV感染を持たず、HLA陰性で、分類不能型免疫不全を患う患者においても、エピトープRVKEVPKEL、及びBob-1内の他のエピトープを認識するBob-1特異的T細胞を特定することができた。エピトープRVKEVPKELは、HLA A2陰性患者によっても認識された。これは、このエピトープが、HLA A2以外の他のエピトープによっても認識されることを示す。
【0117】
好ましいT細胞分析アッセイはELISPOTアッセイであった。これは進化を遂げ、免疫学において抗原特異的T細胞検出のための標準的アッセイとなっている。ELISPOTアッセイは、添加物を伴うRPMI 1640、及び5%ヒトAB血清(Sigma-Aldrich, Steinheim、ドイツ)から成るR5AB培養液を用いて行った。抹消血又はリンパ節から新たに単離したリンパ球(PBMC)、及び、ペプチド刺激PBMCの両方を用いた。ニトロセスロース・フィルター基板マイクロタイター・プレート(96ウェル、MAHA-S-4510、Millipore、Molsheim、ドイツ)に、50μlのインターフェロンγ抗体1-D1K(Mabtech、ストックホルム、スウェーデン)を10μg/mlの濃度で塗布した。PBSで4回洗浄し、R5ABでブロックした後、100μlのR5ABに懸濁させた5x105のPBMCをあらかじめコートしたウェルに二重に加えた。ペプチドを、最終濃度40μg/mlとなるように直接ウェルに添加し、プレートを、5%CO2において37oCで10時間インキュベートした。0.05%Tween 20(PBS/T 0.05%)を含むPBSで6回洗浄後、100μlのビオチニル化インターフェロンγモノクロナール抗体7-B6-1(Mabtech)を、最終濃度2μg/mlにて5%CO2において37oCで2時間インキュベートした。0.05%PBS/T、100μlのアビジン/ペルオキシダーゼ溶液(Vectastain ABC-Kit, Vector Laboratories、カリフォルニア州、米国)を各ウェルに加えた。室温で1時間インキュベートし、0.05% PBSTで3回、及びPBSで3回洗浄後、0.01%H2Oを含む100μlのAEC基質(3-amino-9-ethylcar-bazole, Sigma-Aldrich)を色素源として加え、スポットを4分以内に現像した。比色反応は、プレートを蒸留水で洗浄することによって停止させ、次にプレートを空気乾燥させた。ビデオによるELISPOT自動読み取り器(AID Autoimmun Diagnostika、ストラスブルグ、ドイツ)を用いてスポットをカウントした。
【0118】
クロム放出アッセイでは、更に、これらのBob-1交差反応性CTLは、Bob-1発現、HIV陰性細胞にも特異的に結合し、破壊することが可能であることが示された。
【0119】
このために、PBMCを、10U/mlのインターロイキン-2を添加した1mlのR 10培養液において最終濃度2μg/mlの本発明の合成ペプチドによって感作した。2週間後、標準的クロム放出アッセイにおいて、増殖細胞を、ペプチドパルス負荷PBMCの特異的認識に関して試験した。ペプチド特異的CTL細胞系統を、2週間に1回、ペプチドパルス被爆PBMC(60Gyによる被爆)、及び被爆異種フィーダー細胞(40Gyによる被爆)によって再刺激した。
【0120】
II.免疫グロブリン欠如患者におけるBob-1交差反応性T細胞の特定及び分離
T細胞分析アッセイを用いて、本発明者達は、免疫グロブリン(Ig)を欠如する患者において、1種以上のBob-1エピトープに対して著明な特異性を示すT細胞を特定することができた。
【0121】
次に、クロム放出アッセイにおいて、これらのBob-1特異的T細胞は、エプスタインバー・ウィルス(EBV)によって変形された自己B細胞に特異的に結合し破壊することが可能であることが示された。この方法は、Bob-1発現性B細胞の、T細胞誘発による自己免疫性喪失に苦しむ患者を特定し、その特性を解明するための診断ツールとなった。この新たに発見された自己免疫疾患は、「Bob-1関連T細胞自己免疫」と名づけられた。
【0122】
同じ背景において、Bob-1発現B細胞に対するこの自己免疫反応は、患者におけるIgレベルの低下と相関することが示された。従って、Bob-1タンパク質に対する自己免疫反応は、体液性免疫欠陥、中でも、リンパ小節B細胞の破壊によって特徴づけられる体液性免疫欠陥を引き起こす可能性のあることが示された。一方、このような患者では、末梢のB細胞数はまったく正常である場合があるのに、免疫グロブリンレベルが低下する。これは、安静な循環B細胞に比べて、リンパ小節中心部のB細胞におけるBob-1発現はより高レベルであることによって説明される。免疫グロブリンの漸次的低下は、多くの患者において感染合併症の出現を伴う。Bob-1関連T細胞自己免疫の発見によって、一般に「分類不能型免疫不全」と呼ばれるこの疾患を持つ患者の少なくとも一つのサブ群の病因が初めて本発明者達によって説明された。
【0123】
本発明は、「分類不能型免疫不全症候群」を持つ患者の病因ばかりでなく、他の重要な疾患、例えば、”MGUS”(意義不明モノクロナール免疫グロブリン血症)及び形質細胞腫(多発性骨髄腫)の病因の探求にも貢献する。
【0124】
MGUS及び形質細胞腫患者は、その血清の中に、拡大B細胞クローン由来のモノクロナール免疫グロブリンである副次タンパク質を持つ。MGUSは最大3%の発生率を持つ主に老人に見られる一般的疾患であるが、MGUS患者は、非ホジキン型リンパ腫に分類される悪性腫瘍である形質細胞腫を発症する危険性がきわめて高い。
【0125】
本発明者達は、MGUS及び形質細胞腫は、Bob-1関連T細胞自己免疫を持つ患者に出現する可能性のあることを立証することができた。リンパ小節中心部の、正常なBob-1発現B細胞の、自己反応性T細胞による破壊は、B細胞免疫反応の制御不能、及び、リンパ臓器におけるB細胞ゾーンの消失を招き、そのために、Bob-1特異的CTL活性に対して耐性を持つ、遺伝的損傷を被り、修飾されたB細胞クローンの発達及びクローン拡大の機会が与えられることになる。本発明は、MGUS及び形質細胞腫の病因について重要な見解を提供する。すなわち、これらの障害において通常観察される正常免疫グロブリンの欠如は、モノクロナールB細胞集団の拡大の結果ではなく、逆に、自己反応性B細胞によるリンパ小節B細胞の減衰が、MGUS及び形質細胞腫発症の前提要件となっている。
【0126】
これらの事実の結果、本発明の方法に従って、Bob-1特異的TC又はCTLをアネルギー化する、或いは、抑制することによってCVID、MGUS、及び形質細胞腫を治療することが可能な方策と考えられる。この状況下では、正常なB細胞集団が回復し、それは、正常な免疫グロブリンの生産を取り戻し、モノクロナールB細胞クローンの現状以上の拡大を阻止すると考えられる。
【0127】
III.各種ペプチドによるTC誘発の特異性を試験するためのクロム放出アッセイ
HIV患者から単離されたT細胞を、ペプチドILKDPVHGV及び小用量のインターロイキン2によってペプチド刺激した。次に、過剰増殖したCTLを、クロム放出アッセイにおいてそのペプチド特異的分解について試験した。
【0128】
このために、B細胞とT細胞の融合であり、TAPトランスポーター欠陥を持ち、従って内部のBob-1タンパク質を提示することができない特異的HLA-A2陽性T細胞を、放射標識クロム及び各種ペプチドと共にインキュベートした。次いで、数回の洗浄工程の後、CTLを、この標識及びペプチド提示T2細胞とインキュベートし、クロムの放出を測定した。
【0129】
図1に示すように、HIV患者から単離されたCTLは、ペプチド提示T2細胞を特異的に認識し、破壊する。
【0130】
修飾Bob-1タンパク質由来のペプチドは、正常なBob-1タンパク質由来ペプチドに比べて優れた成績を示すことが明らかになった。これは、修正ペプチドは、本発明者等によって、HLA A2分子に対する結合が最適となるように修飾されたという事実による。
【0131】
IV.各種ペプチドによるTC誘発の特異性を試験するためのクロム放出アッセイ
体液性免疫欠陥を抱える患者から単離されたT細胞を、HIV由来ペプチドILKDPVHGVと、小用量のインターロイキン2と共にインキュベートした。次に、過剰増殖CTLにおいて、5時間クロムアッセイにおいて、そのペプチド特異的細胞分解について試験した。
【0132】
このために、B細胞とT細胞の融合であり、TAPトランスポーター欠陥を持ち、従って内部のBob-1タンパク質を提示することができない特異的HLA-A2陽性T細胞を、放射標識クロム及び各種ペプチドと共にインキュベートした。次いで、数回の洗浄工程の後、増殖CTLを、この標識及びペプチド提示T2細胞とインキュベートし、クロムの放出を測定した。
【0133】
図2に示すように、患者から単離されたCTLは、HIV由来ペプチドILKDPVHGVを提示するT2細胞を特異的に認識し、更に、Bob-1由来ペプチドRVKEVPKEL、又は修飾Bob-1由来ペプチドFLKEPVKELに対して高い交差反応性を示す。
【0134】
V.各種ペプチドによる誘発CTLの交差反応性を分析するELISPOTアッセイ
一方のELISPOTアッセイでは(図3a参照)、体液性免疫欠陥を持つ患者から単離したPBMCを、HIV由来ペプチドILKDPVHGVで刺激し、次に、増殖した特異的CTLを、HIV由来ペプチドILKDPVHGVを特異的に認識し、更に、Bob-1由来ペプチドFLKEPVKELに対して交差反応する能力について分析した。第2のELISPOTアッセイでは(図3b参照)、体液性免疫欠陥を持つ患者から単離したPBMCを、Bob-1由来ペプチドFLKEPVKELで刺激し、次に、増殖した特異的CTLを、Bob-1由来ペプチドFLKEPVKELを特異的に認識し、更に、HIV由来ペプチドILKDPVHGVに対して交差反応する能力について分析した。
【0135】
結果は、Bob-1由来ペプチドFLKEPVKELと、HIV由来ペプチドILKDPVHGVとの間には強力な交差反応性のあることをはっきりと示す。
【0136】
VI.分類不能型免疫不全患者から得られたBob-1特異的CD4 Tヘルパー細胞の単離と特性解明
HIV-1陰性の、分類不能型免疫不全患者において、本発明は、Bob-1特異的T細胞を特定することができた。例えば、このタイプの免疫不全を持つ患者から得られたCD4+ Tヘルパー細胞は、Bob-1由来ペプチドDSDAYALNHTLSVEGFを特異的に認識した。
【0137】
分類不能型免疫不全で、IgG、IgA、及びIgMの血清レベル低下による反復的感染によって特徴づけられる患者から得られたPBMCを、全体Bob-1タンパク質に延長する、重複ペプチドプールによって刺激した。5種のペプチドプールはそれぞれ、10アミノ酸が重複する、5種類の16から20アミノ酸長ペプチドを含んでいた。ガンマIFN ELISPOTによって分析した増殖細胞は、Bob-1タンパク質のアミノ酸201から256に対応する5種類のペプチドを含むペプチドプール5に対して特異的認識を示した(図4)。
【0138】
個々のペプチドについて更に分析したところ、Bob-1タンパク質のアミノ酸241から256に対応する配列DSDAYALNHTLSVEGFを持つペプチド25の認識が示された。
【0139】
更に別の実験で、CD4+又はCD8+ T細胞を、DSDAYALNHTLSVEGF特異的細胞系統から脱落させた。脱落は、標準的磁気細胞分離法を用い(Easy Sep登録商標、Stem Cell Technologies、バンクーバー、ブリティシュ・コロンビア)、磁気ビーズに結合するCD4又はCD8特異的モノクロナール抗体によって行った。
【0140】
この実験は、この患者から得られたBob-1ペプチド25特異的T細胞はCD4 Tヘルパー細胞であることをはっきりと証明した。
【0141】
更に別のELISPOT実験において、DSDAYALNHTLSVEGF特異的細胞系統に更に欠失ペプチドの特徴を付与した。この実験では、50000個の細胞を欠失ペプチドと一晩インキュベートし、標準ELISPOTアッセイにおいてガンマIFN生産について分析した。これらの実験は、DSDAYALNHTLSVEGF特異的細胞はペプチドALNHTLSVEGFを依然として認識するが、一方、ペプチドYALNHTLSVEGはあまりよく認識されず、C末端のGを省略したペプチドは認識されなかった。これは、最適エピトープは、ペプチドALNHTLSVEGF(アミノ酸246−アミノ酸256)であることを示す(図5)。更にその後の実験によって、DSDAYALNHTLSVEGF特異的細胞のHLAタイプが明らかにされた(図6及び7)。
【0142】
同じ患者で、アミノ酸51から110に広がる、5種の20アミノ酸長ペプチドを含むペプチドプール2でPBMCを刺激し、ELISPOT分析で調べたところ、ペプチドaa81-aa100を特異的に認識するT細胞の増殖が明らかにされた(図8)。
【0143】
アミノ酸101から160に広がる、5種の20アミノ酸長ペプチドを含むペプチドプール3でPBMCを刺激し、ELISPOT分析で調べたところ、ペプチドaa141-aa160を特異的に認識するT細胞の増殖が明らかにされた(図9)。
【0144】
もっとも驚くべきことは、患者の内のあるものは、Bob-1特異的T細胞、特に、DSDAYALNHTLSVEGF特異細胞を誘発することによって、そのリューマチ性自己免疫疾患の治癒を見たことである。
【0145】
更に、そのような患者は、他のBob-1由来ペプチド、例えば、TYASPPLITNVTTRSSATPA、及びAALCAGWLSQPTPATLQPLAも認識した。これは、これらのペプチドも、Bob-1依存性疾患又は障害、例えば、腫瘍、リンパ腫、又は自己免疫疾患の治療に有用であることを示す。
【0146】
VII.HIV-1及びHIV-2感染患者から得られたBob-1特異的CD8細胞(CTL)の単離と特性解明
HIV-1患者において、本発明者達は、Bob-1由来ペプチドに対して特異的な様々なT細胞を特定することができた。様々な患者において、特異的T細胞が特異性を示す各種ペプチドの要約を図10において見て取ることができる。
【0147】
この分析のために、3百万個のPBMCをそれぞれ、4−5種のBob-1ペプチドから成るプールで刺激し、2−3週間後、増殖細胞を、標準的ガンマIFN-ELISPOTアッセイにおいてBobプールの認識に関して試験した。次に、ペプチドプールを認識するPBMCを、第2ELISPOTアッセイにおいて個々のペプチドについて試験した。図10において、個々のペプチドに対する反応性を×でマークして示す。使用したペプチドは、Bob-1タンパク質に基づいて番号付けしたアミノ酸を持つBob-1由来ペプチドである。
【0148】
HIV感染患者において、主にCTL、又はCD8+ T細胞が特定されたが、CD4+ T細胞も特定されたことは注目すべきである。
【0149】
これらの結果は、HIV-1感染の病因に関する長い間の謎を解明するのに役立つ。HIV-1感染におけるリンパ節病理の重要な特徴は、CD8+ T細胞がB細胞小節に侵入することであることが20年来知られている。通常、B細胞小節は、B細胞、小節樹状細胞、及び若干のCD4+ T細胞から成る。CD8+ T細胞によるリンパ小節の侵入、及びCTLによる小節の破壊は、HIV-1感染の標識であり、他の疾患ではめったに見られない。HIV-1によって感染されるのは、仮令あったとしても、ごく僅かな小節の樹状細胞及びB細胞だけであるから、CTLによる小節の破壊はずっと謎であった。小節内部では、相当数のHIV-1粒子が、補体受容体を介して小節樹状細胞に結合する。一方、HIV-1は、CD4+及びCD8+ T細胞に対して走化性を持つ、そのエンベロープの糖タンパク質gp120を放出することが知られている。現在本発明によれば、HIV-1病因の重要因子は下記のように説明される。HIV-1は、放出gp120を介して、CD8+ T細胞を引き付けて、通常CD8+ T細胞が検出されないリンパ小節の中に導くことが可能である。HIV-1 gp120の、この走化性作用によって、Bob-1特異的T細胞もリンパ節を指向し、そこにおいて、Bob-1を発現することが知られる活性化B細胞を殺戮する。これは、HIV-1患者は、新規抗原に対して免疫反応を惹起しない、また、HIV-1感染患者では中和抗体の生産が阻害されるという以前から知られる事実を説明する。なぜなら、中和抗体の生産は、小節内におけるB細胞によるHIV-1粒子の認識に依存するからである。従って、本発明は、Bob-1特異的T細胞の反応性は、HIV-1病因に対する重要な貢献因子であることを示す重要な証拠を提供する。
【0150】
これらの所見はHIV-2感染にとっても重要である。なぜなら、HIV-2感染患者からもBob-1特異的T細胞を単離することが可能だからである(図12)。
【0151】
Bob-1発現B細胞の特異的殺作用を更に明らかにするために、Bob-1特異的CTL細胞系統(ペプチドaa71-90(Bob 8クローン)、aa91-110(Bob10クローン)、及びaa210-220(Bobクローン)に対して特異的)を、標準的クロム放出アッセイにおいて自己EBV変形B-LCLの認識について試験した。これらのCTLは全て、それぞれの特異的ペプチドによって感作されたB細胞は殺したが、特異的ペプチド無しのB細胞は殺さなかった(図11)。これは、Bob-1ペプチドの特異的認識を示す。3種のCTL細胞系統は全て、CD8特異的抗体で染色したところCD8+ T細胞であることが示された。
【0152】
これらの結果は、Bob由来ペプチドに対して特異的なCTL細胞系統は効率が高いことを示す。HIV感染におけるリンパ節障害の原因にはこのようなBob-1特異的CTL細胞系統が関与すると思われるが、これらの細胞系統は、Bob-1発現細胞を除去する効率が高く、Bob-1発現性リンパ腫を始め、Bob-1タンパク質の発現と相関する疾患又は障害の治療のため薬剤として使用することが可能である。
【0153】
Bob-1特異的T細胞反応の大きさを、HIV-1特異的T細胞反応と比較するために、我々は、HLA B27陽性、HIV-1感染患者において、Bob-1ペプチドプールによる刺激、又は、免疫主体HLA B27限定HIV-1 gagペプチドKRWIILGLNKによる刺激のいずれかによるペプチド刺激T細胞系統のELIPOT反応を比較した。この実験の結果(図13)は、Bob-1ペプチドの認識は、HIV-1ペプチドの認識と同様の大きさで起こることを示す。
【0154】
IX.Bob-1特異的T細胞誘発のためのワクチン作用モデルとしてのインビトロ刺激
更に別の一組の実験において、本発明者達は、健康人においても、Bob-1特異的T細胞誘発を刺激することが可能であることを証明した。
【0155】
このために、健康人のPBMCを、前述のように、Bob-1由来ペプチドの内から選択された1ペプチドを負荷した自己樹状細胞によって刺激した。この樹状細胞は、PBMCを、gm-CSF及びIL4と共に5日間インキュベートし、更に、標準プロトコール(Berger TG, Feuerstein B, Strasser E, Hirsch U, Schreiner D, Schuler G, Schuler-Thurner B. Large-scale generation of mature monocyte-derived dendritic cells for clinical application in cell factories. Journal of immunological methods 2002, 268:131-140)に従って複数サイトカインの混合液とインキュベートすることによって成熟させるという標準プロトコールに従って生成した。樹状細胞は、Bob-1由来ペプチドの内から選択された1ペプチドと2時間インキュベートし、2回洗浄し、3百万個の自己PBMCに加えた。図14に、Bob-1特異的T細胞の増殖に対するこの刺激の効率が示される。このインビトロ免疫化は、インビボ免疫化のモデル反応を表すが、Bob-1特異的T細胞の著明な誘発を招くことが見て取れる。
【0156】
従って、上記結果は、Bob-1由来ペプチドによるインビボ免疫化は、インビボにおいてBob-1特異的T細胞の誘発及び刺激を招く可能性のあることを示す。従って、Bob-1特異的T細胞を用いることによって、インビボにおいて、Bob-1発現リンパ腫のみならず、Bob-1タンパク質発現と相関する疾患又は障害を治療することも可能である。
【図面の簡単な説明】
【0157】
【図1】図1は、HLA-A2-陽性T2細胞を、放射標識クロム及び各種ペプチドとインキュベートした、クロム放出アッセイの結果を示す。数回の洗浄工程の後、HIV患者から単離し、ペプチドILKDPVHGVに対して特異性を持つCTLの過剰増殖刺激を受けたCTLを、標識された、ペプチド提示T2細胞と共にインキュベートし、クロムの放出を測定する。提示された各種ペプチドに依存する特異的細胞分解を示す。HIV由来ペプチドILKDPVHGV と、Bob-1由来ペプチドFLKEPVKEL、又は修飾Bob-1由来ペプチドRVKEVPKELとの間の交差反応性も示される。
【図2】図2は、特異的HLA-A2-陽性T2細胞を、放射標識クロム及び各種ペプチドとインキュベートした、クロム放出アッセイの結果を示す。数回の洗浄工程の後、体液性免疫欠陥を持つ患者から単離し、ペプチドILKDPVHGVに対して特異性を持つCTLの過剰増殖刺激を受けたCTLを、標識された、ペプチド提示T2細胞と共にインキュベートし、クロムの放出を測定する。提示された各種ペプチドに依存する特異的細胞分解を示す。HIV由来ペプチドILKDPVHGV と、Bob-1由来ペプチドFLKEPVKEL、又は修飾Bob-1由来ペプチドRVKEVPKELとの間の交差反応性も示される。
【図3a】図3aは、ELISPOTアッセイにおいて、体液性免疫欠陥を持つ患者から単離したPBMCを、HIV由来ペプチドILKDPVHGVで刺激し、次に、増殖した特異的CTLを、HIV由来ペプチドILKDPVHGVを特異的に認識する能力、及び、Bob-1由来ペプチドFLKEPVKELに対して交差反応する能力について分析した。
【図3b】図3bは、ELISPOTアッセイにおいて、体液性免疫欠陥を持つ患者から単離したPBMCを、Bob-1由来ペプチドFLKEPVKELで刺激し、次に、増殖した特異的CTLを、Bob-1由来ペプチドFLKEPVKELを特異的に認識を特異的に認識する能力、及び、HIV由来ペプチドILKDPVHGVに対して交差反応する能力について分析した。
【図4】図4は、ELISPOTアッセイにおいて、分類不能型免疫不全(CVID)を抱えるHIV-1陰性患者から単離したPBMCを、5種類のペプチドプールであって、それぞれ、10アミノ酸が重複する、5種類の16から20アミノ酸長ペプチドを含むプールで刺激した。これら5種類のプールに含まれる25種のペプチドは、ヒトBob-1全タンパク質に広がる、10アミノ酸長の重複を持つ1組の重複ペプチドから得られたものであった。ガンマIFN ELISPOTで試験した増殖した特異的T細胞は、Bob-1タンパク質のアミノ酸201から256に広がる5種類のペプチドを含むペプチドプール5に対して特異的認識を示した。更に分析したところ、ペプチドプール5に対して特異的なT細胞は、ペプチドDSDAYALNHTLSVEGF(Bob-1のアミノ酸241から256)を特異的に認識するが、このプール内の他のペプチドは認識しないことが明らかになった。
【図5】図5は、分類不能型免疫不全患者から得られたBob特異的CD4細胞のエピトープ分析を示す。分類不能型免疫不全患者由来のPBMCをBob-1ペプチド25(= DSDAYALNHTLSVEGFで、Bob-1のアミノ酸241から256に対応)で刺激した。Bobペプチド25を特異的に認識する増殖細胞を更に、二重の50000個細胞、及び欠失させた合成ペプチドを用いたガンマIFN-ELISPOTアッセイにて分析した。この実験によって、Bob特異的細胞系統は、ペプチドALNHTLSVEGFを特異的に認識するが、C末端のFを欠失したペプチドでは効率が下がり、C末端のGを欠失するといずれのペプチドも効力を失うことが示された。
【図6】図6は、分類不能型免疫不全患者から得られたBob特異的CD4細胞のエピトープ分析を示す。分類不能型免疫不全患者由来のPBMCをBobペプチド25(= DSDAYALNHTLSVEGFで、Bobのアミノ酸241から256に対応)で刺激した。Bobペプチド25を特異的に認識する増殖細胞を更にガンマIFN-ELISPOTアッセイにて分析した。分析には、二重の50000個細胞、及びEBV変形自己B細胞(B-LCL)を、Bobペプチド25、及びHLAクラスII DR、DQ、又はDP Bob-25に対する抗体を添加して、又は無添加でインキュベートしたものを用いた。Bob25誘発ガンマインターフェロン生産は、HLA DQに対する抗体とインキュベートすることによって抑制されたが、HLA DR及びDP分子にたいする抗体によっては抑制されなかった。これは、Bobペプチド25はHLA DQによって提示されることを示す。
【図7】図7は、分類不能型免疫不全患者から得られたBob特異的CD4細胞のエピトープ分析を示す。分類不能型免疫不全患者由来のPBMCをBobペプチド25(= DSDAYALNHTLSVEGFで、Bobのアミノ酸241から256に対応)で刺激した。その患者のHLAクラスIIタイプは、DR11、DR13、DQ0301、DQ0604である。Bobペプチド25を特異的に認識する増殖細胞を更にガンマIFN-ELISPOTアッセイにて分析した。分析には、二重の50000個細胞、及び、自己、及びHLAクラスII適合EBV変形B細胞(B-LCL)を、Bobペプチド25を添加して、又は無添加でインキュベートしたものを用いた。Bob25誘発ガンマインターフェロン生産は、DQ0604を発現する、Bobペプチド25とインキュベートしたB細胞系統によって刺激されたが、DQ0301又はDR11を発現するB細胞系統によっては刺激されなかった。これは、分類不能型免疫不全患者では、HLA DQ0604分子がBobペプチド25に特異的に結合し、且つ、Bobペプチド25をCD4+ T細胞に提示することを示す。
【図8】図8は、分類不能型免疫不全患者から得られたBob特異的CD4細胞のエピトープ分析を示す。分類不能型免疫不全患者由来のPBMCを、Bob-1のアミノ酸51から110に対応する、10アミノ酸長の重複を持つ5種の20アミノ酸(aa)長ペプチドを含むペプチドプールで刺激した。二重の50000個細胞及び合成欠失ペプチドを用いたガンマIFN-ELISPOTアッセイにおいて、増殖細胞はBobペプチドaa81-100を特異的に認識した。この実験は、Bob特異的細胞系統は、AALCAGWLSQPTPATLQPLA(アミノ酸81−100に対応)を特異的に認識することを示す。
【図9】図9は、分類不能型免疫不全患者から得られたBob特異的CD4細胞のエピトープ分析を示す。分類不能型免疫不全患者由来のPBMCを、Bob-1のアミノ酸101から160に対応する、10アミノ酸長の重複を持つ5種の20アミノ酸(aa)長ペプチドを含むペプチドプールで刺激した。二重の50000個細胞及び合成欠失ペプチドを用いたガンマIFN-ELISPOTアッセイにおいて、増殖細胞はBobペプチド141−160を特異的に認識した。この実験は、Bob特異的細胞系統は、TYASPPLITNVTTRSSATPA(アミノ酸141−160に対応)を特異的に認識することを示す。
【図10】図10は、HIV-1感染患者から得られたペプチド刺激PBMCによる、Bob-1重複ペプチドの認識を表として示す。患者#14はHIV-2感染であり、他の患者は全てHIV-1感染である。表の最上段には、Bob-1タンパク質に基づいて番号付けしたアミノ酸を持つ重複ペプチドが示される。3百万個のPBMCをそれぞれ、4−5種のBob-1ペプチドから成るプールで刺激し、2−3週間後、増殖細胞を、標準的ガンマIFN-ELISPOTアッセイにおいてBobプールの認識に関して試験した。次に、ペプチドプールを認識するPBMCを、第2ELISPOTアッセイにおいて個々のペプチドについて試験した。個々のペプチドに対する反応性を×でマークして示した。
【図11】図11は、Bob-1特異的CTL細胞系統(ペプチドaa71-90(Bob 8クローン)、aa91-110(Bob10クローン)、及びaa210-220(Bobクローン)に対して特異的)によるBob-1発現B細胞の特異的殺作用を示す。これらの細胞系統を、標準的クロム放出アッセイにおいて自己EBV変形B-LCLの認識について試験した。これらのCTLは全て、それぞれの特異的ペプチドによって感作されたB細胞は殺したが、特異的ペプチド無しのB細胞は殺さなかった。これは、Bob-1ペプチドの特異的認識を示す。3種のCTL細胞系統は全て、CD8特異的抗体で染色したところCD8+ T細胞であることが示された。
【図12】図12は、HIV-2感染患者から得られたT細胞系統による、Bob-1特異的ペプチドaa171-190の認識を示す。この患者からのPBMCを、Bob-1配列のaa151-210に広がる5種の重複ペプチドのプールで刺激した。増殖細胞を、ガンマインターフェロンELIPOTアッセイにおいて、aa151-210及び個々のペプチドから成るペプチドプールの認識について試験した。実験は、細胞系統によってペプチドaa171-190が特異的に認識されることを示した。
【図13】図13は、HIV-1感染患者から得られたCTL細胞系統による、HIV-1特異的ペプチドKRWIILGLNK(KK10)と比べた場合の、Bob-1特異的ペプチドの認識を示す。患者のPBMCを、Bob-1特異的ペプチドプール及びペプチドKK10によって刺激した。各プールは、10アミノ酸重複を持つ、5種の20アミノ酸長ペプチドを含む。PBMCを、10% FCS及び10単位のインターロイキン2を添加した、1ml RPMI培養液において24ウェルプレートにてペプチド(それぞれ1μg/mlの濃度で)とインキュベートした。増殖細胞系統を、ガンマIFN-ELISPOTにおいて特異的認識について試験した。この実験は、Bob-1特異液ペプチドプールaa101-160、及びペプチドプールaa51-aa110の特異的認識は、免疫主体HLA B27限定gagエピトープKRWIILGLNKの認識と同様の大きさであることを示す。SFU=スポット形成単位。
【図14】図14は、あらかじめBob-1ペプチドによってPBMCを刺激された健康人において生成されたT細胞系統によるガンマIFN-ELISPOTアッセイの結果を示す。プール1特異的、又は、プール4特異的細胞系統において、それぞれのプール及び表示のペプチドによる刺激後に得られるペプチド特異的T細胞数が示される。プール1による刺激後に生成したT細胞系統は、Bob-1ペプチドaa21-40に対して特異的認識を示し(図14の上段)、プール4による刺激後に生成したT細胞系統は、Bob-1ペプチドaa171-190に対して特異的認識を示した(図14の下段)。T細胞系統は、Bob-1タンパク質のaa1-aa256に対応する、それぞれが、10アミノ酸長の重複を持つ、5種の20アミノ酸(aa)長ペプチドを含む、異なる5種のプールで、末梢血単核球(PBMC)を刺激することによって生成した。ペプチドプールは、標準プロトコール(Berger TG, Feuerstein B, Strasser E, Hirsch U, Schreiner D, Schuler G, Schuler-Thurner B. Large-scale generation of mature monocyte-derived dendritic cells for clinical application in cell factories. Journal of immunological methods 2002, 268:131-140)に従って生成した自己樹状細胞によって提示させた。この実験は、健康人のPBMCのインビトロ刺激も、Bob-1特異的T細胞の著明な増殖をもたらすことを証明した。従って、これは、Bob-1特異的T細胞反応のインビトロ誘発のためのモデルとなる。
【特許請求の範囲】
【請求項1】
Bob−1特異的及び/又はBob−1交差反応性T細胞の特定、単離、及び/又は誘発のための単離ペプチドの使用。
【請求項2】
請求項1に記載の使用において、前記ペプチドは、一般的アミノ酸配列:
X1X2KX3PX4X5X6X7
式中、
−X1は、任意の天然アミノ酸、特に、アルギニン(R)、イソロイシン(I)、フェニルアラニン(F)、チロシン(T)、又はセリン(S)を含む群から選択され、
−X2は、メチオニン(M)、バリン(V)、ロイシン(L)、又はイソロイシン(I)であり、
−X3は、グルタミン酸(E)、又はアスパラギン酸(D)であり、
−X4は、任意の天然アミノ酸、特に、バリン(V)、ロイシン(L)、イソロイシン(I)、又はアラニン(A)を含む群から選択され、
−X5は、任意の天然アミノ酸、特に、ヒスチジン(H)又はロイシン(L)を含む群から選択され、
−X6は、任意の天然アミノ酸、特に、グルタミン酸(E)又はグリシン(G)を含む群から選択され、且つ、
−X7は、メチオニン(M)、バリン(V)、ロイシン(L)、イソロイシン(I)、又はアラニン(A)である、
を有することを特徴とする、使用。
【請求項3】
請求項1又は2に記載の使用において、前記単離ペプチドは、ペプチド:
FLKEPVKEV,SLKEPVKEL,YLKEPVKEL,FLKEPVKEL,ILKEPVHEV,ILKEPVHGV,RVKEPVKEL,DSDAYALNHTLSVEGF,AYALNHTLSVEGF,YALNHTLSVEGF,YALNHTLSVEG,ALNHTLSVEGF,TYASPPLITNVTTRSSATPA.AALCAGWLSQPTPATLQPLA,MLWQKPTAPEQAPAPARPYQ(1−20),QAPAPARPYQGVRVKEPVKE(11−30),GVRVKEPVKELLRRKRGHAS(21−40),LLRRKRGHASSGAAPAPTAV(31−50),SGAAPAPTAVVLPHQPLATY(41−60),VLPHQPLATYTTVGPSCLDM(51−70),TTVGPSCLDMEGSVSAVTEE(61−80),EGSVSAVTEEAALCAGWLSQ(71−90),AALCAGWLSQPTPATLQPLA(81−100),PTPATLQPLAPWTPYTEYVP(91−110),PWTPYTEYVPHEAVSCPYSA(101−120),HEAVSCPYSADMYVQPVCPS(111−130),DMYVQPVCPSYTVVGPSSVL(121−140),YTVVGPSSVLTYASPPLITN(131−150),TYASPPLITNVTTRSSATPA(141−160),VTTRSSATPAVGPPLEGPEH(151−170),VGPPLEGPEHQAPLTYFPWP(161−180),QAPLTYFPWPQPLSTLPTST(171−190),QPLSTLPTSTLQYQPPAPAL(181−200),LQYQPPAPALPGPQFVQLPI(191−210),PGPQFVQLPISIPEPVLQDM(201−220),SIPEPVLQDMEDPRRAASSL(211−231),EDPRRAASSLTIDKLLLEEE(221−241),TIDKLLLEEEDSDAYALNHT(231−251)、及びDSDAYALNHTLSVEGF(241−256)
から成る群より選択されることを特徴とする、使用。
【請求項4】
請求項1から3のいずれか1項の使用において、前記ペプチドは、請求項3に列挙された配列の、9個又はそれ以上のアミノ酸の断片、又は、アミノ酸配列:
DSDAYALNHTLSVEGF,TYASPPLITNVTTRSSATPA,AALCAGWLSQPTPATLQPLA,MLWQKPTAPEQAPAPARPYQ,QAPAPARPYQGVRVKEPVKE,GVRVKEPVKELLRRKRGHAS,LLRRKRGHASSGAAPAPTAV,SGAAPAPTAVVLPHQPLATY,VLPHQPLATYTTVGPSCLDM,TTVGPSCLDMEGSVSAVTEE,EGSVSAVTEEAALCAGWLSQ,AALCAGWLSQPTPATLQPLA,PTPATLQPLAPWTPYTEYVP,PWTPYTEYVPHEAVSCPYSA,HEAVSCPYSADMYVQPVCPS,DMYVQPVCPSYTVVGPSSVL,YTVVGPSSVLTYASPPLITN,TYASPPLITNVTTRSSATPA,VTTRSSATPAVGPPLEGPEH,VGPPLEGPEHQAPLTYFPWP,QAPLTYFPWPQPLSTLPTST,QPLSTLPTSTLQYQPPAPAL,LQYQPPAPALPGPQFVQLPI,PGPQFVQLPISIPEPVLQDM,SIPEPVLQDMEDPRRAASSL,EDPRRAASSLTIDKLLLEEE,TIDKLLLEEEDSDAYALNHT,又はDSDAYALNHTLSVEGF
の修飾種であることを特徴とする、使用。
【請求項5】
請求項1から4のいずれか1項に記載の使用において、請求項1から4のいずれか1項に記載の1種又はそれ以上のペプチドを単独で、或いは組み合わせてコードする核酸配列を用いることを特徴とする、使用。
【請求項6】
請求項1から4のいずれか1項に含まれるペプチドに対して特異的な、及び/又は交差反応性を持つ単離T細胞において、請求項1から4のいずれか1項に記載のペプチド、その断片及び/又はエピトープを用いることによって誘発されることを特徴とする、T細胞。
【請求項7】
請求項6に記載の単離T細胞において、T細胞が、細胞傷害性であることを特徴とする、単離T細胞。
【請求項8】
請求項6に記載の単離T細胞において、T細胞が、CD4+ Tヘルパー細胞であることを特徴とする、単離T細胞。
【請求項9】
請求項1から4のいずれか1項に含まれるペプチドにおいて、核酸配列が、医薬品又はワクチンとして、請求項1から4のいずれか1項に含まれる1種又はそれ以上のペプチド、又は、請求項6から8に記載のT細胞をコードすることを特徴とする、ペプチド。
【請求項10】
請求項1から4のいずれか1項に含まれるペプチドにおいて、核酸配列が、悪性リンパ腫、Bob−1発現腫瘍、自己免疫疾患、HIV−1及びHIV−2感染、及び/又は、Bob−1タンパク質の発現又は過剰発現と相関する疾患又は障害の治療に使用するための、請求項1から4のいずれか1項に含まれる1種又はそれ以上のペプチド、又は、請求項6から8によるT細胞をコードすることを特徴とする、ペプチド。
【請求項11】
請求項1から4のいずれか1項に含まれるペプチドを含む組成物において、核酸配列が、請求項1から4のいずれか1項に含まれる1種又はそれ以上のペプチド、又は、請求項6から8に記載のT細胞、及び製薬学的に受容可能な担体、及び/又は、希釈剤をコードすることを特徴とする、組成物。
【請求項12】
請求項1から4のいずれか1項に含まれるペプチドを含むワクチンにおいて、核酸配列が、Bob−1特異及び/又はBob−1交差反応性T細胞を誘発するために、請求項1から4のいずれか1項に含まれる1種又はそれ以上のペプチド、又は、請求項6から8に記載のT細胞をコードすることを特徴とするワクチン。
【請求項13】
インビトロT細胞集団におけるT細胞であって、Bob−1タンパク、その断片又はエピトープ、或いは、請求項1から4のいずれか1項に含まれる少なくとも1個のペプチドに対して特異的及び/又は交差反応的であるT細胞の数を増加する方法が、
−PBMCの集団を、Bob−1タンパク、その断片又はエピトープ、或いは、請求項1から4のいずれか1項に含まれる少なくとも1個のペプチドに接触させることと;
−選択的に、反応物に免疫ホルモンを加えることと;
−刺激された集団のT細胞増殖の誘発を適当なアッセイで分析することであって、好ましいアッセイは、ELISPOT、クロム放出アッセイ、又は、HLAテトラマ等の可溶性HLAペプチド複合体によるペプチド特異T細胞の直接視覚化である分析と;選択的に、
−刺激されたT細胞であって、Bob−1タンパク質、その断片又はエピトープに対して特異的及び/又は交差反応的であるT細胞を単離することと;
を含むことを特徴とする、方法。
【請求項14】
Bob−1発現と相関する疾患又は障害を診断する方法が、
−患者からPBMCを単離することと;
−Bob−1タンパク質、その断片又はエピトープ、或いは、請求項1から4のいずれか1項に含まれる少なくとも1個のペプチドに、PBMCを接触させることと;
−適当なアッセイにおいて、Bob−1特異的及び/又はBob−1交差反応的T細胞の量を分析することであって、好ましいアッセイは、ELISPOTアッセイ、クロム放出アッセイ、抗原刺激後のT細胞の細胞内又は細胞外サイトカイン染色、又は、HLAテトラマ等の可溶性HLAペプチド複合体による特異的T細胞の直接視覚化である分析と;
−更なる生理的パラメータと、Bob−1特異的又は交差反応的T細胞の量とを分析し、比較することと;
を含むことを特徴とする、方法。
【請求項15】
容器、及び、請求項1から4のいずれか1項に含まれる1種又はそれ以上のペプチドを含む診断キットにおいて、核酸配列が、請求項1から4のいずれか1項に含まれる1種又はそれ以上のペプチド、又は、請求項6から8に記載の少なくとも1種のT細胞をコードすることを特徴とする診断キット。
【請求項16】
Bob−1タンパク質、その断片又はエピトープ、修飾Bob−1タンパク質、その断片又はエピトープ、請求項1から4のいずれか1項に含まれる任意のペプチド、核酸配列が、請求項1から4のいずれか1項に含まれる1種又はそれ以上のペプチド、又は請求項6から8に記載のT細胞をコードする、又は、請求項13若しくは14に記載の方法を、Bob−1タンパク質発現と相関する疾患又は障害の診断する用法。
【請求項17】
これらを必要とする患者のBob−1発現リンパ腫、又はその他のBob−1発現腫瘍を治療する方法が、
−活性化Bob−1特異的及び/又は交差反応性T細胞を患者に投与することであって、Bob−1タンパク質、その断片又はエピトープ、修飾Bob−1タンパク質、その断片又はエピトープ、及び/又は、請求項1から4のいずれか1項に含まれる任意のペプチドとインキュベートすることによってex vivo誘発し、活性化した活性化Bob−1特異的及び/又は交差反応性T細胞を投与することと;選択的に、
−追加の交換療法として免疫グロブリンを投与することと;
を含むことを特徴とする、方法。
【請求項18】
これらを必要とする患者のBob−1発現リンパ腫、又は他のBob−1発現腫瘍を治療する方法が、
−Bob−1特異的T細胞を誘発するために請求項12に記載のワクチンを投与することと;選択的に
−追加の交換療法として免疫グロブリンを投与することと;
を含むことを特徴とする、方法。
【請求項19】
これらを必要とする患者の自己免疫疾患、自己免疫障害、及び/又は、アレルギーを治療する方法が、
−活性化Bob−1特異的及び/又は交差反応性T細胞を患者に投与することであって、Bob−1タンパク質、その断片又はエピトープ、修飾Bob−1タンパク質、その断片又はエピトープ、及び/又は、請求項1から4のいずれか1項に含まれる任意のペプチドとインキュベートすることによってex vivo誘発し、活性化した活性化Bob−1特異的及び/又は交差反応性T細胞を投与することと;選択的に、
−追加の交換療法として免疫グロブリンを投与すること、
を含むことを特徴とする、方法。
【請求項20】
これらを必要とする患者の自己免疫疾患、自己免疫障害、及び/又は、アレルギーを治療する方法が、
−Bob−1特異的T細胞を誘発するために請求項12によるワクチンを投与することと;選択的に、
−追加の交換療法として免疫グロブリンを投与することと;
を含むことを特徴とする、方法。
【請求項21】
生きている動物又はヒトにおいて免疫反応を誘発する方法が、
−Bob−1タンパク質、その断片又はエピトープ、修飾Bob−1タンパク質、その断片又はエピトープ、請求項1から4のいずれか1項に含まれる複数のペプチドの少なくとも1個のペプチド、請求項1から4のいずれか1項に含まれる複数のペプチドの1種以上をコードする核酸配列、請求項6から8によるT細胞、及び/又は、請求項12によるワクチンを、前記生きている動物又はヒトに投与することと;選択的に、
−前記生きている動物又はヒトに対する免疫反応を強化するために免疫ホルモン、アジュバント、又は介在因子を投与することと;
を含む前記方法。
【請求項22】
Bob−1関連自己免疫疾患、特に分類不能型免疫不全、及びHIV−1及びHIV−1による感染症を治療する方法が、
−Bob−1タンパク質、その断片又はエピトープ、修飾Bob−1タンパク質、その断片又はエピトープ、請求項1から4のいずれか1項に含まれる複数のペプチドの少なくとも1個のペプチド、請求項1から4のいずれか1項に含まれる複数のペプチドの1種以上をコードする核酸配列、請求項6から8によるT細胞、及び/又は、請求項12によるワクチンとインキュベート、或いは、それによって変換して得られる未熟、又は半成熟の樹状細胞を、生きている動物又はヒトに投与すること;
を含むことを特徴とする、方法。
【請求項23】
Bob−1関連自己免疫疾患、特に分類不能型免疫不全、及びHIV−1及びHIV−2による感染症を治療する方法が、
−修飾Bob−1タンパク質、その断片又はエピトープ、又は、請求項3に含まれるペプチドから得られる少なくとも1個の修飾ペプチド、又は、請求項3に含まれる複数のペプチドの1種以上をコードする核酸配列から得られる、ペプチドリガンドとして作用する修飾ペプチドとインキュベート、或いは、それによって変換して得られる未熟、又は半成熟の樹状細胞を、生きている動物又はヒトに投与すること;
を含むことを特徴とする、方法。
【請求項1】
Bob−1特異的及び/又はBob−1交差反応性T細胞の特定、単離、及び/又は誘発のための単離ペプチドの使用。
【請求項2】
請求項1に記載の使用において、前記ペプチドは、一般的アミノ酸配列:
X1X2KX3PX4X5X6X7
式中、
−X1は、任意の天然アミノ酸、特に、アルギニン(R)、イソロイシン(I)、フェニルアラニン(F)、チロシン(T)、又はセリン(S)を含む群から選択され、
−X2は、メチオニン(M)、バリン(V)、ロイシン(L)、又はイソロイシン(I)であり、
−X3は、グルタミン酸(E)、又はアスパラギン酸(D)であり、
−X4は、任意の天然アミノ酸、特に、バリン(V)、ロイシン(L)、イソロイシン(I)、又はアラニン(A)を含む群から選択され、
−X5は、任意の天然アミノ酸、特に、ヒスチジン(H)又はロイシン(L)を含む群から選択され、
−X6は、任意の天然アミノ酸、特に、グルタミン酸(E)又はグリシン(G)を含む群から選択され、且つ、
−X7は、メチオニン(M)、バリン(V)、ロイシン(L)、イソロイシン(I)、又はアラニン(A)である、
を有することを特徴とする、使用。
【請求項3】
請求項1又は2に記載の使用において、前記単離ペプチドは、ペプチド:
FLKEPVKEV,SLKEPVKEL,YLKEPVKEL,FLKEPVKEL,ILKEPVHEV,ILKEPVHGV,RVKEPVKEL,DSDAYALNHTLSVEGF,AYALNHTLSVEGF,YALNHTLSVEGF,YALNHTLSVEG,ALNHTLSVEGF,TYASPPLITNVTTRSSATPA.AALCAGWLSQPTPATLQPLA,MLWQKPTAPEQAPAPARPYQ(1−20),QAPAPARPYQGVRVKEPVKE(11−30),GVRVKEPVKELLRRKRGHAS(21−40),LLRRKRGHASSGAAPAPTAV(31−50),SGAAPAPTAVVLPHQPLATY(41−60),VLPHQPLATYTTVGPSCLDM(51−70),TTVGPSCLDMEGSVSAVTEE(61−80),EGSVSAVTEEAALCAGWLSQ(71−90),AALCAGWLSQPTPATLQPLA(81−100),PTPATLQPLAPWTPYTEYVP(91−110),PWTPYTEYVPHEAVSCPYSA(101−120),HEAVSCPYSADMYVQPVCPS(111−130),DMYVQPVCPSYTVVGPSSVL(121−140),YTVVGPSSVLTYASPPLITN(131−150),TYASPPLITNVTTRSSATPA(141−160),VTTRSSATPAVGPPLEGPEH(151−170),VGPPLEGPEHQAPLTYFPWP(161−180),QAPLTYFPWPQPLSTLPTST(171−190),QPLSTLPTSTLQYQPPAPAL(181−200),LQYQPPAPALPGPQFVQLPI(191−210),PGPQFVQLPISIPEPVLQDM(201−220),SIPEPVLQDMEDPRRAASSL(211−231),EDPRRAASSLTIDKLLLEEE(221−241),TIDKLLLEEEDSDAYALNHT(231−251)、及びDSDAYALNHTLSVEGF(241−256)
から成る群より選択されることを特徴とする、使用。
【請求項4】
請求項1から3のいずれか1項の使用において、前記ペプチドは、請求項3に列挙された配列の、9個又はそれ以上のアミノ酸の断片、又は、アミノ酸配列:
DSDAYALNHTLSVEGF,TYASPPLITNVTTRSSATPA,AALCAGWLSQPTPATLQPLA,MLWQKPTAPEQAPAPARPYQ,QAPAPARPYQGVRVKEPVKE,GVRVKEPVKELLRRKRGHAS,LLRRKRGHASSGAAPAPTAV,SGAAPAPTAVVLPHQPLATY,VLPHQPLATYTTVGPSCLDM,TTVGPSCLDMEGSVSAVTEE,EGSVSAVTEEAALCAGWLSQ,AALCAGWLSQPTPATLQPLA,PTPATLQPLAPWTPYTEYVP,PWTPYTEYVPHEAVSCPYSA,HEAVSCPYSADMYVQPVCPS,DMYVQPVCPSYTVVGPSSVL,YTVVGPSSVLTYASPPLITN,TYASPPLITNVTTRSSATPA,VTTRSSATPAVGPPLEGPEH,VGPPLEGPEHQAPLTYFPWP,QAPLTYFPWPQPLSTLPTST,QPLSTLPTSTLQYQPPAPAL,LQYQPPAPALPGPQFVQLPI,PGPQFVQLPISIPEPVLQDM,SIPEPVLQDMEDPRRAASSL,EDPRRAASSLTIDKLLLEEE,TIDKLLLEEEDSDAYALNHT,又はDSDAYALNHTLSVEGF
の修飾種であることを特徴とする、使用。
【請求項5】
請求項1から4のいずれか1項に記載の使用において、請求項1から4のいずれか1項に記載の1種又はそれ以上のペプチドを単独で、或いは組み合わせてコードする核酸配列を用いることを特徴とする、使用。
【請求項6】
請求項1から4のいずれか1項に含まれるペプチドに対して特異的な、及び/又は交差反応性を持つ単離T細胞において、請求項1から4のいずれか1項に記載のペプチド、その断片及び/又はエピトープを用いることによって誘発されることを特徴とする、T細胞。
【請求項7】
請求項6に記載の単離T細胞において、T細胞が、細胞傷害性であることを特徴とする、単離T細胞。
【請求項8】
請求項6に記載の単離T細胞において、T細胞が、CD4+ Tヘルパー細胞であることを特徴とする、単離T細胞。
【請求項9】
請求項1から4のいずれか1項に含まれるペプチドにおいて、核酸配列が、医薬品又はワクチンとして、請求項1から4のいずれか1項に含まれる1種又はそれ以上のペプチド、又は、請求項6から8に記載のT細胞をコードすることを特徴とする、ペプチド。
【請求項10】
請求項1から4のいずれか1項に含まれるペプチドにおいて、核酸配列が、悪性リンパ腫、Bob−1発現腫瘍、自己免疫疾患、HIV−1及びHIV−2感染、及び/又は、Bob−1タンパク質の発現又は過剰発現と相関する疾患又は障害の治療に使用するための、請求項1から4のいずれか1項に含まれる1種又はそれ以上のペプチド、又は、請求項6から8によるT細胞をコードすることを特徴とする、ペプチド。
【請求項11】
請求項1から4のいずれか1項に含まれるペプチドを含む組成物において、核酸配列が、請求項1から4のいずれか1項に含まれる1種又はそれ以上のペプチド、又は、請求項6から8に記載のT細胞、及び製薬学的に受容可能な担体、及び/又は、希釈剤をコードすることを特徴とする、組成物。
【請求項12】
請求項1から4のいずれか1項に含まれるペプチドを含むワクチンにおいて、核酸配列が、Bob−1特異及び/又はBob−1交差反応性T細胞を誘発するために、請求項1から4のいずれか1項に含まれる1種又はそれ以上のペプチド、又は、請求項6から8に記載のT細胞をコードすることを特徴とするワクチン。
【請求項13】
インビトロT細胞集団におけるT細胞であって、Bob−1タンパク、その断片又はエピトープ、或いは、請求項1から4のいずれか1項に含まれる少なくとも1個のペプチドに対して特異的及び/又は交差反応的であるT細胞の数を増加する方法が、
−PBMCの集団を、Bob−1タンパク、その断片又はエピトープ、或いは、請求項1から4のいずれか1項に含まれる少なくとも1個のペプチドに接触させることと;
−選択的に、反応物に免疫ホルモンを加えることと;
−刺激された集団のT細胞増殖の誘発を適当なアッセイで分析することであって、好ましいアッセイは、ELISPOT、クロム放出アッセイ、又は、HLAテトラマ等の可溶性HLAペプチド複合体によるペプチド特異T細胞の直接視覚化である分析と;選択的に、
−刺激されたT細胞であって、Bob−1タンパク質、その断片又はエピトープに対して特異的及び/又は交差反応的であるT細胞を単離することと;
を含むことを特徴とする、方法。
【請求項14】
Bob−1発現と相関する疾患又は障害を診断する方法が、
−患者からPBMCを単離することと;
−Bob−1タンパク質、その断片又はエピトープ、或いは、請求項1から4のいずれか1項に含まれる少なくとも1個のペプチドに、PBMCを接触させることと;
−適当なアッセイにおいて、Bob−1特異的及び/又はBob−1交差反応的T細胞の量を分析することであって、好ましいアッセイは、ELISPOTアッセイ、クロム放出アッセイ、抗原刺激後のT細胞の細胞内又は細胞外サイトカイン染色、又は、HLAテトラマ等の可溶性HLAペプチド複合体による特異的T細胞の直接視覚化である分析と;
−更なる生理的パラメータと、Bob−1特異的又は交差反応的T細胞の量とを分析し、比較することと;
を含むことを特徴とする、方法。
【請求項15】
容器、及び、請求項1から4のいずれか1項に含まれる1種又はそれ以上のペプチドを含む診断キットにおいて、核酸配列が、請求項1から4のいずれか1項に含まれる1種又はそれ以上のペプチド、又は、請求項6から8に記載の少なくとも1種のT細胞をコードすることを特徴とする診断キット。
【請求項16】
Bob−1タンパク質、その断片又はエピトープ、修飾Bob−1タンパク質、その断片又はエピトープ、請求項1から4のいずれか1項に含まれる任意のペプチド、核酸配列が、請求項1から4のいずれか1項に含まれる1種又はそれ以上のペプチド、又は請求項6から8に記載のT細胞をコードする、又は、請求項13若しくは14に記載の方法を、Bob−1タンパク質発現と相関する疾患又は障害の診断する用法。
【請求項17】
これらを必要とする患者のBob−1発現リンパ腫、又はその他のBob−1発現腫瘍を治療する方法が、
−活性化Bob−1特異的及び/又は交差反応性T細胞を患者に投与することであって、Bob−1タンパク質、その断片又はエピトープ、修飾Bob−1タンパク質、その断片又はエピトープ、及び/又は、請求項1から4のいずれか1項に含まれる任意のペプチドとインキュベートすることによってex vivo誘発し、活性化した活性化Bob−1特異的及び/又は交差反応性T細胞を投与することと;選択的に、
−追加の交換療法として免疫グロブリンを投与することと;
を含むことを特徴とする、方法。
【請求項18】
これらを必要とする患者のBob−1発現リンパ腫、又は他のBob−1発現腫瘍を治療する方法が、
−Bob−1特異的T細胞を誘発するために請求項12に記載のワクチンを投与することと;選択的に
−追加の交換療法として免疫グロブリンを投与することと;
を含むことを特徴とする、方法。
【請求項19】
これらを必要とする患者の自己免疫疾患、自己免疫障害、及び/又は、アレルギーを治療する方法が、
−活性化Bob−1特異的及び/又は交差反応性T細胞を患者に投与することであって、Bob−1タンパク質、その断片又はエピトープ、修飾Bob−1タンパク質、その断片又はエピトープ、及び/又は、請求項1から4のいずれか1項に含まれる任意のペプチドとインキュベートすることによってex vivo誘発し、活性化した活性化Bob−1特異的及び/又は交差反応性T細胞を投与することと;選択的に、
−追加の交換療法として免疫グロブリンを投与すること、
を含むことを特徴とする、方法。
【請求項20】
これらを必要とする患者の自己免疫疾患、自己免疫障害、及び/又は、アレルギーを治療する方法が、
−Bob−1特異的T細胞を誘発するために請求項12によるワクチンを投与することと;選択的に、
−追加の交換療法として免疫グロブリンを投与することと;
を含むことを特徴とする、方法。
【請求項21】
生きている動物又はヒトにおいて免疫反応を誘発する方法が、
−Bob−1タンパク質、その断片又はエピトープ、修飾Bob−1タンパク質、その断片又はエピトープ、請求項1から4のいずれか1項に含まれる複数のペプチドの少なくとも1個のペプチド、請求項1から4のいずれか1項に含まれる複数のペプチドの1種以上をコードする核酸配列、請求項6から8によるT細胞、及び/又は、請求項12によるワクチンを、前記生きている動物又はヒトに投与することと;選択的に、
−前記生きている動物又はヒトに対する免疫反応を強化するために免疫ホルモン、アジュバント、又は介在因子を投与することと;
を含む前記方法。
【請求項22】
Bob−1関連自己免疫疾患、特に分類不能型免疫不全、及びHIV−1及びHIV−1による感染症を治療する方法が、
−Bob−1タンパク質、その断片又はエピトープ、修飾Bob−1タンパク質、その断片又はエピトープ、請求項1から4のいずれか1項に含まれる複数のペプチドの少なくとも1個のペプチド、請求項1から4のいずれか1項に含まれる複数のペプチドの1種以上をコードする核酸配列、請求項6から8によるT細胞、及び/又は、請求項12によるワクチンとインキュベート、或いは、それによって変換して得られる未熟、又は半成熟の樹状細胞を、生きている動物又はヒトに投与すること;
を含むことを特徴とする、方法。
【請求項23】
Bob−1関連自己免疫疾患、特に分類不能型免疫不全、及びHIV−1及びHIV−2による感染症を治療する方法が、
−修飾Bob−1タンパク質、その断片又はエピトープ、又は、請求項3に含まれるペプチドから得られる少なくとも1個の修飾ペプチド、又は、請求項3に含まれる複数のペプチドの1種以上をコードする核酸配列から得られる、ペプチドリガンドとして作用する修飾ペプチドとインキュベート、或いは、それによって変換して得られる未熟、又は半成熟の樹状細胞を、生きている動物又はヒトに投与すること;
を含むことを特徴とする、方法。
【図1】


【図2】


【図3a】


【図3b】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3a】


【図3b】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公表番号】特表2008−509878(P2008−509878A)
【公表日】平成20年4月3日(2008.4.3)
【国際特許分類】
【出願番号】特願2007−507757(P2007−507757)
【出願日】平成17年4月14日(2005.4.14)
【国際出願番号】PCT/EP2005/003947
【国際公開番号】WO2005/100390
【国際公開日】平成17年10月27日(2005.10.27)
【出願人】(506345889)フリードリッヒ−アレクサンダー ウニベルジテート アーランガー/ニュールンベルク (1)
【Fターム(参考)】
【公表日】平成20年4月3日(2008.4.3)
【国際特許分類】
【出願日】平成17年4月14日(2005.4.14)
【国際出願番号】PCT/EP2005/003947
【国際公開番号】WO2005/100390
【国際公開日】平成17年10月27日(2005.10.27)
【出願人】(506345889)フリードリッヒ−アレクサンダー ウニベルジテート アーランガー/ニュールンベルク (1)
【Fターム(参考)】
[ Back to top ]

