CCR1受容体アンタゴニストとしてのインダゾール及びピラゾロピリジン化合物
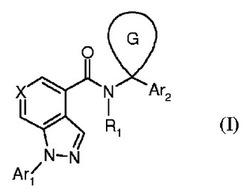
下記式(I)

(I)
(式中、Xは窒素又はC-R2であり;Ar1は、それぞれ任意に1〜3個のRaで置換されていてもよい炭素環、ヘテロアリール又はヘテロシクリルであり;Ar2は、それぞれ任意に1〜3個のRbで置換されていてもよい炭素環、ヘテロアリール又はヘテロシクリルであり;環式Gは、それぞれ任意に1〜2個のR8で置換されていてもよい炭素環、又はヘテロシクリルであり;R1は、水素、C1-6アルキル又はC1-6アルコキシC1-6アルキルである)のCCR1受容体アンタゴニストを開示する。式(I)の化合物を含む組成物、式(I)の化合物の製造方法及び使用方法をも開示する。

(I)
(式中、Xは窒素又はC-R2であり;Ar1は、それぞれ任意に1〜3個のRaで置換されていてもよい炭素環、ヘテロアリール又はヘテロシクリルであり;Ar2は、それぞれ任意に1〜3個のRbで置換されていてもよい炭素環、ヘテロアリール又はヘテロシクリルであり;環式Gは、それぞれ任意に1〜2個のR8で置換されていてもよい炭素環、又はヘテロシクリルであり;R1は、水素、C1-6アルキル又はC1-6アルコキシC1-6アルキルである)のCCR1受容体アンタゴニストを開示する。式(I)の化合物を含む組成物、式(I)の化合物の製造方法及び使用方法をも開示する。
【発明の詳細な説明】
【技術分野】
【0001】
(出願データ)
この出願は、2009年10月21日に出願された米国仮出願第61/253,590号の優先権を主張する。
(発明の分野)
この発明は、アリール-又はヘテロアリール-カルボシクリルアミン、及びアリール-又はヘテロアリール-ヘテロシクリルアミンを含有するインダゾール及びピラゾロピリジンに関するのものであり、CCR1活性のアンタゴニストとして有用であり、ひいては関節リウマチ及び多発性硬化症などの自己免疫疾患を含めたCCR1の活性によって媒介又は持続される種々の疾患及び障害の治療に有用である。この発明は、これらの化合物を含む医薬組成物、種々の疾患及び障害の治療におけるこれらの化合物の使用方法、これらの化合物の調製方法並びにこれらの方法において有用な中間体にも関する。
【背景技術】
【0002】
(発明の背景)
走化性サイトカイン受容体1(CCR1)は、特異的ケモカイン(>50)と相互作用して白血球輸送、顆粒開口放出、遺伝子転写、分裂促進作用及びアポトーシスを媒介する走化性サイトカイン(ケモカイン)受容体の大ファミリー(>20)に属する。ケモカインは、基本的及び炎症性白血球輸送を媒介するそれらの能力で最もよく知られている。少なくとも3種のケモカイン(MIP-1α/CCL3、MCP3/CCL7及びRANTES/CCL5)のCCR1への結合は、単球、マクロファージ及びTH1細胞の、関節リウマチ(RA)及び多発性硬化症(MS)患者の炎症組織への輸送に関与する(Trebst et al. (2001) American J of Pathology 159 p. 1701)。MS患者のCNS内では、マクロファージ炎症性タンパク質1α(MIP-1α)、マクロファージ化学誘引物質タンパク質3(MCP-3)及び血小板やT細胞由来の好酸球走化性物質(regulated on activation, normal T-cell expressed and secreted)(RANTES)が全て見られるが、MSの実験的自己免疫性脳脊髄炎(experimental autoimmune encephalomyelitis)(EAE)モデルのCNS内ではMIP-1α及びRANTESが見られる(概説:Gerard and Rollins (2001) Nature Immunology)。RA患者の炎症滑膜内のマクロファージ及びTh1細胞は、MIP-1α及びRANTESの主プロデューサーであり、持続的にRA患者の滑膜組織に白血球を補充して慢性炎症を伝播する(Volin et al. (1998) Clin. Immunol. Immunopathology; Koch et al. (1994) J. Clin. Investigation; Conlon et al. (1995) Eur. J. Immunology)。CCR1及びそのケモカインリガンドとの相互作用をアンタゴナイズすることは、単球、マクロファージ及びTh1細胞の炎症組織への走化性を遮断し、それによってRA及びMSなどの自己免疫疾患と関連する慢性炎症を寛解させると仮定されている。
【0003】
多発性硬化症のモデルである実験的自己免疫性脳脊髄炎(EAE)と関連する慢性炎症の発生及び進行におけるCCR1の役割の証拠は、CCR1の遺伝子欠失及び小分子アンタゴニストの両方に基づいている。CCR1欠損マウスは活性EAEの感受性低下(55%対100%)及び重症度低下(1.2対2.5)を示すことが分かった(Rottman et al. (2000) Eur. J. Immunology)。さらに、ラットCCR1に対して中程度の親和性を有する(Ki=120nM)、CCR1の小分子アンタゴニストの投与は、静脈内投与した場合にEAEの発症を遅らせ、またその重症度を下げることが分かった(Liang et al. (2000) J. Biol. Chemistry)。CCR1リガンドMIP-1αに特異的な抗体によるマウスの治療が、CNSに補充されるT細胞及びマクロファージの数を減らすことによって、急性及び再発性EAEの発生を予防するのに有効であることも分かっている(Karpus et al. (1995) J. Immunology; Karpus and Kennedy (1997) J. Leucocyte Biology)。このように、少なくとも1つのCCR1リガンドが白血球をCNSに補充し、EAEにおける慢性炎症を伝播し、EAE及びMSにおけるCCR1の役割についてのさらなるin vivoバリデーションをもたらすことが実証されている。
【0004】
RAと関連する慢性炎症の発生及び伝播におけるCCR1のin vivoバリデーションも重要である。例えば、DBA/1マウスのコラーゲン誘発関節炎(collagen induced arthritis)(CIA)モデルにおけるCCR1アンタゴニストの投与が滑膜炎症及び関節破壊を減少させるのに有効であることが分かっている(Plater-Zyberk et al. (1997) Immunology Letters)。別の刊行物は、マウスCCR1の強力アンタゴニストが経口投与したときにLPS加速されたコラーゲン誘発関節炎(CIA)の重症度を減少させる(58%)ことを記載した(Biorganic and MeジCinal Chemistry Letters 15, 2005, 5160-5164)。経口CCR1アンタゴニストによる第Ib相臨床治験の公表結果は、副作用なしで臨床的改善に向かう傾向を実証した(Haringman et al. (2003) Ann. Rheum. Dis.)。18日目に患者の1/3が関節リウマチの徴候及び症状の20%改善(ACR20)を達成し、CCR1陽性細胞は処置患者の滑膜で70%減少し、CD4+T細胞の50%減少、CD8+T細胞の50%減少及びマクロファージの34%減少など、特異的細胞型が有意に減少した。
上記で引用した当該研究のような研究は、MS及びRAにおけるCCR1の役割を支持し、かつCCR1アンタゴニストの開発の治療上の理論的根拠を提供する。
【発明の概要】
【発明が解決しようとする課題】
【0005】
(発明の概要)
本発明は、CCR1とそのリガンドの相互作用を遮断し、ひいては自己免疫疾患、例えば関節リウマチ及び多発性硬化症などのCCR1の活性によって媒介又は持続される種々の疾患及び障害の治療に有用な新規化合物を提供する。この発明は、これらの化合物を含む医薬組成物、種々の疾患及び障害の治療におけるこれらの化合物の使用方法、これらの化合物の調製方法及びこれらの方法で有用な中間体にも関する。
【課題を解決するための手段】
【0006】
(発明の詳細な説明)
その最も広い一般的態様では、本発明は、下記式(I)
【0007】
【化1】

(I)
【0008】
(式中、
Xは、窒素又はC-R2であり;
Ar1は、それぞれ任意に1〜3個のRaで置換されていてもよい炭素環、ヘテロアリール又はヘテロシクリルであり;
Ar2は、それぞれ任意に1〜3個のRbで置換されていてもよい炭素環、ヘテロアリール又はヘテロシクリルであり;
環式Gは、それぞれ任意に1〜2個のRgで置換されていてもよい炭素環、又はヘテロシクリルであり;
R1は、水素、C1-6アルキル又はC1-6アルコキシC1-6アルキルであり;
R2は、水素又はRaであり;
Raは、C1-6アルキル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルチオ、C1-6アルキルスルホニル、C1-6アルコキシカルボニル、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C3-6シクロアルキルアミノ、C1-6アルキルアミノカルボニル、C1-6アシル、C1-6アシルアミノ、C1-6ジアルキルアミノカルボニル、ヒドロキシル、ハロゲン、シアノ、ニトロ、オキソ、R3-S(O)m-NH-、R3-NH-S(O)m-、アリール又はカルボキシルであり;
Rbは、ヒドロキシル、カルボキシル、ハロゲン、-(CH2)n-CN、-(CH2)n-CO2C1-6アルキル、ニトロ、-SO3H、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルC(O)-、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)m-NRe-、R3-NRe-S(O)m(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-(CH2)n-NRcRd、ヘテロシクリル、アリール又はヘテロアリールであり、各Rbは、可能であれば、任意にハロゲン化されるか又は1〜3個のC1-6アルキル、ヒドロキシル、C1-6アシル、C1-6アルコキシカルボニル、C1-6アルキル-S(O)m-、アリール若しくはカルボキシルで置換されていてもよく;
各Rc、Rdは、独立に水素、C1-6アルキル、C1-6アシル、C3-10シクロアルキル、C1-6アルコキシ、ヒドロキシC1-6アルキル、シアノ-C1-6アルキル、C1-6アルキルC1-6アルコキシ、C1-6アルキルスルホニル、C1-6アルコキシカルボニルC0-3アルキル、C1-6アルコキシカルボニルC3-10シクロアルキル、-(CH2)n-C(O)-NReRf又は-(CH2)n-NReRfであり;
各Re、Rfは、独立に水素、C1-6アルキル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルコキシC1-6アルキル、モノ若しくはジC1-6アルキルアミノC1-6アルキル、ヒドロキシC1-6アルキル又はC1-6アシルであり;
Rgは、C1-6アルキル(ここで、該C1-6アルキルは、任意に部分的又は完全にハロゲン化されていてもよい)、C2-6アルケニル、炭素環、C1-6アルコキシ、カルボシクリル-C1-6アルコキシ、カルボシクリル-C1-6アルキル、ヒドロキシC1-6アルキル、ヒドロキシル、-(CH2)n-CO2C1-6アルキル又はオキソであり;
R3は、水素、C1-6アルキル、C3-6シクロアルキル、ヘテロシクリル(CH2)0-1、モノ-若しくはジ-C1-6アルキルアミノ、モノ-若しくはジ-C1-6アルキルアミノ(CH2)2-3N(Re)-、アリール又はヘテロアリールであり、それぞれ任意に1〜3個のC1-6アルキル、C3-6シクロアルキル、C1-6アルコキシ、ハロゲン、ヒドロキシル、オキソ、カルボキシル、-C(O)NReRf、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C1-6アルコキシカルボニル又はC1-6アシルアミノで置換されていてもよく;
各n、yは、独立に0〜3であり;
各mは、独立に0〜2である)
の化合物又はその医薬的に許容できる塩を提供する。
【発明を実施するための形態】
【0009】
本発明の別の実施形態では、直前に与えたとおりの式(I)の化合物であり、かつ式中、
環式Gが、任意に1〜2個のRgで置換されていてもよい炭素環である
化合物が提供される。
本発明の別の実施形態では、直前に与えたとおりの式(I)の化合物であり、かつ式中、
Xが窒素であり;
Ar1が、任意に1〜3個のRaで置換されていてもよい炭素環であり;
Ar2が、それぞれ任意に1〜3個のRbで置換されていてもよい炭素環又はヘテロアリーであり;
R1が水素であり;
Raが、C1-3アルキル、C1-3アルコキシ、ジ-C1-6アルキルアミノ、メチルスルホニル、ハロゲン、又はシアノであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-(CH2)n-CN、-(CH2)n-CO2C1-6アルキル、ニトロ、-SO3H、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルC(O)-、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)m-NRe-、R3-NRe-S(O)m(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-(CH2)n-NRcRd、ヘテロシクリル、アリール又はヘテロアリールであり、各Rbは、可能であれば、任意にハロゲン化されるか又は1〜3個のC1-6アルキル、C1-6アシル、C1-6アルコキシカルボニル、C1-6アルキル-S(O)m-、アリール若しくはカルボキシルで置換されていてもよく;
R3が、水素、C1-6アルキル、C3-6シクロアルキル、ヘテロシクリル(CH2)0-1、モノ-若しくはジ-C1-6アルキルアミノ、モノ-若しくはジ-C1-6アルキルアミノ(CH2)2-3N(C1-6アルキル)-、アリール又はヘテロアリールであり、それぞれ任意に1〜2個のC1-6アルキル、C3-6シクロアルキル、C1-6アルコキシ、ハロゲン、ヒドロキシル、オキソ、カルボキシル、-C(O)NReRf、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C1-6アルコキシカルボニル又はC1-6アシルアミノで置換されていてもよい
化合物が提供される。
【0010】
本発明のさらなる実施形態では、直前に与えたとおりの式(I)の化合物であり、かつ式中、
Ar1が、1〜2個のRaで置換されているフェニルであり;
Ar2が、それぞれ任意に1〜2個のRbで置換されていてもよいフェニル、チアジアゾリル、オキサジアゾリル、ピリミジニル、フラニル、チアゾリル又はピリジルであり;
環式Gがシクロプロピル又はシクロブチルであり;
Raがハロゲンであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-CF3、-CN、-SO3H、C1-3アルキル、C3-6シクロアルキル C1-3アルコキシ、-(CH2)n-CO2C1-3アルキル、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)2-NRe-、R3-NRe-S(O)2(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-NRcRd、又はモルフォリニルであり;
各Rc、Rdが、独立に水素、C1-3アルキル、C1-3アシル、シアノ-C1-3アルキル、C1-3アルコキシカルボニルC0-3アルキル、C1-3アルコキシカルボニルC3-6シクロアルキル、又は-(CH2)n-C(O)-NReRfであり;
各Re、Rfが、独立に水素又はC1-3アルキルであり;
R3が、水素又はそれぞれ任意に1〜2個のC1-6アルコキシ若しくはオキソで置換されていてもよいC1-6アルキルである
化合物が提供される。
【0011】
本発明の別の実施形態では、最も広い一般的実施形態で与えたとおりの式(I)の化合物であり、かつ式中、
環式Gがシクロプロピルであり;
Raが-F又は-Clであり;
Rbが、-CH3、カルボキシル、-F、-Cl、-Br、-I、-CF3、シクロプロピル、-OCH3、-CO2Me、-NRcRd、-CH2-NRcRd、R3-S(O)m-、R3-S(O)2-NRe-、R3-NRe-S(O)2-、-NRf-C(O)-Re、-C(O)NRcRd又はモルフォリニルであり;
各Rc、Rdが、独立に水素、-CH3、-C(O)CH3、-CH2CN、C1-4アルコキシカルボニル、メトキシカルボニル-C1-2アルキル-、メトキシカルボニル-C3シクロアルキル-又は-(CH2)-C(O)-NReRfであり;
各Re、Rfが、独立に水素又は-CH3であり;
R3が水素又はそれぞれ任意に1〜2個の-OCH3若しくはオキソで置換されていてもよいC1-4アルキルである
化合物が提供される。
【0012】
本発明の別の実施形態では、最も広い一般的実施形態で与えたとおりの式(I)の化合物であり、かつ式中、
XがC-R2であり;
Ar1が、任意に1〜3個のRaで置換されていてもよい炭素環であり;
Ar2が、それぞれ任意に1〜3個のRbで置換されていてもよい炭素環又はヘテロアリールであり;
環式Gが、任意に1〜2個のRgで置換されていてもよい炭素環であり;
R1が水素であり;
R2が水素又はRaであり;
Raが、C1-3アルキル、C1-3アルコキシ、ジ-C1-6アルキルアミノ、メチルスルホニル、ハロゲン、又はシアノであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-(CH2)n-CN、-(CH2)n-CO2C1-6アルキル、ニトロ、-SO3H、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルC(O)-、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)m-NRe-、R3-NRe-S(O)m(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-(CH2)n-NRcRd、ヘテロシクリル、アリール又はヘテロアリールであり、各Rbは、可能であれば、任意にハロゲン化されるか又は1〜3個のC1-6アルキル、C1-6アシル、C1-6アルコキシカルボニル、C1-6アルキル-S(O)m-、アリール若しくはカルボキシルで置換されていてもよく;
各Rc、Rdが、独立に水素、C1-6アルキル、C1-6アシル、C3-10シクロアルキル、C1-6アルコキシ、ヒドロキシC1-6アルキル、シアノC1-6アルキル、C1-6アルキルC1-6アルコキシ、C1-6アルキルスルホニル、C1-6アルコキシカルボニルC0-3アルキル、C1-6アルコキシカルボニルC3-10シクロアルキル、-(CH2)n-C(O)-NReRf又は-(CH2)n-NReRfであり;
各Re、Rfが、独立に水素、C1-6アルキル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルコキシC1-6アルキル、モノ若しくはジC1-6アルキルアミノC1-6アルキル、ヒドロキシC1-6アルキル又はC1-6アシルであり;
R3が、水素、C1-6アルキル、C3-6シクロアルキル、ヘテロシクリル(CH2)0-1、モノ-若しくはジ-C1-6アルキルアミノ、モノ-若しくはジ-C1-6アルキルアミノ(CH2)2-3N(C1-6アルキル)-、アリール又はヘテロアリールであり、それぞれ任意に1〜2個のC1-6アルキル、C3-6シクロアルキル、C1-6アルコキシ、ハロゲン、ヒドロキシル、オキソ、カルボキシル、-C(O)NReRf、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C1-6アルコキシカルボニル又はC1-6アシルアミノで置換されていてもよい
化合物が提供される。
【0013】
本発明のさらなる実施形態では、直前で与えたとおりの式(I)の化合物であり、かつ式中、
Ar1が、1〜2個のRaで置換されているフェニルであり;
Ar2が、それぞれ任意に1〜2個のRbで置換されていてもよいフェニル、チアジアゾリル、オキサジアゾリル、ピリミジニル、フラニル、チアゾリル又はピリジルであり;
環式Gが、シクロプロピル又はシクロブチルであり;
Raが、C1-3アルキル、メチルスルホニル、ハロゲン、又はシアノであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-CF3、-CN、-SO3H、C1-3アルキル、C3-6シクロアルキル C1-3アルコキシ、-(CH2)n-CO2C1-3アルキル、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)2-NRe-、R3-NRe-S(O)2(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-NRcRd、又はモルフォリニルであり;
各Rc、Rdが、独立に水素、C1-3アルキル、C1-3アシル、シアノ-C1-3アルキル、C1-3アルコキシカルボニルC0-3アルキル、C1-3アルコキシカルボニルC3-6シクロアルキル、又は-(CH2)n-C(O)-NReRfであり;
各Re、Rfが、独立に水素又はC1-3アルキルであり;
R3が、水素又はそれぞれ任意に1〜2個のC1-6アルコキシ若しくはオキソで置換されていてもよいC1-6アルキルである
化合物が提供される。
【0014】
本発明の別の実施形態では、直前で与えたとおりの式(I)の化合物であり、かつ式中、
環式Gがシクロプロピルであり;
Raが、-F又は-Cl、メチル、メチルスルホニル又はシアノであり;
Rbが、-CH3、カルボキシル、-F、-Cl、-Br、-I、-CF3、シクロプロピル、-OCH3、-CO2Me、-NRcRd、-(CH2)-NRcRd、R3-S(O)m-、R3-S(O)2-NRe-、R3-NRe-S(O)2-、-NRf-C(O)-Re、-C(O)NRcRd又はモルフォリニルであり;
各Rc、Rdが、独立に水素、-CH3、-C(O)CH3、-CH2CN、C1-4アルコキシカルボニル、メトキシカルボニル-C1-2アルキル-、メトキシカルボニル-C3シクロアルキル-又は-(CH2)-C(O)-NReRfであり;
各Re、Rfが、独立に水素又は-CH3であり;
R3が水素又はそれぞれ任意に1〜2個の-OCH3若しくはオキソで置換されていてもよいC1-4アルキルである
化合物が提供される。
【0015】
本発明の別の実施形態では、適用できる場合に上述した実施形態のいずれか1つに従う式(I)の化合物であり、かつ式中、
環式Gが、シクロプロピル又はシクロブチルである
化合物が提供される。
本発明の別の実施形態では、直前で与えたとおりの式(I)の化合物であり、かつ式中、
環式Gがシクロプロピルである
化合物が提供される。
本発明の別の実施形態では、適用できる場合に上述した実施形態のいずれか1つに従う式(I)の化合物であり、かつ式中、
Rcが水素又はC1-6アルキルであり、かつRdが、C1-6アシル、シアノ-C1-6アルキル-、C1-6アルコキシカルボニル-C0-3アルキル-、C1-6アルコキシカルボニルC3-10シクロアルキル、又は-(CH2)n-C(O)-NReRfであり;
各Re、Rfが、独立に水素、C1-6アルキルである
化合物が提供される。
本発明の別の実施形態では、適用できる場合に上述した実施形態のいずれか1つに従う式(I)の化合物であり、かつ式中、
Ar2が、それぞれ任意に1又は2個のRbで置換されていてもよいフェニル、ピリミジニル、フラニル、チアゾリル又はピリジルであり;
Rbが、-SO2Me、-I、-Br、-Cl、-CF3、-OMe、-NMe2、-CONHMe、-SO2NH2である
化合物が提供される。
本発明の別の実施形態では、適用できる場合に上述した実施形態のいずれか1つに従う式(I)の化合物であり、かつ式中、Ar2が下記である化合物又はその医薬的に許容できる塩が提供される。
【0016】
【化2】

【0017】
本発明の別の実施形態では、適用できる場合に上述した実施形態のいずれか1つに従う式(I)の化合物であり、かつ式中、
Rgが、
i)C1-2アルキル、-CF3、C2アルケニル、フェニル、C1-4アルコキシ、カルボシクリルCH2O-、カルボシクリルCH2- -CH2OH、ヒドロキシル、-CO2C1-4アルキル又はオキソ;
又は
ii)メチル、ビニル、-CF3、フェニル、-CH2OH、又はヒドロキシルである
化合物が提供される。
一般的合成スキーム、実施例、及び技術上周知の方法で製造可能な本発明の代表化合物を以下に示す。
【0018】
表I

【0019】
(表I続き)

【0020】
(表I続き)

【0021】
(表I続き)

【0022】
(表I続き)

【0023】
(表I続き)

【0024】
(表I続き)

【0025】
(表I続き)

【0026】
(表I続き)

【0027】
(表I続き)

【0028】
(表I続き)

【0029】
(表I続き)

【0030】
(表I続き)

【0031】
(表I続き)

【0032】
(表I続き)

【0033】
(表I続き)

(a) HPLC-MS法については合成例セクションを参照されたい。
(b) 全ての化合物について観測[M+H]+が報告されている。臭素含有化合物については2つの臭素異性体(すなわち、79Br及び81Br)の観測[M+H]+が報告されている。
【0034】
この出願で上述した全ての化合物では、命名法が構造と矛盾する場合、化合物は構造によって定義されるものと解釈すべきである。
本発明は、本発明の1種以上の化合物、又はその医薬的に許容できる誘導体を活性物質として含有し、任意に通常の賦形剤及び/又は担体と組み合わせてよい医薬組成物にも関する。
本発明の化合物には、それらの同位体標識形も含まれる。本発明の組合せの活性薬の同位体標識形は、前記活性薬の1個以上の原子が、通常自然界に見られる前記原子の原子質量又は質量数と異なる原子質量又は質量数を有する原子と置き換わっているという事実を別にすれば、前記活性薬と同一である。容易に商業的に入手でき、かつよく確立された手順に従って本発明の組合せの活性薬に取り込める同位体の例としては、水素、炭素、窒素、酸素、リン、フッ素及び塩素の同位体、例えば、それぞれ、2H、3H、13C、14C、15N、18O、17O、31P、32P、35S、18F、及び36Clが挙げられる。1個以上の上記同位体及び/又は他原子の他の同位体を含有する、本発明の組合せの活性薬、そのプロドラッグ、又はどちらかの医薬的に許容できる塩は、本発明の範囲内であると考えられる。
【0035】
本発明は、ラセミ体及びラセミ混合物、単一のエナンチオマー、ジアステレオマー混合物並びに個々のジアステレオマーとして存在し得る、1個以上の不斉炭素原子を含有する上記いずれの化合物の使用をも包含する。異性体は、エナンチオマー及びジアステレオマーであると定義されるものとする。これらの化合物の全ての該異性形は、明示的に本発明に包含される。各ステレオジェン炭素はR若しくはS配置、又は組合せの配置にあり得る。
本発明の一部の化合物は、複数の互変異性形で存在し得る。本発明は、全ての該互変異性体の使用方法を包含する。
この明細書で使用する全ての用語は、特に指定のない限り、当技術分野で周知のようにそれらの通常の意味に解釈するものとする。例えば、「C1-4アルコキシ」は、末端酸素を有するC1-4アルキル、例えばメトキシ、エトキシ、プロポキシ、ブトキシ等である。全てのアルキル、アルケニル及びアルキニル基は、構造的に可能であり、かつ特に指定のない限り、分岐又は非分岐と解釈するものとする。他のさらに具体的な定義は以下のとおりである。
炭素環には、3〜12個の炭素原子を含有する炭化水素環がある。これらの炭素環は芳香族又は非芳香族のどちらの環系であってもよい。非芳香族環系は一不飽和又は多不飽和であり得る。好ましい炭素環としては、限定するものではないが、シクロプロピル、シクロブチル、シクロペンチル、シクロペンテニル、シクロヘキシル、シクロヘキセニル、シクロヘプタニル、シクロヘプテニル、フェニル、インダニル、インデニル、ベンゾシクロブタニル、ジヒドロナフチル、テトラヒドロナフチル、ナフチル、デカヒドロナフチル、ベンゾシクロヘプタニル及びベンゾシクロヘプテニルが挙げられる。シクロブタニルとシクロブチルのようなシクロアルキルの一定の用語は互換的に用いられる。
用語「ヘテロ環」は、安定な非芳香族4〜8員(好ましくは、4又は6員)単環式又は非芳香族8〜11員二環式又はスピロ環式ヘテロ環基を意味し、飽和又は不飽和のいずれであってもよい。各ヘテロ環は、炭素原子と、1個以上、好ましくは1〜4個の、窒素、酸素及びイオウから選択されるヘテロ原子とから成る。ヘテロ環は、結果として安定構造の生成をもたらす、該環のいずれの原子によっても付着され得る。
用語「ヘテロアリール」は、1〜4個のN、O及びS等のヘテロ原子を含有する芳香族5〜8員単環式又は8〜11員二環式環を意味するものと解釈すべきである。
特に指定のない限り、ヘテロ環及びヘテロアリールとしては、限定するものではないが、例えば、フラニル、ピラニル、ベンゾオキサゾリル、ベンゾチアゾリル、ベンゾイミダゾリル、テトラヒドロピラニル、ジオキサニル、ジオキソラニル、テトラヒドロフラニル、オキサゾリル、イソオキサゾリル、チアゾリル、ピラゾリル、ピロリル、イミダゾリル、チエニル、チアジアゾリル、チオモルフォリニル、1,1-ジオキソ-1λ6-チオモルフォリニル、モルフォリニル、ピリジル、ピリミジニル、ピリダジニル、ピラジニル、トリアジニル、ピロリジニル、ピペリジニル、ピペラジニル、プリニル、キノリニル、ジヒドロ-2H-キノリニル、イソキノリニル、キナゾリニル、インダゾリル、チエノ[2,3-d]ピリミジニル、インドリル、イソインドリル、ベンゾフラニル、ベンゾピラニル及びベンゾジオキソリルが挙げられる。
本明細書では、用語「ヘテロ原子」は、炭素以外の原子、例えばO、N、S及びP等を意味するものと解釈すべきである。
【0036】
全てのアルキル基又は炭素鎖では、1個以上の炭素原子が任意に、ヘテロ原子:O、S又はNと置き換わることができ、Nが置換されていなければそれはNHであると解釈すべきであり、ヘテロ原子は、分岐又は非分岐鎖内の末端炭素原子又は内部炭素原子のどちらとも置き換わり得ることをも理解すべきである。このような基は、オキソ等の基で上述したように置換されて、限定するものではないが、アルコキシカルボニル、アシル、アミド及びチオキソ等の定義をもたらし得る。
本明細書では、用語「アリール」は、本明細書で定義どおりの芳香族炭素環又はヘテロアリールを意味するものと解釈すべきである。各アリール又はヘテロアリールには、特に指定のない限り、その部分的又は完全に水素化された誘導体が含まれる。例えば、キノリニルにはデカヒドロキノリニル及びテトラヒドロキノリニルが含まれ、ナフチルにはその水素化誘導体、例えばテトラヒドロナフチルが含まれる。当業者には、本明細書に記載のアリール及びヘテロアリール化合物の他の部分的又は完全に水素化された誘導体が明らかであろう。
本明細書では、「窒素」及び「イオウ」には、窒素及びイオウのいずれの酸化形並びにいずれの塩基性窒素の四級化形をも含まれる。例えば、-S-C1-6アルキル基では、特に指定のない限り、これは-S(O)-C1-6アルキル及び-S(O)2-C1-6アルキルを包含するものと解釈すべきである。
【0037】
用語「アルキル」は、1〜10個の炭素原子を含有する飽和脂肪族基又は2〜12個の炭素原子を含有する一不飽和若しくは多不飽和脂肪族炭化水素基を表す。一不飽和若しくは多不飽和脂肪族炭化水素基は、それぞれ少なくとも1つの二重結合又は三重結合を含有しなければならない。「アルキル」は分岐及び非分岐の両アルキル基を表す。「alk」又は「アルキル」接頭辞を用いたいずれの合成語も「アルキル」の上記定義に従う類似語を表す。例えば、「アルコキシ」、「アルキチオ(alkythio)」等の用語は、酸素又はイオウ原子を介して第2の基に結合しているアルキル基を表す。「アルカノイル」は、カルボニル基(C=O)に結合しているアルキル基を表す。
用語「ハロゲン」は、本明細書で用いられる場合、臭素、塩素、フッ素又はヨウ素、好ましくはフッ素を意味するものと解釈すべきである。「ハロゲン化」、「部分的又は完全にハロゲン化された」;部分的又は完全にフッ素化された;「1個以上のハロゲン原子で置換された」という定義は、例えば、1個以上の炭素原子についてモノハロ、ジハロ又はトリハロ誘導体を包含する。アルキルでは、非限定例は-CH2CHF2、-CF3等であろう。
本明細書に記載の各アルキル、炭素環、ヘテロ環若しくはヘテロアリール、又はその類似体は、任意に部分的又は完全にハロゲン化されることがあるものと解釈すべきである。
【0038】
本発明の化合物は、当業者には分かるように「化学的に安定している」と考えられる化合物のみである。例えば、「ダングリング原子価(dangling valency)」、又は「カルボアニオン」を有するであろう化合物は、本明細書で開示される発明方法により企図される化合物ではない。
本発明は、式(I)の化合物の医薬的に許容できる誘導体を包含する。「医薬的に許容できる誘導体」は、いずれの医薬的に許容できる塩若しくはエステル、又は患者に投与すると本発明に有用な化合物を(直接又は間接的に)もたらし得るいずれの他の化合物も、或いは薬理学的に活性な代謝物又はその薬理学的に活性な残基を表す。薬理学的に活性な代謝物とは、酵素的又は化学的に代謝され得る本発明のいずれの化合物をも意味するものと解釈すべきである。これには、例えば、本発明の化合物のヒドロキシル化又は酸化誘導体が含まれる。
医薬的に許容できる塩には、医薬的に許容できる無機及び有機酸並びに無機及び有機塩基から誘導される当該塩がある。適切な酸の例としては、塩酸、臭化水素酸、硫酸、硝酸、過塩素酸、フマル酸、マレイン酸、リン酸、グリコール酸、乳酸、サリチル酸、コハク酸、トルエン-p-硫酸、酒石酸、酢酸、クエン酸、メタンスルホン酸、ギ酸、安息香酸、マロン酸、ナフタレン-2-硫酸及びベンゼンスルホン酸が挙げられる。シュウ酸のような他の酸は、それ自体は医薬的に許容性でないが、化合物及びそれらの医薬的に許容できる酸付加塩を得るときの中間体として有用な塩の調製で利用可能である。適切な塩基から誘導される塩としては、アルカリ金属(例えば、ナトリウム)、アルカリ土類金属(例えば、マグネシウム)、アンモニウム及びN-(C1-C4アルキル)4+塩が挙げられる。
【0039】
さらに、本発明の化合物のプロドラッグの使用が本発明の範囲内である。プロドラッグは、単純な化学変換によって変化して本発明の化合物を生成する当該化合物を包含する。単純な化学変換には、加水分解、酸化及び還元がある。詳細には、プロドラッグを患者に投与すると、プロドラッグが上記開示化合物に変換され、これによって所望の薬理作用を与えることができる。
後述する一般的合成方法を用いて式Iの化合物を製造することができ、これらの方法も本発明の一部を構成する。
【0040】
(一般的合成方法)
本発明は、式Iの化合物の製造方法をさらに提供する。以下に示す一般的方法及び実施例、並びに当業者に周知であり、かつ化学文献に報告された方法によって本発明の化合物を調製することができる。
特に指定のない限り、当業者は、溶媒、温度、圧力、その他の反応条件を容易に選択し得る。「合成例」セクションで具体的手順を提供する。
アリール-又はヘテロアリール-シクロアルキルアミン中間体は商業的に入手可能であり、又は一般的手順若しくは下記参考文献(参照によってその全体をここに援用する)に従って調製され、或いは化学文献に記載の方法を用いて当業者によって調製され得る。
アリール-又はヘテロアリール-シクロプロピルアミンは、グリニャール試薬(Szymoniak, J. et al. J. Org. Chem. 2002, 67, 3965、及びBertus, P. et al. J. Org. Chem. 2003, 68, 7133)又は亜鉛試薬(de Meijere, A. et al. Org. Lett. 5, 2003, 753)を用いる対応アリールニトリル又はヘテロアリールニトリルのチタンアルコキシド媒介還元的シクロプロパン化によって合成可能である。或いは、アリール-シクロプロピルアミンは、アリールニトリル又はアリールエステルからシクロアルキル化(例えば、Jonczyk, A. et al. Org. Prep. Proc. 27, 1995, 355)後、ニトリル又はエステル基のカルボン酸への変換、結果として生じるカルボン酸のカルバミン酸エステルへのクルチウス転位(例えば、Hanano, T. et al. Bioorg. Med. Chem. Lett. 10, 2000, 881)、及び結果として生じるカルバミン酸エステルの脱保護によって合成可能である。
アミド結合形成は、技術上周知の標準的なカップリング条件(例えば、参照によってその全体をここに援用するBodanszky, M. The Practice of Peptide Synthesis, Springer-Verlag, 1984)、例えばカルボン酸とアミンを1-(3-ジメチルアミノプロピル)-3-エチルカルボジイミド(EDC)及び1-ヒドロキシベンゾトリアゾールの存在下で反応させることによって行える。薄層クロマトグラフィー(TLC)等の定法によって反応の進行をモニターすることができる。カラムクロマトグラフィー、HPLC又は再結晶などの技術上周知の方法で中間体及び生成物を精製することができる。
【0041】
以下及び「合成例」セクションに記載の方法を用いて式Iaの化合物(すなわち、Xが窒素である式Iの化合物、スキームI、II及びIII)、及び式Ibの化合物(すなわち、XがC-R2である式Iの化合物、スキームIV及びV)を調製することができる。下記スキーム中、Ar1、Ar2、環式G、X、R1及びR2は、式Iの詳細な説明で定義した意味を有するものとする。
下記スキームI〜IIIに従って式Iaの化合物を調製することができる。
【0042】
スキームI
【化3】

【0043】
スキームIに示すように、酢酸ナトリウムの存在下かつ適切な溶媒、例えばEtOH中で、Ar1を有している式IIIの適切なヒドラジン(遊離塩基又は適切な塩形態、例えば塩酸塩)を3,5-ジブロモ-4-ピリジンカルボキサルデヒドIIと反応させて式IVのヒドラゾンをもたらし得る。式IVの化合物を適切な試薬、例えばジアミンリガンド(例えば、trans-N,N’-ジメチルシクロヘキサン-1,2-ジアミン)、銅塩(例えば、CuI)、塩基(例えば、K2CO3)、及び溶媒(例えば、N-メチル-2-ピロリジノン)の存在下で環化させて式Vの化合物をもたらし得る。密封圧力容器内にて加圧されたCO雰囲気下(好ましくは約15バール)、適切なクロスカップリング試薬、例えばPd触媒(例えば、Pd(PhCN)2Cl2)、リガンド[例えば、1,1-ビス(ジフェニルホスフィノ)フェロセン(dppf)]、塩基(例えば、Et3N)、及び溶媒(例えば、トルエン)の存在下でブロモ-アザインダゾールVを式VIの適切なアミンと加熱して式Iaの所望化合物を与え得る。
【0044】
スキームII
【化4】

【0045】
或いは、スキームIIに示す一般手順に従って式Iaの化合物を合成することができる。式Vのブロモ-アザインダゾールを加圧CO雰囲気下、無水エタノール中で上述したように適切なPd触媒、リガンド及び塩基の存在下で加熱して式VIIのエチルエステルをもたらし、これをメタノール水溶液等の適切な溶媒系中で適切な水酸化物塩基(例えば、KOH)により加水分解して式VIIIのカルボン酸を与え得る。カルボン酸VIIIを技術上周知のアミドカップリング条件下で式VIの適切なアミンと反応させてよい。例えば、適切な溶媒(例えば、ジメチルホルムアミド又はN-メチルピロリジノン)中、式VIの適切なアミン、適切な塩基(例えば、トリエチルアミン又はN,N-ジイソプロピルエチルアミン)の存在下で酸VIIIを適切な活性化試薬、例えば塩化チオニル、塩化オキサリル、(ベンゾトリアゾール-1-イルオキシ)トリピロリジノホスホニウム-ヘキサフルオロホスファート(PyBOP)、O-(7-アザベンゾトリアゾール-1-イル)-N,N,N’,N’-テトラメチルウロニウムヘキサフルオロホスファート(HATU)、O-(ベンゾトリアゾール-1-イル)-N,N,N’,N’-テトラメチルウロニウムヘキサフルオロホスファート(HBTU)、又はO-(ベンゾトリアゾール-1-イル)-N,N,N’,N’-テトラメチルウロニウムテトラフルオロボラート(TBTU)等で処理して式Iaの所望化合物をもたらし得る。
【0046】
スキームIII
【化5】

【0047】
或いは、スキームIIIに示す合成シークエンスに従って式VIIIのカルボン酸を調製することができる。塩基(例えば、KOH水溶液、NaOH水溶液、LiOH水溶液、CsOH水溶液、NaOMe、NaOEt、KOt-Bu又はKOt-アミル)の存在下、適切な温度(好ましくは約80℃)で極性非プロトン性溶媒(例えば、NMP、DMF、DMAC、又はDMPU)を用いて式IIの化合物を式IIIの適切なヒドラジン(遊離塩基又は適切な塩形態、例えば塩酸塩)と反応させて式Vの化合物をもたらし得る。THF、MTBE、Et2O、DME又はジオキサン等の適切な極性非プロトン性溶媒中、適切な反応温度(好ましくは約-20℃)でブロモ-アザインダゾールVを適切なグリニャール試薬(例えば、R-MgCl、式中、Rはイソプロピル、n-ブチル、sec-ブチル及びシクロヘキシルから選択され得る)、及びCO2と反応させて式VIIIのカルボン酸を与え、これを上述したように式Iの化合物に変えることができる。
式Ibの化合物は下記スキームIV及びVに示すように調製可能である。これらのスキーム中、Ar1、Ar2、G、X、R1及びR2は、式Iの化合物の詳細な説明で定義した意味を有するものとする。
【0048】
スキームIV
【化6】

【0049】
スキームIVに示すように、技術上周知のアミド結合カップリング条件、例えば上記条件を用いて式IXのインダゾール-4-カルボン酸を式VIの適切なアミンに連結させ得る。結果として生じるインダゾール-4-カルボキサミドを、化学文献で知られているクロスカップリング条件下、例えば、適切な溶媒(例えば、DMF)中、適切な試薬、例えば触媒(例えば、CuI)、塩基(例えば、K2CO3)、及びリガンド(例えば、ラセミtrans-N,N’-ジメチルシクロヘキサン-1,2-ジアミン)の存在下で適切な温度(好ましくは約120℃)にて加熱下、式XIの適切なハロゲン化アリールと反応させて式Ibの化合物をもたらし得る。
或いは、下記スキームVに示すように、式Ibの化合物を合成することができる。
【0050】
スキームV
【化7】

【0051】
技術上周知のエステル化条件、例えば適切な溶媒系(例えば、メタノール及びトルエン)中でのトリメチルシリルジアゾメタンによる処理を利用して式IXのインダゾール-4-カルボン酸をその対応する式XIIのカルボン酸エステルに変換することができる。エステルXIIを上記クロスカップリング条件下で式XIの適切なハロゲン化アリールと反応させて式XIIIのインダゾール-4-カルボン酸エステルをもたらし、これを適切な水性溶媒系(例えば、水及びメタノール)中での適切な塩基(例えば、NaOH)による処理のような標準的な加水分解条件下で式XIVの酸に変えることができる。前述したように、技術上周知のアミドカップリング条件下でアミンVIと反応させることによって、式XIVの酸を式Ibの化合物に変えることができる。
上記方法で調製された式Iの化合物をさらに技術上周知かつ下記「合成例」セクションで例示される方法によって式Iのさらなる化合物に変えることができる。
以下(すなわち、スキームVI〜IX)及び「合成例」セクションに記載の方法を用いて中間体VIを調製し、これを式Iの化合物の調製で使用することができる。下記スキーム中、環式G、Ar2及びRbは、式Iの化合物の詳細な説明で定義した意味を有するものとする。
式VIaの中間体(すなわち、Ar2が1,3,4-チアゾールである式VIの中間体)は下記スキームVIに従って調製可能である。
【0052】
スキームVI
【化8】

【0053】
スキームVIに示すように、式XV(式中、PGは適切な保護基(例えば、Cbz)である)のアミノ酸を上記条件のような技術上周知のアミドカップリング条件を利用してBoc保護ヒドラジンXVIと連結してBoc保護ヒドラジドXVIIをもたらし得る。式XVIIの化合物をトルエン等の適切な溶媒中、適切な温度(例えば、約90℃)でローソン試薬(Lawesson’s Reagent)と反応させて、対応するBoc保護チオヒドラジドをもたらし、これを例えばジオキサン中4NのHClのような適切な酸を用いて脱保護して、チオヒドラジドXVIIIの適切な塩形態(例えば、塩酸塩)をもたし得る。式XVIIIの化合物を適切な試薬、例えばジエチルクロロホスファートXIX及び適切な塩基(例えば、Et3N)の存在下でDMFと反応させて、対応する1,3,4-チアゾールをもたらし、これを適切な試薬(例えば、酢酸中48%のHBr)で脱保護して式VIaの中間体を与える得る。
さらに、式VIbの中間体(すなわち、Ar2が1,2,4-オキサジアゾールである式VIの中間体)は下記スキームVIIに従って調製可能である。
【0054】
スキームVII
【化9】

【0055】
スキームVIIに示すように、上記条件のような標準的なアミド結合カップリング条件を利用し、かつ適切なアンモニウム塩、例えば炭酸アンモニウム、適切な塩基(例えば、Et3N)及び適切な溶媒(例えば、DMF)の存在下で式XVの適切に保護されたアミノ酸(すなわち、PGは適切な保護基、例えばCbzである)を対応するアミドXXに変えることができる。式XXのアミドを適切な溶媒(例えば、DMF)の存在下及び適切な温度(例えば、約0℃〜30℃)で適切な脱水試薬、例えば塩化シアヌルと反応させて式XXIのニトリルをもたらし得る。適切な塩基、例えば炭酸カリウムの存在下、適切な溶媒(例えば、エタノール)中かつ適切な温度(例えば、約79℃)で化合物XXIをヒドロキシルアミン塩酸塩と反応させて式XXIIの化合物をもたらし得る。適切な溶媒(例えば、DMF)中、かつ適切な条件(例えば、約100℃で加熱)下で技術上周知のアミド結合カップリング試薬(例えば、CDI)を用いてアミドキシムXXIIを式XXIIIの適切なカルボン酸と反応させて、対応する1,2,4-オキサジアゾール誘導体を与え、これを上述したようにN-脱保護して式VIbの中間体を与え得る。
式VIcの中間体(すなわち、Ar2が1,2,4-オキサジアゾールの異なる位置異性体である式VIの中間体)は、下記スキームVIIIに従って調製可能である。
【0056】
スキームVIII
【化10】

【0057】
式XXIVのアミドキシムは、上述した適切な条件下で対応するニトリルにヒドロキシルアミンを添加して調製し得る。スキームVIIIに示すように、適切な溶媒、例えばDMF中、かつ適切な条件(例えば、約100℃で加熱)下で適切なアミドカップリング試薬、例えばCDIを利用して、アミドキシムXXIVを式XV(式中、PGは適切な保護基(例えば、Boc)である)のアミノ酸と反応させて、対応する1,2,4-オキサジアゾールをもたらし、これを適切な条件(例えば、ジオキサン中4NのHClのような適切な酸との反応)下でN-脱保護して式VIcの中間体を与え得る。
式VIdの中間体(すなわち、Ar2がピリミジンである式VIの中間体)は下記スキームIXに従って調製可能である。
【0058】
スキームIX
【化11】

【0059】
スキームIXに示すように、式XXI(式中、PGは適切な保護基、例えばBocである)の適切に保護されたアミノカルボニトリルを、適切な試薬、例えばエタノール中のナトリウムエトキシドとの反応後、塩化アンモニウム及びアンモニアで処理して、対応するアミジン塩酸塩XXVに変えることができる。別の合成変換では、適切な溶媒、例えばCHCl3中で適切な試薬(例えば、Br2及びNIS)を用いて3-ジメチルアミノプロペナールXXVIをハロゲン化して式XXVIIの2-ハロゲン置換3-ジメチルアミノプロペナール(すなわち、RbがBr又はIである)を与え得る。引き続き、適切な溶媒(例えば、EtOH)中及び適切な温度(例えば、約80℃)でアミジン塩酸塩XXVを式XXVIIの化合物と反応させて式XXVIIIのピリミジンをもたらし得る。技術上周知かつ上述した条件を利用して化合物XXVIIIをN-脱保護して式VIdの中間体を与え得る。
式VIの中間体の合成で使用し得る式XVの適切に保護されたアミノ酸は、商業的に入手可能であり、或いは下記参考文献(参照によってその全体をここに援用する)に従って調製可能であり、或いは化学文献に記載の方法を利用して当業者により調製可能である。
3-tert-ブトキシカルボニルアミノ-オキセタン-3-カルボン酸は、特許出願WO 2009/070485 A1に記載の手順に従って合成可能である。
以下に商業的に入手可能な非天然アミノ酸の例を示す。これらの例は、本発明の実施形態を支持するためであり、決して本発明の範囲を限定するものと解釈すべきでない。技術上周知の標準的な条件によってアミノ酸の適切な保護を行うことができる(総覧のためには、参照によってその全体をここに援用するGreene, T. W.; Wuts, P. G. M. Protective Groups in Organic Synthesis, 3rd Ed., Wiley, New York, 1999を参照されたい)。
【0060】
【化12】

【0061】
(合成例)
一般的方法:特に指定のない限り、全ての反応を室温で行った。全ての化合物を下記方法の少なくとも1つで特徴づけた:1H NMR、HPLC、HPLC-MS、及び融点。
報告MSデータは観測[M+H]+についてである。臭素含有化合物では、臭素同位体(すなわち、79Br及び81Br)の一方又は両方について[M+H]+を報告している。
表Iには下記方法の1つを利用して保持時間(RT)を報告している。
【0062】

【0063】
(表続き)

【0064】

【0065】
(中間体の合成)
以下のヘテロアリール-シクロプロピルアミン中間体又はそれらの対応塩形態の合成は特許出願WO 2009/070485 A1に記載されている。
【0066】
【化13】

*中間体は、適切な試薬を使用し、かつ関連類似体についての参考文献に記載の手順に従ってを調製可能である。
【実施例】
【0067】
実施例1:1-(4-フルオロフェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1)の合成
【0068】
【化14】

【0069】
1Lのフラスコに3,5-ジブロモピリジン-4-カルボキサルデヒド(50.0g,189mmol,1.0当量)及び4-フルオロフェニルヒドラジン塩酸塩(31.0g,191mmol,1.01当量)を入れる。NMP(250mL)を入れ、結果として生じるスラリーを周囲温度で2時間撹拌する。KOH水溶液を85% KOHペレット(27.4g,415mmol,2.2当量)と水(27.4mL)から調製し、このKOH溶液を反応混合物に加える。該バッチを80℃に加熱し、この温度で30〜60分間維持する。次に水(250mL)を80℃で加え、結果として生じるスラリーを4〜16時間かけて周囲温度に冷ます。スラリーをろ過し、固体を水で洗浄し、真空下でオーブン乾燥させて4-ブロモ-1-(4-フルオロフェニル)-1H-ピラゾロ[3,4-c]ピリジンを固体として得る。
1Lのフラスコに4-ブロモ-1-(4-フルオロフェニル)-1H-ピラゾロ[3,4-c]ピリジン(50.0g,171mmol,1当量)及びTHF(300mL)を入れる。該スラリーを-20℃に冷却する。i-PrMgCl溶媒(128.2mL,256.4mmol,THF中2.0M,1.5当量)を-10℃未満の温度を維持する速度で加える。反応を-10℃で3時間維持する。温度上昇ピークまでCO2ガスを反応混合物中で泡立てると、温度が下がり始める。温度を22℃に調整し、i-PrOAc(325mL)を添加する。濃HCl(55mL)と水(195mL)からHCl水溶液を調製する。このHCl溶液の約10mLを反応混合物に加えてpHを6〜7にする。次に混合物を55℃に加熱し、約240mLの残りのHCl溶液を加える。反応を1時間かけて周囲温度に冷まし、この温度で1時間維持し、ろ過する。固体を水とi-PrOAcで洗浄し、真空下でオーブン乾燥させて表題化合物を固体として得る。
【0070】
実施例2:1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸(2)の合成
【0071】
【化15】

【0072】
インダゾール-4-カルボン酸(2.00g,12.3mmol)をメタノール(20mL)及びトルエン(30mL)に室温で懸濁させる。トルエン中2Mのトリメチルシリルジアゾメタン溶液(12mL,24mmol)をゆっくり添加し、混合物を室温で溶液が黄変するまで撹拌する。反応を濃酢酸(5mL)でクエンチし、真空中で溶媒を除去する。ヘキサン中0〜30%の酢酸エチルの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して1H-インダゾール-4-カルボン酸メチルエステルを得る。
1H-インダゾール-4-カルボン酸メチルエステル(5.0g,28mmol)、ヨウ化銅(5.7g,3.0mmol)、炭酸カリウム(4.15g,30.0mmol)及び4-フルオロヨードベンゼン(3.47g,30.0mmol)の混合物を封管に室温で充填する。管を排気し、アルゴンで埋め戻してジメチルホルムアミド(20mL)、次いでrac-trans-N,N’-ジメチルシクロヘキサン-1,2-ジアミン(0.93g,6.5mmol)を加える。溶液を120℃で3時間撹拌してから室温に冷まして水(50mL)と酢酸エチル(80mL)で希釈する。有機層を分け、ブライン(30mL)で洗浄し、硫酸ナトリウム上で乾燥させる。粗生成物をろ過し、濃縮し、ヘキサン中0〜30%の酢酸エチルの勾配を用いて溶出するシリカゲルクロマトグラフィーで精製して1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸メチルエステルを得る。
水(20mL)とメタノール(20mL)中の1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸メチルエステル(2.0g,7.4mmol)の撹拌溶液に2N水酸化ナトリウム溶液(10mL)を添加する。溶液を温めて1時間還流させる。溶液を室温に冷まして1N HCl水溶液で酸性にしてpHを3〜4にする。混合物をろ過し、結果として生じる固体をMeOH(30mL)で洗浄し、乾燥させて1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸を得る。
【0073】
実施例3:1-(6-ブロモ-ピリジン-3-イル)-シクロプロピルアミンビストリフルオロ酢酸塩(3)の合成
【0074】
【化16】

【0075】
機械的撹拌機を備えたオーブン乾燥した2Lの丸底フラスコにAr雰囲気下で無水THF(750mL)、次いでTi(Oi-Pr)4(72.8mL,246mmol)を入れる。溶液をAr下でパージし、50℃に加熱する。混合物に6-ブロモ-ニコチノニトリル(30.0g,164mmol)を添加した後、THF中のエチルマグネシウムブロミドの1M溶液(410mL,410mmol)を滴下して添加する(40分かけて)。反応を50℃で撹拌させる。3時間後、反応混合物を室温に冷ましてHClの3M水溶液(約350mL)を加える。混合物を分液ロートに移してエチルエーテル(3×500mL)で洗浄する。水層を一晩静置する。次に水層をNaOHの2M水溶液で塩基性にしてpHを10にする。溶液をEtOAc(500mL)で希釈し、結果として生じる溶液を5分間激しく撹拌する。層が緩徐に分離するまで溶液を静置する。有機層をデカントし、同じ抽出プロセスを2回繰り返す。有機層を混ぜ合わせ、ブライン(50mL)で洗浄し、MgSO4上で乾燥させ、真空中で濃縮して油を得る。CH2Cl2中0〜10%のMeOHの勾配を利用するシリカゲルクロマトグラフィーで粗製油を精製して1-(6-ブロモ-ピリジン-3-イル)-シクロプロピルアミンを油として得、これは緩徐に結晶化する(ES+ m/z 213.3, 215.3)。
1-(6-ブロモ-ピリジン-3-イル)-シクロプロピルアミン(1.16g,4.60mmol)をCH2Cl2(20mL)に溶かす。Et3N(0.78mL,5.6mmol)とBoc2O(1.11g,5.10mmol)を連続して加え、反応を室温で撹拌する。20時間後、反応をCH2Cl2(20mL)及び水(20mL)で希釈し、層を分ける。水層をCH2Cl2(100mL)で抽出する。混ぜ合わせたCH2Cl2層をブラインで洗浄し、MgSO4上で乾燥させ、濃縮して[1-(6-ブロモ-ピリジン-3-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステルを固体として得る。
[1-(6-ブロモ-ピリジン-3-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステル(0.800g,2.55mmol)をCH2Cl2(10mL)に溶かす。TFA(5mL)を滴下して加える。4時間後、反応を真空中で濃縮して表題化合物を油として得る(ES+ m/z 213.1, 215.1)。
【0076】
実施例4:1-(5-ブロモ-ピリミジン-2-イル)-シクロプロピルアミン二塩酸塩(4)の合成
【0077】
【化17】

【0078】
3-ジメチルアミノ-プロペナール(50mL,500mmol)をCHCl3(400mL)に室温で溶かす。臭素(25.7mL,0.500mol)を注射器で5分かけて手際よく加える。30分後、反応を200mLのNa2S2O3飽和水溶液と200mLのNaHCO3飽和水溶液との混合物に注ぎ、混合物をCH2Cl2(3×100mL)で抽出する。混ぜ合わせた有機層をMgSO4上で乾燥させ、濃縮して固体を得る。固体をEtOAc(200mL)に溶かし、不溶物質をろ別し、ろ液を真空中で濃縮し、結果として生じる固体をヘキサン中50%のEtOAc溶液で洗浄して3-ジメチルアミノ-2-ブロモ-プロペナールを固体として得る(ES+ m/z 178.28)。
(1-カルバムイミドイル-シクロプロピル)-カルバミン酸tert-ブチルエステル塩酸塩(1.0g,4.2mmol)(特許出願WO 2009/070485 A1に記載の手順に従って調製した)及び3-ジメチルアミノ-2-ブロモ-プロペナール(1.1g,6.4mmol)を圧力管内のEtOH(2mL)に加える。反応容器に蓋をし、混合物を80℃で24時間加熱する。混合物を室温に冷ましてメタノール(20mL)を加える。結果として生じる固体をろ過し、ろ液を真空中で濃縮する。残留物をCH2Cl2(50mL)で溶かして固体をろ過する。ろ液を濃縮し、残留物をシリカゲルクロマトグラフィーでヘキサン中0〜50%のEtOAcの勾配を用いて精製して[1-(5-ブロモ-ピリミジン-2-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステルを固体として得る。
[1-(5-ブロモ-ピリミジン-2-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステル(1.18g,3.76mmol)をCH2Cl2(5mL)に室温で溶かす。ジオキサン中HClの4M溶液(9.4mL,38mmol)を加える。2時間後、N2流によって溶媒を除去し、粗製表題化合物を固体として得、精製せずに使用する(ES+ m/z 216.3)。
【0079】
実施例5:[1-(5-ヨード-フラン-2-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステル(5)の合成
【0080】
【化18】

【0081】
無水DMF(77mL)中の(1-フラン-2-イル-シクロプロピル)-カルバミン酸tert-ブチルエステル(4.30g,19.3mmol)(特許出願WO 2009/070485 A1に記載の手順に従って調製した)の溶液に室温で固形N-ヨードスクシンイミド(4.77g,21.2mmol)を一度に加える。2.5時間後、反応をNa2S2O3飽和水溶液(75mL)、水(75mL)、及びエチルエーテル(100mL)で希釈する。相を分け、水層をエチルエーテル(2×100mL)で抽出する、混ぜ合わせた有機層をNa2SO4上で乾燥させて濃縮する。結果として生じる固体をヘキサンと摩砕して表題化合物を粉末として得る(ES+ m/z 350.5)。
【0082】
実施例6:3-(1-アミノ-シクロプロピル)-安息香酸メチルエステル(6)の合成
【0083】
【化19】

【0084】
塩化アセチル(0.600mL,8.46mmol)を0℃でメタノール(15mL)に添加し、この溶液を室温に温める。20分間の撹拌後、3-アミノシクロプロピル安息香酸(0.500g,2.82mmol)を加え、反応混合物を加熱して還流させる。16時間後、混合物を65℃にて窒素流下で濃縮する。残留物を炭酸水素ナトリウム飽和水溶液(50mL)で中和し、酢酸エチル(3×50mL)で抽出する。混ぜ合わせた有機層をブライン(100mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮して粗製表題生成物を得、精製せずに使用する。
【0085】
実施例7:1-(2-ブロモ-ピリジン-4-イル)-シクロプロピルアミン トリフルオロ酢酸塩(7)の合成
【0086】
【化20】

【0087】
ジクロロメタン(30mL)中の(2-ブロモ-ピリジン-4-イル)-メタノール(3.00g,16.0mmol)とN,N-ジイソプロピルエチルアミン(8.3mL,48mmol)の0℃撹拌溶液にメタンスルホニルクロリド(1.30mL,16.8mmol)を加える。結果として生じる混合物を室温に温める。1時間後、混合物をジクロロメタン(20mL)で希釈し、塩化アンモニウム飽和水溶液(3×10mL)、炭酸水素ナトリウム飽和水溶液(10mL)、ブライン(10mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮して粗製メタンスルホン酸2-ブロモ-ピリジン-4-イルメチルエステルを得、精製せずに使用する。
メタンスルホン酸2-ブロモ-ピリジン-4-イルメチルエステル(4.24g,15.9mmol)をエタノール(30mL)と水(6mL)の混合物中のシアン化カリウム(1.02g,15.1mmol)の撹拌溶液に室温で添加する。72時間後、酢酸エチル(80mL)及び炭酸水素ナトリウム飽和水溶液(40mL)を加えて相を分ける。有機層を水(3×40mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。結果として生じる残留物を、ヘプタン中0〜60%の酢酸エチルの勾配を用いて溶出するシリカゲルクロマトグラフィーで精製して(2-ブロモ-ピリジン-4-イル)-アセトニトリルを得る(ES+ m/z 197.41; 199.40)。
乾燥Et2O(5mL)と乾燥DMSO(1mL)の混合物中の(2-ブロモ-ピリジン-4-イル)-アセトニトリル(1.20g,6.09mmol)と1,2-ジブロモエタン(0.663mL,7.61mmol)の溶液を乾燥DMSO(10mL)中のNaHの懸濁液(鉱油中60%の分散液,585mg,14.6mmol)に、結果として生じる発熱を水浴内で冷却することによって制御しながら添加し、結果として生じる混合物を室温で撹拌する。18時間後、水(10mL)と酢酸エチル(10mL)を添加し、相を分け、水層を酢酸エチル(3×10mL)で抽出する。混ぜ合わせた有機層をブライン(30mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。残留物をSiO2上でヘプタン中0〜60%の酢酸エチルの勾配で溶出して精製して1-(2-ブロモ-ピリジン-4-イル)-シクロプロパンカルボニトリルを固体として得る(ES+ m/z 223.36; 225.39)。
トルエン(30mL)中1-(2-ブロモ-ピリジン-4-イル)-シクロプロパンカルボニトリル(1.16g,5.20mmol)の溶液にDIBAL-H(10.4mL,トルエン中1M)を-78℃で加える。混合物を-78℃で1時間撹拌し、室温に温める。1時間後、酢酸エチル(30mL)を添加した後、H2SO4の1M水溶液(30mL)を加える。相を分け、水層を酢酸エチル(3×50mL)で抽出する。混ぜ合わせた有機層をMgSO4上で乾燥させ、ろ過かつ濃縮して粗製1-(2-ブロモ-ピリジン-4-イル)-シクロプロパンカルバルデヒドを得(ES+ m/z 226.48; 228.47)、精製せずに使用する。
5mLの水中の塩化ナトリウム(368mg,3.26mmol)とリン酸二水素ナトリウム一水和物(449mg,3.26mmol)の溶液をtert-ブタノール(12mL)中の粗製1-(2-ブロモ-ピリジン-4-イル)-シクロプロパンカルバルデヒド(566mg,2.50mmol)と2-メチル-2-ブテン(1.73mL,16.3mmol)の溶液に滴下して添加し、結果として生じる反応混合物を室温で撹拌する。18時間後、混合物を真空中で濃縮し、HClの1M水溶液で酸性にしてpHを2とし、ブライン(25mL)で希釈し、酢酸エチル(3×50mL)で抽出する。混ぜ合わせた有機層をNa2SO4上で乾燥させ、ろ過かつ濃縮して粗製1-(2-ブロモ-ピリジン-4-イル)-シクロプロパンカルボン酸を得、精製せずに使用する。
圧力容器内のtert-ブタノール(7mL)中の粗製1-(2-ブロモ-ピリジン-4-イル)-シクロプロパンカルボン酸(0.350g,1.45mmol)の溶液にジフェニルホスホリルアジド(0.312mL,1.45mmol)及びトリエチルアミン(0.202mL,1.45mmol)を加える。封管して反応混合物を90℃で撹拌する。4時間後、圧力容器を氷浴内で冷却し、排気かつ開口する。反応混合物を真空中で濃縮する。結果として生じる残留物を酢酸エチル(70mL)に溶かし、塩化アンモニウム飽和水溶液(70mL)及び炭酸水素ナトリウム飽和水溶液(70mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。ヘプタン中0〜50%の酢酸エチルの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して[1-(2-ブロモ-ピリジン-4-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステルを得る。
ジクロロメタン(3mL)中の[1-(2-ブロモ-ピリジン-4-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステル(0.160g,0.511mmol)の撹拌溶液にトリフルオロ酢酸(1.0mL,13mmol)を室温で加える。18時間後、反応混合物を真空中で濃縮して粗製表題化合物を油として得(ES+ m/z 213.49, 215.40)、精製せずに使用する。
【0088】
実施例8:1-(2-ブロモ-ピリジン-4-イル)-シクロブチルアミントリフルオロ酢酸塩(8)の合成
【0089】
【化21】

【0090】
1-(2-ブロモ-ピリジン-4-イル)-シクロブテンカルボニトリルは、(2-ブロモ-ピリジン-4-イル)-アセトニトリル(1.50g,7.61mmol)から実施例7に記載のシクロアルキル化手順に従い、1,2-ジブロモエタンの代わりに1,3-ジブロモプロパンを用いて調製される。
1-(2-ブロモ-ピリジン-4-イル)-シクロブテンカルバルデヒドは、1-(2-ブロモ-ピリジン-4-イル)-シクロブテンカルボニトリル(1.26g,5.20mmol)から実施例7に記載のDIBAL-H手順に従って調製される。
1-(2-ブロモ-ピリジン-4-イル)-シクロブテンカルボン酸(ES+ m/z 256.40, 258.38)は、1-(2-ブロモ-ピリジン-4-イル)-シクロブテンカルバルデヒド(532mg,2.22mmol)から実施例7に記載の酸化手順に従って調製される。
[1-(2-ブロモ-ピリジン-4-イル)-シクロブチル]-カルバミン酸tert-ブチルエステル(ES+ m/z 327.54, 329.46)は、1-(2-ブロモ-ピリジン-4-イル)-シクロブテンカルボン酸(0.100g,0.390mmol)から実施例7に記載のクルチウス転位手順に従い、100℃の反応温度を利用して調製される。
表題化合物(ES+ m/z 227.30, 229.27)は、[1-(2-ブロモ-ピリジン-4-イル)-シクロブチル]-カルバミン酸tert-ブチルエステル(82.0mg,0.262mmol)から実施例7に記載のBoc-脱保護手順に従って調製される。
【0091】
実施例9:1-(5-メタンスルホニル-フラン-2-イル)-シクロプロピルアミン塩酸塩(9)の合成
【0092】
【化22】

【0093】
[1-(5-メタンスルホニル-フラン-2-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステルは、[1-(5-ヨード-フラン-2-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステル(0.500g,1.43mmol)から実施例19に記載のヨウ化銅(I)媒介カップリング手順に従って調製されるが、カップリング相手として3-メトキシ-3-オキソプロパン-1-スルフィン酸ナトリウムの代わりにメタンスルフィン酸ナトリウムを使用する。
[1-(5-メタンスルホニル-フラン-2-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステル(0.430g,1.42mmol)をHClのジオキサン中4M溶液(5.0mL,20mmol)に室温で溶かす。16時間の撹拌後、混合物を窒素流下でエバポレートする。結果として生じる油状固体を酢酸エチル(5mL)に懸濁させ、エチルエーテル(25mL)を加え、混合物をろ過して粗製表題生成物を得、精製せずに使用する。
【0094】
(式Iの化合物の合成)
実施例10:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(5-メタンスルホニル-フラン-2-イル)-シクロプロピル]-アミド(10)の合成
【0095】
【化23】

【0096】
DMF(30mL)中1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(0.310g,1.21mmol)、N,N-ジイソプロピルエチルアミン(0.630mL,3.62mmol)及び1-(5-メタンスルホニル-フラン-2-イル)-シクロプロピルアミン-塩酸塩(364mg,1.53mmol)の撹拌混合物に(ベンゾトリアゾール-1-イルオキシ)トリピロリジノホスホニウムヘキサフルオロホスファート(PyBOP)(0.650g,1.25mmol)を加える。18時間後、混合物を塩化アンモニウム飽和水溶液(100mL)で希釈し、酢酸エチル(4×30mL)で抽出する。混ぜ合わせた有機層をブライン(50mL)で洗浄し、硫酸ナトリウム上で乾燥させ、ろ過かつ濃縮する。ヘキサン中0〜100%の酢酸エチルの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して表題化合物を固体として得る。
以下の化合物は実施例10に記載のカップリング方法を利用して調製されるが、N,N-ジイソプロピルエチルアミンをトリエチルアミンに取り換える:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(5-ブロモ-ピリミジン-2-イル)-シクロプロピル]-アミド。
【0097】
実施例11:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(2-ブロモ-ピリジン-4-イル)-シクロプロピル]-アミド(11)
【0098】
【化24】

【0099】
DMF(2mL)中の1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(0.120g,0.467mmol)の混合物にHATU(186mg,0.490mmol)を加える。30分後、N,N-ジイソプロピルエチルアミン(325μL,1.87mmol)及び1-(2-ブロモ-ピリジン-4-イル)-シクロプロピルアミン-トリフルオロ酢酸塩(223mg,0.507mmol)を加えると、反応混合物が均質になった。18時間後、混合物を真空中で濃縮し、酢酸エチル(50mL)中で再構成し、1N水酸化ナトリウム(3×50mL)で洗浄する。有機層を塩化アンモニウム飽和水溶液(2×50mL)、炭酸水素ナトリウム飽和水溶液(50mL)、ブライン(50mL)で洗浄し、MgSO4上で乾燥させ、ろ過し、真空中で濃縮する。塩化メチレン中0〜10%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を2回精製して表題化合物を固体として得る。
以下の化合物は、実施例11に記載のカップリング方法を用いて調製される:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-ブロモ-ピリジン-3-イル)-シクロプロピル]-アミド;及び
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1-ピリジン-4-イル-シクロプロピル)-アミド。
【0100】
実施例12:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1-1,3,4-チアゾール-2-イル-シクロプロピル)-アミド(12)の合成
【0101】
【化25】

【0102】
DMF(2mL)中の1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(90.0mg,0.350mmol)の懸濁液にN,N-ジイソプロピルエチルアミン(243μL,1.40mmol)及びHBTU(159mg,0.420mmol)を加える。20分後、DMF(1mL)中の1-1,3,4-チアゾール-2-イル-シクロプロピルアミン(51.0mg,0.361mmol)の溶液を加えて混合物を室温で一晩撹拌する。反応混合物を炭酸水素ナトリウム飽和水溶液(50mL)に注ぎ、酢酸エチル(30mL)を添加して相を分ける。水層をブラインで処理し、酢酸エチル(3×20mL)で抽出する。混ぜ合わせた有機層を真空中で濃縮する。塩化メチレン中0〜10%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで粗製物質を精製して表題化合物を固体として得る。
【0103】
実施例13:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-ブロモ-フェニル)-シクロプロピル]-アミド(13)の合成
【0104】
【化26】

【0105】
DMF(18mL)中の1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(0.500g,1.94mmol)、1-(3-ブロモフェニル)シクロプロパンアミン(453mg,2.14mmol)及びN,N-ジイソプロピルエチルアミン(1.73mL,9.72mmol)の溶液にTBTU(0.780g,2.43mmol)を加える。2時間後、混合物を真空中で濃縮し、酢酸エチル(200mL)に溶かし、2N水酸化ナトリウム(3×100mL)、塩化アンモニウム飽和水溶液(2×100mL)、炭酸水素ナトリウム飽和水溶液(100mL)、ブライン(100mL)で洗浄する。有機層をMgSO4上で乾燥させ、シリカゲルのパッドを通して酢酸エチル(3×100mL)で溶出してろ過し、真空中で濃縮する。ヘプタン中50〜70%の酢酸エチルの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して固体を得、これを塩化メチレンと摩砕して表題化合物を固体として得る。
以下の化合物は、実施例13に記載のカップリング方法を利用して調製される:
3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-安息香酸メチルエステル;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(2-ブロモ-ピリジン-4-イル)-シクロブチル]-アミド;及び
1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド。
【0106】
実施例14:3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-安息香酸(14)の合成
【0107】
【化27】

【0108】
THF/メタノール/水の混合物(22.5mL,3:1:1)中の3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-安息香酸メチルエステル(0.650g,1.51mmol)の溶液にLiOH・H2O(253mg,6.04mmol)を加える。3時間後、反応混合物を氷酢酸で中和し、真空中で濃縮する。残留物を塩化メチレン中20%のメタノール溶液(100mL)に溶かす。水(100mL)を加えて混合物を2M塩酸水溶液で酸性にしてpHを4とする。相を分け、水層を塩化メチレン中20%のメタノールで抽出する(9×100mL)。混ぜ合わせた有機層をMgSO4上で乾燥させ、ろ過し、約50mLに濃縮する。結果として生じる結晶化固体をろ過し、冷却メタノール(3×2mL)で洗浄し、空気乾燥させて表題化合物を固体として得る。
【0109】
実施例15:[3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ベンゾイルアミノ]-酢酸メチルエステル(15)の合成
【0110】
【化28】

【0111】
DMF(4.5mL)中の3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-安息香酸(0.200g,0.480mmol)、Gly-OMe・HCl(68.1mg,0.543mmol)及びN,N-ジイソプロピルエチルアミン(426μL,2.40mmol)の溶液にTBTU(192mg,0.600mmol)を加える。4時間後、混合物を真空中で濃縮する。残留物を酢酸エチル(100mL)に溶かして2N水酸化ナトリウム(3×50mL)、塩化アンモニウム飽和水溶液(2×50mL)、炭酸水素ナトリウム飽和水溶液(50mL)、ブライン(50mL)で洗浄する。有機層をMgSO4上で乾燥させ、ろ過かつ濃縮する。塩化メチレン中0〜8%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して泡を得、これをエーテル(3mL)と摩砕し、ろ過し、冷却エーテル(3×3mL)で洗浄し、空気乾燥させて表題化合物を得る。
以下の化合物は、実施例15に記載のカップリング方法を利用して調製される:
1-[3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ベンゾイルアミノ]-シクロプロパンカルボン酸メチルエステル;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸{1-[3-(シアノメチル-カルバモイル)-フェニル]-シクロプロピル}-アミド;及び
(S)-2-[3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ベンゾイルアミノ]-プロピオン酸メチルエステル。
【0112】
実施例16:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-カルバモイル-フェニル)-シクロプロピル]-アミド(16)の合成
【0113】
【化29】

【0114】
メタノール中アンモニアの7M溶液(1.00mL,7.00mmol)中の3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-安息香酸メチルエステル(70.0mg,0.163mmol)の溶液を密閉圧力管内で120℃にて撹拌する。78時間後、反応容器を室温に冷まし、排気かつ開口する。反応混合物を真空中で濃縮し、結果として生じる残留物を、塩化メチレン中0〜10%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで精製して表題化合物を固体として得る。
以下の化合物は、実施例16に記載の方法を利用して調製される:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸{1-[3-(カルバモイルメチル-カルバモイル)-フェニル]-シクロプロピル}-アミド。
【0115】
実施例17:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-メチルカルバモイル-フェニル)-シクロプロピル]-アミド(17)の合成
【0116】
【化30】

【0117】
メタノール中メチルアミンの2M溶液(3.0mL,6.0mmol)中の3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-安息香酸メチルエステル(70.0mg,0.163mmol)の混合物を密閉圧力管内で90℃にて撹拌する。18時間後、反応容器を室温に冷まし、排気かつ開口する。反応混合物を真空中で濃縮する。塩化メチレン中0〜8%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して表題化合物を固体として得る。
以下の化合物は、実施例17に記載の方法を利用して調製される:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸{1-[3-(メチルカルバモイルメチル-カルバモイル)-フェニル]-シクロプロピル}-アミド。
【0118】
実施例18:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-メタンスルホニル-ピリジン-3-イル)-シクロプロピル]-アミド(18)の合成
【0119】
【化31】

【0120】
DMSO(1mL)中の1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-ブロモ-ピリジン-3-イル)-シクロプロピル]-アミド(72.7mg,0.161mmol)、メタンスルフィン酸ナトリウム(32.8mg,0.321mmol)及びヨウ化銅(I)(61.2mg,0.321mmol)の溶液を排気し、アルゴンで3回パージして130℃で加熱する。45分後、反応を室温に冷ましてN,N’-ジメチルエチレンジアミン(69μL,0.64mmol)を加える。混合物を30分間撹拌し、酢酸エチル(20mL)で希釈し、15分間撹拌する。塩化アンモニウム飽和水溶液(20mL)を添加し;結果として生じる混合物を30分間超音波処理し、酢酸エチル(100mL)で希釈する。相を分けて水層を酢酸エチル(3×20mL)で抽出する。混ぜ合わせた有機層を塩化アンモニウム飽和水溶液(2×50mL)、炭酸水素ナトリウム飽和水溶液(50mL)、ブライン(50mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。結果として生じる残留物を、塩化メチレン中0〜8%のメタノールの勾配を用いて溶出するシカゲルクロマトグラフィーで精製して表題化合物を固体として得る。
以下の化合物は、実施例18に記載の方法を利用して調製される:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(5-メタンスルホニル-ピリミジン-2-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-メタンスルホニル-フェニル)-シクロプロピル]-アミド;及び
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロブチル]-アミド。
【0121】
実施例19:3-[5-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ピリジン-2-スルホニル]-プロピオン酸メチルエステル(19)の合成
【0122】
【化32】

【0123】
DMSO(2mL)中1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-ブロモ-ピリジン-3-イル)-シクロプロピル]-アミド(0.250g,0.553mmol)、3-メトキシ-3-オキソプロパン-1-スルフィン酸ナトリウム(289mg,1.66mmol)及びヨウ化銅(I)(316mg,1.66mmol)の溶液をマイクロ波管に入れ、排気してアルゴンで3回パージする。反応混合物をマイクロ波内で110℃にて2時間加熱し、酢酸エチル(200mL)で希釈し、塩化アンモニウム飽和水溶液(4×100mL)、炭酸水素ナトリウム飽和水溶液(100mL)、ブライン(100mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。結果として生じる残留物を、ヘプタン中50〜100%の酢酸エチルの勾配を用いて溶出するシリカゲルクロマトグラフィーで精製して表題化合物を固体として得る。
以下の化合物は、実施例19に記載の方法を利用して調製される:
3-[3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ベンゼンスルホニル]-プロピオン酸メチルエステル。
【0124】
実施例20:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-スルファモイル-ピリジン-3-イル)-シクロプロピル]-アミド(20)の合成
【0125】
【化33】

【0126】
DMSO(4mL)中の3-[5-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ピリジン-2-スルホニル]-プロピオン酸メチルエステル(153mg,0.292mmol)の撹拌溶液に、ナトリウムメトキシドのメタノール中の新たに調製した15%溶液(0.110mL,0.306mmol)を添加する。15分後、混合物を水浴に入れ、水(16mL)中のN-ヒドロキシルアミン-O-スルホン酸(661mg,5.84mmol)と酢酸ナトリウム(384mg,4.68mmol)の溶液を加える。水浴を除去して反応混合物を室温で撹拌する。60時間後、混合物を酢酸エチル(20mL)及び水(20mL)で希釈する。相を分けて水層を酢酸エチル(3×20mL)で抽出する。混ぜ合わせた有機層のpHを10%炭酸水素ナトリウム水溶液で7に調整する。有機層を水(3×20mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。100%酢酸エチルで溶出するシリカゲルクロマトグラフィーで残留物を精製する。結果として生じる固体をエーテルと摩砕し(3回)、ろ過し、真空下で乾燥させて表題化合物を固体として得る。
以下の化合物は、実施例20に記載の方法を利用して調製される:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-スルファモイル-フェニル)-シクロプロピル]-アミド。
【0127】
実施例21:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-メチルアミノ-ピリジン-3-イル)-シクロプロピル]-アミド(21)の合成
【0128】
【化34】

【0129】
N-メチルホルムアミド(1mL)中、1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-ブロモ-ピリジン-3-イル)-シクロプロピル]-アミド(0.200g,0.442mmol)、エタノール中33%のメチルアミン(0.250mL,1.99mmol)で充填した圧力管を160℃で加熱する。36時間後、反応を室温に冷まして酢酸エチル(20mL)及び水(20mL)で希釈する。相を分けて水層を酢酸エチル(3×20mL)で抽出する。混ぜ合わせた有機層を塩化アンモニウム飽和水溶液(3×100mL)、炭酸水素ナトリウム飽和水溶液(100mL)、ブライン(100mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。ジクロロメタン中0〜15%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して表題化合物を固体として得る。
【0130】
実施例22:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-モルフォリン-4-イル-ピリジン-3-イル)-シクロプロピル]-アミド(22)の合成
【0131】
【化35】

【0132】
DMSO(1mL)中の1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-ブロモ-ピリジン-3-イル)-シクロプロピル]-アミド(35mg,0.077mmol)とモルフォリン(68μL,0.77mmol)の溶液を圧力管内で160℃にて加熱する。40時間後、混合物を室温に冷まし、EtOAc(50mL)で希釈し、塩化アンモニウム飽和水溶液(2×50mL)、炭酸水素ナトリウム飽和水溶液(50mL)、ブライン(50mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。結果として生じる固体を、ジクロロメタン中0〜5%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで精製して固体を得、これをエーテル(5mL)と摩砕し、ろ過し、乾燥させて表題化合物を得る。
【0133】
実施例23:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-トリフルオロメチル-フェニル)-シクロプロピル]-アミド(23)の合成
【0134】
【化36】

【0135】
塩化メチレン(1mL)中の1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(40.0mg,0.156mmol)の懸濁液に塩化オキサリル(14μL,0.16mmol)を滴下して添加する。10分後、一滴のN,N-ジメチルホルムアミドを加えて懸濁液を室温で撹拌する。60分後、追加分の塩化オキサリル(14μL,0.16mmol)及び一滴のN,N-ジメチルホルムアミドを添加する。30分の撹拌後、溶媒を真空中で除去し;残留物を塩化メチレン(1mL)に懸濁させて真空中で濃縮する。残留物を真空下で30分間乾燥させ、塩化メチレン(1mL)に懸濁させて塩化メチレン(500μL)中の1-(3-トリフルオロメチル-フェニル)-シクロプロピルアミン塩酸塩(74.1mg,0.312mmol)とN,N-ジイソプロピルエチルアミン(0.080mL,0.46mmol)の溶液に加える。室温で15時間振とうさせた後、反応をメタノール(500μL)でクエンチして濃縮する。BEHカラム(2.1×50mm C18 1.7μM)及び0.05%ギ酸を含む水中10〜95%のアセトニトリルの勾配を利用する逆相HPLCで残留物を精製して表題化合物を得る。
以下の化合物は、実施例23に記載の方法を利用して調製される:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-メトキシ-フェニル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-ジメチルアミノ-ピリジン-2-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1-ピリジン-3-イル-シクロプロピル)-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-メトキシ-フェニル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-フルオロ-フェニル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1-m-トリル-シクロプロピル)-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-クロロ-フェニル)-シクロプロピル]-アミド;
4-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-安息香酸;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-フルオロ-フェニル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-クロロ-フェニル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1-p-トリル-シクロプロピル)-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1-フェニル-シクロプロピル)-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1-o-トリル-シクロプロピル)-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-シクロプロピル-1,2,4-オキサジアゾール-5-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(5-シクロプロピル-1,2,4-オキサジアゾール-3-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(2-メチル-チアゾール-4-イル)-シクロプロピル]-アミド;
[2-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ピリジン-4-イルメチル]-カルバミン酸tert-ブチルエステル;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-メトキシ-ピリジン-2-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-クロロ-ピリジン-2-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(5-ブロモ-ピリジン-2-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-ヨード-ピリジン-2-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-ブロモ-フェニル)-シクロプロピル]-アミド;
[6-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ピリジン-3-イルメチル]-カルバミン酸tert-ブチルエステル;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-メトキシ-フェニル)-シクロブチル]-アミド;及び
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-フルオロ-フェニル)-シクロブチル]-アミド。
以下の化合物は、実施例23に記載のカップリング方法を利用した後、実施例7に記載の方法に従ってBoc-脱保護して調製される:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-アミノメチル-ピリジン-2-イル)-シクロプロピル]-アミド;及び
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(5-アミノメチル-ピリジン-2-イル)-シクロプロピル]-アミド。
【0136】
実施例24:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸{1-[6-(アセチル-メチル-アミノ)-ピリジン-3-イル]-シクロプロピル}-アミド(24)の合成
【0137】
【化37】

【0138】
無水酢酸(1mL)中の1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-メチルアミノ-ピリジン-3-イル)-シクロプロピル]-アミド(40mg,0.099mmol)の溶液を60℃で16時間加熱する。この溶液を室温に冷まし、3mLの1N NaOH水溶液で希釈し、20分間撹拌し、酢酸エチル(5mL)で抽出する。有機層を硫酸マグネシウム上で乾燥させ、ろ過かつ濃縮する。ジクロロメタン中0〜10%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して表題化合物を得る。
【0139】
実施例25:6-ブロモ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド(25a)、及び1-(4-フルオロ-フェニル)-6-ヨード-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド(25b)の合成
【0140】
【化38】

【0141】
実施例2に記載の銅媒介クロスカップリング手順に従って6-ブロモ-1H-インダゾール-4-カルボン酸メチルエステル(10.0g,39.2mmol)から6-ブロモ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸メチルエステルと1-(4-フルオロ-フェニル)-6-ヨード-1H-インダゾール-4-カルボン酸メチルエステルの混合物を調製する。
THF(12mL)、メタノール(4mL)、及び水(4mL)中の6-ブロモ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸メチルエステルと1-(4-フルオロ-フェニル)-6-ヨード-1H-インダゾール-4-カルボン酸メチルエステルの混合物(500mg)の溶液にLiOH・H2O(240mg,5.73mmol)を加える。室温で4時間撹拌した後、反応混合物を1M HClで中和し、濃縮し、ジクロロメタン中20%のメタノール溶液(100mL)で希釈する。水(100mL)を加え、混合物のpHを1M HClで4に調整する。相を分けて水層をジクロロメタン中20%のメタノール溶液(9×100mL)で抽出する。混ぜ合わせた有機層を硫酸マグネシウム上で乾燥させ、ろ過かつ濃縮して6-ブロモ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸と1-(4-フルオロ-フェニル)-6-ヨード-1H-インダゾール-4-カルボン酸の混合物を固体として得る。
表題化合物は、実施例13に記載のカップリング手順に従い、6-ブロモ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸と1-(4-フルオロ-フェニル)-6-ヨード-1H-インダゾール-4-カルボン酸の混合物(420mg)、及び1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピルアミントリフルオロ酢酸塩(851mg,1.93mmol)を用いて調製され、かつC18カラム及び0.1%トリフルオロ酢酸を含む水中のアセトニトリルの勾配を利用する逆相HPLCで精製される。中間体1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピルアミントリフルオロ酢酸塩は、[1-(2-ブロモ-ピリジン-4-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステルから、WO 2009/134666(実施例7)に記載の銅媒介カップリング手順後、上記Boc脱保護手順(実施例3)に従って調製される。
【0142】
実施例26:1-(4-フルオロ-フェニル)-6-メタンスルホニル-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド(26)の合成
【0143】
【化39】

【0144】
表題化合物は、実施例18に記載のカップリング手順に従い、6-ブロモ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミドと1-(4-フルオロ-フェニル)-6-ヨード-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミドの混合物(100mg)から合成される。
【0145】
実施例27:6-シアノ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド(27)の合成
【0146】
【化40】

【0147】
DMF(1.0mL,脱気かつ無水)中の6-ブロモ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド、及び1-(4-フルオロ-フェニル)-6-ヨード-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド(150mg)の撹拌溶液にテトラキス(トリフェニルホスフィン)パラジウム(33mg,0.028mmol)及びシアン化亜鉛(40mg,0.34mmol)を添加する。溶液を排気し、アルゴンでパージし(3回)、120℃に温める。3時間後、反応を室温に冷まし、塩化アンモニウム飽和水溶液(50mL)で希釈し、酢酸エチル(3×50mL)で抽出する。混ぜ合わせた有機層をブライン(50mL)で洗浄し、硫酸マグネシウム上で乾燥させ、ろ過かつ濃縮する。ヘプタン中50〜100%の酢酸エチルの勾配を利用してSiO2上で残留物を精製して固体を得、これをエチルエーテルと摩砕して表題生成物を得る。
【0148】
(生物学的特性の評価)
CCR1トランスフェクト細胞内のカルシウム流を測定する機能性細胞アッセイにおけるCCR1とMIP-1αの相互作用を遮断する能力について化合物を評価する。
Chemicon Corporationから購入した安定に組換えCCR1及びG-α-16を発現している非接着性細胞(HTS005C)を、10%FBS、0.4mg/mLのジェネテシン(Geneticin)及びペニシリン/ストレプトマイシンを補充したRPMI 1640培地(Mediatech 10-080-CM)内で培養する。アッセイ当日、細胞にカルシウム4色素(Molecular Devices R7448)とプロベネシド(Probenecid)(Invitrogen P346400)を8E5細胞/mLで1時間室温にて負荷する。1時間後、細胞を384ウェル組織培養処理プレートに20,000細胞/ウェルの密度で播種する。適切に希釈した試験化合物を、3,000nMの最大濃度に達するようにウェルに添加する(10用量合計で4倍希釈)。DMSOの最終濃度は1%である。緩衝液は、pH7.4で20mMのHEPESを含むHBSS(Invitrogen 14025)である。細胞を37℃で30分、次に室温で30分インキュベートする。プレートをHAMAMATSU FDSS6000に移し、1%BSA中のMIP-1αをEC80最終濃度で添加する。色素負荷の開始の4時間以内で全てのプレートを解読しなければならない。化合物の代わりに希釈DMSOを含むウェル+/-MIP-1αがコントロールとして役立つ。Activity Baseソフトウェアを用いてデータを解析する。
一般に、上記アッセイにおける化合物の好ましい効力範囲(IC50)は0.1nM〜3μMであり、最も好ましい効力範囲は0.1nM〜50nMである。
本発明の代表化合物を上記アッセイで試験すると、それらはCCR1アンタゴニストとしての活性を示した。これは本発明の別の実施形態を表す。
【0149】
表II

【0150】
(表II続き)

【0151】
(表II続き)

【0152】
(表II続き)

【0153】
(表II続き)

【0154】
(使用方法)
本発明の化合物は、CCR1とそのケモカインリガンドとの相互作用の有効なアンタゴニストなので、CCR1媒介活性を阻害する。従って、本発明の一実施形態では、本発明の化合物を使用する自己免疫障害の治療方法を提供する。別の実施形態では、本発明の化合物を使用する炎症性障害の治療方法を提供する。
理論によって拘束されることを望むものではないが、CCR1とそのケモカインリガンドとの相互作用をアンタゴナイズすることによって、本化合物は、単球、マクロファージ樹状細胞、好酸球、及びT細胞(TH1)細胞並びに炎症組織に対してCCR1陽性の他細胞などの炎症誘発性細胞の走化性を遮断し、それによって自己免疫疾患と関連する慢性炎症を寛解させる。このように、CCR1活性の阻害は、種々の自己免疫障害、例えば炎症性疾患、自己免疫疾患、臓器移植拒絶反応(Horuk et al. (2001) JBC 276 p. 4199)及び骨髄移植拒絶反応並びに炎症誘発性細胞の流入と関連する他の障害などを予防及び治療するための魅力的な手段である。例えば、本発明の化合物を用いて急性若しくは慢性炎症、アレルギー、接触皮膚炎、乾癬、関節リウマチ、多発性硬化症、1型糖尿病、炎症性腸疾患、ギラン・バレー症候群、クローン病、潰瘍性大腸炎、移植片対宿主病(及び他の形態の臓器又は骨髄移植拒絶反応)、アルツハイマー病(Halks-Miller et al. (2003) Ann Neurol 54 p.638)、喘息(Jouber et al. (2008) J. Immun180 p. 1268)、慢性腎臓病(Topham et al. (1999) J. Clin. Invest. 104 p. 1549)、敗血症(He et al. (2007) Am J. Physio 292 p. G1173)、自己免疫性心筋炎(Futamats et al. (2006) J Mol Cell Cardiology 40 p. 853)、多発性骨髄腫(Blood (2001) 97 pp 3349-3353)、COPD(Expert Opin. Investig. Drugs (2005) 14 pp 785-796)及び全身性エリテマトーデスを予防又は治療することができる。特に、本化合物を用いて関節リウマチ及び多発性硬化症を予防又は治療することができる。当業者には炎症誘発性細胞の輸送と関連する他の障害が明白であろうし、それらを本発明の化合物及び組成物で治療することもできる。
上記疾患及び障害の治療のため、治療的に有効な用量は、一般的に本発明の化合物の投薬当たり約0.01mg/kg(体重)〜約100mg/kg(体重);好ましくは投薬当たり約0.1mg/kg(体重)〜約20mg/kg(体重)の範囲内である。例えば、70kgのヒトへの投与では、用量範囲は、本発明の化合物の投薬当たり約0.7mg〜約7000mg、好ましくは投薬当たり約7.0mg〜約1400mgである。最適な投薬レベル及びパターンを決定するためにはある程度の日常的な用量の最適化が必要であろう。1日に1〜6回活性成分を投与してよい。
【0155】
(一般的投与及び医薬組成物)
医薬品として使用する場合、本発明の化合物は典型的に医薬組成物の形で投与される。該組成物は製薬技術で周知の技術を利用して調製可能であり、少なくとも1種の本発明の化合物を含む。本発明の化合物は単独で投与してもよく或いは本発明の化合物の安定性を増強するか、又は特定の実施形態では本発明の化合物を含む医薬組成物の投与を容易にするか、又は溶解若しくは分散を高めるか、又はアンタゴニスト活性を高めるか、又は補助治療を提供する等のアジュバントと組み合わせて投与してもよい。本発明の化合物を単独で使用してよく、或いは本発明の他の活性物質と共に、また必要に応じて他の薬理学的に活性な物質と共に使用してもよい。一般に、本発明の化合物は治療的又は医薬的に有効な量で投与されるが、診断又は他の目的では、より少ない量で投与され得る。
医薬組成物の許容されるいるいずれの投与様式を利用しても、本発明の化合物の投与を純粋な形態又は適切な医薬組成物で行うことができる。従って、投与は、例えば、固体、半固体、凍結乾燥粉末の形態、又は液体剤形、例えば、錠剤、座剤、丸剤、軟弾性及び硬ゼラチンカプセル剤、散剤、溶液、懸濁液、又はエアロゾル等で、好ましくは正確な薬用量の簡単な投与に適した単位剤形で、経口、頬側(例えば、舌下)、経鼻、非経口、局所、経皮、経膣、経直腸投与であってよい。医薬組成物は、一般的に通常の医薬担体又は賦形剤と、活性薬として本発明の化合物とを含み、かつさらに、他の医薬、薬剤、担体、アジュバント、希釈剤、ビヒクル、又はその組合せを含むであろう。このような医薬的に許容できる賦形剤、担体、又は添加剤並びに種々の様式又は投与用の医薬組成物の製造方法は当業者に周知である。技術水準は、例えば、Remington: The Science and Practice of Pharmacy, 20th Edition, A. Gennaro (ed.), Lippincott Williams & Wilkins, 2000; Handbook of Pharmaceutical Additives, Michael & Irene Ash (eds.), Gower, 1995; Handbook of Pharmaceutical Excipients, A.H. Kibbe (ed.), American Pharmaceutical Ass’n, 2000; H.C. Ansel and N.G. Popovish, Pharmaceutical Dosage Forms and Drug Delivery Systems, 5th ed., Lea and Febiger, 1990によって証明されており;上記文献は、技術水準をよりよく説明するため、それぞれ参照によってその全体がここに援用される。
当業者が予想するように、特定の医薬製剤で利用される本発明の化合物の形態は、その製剤が有効であるために必要とされる適切な物理的特性(例えば、水溶性)を有するように(例えば、塩)選択されるであろう。
【技術分野】
【0001】
(出願データ)
この出願は、2009年10月21日に出願された米国仮出願第61/253,590号の優先権を主張する。
(発明の分野)
この発明は、アリール-又はヘテロアリール-カルボシクリルアミン、及びアリール-又はヘテロアリール-ヘテロシクリルアミンを含有するインダゾール及びピラゾロピリジンに関するのものであり、CCR1活性のアンタゴニストとして有用であり、ひいては関節リウマチ及び多発性硬化症などの自己免疫疾患を含めたCCR1の活性によって媒介又は持続される種々の疾患及び障害の治療に有用である。この発明は、これらの化合物を含む医薬組成物、種々の疾患及び障害の治療におけるこれらの化合物の使用方法、これらの化合物の調製方法並びにこれらの方法において有用な中間体にも関する。
【背景技術】
【0002】
(発明の背景)
走化性サイトカイン受容体1(CCR1)は、特異的ケモカイン(>50)と相互作用して白血球輸送、顆粒開口放出、遺伝子転写、分裂促進作用及びアポトーシスを媒介する走化性サイトカイン(ケモカイン)受容体の大ファミリー(>20)に属する。ケモカインは、基本的及び炎症性白血球輸送を媒介するそれらの能力で最もよく知られている。少なくとも3種のケモカイン(MIP-1α/CCL3、MCP3/CCL7及びRANTES/CCL5)のCCR1への結合は、単球、マクロファージ及びTH1細胞の、関節リウマチ(RA)及び多発性硬化症(MS)患者の炎症組織への輸送に関与する(Trebst et al. (2001) American J of Pathology 159 p. 1701)。MS患者のCNS内では、マクロファージ炎症性タンパク質1α(MIP-1α)、マクロファージ化学誘引物質タンパク質3(MCP-3)及び血小板やT細胞由来の好酸球走化性物質(regulated on activation, normal T-cell expressed and secreted)(RANTES)が全て見られるが、MSの実験的自己免疫性脳脊髄炎(experimental autoimmune encephalomyelitis)(EAE)モデルのCNS内ではMIP-1α及びRANTESが見られる(概説:Gerard and Rollins (2001) Nature Immunology)。RA患者の炎症滑膜内のマクロファージ及びTh1細胞は、MIP-1α及びRANTESの主プロデューサーであり、持続的にRA患者の滑膜組織に白血球を補充して慢性炎症を伝播する(Volin et al. (1998) Clin. Immunol. Immunopathology; Koch et al. (1994) J. Clin. Investigation; Conlon et al. (1995) Eur. J. Immunology)。CCR1及びそのケモカインリガンドとの相互作用をアンタゴナイズすることは、単球、マクロファージ及びTh1細胞の炎症組織への走化性を遮断し、それによってRA及びMSなどの自己免疫疾患と関連する慢性炎症を寛解させると仮定されている。
【0003】
多発性硬化症のモデルである実験的自己免疫性脳脊髄炎(EAE)と関連する慢性炎症の発生及び進行におけるCCR1の役割の証拠は、CCR1の遺伝子欠失及び小分子アンタゴニストの両方に基づいている。CCR1欠損マウスは活性EAEの感受性低下(55%対100%)及び重症度低下(1.2対2.5)を示すことが分かった(Rottman et al. (2000) Eur. J. Immunology)。さらに、ラットCCR1に対して中程度の親和性を有する(Ki=120nM)、CCR1の小分子アンタゴニストの投与は、静脈内投与した場合にEAEの発症を遅らせ、またその重症度を下げることが分かった(Liang et al. (2000) J. Biol. Chemistry)。CCR1リガンドMIP-1αに特異的な抗体によるマウスの治療が、CNSに補充されるT細胞及びマクロファージの数を減らすことによって、急性及び再発性EAEの発生を予防するのに有効であることも分かっている(Karpus et al. (1995) J. Immunology; Karpus and Kennedy (1997) J. Leucocyte Biology)。このように、少なくとも1つのCCR1リガンドが白血球をCNSに補充し、EAEにおける慢性炎症を伝播し、EAE及びMSにおけるCCR1の役割についてのさらなるin vivoバリデーションをもたらすことが実証されている。
【0004】
RAと関連する慢性炎症の発生及び伝播におけるCCR1のin vivoバリデーションも重要である。例えば、DBA/1マウスのコラーゲン誘発関節炎(collagen induced arthritis)(CIA)モデルにおけるCCR1アンタゴニストの投与が滑膜炎症及び関節破壊を減少させるのに有効であることが分かっている(Plater-Zyberk et al. (1997) Immunology Letters)。別の刊行物は、マウスCCR1の強力アンタゴニストが経口投与したときにLPS加速されたコラーゲン誘発関節炎(CIA)の重症度を減少させる(58%)ことを記載した(Biorganic and MeジCinal Chemistry Letters 15, 2005, 5160-5164)。経口CCR1アンタゴニストによる第Ib相臨床治験の公表結果は、副作用なしで臨床的改善に向かう傾向を実証した(Haringman et al. (2003) Ann. Rheum. Dis.)。18日目に患者の1/3が関節リウマチの徴候及び症状の20%改善(ACR20)を達成し、CCR1陽性細胞は処置患者の滑膜で70%減少し、CD4+T細胞の50%減少、CD8+T細胞の50%減少及びマクロファージの34%減少など、特異的細胞型が有意に減少した。
上記で引用した当該研究のような研究は、MS及びRAにおけるCCR1の役割を支持し、かつCCR1アンタゴニストの開発の治療上の理論的根拠を提供する。
【発明の概要】
【発明が解決しようとする課題】
【0005】
(発明の概要)
本発明は、CCR1とそのリガンドの相互作用を遮断し、ひいては自己免疫疾患、例えば関節リウマチ及び多発性硬化症などのCCR1の活性によって媒介又は持続される種々の疾患及び障害の治療に有用な新規化合物を提供する。この発明は、これらの化合物を含む医薬組成物、種々の疾患及び障害の治療におけるこれらの化合物の使用方法、これらの化合物の調製方法及びこれらの方法で有用な中間体にも関する。
【課題を解決するための手段】
【0006】
(発明の詳細な説明)
その最も広い一般的態様では、本発明は、下記式(I)
【0007】
【化1】

(I)
【0008】
(式中、
Xは、窒素又はC-R2であり;
Ar1は、それぞれ任意に1〜3個のRaで置換されていてもよい炭素環、ヘテロアリール又はヘテロシクリルであり;
Ar2は、それぞれ任意に1〜3個のRbで置換されていてもよい炭素環、ヘテロアリール又はヘテロシクリルであり;
環式Gは、それぞれ任意に1〜2個のRgで置換されていてもよい炭素環、又はヘテロシクリルであり;
R1は、水素、C1-6アルキル又はC1-6アルコキシC1-6アルキルであり;
R2は、水素又はRaであり;
Raは、C1-6アルキル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルチオ、C1-6アルキルスルホニル、C1-6アルコキシカルボニル、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C3-6シクロアルキルアミノ、C1-6アルキルアミノカルボニル、C1-6アシル、C1-6アシルアミノ、C1-6ジアルキルアミノカルボニル、ヒドロキシル、ハロゲン、シアノ、ニトロ、オキソ、R3-S(O)m-NH-、R3-NH-S(O)m-、アリール又はカルボキシルであり;
Rbは、ヒドロキシル、カルボキシル、ハロゲン、-(CH2)n-CN、-(CH2)n-CO2C1-6アルキル、ニトロ、-SO3H、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルC(O)-、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)m-NRe-、R3-NRe-S(O)m(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-(CH2)n-NRcRd、ヘテロシクリル、アリール又はヘテロアリールであり、各Rbは、可能であれば、任意にハロゲン化されるか又は1〜3個のC1-6アルキル、ヒドロキシル、C1-6アシル、C1-6アルコキシカルボニル、C1-6アルキル-S(O)m-、アリール若しくはカルボキシルで置換されていてもよく;
各Rc、Rdは、独立に水素、C1-6アルキル、C1-6アシル、C3-10シクロアルキル、C1-6アルコキシ、ヒドロキシC1-6アルキル、シアノ-C1-6アルキル、C1-6アルキルC1-6アルコキシ、C1-6アルキルスルホニル、C1-6アルコキシカルボニルC0-3アルキル、C1-6アルコキシカルボニルC3-10シクロアルキル、-(CH2)n-C(O)-NReRf又は-(CH2)n-NReRfであり;
各Re、Rfは、独立に水素、C1-6アルキル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルコキシC1-6アルキル、モノ若しくはジC1-6アルキルアミノC1-6アルキル、ヒドロキシC1-6アルキル又はC1-6アシルであり;
Rgは、C1-6アルキル(ここで、該C1-6アルキルは、任意に部分的又は完全にハロゲン化されていてもよい)、C2-6アルケニル、炭素環、C1-6アルコキシ、カルボシクリル-C1-6アルコキシ、カルボシクリル-C1-6アルキル、ヒドロキシC1-6アルキル、ヒドロキシル、-(CH2)n-CO2C1-6アルキル又はオキソであり;
R3は、水素、C1-6アルキル、C3-6シクロアルキル、ヘテロシクリル(CH2)0-1、モノ-若しくはジ-C1-6アルキルアミノ、モノ-若しくはジ-C1-6アルキルアミノ(CH2)2-3N(Re)-、アリール又はヘテロアリールであり、それぞれ任意に1〜3個のC1-6アルキル、C3-6シクロアルキル、C1-6アルコキシ、ハロゲン、ヒドロキシル、オキソ、カルボキシル、-C(O)NReRf、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C1-6アルコキシカルボニル又はC1-6アシルアミノで置換されていてもよく;
各n、yは、独立に0〜3であり;
各mは、独立に0〜2である)
の化合物又はその医薬的に許容できる塩を提供する。
【発明を実施するための形態】
【0009】
本発明の別の実施形態では、直前に与えたとおりの式(I)の化合物であり、かつ式中、
環式Gが、任意に1〜2個のRgで置換されていてもよい炭素環である
化合物が提供される。
本発明の別の実施形態では、直前に与えたとおりの式(I)の化合物であり、かつ式中、
Xが窒素であり;
Ar1が、任意に1〜3個のRaで置換されていてもよい炭素環であり;
Ar2が、それぞれ任意に1〜3個のRbで置換されていてもよい炭素環又はヘテロアリーであり;
R1が水素であり;
Raが、C1-3アルキル、C1-3アルコキシ、ジ-C1-6アルキルアミノ、メチルスルホニル、ハロゲン、又はシアノであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-(CH2)n-CN、-(CH2)n-CO2C1-6アルキル、ニトロ、-SO3H、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルC(O)-、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)m-NRe-、R3-NRe-S(O)m(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-(CH2)n-NRcRd、ヘテロシクリル、アリール又はヘテロアリールであり、各Rbは、可能であれば、任意にハロゲン化されるか又は1〜3個のC1-6アルキル、C1-6アシル、C1-6アルコキシカルボニル、C1-6アルキル-S(O)m-、アリール若しくはカルボキシルで置換されていてもよく;
R3が、水素、C1-6アルキル、C3-6シクロアルキル、ヘテロシクリル(CH2)0-1、モノ-若しくはジ-C1-6アルキルアミノ、モノ-若しくはジ-C1-6アルキルアミノ(CH2)2-3N(C1-6アルキル)-、アリール又はヘテロアリールであり、それぞれ任意に1〜2個のC1-6アルキル、C3-6シクロアルキル、C1-6アルコキシ、ハロゲン、ヒドロキシル、オキソ、カルボキシル、-C(O)NReRf、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C1-6アルコキシカルボニル又はC1-6アシルアミノで置換されていてもよい
化合物が提供される。
【0010】
本発明のさらなる実施形態では、直前に与えたとおりの式(I)の化合物であり、かつ式中、
Ar1が、1〜2個のRaで置換されているフェニルであり;
Ar2が、それぞれ任意に1〜2個のRbで置換されていてもよいフェニル、チアジアゾリル、オキサジアゾリル、ピリミジニル、フラニル、チアゾリル又はピリジルであり;
環式Gがシクロプロピル又はシクロブチルであり;
Raがハロゲンであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-CF3、-CN、-SO3H、C1-3アルキル、C3-6シクロアルキル C1-3アルコキシ、-(CH2)n-CO2C1-3アルキル、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)2-NRe-、R3-NRe-S(O)2(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-NRcRd、又はモルフォリニルであり;
各Rc、Rdが、独立に水素、C1-3アルキル、C1-3アシル、シアノ-C1-3アルキル、C1-3アルコキシカルボニルC0-3アルキル、C1-3アルコキシカルボニルC3-6シクロアルキル、又は-(CH2)n-C(O)-NReRfであり;
各Re、Rfが、独立に水素又はC1-3アルキルであり;
R3が、水素又はそれぞれ任意に1〜2個のC1-6アルコキシ若しくはオキソで置換されていてもよいC1-6アルキルである
化合物が提供される。
【0011】
本発明の別の実施形態では、最も広い一般的実施形態で与えたとおりの式(I)の化合物であり、かつ式中、
環式Gがシクロプロピルであり;
Raが-F又は-Clであり;
Rbが、-CH3、カルボキシル、-F、-Cl、-Br、-I、-CF3、シクロプロピル、-OCH3、-CO2Me、-NRcRd、-CH2-NRcRd、R3-S(O)m-、R3-S(O)2-NRe-、R3-NRe-S(O)2-、-NRf-C(O)-Re、-C(O)NRcRd又はモルフォリニルであり;
各Rc、Rdが、独立に水素、-CH3、-C(O)CH3、-CH2CN、C1-4アルコキシカルボニル、メトキシカルボニル-C1-2アルキル-、メトキシカルボニル-C3シクロアルキル-又は-(CH2)-C(O)-NReRfであり;
各Re、Rfが、独立に水素又は-CH3であり;
R3が水素又はそれぞれ任意に1〜2個の-OCH3若しくはオキソで置換されていてもよいC1-4アルキルである
化合物が提供される。
【0012】
本発明の別の実施形態では、最も広い一般的実施形態で与えたとおりの式(I)の化合物であり、かつ式中、
XがC-R2であり;
Ar1が、任意に1〜3個のRaで置換されていてもよい炭素環であり;
Ar2が、それぞれ任意に1〜3個のRbで置換されていてもよい炭素環又はヘテロアリールであり;
環式Gが、任意に1〜2個のRgで置換されていてもよい炭素環であり;
R1が水素であり;
R2が水素又はRaであり;
Raが、C1-3アルキル、C1-3アルコキシ、ジ-C1-6アルキルアミノ、メチルスルホニル、ハロゲン、又はシアノであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-(CH2)n-CN、-(CH2)n-CO2C1-6アルキル、ニトロ、-SO3H、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルC(O)-、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)m-NRe-、R3-NRe-S(O)m(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-(CH2)n-NRcRd、ヘテロシクリル、アリール又はヘテロアリールであり、各Rbは、可能であれば、任意にハロゲン化されるか又は1〜3個のC1-6アルキル、C1-6アシル、C1-6アルコキシカルボニル、C1-6アルキル-S(O)m-、アリール若しくはカルボキシルで置換されていてもよく;
各Rc、Rdが、独立に水素、C1-6アルキル、C1-6アシル、C3-10シクロアルキル、C1-6アルコキシ、ヒドロキシC1-6アルキル、シアノC1-6アルキル、C1-6アルキルC1-6アルコキシ、C1-6アルキルスルホニル、C1-6アルコキシカルボニルC0-3アルキル、C1-6アルコキシカルボニルC3-10シクロアルキル、-(CH2)n-C(O)-NReRf又は-(CH2)n-NReRfであり;
各Re、Rfが、独立に水素、C1-6アルキル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルコキシC1-6アルキル、モノ若しくはジC1-6アルキルアミノC1-6アルキル、ヒドロキシC1-6アルキル又はC1-6アシルであり;
R3が、水素、C1-6アルキル、C3-6シクロアルキル、ヘテロシクリル(CH2)0-1、モノ-若しくはジ-C1-6アルキルアミノ、モノ-若しくはジ-C1-6アルキルアミノ(CH2)2-3N(C1-6アルキル)-、アリール又はヘテロアリールであり、それぞれ任意に1〜2個のC1-6アルキル、C3-6シクロアルキル、C1-6アルコキシ、ハロゲン、ヒドロキシル、オキソ、カルボキシル、-C(O)NReRf、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C1-6アルコキシカルボニル又はC1-6アシルアミノで置換されていてもよい
化合物が提供される。
【0013】
本発明のさらなる実施形態では、直前で与えたとおりの式(I)の化合物であり、かつ式中、
Ar1が、1〜2個のRaで置換されているフェニルであり;
Ar2が、それぞれ任意に1〜2個のRbで置換されていてもよいフェニル、チアジアゾリル、オキサジアゾリル、ピリミジニル、フラニル、チアゾリル又はピリジルであり;
環式Gが、シクロプロピル又はシクロブチルであり;
Raが、C1-3アルキル、メチルスルホニル、ハロゲン、又はシアノであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-CF3、-CN、-SO3H、C1-3アルキル、C3-6シクロアルキル C1-3アルコキシ、-(CH2)n-CO2C1-3アルキル、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)2-NRe-、R3-NRe-S(O)2(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-NRcRd、又はモルフォリニルであり;
各Rc、Rdが、独立に水素、C1-3アルキル、C1-3アシル、シアノ-C1-3アルキル、C1-3アルコキシカルボニルC0-3アルキル、C1-3アルコキシカルボニルC3-6シクロアルキル、又は-(CH2)n-C(O)-NReRfであり;
各Re、Rfが、独立に水素又はC1-3アルキルであり;
R3が、水素又はそれぞれ任意に1〜2個のC1-6アルコキシ若しくはオキソで置換されていてもよいC1-6アルキルである
化合物が提供される。
【0014】
本発明の別の実施形態では、直前で与えたとおりの式(I)の化合物であり、かつ式中、
環式Gがシクロプロピルであり;
Raが、-F又は-Cl、メチル、メチルスルホニル又はシアノであり;
Rbが、-CH3、カルボキシル、-F、-Cl、-Br、-I、-CF3、シクロプロピル、-OCH3、-CO2Me、-NRcRd、-(CH2)-NRcRd、R3-S(O)m-、R3-S(O)2-NRe-、R3-NRe-S(O)2-、-NRf-C(O)-Re、-C(O)NRcRd又はモルフォリニルであり;
各Rc、Rdが、独立に水素、-CH3、-C(O)CH3、-CH2CN、C1-4アルコキシカルボニル、メトキシカルボニル-C1-2アルキル-、メトキシカルボニル-C3シクロアルキル-又は-(CH2)-C(O)-NReRfであり;
各Re、Rfが、独立に水素又は-CH3であり;
R3が水素又はそれぞれ任意に1〜2個の-OCH3若しくはオキソで置換されていてもよいC1-4アルキルである
化合物が提供される。
【0015】
本発明の別の実施形態では、適用できる場合に上述した実施形態のいずれか1つに従う式(I)の化合物であり、かつ式中、
環式Gが、シクロプロピル又はシクロブチルである
化合物が提供される。
本発明の別の実施形態では、直前で与えたとおりの式(I)の化合物であり、かつ式中、
環式Gがシクロプロピルである
化合物が提供される。
本発明の別の実施形態では、適用できる場合に上述した実施形態のいずれか1つに従う式(I)の化合物であり、かつ式中、
Rcが水素又はC1-6アルキルであり、かつRdが、C1-6アシル、シアノ-C1-6アルキル-、C1-6アルコキシカルボニル-C0-3アルキル-、C1-6アルコキシカルボニルC3-10シクロアルキル、又は-(CH2)n-C(O)-NReRfであり;
各Re、Rfが、独立に水素、C1-6アルキルである
化合物が提供される。
本発明の別の実施形態では、適用できる場合に上述した実施形態のいずれか1つに従う式(I)の化合物であり、かつ式中、
Ar2が、それぞれ任意に1又は2個のRbで置換されていてもよいフェニル、ピリミジニル、フラニル、チアゾリル又はピリジルであり;
Rbが、-SO2Me、-I、-Br、-Cl、-CF3、-OMe、-NMe2、-CONHMe、-SO2NH2である
化合物が提供される。
本発明の別の実施形態では、適用できる場合に上述した実施形態のいずれか1つに従う式(I)の化合物であり、かつ式中、Ar2が下記である化合物又はその医薬的に許容できる塩が提供される。
【0016】
【化2】

【0017】
本発明の別の実施形態では、適用できる場合に上述した実施形態のいずれか1つに従う式(I)の化合物であり、かつ式中、
Rgが、
i)C1-2アルキル、-CF3、C2アルケニル、フェニル、C1-4アルコキシ、カルボシクリルCH2O-、カルボシクリルCH2- -CH2OH、ヒドロキシル、-CO2C1-4アルキル又はオキソ;
又は
ii)メチル、ビニル、-CF3、フェニル、-CH2OH、又はヒドロキシルである
化合物が提供される。
一般的合成スキーム、実施例、及び技術上周知の方法で製造可能な本発明の代表化合物を以下に示す。
【0018】
表I

【0019】
(表I続き)

【0020】
(表I続き)

【0021】
(表I続き)

【0022】
(表I続き)

【0023】
(表I続き)

【0024】
(表I続き)

【0025】
(表I続き)

【0026】
(表I続き)

【0027】
(表I続き)

【0028】
(表I続き)

【0029】
(表I続き)

【0030】
(表I続き)

【0031】
(表I続き)

【0032】
(表I続き)

【0033】
(表I続き)

(a) HPLC-MS法については合成例セクションを参照されたい。
(b) 全ての化合物について観測[M+H]+が報告されている。臭素含有化合物については2つの臭素異性体(すなわち、79Br及び81Br)の観測[M+H]+が報告されている。
【0034】
この出願で上述した全ての化合物では、命名法が構造と矛盾する場合、化合物は構造によって定義されるものと解釈すべきである。
本発明は、本発明の1種以上の化合物、又はその医薬的に許容できる誘導体を活性物質として含有し、任意に通常の賦形剤及び/又は担体と組み合わせてよい医薬組成物にも関する。
本発明の化合物には、それらの同位体標識形も含まれる。本発明の組合せの活性薬の同位体標識形は、前記活性薬の1個以上の原子が、通常自然界に見られる前記原子の原子質量又は質量数と異なる原子質量又は質量数を有する原子と置き換わっているという事実を別にすれば、前記活性薬と同一である。容易に商業的に入手でき、かつよく確立された手順に従って本発明の組合せの活性薬に取り込める同位体の例としては、水素、炭素、窒素、酸素、リン、フッ素及び塩素の同位体、例えば、それぞれ、2H、3H、13C、14C、15N、18O、17O、31P、32P、35S、18F、及び36Clが挙げられる。1個以上の上記同位体及び/又は他原子の他の同位体を含有する、本発明の組合せの活性薬、そのプロドラッグ、又はどちらかの医薬的に許容できる塩は、本発明の範囲内であると考えられる。
【0035】
本発明は、ラセミ体及びラセミ混合物、単一のエナンチオマー、ジアステレオマー混合物並びに個々のジアステレオマーとして存在し得る、1個以上の不斉炭素原子を含有する上記いずれの化合物の使用をも包含する。異性体は、エナンチオマー及びジアステレオマーであると定義されるものとする。これらの化合物の全ての該異性形は、明示的に本発明に包含される。各ステレオジェン炭素はR若しくはS配置、又は組合せの配置にあり得る。
本発明の一部の化合物は、複数の互変異性形で存在し得る。本発明は、全ての該互変異性体の使用方法を包含する。
この明細書で使用する全ての用語は、特に指定のない限り、当技術分野で周知のようにそれらの通常の意味に解釈するものとする。例えば、「C1-4アルコキシ」は、末端酸素を有するC1-4アルキル、例えばメトキシ、エトキシ、プロポキシ、ブトキシ等である。全てのアルキル、アルケニル及びアルキニル基は、構造的に可能であり、かつ特に指定のない限り、分岐又は非分岐と解釈するものとする。他のさらに具体的な定義は以下のとおりである。
炭素環には、3〜12個の炭素原子を含有する炭化水素環がある。これらの炭素環は芳香族又は非芳香族のどちらの環系であってもよい。非芳香族環系は一不飽和又は多不飽和であり得る。好ましい炭素環としては、限定するものではないが、シクロプロピル、シクロブチル、シクロペンチル、シクロペンテニル、シクロヘキシル、シクロヘキセニル、シクロヘプタニル、シクロヘプテニル、フェニル、インダニル、インデニル、ベンゾシクロブタニル、ジヒドロナフチル、テトラヒドロナフチル、ナフチル、デカヒドロナフチル、ベンゾシクロヘプタニル及びベンゾシクロヘプテニルが挙げられる。シクロブタニルとシクロブチルのようなシクロアルキルの一定の用語は互換的に用いられる。
用語「ヘテロ環」は、安定な非芳香族4〜8員(好ましくは、4又は6員)単環式又は非芳香族8〜11員二環式又はスピロ環式ヘテロ環基を意味し、飽和又は不飽和のいずれであってもよい。各ヘテロ環は、炭素原子と、1個以上、好ましくは1〜4個の、窒素、酸素及びイオウから選択されるヘテロ原子とから成る。ヘテロ環は、結果として安定構造の生成をもたらす、該環のいずれの原子によっても付着され得る。
用語「ヘテロアリール」は、1〜4個のN、O及びS等のヘテロ原子を含有する芳香族5〜8員単環式又は8〜11員二環式環を意味するものと解釈すべきである。
特に指定のない限り、ヘテロ環及びヘテロアリールとしては、限定するものではないが、例えば、フラニル、ピラニル、ベンゾオキサゾリル、ベンゾチアゾリル、ベンゾイミダゾリル、テトラヒドロピラニル、ジオキサニル、ジオキソラニル、テトラヒドロフラニル、オキサゾリル、イソオキサゾリル、チアゾリル、ピラゾリル、ピロリル、イミダゾリル、チエニル、チアジアゾリル、チオモルフォリニル、1,1-ジオキソ-1λ6-チオモルフォリニル、モルフォリニル、ピリジル、ピリミジニル、ピリダジニル、ピラジニル、トリアジニル、ピロリジニル、ピペリジニル、ピペラジニル、プリニル、キノリニル、ジヒドロ-2H-キノリニル、イソキノリニル、キナゾリニル、インダゾリル、チエノ[2,3-d]ピリミジニル、インドリル、イソインドリル、ベンゾフラニル、ベンゾピラニル及びベンゾジオキソリルが挙げられる。
本明細書では、用語「ヘテロ原子」は、炭素以外の原子、例えばO、N、S及びP等を意味するものと解釈すべきである。
【0036】
全てのアルキル基又は炭素鎖では、1個以上の炭素原子が任意に、ヘテロ原子:O、S又はNと置き換わることができ、Nが置換されていなければそれはNHであると解釈すべきであり、ヘテロ原子は、分岐又は非分岐鎖内の末端炭素原子又は内部炭素原子のどちらとも置き換わり得ることをも理解すべきである。このような基は、オキソ等の基で上述したように置換されて、限定するものではないが、アルコキシカルボニル、アシル、アミド及びチオキソ等の定義をもたらし得る。
本明細書では、用語「アリール」は、本明細書で定義どおりの芳香族炭素環又はヘテロアリールを意味するものと解釈すべきである。各アリール又はヘテロアリールには、特に指定のない限り、その部分的又は完全に水素化された誘導体が含まれる。例えば、キノリニルにはデカヒドロキノリニル及びテトラヒドロキノリニルが含まれ、ナフチルにはその水素化誘導体、例えばテトラヒドロナフチルが含まれる。当業者には、本明細書に記載のアリール及びヘテロアリール化合物の他の部分的又は完全に水素化された誘導体が明らかであろう。
本明細書では、「窒素」及び「イオウ」には、窒素及びイオウのいずれの酸化形並びにいずれの塩基性窒素の四級化形をも含まれる。例えば、-S-C1-6アルキル基では、特に指定のない限り、これは-S(O)-C1-6アルキル及び-S(O)2-C1-6アルキルを包含するものと解釈すべきである。
【0037】
用語「アルキル」は、1〜10個の炭素原子を含有する飽和脂肪族基又は2〜12個の炭素原子を含有する一不飽和若しくは多不飽和脂肪族炭化水素基を表す。一不飽和若しくは多不飽和脂肪族炭化水素基は、それぞれ少なくとも1つの二重結合又は三重結合を含有しなければならない。「アルキル」は分岐及び非分岐の両アルキル基を表す。「alk」又は「アルキル」接頭辞を用いたいずれの合成語も「アルキル」の上記定義に従う類似語を表す。例えば、「アルコキシ」、「アルキチオ(alkythio)」等の用語は、酸素又はイオウ原子を介して第2の基に結合しているアルキル基を表す。「アルカノイル」は、カルボニル基(C=O)に結合しているアルキル基を表す。
用語「ハロゲン」は、本明細書で用いられる場合、臭素、塩素、フッ素又はヨウ素、好ましくはフッ素を意味するものと解釈すべきである。「ハロゲン化」、「部分的又は完全にハロゲン化された」;部分的又は完全にフッ素化された;「1個以上のハロゲン原子で置換された」という定義は、例えば、1個以上の炭素原子についてモノハロ、ジハロ又はトリハロ誘導体を包含する。アルキルでは、非限定例は-CH2CHF2、-CF3等であろう。
本明細書に記載の各アルキル、炭素環、ヘテロ環若しくはヘテロアリール、又はその類似体は、任意に部分的又は完全にハロゲン化されることがあるものと解釈すべきである。
【0038】
本発明の化合物は、当業者には分かるように「化学的に安定している」と考えられる化合物のみである。例えば、「ダングリング原子価(dangling valency)」、又は「カルボアニオン」を有するであろう化合物は、本明細書で開示される発明方法により企図される化合物ではない。
本発明は、式(I)の化合物の医薬的に許容できる誘導体を包含する。「医薬的に許容できる誘導体」は、いずれの医薬的に許容できる塩若しくはエステル、又は患者に投与すると本発明に有用な化合物を(直接又は間接的に)もたらし得るいずれの他の化合物も、或いは薬理学的に活性な代謝物又はその薬理学的に活性な残基を表す。薬理学的に活性な代謝物とは、酵素的又は化学的に代謝され得る本発明のいずれの化合物をも意味するものと解釈すべきである。これには、例えば、本発明の化合物のヒドロキシル化又は酸化誘導体が含まれる。
医薬的に許容できる塩には、医薬的に許容できる無機及び有機酸並びに無機及び有機塩基から誘導される当該塩がある。適切な酸の例としては、塩酸、臭化水素酸、硫酸、硝酸、過塩素酸、フマル酸、マレイン酸、リン酸、グリコール酸、乳酸、サリチル酸、コハク酸、トルエン-p-硫酸、酒石酸、酢酸、クエン酸、メタンスルホン酸、ギ酸、安息香酸、マロン酸、ナフタレン-2-硫酸及びベンゼンスルホン酸が挙げられる。シュウ酸のような他の酸は、それ自体は医薬的に許容性でないが、化合物及びそれらの医薬的に許容できる酸付加塩を得るときの中間体として有用な塩の調製で利用可能である。適切な塩基から誘導される塩としては、アルカリ金属(例えば、ナトリウム)、アルカリ土類金属(例えば、マグネシウム)、アンモニウム及びN-(C1-C4アルキル)4+塩が挙げられる。
【0039】
さらに、本発明の化合物のプロドラッグの使用が本発明の範囲内である。プロドラッグは、単純な化学変換によって変化して本発明の化合物を生成する当該化合物を包含する。単純な化学変換には、加水分解、酸化及び還元がある。詳細には、プロドラッグを患者に投与すると、プロドラッグが上記開示化合物に変換され、これによって所望の薬理作用を与えることができる。
後述する一般的合成方法を用いて式Iの化合物を製造することができ、これらの方法も本発明の一部を構成する。
【0040】
(一般的合成方法)
本発明は、式Iの化合物の製造方法をさらに提供する。以下に示す一般的方法及び実施例、並びに当業者に周知であり、かつ化学文献に報告された方法によって本発明の化合物を調製することができる。
特に指定のない限り、当業者は、溶媒、温度、圧力、その他の反応条件を容易に選択し得る。「合成例」セクションで具体的手順を提供する。
アリール-又はヘテロアリール-シクロアルキルアミン中間体は商業的に入手可能であり、又は一般的手順若しくは下記参考文献(参照によってその全体をここに援用する)に従って調製され、或いは化学文献に記載の方法を用いて当業者によって調製され得る。
アリール-又はヘテロアリール-シクロプロピルアミンは、グリニャール試薬(Szymoniak, J. et al. J. Org. Chem. 2002, 67, 3965、及びBertus, P. et al. J. Org. Chem. 2003, 68, 7133)又は亜鉛試薬(de Meijere, A. et al. Org. Lett. 5, 2003, 753)を用いる対応アリールニトリル又はヘテロアリールニトリルのチタンアルコキシド媒介還元的シクロプロパン化によって合成可能である。或いは、アリール-シクロプロピルアミンは、アリールニトリル又はアリールエステルからシクロアルキル化(例えば、Jonczyk, A. et al. Org. Prep. Proc. 27, 1995, 355)後、ニトリル又はエステル基のカルボン酸への変換、結果として生じるカルボン酸のカルバミン酸エステルへのクルチウス転位(例えば、Hanano, T. et al. Bioorg. Med. Chem. Lett. 10, 2000, 881)、及び結果として生じるカルバミン酸エステルの脱保護によって合成可能である。
アミド結合形成は、技術上周知の標準的なカップリング条件(例えば、参照によってその全体をここに援用するBodanszky, M. The Practice of Peptide Synthesis, Springer-Verlag, 1984)、例えばカルボン酸とアミンを1-(3-ジメチルアミノプロピル)-3-エチルカルボジイミド(EDC)及び1-ヒドロキシベンゾトリアゾールの存在下で反応させることによって行える。薄層クロマトグラフィー(TLC)等の定法によって反応の進行をモニターすることができる。カラムクロマトグラフィー、HPLC又は再結晶などの技術上周知の方法で中間体及び生成物を精製することができる。
【0041】
以下及び「合成例」セクションに記載の方法を用いて式Iaの化合物(すなわち、Xが窒素である式Iの化合物、スキームI、II及びIII)、及び式Ibの化合物(すなわち、XがC-R2である式Iの化合物、スキームIV及びV)を調製することができる。下記スキーム中、Ar1、Ar2、環式G、X、R1及びR2は、式Iの詳細な説明で定義した意味を有するものとする。
下記スキームI〜IIIに従って式Iaの化合物を調製することができる。
【0042】
スキームI
【化3】

【0043】
スキームIに示すように、酢酸ナトリウムの存在下かつ適切な溶媒、例えばEtOH中で、Ar1を有している式IIIの適切なヒドラジン(遊離塩基又は適切な塩形態、例えば塩酸塩)を3,5-ジブロモ-4-ピリジンカルボキサルデヒドIIと反応させて式IVのヒドラゾンをもたらし得る。式IVの化合物を適切な試薬、例えばジアミンリガンド(例えば、trans-N,N’-ジメチルシクロヘキサン-1,2-ジアミン)、銅塩(例えば、CuI)、塩基(例えば、K2CO3)、及び溶媒(例えば、N-メチル-2-ピロリジノン)の存在下で環化させて式Vの化合物をもたらし得る。密封圧力容器内にて加圧されたCO雰囲気下(好ましくは約15バール)、適切なクロスカップリング試薬、例えばPd触媒(例えば、Pd(PhCN)2Cl2)、リガンド[例えば、1,1-ビス(ジフェニルホスフィノ)フェロセン(dppf)]、塩基(例えば、Et3N)、及び溶媒(例えば、トルエン)の存在下でブロモ-アザインダゾールVを式VIの適切なアミンと加熱して式Iaの所望化合物を与え得る。
【0044】
スキームII
【化4】

【0045】
或いは、スキームIIに示す一般手順に従って式Iaの化合物を合成することができる。式Vのブロモ-アザインダゾールを加圧CO雰囲気下、無水エタノール中で上述したように適切なPd触媒、リガンド及び塩基の存在下で加熱して式VIIのエチルエステルをもたらし、これをメタノール水溶液等の適切な溶媒系中で適切な水酸化物塩基(例えば、KOH)により加水分解して式VIIIのカルボン酸を与え得る。カルボン酸VIIIを技術上周知のアミドカップリング条件下で式VIの適切なアミンと反応させてよい。例えば、適切な溶媒(例えば、ジメチルホルムアミド又はN-メチルピロリジノン)中、式VIの適切なアミン、適切な塩基(例えば、トリエチルアミン又はN,N-ジイソプロピルエチルアミン)の存在下で酸VIIIを適切な活性化試薬、例えば塩化チオニル、塩化オキサリル、(ベンゾトリアゾール-1-イルオキシ)トリピロリジノホスホニウム-ヘキサフルオロホスファート(PyBOP)、O-(7-アザベンゾトリアゾール-1-イル)-N,N,N’,N’-テトラメチルウロニウムヘキサフルオロホスファート(HATU)、O-(ベンゾトリアゾール-1-イル)-N,N,N’,N’-テトラメチルウロニウムヘキサフルオロホスファート(HBTU)、又はO-(ベンゾトリアゾール-1-イル)-N,N,N’,N’-テトラメチルウロニウムテトラフルオロボラート(TBTU)等で処理して式Iaの所望化合物をもたらし得る。
【0046】
スキームIII
【化5】

【0047】
或いは、スキームIIIに示す合成シークエンスに従って式VIIIのカルボン酸を調製することができる。塩基(例えば、KOH水溶液、NaOH水溶液、LiOH水溶液、CsOH水溶液、NaOMe、NaOEt、KOt-Bu又はKOt-アミル)の存在下、適切な温度(好ましくは約80℃)で極性非プロトン性溶媒(例えば、NMP、DMF、DMAC、又はDMPU)を用いて式IIの化合物を式IIIの適切なヒドラジン(遊離塩基又は適切な塩形態、例えば塩酸塩)と反応させて式Vの化合物をもたらし得る。THF、MTBE、Et2O、DME又はジオキサン等の適切な極性非プロトン性溶媒中、適切な反応温度(好ましくは約-20℃)でブロモ-アザインダゾールVを適切なグリニャール試薬(例えば、R-MgCl、式中、Rはイソプロピル、n-ブチル、sec-ブチル及びシクロヘキシルから選択され得る)、及びCO2と反応させて式VIIIのカルボン酸を与え、これを上述したように式Iの化合物に変えることができる。
式Ibの化合物は下記スキームIV及びVに示すように調製可能である。これらのスキーム中、Ar1、Ar2、G、X、R1及びR2は、式Iの化合物の詳細な説明で定義した意味を有するものとする。
【0048】
スキームIV
【化6】

【0049】
スキームIVに示すように、技術上周知のアミド結合カップリング条件、例えば上記条件を用いて式IXのインダゾール-4-カルボン酸を式VIの適切なアミンに連結させ得る。結果として生じるインダゾール-4-カルボキサミドを、化学文献で知られているクロスカップリング条件下、例えば、適切な溶媒(例えば、DMF)中、適切な試薬、例えば触媒(例えば、CuI)、塩基(例えば、K2CO3)、及びリガンド(例えば、ラセミtrans-N,N’-ジメチルシクロヘキサン-1,2-ジアミン)の存在下で適切な温度(好ましくは約120℃)にて加熱下、式XIの適切なハロゲン化アリールと反応させて式Ibの化合物をもたらし得る。
或いは、下記スキームVに示すように、式Ibの化合物を合成することができる。
【0050】
スキームV
【化7】

【0051】
技術上周知のエステル化条件、例えば適切な溶媒系(例えば、メタノール及びトルエン)中でのトリメチルシリルジアゾメタンによる処理を利用して式IXのインダゾール-4-カルボン酸をその対応する式XIIのカルボン酸エステルに変換することができる。エステルXIIを上記クロスカップリング条件下で式XIの適切なハロゲン化アリールと反応させて式XIIIのインダゾール-4-カルボン酸エステルをもたらし、これを適切な水性溶媒系(例えば、水及びメタノール)中での適切な塩基(例えば、NaOH)による処理のような標準的な加水分解条件下で式XIVの酸に変えることができる。前述したように、技術上周知のアミドカップリング条件下でアミンVIと反応させることによって、式XIVの酸を式Ibの化合物に変えることができる。
上記方法で調製された式Iの化合物をさらに技術上周知かつ下記「合成例」セクションで例示される方法によって式Iのさらなる化合物に変えることができる。
以下(すなわち、スキームVI〜IX)及び「合成例」セクションに記載の方法を用いて中間体VIを調製し、これを式Iの化合物の調製で使用することができる。下記スキーム中、環式G、Ar2及びRbは、式Iの化合物の詳細な説明で定義した意味を有するものとする。
式VIaの中間体(すなわち、Ar2が1,3,4-チアゾールである式VIの中間体)は下記スキームVIに従って調製可能である。
【0052】
スキームVI
【化8】

【0053】
スキームVIに示すように、式XV(式中、PGは適切な保護基(例えば、Cbz)である)のアミノ酸を上記条件のような技術上周知のアミドカップリング条件を利用してBoc保護ヒドラジンXVIと連結してBoc保護ヒドラジドXVIIをもたらし得る。式XVIIの化合物をトルエン等の適切な溶媒中、適切な温度(例えば、約90℃)でローソン試薬(Lawesson’s Reagent)と反応させて、対応するBoc保護チオヒドラジドをもたらし、これを例えばジオキサン中4NのHClのような適切な酸を用いて脱保護して、チオヒドラジドXVIIIの適切な塩形態(例えば、塩酸塩)をもたし得る。式XVIIIの化合物を適切な試薬、例えばジエチルクロロホスファートXIX及び適切な塩基(例えば、Et3N)の存在下でDMFと反応させて、対応する1,3,4-チアゾールをもたらし、これを適切な試薬(例えば、酢酸中48%のHBr)で脱保護して式VIaの中間体を与える得る。
さらに、式VIbの中間体(すなわち、Ar2が1,2,4-オキサジアゾールである式VIの中間体)は下記スキームVIIに従って調製可能である。
【0054】
スキームVII
【化9】

【0055】
スキームVIIに示すように、上記条件のような標準的なアミド結合カップリング条件を利用し、かつ適切なアンモニウム塩、例えば炭酸アンモニウム、適切な塩基(例えば、Et3N)及び適切な溶媒(例えば、DMF)の存在下で式XVの適切に保護されたアミノ酸(すなわち、PGは適切な保護基、例えばCbzである)を対応するアミドXXに変えることができる。式XXのアミドを適切な溶媒(例えば、DMF)の存在下及び適切な温度(例えば、約0℃〜30℃)で適切な脱水試薬、例えば塩化シアヌルと反応させて式XXIのニトリルをもたらし得る。適切な塩基、例えば炭酸カリウムの存在下、適切な溶媒(例えば、エタノール)中かつ適切な温度(例えば、約79℃)で化合物XXIをヒドロキシルアミン塩酸塩と反応させて式XXIIの化合物をもたらし得る。適切な溶媒(例えば、DMF)中、かつ適切な条件(例えば、約100℃で加熱)下で技術上周知のアミド結合カップリング試薬(例えば、CDI)を用いてアミドキシムXXIIを式XXIIIの適切なカルボン酸と反応させて、対応する1,2,4-オキサジアゾール誘導体を与え、これを上述したようにN-脱保護して式VIbの中間体を与え得る。
式VIcの中間体(すなわち、Ar2が1,2,4-オキサジアゾールの異なる位置異性体である式VIの中間体)は、下記スキームVIIIに従って調製可能である。
【0056】
スキームVIII
【化10】

【0057】
式XXIVのアミドキシムは、上述した適切な条件下で対応するニトリルにヒドロキシルアミンを添加して調製し得る。スキームVIIIに示すように、適切な溶媒、例えばDMF中、かつ適切な条件(例えば、約100℃で加熱)下で適切なアミドカップリング試薬、例えばCDIを利用して、アミドキシムXXIVを式XV(式中、PGは適切な保護基(例えば、Boc)である)のアミノ酸と反応させて、対応する1,2,4-オキサジアゾールをもたらし、これを適切な条件(例えば、ジオキサン中4NのHClのような適切な酸との反応)下でN-脱保護して式VIcの中間体を与え得る。
式VIdの中間体(すなわち、Ar2がピリミジンである式VIの中間体)は下記スキームIXに従って調製可能である。
【0058】
スキームIX
【化11】

【0059】
スキームIXに示すように、式XXI(式中、PGは適切な保護基、例えばBocである)の適切に保護されたアミノカルボニトリルを、適切な試薬、例えばエタノール中のナトリウムエトキシドとの反応後、塩化アンモニウム及びアンモニアで処理して、対応するアミジン塩酸塩XXVに変えることができる。別の合成変換では、適切な溶媒、例えばCHCl3中で適切な試薬(例えば、Br2及びNIS)を用いて3-ジメチルアミノプロペナールXXVIをハロゲン化して式XXVIIの2-ハロゲン置換3-ジメチルアミノプロペナール(すなわち、RbがBr又はIである)を与え得る。引き続き、適切な溶媒(例えば、EtOH)中及び適切な温度(例えば、約80℃)でアミジン塩酸塩XXVを式XXVIIの化合物と反応させて式XXVIIIのピリミジンをもたらし得る。技術上周知かつ上述した条件を利用して化合物XXVIIIをN-脱保護して式VIdの中間体を与え得る。
式VIの中間体の合成で使用し得る式XVの適切に保護されたアミノ酸は、商業的に入手可能であり、或いは下記参考文献(参照によってその全体をここに援用する)に従って調製可能であり、或いは化学文献に記載の方法を利用して当業者により調製可能である。
3-tert-ブトキシカルボニルアミノ-オキセタン-3-カルボン酸は、特許出願WO 2009/070485 A1に記載の手順に従って合成可能である。
以下に商業的に入手可能な非天然アミノ酸の例を示す。これらの例は、本発明の実施形態を支持するためであり、決して本発明の範囲を限定するものと解釈すべきでない。技術上周知の標準的な条件によってアミノ酸の適切な保護を行うことができる(総覧のためには、参照によってその全体をここに援用するGreene, T. W.; Wuts, P. G. M. Protective Groups in Organic Synthesis, 3rd Ed., Wiley, New York, 1999を参照されたい)。
【0060】
【化12】

【0061】
(合成例)
一般的方法:特に指定のない限り、全ての反応を室温で行った。全ての化合物を下記方法の少なくとも1つで特徴づけた:1H NMR、HPLC、HPLC-MS、及び融点。
報告MSデータは観測[M+H]+についてである。臭素含有化合物では、臭素同位体(すなわち、79Br及び81Br)の一方又は両方について[M+H]+を報告している。
表Iには下記方法の1つを利用して保持時間(RT)を報告している。
【0062】

【0063】
(表続き)

【0064】

【0065】
(中間体の合成)
以下のヘテロアリール-シクロプロピルアミン中間体又はそれらの対応塩形態の合成は特許出願WO 2009/070485 A1に記載されている。
【0066】
【化13】

*中間体は、適切な試薬を使用し、かつ関連類似体についての参考文献に記載の手順に従ってを調製可能である。
【実施例】
【0067】
実施例1:1-(4-フルオロフェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1)の合成
【0068】
【化14】

【0069】
1Lのフラスコに3,5-ジブロモピリジン-4-カルボキサルデヒド(50.0g,189mmol,1.0当量)及び4-フルオロフェニルヒドラジン塩酸塩(31.0g,191mmol,1.01当量)を入れる。NMP(250mL)を入れ、結果として生じるスラリーを周囲温度で2時間撹拌する。KOH水溶液を85% KOHペレット(27.4g,415mmol,2.2当量)と水(27.4mL)から調製し、このKOH溶液を反応混合物に加える。該バッチを80℃に加熱し、この温度で30〜60分間維持する。次に水(250mL)を80℃で加え、結果として生じるスラリーを4〜16時間かけて周囲温度に冷ます。スラリーをろ過し、固体を水で洗浄し、真空下でオーブン乾燥させて4-ブロモ-1-(4-フルオロフェニル)-1H-ピラゾロ[3,4-c]ピリジンを固体として得る。
1Lのフラスコに4-ブロモ-1-(4-フルオロフェニル)-1H-ピラゾロ[3,4-c]ピリジン(50.0g,171mmol,1当量)及びTHF(300mL)を入れる。該スラリーを-20℃に冷却する。i-PrMgCl溶媒(128.2mL,256.4mmol,THF中2.0M,1.5当量)を-10℃未満の温度を維持する速度で加える。反応を-10℃で3時間維持する。温度上昇ピークまでCO2ガスを反応混合物中で泡立てると、温度が下がり始める。温度を22℃に調整し、i-PrOAc(325mL)を添加する。濃HCl(55mL)と水(195mL)からHCl水溶液を調製する。このHCl溶液の約10mLを反応混合物に加えてpHを6〜7にする。次に混合物を55℃に加熱し、約240mLの残りのHCl溶液を加える。反応を1時間かけて周囲温度に冷まし、この温度で1時間維持し、ろ過する。固体を水とi-PrOAcで洗浄し、真空下でオーブン乾燥させて表題化合物を固体として得る。
【0070】
実施例2:1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸(2)の合成
【0071】
【化15】

【0072】
インダゾール-4-カルボン酸(2.00g,12.3mmol)をメタノール(20mL)及びトルエン(30mL)に室温で懸濁させる。トルエン中2Mのトリメチルシリルジアゾメタン溶液(12mL,24mmol)をゆっくり添加し、混合物を室温で溶液が黄変するまで撹拌する。反応を濃酢酸(5mL)でクエンチし、真空中で溶媒を除去する。ヘキサン中0〜30%の酢酸エチルの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して1H-インダゾール-4-カルボン酸メチルエステルを得る。
1H-インダゾール-4-カルボン酸メチルエステル(5.0g,28mmol)、ヨウ化銅(5.7g,3.0mmol)、炭酸カリウム(4.15g,30.0mmol)及び4-フルオロヨードベンゼン(3.47g,30.0mmol)の混合物を封管に室温で充填する。管を排気し、アルゴンで埋め戻してジメチルホルムアミド(20mL)、次いでrac-trans-N,N’-ジメチルシクロヘキサン-1,2-ジアミン(0.93g,6.5mmol)を加える。溶液を120℃で3時間撹拌してから室温に冷まして水(50mL)と酢酸エチル(80mL)で希釈する。有機層を分け、ブライン(30mL)で洗浄し、硫酸ナトリウム上で乾燥させる。粗生成物をろ過し、濃縮し、ヘキサン中0〜30%の酢酸エチルの勾配を用いて溶出するシリカゲルクロマトグラフィーで精製して1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸メチルエステルを得る。
水(20mL)とメタノール(20mL)中の1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸メチルエステル(2.0g,7.4mmol)の撹拌溶液に2N水酸化ナトリウム溶液(10mL)を添加する。溶液を温めて1時間還流させる。溶液を室温に冷まして1N HCl水溶液で酸性にしてpHを3〜4にする。混合物をろ過し、結果として生じる固体をMeOH(30mL)で洗浄し、乾燥させて1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸を得る。
【0073】
実施例3:1-(6-ブロモ-ピリジン-3-イル)-シクロプロピルアミンビストリフルオロ酢酸塩(3)の合成
【0074】
【化16】

【0075】
機械的撹拌機を備えたオーブン乾燥した2Lの丸底フラスコにAr雰囲気下で無水THF(750mL)、次いでTi(Oi-Pr)4(72.8mL,246mmol)を入れる。溶液をAr下でパージし、50℃に加熱する。混合物に6-ブロモ-ニコチノニトリル(30.0g,164mmol)を添加した後、THF中のエチルマグネシウムブロミドの1M溶液(410mL,410mmol)を滴下して添加する(40分かけて)。反応を50℃で撹拌させる。3時間後、反応混合物を室温に冷ましてHClの3M水溶液(約350mL)を加える。混合物を分液ロートに移してエチルエーテル(3×500mL)で洗浄する。水層を一晩静置する。次に水層をNaOHの2M水溶液で塩基性にしてpHを10にする。溶液をEtOAc(500mL)で希釈し、結果として生じる溶液を5分間激しく撹拌する。層が緩徐に分離するまで溶液を静置する。有機層をデカントし、同じ抽出プロセスを2回繰り返す。有機層を混ぜ合わせ、ブライン(50mL)で洗浄し、MgSO4上で乾燥させ、真空中で濃縮して油を得る。CH2Cl2中0〜10%のMeOHの勾配を利用するシリカゲルクロマトグラフィーで粗製油を精製して1-(6-ブロモ-ピリジン-3-イル)-シクロプロピルアミンを油として得、これは緩徐に結晶化する(ES+ m/z 213.3, 215.3)。
1-(6-ブロモ-ピリジン-3-イル)-シクロプロピルアミン(1.16g,4.60mmol)をCH2Cl2(20mL)に溶かす。Et3N(0.78mL,5.6mmol)とBoc2O(1.11g,5.10mmol)を連続して加え、反応を室温で撹拌する。20時間後、反応をCH2Cl2(20mL)及び水(20mL)で希釈し、層を分ける。水層をCH2Cl2(100mL)で抽出する。混ぜ合わせたCH2Cl2層をブラインで洗浄し、MgSO4上で乾燥させ、濃縮して[1-(6-ブロモ-ピリジン-3-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステルを固体として得る。
[1-(6-ブロモ-ピリジン-3-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステル(0.800g,2.55mmol)をCH2Cl2(10mL)に溶かす。TFA(5mL)を滴下して加える。4時間後、反応を真空中で濃縮して表題化合物を油として得る(ES+ m/z 213.1, 215.1)。
【0076】
実施例4:1-(5-ブロモ-ピリミジン-2-イル)-シクロプロピルアミン二塩酸塩(4)の合成
【0077】
【化17】

【0078】
3-ジメチルアミノ-プロペナール(50mL,500mmol)をCHCl3(400mL)に室温で溶かす。臭素(25.7mL,0.500mol)を注射器で5分かけて手際よく加える。30分後、反応を200mLのNa2S2O3飽和水溶液と200mLのNaHCO3飽和水溶液との混合物に注ぎ、混合物をCH2Cl2(3×100mL)で抽出する。混ぜ合わせた有機層をMgSO4上で乾燥させ、濃縮して固体を得る。固体をEtOAc(200mL)に溶かし、不溶物質をろ別し、ろ液を真空中で濃縮し、結果として生じる固体をヘキサン中50%のEtOAc溶液で洗浄して3-ジメチルアミノ-2-ブロモ-プロペナールを固体として得る(ES+ m/z 178.28)。
(1-カルバムイミドイル-シクロプロピル)-カルバミン酸tert-ブチルエステル塩酸塩(1.0g,4.2mmol)(特許出願WO 2009/070485 A1に記載の手順に従って調製した)及び3-ジメチルアミノ-2-ブロモ-プロペナール(1.1g,6.4mmol)を圧力管内のEtOH(2mL)に加える。反応容器に蓋をし、混合物を80℃で24時間加熱する。混合物を室温に冷ましてメタノール(20mL)を加える。結果として生じる固体をろ過し、ろ液を真空中で濃縮する。残留物をCH2Cl2(50mL)で溶かして固体をろ過する。ろ液を濃縮し、残留物をシリカゲルクロマトグラフィーでヘキサン中0〜50%のEtOAcの勾配を用いて精製して[1-(5-ブロモ-ピリミジン-2-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステルを固体として得る。
[1-(5-ブロモ-ピリミジン-2-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステル(1.18g,3.76mmol)をCH2Cl2(5mL)に室温で溶かす。ジオキサン中HClの4M溶液(9.4mL,38mmol)を加える。2時間後、N2流によって溶媒を除去し、粗製表題化合物を固体として得、精製せずに使用する(ES+ m/z 216.3)。
【0079】
実施例5:[1-(5-ヨード-フラン-2-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステル(5)の合成
【0080】
【化18】

【0081】
無水DMF(77mL)中の(1-フラン-2-イル-シクロプロピル)-カルバミン酸tert-ブチルエステル(4.30g,19.3mmol)(特許出願WO 2009/070485 A1に記載の手順に従って調製した)の溶液に室温で固形N-ヨードスクシンイミド(4.77g,21.2mmol)を一度に加える。2.5時間後、反応をNa2S2O3飽和水溶液(75mL)、水(75mL)、及びエチルエーテル(100mL)で希釈する。相を分け、水層をエチルエーテル(2×100mL)で抽出する、混ぜ合わせた有機層をNa2SO4上で乾燥させて濃縮する。結果として生じる固体をヘキサンと摩砕して表題化合物を粉末として得る(ES+ m/z 350.5)。
【0082】
実施例6:3-(1-アミノ-シクロプロピル)-安息香酸メチルエステル(6)の合成
【0083】
【化19】

【0084】
塩化アセチル(0.600mL,8.46mmol)を0℃でメタノール(15mL)に添加し、この溶液を室温に温める。20分間の撹拌後、3-アミノシクロプロピル安息香酸(0.500g,2.82mmol)を加え、反応混合物を加熱して還流させる。16時間後、混合物を65℃にて窒素流下で濃縮する。残留物を炭酸水素ナトリウム飽和水溶液(50mL)で中和し、酢酸エチル(3×50mL)で抽出する。混ぜ合わせた有機層をブライン(100mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮して粗製表題生成物を得、精製せずに使用する。
【0085】
実施例7:1-(2-ブロモ-ピリジン-4-イル)-シクロプロピルアミン トリフルオロ酢酸塩(7)の合成
【0086】
【化20】

【0087】
ジクロロメタン(30mL)中の(2-ブロモ-ピリジン-4-イル)-メタノール(3.00g,16.0mmol)とN,N-ジイソプロピルエチルアミン(8.3mL,48mmol)の0℃撹拌溶液にメタンスルホニルクロリド(1.30mL,16.8mmol)を加える。結果として生じる混合物を室温に温める。1時間後、混合物をジクロロメタン(20mL)で希釈し、塩化アンモニウム飽和水溶液(3×10mL)、炭酸水素ナトリウム飽和水溶液(10mL)、ブライン(10mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮して粗製メタンスルホン酸2-ブロモ-ピリジン-4-イルメチルエステルを得、精製せずに使用する。
メタンスルホン酸2-ブロモ-ピリジン-4-イルメチルエステル(4.24g,15.9mmol)をエタノール(30mL)と水(6mL)の混合物中のシアン化カリウム(1.02g,15.1mmol)の撹拌溶液に室温で添加する。72時間後、酢酸エチル(80mL)及び炭酸水素ナトリウム飽和水溶液(40mL)を加えて相を分ける。有機層を水(3×40mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。結果として生じる残留物を、ヘプタン中0〜60%の酢酸エチルの勾配を用いて溶出するシリカゲルクロマトグラフィーで精製して(2-ブロモ-ピリジン-4-イル)-アセトニトリルを得る(ES+ m/z 197.41; 199.40)。
乾燥Et2O(5mL)と乾燥DMSO(1mL)の混合物中の(2-ブロモ-ピリジン-4-イル)-アセトニトリル(1.20g,6.09mmol)と1,2-ジブロモエタン(0.663mL,7.61mmol)の溶液を乾燥DMSO(10mL)中のNaHの懸濁液(鉱油中60%の分散液,585mg,14.6mmol)に、結果として生じる発熱を水浴内で冷却することによって制御しながら添加し、結果として生じる混合物を室温で撹拌する。18時間後、水(10mL)と酢酸エチル(10mL)を添加し、相を分け、水層を酢酸エチル(3×10mL)で抽出する。混ぜ合わせた有機層をブライン(30mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。残留物をSiO2上でヘプタン中0〜60%の酢酸エチルの勾配で溶出して精製して1-(2-ブロモ-ピリジン-4-イル)-シクロプロパンカルボニトリルを固体として得る(ES+ m/z 223.36; 225.39)。
トルエン(30mL)中1-(2-ブロモ-ピリジン-4-イル)-シクロプロパンカルボニトリル(1.16g,5.20mmol)の溶液にDIBAL-H(10.4mL,トルエン中1M)を-78℃で加える。混合物を-78℃で1時間撹拌し、室温に温める。1時間後、酢酸エチル(30mL)を添加した後、H2SO4の1M水溶液(30mL)を加える。相を分け、水層を酢酸エチル(3×50mL)で抽出する。混ぜ合わせた有機層をMgSO4上で乾燥させ、ろ過かつ濃縮して粗製1-(2-ブロモ-ピリジン-4-イル)-シクロプロパンカルバルデヒドを得(ES+ m/z 226.48; 228.47)、精製せずに使用する。
5mLの水中の塩化ナトリウム(368mg,3.26mmol)とリン酸二水素ナトリウム一水和物(449mg,3.26mmol)の溶液をtert-ブタノール(12mL)中の粗製1-(2-ブロモ-ピリジン-4-イル)-シクロプロパンカルバルデヒド(566mg,2.50mmol)と2-メチル-2-ブテン(1.73mL,16.3mmol)の溶液に滴下して添加し、結果として生じる反応混合物を室温で撹拌する。18時間後、混合物を真空中で濃縮し、HClの1M水溶液で酸性にしてpHを2とし、ブライン(25mL)で希釈し、酢酸エチル(3×50mL)で抽出する。混ぜ合わせた有機層をNa2SO4上で乾燥させ、ろ過かつ濃縮して粗製1-(2-ブロモ-ピリジン-4-イル)-シクロプロパンカルボン酸を得、精製せずに使用する。
圧力容器内のtert-ブタノール(7mL)中の粗製1-(2-ブロモ-ピリジン-4-イル)-シクロプロパンカルボン酸(0.350g,1.45mmol)の溶液にジフェニルホスホリルアジド(0.312mL,1.45mmol)及びトリエチルアミン(0.202mL,1.45mmol)を加える。封管して反応混合物を90℃で撹拌する。4時間後、圧力容器を氷浴内で冷却し、排気かつ開口する。反応混合物を真空中で濃縮する。結果として生じる残留物を酢酸エチル(70mL)に溶かし、塩化アンモニウム飽和水溶液(70mL)及び炭酸水素ナトリウム飽和水溶液(70mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。ヘプタン中0〜50%の酢酸エチルの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して[1-(2-ブロモ-ピリジン-4-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステルを得る。
ジクロロメタン(3mL)中の[1-(2-ブロモ-ピリジン-4-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステル(0.160g,0.511mmol)の撹拌溶液にトリフルオロ酢酸(1.0mL,13mmol)を室温で加える。18時間後、反応混合物を真空中で濃縮して粗製表題化合物を油として得(ES+ m/z 213.49, 215.40)、精製せずに使用する。
【0088】
実施例8:1-(2-ブロモ-ピリジン-4-イル)-シクロブチルアミントリフルオロ酢酸塩(8)の合成
【0089】
【化21】

【0090】
1-(2-ブロモ-ピリジン-4-イル)-シクロブテンカルボニトリルは、(2-ブロモ-ピリジン-4-イル)-アセトニトリル(1.50g,7.61mmol)から実施例7に記載のシクロアルキル化手順に従い、1,2-ジブロモエタンの代わりに1,3-ジブロモプロパンを用いて調製される。
1-(2-ブロモ-ピリジン-4-イル)-シクロブテンカルバルデヒドは、1-(2-ブロモ-ピリジン-4-イル)-シクロブテンカルボニトリル(1.26g,5.20mmol)から実施例7に記載のDIBAL-H手順に従って調製される。
1-(2-ブロモ-ピリジン-4-イル)-シクロブテンカルボン酸(ES+ m/z 256.40, 258.38)は、1-(2-ブロモ-ピリジン-4-イル)-シクロブテンカルバルデヒド(532mg,2.22mmol)から実施例7に記載の酸化手順に従って調製される。
[1-(2-ブロモ-ピリジン-4-イル)-シクロブチル]-カルバミン酸tert-ブチルエステル(ES+ m/z 327.54, 329.46)は、1-(2-ブロモ-ピリジン-4-イル)-シクロブテンカルボン酸(0.100g,0.390mmol)から実施例7に記載のクルチウス転位手順に従い、100℃の反応温度を利用して調製される。
表題化合物(ES+ m/z 227.30, 229.27)は、[1-(2-ブロモ-ピリジン-4-イル)-シクロブチル]-カルバミン酸tert-ブチルエステル(82.0mg,0.262mmol)から実施例7に記載のBoc-脱保護手順に従って調製される。
【0091】
実施例9:1-(5-メタンスルホニル-フラン-2-イル)-シクロプロピルアミン塩酸塩(9)の合成
【0092】
【化22】

【0093】
[1-(5-メタンスルホニル-フラン-2-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステルは、[1-(5-ヨード-フラン-2-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステル(0.500g,1.43mmol)から実施例19に記載のヨウ化銅(I)媒介カップリング手順に従って調製されるが、カップリング相手として3-メトキシ-3-オキソプロパン-1-スルフィン酸ナトリウムの代わりにメタンスルフィン酸ナトリウムを使用する。
[1-(5-メタンスルホニル-フラン-2-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステル(0.430g,1.42mmol)をHClのジオキサン中4M溶液(5.0mL,20mmol)に室温で溶かす。16時間の撹拌後、混合物を窒素流下でエバポレートする。結果として生じる油状固体を酢酸エチル(5mL)に懸濁させ、エチルエーテル(25mL)を加え、混合物をろ過して粗製表題生成物を得、精製せずに使用する。
【0094】
(式Iの化合物の合成)
実施例10:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(5-メタンスルホニル-フラン-2-イル)-シクロプロピル]-アミド(10)の合成
【0095】
【化23】

【0096】
DMF(30mL)中1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(0.310g,1.21mmol)、N,N-ジイソプロピルエチルアミン(0.630mL,3.62mmol)及び1-(5-メタンスルホニル-フラン-2-イル)-シクロプロピルアミン-塩酸塩(364mg,1.53mmol)の撹拌混合物に(ベンゾトリアゾール-1-イルオキシ)トリピロリジノホスホニウムヘキサフルオロホスファート(PyBOP)(0.650g,1.25mmol)を加える。18時間後、混合物を塩化アンモニウム飽和水溶液(100mL)で希釈し、酢酸エチル(4×30mL)で抽出する。混ぜ合わせた有機層をブライン(50mL)で洗浄し、硫酸ナトリウム上で乾燥させ、ろ過かつ濃縮する。ヘキサン中0〜100%の酢酸エチルの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して表題化合物を固体として得る。
以下の化合物は実施例10に記載のカップリング方法を利用して調製されるが、N,N-ジイソプロピルエチルアミンをトリエチルアミンに取り換える:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(5-ブロモ-ピリミジン-2-イル)-シクロプロピル]-アミド。
【0097】
実施例11:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(2-ブロモ-ピリジン-4-イル)-シクロプロピル]-アミド(11)
【0098】
【化24】

【0099】
DMF(2mL)中の1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(0.120g,0.467mmol)の混合物にHATU(186mg,0.490mmol)を加える。30分後、N,N-ジイソプロピルエチルアミン(325μL,1.87mmol)及び1-(2-ブロモ-ピリジン-4-イル)-シクロプロピルアミン-トリフルオロ酢酸塩(223mg,0.507mmol)を加えると、反応混合物が均質になった。18時間後、混合物を真空中で濃縮し、酢酸エチル(50mL)中で再構成し、1N水酸化ナトリウム(3×50mL)で洗浄する。有機層を塩化アンモニウム飽和水溶液(2×50mL)、炭酸水素ナトリウム飽和水溶液(50mL)、ブライン(50mL)で洗浄し、MgSO4上で乾燥させ、ろ過し、真空中で濃縮する。塩化メチレン中0〜10%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を2回精製して表題化合物を固体として得る。
以下の化合物は、実施例11に記載のカップリング方法を用いて調製される:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-ブロモ-ピリジン-3-イル)-シクロプロピル]-アミド;及び
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1-ピリジン-4-イル-シクロプロピル)-アミド。
【0100】
実施例12:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1-1,3,4-チアゾール-2-イル-シクロプロピル)-アミド(12)の合成
【0101】
【化25】

【0102】
DMF(2mL)中の1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(90.0mg,0.350mmol)の懸濁液にN,N-ジイソプロピルエチルアミン(243μL,1.40mmol)及びHBTU(159mg,0.420mmol)を加える。20分後、DMF(1mL)中の1-1,3,4-チアゾール-2-イル-シクロプロピルアミン(51.0mg,0.361mmol)の溶液を加えて混合物を室温で一晩撹拌する。反応混合物を炭酸水素ナトリウム飽和水溶液(50mL)に注ぎ、酢酸エチル(30mL)を添加して相を分ける。水層をブラインで処理し、酢酸エチル(3×20mL)で抽出する。混ぜ合わせた有機層を真空中で濃縮する。塩化メチレン中0〜10%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで粗製物質を精製して表題化合物を固体として得る。
【0103】
実施例13:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-ブロモ-フェニル)-シクロプロピル]-アミド(13)の合成
【0104】
【化26】

【0105】
DMF(18mL)中の1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(0.500g,1.94mmol)、1-(3-ブロモフェニル)シクロプロパンアミン(453mg,2.14mmol)及びN,N-ジイソプロピルエチルアミン(1.73mL,9.72mmol)の溶液にTBTU(0.780g,2.43mmol)を加える。2時間後、混合物を真空中で濃縮し、酢酸エチル(200mL)に溶かし、2N水酸化ナトリウム(3×100mL)、塩化アンモニウム飽和水溶液(2×100mL)、炭酸水素ナトリウム飽和水溶液(100mL)、ブライン(100mL)で洗浄する。有機層をMgSO4上で乾燥させ、シリカゲルのパッドを通して酢酸エチル(3×100mL)で溶出してろ過し、真空中で濃縮する。ヘプタン中50〜70%の酢酸エチルの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して固体を得、これを塩化メチレンと摩砕して表題化合物を固体として得る。
以下の化合物は、実施例13に記載のカップリング方法を利用して調製される:
3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-安息香酸メチルエステル;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(2-ブロモ-ピリジン-4-イル)-シクロブチル]-アミド;及び
1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド。
【0106】
実施例14:3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-安息香酸(14)の合成
【0107】
【化27】

【0108】
THF/メタノール/水の混合物(22.5mL,3:1:1)中の3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-安息香酸メチルエステル(0.650g,1.51mmol)の溶液にLiOH・H2O(253mg,6.04mmol)を加える。3時間後、反応混合物を氷酢酸で中和し、真空中で濃縮する。残留物を塩化メチレン中20%のメタノール溶液(100mL)に溶かす。水(100mL)を加えて混合物を2M塩酸水溶液で酸性にしてpHを4とする。相を分け、水層を塩化メチレン中20%のメタノールで抽出する(9×100mL)。混ぜ合わせた有機層をMgSO4上で乾燥させ、ろ過し、約50mLに濃縮する。結果として生じる結晶化固体をろ過し、冷却メタノール(3×2mL)で洗浄し、空気乾燥させて表題化合物を固体として得る。
【0109】
実施例15:[3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ベンゾイルアミノ]-酢酸メチルエステル(15)の合成
【0110】
【化28】

【0111】
DMF(4.5mL)中の3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-安息香酸(0.200g,0.480mmol)、Gly-OMe・HCl(68.1mg,0.543mmol)及びN,N-ジイソプロピルエチルアミン(426μL,2.40mmol)の溶液にTBTU(192mg,0.600mmol)を加える。4時間後、混合物を真空中で濃縮する。残留物を酢酸エチル(100mL)に溶かして2N水酸化ナトリウム(3×50mL)、塩化アンモニウム飽和水溶液(2×50mL)、炭酸水素ナトリウム飽和水溶液(50mL)、ブライン(50mL)で洗浄する。有機層をMgSO4上で乾燥させ、ろ過かつ濃縮する。塩化メチレン中0〜8%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して泡を得、これをエーテル(3mL)と摩砕し、ろ過し、冷却エーテル(3×3mL)で洗浄し、空気乾燥させて表題化合物を得る。
以下の化合物は、実施例15に記載のカップリング方法を利用して調製される:
1-[3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ベンゾイルアミノ]-シクロプロパンカルボン酸メチルエステル;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸{1-[3-(シアノメチル-カルバモイル)-フェニル]-シクロプロピル}-アミド;及び
(S)-2-[3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ベンゾイルアミノ]-プロピオン酸メチルエステル。
【0112】
実施例16:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-カルバモイル-フェニル)-シクロプロピル]-アミド(16)の合成
【0113】
【化29】

【0114】
メタノール中アンモニアの7M溶液(1.00mL,7.00mmol)中の3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-安息香酸メチルエステル(70.0mg,0.163mmol)の溶液を密閉圧力管内で120℃にて撹拌する。78時間後、反応容器を室温に冷まし、排気かつ開口する。反応混合物を真空中で濃縮し、結果として生じる残留物を、塩化メチレン中0〜10%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで精製して表題化合物を固体として得る。
以下の化合物は、実施例16に記載の方法を利用して調製される:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸{1-[3-(カルバモイルメチル-カルバモイル)-フェニル]-シクロプロピル}-アミド。
【0115】
実施例17:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-メチルカルバモイル-フェニル)-シクロプロピル]-アミド(17)の合成
【0116】
【化30】

【0117】
メタノール中メチルアミンの2M溶液(3.0mL,6.0mmol)中の3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-安息香酸メチルエステル(70.0mg,0.163mmol)の混合物を密閉圧力管内で90℃にて撹拌する。18時間後、反応容器を室温に冷まし、排気かつ開口する。反応混合物を真空中で濃縮する。塩化メチレン中0〜8%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して表題化合物を固体として得る。
以下の化合物は、実施例17に記載の方法を利用して調製される:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸{1-[3-(メチルカルバモイルメチル-カルバモイル)-フェニル]-シクロプロピル}-アミド。
【0118】
実施例18:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-メタンスルホニル-ピリジン-3-イル)-シクロプロピル]-アミド(18)の合成
【0119】
【化31】

【0120】
DMSO(1mL)中の1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-ブロモ-ピリジン-3-イル)-シクロプロピル]-アミド(72.7mg,0.161mmol)、メタンスルフィン酸ナトリウム(32.8mg,0.321mmol)及びヨウ化銅(I)(61.2mg,0.321mmol)の溶液を排気し、アルゴンで3回パージして130℃で加熱する。45分後、反応を室温に冷ましてN,N’-ジメチルエチレンジアミン(69μL,0.64mmol)を加える。混合物を30分間撹拌し、酢酸エチル(20mL)で希釈し、15分間撹拌する。塩化アンモニウム飽和水溶液(20mL)を添加し;結果として生じる混合物を30分間超音波処理し、酢酸エチル(100mL)で希釈する。相を分けて水層を酢酸エチル(3×20mL)で抽出する。混ぜ合わせた有機層を塩化アンモニウム飽和水溶液(2×50mL)、炭酸水素ナトリウム飽和水溶液(50mL)、ブライン(50mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。結果として生じる残留物を、塩化メチレン中0〜8%のメタノールの勾配を用いて溶出するシカゲルクロマトグラフィーで精製して表題化合物を固体として得る。
以下の化合物は、実施例18に記載の方法を利用して調製される:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(5-メタンスルホニル-ピリミジン-2-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-メタンスルホニル-フェニル)-シクロプロピル]-アミド;及び
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロブチル]-アミド。
【0121】
実施例19:3-[5-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ピリジン-2-スルホニル]-プロピオン酸メチルエステル(19)の合成
【0122】
【化32】

【0123】
DMSO(2mL)中1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-ブロモ-ピリジン-3-イル)-シクロプロピル]-アミド(0.250g,0.553mmol)、3-メトキシ-3-オキソプロパン-1-スルフィン酸ナトリウム(289mg,1.66mmol)及びヨウ化銅(I)(316mg,1.66mmol)の溶液をマイクロ波管に入れ、排気してアルゴンで3回パージする。反応混合物をマイクロ波内で110℃にて2時間加熱し、酢酸エチル(200mL)で希釈し、塩化アンモニウム飽和水溶液(4×100mL)、炭酸水素ナトリウム飽和水溶液(100mL)、ブライン(100mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。結果として生じる残留物を、ヘプタン中50〜100%の酢酸エチルの勾配を用いて溶出するシリカゲルクロマトグラフィーで精製して表題化合物を固体として得る。
以下の化合物は、実施例19に記載の方法を利用して調製される:
3-[3-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ベンゼンスルホニル]-プロピオン酸メチルエステル。
【0124】
実施例20:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-スルファモイル-ピリジン-3-イル)-シクロプロピル]-アミド(20)の合成
【0125】
【化33】

【0126】
DMSO(4mL)中の3-[5-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ピリジン-2-スルホニル]-プロピオン酸メチルエステル(153mg,0.292mmol)の撹拌溶液に、ナトリウムメトキシドのメタノール中の新たに調製した15%溶液(0.110mL,0.306mmol)を添加する。15分後、混合物を水浴に入れ、水(16mL)中のN-ヒドロキシルアミン-O-スルホン酸(661mg,5.84mmol)と酢酸ナトリウム(384mg,4.68mmol)の溶液を加える。水浴を除去して反応混合物を室温で撹拌する。60時間後、混合物を酢酸エチル(20mL)及び水(20mL)で希釈する。相を分けて水層を酢酸エチル(3×20mL)で抽出する。混ぜ合わせた有機層のpHを10%炭酸水素ナトリウム水溶液で7に調整する。有機層を水(3×20mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。100%酢酸エチルで溶出するシリカゲルクロマトグラフィーで残留物を精製する。結果として生じる固体をエーテルと摩砕し(3回)、ろ過し、真空下で乾燥させて表題化合物を固体として得る。
以下の化合物は、実施例20に記載の方法を利用して調製される:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-スルファモイル-フェニル)-シクロプロピル]-アミド。
【0127】
実施例21:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-メチルアミノ-ピリジン-3-イル)-シクロプロピル]-アミド(21)の合成
【0128】
【化34】

【0129】
N-メチルホルムアミド(1mL)中、1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-ブロモ-ピリジン-3-イル)-シクロプロピル]-アミド(0.200g,0.442mmol)、エタノール中33%のメチルアミン(0.250mL,1.99mmol)で充填した圧力管を160℃で加熱する。36時間後、反応を室温に冷まして酢酸エチル(20mL)及び水(20mL)で希釈する。相を分けて水層を酢酸エチル(3×20mL)で抽出する。混ぜ合わせた有機層を塩化アンモニウム飽和水溶液(3×100mL)、炭酸水素ナトリウム飽和水溶液(100mL)、ブライン(100mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。ジクロロメタン中0〜15%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して表題化合物を固体として得る。
【0130】
実施例22:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-モルフォリン-4-イル-ピリジン-3-イル)-シクロプロピル]-アミド(22)の合成
【0131】
【化35】

【0132】
DMSO(1mL)中の1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-ブロモ-ピリジン-3-イル)-シクロプロピル]-アミド(35mg,0.077mmol)とモルフォリン(68μL,0.77mmol)の溶液を圧力管内で160℃にて加熱する。40時間後、混合物を室温に冷まし、EtOAc(50mL)で希釈し、塩化アンモニウム飽和水溶液(2×50mL)、炭酸水素ナトリウム飽和水溶液(50mL)、ブライン(50mL)で洗浄し、MgSO4上で乾燥させ、ろ過かつ濃縮する。結果として生じる固体を、ジクロロメタン中0〜5%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで精製して固体を得、これをエーテル(5mL)と摩砕し、ろ過し、乾燥させて表題化合物を得る。
【0133】
実施例23:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-トリフルオロメチル-フェニル)-シクロプロピル]-アミド(23)の合成
【0134】
【化36】

【0135】
塩化メチレン(1mL)中の1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(40.0mg,0.156mmol)の懸濁液に塩化オキサリル(14μL,0.16mmol)を滴下して添加する。10分後、一滴のN,N-ジメチルホルムアミドを加えて懸濁液を室温で撹拌する。60分後、追加分の塩化オキサリル(14μL,0.16mmol)及び一滴のN,N-ジメチルホルムアミドを添加する。30分の撹拌後、溶媒を真空中で除去し;残留物を塩化メチレン(1mL)に懸濁させて真空中で濃縮する。残留物を真空下で30分間乾燥させ、塩化メチレン(1mL)に懸濁させて塩化メチレン(500μL)中の1-(3-トリフルオロメチル-フェニル)-シクロプロピルアミン塩酸塩(74.1mg,0.312mmol)とN,N-ジイソプロピルエチルアミン(0.080mL,0.46mmol)の溶液に加える。室温で15時間振とうさせた後、反応をメタノール(500μL)でクエンチして濃縮する。BEHカラム(2.1×50mm C18 1.7μM)及び0.05%ギ酸を含む水中10〜95%のアセトニトリルの勾配を利用する逆相HPLCで残留物を精製して表題化合物を得る。
以下の化合物は、実施例23に記載の方法を利用して調製される:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-メトキシ-フェニル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-ジメチルアミノ-ピリジン-2-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1-ピリジン-3-イル-シクロプロピル)-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-メトキシ-フェニル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-フルオロ-フェニル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1-m-トリル-シクロプロピル)-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-クロロ-フェニル)-シクロプロピル]-アミド;
4-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-安息香酸;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-フルオロ-フェニル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-クロロ-フェニル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1-p-トリル-シクロプロピル)-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1-フェニル-シクロプロピル)-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸(1-o-トリル-シクロプロピル)-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(3-シクロプロピル-1,2,4-オキサジアゾール-5-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(5-シクロプロピル-1,2,4-オキサジアゾール-3-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(2-メチル-チアゾール-4-イル)-シクロプロピル]-アミド;
[2-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ピリジン-4-イルメチル]-カルバミン酸tert-ブチルエステル;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-メトキシ-ピリジン-2-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-クロロ-ピリジン-2-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(5-ブロモ-ピリジン-2-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-ヨード-ピリジン-2-イル)-シクロプロピル]-アミド;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-ブロモ-フェニル)-シクロプロピル]-アミド;
[6-(1-{[1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボニル]-アミノ}-シクロプロピル)-ピリジン-3-イルメチル]-カルバミン酸tert-ブチルエステル;
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-メトキシ-フェニル)-シクロブチル]-アミド;及び
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-フルオロ-フェニル)-シクロブチル]-アミド。
以下の化合物は、実施例23に記載のカップリング方法を利用した後、実施例7に記載の方法に従ってBoc-脱保護して調製される:
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(4-アミノメチル-ピリジン-2-イル)-シクロプロピル]-アミド;及び
1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(5-アミノメチル-ピリジン-2-イル)-シクロプロピル]-アミド。
【0136】
実施例24:1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸{1-[6-(アセチル-メチル-アミノ)-ピリジン-3-イル]-シクロプロピル}-アミド(24)の合成
【0137】
【化37】

【0138】
無水酢酸(1mL)中の1-(4-フルオロ-フェニル)-1H-ピラゾロ[3,4-c]ピリジン-4-カルボン酸[1-(6-メチルアミノ-ピリジン-3-イル)-シクロプロピル]-アミド(40mg,0.099mmol)の溶液を60℃で16時間加熱する。この溶液を室温に冷まし、3mLの1N NaOH水溶液で希釈し、20分間撹拌し、酢酸エチル(5mL)で抽出する。有機層を硫酸マグネシウム上で乾燥させ、ろ過かつ濃縮する。ジクロロメタン中0〜10%のメタノールの勾配を用いて溶出するシリカゲルクロマトグラフィーで残留物を精製して表題化合物を得る。
【0139】
実施例25:6-ブロモ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド(25a)、及び1-(4-フルオロ-フェニル)-6-ヨード-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド(25b)の合成
【0140】
【化38】

【0141】
実施例2に記載の銅媒介クロスカップリング手順に従って6-ブロモ-1H-インダゾール-4-カルボン酸メチルエステル(10.0g,39.2mmol)から6-ブロモ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸メチルエステルと1-(4-フルオロ-フェニル)-6-ヨード-1H-インダゾール-4-カルボン酸メチルエステルの混合物を調製する。
THF(12mL)、メタノール(4mL)、及び水(4mL)中の6-ブロモ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸メチルエステルと1-(4-フルオロ-フェニル)-6-ヨード-1H-インダゾール-4-カルボン酸メチルエステルの混合物(500mg)の溶液にLiOH・H2O(240mg,5.73mmol)を加える。室温で4時間撹拌した後、反応混合物を1M HClで中和し、濃縮し、ジクロロメタン中20%のメタノール溶液(100mL)で希釈する。水(100mL)を加え、混合物のpHを1M HClで4に調整する。相を分けて水層をジクロロメタン中20%のメタノール溶液(9×100mL)で抽出する。混ぜ合わせた有機層を硫酸マグネシウム上で乾燥させ、ろ過かつ濃縮して6-ブロモ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸と1-(4-フルオロ-フェニル)-6-ヨード-1H-インダゾール-4-カルボン酸の混合物を固体として得る。
表題化合物は、実施例13に記載のカップリング手順に従い、6-ブロモ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸と1-(4-フルオロ-フェニル)-6-ヨード-1H-インダゾール-4-カルボン酸の混合物(420mg)、及び1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピルアミントリフルオロ酢酸塩(851mg,1.93mmol)を用いて調製され、かつC18カラム及び0.1%トリフルオロ酢酸を含む水中のアセトニトリルの勾配を利用する逆相HPLCで精製される。中間体1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピルアミントリフルオロ酢酸塩は、[1-(2-ブロモ-ピリジン-4-イル)-シクロプロピル]-カルバミン酸tert-ブチルエステルから、WO 2009/134666(実施例7)に記載の銅媒介カップリング手順後、上記Boc脱保護手順(実施例3)に従って調製される。
【0142】
実施例26:1-(4-フルオロ-フェニル)-6-メタンスルホニル-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド(26)の合成
【0143】
【化39】

【0144】
表題化合物は、実施例18に記載のカップリング手順に従い、6-ブロモ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミドと1-(4-フルオロ-フェニル)-6-ヨード-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミドの混合物(100mg)から合成される。
【0145】
実施例27:6-シアノ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド(27)の合成
【0146】
【化40】

【0147】
DMF(1.0mL,脱気かつ無水)中の6-ブロモ-1-(4-フルオロ-フェニル)-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド、及び1-(4-フルオロ-フェニル)-6-ヨード-1H-インダゾール-4-カルボン酸[1-(2-メタンスルホニル-ピリジン-4-イル)-シクロプロピル]-アミド(150mg)の撹拌溶液にテトラキス(トリフェニルホスフィン)パラジウム(33mg,0.028mmol)及びシアン化亜鉛(40mg,0.34mmol)を添加する。溶液を排気し、アルゴンでパージし(3回)、120℃に温める。3時間後、反応を室温に冷まし、塩化アンモニウム飽和水溶液(50mL)で希釈し、酢酸エチル(3×50mL)で抽出する。混ぜ合わせた有機層をブライン(50mL)で洗浄し、硫酸マグネシウム上で乾燥させ、ろ過かつ濃縮する。ヘプタン中50〜100%の酢酸エチルの勾配を利用してSiO2上で残留物を精製して固体を得、これをエチルエーテルと摩砕して表題生成物を得る。
【0148】
(生物学的特性の評価)
CCR1トランスフェクト細胞内のカルシウム流を測定する機能性細胞アッセイにおけるCCR1とMIP-1αの相互作用を遮断する能力について化合物を評価する。
Chemicon Corporationから購入した安定に組換えCCR1及びG-α-16を発現している非接着性細胞(HTS005C)を、10%FBS、0.4mg/mLのジェネテシン(Geneticin)及びペニシリン/ストレプトマイシンを補充したRPMI 1640培地(Mediatech 10-080-CM)内で培養する。アッセイ当日、細胞にカルシウム4色素(Molecular Devices R7448)とプロベネシド(Probenecid)(Invitrogen P346400)を8E5細胞/mLで1時間室温にて負荷する。1時間後、細胞を384ウェル組織培養処理プレートに20,000細胞/ウェルの密度で播種する。適切に希釈した試験化合物を、3,000nMの最大濃度に達するようにウェルに添加する(10用量合計で4倍希釈)。DMSOの最終濃度は1%である。緩衝液は、pH7.4で20mMのHEPESを含むHBSS(Invitrogen 14025)である。細胞を37℃で30分、次に室温で30分インキュベートする。プレートをHAMAMATSU FDSS6000に移し、1%BSA中のMIP-1αをEC80最終濃度で添加する。色素負荷の開始の4時間以内で全てのプレートを解読しなければならない。化合物の代わりに希釈DMSOを含むウェル+/-MIP-1αがコントロールとして役立つ。Activity Baseソフトウェアを用いてデータを解析する。
一般に、上記アッセイにおける化合物の好ましい効力範囲(IC50)は0.1nM〜3μMであり、最も好ましい効力範囲は0.1nM〜50nMである。
本発明の代表化合物を上記アッセイで試験すると、それらはCCR1アンタゴニストとしての活性を示した。これは本発明の別の実施形態を表す。
【0149】
表II

【0150】
(表II続き)

【0151】
(表II続き)

【0152】
(表II続き)

【0153】
(表II続き)

【0154】
(使用方法)
本発明の化合物は、CCR1とそのケモカインリガンドとの相互作用の有効なアンタゴニストなので、CCR1媒介活性を阻害する。従って、本発明の一実施形態では、本発明の化合物を使用する自己免疫障害の治療方法を提供する。別の実施形態では、本発明の化合物を使用する炎症性障害の治療方法を提供する。
理論によって拘束されることを望むものではないが、CCR1とそのケモカインリガンドとの相互作用をアンタゴナイズすることによって、本化合物は、単球、マクロファージ樹状細胞、好酸球、及びT細胞(TH1)細胞並びに炎症組織に対してCCR1陽性の他細胞などの炎症誘発性細胞の走化性を遮断し、それによって自己免疫疾患と関連する慢性炎症を寛解させる。このように、CCR1活性の阻害は、種々の自己免疫障害、例えば炎症性疾患、自己免疫疾患、臓器移植拒絶反応(Horuk et al. (2001) JBC 276 p. 4199)及び骨髄移植拒絶反応並びに炎症誘発性細胞の流入と関連する他の障害などを予防及び治療するための魅力的な手段である。例えば、本発明の化合物を用いて急性若しくは慢性炎症、アレルギー、接触皮膚炎、乾癬、関節リウマチ、多発性硬化症、1型糖尿病、炎症性腸疾患、ギラン・バレー症候群、クローン病、潰瘍性大腸炎、移植片対宿主病(及び他の形態の臓器又は骨髄移植拒絶反応)、アルツハイマー病(Halks-Miller et al. (2003) Ann Neurol 54 p.638)、喘息(Jouber et al. (2008) J. Immun180 p. 1268)、慢性腎臓病(Topham et al. (1999) J. Clin. Invest. 104 p. 1549)、敗血症(He et al. (2007) Am J. Physio 292 p. G1173)、自己免疫性心筋炎(Futamats et al. (2006) J Mol Cell Cardiology 40 p. 853)、多発性骨髄腫(Blood (2001) 97 pp 3349-3353)、COPD(Expert Opin. Investig. Drugs (2005) 14 pp 785-796)及び全身性エリテマトーデスを予防又は治療することができる。特に、本化合物を用いて関節リウマチ及び多発性硬化症を予防又は治療することができる。当業者には炎症誘発性細胞の輸送と関連する他の障害が明白であろうし、それらを本発明の化合物及び組成物で治療することもできる。
上記疾患及び障害の治療のため、治療的に有効な用量は、一般的に本発明の化合物の投薬当たり約0.01mg/kg(体重)〜約100mg/kg(体重);好ましくは投薬当たり約0.1mg/kg(体重)〜約20mg/kg(体重)の範囲内である。例えば、70kgのヒトへの投与では、用量範囲は、本発明の化合物の投薬当たり約0.7mg〜約7000mg、好ましくは投薬当たり約7.0mg〜約1400mgである。最適な投薬レベル及びパターンを決定するためにはある程度の日常的な用量の最適化が必要であろう。1日に1〜6回活性成分を投与してよい。
【0155】
(一般的投与及び医薬組成物)
医薬品として使用する場合、本発明の化合物は典型的に医薬組成物の形で投与される。該組成物は製薬技術で周知の技術を利用して調製可能であり、少なくとも1種の本発明の化合物を含む。本発明の化合物は単独で投与してもよく或いは本発明の化合物の安定性を増強するか、又は特定の実施形態では本発明の化合物を含む医薬組成物の投与を容易にするか、又は溶解若しくは分散を高めるか、又はアンタゴニスト活性を高めるか、又は補助治療を提供する等のアジュバントと組み合わせて投与してもよい。本発明の化合物を単独で使用してよく、或いは本発明の他の活性物質と共に、また必要に応じて他の薬理学的に活性な物質と共に使用してもよい。一般に、本発明の化合物は治療的又は医薬的に有効な量で投与されるが、診断又は他の目的では、より少ない量で投与され得る。
医薬組成物の許容されるいるいずれの投与様式を利用しても、本発明の化合物の投与を純粋な形態又は適切な医薬組成物で行うことができる。従って、投与は、例えば、固体、半固体、凍結乾燥粉末の形態、又は液体剤形、例えば、錠剤、座剤、丸剤、軟弾性及び硬ゼラチンカプセル剤、散剤、溶液、懸濁液、又はエアロゾル等で、好ましくは正確な薬用量の簡単な投与に適した単位剤形で、経口、頬側(例えば、舌下)、経鼻、非経口、局所、経皮、経膣、経直腸投与であってよい。医薬組成物は、一般的に通常の医薬担体又は賦形剤と、活性薬として本発明の化合物とを含み、かつさらに、他の医薬、薬剤、担体、アジュバント、希釈剤、ビヒクル、又はその組合せを含むであろう。このような医薬的に許容できる賦形剤、担体、又は添加剤並びに種々の様式又は投与用の医薬組成物の製造方法は当業者に周知である。技術水準は、例えば、Remington: The Science and Practice of Pharmacy, 20th Edition, A. Gennaro (ed.), Lippincott Williams & Wilkins, 2000; Handbook of Pharmaceutical Additives, Michael & Irene Ash (eds.), Gower, 1995; Handbook of Pharmaceutical Excipients, A.H. Kibbe (ed.), American Pharmaceutical Ass’n, 2000; H.C. Ansel and N.G. Popovish, Pharmaceutical Dosage Forms and Drug Delivery Systems, 5th ed., Lea and Febiger, 1990によって証明されており;上記文献は、技術水準をよりよく説明するため、それぞれ参照によってその全体がここに援用される。
当業者が予想するように、特定の医薬製剤で利用される本発明の化合物の形態は、その製剤が有効であるために必要とされる適切な物理的特性(例えば、水溶性)を有するように(例えば、塩)選択されるであろう。
【特許請求の範囲】
【請求項1】
下記式(I)
【化1】

(I)
(式中、
Xは、窒素又はC-R2であり;
Ar1は、それぞれ任意に1〜3個のRaで置換されていてもよい炭素環、ヘテロアリール又はヘテロシクリルであり;
Ar2は、それぞれ任意に1〜3個のRbで置換されていてもよい炭素環、ヘテロアリール又はヘテロシクリルであり;
環式Gは、それぞれ任意に1〜2個のRgで置換されていてもよい炭素環、又はヘテロシクリルであり;
R1は、水素、C1-6アルキル又はC1-6アルコキシC1-6アルキルであり;
R2は、水素又はRaであり;
Raは、C1-6アルキル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルチオ、C1-6アルキルスルホニル、C1-6アルコキシカルボニル、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C3-6シクロアルキルアミノ、C1-6アルキルアミノカルボニル、C1-6アシル、C1-6アシルアミノ、C1-6ジアルキルアミノカルボニル、ヒドロキシル、ハロゲン、シアノ、ニトロ、オキソ、R3-S(O)m-NH-、R3-NH-S(O)m-、アリール又はカルボキシルであり;
Rbは、ヒドロキシル、カルボキシル、ハロゲン、-(CH2)n-CN、-(CH2)n-CO2C1-6アルキル、ニトロ、-SO3H、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルC(O)-、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)m-NRe-、R3-NRe-S(O)m(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-(CH2)n-NRcRd、ヘテロシクリル、アリール又はヘテロアリールであり、各Rbは、可能であれば、任意にハロゲン化されるか又は1〜3個のC1-6アルキル、ヒドロキシル、C1-6アシル、C1-6アルコキシカルボニル、C1-6アルキル-S(O)m-、アリール若しくはカルボキシルで置換されていてもよく;
各Rc、Rdは、独立に水素、C1-6アルキル、C1-6アシル、C3-10シクロアルキル、C1-6アルコキシ、ヒドロキシC1-6アルキル、シアノ-C1-6アルキル、C1-6アルキルC1-6アルコキシ、C1-6アルキルスルホニル、C1-6アルコキシカルボニルC0-3アルキル、C1-6アルコキシカルボニルC3-10シクロアルキル、-(CH2)n-C(O)-NReRf又は-(CH2)n-NReRfであり;
各Re、Rfは、独立に水素、C1-6アルキル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルコキシC1-6アルキル、モノ若しくはジC1-6アルキルアミノC1-6アルキル、ヒドロキシC1-6アルキル又はC1-6アシルであり;
Rgは、C1-6アルキル(ここで、該C1-6アルキルは、任意に部分的又は完全にハロゲン化されていてもよい)、C2-6アルケニル、炭素環、C1-6アルコキシ、カルボシクリル-C1-6アルコキシ、カルボシクリル-C1-6アルキル、ヒドロキシC1-6アルキル、ヒドロキシル、-(CH2)n-CO2C1-6アルキル又はオキソであり;
R3は、水素、C1-6アルキル、C3-6シクロアルキル、ヘテロシクリル(CH2)0-1、モノ-若しくはジ-C1-6アルキルアミノ、モノ-若しくはジ-C1-6アルキルアミノ(CH2)2-3N(Re)-、アリール又はヘテロアリールであり、それぞれ任意に1〜3個のC1-6アルキル、C3-6シクロアルキル、C1-6アルコキシ、ハロゲン、ヒドロキシル、オキソ、カルボキシル、-C(O)NReRf、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C1-6アルコキシカルボニル又はC1-6アシルアミノで置換されていてもよく;
各n、yは、独立に0〜3であり;
各mは、独立に0〜2である)
の化合物又はその医薬的に許容できる塩。
【請求項2】
式中、
環式Gが、任意に1〜2個のRgで置換されていてもよい炭素環である、
請求項1に記載の化合物又はその医薬的に許容できる塩。
【請求項3】
式中、
Xが窒素であり;
Ar1が、任意に1〜3個のRaで置換されていてもよい炭素環であり;
Ar2が、それぞれ任意に1〜3個のRbで置換されていてもよい炭素環又はヘテロアリーであり;
R1が水素であり;
Raが、C1-3アルキル、C1-3アルコキシ、ジ-C1-6アルキルアミノ、メチルスルホニル、ハロゲン、又はシアノであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-(CH2)n-CN、-(CH2)n-CO2C1-6アルキル、ニトロ、-SO3H、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルC(O)-、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)m-NRe-、R3-NRe-S(O)m(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-(CH2)n-NRcRd、ヘテロシクリル、アリール又はヘテロアリールであり、各Rbは、可能であれば、任意にハロゲン化されるか又は1〜3個のC1-6アルキル、C1-6アシル、C1-6アルコキシカルボニル、C1-6アルキル-S(O)m-、アリール若しくはカルボキシルで置換されていてもよく;
R3が、水素、C1-6アルキル、C3-6シクロアルキル、ヘテロシクリル(CH2)0-1、モノ-若しくはジ-C1-6アルキルアミノ、モノ-若しくはジ-C1-6アルキルアミノ(CH2)2-3N(C1-6アルキル)-、アリール又はヘテロアリールであり、それぞれ任意に1〜2個のC1-6アルキル、C3-6シクロアルキル、C1-6アルコキシ、ハロゲン、ヒドロキシル、オキソ、カルボキシル、-C(O)NReRf、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C1-6アルコキシカルボニル又はC1-6アシルアミノで置換されていてもよい、
請求項2に記載の化合物又はその医薬的に許容できる塩。
【請求項4】
式中、
Ar1が、1〜2個のRaで置換されているフェニルであり;
Ar2が、それぞれ任意に1〜2個のRbで置換されていてもよいフェニル、チアジアゾリル、オキサジアゾリル、ピリミジニル、フラニル、チアゾリル又はピリジルであり;
環式Gがシクロプロピル又はシクロブチルであり;
Raがハロゲンであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-CF3、-CN、-SO3H、C1-3アルキル、C3-6シクロアルキルC1-3アルコキシ、-(CH2)n-CO2C1-3アルキル、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)2-NRe-、R3-NRe-S(O)2(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-NRcRd、又はモルフォリニルであり;
各Rc、Rdが、独立に水素、C1-3アルキル、C1-3アシル、シアノ-C1-3アルキル、C1-3アルコキシカルボニルC0-3アルキル、C1-3アルコキシカルボニルC3-6シクロアルキル、又は-(CH2)n-C(O)-NReRfであり;
各Re、Rfが、独立に水素又はC1-3アルキルであり;
R3が、水素又はそれぞれ任意に1〜2個のC1-6アルコキシ若しくはオキソで置換されていてもよいC1-6アルキルである、
請求項3に記載の化合物又はその医薬的に許容できる塩。
【請求項5】
式中、
環式Gがシクロプロピルであり;
Raが-F又は-Clであり;
Rbが、-CH3、カルボキシル、-F、-Cl、-Br、-I、-CF3、シクロプロピル、-OCH3、-CO2Me、-NRcRd、-CH2-NRcRd、R3-S(O)m-、R3-S(O)2-NRe-、R3-NRe-S(O)2-、-NRf-C(O)-Re、-C(O)NRcRd又はモルフォリニルであり;
各Rc、Rdが、独立に水素、-CH3、-C(O)CH3、-CH2CN、C1-4アルコキシカルボニル、メトキシカルボニル-C1-2アルキル-、メトキシカルボニル-C3シクロアルキル-又は-(CH2)-C(O)-NReRfであり;
各Re、Rfが、独立に水素又は-CH3であり;
R3が水素又はそれぞれ任意に1〜2個の-OCH3若しくはオキソで置換されていてもよいC1-4アルキルである、
請求項4に記載の化合物又はその医薬的に許容できる塩。
【請求項6】
式中、
XがC-R2であり;
Ar1が、任意に1〜3個のRaで置換されていてもよい炭素環であり;
Ar2が、それぞれ任意に1〜3個のRbで置換されていてもよい炭素環又はヘテロアリールであり;
環式Gが、任意に1〜2個のRgで置換されていてもよい炭素環であり;
R1が水素であり;
R2が水素又はRaであり;
Raが、C1-3アルキル、C1-3アルコキシ、ジ-C1-6アルキルアミノ、メチルスルホニル、ハロゲン、又はシアノであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-(CH2)n-CN、-(CH2)n-CO2C1-6アルキル、ニトロ、-SO3H、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルC(O)-、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)m-NRe-、R3-NRe-S(O)m(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-(CH2)n-NRcRd、ヘテロシクリル、アリール又はヘテロアリールであり、各Rbは、可能であれば、任意にハロゲン化されるか又は1〜3個のC1-6アルキル、C1-6アシル、C1-6アルコキシカルボニル、C1-6アルキル-S(O)m-、アリール若しくはカルボキシルで置換されていてもよく;
各Rc、Rdが、独立に水素、C1-6アルキル、C1-6アシル、C3-10シクロアルキル、C1-6アルコキシ、ヒドロキシC1-6アルキル、シアノC1-6アルキル、C1-6アルキルC1-6アルコキシ、C1-6アルキルスルホニル、C1-6アルコキシカルボニルC0-3アルキル、C1-6アルコキシカルボニルC3-10シクロアルキル、-(CH2)n-C(O)-NReRf又は-(CH2)n-NReRfであり;
各Re、Rfが、独立に水素、C1-6アルキル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルコキシC1-6アルキル、モノ若しくはジC1-6アルキルアミノC1-6アルキル、ヒドロキシC1-6アルキル又はC1-6アシルであり;
R3が、水素、C1-6アルキル、C3-6シクロアルキル、ヘテロシクリル(CH2)0-1、モノ-若しくはジ-C1-6アルキルアミノ、モノ-若しくはジ-C1-6アルキルアミノ(CH2)2-3N(C1-6アルキル)-、アリール又はヘテロアリールであり、それぞれ任意に1〜2個のC1-6アルキル、C3-6シクロアルキル、C1-6アルコキシ、ハロゲン、ヒドロキシル、オキソ、カルボキシル、-C(O)NReRf、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C1-6アルコキシカルボニル又はC1-6アシルアミノで置換されていてもよい、
請求項5に記載の化合物又はその医薬的に許容できる塩。
【請求項7】
式中、
Ar1が、1〜2個のRaで置換されているフェニルであり;
Ar2が、それぞれ任意に1〜2個のRbで置換されていてもよいフェニル、チアジアゾリル、オキサジアゾリル、ピリミジニル、フラニル、チアゾリル又はピリジルであり;
環式Gが、シクロプロピル又はシクロブチルであり;
Raが、C1-3アルキル、メチルスルホニル、ハロゲン、又はシアノであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-CF3、-CN、-SO3H、C1-3アルキル、C3-6シクロアルキルC1-3アルコキシ、-(CH2)n-CO2C1-3アルキル、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)2-NRe-、R3-NRe-S(O)2(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-NRcRd、又はモルフォリニルであり;
各Rc、Rdが、独立に水素、C1-3アルキル、C1-3アシル、シアノ-C1-3アルキル、C1-3アルコキシカルボニルC0-3アルキル、C1-3アルコキシカルボニルC3-6シクロアルキル、又は-(CH2)n-C(O)-NReRfであり;
各Re、Rfが、独立に水素又はC1-3アルキルであり;
R3が、水素又はそれぞれ任意に1〜2個のC1-6アルコキシ若しくはオキソで置換されていてもよいC1-6アルキルである、
請求項6に記載の化合物又はその医薬的に許容できる塩。
【請求項8】
式中、
環式Gがシクロプロピルであり;
Raが、-F又は-Cl、メチル、メチルスルホニル又はシアノであり;
Rbが、-CH3、カルボキシル、-F、-Cl、-Br、-I、-CF3、シクロプロピル、-OCH3、-CO2Me、-NRcRd、-(CH2)-NRcRd、R3-S(O)m-、R3-S(O)2-NRe-、R3-NRe-S(O)2-、-NRf-C(O)-Re、-C(O)NRcRd又はモルフォリニルであり;
各Rc、Rdが、独立に水素、-CH3、-C(O)CH3、-CH2CN、C1-4アルコキシカルボニル、メトキシカルボニル-C1-2アルキル-、メトキシカルボニル-C3シクロアルキル-又は-(CH2)-C(O)-NReRfであり;
各Re、Rfが、独立に水素又は-CH3であり;
R3が水素又はそれぞれ任意に1〜2個の-OCH3若しくはオキソで置換されていてもよいC1-4アルキルである、
請求項7に記載の化合物又はその医薬的に許容できる塩。
【請求項9】
式中、
環式Gが、シクロプロピル又はシクロブチルである、
請求項8に記載の化合物又はその医薬的に許容できる塩。
【請求項10】
式中、
環式Gがシクロプロピルである、
請求項9に記載の化合物又はその医薬的に許容できる塩。
【請求項11】
式中、
Rcが水素又はC1-6アルキルであり、かつRdがC1-6アシル、シアノ-C1-6アルキル-、C1-6アルコキシカルボニル-C0-3アルキル-、C1-6アルコキシカルボニルC3-10シクロアルキル、又は-(CH2)n-C(O)-NReRfであり;
各Re、Rfが、独立に水素、C1-6アルキルである、
請求項10に記載の化合物又はその医薬的に許容できる塩。
【請求項12】
式中、
Ar2が、それぞれ任意に1又は2個のRbで置換されていてもよいフェニル、ピリミジニル、フラニル、チアゾリル又はピリジルであり;
Rbが、-SO2Me、-I、-Br、-Cl、-CF3、-OMe、-NMe2、-CONHMe、-SO2NH2である、
請求項11に記載の化合物又はその医薬的に許容できる塩。
【請求項13】
式中、Ar2が下記
【化2】

である、
請求項12に記載の化合物又はその医薬的に許容できる塩。
【請求項14】
式中、
Rgが、
i)C1-2アルキル、-CF3、C2アルケニル、フェニル、C1-4アルコキシ、カルボシクリルCH2O-、カルボシクリルCH2- -CH2OH、ヒドロキシル、-CO2C1-4アルキル又はオキソ;
又は
ii)メチル、ビニル、-CF3、フェニル、-CH2OH、又はヒドロキシルである、
請求項13に記載の化合物又はその医薬的に許容できる塩。
【請求項15】
下記
【化3】







から選択される化合物又はその医薬的に許容できる塩。
【請求項16】
医薬的に有効な量の請求項1に記載の化合物と、1種以上の医薬担体及び/又はアジュバントとを含む医薬組成物。
【請求項17】
慢性炎症、アレルギー、接触皮膚炎、乾癬、関節リウマチ、多発性硬化症、1型糖尿病、炎症性腸疾患、ギラン・バレー症候群、クローン病、潰瘍性大腸炎、移植片対宿主病、アルツハイマー病、喘息、慢性腎臓病、敗血症、自己免疫性心筋炎及び全身性エリテマトーデスの治療方法であって、医薬的に有効な量の請求項1に記載の化合物を患者に投与する工程を含む方法。
【請求項18】
前記治療が関節リウマチ及び多発性硬化症のためである、請求項17に記載の方法。
【請求項19】
前記治療が関節リウマチのためである、請求項17に記載の方法。
【請求項20】
前記治療が多発性硬化症のためである、請求項17に記載の方法。
【請求項1】
下記式(I)
【化1】

(I)
(式中、
Xは、窒素又はC-R2であり;
Ar1は、それぞれ任意に1〜3個のRaで置換されていてもよい炭素環、ヘテロアリール又はヘテロシクリルであり;
Ar2は、それぞれ任意に1〜3個のRbで置換されていてもよい炭素環、ヘテロアリール又はヘテロシクリルであり;
環式Gは、それぞれ任意に1〜2個のRgで置換されていてもよい炭素環、又はヘテロシクリルであり;
R1は、水素、C1-6アルキル又はC1-6アルコキシC1-6アルキルであり;
R2は、水素又はRaであり;
Raは、C1-6アルキル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルチオ、C1-6アルキルスルホニル、C1-6アルコキシカルボニル、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C3-6シクロアルキルアミノ、C1-6アルキルアミノカルボニル、C1-6アシル、C1-6アシルアミノ、C1-6ジアルキルアミノカルボニル、ヒドロキシル、ハロゲン、シアノ、ニトロ、オキソ、R3-S(O)m-NH-、R3-NH-S(O)m-、アリール又はカルボキシルであり;
Rbは、ヒドロキシル、カルボキシル、ハロゲン、-(CH2)n-CN、-(CH2)n-CO2C1-6アルキル、ニトロ、-SO3H、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルC(O)-、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)m-NRe-、R3-NRe-S(O)m(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-(CH2)n-NRcRd、ヘテロシクリル、アリール又はヘテロアリールであり、各Rbは、可能であれば、任意にハロゲン化されるか又は1〜3個のC1-6アルキル、ヒドロキシル、C1-6アシル、C1-6アルコキシカルボニル、C1-6アルキル-S(O)m-、アリール若しくはカルボキシルで置換されていてもよく;
各Rc、Rdは、独立に水素、C1-6アルキル、C1-6アシル、C3-10シクロアルキル、C1-6アルコキシ、ヒドロキシC1-6アルキル、シアノ-C1-6アルキル、C1-6アルキルC1-6アルコキシ、C1-6アルキルスルホニル、C1-6アルコキシカルボニルC0-3アルキル、C1-6アルコキシカルボニルC3-10シクロアルキル、-(CH2)n-C(O)-NReRf又は-(CH2)n-NReRfであり;
各Re、Rfは、独立に水素、C1-6アルキル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルコキシC1-6アルキル、モノ若しくはジC1-6アルキルアミノC1-6アルキル、ヒドロキシC1-6アルキル又はC1-6アシルであり;
Rgは、C1-6アルキル(ここで、該C1-6アルキルは、任意に部分的又は完全にハロゲン化されていてもよい)、C2-6アルケニル、炭素環、C1-6アルコキシ、カルボシクリル-C1-6アルコキシ、カルボシクリル-C1-6アルキル、ヒドロキシC1-6アルキル、ヒドロキシル、-(CH2)n-CO2C1-6アルキル又はオキソであり;
R3は、水素、C1-6アルキル、C3-6シクロアルキル、ヘテロシクリル(CH2)0-1、モノ-若しくはジ-C1-6アルキルアミノ、モノ-若しくはジ-C1-6アルキルアミノ(CH2)2-3N(Re)-、アリール又はヘテロアリールであり、それぞれ任意に1〜3個のC1-6アルキル、C3-6シクロアルキル、C1-6アルコキシ、ハロゲン、ヒドロキシル、オキソ、カルボキシル、-C(O)NReRf、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C1-6アルコキシカルボニル又はC1-6アシルアミノで置換されていてもよく;
各n、yは、独立に0〜3であり;
各mは、独立に0〜2である)
の化合物又はその医薬的に許容できる塩。
【請求項2】
式中、
環式Gが、任意に1〜2個のRgで置換されていてもよい炭素環である、
請求項1に記載の化合物又はその医薬的に許容できる塩。
【請求項3】
式中、
Xが窒素であり;
Ar1が、任意に1〜3個のRaで置換されていてもよい炭素環であり;
Ar2が、それぞれ任意に1〜3個のRbで置換されていてもよい炭素環又はヘテロアリーであり;
R1が水素であり;
Raが、C1-3アルキル、C1-3アルコキシ、ジ-C1-6アルキルアミノ、メチルスルホニル、ハロゲン、又はシアノであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-(CH2)n-CN、-(CH2)n-CO2C1-6アルキル、ニトロ、-SO3H、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルC(O)-、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)m-NRe-、R3-NRe-S(O)m(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-(CH2)n-NRcRd、ヘテロシクリル、アリール又はヘテロアリールであり、各Rbは、可能であれば、任意にハロゲン化されるか又は1〜3個のC1-6アルキル、C1-6アシル、C1-6アルコキシカルボニル、C1-6アルキル-S(O)m-、アリール若しくはカルボキシルで置換されていてもよく;
R3が、水素、C1-6アルキル、C3-6シクロアルキル、ヘテロシクリル(CH2)0-1、モノ-若しくはジ-C1-6アルキルアミノ、モノ-若しくはジ-C1-6アルキルアミノ(CH2)2-3N(C1-6アルキル)-、アリール又はヘテロアリールであり、それぞれ任意に1〜2個のC1-6アルキル、C3-6シクロアルキル、C1-6アルコキシ、ハロゲン、ヒドロキシル、オキソ、カルボキシル、-C(O)NReRf、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C1-6アルコキシカルボニル又はC1-6アシルアミノで置換されていてもよい、
請求項2に記載の化合物又はその医薬的に許容できる塩。
【請求項4】
式中、
Ar1が、1〜2個のRaで置換されているフェニルであり;
Ar2が、それぞれ任意に1〜2個のRbで置換されていてもよいフェニル、チアジアゾリル、オキサジアゾリル、ピリミジニル、フラニル、チアゾリル又はピリジルであり;
環式Gがシクロプロピル又はシクロブチルであり;
Raがハロゲンであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-CF3、-CN、-SO3H、C1-3アルキル、C3-6シクロアルキルC1-3アルコキシ、-(CH2)n-CO2C1-3アルキル、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)2-NRe-、R3-NRe-S(O)2(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-NRcRd、又はモルフォリニルであり;
各Rc、Rdが、独立に水素、C1-3アルキル、C1-3アシル、シアノ-C1-3アルキル、C1-3アルコキシカルボニルC0-3アルキル、C1-3アルコキシカルボニルC3-6シクロアルキル、又は-(CH2)n-C(O)-NReRfであり;
各Re、Rfが、独立に水素又はC1-3アルキルであり;
R3が、水素又はそれぞれ任意に1〜2個のC1-6アルコキシ若しくはオキソで置換されていてもよいC1-6アルキルである、
請求項3に記載の化合物又はその医薬的に許容できる塩。
【請求項5】
式中、
環式Gがシクロプロピルであり;
Raが-F又は-Clであり;
Rbが、-CH3、カルボキシル、-F、-Cl、-Br、-I、-CF3、シクロプロピル、-OCH3、-CO2Me、-NRcRd、-CH2-NRcRd、R3-S(O)m-、R3-S(O)2-NRe-、R3-NRe-S(O)2-、-NRf-C(O)-Re、-C(O)NRcRd又はモルフォリニルであり;
各Rc、Rdが、独立に水素、-CH3、-C(O)CH3、-CH2CN、C1-4アルコキシカルボニル、メトキシカルボニル-C1-2アルキル-、メトキシカルボニル-C3シクロアルキル-又は-(CH2)-C(O)-NReRfであり;
各Re、Rfが、独立に水素又は-CH3であり;
R3が水素又はそれぞれ任意に1〜2個の-OCH3若しくはオキソで置換されていてもよいC1-4アルキルである、
請求項4に記載の化合物又はその医薬的に許容できる塩。
【請求項6】
式中、
XがC-R2であり;
Ar1が、任意に1〜3個のRaで置換されていてもよい炭素環であり;
Ar2が、それぞれ任意に1〜3個のRbで置換されていてもよい炭素環又はヘテロアリールであり;
環式Gが、任意に1〜2個のRgで置換されていてもよい炭素環であり;
R1が水素であり;
R2が水素又はRaであり;
Raが、C1-3アルキル、C1-3アルコキシ、ジ-C1-6アルキルアミノ、メチルスルホニル、ハロゲン、又はシアノであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-(CH2)n-CN、-(CH2)n-CO2C1-6アルキル、ニトロ、-SO3H、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルキルC(O)-、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)m-NRe-、R3-NRe-S(O)m(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-(CH2)n-NRcRd、ヘテロシクリル、アリール又はヘテロアリールであり、各Rbは、可能であれば、任意にハロゲン化されるか又は1〜3個のC1-6アルキル、C1-6アシル、C1-6アルコキシカルボニル、C1-6アルキル-S(O)m-、アリール若しくはカルボキシルで置換されていてもよく;
各Rc、Rdが、独立に水素、C1-6アルキル、C1-6アシル、C3-10シクロアルキル、C1-6アルコキシ、ヒドロキシC1-6アルキル、シアノC1-6アルキル、C1-6アルキルC1-6アルコキシ、C1-6アルキルスルホニル、C1-6アルコキシカルボニルC0-3アルキル、C1-6アルコキシカルボニルC3-10シクロアルキル、-(CH2)n-C(O)-NReRf又は-(CH2)n-NReRfであり;
各Re、Rfが、独立に水素、C1-6アルキル、C3-10シクロアルキル、C1-6アルコキシ、C1-6アルコキシC1-6アルキル、モノ若しくはジC1-6アルキルアミノC1-6アルキル、ヒドロキシC1-6アルキル又はC1-6アシルであり;
R3が、水素、C1-6アルキル、C3-6シクロアルキル、ヘテロシクリル(CH2)0-1、モノ-若しくはジ-C1-6アルキルアミノ、モノ-若しくはジ-C1-6アルキルアミノ(CH2)2-3N(C1-6アルキル)-、アリール又はヘテロアリールであり、それぞれ任意に1〜2個のC1-6アルキル、C3-6シクロアルキル、C1-6アルコキシ、ハロゲン、ヒドロキシル、オキソ、カルボキシル、-C(O)NReRf、アミノ、モノ-若しくはジ-C1-6アルキルアミノ、C1-6アルコキシカルボニル又はC1-6アシルアミノで置換されていてもよい、
請求項5に記載の化合物又はその医薬的に許容できる塩。
【請求項7】
式中、
Ar1が、1〜2個のRaで置換されているフェニルであり;
Ar2が、それぞれ任意に1〜2個のRbで置換されていてもよいフェニル、チアジアゾリル、オキサジアゾリル、ピリミジニル、フラニル、チアゾリル又はピリジルであり;
環式Gが、シクロプロピル又はシクロブチルであり;
Raが、C1-3アルキル、メチルスルホニル、ハロゲン、又はシアノであり;
Rbが、ヒドロキシル、カルボキシル、ハロゲン、-CF3、-CN、-SO3H、C1-3アルキル、C3-6シクロアルキルC1-3アルコキシ、-(CH2)n-CO2C1-3アルキル、-(CH2)n-NRcRd、R3-S(O)m(CH2)0-1-、R3-S(O)2-NRe-、R3-NRe-S(O)2(CH2)0-1-、-NRf-C(O)-Re、-(CH2)y-C(O)-NRcRd、又はモルフォリニルであり;
各Rc、Rdが、独立に水素、C1-3アルキル、C1-3アシル、シアノ-C1-3アルキル、C1-3アルコキシカルボニルC0-3アルキル、C1-3アルコキシカルボニルC3-6シクロアルキル、又は-(CH2)n-C(O)-NReRfであり;
各Re、Rfが、独立に水素又はC1-3アルキルであり;
R3が、水素又はそれぞれ任意に1〜2個のC1-6アルコキシ若しくはオキソで置換されていてもよいC1-6アルキルである、
請求項6に記載の化合物又はその医薬的に許容できる塩。
【請求項8】
式中、
環式Gがシクロプロピルであり;
Raが、-F又は-Cl、メチル、メチルスルホニル又はシアノであり;
Rbが、-CH3、カルボキシル、-F、-Cl、-Br、-I、-CF3、シクロプロピル、-OCH3、-CO2Me、-NRcRd、-(CH2)-NRcRd、R3-S(O)m-、R3-S(O)2-NRe-、R3-NRe-S(O)2-、-NRf-C(O)-Re、-C(O)NRcRd又はモルフォリニルであり;
各Rc、Rdが、独立に水素、-CH3、-C(O)CH3、-CH2CN、C1-4アルコキシカルボニル、メトキシカルボニル-C1-2アルキル-、メトキシカルボニル-C3シクロアルキル-又は-(CH2)-C(O)-NReRfであり;
各Re、Rfが、独立に水素又は-CH3であり;
R3が水素又はそれぞれ任意に1〜2個の-OCH3若しくはオキソで置換されていてもよいC1-4アルキルである、
請求項7に記載の化合物又はその医薬的に許容できる塩。
【請求項9】
式中、
環式Gが、シクロプロピル又はシクロブチルである、
請求項8に記載の化合物又はその医薬的に許容できる塩。
【請求項10】
式中、
環式Gがシクロプロピルである、
請求項9に記載の化合物又はその医薬的に許容できる塩。
【請求項11】
式中、
Rcが水素又はC1-6アルキルであり、かつRdがC1-6アシル、シアノ-C1-6アルキル-、C1-6アルコキシカルボニル-C0-3アルキル-、C1-6アルコキシカルボニルC3-10シクロアルキル、又は-(CH2)n-C(O)-NReRfであり;
各Re、Rfが、独立に水素、C1-6アルキルである、
請求項10に記載の化合物又はその医薬的に許容できる塩。
【請求項12】
式中、
Ar2が、それぞれ任意に1又は2個のRbで置換されていてもよいフェニル、ピリミジニル、フラニル、チアゾリル又はピリジルであり;
Rbが、-SO2Me、-I、-Br、-Cl、-CF3、-OMe、-NMe2、-CONHMe、-SO2NH2である、
請求項11に記載の化合物又はその医薬的に許容できる塩。
【請求項13】
式中、Ar2が下記
【化2】

である、
請求項12に記載の化合物又はその医薬的に許容できる塩。
【請求項14】
式中、
Rgが、
i)C1-2アルキル、-CF3、C2アルケニル、フェニル、C1-4アルコキシ、カルボシクリルCH2O-、カルボシクリルCH2- -CH2OH、ヒドロキシル、-CO2C1-4アルキル又はオキソ;
又は
ii)メチル、ビニル、-CF3、フェニル、-CH2OH、又はヒドロキシルである、
請求項13に記載の化合物又はその医薬的に許容できる塩。
【請求項15】
下記
【化3】







から選択される化合物又はその医薬的に許容できる塩。
【請求項16】
医薬的に有効な量の請求項1に記載の化合物と、1種以上の医薬担体及び/又はアジュバントとを含む医薬組成物。
【請求項17】
慢性炎症、アレルギー、接触皮膚炎、乾癬、関節リウマチ、多発性硬化症、1型糖尿病、炎症性腸疾患、ギラン・バレー症候群、クローン病、潰瘍性大腸炎、移植片対宿主病、アルツハイマー病、喘息、慢性腎臓病、敗血症、自己免疫性心筋炎及び全身性エリテマトーデスの治療方法であって、医薬的に有効な量の請求項1に記載の化合物を患者に投与する工程を含む方法。
【請求項18】
前記治療が関節リウマチ及び多発性硬化症のためである、請求項17に記載の方法。
【請求項19】
前記治療が関節リウマチのためである、請求項17に記載の方法。
【請求項20】
前記治療が多発性硬化症のためである、請求項17に記載の方法。
【公表番号】特表2013−508376(P2013−508376A)
【公表日】平成25年3月7日(2013.3.7)
【国際特許分類】
【出願番号】特願2012−535292(P2012−535292)
【出願日】平成22年10月19日(2010.10.19)
【国際出願番号】PCT/US2010/053142
【国際公開番号】WO2011/049917
【国際公開日】平成23年4月28日(2011.4.28)
【出願人】(503385923)ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング (976)
【Fターム(参考)】
【公表日】平成25年3月7日(2013.3.7)
【国際特許分類】
【出願日】平成22年10月19日(2010.10.19)
【国際出願番号】PCT/US2010/053142
【国際公開番号】WO2011/049917
【国際公開日】平成23年4月28日(2011.4.28)
【出願人】(503385923)ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング (976)
【Fターム(参考)】
[ Back to top ]

