CNNについての亜鉛フィンガー結合ドメイン
【課題】式CNNを示すヌクレオチド配列に結合する亜鉛フィンガーヌクレオチド結合領域を含むポリペプチドの提供。
【解決手段】式5’−(CNN)−3’で示される標的ヌクレオチドに特異的に結合する亜鉛フィンガーのα−ヘリックスドメイン内のアミノ酸残基配列に特異的に結合する、亜鉛フィンガーのα−ヘリックスドメイン内のアミノ酸残基配列を有する複数のポリペプチド、そのようなポリペプチドをコードするポリヌクレオチド、およびそのようなポリペプチド、組成物およびポリヌクレオチドを用いて遺伝子発現を調節する方法。
【解決手段】式5’−(CNN)−3’で示される標的ヌクレオチドに特異的に結合する亜鉛フィンガーのα−ヘリックスドメイン内のアミノ酸残基配列に特異的に結合する、亜鉛フィンガーのα−ヘリックスドメイン内のアミノ酸残基配列を有する複数のポリペプチド、そのようなポリペプチドをコードするポリヌクレオチド、およびそのようなポリペプチド、組成物およびポリヌクレオチドを用いて遺伝子発現を調節する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本明細書に報告されるいくつかの研究を支援するために使用された資金は、国立衛生研究所によって提供された(NIH GM53910号)。したがって、米国政府は、本発明に一定の権利を有しうる。
【0002】
関連出願に対する関連資料
本出願は、2001年8月20日に出願された米国仮特許出願番号第60/313,864号および第60/313,693号の一部継続出願であり、それらの開示を、参照により本明細書の一部とする。
【0003】
発明の分野
本発明の分野は、標的ヌクレオチドに結合する亜鉛フィンガータンパク質である。さらに詳細には、本発明は、式5’−(CNN)−3’で示される標的ヌクレオチドに特異的に結合する亜鉛フィンガーのα−ヘリックスドメイン内のアミノ酸残基配列に関する。
【背景技術】
【0004】
人工的な転写因子の構築は、過去数年、おおいに興味があるものであった。遺伝子発現を、制御ドメインに融合したポリダクチル亜鉛フィンガータンパク質によって特異的に調節することができる。Cys2−His2ファミリーの亜鉛フィンガードメインは、それらのモジュラー構造により、人工的な転写因子の構築にとって最も将来有望であった。各ドメインは、およそ30個のアミノ酸から構成され、そして保存的Cys2−His2残基による疎水性相互作用および亜鉛イオンのキレート化により安定化されたα−構造に折り畳まれる。現在までに、亜鉛フィンガータンパク質のこのファミリーの最も特徴付けられているタンパク質は、マウス転写因子Zif268である[Pavletichら、(1991年)Science252巻(5007)、809−817頁;Elrod−Ericksonら、(1996年)Structure 4巻(10)、1171−1180頁]。Zif268/DNA複合体の解析は、DNA結合が、それぞれ、1、3および6位にあるα−ヘリックスのアミノ酸残基と、3bpDNAサブサイトの3’、中間、および5’ヌクレオチドとの相互作用により大体は達成されることを示唆した。1、2および5位は、DNAのリン酸骨格と直接または水により媒介されて接触することが示されている。ロイシンは、通常は、4位に見られ、そしてドメインの疎水性コアにパッケージされる。α−ヘリックスの2位は、他のヘリックス残基と相互作用し、そしてさらに、3bpサブサイトの外側のヌクレオチドと接触することができることが示されている[Pavletichら、(1991年)Science 252巻(5007)、809−817頁;Elrod−Ericksonら、(1996年)Structure 4巻(10)、1171−1180頁;Isalan,M.ら、(1997年)Proc Natl Acad Sci USA 94巻(11)、5617−5621頁]。
【0005】
各々の5’−GNN−3’DNAサブサイトを高い特異性および親和性で認識するモジュールである亜鉛フィンガードメインの選択、および部位特異的突然変異誘発によるそれらの精製が示された(米国特許番号第6,140,081号、その開示を、参照により本明細書の一部とする。)。これらのモジュールドメインは、ヒトまたは他のあらゆるゲノム中に固有に存在する18bpにわたるDNA配列を認識する亜鉛フィンガータンパク質に構築され得る。さらに、これらのタンパク質は、転写因子として機能し、そして制御ドメインに融合されるときに遺伝子発現を変更させる能力があり、そしてさらには核ホルモン受容体のリガンド結合ドメインに対する融合により、ホルモン依存性となることもできる。任意のDNA配列に結合する亜鉛フィンガー基本の転写因子を迅速に構築させるために、64個の可能性のあるDNAトリプレットの各々を認識する現存の組のモジュール亜鉛フィンガードメインを伸長させることが重要である。この目的は、ファージディスプレイ選択および/または合理的設計により達成することができる。亜鉛フィンガー/DNA相互作用についての構造データが限られているため、亜鉛タンパク質の合理的設計は、非常に時間を消耗し、そして不可能であることも多くある。さらに、ほとんどの自然界に存在する亜鉛フィンガータンパク質は、5’−(GNN)−3’型のDNA配列を認識するドメインから構成される。5’−NNN−3’型のDNA標的配列に結合する新規の亜鉛フィンガードメインを同定するための最も見込みのあるアプローチは、ファージディスプレイによる選択である。このアプローチにとっての制限段階は、5’アデニン、シトシンまたはチミンの特異化を可能にするライブラリーの構築である。ファージディスプレイ選択は、このタンパク質の様々のフィンガーをランダム化したZif268に基づいた[Chooら、(1994年)Proc. Natl. Acad. Sci. U.S.A. 91巻(23)、11168−72頁;Rebarら、(1994年)、Science(ワシントン,ディーシー、1883−)263巻(5147)、671−3頁;Jamiesonら、(1994年)Biochemistry 33巻、5689−5695頁;Wuら、(1995年)PNAS 92巻、344−348頁;Jamiesonら、(1996年)Proc Natl Acad Sci USA 93巻、12834−12839頁;Greismanら、(1997年)Science 275(5300)、657−661頁]。5’−GNN−3’型のDNA配列を認識する1組の16個のドメインは、Zif268の誘導体であるC7のフィンガー2[Wuら、(1995年)PNAS 92巻、344−348頁;Wu、1995]がランダム化されたライブラリーから先に報告された[Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁]。このような攻略法では、選択は、フィンガー2サブサイトにおける5’グアニンまたはチミンの相補的塩基と接触を作るフィンガー3のAsp2により5’−GNN−3’または5’−TNN−3’を認識するドメインに限定される[Pavletichら、(1991年)Science 252巻(5007)、809−817頁;Elrod−Ericksonら、(1996年)Structure 4巻(10)、1171−1180頁]。
【発明の概要】
【発明が解決しようとする課題】
【0006】
本アプローチは、科学的共有物により亜鉛フィンガータンパク質の迅速な構築を可能にする亜鉛フィンガードメインのモジュール方式に基づいており、そして交差サブサイト相互作用により課される制限に関する懸念が、限定された数の事例にのみ起こることを示す。本開示は、5’−CNN−3’型のDNA配列を特異的に認識する亜鉛フィンガードメインを選択する新たな攻略法を導入する。これらのドメインの特異的DNA結合特性は、16個の5’−CNN−3’トリプレット全てに対する多標的ELISAにより評価された。これらのドメインは、種々の数の5’−CNN−3’ドメインを含み、各々18bpにわたる配列を特異的に認識するポリダクチルタンパク質に容易に組み込むことができる。さらに、これらのドメインは、制御ドメインに融合された場合には、遺伝子発現を特異的に変更することができる。これらの結果は、予め定義された構築ブロックからポリダクチルタンパク質を構築する可能性の基礎となる。さらに、ここに特徴付けられたドメインは、人工的な転写因子で標的にされうるDNA配列の数を大いに増大させる。
【課題を解決するための手段】
【0007】
発明の簡潔な要約
1つの態様では、本発明は、その領域が、式CNN(式中、Nは、A、C、GまたはTである)で示される標的ヌクレオチドに優先的に結合する5から10個までのアミノ酸残基のヌクレオチド結合領域を含む、単離および精製された亜鉛フィンガーヌクレオチド結合ポリペプチドを提供する。好ましくは、標的ヌクレオチドは、式CAA、CAC、CAG、CAT、CCA、CCC、CCG、CCT、CGA、CGC、CGG、CGT、CTA、CTC、CTGまたはCTTを含む。1つの実施態様では、本発明のポリペプチドは、配列番号1〜25のいずれかと同じヌクレオチド結合特性を有しているアミノ酸残基配列を有する結合領域を含む。このようなポリペプチドは、配列番号1〜25のいずれかと、ヌクレオチド標的に対する結合について競合する。好ましくは、結合領域は、配列番号1〜25のいずれかを示すアミノ酸残基配列を有する。1つの実施態様では、本発明は、配列番号1〜25のいずれかのアミノ酸残基配列から構成される、単離および精製された亜鉛フィンガーヌクレオチド結合ポリペプチドを提供する。
【0008】
別の態様では、本発明は、本明細書中に開示されるように、複数の、そして好ましくは約2から約12個までの亜鉛フィンガーヌクレオチド結合ポリペプチドを含むペプチド組成物を提供する。ポリペプチドは、5から15個までのアミノ酸残基の可撓性のペプチドリンカーを介して連結されるように、作動可能であるように連結される。作動可能であるように連結されるのは、好ましくは、配列番号30に示されるもののように、可撓性のペプチドリンカーを介して起こる。このような組成物は、式5’−(CNN)n−3’(式中、Nは、A、C、GまたはTであり、そしてnは、2から12までである)の配列を含むヌクレオチド配列に結合する。好ましくは、組成物は、約2から約6個までの亜鉛フィンガーヌクレオチド結合ポリペプチドを含み、そして式5’−(CNN)n−3’(式中、nは、2から6までである)の配列を含むヌクレオチド配列に結合する。結合は、1fMから10μMまでのKDで起こる。好ましくは、結合は、10fMから1μMまで、10pMから100nMまで、100pMから10nMまでのKDで、そしてさらに好ましくは1nMから10nMまでのKDで起こる。好ましい実施態様では、本発明のポリペプチドと組成物の両方は、転写のリプレッサーまたは転写の活性化因子のような1つまたはそれ以上の転写制御因子に作動可能であるように連結される。
【0009】
本発明は、さらに、本発明のポリペプチドまたは組成物をコードするポリヌクレオチド、このようなポリヌクレオチドを含む発現ベクター、およびポリヌクレオチドまたは発現ベクターで形質転換された宿主細胞を提供する。
【0010】
本発明は、さらに、標的ヌクレオチド配列5’−(CNN)−3’を含むヌクレオチド配列の発現を制御する方法を提供する。標的ヌクレオチド配列を、長い5’−(NNN)−3’配列内のいずれかの場所に配置することができる。この方法は、本明細書中に規定するような有効量の亜鉛フィンガーヌクレオチド結合ポリペプチドまたは組成物に、ヌクレオチド配列をさらす段階を含む。1つの実施態様では、方法は、配列5’−(CNN)n−3’(式中、nは、2から12までである)を含むヌクレオチド配列の発現を制御する。その方法は、本発明の有効量の組成物に、ヌクレオチド配列をさらす段階を含む。配列5’−(CNN)n−3’を、ヌクレオチド配列の転写領域に、ヌクレオチド配列のプロモーター領域に、または発現配列タグ内に配置することができる。組成物は、好ましくは、転写のリプレッサーまたは転写の活性化因子のような1つまたはそれ以上の転写制御因子に作動可能であるように連結される。1つの実施態様では、ヌクレオチド配列は、真核生物の遺伝子、原核生物の遺伝子またはウイルス遺伝子のような遺伝子である。真核生物の遺伝子は、ヒト遺伝子のような哺乳類遺伝子または植物遺伝子でありうる。原核生物の遺伝子は、細菌遺伝子でありうる。
【図面の簡単な説明】
【0011】
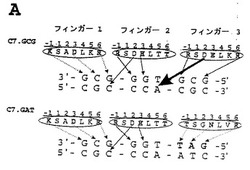
【図1】本明細書の一部を形成する図面において、図1は、1Aおよび1Bと示された2つのパネルにおいて、概略的に、亜鉛フィンガーファージディスプレイライブラリー(A)の構築およびC7タンパク質(B)についての多標的特異性ELISAを示す。
【0012】
定義
特に定義されない限り、本明細書中で使用される全ての技術的および科学的用語は、本発明が属する業界の当業者に一般に理解されるのと同じ意味を示す。
【0013】
本明細書中で使用される場合、転写制御ドメインまたは因子は、遺伝子転写を制御するように機能する本明細書中で提供される融合ポリペプチドの一部をいう。例示の、そして好ましい転写リプレッサードメインは、ERD、KRAB、SID、デアセチラーゼ、ならびにそれらの誘導体、多量体、およびKRAB−ERD、SID−ERD、(KRAB)2、(KRAB)3、KRAB−A、(KRAB−A)2、(SID)2、(KRAB−A)−SIDおよびSID−(KRAB−A)のようなそれの組合わせである。本明細書中で使用される場合、ヌクレオチド結合ドメインまたは領域は、特異的核酸結合能力を与える、本明細書中に提供されるポリペプチドまたは組成物の一部をいう。ヌクレオチド結合領域は、特異的遺伝子に対して対象のポリペプチドを標的化するように作用する。本明細書中で使用される場合、作動可能であるように連結されるとは、例えば、ポリペプチドの構成要素が、各々が意図されるとおりに作用するか、または機能するように連結されることを意味する。例えば、リプレッサーは、リプレッサーがその結合ドメインを介して標的ヌクレオチドに結合されると、転写を阻害または妨げるように作用するような様式で、結合ドメインに連結される。構成要素の間またはその中の連結は、直接的、またはリンカーを介してのように間接的でありうる。その構成要素は、必ずしも隣接してはいない。したがって、リプレッサードメインは、当該分野で十分に知られるあらゆる連結手順を使用してヌクレオチド結合ドメインに連結することができる。2つのドメインの間にリンカー部分を含むことが、必要がある可能性がある。このようなリンカー部分は、概して、ドメインの間に間隔を生じるための短いアミノ酸残基の配列である。リンカーは、結合またはリプレッサードメインの機能のいずれかを妨害しない限り、あらゆる配列を使用することができる。
【0014】
本明細書中で使用される場合、「調節する」は、過剰活性化されるときには、亜鉛フィンガーヌクレオチド結合モチーフを含むプロモーターからの発現の阻害または抑制を、そして過少活性化されるときには、このようなプロモーターからの発現の増大または増強を想定する。
【0015】
本明細書中で使用される場合、本明細書中に示す種々のアミノ酸配列で生じるアミノ酸は、それらのよく知られた三文字または一文字の略号によって識別される。種々のDNAフラグメントで生じるヌクレオチドは、当該分野で日常的に使用される標準の一文字表記で示される。
【0016】
ペプチドまたはタンパク質では、アミノ酸の適切な保存的置換は、当業者に知られており、そして、一般に、生じる分子の生物学的活性を改変することなく行われうる。当業者らは、一般に、ポリペプチドの非必須領域における単一アミノ酸の置換が、実質的に生物学的活性を改変しないことを認識している(例えば、Watsonら、「遺伝子の分子生物学」第4版、1987年、ザ・ベンジャミン/クーニングズ・パブ.シーオー.、224頁を参照)。
【0017】
本明細書中で使用される場合、「発現ベクター」は、本明細書中で融合タンパク質をコードする核酸、または本明細書中で提供される発現カセットのような、異種DNAの挿入または組込みにより操作された、当該分野で知られるプラスミド、ウイルスまたは他のビヒクルをいう。このような発現ベクターは、細胞に挿入された核酸の効率的な転写のためのプロモーター配列を含む。発現ベクターは、概して、複製起点、プロモーター、ならびに形質転換細胞の表現型選択を可能にする特異的遺伝子を含む。
【0018】
本明細書中で使用される場合、「宿主細胞」は、その中でベクターが増殖でき、そしてそのDNAが発現される細胞である。その用語は、対象の宿主細胞のあらゆる子孫をも含む。複製の間に起こる突然変異が生じる可能性があるので、全ての子孫が、親細胞と同一ではない場合があることが理解される。このような子孫は、用語「宿主細胞」が使用されるときに含まれる。外来DNAが、宿主で継続して維持される安定な導入方法は、当該分野で知られている。
【0019】
本明細書中で使用される場合、遺伝子治療は、このような治療が想定される障害または症状を示す、哺乳動物、特にヒトの特定の細胞である標的細胞に異種DNAを導入することを含む。異種DNAが発現され、そしてそれによりコードされる治療用産物が生産されるような様式で、DNAを、選択した標的細胞に導入する。別の方法として、異種DNAは、ある種の様式では、治療用産物をコードするDNAの発現を仲介する場合があり、または、ある種の様式においては、直接的または間接的に治療用産物の発現を仲介するペプチドまたはRNAのような産物をコードする場合もある。遺伝子治療は、欠陥遺伝子を置換するか、または哺乳類またはそれが導入される細胞によって産生される遺伝子産物を補足する、遺伝子産物をコードする核酸を送達するためにも使用されうる。導入された核酸は、哺乳類宿主で正常には産生されないか、または治療的に有効な量で、または治療に有用な時間では産生されない、それの成長因子阻害剤、または腫瘍壊死因子もしくはその受容体のようなそれの阻害剤のような治療用化合物をコードする場合もある。治療用産物をコードする異種DNAは、産物またはそれの発現を増強するか、または別の方法では改変するために、罹患した宿主の細胞に導入する前に、修飾することもできる。遺伝子治療は、遺伝子発現の阻害剤またはリプレッサーまたは他のモジュレーターの送達を含むこともある。
【0020】
本明細書中で使用される場合、異種DNAは、それを発現する細胞によりインビボでは通常は産生されないRNAおよびタンパク質をコードするか、または転写、翻訳または他の制御可能な生化学的過程に影響を与えることによって、内因性DNAの発現を改変するメディエーターを仲介するかまたはコードするDNAである。異種DNAは、外来DNAとも呼ばれる場合がある。当業者が、それらが発現される細胞に対して異種または外来として認識するまたは考えるあらゆるDNAが、異種DNAによって本明細書中に含まれる。異種DNAの例としては、それに限定されないが、薬剤耐性を付与するタンパク質のような追跡可能なマーカータンパク質をコードするDNA、抗癌剤、酵素およびホルモンのような治療上有効な物質をコードするDNA、ならびに抗体のような他の型のタンパク質をコードするDNAが挙げられる。異種DNAによってコードされる抗体は、異種DNAが導入された細胞の表面で分泌または発現される場合がある。
【0021】
以後、本明細書中で、異種DNAまたは外来DNAは、ゲノム中で見られる対の片方のDNA分子として正確な配向および位置には存在しないDNA分子が挙げられる。これは、別の生物または種(すなわち、外因性)に由来するDNA分子をもまた意味する。
【0022】
本明細書中で使用される場合、治療上有効な産物は、宿主への核酸の導入により、症状、遺伝性または後天性疾患の発現を緩和または排除するか、または疾患を治癒させる産物が発現される異種核酸、典型的にはDNAによりコードされる産物である。概して、所望の遺伝子産物をコードするDNAを、プラスミドベクターにクローニングさせ、そしてパッケージング細胞のような産生細胞へのリン酸カルシウム仲介DNA取込(Somat、Cell.Mol.Genet.7巻:603−616頁(1981年)を参照)またはマイクロインジェクションのような日常的方法によって導入する。産生細胞中での増幅の後、異種DNAを含むベクターを、選択された標的細胞に導入する。
【0023】
本明細書中で使用される場合、発現または送達ベクターは、外来または異種DNAが、適切な宿主細胞での発現のために挿入されうる、すなわち、DNAによってコードされるタンパク質またはポリペプチドが、宿主細胞の系で合成される、任意のプラスミドまたはウイルスをいう。1つまたはそれ以上のタンパク質をコードするDNAセグメント(遺伝子)の発現を指示する能力のあるベクターは、「発現ベクター」として本明細書中で呼ばれる。さらに、逆転写酵素を使用して産生されるmRNAからcDNA(相補的DNA)をクローニングすることができるベクターもまた含まれる。本明細書中で使用される場合、遺伝子は、そのヌクレオチド配列がRNAまたはポリペプチドをコードする核酸分子をいう。遺伝子は、RNAまたはDNAのいずれかでありうる。遺伝子は、コード領域の前後の領域(リーダーおよびトレーラー)、ならびに個々のコードセグメント(エクソン)の間の介在配列(イントロン)を含みうる。
【0024】
本明細書中で使用される場合、核酸分子またはポリペプチドまたは他の生物分子に関して単離されたとは、核酸またはポリペプチドが、ポリペプチドまたは核酸が得られた遺伝的環境から分離されたことを意味する。そして、それは、天然の状態から改変されていることも意味しうる。例えば、生きている動物中に自然界において存在するポリヌクレオチドまたはポリペプチドは、「単離」されていないが、しかしこの天然状態で同時に存在する物質から分離された同じポリヌクレオチドまたはポリペプチドは、その用語が本明細書中で使用される場合には、「単離」されている。したがって、組換え宿主細胞内で産生されたおよび/またはその中に含まれるポリペプチドまたはポリヌクレオチドは、単離されていると考えられる。さらに、組換え宿主細胞から、または生来の源から部分的に、または実質的に精製されているポリペプチドまたはポリヌクレオチドもまた、「単離ポリペプチド」または「単離ポリヌクレオチド」として意図される。例えば、組換えで産生されたバージョンの化合物は、Smithら(1988年)Gene 67巻:31−40頁に記述される1段階法によって実質的に精製されうる。用語の単離されたと精製されたは、しばしば、互換的に使用される。
【0025】
したがって、「単離された」によって、核酸は、自然界に存在するゲノム中で、目的の核酸をコードする遺伝子にすぐ隣接しているような遺伝子のコード配列を含まない。単離されたDNAは、一本鎖または二本鎖であり得て、そしてゲノムDNA、cDNA、組換えハイブリッドDNA、または合成DNAでありうる。これは、生来のDNA配列と一致しうるか、または1つまたはそれ以上のヌクレオチドの欠失、付加、または置換によりこのような配列と異なる場合もある。
【0026】
単離または精製は、それが生物学的細胞または宿主から作られる調製物についていう場合には、目的のDNAまたはタンパク質の粗抽出物を含む特定のDNAまたはタンパク質を含むあらゆる細胞抽出物を意味する。例えば、タンパク質の場合に、精製された調製物は、個々の技術または一連の調製または生化学的技術に従って得ることができ、そして目的のDNAまたはタンパク質は、これらの調製物中で種々の純度で存在しうる。手段として、例えば、それに限定されないが、硫酸アンモニウム分画、ゲル濾過、イオン交換クロマトグラフィー、アフィニティークロマトグラフィー、密度勾配遠心分離および電気泳動を挙げることができる。
【0027】
「実質的に純粋な」または「単離された」DNAまたはタンパク質の調製物は、そのようなDNAまたはタンパク質が、通常の天然の状態でそれが結合する、自然界に存在する物質を含まない調製物を意味すると見なされるべきである。「本質的に純粋な」は、目的のDNAまたはタンパク質を少なくとも95%含む「高度に」精製された調製物を意味すると見なされるべきである。
【0028】
目的のDNAまたはタンパク質を含む細胞抽出物は、タンパク質を発現するか、または目的のDNAを含む細胞から得られた均質な調製物または細胞を含まない調製物を意味すると見なされるべきである。用語「細胞抽出物」は、培地、特に細胞が除去されている使用済み培養培地を含むことが意図される。
【0029】
本明細書中で使用される場合、「調節」は、機能の抑制、増強または誘導をいう。例えば、亜鉛フィンガー核酸結合ドメインおよびその変異体は、プロモーター内のモチーフに結合し、それによりプロモーター細胞ヌクレオチド配列に作動可能であるように連結される遺伝子の転写を増強または抑制することによって、プロモーター配列を調節することができる。別の方法として、調節は、亜鉛フィンガー−ヌクレオチド結合ポリペプチド変異体が、構造遺伝子に結合し、そしてDNA依存性RNAポリメラーゼを遺伝子の読み取りからブロックし、したがって該遺伝子の転写を阻害することを特徴とする遺伝子の転写の阻害を含みうる。構造遺伝子は、例えば、正常な細胞遺伝子または癌遺伝子でありうる。別の方法として、調節は、転写産物の翻訳の阻害を含む場合もある。
【0030】
本明細書中で使用される場合、「阻害」は、プロモーターに作動可能であるように連結される構造遺伝子の転写の活性化のレベルの抑制をいう。例えば、本発明の方法に関しては、遺伝子は、亜鉛フィンガー−ヌクレオチド結合モチーフを包含する。
【0031】
本明細書中で使用される場合、転写制御領域は、標的細胞中での遺伝子発現を駆動する領域をいう。本明細書での使用に適切な転写の調節領域は、それに限定されないが、ヒトサイトメガロウイルス(CMV)即時−初期エンハンサー/プロモーター、SV40初期エンハンサー/プロモーター、JCポリオマウイルスプロモーター、アルブミンプロモーター、PGK、およびCMVエンハンサーに結合させたα−アクチンプロモーターが挙げられる。
【0032】
本明細書中で使用される場合、遺伝子のプロモーター領域としては、構造遺伝子に対して、典型的には5’に位置する制御構成要素が挙げられる。遺伝子が活性化される場合、転写因子として知られるタンパク質は、遺伝子のプロモーター領域に結合させられる。この構築物は、酵素が、DNAからRNAに第二遺伝子セグメントを転写することを可能にすることによって、「スイッチを付ける」に類似する。ほとんどの場合に、生じるRNA分子は、特異的タンパク質の合成のためのテンプレートとして役割を果たす。ときどき、RNA自体が最終産物である。プロモーター領域は、正常な細胞プロモーターまたは例えば、腫瘍−プロモーターでありうる。腫瘍−プロモーターは、一般にウイルス由来のプロモーターである。亜鉛フィンガー結合ポリペプチドがそれに対して標的化されうるウイルスプロモーターとしては、それに限定されないが、レトロウイルスの長い末端反復配列(LTR)、およびヒトT細胞向性ウイルス(HTLV)1および2、ならびにヒト免疫不全ウイルス(HIV)1または2のようなレンチウイルスプロモーターが挙げられる。
【0033】
本明細書中で使用される場合、「有効量」は、予め活性化されたプロモーターの不活性化を生じる量、または亜鉛フィンガーヌクレオチド結合モチーフを含むプロモーターの不活性化を生じる量、または構造遺伝子の転写またはRNAの翻訳をブロックする量を包含する。必要とされる亜鉛フィンガー由来のヌクレオチド結合ポリペプチドの量は、現存するタンパク質/プロモーター複合体中の生来の亜鉛フィンガ−ーヌクレオチド結合タンパク質を置換するのに必要な量であるか、またはプロモーター自体との複合体の形成について生来の亜鉛フィンガー−ヌクレオチド結合タンパク質と競合するために必要な量のいずれかである。同様に、構造遺伝子またはRNAをブロックするために必要な量は、それぞれ、RNAポリメラーゼに結合し、そしてそれが遺伝子上で読み取るのをブロックする量であるか、または翻訳を阻害する量である。好ましくは、この方法は、細胞内で行われる。プロモーターまたは構造遺伝子を機能的に不活性化することにより、転写または翻訳を抑制する。亜鉛フィンガー−ヌクレオチド結合タンパク質モチーフを含む細胞ヌクレオチド配列に結合するか、またはそれと「接触する」ための阻害タンパク質の有効量の送達は、レトロウイルスベクターまたはリポゾームによるような本明細書中に記載されている機構のうちの1つ、または当該分野でよく知られる他の方法によって達成されうる。
【0034】
本明細書中で使用される場合、「短縮された」は、生来の亜鉛フィンガー結合タンパク質に見られる全数未満の亜鉛フィンガーを含むか、望まれない配列が欠失している亜鉛フィンガー−ヌクレオチド結合ポリペプチド誘導体をいう。例えば、9個の亜鉛フィンガーを天然の状態で含む亜鉛フィンガー−ヌクレオチド結合タンパク質TFIIIAの短縮は、わずか1個から3個の亜鉛フィンガーを有するポリペプチドでありうる。伸長は、別の亜鉛フィンガーモジュールが加えられた亜鉛フィンガーポリペプチドをいう。例えば、TFIIIAは、3個の亜鉛フィンガードメインを加えることにより12個のフィンガーにまで伸長させることができる。さらに、短縮型の亜鉛フィンガー−ヌクレオチド結合ポリペプチドは、1つ以上の野生型ポリペプチドに由来する亜鉛フィンガーモジュールを包含し、したがって、「ハイブリッド」亜鉛フィンガー−ヌクレオチド結合ポリペプチドを生じうる。
【0035】
本明細書中で使用される場合、「突然変異誘発された」は、タンパク質をコードするDNAのランダムまたは部位特異的突然変異誘発を達成するための公知方法のいずれかを行うことにより得られた亜鉛フィンガー由来のヌクレオチド結合ポリペプチドをいう。例えば、TFIIIAでは、突然変異誘発は、コンセンサス配列の1つまたはそれ以上の反復中の非保存残基を置換するために行われうる。短縮型の亜鉛フィンガー−ヌクレオチド結合タンパク質も、突然変異誘発されうる。
【0036】
本明細書中で使用される場合、ポリペプチド「変異体」または「誘導体」は、突然変異誘発形態のポリペプチド、または組換えにより産生されているが、リガンドまたは核酸分子に結合するか、転写を調節する能力のような、所望の活性をなお保有しているポリペプチドをいう。
【0037】
本明細書中で使用される場合、亜鉛フィンガー−ヌクレオチド結合ポリペプチド「変異体」または「誘導体」は、突然変異形態の亜鉛フィンガータンパク質または組換えにより産生されたものであるポリペプチドをいう。変異体は、例えば、第二のタンパク質の亜鉛フィンガードメインに連結された1つのタンパク質に由来する亜鉛フィンガードメインを含むハイブリッドでありうる。ドメインは、野生型であるか、または突然変異を誘発しうる。「変異体」または「誘導体」としては、野生型タンパク質中の元来の数未満のフィンガーを含む短縮形態の野生型亜鉛フィンガータンパク質が挙げられる。それから誘導体または変異体が産生されうる亜鉛フィンガー−ヌクレオチド結合ポリペプチドの例としては、TFIIIAおよびzif268が挙げられる。類似の用語は、「変異体」または「誘導体」核ホルモン受容体および「変異体」または「誘導体」転写エフェクタードメインをいうために使用される。
【0038】
本明細書中で使用される場合、「亜鉛フィンガー−ヌクレオチド結合標的またはモチーフ」は、亜鉛フィンガー−ヌクレオチド結合誘導体ポリペプチドが、それに特異的に結合するヌクレオチドセグメントの二次元または三次元特性をいう。一般に5個のヌクレオチドまたはそれ未満のヌクレオチド配列、それに加えて、これらに限定されないが主溝および副溝ならびにヘリックスの表面のようなDNA二重ヘリックスの三次元構造がこの定義に含まれる。モチーフは、概して、亜鉛フィンガーポリペプチドが結合できる適切な長さの任意の配列である。例えば、3フィンガーポリペプチドは、典型的には、約9から約14個までの塩基対を有するモチーフに結合する。好ましくは、認識配列は、ゲノム内の特異性を確実にするためには、少なくとも約16個の塩基対である。したがって、あらゆる特異性の亜鉛フィンガー−ヌクレオチド結合ポリペプチドが提供される。亜鉛フィンガー結合モチーフは、経験的に設計されるか、それに対して亜鉛フィンガータンパク質が結合するように設計される、任意の配列でありうる。モチーフは、制御配列、エキソン、イントロン、またはあらゆる非コード配列を含めた任意のDNAまたはRNA配列中に見ることができる。
【0039】
本明細書中で使用される場合、それらが、組成物、担体、希釈剤および試薬に引用される場合、用語「医薬上許容される」、「生理学的に寛容な」、およびそれらの文法的語尾変化は、互換的に使用され、そしてそれらの物質を、組成物の投与を禁じる程度までである悪心、眩暈感、胃の不調等の望ましくない生理学的副作用を生じることなくヒトに投与できることを表す。
【0040】
本明細書中で使用される場合、用語「ベクター」は、様々の遺伝的環境の間で、それが作動可能であるように連結されている別の核酸を輸送することができる核酸分子をいう。好ましいベクターは、それらが作動可能であるように連結されるDNAセグメント中に存在する構造遺伝子産物を自律複製および発現することができるものである。したがって、ベクターは、好ましくは、レプリコンおよび先に記述したような選択マーカーを含む。
【0041】
DNAフラグメントを含む核酸分子に関して本明細書中で使用される場合、語句「作動可能であるように連結される」は、作動可能であるように連結された部分が意図されるとおり機能するように、一本鎖または二本鎖形態にかかわらず、好ましくは従来のホスホジエステル結合により、DNAの1つの鎖中に、配列またはセグメントが、共有結合により結合されることを意味する。本明細書中で提供される転写ユニットまたはカセットが、それに対して作動可能であるように連結されるベクターの選択は、当該分野でよく知られているように、直接的に、望まれる機能特性、例えば、ベクター複製およびタンパク質発現、そして形質転換される宿主細胞に依存し、そしてこれらは、組換えDNA分子構築の分野において生来存在している限定である。
【0042】
本明細書中で使用される場合、治療用組成物の投与は、あらゆる手順により行うことができ、そして例として、それに限定されないが、皮下、静脈内、筋肉内、胸骨内、輸液技術、腹腔内での投与および非経腸投与が挙げられる。
【0043】
I.本発明
本発明は、亜鉛フィンガー−ヌクレオチド結合ポリペプチド、1つまたはそれ以上のこのようなポリペプチドを含む組成物、このようなポリペプチドおよび組成物をコードするポリヌクレオチド、このようなポリヌクレオチドを含む発現ベクター、このようなポリヌクレオチドまたは発現ベクターで形質転換された細胞、およびヌクレオチド構造および/または機能を調節するためのポリペプチド、組成物、ポリヌクレオチドおよび発現ベクターの使用法を提供する。
【0044】
II.ポリペプチド
本発明は、単離および精製された亜鉛フィンガーヌクレオチド結合ポリペプチドを提供する。ポリペプチドは、5から10個までのアミノ酸残基、好ましくは約7個のアミノ酸残基のヌクレオチド結合領域を含む。ヌクレオチド結合領域は、式CNN(式中、Nは、A、C、GまたはTである)の標的ヌクレオチドに優先的に結合する。好ましくは、標的ヌクレオチドは、式CAA、CAC、CAG、CAT、CCA、CCC、CCG、CCT、CGA、CGC、CGG、CGT、CTA、CTC、CTGまたはCTTを有する。
【0045】
本発明のポリペプチドは、自然界には存在しない変異体である。本明細書中で使用される場合、用語「自然界には存在しない」は、例えば、以下の(a)自然界には存在しないアミノ酸配列から構成されるペプチド;(b)それが自然界に存在する場合にはペプチドと関係していない、自然界には存在しない二次構造を有するペプチド;(c)そのペプチドが自然界に存在する生物の種とは通常は結合していない1つまたはそれ以上のアミノ酸を包含するペプチド;(d)ペプチドを構成する1つまたはそれ以上のアミノ酸の立体異性体を含み、その立体異性体が自然界に存在する場合には該ペプチドに関係していない、ペプチド;(e)天然のアミノ酸のもの以外の1つまたはそれ以上の化合物部分を含むペプチド;または(f)自然界に存在するアミノ酸配列の単離された部分(例えば、短縮配列)の1つまたはそれ以上を意味する。本発明のポリペプチドは、単離形態で存在し、そして混入物質を実質的に含まないように精製される。ポリペプチドは、合成の性質のものである。すなわち、ポリペプチドは、天然の源から単離および精製されるか、または当該分野でよく知られる技術を用いて新たに作成される。亜鉛フィンガー−ヌクレオチド結合ポリペプチドは、好ましくは、突然変異誘発形態の亜鉛フィンガータンパク質、または組換えにより作成されたポリペプチドをいう。ポリペプチドは、例えば、第二タンパク質の亜鉛フィンガードメインに連結された1つのタンパク質由来の亜鉛フィンガードメインを含むハイブリッドである場合もある。ドメインは、野生型であるか、または突然変異誘発される場合もある。ポリペプチドとしては、短縮形態の野生型亜鉛フィンガータンパク質が挙げられる。それからポリペプチドが産生されうる亜鉛フィンガータンパク質の例としては、TFIIIAおよびzif268が挙げられる。
【0046】
本発明の亜鉛フィンガー−ヌクレオチド結合ポリペプチドは、そのヘプタマー配列が、標的ヌクレオチドに対する結合特異性を決定する、ポリペプチドのα−ヘリックスドメイン内に特有のヘプタマー(7個のアミノ酸残基の連続配列)を含む。そのヘプタマー配列は、α−ヘリックスドメイン内のあらゆる場所に配置されうるが、しかし、当該分野での慣習に従って残基番号付けした場合には、そのような残基として−1位から6位まで伸長したヘプタマーが好ましい。本発明のポリペプチドは、亜鉛フィンガータンパク質の一部として機能するように、当該分野で知られるあらゆるβ−シートおよびフレームワーク配列を含むことができる。多数の亜鉛フィンガー−ヌクレオチド結合ポリペプチドを作成し、そしてCNNトリプレットを含む標的ヌクレオチドに対する結合特異性について試験した。
【0047】
亜鉛フィンガー−ヌクレオチド結合ポリペプチド誘導体は、短縮または伸長により、野生型亜鉛フィンガータンパク質から、または部位特異的突然変異誘発法により、もしくはそのような手順の組み合わせにより、野生型から誘導されたポリペプチドの変異体として、誘導または生成されうる。用語「短縮された」は、生来の亜鉛フィンガー結合タンパク質に見られる全数より少ない亜鉛フィンガーを含むか、または望ましくない配列が欠失している亜鉛フィンガー−ヌクレオチド結合ポリペプチドをいう。例えば、自然界においては9個の亜鉛フィンガーを含む亜鉛フィンガー−ヌクレオチド結合タンパク質TFIIIAの短縮は、わずか1個から3個の亜鉛フィンガーを有するポリペプチドでありうる。伸長は、さらに亜鉛フィンガーモジュールが付加されている亜鉛フィンガーポリペプチドをいう。例えば、TFIIIAは、3個の亜鉛フィンガードメインを付加することによって、12個のフィンガーまで伸長することができる。さらに、短縮型の亜鉛フィンガー−ヌクレオチド結合ポリペプチドは、1個以上の野生型ポリペプチドに由来する亜鉛フィンガーモジュールを含む場合があり、これにより「ハイブリッド」亜鉛フィンガー−ヌクレオチド結合ポリペプチドを生じる。
【0048】
用語「突然変異誘発された」は、タンパク質をコードするDNAのランダムまたは部位特異的突然変異誘発を達成するために公知方法のいずれかを行うことによって得られた亜鉛フィンガー由来のヌクレオチド結合ポリペプチドをいう。例えば、TFIIIAでは、突然変異誘発は、コンセンサス配列の1つまたはそれ以上の反復中の非保存残基を置換するように行うことができる。短縮型の亜鉛フィンガー−ヌクレオチド結合タンパク質も、突然変異誘発させることができる。亜鉛フィンガー−ヌクレオチド結合モチーフを含むヌクレオチド配列の機能を阻害するために、本発明によって短縮、伸長および/または突然変異誘発されうる既知の亜鉛フィンガー−ヌクレオチド結合ポリペプチドの例としては、TFIIIAおよびzif268が挙げられる。当業者らは、他の亜鉛フィンガー−ヌクレオチド結合タンパク質を知っている。
【0049】
1つの実施態様では、本発明のポリペプチドは、配列番号1〜25のいずれかと同じヌクレオチド結合特性を有しているアミノ酸残基配列を有している結合領域を含む。どのようにそれらの結合特性が決定されるかについての詳細な説明は、本明細書中の以下の実施例に見ることができる。このようなポリペプチドは、配列番号1〜25のいずれかと、ヌクレオチド標的への結合について競合する。すなわち、好ましいポリペプチドは、競合様式で、配列番号1〜25のいずれかの結合を置き換える結合領域を含む。競合結合を決定する手順は、当該分野でよく知られている。好ましくは、結合領域は、配列番号1〜25のいずれかのアミノ酸残基配列を有する。
【0050】
本発明のポリペプチドは、当該分野でよく知られる多様な標準的技術を使用して作成することができる。実施例において以後に詳細に開示するように、亜鉛フィンガータンパク質のファージディスプレイライブラリーを作成し、そして配列特異的タンパク質の濃縮に有利である条件で選択した。多数の配列を認識する亜鉛フィンガードメインには、ファージ選択データおよび構造情報の両方によって導かれる部位特異的突然変異誘発による精製が必要であった。
【0051】
先に、本発明者らは、マウス転写因子Zif268の変異体であるC7に基づいたファージディスプレイ選択によって単離し、そして部位特異的突然変異誘発によって精製した5’−GNN−3’型のDNA配列の各々を特異的に認識する16個の亜鉛フィンガードメインの特徴付けを報告した[Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁;Dreierら、(2000年)J. Mol. Biol. 303巻、489−502頁;および米国特許番号第6,140,081号、その開示を、参照により本明細書の一部とする。]。全ての場合に3つの残基の全てがDNA塩基と接触するというわけではないが、一般に、Cys2−His2型の亜鉛フィンガードメインの特異的DNA認識は、各α−ヘリックスのアミノ酸残基1、3および6により仲介される。1つの優勢な交差サブサイト相互作用は、認識ヘリックスの2位より観察された。Asp2は、以下の3bpサブサイトのそれぞれ、5’チミンまたはグアニンの相補的アデニンまたはシトシンと直接接触させることによって、亜鉛フィンガードメインの結合を安定化することが示されている。これらのモジュール以外での相互作用は、標的部位重複と見なされている。さらに、伸長された結合部位を作成する3bpサブサイトの外側でヌクレオチドとのアミノ酸の他の相互作用が報告されている[Pavletichら、(1991年)Science 252巻(5007)、809−817頁;Elrod−Ericksonら、(1996年)Structure 4巻(10)、1171−1180頁;Isalanら、(1997年)Proc Natl Acad Sci USA 94巻(11)、5617−5621頁]。
【0052】
グアニンまたはチミン以外の5’ヌクレオチドに結合する亜鉛フィンガードメインについての以前に報告されたファージディスプレイライブラリー選択は、フィンガー−3認識ヘリックスRSD−E−LKR(配列番号26)(図1)の2位でのアスパラギン酸による交差サブサイト相互作用により、不成功に終わった。人工的な転写因子の構築のための亜鉛フィンガードメインの利用可能性を拡大するために、5’−ANN−3’型のDNA配列を特異的に認識するドメインが選択された(2001年2月21日に出願された米国特許出願番号第09/791,106号、その開示を、参照により本明細書の一部とする。)。他のグループは、4個の5’−ANN−3’サブサイト、5’−AAA−3’、5’−AAG−3’、5’−ACA−3’、および5’−ATA−3’を認識するドメインの特徴付けに至った連続的な選択法を記述した[Greismanら、(1997年)Science 275巻(5300)、657−661頁;Wolfeら、(1999年)J Mol Biol 285巻(5)、1917−1934頁]。本開示は、標的部位重複を排除することによって、CNN部位を認識する亜鉛フィンガードメインを選択するアプローチを使用する。最初に、サブサイト5’−GCG−3’に結合するC7のフィンガー3(RSD−E−RKR)(配列番号27)を、2位にアスパラギン酸を含まないドメインと交換した(図1)。フィンガーの2位でトリプレット5’−GAT−3’に高い特異性で結合することが以前に特徴付けられているヘリックスTSG−N−LVR(配列番号28)を、優れた候補と考えた。フィンガーの3位に、C7のフィンガー1および2、ならびに5’−GAT−3’−認識ヘリックスを含むこの3−フィンガータンパク質(C7.GAT;図1A、下部パネル)を、元のC7タンパク質(C7.GCG;図1B)との比較において、多標的ELISAによって、様々のフィンガー−2サブサイトを有する標的に対するDNA結合特異性について分析した。両方のタンパク質は、5’−TGG−3’サブサイトに結合した(C7.GCGは、以前に報告されているフィンガー3のAsp2によるチミンまたはグアニンの5’特異化により、5’−GGG−3’にも結合することに留意のこと)。フィンガー−2サブサイトの5’ヌクレオチドの認識を、16個全ての5’−XNN−3’標的部位(X=アデニン、グアニン、シトシンまたはチミン)の混合物を使用して評価した。実際に、元来のC7.GCGタンパク質が、フィンガー2の5’位置でグアニンまたはチミンを指定する一方で、C7.GATは、塩基を指定せず、それにより5’チミンに相補的なアデニンに対する交差サブサイト相互作用を破壊することが示される。部位特異的突然変異誘発により、Asp2が、Ala2に置換されているZif268の変異体について同様の効果が以前に報告されている[Isalanら、(1997年)Proc Natl Acad Sci USA 94巻(11)、5617−5621頁;Dreierら、(2000年)J. Mol. Biol. 303巻、489−502頁]。ゲル移動性のシフトの分析によって測定されたC7.GATの親和性が、C7.GCGについての0.5nMと比較して約400nMと比較的低いことが分かっており[Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁]、そしてこれは、フィンガー3におけるAsp2の欠如に一部起因する可能性がある。
【0053】
3−フィンガータンパク質C7.GATに基づいて、ファージディスプレイベクターpComb3H中に、ライブラリーが構築された[Barbasら、(1991年)Proc. Natl. Acad. Sci. USA 88巻、7978−7982頁;Raderら、(1997年)Curr. Opin. Biotechnol. 8巻(4)、503−508頁]。ランダム化は、VNSコドンドーピング攻略法(V=アデニン、シトシンまたはグアニン、N=アデニン、シトシン、グアニンまたはチミン、S=シトシンまたはグアニン)を使用して、フィンガー2のα−ヘリックスの-1、1、2、3、5および6位に関して行われた。これは、それぞれのランダム化されたアミノ酸位置について24の可能性を与えたのに対して、芳香族アミノ酸Trp、Phe、およびTyrならびに停止コドンを、この攻略法においては排除した。Leuは、Cys2−His2型の亜鉛フィンガードメインの認識ヘリックスの4位に優先的に見られるので、この位置はランダム化されなかった。ER2537細胞(New England Biolabs)へのこのライブラリーの形質転換の後、ライブラリーは、1.5×109個の構成要素を含んだ。これは、必要なライブラリーの大きさの60倍であり、そして全てのアミノ酸組合わせを含むのに十分であった。
【0054】
ビオチニル化されていないコンペティターDNAの存在下で、16個の5’−GAT−CNN−GCG−3’(配列番号29)のそれぞれに対してビオチニル化したヘアピン標的オリゴヌクレオチドの各々に結合させて、亜鉛フィンガー−ディスプレイイングファージの6回の選択を行った。ビオチニル化された標的オリゴヌクレオチドの量を減少させ、そしてコンペティターオリゴヌクレオチド混合物の量を増加させることによって、選択のストリンジェンシーをそれぞれの回において増大させた。6回目の段階で、標的濃度は、通常18nMであり、5’−ANN−3’、5’−GNN−3’、および5’−TNN−3’コンペティター混合物は、それぞれ、各オリゴヌクレオチドプールについて5倍過剰であり、そして特異的5’−CNN−3’混合物(標的配列を排除する)は、10倍過剰であった。ビオチニル化した標的オリゴヌクレオチドに結合するファージを、ストレプトアビシンでコーティングした磁性ビーズに捕捉させることにより回収した。クローンは、通常、6回目の選択の後に分析した。
【0055】
III.組成物
別の態様においては、本発明は、5’−(CNN)n−3’(式中、nは、1より大きな整数である)として定義されるヌクレオチド標的モチーフに特異的に結合するような様式で作動可能であるように連結された複数の亜鉛フィンガー−ヌクレオチド結合ポリペプチドを提供する。標的モチーフは、任意の長いヌクレオチド配列(例えば、3から13個まで、またはそれ以上のTNN、GNN、ANNまたはNNNの配列)内に配置されうる。好ましくは、nは、2から約12までの整数であり、そしてさらに好ましくは2から6までである。好ましくは、個々のポリペプチドを、オリゴペプチドリンカーと連結させる。このようなリンカーは、自然界に存在する亜鉛フィンガータンパク質中に見られるリンカーに似ているのが好ましい。本発明に使用するための好ましいリンガーは、アミノ酸残基配列TGEKP(配列番号30)である。グリシンまたはセリン反復のような他のリンカーは、ペプチド(例えば、一本鎖抗体ドメイン)を連結させるためのものであることが当該分野でよく知られており、そして本発明の組成物中で使用することができる。
【0056】
本発明のポリペプチドまたは組成物は、1つまたはそれ以上の官能性ペプチドに作動可能であるように連結することができる。このような官能性ペプチドは、当該分野でよく知られており、そしてリプレッサーもしくは活性化ドメインのような転写制御因子、または他の機能を有しているペプチドであることもできる。例でありそして好ましいこのような官能性ペプチドは、ヌクレアーゼ、メチラーゼ、核局在化ドメイン、およびエンドヌクレアーゼまたはエクトヌクレアーゼのような制限酵素である(例えば、ChandrasegaranおよびSmith、Biol. Chem.、380巻:841−848頁、1999年を参照)。
【0057】
例示的な抑制ドメインペプチドは、ets2リプレッサー因子(ERF)のアミノ酸473から530までによって定義されるERFリプレッサードメイン(ERD)である(Sgouras, D. N.、Athanasiou, M. A.、Beal, G. J., Jr.、Fisher, R. J.、Blair, D. G.およびMavrothalassitis, G. J.、(1995年)EMBO J. 14巻、4781−4793頁)。このドメインは、etsファミリーの転写因子の活性に対するERFの拮抗効果を仲介する。合成リプレッサーは、亜鉛フィンガータンパク質のN−またはC−末端へのこのドメインの融合によって構築される。第二のリプレッサータンパク質は、Krueppel−結合ボックス(KRAB)ドメインを使用して作成される(Margolin, J. F.、Friedman, J. R.、Meyer, W.、K.−H.、Vissing, H.、Thiesen, H.−J.およびRauscher III, F. J.、(1994年)Proc. Natl. Acad. Sci. USA 91巻、4509−4513頁)。このリプレッサードメインは、亜鉛フィンガータンパク質のN末端に共通して見られ、そしておそらく、RINGフィンガータンパク質KAP−1(Friedman, J. R.、Fredericks, W. J.、Jensen, D. E.、Speicher, D. W.、Huang, X.−P.、Neilson, E. G.およびRauscher III,F. J.(1996年)Genes & Dev. 10巻、2067−2078頁)と相互作用させることにより、距離および配向には依存しない様式(Pengue, G.およびLania, L.、(1996年)Proc. Natl. Acad. Sci. USA 93巻、1015−1020頁)でのTATA依存性転写に対するその抑制活性を発揮する。本発明者らは、亜鉛フィンガータンパク質KOX1のアミノ酸1から97の間に見られるKRABドメインを利用した(Margolin, J. F.、Friedman, J. R.、Meyer, W., K.−H.、Vissing, H.、Thiesen, H.−J.およびRauscher III, F. J.(1994年)Proc. Natl. Acad. Sci. USA 91巻、4509−4513頁)。この場合には、亜鉛フィンガーポリペプチドとのN末端融合が構築される。最終的に、抑制のためのヒストン脱アセチル化の有用性を調べるために、Mad mSIN3相互作用ドメイン(SID)のアミノ酸1から36までを、亜鉛フィンガータンパク質のN末端に融合させる(Ayer, D. E.、Laherty, C. D.、Lawrence, Q. A.、Armstrong, A. P.およびEisenman, R. N.、(1996年)、Mol. Cell. Biol. 16巻、5772−5781頁)。この小さいドメインは、転写因子MadのN末端に見られ、そしてmSIN3と相互作用することによるその転写抑制を仲介する原因であり、そしてそれは、順に、コリプレッサーN−CoRと、そしてヒストンデアセチラーゼmRPD1と相互作用する(Heinzel, T.、Lavinsky, R. M.、Mullen, T.−M.、Ssderstrsm, M.、Laherty, C. D.、Torchia, J.、Yang, W.−M.、Brard, G.、Ngo, S. D.ら(1997年)Nature 387巻、43−46頁)。遺伝子特異的活性化を試験するために、亜鉛フィンガーポリペプチドを、単純ヘルペスウイルスVP16タンパク質のアミノ酸413から489までに(Sadowski, I.、Ma, J.、Triezenberg, S.およびPtashne, M.、(1988年)Nature 335巻、563−564頁)、またはVP64と呼ばれるVP16の最小活性化ドメインの人工的な四量体反復(Seipel, K.、Georgiev, O.およびSchaffner, W.(1992年)EMBO J. 11巻、4961−4968頁)に融合させることによって、転写活性化因子が作成される。
【0058】
上記に示すような本発明のポリヌクレオチドは、1つまたはそれ以上の転写調節または制御因子に作動可能であるように連結させることができる。転写活性化因子または転写サプレッサーまたはリプレッサーのような調節因子は、当該分野でよく知られている。このような因子にポリペプチドを作動可能であるように連結させるための手順もまた、当該分野でよく知られている。例でありそして好ましいこのような因子、および遺伝子発現を調節するためのそれらの使用法を、以下に詳細に検討する。
【0059】
遺伝子特異的転写制御因子として亜鉛フィンガータンパク質を使用する案を試験するために、6−フィンガータンパク質を、多数のエフェクタードメインに融合させる。3つのヒト由来のリプレッサードメインのいずれかを、亜鉛フィンガータンパク質に取り付けることにより、転写リプレッサーを生じさせる。第一のリプレッサータンパク質は、ets2リプレッサー因子(ERF)のアミノ酸473から530までにより定義されるERFリプレッサードメイン(ERD)(Sgouras, D. N.、Athanasiou, M. A.、Beal, G. J., Jr.、Fisher, R. J.、Blair, D. G.およびMavrothalassitis, G. J.、(1995年)EMBO J. 14巻、4781−4793頁)を使用して作成される。このドメインは、etsファミリーの転写因子の活性に対するERFの拮抗効果を仲介する。亜鉛フィンガータンパク質のC末端へのこのドメインの融合により、合成リプレッサーを構築する。Kruepple結合ボックス(KRAB)ドメイン(Margolin, J. F.、Friedman, J. R.、Meyer, W., K.−H.、Vissing, H.、Thiesen, H.−J.およびRauscher III, F. J.、(1994年)Proc. Natl. Acad. Sci. USA 91巻、4509−4513頁)を使用して、第二のリプレッサータンパク質を作成する。このリプレッサードメインは、亜鉛フィンガータンパク質のN末端で共通して見られ、そしておそらく、RINGフィンガータンパク質KAP−1(Friedman, J. R.、Fredericks, W. J.、Jensen, D. E.、Speicher, D. W.、Huang, X.−P.、Neilson, E. G.およびRauscher III, F. J.(1996年)Genes & Dev. 10巻、2067−2078頁)と相互作用することにより、距離および配向には依存しない様式で(Pengue, G.およびLania, L.、(1996年)Proc. Natl. Acad. Sci. USA 93巻、1015−1020頁)TATA依存性転写に対するその抑制活性を発揮する。本発明者らは、亜鉛フィンガータンパク質KOX1のアミノ酸1から97の間に見られるKRABドメインを利用する(Margolin, J. F.、Friedman, J. R.、Meyer, W., K.−H.、Vissing, H.、Thiesen, H.−J.およびRauscher III, F. J.(1994年)Proc. Natl. Acad. Sci. USA 91巻、4509−4513頁)。この場合には、6−フィンガータンパク質とのN末端融合体を構築する。最終的に、抑制のためのヒストン脱アセチル化の有用性を調べるために、Mad mSIN3相互作用ドメイン(SID)のアミノ酸1から36までが、亜鉛フィンガータンパク質のN末端に融合させられる(Ayer, D. E.、Laherty, C. D.、Lawrence, Q. A.、Armstrong, A. P.およびEisenman, R. N.、(1996年)、Mol. Cell. Biol. 16巻、5772−5781頁)。この小さいドメインは、転写因子MadのN末端で見られ、そしてmSIN3との相互作用によるその転写抑制を仲介する原因であり、そしてそれは、順に、コリプレッサーN−CoRと、そしてヒストンデアセチラーゼmRPD1と相互作用する(Heinzel, T.、Lavinsky, R. M.、Mullen, T.−M.、Ssderstrsm, M.、Laherty, C. D.、Torchia, J.、Yang, W.−M.、Brard, G.、Ngo, S. D.および等(1997年)Nature 387巻、43−46頁)。
【0060】
遺伝子特異的活性化を試験するために、亜鉛フィンガータンパク質を、単純ヘルペスウイルスVP16タンパク質のアミノ酸413から489までに(Sadowski, I.、Ma, J.、Triezenberg, S.およびPtashne, M.、(1988年)Nature 335巻、563−564頁)、またはVP64と呼ばれるVP16の最小活性化ドメインDALDDFDLDML(配列番号36)の人工的な四量体反復(Seipel, K.、Georgiev, O.およびSchaffner, W.(1992年)EMBO J. 11巻、4961−4968頁)に融合させることによって、転写活性化因子を生じさせる。
【0061】
ルシフェラーゼレポーター遺伝子に結合したerbB−2プロモーターのフラグメントを含むレポーター構築物を生じさせて、本発明者らが設計した転写制御因子の特異的活性を試験する。標的レポータープラスミドは、ATG開始コドンに関してヌクレオチド−758から−1を含む。プロモーターフラグメントは、以前の観察(Hudson, L. G.、Ertl, A. P.およびGill, G. N.、(1990年)J. Biol. Chem. 265巻、4389−4393頁)と一致して、HeLa細胞に一時的にトランスフェクトされた場合に、同様の活性を示す。erbB−2プロモーター活性に対する亜鉛フィンガーリプレッサードメイン融合構築物の作用を試験するために、HeLa細胞を、亜鉛フィンガー発現ベクターおよびルシフェラーゼレポーター構築物で、一次的に同時トランスフェクトさせる。明らかな抑制が、それぞれの構築物について観察される。転写の活性化を仲介する遺伝子特異的ポリダクチルタンパク質の有用性を、同じ2つのレポーター構築物を使用して調べる。
【0062】
本明細書中のデータは、新規の9bpおよび18bpのDNA標的部位に結合することができる亜鉛フィンガータンパク質を、5’−CNN−3’部位を認識する予め定義されたドメインを使用して迅速に作成することができることを示す。この情報は、それぞれが18bpのDNA配列と結合することができる166あるいは1700万個の新規の6−フィンガータンパク質の作成に十分である。新規の亜鉛フィンガータンパク質の構築のためのこの迅速な方法論は、他の研究者によって提案された亜鉛フィンガードメインの連続的な作成および選択(Greisman, H. A.およびPabo, C. O.(1997年)Science 275巻、657−661頁)よりも多くの利点を有し、そして上に定義するような標的重複の問題の可能性が、5’−CNN−3’部位を標的にするタンパク質において回避することができることを示唆する構造の情報を利用する。複雑でありそして十分に研究されたerbB−2プロモーターおよび生存しているヒト細胞を使用して、データは、適切なエフェクタードメインとともに与えられた場合には、これらのタンパク質は、発現を刺激または活性化し、そしてこれらの実験のバックグランドのレベル以下までの段階的なレベルの減少を生じるために使用することができることを示す。
【0063】
IV.ポリヌクレオチド、発現ベクターおよび形質転換細胞
本発明は、亜鉛フィンガー−ヌクレオチド結合ポリペプチドをコードするヌクレオチド配列を含む。生来の、短縮型、および伸長型のポリペプチドを含む本発明の亜鉛フィンガー−ヌクレオチド結合ポリペプチドをコードするDNA配列は、いくつかの方法によって得ることができる。例えば、当該分野で十分に知られているハイブリダイゼーション手順を使用して、DNAを単離することができる。これらとしては、それに限定されないが、(1)共通のヌクレオチド配列を検出するための、ゲノムまたはcDNAライブラリーへのプローブのハイブリダイゼーション;(2)共通の構造上の特徴を検出するための発現ライブラリーの抗体スクリーニング;および(3)ポリメラーゼ連鎖反応(PCR)による合成が挙げられる。本発明のRNA配列は、当該分野で知られる方法により得ることができる(例えば、Current Protocols in Molecular Biology、Ausubelら編、1989年を参照)。
【0064】
本発明の亜鉛フィンガー−ヌクレオチド結合ポリペプチドをコードする特異的DNA配列の作成は、(1)ゲノムDNAからの二本鎖DNA配列の単離;(2)目的のポリペプチドについての必要なコドンを提供するDNA配列の化学的製造;および(3)真核生物の供与体細胞から単離されたmRNAの逆転写による二本鎖DNA配列のインビトロ合成によって得ることができる。後者の場合には、一般にcDNAと呼ばれるmRNAの二本鎖DNA相補鎖が、最終的に形成される。組換え手順での使用のための特異的DNA配列を生じさせるこれら3つの方法のうち、ゲノムDNAの単離は最も一般的でない。これは、イントロンの存在により、哺乳類ペプチドの微生物での発現を得ることが望ましい場合に、特に一般的ではない。亜鉛フィンガー由来のDNA結合ポリペプチドを得るためには、DNA配列の合成が、所望のポリペプチド産物のアミノ酸残基の全配列が知られている場合に、最も頻繁に選択される方法である。所望のポリペプチドのアミノ酸残基の全配列が知られていない場合、DNA配列の直接合成は不可能であり、そして選択される方法はcDNA配列の形成である。そのうち、目的のcDNA配列を単離するための標準的な手順は、高レベルの遺伝子発現を示す供与体細胞中に豊富に存在するmRNAの逆転写に由来するプラスミド担持cDNAライブラリーの形成である。ポリメラーゼ連鎖反応技術と組合わせて使用される場合には、極めて少量の発現産物をクローン化することができる。ポリペプチドのアミノ酸配列の重要な部分が既知である場合には、標的cDNAに存在すると推定される配列を複製する標識された一本または二本鎖DNAまたはRNAプローブ配列の産生が、一本鎖形態に変性させられたクローン化されたcDNAのコピーに対して行われるDNA/DNAハイブリダイゼーション手順において使用される場合がある(Jayら、Nucleic Acid Research 11巻:2325頁、1983年)。
【0065】
V.医薬組成物
別の態様においては、本発明は、医薬上許容される担体と組合わせて、治療上有効な量の亜鉛フィンガー−ヌクレオチド結合ポリペプチドまたは組成物、または亜鉛フィンガー−ヌクレオチド結合ポリペプチドをコードする治療上有効な量のヌクレオチド配列を包含する医薬組成物を提供する。
【0066】
本明細書中で使用される場合、それらが、組成物、担体、希釈剤および試薬について言及する場合には、用語「医薬上許容される」、「生理学的に寛容な」およびそれらの文法的語尾変化は、互換的に使用され、そしてこれらの物質を、組成物の投与を禁じる程度までである悪心、眩暈感、胃の不調などのような望ましくない生理学的な副作用を生じることなく、ヒトに投与することができることを表す。
【0067】
本明細書中の溶解または分散される有効成分を含む薬理学的組成物の製造は、当該分野で十分に知られている。典型的には、このような組成物は、液体溶液または懸濁液、水性または非水性であるかのいずれかとして、滅菌の注射可能なものとして製造される。しかし使用の前に液体とする、溶液または懸濁用の固体の形態を製造することもできる。製造物は、乳化させることもできる。有効成分は、医薬上許容される、そして有効成分と適合性であり、そして本明細書中に記載されている治療方法での使用に適切な量の賦形剤と混合することもできる。例えば、適切な賦形剤は、水、生理食塩水、デキストロース、グリセロール、エタノールなど、およびそれの組み合わせである。さらに、望ましい場合には、組成物は、湿潤剤または乳化剤、ならびにpH緩衝剤および有効成分の効力を増強するもののような補助的物質を少量含むことができる。
【0068】
本発明の治療用医薬組成物は、本明細書に記載の成分の医薬上許容される塩を含むことができる。医薬上許容される塩は、例えば、塩酸またはリン酸のような無機酸、または酢酸、酒石酸、マンデル酸などの有機酸で形成される酸付加塩(ポリペプチドの遊離のアミノ基で形成される)を含む。遊離のカルボキシル基で形成される塩は、例えば、ナトリウム、カリウム、アンモニウム、カルシウムまたは水酸化第二鉄のような無機塩基、およびイソプロピルアミン、トリメチルアミン、2−エチルアミノエタノール、ヒスチジン、プロカインなどの有機塩基から誘導することもできる。生理学的に寛容な担体は、当該分野でよく知られている。液体の担体の例は、有効成分および水に加えてなにも材料を含まないか、または生理学的pH値のリン酸ナトリウム、生理食塩水、または両方、例えばリン酸緩衝生理食塩水のような緩衝剤を含む滅菌の水溶液である。なお、さらに、水性担体は、1つ以上の緩衝塩、ならびに塩化ナトリウムおよび塩化カリウムのような塩、デキストロース、プロピレングリコール、ポリエチレングリコールおよび他の溶質を含むこともできる。液体組成物は、水に加えて、そして水以外の液相を含むこともできる。このようなさらなる液相の例は、グリセリン、綿実油のような植物油、オレイン酸エチルのような有機エステル、および水−油エマルションである。
【0069】
VI.使用法
1つの実施態様においては、本発明の方法は、CNN標的配列を含むヌクレオチド配列の発現を調節(阻害または抑制)するプロセスを含む。この方法は、モチーフに結合する本発明の亜鉛フィンガー−ヌクレオチド結合ポリペプチドの有効量とヌクレオチドを接触させる段階を包含する。ヌクレオチド配列がプロモーターである場合には、この方法は、亜鉛フィンガー−DNA結合モチーフを含むプロモーターの転写のトランス活性化を阻害することを包含する。用語「阻害する」は、例えば、亜鉛フィンガー−ヌクレオチド結合モチーフを含む、プロモーターに作動可能であるように連結される構造遺伝子の転写活性化のレベルの抑制をいう。さらに、亜鉛フィンガー−ヌクレオチド結合ポリペプチドは、構造遺伝子内またはRNA配列中の標的に結合することができる。
【0070】
用語「有効量」は、予め活性化されたプロモーターの不活性化を生じる量、または標的ヌクレオチドを含むプロモーターの不活性化を生じる量、または構造遺伝子の転写またはRNAの翻訳をブロックする量を包含する。必要な亜鉛フィンガー由来のヌクレオチド結合ポリペプチドの量は、既存のタンパク質/プロモーター複合体中の生来の亜鉛フィンガー−ヌクレオチド結合タンパク質を置換するのに必要な量、または生来の亜鉛フィンガー−ヌクレオチド結合タンパク質と競合して、プロモーター自体と複合体を形成するのに必要な量のいずれかである。同様に、構造遺伝子またはRNAをブロックするために必要な量は、それぞれ、RNAポリメラーゼに結合し、そしてRNAポリメラーゼが遺伝子上で読み取るのをブロックする量、または翻訳を阻害する量である。好ましくは、この方法は、細胞内で行われる。プロモーターまたは構造遺伝子を機能的に不活性化することにより、転写または翻訳は抑制される。標的配列を含む細胞ヌクレオチド配列に結合またはそれと「接触する」ための有効量の阻害タンパク質の送達は、レトロウイルスベクターまたはリポソームによるような本明細書中に記載されている機構の1つ、あるいは当該分野でよく知られている他の方法によって行うことができる。用語「調節する」は、機能の抑制、増強または誘発をいう。例えば、本発明の亜鉛フィンガー−ヌクレオチド結合ポリペプチドは、プロモーター内の標的配列に結合し、それによりプロモーターヌクレオチド配列に作動可能であるように連結された遺伝子の転写を増強または抑制することによって、プロモーター配列を調節することができる。別の方法として、調節は、亜鉛フィンガー−ヌクレオチド結合ポリペプチドが、構造遺伝子に結合し、そしてDNA依存性RNAポリメラーゼが遺伝子を読み取ることをブロックし、したがって遺伝子の転写を阻害することを特徴とする、遺伝子の転写の阻害を含みうる。構造遺伝子は、例えば、正常な細胞性遺伝子または癌遺伝子であることもできる。別の方法として、調節は、転写産物の翻訳の阻害を含みうる。
【0071】
遺伝子のプロモーター領域は、構造遺伝子に対して一般的には5’にある調節要素を含む。遺伝子が活性化されるべきである場合、転写因子として知られるタンパク質は、遺伝子のプロモーター領域に結合させられる。この構築物は、酵素がDNAからRNAへの二次遺伝子セグメントを転写することを可能にすることによって、「スイッチを入れる」ことを真似る。ほとんどの場合に、生じるRNA分子は、特異的タンパク質の合成のためのテンプレートとして役割を果たす;ときどき、RNA自体が最終産物である。
【0072】
プロモーター領域は、正常な細胞プロモーターまたは、例えば、腫瘍プロモーターである場合がある。腫瘍プロモーターは、一般に、ウイルス由来のプロモーターである。例えば、レトロウイルスの長い末端反復配列(LTR)は、本発明の亜鉛フィンガー結合ポリペプチド変異体についての標的でありうるプロモーター領域である。ヒトT細胞向性ウイルス(HTLV)1および2、またはヒト免疫不全ウイルス(HIV)1または2のような病原体を含むレンチウイルスの群のメンバーに由来するプロモーターは、本発明の亜鉛フィンガー結合ポリペプチドによる転写調節のために標的化される可能性があるウイルス性プロモーター領域の例である。
【0073】
標的CNNヌクレオチド配列を、遺伝子の転写領域に、または発現配列タグ中に配置することができる。標的配列を含む遺伝子は、植物遺伝子、動物遺伝子またはウイルス遺伝子であることができる。遺伝子は、真核生物の遺伝子、または細菌遺伝子のような原核生物の遺伝子でありうる。動物の遺伝子は、ヒト遺伝子を含めた哺乳類遺伝子でありうる。好ましい実施態様では、ヌクレオチドの発現を調節する方法は、ポリペプチドをコードするポリヌクレオチドを有する標的ヌクレオチド配列または本発明の組成物を含む細胞を形質転換させることによって行われる。好ましくは、コードポリヌクレオチドは、標的細胞中での使用に適切な発現ベクターに含まれる。適切な発現ベクターは、当該分野でよく知られている。
【0074】
CNN標的は、他の標的トリプレット配列とのあらゆる組合わせで存在する。すなわち、特定のCNN標的は、伸長されたCNN配列(例えば、[CNN]2−12)の一部として、または(GNN)1−12、(ANN)1−12、(TNN)1−12、または(NNN)1−12のような他のあらゆる伸長された配列の一部として存在することができる。以下の実施例は、本発明の好ましい実施態様を示し、決して明細書および特許請求の範囲を限定しない。
【実施例1】
【0075】
亜鉛フィンガーライブラリーの構築およびファージディスプレイによる選択
亜鉛フィンガーライブラリーの構築を、以前に記述されたC7タンパク質を基礎とした([Wuら、(1995年)PNAS 92巻、344−348頁];図1A、上部パネル)。5’−GCG−3’サブサイトを認識するフィンガー3を、フィンガー3をコードするプライマー(5’−GAGGAAGTTTGCCACCAGTGGCAACCTGGTGAGGCATACCAAAATC−3’)(配列番号31)およびpMal特異的プライマー(5’−GTAAAACGACGGCCAGTGCCAAGC−3’)(配列番号32)を使用する重複PCR法により、5’−GAT−3’サブサイト[Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁]に結合するドメインで置換した。PCR重複伸長による亜鉛フィンガーライブラリーのランダム化は、基本的には記載されているとおりに行った[Wuら、(1995年)PNAS 92巻、344−348頁;Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁]。ライブラリーを、ファージミドベクターpComb3H[Raderら、(1997年)Curr. Opin. Biotechnol. 8巻(4)、503−508頁]に連結した。ファージの成長および沈殿を、以前に記載されているように行った[Barbasら、(1991年)Methods:Companion Methods Enzymol. 2巻(2)、119−124頁;Barbasら、(1991年)Proc. Natl. Acad. Sci. USA 88巻、7978−7982頁;Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁]。結合反応を、500mlの容量の亜鉛緩衝液A(ZBA:10mM Tris、pH7.5/90mM KCl/1mM MgCl2/90mM ZnCl2)/0.2%BSA/5mM DDT/1% Blotto(Biorad)/100mlの沈殿させたファージ(1013コロニー形成単位)を含む20mg二本鎖の剪断したニシンの精子DNA中で行った。1時間、4℃で、ファージを、ビオチニル化されていないコンペティターオリゴヌクレオチドに結合させ、その後、ビオチニル化した標的オリゴヌクレオチドを添加した。結合を4℃で、一晩継続して行った。1時間、50mlストレプトアビジンでコーティングした磁性ビーズ(Dynal;ZBA中の5% Blottoでブロックした)とともにインキュベーションした後、ビーズを、500ml ZBA/2% Tween 20/5mM DTTで10回洗浄し、そしてTweenを含まない緩衝液で1回洗浄した。30分間、室温で、TBS(Tris緩衝生理食塩水)中の25mlトリプシン(10mg/ml)中でのインキュベーションにより、結合ファージの溶出を行った。ヘアピンコンペティターオリゴヌクレオチドは、配列5’−GGCCGCN’N’N’ATCGAGTTTTCTCGATNN NGCGGCC−3’(配列番号33)(標的オリゴヌクレオチドをビオチニル化した)(ここで、NNNは、フィンガー−2サブサイトオリゴヌクレオチドを表し、N’N’N’は、それの相補的塩基である)を有した。標的オリゴヌクレオチドは、通常、最初の3回の選択では、72nMで添加され、その後、6回目および最後の回においては36nMおよび18nMに減少させた。コンペティターとして、5’−TGG−3’フィンガー−2サブサイトオリゴヌクレオチドを、親クローンと競合させるために使用した。それぞれ、標的部位を除き、15個のフィンガー−2 5’−CNN−3’サブサイトの等モル混合液、および型5’−ANN−3’、5’−GNN−3’、および5’−TNN−3’の各フィンガー−2サブサイトのコンペティター混合液を、連続して行ったそれぞれの回の選択において量を増大させながら添加した。通常は、非特異的5’−CNN−3’コンペティター混合物を初回に添加した。
【実施例2】
【0076】
多標的特異性のアッセイおよびゲル移動度のシフトの分析
亜鉛フィンガーコード配列を、pComb3Hから、改変された細菌発現ベクターpMal−c2(New England Biolabs)にサブクローニングした。XL1−Blue(Stratagene)への形質転換の後、亜鉛フィンガー−マルトース結合タンパク質(MBP)融合体を、1nMのイソプロピルb−D−チオガラクトシド(IPTG)の添加の後に発現させた。これらの細菌培養物の凍結/融解抽出物を、ストレプトアビジンでコーティングされた96ウェルプレート(Pierce)に1:2希釈でアプライし、そしてそれぞれ、16個の5’−GAT CNN GCG−3’(配列番号34)標的部位の各々に対するDNA結合特異性を試験した。ELISA(酵素結合免疫吸着アッセイ)を、基本的には記載されているとおりに行った[Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁;Dreierら、(2000年)J. Mol. Biol. 303巻、489−502頁]。マウスの抗MBP(マルトース結合タンパク質)抗体(Sigma、1:1000)とともにインキュベーションした後、アルカリフォスファターゼに結合させられたヤギの抗マウス抗体(Sigma、1:1000)を作用させた。アルカリフォスファターゼ基質(Sigma)の添加後に検出し、そしてOD405を、SOFTMAX2.35(Molecular Devices)で測定した。
【0077】
基本的には記載されているように、精製されたタンパク質(Protein Fusion and Purification Systems, New England Biolabs)を用いて、ゲルシフト分析を行った。
【実施例3】
【0078】
フィンガー2の部位特異的突然変異誘発
フィンガー−2突然変異体を、記載されているようにPCRによって構築した[Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁;Dreierら、(2000年)J. Mol. Biol. 303巻、489−502頁]。PCRテンプレートとして、5’−TGG−3’フィンガー2および5’−GAT−3’フィンガー3を含むライブラリークローンを使用した。突然変異誘発したフィンガー2および5’−GAT−3’フィンガー3を含むPCR産物を、改変されたpMal−c2ベクター中に、C7のフィンガー1とインフレームで、NsiIおよびSpeI制限部位を介して(New England Biolabs)にサブクローニングした。記載されているように、SP1Cフレームワークを使用してフィンガー−2スティッチェリー(stitchery)によって、3フィンガータンパク質を構築した[Beerliら、(1998年)Proc Natl Acad Sci USA 95巻(25)、14628−14633頁]。この作業でにおいて作成したタンパク質は、5’−GNN−3’DNA配列を認識するヘリックス[Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁]、ならびに本明細書中に記載されている5’−ANN−3’および5’−TAG−3’ヘリックスを含んだ。6フィンガータンパク質を、適合性XmaIおよびBsrFI制限部位により組み立てた。IPTGで誘導した凍結/融解細菌抽出物により、DNA結合特性の分析を行った。
【実施例4】
【0079】
一般的方法
トランスフェクションおよびルシフェラーゼアッセイ
40〜60%の集密度でHeLa細胞を使用した。24ウェルプレート中の160ngレポータープラスミド(pGL3−プロモーター構築物)および40ngのエフェクタープラスミド(pcDNA3中の亜鉛フィンガー−エフェクタードメイン融合体)で、細胞をトランスフェクトさせた。細胞抽出物を、トランスフェクションの48時間後に調製し、そしてMicroLumatのLB96Pルミノメーター(EG & Berthold、Gaithersburg, MD)で、ルシフェラーゼアッセイ試薬(Promega)を用いて測定した。
【0080】
レトロウイルス遺伝子標的化およびフローサイトメトリー分析
これらのアッセイを、記載されているように行った[Beerliら、(2000年)Proc Natl Acad Sci USA 97巻(4)、1495−1500頁;Beerliら、(2000年)J. Biol. Chem. 275巻(42)、32617−32627頁]。一次抗体として、ErbB−1特異的mAb EGFR(Santa Cruz)、ErbB−2特異的mAb FSP77(Nancy E. Hynesからの寄贈;Harwerthら、1992年)およびErbB−3特異的mAb SGP1(Oncogene Research Products)を使用した。蛍光標識されたロバF(ab’)2抗マウスIgGを、二次抗体として使用した(Jackson Immuno−Research)。
【実施例5】
【0081】
ELISAアッセイのためのpMal−融合タンパク質の細菌抽出物
選択した亜鉛フィンガータンパク質を、発現用のpMalベクター(New England Biolabs)にクローニングした。エレクトロポレーションにより、構築物をE. coli XL1−Blue株に移し、そして503g/mlカルベネシリンを含むLBプレート上で画線培養した。各変異体の4個の単独コロニーを、503g/mlカルベネシリンおよび1%のグリコースを含む3mlのSB培地に接種した。培養物を、37℃で、一晩増殖させた。1.2mlの培養物を、503g/mlカルベネシリン、0.2%のグリコース、903g/ml ZnCl2を含む20mlの新しいSB培地に移し、そしてさらに2時間、37℃で増殖させた。IPTGを、0.3mMの最終濃度まで添加した。インキュベーションを、2時間継続した。培養物を、Beckman GPR遠心分離装置で、3500rpmで、5分間、4℃で遠心分離した。細菌ペレットを、5mMの新しいDTTを含む1.2mlの亜鉛緩衝液A中に再懸濁させた。ドライアイス/エタノールおよび温水を使用した凍結/融解手順によって、タンパク質抽出物を単離した。この手順を6回繰返した。サンプルを、Eppendorf遠心分離装置で、5分間、4℃で遠心分離した。上清を、滅菌した1.5ml遠心分離管に移し、そしてELISAアッセイに使用した。
【0082】
ELISAアッセイ
C7.GATのフィンガー−2変異体を、マルトース結合タンパク質(MBP)との融合体として細菌発現ベクターにサブクローニングし、そしてタンパク質を、1mM IPTG(タンパク質(p)には、それらが選択されたフィンガー−2サブサイトの名称を与えた)での誘導により発現させた。型5’−GAT CNN GCG−3’(配列番号34)の16個のフィンガー−2サブサイトのそれぞれに対する酵素結合免疫吸着アッセイ(ELISA)によって、タンパク質を試験して、それらのDNA結合特異性を調べた。
【0083】
さらに、特異的標的オリゴヌクレオチド、および中間トリプレットの5’−ヌクレオチドでのみ異なる3つのサブサイトに対して、亜鉛フィンガータンパク質をさらすことによって、5’−ヌクレオチド認識を分析した。例えば、pCAAを、5’−AAA−3’、5’−CAA−3’、5’−GAA−3’、および5’−TAA−3’サブサイトについて試験した。試験した3−フィンガータンパク質の多くは、それらが選択されたフィンガー−2サブサイトについて正確なDNA結合特異性を示した(下の表1を参照)。
【0084】
【表1】

【表2】

【実施例6】
【0085】
ゲル移動度のシフトのアッセイ
ZBA/5mM DTTをカラム緩衝液として使用したことを除いて、Protein Fusion and Purification Systems(New England Biolabs)を使用して、転写制御因子に連結させた亜鉛フィンガーポリペプチドを、>90%の均一性にまで精製した。BSA標準に対する比較により、タンパク質純度および濃度を、Coomassie−blueで染色した15%のSDS−PAGEゲルから測定した。標的オリゴヌクレオチドを、[32P]を用いてそれらの5’または3’末端で標識し、そしてゲル精製した。タンパク質の11個の3倍連続希釈物を、室温で、3時間、20μlの結合反応液(1×結合緩衝液/10%グリセロール/>>1pM標的オリゴヌクレオチド)中でインキュベートし、その後、0.5×TBE緩衝液中の5%ポリアクリルアミドゲル上で分離した。PhosphorImager and ImageQuantソフトウェア(Molecular Dynamics)を使用して、乾燥ゲルを定量し、そしてKDを、スキャッチャード分析によって決定した。
【実施例7】
【0086】
亜鉛フィンガー−エフェクタードメイン融合タンパク質の構築
亜鉛フィンガー−エフェクタードメイン融合タンパク質の構築のために、etsリプレッサー因子(ERF)のリプレッサードメイン(ERD)のアミノ酸473から530までをコードするDNA(Sgouras, D. N.、Athanasiou, M. A.、Beal, G. J., Jr.、Fisher, R. J.、Blair, D. G.およびMavrothalassitis, G. J.、(1995年)EMBO J. 14巻、4781−4793頁)、KOX1のKRABドメインのアミノ酸1から97まで(Margolin, J. F.、Friedman, J. R.、Meyer, W.,K.−H.、Vissing, H.、Thiesen, H.−J.およびRauscher III, F. J.(1994年)Proc. Natl. Acad. Sci. USA 91巻、4509−4513頁)、またはMad mSIN3相互作用ドメイン(SID)のアミノ酸1から36まで(Ayer, D. E.、Laherty, C. D.、Lawrence, Q. A.、Armstrong, A. P.およびEisenman, R. N.、(1996年)、Mol. Cell. Biol. 16巻、5772−5781頁)を、Taq DNAポリメラーゼを使用して重複オリゴヌクレオチドから構築した。VP16転写活性化ドメインのアミノ酸413から489までのコード領域(Sadowski, I.、Ma, J.、Triezenberg, S.およびPtashne, M.、(1988年)Nature 335巻、563−564頁)を、pcDNA3/C7−C7−VP16(10)からPCR増幅する。VP16の最小活性化ドメインの四量体反復をコードし、アミノ酸437から447までを含むVP64 DNA(Seipel, K.、Georgiev, O.およびSchaffner, W.、(1992年)EMBO J. 11巻、4961−4968頁)を、2つの対の相補的オリゴヌクレオチドから作成した。得られたフラグメントを、標準的なクローニング手順により、生じる構築物のそれぞれが内部SV40核局在化シグナルとC末端HAデカペプチドタグとを含むように、亜鉛フィンガーコード領域に融合させた。融合構築物を、真核生物の発現ベクターpcDNA3(Invitrogen)にクローニングした。
【実施例8】
【0087】
ルシフェラーゼレポータープラスミドの構築
ATG開始コドンに関してヌクレオチド−758から−1までを含むerbB−2プロモーターフラグメントを、TaqExpand DNAポリメラーゼミックス(Boehringer Mannheim)を用いてヒト骨髄のゲノムDNAからPCR増幅し、そしてホタルのルシフェラーゼ遺伝子の上流に、pGL3 basic(Promega)にクローニングした。ヌクレオチド−1571から−24までを包含するヒトerbB−2プロモーターフラグメントを、Hind3消化により、pSVOALD5’/erbB−2(N−N)(Hudson, L. G.、Ertl, A. P.およびGill, G. N.、(1990年)J. Biol. Chem. 265巻、4389−4393頁)から切り出し、そしてホタルのルシフェラーゼ遺伝子の上流で、pGL3 basicにサブクローニングした。
【実施例9】
【0088】
ルシフェラーゼアッセイ
全てのトランスフェクションのために、40〜60%の集密度でHeLa細胞を使用した。一般的には、細胞を、リポフェクタミン試薬(Gibco BRL)を使用して、6ウェル皿のウェルの中の400ngレポータープラスミド(pGL3−プロモーター構築物、あるいは陰性対照としてのpGL3ベーシック)、50ngのエフェクタープラスミド(pcDNA3の亜鉛フィンガー構築物、あるいは陰性対照としての空のpcDNA3)、および200ngの内部標準プラスミド(phrAct−bGal)でトランスフェクトした。細胞抽出物を、トランスフェクションの約48時間後に調製した。MicroLumatのLB96Pルミノメーター(EG & Berthold、Gaithersburg, MD)中で、ルシフェラーゼ活性を、ルシフェラーゼアッセイ試薬(Promega)で測定し、bGal活性をGalacto−Light(Tropix)で測定した。ルシフェラーゼ活性は、bGal活性について標準化した。
【実施例10】
【0089】
HeLa細胞中でのerbB−2遺伝子の調節
erbB−2遺伝子を、制御を行う標的とした。生来のerbB−2遺伝子を制御するために、合成リプレッサータンパク質およびトランス活性化因子タンパク質を利用した(R. R. Beerli, D. J. Segal, B. Dreier, C. F. Barbas, III, Proc. Natl. Acad. Sci. USA 95巻、14628頁(1998年))。6個の予め定義した、およびモジュラーの亜鉛フィンガードメインから、このDNA結合タンパク質を構築した(D. J. Segal, B. Dreier, R. R. Beerli, C. F. Barbas, III, Proc. Natl. Acad. Sci. USA 96巻、2758頁(1999年))。リプレッサータンパク質は、Kox−1 KRABドメインを含む(J. F. Margolinら、Proc. Natl. Acad. Sci. USA 91巻、4509頁(1994年))のに対して、トランス活性化因子VP64は、単純ヘルペスウイルスタンパク質VP16に由来する最小活性化ドメインの四量体反復を含む(K. Seipel、O. Georgiev、W. Schaffner、EMBO J. 11巻、4961頁(1992年))。
【0090】
ヒト子宮頸癌細胞株HeLaの誘導体であるHeLa/tet−オフを利用した(M. GossenおよびH. Bujard、Proc. Natl. Acad. Sci. USA 89巻、5547頁(1992年))。HeLa細胞は、上皮起源のものであるので、それらは、ErbB−2を発現し、そしてerbB−2遺伝子標的化の研究に十分に適している。HeLa/tet−オフ細胞は、テトラサイクリンで制御されるトランス活性化因子を産生し、したがって、成長培地からテトラサイクリンまたはその誘導体ドキシサイクリン(Dox)を除去することによって、テトラサイクリン応答性構成要素(TRE)の制御下で目的の遺伝子を誘導することができる。本発明者らは、化学的制御下に本発明者らの転写因子を配置するためにこのシステムを使用する。したがって、リプレッサーおよび活性化因子プラスミドを構築し、そしてBamH1およびCla1制限部位を使用してpRevTRE(Clontech)に、そしてBamH1およびNot1制限部位を使用してpMX−IRES−GFP[X. Liuら、Proc. Natl. Acad. Sci. USA 94巻、10669頁(1997年)]にサブクローニングした。PCR増幅の忠実度を、配列決定によって確認し、HeLa/tet−オフ細胞にトランスフェクトし、そして20個の安定なクローンをそれぞれ単離し、そしてDox依存性の標的遺伝子の制御について分析した。構築物を、Lipofectamine Plus試薬(Gibco BRL)を使用してHeLa/tet−オフ細胞株(M. GossenおよびH. Bujard、Proc. Natl. Acad. Sci. USA 89巻、5547頁(1992年))にトランスフェクトした。2mg/ml Doxの存在下で、ハイグロマイシン含有培地での2週間の選択の後、安定なクローンを単離し、そしてErbB−2発現のDox依存性制御について分析した。ウエスタンブロット、免疫沈降、ノーザンブロット、およびフローサイトメトリー分析を、基本的には記載されているように行った[D. Graus−Porta、R. R. Beerli、N. E. Hynes、Mol. Cell. Biol. 15巻、1182頁(1995年)]。erbB−2プロモーター活性の読取として、ErbB−2タンパク質レベルを、ウエスタンブロッティングによって最初に分析した。これらのクローンのかなりの画分が、4日間のDoxの除去の間のErbB−2発現の制御、すなわち、リプレッサークローンにおけるErbB−2の下方制御、および活性化因子クローンにおける上方調節を示した。ErbB−2タンパク質レベルは、それらの特異的mRNAの変化のレベルと相関関係を示し、そしてErbB−2発現の制御が、転写の抑制または活性化の結果であることを示している。
【実施例11】
【0091】
レトロウイルスベクターpMX−IRES−GFPへのE2S−KRAB、E2S−VP64、E3F−KRABおよびE3F−VP64タンパク質のコード領域の導入
いくつかの細胞株中でE2S−KRAB、E2S−VP64、E3F−KRABおよびE3F−VP64タンパク質(下の表2を参照)を発現させるために、これらのコード領域を、レトロウイルスベクターpMX−IRES−GFPに導入した。
【0092】
【表3】

【0093】
ErbB−2またはErbB−3プロモーターの特異的領域に結合するこれらの構築物の配列を、選択した(表2を参照)。コード領域を、pcDNA3に基づく発現プラスミド(R. R. Beerli、D. J. Segal、B. Dreier、C. F. Barbas, III、Proc. Natl. Acad. Sci. USA 95巻、14628頁(1998年))からPCR増幅させ、そしてBamH1およびCla1制限部位を使用してpRevTRE(Clontech)中に、ならびにBamH1およびNot1制限部位を使用してpMX−IRES−GFP[X. Liuら、Proc. Natl. Acad. Sci. USA 94巻、10669頁(1997年)]中にサブクローニングした。PCR増幅の忠実度を、配列決定によって確認した。このベクターは、亜鉛フィンガータンパク質の翻訳のための単一のバイシストロン性メッセージと、内部リボソーム進入部位(IRES)から緑色蛍光タンパク質(GEP)を発現する。両方のコード領域が同じmRNAを共有するので、それらの発現は、互いに物理的に連結されており、そしてGFPの発現が亜鉛フィンガー発現の指標となる。その後、これらのプラスミドから調製したウイルスを使用して、ヒト癌細胞株A431を感染させた。
【実施例12】
【0094】
ErbB−2およびErbB−3の遺伝子発現の制御
実施例11から得られたプラスミドを、Lipofectamine Plus(Gibco BRL)を使用して両種指向性パッケージング細胞株であるPhoenix Amphoに一時的にトランスフェクトさせ、そして2日後、培養上清を用いて、8mg/mlのポリブレンの存在下で標的細胞を感染させた。感染の3日後、細胞を、分析のために回収した。感染の3日後、ErbB−2およびErbB−3発現を、フローサイトメトリにより測定した。結果は、E2S−KRABおよびE2S−VP64組成物が、それぞれ、ErbB−2遺伝子発現を阻害および増強したことを示す。データもまた、E3F−KRABおよびE3F−VP64組成物が、それぞれ、ErbB−2遺伝子発現を阻害および増強したことを示す。
【0095】
ヒトerbB−2およびerbB−3遺伝子を、亜鉛フィンガーに基づく転写スイッチの開発
のためのモデル標的として選択した。ErbBレセプターファミリーのメンバーは、ヒトの悪性腫瘍の発生に重要な役割を果たす。特に、erbB−2は、乳房、卵巣、肺、胃、および唾液腺を含む多数の部位で生じるヒトの腺癌の高い割合において、遺伝子増幅および/または転写の脱制御の結果として過剰発現される(Hynes, N. E.およびStern, D. F.(1994年)Biochim. Biophys. Acta 1198巻、165−184頁)。ErbB−2の発現が増大したことは、その固有のチロシンキナーゼの恒常的な活性化を誘導し、そして培養細胞の形質転換を生じることが示されている。多数の臨床研究が、ErbB−2の発現レベルが増大している腫瘍を保有している患者は進行が遅いことを示した(Hynes, N. E.およびStern, D. F.(1994年)Biochim. Biophys. Acta 1198巻、165−184頁)。ヒトの癌におけるそれの関与に加えて、erbB−2は、哺乳類の成体および胚発生の間の両方において、重要な生物学的役割を果たす(Hynes, N. E.およびStern, D. F.(1994年)Biochim. Biophys. Acta 1198巻、165−184頁、Altiok, N.、Bessereau, J.−L.およびChangeux, J.−P.、(1995年)EMBO J. 14巻、4258−4266頁、Lee, K.−F.、Simon, H.、Chen, H.、Bates, B.、Hung, M.−C.およびHauser, C.、(1995年)Nature 378巻、394−398頁)。
【0096】
したがって、erbB−2プロモーターは、人工的な転写制御因子の開発のための興味深い試験例を表す。このプロモーターは、詳細に特徴付けられており、そして比較的複雑であり、そしてTATA依存性転写開始部位およびTATA非依存性転写開始部位の両方を含むことが示されている(Ishii, S.、Imamoto, F.、Yamanashi, Y.、Yoyoshima, K.およびYamamoto, T.、(1987年)Proc. Natl. Acad. Sci. USA 84巻、4374−4378頁)。初期の研究は、ポリダクチルタンパク質が、転写を特異的に活性化または抑制する転写制御因子として作用することができることを示したにもかかわらず、これらのタンパク質は、タンパク質結合部位の6個の直列の反復に対して、人工的なプロモーターの上流で結合した(Liu, Q.、Segal, D. J.、Ghiara, J. B.およびBarbas III, C. F.(1997年)Proc. Natl. Acad. Sci. USA 94巻、5525−5530頁)。さらに、この研究は、それらの結合特異性が変更されていないポリダクチルタンパク質を利用した。本明細書において、本発明者らは、生来のerbB−2およびerbB−3プロモーター中の単一の部位に結合する予め定義された構築ブロックから構築されるポリダクチルタンパク質の効力を試験した。
【0097】
所望のDNA結合特異性を有しているポリダクチルタンパク質を作成するために、本研究は、予め定義された亜鉛フィンガードメインの構築に注目し、これをGreismanおよびPaboによって提案される連続選択攻略法と対比させた(Greisman, H. A.およびPabo, C. O.(1997年)Science 275巻、657−661頁)。このような攻略法には、それぞれの必要なタンパク質についての6個の亜鉛フィンガーライブラリーの連続的な作成および選択が必要であり、そしてこのことがこの実験アプローチを、ほとんどの研究室で利用できなくさせ、そして全てに極端に時間のかかるものとしている。さらに、この攻略法で結合する別の配列に対する特異的陰性選択を行うことが困難であるので、タンパク質は、最近報告されたとおり、比較的非特異的である結果を生じる場合がある(Kim, J.−S.およびPabo, C. O.、(1997年)J. Biol. Chem. 272巻、29795−29800頁)。
【0098】
18bpのDNA配列を認識する3−フィンガータンパク質を作成するための2つの異なる攻略法の一般的有用性を調べた。それぞれの攻略法は、亜鉛フィンガードメインのモジュール特性に基づき、そして5’−NNN−3’のトリプレットを認識する亜鉛フィンガードメインのファミリーを利用した。ハーフサイトerbB−2またはerbB−3標的部位を認識する3つの6−フィンガータンパク質を、予め定義したフィンガー2(F2)ドメイン変異体を、PCR構築法を使用して一緒に融合することによって、最初の攻略法において作成した。
【0099】
電気泳動移動度のシフトのアッセイによって、その標的に対するタンパク質のそれぞれの親和性を測定した。これらの研究は、亜鉛フィンガーペプチドが、Zif268および他の自然界に存在する転写因子に匹敵する親和性を有していることを示した。
DNA標的部位についての各タンパク質の親和性は、ゲルシフト分析により測定する。
【技術分野】
【0001】
本明細書に報告されるいくつかの研究を支援するために使用された資金は、国立衛生研究所によって提供された(NIH GM53910号)。したがって、米国政府は、本発明に一定の権利を有しうる。
【0002】
関連出願に対する関連資料
本出願は、2001年8月20日に出願された米国仮特許出願番号第60/313,864号および第60/313,693号の一部継続出願であり、それらの開示を、参照により本明細書の一部とする。
【0003】
発明の分野
本発明の分野は、標的ヌクレオチドに結合する亜鉛フィンガータンパク質である。さらに詳細には、本発明は、式5’−(CNN)−3’で示される標的ヌクレオチドに特異的に結合する亜鉛フィンガーのα−ヘリックスドメイン内のアミノ酸残基配列に関する。
【背景技術】
【0004】
人工的な転写因子の構築は、過去数年、おおいに興味があるものであった。遺伝子発現を、制御ドメインに融合したポリダクチル亜鉛フィンガータンパク質によって特異的に調節することができる。Cys2−His2ファミリーの亜鉛フィンガードメインは、それらのモジュラー構造により、人工的な転写因子の構築にとって最も将来有望であった。各ドメインは、およそ30個のアミノ酸から構成され、そして保存的Cys2−His2残基による疎水性相互作用および亜鉛イオンのキレート化により安定化されたα−構造に折り畳まれる。現在までに、亜鉛フィンガータンパク質のこのファミリーの最も特徴付けられているタンパク質は、マウス転写因子Zif268である[Pavletichら、(1991年)Science252巻(5007)、809−817頁;Elrod−Ericksonら、(1996年)Structure 4巻(10)、1171−1180頁]。Zif268/DNA複合体の解析は、DNA結合が、それぞれ、1、3および6位にあるα−ヘリックスのアミノ酸残基と、3bpDNAサブサイトの3’、中間、および5’ヌクレオチドとの相互作用により大体は達成されることを示唆した。1、2および5位は、DNAのリン酸骨格と直接または水により媒介されて接触することが示されている。ロイシンは、通常は、4位に見られ、そしてドメインの疎水性コアにパッケージされる。α−ヘリックスの2位は、他のヘリックス残基と相互作用し、そしてさらに、3bpサブサイトの外側のヌクレオチドと接触することができることが示されている[Pavletichら、(1991年)Science 252巻(5007)、809−817頁;Elrod−Ericksonら、(1996年)Structure 4巻(10)、1171−1180頁;Isalan,M.ら、(1997年)Proc Natl Acad Sci USA 94巻(11)、5617−5621頁]。
【0005】
各々の5’−GNN−3’DNAサブサイトを高い特異性および親和性で認識するモジュールである亜鉛フィンガードメインの選択、および部位特異的突然変異誘発によるそれらの精製が示された(米国特許番号第6,140,081号、その開示を、参照により本明細書の一部とする。)。これらのモジュールドメインは、ヒトまたは他のあらゆるゲノム中に固有に存在する18bpにわたるDNA配列を認識する亜鉛フィンガータンパク質に構築され得る。さらに、これらのタンパク質は、転写因子として機能し、そして制御ドメインに融合されるときに遺伝子発現を変更させる能力があり、そしてさらには核ホルモン受容体のリガンド結合ドメインに対する融合により、ホルモン依存性となることもできる。任意のDNA配列に結合する亜鉛フィンガー基本の転写因子を迅速に構築させるために、64個の可能性のあるDNAトリプレットの各々を認識する現存の組のモジュール亜鉛フィンガードメインを伸長させることが重要である。この目的は、ファージディスプレイ選択および/または合理的設計により達成することができる。亜鉛フィンガー/DNA相互作用についての構造データが限られているため、亜鉛タンパク質の合理的設計は、非常に時間を消耗し、そして不可能であることも多くある。さらに、ほとんどの自然界に存在する亜鉛フィンガータンパク質は、5’−(GNN)−3’型のDNA配列を認識するドメインから構成される。5’−NNN−3’型のDNA標的配列に結合する新規の亜鉛フィンガードメインを同定するための最も見込みのあるアプローチは、ファージディスプレイによる選択である。このアプローチにとっての制限段階は、5’アデニン、シトシンまたはチミンの特異化を可能にするライブラリーの構築である。ファージディスプレイ選択は、このタンパク質の様々のフィンガーをランダム化したZif268に基づいた[Chooら、(1994年)Proc. Natl. Acad. Sci. U.S.A. 91巻(23)、11168−72頁;Rebarら、(1994年)、Science(ワシントン,ディーシー、1883−)263巻(5147)、671−3頁;Jamiesonら、(1994年)Biochemistry 33巻、5689−5695頁;Wuら、(1995年)PNAS 92巻、344−348頁;Jamiesonら、(1996年)Proc Natl Acad Sci USA 93巻、12834−12839頁;Greismanら、(1997年)Science 275(5300)、657−661頁]。5’−GNN−3’型のDNA配列を認識する1組の16個のドメインは、Zif268の誘導体であるC7のフィンガー2[Wuら、(1995年)PNAS 92巻、344−348頁;Wu、1995]がランダム化されたライブラリーから先に報告された[Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁]。このような攻略法では、選択は、フィンガー2サブサイトにおける5’グアニンまたはチミンの相補的塩基と接触を作るフィンガー3のAsp2により5’−GNN−3’または5’−TNN−3’を認識するドメインに限定される[Pavletichら、(1991年)Science 252巻(5007)、809−817頁;Elrod−Ericksonら、(1996年)Structure 4巻(10)、1171−1180頁]。
【発明の概要】
【発明が解決しようとする課題】
【0006】
本アプローチは、科学的共有物により亜鉛フィンガータンパク質の迅速な構築を可能にする亜鉛フィンガードメインのモジュール方式に基づいており、そして交差サブサイト相互作用により課される制限に関する懸念が、限定された数の事例にのみ起こることを示す。本開示は、5’−CNN−3’型のDNA配列を特異的に認識する亜鉛フィンガードメインを選択する新たな攻略法を導入する。これらのドメインの特異的DNA結合特性は、16個の5’−CNN−3’トリプレット全てに対する多標的ELISAにより評価された。これらのドメインは、種々の数の5’−CNN−3’ドメインを含み、各々18bpにわたる配列を特異的に認識するポリダクチルタンパク質に容易に組み込むことができる。さらに、これらのドメインは、制御ドメインに融合された場合には、遺伝子発現を特異的に変更することができる。これらの結果は、予め定義された構築ブロックからポリダクチルタンパク質を構築する可能性の基礎となる。さらに、ここに特徴付けられたドメインは、人工的な転写因子で標的にされうるDNA配列の数を大いに増大させる。
【課題を解決するための手段】
【0007】
発明の簡潔な要約
1つの態様では、本発明は、その領域が、式CNN(式中、Nは、A、C、GまたはTである)で示される標的ヌクレオチドに優先的に結合する5から10個までのアミノ酸残基のヌクレオチド結合領域を含む、単離および精製された亜鉛フィンガーヌクレオチド結合ポリペプチドを提供する。好ましくは、標的ヌクレオチドは、式CAA、CAC、CAG、CAT、CCA、CCC、CCG、CCT、CGA、CGC、CGG、CGT、CTA、CTC、CTGまたはCTTを含む。1つの実施態様では、本発明のポリペプチドは、配列番号1〜25のいずれかと同じヌクレオチド結合特性を有しているアミノ酸残基配列を有する結合領域を含む。このようなポリペプチドは、配列番号1〜25のいずれかと、ヌクレオチド標的に対する結合について競合する。好ましくは、結合領域は、配列番号1〜25のいずれかを示すアミノ酸残基配列を有する。1つの実施態様では、本発明は、配列番号1〜25のいずれかのアミノ酸残基配列から構成される、単離および精製された亜鉛フィンガーヌクレオチド結合ポリペプチドを提供する。
【0008】
別の態様では、本発明は、本明細書中に開示されるように、複数の、そして好ましくは約2から約12個までの亜鉛フィンガーヌクレオチド結合ポリペプチドを含むペプチド組成物を提供する。ポリペプチドは、5から15個までのアミノ酸残基の可撓性のペプチドリンカーを介して連結されるように、作動可能であるように連結される。作動可能であるように連結されるのは、好ましくは、配列番号30に示されるもののように、可撓性のペプチドリンカーを介して起こる。このような組成物は、式5’−(CNN)n−3’(式中、Nは、A、C、GまたはTであり、そしてnは、2から12までである)の配列を含むヌクレオチド配列に結合する。好ましくは、組成物は、約2から約6個までの亜鉛フィンガーヌクレオチド結合ポリペプチドを含み、そして式5’−(CNN)n−3’(式中、nは、2から6までである)の配列を含むヌクレオチド配列に結合する。結合は、1fMから10μMまでのKDで起こる。好ましくは、結合は、10fMから1μMまで、10pMから100nMまで、100pMから10nMまでのKDで、そしてさらに好ましくは1nMから10nMまでのKDで起こる。好ましい実施態様では、本発明のポリペプチドと組成物の両方は、転写のリプレッサーまたは転写の活性化因子のような1つまたはそれ以上の転写制御因子に作動可能であるように連結される。
【0009】
本発明は、さらに、本発明のポリペプチドまたは組成物をコードするポリヌクレオチド、このようなポリヌクレオチドを含む発現ベクター、およびポリヌクレオチドまたは発現ベクターで形質転換された宿主細胞を提供する。
【0010】
本発明は、さらに、標的ヌクレオチド配列5’−(CNN)−3’を含むヌクレオチド配列の発現を制御する方法を提供する。標的ヌクレオチド配列を、長い5’−(NNN)−3’配列内のいずれかの場所に配置することができる。この方法は、本明細書中に規定するような有効量の亜鉛フィンガーヌクレオチド結合ポリペプチドまたは組成物に、ヌクレオチド配列をさらす段階を含む。1つの実施態様では、方法は、配列5’−(CNN)n−3’(式中、nは、2から12までである)を含むヌクレオチド配列の発現を制御する。その方法は、本発明の有効量の組成物に、ヌクレオチド配列をさらす段階を含む。配列5’−(CNN)n−3’を、ヌクレオチド配列の転写領域に、ヌクレオチド配列のプロモーター領域に、または発現配列タグ内に配置することができる。組成物は、好ましくは、転写のリプレッサーまたは転写の活性化因子のような1つまたはそれ以上の転写制御因子に作動可能であるように連結される。1つの実施態様では、ヌクレオチド配列は、真核生物の遺伝子、原核生物の遺伝子またはウイルス遺伝子のような遺伝子である。真核生物の遺伝子は、ヒト遺伝子のような哺乳類遺伝子または植物遺伝子でありうる。原核生物の遺伝子は、細菌遺伝子でありうる。
【図面の簡単な説明】
【0011】
【図1】本明細書の一部を形成する図面において、図1は、1Aおよび1Bと示された2つのパネルにおいて、概略的に、亜鉛フィンガーファージディスプレイライブラリー(A)の構築およびC7タンパク質(B)についての多標的特異性ELISAを示す。
【0012】
定義
特に定義されない限り、本明細書中で使用される全ての技術的および科学的用語は、本発明が属する業界の当業者に一般に理解されるのと同じ意味を示す。
【0013】
本明細書中で使用される場合、転写制御ドメインまたは因子は、遺伝子転写を制御するように機能する本明細書中で提供される融合ポリペプチドの一部をいう。例示の、そして好ましい転写リプレッサードメインは、ERD、KRAB、SID、デアセチラーゼ、ならびにそれらの誘導体、多量体、およびKRAB−ERD、SID−ERD、(KRAB)2、(KRAB)3、KRAB−A、(KRAB−A)2、(SID)2、(KRAB−A)−SIDおよびSID−(KRAB−A)のようなそれの組合わせである。本明細書中で使用される場合、ヌクレオチド結合ドメインまたは領域は、特異的核酸結合能力を与える、本明細書中に提供されるポリペプチドまたは組成物の一部をいう。ヌクレオチド結合領域は、特異的遺伝子に対して対象のポリペプチドを標的化するように作用する。本明細書中で使用される場合、作動可能であるように連結されるとは、例えば、ポリペプチドの構成要素が、各々が意図されるとおりに作用するか、または機能するように連結されることを意味する。例えば、リプレッサーは、リプレッサーがその結合ドメインを介して標的ヌクレオチドに結合されると、転写を阻害または妨げるように作用するような様式で、結合ドメインに連結される。構成要素の間またはその中の連結は、直接的、またはリンカーを介してのように間接的でありうる。その構成要素は、必ずしも隣接してはいない。したがって、リプレッサードメインは、当該分野で十分に知られるあらゆる連結手順を使用してヌクレオチド結合ドメインに連結することができる。2つのドメインの間にリンカー部分を含むことが、必要がある可能性がある。このようなリンカー部分は、概して、ドメインの間に間隔を生じるための短いアミノ酸残基の配列である。リンカーは、結合またはリプレッサードメインの機能のいずれかを妨害しない限り、あらゆる配列を使用することができる。
【0014】
本明細書中で使用される場合、「調節する」は、過剰活性化されるときには、亜鉛フィンガーヌクレオチド結合モチーフを含むプロモーターからの発現の阻害または抑制を、そして過少活性化されるときには、このようなプロモーターからの発現の増大または増強を想定する。
【0015】
本明細書中で使用される場合、本明細書中に示す種々のアミノ酸配列で生じるアミノ酸は、それらのよく知られた三文字または一文字の略号によって識別される。種々のDNAフラグメントで生じるヌクレオチドは、当該分野で日常的に使用される標準の一文字表記で示される。
【0016】
ペプチドまたはタンパク質では、アミノ酸の適切な保存的置換は、当業者に知られており、そして、一般に、生じる分子の生物学的活性を改変することなく行われうる。当業者らは、一般に、ポリペプチドの非必須領域における単一アミノ酸の置換が、実質的に生物学的活性を改変しないことを認識している(例えば、Watsonら、「遺伝子の分子生物学」第4版、1987年、ザ・ベンジャミン/クーニングズ・パブ.シーオー.、224頁を参照)。
【0017】
本明細書中で使用される場合、「発現ベクター」は、本明細書中で融合タンパク質をコードする核酸、または本明細書中で提供される発現カセットのような、異種DNAの挿入または組込みにより操作された、当該分野で知られるプラスミド、ウイルスまたは他のビヒクルをいう。このような発現ベクターは、細胞に挿入された核酸の効率的な転写のためのプロモーター配列を含む。発現ベクターは、概して、複製起点、プロモーター、ならびに形質転換細胞の表現型選択を可能にする特異的遺伝子を含む。
【0018】
本明細書中で使用される場合、「宿主細胞」は、その中でベクターが増殖でき、そしてそのDNAが発現される細胞である。その用語は、対象の宿主細胞のあらゆる子孫をも含む。複製の間に起こる突然変異が生じる可能性があるので、全ての子孫が、親細胞と同一ではない場合があることが理解される。このような子孫は、用語「宿主細胞」が使用されるときに含まれる。外来DNAが、宿主で継続して維持される安定な導入方法は、当該分野で知られている。
【0019】
本明細書中で使用される場合、遺伝子治療は、このような治療が想定される障害または症状を示す、哺乳動物、特にヒトの特定の細胞である標的細胞に異種DNAを導入することを含む。異種DNAが発現され、そしてそれによりコードされる治療用産物が生産されるような様式で、DNAを、選択した標的細胞に導入する。別の方法として、異種DNAは、ある種の様式では、治療用産物をコードするDNAの発現を仲介する場合があり、または、ある種の様式においては、直接的または間接的に治療用産物の発現を仲介するペプチドまたはRNAのような産物をコードする場合もある。遺伝子治療は、欠陥遺伝子を置換するか、または哺乳類またはそれが導入される細胞によって産生される遺伝子産物を補足する、遺伝子産物をコードする核酸を送達するためにも使用されうる。導入された核酸は、哺乳類宿主で正常には産生されないか、または治療的に有効な量で、または治療に有用な時間では産生されない、それの成長因子阻害剤、または腫瘍壊死因子もしくはその受容体のようなそれの阻害剤のような治療用化合物をコードする場合もある。治療用産物をコードする異種DNAは、産物またはそれの発現を増強するか、または別の方法では改変するために、罹患した宿主の細胞に導入する前に、修飾することもできる。遺伝子治療は、遺伝子発現の阻害剤またはリプレッサーまたは他のモジュレーターの送達を含むこともある。
【0020】
本明細書中で使用される場合、異種DNAは、それを発現する細胞によりインビボでは通常は産生されないRNAおよびタンパク質をコードするか、または転写、翻訳または他の制御可能な生化学的過程に影響を与えることによって、内因性DNAの発現を改変するメディエーターを仲介するかまたはコードするDNAである。異種DNAは、外来DNAとも呼ばれる場合がある。当業者が、それらが発現される細胞に対して異種または外来として認識するまたは考えるあらゆるDNAが、異種DNAによって本明細書中に含まれる。異種DNAの例としては、それに限定されないが、薬剤耐性を付与するタンパク質のような追跡可能なマーカータンパク質をコードするDNA、抗癌剤、酵素およびホルモンのような治療上有効な物質をコードするDNA、ならびに抗体のような他の型のタンパク質をコードするDNAが挙げられる。異種DNAによってコードされる抗体は、異種DNAが導入された細胞の表面で分泌または発現される場合がある。
【0021】
以後、本明細書中で、異種DNAまたは外来DNAは、ゲノム中で見られる対の片方のDNA分子として正確な配向および位置には存在しないDNA分子が挙げられる。これは、別の生物または種(すなわち、外因性)に由来するDNA分子をもまた意味する。
【0022】
本明細書中で使用される場合、治療上有効な産物は、宿主への核酸の導入により、症状、遺伝性または後天性疾患の発現を緩和または排除するか、または疾患を治癒させる産物が発現される異種核酸、典型的にはDNAによりコードされる産物である。概して、所望の遺伝子産物をコードするDNAを、プラスミドベクターにクローニングさせ、そしてパッケージング細胞のような産生細胞へのリン酸カルシウム仲介DNA取込(Somat、Cell.Mol.Genet.7巻:603−616頁(1981年)を参照)またはマイクロインジェクションのような日常的方法によって導入する。産生細胞中での増幅の後、異種DNAを含むベクターを、選択された標的細胞に導入する。
【0023】
本明細書中で使用される場合、発現または送達ベクターは、外来または異種DNAが、適切な宿主細胞での発現のために挿入されうる、すなわち、DNAによってコードされるタンパク質またはポリペプチドが、宿主細胞の系で合成される、任意のプラスミドまたはウイルスをいう。1つまたはそれ以上のタンパク質をコードするDNAセグメント(遺伝子)の発現を指示する能力のあるベクターは、「発現ベクター」として本明細書中で呼ばれる。さらに、逆転写酵素を使用して産生されるmRNAからcDNA(相補的DNA)をクローニングすることができるベクターもまた含まれる。本明細書中で使用される場合、遺伝子は、そのヌクレオチド配列がRNAまたはポリペプチドをコードする核酸分子をいう。遺伝子は、RNAまたはDNAのいずれかでありうる。遺伝子は、コード領域の前後の領域(リーダーおよびトレーラー)、ならびに個々のコードセグメント(エクソン)の間の介在配列(イントロン)を含みうる。
【0024】
本明細書中で使用される場合、核酸分子またはポリペプチドまたは他の生物分子に関して単離されたとは、核酸またはポリペプチドが、ポリペプチドまたは核酸が得られた遺伝的環境から分離されたことを意味する。そして、それは、天然の状態から改変されていることも意味しうる。例えば、生きている動物中に自然界において存在するポリヌクレオチドまたはポリペプチドは、「単離」されていないが、しかしこの天然状態で同時に存在する物質から分離された同じポリヌクレオチドまたはポリペプチドは、その用語が本明細書中で使用される場合には、「単離」されている。したがって、組換え宿主細胞内で産生されたおよび/またはその中に含まれるポリペプチドまたはポリヌクレオチドは、単離されていると考えられる。さらに、組換え宿主細胞から、または生来の源から部分的に、または実質的に精製されているポリペプチドまたはポリヌクレオチドもまた、「単離ポリペプチド」または「単離ポリヌクレオチド」として意図される。例えば、組換えで産生されたバージョンの化合物は、Smithら(1988年)Gene 67巻:31−40頁に記述される1段階法によって実質的に精製されうる。用語の単離されたと精製されたは、しばしば、互換的に使用される。
【0025】
したがって、「単離された」によって、核酸は、自然界に存在するゲノム中で、目的の核酸をコードする遺伝子にすぐ隣接しているような遺伝子のコード配列を含まない。単離されたDNAは、一本鎖または二本鎖であり得て、そしてゲノムDNA、cDNA、組換えハイブリッドDNA、または合成DNAでありうる。これは、生来のDNA配列と一致しうるか、または1つまたはそれ以上のヌクレオチドの欠失、付加、または置換によりこのような配列と異なる場合もある。
【0026】
単離または精製は、それが生物学的細胞または宿主から作られる調製物についていう場合には、目的のDNAまたはタンパク質の粗抽出物を含む特定のDNAまたはタンパク質を含むあらゆる細胞抽出物を意味する。例えば、タンパク質の場合に、精製された調製物は、個々の技術または一連の調製または生化学的技術に従って得ることができ、そして目的のDNAまたはタンパク質は、これらの調製物中で種々の純度で存在しうる。手段として、例えば、それに限定されないが、硫酸アンモニウム分画、ゲル濾過、イオン交換クロマトグラフィー、アフィニティークロマトグラフィー、密度勾配遠心分離および電気泳動を挙げることができる。
【0027】
「実質的に純粋な」または「単離された」DNAまたはタンパク質の調製物は、そのようなDNAまたはタンパク質が、通常の天然の状態でそれが結合する、自然界に存在する物質を含まない調製物を意味すると見なされるべきである。「本質的に純粋な」は、目的のDNAまたはタンパク質を少なくとも95%含む「高度に」精製された調製物を意味すると見なされるべきである。
【0028】
目的のDNAまたはタンパク質を含む細胞抽出物は、タンパク質を発現するか、または目的のDNAを含む細胞から得られた均質な調製物または細胞を含まない調製物を意味すると見なされるべきである。用語「細胞抽出物」は、培地、特に細胞が除去されている使用済み培養培地を含むことが意図される。
【0029】
本明細書中で使用される場合、「調節」は、機能の抑制、増強または誘導をいう。例えば、亜鉛フィンガー核酸結合ドメインおよびその変異体は、プロモーター内のモチーフに結合し、それによりプロモーター細胞ヌクレオチド配列に作動可能であるように連結される遺伝子の転写を増強または抑制することによって、プロモーター配列を調節することができる。別の方法として、調節は、亜鉛フィンガー−ヌクレオチド結合ポリペプチド変異体が、構造遺伝子に結合し、そしてDNA依存性RNAポリメラーゼを遺伝子の読み取りからブロックし、したがって該遺伝子の転写を阻害することを特徴とする遺伝子の転写の阻害を含みうる。構造遺伝子は、例えば、正常な細胞遺伝子または癌遺伝子でありうる。別の方法として、調節は、転写産物の翻訳の阻害を含む場合もある。
【0030】
本明細書中で使用される場合、「阻害」は、プロモーターに作動可能であるように連結される構造遺伝子の転写の活性化のレベルの抑制をいう。例えば、本発明の方法に関しては、遺伝子は、亜鉛フィンガー−ヌクレオチド結合モチーフを包含する。
【0031】
本明細書中で使用される場合、転写制御領域は、標的細胞中での遺伝子発現を駆動する領域をいう。本明細書での使用に適切な転写の調節領域は、それに限定されないが、ヒトサイトメガロウイルス(CMV)即時−初期エンハンサー/プロモーター、SV40初期エンハンサー/プロモーター、JCポリオマウイルスプロモーター、アルブミンプロモーター、PGK、およびCMVエンハンサーに結合させたα−アクチンプロモーターが挙げられる。
【0032】
本明細書中で使用される場合、遺伝子のプロモーター領域としては、構造遺伝子に対して、典型的には5’に位置する制御構成要素が挙げられる。遺伝子が活性化される場合、転写因子として知られるタンパク質は、遺伝子のプロモーター領域に結合させられる。この構築物は、酵素が、DNAからRNAに第二遺伝子セグメントを転写することを可能にすることによって、「スイッチを付ける」に類似する。ほとんどの場合に、生じるRNA分子は、特異的タンパク質の合成のためのテンプレートとして役割を果たす。ときどき、RNA自体が最終産物である。プロモーター領域は、正常な細胞プロモーターまたは例えば、腫瘍−プロモーターでありうる。腫瘍−プロモーターは、一般にウイルス由来のプロモーターである。亜鉛フィンガー結合ポリペプチドがそれに対して標的化されうるウイルスプロモーターとしては、それに限定されないが、レトロウイルスの長い末端反復配列(LTR)、およびヒトT細胞向性ウイルス(HTLV)1および2、ならびにヒト免疫不全ウイルス(HIV)1または2のようなレンチウイルスプロモーターが挙げられる。
【0033】
本明細書中で使用される場合、「有効量」は、予め活性化されたプロモーターの不活性化を生じる量、または亜鉛フィンガーヌクレオチド結合モチーフを含むプロモーターの不活性化を生じる量、または構造遺伝子の転写またはRNAの翻訳をブロックする量を包含する。必要とされる亜鉛フィンガー由来のヌクレオチド結合ポリペプチドの量は、現存するタンパク質/プロモーター複合体中の生来の亜鉛フィンガ−ーヌクレオチド結合タンパク質を置換するのに必要な量であるか、またはプロモーター自体との複合体の形成について生来の亜鉛フィンガー−ヌクレオチド結合タンパク質と競合するために必要な量のいずれかである。同様に、構造遺伝子またはRNAをブロックするために必要な量は、それぞれ、RNAポリメラーゼに結合し、そしてそれが遺伝子上で読み取るのをブロックする量であるか、または翻訳を阻害する量である。好ましくは、この方法は、細胞内で行われる。プロモーターまたは構造遺伝子を機能的に不活性化することにより、転写または翻訳を抑制する。亜鉛フィンガー−ヌクレオチド結合タンパク質モチーフを含む細胞ヌクレオチド配列に結合するか、またはそれと「接触する」ための阻害タンパク質の有効量の送達は、レトロウイルスベクターまたはリポゾームによるような本明細書中に記載されている機構のうちの1つ、または当該分野でよく知られる他の方法によって達成されうる。
【0034】
本明細書中で使用される場合、「短縮された」は、生来の亜鉛フィンガー結合タンパク質に見られる全数未満の亜鉛フィンガーを含むか、望まれない配列が欠失している亜鉛フィンガー−ヌクレオチド結合ポリペプチド誘導体をいう。例えば、9個の亜鉛フィンガーを天然の状態で含む亜鉛フィンガー−ヌクレオチド結合タンパク質TFIIIAの短縮は、わずか1個から3個の亜鉛フィンガーを有するポリペプチドでありうる。伸長は、別の亜鉛フィンガーモジュールが加えられた亜鉛フィンガーポリペプチドをいう。例えば、TFIIIAは、3個の亜鉛フィンガードメインを加えることにより12個のフィンガーにまで伸長させることができる。さらに、短縮型の亜鉛フィンガー−ヌクレオチド結合ポリペプチドは、1つ以上の野生型ポリペプチドに由来する亜鉛フィンガーモジュールを包含し、したがって、「ハイブリッド」亜鉛フィンガー−ヌクレオチド結合ポリペプチドを生じうる。
【0035】
本明細書中で使用される場合、「突然変異誘発された」は、タンパク質をコードするDNAのランダムまたは部位特異的突然変異誘発を達成するための公知方法のいずれかを行うことにより得られた亜鉛フィンガー由来のヌクレオチド結合ポリペプチドをいう。例えば、TFIIIAでは、突然変異誘発は、コンセンサス配列の1つまたはそれ以上の反復中の非保存残基を置換するために行われうる。短縮型の亜鉛フィンガー−ヌクレオチド結合タンパク質も、突然変異誘発されうる。
【0036】
本明細書中で使用される場合、ポリペプチド「変異体」または「誘導体」は、突然変異誘発形態のポリペプチド、または組換えにより産生されているが、リガンドまたは核酸分子に結合するか、転写を調節する能力のような、所望の活性をなお保有しているポリペプチドをいう。
【0037】
本明細書中で使用される場合、亜鉛フィンガー−ヌクレオチド結合ポリペプチド「変異体」または「誘導体」は、突然変異形態の亜鉛フィンガータンパク質または組換えにより産生されたものであるポリペプチドをいう。変異体は、例えば、第二のタンパク質の亜鉛フィンガードメインに連結された1つのタンパク質に由来する亜鉛フィンガードメインを含むハイブリッドでありうる。ドメインは、野生型であるか、または突然変異を誘発しうる。「変異体」または「誘導体」としては、野生型タンパク質中の元来の数未満のフィンガーを含む短縮形態の野生型亜鉛フィンガータンパク質が挙げられる。それから誘導体または変異体が産生されうる亜鉛フィンガー−ヌクレオチド結合ポリペプチドの例としては、TFIIIAおよびzif268が挙げられる。類似の用語は、「変異体」または「誘導体」核ホルモン受容体および「変異体」または「誘導体」転写エフェクタードメインをいうために使用される。
【0038】
本明細書中で使用される場合、「亜鉛フィンガー−ヌクレオチド結合標的またはモチーフ」は、亜鉛フィンガー−ヌクレオチド結合誘導体ポリペプチドが、それに特異的に結合するヌクレオチドセグメントの二次元または三次元特性をいう。一般に5個のヌクレオチドまたはそれ未満のヌクレオチド配列、それに加えて、これらに限定されないが主溝および副溝ならびにヘリックスの表面のようなDNA二重ヘリックスの三次元構造がこの定義に含まれる。モチーフは、概して、亜鉛フィンガーポリペプチドが結合できる適切な長さの任意の配列である。例えば、3フィンガーポリペプチドは、典型的には、約9から約14個までの塩基対を有するモチーフに結合する。好ましくは、認識配列は、ゲノム内の特異性を確実にするためには、少なくとも約16個の塩基対である。したがって、あらゆる特異性の亜鉛フィンガー−ヌクレオチド結合ポリペプチドが提供される。亜鉛フィンガー結合モチーフは、経験的に設計されるか、それに対して亜鉛フィンガータンパク質が結合するように設計される、任意の配列でありうる。モチーフは、制御配列、エキソン、イントロン、またはあらゆる非コード配列を含めた任意のDNAまたはRNA配列中に見ることができる。
【0039】
本明細書中で使用される場合、それらが、組成物、担体、希釈剤および試薬に引用される場合、用語「医薬上許容される」、「生理学的に寛容な」、およびそれらの文法的語尾変化は、互換的に使用され、そしてそれらの物質を、組成物の投与を禁じる程度までである悪心、眩暈感、胃の不調等の望ましくない生理学的副作用を生じることなくヒトに投与できることを表す。
【0040】
本明細書中で使用される場合、用語「ベクター」は、様々の遺伝的環境の間で、それが作動可能であるように連結されている別の核酸を輸送することができる核酸分子をいう。好ましいベクターは、それらが作動可能であるように連結されるDNAセグメント中に存在する構造遺伝子産物を自律複製および発現することができるものである。したがって、ベクターは、好ましくは、レプリコンおよび先に記述したような選択マーカーを含む。
【0041】
DNAフラグメントを含む核酸分子に関して本明細書中で使用される場合、語句「作動可能であるように連結される」は、作動可能であるように連結された部分が意図されるとおり機能するように、一本鎖または二本鎖形態にかかわらず、好ましくは従来のホスホジエステル結合により、DNAの1つの鎖中に、配列またはセグメントが、共有結合により結合されることを意味する。本明細書中で提供される転写ユニットまたはカセットが、それに対して作動可能であるように連結されるベクターの選択は、当該分野でよく知られているように、直接的に、望まれる機能特性、例えば、ベクター複製およびタンパク質発現、そして形質転換される宿主細胞に依存し、そしてこれらは、組換えDNA分子構築の分野において生来存在している限定である。
【0042】
本明細書中で使用される場合、治療用組成物の投与は、あらゆる手順により行うことができ、そして例として、それに限定されないが、皮下、静脈内、筋肉内、胸骨内、輸液技術、腹腔内での投与および非経腸投与が挙げられる。
【0043】
I.本発明
本発明は、亜鉛フィンガー−ヌクレオチド結合ポリペプチド、1つまたはそれ以上のこのようなポリペプチドを含む組成物、このようなポリペプチドおよび組成物をコードするポリヌクレオチド、このようなポリヌクレオチドを含む発現ベクター、このようなポリヌクレオチドまたは発現ベクターで形質転換された細胞、およびヌクレオチド構造および/または機能を調節するためのポリペプチド、組成物、ポリヌクレオチドおよび発現ベクターの使用法を提供する。
【0044】
II.ポリペプチド
本発明は、単離および精製された亜鉛フィンガーヌクレオチド結合ポリペプチドを提供する。ポリペプチドは、5から10個までのアミノ酸残基、好ましくは約7個のアミノ酸残基のヌクレオチド結合領域を含む。ヌクレオチド結合領域は、式CNN(式中、Nは、A、C、GまたはTである)の標的ヌクレオチドに優先的に結合する。好ましくは、標的ヌクレオチドは、式CAA、CAC、CAG、CAT、CCA、CCC、CCG、CCT、CGA、CGC、CGG、CGT、CTA、CTC、CTGまたはCTTを有する。
【0045】
本発明のポリペプチドは、自然界には存在しない変異体である。本明細書中で使用される場合、用語「自然界には存在しない」は、例えば、以下の(a)自然界には存在しないアミノ酸配列から構成されるペプチド;(b)それが自然界に存在する場合にはペプチドと関係していない、自然界には存在しない二次構造を有するペプチド;(c)そのペプチドが自然界に存在する生物の種とは通常は結合していない1つまたはそれ以上のアミノ酸を包含するペプチド;(d)ペプチドを構成する1つまたはそれ以上のアミノ酸の立体異性体を含み、その立体異性体が自然界に存在する場合には該ペプチドに関係していない、ペプチド;(e)天然のアミノ酸のもの以外の1つまたはそれ以上の化合物部分を含むペプチド;または(f)自然界に存在するアミノ酸配列の単離された部分(例えば、短縮配列)の1つまたはそれ以上を意味する。本発明のポリペプチドは、単離形態で存在し、そして混入物質を実質的に含まないように精製される。ポリペプチドは、合成の性質のものである。すなわち、ポリペプチドは、天然の源から単離および精製されるか、または当該分野でよく知られる技術を用いて新たに作成される。亜鉛フィンガー−ヌクレオチド結合ポリペプチドは、好ましくは、突然変異誘発形態の亜鉛フィンガータンパク質、または組換えにより作成されたポリペプチドをいう。ポリペプチドは、例えば、第二タンパク質の亜鉛フィンガードメインに連結された1つのタンパク質由来の亜鉛フィンガードメインを含むハイブリッドである場合もある。ドメインは、野生型であるか、または突然変異誘発される場合もある。ポリペプチドとしては、短縮形態の野生型亜鉛フィンガータンパク質が挙げられる。それからポリペプチドが産生されうる亜鉛フィンガータンパク質の例としては、TFIIIAおよびzif268が挙げられる。
【0046】
本発明の亜鉛フィンガー−ヌクレオチド結合ポリペプチドは、そのヘプタマー配列が、標的ヌクレオチドに対する結合特異性を決定する、ポリペプチドのα−ヘリックスドメイン内に特有のヘプタマー(7個のアミノ酸残基の連続配列)を含む。そのヘプタマー配列は、α−ヘリックスドメイン内のあらゆる場所に配置されうるが、しかし、当該分野での慣習に従って残基番号付けした場合には、そのような残基として−1位から6位まで伸長したヘプタマーが好ましい。本発明のポリペプチドは、亜鉛フィンガータンパク質の一部として機能するように、当該分野で知られるあらゆるβ−シートおよびフレームワーク配列を含むことができる。多数の亜鉛フィンガー−ヌクレオチド結合ポリペプチドを作成し、そしてCNNトリプレットを含む標的ヌクレオチドに対する結合特異性について試験した。
【0047】
亜鉛フィンガー−ヌクレオチド結合ポリペプチド誘導体は、短縮または伸長により、野生型亜鉛フィンガータンパク質から、または部位特異的突然変異誘発法により、もしくはそのような手順の組み合わせにより、野生型から誘導されたポリペプチドの変異体として、誘導または生成されうる。用語「短縮された」は、生来の亜鉛フィンガー結合タンパク質に見られる全数より少ない亜鉛フィンガーを含むか、または望ましくない配列が欠失している亜鉛フィンガー−ヌクレオチド結合ポリペプチドをいう。例えば、自然界においては9個の亜鉛フィンガーを含む亜鉛フィンガー−ヌクレオチド結合タンパク質TFIIIAの短縮は、わずか1個から3個の亜鉛フィンガーを有するポリペプチドでありうる。伸長は、さらに亜鉛フィンガーモジュールが付加されている亜鉛フィンガーポリペプチドをいう。例えば、TFIIIAは、3個の亜鉛フィンガードメインを付加することによって、12個のフィンガーまで伸長することができる。さらに、短縮型の亜鉛フィンガー−ヌクレオチド結合ポリペプチドは、1個以上の野生型ポリペプチドに由来する亜鉛フィンガーモジュールを含む場合があり、これにより「ハイブリッド」亜鉛フィンガー−ヌクレオチド結合ポリペプチドを生じる。
【0048】
用語「突然変異誘発された」は、タンパク質をコードするDNAのランダムまたは部位特異的突然変異誘発を達成するために公知方法のいずれかを行うことによって得られた亜鉛フィンガー由来のヌクレオチド結合ポリペプチドをいう。例えば、TFIIIAでは、突然変異誘発は、コンセンサス配列の1つまたはそれ以上の反復中の非保存残基を置換するように行うことができる。短縮型の亜鉛フィンガー−ヌクレオチド結合タンパク質も、突然変異誘発させることができる。亜鉛フィンガー−ヌクレオチド結合モチーフを含むヌクレオチド配列の機能を阻害するために、本発明によって短縮、伸長および/または突然変異誘発されうる既知の亜鉛フィンガー−ヌクレオチド結合ポリペプチドの例としては、TFIIIAおよびzif268が挙げられる。当業者らは、他の亜鉛フィンガー−ヌクレオチド結合タンパク質を知っている。
【0049】
1つの実施態様では、本発明のポリペプチドは、配列番号1〜25のいずれかと同じヌクレオチド結合特性を有しているアミノ酸残基配列を有している結合領域を含む。どのようにそれらの結合特性が決定されるかについての詳細な説明は、本明細書中の以下の実施例に見ることができる。このようなポリペプチドは、配列番号1〜25のいずれかと、ヌクレオチド標的への結合について競合する。すなわち、好ましいポリペプチドは、競合様式で、配列番号1〜25のいずれかの結合を置き換える結合領域を含む。競合結合を決定する手順は、当該分野でよく知られている。好ましくは、結合領域は、配列番号1〜25のいずれかのアミノ酸残基配列を有する。
【0050】
本発明のポリペプチドは、当該分野でよく知られる多様な標準的技術を使用して作成することができる。実施例において以後に詳細に開示するように、亜鉛フィンガータンパク質のファージディスプレイライブラリーを作成し、そして配列特異的タンパク質の濃縮に有利である条件で選択した。多数の配列を認識する亜鉛フィンガードメインには、ファージ選択データおよび構造情報の両方によって導かれる部位特異的突然変異誘発による精製が必要であった。
【0051】
先に、本発明者らは、マウス転写因子Zif268の変異体であるC7に基づいたファージディスプレイ選択によって単離し、そして部位特異的突然変異誘発によって精製した5’−GNN−3’型のDNA配列の各々を特異的に認識する16個の亜鉛フィンガードメインの特徴付けを報告した[Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁;Dreierら、(2000年)J. Mol. Biol. 303巻、489−502頁;および米国特許番号第6,140,081号、その開示を、参照により本明細書の一部とする。]。全ての場合に3つの残基の全てがDNA塩基と接触するというわけではないが、一般に、Cys2−His2型の亜鉛フィンガードメインの特異的DNA認識は、各α−ヘリックスのアミノ酸残基1、3および6により仲介される。1つの優勢な交差サブサイト相互作用は、認識ヘリックスの2位より観察された。Asp2は、以下の3bpサブサイトのそれぞれ、5’チミンまたはグアニンの相補的アデニンまたはシトシンと直接接触させることによって、亜鉛フィンガードメインの結合を安定化することが示されている。これらのモジュール以外での相互作用は、標的部位重複と見なされている。さらに、伸長された結合部位を作成する3bpサブサイトの外側でヌクレオチドとのアミノ酸の他の相互作用が報告されている[Pavletichら、(1991年)Science 252巻(5007)、809−817頁;Elrod−Ericksonら、(1996年)Structure 4巻(10)、1171−1180頁;Isalanら、(1997年)Proc Natl Acad Sci USA 94巻(11)、5617−5621頁]。
【0052】
グアニンまたはチミン以外の5’ヌクレオチドに結合する亜鉛フィンガードメインについての以前に報告されたファージディスプレイライブラリー選択は、フィンガー−3認識ヘリックスRSD−E−LKR(配列番号26)(図1)の2位でのアスパラギン酸による交差サブサイト相互作用により、不成功に終わった。人工的な転写因子の構築のための亜鉛フィンガードメインの利用可能性を拡大するために、5’−ANN−3’型のDNA配列を特異的に認識するドメインが選択された(2001年2月21日に出願された米国特許出願番号第09/791,106号、その開示を、参照により本明細書の一部とする。)。他のグループは、4個の5’−ANN−3’サブサイト、5’−AAA−3’、5’−AAG−3’、5’−ACA−3’、および5’−ATA−3’を認識するドメインの特徴付けに至った連続的な選択法を記述した[Greismanら、(1997年)Science 275巻(5300)、657−661頁;Wolfeら、(1999年)J Mol Biol 285巻(5)、1917−1934頁]。本開示は、標的部位重複を排除することによって、CNN部位を認識する亜鉛フィンガードメインを選択するアプローチを使用する。最初に、サブサイト5’−GCG−3’に結合するC7のフィンガー3(RSD−E−RKR)(配列番号27)を、2位にアスパラギン酸を含まないドメインと交換した(図1)。フィンガーの2位でトリプレット5’−GAT−3’に高い特異性で結合することが以前に特徴付けられているヘリックスTSG−N−LVR(配列番号28)を、優れた候補と考えた。フィンガーの3位に、C7のフィンガー1および2、ならびに5’−GAT−3’−認識ヘリックスを含むこの3−フィンガータンパク質(C7.GAT;図1A、下部パネル)を、元のC7タンパク質(C7.GCG;図1B)との比較において、多標的ELISAによって、様々のフィンガー−2サブサイトを有する標的に対するDNA結合特異性について分析した。両方のタンパク質は、5’−TGG−3’サブサイトに結合した(C7.GCGは、以前に報告されているフィンガー3のAsp2によるチミンまたはグアニンの5’特異化により、5’−GGG−3’にも結合することに留意のこと)。フィンガー−2サブサイトの5’ヌクレオチドの認識を、16個全ての5’−XNN−3’標的部位(X=アデニン、グアニン、シトシンまたはチミン)の混合物を使用して評価した。実際に、元来のC7.GCGタンパク質が、フィンガー2の5’位置でグアニンまたはチミンを指定する一方で、C7.GATは、塩基を指定せず、それにより5’チミンに相補的なアデニンに対する交差サブサイト相互作用を破壊することが示される。部位特異的突然変異誘発により、Asp2が、Ala2に置換されているZif268の変異体について同様の効果が以前に報告されている[Isalanら、(1997年)Proc Natl Acad Sci USA 94巻(11)、5617−5621頁;Dreierら、(2000年)J. Mol. Biol. 303巻、489−502頁]。ゲル移動性のシフトの分析によって測定されたC7.GATの親和性が、C7.GCGについての0.5nMと比較して約400nMと比較的低いことが分かっており[Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁]、そしてこれは、フィンガー3におけるAsp2の欠如に一部起因する可能性がある。
【0053】
3−フィンガータンパク質C7.GATに基づいて、ファージディスプレイベクターpComb3H中に、ライブラリーが構築された[Barbasら、(1991年)Proc. Natl. Acad. Sci. USA 88巻、7978−7982頁;Raderら、(1997年)Curr. Opin. Biotechnol. 8巻(4)、503−508頁]。ランダム化は、VNSコドンドーピング攻略法(V=アデニン、シトシンまたはグアニン、N=アデニン、シトシン、グアニンまたはチミン、S=シトシンまたはグアニン)を使用して、フィンガー2のα−ヘリックスの-1、1、2、3、5および6位に関して行われた。これは、それぞれのランダム化されたアミノ酸位置について24の可能性を与えたのに対して、芳香族アミノ酸Trp、Phe、およびTyrならびに停止コドンを、この攻略法においては排除した。Leuは、Cys2−His2型の亜鉛フィンガードメインの認識ヘリックスの4位に優先的に見られるので、この位置はランダム化されなかった。ER2537細胞(New England Biolabs)へのこのライブラリーの形質転換の後、ライブラリーは、1.5×109個の構成要素を含んだ。これは、必要なライブラリーの大きさの60倍であり、そして全てのアミノ酸組合わせを含むのに十分であった。
【0054】
ビオチニル化されていないコンペティターDNAの存在下で、16個の5’−GAT−CNN−GCG−3’(配列番号29)のそれぞれに対してビオチニル化したヘアピン標的オリゴヌクレオチドの各々に結合させて、亜鉛フィンガー−ディスプレイイングファージの6回の選択を行った。ビオチニル化された標的オリゴヌクレオチドの量を減少させ、そしてコンペティターオリゴヌクレオチド混合物の量を増加させることによって、選択のストリンジェンシーをそれぞれの回において増大させた。6回目の段階で、標的濃度は、通常18nMであり、5’−ANN−3’、5’−GNN−3’、および5’−TNN−3’コンペティター混合物は、それぞれ、各オリゴヌクレオチドプールについて5倍過剰であり、そして特異的5’−CNN−3’混合物(標的配列を排除する)は、10倍過剰であった。ビオチニル化した標的オリゴヌクレオチドに結合するファージを、ストレプトアビシンでコーティングした磁性ビーズに捕捉させることにより回収した。クローンは、通常、6回目の選択の後に分析した。
【0055】
III.組成物
別の態様においては、本発明は、5’−(CNN)n−3’(式中、nは、1より大きな整数である)として定義されるヌクレオチド標的モチーフに特異的に結合するような様式で作動可能であるように連結された複数の亜鉛フィンガー−ヌクレオチド結合ポリペプチドを提供する。標的モチーフは、任意の長いヌクレオチド配列(例えば、3から13個まで、またはそれ以上のTNN、GNN、ANNまたはNNNの配列)内に配置されうる。好ましくは、nは、2から約12までの整数であり、そしてさらに好ましくは2から6までである。好ましくは、個々のポリペプチドを、オリゴペプチドリンカーと連結させる。このようなリンカーは、自然界に存在する亜鉛フィンガータンパク質中に見られるリンカーに似ているのが好ましい。本発明に使用するための好ましいリンガーは、アミノ酸残基配列TGEKP(配列番号30)である。グリシンまたはセリン反復のような他のリンカーは、ペプチド(例えば、一本鎖抗体ドメイン)を連結させるためのものであることが当該分野でよく知られており、そして本発明の組成物中で使用することができる。
【0056】
本発明のポリペプチドまたは組成物は、1つまたはそれ以上の官能性ペプチドに作動可能であるように連結することができる。このような官能性ペプチドは、当該分野でよく知られており、そしてリプレッサーもしくは活性化ドメインのような転写制御因子、または他の機能を有しているペプチドであることもできる。例でありそして好ましいこのような官能性ペプチドは、ヌクレアーゼ、メチラーゼ、核局在化ドメイン、およびエンドヌクレアーゼまたはエクトヌクレアーゼのような制限酵素である(例えば、ChandrasegaranおよびSmith、Biol. Chem.、380巻:841−848頁、1999年を参照)。
【0057】
例示的な抑制ドメインペプチドは、ets2リプレッサー因子(ERF)のアミノ酸473から530までによって定義されるERFリプレッサードメイン(ERD)である(Sgouras, D. N.、Athanasiou, M. A.、Beal, G. J., Jr.、Fisher, R. J.、Blair, D. G.およびMavrothalassitis, G. J.、(1995年)EMBO J. 14巻、4781−4793頁)。このドメインは、etsファミリーの転写因子の活性に対するERFの拮抗効果を仲介する。合成リプレッサーは、亜鉛フィンガータンパク質のN−またはC−末端へのこのドメインの融合によって構築される。第二のリプレッサータンパク質は、Krueppel−結合ボックス(KRAB)ドメインを使用して作成される(Margolin, J. F.、Friedman, J. R.、Meyer, W.、K.−H.、Vissing, H.、Thiesen, H.−J.およびRauscher III, F. J.、(1994年)Proc. Natl. Acad. Sci. USA 91巻、4509−4513頁)。このリプレッサードメインは、亜鉛フィンガータンパク質のN末端に共通して見られ、そしておそらく、RINGフィンガータンパク質KAP−1(Friedman, J. R.、Fredericks, W. J.、Jensen, D. E.、Speicher, D. W.、Huang, X.−P.、Neilson, E. G.およびRauscher III,F. J.(1996年)Genes & Dev. 10巻、2067−2078頁)と相互作用させることにより、距離および配向には依存しない様式(Pengue, G.およびLania, L.、(1996年)Proc. Natl. Acad. Sci. USA 93巻、1015−1020頁)でのTATA依存性転写に対するその抑制活性を発揮する。本発明者らは、亜鉛フィンガータンパク質KOX1のアミノ酸1から97の間に見られるKRABドメインを利用した(Margolin, J. F.、Friedman, J. R.、Meyer, W., K.−H.、Vissing, H.、Thiesen, H.−J.およびRauscher III, F. J.(1994年)Proc. Natl. Acad. Sci. USA 91巻、4509−4513頁)。この場合には、亜鉛フィンガーポリペプチドとのN末端融合が構築される。最終的に、抑制のためのヒストン脱アセチル化の有用性を調べるために、Mad mSIN3相互作用ドメイン(SID)のアミノ酸1から36までを、亜鉛フィンガータンパク質のN末端に融合させる(Ayer, D. E.、Laherty, C. D.、Lawrence, Q. A.、Armstrong, A. P.およびEisenman, R. N.、(1996年)、Mol. Cell. Biol. 16巻、5772−5781頁)。この小さいドメインは、転写因子MadのN末端に見られ、そしてmSIN3と相互作用することによるその転写抑制を仲介する原因であり、そしてそれは、順に、コリプレッサーN−CoRと、そしてヒストンデアセチラーゼmRPD1と相互作用する(Heinzel, T.、Lavinsky, R. M.、Mullen, T.−M.、Ssderstrsm, M.、Laherty, C. D.、Torchia, J.、Yang, W.−M.、Brard, G.、Ngo, S. D.ら(1997年)Nature 387巻、43−46頁)。遺伝子特異的活性化を試験するために、亜鉛フィンガーポリペプチドを、単純ヘルペスウイルスVP16タンパク質のアミノ酸413から489までに(Sadowski, I.、Ma, J.、Triezenberg, S.およびPtashne, M.、(1988年)Nature 335巻、563−564頁)、またはVP64と呼ばれるVP16の最小活性化ドメインの人工的な四量体反復(Seipel, K.、Georgiev, O.およびSchaffner, W.(1992年)EMBO J. 11巻、4961−4968頁)に融合させることによって、転写活性化因子が作成される。
【0058】
上記に示すような本発明のポリヌクレオチドは、1つまたはそれ以上の転写調節または制御因子に作動可能であるように連結させることができる。転写活性化因子または転写サプレッサーまたはリプレッサーのような調節因子は、当該分野でよく知られている。このような因子にポリペプチドを作動可能であるように連結させるための手順もまた、当該分野でよく知られている。例でありそして好ましいこのような因子、および遺伝子発現を調節するためのそれらの使用法を、以下に詳細に検討する。
【0059】
遺伝子特異的転写制御因子として亜鉛フィンガータンパク質を使用する案を試験するために、6−フィンガータンパク質を、多数のエフェクタードメインに融合させる。3つのヒト由来のリプレッサードメインのいずれかを、亜鉛フィンガータンパク質に取り付けることにより、転写リプレッサーを生じさせる。第一のリプレッサータンパク質は、ets2リプレッサー因子(ERF)のアミノ酸473から530までにより定義されるERFリプレッサードメイン(ERD)(Sgouras, D. N.、Athanasiou, M. A.、Beal, G. J., Jr.、Fisher, R. J.、Blair, D. G.およびMavrothalassitis, G. J.、(1995年)EMBO J. 14巻、4781−4793頁)を使用して作成される。このドメインは、etsファミリーの転写因子の活性に対するERFの拮抗効果を仲介する。亜鉛フィンガータンパク質のC末端へのこのドメインの融合により、合成リプレッサーを構築する。Kruepple結合ボックス(KRAB)ドメイン(Margolin, J. F.、Friedman, J. R.、Meyer, W., K.−H.、Vissing, H.、Thiesen, H.−J.およびRauscher III, F. J.、(1994年)Proc. Natl. Acad. Sci. USA 91巻、4509−4513頁)を使用して、第二のリプレッサータンパク質を作成する。このリプレッサードメインは、亜鉛フィンガータンパク質のN末端で共通して見られ、そしておそらく、RINGフィンガータンパク質KAP−1(Friedman, J. R.、Fredericks, W. J.、Jensen, D. E.、Speicher, D. W.、Huang, X.−P.、Neilson, E. G.およびRauscher III, F. J.(1996年)Genes & Dev. 10巻、2067−2078頁)と相互作用することにより、距離および配向には依存しない様式で(Pengue, G.およびLania, L.、(1996年)Proc. Natl. Acad. Sci. USA 93巻、1015−1020頁)TATA依存性転写に対するその抑制活性を発揮する。本発明者らは、亜鉛フィンガータンパク質KOX1のアミノ酸1から97の間に見られるKRABドメインを利用する(Margolin, J. F.、Friedman, J. R.、Meyer, W., K.−H.、Vissing, H.、Thiesen, H.−J.およびRauscher III, F. J.(1994年)Proc. Natl. Acad. Sci. USA 91巻、4509−4513頁)。この場合には、6−フィンガータンパク質とのN末端融合体を構築する。最終的に、抑制のためのヒストン脱アセチル化の有用性を調べるために、Mad mSIN3相互作用ドメイン(SID)のアミノ酸1から36までが、亜鉛フィンガータンパク質のN末端に融合させられる(Ayer, D. E.、Laherty, C. D.、Lawrence, Q. A.、Armstrong, A. P.およびEisenman, R. N.、(1996年)、Mol. Cell. Biol. 16巻、5772−5781頁)。この小さいドメインは、転写因子MadのN末端で見られ、そしてmSIN3との相互作用によるその転写抑制を仲介する原因であり、そしてそれは、順に、コリプレッサーN−CoRと、そしてヒストンデアセチラーゼmRPD1と相互作用する(Heinzel, T.、Lavinsky, R. M.、Mullen, T.−M.、Ssderstrsm, M.、Laherty, C. D.、Torchia, J.、Yang, W.−M.、Brard, G.、Ngo, S. D.および等(1997年)Nature 387巻、43−46頁)。
【0060】
遺伝子特異的活性化を試験するために、亜鉛フィンガータンパク質を、単純ヘルペスウイルスVP16タンパク質のアミノ酸413から489までに(Sadowski, I.、Ma, J.、Triezenberg, S.およびPtashne, M.、(1988年)Nature 335巻、563−564頁)、またはVP64と呼ばれるVP16の最小活性化ドメインDALDDFDLDML(配列番号36)の人工的な四量体反復(Seipel, K.、Georgiev, O.およびSchaffner, W.(1992年)EMBO J. 11巻、4961−4968頁)に融合させることによって、転写活性化因子を生じさせる。
【0061】
ルシフェラーゼレポーター遺伝子に結合したerbB−2プロモーターのフラグメントを含むレポーター構築物を生じさせて、本発明者らが設計した転写制御因子の特異的活性を試験する。標的レポータープラスミドは、ATG開始コドンに関してヌクレオチド−758から−1を含む。プロモーターフラグメントは、以前の観察(Hudson, L. G.、Ertl, A. P.およびGill, G. N.、(1990年)J. Biol. Chem. 265巻、4389−4393頁)と一致して、HeLa細胞に一時的にトランスフェクトされた場合に、同様の活性を示す。erbB−2プロモーター活性に対する亜鉛フィンガーリプレッサードメイン融合構築物の作用を試験するために、HeLa細胞を、亜鉛フィンガー発現ベクターおよびルシフェラーゼレポーター構築物で、一次的に同時トランスフェクトさせる。明らかな抑制が、それぞれの構築物について観察される。転写の活性化を仲介する遺伝子特異的ポリダクチルタンパク質の有用性を、同じ2つのレポーター構築物を使用して調べる。
【0062】
本明細書中のデータは、新規の9bpおよび18bpのDNA標的部位に結合することができる亜鉛フィンガータンパク質を、5’−CNN−3’部位を認識する予め定義されたドメインを使用して迅速に作成することができることを示す。この情報は、それぞれが18bpのDNA配列と結合することができる166あるいは1700万個の新規の6−フィンガータンパク質の作成に十分である。新規の亜鉛フィンガータンパク質の構築のためのこの迅速な方法論は、他の研究者によって提案された亜鉛フィンガードメインの連続的な作成および選択(Greisman, H. A.およびPabo, C. O.(1997年)Science 275巻、657−661頁)よりも多くの利点を有し、そして上に定義するような標的重複の問題の可能性が、5’−CNN−3’部位を標的にするタンパク質において回避することができることを示唆する構造の情報を利用する。複雑でありそして十分に研究されたerbB−2プロモーターおよび生存しているヒト細胞を使用して、データは、適切なエフェクタードメインとともに与えられた場合には、これらのタンパク質は、発現を刺激または活性化し、そしてこれらの実験のバックグランドのレベル以下までの段階的なレベルの減少を生じるために使用することができることを示す。
【0063】
IV.ポリヌクレオチド、発現ベクターおよび形質転換細胞
本発明は、亜鉛フィンガー−ヌクレオチド結合ポリペプチドをコードするヌクレオチド配列を含む。生来の、短縮型、および伸長型のポリペプチドを含む本発明の亜鉛フィンガー−ヌクレオチド結合ポリペプチドをコードするDNA配列は、いくつかの方法によって得ることができる。例えば、当該分野で十分に知られているハイブリダイゼーション手順を使用して、DNAを単離することができる。これらとしては、それに限定されないが、(1)共通のヌクレオチド配列を検出するための、ゲノムまたはcDNAライブラリーへのプローブのハイブリダイゼーション;(2)共通の構造上の特徴を検出するための発現ライブラリーの抗体スクリーニング;および(3)ポリメラーゼ連鎖反応(PCR)による合成が挙げられる。本発明のRNA配列は、当該分野で知られる方法により得ることができる(例えば、Current Protocols in Molecular Biology、Ausubelら編、1989年を参照)。
【0064】
本発明の亜鉛フィンガー−ヌクレオチド結合ポリペプチドをコードする特異的DNA配列の作成は、(1)ゲノムDNAからの二本鎖DNA配列の単離;(2)目的のポリペプチドについての必要なコドンを提供するDNA配列の化学的製造;および(3)真核生物の供与体細胞から単離されたmRNAの逆転写による二本鎖DNA配列のインビトロ合成によって得ることができる。後者の場合には、一般にcDNAと呼ばれるmRNAの二本鎖DNA相補鎖が、最終的に形成される。組換え手順での使用のための特異的DNA配列を生じさせるこれら3つの方法のうち、ゲノムDNAの単離は最も一般的でない。これは、イントロンの存在により、哺乳類ペプチドの微生物での発現を得ることが望ましい場合に、特に一般的ではない。亜鉛フィンガー由来のDNA結合ポリペプチドを得るためには、DNA配列の合成が、所望のポリペプチド産物のアミノ酸残基の全配列が知られている場合に、最も頻繁に選択される方法である。所望のポリペプチドのアミノ酸残基の全配列が知られていない場合、DNA配列の直接合成は不可能であり、そして選択される方法はcDNA配列の形成である。そのうち、目的のcDNA配列を単離するための標準的な手順は、高レベルの遺伝子発現を示す供与体細胞中に豊富に存在するmRNAの逆転写に由来するプラスミド担持cDNAライブラリーの形成である。ポリメラーゼ連鎖反応技術と組合わせて使用される場合には、極めて少量の発現産物をクローン化することができる。ポリペプチドのアミノ酸配列の重要な部分が既知である場合には、標的cDNAに存在すると推定される配列を複製する標識された一本または二本鎖DNAまたはRNAプローブ配列の産生が、一本鎖形態に変性させられたクローン化されたcDNAのコピーに対して行われるDNA/DNAハイブリダイゼーション手順において使用される場合がある(Jayら、Nucleic Acid Research 11巻:2325頁、1983年)。
【0065】
V.医薬組成物
別の態様においては、本発明は、医薬上許容される担体と組合わせて、治療上有効な量の亜鉛フィンガー−ヌクレオチド結合ポリペプチドまたは組成物、または亜鉛フィンガー−ヌクレオチド結合ポリペプチドをコードする治療上有効な量のヌクレオチド配列を包含する医薬組成物を提供する。
【0066】
本明細書中で使用される場合、それらが、組成物、担体、希釈剤および試薬について言及する場合には、用語「医薬上許容される」、「生理学的に寛容な」およびそれらの文法的語尾変化は、互換的に使用され、そしてこれらの物質を、組成物の投与を禁じる程度までである悪心、眩暈感、胃の不調などのような望ましくない生理学的な副作用を生じることなく、ヒトに投与することができることを表す。
【0067】
本明細書中の溶解または分散される有効成分を含む薬理学的組成物の製造は、当該分野で十分に知られている。典型的には、このような組成物は、液体溶液または懸濁液、水性または非水性であるかのいずれかとして、滅菌の注射可能なものとして製造される。しかし使用の前に液体とする、溶液または懸濁用の固体の形態を製造することもできる。製造物は、乳化させることもできる。有効成分は、医薬上許容される、そして有効成分と適合性であり、そして本明細書中に記載されている治療方法での使用に適切な量の賦形剤と混合することもできる。例えば、適切な賦形剤は、水、生理食塩水、デキストロース、グリセロール、エタノールなど、およびそれの組み合わせである。さらに、望ましい場合には、組成物は、湿潤剤または乳化剤、ならびにpH緩衝剤および有効成分の効力を増強するもののような補助的物質を少量含むことができる。
【0068】
本発明の治療用医薬組成物は、本明細書に記載の成分の医薬上許容される塩を含むことができる。医薬上許容される塩は、例えば、塩酸またはリン酸のような無機酸、または酢酸、酒石酸、マンデル酸などの有機酸で形成される酸付加塩(ポリペプチドの遊離のアミノ基で形成される)を含む。遊離のカルボキシル基で形成される塩は、例えば、ナトリウム、カリウム、アンモニウム、カルシウムまたは水酸化第二鉄のような無機塩基、およびイソプロピルアミン、トリメチルアミン、2−エチルアミノエタノール、ヒスチジン、プロカインなどの有機塩基から誘導することもできる。生理学的に寛容な担体は、当該分野でよく知られている。液体の担体の例は、有効成分および水に加えてなにも材料を含まないか、または生理学的pH値のリン酸ナトリウム、生理食塩水、または両方、例えばリン酸緩衝生理食塩水のような緩衝剤を含む滅菌の水溶液である。なお、さらに、水性担体は、1つ以上の緩衝塩、ならびに塩化ナトリウムおよび塩化カリウムのような塩、デキストロース、プロピレングリコール、ポリエチレングリコールおよび他の溶質を含むこともできる。液体組成物は、水に加えて、そして水以外の液相を含むこともできる。このようなさらなる液相の例は、グリセリン、綿実油のような植物油、オレイン酸エチルのような有機エステル、および水−油エマルションである。
【0069】
VI.使用法
1つの実施態様においては、本発明の方法は、CNN標的配列を含むヌクレオチド配列の発現を調節(阻害または抑制)するプロセスを含む。この方法は、モチーフに結合する本発明の亜鉛フィンガー−ヌクレオチド結合ポリペプチドの有効量とヌクレオチドを接触させる段階を包含する。ヌクレオチド配列がプロモーターである場合には、この方法は、亜鉛フィンガー−DNA結合モチーフを含むプロモーターの転写のトランス活性化を阻害することを包含する。用語「阻害する」は、例えば、亜鉛フィンガー−ヌクレオチド結合モチーフを含む、プロモーターに作動可能であるように連結される構造遺伝子の転写活性化のレベルの抑制をいう。さらに、亜鉛フィンガー−ヌクレオチド結合ポリペプチドは、構造遺伝子内またはRNA配列中の標的に結合することができる。
【0070】
用語「有効量」は、予め活性化されたプロモーターの不活性化を生じる量、または標的ヌクレオチドを含むプロモーターの不活性化を生じる量、または構造遺伝子の転写またはRNAの翻訳をブロックする量を包含する。必要な亜鉛フィンガー由来のヌクレオチド結合ポリペプチドの量は、既存のタンパク質/プロモーター複合体中の生来の亜鉛フィンガー−ヌクレオチド結合タンパク質を置換するのに必要な量、または生来の亜鉛フィンガー−ヌクレオチド結合タンパク質と競合して、プロモーター自体と複合体を形成するのに必要な量のいずれかである。同様に、構造遺伝子またはRNAをブロックするために必要な量は、それぞれ、RNAポリメラーゼに結合し、そしてRNAポリメラーゼが遺伝子上で読み取るのをブロックする量、または翻訳を阻害する量である。好ましくは、この方法は、細胞内で行われる。プロモーターまたは構造遺伝子を機能的に不活性化することにより、転写または翻訳は抑制される。標的配列を含む細胞ヌクレオチド配列に結合またはそれと「接触する」ための有効量の阻害タンパク質の送達は、レトロウイルスベクターまたはリポソームによるような本明細書中に記載されている機構の1つ、あるいは当該分野でよく知られている他の方法によって行うことができる。用語「調節する」は、機能の抑制、増強または誘発をいう。例えば、本発明の亜鉛フィンガー−ヌクレオチド結合ポリペプチドは、プロモーター内の標的配列に結合し、それによりプロモーターヌクレオチド配列に作動可能であるように連結された遺伝子の転写を増強または抑制することによって、プロモーター配列を調節することができる。別の方法として、調節は、亜鉛フィンガー−ヌクレオチド結合ポリペプチドが、構造遺伝子に結合し、そしてDNA依存性RNAポリメラーゼが遺伝子を読み取ることをブロックし、したがって遺伝子の転写を阻害することを特徴とする、遺伝子の転写の阻害を含みうる。構造遺伝子は、例えば、正常な細胞性遺伝子または癌遺伝子であることもできる。別の方法として、調節は、転写産物の翻訳の阻害を含みうる。
【0071】
遺伝子のプロモーター領域は、構造遺伝子に対して一般的には5’にある調節要素を含む。遺伝子が活性化されるべきである場合、転写因子として知られるタンパク質は、遺伝子のプロモーター領域に結合させられる。この構築物は、酵素がDNAからRNAへの二次遺伝子セグメントを転写することを可能にすることによって、「スイッチを入れる」ことを真似る。ほとんどの場合に、生じるRNA分子は、特異的タンパク質の合成のためのテンプレートとして役割を果たす;ときどき、RNA自体が最終産物である。
【0072】
プロモーター領域は、正常な細胞プロモーターまたは、例えば、腫瘍プロモーターである場合がある。腫瘍プロモーターは、一般に、ウイルス由来のプロモーターである。例えば、レトロウイルスの長い末端反復配列(LTR)は、本発明の亜鉛フィンガー結合ポリペプチド変異体についての標的でありうるプロモーター領域である。ヒトT細胞向性ウイルス(HTLV)1および2、またはヒト免疫不全ウイルス(HIV)1または2のような病原体を含むレンチウイルスの群のメンバーに由来するプロモーターは、本発明の亜鉛フィンガー結合ポリペプチドによる転写調節のために標的化される可能性があるウイルス性プロモーター領域の例である。
【0073】
標的CNNヌクレオチド配列を、遺伝子の転写領域に、または発現配列タグ中に配置することができる。標的配列を含む遺伝子は、植物遺伝子、動物遺伝子またはウイルス遺伝子であることができる。遺伝子は、真核生物の遺伝子、または細菌遺伝子のような原核生物の遺伝子でありうる。動物の遺伝子は、ヒト遺伝子を含めた哺乳類遺伝子でありうる。好ましい実施態様では、ヌクレオチドの発現を調節する方法は、ポリペプチドをコードするポリヌクレオチドを有する標的ヌクレオチド配列または本発明の組成物を含む細胞を形質転換させることによって行われる。好ましくは、コードポリヌクレオチドは、標的細胞中での使用に適切な発現ベクターに含まれる。適切な発現ベクターは、当該分野でよく知られている。
【0074】
CNN標的は、他の標的トリプレット配列とのあらゆる組合わせで存在する。すなわち、特定のCNN標的は、伸長されたCNN配列(例えば、[CNN]2−12)の一部として、または(GNN)1−12、(ANN)1−12、(TNN)1−12、または(NNN)1−12のような他のあらゆる伸長された配列の一部として存在することができる。以下の実施例は、本発明の好ましい実施態様を示し、決して明細書および特許請求の範囲を限定しない。
【実施例1】
【0075】
亜鉛フィンガーライブラリーの構築およびファージディスプレイによる選択
亜鉛フィンガーライブラリーの構築を、以前に記述されたC7タンパク質を基礎とした([Wuら、(1995年)PNAS 92巻、344−348頁];図1A、上部パネル)。5’−GCG−3’サブサイトを認識するフィンガー3を、フィンガー3をコードするプライマー(5’−GAGGAAGTTTGCCACCAGTGGCAACCTGGTGAGGCATACCAAAATC−3’)(配列番号31)およびpMal特異的プライマー(5’−GTAAAACGACGGCCAGTGCCAAGC−3’)(配列番号32)を使用する重複PCR法により、5’−GAT−3’サブサイト[Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁]に結合するドメインで置換した。PCR重複伸長による亜鉛フィンガーライブラリーのランダム化は、基本的には記載されているとおりに行った[Wuら、(1995年)PNAS 92巻、344−348頁;Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁]。ライブラリーを、ファージミドベクターpComb3H[Raderら、(1997年)Curr. Opin. Biotechnol. 8巻(4)、503−508頁]に連結した。ファージの成長および沈殿を、以前に記載されているように行った[Barbasら、(1991年)Methods:Companion Methods Enzymol. 2巻(2)、119−124頁;Barbasら、(1991年)Proc. Natl. Acad. Sci. USA 88巻、7978−7982頁;Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁]。結合反応を、500mlの容量の亜鉛緩衝液A(ZBA:10mM Tris、pH7.5/90mM KCl/1mM MgCl2/90mM ZnCl2)/0.2%BSA/5mM DDT/1% Blotto(Biorad)/100mlの沈殿させたファージ(1013コロニー形成単位)を含む20mg二本鎖の剪断したニシンの精子DNA中で行った。1時間、4℃で、ファージを、ビオチニル化されていないコンペティターオリゴヌクレオチドに結合させ、その後、ビオチニル化した標的オリゴヌクレオチドを添加した。結合を4℃で、一晩継続して行った。1時間、50mlストレプトアビジンでコーティングした磁性ビーズ(Dynal;ZBA中の5% Blottoでブロックした)とともにインキュベーションした後、ビーズを、500ml ZBA/2% Tween 20/5mM DTTで10回洗浄し、そしてTweenを含まない緩衝液で1回洗浄した。30分間、室温で、TBS(Tris緩衝生理食塩水)中の25mlトリプシン(10mg/ml)中でのインキュベーションにより、結合ファージの溶出を行った。ヘアピンコンペティターオリゴヌクレオチドは、配列5’−GGCCGCN’N’N’ATCGAGTTTTCTCGATNN NGCGGCC−3’(配列番号33)(標的オリゴヌクレオチドをビオチニル化した)(ここで、NNNは、フィンガー−2サブサイトオリゴヌクレオチドを表し、N’N’N’は、それの相補的塩基である)を有した。標的オリゴヌクレオチドは、通常、最初の3回の選択では、72nMで添加され、その後、6回目および最後の回においては36nMおよび18nMに減少させた。コンペティターとして、5’−TGG−3’フィンガー−2サブサイトオリゴヌクレオチドを、親クローンと競合させるために使用した。それぞれ、標的部位を除き、15個のフィンガー−2 5’−CNN−3’サブサイトの等モル混合液、および型5’−ANN−3’、5’−GNN−3’、および5’−TNN−3’の各フィンガー−2サブサイトのコンペティター混合液を、連続して行ったそれぞれの回の選択において量を増大させながら添加した。通常は、非特異的5’−CNN−3’コンペティター混合物を初回に添加した。
【実施例2】
【0076】
多標的特異性のアッセイおよびゲル移動度のシフトの分析
亜鉛フィンガーコード配列を、pComb3Hから、改変された細菌発現ベクターpMal−c2(New England Biolabs)にサブクローニングした。XL1−Blue(Stratagene)への形質転換の後、亜鉛フィンガー−マルトース結合タンパク質(MBP)融合体を、1nMのイソプロピルb−D−チオガラクトシド(IPTG)の添加の後に発現させた。これらの細菌培養物の凍結/融解抽出物を、ストレプトアビジンでコーティングされた96ウェルプレート(Pierce)に1:2希釈でアプライし、そしてそれぞれ、16個の5’−GAT CNN GCG−3’(配列番号34)標的部位の各々に対するDNA結合特異性を試験した。ELISA(酵素結合免疫吸着アッセイ)を、基本的には記載されているとおりに行った[Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁;Dreierら、(2000年)J. Mol. Biol. 303巻、489−502頁]。マウスの抗MBP(マルトース結合タンパク質)抗体(Sigma、1:1000)とともにインキュベーションした後、アルカリフォスファターゼに結合させられたヤギの抗マウス抗体(Sigma、1:1000)を作用させた。アルカリフォスファターゼ基質(Sigma)の添加後に検出し、そしてOD405を、SOFTMAX2.35(Molecular Devices)で測定した。
【0077】
基本的には記載されているように、精製されたタンパク質(Protein Fusion and Purification Systems, New England Biolabs)を用いて、ゲルシフト分析を行った。
【実施例3】
【0078】
フィンガー2の部位特異的突然変異誘発
フィンガー−2突然変異体を、記載されているようにPCRによって構築した[Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁;Dreierら、(2000年)J. Mol. Biol. 303巻、489−502頁]。PCRテンプレートとして、5’−TGG−3’フィンガー2および5’−GAT−3’フィンガー3を含むライブラリークローンを使用した。突然変異誘発したフィンガー2および5’−GAT−3’フィンガー3を含むPCR産物を、改変されたpMal−c2ベクター中に、C7のフィンガー1とインフレームで、NsiIおよびSpeI制限部位を介して(New England Biolabs)にサブクローニングした。記載されているように、SP1Cフレームワークを使用してフィンガー−2スティッチェリー(stitchery)によって、3フィンガータンパク質を構築した[Beerliら、(1998年)Proc Natl Acad Sci USA 95巻(25)、14628−14633頁]。この作業でにおいて作成したタンパク質は、5’−GNN−3’DNA配列を認識するヘリックス[Segalら、(1999年)Proc Natl Acad Sci USA 96巻(6)、2758−2763頁]、ならびに本明細書中に記載されている5’−ANN−3’および5’−TAG−3’ヘリックスを含んだ。6フィンガータンパク質を、適合性XmaIおよびBsrFI制限部位により組み立てた。IPTGで誘導した凍結/融解細菌抽出物により、DNA結合特性の分析を行った。
【実施例4】
【0079】
一般的方法
トランスフェクションおよびルシフェラーゼアッセイ
40〜60%の集密度でHeLa細胞を使用した。24ウェルプレート中の160ngレポータープラスミド(pGL3−プロモーター構築物)および40ngのエフェクタープラスミド(pcDNA3中の亜鉛フィンガー−エフェクタードメイン融合体)で、細胞をトランスフェクトさせた。細胞抽出物を、トランスフェクションの48時間後に調製し、そしてMicroLumatのLB96Pルミノメーター(EG & Berthold、Gaithersburg, MD)で、ルシフェラーゼアッセイ試薬(Promega)を用いて測定した。
【0080】
レトロウイルス遺伝子標的化およびフローサイトメトリー分析
これらのアッセイを、記載されているように行った[Beerliら、(2000年)Proc Natl Acad Sci USA 97巻(4)、1495−1500頁;Beerliら、(2000年)J. Biol. Chem. 275巻(42)、32617−32627頁]。一次抗体として、ErbB−1特異的mAb EGFR(Santa Cruz)、ErbB−2特異的mAb FSP77(Nancy E. Hynesからの寄贈;Harwerthら、1992年)およびErbB−3特異的mAb SGP1(Oncogene Research Products)を使用した。蛍光標識されたロバF(ab’)2抗マウスIgGを、二次抗体として使用した(Jackson Immuno−Research)。
【実施例5】
【0081】
ELISAアッセイのためのpMal−融合タンパク質の細菌抽出物
選択した亜鉛フィンガータンパク質を、発現用のpMalベクター(New England Biolabs)にクローニングした。エレクトロポレーションにより、構築物をE. coli XL1−Blue株に移し、そして503g/mlカルベネシリンを含むLBプレート上で画線培養した。各変異体の4個の単独コロニーを、503g/mlカルベネシリンおよび1%のグリコースを含む3mlのSB培地に接種した。培養物を、37℃で、一晩増殖させた。1.2mlの培養物を、503g/mlカルベネシリン、0.2%のグリコース、903g/ml ZnCl2を含む20mlの新しいSB培地に移し、そしてさらに2時間、37℃で増殖させた。IPTGを、0.3mMの最終濃度まで添加した。インキュベーションを、2時間継続した。培養物を、Beckman GPR遠心分離装置で、3500rpmで、5分間、4℃で遠心分離した。細菌ペレットを、5mMの新しいDTTを含む1.2mlの亜鉛緩衝液A中に再懸濁させた。ドライアイス/エタノールおよび温水を使用した凍結/融解手順によって、タンパク質抽出物を単離した。この手順を6回繰返した。サンプルを、Eppendorf遠心分離装置で、5分間、4℃で遠心分離した。上清を、滅菌した1.5ml遠心分離管に移し、そしてELISAアッセイに使用した。
【0082】
ELISAアッセイ
C7.GATのフィンガー−2変異体を、マルトース結合タンパク質(MBP)との融合体として細菌発現ベクターにサブクローニングし、そしてタンパク質を、1mM IPTG(タンパク質(p)には、それらが選択されたフィンガー−2サブサイトの名称を与えた)での誘導により発現させた。型5’−GAT CNN GCG−3’(配列番号34)の16個のフィンガー−2サブサイトのそれぞれに対する酵素結合免疫吸着アッセイ(ELISA)によって、タンパク質を試験して、それらのDNA結合特異性を調べた。
【0083】
さらに、特異的標的オリゴヌクレオチド、および中間トリプレットの5’−ヌクレオチドでのみ異なる3つのサブサイトに対して、亜鉛フィンガータンパク質をさらすことによって、5’−ヌクレオチド認識を分析した。例えば、pCAAを、5’−AAA−3’、5’−CAA−3’、5’−GAA−3’、および5’−TAA−3’サブサイトについて試験した。試験した3−フィンガータンパク質の多くは、それらが選択されたフィンガー−2サブサイトについて正確なDNA結合特異性を示した(下の表1を参照)。
【0084】
【表1】

【表2】

【実施例6】
【0085】
ゲル移動度のシフトのアッセイ
ZBA/5mM DTTをカラム緩衝液として使用したことを除いて、Protein Fusion and Purification Systems(New England Biolabs)を使用して、転写制御因子に連結させた亜鉛フィンガーポリペプチドを、>90%の均一性にまで精製した。BSA標準に対する比較により、タンパク質純度および濃度を、Coomassie−blueで染色した15%のSDS−PAGEゲルから測定した。標的オリゴヌクレオチドを、[32P]を用いてそれらの5’または3’末端で標識し、そしてゲル精製した。タンパク質の11個の3倍連続希釈物を、室温で、3時間、20μlの結合反応液(1×結合緩衝液/10%グリセロール/>>1pM標的オリゴヌクレオチド)中でインキュベートし、その後、0.5×TBE緩衝液中の5%ポリアクリルアミドゲル上で分離した。PhosphorImager and ImageQuantソフトウェア(Molecular Dynamics)を使用して、乾燥ゲルを定量し、そしてKDを、スキャッチャード分析によって決定した。
【実施例7】
【0086】
亜鉛フィンガー−エフェクタードメイン融合タンパク質の構築
亜鉛フィンガー−エフェクタードメイン融合タンパク質の構築のために、etsリプレッサー因子(ERF)のリプレッサードメイン(ERD)のアミノ酸473から530までをコードするDNA(Sgouras, D. N.、Athanasiou, M. A.、Beal, G. J., Jr.、Fisher, R. J.、Blair, D. G.およびMavrothalassitis, G. J.、(1995年)EMBO J. 14巻、4781−4793頁)、KOX1のKRABドメインのアミノ酸1から97まで(Margolin, J. F.、Friedman, J. R.、Meyer, W.,K.−H.、Vissing, H.、Thiesen, H.−J.およびRauscher III, F. J.(1994年)Proc. Natl. Acad. Sci. USA 91巻、4509−4513頁)、またはMad mSIN3相互作用ドメイン(SID)のアミノ酸1から36まで(Ayer, D. E.、Laherty, C. D.、Lawrence, Q. A.、Armstrong, A. P.およびEisenman, R. N.、(1996年)、Mol. Cell. Biol. 16巻、5772−5781頁)を、Taq DNAポリメラーゼを使用して重複オリゴヌクレオチドから構築した。VP16転写活性化ドメインのアミノ酸413から489までのコード領域(Sadowski, I.、Ma, J.、Triezenberg, S.およびPtashne, M.、(1988年)Nature 335巻、563−564頁)を、pcDNA3/C7−C7−VP16(10)からPCR増幅する。VP16の最小活性化ドメインの四量体反復をコードし、アミノ酸437から447までを含むVP64 DNA(Seipel, K.、Georgiev, O.およびSchaffner, W.、(1992年)EMBO J. 11巻、4961−4968頁)を、2つの対の相補的オリゴヌクレオチドから作成した。得られたフラグメントを、標準的なクローニング手順により、生じる構築物のそれぞれが内部SV40核局在化シグナルとC末端HAデカペプチドタグとを含むように、亜鉛フィンガーコード領域に融合させた。融合構築物を、真核生物の発現ベクターpcDNA3(Invitrogen)にクローニングした。
【実施例8】
【0087】
ルシフェラーゼレポータープラスミドの構築
ATG開始コドンに関してヌクレオチド−758から−1までを含むerbB−2プロモーターフラグメントを、TaqExpand DNAポリメラーゼミックス(Boehringer Mannheim)を用いてヒト骨髄のゲノムDNAからPCR増幅し、そしてホタルのルシフェラーゼ遺伝子の上流に、pGL3 basic(Promega)にクローニングした。ヌクレオチド−1571から−24までを包含するヒトerbB−2プロモーターフラグメントを、Hind3消化により、pSVOALD5’/erbB−2(N−N)(Hudson, L. G.、Ertl, A. P.およびGill, G. N.、(1990年)J. Biol. Chem. 265巻、4389−4393頁)から切り出し、そしてホタルのルシフェラーゼ遺伝子の上流で、pGL3 basicにサブクローニングした。
【実施例9】
【0088】
ルシフェラーゼアッセイ
全てのトランスフェクションのために、40〜60%の集密度でHeLa細胞を使用した。一般的には、細胞を、リポフェクタミン試薬(Gibco BRL)を使用して、6ウェル皿のウェルの中の400ngレポータープラスミド(pGL3−プロモーター構築物、あるいは陰性対照としてのpGL3ベーシック)、50ngのエフェクタープラスミド(pcDNA3の亜鉛フィンガー構築物、あるいは陰性対照としての空のpcDNA3)、および200ngの内部標準プラスミド(phrAct−bGal)でトランスフェクトした。細胞抽出物を、トランスフェクションの約48時間後に調製した。MicroLumatのLB96Pルミノメーター(EG & Berthold、Gaithersburg, MD)中で、ルシフェラーゼ活性を、ルシフェラーゼアッセイ試薬(Promega)で測定し、bGal活性をGalacto−Light(Tropix)で測定した。ルシフェラーゼ活性は、bGal活性について標準化した。
【実施例10】
【0089】
HeLa細胞中でのerbB−2遺伝子の調節
erbB−2遺伝子を、制御を行う標的とした。生来のerbB−2遺伝子を制御するために、合成リプレッサータンパク質およびトランス活性化因子タンパク質を利用した(R. R. Beerli, D. J. Segal, B. Dreier, C. F. Barbas, III, Proc. Natl. Acad. Sci. USA 95巻、14628頁(1998年))。6個の予め定義した、およびモジュラーの亜鉛フィンガードメインから、このDNA結合タンパク質を構築した(D. J. Segal, B. Dreier, R. R. Beerli, C. F. Barbas, III, Proc. Natl. Acad. Sci. USA 96巻、2758頁(1999年))。リプレッサータンパク質は、Kox−1 KRABドメインを含む(J. F. Margolinら、Proc. Natl. Acad. Sci. USA 91巻、4509頁(1994年))のに対して、トランス活性化因子VP64は、単純ヘルペスウイルスタンパク質VP16に由来する最小活性化ドメインの四量体反復を含む(K. Seipel、O. Georgiev、W. Schaffner、EMBO J. 11巻、4961頁(1992年))。
【0090】
ヒト子宮頸癌細胞株HeLaの誘導体であるHeLa/tet−オフを利用した(M. GossenおよびH. Bujard、Proc. Natl. Acad. Sci. USA 89巻、5547頁(1992年))。HeLa細胞は、上皮起源のものであるので、それらは、ErbB−2を発現し、そしてerbB−2遺伝子標的化の研究に十分に適している。HeLa/tet−オフ細胞は、テトラサイクリンで制御されるトランス活性化因子を産生し、したがって、成長培地からテトラサイクリンまたはその誘導体ドキシサイクリン(Dox)を除去することによって、テトラサイクリン応答性構成要素(TRE)の制御下で目的の遺伝子を誘導することができる。本発明者らは、化学的制御下に本発明者らの転写因子を配置するためにこのシステムを使用する。したがって、リプレッサーおよび活性化因子プラスミドを構築し、そしてBamH1およびCla1制限部位を使用してpRevTRE(Clontech)に、そしてBamH1およびNot1制限部位を使用してpMX−IRES−GFP[X. Liuら、Proc. Natl. Acad. Sci. USA 94巻、10669頁(1997年)]にサブクローニングした。PCR増幅の忠実度を、配列決定によって確認し、HeLa/tet−オフ細胞にトランスフェクトし、そして20個の安定なクローンをそれぞれ単離し、そしてDox依存性の標的遺伝子の制御について分析した。構築物を、Lipofectamine Plus試薬(Gibco BRL)を使用してHeLa/tet−オフ細胞株(M. GossenおよびH. Bujard、Proc. Natl. Acad. Sci. USA 89巻、5547頁(1992年))にトランスフェクトした。2mg/ml Doxの存在下で、ハイグロマイシン含有培地での2週間の選択の後、安定なクローンを単離し、そしてErbB−2発現のDox依存性制御について分析した。ウエスタンブロット、免疫沈降、ノーザンブロット、およびフローサイトメトリー分析を、基本的には記載されているように行った[D. Graus−Porta、R. R. Beerli、N. E. Hynes、Mol. Cell. Biol. 15巻、1182頁(1995年)]。erbB−2プロモーター活性の読取として、ErbB−2タンパク質レベルを、ウエスタンブロッティングによって最初に分析した。これらのクローンのかなりの画分が、4日間のDoxの除去の間のErbB−2発現の制御、すなわち、リプレッサークローンにおけるErbB−2の下方制御、および活性化因子クローンにおける上方調節を示した。ErbB−2タンパク質レベルは、それらの特異的mRNAの変化のレベルと相関関係を示し、そしてErbB−2発現の制御が、転写の抑制または活性化の結果であることを示している。
【実施例11】
【0091】
レトロウイルスベクターpMX−IRES−GFPへのE2S−KRAB、E2S−VP64、E3F−KRABおよびE3F−VP64タンパク質のコード領域の導入
いくつかの細胞株中でE2S−KRAB、E2S−VP64、E3F−KRABおよびE3F−VP64タンパク質(下の表2を参照)を発現させるために、これらのコード領域を、レトロウイルスベクターpMX−IRES−GFPに導入した。
【0092】
【表3】

【0093】
ErbB−2またはErbB−3プロモーターの特異的領域に結合するこれらの構築物の配列を、選択した(表2を参照)。コード領域を、pcDNA3に基づく発現プラスミド(R. R. Beerli、D. J. Segal、B. Dreier、C. F. Barbas, III、Proc. Natl. Acad. Sci. USA 95巻、14628頁(1998年))からPCR増幅させ、そしてBamH1およびCla1制限部位を使用してpRevTRE(Clontech)中に、ならびにBamH1およびNot1制限部位を使用してpMX−IRES−GFP[X. Liuら、Proc. Natl. Acad. Sci. USA 94巻、10669頁(1997年)]中にサブクローニングした。PCR増幅の忠実度を、配列決定によって確認した。このベクターは、亜鉛フィンガータンパク質の翻訳のための単一のバイシストロン性メッセージと、内部リボソーム進入部位(IRES)から緑色蛍光タンパク質(GEP)を発現する。両方のコード領域が同じmRNAを共有するので、それらの発現は、互いに物理的に連結されており、そしてGFPの発現が亜鉛フィンガー発現の指標となる。その後、これらのプラスミドから調製したウイルスを使用して、ヒト癌細胞株A431を感染させた。
【実施例12】
【0094】
ErbB−2およびErbB−3の遺伝子発現の制御
実施例11から得られたプラスミドを、Lipofectamine Plus(Gibco BRL)を使用して両種指向性パッケージング細胞株であるPhoenix Amphoに一時的にトランスフェクトさせ、そして2日後、培養上清を用いて、8mg/mlのポリブレンの存在下で標的細胞を感染させた。感染の3日後、細胞を、分析のために回収した。感染の3日後、ErbB−2およびErbB−3発現を、フローサイトメトリにより測定した。結果は、E2S−KRABおよびE2S−VP64組成物が、それぞれ、ErbB−2遺伝子発現を阻害および増強したことを示す。データもまた、E3F−KRABおよびE3F−VP64組成物が、それぞれ、ErbB−2遺伝子発現を阻害および増強したことを示す。
【0095】
ヒトerbB−2およびerbB−3遺伝子を、亜鉛フィンガーに基づく転写スイッチの開発
のためのモデル標的として選択した。ErbBレセプターファミリーのメンバーは、ヒトの悪性腫瘍の発生に重要な役割を果たす。特に、erbB−2は、乳房、卵巣、肺、胃、および唾液腺を含む多数の部位で生じるヒトの腺癌の高い割合において、遺伝子増幅および/または転写の脱制御の結果として過剰発現される(Hynes, N. E.およびStern, D. F.(1994年)Biochim. Biophys. Acta 1198巻、165−184頁)。ErbB−2の発現が増大したことは、その固有のチロシンキナーゼの恒常的な活性化を誘導し、そして培養細胞の形質転換を生じることが示されている。多数の臨床研究が、ErbB−2の発現レベルが増大している腫瘍を保有している患者は進行が遅いことを示した(Hynes, N. E.およびStern, D. F.(1994年)Biochim. Biophys. Acta 1198巻、165−184頁)。ヒトの癌におけるそれの関与に加えて、erbB−2は、哺乳類の成体および胚発生の間の両方において、重要な生物学的役割を果たす(Hynes, N. E.およびStern, D. F.(1994年)Biochim. Biophys. Acta 1198巻、165−184頁、Altiok, N.、Bessereau, J.−L.およびChangeux, J.−P.、(1995年)EMBO J. 14巻、4258−4266頁、Lee, K.−F.、Simon, H.、Chen, H.、Bates, B.、Hung, M.−C.およびHauser, C.、(1995年)Nature 378巻、394−398頁)。
【0096】
したがって、erbB−2プロモーターは、人工的な転写制御因子の開発のための興味深い試験例を表す。このプロモーターは、詳細に特徴付けられており、そして比較的複雑であり、そしてTATA依存性転写開始部位およびTATA非依存性転写開始部位の両方を含むことが示されている(Ishii, S.、Imamoto, F.、Yamanashi, Y.、Yoyoshima, K.およびYamamoto, T.、(1987年)Proc. Natl. Acad. Sci. USA 84巻、4374−4378頁)。初期の研究は、ポリダクチルタンパク質が、転写を特異的に活性化または抑制する転写制御因子として作用することができることを示したにもかかわらず、これらのタンパク質は、タンパク質結合部位の6個の直列の反復に対して、人工的なプロモーターの上流で結合した(Liu, Q.、Segal, D. J.、Ghiara, J. B.およびBarbas III, C. F.(1997年)Proc. Natl. Acad. Sci. USA 94巻、5525−5530頁)。さらに、この研究は、それらの結合特異性が変更されていないポリダクチルタンパク質を利用した。本明細書において、本発明者らは、生来のerbB−2およびerbB−3プロモーター中の単一の部位に結合する予め定義された構築ブロックから構築されるポリダクチルタンパク質の効力を試験した。
【0097】
所望のDNA結合特異性を有しているポリダクチルタンパク質を作成するために、本研究は、予め定義された亜鉛フィンガードメインの構築に注目し、これをGreismanおよびPaboによって提案される連続選択攻略法と対比させた(Greisman, H. A.およびPabo, C. O.(1997年)Science 275巻、657−661頁)。このような攻略法には、それぞれの必要なタンパク質についての6個の亜鉛フィンガーライブラリーの連続的な作成および選択が必要であり、そしてこのことがこの実験アプローチを、ほとんどの研究室で利用できなくさせ、そして全てに極端に時間のかかるものとしている。さらに、この攻略法で結合する別の配列に対する特異的陰性選択を行うことが困難であるので、タンパク質は、最近報告されたとおり、比較的非特異的である結果を生じる場合がある(Kim, J.−S.およびPabo, C. O.、(1997年)J. Biol. Chem. 272巻、29795−29800頁)。
【0098】
18bpのDNA配列を認識する3−フィンガータンパク質を作成するための2つの異なる攻略法の一般的有用性を調べた。それぞれの攻略法は、亜鉛フィンガードメインのモジュール特性に基づき、そして5’−NNN−3’のトリプレットを認識する亜鉛フィンガードメインのファミリーを利用した。ハーフサイトerbB−2またはerbB−3標的部位を認識する3つの6−フィンガータンパク質を、予め定義したフィンガー2(F2)ドメイン変異体を、PCR構築法を使用して一緒に融合することによって、最初の攻略法において作成した。
【0099】
電気泳動移動度のシフトのアッセイによって、その標的に対するタンパク質のそれぞれの親和性を測定した。これらの研究は、亜鉛フィンガーペプチドが、Zif268および他の自然界に存在する転写因子に匹敵する親和性を有していることを示した。
DNA標的部位についての各タンパク質の親和性は、ゲルシフト分析により測定する。
【特許請求の範囲】
【請求項1】
5から10個までのアミノ酸残基のヌクレオチド結合領域を含み、該領域が、式CNN(式中、NはA、C、GまたはTである)で示される標的ヌクレオチドに優先的に結合する、単離および精製された亜鉛フィンガーヌクレオチド結合ポリペプチド。
【請求項2】
標的ヌクレオチドが、式CAN、CCN、CGN、CTN、CNA、CNC、CNGまたはCNTを含む、請求項1に記載のポリペプチド。
【請求項3】
標的ヌクレオチドが、式CAA、CAC、CAG、CAT、CCA、CCC、CCG、CCT、CGA、CGC、CGG、CGT、CTA、CTC、CTGまたはCTTを含む、請求項1に記載のポリペプチド。
【請求項4】
結合領域が、配列番号1〜25のいずれかと同じヌクレオチド結合特性を示すアミノ酸残基配列を有する請求項1に記載のポリペプチド。
【請求項5】
配列番号1〜25のいずれかと、ヌクレオチド標的への結合について競合する、請求項1に記載のポリペプチド。
【請求項6】
結合領域が、配列番号1〜25のいずれかのアミノ酸残基配列を有する、請求項1に記載のポリペプチド。
【請求項7】
ポリペプチドが互いに作動可能であるように連結される、請求項1の複数のポリペプチドを包含するペプチド組成物。
【請求項8】
1つまたはそれ以上の転写調節因子に作動可能であるように連結された、請求項1に記載のポリペプチド。
【請求項9】
請求項1に記載のポリペプチドをコードする、単離および精製されたポリヌクレオチド。
【請求項10】
請求項7に記載のペプチド組成物をコードする、単離および精製されたポリヌクレオチド。
【請求項11】
請求項9に記載のポリヌクレオチドを含む、発現ベクター。
【請求項12】
請求項10に記載のポリヌクレオチドを含む、発現ベクター。
【請求項13】
請求項9に記載のポリヌクレオチドで形質転換された、宿主細胞。
【請求項14】
請求項10に記載のポリヌクレオチドで形質転換された、宿主細胞。
【請求項15】
請求項11に記載の発現ベクターで形質転換された、宿主細胞。
【請求項16】
請求項12に記載の発現ベクターで形質転換された、宿主細胞。
【請求項17】
請求項7に記載の有効量の組成物に、ヌクレオチド配列をさらすことを特徴とする、配列5’−(CNN)n−3’(式中、nは、2から12までである)を含むヌクレオチド配列の発現を調節する、方法。
【請求項1】
5から10個までのアミノ酸残基のヌクレオチド結合領域を含み、該領域が、式CNN(式中、NはA、C、GまたはTである)で示される標的ヌクレオチドに優先的に結合する、単離および精製された亜鉛フィンガーヌクレオチド結合ポリペプチド。
【請求項2】
標的ヌクレオチドが、式CAN、CCN、CGN、CTN、CNA、CNC、CNGまたはCNTを含む、請求項1に記載のポリペプチド。
【請求項3】
標的ヌクレオチドが、式CAA、CAC、CAG、CAT、CCA、CCC、CCG、CCT、CGA、CGC、CGG、CGT、CTA、CTC、CTGまたはCTTを含む、請求項1に記載のポリペプチド。
【請求項4】
結合領域が、配列番号1〜25のいずれかと同じヌクレオチド結合特性を示すアミノ酸残基配列を有する請求項1に記載のポリペプチド。
【請求項5】
配列番号1〜25のいずれかと、ヌクレオチド標的への結合について競合する、請求項1に記載のポリペプチド。
【請求項6】
結合領域が、配列番号1〜25のいずれかのアミノ酸残基配列を有する、請求項1に記載のポリペプチド。
【請求項7】
ポリペプチドが互いに作動可能であるように連結される、請求項1の複数のポリペプチドを包含するペプチド組成物。
【請求項8】
1つまたはそれ以上の転写調節因子に作動可能であるように連結された、請求項1に記載のポリペプチド。
【請求項9】
請求項1に記載のポリペプチドをコードする、単離および精製されたポリヌクレオチド。
【請求項10】
請求項7に記載のペプチド組成物をコードする、単離および精製されたポリヌクレオチド。
【請求項11】
請求項9に記載のポリヌクレオチドを含む、発現ベクター。
【請求項12】
請求項10に記載のポリヌクレオチドを含む、発現ベクター。
【請求項13】
請求項9に記載のポリヌクレオチドで形質転換された、宿主細胞。
【請求項14】
請求項10に記載のポリヌクレオチドで形質転換された、宿主細胞。
【請求項15】
請求項11に記載の発現ベクターで形質転換された、宿主細胞。
【請求項16】
請求項12に記載の発現ベクターで形質転換された、宿主細胞。
【請求項17】
請求項7に記載の有効量の組成物に、ヌクレオチド配列をさらすことを特徴とする、配列5’−(CNN)n−3’(式中、nは、2から12までである)を含むヌクレオチド配列の発現を調節する、方法。
【図1】




【公開番号】特開2009−159966(P2009−159966A)
【公開日】平成21年7月23日(2009.7.23)
【国際特許分類】
【出願番号】特願2009−12979(P2009−12979)
【出願日】平成21年1月23日(2009.1.23)
【分割の表示】特願2003−521805(P2003−521805)の分割
【原出願日】平成14年8月20日(2002.8.20)
【出願人】(593052785)ザ スクリップス リサーチ インスティテュート (91)
【Fターム(参考)】
【公開日】平成21年7月23日(2009.7.23)
【国際特許分類】
【出願日】平成21年1月23日(2009.1.23)
【分割の表示】特願2003−521805(P2003−521805)の分割
【原出願日】平成14年8月20日(2002.8.20)
【出願人】(593052785)ザ スクリップス リサーチ インスティテュート (91)
【Fターム(参考)】
[ Back to top ]

