CYP1B1核酸および使用の方法
【課題】天然型のCYP1B1転写物の非翻訳領域(UTR)に認められる配列を欠いた転写ユニットである、CYP1B1ポリペプチドまたはその部分をコードする転写ユニットを含む核酸を提供する。
【解決手段】核酸は翻訳抑制因子を欠いており、このため、CYP1B1ポリペプチドまたはその部分の翻訳が増強される。核酸によってコードされるポリペプチドは、哺乳動物における免疫応答を誘発するのに有用であり、哺乳動物へ投与、および増殖性疾患または癌の治療に使用する。
【解決手段】核酸は翻訳抑制因子を欠いており、このため、CYP1B1ポリペプチドまたはその部分の翻訳が増強される。核酸によってコードされるポリペプチドは、哺乳動物における免疫応答を誘発するのに有用であり、哺乳動物へ投与、および増殖性疾患または癌の治療に使用する。
【発明の詳細な説明】
【技術分野】
【0001】
発明の分野
本発明は、CYP1B1核酸、および免疫応答を誘導するための使用方法に関する。
【背景技術】
【0002】
発明の背景
シトクロムP450は大規模な遺伝子ファミリーを構成する酵素であり、発癌物質の可能性がある多くの物質および複数の抗癌剤を含む、さまざまな生体異物の酸化的活性化および/または不活性化にかかわっている(GuengerichおよびShimada(1991)Chem. Res. Toxicol. 4:931(非特許文献1);GonzalezおよびGelboin(1994)Drug Metab. Rev. 26:165(非特許文献2);Kivistoら(1995)Br. J. Clin. Pharmacol. 40:523(非特許文献3))。
【0003】
ヒトCYP1遺伝子ファミリーは主なP450ファミリーの1つであり、2つのサブファミリーに分類される3つの独立した形態からなる。CYP1B1は一方のサブファミリーに属し、長さは543アミノ酸である。これはCYP1A2サブファミリーの2つのメンバーとは構造的に異なる(Tangら、J. Biol. Chem.(1996)271:28324(非特許文献4))。
【0004】
乳癌、食道癌および軟部組織肉腫を含むさまざまな種類の癌の研究により、CYP1B1型のP450が腫瘍特異的に発現される可能性が示されている(Murrayら(1991)Br. J. Cancer 63:1021(非特許文献5);Murrayら(1993)J. Pathol. 171:49(非特許文献6);Murrayら(1994)Gut 35:599(非特許文献7)を参照)。CYP1B1の免疫組織化学的研究からは、複数の異なる種類の腫瘍で強い免疫反応性が認められている(膀胱、乳房、結腸、腎臓、肺、食道、卵巣、皮膚、胃、子宮、骨および結合組織、リンパ節、脳ならびに巣)(国際公開公報第97/12246号(特許文献1)を参照、これは参照として本明細書に組み入れられる)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】国際公開公報第97/12246号
【非特許文献】
【0006】
【非特許文献1】GuengerichおよびShimada(1991)Chem. Res. Toxicol. 4:931
【非特許文献2】GonzalezおよびGelboin(1994)Drug Metab. Rev. 26:165
【非特許文献3】Kivistoら(1995)Br. J. Clin. Pharmacol. 40:523
【非特許文献4】Tangら、J. Biol. Chem.(1996)271:28324
【非特許文献5】Murrayら(1991)Br. J. Cancer 63:1021
【非特許文献6】Murrayら(1993)J. Pathol. 171:49
【非特許文献7】Murrayら(1994)Gut 35:599
【発明の概要】
【0007】
本発明は、CYP1B1ポリペプチドまたはその部分をコードし、翻訳抑制因子(translational repressor element)を欠いた転写ユニットを含む、核酸を構築しうるという発見に基づく。これらの因子は、天然型のCYP1B1転写物の非翻訳領域(UTR)に位置してもコード配列中に位置してもよく、またはその両方でもよい。本発明の核酸は、CYP1B1内因性翻訳抑制因子の一部または全体を欠いており、このため、CYP1B1ポリペプチドまたはその部分の翻訳が増強される系を提供する。本発明の核酸が、コードされるタンパク質の免疫原性を強める変異、欠失、挿入または転位を含むことも可能である。本明細書に記載の核酸によってコードされるポリペプチドは、哺乳動物における免疫応答を誘発するのに有用である。
【0008】
1つの局面において、本発明は、MHCクラスIもしくはクラスII分子と結合するペプチドまたはB細胞エピトープであるペプチドを含むCYP1B1またはそれらの一部を含むポリペプチドをコードするコード配列を含む転写ユニットを含む核酸を特徴とする。転写ユニットは、コード配列と機能的に結合した翻訳抑制因子を含まない。
【0009】
本明細書で用いる「転写ユニット」とは、翻訳開始シグナルを含み、その後に選択的にはイントロンならびに適切なスプライスドナー部位およびアクセプター部位を含むオープンリーディングフレームがあり、その後に終結コドンがある核酸のことを指し、ここで核酸は(1)RNAまたは(2)転写されてRNAとなるヌクレオチド配列のいずれかである。「翻訳開始シグナル」とは、コザックコンセンサス配列の状況下にある開始コドンのことを指す。「翻訳抑制因子」とは、それが存在すると、転写物によってコードされるポリペプチドの翻訳レベルが、そのヌクレオチド配列を欠く転写物よりも少なくとも25%低下する、転写物の非翻訳領域に位置するヌクレオチド配列のことを指す。翻訳抑制因子は、例えばリボソームの転写物との結合を妨げることにより、または転写物の半減期を短縮することにより、翻訳レベルを低下させることが可能である。
【0010】
本明細書に記載の核酸によってコードされるポリペプチドは、長さが少なくとも8アミノ酸のCYP1B1区域を含む。1つの例では、ポリペプチドは配列FLDPRPLTV(配列番号:22)を含む。もう1つの例では、ポリペプチドは配列番号:31〜39のいずれかの配列を含む。もう1つの例では、ポリペプチドの長さは400、300、200または100未満のアミノ酸である。
【0011】
本明細書で用いる「区域(segment)」とは、(a)CYP1B1タンパク質の一部(すなわち全体に満たない断片)の配列に対応し、(b)1つまたは複数のエピトープを含む、アミノ酸配列のことである。明確に言えば、「区域」は本明細書では、本発明の核酸によってコードされるポリペプチドの一部のことを意味し、「部分(portion)」という用語は天然のタンパク質の該当部分のことを意味する。「エピトープ」とは、MHCクラスIもしくはクラスII分子の結合溝または抗体の抗原結合領域と結合するペプチドのことを指す。翻訳を促すために、本発明の上記または他の任意のコード配列の5'末端にメチオニンコドンを含めることができる。さらに、本明細書に記載の核酸によってコードされるポリペプチドが、以下にさらに詳細に説明する、ターゲティングシグナル(targeting signal)をコードすることも可能である。
【0012】
本明細書に記載の転写ユニットは、RNA安定化配列を含みうる。「RNA安定化配列」とは、それが存在すると転写物の半減期がそのヌクレオチド配列を欠く転写物よりも長くなる、転写物の非翻訳領域(UTR)(5'もしくは3' UTRまたはその両方)に位置するヌクレオチド配列のことを指す。
【0013】
本明細書に記載の核酸は、転写ユニットと機能的に結合した誘導性プロモーター配列を含みうる。「誘導性プロモーター配列」とは、作用物質(agent)、例えば金属または他の何らかの非タンパク質性化合物がそのヌクレオチド配列と結合すると、そのヌクレオチド配列が機能的に結合した転写ユニットの転写の増強がもたらされるようなヌクレオチド配列のことを指す。誘導性プロモーター配列の一例はメタロチオネインプロモーターである。
【0014】
本発明の核酸によってコードされるポリペプチドは、選択的にはターゲティングシグナルを含んでもよい。ターゲティングシグナルとは、それが結合したペプチドの細胞内輸送または分泌を指令するペプチドのことである。ターゲティングシグナルは、それがその部位で作用する限り、ハイブリッド型ポリペプチドのアミノ末端、例えばシグナル配列にあっても、カルボキシ末端にあっても、または内部にあってもよい。
【0015】
ターゲティングシグナルは、例えばシグナル配列でありうる。それが結合したコードされるタンパク質を小胞体に向かわせる、および/またはコードされるタンパク質の分泌を引き起こす、任意のシグナル配列が適している。好ましいターゲティングシグナルの1つは、HLA-DRαのシグナルペプチド:

である。本明細書に記載のポリペプチドと結合させることが可能なもう1つのシグナル配列は、以下の配列を有する:

本明細書に記載のポリペプチドと結合させることが可能なもう1つのシグナル配列は、E1Aシグナル配列である。
【0016】
選択的には、ターゲティングシグナルを、シグナルペプチダーゼなどによるエピトープからのターゲティング配列の切断を促すために、ターゲティングシグナルと隣接区域との接合部にアミノ酸置換が導入されるように改変してもよい。
【0017】
もう1つの局面において、本発明は、MHCクラスIまたはクラスII分子と結合するペプチドを含むCYP1B1またはその一部を含むポリペプチドをコードするコード配列を含む転写ユニットを含む核酸であって、転写ユニットが配列番号:18または配列番号:19の150個の連続したヌクレオチドを含んでいない核酸を特徴とする。CYP1B1またはその一部は、哺乳動物、例えばヒトの天然のCYP1B1ポリペプチドの配列に対応することが好ましい。
【0018】
1つの例において、転写ユニットは配列番号:3〜9または15〜17のうち少なくとも1つを含まない。もう1つの例において、転写ユニットは配列番号:18または配列番号:19の50、25または10個の連続したヌクレオチドを含まない。もう1つの例において、転写ユニットは配列番号:3〜9および15〜17をいずれも含まない。
【0019】
転写ユニットは、コード配列と機能的に結合した翻訳調節配列を含みうる。「翻訳調節配列」とは、ある作用物質がそのヌクレオチド配列と結合すると、そのヌクレオチド配列が機能的に結合したコード配列によってコードされるポリペプチドの翻訳の増強がもたらされるようなヌクレオチド配列のことを指す。1つの例において、翻訳調節配列は鉄応答性配列である。
【0020】
もう1つの局面において、本発明は、CYP1B1の第1および第2の区域を含むハイブリッド型ポリペプチドをコードする転写ユニットを含む核酸を特徴とする。第1のおよび第2の区域は連続しているか、またはスペーサーアミノ酸もしくはスペーサーペプチドによって分離されている。第1のおよび第2の区域のそれぞれの長さが少なくとも8アミノ酸であり、CYP1B1の非連続的な部分である。
【0021】
「スペーサーアミノ酸」とは、本発明のポリペプチド中の2つの近接した区域(順に「A」および「B」)の間に挿入される単一の残基であって、完全長CYP1B1タンパク質においてAのカルボキシ末端に隣接するアミノ酸と異なり、Bのアミノ末端に隣接するアミノ酸とも異なる残基のことを意味する。すなわち、スペーサーアミノ酸は、本発明のポリペプチド中に、CYP1B1由来のAの配列およびCYP1B1由来のBの配列との不連続点を形成する。アミノ酸は通常、20種の天然アミノ酸、例えばAla、Leu、IleまたはGlyなどのいずれかであるが、一般的には(1)CYP1B1中でAのカルボキシ末端に自然下で隣接するもの、および(2)CYP1B1中でBのアミノ末端に自然下で隣接するものを除く、任意のアミノ酸が可能である。
【0022】
「スペーサー配列」とは、本発明のポリペプチド中の2つの近接した区域、例えば「A」と「B」との間に挿入される2つ以上のアミノ酸の配列のことを意味する。スペーサーの配列は、AおよびBの由来である完全長CYP1B1タンパク質においてAのカルボキシ末端およびBのアミノ末端に隣接する配列とは異なる。すなわち、スペーサー配列は、本発明のポリペプチド中に、CYP1B1由来のAの配列およびY由来のBの配列の双方との不連続点を形成する。
【0023】
スペーサー配列の例には、Ala Ala、Ala Leu、Leu Leu、Leu Ala、Len Ile、Ala Ala Ala、Ala Gly Leu、Phe Ile Ileなどが含まれる。一般に、スペーサー配列は非極性アミノ酸を含むと考えられるが、Glu、Gln、Ser、HisおよびAsnなどの極性残基も存在することができ、特に3残基を上回るスペーサー配列ではそうであると考えられる。各スペーサー配列の全長および性質に関する唯一の外延は、ポリペプチドおよび/または核酸の合成、タンパク質分解プロセシングおよび操作の容易さに関する考慮によるものである。約4または5残基よりも長いスペーサー配列を用いることは一般に不必要であり、おそらくは望ましくないと思われるが、それらは例えば、6、8、10、15、20、30または50残基であってもよいと考えられる。当然ながら、それらは50残基よりもさらに長くてもよいと考えられる。
【0024】
スペーサーアミノ酸およびスペーサー配列は、タンパク質の安定性を変化させるため、またはエピトープを放出するプロセシングを促すために有用である。スペーサーは通常、細胞内でのタンパク質分解プロセシングにより、所定の区域内のエピトープ間にある任意の配列とともにポリペプチドから除去される。このため、エピトープがMHC分子または(細胞からの分泌後に)抗体と結合する能力は損なわれない。時には、スペーサーアミノ酸またはスペーサー配列の一部が不完全なプロセシングのためにエピトープと結合したまま残ることも考えられる。これは一般に、MHC分子との結合に対してほとんどまたは全く影響を及ぼさない。
【0025】
本明細書に記載の核酸によってコードされるハイブリッド型ポリペプチドは、CYP1B1の追加的な区域、例えば第3、第4、第5、第6の区域をさらに含みうる。これらの追加的な区域はそれぞれ長さが少なくとも8アミノ酸であり、CYP1B1の非連続的な部分を構成している。
【0026】
スペーサーは選択的には、CYP1B1以外のタンパク質由来のT細胞および/またはB細胞エピトープを含むことができる。例えば、スペーサーは、破傷風トキソイドまたはPADRE T細胞エピトープ(例えば、米国特許第5,662,907号を参照)をコードしうる。
【0027】
本発明はまた、本明細書に記載の核酸およびアジュバントまたは免疫刺激物質を含む、組成物も特徴とする。アジュバントおよび「免疫刺激物質」とは、抗原特異的でない様式で免疫応答を誘発する物質、または樹状細胞などの専門化した抗原提示細胞の分化もしくは活性化を誘導する物質のことを指す。アジュバントの例には、ミョウバン、金、モノホスホリルリピドA、サポニン、油性乳剤、QS21およびフロイントアジュバントが含まれる。免疫刺激物質の例には以下のものが含まれる:例えば長さ18〜30ヌクレオチドのCpG含有オリゴヌクレオチド;IL-12、GM-CSF、IL-2またはIFN-γなどのサイトカイン;B7-1、B7-2、CCR5などの細胞表面受容体;ならびに脂質、核酸、糖質および細菌性ポリペプチド。
【0028】
本発明は、本明細書に記載の核酸およびIL-12、GM-CSF、IL-2、IFN-γまたは細菌性ポリペプチドなどの免疫刺激物質をコードする核酸を含む組成物も含む。
【0029】
本発明は、本明細書に記載の核酸および薬学的に許容される担体を含む治療的組成物も含む。本発明はまた、微粒子、例えば、ポリマーマトリックスまたはシェルおよび本明細書に記載の核酸を含むミクロスフェアも含む。本発明はまた、ポリマーネットワーク、例えばヒドロゲルおよび本明細書に記載の核酸も含む。
【0030】
もう1つの局面において、本発明は、本明細書に記載の核酸を哺乳動物に投与することによる、哺乳動物における免疫応答の誘導方法を特徴とする。1つの例において、哺乳動物は癌に罹患している、またはその危険性がある。核酸は皮下、鼻腔内または筋肉内などのさまざまな経路によって投与することが可能である。核酸の注射後に注射部位で電気穿孔法を行ってもよい。本方法によって生じる免疫応答をCYP1B1に向かわせることが可能である。本方法はT細胞応答および/またはB細胞応答を引き起こしうる。
【0031】
本発明は、本明細書に記載の微粒子またはポリマーネットワークを哺乳動物に投与することによる、哺乳動物における免疫応答の誘導方法も特徴とする。
【0032】
本発明はまた、免疫応答を生じさせる方法であって、(1)哺乳動物の腫瘍または腫瘍内でのCYP1B1の発現を検出する段階;および(2)本明細書に記載の核酸を哺乳動物に投与する段階を含み、投与によって哺乳動物における抗CYP1B1免疫応答が誘発される方法も特徴とする。
【0033】
本発明はまた、哺乳動物における腫瘍増殖または腫瘍活性を低下させる方法も特徴とする。本方法は以下の段階を含む:(1)腫瘍を有する哺乳動物を同定する段階;(2)本明細書に記載の核酸を哺乳動物に投与する段階;および(3)核酸の投与後の腫瘍のサイズまたは活性の低下を検出する段階。本明細書で用いる「腫瘍活性」とは、腫瘍細胞の増殖を促進する、腫瘍細胞によって分泌される可溶性因子のことを指す。本方法はさらに、核酸を投与する前に腫瘍内でのCYP1B1の発現を検出する段階を含みうる。
【0034】
本発明はまた、哺乳動物の再発までの期間、寿命または生活の質を増大させる方法も特徴とする。本方法は以下の段階を含む:(1)腫瘍を有する哺乳動物を同定する段階;(2)本明細書に記載の核酸を哺乳動物に投与する段階;および(3)核酸の投与後の哺乳動物の再発までの期間、寿命または生活の質の増大を評価する段階。再発までの期間、寿命または生活の質の増大は、例えば、化学療法の必要性の低下もしくは化学療法薬の投与期間の短縮、鎮痛薬の必要性の低下もしくは鎮痛薬の投与期間の短縮、または入院もしくは薬物療法の必要性もしくは期間の低下もしくは短縮によって評価することができる。
【0035】
もう1つの局面において、本発明は、本明細書に記載の核酸を細胞に送達することによる、免疫応答の誘導方法を特徴とする。免疫応答の誘導はインビトロ、インビボまたはエクスビボのいずれで行ってもよい。例えば、抗CYP1B1 T細胞を、例えば、CYP1B1を発現する樹状細胞などの抗原提示細胞とのインキュベーションまたはCYP1B1タンパク質もしくはペプチドによるパルス刺激によって細胞培養下で作製し、その後に個体、例えば、癌に罹患した個体またはその危険性がある個体に再び導入することができる。
【0036】
もう1つの局面において、本発明は、核酸を哺乳動物に投与することによる、哺乳動物における免疫応答の誘導方法を特徴とする。本方法において、哺乳動物は第1の種に属し、例えば哺乳動物はヒトであり、核酸はMHCクラスIもしくはクラスII分子または免疫グロブリン受容体と結合するCYP1B1またはその一部を含むポリペプチドをコードするが、ここでCYP1B1またはその一部は第2の種、例えばラットまたはマウスなどの齧歯動物の天然のCYP1B1ポリペプチドの配列と同一である。
【0037】
本方法に従って投与される核酸は、MHCクラスIもしくはクラスII分子または免疫グロブリン受容体と結合するCYP1B1またはその一部を含むポリペプチドをコードする任意の核酸でありうる。1つの例において、核酸は本発明の核酸である。核酸は裸の核酸として哺乳動物に送達することもでき、または微粒子などの送達媒体とともに送達することもできる。MHCクラスIまたはクラスII分子と結合するCYP1B1またはその一部は、第1の種の天然のCYP1B1ポリペプチドの配列と同一でないことが好ましい。核酸を、選択的には、本明細書に記載の免疫刺激物質とともに投与することができる。
【0038】
核酸を投与する哺乳動物は、細胞増殖性疾患、例えば癌を有する、またはその危険性があるものでよい。1つの例では、核酸を哺乳動物に投与する前に、哺乳動物を細胞増殖性疾患、例えば腫瘍を有するものとして同定する。
【0039】
本発明の1つの利点は、本明細書に記載の核酸により、CYP1B1ポリペプチドが通常は産生されないまたは低レベルで産生される細胞において、CYP1B1ポリペプチドまたはその一部の翻訳が可能になることである。
【0040】
本明細書に記載の核酸構築物のいくつかのさらにもう1つの利点は、安定性が変化した、および/または酵素活性が変化、低下もしくは消失した、ポリペプチドの翻訳が可能になることである。ポリペプチドの安定性を変更することにより、そのプロセシングおよびその後の免疫系による認識を増強させることができる。CYP1B1タンパク質の酵素活性を変更することにより、望ましくない生物活性が低下または消失する。
【0041】
本発明の特定の構築物のさらにもう1つの利点は、CYP1B1タンパク質の部分的または変化した配列のみを有する、ポリペプチド由来のMHCクラスIまたはクラスII結合性エピトープの送達が可能になることである。すなわち、完全長CYP1B1ポリペプチドの発現に伴う有害な影響が避けられる。加えて、コードされるCYP1B1タンパク質のコード配列の変更により、抗原に対する自己寛容が遮断されると考えられる。
【0042】
本発明の特定の構築物のさらにもう1つの利点は、本明細書に記載のポリペプチドの内部でのエピトープの組み合わせにより、少なくとも1つ、一般的には複数のCYP1B1エピトープが種々のHLAアロタイプのそれぞれによって提示される可能性が高まることである。これにより、ポリペプチドをコードする単一の核酸を用いて、HLA遺伝子座に多型のある個体の集団に免疫処置を行うことが可能になる。
【0043】
別に定義する場合を除き、本明細書で用いるすべての技術用語および科学用語は、本発明が属する当業者が一般に理解しているものと同じ意味を持つ。本発明の実施または検討のために本明細書に記載したものと同様または同等の方法および材料を用いることができるが、好ましい方法および材料は以下に説明するものである。本明細書で言及するすべての刊行物、特許出願、特許およびその他の参考文献は、その全体が参照として本明細書に組み入れられる。対立が生じた場合には、定義を含め、本明細書が支配的であるものとする。さらに、材料、方法および実施例は例示的なものに過ぎず、限定を意図したものではない。
【0044】
本発明のその他の特徴および利点は、以下の詳細な説明および特許請求の範囲から明らかになると考えられる。
【図面の簡単な説明】
【0045】
【図1A】CYP1B1をコードする核酸(配列番号:1)およびポリペプチド(配列番号:2)の配列を示している。
【図1B】図1Aの続きを示す図である。
【図1C】図1Bの続きを示す図である。
【図1D】図1Cの続きを示す図である。
【図2】オープンリーディングフレーム(ORF)および種々の量の非翻訳領域(UTR)を含むCYP1B1 cDNA構築物の概略図である。
【図3】CYP1B1ポリペプチド(配列番号:2)ならびにいくつかのCYP1B1切断型および欠失型変異体の概略図である。
【図4】CYP1B1発現ベクターによる免疫処置を行ったマウスにおけるCYP1B1応答性T細胞の生成を示している。
【図5】CYP1B1変種発現ベクターによる免疫処置を行ったマウスにおけるCYP1B1応答性T細胞の生成を示している。
【図6】CYP1B1発現ベクターによる免疫処置に続いて電気穿孔法を行ったマウスにおけるCYP1B1応答性T細胞の生成を示している。
【図7】ポリマーネットワーク中に含まれるCYP1B1発現ベクターによる免疫処置を行ったマウスにおけるCYP1B1応答性T細胞の生成を示している。
【図8】微粒子内に含まれるCYP1B1発現ベクターによる免疫処置を行ったマウスにおけるCYP1B1応答性T細胞の生成を示している。
【図9】CYP1B1発現ベクターによる免疫処置を行ったマウスにおけるCYP1B1応答性MHCクラスII拘束性T細胞の生成を示している。
【0046】
詳細な説明
本発明は、天然型のCYP1B1転写物の非翻訳領域(UTR)に認められる配列を欠いた転写ユニットである、CYP1B1ポリペプチドまたはその部分をコードする転写ユニットを含む核酸を提供する。天然型のCYP1B1転写物は、少なくともある種の細胞環境で翻訳の部分的または全体的な抑制の一因となる翻訳抑制因子を含むと考えられている。本発明の核酸は翻訳抑制因子を欠いており、このため、CYP1B1ポリペプチドまたはその部分の翻訳が増強される系を提供する。
【0047】
本発明の核酸は、個体におけるCYP1B1特異的な免疫応答の誘発または増強のためのツールとして有用である。本核酸は天然のCYP1B1転写物に含まれる翻訳抑制因子を欠いているため、CYP1B1タンパク質またはその一部の産生を可能とし、これによって免疫応答の発生を促進する。本発明の核酸は多数のCYP1B1エピトープをコードしうるため、多岐にわたるMHCアロタイプを含む集団において免疫応答を誘発させるために有用である。本発明の核酸は、コードされるタンパク質の免疫原性を高めるのに役立つ変異、欠失、挿入または転位を含むこともできる。こうすることにより、改変されたCYP1B1配列を含むタンパク質が自己寛容を引き起こすのを妨げられると考えられる。加えて、本発明の核酸は、天然のCYP1B1転写物に含まれる翻訳抑制因子を欠くため、インビトロまたはインビボのいずれかでCYP1B1ポリペプチドまたはその部分を生成させる目的にも有用である。
【0048】
核酸
本発明の核酸は、(1)CYP1B1ポリペプチドまたはその一部をコードするが(2)天然のCYP1B1転写物には対応しない、転写ユニットを含む。ヒトCYP1B1の核酸配列(配列番号:1)およびタンパク質配列(配列番号:2)を図1A〜1Dに示す。本明細書ではこれらの配列を本発明の核酸を説明するための基準(reference)として用いる。天然のヒトCYP1B1核酸の配列はジェンバンク(GenBank)(商標)アクセッション番号U03688、およびタング(Tang)ら(1996)J. Biol. Chem. 271:28324に記載されており、その内容は参照として組み入れられる。ラットおよびマウスなどの他の哺乳動物でオルソロガスなCYP1B1配列が同定されている(Walkerら(1995)Carcinogenesis 16:1319;Shenら(1994)DNA Cell Biology 13:763;Savasら(1994)J. Biol. Chem. 269:14905;これらは参照として本明細書に組み入れられる)。ヒト、ラットおよびマウスなどの改変型の真核生物CYP1B1核酸も本発明に含まれる。
【0049】
5'および/または3' UTRに含まれ、翻訳抑制因子として作用する特定の配列を転写ユニットが欠いている点で、本発明の核酸は天然のCYP1B1核酸とは異なる。翻訳抑制因子の実体はさまざまな方法によって決定しうる。
【0050】
ヌクレオチド配列が翻訳抑制因子を含むか否かを判定する第1の方法では、完全長RNAの配列を、例えばコンピュータプログラムにより、翻訳抑制にかかわるコンセンサス配列の存在に関して解析する。例えば、コンピュータ解析により、リプレッサー物質(例えばリプレッサータンパク質)が結合しうる配列を同定することができる。もう1つの例では、コンピュータ解析により、RNA不安定化配列として作用する配列、例えば、それが存在することによって少なくともある種の細胞環境で転写物の半減期が短縮するヌクレオチド配列を同定することができる。もう1つの例では、コンピュータ解析により、転写物中に二次構造を形成すると思われる、翻訳抑制にかかわるコンセンサス配列を同定することができる。
【0051】
配列番号:1の配列に対応するCYP1B1 RNA転写物のUTRの解析により、二次構造と推定される領域が同定された。この解析は、ズーカー(Zuker)およびターナー(Turner)によるmfoldプログラムのバージョン3.0を用いて行った(Zukerら(1999)、「RNAの二次構造の予測のためのアルゴリズムおよび熱力学:実践的ガイド(Algorithms and Thermodynamics for RNA Secondary Structure Prediction:A Practical Guide)」、「RNAの生化学およびバイオテクノロジー(RNA Biochemistry and Biotechnology)」中、11〜43、J. Barciszewski & B.F.C. Clark編、NATO ASIシリーズ、Kluwer Academic Publishers;Mathewsら(1999)J. Mol. Biol. 288:911〜940)。mfoldは自由エネルギーの最小化に基づくRNA二次構造の予測のためのズーカー(Zuker)アルゴリズムを具体化したものである。本解析におけるフォールディング温度は37℃に固定される。
【0052】
CYP1B1 RNA転写物中の二次構造と予想される領域を表1に示す。これらの領域は翻訳リプレッサーと推定されるものを構成しており、このため、本発明の核酸はこれらの配列、配列番号:3〜17のうち1つまたは複数(例えば、2、3、4、5、6、7、8、9、10、11、12、13、14または15個)を欠くことが可能である。
【0053】
〔表1〕 CYP1B1転写物の非翻訳領域の二次構造解析

【0054】
ヌクレオチド配列が翻訳抑制因子を含むか否かを判定する第2の方法では、改変されたCYP1B1転写物によって産生されるタンパク質の量を野生型CYP1B1転写物と比較する実験的な評価により、翻訳抑制因子を同定することができる。例えば、配列番号:1の配列のUTR欠失変異体を構築し、変異体および配列番号:1の配列のそれぞれを別の細胞集団で発現させて、変異体および野生型のそれぞれから産生されたCYP1B1タンパク質の量を比較する。改変された転写物の方が野生型CYP1B1よりもタンパク質産生を増強させるならば、それには1つまたは複数の翻訳抑制因子があると考えられる。例えば、本発明の核酸は、配列番号:18の5' UTR配列(配列番号:1のヌクレオチド1〜362)を欠くものでもよい。もう1つの例において、核酸は配列番号:19の3' UTR配列(配列番号:1のヌクレオチド2011〜5128)を欠くものでよい。もう1つの例において、核酸は配列番号:18および配列番号:19の両方を欠くものでよい。配列番号:18および/または配列番号:19の両方を欠いた核酸に加えて、本発明は、配列番号:18および/または配列番号:19のうち特定の数の連続したヌクレオチド、例えば少なくとも400、300、200、150、100、50、25または10個を欠いた核酸も含む。この解析は上記のコンピュータ解析とともに行うことができる。
【0055】
本発明の核酸が、コードされるCYP1B1タンパク質またはその変種の免疫原性を高めるのに役立つ変異、欠失、挿入または転位を含む点で、天然のCYP1B1核酸と異なってもよい。タンパク質の免疫原性を評価する方法は当技術分野で周知であり、これには、核酸による免疫処置を動物に行い、その後にリンパ節、脾臓、血液または血清を採取してT細胞応答またはB細胞応答に関して分析することが含まれる。標準的なアッセイは本明細書に説明されており、これにはCr51アッセイ、エリスポット(Elispot)アッセイ、テトラマーアッセイ、ELISA、CYP1B1に特異的な細胞傷害性T細胞(CTL)を測定するためのFACSによる細胞内サイトカイン染色分析、ヘルパーT応答を測定するためのエリスポット(Elispot)アッセイおよびT細胞増殖試験、ならびにB細胞応答を測定するためのELISAおよびウエスタン分析が含まれる。
【0056】
配列番号:1などのCYP1B1核酸に対する改変は、当業者に周知の方法によって行うことができる。特定の5'および/または3' UTR配列の除去は、適切なプライマー対を用いたテンプレートのPCR増幅および増幅産物の発現ベクター中へのサブクローニングによって行える。例えば、配列番号:18および配列番号:19を欠く核酸は、配列番号:1の核酸をテンプレートとし、配列番号:1の363〜382の領域に対応するプライマー(プライマー1)および配列番号:1の1991〜2010の領域に対応するプライマー(プライマー2)を用いるPCR増幅によって構築可能である。
【0057】
図2A〜2Cは、CYP1B1をコードする核酸の3つの例を示している。これらの図は配列番号:1のヌクレオチド位置を参照している。図2Aは配列番号:1の完全長CYP1B1核酸である。図2Bは配列番号:1の切断型であり、5'UTRおよび3' UTRの一部を欠いたものである。図2Cは、図2AのCYP1B1核酸に存在する5' UTRのすべて、さらには3' UTR配列のすべてを欠いたものである。
【0058】
ポリペプチドをコードする核酸の発現を促進するために、核酸に調節因子を含めることができる。これらの因子には、ヒトまたは他の哺乳動物の細胞における発現を増強させるための配列、例えばプロモーターおよび/またはエンハンサーが含まれる。例えば、T7ポリメラーゼプロモーター、CMV、RSVもしくはLTRなどのウイルスプロモーター、筋特異的プロモーターなどの組織特異的プロモーター、APC特異的プロモーターなどの細胞特異的プロモーター、または誘導性プロモーターを、選択的にはコード配列の5'末端に存在させる。誘導性プロモーターの例には、メタロチオネインプロモーター(例えば、Testaら(1994)Cancer Res. 54:4508を参照)およびテトラサイクリン応答性プロモーター(例えば、Giavazziら(2001)61:309を参照)が含まれる。
【0059】
本核酸に、RNA安定化配列、例えば、コード配列の5'側および/または3'側に置かれたアフリカツメガエル(Xenopus laevis)β-グロビン遺伝子由来のRNA安定化配列;イントロン(これはコード配列の内部または隣接した任意の位置に配置しうる);ポリ(A)付加部位;複製起点;ならびに原核および/または真核宿主における構築物の複製および選択を可能にする選択マーカー(例えばカナマイシン耐性遺伝子)または栄養要求性マーカーをコードする1つまたは複数の遺伝子、を含めることもできる。
【0060】
本核酸に、天然のCYP1B1転写物に由来するものでない翻訳調節配列を含めることもできる。翻訳調節配列は当技術分野で知られている(例えば、AzizおよびMunro(1987)Proc. Natl. Acad. Sci. USA 84:8478を参照)。翻訳調節配列を本明細書に記載の転写ユニットに付加することにより、タンパク質発現の翻訳調節が可能になる。例えば、コードされるタンパク質の翻訳に鉄応答性イベントを付与する目的で、フェリチンmRNAの5' UTRの最初の67ヌクレオチド(AzizおよびMunro、前記)を本明細書に記載の転写ユニットと連結することができる。
【0061】
本核酸に、他の転写シグナルおよび翻訳シグナル、例えばコザック配列、さらにはFLAG、myc、HAまたはHisタグなどの抗体決定基をコードする配列などを、選択的にはコード配列の5'または3'末端であって終止コドンの前に存在するように、含めてもよい。
【0062】
CYP1B1ポリペプチドをコードする核酸は、哺乳動物の抗原提示細胞(APC)における発現を可能にする任意のベクター中に含めることができる。核酸を発現ベクター、すなわち内部でコード配列が発現制御配列と機能的に結合しているベクター中にクローニングしてもよい。本発明に有用なベクターには、線状の核酸断片または環状のDNA、プラスミドベクター、ウイルスベクター、真菌ベクターおよび細菌ベクターが含まれる。「プラスミド」とは、自律性で自己複製能のある染色体外の環状DNAのことである。好ましいウイルスベクターは、レトロウイルス、アデノウイルス、アデノ随伴ウイルス、ポックスウイルス、SV40ウイルス、アルファウイルスまたはヘルペスウイルスに由来するものである。適したベクターの例には、一連のpcDNA哺乳動物発現ベクター(Invitrogen)がある。
【0063】
核酸は単一のポリペプチドをコードすることもでき、二重プロモーターベクターのように、それぞれが異なるプロモーターの制御下にある複数のポリペプチドをコードすることもできる。二重プロモーターベクターにより、所定のベクターから産生されるエピトープの数を減らさずに、2つの短いポリペプチドを単一の長いものの代わりに用いることが可能となる。また、第1のポリペプチドの配列およびおそらくはプロセシングを変化させずに、新たなCYP1B1配列を追加することも可能となる。2つの関係のないタンパク質、例えばCYP1B1および免疫刺激物質をコードすることも可能である。または、核酸は、2つのコード配列の間、例えば本明細書に記載の2つのポリペプチドをコードする核酸配列の間の位置にIRES配列を含む。IRES配列はリボソームを下流の翻訳単位の開始コドンに結合させ、単一のポリシストロン性mRNAからの第2のタンパク質の翻訳を引き起こす。2つ以上のポリペプチドをコードする発現ベクターは、選択的には、1つの分泌性ポリペプチドおよび1つの非分泌性ポリペプチドをコードすることが可能である。このようなベクターは、T細胞応答およびB細胞応答の両方を誘導するために用いることができる。また、2つの関係のないタンパク質、例えばCYP1B1および免疫刺激物質をコードさせるためにこれを用いることもできる。
【0064】
CYP1B1ポリペプチド
本発明の核酸は、MHCクラスIもしくはクラスII分子または免疫グロブリン受容体と結合する少なくとも1つのペプチドエピトープを含むCYP1B1またはその一部を含むポリペプチドをコードする。本明細書に記載のポリペプチドをコードする核酸は、ポリペプチドのアミノ末端に、翻訳を促すためのメチオニン残基をコードすることができる。本ポリペプチドは、CYP1B1の複数のエピトープ、さらにはそれぞれが1つまたは複数のエピトープを含むCYP1B1の複数の区域を含みうる。CYP1B1のMHC結合エピトープは当業者に周知の方法によって同定可能である。MHCクラスI結合ペプチドは一般に長さが8〜10アミノ酸残基であり、一方、MHCクラスII結合ペプチドは一般に長さが12〜30アミノ酸残基である。
【0065】
特定のMHCアレルと結合するエピトープは、CYP1B1由来の一連の重複性ペプチド断片をまず合成し、MHCアレルと結合することが知られた放射標識ペプチドを用いる当技術分野で知られた結合試験によりペプチドを試験することによって同定可能である。被験ペプチドが、例えば、放射標識した被験ペプチドとの競合による評価で、MHCアレルと特異的に結合すること(すなわち、エピトープであること)が示されれば、そのエピトープを別のエピトープ(重複性または隣接性)と組み合わせて何らかの区域を作製または規定することができる。上記の方法および関連した方法の例は、米国特許第6,037,135号、国際公開公報第99/45954号および国際公開公報第044775A2号に記載されており、これらは参照として本明細書に組み入れられる。
【0066】
または、放射標識したβ2-ミクログロブリンおよび被験ペプチドの存在下での可溶性MHCクラスI分子のリフォールディングによってエピトープを同定することもできる。完全な複合体はリフォールディングし、正しいサイズの受容体を生じると考えられる。β2-ミクログロブリンは、被験ペプチドの結合親和性と直接相関する測定可能な速度で複合体から解離する(Garbocziら(1992)Proc. Nat. Acad. Sci. USA 89:3429;Parkerら(1992)J. Biol. Chem. 267:5451;およびParkerら(1992)J. Immunol. 149:1896)。この種のデータの解析により、HLA-A2受容体に関して所定の被験ペプチドの解離時間を予測するアルゴリズムが得られている(Parkerら(1994)J. Immunol. 152:163)。迅速な解離は低い親和性と、緩徐な解離は高い親和性と相関づけられている。このアルゴリズムは敷衍され、HLA-Aアロタイプ、HLA-A1、HLA-A2、HLA-A3、HLA-A11およびHLA-A24に関するエピトープの結合親和性の予測に利用できるようになっている。このアルゴリズムはウェブサイト(http://wwwbimas.dcrt.nih.gov/molbio/hla_bind/index.html)で見ることができる。エピトープが有効な細胞傷害性T細胞(CTL)応答を生じさせるには、それが抗原提示細胞(APC)上のMHC分子と結合し、その結果生じた受容体-リガンド複合体がCTL上に発現されたT細胞受容体によって認識される必要がある。
【0067】
または、米国特許第5,827,516号および米国特許出願第09/372,380号(これらは参照として本明細書に組み入れられる)などに記載された技法を用いてMHCクラスIまたはクラスII結合ペプチドを同定することにより、エピトープを同定することもできる。
【0068】
上記のMHC分子とインビトロで結合するエピトープを、インビトロ免疫感作アッセイで、ヒトT細胞応答を誘発する有効性に関して評価すること(またはT細胞応答を生じさせるために用いること)ができる(例えば、Schultzeら(1997)J. Clin. Invest. 100:2757を参照)。この種のアッセイは以前に、ヒトおよびマウスのT細胞応答性エピトープを同定するために用いられている(Alexanderら(1996)Amer. J. Obstet. and Gynecol、175:1586;Tarpeyら(1994)Immunology 81:222)。これらのアッセイは、免疫療法のために多数の特異的CTLを作製する目的にも用いられる(Tsaiら(1998)Crit. Rev. Immunol. 18:65)。信頼性を確保するためには、被験ペプチドによるパルス刺激を行った樹状細胞(DC)の存在下で1回目のT細胞刺激を行うことが望ましい。さらに、刺激時にIL-10を含めることにより、細胞の培養中に起こることが時にある非特異的な反応が抑制されるとかもしれない。続いて、T細胞の活性化を、λ-IFN分泌を測定するELISAアッセイを用いて、IL-10、IL-4、TNFα、IFN-γもしくはIL-2などのサイトカインを測定するエリスポット(ELISPOT)により、またはλ-IFNなどのサイトカインを含むCD8+、CD16-細胞の増加を三色分析によって判定するFACSを用いることによって検討する。または、T細胞の活性化を、51Cr放出CTLアッセイまたはテトラマーアッセイを用いて測定することもできる(例えば、Molldremら(2000)Nature Med. 6:1018を参照)。
【0069】
所定のアロタイプを有するすべての個体が特定のエピトープに反応するとは限らない可能性がある。例えば、HLA-A2アロタイプを有する細胞を持つある個体は所定のエピトープに反応するが、同じような第2の個体は反応しないことが考えられる。この問題を克服するためには、2体のドナー、さらにより好ましくは3体のドナーからのT細胞に関してそれぞれのHLAアロタイプを検討し、それがT細胞エピトープであることを確認するとよい。さらに一般的なアレル(すなわち、HLA-A2およびHLA-A3)の場合は、最大で4体のドナーを検討することが好ましい。
【0070】
各エピトープの検討は、まず1体のドナーからの細胞を用いて行う。第1のドナーの細胞を用いてエピトープがT細胞応答を誘発しなければ、第2のドナー、さらには第3ドナーからの細胞を用いてさらに検討する。2回または3回の試行を行ってもエピトープがT細胞応答性を示さなければ、選択的には、これをポリペプチドに含めるものとしては選択しない。
【0071】
抗原のインビトロ提示を行う方法を変更することにより、分析を強化することもできる。DCによるT細胞の初回刺激は通常、インビトロ免疫処置の一部である。免疫感作を増強するために、十分な抗原提示およびT細胞刺激が確実に行われるように、例えば、前もって作製した後に凍結しておいたCDを用いて、各刺激時にDCを加えることができる。または、APCの細胞表面CD40受容体に対する抗体結合によって抗原提示細胞(APC)を活性化することにより、T細胞刺激を増強させることもできる。
【0072】
または、エピトープを、HLA分子に対する結合親和性のみに基づいて構築物中に含めるために選択すること、または、本明細書ならびにシッツ(Chicz)ら(1993)J. Exp. Med. 178:27および米国特許第5,827,516号における記載のように、自然にプロセシングされたペプチドの分析に基づいて同定することも可能である。
【0073】
B細胞エピトープは、哺乳動物における免疫応答を誘導する能力に基づいて選択することができる。例えば、CYP1B1ペプチドをフロイントアジュバントと混合してマウスに注射する。免疫処置動物から血清を採取し、CYP1B1に対する応答性に関してウエスタンブロットによる試験を行う(市販されている、Gentest、Woburn MA)。
【0074】
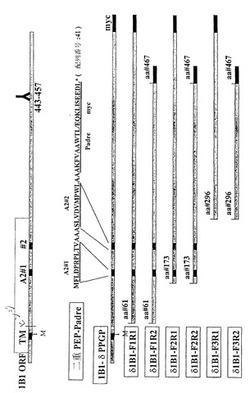
本発明の核酸によってコードされるポリペプチドは、必ずしも配列番号:2の完全長CYP1B1タンパク質を含む必要はない。例えば、本発明の核酸によってコードされるポリペプチドは、天然のCYP1B1の生物活性を欠くことができる(例えば、Heidelら(2000)Cancer Res. 60:3454)。CYP1B1ポリペプチドまたはその一部をコードする核酸が、機能喪失型変異(例えば挿入、欠失、フレームシフト変異または一塩基変異)を有するコード配列を含むこともできる(Baileyら(1998)Cancer Res. 58:5038)。CYP1B1コード配列中のフレームシフト変異の例は、ストイロフ(Stoilov)ら(1997)Hum. Mol. Gen. 6:641およびサーファラージ(Sarfarazi)ら(1997)Hum. Mol. Gen. 6:1667に記載されている。もう1つの例において、ポリペプチドは、ヒンジ領域(例えば、配列番号:2のアミノ酸約38〜61)または配列番号:2のアミノ酸約400〜540の間に位置するCYP1B1のヘム結合部分の保存的コア配列の全体もしくは一部を欠くことができる(Stoilovら(1998)Am. J.Human Genet. 62:573)。もう1つの例において、ポリペプチドは、CYP1B1の酸化還元ドメインの全体もしくは一部を欠くことができ、または活性部位領域(Lewisら(1999)Toxicology 139:53)もしくはタンパク質のフォールディングもしくは安定性のために必要な領域に変異を有することができる。もう1つの例において、ポリペプチドは、配列番号:2のアミノ酸約18〜37の間に位置するCYP1B1膜貫通領域の全体または一部を欠くことができる。
【0075】
図3は、CYP1B1ポリペプチド(配列番号:2)ならびにその断片および変種を示している。図3に示した種々のポリペプチドは、CYP1B1をコードする本明細書に記載の核酸、例えば、5' UTRおよび/または3'UTRの全体または一部を欠く核酸によってコードされうる。ポリペプチドの中には配列番号:22のペプチドを含むものもある。図3に示したCYP1B1断片および変種を以下に説明する。
【0076】
配列番号:31
本ポリペプチドは、CYP1B1のヒンジ領域内に4アミノ酸(配列番号:2の残基51〜54)の欠失を含む。本ポリペプチドは、野生型タンパク質と比較して、残基57(WからCに)、61(GからEに)、365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には下線を付した。配列番号:31のアミノ酸配列を以下に列挙する:

【0077】
配列番号:32
本ポリペプチドは、配列番号:2のアミノ酸1〜60の欠失を含む。欠失はCYP1B1のERドメイン、膜貫通ドメインおよびヒンジ領域を包含する。メチオニン(下線を付した)は配列番号:32のポリペプチドのアミノ末端に位置する。本ポリペプチドは、野生型タンパク質と比較して、残基365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には同じく下線を付した。この配列はF1R1と命名された。配列番号:32のアミノ酸配列を以下に列挙する:

【0078】
配列番号:33
本ポリペプチドは、配列番号:2のアミノ酸1〜60および462〜543の欠失を含む。欠失はCYP1B1のERドメイン、膜貫通ドメインおよびヒンジ領域を包含する。メチオニン(下線を付した)は配列番号:33のポリペプチドのアミノ末端に位置する。本ポリペプチドは、野生型タンパク質と比較して、残基365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には同じく下線を付した。この配列はF1R2と命名された。配列番号:33のアミノ酸配列を以下に列挙する:

【0079】
配列番号:34
本ポリペプチドは、配列番号:2のアミノ酸1〜171の欠失を含む。欠失はCYP1B1のERドメイン、膜貫通ドメインおよびヒンジ領域を包含する。メチオニン(下線を付した)は配列番号:34のポリペプチドのアミノ末端に位置する。本ポリペプチドは、野生型タンパク質と比較して、残基365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には同じく下線を付した。この配列はF2R1と命名された。配列番号:34のアミノ酸配列を以下に列挙する:

【0080】
配列番号:35
本ポリペプチドは、配列番号:2のアミノ酸1〜171および462〜543の欠失を含む。欠失はCYP1B1のERドメイン、膜貫通ドメインおよびヒンジ領域を包含する。メチオニン(下線を付した)は配列番号:35のポリペプチドのアミノ末端に位置する。本ポリペプチドは、野生型タンパク質と比較して、残基365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には同じく下線を付した。この配列はF2R2と命名された。配列番号:35のアミノ酸配列を以下に列挙する:

【0081】
配列番号:36
本ポリペプチドは、配列番号:2のアミノ酸1〜292の欠失を含む。欠失はCYP1B1のERドメイン、膜貫通ドメインおよびヒンジ領域を包含する。本ポリペプチドは、野生型タンパク質と比較して、残基365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には下線を付した。この配列はF3R1と命名された。配列番号:36のアミノ酸配列を以下に列挙する:

【0082】
配列番号:37
本ポリペプチドは、配列番号:2のアミノ酸1〜292および462〜543の欠失を含む。欠失はCYP1B1のERドメイン、膜貫通ドメインおよびヒンジ領域を包含する。本ポリペプチドは、野生型タンパク質と比較して、残基365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には下線を付した。この配列はF3R2と命名された。配列番号:37のアミノ酸配列を以下に列挙する:

【0083】
挿入、欠失、フレームシフト変異または一塩基変異をCYP1B1ポリペプチド配列に導入し、野生型タンパク質と比較して安定性および/または生物活性が変化したポリペプチドを得ることができる。CYP1B1ポリペプチドの安定性を変化させることにより、細胞機構によるそのプロセシングに影響を及ぼすことができる。例えば、安定性の低下したCYP1B1ポリペプチドはより多くのプロセシングを受け、それによってMHCクラスIおよび/またはクラスII分子によって提示されるCYP1B1ペプチドが増加すると考えられる。CYP1B1の生物活性を変化(例えば、低下または消失)させることにより、酵素活性などの不要な活性を低下または消失させることができる。
【0084】
以下のものは、野生型CYP1B1タンパク質と比較して、3つ(配列番号:38)および5つ(配列番号:39)のアミノ酸残基に変化を含むCYP1B1ポリペプチドの例である。
【0085】
配列番号:38
本ポリペプチドは、野生型タンパク質と比較して、残基57(WからCに)、61(GからEに)および365(GからWに)にアミノ酸の変化を含む。変化した残基には下線を付した。配列番号:38のアミノ酸配列を以下に列挙する:

【0086】
配列番号:39
本ポリペプチドは、野生型タンパク質と比較して、残基57(WからCに)、61(GからEに)、365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には下線を付した。配列番号:39のアミノ酸配列を以下に列挙する:

【0087】
上記のように、本明細書に記載の核酸によってコードされるポリペプチドは、MHCクラスIもしくはクラスII分子または免疫グロブリン受容体と結合するCYP1B1またはその一部を含む。ポリペプチドは、配列番号:2に存在する連続したアミノ酸の配列に対応する25、50、150、200、250、300、400、500個またはそれ以上のアミノ酸を含みうる。加えて、ポリペプチドの長さは300、200、150、100または50未満のアミノ酸でありうる。例えば、ポリペプチドは配列番号:20(配列番号:2のアミノ酸1〜272)または配列番号:21(配列番号:2のアミノ酸273〜544)を含みうる。
【0088】
本明細書に記載の任意のCYP1B1ポリペプチドまたはその断片は、野生型CYP1B1タンパク質または改変型CYP1B1配列と同一な配列の全体または一部を含みうる。例えば、本明細書に記載したそれらの任意のものの構造を有するポリペプチド(例えば、図3に示したポリペプチド)を、配列番号:38および/または配列番号:39のポリペプチド中に含まれるアミノ酸変化のうち任意の1つまたは複数(例えば、1つ、2つ、3つ、4つまたは5つ)を含むように作製することができる。
【0089】
本明細書に記載の核酸によってコードされるポリペプチドは、配列番号:2のアミノ酸残基190〜198に対応するアミノ酸配列FLDPRPLTV(配列番号:22)を含みうる。配列番号:22のペプチドは、CYP1B1ポリペプチドの自然にプロセシングされたエピトープである。加えて、ポリペプチドは、配列番号:23(配列番号:2のアミノ酸残基185〜205)の配列に由来する少なくとも8アミノ酸を含むことができる。配列番号:22または配列番号:23を含むポリペプチドの長さは300、200、150、100または50アミノ酸でありうる。
【0090】
さらに、本発明の核酸が、ポリペプチドを希望する細胞内区画に向かわせるターゲティングシグナルであって、そのポリペプチドと結合したターゲティングシグナルをコードする1つまたは複数の配列を含んでもよい。ターゲティングシグナル(この用語は輸送(trafficking)シグナルまたはターゲティング配列と互換的に用いられる)は、タンパク質を分泌の標的とすること、またはポリペプチドを小胞体(ER)、ゴルジ体、核、リソソーム、クラスIIペプチドローディング区画もしくはエンドソームに向かわせることができ、これには、シグナルペプチド(翻訳時にタンパク質をERに向かわせるアミノ末端配列)、KDEL(配列番号:24)などのER保持ペプチド、KFERQ(配列番号:25)、QREFK(配列番号:26)などのリソソームターゲティングペプチド、ならびにQに隣接して一方の側にK、R、D、E、F、I、VおよびLから選択される4残基が並んだ他のペンタペプチドが含まれる。ポリペプチドの分泌を導くターゲティングシグナル(例えば、配列番号:40)も含まれる。また、ポリペプチドの膜への挿入を導くターゲティングシグナル(例えば、膜貫通配列)も含まれる。膜挿入配列を含むポリペプチドを細胞質尾部を有するように構築することもでき、有しないように構築することもできる。
【0091】
ERターゲティング配列の一例は、HLA-DRαリーダー配列、

である。ターゲティング配列がこの特定した25残基配列の一部分(例えば、少なくとも10アミノ酸残基)のみを含んでも、その部分がポリペプチドのERへのターゲティングを生じるのに十分であるならばよい。ターゲティング配列のもう1つの例はE1A配列である。
【0092】
核移行配列には、チャイスキー(Cheisky)ら(1989)Mol. Cell Biol. 9:2487;ロビンス(Robbins)(1991)Cell 64:615;およびディングウォール(Dingwall)ら(1991)TIBS 16:478に記載されたような、ヌクレオプラスミン様およびSV40様の核ターゲティングシグナルが含まれる。いくつかの核移行配列は、

を含む。
【0093】
場合によっては、シグナルペプチダーゼまたは他のタンパク分解物質による切断を促進するために、ターゲティングシグナルのアミノ酸配列を改変することが望ましい。シグナルペプチダーゼの認識配列はフォン・ハイーヌ(Von Heijne)(1986)Nucleic Acids Research 14:4683に記載されている。フォン・ハイーヌ(Von Heijne)の-3、-1ルールを用いると、ターゲティングシグナルが存在する際にシグナルペプチダーゼによる切断が成功する確率を高める配列を選択することができる。
【0094】
場合によっては、ポリペプチドの安定性を変化させることにより、ポリペプチド配列を野生型CYP1B1配列から改変することが望ましい。ポリペプチドの安定性を低下させる1つの方法は、プロテアソームに対するそのターゲティング性を高めることによる。例えば、ユビキチン配列を含むターゲティングシグナルを本明細書に記載のポリペプチドと結合し、ポリペプチドを分解のために細胞プロテアソームに向かわせることができる(例えば、Hochstrasser(1995)Curr. Opin. Cell. Biol. 7:215〜223;Rodriguezら(1997)J. Virol. 71:8497〜8503)。ポリペプチドの安定性を低下させる別の方法では、ポリペプチドが、タンパク質安定性に寄与するCYP1B1配列の全体または一部、例えば、ヒンジ領域(配列番号:2のアミノ酸約38〜61)の全体または一部を欠くことができる。1つの例において、ポリペプチドは配列番号:2のアミノ酸51〜54の間に位置するPPGP領域を欠く(例えば、配列番号:31のポリペプチドを参照)。
【0095】
または、ポリペプチドがターゲティングシグナルを欠くこともでき、こうするとポリペプチドは細胞質に位置すると考えられる。
【0096】
ひとたび細胞内で発現されると、コードされたペプチドはプロセシングされ、複数のMHCクラスI結合エピトープのいずれか1つとなる。MHC分子はペプチドと結合するとT細胞応答を活性化することができる。MHCクラスII結合ペプチドもコードされたペプチドから生じうる。これらのペプチドは、MHCクラスII発現細胞によって提示されるとヘルパーT細胞またはCTLを活性化すると考えられる。他の受容体も、コードされたペプチドまたはプロセシングされたその断片と結合し、NKまたはB細胞などの免疫細胞を活性化しうる。これらの細胞は、本発明のペプチドに反応して誘発されたサイトカインによっても活性化されうる。1つの例では、配列番号:40などの分泌シグナルをポリペプチドに付加し、ポリペプチドの分泌およびB細胞などの免疫細胞の活性化をもたらす。
【0097】
CYP1B1の複数の区域を含むポリペプチドにおいて、ポリエピトープ性ポリペプチド内部の区域の順序は、それらの区域が天然のCYP1B1タンパク質中に存在する順序に対応しうるが、天然のタンパク質中で個々の区域の間にあるアミノ酸配列のいくつか(すなわち、少なくとも1つの残基)が欠失してもよい。または、区域の順序が天然のタンパク質のものと異なってもよい。このプロセスによって作製されるタンパク質は分子進化(例えば、米国特許第6,132,970号を参照)、エクソンシャッフリングまたはドメインシャッフリングのアプローチによってデザインされたものでもよい。
【0098】
ポリペプチドがプロセシングされ、エピトープがMHCによって提示されたか否かを明らかにするためには、ポリエピトープ性ポリペプチドコード配列を含む組換えワクシニアウイルスに感染させた自己脾細胞、PBLまたはEBV形質転換細胞を用いてインビトロT細胞刺激アッセイを行うとよい。これらの標的細胞は、脾細胞またはPBLを、3〜10プラーク形成単位(pfu)/細胞の多重感染度(moi)の組換えワクシニアとともに37℃で2時間インキュベートすることによって作製する。感染後に細胞をペレット化し、洗浄した上でインビトロ刺激アッセイにおける標的として用いる。異なるMHCアロタイプを有する1つまたは複数の個体、例えばマウスまたはヒト由来(またはCYP1B1ポリペプチドもしくは核酸構築物による免疫処置を行った1つもしくは複数の個体由来)の刺激したT細胞を標的細胞とともにインキュベートし、標的細胞がT細胞を刺激する能力を、例えばλ-インターフェロンの発現または分泌によって測定する。
【0099】
または、ポリエピトープ性ポリペプチドからのエピトーププロセシングを、ヒト細胞から精製したプロテアソームを用いて検討することもできる(Theobaldら(1998)J. Exp. Med. 188:1017;Kisselevら(1999)J. Biol. Chem. 289:3363;およびNussbaumら(1998)Proc. Nat. Acad. Sci.(USA)95:12404)。
【0100】
T細胞アッセイのほかに、例えばトランスジェニックマウスを用いるアッセイを用いて、インビボで送達した場合の構築物の機能(例えば、エピトープが正しくプロセシングされて提示されること)を確認することもできる。HLA-A2拘束性の提示を測定するためには、哺乳動物発現ベクター(例えば、プラスミド)中にあるポリエピトープ構築物を微粒子内に封入し、HLA-A2トランスジェニックマウスに筋肉内または皮下注射などの経路によって導入する。または、微粒子送達媒体を用いずに、構築物を例えば、組換えウイルスもしくは細菌ベクター、例えばワクシニアウイルス中にある形で、または裸のDNAとして投与してもよい。その後にインビトロでT細胞応答を評価する(Hedleyら、Nature Med. 4:365〜68、1998)。標的細胞としては、被験A2エピトープによるパルス刺激を加えたT2A2細胞(HLA-A2をコードするDNAをトランスフェクトしたT2細胞)またはEL4.A2細胞(HLA-A2をコードするDNAをトランスフェクトしたEL4細胞)、および本発明の核酸を導入したT2A2細胞が可能である。ペプチドを用いない、または無関係なペプチドによるパルス刺激を加えたEL4.A2細胞またはT2A2細胞を用いる試験を平行して行う。このようにして、本発明の核酸の投与後にインビボでプロセシングされて提示されるHLA-A2エピトープが同定される。陽性の結果が得られれば、ポリエピトープ性ポリペプチドのプロセシングが予想通りに起こったことが示唆される。
【0101】
または、ハンケ(Hanke)ら(1998)Vaccine 16:426の方法に従って、または米国特許出願第60/154,665号および米国特許出願第60/169,846号(これらは参照として本明細書に組み入れられる)に記載されたように、ポリエピトープ性ポリペプチドを作製してもよい。
【0102】
免疫刺激物質
組成物は、本明細書に記載の核酸のほかに、アジュバントもしくは免疫刺激物質、または免疫刺激物質をコードする核酸を含むことが可能である。有用なアジュバントおよび免疫刺激物質の例には以下のものが含まれる:ISCOMS、ウイルス様粒子(VLP)、ミョウバン、金、フロイントアジュバント、サイトカイン、例えばIL-12、GM-CSF、IL-2またはIFN-γなど;B7-1、B7-2またはCCR5などの細胞表面受容体;リポ多糖(LPS);モノホスホリルリピドA;QS21;例えば長さ18〜30ヌクレオチドのCpG含有オリゴヌクレオチド;および細菌毒素などの細菌性ポリペプチド。樹状細胞などの専門化した抗原提示細胞の分化または活性化を刺激する化合物は、免疫刺激物質として有用である。CpG含有オリゴヌクレオチドの例は米国特許第6,239,116号に記載されている。選択的には、本明細書に記載のポリペプチドおよび免疫刺激物質をコードする核酸を、単一のベクター、例えば本明細書に記載の二プロモーターベクターまたはIRESベクター中に含めることができる。または、本発明の核酸が、免疫刺激物質とインフレームに融合したCYP1B1ポリペプチドまたはその一部をコードすることもできる。この種の融合タンパク質の作製方法は当技術分野で周知であり、例えば国際公開公報第95/05849号に記載されている。
【0103】
方法
本発明の核酸を、リンパ増殖性疾患もしくは癌などのさまざまな種類の細胞増殖性疾患を有することが判明している個体、さまざまな種類の癌を有する疑いのある個体、またはさまざまな種類の癌に罹患しやすい個体(例えば、癌の易罹病性に関する遺伝子的および/または遺伝的な徴候、例えばBRCA1遺伝子の変異を有する個体)において免疫原として用いることができる。他の適した個体には、癌に関連した疾患の症状を呈している、またはそれを発症する可能性が高い例が含まれる。核酸は、種々の細胞増殖性疾患または癌、例えば膀胱、乳房、結腸、結合組織、肺、食道、皮膚、リンパ節、脳、卵巣、胃、子宮、精巣および前立腺の癌に関連した疾患を予防または治療するために予防的または治療的に用いることができる。1つの例では、核酸をワクチンとして用いる。
【0104】
ペプチドをコードする核酸は、さまざまな種類の増殖性疾患もしくは癌またはこれらの増殖性疾患もしくは癌に関連した疾患を治療するために、単独で投与することもでき、または当技術分野で知られた他の治療法、例えば化学療法、放射線療法および外科手術と組み合わせて投与することもできる。さらに、本発明の核酸を、免疫応答を増強するためにデザインされた他の治療と組み合わせて、例えば、当技術分野で周知のように、アジュバント、ビタミン、免疫刺激物質またはサイトカイン(またはサイトカインをコードする核酸)との同時投与によって、投与することもできる。核酸および免疫刺激物質を含む組成物については本明細書で説明している。
【0105】
本発明の核酸を、種々の癌またはこれらの癌に関連した疾患の予防または治療のための医薬品の製造に用いることもできる。
【0106】
CYP1B1ポリペプチドまたはその部分をコードする核酸は、急速に増殖している細胞集団または腫瘍、例えば、CYP1B1タンパク質を発現し、CYP1B1ペプチドをMHC分子と関連づけて提示する腫瘍、またはCYP1B1タンパク質を細胞表面に発現する腫瘍に対する癌罹患動物(patient)の免疫応答を誘発するための免疫療法に用いることができる。天然型のCYP1B1転写物は翻訳の部分的または全体的な抑制の一因となる翻訳抑制因子を含むと考えられるため、個体の免疫系はCYP1B1に対してナイーブまたは寛容であると思われる。他の細胞におけるCYP1B1タンパク質の発現は免疫学的自己寛容をもたらすと思われ、このため、自己寛容を妨げる機構によって本発明の核酸の有効性が高まると思われる。例えば、本発明の核酸は翻訳抑制因子を少なくとも1つ欠いており、このため、CYP1B1ポリペプチドまたはその部分の翻訳が増強された系を提供し、それによって個体の免疫系に抗CYP1B1免疫応答を生じさせる能力がある。本明細書に記載のポリペプチドを個体の1つの細胞、例えば非悪性APCなどの非悪性細胞に産生させて、個体の別の細胞、例えば癌細胞に対する体液性および/または細胞免疫応答を生じさせることが可能である。
【0107】
高レベルの発癌物質に曝露された個体、例えば喫煙者の中には、CYP1B1を高レベルに発現し、このためこのタンパク質に対する寛容を示す例があると思われる。本明細書に記載の方法によって抗CYP1B1免疫応答を生じさせることにより、このような個体におけるこの寛容を遮断し、それによってCYP1B1発現細胞、例えば癌細胞に対する免疫応答が生じると考えられる。
【0108】
本明細書に記載の核酸構築物をエクスビボ治療に用いることもできる。例えば、樹状細胞、末梢血単核細胞または骨髄細胞などの細胞を個体または適切なドナーから採取し、核酸組成物または本明細書に記載の核酸によってコードされるポリペプチドによりエクスビボで活性化した上で、個体に戻すことができる。さらに、筋芽細胞などの細胞に本明細書に記載の核酸発現ベクターをトランスフェクトした上で個体に投与することもできる。このため、CYP1B1を発現する筋芽細胞は、抗CYP1B1免疫応答を生じさせるためのCYP1B1のインビボでの源として働く。
【0109】
抗CYP1B1免疫応答を生じさせるための本明細書に記載の方法は、抗CYP1B1免疫応答の発生に付随する、テロメラーゼ、癌胎児性抗原(CEA)またはp53などの1つまたは複数の追加的な癌関連抗原に対する免疫応答を生じさせることも含みうる。このような免疫応答は、第1のポリペプチドが本明細書に記載のCYP1B1含有ポリペプチドであって第2のものが癌関連抗原の全体または一部を含むポリペプチドである、2つのポリペプチドをコードする核酸の投与を含む、さまざまな方法によって活性化することができる。
【0110】
いくつかの態様では、構築物によってコードされるポリペプチドは、間接的なアプローチを介して、免疫応答を増強するため、または自己寛容を遮断するために用いることができる。核酸およびそれらによってコードされるポリペプチドは、局所的または全身的な炎症反応をもたらすと考えられる免疫刺激物質を含みうる。ペプチドエピトープをタンパク質に挿入し、結果として生じるタンパク質を免疫原性にする一例は、国際公開公報第95/05849号に記載があり、これは参照として本明細書に組み入れられる。
【0111】
核酸およびコードされるポリペプチドの効果は、初回刺激(例えば、プラスミド、ウイルスベクターまたは細菌ベクターまたはポリペプチド)の後に、免疫応答の増強を助けるために同じ物質による追加刺激を行うことによって増強させることが可能である(例えば、国際公開公報第98/56919号を参照)。
【0112】
核酸または本発明の核酸によってコードされるポリペプチドは、マウス腫瘍モデルにおける腫瘍の発達を観測するために用いることができる(表2)。マウスに本発明の核酸を含む50μg〜100μgのプラスミドによる免疫処置を1〜3回、3週間間隔で行う。プラスミドは微粒子もしくは他の送達媒体中にある形で送達することができ、または裸のDNAとして送達してもよい。その後に腫瘍細胞をマウスに移植する。免疫処置後の何らかの時点(個々の腫瘍によって異なる)で、腫瘍の増殖または活性を初期の増殖または活性と比べて評価することにより、腫瘍の発達を観測する。腫瘍の増殖が緩徐化もしくは抑制されたこと、または活性が低下したことを判定する。CYP1B1をコードする核酸による免疫処置の前に腫瘍を投与することにより、核酸製剤の治療効果を示すための実験を行うこともできる。
【0113】
〔表2〕 腫瘍/株の組み合わせ

【0114】
本発明は、第1の種に属する哺乳動物における免疫応答を誘発する方法であって、哺乳動物、例えばヒトまたはマウスに対して、MHCクラスIもしくはクラスII分子または免疫グロブリン受容体と結合するCYP1B1ポリペプチドまたはその一部を含むポリペプチドをコードする核酸を投与することによる方法も含む。これらの方法において、CYP1B1ポリペプチドまたはそのMHC結合部分もしくは免疫グロブリン結合部分は、第2の種、例えばマウスまたはラットなどの齧歯動物の天然のCYP1B1ポリペプチドの配列と同一である。本方法に用いる核酸は、選択的には、本発明の核酸、例えば天然型のCYP1B1転写物の非翻訳領域(UTR)に認められる配列を欠いた核酸、または変異、欠失、挿入もしくは転位を有するCYP1B1をコードする核酸でありうる。核酸は裸の状態で、または本明細書に記載の任意の送達媒体を介して、例えば微粒子またはポリマー性ヒドロゲルマトリックス中にある形で、投与することができる。上記の第1の種に対する核酸の送達が、第1の種におけるヘテロクリティック免疫応答、例えば、第1の種によって内因性に産生されるCYP1B1配列に向けられた免疫応答の発生を引き起こしてもよい。このため、本方法は第1の種におけるT細胞寛容を遮断し、CYP1B1 T細胞応答を誘導するために用いうると考えられる。これらの方法において、哺乳動物は癌などの細胞増殖性疾患を有する、またはそれを発症する危険性のあるものでよい。
【0115】
核酸の送達
本発明の組成物を、さまざまな癌に対する免疫応答を誘発させることを意図したペプチドを発現する核酸を適切な細胞内に送達するために用いてもよい。遺伝子送達の利点の一つは、抗原性ペプチドが、免疫原性ペプチドが結合するMHC分子との相互作用が動態的に有利である標的細胞自体の内部で産生されるという点である。これは、抗原性ペプチドをMHC分子に特異的に指向させない標準的なワクチンプロトコールとは対照的である。または、ポリペプチドを分泌させて、B細胞などの免疫細胞の活性化をもたらすことも可能である。
【0116】
本発明の核酸は、標準的な方法、例えばドネリー(Donnelly)ら、J. Imm. Methods 176:145、1994、およびビチエロ(Vitiello)ら、J. Clin. Invest. 95:341、1995に記載された方法を用いて投与することができる。本発明の核酸は、当技術分野で知られた任意の様式で、例えば、筋肉内、静脈内、動脈内、皮内、腹腔内、鼻腔内、膣内、直腸内もしくは皮下に対象に注射することができ、またはそれらを例えば溶液もしくは微粒子を含む粉末の吸入によって消化管、粘膜もしくは気道に導入することができる。または、本発明の組成物を皮膚に適用してもよく、インビトロまたはインビボで細胞または組織への電気穿孔を行ってもよい。または、本発明の組成物を、細胞または組織への導入をもたらす超音波によって投与してもよい。さらに、本発明の組成物を遺伝子銃によって投与してもよい。本発明のポリペプチド、類似体または核酸の持続的で連続的な放出を、例えば浸透ポンプを用いることによって得ることもできる。投与は局所的(例えば、筋肉内、または腫瘍もしくは他の感染部位に対して)または全身的のいずれも可能である。
【0117】
核酸は、生理食塩液、脂質、リポソーム、微粒子もしくはナノスフェアなどの薬学的に許容される担体中にある形で、ヒドロゲルとして、コロイド懸濁液として、または粉末として輸送することができる。それらは裸のままでもよく、または送達媒体および/またはトランスフェクション促進物質と会合もしくは複合体を形成させた上で、脂質、リポソーム、ミクロスフェア、微粒子、マイクロカプセル、金、ナノ粒子、ポリマー、濃縮剤、多糖類、ポリアミノ酸、デンドリマー、サポニン、吸着増強物質、またはストレプトリシンOもしくは脂肪酸などの膜透過化物質といった、当技術分野で知られた送達システムを用いて送達することができる。ヒドロゲルネットワークの例は、2001年2月20日に提出された米国特許出願第60/270,256号に記載されている。
【0118】
核酸は、核酸の核への移動を促す核移行シグナルを含みうる。例えば、核酸は、転写因子などのDNA結合タンパク質が結合するヌクレオチド配列を含むことが可能である。もう1つの例において、ペプチドを主体とする核移行シグナルを本発明の核酸とともに提供し、それによって核酸の核への移動を促すこともできる。有用なシグナルの例には、hnRNA配列およびSV40核移行シグナルが含まれる。核移行ペプチド配列は、例えば、核酸と混合すること、核酸と結合させること、またはリポソームもしくは微粒子などの送達媒体中に組み入れることが可能である。
【0119】
その他の標準的な送達方法、例えば微粒子銃による導入またはエクスビボ治療を用いることもできる。エクスビボ治療では、例えば抗原提示細胞(APC)、樹状細胞、末梢血単核球または骨髄細胞を罹患動物または適当なドナーから採取し、免疫原性組成物によってエクスビボで活性化した上で、哺乳動物に戻すことができる。
【0120】
米国特許第5,783,567号および2000年6月2日に提出された米国特許出願第60/208,830号に記載されたものを含む微粒子を、DNA、RNAまたはポリペプチドなどの高分子を細胞に送達するための媒体として用いることができる。このため、それらは本明細書に記載の核酸を、選択的には免疫刺激物質とともに、個体の細胞に送達するために有用と思われる。微粒子は、ポリマーマトリックス中に抱埋された高分子、またはポリマーのシェル内に封入された高分子を含む。微粒子は、例えば封入されたDNAを非分解状態に維持することにより、高分子の完全性を維持するように作用する。微粒子を、高分子のパルス送達のために、および特定の部位またはマクロファージ、単球もしくは樹状細胞などの特定の細胞もしくは細胞集団に送達するために用いることもできる。
【0121】
ポリマーマトリックスは、乳酸グリコール酸共重合体、デンプン、ゼラチンまたはキチンなどの生分解性コポリマーでありうる。微粒子を特に、対象の食細胞へのDNA分子の送達を最大にするために用いることができる。または、微粒子を組織に注射または移植し、そこで沈着物を形成させることもできる。沈着物が分解するにつれて、核酸が経時的に徐々に放出されて、遊離DNAとして近傍の細胞(APCを含む)に取り込まれる。
【0122】
微粒子は、マチオヴィッツ(Mathiowitz)ら(国際公開公報第95/24929号)ならびに米国特許第5,817,343号および第5,922,253号による記載のようにして製剤化することができ、これらは参照として本明細書に組み入れられる。
【0123】
本発明の核酸は、当技術分野で周知の技法を用いて、脂質、デンドリマーまたはリポソームを介して対象に投与することができる。例えば、免疫原性ポリペプチドまたは免疫原性ペプチドをコードする核酸を有するリポソームは、インビボでCTL反応を誘発することが知られている(Reddyら、J. Immunol. 148:1585、1992;Collinsら、J. Immunol. 148:3336〜3341、1992;Friesら、Proc. Natl. Acad. Sci. USA 89:358、1992;Nabelら、Proc. Natl. Acad. Sci. (USA) 89:5157、1992)。
【0124】
本発明の核酸は、コレステロールおよびクイルA(サポニン)を混合した際にまたはサポニン単独で自然に形成される大きさが30〜40nmの陰性荷電ケージ様構造である、免疫刺激複合体(ISCOMS)を用いて投与することができる。本発明の核酸をISCOMSととともに投与することもでき、または個別に投与することもできる。
【0125】
トキソプラズマ症およびエプスタイン-バーウイルス誘発腫瘍を含むさまざまな感染症の実験モデルで、ISCOMSを抗原の送達媒体として用いて、防御免疫が誘発されている(Mowatら、Immunology Today 12:383〜385、1991)。精製した完全なHIV-1-IIIB gp 160エンベロープ糖タンパク質またはインフルエンザ血球凝集素のいずれかを抗原として、ISCOMS中に封入された抗原の用量が1Fg程度の少なさでもクラスI媒介性CTL反応が生じることが明らかになっている(Takahashiら(1990)Nature 344:873)。
【0126】
体重1kg当たり1回の投与につきDNA約1μg〜200μgの用量を投与することが予想される。罹患動物が成人である場合、ワクチンレジメンは例えば、微粒子または他の送達媒体中にある形で送達する場合は10μg〜1000μgのDNAの筋肉内、静脈内、経口もしくは皮下投与、または裸のDNAの場合は約1μg〜18μgの筋肉内もしくは皮内への1回〜12回の反復投与を含むことができる。当然ながら、医学分野において周知のように、所定の罹患動物(patient)に対する用量は罹患動物の体格、体表面積、年齢、性別、全般的健康状態;投与の時間および経路;投与する特定の化合物;ならびに同時投与するその他の薬剤を含む、多くの要因に依存する。至適用量の決定は、当業者の薬理学者の能力の範囲内に十分に含まれる。
【0127】
核酸に対する免疫系の応答の測定
本明細書に記載の核酸が免疫応答を誘発する能力は、免疫応答を測定するための当技術分野で周知の方法を用いてアッセイすることができる。例えば、細胞傷害性T細胞の生成は、標準的な51Cr放出アッセイにおいて、細胞内サイトカインの発現の測定により、またはMHCテトラマーの使用により、示すことができる。ELISAまたはELISPOTなどの標準的なアッセイを用いて、T細胞活性化に起因するサイトカインプロファイルを測定することもできる。3H-チミジン取り込みおよび当技術分野で知られた他のアッセイなどのアッセイを用いて、T細胞増殖を測定することもできる。T細胞応答性の評価にはDTH反応の測定を用いることができる。B細胞応答はELISAなどの当技術分野で知られたアッセイを用いて測定可能である。
【0128】
その他の方法、例えばデジタル画像化ならびに細胞診、コルポスコピーおよび組織学的な評価を用いて、さまざまな種類の増殖性疾患または癌に対する免疫原性ペプチドおよび免疫原ペプチドをコードする核酸の効果を評価することもできる。
【0129】
以下は本発明の実施に関する実施例である。これらはいかなる形でも本発明の範囲を限定するものとみなされるべきではない。
【0130】
実施例
実施例1 ヒトCYP1B1 cDNA構築物の作製
ヒトCYP1B1(配列番号:2)およびCYP1B1-delta 3(配列番号:38)をコードするcDNAのそれぞれを、2つの異なるプラスミド発現ベクター、pCDNA-3およびp3K中にクローニングした。これらのCYP1B1核酸構築物は543アミノ酸のタンパク質をコードするcDNAを含むが、CYP1B1のすべての非翻訳領域を欠く。CYP1B1-delta 3構築物は、配列番号:2の野生型CYP1B1と比較して、アミノ酸位置57、61および365(アミノ酸57:TrpがCysに変化;アミノ酸61:GlyがGluに変化;アミノ酸365:GlyがTrpに変化;配列番号:38を参照)に3つの置換を含む。発現ベクターpcDNA3-CYPHu1B1、p3k-CYPHu1B1、pcDNA3-CYPHu1B1-delta 3(pcDNAhulB1d3)、p3K-CYPHu1B1-delta 3(p3khu1B1d3)および対照ベクターpcDNA3およびp3Kを、キアゲン(Qiagen)カラムを製造者(Qiagen、Chatsworth、CA)の指示に従って用いて、形質転換大腸菌から精製した。各構築物の配列を決定し、求める変化が導入されたことを確認した。
【0131】
このほかのCYP1B1構築物は以下の通りに作製した。PCRを用いてpcDNA3Hu1B1d5の骨格に欠失を導入した。pcDNA3Hu1B1d5は、5つのアミノ酸:W57C、G61E、G365W、P379LおよびE387Kが置換されたヒトCYP1B1タンパク質をコードする。上流プライマーには、制限部位および以後のコード配列に対してインフレームとなったATGコドンを含めた。下流プライマーには、適切なCYP1B1コード配列に続いて、終止コドンおよびクローニング用の制限部位を含めた。pcDNA3Hu1B1-deltaPPGPは、アミノ酸51〜54(PPGP)が欠失している点を除いてCYP1B1タンパク質の全体を含む。pcDNA3Hu1B1-F1R1にコードされるタンパク質はCYP1B1の最初の60アミノ酸の欠失を含み、pcDNA3Hu1B1-F1R2タンパク質は同じN末端欠失に加えてCYP1B1タンパク質の最後の82アミノ酸の欠失を含む。pcDNA3Hu1B1-F2R1タンパク質はCYP1B1の最初の171アミノ酸の欠失を含み、pcDNA3Hu1B1-F2R2にコードされるタンパク質は同じN末端欠失に加えてCYP1B1の最後の82アミノ酸の欠失を含む。pcDNA3Hu1B1-F3R1タンパク質はCYP1B1の最初の292アミノ酸の欠失を含み、pcDNA3Hu1B1-F3R2は同じN末端欠失に加えてCYP1B1タンパク質の82アミノ酸の欠失を含む(図3)。二重PEP-Padreタンパク質を図3に配列番号:41として示している。
【0132】
HLA-A2/KbトランスジェニックC57Bl/6マウス系統はハイブリッド型MHCクラスI分子を産生する。このハイブリッド分子において、ペプチド結合ドメイン(α1およびα2)はヒトクラスI分子HLA-A*0201に由来し、T細胞上のCD8補助受容体と相互作用するドメイン(α3)はマウスクラスI分子Kbに由来する。この結果生じるマウスは、HLA-A2拘束性エピトープを含む免疫原に反応する能力があり、ヒト標的細胞発現HLA-A2を発現するヒト標的細胞を認識するマウス細胞傷害性T細胞(CTL)を生成する能力がある(Vitielloら、J. Exp. Med. 173:1007、1991)。
【0133】
以下の実施例に述べる実験により、以下のことが示された:1)CYP1B1をコードするプラスミドが発現される;2)CYP1B1タンパク質が翻訳される;3)コードされるタンパク質がインビボでプロセシングされ、ペプチドがクラスI受容体上に提示される;4)T細胞レパートリーはクラスIlペプチド複合体を認識しうる細胞を含む。
【0134】
実施例2 野生型CYP1B1をコードするDNA発現ベクターによるマウスの免疫処置によりインビボでHLA-A2トランスジェニックマウスにおけるT細胞免疫が誘発される
ヒトのクラスI分子HLA-A2.1を発現する6週齡〜8週齡の雌性トランスジェニックマウスの少なくとも3匹の群に対して、pcDNA3-CYPHu1B1またはpcDNA3プラスミドベクターによる免疫処置を行った。それぞれの前頸骨筋に100μgのプラスミドDNAを注射した。追加免疫処置は初回免疫処置の14日後に行った。2回目の免疫処置の12日後に脾細胞を採取した。
【0135】
2〜3匹のマウスから10%ウシ胎仔血清および抗生物質を加えたRPMI-1640培地中に脾臓の単細胞懸濁液を調製した。4℃の0.83%NH4Cl中で細胞を10分間インキュベートすることによって赤血球を溶解させた。洗浄後に細胞をCD8+ T細胞濃縮カラムで製造者のプロトコールに従って分離した(マウスT細胞CD8サブセットカラムキット、R&D System、Minneapolis、MN)。CD8+ T細胞に対して特異的な個々のヒトCYP1B1エピトープの検出には、マウスインターフェロン-γ(IFN-g)酵素結合イムノスポット(ELISpot)アッセイを用いた(マウスIFN-g ELISpot、R&D Systems)。簡潔に述べると、1×105個の精製脾細胞を、10μモルの合成HLA-A2. 1結合ペプチドFLDPRPLTV(配列番号:22)による前パルス刺激を加えるかまたはヒトCYP1B1発現ワクシニアベクターを14時間感染させた同じ数の同系EL-4A2/Kb標的細胞とともに、インビトロでインキュベートした。24時間共培養した後に、ELIspotアッセイを製造者の指示に従って行うことにより(マウスIFN-g ELISpot、R&D Systems)、T細胞活性を測定した。CYP1B1応答性T細胞の頻度を表すスポットを、自動ELISpot読み取りシステムを用いて算定した(図4)。
【0136】
実施例3 CYP1B1変種cDNA構築物はインビボでHLA-A2トランスジェニックマウスにおけるT細胞免疫を誘発する
ヒトのクラスI分子HLA-A2.1を発現する6〜8週齡の雌性トランスジェニックマウスの少なくとも3匹の群に対して、p3K-CYPHu1B1-delta 3またはp3Kプラスミドベクターによる免疫処置を行った。それぞれの前頸骨筋に100μgのプラスミドDNAを注射した。追加免疫処置は初回免疫処置の14日後に行った。2回目の免疫処置の12日後に脾細胞を採取した。
【0137】
2〜3匹のマウスから10%ウシ胎仔血清および抗生物質を加えたRPMI-1640培地中に脾臓の単細胞懸濁液を調製した。4℃の0.83%NH4Cl中で細胞を10分間インキュベートすることによって赤血球を溶解させた。洗浄後に細胞をCD8+ T細胞濃縮カラムで製造者のプロトコールに従って分離した(マウスT細胞CD8サブセットカラムキット、R&D System、Minneapolis、MN)。CD8+ T細胞に対して特異的な個々のヒトCYP1B1エピトープの検出には、マウスインターフェロン-γ(IFN-g)酵素結合イムノスポット(ELISpot)アッセイを用いた(マウスIFN-g ELISpot、R&D Systems)。簡潔に述べると、1×105個の精製脾細胞を、10μモルの合成HLA-A2. 1結合ペプチドFLDPRPLTV(配列番号:22)による前パルス刺激を加えるかまたはヒト1B1発現ワクシニアベクターを14時間感染させた同じ数の同系EL-4A2/Kb標的細胞とともに、インビトロでインキュベートした。24時間共培養した後に、ELIspotアッセイを製造者の指示に従って行うことにより(マウスIFN-g ELISpot、R&D Systems)、T細胞活性を測定した。CYP1B1応答性T細胞の頻度を表すスポットを、自動ELISpot読み取りシステムを用いて算定した(図5)。
【0138】
実施例4 ウエスタンブロット分析による抗CYP1B1抗体の検出
CYP1B1をコードする核酸による免疫処置を行った動物の血清を、以下の通りに、抗CYP1B1抗体の存在に関して検査することができる。30ugのミクロソームタンパク質を含むヒトCYP1B1ミクロソーム(Gentest、Woburn MA)をSDSサンプルバッファー(Boston Bioproducts、Ashland、MA)中で煮沸し、10%Tris-HClアクリルアミドゲル(Bio-Rad、Chicago、Ill)上で電気泳動により分離する。このゲルのエレクトロブロッティングをニトロセルロース(Bio-Rad)に対して行う。非特異的なタンパク質結合部位は、ニトロセルロース膜を5%脱脂乳とともにTBST緩衝液(50mM Tris[pH 8]、150mM NaClおよび0.05%Tween-20)中で室温で60分間インキュベートすることによってブロックする。ニトロセルロースフィルターを、種々の希釈度の免疫マウス被験血清(例えば、CYP1B1ペプチドまたは核酸による免疫処置を行ったマウスからのもの)、またはマウス抗ヒトCYP1B1 443〜457ペプチド5D3mAbハイブリドーマ培養上清をTBST-5%脱脂乳で1:40〜1:3000に希釈したものとともにインキュベートする。次に膜を、ヤギ抗マウス西洋ワサビペルオキシダーゼ抗体(Santa Cruz Biotechnology, Santa Cruz、CA)をTBST 5%脱脂乳で1:2000に希釈したものとともにインキュベートする。各抗体とのインキュベーション後に膜をTBST中で10分間ずつ5回洗浄する。特異的タンパク質バンドの存在を示すために膜をECL試薬(Amersham Pharmacia Biotech、Uppsala、Sweden)で現像する。
【0139】
実施例5 CYP1B1核酸構築物の電気穿孔
p3khu1B1d3 DNAによる単回の免疫処置後にA2/Kbトランスジェニックマウスで誘導されたT細胞応答に対する電気穿孔の効果を検討した。マウスにはp3khu1B1d3またはp3K対照ベクターを注射するか無処置とした。その後に治療群を電気穿孔を行うものとそれ以上の処置を行わないものに分けた。電気穿孔により、CYP190ペプチドによるパルス刺激を加えた場合も天然のCYP1B1タンパク質を発現する組換えワクシニアウイルスを感染させた場合も、EL4-A2/Kb細胞に対するT細胞応答性の頻度は有意に増加した。
【0140】
図6は、HLA-A2/KbトランスジェニックマウスにおけるT細胞応答性が電気穿孔によって増強されることを示している。対をなすマウスの群に対してp3kHu1B1d3DNA、p3K対照DNAによる単回の免疫処置を行った上で、一方の群には電気穿孔を行い(++)、他方には処置を行わなかった。直接的なIFN-γELISpotアッセイによるCD8+ T濃縮脾細胞の検査を、ヒトペプチドCYP190によるパルス刺激を加えた(CYP190)または処置を行わない(無処置)EL4-A2/Kb細胞に対して行った。抗原特異的T細胞の頻度はスポット形成細胞/CD8+ T細胞10e6個として報告する。
【0141】
6〜8週齡のHLA-A2/Kbトランスジェニック雌性マウスを用いた。注射用のプラスミドDNAは、エンドトキシン非含有プラスミド精製キットを製造者の指示に従って用いて作製した(QIAGEN Inc.、Chatsworth、CA)。25μlを各肢の前頸骨筋に注射して計100μgのDNAを投与した。電気穿孔は麻酔したマウスに対してその直後に、BTXニードルアレイ(Model 532)をDNA注射部位の範囲に筋肉内挿入し、ElectoSquarePorator Model T820(Genetronics)によりパルス(100V、パルス長20msec×8回)を与えることによって行った。マウスに対する免疫処置は1回(1群当たりマウス2匹)とし、12日後にアッセイした。CYP1B1に対するマウスCD8+ T細胞の応答は、市販のIFN-γ ELISPOTアッセイキットを製造者の推奨に従って用いるIFN-γ ELISPOTによって分析した(R&D Systems、Minneapolis、MN)。エフェクター細胞としては、プール脾細胞をCD8+ T細胞(マウスT細胞CD8サブセットカラムキット;R&D Systems)に関して濃縮した上で1×105個/ウェルで2つずつプレーティングした。10ug/mlペプチドによるパルス刺激を加えるかプレーティングの前に組換えワクシニアウイルスもしくは野生型ワクシニア(MOI、10)に16〜18時間感染させた1×105個のEL4-A2/Kb細胞/ウェルによってT細胞を刺激した。プレートを24時間インキュベートし、現像した上で自動画像解析により解析した(Zeilnet Consulting, Inc.、New York、NY)。抗原特異的T細胞の頻度はスポット形成細胞(SFC)/CD8+ T細胞1×106個として報告する。マウス胸腺腫細胞株EL4はATCC(Manassas、VA)から入手し、pSV2neoベクター中に挿入したHLA-A2/KBMD cDNAをトランスフェクトした。ヒトCYP1B1ペプチドCYP190(FLDPRPLTV;配列番号:22)は、ハーバード大学医学部バイオポリマー研究所(Harvard Medical School Biopolymers Laboratory)(Boston、MA)から購入した。
【0142】
実施例6 CYP1B1核酸構築物を含むヒドロゲルおよび微粒子
種々の送達系によるCYP1B1d3DNAの送達により、HLA-A2/Kbトランスジェニックマウスにおいて特異的免疫応答を誘発することができる。HLA-A2/Kbトランスジェニックマウスを用いて、ヒドロゲル中にある形で送達されたDNAがインビボで免疫応答を生じさせうるか否かを評価した。変異型CYP1B1 cDNA(pcDNA3Hu1B1d3)をコードするDNA構築物を含む2%ポリマーネットワーク、ヒドロゲル配合物または微粒子の3回の投与により、HLA-A2拘束性CYP190ペプチドによるパルス刺激を加えるか完全長の天然CYP1B1タンパク質をコードする組換えワクシニアウイルスを感染させたEL4-A2/Kb細胞に対する特異的応答性を有する脾臓CD8+ T細胞が高頻度に誘発された。無処置のまま、または野生型ワクシニアウイルスを感染させたEL4-A2/Kb細胞に対する有意な応答性は観察されなかった。配合ベクター(pcDNA 3)DNAによる免疫処置を行ったマウスでは応答は誘発されなかった。
【0143】
図7は、CY1B1 DNA/ヒドロゲル配合物の免疫処置による、A2/KbトランスジェニックマウスにおけるCYP1B1特異的T細胞応答の誘導を示している。HLA-A2トランスジェニックマウスに対して、PLG微粒子内または2%ポリマーネットワークヒドロゲル中にある状態で送達されるpcDNA3DNAまたはpcDNA3Hu1B1d3による免疫処置を3回行った。直接的なIFN-γELISpotアッセイによるCD8+ T濃縮脾細胞の検査を、ヒトペプチドCYP190によるパルス刺激を加える(CYP190)かCYP1B1をコードするワクシニアウイルスを感染させた(vacHu1B1)EL4-A2/Kb細胞に対して行った。処置を行わない(無処置)、ならびに野生型ワクシニアを感染させたEL4-A2/Kb細胞(Vac wt)を対照として含めた。抗原特異的T細胞の頻度はスポット形成細胞/CD8+ T細胞1×106個として報告する。
【0144】
マウス6〜8週齡の雌性マウスをすべての実験に用いた。注射用のプラスミドDNAは、エンドトキシン非含有プラスミド精製キットを製造者の指示に従って用いて作製した(QIAGEN Inc.、Chatsworth、CA)。25μlを各肢の前頸骨筋に注射して計100μgのDNAを投与した。プラスミドDNAは微粒子内に封入するか本明細書に記載のポリマーネットワークヒドロゲル中に配合して免疫処置に用いた。マウスに対する免疫処置は2週間の間隔をおいて3回行い(各群当たりマウス2匹)、最後の免疫処置から12日後にアッセイした。微粒子は3箇所の筋肉:脛骨筋、腓腹筋(ヒラメ筋)および大腿筋に、すなわちマウス1匹当たり6つの部位に投与した。ポリマーネットワークヒドロゲルは100ug DNA/100ulとして1つの脛骨筋当たり50ulを注入した。CYP1B1に対するマウスCD8+ T細胞の応答は、市販のIFN-γ ELISPOTアッセイキットを製造者の推奨に従って用いるIFN-γ ELISPOTによって分析した(R&D Systems、Minneapolis、MN)。エフェクター細胞として、プール脾細胞をCD8+ T細胞(マウスT細胞CD8サブセットカラムキット;R&D Systems)に関して濃縮した上で1×105個/ウェルで2つずつプレーティングした。10ug/mlペプチドによるパルス刺激を加えるかプレーティングの前に組換えワクシニアウイルスもしくは野生型ワクシニア(MOI、10)に16〜18時間感染させた1×105個のEL4-A2/Kb細胞/ウェルによってT細胞を刺激した。プレートを24時間インキュベートし、現像した上で自動画像解析により解析した(Zeilnet Consulting, Inc.、New York、NY)。抗原特異的T細胞の頻度はスポット形成細胞(SFC)/CD8+ T細胞1×106個として報告する。
【0145】
実施例7 CYP1B1核酸構築物を含む微粒子
HLA-A2/Kbトランスジェニックマウスを用いて、PLG微粒子内に封入したDNAがインビボで免疫応答を生じさせうるか否かを評価した。変異型CYP1B1 cDNA(p3khu1B1d3;ZYC300)をコードするDNA構築物を含む微粒子の2回の投与により、完全長の天然huCYP1B1 cDNAをコードする組換えワクシニアウイルスを感染させたEL4-A2/Kb細胞に対する特異的応答性を有するT細胞が誘発された。野生型ワクシニアウイルスを感染させたEL4-A2/Kb細胞に対する有意な応答性は観察されなかった。免疫処置を行わなかったマウスおよびベクター対照による免疫処置を行ったマウスは、いずれの刺激物質に対してもIFN-γ応答を示さなかった。
【0146】
有効な抗腫瘍免疫の誘導には、自己抗原に対するエフェクターT細胞レパートリーの増大が伴う。このトランスジェニックマウスモデルにおけるCYP1B1の治療的腫瘍抗原としての有効性を示唆するデータは、内因性のマウスクラスI MHCと関連づけられたマウスCYP1B1自己決定基に対するT細胞応答が免疫処置後に誘発されることを示すものと考えられる。マウスおよびヒトのCYP1B1にはアミノ酸レベルでかなりの配列相同性がある。以前に記載されたペプチド結合アルゴリズムを用いて、H-Kb結合性CYP1B1ペプチドと予想されるものがマウス特異的自己応答の誘導を検討するための反応物として同定された。このCYP1B1残基77〜84(LARRYGDV;配列番号:42)はヒトおよびマウスのオルソログの間で共通である。このペプチドをヒトCYP 190 HLA-A2エピトープとともに含め、ヒトCYP1B1 DNAを含む微粒子による免疫処置を行ったマウスにおいて応答が検出されうるかを検討した。示した通り、このペプチドに対する明らかな応答を検出できた。
【0147】
図8は、CYP1B1をコードする封入DNAによるマウスの免疫処置により、トランスジェニックマウスにおけるCYP1B1特異的な免疫応答が誘発されることを示している。HLA-A2/Kbトランスジェニックマウスに対して、免疫処置を行わない(左のバー)か、またはp3khu1B1d3(右のバー)もしくはp3k対照(中央のバー)を含む微粒子による免疫処置を2回行った。直接ELISpotアッセイにより、CD8+濃縮脾細胞をEL4-A2/Kb腫瘍細胞に対する免疫応答に関して検査した。標的細胞にはHLA-A2ペプチドCYP190、ペプチドCYP77によるパルス刺激を加えるか、またはCYP1B1-ワクシニア(VacHulB1)もしくはワクシニア野生型対照(Vac Wt)を感染させた。
【0148】
HLA-A2/Kbトランスジェニックマウスに対しては、上記の通りに、PLG微粒子内に封入したエンドトキシン非含有プラスミドを計100μgのDNAとして各肢の前頸骨筋に投与する免疫処置を行った。マウスに対する免疫処置は2週間の間隔で行い、最後の免疫処置から12日後にアッセイした。CYP1B1に対するマウスCD8+ T細胞の応答はIFN-γELISpotアッセイによって分析した。エフェクター脾細胞をCD8+ T-細胞に関して濃縮し、1×105細胞/ウェルで2つずつプレーティングした。10μg/mlペプチドによるパルス刺激を加えるかプレーティングの前に組換えワクシニアウイルスもしくは野生型ワクシニア(MOI、10)に16〜18時間感染させた1×105個のEL4-A2/Kb細胞/ウェルによってT細胞を刺激した。抗原特異的T細胞の頻度はスポット形成細胞/CD8+ T細胞1×106個として報告する。ペプチドCYP77(LARRYGDV;配列番号:42)はヒトおよびマウスのCYP1B1 DNA配列で共通しており、これはマルチプルペプチドシステムズ(Multiple Peptide Systems)社(San Diego、CA)から購入した。
【0149】
実施例8 CYP1B1核酸構築物を注射したマウスにおけるMHCクラスII応答
pcDNA3-Hu1B1がプロセシングおよび提示がなされるタンパク質をコードするか否か、ならびに近交系マウスの多くの系統でMHCクラスII CD4+T細胞応答を誘発しうるか否かを評価するための実験を行った。クラスII CD4+T細胞応答は、CYP1B1タンパク質に由来する合成ペプチドを用いるエクスビボIFN-g Elispotアッセイによって検出した。
【0150】
3種類のマウス系統(C3H、C57/Bl6およびBalb/c)に対して100μgのpcDNA3-Hu1B1を注射した(筋肉内)。第14日にマウスに対して同じ用量のpcDNA3-Hu1B1の追加投与(筋肉内)を行った。第27日に脾臓を摘出し、CD4+T細胞が濃縮された脾細胞をペプチドによるパルス刺激を加えた同系APCに対して検討するIFN-g ELISPOTアッセイを行った。さらに、陰性対照とするために未感作マウスから単離したCD4+T細胞のスクリーニングも行った。CD4+T細胞のすべてを、一連の合成CYP1B1 30量体ペプチド(配列については表3参照)、PHA(陽性アッセイ対照)およびHBV-2(陰性アッセイ対照)に対してスクリーニングした。
【0151】
〔表3〕 合成CYP1B1ペプチド

【0152】
検討した3つのマウス系統のそれぞれで応答を誘発したCYP1B1ペプチドに関する上記のアッセイの結果を表4に示す。報告値はすべて、IFN-gスポット形成細胞(SFC)/CD4+T細胞1,000,000個を表している。
【0153】
〔表4〕C3H、C57/Bl6およびBalb/cマウスにおけるMHCクラスII応答

【0154】
実施例9 CYP1Bの欠失型構築物による免疫処置
CYP1B1の改変によって有効な免疫原が得られるか否かを検討するために、N末端およびC末端の部分を段階的に欠失させた一連のCYP1B1 cDNAを組換え法によって作製した。構築物はp3khu1B1d5骨格にクローニングしたため、この構築物にある5つの点変異を含む。発現を確認するために、構築物を293T細胞(ATCC)にトランスフェクトし、2日後にトランスフェクト細胞から可溶化物を作製した。可溶化物をSDS-PAGEによって分析し、移行させたゲルに対してウエスタン分析を行った。ブロットをCYP1B1に対して特異的なモノクローナル抗体によりプローブ検索し、化学発光により検出を増強した(ECL kit、Amersham)。この実験によるデータから、欠失型構築物から変異型CYP1B1タンパク質が発現されることが示された。
【0155】
これらの構築物がCYP1B1特異的T細胞を誘導したか否かを明らかにするために、HLA-A2/Kdトランスジェニックマウスに対して、切断型CYP1B1 cDNAをコードするDNA構築物による免疫処置を行った。図9は、切断型CYP1B1 DNAの免疫処置によってCYP1B1特異的T細胞が誘導されたことを示している。HLA-A2トランスジェニックマウスには免疫処置を行わないか、または変異型および/もしくは切断型のCYP1B1タンパク質をコードするcDNA構築物による免疫処置を行った。免疫処置マウスから得たCD8+ T濃縮脾細胞の検査を、直接IFN-g ELISpotアッセイにより、ヒトペプチドCYP190(CYP190)もしくはマウスペプチドCYP373(mCYP373)によるパルス刺激を加えるか、野生型ワクシニア(Vac wt)もしくはCYP1B1をコードするワクシニアウイルス (VacHu1B1)を感染させたEL4-A2/Kb細胞に対して行った。処置を行わない(無処置)、ならびに野生型ワクシニアを感染させたEL4-A2/Kb細胞(Vac wt)を対照として含めた。抗原特異的T細胞の頻度はスポット形成細胞(SFC)/CD8+ T細胞1×106個として報告する。指定の構築物をコードするDNAによりマウスの免疫処置を行った。
【0156】
マウス6〜8週齡の雌性マウスをすべての実験に用いた。注射用のプラスミドDNAは、エンドトキシン非含有プラスミド精製キットを製造者の指示に従って用いて作製した(QIAGEN Inc.、Chatsworth、CA)。25μlを各肢の前頸骨筋に注射して計100μgのDNAを投与した。マウスに対する免疫処置は第0日および第14日に行い(各群当たりマウス2匹)、最後の免疫処置から12日後にアッセイした。CYP1B1に対するマウスCD8+ T細胞の応答は、アッセイキットを製造者の推奨に従って用いるIFN-g ELISPOTによって分析した(R&D Systems、Minneapolis、MN)。エフェクター細胞として、プール脾細胞をCD8+ T細胞(マウスT細胞CD8サブセットカラムキット;R&D Systems)に関して濃縮した上で1×105個/ウェルで2つずつプレーティングした。10ug/mlペプチドによるパルス刺激を加えるかプレーティングの前に組換えワクシニアウイルスもしくは野生型ワクシニア(MOI、10)に16〜18時間感染させた1×105個のEL4-A2/Kb細胞/ウェルによってT細胞を刺激した。プレートを24時間インキュベートし、現像した上で自動画像解析により解析した(Zeilnet Consulting, Inc.、New York、NY)。抗原特異的T細胞の頻度はスポット形成細胞(SFC)/CD81細胞1×106個として報告する。マウスペプチドCYP373(SDQQQPNLPYV;配列番号:56)はマルチプルペプチドシステムズ(Multiple Peptide Systems)社(San Diego、CA)から購入した。
【0157】
その他の態様
本発明をその詳細な説明とともに述べてきたが、前記の説明は例示を意図したものであり、添付する特許請求の範囲を限定することを意図したものではない。その他の面、利点および修正は、以下の特許請求の範囲に含まれる。
【技術分野】
【0001】
発明の分野
本発明は、CYP1B1核酸、および免疫応答を誘導するための使用方法に関する。
【背景技術】
【0002】
発明の背景
シトクロムP450は大規模な遺伝子ファミリーを構成する酵素であり、発癌物質の可能性がある多くの物質および複数の抗癌剤を含む、さまざまな生体異物の酸化的活性化および/または不活性化にかかわっている(GuengerichおよびShimada(1991)Chem. Res. Toxicol. 4:931(非特許文献1);GonzalezおよびGelboin(1994)Drug Metab. Rev. 26:165(非特許文献2);Kivistoら(1995)Br. J. Clin. Pharmacol. 40:523(非特許文献3))。
【0003】
ヒトCYP1遺伝子ファミリーは主なP450ファミリーの1つであり、2つのサブファミリーに分類される3つの独立した形態からなる。CYP1B1は一方のサブファミリーに属し、長さは543アミノ酸である。これはCYP1A2サブファミリーの2つのメンバーとは構造的に異なる(Tangら、J. Biol. Chem.(1996)271:28324(非特許文献4))。
【0004】
乳癌、食道癌および軟部組織肉腫を含むさまざまな種類の癌の研究により、CYP1B1型のP450が腫瘍特異的に発現される可能性が示されている(Murrayら(1991)Br. J. Cancer 63:1021(非特許文献5);Murrayら(1993)J. Pathol. 171:49(非特許文献6);Murrayら(1994)Gut 35:599(非特許文献7)を参照)。CYP1B1の免疫組織化学的研究からは、複数の異なる種類の腫瘍で強い免疫反応性が認められている(膀胱、乳房、結腸、腎臓、肺、食道、卵巣、皮膚、胃、子宮、骨および結合組織、リンパ節、脳ならびに巣)(国際公開公報第97/12246号(特許文献1)を参照、これは参照として本明細書に組み入れられる)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】国際公開公報第97/12246号
【非特許文献】
【0006】
【非特許文献1】GuengerichおよびShimada(1991)Chem. Res. Toxicol. 4:931
【非特許文献2】GonzalezおよびGelboin(1994)Drug Metab. Rev. 26:165
【非特許文献3】Kivistoら(1995)Br. J. Clin. Pharmacol. 40:523
【非特許文献4】Tangら、J. Biol. Chem.(1996)271:28324
【非特許文献5】Murrayら(1991)Br. J. Cancer 63:1021
【非特許文献6】Murrayら(1993)J. Pathol. 171:49
【非特許文献7】Murrayら(1994)Gut 35:599
【発明の概要】
【0007】
本発明は、CYP1B1ポリペプチドまたはその部分をコードし、翻訳抑制因子(translational repressor element)を欠いた転写ユニットを含む、核酸を構築しうるという発見に基づく。これらの因子は、天然型のCYP1B1転写物の非翻訳領域(UTR)に位置してもコード配列中に位置してもよく、またはその両方でもよい。本発明の核酸は、CYP1B1内因性翻訳抑制因子の一部または全体を欠いており、このため、CYP1B1ポリペプチドまたはその部分の翻訳が増強される系を提供する。本発明の核酸が、コードされるタンパク質の免疫原性を強める変異、欠失、挿入または転位を含むことも可能である。本明細書に記載の核酸によってコードされるポリペプチドは、哺乳動物における免疫応答を誘発するのに有用である。
【0008】
1つの局面において、本発明は、MHCクラスIもしくはクラスII分子と結合するペプチドまたはB細胞エピトープであるペプチドを含むCYP1B1またはそれらの一部を含むポリペプチドをコードするコード配列を含む転写ユニットを含む核酸を特徴とする。転写ユニットは、コード配列と機能的に結合した翻訳抑制因子を含まない。
【0009】
本明細書で用いる「転写ユニット」とは、翻訳開始シグナルを含み、その後に選択的にはイントロンならびに適切なスプライスドナー部位およびアクセプター部位を含むオープンリーディングフレームがあり、その後に終結コドンがある核酸のことを指し、ここで核酸は(1)RNAまたは(2)転写されてRNAとなるヌクレオチド配列のいずれかである。「翻訳開始シグナル」とは、コザックコンセンサス配列の状況下にある開始コドンのことを指す。「翻訳抑制因子」とは、それが存在すると、転写物によってコードされるポリペプチドの翻訳レベルが、そのヌクレオチド配列を欠く転写物よりも少なくとも25%低下する、転写物の非翻訳領域に位置するヌクレオチド配列のことを指す。翻訳抑制因子は、例えばリボソームの転写物との結合を妨げることにより、または転写物の半減期を短縮することにより、翻訳レベルを低下させることが可能である。
【0010】
本明細書に記載の核酸によってコードされるポリペプチドは、長さが少なくとも8アミノ酸のCYP1B1区域を含む。1つの例では、ポリペプチドは配列FLDPRPLTV(配列番号:22)を含む。もう1つの例では、ポリペプチドは配列番号:31〜39のいずれかの配列を含む。もう1つの例では、ポリペプチドの長さは400、300、200または100未満のアミノ酸である。
【0011】
本明細書で用いる「区域(segment)」とは、(a)CYP1B1タンパク質の一部(すなわち全体に満たない断片)の配列に対応し、(b)1つまたは複数のエピトープを含む、アミノ酸配列のことである。明確に言えば、「区域」は本明細書では、本発明の核酸によってコードされるポリペプチドの一部のことを意味し、「部分(portion)」という用語は天然のタンパク質の該当部分のことを意味する。「エピトープ」とは、MHCクラスIもしくはクラスII分子の結合溝または抗体の抗原結合領域と結合するペプチドのことを指す。翻訳を促すために、本発明の上記または他の任意のコード配列の5'末端にメチオニンコドンを含めることができる。さらに、本明細書に記載の核酸によってコードされるポリペプチドが、以下にさらに詳細に説明する、ターゲティングシグナル(targeting signal)をコードすることも可能である。
【0012】
本明細書に記載の転写ユニットは、RNA安定化配列を含みうる。「RNA安定化配列」とは、それが存在すると転写物の半減期がそのヌクレオチド配列を欠く転写物よりも長くなる、転写物の非翻訳領域(UTR)(5'もしくは3' UTRまたはその両方)に位置するヌクレオチド配列のことを指す。
【0013】
本明細書に記載の核酸は、転写ユニットと機能的に結合した誘導性プロモーター配列を含みうる。「誘導性プロモーター配列」とは、作用物質(agent)、例えば金属または他の何らかの非タンパク質性化合物がそのヌクレオチド配列と結合すると、そのヌクレオチド配列が機能的に結合した転写ユニットの転写の増強がもたらされるようなヌクレオチド配列のことを指す。誘導性プロモーター配列の一例はメタロチオネインプロモーターである。
【0014】
本発明の核酸によってコードされるポリペプチドは、選択的にはターゲティングシグナルを含んでもよい。ターゲティングシグナルとは、それが結合したペプチドの細胞内輸送または分泌を指令するペプチドのことである。ターゲティングシグナルは、それがその部位で作用する限り、ハイブリッド型ポリペプチドのアミノ末端、例えばシグナル配列にあっても、カルボキシ末端にあっても、または内部にあってもよい。
【0015】
ターゲティングシグナルは、例えばシグナル配列でありうる。それが結合したコードされるタンパク質を小胞体に向かわせる、および/またはコードされるタンパク質の分泌を引き起こす、任意のシグナル配列が適している。好ましいターゲティングシグナルの1つは、HLA-DRαのシグナルペプチド:

である。本明細書に記載のポリペプチドと結合させることが可能なもう1つのシグナル配列は、以下の配列を有する:

本明細書に記載のポリペプチドと結合させることが可能なもう1つのシグナル配列は、E1Aシグナル配列である。
【0016】
選択的には、ターゲティングシグナルを、シグナルペプチダーゼなどによるエピトープからのターゲティング配列の切断を促すために、ターゲティングシグナルと隣接区域との接合部にアミノ酸置換が導入されるように改変してもよい。
【0017】
もう1つの局面において、本発明は、MHCクラスIまたはクラスII分子と結合するペプチドを含むCYP1B1またはその一部を含むポリペプチドをコードするコード配列を含む転写ユニットを含む核酸であって、転写ユニットが配列番号:18または配列番号:19の150個の連続したヌクレオチドを含んでいない核酸を特徴とする。CYP1B1またはその一部は、哺乳動物、例えばヒトの天然のCYP1B1ポリペプチドの配列に対応することが好ましい。
【0018】
1つの例において、転写ユニットは配列番号:3〜9または15〜17のうち少なくとも1つを含まない。もう1つの例において、転写ユニットは配列番号:18または配列番号:19の50、25または10個の連続したヌクレオチドを含まない。もう1つの例において、転写ユニットは配列番号:3〜9および15〜17をいずれも含まない。
【0019】
転写ユニットは、コード配列と機能的に結合した翻訳調節配列を含みうる。「翻訳調節配列」とは、ある作用物質がそのヌクレオチド配列と結合すると、そのヌクレオチド配列が機能的に結合したコード配列によってコードされるポリペプチドの翻訳の増強がもたらされるようなヌクレオチド配列のことを指す。1つの例において、翻訳調節配列は鉄応答性配列である。
【0020】
もう1つの局面において、本発明は、CYP1B1の第1および第2の区域を含むハイブリッド型ポリペプチドをコードする転写ユニットを含む核酸を特徴とする。第1のおよび第2の区域は連続しているか、またはスペーサーアミノ酸もしくはスペーサーペプチドによって分離されている。第1のおよび第2の区域のそれぞれの長さが少なくとも8アミノ酸であり、CYP1B1の非連続的な部分である。
【0021】
「スペーサーアミノ酸」とは、本発明のポリペプチド中の2つの近接した区域(順に「A」および「B」)の間に挿入される単一の残基であって、完全長CYP1B1タンパク質においてAのカルボキシ末端に隣接するアミノ酸と異なり、Bのアミノ末端に隣接するアミノ酸とも異なる残基のことを意味する。すなわち、スペーサーアミノ酸は、本発明のポリペプチド中に、CYP1B1由来のAの配列およびCYP1B1由来のBの配列との不連続点を形成する。アミノ酸は通常、20種の天然アミノ酸、例えばAla、Leu、IleまたはGlyなどのいずれかであるが、一般的には(1)CYP1B1中でAのカルボキシ末端に自然下で隣接するもの、および(2)CYP1B1中でBのアミノ末端に自然下で隣接するものを除く、任意のアミノ酸が可能である。
【0022】
「スペーサー配列」とは、本発明のポリペプチド中の2つの近接した区域、例えば「A」と「B」との間に挿入される2つ以上のアミノ酸の配列のことを意味する。スペーサーの配列は、AおよびBの由来である完全長CYP1B1タンパク質においてAのカルボキシ末端およびBのアミノ末端に隣接する配列とは異なる。すなわち、スペーサー配列は、本発明のポリペプチド中に、CYP1B1由来のAの配列およびY由来のBの配列の双方との不連続点を形成する。
【0023】
スペーサー配列の例には、Ala Ala、Ala Leu、Leu Leu、Leu Ala、Len Ile、Ala Ala Ala、Ala Gly Leu、Phe Ile Ileなどが含まれる。一般に、スペーサー配列は非極性アミノ酸を含むと考えられるが、Glu、Gln、Ser、HisおよびAsnなどの極性残基も存在することができ、特に3残基を上回るスペーサー配列ではそうであると考えられる。各スペーサー配列の全長および性質に関する唯一の外延は、ポリペプチドおよび/または核酸の合成、タンパク質分解プロセシングおよび操作の容易さに関する考慮によるものである。約4または5残基よりも長いスペーサー配列を用いることは一般に不必要であり、おそらくは望ましくないと思われるが、それらは例えば、6、8、10、15、20、30または50残基であってもよいと考えられる。当然ながら、それらは50残基よりもさらに長くてもよいと考えられる。
【0024】
スペーサーアミノ酸およびスペーサー配列は、タンパク質の安定性を変化させるため、またはエピトープを放出するプロセシングを促すために有用である。スペーサーは通常、細胞内でのタンパク質分解プロセシングにより、所定の区域内のエピトープ間にある任意の配列とともにポリペプチドから除去される。このため、エピトープがMHC分子または(細胞からの分泌後に)抗体と結合する能力は損なわれない。時には、スペーサーアミノ酸またはスペーサー配列の一部が不完全なプロセシングのためにエピトープと結合したまま残ることも考えられる。これは一般に、MHC分子との結合に対してほとんどまたは全く影響を及ぼさない。
【0025】
本明細書に記載の核酸によってコードされるハイブリッド型ポリペプチドは、CYP1B1の追加的な区域、例えば第3、第4、第5、第6の区域をさらに含みうる。これらの追加的な区域はそれぞれ長さが少なくとも8アミノ酸であり、CYP1B1の非連続的な部分を構成している。
【0026】
スペーサーは選択的には、CYP1B1以外のタンパク質由来のT細胞および/またはB細胞エピトープを含むことができる。例えば、スペーサーは、破傷風トキソイドまたはPADRE T細胞エピトープ(例えば、米国特許第5,662,907号を参照)をコードしうる。
【0027】
本発明はまた、本明細書に記載の核酸およびアジュバントまたは免疫刺激物質を含む、組成物も特徴とする。アジュバントおよび「免疫刺激物質」とは、抗原特異的でない様式で免疫応答を誘発する物質、または樹状細胞などの専門化した抗原提示細胞の分化もしくは活性化を誘導する物質のことを指す。アジュバントの例には、ミョウバン、金、モノホスホリルリピドA、サポニン、油性乳剤、QS21およびフロイントアジュバントが含まれる。免疫刺激物質の例には以下のものが含まれる:例えば長さ18〜30ヌクレオチドのCpG含有オリゴヌクレオチド;IL-12、GM-CSF、IL-2またはIFN-γなどのサイトカイン;B7-1、B7-2、CCR5などの細胞表面受容体;ならびに脂質、核酸、糖質および細菌性ポリペプチド。
【0028】
本発明は、本明細書に記載の核酸およびIL-12、GM-CSF、IL-2、IFN-γまたは細菌性ポリペプチドなどの免疫刺激物質をコードする核酸を含む組成物も含む。
【0029】
本発明は、本明細書に記載の核酸および薬学的に許容される担体を含む治療的組成物も含む。本発明はまた、微粒子、例えば、ポリマーマトリックスまたはシェルおよび本明細書に記載の核酸を含むミクロスフェアも含む。本発明はまた、ポリマーネットワーク、例えばヒドロゲルおよび本明細書に記載の核酸も含む。
【0030】
もう1つの局面において、本発明は、本明細書に記載の核酸を哺乳動物に投与することによる、哺乳動物における免疫応答の誘導方法を特徴とする。1つの例において、哺乳動物は癌に罹患している、またはその危険性がある。核酸は皮下、鼻腔内または筋肉内などのさまざまな経路によって投与することが可能である。核酸の注射後に注射部位で電気穿孔法を行ってもよい。本方法によって生じる免疫応答をCYP1B1に向かわせることが可能である。本方法はT細胞応答および/またはB細胞応答を引き起こしうる。
【0031】
本発明は、本明細書に記載の微粒子またはポリマーネットワークを哺乳動物に投与することによる、哺乳動物における免疫応答の誘導方法も特徴とする。
【0032】
本発明はまた、免疫応答を生じさせる方法であって、(1)哺乳動物の腫瘍または腫瘍内でのCYP1B1の発現を検出する段階;および(2)本明細書に記載の核酸を哺乳動物に投与する段階を含み、投与によって哺乳動物における抗CYP1B1免疫応答が誘発される方法も特徴とする。
【0033】
本発明はまた、哺乳動物における腫瘍増殖または腫瘍活性を低下させる方法も特徴とする。本方法は以下の段階を含む:(1)腫瘍を有する哺乳動物を同定する段階;(2)本明細書に記載の核酸を哺乳動物に投与する段階;および(3)核酸の投与後の腫瘍のサイズまたは活性の低下を検出する段階。本明細書で用いる「腫瘍活性」とは、腫瘍細胞の増殖を促進する、腫瘍細胞によって分泌される可溶性因子のことを指す。本方法はさらに、核酸を投与する前に腫瘍内でのCYP1B1の発現を検出する段階を含みうる。
【0034】
本発明はまた、哺乳動物の再発までの期間、寿命または生活の質を増大させる方法も特徴とする。本方法は以下の段階を含む:(1)腫瘍を有する哺乳動物を同定する段階;(2)本明細書に記載の核酸を哺乳動物に投与する段階;および(3)核酸の投与後の哺乳動物の再発までの期間、寿命または生活の質の増大を評価する段階。再発までの期間、寿命または生活の質の増大は、例えば、化学療法の必要性の低下もしくは化学療法薬の投与期間の短縮、鎮痛薬の必要性の低下もしくは鎮痛薬の投与期間の短縮、または入院もしくは薬物療法の必要性もしくは期間の低下もしくは短縮によって評価することができる。
【0035】
もう1つの局面において、本発明は、本明細書に記載の核酸を細胞に送達することによる、免疫応答の誘導方法を特徴とする。免疫応答の誘導はインビトロ、インビボまたはエクスビボのいずれで行ってもよい。例えば、抗CYP1B1 T細胞を、例えば、CYP1B1を発現する樹状細胞などの抗原提示細胞とのインキュベーションまたはCYP1B1タンパク質もしくはペプチドによるパルス刺激によって細胞培養下で作製し、その後に個体、例えば、癌に罹患した個体またはその危険性がある個体に再び導入することができる。
【0036】
もう1つの局面において、本発明は、核酸を哺乳動物に投与することによる、哺乳動物における免疫応答の誘導方法を特徴とする。本方法において、哺乳動物は第1の種に属し、例えば哺乳動物はヒトであり、核酸はMHCクラスIもしくはクラスII分子または免疫グロブリン受容体と結合するCYP1B1またはその一部を含むポリペプチドをコードするが、ここでCYP1B1またはその一部は第2の種、例えばラットまたはマウスなどの齧歯動物の天然のCYP1B1ポリペプチドの配列と同一である。
【0037】
本方法に従って投与される核酸は、MHCクラスIもしくはクラスII分子または免疫グロブリン受容体と結合するCYP1B1またはその一部を含むポリペプチドをコードする任意の核酸でありうる。1つの例において、核酸は本発明の核酸である。核酸は裸の核酸として哺乳動物に送達することもでき、または微粒子などの送達媒体とともに送達することもできる。MHCクラスIまたはクラスII分子と結合するCYP1B1またはその一部は、第1の種の天然のCYP1B1ポリペプチドの配列と同一でないことが好ましい。核酸を、選択的には、本明細書に記載の免疫刺激物質とともに投与することができる。
【0038】
核酸を投与する哺乳動物は、細胞増殖性疾患、例えば癌を有する、またはその危険性があるものでよい。1つの例では、核酸を哺乳動物に投与する前に、哺乳動物を細胞増殖性疾患、例えば腫瘍を有するものとして同定する。
【0039】
本発明の1つの利点は、本明細書に記載の核酸により、CYP1B1ポリペプチドが通常は産生されないまたは低レベルで産生される細胞において、CYP1B1ポリペプチドまたはその一部の翻訳が可能になることである。
【0040】
本明細書に記載の核酸構築物のいくつかのさらにもう1つの利点は、安定性が変化した、および/または酵素活性が変化、低下もしくは消失した、ポリペプチドの翻訳が可能になることである。ポリペプチドの安定性を変更することにより、そのプロセシングおよびその後の免疫系による認識を増強させることができる。CYP1B1タンパク質の酵素活性を変更することにより、望ましくない生物活性が低下または消失する。
【0041】
本発明の特定の構築物のさらにもう1つの利点は、CYP1B1タンパク質の部分的または変化した配列のみを有する、ポリペプチド由来のMHCクラスIまたはクラスII結合性エピトープの送達が可能になることである。すなわち、完全長CYP1B1ポリペプチドの発現に伴う有害な影響が避けられる。加えて、コードされるCYP1B1タンパク質のコード配列の変更により、抗原に対する自己寛容が遮断されると考えられる。
【0042】
本発明の特定の構築物のさらにもう1つの利点は、本明細書に記載のポリペプチドの内部でのエピトープの組み合わせにより、少なくとも1つ、一般的には複数のCYP1B1エピトープが種々のHLAアロタイプのそれぞれによって提示される可能性が高まることである。これにより、ポリペプチドをコードする単一の核酸を用いて、HLA遺伝子座に多型のある個体の集団に免疫処置を行うことが可能になる。
【0043】
別に定義する場合を除き、本明細書で用いるすべての技術用語および科学用語は、本発明が属する当業者が一般に理解しているものと同じ意味を持つ。本発明の実施または検討のために本明細書に記載したものと同様または同等の方法および材料を用いることができるが、好ましい方法および材料は以下に説明するものである。本明細書で言及するすべての刊行物、特許出願、特許およびその他の参考文献は、その全体が参照として本明細書に組み入れられる。対立が生じた場合には、定義を含め、本明細書が支配的であるものとする。さらに、材料、方法および実施例は例示的なものに過ぎず、限定を意図したものではない。
【0044】
本発明のその他の特徴および利点は、以下の詳細な説明および特許請求の範囲から明らかになると考えられる。
【図面の簡単な説明】
【0045】
【図1A】CYP1B1をコードする核酸(配列番号:1)およびポリペプチド(配列番号:2)の配列を示している。
【図1B】図1Aの続きを示す図である。
【図1C】図1Bの続きを示す図である。
【図1D】図1Cの続きを示す図である。
【図2】オープンリーディングフレーム(ORF)および種々の量の非翻訳領域(UTR)を含むCYP1B1 cDNA構築物の概略図である。
【図3】CYP1B1ポリペプチド(配列番号:2)ならびにいくつかのCYP1B1切断型および欠失型変異体の概略図である。
【図4】CYP1B1発現ベクターによる免疫処置を行ったマウスにおけるCYP1B1応答性T細胞の生成を示している。
【図5】CYP1B1変種発現ベクターによる免疫処置を行ったマウスにおけるCYP1B1応答性T細胞の生成を示している。
【図6】CYP1B1発現ベクターによる免疫処置に続いて電気穿孔法を行ったマウスにおけるCYP1B1応答性T細胞の生成を示している。
【図7】ポリマーネットワーク中に含まれるCYP1B1発現ベクターによる免疫処置を行ったマウスにおけるCYP1B1応答性T細胞の生成を示している。
【図8】微粒子内に含まれるCYP1B1発現ベクターによる免疫処置を行ったマウスにおけるCYP1B1応答性T細胞の生成を示している。
【図9】CYP1B1発現ベクターによる免疫処置を行ったマウスにおけるCYP1B1応答性MHCクラスII拘束性T細胞の生成を示している。
【0046】
詳細な説明
本発明は、天然型のCYP1B1転写物の非翻訳領域(UTR)に認められる配列を欠いた転写ユニットである、CYP1B1ポリペプチドまたはその部分をコードする転写ユニットを含む核酸を提供する。天然型のCYP1B1転写物は、少なくともある種の細胞環境で翻訳の部分的または全体的な抑制の一因となる翻訳抑制因子を含むと考えられている。本発明の核酸は翻訳抑制因子を欠いており、このため、CYP1B1ポリペプチドまたはその部分の翻訳が増強される系を提供する。
【0047】
本発明の核酸は、個体におけるCYP1B1特異的な免疫応答の誘発または増強のためのツールとして有用である。本核酸は天然のCYP1B1転写物に含まれる翻訳抑制因子を欠いているため、CYP1B1タンパク質またはその一部の産生を可能とし、これによって免疫応答の発生を促進する。本発明の核酸は多数のCYP1B1エピトープをコードしうるため、多岐にわたるMHCアロタイプを含む集団において免疫応答を誘発させるために有用である。本発明の核酸は、コードされるタンパク質の免疫原性を高めるのに役立つ変異、欠失、挿入または転位を含むこともできる。こうすることにより、改変されたCYP1B1配列を含むタンパク質が自己寛容を引き起こすのを妨げられると考えられる。加えて、本発明の核酸は、天然のCYP1B1転写物に含まれる翻訳抑制因子を欠くため、インビトロまたはインビボのいずれかでCYP1B1ポリペプチドまたはその部分を生成させる目的にも有用である。
【0048】
核酸
本発明の核酸は、(1)CYP1B1ポリペプチドまたはその一部をコードするが(2)天然のCYP1B1転写物には対応しない、転写ユニットを含む。ヒトCYP1B1の核酸配列(配列番号:1)およびタンパク質配列(配列番号:2)を図1A〜1Dに示す。本明細書ではこれらの配列を本発明の核酸を説明するための基準(reference)として用いる。天然のヒトCYP1B1核酸の配列はジェンバンク(GenBank)(商標)アクセッション番号U03688、およびタング(Tang)ら(1996)J. Biol. Chem. 271:28324に記載されており、その内容は参照として組み入れられる。ラットおよびマウスなどの他の哺乳動物でオルソロガスなCYP1B1配列が同定されている(Walkerら(1995)Carcinogenesis 16:1319;Shenら(1994)DNA Cell Biology 13:763;Savasら(1994)J. Biol. Chem. 269:14905;これらは参照として本明細書に組み入れられる)。ヒト、ラットおよびマウスなどの改変型の真核生物CYP1B1核酸も本発明に含まれる。
【0049】
5'および/または3' UTRに含まれ、翻訳抑制因子として作用する特定の配列を転写ユニットが欠いている点で、本発明の核酸は天然のCYP1B1核酸とは異なる。翻訳抑制因子の実体はさまざまな方法によって決定しうる。
【0050】
ヌクレオチド配列が翻訳抑制因子を含むか否かを判定する第1の方法では、完全長RNAの配列を、例えばコンピュータプログラムにより、翻訳抑制にかかわるコンセンサス配列の存在に関して解析する。例えば、コンピュータ解析により、リプレッサー物質(例えばリプレッサータンパク質)が結合しうる配列を同定することができる。もう1つの例では、コンピュータ解析により、RNA不安定化配列として作用する配列、例えば、それが存在することによって少なくともある種の細胞環境で転写物の半減期が短縮するヌクレオチド配列を同定することができる。もう1つの例では、コンピュータ解析により、転写物中に二次構造を形成すると思われる、翻訳抑制にかかわるコンセンサス配列を同定することができる。
【0051】
配列番号:1の配列に対応するCYP1B1 RNA転写物のUTRの解析により、二次構造と推定される領域が同定された。この解析は、ズーカー(Zuker)およびターナー(Turner)によるmfoldプログラムのバージョン3.0を用いて行った(Zukerら(1999)、「RNAの二次構造の予測のためのアルゴリズムおよび熱力学:実践的ガイド(Algorithms and Thermodynamics for RNA Secondary Structure Prediction:A Practical Guide)」、「RNAの生化学およびバイオテクノロジー(RNA Biochemistry and Biotechnology)」中、11〜43、J. Barciszewski & B.F.C. Clark編、NATO ASIシリーズ、Kluwer Academic Publishers;Mathewsら(1999)J. Mol. Biol. 288:911〜940)。mfoldは自由エネルギーの最小化に基づくRNA二次構造の予測のためのズーカー(Zuker)アルゴリズムを具体化したものである。本解析におけるフォールディング温度は37℃に固定される。
【0052】
CYP1B1 RNA転写物中の二次構造と予想される領域を表1に示す。これらの領域は翻訳リプレッサーと推定されるものを構成しており、このため、本発明の核酸はこれらの配列、配列番号:3〜17のうち1つまたは複数(例えば、2、3、4、5、6、7、8、9、10、11、12、13、14または15個)を欠くことが可能である。
【0053】
〔表1〕 CYP1B1転写物の非翻訳領域の二次構造解析

【0054】
ヌクレオチド配列が翻訳抑制因子を含むか否かを判定する第2の方法では、改変されたCYP1B1転写物によって産生されるタンパク質の量を野生型CYP1B1転写物と比較する実験的な評価により、翻訳抑制因子を同定することができる。例えば、配列番号:1の配列のUTR欠失変異体を構築し、変異体および配列番号:1の配列のそれぞれを別の細胞集団で発現させて、変異体および野生型のそれぞれから産生されたCYP1B1タンパク質の量を比較する。改変された転写物の方が野生型CYP1B1よりもタンパク質産生を増強させるならば、それには1つまたは複数の翻訳抑制因子があると考えられる。例えば、本発明の核酸は、配列番号:18の5' UTR配列(配列番号:1のヌクレオチド1〜362)を欠くものでもよい。もう1つの例において、核酸は配列番号:19の3' UTR配列(配列番号:1のヌクレオチド2011〜5128)を欠くものでよい。もう1つの例において、核酸は配列番号:18および配列番号:19の両方を欠くものでよい。配列番号:18および/または配列番号:19の両方を欠いた核酸に加えて、本発明は、配列番号:18および/または配列番号:19のうち特定の数の連続したヌクレオチド、例えば少なくとも400、300、200、150、100、50、25または10個を欠いた核酸も含む。この解析は上記のコンピュータ解析とともに行うことができる。
【0055】
本発明の核酸が、コードされるCYP1B1タンパク質またはその変種の免疫原性を高めるのに役立つ変異、欠失、挿入または転位を含む点で、天然のCYP1B1核酸と異なってもよい。タンパク質の免疫原性を評価する方法は当技術分野で周知であり、これには、核酸による免疫処置を動物に行い、その後にリンパ節、脾臓、血液または血清を採取してT細胞応答またはB細胞応答に関して分析することが含まれる。標準的なアッセイは本明細書に説明されており、これにはCr51アッセイ、エリスポット(Elispot)アッセイ、テトラマーアッセイ、ELISA、CYP1B1に特異的な細胞傷害性T細胞(CTL)を測定するためのFACSによる細胞内サイトカイン染色分析、ヘルパーT応答を測定するためのエリスポット(Elispot)アッセイおよびT細胞増殖試験、ならびにB細胞応答を測定するためのELISAおよびウエスタン分析が含まれる。
【0056】
配列番号:1などのCYP1B1核酸に対する改変は、当業者に周知の方法によって行うことができる。特定の5'および/または3' UTR配列の除去は、適切なプライマー対を用いたテンプレートのPCR増幅および増幅産物の発現ベクター中へのサブクローニングによって行える。例えば、配列番号:18および配列番号:19を欠く核酸は、配列番号:1の核酸をテンプレートとし、配列番号:1の363〜382の領域に対応するプライマー(プライマー1)および配列番号:1の1991〜2010の領域に対応するプライマー(プライマー2)を用いるPCR増幅によって構築可能である。
【0057】
図2A〜2Cは、CYP1B1をコードする核酸の3つの例を示している。これらの図は配列番号:1のヌクレオチド位置を参照している。図2Aは配列番号:1の完全長CYP1B1核酸である。図2Bは配列番号:1の切断型であり、5'UTRおよび3' UTRの一部を欠いたものである。図2Cは、図2AのCYP1B1核酸に存在する5' UTRのすべて、さらには3' UTR配列のすべてを欠いたものである。
【0058】
ポリペプチドをコードする核酸の発現を促進するために、核酸に調節因子を含めることができる。これらの因子には、ヒトまたは他の哺乳動物の細胞における発現を増強させるための配列、例えばプロモーターおよび/またはエンハンサーが含まれる。例えば、T7ポリメラーゼプロモーター、CMV、RSVもしくはLTRなどのウイルスプロモーター、筋特異的プロモーターなどの組織特異的プロモーター、APC特異的プロモーターなどの細胞特異的プロモーター、または誘導性プロモーターを、選択的にはコード配列の5'末端に存在させる。誘導性プロモーターの例には、メタロチオネインプロモーター(例えば、Testaら(1994)Cancer Res. 54:4508を参照)およびテトラサイクリン応答性プロモーター(例えば、Giavazziら(2001)61:309を参照)が含まれる。
【0059】
本核酸に、RNA安定化配列、例えば、コード配列の5'側および/または3'側に置かれたアフリカツメガエル(Xenopus laevis)β-グロビン遺伝子由来のRNA安定化配列;イントロン(これはコード配列の内部または隣接した任意の位置に配置しうる);ポリ(A)付加部位;複製起点;ならびに原核および/または真核宿主における構築物の複製および選択を可能にする選択マーカー(例えばカナマイシン耐性遺伝子)または栄養要求性マーカーをコードする1つまたは複数の遺伝子、を含めることもできる。
【0060】
本核酸に、天然のCYP1B1転写物に由来するものでない翻訳調節配列を含めることもできる。翻訳調節配列は当技術分野で知られている(例えば、AzizおよびMunro(1987)Proc. Natl. Acad. Sci. USA 84:8478を参照)。翻訳調節配列を本明細書に記載の転写ユニットに付加することにより、タンパク質発現の翻訳調節が可能になる。例えば、コードされるタンパク質の翻訳に鉄応答性イベントを付与する目的で、フェリチンmRNAの5' UTRの最初の67ヌクレオチド(AzizおよびMunro、前記)を本明細書に記載の転写ユニットと連結することができる。
【0061】
本核酸に、他の転写シグナルおよび翻訳シグナル、例えばコザック配列、さらにはFLAG、myc、HAまたはHisタグなどの抗体決定基をコードする配列などを、選択的にはコード配列の5'または3'末端であって終止コドンの前に存在するように、含めてもよい。
【0062】
CYP1B1ポリペプチドをコードする核酸は、哺乳動物の抗原提示細胞(APC)における発現を可能にする任意のベクター中に含めることができる。核酸を発現ベクター、すなわち内部でコード配列が発現制御配列と機能的に結合しているベクター中にクローニングしてもよい。本発明に有用なベクターには、線状の核酸断片または環状のDNA、プラスミドベクター、ウイルスベクター、真菌ベクターおよび細菌ベクターが含まれる。「プラスミド」とは、自律性で自己複製能のある染色体外の環状DNAのことである。好ましいウイルスベクターは、レトロウイルス、アデノウイルス、アデノ随伴ウイルス、ポックスウイルス、SV40ウイルス、アルファウイルスまたはヘルペスウイルスに由来するものである。適したベクターの例には、一連のpcDNA哺乳動物発現ベクター(Invitrogen)がある。
【0063】
核酸は単一のポリペプチドをコードすることもでき、二重プロモーターベクターのように、それぞれが異なるプロモーターの制御下にある複数のポリペプチドをコードすることもできる。二重プロモーターベクターにより、所定のベクターから産生されるエピトープの数を減らさずに、2つの短いポリペプチドを単一の長いものの代わりに用いることが可能となる。また、第1のポリペプチドの配列およびおそらくはプロセシングを変化させずに、新たなCYP1B1配列を追加することも可能となる。2つの関係のないタンパク質、例えばCYP1B1および免疫刺激物質をコードすることも可能である。または、核酸は、2つのコード配列の間、例えば本明細書に記載の2つのポリペプチドをコードする核酸配列の間の位置にIRES配列を含む。IRES配列はリボソームを下流の翻訳単位の開始コドンに結合させ、単一のポリシストロン性mRNAからの第2のタンパク質の翻訳を引き起こす。2つ以上のポリペプチドをコードする発現ベクターは、選択的には、1つの分泌性ポリペプチドおよび1つの非分泌性ポリペプチドをコードすることが可能である。このようなベクターは、T細胞応答およびB細胞応答の両方を誘導するために用いることができる。また、2つの関係のないタンパク質、例えばCYP1B1および免疫刺激物質をコードさせるためにこれを用いることもできる。
【0064】
CYP1B1ポリペプチド
本発明の核酸は、MHCクラスIもしくはクラスII分子または免疫グロブリン受容体と結合する少なくとも1つのペプチドエピトープを含むCYP1B1またはその一部を含むポリペプチドをコードする。本明細書に記載のポリペプチドをコードする核酸は、ポリペプチドのアミノ末端に、翻訳を促すためのメチオニン残基をコードすることができる。本ポリペプチドは、CYP1B1の複数のエピトープ、さらにはそれぞれが1つまたは複数のエピトープを含むCYP1B1の複数の区域を含みうる。CYP1B1のMHC結合エピトープは当業者に周知の方法によって同定可能である。MHCクラスI結合ペプチドは一般に長さが8〜10アミノ酸残基であり、一方、MHCクラスII結合ペプチドは一般に長さが12〜30アミノ酸残基である。
【0065】
特定のMHCアレルと結合するエピトープは、CYP1B1由来の一連の重複性ペプチド断片をまず合成し、MHCアレルと結合することが知られた放射標識ペプチドを用いる当技術分野で知られた結合試験によりペプチドを試験することによって同定可能である。被験ペプチドが、例えば、放射標識した被験ペプチドとの競合による評価で、MHCアレルと特異的に結合すること(すなわち、エピトープであること)が示されれば、そのエピトープを別のエピトープ(重複性または隣接性)と組み合わせて何らかの区域を作製または規定することができる。上記の方法および関連した方法の例は、米国特許第6,037,135号、国際公開公報第99/45954号および国際公開公報第044775A2号に記載されており、これらは参照として本明細書に組み入れられる。
【0066】
または、放射標識したβ2-ミクログロブリンおよび被験ペプチドの存在下での可溶性MHCクラスI分子のリフォールディングによってエピトープを同定することもできる。完全な複合体はリフォールディングし、正しいサイズの受容体を生じると考えられる。β2-ミクログロブリンは、被験ペプチドの結合親和性と直接相関する測定可能な速度で複合体から解離する(Garbocziら(1992)Proc. Nat. Acad. Sci. USA 89:3429;Parkerら(1992)J. Biol. Chem. 267:5451;およびParkerら(1992)J. Immunol. 149:1896)。この種のデータの解析により、HLA-A2受容体に関して所定の被験ペプチドの解離時間を予測するアルゴリズムが得られている(Parkerら(1994)J. Immunol. 152:163)。迅速な解離は低い親和性と、緩徐な解離は高い親和性と相関づけられている。このアルゴリズムは敷衍され、HLA-Aアロタイプ、HLA-A1、HLA-A2、HLA-A3、HLA-A11およびHLA-A24に関するエピトープの結合親和性の予測に利用できるようになっている。このアルゴリズムはウェブサイト(http://wwwbimas.dcrt.nih.gov/molbio/hla_bind/index.html)で見ることができる。エピトープが有効な細胞傷害性T細胞(CTL)応答を生じさせるには、それが抗原提示細胞(APC)上のMHC分子と結合し、その結果生じた受容体-リガンド複合体がCTL上に発現されたT細胞受容体によって認識される必要がある。
【0067】
または、米国特許第5,827,516号および米国特許出願第09/372,380号(これらは参照として本明細書に組み入れられる)などに記載された技法を用いてMHCクラスIまたはクラスII結合ペプチドを同定することにより、エピトープを同定することもできる。
【0068】
上記のMHC分子とインビトロで結合するエピトープを、インビトロ免疫感作アッセイで、ヒトT細胞応答を誘発する有効性に関して評価すること(またはT細胞応答を生じさせるために用いること)ができる(例えば、Schultzeら(1997)J. Clin. Invest. 100:2757を参照)。この種のアッセイは以前に、ヒトおよびマウスのT細胞応答性エピトープを同定するために用いられている(Alexanderら(1996)Amer. J. Obstet. and Gynecol、175:1586;Tarpeyら(1994)Immunology 81:222)。これらのアッセイは、免疫療法のために多数の特異的CTLを作製する目的にも用いられる(Tsaiら(1998)Crit. Rev. Immunol. 18:65)。信頼性を確保するためには、被験ペプチドによるパルス刺激を行った樹状細胞(DC)の存在下で1回目のT細胞刺激を行うことが望ましい。さらに、刺激時にIL-10を含めることにより、細胞の培養中に起こることが時にある非特異的な反応が抑制されるとかもしれない。続いて、T細胞の活性化を、λ-IFN分泌を測定するELISAアッセイを用いて、IL-10、IL-4、TNFα、IFN-γもしくはIL-2などのサイトカインを測定するエリスポット(ELISPOT)により、またはλ-IFNなどのサイトカインを含むCD8+、CD16-細胞の増加を三色分析によって判定するFACSを用いることによって検討する。または、T細胞の活性化を、51Cr放出CTLアッセイまたはテトラマーアッセイを用いて測定することもできる(例えば、Molldremら(2000)Nature Med. 6:1018を参照)。
【0069】
所定のアロタイプを有するすべての個体が特定のエピトープに反応するとは限らない可能性がある。例えば、HLA-A2アロタイプを有する細胞を持つある個体は所定のエピトープに反応するが、同じような第2の個体は反応しないことが考えられる。この問題を克服するためには、2体のドナー、さらにより好ましくは3体のドナーからのT細胞に関してそれぞれのHLAアロタイプを検討し、それがT細胞エピトープであることを確認するとよい。さらに一般的なアレル(すなわち、HLA-A2およびHLA-A3)の場合は、最大で4体のドナーを検討することが好ましい。
【0070】
各エピトープの検討は、まず1体のドナーからの細胞を用いて行う。第1のドナーの細胞を用いてエピトープがT細胞応答を誘発しなければ、第2のドナー、さらには第3ドナーからの細胞を用いてさらに検討する。2回または3回の試行を行ってもエピトープがT細胞応答性を示さなければ、選択的には、これをポリペプチドに含めるものとしては選択しない。
【0071】
抗原のインビトロ提示を行う方法を変更することにより、分析を強化することもできる。DCによるT細胞の初回刺激は通常、インビトロ免疫処置の一部である。免疫感作を増強するために、十分な抗原提示およびT細胞刺激が確実に行われるように、例えば、前もって作製した後に凍結しておいたCDを用いて、各刺激時にDCを加えることができる。または、APCの細胞表面CD40受容体に対する抗体結合によって抗原提示細胞(APC)を活性化することにより、T細胞刺激を増強させることもできる。
【0072】
または、エピトープを、HLA分子に対する結合親和性のみに基づいて構築物中に含めるために選択すること、または、本明細書ならびにシッツ(Chicz)ら(1993)J. Exp. Med. 178:27および米国特許第5,827,516号における記載のように、自然にプロセシングされたペプチドの分析に基づいて同定することも可能である。
【0073】
B細胞エピトープは、哺乳動物における免疫応答を誘導する能力に基づいて選択することができる。例えば、CYP1B1ペプチドをフロイントアジュバントと混合してマウスに注射する。免疫処置動物から血清を採取し、CYP1B1に対する応答性に関してウエスタンブロットによる試験を行う(市販されている、Gentest、Woburn MA)。
【0074】
本発明の核酸によってコードされるポリペプチドは、必ずしも配列番号:2の完全長CYP1B1タンパク質を含む必要はない。例えば、本発明の核酸によってコードされるポリペプチドは、天然のCYP1B1の生物活性を欠くことができる(例えば、Heidelら(2000)Cancer Res. 60:3454)。CYP1B1ポリペプチドまたはその一部をコードする核酸が、機能喪失型変異(例えば挿入、欠失、フレームシフト変異または一塩基変異)を有するコード配列を含むこともできる(Baileyら(1998)Cancer Res. 58:5038)。CYP1B1コード配列中のフレームシフト変異の例は、ストイロフ(Stoilov)ら(1997)Hum. Mol. Gen. 6:641およびサーファラージ(Sarfarazi)ら(1997)Hum. Mol. Gen. 6:1667に記載されている。もう1つの例において、ポリペプチドは、ヒンジ領域(例えば、配列番号:2のアミノ酸約38〜61)または配列番号:2のアミノ酸約400〜540の間に位置するCYP1B1のヘム結合部分の保存的コア配列の全体もしくは一部を欠くことができる(Stoilovら(1998)Am. J.Human Genet. 62:573)。もう1つの例において、ポリペプチドは、CYP1B1の酸化還元ドメインの全体もしくは一部を欠くことができ、または活性部位領域(Lewisら(1999)Toxicology 139:53)もしくはタンパク質のフォールディングもしくは安定性のために必要な領域に変異を有することができる。もう1つの例において、ポリペプチドは、配列番号:2のアミノ酸約18〜37の間に位置するCYP1B1膜貫通領域の全体または一部を欠くことができる。
【0075】
図3は、CYP1B1ポリペプチド(配列番号:2)ならびにその断片および変種を示している。図3に示した種々のポリペプチドは、CYP1B1をコードする本明細書に記載の核酸、例えば、5' UTRおよび/または3'UTRの全体または一部を欠く核酸によってコードされうる。ポリペプチドの中には配列番号:22のペプチドを含むものもある。図3に示したCYP1B1断片および変種を以下に説明する。
【0076】
配列番号:31
本ポリペプチドは、CYP1B1のヒンジ領域内に4アミノ酸(配列番号:2の残基51〜54)の欠失を含む。本ポリペプチドは、野生型タンパク質と比較して、残基57(WからCに)、61(GからEに)、365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には下線を付した。配列番号:31のアミノ酸配列を以下に列挙する:

【0077】
配列番号:32
本ポリペプチドは、配列番号:2のアミノ酸1〜60の欠失を含む。欠失はCYP1B1のERドメイン、膜貫通ドメインおよびヒンジ領域を包含する。メチオニン(下線を付した)は配列番号:32のポリペプチドのアミノ末端に位置する。本ポリペプチドは、野生型タンパク質と比較して、残基365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には同じく下線を付した。この配列はF1R1と命名された。配列番号:32のアミノ酸配列を以下に列挙する:

【0078】
配列番号:33
本ポリペプチドは、配列番号:2のアミノ酸1〜60および462〜543の欠失を含む。欠失はCYP1B1のERドメイン、膜貫通ドメインおよびヒンジ領域を包含する。メチオニン(下線を付した)は配列番号:33のポリペプチドのアミノ末端に位置する。本ポリペプチドは、野生型タンパク質と比較して、残基365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には同じく下線を付した。この配列はF1R2と命名された。配列番号:33のアミノ酸配列を以下に列挙する:

【0079】
配列番号:34
本ポリペプチドは、配列番号:2のアミノ酸1〜171の欠失を含む。欠失はCYP1B1のERドメイン、膜貫通ドメインおよびヒンジ領域を包含する。メチオニン(下線を付した)は配列番号:34のポリペプチドのアミノ末端に位置する。本ポリペプチドは、野生型タンパク質と比較して、残基365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には同じく下線を付した。この配列はF2R1と命名された。配列番号:34のアミノ酸配列を以下に列挙する:

【0080】
配列番号:35
本ポリペプチドは、配列番号:2のアミノ酸1〜171および462〜543の欠失を含む。欠失はCYP1B1のERドメイン、膜貫通ドメインおよびヒンジ領域を包含する。メチオニン(下線を付した)は配列番号:35のポリペプチドのアミノ末端に位置する。本ポリペプチドは、野生型タンパク質と比較して、残基365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には同じく下線を付した。この配列はF2R2と命名された。配列番号:35のアミノ酸配列を以下に列挙する:

【0081】
配列番号:36
本ポリペプチドは、配列番号:2のアミノ酸1〜292の欠失を含む。欠失はCYP1B1のERドメイン、膜貫通ドメインおよびヒンジ領域を包含する。本ポリペプチドは、野生型タンパク質と比較して、残基365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には下線を付した。この配列はF3R1と命名された。配列番号:36のアミノ酸配列を以下に列挙する:

【0082】
配列番号:37
本ポリペプチドは、配列番号:2のアミノ酸1〜292および462〜543の欠失を含む。欠失はCYP1B1のERドメイン、膜貫通ドメインおよびヒンジ領域を包含する。本ポリペプチドは、野生型タンパク質と比較して、残基365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には下線を付した。この配列はF3R2と命名された。配列番号:37のアミノ酸配列を以下に列挙する:

【0083】
挿入、欠失、フレームシフト変異または一塩基変異をCYP1B1ポリペプチド配列に導入し、野生型タンパク質と比較して安定性および/または生物活性が変化したポリペプチドを得ることができる。CYP1B1ポリペプチドの安定性を変化させることにより、細胞機構によるそのプロセシングに影響を及ぼすことができる。例えば、安定性の低下したCYP1B1ポリペプチドはより多くのプロセシングを受け、それによってMHCクラスIおよび/またはクラスII分子によって提示されるCYP1B1ペプチドが増加すると考えられる。CYP1B1の生物活性を変化(例えば、低下または消失)させることにより、酵素活性などの不要な活性を低下または消失させることができる。
【0084】
以下のものは、野生型CYP1B1タンパク質と比較して、3つ(配列番号:38)および5つ(配列番号:39)のアミノ酸残基に変化を含むCYP1B1ポリペプチドの例である。
【0085】
配列番号:38
本ポリペプチドは、野生型タンパク質と比較して、残基57(WからCに)、61(GからEに)および365(GからWに)にアミノ酸の変化を含む。変化した残基には下線を付した。配列番号:38のアミノ酸配列を以下に列挙する:

【0086】
配列番号:39
本ポリペプチドは、野生型タンパク質と比較して、残基57(WからCに)、61(GからEに)、365(GからWに)、379(PからLに)および387(EからKに)にアミノ酸の変化を含む。変化した残基には下線を付した。配列番号:39のアミノ酸配列を以下に列挙する:

【0087】
上記のように、本明細書に記載の核酸によってコードされるポリペプチドは、MHCクラスIもしくはクラスII分子または免疫グロブリン受容体と結合するCYP1B1またはその一部を含む。ポリペプチドは、配列番号:2に存在する連続したアミノ酸の配列に対応する25、50、150、200、250、300、400、500個またはそれ以上のアミノ酸を含みうる。加えて、ポリペプチドの長さは300、200、150、100または50未満のアミノ酸でありうる。例えば、ポリペプチドは配列番号:20(配列番号:2のアミノ酸1〜272)または配列番号:21(配列番号:2のアミノ酸273〜544)を含みうる。
【0088】
本明細書に記載の任意のCYP1B1ポリペプチドまたはその断片は、野生型CYP1B1タンパク質または改変型CYP1B1配列と同一な配列の全体または一部を含みうる。例えば、本明細書に記載したそれらの任意のものの構造を有するポリペプチド(例えば、図3に示したポリペプチド)を、配列番号:38および/または配列番号:39のポリペプチド中に含まれるアミノ酸変化のうち任意の1つまたは複数(例えば、1つ、2つ、3つ、4つまたは5つ)を含むように作製することができる。
【0089】
本明細書に記載の核酸によってコードされるポリペプチドは、配列番号:2のアミノ酸残基190〜198に対応するアミノ酸配列FLDPRPLTV(配列番号:22)を含みうる。配列番号:22のペプチドは、CYP1B1ポリペプチドの自然にプロセシングされたエピトープである。加えて、ポリペプチドは、配列番号:23(配列番号:2のアミノ酸残基185〜205)の配列に由来する少なくとも8アミノ酸を含むことができる。配列番号:22または配列番号:23を含むポリペプチドの長さは300、200、150、100または50アミノ酸でありうる。
【0090】
さらに、本発明の核酸が、ポリペプチドを希望する細胞内区画に向かわせるターゲティングシグナルであって、そのポリペプチドと結合したターゲティングシグナルをコードする1つまたは複数の配列を含んでもよい。ターゲティングシグナル(この用語は輸送(trafficking)シグナルまたはターゲティング配列と互換的に用いられる)は、タンパク質を分泌の標的とすること、またはポリペプチドを小胞体(ER)、ゴルジ体、核、リソソーム、クラスIIペプチドローディング区画もしくはエンドソームに向かわせることができ、これには、シグナルペプチド(翻訳時にタンパク質をERに向かわせるアミノ末端配列)、KDEL(配列番号:24)などのER保持ペプチド、KFERQ(配列番号:25)、QREFK(配列番号:26)などのリソソームターゲティングペプチド、ならびにQに隣接して一方の側にK、R、D、E、F、I、VおよびLから選択される4残基が並んだ他のペンタペプチドが含まれる。ポリペプチドの分泌を導くターゲティングシグナル(例えば、配列番号:40)も含まれる。また、ポリペプチドの膜への挿入を導くターゲティングシグナル(例えば、膜貫通配列)も含まれる。膜挿入配列を含むポリペプチドを細胞質尾部を有するように構築することもでき、有しないように構築することもできる。
【0091】
ERターゲティング配列の一例は、HLA-DRαリーダー配列、

である。ターゲティング配列がこの特定した25残基配列の一部分(例えば、少なくとも10アミノ酸残基)のみを含んでも、その部分がポリペプチドのERへのターゲティングを生じるのに十分であるならばよい。ターゲティング配列のもう1つの例はE1A配列である。
【0092】
核移行配列には、チャイスキー(Cheisky)ら(1989)Mol. Cell Biol. 9:2487;ロビンス(Robbins)(1991)Cell 64:615;およびディングウォール(Dingwall)ら(1991)TIBS 16:478に記載されたような、ヌクレオプラスミン様およびSV40様の核ターゲティングシグナルが含まれる。いくつかの核移行配列は、

を含む。
【0093】
場合によっては、シグナルペプチダーゼまたは他のタンパク分解物質による切断を促進するために、ターゲティングシグナルのアミノ酸配列を改変することが望ましい。シグナルペプチダーゼの認識配列はフォン・ハイーヌ(Von Heijne)(1986)Nucleic Acids Research 14:4683に記載されている。フォン・ハイーヌ(Von Heijne)の-3、-1ルールを用いると、ターゲティングシグナルが存在する際にシグナルペプチダーゼによる切断が成功する確率を高める配列を選択することができる。
【0094】
場合によっては、ポリペプチドの安定性を変化させることにより、ポリペプチド配列を野生型CYP1B1配列から改変することが望ましい。ポリペプチドの安定性を低下させる1つの方法は、プロテアソームに対するそのターゲティング性を高めることによる。例えば、ユビキチン配列を含むターゲティングシグナルを本明細書に記載のポリペプチドと結合し、ポリペプチドを分解のために細胞プロテアソームに向かわせることができる(例えば、Hochstrasser(1995)Curr. Opin. Cell. Biol. 7:215〜223;Rodriguezら(1997)J. Virol. 71:8497〜8503)。ポリペプチドの安定性を低下させる別の方法では、ポリペプチドが、タンパク質安定性に寄与するCYP1B1配列の全体または一部、例えば、ヒンジ領域(配列番号:2のアミノ酸約38〜61)の全体または一部を欠くことができる。1つの例において、ポリペプチドは配列番号:2のアミノ酸51〜54の間に位置するPPGP領域を欠く(例えば、配列番号:31のポリペプチドを参照)。
【0095】
または、ポリペプチドがターゲティングシグナルを欠くこともでき、こうするとポリペプチドは細胞質に位置すると考えられる。
【0096】
ひとたび細胞内で発現されると、コードされたペプチドはプロセシングされ、複数のMHCクラスI結合エピトープのいずれか1つとなる。MHC分子はペプチドと結合するとT細胞応答を活性化することができる。MHCクラスII結合ペプチドもコードされたペプチドから生じうる。これらのペプチドは、MHCクラスII発現細胞によって提示されるとヘルパーT細胞またはCTLを活性化すると考えられる。他の受容体も、コードされたペプチドまたはプロセシングされたその断片と結合し、NKまたはB細胞などの免疫細胞を活性化しうる。これらの細胞は、本発明のペプチドに反応して誘発されたサイトカインによっても活性化されうる。1つの例では、配列番号:40などの分泌シグナルをポリペプチドに付加し、ポリペプチドの分泌およびB細胞などの免疫細胞の活性化をもたらす。
【0097】
CYP1B1の複数の区域を含むポリペプチドにおいて、ポリエピトープ性ポリペプチド内部の区域の順序は、それらの区域が天然のCYP1B1タンパク質中に存在する順序に対応しうるが、天然のタンパク質中で個々の区域の間にあるアミノ酸配列のいくつか(すなわち、少なくとも1つの残基)が欠失してもよい。または、区域の順序が天然のタンパク質のものと異なってもよい。このプロセスによって作製されるタンパク質は分子進化(例えば、米国特許第6,132,970号を参照)、エクソンシャッフリングまたはドメインシャッフリングのアプローチによってデザインされたものでもよい。
【0098】
ポリペプチドがプロセシングされ、エピトープがMHCによって提示されたか否かを明らかにするためには、ポリエピトープ性ポリペプチドコード配列を含む組換えワクシニアウイルスに感染させた自己脾細胞、PBLまたはEBV形質転換細胞を用いてインビトロT細胞刺激アッセイを行うとよい。これらの標的細胞は、脾細胞またはPBLを、3〜10プラーク形成単位(pfu)/細胞の多重感染度(moi)の組換えワクシニアとともに37℃で2時間インキュベートすることによって作製する。感染後に細胞をペレット化し、洗浄した上でインビトロ刺激アッセイにおける標的として用いる。異なるMHCアロタイプを有する1つまたは複数の個体、例えばマウスまたはヒト由来(またはCYP1B1ポリペプチドもしくは核酸構築物による免疫処置を行った1つもしくは複数の個体由来)の刺激したT細胞を標的細胞とともにインキュベートし、標的細胞がT細胞を刺激する能力を、例えばλ-インターフェロンの発現または分泌によって測定する。
【0099】
または、ポリエピトープ性ポリペプチドからのエピトーププロセシングを、ヒト細胞から精製したプロテアソームを用いて検討することもできる(Theobaldら(1998)J. Exp. Med. 188:1017;Kisselevら(1999)J. Biol. Chem. 289:3363;およびNussbaumら(1998)Proc. Nat. Acad. Sci.(USA)95:12404)。
【0100】
T細胞アッセイのほかに、例えばトランスジェニックマウスを用いるアッセイを用いて、インビボで送達した場合の構築物の機能(例えば、エピトープが正しくプロセシングされて提示されること)を確認することもできる。HLA-A2拘束性の提示を測定するためには、哺乳動物発現ベクター(例えば、プラスミド)中にあるポリエピトープ構築物を微粒子内に封入し、HLA-A2トランスジェニックマウスに筋肉内または皮下注射などの経路によって導入する。または、微粒子送達媒体を用いずに、構築物を例えば、組換えウイルスもしくは細菌ベクター、例えばワクシニアウイルス中にある形で、または裸のDNAとして投与してもよい。その後にインビトロでT細胞応答を評価する(Hedleyら、Nature Med. 4:365〜68、1998)。標的細胞としては、被験A2エピトープによるパルス刺激を加えたT2A2細胞(HLA-A2をコードするDNAをトランスフェクトしたT2細胞)またはEL4.A2細胞(HLA-A2をコードするDNAをトランスフェクトしたEL4細胞)、および本発明の核酸を導入したT2A2細胞が可能である。ペプチドを用いない、または無関係なペプチドによるパルス刺激を加えたEL4.A2細胞またはT2A2細胞を用いる試験を平行して行う。このようにして、本発明の核酸の投与後にインビボでプロセシングされて提示されるHLA-A2エピトープが同定される。陽性の結果が得られれば、ポリエピトープ性ポリペプチドのプロセシングが予想通りに起こったことが示唆される。
【0101】
または、ハンケ(Hanke)ら(1998)Vaccine 16:426の方法に従って、または米国特許出願第60/154,665号および米国特許出願第60/169,846号(これらは参照として本明細書に組み入れられる)に記載されたように、ポリエピトープ性ポリペプチドを作製してもよい。
【0102】
免疫刺激物質
組成物は、本明細書に記載の核酸のほかに、アジュバントもしくは免疫刺激物質、または免疫刺激物質をコードする核酸を含むことが可能である。有用なアジュバントおよび免疫刺激物質の例には以下のものが含まれる:ISCOMS、ウイルス様粒子(VLP)、ミョウバン、金、フロイントアジュバント、サイトカイン、例えばIL-12、GM-CSF、IL-2またはIFN-γなど;B7-1、B7-2またはCCR5などの細胞表面受容体;リポ多糖(LPS);モノホスホリルリピドA;QS21;例えば長さ18〜30ヌクレオチドのCpG含有オリゴヌクレオチド;および細菌毒素などの細菌性ポリペプチド。樹状細胞などの専門化した抗原提示細胞の分化または活性化を刺激する化合物は、免疫刺激物質として有用である。CpG含有オリゴヌクレオチドの例は米国特許第6,239,116号に記載されている。選択的には、本明細書に記載のポリペプチドおよび免疫刺激物質をコードする核酸を、単一のベクター、例えば本明細書に記載の二プロモーターベクターまたはIRESベクター中に含めることができる。または、本発明の核酸が、免疫刺激物質とインフレームに融合したCYP1B1ポリペプチドまたはその一部をコードすることもできる。この種の融合タンパク質の作製方法は当技術分野で周知であり、例えば国際公開公報第95/05849号に記載されている。
【0103】
方法
本発明の核酸を、リンパ増殖性疾患もしくは癌などのさまざまな種類の細胞増殖性疾患を有することが判明している個体、さまざまな種類の癌を有する疑いのある個体、またはさまざまな種類の癌に罹患しやすい個体(例えば、癌の易罹病性に関する遺伝子的および/または遺伝的な徴候、例えばBRCA1遺伝子の変異を有する個体)において免疫原として用いることができる。他の適した個体には、癌に関連した疾患の症状を呈している、またはそれを発症する可能性が高い例が含まれる。核酸は、種々の細胞増殖性疾患または癌、例えば膀胱、乳房、結腸、結合組織、肺、食道、皮膚、リンパ節、脳、卵巣、胃、子宮、精巣および前立腺の癌に関連した疾患を予防または治療するために予防的または治療的に用いることができる。1つの例では、核酸をワクチンとして用いる。
【0104】
ペプチドをコードする核酸は、さまざまな種類の増殖性疾患もしくは癌またはこれらの増殖性疾患もしくは癌に関連した疾患を治療するために、単独で投与することもでき、または当技術分野で知られた他の治療法、例えば化学療法、放射線療法および外科手術と組み合わせて投与することもできる。さらに、本発明の核酸を、免疫応答を増強するためにデザインされた他の治療と組み合わせて、例えば、当技術分野で周知のように、アジュバント、ビタミン、免疫刺激物質またはサイトカイン(またはサイトカインをコードする核酸)との同時投与によって、投与することもできる。核酸および免疫刺激物質を含む組成物については本明細書で説明している。
【0105】
本発明の核酸を、種々の癌またはこれらの癌に関連した疾患の予防または治療のための医薬品の製造に用いることもできる。
【0106】
CYP1B1ポリペプチドまたはその部分をコードする核酸は、急速に増殖している細胞集団または腫瘍、例えば、CYP1B1タンパク質を発現し、CYP1B1ペプチドをMHC分子と関連づけて提示する腫瘍、またはCYP1B1タンパク質を細胞表面に発現する腫瘍に対する癌罹患動物(patient)の免疫応答を誘発するための免疫療法に用いることができる。天然型のCYP1B1転写物は翻訳の部分的または全体的な抑制の一因となる翻訳抑制因子を含むと考えられるため、個体の免疫系はCYP1B1に対してナイーブまたは寛容であると思われる。他の細胞におけるCYP1B1タンパク質の発現は免疫学的自己寛容をもたらすと思われ、このため、自己寛容を妨げる機構によって本発明の核酸の有効性が高まると思われる。例えば、本発明の核酸は翻訳抑制因子を少なくとも1つ欠いており、このため、CYP1B1ポリペプチドまたはその部分の翻訳が増強された系を提供し、それによって個体の免疫系に抗CYP1B1免疫応答を生じさせる能力がある。本明細書に記載のポリペプチドを個体の1つの細胞、例えば非悪性APCなどの非悪性細胞に産生させて、個体の別の細胞、例えば癌細胞に対する体液性および/または細胞免疫応答を生じさせることが可能である。
【0107】
高レベルの発癌物質に曝露された個体、例えば喫煙者の中には、CYP1B1を高レベルに発現し、このためこのタンパク質に対する寛容を示す例があると思われる。本明細書に記載の方法によって抗CYP1B1免疫応答を生じさせることにより、このような個体におけるこの寛容を遮断し、それによってCYP1B1発現細胞、例えば癌細胞に対する免疫応答が生じると考えられる。
【0108】
本明細書に記載の核酸構築物をエクスビボ治療に用いることもできる。例えば、樹状細胞、末梢血単核細胞または骨髄細胞などの細胞を個体または適切なドナーから採取し、核酸組成物または本明細書に記載の核酸によってコードされるポリペプチドによりエクスビボで活性化した上で、個体に戻すことができる。さらに、筋芽細胞などの細胞に本明細書に記載の核酸発現ベクターをトランスフェクトした上で個体に投与することもできる。このため、CYP1B1を発現する筋芽細胞は、抗CYP1B1免疫応答を生じさせるためのCYP1B1のインビボでの源として働く。
【0109】
抗CYP1B1免疫応答を生じさせるための本明細書に記載の方法は、抗CYP1B1免疫応答の発生に付随する、テロメラーゼ、癌胎児性抗原(CEA)またはp53などの1つまたは複数の追加的な癌関連抗原に対する免疫応答を生じさせることも含みうる。このような免疫応答は、第1のポリペプチドが本明細書に記載のCYP1B1含有ポリペプチドであって第2のものが癌関連抗原の全体または一部を含むポリペプチドである、2つのポリペプチドをコードする核酸の投与を含む、さまざまな方法によって活性化することができる。
【0110】
いくつかの態様では、構築物によってコードされるポリペプチドは、間接的なアプローチを介して、免疫応答を増強するため、または自己寛容を遮断するために用いることができる。核酸およびそれらによってコードされるポリペプチドは、局所的または全身的な炎症反応をもたらすと考えられる免疫刺激物質を含みうる。ペプチドエピトープをタンパク質に挿入し、結果として生じるタンパク質を免疫原性にする一例は、国際公開公報第95/05849号に記載があり、これは参照として本明細書に組み入れられる。
【0111】
核酸およびコードされるポリペプチドの効果は、初回刺激(例えば、プラスミド、ウイルスベクターまたは細菌ベクターまたはポリペプチド)の後に、免疫応答の増強を助けるために同じ物質による追加刺激を行うことによって増強させることが可能である(例えば、国際公開公報第98/56919号を参照)。
【0112】
核酸または本発明の核酸によってコードされるポリペプチドは、マウス腫瘍モデルにおける腫瘍の発達を観測するために用いることができる(表2)。マウスに本発明の核酸を含む50μg〜100μgのプラスミドによる免疫処置を1〜3回、3週間間隔で行う。プラスミドは微粒子もしくは他の送達媒体中にある形で送達することができ、または裸のDNAとして送達してもよい。その後に腫瘍細胞をマウスに移植する。免疫処置後の何らかの時点(個々の腫瘍によって異なる)で、腫瘍の増殖または活性を初期の増殖または活性と比べて評価することにより、腫瘍の発達を観測する。腫瘍の増殖が緩徐化もしくは抑制されたこと、または活性が低下したことを判定する。CYP1B1をコードする核酸による免疫処置の前に腫瘍を投与することにより、核酸製剤の治療効果を示すための実験を行うこともできる。
【0113】
〔表2〕 腫瘍/株の組み合わせ

【0114】
本発明は、第1の種に属する哺乳動物における免疫応答を誘発する方法であって、哺乳動物、例えばヒトまたはマウスに対して、MHCクラスIもしくはクラスII分子または免疫グロブリン受容体と結合するCYP1B1ポリペプチドまたはその一部を含むポリペプチドをコードする核酸を投与することによる方法も含む。これらの方法において、CYP1B1ポリペプチドまたはそのMHC結合部分もしくは免疫グロブリン結合部分は、第2の種、例えばマウスまたはラットなどの齧歯動物の天然のCYP1B1ポリペプチドの配列と同一である。本方法に用いる核酸は、選択的には、本発明の核酸、例えば天然型のCYP1B1転写物の非翻訳領域(UTR)に認められる配列を欠いた核酸、または変異、欠失、挿入もしくは転位を有するCYP1B1をコードする核酸でありうる。核酸は裸の状態で、または本明細書に記載の任意の送達媒体を介して、例えば微粒子またはポリマー性ヒドロゲルマトリックス中にある形で、投与することができる。上記の第1の種に対する核酸の送達が、第1の種におけるヘテロクリティック免疫応答、例えば、第1の種によって内因性に産生されるCYP1B1配列に向けられた免疫応答の発生を引き起こしてもよい。このため、本方法は第1の種におけるT細胞寛容を遮断し、CYP1B1 T細胞応答を誘導するために用いうると考えられる。これらの方法において、哺乳動物は癌などの細胞増殖性疾患を有する、またはそれを発症する危険性のあるものでよい。
【0115】
核酸の送達
本発明の組成物を、さまざまな癌に対する免疫応答を誘発させることを意図したペプチドを発現する核酸を適切な細胞内に送達するために用いてもよい。遺伝子送達の利点の一つは、抗原性ペプチドが、免疫原性ペプチドが結合するMHC分子との相互作用が動態的に有利である標的細胞自体の内部で産生されるという点である。これは、抗原性ペプチドをMHC分子に特異的に指向させない標準的なワクチンプロトコールとは対照的である。または、ポリペプチドを分泌させて、B細胞などの免疫細胞の活性化をもたらすことも可能である。
【0116】
本発明の核酸は、標準的な方法、例えばドネリー(Donnelly)ら、J. Imm. Methods 176:145、1994、およびビチエロ(Vitiello)ら、J. Clin. Invest. 95:341、1995に記載された方法を用いて投与することができる。本発明の核酸は、当技術分野で知られた任意の様式で、例えば、筋肉内、静脈内、動脈内、皮内、腹腔内、鼻腔内、膣内、直腸内もしくは皮下に対象に注射することができ、またはそれらを例えば溶液もしくは微粒子を含む粉末の吸入によって消化管、粘膜もしくは気道に導入することができる。または、本発明の組成物を皮膚に適用してもよく、インビトロまたはインビボで細胞または組織への電気穿孔を行ってもよい。または、本発明の組成物を、細胞または組織への導入をもたらす超音波によって投与してもよい。さらに、本発明の組成物を遺伝子銃によって投与してもよい。本発明のポリペプチド、類似体または核酸の持続的で連続的な放出を、例えば浸透ポンプを用いることによって得ることもできる。投与は局所的(例えば、筋肉内、または腫瘍もしくは他の感染部位に対して)または全身的のいずれも可能である。
【0117】
核酸は、生理食塩液、脂質、リポソーム、微粒子もしくはナノスフェアなどの薬学的に許容される担体中にある形で、ヒドロゲルとして、コロイド懸濁液として、または粉末として輸送することができる。それらは裸のままでもよく、または送達媒体および/またはトランスフェクション促進物質と会合もしくは複合体を形成させた上で、脂質、リポソーム、ミクロスフェア、微粒子、マイクロカプセル、金、ナノ粒子、ポリマー、濃縮剤、多糖類、ポリアミノ酸、デンドリマー、サポニン、吸着増強物質、またはストレプトリシンOもしくは脂肪酸などの膜透過化物質といった、当技術分野で知られた送達システムを用いて送達することができる。ヒドロゲルネットワークの例は、2001年2月20日に提出された米国特許出願第60/270,256号に記載されている。
【0118】
核酸は、核酸の核への移動を促す核移行シグナルを含みうる。例えば、核酸は、転写因子などのDNA結合タンパク質が結合するヌクレオチド配列を含むことが可能である。もう1つの例において、ペプチドを主体とする核移行シグナルを本発明の核酸とともに提供し、それによって核酸の核への移動を促すこともできる。有用なシグナルの例には、hnRNA配列およびSV40核移行シグナルが含まれる。核移行ペプチド配列は、例えば、核酸と混合すること、核酸と結合させること、またはリポソームもしくは微粒子などの送達媒体中に組み入れることが可能である。
【0119】
その他の標準的な送達方法、例えば微粒子銃による導入またはエクスビボ治療を用いることもできる。エクスビボ治療では、例えば抗原提示細胞(APC)、樹状細胞、末梢血単核球または骨髄細胞を罹患動物または適当なドナーから採取し、免疫原性組成物によってエクスビボで活性化した上で、哺乳動物に戻すことができる。
【0120】
米国特許第5,783,567号および2000年6月2日に提出された米国特許出願第60/208,830号に記載されたものを含む微粒子を、DNA、RNAまたはポリペプチドなどの高分子を細胞に送達するための媒体として用いることができる。このため、それらは本明細書に記載の核酸を、選択的には免疫刺激物質とともに、個体の細胞に送達するために有用と思われる。微粒子は、ポリマーマトリックス中に抱埋された高分子、またはポリマーのシェル内に封入された高分子を含む。微粒子は、例えば封入されたDNAを非分解状態に維持することにより、高分子の完全性を維持するように作用する。微粒子を、高分子のパルス送達のために、および特定の部位またはマクロファージ、単球もしくは樹状細胞などの特定の細胞もしくは細胞集団に送達するために用いることもできる。
【0121】
ポリマーマトリックスは、乳酸グリコール酸共重合体、デンプン、ゼラチンまたはキチンなどの生分解性コポリマーでありうる。微粒子を特に、対象の食細胞へのDNA分子の送達を最大にするために用いることができる。または、微粒子を組織に注射または移植し、そこで沈着物を形成させることもできる。沈着物が分解するにつれて、核酸が経時的に徐々に放出されて、遊離DNAとして近傍の細胞(APCを含む)に取り込まれる。
【0122】
微粒子は、マチオヴィッツ(Mathiowitz)ら(国際公開公報第95/24929号)ならびに米国特許第5,817,343号および第5,922,253号による記載のようにして製剤化することができ、これらは参照として本明細書に組み入れられる。
【0123】
本発明の核酸は、当技術分野で周知の技法を用いて、脂質、デンドリマーまたはリポソームを介して対象に投与することができる。例えば、免疫原性ポリペプチドまたは免疫原性ペプチドをコードする核酸を有するリポソームは、インビボでCTL反応を誘発することが知られている(Reddyら、J. Immunol. 148:1585、1992;Collinsら、J. Immunol. 148:3336〜3341、1992;Friesら、Proc. Natl. Acad. Sci. USA 89:358、1992;Nabelら、Proc. Natl. Acad. Sci. (USA) 89:5157、1992)。
【0124】
本発明の核酸は、コレステロールおよびクイルA(サポニン)を混合した際にまたはサポニン単独で自然に形成される大きさが30〜40nmの陰性荷電ケージ様構造である、免疫刺激複合体(ISCOMS)を用いて投与することができる。本発明の核酸をISCOMSととともに投与することもでき、または個別に投与することもできる。
【0125】
トキソプラズマ症およびエプスタイン-バーウイルス誘発腫瘍を含むさまざまな感染症の実験モデルで、ISCOMSを抗原の送達媒体として用いて、防御免疫が誘発されている(Mowatら、Immunology Today 12:383〜385、1991)。精製した完全なHIV-1-IIIB gp 160エンベロープ糖タンパク質またはインフルエンザ血球凝集素のいずれかを抗原として、ISCOMS中に封入された抗原の用量が1Fg程度の少なさでもクラスI媒介性CTL反応が生じることが明らかになっている(Takahashiら(1990)Nature 344:873)。
【0126】
体重1kg当たり1回の投与につきDNA約1μg〜200μgの用量を投与することが予想される。罹患動物が成人である場合、ワクチンレジメンは例えば、微粒子または他の送達媒体中にある形で送達する場合は10μg〜1000μgのDNAの筋肉内、静脈内、経口もしくは皮下投与、または裸のDNAの場合は約1μg〜18μgの筋肉内もしくは皮内への1回〜12回の反復投与を含むことができる。当然ながら、医学分野において周知のように、所定の罹患動物(patient)に対する用量は罹患動物の体格、体表面積、年齢、性別、全般的健康状態;投与の時間および経路;投与する特定の化合物;ならびに同時投与するその他の薬剤を含む、多くの要因に依存する。至適用量の決定は、当業者の薬理学者の能力の範囲内に十分に含まれる。
【0127】
核酸に対する免疫系の応答の測定
本明細書に記載の核酸が免疫応答を誘発する能力は、免疫応答を測定するための当技術分野で周知の方法を用いてアッセイすることができる。例えば、細胞傷害性T細胞の生成は、標準的な51Cr放出アッセイにおいて、細胞内サイトカインの発現の測定により、またはMHCテトラマーの使用により、示すことができる。ELISAまたはELISPOTなどの標準的なアッセイを用いて、T細胞活性化に起因するサイトカインプロファイルを測定することもできる。3H-チミジン取り込みおよび当技術分野で知られた他のアッセイなどのアッセイを用いて、T細胞増殖を測定することもできる。T細胞応答性の評価にはDTH反応の測定を用いることができる。B細胞応答はELISAなどの当技術分野で知られたアッセイを用いて測定可能である。
【0128】
その他の方法、例えばデジタル画像化ならびに細胞診、コルポスコピーおよび組織学的な評価を用いて、さまざまな種類の増殖性疾患または癌に対する免疫原性ペプチドおよび免疫原ペプチドをコードする核酸の効果を評価することもできる。
【0129】
以下は本発明の実施に関する実施例である。これらはいかなる形でも本発明の範囲を限定するものとみなされるべきではない。
【0130】
実施例
実施例1 ヒトCYP1B1 cDNA構築物の作製
ヒトCYP1B1(配列番号:2)およびCYP1B1-delta 3(配列番号:38)をコードするcDNAのそれぞれを、2つの異なるプラスミド発現ベクター、pCDNA-3およびp3K中にクローニングした。これらのCYP1B1核酸構築物は543アミノ酸のタンパク質をコードするcDNAを含むが、CYP1B1のすべての非翻訳領域を欠く。CYP1B1-delta 3構築物は、配列番号:2の野生型CYP1B1と比較して、アミノ酸位置57、61および365(アミノ酸57:TrpがCysに変化;アミノ酸61:GlyがGluに変化;アミノ酸365:GlyがTrpに変化;配列番号:38を参照)に3つの置換を含む。発現ベクターpcDNA3-CYPHu1B1、p3k-CYPHu1B1、pcDNA3-CYPHu1B1-delta 3(pcDNAhulB1d3)、p3K-CYPHu1B1-delta 3(p3khu1B1d3)および対照ベクターpcDNA3およびp3Kを、キアゲン(Qiagen)カラムを製造者(Qiagen、Chatsworth、CA)の指示に従って用いて、形質転換大腸菌から精製した。各構築物の配列を決定し、求める変化が導入されたことを確認した。
【0131】
このほかのCYP1B1構築物は以下の通りに作製した。PCRを用いてpcDNA3Hu1B1d5の骨格に欠失を導入した。pcDNA3Hu1B1d5は、5つのアミノ酸:W57C、G61E、G365W、P379LおよびE387Kが置換されたヒトCYP1B1タンパク質をコードする。上流プライマーには、制限部位および以後のコード配列に対してインフレームとなったATGコドンを含めた。下流プライマーには、適切なCYP1B1コード配列に続いて、終止コドンおよびクローニング用の制限部位を含めた。pcDNA3Hu1B1-deltaPPGPは、アミノ酸51〜54(PPGP)が欠失している点を除いてCYP1B1タンパク質の全体を含む。pcDNA3Hu1B1-F1R1にコードされるタンパク質はCYP1B1の最初の60アミノ酸の欠失を含み、pcDNA3Hu1B1-F1R2タンパク質は同じN末端欠失に加えてCYP1B1タンパク質の最後の82アミノ酸の欠失を含む。pcDNA3Hu1B1-F2R1タンパク質はCYP1B1の最初の171アミノ酸の欠失を含み、pcDNA3Hu1B1-F2R2にコードされるタンパク質は同じN末端欠失に加えてCYP1B1の最後の82アミノ酸の欠失を含む。pcDNA3Hu1B1-F3R1タンパク質はCYP1B1の最初の292アミノ酸の欠失を含み、pcDNA3Hu1B1-F3R2は同じN末端欠失に加えてCYP1B1タンパク質の82アミノ酸の欠失を含む(図3)。二重PEP-Padreタンパク質を図3に配列番号:41として示している。
【0132】
HLA-A2/KbトランスジェニックC57Bl/6マウス系統はハイブリッド型MHCクラスI分子を産生する。このハイブリッド分子において、ペプチド結合ドメイン(α1およびα2)はヒトクラスI分子HLA-A*0201に由来し、T細胞上のCD8補助受容体と相互作用するドメイン(α3)はマウスクラスI分子Kbに由来する。この結果生じるマウスは、HLA-A2拘束性エピトープを含む免疫原に反応する能力があり、ヒト標的細胞発現HLA-A2を発現するヒト標的細胞を認識するマウス細胞傷害性T細胞(CTL)を生成する能力がある(Vitielloら、J. Exp. Med. 173:1007、1991)。
【0133】
以下の実施例に述べる実験により、以下のことが示された:1)CYP1B1をコードするプラスミドが発現される;2)CYP1B1タンパク質が翻訳される;3)コードされるタンパク質がインビボでプロセシングされ、ペプチドがクラスI受容体上に提示される;4)T細胞レパートリーはクラスIlペプチド複合体を認識しうる細胞を含む。
【0134】
実施例2 野生型CYP1B1をコードするDNA発現ベクターによるマウスの免疫処置によりインビボでHLA-A2トランスジェニックマウスにおけるT細胞免疫が誘発される
ヒトのクラスI分子HLA-A2.1を発現する6週齡〜8週齡の雌性トランスジェニックマウスの少なくとも3匹の群に対して、pcDNA3-CYPHu1B1またはpcDNA3プラスミドベクターによる免疫処置を行った。それぞれの前頸骨筋に100μgのプラスミドDNAを注射した。追加免疫処置は初回免疫処置の14日後に行った。2回目の免疫処置の12日後に脾細胞を採取した。
【0135】
2〜3匹のマウスから10%ウシ胎仔血清および抗生物質を加えたRPMI-1640培地中に脾臓の単細胞懸濁液を調製した。4℃の0.83%NH4Cl中で細胞を10分間インキュベートすることによって赤血球を溶解させた。洗浄後に細胞をCD8+ T細胞濃縮カラムで製造者のプロトコールに従って分離した(マウスT細胞CD8サブセットカラムキット、R&D System、Minneapolis、MN)。CD8+ T細胞に対して特異的な個々のヒトCYP1B1エピトープの検出には、マウスインターフェロン-γ(IFN-g)酵素結合イムノスポット(ELISpot)アッセイを用いた(マウスIFN-g ELISpot、R&D Systems)。簡潔に述べると、1×105個の精製脾細胞を、10μモルの合成HLA-A2. 1結合ペプチドFLDPRPLTV(配列番号:22)による前パルス刺激を加えるかまたはヒトCYP1B1発現ワクシニアベクターを14時間感染させた同じ数の同系EL-4A2/Kb標的細胞とともに、インビトロでインキュベートした。24時間共培養した後に、ELIspotアッセイを製造者の指示に従って行うことにより(マウスIFN-g ELISpot、R&D Systems)、T細胞活性を測定した。CYP1B1応答性T細胞の頻度を表すスポットを、自動ELISpot読み取りシステムを用いて算定した(図4)。
【0136】
実施例3 CYP1B1変種cDNA構築物はインビボでHLA-A2トランスジェニックマウスにおけるT細胞免疫を誘発する
ヒトのクラスI分子HLA-A2.1を発現する6〜8週齡の雌性トランスジェニックマウスの少なくとも3匹の群に対して、p3K-CYPHu1B1-delta 3またはp3Kプラスミドベクターによる免疫処置を行った。それぞれの前頸骨筋に100μgのプラスミドDNAを注射した。追加免疫処置は初回免疫処置の14日後に行った。2回目の免疫処置の12日後に脾細胞を採取した。
【0137】
2〜3匹のマウスから10%ウシ胎仔血清および抗生物質を加えたRPMI-1640培地中に脾臓の単細胞懸濁液を調製した。4℃の0.83%NH4Cl中で細胞を10分間インキュベートすることによって赤血球を溶解させた。洗浄後に細胞をCD8+ T細胞濃縮カラムで製造者のプロトコールに従って分離した(マウスT細胞CD8サブセットカラムキット、R&D System、Minneapolis、MN)。CD8+ T細胞に対して特異的な個々のヒトCYP1B1エピトープの検出には、マウスインターフェロン-γ(IFN-g)酵素結合イムノスポット(ELISpot)アッセイを用いた(マウスIFN-g ELISpot、R&D Systems)。簡潔に述べると、1×105個の精製脾細胞を、10μモルの合成HLA-A2. 1結合ペプチドFLDPRPLTV(配列番号:22)による前パルス刺激を加えるかまたはヒト1B1発現ワクシニアベクターを14時間感染させた同じ数の同系EL-4A2/Kb標的細胞とともに、インビトロでインキュベートした。24時間共培養した後に、ELIspotアッセイを製造者の指示に従って行うことにより(マウスIFN-g ELISpot、R&D Systems)、T細胞活性を測定した。CYP1B1応答性T細胞の頻度を表すスポットを、自動ELISpot読み取りシステムを用いて算定した(図5)。
【0138】
実施例4 ウエスタンブロット分析による抗CYP1B1抗体の検出
CYP1B1をコードする核酸による免疫処置を行った動物の血清を、以下の通りに、抗CYP1B1抗体の存在に関して検査することができる。30ugのミクロソームタンパク質を含むヒトCYP1B1ミクロソーム(Gentest、Woburn MA)をSDSサンプルバッファー(Boston Bioproducts、Ashland、MA)中で煮沸し、10%Tris-HClアクリルアミドゲル(Bio-Rad、Chicago、Ill)上で電気泳動により分離する。このゲルのエレクトロブロッティングをニトロセルロース(Bio-Rad)に対して行う。非特異的なタンパク質結合部位は、ニトロセルロース膜を5%脱脂乳とともにTBST緩衝液(50mM Tris[pH 8]、150mM NaClおよび0.05%Tween-20)中で室温で60分間インキュベートすることによってブロックする。ニトロセルロースフィルターを、種々の希釈度の免疫マウス被験血清(例えば、CYP1B1ペプチドまたは核酸による免疫処置を行ったマウスからのもの)、またはマウス抗ヒトCYP1B1 443〜457ペプチド5D3mAbハイブリドーマ培養上清をTBST-5%脱脂乳で1:40〜1:3000に希釈したものとともにインキュベートする。次に膜を、ヤギ抗マウス西洋ワサビペルオキシダーゼ抗体(Santa Cruz Biotechnology, Santa Cruz、CA)をTBST 5%脱脂乳で1:2000に希釈したものとともにインキュベートする。各抗体とのインキュベーション後に膜をTBST中で10分間ずつ5回洗浄する。特異的タンパク質バンドの存在を示すために膜をECL試薬(Amersham Pharmacia Biotech、Uppsala、Sweden)で現像する。
【0139】
実施例5 CYP1B1核酸構築物の電気穿孔
p3khu1B1d3 DNAによる単回の免疫処置後にA2/Kbトランスジェニックマウスで誘導されたT細胞応答に対する電気穿孔の効果を検討した。マウスにはp3khu1B1d3またはp3K対照ベクターを注射するか無処置とした。その後に治療群を電気穿孔を行うものとそれ以上の処置を行わないものに分けた。電気穿孔により、CYP190ペプチドによるパルス刺激を加えた場合も天然のCYP1B1タンパク質を発現する組換えワクシニアウイルスを感染させた場合も、EL4-A2/Kb細胞に対するT細胞応答性の頻度は有意に増加した。
【0140】
図6は、HLA-A2/KbトランスジェニックマウスにおけるT細胞応答性が電気穿孔によって増強されることを示している。対をなすマウスの群に対してp3kHu1B1d3DNA、p3K対照DNAによる単回の免疫処置を行った上で、一方の群には電気穿孔を行い(++)、他方には処置を行わなかった。直接的なIFN-γELISpotアッセイによるCD8+ T濃縮脾細胞の検査を、ヒトペプチドCYP190によるパルス刺激を加えた(CYP190)または処置を行わない(無処置)EL4-A2/Kb細胞に対して行った。抗原特異的T細胞の頻度はスポット形成細胞/CD8+ T細胞10e6個として報告する。
【0141】
6〜8週齡のHLA-A2/Kbトランスジェニック雌性マウスを用いた。注射用のプラスミドDNAは、エンドトキシン非含有プラスミド精製キットを製造者の指示に従って用いて作製した(QIAGEN Inc.、Chatsworth、CA)。25μlを各肢の前頸骨筋に注射して計100μgのDNAを投与した。電気穿孔は麻酔したマウスに対してその直後に、BTXニードルアレイ(Model 532)をDNA注射部位の範囲に筋肉内挿入し、ElectoSquarePorator Model T820(Genetronics)によりパルス(100V、パルス長20msec×8回)を与えることによって行った。マウスに対する免疫処置は1回(1群当たりマウス2匹)とし、12日後にアッセイした。CYP1B1に対するマウスCD8+ T細胞の応答は、市販のIFN-γ ELISPOTアッセイキットを製造者の推奨に従って用いるIFN-γ ELISPOTによって分析した(R&D Systems、Minneapolis、MN)。エフェクター細胞としては、プール脾細胞をCD8+ T細胞(マウスT細胞CD8サブセットカラムキット;R&D Systems)に関して濃縮した上で1×105個/ウェルで2つずつプレーティングした。10ug/mlペプチドによるパルス刺激を加えるかプレーティングの前に組換えワクシニアウイルスもしくは野生型ワクシニア(MOI、10)に16〜18時間感染させた1×105個のEL4-A2/Kb細胞/ウェルによってT細胞を刺激した。プレートを24時間インキュベートし、現像した上で自動画像解析により解析した(Zeilnet Consulting, Inc.、New York、NY)。抗原特異的T細胞の頻度はスポット形成細胞(SFC)/CD8+ T細胞1×106個として報告する。マウス胸腺腫細胞株EL4はATCC(Manassas、VA)から入手し、pSV2neoベクター中に挿入したHLA-A2/KBMD cDNAをトランスフェクトした。ヒトCYP1B1ペプチドCYP190(FLDPRPLTV;配列番号:22)は、ハーバード大学医学部バイオポリマー研究所(Harvard Medical School Biopolymers Laboratory)(Boston、MA)から購入した。
【0142】
実施例6 CYP1B1核酸構築物を含むヒドロゲルおよび微粒子
種々の送達系によるCYP1B1d3DNAの送達により、HLA-A2/Kbトランスジェニックマウスにおいて特異的免疫応答を誘発することができる。HLA-A2/Kbトランスジェニックマウスを用いて、ヒドロゲル中にある形で送達されたDNAがインビボで免疫応答を生じさせうるか否かを評価した。変異型CYP1B1 cDNA(pcDNA3Hu1B1d3)をコードするDNA構築物を含む2%ポリマーネットワーク、ヒドロゲル配合物または微粒子の3回の投与により、HLA-A2拘束性CYP190ペプチドによるパルス刺激を加えるか完全長の天然CYP1B1タンパク質をコードする組換えワクシニアウイルスを感染させたEL4-A2/Kb細胞に対する特異的応答性を有する脾臓CD8+ T細胞が高頻度に誘発された。無処置のまま、または野生型ワクシニアウイルスを感染させたEL4-A2/Kb細胞に対する有意な応答性は観察されなかった。配合ベクター(pcDNA 3)DNAによる免疫処置を行ったマウスでは応答は誘発されなかった。
【0143】
図7は、CY1B1 DNA/ヒドロゲル配合物の免疫処置による、A2/KbトランスジェニックマウスにおけるCYP1B1特異的T細胞応答の誘導を示している。HLA-A2トランスジェニックマウスに対して、PLG微粒子内または2%ポリマーネットワークヒドロゲル中にある状態で送達されるpcDNA3DNAまたはpcDNA3Hu1B1d3による免疫処置を3回行った。直接的なIFN-γELISpotアッセイによるCD8+ T濃縮脾細胞の検査を、ヒトペプチドCYP190によるパルス刺激を加える(CYP190)かCYP1B1をコードするワクシニアウイルスを感染させた(vacHu1B1)EL4-A2/Kb細胞に対して行った。処置を行わない(無処置)、ならびに野生型ワクシニアを感染させたEL4-A2/Kb細胞(Vac wt)を対照として含めた。抗原特異的T細胞の頻度はスポット形成細胞/CD8+ T細胞1×106個として報告する。
【0144】
マウス6〜8週齡の雌性マウスをすべての実験に用いた。注射用のプラスミドDNAは、エンドトキシン非含有プラスミド精製キットを製造者の指示に従って用いて作製した(QIAGEN Inc.、Chatsworth、CA)。25μlを各肢の前頸骨筋に注射して計100μgのDNAを投与した。プラスミドDNAは微粒子内に封入するか本明細書に記載のポリマーネットワークヒドロゲル中に配合して免疫処置に用いた。マウスに対する免疫処置は2週間の間隔をおいて3回行い(各群当たりマウス2匹)、最後の免疫処置から12日後にアッセイした。微粒子は3箇所の筋肉:脛骨筋、腓腹筋(ヒラメ筋)および大腿筋に、すなわちマウス1匹当たり6つの部位に投与した。ポリマーネットワークヒドロゲルは100ug DNA/100ulとして1つの脛骨筋当たり50ulを注入した。CYP1B1に対するマウスCD8+ T細胞の応答は、市販のIFN-γ ELISPOTアッセイキットを製造者の推奨に従って用いるIFN-γ ELISPOTによって分析した(R&D Systems、Minneapolis、MN)。エフェクター細胞として、プール脾細胞をCD8+ T細胞(マウスT細胞CD8サブセットカラムキット;R&D Systems)に関して濃縮した上で1×105個/ウェルで2つずつプレーティングした。10ug/mlペプチドによるパルス刺激を加えるかプレーティングの前に組換えワクシニアウイルスもしくは野生型ワクシニア(MOI、10)に16〜18時間感染させた1×105個のEL4-A2/Kb細胞/ウェルによってT細胞を刺激した。プレートを24時間インキュベートし、現像した上で自動画像解析により解析した(Zeilnet Consulting, Inc.、New York、NY)。抗原特異的T細胞の頻度はスポット形成細胞(SFC)/CD8+ T細胞1×106個として報告する。
【0145】
実施例7 CYP1B1核酸構築物を含む微粒子
HLA-A2/Kbトランスジェニックマウスを用いて、PLG微粒子内に封入したDNAがインビボで免疫応答を生じさせうるか否かを評価した。変異型CYP1B1 cDNA(p3khu1B1d3;ZYC300)をコードするDNA構築物を含む微粒子の2回の投与により、完全長の天然huCYP1B1 cDNAをコードする組換えワクシニアウイルスを感染させたEL4-A2/Kb細胞に対する特異的応答性を有するT細胞が誘発された。野生型ワクシニアウイルスを感染させたEL4-A2/Kb細胞に対する有意な応答性は観察されなかった。免疫処置を行わなかったマウスおよびベクター対照による免疫処置を行ったマウスは、いずれの刺激物質に対してもIFN-γ応答を示さなかった。
【0146】
有効な抗腫瘍免疫の誘導には、自己抗原に対するエフェクターT細胞レパートリーの増大が伴う。このトランスジェニックマウスモデルにおけるCYP1B1の治療的腫瘍抗原としての有効性を示唆するデータは、内因性のマウスクラスI MHCと関連づけられたマウスCYP1B1自己決定基に対するT細胞応答が免疫処置後に誘発されることを示すものと考えられる。マウスおよびヒトのCYP1B1にはアミノ酸レベルでかなりの配列相同性がある。以前に記載されたペプチド結合アルゴリズムを用いて、H-Kb結合性CYP1B1ペプチドと予想されるものがマウス特異的自己応答の誘導を検討するための反応物として同定された。このCYP1B1残基77〜84(LARRYGDV;配列番号:42)はヒトおよびマウスのオルソログの間で共通である。このペプチドをヒトCYP 190 HLA-A2エピトープとともに含め、ヒトCYP1B1 DNAを含む微粒子による免疫処置を行ったマウスにおいて応答が検出されうるかを検討した。示した通り、このペプチドに対する明らかな応答を検出できた。
【0147】
図8は、CYP1B1をコードする封入DNAによるマウスの免疫処置により、トランスジェニックマウスにおけるCYP1B1特異的な免疫応答が誘発されることを示している。HLA-A2/Kbトランスジェニックマウスに対して、免疫処置を行わない(左のバー)か、またはp3khu1B1d3(右のバー)もしくはp3k対照(中央のバー)を含む微粒子による免疫処置を2回行った。直接ELISpotアッセイにより、CD8+濃縮脾細胞をEL4-A2/Kb腫瘍細胞に対する免疫応答に関して検査した。標的細胞にはHLA-A2ペプチドCYP190、ペプチドCYP77によるパルス刺激を加えるか、またはCYP1B1-ワクシニア(VacHulB1)もしくはワクシニア野生型対照(Vac Wt)を感染させた。
【0148】
HLA-A2/Kbトランスジェニックマウスに対しては、上記の通りに、PLG微粒子内に封入したエンドトキシン非含有プラスミドを計100μgのDNAとして各肢の前頸骨筋に投与する免疫処置を行った。マウスに対する免疫処置は2週間の間隔で行い、最後の免疫処置から12日後にアッセイした。CYP1B1に対するマウスCD8+ T細胞の応答はIFN-γELISpotアッセイによって分析した。エフェクター脾細胞をCD8+ T-細胞に関して濃縮し、1×105細胞/ウェルで2つずつプレーティングした。10μg/mlペプチドによるパルス刺激を加えるかプレーティングの前に組換えワクシニアウイルスもしくは野生型ワクシニア(MOI、10)に16〜18時間感染させた1×105個のEL4-A2/Kb細胞/ウェルによってT細胞を刺激した。抗原特異的T細胞の頻度はスポット形成細胞/CD8+ T細胞1×106個として報告する。ペプチドCYP77(LARRYGDV;配列番号:42)はヒトおよびマウスのCYP1B1 DNA配列で共通しており、これはマルチプルペプチドシステムズ(Multiple Peptide Systems)社(San Diego、CA)から購入した。
【0149】
実施例8 CYP1B1核酸構築物を注射したマウスにおけるMHCクラスII応答
pcDNA3-Hu1B1がプロセシングおよび提示がなされるタンパク質をコードするか否か、ならびに近交系マウスの多くの系統でMHCクラスII CD4+T細胞応答を誘発しうるか否かを評価するための実験を行った。クラスII CD4+T細胞応答は、CYP1B1タンパク質に由来する合成ペプチドを用いるエクスビボIFN-g Elispotアッセイによって検出した。
【0150】
3種類のマウス系統(C3H、C57/Bl6およびBalb/c)に対して100μgのpcDNA3-Hu1B1を注射した(筋肉内)。第14日にマウスに対して同じ用量のpcDNA3-Hu1B1の追加投与(筋肉内)を行った。第27日に脾臓を摘出し、CD4+T細胞が濃縮された脾細胞をペプチドによるパルス刺激を加えた同系APCに対して検討するIFN-g ELISPOTアッセイを行った。さらに、陰性対照とするために未感作マウスから単離したCD4+T細胞のスクリーニングも行った。CD4+T細胞のすべてを、一連の合成CYP1B1 30量体ペプチド(配列については表3参照)、PHA(陽性アッセイ対照)およびHBV-2(陰性アッセイ対照)に対してスクリーニングした。
【0151】
〔表3〕 合成CYP1B1ペプチド

【0152】
検討した3つのマウス系統のそれぞれで応答を誘発したCYP1B1ペプチドに関する上記のアッセイの結果を表4に示す。報告値はすべて、IFN-gスポット形成細胞(SFC)/CD4+T細胞1,000,000個を表している。
【0153】
〔表4〕C3H、C57/Bl6およびBalb/cマウスにおけるMHCクラスII応答

【0154】
実施例9 CYP1Bの欠失型構築物による免疫処置
CYP1B1の改変によって有効な免疫原が得られるか否かを検討するために、N末端およびC末端の部分を段階的に欠失させた一連のCYP1B1 cDNAを組換え法によって作製した。構築物はp3khu1B1d5骨格にクローニングしたため、この構築物にある5つの点変異を含む。発現を確認するために、構築物を293T細胞(ATCC)にトランスフェクトし、2日後にトランスフェクト細胞から可溶化物を作製した。可溶化物をSDS-PAGEによって分析し、移行させたゲルに対してウエスタン分析を行った。ブロットをCYP1B1に対して特異的なモノクローナル抗体によりプローブ検索し、化学発光により検出を増強した(ECL kit、Amersham)。この実験によるデータから、欠失型構築物から変異型CYP1B1タンパク質が発現されることが示された。
【0155】
これらの構築物がCYP1B1特異的T細胞を誘導したか否かを明らかにするために、HLA-A2/Kdトランスジェニックマウスに対して、切断型CYP1B1 cDNAをコードするDNA構築物による免疫処置を行った。図9は、切断型CYP1B1 DNAの免疫処置によってCYP1B1特異的T細胞が誘導されたことを示している。HLA-A2トランスジェニックマウスには免疫処置を行わないか、または変異型および/もしくは切断型のCYP1B1タンパク質をコードするcDNA構築物による免疫処置を行った。免疫処置マウスから得たCD8+ T濃縮脾細胞の検査を、直接IFN-g ELISpotアッセイにより、ヒトペプチドCYP190(CYP190)もしくはマウスペプチドCYP373(mCYP373)によるパルス刺激を加えるか、野生型ワクシニア(Vac wt)もしくはCYP1B1をコードするワクシニアウイルス (VacHu1B1)を感染させたEL4-A2/Kb細胞に対して行った。処置を行わない(無処置)、ならびに野生型ワクシニアを感染させたEL4-A2/Kb細胞(Vac wt)を対照として含めた。抗原特異的T細胞の頻度はスポット形成細胞(SFC)/CD8+ T細胞1×106個として報告する。指定の構築物をコードするDNAによりマウスの免疫処置を行った。
【0156】
マウス6〜8週齡の雌性マウスをすべての実験に用いた。注射用のプラスミドDNAは、エンドトキシン非含有プラスミド精製キットを製造者の指示に従って用いて作製した(QIAGEN Inc.、Chatsworth、CA)。25μlを各肢の前頸骨筋に注射して計100μgのDNAを投与した。マウスに対する免疫処置は第0日および第14日に行い(各群当たりマウス2匹)、最後の免疫処置から12日後にアッセイした。CYP1B1に対するマウスCD8+ T細胞の応答は、アッセイキットを製造者の推奨に従って用いるIFN-g ELISPOTによって分析した(R&D Systems、Minneapolis、MN)。エフェクター細胞として、プール脾細胞をCD8+ T細胞(マウスT細胞CD8サブセットカラムキット;R&D Systems)に関して濃縮した上で1×105個/ウェルで2つずつプレーティングした。10ug/mlペプチドによるパルス刺激を加えるかプレーティングの前に組換えワクシニアウイルスもしくは野生型ワクシニア(MOI、10)に16〜18時間感染させた1×105個のEL4-A2/Kb細胞/ウェルによってT細胞を刺激した。プレートを24時間インキュベートし、現像した上で自動画像解析により解析した(Zeilnet Consulting, Inc.、New York、NY)。抗原特異的T細胞の頻度はスポット形成細胞(SFC)/CD81細胞1×106個として報告する。マウスペプチドCYP373(SDQQQPNLPYV;配列番号:56)はマルチプルペプチドシステムズ(Multiple Peptide Systems)社(San Diego、CA)から購入した。
【0157】
その他の態様
本発明をその詳細な説明とともに述べてきたが、前記の説明は例示を意図したものであり、添付する特許請求の範囲を限定することを意図したものではない。その他の面、利点および修正は、以下の特許請求の範囲に含まれる。
【特許請求の範囲】
【請求項1】
MHCクラスIまたはクラスII分子と結合するペプチドを含むCYP1B1またはその一部を含むポリペプチドをコードするコード配列を含む転写ユニットを含む核酸であって、転写ユニットがコード配列と機能的に結合した翻訳抑制因子を含んでいない核酸。
【請求項2】
ポリペプチドがCYP1B1の長さ8アミノ酸の区域を含む、請求項1記載の核酸。
【請求項3】
ポリペプチドが配列番号:22を含む、請求項2記載の核酸。
【請求項4】
ポリペプチドの長さが100未満のアミノ酸である、請求項3記載の核酸。
【請求項5】
転写ユニットがRNA安定化配列を含む、請求項1記載の核酸。
【請求項6】
転写ユニットと機能的に結合した誘導性プロモーター配列を含む、請求項1記載の核酸。
【請求項7】
ポリペプチドがターゲティングシグナルを含む、請求項1記載の核酸。
【請求項8】
MHCクラスIまたはクラスII分子と結合するペプチドを含むCYP1B1またはその一部を含むポリペプチドをコードするコード配列を含む転写ユニットを含む核酸であって、転写ユニットが配列番号:18または配列番号:19の150個の連続したヌクレオチドを含んでいない核酸。
【請求項9】
転写ユニットが配列番号:3〜9または配列番号:15〜17の少なくとも1つを含まない、請求項8記載の核酸。
【請求項10】
転写ユニットが配列番号:3〜9および配列番号:15〜17をいずれも含まない、請求項9記載の核酸。
【請求項11】
転写ユニットが配列番号:18または配列番号:19の50個の連続したヌクレオチドを含まない、請求項8記載の核酸。
【請求項12】
転写ユニットが配列番号:18または配列番号:19の25個の連続したヌクレオチドを含まない、請求項8記載の核酸。
【請求項13】
転写ユニットが配列番号:18または配列番号:19の10個の連続したヌクレオチドを含まない、請求項8記載の核酸。
【請求項14】
転写ユニットがRNA安定化配列を含む、請求項8記載の核酸。
【請求項15】
誘導性プロモーター配列を含む、請求項8記載の核酸。
【請求項16】
転写ユニットが、コード配列と機能的に結合した翻訳調節配列を含む、請求項8記載の核酸。
【請求項17】
翻訳調節配列が鉄応答性配列である、請求項16記載の核酸。
【請求項18】
ポリペプチドがCYP1B1の長さ8アミノ酸の区域を含む、請求項8記載の核酸。
【請求項19】
ポリペプチドが配列番号:22を含む、請求項18記載の核酸。
【請求項20】
ポリペプチドの長さが100未満のアミノ酸である、請求項19記載の核酸。
【請求項21】
ポリペプチドがターゲティングシグナルを含む、請求項8記載の核酸。
【請求項22】
CYP1B1の第1および第2の区域を含むハイブリッド型ポリペプチドをコードする転写ユニットを含む核酸であって、第1および第2の区域が連続しているか、またはスペーサーアミノ酸もしくはスペーサーペプチドによって分離されており、第1および第2の区域のそれぞれの長さが少なくとも8アミノ酸であり、第1および第2の区域がCYP1B1の非連続的な部分である、核酸。
【請求項23】
ハイブリッド型ポリペプチドがCYP1B1の第3の区域をさらに含み、第3の区域の長さが少なくとも8アミノ酸であり、第1および第3の区域ならびに第2および第3の区域がCYP1B1の非連続的な部分である、請求項22記載の核酸。
【請求項24】
第1の区域が配列番号:22の配列を含む、請求項22記載の核酸。
【請求項25】
ポリペプチドターゲティングシグナルを含む、請求項22記載の核酸。
【請求項26】
請求項1記載の核酸および免疫刺激物質を含む組成物。
【請求項27】
免疫刺激物質が、長さ18〜30ヌクレオチドのCpG含有オリゴヌクレオチドである、請求項26記載の組成物。
【請求項28】
免疫刺激物質がIL-12またはIFN-γである、請求項26記載の組成物。
【請求項29】
免疫刺激物質が脂質、核酸、糖質または細菌性ポリペプチドである、請求項26記載の組成物。
【請求項30】
請求項1記載の核酸および免疫刺激物質をコードする核酸を含む組成物。
【請求項31】
免疫刺激物質がIL-12、IFN-γまたは細菌性ポリペプチドである、請求項30記載の組成物。
【請求項32】
請求項1記載の核酸および薬学的に許容される担体を含む治療的組成物。
【請求項33】
ポリマーマトリックスまたはシェルおよび請求項1記載の核酸を含む微粒子。
【請求項34】
ポリマーマトリックスまたはシェルおよび請求項8記載の核酸を含む微粒子。
【請求項35】
ポリマーマトリックスまたはシェルおよび請求項22記載の核酸を含む微粒子。
【請求項36】
請求項1記載の核酸を哺乳動物に投与する段階を含む、哺乳動物における免疫応答の誘導方法。
【請求項37】
哺乳動物が癌に罹患している、またはその危険性がある、請求項36記載の方法。
【請求項38】
核酸を皮下または筋肉内に投与する、請求項36記載の方法。
【請求項39】
免疫応答がCYP1B1に向けられる、請求項36記載の方法。
【請求項40】
免疫応答がT細胞応答である、請求項39記載の方法。
【請求項41】
免疫応答がB細胞応答である、請求項39記載の方法。
【請求項42】
請求項33記載の微粒子を哺乳動物に投与する段階を含む、哺乳動物における免疫応答の誘導方法。
【請求項43】
以下の段階を含む、免疫応答を生じさせる方法:
哺乳動物の腫瘍内でのCYP1B1の発現を検出する段階;および
請求項1記載の核酸を哺乳動物に投与する段階を含み、投与によって哺乳動物における抗CYP1B1免疫応答が誘発されるような方法。
【請求項44】
以下の段階を含む、哺乳動物における腫瘍増殖または腫瘍活性を低下させる方法:
腫瘍を有する哺乳動物を同定する段階;
請求項1記載の核酸を哺乳動物に投与する段階;および
核酸の投与後の腫瘍のサイズまたは活性の低下を検出する段階。
【請求項45】
核酸を投与する前に腫瘍内でのCYP1B1の発現を検出する段階をさらに含む、請求項44記載の方法。
【請求項46】
哺乳動物における免疫応答の誘導方法であって、MHCクラスIまたはクラスII分子と結合するCYP1B1またはその一部を含むポリペプチドをコードする核酸を哺乳動物に投与する段階を含み、該哺乳動物が第1の種に属し、CYP1B1またはその一部が第2の種の天然のCYP1B1ポリペプチドの配列と同一であるような方法。
【請求項47】
核酸を哺乳動物に投与する前に、該哺乳動物を腫瘍を有する同定する段階をさらに含む、請求項46記載の方法。
【請求項48】
核酸が請求項1記載の核酸である、請求項46記載の方法。
【請求項49】
核酸が請求項22記載の核酸である、請求項46記載の方法。
【請求項50】
第1の種がヒトである、請求項46記載の方法。
【請求項51】
第2の種が齧歯動物である、請求項50記載の方法。
【請求項52】
齧歯動物がラットまたはマウスである、請求項51記載の方法。
【請求項1】
MHCクラスIまたはクラスII分子と結合するペプチドを含むCYP1B1またはその一部を含むポリペプチドをコードするコード配列を含む転写ユニットを含む核酸であって、転写ユニットがコード配列と機能的に結合した翻訳抑制因子を含んでいない核酸。
【請求項2】
ポリペプチドがCYP1B1の長さ8アミノ酸の区域を含む、請求項1記載の核酸。
【請求項3】
ポリペプチドが配列番号:22を含む、請求項2記載の核酸。
【請求項4】
ポリペプチドの長さが100未満のアミノ酸である、請求項3記載の核酸。
【請求項5】
転写ユニットがRNA安定化配列を含む、請求項1記載の核酸。
【請求項6】
転写ユニットと機能的に結合した誘導性プロモーター配列を含む、請求項1記載の核酸。
【請求項7】
ポリペプチドがターゲティングシグナルを含む、請求項1記載の核酸。
【請求項8】
MHCクラスIまたはクラスII分子と結合するペプチドを含むCYP1B1またはその一部を含むポリペプチドをコードするコード配列を含む転写ユニットを含む核酸であって、転写ユニットが配列番号:18または配列番号:19の150個の連続したヌクレオチドを含んでいない核酸。
【請求項9】
転写ユニットが配列番号:3〜9または配列番号:15〜17の少なくとも1つを含まない、請求項8記載の核酸。
【請求項10】
転写ユニットが配列番号:3〜9および配列番号:15〜17をいずれも含まない、請求項9記載の核酸。
【請求項11】
転写ユニットが配列番号:18または配列番号:19の50個の連続したヌクレオチドを含まない、請求項8記載の核酸。
【請求項12】
転写ユニットが配列番号:18または配列番号:19の25個の連続したヌクレオチドを含まない、請求項8記載の核酸。
【請求項13】
転写ユニットが配列番号:18または配列番号:19の10個の連続したヌクレオチドを含まない、請求項8記載の核酸。
【請求項14】
転写ユニットがRNA安定化配列を含む、請求項8記載の核酸。
【請求項15】
誘導性プロモーター配列を含む、請求項8記載の核酸。
【請求項16】
転写ユニットが、コード配列と機能的に結合した翻訳調節配列を含む、請求項8記載の核酸。
【請求項17】
翻訳調節配列が鉄応答性配列である、請求項16記載の核酸。
【請求項18】
ポリペプチドがCYP1B1の長さ8アミノ酸の区域を含む、請求項8記載の核酸。
【請求項19】
ポリペプチドが配列番号:22を含む、請求項18記載の核酸。
【請求項20】
ポリペプチドの長さが100未満のアミノ酸である、請求項19記載の核酸。
【請求項21】
ポリペプチドがターゲティングシグナルを含む、請求項8記載の核酸。
【請求項22】
CYP1B1の第1および第2の区域を含むハイブリッド型ポリペプチドをコードする転写ユニットを含む核酸であって、第1および第2の区域が連続しているか、またはスペーサーアミノ酸もしくはスペーサーペプチドによって分離されており、第1および第2の区域のそれぞれの長さが少なくとも8アミノ酸であり、第1および第2の区域がCYP1B1の非連続的な部分である、核酸。
【請求項23】
ハイブリッド型ポリペプチドがCYP1B1の第3の区域をさらに含み、第3の区域の長さが少なくとも8アミノ酸であり、第1および第3の区域ならびに第2および第3の区域がCYP1B1の非連続的な部分である、請求項22記載の核酸。
【請求項24】
第1の区域が配列番号:22の配列を含む、請求項22記載の核酸。
【請求項25】
ポリペプチドターゲティングシグナルを含む、請求項22記載の核酸。
【請求項26】
請求項1記載の核酸および免疫刺激物質を含む組成物。
【請求項27】
免疫刺激物質が、長さ18〜30ヌクレオチドのCpG含有オリゴヌクレオチドである、請求項26記載の組成物。
【請求項28】
免疫刺激物質がIL-12またはIFN-γである、請求項26記載の組成物。
【請求項29】
免疫刺激物質が脂質、核酸、糖質または細菌性ポリペプチドである、請求項26記載の組成物。
【請求項30】
請求項1記載の核酸および免疫刺激物質をコードする核酸を含む組成物。
【請求項31】
免疫刺激物質がIL-12、IFN-γまたは細菌性ポリペプチドである、請求項30記載の組成物。
【請求項32】
請求項1記載の核酸および薬学的に許容される担体を含む治療的組成物。
【請求項33】
ポリマーマトリックスまたはシェルおよび請求項1記載の核酸を含む微粒子。
【請求項34】
ポリマーマトリックスまたはシェルおよび請求項8記載の核酸を含む微粒子。
【請求項35】
ポリマーマトリックスまたはシェルおよび請求項22記載の核酸を含む微粒子。
【請求項36】
請求項1記載の核酸を哺乳動物に投与する段階を含む、哺乳動物における免疫応答の誘導方法。
【請求項37】
哺乳動物が癌に罹患している、またはその危険性がある、請求項36記載の方法。
【請求項38】
核酸を皮下または筋肉内に投与する、請求項36記載の方法。
【請求項39】
免疫応答がCYP1B1に向けられる、請求項36記載の方法。
【請求項40】
免疫応答がT細胞応答である、請求項39記載の方法。
【請求項41】
免疫応答がB細胞応答である、請求項39記載の方法。
【請求項42】
請求項33記載の微粒子を哺乳動物に投与する段階を含む、哺乳動物における免疫応答の誘導方法。
【請求項43】
以下の段階を含む、免疫応答を生じさせる方法:
哺乳動物の腫瘍内でのCYP1B1の発現を検出する段階;および
請求項1記載の核酸を哺乳動物に投与する段階を含み、投与によって哺乳動物における抗CYP1B1免疫応答が誘発されるような方法。
【請求項44】
以下の段階を含む、哺乳動物における腫瘍増殖または腫瘍活性を低下させる方法:
腫瘍を有する哺乳動物を同定する段階;
請求項1記載の核酸を哺乳動物に投与する段階;および
核酸の投与後の腫瘍のサイズまたは活性の低下を検出する段階。
【請求項45】
核酸を投与する前に腫瘍内でのCYP1B1の発現を検出する段階をさらに含む、請求項44記載の方法。
【請求項46】
哺乳動物における免疫応答の誘導方法であって、MHCクラスIまたはクラスII分子と結合するCYP1B1またはその一部を含むポリペプチドをコードする核酸を哺乳動物に投与する段階を含み、該哺乳動物が第1の種に属し、CYP1B1またはその一部が第2の種の天然のCYP1B1ポリペプチドの配列と同一であるような方法。
【請求項47】
核酸を哺乳動物に投与する前に、該哺乳動物を腫瘍を有する同定する段階をさらに含む、請求項46記載の方法。
【請求項48】
核酸が請求項1記載の核酸である、請求項46記載の方法。
【請求項49】
核酸が請求項22記載の核酸である、請求項46記載の方法。
【請求項50】
第1の種がヒトである、請求項46記載の方法。
【請求項51】
第2の種が齧歯動物である、請求項50記載の方法。
【請求項52】
齧歯動物がラットまたはマウスである、請求項51記載の方法。
【図1A】


【図1B】


【図1C】


【図1D】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図1B】


【図1C】


【図1D】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2009−284908(P2009−284908A)
【公開日】平成21年12月10日(2009.12.10)
【国際特許分類】
【出願番号】特願2009−202171(P2009−202171)
【出願日】平成21年9月2日(2009.9.2)
【分割の表示】特願2008−112089(P2008−112089)の分割
【原出願日】平成13年10月31日(2001.10.31)
【出願人】(509054360)エーザイ コーポレーション オブ ノース アメリカ (5)
【Fターム(参考)】
【公開日】平成21年12月10日(2009.12.10)
【国際特許分類】
【出願日】平成21年9月2日(2009.9.2)
【分割の表示】特願2008−112089(P2008−112089)の分割
【原出願日】平成13年10月31日(2001.10.31)
【出願人】(509054360)エーザイ コーポレーション オブ ノース アメリカ (5)
【Fターム(参考)】
[ Back to top ]

