CYP3A遺伝子の多型検出用プローブ、多型検出方法、薬効評価方法及び多型検出用試薬キット
【課題】CYP3A遺伝子の多型を、高い感度で、簡便に検出できる多型検出用プローブを提供する。
【解決手段】(P1)特定の塩基を含む塩基長11〜50の配列であり、411番目の塩基に対応する塩基がシトシンである以外は上記特定配列と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、上記411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、又は(P1’)上記特定配列のうち401〜411番目の塩基を含む塩基長11〜50の配列であり、上記411番目の塩基に対応する塩基がシトシンである以外は上記特定配列と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズし、上記411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチドである、CYP3A遺伝子の多型を検出するための多型検出用プローブ。
【解決手段】(P1)特定の塩基を含む塩基長11〜50の配列であり、411番目の塩基に対応する塩基がシトシンである以外は上記特定配列と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、上記411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、又は(P1’)上記特定配列のうち401〜411番目の塩基を含む塩基長11〜50の配列であり、上記411番目の塩基に対応する塩基がシトシンである以外は上記特定配列と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズし、上記411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチドである、CYP3A遺伝子の多型を検出するための多型検出用プローブ。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、CYP3A遺伝子の多型検出用プローブ、多型検出方法、薬効評価方法及び多型検出用試薬キットに関する。
【背景技術】
【0002】
CYP(Cytochrome P450)は、ステロイドホルモン等の生体物質の代謝、薬物及び環境汚染物質等の酸化的解毒反応に関与する酸化酵素である。CYPは、多数の分子種を含むスーパーファミリーを形成しており、中でも、CYP3A4及びCYP3A5は、例えば、医薬品の代謝に影響する多型の存在が知られている(非特許文献1)。
【0003】
CYP3A5をコードするCYP3A5遺伝子は、ヒトの第7染色体に位置する。そして、例えば、CYP3A5遺伝子の部分配列(配列番号1)における401番目の塩基(r)について、アデニン(a)からグアニン(g)への変異(CYP3A5*3)等が知られている(非特許文献2等)。この塩基の変異により、スプライシング異常が生じ、CYP3A5の発現が大幅に低下する。
【0004】
また、CYP3A4をコードするCYP3A4遺伝子は、ヒトの第7染色体に位置する。そして、例えば、CYP3A4遺伝子の部分配列(配列番号2)における201番目の塩基(s)について、シトシン(c)からグアニン(g)への変異(CYP3A4*16)等が知られている(非特許文献2等)。この塩基の変異により、CYP3A4の185番目のトレオニン(T)は、セリン(S)に変異する。
【0005】
これらの変異は、例えば、免疫抑制剤タクロリムス等の薬物代謝との関連が報告されている(非特許文献2)。したがって、CYP3A遺伝子における、これらの多型を検出することにより、例えば、薬剤耐性をより高感度で予測できる可能性があると考えられている。
【0006】
現在、遺伝子の多型を検出する方法として、例えば、PCR(Polymerase Chain Reaction)−RFLP(Restriction Fragment Length Polymorphism)法等が知られている(非特許文献3)。この方法は、検出目的の塩基を含む部分を増幅するよう設計されたプライマーを用いてPCRを行い、前記特定塩基における変異の有無によって切断の有無が異なるような制限酵素で切断し、その後、電気泳動で切断されたかどうかを検出する方法である。
【0007】
また、変異を含む領域をPCR法で増幅した後、蛍光色素で標識された核酸プローブを用いて融解曲線分析を行い、融解曲線分析の結果に基づいて塩基配列の変異を解析する方法も知られている(特許文献1参照)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2002−119291号公報
【非特許文献】
【0009】
【非特許文献1】Human Mutation、2004年、Vol.23、Issue 1、p.100−108
【非特許文献2】Clin.Pharmacol.Ther.、2006年、Vol.80、p.179−191
【非特許文献3】Genet.Mol.Res.、2010年、第9巻、第1号、p.34−40
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかしながら、CYP3A遺伝子の変異には、前述の通り、種々の変異が存在している。PCR−RFLP法では、PCR反応後に増幅産物を取り出し、制限酵素処理を行う必要がある。このため、前記増幅産物が、次の反応系に混入する恐れがあり、これに起因して、偽陽性及び偽陰性の結果が得られてしまう場合がある。また、PCR終了後、制限酵素で処理を行い、その後さらに電気泳動を行うため、検出までに必要な時間も非常に長くなる場合がある。さらに、操作が複雑なため、自動化が困難である。これらの現状を踏まえ、CYP3A遺伝子の多型検出のために、さらなる技術開発が待ち望まれていた。
【0011】
本発明は、CYP3A遺伝子の多型を、高い感度で、簡便に検出することを可能にする多型検出用プローブ、これを用いる多型検出方法を提供することを課題とする。また、本発明は、前記多型検出方法を用いた薬効評価方法を提供することを課題とする。さらに本発明は、前記多型検出用プローブを用いた多型検出用試薬キットを提供することを課題とする。
【課題を解決するための手段】
【0012】
本発明は、以下の通りである。
<1> 下記P1、P1’、P2、P2’、P3、P3’、P4、P4’、P5及びP5’からなる群から選択される一種の蛍光標識オリゴヌクレオチドである、CYP3A遺伝子の多型を検出するための多型検出用プローブ;
(P1)配列番号1で示される配列のうち401番目〜411番目の塩基を含む塩基長11〜50の配列であり、配列番号1における411番目の塩基に対応する塩基がシトシンである以外は、配列番号1と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号1で示される配列のうち411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P1’)配列番号1で示される配列のうち401番目〜411番目の塩基を含む塩基長11〜50の配列であり、配列番号1における411番目の塩基に対応する塩基がシトシンである以外は、配列番号1と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズし、配列番号1で示される配列のうち411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P2)配列番号2で示される配列のうち201番目〜205番目の塩基を含む塩基長5〜50の配列であり、配列番号2における205番目の塩基に対応する塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち205番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P2’)配列番号2で示される配列のうち201番目〜205番目の塩基を含む塩基長5〜50の配列であり、配列番号2における205番目の塩基に対応する塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち205番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P3)配列番号2で示される配列のうち190番目〜201番目の塩基を含む塩基長12〜50の配列に相補的な配列であり、配列番号2における190番目の塩基に相補的な塩基がシトシンである以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち190番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P3’)配列番号2で示される配列のうち190番目〜201番目の塩基を含む塩基長12〜50の配列に相補的な配列であり、配列番号2における190番目の塩基に相補的な塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち190番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P4)配列番号2で示される配列のうち186番目〜201番目の塩基を含む塩基長16〜50の配列に相補的な配列であり、配列番号2における186番目の塩基に相補的な塩基がシトシンである以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち186番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P4’)配列番号2で示される配列のうち186番目〜201番目の塩基を含む塩基長16〜50の配列に相補的な配列であり、配列番号2における186番目の塩基に相補的な塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち186番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P5)配列番号3で示される配列のうち496番目〜501番目の塩基を含む塩基長6〜50の配列に相補的な配列であり、配列番号3における496番目の塩基に相補的な塩基がシトシンである以外は、配列番号3の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号3で示される配列のうち496番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P5’)配列番号3で示される配列のうち496番目〜501番目の塩基を含む塩基長6〜50の配列に相補的な配列であり、配列番号3における496番目の塩基に相補的な塩基がシトシンである以外は、配列番号3と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号3で示される配列のうち496番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド。
<2> 前記蛍光標識オリゴヌクレオチドが、配列番号1における401番目の塩基の多型を認識する、<1>に記載の多型検出用プローブ。
<3> 前記蛍光標識オリゴヌクレオチドが、前記蛍光色素で標識された前記塩基を3'末端から数えて1〜3番目に有する、<1>または<2>に記載の多型検出用プローブ。
<4> 前記蛍光標識オリゴヌクレオチドが、前記蛍光色素で標識された前記塩基を3'末端に有する、<1>〜<3>のいずれか一つに記載の多型検出用プローブ。
<5> 前記蛍光標識オリゴヌクレオチドが、標的配列にハイブリダイズしないときに蛍光を発し、且つ、前記標的配列にハイブリダイズしたときに蛍光強度が減少するか又は増加する、<1>〜<4>のいずれか一つに記載の多型検出用プローブ。
<6> 前記蛍光標識オリゴヌクレオチドが、標的配列にハイブリダイズしないときに蛍光を発し、前記標的配列にハイブリダイズしたときに蛍光強度が減少する、<1>〜<5>のいずれか一つに記載の多型検出用プローブ。
<7> 前記P1及びP1’の蛍光標識オリゴヌクレオチドの塩基長が、15〜30塩基長であり、前記P2及びP2’の蛍光標識オリゴヌクレオチドの塩基長が、10〜30塩基長であり、前記P3及びP3’の蛍光標識オリゴヌクレオチドの塩基長が、12〜40塩基長であり、前記P4及びP4’の蛍光標識オリゴヌクレオチドの塩基長が、16〜40塩基長であり、前記P5及びP5’の蛍光標識オリゴヌクレオチドの塩基長が、10〜40塩基長である、<1>〜<6>のいずれか一つに記載の多型検出用プローブ。
<8> 前記P1及びP1’の蛍光標識オリゴヌクレオチドの塩基長が、15〜20塩基長であり、前記P2及びP2’の蛍光標識オリゴヌクレオチドの塩基長が、10〜20塩基長であり、前記P3及びP3’の蛍光標識オリゴヌクレオチドの塩基長が、15〜30塩基長であり、前記P4及びP4’の蛍光標識オリゴヌクレオチドの塩基長が、20〜30塩基長であり、前記P5及びP5’の蛍光標識オリゴヌクレオチドの塩基長が、20〜30塩基長である、<1>〜<7>のいずれか一つに記載の多型検出用プローブ。
<9> 前記多型検出用プローブが、融解曲線分析用のプローブである、<1>〜<8>のいずれか一つに記載の多型検出用プローブ。
<10> 前記多型検出用プローブが、配列番号37、配列番号38、配列番号39、配列番号41、配列番号43又は配列番号45で示される塩基配列を有する、<1>〜<9>のいずれか一つに記載の多型検出用プローブ。
<11> 前記多型検出用プローブが、配列番号4、配列番号6、配列番号8、配列番号10、配列番号44又は配列番号12で示される塩基配列を有する、<1>〜<9>のいずれか一つに記載の多型検出用プローブ。
<12> <1>〜<11>のいずれか一つに記載の多型検出用プローブを用いることにより、CYP3A遺伝子の多型を検出する多型検出方法。
<13> (I)前記多型検出用プローブ及び試料中の一本鎖核酸を接触させて、前記多型検出用プローブ及び前記一本鎖核酸をハイブリダイズさせてハイブリッド形成体を得ること、
(II)前記ハイブリッド形成体を含む試料の温度を変化させることで、前記ハイブリッド形成体を解離させ、前記ハイブリッド形成体の解離に基づく蛍光シグナルの変動を測定すること、
(III)前記蛍光シグナルの変動に基づいてハイブリッド形成体の解離温度であるTm値を検出すること、及び、
(IV)前記Tm値に基づいて、前記試料中の一本鎖核酸における、CYP3A遺伝子の多型の存在を検出すること、
を含む、<12>に記載の多型検出方法。
<14> さらに、前記(I)の前または(I)と同時に、核酸を増幅することを含む、<13>に記載の多型検出方法。
<15> <12>〜<14>のいずれか一つに記載の多型検出方法により、CYP3A遺伝子の多型を検出すること、及び、検出された多型の有無に基づいて、薬剤に対する耐性または薬剤の薬効を評価すること、を含む、薬剤の薬効評価方法。
<16> <1>〜<11>のいずれか一つに記載の多型検出用プローブを含む、CYP3A遺伝子の多型を検出するための多型検出用試薬キット。
<17> さらに、前記多型検出用プローブがハイブリダイズする配列を含む領域を増幅するためのプライマーを含む、<16>に記載の多型検出用試薬キット。
【発明の効果】
【0013】
本発明によれば、CYP3A遺伝子の多型を、高い感度で、簡便に検出することを可能にする多型検出用プローブ、これを用いる多型検出方法を提供できる。また、本発明は、当該多型検出方法を用いた薬効評価方法を提供できる。さらに、本発明は、当該多型検出用プローブを用いた多型検出用試薬キットを提供できる。なお、本発明は、例えば、医療分野に関わらず、生化学等の広い分野におけるCYP3A遺伝子の多型検出に適用できる。
【図面の簡単な説明】
【0014】
【図1】図1は、本発明の実施例1にかかる試料の融解曲線である。
【図2】図2は、本発明の実施例1にかかる試料の融解曲線である。
【図3】図3は、本発明の実施例1にかかる試料の融解曲線である。
【図4】図4は、本発明の実施例1にかかる試料の融解曲線である。
【図5】図5は、本発明の実施例1にかかる試料の融解曲線である。
【図6】図6は、本発明の実施例2にかかる試料の融解曲線である。
【図7】図7は、本発明の実施例3にかかる試料の融解曲線である。
【図8】図8は、比較例1にかかる試料の融解曲線である。
【図9】図9は、比較例2にかかる試料の融解曲線である。
【図10】図10は、本発明の実施例4にかかる試料の融解曲線である。
【図11】図11は、本発明の実施例4にかかる試料の融解曲線である。
【図12】図12は、本発明の実施例4にかかる試料の融解曲線である。
【図13】図13は、本発明の実施例5にかかる試料の融解曲線である。
【図14】図14は、比較例3−1にかかる試料の融解曲線である。
【図15】図15は、比較例3−2にかかる試料の融解曲線である。
【発明を実施するための形態】
【0015】
本発明にかかるCYP3A遺伝子の多型検出用プローブ(以下、単に「多型検出用プローブ」ということがある)は、前記P1、P1’、P2、P2’、P3、P3’、P4、P4’、P5及びP5’からなる群から選択される一種の蛍光標識オリゴヌクレオチドである、CYP3A遺伝子の多型を検出するための多型検出用プローブである。
【0016】
本発明にかかるCYP3A遺伝子多型検出方法は、前記CYP3A遺伝子の多型を検出するための多型検出用プローブを少なくとも1種用いて、CYP3A遺伝子の多型を検出することを含む方法である。本発明にかかる薬剤の薬効評価方法は、前記CYP3A遺伝子多型検出方法によりCYP3A遺伝子の多型を検出すること、及び、検出された多型の有無に基づいて、薬剤に対する耐性または薬剤の薬効を評価することを含む方法である。本発明にかかる多型検出用試薬キットは、CYP3A遺伝子の多型を検出するための多型検出用プローブを含むものである。
【0017】
本発明における「CYP3A遺伝子」は、既に公知である。CYP3A5遺伝子の塩基配列は、NCBIのアクセッションNo.NC000007.13の99245813〜99277621の配列を意味する。CYP3A5遺伝子の部分配列を示す配列番号1は、NCBIのdbSNPのアクセッションNo.NG007938の6683〜7483の配列である。CYP3A4遺伝子の塩基配列は、NCBIのアクセッションNo.NC000007.13の99354583〜99381811の配列を意味する。CYP3A4遺伝子の部分配列を示す配列番号2は、NCBIのdbSNPのアクセッションNo.NG008421の15519〜15928の配列であり、CYP3A4遺伝子の部分配列を示す配列番号3は、NCBIのdbSNPのアクセッションNo.NT007933.14の24616172〜24616872の配列である。配列番号1〜3の塩基配列において、rは、a又はg、sは、c又はg、wは、a、t又はu、vは、g、a又はcを示す。
【0018】
CYP3A5遺伝子の野生型では、配列番号1に示される配列のうち401番目に対応する塩基(r)は、A(アデニン)であるが、変異型では、前記塩基(r)がG(グアニン)に変異している。以下、配列番号1のCYP3A5遺伝子の前記多型を「CYP3A5*3多型」という。CYP3A4遺伝子の野生型では、配列番号2に示される配列のうち201番目に対応する塩基(s)は、C(シトシン)であるが、変異型では、前記塩基(s)がG(グアニン)に変異している。以下、配列番号2のCYP3A4遺伝子の前記多型を「CYP3A4*16多型」という。
【0019】
CYP3A4遺伝子の野生型では、配列番号3に示される配列のうち501番目に対応する塩基(r)は、A(アデニン)であるが、変異型では、前記塩基(r)がG(グアニン)に変異している。以下、配列番号3のCYP3A4遺伝子の前記多型を「CYP3A4*1B多型」という。
【0020】
CYP3A遺伝子において、前記3ヶ所の多型のうち少なくとも一つが前述のような変異型であれば、例えば、免疫抑制剤タクロリムス等の薬物代謝が低下する可能性があると判断できる。
【0021】
本発明において、検出対象となる試料中の試料核酸、多型検出用プローブ又はプライマーの個々の配列に関して、これら互いの相補的な関係に基づいて記述された事項は、特に断らない限り、それぞれの配列と、各配列に対して相補的な配列とについても適用される。各配列に対して相補的な当該配列について本発明の事項を適用する際には、当該相補的な配列が認識する配列は、当業者にとっての技術常識の範囲内で、対応する本明細書に記載された配列に相補的な配列に、明細書全体を読み替えるものとする。
【0022】
本発明において、「Tm値」とは、二本鎖核酸が解離する温度(解離温度:Tm)であって、一般に、260nmにおける吸光度が、吸光度全上昇分の50%に達した時の温度と定義される。即ち、二本鎖核酸、例えば、二本鎖DNAを含む溶液を加熱していくと、260nmにおける吸光度が上昇する。これは、二本鎖DNAにおける両鎖間の水素結合が加熱によってほどけ、一本鎖DNAに解離(DNAの融解)することが原因である。そして、全ての二本鎖DNAが解離して一本鎖DNAになると、その吸光度は加熱開始時の吸光度(二本鎖DNAのみの吸光度)の約1.5倍程度を示し、これによって融解が完了したと判断できる。Tm値は、この現象に基づき設定される。本発明におけるTm値は、特に断らない限り、吸光度が、吸光度全上昇分の50%に達した時の温度をいう。
【0023】
本明細書において「工程」との語は、独立した工程だけでなく、例えば、他の工程と明確に区別できない場合であっても、本工程の所期の作用が達成されれば、本用語に含まれる。また、本明細書において、「〜」を用いて示された数値範囲は、「〜」の前後に記載される数値を、それぞれ最小値及び最大値として含む範囲を示す。また、本発明において、組成物中の各成分の量は、前記組成物中に各成分に該当する物質が複数存在する場合、特に断らない限り、前記組成物中に存在する当該複数の物質の合計量を意味する。本発明において、オリゴヌクレオチドの配列に関して「3’末端から数えて1〜3番目」という場合は、オリゴヌクレオチド鎖の3’末端を1番目として数える。
【0024】
<CYP3A遺伝子多型検出用プローブ>
本発明にかかるCYP3A遺伝子の多型検出用プローブは、前記P1、P1’、P2、P2’、P3、P3’、P4、P4’、P5及びP5’からなる群から選択される一種の蛍光標識オリゴヌクレオチドである、CYP3A遺伝子の多型を検出するための多型検出用プローブである。
【0025】
CYP3A5遺伝子の野生型では、配列番号1に示される配列のうち401番目に対応する塩基(r)は、A(アデニン)であるが、変異型では、前記塩基(r)がG(グアニン)に変異している。以下、配列番号1のCYP3A5遺伝子の前記多型を「CYP3A5*3多型」という。この多型を検出するプローブを、以下、CYP3A5*3用プローブともいう。
【0026】
本発明において、前記P1及びP1’からなる群から選択される一種の蛍光標識オリゴヌクレオチド(以下、「前記(P1)又は(P1’)蛍光標識オリゴヌクレオチド」ともいう。)は、配列番号1に示す塩基配列の401番目の塩基における多型を検出できるプローブである。
【0027】
本発明の前記P1の蛍光標識オリゴヌクレオチドは、具体的には、配列番号1で示される配列のうち401番目〜411番目の塩基を含む配列である。前記P1の蛍光標識オリゴヌクレオチドは、例えば、配列番号1に示す塩基配列の401番目の塩基に対応する塩基(r)が、Aでもよいし、Gでもよい。
(P1)配列番号1で示される配列のうち401番目〜411番目の塩基を含む塩基長11〜50の配列であり、配列番号1における411番目の塩基に対応する塩基がシトシンである以外は、配列番号1と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号1で示される配列のうち411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0028】
本発明の前記P1の蛍光標識オリゴヌクレオチドは、配列番号1における411番目の塩基に対応する塩基がC(シトシン)である以外は、配列番号1と同一の塩基を有する塩基配列に対して同一性を有すことを要する。具体的には、本発明の前記P1の蛍光標識オリゴヌクレオチドは、配列番号1における411番目の塩基に対応する塩基がC(シトシン)である以外は、配列番号1と同一の塩基を有する塩基配列に対して、80%以上の同一性を示す。また、検出感度の観点より、例えば、85%以上の同一性、90%以上の同一性、95%以上の同一性、96%以上の同一性、97%以上の同一性、98%以上の同一性又は99%以上の同一性を示してもよい。また、前記P1の蛍光標識オリゴヌクレオチドは、さらに、配列番号1における411番目の塩基に対応する塩基がC(シトシン)であり、且つ、401番目の塩基に対応する塩基が、r(AまたはG)である以外は、配列番号1と同一の塩基を有する塩基配列に対して同一性を有すことが好ましい。ここで、「配列番号と同一の塩基を有する塩基配列」とは、変更された前記プローブに現れる、前記配列番号の配列における領域を意味する(以下、同様)。
【0029】
本発明の前記P1の蛍光標識オリゴヌクレオチドが、例えば、配列番号1の401番目の塩基に対応する塩基が、変異型のGである場合、例えば、以下のようなことがいえる。本発明の前記P1の蛍光標識オリゴヌクレオチドと、配列番号1における411番目の塩基に対応する塩基がC(シトシン)である以外は配列番号1と同一の塩基を有する塩基配列とを比較した際、その同一性が80%未満である場合には、変異型のCYP3A5遺伝子を含む試料核酸に対する検出感度が低くなる。
【0030】
本発明の前記P1の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号1における401番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。前記蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号1における401番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号1の401番目の塩基に対応する塩基が、変異型Gである場合、変異型のCYP3A5遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0031】
本発明における前記P1’の蛍光標識オリゴヌクレオチドは、配列番号1における411番目の塩基に対応する塩基がC(シトシン)である以外は、配列番号1と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズすることを要する。前記P1’の蛍光標識オリゴヌクレオチドは、例えば、配列番号1に示す塩基配列の401番目の塩基に対応する塩基(r)が、Aでもよいし、Gでもよい。
(P1’)配列番号1で示される配列のうち401番目〜411番目の塩基を含む塩基長11〜50の配列であり、配列番号1における411番目の塩基に対応する塩基がシトシンである以外は、配列番号1と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズし、配列番号1で示される配列のうち411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0032】
前記ハイブリダイゼーションは、公知の方法あるいはそれに準じる方法、例えば、Molecular Cloning 3rd(J. Sambrook et al., Cold Spring Harbor Lab. Press, 2001) に記載の方法等に従って行うことができる。この文献は、参照により本明細書に組み入れられるものとする。ストリンジェントな条件とは、特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。典型的なストリンジェントな条件は、例えば、カリウム濃度は約25mmol/L〜約50mmol/L、及びマグネシウム濃度は約1.0mmol/L〜約5.0mmol/L中において、ハイブリダイゼーションを行う条件があげられる。本発明の条件の1例として、Tris−HCl(pH8.6)、25mmol/LのKCl、及び1.5mmol/LのMgCl2中においてハイブリダイゼーションを行う条件が挙げられるが、これに限定されるものではない。その他、ストリンジェントな条件としては、Molecular Cloning 3rd(J. Sambrook et al., Cold Spring Harbor Lab. Press, 2001)に記載されている。この文献は、参照により本明細書に組み入れられるものとする。当業者は、ハイブリダイゼーション反応や、ハイブリダイゼーション反応液の塩濃度等を変化させることによって、このような条件を容易に選択できる。
【0033】
本発明の前記P1’の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号1における401番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。前記蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号1における401番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号1の401番目の塩基に対応する塩基が、変異型Gである場合、変異型のCYP3A5遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0034】
本発明における前記P1または前記P1’の蛍光標識オリゴヌクレオチドには、前記P1又は前記P1’の蛍光標識オリゴヌクレオチドに、塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドは、前記P1又は前記P1’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、塩基が挿入、欠失又は置換されている場合、その挿入、欠失又は置換の位置は、特に限定されない。挿入、欠失又は置換した塩基の数は、1塩基又は2塩基以上が挙げられる。前記塩基の数は、前記蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜10塩基、又は1塩基〜5塩基が挙げられる。
【0035】
中でも、本発明における前記P1又は前記P1’の蛍光標識オリゴヌクレオチドには、前記P1又は前記P1’の蛍光標識オリゴヌクレオチドの塩基が置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が置換した蛍光標識オリゴヌクレオチドは、前記P1又は前記P1’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、置換の位置は、特に限定されない。例えば、検出感度の観点より、配列番号1で示される配列のうち401番目〜411番目の塩基以外に位置する塩基が置換されることが挙げられる。置換される塩基の数は、1塩基又は2塩基以上が挙げられる。置換される塩基の数は、蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜5塩基、又は1塩基〜3塩基が挙げられる。
【0036】
本発明の前記P1又は前記P1’の蛍光標識オリゴヌクレオチドの長さは、11〜50塩基(mer)であることを要する。前記P1又は前記P1’の蛍光標識オリゴヌクレオチドの長さが、10塩基以下または51塩基以上である場合、CYP3A遺伝子多型の検出感度が低下する。また、本発明の前記P1又は前記P1’の蛍光標識オリゴヌクレオチドの長さは、例えば、15〜30塩基、15〜21塩基、又は15〜20塩基としうる。例えば、前記15〜30塩基という範囲にすることにより、例えば検出感度が高くなる等の傾向がある。また前記P1又は前記P1’の蛍光標識オリゴヌクレオチドの塩基長を変化させることで、例えば、前記P1又は前記P1’の蛍光標識オリゴヌクレオチドがその相補鎖と形成するハイブリッド形成体の解離温度であるTm値を、所望の値とすることができる。
【0037】
以下に、本発明における前記P1の蛍光標識オリゴヌクレオチドの塩基配列の一例を示すが、本発明はこれらに限定されない。
5'-ttgtctttcartatctcttcc-3' (配列番号37)
5'-ttgtctttcagtatctcttcc-3' (配列番号4)(3FL-CYP3A5*3-mt-F1-21)
5'-ttgtctttcaatatctcttcc-3' (配列番号5)
【0038】
本発明の前記P1又は前記P1’の蛍光標識オリゴヌクレオチドは、配列番号1の配列のうち411番目の塩基に対応する塩基が蛍光色素で標識されていることを要する。
【0039】
前記P1又は前記P1’の蛍光標識オリゴヌクレオチドにおいて、この蛍光標識された411番目の塩基は、3’末端から数えて1〜3番目のいずれかの位置に存在することができ、また、3’末端に存在することができる。これにより、例えば、多型検出感度がより向上し、また、前記P1又は前記P1’の蛍光標識オリゴヌクレオチドを、生産性よく得ることができる。
【0040】
本発明において、前記P2、前記P2’、前記P3、前記P3’、前記P4及び前記P4’からなる群より選択される一種の蛍光標識オリゴヌクレオチド(以下、「前記(P2)、(P2’)、(P3)、(P3’)、(P4)又は(P4’)蛍光標識オリゴヌクレオチド」ともいう。)は、配列番号2に示す塩基配列の201番目の塩基における多型を検出できるプローブである。
【0041】
CYP3A4遺伝子の野生型では、配列番号2に示される配列のうち201番目に対応する塩基(s)は、C(シトシン)であるが、変異型では、前記塩基(s)がG(グアニン)に変異している。以下、配列番号2のCYP3A4遺伝子の前記多型を「CYP3A4*16多型」という。この多型を検出するプローブを、以下、CYP3A4*16用プローブともいう。
【0042】
本発明の前記P2の蛍光標識オリゴヌクレオチドは、具体的には、配列番号2で示される配列のうち201番目〜205番目の塩基を含む配列である。前記P2の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に対応する塩基(s)が、Cでもよいし、Gでもよい。
(P2)配列番号2で示される配列のうち201番目〜205番目の塩基を含む塩基長5〜50の配列であり、配列番号2における205番目の塩基に対応する塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち205番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0043】
本発明の前記P2の蛍光標識オリゴヌクレオチドは、配列番号2における205番目の塩基に対応する塩基がC(シトシン)である以外は、配列番号2と同一の塩基を有する塩基配列に対して同一性を有すことを要する。具体的には、本発明の前記P2の蛍光標識オリゴヌクレオチドは、配列番号2における205番目の塩基に対応する塩基がC(シトシン)である以外は、配列番号2と同一の塩基を有する塩基配列に対して、80%以上の同一性を示す。また、検出感度の観点より、例えば、85%以上の同一性、90%以上の同一性、95%以上の同一性、96%以上の同一性、97%以上の同一性、98%以上の同一性又は99%以上の同一性を示してもよい。また、前記P2の蛍光標識オリゴヌクレオチドは、さらに、配列番号2における205番目の塩基に対応する塩基がC(シトシン)であり、且つ、201番目の塩基に対応する塩基が、s(CまたはG)である以外は、配列番号2と同一の塩基を有する塩基配列に対して同一性を有すことが好ましい。
【0044】
本発明の前記P2の蛍光標識オリゴヌクレオチドが、例えば、配列番号2の201番目の塩基に対応する塩基が、変異型のGである場合、例えば、以下のようなことがいえる。本発明の前記P2の蛍光標識オリゴヌクレオチドと、配列番号2における205番目の塩基に対応する塩基がC(シトシン)である以外は、配列番号2と同一の塩基を有する塩基配列とを比較した際、その同一性が80%未満である場合には、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が低くなる。
【0045】
本発明の前記P2の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号2における201番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号2における201番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号2の201番目の塩基に対応する塩基が、変異型Gである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0046】
本発明における前記P2’の蛍光標識オリゴヌクレオチドは、配列番号2における205番目の塩基に対応する塩基がC(シトシン)である以外は、配列番号2と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズすることを要する。前記P2’の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に対応する塩基(s)が、Cでもよいし、Gでもよい。前記ハイブリダイゼーションならびにストリンジェントな条件は、前述の通りである。
(P2’)配列番号2で示される配列のうち201番目〜205番目の塩基を含む塩基長5〜50の配列であり、配列番号2における205番目の塩基に対応する塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち205番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0047】
本発明の前記P2’の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号2における201番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号2における201番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号2の201番目の塩基に対応する塩基が、変異型Gである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0048】
本発明における前記P2または前記P2’の蛍光標識オリゴヌクレオチドには、前記P2又は前記P2’の蛍光標識オリゴヌクレオチドに、塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドは、前記P2又は前記P2’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、塩基が挿入、欠失又は置換されている場合、その挿入、欠失又は置換の位置は、特に限定されない。挿入、欠失又は置換した塩基の数は、1塩基又は2塩基以上が挙げられる。前記塩基の数は、前記蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜10塩基、又は1塩基〜5塩基が挙げられる。
【0049】
中でも、本発明における前記P2又は前記P2’の蛍光標識オリゴヌクレオチドには、前記P2又は前記P2’の蛍光標識オリゴヌクレオチドの塩基が置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が置換した蛍光標識オリゴヌクレオチドは、前記P2又は前記P2’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、置換の位置は、特に限定されない。例えば、検出感度の観点より、配列番号2で示される配列のうち201番目〜205番目の塩基以外に位置する塩基が置換されることが挙げられる。置換される塩基の数は、1塩基又は2塩基以上が挙げられる。置換される塩基の数は、蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜5塩基、又は1塩基〜3塩基が挙げられる。
【0050】
本発明の前記P2又は前記P2’の蛍光標識オリゴヌクレオチドの長さは、5〜50塩基(mer)であることを要する。前記P2又は前記P2’の蛍光標識オリゴヌクレオチドの長さが、4塩基以下または51塩基以上である場合、CYP3A遺伝子多型の検出感度が低下する。また、本発明の前記P2又は前記P2’の蛍光標識オリゴヌクレオチドの長さは、例えば、10〜30塩基、又は10〜20塩基としうる。例えば、前記10〜30塩基という範囲にすることにより、例えば検出感度が高くなる等の傾向がある。また前記P2又は前記P2’の蛍光標識オリゴヌクレオチドの塩基長を変化させることで、例えば、前記P2又は前記P2’の蛍光標識オリゴヌクレオチドがその相補鎖と形成するハイブリッド形成体の解離温度であるTm値を、所望の値とすることができる。
【0051】
以下に、本発明における前記P2の蛍光標識オリゴヌクレオチドの塩基配列の一例を示すが、本発明はこれらに限定されない。
5'-gatgtgatcastagc-3' (配列番号38)
5'-gatgtgatcagtagc-3' (配列番号6)(3T-CYP3A4*16-MF1)
5'-gatgtgatcactagc-3' (配列番号7)
【0052】
本発明の前記P2又は前記P2’の蛍光標識オリゴヌクレオチドは、配列番号2の配列のうち205番目の塩基に対応する塩基が蛍光色素で標識されていることを要する。
【0053】
前記P2又は前記P2’の蛍光標識オリゴヌクレオチドにおいて、この蛍光標識された205番目の塩基は、3’末端から数えて1〜3番目のいずれかの位置に存在することができ、また、3’末端に存在することができる。これにより、例えば、多型検出感度がより向上し、また、前記P2又は前記P2’の蛍光標識オリゴヌクレオチドを、生産性よく得ることができる。
【0054】
本発明において、前記P3及びP3’の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に相補的な塩基(s)が、Gでもよいし、Cでもよい。
【0055】
本発明の前記P3の蛍光標識オリゴヌクレオチドは、具体的には、配列番号2で示される配列のうち190番目〜201番目の塩基を含む配列に相補的な配列である。前記P3の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に相補的な塩基(s)が、Cでもよいし、Gでもよい。
(P3)配列番号2で示される配列のうち190番目〜201番目の塩基を含む塩基長12〜50の配列に相補的な配列であり、配列番号2における190番目の塩基に相補的な塩基がシトシンである以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち190番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0056】
本発明の前記P3の蛍光標識オリゴヌクレオチドは、配列番号2における190番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して同一性を有すことを要する。具体的には、本発明の前記P3の蛍光標識オリゴヌクレオチドは、配列番号2における190番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して、80%以上の同一性を示す。また、検出感度の観点より、例えば、85%以上の同一性、90%以上の同一性、95%以上の同一性、96%以上の同一性、97%以上の同一性、98%以上の同一性又は99%以上の同一性を示してもよい。また、前記P3の蛍光標識オリゴヌクレオチドは、さらに、配列番号2における190番目の塩基に相補的な塩基がC(シトシン)であり、且つ、201番目の塩基に相補的な塩基が、s(CまたはG)である以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して、同一性を有すことが好ましい。
【0057】
本発明の前記P3の蛍光標識オリゴヌクレオチドが、例えば、配列番号2の201番目の塩基に相補的な塩基が、変異型のCである場合、例えば、以下のようなことがいえる。本発明の前記P3の蛍光標識オリゴヌクレオチドと、配列番号2における190番目の塩基に相補的な塩基がC(シトシン)である以外は配列番号2の相補鎖と同一の塩基を有する塩基配列とを比較した際、その同一性が80%未満である場合には、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が低くなる。
【0058】
本発明にかかる前記P3の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号2における201番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号2における201番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号2の201番目の塩基に相補的な塩基が、変異型Cである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0059】
本発明における前記P3’の蛍光標識オリゴヌクレオチドは、配列番号2における190番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズすることを要する。前記P3’の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に相補的な塩基(s)が、Cでもよいし、Gでもよい。前記ハイブリダイゼーションならびにストリンジェントな条件は、前述の通りである。
(P3’)配列番号2で示される配列のうち190番目〜201番目の塩基を含む塩基長12〜50の配列に相補的な配列であり、配列番号2における190番目の塩基に相補的な塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち190番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0060】
本発明の前記P3’の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号2における201番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号2における201番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号2の201番目の塩基に相補的な塩基が、変異型Cである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0061】
本発明における前記P3または前記P3’の蛍光標識オリゴヌクレオチドには、前記P3又は前記P3’の蛍光標識オリゴヌクレオチドに、塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドは、前記P3又は前記P3’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、塩基が挿入、欠失又は置換されている場合、その挿入、欠失又は置換の位置は、特に限定されない。挿入、欠失又は置換した塩基の数は、1塩基又は2塩基以上が挙げられる。前記塩基の数は、前記蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜10塩基、又は1塩基〜5塩基が挙げられる。
【0062】
中でも、本発明における前記P3又は前記P3’の蛍光標識オリゴヌクレオチドには、前記P3又は前記P3’の蛍光標識オリゴヌクレオチドの塩基が置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が置換した蛍光標識オリゴヌクレオチドは、前記P3又は前記P3’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、置換の位置は、特に限定されない。例えば、検出感度の観点より、配列番号3で示される配列のうち190番目〜201番目の塩基以外に位置する塩基に相補的な塩基が置換されることが挙げられる。置換される塩基の数は、1塩基又は2塩基以上が挙げられる。置換される塩基の数は、蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜5塩基、又は1塩基〜3塩基が挙げられる。
【0063】
本発明の前記P3又は前記P3’の蛍光標識オリゴヌクレオチドの長さは、12〜50塩基(mer)であることを要する。前記P3又は前記P3’の蛍光標識オリゴヌクレオチドの長さが、11塩基以下または51塩基以上である場合、CYP3A遺伝子多型の検出感度が低下する。また、本発明の前記P3又は前記P3’の蛍光標識オリゴヌクレオチドの長さは、例えば、12〜40塩基、又は15〜30塩基としうる。例えば、前記12〜40塩基という範囲にすることにより、例えば検出感度が高くなる等の傾向がある。また前記P3又は前記P3’の蛍光標識オリゴヌクレオチドの塩基長を変化させることで、例えば、前記P3又は前記P3’の蛍光標識オリゴヌクレオチドがその相補鎖と形成するハイブリッド形成体の解離温度であるTm値を、所望の値とすることができる。
【0064】
以下に、本発明における前記P3の蛍光標識オリゴヌクレオチドの塩基配列の一例を示すが、本発明はこれらに限定されない。
5'-tgtgctastgatcacatcc-3' (配列番号39)
5'-tgtgctactgatcacatcc-3' (配列番号8)(3T-CYP3A4*16-MR1)
5'-tgtgctagtgatcacatcc-3' (配列番号40)
【0065】
本発明の前記P3又は前記P3’の蛍光標識オリゴヌクレオチドは、配列番号2の配列のうち190番目の塩基に相補的な塩基が蛍光色素で標識されていることを要する。
【0066】
前記P3又は前記P3’の蛍光標識オリゴヌクレオチドにおいて、この蛍光標識された190番目の塩基に相補的な塩基は、3’末端から数えて1〜3番目のいずれかの位置に存在することができ、また、3’末端に存在することができる。これにより、例えば、多型検出感度がより向上し、また、前記P3又は前記P3’の蛍光標識オリゴヌクレオチドを、生産性よく得ることができる。
【0067】
本発明において、前記P4及びP4’の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に相補的な塩基(s)が、Gでもよいし、Cでもよい。
【0068】
本発明の前記P4の蛍光標識オリゴヌクレオチドは、具体的には、配列番号2で示される配列のうち186番目〜201番目の塩基を含む配列に相補的な配列である。前記P4の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に相補的な塩基(s)が、Cでもよいし、Gでもよい。
(P4)配列番号2で示される配列のうち186番目〜201番目の塩基を含む塩基長16〜50の配列に相補的な配列であり、配列番号2における186番目の塩基に相補的な塩基がシトシンである以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち186番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0069】
本発明の前記P4の蛍光標識オリゴヌクレオチドは、配列番号2における186番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して同一性を有すことを要する。具体的には、本発明の前記P4の蛍光標識オリゴヌクレオチドは、配列番号2における186番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して、80%以上の同一性を示す。また、検出感度の観点より、例えば、85%以上の同一性、90%以上の同一性、95%以上の同一性、96%以上の同一性、97%以上の同一性、98%以上の同一性又は99%以上の同一性を示してもよい。また、前記P4の蛍光標識オリゴヌクレオチドは、さらに、配列番号2における186番目の塩基に相補的な塩基がC(シトシン)であり、且つ、201番目の塩基に相補的な塩基が、s(CまたはG)である以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して同一性を有すことが好ましい。
【0070】
本発明の前記P4の蛍光標識オリゴヌクレオチドが、例えば、配列番号2の201番目の塩基に相補的な塩基が、変異型のCである場合、例えば、以下のようなことがいえる。本発明の前記P4の蛍光標識オリゴヌクレオチドと、配列番号4における186番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列とを比較した際、その同一性が80%未満である場合には、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が低くなる。
【0071】
本発明の前記P4の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号2における201番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号2における201番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号2の201番目の塩基に相補的な塩基が、変異型Cである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0072】
本発明における前記P4’の蛍光標識オリゴヌクレオチドは、配列番号2における186番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズすることを要する。前記P4’の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に相補的な塩基(s)が、Cでもよいし、Gでもよい。前記ハイブリダイゼーションならびにストリンジェントな条件は、前述の通りである。
(P4’)配列番号2で示される配列のうち186番目〜201番目の塩基を含む塩基長16〜50の配列に相補的な配列であり、配列番号2における186番目の塩基に相補的な塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち186番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0073】
本発明の前記P4’の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号2における201番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号2における201番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号2の201番目の塩基に相補的な塩基が、変異型Cである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0074】
本発明における前記P4または前記P4’の蛍光標識オリゴヌクレオチドには、前記P4又は前記P4’の蛍光標識オリゴヌクレオチドに、塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドは、前記P4又は前記P4’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、塩基が挿入、欠失又は置換されている場合、その挿入、欠失又は置換の位置は、特に限定されない。挿入、欠失又は置換した塩基の数は、1塩基又は2塩基以上が挙げられる。前記塩基の数は、前記蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜10塩基、又は1塩基〜5塩基が挙げられる。
【0075】
中でも、本発明における前記P4又は前記P4’の蛍光標識オリゴヌクレオチドには、前記P4又は前記P4’の蛍光標識オリゴヌクレオチドの塩基が置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が置換した蛍光標識オリゴヌクレオチドは、前記P4又は前記P4’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、置換の位置は、特に限定されない。例えば、検出感度の観点より、配列番号2で示される配列のうち186番目〜201番目の塩基以外に位置する塩基に相補的な塩基が置換されることが挙げられる。置換される塩基の数は、1塩基又は2塩基以上が挙げられる。置換される塩基の数は、蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜5塩基、又は1塩基〜3塩基が挙げられる。
【0076】
本発明の前記P4又は前記P4’の蛍光標識オリゴヌクレオチドの長さは、16〜50塩基(mer)であることを要する。前記P4又は前記P4’の蛍光標識オリゴヌクレオチドの長さが、15塩基以下または51塩基以上である場合、CYP3A遺伝子多型の検出感度が低下する。また、本発明の前記P4又は前記P4’の蛍光標識オリゴヌクレオチドの長さは、例えば、16〜40塩基、又は20〜30塩基としうる。例えば、前記16〜40塩基という範囲にすることにより、例えば検出感度が高くなる等の傾向がある。また前記P4又は前記P4’の蛍光標識オリゴヌクレオチドの塩基長を変化させることで、例えば、前記P4又は前記P4’の蛍光標識オリゴヌクレオチドがその相補鎖と形成するハイブリッド形成体の解離温度であるTm値を、所望の値とすることができる。
【0077】
以下に、本発明における前記P4の蛍光標識オリゴヌクレオチドの塩基配列の一例を示すが、本発明はこれらに限定されない。
5'-atgatgtgctastgatcacatccatgc-3' (配列番号41)
5'-atgatgtgctactgatcacatccatgc-3' (配列番号10)(U0-3TMR4)
5'-atgatgtgctagtgatcacatccatgc-3' (配列番号42)
5'-gatgtgctastgatcacatccatgc-3' (配列番号43)
5'-gatgtgctactgatcacatccatgc-3' (配列番号44)
5'-gatgtgctagtgatcacatccatgc-3' (配列番号11)
【0078】
本発明の前記P4又は前記P4’の蛍光標識オリゴヌクレオチドは、配列番号2の配列のうち186番目の塩基に相補的な塩基が蛍光色素で標識されていることを要する。
【0079】
前記P4又は前記P4’の蛍光標識オリゴヌクレオチドにおいて、この蛍光標識された186番目の塩基に相補的な塩基は、3’末端から数えて1〜3番目のいずれかの位置に存在することができ、また、3’末端に存在することができる。これにより、例えば、多型検出感度がより向上し、また、前記P4又は前記P4’の蛍光標識オリゴヌクレオチドを、生産性よく得ることができる。
【0080】
本発明において、前記P5及びP5’からなる群より選択される一種の蛍光標識オリゴヌクレオチド(以下、「前記(P5)又は(P5’)蛍光標識オリゴヌクレオチド」ともいう。)は、配列番号3に示す塩基配列の501番目の塩基における多型を検出できるプローブである。
(P5)配列番号3で示される配列のうち496番目〜501番目の塩基を含む塩基長6〜50の配列に相補的な配列であり、配列番号3における496番目の塩基に相補的な塩基がシトシンである以外は、配列番号3の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号3で示される配列のうち496番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
(P5’)配列番号3で示される配列のうち496番目〜501番目の塩基を含む塩基長6〜50の配列に相補的な配列であり、配列番号3における496番目の塩基に相補的な塩基がシトシンである以外は、配列番号3と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号3で示される配列のうち496番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0081】
CYP3A4遺伝子の野生型では、配列番号3に示される配列のうち501番目に対応する塩基(r)は、A(アデニン)であるが、変異型では、前記塩基(r)がG(グアニン)に変異している。以下、配列番号3のCYP3A4遺伝子の前記多型を「CYP3A4*1B多型」という。この多型を検出するプローブを、以下、CYP3A4*1B用プローブともいう。
【0082】
本発明において、前記P5及びP5’の蛍光標識オリゴヌクレオチドは、例えば、配列番号3に示す塩基配列の501番目の塩基に相補的な塩基(y)が、Cでもよいし、Tでもよい。
【0083】
本発明の前記P5の蛍光標識オリゴヌクレオチドは、具体的には、配列番号3で示される配列のうち496番目〜501番目の塩基を含む配列に相補的な配列である。前記P5の蛍光標識オリゴヌクレオチドは、例えば、配列番号3に示す塩基配列の501番目の塩基に相補的な塩基(y)が、Cでもよいし、Tでもよい。
【0084】
本発明の前記P5の蛍光標識オリゴヌクレオチドは、配列番号3における496番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号3の相補鎖と同一の塩基を有する塩基配列に対して同一性を有すことを要する。具体的には、本発明の前記P5の蛍光標識オリゴヌクレオチドは、配列番号3における496番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号3の相補鎖と同一の塩基を有する塩基配列に対して、80%以上の同一性を示す。また、検出感度の観点より、例えば、85%以上の同一性、90%以上の同一性、95%以上の同一性、96%以上の同一性、97%以上の同一性、98%以上の同一性又は99%以上の同一性を示してもよい。また、前記P5の蛍光標識オリゴヌクレオチドは、さらに、配列番号3における496番目の塩基に相補的な塩基がC(シトシン)であり、且つ、501番目の塩基に相補的な塩基が、y(CまたはT)である以外は、配列番号3の相補鎖と同一の塩基を有する塩基配列に対して同一性を有すことが好ましい。
【0085】
本発明の前記P5の蛍光標識オリゴヌクレオチドが、例えば、配列番号3の501番目の塩基に相補的な塩基が、変異型のCである場合、例えば、以下のようなことがいえる。本発明の前記P5の蛍光標識オリゴヌクレオチドと、配列番号5における496番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号5の相補鎖と同一の塩基を有する塩基配列とを比較した際、その同一性が80%未満である場合には、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が低くなる。
【0086】
本発明の前記P5の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号3における501番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号3における501番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号3の501番目の塩基に相補的な塩基が、変異型Cである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0087】
本発明における前記P5’の蛍光標識オリゴヌクレオチドは、配列番号3における496番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号3と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズすることを要する。前記P5’の蛍光標識オリゴヌクレオチドは、例えば、配列番号3に示す塩基配列の501番目の塩基に相補的な塩基(y)が、Cでもよいし、Tでもよい。前記ハイブリダイゼーションならびにストリンジェントな条件は、前述の通りである。
【0088】
本発明の前記P5’の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号3における501番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号3における501番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドが、例えば、配列番号3の501番目の塩基に相補的な塩基が、変異型Cである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0089】
本発明における前記P5または前記P5’の蛍光標識オリゴヌクレオチドには、前記P5又は前記P5’の蛍光標識オリゴヌクレオチドに、塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドは、前記P5又は前記P5’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、塩基が挿入、欠失又は置換されている場合、その挿入、欠失又は置換の位置は、特に限定されない。挿入、欠失又は置換した塩基の数は、1塩基又は2塩基以上が挙げられる。前記塩基の数は、前記蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜10塩基、又は1塩基〜5塩基が挙げられる。
【0090】
中でも、本発明における前記P5又は前記P5’の蛍光標識オリゴヌクレオチドには、前記P5又は前記P5’の蛍光標識オリゴヌクレオチドの塩基が置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が置換した蛍光標識オリゴヌクレオチドは、前記P5又は前記P5’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、置換の位置は、特に限定されない。例えば、検出感度の観点より、配列番号3で示される配列のうち496番目〜501番目の塩基以外に位置する塩基に相補的な塩基が置換されることが挙げられる。置換される塩基の数は、1塩基又は2塩基以上が挙げられる。置換される塩基の数は、蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜5塩基、又は1塩基〜3塩基が挙げられる。
【0091】
本発明の前記P5又は前記P5’の蛍光標識オリゴヌクレオチドの長さは、6〜50塩基(mer)であることを要する。前記P5又は前記P5’の蛍光標識オリゴヌクレオチドの長さが、5塩基以下または51塩基以上である場合、CYP3A遺伝子多型の検出感度が低下する。また、本発明の前記P5又は前記P5’の蛍光標識オリゴヌクレオチドの長さは、例えば、10〜40塩基、又は20〜30塩基としうる。例えば、前記10〜40塩基という範囲にすることにより、例えば検出感度が高くなる等の傾向がある。また前記P5又は前記P5’の蛍光標識オリゴヌクレオチドの塩基長を変化させることで、例えば、前記P5又は前記P5’の蛍光標識オリゴヌクレオチドがその相補鎖と形成するハイブリッド形成体の解離温度であるTm値を、所望の値とすることができる。
【0092】
以下に、本発明における前記P5の蛍光標識オリゴヌクレオチドの塩基配列の一例を示すが、本発明はこれらに限定されない。
5'-taaatcgccgctctcytgccc-3' (配列番号45)
5'-taaatcgccgctctcctgccc-3' (配列番号12)(3PB-CYP3A4*1B-R3)
5'-taaatcgccgctctcttgccc-3' (配列番号13)
【0093】
本発明の前記P5又は前記P5’の蛍光標識オリゴヌクレオチドは、配列番号3の配列のうち496番目の塩基に相補的な塩基が蛍光色素で標識されていることを要する。
【0094】
前記P5又は前記P5’の蛍光標識オリゴヌクレオチドにおいて、この蛍光標識された496番目の塩基に相補的な塩基は、3’末端から数えて1〜3番目のいずれかの位置に存在することができ、また、3’末端に存在することができる。これにより、例えば、多型検出感度がより向上し、また、P5又は前記P5’の蛍光標識オリゴヌクレオチドを、生産性よく得ることができる。
【0095】
前記P1、P1’、P2、P2’、P3、P3’、P4、P4’、P5及びP5’の蛍光標識オリゴヌクレオチドについて、ハイブリッド形成体のTm値は、例えば、Meltcalc 99 free(http://www.meltcalc.com/)を用いて算出できる。設定条件は、特に制限されず、例えば、Oligoconc[μM]0.2、Na eq.[mM]50の条件があげられる。前記ハイブリッド形成体は、検出部位に対応する塩基が変異型である前記蛍光標識オリゴヌクレオチド(変異型蛍光標識オリゴヌクレオチド)と、検出部位が変異型である相補的配列又は検出部位が野生型である相補的配列とのハイブリッド形成体、検出部位に対応する塩基が野生型である前記蛍光標識オリゴヌクレオチド(野生型蛍光標識オリゴヌクレオチド)と、検出部位が変異型である相補的配列又検出部位が野生型である相補的配列とのハイブリッド形成体があげられる。前記変異型蛍光標識オリゴヌクレオチドと変異型相補配列とのTm値は、前記変異型蛍光標識オリゴヌクレオチドと野生型相補配列とのTm値との差が、例えば、3℃以上、4℃以上、5℃以上、30℃以下である。また、前記野生型蛍光標識オリゴヌクレオチドと野生型相補配列とのTm値は、前記野生型蛍光標識オリゴヌクレオチドと変異型相補配列とのTm値との差が、例えば、3℃以上、4℃以上、5℃以上、又は7℃以上等、例えば、30℃以下等である。
【0096】
本発明の前記蛍光標識オリゴヌクレオチドは、例えば、相補鎖にハイブリダイズしていないときの蛍光強度に比べて、相補鎖にハイブリダイズしているときの蛍光強度が減少(消光)するかまたは増加する蛍光標識オリゴヌクレオチドとすることができる。その中でも、相補鎖にハイブリダイズしていないときの蛍光強度に比べて、相補鎖にハイブリダイズしているときの蛍光強度が減少する蛍光標識オリゴヌクレオチドとすることができる。
【0097】
このような蛍光消光現象(Quenching phenomenon)を利用したプローブは、一般的に、グアニン消光プローブと呼ばれており、いわゆるQ Probe(登録商標)として知られている。中でも、3’末端もしくは5’末端がシトシン(C)となるように設計され、その末端のCがグアニン(G)に近づくと、発光が弱くなるように蛍光色素で標識化されたオリゴヌクレオチドであることが、特に好ましい。このようなプローブを使用すれば、例えば、シグナルの変動により、ハイブリダイズと解離とを容易に確認できる。
【0098】
Q Probeを用いた検出方法以外にも、公知の検出様式を適用してもよい。このような検出様式としては、Taq−man Probe法、Hybridization Probe法、Molecular Beacon法又はMGB Probe法などを挙げることができる。
【0099】
前記蛍光色素としては、特に制限されず、例えば、フルオレセイン、リン光体、ローダミン、ポリメチン色素誘導体等があげられる。前記蛍光色素の市販品は、例えば、Pacific Blue、BODIPY FL、FluorePrime、Fluoredite、FAM、Cy3及びCy5、TAMRA等が挙げられる。前記蛍光標識オリゴヌクレオチドの検出条件は、特に制限されず、使用する前記蛍光色素により適宜決定できる。例えば、Pacific Blueは、検出波長445nm〜480nm、TAMRAは、検出波長585nm〜700nm、BODIPY FLは、検出波長520nm〜555nmで検出できる。このような蛍光色素を有するプローブを使用すれば、それぞれの蛍光シグナルの変動により、ハイブリダイズと解離とを容易に確認できる。前記蛍光色素のオリゴヌクレオチドへの結合は、通常の方法、例えば、特開2002−119291号公報等に記載の方法に従って行うことができる。
【0100】
また、前記蛍光標識オリゴヌクレオチドは、例えば、3'末端にリン酸基が付加されてもよい。前記蛍光標識オリゴヌクレオチドの3'末端にリン酸基を付加させておくことで、プローブ自体が遺伝子増幅反応によって伸長することを十分に抑制できるためである。後述するように、変異の有無を検出するDNA(標的DNA)は、PCR等の遺伝子増幅法によって調製できる。その際、3'末端にリン酸基が付加された蛍光標識オリゴヌクレオチドを用いることで、これを増幅反応の反応液中に共存させることができる。また、前記プローブの3'末端に、例えば、前述のような標識化物質(蛍光色素)を付加することによっても、同様の効果が得られる。
【0101】
前記各蛍光標識オリゴヌクレオチドは、CYP3A遺伝子における多型、特に、CYP3A5*3、CYP3A4*16及び/またはCYP3A4*1Bを検出する、CYP3A遺伝子多型検出用プローブとして使用することができる。また、前記CYP3A遺伝子多型検出用プローブは、後述する融解曲線分析用のプローブとして使用することができる。
【0102】
なお、本発明にかかる前記蛍光標識オリゴヌクレオチドは、例えば、前述のような条件に基づいて蛍光色素で標識された塩基を用いる以外は、オリゴヌクレオチドの合成方法として知られている公知の方法、例えば特開2002−119291号公報等に記載の方法に従って作製することができる。
【0103】
<プライマー>
後述するCYP3A遺伝子多型検出方法では、例えば、検出対象となるCYP3A遺伝子多型を含む配列を、PCR法等の増幅法により増幅する場合、プライマーが用いられる。本発明において使用しうるプライマーは、特に制限されず、目的とする検出対象となるCYP3A遺伝子の多型の部位を含む核酸を増幅可能であればよい。前記核酸は、例えば、配列番号1の401番目の塩基に対応する塩基を含む核酸、配列番号2の201番目の塩基に対応する塩基を含む核酸、配列番号3の501番目の塩基に対応する塩基を含む核酸等があげられる。
【0104】
増幅法に適用するプライマーは、本発明の多型検出用プローブがハイブリダイゼーションできる領域が増幅できるものであれば、特に制限されず、配列番号1、配列番号2及び配列番号3で示される塩基配列から、当業者であれば適宜設計できる。前記プライマーの長さ及びTm値は、例えば、12〜40塩基(mer)及び40〜70塩基、又は、16〜30塩基及び55〜60塩基にすることができる。また、プライマーセットの各プライマーの長さは、例えば、同一でなくてもよいが、両プライマーのTm値は、ほぼ同一、又は、両プライマーのTm値の差が5℃以内であることが好ましい。
【0105】
以下に、本発明の多型検出方法において、本発明の多型検出用プローブがハイブリダイズする領域を含む塩基配列の増幅に使用できるプライマーの例を示す。なお、これらは例示であって、本発明を制限するものではない。
【0106】
前記配列番号1で示される配列のうち401番目の塩基(r)における多型を検出するためのプライマーは、下記P6、P6’、P7及びP7’からなる群より選択される少なくとも1種のオリゴヌクレオチドが好ましい。前記ハイブリダイゼーションならびにストリンジェントな条件は、前述の通りである。
(P6)配列番号1で示される塩基配列のうち322番目〜344番目の塩基を含む塩基長23〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチド
(P6’)配列番号1に示す塩基配列において322番目〜344番目の塩基を含む塩基長23〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチド
(P7)配列番号1で示される塩基配列のうち446番目〜463番目の塩基を含む塩基長18〜50塩基の塩基配列の相補鎖に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチド
(P7’)配列番号1に示す塩基配列において446番目〜463番目の塩基を含む塩基長18〜50の塩基配列に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチド
【0107】
前記P6のオリゴヌクレオチドは、配列番号1で示される塩基配列のうち322番目〜344番目の塩基を含む塩基長23〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチドであり、且つ配列番号1における401番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。前記P6’のオリゴヌクレオチドは、配列番号1に示す塩基配列において322番目〜344番目の塩基を含む塩基長23〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチドであり、且つ配列番号1における401番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。
【0108】
前記P7のオリゴヌクレオチドは、配列番号1で示される塩基配列のうち446番目〜463番目の塩基を含む塩基長18〜50塩基の塩基配列の相補鎖に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチドであり、且つ配列番号1における401番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。前記P7’のオリゴヌクレオチドは、配列番号1に示す塩基配列において446番目〜463番目の塩基を含む塩基長18〜50の塩基配列に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチドであり、且つ配列番号1における401番目の塩基を含む領域を増幅するオリゴヌクレオチドでもよい。
【0109】
以下に、本発明の多型検出方法において、前記配列番号1における401番目の塩基(r)を含む領域の増幅に使用できるプライマーの一例を示す。
P6 Fプライマー (配列番号14)(CYP3A5*3 F4)
5'-cgtatgtaccacccagcttaacg-3'
P7 Rプライマー (配列番号15)(CYP3A5*3 R4)
5'-cacaggagccacccaagg-3'
【0110】
また、前記配列番号1における401番目の塩基(r)の多型を検出するためには、前記P6又はP6’で表わされるオリゴヌクレオチド、及びP7又はP7’で表されるオリゴヌクレオチドを、一対のプライマーセットとして用いることがより好ましい。
【0111】
前記配列番号2で示される配列のうち201番目の塩基(s)における多型を検出するためのプライマーは、下記P8、P8’、P9、P9’、P10及びP10’からなる群より選択される少なくとも1種のオリゴヌクレオチドが好ましい。前記ハイブリダイゼーションならびにストリンジェントな条件は、前述の通りである。
(P8)配列番号2で示される塩基配列のうち118番目〜137番目の塩基を含む塩基長20〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチド
(P8’)配列番号2で示される塩基配列のうち118番目〜137番目の塩基を含む塩基長20〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチド
(P9)配列番号2で示される塩基配列のうち22番目〜49番目の塩基を含む塩基長28〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチド
(P9’) 配列番号2で示される塩基配列のうち22番目〜49番目の塩基を含む塩基長28〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチド
(P10)配列番号2で示される塩基配列のうち292番目〜312番目の塩基を含む塩基長21〜50塩基の塩基配列の相補鎖に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチド
(P10’)配列番号2に示す塩基配列において292番目〜312番目の塩基を含む塩基長21〜50の塩基配列に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチド
【0112】
前記P8のオリゴヌクレオチドは、配列番号2で示される塩基配列のうち118番目〜137番目の塩基を含む塩基長20〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチドであり、且つ配列番号2における201番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。前記P8’のオリゴヌクレオチドは、配列番号2で示される塩基配列のうち118番目〜137番目の塩基を含む塩基長20〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチドであり、且つ配列番号2における201番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。
【0113】
前記P9のオリゴヌクレオチドは、配列番号2で示される塩基配列のうち22番目〜49番目の塩基を含む塩基長28〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチドであり、且つ配列番号2における201番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。前記P9’のオリゴヌクレオチドは、配列番号2で示される塩基配列のうち22番目〜49番目の塩基を含む塩基長28〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチドであり、且つ配列番号2における201番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。
【0114】
前記P10のオリゴヌクレオチドは、配列番号2で示される塩基配列のうち292番目〜312番目の塩基を含む塩基長21〜50塩基の塩基配列の相補鎖に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチドであり、且つ配列番号2における201番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。前記P10’のオリゴヌクレオチドは、配列番号2に示す塩基配列において292番目〜312番目の塩基を含む塩基長21〜50の塩基配列に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチドであり、且つ配列番号2における201番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。
【0115】
以下に、本発明の多型検出方法において、前記配列番号2における201番目の塩基(s)を含む領域の増幅に使用できるプライマーの一例を示す。
P8 Fプライマー (配列番号16)
5'-aggatggtaaaaaggtgctg-3'
P10 Rプライマー (配列番号17)
5'-gagagaaagaatggatccaaa-3'
【0116】
前記プライマーは、例えば、後述するように付加配列を有してもよく、以下のプライマーが例示できる。下記配列において、下線部のCTAGA及びGACGAが、前記付加配列に該当する。
P9 Fプライマー (配列番号18)(CYP3A4*16-F6+CTAGA)
5'-CTAGAggagtgtgatagaaggtgatctagtaga-3'
P10 Rプライマー (配列番号28)(U0-R3+GACGA)
5'-GACGAgagagaaagaatggatccaaa-3'
【0117】
また、前記配列番号2における201番目の塩基(s)の多型を検出するためには、前記P8、P8’、P9又はP9’で表わされるオリゴヌクレオチド、及びP10又はP10’で表されるオリゴヌクレオチドを、一対のプライマーセットとして用いることがより好ましい。
【0118】
前記配列番号3で示される配列のうち501番目の塩基(r)における多型を検出するためのプライマーは、下記P11、P11’、P12及びP12’からなる群より選択される少なくとも1種のオリゴヌクレオチドが好ましい。前記ハイブリダイゼーションならびにストリンジェントな条件は、前述の通りである。
(P11)配列番号3で示される塩基配列のうち432番目〜457番目の塩基を含む塩基長26〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチド
(P11’)配列番号3に示す塩基配列において432番目〜457番目の塩基を含む塩基長26〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチド
(P12)配列番号3で示される塩基配列のうち508番目〜539番目の塩基を含む塩基長32〜50塩基の塩基配列の相補鎖に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチド
(P12’)配列番号3に示す塩基配列において508番目〜539番目の塩基を含む塩基長32〜50の塩基配列に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチド
【0119】
前記P11のオリゴヌクレオチドは、配列番号3で示される塩基配列のうち432番目〜457番目の塩基を含む塩基長26〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチドであり、且つ配列番号3における501番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。前記P11’のオリゴヌクレオチドは、配列番号3に示す塩基配列において432番目〜457番目の塩基を含む塩基長26〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチドであり、且つ配列番号3における501番目の塩基を含む領域を増幅するオリゴヌクレオチドでもよい。
【0120】
前記P12のオリゴヌクレオチドは、配列番号3で示される塩基配列のうち508番目〜539番目の塩基を含む塩基長32〜50塩基の塩基配列の相補鎖に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチドであり、且つ配列番号3における501番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。前記P12’のオリゴヌクレオチドは、配列番号3に示す塩基配列において508番目〜539番目の塩基を含む塩基長32〜50の塩基配列に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチドであり、且つ配列番号3における501番目の塩基を含む領域を増幅するオリゴヌクレオチドでもよい。
【0121】
以下に、本発明の多型検出方法において、前記配列番号3における501番目の塩基(r)を含む領域の増幅に使用できるプライマーの一例を示す。
P11 Fプライマー (配列番号26)(CYP3A4-1B-F1)
5'-ctgtaggtgtggcttgttgggatgaa-3'
P12 Rプライマー (配列番号27)(CYP3A4-1B-R1)
5'-ggagccattggcataaaatctattaaatcgc-3'
【0122】
また、前記配列番号3における501番目の塩基(r)の多型を検出するためには、前記P11又はP11’で表わされるオリゴヌクレオチド、及びP12又はP12’で表されるオリゴヌクレオチドを、一対のプライマーセットとして用いることがより好ましい。
【0123】
前記P6、P7、P8、P9、P10、P11及びP12において、前記同一性は、例えば、85%以上の同一性、90%以上の同一性、95%以上の同一性、96%以上の同一性、97%以上の同一性、98%以上の同一性又は99%以上の同一性を示してもよい。
【0124】
本発明におけるプライマーは、前記オリゴヌクレオチドを含むプライマーでもよいし、前記オリゴヌクレオチドからなるプライマーでもよい。前者の場合、本発明のプライマーは、例えば、前記オリゴヌクレオチドの3’末端及び5’末端の少なくとも一方に、付加配列を有してもよい。前記付加配列は、特に制限されず、その長さが、例えば、1〜20塩基長、3〜15塩基長、5〜10塩基長等であり、そのGC含量が、例えば、20〜80%程度、40〜70%程度、40〜60%程度である。
【0125】
本発明の多型の検出方法は、前記蛍光標識ヌクレオチドをプローブとして利用する方法であれば、特に制限されない。前記蛍光標識ヌクレオチドをプローブとして用いる多型検出方法の一例として、Tm解析を利用した多型検出方法について、以下に説明する。
【0126】
<多型検出方法>
本発明にかかるCYP3A遺伝子多型検出方法は、前記CYP3A遺伝子多型検出用プローブを少なくとも1種用いて、CYP3A遺伝子の多型を検出することを含む、CYP3A遺伝子多型検出方法である。本発明にかかる多型検出方法によれば、前記多型検出用プローブを少なくとも1種使用することにより、CYP3A遺伝子の多型を、簡便に、感度よく検出可能にする。
【0127】
本発明の多型検出方法は、CYP3A遺伝子における多型の検出方法であって、下記工程(I)〜(IV)を含むことができ、下記工程(V)を含んでいてもよい。なお、本発明の多型検出方法は、前記多型検出用プローブを使用することが特徴であって、その他の構成や条件等は、以下の記載に制限されない。
(I)前記多型検出用プローブ及び試料中の一本鎖核酸を接触させて、前記多型検出用プローブ及び前記一本鎖核酸をハイブリダイズしてハイブリッド形成体を得ること。
(II)前記ハイブリッド形成体を含む試料の温度を変化させることで、前記ハイブリッド形成体を解離させ、前記ハイブリッド形成体の解離に基づく蛍光シグナルの変動を測定すること。
(III)前記蛍光シグナルの変動に基づいてハイブリッド形成体の解離温度であるTm値を測定すること。
(IV)前記Tm値に基づいて、前記試料中の一本鎖核酸における、CYP3A遺伝子における多型の存在を検出すること。
(V)前記多型の存在に基づいて、前記試料中の一本鎖核酸における、多型を有する一本鎖核酸の存在比を検出すること。
【0128】
また、本発明においては、前記工程(I)〜(IV)又は前記工程(I)〜(V)に加えて、さらに、工程(I)の前又は工程(I)と同時に、核酸を増幅することを含んでいてもよい。なお、前記(III)でTm値を測定することには、例えば、ハイブリッド形成体の解離温度を測定することだけでなく、ハイブリット形成体の融解時に、温度に応じて変動する蛍光シグナルの微分値の大きさを測定することを含んでもよい。
【0129】
本発明において、前記試料中の核酸は、一本鎖核酸でもよいし二本鎖核酸でもよい。前記核酸が二本鎖核酸の場合、例えば、前記蛍光標識オリゴヌクレオチドとハイブリダイズすることに先立って、加熱により前記試料中の二本鎖核酸を融解(解離)させて、一本鎖核酸とすることを含むことが好ましい。二本鎖核酸を一本鎖核酸に解離することによって、前記蛍光標識オリゴヌクレオチドとのハイブリダイズが可能となる。
【0130】
本発明において、試料に含まれる検出対象である核酸は、例えば、生体試料に元来含まれる核酸でもよいが、検出精度が向上できることから、生体試料に元来含まれている核酸を鋳型として、PCR等の増幅法により、CYP3A遺伝子の変異した部位を含む領域を増幅させた増幅産物であることが好ましい。前記増幅産物の長さは、特に制限されないが、例えば、50〜1000塩基(mer)、又は80〜200塩基にすることができる。また、試料中の核酸は、例えば、生体試料由来のRNA(トータルRNA、mRNA等)からRT−PCR(Reverse Transcription PCR)により合成したcDNAであってもよい。
【0131】
本発明において、前記試料中の核酸に対する、本発明の多型検出用プローブの添加割合(モル比)は特に制限されない。試料中のDNAに対して、例えば、1倍以下が挙げられる。また、十分な検出シグナル確保の観点より、前記試料中の核酸に対する、本発明の多型検出用プローブの添加割合(モル比)は、0.1倍以下としうる。ここで、試料中の核酸は、例えば、検出目的の多型が発生している検出対象核酸と、前記多型が発生していない非検出対象核酸との合計でもよいし、検出目的の多型が発生している検出対象配列を含む増幅産物と、前記多型が発生していない非検出対象配列を含む増幅産物との合計でもよい。なお、試料中の核酸における前記検出対象核酸の割合は、通常、不明であるが、結果的に、前記多型検出用プローブの添加割合(モル比)は、検出対象核酸(検出対象配列を含む増幅産物)に対して10倍以下としうる。また、前記多型検出用プローブの添加割合(モル比)は、検出対象核酸(検出対象配列を含む増幅産物)に対して、5倍以下、又は3倍以下としうる。また、その下限は特に制限されないが、例えば、0.001倍以上、0.01倍以上、又は0.1倍以上としうる。
【0132】
前記DNAに対する本発明の多型検出用プローブの添加割合は、例えば、二本鎖核酸に対するモル比でもよいし、一本鎖核酸に対するモル比でもよい。
【0133】
本発明において、Tm値を決定するための温度変化に伴うシグナル変動の測定は、前述のような原理から、260nmの吸光度測定により行うこともできるが、前記多型検出用プローブに付加した標識のシグナルに基づくシグナルであって、一本鎖DNAと前記多型検出用プローブとのハイブリッド形成の状態に応じて変動するシグナルを測定することが好ましい。このため、前記多型検出用プローブとして、前述の蛍光標識オリゴヌクレオチドを使用することが好ましい。前記蛍光標識オリゴヌクレオチドは、例えば、標的配列(相補配列)にハイブリダイズしていないときの蛍光強度に比べて、標的配列にハイブリダイズしているときの蛍光強度が減少(消光)する蛍光標識オリゴヌクレオチド、または標的配列にハイブリダイズしていないときの蛍光強度に比べて、標的配列にハイブリダイズしているときの蛍光強度が増加する蛍光標識オリゴヌクレオチドが挙げられる。
【0134】
前者のようなプローブであれば、例えば、検出対象配列とハイブリッド(二本鎖DNA)を形成している際には蛍光シグナルを示さないか、蛍光シグナルが弱いが、加熱によりプローブが解離すると蛍光シグナルを示すようになるか、蛍光シグナルが増加する。また、後者のプローブであれば、例えば、検出対象配列とハイブリッド(二本鎖DNA)を形成することによって蛍光シグナルを示し、加熱によりプローブが解離すると蛍光シグナルが減少(消失)する。したがって、この蛍光標識に基づく蛍光シグナルの変化を、前記蛍光標識特有の条件(蛍光波長等)で検出することによって、前記260nmの吸光度測定と同様に、融解の進行ならびにTm値の決定を行うことができる。
【0135】
次に、本発明の多型検出方法について、蛍光色素に基づくシグナルの変化を検出する方法について、具体例を挙げて説明する。なお、本発明の多型検出方法は、前記多型検出用プローブを使用すること自体が特徴であり、その他の工程や条件については何ら制限されない。
【0136】
核酸増幅を行う際の鋳型となる核酸を含む試料としては、核酸、特に、CYP3A遺伝子を含んでいればよく、特に制限されない。例えば、大腸や肺等の組織、白血球細胞等の血球、全血、血漿、喀痰、口腔粘膜懸濁液、爪や毛髪等の体細胞、生殖細胞、乳、腹水液、パラフィン包埋組織、胃液、胃洗浄液、尿、腹膜液、羊水、細胞培養などの任意の生物学的起源に由来する又は由来しうるものを挙げられる。なお、試料の採取方法、核酸を含む試料の調製方法等は、特に制限されず、いずれも従来公知の方法が採用できる。また、鋳型となる核酸は、該起源から得られたままで、直接的に使用でき、あるいは、前記サンプルの特性を改変するために前処理した後で使用することができる。例えば、全血を試料とする場合、全血からのゲノムDNAの単離は、従来公知の方法によって行うことができる。例えば、市販のゲノムDNA単離キット(商品名GFX Genomic Blood DNA Purification kit;GEヘルスケアバイオサイエンス社製)等が使用できる。
【0137】
次に、単離したゲノムDNAを含む試料に、前記蛍光標識オリゴヌクレオチドを含む多型検出用プローブを添加する。前記多型検出用プローブは、単離したゲノムDNAを含む液体試料に添加してもよいし、適当な溶媒中でゲノムDNAと混合してもよい。前記溶媒は、特に制限されず、例えば、Tris−HCl等の緩衝液、KCl、MgCl2、MgSO4、グリセロール等を含む溶媒、PCR反応液等、従来公知のものが挙げられる。
【0138】
前記多型検出用プローブの添加のタイミングは、特に制限されず、例えば、後述するPCR等の増幅処理を行う場合、増幅処理の後に、PCR増幅産物に対して添加してもよいし、増幅処理前に添加してもよい。PCR等による増幅処理前に、前記検出用プローブを添加する場合は、例えば、前述のように、前記多型検出用プローブの3'末端に、蛍光色素を付加したり、リン酸基を付加したりすることが好ましい。
【0139】
核酸増幅の方法としては、例えばポリメラーゼを用いる方法等が挙げられる。その例としては、PCR法、ICAN法、LAMP法、NASBA法等が挙げられる。ポリメラーゼを用いる方法により増幅する場合は、本発明プローブの存在下で増幅を行うことが好ましい。用いるプローブ及びポリメラーゼに応じて、増幅の反応条件等を調整することは当業者であれば容易である。これにより、核酸の増幅後にプローブのTm値を解析するだけで多型を評価できるので、反応終了後、増幅産物を取り扱う必要がない。よって、前記増幅産物による汚染の心配がない。また、増幅に必要な機器と同じ機器で検出することが可能なので、容器を移動する必要がなく、自動化も容易である。
【0140】
また、PCR法に用いるDNAポリメラーゼとしては、通常用いられるDNAポリメラーゼを特に制限なく用いることができる。例えば、GeneTaq(ニッポンジーン社製)、PrimeSTAR Max DNA Polymerase(タカラバイオ社製)、Taq ポリメラーゼ等を挙げることができる。ポリメラーゼの使用量としては、特に制限されず、通常用いられている濃度があげられる。例えば、Taqポリメラーゼを用いる場合、反応溶液量50μlに対して、例えば、0.01U〜100Uの濃度とすることができる。これにより、CYP3A遺伝子多型の検出感度が高まるなどの傾向がある。
【0141】
また、PCR法は、通常用いられる条件を適宜選択することで行うことができる。なお、増幅の際、例えば、リアルタイムPCRによって増幅をモニタリングし、試料に含まれるDNA(検出対象配列)のコピー数を調べることもできる。すなわち、PCRによるDNA(検出対象配列)の増幅に従ってハイブリッドを形成するプローブの割合が増えるので、蛍光強度が変動する。これをモニタリングすることで、試料に含まれる検出対象配列(正常DNAまたは変異DNA)のコピー数や存在比を評価できる。
【0142】
本発明の多形検出方法においては、前記蛍光標識オリゴヌクレオチドと、試料中の一本鎖核酸とを接触させて、両者をハイブリダイズさせる。試料中の一本鎖核酸は、例えば、前述のようにして得られたPCR増幅産物を解離することで調製できる。
【0143】
前記PCR増幅産物の解離(解離工程)における加熱温度は、特に制限されず、前記増幅産物が解離できる温度があげられる。前記温度は、例えば、85〜95℃である。加熱時間も特に制限されない。加熱時間は、例えば、1秒〜10分、又は1秒〜5分としうる。
【0144】
また、解離した一本鎖DNAと前記蛍光標識オリゴヌクレオチドとのハイブリダイズは、例えば、前記解離工程の後、前記解離工程における加熱温度を降下させることによって行うことができる。温度条件としては、例えば、40〜50℃である。
【0145】
ハイブリダイズ工程の反応液における各組成の体積や濃度は、特に制限されない。具体例としては、前記反応液におけるDNAの濃度は、例えば、0.01μmol/L〜1μmol/L、又は0.1μmol/L〜0.5μmol/Lとしうる。前記蛍光標識オリゴヌクレオチドの濃度は、例えば、前記DNAに対する添加割合を満たす範囲であり、例えば、0.001μmol/L〜10μmol/L、又は0.001μmol/L〜1μmol/Lとしうる。
【0146】
そして、得られた前記一本鎖DNAと前記蛍光標識オリゴヌクレオチドとのハイブリッド形成体を徐々に加熱し、温度上昇に伴う蛍光シグナルの変動を測定する。例えば、QProbeを使用した場合、一本鎖DNAとハイブリダイズした状態では、解離した状態に比べて蛍光強度が減少(または消光)する。したがって、例えば、蛍光が減少(または消光)しているハイブリッド形成体を徐々に加熱し、温度上昇に伴う蛍光強度の増加を測定すればよい。
【0147】
蛍光強度の変動を測定する際の温度範囲は、特に制限されないが、例えば、開始温度が室温〜85℃、又は25〜70℃としうる。終了温度は、例えば、40〜105℃としうる。また、温度の上昇速度は、特に制限されないが、例えば、0.1℃/秒〜20℃/秒、又は0.3℃/秒〜5℃/秒としうる。
【0148】
次に、前記シグナルの変動を解析してTm値として決定する。具体的には、得られた蛍光強度から各温度における微分値(−d蛍光強度/dt)を算出し、最も低い値を示す温度をTm値として決定できる。また、単位時間当たりの蛍光強度増加量(蛍光強度増加量/t)が最も高い点をTm値として決定することもできる。なお、標識化プローブとして、消光プローブではなく、ハイブリッド形成によりシグナル強度が増加するプローブを使用した場合には、反対に、蛍光強度の減少量を測定すればよい。
【0149】
また、本発明においては、前述のように、ハイブリッド形成体を加熱して、温度上昇に伴う蛍光シグナル変動(好ましくは蛍光強度の増加)を測定するが、この方法に代えて、例えば、ハイブリッド形成時におけるシグナル変動の測定を行ってもよい。すなわち、前記プローブを添加した試料の温度を降下させてハイブリッド形成体を形成する際の前記温度降下に伴う蛍光シグナル変動を測定してもよい。
【0150】
具体例として、QProbeを使用した場合、前記プローブを試料に添加した際には、前記プローブは解離状態にあるため蛍光強度が大きいが、温度の降下によりハイブリッド形成体を形成すると、前記蛍光が減少(または消光)する。したがって、例えば、前記加熱した試料の温度を徐々に降下して、温度下降に伴う蛍光強度の減少を測定すればよい。他方、ハイブリッド形成によりシグナルが増加する標識化プローブを使用した場合、前記プローブを試料に添加した際には、前記プローブは解離状態にあるため蛍光強度が小さい(または消光)が、温度の降下によりハイブリッドを形成すると、蛍光強度が増加するようになる。したがって、例えば、前記試料の温度を徐々に降下して、温度下降に伴う蛍光強度の増加を測定すればよい。
【0151】
本発明の多型検出方法において、前記多型検出用プローブは、例えば、いずれか一種を使用してもよいし、二種以上を併用してもよい。使用する前記多型検出用プローブの種類は、例えば、検出目的の多型に応じて適宜決定できる。本発明においては、例えば、CYP3A5*3多型のみ、CYP3A4*16多型のみ、CYP3A4*1B多型のみを検出してもよいし、いずれか二種又は三種全ての多型を、一つの反応系で検出することもできる。また、前記CYP3A5*3多型、CYP3A4*16多型及びCYP3A4*1B多型の少なくともいずれかと、その他の多型とを、一つの反応系で検出することも可能である。
【0152】
本発明の多型検出方法において、前記多型検出用プローブを二種以上併用する場合、例えば、各プローブが、異なる蛍光色素を有する標識プローブであることが好ましい。前記異なる蛍光色素は、例えば、検出条件の異なる蛍光色素があげられる。
【0153】
複数の遺伝子多型を、同一の系で検出する方法としては、特に制限されるものではない。例えば、各多型を検出できる各プローブを予め混合し、試料に添加してもよいし、一本鎖核酸を含む試料に各多型を検出できる各プローブを連続的に添加してもよい。ここで、「系」とは、蛍光標識オリゴヌクレオチド及び一本鎖核酸がハイブリダイズしたハイブリッド形成体を含む試料で形成される1個の独立した反応系を意味する。
【0154】
<薬効判定方法>
本発明の薬効判定方法は、前述した多型検出方法によりCYP3A遺伝子の多型を検出すること、及び、前記検出結果に基づいて薬剤に対する耐性又は薬剤の薬効を判定することを含む。
【0155】
前記多型検出方法では、本発明における多型検出用プローブを用いて、感度よく且つ簡便に、CYP3A遺伝子の多型を検出する。このため、CYP3A遺伝子におけるこの多型に基づいて、薬剤の判定を感度よく且つ簡便に行うことができる。
【0156】
また、多型の有無、変異配列と正常配列との存在比に基づいて、薬剤に対する耐性や薬剤の薬効を判定することができる。そして、本発明の薬効判定方法は、変異の有無、変異配列の存在比に基づいて、薬剤の投与量の増加、他の治療薬への変更等への切り替え等の疾病の治療方針を決定するのに有用である。前記判定対象となる薬剤としては、例えば、免疫抑制剤、分子標的治療薬、抗うつ薬等が挙げられ、特に免疫抑制剤及び分子標的治療薬が挙げられる。前記薬剤の具体例としては、例えば、タクロリムス等の免疫抑制剤があげられる。
【0157】
前記薬剤は、例えば、以下のような作用機序の物質があげられる。
(1)GABAA(ガンマ−アミノ−ブチル酸レセプター)の特異的な部位に結合する物質:例えば、アルプラゾラム(alprazolam)、エスタゾラム(estazolam)、エスゾピクロン(eszopiclone)、ミダゾラム(midazolam)等の向精神薬
(2)ナトリウムチャンネルの不活性化状態を安定化する物質:例えば、カルバマゼピン(carbamazepine)等の向精神薬
(3)D2部分アゴニスト(D2 partial agonist):例えば、アリピプラゾール(aripiprazole)等の向精神薬
(4)セトロニン 5-HT1Aレセプター部分アゴニスト(serotonin 5-HT1A receptor partial agonist):例えば、ブスピロン(buspirone)等の向精神薬
(5)選択的セロトニン再取り込みインヒビター(selective serotonin reuptake inhibitor):例えば、シタロプラム(citalopram)、フルオキセチン(fluoxetine)等の向精神薬
(6)セロトニン−ノルエピネフリン再取り込みインヒビター(serotonin-norepinephrine reuptake inhibitor):例えば、アミトリプチリン(amitriptyline)等の向精神薬
(7)D2レセプターをブロックする物質:例えば、ハロペリドール(haloperidol)等の向精神薬
(8)5-HT2Aレセプターのアンタゴニスト(antagonist at the 5-HT2A receptors):例えば、ネファゾドン(nefazodone)等の向精神薬
(9)以下のポストシナプスレセプターをブロックするピモジド(Pimozide):
D2(極めて強い)、D3、α1-アドレナリン、5-HT2A(強い)
(10)以下の薬理作用を有するクエチアピン(Quetiapine):
D1 (IC50 = 1268nM),D2 (IC50 = 329nM),D3およびD4レセプターアンタゴニスト,5-HT1A (IC50 = 717nM),5-HT2A (IC50 = 148nM),5-HT2C,および5-HT7レセプターアンタゴニスト,mAChレセプター (IC50 = >5000nM)アンタゴニスト
(11)これらの他に、向精神薬として、例えば、リスペリドン(risperidone)、セルトラリン(sertraline)、トラゾドン(trazodone)、トリアゾラム(triazolam)、ザレプロン(zaleplon)、ゾルピデム(zolpidem)があげられ、喘息用薬(Asthma Medication)として、例えば、フルチカゾン(fluticasone)、サルメテロール(salmeterol)、ジレウトン(zileuton)があげられ、抗生物質/抗真菌薬/免疫抑制剤(Antibiotics/Antifungals/Immunosuppresant)として、例えば、マクロライド系(macrolides)(アジスロマイシンazithromycinを除く)、タクロリムス(Tacrolimus)、イトラコナゾール(itraconazole)、ケトコナゾール(ketoconazole)、テリスロマイシン(telithromycin)があげられ、抗けいれん薬(Anticonvulsants)として、例えば、カルバマゼピン(Carbamazepine)、エトスクシミド(ethosuximide)、フェルバメート(felbamate)、チアガビン(tiagabine)、ゾニサミド(Zonisamide)があげられ、抗ヒスタミン薬(Antihistamines)として、例えば、デスロラタジン(Desloratadine)、フェキソフェナジン(fexofenadine)、ロラタジン(loratadine)があげられ、薬物乱用/治療(Drugs of abuse/treatment)として、例えば、ブプレノルフィン(buprenorphine)、コカイン(cocaine)、フェンタニル(fentanyl)、ケタミン(ketamine)、メタドン(methadone)、オキシコドン(oxycodone)、フェンシクリジン(phencyclidine)があげられ、カルシウムチャネル遮断薬/ホルモン/化学療法剤(Calcium Channel Blockers/Hormones/chemo-therapeutics)として、例えば、コルチゾール(cortisols)、デソゲストレル(p)(desogestrel (p))、エチニルエストラジオール(ethinyl estradiol)、黄体ホルモン(progestins)、プロゲステロン(progesterone)、ビンクリスチン等(vincristine and others)があげられ、その他の薬剤として、例えば、アプレピタント(aprepitant)、シナカルセト(cinacalcet)、エソメプラゾール(esomeprazole)、グラニセトロン(granisetron)、ナテグリニド(nateglinide)、オメプラゾール(omeprazole)、ピオグリタゾン(pioglitazone)、キニジン(quinidine)、シルデナフィル(sildenafil)、スタチン類(Statins)、アトルバスタチン、ロバスタチン、シンバスタチン(atorvastatin, lovastatin, simvastatin)、トルテロジン(tolterodine)があげられ、HIVインヒビター(HIV inhibitor)として、例えば、リトナビル(ritonavir)、サクイナビル(saquinavir)があげられる。なお、これらの薬剤には限定されず、例えば、これらの薬剤と同じまたは類似するメカニズムおよび/または同じまたは類似する経路により代謝される薬剤等も含まれる。
【0158】
<多型検出用試薬キット>
本発明のCYP3A遺伝子における多型を検出するためのCYP3A遺伝子多型検出用試薬キットは、前述した多型検出用プローブを含む。前記多型検出用試薬キットには、CYP3A遺伝子のうち配列番号1で示される配列のうち401番目の塩基における多型、配列番号2で示される配列のうち201番目の塩基における多型及び/又は配列番号3で示される配列のうち501番目の塩基における多型を、簡便にかつ感度よく検出することが可能な前記多型検出用プローブを、少なくとも1種を含むことにより、例えば、CYP3A遺伝子の多型の検出を、より簡便に行うことができる等の傾向がある。
【0159】
また、本発明における多型検出用試薬キットは、前述の検出対象となるCYP3A遺伝子多型を含む配列を増幅するためのプライマーを、さらに含んでいてもよい。これにより、本発明における多型検出用試薬キットは、精度よく、CYP3A遺伝子の多型の検出を行うことができる。なお、前記多型検出用試薬キットに含まれ得る前記プローブ及びプライマーについては、前述した事項をそのまま適用できる。
【0160】
前記多型検出用プローブとして、2種以上の蛍光標識オリゴヌクレオチドを含む場合、それぞれの蛍光標識オリゴヌクレオチドは、混合された状態で含まれていても、別個に含まれていてもよい。また、2種類以上の本発明のプローブが混合された状態で本発明の多型検出用試薬キットに含まれる場合、および、別個の試薬として含まれているが、例えば使用時に同じ反応系で各蛍光標識オリゴヌクレオチドと各検出対象配列とのTm解析を行う場合、2種以上の各プローブは発光波長が互いに異なる蛍光色素で標識化されていることが好ましい。このように蛍光物質の種類を変えることで、同じ反応系であっても、それぞれのプローブについての検出を行うことも可能になる。
【0161】
また、本発明における検出用試薬キットは、前記プローブの他に、本発明の検出方法における核酸増幅を行うのに必要とされる試薬類をさらに含んでいてもよい。また、前記プローブ、前記プライマー及びその他の試薬類は、別個に収容されていてもよいし、それらの一部が混合物とされていてもよい。
【0162】
なお、「別個に収容」とは、各試薬が非接触状態を維持できるように区分けされたものであればよく、必ずしも独立して取り扱い可能な個別の容器に収容される必要はない。
【0163】
本発明の検出用試薬キットは、多型部位を含む配列(プローブがハイブリダイズする領域)を増幅するためのプライマーセットを含むことで、例えば、より高感度に多型を検出できる。
【0164】
さらに、本発明の多型検出用試薬キットは、取り扱い説明書を含むことが好ましい。前記取り扱い説明書は、例えば、前記多型検出用プローブを使用して、検出対象である核酸を含む試料について微分融解曲線を作成し、そのTm値解析を行って、CYP3A遺伝子における変異を検出することが記載された取扱い説明書、又は検出用試薬キットに含まれる若しくは追加的に含むことが可能な各種の試薬について記載された使用説明書があげられる。
【実施例】
【0165】
本発明の実施例について説明する。ただし、本発明は、下記実施例により制限されない。
【0166】
[実施例1]
本例では、野生型の被検核酸と、変異型の被検核酸との共存下、Tm解析を行い、CYP3A遺伝子のCYP3A5*3多型及びCYP3A4*16多型を検出した。
【0167】
核酸試料として、希釈血液、精製ゲノム及びプラスミドを準備した。前記希釈血液は、EDTA採血管を用いて採取した全血10μLと、下記表1に示す希釈液1 70μLとを混合して混合液を調製し、前記混合液 10μLと下記表1に示す希釈液2 70μLとを混合後、さらに、これを95℃で10分間加熱することにより、調製した。前記全血に含まれる被検核酸は、CYP3A5*3多型が、野生型と変異型とのヘテロ型であり、CYP3A4*16多型が、野生型のホモ型である。前記精製ゲノムは、常法により、全血から調製した。前記精製ゲノムは、CYP3A5*3多型が変異型のホモ型であり、CYP3A4*16多型が野生型のホモ型である。前記プラスミドは、CYP3A4遺伝子の部分配列として、配列番号2における塩基番号1〜411のオリゴヌクレオチドが挿入されたCYP3A4*16変異型プラスミドを準備した。前記CYP3A4*16変異型プラスミドにおいて、配列番号2における塩基番号201の塩基(s)は、グアニン(g)である。
【0168】
【表1】

【0169】
前記核酸試料を、下記に示す割合で混合し、下記試料1〜4を調製した。
(試料)
試料 希釈血液 精製ゲノム CYP3A4*16
No. 変異型プラスミド
1 100% 0% 0%
2 0% 100% 0%
3 0% 50% 50%
4 0% 0% 100%
【0170】
前記各試料を含む、50μLのPCR反応混合物を調製した。前記PCR反応混合物は、前記試料4μLと、下記表2に示すPCR反応液の各成分とを、以下の濃度となるように混合して、調製した。前記PCR反応混合物について、全自動SNPs検査装置(商品名i−densy(登録商標)IS−5310、アークレイ社製)を用いて、PCR及びTm解析を行った。前記PCRは、95℃で1分処理した後、95℃1秒及び56℃15秒を1サイクルとして50サイクル繰り返した。そして、さらに、95℃で1秒、40℃で60秒処理した。そして、続けて、前記反応液を、温度の上昇速度を1℃/3秒として、40℃から75℃に加熱していき、蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定することによって、Tm解析を行った。また、コントロールとして、前記試料に代えて、前記希釈液2を用いた以外は、前述と同様にして、PCR及びTm解析を行った。BODIPY FLの検出波長は、520−555nm、TAMRAの検出波長は、585−700nmとした(以下、同様)。
【0171】
【表2】

【0172】
前記CYP3A5*3用プライマー及びCYP3A4*16用プライマーの配列を以下に示す。
(CYP3A5*3用プライマー)
Fプライマー (配列番号14)(CYP3A5*3 F4)
5'-cgtatgtaccacccagcttaacg-3'
Rプライマー (配列番号15)(CYP3A5*3 R4)
5'-cacaggagccacccaagg-3'
(CYP3A4*16用プライマー)
Fプライマー (配列番号16)(UO-F2)
5'-aggatggtaaaaaggtgctg-3'
Rプライマー (配列番号17)(UO-R3)
5'-gagagaaagaatggatccaaa-3'
【0173】
前記CYP3A5*3用プローブは、下記配列のCYP3A5*3変異型プローブを使用した。前記CYP3A5*3用プローブは、CYP3A5*3変異型のCYP3A遺伝子のアンチセンス鎖用の変異型プローブである。前記配列において、下線部の塩基が、CYP3A5*3変異型配列に対して同一性を示す塩基である。前記CYP3A5*3用プローブは、3’末端を、蛍光色素BODIPY FLで標識化した。前記CYP3A4*16用プローブは、下記配列のCYP3A4*16変異型プローブを使用した。前記CYP3A4*16用プローブは、CYP3A4*16変異型のCYP3A遺伝子のセンス鎖用の変異型プローブである。前記配列において、下線部の塩基が、CYP3A4*16変異型配列に相補的な塩基である。前記CYP3A4*16用プローブは、3’末端を、蛍光色素TAMRAで標識化した。
CYP3A5*3用プローブ (配列番号4)(3FL-CYP3A5*3-mt-F1-21)
5'-ttgtctttcaGtatctcttcc-(BODIPY FL)-3'
CYP3A4*16用プローブ (配列番号10)(U0-3TMR4)
5'-atgatgtgctaCtgatcacatccatgc-(TAMRA)-3'
【0174】
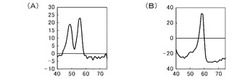
これらの結果を図1〜5に示す。図1〜5は、温度上昇に伴う蛍光強度の変化を示すTm解析のグラフである。図1は、試料1、図2は、試料2、図3は、試料3、図4は、試料4、図5は、コントロールの結果である。図1〜3及び5において、(A)は、CYP3A5*3用プローブに関する融解曲線であり、(B)は、CYP3A4*16用プローブに関する融解曲線である。図4は、CYP3A4*16用プローブに関する融解曲線である。横軸は、測定時の温度(℃)を示し、縦軸は蛍光強度の変化(以下、「蛍光変化量」ともいう)を示し、単位は「d蛍光強度増加量/dt」(dF/dt)とした。前記CYP3A5*3用プローブは、CYP3A5*3野生型とのTm値が49℃付近、CYP3A5*3変異型とのTm値が56℃付近であり、前記CYP3A4*16用プローブは、CYP3A4*16野生型とのTm値が59℃付近、CYP3A4*16変異型とのTm値が67℃付近である。
【0175】
図1(A)に示すように、CYP3A5*3多型について、野生型と変異型とをヘテロ型で有する試料1は、野生型及び変異型のTm値で、それぞれピークが確認された。図1(B)に示すように、CYP3A4*16多型について、野生型をホモ型で有する試料1は、野生型のTm値のみでピークが確認された。
【0176】
図2(A)に示すように、CYP3A5*3多型について、変異型をホモ型で有する試料2は、変異型のTm値のみでピークが確認された。図2(B)に示すように、CYP3A4*16多型について、野生型をホモ型で有する試料2は、野生型のTm値のみでピークが確認された。
【0177】
図3(A)に示すように、CYP3A5*3多型について、変異型をホモ型で有する試料3は、変異型のTm値のみでピークが確認された。図3(B)に示すように、CYP3A4*16多型について、前記精製ゲノムの野生型と前記プラスミドの変異型とを有する試料3は、野生型と変異型のTm値でそれぞれピークが確認された。
【0178】
図4に示すように、CYP3A4*16多型について、変異型をホモ型で有する試料4は、変異型のTm値のみでピークが確認された。なお、CYP3A5*3多型を含む領域の塩基配列を有さない試料4は、CYP3A5*3の多型のピークが確認されなかった。
【0179】
図5(A)及び(B)に示すように、コントロールである希釈液2は、両ピーク共に確認されなかった。
【0180】
[実施例2]
本例では、アンチセンス鎖にハイブリダイズするプローブを使用して、野生型人工核酸及び変異型人工核酸について、Tm解析を行い、CYP3A遺伝子の多型(CYP3A4*16)を検出した。
【0181】
下記配列に示す、配列番号2における塩基番号173〜222に相補的な変異型人工核酸(mt)及び野生型人工核酸(wt)を調製した。前記配列において、下線部が、配列番号2における塩基番号201の塩基に対応する。各人工核酸を0.1μmol/Lに調整して、試料とした。
mt(配列番号19)
ttcactccaratgatgtgctaCtgatcacatccatgctgtaggccccaaa
wt(配列番号20)
ttcactccaratgatgtgctaGtgatcacatccatgctgtaggccccaaa
【0182】
前記各試料を含む、50μLの反応混合物を調製した。前記反応混合物は、下記表3に示す反応液の各成分を、以下の濃度となるように混合して、調製した。前記反応混合物について、全自動SNPs検査装置(商品名i−densy(登録商標)IS−5310、アークレイ社製)を用いて、Tm解析を行った。前記Tm解析は、前記反応液を、95℃で1秒、40℃で60秒処理した後、温度の上昇速度を1℃/3秒として、40℃から75℃に加熱していき、蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定することによって、行った。
【0183】
【表3】

【0184】
前記プローブは、下記配列のCYP3A4*16変異型プローブを使用した。前記プローブは、変異型のCYP3A4遺伝子のアンチセンス鎖用の変異型プローブである。前記配列において、下線部の塩基が、CYP3A4*16変異型配列に対して同一性を示す塩基である。前記プローブは、3’末端を、蛍光色素TAMRAで標識化した。
CYP3A4*16用変異型プローブ (配列番号6)(3T-CYP3A4*16-MF1)
5'-gatgtgatcagtagc-(TAMRA)-3'
【0185】
これらの結果を図6に示す。図6は、温度上昇に伴う蛍光強度の変化を示すTm解析のグラフである。図6において、(A)はmt 100%、(B)はwt 100%の結果である。横軸は、測定時の温度(℃)を示し、縦軸は蛍光強度の変化(以下、「蛍光変化量」ともいう)を示し、単位は「d蛍光強度増加量/dt」(dF/dt)とした。前記CYP3A4*16変異型プローブは、mtとのTm値が60℃付近、wtとのTm値が53℃付近である。
【0186】
図6(A)に示すように、mtは、mtのTm値でのみピークが確認された。一方、図6(B)に示すように、wtは、wtのTm値でのみピークが確認された。
【0187】
[実施例3]
本例では、センス鎖にハイブリダイズするプローブを使用して、野生型人工核酸及び変異型人工核酸について、Tm解析を行い、CYP3A遺伝子の多型(CYP3A4*16)を検出した。以下に示す野生型人工核酸、変異型人工核酸及びCYP3A4*16変異型プローブを使用した以外は、前記実施例2と同様にして、Tm解析を行った。
【0188】
下記配列に示す、配列番号2における塩基番号173〜222に相同な変異型人工核酸(mt)及び野生型人工核酸(wt)を調製した。前記配列において、下線部が、配列番号2における塩基番号201の塩基に対応する。各人工核酸を0.1μmol/Lに調整して、試料とした。
mt(配列番号21)
tttggggcctacagcatggatgtgatcaGtagcacatcatytggagtgaa
wt(配列番号22)
tttggggcctacagcatggatgtgatcaCtagcacatcatytggagtgaa
【0189】
前記プローブは、下記配列のCYP3A4*16変異型プローブを使用した。前記プローブは、変異型のCYP3A4遺伝子のセンス鎖用の変異型プローブである。前記配列において、下線部の塩基が、CYP3A4*16変異型配列に相補的な塩基である。前記プローブは、3’末端を、蛍光色素TAMRAで標識化した。
CYP3A4*16用プローブ (配列番号8)(3T-CYP3A4*16-MR1)
5'-tgtgctactgatcacatcc-(TAMRA)-3'
【0190】
これらの結果を図7に示す。図7は、温度上昇に伴う蛍光強度の変化を示すTm解析のグラフである。図7において、(A)はmt 100%、(B)はwt 100%の結果である。横軸は、測定時の温度(℃)を示し、縦軸は蛍光強度の変化(以下、「蛍光変化量」ともいう)を示し、単位は「d蛍光強度増加量/dt」(dF/dt)とした。前記CYP3A4*16変異型プローブは、mtとのTm値が75℃付近、wtとのTm値が68℃付近である。
【0191】
図7(A)に示すように、mtは、mtのTm値でのみピークが確認された。一方、図7(B)に示すように、wtは、wtのTm値でのみピークが確認された。
【0192】
[比較例1]
本例では、センス鎖にハイブリダイズするプローブを使用して、野生型人工核酸及び変異型人工核酸について、Tm解析を行い、CYP3A遺伝子の多型(CYP3A5*3)を検出した。以下に示す野生型人工核酸、変異型人工核酸及びCYP3A5*3変異型プローブを使用した以外は、前記実施例2と同様にして、Tm解析を行った。
【0193】
下記配列に示す、配列番号1における塩基番号379〜428に相同な変異型人工核酸(mt)及び野生型人工核酸(wt)を調製した。下記配列において、下線部が配列番号1における401番目の塩基に対応する。各人工核酸を0.1μmol/Lに調整して、試料とした。
mt(配列番号23)
taaagagctcttttgtctttcaAtatctcttccctgtttggaccacatta
wt(配列番号24)
taaagagctcttttgtctttcaGtatctcttccctgtttggaccacatta
【0194】
前記プローブは、下記配列のCYP3A5*3変異型プローブを使用した。前記プローブは、変異型のCYP3A5遺伝子のセンス鎖用の変異型プローブである。前記配列において、下線部の塩基が、CYP3A5*3変異型配列に相補的な塩基である。前記CYP3A5*3変異型プローブは、3’末端を、蛍光色素TAMRAで標識化した。
CYP3A5*3変異型プローブ (配列番号25)(5T-CYP3A5*3-mt-R1-22)
5'-(TAMRA)-cagggaagagataCtgaaagac-P-3'
【0195】
これらの結果を図8に示す。図8は、温度上昇に伴う蛍光強度の変化を示すTm解析のグラフである。図8において、(A)はmt 100%、(B)はwt 100%の結果である。横軸は、測定時の温度(℃)を示し、縦軸は蛍光強度の変化(以下、「蛍光変化量」ともいう)を示し、単位は「d蛍光強度増加量/dt」(dF/dt)とした。
【0196】
図8(A)及び(B)に示すように、mt及びwtは共に、明瞭なピークが確認できなかった。
【0197】
[比較例2]
本例では、センス鎖にハイブリダイズするプローブを使用して、野生型人工核酸及び変異型人工核酸について、Tm解析を行い、CYP3A遺伝子の多型(CYP3A4*16)を検出した。以下に示すCYP3A4*16変異型プローブを使用した以外は、前記実施例3と同様にして、Tm解析を行った。
【0198】
前記プローブは、下記配列のCYP3A4*16変異型プローブを使用した。前記プローブは、変異型のCYP3A4遺伝子のセンス鎖用の変異型プローブである。前記配列において、下線部の塩基が、CYP3A4*16変異型配列に相補的な塩基である。前記CYP3A4*16変異型プローブは、3’末端を、蛍光色素TAMRAで標識化した。
CYP3A4*16変異型プローブ (配列番号9)(U0-3TMR2)
5'-ctaCtgatcacatccatgctg-(TAMRA)-3'
【0199】
これらの結果を図9に示す。図9は、温度上昇に伴う蛍光強度の変化を示すTm解析のグラフである。図9において、(A)はmt 100%、(B)はwt 100%の結果である。横軸は、測定時の温度(℃)を示し、縦軸は蛍光強度の変化(以下、「蛍光変化量」ともいう)を示し、単位は「d蛍光強度増加量/dt」(dF/dt)とした。
【0200】
図9(A)に示すように、mtは、mtのTm値のみでピークが確認された。一方、図9(B)に示すように、wtはピークが確認されなかった。
【0201】
[実施例4]
本例では、CYP3A4遺伝子のCYP3A4*1B、CYP3A4*16及びCYP3A5*3の多型を、同一反応液を用いて検出した。
【0202】
核酸試料として、精製ゲノム、プラスミド及び前処理済の全血を準備した。前記精製ゲノムは、常法により、EDTA採血管を用いて採取した全血から調製し、400コピー/μLに調整したものを試料として使用した。前記プラスミドは、CYP3A4遺伝子の部分配列として、配列番号3における塩基番号366〜651のオリゴヌクレオチドが挿入されたCYP3A4*1B変異型プラスミドと、配列番号2における塩基番号1〜411のオリゴヌクレオチドが挿入されたCYP3A4*16変異型プラスミドを準備した。前者のCYP3A4*1B変異型プラスミドは、配列番号3における塩基番号501を変異型(g)とし、後者のCYP3A4*16変異型プラスミドは、配列番号2における塩基番号201を変異型(g)とした。それぞれのプラスミドを2000コピー/μLに調整し、0.5μLずつ混合したものを試料として使用した。前記前処理済の全血は、前記精製ゲノムの調製に使用した同じ前記全血10μLと、前記表1に示す希釈液1 70μLとを混合して混合液を調製し、前記混合液 10μLと前記表1に示す希釈液2 70μLとを混合後、さらに、これを95℃で10分間加熱することにより、調製した。前記全血に含まれる被検核酸は、CYP3A4*1B多型が、野生型のホモ型であり、CYP3A5*3多型が、野生型と変異型とのヘテロ型であり、CYP3A4*16多型が、野生型のホモ型である。
【0203】
前記各試料を含む、50μLのPCR反応混合物を調製した。前記PCR反応混合物は、前記試料と、下記表4に示すPCR反応液の各成分を、以下の濃度となるように混合して、調製した。前記PCR反応混合物において、精製ゲノム試料の濃度は、2×106copy/L、プラスミド試料の濃度は、2×107copy/L、全血試料は、5.3mL/Lとした。前記PCR反応混合物について、全自動SNPs検査装置(商品名i−densy(登録商標)IS−5310、アークレイ社製)を用いて、PCR及びTm解析を行った。前記PCRは、95℃で1分処理した後、95℃1秒及び58℃30秒を1サイクルとして50サイクル繰り返した。そして、さらに、95℃で1秒、40℃で60秒処理した後、前記反応液を、温度の上昇速度を1℃/3秒として、40℃から75℃に加熱していき、蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定することによって、Tm解析を行った。また、コントロールとして、前記試料に代えて、前記希釈液2を用いた以外は、前述と同様にして、PCR及びTm解析を行った。Pacific Blueの検出波長は、445−480nm、BODIPY FLの検出波長は、520−555nm、TAMRAの検出波長は、585−700nmとした。
【0204】
【表4】

【0205】
前記CYP3A4*1B用のプライマー及びプローブの配列を以下に示す。
(CYP3A4*1B用プライマー)
Fプライマー (配列番号26)(CYP3A4-1B-F1)
5'-ctgtaggtgtggcttgttgggatgaa-3'
Rプライマー (配列番号27)(CYP3A4-1B-R1)
5'-ggagccattggcataaaatctattaaatcgc-3'
(CYP3A4*1B用プローブ)
変異型プローブ(配列番号12)(3PB-CYP3A4*1B-R3)
5'-taaatcgccGctctcctgccc-(Pacific Blue)-3'
【0206】
前記CYP3A4*16用のプライマー及びプローブの配列を以下に示す。
(CYP3A4*16用プライマー)
Fプライマー (配列番号18)(CYP3A4*16-F6+CTAGA)
5'-ctagaggagtgtgatagaaggtgatctagtaga-3'
Rプライマー (配列番号28)(U0-R3+GACGA)
5'-GACGAgagagaaagaatggatccaaa-3'
(CYP3A4*16用プローブ)
変異型プローブ(配列番号6)(3T-CYP3A4*16-MF1)
5'-gatgtgatcaGtagc-(TAMRA)-3'
【0207】
前記CYP3A5*3用のプライマー及びプローブの配列を以下に示す。
(CYP3A5*3用プライマー)
Fプライマー (配列番号14)(CYP3A5*3 F4)
5'-cgtatgtaccacccagcttaacg-3'
Rプライマー (配列番号15)(CYP3A5*3 R4)
5'-cacaggagccacccaagg-3'
(CYP3A5*3用プローブ)
変異型プローブ(配列番号4)(3FL-CYP3A5*3-mt-F1-21)
5'-ttgtctttcaGtatctcttcc-(BODIPY FL)-3'
【0208】
これらの結果を図10〜12に示す。図10〜12は、温度上昇に伴う蛍光強度の変化を示すTm解析のグラフである。図10は、精製ゲノムの試料、図11は、混合プラスミドの試料、図12は、前処理済み全血の試料の結果である。図10及び図12において、(A)は、CYP3A4*1B用変異型プローブに関する融解曲線であり、(B)は、CYP3A5*3用変異型プローブに関する融解曲線であり、(C)は、CYP3A4*16用変異型プローブに関する融解曲線である。図11において、(A)は、CYP3A4*1B用変異型プローブに関する融解曲線であり、(B)は、CYP3A4*16用変異型プローブに関する融解曲線である。横軸は、測定時の温度(℃)を示し、縦軸は蛍光強度の変化(以下、「蛍光変化量」ともいう)を示し、単位は「d蛍光強度増加量/dt」(dF/dt)とした。CYP3A4*1B変異型とCYP3A4*1B用変異型プローブとのTm値は、61℃付近、CYP3A5*3変異型とCYP3A5*3用変異型プローブとのTm値は、56℃付近、CYP3A4*16変異型とCYP3A4*16用変異型プローブとのTm値は、53℃付近である。
【0209】
図10(A)に示すように、CYP3A4*1B多型について、野生型のホモ型である精製ゲノムは、変異型のTm値よりも低い温度でピークが確認された。図10(B)に示すように、CYP3A5*3多型について、野生型と変異型のヘテロ型である精製ゲノムは、変異型のTm値とそれよりも低い温度において、合計2つのピークが確認された。図10(C)に示すように、CYP3A4*16多型について、野生型のホモ型である精製ゲノムは、変異型のTm値よりも低い温度でピークが確認された。
【0210】
図11(A)に示すように、CYP3A4*1B多型について、変異型であるプラスミドを含む試料は、変異型のTm値のみでピークが確認された。図11(B)に示すように、CYP3A4*16多型について、変異型であるプラスミドを含む試料は、変異型のTm値のみでピークが確認された。前記プラスミド試料はCYP3A5*3多型を含まないことから、ピークは確認されなかった。
【0211】
図12(A)に示すように、CYP3A4*1B多型について、野生型のホモ型である前処理済み全血は、変異型のTm値よりも低い温度でピークが確認された。図12(B)に示すように、CYP3A5*3多型について、野生型と変異型のヘテロ型である前処理済み全血は、変異型のTm値とそれよりも低い温度において、合計2つのピークが確認された。図12(C)に示すように、CYP3A4*16多型について、野生型のホモ型である前処理済み全血は、変異型のTm値よりも低い温度でピークが確認された。
【0212】
[実施例5]
本例では、センス鎖にハイブリダイズするプローブを使用して、野生型人工核酸及び変異型人工核酸について、Tm解析を行い、CYP3A遺伝子の多型(CYP3A4*1B)を検出した。
【0213】
センス鎖の人工核酸として、下記配列に示す、配列番号3における塩基番号482〜521に相同的な野生型人工核酸(WT1)及び変異型人工核酸(mt1−1、mt1−2)を調製した。前記配列において、下線部が配列番号3における塩基番号501の塩基に対応する。前記配列において、小文字の塩基は、配列番号3とは異なる塩基に置換した。前記各人工核酸を0.1μmol/Lに調整した。
WT1(配列番号29)(CYP3A4*1B-WT-F)
AGCCATAGAGACAAGGGCAAGAGAGgGGCGATTTAATAGA
mt1−1(配列番号30)(CYP3A4*1B-mt1-F)
AGCCATAGAGACAAGGGCAGGAGAGaGGCGATTTAATAGA
mt1−2(配列番号31)(CYP3A4*1B-mt2-F)
AGCCATAGAGACAAGGGCAGGAGAGgGGCGATTTAATAGA
【0214】
前記各人工核酸を含む、50μLの反応混合物を調製した。前記反応混合物は、下記表5に示す反応液の各成分を、以下の濃度となるように混合して、調製した。前記反応混合物について、全自動SNPs検査装置(商品名i−densy(登録商標)IS−5310、アークレイ社製)を用いて、Tm解析を行った。前記Tm解析は、前記反応液を、95℃で1秒、40℃で60秒処理した後、温度の上昇速度を1℃/3秒として、40℃から75℃に加熱していき、蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定することによって、行った。Pacific Blueの検出波長は、445−480nmとした。
【0215】
【表5】

【0216】
前記プローブとして、下記配列のCYP3A4*1B変異型プローブを使用した。前記プローブは、変異型のCYP3A4遺伝子のセンス鎖用の変異型プローブである。前記配列において、下線部の塩基が、CYP3A4*1B変異型配列に相補的な塩基である。
CYP3A4*1B用プローブ (配列番号12)(3PB-CYP3A4*1B-R3)
5'-taaatcgccGctctcctgccc-(Pacific Blue)-3'
【0217】
[比較例3]
(比較例3−1)
本例では、センス鎖にハイブリダイズするプローブを使用して、野生型人工核酸及び変異型人工核酸について、Tm解析を行い、CYP3A遺伝子の多型(CYP3A4*1B)を検出した。
【0218】
前記CYP3A4*1B用プローブとして、下記配列のプローブを使用した。前記プローブは、野生型のCYP3A4遺伝子のセンス鎖用の野生型プローブである。前記配列において、下線部の塩基が、CYP3A4*1B変異型配列に相補的な塩基である。
プローブ3−1(配列番号32)(5PB-CYP3A4*1B-R1)
5'-(Pacific Blue)-ctctcttgcccttgt-3'
【0219】
前記CYP3A4*1B用プローブとして、前記プローブ3−1を使用した以外は、前記実施例5と同様にしてTm解析を行った。
【0220】
(比較例3−2)
本例では、アンチセンス鎖にハイブリダイズするプローブを使用して、野生型人工核酸及び変異型人工核酸について、Tm解析を行い、CYP3A遺伝子の多型(CYP3A4*1B)を検出した。
【0221】
アンチセンス鎖の人工核酸として、下記配列に示す、配列番号3における塩基番号482〜521に相補的な野生型人工核酸(WT2)及び変異型人工核酸(mt2−1、mt2−2)を調製した。前記配列において、下線部が配列番号3における塩基番号501の塩基に対応する。前記各人工核酸を0.1μmol/Lに調整した。
WT2(配列番号33)(CYP3A4*1B-WT-R)
tctattaaatcgccCctctcttgcccttgtctctatggct
mt2−1(配列番号34)(CYP3A4*1B-mt1-R)
tctattaaatcgccTctctcctgcccttgtctctatggct
mt2−2(配列番号35)(CYP3A4*1B-mt2-R)
tctattaaatcgccCctctcctgcccttgtctctatggct
【0222】
前記CYP3A4*1B用プローブとして、下記配列のプローブ2−2を使用した。前記プローブは、野生型のCYP3A4遺伝子のアンチセンス鎖用の野生型プローブである。前記配列において、下線部の塩基が、CYP3A4*1B野生型配列に対して同一性を示す塩基である。
プローブ2−2 (配列番号36)(5PB-CYP3A4*1B-F1)
5'-(Pacific Blue)-CAAGGGCAAGAGAGAG-3'
【0223】
前記野生型人工核酸として、前記WT2、前記変異型人工核酸として、前記mt2−1又はmt2−2を使用し、CYP3A4*1B用プローブとして、前記プローブ2−2を使用した以外は、前記実施例5と同様にしてTm解析を行った。
【0224】
これらの結果を図13〜15に示す。図13〜15は、温度上昇に伴う蛍光強度の変化を示すTm解析のグラフである。図13は、実施例5の結果、図14は、比較例3−1の結果、図15は、比較例3−2の結果である。横軸は、測定時の温度(℃)を示し、縦軸は蛍光強度の変化(以下、「蛍光変化量」ともいう)を示し、単位は「d蛍光強度増加量/dt」(dF/dt)とした。
【0225】
図13に示すように、実施例5では、PCR反応液に、WT1とmt1−1又はWT1とmt1−2とを添加した場合、WT1(55℃)とmt1−1(64℃)又はmt1−2(64℃)のいずれにおいても、ピークが確認された。一方、図14に示すように、比較例3−1では、PCR反応液に、WT1とmt1−1とを添加した場合、WT1とmt1−1とのピークが重なっており、また、WT1とmt1−2とを添加した場合、WT1とmt1−2とのピークは確認されなかった。また、図15に示すように、比較例3−2では、PCR反応液にWT2とmt2−2とを添加した場合、WT2とmt2−2とのピークが重なっており、また、WT2とmt2−1とを添加した場合、WT2とmt2−1とのピークは確認されなかった。
【0226】
以上の通りであるので、本発明によれば、高い感度で、簡便にCYP3A遺伝子における多型を検出することができることが明らかになった。
【0227】
以上、実施形態を参照して本願発明を説明したが、本願発明は上記実施形態に限定されるものではない。本願発明の構成や詳細には、本願発明のスコープ内で当業者が理解し得る様々な変更をすることができる。
【0228】
この出願は、2011年3月9日に出願された日本出願特願2011−051631を基礎とする優先権を主張し、その開示の全てをここに取り込む。
【産業上の利用可能性】
【0229】
本発明の多型検出方法によれば、CYP3A遺伝子の多型を、高い感度で、簡便に検出することを可能にする多型検出用プローブ、これを用いる多型検出方法を提供できる。また、本発明は、当該多型検出方法を用いた薬効評価方法を提供できる。さらに、本発明は、当該多型検出用プローブを用いた多型検出用試薬キットを提供できる。
【技術分野】
【0001】
本発明は、CYP3A遺伝子の多型検出用プローブ、多型検出方法、薬効評価方法及び多型検出用試薬キットに関する。
【背景技術】
【0002】
CYP(Cytochrome P450)は、ステロイドホルモン等の生体物質の代謝、薬物及び環境汚染物質等の酸化的解毒反応に関与する酸化酵素である。CYPは、多数の分子種を含むスーパーファミリーを形成しており、中でも、CYP3A4及びCYP3A5は、例えば、医薬品の代謝に影響する多型の存在が知られている(非特許文献1)。
【0003】
CYP3A5をコードするCYP3A5遺伝子は、ヒトの第7染色体に位置する。そして、例えば、CYP3A5遺伝子の部分配列(配列番号1)における401番目の塩基(r)について、アデニン(a)からグアニン(g)への変異(CYP3A5*3)等が知られている(非特許文献2等)。この塩基の変異により、スプライシング異常が生じ、CYP3A5の発現が大幅に低下する。
【0004】
また、CYP3A4をコードするCYP3A4遺伝子は、ヒトの第7染色体に位置する。そして、例えば、CYP3A4遺伝子の部分配列(配列番号2)における201番目の塩基(s)について、シトシン(c)からグアニン(g)への変異(CYP3A4*16)等が知られている(非特許文献2等)。この塩基の変異により、CYP3A4の185番目のトレオニン(T)は、セリン(S)に変異する。
【0005】
これらの変異は、例えば、免疫抑制剤タクロリムス等の薬物代謝との関連が報告されている(非特許文献2)。したがって、CYP3A遺伝子における、これらの多型を検出することにより、例えば、薬剤耐性をより高感度で予測できる可能性があると考えられている。
【0006】
現在、遺伝子の多型を検出する方法として、例えば、PCR(Polymerase Chain Reaction)−RFLP(Restriction Fragment Length Polymorphism)法等が知られている(非特許文献3)。この方法は、検出目的の塩基を含む部分を増幅するよう設計されたプライマーを用いてPCRを行い、前記特定塩基における変異の有無によって切断の有無が異なるような制限酵素で切断し、その後、電気泳動で切断されたかどうかを検出する方法である。
【0007】
また、変異を含む領域をPCR法で増幅した後、蛍光色素で標識された核酸プローブを用いて融解曲線分析を行い、融解曲線分析の結果に基づいて塩基配列の変異を解析する方法も知られている(特許文献1参照)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2002−119291号公報
【非特許文献】
【0009】
【非特許文献1】Human Mutation、2004年、Vol.23、Issue 1、p.100−108
【非特許文献2】Clin.Pharmacol.Ther.、2006年、Vol.80、p.179−191
【非特許文献3】Genet.Mol.Res.、2010年、第9巻、第1号、p.34−40
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかしながら、CYP3A遺伝子の変異には、前述の通り、種々の変異が存在している。PCR−RFLP法では、PCR反応後に増幅産物を取り出し、制限酵素処理を行う必要がある。このため、前記増幅産物が、次の反応系に混入する恐れがあり、これに起因して、偽陽性及び偽陰性の結果が得られてしまう場合がある。また、PCR終了後、制限酵素で処理を行い、その後さらに電気泳動を行うため、検出までに必要な時間も非常に長くなる場合がある。さらに、操作が複雑なため、自動化が困難である。これらの現状を踏まえ、CYP3A遺伝子の多型検出のために、さらなる技術開発が待ち望まれていた。
【0011】
本発明は、CYP3A遺伝子の多型を、高い感度で、簡便に検出することを可能にする多型検出用プローブ、これを用いる多型検出方法を提供することを課題とする。また、本発明は、前記多型検出方法を用いた薬効評価方法を提供することを課題とする。さらに本発明は、前記多型検出用プローブを用いた多型検出用試薬キットを提供することを課題とする。
【課題を解決するための手段】
【0012】
本発明は、以下の通りである。
<1> 下記P1、P1’、P2、P2’、P3、P3’、P4、P4’、P5及びP5’からなる群から選択される一種の蛍光標識オリゴヌクレオチドである、CYP3A遺伝子の多型を検出するための多型検出用プローブ;
(P1)配列番号1で示される配列のうち401番目〜411番目の塩基を含む塩基長11〜50の配列であり、配列番号1における411番目の塩基に対応する塩基がシトシンである以外は、配列番号1と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号1で示される配列のうち411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P1’)配列番号1で示される配列のうち401番目〜411番目の塩基を含む塩基長11〜50の配列であり、配列番号1における411番目の塩基に対応する塩基がシトシンである以外は、配列番号1と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズし、配列番号1で示される配列のうち411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P2)配列番号2で示される配列のうち201番目〜205番目の塩基を含む塩基長5〜50の配列であり、配列番号2における205番目の塩基に対応する塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち205番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P2’)配列番号2で示される配列のうち201番目〜205番目の塩基を含む塩基長5〜50の配列であり、配列番号2における205番目の塩基に対応する塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち205番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P3)配列番号2で示される配列のうち190番目〜201番目の塩基を含む塩基長12〜50の配列に相補的な配列であり、配列番号2における190番目の塩基に相補的な塩基がシトシンである以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち190番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P3’)配列番号2で示される配列のうち190番目〜201番目の塩基を含む塩基長12〜50の配列に相補的な配列であり、配列番号2における190番目の塩基に相補的な塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち190番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P4)配列番号2で示される配列のうち186番目〜201番目の塩基を含む塩基長16〜50の配列に相補的な配列であり、配列番号2における186番目の塩基に相補的な塩基がシトシンである以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち186番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P4’)配列番号2で示される配列のうち186番目〜201番目の塩基を含む塩基長16〜50の配列に相補的な配列であり、配列番号2における186番目の塩基に相補的な塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち186番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P5)配列番号3で示される配列のうち496番目〜501番目の塩基を含む塩基長6〜50の配列に相補的な配列であり、配列番号3における496番目の塩基に相補的な塩基がシトシンである以外は、配列番号3の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号3で示される配列のうち496番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P5’)配列番号3で示される配列のうち496番目〜501番目の塩基を含む塩基長6〜50の配列に相補的な配列であり、配列番号3における496番目の塩基に相補的な塩基がシトシンである以外は、配列番号3と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号3で示される配列のうち496番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド。
<2> 前記蛍光標識オリゴヌクレオチドが、配列番号1における401番目の塩基の多型を認識する、<1>に記載の多型検出用プローブ。
<3> 前記蛍光標識オリゴヌクレオチドが、前記蛍光色素で標識された前記塩基を3'末端から数えて1〜3番目に有する、<1>または<2>に記載の多型検出用プローブ。
<4> 前記蛍光標識オリゴヌクレオチドが、前記蛍光色素で標識された前記塩基を3'末端に有する、<1>〜<3>のいずれか一つに記載の多型検出用プローブ。
<5> 前記蛍光標識オリゴヌクレオチドが、標的配列にハイブリダイズしないときに蛍光を発し、且つ、前記標的配列にハイブリダイズしたときに蛍光強度が減少するか又は増加する、<1>〜<4>のいずれか一つに記載の多型検出用プローブ。
<6> 前記蛍光標識オリゴヌクレオチドが、標的配列にハイブリダイズしないときに蛍光を発し、前記標的配列にハイブリダイズしたときに蛍光強度が減少する、<1>〜<5>のいずれか一つに記載の多型検出用プローブ。
<7> 前記P1及びP1’の蛍光標識オリゴヌクレオチドの塩基長が、15〜30塩基長であり、前記P2及びP2’の蛍光標識オリゴヌクレオチドの塩基長が、10〜30塩基長であり、前記P3及びP3’の蛍光標識オリゴヌクレオチドの塩基長が、12〜40塩基長であり、前記P4及びP4’の蛍光標識オリゴヌクレオチドの塩基長が、16〜40塩基長であり、前記P5及びP5’の蛍光標識オリゴヌクレオチドの塩基長が、10〜40塩基長である、<1>〜<6>のいずれか一つに記載の多型検出用プローブ。
<8> 前記P1及びP1’の蛍光標識オリゴヌクレオチドの塩基長が、15〜20塩基長であり、前記P2及びP2’の蛍光標識オリゴヌクレオチドの塩基長が、10〜20塩基長であり、前記P3及びP3’の蛍光標識オリゴヌクレオチドの塩基長が、15〜30塩基長であり、前記P4及びP4’の蛍光標識オリゴヌクレオチドの塩基長が、20〜30塩基長であり、前記P5及びP5’の蛍光標識オリゴヌクレオチドの塩基長が、20〜30塩基長である、<1>〜<7>のいずれか一つに記載の多型検出用プローブ。
<9> 前記多型検出用プローブが、融解曲線分析用のプローブである、<1>〜<8>のいずれか一つに記載の多型検出用プローブ。
<10> 前記多型検出用プローブが、配列番号37、配列番号38、配列番号39、配列番号41、配列番号43又は配列番号45で示される塩基配列を有する、<1>〜<9>のいずれか一つに記載の多型検出用プローブ。
<11> 前記多型検出用プローブが、配列番号4、配列番号6、配列番号8、配列番号10、配列番号44又は配列番号12で示される塩基配列を有する、<1>〜<9>のいずれか一つに記載の多型検出用プローブ。
<12> <1>〜<11>のいずれか一つに記載の多型検出用プローブを用いることにより、CYP3A遺伝子の多型を検出する多型検出方法。
<13> (I)前記多型検出用プローブ及び試料中の一本鎖核酸を接触させて、前記多型検出用プローブ及び前記一本鎖核酸をハイブリダイズさせてハイブリッド形成体を得ること、
(II)前記ハイブリッド形成体を含む試料の温度を変化させることで、前記ハイブリッド形成体を解離させ、前記ハイブリッド形成体の解離に基づく蛍光シグナルの変動を測定すること、
(III)前記蛍光シグナルの変動に基づいてハイブリッド形成体の解離温度であるTm値を検出すること、及び、
(IV)前記Tm値に基づいて、前記試料中の一本鎖核酸における、CYP3A遺伝子の多型の存在を検出すること、
を含む、<12>に記載の多型検出方法。
<14> さらに、前記(I)の前または(I)と同時に、核酸を増幅することを含む、<13>に記載の多型検出方法。
<15> <12>〜<14>のいずれか一つに記載の多型検出方法により、CYP3A遺伝子の多型を検出すること、及び、検出された多型の有無に基づいて、薬剤に対する耐性または薬剤の薬効を評価すること、を含む、薬剤の薬効評価方法。
<16> <1>〜<11>のいずれか一つに記載の多型検出用プローブを含む、CYP3A遺伝子の多型を検出するための多型検出用試薬キット。
<17> さらに、前記多型検出用プローブがハイブリダイズする配列を含む領域を増幅するためのプライマーを含む、<16>に記載の多型検出用試薬キット。
【発明の効果】
【0013】
本発明によれば、CYP3A遺伝子の多型を、高い感度で、簡便に検出することを可能にする多型検出用プローブ、これを用いる多型検出方法を提供できる。また、本発明は、当該多型検出方法を用いた薬効評価方法を提供できる。さらに、本発明は、当該多型検出用プローブを用いた多型検出用試薬キットを提供できる。なお、本発明は、例えば、医療分野に関わらず、生化学等の広い分野におけるCYP3A遺伝子の多型検出に適用できる。
【図面の簡単な説明】
【0014】
【図1】図1は、本発明の実施例1にかかる試料の融解曲線である。
【図2】図2は、本発明の実施例1にかかる試料の融解曲線である。
【図3】図3は、本発明の実施例1にかかる試料の融解曲線である。
【図4】図4は、本発明の実施例1にかかる試料の融解曲線である。
【図5】図5は、本発明の実施例1にかかる試料の融解曲線である。
【図6】図6は、本発明の実施例2にかかる試料の融解曲線である。
【図7】図7は、本発明の実施例3にかかる試料の融解曲線である。
【図8】図8は、比較例1にかかる試料の融解曲線である。
【図9】図9は、比較例2にかかる試料の融解曲線である。
【図10】図10は、本発明の実施例4にかかる試料の融解曲線である。
【図11】図11は、本発明の実施例4にかかる試料の融解曲線である。
【図12】図12は、本発明の実施例4にかかる試料の融解曲線である。
【図13】図13は、本発明の実施例5にかかる試料の融解曲線である。
【図14】図14は、比較例3−1にかかる試料の融解曲線である。
【図15】図15は、比較例3−2にかかる試料の融解曲線である。
【発明を実施するための形態】
【0015】
本発明にかかるCYP3A遺伝子の多型検出用プローブ(以下、単に「多型検出用プローブ」ということがある)は、前記P1、P1’、P2、P2’、P3、P3’、P4、P4’、P5及びP5’からなる群から選択される一種の蛍光標識オリゴヌクレオチドである、CYP3A遺伝子の多型を検出するための多型検出用プローブである。
【0016】
本発明にかかるCYP3A遺伝子多型検出方法は、前記CYP3A遺伝子の多型を検出するための多型検出用プローブを少なくとも1種用いて、CYP3A遺伝子の多型を検出することを含む方法である。本発明にかかる薬剤の薬効評価方法は、前記CYP3A遺伝子多型検出方法によりCYP3A遺伝子の多型を検出すること、及び、検出された多型の有無に基づいて、薬剤に対する耐性または薬剤の薬効を評価することを含む方法である。本発明にかかる多型検出用試薬キットは、CYP3A遺伝子の多型を検出するための多型検出用プローブを含むものである。
【0017】
本発明における「CYP3A遺伝子」は、既に公知である。CYP3A5遺伝子の塩基配列は、NCBIのアクセッションNo.NC000007.13の99245813〜99277621の配列を意味する。CYP3A5遺伝子の部分配列を示す配列番号1は、NCBIのdbSNPのアクセッションNo.NG007938の6683〜7483の配列である。CYP3A4遺伝子の塩基配列は、NCBIのアクセッションNo.NC000007.13の99354583〜99381811の配列を意味する。CYP3A4遺伝子の部分配列を示す配列番号2は、NCBIのdbSNPのアクセッションNo.NG008421の15519〜15928の配列であり、CYP3A4遺伝子の部分配列を示す配列番号3は、NCBIのdbSNPのアクセッションNo.NT007933.14の24616172〜24616872の配列である。配列番号1〜3の塩基配列において、rは、a又はg、sは、c又はg、wは、a、t又はu、vは、g、a又はcを示す。
【0018】
CYP3A5遺伝子の野生型では、配列番号1に示される配列のうち401番目に対応する塩基(r)は、A(アデニン)であるが、変異型では、前記塩基(r)がG(グアニン)に変異している。以下、配列番号1のCYP3A5遺伝子の前記多型を「CYP3A5*3多型」という。CYP3A4遺伝子の野生型では、配列番号2に示される配列のうち201番目に対応する塩基(s)は、C(シトシン)であるが、変異型では、前記塩基(s)がG(グアニン)に変異している。以下、配列番号2のCYP3A4遺伝子の前記多型を「CYP3A4*16多型」という。
【0019】
CYP3A4遺伝子の野生型では、配列番号3に示される配列のうち501番目に対応する塩基(r)は、A(アデニン)であるが、変異型では、前記塩基(r)がG(グアニン)に変異している。以下、配列番号3のCYP3A4遺伝子の前記多型を「CYP3A4*1B多型」という。
【0020】
CYP3A遺伝子において、前記3ヶ所の多型のうち少なくとも一つが前述のような変異型であれば、例えば、免疫抑制剤タクロリムス等の薬物代謝が低下する可能性があると判断できる。
【0021】
本発明において、検出対象となる試料中の試料核酸、多型検出用プローブ又はプライマーの個々の配列に関して、これら互いの相補的な関係に基づいて記述された事項は、特に断らない限り、それぞれの配列と、各配列に対して相補的な配列とについても適用される。各配列に対して相補的な当該配列について本発明の事項を適用する際には、当該相補的な配列が認識する配列は、当業者にとっての技術常識の範囲内で、対応する本明細書に記載された配列に相補的な配列に、明細書全体を読み替えるものとする。
【0022】
本発明において、「Tm値」とは、二本鎖核酸が解離する温度(解離温度:Tm)であって、一般に、260nmにおける吸光度が、吸光度全上昇分の50%に達した時の温度と定義される。即ち、二本鎖核酸、例えば、二本鎖DNAを含む溶液を加熱していくと、260nmにおける吸光度が上昇する。これは、二本鎖DNAにおける両鎖間の水素結合が加熱によってほどけ、一本鎖DNAに解離(DNAの融解)することが原因である。そして、全ての二本鎖DNAが解離して一本鎖DNAになると、その吸光度は加熱開始時の吸光度(二本鎖DNAのみの吸光度)の約1.5倍程度を示し、これによって融解が完了したと判断できる。Tm値は、この現象に基づき設定される。本発明におけるTm値は、特に断らない限り、吸光度が、吸光度全上昇分の50%に達した時の温度をいう。
【0023】
本明細書において「工程」との語は、独立した工程だけでなく、例えば、他の工程と明確に区別できない場合であっても、本工程の所期の作用が達成されれば、本用語に含まれる。また、本明細書において、「〜」を用いて示された数値範囲は、「〜」の前後に記載される数値を、それぞれ最小値及び最大値として含む範囲を示す。また、本発明において、組成物中の各成分の量は、前記組成物中に各成分に該当する物質が複数存在する場合、特に断らない限り、前記組成物中に存在する当該複数の物質の合計量を意味する。本発明において、オリゴヌクレオチドの配列に関して「3’末端から数えて1〜3番目」という場合は、オリゴヌクレオチド鎖の3’末端を1番目として数える。
【0024】
<CYP3A遺伝子多型検出用プローブ>
本発明にかかるCYP3A遺伝子の多型検出用プローブは、前記P1、P1’、P2、P2’、P3、P3’、P4、P4’、P5及びP5’からなる群から選択される一種の蛍光標識オリゴヌクレオチドである、CYP3A遺伝子の多型を検出するための多型検出用プローブである。
【0025】
CYP3A5遺伝子の野生型では、配列番号1に示される配列のうち401番目に対応する塩基(r)は、A(アデニン)であるが、変異型では、前記塩基(r)がG(グアニン)に変異している。以下、配列番号1のCYP3A5遺伝子の前記多型を「CYP3A5*3多型」という。この多型を検出するプローブを、以下、CYP3A5*3用プローブともいう。
【0026】
本発明において、前記P1及びP1’からなる群から選択される一種の蛍光標識オリゴヌクレオチド(以下、「前記(P1)又は(P1’)蛍光標識オリゴヌクレオチド」ともいう。)は、配列番号1に示す塩基配列の401番目の塩基における多型を検出できるプローブである。
【0027】
本発明の前記P1の蛍光標識オリゴヌクレオチドは、具体的には、配列番号1で示される配列のうち401番目〜411番目の塩基を含む配列である。前記P1の蛍光標識オリゴヌクレオチドは、例えば、配列番号1に示す塩基配列の401番目の塩基に対応する塩基(r)が、Aでもよいし、Gでもよい。
(P1)配列番号1で示される配列のうち401番目〜411番目の塩基を含む塩基長11〜50の配列であり、配列番号1における411番目の塩基に対応する塩基がシトシンである以外は、配列番号1と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号1で示される配列のうち411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0028】
本発明の前記P1の蛍光標識オリゴヌクレオチドは、配列番号1における411番目の塩基に対応する塩基がC(シトシン)である以外は、配列番号1と同一の塩基を有する塩基配列に対して同一性を有すことを要する。具体的には、本発明の前記P1の蛍光標識オリゴヌクレオチドは、配列番号1における411番目の塩基に対応する塩基がC(シトシン)である以外は、配列番号1と同一の塩基を有する塩基配列に対して、80%以上の同一性を示す。また、検出感度の観点より、例えば、85%以上の同一性、90%以上の同一性、95%以上の同一性、96%以上の同一性、97%以上の同一性、98%以上の同一性又は99%以上の同一性を示してもよい。また、前記P1の蛍光標識オリゴヌクレオチドは、さらに、配列番号1における411番目の塩基に対応する塩基がC(シトシン)であり、且つ、401番目の塩基に対応する塩基が、r(AまたはG)である以外は、配列番号1と同一の塩基を有する塩基配列に対して同一性を有すことが好ましい。ここで、「配列番号と同一の塩基を有する塩基配列」とは、変更された前記プローブに現れる、前記配列番号の配列における領域を意味する(以下、同様)。
【0029】
本発明の前記P1の蛍光標識オリゴヌクレオチドが、例えば、配列番号1の401番目の塩基に対応する塩基が、変異型のGである場合、例えば、以下のようなことがいえる。本発明の前記P1の蛍光標識オリゴヌクレオチドと、配列番号1における411番目の塩基に対応する塩基がC(シトシン)である以外は配列番号1と同一の塩基を有する塩基配列とを比較した際、その同一性が80%未満である場合には、変異型のCYP3A5遺伝子を含む試料核酸に対する検出感度が低くなる。
【0030】
本発明の前記P1の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号1における401番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。前記蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号1における401番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号1の401番目の塩基に対応する塩基が、変異型Gである場合、変異型のCYP3A5遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0031】
本発明における前記P1’の蛍光標識オリゴヌクレオチドは、配列番号1における411番目の塩基に対応する塩基がC(シトシン)である以外は、配列番号1と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズすることを要する。前記P1’の蛍光標識オリゴヌクレオチドは、例えば、配列番号1に示す塩基配列の401番目の塩基に対応する塩基(r)が、Aでもよいし、Gでもよい。
(P1’)配列番号1で示される配列のうち401番目〜411番目の塩基を含む塩基長11〜50の配列であり、配列番号1における411番目の塩基に対応する塩基がシトシンである以外は、配列番号1と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズし、配列番号1で示される配列のうち411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0032】
前記ハイブリダイゼーションは、公知の方法あるいはそれに準じる方法、例えば、Molecular Cloning 3rd(J. Sambrook et al., Cold Spring Harbor Lab. Press, 2001) に記載の方法等に従って行うことができる。この文献は、参照により本明細書に組み入れられるものとする。ストリンジェントな条件とは、特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。典型的なストリンジェントな条件は、例えば、カリウム濃度は約25mmol/L〜約50mmol/L、及びマグネシウム濃度は約1.0mmol/L〜約5.0mmol/L中において、ハイブリダイゼーションを行う条件があげられる。本発明の条件の1例として、Tris−HCl(pH8.6)、25mmol/LのKCl、及び1.5mmol/LのMgCl2中においてハイブリダイゼーションを行う条件が挙げられるが、これに限定されるものではない。その他、ストリンジェントな条件としては、Molecular Cloning 3rd(J. Sambrook et al., Cold Spring Harbor Lab. Press, 2001)に記載されている。この文献は、参照により本明細書に組み入れられるものとする。当業者は、ハイブリダイゼーション反応や、ハイブリダイゼーション反応液の塩濃度等を変化させることによって、このような条件を容易に選択できる。
【0033】
本発明の前記P1’の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号1における401番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。前記蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号1における401番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号1の401番目の塩基に対応する塩基が、変異型Gである場合、変異型のCYP3A5遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0034】
本発明における前記P1または前記P1’の蛍光標識オリゴヌクレオチドには、前記P1又は前記P1’の蛍光標識オリゴヌクレオチドに、塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドは、前記P1又は前記P1’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、塩基が挿入、欠失又は置換されている場合、その挿入、欠失又は置換の位置は、特に限定されない。挿入、欠失又は置換した塩基の数は、1塩基又は2塩基以上が挙げられる。前記塩基の数は、前記蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜10塩基、又は1塩基〜5塩基が挙げられる。
【0035】
中でも、本発明における前記P1又は前記P1’の蛍光標識オリゴヌクレオチドには、前記P1又は前記P1’の蛍光標識オリゴヌクレオチドの塩基が置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が置換した蛍光標識オリゴヌクレオチドは、前記P1又は前記P1’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、置換の位置は、特に限定されない。例えば、検出感度の観点より、配列番号1で示される配列のうち401番目〜411番目の塩基以外に位置する塩基が置換されることが挙げられる。置換される塩基の数は、1塩基又は2塩基以上が挙げられる。置換される塩基の数は、蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜5塩基、又は1塩基〜3塩基が挙げられる。
【0036】
本発明の前記P1又は前記P1’の蛍光標識オリゴヌクレオチドの長さは、11〜50塩基(mer)であることを要する。前記P1又は前記P1’の蛍光標識オリゴヌクレオチドの長さが、10塩基以下または51塩基以上である場合、CYP3A遺伝子多型の検出感度が低下する。また、本発明の前記P1又は前記P1’の蛍光標識オリゴヌクレオチドの長さは、例えば、15〜30塩基、15〜21塩基、又は15〜20塩基としうる。例えば、前記15〜30塩基という範囲にすることにより、例えば検出感度が高くなる等の傾向がある。また前記P1又は前記P1’の蛍光標識オリゴヌクレオチドの塩基長を変化させることで、例えば、前記P1又は前記P1’の蛍光標識オリゴヌクレオチドがその相補鎖と形成するハイブリッド形成体の解離温度であるTm値を、所望の値とすることができる。
【0037】
以下に、本発明における前記P1の蛍光標識オリゴヌクレオチドの塩基配列の一例を示すが、本発明はこれらに限定されない。
5'-ttgtctttcartatctcttcc-3' (配列番号37)
5'-ttgtctttcagtatctcttcc-3' (配列番号4)(3FL-CYP3A5*3-mt-F1-21)
5'-ttgtctttcaatatctcttcc-3' (配列番号5)
【0038】
本発明の前記P1又は前記P1’の蛍光標識オリゴヌクレオチドは、配列番号1の配列のうち411番目の塩基に対応する塩基が蛍光色素で標識されていることを要する。
【0039】
前記P1又は前記P1’の蛍光標識オリゴヌクレオチドにおいて、この蛍光標識された411番目の塩基は、3’末端から数えて1〜3番目のいずれかの位置に存在することができ、また、3’末端に存在することができる。これにより、例えば、多型検出感度がより向上し、また、前記P1又は前記P1’の蛍光標識オリゴヌクレオチドを、生産性よく得ることができる。
【0040】
本発明において、前記P2、前記P2’、前記P3、前記P3’、前記P4及び前記P4’からなる群より選択される一種の蛍光標識オリゴヌクレオチド(以下、「前記(P2)、(P2’)、(P3)、(P3’)、(P4)又は(P4’)蛍光標識オリゴヌクレオチド」ともいう。)は、配列番号2に示す塩基配列の201番目の塩基における多型を検出できるプローブである。
【0041】
CYP3A4遺伝子の野生型では、配列番号2に示される配列のうち201番目に対応する塩基(s)は、C(シトシン)であるが、変異型では、前記塩基(s)がG(グアニン)に変異している。以下、配列番号2のCYP3A4遺伝子の前記多型を「CYP3A4*16多型」という。この多型を検出するプローブを、以下、CYP3A4*16用プローブともいう。
【0042】
本発明の前記P2の蛍光標識オリゴヌクレオチドは、具体的には、配列番号2で示される配列のうち201番目〜205番目の塩基を含む配列である。前記P2の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に対応する塩基(s)が、Cでもよいし、Gでもよい。
(P2)配列番号2で示される配列のうち201番目〜205番目の塩基を含む塩基長5〜50の配列であり、配列番号2における205番目の塩基に対応する塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち205番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0043】
本発明の前記P2の蛍光標識オリゴヌクレオチドは、配列番号2における205番目の塩基に対応する塩基がC(シトシン)である以外は、配列番号2と同一の塩基を有する塩基配列に対して同一性を有すことを要する。具体的には、本発明の前記P2の蛍光標識オリゴヌクレオチドは、配列番号2における205番目の塩基に対応する塩基がC(シトシン)である以外は、配列番号2と同一の塩基を有する塩基配列に対して、80%以上の同一性を示す。また、検出感度の観点より、例えば、85%以上の同一性、90%以上の同一性、95%以上の同一性、96%以上の同一性、97%以上の同一性、98%以上の同一性又は99%以上の同一性を示してもよい。また、前記P2の蛍光標識オリゴヌクレオチドは、さらに、配列番号2における205番目の塩基に対応する塩基がC(シトシン)であり、且つ、201番目の塩基に対応する塩基が、s(CまたはG)である以外は、配列番号2と同一の塩基を有する塩基配列に対して同一性を有すことが好ましい。
【0044】
本発明の前記P2の蛍光標識オリゴヌクレオチドが、例えば、配列番号2の201番目の塩基に対応する塩基が、変異型のGである場合、例えば、以下のようなことがいえる。本発明の前記P2の蛍光標識オリゴヌクレオチドと、配列番号2における205番目の塩基に対応する塩基がC(シトシン)である以外は、配列番号2と同一の塩基を有する塩基配列とを比較した際、その同一性が80%未満である場合には、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が低くなる。
【0045】
本発明の前記P2の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号2における201番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号2における201番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号2の201番目の塩基に対応する塩基が、変異型Gである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0046】
本発明における前記P2’の蛍光標識オリゴヌクレオチドは、配列番号2における205番目の塩基に対応する塩基がC(シトシン)である以外は、配列番号2と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズすることを要する。前記P2’の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に対応する塩基(s)が、Cでもよいし、Gでもよい。前記ハイブリダイゼーションならびにストリンジェントな条件は、前述の通りである。
(P2’)配列番号2で示される配列のうち201番目〜205番目の塩基を含む塩基長5〜50の配列であり、配列番号2における205番目の塩基に対応する塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち205番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0047】
本発明の前記P2’の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号2における201番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号2における201番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号2の201番目の塩基に対応する塩基が、変異型Gである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0048】
本発明における前記P2または前記P2’の蛍光標識オリゴヌクレオチドには、前記P2又は前記P2’の蛍光標識オリゴヌクレオチドに、塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドは、前記P2又は前記P2’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、塩基が挿入、欠失又は置換されている場合、その挿入、欠失又は置換の位置は、特に限定されない。挿入、欠失又は置換した塩基の数は、1塩基又は2塩基以上が挙げられる。前記塩基の数は、前記蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜10塩基、又は1塩基〜5塩基が挙げられる。
【0049】
中でも、本発明における前記P2又は前記P2’の蛍光標識オリゴヌクレオチドには、前記P2又は前記P2’の蛍光標識オリゴヌクレオチドの塩基が置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が置換した蛍光標識オリゴヌクレオチドは、前記P2又は前記P2’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、置換の位置は、特に限定されない。例えば、検出感度の観点より、配列番号2で示される配列のうち201番目〜205番目の塩基以外に位置する塩基が置換されることが挙げられる。置換される塩基の数は、1塩基又は2塩基以上が挙げられる。置換される塩基の数は、蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜5塩基、又は1塩基〜3塩基が挙げられる。
【0050】
本発明の前記P2又は前記P2’の蛍光標識オリゴヌクレオチドの長さは、5〜50塩基(mer)であることを要する。前記P2又は前記P2’の蛍光標識オリゴヌクレオチドの長さが、4塩基以下または51塩基以上である場合、CYP3A遺伝子多型の検出感度が低下する。また、本発明の前記P2又は前記P2’の蛍光標識オリゴヌクレオチドの長さは、例えば、10〜30塩基、又は10〜20塩基としうる。例えば、前記10〜30塩基という範囲にすることにより、例えば検出感度が高くなる等の傾向がある。また前記P2又は前記P2’の蛍光標識オリゴヌクレオチドの塩基長を変化させることで、例えば、前記P2又は前記P2’の蛍光標識オリゴヌクレオチドがその相補鎖と形成するハイブリッド形成体の解離温度であるTm値を、所望の値とすることができる。
【0051】
以下に、本発明における前記P2の蛍光標識オリゴヌクレオチドの塩基配列の一例を示すが、本発明はこれらに限定されない。
5'-gatgtgatcastagc-3' (配列番号38)
5'-gatgtgatcagtagc-3' (配列番号6)(3T-CYP3A4*16-MF1)
5'-gatgtgatcactagc-3' (配列番号7)
【0052】
本発明の前記P2又は前記P2’の蛍光標識オリゴヌクレオチドは、配列番号2の配列のうち205番目の塩基に対応する塩基が蛍光色素で標識されていることを要する。
【0053】
前記P2又は前記P2’の蛍光標識オリゴヌクレオチドにおいて、この蛍光標識された205番目の塩基は、3’末端から数えて1〜3番目のいずれかの位置に存在することができ、また、3’末端に存在することができる。これにより、例えば、多型検出感度がより向上し、また、前記P2又は前記P2’の蛍光標識オリゴヌクレオチドを、生産性よく得ることができる。
【0054】
本発明において、前記P3及びP3’の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に相補的な塩基(s)が、Gでもよいし、Cでもよい。
【0055】
本発明の前記P3の蛍光標識オリゴヌクレオチドは、具体的には、配列番号2で示される配列のうち190番目〜201番目の塩基を含む配列に相補的な配列である。前記P3の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に相補的な塩基(s)が、Cでもよいし、Gでもよい。
(P3)配列番号2で示される配列のうち190番目〜201番目の塩基を含む塩基長12〜50の配列に相補的な配列であり、配列番号2における190番目の塩基に相補的な塩基がシトシンである以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち190番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0056】
本発明の前記P3の蛍光標識オリゴヌクレオチドは、配列番号2における190番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して同一性を有すことを要する。具体的には、本発明の前記P3の蛍光標識オリゴヌクレオチドは、配列番号2における190番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して、80%以上の同一性を示す。また、検出感度の観点より、例えば、85%以上の同一性、90%以上の同一性、95%以上の同一性、96%以上の同一性、97%以上の同一性、98%以上の同一性又は99%以上の同一性を示してもよい。また、前記P3の蛍光標識オリゴヌクレオチドは、さらに、配列番号2における190番目の塩基に相補的な塩基がC(シトシン)であり、且つ、201番目の塩基に相補的な塩基が、s(CまたはG)である以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して、同一性を有すことが好ましい。
【0057】
本発明の前記P3の蛍光標識オリゴヌクレオチドが、例えば、配列番号2の201番目の塩基に相補的な塩基が、変異型のCである場合、例えば、以下のようなことがいえる。本発明の前記P3の蛍光標識オリゴヌクレオチドと、配列番号2における190番目の塩基に相補的な塩基がC(シトシン)である以外は配列番号2の相補鎖と同一の塩基を有する塩基配列とを比較した際、その同一性が80%未満である場合には、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が低くなる。
【0058】
本発明にかかる前記P3の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号2における201番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号2における201番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号2の201番目の塩基に相補的な塩基が、変異型Cである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0059】
本発明における前記P3’の蛍光標識オリゴヌクレオチドは、配列番号2における190番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズすることを要する。前記P3’の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に相補的な塩基(s)が、Cでもよいし、Gでもよい。前記ハイブリダイゼーションならびにストリンジェントな条件は、前述の通りである。
(P3’)配列番号2で示される配列のうち190番目〜201番目の塩基を含む塩基長12〜50の配列に相補的な配列であり、配列番号2における190番目の塩基に相補的な塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち190番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0060】
本発明の前記P3’の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号2における201番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号2における201番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号2の201番目の塩基に相補的な塩基が、変異型Cである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0061】
本発明における前記P3または前記P3’の蛍光標識オリゴヌクレオチドには、前記P3又は前記P3’の蛍光標識オリゴヌクレオチドに、塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドは、前記P3又は前記P3’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、塩基が挿入、欠失又は置換されている場合、その挿入、欠失又は置換の位置は、特に限定されない。挿入、欠失又は置換した塩基の数は、1塩基又は2塩基以上が挙げられる。前記塩基の数は、前記蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜10塩基、又は1塩基〜5塩基が挙げられる。
【0062】
中でも、本発明における前記P3又は前記P3’の蛍光標識オリゴヌクレオチドには、前記P3又は前記P3’の蛍光標識オリゴヌクレオチドの塩基が置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が置換した蛍光標識オリゴヌクレオチドは、前記P3又は前記P3’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、置換の位置は、特に限定されない。例えば、検出感度の観点より、配列番号3で示される配列のうち190番目〜201番目の塩基以外に位置する塩基に相補的な塩基が置換されることが挙げられる。置換される塩基の数は、1塩基又は2塩基以上が挙げられる。置換される塩基の数は、蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜5塩基、又は1塩基〜3塩基が挙げられる。
【0063】
本発明の前記P3又は前記P3’の蛍光標識オリゴヌクレオチドの長さは、12〜50塩基(mer)であることを要する。前記P3又は前記P3’の蛍光標識オリゴヌクレオチドの長さが、11塩基以下または51塩基以上である場合、CYP3A遺伝子多型の検出感度が低下する。また、本発明の前記P3又は前記P3’の蛍光標識オリゴヌクレオチドの長さは、例えば、12〜40塩基、又は15〜30塩基としうる。例えば、前記12〜40塩基という範囲にすることにより、例えば検出感度が高くなる等の傾向がある。また前記P3又は前記P3’の蛍光標識オリゴヌクレオチドの塩基長を変化させることで、例えば、前記P3又は前記P3’の蛍光標識オリゴヌクレオチドがその相補鎖と形成するハイブリッド形成体の解離温度であるTm値を、所望の値とすることができる。
【0064】
以下に、本発明における前記P3の蛍光標識オリゴヌクレオチドの塩基配列の一例を示すが、本発明はこれらに限定されない。
5'-tgtgctastgatcacatcc-3' (配列番号39)
5'-tgtgctactgatcacatcc-3' (配列番号8)(3T-CYP3A4*16-MR1)
5'-tgtgctagtgatcacatcc-3' (配列番号40)
【0065】
本発明の前記P3又は前記P3’の蛍光標識オリゴヌクレオチドは、配列番号2の配列のうち190番目の塩基に相補的な塩基が蛍光色素で標識されていることを要する。
【0066】
前記P3又は前記P3’の蛍光標識オリゴヌクレオチドにおいて、この蛍光標識された190番目の塩基に相補的な塩基は、3’末端から数えて1〜3番目のいずれかの位置に存在することができ、また、3’末端に存在することができる。これにより、例えば、多型検出感度がより向上し、また、前記P3又は前記P3’の蛍光標識オリゴヌクレオチドを、生産性よく得ることができる。
【0067】
本発明において、前記P4及びP4’の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に相補的な塩基(s)が、Gでもよいし、Cでもよい。
【0068】
本発明の前記P4の蛍光標識オリゴヌクレオチドは、具体的には、配列番号2で示される配列のうち186番目〜201番目の塩基を含む配列に相補的な配列である。前記P4の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に相補的な塩基(s)が、Cでもよいし、Gでもよい。
(P4)配列番号2で示される配列のうち186番目〜201番目の塩基を含む塩基長16〜50の配列に相補的な配列であり、配列番号2における186番目の塩基に相補的な塩基がシトシンである以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち186番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0069】
本発明の前記P4の蛍光標識オリゴヌクレオチドは、配列番号2における186番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して同一性を有すことを要する。具体的には、本発明の前記P4の蛍光標識オリゴヌクレオチドは、配列番号2における186番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して、80%以上の同一性を示す。また、検出感度の観点より、例えば、85%以上の同一性、90%以上の同一性、95%以上の同一性、96%以上の同一性、97%以上の同一性、98%以上の同一性又は99%以上の同一性を示してもよい。また、前記P4の蛍光標識オリゴヌクレオチドは、さらに、配列番号2における186番目の塩基に相補的な塩基がC(シトシン)であり、且つ、201番目の塩基に相補的な塩基が、s(CまたはG)である以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して同一性を有すことが好ましい。
【0070】
本発明の前記P4の蛍光標識オリゴヌクレオチドが、例えば、配列番号2の201番目の塩基に相補的な塩基が、変異型のCである場合、例えば、以下のようなことがいえる。本発明の前記P4の蛍光標識オリゴヌクレオチドと、配列番号4における186番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列とを比較した際、その同一性が80%未満である場合には、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が低くなる。
【0071】
本発明の前記P4の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号2における201番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号2における201番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号2の201番目の塩基に相補的な塩基が、変異型Cである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0072】
本発明における前記P4’の蛍光標識オリゴヌクレオチドは、配列番号2における186番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズすることを要する。前記P4’の蛍光標識オリゴヌクレオチドは、例えば、配列番号2に示す塩基配列の201番目の塩基に相補的な塩基(s)が、Cでもよいし、Gでもよい。前記ハイブリダイゼーションならびにストリンジェントな条件は、前述の通りである。
(P4’)配列番号2で示される配列のうち186番目〜201番目の塩基を含む塩基長16〜50の配列に相補的な配列であり、配列番号2における186番目の塩基に相補的な塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち186番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0073】
本発明の前記P4’の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号2における201番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号2における201番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号2の201番目の塩基に相補的な塩基が、変異型Cである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0074】
本発明における前記P4または前記P4’の蛍光標識オリゴヌクレオチドには、前記P4又は前記P4’の蛍光標識オリゴヌクレオチドに、塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドは、前記P4又は前記P4’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、塩基が挿入、欠失又は置換されている場合、その挿入、欠失又は置換の位置は、特に限定されない。挿入、欠失又は置換した塩基の数は、1塩基又は2塩基以上が挙げられる。前記塩基の数は、前記蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜10塩基、又は1塩基〜5塩基が挙げられる。
【0075】
中でも、本発明における前記P4又は前記P4’の蛍光標識オリゴヌクレオチドには、前記P4又は前記P4’の蛍光標識オリゴヌクレオチドの塩基が置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が置換した蛍光標識オリゴヌクレオチドは、前記P4又は前記P4’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、置換の位置は、特に限定されない。例えば、検出感度の観点より、配列番号2で示される配列のうち186番目〜201番目の塩基以外に位置する塩基に相補的な塩基が置換されることが挙げられる。置換される塩基の数は、1塩基又は2塩基以上が挙げられる。置換される塩基の数は、蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜5塩基、又は1塩基〜3塩基が挙げられる。
【0076】
本発明の前記P4又は前記P4’の蛍光標識オリゴヌクレオチドの長さは、16〜50塩基(mer)であることを要する。前記P4又は前記P4’の蛍光標識オリゴヌクレオチドの長さが、15塩基以下または51塩基以上である場合、CYP3A遺伝子多型の検出感度が低下する。また、本発明の前記P4又は前記P4’の蛍光標識オリゴヌクレオチドの長さは、例えば、16〜40塩基、又は20〜30塩基としうる。例えば、前記16〜40塩基という範囲にすることにより、例えば検出感度が高くなる等の傾向がある。また前記P4又は前記P4’の蛍光標識オリゴヌクレオチドの塩基長を変化させることで、例えば、前記P4又は前記P4’の蛍光標識オリゴヌクレオチドがその相補鎖と形成するハイブリッド形成体の解離温度であるTm値を、所望の値とすることができる。
【0077】
以下に、本発明における前記P4の蛍光標識オリゴヌクレオチドの塩基配列の一例を示すが、本発明はこれらに限定されない。
5'-atgatgtgctastgatcacatccatgc-3' (配列番号41)
5'-atgatgtgctactgatcacatccatgc-3' (配列番号10)(U0-3TMR4)
5'-atgatgtgctagtgatcacatccatgc-3' (配列番号42)
5'-gatgtgctastgatcacatccatgc-3' (配列番号43)
5'-gatgtgctactgatcacatccatgc-3' (配列番号44)
5'-gatgtgctagtgatcacatccatgc-3' (配列番号11)
【0078】
本発明の前記P4又は前記P4’の蛍光標識オリゴヌクレオチドは、配列番号2の配列のうち186番目の塩基に相補的な塩基が蛍光色素で標識されていることを要する。
【0079】
前記P4又は前記P4’の蛍光標識オリゴヌクレオチドにおいて、この蛍光標識された186番目の塩基に相補的な塩基は、3’末端から数えて1〜3番目のいずれかの位置に存在することができ、また、3’末端に存在することができる。これにより、例えば、多型検出感度がより向上し、また、前記P4又は前記P4’の蛍光標識オリゴヌクレオチドを、生産性よく得ることができる。
【0080】
本発明において、前記P5及びP5’からなる群より選択される一種の蛍光標識オリゴヌクレオチド(以下、「前記(P5)又は(P5’)蛍光標識オリゴヌクレオチド」ともいう。)は、配列番号3に示す塩基配列の501番目の塩基における多型を検出できるプローブである。
(P5)配列番号3で示される配列のうち496番目〜501番目の塩基を含む塩基長6〜50の配列に相補的な配列であり、配列番号3における496番目の塩基に相補的な塩基がシトシンである以外は、配列番号3の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号3で示される配列のうち496番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
(P5’)配列番号3で示される配列のうち496番目〜501番目の塩基を含む塩基長6〜50の配列に相補的な配列であり、配列番号3における496番目の塩基に相補的な塩基がシトシンである以外は、配列番号3と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号3で示される配列のうち496番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド
【0081】
CYP3A4遺伝子の野生型では、配列番号3に示される配列のうち501番目に対応する塩基(r)は、A(アデニン)であるが、変異型では、前記塩基(r)がG(グアニン)に変異している。以下、配列番号3のCYP3A4遺伝子の前記多型を「CYP3A4*1B多型」という。この多型を検出するプローブを、以下、CYP3A4*1B用プローブともいう。
【0082】
本発明において、前記P5及びP5’の蛍光標識オリゴヌクレオチドは、例えば、配列番号3に示す塩基配列の501番目の塩基に相補的な塩基(y)が、Cでもよいし、Tでもよい。
【0083】
本発明の前記P5の蛍光標識オリゴヌクレオチドは、具体的には、配列番号3で示される配列のうち496番目〜501番目の塩基を含む配列に相補的な配列である。前記P5の蛍光標識オリゴヌクレオチドは、例えば、配列番号3に示す塩基配列の501番目の塩基に相補的な塩基(y)が、Cでもよいし、Tでもよい。
【0084】
本発明の前記P5の蛍光標識オリゴヌクレオチドは、配列番号3における496番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号3の相補鎖と同一の塩基を有する塩基配列に対して同一性を有すことを要する。具体的には、本発明の前記P5の蛍光標識オリゴヌクレオチドは、配列番号3における496番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号3の相補鎖と同一の塩基を有する塩基配列に対して、80%以上の同一性を示す。また、検出感度の観点より、例えば、85%以上の同一性、90%以上の同一性、95%以上の同一性、96%以上の同一性、97%以上の同一性、98%以上の同一性又は99%以上の同一性を示してもよい。また、前記P5の蛍光標識オリゴヌクレオチドは、さらに、配列番号3における496番目の塩基に相補的な塩基がC(シトシン)であり、且つ、501番目の塩基に相補的な塩基が、y(CまたはT)である以外は、配列番号3の相補鎖と同一の塩基を有する塩基配列に対して同一性を有すことが好ましい。
【0085】
本発明の前記P5の蛍光標識オリゴヌクレオチドが、例えば、配列番号3の501番目の塩基に相補的な塩基が、変異型のCである場合、例えば、以下のようなことがいえる。本発明の前記P5の蛍光標識オリゴヌクレオチドと、配列番号5における496番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号5の相補鎖と同一の塩基を有する塩基配列とを比較した際、その同一性が80%未満である場合には、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が低くなる。
【0086】
本発明の前記P5の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号3における501番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号3における501番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドは、例えば、配列番号3の501番目の塩基に相補的な塩基が、変異型Cである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0087】
本発明における前記P5’の蛍光標識オリゴヌクレオチドは、配列番号3における496番目の塩基に相補的な塩基がC(シトシン)である以外は、配列番号3と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズすることを要する。前記P5’の蛍光標識オリゴヌクレオチドは、例えば、配列番号3に示す塩基配列の501番目の塩基に相補的な塩基(y)が、Cでもよいし、Tでもよい。前記ハイブリダイゼーションならびにストリンジェントな条件は、前述の通りである。
【0088】
本発明の前記P5’の蛍光標識オリゴヌクレオチドとしては、例えば、配列番号3における501番目の塩基の多型を認識する蛍光標識オリゴヌクレオチドでもよい。当該蛍光標識オリゴヌクレオチドは、特定の塩基配列を有することに加え、配列番号3における501番目の塩基の多型を認識するという機能を有する。このため、前記蛍光標識オリゴヌクレオチドが、例えば、配列番号3の501番目の塩基に相補的な塩基が、変異型Cである場合、変異型のCYP3A4遺伝子を含む試料核酸に対する検出感度が高くなる傾向がある。
【0089】
本発明における前記P5または前記P5’の蛍光標識オリゴヌクレオチドには、前記P5又は前記P5’の蛍光標識オリゴヌクレオチドに、塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が挿入、欠失又は置換した蛍光標識オリゴヌクレオチドは、前記P5又は前記P5’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、塩基が挿入、欠失又は置換されている場合、その挿入、欠失又は置換の位置は、特に限定されない。挿入、欠失又は置換した塩基の数は、1塩基又は2塩基以上が挙げられる。前記塩基の数は、前記蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜10塩基、又は1塩基〜5塩基が挙げられる。
【0090】
中でも、本発明における前記P5又は前記P5’の蛍光標識オリゴヌクレオチドには、前記P5又は前記P5’の蛍光標識オリゴヌクレオチドの塩基が置換した蛍光標識オリゴヌクレオチドも包含される。前記塩基が置換した蛍光標識オリゴヌクレオチドは、前記P5又は前記P5’の蛍光標識オリゴヌクレオチドと同等程度の作用を示せばよく、置換の位置は、特に限定されない。例えば、検出感度の観点より、配列番号3で示される配列のうち496番目〜501番目の塩基以外に位置する塩基に相補的な塩基が置換されることが挙げられる。置換される塩基の数は、1塩基又は2塩基以上が挙げられる。置換される塩基の数は、蛍光標識オリゴヌクレオチド全体の長さによって異なるが、例えば、1塩基〜5塩基、又は1塩基〜3塩基が挙げられる。
【0091】
本発明の前記P5又は前記P5’の蛍光標識オリゴヌクレオチドの長さは、6〜50塩基(mer)であることを要する。前記P5又は前記P5’の蛍光標識オリゴヌクレオチドの長さが、5塩基以下または51塩基以上である場合、CYP3A遺伝子多型の検出感度が低下する。また、本発明の前記P5又は前記P5’の蛍光標識オリゴヌクレオチドの長さは、例えば、10〜40塩基、又は20〜30塩基としうる。例えば、前記10〜40塩基という範囲にすることにより、例えば検出感度が高くなる等の傾向がある。また前記P5又は前記P5’の蛍光標識オリゴヌクレオチドの塩基長を変化させることで、例えば、前記P5又は前記P5’の蛍光標識オリゴヌクレオチドがその相補鎖と形成するハイブリッド形成体の解離温度であるTm値を、所望の値とすることができる。
【0092】
以下に、本発明における前記P5の蛍光標識オリゴヌクレオチドの塩基配列の一例を示すが、本発明はこれらに限定されない。
5'-taaatcgccgctctcytgccc-3' (配列番号45)
5'-taaatcgccgctctcctgccc-3' (配列番号12)(3PB-CYP3A4*1B-R3)
5'-taaatcgccgctctcttgccc-3' (配列番号13)
【0093】
本発明の前記P5又は前記P5’の蛍光標識オリゴヌクレオチドは、配列番号3の配列のうち496番目の塩基に相補的な塩基が蛍光色素で標識されていることを要する。
【0094】
前記P5又は前記P5’の蛍光標識オリゴヌクレオチドにおいて、この蛍光標識された496番目の塩基に相補的な塩基は、3’末端から数えて1〜3番目のいずれかの位置に存在することができ、また、3’末端に存在することができる。これにより、例えば、多型検出感度がより向上し、また、P5又は前記P5’の蛍光標識オリゴヌクレオチドを、生産性よく得ることができる。
【0095】
前記P1、P1’、P2、P2’、P3、P3’、P4、P4’、P5及びP5’の蛍光標識オリゴヌクレオチドについて、ハイブリッド形成体のTm値は、例えば、Meltcalc 99 free(http://www.meltcalc.com/)を用いて算出できる。設定条件は、特に制限されず、例えば、Oligoconc[μM]0.2、Na eq.[mM]50の条件があげられる。前記ハイブリッド形成体は、検出部位に対応する塩基が変異型である前記蛍光標識オリゴヌクレオチド(変異型蛍光標識オリゴヌクレオチド)と、検出部位が変異型である相補的配列又は検出部位が野生型である相補的配列とのハイブリッド形成体、検出部位に対応する塩基が野生型である前記蛍光標識オリゴヌクレオチド(野生型蛍光標識オリゴヌクレオチド)と、検出部位が変異型である相補的配列又検出部位が野生型である相補的配列とのハイブリッド形成体があげられる。前記変異型蛍光標識オリゴヌクレオチドと変異型相補配列とのTm値は、前記変異型蛍光標識オリゴヌクレオチドと野生型相補配列とのTm値との差が、例えば、3℃以上、4℃以上、5℃以上、30℃以下である。また、前記野生型蛍光標識オリゴヌクレオチドと野生型相補配列とのTm値は、前記野生型蛍光標識オリゴヌクレオチドと変異型相補配列とのTm値との差が、例えば、3℃以上、4℃以上、5℃以上、又は7℃以上等、例えば、30℃以下等である。
【0096】
本発明の前記蛍光標識オリゴヌクレオチドは、例えば、相補鎖にハイブリダイズしていないときの蛍光強度に比べて、相補鎖にハイブリダイズしているときの蛍光強度が減少(消光)するかまたは増加する蛍光標識オリゴヌクレオチドとすることができる。その中でも、相補鎖にハイブリダイズしていないときの蛍光強度に比べて、相補鎖にハイブリダイズしているときの蛍光強度が減少する蛍光標識オリゴヌクレオチドとすることができる。
【0097】
このような蛍光消光現象(Quenching phenomenon)を利用したプローブは、一般的に、グアニン消光プローブと呼ばれており、いわゆるQ Probe(登録商標)として知られている。中でも、3’末端もしくは5’末端がシトシン(C)となるように設計され、その末端のCがグアニン(G)に近づくと、発光が弱くなるように蛍光色素で標識化されたオリゴヌクレオチドであることが、特に好ましい。このようなプローブを使用すれば、例えば、シグナルの変動により、ハイブリダイズと解離とを容易に確認できる。
【0098】
Q Probeを用いた検出方法以外にも、公知の検出様式を適用してもよい。このような検出様式としては、Taq−man Probe法、Hybridization Probe法、Molecular Beacon法又はMGB Probe法などを挙げることができる。
【0099】
前記蛍光色素としては、特に制限されず、例えば、フルオレセイン、リン光体、ローダミン、ポリメチン色素誘導体等があげられる。前記蛍光色素の市販品は、例えば、Pacific Blue、BODIPY FL、FluorePrime、Fluoredite、FAM、Cy3及びCy5、TAMRA等が挙げられる。前記蛍光標識オリゴヌクレオチドの検出条件は、特に制限されず、使用する前記蛍光色素により適宜決定できる。例えば、Pacific Blueは、検出波長445nm〜480nm、TAMRAは、検出波長585nm〜700nm、BODIPY FLは、検出波長520nm〜555nmで検出できる。このような蛍光色素を有するプローブを使用すれば、それぞれの蛍光シグナルの変動により、ハイブリダイズと解離とを容易に確認できる。前記蛍光色素のオリゴヌクレオチドへの結合は、通常の方法、例えば、特開2002−119291号公報等に記載の方法に従って行うことができる。
【0100】
また、前記蛍光標識オリゴヌクレオチドは、例えば、3'末端にリン酸基が付加されてもよい。前記蛍光標識オリゴヌクレオチドの3'末端にリン酸基を付加させておくことで、プローブ自体が遺伝子増幅反応によって伸長することを十分に抑制できるためである。後述するように、変異の有無を検出するDNA(標的DNA)は、PCR等の遺伝子増幅法によって調製できる。その際、3'末端にリン酸基が付加された蛍光標識オリゴヌクレオチドを用いることで、これを増幅反応の反応液中に共存させることができる。また、前記プローブの3'末端に、例えば、前述のような標識化物質(蛍光色素)を付加することによっても、同様の効果が得られる。
【0101】
前記各蛍光標識オリゴヌクレオチドは、CYP3A遺伝子における多型、特に、CYP3A5*3、CYP3A4*16及び/またはCYP3A4*1Bを検出する、CYP3A遺伝子多型検出用プローブとして使用することができる。また、前記CYP3A遺伝子多型検出用プローブは、後述する融解曲線分析用のプローブとして使用することができる。
【0102】
なお、本発明にかかる前記蛍光標識オリゴヌクレオチドは、例えば、前述のような条件に基づいて蛍光色素で標識された塩基を用いる以外は、オリゴヌクレオチドの合成方法として知られている公知の方法、例えば特開2002−119291号公報等に記載の方法に従って作製することができる。
【0103】
<プライマー>
後述するCYP3A遺伝子多型検出方法では、例えば、検出対象となるCYP3A遺伝子多型を含む配列を、PCR法等の増幅法により増幅する場合、プライマーが用いられる。本発明において使用しうるプライマーは、特に制限されず、目的とする検出対象となるCYP3A遺伝子の多型の部位を含む核酸を増幅可能であればよい。前記核酸は、例えば、配列番号1の401番目の塩基に対応する塩基を含む核酸、配列番号2の201番目の塩基に対応する塩基を含む核酸、配列番号3の501番目の塩基に対応する塩基を含む核酸等があげられる。
【0104】
増幅法に適用するプライマーは、本発明の多型検出用プローブがハイブリダイゼーションできる領域が増幅できるものであれば、特に制限されず、配列番号1、配列番号2及び配列番号3で示される塩基配列から、当業者であれば適宜設計できる。前記プライマーの長さ及びTm値は、例えば、12〜40塩基(mer)及び40〜70塩基、又は、16〜30塩基及び55〜60塩基にすることができる。また、プライマーセットの各プライマーの長さは、例えば、同一でなくてもよいが、両プライマーのTm値は、ほぼ同一、又は、両プライマーのTm値の差が5℃以内であることが好ましい。
【0105】
以下に、本発明の多型検出方法において、本発明の多型検出用プローブがハイブリダイズする領域を含む塩基配列の増幅に使用できるプライマーの例を示す。なお、これらは例示であって、本発明を制限するものではない。
【0106】
前記配列番号1で示される配列のうち401番目の塩基(r)における多型を検出するためのプライマーは、下記P6、P6’、P7及びP7’からなる群より選択される少なくとも1種のオリゴヌクレオチドが好ましい。前記ハイブリダイゼーションならびにストリンジェントな条件は、前述の通りである。
(P6)配列番号1で示される塩基配列のうち322番目〜344番目の塩基を含む塩基長23〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチド
(P6’)配列番号1に示す塩基配列において322番目〜344番目の塩基を含む塩基長23〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチド
(P7)配列番号1で示される塩基配列のうち446番目〜463番目の塩基を含む塩基長18〜50塩基の塩基配列の相補鎖に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチド
(P7’)配列番号1に示す塩基配列において446番目〜463番目の塩基を含む塩基長18〜50の塩基配列に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチド
【0107】
前記P6のオリゴヌクレオチドは、配列番号1で示される塩基配列のうち322番目〜344番目の塩基を含む塩基長23〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチドであり、且つ配列番号1における401番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。前記P6’のオリゴヌクレオチドは、配列番号1に示す塩基配列において322番目〜344番目の塩基を含む塩基長23〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチドであり、且つ配列番号1における401番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。
【0108】
前記P7のオリゴヌクレオチドは、配列番号1で示される塩基配列のうち446番目〜463番目の塩基を含む塩基長18〜50塩基の塩基配列の相補鎖に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチドであり、且つ配列番号1における401番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。前記P7’のオリゴヌクレオチドは、配列番号1に示す塩基配列において446番目〜463番目の塩基を含む塩基長18〜50の塩基配列に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチドであり、且つ配列番号1における401番目の塩基を含む領域を増幅するオリゴヌクレオチドでもよい。
【0109】
以下に、本発明の多型検出方法において、前記配列番号1における401番目の塩基(r)を含む領域の増幅に使用できるプライマーの一例を示す。
P6 Fプライマー (配列番号14)(CYP3A5*3 F4)
5'-cgtatgtaccacccagcttaacg-3'
P7 Rプライマー (配列番号15)(CYP3A5*3 R4)
5'-cacaggagccacccaagg-3'
【0110】
また、前記配列番号1における401番目の塩基(r)の多型を検出するためには、前記P6又はP6’で表わされるオリゴヌクレオチド、及びP7又はP7’で表されるオリゴヌクレオチドを、一対のプライマーセットとして用いることがより好ましい。
【0111】
前記配列番号2で示される配列のうち201番目の塩基(s)における多型を検出するためのプライマーは、下記P8、P8’、P9、P9’、P10及びP10’からなる群より選択される少なくとも1種のオリゴヌクレオチドが好ましい。前記ハイブリダイゼーションならびにストリンジェントな条件は、前述の通りである。
(P8)配列番号2で示される塩基配列のうち118番目〜137番目の塩基を含む塩基長20〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチド
(P8’)配列番号2で示される塩基配列のうち118番目〜137番目の塩基を含む塩基長20〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチド
(P9)配列番号2で示される塩基配列のうち22番目〜49番目の塩基を含む塩基長28〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチド
(P9’) 配列番号2で示される塩基配列のうち22番目〜49番目の塩基を含む塩基長28〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチド
(P10)配列番号2で示される塩基配列のうち292番目〜312番目の塩基を含む塩基長21〜50塩基の塩基配列の相補鎖に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチド
(P10’)配列番号2に示す塩基配列において292番目〜312番目の塩基を含む塩基長21〜50の塩基配列に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチド
【0112】
前記P8のオリゴヌクレオチドは、配列番号2で示される塩基配列のうち118番目〜137番目の塩基を含む塩基長20〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチドであり、且つ配列番号2における201番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。前記P8’のオリゴヌクレオチドは、配列番号2で示される塩基配列のうち118番目〜137番目の塩基を含む塩基長20〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチドであり、且つ配列番号2における201番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。
【0113】
前記P9のオリゴヌクレオチドは、配列番号2で示される塩基配列のうち22番目〜49番目の塩基を含む塩基長28〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチドであり、且つ配列番号2における201番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。前記P9’のオリゴヌクレオチドは、配列番号2で示される塩基配列のうち22番目〜49番目の塩基を含む塩基長28〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチドであり、且つ配列番号2における201番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。
【0114】
前記P10のオリゴヌクレオチドは、配列番号2で示される塩基配列のうち292番目〜312番目の塩基を含む塩基長21〜50塩基の塩基配列の相補鎖に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチドであり、且つ配列番号2における201番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。前記P10’のオリゴヌクレオチドは、配列番号2に示す塩基配列において292番目〜312番目の塩基を含む塩基長21〜50の塩基配列に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチドであり、且つ配列番号2における201番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。
【0115】
以下に、本発明の多型検出方法において、前記配列番号2における201番目の塩基(s)を含む領域の増幅に使用できるプライマーの一例を示す。
P8 Fプライマー (配列番号16)
5'-aggatggtaaaaaggtgctg-3'
P10 Rプライマー (配列番号17)
5'-gagagaaagaatggatccaaa-3'
【0116】
前記プライマーは、例えば、後述するように付加配列を有してもよく、以下のプライマーが例示できる。下記配列において、下線部のCTAGA及びGACGAが、前記付加配列に該当する。
P9 Fプライマー (配列番号18)(CYP3A4*16-F6+CTAGA)
5'-CTAGAggagtgtgatagaaggtgatctagtaga-3'
P10 Rプライマー (配列番号28)(U0-R3+GACGA)
5'-GACGAgagagaaagaatggatccaaa-3'
【0117】
また、前記配列番号2における201番目の塩基(s)の多型を検出するためには、前記P8、P8’、P9又はP9’で表わされるオリゴヌクレオチド、及びP10又はP10’で表されるオリゴヌクレオチドを、一対のプライマーセットとして用いることがより好ましい。
【0118】
前記配列番号3で示される配列のうち501番目の塩基(r)における多型を検出するためのプライマーは、下記P11、P11’、P12及びP12’からなる群より選択される少なくとも1種のオリゴヌクレオチドが好ましい。前記ハイブリダイゼーションならびにストリンジェントな条件は、前述の通りである。
(P11)配列番号3で示される塩基配列のうち432番目〜457番目の塩基を含む塩基長26〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチド
(P11’)配列番号3に示す塩基配列において432番目〜457番目の塩基を含む塩基長26〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチド
(P12)配列番号3で示される塩基配列のうち508番目〜539番目の塩基を含む塩基長32〜50塩基の塩基配列の相補鎖に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチド
(P12’)配列番号3に示す塩基配列において508番目〜539番目の塩基を含む塩基長32〜50の塩基配列に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチド
【0119】
前記P11のオリゴヌクレオチドは、配列番号3で示される塩基配列のうち432番目〜457番目の塩基を含む塩基長26〜50の塩基配列に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチドであり、且つ配列番号3における501番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。前記P11’のオリゴヌクレオチドは、配列番号3に示す塩基配列において432番目〜457番目の塩基を含む塩基長26〜50の塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチドであり、且つ配列番号3における501番目の塩基を含む領域を増幅するオリゴヌクレオチドでもよい。
【0120】
前記P12のオリゴヌクレオチドは、配列番号3で示される塩基配列のうち508番目〜539番目の塩基を含む塩基長32〜50塩基の塩基配列の相補鎖に対して、少なくとも80%以上の同一性を有するオリゴヌクレオチドであり、且つ配列番号3における501番目の塩基を含む領域を増幅するオリゴヌクレオチドであってもよい。前記P12’のオリゴヌクレオチドは、配列番号3に示す塩基配列において508番目〜539番目の塩基を含む塩基長32〜50の塩基配列に対してストリンジェントな条件下でハイブリダイズするオリゴヌクレオチドであり、且つ配列番号3における501番目の塩基を含む領域を増幅するオリゴヌクレオチドでもよい。
【0121】
以下に、本発明の多型検出方法において、前記配列番号3における501番目の塩基(r)を含む領域の増幅に使用できるプライマーの一例を示す。
P11 Fプライマー (配列番号26)(CYP3A4-1B-F1)
5'-ctgtaggtgtggcttgttgggatgaa-3'
P12 Rプライマー (配列番号27)(CYP3A4-1B-R1)
5'-ggagccattggcataaaatctattaaatcgc-3'
【0122】
また、前記配列番号3における501番目の塩基(r)の多型を検出するためには、前記P11又はP11’で表わされるオリゴヌクレオチド、及びP12又はP12’で表されるオリゴヌクレオチドを、一対のプライマーセットとして用いることがより好ましい。
【0123】
前記P6、P7、P8、P9、P10、P11及びP12において、前記同一性は、例えば、85%以上の同一性、90%以上の同一性、95%以上の同一性、96%以上の同一性、97%以上の同一性、98%以上の同一性又は99%以上の同一性を示してもよい。
【0124】
本発明におけるプライマーは、前記オリゴヌクレオチドを含むプライマーでもよいし、前記オリゴヌクレオチドからなるプライマーでもよい。前者の場合、本発明のプライマーは、例えば、前記オリゴヌクレオチドの3’末端及び5’末端の少なくとも一方に、付加配列を有してもよい。前記付加配列は、特に制限されず、その長さが、例えば、1〜20塩基長、3〜15塩基長、5〜10塩基長等であり、そのGC含量が、例えば、20〜80%程度、40〜70%程度、40〜60%程度である。
【0125】
本発明の多型の検出方法は、前記蛍光標識ヌクレオチドをプローブとして利用する方法であれば、特に制限されない。前記蛍光標識ヌクレオチドをプローブとして用いる多型検出方法の一例として、Tm解析を利用した多型検出方法について、以下に説明する。
【0126】
<多型検出方法>
本発明にかかるCYP3A遺伝子多型検出方法は、前記CYP3A遺伝子多型検出用プローブを少なくとも1種用いて、CYP3A遺伝子の多型を検出することを含む、CYP3A遺伝子多型検出方法である。本発明にかかる多型検出方法によれば、前記多型検出用プローブを少なくとも1種使用することにより、CYP3A遺伝子の多型を、簡便に、感度よく検出可能にする。
【0127】
本発明の多型検出方法は、CYP3A遺伝子における多型の検出方法であって、下記工程(I)〜(IV)を含むことができ、下記工程(V)を含んでいてもよい。なお、本発明の多型検出方法は、前記多型検出用プローブを使用することが特徴であって、その他の構成や条件等は、以下の記載に制限されない。
(I)前記多型検出用プローブ及び試料中の一本鎖核酸を接触させて、前記多型検出用プローブ及び前記一本鎖核酸をハイブリダイズしてハイブリッド形成体を得ること。
(II)前記ハイブリッド形成体を含む試料の温度を変化させることで、前記ハイブリッド形成体を解離させ、前記ハイブリッド形成体の解離に基づく蛍光シグナルの変動を測定すること。
(III)前記蛍光シグナルの変動に基づいてハイブリッド形成体の解離温度であるTm値を測定すること。
(IV)前記Tm値に基づいて、前記試料中の一本鎖核酸における、CYP3A遺伝子における多型の存在を検出すること。
(V)前記多型の存在に基づいて、前記試料中の一本鎖核酸における、多型を有する一本鎖核酸の存在比を検出すること。
【0128】
また、本発明においては、前記工程(I)〜(IV)又は前記工程(I)〜(V)に加えて、さらに、工程(I)の前又は工程(I)と同時に、核酸を増幅することを含んでいてもよい。なお、前記(III)でTm値を測定することには、例えば、ハイブリッド形成体の解離温度を測定することだけでなく、ハイブリット形成体の融解時に、温度に応じて変動する蛍光シグナルの微分値の大きさを測定することを含んでもよい。
【0129】
本発明において、前記試料中の核酸は、一本鎖核酸でもよいし二本鎖核酸でもよい。前記核酸が二本鎖核酸の場合、例えば、前記蛍光標識オリゴヌクレオチドとハイブリダイズすることに先立って、加熱により前記試料中の二本鎖核酸を融解(解離)させて、一本鎖核酸とすることを含むことが好ましい。二本鎖核酸を一本鎖核酸に解離することによって、前記蛍光標識オリゴヌクレオチドとのハイブリダイズが可能となる。
【0130】
本発明において、試料に含まれる検出対象である核酸は、例えば、生体試料に元来含まれる核酸でもよいが、検出精度が向上できることから、生体試料に元来含まれている核酸を鋳型として、PCR等の増幅法により、CYP3A遺伝子の変異した部位を含む領域を増幅させた増幅産物であることが好ましい。前記増幅産物の長さは、特に制限されないが、例えば、50〜1000塩基(mer)、又は80〜200塩基にすることができる。また、試料中の核酸は、例えば、生体試料由来のRNA(トータルRNA、mRNA等)からRT−PCR(Reverse Transcription PCR)により合成したcDNAであってもよい。
【0131】
本発明において、前記試料中の核酸に対する、本発明の多型検出用プローブの添加割合(モル比)は特に制限されない。試料中のDNAに対して、例えば、1倍以下が挙げられる。また、十分な検出シグナル確保の観点より、前記試料中の核酸に対する、本発明の多型検出用プローブの添加割合(モル比)は、0.1倍以下としうる。ここで、試料中の核酸は、例えば、検出目的の多型が発生している検出対象核酸と、前記多型が発生していない非検出対象核酸との合計でもよいし、検出目的の多型が発生している検出対象配列を含む増幅産物と、前記多型が発生していない非検出対象配列を含む増幅産物との合計でもよい。なお、試料中の核酸における前記検出対象核酸の割合は、通常、不明であるが、結果的に、前記多型検出用プローブの添加割合(モル比)は、検出対象核酸(検出対象配列を含む増幅産物)に対して10倍以下としうる。また、前記多型検出用プローブの添加割合(モル比)は、検出対象核酸(検出対象配列を含む増幅産物)に対して、5倍以下、又は3倍以下としうる。また、その下限は特に制限されないが、例えば、0.001倍以上、0.01倍以上、又は0.1倍以上としうる。
【0132】
前記DNAに対する本発明の多型検出用プローブの添加割合は、例えば、二本鎖核酸に対するモル比でもよいし、一本鎖核酸に対するモル比でもよい。
【0133】
本発明において、Tm値を決定するための温度変化に伴うシグナル変動の測定は、前述のような原理から、260nmの吸光度測定により行うこともできるが、前記多型検出用プローブに付加した標識のシグナルに基づくシグナルであって、一本鎖DNAと前記多型検出用プローブとのハイブリッド形成の状態に応じて変動するシグナルを測定することが好ましい。このため、前記多型検出用プローブとして、前述の蛍光標識オリゴヌクレオチドを使用することが好ましい。前記蛍光標識オリゴヌクレオチドは、例えば、標的配列(相補配列)にハイブリダイズしていないときの蛍光強度に比べて、標的配列にハイブリダイズしているときの蛍光強度が減少(消光)する蛍光標識オリゴヌクレオチド、または標的配列にハイブリダイズしていないときの蛍光強度に比べて、標的配列にハイブリダイズしているときの蛍光強度が増加する蛍光標識オリゴヌクレオチドが挙げられる。
【0134】
前者のようなプローブであれば、例えば、検出対象配列とハイブリッド(二本鎖DNA)を形成している際には蛍光シグナルを示さないか、蛍光シグナルが弱いが、加熱によりプローブが解離すると蛍光シグナルを示すようになるか、蛍光シグナルが増加する。また、後者のプローブであれば、例えば、検出対象配列とハイブリッド(二本鎖DNA)を形成することによって蛍光シグナルを示し、加熱によりプローブが解離すると蛍光シグナルが減少(消失)する。したがって、この蛍光標識に基づく蛍光シグナルの変化を、前記蛍光標識特有の条件(蛍光波長等)で検出することによって、前記260nmの吸光度測定と同様に、融解の進行ならびにTm値の決定を行うことができる。
【0135】
次に、本発明の多型検出方法について、蛍光色素に基づくシグナルの変化を検出する方法について、具体例を挙げて説明する。なお、本発明の多型検出方法は、前記多型検出用プローブを使用すること自体が特徴であり、その他の工程や条件については何ら制限されない。
【0136】
核酸増幅を行う際の鋳型となる核酸を含む試料としては、核酸、特に、CYP3A遺伝子を含んでいればよく、特に制限されない。例えば、大腸や肺等の組織、白血球細胞等の血球、全血、血漿、喀痰、口腔粘膜懸濁液、爪や毛髪等の体細胞、生殖細胞、乳、腹水液、パラフィン包埋組織、胃液、胃洗浄液、尿、腹膜液、羊水、細胞培養などの任意の生物学的起源に由来する又は由来しうるものを挙げられる。なお、試料の採取方法、核酸を含む試料の調製方法等は、特に制限されず、いずれも従来公知の方法が採用できる。また、鋳型となる核酸は、該起源から得られたままで、直接的に使用でき、あるいは、前記サンプルの特性を改変するために前処理した後で使用することができる。例えば、全血を試料とする場合、全血からのゲノムDNAの単離は、従来公知の方法によって行うことができる。例えば、市販のゲノムDNA単離キット(商品名GFX Genomic Blood DNA Purification kit;GEヘルスケアバイオサイエンス社製)等が使用できる。
【0137】
次に、単離したゲノムDNAを含む試料に、前記蛍光標識オリゴヌクレオチドを含む多型検出用プローブを添加する。前記多型検出用プローブは、単離したゲノムDNAを含む液体試料に添加してもよいし、適当な溶媒中でゲノムDNAと混合してもよい。前記溶媒は、特に制限されず、例えば、Tris−HCl等の緩衝液、KCl、MgCl2、MgSO4、グリセロール等を含む溶媒、PCR反応液等、従来公知のものが挙げられる。
【0138】
前記多型検出用プローブの添加のタイミングは、特に制限されず、例えば、後述するPCR等の増幅処理を行う場合、増幅処理の後に、PCR増幅産物に対して添加してもよいし、増幅処理前に添加してもよい。PCR等による増幅処理前に、前記検出用プローブを添加する場合は、例えば、前述のように、前記多型検出用プローブの3'末端に、蛍光色素を付加したり、リン酸基を付加したりすることが好ましい。
【0139】
核酸増幅の方法としては、例えばポリメラーゼを用いる方法等が挙げられる。その例としては、PCR法、ICAN法、LAMP法、NASBA法等が挙げられる。ポリメラーゼを用いる方法により増幅する場合は、本発明プローブの存在下で増幅を行うことが好ましい。用いるプローブ及びポリメラーゼに応じて、増幅の反応条件等を調整することは当業者であれば容易である。これにより、核酸の増幅後にプローブのTm値を解析するだけで多型を評価できるので、反応終了後、増幅産物を取り扱う必要がない。よって、前記増幅産物による汚染の心配がない。また、増幅に必要な機器と同じ機器で検出することが可能なので、容器を移動する必要がなく、自動化も容易である。
【0140】
また、PCR法に用いるDNAポリメラーゼとしては、通常用いられるDNAポリメラーゼを特に制限なく用いることができる。例えば、GeneTaq(ニッポンジーン社製)、PrimeSTAR Max DNA Polymerase(タカラバイオ社製)、Taq ポリメラーゼ等を挙げることができる。ポリメラーゼの使用量としては、特に制限されず、通常用いられている濃度があげられる。例えば、Taqポリメラーゼを用いる場合、反応溶液量50μlに対して、例えば、0.01U〜100Uの濃度とすることができる。これにより、CYP3A遺伝子多型の検出感度が高まるなどの傾向がある。
【0141】
また、PCR法は、通常用いられる条件を適宜選択することで行うことができる。なお、増幅の際、例えば、リアルタイムPCRによって増幅をモニタリングし、試料に含まれるDNA(検出対象配列)のコピー数を調べることもできる。すなわち、PCRによるDNA(検出対象配列)の増幅に従ってハイブリッドを形成するプローブの割合が増えるので、蛍光強度が変動する。これをモニタリングすることで、試料に含まれる検出対象配列(正常DNAまたは変異DNA)のコピー数や存在比を評価できる。
【0142】
本発明の多形検出方法においては、前記蛍光標識オリゴヌクレオチドと、試料中の一本鎖核酸とを接触させて、両者をハイブリダイズさせる。試料中の一本鎖核酸は、例えば、前述のようにして得られたPCR増幅産物を解離することで調製できる。
【0143】
前記PCR増幅産物の解離(解離工程)における加熱温度は、特に制限されず、前記増幅産物が解離できる温度があげられる。前記温度は、例えば、85〜95℃である。加熱時間も特に制限されない。加熱時間は、例えば、1秒〜10分、又は1秒〜5分としうる。
【0144】
また、解離した一本鎖DNAと前記蛍光標識オリゴヌクレオチドとのハイブリダイズは、例えば、前記解離工程の後、前記解離工程における加熱温度を降下させることによって行うことができる。温度条件としては、例えば、40〜50℃である。
【0145】
ハイブリダイズ工程の反応液における各組成の体積や濃度は、特に制限されない。具体例としては、前記反応液におけるDNAの濃度は、例えば、0.01μmol/L〜1μmol/L、又は0.1μmol/L〜0.5μmol/Lとしうる。前記蛍光標識オリゴヌクレオチドの濃度は、例えば、前記DNAに対する添加割合を満たす範囲であり、例えば、0.001μmol/L〜10μmol/L、又は0.001μmol/L〜1μmol/Lとしうる。
【0146】
そして、得られた前記一本鎖DNAと前記蛍光標識オリゴヌクレオチドとのハイブリッド形成体を徐々に加熱し、温度上昇に伴う蛍光シグナルの変動を測定する。例えば、QProbeを使用した場合、一本鎖DNAとハイブリダイズした状態では、解離した状態に比べて蛍光強度が減少(または消光)する。したがって、例えば、蛍光が減少(または消光)しているハイブリッド形成体を徐々に加熱し、温度上昇に伴う蛍光強度の増加を測定すればよい。
【0147】
蛍光強度の変動を測定する際の温度範囲は、特に制限されないが、例えば、開始温度が室温〜85℃、又は25〜70℃としうる。終了温度は、例えば、40〜105℃としうる。また、温度の上昇速度は、特に制限されないが、例えば、0.1℃/秒〜20℃/秒、又は0.3℃/秒〜5℃/秒としうる。
【0148】
次に、前記シグナルの変動を解析してTm値として決定する。具体的には、得られた蛍光強度から各温度における微分値(−d蛍光強度/dt)を算出し、最も低い値を示す温度をTm値として決定できる。また、単位時間当たりの蛍光強度増加量(蛍光強度増加量/t)が最も高い点をTm値として決定することもできる。なお、標識化プローブとして、消光プローブではなく、ハイブリッド形成によりシグナル強度が増加するプローブを使用した場合には、反対に、蛍光強度の減少量を測定すればよい。
【0149】
また、本発明においては、前述のように、ハイブリッド形成体を加熱して、温度上昇に伴う蛍光シグナル変動(好ましくは蛍光強度の増加)を測定するが、この方法に代えて、例えば、ハイブリッド形成時におけるシグナル変動の測定を行ってもよい。すなわち、前記プローブを添加した試料の温度を降下させてハイブリッド形成体を形成する際の前記温度降下に伴う蛍光シグナル変動を測定してもよい。
【0150】
具体例として、QProbeを使用した場合、前記プローブを試料に添加した際には、前記プローブは解離状態にあるため蛍光強度が大きいが、温度の降下によりハイブリッド形成体を形成すると、前記蛍光が減少(または消光)する。したがって、例えば、前記加熱した試料の温度を徐々に降下して、温度下降に伴う蛍光強度の減少を測定すればよい。他方、ハイブリッド形成によりシグナルが増加する標識化プローブを使用した場合、前記プローブを試料に添加した際には、前記プローブは解離状態にあるため蛍光強度が小さい(または消光)が、温度の降下によりハイブリッドを形成すると、蛍光強度が増加するようになる。したがって、例えば、前記試料の温度を徐々に降下して、温度下降に伴う蛍光強度の増加を測定すればよい。
【0151】
本発明の多型検出方法において、前記多型検出用プローブは、例えば、いずれか一種を使用してもよいし、二種以上を併用してもよい。使用する前記多型検出用プローブの種類は、例えば、検出目的の多型に応じて適宜決定できる。本発明においては、例えば、CYP3A5*3多型のみ、CYP3A4*16多型のみ、CYP3A4*1B多型のみを検出してもよいし、いずれか二種又は三種全ての多型を、一つの反応系で検出することもできる。また、前記CYP3A5*3多型、CYP3A4*16多型及びCYP3A4*1B多型の少なくともいずれかと、その他の多型とを、一つの反応系で検出することも可能である。
【0152】
本発明の多型検出方法において、前記多型検出用プローブを二種以上併用する場合、例えば、各プローブが、異なる蛍光色素を有する標識プローブであることが好ましい。前記異なる蛍光色素は、例えば、検出条件の異なる蛍光色素があげられる。
【0153】
複数の遺伝子多型を、同一の系で検出する方法としては、特に制限されるものではない。例えば、各多型を検出できる各プローブを予め混合し、試料に添加してもよいし、一本鎖核酸を含む試料に各多型を検出できる各プローブを連続的に添加してもよい。ここで、「系」とは、蛍光標識オリゴヌクレオチド及び一本鎖核酸がハイブリダイズしたハイブリッド形成体を含む試料で形成される1個の独立した反応系を意味する。
【0154】
<薬効判定方法>
本発明の薬効判定方法は、前述した多型検出方法によりCYP3A遺伝子の多型を検出すること、及び、前記検出結果に基づいて薬剤に対する耐性又は薬剤の薬効を判定することを含む。
【0155】
前記多型検出方法では、本発明における多型検出用プローブを用いて、感度よく且つ簡便に、CYP3A遺伝子の多型を検出する。このため、CYP3A遺伝子におけるこの多型に基づいて、薬剤の判定を感度よく且つ簡便に行うことができる。
【0156】
また、多型の有無、変異配列と正常配列との存在比に基づいて、薬剤に対する耐性や薬剤の薬効を判定することができる。そして、本発明の薬効判定方法は、変異の有無、変異配列の存在比に基づいて、薬剤の投与量の増加、他の治療薬への変更等への切り替え等の疾病の治療方針を決定するのに有用である。前記判定対象となる薬剤としては、例えば、免疫抑制剤、分子標的治療薬、抗うつ薬等が挙げられ、特に免疫抑制剤及び分子標的治療薬が挙げられる。前記薬剤の具体例としては、例えば、タクロリムス等の免疫抑制剤があげられる。
【0157】
前記薬剤は、例えば、以下のような作用機序の物質があげられる。
(1)GABAA(ガンマ−アミノ−ブチル酸レセプター)の特異的な部位に結合する物質:例えば、アルプラゾラム(alprazolam)、エスタゾラム(estazolam)、エスゾピクロン(eszopiclone)、ミダゾラム(midazolam)等の向精神薬
(2)ナトリウムチャンネルの不活性化状態を安定化する物質:例えば、カルバマゼピン(carbamazepine)等の向精神薬
(3)D2部分アゴニスト(D2 partial agonist):例えば、アリピプラゾール(aripiprazole)等の向精神薬
(4)セトロニン 5-HT1Aレセプター部分アゴニスト(serotonin 5-HT1A receptor partial agonist):例えば、ブスピロン(buspirone)等の向精神薬
(5)選択的セロトニン再取り込みインヒビター(selective serotonin reuptake inhibitor):例えば、シタロプラム(citalopram)、フルオキセチン(fluoxetine)等の向精神薬
(6)セロトニン−ノルエピネフリン再取り込みインヒビター(serotonin-norepinephrine reuptake inhibitor):例えば、アミトリプチリン(amitriptyline)等の向精神薬
(7)D2レセプターをブロックする物質:例えば、ハロペリドール(haloperidol)等の向精神薬
(8)5-HT2Aレセプターのアンタゴニスト(antagonist at the 5-HT2A receptors):例えば、ネファゾドン(nefazodone)等の向精神薬
(9)以下のポストシナプスレセプターをブロックするピモジド(Pimozide):
D2(極めて強い)、D3、α1-アドレナリン、5-HT2A(強い)
(10)以下の薬理作用を有するクエチアピン(Quetiapine):
D1 (IC50 = 1268nM),D2 (IC50 = 329nM),D3およびD4レセプターアンタゴニスト,5-HT1A (IC50 = 717nM),5-HT2A (IC50 = 148nM),5-HT2C,および5-HT7レセプターアンタゴニスト,mAChレセプター (IC50 = >5000nM)アンタゴニスト
(11)これらの他に、向精神薬として、例えば、リスペリドン(risperidone)、セルトラリン(sertraline)、トラゾドン(trazodone)、トリアゾラム(triazolam)、ザレプロン(zaleplon)、ゾルピデム(zolpidem)があげられ、喘息用薬(Asthma Medication)として、例えば、フルチカゾン(fluticasone)、サルメテロール(salmeterol)、ジレウトン(zileuton)があげられ、抗生物質/抗真菌薬/免疫抑制剤(Antibiotics/Antifungals/Immunosuppresant)として、例えば、マクロライド系(macrolides)(アジスロマイシンazithromycinを除く)、タクロリムス(Tacrolimus)、イトラコナゾール(itraconazole)、ケトコナゾール(ketoconazole)、テリスロマイシン(telithromycin)があげられ、抗けいれん薬(Anticonvulsants)として、例えば、カルバマゼピン(Carbamazepine)、エトスクシミド(ethosuximide)、フェルバメート(felbamate)、チアガビン(tiagabine)、ゾニサミド(Zonisamide)があげられ、抗ヒスタミン薬(Antihistamines)として、例えば、デスロラタジン(Desloratadine)、フェキソフェナジン(fexofenadine)、ロラタジン(loratadine)があげられ、薬物乱用/治療(Drugs of abuse/treatment)として、例えば、ブプレノルフィン(buprenorphine)、コカイン(cocaine)、フェンタニル(fentanyl)、ケタミン(ketamine)、メタドン(methadone)、オキシコドン(oxycodone)、フェンシクリジン(phencyclidine)があげられ、カルシウムチャネル遮断薬/ホルモン/化学療法剤(Calcium Channel Blockers/Hormones/chemo-therapeutics)として、例えば、コルチゾール(cortisols)、デソゲストレル(p)(desogestrel (p))、エチニルエストラジオール(ethinyl estradiol)、黄体ホルモン(progestins)、プロゲステロン(progesterone)、ビンクリスチン等(vincristine and others)があげられ、その他の薬剤として、例えば、アプレピタント(aprepitant)、シナカルセト(cinacalcet)、エソメプラゾール(esomeprazole)、グラニセトロン(granisetron)、ナテグリニド(nateglinide)、オメプラゾール(omeprazole)、ピオグリタゾン(pioglitazone)、キニジン(quinidine)、シルデナフィル(sildenafil)、スタチン類(Statins)、アトルバスタチン、ロバスタチン、シンバスタチン(atorvastatin, lovastatin, simvastatin)、トルテロジン(tolterodine)があげられ、HIVインヒビター(HIV inhibitor)として、例えば、リトナビル(ritonavir)、サクイナビル(saquinavir)があげられる。なお、これらの薬剤には限定されず、例えば、これらの薬剤と同じまたは類似するメカニズムおよび/または同じまたは類似する経路により代謝される薬剤等も含まれる。
【0158】
<多型検出用試薬キット>
本発明のCYP3A遺伝子における多型を検出するためのCYP3A遺伝子多型検出用試薬キットは、前述した多型検出用プローブを含む。前記多型検出用試薬キットには、CYP3A遺伝子のうち配列番号1で示される配列のうち401番目の塩基における多型、配列番号2で示される配列のうち201番目の塩基における多型及び/又は配列番号3で示される配列のうち501番目の塩基における多型を、簡便にかつ感度よく検出することが可能な前記多型検出用プローブを、少なくとも1種を含むことにより、例えば、CYP3A遺伝子の多型の検出を、より簡便に行うことができる等の傾向がある。
【0159】
また、本発明における多型検出用試薬キットは、前述の検出対象となるCYP3A遺伝子多型を含む配列を増幅するためのプライマーを、さらに含んでいてもよい。これにより、本発明における多型検出用試薬キットは、精度よく、CYP3A遺伝子の多型の検出を行うことができる。なお、前記多型検出用試薬キットに含まれ得る前記プローブ及びプライマーについては、前述した事項をそのまま適用できる。
【0160】
前記多型検出用プローブとして、2種以上の蛍光標識オリゴヌクレオチドを含む場合、それぞれの蛍光標識オリゴヌクレオチドは、混合された状態で含まれていても、別個に含まれていてもよい。また、2種類以上の本発明のプローブが混合された状態で本発明の多型検出用試薬キットに含まれる場合、および、別個の試薬として含まれているが、例えば使用時に同じ反応系で各蛍光標識オリゴヌクレオチドと各検出対象配列とのTm解析を行う場合、2種以上の各プローブは発光波長が互いに異なる蛍光色素で標識化されていることが好ましい。このように蛍光物質の種類を変えることで、同じ反応系であっても、それぞれのプローブについての検出を行うことも可能になる。
【0161】
また、本発明における検出用試薬キットは、前記プローブの他に、本発明の検出方法における核酸増幅を行うのに必要とされる試薬類をさらに含んでいてもよい。また、前記プローブ、前記プライマー及びその他の試薬類は、別個に収容されていてもよいし、それらの一部が混合物とされていてもよい。
【0162】
なお、「別個に収容」とは、各試薬が非接触状態を維持できるように区分けされたものであればよく、必ずしも独立して取り扱い可能な個別の容器に収容される必要はない。
【0163】
本発明の検出用試薬キットは、多型部位を含む配列(プローブがハイブリダイズする領域)を増幅するためのプライマーセットを含むことで、例えば、より高感度に多型を検出できる。
【0164】
さらに、本発明の多型検出用試薬キットは、取り扱い説明書を含むことが好ましい。前記取り扱い説明書は、例えば、前記多型検出用プローブを使用して、検出対象である核酸を含む試料について微分融解曲線を作成し、そのTm値解析を行って、CYP3A遺伝子における変異を検出することが記載された取扱い説明書、又は検出用試薬キットに含まれる若しくは追加的に含むことが可能な各種の試薬について記載された使用説明書があげられる。
【実施例】
【0165】
本発明の実施例について説明する。ただし、本発明は、下記実施例により制限されない。
【0166】
[実施例1]
本例では、野生型の被検核酸と、変異型の被検核酸との共存下、Tm解析を行い、CYP3A遺伝子のCYP3A5*3多型及びCYP3A4*16多型を検出した。
【0167】
核酸試料として、希釈血液、精製ゲノム及びプラスミドを準備した。前記希釈血液は、EDTA採血管を用いて採取した全血10μLと、下記表1に示す希釈液1 70μLとを混合して混合液を調製し、前記混合液 10μLと下記表1に示す希釈液2 70μLとを混合後、さらに、これを95℃で10分間加熱することにより、調製した。前記全血に含まれる被検核酸は、CYP3A5*3多型が、野生型と変異型とのヘテロ型であり、CYP3A4*16多型が、野生型のホモ型である。前記精製ゲノムは、常法により、全血から調製した。前記精製ゲノムは、CYP3A5*3多型が変異型のホモ型であり、CYP3A4*16多型が野生型のホモ型である。前記プラスミドは、CYP3A4遺伝子の部分配列として、配列番号2における塩基番号1〜411のオリゴヌクレオチドが挿入されたCYP3A4*16変異型プラスミドを準備した。前記CYP3A4*16変異型プラスミドにおいて、配列番号2における塩基番号201の塩基(s)は、グアニン(g)である。
【0168】
【表1】

【0169】
前記核酸試料を、下記に示す割合で混合し、下記試料1〜4を調製した。
(試料)
試料 希釈血液 精製ゲノム CYP3A4*16
No. 変異型プラスミド
1 100% 0% 0%
2 0% 100% 0%
3 0% 50% 50%
4 0% 0% 100%
【0170】
前記各試料を含む、50μLのPCR反応混合物を調製した。前記PCR反応混合物は、前記試料4μLと、下記表2に示すPCR反応液の各成分とを、以下の濃度となるように混合して、調製した。前記PCR反応混合物について、全自動SNPs検査装置(商品名i−densy(登録商標)IS−5310、アークレイ社製)を用いて、PCR及びTm解析を行った。前記PCRは、95℃で1分処理した後、95℃1秒及び56℃15秒を1サイクルとして50サイクル繰り返した。そして、さらに、95℃で1秒、40℃で60秒処理した。そして、続けて、前記反応液を、温度の上昇速度を1℃/3秒として、40℃から75℃に加熱していき、蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定することによって、Tm解析を行った。また、コントロールとして、前記試料に代えて、前記希釈液2を用いた以外は、前述と同様にして、PCR及びTm解析を行った。BODIPY FLの検出波長は、520−555nm、TAMRAの検出波長は、585−700nmとした(以下、同様)。
【0171】
【表2】

【0172】
前記CYP3A5*3用プライマー及びCYP3A4*16用プライマーの配列を以下に示す。
(CYP3A5*3用プライマー)
Fプライマー (配列番号14)(CYP3A5*3 F4)
5'-cgtatgtaccacccagcttaacg-3'
Rプライマー (配列番号15)(CYP3A5*3 R4)
5'-cacaggagccacccaagg-3'
(CYP3A4*16用プライマー)
Fプライマー (配列番号16)(UO-F2)
5'-aggatggtaaaaaggtgctg-3'
Rプライマー (配列番号17)(UO-R3)
5'-gagagaaagaatggatccaaa-3'
【0173】
前記CYP3A5*3用プローブは、下記配列のCYP3A5*3変異型プローブを使用した。前記CYP3A5*3用プローブは、CYP3A5*3変異型のCYP3A遺伝子のアンチセンス鎖用の変異型プローブである。前記配列において、下線部の塩基が、CYP3A5*3変異型配列に対して同一性を示す塩基である。前記CYP3A5*3用プローブは、3’末端を、蛍光色素BODIPY FLで標識化した。前記CYP3A4*16用プローブは、下記配列のCYP3A4*16変異型プローブを使用した。前記CYP3A4*16用プローブは、CYP3A4*16変異型のCYP3A遺伝子のセンス鎖用の変異型プローブである。前記配列において、下線部の塩基が、CYP3A4*16変異型配列に相補的な塩基である。前記CYP3A4*16用プローブは、3’末端を、蛍光色素TAMRAで標識化した。
CYP3A5*3用プローブ (配列番号4)(3FL-CYP3A5*3-mt-F1-21)
5'-ttgtctttcaGtatctcttcc-(BODIPY FL)-3'
CYP3A4*16用プローブ (配列番号10)(U0-3TMR4)
5'-atgatgtgctaCtgatcacatccatgc-(TAMRA)-3'
【0174】
これらの結果を図1〜5に示す。図1〜5は、温度上昇に伴う蛍光強度の変化を示すTm解析のグラフである。図1は、試料1、図2は、試料2、図3は、試料3、図4は、試料4、図5は、コントロールの結果である。図1〜3及び5において、(A)は、CYP3A5*3用プローブに関する融解曲線であり、(B)は、CYP3A4*16用プローブに関する融解曲線である。図4は、CYP3A4*16用プローブに関する融解曲線である。横軸は、測定時の温度(℃)を示し、縦軸は蛍光強度の変化(以下、「蛍光変化量」ともいう)を示し、単位は「d蛍光強度増加量/dt」(dF/dt)とした。前記CYP3A5*3用プローブは、CYP3A5*3野生型とのTm値が49℃付近、CYP3A5*3変異型とのTm値が56℃付近であり、前記CYP3A4*16用プローブは、CYP3A4*16野生型とのTm値が59℃付近、CYP3A4*16変異型とのTm値が67℃付近である。
【0175】
図1(A)に示すように、CYP3A5*3多型について、野生型と変異型とをヘテロ型で有する試料1は、野生型及び変異型のTm値で、それぞれピークが確認された。図1(B)に示すように、CYP3A4*16多型について、野生型をホモ型で有する試料1は、野生型のTm値のみでピークが確認された。
【0176】
図2(A)に示すように、CYP3A5*3多型について、変異型をホモ型で有する試料2は、変異型のTm値のみでピークが確認された。図2(B)に示すように、CYP3A4*16多型について、野生型をホモ型で有する試料2は、野生型のTm値のみでピークが確認された。
【0177】
図3(A)に示すように、CYP3A5*3多型について、変異型をホモ型で有する試料3は、変異型のTm値のみでピークが確認された。図3(B)に示すように、CYP3A4*16多型について、前記精製ゲノムの野生型と前記プラスミドの変異型とを有する試料3は、野生型と変異型のTm値でそれぞれピークが確認された。
【0178】
図4に示すように、CYP3A4*16多型について、変異型をホモ型で有する試料4は、変異型のTm値のみでピークが確認された。なお、CYP3A5*3多型を含む領域の塩基配列を有さない試料4は、CYP3A5*3の多型のピークが確認されなかった。
【0179】
図5(A)及び(B)に示すように、コントロールである希釈液2は、両ピーク共に確認されなかった。
【0180】
[実施例2]
本例では、アンチセンス鎖にハイブリダイズするプローブを使用して、野生型人工核酸及び変異型人工核酸について、Tm解析を行い、CYP3A遺伝子の多型(CYP3A4*16)を検出した。
【0181】
下記配列に示す、配列番号2における塩基番号173〜222に相補的な変異型人工核酸(mt)及び野生型人工核酸(wt)を調製した。前記配列において、下線部が、配列番号2における塩基番号201の塩基に対応する。各人工核酸を0.1μmol/Lに調整して、試料とした。
mt(配列番号19)
ttcactccaratgatgtgctaCtgatcacatccatgctgtaggccccaaa
wt(配列番号20)
ttcactccaratgatgtgctaGtgatcacatccatgctgtaggccccaaa
【0182】
前記各試料を含む、50μLの反応混合物を調製した。前記反応混合物は、下記表3に示す反応液の各成分を、以下の濃度となるように混合して、調製した。前記反応混合物について、全自動SNPs検査装置(商品名i−densy(登録商標)IS−5310、アークレイ社製)を用いて、Tm解析を行った。前記Tm解析は、前記反応液を、95℃で1秒、40℃で60秒処理した後、温度の上昇速度を1℃/3秒として、40℃から75℃に加熱していき、蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定することによって、行った。
【0183】
【表3】

【0184】
前記プローブは、下記配列のCYP3A4*16変異型プローブを使用した。前記プローブは、変異型のCYP3A4遺伝子のアンチセンス鎖用の変異型プローブである。前記配列において、下線部の塩基が、CYP3A4*16変異型配列に対して同一性を示す塩基である。前記プローブは、3’末端を、蛍光色素TAMRAで標識化した。
CYP3A4*16用変異型プローブ (配列番号6)(3T-CYP3A4*16-MF1)
5'-gatgtgatcagtagc-(TAMRA)-3'
【0185】
これらの結果を図6に示す。図6は、温度上昇に伴う蛍光強度の変化を示すTm解析のグラフである。図6において、(A)はmt 100%、(B)はwt 100%の結果である。横軸は、測定時の温度(℃)を示し、縦軸は蛍光強度の変化(以下、「蛍光変化量」ともいう)を示し、単位は「d蛍光強度増加量/dt」(dF/dt)とした。前記CYP3A4*16変異型プローブは、mtとのTm値が60℃付近、wtとのTm値が53℃付近である。
【0186】
図6(A)に示すように、mtは、mtのTm値でのみピークが確認された。一方、図6(B)に示すように、wtは、wtのTm値でのみピークが確認された。
【0187】
[実施例3]
本例では、センス鎖にハイブリダイズするプローブを使用して、野生型人工核酸及び変異型人工核酸について、Tm解析を行い、CYP3A遺伝子の多型(CYP3A4*16)を検出した。以下に示す野生型人工核酸、変異型人工核酸及びCYP3A4*16変異型プローブを使用した以外は、前記実施例2と同様にして、Tm解析を行った。
【0188】
下記配列に示す、配列番号2における塩基番号173〜222に相同な変異型人工核酸(mt)及び野生型人工核酸(wt)を調製した。前記配列において、下線部が、配列番号2における塩基番号201の塩基に対応する。各人工核酸を0.1μmol/Lに調整して、試料とした。
mt(配列番号21)
tttggggcctacagcatggatgtgatcaGtagcacatcatytggagtgaa
wt(配列番号22)
tttggggcctacagcatggatgtgatcaCtagcacatcatytggagtgaa
【0189】
前記プローブは、下記配列のCYP3A4*16変異型プローブを使用した。前記プローブは、変異型のCYP3A4遺伝子のセンス鎖用の変異型プローブである。前記配列において、下線部の塩基が、CYP3A4*16変異型配列に相補的な塩基である。前記プローブは、3’末端を、蛍光色素TAMRAで標識化した。
CYP3A4*16用プローブ (配列番号8)(3T-CYP3A4*16-MR1)
5'-tgtgctactgatcacatcc-(TAMRA)-3'
【0190】
これらの結果を図7に示す。図7は、温度上昇に伴う蛍光強度の変化を示すTm解析のグラフである。図7において、(A)はmt 100%、(B)はwt 100%の結果である。横軸は、測定時の温度(℃)を示し、縦軸は蛍光強度の変化(以下、「蛍光変化量」ともいう)を示し、単位は「d蛍光強度増加量/dt」(dF/dt)とした。前記CYP3A4*16変異型プローブは、mtとのTm値が75℃付近、wtとのTm値が68℃付近である。
【0191】
図7(A)に示すように、mtは、mtのTm値でのみピークが確認された。一方、図7(B)に示すように、wtは、wtのTm値でのみピークが確認された。
【0192】
[比較例1]
本例では、センス鎖にハイブリダイズするプローブを使用して、野生型人工核酸及び変異型人工核酸について、Tm解析を行い、CYP3A遺伝子の多型(CYP3A5*3)を検出した。以下に示す野生型人工核酸、変異型人工核酸及びCYP3A5*3変異型プローブを使用した以外は、前記実施例2と同様にして、Tm解析を行った。
【0193】
下記配列に示す、配列番号1における塩基番号379〜428に相同な変異型人工核酸(mt)及び野生型人工核酸(wt)を調製した。下記配列において、下線部が配列番号1における401番目の塩基に対応する。各人工核酸を0.1μmol/Lに調整して、試料とした。
mt(配列番号23)
taaagagctcttttgtctttcaAtatctcttccctgtttggaccacatta
wt(配列番号24)
taaagagctcttttgtctttcaGtatctcttccctgtttggaccacatta
【0194】
前記プローブは、下記配列のCYP3A5*3変異型プローブを使用した。前記プローブは、変異型のCYP3A5遺伝子のセンス鎖用の変異型プローブである。前記配列において、下線部の塩基が、CYP3A5*3変異型配列に相補的な塩基である。前記CYP3A5*3変異型プローブは、3’末端を、蛍光色素TAMRAで標識化した。
CYP3A5*3変異型プローブ (配列番号25)(5T-CYP3A5*3-mt-R1-22)
5'-(TAMRA)-cagggaagagataCtgaaagac-P-3'
【0195】
これらの結果を図8に示す。図8は、温度上昇に伴う蛍光強度の変化を示すTm解析のグラフである。図8において、(A)はmt 100%、(B)はwt 100%の結果である。横軸は、測定時の温度(℃)を示し、縦軸は蛍光強度の変化(以下、「蛍光変化量」ともいう)を示し、単位は「d蛍光強度増加量/dt」(dF/dt)とした。
【0196】
図8(A)及び(B)に示すように、mt及びwtは共に、明瞭なピークが確認できなかった。
【0197】
[比較例2]
本例では、センス鎖にハイブリダイズするプローブを使用して、野生型人工核酸及び変異型人工核酸について、Tm解析を行い、CYP3A遺伝子の多型(CYP3A4*16)を検出した。以下に示すCYP3A4*16変異型プローブを使用した以外は、前記実施例3と同様にして、Tm解析を行った。
【0198】
前記プローブは、下記配列のCYP3A4*16変異型プローブを使用した。前記プローブは、変異型のCYP3A4遺伝子のセンス鎖用の変異型プローブである。前記配列において、下線部の塩基が、CYP3A4*16変異型配列に相補的な塩基である。前記CYP3A4*16変異型プローブは、3’末端を、蛍光色素TAMRAで標識化した。
CYP3A4*16変異型プローブ (配列番号9)(U0-3TMR2)
5'-ctaCtgatcacatccatgctg-(TAMRA)-3'
【0199】
これらの結果を図9に示す。図9は、温度上昇に伴う蛍光強度の変化を示すTm解析のグラフである。図9において、(A)はmt 100%、(B)はwt 100%の結果である。横軸は、測定時の温度(℃)を示し、縦軸は蛍光強度の変化(以下、「蛍光変化量」ともいう)を示し、単位は「d蛍光強度増加量/dt」(dF/dt)とした。
【0200】
図9(A)に示すように、mtは、mtのTm値のみでピークが確認された。一方、図9(B)に示すように、wtはピークが確認されなかった。
【0201】
[実施例4]
本例では、CYP3A4遺伝子のCYP3A4*1B、CYP3A4*16及びCYP3A5*3の多型を、同一反応液を用いて検出した。
【0202】
核酸試料として、精製ゲノム、プラスミド及び前処理済の全血を準備した。前記精製ゲノムは、常法により、EDTA採血管を用いて採取した全血から調製し、400コピー/μLに調整したものを試料として使用した。前記プラスミドは、CYP3A4遺伝子の部分配列として、配列番号3における塩基番号366〜651のオリゴヌクレオチドが挿入されたCYP3A4*1B変異型プラスミドと、配列番号2における塩基番号1〜411のオリゴヌクレオチドが挿入されたCYP3A4*16変異型プラスミドを準備した。前者のCYP3A4*1B変異型プラスミドは、配列番号3における塩基番号501を変異型(g)とし、後者のCYP3A4*16変異型プラスミドは、配列番号2における塩基番号201を変異型(g)とした。それぞれのプラスミドを2000コピー/μLに調整し、0.5μLずつ混合したものを試料として使用した。前記前処理済の全血は、前記精製ゲノムの調製に使用した同じ前記全血10μLと、前記表1に示す希釈液1 70μLとを混合して混合液を調製し、前記混合液 10μLと前記表1に示す希釈液2 70μLとを混合後、さらに、これを95℃で10分間加熱することにより、調製した。前記全血に含まれる被検核酸は、CYP3A4*1B多型が、野生型のホモ型であり、CYP3A5*3多型が、野生型と変異型とのヘテロ型であり、CYP3A4*16多型が、野生型のホモ型である。
【0203】
前記各試料を含む、50μLのPCR反応混合物を調製した。前記PCR反応混合物は、前記試料と、下記表4に示すPCR反応液の各成分を、以下の濃度となるように混合して、調製した。前記PCR反応混合物において、精製ゲノム試料の濃度は、2×106copy/L、プラスミド試料の濃度は、2×107copy/L、全血試料は、5.3mL/Lとした。前記PCR反応混合物について、全自動SNPs検査装置(商品名i−densy(登録商標)IS−5310、アークレイ社製)を用いて、PCR及びTm解析を行った。前記PCRは、95℃で1分処理した後、95℃1秒及び58℃30秒を1サイクルとして50サイクル繰り返した。そして、さらに、95℃で1秒、40℃で60秒処理した後、前記反応液を、温度の上昇速度を1℃/3秒として、40℃から75℃に加熱していき、蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定することによって、Tm解析を行った。また、コントロールとして、前記試料に代えて、前記希釈液2を用いた以外は、前述と同様にして、PCR及びTm解析を行った。Pacific Blueの検出波長は、445−480nm、BODIPY FLの検出波長は、520−555nm、TAMRAの検出波長は、585−700nmとした。
【0204】
【表4】

【0205】
前記CYP3A4*1B用のプライマー及びプローブの配列を以下に示す。
(CYP3A4*1B用プライマー)
Fプライマー (配列番号26)(CYP3A4-1B-F1)
5'-ctgtaggtgtggcttgttgggatgaa-3'
Rプライマー (配列番号27)(CYP3A4-1B-R1)
5'-ggagccattggcataaaatctattaaatcgc-3'
(CYP3A4*1B用プローブ)
変異型プローブ(配列番号12)(3PB-CYP3A4*1B-R3)
5'-taaatcgccGctctcctgccc-(Pacific Blue)-3'
【0206】
前記CYP3A4*16用のプライマー及びプローブの配列を以下に示す。
(CYP3A4*16用プライマー)
Fプライマー (配列番号18)(CYP3A4*16-F6+CTAGA)
5'-ctagaggagtgtgatagaaggtgatctagtaga-3'
Rプライマー (配列番号28)(U0-R3+GACGA)
5'-GACGAgagagaaagaatggatccaaa-3'
(CYP3A4*16用プローブ)
変異型プローブ(配列番号6)(3T-CYP3A4*16-MF1)
5'-gatgtgatcaGtagc-(TAMRA)-3'
【0207】
前記CYP3A5*3用のプライマー及びプローブの配列を以下に示す。
(CYP3A5*3用プライマー)
Fプライマー (配列番号14)(CYP3A5*3 F4)
5'-cgtatgtaccacccagcttaacg-3'
Rプライマー (配列番号15)(CYP3A5*3 R4)
5'-cacaggagccacccaagg-3'
(CYP3A5*3用プローブ)
変異型プローブ(配列番号4)(3FL-CYP3A5*3-mt-F1-21)
5'-ttgtctttcaGtatctcttcc-(BODIPY FL)-3'
【0208】
これらの結果を図10〜12に示す。図10〜12は、温度上昇に伴う蛍光強度の変化を示すTm解析のグラフである。図10は、精製ゲノムの試料、図11は、混合プラスミドの試料、図12は、前処理済み全血の試料の結果である。図10及び図12において、(A)は、CYP3A4*1B用変異型プローブに関する融解曲線であり、(B)は、CYP3A5*3用変異型プローブに関する融解曲線であり、(C)は、CYP3A4*16用変異型プローブに関する融解曲線である。図11において、(A)は、CYP3A4*1B用変異型プローブに関する融解曲線であり、(B)は、CYP3A4*16用変異型プローブに関する融解曲線である。横軸は、測定時の温度(℃)を示し、縦軸は蛍光強度の変化(以下、「蛍光変化量」ともいう)を示し、単位は「d蛍光強度増加量/dt」(dF/dt)とした。CYP3A4*1B変異型とCYP3A4*1B用変異型プローブとのTm値は、61℃付近、CYP3A5*3変異型とCYP3A5*3用変異型プローブとのTm値は、56℃付近、CYP3A4*16変異型とCYP3A4*16用変異型プローブとのTm値は、53℃付近である。
【0209】
図10(A)に示すように、CYP3A4*1B多型について、野生型のホモ型である精製ゲノムは、変異型のTm値よりも低い温度でピークが確認された。図10(B)に示すように、CYP3A5*3多型について、野生型と変異型のヘテロ型である精製ゲノムは、変異型のTm値とそれよりも低い温度において、合計2つのピークが確認された。図10(C)に示すように、CYP3A4*16多型について、野生型のホモ型である精製ゲノムは、変異型のTm値よりも低い温度でピークが確認された。
【0210】
図11(A)に示すように、CYP3A4*1B多型について、変異型であるプラスミドを含む試料は、変異型のTm値のみでピークが確認された。図11(B)に示すように、CYP3A4*16多型について、変異型であるプラスミドを含む試料は、変異型のTm値のみでピークが確認された。前記プラスミド試料はCYP3A5*3多型を含まないことから、ピークは確認されなかった。
【0211】
図12(A)に示すように、CYP3A4*1B多型について、野生型のホモ型である前処理済み全血は、変異型のTm値よりも低い温度でピークが確認された。図12(B)に示すように、CYP3A5*3多型について、野生型と変異型のヘテロ型である前処理済み全血は、変異型のTm値とそれよりも低い温度において、合計2つのピークが確認された。図12(C)に示すように、CYP3A4*16多型について、野生型のホモ型である前処理済み全血は、変異型のTm値よりも低い温度でピークが確認された。
【0212】
[実施例5]
本例では、センス鎖にハイブリダイズするプローブを使用して、野生型人工核酸及び変異型人工核酸について、Tm解析を行い、CYP3A遺伝子の多型(CYP3A4*1B)を検出した。
【0213】
センス鎖の人工核酸として、下記配列に示す、配列番号3における塩基番号482〜521に相同的な野生型人工核酸(WT1)及び変異型人工核酸(mt1−1、mt1−2)を調製した。前記配列において、下線部が配列番号3における塩基番号501の塩基に対応する。前記配列において、小文字の塩基は、配列番号3とは異なる塩基に置換した。前記各人工核酸を0.1μmol/Lに調整した。
WT1(配列番号29)(CYP3A4*1B-WT-F)
AGCCATAGAGACAAGGGCAAGAGAGgGGCGATTTAATAGA
mt1−1(配列番号30)(CYP3A4*1B-mt1-F)
AGCCATAGAGACAAGGGCAGGAGAGaGGCGATTTAATAGA
mt1−2(配列番号31)(CYP3A4*1B-mt2-F)
AGCCATAGAGACAAGGGCAGGAGAGgGGCGATTTAATAGA
【0214】
前記各人工核酸を含む、50μLの反応混合物を調製した。前記反応混合物は、下記表5に示す反応液の各成分を、以下の濃度となるように混合して、調製した。前記反応混合物について、全自動SNPs検査装置(商品名i−densy(登録商標)IS−5310、アークレイ社製)を用いて、Tm解析を行った。前記Tm解析は、前記反応液を、95℃で1秒、40℃で60秒処理した後、温度の上昇速度を1℃/3秒として、40℃から75℃に加熱していき、蛍光色素に応じた検出波長における、経時的な蛍光強度の変化を測定することによって、行った。Pacific Blueの検出波長は、445−480nmとした。
【0215】
【表5】

【0216】
前記プローブとして、下記配列のCYP3A4*1B変異型プローブを使用した。前記プローブは、変異型のCYP3A4遺伝子のセンス鎖用の変異型プローブである。前記配列において、下線部の塩基が、CYP3A4*1B変異型配列に相補的な塩基である。
CYP3A4*1B用プローブ (配列番号12)(3PB-CYP3A4*1B-R3)
5'-taaatcgccGctctcctgccc-(Pacific Blue)-3'
【0217】
[比較例3]
(比較例3−1)
本例では、センス鎖にハイブリダイズするプローブを使用して、野生型人工核酸及び変異型人工核酸について、Tm解析を行い、CYP3A遺伝子の多型(CYP3A4*1B)を検出した。
【0218】
前記CYP3A4*1B用プローブとして、下記配列のプローブを使用した。前記プローブは、野生型のCYP3A4遺伝子のセンス鎖用の野生型プローブである。前記配列において、下線部の塩基が、CYP3A4*1B変異型配列に相補的な塩基である。
プローブ3−1(配列番号32)(5PB-CYP3A4*1B-R1)
5'-(Pacific Blue)-ctctcttgcccttgt-3'
【0219】
前記CYP3A4*1B用プローブとして、前記プローブ3−1を使用した以外は、前記実施例5と同様にしてTm解析を行った。
【0220】
(比較例3−2)
本例では、アンチセンス鎖にハイブリダイズするプローブを使用して、野生型人工核酸及び変異型人工核酸について、Tm解析を行い、CYP3A遺伝子の多型(CYP3A4*1B)を検出した。
【0221】
アンチセンス鎖の人工核酸として、下記配列に示す、配列番号3における塩基番号482〜521に相補的な野生型人工核酸(WT2)及び変異型人工核酸(mt2−1、mt2−2)を調製した。前記配列において、下線部が配列番号3における塩基番号501の塩基に対応する。前記各人工核酸を0.1μmol/Lに調整した。
WT2(配列番号33)(CYP3A4*1B-WT-R)
tctattaaatcgccCctctcttgcccttgtctctatggct
mt2−1(配列番号34)(CYP3A4*1B-mt1-R)
tctattaaatcgccTctctcctgcccttgtctctatggct
mt2−2(配列番号35)(CYP3A4*1B-mt2-R)
tctattaaatcgccCctctcctgcccttgtctctatggct
【0222】
前記CYP3A4*1B用プローブとして、下記配列のプローブ2−2を使用した。前記プローブは、野生型のCYP3A4遺伝子のアンチセンス鎖用の野生型プローブである。前記配列において、下線部の塩基が、CYP3A4*1B野生型配列に対して同一性を示す塩基である。
プローブ2−2 (配列番号36)(5PB-CYP3A4*1B-F1)
5'-(Pacific Blue)-CAAGGGCAAGAGAGAG-3'
【0223】
前記野生型人工核酸として、前記WT2、前記変異型人工核酸として、前記mt2−1又はmt2−2を使用し、CYP3A4*1B用プローブとして、前記プローブ2−2を使用した以外は、前記実施例5と同様にしてTm解析を行った。
【0224】
これらの結果を図13〜15に示す。図13〜15は、温度上昇に伴う蛍光強度の変化を示すTm解析のグラフである。図13は、実施例5の結果、図14は、比較例3−1の結果、図15は、比較例3−2の結果である。横軸は、測定時の温度(℃)を示し、縦軸は蛍光強度の変化(以下、「蛍光変化量」ともいう)を示し、単位は「d蛍光強度増加量/dt」(dF/dt)とした。
【0225】
図13に示すように、実施例5では、PCR反応液に、WT1とmt1−1又はWT1とmt1−2とを添加した場合、WT1(55℃)とmt1−1(64℃)又はmt1−2(64℃)のいずれにおいても、ピークが確認された。一方、図14に示すように、比較例3−1では、PCR反応液に、WT1とmt1−1とを添加した場合、WT1とmt1−1とのピークが重なっており、また、WT1とmt1−2とを添加した場合、WT1とmt1−2とのピークは確認されなかった。また、図15に示すように、比較例3−2では、PCR反応液にWT2とmt2−2とを添加した場合、WT2とmt2−2とのピークが重なっており、また、WT2とmt2−1とを添加した場合、WT2とmt2−1とのピークは確認されなかった。
【0226】
以上の通りであるので、本発明によれば、高い感度で、簡便にCYP3A遺伝子における多型を検出することができることが明らかになった。
【0227】
以上、実施形態を参照して本願発明を説明したが、本願発明は上記実施形態に限定されるものではない。本願発明の構成や詳細には、本願発明のスコープ内で当業者が理解し得る様々な変更をすることができる。
【0228】
この出願は、2011年3月9日に出願された日本出願特願2011−051631を基礎とする優先権を主張し、その開示の全てをここに取り込む。
【産業上の利用可能性】
【0229】
本発明の多型検出方法によれば、CYP3A遺伝子の多型を、高い感度で、簡便に検出することを可能にする多型検出用プローブ、これを用いる多型検出方法を提供できる。また、本発明は、当該多型検出方法を用いた薬効評価方法を提供できる。さらに、本発明は、当該多型検出用プローブを用いた多型検出用試薬キットを提供できる。
【特許請求の範囲】
【請求項1】
下記P1、P1’、P2、P2’、P3、P3’、P4、P4’、P5及びP5’からなる群から選択される一種の蛍光標識オリゴヌクレオチドである、CYP3A遺伝子の多型を検出するための多型検出用プローブ;
(P1)配列番号1で示される配列のうち401番目〜411番目の塩基を含む塩基長11〜50の配列であり、配列番号1における411番目の塩基に対応する塩基がシトシンである以外は、配列番号1と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号1で示される配列のうち411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P1’)配列番号1で示される配列のうち401番目〜411番目の塩基を含む塩基長11〜50の配列であり、配列番号1における411番目の塩基に対応する塩基がシトシンである以外は、配列番号1と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズし、配列番号1で示される配列のうち411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P2)配列番号2で示される配列のうち201番目〜205番目の塩基を含む塩基長5〜50の配列であり、配列番号2における205番目の塩基に対応する塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち205番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P2’)配列番号2で示される配列のうち201番目〜205番目の塩基を含む塩基長5〜50の配列であり、配列番号2における205番目の塩基に対応する塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち205番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P3)配列番号2で示される配列のうち190番目〜201番目の塩基を含む塩基長12〜50の配列に相補的な配列であり、配列番号2における190番目の塩基に相補的な塩基がシトシンである以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち190番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P3’)配列番号2で示される配列のうち190番目〜201番目の塩基を含む塩基長12〜50の配列に相補的な配列であり、配列番号2における190番目の塩基に相補的な塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち190番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P4)配列番号2で示される配列のうち186番目〜201番目の塩基を含む塩基長16〜50の配列に相補的な配列であり、配列番号2における186番目の塩基に相補的な塩基がシトシンである以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち186番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P4’)配列番号2で示される配列のうち186番目〜201番目の塩基を含む塩基長16〜50の配列に相補的な配列であり、配列番号2における186番目の塩基に相補的な塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち186番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P5)配列番号3で示される配列のうち496番目〜501番目の塩基を含む塩基長6〜50の配列に相補的な配列であり、配列番号3における496番目の塩基に相補的な塩基がシトシンである以外は、配列番号3の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号3で示される配列のうち496番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P5’)配列番号3で示される配列のうち496番目〜501番目の塩基を含む塩基長6〜50の配列に相補的な配列であり、配列番号3における496番目の塩基に相補的な塩基がシトシンである以外は、配列番号3と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号3で示される配列のうち496番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド。
【請求項2】
前記蛍光標識オリゴヌクレオチドが、配列番号1における401番目の塩基の多型を認識する、請求項1に記載の多型検出用プローブ。
【請求項3】
前記蛍光標識オリゴヌクレオチドが、前記蛍光色素で標識された前記塩基を3'末端から数えて1〜3番目に有する、請求項1または2に記載の多型検出用プローブ。
【請求項4】
前記蛍光標識オリゴヌクレオチドが、前記蛍光色素で標識された前記塩基を3'末端に有する、請求項1〜3のいずれか一項に記載の多型検出用プローブ。
【請求項5】
前記蛍光標識オリゴヌクレオチドが、標的配列にハイブリダイズしないときに蛍光を発し、且つ、前記標的配列にハイブリダイズしたときに蛍光強度が減少するか又は増加する、請求項1〜4のいずれか一項に記載の多型検出用プローブ。
【請求項6】
前記蛍光標識オリゴヌクレオチドが、標的配列にハイブリダイズしないときに蛍光を発し、前記標的配列にハイブリダイズしたときに蛍光強度が減少する、請求項1〜5のいずれか一項に記載の多型検出用プローブ。
【請求項7】
前記P1及びP1’の蛍光標識オリゴヌクレオチドの塩基長が、15〜30塩基長であり、
前記P2及びP2’の蛍光標識オリゴヌクレオチドの塩基長が、10〜30塩基長であり、
前記P3及びP3’の蛍光標識オリゴヌクレオチドの塩基長が、12〜40塩基長であり、
前記P4及びP4’の蛍光標識オリゴヌクレオチドの塩基長が、16〜40塩基長であり、
前記P5及びP5’の蛍光標識オリゴヌクレオチドの塩基長が、10〜40塩基長である、請求項1〜6のいずれか一項に記載の多型検出用プローブ。
【請求項8】
前記P1及びP1’の蛍光標識オリゴヌクレオチドの塩基長が、15〜20塩基長であり、
前記P2及びP2’の蛍光標識オリゴヌクレオチドの塩基長が、10〜20塩基長であり、
前記P3及びP3’の蛍光標識オリゴヌクレオチドの塩基長が、15〜30塩基長であり、
前記P4及びP4’の蛍光標識オリゴヌクレオチドの塩基長が、20〜30塩基長であり、
前記P5及びP5’の蛍光標識オリゴヌクレオチドの塩基長が、20〜30塩基長である、請求項1〜7のいずれか一項に記載の多型検出用プローブ。
【請求項9】
前記多型検出用プローブが、融解曲線分析用のプローブである、請求項1〜8のいずれか一項に記載の多型検出用プローブ。
【請求項10】
前記多型検出用プローブが、配列番号37、配列番号38、配列番号39、配列番号41、配列番号43又は配列番号45で示される塩基配列を有する、請求項1〜9のいずれか一項に記載の多型検出用プローブ。
【請求項11】
前記多型検出用プローブが、配列番号4、配列番号6、配列番号8、配列番号10、配列番号44又は配列番号12で示される塩基配列を有する、請求項1〜9のいずれか一項に記載の多型検出用プローブ。
【請求項12】
請求項1〜11のいずれか一項に記載の多型検出用プローブを用いることにより、CYP3A遺伝子の多型を検出する多型検出方法。
【請求項13】
(I)前記多型検出用プローブ及び試料中の一本鎖核酸を接触させて、前記多型検出用プローブ及び前記一本鎖核酸をハイブリダイズさせてハイブリッド形成体を得ること、
(II)前記ハイブリッド形成体を含む試料の温度を変化させることで、前記ハイブリッド形成体を解離させ、前記ハイブリッド形成体の解離に基づく蛍光シグナルの変動を測定すること、
(III)前記蛍光シグナルの変動に基づいてハイブリッド形成体の解離温度であるTm値を検出すること、及び、
(IV)前記Tm値に基づいて、前記試料中の一本鎖核酸における、CYP3A遺伝子の多型の存在を検出すること、
を含む、請求項12に記載の多型検出方法。
【請求項14】
さらに、前記(I)の前または(I)と同時に、核酸を増幅することを含む、請求項13に記載の多型検出方法。
【請求項15】
請求項12〜14のいずれか一項に記載の多型検出方法により、CYP3A遺伝子の多型を検出すること、及び、
検出された多型の有無に基づいて、薬剤に対する耐性または薬剤の薬効を評価すること、を含む、薬剤の薬効評価方法。
【請求項16】
請求項1〜11のいずれか一項に記載の多型検出用プローブを含む、CYP3A遺伝子の多型を検出するための多型検出用試薬キット。
【請求項17】
さらに、前記多型検出用プローブがハイブリダイズする配列を含む領域を増幅するためのプライマーを含む、請求項16に記載の多型検出用試薬キット。
【請求項1】
下記P1、P1’、P2、P2’、P3、P3’、P4、P4’、P5及びP5’からなる群から選択される一種の蛍光標識オリゴヌクレオチドである、CYP3A遺伝子の多型を検出するための多型検出用プローブ;
(P1)配列番号1で示される配列のうち401番目〜411番目の塩基を含む塩基長11〜50の配列であり、配列番号1における411番目の塩基に対応する塩基がシトシンである以外は、配列番号1と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号1で示される配列のうち411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P1’)配列番号1で示される配列のうち401番目〜411番目の塩基を含む塩基長11〜50の配列であり、配列番号1における411番目の塩基に対応する塩基がシトシンである以外は、配列番号1と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズし、配列番号1で示される配列のうち411番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P2)配列番号2で示される配列のうち201番目〜205番目の塩基を含む塩基長5〜50の配列であり、配列番号2における205番目の塩基に対応する塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち205番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P2’)配列番号2で示される配列のうち201番目〜205番目の塩基を含む塩基長5〜50の配列であり、配列番号2における205番目の塩基に対応する塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列の相補鎖に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち205番目の塩基に対応する塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P3)配列番号2で示される配列のうち190番目〜201番目の塩基を含む塩基長12〜50の配列に相補的な配列であり、配列番号2における190番目の塩基に相補的な塩基がシトシンである以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち190番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P3’)配列番号2で示される配列のうち190番目〜201番目の塩基を含む塩基長12〜50の配列に相補的な配列であり、配列番号2における190番目の塩基に相補的な塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち190番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P4)配列番号2で示される配列のうち186番目〜201番目の塩基を含む塩基長16〜50の配列に相補的な配列であり、配列番号2における186番目の塩基に相補的な塩基がシトシンである以外は、配列番号2の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号2で示される配列のうち186番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P4’)配列番号2で示される配列のうち186番目〜201番目の塩基を含む塩基長16〜50の配列に相補的な配列であり、配列番号2における186番目の塩基に相補的な塩基がシトシンである以外は、配列番号2と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号2で示される配列のうち186番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P5)配列番号3で示される配列のうち496番目〜501番目の塩基を含む塩基長6〜50の配列に相補的な配列であり、配列番号3における496番目の塩基に相補的な塩基がシトシンである以外は、配列番号3の相補鎖と同一の塩基を有する塩基配列に対して少なくとも80%以上の同一性を有し、配列番号3で示される配列のうち496番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド、
(P5’)配列番号3で示される配列のうち496番目〜501番目の塩基を含む塩基長6〜50の配列に相補的な配列であり、配列番号3における496番目の塩基に相補的な塩基がシトシンである以外は、配列番号3と同一の塩基を有する塩基配列に対してストリンジェントな条件下でハイブリダイズし、配列番号3で示される配列のうち496番目の塩基に相補的な塩基が蛍光色素で標識されている蛍光標識オリゴヌクレオチド。
【請求項2】
前記蛍光標識オリゴヌクレオチドが、配列番号1における401番目の塩基の多型を認識する、請求項1に記載の多型検出用プローブ。
【請求項3】
前記蛍光標識オリゴヌクレオチドが、前記蛍光色素で標識された前記塩基を3'末端から数えて1〜3番目に有する、請求項1または2に記載の多型検出用プローブ。
【請求項4】
前記蛍光標識オリゴヌクレオチドが、前記蛍光色素で標識された前記塩基を3'末端に有する、請求項1〜3のいずれか一項に記載の多型検出用プローブ。
【請求項5】
前記蛍光標識オリゴヌクレオチドが、標的配列にハイブリダイズしないときに蛍光を発し、且つ、前記標的配列にハイブリダイズしたときに蛍光強度が減少するか又は増加する、請求項1〜4のいずれか一項に記載の多型検出用プローブ。
【請求項6】
前記蛍光標識オリゴヌクレオチドが、標的配列にハイブリダイズしないときに蛍光を発し、前記標的配列にハイブリダイズしたときに蛍光強度が減少する、請求項1〜5のいずれか一項に記載の多型検出用プローブ。
【請求項7】
前記P1及びP1’の蛍光標識オリゴヌクレオチドの塩基長が、15〜30塩基長であり、
前記P2及びP2’の蛍光標識オリゴヌクレオチドの塩基長が、10〜30塩基長であり、
前記P3及びP3’の蛍光標識オリゴヌクレオチドの塩基長が、12〜40塩基長であり、
前記P4及びP4’の蛍光標識オリゴヌクレオチドの塩基長が、16〜40塩基長であり、
前記P5及びP5’の蛍光標識オリゴヌクレオチドの塩基長が、10〜40塩基長である、請求項1〜6のいずれか一項に記載の多型検出用プローブ。
【請求項8】
前記P1及びP1’の蛍光標識オリゴヌクレオチドの塩基長が、15〜20塩基長であり、
前記P2及びP2’の蛍光標識オリゴヌクレオチドの塩基長が、10〜20塩基長であり、
前記P3及びP3’の蛍光標識オリゴヌクレオチドの塩基長が、15〜30塩基長であり、
前記P4及びP4’の蛍光標識オリゴヌクレオチドの塩基長が、20〜30塩基長であり、
前記P5及びP5’の蛍光標識オリゴヌクレオチドの塩基長が、20〜30塩基長である、請求項1〜7のいずれか一項に記載の多型検出用プローブ。
【請求項9】
前記多型検出用プローブが、融解曲線分析用のプローブである、請求項1〜8のいずれか一項に記載の多型検出用プローブ。
【請求項10】
前記多型検出用プローブが、配列番号37、配列番号38、配列番号39、配列番号41、配列番号43又は配列番号45で示される塩基配列を有する、請求項1〜9のいずれか一項に記載の多型検出用プローブ。
【請求項11】
前記多型検出用プローブが、配列番号4、配列番号6、配列番号8、配列番号10、配列番号44又は配列番号12で示される塩基配列を有する、請求項1〜9のいずれか一項に記載の多型検出用プローブ。
【請求項12】
請求項1〜11のいずれか一項に記載の多型検出用プローブを用いることにより、CYP3A遺伝子の多型を検出する多型検出方法。
【請求項13】
(I)前記多型検出用プローブ及び試料中の一本鎖核酸を接触させて、前記多型検出用プローブ及び前記一本鎖核酸をハイブリダイズさせてハイブリッド形成体を得ること、
(II)前記ハイブリッド形成体を含む試料の温度を変化させることで、前記ハイブリッド形成体を解離させ、前記ハイブリッド形成体の解離に基づく蛍光シグナルの変動を測定すること、
(III)前記蛍光シグナルの変動に基づいてハイブリッド形成体の解離温度であるTm値を検出すること、及び、
(IV)前記Tm値に基づいて、前記試料中の一本鎖核酸における、CYP3A遺伝子の多型の存在を検出すること、
を含む、請求項12に記載の多型検出方法。
【請求項14】
さらに、前記(I)の前または(I)と同時に、核酸を増幅することを含む、請求項13に記載の多型検出方法。
【請求項15】
請求項12〜14のいずれか一項に記載の多型検出方法により、CYP3A遺伝子の多型を検出すること、及び、
検出された多型の有無に基づいて、薬剤に対する耐性または薬剤の薬効を評価すること、を含む、薬剤の薬効評価方法。
【請求項16】
請求項1〜11のいずれか一項に記載の多型検出用プローブを含む、CYP3A遺伝子の多型を検出するための多型検出用試薬キット。
【請求項17】
さらに、前記多型検出用プローブがハイブリダイズする配列を含む領域を増幅するためのプライマーを含む、請求項16に記載の多型検出用試薬キット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公開番号】特開2012−196209(P2012−196209A)
【公開日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願番号】特願2012−53197(P2012−53197)
【出願日】平成24年3月9日(2012.3.9)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
【公開日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願日】平成24年3月9日(2012.3.9)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
[ Back to top ]

