Co含有溶液の製造方法
【課題】Ni量の高いCoNi原料溶液から、Niを効果的に分離除去でき、Coをより一層選択的に回収できるCo含有溶液の製造方法を提案する。
【解決手段】Ni及びCoを含有する溶液(「CoNi原料溶液」と称する)に還元剤及びCoSを加えて該CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素を硫化物として沈殿除去する一方、イオン化した状態のCo元素を含有するCo含有溶液を得ることを特徴とするCo含有溶液の製造方法を提案する。
【解決手段】Ni及びCoを含有する溶液(「CoNi原料溶液」と称する)に還元剤及びCoSを加えて該CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素を硫化物として沈殿除去する一方、イオン化した状態のCo元素を含有するCo含有溶液を得ることを特徴とするCo含有溶液の製造方法を提案する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、Co及びNiを含有する溶液(「CoNi原料溶液」と称する)から、Niを低減させてCoを多く含むCo含有溶液を製造する方法に関する。かかる製造方法は、例えばリチウムイオン電池の正極材料からCo含有溶液やCo(メタル)を製造する用途などに利用することができる。
【背景技術】
【0002】
リチウムイオン電池は、単位電気量当たりの重量が小さく、それでいてエネルギー密度が高いため、ビデオカメラ、ノートパソコン、携帯電話などの携帯型電子機器、さらには電気自動車やハイブリッド自動車などの電源として急速に普及しつつある。このため、使用済みのリチウムイオン電池(「廃リチウムイオン電池」と称する)などから有価金属を回収することは、資源の有効利用の観点から重要視されている。中でも、リチウム二次電池の正極には高価なCoが使用されているため、Coの回収は特に注目されている。
【0003】
リチウム二次電池の正極活物質には、従来から、4Vの高電圧を有する層構造のLiCoO2が使用されてきたが、最近では、高価なCoの一部をNiやMnなどの遷移金属で置換してなるリチウム複合酸化物が正極活物質として使用されるようになってきている。そのため、この種の廃リチウムイオン電池からCoを回収するには、Co以外の金属を如何に除去するか、特にCoとNiは化学的性質が似ているため、如何にNiを除去してCoのみを選択的に回収できるかが課題であった。
【0004】
このような技術として、例えば特許文献1(特公平6−96455号公報)には、不純物を含有する硫酸コバルト水溶液にコバルト粉を加え、これに水硫化ソーダ、硫化ソーダまたは硫化水素を過剰に加えて反応させ、生成した沈殿を分離したろ液に少量の次亜塩素酸ソーダ若しくは過酸化水素を添加することにより、不純物として存在するニッケル,鉄,銅などを極低濃度まで沈殿除去して高純度硫酸コバルトを得る方法が開示されている。
【0005】
また、特許文献2(特開2006−8463号公報)には、不純物としてニッケル及び鉄を含有するコバルト金属を硫酸水溶液に溶解し、得られた溶液に、鉄粉及び硫化物イオンを生成する化合物を添加し、硫化ニッケルを析出させてニッケルを除去し、次に、得られた溶液に、2価の鉄を酸化させるための酸化剤を添加すると共に当該溶液のpHを3〜5に調整し、水酸化鉄を析出させて鉄を除去するようにして、硫酸コバルト水溶液を得る方法が開示されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特公平6−96455号公報
【特許文献2】特開2006−8463号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
前述のように、最近、リチウム二次電池の正極活物質などにおいて、Coに対するNiの比率が益々高くなって来ている。従来提案されていたCo回収法は、Niの比率がそれほど高くないことを前提とした方法であったため、Niの比率が低いうちはCoを十分に回収することができていたが、最近のようにNiの比率が高くなってくると、Niを十分に除去することができず、Coの回収率を高めることができないという課題を抱えていた。
【0008】
そこで本発明は、Ni量が比較的高いCoNi原料溶液から、Niを効果的に分離除去することができ、Coをより一層選択的に回収することができる、新たなCo含有溶液を製造する方法を提供せんとするものである。
【課題を解決するための手段】
【0009】
本発明は、Ni及びCoを含有する溶液(「CoNi原料溶液」と称する)に還元剤及びCoSを加えて該CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素を硫化物として沈殿除去する一方、イオン化した状態のCo元素を含有するCo含有溶液を得ることを特徴とするCo含有溶液の製造方法を提案する。
【0010】
このように、CoNi原料溶液に還元剤及びCoSを加えて酸化還元電位を−550mV〜−400mVに調整すると、次の式(1)のような反応が生じ、Co元素はイオン化されて溶液中に溶解する一方、Ni元素は硫化物として沈殿除去することができるから、イオン化した状態のCoを選択的に取り込んだCo含有溶液を回収することができる。
式(1)・・2CoS+3Ni2++Fe→2Co2++Ni3S2 ↓+Fe2+
【0011】
そして、このようにして得られたCo含有溶液は、例えば、還元剤及び硫化剤を加えて該溶液の酸化還元電位を−550mV〜−400mVに調整することによって、溶液中のNi元素をさらに沈殿除去することができ、残りのCo元素が溶解した溶液(「Co高純度溶液」と称する)を得ることができる。
【0012】
このようなCo含有溶液の製造方法並びにCo高純度溶液の製造方法は、Niの比率が高いCoNi原料溶液であっても、Niを効率的に分離除去でき、Coを効果的に回収することができるから、例えば、廃リチウムイオン電池の正極材料、特にNiの比率が高まっている最近の正極材料からCoを回収する方法に好適に利用可能である。具体的には、廃リチウムイオン電池の正極材料には、CoやNiのほかにMn、さらにはAl、Cuなどが含まれているから、回収した正極材料或いは正極活物質を硫酸などに溶解して、Co及びNi以外の含有物質を公知の方法によって除去した上で、本発明のCo含有溶液の製造方法並びにCo高純度溶液の製造方法を利用すれば、Niをより一層効果的に除去することができ、Coをより一層選択的に回収することができる。
【図面の簡単な説明】
【0013】
【図1】後述する第1の実施形態の製造工程を示した図である。
【図2】後述する第2の実施形態の製造工程を示した図である。
【図3】後述する第3の実施形態の製造工程を示した図である。
【図4】試験1の結果として、ORPと液中のNi、Fe濃度との関係、並びに、ORPとCo回収率との関係を示したグラフである。
【発明を実施するための形態】
【0014】
以下に本発明の実施形態について詳細に述べるが、本発明の範囲が以下に説明する実施形態に限定されるものではない。
【0015】
<第1の実施形態>
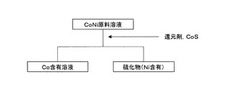
本実施形態は、図1に示すように、Ni及びCoを含有する溶液(「CoNi原料溶液」と称する)に還元剤及びCoSを加えて該CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素を硫化物として沈殿除去する一方、イオン化した状態のCo元素を含有するCo含有溶液を得ることを特徴とする実施形態である。
【0016】
このように、CoNi原料溶液に還元剤(例えば鉄粉)及びCoSを加えて酸化還元電位を−550mV〜−400mVに調整すると、次の式(1)のような反応が生じ、溶液中のNi元素は硫化物として沈殿除去することができ、CoSのCo元素はイオン化して溶液中に溶解させることができるから、イオン化した状態のCo元素としてCo含有溶液中にCoを回収することができる。
この際、例えば還元剤として鉄粉を添加した場合には、Niは式(1)のとおり硫化物となって沈殿する。
式(1)・・2CoS+3Ni2++Fe→2Co2++Ni3S2 ↓+Fe2+
【0017】
CoNi原料溶液は、少なくともNi及びCoを含んでいればよい。Ni及びCo以外の成分を含んでいてもよいが、他の金属元素が含まれていると、Niを除去する際の妨げになる可能性があるため、公知の方法によって除去するのが好ましい。
CoNi原料溶液は、例えばNi及びCoを含有する組成物(合金を含む)を、硫酸などに溶解し、必要に応じて公知の方法によってNi及びCo以外の金属成分を排除するのが好ましい。但し、Feが含まれていても支障が少なく、しかも後工程で排除可能であるため、CoNi原料溶液中にFeが含まれていてもよい。
この際、硫酸のほかに、塩酸、硝酸など公知の酸を用いて溶解してもよい。
また、コバルト酸リチウムなどNi及びCoを含有する化合物を酸溶解する場合には、H2O2や鉄粉などの還元剤を添加するのが好ましい。
【0018】
後述する試験2で示されるように、CoNi原料溶液において、初期Ni濃度が高いほど、CoSからのCo回収率は高くなるが、逆にNi分離率が低下する傾向があるため、両方を考慮すると、CoS中のCoに対するCoNi原料溶液のNiのモル比率(Ni/Co)は0.2〜0.8(mol/mol)であるのが好ましく、特に0.3(mol/mol)以上或いは0.7(mol/mol)以下、中でも特に0.4(mol/mol)以上或いは0.6(mol/mol)以下であるのがより一層好ましい。
CoNi原料溶液の初期温度、すなわち還元剤を加える際の液温は、鉄粉の溶解速度を適正にするため、30〜50℃とするのが好ましい。
【0019】
CoNi原料溶液の初期pH、すなわち還元剤を加える溶液の初期pHは3.0〜6.0に調整するのが好ましい。pH3.0以上であれば、生成した硫化物が硫化水素となって揮散するのを防止することができる。また、pH6.0以下であれば、水酸化物の生成を抑えて硫化物を優先的に生成させることができる。かかる観点から、還元剤を加える際の溶液のpHは4以上、或いは5以下、特に4.5以下であるのがより一層好ましい。
【0020】
本実施形態では、溶液中のNi元素を硫化物として沈殿除去する効果の観点から、CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−400mV以下に調整することが重要である。すなわち、溶液の酸化還元電位を−400mV以下に調整した場合に初めてNi濃度を効果的に低減することができる。他方、−550mVより下げても、それ以上Niの除去率を高めることができないばかりか、還元剤が溶液に大量に溶解して、後工程の負荷が増大してしまう。
よって、還元剤を加えて調整するCoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)としては、−550mV〜−400mVに調整するのが好ましく、中でも−550mV〜−450mVに調整するのがさらに好ましく、その中でも特に−550mV〜−500mVに調整するのがさらに好ましい。
【0021】
還元剤としては、鉄(Fe)、コバルト(Co)、亜鉛(Zn)、アルミニウム(Al)など、Niよりも卑な金属の粉体や、ヒドラジンなどを挙げることができるが、CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整するという観点からは、鉄粉を用いるのが特に好ましい。
還元剤の添加量は、CoNi原料溶液の酸化還元電位を所定範囲に調整することができるように調整すればよい。
【0022】
溶液中のNi元素を硫化物とする硫化剤としては、例えばNaHS、Na2S、H2S、K2Sなどの硫化剤を用いることも可能であるが、硫化剤としての効果、Niの低減効率、並びに余分な分離工程が不要であるという点などから、CoSを用いることが特に好ましい。
【0023】
<第2の実施形態>
本実施形態は、図2に示すように、Ni及びCoを含有するCoNi原料溶液に還元剤及びCoSを加えて該CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素を硫化物として沈殿除去する一方、イオン化した状態のCo元素を含有するCo含有溶液を得るNi低減工程と、
前記Ni低減工程で得られたCo含有溶液に還元剤及び硫化剤を加えて該Co含有溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素をNi硫化物として沈殿させると共に、溶液中のCo元素の一部をCoSとして沈殿させた後、固液分離して、該Ni硫化物及び該CoSを含有するCoS含有組成物と、残りのCo元素が溶解してなる残りのCo元素が溶解した溶液(「Co高純度溶液」と称する)とを分離回収するCoS作製工程とを備えた、実施形態である。
【0024】
このように、Ni低減工程で得られたCo含有溶液に還元剤(例えば鉄粉)及び硫化剤(例えばNaHS)を加えて酸化還元電位を−550mV〜−400mVに調整すると、次のような式(2)(3)反応が生じ、溶液中のCo元素の一部をCoSとして沈殿させると共に、溶液中のNi元素をNi硫化物(例えばN3S2)として沈殿させ、Co高純度溶液を得ることができる。
式(2)・・3Ni2++2NaHS+Fe→Ni3S2↓+2Na++2H++Fe2+
式(3)・・Co2++NaHS→CoS↓+Na++H+
【0025】
また、本実施形態において、CoS作製工程で回収したCoS含有組成物を、次回以降のバッチのNi低減工程においてCoSとして添加すれば、Coの回収率をさらに高めることができる。よって、このようにしてNi低減工程とCoS作製工程とを繰り返すことにより、Coの回収を連続的に行うことができる。
【0026】
本実施形態において、Ni低減工程は、上記第1の実施形態と同様に行えばよい。
Ni低減工程で生じる沈殿は、CoS作製工程の前に取り除くことが好ましい。
【0027】
他方、CoS作製工程においては、Co含有溶液の初期pH、すなわち還元剤を加える際のpHは、第1の実施形態におけるCoNi原料溶液の初期pHと同様である。
また、CoS作製工程におけるCo含有溶液の初期温度、すなわち還元剤を加える際の液温は、第1の実施形態におけるCoNi原料溶液の初期温度と同様である。
【0028】
CoS作製工程では、Niを低濃度まで除去するという観点から、Co含有溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−400mV以下に調整することが重要である。すなわち、溶液の酸化還元電位を−400mV以下に調整した場合に初めてNiを低濃度まで除去することができる。他方、−550mVより下げても、それ以上Niの除去率を高めることができないばかりか、還元剤が溶液に大量に溶解して、後工程の負荷が増大してしまう。
かかる観点から、還元剤を加えて調整するCo含有溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)としては、−550mV〜−400mVに調整するのが好ましく、中でも−550mV〜−450mVに調整するのがさらに好ましく、その中でも特に−550mV〜−500mVに調整するのがさらに好ましい。
【0029】
CoS作製工程で使用する還元剤としては、鉄(Fe)、コバルト(Co)、亜鉛(Zn)、アルミニウム(Al)など、Niよりも卑な金属の粉体や、ヒドラジンなどを挙げることができるが、Co含有溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整するという観点からは、鉄粉が特に好ましい。
還元剤の添加量は、Co含有溶液の酸化還元電位を所定範囲に調整することができるように調整すればよい。
【0030】
CoS作製工程において、溶液中のNi元素を硫化物とする硫化剤としては、例えばNaHS、Na2S、H2S、K2Sなどを用いることが可能であるが、ハンドリング性や安全性など観点から、NaHSが特に好ましい。但し、NaHSに限定するものではない。
そして、この硫化剤は、Niを十分に除去できるという観点から、反応開始時の溶液中の初期Ni含有量に対して1〜10倍モル量の硫化物(S換算)を添加するのが好ましく、特に2〜10倍モル量、中でも特に5倍モル量以上の硫化物(S換算)を添加するのが好ましい。
【0031】
他方、CoS作製工程で回収したCoS含有組成物を、次回以降のバッチのNi低減工程においてCoSとして添加する、すなわち、次回以降のバッチのNi低減工程に投入するようにしてNi低減工程及びCoS作製工程を繰り返すようにすれば、NiをCoSのCoと置換させてNi硫化物(例えばNi3S2)として沈殿除去することができるばかりか、CoSからCoを溶液中へ回収することができるため、Coの回収率をさら高めることができる。よって、Niの比率が高い原料であっても、Niを分離除去してCoの回収率を高めることができる点で優れている。
この際、CoS作製工程で回収したCoS含有組成物には、Ni硫化物(例えばN3S2)及びCoSが含まれているから、Ni硫化物(例えばN3S2)及びCoSを含有する組成物(「CoS含有組成物」と称する)をNi低減工程においてCoSとして添加してもよいし、Ni硫化物(例えばN3S2)を低減してCoSとして添加してもよい。
Ni低減工程に投入するCoS含有組成物に関しては、CoSの比率が高いほどNiの削減量が増えるため好ましいため、CoS含有組成物におけるCo:Niのモル比率は50:50〜100:0が好ましく、特に70:30〜100:0、中でも90:10〜100:0であるのがより一層好ましい。
【0032】
<第3の実施形態>
本実施形態は、本発明の製造方法を、廃リチウムイオン電池の正極材料からCoを回収する方法に利用した実施形態である。
【0033】
リチウムイオン電池の正極活物質には、CoやNiのほかに、Mnが多く含まれており、正極集電体や負極材料に起因する不純物、例えばAl、Cuなどが不純物として含まれている可能性がある。そのため、本発明の製造方法を、リチウムイオン電池の正極材料からCoを回収するのに利用するには、廃リチウムイオン電池から正極材料を分離し、分離回収した正極材料を必要に応じて公知の処理を施した後、当該正極材料、好ましくは正極活物質を主体とする組成物、例えばNi、Mn及びCoを含有する組成物(「CoMnNi含有組成物」と称する)を、硫酸などを用いて溶解させ、次に、Co及びNi以外の金属元素を除去してCoNi原料溶液を調製し、これを上記第1の実施形態又は第2の実施形態と同様に処理すればよい。
【0034】
より具体的には、図3に示すように、先ずは、正極材料、好ましくは正極活物質を主体とする組成物を硫酸などに溶解して原料溶液とすればよい。
この際、硫酸のほかに、塩酸、硝酸など公知の酸を用いて溶解してもよい。
【0035】
次に、溶液中のMnを分離除去すればよい。
Mnの分離方法としては、例えばpH1〜4、40〜80℃程度において、原料溶液にKMnO4や次亜塩素酸ナトリウムどの酸化剤を添加して、二酸化マンガン(MnO2)などとして沈殿させ、公知の固液分離法により、沈殿物を除去すればよい。
こうしてMnを分離除去した溶液には、例えばCo、Ni、Al、Cuなどがイオンとして溶解している。
【0036】
次に、溶液中のCuを分離除去すればよい。
Cuの分離方法としては、原料溶液に例えばFe粉などの還元剤を添加して、Cuメタルとして沈殿させ、公知の固液分離法により、沈殿物を除去すればよい。
この際、還元剤としては、Cuよりも卑な金属、例えばCo粉やAl箔なども用いることができる。
こうしてCuを分離除去した溶液には、例えばCo、Ni、Al、Feなどがイオンとして溶解している。
【0037】
次に、溶液中のAl及びFeを分離除去すればよい。
Alの分離方法としては、溶液にアルカリを添加してpHを3〜5に調整することで、液中のAlをAl(OH)3として沈殿させるAl沈殿処理1を行い、公知の固液分離法により、沈殿物を除去すれば、上記第1の実施形態又は第2の実施形態の原料として好ましいCoNi原料溶液を得ることができる。
この際、アルカリとしては、例えば水酸化ナトリウム(NaOH)、水酸化カリウム(KOH)、水酸化カルシウム(Ca(OH)2)、水酸化コバルト(Co(OH)2)等を用いることができる。
【0038】
さらに得られた溶液に、酸化剤としてH2O2を加えてFeを酸化させた後、例えばアルカリを添加してpHを5〜6に調整し、溶液中のFe及びAlを、それぞれFe(OH)3、Al(OH)3として沈殿させるAl沈殿処理2を行い、公知の固液分離法により、沈殿物を除去すれば、上記第1の実施形態又は第2の実施形態の原料として、より一層好ましいCoNi原料溶液を得ることができる。
この際、酸化剤としては、溶液中の2価の鉄を3価に酸化できるものであればよく、例えば過酸化水素のほかに、次亜塩素酸ナトリウムなどを挙げることができる。
また、pHを調整するアルカリとしては、例えば水酸化ナトリウム(NaOH)、水酸化カリウム(KOH)、水酸化カルシウム(Ca(OH)2)、水酸化コバルト(Co(OH)2)等を挙げることができる。
なお、Al沈殿処理2で得られた沈殿物中には、Co及びNiが若干含まれるため、再度Al沈殿処理1の処理液に戻して繰り返し処理することで、Co回収率をさらに高めることができる。
【0039】
そして、このようにして得られたCoNi原料溶液を、上記第1の実施形態又は第2の実施形態と同様に処理すればよい。
【0040】
第1〜第3の実施形態のようにして得られたCo高純度溶液は、必要に応じて溶液中の鉄(Fe)などCo以外の金属元素を公知の方法で除去した後、公知の方法で処理することにより、Co(メタル)として回収することができる。
例えば、Feを含んだCo高純度溶液に過酸化水素(H2O2)などの酸化剤を添加すると共に、酸化剤を添加した溶液のpHを、アルカリを添加して3〜5に調整することで、溶液中の鉄を水酸化鉄(Fe(OH)3)として沈殿除去することができる。
この際、酸化剤としては、溶液中の2価の鉄を3価に酸化できるものであればよく、例えば過酸化水素のほかに、次亜塩素酸ナトリウムなどを挙げることができる。
また、pHを調整するアルカリとしては、例えば水酸化ナトリウム(NaOH)、水酸化カリウム(KOH)、水酸化カルシウム(Ca(OH)2)、水酸化コバルト(Co(OH)2)等を挙げることができる。
その後、例えばCo高純度溶液に水酸化ナトリウムなどを添加して、液中のCo元素をCo(OH)2として析出させ、硫酸を用いて溶解させた後、電解採取してCo(メタル)として回収することができる。
【0041】
なお、第1〜第3の実施形態で説明した各工程のほかに、公知の他の工程や処理を追加することは任意に可能である。例えば、上記で説明した以外の成分が原料中に含まれる場合に、当該成分を除去するために公知の工程や処理を追加することなどを挙げることができるが、これに限定されるものでもない。
【0042】
<語句の説明>
本発明において、「X〜Y」(X,Yは任意の数字)と記載した場合、特にことわらない限り「X以上Y以下」の意と共に、「好ましくはXより大きい」或いは「好ましくはYより小さい」の意も包含するものである。
また、「X以上」(Xは任意の数字)と記載した場合、特にことわらない限り「好ましくはXより大きい」の意を包含し、「Y以下」(Yは任意の数字)と記載した場合、特にことわらない限り「好ましくはYより小さい」の意も包含するものである。
【実施例】
【0043】
以下、本発明に関する実施例及び比較例について説明する。但し、本発明は以下に説明する内容に限定されるものではない。
【0044】
<試験1>
Niに対してCo濃度が高いCoNi原料溶液を調製し、酸化還元電位(;ORP、参照電極:銀−飽和塩化銀電極)を所定値に調整すると共に、硫化剤としてのNaHSを添加して、ORPとNi濃度、Fe濃度、Co回収率との関係を検討した。
【0045】
(第1工程:CoS作製工程)
Coを34g/L、Niを3.7g/Lの割合で含有するCoNi原料溶液(pH4.0〜4.5、40℃)200mLに、NaHS2.65gを水40mLに溶かしたものを添加すると共に、鉄粉1gを添加し、30分間攪拌した後、孔径5μmのメンブレンフィルターによってろ過して、沈殿物としてのCoS組成物を回収した。
【0046】
(第2工程:Ni低減工程)
Coを21g/L、Niを21g/Lの割合で含有するCoNi原料溶液(pH4.0〜4.5、40℃)200mLに、鉄粉0.5g〜2.5gと第1工程で得られたCoS組成物全量とを添加して適宜ORPを変化させ、30分間攪拌した後、孔径5μmのメンブレンフィルターによってろ過して、ろ液中のNi濃度、ろ液中のFe濃度、さらにはCo濃度を測定し、CoS組成物からのCo回収率(%)を確認した。
【0047】
(考察)
図4に示されるように、鉄粉を添加しORPが下がると、Niが液中から分離され鉄粉が溶解していくことが確認された。このことから、式(4)のような反応が生じていると考えられる。
式(4) 3Ni+2+2CoS+Fe→Ni3S2+2Co2++Fe2+
【0048】
多くの試験を重ねた結果、Ni低減工程では、初期Ni濃度(21g/L)を半減するためには、ORPを−400mV以下、特に−450mV以下とすることが好ましいことが分かった。
また、Ni低減工程では、Ni濃度を4〜6g/Lまで低減するのが最も効率的であることが判明しており、かかるNi濃度にするためには、ORPを−500mV以下にすることが好ましいことも分かった。
【0049】
また、図4に示されるように、鉄粉の添加量を多くすると、ORPが−550mVに近づき、溶解Fe濃度が増大することが分かった。但し、過剰に鉄粉を添加しても、ORPは低下しないため、ORPを−550mVよりも低くすることは鉄粉の無駄である。また、鉄粉が大量に溶解し後工程の負荷が増大するため、適切でない。さらに、式(5)のような反応が考えられ、Coが再度CoSとしてロスするおそれもある。
式(5) Ni3S2 + 2Co+2 + 2Fe→3Ni+ 2CoS+ 2Fe2+
【0050】
さらに、ORP = −540mVのときのCoS組成物からのCo回収率は59%であり、Ni、Feの挙動から式(4)に従って添加したCoSからCoが液中へ回収されていると考えられる。
ろ過して得られた残渣の元素比は、S:Ni:Co =2:2.8:0.4であり、Ni3S2の組成に近い化合物ができていた。ORPがおおむね−400mV以上ではNi分離率が低くなる傾向が認められ、式(4)が十分進行せずにCo回収率が低いと考えられる。
以上の点から、第1工程及び第2工程のいずれにおいても、ORPを−400mV〜−550mVの範囲に調整して反応を進めるのが望ましいと考えることができる。
【0051】
<試験2>
Ni及びCoを含有するCoNi原料溶液(原料)に、鉄粉と、添加量を変えてNaHS(水硫化ナトリウム)とを添加し、CoS沈殿(CoS高含有組成物)を作製し、CoS高含有組成物中のNi量及びCo量を測定した。
【0052】
液温40℃、初期pH5のCoNi原料溶液(Co濃度:40g/L(68mmoL)、Ni濃度:1.0g/L(1.7mmoL))100mLに、Fe粉0.21g及びNaHS3.4〜6.8mmoLを添加して30分間反応させ、ろ過を行い、ろ液とCoS高含有組成物に分離し、CoS高含有組成物中のNi量及びCo量を算出した。
【0053】
CoS高含有組成物中のNi量及びCo量は次のようにして算出した。
この際、CoS高含有組成物中のNiはNi3S2になっていると仮定した。
・CoS高含有組成物中Ni量=CoNi原料溶液中Ni量 −ろ液中Ni量
・CoS高含有組成物中Ni量=NaHS添加量−CoS高含有組成物中Ni量×2÷3
【0054】
【表1】

【0055】
<試験3>
Ni及びCoを含有し、Ni量を変化させたCoNi原料溶液に、鉄粉、CoS及びNi3S2を添加し、Niを除去して、高濃度Niろ液と、高濃度Co組成物を得、Ni分離率とCo回収率を求めた。
【0056】
液温40℃、初期pH5のCoNi原料溶液(Co濃度:40g/L(68mmoL)、Ni濃度:4〜8g/L(6.8〜13.6mmoL))100mLに、Fe粉0.84g、CoS2.4〜5.8mmoL、Ni3S20.5mmoLを添加して30分間反応させ、ろ過を行い、高濃度Niろ液と、高濃度Co組成物を得、それぞれのNi量及びCo量を測定した。
【0057】
Ni分離率及びCo回収率を次のようにして算出した。
・分離したNi量=CoNi原料溶液中Ni量 −高濃度Niろ液中Ni量
・Ni分離率 = 分離したNi量 /CoNi原料溶液中Ni量×100
・Co回収率 = 100−Ni残渣中Co量 /高濃度Co組成物中Co量×100
【0058】
【表2】

【0059】
CoS添加量(1.8〜5.4mmoL)と初期Ni量(4〜8g/L)のmoL比を検討すると、CoS/初期Ni量が小さ過ぎるとNi分離率が不十分となる一方、CoS/初期Ni量が大き過ぎるとCo回収率が悪化することが分かった。
かかる観点から、CoS/初期Ni量は0.2〜0.8mol/molが好ましく、特に0.3〜0.7mol/mol、中でも特に0.4〜0.6mol/molであるのがより好ましいと考えることができる。
【技術分野】
【0001】
本発明は、Co及びNiを含有する溶液(「CoNi原料溶液」と称する)から、Niを低減させてCoを多く含むCo含有溶液を製造する方法に関する。かかる製造方法は、例えばリチウムイオン電池の正極材料からCo含有溶液やCo(メタル)を製造する用途などに利用することができる。
【背景技術】
【0002】
リチウムイオン電池は、単位電気量当たりの重量が小さく、それでいてエネルギー密度が高いため、ビデオカメラ、ノートパソコン、携帯電話などの携帯型電子機器、さらには電気自動車やハイブリッド自動車などの電源として急速に普及しつつある。このため、使用済みのリチウムイオン電池(「廃リチウムイオン電池」と称する)などから有価金属を回収することは、資源の有効利用の観点から重要視されている。中でも、リチウム二次電池の正極には高価なCoが使用されているため、Coの回収は特に注目されている。
【0003】
リチウム二次電池の正極活物質には、従来から、4Vの高電圧を有する層構造のLiCoO2が使用されてきたが、最近では、高価なCoの一部をNiやMnなどの遷移金属で置換してなるリチウム複合酸化物が正極活物質として使用されるようになってきている。そのため、この種の廃リチウムイオン電池からCoを回収するには、Co以外の金属を如何に除去するか、特にCoとNiは化学的性質が似ているため、如何にNiを除去してCoのみを選択的に回収できるかが課題であった。
【0004】
このような技術として、例えば特許文献1(特公平6−96455号公報)には、不純物を含有する硫酸コバルト水溶液にコバルト粉を加え、これに水硫化ソーダ、硫化ソーダまたは硫化水素を過剰に加えて反応させ、生成した沈殿を分離したろ液に少量の次亜塩素酸ソーダ若しくは過酸化水素を添加することにより、不純物として存在するニッケル,鉄,銅などを極低濃度まで沈殿除去して高純度硫酸コバルトを得る方法が開示されている。
【0005】
また、特許文献2(特開2006−8463号公報)には、不純物としてニッケル及び鉄を含有するコバルト金属を硫酸水溶液に溶解し、得られた溶液に、鉄粉及び硫化物イオンを生成する化合物を添加し、硫化ニッケルを析出させてニッケルを除去し、次に、得られた溶液に、2価の鉄を酸化させるための酸化剤を添加すると共に当該溶液のpHを3〜5に調整し、水酸化鉄を析出させて鉄を除去するようにして、硫酸コバルト水溶液を得る方法が開示されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特公平6−96455号公報
【特許文献2】特開2006−8463号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
前述のように、最近、リチウム二次電池の正極活物質などにおいて、Coに対するNiの比率が益々高くなって来ている。従来提案されていたCo回収法は、Niの比率がそれほど高くないことを前提とした方法であったため、Niの比率が低いうちはCoを十分に回収することができていたが、最近のようにNiの比率が高くなってくると、Niを十分に除去することができず、Coの回収率を高めることができないという課題を抱えていた。
【0008】
そこで本発明は、Ni量が比較的高いCoNi原料溶液から、Niを効果的に分離除去することができ、Coをより一層選択的に回収することができる、新たなCo含有溶液を製造する方法を提供せんとするものである。
【課題を解決するための手段】
【0009】
本発明は、Ni及びCoを含有する溶液(「CoNi原料溶液」と称する)に還元剤及びCoSを加えて該CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素を硫化物として沈殿除去する一方、イオン化した状態のCo元素を含有するCo含有溶液を得ることを特徴とするCo含有溶液の製造方法を提案する。
【0010】
このように、CoNi原料溶液に還元剤及びCoSを加えて酸化還元電位を−550mV〜−400mVに調整すると、次の式(1)のような反応が生じ、Co元素はイオン化されて溶液中に溶解する一方、Ni元素は硫化物として沈殿除去することができるから、イオン化した状態のCoを選択的に取り込んだCo含有溶液を回収することができる。
式(1)・・2CoS+3Ni2++Fe→2Co2++Ni3S2 ↓+Fe2+
【0011】
そして、このようにして得られたCo含有溶液は、例えば、還元剤及び硫化剤を加えて該溶液の酸化還元電位を−550mV〜−400mVに調整することによって、溶液中のNi元素をさらに沈殿除去することができ、残りのCo元素が溶解した溶液(「Co高純度溶液」と称する)を得ることができる。
【0012】
このようなCo含有溶液の製造方法並びにCo高純度溶液の製造方法は、Niの比率が高いCoNi原料溶液であっても、Niを効率的に分離除去でき、Coを効果的に回収することができるから、例えば、廃リチウムイオン電池の正極材料、特にNiの比率が高まっている最近の正極材料からCoを回収する方法に好適に利用可能である。具体的には、廃リチウムイオン電池の正極材料には、CoやNiのほかにMn、さらにはAl、Cuなどが含まれているから、回収した正極材料或いは正極活物質を硫酸などに溶解して、Co及びNi以外の含有物質を公知の方法によって除去した上で、本発明のCo含有溶液の製造方法並びにCo高純度溶液の製造方法を利用すれば、Niをより一層効果的に除去することができ、Coをより一層選択的に回収することができる。
【図面の簡単な説明】
【0013】
【図1】後述する第1の実施形態の製造工程を示した図である。
【図2】後述する第2の実施形態の製造工程を示した図である。
【図3】後述する第3の実施形態の製造工程を示した図である。
【図4】試験1の結果として、ORPと液中のNi、Fe濃度との関係、並びに、ORPとCo回収率との関係を示したグラフである。
【発明を実施するための形態】
【0014】
以下に本発明の実施形態について詳細に述べるが、本発明の範囲が以下に説明する実施形態に限定されるものではない。
【0015】
<第1の実施形態>
本実施形態は、図1に示すように、Ni及びCoを含有する溶液(「CoNi原料溶液」と称する)に還元剤及びCoSを加えて該CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素を硫化物として沈殿除去する一方、イオン化した状態のCo元素を含有するCo含有溶液を得ることを特徴とする実施形態である。
【0016】
このように、CoNi原料溶液に還元剤(例えば鉄粉)及びCoSを加えて酸化還元電位を−550mV〜−400mVに調整すると、次の式(1)のような反応が生じ、溶液中のNi元素は硫化物として沈殿除去することができ、CoSのCo元素はイオン化して溶液中に溶解させることができるから、イオン化した状態のCo元素としてCo含有溶液中にCoを回収することができる。
この際、例えば還元剤として鉄粉を添加した場合には、Niは式(1)のとおり硫化物となって沈殿する。
式(1)・・2CoS+3Ni2++Fe→2Co2++Ni3S2 ↓+Fe2+
【0017】
CoNi原料溶液は、少なくともNi及びCoを含んでいればよい。Ni及びCo以外の成分を含んでいてもよいが、他の金属元素が含まれていると、Niを除去する際の妨げになる可能性があるため、公知の方法によって除去するのが好ましい。
CoNi原料溶液は、例えばNi及びCoを含有する組成物(合金を含む)を、硫酸などに溶解し、必要に応じて公知の方法によってNi及びCo以外の金属成分を排除するのが好ましい。但し、Feが含まれていても支障が少なく、しかも後工程で排除可能であるため、CoNi原料溶液中にFeが含まれていてもよい。
この際、硫酸のほかに、塩酸、硝酸など公知の酸を用いて溶解してもよい。
また、コバルト酸リチウムなどNi及びCoを含有する化合物を酸溶解する場合には、H2O2や鉄粉などの還元剤を添加するのが好ましい。
【0018】
後述する試験2で示されるように、CoNi原料溶液において、初期Ni濃度が高いほど、CoSからのCo回収率は高くなるが、逆にNi分離率が低下する傾向があるため、両方を考慮すると、CoS中のCoに対するCoNi原料溶液のNiのモル比率(Ni/Co)は0.2〜0.8(mol/mol)であるのが好ましく、特に0.3(mol/mol)以上或いは0.7(mol/mol)以下、中でも特に0.4(mol/mol)以上或いは0.6(mol/mol)以下であるのがより一層好ましい。
CoNi原料溶液の初期温度、すなわち還元剤を加える際の液温は、鉄粉の溶解速度を適正にするため、30〜50℃とするのが好ましい。
【0019】
CoNi原料溶液の初期pH、すなわち還元剤を加える溶液の初期pHは3.0〜6.0に調整するのが好ましい。pH3.0以上であれば、生成した硫化物が硫化水素となって揮散するのを防止することができる。また、pH6.0以下であれば、水酸化物の生成を抑えて硫化物を優先的に生成させることができる。かかる観点から、還元剤を加える際の溶液のpHは4以上、或いは5以下、特に4.5以下であるのがより一層好ましい。
【0020】
本実施形態では、溶液中のNi元素を硫化物として沈殿除去する効果の観点から、CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−400mV以下に調整することが重要である。すなわち、溶液の酸化還元電位を−400mV以下に調整した場合に初めてNi濃度を効果的に低減することができる。他方、−550mVより下げても、それ以上Niの除去率を高めることができないばかりか、還元剤が溶液に大量に溶解して、後工程の負荷が増大してしまう。
よって、還元剤を加えて調整するCoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)としては、−550mV〜−400mVに調整するのが好ましく、中でも−550mV〜−450mVに調整するのがさらに好ましく、その中でも特に−550mV〜−500mVに調整するのがさらに好ましい。
【0021】
還元剤としては、鉄(Fe)、コバルト(Co)、亜鉛(Zn)、アルミニウム(Al)など、Niよりも卑な金属の粉体や、ヒドラジンなどを挙げることができるが、CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整するという観点からは、鉄粉を用いるのが特に好ましい。
還元剤の添加量は、CoNi原料溶液の酸化還元電位を所定範囲に調整することができるように調整すればよい。
【0022】
溶液中のNi元素を硫化物とする硫化剤としては、例えばNaHS、Na2S、H2S、K2Sなどの硫化剤を用いることも可能であるが、硫化剤としての効果、Niの低減効率、並びに余分な分離工程が不要であるという点などから、CoSを用いることが特に好ましい。
【0023】
<第2の実施形態>
本実施形態は、図2に示すように、Ni及びCoを含有するCoNi原料溶液に還元剤及びCoSを加えて該CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素を硫化物として沈殿除去する一方、イオン化した状態のCo元素を含有するCo含有溶液を得るNi低減工程と、
前記Ni低減工程で得られたCo含有溶液に還元剤及び硫化剤を加えて該Co含有溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素をNi硫化物として沈殿させると共に、溶液中のCo元素の一部をCoSとして沈殿させた後、固液分離して、該Ni硫化物及び該CoSを含有するCoS含有組成物と、残りのCo元素が溶解してなる残りのCo元素が溶解した溶液(「Co高純度溶液」と称する)とを分離回収するCoS作製工程とを備えた、実施形態である。
【0024】
このように、Ni低減工程で得られたCo含有溶液に還元剤(例えば鉄粉)及び硫化剤(例えばNaHS)を加えて酸化還元電位を−550mV〜−400mVに調整すると、次のような式(2)(3)反応が生じ、溶液中のCo元素の一部をCoSとして沈殿させると共に、溶液中のNi元素をNi硫化物(例えばN3S2)として沈殿させ、Co高純度溶液を得ることができる。
式(2)・・3Ni2++2NaHS+Fe→Ni3S2↓+2Na++2H++Fe2+
式(3)・・Co2++NaHS→CoS↓+Na++H+
【0025】
また、本実施形態において、CoS作製工程で回収したCoS含有組成物を、次回以降のバッチのNi低減工程においてCoSとして添加すれば、Coの回収率をさらに高めることができる。よって、このようにしてNi低減工程とCoS作製工程とを繰り返すことにより、Coの回収を連続的に行うことができる。
【0026】
本実施形態において、Ni低減工程は、上記第1の実施形態と同様に行えばよい。
Ni低減工程で生じる沈殿は、CoS作製工程の前に取り除くことが好ましい。
【0027】
他方、CoS作製工程においては、Co含有溶液の初期pH、すなわち還元剤を加える際のpHは、第1の実施形態におけるCoNi原料溶液の初期pHと同様である。
また、CoS作製工程におけるCo含有溶液の初期温度、すなわち還元剤を加える際の液温は、第1の実施形態におけるCoNi原料溶液の初期温度と同様である。
【0028】
CoS作製工程では、Niを低濃度まで除去するという観点から、Co含有溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−400mV以下に調整することが重要である。すなわち、溶液の酸化還元電位を−400mV以下に調整した場合に初めてNiを低濃度まで除去することができる。他方、−550mVより下げても、それ以上Niの除去率を高めることができないばかりか、還元剤が溶液に大量に溶解して、後工程の負荷が増大してしまう。
かかる観点から、還元剤を加えて調整するCo含有溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)としては、−550mV〜−400mVに調整するのが好ましく、中でも−550mV〜−450mVに調整するのがさらに好ましく、その中でも特に−550mV〜−500mVに調整するのがさらに好ましい。
【0029】
CoS作製工程で使用する還元剤としては、鉄(Fe)、コバルト(Co)、亜鉛(Zn)、アルミニウム(Al)など、Niよりも卑な金属の粉体や、ヒドラジンなどを挙げることができるが、Co含有溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整するという観点からは、鉄粉が特に好ましい。
還元剤の添加量は、Co含有溶液の酸化還元電位を所定範囲に調整することができるように調整すればよい。
【0030】
CoS作製工程において、溶液中のNi元素を硫化物とする硫化剤としては、例えばNaHS、Na2S、H2S、K2Sなどを用いることが可能であるが、ハンドリング性や安全性など観点から、NaHSが特に好ましい。但し、NaHSに限定するものではない。
そして、この硫化剤は、Niを十分に除去できるという観点から、反応開始時の溶液中の初期Ni含有量に対して1〜10倍モル量の硫化物(S換算)を添加するのが好ましく、特に2〜10倍モル量、中でも特に5倍モル量以上の硫化物(S換算)を添加するのが好ましい。
【0031】
他方、CoS作製工程で回収したCoS含有組成物を、次回以降のバッチのNi低減工程においてCoSとして添加する、すなわち、次回以降のバッチのNi低減工程に投入するようにしてNi低減工程及びCoS作製工程を繰り返すようにすれば、NiをCoSのCoと置換させてNi硫化物(例えばNi3S2)として沈殿除去することができるばかりか、CoSからCoを溶液中へ回収することができるため、Coの回収率をさら高めることができる。よって、Niの比率が高い原料であっても、Niを分離除去してCoの回収率を高めることができる点で優れている。
この際、CoS作製工程で回収したCoS含有組成物には、Ni硫化物(例えばN3S2)及びCoSが含まれているから、Ni硫化物(例えばN3S2)及びCoSを含有する組成物(「CoS含有組成物」と称する)をNi低減工程においてCoSとして添加してもよいし、Ni硫化物(例えばN3S2)を低減してCoSとして添加してもよい。
Ni低減工程に投入するCoS含有組成物に関しては、CoSの比率が高いほどNiの削減量が増えるため好ましいため、CoS含有組成物におけるCo:Niのモル比率は50:50〜100:0が好ましく、特に70:30〜100:0、中でも90:10〜100:0であるのがより一層好ましい。
【0032】
<第3の実施形態>
本実施形態は、本発明の製造方法を、廃リチウムイオン電池の正極材料からCoを回収する方法に利用した実施形態である。
【0033】
リチウムイオン電池の正極活物質には、CoやNiのほかに、Mnが多く含まれており、正極集電体や負極材料に起因する不純物、例えばAl、Cuなどが不純物として含まれている可能性がある。そのため、本発明の製造方法を、リチウムイオン電池の正極材料からCoを回収するのに利用するには、廃リチウムイオン電池から正極材料を分離し、分離回収した正極材料を必要に応じて公知の処理を施した後、当該正極材料、好ましくは正極活物質を主体とする組成物、例えばNi、Mn及びCoを含有する組成物(「CoMnNi含有組成物」と称する)を、硫酸などを用いて溶解させ、次に、Co及びNi以外の金属元素を除去してCoNi原料溶液を調製し、これを上記第1の実施形態又は第2の実施形態と同様に処理すればよい。
【0034】
より具体的には、図3に示すように、先ずは、正極材料、好ましくは正極活物質を主体とする組成物を硫酸などに溶解して原料溶液とすればよい。
この際、硫酸のほかに、塩酸、硝酸など公知の酸を用いて溶解してもよい。
【0035】
次に、溶液中のMnを分離除去すればよい。
Mnの分離方法としては、例えばpH1〜4、40〜80℃程度において、原料溶液にKMnO4や次亜塩素酸ナトリウムどの酸化剤を添加して、二酸化マンガン(MnO2)などとして沈殿させ、公知の固液分離法により、沈殿物を除去すればよい。
こうしてMnを分離除去した溶液には、例えばCo、Ni、Al、Cuなどがイオンとして溶解している。
【0036】
次に、溶液中のCuを分離除去すればよい。
Cuの分離方法としては、原料溶液に例えばFe粉などの還元剤を添加して、Cuメタルとして沈殿させ、公知の固液分離法により、沈殿物を除去すればよい。
この際、還元剤としては、Cuよりも卑な金属、例えばCo粉やAl箔なども用いることができる。
こうしてCuを分離除去した溶液には、例えばCo、Ni、Al、Feなどがイオンとして溶解している。
【0037】
次に、溶液中のAl及びFeを分離除去すればよい。
Alの分離方法としては、溶液にアルカリを添加してpHを3〜5に調整することで、液中のAlをAl(OH)3として沈殿させるAl沈殿処理1を行い、公知の固液分離法により、沈殿物を除去すれば、上記第1の実施形態又は第2の実施形態の原料として好ましいCoNi原料溶液を得ることができる。
この際、アルカリとしては、例えば水酸化ナトリウム(NaOH)、水酸化カリウム(KOH)、水酸化カルシウム(Ca(OH)2)、水酸化コバルト(Co(OH)2)等を用いることができる。
【0038】
さらに得られた溶液に、酸化剤としてH2O2を加えてFeを酸化させた後、例えばアルカリを添加してpHを5〜6に調整し、溶液中のFe及びAlを、それぞれFe(OH)3、Al(OH)3として沈殿させるAl沈殿処理2を行い、公知の固液分離法により、沈殿物を除去すれば、上記第1の実施形態又は第2の実施形態の原料として、より一層好ましいCoNi原料溶液を得ることができる。
この際、酸化剤としては、溶液中の2価の鉄を3価に酸化できるものであればよく、例えば過酸化水素のほかに、次亜塩素酸ナトリウムなどを挙げることができる。
また、pHを調整するアルカリとしては、例えば水酸化ナトリウム(NaOH)、水酸化カリウム(KOH)、水酸化カルシウム(Ca(OH)2)、水酸化コバルト(Co(OH)2)等を挙げることができる。
なお、Al沈殿処理2で得られた沈殿物中には、Co及びNiが若干含まれるため、再度Al沈殿処理1の処理液に戻して繰り返し処理することで、Co回収率をさらに高めることができる。
【0039】
そして、このようにして得られたCoNi原料溶液を、上記第1の実施形態又は第2の実施形態と同様に処理すればよい。
【0040】
第1〜第3の実施形態のようにして得られたCo高純度溶液は、必要に応じて溶液中の鉄(Fe)などCo以外の金属元素を公知の方法で除去した後、公知の方法で処理することにより、Co(メタル)として回収することができる。
例えば、Feを含んだCo高純度溶液に過酸化水素(H2O2)などの酸化剤を添加すると共に、酸化剤を添加した溶液のpHを、アルカリを添加して3〜5に調整することで、溶液中の鉄を水酸化鉄(Fe(OH)3)として沈殿除去することができる。
この際、酸化剤としては、溶液中の2価の鉄を3価に酸化できるものであればよく、例えば過酸化水素のほかに、次亜塩素酸ナトリウムなどを挙げることができる。
また、pHを調整するアルカリとしては、例えば水酸化ナトリウム(NaOH)、水酸化カリウム(KOH)、水酸化カルシウム(Ca(OH)2)、水酸化コバルト(Co(OH)2)等を挙げることができる。
その後、例えばCo高純度溶液に水酸化ナトリウムなどを添加して、液中のCo元素をCo(OH)2として析出させ、硫酸を用いて溶解させた後、電解採取してCo(メタル)として回収することができる。
【0041】
なお、第1〜第3の実施形態で説明した各工程のほかに、公知の他の工程や処理を追加することは任意に可能である。例えば、上記で説明した以外の成分が原料中に含まれる場合に、当該成分を除去するために公知の工程や処理を追加することなどを挙げることができるが、これに限定されるものでもない。
【0042】
<語句の説明>
本発明において、「X〜Y」(X,Yは任意の数字)と記載した場合、特にことわらない限り「X以上Y以下」の意と共に、「好ましくはXより大きい」或いは「好ましくはYより小さい」の意も包含するものである。
また、「X以上」(Xは任意の数字)と記載した場合、特にことわらない限り「好ましくはXより大きい」の意を包含し、「Y以下」(Yは任意の数字)と記載した場合、特にことわらない限り「好ましくはYより小さい」の意も包含するものである。
【実施例】
【0043】
以下、本発明に関する実施例及び比較例について説明する。但し、本発明は以下に説明する内容に限定されるものではない。
【0044】
<試験1>
Niに対してCo濃度が高いCoNi原料溶液を調製し、酸化還元電位(;ORP、参照電極:銀−飽和塩化銀電極)を所定値に調整すると共に、硫化剤としてのNaHSを添加して、ORPとNi濃度、Fe濃度、Co回収率との関係を検討した。
【0045】
(第1工程:CoS作製工程)
Coを34g/L、Niを3.7g/Lの割合で含有するCoNi原料溶液(pH4.0〜4.5、40℃)200mLに、NaHS2.65gを水40mLに溶かしたものを添加すると共に、鉄粉1gを添加し、30分間攪拌した後、孔径5μmのメンブレンフィルターによってろ過して、沈殿物としてのCoS組成物を回収した。
【0046】
(第2工程:Ni低減工程)
Coを21g/L、Niを21g/Lの割合で含有するCoNi原料溶液(pH4.0〜4.5、40℃)200mLに、鉄粉0.5g〜2.5gと第1工程で得られたCoS組成物全量とを添加して適宜ORPを変化させ、30分間攪拌した後、孔径5μmのメンブレンフィルターによってろ過して、ろ液中のNi濃度、ろ液中のFe濃度、さらにはCo濃度を測定し、CoS組成物からのCo回収率(%)を確認した。
【0047】
(考察)
図4に示されるように、鉄粉を添加しORPが下がると、Niが液中から分離され鉄粉が溶解していくことが確認された。このことから、式(4)のような反応が生じていると考えられる。
式(4) 3Ni+2+2CoS+Fe→Ni3S2+2Co2++Fe2+
【0048】
多くの試験を重ねた結果、Ni低減工程では、初期Ni濃度(21g/L)を半減するためには、ORPを−400mV以下、特に−450mV以下とすることが好ましいことが分かった。
また、Ni低減工程では、Ni濃度を4〜6g/Lまで低減するのが最も効率的であることが判明しており、かかるNi濃度にするためには、ORPを−500mV以下にすることが好ましいことも分かった。
【0049】
また、図4に示されるように、鉄粉の添加量を多くすると、ORPが−550mVに近づき、溶解Fe濃度が増大することが分かった。但し、過剰に鉄粉を添加しても、ORPは低下しないため、ORPを−550mVよりも低くすることは鉄粉の無駄である。また、鉄粉が大量に溶解し後工程の負荷が増大するため、適切でない。さらに、式(5)のような反応が考えられ、Coが再度CoSとしてロスするおそれもある。
式(5) Ni3S2 + 2Co+2 + 2Fe→3Ni+ 2CoS+ 2Fe2+
【0050】
さらに、ORP = −540mVのときのCoS組成物からのCo回収率は59%であり、Ni、Feの挙動から式(4)に従って添加したCoSからCoが液中へ回収されていると考えられる。
ろ過して得られた残渣の元素比は、S:Ni:Co =2:2.8:0.4であり、Ni3S2の組成に近い化合物ができていた。ORPがおおむね−400mV以上ではNi分離率が低くなる傾向が認められ、式(4)が十分進行せずにCo回収率が低いと考えられる。
以上の点から、第1工程及び第2工程のいずれにおいても、ORPを−400mV〜−550mVの範囲に調整して反応を進めるのが望ましいと考えることができる。
【0051】
<試験2>
Ni及びCoを含有するCoNi原料溶液(原料)に、鉄粉と、添加量を変えてNaHS(水硫化ナトリウム)とを添加し、CoS沈殿(CoS高含有組成物)を作製し、CoS高含有組成物中のNi量及びCo量を測定した。
【0052】
液温40℃、初期pH5のCoNi原料溶液(Co濃度:40g/L(68mmoL)、Ni濃度:1.0g/L(1.7mmoL))100mLに、Fe粉0.21g及びNaHS3.4〜6.8mmoLを添加して30分間反応させ、ろ過を行い、ろ液とCoS高含有組成物に分離し、CoS高含有組成物中のNi量及びCo量を算出した。
【0053】
CoS高含有組成物中のNi量及びCo量は次のようにして算出した。
この際、CoS高含有組成物中のNiはNi3S2になっていると仮定した。
・CoS高含有組成物中Ni量=CoNi原料溶液中Ni量 −ろ液中Ni量
・CoS高含有組成物中Ni量=NaHS添加量−CoS高含有組成物中Ni量×2÷3
【0054】
【表1】

【0055】
<試験3>
Ni及びCoを含有し、Ni量を変化させたCoNi原料溶液に、鉄粉、CoS及びNi3S2を添加し、Niを除去して、高濃度Niろ液と、高濃度Co組成物を得、Ni分離率とCo回収率を求めた。
【0056】
液温40℃、初期pH5のCoNi原料溶液(Co濃度:40g/L(68mmoL)、Ni濃度:4〜8g/L(6.8〜13.6mmoL))100mLに、Fe粉0.84g、CoS2.4〜5.8mmoL、Ni3S20.5mmoLを添加して30分間反応させ、ろ過を行い、高濃度Niろ液と、高濃度Co組成物を得、それぞれのNi量及びCo量を測定した。
【0057】
Ni分離率及びCo回収率を次のようにして算出した。
・分離したNi量=CoNi原料溶液中Ni量 −高濃度Niろ液中Ni量
・Ni分離率 = 分離したNi量 /CoNi原料溶液中Ni量×100
・Co回収率 = 100−Ni残渣中Co量 /高濃度Co組成物中Co量×100
【0058】
【表2】

【0059】
CoS添加量(1.8〜5.4mmoL)と初期Ni量(4〜8g/L)のmoL比を検討すると、CoS/初期Ni量が小さ過ぎるとNi分離率が不十分となる一方、CoS/初期Ni量が大き過ぎるとCo回収率が悪化することが分かった。
かかる観点から、CoS/初期Ni量は0.2〜0.8mol/molが好ましく、特に0.3〜0.7mol/mol、中でも特に0.4〜0.6mol/molであるのがより好ましいと考えることができる。
【特許請求の範囲】
【請求項1】
Ni及びCoを含有する溶液(「CoNi原料溶液」と称する)に還元剤及びCoSを加えて該CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素を硫化物として沈殿除去する一方、イオン化した状態のCo元素を含有するCo含有溶液を得ることを特徴とするCo含有溶液の製造方法。
【請求項2】
還元剤として鉄粉を使用することを特徴とする請求項1記載のCo含有溶液の製造方法。
【請求項3】
反応開始時の溶液中のNiに対して0.2〜0.8倍モル量のCoSを添加することを特徴とする請求項1又は2記載のCo含有溶液の製造方法。
【請求項4】
請求項1〜3の何れかに記載の製造方法によって得られたCo含有溶液に還元剤及び硫化剤を加えて該Co含有溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素をNi硫化物として沈殿させると共に、溶液中のCo元素の一部をCoSとして沈殿させ、残りのCo元素が溶解した溶液(「Co高純度溶液」と称する)を得ることを特徴とする、Co高純度溶液の製造方法。
【請求項5】
溶液中のNiに対して1〜10倍モル量の硫化剤(S換算)を添加することを特徴とする請求項4記載のCo含有溶液の製造方法。
【請求項6】
Ni及びCoを含有するCoNi原料溶液に還元剤及びCoSを加えて該CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素を硫化物として沈殿除去する一方、イオン化した状態のCo元素を含有するCo含有溶液を得るNi低減工程と、
前記Ni低減工程で得られたCo含有溶液に還元剤及び硫化剤を加えて該Co含有溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素をNi硫化物として沈殿させると共に、溶液中のCo元素の一部をCoSとして沈殿させた後、固液分離して、該Ni硫化物及び該CoSを含有するCoS含有組成物と、残りのCo元素が溶解したCo高純度溶液とを分離回収するCoS作製工程とを備え、
CoS作製工程で回収したCoS含有組成物を、次回以降のバッチのNi低減工程においてCoSとして添加するようにして、前記Ni低減工程及び前記CoS作製工程を繰り返すことを特徴とするCo高純度溶液の製造方法。
【請求項7】
CoNi原料溶液が、廃リチウムイオン電池の正極材料を溶解して得られたものであることを特徴とする請求項1〜6の何れかに記載のCo高純度溶液の製造方法。
【請求項8】
Ni、Mn及びCoを含有する組成物(「CoMnNi含有組成物」と称する)を酸に溶解してCoMnNi原料溶液を作製する溶解工程と、
前記CoMnNi原料溶液に酸化剤を加えて、該溶液中のMn元素をMn酸化物として沈殿除去して、Ni及びCoを含有するCoNi原料溶液を得るMn除去工程と、
前記Mn除去工程で得られたCoNi原料溶液に還元剤及びCoSを加えて該CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素を硫化物として沈殿除去する一方、イオン化した状態のCo元素を含有するCo含有溶液を得るNi低減工程と、
前記Ni低減工程で得られたCo含有溶液に還元剤及び硫化剤を加えて該Co含有溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素をNi硫化物として沈殿させると共に、溶液中のCo元素の一部をCoSとして沈殿させた後、固液分離して、該Ni硫化物及び該CoSを含有するCoS含有組成物と、残りのCo元素が溶解してなるCo高純度溶液とを分離回収するCoS作製工程とを備え、
CoS作製工程で回収したCoS含有組成物を、次回以降のバッチのNi低減工程においてCoSとして添加するようにして、前記Ni低減工程及び前記CoS作製工程を繰り返すことを特徴とするCo高純度溶液の製造方法。
【請求項1】
Ni及びCoを含有する溶液(「CoNi原料溶液」と称する)に還元剤及びCoSを加えて該CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素を硫化物として沈殿除去する一方、イオン化した状態のCo元素を含有するCo含有溶液を得ることを特徴とするCo含有溶液の製造方法。
【請求項2】
還元剤として鉄粉を使用することを特徴とする請求項1記載のCo含有溶液の製造方法。
【請求項3】
反応開始時の溶液中のNiに対して0.2〜0.8倍モル量のCoSを添加することを特徴とする請求項1又は2記載のCo含有溶液の製造方法。
【請求項4】
請求項1〜3の何れかに記載の製造方法によって得られたCo含有溶液に還元剤及び硫化剤を加えて該Co含有溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素をNi硫化物として沈殿させると共に、溶液中のCo元素の一部をCoSとして沈殿させ、残りのCo元素が溶解した溶液(「Co高純度溶液」と称する)を得ることを特徴とする、Co高純度溶液の製造方法。
【請求項5】
溶液中のNiに対して1〜10倍モル量の硫化剤(S換算)を添加することを特徴とする請求項4記載のCo含有溶液の製造方法。
【請求項6】
Ni及びCoを含有するCoNi原料溶液に還元剤及びCoSを加えて該CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素を硫化物として沈殿除去する一方、イオン化した状態のCo元素を含有するCo含有溶液を得るNi低減工程と、
前記Ni低減工程で得られたCo含有溶液に還元剤及び硫化剤を加えて該Co含有溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素をNi硫化物として沈殿させると共に、溶液中のCo元素の一部をCoSとして沈殿させた後、固液分離して、該Ni硫化物及び該CoSを含有するCoS含有組成物と、残りのCo元素が溶解したCo高純度溶液とを分離回収するCoS作製工程とを備え、
CoS作製工程で回収したCoS含有組成物を、次回以降のバッチのNi低減工程においてCoSとして添加するようにして、前記Ni低減工程及び前記CoS作製工程を繰り返すことを特徴とするCo高純度溶液の製造方法。
【請求項7】
CoNi原料溶液が、廃リチウムイオン電池の正極材料を溶解して得られたものであることを特徴とする請求項1〜6の何れかに記載のCo高純度溶液の製造方法。
【請求項8】
Ni、Mn及びCoを含有する組成物(「CoMnNi含有組成物」と称する)を酸に溶解してCoMnNi原料溶液を作製する溶解工程と、
前記CoMnNi原料溶液に酸化剤を加えて、該溶液中のMn元素をMn酸化物として沈殿除去して、Ni及びCoを含有するCoNi原料溶液を得るMn除去工程と、
前記Mn除去工程で得られたCoNi原料溶液に還元剤及びCoSを加えて該CoNi原料溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素を硫化物として沈殿除去する一方、イオン化した状態のCo元素を含有するCo含有溶液を得るNi低減工程と、
前記Ni低減工程で得られたCo含有溶液に還元剤及び硫化剤を加えて該Co含有溶液の酸化還元電位(参照電極:銀−飽和塩化銀電極)を−550mV〜−400mVに調整して、溶液中のNi元素をNi硫化物として沈殿させると共に、溶液中のCo元素の一部をCoSとして沈殿させた後、固液分離して、該Ni硫化物及び該CoSを含有するCoS含有組成物と、残りのCo元素が溶解してなるCo高純度溶液とを分離回収するCoS作製工程とを備え、
CoS作製工程で回収したCoS含有組成物を、次回以降のバッチのNi低減工程においてCoSとして添加するようにして、前記Ni低減工程及び前記CoS作製工程を繰り返すことを特徴とするCo高純度溶液の製造方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−1750(P2012−1750A)
【公開日】平成24年1月5日(2012.1.5)
【国際特許分類】
【出願番号】特願2010−135908(P2010−135908)
【出願日】平成22年6月15日(2010.6.15)
【出願人】(000006183)三井金属鉱業株式会社 (1,121)
【Fターム(参考)】
【公開日】平成24年1月5日(2012.1.5)
【国際特許分類】
【出願日】平成22年6月15日(2010.6.15)
【出願人】(000006183)三井金属鉱業株式会社 (1,121)
【Fターム(参考)】
[ Back to top ]

