DEXおよびGDF8を用いたスクリーニングアッセイ
本開示のある態様は、哺乳類細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させ、それによって、前記グルココルチコイド受容体および前記ミオスタチン受容体を活性化することを含む方法に関する。また、その方法を用いたスクリーニングアッセイも提供される。
【発明の詳細な説明】
【技術分野】
【0001】
相互参照
本特許出願は、2010年1月15日に出願された米国特許仮出願第61/295,631号の利益を主張するものであり、前記仮出願は、参照によりその全体が本明細書に組み込まれる。
【背景技術】
【0002】
筋肉量の全般的な低下または萎縮は、絶食や、例えば進行癌、腎不全、敗血症、悪液質、関節炎、骨粗鬆症、および糖尿病などの多くの疾患に対する特徴的な反応である。また、筋肉の委縮は、例えば不動化、筋負荷除去、脊髄損傷などの筋肉の不使用または除神経に起因し、萎縮は、例えば、限定はされないが、HIV、慢性心不全、慢性腎臓疾患、肝硬変、熱傷、骨粗鬆症、関節炎など多くの一般的な健康問題に、実質的に寄与する。筋委縮の原因にかかわらず、骨格筋萎縮は、タンパク質含量、線維径、筋出力、および疲労耐性の減少によって特徴付けられる
【0003】
萎縮の進行と関連する筋肉量の低下は、除神経、不動化、絶食に供された動物や筋消耗を誘導できる癌細胞を埋め込まれた動物で研究されてきた。代替的に、萎縮はグルココルチコイド投与を受けた動物で誘導することができる。これら動物において、筋消耗の程度を、筋重量または線維断面積の変化を記録する、さまざまな測定を用いること、および多数の動物を使って動力学的実験を実施することになどによって、判定することができる。筋肉量または動力学における顕著な変化を検出することは、多くの場合、長い待ち期間を必要とする。筋重量および線維断面積の測定には、煩雑な外科的処置、断面面積測定を必要とし、多くの場合、動物は犠牲になる。よって、そのような手順では、通常、多数の動物を必要とし、同じ動物で一連の筋肉を時間的に追跡することが不可能である。
【発明の概要】
【0004】
本開示のある態様は、萎縮反応を誘導する方法に関する。
【0005】
本開示のある態様は、哺乳類細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させ、それによって、グルココルチコイド受容体およびミオスタチン受容体を活性化することを含む方法に関する。また、その方法を含むスクリーニングアッセイも提供される。
【0006】
ひとつの実施形態では、哺乳類細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させ、それによってグルココルチコイド受容体およびミオスタチン受容体を活性化することを含む方法が提供される。ある特定の場合では、接触させることが、哺乳類細胞による萎縮反応を惹起させる。
【0007】
ある特定の場合では、接触させることは、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを哺乳類に投与することによって(すなわち、生体内において)行われうる。他の実施形態では、接触させることは、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドをインビトロにおいて培養細胞と接触させることによって行われうる。
【0008】
特定の実施形態では、グルココルチコイド受容体リガンドを、0.1μΜ〜100μΜの範囲の濃度で哺乳類細胞と接触させ、ミオスタチン受容体リガンドを、1ng/mL〜1000ng/mLの範囲の濃度で哺乳類細胞と接触させうる。グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを、同時または時を異にして、哺乳類細胞と接触させうる。
【0009】
特定の実施形態では、グルココルチコイド受容体リガンドはデキサメタゾンでありうる。ミオスタチン受容体リガンドは、ある特定の場合では、GDF8でありうる。
【0010】
また、スクリーニングアッセイが提供される。ある実施形態では、この方法は、細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドの存在下で候補薬剤と接触させること、ならびに、候補薬剤がグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドに応答して細胞の表現型を変えるか否かを決定することを含む。ある実施形態では、表現型は萎縮反応でありうる。
【0011】
決定することは、ある特定の場合では、細胞による遺伝子発現を測定することによって、例えば、アトロジーンプロモーターリポーター構築物を使って生産される、リポータータンパク質の生産を測定することによって行われうる。ある特定の場合では、アトロジーン遺伝子はMURF‐1またはアトロギン‐1でありうる。
【0012】
ある実施形態では、接触させることは、哺乳類に候補薬剤を投与すること、および哺乳類の筋組織における萎縮反応を評価することによって行われうる。ある特定の場合では、評価することは、筋組織における遺伝子発現を測定すること、および/または筋組織における筋肉量を測定することを含みうる。特定の実施形態では、哺乳類はラットでありうる。
【0013】
特定の実施形態では、接触させることは、候補薬剤をインビトロで培養した細胞と接触させること、および培養細胞による萎縮反応を評価することによって行われうる。この実施形態では、評価することは、培養細胞による遺伝子発現を測定することを含みうる。
【0014】
また、哺乳類細胞、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを含む組成物も提供される。
【図面の簡単な説明】
【0015】
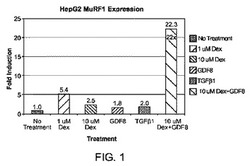
【図1】HepG2細胞において内在性MuRF1の発現がDexおよびGDF8処理によって相乗的に上方制御されることを示す棒グラフである。
【図2】HepG2細胞におけるMuRF1のmRNAがDexおよびGDF8での処理後4時間以内に誘導されることを示すグラフである。
【発明を実施するための形態】
【0016】
定義
「決定すること」、「測定すること」、「評価すること」、「判定すること」および「アッセイすること」という用語は、本明細書において互換可能に使用され、任意の形態の測定を指し、ある要素が存在するか否かを決定することを含む。これらの用語は、定量的および/または定性的な測定の両方を含む。判定することは、相対的または絶対的でありうる。「の存在を決定すること」とは、存在する何かの量を決定すること、および存在するか存在しないかを決定することを含む。
【0017】
「接触させること」という用語とは、引き合わせることまたはまとめることを意味する。したがって、2つのものを、例えば、互いに触れ合わせること、または同じ溶液中で混ぜ合わせることによって、引き合せる、またはまとめた場合、第一のものを第二のものと接触させる。特に指示がない限り、薬剤と接触される細胞は、生体内の細胞、すなわち、多細胞生物内、またはインビトロの細胞、すなわち培養細胞でありうる。
【0018】
「光学的に検出可能なタンパク質」という用語は、その発現をタンパク質によって作り出される光信号の存在によって検出することができるタンパク質を指す。光信号は、例えば、タンパク質が特定の光の波長によって励起でき、および検出可能な別の光の波長を放つ場合、タンパク質によって作られる。光信号は、例えば、タンパク質が光信号をもたらす反応を触媒するとき、タンパク質により作られる。蛍光タンパク質、発光タンパク質などが、光学的に検出可能なタンパク質の例である。
【0019】
「遺伝子」という用語は、プロモーター領域、コーディング配列および3’UTRからなる核酸配列を指す。
【0020】
「タンパク質」および「ポリペプチド」という用語は、本明細書において互換可能に使用される。
【0021】
「核酸」という用語は、DNA、RNA、一本鎖または二本鎖およびその化学的に修飾されたものを包含する。「核酸」および「ポリヌクレオチド」という用語は、本明細書において互換可能に使用される。
【0022】
「非ヒト」動物とは、ヒトでない種のあらゆる哺乳類を指す。
【0023】
「げっ歯類(rodent)」および「げっ歯類(rodents)」という用語は、そこから派生する、今後全世代のあらゆるすべての子孫を含む、系統学的な目であるげっ歯目(Rodentia)に属するすべてのものを指す。
【0024】
「ネズミ(murine)」という用語は、ラットおよびマウスを含む、ネズミ科(Muridae)に属するあらゆるすべてのものを指す。
【0025】
「作動可能に連結した」という用語は、一方の機能がもう一方によって影響されるような、単一の核酸断片の上での核酸配列のつながりを指す。例えば、プロモーターがコーディング配列の発現に影響できる(すなわち、コーディング配列がプロモーターの転写制御下にある)場合、プロモーターはコーディング配列に作動可能に連結している。同様に、IRESがコーディング配列に作動可能に連結する場合、IRESは、そのコーディング配列から転写されるmRNAの翻訳を提供する。「連結されていない」とは、つなげられた遺伝子要素が、お互い密接に関連せず、一方の機能が、もう一方に影響しないことを意味する。
【0026】
「ルシフェラーゼ」という用語は、その基質であるルシフェリンを酸化する際に光を放つ酵素を指す。ルシフェリンおよびルシフェラーゼという用語は、特定のルシフェリンまたはルシフェラーゼを指すものではない。それらは、基質および光を生ずる反応を触媒するその関連酵素(またはタンパク質)に対する総称である。
【0027】
プロモーターに関して「誘導された」という用語は、非誘導状態と比較して、下流の核酸の転写の開始およびすでに転写されている下流の核酸の転写の速度の増加の両方を包含することを意図している。
【0028】
遺伝子に関連して「内在性」という用語は、その遺伝子が細胞に生来あること、すなわち、その遺伝子が非改変細胞のゲノムの特定の座に存在することを示す。内在性遺伝子は、(天然に見出されるように)野生型細胞中のその座に存在する野生型遺伝子でありうる。内在性遺伝子は、野生型遺伝子とゲノムの同じ座に存在する場合、改変内在性遺伝子でありうる。そのような改変内在性遺伝子の例は、そこに外来核酸が挿入された遺伝子である。内在性遺伝子は、核ゲノム、ミトコンドリアゲノムなどに存在しうる。
【0029】
「構築物」という用語は、特定のヌクレオチド配列の発現の目的のために作り出されているか、または他の組み換えヌクレオチド配列の構築に使用されることになる組み換え核酸、一般に、組み換えDNAを指す。構築物は、ベクトルまたはゲノム中に存在してよい。
【0030】
「組み換え体」という用語は、宿主細胞で天然に存在しないポリヌクレオチドまたはポリペプチドを指す。組み換え分子は、天然では存在しない様式で連結された2つ以上の天然に存在する配列を含有しうる。組み換え細胞は、組み換えポリヌクレオチドまたはポリペプチドを含有する。
【0031】
「発現」という用語は、本明細書において使用する場合、遺伝子の核酸配列に基づいてポリペプチドが作られる過程を指す。その過程は、転写および翻訳の両方を含む。
【0032】
核酸配列を細胞に挿入するという文脈で、「導入された」という用語は、「トランスフェクション」または「形質転換」または「形質導入」を意味し、核酸配列が真核生物または原核生物の細胞に取り込まれることへの言及を含み、そこにおいて、核酸配列は、細胞のゲノム(例えば、染色体、プラスミド、プラスチドもしくはミトコンドリアDNA)に取り込まれるか、自律レプリコンに変換されるか、または一時的に発現される(例えば、トランスフェクションされたmRNA)。
【0033】
病態または疾患について「治療すること」または「治療」とは、対象に臨床的な恩恵を提供することを含み、(1)病態の少なくとも1つの症状を予防すること、すなわち、疾患にさらされうるか、疾患の素因があるが、その疾患の症状をまだ経験していないか、症状がでていない哺乳類において、臨床症状を著しく進行しないようにすること、(2)疾患を抑制すること、すなわち、疾患もしくはその症状の進行を止めるもしくは減らすこと、または、(3)疾患を和らげること、すなわち、疾患もしくはその臨床症状の軽減をもたらすことを含む。
【0034】
「候補薬剤」という用語は、それらの筋萎縮への効果をスクリーニングするために、本明細書において記載されている細胞または動物と混ぜ合わされる、オリゴヌクレオチド、ポリヌクレオチド、siRNA(shRNAとして投与されうる)、遺伝子産物、ポリペプチド、例えば大きさが最大2500ダルトン(Da)までの小分子、および薬理化合物を意味する。ある特定の場合では、候補薬剤は、転写されるおよび/または翻訳される核酸として送達され、例えば、RNAi分子またはポリペプチドなどの候補薬剤を提供しうる。
【0035】
「コーディング配列」という用語は、例えば、生体内において適切な調節要素の制御下で置かれた場合、一度転写および翻訳されて、タンパク質を作り出す核酸配列を指す。コーディング配列は、本明細書において使用する場合、連続したORFを有しうるか、またはイントロンもしくは非コーディング配列の存在により遮られたORFを有してもよい。この実施形態では、非コーディング配列は、mRNA前駆体から切り出され、成熟したmRNAを生成する。
【0036】
「筋細胞」という語句は、本明細書において使用する場合、例えば、骨格筋、平滑筋および心筋、これら筋細胞前駆体、筋前駆細胞の分化中に存在するあらゆる中間細胞、筋線維、筋細胞株などの、筋細胞のすべての種類を指す。筋細胞の例としては、筋芽細胞、筋管、ミオサイト、心筋細胞、骨格筋細胞、筋原線維などが挙げられる。筋細胞は、生体内(動物内)またはインビトロ(細胞培養中)に存在しうる。
【0037】
「アトロジーン遺伝子」という語句は、萎縮を誘導する刺激(例えば絶食など)に応答して検出可能な筋萎縮表現型、すなわち検出可能な筋肉量の低下、細胞の委縮などが観察できる前に、その発現が筋肉細胞において誘導される遺伝子を指す。ユビキチンタンパク質リガーゼをコードするMuRF1およびMAFbxが、アトロジーン遺伝子の例であるが、その他のものが存在する。筋萎縮を調節する分子機序は、例えば、Siu et al, Front. Biosci. 2009 14:432-52; Murton et al, Biochim. Biophys. Acta 2008 1782:730-43; Tisdale, Curr. Opin. Support Palliat. Care 2007 1:287-92; Zhang et al, Med. Hypotheses. 2007 69:310-21; Cao et al, Int. J. Biochem. Cell Biol. 2005 37:2088-97; Nader, Int. J. Biochem. Cell Biol. 2005 37:1985-96; Glass, Int. J. Biochem. Cell Biol. 2005 37:1974-84; Du et al, Int. J. Biochem. Cell Biol. 2005 37:2147-55; Franch et al, Curr. Opin. Clin. Nutr. Metab. Care. 2005 8:271-5; Glass, Trends Mol. Med. 2003 9:344-50;およびGlass, Nat. Cell Biol. 2003 5:87-90において、広範囲にわたって概説されている。
【0038】
「アトロジーンプロモーター」という語句は、検出可能な筋萎縮表現型、すなわち、検出可能な筋肉量の低下、細胞の委縮などが観察できる前に、萎縮を誘導する刺激(例えば、絶食など)にさらされた筋細胞において誘導されるプロモーターを指す。アトロジーンプロモーターは、野生型アトロジーン遺伝子のプロモーター、または例えば、野生型アトロジーンプロモーターに少なくとも95%同一である、その活性変異型でありうる。
【0039】
「萎縮反応」という用語は、定量的または定性的に観察可能な、細胞の筋委縮に関連する、あらゆる反応を指す。萎縮反応は、分子レベルで観察可能でありえ、例えば、筋肉に関連する内在性の遺伝子またはアトロジーンプロモーターなどの筋肉に関連するプロモーターによって駆動されるリポータータンパク質などの遺伝子発現の変化を含む。また、萎縮反応は、例えば細胞委縮、細胞死もしくは細胞染色の変化など、細胞表現型の変化を観察することによって細胞レベルで観察可能でありうるか、または、例えば筋肉の量、線維の大きさ、断面積などを観察することによって組織レベルで、観察可能でありうる。筋肉の量の減少は、通常、その筋肉の衰弱を伴う。萎縮反応は、例えば、インビトロ(培養細胞中)または生体内(多細胞動物内)で観察されうる。動物では、筋萎縮は、絶食、悪液質、糖尿病、デキサメタゾン治療、ミオスタチン治療、術後人工呼吸器装着、筋ジストロフィー、高齢者の筋肉減少症性の虚弱および 筋萎縮性側索硬化症、ならびに その他さまざまな筋消耗疾患、病態、および治療により引き起こされうる。
【0040】
「グルココルチコイド受容体」という用語は、GR、GCRおよびNR3C1(核内受容体サブファミリー3、グループC、メンバー1)としても知られており、コルチゾールおよびその他のグルココルチコイドが結合し、活性化する受容体である。グルココルチコイド受容体は、体内のほとんどすべての細胞に発現されており、成長、代謝、および免疫反応を制御する遺伝子を調節する。GRがグルココルチコイドに結合したとき、その主な作用機序は、遺伝子転写の調節である(Lu et al, Pharmacol. Rev. 2006 58: 782-97; Rhen et al, N. Engl. J. Med. 2005 353: 1711-23)。結合していない受容体は、細胞の細胞質に存在している。受容体がグルココルチコイドに結合した後、受容体‐グルココルチコイド複合体は、2つ経路のいずれかをとることができる。活性化されたGR複合体は、核内の抗炎症性のタンパク質の発現を上方制御するか、または、(他の転写因子が細胞質から核へ移行することを防ぐことによって)細胞質中の炎症促進性のタンパク質の発現を抑制するかである。ヒトGRタンパク質およびコードするmRNAは、それぞれ、ジェンバンクアクセション番号NP_000167およびNM_000176により提供される。マウスGRタンパク質およびコードするmRNAは、それぞれ、ジェンバンクアクセション番号NP_03219およびNM_008173により提供される。ヒトゲノムでは、GR遺伝子は、5番染色体上、142.64‐142.8Mbに位置している。グルココルチコイド受容体は、例えば、Kumar(Steroids 1999 64: 310-9)およびKumar(J. Steroid Biochem. Mol. Biol.) 2005 94: 383-94に記載されている。グルココルチコイド受容体に対するリガンドは、グルココルチコイド受容体を活性化する。デキサメタゾンは、グルココルチコイド受容体に対するリガンドの例ではあるが、以下で論じるように、他のものが多く存在する。
【0041】
「GDF8」は、ミオスタチン(MSTN)または増殖分化因子8としても知られており、筋肉の分化および成長を阻害する、分泌型のTGFタンパク質ファミリーに属するものである。ミオスタチンは、主として骨格筋細胞で作られ、血液中を循環し、アクチビンII型受容体と呼ばれる細胞に結合した受容体に結合することによって筋組織に作用する。GDF8の配列は、さまざまな生物について決定されている。ヒトGDF8タンパク質およびコードするmRNAは、それぞれ、ジェンバンクアクセション番号NP_005250およびNM_005259により提供される。マウスGDF8タンパク質およびコードするmRNAは、それぞれ、ジェンバンクアクセション番号NP_034964およびNM_010834により提供される。ヒトゲノムでは、GDF8遺伝子は、2番染色体上、190.63‐190.64Mbに位置している。マウスゲノムでは、GDF8遺伝子は、1番染色体上、53.12‐53.12Mbに位置している。GDF8は、例えば、McPherron(Nature 1997 387: 83-90)およびRodgers(Am. J. Physiol. Endocrinol. Metab. 2007 292: E371-2)に記載されている。
【0042】
「ミオスタチン受容体」という用語は、GDF8がそれを通して作用する受容体を指す。ミオスタチン受容体は、アクチビンIIA受容体(ActRIIA)およびアクチビンIIB受容体(ActRIIB)といったアクチビンII型受容体であると考えられている。オスタチン受容体は、Tsuchidaら(Endocr J. 2008 55:11-21)、Joulia‐Ekazaら(Curr. Opin. Pharmacol. 2007 7:310-5)、Walshら(Biochem. Soc. Trans. 2005 33:1513-7)およびTsuchidaら(Immune Endocr. Metabol. Disord. 2004 4:157-66)に概説されている。ミオスタチン受容体に対するリガンドは、その受容体を活性化する。GDF8は、ミオスタチン受容体に対するリガンドの例ではあるが、以下で論じるように、その他のものが多く存在する。
【0043】
例示的な実施形態の説明
本主題発明についてさらに説明する前に、本発明は記載された特定の実施形態に限定されるものではなく、それ自体は当然のことながら変わりうることが理解されるべきである。また、本発明の範囲は、添付の請求項によってのみ限定されるので、本明細書で使用されている専門用語も特定の実施形態のみを記述する目的のためのものであり、限定することを意図するものではないということも理解されるべきである。
【0044】
数値範囲が提示されている場合において、文章に明確な表記が無い場合は下限の単位の1/10まで、その範囲の上限と下限の間のそれぞれ介在する数値および規定された範囲にあるその他のいかなる規定値または介在する値も本発明に包含されると解される。
【0045】
特に規定されない限り、本明細書において用いられるすべての技術および科学用語は、本発明が属する分野の当業者に普通に理解されるものと同じ意味を有する。本明細書において記載されるものと類似または等価のいかなる方法および材料も本発明の実施または試験に用いることができるが、好適な方法および材料をこれから記載する。本明細書において言及したすべての刊行物は参照により本明細書に組み込まれ、引用された刊行物と関連して方法および/または材料を開示および記載する。
【0046】
本明細書および添付の請求項で使用する場合、「a」、「an」および「the」といった単数形は、文章に明確な記載がない限り、複数対象も含むことに留意すべきである。よって、例えば、「a cell(細胞)」という言及は細胞の複数形を含み、「a candidate agent(候補薬剤)」という言及は一つ以上の候補薬剤および当業者に公知のそれと同等のものを含む、等が挙げられる。さらに、請求項はいかなる随意的な要素も排除するよう書かれうることに留意すべきである。したがって、本明細書は、「単なる」、「唯一の」などのような排他的な専門用語を、請求要素の列挙と関連して使用すること、または「否定的な」制限を使用することについて、先の記載としての役割を果たすものとして意図されている。
【0047】
本明細書において議論されている刊行物は、本出願の出願日前に開示されたもののみ提示している。本明細書における一切の内容は、本発明が先行発明を理由としてこうした刊行物に先行する権利を与えられないことを容認するものと解釈されるべきではない。さらに、提供された刊行物の日付は、実際の刊行日とは異なる可能性があり、個別に確認が必要である可能性がある。
【0048】
本明細書に引用されたすべての刊行物および特許は、個々の刊行物または特許が、各々、参照により組み込まれることが具体的かつ個々に記されたかのように、本明細書に参照により組み込まれ、引用された刊行物と関連して、方法および/または材料を開示および説明するために本明細書に参照により組み込まれる。任意の刊行物の引用は、提出日に先立つその開示のためであり、本発明が先行発明を理由としてこうした刊行物に先行する権利を与えられないことを容認するものと解釈されるべきではない。さらに、提供された刊行物の日付は、実際の刊行日とは異なる可能性があり、個別に確認が必要である可能性がある。
【0049】
本開示を読めば当業者に明らかとなるように、本明細書において記載および例示される個別の実施形態は、それぞれ、個別の構成要素および特徴を有し、本発明の範囲または精神から逸脱することなく、その他の幾つかの実施形態のいずれかの特徴から容易に区別または組み合わせることができる。引用される任意の方法は、引用される事象の順序、または論理的に可能なその他の順序で実行できる。
【0050】
上で述べたように、一般に、哺乳類細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させること含む方法。また、その方法を含むスクリーニングアッセイも提供される。以下の説明では、最初に、グルココルチコイドおよびミオスタチン受容体リガンドについて説明し、続いて、それらリガンド用いられうる方法を説明する。
【0051】
グルココルチコイド受容体リガンド
主題方法に用いられるグルココルチコイド受容体リガンドは、グルココルチコイド受容体に結合し、活性化するあらゆる化合物でありうる。グルココルチコイド受容体の活性化が下流の反応を惹起させる機序は公知である。一般的に言って、リガンドの受容体への結合に際し、受容体リガンド複合体は、細胞核へ移行し、そこで、標的遺伝子のプロモーター領域中のグルココルチコイド応答エレメント(GRE)に結合し、遺伝子発現の調節をもたらす。この過程は、例えば、Newton(Thorax 2000 55: 603-13)に概説されている。グルココルチコイド受容体の活性化は、NF‐κBおよびAP‐1の転写を刺激する能力を阻害する(例えば、Jonat, Cell 1990 62, 1189; Yang- Yen, Cell 1990 62, 1205; Diamond, Science 1990 249, 1266;およびCaldenhoven, Mol. Endocrinol. 1995 9, 401を参照のこと)。
【0052】
グルココルチコイド受容体リガンドは、ステロイド性または非ステロイド性でありうる。グルココルチコイド受容体リガンドのさまざまな例示的な種類は、次の米国特許出願第20090227548号、同第20090170898号、同第20090137655号、同第20090105292号、同第20090075995号、同第20090074675号、同第20080090792号、同第20070281959号、同第20080076795号、同第20070281928号および同第20070149577号に記載され、前記刊行物は、そこに記載されたグルココルチコイド受容体リガンドの開示に関し、参照により組み込まれる。
【0053】
幾つかの実施形態では、グルココルチコイド受容体リガンドは、その塩、溶媒和物および水和物を含む、デキサメタゾン、ベタメタゾン、コルチゾン、ヒドロコルチゾン、メチルプレドニゾロン、プレドニゾロン、トリアムシノロン、酢酸フルドロコルチゾン、トリアムシノロン、フルオコルトロン、クロベタゾール、ジフロラゾン、モメタゾン、デスオキシメタゾンなどのグルココルチコイドでありうる。特定の実施形態では、Begg(Med J. Aust. 1987 146:37-41)によって概説されているように、グルココルチコイド受容体リガンドは、ヒドロコルチゾンの効力の少なくとも10倍の効力を有しうる。
【0054】
グルココルチコイドおよびそれらの作用機序は以下の書物:Glucocorticoid Hormone: Mechanisms of Action by Y. Sakamoto (Editor) Publisher: Springer- Verlag (June 1986); Glucocorticoid Action: Basic and Clinical Implications (Hardcover) by Tomoshige Kino (Editor), Publisher: New York Academy of Sciences; second edition (Aug 30 2004); Glucocorticoids by Goulding (Author) Publisher: Springer/Sci-Tech/Trade; 1 edition (May 11 2001);および Recent Advances in Glucocorticoid Receptor Action by A. Cato (Editor), Publisher: Springer; 1 edition (Nov 11 2002)で概説され、それらは、参照によりそれら全体が組み込まれる。
【0055】
グルココルチコイド受容体リガンドの投与量および投与経路は公知である。
【0056】
ミオスタチン受容体リガンド
主題方法に用いられるミオスタチン受容体リガンドはミオスタチン受容体に結合し、活性化するあらゆる化合物でありうる。そのような化合物としては、例えば、以下のNCBIアクセション番号で規定されるGDF8ペプチドを含む、その活性変異体およびペプチド模倣変異体を含むペプチドおよび非ペプチド性化合物が挙げられる:GI:9506907(ラット(Rattus norvegicus))、GI:6754752(マウス(Mus musculus))、GI:4885259(ホモサピエンス(Homo sapiens))、GI:48314966(ウシ(Bos Taurus))、GI:260809331(ナメクジウオ(Branchiostoma floridae))、GI:51783959(イノシシ(Sus scrofa))、GI:47825371(ニワトリ(Gallus gallus))、GI:18858751(ゼブラフィッシュ(Danio rerio))、GI:121583758(アカゲザル(Macaca mulatta))、GI:50950173(イヌ(Canis lupus familiaris))、GI:120952608(チンパンジー(Pan troglodytes))、GI:198417205(ユウレイボヤ(Ciona intestinalis))およびGI:57164247(ヒツジ(Ovis aries))。ヒトGDF8の構造は、NCBIの構造データベースのMMDB ID:75808に記されている。ある特定の場合では、本明細書において使用するミオスタチン受容体リガンドは、野生型ミオスタチン受容体リガンドに、少なくとも50%と同一、例えば、少なくとも60%同一、少なくとも70%同一、少なくとも80%同一、少なくとも85%同一、少なくとも90%同一、少なくとも95%同一、または少なくとも98%同一であるアミノ酸配列を有しうる。
【0057】
ミオスタチン受容体リガンドを同定するアッセイは公知であり、米国特許出願第20090220491号、同第20090098114号、同第20070149458号、同第20060216279号、同第20050272028号および同第20040248121号に記載されているものが挙げられ、前記刊行物は、それらアッセイに関し、参照により組み込まれる。
【0058】
ミオスタチン受容体を活性化することによる筋肉変性におけるGDF8の役割は、例えば、Tsuchida(Expert Opin. Biol. Ther. 2006 6:147-54)、Wagner(Curr. Opin. Rheumatol. 2005 17:720-4)、Tsuchida(Curr. Drug Targets Immune Endocr. Metabol. Disord. 2004 4:157-66)、およびBellinge(Anim. Genet. 2005 36:1-6)など、さまざまな出版物で概説されており、前記刊行物は、参照により本明細書に組み込まれる。
【0059】
ミオスタチン受容体リガンドの投与量および投与経路は公知である。
【0060】
方法
上記のグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドは、生体内で(すなわち、化合物を動物に投与することにより)、またはインビトロにおいて(すなわち、化合物類を培養で育てられた細胞と接触させることにより)、哺乳類細胞と接触させうる。前記化合物を、同時に細胞と接触させてもよく(例えば、化合物を細胞と接触させる前に、化合物を混ぜ合わせてよい)、または化合物を別々に、同時または時を異にして、細胞と混ぜ合わせてもよい。例示的なインビトロおよび生体内における方法を以下に述べる。
【0061】
インビトロにおける方法では、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドは各々、同じ化合物を単独で使って単離した細胞からの反応をもたらすのに十分である濃度に一致した濃度で、培養哺乳類細胞と独立して接触させてよく、これは当該技術分野において公知である。例示的な有効濃度は、上で引用された参考文献およびその他多くものに記載されており、一般に約0.1〜1000μg/mLの範囲であるが、ある特定の状況では、この範囲外の濃度が用いられうる。一般的に言って、接触させることは、化合物を培地と混合することによって行われる。
【0062】
アッセイで用いられる培養細胞は、グルココルチコイド受容体およびミオスタチン受容体を発現するあらゆる細胞でありうる。細胞が両受容体を内在的に発現しない場合、受容体を、組み換え手段を使って発現してもよい。限定はされないが、サル腎細胞(COS細胞)、SV40によって形質転換したサル腎臓CVI細胞(COS‐7,ATCC CRL165 1);ヒト胚腎細胞(HEK‐293,Graham et al. J. Gen Virol. 36:59 (1977));ベビーハムスター腎細胞(BHK,ATCC CCL 10);チャイニーズハムスター卵巣細胞(CHO,Urlaub and Chasin, Proc. Natl. Acad. Sci. (USA) 77:4216, (1980));マウスセルトリ細胞(TM4,Mather, Biol. Reprod. 23:243-251 (1980));サル腎細胞(CVI ATCC CCL 70);アフリカミドリザル腎細胞(VERO‐76,ATCC CRL‐1587);ヒト子宮頸癌細胞(HELA,ATCC CCL2);イヌ腎細胞(MDCK,ATCC CCL34);バッファローラット肝細胞(BRL 3A,ATCC CRL1442);ヒト肺細胞(W138,ATCC CCL 75);ヒト肝細胞(hep G2,HB 8065);マウス乳房腫瘍(MMT 060562,ATCC CCL 51);TRI細胞(Mather et al., Annals N. Y. Acad. Sci 383:44-68 (1982));NIH/3T3細胞(ATCC CRL‐1658);およびマウスL細胞(ATCC CCL‐1)を含む、例えば培養哺乳類細胞などの、あらゆる動物からの培養細胞が用いられうる。さらなる細胞株は、当業者に明らかになるであろう。幅広い種類の細胞株が、アメリカン・タイプ・カルチャー・コレクション,10801 University Boulevard, Manassas, Va. 20110‐2209から入手可能である。特定の実施形態では、培養細胞は、例えば、骨格筋、平滑筋または心筋由来の培養細胞などの培養ミオサイトでありうる。例示的な実施形態では、培養細胞は、例えば、HL‐1細胞(Claycomb PNAS 1998 95: 2979-2984)、BWEMまたはCLEM細胞(Enelmann et al Molecular and Cellular Biochemistry 1996 157)、L6筋芽細胞またはC2C12、SM3、Aza2、BC3H‐1、BD1、BD2、BD10、TD33、TD38、TD45、TGI、C2、またはAT‐1細胞でありうる。そのような細胞を培養する方法は公知である。
【0063】
培養細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させることは、細胞のグルココルチコイド受容体およびミオスタチン受容体を活性化し、それによって 細胞の表現型を変化させる。ある実施形態では、前記方法は、細胞が化合物がない場合には生じない表現型を示すのに十分な時間、化合物の存在下で細胞を維持することを含む。ある特定の場合では、前記表現型は、細胞増殖表現型、細胞死(アポトーシス)表現型、細胞の形状もしくはサイズの変化、(例えば、炎症性メディエーターの生産の変化として観察される)炎症反応、染色パターンの変化または遺伝子発現の変化でありうる。特定の実施形態では、前記表現型は、上で定義されたように萎縮反応でありうる。
【0064】
ある特定の場合では、細胞は、細胞における遺伝子発現を評価するためのリポーター系を含有しうる。例えば、細胞は、プロモーター(例えば、筋細胞発達または筋消耗の間に誘導または抑制されるプロモーター)に作動可能に連結された、リポータータンパク質(例えば、ルシフェラーゼまたはGFP)のコーディング配列を含有してよく、そこで、細胞を化合物と接触させることは、リポータータンパク質の発現を誘導または抑制する。ある実施形態では、前記プロモーターは、アトロジーンプロモーターでありえ、細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させることは、リポータータンパク質の生産を誘導する。特定の実施形態では、例えば、リポーター発現が内在性プロモーターに作動可能に連結されるように、リポータータンパク質のコーディング配列を内在性遺伝子(例えば、アトロジーン遺伝子)に挿入することによって、または、プロモーターおよびリポーターをコードする配列の両方を含む組み換え核酸を細胞のゲノムに挿入することによって、細胞のゲノムを変更しうる。
【0065】
生体内における方法では、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを、同じ化合物を単独で使って動物からの反応をもたらすのに十分である濃度に一致した個々の濃度で化合物を投与することによって哺乳類細胞と接触させてよく、これは当該技術分野において公知である。例示的な有効濃度は、上で引用された参考文献およびその他多くものに記載されており、一般には、個別に、1投与につき動物1キログラム当たり約0.01〜500ミリグラムの化合物の範囲、例えば、少なくとも約0.1〜100ミリグラムの薬剤/キログラムなどであるが、ある特定の状況では、この範囲外の濃度が用いられうる。一般的に言って、接触させることは、化合物を動物に、例えば経口で、または(静脈内もしくは筋肉内でありうる)注入によって、局所的または全身的に投与することによって行われる。アッセイに用いられる動物は、あらゆる動物、特に、げっ歯類(例えばマウスまたはラット)などの哺乳類でありうる。
【0066】
グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを動物に投与することは、動物の細胞のグルココルチコイド受容体およびミオスタチン受容体を活性化し、それによって、動物の表現型を変化させる。ある実施形態では、前記化合物を投与した後、前記方法は、動物が化合物がない場合には生じない表現型を呈するのに十分な時間、化合物の存在下で動物を維持することを含みうる。ある特定の場合では、表現型は、癌に関連する表現型(細胞増殖、細胞死、もしくは転移に関連する表現型)、または炎症性反応により媒介される表現型(例えば、攻撃誘発に対する免疫系の応答における変化)でありうる。特定の実施形態では、表現型は、先に定義したように、萎縮反応でもよく、そこで、ある実施形態では、筋肉量の変化、筋肉断面の変化、またはミオシン合成の下方制御、ミオシン分解経路の活性化(例えば、ATPに依存するユビキチン/プロテアソーム経路の活性化またはE3ユビキチンリガーゼの誘導を介する)として観察されうる。
【0067】
ある特定の場合では、細胞は、動物における遺伝子発現を評価するための組み換えリポーター系を含有しうる。例えば、動物は、プロモーター(例えば、筋細胞発達または筋消耗の間に誘導または抑制されるプロモーター)に作動可能に連結された、リポータータンパク質(例えば、ルシフェラーゼまたはGFP)のコーディング配列を含有してよく、そこで、細胞を化合物と接触させることは、リポータータンパク質の発現を誘導または抑制する。ある実施形態では、前記プロモーターは、アトロジーンプロモーターでもよく、動物にグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを投与することは、リポータータンパク質の生産を誘導する。特定の実施形態では、例えば、リポーター発現が内在性プロモーターに作動可能に連結されるように、リポータータンパク質のコーディング配列を内在性遺伝子(例えば、アトロジーン遺伝子)に挿入することによって、または、プロモーターおよびリポーターをコードする配列の両方を含む組み換え核酸を動物のゲノムに挿入することによって、細胞のゲノムを変更しうる。
【0068】
スクリーニングアッセイ
上記方法を、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドによって誘導される表現型を調節する薬剤を同定するためのスクリーニングアッセイに利用しうる。特定の実施形態では、前記方法を、筋細胞萎縮の惹起を調節する薬剤を同定するために利用しうる。例示的実施形態では、前記方法は、対象細胞(すなわち、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させる細胞で、その細胞はインビトロまたは生体内に存在できる)を候補薬剤と接触させること、ならびに、もしあれば、候補薬剤のグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドによって誘導される表現型への効果を決定することを含む。特定の実施形態では、表現型を、リポータータンパク質の生産を評価することによって判定しうる。幾つかの実施形態では、前記方法は、細胞を(生体内またはインビトロにおいて)グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドの存在下で候補薬剤と接触させること、ならびに、候補薬剤が、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドに応答して細胞の表現型を変えるかどうかを決定することを含む。
【0069】
「薬剤」という用語は、本明細書において使用する場合、例えばタンパク質または非タンパク質の有機または無機の医薬などのあらゆる分子を表す。特に興味深い薬剤は、筋細胞萎縮の惹起を阻害するようなものである。複数のアッセイを、異なる薬剤濃度で平行して行い、そのさまざまな濃度に対する異なる反応を得る。これらの濃度のうちの1つは、すなわちゼロ濃度または検出のレベル未満で、陰性対照としての役割をする。
【0070】
「候補薬剤」、「試験薬剤」、「薬剤」、「物質」および「化合物」という用語は、本明細書において互換可能に使用される。候補薬剤は、多数の化学的な種類、典型的には、合成、半合成または天然に存在する、無機または有機分子を包含する。候補薬剤としては、合成または天然化合物の大きなライブラリー中に見出されるようなものが挙げられる。例えば、合成化合物ライブライリーは、Maybridge Chemical Co.(Trevillet,Cornwall,UK)、ComGenex(South San Francisco,CA)、およびMicroSource(New Milford,CT)から市販されている。あるいは、細菌、真菌、植物、および動物抽出物の形で、天然化合物ライブラリーは、Pan Labs(Bothell,WA)から入手可能であり、容易に作製される。
【0071】
候補薬剤は、50超約2,500Da未満の分子量をもつ小さい有機または無機化合物でありうる。候補薬剤は、タンパク質との構造的相互作用、特に水素結合に必要な官能基を含み、少なくともアミン基、カルボニル基、ヒドロキシル基またはカルボキシル基を含み、少なくとも2つ化学官能基を含有しうる。候補薬剤は、多くの場合、環式の炭素もしくは複素環式構造および/または芳香族、もしくは1つ以上の上記官能基で置換された多環芳香族構造を含みうる。また、候補薬剤は、例えばペプチド、糖、脂肪酸、ステロイド、プリン、ピリミジン、誘導体、構造類似体またはその組み合わせなど生体分子中にも見出される。
【0072】
候補薬剤は、例えば合成または天然化合物のなど広い種類の源から入手できる。例えば、多数の手段は、例えばランダムされたオリゴペプチドの発現など、広く多様な有機化合物および生体分子のランダムおよび指向性合成に利用可能である。あるいは、細菌、真菌、植物、および動物抽出物の形で、天然化合物ライブラリーは、入手可能で、容易に作製される。加えて、天然または合成的に作製されたライブラリーおよび化合物は、従来の化学的、物理的、および生化学的手段を通して容易に改変され、コンビナトリアルライブラリーの作製に使用されうる。公知の薬物を、アシル化、アルキル化、エステル化、アミド化などの指向性またはランダム学修飾に供し、構造類似体を作製しうる。また、新しい潜在的治療薬剤は、合理的な薬物設計またはコンピューターモデリングなどの方法を使って創出されうる。
【0073】
スクリーニングは、公知の薬理活性化合物およびその化学的類似体、または合理的な薬物設計を通して創出されたものなどの未知の性質をもつ新しい薬剤を対象にしてもよい。
【0074】
表現型を調節する薬剤は、薬剤にさらされていない対照と比較して、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、または少なくとも90%以上、表現型を減少させる。
【0075】
表現型を調節する薬剤を、アシル化、アルキル化、エステル化、アミド化などの、指向性またはランダムおよび/もしくは指向性化学修飾に供し、構造類似体を作製しうる。そのような構造類似体としては、生物学的利用能を増加させ、および/または細胞毒性を減少させるようなものが挙げられる。当業者であれば、容易に、多種多様な構造類似体を想定および作成でき、それらを、増加した生物学的利用能および/または減少した細胞毒性などの所望の性質などについて試験できる。
【0076】
特定の実施形態では、筋細胞萎縮の惹起を調節する薬剤を同定するインビトロにおける方法が提供される。この方法は、一般に、筋細胞萎縮の惹起に際し、リポータータンパク質を作り出す細胞を、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドの存在下で、候補薬剤と接触させること、ならびに、候補薬剤が、候補薬剤で処理していない対照細胞と比較して、細胞によるリポータータンパク質の生産を減少させるか否かを決定することを含む。
【0077】
細胞を候補薬剤と接触させる前、後、または同時に、細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させうる。
【0078】
リポータータンパク質の生産を、細胞を表現型を誘導する条件に供する前および後のいろいろな時点で監視しうる。同様に、候補薬剤の効果を、表現型を幾つかの時点で測定することによって決定しうる。例えば、細胞を候補薬剤に接触させた、5分後、30分後、1時間後、2時間後、4時間後、8時間後、12時間後、24時間後、36時間後、48時間後、72時間後、120時間後、1週間後、2週間後、および最長1ヶ月後に、リポータータンパク質の生産を測定しうる。
【0079】
筋細胞萎縮の惹起を調節する薬剤を同定する生体内スクリーニングアッセイが提供される。この方法は、一般に、筋細胞萎縮の惹起に際し、リポータータンパク質を作り出す動物に、候補薬剤、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを投与すること、ならびに、候補薬剤が、候補薬剤を投与していない対照動物と比較して、前記動物によるリポータータンパク質の生産を減少させるかどうかを決定することを含む。
【0080】
生体内の系において作り出されるあらゆる表現型を、候補薬剤を動物に投与する前および後のいろいろな時点で監視しうる。例えば、候補薬剤の効果を、リポータータンパク質を幾つかの時点で測定することによって決定しうる。例えば、細胞を候補薬剤に接触させた、0時間後、12時間後、24時間後、36時間後、48時間後、72時間後、120時間後、1週間後、2週間後、1ヶ月後、2ヶ月後、3ヶ月後、5ヶ月後などに、リポータータンパク質の生産を測定しうる。ある実施形態では、リポータータンパク質の測定は、アトロジーン遺伝子の発現および細胞/線維の大きさ、形態、筋力などを測定することによって、称賛されうる。
【0081】
上記方法によって同定したあらゆる薬剤を、動物モデルでさらに試験しうる。例えば、1つの実施形態では、動物を、萎縮誘導刺激に供し、候補薬剤と接触させうる。萎縮を誘導することが知られている多くの状況を、萎縮として使用しうる。動物において、筋細胞萎縮は、限定はされないが、絶食、加齢、糖尿病、進行癌、腎不全、敗血症、悪液質、関節炎、骨粗鬆症、糖尿病、除神経、不動化、筋負荷除去、脊髄損傷、グルココルチコイド処理などを含む、多くの刺激によって惹起されうる。インビトロにおいて、筋細胞萎縮は、絶食、細胞の例えば糖質コルチコイド、グルココルチコイドまたはウイルスへの曝露によって惹起されうる。
【0082】
また、哺乳類細胞、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを含む組成物も提供される。組成物中に存在しうる細胞およびリガンドは、上でより詳細に論じられている。
【0083】
有用性
本明細書において提示された生体内およびインビトロアッセイは、筋細胞萎縮を減少させるものを含む、さまざまな表現型を調節する薬剤を同定および試験する方法を提供する。これらの薬剤を、筋細胞萎縮をもつ対象の治療に使用しうる製剤中に使用してよい。加えて、これら薬剤を、筋細胞萎縮を生じるリスクのある対象に、例えば、人工呼吸器を装着することになる手術の前などに、予防的に与えうる。本明細書において提供した方法によって同定された薬剤から恩恵をうけうる対象は、さまざまな刺激によって引き起こされる筋細胞萎縮を有しうるか、またはその危険にさらされうる。これらの刺激としては、絶食、加齢、進行癌、腎不全、敗血症、悪液質、関節炎、骨粗鬆症、および糖尿病が挙げられるが、これらに限定されない。また、筋肉の委縮は、例えば不動化、筋負荷除去、脊髄損傷などの筋肉の不使用または除神経の結果でありうる。ある実施形態では、対象は、HIV、慢性心不全、慢性腎疾患、肝硬変、熱傷、骨粗鬆症、関節炎など、筋細胞萎縮によって悪化する健康状態の問題を有しうる。筋細胞萎縮を阻害する候補化合物をスクリーニングするための細胞および動物モデルを使った方法を使用し、筋細胞萎縮をもつ対象における筋肉のタンパク質含量、線維径、筋出力および疲労耐性を改善する薬剤を同定しうる。
【実施例】
【0084】
以下の実施例は、本発明のある特定の実施形態および態様を実証およびさらに例示するために提供されるものであり、その範囲を限定するものとして解釈してはならない。
【0085】
実施例1
培養したHepG2細胞を、1μΜ デキサメタゾン、10μΜ デキサメタゾン、100ng/mL GDF8、100ng/mL TGFβ1、および10μΜ デキサメタゾン+100ng/mL GDF8に曝露し、内在性MuRF1の発現をTaqman RT‐PCRアッセイを使ったRT‐PCRにより評価した。結果を図1に示す。内在性MuRF1は無処理対照より22倍誘導された。10μΜ デキサメタゾンは、内在性MuRF1の発現を無処理対照より2.5倍誘導し、100ng/mL GDF8は、内在性MuRF1の発現を無処理対照より1.8倍誘導した。デキサメタゾンおよびGDF8の両方を併用した処理は、デキサメタゾンおよびGDF8の個々によるMuRF1の誘導を優に上回ったMuRF1の誘導を引き起こしたことから、内因性MuRF1発現は、デキサメタゾンおよびGDF8により相乗的に上方制御される。
【0086】
図2は、HepG2細胞を、10μΜ デキサメタゾン、および100ng/mL GDF8の両方で処理した後のMuRF1誘導の経時変化を示す。対照と比較して、MuRF1誘導は、処理後4時間で観察できる。
【技術分野】
【0001】
相互参照
本特許出願は、2010年1月15日に出願された米国特許仮出願第61/295,631号の利益を主張するものであり、前記仮出願は、参照によりその全体が本明細書に組み込まれる。
【背景技術】
【0002】
筋肉量の全般的な低下または萎縮は、絶食や、例えば進行癌、腎不全、敗血症、悪液質、関節炎、骨粗鬆症、および糖尿病などの多くの疾患に対する特徴的な反応である。また、筋肉の委縮は、例えば不動化、筋負荷除去、脊髄損傷などの筋肉の不使用または除神経に起因し、萎縮は、例えば、限定はされないが、HIV、慢性心不全、慢性腎臓疾患、肝硬変、熱傷、骨粗鬆症、関節炎など多くの一般的な健康問題に、実質的に寄与する。筋委縮の原因にかかわらず、骨格筋萎縮は、タンパク質含量、線維径、筋出力、および疲労耐性の減少によって特徴付けられる
【0003】
萎縮の進行と関連する筋肉量の低下は、除神経、不動化、絶食に供された動物や筋消耗を誘導できる癌細胞を埋め込まれた動物で研究されてきた。代替的に、萎縮はグルココルチコイド投与を受けた動物で誘導することができる。これら動物において、筋消耗の程度を、筋重量または線維断面積の変化を記録する、さまざまな測定を用いること、および多数の動物を使って動力学的実験を実施することになどによって、判定することができる。筋肉量または動力学における顕著な変化を検出することは、多くの場合、長い待ち期間を必要とする。筋重量および線維断面積の測定には、煩雑な外科的処置、断面面積測定を必要とし、多くの場合、動物は犠牲になる。よって、そのような手順では、通常、多数の動物を必要とし、同じ動物で一連の筋肉を時間的に追跡することが不可能である。
【発明の概要】
【0004】
本開示のある態様は、萎縮反応を誘導する方法に関する。
【0005】
本開示のある態様は、哺乳類細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させ、それによって、グルココルチコイド受容体およびミオスタチン受容体を活性化することを含む方法に関する。また、その方法を含むスクリーニングアッセイも提供される。
【0006】
ひとつの実施形態では、哺乳類細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させ、それによってグルココルチコイド受容体およびミオスタチン受容体を活性化することを含む方法が提供される。ある特定の場合では、接触させることが、哺乳類細胞による萎縮反応を惹起させる。
【0007】
ある特定の場合では、接触させることは、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを哺乳類に投与することによって(すなわち、生体内において)行われうる。他の実施形態では、接触させることは、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドをインビトロにおいて培養細胞と接触させることによって行われうる。
【0008】
特定の実施形態では、グルココルチコイド受容体リガンドを、0.1μΜ〜100μΜの範囲の濃度で哺乳類細胞と接触させ、ミオスタチン受容体リガンドを、1ng/mL〜1000ng/mLの範囲の濃度で哺乳類細胞と接触させうる。グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを、同時または時を異にして、哺乳類細胞と接触させうる。
【0009】
特定の実施形態では、グルココルチコイド受容体リガンドはデキサメタゾンでありうる。ミオスタチン受容体リガンドは、ある特定の場合では、GDF8でありうる。
【0010】
また、スクリーニングアッセイが提供される。ある実施形態では、この方法は、細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドの存在下で候補薬剤と接触させること、ならびに、候補薬剤がグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドに応答して細胞の表現型を変えるか否かを決定することを含む。ある実施形態では、表現型は萎縮反応でありうる。
【0011】
決定することは、ある特定の場合では、細胞による遺伝子発現を測定することによって、例えば、アトロジーンプロモーターリポーター構築物を使って生産される、リポータータンパク質の生産を測定することによって行われうる。ある特定の場合では、アトロジーン遺伝子はMURF‐1またはアトロギン‐1でありうる。
【0012】
ある実施形態では、接触させることは、哺乳類に候補薬剤を投与すること、および哺乳類の筋組織における萎縮反応を評価することによって行われうる。ある特定の場合では、評価することは、筋組織における遺伝子発現を測定すること、および/または筋組織における筋肉量を測定することを含みうる。特定の実施形態では、哺乳類はラットでありうる。
【0013】
特定の実施形態では、接触させることは、候補薬剤をインビトロで培養した細胞と接触させること、および培養細胞による萎縮反応を評価することによって行われうる。この実施形態では、評価することは、培養細胞による遺伝子発現を測定することを含みうる。
【0014】
また、哺乳類細胞、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを含む組成物も提供される。
【図面の簡単な説明】
【0015】
【図1】HepG2細胞において内在性MuRF1の発現がDexおよびGDF8処理によって相乗的に上方制御されることを示す棒グラフである。
【図2】HepG2細胞におけるMuRF1のmRNAがDexおよびGDF8での処理後4時間以内に誘導されることを示すグラフである。
【発明を実施するための形態】
【0016】
定義
「決定すること」、「測定すること」、「評価すること」、「判定すること」および「アッセイすること」という用語は、本明細書において互換可能に使用され、任意の形態の測定を指し、ある要素が存在するか否かを決定することを含む。これらの用語は、定量的および/または定性的な測定の両方を含む。判定することは、相対的または絶対的でありうる。「の存在を決定すること」とは、存在する何かの量を決定すること、および存在するか存在しないかを決定することを含む。
【0017】
「接触させること」という用語とは、引き合わせることまたはまとめることを意味する。したがって、2つのものを、例えば、互いに触れ合わせること、または同じ溶液中で混ぜ合わせることによって、引き合せる、またはまとめた場合、第一のものを第二のものと接触させる。特に指示がない限り、薬剤と接触される細胞は、生体内の細胞、すなわち、多細胞生物内、またはインビトロの細胞、すなわち培養細胞でありうる。
【0018】
「光学的に検出可能なタンパク質」という用語は、その発現をタンパク質によって作り出される光信号の存在によって検出することができるタンパク質を指す。光信号は、例えば、タンパク質が特定の光の波長によって励起でき、および検出可能な別の光の波長を放つ場合、タンパク質によって作られる。光信号は、例えば、タンパク質が光信号をもたらす反応を触媒するとき、タンパク質により作られる。蛍光タンパク質、発光タンパク質などが、光学的に検出可能なタンパク質の例である。
【0019】
「遺伝子」という用語は、プロモーター領域、コーディング配列および3’UTRからなる核酸配列を指す。
【0020】
「タンパク質」および「ポリペプチド」という用語は、本明細書において互換可能に使用される。
【0021】
「核酸」という用語は、DNA、RNA、一本鎖または二本鎖およびその化学的に修飾されたものを包含する。「核酸」および「ポリヌクレオチド」という用語は、本明細書において互換可能に使用される。
【0022】
「非ヒト」動物とは、ヒトでない種のあらゆる哺乳類を指す。
【0023】
「げっ歯類(rodent)」および「げっ歯類(rodents)」という用語は、そこから派生する、今後全世代のあらゆるすべての子孫を含む、系統学的な目であるげっ歯目(Rodentia)に属するすべてのものを指す。
【0024】
「ネズミ(murine)」という用語は、ラットおよびマウスを含む、ネズミ科(Muridae)に属するあらゆるすべてのものを指す。
【0025】
「作動可能に連結した」という用語は、一方の機能がもう一方によって影響されるような、単一の核酸断片の上での核酸配列のつながりを指す。例えば、プロモーターがコーディング配列の発現に影響できる(すなわち、コーディング配列がプロモーターの転写制御下にある)場合、プロモーターはコーディング配列に作動可能に連結している。同様に、IRESがコーディング配列に作動可能に連結する場合、IRESは、そのコーディング配列から転写されるmRNAの翻訳を提供する。「連結されていない」とは、つなげられた遺伝子要素が、お互い密接に関連せず、一方の機能が、もう一方に影響しないことを意味する。
【0026】
「ルシフェラーゼ」という用語は、その基質であるルシフェリンを酸化する際に光を放つ酵素を指す。ルシフェリンおよびルシフェラーゼという用語は、特定のルシフェリンまたはルシフェラーゼを指すものではない。それらは、基質および光を生ずる反応を触媒するその関連酵素(またはタンパク質)に対する総称である。
【0027】
プロモーターに関して「誘導された」という用語は、非誘導状態と比較して、下流の核酸の転写の開始およびすでに転写されている下流の核酸の転写の速度の増加の両方を包含することを意図している。
【0028】
遺伝子に関連して「内在性」という用語は、その遺伝子が細胞に生来あること、すなわち、その遺伝子が非改変細胞のゲノムの特定の座に存在することを示す。内在性遺伝子は、(天然に見出されるように)野生型細胞中のその座に存在する野生型遺伝子でありうる。内在性遺伝子は、野生型遺伝子とゲノムの同じ座に存在する場合、改変内在性遺伝子でありうる。そのような改変内在性遺伝子の例は、そこに外来核酸が挿入された遺伝子である。内在性遺伝子は、核ゲノム、ミトコンドリアゲノムなどに存在しうる。
【0029】
「構築物」という用語は、特定のヌクレオチド配列の発現の目的のために作り出されているか、または他の組み換えヌクレオチド配列の構築に使用されることになる組み換え核酸、一般に、組み換えDNAを指す。構築物は、ベクトルまたはゲノム中に存在してよい。
【0030】
「組み換え体」という用語は、宿主細胞で天然に存在しないポリヌクレオチドまたはポリペプチドを指す。組み換え分子は、天然では存在しない様式で連結された2つ以上の天然に存在する配列を含有しうる。組み換え細胞は、組み換えポリヌクレオチドまたはポリペプチドを含有する。
【0031】
「発現」という用語は、本明細書において使用する場合、遺伝子の核酸配列に基づいてポリペプチドが作られる過程を指す。その過程は、転写および翻訳の両方を含む。
【0032】
核酸配列を細胞に挿入するという文脈で、「導入された」という用語は、「トランスフェクション」または「形質転換」または「形質導入」を意味し、核酸配列が真核生物または原核生物の細胞に取り込まれることへの言及を含み、そこにおいて、核酸配列は、細胞のゲノム(例えば、染色体、プラスミド、プラスチドもしくはミトコンドリアDNA)に取り込まれるか、自律レプリコンに変換されるか、または一時的に発現される(例えば、トランスフェクションされたmRNA)。
【0033】
病態または疾患について「治療すること」または「治療」とは、対象に臨床的な恩恵を提供することを含み、(1)病態の少なくとも1つの症状を予防すること、すなわち、疾患にさらされうるか、疾患の素因があるが、その疾患の症状をまだ経験していないか、症状がでていない哺乳類において、臨床症状を著しく進行しないようにすること、(2)疾患を抑制すること、すなわち、疾患もしくはその症状の進行を止めるもしくは減らすこと、または、(3)疾患を和らげること、すなわち、疾患もしくはその臨床症状の軽減をもたらすことを含む。
【0034】
「候補薬剤」という用語は、それらの筋萎縮への効果をスクリーニングするために、本明細書において記載されている細胞または動物と混ぜ合わされる、オリゴヌクレオチド、ポリヌクレオチド、siRNA(shRNAとして投与されうる)、遺伝子産物、ポリペプチド、例えば大きさが最大2500ダルトン(Da)までの小分子、および薬理化合物を意味する。ある特定の場合では、候補薬剤は、転写されるおよび/または翻訳される核酸として送達され、例えば、RNAi分子またはポリペプチドなどの候補薬剤を提供しうる。
【0035】
「コーディング配列」という用語は、例えば、生体内において適切な調節要素の制御下で置かれた場合、一度転写および翻訳されて、タンパク質を作り出す核酸配列を指す。コーディング配列は、本明細書において使用する場合、連続したORFを有しうるか、またはイントロンもしくは非コーディング配列の存在により遮られたORFを有してもよい。この実施形態では、非コーディング配列は、mRNA前駆体から切り出され、成熟したmRNAを生成する。
【0036】
「筋細胞」という語句は、本明細書において使用する場合、例えば、骨格筋、平滑筋および心筋、これら筋細胞前駆体、筋前駆細胞の分化中に存在するあらゆる中間細胞、筋線維、筋細胞株などの、筋細胞のすべての種類を指す。筋細胞の例としては、筋芽細胞、筋管、ミオサイト、心筋細胞、骨格筋細胞、筋原線維などが挙げられる。筋細胞は、生体内(動物内)またはインビトロ(細胞培養中)に存在しうる。
【0037】
「アトロジーン遺伝子」という語句は、萎縮を誘導する刺激(例えば絶食など)に応答して検出可能な筋萎縮表現型、すなわち検出可能な筋肉量の低下、細胞の委縮などが観察できる前に、その発現が筋肉細胞において誘導される遺伝子を指す。ユビキチンタンパク質リガーゼをコードするMuRF1およびMAFbxが、アトロジーン遺伝子の例であるが、その他のものが存在する。筋萎縮を調節する分子機序は、例えば、Siu et al, Front. Biosci. 2009 14:432-52; Murton et al, Biochim. Biophys. Acta 2008 1782:730-43; Tisdale, Curr. Opin. Support Palliat. Care 2007 1:287-92; Zhang et al, Med. Hypotheses. 2007 69:310-21; Cao et al, Int. J. Biochem. Cell Biol. 2005 37:2088-97; Nader, Int. J. Biochem. Cell Biol. 2005 37:1985-96; Glass, Int. J. Biochem. Cell Biol. 2005 37:1974-84; Du et al, Int. J. Biochem. Cell Biol. 2005 37:2147-55; Franch et al, Curr. Opin. Clin. Nutr. Metab. Care. 2005 8:271-5; Glass, Trends Mol. Med. 2003 9:344-50;およびGlass, Nat. Cell Biol. 2003 5:87-90において、広範囲にわたって概説されている。
【0038】
「アトロジーンプロモーター」という語句は、検出可能な筋萎縮表現型、すなわち、検出可能な筋肉量の低下、細胞の委縮などが観察できる前に、萎縮を誘導する刺激(例えば、絶食など)にさらされた筋細胞において誘導されるプロモーターを指す。アトロジーンプロモーターは、野生型アトロジーン遺伝子のプロモーター、または例えば、野生型アトロジーンプロモーターに少なくとも95%同一である、その活性変異型でありうる。
【0039】
「萎縮反応」という用語は、定量的または定性的に観察可能な、細胞の筋委縮に関連する、あらゆる反応を指す。萎縮反応は、分子レベルで観察可能でありえ、例えば、筋肉に関連する内在性の遺伝子またはアトロジーンプロモーターなどの筋肉に関連するプロモーターによって駆動されるリポータータンパク質などの遺伝子発現の変化を含む。また、萎縮反応は、例えば細胞委縮、細胞死もしくは細胞染色の変化など、細胞表現型の変化を観察することによって細胞レベルで観察可能でありうるか、または、例えば筋肉の量、線維の大きさ、断面積などを観察することによって組織レベルで、観察可能でありうる。筋肉の量の減少は、通常、その筋肉の衰弱を伴う。萎縮反応は、例えば、インビトロ(培養細胞中)または生体内(多細胞動物内)で観察されうる。動物では、筋萎縮は、絶食、悪液質、糖尿病、デキサメタゾン治療、ミオスタチン治療、術後人工呼吸器装着、筋ジストロフィー、高齢者の筋肉減少症性の虚弱および 筋萎縮性側索硬化症、ならびに その他さまざまな筋消耗疾患、病態、および治療により引き起こされうる。
【0040】
「グルココルチコイド受容体」という用語は、GR、GCRおよびNR3C1(核内受容体サブファミリー3、グループC、メンバー1)としても知られており、コルチゾールおよびその他のグルココルチコイドが結合し、活性化する受容体である。グルココルチコイド受容体は、体内のほとんどすべての細胞に発現されており、成長、代謝、および免疫反応を制御する遺伝子を調節する。GRがグルココルチコイドに結合したとき、その主な作用機序は、遺伝子転写の調節である(Lu et al, Pharmacol. Rev. 2006 58: 782-97; Rhen et al, N. Engl. J. Med. 2005 353: 1711-23)。結合していない受容体は、細胞の細胞質に存在している。受容体がグルココルチコイドに結合した後、受容体‐グルココルチコイド複合体は、2つ経路のいずれかをとることができる。活性化されたGR複合体は、核内の抗炎症性のタンパク質の発現を上方制御するか、または、(他の転写因子が細胞質から核へ移行することを防ぐことによって)細胞質中の炎症促進性のタンパク質の発現を抑制するかである。ヒトGRタンパク質およびコードするmRNAは、それぞれ、ジェンバンクアクセション番号NP_000167およびNM_000176により提供される。マウスGRタンパク質およびコードするmRNAは、それぞれ、ジェンバンクアクセション番号NP_03219およびNM_008173により提供される。ヒトゲノムでは、GR遺伝子は、5番染色体上、142.64‐142.8Mbに位置している。グルココルチコイド受容体は、例えば、Kumar(Steroids 1999 64: 310-9)およびKumar(J. Steroid Biochem. Mol. Biol.) 2005 94: 383-94に記載されている。グルココルチコイド受容体に対するリガンドは、グルココルチコイド受容体を活性化する。デキサメタゾンは、グルココルチコイド受容体に対するリガンドの例ではあるが、以下で論じるように、他のものが多く存在する。
【0041】
「GDF8」は、ミオスタチン(MSTN)または増殖分化因子8としても知られており、筋肉の分化および成長を阻害する、分泌型のTGFタンパク質ファミリーに属するものである。ミオスタチンは、主として骨格筋細胞で作られ、血液中を循環し、アクチビンII型受容体と呼ばれる細胞に結合した受容体に結合することによって筋組織に作用する。GDF8の配列は、さまざまな生物について決定されている。ヒトGDF8タンパク質およびコードするmRNAは、それぞれ、ジェンバンクアクセション番号NP_005250およびNM_005259により提供される。マウスGDF8タンパク質およびコードするmRNAは、それぞれ、ジェンバンクアクセション番号NP_034964およびNM_010834により提供される。ヒトゲノムでは、GDF8遺伝子は、2番染色体上、190.63‐190.64Mbに位置している。マウスゲノムでは、GDF8遺伝子は、1番染色体上、53.12‐53.12Mbに位置している。GDF8は、例えば、McPherron(Nature 1997 387: 83-90)およびRodgers(Am. J. Physiol. Endocrinol. Metab. 2007 292: E371-2)に記載されている。
【0042】
「ミオスタチン受容体」という用語は、GDF8がそれを通して作用する受容体を指す。ミオスタチン受容体は、アクチビンIIA受容体(ActRIIA)およびアクチビンIIB受容体(ActRIIB)といったアクチビンII型受容体であると考えられている。オスタチン受容体は、Tsuchidaら(Endocr J. 2008 55:11-21)、Joulia‐Ekazaら(Curr. Opin. Pharmacol. 2007 7:310-5)、Walshら(Biochem. Soc. Trans. 2005 33:1513-7)およびTsuchidaら(Immune Endocr. Metabol. Disord. 2004 4:157-66)に概説されている。ミオスタチン受容体に対するリガンドは、その受容体を活性化する。GDF8は、ミオスタチン受容体に対するリガンドの例ではあるが、以下で論じるように、その他のものが多く存在する。
【0043】
例示的な実施形態の説明
本主題発明についてさらに説明する前に、本発明は記載された特定の実施形態に限定されるものではなく、それ自体は当然のことながら変わりうることが理解されるべきである。また、本発明の範囲は、添付の請求項によってのみ限定されるので、本明細書で使用されている専門用語も特定の実施形態のみを記述する目的のためのものであり、限定することを意図するものではないということも理解されるべきである。
【0044】
数値範囲が提示されている場合において、文章に明確な表記が無い場合は下限の単位の1/10まで、その範囲の上限と下限の間のそれぞれ介在する数値および規定された範囲にあるその他のいかなる規定値または介在する値も本発明に包含されると解される。
【0045】
特に規定されない限り、本明細書において用いられるすべての技術および科学用語は、本発明が属する分野の当業者に普通に理解されるものと同じ意味を有する。本明細書において記載されるものと類似または等価のいかなる方法および材料も本発明の実施または試験に用いることができるが、好適な方法および材料をこれから記載する。本明細書において言及したすべての刊行物は参照により本明細書に組み込まれ、引用された刊行物と関連して方法および/または材料を開示および記載する。
【0046】
本明細書および添付の請求項で使用する場合、「a」、「an」および「the」といった単数形は、文章に明確な記載がない限り、複数対象も含むことに留意すべきである。よって、例えば、「a cell(細胞)」という言及は細胞の複数形を含み、「a candidate agent(候補薬剤)」という言及は一つ以上の候補薬剤および当業者に公知のそれと同等のものを含む、等が挙げられる。さらに、請求項はいかなる随意的な要素も排除するよう書かれうることに留意すべきである。したがって、本明細書は、「単なる」、「唯一の」などのような排他的な専門用語を、請求要素の列挙と関連して使用すること、または「否定的な」制限を使用することについて、先の記載としての役割を果たすものとして意図されている。
【0047】
本明細書において議論されている刊行物は、本出願の出願日前に開示されたもののみ提示している。本明細書における一切の内容は、本発明が先行発明を理由としてこうした刊行物に先行する権利を与えられないことを容認するものと解釈されるべきではない。さらに、提供された刊行物の日付は、実際の刊行日とは異なる可能性があり、個別に確認が必要である可能性がある。
【0048】
本明細書に引用されたすべての刊行物および特許は、個々の刊行物または特許が、各々、参照により組み込まれることが具体的かつ個々に記されたかのように、本明細書に参照により組み込まれ、引用された刊行物と関連して、方法および/または材料を開示および説明するために本明細書に参照により組み込まれる。任意の刊行物の引用は、提出日に先立つその開示のためであり、本発明が先行発明を理由としてこうした刊行物に先行する権利を与えられないことを容認するものと解釈されるべきではない。さらに、提供された刊行物の日付は、実際の刊行日とは異なる可能性があり、個別に確認が必要である可能性がある。
【0049】
本開示を読めば当業者に明らかとなるように、本明細書において記載および例示される個別の実施形態は、それぞれ、個別の構成要素および特徴を有し、本発明の範囲または精神から逸脱することなく、その他の幾つかの実施形態のいずれかの特徴から容易に区別または組み合わせることができる。引用される任意の方法は、引用される事象の順序、または論理的に可能なその他の順序で実行できる。
【0050】
上で述べたように、一般に、哺乳類細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させること含む方法。また、その方法を含むスクリーニングアッセイも提供される。以下の説明では、最初に、グルココルチコイドおよびミオスタチン受容体リガンドについて説明し、続いて、それらリガンド用いられうる方法を説明する。
【0051】
グルココルチコイド受容体リガンド
主題方法に用いられるグルココルチコイド受容体リガンドは、グルココルチコイド受容体に結合し、活性化するあらゆる化合物でありうる。グルココルチコイド受容体の活性化が下流の反応を惹起させる機序は公知である。一般的に言って、リガンドの受容体への結合に際し、受容体リガンド複合体は、細胞核へ移行し、そこで、標的遺伝子のプロモーター領域中のグルココルチコイド応答エレメント(GRE)に結合し、遺伝子発現の調節をもたらす。この過程は、例えば、Newton(Thorax 2000 55: 603-13)に概説されている。グルココルチコイド受容体の活性化は、NF‐κBおよびAP‐1の転写を刺激する能力を阻害する(例えば、Jonat, Cell 1990 62, 1189; Yang- Yen, Cell 1990 62, 1205; Diamond, Science 1990 249, 1266;およびCaldenhoven, Mol. Endocrinol. 1995 9, 401を参照のこと)。
【0052】
グルココルチコイド受容体リガンドは、ステロイド性または非ステロイド性でありうる。グルココルチコイド受容体リガンドのさまざまな例示的な種類は、次の米国特許出願第20090227548号、同第20090170898号、同第20090137655号、同第20090105292号、同第20090075995号、同第20090074675号、同第20080090792号、同第20070281959号、同第20080076795号、同第20070281928号および同第20070149577号に記載され、前記刊行物は、そこに記載されたグルココルチコイド受容体リガンドの開示に関し、参照により組み込まれる。
【0053】
幾つかの実施形態では、グルココルチコイド受容体リガンドは、その塩、溶媒和物および水和物を含む、デキサメタゾン、ベタメタゾン、コルチゾン、ヒドロコルチゾン、メチルプレドニゾロン、プレドニゾロン、トリアムシノロン、酢酸フルドロコルチゾン、トリアムシノロン、フルオコルトロン、クロベタゾール、ジフロラゾン、モメタゾン、デスオキシメタゾンなどのグルココルチコイドでありうる。特定の実施形態では、Begg(Med J. Aust. 1987 146:37-41)によって概説されているように、グルココルチコイド受容体リガンドは、ヒドロコルチゾンの効力の少なくとも10倍の効力を有しうる。
【0054】
グルココルチコイドおよびそれらの作用機序は以下の書物:Glucocorticoid Hormone: Mechanisms of Action by Y. Sakamoto (Editor) Publisher: Springer- Verlag (June 1986); Glucocorticoid Action: Basic and Clinical Implications (Hardcover) by Tomoshige Kino (Editor), Publisher: New York Academy of Sciences; second edition (Aug 30 2004); Glucocorticoids by Goulding (Author) Publisher: Springer/Sci-Tech/Trade; 1 edition (May 11 2001);および Recent Advances in Glucocorticoid Receptor Action by A. Cato (Editor), Publisher: Springer; 1 edition (Nov 11 2002)で概説され、それらは、参照によりそれら全体が組み込まれる。
【0055】
グルココルチコイド受容体リガンドの投与量および投与経路は公知である。
【0056】
ミオスタチン受容体リガンド
主題方法に用いられるミオスタチン受容体リガンドはミオスタチン受容体に結合し、活性化するあらゆる化合物でありうる。そのような化合物としては、例えば、以下のNCBIアクセション番号で規定されるGDF8ペプチドを含む、その活性変異体およびペプチド模倣変異体を含むペプチドおよび非ペプチド性化合物が挙げられる:GI:9506907(ラット(Rattus norvegicus))、GI:6754752(マウス(Mus musculus))、GI:4885259(ホモサピエンス(Homo sapiens))、GI:48314966(ウシ(Bos Taurus))、GI:260809331(ナメクジウオ(Branchiostoma floridae))、GI:51783959(イノシシ(Sus scrofa))、GI:47825371(ニワトリ(Gallus gallus))、GI:18858751(ゼブラフィッシュ(Danio rerio))、GI:121583758(アカゲザル(Macaca mulatta))、GI:50950173(イヌ(Canis lupus familiaris))、GI:120952608(チンパンジー(Pan troglodytes))、GI:198417205(ユウレイボヤ(Ciona intestinalis))およびGI:57164247(ヒツジ(Ovis aries))。ヒトGDF8の構造は、NCBIの構造データベースのMMDB ID:75808に記されている。ある特定の場合では、本明細書において使用するミオスタチン受容体リガンドは、野生型ミオスタチン受容体リガンドに、少なくとも50%と同一、例えば、少なくとも60%同一、少なくとも70%同一、少なくとも80%同一、少なくとも85%同一、少なくとも90%同一、少なくとも95%同一、または少なくとも98%同一であるアミノ酸配列を有しうる。
【0057】
ミオスタチン受容体リガンドを同定するアッセイは公知であり、米国特許出願第20090220491号、同第20090098114号、同第20070149458号、同第20060216279号、同第20050272028号および同第20040248121号に記載されているものが挙げられ、前記刊行物は、それらアッセイに関し、参照により組み込まれる。
【0058】
ミオスタチン受容体を活性化することによる筋肉変性におけるGDF8の役割は、例えば、Tsuchida(Expert Opin. Biol. Ther. 2006 6:147-54)、Wagner(Curr. Opin. Rheumatol. 2005 17:720-4)、Tsuchida(Curr. Drug Targets Immune Endocr. Metabol. Disord. 2004 4:157-66)、およびBellinge(Anim. Genet. 2005 36:1-6)など、さまざまな出版物で概説されており、前記刊行物は、参照により本明細書に組み込まれる。
【0059】
ミオスタチン受容体リガンドの投与量および投与経路は公知である。
【0060】
方法
上記のグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドは、生体内で(すなわち、化合物を動物に投与することにより)、またはインビトロにおいて(すなわち、化合物類を培養で育てられた細胞と接触させることにより)、哺乳類細胞と接触させうる。前記化合物を、同時に細胞と接触させてもよく(例えば、化合物を細胞と接触させる前に、化合物を混ぜ合わせてよい)、または化合物を別々に、同時または時を異にして、細胞と混ぜ合わせてもよい。例示的なインビトロおよび生体内における方法を以下に述べる。
【0061】
インビトロにおける方法では、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドは各々、同じ化合物を単独で使って単離した細胞からの反応をもたらすのに十分である濃度に一致した濃度で、培養哺乳類細胞と独立して接触させてよく、これは当該技術分野において公知である。例示的な有効濃度は、上で引用された参考文献およびその他多くものに記載されており、一般に約0.1〜1000μg/mLの範囲であるが、ある特定の状況では、この範囲外の濃度が用いられうる。一般的に言って、接触させることは、化合物を培地と混合することによって行われる。
【0062】
アッセイで用いられる培養細胞は、グルココルチコイド受容体およびミオスタチン受容体を発現するあらゆる細胞でありうる。細胞が両受容体を内在的に発現しない場合、受容体を、組み換え手段を使って発現してもよい。限定はされないが、サル腎細胞(COS細胞)、SV40によって形質転換したサル腎臓CVI細胞(COS‐7,ATCC CRL165 1);ヒト胚腎細胞(HEK‐293,Graham et al. J. Gen Virol. 36:59 (1977));ベビーハムスター腎細胞(BHK,ATCC CCL 10);チャイニーズハムスター卵巣細胞(CHO,Urlaub and Chasin, Proc. Natl. Acad. Sci. (USA) 77:4216, (1980));マウスセルトリ細胞(TM4,Mather, Biol. Reprod. 23:243-251 (1980));サル腎細胞(CVI ATCC CCL 70);アフリカミドリザル腎細胞(VERO‐76,ATCC CRL‐1587);ヒト子宮頸癌細胞(HELA,ATCC CCL2);イヌ腎細胞(MDCK,ATCC CCL34);バッファローラット肝細胞(BRL 3A,ATCC CRL1442);ヒト肺細胞(W138,ATCC CCL 75);ヒト肝細胞(hep G2,HB 8065);マウス乳房腫瘍(MMT 060562,ATCC CCL 51);TRI細胞(Mather et al., Annals N. Y. Acad. Sci 383:44-68 (1982));NIH/3T3細胞(ATCC CRL‐1658);およびマウスL細胞(ATCC CCL‐1)を含む、例えば培養哺乳類細胞などの、あらゆる動物からの培養細胞が用いられうる。さらなる細胞株は、当業者に明らかになるであろう。幅広い種類の細胞株が、アメリカン・タイプ・カルチャー・コレクション,10801 University Boulevard, Manassas, Va. 20110‐2209から入手可能である。特定の実施形態では、培養細胞は、例えば、骨格筋、平滑筋または心筋由来の培養細胞などの培養ミオサイトでありうる。例示的な実施形態では、培養細胞は、例えば、HL‐1細胞(Claycomb PNAS 1998 95: 2979-2984)、BWEMまたはCLEM細胞(Enelmann et al Molecular and Cellular Biochemistry 1996 157)、L6筋芽細胞またはC2C12、SM3、Aza2、BC3H‐1、BD1、BD2、BD10、TD33、TD38、TD45、TGI、C2、またはAT‐1細胞でありうる。そのような細胞を培養する方法は公知である。
【0063】
培養細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させることは、細胞のグルココルチコイド受容体およびミオスタチン受容体を活性化し、それによって 細胞の表現型を変化させる。ある実施形態では、前記方法は、細胞が化合物がない場合には生じない表現型を示すのに十分な時間、化合物の存在下で細胞を維持することを含む。ある特定の場合では、前記表現型は、細胞増殖表現型、細胞死(アポトーシス)表現型、細胞の形状もしくはサイズの変化、(例えば、炎症性メディエーターの生産の変化として観察される)炎症反応、染色パターンの変化または遺伝子発現の変化でありうる。特定の実施形態では、前記表現型は、上で定義されたように萎縮反応でありうる。
【0064】
ある特定の場合では、細胞は、細胞における遺伝子発現を評価するためのリポーター系を含有しうる。例えば、細胞は、プロモーター(例えば、筋細胞発達または筋消耗の間に誘導または抑制されるプロモーター)に作動可能に連結された、リポータータンパク質(例えば、ルシフェラーゼまたはGFP)のコーディング配列を含有してよく、そこで、細胞を化合物と接触させることは、リポータータンパク質の発現を誘導または抑制する。ある実施形態では、前記プロモーターは、アトロジーンプロモーターでありえ、細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させることは、リポータータンパク質の生産を誘導する。特定の実施形態では、例えば、リポーター発現が内在性プロモーターに作動可能に連結されるように、リポータータンパク質のコーディング配列を内在性遺伝子(例えば、アトロジーン遺伝子)に挿入することによって、または、プロモーターおよびリポーターをコードする配列の両方を含む組み換え核酸を細胞のゲノムに挿入することによって、細胞のゲノムを変更しうる。
【0065】
生体内における方法では、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを、同じ化合物を単独で使って動物からの反応をもたらすのに十分である濃度に一致した個々の濃度で化合物を投与することによって哺乳類細胞と接触させてよく、これは当該技術分野において公知である。例示的な有効濃度は、上で引用された参考文献およびその他多くものに記載されており、一般には、個別に、1投与につき動物1キログラム当たり約0.01〜500ミリグラムの化合物の範囲、例えば、少なくとも約0.1〜100ミリグラムの薬剤/キログラムなどであるが、ある特定の状況では、この範囲外の濃度が用いられうる。一般的に言って、接触させることは、化合物を動物に、例えば経口で、または(静脈内もしくは筋肉内でありうる)注入によって、局所的または全身的に投与することによって行われる。アッセイに用いられる動物は、あらゆる動物、特に、げっ歯類(例えばマウスまたはラット)などの哺乳類でありうる。
【0066】
グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを動物に投与することは、動物の細胞のグルココルチコイド受容体およびミオスタチン受容体を活性化し、それによって、動物の表現型を変化させる。ある実施形態では、前記化合物を投与した後、前記方法は、動物が化合物がない場合には生じない表現型を呈するのに十分な時間、化合物の存在下で動物を維持することを含みうる。ある特定の場合では、表現型は、癌に関連する表現型(細胞増殖、細胞死、もしくは転移に関連する表現型)、または炎症性反応により媒介される表現型(例えば、攻撃誘発に対する免疫系の応答における変化)でありうる。特定の実施形態では、表現型は、先に定義したように、萎縮反応でもよく、そこで、ある実施形態では、筋肉量の変化、筋肉断面の変化、またはミオシン合成の下方制御、ミオシン分解経路の活性化(例えば、ATPに依存するユビキチン/プロテアソーム経路の活性化またはE3ユビキチンリガーゼの誘導を介する)として観察されうる。
【0067】
ある特定の場合では、細胞は、動物における遺伝子発現を評価するための組み換えリポーター系を含有しうる。例えば、動物は、プロモーター(例えば、筋細胞発達または筋消耗の間に誘導または抑制されるプロモーター)に作動可能に連結された、リポータータンパク質(例えば、ルシフェラーゼまたはGFP)のコーディング配列を含有してよく、そこで、細胞を化合物と接触させることは、リポータータンパク質の発現を誘導または抑制する。ある実施形態では、前記プロモーターは、アトロジーンプロモーターでもよく、動物にグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを投与することは、リポータータンパク質の生産を誘導する。特定の実施形態では、例えば、リポーター発現が内在性プロモーターに作動可能に連結されるように、リポータータンパク質のコーディング配列を内在性遺伝子(例えば、アトロジーン遺伝子)に挿入することによって、または、プロモーターおよびリポーターをコードする配列の両方を含む組み換え核酸を動物のゲノムに挿入することによって、細胞のゲノムを変更しうる。
【0068】
スクリーニングアッセイ
上記方法を、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドによって誘導される表現型を調節する薬剤を同定するためのスクリーニングアッセイに利用しうる。特定の実施形態では、前記方法を、筋細胞萎縮の惹起を調節する薬剤を同定するために利用しうる。例示的実施形態では、前記方法は、対象細胞(すなわち、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させる細胞で、その細胞はインビトロまたは生体内に存在できる)を候補薬剤と接触させること、ならびに、もしあれば、候補薬剤のグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドによって誘導される表現型への効果を決定することを含む。特定の実施形態では、表現型を、リポータータンパク質の生産を評価することによって判定しうる。幾つかの実施形態では、前記方法は、細胞を(生体内またはインビトロにおいて)グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドの存在下で候補薬剤と接触させること、ならびに、候補薬剤が、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドに応答して細胞の表現型を変えるかどうかを決定することを含む。
【0069】
「薬剤」という用語は、本明細書において使用する場合、例えばタンパク質または非タンパク質の有機または無機の医薬などのあらゆる分子を表す。特に興味深い薬剤は、筋細胞萎縮の惹起を阻害するようなものである。複数のアッセイを、異なる薬剤濃度で平行して行い、そのさまざまな濃度に対する異なる反応を得る。これらの濃度のうちの1つは、すなわちゼロ濃度または検出のレベル未満で、陰性対照としての役割をする。
【0070】
「候補薬剤」、「試験薬剤」、「薬剤」、「物質」および「化合物」という用語は、本明細書において互換可能に使用される。候補薬剤は、多数の化学的な種類、典型的には、合成、半合成または天然に存在する、無機または有機分子を包含する。候補薬剤としては、合成または天然化合物の大きなライブラリー中に見出されるようなものが挙げられる。例えば、合成化合物ライブライリーは、Maybridge Chemical Co.(Trevillet,Cornwall,UK)、ComGenex(South San Francisco,CA)、およびMicroSource(New Milford,CT)から市販されている。あるいは、細菌、真菌、植物、および動物抽出物の形で、天然化合物ライブラリーは、Pan Labs(Bothell,WA)から入手可能であり、容易に作製される。
【0071】
候補薬剤は、50超約2,500Da未満の分子量をもつ小さい有機または無機化合物でありうる。候補薬剤は、タンパク質との構造的相互作用、特に水素結合に必要な官能基を含み、少なくともアミン基、カルボニル基、ヒドロキシル基またはカルボキシル基を含み、少なくとも2つ化学官能基を含有しうる。候補薬剤は、多くの場合、環式の炭素もしくは複素環式構造および/または芳香族、もしくは1つ以上の上記官能基で置換された多環芳香族構造を含みうる。また、候補薬剤は、例えばペプチド、糖、脂肪酸、ステロイド、プリン、ピリミジン、誘導体、構造類似体またはその組み合わせなど生体分子中にも見出される。
【0072】
候補薬剤は、例えば合成または天然化合物のなど広い種類の源から入手できる。例えば、多数の手段は、例えばランダムされたオリゴペプチドの発現など、広く多様な有機化合物および生体分子のランダムおよび指向性合成に利用可能である。あるいは、細菌、真菌、植物、および動物抽出物の形で、天然化合物ライブラリーは、入手可能で、容易に作製される。加えて、天然または合成的に作製されたライブラリーおよび化合物は、従来の化学的、物理的、および生化学的手段を通して容易に改変され、コンビナトリアルライブラリーの作製に使用されうる。公知の薬物を、アシル化、アルキル化、エステル化、アミド化などの指向性またはランダム学修飾に供し、構造類似体を作製しうる。また、新しい潜在的治療薬剤は、合理的な薬物設計またはコンピューターモデリングなどの方法を使って創出されうる。
【0073】
スクリーニングは、公知の薬理活性化合物およびその化学的類似体、または合理的な薬物設計を通して創出されたものなどの未知の性質をもつ新しい薬剤を対象にしてもよい。
【0074】
表現型を調節する薬剤は、薬剤にさらされていない対照と比較して、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、または少なくとも90%以上、表現型を減少させる。
【0075】
表現型を調節する薬剤を、アシル化、アルキル化、エステル化、アミド化などの、指向性またはランダムおよび/もしくは指向性化学修飾に供し、構造類似体を作製しうる。そのような構造類似体としては、生物学的利用能を増加させ、および/または細胞毒性を減少させるようなものが挙げられる。当業者であれば、容易に、多種多様な構造類似体を想定および作成でき、それらを、増加した生物学的利用能および/または減少した細胞毒性などの所望の性質などについて試験できる。
【0076】
特定の実施形態では、筋細胞萎縮の惹起を調節する薬剤を同定するインビトロにおける方法が提供される。この方法は、一般に、筋細胞萎縮の惹起に際し、リポータータンパク質を作り出す細胞を、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドの存在下で、候補薬剤と接触させること、ならびに、候補薬剤が、候補薬剤で処理していない対照細胞と比較して、細胞によるリポータータンパク質の生産を減少させるか否かを決定することを含む。
【0077】
細胞を候補薬剤と接触させる前、後、または同時に、細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させうる。
【0078】
リポータータンパク質の生産を、細胞を表現型を誘導する条件に供する前および後のいろいろな時点で監視しうる。同様に、候補薬剤の効果を、表現型を幾つかの時点で測定することによって決定しうる。例えば、細胞を候補薬剤に接触させた、5分後、30分後、1時間後、2時間後、4時間後、8時間後、12時間後、24時間後、36時間後、48時間後、72時間後、120時間後、1週間後、2週間後、および最長1ヶ月後に、リポータータンパク質の生産を測定しうる。
【0079】
筋細胞萎縮の惹起を調節する薬剤を同定する生体内スクリーニングアッセイが提供される。この方法は、一般に、筋細胞萎縮の惹起に際し、リポータータンパク質を作り出す動物に、候補薬剤、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを投与すること、ならびに、候補薬剤が、候補薬剤を投与していない対照動物と比較して、前記動物によるリポータータンパク質の生産を減少させるかどうかを決定することを含む。
【0080】
生体内の系において作り出されるあらゆる表現型を、候補薬剤を動物に投与する前および後のいろいろな時点で監視しうる。例えば、候補薬剤の効果を、リポータータンパク質を幾つかの時点で測定することによって決定しうる。例えば、細胞を候補薬剤に接触させた、0時間後、12時間後、24時間後、36時間後、48時間後、72時間後、120時間後、1週間後、2週間後、1ヶ月後、2ヶ月後、3ヶ月後、5ヶ月後などに、リポータータンパク質の生産を測定しうる。ある実施形態では、リポータータンパク質の測定は、アトロジーン遺伝子の発現および細胞/線維の大きさ、形態、筋力などを測定することによって、称賛されうる。
【0081】
上記方法によって同定したあらゆる薬剤を、動物モデルでさらに試験しうる。例えば、1つの実施形態では、動物を、萎縮誘導刺激に供し、候補薬剤と接触させうる。萎縮を誘導することが知られている多くの状況を、萎縮として使用しうる。動物において、筋細胞萎縮は、限定はされないが、絶食、加齢、糖尿病、進行癌、腎不全、敗血症、悪液質、関節炎、骨粗鬆症、糖尿病、除神経、不動化、筋負荷除去、脊髄損傷、グルココルチコイド処理などを含む、多くの刺激によって惹起されうる。インビトロにおいて、筋細胞萎縮は、絶食、細胞の例えば糖質コルチコイド、グルココルチコイドまたはウイルスへの曝露によって惹起されうる。
【0082】
また、哺乳類細胞、グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドを含む組成物も提供される。組成物中に存在しうる細胞およびリガンドは、上でより詳細に論じられている。
【0083】
有用性
本明細書において提示された生体内およびインビトロアッセイは、筋細胞萎縮を減少させるものを含む、さまざまな表現型を調節する薬剤を同定および試験する方法を提供する。これらの薬剤を、筋細胞萎縮をもつ対象の治療に使用しうる製剤中に使用してよい。加えて、これら薬剤を、筋細胞萎縮を生じるリスクのある対象に、例えば、人工呼吸器を装着することになる手術の前などに、予防的に与えうる。本明細書において提供した方法によって同定された薬剤から恩恵をうけうる対象は、さまざまな刺激によって引き起こされる筋細胞萎縮を有しうるか、またはその危険にさらされうる。これらの刺激としては、絶食、加齢、進行癌、腎不全、敗血症、悪液質、関節炎、骨粗鬆症、および糖尿病が挙げられるが、これらに限定されない。また、筋肉の委縮は、例えば不動化、筋負荷除去、脊髄損傷などの筋肉の不使用または除神経の結果でありうる。ある実施形態では、対象は、HIV、慢性心不全、慢性腎疾患、肝硬変、熱傷、骨粗鬆症、関節炎など、筋細胞萎縮によって悪化する健康状態の問題を有しうる。筋細胞萎縮を阻害する候補化合物をスクリーニングするための細胞および動物モデルを使った方法を使用し、筋細胞萎縮をもつ対象における筋肉のタンパク質含量、線維径、筋出力および疲労耐性を改善する薬剤を同定しうる。
【実施例】
【0084】
以下の実施例は、本発明のある特定の実施形態および態様を実証およびさらに例示するために提供されるものであり、その範囲を限定するものとして解釈してはならない。
【0085】
実施例1
培養したHepG2細胞を、1μΜ デキサメタゾン、10μΜ デキサメタゾン、100ng/mL GDF8、100ng/mL TGFβ1、および10μΜ デキサメタゾン+100ng/mL GDF8に曝露し、内在性MuRF1の発現をTaqman RT‐PCRアッセイを使ったRT‐PCRにより評価した。結果を図1に示す。内在性MuRF1は無処理対照より22倍誘導された。10μΜ デキサメタゾンは、内在性MuRF1の発現を無処理対照より2.5倍誘導し、100ng/mL GDF8は、内在性MuRF1の発現を無処理対照より1.8倍誘導した。デキサメタゾンおよびGDF8の両方を併用した処理は、デキサメタゾンおよびGDF8の個々によるMuRF1の誘導を優に上回ったMuRF1の誘導を引き起こしたことから、内因性MuRF1発現は、デキサメタゾンおよびGDF8により相乗的に上方制御される。
【0086】
図2は、HepG2細胞を、10μΜ デキサメタゾン、および100ng/mL GDF8の両方で処理した後のMuRF1誘導の経時変化を示す。対照と比較して、MuRF1誘導は、処理後4時間で観察できる。
【特許請求の範囲】
【請求項1】
哺乳類細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させ、それによって前記グルココルチコイド受容体および前記ミオスタチン受容体を活性化することを含む方法。
【請求項2】
前記接触させることが、前記哺乳類細胞による萎縮反応を惹起する請求項1の方法。
【請求項3】
前記接触させることが、前記グルココルチコイド受容体リガンドおよび前記ミオスタチン受容体リガンドを哺乳類に投与することによって行われる請求項1の方法。
【請求項4】
前記接触させることが、前記グルココルチコイド受容体リガンドおよび前記ミオスタチン受容体リガンドをインビトロにおいて培養細胞と接触させることによって行われる請求項1の方法。
【請求項5】
前記培養細胞が、前記グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドによって誘導され、リポータータンパク質をコードするコーディング配列に作動可能に連結されたプロモーターを含む組み換え核酸を含む、請求項4の方法。
【請求項6】
前記グルココルチコイド受容体リガンドが、0.1μΜ〜100μΜの範囲の濃度で前記哺乳類細胞と接触する請求項4の方法。
【請求項7】
前記ミオスタチン受容体リガンドが、1ng/mL〜1000ng/mLの範囲の濃度で前記哺乳類細胞と接触する請求項4の方法。
【請求項8】
前記グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドが、同時に前記哺乳類細胞と接触する請求項1の方法。
【請求項9】
前記グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドが、時を異にして前記哺乳類細胞と接触する請求項1の方法。
【請求項10】
前記グルココルチコイド受容体リガンドが、デキサメタゾンである請求項1の方法。
【請求項11】
前記ミオスタチン受容体リガンドが、GDF8である請求項1の方法。
【請求項12】
細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドの存在下で候補薬剤と接触させること、ならびに、前記候補薬剤が、前記グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドに応答して前記細胞の表現型を変えるか否かを決定することを含むスクリーニングの方法。
【請求項13】
前記表現型が、萎縮反応である請求項12の方法。
【請求項14】
前記決定することが、前記細胞によるアトロジーン遺伝子の発現を測定することによって行われる請求項13の方法。
【請求項15】
前記決定することが、リポータータンパク質の生産を測定することによって行われ、前記リポータータンパク質がアトロジーンプロモーター‐リポーター構築物を使って生産される請求項14の方法。
【請求項16】
前記アトロジーン遺伝子が、MURF‐1またはアトロギン‐1である請求項14の方法。
【請求項17】
前記接触させることが、哺乳類に前記候補薬剤を投与することによって行われ、哺乳類の筋組織における萎縮反応を評価する、請求項12の方法。
【請求項18】
前記評価することが、前記筋組織における遺伝子発現を測定することを含む請求項17の方法。
【請求項19】
前記評価することが、筋肉量を測定することを含む請求項17の方法。
【請求項20】
前記哺乳類が、ラットである請求項17に記載の方法。
【請求項21】
前記接触させることが、前記候補薬剤をインビトロで培養した細胞と接触させることによって行われ、前記培養細胞による萎縮反応を評価する、請求項12の方法。
【請求項22】
前記評価することが、前記培養細胞における遺伝子発現を測定することを含む請求項21の方法。
【請求項23】
前記候補薬剤が、siRNAである請求項12の方法。
【請求項1】
哺乳類細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドと接触させ、それによって前記グルココルチコイド受容体および前記ミオスタチン受容体を活性化することを含む方法。
【請求項2】
前記接触させることが、前記哺乳類細胞による萎縮反応を惹起する請求項1の方法。
【請求項3】
前記接触させることが、前記グルココルチコイド受容体リガンドおよび前記ミオスタチン受容体リガンドを哺乳類に投与することによって行われる請求項1の方法。
【請求項4】
前記接触させることが、前記グルココルチコイド受容体リガンドおよび前記ミオスタチン受容体リガンドをインビトロにおいて培養細胞と接触させることによって行われる請求項1の方法。
【請求項5】
前記培養細胞が、前記グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドによって誘導され、リポータータンパク質をコードするコーディング配列に作動可能に連結されたプロモーターを含む組み換え核酸を含む、請求項4の方法。
【請求項6】
前記グルココルチコイド受容体リガンドが、0.1μΜ〜100μΜの範囲の濃度で前記哺乳類細胞と接触する請求項4の方法。
【請求項7】
前記ミオスタチン受容体リガンドが、1ng/mL〜1000ng/mLの範囲の濃度で前記哺乳類細胞と接触する請求項4の方法。
【請求項8】
前記グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドが、同時に前記哺乳類細胞と接触する請求項1の方法。
【請求項9】
前記グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドが、時を異にして前記哺乳類細胞と接触する請求項1の方法。
【請求項10】
前記グルココルチコイド受容体リガンドが、デキサメタゾンである請求項1の方法。
【請求項11】
前記ミオスタチン受容体リガンドが、GDF8である請求項1の方法。
【請求項12】
細胞をグルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドの存在下で候補薬剤と接触させること、ならびに、前記候補薬剤が、前記グルココルチコイド受容体リガンドおよびミオスタチン受容体リガンドに応答して前記細胞の表現型を変えるか否かを決定することを含むスクリーニングの方法。
【請求項13】
前記表現型が、萎縮反応である請求項12の方法。
【請求項14】
前記決定することが、前記細胞によるアトロジーン遺伝子の発現を測定することによって行われる請求項13の方法。
【請求項15】
前記決定することが、リポータータンパク質の生産を測定することによって行われ、前記リポータータンパク質がアトロジーンプロモーター‐リポーター構築物を使って生産される請求項14の方法。
【請求項16】
前記アトロジーン遺伝子が、MURF‐1またはアトロギン‐1である請求項14の方法。
【請求項17】
前記接触させることが、哺乳類に前記候補薬剤を投与することによって行われ、哺乳類の筋組織における萎縮反応を評価する、請求項12の方法。
【請求項18】
前記評価することが、前記筋組織における遺伝子発現を測定することを含む請求項17の方法。
【請求項19】
前記評価することが、筋肉量を測定することを含む請求項17の方法。
【請求項20】
前記哺乳類が、ラットである請求項17に記載の方法。
【請求項21】
前記接触させることが、前記候補薬剤をインビトロで培養した細胞と接触させることによって行われ、前記培養細胞による萎縮反応を評価する、請求項12の方法。
【請求項22】
前記評価することが、前記培養細胞における遺伝子発現を測定することを含む請求項21の方法。
【請求項23】
前記候補薬剤が、siRNAである請求項12の方法。
【図1】


【図2】




【図2】


【公表番号】特表2013−516986(P2013−516986A)
【公表日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願番号】特願2012−548973(P2012−548973)
【出願日】平成23年1月5日(2011.1.5)
【国際出願番号】PCT/US2011/020266
【国際公開番号】WO2011/087946
【国際公開日】平成23年7月21日(2011.7.21)
【出願人】(504294145)ライジェル ファーマシューティカルズ, インコーポレイテッド (63)
【Fターム(参考)】
【公表日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願日】平成23年1月5日(2011.1.5)
【国際出願番号】PCT/US2011/020266
【国際公開番号】WO2011/087946
【国際公開日】平成23年7月21日(2011.7.21)
【出願人】(504294145)ライジェル ファーマシューティカルズ, インコーポレイテッド (63)
【Fターム(参考)】
[ Back to top ]

