DNAメチル化検出用試料の調製方法
【課題】メチル化DNAの検出において、迅速かつ安定して検出結果を得られる、簡便なDNAメチル化検出用試料の調製方法、DNAメチル化検出方法、生体試料前処理液及び試薬キットを提供する。
【解決手段】本発明のDNAメチル化検出用のDNAメチル化検出用試料を調製するための生体試料前処理液はプロテアーゼを含み、生体試料から核酸試料を調製する工程を省き、生体試料の溶解液を亜硫酸水素塩で直接処理することでDNAのメチル化を検出する際に、安定した検出結果を得ることができる。
【解決手段】本発明のDNAメチル化検出用のDNAメチル化検出用試料を調製するための生体試料前処理液はプロテアーゼを含み、生体試料から核酸試料を調製する工程を省き、生体試料の溶解液を亜硫酸水素塩で直接処理することでDNAのメチル化を検出する際に、安定した検出結果を得ることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、DNAのメチル化を検出するために用いられる試料(DNAメチル化検出用試料)の調製方法、DNAのメチル化を検出する方法、これらの方法に用いられる生体試料前処理液及び試薬キットに関する。
【背景技術】
【0002】
高等真核生物の染色体DNAでは、DNAを構成する塩基のうちC(シトシン)の5位がメチル化修飾を受けていることがある。この高等真核生物におけるDNAのメチル化は、原核生物の場合とは異なり、遺伝情報の発現抑制機構として機能している。例えば、ある遺伝子のCpGを多く含む領域(CpGアイランド、CG島)がメチル化されていると、その遺伝子の転写が抑制される。それに対して、CpGアイランドがメチル化を受けていないと、プロモーター領域に転写因子が結合可能となり、遺伝子が転写可能な状態になる。このように、DNAのメチル化は、遺伝子発現の制御機構の1つであり、初期胚発生、組織特異的な遺伝子の発現、哺乳動物に特徴的な現象である遺伝子刷り込みやX染色体の不活性化、染色体の安定化、DNA複製のタイミング等の様々な生理的、病理的な現象に重要な役割を果たしている。さらに近年、がんやその他の疾病にこのDNAのメチル化が強く関与することが明らかになってきている。
【0003】
DNAのメチル化を解析する方法として、一般的にメチル化特異的PCR(Methylation specific Polymerase Chain Reaction、以下「MS−PCR」という)が用いられている(非特許文献1参照)。この従来用いられている方法(以下、「標準法」という)は、通常、1)生体試料からのゲノムDNA抽出(約3時間)、2)抽出されたゲノムDNAの亜硫酸水素塩処理(約16時間)、3)修飾されたゲノムDNAの精製(約1時間)、及び4)PCR(約2時間)の4ステップで行われており、非常に時間がかかっていた(合計約22時間)。特に、PCRに至るまでの生体試料の前処理(DNAメチル化検出用試料の調製)が煩雑であり、前処理(上記1〜3)だけで約20時間かかることが問題であった。
【0004】
長時間かかる前処理時間を短縮させるべく、上記2)の亜硫酸水素塩処理を、高濃度の亜硫酸水素塩で行う方法が提案された(非特許文献2参照)。非特許文献2の方法(以下、「迅速法」という)によれば、標準法で約16時間かかっていた亜硫酸水素塩処理を約20分で行うことができるため、前処理時間が約20時間から約4時間へと短縮される。しかし、この迅速法を用いても、前処理に約4時間を要する。
【0005】
このように、検体から核酸試料を調製する工程を省き、容易にかつ微量の細胞検体からメチル化されたDNAを検出することができる方法の開発が強く望まれている。
【0006】
また、近年、極微量の細胞検体をグアニジンチオシアネート、ヨウ化ナトリウム、尿素、SDS等の従来公知のタンパク質変性剤を含む溶液で溶解した後に、調製した細胞検体溶解液を、標準法により亜硫酸水素塩で直接処理することで、タンパク質除去等の過程を行わずに細胞検体に含まれるDNAを修飾するメチル化DNAを検出する方法が知られている(特許文献1参照)。
【非特許文献1】James G.HERMAN et al., Methylation−specific PCR:A novel PCR assay for methylation status of CpG islands, Proc. Natl. Acad. Sci. USA, Vol.93, pp.9821−9826, September 1996
【非特許文献2】Masahiko SHIRAISHI and Hikoya HAYATSU, High−Speed Conversion of Cytosine to Uracil in Bisulfite Genomic Sequencing Analysis of DNA Methylation, DNA RESEARCH 11,409−415(2004)
【特許文献1】特開2005−058217号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明は、生体試料から核酸試料を調製する工程を省き、生体試料の溶解液を、亜硫酸水素塩で直接処理することでDNAのメチル化を検出する際に、安定して検出結果を得ることができる、簡便なDNAメチル化検出用試料の調製方法、DNAメチル化検出方法、生体試料前処理液及び試薬キットを提供することを目的とする。
【0008】
また本発明のDNAメチル化検出用試料の調製方法、DNAメチル化検出方法、生体試料前処理液及び試薬キットは、細胞を含む生体試料のタンパク含量が高い場合、特に迅速法を用いてDNAのメチル化検出を行う場合に有用である。
【課題を解決するための手段】
【0009】
本発明者等は、特許文献1に記載の方法では、生体試料中のタンパク含量が多い場合、DNAメチル化検出の検出結果に不良が出ること、及び特に迅速法を用い高濃度の亜硫酸水素塩で処理した際、生体試料中のタンパク質の塩析が検出結果に影響を与えることを見出し、プロテアーゼを含む生体試料前処理液で生体試料を処理することで、安定した検出結果を得るに至り、本発明を完成した。
【0010】
すなわち、本発明は、
(1)DNAメチル化検出用試料を調製するための生体試料前処理液であって、プロテアーゼを含む水溶液からなる生体試料前処理液;
(2)界面活性剤及び/又はカオトロピック剤をさらに含む、(1)に記載の生体試料前処理液;
(3)前記界面活性剤及び/又はカオトロピック剤が、ドデシル硫酸ナトリウム、尿素、及び/又は塩酸グアニジンである、(2)に記載の生体試料前処理液;
(4)DNAを切断することのできる切断剤をさらに含む、(1)〜(3)のいずれか1に記載の生体試料前処理液;
(5)pHが7〜10である(1)〜(4)のいずれか1に記載の生体試料前処理液;
(6)DNAメチル化検出用試料を調製するための試薬キットであって、(1)〜(5)のいずれか1に記載の生体試料前処理液からなる第1試薬と、DNAに含まれる非メチル化シトシンを他の塩基に変換する変換剤を含む第2試薬とからなる試薬キット;
(7)前記変換剤が、亜硫酸水素塩である(6)に記載の試薬キット;
(8)前記亜硫酸水素塩の濃度が、4〜8mMである(7)に記載の方法;
(9)DNAメチル化検出用試料の調製方法であって、プロテアーゼを含む水溶液からなる生体試料前処理液と細胞を含む生体試料を混合する工程と、得られた混合液に、変換剤を添加して混合物中のDNAに含まれる非メチル化シトシンを他の塩基に変換する工程からなるDNAメチル化検出用試料の調製方法;
(10)前記生体試料が、血清、血漿、生体組織又は乳腺分泌液である(9)に記載の方法;
(11)前記細胞が腫瘍細胞である(9)又は(10)に記載の方法;
(12)生体試料前処理液と生体試料を混合する工程の前に、細胞を含む生体試料を界面活性剤及び/又はカオトロピック剤を含む溶解液で溶解する工程、を含む(9)〜(11)のいずれか1に記載の方法;
(13)生体試料におけるDNAメチル化検出方法であって、プロテアーゼを含む水溶液からなる生体試料前処理液と細胞を含む生体試料を混合する工程と、 得られた混合液に、DNAに含まれる非メチル化シトシンを他の塩基に変換するための変換剤を添加してDNAメチル化検出用試料を調製する工程と、他の塩基への変換前のDNAの所定領域にハイブリダイズするポリヌクレオチドを用いて、DNAメチル化検出用試料に含まれるDNAのメチル化を検出する工程と、からなるDNAメチル化検出方法;
(14)前記DNAの所定領域が、遺伝子のCpGアイランドを含む領域である(13)に記載の方法;
を提供するものである。
【発明の効果】
【0011】
本発明によれば、メチル化DNAの検出において、特に生体試料の量や迅速法の使用に係わらず、迅速かつ安定して検出結果を得られる、簡便なDNAメチル化検出用試料の調製方法、DNAメチル化検出方法、生体試料前処理液及び試薬キットを提供することができる。
【発明を実施するための最良の形態】
【0012】
本実施形態のDNAメチル化検出用試料の調製方法は、プロテアーゼを含む水溶液からなる生体試料前処理液と細胞を含む生体試料を混合する工程(混合工程)と、得られた混合液に、変換剤を添加して混合物中のDNAに含まれる非メチル化シトシンを他の塩基に変換する工程(変換工程)、を含んでいる。
【0013】
本実施形態において、水溶液とは、溶媒として水を含むものであれば特に限定されず、アルコール等の有機溶媒を含んでいても良い。
【0014】
本実施形態におけるプロテアーゼとしては、タンパク質を分解する酵素であれば、特に制限されるものではないが、例えば、サーモリシン、サーモアーゼ、パパイン、トリプシン、プロナーゼ、α−キモトリプシン、ズブチリシン、ペプシン、プラスミン及びプロテイナーゼKなどが挙げられ、特にプロテイナーゼKが好ましい。
【0015】
生体試料前処理液に含まれるプロテアーゼの濃度は、使用されるプロテアーゼにより適宜選択すれば良く、特に制限されるものではないが、例えばプロテイナーゼKを使用する場合、生体試料前処理液中の濃度としては、0.5〜40mg/mlが好ましい。
【0016】
本実施形態において生体試料としては、生体から採取される細胞を含んだ試料であれば、特に制限されるものではないが、例えば、ヒト等の動物から採取したリンパ節や血液等の組織、血漿、血清、尿、唾液、体液、乳腺分泌物、ヒト等の動物から採取した組織、培養組織、及び培養細胞等が挙げられ、特に血清、血漿、生体組織、及び乳腺分泌液が好ましい。
【0017】
本実施形態における、生体試料前処理液としては、細胞を含む生体試料からDNAメチル化検出に用いられるDNAメチル化検出用試料を調製するためのものであって、プロテアーゼを含む水溶液であれば、特に制限されないが、界面活性剤及び/又はカオトロピック剤をさらに含む水溶液が好ましい。
【0018】
界面活性剤としては、細胞を可溶化できるものであれば、陰イオン性界面活性剤、陽イオン性界面活性剤、両性界面活性剤及び非イオン性界面活性剤のうち、いずれを使用してもよく、その中でも陰イオン性界面活性剤が好ましい。
【0019】
陰イオン性界面活性剤としては、ドデシル硫酸ナトリウム(SDS)、テトラデシル硫酸ナトリウム、ドデシルスルホン酸ナトリウム、テトラデシルスルホン酸ナトリウム、コール酸ナトリウム(CHO)、デオキシコール酸ナトリウム(DOC)、タウロコール酸ナトリウム、タウロデオキシコール酸ナトリウム等が挙げられ、この中でもタンパク質に対して高い親和性を有するドデシル硫酸ナトリウム(SDS)が好ましい。
【0020】
生体試料前処理液に含まれる界面活性剤の濃度は、使用する界面活性剤の種類に応じて好適な濃度を選択することが望ましい。例えば、生体試料前処理液に含まれる陰イオン性界面活性剤の濃度は、0.1〜10体積%が好ましく、0.5〜5体積%がより好ましい。
【0021】
カオトロピック剤としては、水の分子構造を不安定化する性質を持ち、疎水性分子に作用する疎水結合が弱められ、水溶性が増加するものであれば、特に制限されないが、チオシアン酸グアニジン、チオシアン酸ナトリウム、塩酸グアニジン、ヨウ化ナトリウム、ヨウ化カリウム及び尿素等が挙げられ、塩酸グアニジン及び尿素が好ましい。
【0022】
生体試料前処理液に含まれるカオトロピック剤の濃度は、使用されるカオトロピック剤により適宜選択すれば良く、特に制限されるものではない。より具体的には、例えばカオトロピック剤として、塩酸グアニジンを使用する場合、生体試料前処理液中の濃度としては、0.5〜8Mが好ましく、1〜6Mがより好ましい。また、カオトロピック剤として、尿素を使用する場合、生体試料前処理液中の濃度としては、1〜24Mが好ましい。
【0023】
また、生体試料前処理液のpHは、プロテアーゼの酵素反応が働くことができれば、特に制限されるものではないが、生体試料と混合したときに、細胞に含まれるRNAの分解を促進するためにも中性から弱アルカリ性、特にpH7〜10が好ましい。さらに、前記pHを一定に保つために、前記生体試料前処理液は、公知の緩衝液を含んでもよい。
【0024】
本実施形態における、混合工程としては、生体試料と生体試料前処理液が十分に混合され、生体試料のタンパク質が、生体試料前処理液中のプロテアーゼと反応できれば、特に制限されるものではないが、例えば25〜70℃で5〜120分間攪拌することにより行うことができる。
【0025】
生体試料前処理液の添加量としては、生体試料の量や生体試料前処理液中のプロテアーゼの濃度等に応じて適宜調節することができ、特に制限されるものではないが、例えば、100〜1000μl、好ましくは200〜600μlが、その後の変換工程における、操作性等の観点から好ましい。
【0026】
また、混合工程の前に、細胞を含む生体試料を界面活性剤及び/又はカオトロピック剤を含む溶解液で溶解する、溶解工程を行うこともできる。このように、予め生体試料に含まれる細胞を可溶化した後に、混合工程を行うことによって、好適にプロテアーゼによるタンパク質の分解を行うことができる。
【0027】
溶解工程の条件としては、界面活性剤及び/又はカオトロピック剤により、細胞が可溶化できるものであれば、特に制限されるものではないが、例えば25〜70℃で5〜120分間攪拌することにより行うことができる。
【0028】
溶解液の添加量としては、生体試料の量や溶解液中の界面活性剤及び/又はカオトロピック剤の濃度等に応じて適宜調節することができ、特に制限されるものではないが、例えば、100〜1000μl、好ましくは200〜600μlが、その後の変換工程における、操作性等の観点から好ましい。
【0029】
更に、混合工程及び/又は溶解工程の前後において、生体試料に含まれる細胞を物理的に破砕する、破砕工程を行っても良い。例えば、生体試料として切除組織などの細胞塊を用いる場合は、細胞塊と生体試料前処理液又は溶解液との混合後に細胞塊をホモジナイズする等が挙げられる。
【0030】
本実施形態における、変換工程としては、上記混合工程で得られた混合液に変換剤を添加することにより、DNAに含まれる非メチル化シトシンを他の塩基に変換することができれば、特に制限されるものではないが、上述の迅速法が反応時間の短縮の観点から好ましい。
【0031】
ここで、非メチル化シトシン変換剤とは、DNAに含まれる非メチル化シトシンを他の塩基に変換する、即ち、非メチル化シトシンを、シトシン以外の塩基(ウラシル、チミン、アデニン又はグアニン)に変換するものである。このような非メチル化シトシン変換剤として、亜硫酸水素塩(バイサルファイト)が好ましく用いられる。亜硫酸水素塩としては、亜硫酸水素のナトリウム塩、カリウム塩、カルシウム塩、マグネシウム塩などを用いることができる。これらのうち何れか1つ以上を用いてDNAを処理すると、DNA中の非メチル化シトシンは脱アミノ化によってウラシルへ変換される。一方、上記のような非メチル化シトシン変換剤はDNA中のメチル化シトシンには作用せず、変換は起こらない。この非メチル化シトシン変換剤は、溶媒に溶解し、溶液として用いることが好ましい。
【0032】
非メチル化シトシン変換剤として亜硫酸水素塩を用いる場合、生体試料中のDNAの非メチル化シトシンを充分に変換できる程度であれば添加量は特に限定されないが、例えば、1M以上、好ましくは1〜15M、より好ましくは3〜10Mである。例えば、生体試料に4Mの亜硫酸水素ナトリウムを添加する場合、10〜90分間、50〜80℃でインキュベートすることにより非メチル化シトシンのウラシルへの変換を行うことができる。また、亜硫酸水素塩を低濃度(例えば10Mの亜硫酸水素ナトリウムの水溶液400μl)で用いる場合は、非メチル化シトシンを充分に変換できる程度の時間及び温度で変換を行えばよい。非メチル化シトシン変換剤は亜硫酸水素塩に限られるものではなく、メチル化シトシンではなく非メチル化シトシンを選択的に他の塩基に変換する他の非メチル化シトシン変換剤を使用することもできる。
【0033】
DNAメチル化検出に用いられるDNAメチル化検出用試料を上記の混合工程及び変換工程で調製することにより、特に、生体試料が多量に存在する場合、及び上述の迅速法を使用した場合に、従来の特許文献1に記載のタンパク質変性剤のみで調製したDNAメチル化検出用試料では検出できなかったDNAのメチル化を検出することができる。
【0034】
また、本実施形態のDNAメチル化検出用試料の調製方法は、ゲノムDNAの抽出を省略することができるため、短時間でDNAメチル化検出用試料を調製することが可能である。更に、前処理を1つの容器内で行えるため、分注の必要がない。そのため、分注の際に生じる試料のロスを減らすことができ、検出感度を上げることができる。
【0035】
さらに、この方法は少ない工程で簡便に実行され得るため、装置等によるDNAメチル化検出用試料調製の自動化に非常に適している。また、本法を用いると、標準法で長時間かけて非メチル化シトシンのウラシルへの変換を行った場合と同等又はそれ以上の効率で非メチル化シトシンからウラシルへの変換を行うことができる。
【0036】
本実施形態において、変換工程を行う前に、DNAを切断する工程を含むこともできる。生体試料に含まれるDNAを予め適当な長さに切断して断片化しておくことにより、変換工程での非メチル化シトシンの変換を効率よく行うことができる。DNAの切断は、超音波処理(ソニケーション)等の物理的処理、アルカリ処理等の化学的処理、制限酵素等を用いる酵素処理等により行うことができる。これらのうち水酸化ナトリウムや制限酵素等のDNAを切断できる物質(切断剤)を用いることが好ましい。例えば、切断剤として水酸化ナトリウムを用いる場合、5〜15Nの水酸化ナトリウム溶液を、混合工程で得られた混合液に5〜30μl添加し、5〜15分間10〜40℃でインキュベートすることによりDNAの切断を行うことができる。
【0037】
DNAの切断に上記化学的処理又は酵素処理を行う場合には、アルカリ処理に用いる物質(例えば、水酸化ナトリウム)又は酵素(例えば、制限エンドヌクレアーゼ)を切断剤として、上記生体試料前処理液に添加することも可能である。この場合、生体試料と生体試料前処理液との混合を行うだけで、試料の可溶化と、切断工程とを一度の操作で行うことができるため、DNAメチル化検出用試料の調製時間(前処理時間)をさらに短縮することができる。水酸化ナトリウムを用いる場合、生体試料前処理液中の水酸化ナトリウム濃度は、好ましくは0.1〜1N、より好ましくは0.2〜0.5Nである。DNAの切断は、変換剤の添加前であれば、どの時点で行ってもよい。
【0038】
また、本実施形態において、変換工程を行う前に、生体試料中に含まれる二本鎖DNAを一本鎖DNAにする工程を含むこともできる。二本鎖DNAを一本鎖DNAにすることによって、変換工程での非メチル化シトシンの変換を効率よく行うことができ、また、後述するメチル化特異的PCR等の際、DNAポリメラーゼがDNAに結合しやすくなりメチル化DNAの検出をより円滑に行うことができる。
【0039】
二本鎖DNAを一本鎖DNAにする方法としては、二本鎖DNAを一本鎖DNAにすることができるものであれば、特に限定されるものではないが、例えば、DNAヘリカーゼ等の酵素を用いる方法、DNAを含む溶液の温度を上げる等の物理的な方法、及び水酸化ナトリウムでDNAをアルカリ処理する化学的方法等の公知の方法が挙げられ、特に水酸化ナトリウムでDNAをアルカリ処理する化学的方法が、DNAの切断も同時に行うことができ好ましい。
【0040】
本実施形態における、DNAメチル化検出用試料を調製するための試薬キットとしては、上記の生体試料前処理液からなる第1試薬及び変換剤を含む第2試薬からなるDNAメチル化検出用試料の試薬キットを用いることができる。この試薬キットを用いることにより、メチル化DNAの検出において、特に生体試料中のタンパク含有量や迅速法の使用に係わらず、安定して検出結果を得ることができ、DNAメチル化検出用試料を短時間で調製することができる。
【0041】
また、本実施形態の試薬キットは、上記の溶解液及び/又は切断剤をさらに含んでいても良い。この際、生体試料前処理液、変換剤、溶解液及び切断剤はそれぞれ別の容器に収容しても良いし、生体試料前処理液と切断剤とを同一の容器に収容し、変換剤を別の容器に収容しても良い。
【0042】
図1に試薬キットの一例を示す。図1の試薬キットは第1試薬及び第2試薬を備える。生体試料前処理液1からなる第1試薬は、試薬容器2に収容されている。変換剤3からなる第2試薬は、試薬容器4に収容されている。尚、上述のごとく、溶解液及び/又は切断剤を別の試薬容器に収容したものを更に備えても良い。
【0043】
本実施形態の生体試料におけるDNAメチル化検出方法は、上述したDNAメチル化検出用試料の調製方法に加え、変換工程前のDNAの所定領域にハイブリダイズするポリヌクレオチド用いて、DNAメチル化検出用試料に含まれるDNAのメチル化を検出する工程(検出工程)を含んでいる。また、検出結果の信頼性の観点から、非メチル化シトシンから変換された他の塩基を有するDNAの所定領域にハイブリダイズするポリヌクレオチドをさらに用いることが好ましい。
【0044】
本実施形態のDNAメチル化検出用試料の調製方法により調製されたDNAメチル化検出用試料は、生体試料と生体試料前処理液との混合液に変換剤を添加して得られる試料であって、この中には変換剤によって非メチル化シトシンから変換された他の塩基と5−メチルシトシンとが存在している。この変換された他の塩基と5−メチルシトシンとを識別するため、DNAメチル化検出用試料についてDNAの増幅、検出、又はこの両方の方法を行い、DNAの所定領域のメチル化状態を決定することができる。
【0045】
DNAメチル化検出は、非メチル化シトシンを他の塩基に変換する前の配列(即ち、メチル化シトシンを含む配列:以下、非変換配列とする)に特異的にハイブリダイズするポリヌクレオチドと、必要に応じ変換後の配列(以下、変換配列とする)に特異的にハイブリダイズするポリヌクレオチドとを用いて行われる。該ポリヌクレオチドをプライマーとして用い、PCR等の核酸増幅を行うことによりメチル化を検出することができる。また、該ポリヌクレオチドを基板に固定したDNAチップを用いてメチル化検出を行ってもよい。
【0046】
例えば、メチル化又は非メチル化のいずれかに変換したDNAと特異的にハイブリダイズするPCRプライマーを用いるメチル化特異的PCR(MS−PCR)、亜硫酸水素塩ゲノム配列決定、COBRA(Combined Bisulfite Restriction Analysis)、Ms−SNuPE(Methylation-sensitive Single-Nucleotide Primer Extension)等が挙げられる。また、上記のポリヌクレオチドを用いてLAMP法(USP6410278号参照)を行うことによりメチル化の検出を行ってもよい。
【0047】
MS−PCRを用いる場合、具体的には以下のようにしてメチル化を検出することができる。
1)生体試料から調製されたDNAメチル化検出用試料を2つのチューブに分注する(これらをDNAメチル化検出用試料1及びDNAメチル化検出用試料2とする)。
2)DNAメチル化検出用試料1に変換配列に特異的にハイブリダイズするポリヌクレオチド、DNAポリメラーゼ、及びdNTPs(dATP、dGTP、dTTP及びdCTP)を添加し、PCR反応液1を調製する。
3)DNAメチル化検出用試料2に非変換配列に特異的にハイブリダイズするポリヌクレオチド、DNAポリメラーゼ、及びdNTPs(dATP、dGTP、dTTP及びdCTP)を添加し、PCR反応液2を調製する。
4)PCR反応液1及び2を用いて、PCRを行う。
5)アガロースゲル電気泳動など、後述の検出方法で目的とする配列が増幅しているか否かを確認する。
【0048】
5)の結果、PCR反応液1でDNAの増幅が確認され、PCR反応液2でDNAの増幅が確認されなかった場合、ポリヌクレオチドがハイブリダイズする領域がメチル化されていないことがわかる。逆に、PCR反応液1でDNAの増幅が確認されず、PCR反応液2でDNAの増幅が確認された場合、ポリヌクレオチドがハイブリダイズする領域がメチル化されていることがわかる。
【0049】
増幅されたDNAを検出する方法は、特に限定されず、公知の方法によって検出することができる。例えば、アガロースゲル電気泳動法、蛍光標識を使用したプローブにより検出するリアルタイム検出法(この場合、上記4)及び5)を同時に行うことができる)、DNA合成の際の副生成物(ピロリン酸マグネシウム)の濁り(濁度)を測定する濁度測定法、必要に応じて酵素による切断パターンの確認や、直接シークエンス解析で塩基配列を決定する方法等を用いることができる。また、非特異的な増幅バンドが多くて特異バンドの判別が困難な場合は、標的とする増幅域内のプローブを用いたサザンブロット法等により特異バンドを確認することができる。
【0050】
ここで、上記ポリヌクレオチドはプライマーとして働くことができ、修飾型又は非修飾型DNAの相補鎖と配列特異的なハイブリダイゼーション(アニーリング)が可能な、直線状の一本鎖のオリゴマーのDNA又はRNAであり、増幅過程の間、特異的且つ効率的な重合反応(プライマー伸長)の開始を提供するような適当な配列および十分な長さを有するものである。プライマーの長さとしては、特に限定されないが、PCRに用いる場合は、5〜50merが好ましく、10〜30merがより好ましい。プライマーは一本鎖が好ましいが、鎖が最初に分離されるならば二本鎖を使用することも可能である。プライマーは、任意の適当な方法、例えば常用のホスホトリエステル法及びホスホジエステル法又は当業界で一般的に知られている自動化された態様を用いて調製することができる。
【0051】
使用するプライマーは、上述のDNAの所定領域に実質的に相補的になるように、しかも適切なGC含量となるようにデザインされることが好ましい。すなわち、上記ポリヌクレオチドは、上記変換工程の後で、特に、未処理又は非修飾DNA、メチル化DNA、及び非メチル化DNAを識別する。センスプライマー中にはCが存在せず、アンチセンスプライマー中にはGが存在しないであろうから、通常、本発明の方法で使用するオリゴヌクレオチドプライマーには、その配列中に比較的少量のC又はGが含まれる。
【0052】
ここでは、変換工程で変換剤として亜硫酸水素塩を用いた場合について説明する。第2工程で、亜硫酸水素塩によって非メチル化シトシンは、ウラシルに変換されるが、5−メチルシトシンは変換されることなくそのまま残っている。従って、変換されたウラシルを有する(非メチル化)ゲノムDNAを鋳型として、ウラシルを有する領域にハイブリダイズするポリヌクレオチドを用いて核酸増幅を行うことにより、増幅産物が生成されるが、5−メチルシトシンを含む領域にハイブリダイズするポリヌクレオチドでは増幅されずに産物が得られない。その一方で、5−メチルシトシンを有する(メチル化)ゲノムDNAは、ウラシルを有する領域にハイブリダイズするポリヌクレオチドでは増幅されずに産物が得られないが、5−メチルシトシンを含む領域にハイブリダイズするポリヌクレオチドによって増幅されて産物を与える。この産物を、例えばアガロースゲル電気泳動法によって検出することにより、DNAの所定領域がメチル化されていたか否かを解析することができる。
【0053】
本実施形態において、DNAの所定領域としては、生体試料に含まれるDNAの所望の領域でよく、特に制限されるものではないが、遺伝子のCpGアイランドが好ましい。CpGアイランドは遺伝子の転写に関係するDNA配列であり、主に遺伝子のエクソンの上流領域(プロモーター領域)に存在し、イントロンやエクソンに存在することもある。CpGアイランドがメチル化されている場合は、遺伝子の転写が抑制されていることを示し、メチル化されていない場合はプロモーター領域に転写因子が結合可能であるため、この遺伝子が転写されている、或いは転写可能な状態であることを示す。
【0054】
ここで、遺伝子としては、がん抑制遺伝子、がん遺伝子、及び腫瘍マーカーをコードする遺伝子(以下、腫瘍マーカー遺伝子とする)からなる群より選択される少なくとも1つであることが好ましい。がん抑制遺伝子としては、RB1(網膜芽細胞腫タンパク質:Retinoblastoma 1 protein)遺伝子、RRCA1遺伝子、APC(大腸腺腫症:Adenomatous polyosis of the colon)遺伝子、p53遺伝子、p16遺伝子、p15遺伝子、ERα(エストロゲンレセプター1:Estrogen Receptor 1)遺伝子、E−cad(Eカドヘリン)遺伝子、VHL(von Hipple-Lindau病)遺伝子、RASSF1A(RASassociation domain family protein)遺伝子等が挙げられ、がん遺伝子としては、RAS遺伝子、RAF遺伝子、MYC遺伝子等が挙げられる。腫瘍マーカー遺伝子としては、CEA(癌胎児性抗原:Carcinoembryonic antigen-related cell adhesion molecule 5)遺伝子、PSA(前立腺特異抗原:Prostate specific antigen)遺伝子、CA15−3遺伝子、EpCAM(Epithelial cellular adhesion molecule)遺伝子等が挙げられる。
【0055】
本実施形態の生体試料におけるDNAメチル化検出方法を用いて、これらの遺伝子のCpGアイランドのメチル化を検出することにより、疾患に罹患するリスクや薬剤感受性の予測などの遺伝子検査に応用することができる。
【0056】
例えば、所定の腫瘍細胞のがん抑制遺伝子のCpGアイランドがメチル化されている場合及び/又はがん遺伝子のCpGアイランドがメチル化されていない場合、この腫瘍細胞は悪性であると予測することができる。また、抗がん剤などの特定の薬剤を細胞外に排出する遺伝子や薬剤を分解する遺伝子のCpGアイランドがメチル化されている場合、この細胞は薬剤に対する耐性が低い、即ち、この薬剤に対して感受性であると判定することができる。また、所定の腫瘍細胞の腫瘍マーカー遺伝子のCpGアイランドのメチル化を検出することにより、腫瘍の種類を特定する(原発巣を特定する)ことも可能である。また、がん細胞の存否が不明な生体試料を用いて上述の遺伝子のCpGアイランドのメチル化を検出することにより、この生体試料に腫瘍細胞が含まれているか否かを判定することができ、腫瘍の早期発見や腫瘍に罹患するリスクの判定などを行うことができる。
【0057】
このように、疾患に罹患するリスクや薬剤感受性の予測などの遺伝子検査に応用するばあい、患者から採取した血清等のタンパク含有量が高い生体試料を用いる場合が多々あるため、従来の特許文献1に記載のタンパク質変性剤のみで調製したDNAメチル化検出用試料によりDNAメチル化検出を行った場合、十分な検出結果を得られない可能性が高い。また、遺伝子検査を迅速に行うべく、迅速法用いることで、更に検出結果の十分な取得ができず、臨床への応用が困難であった。
【0058】
本実施形態のDNAメチル化検出方法は、短時間且つ簡便な操作で、安定した検出結果を得ることができるため、上述のような遺伝子検査などの臨床検査に好適に用いることができる。また、迅速且つ簡便な本発明の方法を用いることにより、DNAのメチル化に関する研究スピードを向上させることができる。
【0059】
以下、実施例を挙げて本発明を詳細に説明するが、本発明はこれらに限定されるものではない。
【実施例】
【0060】
<生体試料の調製>
1ngのヒト乳癌由来の培養細胞であるMDA231由来のゲノムDNAに、300μlのヒト血清を加え、生体試料とした。また、コントロールとして、MDA231由来のゲノムDNAを含まない、ヒト血清300μlのみの生体試料を用いた。
【0061】
<生体試料前処理液の調製>
以下に示す、生体試料前処理液A〜Fを調整した。尚、コントロールは320μlの蒸留水を使用した。
生体試料前処理液A:
最終濃度4Mの尿素の水溶液300μlと、20mg/mlのプロテイナーゼKの水溶液20μlを混合し、320μlの生体試料前処理液Aを得た。
生体試料前処理液B:
最終濃度4Mの塩酸グアニジンの水溶液300μlと、20mg/mlのプロテイナーゼKの水溶液20μlを混合し、320μlの生体試料前処理液Bを得た。
生体試料前処理液C:
最終濃度1%のSDSの水溶液300と、20mg/mlのプロテイナーゼKの水溶液20μlを混合し、320μlの生体試料前処理液Cを得た。
生体試料前処理液D:
最終濃度1%のSDSの水溶液300と、蒸留水20μlを混合し、320μlの生体試料前処理液Dを得た。
生体試料前処理液E:
最終濃度4Mの尿素の水溶液300μlと、蒸留水20μlを混合し、320μlの生体試料前処理液Eを得た。
生体試料前処理液F:
最終濃度4Mの塩酸グアニジンの水溶液300μlと、蒸留水20μlを混合し、320μlの生体試料前処理液Fを得た。
【0062】
<DNAメチル化検出の操作手順>
調製した生体試料前処理液A〜Fを用いて、ヒト乳癌由来の培養細胞であるMDA231のERα遺伝子及びE−cad遺伝子のCpGアイランドのメチル化を、以下の操作手順で行った。
1) 生体試料及び生体試料前処理液A〜Fのいずれか1を混合し、50℃で1時間撹拌する。
2) 20μlの10N NaOHの水溶液を加え、37℃で10分間インキュベートする。
3) 600μlの10M 亜硫酸水素ナトリウムの水溶液を加え、80℃で40分間インキュベートする。
4) 亜硫酸水素塩処理されたゲノム溶液(DNAメチル化検出用試料)を、DNA精製キット(Qiagen社製QlAquik(商品名))を用いて回収する。
5) 回収したDNAメチル化検出用試料2.0μlを用いて、PCRを行う。また、反応後の反応液は4℃で保存する。
6) PCR反応後の反応液を2%アガロースゲルのウェルに収容し、電気泳動を行う。
7) 電気泳動後のアガロースゲルを臭化エチジウムで染色し、ERα遺伝子及びE−cad遺伝子のそれぞれのバンドの確認を行う。
【0063】
<PCR反応液を調製>
上記操作手順4)で回収したDNAメチル化検出用試料2.0μlと、以下の物質とを混合し、上記操作手順5)におけるPCRのPCR反応液25μlを調製した。
10× PCRバッファー(2.5μl)
2.5mM dNTP(2μl)
10μM センスプライマー(1.0μl)
10μM アンチセンスプライマー(1.0μl)
FastStart Taq DNAポリメラーゼ(0.2μl、Roche 12032902001)
水(16.3μl)
【0064】
ERα遺伝子CpGアイランドのメチル化検出用プライマーとして、以下の配列番号1及び2に示される、非変換配列に特異的なプライマーセット(以下、メチル化プライマーセットとする)を用いた。
<メチル化プライマーセット>
センスプライマー:TTTTGGGATTGTATTTGTTTTCGTC (配列番号1)
アンチセンスプライマー:AACAAAATACAAACCGTATCCCCG (配列番号2)
【0065】
上記ERα遺伝子CpGアイランドのメチル化検出のために調製したPCR反応液を用いて下記条件でPCRを行った。
95℃、9.5分
以下の工程i)〜iii)を45サイクル;
i) 95℃、30秒
ii) 60℃、15秒
iii)72℃、30秒
【0066】
E−cad遺伝子CpGアイランドのメチル化検出用プライマーとして、以下のメチル化プライマーセットを用いた。
<メチル化プライマーセット>
センスプライマー:5'-TTAGGTTAGAGGGTTATCGCGT-3' (配列番号3)
アンチセンスプライマー:5'-TAACTAAAAATTCACCTACCGAC-3' (配列番号4)
【0067】
上記E−cad遺伝子CpGアイランドのメチル化検出のために調製したPCR反応液を用いて下記条件でPCRを行った。
95℃、9.5分
以下の工程i)〜iii)を45サイクル;
i) 95℃、30秒
ii) 60℃、15秒
iii)72℃、30秒
【0068】
(実施例1)
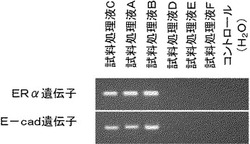
生体試料前処理液A、生体試料前処理液B及びコントロールを用いた場合の、メチル化DNAの検出結果を図2に示す。図2から明らかなように、プロテアーゼであるプロテイナーゼKと、カオトロピックイオンである尿素又は塩酸グアニジンを含有した生体試料前処理液A及び生体試料前処理液Bでは、ERα遺伝子及びE−cad遺伝子のいずれもメチル化DNAを検出することができたが、コントロールである蒸留水では、メチル化DNAを検出することができなかった。また、MDA231由来のゲノムDNAを含まない生体試料については、生体試料前処理液A及び生体試料前処理液Bいずれも、メチル化DNAは検出されなかった。
【0069】
(実施例2)
生体試料前処理液A〜F及びコントロールを用いた場合の、MDA231由来のゲノムDNAが含まれている生体試料の、メチル化DNAの検出結果を図3に示す。図3から明らかなように、プロテアーゼであるプロテイナーゼKを含有する生体試料前処理液A〜Cは、ERα遺伝子及びE−cad遺伝子のいずれもメチル化DNAを検出することができたが、プロテイナーゼKを有さない生体試料前処理液D〜Fはコントロールと同様に、メチル化DNAを検出することができなかった。
【0070】
以上の結果から、DNAメチル化検出用試料を調製するための生体試料前処理液において、SDS等の界面活性剤や尿素及び塩酸グアニジン等のカオトロピック剤のみでプロテイナーゼK等のプロテアーゼを含有しない生体試料前処理液では、特に血清等の高濃度のタンパク質を有する生体試料のメチル化DNAの検出結果を十分得ることができないが、生体前処理液にプロテアーゼを含有することで、安定したメチル化DNAの検出結果を得ることが可能となることが明らかとなった。
【図面の簡単な説明】
【0071】
【図1】DNAメチル化検出用試料を調製するための試薬キットの模式図である。
【図2】生体試料前処理液A、生体試料前処理液B及びコントロールを用いた、ERα遺伝子及びE−cad遺伝子のCpGアイランドのメチル化検出結果を示す図である。
【図3】生体試料前処理液A〜F及びコントロールを用いた、ERα遺伝子及びE−cad遺伝子のCpGアイランドのメチル化検出結果を示す図である。
【技術分野】
【0001】
本発明は、DNAのメチル化を検出するために用いられる試料(DNAメチル化検出用試料)の調製方法、DNAのメチル化を検出する方法、これらの方法に用いられる生体試料前処理液及び試薬キットに関する。
【背景技術】
【0002】
高等真核生物の染色体DNAでは、DNAを構成する塩基のうちC(シトシン)の5位がメチル化修飾を受けていることがある。この高等真核生物におけるDNAのメチル化は、原核生物の場合とは異なり、遺伝情報の発現抑制機構として機能している。例えば、ある遺伝子のCpGを多く含む領域(CpGアイランド、CG島)がメチル化されていると、その遺伝子の転写が抑制される。それに対して、CpGアイランドがメチル化を受けていないと、プロモーター領域に転写因子が結合可能となり、遺伝子が転写可能な状態になる。このように、DNAのメチル化は、遺伝子発現の制御機構の1つであり、初期胚発生、組織特異的な遺伝子の発現、哺乳動物に特徴的な現象である遺伝子刷り込みやX染色体の不活性化、染色体の安定化、DNA複製のタイミング等の様々な生理的、病理的な現象に重要な役割を果たしている。さらに近年、がんやその他の疾病にこのDNAのメチル化が強く関与することが明らかになってきている。
【0003】
DNAのメチル化を解析する方法として、一般的にメチル化特異的PCR(Methylation specific Polymerase Chain Reaction、以下「MS−PCR」という)が用いられている(非特許文献1参照)。この従来用いられている方法(以下、「標準法」という)は、通常、1)生体試料からのゲノムDNA抽出(約3時間)、2)抽出されたゲノムDNAの亜硫酸水素塩処理(約16時間)、3)修飾されたゲノムDNAの精製(約1時間)、及び4)PCR(約2時間)の4ステップで行われており、非常に時間がかかっていた(合計約22時間)。特に、PCRに至るまでの生体試料の前処理(DNAメチル化検出用試料の調製)が煩雑であり、前処理(上記1〜3)だけで約20時間かかることが問題であった。
【0004】
長時間かかる前処理時間を短縮させるべく、上記2)の亜硫酸水素塩処理を、高濃度の亜硫酸水素塩で行う方法が提案された(非特許文献2参照)。非特許文献2の方法(以下、「迅速法」という)によれば、標準法で約16時間かかっていた亜硫酸水素塩処理を約20分で行うことができるため、前処理時間が約20時間から約4時間へと短縮される。しかし、この迅速法を用いても、前処理に約4時間を要する。
【0005】
このように、検体から核酸試料を調製する工程を省き、容易にかつ微量の細胞検体からメチル化されたDNAを検出することができる方法の開発が強く望まれている。
【0006】
また、近年、極微量の細胞検体をグアニジンチオシアネート、ヨウ化ナトリウム、尿素、SDS等の従来公知のタンパク質変性剤を含む溶液で溶解した後に、調製した細胞検体溶解液を、標準法により亜硫酸水素塩で直接処理することで、タンパク質除去等の過程を行わずに細胞検体に含まれるDNAを修飾するメチル化DNAを検出する方法が知られている(特許文献1参照)。
【非特許文献1】James G.HERMAN et al., Methylation−specific PCR:A novel PCR assay for methylation status of CpG islands, Proc. Natl. Acad. Sci. USA, Vol.93, pp.9821−9826, September 1996
【非特許文献2】Masahiko SHIRAISHI and Hikoya HAYATSU, High−Speed Conversion of Cytosine to Uracil in Bisulfite Genomic Sequencing Analysis of DNA Methylation, DNA RESEARCH 11,409−415(2004)
【特許文献1】特開2005−058217号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明は、生体試料から核酸試料を調製する工程を省き、生体試料の溶解液を、亜硫酸水素塩で直接処理することでDNAのメチル化を検出する際に、安定して検出結果を得ることができる、簡便なDNAメチル化検出用試料の調製方法、DNAメチル化検出方法、生体試料前処理液及び試薬キットを提供することを目的とする。
【0008】
また本発明のDNAメチル化検出用試料の調製方法、DNAメチル化検出方法、生体試料前処理液及び試薬キットは、細胞を含む生体試料のタンパク含量が高い場合、特に迅速法を用いてDNAのメチル化検出を行う場合に有用である。
【課題を解決するための手段】
【0009】
本発明者等は、特許文献1に記載の方法では、生体試料中のタンパク含量が多い場合、DNAメチル化検出の検出結果に不良が出ること、及び特に迅速法を用い高濃度の亜硫酸水素塩で処理した際、生体試料中のタンパク質の塩析が検出結果に影響を与えることを見出し、プロテアーゼを含む生体試料前処理液で生体試料を処理することで、安定した検出結果を得るに至り、本発明を完成した。
【0010】
すなわち、本発明は、
(1)DNAメチル化検出用試料を調製するための生体試料前処理液であって、プロテアーゼを含む水溶液からなる生体試料前処理液;
(2)界面活性剤及び/又はカオトロピック剤をさらに含む、(1)に記載の生体試料前処理液;
(3)前記界面活性剤及び/又はカオトロピック剤が、ドデシル硫酸ナトリウム、尿素、及び/又は塩酸グアニジンである、(2)に記載の生体試料前処理液;
(4)DNAを切断することのできる切断剤をさらに含む、(1)〜(3)のいずれか1に記載の生体試料前処理液;
(5)pHが7〜10である(1)〜(4)のいずれか1に記載の生体試料前処理液;
(6)DNAメチル化検出用試料を調製するための試薬キットであって、(1)〜(5)のいずれか1に記載の生体試料前処理液からなる第1試薬と、DNAに含まれる非メチル化シトシンを他の塩基に変換する変換剤を含む第2試薬とからなる試薬キット;
(7)前記変換剤が、亜硫酸水素塩である(6)に記載の試薬キット;
(8)前記亜硫酸水素塩の濃度が、4〜8mMである(7)に記載の方法;
(9)DNAメチル化検出用試料の調製方法であって、プロテアーゼを含む水溶液からなる生体試料前処理液と細胞を含む生体試料を混合する工程と、得られた混合液に、変換剤を添加して混合物中のDNAに含まれる非メチル化シトシンを他の塩基に変換する工程からなるDNAメチル化検出用試料の調製方法;
(10)前記生体試料が、血清、血漿、生体組織又は乳腺分泌液である(9)に記載の方法;
(11)前記細胞が腫瘍細胞である(9)又は(10)に記載の方法;
(12)生体試料前処理液と生体試料を混合する工程の前に、細胞を含む生体試料を界面活性剤及び/又はカオトロピック剤を含む溶解液で溶解する工程、を含む(9)〜(11)のいずれか1に記載の方法;
(13)生体試料におけるDNAメチル化検出方法であって、プロテアーゼを含む水溶液からなる生体試料前処理液と細胞を含む生体試料を混合する工程と、 得られた混合液に、DNAに含まれる非メチル化シトシンを他の塩基に変換するための変換剤を添加してDNAメチル化検出用試料を調製する工程と、他の塩基への変換前のDNAの所定領域にハイブリダイズするポリヌクレオチドを用いて、DNAメチル化検出用試料に含まれるDNAのメチル化を検出する工程と、からなるDNAメチル化検出方法;
(14)前記DNAの所定領域が、遺伝子のCpGアイランドを含む領域である(13)に記載の方法;
を提供するものである。
【発明の効果】
【0011】
本発明によれば、メチル化DNAの検出において、特に生体試料の量や迅速法の使用に係わらず、迅速かつ安定して検出結果を得られる、簡便なDNAメチル化検出用試料の調製方法、DNAメチル化検出方法、生体試料前処理液及び試薬キットを提供することができる。
【発明を実施するための最良の形態】
【0012】
本実施形態のDNAメチル化検出用試料の調製方法は、プロテアーゼを含む水溶液からなる生体試料前処理液と細胞を含む生体試料を混合する工程(混合工程)と、得られた混合液に、変換剤を添加して混合物中のDNAに含まれる非メチル化シトシンを他の塩基に変換する工程(変換工程)、を含んでいる。
【0013】
本実施形態において、水溶液とは、溶媒として水を含むものであれば特に限定されず、アルコール等の有機溶媒を含んでいても良い。
【0014】
本実施形態におけるプロテアーゼとしては、タンパク質を分解する酵素であれば、特に制限されるものではないが、例えば、サーモリシン、サーモアーゼ、パパイン、トリプシン、プロナーゼ、α−キモトリプシン、ズブチリシン、ペプシン、プラスミン及びプロテイナーゼKなどが挙げられ、特にプロテイナーゼKが好ましい。
【0015】
生体試料前処理液に含まれるプロテアーゼの濃度は、使用されるプロテアーゼにより適宜選択すれば良く、特に制限されるものではないが、例えばプロテイナーゼKを使用する場合、生体試料前処理液中の濃度としては、0.5〜40mg/mlが好ましい。
【0016】
本実施形態において生体試料としては、生体から採取される細胞を含んだ試料であれば、特に制限されるものではないが、例えば、ヒト等の動物から採取したリンパ節や血液等の組織、血漿、血清、尿、唾液、体液、乳腺分泌物、ヒト等の動物から採取した組織、培養組織、及び培養細胞等が挙げられ、特に血清、血漿、生体組織、及び乳腺分泌液が好ましい。
【0017】
本実施形態における、生体試料前処理液としては、細胞を含む生体試料からDNAメチル化検出に用いられるDNAメチル化検出用試料を調製するためのものであって、プロテアーゼを含む水溶液であれば、特に制限されないが、界面活性剤及び/又はカオトロピック剤をさらに含む水溶液が好ましい。
【0018】
界面活性剤としては、細胞を可溶化できるものであれば、陰イオン性界面活性剤、陽イオン性界面活性剤、両性界面活性剤及び非イオン性界面活性剤のうち、いずれを使用してもよく、その中でも陰イオン性界面活性剤が好ましい。
【0019】
陰イオン性界面活性剤としては、ドデシル硫酸ナトリウム(SDS)、テトラデシル硫酸ナトリウム、ドデシルスルホン酸ナトリウム、テトラデシルスルホン酸ナトリウム、コール酸ナトリウム(CHO)、デオキシコール酸ナトリウム(DOC)、タウロコール酸ナトリウム、タウロデオキシコール酸ナトリウム等が挙げられ、この中でもタンパク質に対して高い親和性を有するドデシル硫酸ナトリウム(SDS)が好ましい。
【0020】
生体試料前処理液に含まれる界面活性剤の濃度は、使用する界面活性剤の種類に応じて好適な濃度を選択することが望ましい。例えば、生体試料前処理液に含まれる陰イオン性界面活性剤の濃度は、0.1〜10体積%が好ましく、0.5〜5体積%がより好ましい。
【0021】
カオトロピック剤としては、水の分子構造を不安定化する性質を持ち、疎水性分子に作用する疎水結合が弱められ、水溶性が増加するものであれば、特に制限されないが、チオシアン酸グアニジン、チオシアン酸ナトリウム、塩酸グアニジン、ヨウ化ナトリウム、ヨウ化カリウム及び尿素等が挙げられ、塩酸グアニジン及び尿素が好ましい。
【0022】
生体試料前処理液に含まれるカオトロピック剤の濃度は、使用されるカオトロピック剤により適宜選択すれば良く、特に制限されるものではない。より具体的には、例えばカオトロピック剤として、塩酸グアニジンを使用する場合、生体試料前処理液中の濃度としては、0.5〜8Mが好ましく、1〜6Mがより好ましい。また、カオトロピック剤として、尿素を使用する場合、生体試料前処理液中の濃度としては、1〜24Mが好ましい。
【0023】
また、生体試料前処理液のpHは、プロテアーゼの酵素反応が働くことができれば、特に制限されるものではないが、生体試料と混合したときに、細胞に含まれるRNAの分解を促進するためにも中性から弱アルカリ性、特にpH7〜10が好ましい。さらに、前記pHを一定に保つために、前記生体試料前処理液は、公知の緩衝液を含んでもよい。
【0024】
本実施形態における、混合工程としては、生体試料と生体試料前処理液が十分に混合され、生体試料のタンパク質が、生体試料前処理液中のプロテアーゼと反応できれば、特に制限されるものではないが、例えば25〜70℃で5〜120分間攪拌することにより行うことができる。
【0025】
生体試料前処理液の添加量としては、生体試料の量や生体試料前処理液中のプロテアーゼの濃度等に応じて適宜調節することができ、特に制限されるものではないが、例えば、100〜1000μl、好ましくは200〜600μlが、その後の変換工程における、操作性等の観点から好ましい。
【0026】
また、混合工程の前に、細胞を含む生体試料を界面活性剤及び/又はカオトロピック剤を含む溶解液で溶解する、溶解工程を行うこともできる。このように、予め生体試料に含まれる細胞を可溶化した後に、混合工程を行うことによって、好適にプロテアーゼによるタンパク質の分解を行うことができる。
【0027】
溶解工程の条件としては、界面活性剤及び/又はカオトロピック剤により、細胞が可溶化できるものであれば、特に制限されるものではないが、例えば25〜70℃で5〜120分間攪拌することにより行うことができる。
【0028】
溶解液の添加量としては、生体試料の量や溶解液中の界面活性剤及び/又はカオトロピック剤の濃度等に応じて適宜調節することができ、特に制限されるものではないが、例えば、100〜1000μl、好ましくは200〜600μlが、その後の変換工程における、操作性等の観点から好ましい。
【0029】
更に、混合工程及び/又は溶解工程の前後において、生体試料に含まれる細胞を物理的に破砕する、破砕工程を行っても良い。例えば、生体試料として切除組織などの細胞塊を用いる場合は、細胞塊と生体試料前処理液又は溶解液との混合後に細胞塊をホモジナイズする等が挙げられる。
【0030】
本実施形態における、変換工程としては、上記混合工程で得られた混合液に変換剤を添加することにより、DNAに含まれる非メチル化シトシンを他の塩基に変換することができれば、特に制限されるものではないが、上述の迅速法が反応時間の短縮の観点から好ましい。
【0031】
ここで、非メチル化シトシン変換剤とは、DNAに含まれる非メチル化シトシンを他の塩基に変換する、即ち、非メチル化シトシンを、シトシン以外の塩基(ウラシル、チミン、アデニン又はグアニン)に変換するものである。このような非メチル化シトシン変換剤として、亜硫酸水素塩(バイサルファイト)が好ましく用いられる。亜硫酸水素塩としては、亜硫酸水素のナトリウム塩、カリウム塩、カルシウム塩、マグネシウム塩などを用いることができる。これらのうち何れか1つ以上を用いてDNAを処理すると、DNA中の非メチル化シトシンは脱アミノ化によってウラシルへ変換される。一方、上記のような非メチル化シトシン変換剤はDNA中のメチル化シトシンには作用せず、変換は起こらない。この非メチル化シトシン変換剤は、溶媒に溶解し、溶液として用いることが好ましい。
【0032】
非メチル化シトシン変換剤として亜硫酸水素塩を用いる場合、生体試料中のDNAの非メチル化シトシンを充分に変換できる程度であれば添加量は特に限定されないが、例えば、1M以上、好ましくは1〜15M、より好ましくは3〜10Mである。例えば、生体試料に4Mの亜硫酸水素ナトリウムを添加する場合、10〜90分間、50〜80℃でインキュベートすることにより非メチル化シトシンのウラシルへの変換を行うことができる。また、亜硫酸水素塩を低濃度(例えば10Mの亜硫酸水素ナトリウムの水溶液400μl)で用いる場合は、非メチル化シトシンを充分に変換できる程度の時間及び温度で変換を行えばよい。非メチル化シトシン変換剤は亜硫酸水素塩に限られるものではなく、メチル化シトシンではなく非メチル化シトシンを選択的に他の塩基に変換する他の非メチル化シトシン変換剤を使用することもできる。
【0033】
DNAメチル化検出に用いられるDNAメチル化検出用試料を上記の混合工程及び変換工程で調製することにより、特に、生体試料が多量に存在する場合、及び上述の迅速法を使用した場合に、従来の特許文献1に記載のタンパク質変性剤のみで調製したDNAメチル化検出用試料では検出できなかったDNAのメチル化を検出することができる。
【0034】
また、本実施形態のDNAメチル化検出用試料の調製方法は、ゲノムDNAの抽出を省略することができるため、短時間でDNAメチル化検出用試料を調製することが可能である。更に、前処理を1つの容器内で行えるため、分注の必要がない。そのため、分注の際に生じる試料のロスを減らすことができ、検出感度を上げることができる。
【0035】
さらに、この方法は少ない工程で簡便に実行され得るため、装置等によるDNAメチル化検出用試料調製の自動化に非常に適している。また、本法を用いると、標準法で長時間かけて非メチル化シトシンのウラシルへの変換を行った場合と同等又はそれ以上の効率で非メチル化シトシンからウラシルへの変換を行うことができる。
【0036】
本実施形態において、変換工程を行う前に、DNAを切断する工程を含むこともできる。生体試料に含まれるDNAを予め適当な長さに切断して断片化しておくことにより、変換工程での非メチル化シトシンの変換を効率よく行うことができる。DNAの切断は、超音波処理(ソニケーション)等の物理的処理、アルカリ処理等の化学的処理、制限酵素等を用いる酵素処理等により行うことができる。これらのうち水酸化ナトリウムや制限酵素等のDNAを切断できる物質(切断剤)を用いることが好ましい。例えば、切断剤として水酸化ナトリウムを用いる場合、5〜15Nの水酸化ナトリウム溶液を、混合工程で得られた混合液に5〜30μl添加し、5〜15分間10〜40℃でインキュベートすることによりDNAの切断を行うことができる。
【0037】
DNAの切断に上記化学的処理又は酵素処理を行う場合には、アルカリ処理に用いる物質(例えば、水酸化ナトリウム)又は酵素(例えば、制限エンドヌクレアーゼ)を切断剤として、上記生体試料前処理液に添加することも可能である。この場合、生体試料と生体試料前処理液との混合を行うだけで、試料の可溶化と、切断工程とを一度の操作で行うことができるため、DNAメチル化検出用試料の調製時間(前処理時間)をさらに短縮することができる。水酸化ナトリウムを用いる場合、生体試料前処理液中の水酸化ナトリウム濃度は、好ましくは0.1〜1N、より好ましくは0.2〜0.5Nである。DNAの切断は、変換剤の添加前であれば、どの時点で行ってもよい。
【0038】
また、本実施形態において、変換工程を行う前に、生体試料中に含まれる二本鎖DNAを一本鎖DNAにする工程を含むこともできる。二本鎖DNAを一本鎖DNAにすることによって、変換工程での非メチル化シトシンの変換を効率よく行うことができ、また、後述するメチル化特異的PCR等の際、DNAポリメラーゼがDNAに結合しやすくなりメチル化DNAの検出をより円滑に行うことができる。
【0039】
二本鎖DNAを一本鎖DNAにする方法としては、二本鎖DNAを一本鎖DNAにすることができるものであれば、特に限定されるものではないが、例えば、DNAヘリカーゼ等の酵素を用いる方法、DNAを含む溶液の温度を上げる等の物理的な方法、及び水酸化ナトリウムでDNAをアルカリ処理する化学的方法等の公知の方法が挙げられ、特に水酸化ナトリウムでDNAをアルカリ処理する化学的方法が、DNAの切断も同時に行うことができ好ましい。
【0040】
本実施形態における、DNAメチル化検出用試料を調製するための試薬キットとしては、上記の生体試料前処理液からなる第1試薬及び変換剤を含む第2試薬からなるDNAメチル化検出用試料の試薬キットを用いることができる。この試薬キットを用いることにより、メチル化DNAの検出において、特に生体試料中のタンパク含有量や迅速法の使用に係わらず、安定して検出結果を得ることができ、DNAメチル化検出用試料を短時間で調製することができる。
【0041】
また、本実施形態の試薬キットは、上記の溶解液及び/又は切断剤をさらに含んでいても良い。この際、生体試料前処理液、変換剤、溶解液及び切断剤はそれぞれ別の容器に収容しても良いし、生体試料前処理液と切断剤とを同一の容器に収容し、変換剤を別の容器に収容しても良い。
【0042】
図1に試薬キットの一例を示す。図1の試薬キットは第1試薬及び第2試薬を備える。生体試料前処理液1からなる第1試薬は、試薬容器2に収容されている。変換剤3からなる第2試薬は、試薬容器4に収容されている。尚、上述のごとく、溶解液及び/又は切断剤を別の試薬容器に収容したものを更に備えても良い。
【0043】
本実施形態の生体試料におけるDNAメチル化検出方法は、上述したDNAメチル化検出用試料の調製方法に加え、変換工程前のDNAの所定領域にハイブリダイズするポリヌクレオチド用いて、DNAメチル化検出用試料に含まれるDNAのメチル化を検出する工程(検出工程)を含んでいる。また、検出結果の信頼性の観点から、非メチル化シトシンから変換された他の塩基を有するDNAの所定領域にハイブリダイズするポリヌクレオチドをさらに用いることが好ましい。
【0044】
本実施形態のDNAメチル化検出用試料の調製方法により調製されたDNAメチル化検出用試料は、生体試料と生体試料前処理液との混合液に変換剤を添加して得られる試料であって、この中には変換剤によって非メチル化シトシンから変換された他の塩基と5−メチルシトシンとが存在している。この変換された他の塩基と5−メチルシトシンとを識別するため、DNAメチル化検出用試料についてDNAの増幅、検出、又はこの両方の方法を行い、DNAの所定領域のメチル化状態を決定することができる。
【0045】
DNAメチル化検出は、非メチル化シトシンを他の塩基に変換する前の配列(即ち、メチル化シトシンを含む配列:以下、非変換配列とする)に特異的にハイブリダイズするポリヌクレオチドと、必要に応じ変換後の配列(以下、変換配列とする)に特異的にハイブリダイズするポリヌクレオチドとを用いて行われる。該ポリヌクレオチドをプライマーとして用い、PCR等の核酸増幅を行うことによりメチル化を検出することができる。また、該ポリヌクレオチドを基板に固定したDNAチップを用いてメチル化検出を行ってもよい。
【0046】
例えば、メチル化又は非メチル化のいずれかに変換したDNAと特異的にハイブリダイズするPCRプライマーを用いるメチル化特異的PCR(MS−PCR)、亜硫酸水素塩ゲノム配列決定、COBRA(Combined Bisulfite Restriction Analysis)、Ms−SNuPE(Methylation-sensitive Single-Nucleotide Primer Extension)等が挙げられる。また、上記のポリヌクレオチドを用いてLAMP法(USP6410278号参照)を行うことによりメチル化の検出を行ってもよい。
【0047】
MS−PCRを用いる場合、具体的には以下のようにしてメチル化を検出することができる。
1)生体試料から調製されたDNAメチル化検出用試料を2つのチューブに分注する(これらをDNAメチル化検出用試料1及びDNAメチル化検出用試料2とする)。
2)DNAメチル化検出用試料1に変換配列に特異的にハイブリダイズするポリヌクレオチド、DNAポリメラーゼ、及びdNTPs(dATP、dGTP、dTTP及びdCTP)を添加し、PCR反応液1を調製する。
3)DNAメチル化検出用試料2に非変換配列に特異的にハイブリダイズするポリヌクレオチド、DNAポリメラーゼ、及びdNTPs(dATP、dGTP、dTTP及びdCTP)を添加し、PCR反応液2を調製する。
4)PCR反応液1及び2を用いて、PCRを行う。
5)アガロースゲル電気泳動など、後述の検出方法で目的とする配列が増幅しているか否かを確認する。
【0048】
5)の結果、PCR反応液1でDNAの増幅が確認され、PCR反応液2でDNAの増幅が確認されなかった場合、ポリヌクレオチドがハイブリダイズする領域がメチル化されていないことがわかる。逆に、PCR反応液1でDNAの増幅が確認されず、PCR反応液2でDNAの増幅が確認された場合、ポリヌクレオチドがハイブリダイズする領域がメチル化されていることがわかる。
【0049】
増幅されたDNAを検出する方法は、特に限定されず、公知の方法によって検出することができる。例えば、アガロースゲル電気泳動法、蛍光標識を使用したプローブにより検出するリアルタイム検出法(この場合、上記4)及び5)を同時に行うことができる)、DNA合成の際の副生成物(ピロリン酸マグネシウム)の濁り(濁度)を測定する濁度測定法、必要に応じて酵素による切断パターンの確認や、直接シークエンス解析で塩基配列を決定する方法等を用いることができる。また、非特異的な増幅バンドが多くて特異バンドの判別が困難な場合は、標的とする増幅域内のプローブを用いたサザンブロット法等により特異バンドを確認することができる。
【0050】
ここで、上記ポリヌクレオチドはプライマーとして働くことができ、修飾型又は非修飾型DNAの相補鎖と配列特異的なハイブリダイゼーション(アニーリング)が可能な、直線状の一本鎖のオリゴマーのDNA又はRNAであり、増幅過程の間、特異的且つ効率的な重合反応(プライマー伸長)の開始を提供するような適当な配列および十分な長さを有するものである。プライマーの長さとしては、特に限定されないが、PCRに用いる場合は、5〜50merが好ましく、10〜30merがより好ましい。プライマーは一本鎖が好ましいが、鎖が最初に分離されるならば二本鎖を使用することも可能である。プライマーは、任意の適当な方法、例えば常用のホスホトリエステル法及びホスホジエステル法又は当業界で一般的に知られている自動化された態様を用いて調製することができる。
【0051】
使用するプライマーは、上述のDNAの所定領域に実質的に相補的になるように、しかも適切なGC含量となるようにデザインされることが好ましい。すなわち、上記ポリヌクレオチドは、上記変換工程の後で、特に、未処理又は非修飾DNA、メチル化DNA、及び非メチル化DNAを識別する。センスプライマー中にはCが存在せず、アンチセンスプライマー中にはGが存在しないであろうから、通常、本発明の方法で使用するオリゴヌクレオチドプライマーには、その配列中に比較的少量のC又はGが含まれる。
【0052】
ここでは、変換工程で変換剤として亜硫酸水素塩を用いた場合について説明する。第2工程で、亜硫酸水素塩によって非メチル化シトシンは、ウラシルに変換されるが、5−メチルシトシンは変換されることなくそのまま残っている。従って、変換されたウラシルを有する(非メチル化)ゲノムDNAを鋳型として、ウラシルを有する領域にハイブリダイズするポリヌクレオチドを用いて核酸増幅を行うことにより、増幅産物が生成されるが、5−メチルシトシンを含む領域にハイブリダイズするポリヌクレオチドでは増幅されずに産物が得られない。その一方で、5−メチルシトシンを有する(メチル化)ゲノムDNAは、ウラシルを有する領域にハイブリダイズするポリヌクレオチドでは増幅されずに産物が得られないが、5−メチルシトシンを含む領域にハイブリダイズするポリヌクレオチドによって増幅されて産物を与える。この産物を、例えばアガロースゲル電気泳動法によって検出することにより、DNAの所定領域がメチル化されていたか否かを解析することができる。
【0053】
本実施形態において、DNAの所定領域としては、生体試料に含まれるDNAの所望の領域でよく、特に制限されるものではないが、遺伝子のCpGアイランドが好ましい。CpGアイランドは遺伝子の転写に関係するDNA配列であり、主に遺伝子のエクソンの上流領域(プロモーター領域)に存在し、イントロンやエクソンに存在することもある。CpGアイランドがメチル化されている場合は、遺伝子の転写が抑制されていることを示し、メチル化されていない場合はプロモーター領域に転写因子が結合可能であるため、この遺伝子が転写されている、或いは転写可能な状態であることを示す。
【0054】
ここで、遺伝子としては、がん抑制遺伝子、がん遺伝子、及び腫瘍マーカーをコードする遺伝子(以下、腫瘍マーカー遺伝子とする)からなる群より選択される少なくとも1つであることが好ましい。がん抑制遺伝子としては、RB1(網膜芽細胞腫タンパク質:Retinoblastoma 1 protein)遺伝子、RRCA1遺伝子、APC(大腸腺腫症:Adenomatous polyosis of the colon)遺伝子、p53遺伝子、p16遺伝子、p15遺伝子、ERα(エストロゲンレセプター1:Estrogen Receptor 1)遺伝子、E−cad(Eカドヘリン)遺伝子、VHL(von Hipple-Lindau病)遺伝子、RASSF1A(RASassociation domain family protein)遺伝子等が挙げられ、がん遺伝子としては、RAS遺伝子、RAF遺伝子、MYC遺伝子等が挙げられる。腫瘍マーカー遺伝子としては、CEA(癌胎児性抗原:Carcinoembryonic antigen-related cell adhesion molecule 5)遺伝子、PSA(前立腺特異抗原:Prostate specific antigen)遺伝子、CA15−3遺伝子、EpCAM(Epithelial cellular adhesion molecule)遺伝子等が挙げられる。
【0055】
本実施形態の生体試料におけるDNAメチル化検出方法を用いて、これらの遺伝子のCpGアイランドのメチル化を検出することにより、疾患に罹患するリスクや薬剤感受性の予測などの遺伝子検査に応用することができる。
【0056】
例えば、所定の腫瘍細胞のがん抑制遺伝子のCpGアイランドがメチル化されている場合及び/又はがん遺伝子のCpGアイランドがメチル化されていない場合、この腫瘍細胞は悪性であると予測することができる。また、抗がん剤などの特定の薬剤を細胞外に排出する遺伝子や薬剤を分解する遺伝子のCpGアイランドがメチル化されている場合、この細胞は薬剤に対する耐性が低い、即ち、この薬剤に対して感受性であると判定することができる。また、所定の腫瘍細胞の腫瘍マーカー遺伝子のCpGアイランドのメチル化を検出することにより、腫瘍の種類を特定する(原発巣を特定する)ことも可能である。また、がん細胞の存否が不明な生体試料を用いて上述の遺伝子のCpGアイランドのメチル化を検出することにより、この生体試料に腫瘍細胞が含まれているか否かを判定することができ、腫瘍の早期発見や腫瘍に罹患するリスクの判定などを行うことができる。
【0057】
このように、疾患に罹患するリスクや薬剤感受性の予測などの遺伝子検査に応用するばあい、患者から採取した血清等のタンパク含有量が高い生体試料を用いる場合が多々あるため、従来の特許文献1に記載のタンパク質変性剤のみで調製したDNAメチル化検出用試料によりDNAメチル化検出を行った場合、十分な検出結果を得られない可能性が高い。また、遺伝子検査を迅速に行うべく、迅速法用いることで、更に検出結果の十分な取得ができず、臨床への応用が困難であった。
【0058】
本実施形態のDNAメチル化検出方法は、短時間且つ簡便な操作で、安定した検出結果を得ることができるため、上述のような遺伝子検査などの臨床検査に好適に用いることができる。また、迅速且つ簡便な本発明の方法を用いることにより、DNAのメチル化に関する研究スピードを向上させることができる。
【0059】
以下、実施例を挙げて本発明を詳細に説明するが、本発明はこれらに限定されるものではない。
【実施例】
【0060】
<生体試料の調製>
1ngのヒト乳癌由来の培養細胞であるMDA231由来のゲノムDNAに、300μlのヒト血清を加え、生体試料とした。また、コントロールとして、MDA231由来のゲノムDNAを含まない、ヒト血清300μlのみの生体試料を用いた。
【0061】
<生体試料前処理液の調製>
以下に示す、生体試料前処理液A〜Fを調整した。尚、コントロールは320μlの蒸留水を使用した。
生体試料前処理液A:
最終濃度4Mの尿素の水溶液300μlと、20mg/mlのプロテイナーゼKの水溶液20μlを混合し、320μlの生体試料前処理液Aを得た。
生体試料前処理液B:
最終濃度4Mの塩酸グアニジンの水溶液300μlと、20mg/mlのプロテイナーゼKの水溶液20μlを混合し、320μlの生体試料前処理液Bを得た。
生体試料前処理液C:
最終濃度1%のSDSの水溶液300と、20mg/mlのプロテイナーゼKの水溶液20μlを混合し、320μlの生体試料前処理液Cを得た。
生体試料前処理液D:
最終濃度1%のSDSの水溶液300と、蒸留水20μlを混合し、320μlの生体試料前処理液Dを得た。
生体試料前処理液E:
最終濃度4Mの尿素の水溶液300μlと、蒸留水20μlを混合し、320μlの生体試料前処理液Eを得た。
生体試料前処理液F:
最終濃度4Mの塩酸グアニジンの水溶液300μlと、蒸留水20μlを混合し、320μlの生体試料前処理液Fを得た。
【0062】
<DNAメチル化検出の操作手順>
調製した生体試料前処理液A〜Fを用いて、ヒト乳癌由来の培養細胞であるMDA231のERα遺伝子及びE−cad遺伝子のCpGアイランドのメチル化を、以下の操作手順で行った。
1) 生体試料及び生体試料前処理液A〜Fのいずれか1を混合し、50℃で1時間撹拌する。
2) 20μlの10N NaOHの水溶液を加え、37℃で10分間インキュベートする。
3) 600μlの10M 亜硫酸水素ナトリウムの水溶液を加え、80℃で40分間インキュベートする。
4) 亜硫酸水素塩処理されたゲノム溶液(DNAメチル化検出用試料)を、DNA精製キット(Qiagen社製QlAquik(商品名))を用いて回収する。
5) 回収したDNAメチル化検出用試料2.0μlを用いて、PCRを行う。また、反応後の反応液は4℃で保存する。
6) PCR反応後の反応液を2%アガロースゲルのウェルに収容し、電気泳動を行う。
7) 電気泳動後のアガロースゲルを臭化エチジウムで染色し、ERα遺伝子及びE−cad遺伝子のそれぞれのバンドの確認を行う。
【0063】
<PCR反応液を調製>
上記操作手順4)で回収したDNAメチル化検出用試料2.0μlと、以下の物質とを混合し、上記操作手順5)におけるPCRのPCR反応液25μlを調製した。
10× PCRバッファー(2.5μl)
2.5mM dNTP(2μl)
10μM センスプライマー(1.0μl)
10μM アンチセンスプライマー(1.0μl)
FastStart Taq DNAポリメラーゼ(0.2μl、Roche 12032902001)
水(16.3μl)
【0064】
ERα遺伝子CpGアイランドのメチル化検出用プライマーとして、以下の配列番号1及び2に示される、非変換配列に特異的なプライマーセット(以下、メチル化プライマーセットとする)を用いた。
<メチル化プライマーセット>
センスプライマー:TTTTGGGATTGTATTTGTTTTCGTC (配列番号1)
アンチセンスプライマー:AACAAAATACAAACCGTATCCCCG (配列番号2)
【0065】
上記ERα遺伝子CpGアイランドのメチル化検出のために調製したPCR反応液を用いて下記条件でPCRを行った。
95℃、9.5分
以下の工程i)〜iii)を45サイクル;
i) 95℃、30秒
ii) 60℃、15秒
iii)72℃、30秒
【0066】
E−cad遺伝子CpGアイランドのメチル化検出用プライマーとして、以下のメチル化プライマーセットを用いた。
<メチル化プライマーセット>
センスプライマー:5'-TTAGGTTAGAGGGTTATCGCGT-3' (配列番号3)
アンチセンスプライマー:5'-TAACTAAAAATTCACCTACCGAC-3' (配列番号4)
【0067】
上記E−cad遺伝子CpGアイランドのメチル化検出のために調製したPCR反応液を用いて下記条件でPCRを行った。
95℃、9.5分
以下の工程i)〜iii)を45サイクル;
i) 95℃、30秒
ii) 60℃、15秒
iii)72℃、30秒
【0068】
(実施例1)
生体試料前処理液A、生体試料前処理液B及びコントロールを用いた場合の、メチル化DNAの検出結果を図2に示す。図2から明らかなように、プロテアーゼであるプロテイナーゼKと、カオトロピックイオンである尿素又は塩酸グアニジンを含有した生体試料前処理液A及び生体試料前処理液Bでは、ERα遺伝子及びE−cad遺伝子のいずれもメチル化DNAを検出することができたが、コントロールである蒸留水では、メチル化DNAを検出することができなかった。また、MDA231由来のゲノムDNAを含まない生体試料については、生体試料前処理液A及び生体試料前処理液Bいずれも、メチル化DNAは検出されなかった。
【0069】
(実施例2)
生体試料前処理液A〜F及びコントロールを用いた場合の、MDA231由来のゲノムDNAが含まれている生体試料の、メチル化DNAの検出結果を図3に示す。図3から明らかなように、プロテアーゼであるプロテイナーゼKを含有する生体試料前処理液A〜Cは、ERα遺伝子及びE−cad遺伝子のいずれもメチル化DNAを検出することができたが、プロテイナーゼKを有さない生体試料前処理液D〜Fはコントロールと同様に、メチル化DNAを検出することができなかった。
【0070】
以上の結果から、DNAメチル化検出用試料を調製するための生体試料前処理液において、SDS等の界面活性剤や尿素及び塩酸グアニジン等のカオトロピック剤のみでプロテイナーゼK等のプロテアーゼを含有しない生体試料前処理液では、特に血清等の高濃度のタンパク質を有する生体試料のメチル化DNAの検出結果を十分得ることができないが、生体前処理液にプロテアーゼを含有することで、安定したメチル化DNAの検出結果を得ることが可能となることが明らかとなった。
【図面の簡単な説明】
【0071】
【図1】DNAメチル化検出用試料を調製するための試薬キットの模式図である。
【図2】生体試料前処理液A、生体試料前処理液B及びコントロールを用いた、ERα遺伝子及びE−cad遺伝子のCpGアイランドのメチル化検出結果を示す図である。
【図3】生体試料前処理液A〜F及びコントロールを用いた、ERα遺伝子及びE−cad遺伝子のCpGアイランドのメチル化検出結果を示す図である。
【特許請求の範囲】
【請求項1】
DNAメチル化検出用試料を調製するための生体試料前処理液であって、プロテアーゼを含む水溶液からなる生体試料前処理液。
【請求項2】
界面活性剤及び/又はカオトロピック剤をさらに含む、請求項1に記載の生体試料前処理液。
【請求項3】
前記界面活性剤及び/又はカオトロピック剤が、ドデシル硫酸ナトリウム、尿素、及び/又は塩酸グアニジンである、請求項2に記載の生体試料前処理液。
【請求項4】
DNAを切断することのできる切断剤をさらに含む、請求項1〜3のいずれか1項に記載の生体試料前処理液。
【請求項5】
pHが7〜10である請求項1〜4のいずれか1項に記載の生体試料前処理液。
【請求項6】
DNAメチル化検出用試料を調製するための試薬キットであって、請求項1〜5のいずれか1項に記載の生体試料前処理液からなる第1試薬と、DNAに含まれる非メチル化シトシンを他の塩基に変換する変換剤を含む第2試薬とからなる試薬キット。
【請求項7】
前記変換剤が、亜硫酸水素塩である請求項6に記載の試薬キット。
【請求項8】
前記亜硫酸水素塩の濃度が、4〜8mMである請求項7に記載の方法。
【請求項9】
DNAメチル化検出用試料の調製方法であって、
プロテアーゼを含む水溶液からなる生体試料前処理液と細胞を含む生体試料を混合する工程と、
得られた混合液に、変換剤を添加して混合物中のDNAに含まれる非メチル化シトシンを他の塩基に変換する工程からなるDNAメチル化検出用試料の調製方法。
【請求項10】
前記生体試料が、血清、血漿、生体組織又は乳腺分泌液である請求項9に記載の方法。
【請求項11】
前記細胞が腫瘍細胞である請求項9又は10に記載の方法。
【請求項12】
生体試料前処理液と生体試料を混合する工程の前に、細胞を含む生体試料を界面活性剤及び/又はカオトロピック剤を含む溶解液で溶解する工程、を含む請求項9〜11のいずれか1項に記載の方法。
【請求項13】
生体試料におけるDNAメチル化検出方法であって、
プロテアーゼを含む水溶液からなる生体試料前処理液と細胞を含む生体試料を混合する工程と、
得られた混合液に、DNAに含まれる非メチル化シトシンを他の塩基に変換するための変換剤を添加してDNAメチル化検出用試料を調製する工程と、
他の塩基への変換前のDNAの所定領域にハイブリダイズするポリヌクレオチドを用いて、DNAメチル化検出用試料に含まれるDNAのメチル化を検出する工程と、からなるDNAメチル化検出方法。
【請求項14】
前記DNAの所定領域が、遺伝子のCpGアイランドを含む領域である請求項13に記載の方法。
【請求項1】
DNAメチル化検出用試料を調製するための生体試料前処理液であって、プロテアーゼを含む水溶液からなる生体試料前処理液。
【請求項2】
界面活性剤及び/又はカオトロピック剤をさらに含む、請求項1に記載の生体試料前処理液。
【請求項3】
前記界面活性剤及び/又はカオトロピック剤が、ドデシル硫酸ナトリウム、尿素、及び/又は塩酸グアニジンである、請求項2に記載の生体試料前処理液。
【請求項4】
DNAを切断することのできる切断剤をさらに含む、請求項1〜3のいずれか1項に記載の生体試料前処理液。
【請求項5】
pHが7〜10である請求項1〜4のいずれか1項に記載の生体試料前処理液。
【請求項6】
DNAメチル化検出用試料を調製するための試薬キットであって、請求項1〜5のいずれか1項に記載の生体試料前処理液からなる第1試薬と、DNAに含まれる非メチル化シトシンを他の塩基に変換する変換剤を含む第2試薬とからなる試薬キット。
【請求項7】
前記変換剤が、亜硫酸水素塩である請求項6に記載の試薬キット。
【請求項8】
前記亜硫酸水素塩の濃度が、4〜8mMである請求項7に記載の方法。
【請求項9】
DNAメチル化検出用試料の調製方法であって、
プロテアーゼを含む水溶液からなる生体試料前処理液と細胞を含む生体試料を混合する工程と、
得られた混合液に、変換剤を添加して混合物中のDNAに含まれる非メチル化シトシンを他の塩基に変換する工程からなるDNAメチル化検出用試料の調製方法。
【請求項10】
前記生体試料が、血清、血漿、生体組織又は乳腺分泌液である請求項9に記載の方法。
【請求項11】
前記細胞が腫瘍細胞である請求項9又は10に記載の方法。
【請求項12】
生体試料前処理液と生体試料を混合する工程の前に、細胞を含む生体試料を界面活性剤及び/又はカオトロピック剤を含む溶解液で溶解する工程、を含む請求項9〜11のいずれか1項に記載の方法。
【請求項13】
生体試料におけるDNAメチル化検出方法であって、
プロテアーゼを含む水溶液からなる生体試料前処理液と細胞を含む生体試料を混合する工程と、
得られた混合液に、DNAに含まれる非メチル化シトシンを他の塩基に変換するための変換剤を添加してDNAメチル化検出用試料を調製する工程と、
他の塩基への変換前のDNAの所定領域にハイブリダイズするポリヌクレオチドを用いて、DNAメチル化検出用試料に含まれるDNAのメチル化を検出する工程と、からなるDNAメチル化検出方法。
【請求項14】
前記DNAの所定領域が、遺伝子のCpGアイランドを含む領域である請求項13に記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2008−212009(P2008−212009A)
【公開日】平成20年9月18日(2008.9.18)
【国際特許分類】
【出願番号】特願2007−50748(P2007−50748)
【出願日】平成19年2月28日(2007.2.28)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
【公開日】平成20年9月18日(2008.9.18)
【国際特許分類】
【出願日】平成19年2月28日(2007.2.28)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
[ Back to top ]

