DP2アンタゴニストおよびその使用
本明細書には、DP2アンタゴニス2−(3−(2−((tert−ブチルチオ)メチル)−4−(2,2−ジメチル−プロピオニルアミノ)フェノキシ)−4−メトキシフェニル)酢酸またはその薬学的に許容可能な塩が記載される。また、DP2アンタゴニスまたはその薬学的に許容可能な塩を調製する方法も記載される。また、DP2アンタゴニスまたはその薬学的に許容可能な塩を含む哺乳動物に投与するのに適切な医薬組成物、および呼吸器疾患又は疾病、アレルギー性疾患又は疾病、炎症性疾患又は疾病のほか、他のプロスタグランジンD2−依存性又はプロスタグランジンD2−媒介性疾患又は疾病を処置するためのそのような医薬組成物を使用する方法も本明細書に記載される。
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
2−(3−(2−((tert−ブチルチオ)メチル)−4−(2,2−ジメチル−プロピオニルアミノ)フェノキシ)−4−メトキシフェニル)酢酸(化合物1)の薬学的に許容可能な塩であって、該薬学的に許容可能な塩が、カルシウム塩、カリウム塩、ナトリウム塩、アンモニウム塩、L−アルギニン塩、L−リジン塩又はN−メチル−D−グルカミン塩であることを特徴とする塩。
【請求項2】
前記薬学的に許容可能な塩が、ナトリウム塩であり、該ナトリウム塩が、化合物2の構造
【化1】

を有することを特徴とする請求項1に記載の薬学的に許容可能な塩。
【請求項3】
化合物2が非結晶性であることを特徴とする請求項2に記載の薬学的に許容可能な塩。
【請求項4】
化合物2が結晶性であることを特徴とする請求項2に記載の薬学的に許容可能な塩。
【請求項5】
化合物2が結晶性であり、以下の特性:
(a)3.7°2θ、13.5°2θ、17.1°2θおよび18.8°2θで特徴的なピークを有するX線粉末回析(XRPD)パターン、
(b)3.7°2θ、13.5°2θ、17.1°2θおよび18.8°2θで特徴的なピーク、および6.8°2θ、8.7°2θ、11.1°2θ、15.7°2θ、17.5°2θおよび17.9°2θから選択される少なくとも1つのさらなる特徴的なピークを有するX線粉末回析(XRPD)パターン、
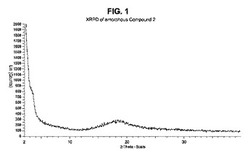
(c)図2に示されるパターンとほぼ同じX線粉末回析(XRPD)パターン、
(d)約70℃、約122℃、および約138℃で吸熱を伴うDSCサーモグラム、
(e)図3に示されるのとほぼ同じDSCサーモグラム、
の少なくとも1つを有することを特徴とする請求項4に記載の薬学的に許容可能な塩。
【請求項6】
化合物2が結晶性であり、特性(a)、(b)、(c)、(d)および(e)を有することを特徴とする請求項5に記載の薬学的に許容可能な塩。
【請求項7】
化合物2の結晶形態がヘプタンとアセトンを含む溶液から得られたことを特徴とする請求項4乃至6のいずれか1項に記載の薬学的に許容可能な塩。
【請求項8】
前記薬学的に許容可能な塩が溶媒和されていることを特徴とする請求項1乃至7のいずれか1項に記載の薬学的に許容可能な塩。
【請求項9】
2−(3−(2−((tert−ブチルチオ)メチル)−4−(2,2−ジメチル−プロピオニルアミノ)フェノキシ)−4−メトキシフェニル)酢酸(化合物1)の結晶形態。
【請求項10】
化合物1の結晶形態が、以下の特性:
(a)11.4°2θ、16.9°2θ、17.9°2θおよび18.9°2θで特徴的なピークを有するX線粉末回析(XRPD)パターン、
(b)図4に示されるのとほぼ同じX線粉末回析(XRPD)パターン、
(c)約32℃、約77℃および約136℃で吸熱を伴うDSCサーモグラム、
の少なくとも1つを有することを特徴とする請求項9に記載の結晶形態。
【請求項11】
化合物1の結晶形態が、特性(a)、(b)および(c)を有することを特徴とする請求項10に記載の結晶形態。
【請求項12】
化合物1の結晶形態が、以下の特性:
(a)11.5°2θ、17.9°2θ、19.0°2θおよび20.6°2θの特徴的なピークを有するX線粉末回析(XRPD)パターン、
(b)11.5°2θ、17.9°2θ、19.0°2θおよび20.6°2θの特徴的なピーク、および12.3°2θ、13.6°2θ、16.5°2θ、16.9°2θ、22.5°2θ、22.7°2θおよび23.0°2θから選ばれた少なくとも1つのさらなる特徴的なピークを有するX線粉末回折(XRPD)パターン、
(c)図5に示されるのとほぼ同じX線粉末回析(XRPD)パターン、
(d)約52℃、および約139℃で吸熱を伴うDSCサーモグラム、
の少なくとも1つを有することを特徴とする請求項9に記載の結晶形態。
【請求項13】
化合物1の結晶形態が、特性(a)、(b)、(c)および(d)を有することを特徴とする請求項12に記載の結晶形態。
【請求項14】
化合物1の結晶形態が、以下の特性:
(a)8.1°2θ、11.9°2θ、18.2°2θおよび18.9°2θで特徴的なピークを有するX線粉末回析(XRPD)パターン、
(b)8.1°2θ、11.9°2θ、18.2°2θおよび18.9°2θで特徴的なピーク、および6.3°2θ、13.5°2θ、16.3°2θ、16.5°2θ、18.7°2θ、19.5°2θ、21.5°2θおよび23.4°2θから選択される少なくとも1つのさらなる特徴的なピークを有するX線粉末回析(XRPD)パターン、
(c)図6に示されるのとほぼ同じX線粉末回析(XRPD)パターン、
(d)約38℃、および約147℃で吸熱を伴うDSCサーモグラム、
の少なくとも1つを有することを特徴とする請求項9に記載の結晶形態。
【請求項15】
化合物1の結晶形態が、特性(a)、(b)、(c)および(d)を有することを特徴とする請求項14に記載の結晶形態。
【請求項16】
化合物1の結晶形態が、以下の特性:
(a)12.3°2θ、16.5°2θ、20.6°2θおよび22.0°2θで特徴的なピークを有するX線粉末回析(XRPD)パターン、
(b)12.3°2θ、16.5°2θ、20.6°2θおよび22.0°2θの特徴的なピーク、および4.1°2θ、8.2°2θ、11.4°2θ、18.5°2θおよび24.8°2θから選択される少なくとも1つのさらなる特徴的なピークを有するX線粉末回折(XRPD)パターン、
(c)図7に示されるのとほぼ同じX線粉末回析(XRPD)パターン、
の少なくとも1つを有することを特徴とする請求項9に記載の結晶形態。
【請求項17】
化合物1の結晶形態が、特性(a)、(b)および(c)を有することを特徴とする請求項16に記載の結晶形態。
【請求項18】
前記結晶形態が溶媒和されていることを特徴とする請求項9乃至17のいずれか1項に記載の結晶形態。
【請求項19】
請求項1乃至18のいずれか1項に係る2−(3−(2−((tert−ブチルチオ)メチル)−4−(2,2−ジメチル−プロピオニルアミノ)フェノキシ)−4−メトキシフェニル)酢酸(化合物1)またはその薬学的に許容可能な塩と、薬学的に許容可能な担体、希釈剤及び賦形剤から選択される少なくとも1つの成分とを含む医薬組成物。
【請求項20】
前記医薬組成物が、2−(3−(2−((tert−ブチルチオ)メチル)−4−(2,2−ジメチル−プロピオニルアミノ)フェノキシ)−4−メトキシフェニル)酢酸,ナトリウム塩(化合物2)を含むことを特徴とする請求項19に記載の医薬組成物。
【請求項21】
前記医薬組成物が、結晶性の2−(3−(2−((tert−ブチルチオ)メチル)−4−(2,2−ジメチル−プロピオニルアミノ)フェノキシ)−4−メトキシフェニル)酢酸,ナトリウム塩(化合物2)を含むことを特徴とする請求項19に記載の医薬組成物。
【請求項22】
前記医薬組成物が哺乳動物に経口投与するのに適した形態であることを特徴とする請求項19乃至21のいずれか1項に記載の医薬組成物。
【請求項23】
前記医薬組成物が、丸剤、カプセル剤、錠剤、水溶液、水性懸濁液、非水溶液、または非水性懸濁液の形態であることを特徴とする請求項22に記載の医薬組成物。
【請求項24】
前記医薬組成物が、経口の固体剤形であることを特徴とする請求項22に記載の医薬組成物。
【請求項25】
前記医薬組成物が、約0.5mgから約1000mgまでの化合物2を含むことを特徴とする請求項19乃至24のいずれか1項に記載の医薬組成物。
【請求項26】
哺乳動物において、呼吸器疾患または疾病、炎症性疾患または疾病、またはアレルギー性疾患または疾病、またはそれらの組み合わせを処置または予防する方法であって、該方法は、該哺乳動物に請求項19乃至25のいずれか1項に記載の医薬組成物を投与する工程を含むことを特徴とする方法。
【請求項27】
前記呼吸器疾患または疾病、炎症性疾患または疾病、またはアレルギー性疾患または疾病が、喘息、成人型呼吸窮迫症候群、等炭酸ガス性過呼吸、鼻炎、慢性閉塞性肺疾患、慢性気管支炎、肺気腫、肺高血圧症、嚢胞性線維症、アレルギー性眼疾患または疾病、炎症性眼疾患または疾病、アレルギー性皮膚疾患または疾病、または炎症性皮膚疾患または疾病であることを特徴とする請求項26に記載の方法。
【請求項28】
哺乳動物に請求項19乃至25のいずれか1項に記載の医薬組成物を投与する工程を含む、哺乳動物において喘息を処置または予防する方法。
【請求項29】
哺乳動物に請求項19乃至25のいずれか1項に記載の医薬組成物を投与する工程を含む、哺乳動物において鼻炎を処置する方法。
【請求項30】
前記医薬組成物が哺乳動物に毎日投与されることを特徴とする請求項26乃至29のいずれか1項に記載の方法。
【請求項31】
前記医薬組成物が、
(a)化合物1又はその薬学的に許容可能な塩が哺乳動物に毎日投与される第1期間と、
(b)化合物1またはその薬学的に許容可能な塩が、(a)と比較して、減少された量で哺乳動物に投与される間の少なくとも7日間の第2期間と、
を含む処置周期で投与されることを特徴とする請求項26乃至29のいずれか1項に記載の方法。
【請求項32】
ヒトにおいて、呼吸器疾患または疾病、炎症性疾患または疾病、またはアレルギー性疾患または疾病、またはそれらの組み合わせを処置又は予防する際に使用するための請求項1乃至18のいずれか1項に記載の2−(3−(2−((tert−ブチルチオ)メチル)−4−(2,2−ジメチル−プロピオニルアミノ)フェノキシ)−4−メトキシフェニル)酢酸(化合物1)またはその薬学的に許容可能な塩。
【請求項1】
2−(3−(2−((tert−ブチルチオ)メチル)−4−(2,2−ジメチル−プロピオニルアミノ)フェノキシ)−4−メトキシフェニル)酢酸(化合物1)の薬学的に許容可能な塩であって、該薬学的に許容可能な塩が、カルシウム塩、カリウム塩、ナトリウム塩、アンモニウム塩、L−アルギニン塩、L−リジン塩又はN−メチル−D−グルカミン塩であることを特徴とする塩。
【請求項2】
前記薬学的に許容可能な塩が、ナトリウム塩であり、該ナトリウム塩が、化合物2の構造
【化1】

を有することを特徴とする請求項1に記載の薬学的に許容可能な塩。
【請求項3】
化合物2が非結晶性であることを特徴とする請求項2に記載の薬学的に許容可能な塩。
【請求項4】
化合物2が結晶性であることを特徴とする請求項2に記載の薬学的に許容可能な塩。
【請求項5】
化合物2が結晶性であり、以下の特性:
(a)3.7°2θ、13.5°2θ、17.1°2θおよび18.8°2θで特徴的なピークを有するX線粉末回析(XRPD)パターン、
(b)3.7°2θ、13.5°2θ、17.1°2θおよび18.8°2θで特徴的なピーク、および6.8°2θ、8.7°2θ、11.1°2θ、15.7°2θ、17.5°2θおよび17.9°2θから選択される少なくとも1つのさらなる特徴的なピークを有するX線粉末回析(XRPD)パターン、
(c)図2に示されるパターンとほぼ同じX線粉末回析(XRPD)パターン、
(d)約70℃、約122℃、および約138℃で吸熱を伴うDSCサーモグラム、
(e)図3に示されるのとほぼ同じDSCサーモグラム、
の少なくとも1つを有することを特徴とする請求項4に記載の薬学的に許容可能な塩。
【請求項6】
化合物2が結晶性であり、特性(a)、(b)、(c)、(d)および(e)を有することを特徴とする請求項5に記載の薬学的に許容可能な塩。
【請求項7】
化合物2の結晶形態がヘプタンとアセトンを含む溶液から得られたことを特徴とする請求項4乃至6のいずれか1項に記載の薬学的に許容可能な塩。
【請求項8】
前記薬学的に許容可能な塩が溶媒和されていることを特徴とする請求項1乃至7のいずれか1項に記載の薬学的に許容可能な塩。
【請求項9】
2−(3−(2−((tert−ブチルチオ)メチル)−4−(2,2−ジメチル−プロピオニルアミノ)フェノキシ)−4−メトキシフェニル)酢酸(化合物1)の結晶形態。
【請求項10】
化合物1の結晶形態が、以下の特性:
(a)11.4°2θ、16.9°2θ、17.9°2θおよび18.9°2θで特徴的なピークを有するX線粉末回析(XRPD)パターン、
(b)図4に示されるのとほぼ同じX線粉末回析(XRPD)パターン、
(c)約32℃、約77℃および約136℃で吸熱を伴うDSCサーモグラム、
の少なくとも1つを有することを特徴とする請求項9に記載の結晶形態。
【請求項11】
化合物1の結晶形態が、特性(a)、(b)および(c)を有することを特徴とする請求項10に記載の結晶形態。
【請求項12】
化合物1の結晶形態が、以下の特性:
(a)11.5°2θ、17.9°2θ、19.0°2θおよび20.6°2θの特徴的なピークを有するX線粉末回析(XRPD)パターン、
(b)11.5°2θ、17.9°2θ、19.0°2θおよび20.6°2θの特徴的なピーク、および12.3°2θ、13.6°2θ、16.5°2θ、16.9°2θ、22.5°2θ、22.7°2θおよび23.0°2θから選ばれた少なくとも1つのさらなる特徴的なピークを有するX線粉末回折(XRPD)パターン、
(c)図5に示されるのとほぼ同じX線粉末回析(XRPD)パターン、
(d)約52℃、および約139℃で吸熱を伴うDSCサーモグラム、
の少なくとも1つを有することを特徴とする請求項9に記載の結晶形態。
【請求項13】
化合物1の結晶形態が、特性(a)、(b)、(c)および(d)を有することを特徴とする請求項12に記載の結晶形態。
【請求項14】
化合物1の結晶形態が、以下の特性:
(a)8.1°2θ、11.9°2θ、18.2°2θおよび18.9°2θで特徴的なピークを有するX線粉末回析(XRPD)パターン、
(b)8.1°2θ、11.9°2θ、18.2°2θおよび18.9°2θで特徴的なピーク、および6.3°2θ、13.5°2θ、16.3°2θ、16.5°2θ、18.7°2θ、19.5°2θ、21.5°2θおよび23.4°2θから選択される少なくとも1つのさらなる特徴的なピークを有するX線粉末回析(XRPD)パターン、
(c)図6に示されるのとほぼ同じX線粉末回析(XRPD)パターン、
(d)約38℃、および約147℃で吸熱を伴うDSCサーモグラム、
の少なくとも1つを有することを特徴とする請求項9に記載の結晶形態。
【請求項15】
化合物1の結晶形態が、特性(a)、(b)、(c)および(d)を有することを特徴とする請求項14に記載の結晶形態。
【請求項16】
化合物1の結晶形態が、以下の特性:
(a)12.3°2θ、16.5°2θ、20.6°2θおよび22.0°2θで特徴的なピークを有するX線粉末回析(XRPD)パターン、
(b)12.3°2θ、16.5°2θ、20.6°2θおよび22.0°2θの特徴的なピーク、および4.1°2θ、8.2°2θ、11.4°2θ、18.5°2θおよび24.8°2θから選択される少なくとも1つのさらなる特徴的なピークを有するX線粉末回折(XRPD)パターン、
(c)図7に示されるのとほぼ同じX線粉末回析(XRPD)パターン、
の少なくとも1つを有することを特徴とする請求項9に記載の結晶形態。
【請求項17】
化合物1の結晶形態が、特性(a)、(b)および(c)を有することを特徴とする請求項16に記載の結晶形態。
【請求項18】
前記結晶形態が溶媒和されていることを特徴とする請求項9乃至17のいずれか1項に記載の結晶形態。
【請求項19】
請求項1乃至18のいずれか1項に係る2−(3−(2−((tert−ブチルチオ)メチル)−4−(2,2−ジメチル−プロピオニルアミノ)フェノキシ)−4−メトキシフェニル)酢酸(化合物1)またはその薬学的に許容可能な塩と、薬学的に許容可能な担体、希釈剤及び賦形剤から選択される少なくとも1つの成分とを含む医薬組成物。
【請求項20】
前記医薬組成物が、2−(3−(2−((tert−ブチルチオ)メチル)−4−(2,2−ジメチル−プロピオニルアミノ)フェノキシ)−4−メトキシフェニル)酢酸,ナトリウム塩(化合物2)を含むことを特徴とする請求項19に記載の医薬組成物。
【請求項21】
前記医薬組成物が、結晶性の2−(3−(2−((tert−ブチルチオ)メチル)−4−(2,2−ジメチル−プロピオニルアミノ)フェノキシ)−4−メトキシフェニル)酢酸,ナトリウム塩(化合物2)を含むことを特徴とする請求項19に記載の医薬組成物。
【請求項22】
前記医薬組成物が哺乳動物に経口投与するのに適した形態であることを特徴とする請求項19乃至21のいずれか1項に記載の医薬組成物。
【請求項23】
前記医薬組成物が、丸剤、カプセル剤、錠剤、水溶液、水性懸濁液、非水溶液、または非水性懸濁液の形態であることを特徴とする請求項22に記載の医薬組成物。
【請求項24】
前記医薬組成物が、経口の固体剤形であることを特徴とする請求項22に記載の医薬組成物。
【請求項25】
前記医薬組成物が、約0.5mgから約1000mgまでの化合物2を含むことを特徴とする請求項19乃至24のいずれか1項に記載の医薬組成物。
【請求項26】
哺乳動物において、呼吸器疾患または疾病、炎症性疾患または疾病、またはアレルギー性疾患または疾病、またはそれらの組み合わせを処置または予防する方法であって、該方法は、該哺乳動物に請求項19乃至25のいずれか1項に記載の医薬組成物を投与する工程を含むことを特徴とする方法。
【請求項27】
前記呼吸器疾患または疾病、炎症性疾患または疾病、またはアレルギー性疾患または疾病が、喘息、成人型呼吸窮迫症候群、等炭酸ガス性過呼吸、鼻炎、慢性閉塞性肺疾患、慢性気管支炎、肺気腫、肺高血圧症、嚢胞性線維症、アレルギー性眼疾患または疾病、炎症性眼疾患または疾病、アレルギー性皮膚疾患または疾病、または炎症性皮膚疾患または疾病であることを特徴とする請求項26に記載の方法。
【請求項28】
哺乳動物に請求項19乃至25のいずれか1項に記載の医薬組成物を投与する工程を含む、哺乳動物において喘息を処置または予防する方法。
【請求項29】
哺乳動物に請求項19乃至25のいずれか1項に記載の医薬組成物を投与する工程を含む、哺乳動物において鼻炎を処置する方法。
【請求項30】
前記医薬組成物が哺乳動物に毎日投与されることを特徴とする請求項26乃至29のいずれか1項に記載の方法。
【請求項31】
前記医薬組成物が、
(a)化合物1又はその薬学的に許容可能な塩が哺乳動物に毎日投与される第1期間と、
(b)化合物1またはその薬学的に許容可能な塩が、(a)と比較して、減少された量で哺乳動物に投与される間の少なくとも7日間の第2期間と、
を含む処置周期で投与されることを特徴とする請求項26乃至29のいずれか1項に記載の方法。
【請求項32】
ヒトにおいて、呼吸器疾患または疾病、炎症性疾患または疾病、またはアレルギー性疾患または疾病、またはそれらの組み合わせを処置又は予防する際に使用するための請求項1乃至18のいずれか1項に記載の2−(3−(2−((tert−ブチルチオ)メチル)−4−(2,2−ジメチル−プロピオニルアミノ)フェノキシ)−4−メトキシフェニル)酢酸(化合物1)またはその薬学的に許容可能な塩。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公表番号】特表2013−516475(P2013−516475A)
【公表日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願番号】特願2012−548102(P2012−548102)
【出願日】平成23年1月5日(2011.1.5)
【国際出願番号】PCT/US2011/020264
【国際公開番号】WO2011/085033
【国際公開日】平成23年7月14日(2011.7.14)
【出願人】(510209672)アミラ ファーマシューティカルズ,インク. (17)
【Fターム(参考)】
【公表日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願日】平成23年1月5日(2011.1.5)
【国際出願番号】PCT/US2011/020264
【国際公開番号】WO2011/085033
【国際公開日】平成23年7月14日(2011.7.14)
【出願人】(510209672)アミラ ファーマシューティカルズ,インク. (17)
【Fターム(参考)】
[ Back to top ]

