DR3遺伝子のd領域に結合するポリペプチドおよびその利用
【課題】 ヒト関節リウマチの発症のメカニズムの解明に有用なポリペプチドおよびポリヌクレオチドを提供するとともに、ヒト関節リウマチの発症または発症可能性を高精度に判定することのできる診断キットおよび診断方法を提供する。
【解決手段】 関節リウマチの疾患関与遺伝子DR3のSNP部位に結合するポリペプチドを検索し、DR3遺伝子のd領域に結合するポリペプチドおよび当該ポリペプチドをコードするポリヌクレオチドを同定する。
【解決手段】 関節リウマチの疾患関与遺伝子DR3のSNP部位に結合するポリペプチドを検索し、DR3遺伝子のd領域に結合するポリペプチドおよび当該ポリペプチドをコードするポリヌクレオチドを同定する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、関節リウマチの発症に関与するポリペプチドおよび当該ポリペプチドをコードするポリヌクレオチド、およびこれらを用いる関節リウマチの発症またはその発症可能性の診断キット、診断方法、および関節リウマチの治療薬剤に関するものである。
【背景技術】
【0002】
関節リウマチ(rheumatoid arthritis:以下「RA」ともいう)は、多発するびらん性関節炎を主徴とするが、同時に多臓器を障害する原因不明の全身性炎症疾患である。RAは寛解と増悪とを繰り返しながら慢性に進行し、無治療で放置すると関節の破壊や変形を来し、やがて運動器の機能障害を呈してくる。時には生命をも脅かす。したがって、RA患者は身体的にも精神的にも大きな苦痛を生涯に亘って背負うことになる。
【0003】
RAは、その発症の仕方も多種多様であり、その診断には、アメリカリウマチ学会の診断基準が広く利用されている。しかしながら、RAの発症は、通常、緩徐で数週間から数ヶ月にわたり、アメリカリウマチ学会の診断基準における客観的な指標としてのリウマトイド因子の存在は、その陽性率が3ヶ月以内で33%、12ヶ月以上においても88%程度(例えば、非特許文献1を参照のこと)であり、RAと確実に診断するには至っていない。そこで、組換え抗原と反応する患者血清中のリウマチ性関節炎関連抗体IgM抗体を検出し、リウマチ性関節炎を診断しようとする試みなどがなされている(例えば、特許文献1を参照のこと)。
【0004】
また、RAの治療は、RA病態の病状の進行過程によって選択すべき治療手段は異なるのが通常である。一般的に確定診断が下せない初期では、非ステロイド抗炎症薬(NSAID)を投与し、確定診断が下せた場合は、NSAIDに加えて疾患修飾性リウマチ薬(DMARD)を投与する。特にRA発症の初期には、確定診断を下すことは困難であり、現状では、NSAIDを投与し、経過を慎重に観察しながら膠原病を含む他のリウマチ疾患との鑑別を同時に行っている。さらに症状が進行した場合は、ステロイド薬の投与を行う場合もあり、疼痛のための薬物療法と共に関節機能の維持・回復に対して理学療法・装具療法を行う。また、関節破壊により日常生活が不自由になった場合には、手術療法を行う場合もある。
【0005】
特許文献2では、本願発明者らが、マイクロサテライトマーカーを用いた連鎖解析をRA患者およびその血縁者に対して実施することにより、関節リウマチの疾患遺伝子が位置する3カ所の遺伝子座を特定し、以下の疾患遺伝子を同定している。
(1)ヒト第1染色体の、マイクロサテライトマーカーD1S214および/またはD1S253がハイブリダイズするDNA配列から±1センチモルガン以内に位置する関節リウマチの疾患遺伝子。
(2)ヒト第8染色体の、マイクロサテライトマーカーD8S556がハイブリダイズするDNA配列から±1センチモルガン以内に位置する関節リウマチの疾患遺伝子。
(3)ヒトX染色体の、マイクロサテライトマーカーDXSl001、DXS1047、DXS1205、DXS1227および/またはDXS1232がハイブリダイズするDNA配列から±1センチモルガン以内に位置する関節リウマチの疾患遺伝子。
【0006】
また、非特許文献2には、本願発明者らが、前記先願発明の各疾患関与遺伝子にうち、前記(1)の疾患関与遺伝子に関係するマーカーD1S214およびD1S253の疾患関与遺伝子として、デスレセプター3(death receptor 3:「DR3」または「DR3遺伝子」ともいう)を挙げ、健常人とRA患者との間にDR3の制限断片長多型を確認し、DR3がRAにおける疾患関与遺伝子である可能性を示唆している。
【0007】
さらに、特許文献3では、本願発明者らが、DR3遺伝子のゲノム変異と関節リウマチ(慢性関節リウマチ)発症との関係について開示している。
【特許文献1】特開平10−513257号(公開日:平成10年12月15日)
【特許文献2】国際公開WO98/51791号(国際公開日:1998年11月19日)
【特許文献3】国際公開WO02/34912(国際公開日:2002年5月2日)
【非特許文献1】治療、第73巻、第3号、第23〜27頁、1991年
【非特許文献2】リウマチ、第39号、第2号、第444頁および第445頁(1999年)
【発明の開示】
【発明が解決しようとする課題】
【0008】
上述のように、種々の自己免疫疾患について積極的な研究成果が数多く報告されているが、自己免疫疾患(特に、関節リウマチ)の発症を客観的に診断する技術は未だ十分に確立されているとはいえない。このため、関節リウマチをはじめとする自己免疫疾患の発症についての客観的かつ正確な診断に寄与できる、新たな技術の確立が強く望まれていた。
【0009】
本発明は、上記の問題点に鑑みてなされたものであり、その目的は、関節リウマチの発症について、客観的かつ正確な診断を可能とするための因子、ならびに当該因子を用いる診断キット、診断方法および薬剤を提供することにある。
【課題を解決するための手段】
【0010】
本発明者らは、RAの疾患遺伝子の1つとして同定したDR3(デスレセプター3)の4ヶ所のSNP(それぞれSNPa、SNPc、SNPd、およびSNPe)および14塩基の欠損が、関節リウマチ(RA)家系発症例において有意に観察されることを見出している(特許文献3を参照のこと)。中でも、SNPdは、機能変異を伴うDR3スプラインシングバリアントを産生することが示唆されている。しかし、このようなスプライシングバリアントがどのような機序に基づいて産生されるのかは未だ不明である。そこで、本発明者らは、上記バリアントの産生機構を解明することを目的として、DR3の変異領域に結合する因子の探索を試みた。具体的には、4つのSNP(SNPa、SNPc、SNPd、およびSNPe)に関する多型部位における正常型配列または変異型配列をそれぞれ含むオリゴヌクレオチドプローブを作製し、DR3遺伝子に対するゲルシフト法によって、DR3変異領域に結合する因子の存在を検討した。
【0011】
その結果、SNPdを含むプローブを用いた場合でのみバンドシフトが認められ、SNPdに対して特異的に結合する因子が存在することが示された。
【0012】
このように、本発明者らは、DR3ゲノムDNAにおけるd領域に結合する因子が存在することを見出し、当該因子がDR3スプライシングバリアントを産生させる要因の1つであることを示した。また、当該因子を用いることによって、被験体または被験体由来のサンプル(例えば、細胞)における、DR3の変異に基づくRAの発症またはその発症可能性を判定することができることを見出した。さらに、当該因子が、関節リウマチの新たな予防法、治療法および治療薬剤としても有用であることを見出した。これらの知見に基づいて、本発明者らは本発明を完成させるに至った。
【0013】
本発明に係るポリペプチドは、DR3遺伝子のd領域に結合することを特徴としている。
【0014】
本発明に係るポリペプチドは、配列番号7に示される塩基配列からなるポリヌクレオチドに結合することを特徴としている。
【0015】
本発明に係るポリペプチドは、配列番号8に示される塩基配列からなるポリヌクレオチドに結合しないことが好ましい。
【0016】
本発明に係るポリヌクレオチドは、上記のポリペプチドをコードすることを特徴としている。
【0017】
本発明に係る診断キットは、関節リウマチの発症またはその発症可能性を判定するために、上記のポリペプチドを備えることを特徴としている。
【0018】
本発明に係る診断キットは、関節リウマチの発症またはその発症可能性を判定するために、上記のポリヌクレオチドを備えることを特徴としている。
【0019】
本発明に係る診断方法は、関節リウマチの発症またはその発症可能性を判定するために、上記のポリペプチドを用いることを特徴としている。
【0020】
本発明に係る診断方法は、関節リウマチの発症またはその発症可能性を判定するために、上記のポリヌクレオチドを用いることを特徴としている。
【0021】
本発明に係る薬剤は、関節リウマチを治療するために、上記のポリペプチドを含むことを特徴としている。
【0022】
本発明に係る薬剤は、関節リウマチを治療するために、上記のポリヌクレオチドを含むことを特徴としている。
【0023】
本発明に係るスクリーニングキットは、配列番号7に示される塩基配列からなるポリヌクレオチドを備えることを特徴としている。
【0024】
本発明に係るスクリーニングキットは、配列番号8に示される塩基配列からなるポリヌクレオチドをさらに備えることが好ましい。
【0025】
本発明に係るスクリーニング方法は、配列番号7に示される塩基配列からなるポリヌクレオチドを用いることを特徴としている。
【0026】
本発明に係るスクリーニングキットは、配列番号8に示される塩基配列からなるポリヌクレオチドをさらに用いることが好ましい。
【発明の効果】
【0027】
本発明に係るポリペプチドまたはポリヌクレオチドは、ヒト関節リウマチの発症のメカニズムの解明に有効に利用することができる。さらに、本発明のポリペプチドまたはポリヌクレオチドは、関節リウマチの診断、関節リウマチの発症可能性の判定、関節リウマチの適切な治療薬剤の開発に利用することができる。
【0028】
また、本発明に係る関節リウマチの診断キットおよび診断方法によれば、関節リウマチの発症、または、その発症可能性の判定を、高精度かつ簡便に行うことができる。それゆえ、関節リウマチの予防および治療に役立てることができる。
【発明を実施するための最良の形態】
【0029】
本発明者らは、特許文献3に示すように、被験者から得られた細胞において、配列番号1に示される塩基配列を有するDR3のゲノムDNA配列中の下記の変異を見出している:
(a)第1755位の塩基がアデニン(A)からグアニン(G)への置換(SNPa);
(b)第2443〜2456位の塩基の欠損;
(c)第2531位の塩基がシトシン(C)からチミン(T)への置換(SNPc);
(d)第2678位の塩基がアデニン(A)からチミン(T)への置換(SNPd);および
(e)第2826位の塩基がアデニン(A)からグアニン(G)への置換(SNPe)。
【0030】
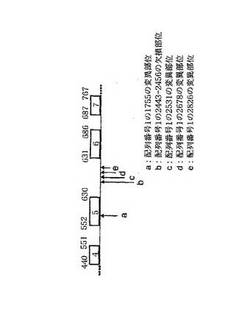
図1に示すように、第1755位の塩基は、DR3ゲノムDNAのエキソン領域(エキソン5)内にあり、配列番号2に示されるアミノ酸配列からなるDR3ポリペプチドにおいては、上記(a)の変異に伴って第159位のアミノ酸のアスパラギン酸からグリシンへ変異する。一方、上記(b)〜(e)の変異は、DR3ゲノムのイントロン領域にある。
【0031】
本明細書中で使用される場合、用語「a領域」は、DR3のゲノムDNAにおける上記(a)の変異を含む領域が意図される。用語「b領域」〜「e領域」もまた、本明細書中で同様に使用される。
【0032】
a領域は、好ましくは、配列番号1に示される塩基配列の第1744〜1767位からなり、より好ましくは、配列番号3に示される塩基配列からなる。a領域におけるSNP(SNPa)は、配列番号1に示される塩基配列の第1755位の塩基がアデニン(A)からグアニン(G)に置換されている(配列番号4)。c領域は、好ましくは、配列番号1に示される塩基配列の第2520〜2543位からなり、より好ましくは、配列番号5に示される塩基配列からなる。c領域におけるSNP(SNPc)は、配列番号1に示される塩基配列の第2531位の塩基がシトシン(C)からチミン(T)に置換されている(配列番号6)。d領域は、好ましくは、配列番号1に示される塩基配列の第2667〜2690位からなり、より好ましくは、配列番号7に示される塩基配列からなる。d領域におけるSNP(SNPd)は、配列番号1に示される塩基配列の第2678位の塩基がアデニン(A)からチミン(T)に置換されている(配列番号8)。e領域は、好ましくは、配列番号1に示される塩基配列の第2815〜2838位からなり、より好ましくは、配列番号9に示される塩基配列からなる。e領域におけるSNP(SNPe)は、配列番号1に示される塩基配列の第2826位の塩基がアデニン(A)からグアニン(G)に置換されている(配列番号10)。
【0033】
塩基配列に関して本明細書中で使用される場合、特に断らない限り、A、C、GおよびTは、アデニン、シトシン、グアニンおよびチミンの各塩基を示す。また、アミノ酸およびアミノ酸残基は、IUPACおよびIUBの定める1文字表記または3文字表記を使用する。また、転写産物とは、ゲノムが転写および翻訳される結果として生じる産物であり、たとえば、mRNA、cDNAおよびタンパク質(ポリペプチド)などが挙げられる。
【0034】
配列番号1に示される塩基配列の第1755位の塩基は、cDNAとしてジーンバンクに登録されている配列(アクセッション番号NM_003790)の564番目の塩基に相当する。このゲノムDNAのエキソン5の3’末端の塩基を基準とし、一塩基後のイントロンの塩基を1番目とすると位置2443〜2456の欠損は、エキソン5の3’末端から622〜635番目の塩基の欠損に相当する。また、エキソン6の5’末端の塩基を基準とし、一塩基前のイントロンの塩基番号を−1番目とすると、位置2531の変異は、−538番目、位置2678の変異は−391番目、位置2826の変異は−243番目の塩基に相当する(図1)。なお、Tが28塩基連続する領域(位置2443〜2470)においては、その数が3塩基分増減する可能性があり、変異型ゲノムのTが14塩基連続する領域も同様にしてその数が3塩基分増減する可能性がある。
【0035】
以下、本発明についてより詳細に説明するが、本発明はこの記載に限定されるものではない。
【0036】
〔1〕ポリペプチド
本発明は、DR3遺伝子のd領域に結合するポリペプチドを提供する。一実施形態において、本発明に係るポリペプチドは、配列番号7に示される塩基配列からなるポリヌクレオチドに結合することが好ましい。さらなる実施形態において、本発明に係るポリヌクレオチドは、配列番号7に示される塩基配列からなるポリヌクレオチドに結合するが、配列番号8に示される塩基配列からなるポリヌクレオチドに結合しないことが好ましい。
【0037】
本明細書中で使用される場合、用語「ポリペプチド」は、「ペプチド」または「タンパク質」と交換可能に使用される。本発明に係るポリペプチドはまた、天然供給源より単離されても、組換え生成されても、化学合成されてもよい。
【0038】
用語「単離された」ポリペプチドまたはタンパク質は、その天然の環境から取り出されたポリペプチドまたはタンパク質が意図される。例えば、宿主細胞中で発現された組換え産生されたポリペプチドおよびタンパク質は、任意の適切な技術によって実質的に精製されている天然または組換えのポリペプチドおよびタンパク質と同様に、単離されていると考えられる。
【0039】
本発明に係るポリペプチドは、天然の細胞もしくは組織由来の精製産物、化学合成手順の産物、または原核生物宿主もしくは真核生物宿主(例えば、細菌細胞、酵母細胞、高等植物細胞、昆虫細胞、および哺乳動物細胞を含む)から組換え技術によって産生されることが好ましい。
【0040】
一実施形態において、本発明に係るポリペプチドは、被験体由来の細胞または組織の抽出液から精製されることが好ましい。ポリペプチドを精製する工程は、周知の方法(例えば、細胞または組織を破壊した後に遠心分離して可溶性画分を回収する方法)で細胞または組織から細胞抽出液(例えば、核抽出液)を調製した後、この細胞抽出液から周知の方法(例えば、硫安沈殿またはエタノール沈殿、酸抽出、陰イオンまたは陽イオン交換クロマトグラフィー、ホスホセルロースクロマトグラフィー、疎水性相互作用クロマトグラフィー、アフィニティークロマトグラフィー、ヒドロキシアパタイトクロマトグラフィー、およびレクチンクロマトグラフィー)によって精製する工程が好ましいが、これらに限定されない。
【0041】
使用する細胞は、公知の方法に従って被験体の全ての細胞(例えば、末梢リンパ球、滑膜細胞、および各臓器など)から得ることができる。得られた細胞は、適宜、培養し、増殖させて利用することができる。好ましい細胞としては、Jurkat細胞、Hela細胞、TF−1細胞、MOLT4細胞などが挙げられる。
【0042】
また、本発明に係るポリペプチドは、DR3シグナル伝達に関与することが示唆される。従って、使用する細胞を、DR3シグナル伝達経路を駆動するために刺激することが好ましい。刺激に利用する試薬としては、例えば、デスレセプターのリガンド(例えば、Fasリガンド、TNF、DR3リガンドなど)、抗Fas抗体、アクチノマイシンD、放射線、グルココルチコイド、ホルボール12−ミリステート13−アセテート(PMA)、およびフィトヘマグルチニン(PHA)などが挙げられるがこれらに限定されない。また、これらを2種以上組合わせて利用してもよい。これらの試薬のうち、好ましくは、DR3リガンド、PMA、およびPHA、より好ましくは、DR3リガンドである。
【0043】
試薬を添加する時間は、特に限定されないが、例えば、1時間〜72時間程度であればよく、好ましくは、12〜48時間であればよい。また、刺激を与えないコントロール細胞を用意する必要がある。
【0044】
他の実施形態において、本発明に係るポリペプチドは、後述する本発明に係るポリヌクレオチド(本発明に係るポリペプチドをコードするポリヌクレオチド)を宿主細胞に導入して、そのポリペプチドを細胞内発現させた状態であってもよいし、発現させた細胞または組織などから単離精製されてもよい。
【0045】
上記ポリヌクレオチドを宿主細胞に導入するために、種々のベクターが使用され得る。ベクターの具体的な種類は特に限定されず、宿主細胞中で発現可能なベクターを適宜選択すればよい。すなわち、宿主細胞の種類に応じて、確実に上記ポリヌクレオチドを発現させるために適宜プロモーター配列を選択し、これと上記ポリヌクレオチドを各種プラスミド等に組み込んだベクターを発現ベクターとして用いればよい。
【0046】
発現ベクターは、好ましくは少なくとも1つの選択マーカーを含む。このようなマーカーとしては、真核生物細胞培養についてはジヒドロ葉酸レダクターゼまたはネオマイシン耐性、およびE.coliおよび他の細菌における培養についてはテトラサイクリン耐性遺伝子またはアンピシリン耐性遺伝子が挙げられる。
【0047】
上記選択マーカーを用いれば、上記ポリヌクレオチドが宿主細胞に導入されたか否か、さらには宿主細胞中で確実に発現しているか否かを確認することができる。
【0048】
上記の宿主細胞は、特に限定されるものではなく、従来公知の各種細胞を好適に用いることができる。具体的には、例えば、大腸菌(Escherichia coli)等の細菌、酵母(出芽酵母Saccharomyces cerevisiae、分裂酵母Schizosaccharomyces pombe)、線虫(Caenorhabditis elegans)、アフリカツメガエル(Xenopus laevis)の卵母細胞等を挙げることができるが、特に限定されるものではない。上記の宿主細胞のための適切な培養培地および条件は当分野で周知である。
【0049】
上記発現ベクターを宿主細胞に導入する方法、すなわち形質転換法も特に限定されるものではなく、電気穿孔法、リン酸カルシウム法、リポソーム法、DEAEデキストラン法等の従来公知の方法を好適に用いることができる。また、例えば、本発明に係るポリペプチドを昆虫で転移発現させる場合には、バキュロウイルスを用いた発現系を用いればよい。
【0050】
また、本実施形態に係るポリペプチドは、付加的なポリペプチドを含むものであってもよい。付加的なポリペプチドとしては、例えば、HisやMyc、Flag等のエピトープ標識ポリペプチドが挙げられる。好ましい実施形態において、本発明に係るポリペプチドは、融合タンパク質のような改変された形態で組換え発現され得る。例えば、本発明に係るポリペプチドの付加的なアミノ酸、特に荷電性アミノ酸の領域が、宿主細胞内での、精製の間または引き続く操作および保存の間の安定性および持続性を改善するために、ポリペプチドのN末端に付加され得る。
【0051】
遺伝子が細胞に導入されたか否かの確認は、PCR法、サザンハイブリダイゼーション法、ノーザンハイブリダイゼーション法などによって行うことができる。例えば、形質転換細胞からDNAを調製し、DNA特異的プライマーを設計してPCRを行う。PCRは、前記プラスミドを調製するために使用した条件と同様の条件で行うことができる。その後は、増幅産物についてアガロースゲル電気泳動、ポリアクリルアミドゲル電気泳動またはキャピラリー電気泳動などを行い、臭化エチジウム、SYBR Green液などによって染色し、そして増幅産物を1本のバンドとして検出することによって、形質転換されたことを確認することができる。また、予め蛍光色素などによって標識したプライマーを用いてPCRを行い、増幅産物を検出することもできる。さらに、マイクロプレートなどの固相に増幅産物を結合させ、蛍光または酵素反応などによって増幅産物を確認する方法も採用することができる。
【0052】
別の実施形態において、本発明に係るポリペプチドは、化学合成の公知の方法を使用して合成され得る。例えば、Houghtenは、4週間未満で調製されそして特徴付けられたHA1ポリペプチドセグメントの単一アミノ酸改変体を示す10〜20mgの248の異なる13残基ペプチドのような多数のペプチドの合成のための簡単な方法を記載している。Houghten,R.A.,Proc.Natl.Acad.Sci.USA 82:5131−5135(1985)。この「Simultaneous Multiple Peptide Synthesis(SMPS)」プロセスは、さらにHoughtenら(1986)の米国特許第4,631,211号に記載される。この手順において、種々のペプチドの固相合成のための個々の樹脂は、別々の溶媒透過性パケットに含まれ、固相法に関連する多くの同一の反復工程の最適な使用を可能にする。完全なマニュアル手順は、500〜1000以上の合成が同時に行われるのを可能にする(Houghtenら、前出、5134)。これらの文献は、本明細書中に参考として援用される。
【0053】
本発明に係るポリペプチドは、関節リウマチの発症またはその発症可能性を判定するため方法およびキット、ならびに関節リウマチを治療するための薬剤において有用である。
【0054】
このように、本発明に係るポリペプチドは、少なくとも、DR3遺伝子のd領域(好ましくは、配列番号7に示される塩基配列からなるポリヌクレオチド)に結合するポリペプチドであればよいといえる。すなわち、当該ポリペプチドが、特定の機能(例えば、タグ)を有する任意のアミノ酸配列とからなるポリペプチドと連結されている場合もまた本発明に含まれることに留意すべきである。また、当該ポリペプチドおよび当該任意のアミノ酸配列は、それぞれの機能を阻害しないように適切なリンカーペプチドで連結されていてもよい。
【0055】
つまり、本発明の目的は、DR3遺伝子のd領域に結合するポリペプチドを提供することにあるのであって、本明細書中に具体的に記載したポリペプチド作製方法等に存するのではない。したがって、上記各方法以外によって取得されるポリペプチドも本発明の範囲に属することに留意しなければならない。
【0056】
〔2〕ポリヌクレオチド
本発明は、本発明に係る上記ポリペプチドをコードするポリヌクレオチドを提供する。本明細書中で使用される場合、用語「ポリヌクレオチド」は、「遺伝子」、「核酸」または「核酸分子」と交換可能に使用され、ヌクレオチドの重合体が意図される。本明細書中で使用される場合、用語「塩基配列」は、「遺伝子配列」、「核酸配列」または「ヌクレオチド配列」と交換可能に使用され、デオキシリボヌクレオチド(A、G、CおよびTと省略される)の配列として示される。
【0057】
本発明に係るポリヌクレオチドは、より長いポリヌクレオチド(例えば、本発明に係るDR3結合タンパク質をコードするcDNA全長からなるポリヌクレオチド)の切断フラグメントとして生成されても、化合合成されてもよい。例えば、制限エンドヌクレアーゼ切断または超音波による剪断は、種々のサイズのフラグメントを作製するために容易に使用され得る。あるいは、このようなフラグメントは、合成的に作製され得る。適切なフラグメント(オリゴヌクレオチド)が、Applied Biosystems Incorporated(ABI,850 Lincoln Center Dr.,Foster City,CA 94404)392型シンセサイザーなどによって合成される。
【0058】
本発明に係るポリヌクレオチドを取得する方法として、PCR等の増幅手段を用いる方法を挙げることができる。例えば、本発明に係るポリヌクレオチドのcDNAのうち、5’側および3’側の配列(またはその相補配列)の中からそれぞれプライマーを調製し、これらプライマーを用いてゲノムDNA(またはcDNA)等を鋳型にしてPCR等を行い、両プライマー間に挟まれるDNA領域を増幅することで、本発明に係るポリヌクレオチドを含むDNA断片を大量に取得できる。
【0059】
また本発明に係るポリヌクレオチドは、その5’側または3’側で上述のタグ標識(タグ配列またはマーカー配列)をコードするポリヌクレオチドに融合され得る。
【0060】
つまり、本発明の目的は、DR3のd領域に結合するポリペプチドをコードするポリヌクレオチドを提供することにあるのであって、本明細書中に具体的に記載したポリヌクレオチドの作製方法等に存するのではない。したがって、上記各方法以外によって取得されるポリヌクレオチドもまた本発明の範囲に属することに留意しなければならない。
【0061】
〔3〕診断キットおよび診断方法
本発明は、関節リウマチの発症またはその発症可能性を判定するための診断キットを提供する。本明細書中で使用される場合、関節リウマチの「発症可能性」とは、関節リウマチ(RA)が発生する危険度を示す指標をいい、発症可能性が高ければそれだけRAになりやすく、逆に発症可能性が低ければRAになり難いということを示す。一実施形態において、本発明に係る診断キットは、本発明に係るポリペプチドを備えることが好ましい。他の実施形態において、本発明に係る診断キットは、本発明に係るポリヌクレオチドを備えることが好ましい。また、本発明に係る診断キットは、他の試薬を併せて備えてもよい。
【0062】
本発明はまた、関節リウマチの発症またはその発症可能性を判定するための診断方法を提供する。一実施形態において、本発明に係る診断キットは、本発明に係るポリペプチドを用いることが好ましい。他の実施形態において、本発明に係る診断キットは、本発明に係るポリヌクレオチドを用いることが好ましい。また、本発明に係る診断方法は、他の工程を包含してもよい。
【0063】
本発明に係る診断(判定)キットおよび診断(判定)方法を使用することにより、RAの診断(発症またはその発症可能性の判定)を高精度に行うことができる。
【0064】
〔4〕治療薬剤および治療方法
本発明は、関節リウマチを治療するための薬剤を提供する。一実施形態において、本発明に係る治療薬剤は、本発明に係るポリペプチドを含むことが好ましい。他の実施形態において、本発明に係る診断キットは、本発明に係るポリヌクレオチドを含むことが好ましい。また、本発明に係る診断キットは、薬学的に受容可能なキャリアを併せて含んでもよい。
【0065】
本発明はまた、関節リウマチを治療するための方法を提供する。一実施形態において、本発明に係る治療方法は、本発明に係るポリペプチドを用いることが好ましい。他の実施形態において、本発明に係る治療方法は、本発明に係るポリヌクレオチドを用いることが好ましい。また、本発明に係る治療方法は、他の工程を包含してもよい。
【0066】
本発明に係る治療薬剤および治療方法を使用することにより、RAを有意に治療することができる。
【0067】
〔5〕スクリーニングキットおよびスクリーニング方法
本発明は、DR3遺伝子のd領域に結合するポリペプチドをスクリーニングするためのスクリーニングキットを提供する。一実施形態において、本発明に係るスクリーニングキットは、配列番号7に示される塩基配列からなるポリヌクレオチドを備えることが好ましい。さらなる実施形態において、本発明に係るスクリーニングキットは、配列番号8に示される塩基配列からなるポリヌクレオチドをさらに備えることが好ましい。
【0068】
本発明はまた、DR3遺伝子のd領域に結合するポリペプチドをスクリーニングするためのスクリーニング方法を提供する。一実施形態において、本発明に係るスクリーニング方法は、配列番号7に示される塩基配列からなるポリヌクレオチドを用いることが好ましい。さらなる実施形態において、本発明に係るスクリーニング方法は、配列番号8に示される塩基配列からなるポリヌクレオチドをさらに用いることが好ましい。
【0069】
以下、実施例を示し、本発明についてさらに詳しく説明するが、もちろん、本発明は以下の実施例に限定されるものではなく、細部については様々な態様が可能であることはいうまでもない。さらに、本発明は上述した実施形態に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。
【実施例】
【0070】
〔実施例1:DR3遺伝子の変異領域a、c、d、eに対するオリゴヌクレオチドを用いたゲルシフト法による解析〕
本発明者らは、4つのSNP(SNPa、SNPc、SNPd、およびSNPe)に関する正常型配列または変異型配列をそれぞれ含む24bpのオリゴヌクレオチドプローブを作製し、DR3遺伝子に対するゲルシフト法によって、DR3変異領域に結合する因子の存在を検討した。
【0071】
Jurkat細胞(2×106細胞)を、20ng/ml ホルボール12−ミリステート13−アセテート(PMA)および1μg/ml フィトヘマグルチニン(PHA)によって刺激(または未刺激)した。
【0072】
刺激24時間後、上記の細胞を500μlの低張緩衝液(10mM Hepes−KOH(pH7.9)、1.5mM MgCl2、10mM KCl、0.5mM エチレンジアミン四酢酸(EDTA)、0.5mM ジチオトレイトール(DTT)、0.5mM フェニルメチルスルホニルフルオリド(PMSF)、1μM ロイペプチン、1μM アプロチニン)に懸濁し、氷冷下にて10分間放置した。さらに、10% Nonidet P−40(NP−40)5μlを添加して、氷冷下にて20分間インキュベートした後、2,000×gで3分間遠心分離して核画分を得た。
【0073】
この核画分に200μlの溶出緩衝液(20mM Hepes−KOH(pH7.9)、10%グリセロール、420mM NaCl、1.5mM MgCl2、0.2mM エチレンジアミン四酢酸(EDTA)、0.5mM ジチオトレイトール(DTT)、0.5mM フェニルメチルスルホニルフルオリド(PMSF)、1μM ロイペプチン、1μM アプロチニン)を添加して、氷上で30分間振盪した後に15,000×gで15分間遠心分離して得た上清を核抽出液とした。
【0074】
4つのSNP(SNPa、SNPc、SNPd、およびSNPe)に関する多型部位における正常型配列または変異型配列をそれぞれ含む24bpのオリゴヌクレオチドプローブを作製した。
【0075】
【化1】

【0076】
これらのプローブを、DIG−11−ddUTP(ロシュ・ダイアグノスティックス社)を用いて末端標識して、ジゴキシゲニン(DIG)標識2本鎖オリゴヌクレオチドプローブを得た。
【0077】
20mM Hepes−KOH(pH7.9)、10%グリセロール、20mM KCl、0.5mM エチレンジアミン四酢酸(EDTA)、0.5mM ジチオトレイトール(DTT)、0.5mM フェニルメチルスルホニルフルオリド(PMSF)、1μg BSA、0.5μg poly(dI−dC)(アマシャムバイオサイエンス社)を含む全量20μlの反応系において、核抽出液5μgおよび上記DIG標識2本鎖オリゴヌクレオチドプローブ(各0.5pmole)を反応させた。
【0078】
反応後のサンプルを、1×TGE緩衝液(pH8.5)(50mM Tris−HCl、380mM グリシン、2mM エチレンジアミン四酢酸)を用いて、4%ポリアクリルアミドゲルにて電気泳動した後、ナイロンメンブレンプラスチャージ(ロシュ・ダイアグノスティックス社)に転写した。DIG標識オリゴヌクレオチドを転写したメンブレンを、アルカリホスファターゼ標識F(ab)2抗DIG抗体(ロシュ・ダイアグノスティックス社)と反応させた後、100μg/ml CSPD基質(ロシュ・ダイアグノスティックス社)を用いた化学発光反応によって可視化した(図2)。
【0079】
その結果、SNPdを含むプローブでのみバンドシフトが認められ、SNPdに対して特異的に結合する因子が存在することが示された。この因子は、SNPdを含む変異型配列と比較して正常型配列に強く結合し、この結合は、細胞をPHAおよびPMAによって刺激することによってさらに増強した(図2)。
〔実施例2:UVクロスリンク法を用いたd領域結合タンパク質の分子量の解析〕
未刺激のJurkat細胞(2×106細胞)を、500μlの低張緩衝液(10mM Hepes−KOH(pH7.9)、1.5mM 塩化マグネシウム、10mM 塩化カリウム、0.5mM エチレンジアミン四酢酸、0.5mM ジチオスレイトール(DTT)、0.5mM フェニルメチルスルホニルフルオリド(PMSF)、1μM ロイペプチン、1μM アプロチニンを含む)に懸濁した後、氷冷下で10分間放置した。さらに、10% Nonidet P−40(NP−40)5μlを加え、氷冷下で20分間インキュベートした後、2000×gにて3分間遠心した。核分画を回収し、200μlの溶出緩衝液(20mM Hepes−KOH(pH7.9)、10% グリセロール、420mM 塩化ナトリウム、1.5mM 塩化マグネシウム、0.2mM エチレンジアミン四酢酸、0.5mM ジチオスレイトール、0.5mM フェニルメチルスルホニルフルオリド、1μMロイペプチン、1μMアプロチニンを含む)を加え、氷上で30分間振湯した後、15000×gにて15分間遠心した。得られた上清を核抽出液とした。
【0080】
d領域に対するビオチン標識2本鎖DNAプローブ(配列番号7および8)を、Psoralen−Biotin conjugate(アンビオン社製)を用いて標識した。全量20μlの反応系において、上記核抽出液5μgおよび40fmolの上記プローブを含む反応液(100mM Tris−HCl(pH8.0)、5mM エチレンジアミン四酢酸、2mM β−メルカプトエタノール、0.1mM 塩化亜鉛、12.5% グリセロール)を室温で20分間反応させた。
【0081】
反応後のサンプルにUV光(254 nm)を氷冷下に10分間照射し、次いで100mM 硫酸マグネシウム、100mM 塩化カルシウムを各2μl加えた。さらに、デオキシリボヌクレアーゼI(和光純薬工業社製)5μgおよびミクロコッカルヌクレアーゼ(フェルメンタス社製)1unitを加えた後、37℃で30分間反応させた。ドデシル硫酸ナトリウム(SDS)−サンプル緩衝液(0.062M Tris−HCl(pH6.8)、2% SDS、5% β−メルカプトエタノール、10% グリセロール、0.002% ブロモフェノールブルーを含む)を加えて反応を停止し、95℃で5分間加熱して、SDS−ポリアクリルアミド電気泳動(PAGE)のサンプルとした。
【0082】
得られたサンプルをビオチン標識分子量マーカー(アマシャムバイオサイエンス社製)とともに、7.5〜15%勾配SDS−ポリアクリルアミドゲル(バイオクラフト社製)にて、常法に従って泳動した。泳動後、SDS−PAGEにて分離したサンプルを、ナイロンメンブレン プラスチャージ(ロシュ・ダイアグノスティックス社製)に転写した。ビオチン標識DNAプローブをアルカリフォスファターゼ標識ストレプトアビジン(アンビオン社製)と反応させた後、CDP−Star基質(アンビオン社製)を用いた化学発光反応によって可視化して、目的蛋白質を検出した。
【0083】
〔実施例3:d領域結合タンパク質のアフィニティー精製〕
未刺激のJurkat細胞(2×106細胞)を、500μlの低張緩衝液(10mM Hepes−KOH(pH7.9)、1.5mM 塩化マグネシウム、10mM 塩化カリウム、0.5mM エチレンジアミン四酢酸、0.5mM ジチオスレイトール(DTT)、0.5mM フェニルメチルスルホニルフルオリド(PMSF)、1μM ロイペプチン、1μM アプロチニンを含む)に懸濁した後、氷冷下で10分間放置した。さらに、10% Nonidet P−40(NP−40)5μlを加え、氷冷下で20分間インキュベートした後、2000×gにて3分間遠心した。核分画を回収し、200μlの溶出緩衝液(20mM Hepes−KOH(pH7.9)、10% グリセロール、420mM 塩化ナトリウム、1.5mM 塩化マグネシウム、0.2mM エチレンジアミン四酢酸、0.5mM ジチオスレイトール、0.5mM フェニルメチルスルホニルフルオリド、1μMロイペプチン、1μMアプロチニンを含む)を加え、氷上で30分間振湯した後、15000×gにて15分間遠心した。得られた上清を核抽出液とした。
【0084】
100μlの50%ストレプトアビジン−アガロースビーズ溶液に洗浄緩衝液(20mM Hepes−KOH(pH7.6)、100mM 塩化カリウム、0.01% NP−40を含む)を加えて、ビーズを洗浄した。ブロッキング緩衝液(20mM Hepes−KOH(pH7.6)、300mM 塩化カリウム、0.01% NP−40、0.5mg/ml 牛血清アルブミン(BSA))を加えて、4℃で30分間反応させた後、洗浄緩衝液でビーズを洗浄し、100μlの洗浄緩衝液中に懸濁した。
【0085】
全量100μlの反応系において、得られたビーズ懸濁液20μlと1μgのd領域を3回繰り返したビオチン末端標識2本鎖オリゴヌクレオチド(配列番号7および8)を含む反応液(20mM Hepes−KOH(pH7.6)、100mM 塩化カリウム、0.01% NP−40、0.5mg/ml BSAを含む)を4℃で1時間反応させた。
【0086】
次いで、結合緩衝液1(10mM Hepes−KOH(pH7.9)、100mM 塩化カリウム、2mM 塩化マグネシウム、0.5mM エチレンジアミン四酢酸、10% グリセロール、1mM ジチオスレイトール、0.2% Tween20)を用いてビーズを洗浄し、20μlの結合緩衝液1に懸濁した。全量200μlの反応系において、得られたビーズ懸濁液20μlと核抽出液100μgを含む結合緩衝液2(10mM Hepes−KOH(pH7.9)、100mM 塩化カリウム、2mM 塩化マグネシウム、0.5mM エチレンジアミン四酢酸、10% グリセロール、1mM ジチオスレイトール、0.2% Tween20、50ng/μl Poly(dI−dC)(アマシャムバイオサイエンス社製)、0.2μg/μl牛血清アルブミン)を4℃で30分間反応させた。
【0087】
反応後に、結合緩衝液1でビーズを洗浄し、蛋白抽出緩衝液(58mM Tris−HCl(pH6.8)、6% グリセロール、1.7% SDS、0.0025% ブロモフェノールブルー、0.8% β−メルカプトエタノールを含む)を加えて、95℃で5分間加熱し、SDS−ポリアクリルアミド電気泳動(PAGE)のサンプルとした。得られたサンプルをプロテインマーカー(アプロサイエンス社製)とともに7.5〜15%勾配SDS−ポリアクリルアミドゲル(バイオクラフト社製)にて、常法に従って泳動した。泳動後、分離したタンパク質を、銀染色IIキットワコー(和光純薬工業)を用いて銀染色して、目的蛋白質を検出した。
【産業上の利用可能性】
【0088】
本発明に係るポリペプチドおよびポリヌクレオチドは、関節リウマチの発症のメカニズムの解明に有効に利用することができる。また、本発明を用いれば、関節リウマチの発症またはその発症可能性を高精度に簡便かつ確実に診断(検出)することができる。それゆえ、本発明は関節リウマチの予防および治療の分野において、高い利用可能性を有している。
【図面の簡単な説明】
【0089】
【図1】図1は、DR3ゲノム配列におけるSNPの部位を示す図である。
【図2】図2は、4つのSNP(SNPa、SNPc、SNPd、およびSNPe)に関する正常型配列または変異型配列をそれぞれ含むオリゴヌクレオチドプローブを用いたゲルシフト法の結果を示す図である。
【技術分野】
【0001】
本発明は、関節リウマチの発症に関与するポリペプチドおよび当該ポリペプチドをコードするポリヌクレオチド、およびこれらを用いる関節リウマチの発症またはその発症可能性の診断キット、診断方法、および関節リウマチの治療薬剤に関するものである。
【背景技術】
【0002】
関節リウマチ(rheumatoid arthritis:以下「RA」ともいう)は、多発するびらん性関節炎を主徴とするが、同時に多臓器を障害する原因不明の全身性炎症疾患である。RAは寛解と増悪とを繰り返しながら慢性に進行し、無治療で放置すると関節の破壊や変形を来し、やがて運動器の機能障害を呈してくる。時には生命をも脅かす。したがって、RA患者は身体的にも精神的にも大きな苦痛を生涯に亘って背負うことになる。
【0003】
RAは、その発症の仕方も多種多様であり、その診断には、アメリカリウマチ学会の診断基準が広く利用されている。しかしながら、RAの発症は、通常、緩徐で数週間から数ヶ月にわたり、アメリカリウマチ学会の診断基準における客観的な指標としてのリウマトイド因子の存在は、その陽性率が3ヶ月以内で33%、12ヶ月以上においても88%程度(例えば、非特許文献1を参照のこと)であり、RAと確実に診断するには至っていない。そこで、組換え抗原と反応する患者血清中のリウマチ性関節炎関連抗体IgM抗体を検出し、リウマチ性関節炎を診断しようとする試みなどがなされている(例えば、特許文献1を参照のこと)。
【0004】
また、RAの治療は、RA病態の病状の進行過程によって選択すべき治療手段は異なるのが通常である。一般的に確定診断が下せない初期では、非ステロイド抗炎症薬(NSAID)を投与し、確定診断が下せた場合は、NSAIDに加えて疾患修飾性リウマチ薬(DMARD)を投与する。特にRA発症の初期には、確定診断を下すことは困難であり、現状では、NSAIDを投与し、経過を慎重に観察しながら膠原病を含む他のリウマチ疾患との鑑別を同時に行っている。さらに症状が進行した場合は、ステロイド薬の投与を行う場合もあり、疼痛のための薬物療法と共に関節機能の維持・回復に対して理学療法・装具療法を行う。また、関節破壊により日常生活が不自由になった場合には、手術療法を行う場合もある。
【0005】
特許文献2では、本願発明者らが、マイクロサテライトマーカーを用いた連鎖解析をRA患者およびその血縁者に対して実施することにより、関節リウマチの疾患遺伝子が位置する3カ所の遺伝子座を特定し、以下の疾患遺伝子を同定している。
(1)ヒト第1染色体の、マイクロサテライトマーカーD1S214および/またはD1S253がハイブリダイズするDNA配列から±1センチモルガン以内に位置する関節リウマチの疾患遺伝子。
(2)ヒト第8染色体の、マイクロサテライトマーカーD8S556がハイブリダイズするDNA配列から±1センチモルガン以内に位置する関節リウマチの疾患遺伝子。
(3)ヒトX染色体の、マイクロサテライトマーカーDXSl001、DXS1047、DXS1205、DXS1227および/またはDXS1232がハイブリダイズするDNA配列から±1センチモルガン以内に位置する関節リウマチの疾患遺伝子。
【0006】
また、非特許文献2には、本願発明者らが、前記先願発明の各疾患関与遺伝子にうち、前記(1)の疾患関与遺伝子に関係するマーカーD1S214およびD1S253の疾患関与遺伝子として、デスレセプター3(death receptor 3:「DR3」または「DR3遺伝子」ともいう)を挙げ、健常人とRA患者との間にDR3の制限断片長多型を確認し、DR3がRAにおける疾患関与遺伝子である可能性を示唆している。
【0007】
さらに、特許文献3では、本願発明者らが、DR3遺伝子のゲノム変異と関節リウマチ(慢性関節リウマチ)発症との関係について開示している。
【特許文献1】特開平10−513257号(公開日:平成10年12月15日)
【特許文献2】国際公開WO98/51791号(国際公開日:1998年11月19日)
【特許文献3】国際公開WO02/34912(国際公開日:2002年5月2日)
【非特許文献1】治療、第73巻、第3号、第23〜27頁、1991年
【非特許文献2】リウマチ、第39号、第2号、第444頁および第445頁(1999年)
【発明の開示】
【発明が解決しようとする課題】
【0008】
上述のように、種々の自己免疫疾患について積極的な研究成果が数多く報告されているが、自己免疫疾患(特に、関節リウマチ)の発症を客観的に診断する技術は未だ十分に確立されているとはいえない。このため、関節リウマチをはじめとする自己免疫疾患の発症についての客観的かつ正確な診断に寄与できる、新たな技術の確立が強く望まれていた。
【0009】
本発明は、上記の問題点に鑑みてなされたものであり、その目的は、関節リウマチの発症について、客観的かつ正確な診断を可能とするための因子、ならびに当該因子を用いる診断キット、診断方法および薬剤を提供することにある。
【課題を解決するための手段】
【0010】
本発明者らは、RAの疾患遺伝子の1つとして同定したDR3(デスレセプター3)の4ヶ所のSNP(それぞれSNPa、SNPc、SNPd、およびSNPe)および14塩基の欠損が、関節リウマチ(RA)家系発症例において有意に観察されることを見出している(特許文献3を参照のこと)。中でも、SNPdは、機能変異を伴うDR3スプラインシングバリアントを産生することが示唆されている。しかし、このようなスプライシングバリアントがどのような機序に基づいて産生されるのかは未だ不明である。そこで、本発明者らは、上記バリアントの産生機構を解明することを目的として、DR3の変異領域に結合する因子の探索を試みた。具体的には、4つのSNP(SNPa、SNPc、SNPd、およびSNPe)に関する多型部位における正常型配列または変異型配列をそれぞれ含むオリゴヌクレオチドプローブを作製し、DR3遺伝子に対するゲルシフト法によって、DR3変異領域に結合する因子の存在を検討した。
【0011】
その結果、SNPdを含むプローブを用いた場合でのみバンドシフトが認められ、SNPdに対して特異的に結合する因子が存在することが示された。
【0012】
このように、本発明者らは、DR3ゲノムDNAにおけるd領域に結合する因子が存在することを見出し、当該因子がDR3スプライシングバリアントを産生させる要因の1つであることを示した。また、当該因子を用いることによって、被験体または被験体由来のサンプル(例えば、細胞)における、DR3の変異に基づくRAの発症またはその発症可能性を判定することができることを見出した。さらに、当該因子が、関節リウマチの新たな予防法、治療法および治療薬剤としても有用であることを見出した。これらの知見に基づいて、本発明者らは本発明を完成させるに至った。
【0013】
本発明に係るポリペプチドは、DR3遺伝子のd領域に結合することを特徴としている。
【0014】
本発明に係るポリペプチドは、配列番号7に示される塩基配列からなるポリヌクレオチドに結合することを特徴としている。
【0015】
本発明に係るポリペプチドは、配列番号8に示される塩基配列からなるポリヌクレオチドに結合しないことが好ましい。
【0016】
本発明に係るポリヌクレオチドは、上記のポリペプチドをコードすることを特徴としている。
【0017】
本発明に係る診断キットは、関節リウマチの発症またはその発症可能性を判定するために、上記のポリペプチドを備えることを特徴としている。
【0018】
本発明に係る診断キットは、関節リウマチの発症またはその発症可能性を判定するために、上記のポリヌクレオチドを備えることを特徴としている。
【0019】
本発明に係る診断方法は、関節リウマチの発症またはその発症可能性を判定するために、上記のポリペプチドを用いることを特徴としている。
【0020】
本発明に係る診断方法は、関節リウマチの発症またはその発症可能性を判定するために、上記のポリヌクレオチドを用いることを特徴としている。
【0021】
本発明に係る薬剤は、関節リウマチを治療するために、上記のポリペプチドを含むことを特徴としている。
【0022】
本発明に係る薬剤は、関節リウマチを治療するために、上記のポリヌクレオチドを含むことを特徴としている。
【0023】
本発明に係るスクリーニングキットは、配列番号7に示される塩基配列からなるポリヌクレオチドを備えることを特徴としている。
【0024】
本発明に係るスクリーニングキットは、配列番号8に示される塩基配列からなるポリヌクレオチドをさらに備えることが好ましい。
【0025】
本発明に係るスクリーニング方法は、配列番号7に示される塩基配列からなるポリヌクレオチドを用いることを特徴としている。
【0026】
本発明に係るスクリーニングキットは、配列番号8に示される塩基配列からなるポリヌクレオチドをさらに用いることが好ましい。
【発明の効果】
【0027】
本発明に係るポリペプチドまたはポリヌクレオチドは、ヒト関節リウマチの発症のメカニズムの解明に有効に利用することができる。さらに、本発明のポリペプチドまたはポリヌクレオチドは、関節リウマチの診断、関節リウマチの発症可能性の判定、関節リウマチの適切な治療薬剤の開発に利用することができる。
【0028】
また、本発明に係る関節リウマチの診断キットおよび診断方法によれば、関節リウマチの発症、または、その発症可能性の判定を、高精度かつ簡便に行うことができる。それゆえ、関節リウマチの予防および治療に役立てることができる。
【発明を実施するための最良の形態】
【0029】
本発明者らは、特許文献3に示すように、被験者から得られた細胞において、配列番号1に示される塩基配列を有するDR3のゲノムDNA配列中の下記の変異を見出している:
(a)第1755位の塩基がアデニン(A)からグアニン(G)への置換(SNPa);
(b)第2443〜2456位の塩基の欠損;
(c)第2531位の塩基がシトシン(C)からチミン(T)への置換(SNPc);
(d)第2678位の塩基がアデニン(A)からチミン(T)への置換(SNPd);および
(e)第2826位の塩基がアデニン(A)からグアニン(G)への置換(SNPe)。
【0030】
図1に示すように、第1755位の塩基は、DR3ゲノムDNAのエキソン領域(エキソン5)内にあり、配列番号2に示されるアミノ酸配列からなるDR3ポリペプチドにおいては、上記(a)の変異に伴って第159位のアミノ酸のアスパラギン酸からグリシンへ変異する。一方、上記(b)〜(e)の変異は、DR3ゲノムのイントロン領域にある。
【0031】
本明細書中で使用される場合、用語「a領域」は、DR3のゲノムDNAにおける上記(a)の変異を含む領域が意図される。用語「b領域」〜「e領域」もまた、本明細書中で同様に使用される。
【0032】
a領域は、好ましくは、配列番号1に示される塩基配列の第1744〜1767位からなり、より好ましくは、配列番号3に示される塩基配列からなる。a領域におけるSNP(SNPa)は、配列番号1に示される塩基配列の第1755位の塩基がアデニン(A)からグアニン(G)に置換されている(配列番号4)。c領域は、好ましくは、配列番号1に示される塩基配列の第2520〜2543位からなり、より好ましくは、配列番号5に示される塩基配列からなる。c領域におけるSNP(SNPc)は、配列番号1に示される塩基配列の第2531位の塩基がシトシン(C)からチミン(T)に置換されている(配列番号6)。d領域は、好ましくは、配列番号1に示される塩基配列の第2667〜2690位からなり、より好ましくは、配列番号7に示される塩基配列からなる。d領域におけるSNP(SNPd)は、配列番号1に示される塩基配列の第2678位の塩基がアデニン(A)からチミン(T)に置換されている(配列番号8)。e領域は、好ましくは、配列番号1に示される塩基配列の第2815〜2838位からなり、より好ましくは、配列番号9に示される塩基配列からなる。e領域におけるSNP(SNPe)は、配列番号1に示される塩基配列の第2826位の塩基がアデニン(A)からグアニン(G)に置換されている(配列番号10)。
【0033】
塩基配列に関して本明細書中で使用される場合、特に断らない限り、A、C、GおよびTは、アデニン、シトシン、グアニンおよびチミンの各塩基を示す。また、アミノ酸およびアミノ酸残基は、IUPACおよびIUBの定める1文字表記または3文字表記を使用する。また、転写産物とは、ゲノムが転写および翻訳される結果として生じる産物であり、たとえば、mRNA、cDNAおよびタンパク質(ポリペプチド)などが挙げられる。
【0034】
配列番号1に示される塩基配列の第1755位の塩基は、cDNAとしてジーンバンクに登録されている配列(アクセッション番号NM_003790)の564番目の塩基に相当する。このゲノムDNAのエキソン5の3’末端の塩基を基準とし、一塩基後のイントロンの塩基を1番目とすると位置2443〜2456の欠損は、エキソン5の3’末端から622〜635番目の塩基の欠損に相当する。また、エキソン6の5’末端の塩基を基準とし、一塩基前のイントロンの塩基番号を−1番目とすると、位置2531の変異は、−538番目、位置2678の変異は−391番目、位置2826の変異は−243番目の塩基に相当する(図1)。なお、Tが28塩基連続する領域(位置2443〜2470)においては、その数が3塩基分増減する可能性があり、変異型ゲノムのTが14塩基連続する領域も同様にしてその数が3塩基分増減する可能性がある。
【0035】
以下、本発明についてより詳細に説明するが、本発明はこの記載に限定されるものではない。
【0036】
〔1〕ポリペプチド
本発明は、DR3遺伝子のd領域に結合するポリペプチドを提供する。一実施形態において、本発明に係るポリペプチドは、配列番号7に示される塩基配列からなるポリヌクレオチドに結合することが好ましい。さらなる実施形態において、本発明に係るポリヌクレオチドは、配列番号7に示される塩基配列からなるポリヌクレオチドに結合するが、配列番号8に示される塩基配列からなるポリヌクレオチドに結合しないことが好ましい。
【0037】
本明細書中で使用される場合、用語「ポリペプチド」は、「ペプチド」または「タンパク質」と交換可能に使用される。本発明に係るポリペプチドはまた、天然供給源より単離されても、組換え生成されても、化学合成されてもよい。
【0038】
用語「単離された」ポリペプチドまたはタンパク質は、その天然の環境から取り出されたポリペプチドまたはタンパク質が意図される。例えば、宿主細胞中で発現された組換え産生されたポリペプチドおよびタンパク質は、任意の適切な技術によって実質的に精製されている天然または組換えのポリペプチドおよびタンパク質と同様に、単離されていると考えられる。
【0039】
本発明に係るポリペプチドは、天然の細胞もしくは組織由来の精製産物、化学合成手順の産物、または原核生物宿主もしくは真核生物宿主(例えば、細菌細胞、酵母細胞、高等植物細胞、昆虫細胞、および哺乳動物細胞を含む)から組換え技術によって産生されることが好ましい。
【0040】
一実施形態において、本発明に係るポリペプチドは、被験体由来の細胞または組織の抽出液から精製されることが好ましい。ポリペプチドを精製する工程は、周知の方法(例えば、細胞または組織を破壊した後に遠心分離して可溶性画分を回収する方法)で細胞または組織から細胞抽出液(例えば、核抽出液)を調製した後、この細胞抽出液から周知の方法(例えば、硫安沈殿またはエタノール沈殿、酸抽出、陰イオンまたは陽イオン交換クロマトグラフィー、ホスホセルロースクロマトグラフィー、疎水性相互作用クロマトグラフィー、アフィニティークロマトグラフィー、ヒドロキシアパタイトクロマトグラフィー、およびレクチンクロマトグラフィー)によって精製する工程が好ましいが、これらに限定されない。
【0041】
使用する細胞は、公知の方法に従って被験体の全ての細胞(例えば、末梢リンパ球、滑膜細胞、および各臓器など)から得ることができる。得られた細胞は、適宜、培養し、増殖させて利用することができる。好ましい細胞としては、Jurkat細胞、Hela細胞、TF−1細胞、MOLT4細胞などが挙げられる。
【0042】
また、本発明に係るポリペプチドは、DR3シグナル伝達に関与することが示唆される。従って、使用する細胞を、DR3シグナル伝達経路を駆動するために刺激することが好ましい。刺激に利用する試薬としては、例えば、デスレセプターのリガンド(例えば、Fasリガンド、TNF、DR3リガンドなど)、抗Fas抗体、アクチノマイシンD、放射線、グルココルチコイド、ホルボール12−ミリステート13−アセテート(PMA)、およびフィトヘマグルチニン(PHA)などが挙げられるがこれらに限定されない。また、これらを2種以上組合わせて利用してもよい。これらの試薬のうち、好ましくは、DR3リガンド、PMA、およびPHA、より好ましくは、DR3リガンドである。
【0043】
試薬を添加する時間は、特に限定されないが、例えば、1時間〜72時間程度であればよく、好ましくは、12〜48時間であればよい。また、刺激を与えないコントロール細胞を用意する必要がある。
【0044】
他の実施形態において、本発明に係るポリペプチドは、後述する本発明に係るポリヌクレオチド(本発明に係るポリペプチドをコードするポリヌクレオチド)を宿主細胞に導入して、そのポリペプチドを細胞内発現させた状態であってもよいし、発現させた細胞または組織などから単離精製されてもよい。
【0045】
上記ポリヌクレオチドを宿主細胞に導入するために、種々のベクターが使用され得る。ベクターの具体的な種類は特に限定されず、宿主細胞中で発現可能なベクターを適宜選択すればよい。すなわち、宿主細胞の種類に応じて、確実に上記ポリヌクレオチドを発現させるために適宜プロモーター配列を選択し、これと上記ポリヌクレオチドを各種プラスミド等に組み込んだベクターを発現ベクターとして用いればよい。
【0046】
発現ベクターは、好ましくは少なくとも1つの選択マーカーを含む。このようなマーカーとしては、真核生物細胞培養についてはジヒドロ葉酸レダクターゼまたはネオマイシン耐性、およびE.coliおよび他の細菌における培養についてはテトラサイクリン耐性遺伝子またはアンピシリン耐性遺伝子が挙げられる。
【0047】
上記選択マーカーを用いれば、上記ポリヌクレオチドが宿主細胞に導入されたか否か、さらには宿主細胞中で確実に発現しているか否かを確認することができる。
【0048】
上記の宿主細胞は、特に限定されるものではなく、従来公知の各種細胞を好適に用いることができる。具体的には、例えば、大腸菌(Escherichia coli)等の細菌、酵母(出芽酵母Saccharomyces cerevisiae、分裂酵母Schizosaccharomyces pombe)、線虫(Caenorhabditis elegans)、アフリカツメガエル(Xenopus laevis)の卵母細胞等を挙げることができるが、特に限定されるものではない。上記の宿主細胞のための適切な培養培地および条件は当分野で周知である。
【0049】
上記発現ベクターを宿主細胞に導入する方法、すなわち形質転換法も特に限定されるものではなく、電気穿孔法、リン酸カルシウム法、リポソーム法、DEAEデキストラン法等の従来公知の方法を好適に用いることができる。また、例えば、本発明に係るポリペプチドを昆虫で転移発現させる場合には、バキュロウイルスを用いた発現系を用いればよい。
【0050】
また、本実施形態に係るポリペプチドは、付加的なポリペプチドを含むものであってもよい。付加的なポリペプチドとしては、例えば、HisやMyc、Flag等のエピトープ標識ポリペプチドが挙げられる。好ましい実施形態において、本発明に係るポリペプチドは、融合タンパク質のような改変された形態で組換え発現され得る。例えば、本発明に係るポリペプチドの付加的なアミノ酸、特に荷電性アミノ酸の領域が、宿主細胞内での、精製の間または引き続く操作および保存の間の安定性および持続性を改善するために、ポリペプチドのN末端に付加され得る。
【0051】
遺伝子が細胞に導入されたか否かの確認は、PCR法、サザンハイブリダイゼーション法、ノーザンハイブリダイゼーション法などによって行うことができる。例えば、形質転換細胞からDNAを調製し、DNA特異的プライマーを設計してPCRを行う。PCRは、前記プラスミドを調製するために使用した条件と同様の条件で行うことができる。その後は、増幅産物についてアガロースゲル電気泳動、ポリアクリルアミドゲル電気泳動またはキャピラリー電気泳動などを行い、臭化エチジウム、SYBR Green液などによって染色し、そして増幅産物を1本のバンドとして検出することによって、形質転換されたことを確認することができる。また、予め蛍光色素などによって標識したプライマーを用いてPCRを行い、増幅産物を検出することもできる。さらに、マイクロプレートなどの固相に増幅産物を結合させ、蛍光または酵素反応などによって増幅産物を確認する方法も採用することができる。
【0052】
別の実施形態において、本発明に係るポリペプチドは、化学合成の公知の方法を使用して合成され得る。例えば、Houghtenは、4週間未満で調製されそして特徴付けられたHA1ポリペプチドセグメントの単一アミノ酸改変体を示す10〜20mgの248の異なる13残基ペプチドのような多数のペプチドの合成のための簡単な方法を記載している。Houghten,R.A.,Proc.Natl.Acad.Sci.USA 82:5131−5135(1985)。この「Simultaneous Multiple Peptide Synthesis(SMPS)」プロセスは、さらにHoughtenら(1986)の米国特許第4,631,211号に記載される。この手順において、種々のペプチドの固相合成のための個々の樹脂は、別々の溶媒透過性パケットに含まれ、固相法に関連する多くの同一の反復工程の最適な使用を可能にする。完全なマニュアル手順は、500〜1000以上の合成が同時に行われるのを可能にする(Houghtenら、前出、5134)。これらの文献は、本明細書中に参考として援用される。
【0053】
本発明に係るポリペプチドは、関節リウマチの発症またはその発症可能性を判定するため方法およびキット、ならびに関節リウマチを治療するための薬剤において有用である。
【0054】
このように、本発明に係るポリペプチドは、少なくとも、DR3遺伝子のd領域(好ましくは、配列番号7に示される塩基配列からなるポリヌクレオチド)に結合するポリペプチドであればよいといえる。すなわち、当該ポリペプチドが、特定の機能(例えば、タグ)を有する任意のアミノ酸配列とからなるポリペプチドと連結されている場合もまた本発明に含まれることに留意すべきである。また、当該ポリペプチドおよび当該任意のアミノ酸配列は、それぞれの機能を阻害しないように適切なリンカーペプチドで連結されていてもよい。
【0055】
つまり、本発明の目的は、DR3遺伝子のd領域に結合するポリペプチドを提供することにあるのであって、本明細書中に具体的に記載したポリペプチド作製方法等に存するのではない。したがって、上記各方法以外によって取得されるポリペプチドも本発明の範囲に属することに留意しなければならない。
【0056】
〔2〕ポリヌクレオチド
本発明は、本発明に係る上記ポリペプチドをコードするポリヌクレオチドを提供する。本明細書中で使用される場合、用語「ポリヌクレオチド」は、「遺伝子」、「核酸」または「核酸分子」と交換可能に使用され、ヌクレオチドの重合体が意図される。本明細書中で使用される場合、用語「塩基配列」は、「遺伝子配列」、「核酸配列」または「ヌクレオチド配列」と交換可能に使用され、デオキシリボヌクレオチド(A、G、CおよびTと省略される)の配列として示される。
【0057】
本発明に係るポリヌクレオチドは、より長いポリヌクレオチド(例えば、本発明に係るDR3結合タンパク質をコードするcDNA全長からなるポリヌクレオチド)の切断フラグメントとして生成されても、化合合成されてもよい。例えば、制限エンドヌクレアーゼ切断または超音波による剪断は、種々のサイズのフラグメントを作製するために容易に使用され得る。あるいは、このようなフラグメントは、合成的に作製され得る。適切なフラグメント(オリゴヌクレオチド)が、Applied Biosystems Incorporated(ABI,850 Lincoln Center Dr.,Foster City,CA 94404)392型シンセサイザーなどによって合成される。
【0058】
本発明に係るポリヌクレオチドを取得する方法として、PCR等の増幅手段を用いる方法を挙げることができる。例えば、本発明に係るポリヌクレオチドのcDNAのうち、5’側および3’側の配列(またはその相補配列)の中からそれぞれプライマーを調製し、これらプライマーを用いてゲノムDNA(またはcDNA)等を鋳型にしてPCR等を行い、両プライマー間に挟まれるDNA領域を増幅することで、本発明に係るポリヌクレオチドを含むDNA断片を大量に取得できる。
【0059】
また本発明に係るポリヌクレオチドは、その5’側または3’側で上述のタグ標識(タグ配列またはマーカー配列)をコードするポリヌクレオチドに融合され得る。
【0060】
つまり、本発明の目的は、DR3のd領域に結合するポリペプチドをコードするポリヌクレオチドを提供することにあるのであって、本明細書中に具体的に記載したポリヌクレオチドの作製方法等に存するのではない。したがって、上記各方法以外によって取得されるポリヌクレオチドもまた本発明の範囲に属することに留意しなければならない。
【0061】
〔3〕診断キットおよび診断方法
本発明は、関節リウマチの発症またはその発症可能性を判定するための診断キットを提供する。本明細書中で使用される場合、関節リウマチの「発症可能性」とは、関節リウマチ(RA)が発生する危険度を示す指標をいい、発症可能性が高ければそれだけRAになりやすく、逆に発症可能性が低ければRAになり難いということを示す。一実施形態において、本発明に係る診断キットは、本発明に係るポリペプチドを備えることが好ましい。他の実施形態において、本発明に係る診断キットは、本発明に係るポリヌクレオチドを備えることが好ましい。また、本発明に係る診断キットは、他の試薬を併せて備えてもよい。
【0062】
本発明はまた、関節リウマチの発症またはその発症可能性を判定するための診断方法を提供する。一実施形態において、本発明に係る診断キットは、本発明に係るポリペプチドを用いることが好ましい。他の実施形態において、本発明に係る診断キットは、本発明に係るポリヌクレオチドを用いることが好ましい。また、本発明に係る診断方法は、他の工程を包含してもよい。
【0063】
本発明に係る診断(判定)キットおよび診断(判定)方法を使用することにより、RAの診断(発症またはその発症可能性の判定)を高精度に行うことができる。
【0064】
〔4〕治療薬剤および治療方法
本発明は、関節リウマチを治療するための薬剤を提供する。一実施形態において、本発明に係る治療薬剤は、本発明に係るポリペプチドを含むことが好ましい。他の実施形態において、本発明に係る診断キットは、本発明に係るポリヌクレオチドを含むことが好ましい。また、本発明に係る診断キットは、薬学的に受容可能なキャリアを併せて含んでもよい。
【0065】
本発明はまた、関節リウマチを治療するための方法を提供する。一実施形態において、本発明に係る治療方法は、本発明に係るポリペプチドを用いることが好ましい。他の実施形態において、本発明に係る治療方法は、本発明に係るポリヌクレオチドを用いることが好ましい。また、本発明に係る治療方法は、他の工程を包含してもよい。
【0066】
本発明に係る治療薬剤および治療方法を使用することにより、RAを有意に治療することができる。
【0067】
〔5〕スクリーニングキットおよびスクリーニング方法
本発明は、DR3遺伝子のd領域に結合するポリペプチドをスクリーニングするためのスクリーニングキットを提供する。一実施形態において、本発明に係るスクリーニングキットは、配列番号7に示される塩基配列からなるポリヌクレオチドを備えることが好ましい。さらなる実施形態において、本発明に係るスクリーニングキットは、配列番号8に示される塩基配列からなるポリヌクレオチドをさらに備えることが好ましい。
【0068】
本発明はまた、DR3遺伝子のd領域に結合するポリペプチドをスクリーニングするためのスクリーニング方法を提供する。一実施形態において、本発明に係るスクリーニング方法は、配列番号7に示される塩基配列からなるポリヌクレオチドを用いることが好ましい。さらなる実施形態において、本発明に係るスクリーニング方法は、配列番号8に示される塩基配列からなるポリヌクレオチドをさらに用いることが好ましい。
【0069】
以下、実施例を示し、本発明についてさらに詳しく説明するが、もちろん、本発明は以下の実施例に限定されるものではなく、細部については様々な態様が可能であることはいうまでもない。さらに、本発明は上述した実施形態に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。
【実施例】
【0070】
〔実施例1:DR3遺伝子の変異領域a、c、d、eに対するオリゴヌクレオチドを用いたゲルシフト法による解析〕
本発明者らは、4つのSNP(SNPa、SNPc、SNPd、およびSNPe)に関する正常型配列または変異型配列をそれぞれ含む24bpのオリゴヌクレオチドプローブを作製し、DR3遺伝子に対するゲルシフト法によって、DR3変異領域に結合する因子の存在を検討した。
【0071】
Jurkat細胞(2×106細胞)を、20ng/ml ホルボール12−ミリステート13−アセテート(PMA)および1μg/ml フィトヘマグルチニン(PHA)によって刺激(または未刺激)した。
【0072】
刺激24時間後、上記の細胞を500μlの低張緩衝液(10mM Hepes−KOH(pH7.9)、1.5mM MgCl2、10mM KCl、0.5mM エチレンジアミン四酢酸(EDTA)、0.5mM ジチオトレイトール(DTT)、0.5mM フェニルメチルスルホニルフルオリド(PMSF)、1μM ロイペプチン、1μM アプロチニン)に懸濁し、氷冷下にて10分間放置した。さらに、10% Nonidet P−40(NP−40)5μlを添加して、氷冷下にて20分間インキュベートした後、2,000×gで3分間遠心分離して核画分を得た。
【0073】
この核画分に200μlの溶出緩衝液(20mM Hepes−KOH(pH7.9)、10%グリセロール、420mM NaCl、1.5mM MgCl2、0.2mM エチレンジアミン四酢酸(EDTA)、0.5mM ジチオトレイトール(DTT)、0.5mM フェニルメチルスルホニルフルオリド(PMSF)、1μM ロイペプチン、1μM アプロチニン)を添加して、氷上で30分間振盪した後に15,000×gで15分間遠心分離して得た上清を核抽出液とした。
【0074】
4つのSNP(SNPa、SNPc、SNPd、およびSNPe)に関する多型部位における正常型配列または変異型配列をそれぞれ含む24bpのオリゴヌクレオチドプローブを作製した。
【0075】
【化1】

【0076】
これらのプローブを、DIG−11−ddUTP(ロシュ・ダイアグノスティックス社)を用いて末端標識して、ジゴキシゲニン(DIG)標識2本鎖オリゴヌクレオチドプローブを得た。
【0077】
20mM Hepes−KOH(pH7.9)、10%グリセロール、20mM KCl、0.5mM エチレンジアミン四酢酸(EDTA)、0.5mM ジチオトレイトール(DTT)、0.5mM フェニルメチルスルホニルフルオリド(PMSF)、1μg BSA、0.5μg poly(dI−dC)(アマシャムバイオサイエンス社)を含む全量20μlの反応系において、核抽出液5μgおよび上記DIG標識2本鎖オリゴヌクレオチドプローブ(各0.5pmole)を反応させた。
【0078】
反応後のサンプルを、1×TGE緩衝液(pH8.5)(50mM Tris−HCl、380mM グリシン、2mM エチレンジアミン四酢酸)を用いて、4%ポリアクリルアミドゲルにて電気泳動した後、ナイロンメンブレンプラスチャージ(ロシュ・ダイアグノスティックス社)に転写した。DIG標識オリゴヌクレオチドを転写したメンブレンを、アルカリホスファターゼ標識F(ab)2抗DIG抗体(ロシュ・ダイアグノスティックス社)と反応させた後、100μg/ml CSPD基質(ロシュ・ダイアグノスティックス社)を用いた化学発光反応によって可視化した(図2)。
【0079】
その結果、SNPdを含むプローブでのみバンドシフトが認められ、SNPdに対して特異的に結合する因子が存在することが示された。この因子は、SNPdを含む変異型配列と比較して正常型配列に強く結合し、この結合は、細胞をPHAおよびPMAによって刺激することによってさらに増強した(図2)。
〔実施例2:UVクロスリンク法を用いたd領域結合タンパク質の分子量の解析〕
未刺激のJurkat細胞(2×106細胞)を、500μlの低張緩衝液(10mM Hepes−KOH(pH7.9)、1.5mM 塩化マグネシウム、10mM 塩化カリウム、0.5mM エチレンジアミン四酢酸、0.5mM ジチオスレイトール(DTT)、0.5mM フェニルメチルスルホニルフルオリド(PMSF)、1μM ロイペプチン、1μM アプロチニンを含む)に懸濁した後、氷冷下で10分間放置した。さらに、10% Nonidet P−40(NP−40)5μlを加え、氷冷下で20分間インキュベートした後、2000×gにて3分間遠心した。核分画を回収し、200μlの溶出緩衝液(20mM Hepes−KOH(pH7.9)、10% グリセロール、420mM 塩化ナトリウム、1.5mM 塩化マグネシウム、0.2mM エチレンジアミン四酢酸、0.5mM ジチオスレイトール、0.5mM フェニルメチルスルホニルフルオリド、1μMロイペプチン、1μMアプロチニンを含む)を加え、氷上で30分間振湯した後、15000×gにて15分間遠心した。得られた上清を核抽出液とした。
【0080】
d領域に対するビオチン標識2本鎖DNAプローブ(配列番号7および8)を、Psoralen−Biotin conjugate(アンビオン社製)を用いて標識した。全量20μlの反応系において、上記核抽出液5μgおよび40fmolの上記プローブを含む反応液(100mM Tris−HCl(pH8.0)、5mM エチレンジアミン四酢酸、2mM β−メルカプトエタノール、0.1mM 塩化亜鉛、12.5% グリセロール)を室温で20分間反応させた。
【0081】
反応後のサンプルにUV光(254 nm)を氷冷下に10分間照射し、次いで100mM 硫酸マグネシウム、100mM 塩化カルシウムを各2μl加えた。さらに、デオキシリボヌクレアーゼI(和光純薬工業社製)5μgおよびミクロコッカルヌクレアーゼ(フェルメンタス社製)1unitを加えた後、37℃で30分間反応させた。ドデシル硫酸ナトリウム(SDS)−サンプル緩衝液(0.062M Tris−HCl(pH6.8)、2% SDS、5% β−メルカプトエタノール、10% グリセロール、0.002% ブロモフェノールブルーを含む)を加えて反応を停止し、95℃で5分間加熱して、SDS−ポリアクリルアミド電気泳動(PAGE)のサンプルとした。
【0082】
得られたサンプルをビオチン標識分子量マーカー(アマシャムバイオサイエンス社製)とともに、7.5〜15%勾配SDS−ポリアクリルアミドゲル(バイオクラフト社製)にて、常法に従って泳動した。泳動後、SDS−PAGEにて分離したサンプルを、ナイロンメンブレン プラスチャージ(ロシュ・ダイアグノスティックス社製)に転写した。ビオチン標識DNAプローブをアルカリフォスファターゼ標識ストレプトアビジン(アンビオン社製)と反応させた後、CDP−Star基質(アンビオン社製)を用いた化学発光反応によって可視化して、目的蛋白質を検出した。
【0083】
〔実施例3:d領域結合タンパク質のアフィニティー精製〕
未刺激のJurkat細胞(2×106細胞)を、500μlの低張緩衝液(10mM Hepes−KOH(pH7.9)、1.5mM 塩化マグネシウム、10mM 塩化カリウム、0.5mM エチレンジアミン四酢酸、0.5mM ジチオスレイトール(DTT)、0.5mM フェニルメチルスルホニルフルオリド(PMSF)、1μM ロイペプチン、1μM アプロチニンを含む)に懸濁した後、氷冷下で10分間放置した。さらに、10% Nonidet P−40(NP−40)5μlを加え、氷冷下で20分間インキュベートした後、2000×gにて3分間遠心した。核分画を回収し、200μlの溶出緩衝液(20mM Hepes−KOH(pH7.9)、10% グリセロール、420mM 塩化ナトリウム、1.5mM 塩化マグネシウム、0.2mM エチレンジアミン四酢酸、0.5mM ジチオスレイトール、0.5mM フェニルメチルスルホニルフルオリド、1μMロイペプチン、1μMアプロチニンを含む)を加え、氷上で30分間振湯した後、15000×gにて15分間遠心した。得られた上清を核抽出液とした。
【0084】
100μlの50%ストレプトアビジン−アガロースビーズ溶液に洗浄緩衝液(20mM Hepes−KOH(pH7.6)、100mM 塩化カリウム、0.01% NP−40を含む)を加えて、ビーズを洗浄した。ブロッキング緩衝液(20mM Hepes−KOH(pH7.6)、300mM 塩化カリウム、0.01% NP−40、0.5mg/ml 牛血清アルブミン(BSA))を加えて、4℃で30分間反応させた後、洗浄緩衝液でビーズを洗浄し、100μlの洗浄緩衝液中に懸濁した。
【0085】
全量100μlの反応系において、得られたビーズ懸濁液20μlと1μgのd領域を3回繰り返したビオチン末端標識2本鎖オリゴヌクレオチド(配列番号7および8)を含む反応液(20mM Hepes−KOH(pH7.6)、100mM 塩化カリウム、0.01% NP−40、0.5mg/ml BSAを含む)を4℃で1時間反応させた。
【0086】
次いで、結合緩衝液1(10mM Hepes−KOH(pH7.9)、100mM 塩化カリウム、2mM 塩化マグネシウム、0.5mM エチレンジアミン四酢酸、10% グリセロール、1mM ジチオスレイトール、0.2% Tween20)を用いてビーズを洗浄し、20μlの結合緩衝液1に懸濁した。全量200μlの反応系において、得られたビーズ懸濁液20μlと核抽出液100μgを含む結合緩衝液2(10mM Hepes−KOH(pH7.9)、100mM 塩化カリウム、2mM 塩化マグネシウム、0.5mM エチレンジアミン四酢酸、10% グリセロール、1mM ジチオスレイトール、0.2% Tween20、50ng/μl Poly(dI−dC)(アマシャムバイオサイエンス社製)、0.2μg/μl牛血清アルブミン)を4℃で30分間反応させた。
【0087】
反応後に、結合緩衝液1でビーズを洗浄し、蛋白抽出緩衝液(58mM Tris−HCl(pH6.8)、6% グリセロール、1.7% SDS、0.0025% ブロモフェノールブルー、0.8% β−メルカプトエタノールを含む)を加えて、95℃で5分間加熱し、SDS−ポリアクリルアミド電気泳動(PAGE)のサンプルとした。得られたサンプルをプロテインマーカー(アプロサイエンス社製)とともに7.5〜15%勾配SDS−ポリアクリルアミドゲル(バイオクラフト社製)にて、常法に従って泳動した。泳動後、分離したタンパク質を、銀染色IIキットワコー(和光純薬工業)を用いて銀染色して、目的蛋白質を検出した。
【産業上の利用可能性】
【0088】
本発明に係るポリペプチドおよびポリヌクレオチドは、関節リウマチの発症のメカニズムの解明に有効に利用することができる。また、本発明を用いれば、関節リウマチの発症またはその発症可能性を高精度に簡便かつ確実に診断(検出)することができる。それゆえ、本発明は関節リウマチの予防および治療の分野において、高い利用可能性を有している。
【図面の簡単な説明】
【0089】
【図1】図1は、DR3ゲノム配列におけるSNPの部位を示す図である。
【図2】図2は、4つのSNP(SNPa、SNPc、SNPd、およびSNPe)に関する正常型配列または変異型配列をそれぞれ含むオリゴヌクレオチドプローブを用いたゲルシフト法の結果を示す図である。
【特許請求の範囲】
【請求項1】
DR3遺伝子のd領域に結合することを特徴とするポリペプチド。
【請求項2】
配列番号7に示される塩基配列からなるポリヌクレオチドに結合することを特徴とするポリペプチド。
【請求項3】
配列番号8に示される塩基配列からなるポリヌクレオチドに結合しないことを特徴とする請求項1または2に記載のポリペプチド。
【請求項4】
請求項1〜3のいずれか1項に記載のポリペプチドをコードすることを特徴とするポリヌクレオチド。
【請求項5】
請求項1〜3のいずれか1項に記載のポリペプチドまたは請求項4に記載のポリヌクレオチドを備えることを特徴とする、関節リウマチの発症またはその発症可能性を判定するための診断キット。
【請求項6】
請求項1〜3のいずれか1項に記載のポリペプチドまたは請求項4に記載のポリヌクレオチドを用いることを特徴とする、関節リウマチの発症またはその発症可能性を判定するための診断方法。
【請求項7】
請求項1〜3のいずれか1項に記載のポリペプチドまたは請求項4に記載のポリヌクレオチドを含むことを特徴とする関節リウマチの治療薬剤。
【請求項8】
配列番号7に示される塩基配列からなるポリヌクレオチドを備えることを特徴とするDR3遺伝子のd領域に結合するポリペプチドをスクリーニングするためのスクリーニングキット。
【請求項9】
配列番号8に示される塩基配列からなるポリヌクレオチドをさらに備えることを特徴とする請求項8に記載のスクリーニングキット。
【請求項10】
配列番号7に示される塩基配列からなるポリヌクレオチドを用いることを特徴とするDR3遺伝子のd領域に結合するポリペプチドをスクリーニングするためのスクリーニング方法。
【請求項1】
DR3遺伝子のd領域に結合することを特徴とするポリペプチド。
【請求項2】
配列番号7に示される塩基配列からなるポリヌクレオチドに結合することを特徴とするポリペプチド。
【請求項3】
配列番号8に示される塩基配列からなるポリヌクレオチドに結合しないことを特徴とする請求項1または2に記載のポリペプチド。
【請求項4】
請求項1〜3のいずれか1項に記載のポリペプチドをコードすることを特徴とするポリヌクレオチド。
【請求項5】
請求項1〜3のいずれか1項に記載のポリペプチドまたは請求項4に記載のポリヌクレオチドを備えることを特徴とする、関節リウマチの発症またはその発症可能性を判定するための診断キット。
【請求項6】
請求項1〜3のいずれか1項に記載のポリペプチドまたは請求項4に記載のポリヌクレオチドを用いることを特徴とする、関節リウマチの発症またはその発症可能性を判定するための診断方法。
【請求項7】
請求項1〜3のいずれか1項に記載のポリペプチドまたは請求項4に記載のポリヌクレオチドを含むことを特徴とする関節リウマチの治療薬剤。
【請求項8】
配列番号7に示される塩基配列からなるポリヌクレオチドを備えることを特徴とするDR3遺伝子のd領域に結合するポリペプチドをスクリーニングするためのスクリーニングキット。
【請求項9】
配列番号8に示される塩基配列からなるポリヌクレオチドをさらに備えることを特徴とする請求項8に記載のスクリーニングキット。
【請求項10】
配列番号7に示される塩基配列からなるポリヌクレオチドを用いることを特徴とするDR3遺伝子のd領域に結合するポリペプチドをスクリーニングするためのスクリーニング方法。
【図1】


【図2】




【図2】


【公開番号】特開2006−67829(P2006−67829A)
【公開日】平成18年3月16日(2006.3.16)
【国際特許分類】
【出願番号】特願2004−252358(P2004−252358)
【出願日】平成16年8月31日(2004.8.31)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2004年(平成16年)3月15日 有限責任中間法人日本リウマチ学会発行の「第48回 日本リウマチ学会総会・学術集会抄録集」に発表
【出願人】(504156706)株式会社膠原病研究所 (13)
【Fターム(参考)】
【公開日】平成18年3月16日(2006.3.16)
【国際特許分類】
【出願日】平成16年8月31日(2004.8.31)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2004年(平成16年)3月15日 有限責任中間法人日本リウマチ学会発行の「第48回 日本リウマチ学会総会・学術集会抄録集」に発表
【出願人】(504156706)株式会社膠原病研究所 (13)
【Fターム(参考)】
[ Back to top ]

