EC−SODの新規な用途及びその製造方法
本発明はEC−SOD蛋白質、又はこれらをコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とする血管新生による疾患又はアレルギー疾患の予防又は治療用組成物及びEC−SOD蛋白質の製造方法に関する。前記EC−SOD蛋白質又はこれらをコーデイングするポリヌクレオチドが挿入されたベクターは血管新生を誘導するVEGF及びMMP−9の発現を抑制して、血管新生を抑制する効果が優れ、血管新生による疾患予防及び治療に有用に使用することができ、アレルギー疾患を誘発するTh2細胞の過分化を遮断して転写因子(NF−kB)活性を阻害し、人間肥満細胞の脱顆粒(degranulation)を減少させることにより、アレルギー疾患の予防及び治療に有用に使用し得る。さらに、本発明のEC−SOD蛋白質の製造方法は、前記のような活性を有するEC−SOD蛋白質を大量に生産することができて産業的に有用に使用し得る。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はEC−SOD蛋白質の新規な用途及びその製造方法に関する。具体的に本発明はEC−SOD蛋白質、又はこれらをコーディングするポリヌクレオチドが挿入されたベクターを有効成分とする、血管新生による疾患又はアレルギー疾患の予防又は治療用組成物及びEC−SOD蛋白質の製造方法に関する。
【背景技術】
【0002】
SOD(superoxide dismutase)は活性酸素を除去するばかりでなく、他の抗酸化酵素が作用し得るようにして、細胞を保護するよう機能し、今までに知られているSODには銅と亜鉛原子を有しているCu/Zn SOD(SOD1),マンガン原子を有しているMn SOD(SOD2)及び細胞表面、又は細胞外液に存在するEC−SOD(extracellular superoxide dismutase)等がある。
【0003】
特に、EC−SODはCu/Zn SODのように銅及び亜鉛原子を有しているものの、C−末端側にヘパリン結合ドメイン(heparin binding domain)が存在すると言う特徴がある。EC−SODはヘパリン結合ドメインを有している為、細胞膜のヘパリンに結合され、細胞膜を保護する役割をするものと推定されている。文献によれば、EC−SODは血漿と細胞外基質等において、生体防御作用を担当しているものとして知られている(Marklund et al,Biochem.J.266,213−219,1990;Su et al.,Am J Respir Cell Mol Biol.,Feb 16(2),162−70,1997;Luoma et al.,Thromb.Vasc.Bio.18,157−167,1998)。EC−SODのヘパリン結合ドメインが、核局在化シグナル(nuciear localization signal)として働き、胸腺(thymus)と睾丸細胞(testis cell)において、核内に位置して酸化的ストレスからゲノムDNAを保護し、酸化還元反応に敏感な転写作用を調節するとして報告されている(Ookawara T et al.,BBRC,296,54−61,2002)。本発明者等は、大韓民国特許第10−0676502号において、EC−SODが皮膚細胞内活性酸素腫を除去し、表皮細胞の過増殖を抑制して乾癬等の皮膚疾患を治療する効果があることを開示している。
【0004】
一方、血管新生(Angiogenesis)とは、既存の微細血管から新たな毛細血管が形成される過程である。正常には胚芽の発達(embryonic development)の際、傷の治癒、周期的な女性の生殖器系統の変化の時にのみ起こり、その他の正常な条件では殆ど起こらない現象である。しかしながら、血管新生が自律的に調節できない時、病的に成長することにより癌のような疾患が誘発される。
【0005】
前記血管新生過程は腫瘍サイトカイン、血管内皮細胞成長因子(VEGF)及び塩基繊維芽細胞成長因子(bFGF)により、内皮細胞の成長を促進させる段階、メタロプロテアーゼ(MMP)により細胞外基質蛋白質を分解させる段階、細胞膜接着分子、内皮細胞分化及び管形成により媒介される内皮細胞の移動段階のような多様な段階で構成されている(Bussolino,F.et al.,Trends Biochem.Sci.22:251−256,1997;Kuwano,M.et al.,Intern.Med.40:556−572,2001;Risan,W.Angiogenesis and endothelial cell function.Arzneimittelforschung44:416−417,1994)。従って、前記過程等の阻害は血管新生と関連した癌及び他の人間の疾病の治療の為の新たな治療戦略として台頭するようになった。前記目的の為、多様な種類の血管新生抑制剤が開発された。前記抑制剤は天然的であるか又は合成された物質にして、蛋白質分解酵素抑制剤、チロシンリン酸化酵素の抑制剤、ケモカイン、インタルキン及び基質蛋白質の分解切片を含む(Abedi,H.et al.,J.Biol.Chem.272:15442−15451,1997;Cao,Y.,Int.J.Biochem.Cell Biol.33:357−369,2001;Fong,T.Aet al. ,Cancew Res.59:99−106,1999;Kwon,H.J.et al.,Acalycigorgia inermis.J.Microbiol.B iotechnol.11:656−662,2001.)。前記抗血管新生分子等は内皮細胞増殖、移動、蛋白質分解活性及び管形成の抑制ばかりでなく、細胞自殺(apoptosis)の誘導を含む多くの過程に影響を及ぼす(Forkman,J.et al.,Semin.Cancer Biol.3:89−96,1992;Kis hi,K.et.al.,Nippon Rinsho 58:1747−1762,2000;Marme,D.,Onkologie 1:1−5,2001)。
【0006】
前記分子等の抗血管新生機能はin vitro及びin vivoにおいて良く研究されたものの、幾つかの物質は現在臨床試験を実施している(Deplanque,G. et al.,Eur.J.Cancer36:1713−1724,2000;Li ekens,et.al.,Biochem.Pharmacol.61:253−2 70,2001;Mross,K.,Drug Resist.Updat.3:22 3−235,2000)。
【0007】
活性酸素腫が血管新生の主要な調節者として報告されているものの(Jolanta Grzenkowicz−Wydra.et.al.,Mol Cell Biochem.,264(1−2):169−81,2004)、活性酸素腫を除去するSODと血管新生との関連性に対しては十分に調査されたものがない。最近SODの中で銅と亜鉛原子を有しているCu/Zn SOD(SOD1)を過発現させると、血管新生が促進され、前記SOD1を抑制すると血管新生を抑制し(Jolanta Grzenkowicz−Wydra.et.al.,Mol Cell Biochem.,264(1−2):169−81,2004)、SOD1の抑制剤であるATN−224が血管新生を抑制して抗癌剤として使用することができ、現在第2相臨床試験中であるとして報告されている(Juarez et al.Clin Cancer Res.,12:4974−4982,2006)。しかしながら、EC−SODと血管新生の関連性に対しては報告された例が全くない。
【0008】
一方、産業の発達により、環境汚染、新たな合成新物質の増加、住居環境の変化によりアレルギーを誘発する因子が増加し、これに伴い喘息、アレルギー疾患により苦痛にさらされている人間等の数が漸次増加してきた。一旦侵入した異物に対して生体が特異な抵抗を示す機能を免疫と称し、アレルギーとは、免疫反応の過敏症の一つであり、アトピー性皮膚炎、気管支喘息、花粉症は代表的なアレルギー性疾患である。アレルギー反応に伴う臨床的症状等は、大きくは、アレルギー疾患の種類に伴う反応初期の特異な免疫反応と反応後期の炎症反応とに区分される。このようなアレルギー反応は大部分が肥満細胞を媒介に起こるものの、肥満細胞は皮膚、呼吸器、胃腸管の粘膜、リンパ管周囲、血管周囲、脳等全身の臓器に広く分布し、アレルギー反応の原因細胞として知られている。肥満細胞を活性化させる媒介物質としては、細胞の細胞膜に存在する高親和性のIgE収容体に結合されているIgE抗体(FcεRI)、化合物48/80(compound48/80)等が知られている。IgE抗体による肥満細胞の活性化機序は次の通りである。IgE収容体に結合されているIgE抗体が抗原により、架橋(Bridge)を形成すると、ホスホリパーゼC、蛋白質リン酸化酵素C、カルシウムイオンの作用を経て顆粒に貯蔵されていたヒスタミン(histamine)、コンドロイチン(chondroitin)硫酸塩、ヘパリン(heparin)、蛋白質分解酵素等が遊離されることにより、前記の初期反応段階を媒介する。ヒスタミンを含む電気化学伝達物質等はアレルギー初期反応で現れる臨床的症状等を誘発する原因物質等であり、この内、ヒスタミンが最も多くの量を占める。つまり、アレルギー初期反応では、ヒスタミンの発現による作用が主を為し、その臨床的症状としては血管拡張、浮腫等がある。
【0009】
現在前記アレルギー疾患の治療には、抗ヒスタミン剤やステロイド剤等が多く活用されている。しかしながら、このような薬物はその効果が一時的な場合が大部分であって、副作用が甚だしい場合も多い。従って、急増するアレルギー性疾患の予防及び治療効果を有しながら、副作用が少なく効果が持続的な新たな物質の開発が切実に要請される状況である。ただ、EC−SODがアレルギー疾患の治療効果があるか、否かに対しては全く知られていない。
【0010】
さらに、前記EC−SODが多様な活性を有しているとしても、これの大量生産方法が開発されないと、産業において効率的に利用できない問題点がある。しかしながら、今まで開発された蛋白質の大量生産方法は、大腸菌等の宿主細胞を発現ベクターで形質転換してこれらの発現を誘導するものであるものの、蛋白質の大量生産は、しばしば内包体(inclusion body)の形成を招き、これにより蛋白質の元来の活性がなくなるか、又は減少する問題点があった。
【0011】
本発明者等はEC−SODに対する研究を重ねて行く中で、EC−SOD蛋白質が血管新生又はアレルギー疾患を治療又は予防し得る活性があることを発見し、前記のような活性を有するEC−SOD蛋白質を生産し得る方法を見出し、本発明を完成した。
【発明の概要】
【発明が解決しようとする課題】
【0012】
従って、本発明の目的は、EC−SOD蛋白質を有効成分とする血管新生による疾患の予防又は治療用組成物を提供することである。
本発明のさらに他の目的は、前記EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とする血管新生による疾患の予防又は治療用組成物を提供することである。
本発明のさらに他の目的は、前記EC−SOD蛋白質を有効成分とするアレルギー疾患の予防又は治療用組成物を提供することである。
本発明のさらに他の目的は、前記EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とするアレルギー疾患の予防又は治療用組成物を提供することである。
本発明のさらに他の目的は、前記EC−SOD蛋白質の製造方法を提供することである。
【課題を解決するための手段】
【0013】
前記のような目的を達成する為に、本発明はEC−SOD蛋白質を有効成分とする血管新生による疾患の予防又は治療用組成物を提供する。
さらに、本発明は前記EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とする血管新生による疾患の予防又は治療用組成物を提供する。
さらに、本発明はEC−SOD蛋白質を有効成分とするアレルギー疾患の予防又は治療用組成物を提供する。
さらに、本発明はEC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とするアレルギー疾患の予防又は治療用組成物を提供する。さらに、本発明は(a)EC−SOD蛋白質をコーデイングするポリヌクレオチドを発現ベクターにクローニングする段階;(b)前記発現ベクターを宿主細胞に導入して宿主細胞を形質転換する段階;(c)前記形質転換された宿主細胞を培養してEC−SOD蛋白質を発現する段階;(d)発現されたEC−SOD蛋白質の内包体を収得する段階;及び(e)前記内包体の溶解及びリホールディング(refolding)を誘導する段階を含むことを特徴とするEC−SOD蛋白質の製造方法を提供する。
【0014】
以下、本発明の内容をより詳細に説明する。
本発明で発現ベクターとは、適当な宿主細胞より目的蛋白質又は目的RNAを発現できるベクターであり、遺伝子挿入物が発現されるように作動可能に連結された必須的な調節要素を含む遺伝子製作物を言う。
本発明で用語、“作動可能に連結された(operably linked)”とは、一般的な機能を遂行できるように核酸発現調節配列と、目的とする蛋白質又はRNAをコーデイングする核酸配列が機能的に連結(functional linkage)されていることを言う。例えば、プロモータと蛋白質又はRNAをコーデイングする核酸配列が作動可能に連結され、コーデイングする核酸配列の発現に影響を及ぼし得る。組換えベクターとの作動的連結は、当該技術分野で広く知られた遺伝子組換え技術を利用して製造することができ、部位−特異的RNA切断及び連結は当該技術分野で一般的に知られた酵素等を使用する。
【0015】
本発明は、EC−SOD蛋白質を有効成分とする血管新生による疾患の予防又は治療用組成物を提供する。
前記EC−SOD蛋白質はこれに限定はされないものの、好ましくは、天然型又は組換えEC−SOD蛋白質を言う。前記天然型EC−SOD蛋白質はこれに限定はされないものの、マウス又は人間より由来したものであることを特徴とし、最も好ましくは、人間より由来したものであることを特徴とする。前記天然型EC−SOD蛋白質はこれに限定はされないものの、好ましくは、配列番号3及び配列番号5のアミノ酸配列を有することを特徴とし、最も好ましくは、配列番号3を有することを特徴とする。一方、前記組換えEC−SOD蛋白質は、前記天然型EC−SODから組換え技術により製造され、その活性を維持するものであればこれに限定はされないものの、好ましくは、配列番号1アミノ酸配列を有することを特徴とする。
【0016】
さらに、本発明は前記EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とする血管新生による疾患の予防又は治療用組成物を提供する。
前記EC−SOD蛋白質をコーデイングするポリヌクレオチドは、前記天然型EC−SOD蛋白質又は組換えEC−SOD蛋白質をコーデイングし得るポリヌクレオチドを意味し、これに限定はされないものの、好ましくは、配列番号2、配列番号4及び配列番号6からなる群より選ばれた塩基配列を有することを特徴とする。
【0017】
本発明の一実施例では、公知された方法でマウスより由来したEC−SODを過発現するマウスを製造し(<実施例1>参照)前記マウスにUVBを照射した後、組織の形態変化を野生型マウスと比較した。その結果、野生型マウスではUVB照射により血管新生が誘導されたものの、EC−SOD過発現マウスではUVB照射による血管新生が著しく抑制されていることを確認できた(<実施例2ー1>参照)。
【0018】
さらに、本発明の他の実施例では前記EC−SOD過発現マウスにおいて、紫外線照射による血管内皮細胞成長因子(VEGF)及びMMP−9の発現程度をウェスタンブロット(<実施例2ー2>)、免疫組織化学的方法(<実施例2ー3>)及びザイモグラフィー方法(<実施例2ー4>)を利用して調査した。その結果、紫外線照射により野生型マウスではVEGF及びMMP−9の発現が増加されたものの、EC−SOD過発現マウスではVEGF及びMMP−9の発現が著しく抑制されることを確認することができた。前記実験結果からEC−SODが血管新生を誘導するVEGFの発現を抑制して、血管新生を調節するMMP−9の発現を抑制して血管新生を抑制することが分った。
【0019】
さらに、本発明者等はさらに他の実施例でヘパリンドメインが除去された組換えEC−SODを大腸菌で発現させ、分離してリホールディング(refolding)と精製過程を経た組換えEC−SOD蛋白質を生産(<実施例1>参照)して前記蛋白質が血管新生を抑制するか否かを確認(<実施例3>)した。その結果、紫外線照射によりVEGFの発現が誘導されるものの、前記組換えEC−SOD蛋白質を処理した場合には、前記VEGFの発現が抑制されることが確認できた。
【0020】
従って、前記EC−SOD蛋白質又はこれをコーデイングするポリヌクレオチドが挿入されたベクターは、血管新生による疾患の予防及び治療に効果的に使用できる。前記血管新生による疾患には、VEGF(Vascular endothelial growth factor)発現及びMMP(matrix metalloproteinase)−9の発現により誘発されることを全て含み、これに限定はされないものの、好ましくは癌、糖尿病、リウマチ性関節炎、動脈硬化、血管腫、血管繊維腫、糖尿病性網膜症、早熟児の網膜症、新生血管性緑内障、新生血管による角膜疾患、退化斑、斑点の変性、翼状片、網膜変性、後水晶体繊維増殖症、顆粒性結膜炎、毛細管拡張症、化膿性肉芽腫及びニキビが挙げられる(Ophthalmol 102,1261−1262,1995;J Am Acad Derm 34(3):486−497,1996;Circultion 93(4):632−682,1996;Cell 86:353−364,1996)。
【0021】
さらに、本発明はEC−SOD蛋白質を有効成分とするアレルギー疾患の予防又は治療用組成物を提供する。
上述した通り、EC−SOD蛋白質はこれに限定はされないものの、好ましくは天然型又は組換え蛋白質を言う。前記天然型EC−SOD蛋白質は、これに限定はされないものの、好ましくはマウス又は人間より由来したことであることを特徴とし、最も好ましくは、人間より由来したことを特徴とする。前記天然型EC−SOD蛋白質は、これに限定はされないものの、好ましくは配列番号3及び配列番号5のアミノ酸配列を有することを特徴とし、最も好ましくは、配列番号3を有することを特徴とする。一方、前記組換えEC−SOD蛋白質は前記天然型EC−SODから組換え技術により製造され、その活性を維持するものであればこれに限定はされないものの、好ましくは配列番号1アミノ酸配列を有することを特徴とする。
【0022】
さらに、本発明は前記EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とするアレルギー疾患の予防又は治療用組成物を提供する。
上述した通り、前記EC−SOD蛋白質をコーデイングするポリヌクレオチドは、前記天然型EC−SOD蛋白質又は組換えEC−SOD蛋白質をコーデイングし得るポリヌクレオチドを意味し、これに限定はされないものの、好ましくは配列番号2、配列番号4及び配列番号6からなる群より選ばれた塩基配列を有することを特徴とする。
【0023】
本発明の一実施例では、組換えEC−SOD蛋白質によるT細胞増殖及び分化に及ぼす影響を確認した結果、前記組換えEC−SODはT細胞でThl側のサイトカインIFN−γの形成を誘導し、Th2側のサイトカインであるIL−4の形成を抑制することが分った。従って、組換えEC−SODはT細胞の分化に影響を及ぼすことが分り、アレルギー疾患を誘発するTh2細胞の過分化を遮断し、Th1細胞への分化を誘導することにより、アレルギー疾患を治療又は予防するにおいて有用に使用できることが分った(<実施例4>参照)。
【0024】
さらに、本発明のさらに他の一実施例では、天然型EC−SOD蛋白質である人間由来のEC−SOD蛋白質のT細胞分化に及ぼす影響を確認した結果、前記EC−SODもやはりアレルギー疾患を誘発するTh2細胞の過分化を遮断してTh1細胞への分化を誘導することが分った(<実施例5>参照)。
【0025】
さらに、本発明のさらに他の一実施例では組換えEC−SOD蛋白質の転写因子活性を阻害する効果があるか、否かを確認した結果、組換えEC−SODはNF−κBの非正常的な活性を阻害し得ることが分かり(<実施例6>参照)、さらに、人間肥満細胞の脱顆粒(degranulation)を減少させる効果があることを確認し、肥満細胞の脱顆粒により肥満細胞内にあったヒスタミン等の媒介物質が現れ、アレルギー等の炎症反応が起こると言う事実を考慮するに、本発明の組換えEC−SODはアレルギー疾患を予防又は治療に有用に使用できることが分った(<実施例7>参照)。
【0026】
従って、前記EC−SOD蛋白質又はこれをコーデイングするポリヌクレオチドが挿入されたベクターは、アレルギー疾患の予防及び治療用組成物として有用に使用できる。前記アレルギー疾患はアレルギー性喘息、アレルギー性鼻炎、アレルギー中耳炎、アナフィラキシショック(anaphylatic shock)、アレルギー性皮膚疾患、アトピー性皮膚炎、乾癬、接触性アレルギー皮膚炎及び蕁麻疹からなる群より選ばれたものであることを特徴とする。
【0027】
前記本発明の組成物に含まれるEC−SOD蛋白質にはこれらと実質的に同等な生理活性を有する蛋白質を含む。実質的に同等な生理活性を有する蛋白質には、EC−SOD蛋白質の機能的同等物(functional equivalent)及び機能的誘導体(functional derivative)が含まれる。
本発明で“機能的同等物”とは、配列番号3で表示されるアミノ酸配列を有するEC−SODと実質的に同等な生理活性を示すポリペプチドを言う。
【0028】
前記にて“同等な生理活性”とは、血管新生又はアレルギーを抑制する活性を言う。前記機能的同等物は、配列番号3で表示されるアミノ酸配列と少なくとも70%以上、好ましくは、80%以上、より好ましくは、90%以上の配列相同性(homology)を有するポリペプチドでもあり得る。前記機能的同等物とは、アミノ酸の付加、置換又は欠失の結果、配列番号3で表示されるペプチドと少なくとも70%以上の、好ましくは80%、さらに好ましくは90%以上の配列相同性(つまり、同一性)を有するものにして、例えば、71%,72%,73%,74%,75%,76%,77%,78%,79%,80%,81%,82%,83%,84%,85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,58%,99%,100%の配列相同性を有することを含み、配列番号3で表示されるペプチドと実質的に同質の生理活性を示すペプチドを言う。本明細書で配列相同性及び同質性は、配列番号3で表示されるアミノ酸配列と、候補配列を整列してギャップ(gaps)を導入した後、配列番号3で表示されるアミノ酸配列に対する候補配列のアミノ酸残基の百分率として定義される。必要な場合、最大百分率配列同質性を収得する為に、配列同質性の部分として保存的置換は考慮しない。配列番号3で表示されるアミノ酸配列のN−末端、C−末端又は内部伸長、欠損又は挿入は配列同質性又は相同性に影響を及ぼす配列として解析されない。さらに、前記配列同質性は2個のポリペプチドのアミノ酸配列の類似した部分を比較する為に使用される一般的な標準方法により決定できる。BLAST又はFASTAのようなコンピュータプログラムは、2個のポリペプチドをそれぞれのアミノ酸が最適にマッチング(matching)するように整列する(一つ又は二つの配列の全長配列に沿って又は一つ又は二つの配列の予測された部分に沿って)。前記プログラムはデフォルトオープニングペナルティー(default opening penalty)及びデフォルトギャップペナルティー(default gap penalty)を提供し、コンピュータプログラムと共に、連携されて使用され得るPAM250(標準スコアリングマトリックス;Dayhoff et al.,in Atlas of Protein Sequence and Structure,vol 5,supp.3,1978)のようなスコアリングマトリックスを提供する。例えば、百分率同質性は次のように計算できる:一致する配列(indentical matches)の総数に100を掛け、対応されるスパン(machted span)内のより長い配列の長さと、二つの配列を整列する為に、より長い配列内に導入されたギャップ(gaps)の数の和で割る。本発明の機能的同等物の範囲には、本発明に伴うポリペプチドの基本骨格及びこれの生理活性を維持しながら、ポリペプチドの一部化学構造が変形されたポリペプチド誘導体も含まれる。例えば、本発明のポリペプチドの安定性、貯蔵性、揮発性又は溶解度等を変更させる為の構造変更がこれに含まれる。
【0029】
さらに、本発明の組成物に使用されるポリヌクレオチド配列はDNA,cDNA及びRNA配列を全て含む。好ましくは、前記ポリヌクレオチドは配列番号2,配列番号4及び配列番号6からなる群より選ばれた塩基配列を有する。本発明の組成物は前記ポリヌクレオチドを含むプラスミド又はウイルスべクターのような発現べクターを有効成分とする。前記本発明に伴う発現べクターはEC−SOD蛋白質のcDNA及びこれらの発現を調節できる発現調節配列を含めている。前記ポリヌクレオチドはて天然で分離されるか、又は当業界に公知された遺伝工学的方法により製造できる。
【0030】
前記にて発現調節配列(expression control sequence)とは、特定の宿主細胞において作動可能に連結された配列の発現に必須のDNA配列を意味する。前記発現調節配列には、転写を実施する為のプロモーター、前記転写を調節する為の任意のオペレータ配列、適合したmRNAリボソーム結合部位をコーディングする配列及び転写及び解読の終結を調節する配列を含む。例えば、原核生物に適した調節配列はプロモータ、オペレータ配列及びリボソーム結合部位を含む。真核細胞は、プロモータ、ポリアデニル化シグナル及びインハンサーがこれに含まれ得る。
【0031】
前記発現べクターを挿入した後、感染(infection)、形質感染(transfection)又は形質導入(transduction)等の当業界に公知された方法により発現型で標的細胞内に導入させ得る。
【0032】
プラスミド発現べクターを利用した遺伝子伝達方法は、哺乳動物細胞に直接的にプラスミドDNAを伝達する方法として、FDAから承認を得た人間に使用し得る方法である(Nobel,E.G.,et al.,Science,249:1285−1 288,1990)。プラスミドDNAはウイルスべクターとは異なり均質に精製できる長所がある。本発明で使用し得るプラスミド発現べクターは、当業界に公知された哺乳動物発現プラスミドを使用し得る。例えば、これに限定はされないものの、pRK5(ヨーロッパ特許第307,247号)、pSV16B(国際特許公開第91/082 91号)及びpVL1392(PharMingen)等が代表的である。前記核酸を 含むプラスミド発現べクター(plasmid expression vector)は当業界に公知された方法、例えば、これに限定はされないものの、一時的形質感染(transient transfection)、微細注射、形質導入(transduction)、細胞融合、カルシウムホスフェート沈殿法、リポソーム媒介された形質感染(liposome−mediated transfection)、DEAEデキストラン媒介された形質感染(DEAE Dextran−mediated transfection)、ポリブレン媒介された形質感染(polybrene−mediated transfection)、電気穿孔法(electroporation)、遺伝子銃(gene gun)及び細胞内にDNAを流入させる為の他の公知の方法により標的細胞内に導入できる(Wu et al.,J.Bio Chem.,267:963−967,1992;Wu and Wu,J.Bio Chem.,263;14621−14624,1988)。
【0033】
さらに、前記ポリヌクレオチドを含むウイルス発現べクターでは、これに限定はされないものの、レトロウイルス(retrovirus)、アデノウイルス(adenovirus)、ヘルペスウイルス(herpes virus)、アビポックス ウイルス(avipox virus)及びレンチウイルス(lentivirus)等が含まれる。前記レトロウイルスべクターはウイルス遺伝子が全て除去されたか、若しくは変更され非ウイルス蛋白質がウイルスべクターにより、感染された細胞内で作れるように作製されたものである。遺伝子療法の為のレトロウイルスべクターの主要長所は多量の遺伝子を複製細胞内に伝達し、細胞DNAウイルスに伝達された遺伝子を正確に統合し、遺伝子形質感染後連続的な感染が誘発されないことである(Miller,A.D.,Nature,357:455−460,1992)。FDAで認証されたレトロウイルスべクターはPA317アンフォトロフイックレトロウイルスパッケージ細胞を利用して製造したものである(Miller,A.D.and Buttimore,C.,Molec.Cell Biol.,6:2895−2902,1986)。非レトロウイルスべクターには、前記にて言及した通り、アデノウイルスがある(Rosenfeld et al.,Cell,68:143−155,1992;Jaffe et al.,Nature Genetics,1:372−378,1992;Lemarchand et al.,Proc.Natl.Acad.Sci.USA,89:6482−6486,1992)。アデノウイルスの主要長所は多量のDNA断片(36kbゲノム)を運搬し、極めて高い力価で非複製細胞を感染させる能力があることである。さらに、ヘルペスウイルスも人間遺伝子療法の為有用に使用できる(Wolfe,J.H.,et al.,Nature Genetics,1:379−384,1992)。レンチウイルスはレトロウイルスの一種にして1990年代後半から開発され始めた新たなレトロウイルス輸送体としてHIV骨格(backbone)を変形したものである。既存のレトロウイルス輸送体等とは違って細胞分裂周期に影響されずに、分裂が活発な細胞ばかりでなく、分裂が活発でない細胞でも遺伝子発現効率が比較的良い。従って、造血幹細胞等のように分裂が遅い細胞でも他のウイルス性水素体より発現効率が良いことから、最近造血幹細胞角質細胞を利用した細胞治療分野で遺伝子伝達用輸送体として研究が活発に進行されている。この他にも公知された適切なウィルスベクターが本発明に使用できる。
【0034】
前記本発明の組成物には、薬学的に許容される担体を追加して含め得る。前記にて“薬学的に許容される”とは、生理学的に許容されて、人間に投与される時、通常的に胃腸障害、眩気症等のようなアレルギー反応又はこれと類似した反応を起こさない組成物を言う。
【0035】
薬学的に許容される担体には、例えば、経口投与用担体又は非経口投与用担体を追加して含め得る。経口投与用担体はラクトース、澱粉、セルロース誘導体、マグネシウムステアレート、ステアリン酸等を含め得る。さらに、非経口投与用担体は水、適切なオイル、食塩水、水性グルコース及びグリコール等を含むことができ、安定化剤及び保存剤を追加して含め得る。適切な安定化剤には亜硫酸水素ナトリウム、亜硫酸ナトリウム又はアスコロビン酸のような抗酸化剤がある。適切な保存剤にはベンズアルコニウムクロライド、メチル又はプロピールパラベン及びクロロブタノールがある。その他の薬学的に許容される担体には、次の文献に記載されていることを参考にする(Remington′s Pharmaceutical Sciences,19th ed. ,Mack Publishing Company,Easton,PA,1995)。本発明に伴う蛋白質又はこれをコーデイングするポリヌクレオチドが挿入されたベクターは、上述したような薬学的に許容される担体と混合して公知の方法により、多様な非経口又は経口投与用形態で製造され得る。非経口投与用剤形には、等張性水溶液又は懸濁液形態のような注射用剤形及び軟膏剤形態の剤形が好ましい。注射用剤形は適切な分散剤又は湿潤剤及び懸濁化剤を使用して当業界に公知された技術により製造できる。例えば、各成分を食塩水又は緩衝液に溶解させ、注射用として剤形化できる。さらに、経口投与用剤形には、これに限定はされないものの、粉末、顆粒、錠剤、丸薬及びカプセル等があり、これらの剤形は有効成分以外に希釈剤(例:ラクトース、デキストロース、スクロース、マンニトール、ソルビトール、セルロース及び/又はグリーシン)、滑沢剤(例:シリカ、タルク、ステアリン酸及びそのマグネシウム又はカルシウム塩及び/又はポリエチレングリコール)を含め得る。製剤はさらに、マグネシウムアルミニウムシリケート、澱粉ペースト、ゼラチン、トラガカント、メチルセルロース、ナトリウムカルボキシメチルセルロース及び/又はポリビニルピロリジンのような結合剤を含むことができ、場合によっては、澱粉、寒天、アルギン酸又はそのナトリウム塩のような崩解剤又は沸騰混合剤及び/又は吸収剤、着色剤、香味剤、及び甘味剤を含め得る。前記剤形は通常的な混合、顆粒化又はコーテイング方法により製造できる。
【0036】
本発明に伴う組成物の投与経路は、これらに限定されるものではなく、生命工学的技法を利用するか、又は既存の製造法を利用して口腔、静脈内、筋肉内、動脈内、骨髄内、境膜内、心臓内、経皮、皮下、腹腔内、鼻腔内、腸管、局所、舌下又は直腸が含まれる。
【0037】
好ましくは、本発明に伴う組成物は、皮下、静脈内、筋肉内、関節内、滑液嚢内、胸骨内、境膜内、病巣内及び頭蓋骨内注射又は注入のような方法で非経口的に投与できる。例えば、注射用として剤形化された本発明に伴う組成物を、4〜6mmの細い針で皮膚の下層に一定量を注入、又は30ゲージ(gage)注射用針で皮膚を軽く短刺(prick)する方法であるメッソーテラピー(Messo therapy)法により投与できる。さらに、皮膚に適用する場合、軟膏剤のような形態で剤形化して経皮投与できる。前記にて“経皮投与”とは、組成物を局所的に皮膚に投与して組成物に含有された有効な量の活性成分が皮膚内に伝達されることを意味する。特に、本発明のEC−SOD蛋白質を有効成分とする組成物の場合には、皮膚に直接塗布する経皮投与方法により、投与するのが好ましい。さらには、本発明の組成物は蛋白質伝達方法と関連した生命工学的技法を利用して投与できる。
【0038】
前記本発明に伴う組成物は、予防又は治療効果を示す量で患者に投与し得る。一般的な1日投与量としては体重1kgに対し約0.0001乃至100mgの範囲で投与できる。好ましくは、体重1kgに対し約0.01乃至1mgの範囲で投与できる。本発明の組成物は好ましい投与量範囲内で1回又は複数回に分割投与できる。しかしながら、本発明に伴う組成物の投与量は投与経路、投与対象、年令、性別、体重、個人差及び疾病状態により適切に選択できる。
【0039】
さらに、本発明は(a)EC−SOD蛋白質をコーデイングするポリヌクレオチドを発現ベクターにクローニングする段階;(b)前記発現ベクターを宿主細胞に導入して宿主細胞を形質転換する段階;(c)前記形質転換された宿主細胞を培養して、EC−SOD蛋白質を発現する段階;(d)前記発現されたEC−SOD蛋白質の内包体を収得する段階;及び(e)前記内包体の溶解及びリホールディングを誘導する段階を含むことを特徴とするEC−SOD蛋白質の製造方法を提供する。
【0040】
前記(a)段階におけるEC−SOD蛋白質をコーデイングするポリヌクレオチドを発現ベクターにクローニングすることは、当業界に公知された通常の組換えDNA技法を利用して行うことができ、前記EC−SOD蛋白質をコーデイングするポリヌクレオチドは、前記天然型EC−SOD蛋白質又は組換えEC−SOD蛋白質をコーデイングできるポリヌクレオチドを意味し、これに限定はされないものの、好ましくは、配列番号2,配列番号4及び配列番号6からなる群より選ばれた塩基配列を有することを特徴とする。前記ポリヌクレオチドは適切なプライマーを使用してPCR増幅することにより作製できる。他の方法として当業界に公知された標準方法により、例えば、自動DNA合成器(Biosearch又はApplied Biosystems社で販売するもの)を使用してDNA配列を合成することもできる。発現ベクターは当業界で使用する通常の発現ベクターを使用することができ、その宿主細胞によって適切なものを選択して使用することができ、例えば、宿主細胞が大腸菌の場合、pET28aベクター(Novagene,米国)を使用することができる。本発明の製造方法はEC−SODを大量発現して生産しようとすることから、この目的を達する限りにおいて任意の発現ベクターを適切に選択して使用できる。
【0041】
本発明のベクターはプラスミドベクター、コスミドベクター、バクテリオファージベクター及びウイルスベクター等を含むもののこれに限定はされない。適切な発現ベクターはプロモータ、オペレータ、開始コドン、終結コドン、ポリアデニル化シグナル及びインハンサ(促進遺伝子)のような発現調節配列の他にも、膜標的化又は分泌の為のシグナル配列又はリーダ配列を含み、目的により多様に製造できる。ベクターのプロモータは構成的(constitutive)又は誘導性(inducible)でもあり得る。さらに、発現ベクターはベクターを含有する宿主細胞を選択する為の選択マーカーを含み、複製可能な発現ベクターの場合複製起源を含む。
【0042】
前記(b)段階の発現ベクターを宿主細胞に導入して形質転換することは、核酸を宿主細胞に導入する如何なる方法も含まれ、当業者に公知された形質転換技術により行われ得る。微細射出法(microprojectile bombardment)、電気衝撃遺伝子伝達法(electroporation)、リン酸カルシウム(CaP04)沈澱、塩化カルシウム(CaCl2)沈澱、PEG−媒介融合法(PEG−mediated fusion)、微細注入法(microinjection)及びリポソム媒介法(liposome−mediated method)等が含まれるもののこれに限定はされない。
【0043】
上記場合において、宿主細胞は原核細胞又は眞核細胞を使用できるものの、好ましくは、宿主細胞としては大腸菌(Escherichia coli)、バシルスサブチリス(Bacillus subtilis)、ストレプトマイセス(Streptomyces)、シュードモナス(Pseudomonas)、プロテウスミラビリス(Proteus mirabilis)又はスターフィロコキュス(Staphylococcus)のような原核宿主細胞、眞菌(例えば、アスペルギルス(Aspergillus)、酵母(例えば、ピキアパストリス(Pichia pastoris))、サカロマイセスセルビジエ(Saccharomyces cerevisiae)、シゾサカロマイセス(Schizosaccharomyces)、ニュロスポラクラサ(Neurospora crassa)等のような下等眞核細胞、昆虫細胞、植物細胞、哺乳動物等を含む高等眞核生物由来の細胞を宿主細胞として使用できるものの、これに限定はされない。さらに、好ましくは、本発明の宿主細胞は大腸菌を使用できる。前記(c)段階の宿主細胞の培養及び発現は、形質転換された宿主細胞内でEC−SOD蛋白質が発現されるように、適切な培地及び条件下で培養することを含む。前記形質転換された細胞を培養して蛋白質を発現させる方法は、当業界に公知されており、例えば、形質転換された細胞が成長できる適切な培地に接種して種培養した後、これを本培養用培地に接種して適切な条件で培養することにより、蛋白質の発現を誘導することができる。
【0044】
前記(d)段階の内包体の収得は不溶性の内包体を分離して収得する為の、公知の方法を使用することができ、例えば、遠心分離により細胞沈澱物内で内包体を収得することができる。
【0045】
前記(e)段階の内包体の溶解及びリホールディングの誘導は、当業界に公知された通常の方法、例えば、蛋白質変成剤を含む緩衝溶液で内包体を溶解させ、金属親和性樹脂コラムに吸着させ、変成剤の濃度を下げながらリホールディングを誘導する方法により行われる。
【0046】
例えば、前記内包体の溶解及びリホールディングの誘導は、変成剤である8Mウレア(urea)を添加したTris緩衝溶液(8M urea,50mM Tris−C1,100mM NaCl)に内包体を溶解し、金属親和性樹脂が充填されたコラムに吸着させ、1Mウレアを添加したTris緩衝溶液でコラムに濃度勾配を与えながら、ウレアを除々に除去してリホールディングを誘導する方法により行える。引き続き、前記コラムとの吸着性が強い溶出緩衝溶液や、pHが低い(一般的に4以下)溶出緩衝溶液を前記コラムの上部から流入させることにより、これをコラム下部から収得してリホールディングされた純粋な蛋白質を得ることができる。例えば、これは金属親和性クロマトグラフィーコラムとの吸着性が強い、イミダゾル(一般的に1M)が含有された溶出緩衝溶液を前記コラムの上部から流入させることにより、これをコラム下部から収得してリホールディングされた純粋な蛋白質を得ることができる。さらに、前記溶出緩衝溶液は時間により漸次的に濃い濃度の溶液が投入されるように、つまり、濃度勾配を有するようにコラムに投入することが、リホールディングされた蛋白質の収得率を高めることができて好ましい。
【0047】
本発明のEC−SODの製造方法は(f)ゲル濾過コラム(gel−filtration column)により、分離、精製する段階を追加して含めることができ、以降追加精製、濃縮、溶媒交換等の目的により、当業界に公知された多様な分離及び精 製方法を介して行うことができ、例えば、塩析(硫酸アンモニウム沈澱及びリン酸ナトリウム沈澱)、溶媒沈澱(アセトン、エタノール等を利用した蛋白質分画沈澱)、透析、ゲル濾過、イオン交換クロマトグラフィー、逆相コラムクロマトグラフィー及び親和性クロマトグラフィー等の技法を、単独又は組合わせで適用させEC−SOD蛋白質を製造できる。
【0048】
本発明で使用される標準組換えDNA及び分子クローニング技術は、当該分野に広く公知されており、下記の文献に記載されている(Sambrook,J.,Fritsch,E.F.and Maniatis,T.,Molecular Cloning:A Laboratory Manual, 2nd ed.,Cold Spring Harbor Laboratory:Cold Spring Harbor,NY(1989);by Silhavy,T.J.,Bennan,M.L.and Enquist,L.W.,Experiments with Gene Fusions,Cold Spring Harbor Laboratory,NY(1984);and by Ausubel,F.M.et al.,Current Protocols in Molecular Biology,published by Greene publishing Assoc.and Wiley−Interscience(1987))。
【0049】
上述した通り、EC−SOD蛋白質又はこれらをコーデイングするポリヌクレオチドが挿入されたベクターは、必要とする個体に有効な量で投与して血管新生による疾患又はアレルギー疾患の予防又は治療方法に有用に使用することができ、従って、血管新 生による疾患又はアレルギー疾患の治療剤製造の為にも有用に使用できる。
【発明の効果】
【0050】
前記の通り、EC−SOD蛋白質又はこれらをコーデイングするポリヌクレオチドが挿入されたベクターは、血管新生を誘導するVEGF及びMMP−9の発現を抑制して、血管新生を抑制する効果が優れているので、血管新生による疾患の予防及び治療に有用に使用することができ、アレルギー疾患を誘発するTh2細胞の過分化を遮断して、転写因子(NF−κ8)活性を阻害し、人間肥満細胞の脱顆粒(degranulation)を減少させることにより、アレルギー疾患の予防及び治療に有用に使用することができる。さらに、本発明のEC−SOD蛋白質の製造方法は、前記のような活性を有するEC−SODを大量に生産することができて、産業的に有用に使用することができる。
【図面の簡単な説明】
【0051】
【図1】図1は本発明の組換えEC−SOD蛋白質の高速蛋白質精製用液状クロマトグラフィーの結果を示したグラフである(A:線平衡区間、B:試料投入区間、C:コラム洗滌区間、D:リホールディング区間、E:リホールディング平衡区間、F:溶出区間、G:コラム洗浄区間、X軸:時間及び体積(時:分:秒、mL),Y軸:UV吸光度(Unit))。
【図2】図2は本発明に伴うリホールディング及び精製された組換えEC−SOD蛋白質をSDS−PAGEで分析した結果を示したクマシーブルー蛋白質染色写真である(M:分子量サイズマーカー、A:8Mウレア緩衝溶液で溶解された内包体(リホールディング精製前の試料)、B:コラムに吸着されずに溶出された内包体不純物、C:リホールディング精製後溶出されたEC−SOD、D:脱塩精製後限外濾過法により濃縮されたEC−SOD)。
【図3】図3は抗EC−SOD蛋白質抗体を利用して、組換えEC−SOD蛋白質をウェスタンブロットで確認した結果である(SM:size marker,1:対照群(HaCaT人間EC−SOD)、2:本発明の組換えEC−SOD蛋白質)。
【図4】図4は精製過程中EC−SOD活性を確認した結果である(209 FT:精製工程中吸着されずに溶出された試料、209E1:金属親和性クロマトグラフィーコラムでリホールディングされた1次精製された組換えEC−SOD蛋白質、209 E2:ゲル濾過コラムで分離、精製された組換えEC−SOD蛋白質)。
【図5】図5は組換えEC−SOD蛋白質によるHaCaT細胞において、UVBの誘発されたROSの阻害効果を確認した結果である(UVB:UVBのみ照射した場合、EC−SOD+UVB:UVBを照射してEC−SODを処理した場合)。
【図6】図6は紫外線照射によるマウスの背皮膚組織の形態相変化を示した写真である(A:野生型マウス、B:EC−SOD過発現マウス、C:野生型マウスにUVBを照射、D:EC−SOD過発現マウスにUVBを照射)。
【図7】図7は紫外線照射によるマウス濃度組織において、VEGFの発現様相をウェスタンブロットで分析した結果を示したものである。Actinはローディング対照群として使用した(WT:野生型マウス、TG:EC−SOD過発現マウス)。
【図8】図8はマウスにUVBを照射した後、VEGFの発現様相を免疫組織化学的方法で分析した結果を示したものである(A:野生型マウス、B:EC−SOD過発現マウス、C:野生型マウスにUVBを照射、D:EC−SOD過発現マウスにUVBを照射)。
【図9】図9はマウスにUVBを照射し、MMP−9の発現様相をザイモグラフィーで分析した結果である(レーン1:野生型マウス、レーン2:EC−SOD過発現マウス、レーン3:野生型マウスにUVB照射、レーン4:EC−SOD過発現マウスにUVB照射)
【図10】図10は皮膚角質形成細胞株に紫外線を照射して、本発明の組換えEC−SOD処理に伴うVEGFの発現様相を免疫組織化学的方法で照射した結果である(A:野生型マウス、B:UVB照射、C:組換えEC−SOD処理+UVB照射、D:組換えEC−SOD処理)。
【図11】図11は組換えEC−SOD蛋白質を処理した場合、T−細胞増殖に及ぼす影響を確認した結果である(Neg:何等の処理も施さない試験群)。
【図12】図12は組換えEC−SOD蛋白質処理時、T−細胞の分化に及ぼす影響をIL−4分泌量で確認した結果である(neg:抗原が処理されていない試験群、−:抗原(Ova peptide)のみ処理された試験群、p:抗原(Ova peptide)とPBSに含まれているEC−SODを共に処理した試験群、NB:抗原(Ova peptide)とSodium borateに含まれているEC−SODを共に処理した試験群)。
【図13】図13は組換えEC−SOD蛋白質処理時、T−細胞の分化に及ぼす影響をサイトカインIL−4とINF−gの分泌量で確認した結果である(neg:抗原が処理されていない試験群。−:抗原(Ova peptide)のみ処理した試験群)。
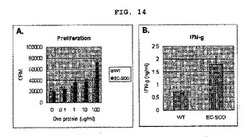
【図14】図14は人間のEC−SOD遺伝子を過発現させたマウスにOva蛋白質と免疫補助剤CFA(Compleat Freund′s Adjuvant)を投与した場合、EC−SODが細胞増殖とサイトカイン生成にどんな影響を与えるかを観察した結果である。
【図15】図15は人間のEC−SOD遺伝子を過発現させたマウスにOva蛋白質と免疫補助剤Alum(Aluminum Hydroxide)を投与した場合、EC−SODが細胞増殖と、サイトカイン生成にどんな影響を与えるかを観察した結果である。
【図16】図16は組換えEC−SOD蛋白質のNF−κBの活性化抑制を確認した結果である(Control:EC−SODが形質感染されたHaCaT細胞にUV処理をしない群、UVB:HaCaT細胞にUVBを100J/m2で照射した群、EC−SOD/UVB:HaCaT細胞に組換えEC−SOD蛋白質を処理してUVBを100J/m2で照射した群)。
【図17】図17は組換えEC−SOD蛋白質の肥満細胞脱顆粒抑制効果を確認した結果、(A)及びこれの顕微鏡写真(B)である(C0n:何等の処理も施さない人間肥満細胞群、EC−SOD:EC−SODを処理した群、A+P:細胞内のカルシウム濃度が高い群、A+P+EC−SOD:EC−SODを前処理して細胞内のカルシウム濃度が高い群)。
【発明を実施するための形態】
【0052】
以下、本発明を実施例により詳細に説明する。
ただし、実施例には本発明を単に例示するものであり、本発明の内容が下記実施例に限定されるものではない。
【0053】
<実験例1>
EC−SODを過発現するマウスの製造
先ず、マウスより由来したEC−SODを過発現するマウスを下記のような方法で製造した。一方、前記マウスより由来したEC−SOD塩基配列とアミノ酸配列をそれぞれ配列番号6及び配列番号5に記載した。
野生型BDF1マウスは8乃至10週齢BDF1マウス(中央実験動物)を使用した。EC−SOD過発現マウスは8乃至10週齢BDF1マウスを使用し、公知された方法により製造した(H.Y.Ha.et.al.,Biochem Biophys Res Commun,348:450−458,2006)。動物使用の為の実験方法はカトリック医科学研究所生命倫理委員会により承認を受けて使用した。
【0054】
具体的には、韓国生命工学研究所で交雑種マウス(C57BL/6Χ CBAのF1)を購入し、過剰排卵を誘発するためにPMSG(pregnant mare′s serum gonadotropin)と、hCG(human chrionic gonadotropin)を48時間間隔で、それぞれ5IUずつ雌の二十日鼠の腹腔内に注射し、同一系統の雄の二十日鼠と1:1で交尾させた。翌日の朝腟栓を確認し、腟栓がある個体のみ屠殺して卵管を切取した後、卵管膨大部から受精卵を回収した。培養液は0.4%BSAが添加されたM16培養液を使用した。
【0055】
皮膚組織に選別的なEC−SOD過発現が誘導されたマウスを作る為に、マウスEC−SODのcDNA(配列番号6)を含むpCRII TOPOベクター(翰林大学校医科大学、徐俊教教授より提供)において制限酵素でマウスEC−SODのcDNA部分を切断して、人間ゼラチンK14プロモータを含んでいるpBS KSベクターに挿入した。さらに、このベクターに鶏のオブアルブミンポリ(A)(ovalbumin poly(A))を挿入して試験管内(in vitro)での発現を容易にした。受精卵にDNAを注入する為に、発現ベクターを制限酵素HindとXholで切断して使用した。制限酵素で切断したDNAは1%アガロスゲルに電気泳動した後、透析(dialysis)して回収した後、フェノールクロロホルムで分離して生成した。これを10mM Tris(pH7.4/0.2mM EDTA)濃度で透析して最終濃度が4ng/lになるようにした。外来遺伝子を含むDNA溶液を1細胞期受精卵の全核に注入した。外来遺伝子が注入された受精卵等を2細胞期まで培養した後、健康な状態の受精卵のみを選別した。発情した雌ICRを雄と交尾させた後、翌日腟栓を確認して確認されたものを代理母として使用した。2細胞期までよく育った受精卵を15−20個程を採り代理母の卵管膨大部に微細管を利用して移植した後、筋肉層と表皮を縫合した。移植後生まれた産子を3週程度育て、これらの尻尾を1cm程切断した後、溶解緩衝液(lysis buffer)に入れ、55℃で処理した後、フェノール(phenol)添加してゲノムDNA(genomic DNA)を抽出した。前記ゲノムDNAを下記のPCRプライマーセットを利用してPCR増幅することにより、形質転換可否を確認した。PCR条件は94℃で1回、94℃で30秒間、51℃で30秒間、72.5℃で45秒間30回繰返した後、72.5℃で5分間1回実施した。
センスプライマー(配列番号7)
5′−TTG TCT CTA ATA GAG GGT C−3′
アンチセンスプライマー(配列番号8)
5′−TCA AGC CTG TCT ATC TTC T−3′
【0056】
一方、人間より由来したEC−SODを過発現するマウスは、米国コロラドNational Jewish Medical&Research Centerから寄贈を受けた(Oury et al.,JBC 268(21):15394,1993)。
【0057】
<実施例1>
生物学的活性を有する組換えEC−SOD蛋白質の製造
<1−1>組換えEC−SOD蛋白質発現の為の融合EC−SOD遺伝子のクローニング
生物学的活性を有する組換えEC−SOD蛋白質を製造する為に、人間由来のEC−SODのN−末端部位にある信号ペプチド(signal peptide)を除去して、C−末端部位の13個アミノ酸が除去された209個のアミノ酸からなる、組換えEC−SODを次のような方法でクローニングした(前記組換えEC−SOD塩基配 列と、アミノ酸配列は、それぞれ配列番号2及び配列番号1に記載し、前記人間由来のEC−SOD塩基配列と、アミノ酸配列はそれぞれ配列番号4及び配列番号3に記載した)。
【0058】
人間由来のEC−SOD cDNA(配列番号4)を含むpUC 18−hEC−SOD(スウエーデン、Clinical chemistry,Marklund professorより提供)べクターを鋳型として下記プライマーを利用してPCR増幅することにより、人間EC−SODのcDNAを製造した。
センスプライマー(配列番号9)
5′−tagattctggacgggcgagga−3′
アンチセンスプライマー(配列番号10)
5′−tactcgagtcactctgagtgct−3′
【0059】
PCR増幅条件は、95℃で5分、95℃で30秒、55℃で30秒、72℃で1分(30回)、72℃で5分の条件でPful重合酵素を利用して行った。増幅された遺伝子産物を制限酵素EcoRIとXhoIで切断した後、同一な制限酵素で切断されたpET28aべクター(NovaGene,米国)に4℃で12時間T4 ligaseを利用して接合した。前記べクターを大腸菌DH5aに形質感染させ、前記形質転換体をカナマイシン25mg/mLを含有するLB固体培地で培養して選別した。選別された形質転換体に組換えEC−SOD遺伝子が正しく挿入されたか、否かを遺伝子配列分析を実施して確認した。組換えEC−SOD遺伝子が挿入されたことが確認された形質転換体でべクターを分離して、過発現用大腸菌宿主細胞である大腸菌BL21(NovaGene,米国)に挿入してカナマイシン25mg/mLを含有するLB固体培地で培養しながら過発現菌株を選別した。
【0060】
<1−2>組換えEC−SOD蛋白質の発現
前記<実施例1−1>で選別された菌株を37℃,カナマイシン25mg/mLを含有するLB液体培地で培養した。これをOD(Optical Density)600nmで0.6に達した時、IPTG(1mM)を添加して蛋白質発現を誘導し、37℃で6時間本培養をして組換えEC−SOD蛋白質を発現させた。
【0061】
<1−3>組換えEC−SOD蛋白質のリホールディング誘導及び精製
発現が終了された培養液で遠心分離により、細胞を収得した後、100mM塩化カルシウムが含有された50mM Tris緩衝溶液(pH7.5)で懸濁し、超音波粉砕機で細胞を破壊した。これを遠心分離して沈殿層のみを分離し、前記100mM塩化カルシウムが含有された50mM Tris緩衝溶液で3回繰返して洗浄した。洗浄された細胞沈殿物には、不溶性蛋白質内包体(inclusion body)を含有している。洗浄された内包体(融合蛋白質含量50%)10mgをTris緩衝溶液(50mM Tris−C1,100mM NaCl,pH7.5)に入れ、8Mウレアを添加して溶解した。室温で2時間完全に懸濁して、遠心分離により相分離し、上層の水溶液層は溶解された不溶性組換えEC−SOD蛋白質内包体を含有していることからこれを収得した(内包体溶液)。
【0062】
組換えEC−SODリホールディングと精製の為に、高速蛋白質精製用液状クロマトグラフィー機器(FPLC,Fast Protein Purification Liquid Chromatography)を利用して下記の通り行った:前記緩衝溶液(8M urea,50mM Tris−C1,100mM NaCl,pH7.5)を流速1ml/minで金属親和性樹脂が満たされた平衡状態のクロマトグラフィーコラム(HisTrap FF crude 5ml,GE Healthcare,米国)に流入させて平衡させ、前記にて収得した内包体溶液5mlを金属親和性樹脂が満たされた平衡状態のクロマトグラフィーコラム(3ml)の上部方向に1mL/minで注入して、前記コラム内の固体支持体に前記折り畳み不全(unfolded)蛋白質を吸着させた。
【0063】
注入終了後、吸着されない固形物質等を除去する為に、前記緩衝溶液50mlをコラム上部方向に1mL/minで注入した。このようにコラム内で細胞の滓を完全に除去した後、EC−SOD活性に影響及ぼすZnとCuを含み、1Mウレアが含有されたトリス緩衝溶液(8M Tris緩衝溶液、1M urea,100mM NaCl,100mM ZnCl2 ,50mM CuSO4 、pH7.5)をコラム上部方向に0.5mL/minで線形的濃度勾配を与えながら注入し、コラム内の変性剤濃度を漸次減らすことにより、固体マトリックスに吸着された折り畳み不全(unfolded)蛋白質を天然状態の3次元的構造を有して金属イオン(ZnとCu)が完全に目的蛋白質に置換させて活性を有するようにリホールディングさせた。
その後、2Mイミダゾールと1Mウレアが含有されたトリス緩衝溶液を濃度勾配を与えてコラムの上部から下部方向に供給した。リホールディング融合蛋白質は0.5Mイミダゾール濃度の溶出緩衝液が供給された時、溶出された(図1参照)。
【0064】
<1−4>組換えEC−SOD蛋白質分離精製
前記<実施例1−3>から溶出された蛋白質より多量のイミダゾールを除去して、完全にリホールディングさせ、複合体を大きさ別に分離する為に、高速蛋白質精製用液状クロマトグラフィー機器と、ゲル濾過クロマトグラフィー(gel filtration chromatography)コラム(Sepharose 12 column)を利用した。この工程ではトリス緩衝溶液(50mM Tris Cl 100mM NaCl,pH7.5)又はリン酸緩衝溶液(Phosphate Buffered Saline pH7.5)をコラム上部方向に0.5mL/minで流入させ、分離及び精製した。分離された目的蛋白質は限外濾過法で濃縮した。
その結果、本発明の組換えEC−SOD蛋白質を得ることができ、それぞれの精製段階における試料をSDS−PAGEで分析した結果、図2に示した通り、組換えEC−SODが良く分離されたことが分かった。
【0065】
<1−5>ウェスタンブロットを介した組換えEC−SOD蛋白質の確認
前記<実施例1−4>で分離、精製された組換えEC−SODが確かであるか、否かを確認する為に、ウェスタンブロット(western blot)を実施した。EC−SOD標準蛋白質には、人間の皮膚角質形成細胞(keratinocyte)細胞株であるHaCaT(ドイツCancer Research N.Fusenig教授より提供)から発現された人間EC−SODを使用した。HaCaTから発現された人間EC−SODと、前記<実施例1−4>で分離、精製された組換えEC−SOD蛋白質等を10%のポリアクリルアミドゲルで電気泳動で分離し、ポリビニリデンフルオライトメンブレーン(Gelman Laboratory,MI,米国)に移した。その後、ポリビニリデンフルオリドメンブレンを5%の脱脂粉乳でブロッキング(blocking)した後、抗EC−SODポリクローナル抗体(1:500,サンタクルズ、USA)と共に培養した。前記膜を水洗した後、パーオキシダーゼが結合されている2次抗体IgG(サンタクルズ、米国)を使って培養し、再度水洗した後、ECL検出キット(GE Healthcare,米国)を利用して製造社の指針に従い発色した。
その結果、図3に示した通り、HaCaTから発現された人間EC−SOD(レーン1)で陽性を示し、分離精製された組換えEC−SOD蛋白質(レーン2)でも検出され、精製された蛋白質が人間EC−SODであることが分かった。
【0066】
<1−6>組換えEC−SOD蛋白質の活性検査
前記分離精製された組換えEC−SOD蛋白質がSODの生物学的活性を有するか否かを確認する為に、SOD Assay Kit−WST(Dojindo Molecular Technology,米国)を利用して製造社の指針に従い活性テストをした。
その結果、図4に示した通り、精製工程中に吸着されずに溶出された試料(209FT)は、活性を示さず金属親和性クロマトグラフィーコラムでリホールディングされた、1次精製された組換えEC−SOD蛋白質(209E1)の活性は、250unit/mg proteinであり、ゲル濾過コラムを利用して分離、精製された組換えEC−SOD蛋白質(209E2)の活性は360unit/mg proteinを呈した。
【0067】
<1−7>分離、精製された組換えEC−SOD蛋白質のROS除去効果確認
組換えEC−SOD蛋白質のHaCaT cellにおけるROS(reactive oxygen species)除去効果を見る為に、前記<実施例1−4>にて分離、精製された組換えEC−SOD蛋白質を以下の通り処理した。
皮膚角質形成細胞(HaCaT)を18mmカバースリップに1×104cells/wellに分株した後、10%牛胎児血清(FBS,GIBCO)及び100units/mlペニシリンと、100g/mlストレプトマイシンを1%添加したIMDM(Isocove′s modified Dulbecco′s medium,GIBCO)培地を使用して、5%CO2、37℃の条件で培養した。付着された細胞が約30〜40%コンフルエント(confluent)になったら、牛胎児血清を取除いて24時間培養した。細胞が50〜60%コンフルエント(confluent)になったら、前記EC−SOD10μgで細胞を30分間前処理した。UVB(100J/m2)で3時間照射した後、10MmDCFH−DAと37℃で30分間反応させ、蛍光顕微鏡で観察した。写真はZeissデジタルカメラを利用して撮影した。
その結果、図5に示した通り、UVBのみ照射した場合(UVB)ROSが除去されなかったものの、UVBを照射して本発明の組換えEC−SODを処理した場合(ECSOD+UVB)、ROSが効果的に除去されたことが分った。
【0068】
<実施例2>
天然型EC−SOD蛋白質の血管新生抑制効果
<2−1>EC−SOD過発現マウスと野生型マウスの形態学的比較
前記<実験例1>にて製造されたマウスより由来したEC−SODを過発現するマウスと、野生型BDF1マウスの背側皮膚に2kJ/m2で24時間間隔でUVBを4回照射した。つまり、前記マウス等の背側皮膚をUVB照射2日前に除毛し、280nm〜340nm波長範囲で305nmの最大エネルギーを有する6個のUVBランプ(FS24T12/UVB/HO,290−320nm,Voltare社、Fairfeild,CT,米国)を使用して、8週齢のマウス24匹に200mJ/cm2で一定に照射した。UVB照射する間ランプの高さは、麻酔されたマウスの背側皮膚表面に0.3mW/cm2で照射されるように調節した。各群のマウス(各群(n−6))等に24時間間隔で4回UVBを照射し、実験の為、4回目照射1時間後にマウスを犠牲にした。犠牲にしたマウスの背側皮膚患部を切開して肉眼で観察した結果を図6に示した。
前記図6に示した通り、野生型マウスに紫外線UVBを照射DQ場合(図6C)には、紫外線を照射しなかった場合(図6A)と比較して新生血管形成、皮膚炎症反応と紅斑が著しく誘導された。しかしながら、EC−SOD過発現マウスでは、紫外線照射前(図6B)と、照射後(図6D)に統計学的に意味のある差が無かった。つまり、紫外線UVB照射により、誘導された野生型マウスにおいて(図6B)の新生血管形成がEC−SOD過発現マウス(図6D)において著しく抑制されることが分った。前記結果からEC−SODは新生血管形成を抑制する機能があることを推定することができた。
【0069】
<2−2>ウェスタンブロット
前記<実験例1>で製造されたマウスより由来したEC−SODを過発現するマウスにおいて、血管新生過程を誘導する血管内皮細胞成長因子(VEGF)の発現程度をウェスタンブロットを利用して調査した。
前記実施例<2−1>で犠牲にしたEC−SOD過発現マウスと、野生型マウスそれぞれの背皮膚組織又は細胞を抽出溶液(50mMのTris HC1 pH8.0,5mMのEDTA,150mMのNaCl,0.5%のdeoxycholateナトリウム、1%のNonidet P−40,0.1%のSDS,1mMのPMSF,1mMのNaF,1mMのNaVO4さらに、プロテアーゼ抑制剤カクテル(Roche,ドイツ)で均質に抽出した。蛋白質濃度を決定する為に、バイオラド蛋白質キット(Bio−Rad,CA,USA)を使用し、牛胎児血清アルブミン(BSA)を標準物質として使用した。前記蛋白質抽出物等を10%のポリアクリルアミドゲルの上で分離し、ポリビニリデンフルオリドメンブレン(Gelman Laboratory,MI,米国)に移し、ポリビニリデンフルオリドメンブレンを5%の脱脂粉乳でブロッキング(blocking)した後、抗VEGFポリクローナル抗体(1:500,サンタクルズ、米国)と、抗ベータアクチン抗体それぞれと共に培養した。前記膜を水洗した後、パーオキシダーゼが結合されている2次抗体IgG(サンタクルズ、米国)と培養し再び水洗した後、ECL検出キットを利用して発色した。
実験の結果、UVB照射により野生型マウスにおいてVEGFの発現量が増加したものの、UVB照射されたEC−SOD過発現されたマウスでは、VEGFの発現が著しく減少された(図7)。前記の結果からEC−SODが血管新生抑制効果があることが再び確認できた。
【0070】
<2−3>免疫組織化学的調査(Immunohistochmical examination)
EC−SODがVEGFの発現を抑制するか、否かを免疫組織化学的方法により再び確認した。
前記実施例<2−1>において、犠牲にしたEC−SOD過発現マウスと、野生型マウスそれぞれの背皮膚組織を0.5Mのリン酸塩緩衝液(pH7.4)で作った4%のパラホルムアルデヒドで固定させた。流水で水洗後、エタノールで脱水し、パラフィンに包埋させ、5mmの厚さで切片してガラススライドに付着した。前記切片をキシレン溶液を使用して脱パラフィンし、エタノールで含水した後、ヘマトキシリンとエオシンで染色した。脱パラフィンされた組織切片に3%の過酸化水素を処理してブロッキングした。非特異的結合と背景染色を減らす為に、前記切片を10%羊の血清で処理した。各組織スライドを抗VEGFポリクローナル抗体(1:500,サンタクルズ、米国)で処理し、ストレプタビジン−バイオチンキット(LSAB,Dako,CA,米国)を利用してアビジンーバイオチンーイムノパーオキシダーゼコンプレックス法で視覚化した。染色された組織を水洗した後、ジアミノベンチジン(DAB)で発色し、0.2%のメイアーヘマトキシリン(シグマ、MO,米国)で対照染色を行いその結果を図8に示した。
前記図8に示した通り、野生型マウスにおいて、UVB照射によりVEGFが多く発現されたものの、EC−SODが過発現されたマウスでは野生型マウスに比べてVEGFの発現が著しく抑制され、前記実施例<1−2>の結果と一致する結果を得た。前記結果等から、生体内(in−vivo)で天然型EC−SODが血管新生を誘導するVEGF発現を抑制して血管新生を抑制する効果があることが分った。
【0071】
<2−4>EC−SOD過発現マウスにおけるMMP−9の発現水準調査
細胞外の基質蛋白質を分解するMMP蛋白質は、VEGFと共に、血管新生の重要調節因子である。特に、MMP9はVEGFーVEGFRシステムを介して腫瘍の血管新生過程を調節する因子として知られている(Bergers et al.,Nat. Cell Biol.,2:737−744,2000)。従って、本発明者等はEC−SOD過発現マウスにおいて、UVB照射によるMMP−9発現水準を調査した。
前記実施例<2−1>で犠牲にしたEC−SOD過発現マウスと、野生型マウスそれぞれの背皮膚組織に1mg/ml gelatin(100mg/ml)を混合してSODーPAGEを行った後、ゲルを2.5%トリトンX−100で20分間処理して水洗する。Zymography反応溶液(1M Tris(pH7.5),1M CaCl2,5M NaCl,0.2mM ZnCl2,25%TX−100,0.2% NaN3)で37℃にて16時間反応させ、1時間染色した後、1時間脱色する。オーブンで1時間乾燥させ分析した結果を図9に示した。
前記図9に示した通り、紫外線照射する前の野生型マウスとEC−SOD過発現マウスのMMP−9の発現水準は別段の差がなかった。しかしながら、UVB照射により、野生型マウスはMMP−9の発現が増加するものの、EC−SODマウスの場合には、MMP−9の発現が野生型マウスに比べて著しく抑制される。
前記結果から、生体内で天然型EC−SODがVEGFの発現を抑制するばかりでなく、VEGFーVEGFRシステムを介した血管新生関連信号伝達に関与するMMP−9の発現を抑制して血管新生を効果的に抑制することが分った。
【0072】
<実施例3>
組換えEC−SOD蛋白質の血管新生抑制効果
前記<実施例1>で分離、精製された組換えEC−SOD蛋白質を利用して、血管新生を抑制する効果があるか、否かを調査した。皮膚角質形成細胞(HaCaT)を18mmカバースリップに1×104 cells/wellで分株する。10%牛胎児血清(FBS,GIBCO)及び100units/mlペニシリン(penicillin)と、100g/mlストレプトマイシン(streptomycin)を1%添加したIMDM(Isocove′s modified Dulbecco′s medium,GIBCO)培地を使用して5%CO2、37℃の条件で培養した。付着された細胞が30〜40%コンフルエント(confluent)になったら、牛胎児血清を取除いた後、24時間培養した。細胞が50〜60%コンフルエント(confluent)になったら、EC−SOD10μgで前処理する。30分間、精製された組換えEC−SOD蛋白質で処理した後、紫外線100Jで処理し、24時間後皮膚角質形成細胞株をパラホルムアルデヒドで固定して、免疫染色を実施した。固定された細胞を10%正常羊血清(normal goat serum)を利用してブロッキング(blocking)した後、リン酸緩衝液(PBS)で3回水洗した。ここにVEGF(Vascular endothelial growth factor)に対する免疫染色の為、兎抗VEGF抗体(rabbit anti VEGF antibody,santacuz,米国)でそれぞれ処理した後、4℃で16時間以上反応させた。FITCが融合された抗二十日鼠IgG2次抗体(anti−mouse IgG secondary antibody,zymed,米国)を利用して蛍光染色した後、蛍光顕微鏡(Carl Zeiss,ドイツ)で観察した。
その結果、図10に示した通り、UVBを照射しない対照群(control)に比べてUVBを照射した場合(UVB)VEGFの発現が著しく増加された。さらに、UVB照射した群に前記組換え蛋白質を処理した場合(EC−SOD/UVB)には、VEGFの発現が著しく抑制されることを確認し、組換えEC−SOD蛋白質により、血管新生が抑制されることが分った。
【0073】
<実施例4>
組換えEC−SOD蛋白質によるT細胞増殖及び分化に及ぼす影響
<4−1>組換えEC−SODのT細胞増殖及び分化に及ぼす影響の確認
EC−SODが免疫細胞であるT細胞に影響を及ぼすか、否かを調べるために、特異抗原(Ovalbumin)に反応するTCR(T cell receptor)形質転換マウス(DO.11.10.浦項工大成永哲教授より提供)を使用して下記の通り調査した。
EC−SODがT細胞の増殖に影響を与えるか否かを確認する為、前記形質転換したマウス脾臓より分離した細胞を、抗原であるオブアルブミンペプチド(Ova peptide)と共に、72時間培養し、最後の16時間3Hと培養した後、放射線量を測定してT細胞の増殖を確認した。
その結果、図11に示した通り、EC−SODを添加しない群と、EC−SODをそれぞれ1μg/ml又は10μg/ml添加した群で放射線量の差が殆どなく、EC−SODが殆どT細胞増殖に影響を与えないことが分った。
【0074】
<4−2>組換えEC−SODのT細胞分化に及ぼす影響確認
T細胞の増殖に影響を及ぼさなくてもT細胞の分化に影響を及ぼし得る為、分化を知り得るT細胞のサイトカインを測定した。
脾臓細胞を抗原であるオブアルブミンペプチドと共に、48時間培養後培養培地に生成されたIL−4(interleukin−4)サイトカインを測定した。測定方法は、BD(Becton Dickinson and Company,米国)会社のELISA−kitを利用して、製造社の指針に従い測定した。
その結果、図12に示した通り、EC−SODがIL−4の形成を減少させることが分った。この結果により、EC−SODがT細胞の分化に影響を及ぼし得る(neg.:抗原が処理されない試験群、−:抗原(Ova peptide)のみ処理された試験群、p:抗原(Ova peptide)とPBSに入っているEC−SODを一緒に処理した試験群、NB:抗原(Ova peptide)とSodium borateに含まれているEC−SODを一緒に処理した試験群、全ての試験群は一緒に48時間培養培地に入れて処理された)。
一方、本発明の組換えEC−SODT細胞分化に及ぼす影響を具体的に調べる為に、前記組換えEC−SODをマウスのT細胞に投与してIL−4及びINF−γ等のサイトカインの生成量を比較した。
具体的に特定抗原であるOvaペプチドのみを認知するTCR(T cell receptor)遺伝子過発現マウスであるDO 11.10(浦項工大成永哲教授より提供)脾臓においてCD4細胞をMACS(Miltenyi Biotech)を利用して分離した。抗原提示細胞で正常マウスであるBalb/cマウス脾臓細胞全体をγーirradiationし、Ovaペプチド(1μg/ml,Ova323−339,ペプトロン社)及びMACSで分離したCD4 T細胞と共にRPMI1640培地で10%FBSを入れて培養した。培養過程で、前記<実施例1>で分離精製された組換えEC−SODを前記培養に与えた。72時間後に培養液を採集してELISA(抗体:Becton Dickinson)で培養液内のIL−4とIFN−γの量を定量した。
その結果、図13に示した通り、前記<実施例1>で分離精製された組換えEC−SODは、T細胞において、Thl側のサイトカインであるIFN−γの形成を誘導し、Th2側のサイトカインであるIL−4の形成を抑制することが分った。従って、組換えEC−SODは免疫細胞に影響を及ぼし、特に、T細胞の分化に影響を及ぼすことが分った。
従って、本発明の組換えEC−SODはアレルギー疾患を誘発するTh2細胞の過分化を遮断し、Th1細胞への分化を誘導することにより、アレルギー疾患を治療又は予防に有用に使用できるとこが分った。
【0075】
<実施例5>
天然型EC−SOD蛋白質のT細胞分化に及ぼす影響
前記<実験例1>に記載された人間のEC−SODを過発現させたマウスにOva蛋白質とTh1側に免疫を誘導する免疫補助剤CFA(Complete Freund′s Adjuvant,Sigma社)を、Th2側にはAlum(Aluminum Hydroxide,Pierce社)を混合して、それぞれ25μgずつ足裏と尻尾に免疫処理した後、11日後に炎症が発生したリンパ球で細胞を分離し、EC−SODが細胞増殖とサイトカイン生成に影響を及ぼすか否かを観察した。
前記細胞増殖には、リンパ球細胞5×105を96well plateに培養し、培養3日後に同位元素である3Hを培養液にいれて、16時間後に細胞内の同位元素含量をβ−counterを利用して促進することにより細胞増殖を観察した。さらに、抗原特異的な反応であることを確認する為に、Ova蛋白質の量を異にして細胞増殖を観察した。サイトカイン発現を観察する為に、リンパ球細胞5×106を46well plateに培養し、72時間後に培養液を採取して、ELISAで培養液内のIL−4とIFN−γの量を定量してその結果を図14及び図15に記載した。
前記図14及び図15に記載された通り、Th1分化を誘導するCFAを免疫補助剤として使用した場合、リンパ細胞増殖が正常マウスのリンパ細胞より若干増加することを観察した。IFN−γの発現が増加されたことを観察した。さらに、Th2分化を誘導するAlumを免疫補助剤として使用した時、リンパ細胞増殖が正常マウスのリンパ細胞より減少し、IL−4の発現が減少されたことを観察した。このような結果は、EC−SODがT細胞の分化に影響を及ぼすものの、特に、主にTh1側に分化させ、Th2側への分化を抑制させることが分った。
従って、天然型EC−SODは、アレルギー疾患を誘発するTh2細胞の過分化を遮断してTh1細胞への分化を誘導することにより、アレルギー疾患を治療又は予防に有用に使用できることが分った。
【0076】
<実施例6>
組換えEC−SOD蛋白質の転写因子活性阻害効果確認
紫外線によるNF−κB活性化に対するEC−SOD効果を調べる為に、HaCaT cellを14mm培養スライドに細胞を接種した後、牛胎児血清(fetal bovine serum)が10%含まれたDMEM(Dulbecco′s modified Eagle′s medium)培地で24時間培養した。24時間培養後、牛胎児血清が1%含まれたDMEM培地で24時間飢餓処理(starvati on)をした。処理後それぞれ10μgのEC−SODを30分間処理した後(前処理)リン酸緩衝液(Phosphate buffered saline,PBS)を利用して細胞を3回水洗した後、NF−κB活性化を誘導する為に、100J/m2の紫外線を照射した。紫外線照射直後、細胞を再びリン酸緩衝液で水洗して牛胎児血清が1%含まれたDMEM培地にEC−SODを前処理濃度と同じく処理して、さらに4時間培養した。以降、細胞をメタノールで5分間固定して免疫染色を実施した。このように固定された細胞を10%正常羊血清(normal goat serum)を利用してブロッキング(blocking)した後、リン酸緩衝液(PBS)で3回水洗した。 ここに、EC−SODとNF−κBに対する免疫染色の為に、二十日鼠抗EC−SOD 抗体(mouse anti EC−SOD antibody,Labfrontier,韓国)と、兎抗NF−κB抗体(rabbit anti NF−κB an tibody,santacuz,米国)をそれぞれ処理し、4℃で16時間反応させた。これをTRITC(tetramethyl rhodamine isothi ocyanate)が融合された抗兎IgG2次抗体(antiーrabbit IgG secondary antibody,serotec,英国)とFITCが融合された、抗二十日鼠IgG2次抗体(antiーmouse IgG se condary antibody,zymed,米国)を利用して蛍光染色した後、hoechst(Sigma,米国)でカウンター染色した。
その結果、図16(200倍比率)に示した通り、対照群(control,EC−SODが形質感染されたHaCaT細胞にUV処理を施していない群)において、NF−κBは細胞質及び核で免疫染色がなされず、NF−κBが不活性されたことが分った(A,D,G,J)。UVB群(HaCaT細胞にUVBを100J/m2で照射した群)では、速やかに核(nuclear)部位と核周囲(perinuclear)部位で、NF−κBが活性化されることが観察された(B,E,H,K)。これに比べて、ECSOD/UVB群(HaCaT cellに本発明の組換えEC−SOD蛋白質を処理し、UVBを100J/m2で照射した群)では、UVB群に比べて著しく核部位のNF−κBの活性化が阻害されることが観察された(C,F,I,L)。このような結果により、本願発明の組換えEC−SODが転写因子であるNF−κBの活性化を抑制することが分った。
従って、本願発明の組換えEC−SODはNF−κBの非正常的な活性を防ぎ、アレルギー等の自己免疫疾患を予防又は治療に有用に使用できることが分った。
【0077】
<実施例7>
組換えEC−SOD蛋白質の人間肥満細胞脱顆粒(degranulation)の減少効果確認
EC−SODが人間肥満細胞の脱顆粒(degranulation)にどのような影響を及ぼすか、否かを調べる為に、トルイジンブルーで染色した後、細胞100個の内、脱顆粒が起こった細胞数を数えてみた。
人間肥満細胞(semi,Human Mast Cell−1(HMC−1),慶熙大学校金炯敏教授より提供)を18×18mmカバースリーブに1×104cells/カバースリーブで分株した。培地は10%牛胎児血清(FBS,GIBCO)及び100units/mlペニシリンと100g/mlストレプトマイシン1%で添加したIMDM(Isocove′s modified Dulbecco′s medium,GIBCO)を使用して5%CO2、37℃の条件で培養した。この細胞は半付着細胞(semi−adhesion)である為、付着された細胞と付着されない細胞の比率は4:6程度であるものの、付着された細胞が約30−40%コンフルエント(confluent)した時、EC−SOD5μgで、1時間前処理した後、カルシウムチャンネルであるA23187 1μMとホルボルミリステートアセテート(Phorbol 12−Myristate 13−Acetate,PMA)50nMで処理して、細胞内のカルシウム濃度を高めた。
12時間後に、リン酸緩衝溶液(PBS)で人間肥満細胞を洗浄し、4%パラホルムアルデヒド(paraformaldehyde)で10分間固定させた。リン酸緩衝溶液で洗浄し、酸性を帯びた(pH2.3)1%の塩水に溶解されている0.1%トルイジン(toluidine)ブルー溶液で2−3分間染色した。再び水で洗浄した後、95%,100%アルコールで脱水させ、キシレン(xylene)で固定させ、100個の染色させた細胞のうち脱顆粒が起こった細胞数を数えてみた。
その結果、図17Aに示した通り、何等の処理もしていない人間肥満細胞群(対照群,con)で脱顆粒された細胞数は10個、EC−SODを処理した群(EC−SOD)で脱顆粒された細胞数は16個であった。これに比べて肥満細胞を活性化させ、脱顆粒を誘導する為に、細胞内のカルシウム濃度を高めた群(A+P)では脱顆粒された細胞数が55個で、5倍以上増加したものの、EC−SODを前処理して細胞内のカルシウム濃度を高めた群(A+P+EC−SOD)では、脱顆粒された細胞数が25個までさらに減少した。これはEC−SODの作用による活性酸素抑制により、脱顆粒減少が起こったことを示している。肥満細胞脱顆粒に対する顕微鏡写真は図17Bの通りである。
従って、肥満細胞の脱顆粒により肥満細胞内にあったヒスタミン等の媒介物質がでてきて、アレルギー等の炎症反応が起るとの事実を考慮するに、本発明の組換えEC−SODは人間肥満細胞脱顆粒(degranulation)を減少させ、アレルギー疾患を予防又は治療に有用に使用でき得ることが分った。
【産業上の利用可能性】
【0078】
EC−SOD蛋白質又はこれらをコーデイングするポリヌクレオチドが挿入されたベクターは、血管新生を誘導するVEGF及びMMP−9の発現を抑制して血管新生を抑制する効果が優れているので、血管新生による疾患の予防及び治療に有用に使用することができ、アレルギー疾患を誘発するTh2細胞の過分化を遮断し、転写因子(NF−kB)活性を阻害し、人間肥満細胞の脱顆粒を減少させることにより、アレルギー疾患の予防及び治療に有用に使用できる。さらに、本発明のEC−SOD蛋白質の製造方法は前記のような活性を有するEC−SODを大量に生産することができ、産業的に有用に使用できる。
【技術分野】
【0001】
本発明はEC−SOD蛋白質の新規な用途及びその製造方法に関する。具体的に本発明はEC−SOD蛋白質、又はこれらをコーディングするポリヌクレオチドが挿入されたベクターを有効成分とする、血管新生による疾患又はアレルギー疾患の予防又は治療用組成物及びEC−SOD蛋白質の製造方法に関する。
【背景技術】
【0002】
SOD(superoxide dismutase)は活性酸素を除去するばかりでなく、他の抗酸化酵素が作用し得るようにして、細胞を保護するよう機能し、今までに知られているSODには銅と亜鉛原子を有しているCu/Zn SOD(SOD1),マンガン原子を有しているMn SOD(SOD2)及び細胞表面、又は細胞外液に存在するEC−SOD(extracellular superoxide dismutase)等がある。
【0003】
特に、EC−SODはCu/Zn SODのように銅及び亜鉛原子を有しているものの、C−末端側にヘパリン結合ドメイン(heparin binding domain)が存在すると言う特徴がある。EC−SODはヘパリン結合ドメインを有している為、細胞膜のヘパリンに結合され、細胞膜を保護する役割をするものと推定されている。文献によれば、EC−SODは血漿と細胞外基質等において、生体防御作用を担当しているものとして知られている(Marklund et al,Biochem.J.266,213−219,1990;Su et al.,Am J Respir Cell Mol Biol.,Feb 16(2),162−70,1997;Luoma et al.,Thromb.Vasc.Bio.18,157−167,1998)。EC−SODのヘパリン結合ドメインが、核局在化シグナル(nuciear localization signal)として働き、胸腺(thymus)と睾丸細胞(testis cell)において、核内に位置して酸化的ストレスからゲノムDNAを保護し、酸化還元反応に敏感な転写作用を調節するとして報告されている(Ookawara T et al.,BBRC,296,54−61,2002)。本発明者等は、大韓民国特許第10−0676502号において、EC−SODが皮膚細胞内活性酸素腫を除去し、表皮細胞の過増殖を抑制して乾癬等の皮膚疾患を治療する効果があることを開示している。
【0004】
一方、血管新生(Angiogenesis)とは、既存の微細血管から新たな毛細血管が形成される過程である。正常には胚芽の発達(embryonic development)の際、傷の治癒、周期的な女性の生殖器系統の変化の時にのみ起こり、その他の正常な条件では殆ど起こらない現象である。しかしながら、血管新生が自律的に調節できない時、病的に成長することにより癌のような疾患が誘発される。
【0005】
前記血管新生過程は腫瘍サイトカイン、血管内皮細胞成長因子(VEGF)及び塩基繊維芽細胞成長因子(bFGF)により、内皮細胞の成長を促進させる段階、メタロプロテアーゼ(MMP)により細胞外基質蛋白質を分解させる段階、細胞膜接着分子、内皮細胞分化及び管形成により媒介される内皮細胞の移動段階のような多様な段階で構成されている(Bussolino,F.et al.,Trends Biochem.Sci.22:251−256,1997;Kuwano,M.et al.,Intern.Med.40:556−572,2001;Risan,W.Angiogenesis and endothelial cell function.Arzneimittelforschung44:416−417,1994)。従って、前記過程等の阻害は血管新生と関連した癌及び他の人間の疾病の治療の為の新たな治療戦略として台頭するようになった。前記目的の為、多様な種類の血管新生抑制剤が開発された。前記抑制剤は天然的であるか又は合成された物質にして、蛋白質分解酵素抑制剤、チロシンリン酸化酵素の抑制剤、ケモカイン、インタルキン及び基質蛋白質の分解切片を含む(Abedi,H.et al.,J.Biol.Chem.272:15442−15451,1997;Cao,Y.,Int.J.Biochem.Cell Biol.33:357−369,2001;Fong,T.Aet al. ,Cancew Res.59:99−106,1999;Kwon,H.J.et al.,Acalycigorgia inermis.J.Microbiol.B iotechnol.11:656−662,2001.)。前記抗血管新生分子等は内皮細胞増殖、移動、蛋白質分解活性及び管形成の抑制ばかりでなく、細胞自殺(apoptosis)の誘導を含む多くの過程に影響を及ぼす(Forkman,J.et al.,Semin.Cancer Biol.3:89−96,1992;Kis hi,K.et.al.,Nippon Rinsho 58:1747−1762,2000;Marme,D.,Onkologie 1:1−5,2001)。
【0006】
前記分子等の抗血管新生機能はin vitro及びin vivoにおいて良く研究されたものの、幾つかの物質は現在臨床試験を実施している(Deplanque,G. et al.,Eur.J.Cancer36:1713−1724,2000;Li ekens,et.al.,Biochem.Pharmacol.61:253−2 70,2001;Mross,K.,Drug Resist.Updat.3:22 3−235,2000)。
【0007】
活性酸素腫が血管新生の主要な調節者として報告されているものの(Jolanta Grzenkowicz−Wydra.et.al.,Mol Cell Biochem.,264(1−2):169−81,2004)、活性酸素腫を除去するSODと血管新生との関連性に対しては十分に調査されたものがない。最近SODの中で銅と亜鉛原子を有しているCu/Zn SOD(SOD1)を過発現させると、血管新生が促進され、前記SOD1を抑制すると血管新生を抑制し(Jolanta Grzenkowicz−Wydra.et.al.,Mol Cell Biochem.,264(1−2):169−81,2004)、SOD1の抑制剤であるATN−224が血管新生を抑制して抗癌剤として使用することができ、現在第2相臨床試験中であるとして報告されている(Juarez et al.Clin Cancer Res.,12:4974−4982,2006)。しかしながら、EC−SODと血管新生の関連性に対しては報告された例が全くない。
【0008】
一方、産業の発達により、環境汚染、新たな合成新物質の増加、住居環境の変化によりアレルギーを誘発する因子が増加し、これに伴い喘息、アレルギー疾患により苦痛にさらされている人間等の数が漸次増加してきた。一旦侵入した異物に対して生体が特異な抵抗を示す機能を免疫と称し、アレルギーとは、免疫反応の過敏症の一つであり、アトピー性皮膚炎、気管支喘息、花粉症は代表的なアレルギー性疾患である。アレルギー反応に伴う臨床的症状等は、大きくは、アレルギー疾患の種類に伴う反応初期の特異な免疫反応と反応後期の炎症反応とに区分される。このようなアレルギー反応は大部分が肥満細胞を媒介に起こるものの、肥満細胞は皮膚、呼吸器、胃腸管の粘膜、リンパ管周囲、血管周囲、脳等全身の臓器に広く分布し、アレルギー反応の原因細胞として知られている。肥満細胞を活性化させる媒介物質としては、細胞の細胞膜に存在する高親和性のIgE収容体に結合されているIgE抗体(FcεRI)、化合物48/80(compound48/80)等が知られている。IgE抗体による肥満細胞の活性化機序は次の通りである。IgE収容体に結合されているIgE抗体が抗原により、架橋(Bridge)を形成すると、ホスホリパーゼC、蛋白質リン酸化酵素C、カルシウムイオンの作用を経て顆粒に貯蔵されていたヒスタミン(histamine)、コンドロイチン(chondroitin)硫酸塩、ヘパリン(heparin)、蛋白質分解酵素等が遊離されることにより、前記の初期反応段階を媒介する。ヒスタミンを含む電気化学伝達物質等はアレルギー初期反応で現れる臨床的症状等を誘発する原因物質等であり、この内、ヒスタミンが最も多くの量を占める。つまり、アレルギー初期反応では、ヒスタミンの発現による作用が主を為し、その臨床的症状としては血管拡張、浮腫等がある。
【0009】
現在前記アレルギー疾患の治療には、抗ヒスタミン剤やステロイド剤等が多く活用されている。しかしながら、このような薬物はその効果が一時的な場合が大部分であって、副作用が甚だしい場合も多い。従って、急増するアレルギー性疾患の予防及び治療効果を有しながら、副作用が少なく効果が持続的な新たな物質の開発が切実に要請される状況である。ただ、EC−SODがアレルギー疾患の治療効果があるか、否かに対しては全く知られていない。
【0010】
さらに、前記EC−SODが多様な活性を有しているとしても、これの大量生産方法が開発されないと、産業において効率的に利用できない問題点がある。しかしながら、今まで開発された蛋白質の大量生産方法は、大腸菌等の宿主細胞を発現ベクターで形質転換してこれらの発現を誘導するものであるものの、蛋白質の大量生産は、しばしば内包体(inclusion body)の形成を招き、これにより蛋白質の元来の活性がなくなるか、又は減少する問題点があった。
【0011】
本発明者等はEC−SODに対する研究を重ねて行く中で、EC−SOD蛋白質が血管新生又はアレルギー疾患を治療又は予防し得る活性があることを発見し、前記のような活性を有するEC−SOD蛋白質を生産し得る方法を見出し、本発明を完成した。
【発明の概要】
【発明が解決しようとする課題】
【0012】
従って、本発明の目的は、EC−SOD蛋白質を有効成分とする血管新生による疾患の予防又は治療用組成物を提供することである。
本発明のさらに他の目的は、前記EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とする血管新生による疾患の予防又は治療用組成物を提供することである。
本発明のさらに他の目的は、前記EC−SOD蛋白質を有効成分とするアレルギー疾患の予防又は治療用組成物を提供することである。
本発明のさらに他の目的は、前記EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とするアレルギー疾患の予防又は治療用組成物を提供することである。
本発明のさらに他の目的は、前記EC−SOD蛋白質の製造方法を提供することである。
【課題を解決するための手段】
【0013】
前記のような目的を達成する為に、本発明はEC−SOD蛋白質を有効成分とする血管新生による疾患の予防又は治療用組成物を提供する。
さらに、本発明は前記EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とする血管新生による疾患の予防又は治療用組成物を提供する。
さらに、本発明はEC−SOD蛋白質を有効成分とするアレルギー疾患の予防又は治療用組成物を提供する。
さらに、本発明はEC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とするアレルギー疾患の予防又は治療用組成物を提供する。さらに、本発明は(a)EC−SOD蛋白質をコーデイングするポリヌクレオチドを発現ベクターにクローニングする段階;(b)前記発現ベクターを宿主細胞に導入して宿主細胞を形質転換する段階;(c)前記形質転換された宿主細胞を培養してEC−SOD蛋白質を発現する段階;(d)発現されたEC−SOD蛋白質の内包体を収得する段階;及び(e)前記内包体の溶解及びリホールディング(refolding)を誘導する段階を含むことを特徴とするEC−SOD蛋白質の製造方法を提供する。
【0014】
以下、本発明の内容をより詳細に説明する。
本発明で発現ベクターとは、適当な宿主細胞より目的蛋白質又は目的RNAを発現できるベクターであり、遺伝子挿入物が発現されるように作動可能に連結された必須的な調節要素を含む遺伝子製作物を言う。
本発明で用語、“作動可能に連結された(operably linked)”とは、一般的な機能を遂行できるように核酸発現調節配列と、目的とする蛋白質又はRNAをコーデイングする核酸配列が機能的に連結(functional linkage)されていることを言う。例えば、プロモータと蛋白質又はRNAをコーデイングする核酸配列が作動可能に連結され、コーデイングする核酸配列の発現に影響を及ぼし得る。組換えベクターとの作動的連結は、当該技術分野で広く知られた遺伝子組換え技術を利用して製造することができ、部位−特異的RNA切断及び連結は当該技術分野で一般的に知られた酵素等を使用する。
【0015】
本発明は、EC−SOD蛋白質を有効成分とする血管新生による疾患の予防又は治療用組成物を提供する。
前記EC−SOD蛋白質はこれに限定はされないものの、好ましくは、天然型又は組換えEC−SOD蛋白質を言う。前記天然型EC−SOD蛋白質はこれに限定はされないものの、マウス又は人間より由来したものであることを特徴とし、最も好ましくは、人間より由来したものであることを特徴とする。前記天然型EC−SOD蛋白質はこれに限定はされないものの、好ましくは、配列番号3及び配列番号5のアミノ酸配列を有することを特徴とし、最も好ましくは、配列番号3を有することを特徴とする。一方、前記組換えEC−SOD蛋白質は、前記天然型EC−SODから組換え技術により製造され、その活性を維持するものであればこれに限定はされないものの、好ましくは、配列番号1アミノ酸配列を有することを特徴とする。
【0016】
さらに、本発明は前記EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とする血管新生による疾患の予防又は治療用組成物を提供する。
前記EC−SOD蛋白質をコーデイングするポリヌクレオチドは、前記天然型EC−SOD蛋白質又は組換えEC−SOD蛋白質をコーデイングし得るポリヌクレオチドを意味し、これに限定はされないものの、好ましくは、配列番号2、配列番号4及び配列番号6からなる群より選ばれた塩基配列を有することを特徴とする。
【0017】
本発明の一実施例では、公知された方法でマウスより由来したEC−SODを過発現するマウスを製造し(<実施例1>参照)前記マウスにUVBを照射した後、組織の形態変化を野生型マウスと比較した。その結果、野生型マウスではUVB照射により血管新生が誘導されたものの、EC−SOD過発現マウスではUVB照射による血管新生が著しく抑制されていることを確認できた(<実施例2ー1>参照)。
【0018】
さらに、本発明の他の実施例では前記EC−SOD過発現マウスにおいて、紫外線照射による血管内皮細胞成長因子(VEGF)及びMMP−9の発現程度をウェスタンブロット(<実施例2ー2>)、免疫組織化学的方法(<実施例2ー3>)及びザイモグラフィー方法(<実施例2ー4>)を利用して調査した。その結果、紫外線照射により野生型マウスではVEGF及びMMP−9の発現が増加されたものの、EC−SOD過発現マウスではVEGF及びMMP−9の発現が著しく抑制されることを確認することができた。前記実験結果からEC−SODが血管新生を誘導するVEGFの発現を抑制して、血管新生を調節するMMP−9の発現を抑制して血管新生を抑制することが分った。
【0019】
さらに、本発明者等はさらに他の実施例でヘパリンドメインが除去された組換えEC−SODを大腸菌で発現させ、分離してリホールディング(refolding)と精製過程を経た組換えEC−SOD蛋白質を生産(<実施例1>参照)して前記蛋白質が血管新生を抑制するか否かを確認(<実施例3>)した。その結果、紫外線照射によりVEGFの発現が誘導されるものの、前記組換えEC−SOD蛋白質を処理した場合には、前記VEGFの発現が抑制されることが確認できた。
【0020】
従って、前記EC−SOD蛋白質又はこれをコーデイングするポリヌクレオチドが挿入されたベクターは、血管新生による疾患の予防及び治療に効果的に使用できる。前記血管新生による疾患には、VEGF(Vascular endothelial growth factor)発現及びMMP(matrix metalloproteinase)−9の発現により誘発されることを全て含み、これに限定はされないものの、好ましくは癌、糖尿病、リウマチ性関節炎、動脈硬化、血管腫、血管繊維腫、糖尿病性網膜症、早熟児の網膜症、新生血管性緑内障、新生血管による角膜疾患、退化斑、斑点の変性、翼状片、網膜変性、後水晶体繊維増殖症、顆粒性結膜炎、毛細管拡張症、化膿性肉芽腫及びニキビが挙げられる(Ophthalmol 102,1261−1262,1995;J Am Acad Derm 34(3):486−497,1996;Circultion 93(4):632−682,1996;Cell 86:353−364,1996)。
【0021】
さらに、本発明はEC−SOD蛋白質を有効成分とするアレルギー疾患の予防又は治療用組成物を提供する。
上述した通り、EC−SOD蛋白質はこれに限定はされないものの、好ましくは天然型又は組換え蛋白質を言う。前記天然型EC−SOD蛋白質は、これに限定はされないものの、好ましくはマウス又は人間より由来したことであることを特徴とし、最も好ましくは、人間より由来したことを特徴とする。前記天然型EC−SOD蛋白質は、これに限定はされないものの、好ましくは配列番号3及び配列番号5のアミノ酸配列を有することを特徴とし、最も好ましくは、配列番号3を有することを特徴とする。一方、前記組換えEC−SOD蛋白質は前記天然型EC−SODから組換え技術により製造され、その活性を維持するものであればこれに限定はされないものの、好ましくは配列番号1アミノ酸配列を有することを特徴とする。
【0022】
さらに、本発明は前記EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とするアレルギー疾患の予防又は治療用組成物を提供する。
上述した通り、前記EC−SOD蛋白質をコーデイングするポリヌクレオチドは、前記天然型EC−SOD蛋白質又は組換えEC−SOD蛋白質をコーデイングし得るポリヌクレオチドを意味し、これに限定はされないものの、好ましくは配列番号2、配列番号4及び配列番号6からなる群より選ばれた塩基配列を有することを特徴とする。
【0023】
本発明の一実施例では、組換えEC−SOD蛋白質によるT細胞増殖及び分化に及ぼす影響を確認した結果、前記組換えEC−SODはT細胞でThl側のサイトカインIFN−γの形成を誘導し、Th2側のサイトカインであるIL−4の形成を抑制することが分った。従って、組換えEC−SODはT細胞の分化に影響を及ぼすことが分り、アレルギー疾患を誘発するTh2細胞の過分化を遮断し、Th1細胞への分化を誘導することにより、アレルギー疾患を治療又は予防するにおいて有用に使用できることが分った(<実施例4>参照)。
【0024】
さらに、本発明のさらに他の一実施例では、天然型EC−SOD蛋白質である人間由来のEC−SOD蛋白質のT細胞分化に及ぼす影響を確認した結果、前記EC−SODもやはりアレルギー疾患を誘発するTh2細胞の過分化を遮断してTh1細胞への分化を誘導することが分った(<実施例5>参照)。
【0025】
さらに、本発明のさらに他の一実施例では組換えEC−SOD蛋白質の転写因子活性を阻害する効果があるか、否かを確認した結果、組換えEC−SODはNF−κBの非正常的な活性を阻害し得ることが分かり(<実施例6>参照)、さらに、人間肥満細胞の脱顆粒(degranulation)を減少させる効果があることを確認し、肥満細胞の脱顆粒により肥満細胞内にあったヒスタミン等の媒介物質が現れ、アレルギー等の炎症反応が起こると言う事実を考慮するに、本発明の組換えEC−SODはアレルギー疾患を予防又は治療に有用に使用できることが分った(<実施例7>参照)。
【0026】
従って、前記EC−SOD蛋白質又はこれをコーデイングするポリヌクレオチドが挿入されたベクターは、アレルギー疾患の予防及び治療用組成物として有用に使用できる。前記アレルギー疾患はアレルギー性喘息、アレルギー性鼻炎、アレルギー中耳炎、アナフィラキシショック(anaphylatic shock)、アレルギー性皮膚疾患、アトピー性皮膚炎、乾癬、接触性アレルギー皮膚炎及び蕁麻疹からなる群より選ばれたものであることを特徴とする。
【0027】
前記本発明の組成物に含まれるEC−SOD蛋白質にはこれらと実質的に同等な生理活性を有する蛋白質を含む。実質的に同等な生理活性を有する蛋白質には、EC−SOD蛋白質の機能的同等物(functional equivalent)及び機能的誘導体(functional derivative)が含まれる。
本発明で“機能的同等物”とは、配列番号3で表示されるアミノ酸配列を有するEC−SODと実質的に同等な生理活性を示すポリペプチドを言う。
【0028】
前記にて“同等な生理活性”とは、血管新生又はアレルギーを抑制する活性を言う。前記機能的同等物は、配列番号3で表示されるアミノ酸配列と少なくとも70%以上、好ましくは、80%以上、より好ましくは、90%以上の配列相同性(homology)を有するポリペプチドでもあり得る。前記機能的同等物とは、アミノ酸の付加、置換又は欠失の結果、配列番号3で表示されるペプチドと少なくとも70%以上の、好ましくは80%、さらに好ましくは90%以上の配列相同性(つまり、同一性)を有するものにして、例えば、71%,72%,73%,74%,75%,76%,77%,78%,79%,80%,81%,82%,83%,84%,85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,58%,99%,100%の配列相同性を有することを含み、配列番号3で表示されるペプチドと実質的に同質の生理活性を示すペプチドを言う。本明細書で配列相同性及び同質性は、配列番号3で表示されるアミノ酸配列と、候補配列を整列してギャップ(gaps)を導入した後、配列番号3で表示されるアミノ酸配列に対する候補配列のアミノ酸残基の百分率として定義される。必要な場合、最大百分率配列同質性を収得する為に、配列同質性の部分として保存的置換は考慮しない。配列番号3で表示されるアミノ酸配列のN−末端、C−末端又は内部伸長、欠損又は挿入は配列同質性又は相同性に影響を及ぼす配列として解析されない。さらに、前記配列同質性は2個のポリペプチドのアミノ酸配列の類似した部分を比較する為に使用される一般的な標準方法により決定できる。BLAST又はFASTAのようなコンピュータプログラムは、2個のポリペプチドをそれぞれのアミノ酸が最適にマッチング(matching)するように整列する(一つ又は二つの配列の全長配列に沿って又は一つ又は二つの配列の予測された部分に沿って)。前記プログラムはデフォルトオープニングペナルティー(default opening penalty)及びデフォルトギャップペナルティー(default gap penalty)を提供し、コンピュータプログラムと共に、連携されて使用され得るPAM250(標準スコアリングマトリックス;Dayhoff et al.,in Atlas of Protein Sequence and Structure,vol 5,supp.3,1978)のようなスコアリングマトリックスを提供する。例えば、百分率同質性は次のように計算できる:一致する配列(indentical matches)の総数に100を掛け、対応されるスパン(machted span)内のより長い配列の長さと、二つの配列を整列する為に、より長い配列内に導入されたギャップ(gaps)の数の和で割る。本発明の機能的同等物の範囲には、本発明に伴うポリペプチドの基本骨格及びこれの生理活性を維持しながら、ポリペプチドの一部化学構造が変形されたポリペプチド誘導体も含まれる。例えば、本発明のポリペプチドの安定性、貯蔵性、揮発性又は溶解度等を変更させる為の構造変更がこれに含まれる。
【0029】
さらに、本発明の組成物に使用されるポリヌクレオチド配列はDNA,cDNA及びRNA配列を全て含む。好ましくは、前記ポリヌクレオチドは配列番号2,配列番号4及び配列番号6からなる群より選ばれた塩基配列を有する。本発明の組成物は前記ポリヌクレオチドを含むプラスミド又はウイルスべクターのような発現べクターを有効成分とする。前記本発明に伴う発現べクターはEC−SOD蛋白質のcDNA及びこれらの発現を調節できる発現調節配列を含めている。前記ポリヌクレオチドはて天然で分離されるか、又は当業界に公知された遺伝工学的方法により製造できる。
【0030】
前記にて発現調節配列(expression control sequence)とは、特定の宿主細胞において作動可能に連結された配列の発現に必須のDNA配列を意味する。前記発現調節配列には、転写を実施する為のプロモーター、前記転写を調節する為の任意のオペレータ配列、適合したmRNAリボソーム結合部位をコーディングする配列及び転写及び解読の終結を調節する配列を含む。例えば、原核生物に適した調節配列はプロモータ、オペレータ配列及びリボソーム結合部位を含む。真核細胞は、プロモータ、ポリアデニル化シグナル及びインハンサーがこれに含まれ得る。
【0031】
前記発現べクターを挿入した後、感染(infection)、形質感染(transfection)又は形質導入(transduction)等の当業界に公知された方法により発現型で標的細胞内に導入させ得る。
【0032】
プラスミド発現べクターを利用した遺伝子伝達方法は、哺乳動物細胞に直接的にプラスミドDNAを伝達する方法として、FDAから承認を得た人間に使用し得る方法である(Nobel,E.G.,et al.,Science,249:1285−1 288,1990)。プラスミドDNAはウイルスべクターとは異なり均質に精製できる長所がある。本発明で使用し得るプラスミド発現べクターは、当業界に公知された哺乳動物発現プラスミドを使用し得る。例えば、これに限定はされないものの、pRK5(ヨーロッパ特許第307,247号)、pSV16B(国際特許公開第91/082 91号)及びpVL1392(PharMingen)等が代表的である。前記核酸を 含むプラスミド発現べクター(plasmid expression vector)は当業界に公知された方法、例えば、これに限定はされないものの、一時的形質感染(transient transfection)、微細注射、形質導入(transduction)、細胞融合、カルシウムホスフェート沈殿法、リポソーム媒介された形質感染(liposome−mediated transfection)、DEAEデキストラン媒介された形質感染(DEAE Dextran−mediated transfection)、ポリブレン媒介された形質感染(polybrene−mediated transfection)、電気穿孔法(electroporation)、遺伝子銃(gene gun)及び細胞内にDNAを流入させる為の他の公知の方法により標的細胞内に導入できる(Wu et al.,J.Bio Chem.,267:963−967,1992;Wu and Wu,J.Bio Chem.,263;14621−14624,1988)。
【0033】
さらに、前記ポリヌクレオチドを含むウイルス発現べクターでは、これに限定はされないものの、レトロウイルス(retrovirus)、アデノウイルス(adenovirus)、ヘルペスウイルス(herpes virus)、アビポックス ウイルス(avipox virus)及びレンチウイルス(lentivirus)等が含まれる。前記レトロウイルスべクターはウイルス遺伝子が全て除去されたか、若しくは変更され非ウイルス蛋白質がウイルスべクターにより、感染された細胞内で作れるように作製されたものである。遺伝子療法の為のレトロウイルスべクターの主要長所は多量の遺伝子を複製細胞内に伝達し、細胞DNAウイルスに伝達された遺伝子を正確に統合し、遺伝子形質感染後連続的な感染が誘発されないことである(Miller,A.D.,Nature,357:455−460,1992)。FDAで認証されたレトロウイルスべクターはPA317アンフォトロフイックレトロウイルスパッケージ細胞を利用して製造したものである(Miller,A.D.and Buttimore,C.,Molec.Cell Biol.,6:2895−2902,1986)。非レトロウイルスべクターには、前記にて言及した通り、アデノウイルスがある(Rosenfeld et al.,Cell,68:143−155,1992;Jaffe et al.,Nature Genetics,1:372−378,1992;Lemarchand et al.,Proc.Natl.Acad.Sci.USA,89:6482−6486,1992)。アデノウイルスの主要長所は多量のDNA断片(36kbゲノム)を運搬し、極めて高い力価で非複製細胞を感染させる能力があることである。さらに、ヘルペスウイルスも人間遺伝子療法の為有用に使用できる(Wolfe,J.H.,et al.,Nature Genetics,1:379−384,1992)。レンチウイルスはレトロウイルスの一種にして1990年代後半から開発され始めた新たなレトロウイルス輸送体としてHIV骨格(backbone)を変形したものである。既存のレトロウイルス輸送体等とは違って細胞分裂周期に影響されずに、分裂が活発な細胞ばかりでなく、分裂が活発でない細胞でも遺伝子発現効率が比較的良い。従って、造血幹細胞等のように分裂が遅い細胞でも他のウイルス性水素体より発現効率が良いことから、最近造血幹細胞角質細胞を利用した細胞治療分野で遺伝子伝達用輸送体として研究が活発に進行されている。この他にも公知された適切なウィルスベクターが本発明に使用できる。
【0034】
前記本発明の組成物には、薬学的に許容される担体を追加して含め得る。前記にて“薬学的に許容される”とは、生理学的に許容されて、人間に投与される時、通常的に胃腸障害、眩気症等のようなアレルギー反応又はこれと類似した反応を起こさない組成物を言う。
【0035】
薬学的に許容される担体には、例えば、経口投与用担体又は非経口投与用担体を追加して含め得る。経口投与用担体はラクトース、澱粉、セルロース誘導体、マグネシウムステアレート、ステアリン酸等を含め得る。さらに、非経口投与用担体は水、適切なオイル、食塩水、水性グルコース及びグリコール等を含むことができ、安定化剤及び保存剤を追加して含め得る。適切な安定化剤には亜硫酸水素ナトリウム、亜硫酸ナトリウム又はアスコロビン酸のような抗酸化剤がある。適切な保存剤にはベンズアルコニウムクロライド、メチル又はプロピールパラベン及びクロロブタノールがある。その他の薬学的に許容される担体には、次の文献に記載されていることを参考にする(Remington′s Pharmaceutical Sciences,19th ed. ,Mack Publishing Company,Easton,PA,1995)。本発明に伴う蛋白質又はこれをコーデイングするポリヌクレオチドが挿入されたベクターは、上述したような薬学的に許容される担体と混合して公知の方法により、多様な非経口又は経口投与用形態で製造され得る。非経口投与用剤形には、等張性水溶液又は懸濁液形態のような注射用剤形及び軟膏剤形態の剤形が好ましい。注射用剤形は適切な分散剤又は湿潤剤及び懸濁化剤を使用して当業界に公知された技術により製造できる。例えば、各成分を食塩水又は緩衝液に溶解させ、注射用として剤形化できる。さらに、経口投与用剤形には、これに限定はされないものの、粉末、顆粒、錠剤、丸薬及びカプセル等があり、これらの剤形は有効成分以外に希釈剤(例:ラクトース、デキストロース、スクロース、マンニトール、ソルビトール、セルロース及び/又はグリーシン)、滑沢剤(例:シリカ、タルク、ステアリン酸及びそのマグネシウム又はカルシウム塩及び/又はポリエチレングリコール)を含め得る。製剤はさらに、マグネシウムアルミニウムシリケート、澱粉ペースト、ゼラチン、トラガカント、メチルセルロース、ナトリウムカルボキシメチルセルロース及び/又はポリビニルピロリジンのような結合剤を含むことができ、場合によっては、澱粉、寒天、アルギン酸又はそのナトリウム塩のような崩解剤又は沸騰混合剤及び/又は吸収剤、着色剤、香味剤、及び甘味剤を含め得る。前記剤形は通常的な混合、顆粒化又はコーテイング方法により製造できる。
【0036】
本発明に伴う組成物の投与経路は、これらに限定されるものではなく、生命工学的技法を利用するか、又は既存の製造法を利用して口腔、静脈内、筋肉内、動脈内、骨髄内、境膜内、心臓内、経皮、皮下、腹腔内、鼻腔内、腸管、局所、舌下又は直腸が含まれる。
【0037】
好ましくは、本発明に伴う組成物は、皮下、静脈内、筋肉内、関節内、滑液嚢内、胸骨内、境膜内、病巣内及び頭蓋骨内注射又は注入のような方法で非経口的に投与できる。例えば、注射用として剤形化された本発明に伴う組成物を、4〜6mmの細い針で皮膚の下層に一定量を注入、又は30ゲージ(gage)注射用針で皮膚を軽く短刺(prick)する方法であるメッソーテラピー(Messo therapy)法により投与できる。さらに、皮膚に適用する場合、軟膏剤のような形態で剤形化して経皮投与できる。前記にて“経皮投与”とは、組成物を局所的に皮膚に投与して組成物に含有された有効な量の活性成分が皮膚内に伝達されることを意味する。特に、本発明のEC−SOD蛋白質を有効成分とする組成物の場合には、皮膚に直接塗布する経皮投与方法により、投与するのが好ましい。さらには、本発明の組成物は蛋白質伝達方法と関連した生命工学的技法を利用して投与できる。
【0038】
前記本発明に伴う組成物は、予防又は治療効果を示す量で患者に投与し得る。一般的な1日投与量としては体重1kgに対し約0.0001乃至100mgの範囲で投与できる。好ましくは、体重1kgに対し約0.01乃至1mgの範囲で投与できる。本発明の組成物は好ましい投与量範囲内で1回又は複数回に分割投与できる。しかしながら、本発明に伴う組成物の投与量は投与経路、投与対象、年令、性別、体重、個人差及び疾病状態により適切に選択できる。
【0039】
さらに、本発明は(a)EC−SOD蛋白質をコーデイングするポリヌクレオチドを発現ベクターにクローニングする段階;(b)前記発現ベクターを宿主細胞に導入して宿主細胞を形質転換する段階;(c)前記形質転換された宿主細胞を培養して、EC−SOD蛋白質を発現する段階;(d)前記発現されたEC−SOD蛋白質の内包体を収得する段階;及び(e)前記内包体の溶解及びリホールディングを誘導する段階を含むことを特徴とするEC−SOD蛋白質の製造方法を提供する。
【0040】
前記(a)段階におけるEC−SOD蛋白質をコーデイングするポリヌクレオチドを発現ベクターにクローニングすることは、当業界に公知された通常の組換えDNA技法を利用して行うことができ、前記EC−SOD蛋白質をコーデイングするポリヌクレオチドは、前記天然型EC−SOD蛋白質又は組換えEC−SOD蛋白質をコーデイングできるポリヌクレオチドを意味し、これに限定はされないものの、好ましくは、配列番号2,配列番号4及び配列番号6からなる群より選ばれた塩基配列を有することを特徴とする。前記ポリヌクレオチドは適切なプライマーを使用してPCR増幅することにより作製できる。他の方法として当業界に公知された標準方法により、例えば、自動DNA合成器(Biosearch又はApplied Biosystems社で販売するもの)を使用してDNA配列を合成することもできる。発現ベクターは当業界で使用する通常の発現ベクターを使用することができ、その宿主細胞によって適切なものを選択して使用することができ、例えば、宿主細胞が大腸菌の場合、pET28aベクター(Novagene,米国)を使用することができる。本発明の製造方法はEC−SODを大量発現して生産しようとすることから、この目的を達する限りにおいて任意の発現ベクターを適切に選択して使用できる。
【0041】
本発明のベクターはプラスミドベクター、コスミドベクター、バクテリオファージベクター及びウイルスベクター等を含むもののこれに限定はされない。適切な発現ベクターはプロモータ、オペレータ、開始コドン、終結コドン、ポリアデニル化シグナル及びインハンサ(促進遺伝子)のような発現調節配列の他にも、膜標的化又は分泌の為のシグナル配列又はリーダ配列を含み、目的により多様に製造できる。ベクターのプロモータは構成的(constitutive)又は誘導性(inducible)でもあり得る。さらに、発現ベクターはベクターを含有する宿主細胞を選択する為の選択マーカーを含み、複製可能な発現ベクターの場合複製起源を含む。
【0042】
前記(b)段階の発現ベクターを宿主細胞に導入して形質転換することは、核酸を宿主細胞に導入する如何なる方法も含まれ、当業者に公知された形質転換技術により行われ得る。微細射出法(microprojectile bombardment)、電気衝撃遺伝子伝達法(electroporation)、リン酸カルシウム(CaP04)沈澱、塩化カルシウム(CaCl2)沈澱、PEG−媒介融合法(PEG−mediated fusion)、微細注入法(microinjection)及びリポソム媒介法(liposome−mediated method)等が含まれるもののこれに限定はされない。
【0043】
上記場合において、宿主細胞は原核細胞又は眞核細胞を使用できるものの、好ましくは、宿主細胞としては大腸菌(Escherichia coli)、バシルスサブチリス(Bacillus subtilis)、ストレプトマイセス(Streptomyces)、シュードモナス(Pseudomonas)、プロテウスミラビリス(Proteus mirabilis)又はスターフィロコキュス(Staphylococcus)のような原核宿主細胞、眞菌(例えば、アスペルギルス(Aspergillus)、酵母(例えば、ピキアパストリス(Pichia pastoris))、サカロマイセスセルビジエ(Saccharomyces cerevisiae)、シゾサカロマイセス(Schizosaccharomyces)、ニュロスポラクラサ(Neurospora crassa)等のような下等眞核細胞、昆虫細胞、植物細胞、哺乳動物等を含む高等眞核生物由来の細胞を宿主細胞として使用できるものの、これに限定はされない。さらに、好ましくは、本発明の宿主細胞は大腸菌を使用できる。前記(c)段階の宿主細胞の培養及び発現は、形質転換された宿主細胞内でEC−SOD蛋白質が発現されるように、適切な培地及び条件下で培養することを含む。前記形質転換された細胞を培養して蛋白質を発現させる方法は、当業界に公知されており、例えば、形質転換された細胞が成長できる適切な培地に接種して種培養した後、これを本培養用培地に接種して適切な条件で培養することにより、蛋白質の発現を誘導することができる。
【0044】
前記(d)段階の内包体の収得は不溶性の内包体を分離して収得する為の、公知の方法を使用することができ、例えば、遠心分離により細胞沈澱物内で内包体を収得することができる。
【0045】
前記(e)段階の内包体の溶解及びリホールディングの誘導は、当業界に公知された通常の方法、例えば、蛋白質変成剤を含む緩衝溶液で内包体を溶解させ、金属親和性樹脂コラムに吸着させ、変成剤の濃度を下げながらリホールディングを誘導する方法により行われる。
【0046】
例えば、前記内包体の溶解及びリホールディングの誘導は、変成剤である8Mウレア(urea)を添加したTris緩衝溶液(8M urea,50mM Tris−C1,100mM NaCl)に内包体を溶解し、金属親和性樹脂が充填されたコラムに吸着させ、1Mウレアを添加したTris緩衝溶液でコラムに濃度勾配を与えながら、ウレアを除々に除去してリホールディングを誘導する方法により行える。引き続き、前記コラムとの吸着性が強い溶出緩衝溶液や、pHが低い(一般的に4以下)溶出緩衝溶液を前記コラムの上部から流入させることにより、これをコラム下部から収得してリホールディングされた純粋な蛋白質を得ることができる。例えば、これは金属親和性クロマトグラフィーコラムとの吸着性が強い、イミダゾル(一般的に1M)が含有された溶出緩衝溶液を前記コラムの上部から流入させることにより、これをコラム下部から収得してリホールディングされた純粋な蛋白質を得ることができる。さらに、前記溶出緩衝溶液は時間により漸次的に濃い濃度の溶液が投入されるように、つまり、濃度勾配を有するようにコラムに投入することが、リホールディングされた蛋白質の収得率を高めることができて好ましい。
【0047】
本発明のEC−SODの製造方法は(f)ゲル濾過コラム(gel−filtration column)により、分離、精製する段階を追加して含めることができ、以降追加精製、濃縮、溶媒交換等の目的により、当業界に公知された多様な分離及び精 製方法を介して行うことができ、例えば、塩析(硫酸アンモニウム沈澱及びリン酸ナトリウム沈澱)、溶媒沈澱(アセトン、エタノール等を利用した蛋白質分画沈澱)、透析、ゲル濾過、イオン交換クロマトグラフィー、逆相コラムクロマトグラフィー及び親和性クロマトグラフィー等の技法を、単独又は組合わせで適用させEC−SOD蛋白質を製造できる。
【0048】
本発明で使用される標準組換えDNA及び分子クローニング技術は、当該分野に広く公知されており、下記の文献に記載されている(Sambrook,J.,Fritsch,E.F.and Maniatis,T.,Molecular Cloning:A Laboratory Manual, 2nd ed.,Cold Spring Harbor Laboratory:Cold Spring Harbor,NY(1989);by Silhavy,T.J.,Bennan,M.L.and Enquist,L.W.,Experiments with Gene Fusions,Cold Spring Harbor Laboratory,NY(1984);and by Ausubel,F.M.et al.,Current Protocols in Molecular Biology,published by Greene publishing Assoc.and Wiley−Interscience(1987))。
【0049】
上述した通り、EC−SOD蛋白質又はこれらをコーデイングするポリヌクレオチドが挿入されたベクターは、必要とする個体に有効な量で投与して血管新生による疾患又はアレルギー疾患の予防又は治療方法に有用に使用することができ、従って、血管新 生による疾患又はアレルギー疾患の治療剤製造の為にも有用に使用できる。
【発明の効果】
【0050】
前記の通り、EC−SOD蛋白質又はこれらをコーデイングするポリヌクレオチドが挿入されたベクターは、血管新生を誘導するVEGF及びMMP−9の発現を抑制して、血管新生を抑制する効果が優れているので、血管新生による疾患の予防及び治療に有用に使用することができ、アレルギー疾患を誘発するTh2細胞の過分化を遮断して、転写因子(NF−κ8)活性を阻害し、人間肥満細胞の脱顆粒(degranulation)を減少させることにより、アレルギー疾患の予防及び治療に有用に使用することができる。さらに、本発明のEC−SOD蛋白質の製造方法は、前記のような活性を有するEC−SODを大量に生産することができて、産業的に有用に使用することができる。
【図面の簡単な説明】
【0051】
【図1】図1は本発明の組換えEC−SOD蛋白質の高速蛋白質精製用液状クロマトグラフィーの結果を示したグラフである(A:線平衡区間、B:試料投入区間、C:コラム洗滌区間、D:リホールディング区間、E:リホールディング平衡区間、F:溶出区間、G:コラム洗浄区間、X軸:時間及び体積(時:分:秒、mL),Y軸:UV吸光度(Unit))。
【図2】図2は本発明に伴うリホールディング及び精製された組換えEC−SOD蛋白質をSDS−PAGEで分析した結果を示したクマシーブルー蛋白質染色写真である(M:分子量サイズマーカー、A:8Mウレア緩衝溶液で溶解された内包体(リホールディング精製前の試料)、B:コラムに吸着されずに溶出された内包体不純物、C:リホールディング精製後溶出されたEC−SOD、D:脱塩精製後限外濾過法により濃縮されたEC−SOD)。
【図3】図3は抗EC−SOD蛋白質抗体を利用して、組換えEC−SOD蛋白質をウェスタンブロットで確認した結果である(SM:size marker,1:対照群(HaCaT人間EC−SOD)、2:本発明の組換えEC−SOD蛋白質)。
【図4】図4は精製過程中EC−SOD活性を確認した結果である(209 FT:精製工程中吸着されずに溶出された試料、209E1:金属親和性クロマトグラフィーコラムでリホールディングされた1次精製された組換えEC−SOD蛋白質、209 E2:ゲル濾過コラムで分離、精製された組換えEC−SOD蛋白質)。
【図5】図5は組換えEC−SOD蛋白質によるHaCaT細胞において、UVBの誘発されたROSの阻害効果を確認した結果である(UVB:UVBのみ照射した場合、EC−SOD+UVB:UVBを照射してEC−SODを処理した場合)。
【図6】図6は紫外線照射によるマウスの背皮膚組織の形態相変化を示した写真である(A:野生型マウス、B:EC−SOD過発現マウス、C:野生型マウスにUVBを照射、D:EC−SOD過発現マウスにUVBを照射)。
【図7】図7は紫外線照射によるマウス濃度組織において、VEGFの発現様相をウェスタンブロットで分析した結果を示したものである。Actinはローディング対照群として使用した(WT:野生型マウス、TG:EC−SOD過発現マウス)。
【図8】図8はマウスにUVBを照射した後、VEGFの発現様相を免疫組織化学的方法で分析した結果を示したものである(A:野生型マウス、B:EC−SOD過発現マウス、C:野生型マウスにUVBを照射、D:EC−SOD過発現マウスにUVBを照射)。
【図9】図9はマウスにUVBを照射し、MMP−9の発現様相をザイモグラフィーで分析した結果である(レーン1:野生型マウス、レーン2:EC−SOD過発現マウス、レーン3:野生型マウスにUVB照射、レーン4:EC−SOD過発現マウスにUVB照射)
【図10】図10は皮膚角質形成細胞株に紫外線を照射して、本発明の組換えEC−SOD処理に伴うVEGFの発現様相を免疫組織化学的方法で照射した結果である(A:野生型マウス、B:UVB照射、C:組換えEC−SOD処理+UVB照射、D:組換えEC−SOD処理)。
【図11】図11は組換えEC−SOD蛋白質を処理した場合、T−細胞増殖に及ぼす影響を確認した結果である(Neg:何等の処理も施さない試験群)。
【図12】図12は組換えEC−SOD蛋白質処理時、T−細胞の分化に及ぼす影響をIL−4分泌量で確認した結果である(neg:抗原が処理されていない試験群、−:抗原(Ova peptide)のみ処理された試験群、p:抗原(Ova peptide)とPBSに含まれているEC−SODを共に処理した試験群、NB:抗原(Ova peptide)とSodium borateに含まれているEC−SODを共に処理した試験群)。
【図13】図13は組換えEC−SOD蛋白質処理時、T−細胞の分化に及ぼす影響をサイトカインIL−4とINF−gの分泌量で確認した結果である(neg:抗原が処理されていない試験群。−:抗原(Ova peptide)のみ処理した試験群)。
【図14】図14は人間のEC−SOD遺伝子を過発現させたマウスにOva蛋白質と免疫補助剤CFA(Compleat Freund′s Adjuvant)を投与した場合、EC−SODが細胞増殖とサイトカイン生成にどんな影響を与えるかを観察した結果である。
【図15】図15は人間のEC−SOD遺伝子を過発現させたマウスにOva蛋白質と免疫補助剤Alum(Aluminum Hydroxide)を投与した場合、EC−SODが細胞増殖と、サイトカイン生成にどんな影響を与えるかを観察した結果である。
【図16】図16は組換えEC−SOD蛋白質のNF−κBの活性化抑制を確認した結果である(Control:EC−SODが形質感染されたHaCaT細胞にUV処理をしない群、UVB:HaCaT細胞にUVBを100J/m2で照射した群、EC−SOD/UVB:HaCaT細胞に組換えEC−SOD蛋白質を処理してUVBを100J/m2で照射した群)。
【図17】図17は組換えEC−SOD蛋白質の肥満細胞脱顆粒抑制効果を確認した結果、(A)及びこれの顕微鏡写真(B)である(C0n:何等の処理も施さない人間肥満細胞群、EC−SOD:EC−SODを処理した群、A+P:細胞内のカルシウム濃度が高い群、A+P+EC−SOD:EC−SODを前処理して細胞内のカルシウム濃度が高い群)。
【発明を実施するための形態】
【0052】
以下、本発明を実施例により詳細に説明する。
ただし、実施例には本発明を単に例示するものであり、本発明の内容が下記実施例に限定されるものではない。
【0053】
<実験例1>
EC−SODを過発現するマウスの製造
先ず、マウスより由来したEC−SODを過発現するマウスを下記のような方法で製造した。一方、前記マウスより由来したEC−SOD塩基配列とアミノ酸配列をそれぞれ配列番号6及び配列番号5に記載した。
野生型BDF1マウスは8乃至10週齢BDF1マウス(中央実験動物)を使用した。EC−SOD過発現マウスは8乃至10週齢BDF1マウスを使用し、公知された方法により製造した(H.Y.Ha.et.al.,Biochem Biophys Res Commun,348:450−458,2006)。動物使用の為の実験方法はカトリック医科学研究所生命倫理委員会により承認を受けて使用した。
【0054】
具体的には、韓国生命工学研究所で交雑種マウス(C57BL/6Χ CBAのF1)を購入し、過剰排卵を誘発するためにPMSG(pregnant mare′s serum gonadotropin)と、hCG(human chrionic gonadotropin)を48時間間隔で、それぞれ5IUずつ雌の二十日鼠の腹腔内に注射し、同一系統の雄の二十日鼠と1:1で交尾させた。翌日の朝腟栓を確認し、腟栓がある個体のみ屠殺して卵管を切取した後、卵管膨大部から受精卵を回収した。培養液は0.4%BSAが添加されたM16培養液を使用した。
【0055】
皮膚組織に選別的なEC−SOD過発現が誘導されたマウスを作る為に、マウスEC−SODのcDNA(配列番号6)を含むpCRII TOPOベクター(翰林大学校医科大学、徐俊教教授より提供)において制限酵素でマウスEC−SODのcDNA部分を切断して、人間ゼラチンK14プロモータを含んでいるpBS KSベクターに挿入した。さらに、このベクターに鶏のオブアルブミンポリ(A)(ovalbumin poly(A))を挿入して試験管内(in vitro)での発現を容易にした。受精卵にDNAを注入する為に、発現ベクターを制限酵素HindとXholで切断して使用した。制限酵素で切断したDNAは1%アガロスゲルに電気泳動した後、透析(dialysis)して回収した後、フェノールクロロホルムで分離して生成した。これを10mM Tris(pH7.4/0.2mM EDTA)濃度で透析して最終濃度が4ng/lになるようにした。外来遺伝子を含むDNA溶液を1細胞期受精卵の全核に注入した。外来遺伝子が注入された受精卵等を2細胞期まで培養した後、健康な状態の受精卵のみを選別した。発情した雌ICRを雄と交尾させた後、翌日腟栓を確認して確認されたものを代理母として使用した。2細胞期までよく育った受精卵を15−20個程を採り代理母の卵管膨大部に微細管を利用して移植した後、筋肉層と表皮を縫合した。移植後生まれた産子を3週程度育て、これらの尻尾を1cm程切断した後、溶解緩衝液(lysis buffer)に入れ、55℃で処理した後、フェノール(phenol)添加してゲノムDNA(genomic DNA)を抽出した。前記ゲノムDNAを下記のPCRプライマーセットを利用してPCR増幅することにより、形質転換可否を確認した。PCR条件は94℃で1回、94℃で30秒間、51℃で30秒間、72.5℃で45秒間30回繰返した後、72.5℃で5分間1回実施した。
センスプライマー(配列番号7)
5′−TTG TCT CTA ATA GAG GGT C−3′
アンチセンスプライマー(配列番号8)
5′−TCA AGC CTG TCT ATC TTC T−3′
【0056】
一方、人間より由来したEC−SODを過発現するマウスは、米国コロラドNational Jewish Medical&Research Centerから寄贈を受けた(Oury et al.,JBC 268(21):15394,1993)。
【0057】
<実施例1>
生物学的活性を有する組換えEC−SOD蛋白質の製造
<1−1>組換えEC−SOD蛋白質発現の為の融合EC−SOD遺伝子のクローニング
生物学的活性を有する組換えEC−SOD蛋白質を製造する為に、人間由来のEC−SODのN−末端部位にある信号ペプチド(signal peptide)を除去して、C−末端部位の13個アミノ酸が除去された209個のアミノ酸からなる、組換えEC−SODを次のような方法でクローニングした(前記組換えEC−SOD塩基配 列と、アミノ酸配列は、それぞれ配列番号2及び配列番号1に記載し、前記人間由来のEC−SOD塩基配列と、アミノ酸配列はそれぞれ配列番号4及び配列番号3に記載した)。
【0058】
人間由来のEC−SOD cDNA(配列番号4)を含むpUC 18−hEC−SOD(スウエーデン、Clinical chemistry,Marklund professorより提供)べクターを鋳型として下記プライマーを利用してPCR増幅することにより、人間EC−SODのcDNAを製造した。
センスプライマー(配列番号9)
5′−tagattctggacgggcgagga−3′
アンチセンスプライマー(配列番号10)
5′−tactcgagtcactctgagtgct−3′
【0059】
PCR増幅条件は、95℃で5分、95℃で30秒、55℃で30秒、72℃で1分(30回)、72℃で5分の条件でPful重合酵素を利用して行った。増幅された遺伝子産物を制限酵素EcoRIとXhoIで切断した後、同一な制限酵素で切断されたpET28aべクター(NovaGene,米国)に4℃で12時間T4 ligaseを利用して接合した。前記べクターを大腸菌DH5aに形質感染させ、前記形質転換体をカナマイシン25mg/mLを含有するLB固体培地で培養して選別した。選別された形質転換体に組換えEC−SOD遺伝子が正しく挿入されたか、否かを遺伝子配列分析を実施して確認した。組換えEC−SOD遺伝子が挿入されたことが確認された形質転換体でべクターを分離して、過発現用大腸菌宿主細胞である大腸菌BL21(NovaGene,米国)に挿入してカナマイシン25mg/mLを含有するLB固体培地で培養しながら過発現菌株を選別した。
【0060】
<1−2>組換えEC−SOD蛋白質の発現
前記<実施例1−1>で選別された菌株を37℃,カナマイシン25mg/mLを含有するLB液体培地で培養した。これをOD(Optical Density)600nmで0.6に達した時、IPTG(1mM)を添加して蛋白質発現を誘導し、37℃で6時間本培養をして組換えEC−SOD蛋白質を発現させた。
【0061】
<1−3>組換えEC−SOD蛋白質のリホールディング誘導及び精製
発現が終了された培養液で遠心分離により、細胞を収得した後、100mM塩化カルシウムが含有された50mM Tris緩衝溶液(pH7.5)で懸濁し、超音波粉砕機で細胞を破壊した。これを遠心分離して沈殿層のみを分離し、前記100mM塩化カルシウムが含有された50mM Tris緩衝溶液で3回繰返して洗浄した。洗浄された細胞沈殿物には、不溶性蛋白質内包体(inclusion body)を含有している。洗浄された内包体(融合蛋白質含量50%)10mgをTris緩衝溶液(50mM Tris−C1,100mM NaCl,pH7.5)に入れ、8Mウレアを添加して溶解した。室温で2時間完全に懸濁して、遠心分離により相分離し、上層の水溶液層は溶解された不溶性組換えEC−SOD蛋白質内包体を含有していることからこれを収得した(内包体溶液)。
【0062】
組換えEC−SODリホールディングと精製の為に、高速蛋白質精製用液状クロマトグラフィー機器(FPLC,Fast Protein Purification Liquid Chromatography)を利用して下記の通り行った:前記緩衝溶液(8M urea,50mM Tris−C1,100mM NaCl,pH7.5)を流速1ml/minで金属親和性樹脂が満たされた平衡状態のクロマトグラフィーコラム(HisTrap FF crude 5ml,GE Healthcare,米国)に流入させて平衡させ、前記にて収得した内包体溶液5mlを金属親和性樹脂が満たされた平衡状態のクロマトグラフィーコラム(3ml)の上部方向に1mL/minで注入して、前記コラム内の固体支持体に前記折り畳み不全(unfolded)蛋白質を吸着させた。
【0063】
注入終了後、吸着されない固形物質等を除去する為に、前記緩衝溶液50mlをコラム上部方向に1mL/minで注入した。このようにコラム内で細胞の滓を完全に除去した後、EC−SOD活性に影響及ぼすZnとCuを含み、1Mウレアが含有されたトリス緩衝溶液(8M Tris緩衝溶液、1M urea,100mM NaCl,100mM ZnCl2 ,50mM CuSO4 、pH7.5)をコラム上部方向に0.5mL/minで線形的濃度勾配を与えながら注入し、コラム内の変性剤濃度を漸次減らすことにより、固体マトリックスに吸着された折り畳み不全(unfolded)蛋白質を天然状態の3次元的構造を有して金属イオン(ZnとCu)が完全に目的蛋白質に置換させて活性を有するようにリホールディングさせた。
その後、2Mイミダゾールと1Mウレアが含有されたトリス緩衝溶液を濃度勾配を与えてコラムの上部から下部方向に供給した。リホールディング融合蛋白質は0.5Mイミダゾール濃度の溶出緩衝液が供給された時、溶出された(図1参照)。
【0064】
<1−4>組換えEC−SOD蛋白質分離精製
前記<実施例1−3>から溶出された蛋白質より多量のイミダゾールを除去して、完全にリホールディングさせ、複合体を大きさ別に分離する為に、高速蛋白質精製用液状クロマトグラフィー機器と、ゲル濾過クロマトグラフィー(gel filtration chromatography)コラム(Sepharose 12 column)を利用した。この工程ではトリス緩衝溶液(50mM Tris Cl 100mM NaCl,pH7.5)又はリン酸緩衝溶液(Phosphate Buffered Saline pH7.5)をコラム上部方向に0.5mL/minで流入させ、分離及び精製した。分離された目的蛋白質は限外濾過法で濃縮した。
その結果、本発明の組換えEC−SOD蛋白質を得ることができ、それぞれの精製段階における試料をSDS−PAGEで分析した結果、図2に示した通り、組換えEC−SODが良く分離されたことが分かった。
【0065】
<1−5>ウェスタンブロットを介した組換えEC−SOD蛋白質の確認
前記<実施例1−4>で分離、精製された組換えEC−SODが確かであるか、否かを確認する為に、ウェスタンブロット(western blot)を実施した。EC−SOD標準蛋白質には、人間の皮膚角質形成細胞(keratinocyte)細胞株であるHaCaT(ドイツCancer Research N.Fusenig教授より提供)から発現された人間EC−SODを使用した。HaCaTから発現された人間EC−SODと、前記<実施例1−4>で分離、精製された組換えEC−SOD蛋白質等を10%のポリアクリルアミドゲルで電気泳動で分離し、ポリビニリデンフルオライトメンブレーン(Gelman Laboratory,MI,米国)に移した。その後、ポリビニリデンフルオリドメンブレンを5%の脱脂粉乳でブロッキング(blocking)した後、抗EC−SODポリクローナル抗体(1:500,サンタクルズ、USA)と共に培養した。前記膜を水洗した後、パーオキシダーゼが結合されている2次抗体IgG(サンタクルズ、米国)を使って培養し、再度水洗した後、ECL検出キット(GE Healthcare,米国)を利用して製造社の指針に従い発色した。
その結果、図3に示した通り、HaCaTから発現された人間EC−SOD(レーン1)で陽性を示し、分離精製された組換えEC−SOD蛋白質(レーン2)でも検出され、精製された蛋白質が人間EC−SODであることが分かった。
【0066】
<1−6>組換えEC−SOD蛋白質の活性検査
前記分離精製された組換えEC−SOD蛋白質がSODの生物学的活性を有するか否かを確認する為に、SOD Assay Kit−WST(Dojindo Molecular Technology,米国)を利用して製造社の指針に従い活性テストをした。
その結果、図4に示した通り、精製工程中に吸着されずに溶出された試料(209FT)は、活性を示さず金属親和性クロマトグラフィーコラムでリホールディングされた、1次精製された組換えEC−SOD蛋白質(209E1)の活性は、250unit/mg proteinであり、ゲル濾過コラムを利用して分離、精製された組換えEC−SOD蛋白質(209E2)の活性は360unit/mg proteinを呈した。
【0067】
<1−7>分離、精製された組換えEC−SOD蛋白質のROS除去効果確認
組換えEC−SOD蛋白質のHaCaT cellにおけるROS(reactive oxygen species)除去効果を見る為に、前記<実施例1−4>にて分離、精製された組換えEC−SOD蛋白質を以下の通り処理した。
皮膚角質形成細胞(HaCaT)を18mmカバースリップに1×104cells/wellに分株した後、10%牛胎児血清(FBS,GIBCO)及び100units/mlペニシリンと、100g/mlストレプトマイシンを1%添加したIMDM(Isocove′s modified Dulbecco′s medium,GIBCO)培地を使用して、5%CO2、37℃の条件で培養した。付着された細胞が約30〜40%コンフルエント(confluent)になったら、牛胎児血清を取除いて24時間培養した。細胞が50〜60%コンフルエント(confluent)になったら、前記EC−SOD10μgで細胞を30分間前処理した。UVB(100J/m2)で3時間照射した後、10MmDCFH−DAと37℃で30分間反応させ、蛍光顕微鏡で観察した。写真はZeissデジタルカメラを利用して撮影した。
その結果、図5に示した通り、UVBのみ照射した場合(UVB)ROSが除去されなかったものの、UVBを照射して本発明の組換えEC−SODを処理した場合(ECSOD+UVB)、ROSが効果的に除去されたことが分った。
【0068】
<実施例2>
天然型EC−SOD蛋白質の血管新生抑制効果
<2−1>EC−SOD過発現マウスと野生型マウスの形態学的比較
前記<実験例1>にて製造されたマウスより由来したEC−SODを過発現するマウスと、野生型BDF1マウスの背側皮膚に2kJ/m2で24時間間隔でUVBを4回照射した。つまり、前記マウス等の背側皮膚をUVB照射2日前に除毛し、280nm〜340nm波長範囲で305nmの最大エネルギーを有する6個のUVBランプ(FS24T12/UVB/HO,290−320nm,Voltare社、Fairfeild,CT,米国)を使用して、8週齢のマウス24匹に200mJ/cm2で一定に照射した。UVB照射する間ランプの高さは、麻酔されたマウスの背側皮膚表面に0.3mW/cm2で照射されるように調節した。各群のマウス(各群(n−6))等に24時間間隔で4回UVBを照射し、実験の為、4回目照射1時間後にマウスを犠牲にした。犠牲にしたマウスの背側皮膚患部を切開して肉眼で観察した結果を図6に示した。
前記図6に示した通り、野生型マウスに紫外線UVBを照射DQ場合(図6C)には、紫外線を照射しなかった場合(図6A)と比較して新生血管形成、皮膚炎症反応と紅斑が著しく誘導された。しかしながら、EC−SOD過発現マウスでは、紫外線照射前(図6B)と、照射後(図6D)に統計学的に意味のある差が無かった。つまり、紫外線UVB照射により、誘導された野生型マウスにおいて(図6B)の新生血管形成がEC−SOD過発現マウス(図6D)において著しく抑制されることが分った。前記結果からEC−SODは新生血管形成を抑制する機能があることを推定することができた。
【0069】
<2−2>ウェスタンブロット
前記<実験例1>で製造されたマウスより由来したEC−SODを過発現するマウスにおいて、血管新生過程を誘導する血管内皮細胞成長因子(VEGF)の発現程度をウェスタンブロットを利用して調査した。
前記実施例<2−1>で犠牲にしたEC−SOD過発現マウスと、野生型マウスそれぞれの背皮膚組織又は細胞を抽出溶液(50mMのTris HC1 pH8.0,5mMのEDTA,150mMのNaCl,0.5%のdeoxycholateナトリウム、1%のNonidet P−40,0.1%のSDS,1mMのPMSF,1mMのNaF,1mMのNaVO4さらに、プロテアーゼ抑制剤カクテル(Roche,ドイツ)で均質に抽出した。蛋白質濃度を決定する為に、バイオラド蛋白質キット(Bio−Rad,CA,USA)を使用し、牛胎児血清アルブミン(BSA)を標準物質として使用した。前記蛋白質抽出物等を10%のポリアクリルアミドゲルの上で分離し、ポリビニリデンフルオリドメンブレン(Gelman Laboratory,MI,米国)に移し、ポリビニリデンフルオリドメンブレンを5%の脱脂粉乳でブロッキング(blocking)した後、抗VEGFポリクローナル抗体(1:500,サンタクルズ、米国)と、抗ベータアクチン抗体それぞれと共に培養した。前記膜を水洗した後、パーオキシダーゼが結合されている2次抗体IgG(サンタクルズ、米国)と培養し再び水洗した後、ECL検出キットを利用して発色した。
実験の結果、UVB照射により野生型マウスにおいてVEGFの発現量が増加したものの、UVB照射されたEC−SOD過発現されたマウスでは、VEGFの発現が著しく減少された(図7)。前記の結果からEC−SODが血管新生抑制効果があることが再び確認できた。
【0070】
<2−3>免疫組織化学的調査(Immunohistochmical examination)
EC−SODがVEGFの発現を抑制するか、否かを免疫組織化学的方法により再び確認した。
前記実施例<2−1>において、犠牲にしたEC−SOD過発現マウスと、野生型マウスそれぞれの背皮膚組織を0.5Mのリン酸塩緩衝液(pH7.4)で作った4%のパラホルムアルデヒドで固定させた。流水で水洗後、エタノールで脱水し、パラフィンに包埋させ、5mmの厚さで切片してガラススライドに付着した。前記切片をキシレン溶液を使用して脱パラフィンし、エタノールで含水した後、ヘマトキシリンとエオシンで染色した。脱パラフィンされた組織切片に3%の過酸化水素を処理してブロッキングした。非特異的結合と背景染色を減らす為に、前記切片を10%羊の血清で処理した。各組織スライドを抗VEGFポリクローナル抗体(1:500,サンタクルズ、米国)で処理し、ストレプタビジン−バイオチンキット(LSAB,Dako,CA,米国)を利用してアビジンーバイオチンーイムノパーオキシダーゼコンプレックス法で視覚化した。染色された組織を水洗した後、ジアミノベンチジン(DAB)で発色し、0.2%のメイアーヘマトキシリン(シグマ、MO,米国)で対照染色を行いその結果を図8に示した。
前記図8に示した通り、野生型マウスにおいて、UVB照射によりVEGFが多く発現されたものの、EC−SODが過発現されたマウスでは野生型マウスに比べてVEGFの発現が著しく抑制され、前記実施例<1−2>の結果と一致する結果を得た。前記結果等から、生体内(in−vivo)で天然型EC−SODが血管新生を誘導するVEGF発現を抑制して血管新生を抑制する効果があることが分った。
【0071】
<2−4>EC−SOD過発現マウスにおけるMMP−9の発現水準調査
細胞外の基質蛋白質を分解するMMP蛋白質は、VEGFと共に、血管新生の重要調節因子である。特に、MMP9はVEGFーVEGFRシステムを介して腫瘍の血管新生過程を調節する因子として知られている(Bergers et al.,Nat. Cell Biol.,2:737−744,2000)。従って、本発明者等はEC−SOD過発現マウスにおいて、UVB照射によるMMP−9発現水準を調査した。
前記実施例<2−1>で犠牲にしたEC−SOD過発現マウスと、野生型マウスそれぞれの背皮膚組織に1mg/ml gelatin(100mg/ml)を混合してSODーPAGEを行った後、ゲルを2.5%トリトンX−100で20分間処理して水洗する。Zymography反応溶液(1M Tris(pH7.5),1M CaCl2,5M NaCl,0.2mM ZnCl2,25%TX−100,0.2% NaN3)で37℃にて16時間反応させ、1時間染色した後、1時間脱色する。オーブンで1時間乾燥させ分析した結果を図9に示した。
前記図9に示した通り、紫外線照射する前の野生型マウスとEC−SOD過発現マウスのMMP−9の発現水準は別段の差がなかった。しかしながら、UVB照射により、野生型マウスはMMP−9の発現が増加するものの、EC−SODマウスの場合には、MMP−9の発現が野生型マウスに比べて著しく抑制される。
前記結果から、生体内で天然型EC−SODがVEGFの発現を抑制するばかりでなく、VEGFーVEGFRシステムを介した血管新生関連信号伝達に関与するMMP−9の発現を抑制して血管新生を効果的に抑制することが分った。
【0072】
<実施例3>
組換えEC−SOD蛋白質の血管新生抑制効果
前記<実施例1>で分離、精製された組換えEC−SOD蛋白質を利用して、血管新生を抑制する効果があるか、否かを調査した。皮膚角質形成細胞(HaCaT)を18mmカバースリップに1×104 cells/wellで分株する。10%牛胎児血清(FBS,GIBCO)及び100units/mlペニシリン(penicillin)と、100g/mlストレプトマイシン(streptomycin)を1%添加したIMDM(Isocove′s modified Dulbecco′s medium,GIBCO)培地を使用して5%CO2、37℃の条件で培養した。付着された細胞が30〜40%コンフルエント(confluent)になったら、牛胎児血清を取除いた後、24時間培養した。細胞が50〜60%コンフルエント(confluent)になったら、EC−SOD10μgで前処理する。30分間、精製された組換えEC−SOD蛋白質で処理した後、紫外線100Jで処理し、24時間後皮膚角質形成細胞株をパラホルムアルデヒドで固定して、免疫染色を実施した。固定された細胞を10%正常羊血清(normal goat serum)を利用してブロッキング(blocking)した後、リン酸緩衝液(PBS)で3回水洗した。ここにVEGF(Vascular endothelial growth factor)に対する免疫染色の為、兎抗VEGF抗体(rabbit anti VEGF antibody,santacuz,米国)でそれぞれ処理した後、4℃で16時間以上反応させた。FITCが融合された抗二十日鼠IgG2次抗体(anti−mouse IgG secondary antibody,zymed,米国)を利用して蛍光染色した後、蛍光顕微鏡(Carl Zeiss,ドイツ)で観察した。
その結果、図10に示した通り、UVBを照射しない対照群(control)に比べてUVBを照射した場合(UVB)VEGFの発現が著しく増加された。さらに、UVB照射した群に前記組換え蛋白質を処理した場合(EC−SOD/UVB)には、VEGFの発現が著しく抑制されることを確認し、組換えEC−SOD蛋白質により、血管新生が抑制されることが分った。
【0073】
<実施例4>
組換えEC−SOD蛋白質によるT細胞増殖及び分化に及ぼす影響
<4−1>組換えEC−SODのT細胞増殖及び分化に及ぼす影響の確認
EC−SODが免疫細胞であるT細胞に影響を及ぼすか、否かを調べるために、特異抗原(Ovalbumin)に反応するTCR(T cell receptor)形質転換マウス(DO.11.10.浦項工大成永哲教授より提供)を使用して下記の通り調査した。
EC−SODがT細胞の増殖に影響を与えるか否かを確認する為、前記形質転換したマウス脾臓より分離した細胞を、抗原であるオブアルブミンペプチド(Ova peptide)と共に、72時間培養し、最後の16時間3Hと培養した後、放射線量を測定してT細胞の増殖を確認した。
その結果、図11に示した通り、EC−SODを添加しない群と、EC−SODをそれぞれ1μg/ml又は10μg/ml添加した群で放射線量の差が殆どなく、EC−SODが殆どT細胞増殖に影響を与えないことが分った。
【0074】
<4−2>組換えEC−SODのT細胞分化に及ぼす影響確認
T細胞の増殖に影響を及ぼさなくてもT細胞の分化に影響を及ぼし得る為、分化を知り得るT細胞のサイトカインを測定した。
脾臓細胞を抗原であるオブアルブミンペプチドと共に、48時間培養後培養培地に生成されたIL−4(interleukin−4)サイトカインを測定した。測定方法は、BD(Becton Dickinson and Company,米国)会社のELISA−kitを利用して、製造社の指針に従い測定した。
その結果、図12に示した通り、EC−SODがIL−4の形成を減少させることが分った。この結果により、EC−SODがT細胞の分化に影響を及ぼし得る(neg.:抗原が処理されない試験群、−:抗原(Ova peptide)のみ処理された試験群、p:抗原(Ova peptide)とPBSに入っているEC−SODを一緒に処理した試験群、NB:抗原(Ova peptide)とSodium borateに含まれているEC−SODを一緒に処理した試験群、全ての試験群は一緒に48時間培養培地に入れて処理された)。
一方、本発明の組換えEC−SODT細胞分化に及ぼす影響を具体的に調べる為に、前記組換えEC−SODをマウスのT細胞に投与してIL−4及びINF−γ等のサイトカインの生成量を比較した。
具体的に特定抗原であるOvaペプチドのみを認知するTCR(T cell receptor)遺伝子過発現マウスであるDO 11.10(浦項工大成永哲教授より提供)脾臓においてCD4細胞をMACS(Miltenyi Biotech)を利用して分離した。抗原提示細胞で正常マウスであるBalb/cマウス脾臓細胞全体をγーirradiationし、Ovaペプチド(1μg/ml,Ova323−339,ペプトロン社)及びMACSで分離したCD4 T細胞と共にRPMI1640培地で10%FBSを入れて培養した。培養過程で、前記<実施例1>で分離精製された組換えEC−SODを前記培養に与えた。72時間後に培養液を採集してELISA(抗体:Becton Dickinson)で培養液内のIL−4とIFN−γの量を定量した。
その結果、図13に示した通り、前記<実施例1>で分離精製された組換えEC−SODは、T細胞において、Thl側のサイトカインであるIFN−γの形成を誘導し、Th2側のサイトカインであるIL−4の形成を抑制することが分った。従って、組換えEC−SODは免疫細胞に影響を及ぼし、特に、T細胞の分化に影響を及ぼすことが分った。
従って、本発明の組換えEC−SODはアレルギー疾患を誘発するTh2細胞の過分化を遮断し、Th1細胞への分化を誘導することにより、アレルギー疾患を治療又は予防に有用に使用できるとこが分った。
【0075】
<実施例5>
天然型EC−SOD蛋白質のT細胞分化に及ぼす影響
前記<実験例1>に記載された人間のEC−SODを過発現させたマウスにOva蛋白質とTh1側に免疫を誘導する免疫補助剤CFA(Complete Freund′s Adjuvant,Sigma社)を、Th2側にはAlum(Aluminum Hydroxide,Pierce社)を混合して、それぞれ25μgずつ足裏と尻尾に免疫処理した後、11日後に炎症が発生したリンパ球で細胞を分離し、EC−SODが細胞増殖とサイトカイン生成に影響を及ぼすか否かを観察した。
前記細胞増殖には、リンパ球細胞5×105を96well plateに培養し、培養3日後に同位元素である3Hを培養液にいれて、16時間後に細胞内の同位元素含量をβ−counterを利用して促進することにより細胞増殖を観察した。さらに、抗原特異的な反応であることを確認する為に、Ova蛋白質の量を異にして細胞増殖を観察した。サイトカイン発現を観察する為に、リンパ球細胞5×106を46well plateに培養し、72時間後に培養液を採取して、ELISAで培養液内のIL−4とIFN−γの量を定量してその結果を図14及び図15に記載した。
前記図14及び図15に記載された通り、Th1分化を誘導するCFAを免疫補助剤として使用した場合、リンパ細胞増殖が正常マウスのリンパ細胞より若干増加することを観察した。IFN−γの発現が増加されたことを観察した。さらに、Th2分化を誘導するAlumを免疫補助剤として使用した時、リンパ細胞増殖が正常マウスのリンパ細胞より減少し、IL−4の発現が減少されたことを観察した。このような結果は、EC−SODがT細胞の分化に影響を及ぼすものの、特に、主にTh1側に分化させ、Th2側への分化を抑制させることが分った。
従って、天然型EC−SODは、アレルギー疾患を誘発するTh2細胞の過分化を遮断してTh1細胞への分化を誘導することにより、アレルギー疾患を治療又は予防に有用に使用できることが分った。
【0076】
<実施例6>
組換えEC−SOD蛋白質の転写因子活性阻害効果確認
紫外線によるNF−κB活性化に対するEC−SOD効果を調べる為に、HaCaT cellを14mm培養スライドに細胞を接種した後、牛胎児血清(fetal bovine serum)が10%含まれたDMEM(Dulbecco′s modified Eagle′s medium)培地で24時間培養した。24時間培養後、牛胎児血清が1%含まれたDMEM培地で24時間飢餓処理(starvati on)をした。処理後それぞれ10μgのEC−SODを30分間処理した後(前処理)リン酸緩衝液(Phosphate buffered saline,PBS)を利用して細胞を3回水洗した後、NF−κB活性化を誘導する為に、100J/m2の紫外線を照射した。紫外線照射直後、細胞を再びリン酸緩衝液で水洗して牛胎児血清が1%含まれたDMEM培地にEC−SODを前処理濃度と同じく処理して、さらに4時間培養した。以降、細胞をメタノールで5分間固定して免疫染色を実施した。このように固定された細胞を10%正常羊血清(normal goat serum)を利用してブロッキング(blocking)した後、リン酸緩衝液(PBS)で3回水洗した。 ここに、EC−SODとNF−κBに対する免疫染色の為に、二十日鼠抗EC−SOD 抗体(mouse anti EC−SOD antibody,Labfrontier,韓国)と、兎抗NF−κB抗体(rabbit anti NF−κB an tibody,santacuz,米国)をそれぞれ処理し、4℃で16時間反応させた。これをTRITC(tetramethyl rhodamine isothi ocyanate)が融合された抗兎IgG2次抗体(antiーrabbit IgG secondary antibody,serotec,英国)とFITCが融合された、抗二十日鼠IgG2次抗体(antiーmouse IgG se condary antibody,zymed,米国)を利用して蛍光染色した後、hoechst(Sigma,米国)でカウンター染色した。
その結果、図16(200倍比率)に示した通り、対照群(control,EC−SODが形質感染されたHaCaT細胞にUV処理を施していない群)において、NF−κBは細胞質及び核で免疫染色がなされず、NF−κBが不活性されたことが分った(A,D,G,J)。UVB群(HaCaT細胞にUVBを100J/m2で照射した群)では、速やかに核(nuclear)部位と核周囲(perinuclear)部位で、NF−κBが活性化されることが観察された(B,E,H,K)。これに比べて、ECSOD/UVB群(HaCaT cellに本発明の組換えEC−SOD蛋白質を処理し、UVBを100J/m2で照射した群)では、UVB群に比べて著しく核部位のNF−κBの活性化が阻害されることが観察された(C,F,I,L)。このような結果により、本願発明の組換えEC−SODが転写因子であるNF−κBの活性化を抑制することが分った。
従って、本願発明の組換えEC−SODはNF−κBの非正常的な活性を防ぎ、アレルギー等の自己免疫疾患を予防又は治療に有用に使用できることが分った。
【0077】
<実施例7>
組換えEC−SOD蛋白質の人間肥満細胞脱顆粒(degranulation)の減少効果確認
EC−SODが人間肥満細胞の脱顆粒(degranulation)にどのような影響を及ぼすか、否かを調べる為に、トルイジンブルーで染色した後、細胞100個の内、脱顆粒が起こった細胞数を数えてみた。
人間肥満細胞(semi,Human Mast Cell−1(HMC−1),慶熙大学校金炯敏教授より提供)を18×18mmカバースリーブに1×104cells/カバースリーブで分株した。培地は10%牛胎児血清(FBS,GIBCO)及び100units/mlペニシリンと100g/mlストレプトマイシン1%で添加したIMDM(Isocove′s modified Dulbecco′s medium,GIBCO)を使用して5%CO2、37℃の条件で培養した。この細胞は半付着細胞(semi−adhesion)である為、付着された細胞と付着されない細胞の比率は4:6程度であるものの、付着された細胞が約30−40%コンフルエント(confluent)した時、EC−SOD5μgで、1時間前処理した後、カルシウムチャンネルであるA23187 1μMとホルボルミリステートアセテート(Phorbol 12−Myristate 13−Acetate,PMA)50nMで処理して、細胞内のカルシウム濃度を高めた。
12時間後に、リン酸緩衝溶液(PBS)で人間肥満細胞を洗浄し、4%パラホルムアルデヒド(paraformaldehyde)で10分間固定させた。リン酸緩衝溶液で洗浄し、酸性を帯びた(pH2.3)1%の塩水に溶解されている0.1%トルイジン(toluidine)ブルー溶液で2−3分間染色した。再び水で洗浄した後、95%,100%アルコールで脱水させ、キシレン(xylene)で固定させ、100個の染色させた細胞のうち脱顆粒が起こった細胞数を数えてみた。
その結果、図17Aに示した通り、何等の処理もしていない人間肥満細胞群(対照群,con)で脱顆粒された細胞数は10個、EC−SODを処理した群(EC−SOD)で脱顆粒された細胞数は16個であった。これに比べて肥満細胞を活性化させ、脱顆粒を誘導する為に、細胞内のカルシウム濃度を高めた群(A+P)では脱顆粒された細胞数が55個で、5倍以上増加したものの、EC−SODを前処理して細胞内のカルシウム濃度を高めた群(A+P+EC−SOD)では、脱顆粒された細胞数が25個までさらに減少した。これはEC−SODの作用による活性酸素抑制により、脱顆粒減少が起こったことを示している。肥満細胞脱顆粒に対する顕微鏡写真は図17Bの通りである。
従って、肥満細胞の脱顆粒により肥満細胞内にあったヒスタミン等の媒介物質がでてきて、アレルギー等の炎症反応が起るとの事実を考慮するに、本発明の組換えEC−SODは人間肥満細胞脱顆粒(degranulation)を減少させ、アレルギー疾患を予防又は治療に有用に使用でき得ることが分った。
【産業上の利用可能性】
【0078】
EC−SOD蛋白質又はこれらをコーデイングするポリヌクレオチドが挿入されたベクターは、血管新生を誘導するVEGF及びMMP−9の発現を抑制して血管新生を抑制する効果が優れているので、血管新生による疾患の予防及び治療に有用に使用することができ、アレルギー疾患を誘発するTh2細胞の過分化を遮断し、転写因子(NF−kB)活性を阻害し、人間肥満細胞の脱顆粒を減少させることにより、アレルギー疾患の予防及び治療に有用に使用できる。さらに、本発明のEC−SOD蛋白質の製造方法は前記のような活性を有するEC−SODを大量に生産することができ、産業的に有用に使用できる。
【特許請求の範囲】
【請求項1】
EC−SOD蛋白質を有効成分とする血管新生による疾患の予防又は治療用組成物。
【請求項2】
前記EC−SOD蛋白質は、配列番号1、配列番号3及び配列番号5からなる群より選ばれたアミノ酸配列を有することを特徴とする第1項記載の血管新生による疾患の予防又は治療用組成物。
【請求項3】
前記血管新生による疾患は、癌、糖尿病、リウマチ性関節炎、動脈硬化、血管腫、血管繊維腫、糖尿病性網膜症、早熟児の網膜症、新生血管性緑内障、新生血管による角膜疾患、退化斑、斑点の変性、翼状片、網膜変性、後水晶体繊維増殖症、顆粒性結膜炎、毛細管拡張症、化膿性肉芽腫及びニキビからなる群より選ばれたことを特徴とする第1項記載の血管新生による疾患の予防又は治療用組成物。
【請求項4】
EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とすることを特徴とする第1項記載の血管新生による疾患の予防又は治療用組成物。
【請求項5】
前記ポリヌクレオチドは配列番号2、配列番号4及び配列番号6からなる群より選ばれた塩基配列を有することを特徴とする第4項記載の血管新生による疾患の予防又は治療用組成物。
【請求項6】
前記血管新生による疾患は、癌、糖尿病、リウマチ性関節炎、動脈硬化、血管腫、血管繊維腫、糖尿病性網膜症、早熟児の網膜症、新生血管性緑内障、新生血管による角膜疾患、退化斑、斑点の変性、翼状片、網膜変性、後水晶体繊維増殖症、顆粒性結膜炎、毛細管拡張症、化膿性肉芽腫及びニキビからなる群より選ばれたことを特徴とする第4項記載の血管新生による疾患の予防又は治療用組成物。
【請求項7】
EC−SOD蛋白質を有効成分とするアレルギー疾患の予防又は治療用組成物。
【請求項8】
前記EC−SOD蛋白質は配列番号1、配列番号3及び配列番号5からなる群より選ばれたアミノ酸配列を有することを特徴とする第7項記載のアレルギー疾患の予防又は治療用組成物。
【請求項9】
前記アレルギー疾患はアレルギー性喘息、アレルギー性鼻炎、アレルギー性中耳炎、アナフィラキシショック(anaphylatic shock)、アレルギー性皮膚疾患、アトピー性皮膚炎、乾癬、接触性アレルギー性鼻炎及び蕁麻疹からなる群より選ばれたことを特徴とする第7項記載のアレルギー疾患の予防又は治療用組成物。
【請求項10】
EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とすることを特徴とする第7項記載のアレルギー疾患の予防又は治療用組成物。
【請求項11】
前記ポリヌクレオチドは配列番号2、配列番号4及び配列番号6からなる群より選ばれた塩基配列を有することを特徴とする第10項記載のアレルギー疾患の予防又は治療用組成物。
【請求項12】
前記アレルギー疾患はアレルギー性喘息、アレルギー性鼻炎、アレルギー性中耳炎、アナフィラキシショック(anaphylatic shock)、アレルギー性皮 膚疾患、アトピー性皮膚炎、乾癬、接触性アレルギー皮膚炎及び蕁麻疹からなる群より選ばれたことを特徴とする第10項記載のアレルギー疾患の予防又は治療用組成物。
【請求項13】
(a)EC−SOD蛋白質をコーデイングするポリヌクレオチドを発現するベクターにクローニングする段階;
(b)前記発現ベクターを宿主細胞に導入して宿主細胞を形質転換する段階;
(c)前記形質転換された宿主細胞を培養してEC−SOD蛋白質を発現させる段階;
(d)前記発現されたEC−SOD蛋白質の内包体を収得する段階;及び
(e)前記内包体の溶解及びリホールディングを誘導する段階を含むことを特徴とするEC−SOD蛋白質の製造方法。
【請求項14】
前記ポリヌクレオチドは配列番号2、配列番号4及び配列番号6からなる群より選ばれた塩基配列を有することを特徴とする第13項記載のEC−SOD蛋白質の製造方法。
【請求項15】
前記製造方法は(f)ゲル濾過コラム(gel−filtration column)により分離及び生成する段階を追加して含むことを特徴とする第13項記載のEC−SOD蛋白質の製造方法。
【請求項16】
前記宿主細胞は大腸菌であることを特徴とする第13項記載のEC−SOD蛋白質の製造方法。
【請求項17】
前記(e)段階の内包体の溶解及びリホールディングの誘導は、蛋白質変性剤を含む緩衝溶液で内包体を溶解させ、金属親和性樹脂コラムに吸着させ、変性剤の濃度を低めながらリホールディングを誘導する方法により実施することを特徴とする第13項記載のEC−SOD蛋白質の製造方法。
【請求項18】
第13項の方法により製造されたEC−SOD蛋白質。
【請求項19】
EC−SOD蛋白質を必要とする個体に有効な量で投与することを含む血管新生による疾患の予防又は治療方法。
【請求項20】
EC−SOD蛋白質の血管新生による治療剤製造の為の用途。
【請求項21】
EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを必要とする個体に有効な量で投与することを含む血管新生による疾患の予防又は治療方法。
【請求項22】
EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターの血管新生による疾患の治療剤製造の為の用途。
【請求項23】
EC−SOD蛋白質を必要とする個体に有効な量で投与することを含むアレルギー疾患の予防又は治療方法。
【請求項24】
EC−SOD蛋白質のアレルギー疾患の治療剤製造の為の用途。
【請求項25】
EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを必要とする個体に有効な量で投与することを含むアレルギー疾患の予防又は治療方法。
【請求項26】
EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターのアレルギー疾患の治療剤製造の為の用途。
【請求項1】
EC−SOD蛋白質を有効成分とする血管新生による疾患の予防又は治療用組成物。
【請求項2】
前記EC−SOD蛋白質は、配列番号1、配列番号3及び配列番号5からなる群より選ばれたアミノ酸配列を有することを特徴とする第1項記載の血管新生による疾患の予防又は治療用組成物。
【請求項3】
前記血管新生による疾患は、癌、糖尿病、リウマチ性関節炎、動脈硬化、血管腫、血管繊維腫、糖尿病性網膜症、早熟児の網膜症、新生血管性緑内障、新生血管による角膜疾患、退化斑、斑点の変性、翼状片、網膜変性、後水晶体繊維増殖症、顆粒性結膜炎、毛細管拡張症、化膿性肉芽腫及びニキビからなる群より選ばれたことを特徴とする第1項記載の血管新生による疾患の予防又は治療用組成物。
【請求項4】
EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とすることを特徴とする第1項記載の血管新生による疾患の予防又は治療用組成物。
【請求項5】
前記ポリヌクレオチドは配列番号2、配列番号4及び配列番号6からなる群より選ばれた塩基配列を有することを特徴とする第4項記載の血管新生による疾患の予防又は治療用組成物。
【請求項6】
前記血管新生による疾患は、癌、糖尿病、リウマチ性関節炎、動脈硬化、血管腫、血管繊維腫、糖尿病性網膜症、早熟児の網膜症、新生血管性緑内障、新生血管による角膜疾患、退化斑、斑点の変性、翼状片、網膜変性、後水晶体繊維増殖症、顆粒性結膜炎、毛細管拡張症、化膿性肉芽腫及びニキビからなる群より選ばれたことを特徴とする第4項記載の血管新生による疾患の予防又は治療用組成物。
【請求項7】
EC−SOD蛋白質を有効成分とするアレルギー疾患の予防又は治療用組成物。
【請求項8】
前記EC−SOD蛋白質は配列番号1、配列番号3及び配列番号5からなる群より選ばれたアミノ酸配列を有することを特徴とする第7項記載のアレルギー疾患の予防又は治療用組成物。
【請求項9】
前記アレルギー疾患はアレルギー性喘息、アレルギー性鼻炎、アレルギー性中耳炎、アナフィラキシショック(anaphylatic shock)、アレルギー性皮膚疾患、アトピー性皮膚炎、乾癬、接触性アレルギー性鼻炎及び蕁麻疹からなる群より選ばれたことを特徴とする第7項記載のアレルギー疾患の予防又は治療用組成物。
【請求項10】
EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを有効成分とすることを特徴とする第7項記載のアレルギー疾患の予防又は治療用組成物。
【請求項11】
前記ポリヌクレオチドは配列番号2、配列番号4及び配列番号6からなる群より選ばれた塩基配列を有することを特徴とする第10項記載のアレルギー疾患の予防又は治療用組成物。
【請求項12】
前記アレルギー疾患はアレルギー性喘息、アレルギー性鼻炎、アレルギー性中耳炎、アナフィラキシショック(anaphylatic shock)、アレルギー性皮 膚疾患、アトピー性皮膚炎、乾癬、接触性アレルギー皮膚炎及び蕁麻疹からなる群より選ばれたことを特徴とする第10項記載のアレルギー疾患の予防又は治療用組成物。
【請求項13】
(a)EC−SOD蛋白質をコーデイングするポリヌクレオチドを発現するベクターにクローニングする段階;
(b)前記発現ベクターを宿主細胞に導入して宿主細胞を形質転換する段階;
(c)前記形質転換された宿主細胞を培養してEC−SOD蛋白質を発現させる段階;
(d)前記発現されたEC−SOD蛋白質の内包体を収得する段階;及び
(e)前記内包体の溶解及びリホールディングを誘導する段階を含むことを特徴とするEC−SOD蛋白質の製造方法。
【請求項14】
前記ポリヌクレオチドは配列番号2、配列番号4及び配列番号6からなる群より選ばれた塩基配列を有することを特徴とする第13項記載のEC−SOD蛋白質の製造方法。
【請求項15】
前記製造方法は(f)ゲル濾過コラム(gel−filtration column)により分離及び生成する段階を追加して含むことを特徴とする第13項記載のEC−SOD蛋白質の製造方法。
【請求項16】
前記宿主細胞は大腸菌であることを特徴とする第13項記載のEC−SOD蛋白質の製造方法。
【請求項17】
前記(e)段階の内包体の溶解及びリホールディングの誘導は、蛋白質変性剤を含む緩衝溶液で内包体を溶解させ、金属親和性樹脂コラムに吸着させ、変性剤の濃度を低めながらリホールディングを誘導する方法により実施することを特徴とする第13項記載のEC−SOD蛋白質の製造方法。
【請求項18】
第13項の方法により製造されたEC−SOD蛋白質。
【請求項19】
EC−SOD蛋白質を必要とする個体に有効な量で投与することを含む血管新生による疾患の予防又は治療方法。
【請求項20】
EC−SOD蛋白質の血管新生による治療剤製造の為の用途。
【請求項21】
EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを必要とする個体に有効な量で投与することを含む血管新生による疾患の予防又は治療方法。
【請求項22】
EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターの血管新生による疾患の治療剤製造の為の用途。
【請求項23】
EC−SOD蛋白質を必要とする個体に有効な量で投与することを含むアレルギー疾患の予防又は治療方法。
【請求項24】
EC−SOD蛋白質のアレルギー疾患の治療剤製造の為の用途。
【請求項25】
EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターを必要とする個体に有効な量で投与することを含むアレルギー疾患の予防又は治療方法。
【請求項26】
EC−SOD蛋白質をコーデイングするポリヌクレオチドが挿入されたベクターのアレルギー疾患の治療剤製造の為の用途。
【図1】


【図2】


【図3】


【図5】


【図6A】


【図6B】


【図6C】


【図6D】


【図7】


【図8】


【図9】


【図4】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図5】


【図6A】


【図6B】


【図6C】


【図6D】


【図7】


【図8】


【図9】


【図4】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公表番号】特表2010−522159(P2010−522159A)
【公表日】平成22年7月1日(2010.7.1)
【国際特許分類】
【出願番号】特願2009−554454(P2009−554454)
【出願日】平成20年3月24日(2008.3.24)
【国際出願番号】PCT/KR2008/001636
【国際公開番号】WO2008/115039
【国際公開日】平成20年9月25日(2008.9.25)
【出願人】(509004837)インダストリーアカデミック コーポレーション ファンデーション, ザ カトリックユニバーシティ オブ コリア (2)
【Fターム(参考)】
【公表日】平成22年7月1日(2010.7.1)
【国際特許分類】
【出願日】平成20年3月24日(2008.3.24)
【国際出願番号】PCT/KR2008/001636
【国際公開番号】WO2008/115039
【国際公開日】平成20年9月25日(2008.9.25)
【出願人】(509004837)インダストリーアカデミック コーポレーション ファンデーション, ザ カトリックユニバーシティ オブ コリア (2)
【Fターム(参考)】
[ Back to top ]

